Способ повышения экспрессии рнк в клетке - RU2784654C2
Код документа: RU2784654C2
Чертежи










Описание
Область техники
Настоящее изобретение описывает фактор вирусного происхождения, который при предоставлении в клетки, например, путем трансфекции клеток РНК, кодирующей фактор вирусного происхождения, увеличивает экспрессию РНК, кодирующей пептид или белок, в клетках. В частности, фактор вирусного происхождения увеличивает выживаемость клеток, в частности, при повторном трансфицировании РНК и уменьшает IFN ответ клеток на трансфицированную РНК. Соответственно, настоящее изобретение предоставляет способы и средства для повышения экспрессии РНК в клетках. Клетки предпочтительно трансфицируются РНК.
Уровень техники
Использование РНК для доставки чужеродной генетической информации в клетки-мишени представляет собой заманчивую альтернативу ДНК. Преимущества использования РНК включают транзиентную экспрессию и нетрансформирующий характер. РНК не нуждается во вхождении в ядро для того, чтобы экспрессироваться и, более того, она не может интегрироваться в геном хозяина, тем самым, устраняя риск онкогенеза.
РНК описывается как пригодная для де-дифференциации соматических клеток в клетки, подобные стволовым, без формирования эмбриона или плода. Де-дифференциация соматических клеток в клетки, имеющие характеристики стволовых клеток, в частности плюрипотентность, может осуществляться путем введения РНК, кодирующей факторы, индуцирующие де-дифференциацию соматических клеток в соматические клетки (также называемые факторами перепрограммирования транскрипции (rTF) или просто перепрограммирующими факторами), и культивирования соматических клеток при обеспечении возможности клеткам де-дифференцировать. После того, как они стали де-дифференцированными, данные клетки могут быть индуцированы, чтобы повторно дифференцировать в тот же самый или другой тип соматических клеток, такой как нейрональныйй, гематопоэтический, мышечный, эпителиальный и другие типы клеток. Таким образом, такие подобные стволовым клетки могут иметь медицинское применение для лечения дегенеративных болезней с помощью «клеточной терапии» и могут использоваться в новых стратегиях лечения сердечных, неврологических, эндокринологических, сосудистых, ретинальных, дерматологических, скелетно-мышечных нарушений и других заболеваний.
Однако, экзогенная одноцепочечная РНК активирует механизмы защиты в клетках млекопитающих. Таким образом, генный перенос на основе РНК, как правило, сопровождается индукцией IFN-ответа, который препятствует непрерывной экспрессии доставленной РНК.
Раскрытие изобретения
Согласно изобретению наблюдается, что белок уклонения вируса NSs (N) Toscana virus является сильным ингибитором IFN-ответа и может использоваться в комбинации с РНК трансфекцией. Кроме того, согласно изобретению отмечается, что белок уклонения вируса NSs (N) Toscana virus может использоваться, чтобы заменить EKB (E3, K3, B18R) для успешной РНК-основанной экспрессии белков, представляющих интерес.
В одном аспекте изобретение имеет отношение к способу экспрессии пептида или белка (также называемого пептидом или белком, представляющим интерес, в данном описании) в клетке, содержащему стадии (i) введения РНК, кодирующей пептид или белок, в клетку и (ii) предоставления фактора вирусного происхождения фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, в клетку.
В одном варианте осуществления фактор вирусного происхождения содержит NSs белок Toscana virus.
В одном варианте осуществления РНК вводится в клетку неоднократно. В одном варианте осуществления РНК вводится в клетку с помощью электропорации или липофекции.
В одном варианте осуществления РНК представляет собой in vitro транскрибированную РНК.
В одном варианте осуществления предоставление фактора вирусного происхождения в клетку включает введение нуклеиновой кислоты, такой как РНК, кодирующей фактор вирусного происхождения, в клетку.
В одном варианте осуществления способ изобретения может дополнительно включать (i) предотвращение «захвата» IFN рецептора внеклеточным IFN и/или (ii) ингибирование внутриклеточной IFN передачи сигнала. Таким образом, в одном варианте осуществления способ изобретения включает предоставление одного или более из вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3, такого как вирус осповакцины B18R и/или вирус осповакцины E3, в клетку. В одном варианте осуществления предоставление одного или более из числа вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в клетку включает введение нуклеиновой кислоты, такой как РНК, кодирующей то же самое, в клетку.
Однако, согласно изобретению наблюдается, что белок уклонения вируса NSs (N) от вируса Toscana может использоваться, чтобы полностью заменить EKB (E3, K3, B18R) для успешной РНК-основанной экспрессии белков, представляющих интерес. Таким образом, в одном варианте осуществления способ изобретения содержит предоставление фактора вирусного происхождения в клетку, но не включает предоставление одного или более из вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в клетку, предпочтительно не содержит предоставление любого из вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в клетку, и более предпочтительно не включает предоставление какого-либо ингибитора IFN-ответа за исключением фактора вирусного происхождения в клетку.
В одном варианте осуществления предоставление фактора вирусного происхождения в клетку увеличивает стабильность и/или экспрессию РНК в клетке по сравнению с ситуацией, когда фактор вирусного происхождения не предоставляется.
В одном варианте осуществления увеличение экспрессии РНК в клетке предпочтительно включает увеличение уровня экспрессии и/или увеличение продолжительности экспрессии РНК в клетке.
В одном варианте осуществления предоставление фактора вирусного происхождения в клетку увеличивает жизнеспособность клетки по сравнению с ситуацией, когда фактор вирусного происхождения не предоставляется.
В одном варианте осуществления клетка является клеткой, обладающей барьерной функцией. В одном варианте осуществления клетка является фибробластом, кератиноцитом, эпителиальной клеткой или эндотелиальной клеткой, при этом эндотелиальная клетка предпочтительно является эндотелиальной клеткой сердца, эндотелиальной клеткой легкого или эндотелиальной клеткой пупочной вены. В одном варианте осуществления клетка является T-клеткой или антиген-презентирующей клеткой. В одном варианте осуществления клетка является человеческой клеткой.
Изобретение также имеет отношение к способу предоставления клеток, имеющих характеристики стволовой клетки, включающему стадии (i) предоставления клеточной популяции, содержащей соматические клетки, (ii) предоставления фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus в соматические клетки, (iii) введения РНК, кодирующей один или более факторов перепрограммирования в соматические клетки, и (iv) обеспечения возможности развития клеток, обладающих характеристиками стволовой клетки.
В одном варианте осуществления фактор вирусного происхождения включает NSs белок Toscana virus.
В одном варианте осуществления РНК вводится в соматические клетки неоднократно. В одном варианте осуществления РНК вводится в соматические клетки с помощью электропорации или липофекции.
В одном варианте осуществления РНК представляет собой in vitro транскрибированную РНК.
В одном варианте осуществления предоставление фактора вирусного происхождения в соматические клетки включает введение нуклеиновой кислоты, такой как РНК, кодирующая фактор вирусного происхождения, в соматические клетки.
В одном варианте осуществления способ изобретения может дополнительно включать (i) предотвращение «захвата» IFN рецептора внеклеточным IFN и/или (ii) ингибирование внутриклеточной IFN передачи сигнала. Таким образом, в одном варианте осуществления способ изобретения содержит предоставление одного или более из вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3, такого как вирус осповакцины B18R и/или вирус осповакцины E3, в соматические клетки. В одном варианте осуществления предоставление одного или более из вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в соматические клетки включает введение нуклеиновой кислоты, такой как РНК, кодирующая то же самое, в соматические клетки.
Однако, согласно изобретению наблюдается, что белок уклонения вируса NSs (N) от вируса Toscana может использоваться, чтобы полностью заменить EKB (E3, K3, B18R) для успешной РНК-основанной экспрессии белков, представляющих интерес. Таким образом, в одном варианте осуществления способ изобретения включает предоставление фактора вирусного происхождения в соматические клетки, но также включает предоставление одного или более из числа вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в соматические клетки, предпочтительно не содержит предоставление любого из числа вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3 в соматические клетки, и более предпочтительно не включает предоставление какого-либо ингибитора IFN-ответа за исключением фактора вирусного происхождения в соматические клетки.
В одном варианте осуществления предоставление фактора вирусного происхождения в соматические клетки увеличивает устойчивость и/или экспрессию РНК в соматических клетках по сравнению с ситуацией, когда фактор вирусного происхождения не предоставляется.
В одном варианте осуществления увеличение экспрессии РНК в соматических клетках предпочтительно включает увеличение уровня экспрессии и/или увеличение продолжительности экспрессии РНК в соматических клетках.
В одном варианте осуществления предоставление фактора вирусного происхождения в соматические клетки увеличивает жизнеспособность клетки по сравнению с ситуацией, когда фактор вирусного происхождения не предоставляется.
В одном варианте осуществления способ дополнительно включает введение в соматические клетки микроРНК, увеличивающей перепрограммирование соматических клеток в клетки, обладающие характеристиками стволовых клеток.
В одном варианте осуществления один или более перепрограммирующих факторов включают OCT4 и SOX2. Один или более перепрограммирующих факторов могут дополнительно включать KLF4 и/или c-MYC и/или NANOG и/или LIN28. В одном варианте осуществления один или более перепрограммирующих факторов включают OCT4, SOX2, KLF4 и c-MYC и могут дополнительно включать LIN28 и необязательно NANOG. В одном варианте осуществления один или более перепрограммирующих факторов включают OCT4, SOX2, NANOG и LIN28.
В одном варианте осуществления способ дополнительно включает стадию культивирования соматических клеток в присутствии, по меньшей мере, одного ингибитора гистондеацетилазы, при этом, по меньшей мере, один ингибитор гистондеацетилазы предпочтительно включает вальпроевую кислоту, бутират натрия, трихостатин A и/или скриптаид.
В одном варианте осуществления стадия обеспечения возможности развития клеток, обладающих характеристиками стволовых клеток, включает культивирование соматических клеток в условиях культивирования эмбриональных стволовых клеток.
В одном варианте осуществления характеристики стволовой клетки включают морфологию эмбриональной стволовой клетки.
В одном варианте осуществления клетки, обладающие характеристиками стволовой клетки, имеют нормальные кариотипы, демонстрируют теломеразную активность, экспрессируют маркеры клеточной поверхности, являющиеся характерными для эмбриональных стволовых клеток, и/или экспрессируют гены, являющиеся характерными для эмбриональных стволовых клеток.
В одном варианте осуществления клетки, обладающие характеристиками стволовой клетки, демонстрируют плюрипотентный статус.
В одном варианте осуществления клетки, обладающие характеристиками стволовой клетки обладают дифференцировочным потенциалом, чтобы дифференцировать в развитые производные всех трех первичных зародышевых слоев.
В одном варианте осуществления соматические клетки представляют собой фибробласты, такие как фибробласты легких, фибробласты крайней плоти или фибробласты кожи, кератиноциты или эндотелиальные клетки-предшественники. Предпочтительно, соматические клетки являются человеческими клетками.
Изобретение также имеет отношение к способу предоставления дифференцированных клеточных типов, включающему стадии (i) предоставления клеток, обладающих характеристиками стволовых клеток, с применением метода получения клеток, имеющих характеристики стволовых клеток, согласно изобретению, и (ii) культивирования клеток, обладающих характеристиками стволовых клеток, в условиях, вызывающих или прямую частичную или полную дифференцировку в дифференцированный клеточный тип.
Изобретение также имеет отношение к композиции, включающей нуклеиновую кислоту, такую как РНК, кодирующая фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus. Кроме того, изобретение также имеет отношение к набору, содержащему композицию изобретения. В одном варианте осуществления композиция или набор изобретения используется в способах изобретения. Соответственно, набор может содержать инструкции, такие как напечатанные инструкции, имеющие отношение к использованию набора в способах, описанных в этом документе. Различные варианты осуществления композиции или набора изобретения описаны выше для способов изобретения.
В одном варианте осуществления композиция или набор изобретения содержит РНК, предназначенную для введения в клетку для экспрессии, например, РНК, кодирующую один или более представляющих интерес пептидов или белков, таких как один или более факторов перепрограммирования.
Изобретение может использоваться, например, для увеличения экспрессии представляющих интерес пептидов или белков после трансфекции клеток РНК, кодирующей такие представляющие интерес пептиды или белки. Конкретнее, при продуцировании рекомбинантных белков возможно использование способов и агентов изобретения для экспрессии рекомбинантных белков в системах на основе клеток. Среди прочего, это дает возможность уменьшить стоимость производства.
Также возможно использование способов и агентов изобретения в целях генной терапии. Соответственно, РНК для трансфицирования может представлять собой генотерапевтический вектор и может использоваться для экспрессии трансгена. Клетки могут быть трансфицированы этими векторами in vitro, например, лимфоциты или дендритные клетки, или же in vivo путем прямого введения.
РНК может использоваться, например, для временной экспрессии генов с возможными областями применения в виде РНК-основанных вакцин, которые трансфицируются в клетки in vitro или вводятся непосредственно in vivo, для временной экспрессии функциональных рекомбинантных белков in vitro, например для того, чтобы инициировать процессы дифференцировки в клетках или исследовать функции белков, и временной экспрессии функциональных рекомбинантных белков, таких как эритропоэтин, гормоны, ингибиторы коагуляции и т.д., in vivo, в частности, в качестве фармацевтических средств.
РНК может использоваться, в частности, для трансфекции антиген-презентирующих клеток и таким образом в качестве инструмента для доставки антигена, который должен презентироваться, и для «нагрузки» антиген-презентирующих клеток указанным антигеном, который должен презентироваться in vitro и in vivo. Такие антиген-презентирующие клетки могут использоваться для стимуляции T-клеток, в частности CD4+ и/или CD8+ T-клеток.
Подробное описание изобретения
Несмотря на то, что настоящее изобретение подробно описывается ниже, следует понимать, что это изобретение не ограничивается конкретными методиками, протоколами и реактивами, описанными в данной области техники, поскольку они могут варьировать. Также следует понимать, что использованная в описании терминология предназначается только для описания конкретных вариантов осуществления и не предназначается для ограничения объема настоящего изобретения, которое ограничивается только прилагаемыми пунктами формулы изобретения. Если не указано иное, все технические и научные термины, использованные в данном документе, имеют то же самое значение, которое обычно понятно среднему специалисту в данной области техники.
В дальнейшем будут описаны компоненты настоящего изобретения. Эти компоненты перечисляются при помощи специфических вариантов осуществления, однако, следует понимать, что они могут комбинироваться любым образом и в любом количестве для получения дополнительных вариантов осуществления. Различные описанные примеры и предпочтительные варианты осуществления не должны истолковываться как ограничивающие настоящее изобретение только до точно описанных вариантов осуществления. Следует понимать, что данное описание обосновывает и включает варианты осуществления, которые комбинируют точно описанные варианты осуществления с любым числом раскрытых и/или предпочтительных компонентов. Кроме того, любые перестановки и комбинации всех описанных компонентов в данной заявке следует считать раскрытыми описанием настоящей заявки, если контекст не указывает иначе.
Предпочтительно, использованные в описании термины определены как описано в “Многоязычном словаре биотехнологических терминов: (IUPAC Рекомендации)”, H.G.W. Leuenberger, B. Nagel, и H. Kölbl, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
В практике осуществления настоящего изобретения будут использоваться, если не указано иное, общепринятые методы химии, биохимии, клеточной биологии, иммунологии и технологии рекомбинантных ДНК, которые объясняются в литературе, имеющей отношение к данной области техники (см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
На всем протяжении данного подробного описания и пунктов формулы изобретения, которая следует ниже, если по контексту не требуется иное, слово «содержать», и его варианты, такие как «содержит» и «содержащий», подразумевает включение установленного элемента, целого числа или стадии или группы элементов, целых чисел или стадий, но не исключение какого-либо другого элемента, целого числа или стадии или группы элементов, целых чисел или стадий. Термины в форме единственного числа, использованные в контексте описания изобретения (особенно в контексте пунктов формулы изобретения), должны истолковываться как включающие и единственное число и множественное число, если в документе не указано иное или это явно не противоречит контексту. Перечисление диапазонов значений в описании служит только в качестве сокращенного способа упоминания индивидуально каждого отдельного значения, попадающего в указанный диапазон. Если в описании не указано иное, каждое отдельное значение включается в подробное описание так, как будто бы они были процитированы в описании каждое в отдельности. Все способы, описанные в данном документе, могут осуществляться в любом подходящем порядке, если в описании не указано иное или иначе явно не противоречит контексту. Использование всех без исключения примеров, или типичного языка (например, «такой как»), предоставленных в описании, предназначается исключительно для того, чтобы лучше иллюстрировать изобретение, и не предназначается для ограничения объема изобретения, заявленного иным образом. Ни одна формулировка в данном подробном описании не должна рассматриваться как указывающая на какой-либо незаявленный элемент, необходимый для осуществления изобретения на практике.
Некоторые документы цитируются на протяжении всего текста этого описания. Каждый из документов, упомянутых в описании (включая все патенты, патентные заявки, научные публикации, спецификации производителя, инструкции и т.д.), будь то выше или ниже, полностью включается в описание путем отсылки. Ничто из содержащегося в настоящем документе не должно истолковываться как допущение того, что изобретение не имеет права датировать такое раскрытие посредством предшествующего изобретения.
Согласно изобретению отмечается, что белок уклонения вируса NSs (N) Toscana вируса является сильным ингибитором IFN-ответа и может использоваться в комбинации с РНК трансфекцией для того, чтобы увеличить экспрессию представляющего интерес пептида или белка, кодированного РНК.
В одном варианте осуществления способ изобретения представляет собой in vitro способ. В одном варианте осуществления способ изобретения включает или не включает извлечение клеток у человека или животного, например, с помощью хирургической операции. Клетки, являющиеся результатом методов изобретения, могут быть введены субъекту. Клетки могут быть аутологичными, сингенными, аллогенными или гетерологичными по отношению к субъекту. Трансфицированные клетки могут быть введены субъекту при помощи любых способов, известных в данной области техники.
В других вариантах осуществления клетки могут присутствовать у субъекта, например, пациента. В этих вариантах осуществления способы изобретения являются in vivo способами, которые включают введение РНК субъекту.
В одном варианте осуществления изобретения клетки предоставляются с фактором вирусного происхождения вирусного происхождения, содержащим NSs белок Toscana вируса или функциональный вариант NSs белка Toscana вируса, до, одновременно с и/или после введения РНК, кодирующей пептид или белок, который должен экспрессироваться, например, один или более перепрограммирующих факторов, или после первого введения (например, в случае повторных трансфекций) РНК. В одном варианте осуществления клетки предоставляются с фактором вирусного происхождения, содержащим NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus после, предпочтительно сразу после введения РНК или первого введения (например, в случае повторных трансфекций) РНК.
В одном особенно предпочтительном варианте осуществления клетки предоставляются с фактором вирусного происхождения, содержащим NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, посредством введения РНК, кодирующей фактор вирусного происхождения в клетках. В одном варианте осуществления изобретения РНК, кодирующая фактор вирусного происхождения, вводится в клетки до, одновременно с и/или после введения РНК, кодирующей пептид или белок, который должен экспрессироваться, или первого введения (например, в случае повторных трансфекций) РНК, кодирующей пептид или белок, который должен экспрессироваться. В одном варианте осуществления РНК, кодирующая фактор вирусного происхождения, вводится в клетки после, предпочтительно сразу после введения РНК, кодирующей пептид или белок, который должен экспрессироваться, или первого введения (например, в случае повторных трансфекций) РНК, кодирующей пептид или белок, который должен экспрессироваться.
Семейство Bunyaviridae включает инфицирующие животных роды Orthobunyavirus, Phlebovirus, Hantavirus и Nairovirus и инфицирующий растения род Tospovirus. Phleboviruses составляют группа флеботомной (москитной) лихорадки и группа Uukuniemi. Некоторые члены группы флеботомной лихорадки, включая вирус Рифт-Валли (RVFV), вирус тосканской лихорадки (TOSV), сицилийский вирус москитной лихорадки (SFSV) и вирус Пунта-Торо (PTV), являются патогенными для людей. TOSV представляет собой оболочечный вирус, несущий геном отрицательно-полярной одноцепочечной РНК, содержащий три сегмента, которые обозначаются L (большой), M (средний) и S (маленький). L-сегмент кодирует вирусную полимеразу (L), M-сегмент кодирует гликопротеины оболочки Gn и Gc, и S-сегмент кодирует нуклеопротеин (N). Кроме того, S-сегмент также кодирует неструктурный белок NSs амбисмысловым образом. Флебовирусные NSs белки играют важную роль в уклонении вируса от врожденных иммунных ответов хозяина.
Согласно изобретению термин «NSs белок вируса тосканской лихорадки (Toscana virus)» имеет отношение к неструктурному белку NSs вируса тосканской лихорадки (Toscana virus). В частности, термин относится к белку, содержащему следующую аминокислотную последовательность:
MQSRAVILKHRSGSGHKRSLPRFYIDCDLDTFDFEKGCSLIENEFPIYINNYEVVYKSKPTLSHFLIEKEFPAVLGPGMISAVRTRLYEPTMRELYQESIHQLKRNNKKYLLSALRWPTGIPTLEFIDYYFEELLFLSEFDPGSIQRYLKLLVKASGLYNSTIEEQLVEIHRRVLIEGKKHGLTAFDLPGNDILGDICVVQAARVTRLVAKTFSKMTRDTHLMIYFSISPVELVLNKLDKKEDKRAKAKGLMSMCAARSYDYFMRTDLGFRETALSTFWAKDWPTLQETILSDKRCLKEDMRVTKWLPSPPHYPPL (SEQ ID NO: 1).
Термин «функциональный вариант NSs белка Toscana virus» имеет отношение к любому белку, в частности, к любому вирус-производному белку, демонстрирующему функции, сходные с NSs белком Toscana вируса. Одна конкретная функция заключается в увеличении экспрессии РНК, кодирующей пептид или белок в клетках. Соответственно, данный термин включает белки, содержащие функциональные фрагменты NSs белка Toscana вируса или функциональные варианты последовательности NSs белка Toscana вируса или его фрагментов.
«Фрагмент» в отношении аминокислотной последовательности (пептида или белка) относится к части аминокислотной последовательности, т.е. последовательности, которая представляет собой аминокислотную последовательность, укороченную на N-конце и/или C-конце. Фрагмент, укороченный на C-конце (N-концевой фрагмент) получается, например, путем трансляции укороченной открытой рамки считывания, у которой отсутствует 3'-конец открытой рамки считывания. Фрагмент, укороченный на N-конце (C-концевой фрагмент) получается, например, путем трансляции укороченной открытой рамки считывания, у которой отсутствует 5'-конец открытой рамки считывания, в том случае, если укороченная открытая рамка считывания содержит стартовый кодон, служащий для инициации трансляции. Фрагмент аминокислотной последовательности содержит, например, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90% аминокислотных остатков из аминокислотной последовательности.
Термин «вариант» включает все сплайс-варианты, посттранслянционно модифицированные варианты, конформации, изоформы и видовые гомологи, в частности те, которые экспрессируются клетками в природных условиях.
В целях настоящего изобретения «варианты» аминокислотной последовательности включают варианты с вставкой аминокислоты, варианты с добавлением аминокислоты, варианты с удалением аминокислоты и/или варианты с заменой аминокислоты. Варианты с вставкой аминокислоты включают вставки одной или двух или более аминокислот в отдельную аминокислотную последовательность. В случае вариантов аминокислотной последовательности, имеющих вставку, в определенный участок в аминокислотной последовательности вставляется один или более аминокислотных остатков, при этом также возможна случайная вставка с соответствующим отбором конечного продукта. Варианты с добавлением аминокислот включают амино- и/или карбоксиконцевое «слияние» одной или более аминокислот, например, 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Варианты с делецией аминокислот характеризуются удалением одной или более аминокислот из последовательности, например, удалением 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Делеции могут находиться в любом положении белка. Варианты с делецией аминокислот, которые содержат делецию на N-концевой и/или C-концевой области белка, также называются вариантами с N-концевым и/или C-концевым укорочением. Варианты с аминокислотной заменой характеризуются тем, что по меньшей мере один остаток в последовательности удаляется, а другой остаток вставляется на его место. Предпочтение отдается модификациям, имеющимся в положениях в аминокислотной последовательности, которые не являются консервативными между гомологичными белками или пептидами, и/или замене аминокислот на другие аминокислоты, имеющие сходные свойства. Предпочтительно, аминокислотные изменения в вариантах белков являются консервативными аминокислотными изменениями, т.е. заменами аналогично заряженных или незаряженных аминокислот. Консервативная аминокислотная замена касается замены одной из семейства аминокислот, которые являются связанными в своих боковых цепях. Аминокислоты природного происхождения обычно подразделяются на четыре семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда вместе классифицируются как ароматические аминокислоты.
Предпочтительно степень сходства, предпочтительно идентичность между отдельно взятой аминокислотной последовательностью и аминокислотной последовательностью, которая является вариантом указанной отдельно взятой аминокислотной последовательности, составляет, по меньшей мере, около 60%, 65%, 70%, 80%, 81%, 82%, 83%, 84%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Степень сходства или идентичность дается предпочтительно для аминокислотного участка, который составляет, по меньшей мере, около 10%, по меньшей мере, около 20%, по меньшей мере, около 30%, по меньшей мере, около 40%, по меньшей мере, около 50%, по меньшей мере, около 60%, по меньшей мере, около 70%, по меньшей мере, около 80%, по меньшей мере, около 90% или около 100% полной длины эталонной аминокислотной последовательности. Например, если эталонная аминокислотная последовательность состоит из 200 аминокислот, степень сходства или идентичность дается предпочтительно, по меньшей мере, примерно для 20, по меньшей мере, примерно 40, по меньшей мере, примерно 60, по меньшей мере, примерно 80, по меньшей мере, примерно 100, по меньшей мере, примерно 120, по меньшей мере, примерно 140, по меньшей мере, примерно 160, по меньшей мере, примерно 180, или примерно для 200 аминокислот, предпочтительно непрерывных аминокислот. В предпочтительных вариантах осуществления степень сходства или идентичность дается в отношении полной длины эталонной аминокислотной последовательности. Выравнивание для определения сходства последовательности, предпочтительно идентичности последовательности, может быть выполнено с помощью известных в данной области техники способов, предпочтительно с помощью наилучшего способа выравнивания последовательности, например, Align, с использованием стандартных настроек, предпочтительно EMBOSS::needle, Матрица: Blosum62, открытие гэпа 10.0, продолжение гэпа 0.5.
«Сходство последовательности» указывает на процент аминокислот, которые являются или идентичными или которые представляют консервативные аминокислотные замены. «Идентичность последовательности» между двумя аминокислотными последовательностями показывает процент аминокислот или нуклеотидов, являющихся идентичными между последовательностями.
Термин «процент идентичности» предназначен для обозначения процента остатков аминокислот, которые являются идентичными между двумя сравниваемыми последовательностями, полученного после лучшего выравнивания, этот процент является чисто статистическим, а различия между двумя последовательностями распределяются случайным образом и на протяжении всей их длины. Сравнение последовательностей между двумя аминокислотными последовательностями обычно осуществляется путем сравнения этих последовательностей после их оптимального выравнивания, указанное сравнение осуществляется при помощи сегмента или «окна сравнения» для того, чтобы идентифицировать и сравнить локальные области сходства последовательности. Оптимальное выравнивание последовательностей для сравнения может производиться, кроме ручного способа, путем использования алгоритма поиска локальной гомологии Смита-Уотермана, 1981, Ads App. Math. 2, 482, за счет использования алгоритма поиска локальной гомологии Нидлмана-Вунша, 1970, J. Mol. Biol. 48, 443, за счет использования алгоритма поиска локальной гомологии Пирсона-Липмана, 1988, Proc. Natl Acad. Sci. USA 85, 2444, или при помощи компьютерных программ, которые используют эти алгоритмы (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wis.).
Процент идентичности вычисляется путем определения числа идентичных положений между двумя сравниваемыми последовательностями, делением этого числа на число сравниваемых положений и умножением полученного результата на 100, для того, чтобы получить процент идентичности между этими двумя последовательностями.
Гомологичные аминокислотные последовательности демонстрируют согласно изобретению по меньшей мере, 40%, в частности по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90% и предпочтительно по меньшей мере, 95%, по меньшей мере, 98 или по меньшей мере, 99% идентичность аминокислотных остатков.
Варианты аминокислотных последовательностей, описанные в этом документе, могут быть легко получены специалистом, например, путем манипуляции с рекомбинантной ДНК. Манипулирование ДНК последовательностями для получения пептидов или белков, имеющих замены, добавления, вставки или делеции, подробно описывается, например, в Sambrook et al. (1989). Более того, пептиды и аминокислотные варианты, описанные в этом документе, могут быть легко получены при помощи известных методов пептидного синтеза, таких как, например, твердофазный синтез и подобные способы.
Изобретение включает производные пептидов или белков, описанных в этом документе, которые охватываются терминами «пептид» и «белок». Согласно изобретению «производные» белков и пептидов являются модифицированными формами белков и пептидов. Такие модификации включают любые химические модификации и содержат одиночные или множественные замены, делеции и/или добавления каких-либо молекул, связанных с белком или пептидом, таких как углеводороды, липиды и/или белки или пептиды. В одном варианте осуществления «производные» белков или пептидов включают модифицированные аналоги, возникающие в результате гликозилирования, ацетилирования, фосфорилирования, амидирования, пальмитоилирования, миристиолирования, изопренилирования, липидирования, алкилирования, дериватизации, введения защитных/блокирующих групп, протеолитического расщепления или связывания с антителом или с другим клеточным лигандом. Термин «производное» также распространяется на все функциональные химические эквиваленты указанных белков и пептидов. Предпочтительно модифицированный пептид обладает повышенной стабильностью и/или повышенной иммуногенностью.
В одном варианте осуществления способы изобретения могут дополнительно включать (i) предотвращение «захвата» IFN рецептора внеклеточным IFN и/или (ii) ингибирование внутриклеточной IFN передачи сигнала. Это может быть достигнуто путем предоставления в клетку (i) агента, предотвращающего «захват» IFN рецептора внеклеточным IFN, и/или (ii) агента, ингибирующего внутриклеточный IFN сигнальный путь.
В одном варианте осуществления клетки подвергаются воздействию, для того, чтобы (i) предотвратить «захват» IFN рецептора внеклеточным IFN и/или (ii) ингибировать внутриклеточную IFN передачу сигнала до, одновременно с и/или после введения РНК, кодирующей пептид или белок, который должен экспрессироваться, или после первого введения (например, в случае повторных трансфекций) РНК. В одном варианте осуществления клетки подвергаются воздействию, для того, чтобы (i) предотвратить «захват» IFN рецептора внеклеточным IFN и/или (ii) ингибировать внутриклеточную IFN передачу сигнала после, предпочтительно сразу после введения РНК или первого введения (например, в случае повторных трансфекций) РНК.
Интерфероны являются важными цитокинами, для которых характерна противовирусная, антипролиферативная и иммуномодулирующая активность. Интерфероны могут быть сгруппированы в два типа. IFN-гамма является единственным интерфероном II типа; все другие являются интерферонами I типа. Интерфероны I типа и II типа различаются по структуре гена (ген интерферона II типа имеет три экзона; I типа - один), расположением на хромосоме (у человека ген интерферона II типа располагается на хромосоме-12; гены интерферонов I типа связаны между собой и располагаются хромосоме-9) и типами тканей, где они продуцируются (интерфероны I типа синтезируются повсеместно, II типа - лимфоцитами). Интерфероны I типа конкурентно ингибируют друг друга, связываясь с клеточными рецепторами, в то время как интерферон II типа имеет отдельный рецептор. Согласно изобретению термин «интерферон» или «IFN» предпочтительно относится к интерферонам I типа, в частности IFN-альфа и IFN-бета.
IFN вызывают экспрессию множества противовирусных генов, которые могут вмешиваться в цикл репликации вируса. Согласно изобретению термин «обладающий антивирусной активностью эффекторный белок» имеет отношение к группе белков, кодированных IFN-стимулируемыми генами (ISGs), транскрипция которых инициируется IFN типа I. Эти белки нацеливаются на различные вирусные компоненты и различные стадии цикла жизни вируса с целью устранить инвазию вирусов. «Обладающие антивирусной активностью эффекторные белки» вовлекаются в разные эффекторные пути, индивидуально блокируя транскрипцию вируса, разрушая вирусную РНК, ингибируя трансляцию и модифицируя функцию белков, чтобы контролировать все этапы репликации вируса. Такие белки включают 2′,5′-олигоаденилат-синтетазу (OAS), в частности 2′,5′-олигоаденилат-синтетазу 1 (OAS1), РНК-зависимую протеинкиназу R (PKR) и RNaseL. И PKR и OAS напрямую активируются dsРНК. Следовательно, dsРНК индуцирует экспрессию этих обладающих антивирусной активностью эффекторных белков и также является необходимой для их активации.
Согласно изобретению, термин «предотвращение «захвата» IFN рецептора внеклеточным IFN» имеет отношение к ингибированию, т.е. блокированию или уменьшению взаимодействия IFNs, в частности IFNs I типа, с их специфическими рецепторами, таким образом, ингибируя или уменьшая функцию IFN. «Захват» IFN рецептора внеклеточным IFN может быть предотвращен, например, путем предоставления связывающего агента для внеклеточного IFN. Те аспекты настоящего изобретения, которые вовлекают один или более белков или пептидов в предотвращение «захвата» IFN рецептора внеклеточным IFN, такие как белки или пептиды, раскрытые в этом документе, например, один или более связывающих агентов для внеклеточного IFN, могут включать предоставление нуклеиновых кислот, в частности РНК, кодирующей эти один или более белков или пептидов, в клетки, например, путем введения нуклеиновых кислот в клетки.
Например, B18R белок является кодируемым вирусом осповакцины рецептором интерферона типа I со специфичностью к мышиным, человеческим, кроличьим, свиным, крысиным и коровьим интерферонам I типа, который обладает сильной нейтрализующей активностью. B18R белок, кодированный B18R геном штамма Western Reserve вируса осповакцины. Гликопротеин 60-65 kD относится к рецепторам интерлейкина-1 и является членом суперсемейства иммуноглобулинов, в отличие от IFN-рецепторов другого I типа, которые относятся к семейству рецепторов цитокинов II класса. Белок B18R имеет высокую аффинность (KD, 174 pM) к человеческому IFN альфа. Среди вирусных модификаторов ответа хозяина белок B18R является единственным в своем роде, поскольку он существует как растворимый внеклеточный, а также поверхностноклеточный белок, обеспечивающий блокировку и аутокринных и паракринных функций IFN. Показано, что белок B18R ингибирует противовирусную активность IFN-альфа1, IFN-альфа2, IFN-альфа-8/1/8 и IFN-омега в клетках человека. Растворимый B18R белок является высокоэффективным в отношении нейтрализации интерферонов I типа, которые включают IFN-альфа, бета, дельта, каппа.
«Захват» IFN рецептора внеклеточным IFN, кроме того, может быть предотвращен, например, путем снижения уровня IFN, в частности внеклеточного IFN. В одном варианте осуществления «захват» IFN рецептора внеклеточным IFN предотвращается путем воспрепятствования экспрессии гена IFN. Например, специфическим ингибитором экспрессии IFN гена является протеиновый комплекс сериновой протеазы NS3/4A вируса гепатита C, который способен препятствовать и уменьшать IFN промоторную активность.
Согласно изобретению термин «внутриклеточная IFN передача сигнала» имеет отношение к событиям внутриклеточной передачи сигнала и эффекторным функциям, в частности противовирусным функциям, которые активируются при взаимодействии IFNs с их специфическими рецепторами, и включает функции белков, которые индуцируются IFN, в частности обладающими антивирусной активностью эффекторными белками. В частности, термин «внутриклеточная IFN передача сигнала» включает распространение сигнала и эффекторные функции, в частности противовирусные функции, проявляемые белками, которые являются частью PKR-зависимого пути, в частности PKR и eIF2-альфа, и/или OAS-зависимого пути, в частности OAS и RNaseL.
Термин «ингибирование внутриклеточной IFN передачи сигнала» имеет отношение к ингибированию или уменьшению внутриклеточной IFN передачи сигнала, которое может достигаться путем ингибирования экспрессии, активности или активации белков, участвующих во внутриклеточной IFN передаче сигнала, в частности белков, которые являются частью PKR-зависимого пути и/или OAS-зависимого пути. Например, многие вирусы имеют развитые механизмы для препятствования PKR и OAS/RNase L путям. Эти механизмы могут использоваться согласно изобретению для ингибирования внутриклеточной IFN передачи сигнала. Те аспекты настоящего изобретения, которые вовлекают один или более белков или пептидов в ингибирование внутриклеточной IFN передачи сигнала, такие как белки или пептиды, раскрытые в этом документе, например, один или более белков или пептидов, ингибирующих PKR-зависимый путь и/или OAS-зависимый путь, могут включать предоставление нуклеиновых кислот, в частности РНК, кодирующей эти один или более белков или пептидов, в клетки, например, путем введения нуклеиновых кислот в клетки.
Согласно изобретению PKR-зависимый путь может быть заингибирован агентом, ингибирующим или уменьшающим активность или активацию PKR, или агентом, дефосфорилирующим eIF2-альфа или предотвращающим его фосфорилирование, тем самым обрывая PKR-индуцированный сигнал. Например, внутриклеточная IFN передача сигнала может быть заингибирована согласно изобретению с помощью каких-либо вирусных защитных механизмов против PKR сигнального каскада. В этом отношении, изобретение предполагает использование дцРНК-ловушки (например, аденовирусной VAI RNA; вируса Эпштейна-Барр EBER; HIV TAR), соединений, вызывающих PKR деградацию (например, полиовирус 2Apro), соединений, ингибирующих активацию PKR, например, посредством «упрятывания» вирусной дцРНК (например, вирус осповакцины E3/E3L; реновирус сигма3; вирус гриппа NS1, вирус простого герпеса 1 типа (HSV-1) US11), соединений, блокирующих димеризацию (например, вирус гриппа p58IPK; вирус гепатита C NS5A), псевдосубстратов (например, вирус осповакцины K3/K3L; HIV Tat) или дефосфорилирования субстрата (например, вирус простого герпеса ICP34.5). Вирус осповакцины E3 представляет собой 25 kDa дцРНК-связывающий белок (кодированный геном E3L), который связывается и блокирует дцРНК, чтобы предотвратить активацию PKR и OAS. E3 может связываться непосредственно с PKR и ингибировать его активность, что приводит к уменьшенному фосфорилированию eIF2-альфа. Ген K3L вируса осповакцины кодирует 10.5 kDa гомолог субъединицы eIF2-альфа, которая действует как неподдающийся фосфорилированию псевдосубстрат PKR и конкурентно ингибирует фосфорилирование eIF2-альфа. Вирус осповакцины C7/C7L ингибирует фосфорилирование eIF2-альфа. Белок ICP34.5 от HSV-1 функционирует как регуляторная субъединица клеточной PP1 фосфатазы, направляя ее на то, чтобы дефосфорилировать eIF2-альфа, тем самым прекращая PKR-индуцированный сигнал. Белки мышиного цитомегаловируса (MCMV) m142 и m143 характеризуются как дцРНК связывающие белки, которые ингибируют PKR активацию, фосфорилирование фактора инициации трансляции eIF2 и выключают последующий синтез белка.
РНК-ловушка (decoy RNA) является РНК-псевдосубстратом, который имеет сходную структуру с РНК- субстратом фермента, для того, чтобы фермент связался с псевдосубстратом, а не с настоящим субстратом, таким образом блокируя активность фермента.
Согласно настоящему изобретению термин «уменьшение активности РНК-зависимой протеинкиназы (PKR)» имеет отношение к воздействиям, которые приводят к более низкой степени гомодимеризации PKR, к более низкой степени аутофосфорилирования PKR и/или к более низкой степени фосфорилирования мишеней, которые являются субстратами PKR, такими как eIF2-альфа, по сравнению с нормальной ситуацией, в частности нормальной ситуацией в клетке, при этом активность PKR не уменьшается/не уменьшается человеком. Предпочтительно, указанный термин включает все воздействия, которые приводят к более низкой степени аутофосфорилирования PKR и/или к более низкой степени фосфорилирования мишеней, которые являются субстратами PKR.
В одном варианте осуществления уменьшение активности РНК-зависимой протеинкиназы (PKR) в клетке включает обработку клетки ингибитором экспрессии и/или активности PKR. Согласно изобретению фраза «ингибировать экспрессию и/или активность» включает полное или преимущественно полное ингибирование экспрессии и/или активности и уменьшение экспрессии и/или активности.
В одном варианте осуществления указанный PKR ингибитор направлен на PKR белок и предпочтительно является специфическим для PKR. PKR может быть заингибирована разными путями, например, посредством ингибирования PKR аутофосфорилирования и/или димеризации, предоставления PKR псевдо-активатора или предоставления PKR псевдосубстрата. PKR ингибитор может быть агентом, вовлеченным в механизм вирусной защиты, как обсуждалось выше. Например, вирус осповакцины E3L кодирует дцРНК-связывающий белок, который ингибирует PKR в инфицированных вирусом клетках, предположительно путем секвестирования дцРНК активаторов. K3, также кодированный вирусом осповакцины, функционирует как псевдосубстрат-ингибитор путем связывания с PKR. Таким образом, предоставление вируса осповакцины E3L может приводить к ингибированию PKR. Предоставление РНК VAI аденовируса, HIV Tat или РНК вируса Эпштейна-Барр EBER1 может приводить к PKR псевдо-активации. Таким образом, например, все вирусные факторы, т.е. ингибиторы вирусного происхождения, блокирующие PKR активность, такие как описанные в этом документе, могут использоваться для уменьшения активности PKR.
В одном варианте осуществления PKR ингибитор является химическим ингибитором. Предпочтительно, PKR ингибитор является ингибитором РНК-индуцированного PKR аутофосфорилирования. Предпочтительно, PKR ингибитор является направленным на ATP-связывающий участок ингибитором PKR.
В одном варианте осуществления PKR ингибитор представляет собой 6,8-дигидро-8-(1H-имидазол-5-илметилен-7H-пирроло[2,3-g]бензотиазол-7-он.
В одном варианте осуществления PKR ингибитор представляет собой 2-аминопурин.
В следующем варианте осуществления ингибитором активности PKR является антитело, специфически связывающееся с PKR. Связывание антитела с PKR может препятствовать функционированию PKR, например, путем ингибирования связывающей активности или каталитической активности.
В одном варианте осуществления предполагается уменьшать активность PKR в клетке путем обработки клетки одним или более ингибиторами вирусного происхождения, такими как вирус осповакцины E3 и/или K3, а также обработки клетки одним или более химическими PKR ингибиторами, такими как 6,8-дигидро-8-(1H-имидазол-5-илметилен)-7H-пирроло[2,3-g]бензотиазол-7-он и/или 2-аминопурин.
Согласно изобретению OAS-зависимый путь может быть заингибирован агентом, ингибирующим или уменьшающим активность или активацию OAS и/или RNaseL. Например, вирус осповакцины E3 представляет собой 25 kDa дцРНК-связывающий белок (кодированный геном E3L), который связывает и блокирует дцРНК, чтобы предотвратить активацию OAS.
Согласно настоящему изобретению термин «уменьшение активности OAS» предпочтительно имеет отношение к воздействиям, приводящим к более низкой степени продуцирования 2′,5′-олигоаденилатов и, таким образом, активации RNaseL.
В одном варианте осуществления уменьшение активности OAS и/или RNaseL в клетке включает обработку клетки ингибитором экспрессии и/или активности OAS и/или RNaseL. Согласно изобретению фраза «ингибировать экспрессию и/или активность» включает полное или практически полное ингибирование экспрессии и/или активности и уменьшение экспрессии и/или активности.
В одном варианте осуществления ингибирование экспрессии PKR, OAS или RNaseL, в дальнейшем под названием «целевой белок», может происходить путем ингибирования продуцирования или уменьшения уровня транскрипта, т.е. мРНК, кодирующей целевой белок, например, путем ингибирования транскрипции или индуцирования деградации транскрипта, и/или путем ингибирования продуцирования целевого белка, например, путем ингибирования трансляции транскрипта, кодирующего целевой белок. В одном варианте осуществления указанный ингибитор является специфическим для нуклеиновой кислоты, кодирующей целевой белок. В конкретном варианте осуществления ингибитор экспрессии целевого белка является ингибитором нуклеиновой кислоты (например, антисмысловой молекулой, рибозимом, iРНК, siРНК или ДНК, кодирующей то же самое), селективно гибридизирующимся с и являющимся специфическим для нуклеиновой кислоты, кодирующей целевой белок, таким образом ингибирующим (например, уменьшающим) его транскрипцию и/или трансляцию.
В одном варианте осуществления предотвращение «захвата» IFN рецептора внеклеточным IFN ингибирует аутокринные и/или паракринные функции IFN. В одном варианте осуществления предотвращение «захвата» IFN рецептора внеклеточным IFN включает предоставление связывающего агента для внеклеточного IFN, такого как вирусный связывающий агент для внеклеточного IFN. В одном варианте осуществления вирусный связывающий агент для внеклеточного IFN является вирусным рецептором интерферона. В одном варианте осуществления вирусный связывающий агент для внеклеточного IFN является вирусом осповакцины B18R. В одном варианте осуществления вирусный связывающий агент для внеклеточного IFN предоставляется в клетку в форме нуклеиновой кислоты, кодирующей связывающий агент, при этом нуклеиновая кислота предпочтительно является РНК.
В одном варианте осуществления ингибирование внутриклеточной IFN передачи сигнала включает ингибирование одного или более IFN-индуцируемых обладающих антивирусной активностью эффекторных белков. В одном варианте осуществления IFN-индуцируемый обладающий антивирусной активностью эффекторный белок выбирают из группы, состоящей из РНК-зависимой протеинкиназы (PKR), 2′,5′-олигоаденилат синтетазы (OAS) и RNaseL. В одном варианте осуществления ингибирование внутриклеточной IFN передачи сигнала включает ингибирование PKR-зависимого пути и/или OAS-зависимого пути. В одном варианте осуществления ингибирование PKR-зависимого пути включает ингибирование eIF2-альфа фосфорилирования. В одном варианте осуществления ингибирование eIF2-альфа фосфорилирования включает ингибирование PKR и/или предоставление псевдосубстрата, имитирующего eIF2-альфа. В одном варианте осуществления псевдосубстрат, имитирующий eIF2-альфа, является вирусным псевдосубстратом, имитирующим eIF2-альфа. В одном варианте осуществления вирусный псевдосубстрат, имитирующий eIF2-альфа, является вирусом осповакцины K3. В одном варианте осуществления вирусный псевдосубстрат, имитирующий eIF2-альфа, предоставляется в клетку в форме нуклеиновой кислоты, кодирующей вирусный псевдосубстрат, при этом нуклеиновая кислота является предпочтительно РНК. В одном варианте осуществления ингибирование PKR включает обработку клетки, по меньшей мере, одним PKR ингибитором. В одном варианте осуществления PKR ингибитор ингибирует РНК-индуцированное PKR аутофосфорилирование. В одном варианте осуществления PKR ингибитор является направленным на ATP-связывающий участок ингибитором PKR. В одном варианте осуществления PKR ингибитор является соединением имидазоло-оксиндола. В одном варианте осуществления PKR ингибитор представляет собой 6,8-дигидро-8-(1H-имидазол-5-илметилен)-7H-пирроло[2,3-g]бензотиазол-7-он и/или 2-аминопурин. В одном варианте осуществления PKR ингибитор представляет собой вирусный ингибитор PKR. В одном варианте осуществления вирусный ингибитор PKR представляет собой вирус осповакцины E3. В одном варианте осуществления вирусный ингибитор PKR предоставляется в клетку в форме нуклеиновой кислоты, кодирующей ингибитор, при этом нуклеиновая кислота является предпочтительно РНК. В одном варианте осуществления ингибирование PKR включает экспрессию «молчащего гена» PKR. В одном варианте осуществления ингибирование OAS-зависимого пути включает ингибирование активации RNaseL. В одном варианте осуществления ингибирование OAS-зависимого пути включает ингибирование OAS. В одном варианте осуществления ингибирование OAS включает обработку клетки, по меньшей мере, одним OAS ингибитором. В одном варианте осуществления OAS ингибитор представляет собой вирусный ингибитор OAS. В одном варианте осуществления вирусный ингибитор OAS является вирусом осповакцины E3. В одном варианте осуществления вирусный ингибитор OAS предоставляется в клетку в форме нуклеиновой кислоты, кодирующей ингибитор.
В одном варианте осуществления стадии (i) предотвращения «захвата» IFN рецептора внеклеточным IFN и/или (ii) ингибирования внутриклеточной IFN передачи сигнала включают обработку клетки (i) вирусом осповакцины B18R и/или (ii) вирусом осповакцины E3 или вирусом осповакцины K3, или и тем и другим. В одном варианте осуществления вирус осповакцины B18R и/или вирус осповакцины E3 и/или вирус осповакцины K3 предоставляется в клетку в форме нуклеиновой кислоты, кодирующей вирус осповакцины B18R и/или вирус осповакцины E3 и/или вирус осповакцины K3, или на одной и той же или на двух или более различных молекулах нуклеиновой кислоты , при этом нуклеиновая кислота предпочтительно представляет собой РНК, которая предпочтительно вводится в клетку вместе с РНК, которая должна экспрессироваться в клетке и необязательно РНК, кодирующую фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus.
Белок уклонения вируса NSs (N) Toscana virus может заменить EKB (E3, K3, B18R) для успешного ингибирования IFN ответа. Соответственно, способы изобретения, в одном варианте осуществления не включают предоставление в клетку (i) агента, предотвращающего «захват» IFN рецептора внеклеточным IFN, и/или (ii) агента, ингибирующего внутриклеточную IFN передачу сигнала. Соответственно, способы изобретения, в одном варианте осуществления не включают предоставление в клетку вируса осповакцины B18R и/или вируса осповакцины E3 и/или вируса осповакцины K3 и предпочтительно не включают предоставление в клетку любого из числа вируса осповакцины B18R, вируса осповакцины E3 и вируса осповакцины K3.
Следует понимать, что согласно изобретению вместо IFN ингибитора, упомянутого выше (включая фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus), могут предоставляться нуклеиновые кислоты, кодирующие белки. Фраза «предоставляется в форме нуклеиновой кислоты», использованная в описании, обеспечивает объяснение такой возможности. Например, клетки могут быть трансфицированы нуклеиновой кислотой, в частности РНК, кодирующей данный белок, и нуклеиновая кислота может экспрессироваться в клетках, для того, чтобы продуцировать белок.
Нуклеиновая кислота согласно изобретению предпочтительно является дезоксирибонуклеиновой кислотой (ДНК) или рибонуклеиновой кислотой (РНК), более предпочтительно РНК, наиболее предпочтительно in vitro транскрибируемой РНК (IVT РНК). Нуклеиновые кислоты согласно изобретению включают геномную ДНК, кДНК, мРНК, произведенные рекомбинантным путем или синтезированные химическим путем молекулы. Согласно изобретению, нуклеиновая кислота может присутствовать в виде одноцепочечной или двухцепочечной и линейной или ковалентно замкнутой кольцевой молекулы. Нуклеиновая кислота может согласно изобретению быть изолирована. Термин «изолированная нуклеиновая кислота» означает, согласно изобретению, что нуклеиновая кислота (i) была амплифицирована in vitro, например, посредством полимеразной цепной реакции (PCR), (ii) была произведена рекомбинантным путем при помощи клонирования, (iii) была очищена, например, путем расщепления и отделения с помощью гель-электрофореза, или (iv) была синтезирована, например, с помощью химического синтеза. Нуклеиновая кислота может применяться для введения в клетки, т.е. трансфекции клеток, в частности, в форме РНК, которая может быть получена путем in vitro транскрипции с ДНК матрицы. Более того, РНК может быть модифицирована до применения путем стабилизации последовательностей, кэппинга и полиаденилирования.
В качестве нуклеиновой кислоты, в частности РНК, для экспрессии более чем одного пептида или белка, может использоваться или нуклеиновая кислота такого типа, в которой разные пептиды или белки кодируются открытыми рамками считывания (ORFs), присутствующими в разных молекулах нуклеиновых кислот, или нуклеиновая кислота такого типа, в которой разные пептиды или белки кодируются открытыми рамками считывания (ORFs), присутствующими в одной и той же молекуле нуклеиновой кислоты. Соответственно, РНК, кодирующая более чем один пептид или белок, такая как РНК, кодирующая более чем один перепрограммирующий фактор, может иметь отношение к смеси разных РНК молекул, содержащих разные ORFs, кодирующие разные пептиды или белки, или к одной РНК молекуле, содержащей разные ORFs, кодирующие разные пептиды или белки.
В контексте настоящего изобретения термин «РНК» имеет отношение к молекуле, которая содержит остатки рибонуклеотидов и предпочтительно состоит полностью или практически состоит из остатков рибонуклеотидов. Термин «рибонуклеотид» имеет отношение к нуклеотиду с гидроксильной группой в 2'-положении β-D-рибофуранозильной группы. Термин «РНК» включает двухцепочечную РНК, одноцепочечную РНК, изолированную РНК, такую как частично или полностью очищенная РНК, практически чистую РНК, синтетическую РНК и рекомбинантно созданную РНК, такую как модифицированная РНК, которая отличается от РНК природного происхождения добавлением, делецией, заменой и/или изменением одного или более нуклеотидов. Такие изменения могут включать добавление ненуклеотидного материала, например, к концу(ам) РНК или внутрь, например к одному или более нуклеотидам РНК. Нуклеотиды в молекулах РНК также могут содержать нестандартные нуклеотиды, такие как неприродные нуклеотиды или синтезированные химическим способом нуклеотиды или дезоксинуклеотиды. Эти измененные РНК могут называться аналогами, в частности, аналогами РНК, существующих в природе. Согласно изобретению РНК включает мРНК.
Термин «мРНК» означает «матричная РНК» и имеет отношение к транскрипту, который создается с помощью ДНК матрицы и кодирует пептид или белок. Как правило, мРНК содержит 5'-UTR, кодирующий белок участок, 3'-UTR и поли(A) последовательность. мРНК может быть получена с помощью транскрипции in vitro с ДНК матрицы. Метод транскрипции in vitro известен специалистам. Например, существует целый ряд коммерчески доступных наборов для транскрипции in vitro.
Согласно изобретению, РНК, кодирующая пептид или белок (также называемый в описании пептид или белок, представляющий интерес) например, РНК, кодирующая один или более факторов перепрограммирования, может быть мРНК, кодирующей пептид или белок, или самореплицирующейся РНК, такой как РНК репликон, кодирующий пептид или белок. Более того, РНК, кодирующая фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, для предоставления в клетки согласно изобретению, может быть мРНК, кодирующей фактор вирусного происхождения, или самореплицирующейся РНК, такой как РНК репликон, кодирующий фактор вирусного происхождения. В одном варианте осуществления изобретения РНК, кодирующая представляющий интерес пептид или белок, которая является мРНК, кодирующей интересующий пептид или белок, котрансфицируется вместе с РНК, кодирующей фактор вирусного происхождения, которая является мРНК, кодирующей фактор вирусного происхождения. В одном варианте осуществления изобретения РНК, кодирующая представляющий интерес пептид или белок, которая является РНК репликоном, кодирующим интересующий пептид или белок, котрансфицируется вместе с РНК, кодирующей фактор вирусного происхождения, которая является мРНК, кодирующей фактор вирусного происхождения. Если репликон РНК представляет собой транс-репликон РНК, также может котрансфицироваться РНК, например, мРНК, кодирующая альфавирусный неструктурный белок (также называемый в описании РНК конструкцией для экспрессии функционального альфавирусного неструктурного белка). «Котрансфекция» относится к трансфекции разных нуклеиновых кислот или в один и тот же момент времени или в разные моменты времени.
В одном варианте осуществления настоящего изобретения РНК является самореплицирующейся РНК, такой как одноцепочечная самореплицирующаяся РНК. В одном варианте осуществления самореплицирующаяся РНК является одноцепочечной положительно-полярной РНК. В одном варианте осуществления самореплицирующаяся РНК является вирусной РНК или РНК, происходящей от вирусной РНК. В одном варианте осуществления самореплицирующаяся РНК является альфавирусной геномной РНК или происходит от альфавирусной геномной РНК. В одном варианте осуществления самореплицирующаяся РНК является вектором экспрессии вирусных генов. В одном варианте осуществления вирус является вирусом леса Семлики. В одном варианте осуществления самореплицирующаяся РНК содержит один или более трансгенов. В одном варианте осуществления если РНК является вирусной РНК или происходит от вирусной РНК, трансгены могут частично или полностью заменить вирусные последовательности, такие как вирусные последовательности, кодирующие структурные белки. В одном варианте осуществления самореплицирующаяся РНК является in vitro транскрибируемой РНК.
Альфавирусы являются типичными представителями положительно-цепочечных РНК вирусов. Геном альфавирусов кодирует неструктурные белки (участвующие в транскрипции, модификации и репликация вирусной РНК и в модификации белков) и структурные белки (образующие вирусную частицу). В большинстве случаев в геноме имеется две открытые рамки считывания (ORFs). Четыре неструктурных белка (nsP1-nsP4), как правило, кодируются вместе первой ORF, начиная около 5′ конца генома, тогда как альфавирусные структурные белки кодируются вместе второй ORF, которая обнаружена ниже первой ORF и располагается около 3' конца генома. В большинстве случае первая ORF больше, чем вторая ORF, отношение составляет примерно 2:1. В клетках, инфицированных альфавирусом, только нуклеиновокислотная последовательность, кодирующая неструктурные белки, транслируется геномной РНК, тогда как генетическая информация, кодирующая структурные белки, является транслируемой с субгеномного транскрипта, который представляет собой молекулу РНК, которая напоминает эукариотическую матричную РНК (мРНК; Gould et al., 2010, Antiviral Res., vol. 87 pp. 111-124). После инфицирования, т.е. на ранних стадиях жизненного цикла вируса, (+) цепочечная геномная РНК напрямую действует подобно матричной РНК для трансляции открытой рамки считывания, кодирующей неструктурный поли-белок (nsP1234). У некоторых альфавирусов имеется опал стоп-кодон между кодирующими последовательностями nsP3 и nsP4: полибелок P123, содержащий nsP1, nsP2 и nsP3, продуцируется, когда трансляция прекращается на опал стоп-кодоне, и полибелок P1234, содержащий кроме того nsP4, продуцируется после сквозного прочитывания этого опал кодона (Strauss & Strauss, Microbiol. Rev., 1994, vol. 58, pp. 491-562; Rupp et al., 2015, J. Gen. Virology, vol. 96, pp. 2483-2500). nsP1234 автопротеолитически расщепляется на фрагменты nsP123 и nsP4. Полипептиды nsP123 и nsP4 соединяются с образованием (-) цепочечного репликазного комплекса, который транскрибирует (-)цепочечную РНК, используя (+)цепочечную геномную РНК в качестве матрицы. Как правило, на более поздних стадиях nsP123 фрагмент полностью расщепляется на отдельные белки nsP1, nsP2 и nsP3 (Shirako & Strauss, 1994, J. Virol., vol. 68, pp. 1874-1885). Все четыре белка образуют (+)цепочечный репликазный комплекс, который синтезирует новые (+)цепочечные геномы, используя (-)цепочечный комплемент геномной РНК в качестве матрицы (Kim et al., 2004, Virology, vol. 323, pp. 153-163, Vasiljeva et al., 2003, J. Biol. Chem. vol. 278, pp. 41636-41645).
Альфавирусные структурные белки (коровый нуклеокапсидный белок C, белок оболочки E2 и белок оболочки E1, все составляющие элементы вирусной частицы) в большинстве случаев кодируются одной открытой рамкой считывания под контролем субгеномного промотора (Strauss & Strauss, Microbiol. Rev., 1994, vol. 58, pp. 491-562). Субгеномный промотор распознается альфавирусными неструктурными белками, действующими в cis. В частности, альфавирусная репликаза синтезирует (+)цепочечный субгеномный транскрипт, используя (-)цепочечный комплемент геномной РНК в качестве матрицы. (+)цепочечный субгеномный транскрипт кодирует альфавирусные структурные белки (Kim et al., 2004, Virology, vol. 323, pp. 153-163, Vasiljeva et al., 2003, J. Biol. Chem. vol. 278, pp. 41636-41645). Субгеномный РНК транскрипт служит в качестве матрицы для трансляции открытой рамки считывания, кодирующей структурные белки как один поли-белок, и поли-белок расщепляется, чтобы дать структурные белки. На поздней стадии альфавирусной инфекции в клетке-хозяине сигнал упаковки, который располагается в пределах кодирующей последовательности nsP2 обеспечивает селективную упаковку геномной РНК в почкующиеся вирионы, упакованные структурными белками (White et al., 1998, J. Virol., vol. 72, pp. 4320-4326).
В вариантах осуществления изобретения самореплицирующаяся РНК может быть РНК репликоном, который является цис-репликоном или транс-репликоном. Например, открытая рамка считывания, кодирующая альфавирусные структурные белки, может быть заменена открытой рамкой считывания, кодирующей представляющий интерес белок. Системы trans-репликации на основе альфавирусов основаны на элементах альфавирусной нуклеотидной последовательности на двух отдельных молекулах нуклеиновой кислоты: одна молекула нуклеиновой кислоты кодирует вирусную репликазу (в основном как поли-белок nsP1234), а другая молекула нуклеиновой кислоты может реплицироваться указанной репликазой в trans (отсюда вытекает обозначение системы trans-репликации). trans-репликация требует присутствия обеих этих молекул нуклеиновой кислоты в данной клетке-хозяине. Молекула нуклеиновой кислоты, способная реплицироваться репликазой в trans, должна содержать некоторые элементы альфавирусной последовательности, чтобы обеспечить распознавание и РНК синтез при помощи альфавирусной репликазы.
Согласно настоящему изобретению “РНК репликация” как правило имеет отношение к молекуле РНК, синтезированной на основе нуклеотидной последовательности данной молекулы РНК (молекулы РНК матрицы). РНК молекула, которая синтезируется может быть, например, идентичной или комплементарной к молекуле РНК матрицы. В общем, репликация РНК может происходить посредством синтеза ДНК посредника, или может происходить прямо путем РНК-зависимой РНК репликации, опосредованной РНК-зависимой РНК полимеразой (RdRP). В случае альфавирусов РНК репликация не происходит через ДНК посредник, но опосредуется РНК-зависимой РНК полимеразой (RdRP): матричная РНК цепь (первая РНК цепь) - или ее часть - служит в качестве матрицы для синтеза второй РНК цепи, которая является комплементарной с первой РНК цепью или ее частью. Вторая РНК цепь - или ее часть - в свою очередь может необязательно служить в качестве матрицы для синтеза третьей РНК цепи, которая является комплементарной со второй РНК цепью или с ее частью. Вследствие этого, третья РНК цепь является идентичной с первой РНК цепью или ее частью. Таким образом, РНК-зависимая РНК полимераза способна прямо синтезировать комплементарную РНК цепь матрицы, и непрямо синтезировать идентичную РНК цепь (через посредство комплементарной промежуточной цепи).
Нуклеиновокислотная конструкция, которая может быть реплицирована репликазой, предпочтительно альфавирусной репликазой, называется репликоном. Согласно изобретению термин «репликон» определяет РНК молекулу, которая может реплицироваться РНК-зависимой РНК полимеразой, давая - без ДНК посредника - одну или множество идентичных или практически идентичных копий РНК репликона. «Без ДНК посредника» означает, что никакая копия дезокирибонуклеиновой кислоты (ДНК) или комплемент репликона не формируется в процессе образования копий РНК репликона, и/или что никакая молекула дезокирибонуклеиновой кислоты (ДНК) не используется в качестве матрицы в процессе образования копий РНК репликона, или ее комплемента. Функция репликазы обычно обеспечивается функциональным альфавирусным неструктурным белком.
РНК репликон изобретения предпочтительно содержит 5' последовательность узнавания репликации и 3' последовательность узнавания репликации. Последовательность узнавания репликации является нуклеиновокислотной последовательностью, которая может распознаваться функциональным альфавирусным неструктурным белком.
В одном варианте осуществления 5' последовательность узнавания репликации и 3' последовательность узнавания репликации способны направлять репликацию РНК репликона согласно настоящему изобретению в присутствии функционального альфавирусного неструктурного белка. Таким образом, когда эти последовательности распознавания присутствуют отдельно или предпочтительно вместе, они направляют репликацию РНК репликона в присутствии функционального альфавирусного неструктурного белка.
Предпочтительно, что функциональный альфавирусный неструктурный белок предоставляется в цис (кодированный как интересующий белок открытой рамкой считывания на репликоне) или в транс (кодированный как интересующий белок открытой рамкой считывания на отдельной репликазной конструкции), которая способна распознавать и 5' последовательность узнавания репликации и 3' последовательность узнавания репликации репликона.
РНК репликон согласно настоящему изобретению предпочтительно является одноцепочечной молекулой РНК. РНК репликон согласно настоящему изобретению как правило является (+)цепочечной молекулой РНК. В одном варианте осуществления РНК репликон настоящего изобретения является изолированной молекулой нуклеиновой кислоты.
Согласно изобретению РНК репликон может происходить из альфавируса, выбранного из группы, состоящей из перечисленного далее: Barmah Forest вирусный комплекс (содержащий вирус Barmah Forest); комплекс восточного энцефалита лошадей (содержащий семь антигенных типов вируса восточного лошадиного энцефалита); вирусный комплекс Мидделбург (содержащий Мидделбург вирус); Ndumu вирусный комплекс (содержащий Ndumu вирус); комплекс вируса леса Семлики (содержащий Bebaru вирус, чикунгунья вирус, Mayaro вирус и его подтип Una вирус, вирус О'Нъонг-нъонг и его подтип Igbo-Ora вирус, Росс-Ривер вирус и его подтипы Bebaru вирус, Getah вирус, Sagiyama вирус, вирус леса Семлики и его подтип Me Tri вирус); комплекс Венесуэльского конского энцефалита (содержащий Cabassou вирус, Everglades вирус, Mosso das Pedras вирус, Mucambo вирус, Paramana вирус, Pixuna вирус, Rio Negro вирус, Trocara вирус и его подтип Bijou Bridge вирус, вирус венесуэльского энцефалита лошадей); комплекс западного энцефалита лошадей (содержащий Aura вирус, Babanki вирус, Kyzylagach вирус, вирус Синдбис, Ockelbo вирус, Whataroa вирус, Buggy Creek вирус, Fort Morgan вирус, Highlands J вирус, вирус западного энцефалита лошадей); и некоторые неклассифицированные вирусы, включая вирус панкреатической болезни Salmon; вирус нарколептической болезни; вирус южного морского слона; Tonate вирус. Более предпочтительно альфавирус выбирают из группы, состоящей из комплекса вируса леса Семлики (содержащего вирусные типы, как указано выше, включая вирус леса Семлики), комплекса западного энцефалита лошадей (содержащего вирусные типы как указано выше, включая вирус Синдбис), вируса восточного энцефалита лошадей (содержащего вирусные типы как указано выше), комплекса Венесуэльского конского энцефалита (содержащего вирусные типы как указано выше, включая вирус Венесуэльского конского энцефалита). В следующем предпочтительном варианте осуществления альфавирус представляет собой вирус леса Семлики. В альтернативном дополнительном предпочтительном варианте осуществления вирус представляет собой вирус Синдбис. В альтернативном дополнительном предпочтительном варианте осуществления альфавирус представляет собой вирус венесуэльского энцефалита лошадей.
РНК молекулы согласно изобретению необязательно могут характеризоваться дополнительными свойствами, например, 5'-кэпом, 5'-UTR, 3'-UTR, поли(A) последовательностью и/или адаптацией частоты использования кодона. Подробности описаны далее.
В некоторых вариантах осуществления, РНК (мРНК и/или репликон РНК) согласно настоящему изобретению содержит 5'-кэп.
Термины «5'-кэп», «кэп», «5'-кэп структура», «кэп структура» используются синонимично, для обозначения динуклеотида, обнаруженного на 5' конце некоторых эукариотических первичных транскриптов, таких как предшественник матричной РНК. 5'-кэп представляет собой структуру, в которой (необязательно модифицированный) гуанозин соединяется с первым нуклеотидом мРНК молекулы посредством 5' - 5' трифосфатной связи (или модифицированной трифосфатной связи в случае определенных кэп-аналогов). Термины могут относиться к обычному кэпу или к аналогу кэпа.
«РНК, содержащая 5'-кэп» или «РНК, которая предоставляется с 5'-кэпом» или «РНК, модифицированная 5'-кэпом» или «кэпированная РНК» имеет отношение к РНК, содержащей 5'-кэп. Например, предоставление РНК с 5'-кэпом может быть обеспечено при помощи in vitro транскрипции ДНК матрицы в присутствии указанного 5'-кэпа, при этом указанный 5'-кэп котранскрипционно включается в образующуюся РНК цепь, или РНК может быть образована, например, путем in vitro транскрипции, и 5'-кэп может присоединяться к РНК пост-транскрипционно с использованием кэпирующих ферментов, например, кэпирующих ферментов вируса осповакцины. В кэпированной РНК 3' положение первого основания (кэпированной) РНК молекулы соединено с 5' положением следующего основания РНК молекулы («второе основание») посредством фосфодиэфирной связи.
Присутствие кэпа на молекуле РНК является категорически предпочтительным, если трансляции нуклеиновокислотной последовательности, кодирующей белок на ранних стадиях после введения соответствующей РНК в клетки-хозяева или в организм-хозяина, является желательной. Например, наличие кэпа обеспечивает, что интересующий ген, кодированный РНК, эффективно транслируется на ранних стадиях после введения соответствующей РНК в клетки-хозяева. «Ранние стадии» обычно означает в течение первого 1 часа, или в пределах первых двух часов, или в пределах первых трех часов после введения РНК.
Присутствие кэпа на РНК репликоне также является предпочтительным, если желательно, чтобы трансляция происходила при отсутствии функциональной репликазы, или в том случае, когда только незначительные уровни репликазы присутствуют в клетке-хозяине. Например, даже если молекула нуклеиновой кислоты, кодирующая репликазу, вводится в клетку-хозяина, на ранних стадиях после введения уровни репликазы будут в большинстве случаев минимальными. Согласно изобретению предпочтительно, что РНК конструкция для экспрессии функционального альфавирусного неструктурного белка содержит 5'-кэп.
В частности, когда РНК репликон согласно настоящему изобретению не используется или предоставляется вместе со второй молекулой нуклеиновой кислоты (например, мРНК), которая кодирует функциональный альфавирусный неструктурный белок, предпочтительно, что РНК репликон содержит 5'-кэп. Независимо, РНК репликон также может содержать 5'-кэп, даже когда он используется или предоставляется вместе со второй молекулой нуклеиновой кислоты, которая кодирует функциональный альфавирусный неструктурный белок.
Термин «традиционный 5'-кэп» относится к 5'-кэпу природного происхождения, предпочтительно к кэпу 7-метилгуанозин. В кэпе 7-метилгуанозин гуанозин кэпа представляет собой модифицированный гуанозин, при этом модификация заключается в метилировании в 7-положении.
В контексте настоящего изобретения термин «аналог 5'-кэпа” относится к молекулярной структуре, которая имеет сходство с традиционным 5'-кэпом, но модифицируется, чтобы обладать способностью стабилизировать РНК в случае прикрепления к ней, предпочтительно in vivo и/или в клетке. Аналог кэпа не является традиционным 5'-кэпом.
В случае эукариотической мРНК, как обычно описывается, мРНК 5'-кэп вовлекается в эффективную трансляцию мРНК: в общем, у эукариот трансляция инициируется только на 5' конце молекулы матричной РНК (мРНК), за исключением случаев, когда присутствует внутренний сайт связывания рибосомы (IRES). Эукариотические клетки способны обеспечивать РНК с 5'-кэпом в ходе транскрипции в ядре: вновь синтезированные мРНК обычно модифицируются с помощью 5'-кэп структуры, например, когда транскрипт достигает длины от 20 до 30 нуклеотидов. Во-первых, 5' концевой нуклеотид pppN (ppp обозначает трифосфат; N обозначает любой нуклеозид) превращается в клетке в 5' GpppN при помощи кэпирующего фермента, обладающего РНК 5'-трифосфатазной и гуанилилтрансферазной активностями. GpppN впоследствии может метилироваться в клетке при помощи второго фермента с (гуанин-7)-метилтрансферазной активностью с образованием моно-метилированного m7GpppN кэпа. В одном варианте осуществления 5'-кэп, использованный в настоящем изобретении, является природным 5'-кэпом.
В настоящем изобретении природный 5'-кэп динуклеотид обычно выбирают из группы, состоящей из неметилированного кэп-динуклеотида (G(5')ppp(5')N; также называемого GpppN) и метилированного кэп-динуклеотида ((m7G(5')ppp(5')N; также называемого m7GpppN). m7GpppN (в котором N представляет собой G) представлен следующей формулой:
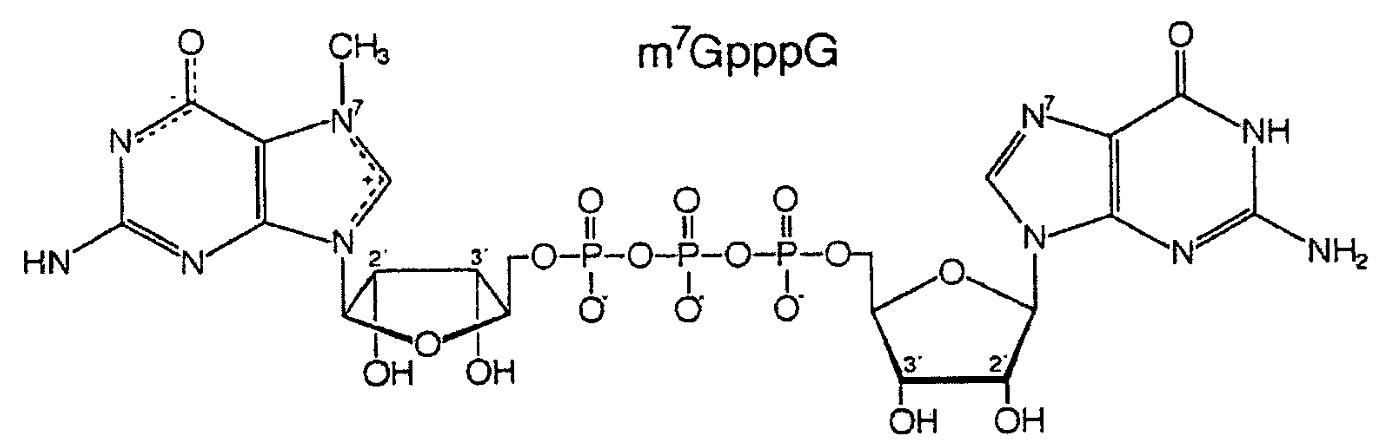
Кэпированная РНК настоящего изобретения может быть получена in vitro, и следовательно, не зависит от механизма кэпирования в клетке-хозяине. Наиболее часто используемый способ получения кэпированных РНК in vitro заключается в том, чтобы транскрибировать ДНК матрицу с помощью или бактериальной РНК полимеразы или РНК полимеразы бактериофага в присутствии всех четырех рибонуклеозид трифосфатов и кэп-динуклеотида, такого как m7G(5')ppp(5')G (также называемого m7GpppG). РНК полимераза инициирует транскрипцию путем нуклеофильной атаки 3'-OH гуанозинового фрагмента m7GpppG на α-фосфате следующего собранного нуклеозид трифосфата (pppN), давая в результате промежуточный m7GpppGpN (в котором N является вторым основанием молекулы РНК). Образование альтернативного GTP-инициированного продукта pppGpN подавляется установлением молярного соотношения кэпа к GTP между 5 и 10 в ходе in vitro транскрипции.
В предпочтительных вариантах осуществления настоящего изобретения 5'-кэп (если имеется) представляет собой аналог 5'-кэпа. Эти варианты осуществления являются особенно подходящими в том случае, если РНК получается путем in vitro транскрипции, например, является in vitro транскрибированной РНК (IVT-РНК). Аналоги кэпа, как было описано первоначально, облегчают задачу крупномасштабного синтеза РНК транскриптов методом in vitro транскрипции.
Что касается матричной РНК, в принципе на сегодняшний день описаны некоторые аналоги кэпа (синтетические кэпы) и все они могут использоваться в контексте настоящего изобретения. В идеальном варианте выбирают аналог кэпа, который ассоциируется с более высокой эффективностью трансляции и/или повышенной устойчивостью к деградации in vivo и/или повышенной устойчивостью к деградации in vitro.
Предпочтительно, используется кэп-аналог, который может быть включен в РНК цепь только в одной ориентации. Pasquinelli et al. (1995, RNA J., vol., 1, pp. 957-967) продемонстрировали, что в ходе in vitro транскрипции РНК полимеразы бактериофагов используют единицу 7-метилгуанозина для инициации транскрипции, таким образом около 40-50% транскриптов с кэпом сохраняет кэп-динуклеотид в обратной ориентации (т.е. первоначальным продуктом реакции является Gpppm7GpN). По сравнению с РНК с правильным кэпом РНК с обратным кэпом не являются функциональными в отношении трансляции нуклеиновокислотной последовательности в белок. Таким образом, желательно помещать кэп в правильной ориентации, т.е. приводя в результате к РНК со структурой, практически соответствующей m7GpppGpN и т.д. Было показано, что обратная интеграция кэп-динуклеотида ингибируется заменой или 2'- или 3'-OH группы метилированной единицы гуанозина (Stepinski et al., 2001; RNA J., vol. 7, pp. 1486-1495; Peng et al., 2002; Org. Lett., vol. 24, pp. 161-164). РНК, которые синтезируются в присутствии таких «не-переворачиваемых» кэп-аналогов, транслируются более эффективно, чем РНК, которые являются транскибируемыми in vitro в присутствии традиционного 5'-кэпа m7GpppG. Исходя из этого, один аналог кэпа, в котором 3' OH группа метилированной единицы гуанозина заменяется на OCH3, описан, например, Holtkamp et al., 2006, Blood, vol. 108, pp. 4009-4017 (7-метил(3'-O-метил)GpppG; «не-переворачиваемый» кэп-аналог (ARCA)). ARCA является подходящим кэп-динуклеотидом согласно настоящему изобретению.

В предпочтительном варианте осуществления настоящего изобретения РНК настоящего изобретения практически не чувствительна к декэпированию. Это важно по той причине, что в большинстве случаев количество белка, продуцированного от синтетических мРНК, введенных в культивируемые клетки млекопитающих, ограничивается естественной деградацией мРНК. Один in vivo путь деградации мРНК начинается с удаления мРНК кэпа. Это удаление катализируется гетеродимерной пирофосфатазой, которая содержит регуляторную субъединицу (Dcp1) и каталитическую субъединицу (Dcp2). Каталитическая субъединица расщепляется между α и β фосфатными группами трифосфатного мостика. В настоящем изобретении может быть выбран или может присутствовать аналог кэпа, не являющийся чувствительным, или в меньшей степени чувствительный, к такому типу расщепления. Подходящий аналог кэпа для этой цели может быть выбран из кэп-динуклеотида согласно формуле (I):

в которой R1 выбирают из группы, состоящей из необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного арила и необязательно замещенного гетероарила,
R2 и R3 независимо выбирают из группы, состоящей из H, гало, OH и необязательно замещенного алкокси, или R2 и R3 вместе образуют O-X-O, при этом X выбирают из группы, состоящей из необязательно замещенного CH2, CH2CH2, CH2CH2CH2, CH2CH(CH3) и C(CH3)2, или R2 объединяется с атомом водорода в положении 4' кольца, к которому присоединяется R2 с образованием -O-CH2- или -CH2-O-,
R5 выбирают из группы, состоящей из S, Se и BH3,
R4 и R6 независимо выбирают из группы, состоящей из O, S, Se, и BH3.
n это 1, 2, или 3.
Предпочтительные варианты осуществления для R1, R2, R3, R4, R5, R6 раскрываются в WO 2011/015347 A1 и соответственно могут быть выбраны в настоящем изобретении.
Например, в предпочтительном варианте осуществления настоящего изобретения РНК настоящего изобретения содержит фосфоротиоатный-кэп-аналог. Фосфоротиоатные-кэп-аналоги являются особыми кэп-аналогами, в которых один из трех немостиковых атомов O в цепи трифосфата заменяется на атом S, т.е. один из R4, R5 или R6 в Формуле (I) является S. Фосфоротиоатные-кэп-аналоги описаны J. Kowalska et al., 2008, RNA, vol. 14, pp. 1119-1131, как решение нежелательного процесса декэпирования, и таким образом увеличение стабильности РНК in vivo. В частности, замена атома кислорода на атом серы в бета-фосфатной группе 5'-кэпа приводит в результате к стабилизации от Dcp2. В таком варианте осуществления, который является предпочтительным в настоящем изобретении, R5 в Формуле (I) является S; и R4 и R6 являются O.
В следующем предпочтительном варианте осуществления настоящего изобретения РНК настоящего изобретения содержит фосфоротиоатный-кэп-аналог, в котором фосфоротиоатная модификация РНК 5'-кэпа комбинируется с «не-переворачиваемый» модификацией кэп аналога (ARCA). Соответствующие ARCA-фосфоротиоатные-кэп-аналоги описаны в WO 2008/157688 A2, и все они могут использоваться в РНК настоящего изобретения. В таком варианте осуществления, по меньшей мере, один из R2 или R3 в Формуле (I) не является OH, предпочтительно один из числа R2 и R3 является метокси (OCH3), а другой из R2 и R3 является предпочтительно OH. В предпочтительном варианте осуществления атом кислорода заменяется на атом серы в бета-фосфатной группе (так, что R5 в Формуле (I) является S; и R4 и R6 являются O). Полагают, что фосфоротиоатная модификация ARCA обеспечивает, что α, β и γ фосфоротиоатные группы располагаются в точности в пределах активных сайтов кэп-связывающих белков как в трансляционном механизме, так и в механизме декэпирования. По меньшей мере, некоторые из этих аналогов являются преимущественно устойчивыми к пирофосфатазе Dcp1/Dcp2. Было описано, что фосфоротиоат-модифицированные ARCAs обладают значительно большей аффинностью в отношении eIF4E, чем соответствующие ARCA, лишенные фосфоротиоатной группы.
Соответствующий кэп аналог, который является особенно предпочтительным в настоящем изобретении, т.е. m27,2'-OGppspG, называется бета-S-ARCA (WO 2008/157688 A2; Kuhn et al., Gene Ther., 2010, vol. 17, pp. 961-971). Таким образом, в одном варианте осуществления настоящего изобретения РНК настоящего изобретения модифицируется бета-S-ARCA. Бета-S-ARCA представляет собой следующую структуру:

В общем, замена атома кислорода на атом серы в фосфате мостика дает в результате фосфоротиоатные диастереомеры, которые обозначаются D1 и D2, исходя из их профиля элюции в HPLC. Коротко, D1 диастереомер бета-S-ARCA» или «бета-S-ARCA(D1)» является диастереомером бета-S-ARCA, который элюирует первым на HPLC колонке по сравнению с D2 диастереомером бета-S-ARCA (бета-S-ARCA(D2)) и таким образом демонстрирует более короткое время удерживания. Определение стереохимической конфигурации с помощью HPLC описано в WO 2011/015347 A1.
В первом особенно предпочтительном варианте осуществления настоящего изобретения РНК настоящего изобретения модифицируется с использованием бета-S-ARCA(D2) диастереомера. Два диастереомера бета-S-ARCA различаются по чувствительности в отношении нуклеаз. Показано, что РНК, несущая D2 диастереомер бета-S-ARCA, является почти полностью устойчивой в отношении Dcp2 расщепления (только 6% расщепления по сравнению с РНК, которая синтезируется в присутствии немодифицированного ARCA 5'-кэпа), в то время как РНК с бета-S-ARCA(D1) 5'-кэпом демонстрирует среднюю чувствительность к Dcp2 расщеплению (71% расщепления). Кроме того, было показано, что повышенная устойчивость в отношении Dcp2 расщепления коррелирует с повышенной экспрессией белка в клетках млекопитающих. В частности, показано, что РНК, несущие бета-S-ARCA(D2) кэп, являются более эффективно транслируемыми в клетках млекопитающих, чем РНК, несущие бета-S-ARCA(D1) кэп. Следовательно, в одном варианте осуществления настоящего изобретения РНК настоящего изобретения модифицируется кэп-аналогом согласно Формуле (I), который характеризуется стереохимической конфигурацией на P атоме, содержащем заместитель R5 в Формуле (I), что соответствует заместителю на Pβ атоме D2 диастереомера бета-S-ARCA. В таком варианте осуществления R5 в Формуле (I) является S; и R4 и R6 являются O. Кроме того, по меньшей мере, один из R2 или R3 в Формуле (I) предпочтительно не является OH, предпочтительно один из R2 и R3 является метокси (OCH3), а другой из R2 и R3 предпочтительно является OH.
Во втором особенно предпочтительном варианте осуществления РНК настоящего изобретения модифицируется бета-S-ARCA(D1) диастереомером. Этот вариант осуществления в особенности подходит для переноса кэпированной РНК в незрелые антиген-презентирующие клетки, например, с целью вакцинации. Было показано, что бета-S-ARCA(D1) диастереомер, после переноса соответствующим образом кэпированной РНК в незрелые антиген-презентирующие клетки, является особенно подходящим для увеличения стабильности РНК, увеличения эффективности трансляции РНК, продления трансляции РНК, увеличения экспрессии РНК общего белка, и/или увеличения иммунного ответа против антигена или антигенного пептида, кодированного указанной РНК (Kuhn et al., 2010, Gene Ther., vol. 17, pp. 961-971). Следовательно, в альтернативном варианте осуществления настоящего изобретения РНК настоящего изобретения модифицируется с использованием кэп аналога согласно Формуле (I), который характеризуется стереохимической конфигурацией на P атоме, содержащем заместитель R5 в Формуле (I), что соответствует заместителю на Pβ атоме D1 диастереомера бета-S-ARCA. Соответствующие кэп аналоги и варианты их осуществления описаны в WO 2011/015347 A1 и Kuhn et al., 2010, Gene Ther., vol. 17, pp. 961-971. В настоящем изобретении может использоваться любой кэп аналог, описанный в WO 2011/015347 A1, в котором стереохимическая конфигурация на P атоме, содержащем заместитель R5 соответствует заместителю на Pβ атоме D1 диастереомера бета-S-ARCA. Предпочтительно, R5 в Формуле (I) является S; и R4 и R6 являются O. В дополнение к этому, по меньшей мере, один из R2 или R3 в Формуле (I) предпочтительно не является OH, предпочтительно один из R2 и R3 является метокси (OCH3), а другой из R2 и R3 предпочтительно является OH.
В одном варианте осуществления РНК настоящего изобретения модифицируется 5'-кэп структурой согласно Формуле (I), в которой любая одна фосфатная группа заменяется боранофосфатной группой или фосфороселеноатной группой. Такие кэпы обладают повышенной устойчивостью, как in vitro, так и in vivo. Необязательно, соответствующее соединение имеет 2'-O- или 3'-O-алкильную группу (при этом алкил предпочтительно является метилом); соответствующие кэп аналоги называются BH3-ARCAs или Se-ARCAs. Соединения, которые особенно подходят для кэпирования мРНК, включают β-BH3-ARCAs и β-Se-ARCAs, как описано в WO 2009/149253 A2. Для этих соединений стереохимическая конфигурация на P атоме, содержащем заместитель R5 в Формуле (I), который соответствует заместителю на Pβ атоме D1 диастереомера бета-S-ARCA, является предпочтительной.
Термин «нетранслируемая область» или «UTR» имеет отношение к области в молекуле ДНК, которая транскрибируется, но не транслируется в аминокислотную последовательность, или к соответствующей области в РНК молекуле, такой как мРНК молекула. Нетранслируемая область (UTR) может присутствовать 5' (выше) открытой рамки считывания (5'-UTR) и/или 3' (ниже) открытой рамки считывания (3'-UTR).
3'-UTR, если присутствует, располагается на 3' конце гена, ниже терминирующего кодона белок-кодирующей области, однако термин «3'-UTR» предпочтительно не включает поли(A) хвоста. Таким образом, 3'-UTR находится выше поли(A) хвоста (если имеется), например, прямо по соседству с поли(A) хвостом.
5'-UTR, если присутствует, располагается на 5' конце гена, выше инициирующего кодона белок-кодирующей области. 5'-UTR находится ниже 5'-кэпа (если имеется), например, прямо по соседству с 5'-кэпом.
5'- и/или 3'-нетранслируемые области согласно изобретению могут быть функционально связаны с открытой рамкой считывания, для того, чтобы эти области связывались с открытой рамкой считывания таким образом, чтобы стабильность и/или эффективность трансляции РНК, содержащей указанную открытую рамку считывания, повысились.
В некоторых вариантах осуществления мРНК согласно настоящему изобретению содержит 5'-UTR и/или 3'-UTR.
В предпочтительном варианте осуществления мРНК согласно настоящему изобретению содержит
(1) 5'-UTR,
(2) открытую рамку считывания и
(3) 3'-UTR.
UTRs вовлечены в стабильность и эффективность трансляции РНК. И то и другое может быть улучшено, за исключением структурных модификаций, касающихся 5'-кэпа и/или 3' поли(A)-хвоста, как описано в документе, путем отбора определенных 5' и/или 3' нетранслируемых областей (UTRs). Понятно, что элементы последовательности в UTRs влияют на эффективность трансляции (главным образом 5'-UTR) и РНК стабильность (главным образом 3'-UTR). Предпочтительно, что 5'-UTR, являющийся активным, присутствует для того, чтобы увеличить эффективность трансляции и/или стабильность РНК. Независимо или дополнительно, предпочтительно, что 3'-UTR, являющийся активным, присутствует для того, чтобы увеличить эффективность трансляции и/или стабильность РНК.
Термины «активный, для того, чтобы увеличить эффективность трансляции» и/или «активный, для того, чтобы увеличить стабильность» относительно первой нуклеиновокислотной последовательности (например, UTR) означает, что первая нуклеиновокислотная последовательность способна модифицировать, в общем транскрипте со второй нуклеиновокислотной последовательностью, эффективность трансляции и/или стабильность указанной второй нуклеиновокислотной последовательности таким образом, что указанная эффективность трансляции и/или стабильность увеличивается в сравнении с эффективностью трансляции и/или стабильностью указанной второй нуклеиновокислотной последовательности при отсутствии указанной первой нуклеиновокислотной последовательности.
3'-UTR, как правило, имеет в длину от 200 до 2000 нуклеотидов, например, от 500 до 1500 нуклеотидов. 3'-нетранслируемые области мРНК иммуноглобулинов являются относительно короткими (меньше чем около 300 нуклеотидов), тогда как 3'- нетранслируемые области других генов являются относительно длинными. Например, 3'-нетранслируемая область tPA составляет около 800 нуклеотидов в длину, нетранслируемая область фактора VIII составляет около 1800 нуклеотидов в длину и нетранслируемая область эритропоэтина составляет около 560 нуклеотидов в длину. 3'-нетранслируемые области мРНК млекопитающих, как правило, имеют гомологичную область, известную как гексануклеотидная последовательность AAUAAA. Эта последовательность является предположительно сигналом присоединения поли(A) и часто располагается на 10-30 оснований выше сайта присоединения поли(A). 3'- нетранслируемые области могут содержать один или более инвертированных повторов, которые могут свертываться с образованием структур «петля-на-стебле», которые действуют как барьеры для экзорибонуклеаз или взаимодействуют с белками, которые, как известно, увеличивают стабильность РНК (например, РНК-связывающие белки).
В некоторых вариантах осуществления РНК согласно настоящему изобретению содержит 3'-поли(A) последовательность.
Согласно изобретению, в одном варианте осуществления поли(A) последовательность содержит или в основном состоит или состоит, меньшей мере, из 20, предпочтительно по меньшей мере 26, предпочтительно по меньшей мере 40, предпочтительно по меньшей мере 80, предпочтительно по меньшей мере 100 и предпочтительно вплоть до 500, предпочтительно вплоть до 400, предпочтительно вплоть до 300, предпочтительно до 200 и, в частности, из 150 A нуклеотидов, и в частности примерно 120 A нуклеотидов. В этом контексте «в основном состоит из» означает, что большинство нуклеотидов в поли(A) последовательности, в большинстве случаев, по меньшей мере, 50%, и предпочтительно, по меньшей мере, 75% от числа нуклеотидов в «поли(A) последовательности», являются A нуклеотидами (аденилат), но допускает, что остальные нуклеотиды являются нуклеотидами, отличными от A нуклеотидов, такими как U нуклеотиды (уридилат), G нуклеотиды (гуанилат), C нуклеотиды (цитидилат). В этом контексте «состоит из» означает, что все нуклеотиды в поли(A) последовательности, т.е. 100% от числа нуклеотидов в поли(A) последовательности, являются A нуклеотидами. Термин «A нуклеотид» или «A» относится к аденилату.
Действительно, продемонстрировано, что 3' поли(A) последовательность примерно из 120 A нуклеотидов оказывает благоприятное влияние на уровни РНК в трансфицированных эукариотических клетках, а также на уровни белка, который транслируется с открытой рамки считывания, которая присутствует выше (5') 3' поли(A) последовательности (Holtkamp et al., 2006, Blood, vol. 108, pp. 4009-4017).
Настоящее изобретение предоставляет 3' поли(A) последовательность, предназначенную для присоединения в ходе РНК транскрипции, т.е. в ходе получения in vitro транскрибированной РНК, на основе ДНК матрицы, содержащей повторные dT нуклеотиды (дезокситимидилат) в цепи, комплементарной кодирующей цепи. ДНК последовательность, кодирующая поли(A) последовательность (кодирующая цепь), называется поли(A) кассета.
В предпочтительном варианте осуществления настоящего изобретения 3' поли(A) кассета, присутствующая в кодирующей цепи ДНК, в основном состоит из dA нуклеотидов, но прерывается случайной последовательностью, имеющей равномерное распределение четырех нуклеотидов (dA, dC, dG, dT). Такая случайная последовательность может иметь от 5 до 50, предпочтительно от 10 до 30, более предпочтительно от 10 до 20 нуклеотидов в длину. Такая кассета раскрывается в WO 2016/005004 A1. Любая поли(A) кассета, раскрытая в WO 2016/005004 A1 может использоваться в настоящем изобретении. Поли(A) кассета, которая состоит в основном из dA нуклеотидов, но прерывается случайной последовательностью, имеющей равномерное распределение четырех нуклеотидов (dA, dC, dG, dT) и имеющей длину, например, от 5 до 50 нуклеотидов, демонстрирующей, на ДНК уровне, постоянное размножение плазмидной ДНК в E.coli и также ассоциируется, на РНК уровне, с полезными свойствами в отношении обеспечения РНК стабильности и эффективности трансляции.
В связи с этим, в предпочтительном варианте осуществления настоящего изобретения 3' поли(A) последовательность, содержащаяся в РНК молекуле, описанной в этом документе, в основном состоит из A нуклеотидов, но прерывается случайной последовательностью, имеющей равномерное распределение четырех нуклеотидов (A, C, G, U). Такая случайная последовательность может иметь от 5 до 50, предпочтительно от 10 до 30, более предпочтительно от 10 до 20 нуклеотиды в длину.
Последовательности нуклеиновых кислот, точно определенные в этом документе, в частности транскрибируемые и кодирующие последовательности нуклеиновых кислот, могут быть функционально связаны с любыми последовательностями контроля экспрессии, которые могут быть гомологичными или гетерологичными с указанными последовательностями нуклеиновых кислот, при этом термин «гомологичный» имеет отношение к тому обстоятельству, что последовательность нуклеиновой кислоты является также функционально связанной по природе с последовательностью контроля экспрессии, и термин «гетерологичный» имеет отношение к тому обстоятельству, что последовательность нуклеиновой кислоты не является по природе функционально связанной с последовательностью контроля экспрессии.
Транскрибируемая последовательность нуклеиновой кислоты или последовательность нуклеиновой кислоты, кодирующая пептид или белок, и последовательность контроля экспрессии являются «функционально» связанными друг с другом в том случае, если они ковалентно связываются друг с другом так, что транскрипция или экспрессия транскрибируемой или кодирующей последовательности нуклеиновой кислоты находится под контролем или под влиянием последовательности контроля экспрессии. Если последовательность нуклеиновой кислоты должна быть транслирована в функциональный пептид или белок, индукция последовательности контроля экспрессии, функционально связанной с кодирующей последовательностью, приводит к транскрипции указанной кодирующей последовательности, не вызывая сдвига рамки в кодирующей последовательности, или кодирующая последовательность является неспособной транслироваться в желательный пептид или белок.
Термин «последовательность контроля экспрессии» включает согласно изобретению промоторы, последовательности связывания рибосом и другие элементы контроля, контролирующие транскрипцию гена или трансляцию РНК. В отдельных вариантах осуществления изобретения последовательности контроля экспрессии могут регулироваться. Точная структура последовательностей контроля экспрессии может варьировать в зависимости от видов или типов клеток, но обычно включает 5'-нетранскрибируемую и 5'- и 3'-нетранслируемые последовательности, вовлеченные в инициацию транскрипции и трансляции, соответственно, такие как TATA бокс, кэпирующая последовательность, CAAT последовательность и тому подобное. Конкретнее, 5'-нетранскрибируемые последовательности контроля экспрессии содержат промоторную область, которая включает промоторную последовательность для контроля транскрипции функционально связанного гена. Последовательности контроля экспрессии также могут содержать энхансерные последовательности или активирующие последовательности.
Термин «промотор» или «промоторная область» относится к ДНК последовательности выше (5') кодирующей последовательности гена, которая контролирует экспрессию указанной кодирующей последовательности путем обеспечения сайта распознавания и связывания для РНК полимеразы. Промоторная область может включать, кроме того, сайты распознавания и связывания для дополнительных факторов, участвующих в регуляции транскрипции указанного гена. Промотор может контролировать транскрипцию прокариотического или эукариотического гена. Промотор может быть «индуцибельным» и инициировать транскрипцию в ответ на индуктор или может быть «конститутивным», если транскрипция не контролируется индуктором. Индуцибельный промотор экспрессируется только в очень небольшой степени или совсем не идуцируется, если индуктор отсутствует. В присутствии индуктора ген «включается» или уровень транскрипции повышается. Обычно это опосредуется путем связывания специального фактора транскрипции.
Примерами предпочтительных промоторов согласно изобретению являются промоторы для SP6, T3 или T7 полимераза.
Согласно изобретению, термин «экспрессия» используется в его самом общем значении и включает экспрессию РНК и/или белка. Он также включает частичную экспрессию нуклеиновых кислот. Более того, экспрессия может быть транзиентной или стабильной. В отношении РНК термин «экспрессия» или «трансляция» имеет отношение к процессу в рибосомах клетки, посредством которого цепь матричной РНК управляет сборкой последовательности аминокислот, чтобы получить пептид или белок.
В контексте настоящего изобретения термин «транскрипция» относится к процессу, в котором генетический код в ДНК последовательности транскрибируется в РНК. В дальнейшем РНК может транслироваться в белок. Согласно настоящему изобретению термин «транскрипция» включает «in vitro транскрипцию», в которой термин «in vitro транскрипция» имеет отношение к процессу, в котором РНК, в частности мРНК, синтезируется in vitro в бесклеточной системе. Предпочтительно, для создания транскриптов применяются клонирующие векторы. Эти клонирующие векторы в большинстве случаев обозначаются как транскрипционные векторы и согласно настоящему изобретению охватываются термином «вектор». Согласно настоящему изобретению РНК предпочтительно представляет собой in vitro транскрибированную РНК (IVT-RNA) и может быть получена путем in vitro транскрипции соответствующей ДНК матрицы. Промотор для контролирования транскрипции может быть любым промотором для любой РНК полимеразы. ДНК матрица для in vitro транскрипции может быть получена путем клонирования нуклеиновой кислоты, в частности кДНК, и введения ее в соответствующий вектор для in vitro транскрипции. кДНК может быть получена путем обратной транскрипции РНК.
Термины, такие как «повышение экспрессии», «повышенная экспрессия» или «увеличенная экспрессия», означают в контексте настоящего изобретения, что количество пептида или белка, экспрессированного данным числом РНК-молекул является более высоким, чем количество пептида или белка, экспрессированного тем же самым числом РНК-молекул, при этом экспрессия РНК молекул осуществляется в одинаковых условиях за исключением условия, которое приводит к повышенной или увеличенной экспрессии РНК, такого как предоставление фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, в клетку по сравнению с отсутствием предоставления фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, в клетку. В этом контексте «одинаковые условия» имеют отношение к ситуации, в которой одинаковые РНК последовательности, кодирующие тот же самый пептид или белок, вводятся теми же самыми способами в те же самые клетки, клетки культивируются при одинаковых условиях (за исключением условия, которое приводит к повышенной или увеличенной экспрессии) и количество пептида или белка измеряется теми же самыми способами. Количество пептида или белка может предоставляться в молях, или по весу, например, в граммах, или по массе или по активности полипептида, например, если пептид или белок является ферментом, он может быть предоставлен в виде каталитической активности, или если пептид или белок является антителом или антигеном или рецептором, он может быть предоставлен в виде аффинности связывания. В одном варианте осуществления такие термины как «повышение экспрессии», «повышенная экспрессия» или «увеличенная экспрессия», означают в контексте настоящего изобретения, что количество пептида или белка, белка, экспрессированного данным числом РНК-молекул и в пределах данного периода времени является более высоким, чем количество пептида или белка, экспрессированного тем же самым числом РНК-молекул и в пределах того же самого периода времени. Например, максимальное значение пептида или белка, экспрессированного данным количеством молекул РНК в определенный момент времени может быть выше, чем максимальное значение пептида или белка, экспрессированного тем же самым количеством молекул РНК. В других вариантах осуществления максимальное значение пептида или белка, экспрессированного данным количеством молекул РНК не обязательно должно быть более высоким, чем максимальное значение пептида или белка, экспрессированного тем же самым количеством молекул РНК, однако, среднее количество пептида или белка, экспрессированного тем же самым количеством молекул РНК в пределах данного периода времени может быть более высоким, чем среднее количество пептида или белка, экспрессированного тем же самым количеством молекул РНК. Последние случаи называются в данном описании «более высокий уровень экспрессии» или «повышенный уровень экспрессии» и имеют отношение к более высоким максимальным значениям экспрессии и/или к более высоким средним значениям экспрессии. Альтернативно или дополнительно, такие термины как «повышение экспрессии», «повышенная экспрессия» или «увеличенная экспрессия», означают также в контексте настоящего изобретения, что время, за которое пептид или белок экспрессируется молекулами РНК может быть более длинным, чем время, за которое пептид или белок экспрессируется теми же самыми молекулами РНК. Таким образом, в одном варианте осуществления такие термины, как «повышение экспрессии», «повышенная экспрессия» или «увеличенная экспрессия», означают также в контексте настоящего изобретения, что количество пептида или белка, экспрессированного данным количеством молекул РНК, является более высоким, чем количество пептида или белка, экспрессированного тем же самым количеством молекул РНК, поскольку период времени, в течение которого РНК стабильно присутствует и экспрессируется, является более длинным, чем период времени, в течение которого то же самое количество РНК молекул стабильно присутствует и экспрессируется. Эти случаи также называются в данном описании «увеличенной продолжительностью экспрессии». Предпочтительно, такие более длинные периоды времени относятся к экспрессии, по меньшей мере, в течение 48 часов, предпочтительно, по меньшей мере, в течение 72 часов, более предпочтительно, по меньшей мере, в течение 96 часов, в частности, по меньшей мере, в течение 120 часов или даже дольше после введения РНК или после первого введения (например, в случае повторных трансфекций) РНК в клетку.
Уровень экспрессии и/или продолжительность экспрессии РНК может определяться путем измерения количества, например, общего экспрессированного количества и/или количества, экспрессированного в данный период времени, и/или времени экспрессии пептида или белка, кодированного РНК, например, путем использования метода ELISA, иммуногистохимического метода, метода количественного анализа изображения, вестерн-блоттинга, масс-спектрометрии, количественного метода иммуногистохимии или ферментного анализа.
Согласно изобретению термин «РНК кодирование» относительно определенного пептида или белка означает, что РНК, если присутствует в соответствующей окружающей обстановке, предпочтительно в клетке, может экспрессироваться, чтобы продуцировать указанный пептид или белок. Предпочтительно, РНК согласно изобретению способна взаимодействовать с клеточным механизмом трансляции, чтобы обеспечить пептид или белок, который она кодирует.
В отдельных вариантах осуществления РНК согласно изобретению включает один тип РНК молекулы, популяцию разных РНК молекул, например, смесь разных РНК молекул необязательно кодирующих разные пептиды и/или белки, РНК цельной клетки, библиотеку РНК или ее часть, например, библиотеку РНК молекул, экспрессированных в конкретном типе клеток, таком как недифференцированные клетки, в частности стволовые клетки, такие как эмбриональные стволовые клетки, или фракцию библиотеки молекул РНК, такую как РНК с улучшенной экспрессией в недифференцированных клетках, в частности стволовых клетках, таких как эмбриональные стволовые клетки относительно дифференцированных клеток. Таким образом, согласно изобретению термин «РНК» может включать смесь молекул РНК, РНК цельной клетки или ее фракцию, которая может быть получена с помощью процесса, включающего изоляцию РНК из клеток, и/или с помощью рекомбинантных методов, в частности, путем in vitro транскрипции.
РНК, использованная согласно настоящему изобретению, может иметь известный состав (в этом варианте осуществления предпочтительно является известным, какие пептиды или белки экспрессируются РНК) или состав РНК может быть частично или полностью неизвестным. Альтернативно, РНК использованная согласно настоящему изобретению, может обладать известной функцией, или функция РНК может быть частично или полностью неизвестной.
Предпочтительно, согласно изобретению, РНК, которая должна экспрессироваться в клетке, вводится в указанную клетку или in vitro или in vivo, предпочтительно in vitro. РНК может быть введена в клетку до, после и/или одновременно с предоставлением фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, в клетку. Предпочтительно, фактор вирусного происхождения, содержащий Toscana virus NSs белок или функциональный вариант NSs белка Toscana virus предоставляется в том случае, если экспрессия РНК в клетке желательна. В одном варианте осуществления способов согласно изобретению РНК, которая должна быть введена в клетку, получают путем in vitro транскрипции соответствующей ДНК матрицы.
Согласно изобретению РНК может быть введена в клетки или in vitro или in vivo, предпочтительно in vitro. Клетки, в которые РНК вводится in vitro, могут быть введены пациенту, предпочтительно после экспрессии РНК in vitro способами изобретения.
Термин «трансфекция» имеет отношение к введению нуклеиновых кислот, в частности РНК, в клетку. Для целей настоящего изобретения термин «трансфекция» также включает введение нуклеиновой кислоты в клетку или поглощение нуклеиновой кислоты такой клеткой, при этом клетка может присутствовать у субъекта, например, пациента. Таким образом, согласно настоящему изобретению клетка для трансфекции нуклеиновой кислоты, описанной в данном документе, может присутствовать in vitro или in vivo, например, клетка может образовывать часть органа, ткани и/или организма пациента. Согласно изобретению трансфекция может быть транзиентной или стабильной. Что касается некоторых вариантов применения трансфекции, достаточно, если трансфицированный генетический материал экспрессируется только транзиентно. Поскольку нуклеиновая кислота, введенная в процессе трансфекции, обычно не интегрируется в ядерный геном, чужеродная нуклеиновая кислота будет «разбавляться» в процессе митоза или будет деградироваться. Клетки, обеспечивающие эписомальную амплификацию нуклеиновых кислот, значительно уменьшают скорость «разбавления». В том случае, если желательно, чтобы трансфицированная нуклеиновя кислота действительно оставалась в геноме клетки и ее дочерних клеток, должна происходить стабильная трансфекция. РНК может быть трансфицирована в клетки для транзиентной экспрессии кодированного ею белка.
Согласно настоящему изобретению может использоваться любая методика, подходящая для введения, т.е. переноса или трансфекции, нуклеиновых кислот в клетки. Предпочтительно, РНК трансфицируется в клетки с помощью стандартных методов. Такие методы включают электропорацию, липофекцию и микроинъекцию. В одном особенно предпочтительном варианте осуществления настоящего изобретения РНК вводится в клетки с помощью электропорации. Электропорация или электропермеабилизация имеет отношение к значительному увеличению электропроводимости и проницаемости клеточной плазматической мембраны, вызванной приложением внешнего электрического поля. Она обычно используется в молекулярной биологии как способ введения некоторых веществ в клетку. Согласно изобретению предпочтительно, что введение нуклеиновой кислоты, кодирующей белок или пептид, в клетки приводит к экспрессии указанного белка или пептида.
Клетка может экспрессировать кодированный пептид или белок внутриклеточно (например, в цитоплазме и/или в ядре), может секретировать кодированный пептид или белок или может экспрессировать его на поверхности.
Согласно настоящему изобретению клетка может быть изолированной клеткой или она может образовывать часть органа, ткани и/или организма. Согласно настоящему изобретению введение нуклеиновой кислоты осуществляется или в виде «голой» нуклеиновой кислоты или в комбинации с введением некоторого реагента. Предпочтительным является введение нуклеиновых кислот в виде «голых» нуклеиновых кислот. Предпочтительно, РНК вводится в комбинации со стабилизирующими веществами, такими как ингибиторы РНазы. Настоящее изобретение также предусматривает повторное введение нуклеиновых кислот в клетки, чтобы обеспечить возможность устойчивой экспрессии в течение длительных периодов времени.
Согласно изобретению нуклеиновые кислоты могут быть направлены в определенные клетки. В таких вариантах осуществления носитель, использованный для введения нуклеиновой кислоты в клетку (например, ретровирус или липосома), может иметь связанную нацеливающую молекулу. Например, молекула, такая как антитело, специфическое к поверхностному мембранному белку на клетке-мишени, или лиганд для рецептора на клетке-мишени, может быть встроена в или связана с носителем нуклеиновой кислоты. Если желательным является введение нуклеиновой кислоты с помощью липосом, белки, связанные с поверхностным мембранным белком, имеющим отношение к эндоцитозу, могут быть включены в липосомную композицию с целью обеспечения нацеливания и/или абсорбции. Такие белки включают капсидные белки или их фрагменты, которые являются специфическими к конкретному типу клеток, антителами к белкам, которые являются интернализованными, белками, нацеленными на внутриклеточный сайт и тому подобное.
Согласно изобретению термин «введение РНК в клетки» включает и предпочтительно относится к вариантам осуществления, в которых РНК вводится только в часть клеток, и часть клеток остается нетрансфицированной. Если более чем одна РНК молекула должна быть введена в клетки, например, более чем одна молекула РНК, экспрессирующая функциональный набор факторов перепрограммирования, или РНК, кодирующая представляющий интерес белок, и РНК, кодирующая фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, данный термин включает и предпочтительно относится к вариантам осуществления, в которых все РНК молекулы вводятся только в часть клеток и часть клеток остается нетрансфицированной или остается трансфицированной, но не всеми из указанных молекул РНК. В любом случае, если согласно изобретению более чем одна молекула РНК должна быть введена в клетки, например, более чем одна молекула РНК, экспрессирующая функциональный набор факторов перепрограммирования, цель заключается в том, чтобы ввести все РНК молекулы в клетку, например, чтобы экспрессировать функциональный набор факторов перепрограммирования в одной клетке.
Термины, такие как «улучшение жизнеспособности клетки», «увеличенная жизнеспособность клетки» или «повышенная жизнеспособность клетки», означают в контексте настоящего изобретения, что количество жизнеспособных или живых клеток при определенных условиях выше, чем количество жизнеспособных или живых клеток при других условиях, при этом культивирование осуществляется при тех же самых условиях, за исключением условия, которое приводит к улучшенной или повышенной или жизнеспособности клеток, такого как предоставление фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus в клетку по сравнению с отсутствием предоставления фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus в клетку. В этом контексте «те же самые условия» относится к ситуации, в которой используются такие же клетки, клетки культивируются в одинаковых условиях (за исключением условия, приводящего к улучшенной или повышенной жизнеспособности клеток) и жизнеспособность клеток определяется теми же самыми способами. «Те же самые условия» также включают введение или повторное введение РНК в клетки.
Термин «клетка» или «клетка-хозяин» предпочтительно имеет отношение к интактной клетке, т.е. клетке с интактной мембраной, которая не выпускает свои нормальные внутриклеточные компоненты, такие как ферменты, органеллы или генетический материал. Интактная клетка предпочтительно является жизнеспособной клеткой, т.е. живой клеткой, способной осуществлять свои нормальные метаболические функции. Предпочтительно указанный термин согласно изобретению относится к любой клетке, которая может быть трансформирована или трансфицирована экзогенной нуклеиновой кислотой. Термин «клетка» включает согласно изобретению прокариотические клетки (например, E. coli) или эукариотические клетки. Клетки млекопитающих являются особенно предпочтительными, такие как клетки людей, мышей, хомяков, свиней, коз и приматов. Клетки могут происходить из многих типов тканей и содержат первичные клетки и клеточные линии. Конкретные примеры включают кератиноциты, лейкоциты периферической крови, стволовые клетки костного мозга и эмбриональные стволовые клетки. В других вариантах осуществления клетка-хозяин является антиген-презентирующей клеткой, в частности, дендритной клеткой, моноцитом или макрофагом. В одном варианте осуществления клетка является соматической клеткой, как описано в этом документе. В одном варианте осуществления клетка является клеткой, обладающей барьерной функцией. Предпочтительно, клетка является фибробластом, таким как фибробласт, описанный в этом документе, кератиноцитом, эпителиальной клеткой или эндотелиальной клеткой, такой как эндотелиальная клетка сердца, эндотелиальная клетка легкого или эндотелиальная клетка пупочной вены. Предпочтительно, клетка является человеческой клеткой.
Фибробласт является типом клетки, который синтезирует внеклеточный матрикс и коллаген и играет решающую роль в заживлении ран. Основная функция фибробластов состоит в сохранении структурной целостности соединительной ткани путем непрерывного выделения предшественников внеклеточного матрикса. Фибробласты являются самыми распространенными клетками соединительной ткани у животных. Фибробласты являются морфологически гетерогенными с различными признаками в зависимости от их локализации и активности.
Кератиноциты являются преобладающим типом клеток в эпидермисе, наружном слое кожи человека. Первичной функцией кератиноцитов является образование кератинового слоя, который защищает кожу и подлежащих тканей от вреда, наносимого окружающей средой, такого как температура, УФ излучение и потеря влаги.
Эпителий является тканью, состоящей из клеток, которые выстилают полости и поверхности структур по всему организму. Многие железы также формируются из эпителиальной ткани. Он лежит сверху соединительной ткани, и эти два слоя разделяются базальной мембраной. У людей эпителий классифицируется как первичная ткань организма, другими тканями являются соединительная ткань, мышечная ткань и нервная ткань. Функции эпителиальных клеток включают секрецию, селективную абсорбцию, защиту, трансцеллюлярный транспорт и распознавание ощущения.
Эндотелий представляет собой тонкий слой клеток, выстилающих внутреннюю поверхность кровеносных сосудов, образуя поверхность контакта между циркулирующей в просвете кровью и остальной частью сосудистой стенки. Эти клетки называются эндотелиальными клетками. Эндотелиальные клетки выстилают всю кровеносную систему, от сердца до самого мелкого капилляра. Эндотелиальная ткань является специализированным типом эпителиальной ткани.
Термин «рекомбинантный» в контексте настоящего изобретения означает «сделанный методами генной инженерии». Предпочтительно, в контексте настоящего изобретения «рекомбинантный объект», такой как рекомбинантная клетка, не встречается в природе.
Термин «встречающийся в природе, природный», использованный в описании, относится к тому факту, что объект может быть обнаружен в природе. Например, пептид или нуклеиновая кислота, которая присутствует в организме (включая вирусы) и может быть изолирована из источника в природе и которая не является преднамеренно модифицированной человеком в лаборатории, является встречающей в природе, природной.
РНК, которая должна быть экспрессирована в клетке, кодирует один или более пептидов или белков, представляющих интерес. Соответственно, РНК может содержать одну или более открытых рамок считывания (ORFs), кодирующих один или более пептидов или белков, представляющих интерес. РНК, которая должна быть экспрессирована в клетке, может кодировать целый ряд пептидов или белков, представляющих интерес, в частности пептиды или белки, которые представляют интерес, в том случае, когда экспрессируются в определенном типе клеток, поскольку они могут выполнять определенную функцию, когда экспрессируются в указанном типе клеток.
Согласно настоящему изобретению термин «пептид» включает олиго- и полипептиды и относится к субстанциям, которые содержат две или более, предпочтительно 3 или более, предпочтительно 4 или более, предпочтительно 6 или более, предпочтительно 8 или более, предпочтительно 10 или более, предпочтительно 13 или более, предпочтительно 16 или более, предпочтительно 20 или более, и предпочтительно до 50, предпочтительно 100 или предпочтительно 150, последовательно соединенных аминокислот, связанных друг с другом пептидными связями. Термин «белок» имеет отношение к большим пептидам, предпочтительно пептидам, имеющим, по меньшей мере, 151 аминокислот, причем термины «пептид» и «белок» обычно используются в данном описании как синонимы.
Термины «пептид» и «белок» включают согласно изобретению субстанции, которые содержат не только аминокислотные компоненты, но также неаминокислотные компоненты, такие как сахара и фосфатные структуры, и также включают субстанции, содержащие такие связи, как эфирные, тиоэфирные или дисульфидные связи.
РНК согласно настоящему изобретению может кодировать один пептид или белок или множество пептидов или белков. Несколько пептидов или белков может кодироваться как один полипептид (гибридный полипептид) или как отдельные пептиды или белки. Поли-белок или гибридный полипептид может содержать отдельные полипептиды, разделенные при необходимости сайтом аутокаталитического расщепления протеазой (например, 2A белок вируса ящура), или интеин.
Согласно изобретению в одном варианте осуществления РНК содержит или состоит из фармацевтически активной РНК. «Фармацевтически активная РНК» может быть РНК, которая кодирует фармацевтически активный пептид или белок.
«Фармацевтически активный пептид или белок» оказывает положительное или полезное воздействие на состояние или болезненное состояние субъекта при введении субъекту в терапевтически эффективном количестве. Предпочтительно, фармацевтически активный пептид или белок обладает лечебными или паллеативными свойствами и может вводиться с целью улучшения, ослабления, облегчения, полного уничтожения, задержки начала или уменьшения тяжести одного или более симптомов болезни или нарушения. Фармацевтически активный пептид или белок может обладать профилактическими свойствами и может использоваться для отсрочки начала болезни или уменьшения тяжести такой болезни или патологического состояния. Термин «фармацевтически активный пептид или белок» включает целые белки или полипептиды, и также может относиться к его фармацевтически активным фрагментам. Он также включает фармацевтически активные аналоги пептида или белка. Термин «фармацевтически активный пептид или белок» включает пептиды и белки, которые являются антигенами, т.е. пептид или белок вызывает иммунный ответ у субъекта, который может быть терапевтическим или частично или полностью защитным.
В одном варианте осуществления фармацевтически активный пептид или белок is или comprises an иммунологически активное соединение или антиген или эпитоп.
Согласно изобретению термин «иммунологически активное соединение» относится к любому соединению, изменяющему иммунный ответ, предпочтительно путем стимулирования и/или подавления созревания иммунных клеток, стимулирования и/или подавления биосинтеза цитокинов, и/или изменения гуморального иммунитета путем стимулирования выработки антител B-клетками. В одном варианте осуществления иммунный ответ включает стимулирование гуморального иммунного ответа (обычно включающего иммуноглобулин G (IgG)). Иммунологически активные соединения обладают сильной иммуностимулирующей активностью, включая, но не ограничиваясь этим, противовирусную и противоопухолевую активность, и также могут подавлять другие аспекты иммунного ответа, например сдвиг иммунного ответа от TH2 иммунного ответа, который пригоден для лечения большого числа TH2 опосредованных болезней.
Согласно изобретению термин «антиген» или «иммуноген» охватывает любое вещество, которое будет вызывать иммунный ответ. В частности, «антиген» относится к любой субстанции, которая специфически реагирует с антителами или T-лимфоцитами (T-клетками). Согласно настоящему изобретению термин «антиген» включает любую молекулу, которая содержит, по меньшей мере, один эпитоп. Предпочтительно, антиген в контексте настоящего изобретения является молекулой, которая, необязательно после процессинга, вызывает иммунную реакцию, которая предпочтительно является специфической к данному антигену. Согласно настоящему изобретению может использоваться любой подходящий антиген, который является потенциально подходящим для иммунной реакции, при этом иммунная реакция может быть как гуморальной, так и клеточной иммунной реакцией. В контексте вариантов осуществления настоящего изобретения антиген предпочтительно презентируется клеткой, предпочтительно антиген-презентирующей клеткой, в контексте MHC молекул, что приводит к иммунной реакции против данного антигена. Антиген предпочтительно является продуктом, который соответствует или происходит от антигена природного происхождения. Такие антигены природного происхождения могут включать или могут происходить от аллергенов, вирусов, бактерий, грибков, паразитов и других инфекционных агентов и патогенов или антиген также может быть опухолевым антигеном. Согласно настоящему изобретению антиген может соответствовать продукту природного происхождения, например, вирусному белку или его части. В предпочтительных вариантах осуществления антиген является поверхностным полипептидом, т.е. полипептидом от природы размещенным на поверхности клетки, патогена, бактерии, вируса, грибка, паразита, аллергена или опухоли. Антиген может вызвать иммунный ответ против клетки, патогена, бактерии, вируса, грибка, паразита, аллергена или опухоли.
Термин «патоген» относится к патогенному биологическому материалу, способному вызвать болезнь в организме, предпочтительно в организме позвоночного. Патогены включают микроорганизмы, такие как бактерии, одноклеточные эукариотические организмы (простейшие), грибы, а также вирусы.
Термины «эпитоп», «антигенный пептид», «эпитоп антигена», «иммуногенный пептид» и «MHC связывающий пептид» используются взаимозаменяемым образом в этом документе и относятся к антигенной детерминанте в молекуле, такой как антиген, т.е. к части в или фрагменту иммунологически активного соединения, которое распознается иммунной системой, например, которое распознается T-клеткой, в частности, когда презентируется в рамках MHC молекул. Эпитоп белка предпочтительно содержит непрерывную или прерывистую часть указанного белка и предпочтительно составляет от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислот в длину, например, эпитоп может предпочтительно иметь 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот в длину. Согласно изобретению эпитоп может связываться с MHC молекулами, такими как MHC молекулы на поверхности клетки и таким образом, может быть «MHC связывающим пептидом» или «антигенным пептидом». Термин «главный комплекс гистосовместимости» и аббревиатура «MHC» включает молекулы MHC I класса и MHC II класса и имеет отношение к комплексу генов, который присутствует у всех позвоночных. MHC белки или молекулы важны для передачи сигналов между лимфоцитами и антиген-презентирующими клетками или пораженными болезнью клетками в иммунных реакциях, при этом MHC белки или молекулы связываются с пептидами и презентируют их для распознавания T клеточными рецепторами. Белки, кодированные MHC, экспрессируются на поверхности клеток и представляют T-клетке как собственные антигены (фрагменты пептидов самих клеток), так и чужеродные антигены (например, фрагменты инвазивных микроорганизмов). Предпочтительно, такие иммуногенные участки связываются с молекулой MHC I класса или молекулой II класса. При использовании в описании иммуногенный участок, как говорят, «связывается с» молекулой MHC I класса или II класса, если такое связывание обнаруживается при помощи каких-либо методов анализа, известных в данной области техники. Термин «MHC связывающий пептид» имеет отношение к пептиду, который связывается с молекулой MHC I класса и/или молекулой MHC II класса. В случае комплексов MHC I класс /пептид, связывающие пептиды имеют, как правило, 8-10 аминокислот в длину, хотя более короткие или длинные пептиды могут быть эффективными. В случае комплексов MHC II класс /пептид, связывающие пептиды имеют, как правило, 10-25 аминокислот в длину и являются, в частности, длиной 13-18 аминокислот, тогда как более короткие или длинные пептиды могут быть эффективными.
В одном варианте осуществления белок, представляющий интерес, согласно настоящему изобретению содержит эпитоп, подходящий ля вакцинации организма-мишени. Специалистам в данной области техники известно, что один из принципов иммунологии и вакцинации основывается на том факте, что иммунозащитная реакция на болезнь вырабатывается путем иммунизации организма антигеном, который является иммунологически релевантным относительно той болезни, которую необходимо лечить. Согласно настоящему изобретению антиген выбирают из группы, состоящей из собственного антигена и чужеродного антигена. Чужеродный антиген предпочтительно является бактериальным антигеном, вирусным антигеном, грибковым антигеном, аллергеном или антигеном паразита. Предпочтительно, что антиген содержит эпитоп, способный вызывать иммунный ответ в организме-мишени. Например, эпитоп может вызывать иммунный ответ против бактерии, вируса, грибка, паразита, аллергена или опухоли.
В некоторых вариантах осуществления чужеродный антиген является бактериальным антигеном. В некоторых вариантах осуществления антиген вызывает иммунный ответ против бактерии, которая инфицирует животных, включая птиц, рыб и млекопитающих, включая домашних животных. Предпочтительно, бактерия, против которой вызывается иммунный ответ, является патогенной бактерией.
В некоторых вариантах осуществления чужеродный антиген является вирусным антигеном. Вирусный антиген, например, может быть пептидом, происходящим от белка вирусной поверхности, например, капсидным полипептидом или полипептидом шиповидного отростка. В некоторых вариантах осуществления антиген вызывает иммунный ответ против вируса, который инфицирует животных, включая птиц, рыб и млекопитающих, включая домашних животных. Предпочтительно, вирус, против которого вызывается иммунный ответ, является патогенным вирусом.
В некоторых вариантах осуществления чужеродный антиген является полипептидом или белком грибка. В некоторых вариантах осуществления антиген вызывает иммунный ответ против грибка, который инфицирует животных, включая птиц, рыб и млекопитающих, включая домашних животных. Предпочтительно, грибок, против которого вызывается иммунный ответ, является патогенным грибком.
В некоторых вариантах осуществления чужеродный антиген является полипептидом или белком от одноклеточного эукариотического паразита. В некоторых вариантах осуществления антиген вызывает иммунный ответ против одноклеточного эукариотического паразита, предпочтительно патогенного одноклеточного эукариотического паразита. Патогенные одноклеточные эукариотические паразиты могут происходить, например, из рода Plasmodium, например, P. falciparum, P. vivax, P. malariae или P. ovale, из рода Leishmania, или из рода Trypanosoma, например, T. cruzi или T. brucei.
В некоторых вариантах осуществления чужеродный антиген является аллергенным полипептидом или аллергенным белком. Аллергенный белок или аллергенный полипептид также является пригодным для аллерговакцинации, также известной под названием гипосенсибилизация.
В некоторых вариантах осуществления антиген является собственным антигеном, в частности, опухолевым антигеном. Опухолевые антигены и их определение известны специалистам.
В контексте настоящего изобретения термин «опухолевый антиген» или «опухоль-ассоциированный антиген» относится к белкам, которые при нормальных условиях являются специфически экспрессированными в ограниченном количестве тканей и/или органов или на специфических стадиях развития, например, опухолевый антиген может при нормальных условиях специфически экспрессироваться в ткани желудка, предпочтительно в слизистой оболочке желудка, в репродуктивных органах, например, в мужских половых железах, в трофобластической ткани, например, в плаценте, или в клетках зародышевой линии, и экспрессируются или аберрантно экспрессируются в одной или более опухолевой или злокачественной тканях. В этом контексте «ограниченное число» предпочтительно означает не более чем 3, более предпочтительно не более чем 2. Опухолевые антигены в контексте настоящего изобретения включают, например, дифференцировочные антигены, предпочтительно дифференцировочные антигены, специфичные для определенного типа клеток, т.е. белки, которые при нормальных условиях специфически экспрессируются в определенных типах клеток на определенной стадии дифференцировки, раковые/тестикулярные антигены, т.е. белки, которые при нормальных условиях специфически экспрессируются в яичках и иногда в плаценте и антигены, специфичные для зародышевой линии. В контексте настоящего изобретения опухолевый антиген предпочтительно ассоциируется с клеточной поверхностью раковой клетки и предпочтительно не экспрессируется или крайне редко экспрессируется в нормальных тканях. Предпочтительно, опухолевый антиген или аберрантная экспрессия опухолевого антигена идентифицирует раковые клетки. В контексте настоящего изобретения опухолевый антиген, который экспрессируется раковой клеткой у субъекта, например, у пациента, страдающего от ракового заболевания, предпочтительно является собственным белком у указанного субъекта. В предпочтительных вариантах осуществления опухолевый антиген в контексте настоящего изобретения при нормальных условиях специфически экспрессируется в ткани или органе, который является несущественным, т.е. тканях или органах, повреждение которых иммунной системой не приводит к смерти субъекта, или в органах или структурах организма, которые не являются или являются трудно доступными для иммунной системы. Предпочтительно, аминокислотная последовательность опухолевого антигена является идентичной между опухолевым антигеном, который экспрессируется в нормальных тканях, и опухолевым антигеном, который экспрессируется в раковых тканях.
Примерами опухолевых антигенов, которые могут использоваться в настоящем изобретении, являются p53, ART-4, BAGE, бета-катенин/m, Bcr-abL CAMEL, CAP-1, CASP-8, CDC27/m, CDK4/m, CEA, белки клеточной поверхности семейства клаудина, такие как CLAUDIN-6, CLAUDIN-18.2 и CLAUDIN-12, c-MYC, CT, Cyp-B, DAM, ELF2M, ETV6-AML1, G250, GAGE, GnT-V, Gap100, HAGE, HER-2/neu, HPV-E7, HPV-E6, HAST-2, hTERT (or hTRT), LAGE, LDLR/FUT, MAGE-A, предпочтительно MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, или MAGE-A12, MAGE-B, MAGE-C, MART-1/Melan-A, MC1R, Myosin/m, MUC1, MUM-1, -2, -3, NA88-A, NF1, NY-ESO-1, NY-BR-1, p190 минорный BCR-abL, Pm1/RARa, PRAME, протеиназа 3, PSA, PSM, RAGE, RU1 или RU2, SAGE, SART-1 или SART-3, SCGB3A2, SCP1, SCP2, SCP3, SSX, SURVIVIN, TEL/AML1, TPI/m, TRP-1, TRP-2, TRP-2/INT2, TPTE и WT. Особенно предпочтительные опухолевые антигены включают CLAUDIN-18.2 (CLDN18.2) и CLAUDIN-6 (CLDN6).
Если, согласно настоящему изобретению, желательно вызвать или повысить иммунный ответ путем использования РНК, как описано в этом документе, антигены или эпитопы, кодированные РНК, или продукты процессинга могут быть представлены белками главного комплекса гистосовместимости (MHC), экспрессированными на антиген-презентирующих клетках, таких как дендритные клетки. Затем MHC пептидный комплекс может распознаваться иммунными клетками, такими как T-клетки, приводя к их активации. Таким образом, предпочтительными клетками, используемыми в сочетании с РНК, кодирующей антигенные белки или пептиды, являются антиген-презентирующие клетки, такие как дендритные клетки.
Таким образом, настоящее изобретение предусматривает варианты осуществления, в которых РНК, кодирующая антиген, вводится в антиген-презентирующие клетки ex vivo, например, антиген-презентирующие клетки, взятые у пациента, для того, чтобы экспрессировать антиген, и антиген-презентирующие клетки, необязательно клонально размноженные ex vivo, «пересаживаются» пациенту, например, тому же самому пациенту. Трансфицированные клетки могут вводиться пациенту при помощи любых способов, известных в данной области техники, предпочтительно в стерильной форме с помощью внутривенного, внутриполостного, внутрибрюшинного или внутриопухолевого введения.
В одном варианте осуществления РНК, кодирующая антиген, может вводиться млекопитающему, в частности, в том случае, если желательно лечение млекопитающего, имеющего болезнь, связанную с антигеном. Та же самая РНК может содержать открытую рамку считывания, кодирующую фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, или может быть дополнительно введена РНК, содержащая открытую рамку считывания, кодирующую фактор вирусного происхождения, содержащий NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus. РНК «пересаживается» в антиген-презентирующие клетки млекопитающих (моноциты, макрофаги, дендритные клетки или другие клетки). Образуется продукт антигенной трансляции РНК, и этот продукт «вывешивается» на поверхности клеток для распознавания T-клетками.
Способы изобретения могут вовлекать антиген-презентирующие клетки для экспрессии РНК, кодирующей антиген. В этих целях способы изобретения могут включать введение РНК, кодирующей антигены, в антиген-презентирующие клетки, такие как дендритные клетки. Для трансфекции антиген-презентирующих клеток, таких как дендритные клетки, может использоваться фармацевтическая композиция, содержащая РНК, кодирующая антиген. Кроме того, пациенту может вводиться средство доставки, которое нацеливает РНК на дендритную или другую антиген-презентирующую клетку, приводя к трансфекции, которая реализуется in vivo.
В некоторых вариантах осуществления не требуется, чтобы фармацевтически активный пептид или белок являлся антигеном, вызывающим иммунный ответ. Подходящие фармацевтически активные белки или пептиды могут быть выбраны из группы, состоящей из цитокинов и белков иммунной системы, таких как иммунологически активные соединения (например, интерлейкины, колониестимулирующий фактор (CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, фактор некроза опухолей (TNF), интерфероны, интегрины, адрессины, селетины, «хоминг» рецепторы, T клеточные рецепторы, иммуноглобулины), гормоны (инсулин, тиреоидный гормон, катехоламины, гонадотропины, трофические гормоны, пролактин, окситоцин, дофамин, бычий соматотропин, лептины и тому подобное), гормоны роста (например, гормон роста человека), факторы роста (например, эпидермальный фактор роста, фактор роста нервов, инсулин-подобный фактор роста и тому подобное), рецепторы факторов роста, ферменты (тканевой активатор плазминогена, стрептокиназа, холестерин биосинтетический или деструктивный, стериодогенные ферменты, киназы, фосфодиэстеразы, метилазы, деметилазы, дегидрогеназы, целлюлазы, протеазы, липазы, фосфолипазы, ароматазы, цитохромы, аденилат- и гуанилатциклазы, нейроамидазы и тому подобное), рецепторы (рецепторы стероидных гормонов, рецепторы пептидов), связывающие белки (гормон роста или белки, связывающие фактор роста, и тому подобное), факторы транскрипции и трансляции, белки, подавляющие рост опухолей (например, белки, ингибирующие ангиогенез), структурные белки (такие как коллаген, фиброин, фибронектин, эластин, тубулин, актин и миозин), белки крови (тромбин, сывороточный альбумин, Фактор VII, Фактор VIII, инсулин, Фактор IX, Фактор X, тканевой активатор плазминогена, белок C, фактор фон Виллебранда, антитромбин III, глюкоцереброзидаза, эритропоэтин, гранулоцитарный колониестимулирующий фактор (GCSF) или модифицированный Фактор VIII, антикоагулянты и тому подобное. В одном варианте осуществления фармацевтически активный белок согласно изобретению является цитокином, который участвует в регулировании лимфоидного гомеостаза, предпочтительно цитокином, который участвует и предпочтительно вызывает или увеличивает развитие, примирование, распространение, дифференцировку и/или выживаемость T-клеток. В одном варианте осуществления цитокин является интерлейкином, например, IL-2, IL-7, IL-12, IL-15, или IL-21.
Клетки, экспрессирующие пептид или белок, как описано в этом документе, могут использоваться в терапевтическом или профилактическом лечении различных болезней, в частности, болезней, при которых предоставление указанного пептида или белка приводит к терапевтическому или профилактическому эффекту. Например, экспрессия антигена, происходящего от вируса, может быть полезна при лечении вирусного заболевания, вызванного указанным вирусом. Экспрессия опухолевого антигена может быть полезна при лечении ракового заболевания, при котором раковые клетки экспрессируют указанный опухолевый антиген.
Термин «болезнь» имеет отношение к ненормальному состоянию, негативно сказывающемуся на организме индивидуума. Болезнь часто рассматривается как медицинское состояние, связанное с определенными симптомами и признаками. Болезнь может быть вызвана факторами, происходящими из внешних источников, таких как инфекционная болезнь, или может быть вызвана внутренними дисфункциями, такими как аутоиммунные болезни.
Согласно изобретения термин «болезнь» также имеет отношение к раковым заболеваниям. Термины «раковая болезнь» или «рак» (медицинский термин: злокачественное новообразование) относится к классу болезней, в котором группа клеток демонстрирует неконтролируемый рост (деление сверх нормальных пределов), инвазия (вторжение и разрушение соседних тканей) и иногда метастазирование (распространение в другие местоположения в организме через лимфу или кровь). Эти три злокачественные свойства раков отличают их от доброкачественных опухолей, которые являются самоограничивающимися и не вторгаются и не метастазируют. Большинство раков образуют опухоль, т.е. увеличение объема или повреждение, образованное ненормальным ростом клеток (называемых неопластическими клетками или опухолевыми клетками), однако не которые, например, лейкемия, нет. Примеры раков включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому, глиому и лейкемию. Конкретнее, примеры таких раков включают рак кости, рак крови, рак легких, рак печени, рак поджелудочной железы, рак кожи, рак головы или шеи, накожную или внутриглазную злокачественную меланому, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, рак предстательной железы, рак матки, карциному половых и репродуктивных органов, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак мочевого пузыря, рак почки, почечно-клеточную карциному, карциному почечной лоханки, новобразования центральной нервной системы (CNS), нейроэктодермальный рак, опухоли спинного мозга, глиому, менингиому и аденому гипофиза. Термин «рак» согласно изобретению также включает метастазы рака.
Термин «инфекционная болезнь» относится к любому заболеванию, которое может передаваться от индивидуума к индивидууму или от организма к организму и вызывается микробным агентом (например, обычная простуда). Примеры инфекционных болезней включают вирусные инфекционные болезни, такие как СПИД (ВИЧ), гепатит A, B или C, герпес, опоясывающий герпес (ветряная оспа), коревая краснуха (вирус краснухи), желтая лихорадка, денге и т.д. флавивирус, вирусы гриппа, геморрагические инфекционные болезни (Марбурга и Эбола вирусы), и тяжелый острый респираторный синдром (SARS), бактериальные инфекционные заболевания, такие как болезнь легионеров (Legionella), болезни, передающиеся половым путем (например, хламидия или гоноррея), язва желудка (Helicobacter), холера (Vibrio), туберкулез, дифтерия, инфекции E.coli, Staphylococci, Salmonella или Streptococci (столбняк); инфекции простейшими патогенами, такими как малярия, летаргический энцефалит, лейшманиоз, токсоплазмоз, т.е. инфекции Plasmodium, Trypanosoma, Leishmania и Toxoplasma; или грибковые инфекции, которые вызываются, например, Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis или Candida albicans.
Термин «аутоиммунное заболевание» относится к любому заболеванию, при котором организм продуцирует иммуногенный (т.е. ответ иммунной системы) ответ на определенный компонент своей собственной ткани. Другими словами, иммунная система теряет свою способность распознавать какую-нибудь ткань или систему в организме как свою, нацеливается на нее и атакует, как если бы она была чужеродной. Аутоиммунные заболевания можно классифицировать на те, при которых преимущественно один орган затрагивается поражается (например, гемолитическая анемия и антииммунный тироидит), и те, при которых процесс аутоиммунного заболевания распространяется через многие ткани (например, системная красная волчанка). Например, полагают, что рассеянный склероз вызывается T-клетками, атакующими оболочки, покрывающие нервные волокна головного и спинного мозга. Это приводит к потере координации, слабости и расфокусированному зрению. Аутоиммунные заболевания известны в данной области техники и включают, например, аутоиммунный тиреоидит (тиреоидит Хашимото), заболевание Грейвса, волчанку, рассеянный склероз, ревматоидный артрит, гемолитическую анемию, антииммунный тироидит, системную красную волчанку, глютеновую болезнь, болезнь Крона, колит, диабет, склеродерму, псориаз и тому подобное.
РНК, описанная в этом документе, также является пригодной для экспрессии T-клеточного рецептора или искусственного T-клеточного рецептора в клетке, в частности, иммунной эффекторной клетки, такой как T-клетка, in vitro или in vivo. Таким образом, в одном варианте осуществления пептид или белок, кодированный РНК, описанной в этом документе, представляет собой одну или более цепей T-клеточного рецептора или искусственного T-клеточного рецептора.
Клетки, созданные инженерным путем, для того, чтобы экспрессировать такой T-клеточный рецептор или искусственный T-клеточный рецептор, пригодны для лечения болезней, характеризующихся экспрессией антигенов, таких как антигены, описанные в этом документе, которые связываются T-клеточным рецептором или искусственным T-клеточным рецептором, в частности, описанных в этом документе болезней. Терапия адоптивным переносом клеток с использованием сконструированных T-клеток, экспрессирующих T-клеточные рецепторным или искусственные T-клеточные рецепторы, является вселяющим надежды терапевтическим подходом. Например, T-клетки пациента могут быть генетически сконструированы (генетически модифицированы) для того, чтобы экспрессировать T-клеточные рецепторы или искусственные T-клеточные рецепторы, специфически направленные на антигены на пораженных клетках пациента, а затем «внедрены» обратно пациенту.
Таким образом, в следующем аспекте настоящее изобретение предоставляет способ продуцирования иммунореактивной клетки, включающий стадию введения в T-клетку или ее предшественника одной или более молекул РНК, кодирующей цепи T-клеточного рецептора или цепь(и) искусственного T-клеточного рецептора, и предоставления фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus в клетку.
Термин «иммунореактивная клетка» или «иммунная эффекторная клетка» в контексте настоящего изобретения относится к клетке, которая выполняет эффекторные функции во время иммунной реакции. «Иммунореактивная клетка» предпочтительно способна связывать антиген такой как антиген, экспрессированный на поверхности клетки или презентированный на поверхности клетки применительно к MHC молекулам, и опосредовать иммунный ответ. Например, такие клетки секретируют цитокины и/или хемокины, убивают микробов, секретируют антитела, узнают инфицированные и раковые клетки и необязательно устраняют такие клетки. Например, иммунореактивные клетки включают T-клетки (цитотоксические T-клетки, хелперные T-клетки, инфильтрирующие опухоль T-клетки), B клетки, клетки натуральные киллеры, нейтрофилы, макрофаги и дендритные клетки. Предпочтительно, в контексте настоящего изобретения «иммунореактивными клетками» являются T-клетки, предпочтительно CD4+ и/или CD8+ T-клетки. Согласно изобретению термин «иммунореактивная клетка» также включает клетку, которая может созревать в иммунную клетку (такая как T-клетка, в частности T хелперная клетка или цитолитическая T клетка) при помощи соответствующего стимулирования. Иммунореактивные клетки включают CD34+ гематопоэтические стволовые клетки, незрелые и зрелые T-клетки и незрелые и зрелые B-клетки. Дифференцировка предшественников T-клеток в цитолитическую T-клетку, под воздействием антигена, сходна с клональной селекцией иммунной системы.
Большинство T-клеток имеет T-клеточный рецептор (TCR), существующий в виде комплекса из нескольких белков. Реально существующий T-клеточный рецептор состоит из двух отдельных пептидных цепей, которые продуцируются от независимых генов T-клеточного рецептора альфа и бета (TCRα и TCRβ) и называются α- и β-TCR цепями. γδ T-клетки (гамма дельта T-клетки) представляют небольшое подмножество T-клеток, которые обладают разным T-клеточным рецептором (TCR) на своей поверхности. Однако, в γδ T-клетках TCR состоит из одной γ-цепи и одной δ-цепи. Эта группа T-клеток намного меньше (2% от всех T-клеток), чем группа αβ T клеток. В предпочтительном варианте осуществления изобретения T-клеточный рецептор содержит α- и β-TCR цепи. РНК, кодирующая α- и β-цепи T-клеточного рецептора, может содержаться на отдельных молекулах нуклеиновой кислоты, т.е., РНК молекулах, или альтернативно, на одной РНК молекуле. Соответственно, экспрессия T-клеточного рецептора в клетке требует котрансфекции отдельных молекул РНК, кодирующих разные цепи T-клеточного рецептора или трансфекции молекулы РНК только одного типа, кодирующей разные цепи T-клеточного рецептора.
Предоставляются сконструированные рецепторы, называемые в данном документе «искусственный T-клеточный рецептор», «химерный антигенный рецептор (CAR)» или «химерный T-клеточный рецептор», которые обеспечивают произвольную специфичность, такую как специфичность моноклонального антитела к иммунной эффекторной клетке, такой как T-клетка. Такие T-клетки не обязательно нуждаются в процессинге и презентации антигена для распознавания клетки-мишени, но в то же время могут распознать любой антиген, присутствующий на клетке-мишени. Согласно изобретению, искусственный T-клеточный рецептор может содержать антиген-связывающий домен, например, антиген-связывающие участки антител и T-клеточных рецепторов, такие как одноцепочечные вариабельные фрагменты (scFv), T-клеточный сигнальный домен, например, эндодомен CD3-дзэта, и необязательно один или более костимулирующих доменов, например, CD28, CD137 (4-1BB), CD134 (OX40), и CD278 (ICOS).
РНК, описанная в этом документе, также является пригодной для перепрограммирования или де-дифференциации соматических клеток в клетки, подобные стволовым, т.е. клетки, имеющие характеристики стволовых клеток, in vitro или in vivo. Это подразумевает транзиентную экспрессию факторов перепрограммирования in vitro или in vivo для того, чтобы инициировать процессы перепрограммирования или де-дифференциации в клетках. Таким образом, в одном варианте осуществления пептид или белок, кодированный РНК, описанной в этом документе, является фактором, обеспечивающим возможность перепрограммирования соматических клеток в клетки, обладающие характеристиками стволовых клеток. Клетки, подобные стволовым, могут предоставляться согласно изобретению без получения эмбрионов или плодов. Де-дифференциация соматических клеток в клетки, обладающие характеристиками стволовых клеток, в частности плюрипотентностью, может осуществляться введением РНК, кодирующей факторы, индуцирующие де-дифференциацию соматических клеток в соматические клетки (также называемые факторами перепрограммирования транскрипции (rTF) или факторами перепрограммирования) и культивированием соматических клеток, дающим возможность клеткам де-дифференцировать. После того, как клетки стали дедифференцированными, эти клетки могут быть подвергнуты воздействию с целью повторной дифференциации в тот же самый или другой тип соматических клеток, такой как нейронный, гематопоэтический, мышечный, эпителиальный и другие типы клеток. Таким образом, такие клетки, подобные стволовым, могут иметь медицинское применение для лечения дегенеративных заболеваний методом «клеточной терапии» и могут использоваться в новых медицинских стратегиях при лечении сердечных, неврологических, эндокринологических, сосудистых, ретинальных, дерматологических, скелетно-мышечных нарушений и других заболеваний.
Соответственно, изобретение также имеет отношение к способу предоставления клеток, обладающих характеристиками стволовых клеток, содержащему стадии (i) предоставления клеточной популяции, содержащей соматические клетки, (ii) предоставления фактора вирусного происхождения, содержащего NSs белок Toscana virus или функциональный вариант NSs белка Toscana virus, в соматические клетки, (iii) введения РНК, кодирующей один или более факторов перепрограммирования в соматические клетки, и (iv) обеспечения возможности развития клеток, обладающих характеристиками стволовых клеток.
В одном варианте осуществления один или более факторов перепрограммирования включают OCT4 и SOX2. Один или более факторов перепрограммирования могут дополнительно включать KLF4 и/или c-MYC и/или NANOG и/или LIN28. В одном варианте осуществления один или более факторов перепрограммирования включают OCT4, SOX2, KLF4 и c-MYC и могут дополнительно включать LIN28 и необязательно NANOG. В одном варианте осуществления один или более факторов перепрограммирования включают OCT4, SOX2, NANOG и LIN28.
В одном варианте осуществления способ дополнительно включает стадию культивирования соматических клеток в присутствии, по меньшей мере, одного ингибитора гистондеацетилазы, при этом, по меньшей мере, один ингибитор гистондеацетилазы предпочтительно содержит вальпроевую кислоту, бутират натрия, трихостатин A и/или скриптаид.
В одном варианте осуществления стадия обеспечения возможности развития клеток, обладающих характеристиками стволовых клеток, включает культивирование соматических клеток в условиях культивирования эмбриональных стволовых клеток.
В одном варианте осуществления характеристики стволовых клеток включают морфологию эмбриональных стволовых клеток.
В одном варианте осуществления клетки, обладающие характеристиками стволовых клеток, имеют нормальный кариотип, демонстрируют теломеразную активность, экспрессируют маркеры клеточной поверхности, являющиеся характерными для эмбриональных стволовых клеток, и/или экспрессируют гены, являющиеся характерными для эмбриональных стволовых клеток.
В одном варианте осуществления клетки, обладающие характеристиками стволовой клетки, демонстрируют плюрипотентный статус.
В одном варианте осуществления клетки, обладающие характеристиками стволовой клетки обладают дифференцировочным потенциалом, чтобы дифференцировать в развитые производные всех трех первичных зародышевых слоев.
В одном варианте осуществления соматические клетки представляют собой фибробласты, такие как фибробласты легких, фибробласты крайней плоти или фибробласты кожи. Предпочтительно, соматические клетки являются человеческими клетками.
В одном варианте осуществления РНК вводится в соматические клетки с помощью электропорации или липофекции. В одном варианте осуществления РНК вводится в соматические клетки повторно.
В одном варианте осуществления введение РНК, кодирующей факторы перепрограммирования, как раскрывается в описании, в соматические клетки, приводит к экспрессии указанных факторов в течение продолжительного периода времени, предпочтительно, по меньшей мере, в течение 10 дней, предпочтительно, по меньшей мере, в течение 11 дней и более предпочтительно, по меньшей мере, в течение 12 дней. Для достижения такой длительной экспрессии, РНК вводится в клетки предпочтительно периодически (т.е. повторно) более чем один раз, предпочтительно при помощи электропорации. Предпочтительно, РНК вводится в клетки, по меньшей мере, два раза, более предпочтительно, по меньшей мере, 3 раза, более предпочтительно, по меньшей мере, 4 раза, даже более предпочтительно, по меньшей мере, 5 раза и до предпочтительно 6 раз, более предпочтительно до 7 раз или даже до 8, 9 или 10 раз, предпочтительно в течение периода времени, по меньшей мере, 10 дней, предпочтительно, по меньшей мере, в течение 11 дней и более предпочтительно, по меньшей мере, в течение 12 дней, чтобы обеспечить экспрессию одного или более факторов в течение продолжительного периода времени. Предпочтительно, периоды времени, проходящие между повторными введениями РНК составляют от 24 часов до 120 часов, предпочтительно от 48 часов до 96 часов. В одном варианте осуществления периоды времени, проходящие между повторными введениями РНК, являются не длиннее, чем 72 часа, предпочтительно не длиннее, чем 48 часов или 36 часов. В одном варианте осуществления до начала следующей электропорации, клеткам обеспечивается возможность восстановления от предыдущей электропорации. В любом случае, условия должны быть выбраны так, чтобы факторы экспрессировались в клетках в количествах и в течение периодов времени, способствующих процессу перепрограммирования.
«Стволовая клетка» это клетка, обладающая способностью самовосстанавливаться, оставаться недифференцированной и становиться дифференцированной. Стволовая клетка может делиться без ограничения, по меньшей мере, в течение продолжительности жизни животного, для которого она свойственна по природе. Стволовая клетка не является терминально дифференцированной; она не находится на конечной стадии пути дифференцировки. Когда стволовая клетка делится, ее дочерняя клетка может или оставаться стволовой клеткой или вступить на путь, который приводит к окончательной дифференцировке.
Тотипотентные стволовые клетки являются клетками, имеющими свойства тотипотентной дифференцировки, и являются способными развиться в целый организм. Клетки обладают этим свойством до 8-клеточной стадии после оплодотворения ооцита сперматозоидом. В том случае, когда эти клетки изолируются и трансплантируются в матку, они могут развиться в целостный организм.
Плюрипотентные стволовые клетки являются клетками, способными развиться в различные клетки и ткани, происходящие из эктодермального, мезодермального и эндодермального слоев. Плюрипотентные стволовые клетки, происходящие из внутренней клеточной массы, локализованной внутри бластоцитов, и образовавшиеся через 4-5 дней после оплодотворения, называются «эмбриональными стволовыми клетками» и могут дифференцироваться в различные клетки других тканей, но не могут образовывать новые живые организмы.
Мультипотентные стволовые клетки являются клетками, дифференцирующимися в норме только в типы клеток, специфичные для ткани или органа их происхождения. Мультипотентные стволовые клетки участвуют не только в росте и развитии различных тканей и органов в ходе зародышевого, неонатального и взрослого периодов, но также в поддержании гомеостаза зрелой ткани, кроме того, они обладают функцией индукции регенерации после повреждения ткани. Тканеспецифичные мультипотентные клетки в совокупности называются «взрослые стволовые клетки».
«Эмбриональные стволовые клетки» или «ESC» являются стволовыми клетками, которые присутствуют в или изолируются из эмбриона. Они могут быть плюрипотентными, обладающими способностью дифференцироваться во все клетки, присутствующие в организме, или мультипотентными, со способностью дифференцироваться более чем в один тип клеток.
При использовании в описании «эмбрион» имеет отношение к животному на ранних стадиях его развития. Эти стадии характеризуются имплантацией и гаструляцией, при которых определяются и устанавливаются три зародышевых листка с последующей дифференцировкой зародышевых листков в соответствующие органы и системы органов. Три зародышевых листка - это эндодерма, эктодерма и мезодерма.
«Бластоциста» - это эмбрион на ранней стадии развития, при которой оплодотворенная яйцеклетка подвергается расщеплению, и формируется или уже сформирован сферический слой клеток, окружающий заполненную жидкостью полость. Этот сферический слой клеток является трофэктодермой. Внутри трофэктодермы находится скопление клеток, называемое внутренней клеточной массой (ICM). Трофэктодерма является предшественником плаценты, а ICM является предшественником эмбриона.
Взрослая стволовая клетка, также называемая соматической стволовой клеткой, является стволовой клеткой, обнаруженной у взрослых особей. Взрослая стволовая клетка обнаруживается в дифференцированной ткани, может возобновлять себя и может дифференцировать, с некоторыми ограничениями, давая специализированные типы клеток ее ткани происхождения. Примеры включают мезенхимельные стволовые клетки, гематопоэтические стволовые клетки и невральные стволовые клетки.
«Дифференцированная клетка» - это зрелая клетка, которая уже прошла прогрессирующие стадии развития и пришла к более специализированной форме или функции. Клеточная дифференцировка - это процесс, которому подвергается клетка, и в ходе которого она созревает до явно специализированного клеточного типа. Дифференцированные клетки имеют различные характеристики, выполняют специфические функции и делятся с меньшей долей вероятности, чем их менее дифференцированные аналоги.
«Недифференцированная» клетка, например, незрелая, эмбриональная или примитивная клетка, как правило, имеет неспецифический внешний вид, может проявлять несколько видов неспецифической активности и может неэффективно, если вообще может, выполнять функции, обычно выполняемые дифференцированными клетками.
«Соматическая клетка» относится ко всем без исключения дифференцированным клеткам и не включает стволовые клетки, зародышевые клетки или гаметы. Предпочтительно, «соматическая клетка» при использовании в описании относится к окончательно дифференцированной клетке. В одном варианте осуществления соматические клетки являются фибробластами, такими как фибробласты легких, фибробласты крайней плоти или фибробласты кожи или кератиноциты.
В одном варианте осуществления соматические клетки являются соматическими клетками, происходящими из эмбриональной стволовой клетки с мезенхимальным фенотипом. В предпочтительном варианте осуществления соматические клетки являются фибробластами, такими как эмбриональные фибробласты или постнатальные фибробласты или кератиноциты, предпочтительно кератиноциты, происходящие из волосяного фолликула. В дополнительных вариантах осуществления фибробласты являются легочными фибробластами, фибробластами крайней плоти или фибробластами кожи. В отдельных вариантах осуществления фибробласты являются фибробластами, депонированными в Американской коллекции типовых структур (ATCC) под кат. № CCL-186, депонированными в Американской коллекции типовых структур (ATCC) под кат. № CRL-2097 или депонированными в Американской коллекции типовых структур (ATCC) под кат. № CRL-2522, размещенными в SBI System Biosciences под кат. № PC501A-HFF, или размещенными в Innoprot под кат. № P10857. В одном варианте осуществления фибробласты являются фибробластами кожи взрослого человека. Предпочтительно, соматические клетки являются человеческими клетками. Согласно настоящему изобретению соматические клетки могут быть генетически модифицированными.
При использовании в описании «коммитированные» относится к клеткам, которые считаются постоянно настроенными на выполнение определенной функции. Коммитированные клетки также называются «терминально-дифференцированными клетками».
При использовании в описании «дифференцировка» имеет отношение к адаптации клеток для конкретной формы или функции. Дифференцировка клеток дает в результате более коммитированную клетку.
При использовании в описании «де-дифференцировка» имеет отношение к потере специализации по форме или функции. Де-дифференцировка клеток дает в результате менее коммитированную клетку.
При использовании в описании «перепрограммирование» относится к переключению генетической программы клетки. Перепрограммированная клетка предпочтительно демонстрирует плюрипотентность.
Термины «де-дифференцированная» и «перепрограммированная» или сходные термины используются в описании взаимозаменяемым образом, чтобы обозначить клетки, происходящие из соматических клеток, обладающих характеристиками стволовых клеток. Однако, указанные термины не предназначаются для ограничения объекта изобретения, раскрытого в описании, при рассмотрении с механистической и функциональной точки зрения.
При использовании в описании «зародышевая клетка» относится к репродуктивной клетке, такой как сперматоцит или ооцит, или клетке, которая разовьется в репродуктивную клетку.
При использовании в описании «плюрипотентная» относится к клеткам, которые могут давать начало любому типу клеток за исключением клеток плаценты или других поддерживающих клеток матки.
Термин «клетки, обладающие характеристиками стволовых клеток,» используется в описании, чтобы обозначить клетки, которые, несмотря на то, что они происходят от дифференцированных соматических нестволовых клеток, демонстрируют один или более признаков, типичных для стволовых клеток, в частности, эмбриональных стволовых клеток. Такие признаки включают морфологию эмбриональной стволовой клетки, например, плотные колонии, высокое ядерно-цитоплазматическое отношение и четко выраженные ядрышки, нормальный кариотип, проявление теломеразной активности, экспрессию маркеров клеточной поверхности, которые являются характерными для эмбриональных стволовых клеток, и/или экспрессию генов, которые являются характерными для эмбриональных стволовых клеток. Маркеры клеточной поверхности, являющиеся характерными для эмбриональных стволовых клеток, например, выбирают из группы, состоящей из этап-специфичного эбрионального антигена-3 (SSEA-3), SSEA-4, связанного с опухолью антигена-1-60 (TRA-1-60), TRA-1-81 и TRA-2-49/6E. Гены, являющиеся характерными для эмбриональных стволовых клеток, выбирают, например, из группы, состоящей из эндогенного OCT4, эндогенного NANOG, гена фактора роста и дифференцировки 3 (GDF3), гена пониженной экспрессии 1 (REX1), гена фактора роста фибробластов 4 (FGF4), гена 1 специфического для эмбриональной клетки (ESG1), гена, связанного с развитием плюрипотентности 2 (DPPA2), DPPA4 и гена обратной транскриптазы теломеразы (TERT). В одном варианте осуществления один или более признаков, типичных для стволовой клетки включают плюрипотентность. В одном варианте осуществления клетки, имеющие характеристики стволовых клеток, демонстрируют плюрипотентный статус. В одном варианте осуществления клетки, имеющие характеристики стволовых клеток, обладают дифференцировочным потенциалом, чтобы дифференцировать в развитые производные всех трех первичных зародышевых слоев. В одном варианте осуществления первичный зародышевый слой является эндодермой, а развитое производное является эпителиальной тканью, подобной ткани кишечника. В следующем варианте осуществления первичный зародышевый слой является мезодермой, а развитое производное является поперечно-полосатой мышцей и/или хрящом. В еще одном варианте осуществления первичный зародышевый слой является эктодермой, а развитое производное является нервной тканью и/или эпидермальной тканью. В одном предпочтительном варианте осуществления клетки, имеющие характеристики стволовых клеток, обладают дифференцировочным потенциалом, чтобы дифференцировать в нервные клетки и/или кардиомиоциты. Согласно изобретению термины «клетки, имеющие характеристики стволовых клеток,» «клетки, обладающие свойствами стволовых клеток,» «подобные стволовым клетки», «перепрограммированные клетки» и «де-дифференцированные клетки» или сходные термины имеют сходное значение и используются в описании взаимозаменяемым образом.
Термин «фактор перепрограммирования» согласно изобретению включает белки и пептиды, а также их производные и варианты, вызывающие необязательно совместно с дополнительными агентами, такими как дополнительные факторы перепрограммирования, перепрограммирование соматических клеток в клетки, имеющие характеристики стволовых клеток. Например, термин «фактор перепрограммирования» включает OCT4, SOX2, NANOG, LIN28, KLF4 и c-MYC.
Факторы перепрограммирования могут быть факторами от любого вида животных; например, млекопитающих и грызунов. Примеры млекопитающих включают, но не ограничиваются этим, человека и приматов, не являющихся человеком. Приматы включают, без ограничения, человека, шимпанзе, бабуина, яванского макака и любых других обезьян Нового или Старого света. Грызуны включают, но не ограничиваются этим, мышь, крысу, морскую свинку, хомяка и песчанку.
В одном варианте осуществления настоящего изобретения факторы перепрограммирования, способные обеспечить перепрограммирование соматических клеток в клетки, обладающие характеристиками стволовых клеток, включают набор факторов, выбранных из группы, состоящей из (i) OCT4 и SOX2, (ii) OCT4, SOX2, и один или оба из NANOG и LIN28, (iii) OCT4, SOX2 и один или оба из KLF4 и c-MYC. В одном варианте осуществления указанные факторы перепрограммирования включают OCT4, SOX2, NANOG и LIN28, OCT4, SOX2, KLF4 и c-MYC или OCT4, SOX2, KLF4, c-MYC, NANOG и LIN28.
OCT4 является транскрипционным фактором из эукариотических POU транскрипционных факторов и индикатором плюрипотентности эмбриональных стволовых клеток. Он представляет собой экспрессированный с материнской стороны октамер-связывающий белок. Согласно наблюдениям, он присутствует в ооцитах, внутренней клеточной массе бластоцитов и также в примордиальной клетке. Ген POU5F1 кодирует OCT4 белок. Синонимы названия гена включают OCT3, OCT4, OTF3 и MGC22487. Присутствие OCT4 в определенных концентрациях является необходимым условием для того, чтобы эмбриональные стволовые клетки оставались недифференцированными. Предпочтительно «OCT4 белок» или просто «OCT4» относится к человеческому OCT4.
Sox2 является членом Sox (SRY-родственный HMG бокс) семейства генов, которые кодируют факторы транскрипции при помощи одного HMG ДНК-связывающего домена. Обнаружено, что SOX2 контролирует нейтральные клетки-предшественники путем ингибирования их способности к дифференциации. Репрессия фактора приводит к отслаиванию от вентрикулярной зоны, за которым следует выход из клеточного цикла. Эти клетки также начинают утрачивать свой характер клеток-предшественников посредством утраты маркеров клеток-предшественников и маркеров ранней нейтральной дифференцировки. Предпочтительно, «SOX2 белок» или просто «SOX2» относится к человеческому SOX2.
NANOG представляет собой ген гомеодомена NK-2 типа, и как предполагается, играет ключевую роль в сохранении плюрипотентности стволовых клеток вероятно путем регулирования экспрессии генов, крайне важных для самообновления и дифференцировки эмбриональных стволовых клеток. NANOG служит в качестве активатора транскрипции вместе с двумя необычайно эффективными доменами активации, лежащими в его C-конце. Уменьшение NANOG экспрессии включает дифференциацию эмбриональных стволовых клеток. Предпочтительно, «NANOG белок» или просто «NANOG» имеет отношение к человеческому NANOG.
LIN28 является консервативным цитоплазматическим белком с необычным спариванием РНК-связывающих мотивов: домен холодового шока и пара «цинковых пальцев» CCHC ретровирусного типа. У млекопитающих он широко распространен в различных типах недифференцированных клеток. В плюрипотентных клетках млекопитающих LIN28 определяется в RNаза-чувствительных комплексах с поли(A)-связывающим белком, и в полисомальных фракциях градиента сахарозы, свидетельствуя о том, что он связан с трансляцией мРНК. Предпочтительно, «LIN28 белок» или просто «LIN28» относится к человеческому LIN28.
Krueppel-подобный фактор (KLF4) является транскрипционным фактором «цинковый палец», который сильно экспрессируется в постмитотических эпителиальных клетках разных тканей, например, толстого кишечника, желудка и кожи. KLF4 необходим для конечной дифференцировки этих клеток и вовлечен в регуляцию клеточного цикла. Предпочтительно, «KLF4 белок» или просто «KLF4» относится к человеческому KLF4.
MYC (cMYC) является протоонкогеном, который сверхэкспрессируется в самых разных видах раков человека. Когда он является мутированным определенным образом или сверхэкспрессируется, он повышает клеточную пролиферацию и функции как онкоген. MYC ген кодирует транскрипционный фактор, который регулирует экспрессию 15% всех генов посредством связывания Enhancer Box последовательностей (E-боксы) и привлечения гистон ацетилтрансфераз (HATs). MYC относится к MYC семейству факторов транскрипции, которое также включает N-MYC и L-MYC гены. MYC-семейство факторов транскрипции содержит bHLH/LZ домен (базовая спираль-петля-спираль лейциновая молния). Предпочтительно, «cMYC белок» или просто «cMYC» относится к человеческому cMYC.
Следует понимать, что ссылка в описании на специфические факторы, такие как OCT4, SOX2, NANOG, LIN28, KLF4 или c-MYC, также включает все варианты этих факторов. В частности, также должно быть понятно, что включаются все сплайс-варианты, посттранслянционно модифицированные варианты, конформации, изоформы и видовые гомологи этих факторов, которые в природных условиях экспрессируются клетками.
Согласно изобретению вариант пептида или белка предпочтительно обладает функциональным свойством пептида или белка, от которого он был получен. Такими функциональными свойствами являются свойства, описанные в этом документе для OCT4, SOX2, NANOG, LIN28, KLF4 и c-MYC, соответственно. Предпочтительно вариант пептида или белка обладает тем же самым свойством перепрограммирования животной дифференцированной клетки, как пептид или белок, от которого он был получен. Предпочтительно, вариант индуцирует или повышает перепрограммирование животной дифференцированной клетки.
«Функциональный набор факторов перепрограммирования» является набором факторов перепрограммирования, пригодным для перепрограммирования соматических клеток в клетки, имеющие характеристики стволовых клеток, т.е., когда набор факторов перепрограммирования экспрессируется в соматических клетках, это является достаточным для осуществления перепрограммирования соматических клеток в клетки, имеющие характеристики стволовых клеток.
В одном варианте осуществления изобретения функциональный набор факторов перепрограммирования может включать больше чем один фактор перепрограммирования, при этом все они должны присутствовать в клетке для того, чтобы получить перепрограммирование. Соответственно, настоящее изобретение включает варианты осуществления, в которых набор РНК молекул, таких как набор РНК репликонов, кодирует разные факторы перепрограммирования. Например, разные РНК молекулы могут содержать разные открытые рамки считывания, кодирующие различные факторы перепрограммирования. Эти разные РНК молекулы, т.е. набор РНК молекул, могут быть совместно инокулированы в клетку, чтобы предоставить функциональный набор факторов перепрограммирования.
Термин «микроРНК» имеет отношение к некодирующим РНК, длиной 21-23 нуклеотидов, обнаруженным в эукариотических клетках, которые вызывая деградацию и/или предотвращая трансляцию целевых мРНК, модулируют множество клеточных функций, включая функции, связанные с ESC самообновлением/дифференцировкой и прохождением по клеточному циклу. микроРНК являются пост-транскрипционными регуляторами, которые связываются с комплементарными последовательностями на целевых матричных РНК транскриптах (мРНК), обычно приводя в результате к трансляционному подавлению или целевой деградации и сайленсигу гена. Обнаружено, что микроРНК в правильной комбинации способны индуцировать прямое перепрограммирование соматических клеток в клетки, имеющие характеристики стволовых клеток in vitro. Например, согласно наблюдениям, микроРНК кластер 302-367 повышает перепрограммирование соматических клеток.
Предпочтительно, стадия, обеспечивающая возможность развития клеток, обладающих характеристиками стволовых клеток, включает культивирование соматических клеток при условиях культивирования эмбриональных стволовых клеток, предпочтительно условий, подходящих для сохранения плюрипотентных стволовых клеток в недифференцированном состоянии.
Предпочтительно, чтобы обеспечить возможность развития клеток, обладающих характеристиками стволовых клеток, клетки культивируются в присутствии одного или более ингибиторов ДНК метилтрансферазы и/или одного или более ингибиторов гистон деацетилазы. Предпочтительные соединения выбирают из группы, состоящей из 5'-азацитидина (5'-azaC), субероиланилидгидроксамовой кислоты (SAHA), дексаметазона, трихостатина A (TSA), бутирата натрия (NaBu), скриптаида и вальпроевой кислоты (VPA). Предпочтительно, клетки культивируются в присутствии вальпроевой кислоты (VPA), предпочтительно в концентрации в пределах от 0,5 до 10 мМ, более предпочтительно в пределах от 1 и 5 мМ, наиболее предпочтительно в концентрации около 2 мМ.
Способы настоящего изобретения могут использоваться для выполнения де-дифференцировки любого типа соматической клетки. Клетки, которые могут использоваться, включают клетки, которые могут быть де-дифференцированы или перепрограммированы способами настоящего изобретения, в частности клетки, которые являются полностью или частично дифференцированными, более предпочтительно окончательно дифференцированными. Предпочтительно, соматическая клетка является диплоидной клеткой, происходящей от предэмбриональных, эмбриональных, фетальных и постнатальных многоклеточных организмов. Примеры клеток, которые могут использоваться, включают, но не ограничиваются этим, фибробласты, такие как фетальные и неонатальные фибробласты или взрослые фибробласты, кератиноциты, в частности первичные кератиноциты, более предпочтительно кератиноциты, полученные из волос, жировые клетки, эпителиальные клетки, эпидермальные клетки, хондроциты, кумулюсные клетки, нервные клетки, глиальные клетки, астроциты, кардиальные клетки, клетки пищевода, мышечные клетки, меланоциты, гематопоэтические клетки, остеоциты, макрофаги, моноциты и мононуклеарные клетки. Примеры клеток, которые могут использоваться, включают полученные из крови эндотелиальные клетки и эндотелиальные клетки-предшественники и полученные из мочи эпителиальные клетки.
Клетки, которые могут использоваться вместе со способами изобретения, могут быть клетками любого вида животных; например, млекопитающих и грызунов. Примеры клеток млекопитающих, которые могут быть де-дифференцированными и ре-дифференцированными с помощью настоящего изобретения, включают, но не ограничиваются этим, клетки человека и клетки приматов, не являющихся человеком. Клетки приматов, которые могут использоваться с данным изобретением, включают, но не ограничиваются этим, клетки человека, шимпанзе, бабуина, яванского макака и любых других обезьян Нового или Старого света. Клетки грызунов, с использованием которых может выполняться изобретение, включают, но не ограничиваются этим, клетки мыши, крысы, морской свинки, хомяка и песчанки.
Ожидается, что де-дифференцированные клетки, полученные согласно настоящему изобретению, демонстрируют многие из тех же требований как плюрипотентные стволовые клетки и могут расти и поддерживаться при условиях, используемых для эмбриональных стволовых клеток, например, в ES клеточной среде или любой среде, которая поддерживает рост эмбриональных клеток. Эмбриональные стволовые клетки сохраняют свою плюрипотентность in vitro, когда поддерживаются на инактивированных фетальных фибробластах, таких как облученные мышиные эмбриональные фибробласты или человеческие фибробласты (например, фибробласты крайней плоти человека, фибробласты кожи человека, фибробласты эндометрия человека, фибробласты маточной трубы человека) в культуре. В одном варианте осуществления человеческие питающие клетки могут быть аутологичными питающим клеткам, полученным из той же самой культуры перепрограммированных клеток путем прямой дифференцировки.
Кроме того, человеческие эмбриональные стволовые клетки могут успешно размножаться на матригеле в среде, кондиционированной мышиными фетальными фибробластами. Человеческие стволовые клетки могут расти в культуре в течение длительных периодов времени и оставаться недифференцированными при специальных условиях культивирования.
В некоторых вариантах осуществления условия культивирования клеток могут включать контактирование клеток с факторами, способными ингибировать дифференцировку или иным образом потенцировать де-дифференцировку клеток, например, предотвращать дифференцировку клеток в не-ES клетки, трофэктодерму или другие типы клеток.
Де-дифференцированные клетки, полученные согласно настоящему изобретению, могут быть оценены с помощью методов, включая мониторинг изменений в фенотипе клеток и характеристику экспрессии их гена и белка. Экспрессию гена можно определить с помощью RT-PCR, а продукты трансляции можно определить с помощью иммуногистохимических методов и вестерн-блоттинга. В частности, де-дифференцированные клетки могут быть охарактеризованы с целью установления профиля экспрессии генов и будут ли перепрограммированные клетки демонстрировать профиль экспрессии генов, сходный с профилем экспрессии, ожидаемым от недифференцированной, плюрипотентной контрольной клетки, такой как эмбриональная стволовая клетка, при помощи методов, хорошо известных в данной области техники, включая транскриптомику.
Экспрессия следующих генов де-дифференцированных клеток может оцениваться в отношении: OCT4, NANOG, LIN28, гена фактора роста и дифференцировки 3 (GDF3), гена пониженной экспрессии 1 (REX1), гена фактора роста фибробластов 4 (FGF4), гена 1 специфического для эмбриональной клетки (ESG1), гена, связанного с развитием плюрипотентности 2 (DPPA2), DPPA4 и гена обратной транскриптазы теломеразы (TERT), эмбрионального антигена-3 (SSEA-3), SSEA-4, опухоль-родственного антигена-1-60 (TRA-1-60), TRA-1-81 и TRA-2-49/6E.
Недифференцированные или эмбриональные стволовые клетки, с которыми можно сравнить перепрограммированные клетки, могут происходить от тех же самых видов, как дифференцированные соматические клетки. Альтернативно, недифференцированные или эмбриональные стволовые клетки, с которыми можно сравнить перепрограммированные клетки, могут происходить из разных видов, как дифференцированные соматические клетки.
В некоторых вариантах осуществления существует сходство набора экспрессирующихся генов между перепрограммированной клеткой и недифференцированной клеткой, например, эмбриональной стволовой клеткой, если определенные гены специфически экспрессированные в недифференцированной клетке также экспрессируются в перепрограммированной клетке. Например, некоторые гены, например, теломеразы, который в большинстве случаев является необнаруживаемым в дифференцированных соматических клетках, могут использоваться для контролирования степени перепрограммирования. Аналогично, для некоторых генов отсутствие экспрессии может использоваться для оценки степени перепрограммирования.
Способность к самообновлению, характеризующаяся индукцией теломеразной активности, является другой характеристикой стволовой клетки, которую можно контролировать в де-дифференцированных клетках.
Кариотипический анализ может осуществляться с помощью хромосомных препаратов из митотических клеток, спектрального кариотипирования, анализа длины теломер, гибридизации полного генома или других методов, хорошо известных в данной области техники.
Используя настоящее изобретение, РНК, кодирующая соответствующие факторы, вносится в одну или более соматических клеток, например, путем электропорации. После внесения клетки предпочтительно культивируются с использованием условий, которые обеспечивают поддержание де-дифференцированных клеток (т.е. условий культивирования стволовых клеток). Затем количество де-дифференцированных клеток может быть увеличено и можно индуцировать ре-дифференцировку клеток в различные типы соматических клеток, необходимых для клеточной терапии. Де-дифференцированные клетки, полученные согласно настоящему изобретению, можно побудить к дифференцировке в один или более желательных типов соматических клеток in vitro или in vivo.
Предпочтительно, де-дифференцированные клетки, полученные согласно настоящему изобретению, могут породить клетки любого из трех эмбриональных зародышевых листков, т.е. эндодермы, мезодермы и эктодермы. Например, де-дифференцированные клетки могут дифференцировать в скелетную мышцу, скелет, дерму кожи, соединительную ткань, мочеполовую систему, сердце, кровь (лимфоциты) и селезенку (мезодерма); желудок, толстую кишку, печень, поджелудочную железу, мочевой пузырь; выстилку мочеиспускательного канала, эпителиальные части трахеи, легкие, глотку, щитовидную железу, паращитовидную железу, кишечник (эндодерма); или центральную нервную систему, черепную и сенсорную, сетчатку и хрусталик, нервные узлы и нервы, пигментные клетки, соединительную ткань головы, эпидермис, волосы, молочные железы (эктодерма). Де-дифференцированные клетки, полученные согласно настоящему изобретению, могут быть ре-дифференцированы in vitro или in vivo при помощи методов, известных в данной области техники.
В одном варианте осуществления настоящего изобретения перепрограммированные клетки, образовавшиеся в результате применения способов данного изобретения, используются для получения дифференцированного потомства. Таким образом, в одном аспекте настоящее изобретение предоставляет способ получения дифференцированных клеток, включающий: (i) получение перепрограммированных клеток при помощи способов этого изобретения; и (ii) стимулирование дифференцировки перепрограммированных клеток для получения дифференцированных клеток. Стадия (ii) может осуществляться in vivo или in vitro. Кроме того, дифференцировка может быть вызвана присутствием соответствующих факторов дифференцировки, которые могут быть добавлены или присутствуют in situ, например, в организме, органе или ткани, в которую перепрограммированные клетки были внесены. Дифференцированные клетки могут использоваться с целью получения клеток, тканей и/или органов, предпочтительно используемых в области трансплантации клеток, тканей и/или органов. При необходимости могут быть внесены генетические модификации, например, в соматические клетки до перепрограммирования. Дифференцированные клетки настоящего изобретения предпочтительно не сохраняют плюрипотентность эмбриональной стволовой клетки или эмбриональной зародышевой клетки, и являются, в сущности, ткане-специфическими частично или полностью дифференцированными клетками.
Одно преимущество способов настоящего изобретения заключается в том, что перепрограммированные клетки, полученные с помощью настоящего изобретения, можно подвергнуть дифференцировке без предварительной селекции или очистки или создания клеточной линии. Соответственно в некоторых вариантах осуществления гетерогенная популяция клеток, содержащая перепрограммированные клетки, дифференцируется в желательный тип клеток. В одном варианте осуществления смесь клеток, полученная способами настоящего изобретения, подвергается воздействию одного или более факторов дифференцировки и культивируется in vitro.
Способы дифференцировки перепрограммированных клеток, полученных способами, описанными в этом документе, могут содержать стадию пермеабилизации перепрограммированных клеток. Например, клетки, созданные методами перепрограммирования, описанными в данном документе, или альтернативно гетерогенная смесь клеток, содержащих перепрограммированные клетки, может быть пермеабилизирована до воздействия одного или более факторов дифференцировки или клеточного экстракта или другого препарата, содержащего факторы дифференцировки.
Например, дифференцированные клетки можно получить путем культивирования недифференцированных перепрограммированных клеток в присутствии, по меньшей мере, одного фактора дифференцировки и отбора дифференцированных клеток из культуры. Селекция дифференцированных клеток может основываться на фенотипе, таком как экспрессия определенных клеточных маркеров, присутствующих на дифференцированных клетках, или на функциональных анализах (например, способности осуществлять одну или более функций отдельного дифференцированного клеточного типа).
В другом варианте осуществления перепрограммированные клетки согласно настоящему изобретению являются генетически модифицированными посредством вставки, делеции или модификации их ДНК последовательности(ей).
Перепрограммированные или де-дифференцированные клетки, полученные согласно настоящему изобретению, или клетки, происходящие от перепрограммированных или де-дифференцированных клеток, пригодны для применения в исследованиях и в терапии. Перепрограммированные плюрипотентные клетки могут быть дифференцированы в любые клетки в организме, включая, без ограничения, клетки кожи, хряща, кости, скелетных мышц, сердечной мышцы, почечные, гепатические клетки, клетки крови и кроветворные клетки, клетки-васкулярные предшественники, клетки эндотелия сосудов, бета-клетки поджелудочной железы, нервные, глиальные, ретинальные, нейрональные, интестинальные, легочные клетки и клетки печени.
Перепрограммированные клетки пригодны для регенеративной/репаративной терапии и могут трансплантироваться пациенту, нуждающемуся в этом. В одном варианте осуществления клетки являются аутологичными по отношению к пациенту.
Перепрограммированные клетки, предоставленные в соответствии с настоящим изобретением, могут использоваться, например, при лечении сердечных, неврологических, эндокринологических, сосудистых, ретинальных, дерматологических, скелетно-мышечных нарушений и других заболеваний.
Например, и без ограничения, перепрограммированные клетки настоящего изобретения могут использоваться для восполнения клеток у животных, чьи природные клетки исчерпаны вследствие возраста или подавляющей терапии, такой как радиотерапия и химиотерапия рака. В другом неограничивающем примере перепрограммированные клетки настоящего изобретения применяются в регенерации органа и восстановлении ткани. В одном варианте осуществления настоящего изобретения перепрограммированные клетки могут использоваться для возобновления поврежденной мышечной ткани, включая дистрофичные мышцы и мышцы, поврежденные ишемическими событиями, такими как инфаркт миокарда. В другом варианте осуществления настоящего изобретения перепрограммированные клетки, раскрытые в описании, могут использоваться для улучшения рубцевания ткани у животных, включая людей, после травматического повреждения или хирургической операции. В этом варианте осуществления перепрограммированные клетки настоящего изобретения вводятся систематически, например, внутривенно, и мигрируют к месту только что травмированной ткани, привлеченные циркулирующими цитокинами, секретируемыми поврежденными клетками. В другом варианте осуществления настоящего изобретения перепрограммированные клетки могут вводиться локально в точку приложения терапии, нуждающуюся в репарации или регенерации.
Агенты, описанные в этом документе, такие как нуклеиновые кислоты, в частности РНК, и клетки, в частности при использовании в вариантах лечения, описанных в этом документе, могут присутствовать в форме фармацевтической композиции или набора, содержащего агент и необязательно один или более фармацевтически приемлемых носителей, разбавителей и/или эксципиентов.
Фармацевтические композиции предпочтительно являются стерильными и содержат эффективное количество нуклеиновой кислоты.
Фармацевтические композиции в большинстве случаев предоставляются в стандартной лекарственной форме и могут быть приготовлены способом, известным в данной области техники. Фармацевтическая композиция может быть, например, в форме раствора или суспензии.
Фармацевтическая композиция может содержать соли, буферные вещества, консервирующие вещества, носители, разбавители и/или эксципиенты, которые предпочтительно являются фармацевтически приемлемыми. Термин «фармацевтически приемлемый» имеет отношение к нетоксичности материала, который не вмешивается в действие активного компонента(ов) фармацевтической композиции.
Соли, не являющиеся фармацевтически приемлемыми, могут использоваться для получения фармацевтически приемлемых солей и включаются в изобретение. Фармацевтически приемлемые соли такого рода включают, неограничивающим образом, соли, полученные из следующих кислот: хлористоводородной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоновой, янтарной кислоты и тому подобных. Фармацевтически приемлемые соли также могут быть приготовлены в виде солей щелочных металлов или солей щелочно-земельных металлов, таких как соли натрия, соли калия или соли кальция.
Подходящие буферные вещества, подходящие для использования в фармацевтической композиции, включают уксусную кислоту в виде соли, лимонную кислоту в виде соли, борную кислоту в виде соли и фосфорную кислоту в виде соли.
Подходящие для использования в фармацевтической композиции консервирующие вещества включают бензалкония хлорид, хлорбутанол, парабен и тимеросал.
Термин «носитель» относится к органическому или неорганическому компоненту, природного или неприродного (искусственного) происхождения, с которым комбинируется активный компонент с целью способствовать, увеличить или обеспечить применение. Согласно изобретению термин «носитель» также включает один или более совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые пригодны для введения пациенту.
Возможными веществами-носителями для парентерального введения являются, например, стерильная вода, растворы глюкозы, Рингера, лактата Рингера, стерильный раствор хлорида натрия, полиалкиленгликоли, гидрогенизированные нафталины и, в частности, биосовместимые лактидные полимеры, сополимеры лактид/гликолид или сополимеры полиоксиэтилен/полиоксипропилен.
Термин «эксципиент», использованный в описании, имеет целью отметить все вещества, которые могут присутствовать в фармацевтической композиции и которые не являются активными ингредиентами, такие как, например, носители, связывающие вещества, смазывающие вещества, загущающие вещества, поверхностно-активные вещества, консервирующие вещества, эмульгирующие вещества, буферы, ароматизирующие вещества или красящие вещества.
Фармацевтические композиции, описанные в данном документе, могут быть введены любым общепринятым путем, например, путем парентерального введения, включая инъекцию или инфузию. Введение предпочтительно является парентеральным, например, внутривенным, внутриартериальным, подкожным, в лимфатический узел, внутрикожным или внутримышечным.
Композиции, подходящие для парентерального введения обычно содержат стерильный водный или безводный препарат активного соединения, который предпочтительно является изотоническим с кровью реципиента. Примерами совместимых носителей и растворителей являются раствор Рингера и изотонический раствор хлорида натрия. В дополнение к этому, как правило, стерильные жирные масла используются в качестве среды для раствора или суспензии.
Средства и композиции, описанные в этом документе, предпочтительно вводятся в эффективных количествах. «Эффективное количество» имеет отношение к количеству, которое обеспечивает желательную реакцию или желательный эффект отдельно или вместе с дополнительными дозами. В случае лечения конкретной болезни или определенного состояния желательная реакция предпочтительно имеет отношение к ингибированию течения болезни. Сюда включается замедление прогрессирования болезни, в частности, прерывание и изменение направления течения процесса болезни на противоположное. Желательной реакцией при лечении болезни или состояния также может быть задержка начала или предотвращение начала указанной болезни или указанного состояния.
Эффективное количество средства или композиции, описанной в этом документе, будет зависеть от состояния, требующего лечения, тяжести заболевания, индивидуальных параметров пациента, включая возраст, физиологическое состояние, размер и вес, продолжительности лечения, типа сопроводительной терапии (если имеется), конкретного способа введения и сходных факторов. Соответственно, вводимые дозы агентов, описанных в этом документе, могут зависеть от этих параметров. В том случае, когда реакция у пациента является недостаточной при использовании первоначальной дозы, может использоваться более высокая доза (или более высокая доза практически достигается путем использования другого, более локализованного способа введения).
Настоящее изобретение далее подробно описывается при помощи следующих фигур и примеров, которые следует рассматривать только в качестве иллюстрации, а не в качестве ограничения. На основе описания и примеров для квалифицированных специалистов становятся доступными дополнительные варианты осуществления, которые равным образом попадают в рамки изобретения.
Краткое описание фигур
Фигура 1. NSs может заменить EKB для ингибирования IFN-ответа на синтетическую мРНК в фибробластах человека.
Фигура 2. NSs обеспечивает перепрограммирование на РНК-основе.
Фигура 3. NSs ингибирует IFN-ответ на SFV-самореплицирующуюся РНК и предотвращает активацию протеинкиназы R.
Фигура 4. NSs повышает уровень трансфекции при использовании VEEV самореплицирующейся РНК, повышает трансляцию и блокирует IFN-ответ.
Фигура 5. NSs повышает экспрессию VEEV транс-репликонов и ингибирует IFN-ответ.
Фигура 6. NSs повышает экспрессию трансрепликона в иммунных клетках.
Фигура 7. NSs повышает экспрессию VEEV транс-реплицирующейся и самореплицирующейся РНК в иммунных клетках и предотвращает клеточную смерть.
Примеры
Пример 1. NSs может заменить EKB для ингибирования IFN-ответа на синтетическую мРНК в фибробластах человека
Получение индуцированных плюрипотентных стволовых (iPS) клеток заключает в себе серьезную возможность освободить изучение стволовых клеток от этических вопросов, связанных с использованием человеческих эмбриональных стволовых (hES) клеток. Непрерывная экспрессия экзогенных ассоциированных с плюрипотентностью транскрипционных факторов (TF) до тех пор, пока плюрипотентность обеспечивается эндогенной сетью плюрипотентности, является, таким образом, главным условием для обеспечения перепрограммирования соматических клеток. Относительно перехода к клиническому применению iPS-технологии, крайне необходимо преодолеть любой риск геномной интеграции в геном клеток-мишеней. Вследствие этого синтетическая мРНК вероятно является самым подходящим вектором, поскольку синтетическая мРНК является строго транзиентной, и сложные РНК смеси могут быть легко трансфицированы в соматические клетки. Тем не менее, синтетическая мРНК распознается клеточными рецепторами, которые могут различать характерные молекулярные паттерны, отличающиеся от клеточных РНК. Это приводит к защитным механизмам клетки, что влечет за собой апоптоз, перестройку цитоскелета, деградацию РНК и выключение трансляции, которая препятствует успешному перепрограммированию клеток. Мы смогли создать подход к перепрограммированию на основе немодифицированной РНК, в котором используются белки уклонения вируса E3, K3 и B18R (EKB), чтобы препятствовать IFN-ответу клетки, обеспечивая возможность успешного перепрограммирования человеческих фибробластов и разрастающихся эндотелиальных клеток-предшественников из крови (EPCs) (Hum Gene Ther. 2015 Nov;26(11):751-66). Было показано, что белок уклонения вируса NSs Toscana virus является эффективным ингибитором IFN-ответа. В данной работе мы изучали воздействие NSs на IFN-ответ человеческих фибробластов. На первом этапе анализировали воздействие NSs на экспрессию репортерного гена (GFP), уменьшение IFN-ответа генов (OAS1/IFNβ) и выживаемость клеток после ежедневных липофекций в сравнении с золотым стандартом EKB.
Первичные фибробласты крайней плоти человека (HFFs, System Bioscience) высевали в 6 лунок (100000 клеток/лунку) и подвергали липофекции на следующий день, используя 6 мкл RNAiMAX (Invitrogen) и 1,4 мкг немодифицированной синтетической мРНК (in vitro транскрибированной). Таким образом, смеси синтетических мРНК состояли из 0,8 мкг зеленого флуоресцентного белка (GFP) вместе с различными смесями белков IFN- уклонения E3 (E), K3 (K), B18R (B) и/или NSs (N), как показано на фигуре 1A. Использовали 0,2 мкг синтетической мРНК каждого белка IFN-уклонения, а синтетическую мРНК, кодирующую люциферазу (Luc), использовали, чтобы довести смеси до 1,4 мкг. Липофекции проводили согласно инструкциям производителей. Клетки собирали через 24 часа после трансфекции и половину клеток использовали для анализа GFP экспрессии с помощью FACS. Было показано, что все образцы были липофектированы одинаково с эффективностью трансфекции 91-96% (фигура 1A, левая панель). Мы наблюдали ~3-кратное увеличение GFP мРНК трансляции при котрансфицировании с EKB. Это увеличение было немного ниже, когда N использовали в отдельности, и немного выше при котрансфекции с EN. Дополнительные белки IFN-уклонения (K и B) не повышали дополнительно трансляцию GFP мРНК.
Остальную часть клеток из предыдущего эксперимента осаждали центрифугированием, изолировали общую РНК и количественно определяли мРНК-экспрессию IFNβ и OAS1 с помощью qRT-PCR (фигура 1B). Как и ожидалось, EKB способен снижать индукцию IFNβ и OAS1 экспрессию при помощи синтетической мРНК при котрансфекции. Это также может достигаться с одним N, а еще лучше в случае IFNβ индукции. N в комбинации с другими белками уклонения вирусов (EKB) уменьшал IFN-ответ клетки на синтетическую мРНК до минимума.
HFFs высевали в 6 лунок (100000 клеток/лунку) и подвергали липофекции в течение трех последовательных дней, используя 6 мкл RNAiMAX (Invitrogen) и 1,4 мкг синтетической мРНК. Смеси синтетической мРНК, таким образом, состояли из 0,8 мкг GFP вместе с различными смесями белков IFN-уклонения E3 (E), K3 (K), B18R (B) и / или NSs (N), как указано на фигуре 1C. Использовали 0,2 мкг синтетической мРНК каждого белка IFN- избегания, и синтетическую мРНК, кодирующую люциферазу (Luc), использовали, чтобы довести смеси до 1,4 мкг. Липофекции проводили согласно инструкциям производителей. Через 24часа после последней липофекции оценивали жизнеспособность клеток с использованием набора Cell Proliferation Kit II (Roche) и нормализации относительно ложно-трансфицированных клеток. Как и ожидалось, клетки погибали после повторной трансфекции синтетической мРНК. От этого можно избавиться путем котрансфекции с EKB. Неожиданно, N в отдельности был также способен повысить выживаемость клеток и, следовательно, мог заменить EKB. При комбинировании с E3 наблюдался также слабый пролиферативный эффект.
Клетки из предыдущего эксперимента осаждали центифугированием через 24 часа после последней трансфекции, изолировали общую РНК и количественно определяли мРНК-экспрессию IFNβ и OAS1 при помощи qRT-PCR (фигура 1D). В соответствии с анализом выживаемости, показанном на фигуре 1C, EKB значительно снижает индуцию IFNβ и OAS1 с помощью синететической мРНК. Это также может достигаться, когда EKB заменяется одним N. Если N комбинируется с другими белками уклонения вирусов, IFN-ответ клеток почти что гасится.
Эти результаты показывают, что NSs может заменить EKB в рамках ингибирования IFN-ответа на синтетическую мРНК в человеческих фибробластах. NSs в отдельности способен препятствовать снижению трансляции, он ингибирует активацию генов IFN-ответа и предотвращает снижение жизнеспособности клеток.
Пример 2. NSs обеспечивает перепрограммирование на основе РНК
Как показано в Примере 1, NSs может заменить EKB при ингибировании IFN-ответа на синтетическую мРНК в человеческих фибробластах. Как было сказано выше, ранее мы разработали подход перепрограммирования на основе РНК, в котором используются белки уклонения вируса E3, K3 и B18R (EKB) для того, чтобы препятствовать IFN-ответу клетки, обеспечивая успешное перепрограммирование человеческих фибробластов и «разрастание» эндотелиальных клеток-предшественников из крови (EPCs) в человеческие индуцированные плюрипотентные стволовые (iPS) клетки (Hum Gene Ther. 2015 Nov;26(11):751-66). В этом примере мы исследовали, способны ли NSs в отдельности способствовать РНК-основанному перепрограммированию человеческих фибробластов.
Фигура 2A показывает временные рамки перепрограммирования первичных фибробластов кожи человека (HDFs, Innoprot). 40000 клеток высевали в 12-луночные планшеты и после 4 часов культивирования подвергали липофекции в течение четырех последовательных дней при помощи смесей синтетических мРНК, которые состояли из 0,33 мкг немодифицированной синтетической мРНК, кодирующей транскрипционные факторы перепрограммирования (TF) OCT4, SOX2, KLF4, cMYC, NANOG и LIN28 (O3SKMNL), (3:1:1:1:1:1) с использованием 0,08 мкг каждого B18R, E3 и K3 (EKB) или 0,24 мкг NSs (N) в отдельности и в обоих случаях с использованием 0,17 мкг смеси микроРНК, состоящей из микроРНК 302a-d и 367 (1:1:1:1:1). Клетки культивировали в среде для эмбриональных стволовых клеток человека (hES) (NutriStem media, Stemgent) и проводили липофекцию с использованием 2,5 мкл RNAiMAX (Life Technologies) на 12 лунок согласно инструкциям производителя. Начиная с 9 дня наблюдали образование колоний, анализ колоний проводили на день 0.
Сформировавшиеся колонии были окрашены в отношении щелочной фосфатазы (AP) на день 10 с использованием набора AP Staining Kit (SBI) согласно инструкциям производителя. Для общего представления характерные примеры окрашивания показаны на фигуре 2B. Стало очевидным, что образование AP положительных колоний (красный/черный) является почти сходным, когда EKB или N используется отдельно.
AP положительные колонии из двух независимых экспериментов были подсчитаны и показаны на фигуре 2C как среднее количество колоний ± SD (n=2). Данные подтвердили результаты из обзора: РНК-основанное перепрограммирование фибробластов человека в iPS клетки может осуществляться с использованием EKB или NSs в отдельности со сходной эффективностью перепрограммирования.
Морфология полученных в результате iPS-клеточных колоний при использовании одного NSs вместо EKB была сходна с морфологией hES с плотноупакованными небольшими клетками в отдельных колониях и четко определенными границами (фигура 2D). Эти колонии могут быть равным образом окрашены положительно в отношении AP (фигура 2E) (красный/черный) и hES маркера клеточной поверхности TRA-1-81 (фигура 2F) (зеленый/белый). TRA-1-81 прижизненное окрашивание проводили с использованием Stain-Alive TRA-1-81 антитела (Stemgent) согласно инструкциям производителей. Показаны изображения характерных колоний.
Чтобы дополнительно оценить плюрипотентность колоний, клетки осаждали центрифугированием, изолировали общую РНК и количественно определяли мРНК-экспрессию hES-маркеров OCT4 (эндогенный), NANOG (эндогенный), LIN28 (эндогенный), TERT и REX1 количественно определяли с помощью qRT-PCR. мРНК экспрессия была нормализована относительно экспрессии HPRT и показана как средняя кратная индукция ± SD (n=2) по сравнению с уровнями транскрипта введенных клеток. Все анализируемые маркеры были высоко экспрессированными по сравнению с введенными клетками, показывая плюрипотентность перепрограммированных клеток. И в этом случае не наблюдалось достоверного различия, наблюдаемого в том случае, когда использовали один NSs вместо EKB, чтобы способствовать РНК-основанному перепрограммированию фибробластов человека (фигура 2G).
NSs способен уменьшать IFN-ответ фибробластов человека на синтетическую мРНК до сходной степени как в случае использования трех белков уклонения вируса E3, K3 и B18R. Это обеспечивает возможность неоднократных трансфекций РНК-основанного коктейля перепрограммирования, что приводит к успешному перепрограммированию фибробластов человека в человеческие iPS клетки. Успешное перепрограммирование клеток с использованием одного NSs вместо EKB было при этом подтверждено морфологией, подобной hES-клеткам, AP-активностью и экспрессией hES-поверхностноклеточных и эндогенных маркеров полученных iPS-клеточных колоний. Было показано, что эффективность перепрограммирования и качество перепрограммирования с использованием NSs были не хуже обеспеченного EKB РНК-основанного перепрограммирования.
Пример 3. NSs ингибирует IFN-ответ на SFV-самореплицирующуюся РНК и предотвращает активацию протеинкиназы R
Фибробласты крайней плоти человека высевали в 6-луночные планшеты и трансфицировали на следующий день. С этой целью 2,5мкг GFP кодирующей самореплицирующейся РНК (вирусное происхождение от вируса леса Семлики), или 1,25мкг самореплицирующейся РНК вместе с 1,25мкг мРНК, кодирующей или E3 вируса осповакцины или NSs Toscana virus, объединяли в составе MessengerMax и добавляли в клетки. Клетки собирали через 17 часов после трансфекции и использовали, чтобы определить ответ интерферонов с помощью qPCR (повышенная регуляция IFNβ и OAS1) и PKR-деградацию и активацию с помощью иммуноблоттинга по сравнению с общим PKR и аутофосфорилированным PKR (p-PKR). NSs приводил к более выраженному снижению IFN-ответа, чем E3 (фигура 3A). NSs сверхэкспрессия снижала PKR экспрессию по сравнению с нетрансфицированными (untr.) клетками, клетками, трансфицированными с использованием одного репликона или репликона +E3. Однако, он не предотвращает активацию остального PKR (фигура 3B). Фигура 3C показывает денситометрическое определение по интенсивности полос PKR-блота.
Пример 4. NSs повышает уровни трансфекции при использовании VEEV самореплицирующейся РНК, повышает трансляцию и блокирует IFN-ответ
Фибробласты крайней плоти человека высевали в 6-луночные планшеты и на следующий день трансфицировали. С этой целью 1,1мкг GFP кодирующей самореплицирующейся РНК (вирусного происхождения, вирус Венесуэльского конского энцефалита) и 1,4мкг мРНК, кодирующей или инфракрасный флуоресцентный белок (iRFP) или E3 вируса осповакцины или NSs Toscana virus, были собраны в состав MessengerMax, который добавили в клетки. Через 24 часа клетки собрали, чтобы определить уровни трансфекции с помощью проточной цитометрии и ответ интерферона с помощью qPCR (повышенная регуляция IFNb и OAS1). Проточный цитометрический анализ показал повышенный уровень трансфекции после котрансфекции E3 и NSs (untr. = нетрансфицированные клетки) (фигура 4A,B). Котрансгенный перенос NSs приводит к более выраженному снижению IFN-ответа, чем котрансгенный перенос E3 (фигура 4C).
Пример 5. NSs повышает экспрессию VEEV транс-репликонов и ингибирует IFN-ответ
Фибробласты крайней плоти человека были подвергнуты электропорации с использованием 1,4мкг мРНК, кодирующей VEEV репликазу, 0,3мкг транс-реплицирующейся РНК, кодирующей GFP, и 0,3мкг транс-реплицирующейся РНК, кодирующей люциферазу. Чтобы ингибировать интерфероновый ответ, к образцам добавили 2мкг NSs мРНК, E3 мРНК или E3 и B18 мРНК (1мкг каждого). Через 24 часа клетки собирали, чтобы проанализировать GFP экспрессию с помощью проточной цитометрии (фигура 5A) и интерфероновый ответ с помощью qPCR (активация IFNb и OAS1) (фигура 5B). Кроме того, экспрессию люциферазы оценивали в течение 5 дней в указанные временные точки, показанные на фигуре 5C.
NSs повышает экспрессию не хуже комбинации E3 и B18 и сравнительно ингибирует IFN ответ.
Пример 6. NSs улучшает экспрессию трансрепликона в иммунных клетках
Покоящиеся периферические CD8 положительные человеческие T-клетки были подвергнуты электропорации с использованием 5мкг мРНК, кодирующей VEEV репликазу, и 5 мкг транс-реплицирующейся РНК, кодирующей люциферазу. Чтобы ингибировать интерфероновый ответ, к образцам добавляли 5мкг NSs мРНК или E3 мРНК. Экспрессию люциферазы оценивали в указанные временные точки, показанные на фигуре 6A.
Человеческие периферические незрелые дендритные клетки были подвергнуты электропорации с использованием 1,4 мкг мРНК, кодирующей VEEV репликазу, 0,3мкг транс-реплицирующейся РНК, кодирующей люциферазу, и 0,3мкг транс-реплицирующейся РНК, кодирующей GFP. Чтобы ингибировать интерфероновый ответ, к образцам добавляли 2 мкг NSs мРНК или E3 мРНК. Экспрессию люциферазы оценивали в указанные временные точки, показанные на фигуре 6B.
Пример 7. NSs улучшает экспрессию VEEV транс-реплицирующейся и само-реплицирующейся РНК в иммунных клетках и предотвращает клеточную смерть.
(A) Человеческие периферические незрелые дендритные клетки были подвергнуты липофекции при помощи MessengerMax (Invitrogen) в 96-луночных планшетах с использованием 25 нг общей РНК на лунку. 3 нг трансреплицирующейся РНК, кодирующей люциферазу, котрансфицировали с или без 12 нг мРНК, кодирующей VEEV репликазу (+Rep), и 10 нг мРНК, кодирующей GFP (+GFP), или ингибитором NSs (+NSs), как указано. Экспрессию люциферазы оценивали в указанные временные точки (BrightGlo Assay; Promega). (B) Также была оценена жизнеспособность трансфицированных клеток (CellTiterGlo assay; Promega), которую наносили на график в зависимости от жизнеспособности нетрансфицированных клеток. (C, D) Одновременно, клетки также были трансфицированы 10 нг VEEV-репликоном, кодирующим люциферазу, и или GFP или NSs. Экспрессию люциферазы (C) и жизнеспособность (D) прослеживали в течение 72 часов после липофекции.
В дендритных клетках NSs продлевает экспрессию само- и транс-реплицирующейся РНК и ингибирует клеточную смерть.


Реферат
Настоящее изобретение относится к области биотехнологии, в частности к новым способам повышения экспрессии белка в клетках. Изобретение описывает фактор вирусного происхождения, который при предоставлении в клетки, например, путем трансфекции клеток РНК, кодирующей фактор вирусного происхождения, увеличивает экспрессию РНК, кодирующей пептид или белок. 2 н. и 11 з.п. ф-лы, 7 ил., 7 пр.

Комментарии