Способ очистки поверхностного антигена вируса гепатита b, содержащего пре s2 пептид, из рекомбинантных клеток дрожжей, вакцина для иммунизации против гепатита b - RU2122430C1
Код документа: RU2122430C1
Чертежи
Описание
Настоящее изобретение относится к способу очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид; и более конкретно к способу очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид из рекомбинантной дрожжевой клетки, который включает стадию разрыва клетки, и где потере пре S2 пептида препятствует использование хаотропной соли, с последующей экстракцией, осаждением, адсорбцией на ангидриде кремния и колоночной хроматографией.
Предпосылки изобретения
Гепатит B является одним из наиболее распространенных в мире заболеваний и считают, что
приблизительно 200 - 300 миллионов людей являются носителями вируса гепатита В ("HBV"). Заражение HBV часто развивается в цирроз печени и печеночно-клеточный рак, что может привести к смерти.
До настоящего времени не было получено средство лечения гепатита B, и поэтому было уделено особое внимание получению вакцин.
Blumberg и др. выделили Австралийский антиген из крови больных гепатитом B в 1955 г.; и Krugman и др. опубликовали в 1971 г. метод активной иммунизации, использующий термообработанную сыворотку человека, содержащую HBV, дающий возможность получать вакцины против гепатита B. После этого на рынке появилось первое поколение вакцин против гепатита B, которые готовились отделением и очисткой поверхностного антигена вируса гепатита B (HBsAg) из плазмы крови больных гепатитом B (M.R. Hilleman и др. Develop. Bio. Standart, 54, 3 - 12 (1983)).
Однако вакцины, полученные из плазмы крови, имеют ряд недостатков: их способы очистки и инактивации трудоемки и требуют больших затрат, запасы человеческой крови ограничены и привитый субъект может быть заражен патогенами из источника крови.
Соответственно с тем, чтобы решить упомянутые проблемы, в разработке вакцин против гепатита B пытались применить методы генной инженерии.
Например, Valenguela и др. разработали способ получения HBsAg в дрожжах (Nature, 293, 347 - 350 (1982)). Рекомбинантный HBsAg (r-HBsAg) состоит преимущественно из S белка (P25), имеющего 226 аминокислот, и при очистке он образует частицы поверхностного антигена, которые почти идентичны частицам HBsAg, отделенным от плазмы крови.
K. H. Heermann и др. заявили, что белок вирусной оболочки гепатита B содержит значительные количества L-белка (пре S1 + пре S2 + S : p 39) и M-белка (пре S2 + S : p31), а также S-белок (J. Virol. Nov., 396 - 402 (1984)). Как известно, пре S1 пептид играет важную роль во влиянии вируса гепатита B на печень после его внедрения в человеческое тело. В экспериментах на животных было доказано, что пре S2 пептид, который состоит из 55 аминокислот, помогает образованию антител против поверхностного антигена. (D.R. Milich и др. Proc. Natl. Acad. Sci., США, 82, 8168 - 8172 (1985)).
Кроме того, известно, что антитела, выработанные против пре S2 пептида, демонстрируют защитную активность против вирусной инфекции (Y. Ito и др., Proc. Natl. Acad. Sci., США, 83, 9174 - 9178 (1986)). Поэтому вакцина, содержащая пре S2 пептид, может быть полезна лицу, которое не может вырабатывать антитела против пре - существующего поверхностного антигена. Разработка такой вакцины также важна для защиты против заражения недавно открытыми вариантами вируса гепатита B.
Однако поскольку пре S пептид очень чувствителен к протеазам, присутствующим в дрожжевой клетке, получение поверхностного антигена вируса гепатита B, содержащего пре S пептид, столкнулось с различными трудностями. Чтобы их преодолеть Kobayashi и др. получили вакцину, которая готовится путем генетической модификации чувствительной к протеазе области между пре S2 и S пептидами (J. Bacteriology, 8, 1 - 22(1988)); и патент США N 4742158 раскрывает способ получения вакцины, содержащей пре S пептид, в котором пептид защищен от разрушения протеазой использованием ингибитора протеазы на стадии разрыва клетки. Однако действие генетической модификации Kobayashi и др. на активность пре S2 пептида не было охарактеризовано полностью, и последний способ не представляется практичным, поскольку в способе массовой очистки использовать ингибиторы протеазы слишком дорого. Кроме того, уровень пре S2 пептида нельзя сохранить за пределами определенного количества независимо от количества добавляемых ингибиторов протеазы, если время очистки увеличивается по мере увеличения масштаба очистки или повышения требований.
Европейский патент N 0337492 A1 предлагает способ очистки HBsAg от культуры Pichia с использованием тиоцианата калия. Тиоцианат калия используется для увеличения выхода липофильных белков, и весь способ направлен на очистку HBsAg, содержащего только S пептид. Если HBsAg еще содержит пре S2 пептид, состоящий из 55 аминокислот перед S пептидом, состоящим из 226 аминокислот, он обладает иммунологическими свойствами, напоминающими свойства поверхностного антигена, содержащего только S пептид, поскольку антигенность и иммуногенность S-пептидной половины одинаковы. Однако два поверхностные антигена очень различны по своим физико-химическим свойствам. В частности, пре S2 пептид достаточно гидрофилен при расположении на поверхности антигенной частицы и, следовательно, имеет важное влияние на процесс очистки.
Поэтому были разработаны различные способы очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид.
Европейский патент N 0130178 A1 описывает способ очистки HBsAg, содержащего пре S2 пептид, который характеризуется отделением поверхностного антигена использованием двух жидких фаз, которые готовятся добавлением подходящего количества декстрана и гликоля к дрожжевому экстракту. Однако этот способ не снимает проблем, которые заключаются в том, что отделенный поверхностный антиген недостаточно чист, он не пригоден для процесса очистки в большом масштабе, так как декстран и полиэтиленгликоль дороги, и он не экономичен, поскольку требуется дополнительная процедура для удаления используемого ПАВ.
В патенте США N 4 742 158 предлагается способ очистки HBsAg, содержащего пре S2 пептид, который включает подготовку дрожжевого экстракта при наличии различных ингибиторов протеазы и очистку из него поверхностного антигена серией стадий колоночно-хроматографического отделения с использованием аффинной колонны, в которой полимер альбумина человеческой сыворотки прикреплен к гелевой матрице, а также гидрофобной колонны с элюированием ПАВ. Однако этот способ также имеет ряд недостатков: используемые в способе ингибиторы протеазы являются очень дорогостоящими, аффинная колонна не пригодна для очистки в промышленных масштабах и требуется специальная операция для удаления ПАВ, используемого в гидрофобной колоночной хроматографии.
M. Kobayashi и др. предложили также способ очистки HBsAg, содержащего пре S2 пептид (J. Biotechnology 8, 1 - 22 (1988). Однако этот способ не пригоден для очистки в промышленных масштабах, так как используют иммуноаффинную колонну, которая дает низкий выход.
В патенте Кореи N 065 305 описывается способ очистки HBsAg, который включает pH преципитацию и колоночные хроматографии на ангидриде кремния и анионном обмене. Этот способ имеет недостаток в том, что трудно поддерживать содержание пре S2 пептида на нужном уровне, так как на первоначальной стадии способа пре S2 пептид переваривается протеазами.
Поэтому существует необходимость эффективного способа очистки HBsAg, содержащего пре S2 пептид.
Сущность изобретения
Основной задачей изобретения является обеспечение способа очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид, из
дрожжевой клетки в достаточно чистом виде, позволяющей непосредственно его ввести в вакцину.
В соответствии с одним аспектом настоящего изобретения предлагается способ очистки поверхностного антигена вируса гепатита B, содержащего пре S пептид, который экспрессирован в рекомбинантном организме, и способ отличается тем, что клетки рекомбинантного организма разрываются с использованием буфера, содержащего хаотропную соль.
Краткое описание чертежей
Вышеупомянутая и другие задачи настоящего изобретения и его особенностей будут очевидны из
следующего описания изобретения и чертежа, на котором
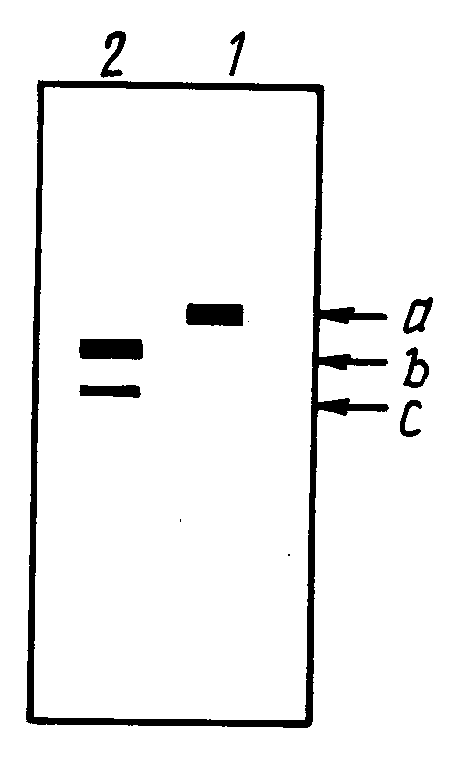
показан результат электрофореза в 15% додецилсульфате натрия полиакриламидном геле (SDS - PAGE), который подтверждает содержание пре S2
пептида в HBsAg, когда поверхностный антиген, содержащий преS2 пептид, очищается в присутствии тиоцианата натрия в качестве хаотропной соли.
Подробное описание изобретения
Настоящее изобретение предусматривает способ очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид, экспрессированный в рекомбинантном организме, при этом способ характеризуется
тем, что клетки рекомбинантного организма разрываются с использованием буфера, включающего хаотропную соль, с тем, чтобы свести к минимуму потерю пре S2 пептида. Использование буфера, содержащего
хаотропную соль для разрыва клеток, способствует образованию частиц HBsAg и защищает пре S2 пептид от действия протеазы, которое обычно имеет место на первоначальной стадии очистки, что сохраняет пре
S2 пептида на постоянном уровне до завершения процесса очистки.
Способ настоящего изобретения можно применять к способу очистки HBsAg, который продуцируется в любом из подходящих рекомбинантных организмов, предпочтительно рекомбинантной дрожжевой клетке, например Saccharomyces cerevisiae.
Подходящие хаотропные соли, которые можно использовать в настоящем изобретении, включают тиоцианат натрия, тиоцианат калия, тиоцианат аммония, гуанидий гидрохлорид и мочевину, при этом лучше всего использовать тиоцианат натрия.
Для разрушения клетки в способе изобретения приемлема любая традиционная буферная система, например фосфатный буфер и Трис буфер, pH предпочтителен в диапазоне от 6 до 8. Концентрация хаотропной соли в буфере может составлять от 1 до 8 М, лучше от 1 до 3 М.
Когда рекомбинантная клетка разрывается с использованием буфера, содержащего хаотропную соль, как описано выше, остальной процесс очистки
можно проводить, используя любую комбинацию стадий традиционной очистки, хотя предпочтительный вариант включает следующие стадии:
а) добавление ПАВ к клеточному гомогенату рекомбинантных
клеток для экстракции поверхностного антигена из мембран клеток;
б) повышение растворимости и ускорение образования частиц поверхностного антигена в экстракте, полученном в стадии а)
подщелачиванием экстракта;
в) осаждение и удаление остатков клеток, липидов и примесей белков и экстракта, обработанного на стадии б), окислением и затем центрифугированием экстракта, чтобы
получить раствор, содержащий поверхностный антиген;
г) взаимодействие раствора, полученного на стадии в), с ангидридом кремния для адсорбции поверхностного антигена на нем, вымывания примесей
белков и десорбции поверхностного антигена из ангидрида кремния с использованием буфера для получения фракции очищенного поверхностного антигена;
д) проведение гидрофобной колоночной
хроматографии фракции очищенного поверхностного антигена, полученного на стадии г), для получения фракций, содержащих поверхностный антиген; и
е) очистка фракций, полученных на стадии д)
гель-фильтрационной хроматографией, методом молекулярных сит с получением поверхностного антигена в чистом виде.
Примеры ПАВ, которые могут использоваться на стадии а) для экстракции поверхностного антигена из клеточной мембраны, включают: Твин 20, Твин 80, Тритон X-100 и деоксихолат натрия, предпочтительно Твин 20. ПАВ может использоваться в количестве от 0,1 до 0,5% (вес/об.), предпочтительно от 0,1 до 0,2% (вес/об.) от количества клеточного гомогената.
Чтобы повысить растворимость поверхностного антигена в клеточном гомогенате и улучшить образование его частиц, рекомендуется повысить pH экстракта поверхностного антигена до 11,0 - 13,5 использованием основания - предпочтительно гидроксида натрия и гидроксида калия. Этот процесс подщелачивания способствует образованию частиц HBsAg за счет увеличения межмолекулярной дисульфидной связи и диссоциации примесей белков от HB sAg в результате повышенной растворимости. После этого экстракту лучше дать выстояться при температуре от 0 до 30oC в течение 0,5 - 1,0 часа.
Затем экстракт подкисляют для осаждения остатков клеток, липидов и примесей белков, при этом pH экстракта доводят до 4,5 - 6,0. На этой стадии можно использовать любую из неорганических или органических кислот, хотя предпочтителен 10 - 30% раствор уксусной кислоты. Реакцию подкисления можно проводить при температуре от 0 до 30o в течение времени от 0,5 до 2 часов, лучше с перемешиванием. Подкисленный экстракт центрифугируется для удаления полученных осадков и получения надосадочной жидкости, содержащей поверхностный антиген. Преимущество этого процесса заключается в том, что одна стадия обычного центрифугирования удаляет одновременно остатки клеток, липида и примеси белков, при этом выход поверхностного антигена высок благодаря предшествующей стадии растворения поверхностного антигена при высоких значениях pH.
Повышение и затем снижение pH клеточного экстракта стабилизирует образование частиц поверхностного антигена и является очень эффективным для удаления липидов и примесей белков.
Однако, когда на стадии разрыва клеток используется тиоцианат в качестве хаотропной соли, во время окисления может выделяться неприятный запах. Сама соль тиоцианата представляет собой безвредное соединение без цвета и запаха, и ион тиоцианата достаточно стабилен в растворе. Поэтому можно считать, что запах, появляющийся на стадии окисления, возникает от реакций тиоцианата с некоторыми веществами в клеточном экстракте. В случае очистки в небольшом количестве оператор может перенести этот запах, но при работе с большими масштабами желательно удалить тиоцианат до стадии окисления.
Например, тиоцианат можно удалить добавлением подходящей соли к клеточному экстракту для осаждения соли тиоцианата вместе с некоторыми примесями белков непосредственно после стадии а) удалением осадков, например центрифугированием, и диафильтрацией полученного надосадочного слоя жидкости. Поверхностный антиген не осаждается во время этого процесса. Кроме того, удаление тиоцианата проводится параллельно с удалением части примесей белков, что облегчает процессы дальнейшей очистки.
Предпочтительные соли, которые можно применять при дезодорации, это соли многозарядных ионов, например сульфат натрия и сульфат аммония в концентрации от 8 до 15% (вес/об.). После экстракции поверхностного антигена из клеточной мембраны добавляется соль, и реакция протекает при комнатной температуре в течение 0,5 - 2 часов при перемешивании или без него. Полученные осадки можно удалить традиционным методом, скажем центрифугированием, чтобы получить надосадочную жидкость, содержащую поверхностный антиген. Полученная надосадочная жидкость подвергается повторным процессам диафильтрации для удаления тиоцианата и сульфата. Буфер, используемый на этой стадии, предпочтительно имеет pH от 6 до 8. Когда стадии солевой обработки, центрифугирования и диафильтрации завершены, полученная надосадочная жидкость подвергается способам стадий б) и в).
Надосадочная жидкость, полученная в стадии в), которая содержит поверхностный антиген, обрабатывается ангидридом кремния с использованием колонного или периодического процесса, при этом предпочитается периодический процесс. Приемлемым ангидридом кремния для использования в этой стадии является микрокристаллический ангидрид кремния с площадью поверхности от 100 до 500 м2/г, и желательно использовать Aerosil 380 (Degussa, Германия). Надосадочная жидкость, содержащая поверхностный антиген, контактирует с суспензией ангидрида кремния при pH от 6 до 8 и температуре от 4 до 30oC в течение 2 - 16 часов с энергичным перемешиванием. Количество осушенного ангидрида кремния для адсорбции поверхностного антигена составляет предпочтительно около 5% (вес/вес) от веса клеточного осадка. Комплекс поверхностный антиген-ангидрид кремния выделяется из раствора традиционным способом, например центрифугированием.
После этого комплекс промывается, например, три раза буфером с pH от 6 до 8, предпочтительным буфером является фосфат натрия - хлорид натрия для удаления остаточных примесей из ангидрида кремния. Поверхностный антиген можно десорбировать из ангидрида кремния взаимодействием комплекса с подходящим буфером в течение приблизительно 2 часов. На этой стадии можно использовать буфер с pH от 8,8 до 11,0, желательно буфер карбоната натрия - бикарбоната натрия. Буфер может также содержать мочевину в концентрации от 1 до 8 М и ПАВ, желательно деоксихолат натрия, в концентрации от 0.1 до 0.3 вес.%. Затем ангидрид кремния извлекается из раствора традиционным способом, например центрифугированием, чтобы получить надосадочную жидкость, содержащую поверхностный антиген. Однако, когда на стадии десорбции используется диоксихолат натрия, необходимо удалить его повторной диафильтрацией.
Надосадочная жидкость, полученная выше, которая содержит поверхностный антиген, может затем очищаться гидрофобной колоночной хроматографией, в которой гидрофобной смолой является предпочтительно агарозный гель с остатками фенила. До внесения надосадочной жидкости материал заполнения, т.е. гидрофобная смола уравновешивается буфером, pH которого от 8,8 до 11,0, и который может быть аналогичным описанным в предшествующей стадии. Буфер может содержать мочевину в концентрации от 1 до 4 М, чтобы максимально удалить примеси белков, которые менее гидрофобны, чем поверхностный антиген.
Затем надосадочная жидкость, содержащая поверхностный антиген, пропускается через колонну и контактирует в ней с заполняющим материалом. Колонна тщательно промывается уравновешивающим буфером, содержащим 10 - 40 вес.% этиленгликоля, чтобы удалить относительно слабо адсорбированные примеси белков из заполняющего материала. Затем поверхностный антиген, связанный с гидрофобной смолой, элюируется уравновешивающим буфером, содержащим 60 - 80% этиленгликоля.
Эта гидрофобная колоночная хроматография представляет собой очень эффективную стадию очистки, в которой большая часть оставшихся примесей в надосадочной жидкости после стадии адсорбции ангидридом кремния удаляется. В частности, пирогенные материалы, которые трудно удалить традиционным способом, можно извлечь на этой стадии. Мочевину и этиленгликоль, которые остаются во фракциях, содержащих поверхностный антиген, можно удалить, например, диализом или повторной диафильтрацией, в которых желательно использовать буфер с pH от 6 до 8.
Фракции, содержащие поверхностный антиген, полученные из гидрофобной колоночной хроматографии, далее очищаются гель-фильтрационной хроматографией методом молекулярных сит до такой степени, что очищенный антиген можно использовать в приготовлении вакцины.
Иллюстративные полярные матрицы, которые можно использовать в качестве заполняющего колонну материала, включают, например, агарозный гель, декстрановый гель и полиакриламидный гель с пределом эксклюзии по меньшей мере 1 000 000, предпочтительным интервалом фракционирования является от 5 000 до 500 000. Гель-фильтрационная хроматография методом молекулярных сит проводится пропусканием фракций, содержащих поверхностный антиген, через колонку, уравновешенную Трис или фосфатным буфером с pH от 6 до 8, который содержит хлорид натрия в концентрации от 0,1 до 0,2 М и элюированием поверхностного антигена тем же буфером.
Фракции, содержащие поверхностный антиген, соединяются вместе, и чистота поверхностного антигена и пре S2 пептида, содержащегося в нем, определяется SDS-PAGS. Результаты различных экспериментов, описанных в последующих примерах, свидетельствуют о высокой чистоте поверхностного антигена, очищенного способом настоящего изобретения, и высоком содержании в нем пре S2 пептида для возможности непосредственного использования очищенного антигена в приготовлении вакцины.
Приведенные ниже примеры иллюстрируют настоящее изобретение, не ограничивая его объем.
Кроме того, указанные ниже процентные величины для твердых веществ и твердой смеси, жидких в жидкой и твердых в жидкой, представляют собой соотношения вес/вес, об./об. и вес/об.
Пример 1
(Стадия 1) Разрушение дрожжевой клетки
Рекомбинантные клетки Saccharamyces cerevisiae KCTC 0098BP, которые способны экспрессировать поверхностный антиген гепатита
B, содержащий пре S2 пептид, культивируют при 27oC в 30 л среды YEPD (1% дрожжевой экстракт, 2% дрожжевой пептон, 1,6% глюкоза). 70 г полученной таким образом дрожжевой клеточной массы
смешивают со 140 мл буфера 1/50 мМ Трис, pH 7,2, 1 М тиоцианат натрия, 0,15 М хлорид натрия, 10 мМ этилендиаминтетрауксусная кислота (ЭДТА) и 1 мМ фенилметилсульфонилфторид (ФМСФ), и смесь помещают в
контейнер для размельчения (Biospec Products, OKLA, США), содержащий 210 мл стеклянных шариков с диаметром 0,5 мм.
Контейнер погружают в ледяную воду и мешалку включают 3 раза по 5 минут с интервалом 15 минут. Полученный клеточный гомогенат отделяют от стеклянных шариков, промывают их 210 мл буфера 1 и промывочный раствор объединяют с клеточным гомогенатом.
(Стадия 2) Экстракция и растворение поверхностного антигена
К клеточному гомогенату, полученному в (Стадии 1), добавляют 0,1% (вес/об.) Твин 20 и смесь перемешивают при комнатной температуре
2 часа.
pH раствора доводят до 11,5 добавлением 5N гидроксида натрия и перемешивают его при комнатной температуре 1 час. pH полученного раствора доводят до 5,2 добавлением 20% уксусной кислоты, перемешивают его при комнатной температуре 30 минут и затем оставляют на 30 минут.
Раствор центрифугируют при 8oC для удаления клеточных остатков вместе с осадками.
pH надосадочной жидкости, содержащей поверхностный антиген, доводят до 7,2 добавлением 5N гидроксида натрия. В этот момент объем надосадочной жидкости составляет около 300 мл.
(Стадия 3) Адсорбция и десорбция с использованием ангидрида кремния.
Высушенный ангидрид кремния смешивают с водой с получением 5% суспензии (сухой вес/объем суспензии) к надосадочной жидкости, полученной в (Стадии 2), добавляют 70 мл этой суспензии и смесь перемешивают при комнатной температуре 2 часа. Полученный раствор центрифугируют со скоростью 5,500 об/мин 10 минут для удаления надосадочного слоя жидкости и полученный ангидрид кремния, на котором адсорбировался поверхностный антиген, промывают два раза фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия.
Промытый ангидрид кремния вносят в 70 мл 50 мМ карбонатного буфера (pH 9,5), содержащего 1 М мочевину, и смесь перемешивают при комнатной температуре 1 час с целью десорбции поверхностного антигена из ангидрида кремния. При этом pH буфера составляет 9,2. Раствор центрифугируют (ротор Beckman JA 14) со скоростью 12,000 об/мин в течение 30 минут с получением надосадочной жидкости, содержащей поверхностный антиген.
Количество поверхностного антигена вируса гепатита B в надосадочной жидкости составляет около 6,5 мг при измерении оборудованием (набором) Auqyme (Abbott, США).
Сравнительный пример
Повторяют те же процедуры, что в примере 1, за исключением того, что тиоцианат натрия не включают в буфер 1,
чтобы получить раствор очищенного поверхностного антигена. В результате количество поверхностного антигена вируса гепатита B в надосадочной жидкости при измерении набором Auqyme составляет 7,1 мг.
Растворы поверхностного антигена, полученные в примере и сравнительном примере, подвергают электрофорезу в 15% додецилсульфате натрия-полиакриламидном геле (SDS-PAGE) с последующим окрашиванием серебром. Результат показан на чертеже, на котором колонки 1 и 2 представляют растворы поверхностного антигена, полученные в примере 1 и сравнительном примере соответственно. Здесь A показывает полосу интактного белка; и B и C - фрагменты белка в результате разрушения протеазой.
Как показано на чертеже, поверхностный антиген с высоким содержанием пре S2 пептида, можно очистить из дрожжевых клеток в соответствии со способом настоящего изобретения, и выход его будет высоким.
Пример 2
(Стадия 1) Разрушение дрожжевой клетки
Рекомбинантные клетки Saccharomyces cerevisiae KCTC 0098BP, способные экспрессировать поверхностный антиген гепатита B, содержащие пре S2 пептид, культивируют при 27oC в 300 л среды YEPD. 3
кг полученной таким образом дрожжевой клеточной массы смешивают с 6 л буфера 1 и смесь дважды пропускают через Dynomill (Glenmills, Япония), содержащую 3 л стеклянных шариков диаметром 0,5 мм при
10oC со скоростью протока 650 мл/мин для разрушения дрожжевых клеток.
Полученный клеточный гомогенат отделяют от стеклянных шариков, стеклянные шарики промывают 9 л буфера 1 и промывочный раствор объединяют с клеточным гомогенатом. При измерении набором Augyme количество HBsAg в надосадочной жидкости составило около 754 мг.
(Стадия 2) Экстракция и
растворение поверхностного антигена
К клеточному гомогенату, полученному в (Стадии 1), добавляют 0,1% (вес. /об.) Твин 20 и смесь перемешивают при комнатной температуре 2 часа.
pH раствора доводят до 11,5 добавлением 5N гидроксида натрия и перемешивают при комнатной температуре 1 час. pH полученного раствора затем доводят до 5,2 добавлением 20% уксусной кислоты, перемешивают при комнатной температуре 30 минут и затем оставляют на 30 минут.
Раствор центрифугируют при 8oC для удаления клеточных остатков вместе с осадками.
pH надосадочной жидкости, содержащей поверхностный антиген, доводят до 7,2 добавлением 5N гидроксида натрия. В результате окончательный объем надосадочной жидкости составляет около 12 л и количество HBsAg в надосадочной жидкости - около 1,250 мг при измерении набором Augyme.
Выход поверхностного антигена составил 165,8% от количества поверхностного антигена, определенного в (Стадии 1). Этот неожиданно высокий выход имел место в основном благодаря комбинированным действиям ПАВ и щелочи, что повысило антигенность и способствовало растворимости поверхностного антигена.
(Стадия 3) Адсорбция и десорбция с использованием ангидрида кремния
Надосадочную жидкость, полученную на (Стадии 2), разбавляют двойным объемом 0,15 М
хлорида натрия и затем адсорбируют на ангидриде кремния (Aerosil 380) в соответствии со следующей методикой. В осушенный ангидрид кремния добавляют воду для получения 10% суспензии (сухой вес/объем
суспензии), 1,5 л которой добавляют к надосадочной жидкости, полученной в (Стадии 2), и смесь перемешивают при 4oC всю ночь.
Полученный раствор центрифугируют со скоростью 5, 500 об/мин 10 минут для удаления надосадочной жидкости и осажденный ангидрид кремния, на котором адсорбировался поверхностный антиген, промывают дважды фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия.
Промытый ангидрид кремния добавляют к 3 л 50 мМ карбонатного буфера (pH 9,5), содержащего 1 М мочевину, и смесь перемешивают при комнатной температуре 2 часа, чтобы десорбировать поверхностный антиген из ангидрида кремния. В этот момент pH буфера составляет 9,2. Раствор центрифугируют со скоростью 8,700 об/мин 30 минут для получения надосадочной жидкости, содержащей поверхностный антиген.
При измерении набором Augyme количество HBsAg в надосадочной жидкости составило около 895 мг (выход: 118,7%).
(Стадия 4) Гидрофобная
колоночная хроматография
К надосадочной жидкости, полученной в (Стадии 3), содержащей поверхностный антиген, добавляют мочевину до окончательной концентрации в 4 М и полученный раствор
пропускают через фенил-агарозную колонку, уравновешенную 50 мМ карбонатным буфером (pH 9,2), содержащим 4 М мочевину. Колонку промывают тем же буфером, содержащим 20% этиленгликоль; затем тот же буфер,
содержащий 60% этиленгликоль, добавлялся к колонке для элюирования поверхностного антигена.
Элюированные фракции, содержащие поверхностный антиген, объединяют и фильтруют с помощью диафильтрационной системы Amicon (Amicon, США) с молекулярной величиной отсечения 100,000, чтобы удалить мочевину и этиленгликоль в элюате, и полученный фильтрат концентрируют с использованием той же системы.
Количество HBsAg в фильтрате составило около 546 мг при измерении набором Augyme (выход: 72,4%).
(Стадия 5) Гель-фильтрационная хроматография 8 л Sepharose CL - 4B (Pharmacia, США) погружают в колонку и уравновешивают ее фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия. Концентрат, содержащий поверхностный антиген, который был получен в (Стадии 4), пропускают через колонку и элюируют тем же буфером с получением фракций, содержащих поверхностный антиген.
Количество HBsAg (включающего и интактный антиген, и его фрагменты, подвергшиеся разрушению протеазой) в объединенных фракциях составило приблизительно 540 мг при измерении набором Augyme (выход: 71,6%), и чистота поверхностного антигена была около 98,2%. При измерении SDS-PAGE содержание пре S2 пептида в общем количестве поверхностного антигена составило около 75%. Раствор очищенного поверхностного антигена, полученного таким образом, фильтруют через фильтр в 0,2 мк (Corning, США), и фильтрат хранят при 4oC.
Пример 3
(Стадия 1) Разрушение дрожжевой клетки.
Рекомбинантные клетки Saccharomyces cerevisiae КСТС 0098ВР культивируют при 27oC в 300 л среды YEPD, 4 кг полученной дрожжевой клеточной массы смешивают с 8 л буфера 1 и смесь пропускают дважды через Dynomill (Glenmills, Япония), содержащую 3 л стеклянных шариков с диаметром 0,5 мм при 10oC со скоростью протока 650 мл/мин, чтобы разрушить дрожжевые клетки.
Полученный клеточный гомогенат отделяют от стеклянных шариков, промывают их 12 л буфера 1 и промывочный раствор объединяют с клеточным гомогенатом.
(Стадия 2) Экстракция и растворение поверхностного антигена.
К клеточному гомогенату, полученному в (Стадии 1), добавляют 0,1% (вес/об.) Твин 20 и смесь перемешивают при комнатной температуре 2 часа.
К раствору добавляют насыщенный раствор сульфата аммония до окончательной концентрации в 10% и смесь перемешивают при комнатной температуре 1 час. Полученный раствор центрифугируют при 8oC для удаления остатков клеток вместе с осадками.
Надосадочную жидкость отфильтровывают с помощью диафильтрационной системы Amicon (Amicon, США) с молекулярной величиной отсечения 100,000 с использованием 20 мМ Трис буфера (pH 7,5) с целью удаления тиоцианата и сульфата натрия в ней и затем концентрируют с использованием той же системы до окончательного объема, равного 6 л.
pH концентрата доводят до 11,5 добавлением 5N гидроксида натрия и перемешивают при комнатной температуре 1 час. pH полученного раствора доводят до 5,2 постепенным добавлением 20% уксусной кислоты, перемешивают при комнатной температуре 30 минут и затем оставляют на 30 минут. Раствор центрифугируют при 8oC для удаления остатков клеток вместе с осадками.
pH надосадочной жидкости доводят до 7,2 добавлением 5N гидроксида натрия, и при измерении набором Augyme количество HBsAg в ней составило около 1,400 мг.
(Стадия 3) Адсорбция и десорбция с использованием ангидрида кремния.
Надосадочную жидкость, полученную на (Стадии 2), адсорбируют на ангидриде кремния (Aerosil 380) в соответствии со следующей методикой. Осушенный ангидрид кремния смешивают с водой с получением 10% суспензии (сухой вес/объем суспензии), 2 л суспензии добавляют к надосадочной жидкости, полученной в (Стадии 2), и смесь перемешивают при 4oC всю ночь.
Полученный раствор центрифугируют со скоростью 5,500 об/мин 10 минут для удаления надосадочной жидкости и осажденный ангидрид кремния, на котором адсорбировался поверхностный антиген, промывают дважды фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия.
Промытый ангидрид кремния добавляют к 4 л 50 мМ карбонатного буфера (pH 9,5), содержащего 1 М мочевину, и смесь перемешивают при комнатной температуре 2 часа для десорбции поверхностного антигена с ангидрида кремния. В этот момент величина pH буфера равна 9,2. Раствор центрифугируют с скоростью 8,700 об/мин с получением надосадочной жидкости, содержащей поверхностный антиген.
При измерении набором Augyme количество HBsAg в надосадочной жидкости составило около 840 мг.
(Стадия 4) Гидрофобная колоночная хроматография.
К надосадочной жидкости, полученной в (Стадии 3), содержащей поверхностный антиген, добавляют мочевину до окончательной концентрации в 4 М, и полученный раствор пропускают через фенил-агарозную колонку, уравновешенную 50 мМ карбонатным буфером (pH 9,2), содержащим 4 М мочевину. Колонку промывают тем же буфером, содержащим 20% этиленгликоль; затем тот же буфер, содержащий 60% этиленгликоль, вносят в колонку для элюирования поверхностного антигена.
Элюированные фракции, содержащие поверхностный антиген, объединяют и фильтруют с помощью дифракционной системы Amicon (Amicon, США) с молекулярной величиной отсечения 100,000, чтобы удалить мочевину и этиленгликоль в элюате, и полученный фильтрат концентрируют с использованием той же системы.
При измерении набором Augyme количество HBsAg в фильтрате составило около 527 мг.
(Стадия 5) Гель-фильтрационная
хроматография
8 л Sepharose CL-4B (Pharmacia, США) помещают в колонку и уравновешивают фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия. Концентрат, содержащий поверхностный
антиген, который был получен в Стадии 4, пропускают через колонку и элюируют тем же буфером для получения фракций, содержащих поверхностный антиген.
Количество поверхностного антигена вируса гепатита B в объединенных фракциях составило около 480 мг при измерении набором Augyme, в чистота поверхностного антигена была около 98,8%. При измерении SDS-PAGE содержание пре S2 пептида в общем количестве поверхностного антигена составило около 75%. Раствор очищенного поверхностного антигена, полученный таким образом, фильтруют через фильтрат в 0,2 мк (Corning, США) и фильтрат хранят при 4oC.
Пример 4.
Иммуногенность S и пре S2 пептидов в поверхностных антигенах, полученных в примерах 2 и 3 (далее упоминаются как "поверхностный антиген 2" или "поверхностный антиген 3"), подтверждалась следующими экспериментами, в которых использовались морские свинки.
1 мл (200 мкг/мл) поверхностного антигена 2 или 3 добавляют к 18 мл фосфатного буфера (pH 7,2), содержащего 0,15 М хлорид натрия и смесь фильтруют через фильтрующий шприц в 0,2 мк. Фильтрат вносят в 1 мл 3% алгидро-геля (Superfos, Biosector, Дания). Указанную процедуру проводят в асептических условиях.
Каждой из 11 морских свинок весом около 350 г подкожно вводят 1 мл композиции поверхностного антигена 2 или 3, приготовленной выше, инъекции делают дважды с интервалом в 15 дней. После 30 дней со дня первой инъекции кровь каждой морской свинки берут на анализ и получают из нее сыворотку. При анализе сыворотки набором Ausab (Abbott, США) показатели продуцирования антител против S пептидов поверхностного антигена 2 или 3 составили 100%, геометрические значения титров (GMT) поверхностного антигена 2 и 3 составили 33,38 и 29,77 мИЕ/мл соответственно.
Показатель продуцирования антител против пре S2 пептида определяют в соответствии со следующей процедурой. 50 мкл (1 мг/мл) пре S2 пептида, имеющего N-концевые 26 аминокислот, которые синтезировались синтезатором пептида (Applied Biosystems, США) с использованием автоматизированного твердофазного синтеза пептидов, и 20 мкл (10 мг/мл) поли L-лизина добавляют к 200 мкл 50 мМ ацетатного буфера (pH 4,5). В смесь вносят 10 мкл 1% EDC (1-этил-3-(3-диметил-аминопропил)карбодиимида), реакцию проводят при 37oC в течение 1 часа. Затем ее разбавляют 20 мл 10 мМ карбонатного буфера (pH 9,6) и наносят на лунки 96-луночного ELISA планшета в количестве 200 мкл/лунку. Планшет инкубируют при комнатной температуре 20 часов, позволяя адсорбироваться пептиду на поверхности лунки, и затем промывают 3 раза дистиллированной водой.
PBS (физиологический раствор с фосфатным буфером), содержащий 0,5% казеина, наносят на лунки в количестве 250 мкл/лунку; и планшет инкубируют при комнатной температуре более 2 часов с тем, чтобы исключить любые неспецифические реакции, которые могли бы иметь место позднее. В каждую лунку довносят положительные и отрицательные контрольные растворы и 200 мкл серийно разбавленных в 10 раз PBS сыворотки каждой морской свинки (экспериментальная группа). Планшет инкубируют при комнатной температуре 4 часа и затем промывают 5 раз буфером TTBS (0,9% хлорид натрия, 0,05% Твин 20, 10 мМ Трис, pH 7,5). Раствор, содержащий свиное антитело к антителу морской свинки, помеченное пероксидазой хрена обыкновенного (HRP), разбавленный 4000-кратным объемом PBS, содержащим 0,5% казеина, наносят на лунки в количестве 200 мкл/лунку. Планшет инкубируют при 37oC 1 час и промывают 5 раз буфером TTBS.
После этого к каждой лунке добавляют 200 мкл раствора, являющегося субстратом для пероксидазы хрена обыкновенного, который готовят растворением 200 мкг тетраметилбензидина (ТМВ) в 20 мкл ДМСО, добавлением 10 мл 0,1 М ацетатного буфера (pH 5,1) и 20 мкл 30% перекиси водорода и доведением объема раствора до 20 мл добавлением дистиллированной воды. Реакцию ведут до появления цвета. Затем к каждой лунке добавляют 50 мкл 1N серной кислоты, чтобы остановить появление цвета; и данные наблюдений по каждой лунке определяют на длине волны 450 нм планшет-ридером Microplate (Dynatech MP 5000, США).
Если данные наблюдений экспериментальной группы были выше предела эксклюзии (больше величины данных отрицательного контроля в два раза), подтверждалось, что имела место выработка антител против пре S2 пептида и просчитывалось количество морских свинок, которые показали положительную реакцию на антитело.
В результате оба поверхностных антигена 2 и 3 дали 100% показатель выработки антитела.
Пример 5
Чтобы определить иммуногенность S и пре S2 пептидов в поверхностных антигенах 2 и 3, проводились следующие
эксперименты на мышах. 1 мл (200 мкг/мл) поверхностного антигена 2 или 3 добавляют к 18 мл фосфатного буфера (pH 7,2), содержащего 0,15 М хлорид натрия, и смесь фильтруют через фильтрующий шприц в 0,2
мк. Фильтрат смешивают с 1 мл 3% ангидро-геля (Superfos, Biosector, Дания).
Полученный раствор, содержащий 10 мкг/мл поверхностного антигена 2 или 3, разбавляют с разбавителем ангидро-геля (который готовился разбавлением алгидро-геля) до окончательной концентрации в 0,15% фосфатным буфером (pH 7,2), содержащим 0,15 М хлорид натрия, чтобы получить 4 образца с содержанием 0, 01, 0,03, 0,09 и 0,27 нг/мл поверхностного антигена соответственно. Контейнеры, содержащие образцы, встряхивают во избежание осаждения алгидро-геля. Указанную процедуру проводят в стерильных условиях на чистом столе.
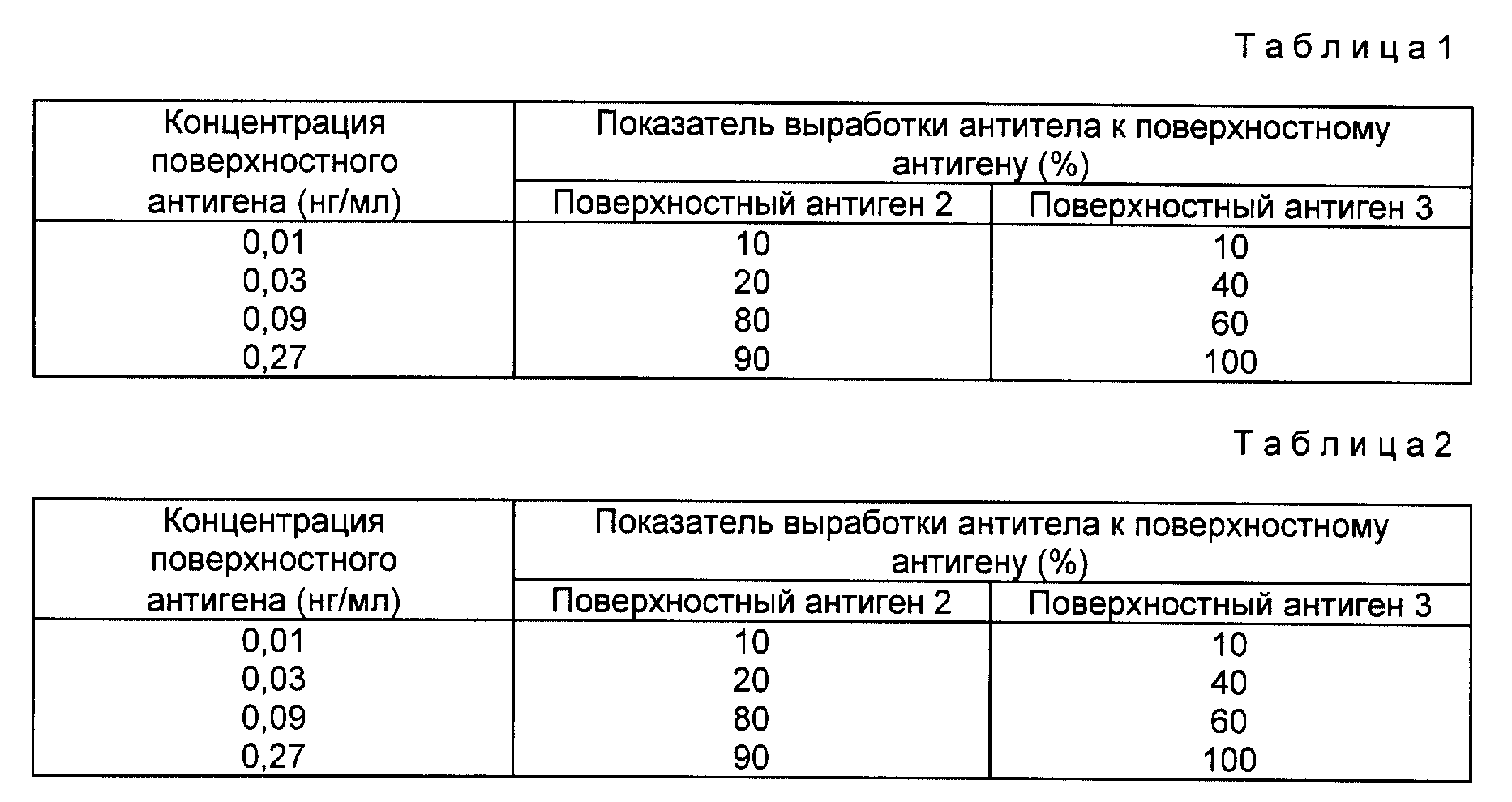
80 мышей возрастом 5 недель разделяют на 8 групп, каждая из 10 мышей и каждой мыши внутрибрюшинно вводят 1 мл каждого из разбавленных растворов поверхностного антигена 2 или 3, подготовленных выше. Через 28 дней после инъекции от каждой мыши берут пробы крови на анализ и из них делают сыворотку. Наличие антител против S пептида определялось набором Ausap (Abbott, США), и показатели выработки антител против S пептидов в поверхностном антигене 2 или 3 указаны в таблице 1.
Наличие антител к пре S2 пептиду определялось в соответствии с методикой, описанной в примере 4, и показатели выработки антител к пре S2 пептидам в поверхностном антигене 2 или 3 представлены в таблице 2.
Эффективную дозу (ЭД50) S и пре S2 пептидов рассчитывают методом единиц вероятности (Finney D.J. Probit Analisis, 1971) с использованием показателей выработки антител, полученных выше. В результате ЭД50 S и пре S2 пептидов в поверхностном антигене 2 составила 0,0580 и 0,0577 нг/мл соответственно и S и пре S2 пептидов в поверхностном антигене 3 - 0,0455 и 0,0469 нг/мл соответственно. Однако, поскольку содержание пре S2 пептида в поверхностном антигене 2 или 3 составляет 75%, ЭД50 пре S2 пептида считают ниже расчетной величины, полученной выше.
Как показано в вышеописанных примерах, поверхностный антиген вируса гепатита B с высоким содержанием пре S2 пептида и высокими иммуногенными свойствами S и пре S2 пептидов можно получить из рекомбинантных дрожжевых клеток в соответствии с настоящим изобретением.
Хотя изобретение было описано по конкретным вариантам, специалистам данной области техники понятно, что допустимы различные модификации и изменения изобретения, которые входят в его объем, определенный прилагаемой формулой.
Реферат
Способ предназначен для очистки поверхностного антигена вируса гепатита B, содержащего пре S2 пептид и может быть использован в биотехнологии и иммунологии для приготовления вакцины против гепатита B. Рекомбинантные клетки дрожжей, экспрессирующие поверхностный антиген, разрушают в буфере, содержащем хаотропную соль и ПАВ. Экстракт подщелачивают до pH 11,0-13,5, после чего подкисляют до pH 4,5-6,0. Дальнейшую очистку антигена проводят путем адсорбции на ангидриде кремния, десорбции буфером, содержащим мочевину, и гель-фильтрацией. Способ позволяет уменьшить разрушение антигена протеазами. Вакцина, содержащая пре S2 пептид, активна в отношении различных вариантов вируса гепатита B. 2 с. и 13 з.п. ф-лы, 1 ил., 2 табл.
Формула
2. Способ по п. 1, отличающийся тем, что хаотропную соль выбирают из группы, состоящей из тиоцианата натрия, тиоцианата калия, тиоцианата аммония, хлорида гуанидия и мочевины.

Комментарии