Модифицированные капсидные белки для улучшения доставки парвовирусных векторов - RU2751953C2
Код документа: RU2751953C2
Чертежи




















Описание
Заявление о приоритете
[0001] В настоящей заявке испрашивается приоритет временной заявки США с регистрационным номером 62/266941, поданной 14 декабря 2015 г., полное содержание которой вводится в настоящее описание посредством ссылки.
Заявление Федеральных Органов
[0002] Настоящее изобретение было осуществлено при поддержке Правительства на гранты №№ AI080726, DK084033, HL112761, AI072176, AR064369 и GM007050, выданные Национальным Институтом здравоохранения. Правительство имеет определенные права на это изобретение.
Область изобретения
[0003] Настоящее изобретение относится к модифицированным капсидным белкам парвовируса с повышенной эффективностью трансдукции, к вирусным векторам, содержащим эти белки, и к способам их применения для доставки нуклеиновых кислот в клетку или индивидууму.
Предпосылки создания изобретения
[0004] Различные серотипы рекомбинантного аденоассоциированного вирусов (rAAV) в настоящее время используются в клинических испытаниях (например, rAAV1 используется для лечения дефицита липопротеин-липазы, rAAV2 используется для лечения наследственного амавроза Лебера, а rAAV8 используется для лечения гемофилии). Из них, rAAV1 считается лучшим для внутримышечной (i.m.) доставки, независимо от того, осуществляют ли лечение непосредственно самого мышечного расстройства (например, мышечной дистрофии) или состояний, на которые может благоприятно влиять секреция терапевтического белка в кровоток (например, в случае дефицита α-1-антитрипсина (AAT)). Основным недостатком этого подхода является субтерапевтические уровни экспрессии трансгена, несмотря на введение высоких доз rAAV. Так, например, хотя результаты клинических испытаний на основе rAAV-AAT продемонcтрировали дозозависимое увеличение уровней ААТ в сыворотке после внутримышечной инъекции, однако, у группы, которой вводили высокие дозы, достигалось лишь ~3% экспрессии ААТ-мишени. Поскольку для этой группы требуются 100 i.m.-инъекций по 1,35 мл каждая, однако, увеличение дозы до уровня, необходимого для лечения заболевания, может оказаться невозможным. Аналогичные наблюдения были задокументированы для недавно апробированного фармацевтического средства на основе rAAV1, Glybera. Для того, чтобы терапия с увеличением уровней гена rAAV стала практическим выбором, в таких случаях, очень важное значение имеет повышение эффективности трансдукции в мышечную ткань.
[0005] Попытки повышения уровня экспрессии трансгена можно подразделить на эндогенные подходы, в которых капсид и трансген rAAV модифицируют для усиления трансдукции, и/или экзогенные подходы, в которых дополнительные терапевтические средства доставляются одновременно с введением rAAV. Хотя экзогенные подходы, такие как подавление иммунной системы, улучшали трансдукцию, однако, наиболее успешной тактикой является процесс интеграции новых открытий в биологии rAAV в протокол клинических испытаний. Это лучше всего иллюстрируется на примере открытия множества природных серотипов AAV и их преимущественных профилей трансдукции в ткани. Это позволяет корректировать доставку серотипа AAV в орган-мишень (например, клинические испытания, осуществляемые путем внутримышечной доставки rAAV, становятся более успешными при использовании rAAV1, в отличие от ранее проводимых испытаний с использованием rAAV2). Кроме того, биологические структурные анализы, осуществляемые путем сравнения серотипов, облегчили непосредственное выделение и рациональное конструирование rAAV, что позволило разработать векторы нового поколения для доставки.
[0006] Была идентифицирована капсидная структура наиболее распространенных серотипов rAAV. Каждый из них содержит 60 повторяющихся мономеров, состоящих из консервативного ядра в виде β-бочки и перемежающихся с крупными петлями, которые формируют топологию поверхности капсида. Путем сравнения структур rAAV2 и rAAV4, были определены наименее гомологичные серотипы, всего девять вариабельных областей (VR; VRI-VRIX). Аминокислотный состав VR сообщает каждому серотипу определенные фенотипы, такие как связывание с рецептором, антигенная реактивность и эффективность трансдукции. Сравнение VR rAAV2 (прототипа rAAV) с более эффективными мышечными трансдукторами, такими как rAAV1, позволило впервые сконструировать капсид rAAV для его применения в клиническом испытании. rAAV2.5 состоит из капсида rAAV2, присоединенного к пяти аминокислотам rAAV1, выделенным по их вкладу в эффективность rAAV1 в мышцах. Последующие исследования показали, что для значительного повышения эффективности rAAV2 в мышцах необходима только одна аминокислотная модификация, а именно, введение различных аминокислот за положением 264 с получением положения 265 de novo. Продолжение предклинических исследований позволило предположить, что перенос rAAV2 ограничен только высокой эффективностью серотипов, таких как rAAV1 и rAAV6, а также высокой распространенностью rAAV2-нейтрализующих антител в популяции. Число серотипов «следующего поколения», которые могут быть использованы для эффективной трансдукции путем модуляции поверхностных аминокислот на капсидном остове, было значительно пополнено.
[0007] Поскольку rAAV1 стал наилучшим выбором для его введения в скелетную мышцу, то есть, он применяется в 67% клинических испытаний путем i.m. и 86% в течение последних 5 лет, то повышение эффективности rAAV1 со временем выведет клинические испытания на новую ступень. Настоящее изобретение относится к модифицированным капсидным белкам, которые обладают улучшенными свойствами, а поэтому являются подходящими для получения векторов с широким спектром применений, включая применение в генотерапии.
Сущность изобретения
[0008] Это исследование позволило понять архитектуру капсида rAAV и на этой основе разработать стратегию, направленную на улучшение его трансдукции в мышцы. В отличие от мутантов rAAV2 с инсерцией в положении 265, делеция в положении 265 капсида rAAV1 обеспечивала наибольшее улучшение доставки трансгена и его экспрессии в мышечной ткани. Кроме того, посредством моделирования гомологии и мутационного анализа, были идентифицированы две области капсида, которые, по всей видимости, действуют вместе по аллостерическому механизму и позволяют регулировать эффективность трансдукции rAAV6 и rAAV2. Полученные результаты выявили механизм региональной дестабилизации в петле VR1, что обусловлено деструкцией паттернов водородных связей. Это открытие позволило осуществлять рациональную мутацию этих дополнительных серотипов в целях повышения эффективности трансдукции по меньшей мере на порядок величин в каждом конкретном случае. Кроме того, экспрессия клинического трансгена ААТ в химерных серотипах rAAV способствует повышению уровня экспрессии в 12,5 раз по сравнению с родительским rAAV1, что подтверждает возможность применения этих конструкций в клинических испытаниях. Эти исследования подтвердили рациональный подход к конструированию с применением структурного моделирования и молекулярного анализа капсида rAAV для улучшения доставки реагентов, наиболее подходящх для исследований по доставке.
[0009] В одном из своих аспектов, настоящее изобретение относится к парвовирусному капсидному белку, содержащему аминокислотную последовательность капсидного белка серотипа AAV или любого другого парвовируса с икосаэдрической капсидной структурой Т=1, где петля вариабельной области 1 (VR1), содержащая аминокислотные остатки 258-272 капсидного белка AAV1 или соответствующие аминокислотные остатки другого AAV или парвовирусного капсидного белка модифицируют путем делеции и/или замены одной или более аминокислотных остатков, что будет приводить к региональной дестабилизации петли из-за нацеленной деструкции паттернов водородных связей, создаваемых этими остатками, и где капсидный белок, содержащий такую модификацию, позволяет получить вирусный вектор, содержащий капсидный белок, повышающий эффективность трансдукции по сравнению с вирусным вектором, включающим капсидный белок, который не содержит такой модификации.
[0010] В своем дополнительном аспекте, настоящее изобретение относится к капсидному белку согласно изобретению, где капсидный белок содержит аминокислотную последовательность серотипа AAV или другого парвовируса, который связывается с сульфатом гепарина, где один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы, и где связывание капсидного белка с сульфатом гепарина существенно снижалось.
[0011] В другом своем аспекте, настоящее изобретение относится к капсидному белку AAV, содержащему аминокислотную последовательность серотипа AAV3a, AAV3b, AAV6 или AAV8, где один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы, и где связывание капсидного белка с сульфатом гепарина существенно снижалось.
[0012] В своем дополнительном аспекте, настоящее изобретение относится к капсидному белку AAV, содержащему аминокислотную последовательность серотипа AAV2, AAV3a или AAV3b, где капсидный белок содержит инсерцию одного или более аминокислотных остатков непосредственно после остатка 264 капсидного белка AAV2 или соответствующего остатка капсидного белка AAV3a или AAV3b, и один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы, где связывание капсидного белка с сульфатом гепарина существенно снижалось; и где капсидный белок позволяет получить вирусный вектор, содержащий капсидный белок, повышающий эффективность трансдукции по сравнению с вирусным вектором, содержащим немодифицированный капсидный белок.
[0013] В другом своем аспекте, настоящее изобретение относится к полинуклеотиду, кодирующему капсидный белок согласно изобретению, к парвовирусному капсиду, содержащему капсидный белок согласно изобретению, к вирусному вектору, содержащему капсидный белок согласно изобретению, и к фармацевтической композиции, содержащей вирусный вектор согласно изобретению.
[0014] В другом своем аспекте, настоящее изобретение относится к способу доставки нуклеиновой кислоты в клетку, где указанный способ включает контактирование клетки с вирусным вектором или с фармацевтической композицией согласно изобретению в условиях, достаточных для проникновения нуклеиновой кислоты в клетку.
[0015] В другом своем аспекте, настоящее изобретение относится к способу доставки нуклеиновой кислоты индивидууму, где указанный способ включает введение индивидууму вирусного вектора или фармацевтической композиции согласно изобретению.
[0016] В другом своем аспекте, настоящее изобретение относится к способу доставки нуклеиновой кислоты индивидууму, где указанный способ включает введение индивидууму клетки, которая контактирует с вирусным вектором или с фармацевтической композицией согласно изобретению в условиях, достаточных для проникновения нуклеиновой кислоты в клетку.
[0017] В своем дополнительном аспекте, настоящее изобретение относится к способу получения рекомбинантной парвовирусной частицы, включающему введение в клетку, подходящую для репликации парвовируса: (а) рекомбинантной парвовирусной матрицы, включающей (i) гетерологичную нуклеиновую кислоту и (ii) по меньшей мере один инвертированный концевой повтор; и (b) полинуклеотида, содержащего репликацирующуюся(иеся) белок-кодирующую(ие) последовательность(и) и последовательность(и), кодирующую(ие) капсидный белок согласно изобретению, в условиях, достаточных для репликации и упаковки рекомбинантной парвовирусной матрицы, и тем самым для продуцирования рекомбинантных парвовирусных частиц в клетке.
[0018] Эти и другие аспекты настоящего изобретения более подробно изложены ниже в описании изобретения.
Краткое описание чертежей
[0019] На фигурах 1А-1D проиллюстрирована in vivo характеризация мутантов rAAV1 в положении 265 после внутримышечной инъекции. (A) Мышам вводили 1е10 вирусного генома (vg) в икроножную мышцу (GC). Экспрессию трансгена люциферазы визуализировали и количественно оценивали путем биолюминесцентной визуализации живых животных через 7 дней после инъекции. Измеренные единицы выражены как число импульсов в минуту по всей представляющей интерес области (CPM/ROI). В целях визуализации, rAAV1 представлен в другом масштабе, чем мутанты в положении 265. Это не влияет на количественную оценку изображения. Для количественной оценки ex vivo фенотипа трансдукции (B) брали инъецированную мышцу и лизировали, а затем проводили люциферазный анализ на лизате ткани. Измерения выражали как относительные световые единицы, нормализованные на мг общего белка (RLU/мг белка). (С) Число копий вирусных трансгенов на клетку (vg/cg) было измерено с помощью кол.ПЦР. (D) Кинетику экспрессии в зависимости от времени оценивали на rAAV1 и rAAV1/T265de1 после инъекции 1e10 vg. Все данные представлены как n=4 на группу; на панели (А) представлено одно репрезентативное изображение на группу.
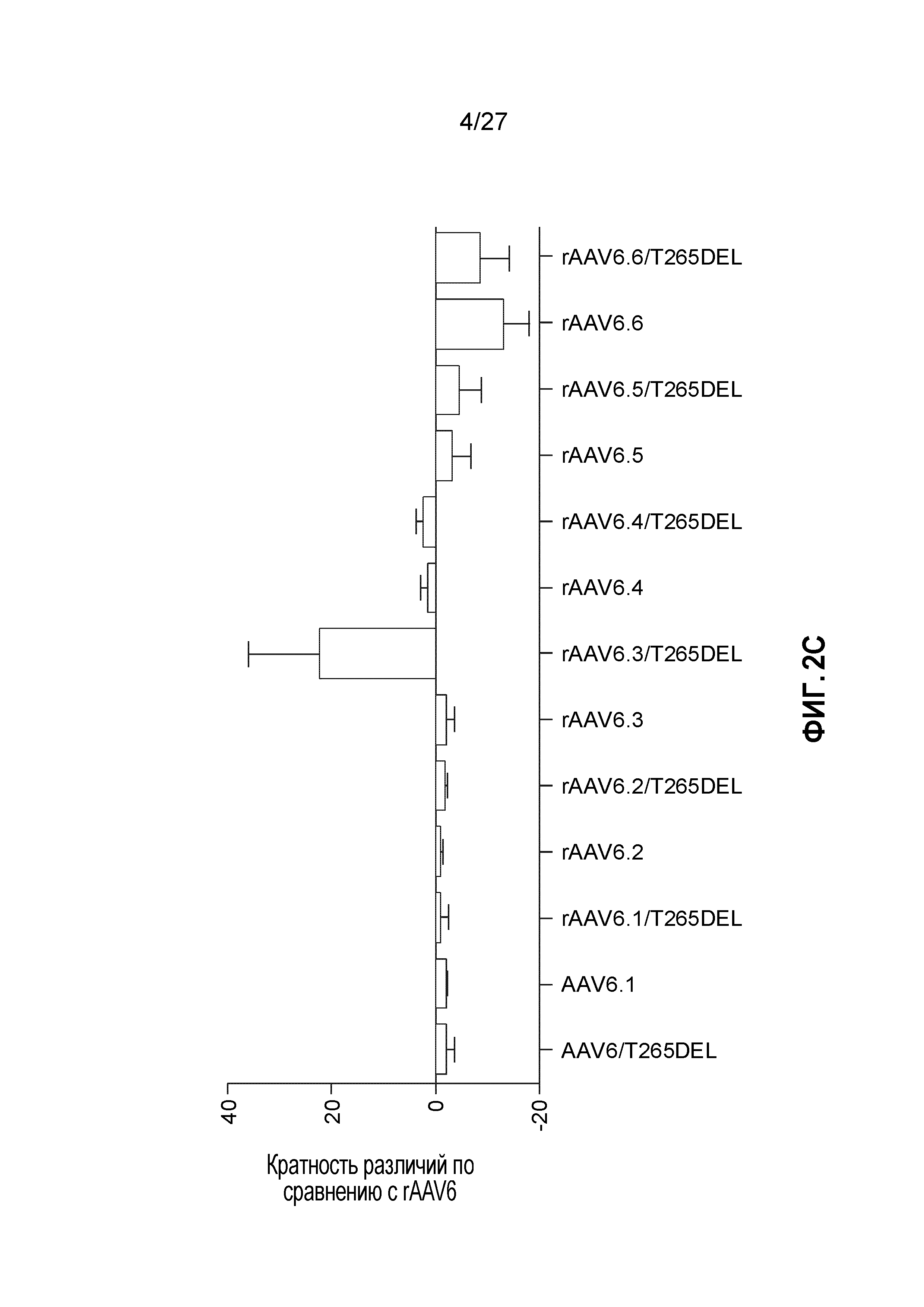
[0020] На фигурах 2A-2C показан фенотип мутанта с делецией в положении 265 rAAV6. (А) Экспрессия трансгена люциферазы через 7 дней после инъекции 1e10 vg либо rAAV6, либо rAAV6/T265del. (В) Выравнивание капсидной области VR1 rAAV1 (светло-серый) и rAAV6 (темно-серый). Остаток 265 выделен темно-синим цветом на rAAV1 и желтым цветом на rAAV6. Изображение было получено в PyMol с использованием имеющихся кристаллографических координат для этих капсидов. (С) Экспрессия трансгена после инъекции точечных мутантов rAAV1 ® rAAV6 в GC мыши. Данные представлены в виде кратного различия по отношению к измеренной экспрессии rAAV6. Все данные представлены как n=4 на группу.
[0001] На фигурах 3А-3D проиллюстрирована визуализация аминокислот в положениях 265 и 531 на капсиде rAAV6. Изображение PyMol было получено с использованием кристаллографических координат капсида rAAV6 (А), где была помечена каждая икосаэдрическая ось симметрии. (B) Крупным планом показана ось симметрии 3-го порядка, где остатки 265 и 531 окрашены пурпурным и оранжевым и обозначены стрелками. (С) Крупным планом показана ось симметрии 5-го порядка, где остатки 265 и 531 окрашены пурпурным и оранжевым и обозначены стрелками. (D) Крупным планом показана ось симметрии 2-го порядка, где остатки 265 и 531 окрашены пурпурным и оранжевым и обозначены стрелками.
[0021] На фигурах 4A-4C проиллюстрировано влияние взаимодействий капсида:гепарина на трансдукцию фенотипа с мутацией в положении 265. (А) Экспрессия трансгена через 7 дней после инъекции мутантов капсида rAAV2 в GC. (B) Представлено PyMol-изображение капсида rAAV6 с остатками T265 (пурпурный), K531 (оранжевый) и R585 (синий) вместе с осью симметрии 3-го порядка. Пунктирная окружность представляет собой общую схему метода футпринтинга по связыванию с гепарином. (С) Экспрессия конструкций трансгенов rAAV2 и rAAV1, вводимых в GC после предварительного инкубирования в физиологическом растворе или в растворе сульфата гепарина. Все данные представлены как n=4 на группу.
[0022] На фигурах 5A-5D показаны профили элюирования при аффинной хроматографии на гепарине для конструкций rAAV2 и rAAV6, используемых в этом исследовании. Конструкции rAAV2 (А, В) и rAAV6 (С, D), используемые в этом исследовании, инкубировали с агарозными сферами, конъюгированными с гепарином, а затем элюировали из сфер при более жестких условиях промывок NaCl. Профили элюирования собирали путем количественной оценки числа вирусных геномов, присутствующих в каждой элюированной фракции с помощью ОТ-кол.ПЦР. Эксперименты были проведены с тремя повторностями, где представлена одна репрезентативная хроматограмма на группу.
[0023] На фиг. 6 показана экспрессия трансгена делеционных сканирующих мутантов VR1 в капсиде rAAV1. Одиночные делеционные мутации были созданы в петле VR1 капсида rAAV1, и эти конструкции были введены в GC мышей в дозе 1e10 vg. Экспрессия трансгена представлена как кратное отличие по отношению к экспрессии, измеренной после инъекции rAAV1. Изображения, показанные над графиком, указывают на остатки, которые были мутированы в этом исследовании, и эти остатки показаны светло-серым, а положение 265 показано темно-серым. На чертеже также показано расположение N- и С-концевых бета-складок, окружающих VR1. Данные представлены как n=4 на группу.
[0024] На фигуре 7 показана концентрация hAAT в сыворотке после i.m.-инъекции конструкций rAAV1 и rAAV6. Капсид rAAV1 и rAAV6, упаковывающий трансген hAAT, вводили в икроножную мышцу в дозе 1e10 vg. Через 5 недель после инъекции брали сыворотку и проводили ELISA для определения количества белка hAAT в крови. Данные представлены как n=4 на группу.
[0025] На фигуре 8 показаны водородные связи в области VR1 капсидов rAAV1 и rAAV6. Атомные пары, участвующие в образовании водородной связи, были вычислены для кристаллографических координат rAAV1 и rAAV6 с помощью анализа на контактирование всех атомов MolProbity, и эти атомные пары были визуализированы с использованием графической программы KiNG. Остатки, содержащие петлю VR1, были помечены. Водородные связи, образованные остатком 265, визуализировали с помощью зеленых точек и обозначали стрелками. Боковые цепи VR1 окрашены оранжевым цветом, а остов белка окрашен желтым цветом.
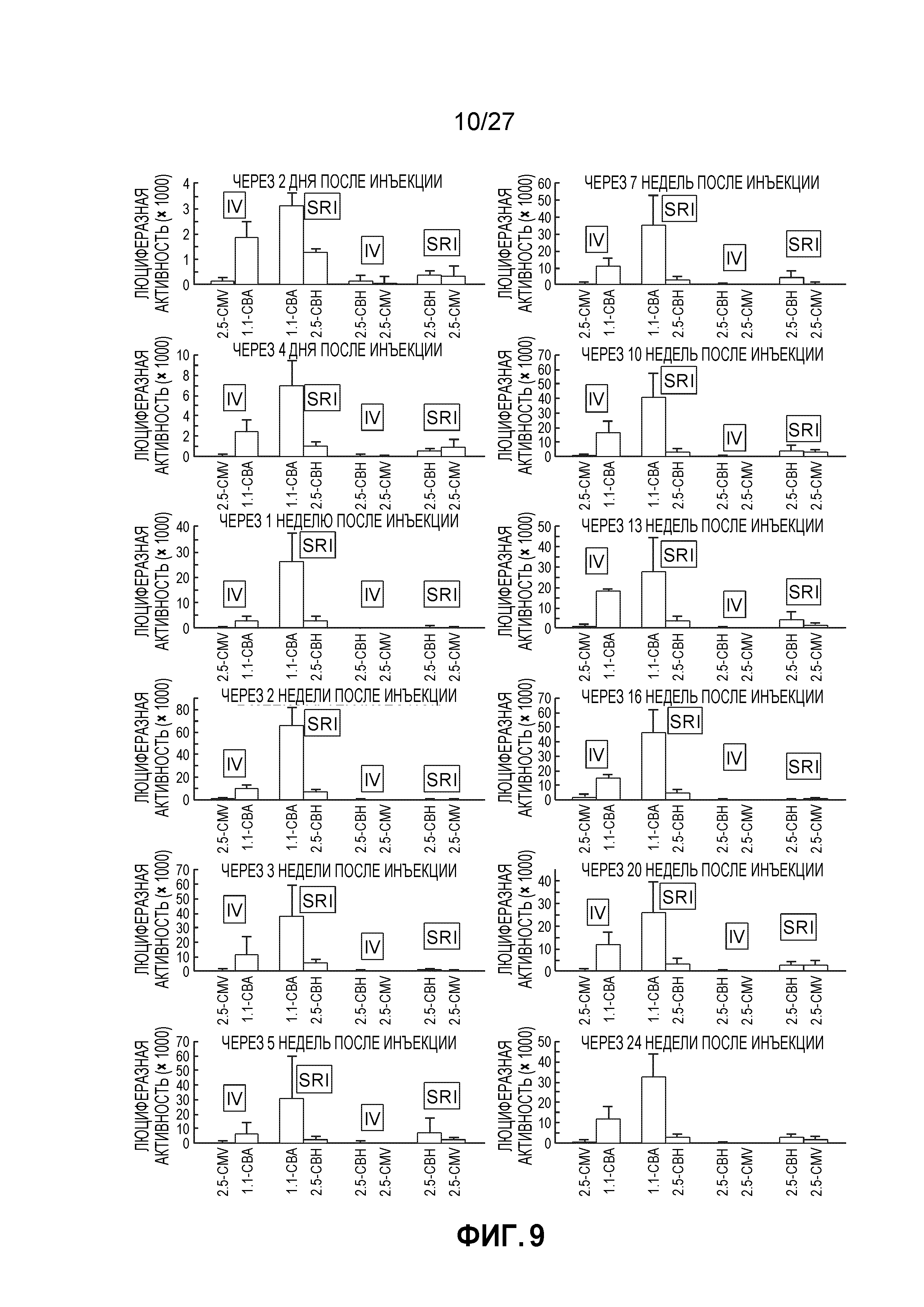
[0026] На фигуре 9 показана экспрессия трансгена после инъекции конструкций rAAV1 и rAAV6 в глаза.
[0027] На фигуре 10 показана экспрессия трансгена после инъекции конструкций rAAV1 и rAAV6 в глаза.
[0028] На фигурах 11А-1H показаны сети водородных связей VR1, визуализированные с помощью визуализирующей компьютерной программы KiNG (A). Главные белковые цепи показаны оранжевым, а боковые цепи показаны светло-зеленым. Водородные связи показаны в виде темно-зеленых облаков со стрелками, указывающими на водородные связи, представленные в VR1. Остатки VR1 были помечены. На панели (В) были выделены следующие связи для rAAV1: HG1 T265 - О S262; О A263 - HG1 T265; ОG S264 - H T265. На панели (С) были выделены следующие связи для rAAV2: OG S264 - H G265; Н A266 - O Q263. На панели (D) были выделены следующие связи для rAAV3b: O Q263 - H A266; О Q263 - H G265. На панели (E) были выделены следующие связи для rAAV4: O L258 - H N261. На панели (F) были выделены следующие связи для rAAV5: H S258 - O V255; O S258 - H N261. На панели (G) были выделены следующие связи для rAAV6: О S264 А - HG S264 A; HG1 T265 - О S262; OG S262 - HD1 H272. На панели (H) были выделены следующие связи для rAAV8: HG1 T265 - O T265. На панели (I) были выделены следующие связи для для rAAV9: HG S265 - O S265; Н G267 - O S263.
[0029] На фигурах 12А-12Н показаны сети водородных связей VR1 в различных серотипах rAAV. PyMol-изображения сфокусированы на петле капсида VR1. Пунктирные линии обозначают водородные связи, присутствующие в кристаллических структурах rAAV1 (PDB ID, 3NG9), rAAV2 (PDB ID, 1LP3), rAAV3b (PDB ID, 3KIC), rAAV4 (PDB ID, 2G8G), rAAV5 (PDB ID, 3NTT), rAAV6 (PDB ID, 30Ah), rAAV8 (PDB ID, 2QAO) и rAAV9 (PDB ID, 3UX1). Аминокислоты VR1, участвующие в образовани сетей водородных связей, изображены в виде отрезков и окрашены зеленым цветом. Аминокислоты, которые были мутированы для проведения этого исследования, окрашены голубоватым цветом. В rAAV1 (А) показаны связи между остатками T265 и S262, T265 и A263, T265 и S264 и S264 и G266. В rAAV2 (В) показаны связи между остатками S264 и G265, и Q263 и A266. В rAAV3b (С) показаны связи между остатками Q263 и A266, и Q263 и G265. В rAAV4 (D) показаны связи между остатками L258 и N261. В rAAV5 (E) показаны связи между остатками S258 и V255, и S258 и N261. В rAAV6 (F) показаны связи между остатками T265 и S262, и S262 и H272. В rAAV8 (G) показаны связи между остатками T265 и T265 (водородный остаток связывается сам с собой). В rAAV9 (H) показаны связи между остатками S263 и G267, и S265 и S265 (водородный остаток связывается сам с собой).
[0030] На фигурах 13A-13F показано биораспределение капсидов rAAV1 и rAAV6, несущих делеционные мутации VR1. Представлено биолюминесцентное изображение капсидов rAAV1 (А) и rAAV6 (D) у живых животных через 9 дней после инъекции в хвостовую вену 1е11 векторных геномов на конструкцию. Через 10 дней после инъекции брали указанные органы, а затем их лизировали и гомогенизировали, после чего оценивали уровень экспрессии люциферазы и содержание общего белка в лизате (В, Е). Величины выражены как относительные световые единицы на миллиграмм общего белка (RLU/мг). Указанную субсерию органов дополнительно обрабатывали с помощью кол.ПЦР (C, F) для определения числа векторных геномов на клеточные геномы (vg/cg). Каждая экспериментальная точка выражена как n=3; изображения представлены в виде одной репрезентативой мыши на группу. Отрезки прямых на графике означают стандартное отклонение.
[0031] На фигурах 14A-14I показано биораспределение капсидов rAAV7, rAAV8 и rAAV9, несущих делеционные мутации VR1. Представлено биолюминесцентное изображение капсидов rAAV7 (А), rAAV8 (D) и rAAV9 (G) у живых животных через 9 дней после инъекции в хвостовую вену 1е11 векторных геномов на конструкцию. Через 10 дней после инъекции брали указанные органы, а затем их лизировали и гомогенизировали, после чего оценивали уровень экспрессии люциферазы и содержание общего белка в лизате (В, Е, Н). Величины выражены как относительные световые единицы на миллиграмм общего белка (RLU/мг). Указанную субсерию органов дополнительно обрабатывали с помощью кол.ПЦР (C, F, I) для определения числа векторных геномов на клеточные геномы (vg/cg). Каждая экспериментальная точка выражена как n=3; изображения представлены в виде одной репрезентативой мыши на группу. Отрезки прямых на графике означают стандартное отклонение.
[0032] На фигурах 15A-15D показано качественное биораспределение мутантных капсидов с делецией VR1 в серотипах rAAV2 и rAAV3b. На панелях (А) и (В), 1е11 vg каждой из указанных конструкций вводили в хвостовую вену. Мышей визуализировали через 10 дней после инъекции. На панелях (С) и (D), 5e11 vg каждой из указанных конструкций вводили в хвостовую вену. Мышей визуализировали через 10 дней после инъекции. Во всех случаях оценивали N=3; где представлена одна репрезентативная мышь для каждой группы.
[0033] На фигурах 16А-16С показано количественное биораспределение мутантных капсидов с делецией VR1 rAAV1 и rAAV6. На панелях (А) и (В) проиллюстрирована экспрессия люциферазы со средними RLU/мг белка для внутренних органов после инъекции в хвостовую вену 1е11 vg указанных конструкций. На панели (С) показано сравнение экспрессии люциферазы со средними RLU/мг белка между rAAV6/T262del и rAAV6/T265del в сердце, в печени и в GC. N=3; Отрезки прямых на графике означают стандартное отклонение.
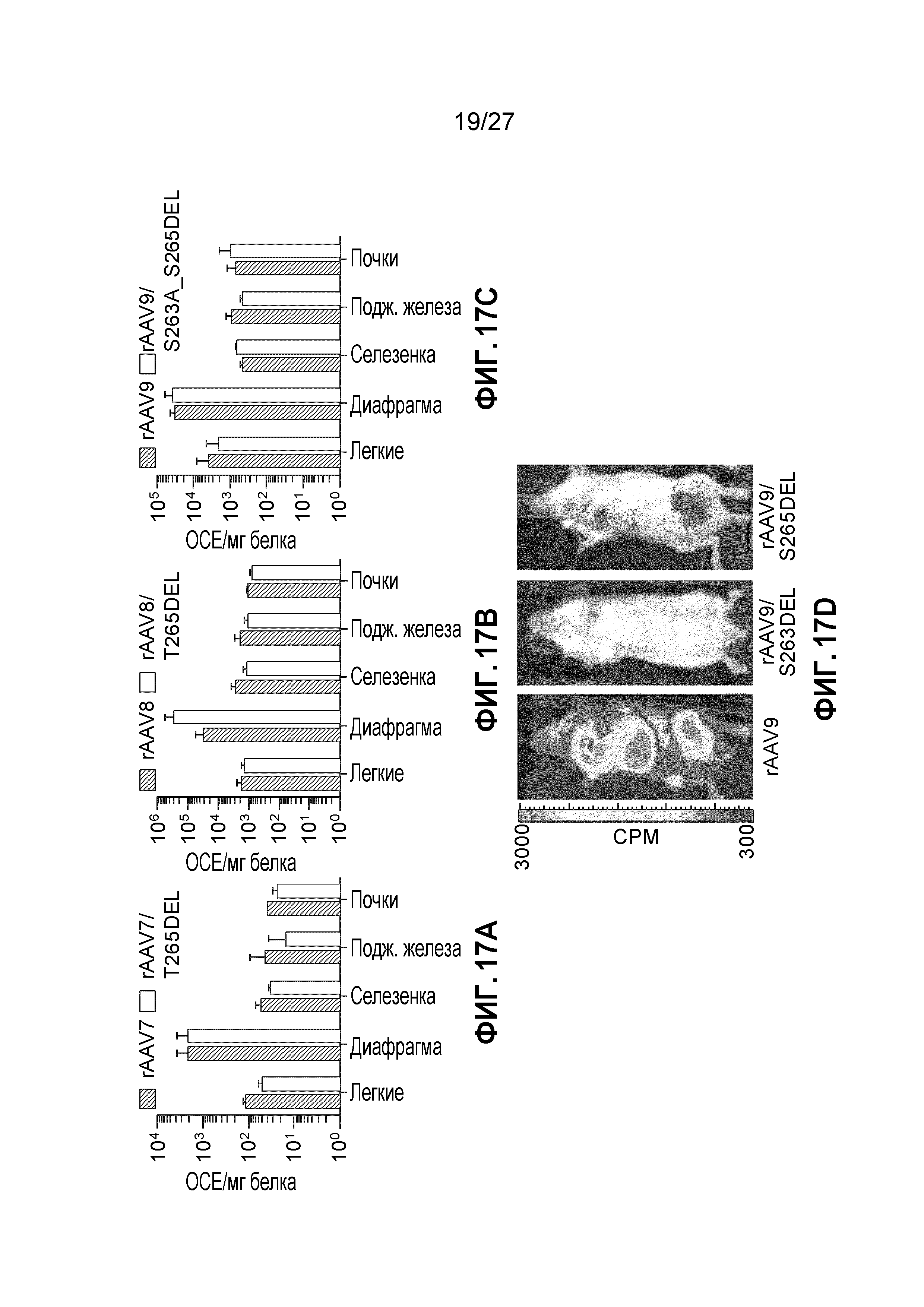
[0034] На фигурах 17А-17D показано количественное и качественное биораспределение мутантных капсидов с делецией VR1 rAAV7, rAAV8 и rAAV9. На панелях (А), (В) и (С) проиллюстрирована экспрессия люциферазы со средними RLU/мг белка для внутренних органов после инъекции в хвостовую вену 1е11 vg указанных конструкций. На панели (D), мышам вводили в хвостовую вену 1е11 vg указанной конструкции, и этих мышей визуализировали через 10 дней после инъекции. N=3 для всех экспериментов; отрезки прямых на графике означают стандартное отклонение. На панели (D) представлена одна репрезентативная мышь для каждой группы.
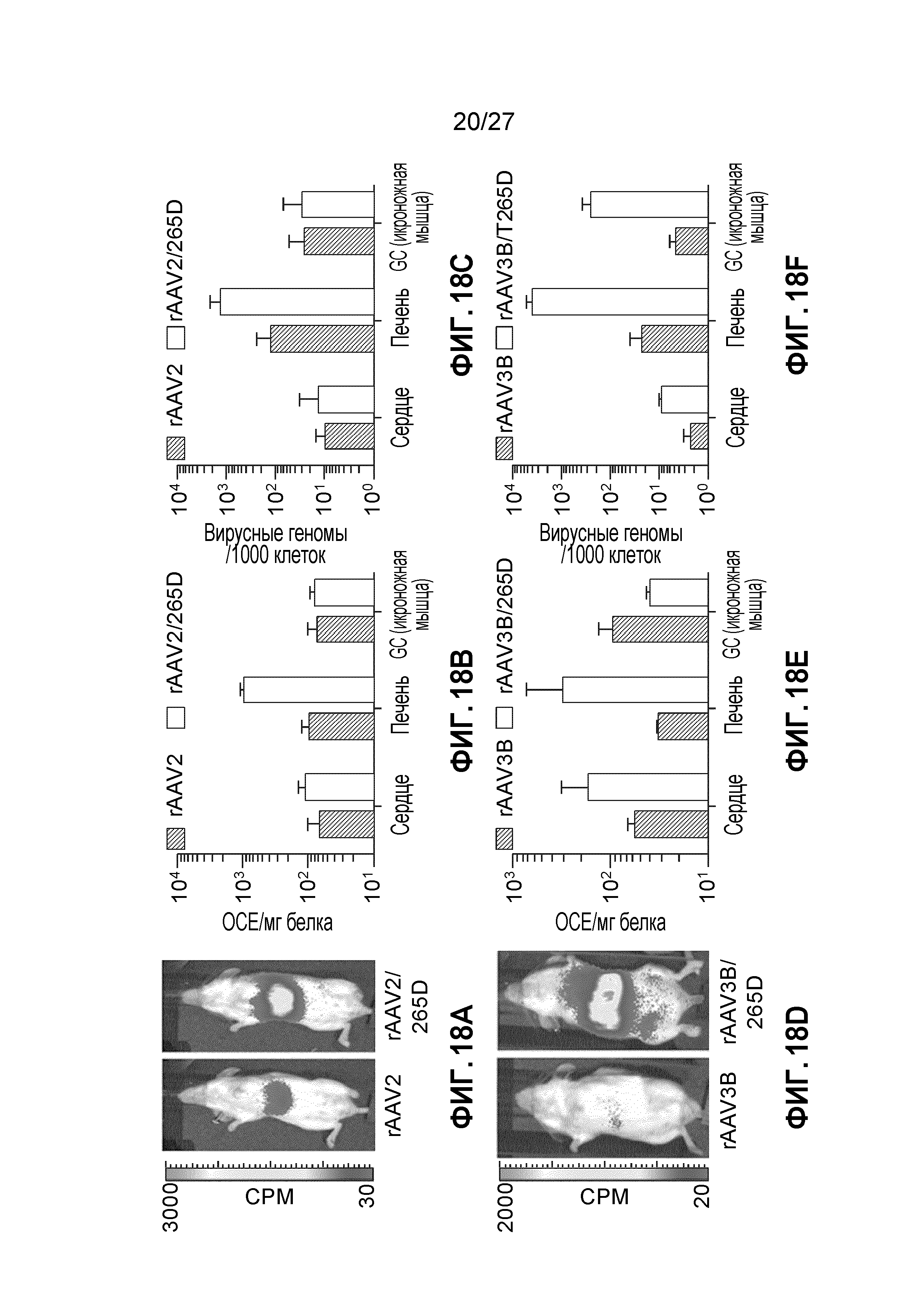
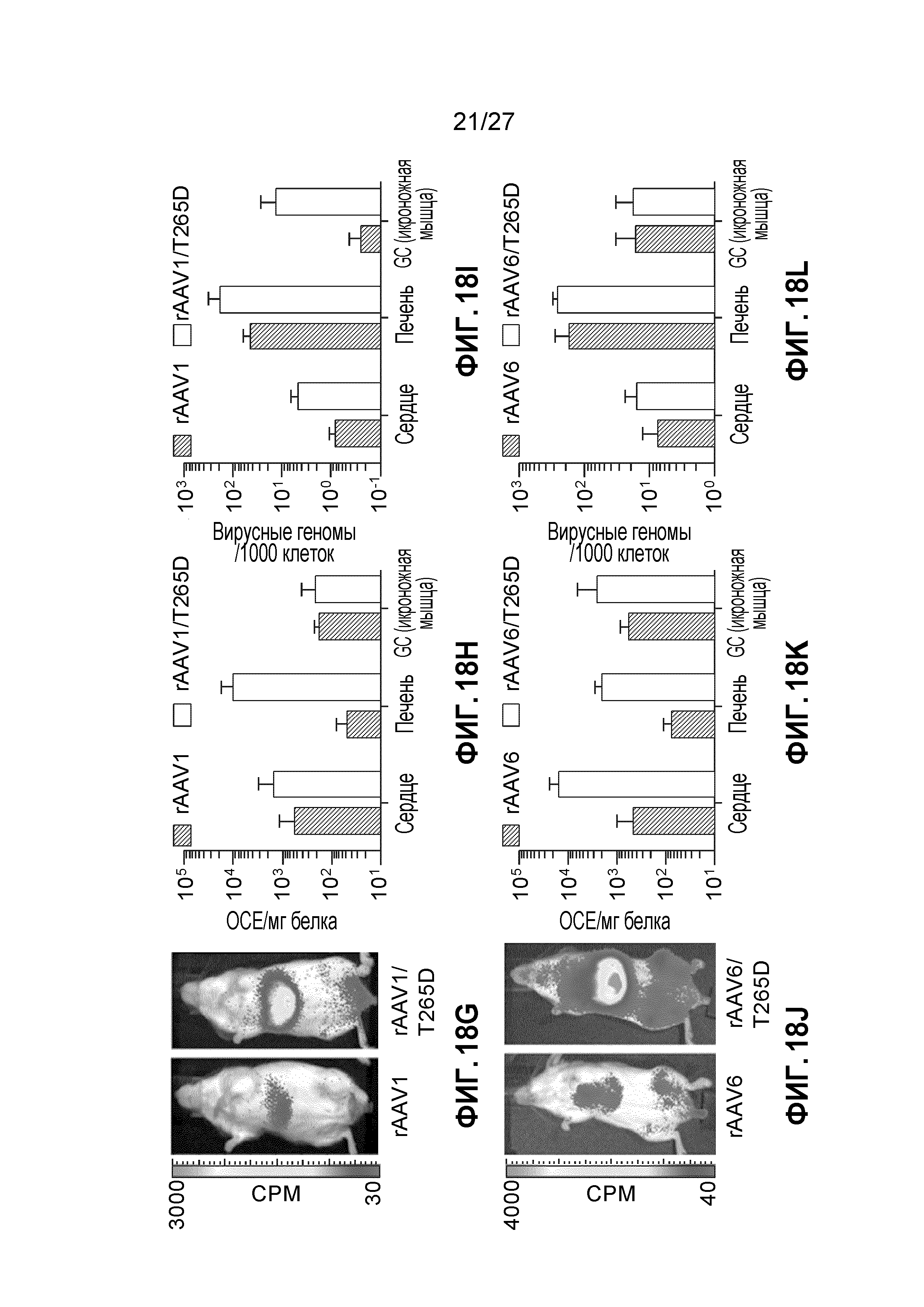
[0035] На фигурах 18А-18L показано биораспределение капсидов rAAV1, rAAV2, rAAV3b и rAAV6, несущих мутации с инсерцией/заменой VR1. Представлено биолюминесцентное изображение капсидов rAAV2 (А), rAAV3b (D), rAAV1 (G) и rAAV6 (J) у живых животных через 9 дней после инъекции в хвостовую вену 1е11 векторных геномов на конструкцию. Через 10 дней после инъекции брали указанные органы, а затем их лизировали и гомогенизировали, после чего оценивали уровень экспрессии люциферазы и содержание общего белка в лизате (B, E, H, K). Величины выражены как относительные световые единицы на миллиграмм общего белка (RLU/мг). Указанную субсерию органов дополнительно обрабатывали с помощью кол.ПЦР (C, F, I, L) для определения числа векторных геномов на клеточные геномы (vg/cg). Каждая экспериментальная точка выражена как n=3; изображения представлены в виде одной репрезентативой мыши на группу. Отрезки прямых на графике означают стандартное отклонение.
[0036] На фигурах 19A-19D показано количественное биораспределение мутантных капсидов VR1 265D rAAV1, rAAV2, rAAV3b и rAAV6. На панелях (А), (В), (С) и (D) проиллюстрирована экспрессия люциферазы со средними RLU/мг белка для внутренних органов после инъекции в хвостовую вену 1е11 vg указанных конструкций. N=3; отрезки прямых на графике означают стандартное отклонение.
[0037] На фигурах 20А-20В показано качественное биораспределение капсидов rAAV8 и rAAV9 с мутацией 265D. На панелях (А) и (В), 1е11 vg каждой из указанных конструкций вводили в хвостовую вену. Мышей визуализировали через 10 дней после инъекции. Во всех случаях оценивали N=3; где представлена одна репрезентативная мышь для каждой группы.
[0038] На фигурах 21А-21D проиллюстрировано влияние способности капсида связываться с гепарином на эффективность трансдукции капсидов, несущих мутации с инсерцией/заменой VR1. Представлены результаты ex vivo анализа на люциферазу на образцах печени, взятых через 10 дней после инъекции у мышей, которым вводили 1е11 vg субсерии капсида rAAV2 (A), включая мутанты в положении 265D, мутанты с отсутствием гепарина и комбинированные мутанты с мутацией 265D и отсутствием гепарина; субсерии капсида rAAV3b (B), включая мутанты в положении 265D, мутанты с отсутствием гепарина и комбинированные мутанты с мутацией 265D и отсутствием гепарина; и субсерии капсида rAAV6 (С), включая мутанты в положении 265D, мутанты с отсутствием гепарина и комбинированные мутанты с мутацией 265D и отсутствием гепарина. Представлены результаты ex vivo анализа на люциферазу на образцах сердца, печени и GC, взятых через 10 дней после инъекции у мышей, которым вводили 1е11 vg субсерии капсида rAAV6 (D), включая мутанты в положении T265del, мутанты с отсутствием гепарина и комбинированные мутанты с мутацией T265del и отсутствием гепарина. Данные представляют собой относительные световые единицы, нормализованные на мг анализируемого белка (RLU/мг). Каждая экспериментальная точка выражена как n=3; а отрезки прямых на графике означают стандартное отклонение.
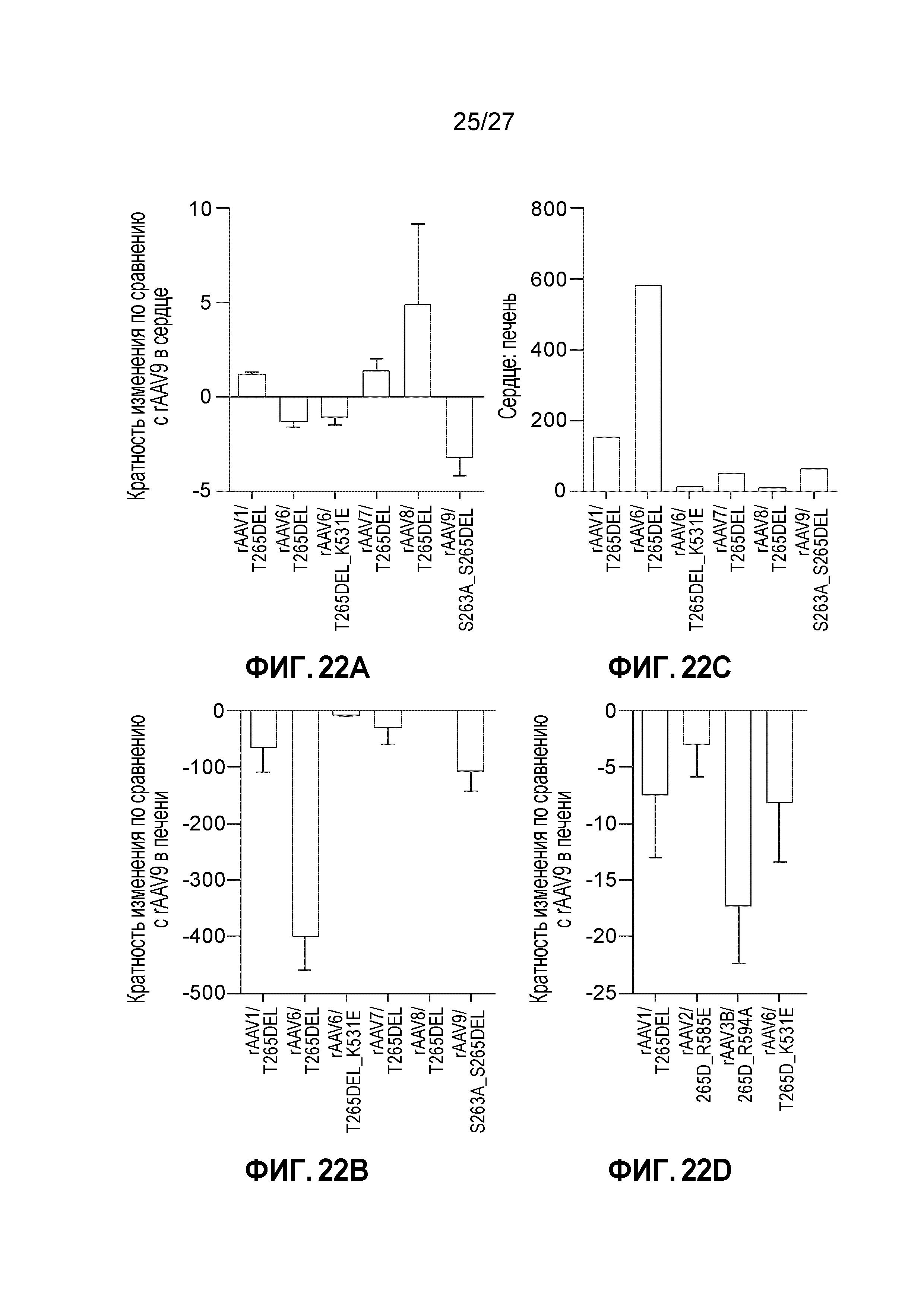
[0039] На фигурах 22А-22D проиллюстрировано сравнение мутанта VR1 и капсида дикого типа в отношении эффективности трансдукции в тканях сердца и печени. Результаты ex vivo анализа на люциферазу на образцах сердца (А) и печени (В), взятых через 10 дней после инъекции 1е11 vg панели мутантных капсидов с делецией VR1. Данные представлены как кратные изменения величин по сравнению с величинами, полученными для rAAV9, после измерения относительных световых единиц на мг анализируемого белка. Показано отношение трансдукции в сердце:печень (С), как было проанализировано в А и В. Показаны результаты ex vivo анализа на люциферазу на образцах ткани печени (D), взятых через 10 дней после инъекции 1е11 vg панели мутантных капсидов с 265D. Данные представлены как кратные изменения величин по сравнению с величинами, полученными для rAAV8, после измерения относительных световых единиц на мг анализируемого белка. Каждая экспериментальная точка выражена как n=3; а отрезки прямых на графике означают стандартное отклонение.
[0040] На фигурах 23А-23В показана эффективность трансдукции капсидов rAAV1 и rAAV6, несущих мутации VR1 в комбинации с заменами тирозина на фенилаланин. Представлены результаты ex vivo анализа на люциферазу на образцах тканей сердца, печени и GC, содержащих панель капсидов rAAV1 (A), несущих мутации с делецией VR1 отдельно и в комбинации с мутациями Y445F, и панель капсидов rAAV6 (В), несущих эквивалентные мутации. Данные представляют собой относительные световые единицы, нормализованные на мг анализируемого белка (RLU/мг). Образцы тканей брали через 10 дней после инъекции 1е11 vg на конструкцию. Каждая экспериментальная точка выражена как n=3; а отрезки прямых на графике означают стандартное отклонение.
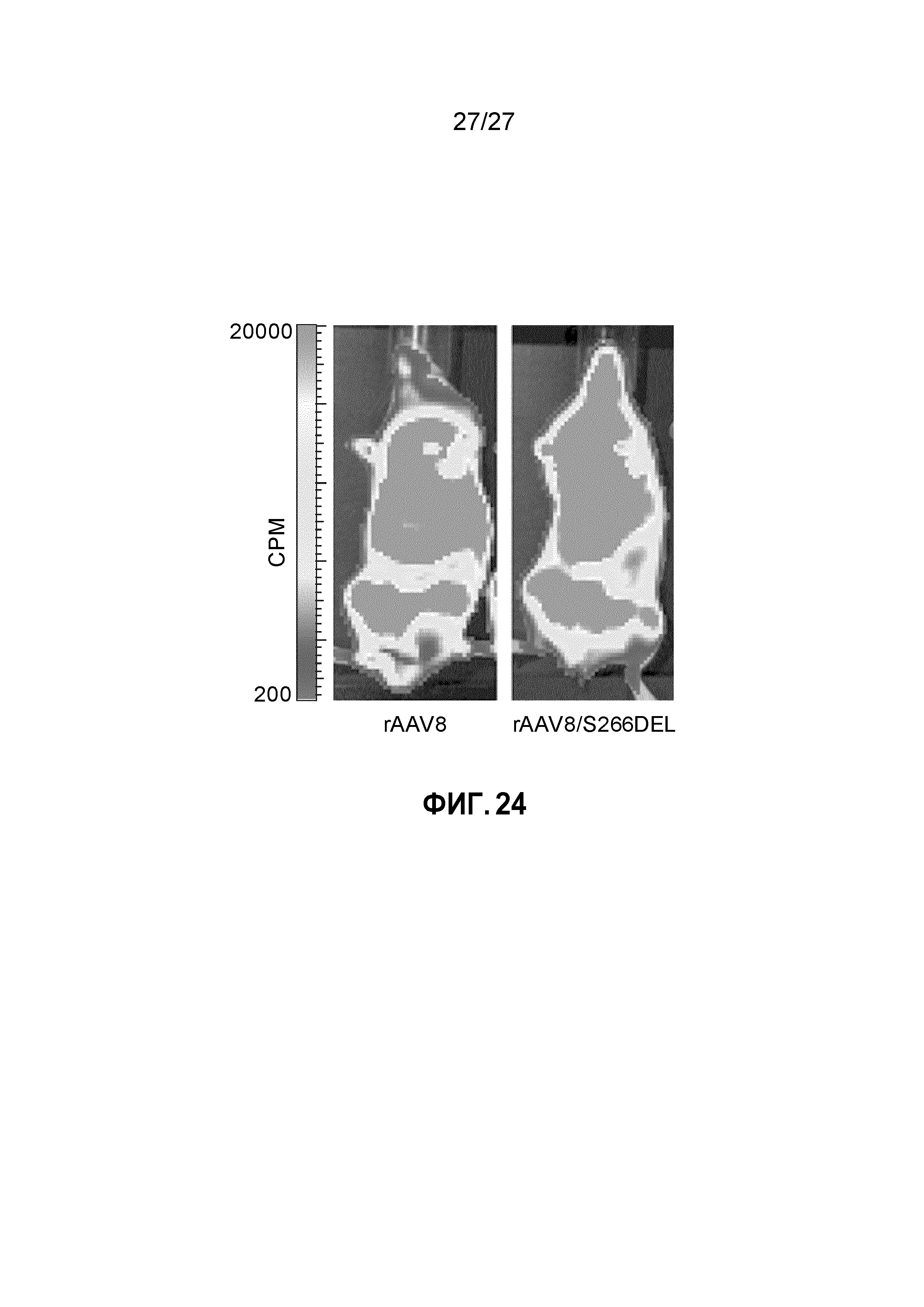
[0041] На фигуре 24 показано качественное биораспределение капсидов rAAV8 и rAAV8/S266del. 1е11 vg каждой из указанных конструкций вводили в хвостовую вену. Мышей визуализировали через 10 дней после инъекции. Во всех случаях оценивали N=3; где представлена одна репрезентативная мышь для каждой группы.
Подробное описание изобретения
[0042] Настоящее изобретение описано со ссылкой на прилагаемые чертежи, на которых проиллюстрированы предпочтительные варианты осуществления изобретения. Однако, настоящее изобретение может быть осуществлено в различных формах и не должно быть истолковано как ограничение вариантов его осуществления, изложенных в настоящем описании. Напротив, эти варианты осуществления представлены для того, чтобы описание было как можно более полным и подробным и полностью соответствовало объему изобретения в данной области техники.
[0043] Если это не оговорено особо, то все используемые здесь технические и научные термины имеют общепринятые значения, известные среднему специалисту в области, к которой относится изобретение. Терминология, используемая в описании настоящего изобретения, приводится лишь в целях раскрытия конкретных вариантов осуществления изобретения и не должна рассматриваться как ограничение изобретения. Все публикации, патентные заявки, патенты и другие упомянутые здесь документы во всей своей полноте вводятся в настоящее описание посредством ссылки.
[0044] Нуклеотидные последовательности представлены здесь в виде только одной цепи, в направлении 5'®3', слева направо, если это не оговорено особо. Нуклеотиды и аминокислоты представлены здесь в форме, рекомендованной Комиссией по биохимической номенклатуре IUPAC-IUB или в форме (для аминокислот) однобуквенного или трехбуквенного кода в соответствии со статьей 37 Кодекса законов США 1.822 и в соответствии с общей практикой. См., например, PatentIn User Manual, 99-102 (Nov. 1990) (Представительство по патентам и торговым знакам США).
[0045] Если это не оговорено особо, то стандартные методы, известные специалистам в данной области, могут быть применены для конструирования рекомбинантного парвовируса и конструкций AAV (rAAV), упаковывающих векторов, экспрессирующих последовательности Rep и/или Cap парвовируса, и временно и стабильно трансфецированных упаковывающих клеток. Такие методы известны специалистам в данной области. См., например, SAMBROOK et al., MOLECULAR CLONING: A LABORATORY MANUAL 2nd Ed. (Cold Spring Harbor, NY, 1989); AUSUBEL et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Green Publishing Associates, Inc. and John Wiley & Sons, Inc., New York).
[0046] Кроме того, в настоящем изобретении также предусматривается, что из некоторых вариантов осуществления изобретения могут быть исключены или удалены любые имеющиеся признаки или комбинации признаков.
[0047] Для дополнительной иллюстрации, если, например, в описании указывается, что конкретная аминокислота может быть выбрана из A, G, I, L и/или V, то это означает, что эта аминокислота может быть выбрана из любой субсерии этих аминокислот, например, A, G, I или L; А, G, I или V; А или G; только L; и т.д., как если бы каждая такая субкомбинация была точно указана в настоящей заявке. Кроме того, это также означает, что могут быть исключены одна или более из конкретно указанных аминокислот. Так, например, в конкретных вариантах осуществления изобретения, аминокислотой не является A, G или I; а также не является А, G или V и т.д., как если бы каждый такой вариант был точно указан в настоящем описании.
Определения
[0048] В нижеследующем описании и в прилагаемой формуле изобретения используются следующие термины.
[0049] Используемые в настоящем описании артикли «a» и «an», употребляемые с существительными в единственном числе, могут относиться и к существительным во множественном числе, если из контекста описания не следует обратное.
[0050] Кроме того, используемый здесь термин «приблизительно», если он относится к измеряемой величине, такой как длина полинуклеотидной или полипептидной последовательности, доза, время, температура и т.п., означает, что эти величины варьируются в пределах 20%, 10%, 5%, 1%, 0,5% или даже 0,1% от указанного количества.
[0051] Кроме того, используемое здесь сочетание союзов «и/или» означает и охватывает любые и все возможные комбинации одного или нескольких связанных перечисленных элементов, а также отсутствие комбинаций при альтернативной интерпретации («или»).
[0052] Используемое здесь словосочетание «состоящий по существу из» следует толковать как включающий перечисленные элементы или стадии и те элементы и стадии, которые не оказывают значительного влияния на основные и новые характеристики заявленного изобретения (например, репликацию rAAV). См., In re Herz, 537 F.2d 549, 551-52, 190 U.S.P.Q. 461, 463 (CCPA 1976) (в оригинале подчеркнуто); см. также MPEP 2111.03. Таким образом, используемый здесь термин «состоящий по существу из» не должен интерпретироваться как эквивалентный термину «содержащий».
[0053] Термин «по существу, состоит из» (и его грамматические варианты), если он относится к полинуклеотидной или полипептидной последовательности согласно изобретению, означает полинуклеотид или полипептид, который состоит из обеих указанных последовательностей (например, SEQ ID NO), и всех десяти или менее (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) дополнительных нуклеотидов или аминокислот у 5'- и/или 3'-концов или у N-конца и/или у С-конца указанной последовательности, расположенных так, чтобы это значительно не влияло на функцию полинуклеотида или полипептида. Все эти десять или менее дополнительных нуклеотидов или аминокислот входят в общее число дополнительных нуклеотидов или аминокислот, добавленных с обоих концов. Термин «существенно изменять», если он применяется к полинуклеотидам согласно изобретению, означает увеличение или снижение уровня экспрессии кодируемого полипептида по меньшей мере приблизительно на 50% или более по сравнению с уровнем экспрессии полинуклеотида, состоящего из указанной последовательности. Термин «существенно изменять», если он применяется к полипептидам согласно изобретению, означает увеличение или снижение активности трансдукции по меньшей мере приблизительно на 50% или более по сравнению с активностью полипептида, состоящего из указанной последовательности.
[0054] Используемый здесь термин «парвовирус» охватывает семейство Parvoviridae, включая автономно реплицирующиеся парвовирусы и депендовирусы. Автономные парвовирусы включают члены рода Parvovirus, Erythrovirus, Densovirus, Iteravirus и Contravirus. Примерами автономных парвовирусов являются, но не ограничиваются ими, мышиный минут-вирус, бычий парвовирус, собачий парвовирус, куриный парвовирус, вирус кошачьей панлейкопении, кошачий парвовирус, гусиный парвовирус, парвовирус H1, парвовирус мускусной утки, змеиный парвовирус и вирус B19. Другие автономные парвовирусы известны специалистам в данной области. См., например, FIELDS et al., VIROLOGY, том 2, глава 69 (4-е изд. публикации Lippincott-Raven).
[0055] Род Dependovirus содержит аденоассоциированные вирусы (AAV), включая, но не ограничиваясь ими, AAV типа 1, AAV типа 2, AAV типа 3 (включая типы 3A и 3B), AAV типа 4, AAV типа 5, AAV типа 6, AAV типа 7, AAV типа 8, AAV типа 9, AAV типа 10, AAV типа 11, AAV типа 12, AAV типа 13, птичий AAV, бычий AAV, собачий AAV, козий AAV, змеиный AAV, лошадиный AAV и овечий AAV. См., например, FIELDS et al., VIROLOGY, том 2, глава 69 (4-ое изд. публикации Lippincott-Raven), и таблицу 1.
[0056] Используемый здесь термин «аденоассоциированный вирус» (AAV), включает, но не ограничивается ими, AAV типа 1, AAV типа 2, AAV типа 3 (включая типы 3А и 3В), AAV типа 4, AAV типа 5, AAV типа 6, AAV типа 7, AAV типа 8, AAV типа 9, AAV типа 10, AAV типа 11, AAV, типа 12, AAV типа 13, змеиный AAV, птичий AAV, бычий AAV, собачий AAV, лошадиный AAV, овечий AAV, козий AAV, AAV креветок и любые другие AAV, которые известны в настоящее или будут обнаружены в будущем. См., например, FIELDS et al., VIROLOGY, т. 2, гл. 69 (4-е изд. публикации Lippincott-Raven). Был идентифицирован ряд относительно новых серотипов и кладотипов AAV (см., например, Gao et al., (2004) J. Virol. 78:6381; Moris et al., (2004) Virol. 33-375; и таблицу 1).
[0057] Частицы и геномы парвовируса согласно изобретению могут происходить, но не ограничиваются ими, от AAV. Геномные последовательности различных серотипов AAV и автономных парвовирусов, а также последовательности нативных белков ITR, Rep и капсидных субъединиц известны специалистам. Такие последовательности можно найти в литературе или в общедоступных базах данных, таких как GenBank. См., например, GenBank рег. №№ NC_002077, NC_001401, NC_001729, NC_001863, NC_001829, NC_001862, NC_000883, NC_001701, NC_001510, NC_006152, NC_006261, AF063497, U89790, AF043303, AF028705, AF028704, J02275, J01901, J02275, X01457, AF288061, AH009962, AY028226, AY028223, AY631966, AX753250, EU285562, NC_001358, NC_001540, AF513851, AF513852 и AY530579, описание которых вводятся в настоящее описание посредством ссылки, для изучения последовательностей нуклеиновых кислот и аминокислотных последовательностей парвовируса и AAV. См., также, например, Bantel-Schaal et al., (1999) J.Virol. 73: 939; Chiorini et al., (1997) J.Virol. 71:6823; Chiorini et al., (1999) J.Virol. 73:1309; Gao et al., (2002) Proc. Nat. Acad. Sci. USA 99:11854; Moris et al., (2004) Virol. 33-375-383; Mori et al., (2004) Virol. 330:375; Muramatsu et al., (1996) Virol. 221:208; Ruffing et al., (1994) J.Gen. Virol. 75:3385; Rutledge et al., (1998) J.Virol. 72:309; Schmidt et al., (2008) J. Virol. 82:8911; Shade et al., (1986) J. Virol. 58:921; Srivastava et al., (1983) J. Virol. 45:555; Xiao et al., (1999) J.Virol. 73:3994; Международные патентные публикации WO 00/28061, WO 99/61601, WO 98/11244; и патент США No. 6156303, описание которых вводятся в настоящее описание посредством ссылки, для изучения последовательностей нуклеиновых кислот и аминокислотных последовательностей парвовируса и AAV. См. также таблицу 1. Описание последовательностей ITR AAV1, AAV2 и AAV3 впервые приводится в публикации Xiao, X., (1996), «Characterization of Adeno-associated virus (AAV) DNA replication and integration» Ph.D. Dissertation, University of Pittsburgh, Pittsburgh, PA (которая во всей своей полноте вводится в настоящее описание посредством ссылки).
Таблица 1
[0058] Используемый здесь термин «тропизм» означает проникновение вируса в клетку, необязательно и предпочтительно с последующей экспрессией (например, с транскрипцией и, необязательно с трансляцией) переносимых вирусным геномом последовательностей в клетке, например, в случае рекомбинантного вируса, с экспрессией гетерологичной(ых) нуклеотидной(ых) последовательности(ей). Специалистам в данной области очевидно, что транскрипция гетерологичной последовательности нуклеиновой кислоты из вирусного генома не может быть инициироваться в отсутствии транс-действующих факторов, например, в случае индуцируемого промотора или какой-либо другой регулируемой последовательности нуклеиновой кислоты. В случае AAV, экспрессия генов из вирусного генома может происходить из стабильно интегрированного провируса, из неинтегрированной эписомы, а также из какой-либо другой формы, которую вирус может принимать внутри клетки.
[0059] Используемый здесь термин «трансдукция» клетки парвовирусом или AAV означает опосредуемый парвовирусом/AAV перенос генетического материала в клетку. См., например, FIELDS et al., VIROLOGY, т.2, гл. 69 (3 изд. публикации Lippincott-Raven).
[0060] Термины «5'-часть» и «3'-часть» являются относительными терминами, определяющими пространственное соотношение между двумя или более элементами. Так, например, «3'-часть» полинуклеотида означает сегмент полинуклеотида, который расположен ниже другого сегмента. Термин «3'-часть» не означает, что сегмент обязательно расположен у 3'-конца полинуклеотида, или даже, обязательно расположен в 3'-половине полинуклеотида, хотя это возможно. Аналогичным образом, «5'-часть» полинуклеотида означает сегмент полинуклеотида, который расположен выше другого сегмента. Термин «5'-часть» не означает, что сегмент обязательно расположен у 5'-конца полинуклеотида, или даже обязательно расположен в 5'-половине полинуклеотида, хотя это возможно.
[0061] Используемый здесь термин «полипептид» включает, если это не оговорено особо, как пептиды, так и белки.
[0062] «Полинуклеотид» представляет собой последовательность нуклеотидных оснований и может представлять собой РНК, ДНК или гибридные последовательности ДНК-РНК (включая природные и не встречающиеся в природе нуклеотиды), а также любые одноцепочечные или двухцепочечные последовательности ДНК.
[0063] Используемый здесь термин «идентичность последовательностей» имеет свое общепринятое значение, известное специалистам. Как известно специалистам в данной области, существует ряд различных программ, которые могут быть использованы для того, чтобы определить, имеет ли полинуклеотид или полипептид последовательности, идентичные или аналогичные известной последовательности. Идентичность или сходство последовательностей могут быть определены стандартными методами, известными специалистам, включая, но не ограничиваясь ими, алгоритм локальной идентичности последовательностей Smith & Waterman, Adv. Appl. Math.2:482 (1981), алгоритм выравнивания идентичных последовательностей Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), метод поиска идентичности Pearson & Lipman, Proc. Natl. Acad. Sci. USA85:2444 (1988), компьютерные программы реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, WI), программа оценки наилучшего соответствия последовательностей, описанная Devereux et al., Nucl. Acid Res. 12:387 (1984), осуществляемая предпочтительно с использованием параметров по умолчанию, или программа контроля.
[0064] Примером подходящего алгоритма является PILEUP. PILEUP позволяет осуществлять выравнивание множества последовательностей, принадлежащих к группе родственных последовательностей с использованием прогрессивных попарных выравниваний. Может быть также построен древовидный график, иллюстрирующий кластеризованную взаимосвязь, используемую для выравнивания. В PILEUP используется упрощенный метод прогрессивного выравнивания Feng & Doolittle, J. Mol. Evol.35:351 (1987), то есть метод, аналогичный методу, описанному Higgins & Sharp, CABIOS5:151 (1989).
[0065] Другим примером подходящего алгоритма является алгоритм BLAST, описанный Altschul et al., J. Mol. Biol. 215:403 (1990) и Karlin et al.,Proc. Natl. Acad. Sci. USA90:5873 (1993). Особенно подходящей программой BLAST является программа WU-BLAST-2, которая была разработана Altschul et al., Meth. Enzymol., 266:460 (1996); blast.wustl/edu/blast/README.html. В WU-BLAST-2 используются несколько параметров поиска, которые предпочтительно установлены по умолчанию. Эти параметры являются динамическими величинами и устанавливаются самой программой в зависимости от состава конкретной последовательности и состава конкретной базы данных, в которой осуществляют поиск представляющих интерес последовательностей, однако, эти величины могут быть скорректированы для повышения чувствительности.
[0066] Другим подходящим алгоритмом является BLAST с пробелами, описанный Altschul et al., Nucleic Acids Res. 25: 3389 (1997).
[0067] Процент идентичности аминокислотных последовательностей определяют путем вычисления соответствующих идентичных остатков, и полученное число делят на общее число остатков более «длинной» последовательности в выровненной области. «Более длинной» последовательностью является последовательность, имеющая наиболее актуальные остатки в выровненной области (пробелы, введенные в WU-BLAST-2 для максимизации оценки выравнивания, не учитываются).
[0068] Аналогичным образом, процент идентичности последовательностей нуклеиновой кислоты определяют как процент нуклеотидных остатков в последовательности-кандидате, которые идентичны нуклеотидам в конкретно описанном здесь полинуклеотиде.
[0069] Выравнивание может включать введение пробелов в выравниваемые последовательности. Кроме того, что касается последовательностей, которые содержат большее или меньшее число нуклеотидов, чем нуклеотиды в конкретно описанных здесь полинуклеотидах, то следует отметить, что в одном варианте осуществления изобретения, процент идентичности последовательностей может быть определен по числу идентичных нуклеотидов по отношению к общему числу нуклеотидов. Так, например, в одном из вариантов осуществления изобретения, идентичность последовательностей, которые являются более короткими, чем конкретно описанная здесь последовательность, может быть определена по числу нуклеотидов в более короткой последовательности. При вычислении процентов идентичности, относительная масса не имеет отношения к различным вариациям последовательности, таким как вставки, делеции, замены и т.д.
[0070] В одном варианте осуществления изобретения, только идентичные последовательности имеют положительную оценку (+1), и всем формам вариации последовательностей, включая пробелы, присваивается значение «0», что исключает необходимость использования взвешенных оценок или параметров, как описано ниже для вычислений подобия последовательностей. Процент идентичности последовательностей может быть вычислен, например, путем деления числа совпадающих идентичных остатков на общее число остатков «более короткой» последовательности в выровненной области и умножения результата на 100. «Более длинной» последовательностью является последовательность, имеющая наиболее актуальные остатки в выровненной области.
[0071] Используемый здесь термин «выделенный» полинуклеотид (например, «выделенная ДНК» или «выделенная РНК») означает полинуклеотид, который был отделен или, по существу, не содержит по меньшей мере некоторых других компонентов природного организма или вируса, например, клеточных или вирусных структурных компонентов или других полипептидов или нуклеиновых кислот, обычно ассоциированных с полинуклеотидом.
[0072] Аналогичным образом, термин «выделенный» полипептид означает полипептид, который был отделен или, по существу, не содержит по меньшей мере некоторых других компонентов природного организма или вируса, например, клеточных или вирусных структурных компонентов или других полипептидов или нуклеиновых кислот, обычно ассоциированных с полипептидом.
[0073] «Терапевтический полипептид» представляет собой полипептид, способный облегчать или ослаблять симптомы, которые являются результатом отсутствия белка или дефекта в белке, в клетке или у индивидуума. Альтернативно, «терапевтический полипептид» представляет собой полипептид, который, в других случаях, дает благоприятный эффект у индивидуума, например, дает противораковый эффект или повышает срок жизнеспособности трансплантата.
[0074] Используемый здесь термин «модифицированный», если он относится к полинуклеотидной или полипептидной последовательности, означает, что эта последовательность отличается от последовательности дикого типа одной или более делециями, добавлениями, заменами или любыми их комбинациями.
[0075] Используемый здесь термин «выделять» или «очищать» (или их грамматические эквиваленты) означает, что этот вирусный вектор по меньшей мере частично отделен по меньшей мере от некоторых других компонентов в исходном материале.
[0076] Термины «лечить», «лечение» или «терапия» (и их грамматические варианты) означают снижение тяжести состояния у индивидуума, по меньшей мере частичное улучшение состояния или его стабилизацию и/или некоторое облегчение, ослабление, снижение или стабилизацию по меньшей мере одного клинического симптома и/или замедление прогрессирования заболевания или расстройства.
[0077] Термины «предотвращать», «предотвращение» и «профилактика» (и их грамматические варианты) относятся к профилактике и/или к замедлению начала развития заболевания, расстройства и/или клинического(их) симптома(ов) у индивидуума, и/или к снижению тяжести заболевания, расстройства и/или клинического(их) симптома(ов) у индивидуума по сравнению с индивидуумами, которые не проходили лечение способами согласно изобретению. Профилактика может быть полной, например, при полном отсутствии заболевания, расстройства и/или клинического(их) симптома(ов). Профилактика также может быть частичной, так, чтобы в случае возникновении заболевания, расстройства и/или клинического(их) симптома(ов) у индивидуума, их тяжесть была меньше, чем это имело бы место в отсутствии профилактики согласно изобретению.
[0078] Используемый здесь термин «терапевтически эффективное» количество означает количество, которое является достаточным для обеспечения некоторого улучшения состояния у индивидуума или достижения желаемого эффекта. Альтернативно, «терапевтически эффективное» количество означает количество, которое будет обеспечивать некоторое уменьшение, ослабление, снижение или стабилизацию по меньшей мере одного клинического симптома у индивидуума. Для специалистов в данной области будет очевидно, что терапевтические эффекты необязательно должны быть полными или лечебными, при условии, что они приносят хоть какую-то пользу индивидууму.
[0079] Используемый здесь термин «профилактически эффективное» количество означает количество, которое является достаточным для профилактики и/или замедления начала развития заболевания, расстройства и/или клинических симптомов у индивидуума и/или для уменьшения и/или ослабления тяжести заболевания, расстройства и/или клинических симптомов у индивидуума по сравнению с индивидуумом, в отношении которого не принимались профилактические меры способами согласно изобретению. Для специалистов в данной области будет очевидно, что профилактических меры необязательно должны быть полными, при условии, что они приносят хоть какую-то пользу индивидууму.
[0080] Используемые здесь термины «гетерологичная нуклеотидная последовательность» и «гетерологичная нуклеиновая кислота» являются синонимами и означают последовательность, которая по своей природе не присутствует в вирусе. В некоторых вариантах осуществления изобретения, гетерологичная нуклеиновая кислота содержит открытую рамку считывания, которая кодирует представляющий интерес полипептид или представляющую интерес нетранслируемую РНК (например, для доставки в клетку или индивидууму).
[0081] Используемые здесь термины «вирусный вектор», «вектор» или «вектор для доставки гена» означают вирусную (например, AAV) частицу, которая функционирует как носитель для доставки нуклеиновой кислоты, и которая содержит векторный геном (например, вирусную ДНК [вДНК]), упакованный в вирион. Альтернативно, в некоторых случаях, термин «вектор» может быть использован для обозначения только векторного генома/вДНК или плазмиды.
[0082] Вирусные векторы согласно изобретению могут также представлять собой дуплексные парвовирусные частицы, описанные в публикации Международной патентной заявки WO 01/92551 (содержание которой во всей своей полноте вводится в настоящее описание посредством ссылки). Таким образом, в некоторых вариантах осуществления изобретения, двухцепочечные (дуплексные) геномы могут быть упакованными.
[0083] «Векторный геном rAAV» или «геном rAAV» представляет собой AAV (т.е. вДНК), который содержит одну или более гетерологичных последовательностей нуклеиновой кислоты. Векторам rAAV для продуцирования вируса обычно требуются лишь 145 оснований ITR в цис-ориентации. Все другие вирусные последовательности являются необязательными и могут быть расположены в транс-ориентации (Muzyczka (1992) Curr. Topics Microbiol. Immunol. 158:97). Обычно, векторный геном rAAV будет сохранить только одну или более последовательностей ITR, что позволяет максимизировать размер трансгена, который может быть эффективно упакован вектором. Структурные и неструктурные белок- кодирующие последовательности могут быть получены в транс-ориентации (например, из вектора, такого как плазмида, или путем стабильной интеграции последовательностей в упаковывающую клетку). В некоторых вариантах осуществления изобретения, векторный геном rAAV содержит по меньшей мере одну последовательность ITR (например, последовательность ITR AAV), необязательно два ITR (например, два ITR AAV), которые обычно расположены на 5'- и 3'-концах векторного генома и фланкируют гетерологичную нуклеиновую кислоту, но не обязательно, должны быть смежными с ней. ITR могут быть одинаковыми или различными.
[0084] Термин «концевой повтор» или «TR» включает любой вирусный концевой повтор или синтетическую последовательность, которые образуют шпилечную структуру и функционируют как инвертированный концевой повтор (то есть опосредуют нужные функции, такие как репликация, упаковка вируса, интеграция и/или «спасение» провируса и т.п.). ITR AAV может представлять собой ITR AAV или ITR не-AAV. Так, например, последовательность ITR не-AAV, такая как последовательность других парвовирусов (например, собачьего парвовируса, бычьего парвовируса, мышиного парвовируса, свиного парвовируса, человеческого парвовируса B-19) или шпилечного SV40, которые служат в качестве ориджина репликации SV40, могут быть использованы в качестве ITR, который может быть также модифицирован путем усечения, замены, делеции, инсерции и/или добавления. Кроме того, ITR может быть частично или полностью синтетическим, таким как «последовательность с двумя D», как описано в патенте США № 5478745, Samulski et al. На фиг. 24 представлены примеры синтетических ITR, рассматриваемых в настоящем изобретении.
[0085] Парвовирусные геномы имеют палиндромные последовательности на обоих 5'- и 3'-концах. Палиндромная природа последовательностей способствует образованию шпилечной структуры, которая стабилизируется за счет образования водородных связей между комплементарными парами оснований. Эта шпилечная структура, предположительно, принимает форму «Y» или «Т». См., например, FIELDS et al., VIROLOGY, том 2, глава 69 (4-е изд. публикации Lippincott-Raven).
[0086] «Инвертированный концевой повтор AAV» или «ITR AAV» может происходить от любого AAV, включая, но не ограничиваясь ими, серотипы 1, 2, 3а, 3b, 4, 5, 6, 7, 8, 9, 10, 11 или 13, змеиный AAV, птичий AAV, бычий AAV, собачий AAV, лошадиный AAV, овечий AAV, козий AAV, AAV креветок и любые другие AAV, которые известны в настоящее время или будут обнаружены в будущем (см., например, таблицу 1). ITR AAV необязательно должен иметь нативную концевую повторяющуюся последовательность (например, нативная последовательность ITR AAV может быть модифицирована путем инсерции, делеции, усечения и/или миссенс-мутации), при условии, что концевой повтор будет опосредовать нужные функции, например, репликацию, упаковку вируса, сохранение вируса и/или спасение провируса и т.п.
[0087] Вирусные векторы согласно изобретению могут также представлять собой «таргетированные» вирусные векторы (например, имеющие направленный тропизм) и/или «гибридный» парвовирус (т.е. в котором присутствуют вирусный ITR и вирусный капсид от различных парвовирусов), как описано в публикации Международной патентной заявки WO 00/28004 и в публикации Chao et al., (2000) Mol. Therapy 2:619.
[0088] Кроме того, вирусный капсид или геномные элементы могут содержать и другие модификации, включая инсерции, делеции и/или замены.
[0089] Используемый здесь термин «аминокислота» охватывает любые природные аминокислоты, их модифицированные формы и синтетические аминокислоты.
[0090] Природные левовращающие (L-)-аминокислоты представлены в Таблице 2.
Таблица 2
[0091] Альтернативно, аминокислотой может быть модифицированный аминокислотный остаток (неограничивающие примеры представлены в Таблице 3), или аминокислота, которая была модифицирована путем посттрансляционной модификации (например, ацетилирования, амидирования, формилирования, гидроксилирования, метилирования, фосфорилирования или сульфирования).
Таблица 3: Производные аминокислотных остатков
[0092] Кроме того, не встречающейся в природе аминокислотой может быть «не-природная» аминокислота, как описано Wang et al., (2006) Annu. Rev. Biophys. Biomol. Struct. 35:225-49. Эти неприродные аминокислоты, преимущественно могут быть использованы для химического связывания представляющих интерес молекул с белком капсида AAV.
[0093] Используемый здесь термин «матрица» или «субстрат» означает полинуклеотидную последовательность, которая может реплицироваться с образованием ДНК парвовируса. Для продуцирования вектора, матрицу обычно встраивают в более крупную нуклеотидную последовательность или конструкцию, включая, но не ограничиваясь ими, плазмиду, вектор на основе «оголенной» ДНК, бактериальную искусственную хромосому (ВАС), дрожжевую искусственную хромосому (YAC) или вирусный вектор (например, аденовирусный вектор, вектор на основе герпесвируса, вектор на основе вируса Эпштейна-Барра, вектор AAV, бакуловирусный вектор, ретровирусный вектор и т.п.). Альтернативно, матрица может быть стабильно встроена в хромосому упаковывающей клетки.
[0094] Используемый здесь термин «Rep-кодирующие последовательности» парвовируса или AAV означает последовательности нуклеиновой кислоты, которые кодируют неструктурные белки парвовируса или AAV, опосредующие репликацию вируса и продуцирование новых вирусных частиц. Эти гены и белки, участвующие в репликации парвовируса и AAV, описаны, например, FIELDS et al., VIROLOGY, том 2, главы 69 и 70 (4-е изд. публикации Lippincott-Raven).
[0095] «Rep-кодирующие последовательности» необязательно кодируют все белки Rep парвовируса или AAV. Так, например, что касается AAV, то последовательности, кодирующие Rep, необязательно кодируют все четыре белка Rep AAV (Rep78, Rep68, Rep52 и Rep40), и действительно, очевидно, что AAV5 экспрессирует только сплайсированные белки Rep68 и Rep40. В репрезентативных вариантах осуществления изобретения, Rep-кодирующие последовательности кодируют по меньшей мере те белки репликации, которые необходимы для репликации вирусного генома и упаковки в новые вирионы. Последовательности, кодирующие Rep, обычно кодируют по меньшей мере один крупный белок Rep (т.е. Rep78/68) и один небольшой белок Rep (т.е. Rep52/40). В конкретных вариантах осуществления изобретения, Rep-кодирующие последовательности кодируют белок Rep78 AAV и белки Rep52 и/или Rep40 AAV. В других вариантах осуществления, Rep-кодирующие последовательности, кодируют белки Rep68 и Rep52 и/или Rep40. В еще одном варианте осуществления изобретения, Rep-кодирующие последовательности кодируют белки Rep68 и Rep52, белки Rep68 и Rep40, белки Rep78 и Rep52 или белки Rep78 и Rep40.
[0096] Используемый здесь термин «крупный белок Rep» означает Rep68 и/или Rep78. Крупные белки Rep согласно изобретению могут представлять собой белки дикого типа или синтетические белки. Крупный белок Rep дикого типа может происходить от любого парвовируса или AAV, включая, но не ограничиваясь ими, серотипы 1, 2, 3а, 3b, 4, 5, 6, 7, 8, 9, 10, 11 или 13, или любой другой AAV, который уже известен или будет обнаружен в будущем (см., например, Таблицу 1). Синтетический крупный белок Rep может быть модифицирован путем инсерции, делеции, усечения и/или миссенс-мутаций.
[0097] Для специалистов в данной области также очевидно, что белки репликации необязательно кодируются одним и тем же полинуклеотидом. Так, например, что касается MVM, то белки NS-1 и NS-2 (которые являются вариантами сплайсинга) могут экспрессироваться независимо друг от друга. Аналогичным образом, для AAV, промотор р19 может быть инактивирован, при этом, крупный(ые) белок(белки) Rep экспрессируется(ются) из одного полинуклеотида, а небольшой(ие) белок(белки) Rep экспрессируется(ются) из другого полинуклеотида. Однако обычно белки репликации удобнее экспрессировать из одной конструкции. В некоторых системах, вирусные промоторы (например, промотор р19 AAV) не могут распознаваться клеткой, а поэтому необходимо экспрессировать крупные и небольшие белки Rep из отдельных экспрессионных кластеров. В других случаях может быть желательным экспрессировать крупные белки Rep и небольшие белки Rep по отдельности, то есть под контролем отдельных элементов регуляции транскрипции и/или трансляции. Так, например, может быть желательным регулировать экспрессию крупных белков Rep для снижения отношения крупных белков Rep к небольшим белкам Rep. В случае клеток насекомых, может оказаться предпочтительным ингибировать экспрессию крупных белков Rep (например, Rep78/68) во избежание токсичности для клеток (см., например, Urabe et al., (2002) Human Gene Therapy 13:1935).
[0098] Используемые здесь «кэп-кодирующие последовательности» парвовируса или ААВ кодируют структурные белки, образующие функциональный капсид парвовируса или AAV (то есть, они могут упаковывать ДНК и инфицировать клетки-мишени). Обычно, кэп-кодирующие последовательности кодируют все субъединицы капсида парвовируса или ААВ, но не все субъединицы капсида мугут кодироваться, если продуцируется функциональный капсид. Обычно, но не обязательно, кэп-кодирующие последовательности присутствуют на одной молекуле нуклеиновой кислоты.
[0099] Капсидная структура автономных парвовирусов и AAV более подробно описана BERNARD N. FIELDS et al., VIROLOGY, том 2, главы 69 и 70 (4-е изд. публикации Lippincott-Raven).
Модифицированные капсидные белки парвовируса
[0100] Настоящее изобретение относится к модифицированным капсидным белкам парвовируса, которые повышают способность к трансдукции ткани и/или обладают модифицированной тканеспецифичностью и могут быть использованы в целях получения парвовирусных векторов для эффективной доставки нуклеиновых кислот в клетки. Авторами настоящего изобретения было обнаружено, что дестабилизация петли в вариабельной области 1 (VR1) капсидного белка посредством разрыва водородных связей между аминокислотными остатками приводит к повышению трансдукции в клетки и/или к повышению модифицированной тканеспецифичности.
[0101] В одном из своих аспектов, настоящее изобретение относится к капсидному белку парвовируса, содержащему аминокислотную последовательность капсидного белка серотипа AAV или любого другого парвовируса с икосаэдрической капсидной структурой Т=1, где петля вариабельной области 1 (VR1), содержащая аминокислоты кислотные остатки 258-272 капсидного белка AAV1 или соответствующие аминокислотные остатки другого капсидного белка AAV или парвовируса была модифицирована путем делеции и/или замены одного или более аминокислотных остатков для региональной дестабилизации в петле за счет нацеленной деструкции паттернов водородных связей, управляемых этими остатками, где капсидный белок, включающий модификацию, позволяет получить вирусный вектор, содержащий капсидный белок с повышенной эффективностью трансдукции и/или повышенной модифицированной тканеспецифичностью по сравнению с вирусным вектором, содержащим капсидный белок, не имеющий такой модификации.
[0102] Серотипы AAV хорошо известны специалистам и описаны выше в Таблице 1. Серотипы AAV имеют икосаэдрическую капсидную структуру Т=1.
[0103] Существует 8 родов подсемейства Parvoviridae, которые способны инфицировать позвоночных, и все они отличаются капсидами, несущими икосаэдрическую симметрию Т=1. Парвовирусами являются, но не ограничиваются ими, следующие вирусы.
1) Амдопарвовирус (Amdoparvovirus)(включая виды: вирус, вызывающий заболевание алеутских норок, амдовирус серой лисицы)
2) Авепарвовирус (включая виды: Aveparvovirus)
3) Бокапарвовирус (Bocaparvovirus) (включая виды: бокапарвовирус 1-3 плотоядных; бокапарвовирус 1 и 2 ластоногих; бокапарвовирус 1 и 2 приматов; бокапарвовирус 1-5 копытных)
4) Копипарвовирус (Copiparvovirus) (включая виды: Copiparvovirus)
5) Депендопарвовирус (Dependoparvovirus) (включая виды: аденоассоциированный депендопарвовирус A; аденоассоциированный депендопарвовирусB; гусиный депендопарвовирус1; птичий депендопарвовирус 1; депендопарвовирус рукокрылых 1; депендопарвовирус ластоногих 1; депендопарвовирус чешуйчатых1)
6) Эритропарвовирус (Erythroparvovirus)(включая виды:эритропарвовирус приматов1-4; эритропарвовирус грызунов 1; эритропарвовирус 1)
7) Протопарвовирус (Protoparvovirus) (включая виды:протопарвовирус плотоядных 1; протопарвовирус грызунов 1 и 2; протопарвовирус копытных 1)
8) Тетрапарвовирус (Tetraparvovirus) (включая виды: тетрапарвовирусрукокрылых1; тетрапарвовирусприматов1; тетрапарвовирускопытных 1-4).
[0104] Последовательности капсидных белков известны специалистам и имеются в базах данных последовательностей, таких как GenBank. Номера используемых здесь аминокислотных остатков в капсидном белке AAV1, AAV2, AAV3b, AAV4, AAV5, AAV6, AAV7, AAV8 и AAV9 относятся к последовательностям, имеющимся в GenBank под регистрационными номерами, указанными в Таблице 1.
[0105] Область VR1 представляет собой хорошо известную часть последовательности капсидного белка серотипов AAV и парвовирусов с икосаэдрической капсидной структурой Т=1. Петля, которая составляет область VR1, состоит, в основном, из аминокислотных остатков 258-272 AAV1 или соответствующих аминокислотных остатков другого AAV или парвовируса. Поскольку петля VR1 имеет хорошо известную структуру, то соответствующие аминокислотные остатки могут быть легко идентифицированы специалистом в данной области. Так, например, в Таблице 4 представлен список репрезентативных аминокислотных остатков VR1. Хотя в данном списке приводятся конкретные остатки, однако, каждому специалисту понятно, что границы области VR1 являются приблизительными и могут варьироваться в зависимости от одного или двух остатков.
Таблица 4
[0106] Область VR1 парвовируса и AAV характеризуется числом водородных связей, которые стабилизируют эту область. Так, например, капсид AAV1 содержит четыре водородных связи в области VR1, а капсид AAV6 содержит две водородных связи в области BR1 (см. фиг. 8). Стабильность петли VR1 может быть снижена путем удаления одной или более водородных связей в этой области, например, путем делеции аминокислотного остатка, участвующего в образовании водородной связи, или замены аминокислотного остатка остатком, который не образует водородную связь. В некоторых вариантах осуществления изобретения, по меньшей мере 1, 2, 3, или 4 или более водородных связей подвергают дизрупции в петле VR1.
[0107] Водородные связи, образованные аминокислотными остатками в петле VR1, могут быть идентифицированы известными методами, включая компьютерный анализ кристаллических структур капсидного белка, анализ структур капсидного белка методом ядерного магнитного резонанса, сравнение гомологии последовательностей и т.п. Примеры аминокислотных остатков, непосредственно участвующих в образовании водородной связи в петле VR1, приводятся в Таблице 5.
Таблица 5
[0108] Так, например, кристаллические структуры могут быть взяты из общедоступных баз данных, например, из банка данных белка RCSB (www.rcsb.org), то есть, из общедоступного депозитария для всех структур, которые были созданы с использованием средства фонда NIH. Отдельные файлы pdb могут быть запущены через программу подтверждения структуры, такую как общедоступная программа подтверждения структуры MolProbity4 (www.molprobidity.biochem.duke.edu), которая позволяет проанализировать геометрические соотношения между отдельными молекулами в кристаллической структуре, а также их электронно-плотные положения и получить визуальную информацию о расположении водородных связей в данной структуре/файла pdb. Выходным параметром программы MolProbity является Kinemage, которая представляет собой графическое изображение кристаллической структуры с включенными водородными связями, и которая может быть визуально оценена с использованием общедоступной компьютерной программы KiNG (www.kinemage.biochem.duke.edu).
[0109] В некоторых вариантах осуществления изобретения, эффективность трансдукции вирусного вектора, содержащего модифицированный капсидный белок, увеличивается по меньшей мере приблизительно на 10%, например, по меньшей мере, приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500% или более, по сравнению с вирусным вектором, содержащим капсидный белок, который не имеет модификации. Капсидный белок, который не имеет модификации, может представлять собой капсидный белок дикого типа или синтетический капсидный белок, при условии, что он не содержит модификаций согласно изобретению. Эффективность трансдукции может быть определена методами, хорошо известными специалистам и описанными в настоящей заявке.
[0110] В некоторых вариантах осуществления изобретения, тканеспецифичность вирусного вектора, содержащего модифицированный капсидный белок, была изменена. В некоторых вариантах осуществления изобретения, трансдукция в мышцы, например, в скелетную и/или сердечную мышцу, увеличивалась по меньшей мере приблизительно на 10%, например, по меньшей мере, приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500% или более, по сравнению с вирусным вектором, содержащим капсидный белок, который не имеет модификации. В некоторых вариантах осуществления изобретения, трансдукция в печень снижалась по меньшей мере приблизительно на 10%, например, по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500% или более, по сравнению с вирусным вектором, содержащим капсидный белок, который не имеет модификации. В некоторых вариантах осуществления, трансдукция в мышцы увеличивалась, а трансдукция в печень снижалась по сравнению с вирусным вектором, содержащим капсидный белок, который не содержит модификации. В некоторых вариантах осуществления изобретения, трансдукция в печень увеличивалась по меньшей мере приблизительно на 10%, например, по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500% или более, по сравнению с вирусным вектором, содержащим капсидный белок, который не имеет модификации.
[0111] В некоторых вариантах осуществления изобретения, капсид модифицируют путем делеции или замены одного или более аминокислотных остатков 258-272 капсидного белка AAV1 или делеции или замены соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 или более остатков. Удаленным или замененным остатком может быть любой остаток в VR1, который способствует изменению состояния ротамера, состоящего из остатков, участвующих в образовании сетей водородных связей. В другом варианте осуществления изобретения, капсид модифицируют путем делеции или замены одного или более аминокислотных остатков 261-269 капсидного белка AAV1 или соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса. В дополнительном варианте осуществления изобретения, капсид модифицируют путем делеции или замены аминокислотного остатка 265 капсидного белка AAV1 или соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса.
[0112] В некоторых вариантах осуществления изобретения, модификацию осуществляют в капсиде AAV1 или AAV6, что приводит к увеличению трансдукции в мышцы и к снижению трансдукции в печень. В некоторых вариантах осуществления изобретения, модификацию осуществляют в капсиде AAV7, AAV8 или AAV9, что приводит к снижению трансдукции в печень и к сохранению трансдукции в мышцы. В некоторых вариантах осуществления изобретения, модификацией является одна или более модификаций, представленных в Таблице 6. В некоторых вариантах осуществления изобретения, модифицированный капсид не происходит от AAV2, AAV3b, AAV4 или AAV5.
Таблица 6. Делеционные мутации в вариабельной области 1.
[0113] В некоторых вариантах осуществления изобретения, капсид модифицируют путем инсерции одного или более аминокислотных остатков (например, аспарагиновой кислоты) за аминокислотным остатком 264 капсидного белка AAV1 или соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса. В другом варианте осуществления изобретения, капсид модифицируют путем замены аминокислотного остатка аминокислотным остатком 265 (например, аспарагиновой кислотой) капсидного белка AAV1 или соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса.
[0114] В некоторых вариантах осуществления изобретения, модификацию осуществляют в капсиде AAV1, AAV2 или AAV3b, что приводит к увеличению трансдукции в печень. В некоторых вариантах осуществления изобретения, модификацию осуществляют в капсиде AAV6, что приводит к увеличению трансдукции в печень и в мышцы. В некоторых вариантах осуществления изобретения, трансдукция в печень увеличивается по меньшей мере приблизительно на 10%, например, по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500% или более, по сравнению с вирусным вектором, содержащим капсидный белок, который не имеет модификации. В других вариантах осуществления изобретения, модификацией является одна или более модификаций, представленных в Таблице 7.
Таблица 7. Мутации путем инсерции и замены аспарагиновой кислоты в вариабельной области 1.
[0115] В другом своем аспекте, настоящее изобретение относится к влиянию снижения способности капсидных белков связываться с сульфатом гепарина на эффективность трансдукции. В приведенных здесь примерах показано, что значительное снижение способности капсидных белков связываться с сульфатом гепарина приводило к повышению эффективности трансдукции. Кроме того, было продемонстрировано, что, в некоторых случаях, значительное снижение способности связываться с сульфатом гепарина приводило к аллостерическому взаимодействию с последующей дестабилизацией петли VR1, и тем самым к значительному повышению эффективности трансдукции по сравнению с трансдукцией, наблюдаемой при введении только одной из этих модификаций.
[0116] В одном из аспектов изобретения, капсидный белок, включающий модификацию в петле VR1, происходит от серотипа AAV или другого парвовируса, который связывается с сульфатом гепарина, где один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы, и где связывание капсидного белка с сульфатом гепарина существенно снижалось. Используемый здесь термин «существенно снижается» относится к снижению способности связываться с сульфатом гепарина по меньшей мере приблизительно на 80%, например, по меньшей мере приблизительно на 85%, 90%, 95%, 96%, 97%, 98%, или 99% или более. Связывание капсидных белков с сульфатом гепарина может быть оценено методами, хорошо известными специалистам и описанными в настоящей заявке.
[0117] В некоторых вариантах осуществления изобретения, капсидный белок, который связывается с сульфатом гепарина, происходит от серотипа AAV2, AAV3a, AAV3b, AAV6 или AAV8. В некоторых вариантах осуществления изобретения, капсидный белок, который связывается с сульфатом гепарина, происходит от серотипа AAV3a, AAV3b, AAV6 или AAV8. Аминокислотный(е) остаток (остатки), участвующий(е) в связывании каждого из этих серотипов с сульфатом гепарина, хорошо известен(известны) специалистам. Примерами являются, но не ограничиваются ими, R484, R487, R585, K532 и R588 в AAV2, K531 в AAV6 и R594 в AAV3b. В некоторых вариантах осуществления изобретения, капсидный белок, который связывается с сульфатом гепарина, включает капсидный белок любого синтетического AAV или парвовируса, которые были модифицированы для сообщения способности связываться с сульфатом гепарина.
[0118] В одном из вариантов осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV6, где аминокислотный остаток 531 был заменен, например, глутаминовой кислотой для значительного снижения уровня связывания с сульфатом гепарина. В другом варианте осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV2, где аминокислотный остаток 585 был заменен, например, глутаминовой кислотой, для значительного снижения уровня связывания с сульфатом гепарина. В другом варианте осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV3b, где аминокислотный остаток 594 был заменен, например, аланином для значительного снижения уровня связывания с сульфатом гепарина.
[0119] В другом своем аспекте, настоящее изобретение относится к капсидным белкам, в которых один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы, где связывание капсидного белка с сульфатом гепарина существенно снижается. В некоторых вариантах осуществления изобретения, эти капсидные белки не имеют модификации в петле VR1. В некоторых вариантах осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV3a, AAV3b, AAV6 или AAV8. В одном из вариантов осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV6, где аминокислотный остаток 531 был заменен, например, глутаминовой кислотой, для значительного снижения уровня связывания с сульфатом гепарина.
[0120] В другом своем аспекте, настоящее изобретение относится к капсидному белку AAV, содержащему аминокислотную последовательность серотипа AAV2, AAV3a или AAV3b, где капсидный белок содержит инсерцию одного или более аминокислотных остатков непосредственно за остатком 264 капсидного белка AAV2 или соответствующего остатка капсидного белка AAV3a или AAV3b, и один или более аминокислотных остатков, которые опосредуют связывание капсидного белка с сульфатом гепарина, были заменены и/или делетированы для значительного снижения уровня связывания капсидного белка с сульфатом гепарина, где указанный капсидный белок позволяет получить вирусный вектор, содержащий капсидный белок и обладающий повышенной эффективностью трансдукции по сравнению с вирусным вектором, содержащим немодифицированный капсидный белок.
[0121] Было продемонстрировано, что инсерция одного или более аминокислотных остатков непосредственно за остатком 264 капсидного белка AAV2 способствует повышению эффективности трансдукции (см., например, патент США № 7892809, который во всей своей полноте вводятся в настоящее описание посредством ссылки). В одном из вариантов осуществления изобретения, инсерцией непосредственно за остатком 264 капсидного белка AAV2 или соответствующего остатка капсидного белка AAV3a или AAV3b является инсерция остатка аспарагиновой кислоты, глутаминовой кислоты или фенилаланина. В одном из вариантов осуществления изобретения, капсидный белок содержит аминокислотную последовательность серотипа AAV2, где аминокислотный остаток 585 был заменен, например, глутаминовой кислотой, для значительного снижения уровня связывания с сульфатом гепарина.
[0122] В другом своем аспекте, настоящее изобретение относится к капсидному белку AAV, имеющему делецию и/или замену одного или более аминокислотных остатков 258-272 капсидного белка AAV1 или соответствующих аминокислотных остатков капсидного белка другого AAV или парвовируса, а также замену тирозинового остатка, например, для повышения эффективности трансдукции в сердце. Было показано, что мутация отобранных тирозиновых остатков на поверхности капсида rAAV повышает эффективность трансдукции rAAV, благодаря предотвращению фосфорилирования и конечной протеасомного расщепления внутриклеточных капсидов перед их проникновением в ядро. (Zhong et al., Virology 381(2):194 (2008)). В некоторых вариантах осуществления изобретения, заменой тирозина является замена Y445F в AAV1 или AAV6.
[0123] В одном своем аспекте, настоящее изобретение относится к полинуклеотиду, кодирующему капсидный белок согласно изобретению. В некоторых вариантах осуществления изобретения, полинуклеотид содержит, по существу, состоит из, или состоит из нее, нуклеотидную последовательность, кодирующую капсидный белок согласно изобретению, например, одну из последовательностей, описанных в настоящей заявке. В других вариантах осуществления изобретения, полинуклеотид содержит, по существу, состоит из, или состоит из нее, нуклеотидную последовательность, кодирующую капсидный белок, которая по меньшей мере на 80%, например, по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична одной из описанных здесь последовательностей капсидного белка.
[0124] В своем дополнительном аспекте, настоящее изобретение относится к парвовирусному капсиду, содержащему капсидный белок согласно изобретению. В некоторых вариантах осуществления изобретения, все капсидные белки в капсиде являются капсидными белками согласно изобретению. В других вариантах осуществления изобретения, некоторые, но не все капсидные белки в капсиде являются капсидными белками согласно изобретению.
[0125] Настоящее изобретение также относится к вирусному вектору, содержащему парвовирусный капсид согласно изобретению. Вирусным вектором может быть парвовирусный вектор, например, вектор AAV. Вирусный вектор может дополнительно содержать нуклеиновую кислоту, включающую рекомбинантную вирусную матрицу, где нуклеиновая кислота инкапсидирована в парвовирусном капсиде. Настоящее изобретение также относится к рекомбинантной парвовирусной частице (например, рекомбинантной частице AAV), содержащей капсидный белок согласно изобретению. Вирусные векторы и вирусные частицы более подробно обсуждаются ниже.
[0126] В некоторых вариантах осуществления изобретения, вирусный вектор обладает модифицированным тропизмом, обусловленным присутствием капсидного белка согласно изобретению. В одном варианте осуществления изобретения, парвовирусный вектор обладает системным тропизмом по отношению к скелетной мышце, сердечной мышце и/или мышце диафрагмы, например, скелетной мышце. В других вариантах осуществления изобретения, парвовирусный вектор обладает пониженным тропизмом по отношению к печени по сравнению с вирусным вектором, содержащим капсидный белок дикого типа.
Методы получения вирусных векторов
[0127] Настоящее изобретение также относится к способам получения вирусных векторов. В одном своем конкретном варианте, настоящее изобретение относится к способу получения рекомбинантной парвовирусной частицы, включающему введение в клетку, подходящую для репликации парвовируса: (а) рекомбинантной парвовирусной матрицы, включающей (i) гетерологичную нуклеиновую кислоту и (ii) ITR парвовируса; (b) полинуклеотида, содержащего Rep-кодирующие последовательности и кэп-кодирующие последовательности согласно изобретению, в условиях, достаточных для репликации и упаковки рекомбинантной парвовирусной матрицы и тем самым для продуцирования рекомбинантных парвовирусных частиц в клетке. Условиями, достаточными для репликации и упаковки рекомбинантной парвовирусной матрицы, могут быть, например, присутствие последовательностей AAV, достаточных для репликации парвовирусной матрицы и инкапсидирования в парвовирусные капсиды (например, последовательности rep парвовируса и последовательности cap парвовируса) и хелперных последовательностей аденовируса и/или герпесвируса. В конкретных вариантах осуществления изобретения, парвовирусная матрица содержит две последовательности ITR парвовируса, которые расположены у 5'- и 3'-конца по отношению к гетерологичной последовательности нуклеиновой кислоты, хотя они необязательно должны быть непосредственно смежными с ними.
[0128] В некоторых вариантах осуществления изобретения, рекомбинантная парвовирусная матрица содержит ITR, который не распознается Rep, что позволяет получить дуплексные векторы AAV, как описано в Международной патентной публикации WO 01/92551.
[0129] Парвовирусную матрицу и последовательности rep и cap парвовируса получают в таких условиях, при которых вирусный вектор, содержащий парвовирусную матрицу, упакованную в парвовирусный капсид, продуцируется в клетке. Этот способ может также включать стадию сбора вирусного вектора из клетки. Вирусный вектор может быть собран из среды и/или путем лизиса клеток.
[0130] Клеткой может быть клетка, которая является пермиссивной для репликации парвовируса. Для этого могут быть использованы любые подходящие клетки, известные специалистам. В конкретных вариантах осуществления изобретения, такая клетка представляет собой клетку млекопитающего (например, примата или человека). В другом варианте, клеткой может быть транс-комплементирующая упаковывающая клеточная линия, которая сообщает функции, отсутствующие у дефектного по репликации хелперного вируса, например, клетки 293 или другие транс-комплементирующие клетки Е1а.
[0131] Последовательности репликации парвовируса и капсида могут быть получены любым методом, известным специалистам. В соответствии с современными протоколами, гены rep/cap обычно экспрессируются на одной плазмиде. Последовательности репликации и упаковки парвовируса необязательно должны быть расположены вместе, хотя это может быть удобно. Парвовирусные последовательности rep и/или cap могут доставляться любым вирусным или невирусным вектором. Так, например, последовательности rep/cap может могут доставляться гибридным аденовирусным или герпесвирусным вектором (например, они могут быь встроены в области E1A или Е3 делетированного аденовирусного вектора). Векторы EBV также могут быть использованы для экспрессии парвовирусных генов cap и rep. Одно из преимуществ этого метода заключается в том, что векторы EBV являются эписомными, но будут сохранять большое число копий во время последовательного деления клеток (то есть, они стабильно интегрируются в клетку в качестве внехромосомных элементов, называемых «ядерной эписомой на основе EBV», см., Margolski, (1992) Curr. Top. Microbiol. Immun. 158:67).
[0132] В качестве дополнительной альтернативы, последовательности rep/cap могут быть стабильно включены в клетку.
[0133] Обычно, последовательности rep/cap парвовируса не фланкируются TR, что предотвращает «спасение» и/или упаковку этих последовательностей.
[0134] Парвовирусная матрица может быть введена в клетку любым известным методом. Так, например, матрица может доставляться посредством не-вирусного вектора (например, плазмиды) или вирусного вектора. В конкретных вариантах осуществления изобретения, парвовирусная матрица доставляется герпесвирусным или аденовирусным вектором (например, встраивается в области E1а или Е3 делетированного аденовируса). В качестве другого примера, в публикации Palombo et al., (1998) J. Virology 72:5025, описан бакуловирусный вектор, несущий репортерный ген, фланкированный TR AAV. Векторы EBV также могут быть использованы для доставки матрицы, как описано выше для генов rep/cap.
[0135] В другом репрезентативном варианте осуществления изобретения, парвовирусная матрица доставляется реплицирующимся вирусом rAAV. В других вариантах осуществления изобретения, провирус ААВ, содержащий парвовирусную матрицу, стабильно интегрируется в хромосому клетки.
[0136] Для повышения титров вируса, клетке могут быть сообщены функции хелперного вируса (например, аденовируса или герпесвируса), которые стимулируют продуктивное инфицирование парвовирусом. Последовательности хелперного вируса, необходимые для репликации парвовируса, известны специалистам. Обычно эти последовательности доставляются хелпернным аденовирусным или герпесвирусным вектором. Альтернативно, аденовирусные или герпесвирусные последовательности могут доставляться другим не-вирусным или вирусным вектором, например, в виде неинфекционной аденовирусной миниплазмиды, которая несет все хелперные гены, стимулирующие эффективное продуцирование парвовируса, как описано Ferrari et al., (1997) Nature Med. 3:1295, и в патентах США №№ 6040183 и 6093570.
[0137] Кроме того, функции хелперного вируса могут обеспечиваться упаковывающей клеткой, содержащей хелперные последовательности, встроенные в хромосому или существующие как стабильный внехромосомный элемент. Обычно хелперные вирусные последовательности не могут упаковываться в вирионы AAV, например, они не фланкируются ITR.
[0138] Специалистам в данной области будет очевидно, что последовательности репликации парвовируса и капсидные последовательности, а также последовательности хелперного вируса (например, аденовирусные последовательности), предпочтительно, конструировать на одной хелперной конструкции. Этой хелперной конструкцией может быть не-вирусная или вирусная конструкция. Неограничивающим примером может служить хелперная конструкция, представляющая собой гибридный аденовирус или гибридный герпесвирус, содержащий гены rep/cap AAV.
[0139] В одном конкретном варианте осуществления изобретения, парвовирусные последовательности rep/cap и аденовирусные хелперные последовательности доставляются одним аденовирусным хелперным вектором. Этот вектор может также содержать парвовирусную матрицу. Парвовирусные последовательности rep/cap и/или парвовирусная матрица могут быть встроены в делетированную область (например, в область Е1а или Е3) аденовируса.
[0140] В другом варианте осуществления изобретения, парвовирусные последовательности rep/cap и аденовирусные хелперные последовательности доставляются одним аденовирусным хелперным вектором. В соответствии с этим вариантом осуществления изобретения, парвовирусная матрица может доставляться как плазмидная матрица.
[0141] В другом иллюстративном варианте осуществления изобретения, парвовирусные последовательности rep/cap и аденовирусные хелперные последовательности доставляются одним аденовирусным хелперным вектором, а парвовирусная матрица интегрируется в клетку в качестве провируса. Альтернативно, парвовирусная матрица доставляется вектором EBV, который присутствует в клетке как внехромосомный элемент (например, в качестве ядерной эписомы на основе EBV).
[0142] В еще одном репрезентативном варианте осуществления изобретения, парвовирусные последовательности rep/cap и аденовирусные хелперные последовательности доставляются одним аденовирусным хелпером. Парвовирусная матрица может присутствовать как отдельный реплицирующийся вирусный вектор. Так, например, парвовирусная матрица может доставляться парвовирусной частицей или второй рекомбинантной аденовирусной частицей.
[0143] В соответствии с вышеупомянутыми способами, гибридный аденовирусный вектор обычно содержит 5'- и 3'-цис-последовательности аденовируса, достаточные для репликации и упаковки аденовируса (например, аденовирусные концевые повторы и последовательность PAC). Парвовирусные последовательности rep/cap и матрица ААV, если она присутствует, встроены в аденовирусный остов и фланкированы 5'- и 3'-цис-последовательностями, а поэтому эти последовательности могут быть упакованы в аденовирусные капсиды. Как описано выше, аденовирусные хелперные последовательности и парвовирусные последовательности rep/cap обычно не фланкируются ITR, а поэтому эти последовательности не упакованы в парвовирусные вирионы.
[0144] В публикации Zhang et al., ((2001) Gene Ther. 18:704-12) описан химерный хелпер, содержащий гены аденовируса и гены rep и cap AAV.
[0145] Герпесвирус может быть также использован в качестве вируса-помощника в методах упаковки парвовирусов. Гибридные герпесвирусы, кодирующие белок (белки) Rep парвовируса могут преимущественно облегчать масштабируемые схемы продуцирования парвовирусного вектора. Был описан гибридный вектор на основе вируса простого герпеса типа I (HSV-1), экспрессирующий гены rep и cap AAV-2 (Conway et al., (1999) Gene Ther. 6:986 и WO 00/17377).
[0146] В другом альтернативном варианте, вирусные векторы согласно изобретению могут быть продуцированы в клетках насекомых с использованием бакуловирусных векторов для доставки генов rep/cap и парвовирусной матрицы, как описано, например, Urabe et al., (2002) Human Gene Ther. 13: 1935-43.
[0147] Исходные парвовирусные векторы, не содержащие контаминирующего хелперного вируса, могут быть получены любым известным методом. Так, например, парвовирус и хелперный вирус могут быть легко дифференцированы по их размеру. Парвовирус может также быть отделен от хелперного вируса исходя из аффинности к субстрату гепарина (Zolotukhin et al., (1999) Gene Therapy 6:973). Делетированные хелперные вирусы, дефектные по репликации, могут быть использованы так, чтобы любой контаминирующий хелперный вирус не был компетентным по репликации. В качестве дополнительной альтернативы может быть использован аденовирусный хелпер, не экспрессирующий позднего гена, поскольку для опосредования упаковки парвовируса требуется только аденовирус, экспрессирующий ранний ген. Аденовирусные мутанты, дефектные по экспрессии позднего гена (например, аденовирусных мутанты ts100K и ts149), известны специалистам.
Рекомбинантные вирусные векторы
[0148] Вирусные векторы согласно изобретению могут быть использованы для доставки нуклеиновых кислот в клетки in vitro, ex vivo и in vivo. В частности, вирусные векторы могут быть преимущественно использованы для доставки или переноса нуклеиновых кислот в клетки животных, включая клетки млекопитающих.
[0149] Любая(ые) представляющая(ие) интерес гетерологичная(ые) последовательность(и) нуклеиновой кислоты может (могут) быть доставлена(ы) в вирусные векторы согласно изобретению. Представляющими интерес нуклеиновыми кислотами являются нуклеиновые кислоты, кодирующие полипептиды, включая терапевтические полипептиды (например, для использования в медицине или ветеринарии), иммуногенные полипептиды (например, для вакцин) или диагностические полипептиды.
[0150] Терапевтическими полипептидами являются, но не ограничиваются ими, трансмембранный регуляторный белок для лечения кистозного фиброза (CFTR), дистрофин (включая мини- и микродистрофины (см. например, Vincent et al., (1993) Nature Genetics 5:130; публикацию патента США No. 2003/017131; публикацию Международной заявки WO/2008/088895, Wang et al., Proc. Natl. Acad. Sci. USA 97:13714-13719 (2000); и Gregorevic et al., Mol. Ther. 16:657-64 (2008)), пропептид миостатин, фоллистатин, растворимый рецептор активина типа II, IGF-1, противовоспалительные полипептиды, такие как доминантный мутант Ikappa B, саркоспан, атрофин (Tinsley et al., (1996) Nature 384:349), мини-атрофин, факторы свертывания крови (например, фактор VIII, фактор IX, фактор Х и т.д.), эритропоэтин, ангиостатин, эндостатин, каталаза, тирозингидроксилаза, супероксиддисмутаза, лептин, рецептор ЛНП, липопротеин-липаза, орнитин-транскарбамилаза, β-глобин, α-глобин, спектрин, α1- антитрипсин, аденозиндезаминаза, гипоксантин-гуанин-фосфорибозил-трансфераза, β-глюкоцереброзидаза, сфингомиелиназа, лизосомная гексозаминидаза А, дегидрогеназа кетокислот с разветвленной цепью, белок RP65, цитокины (например, α-интерферон, β-интерферон, интерферон-γ, интерлейкин-2, интерлейкин-4, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин и т.п.), пептидные факторы роста, нейротропные факторы и гормоны (например, соматотропин, инсулин, инсулиноподобные факторы роста 1 и 2, тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста фибробластов, фактор роста нервных клеток, нейротропный фактор-3 и -4, мозговой нейротропный фактор, белки морфогенеза кости [включая RANKL и VEGF], глиальный фактор роста, трансформирующий фактор роста -α и -β и т.п.), лизосомная кислая α-глюкозидаза, α-галактозидаза А, рецепторы (например, растворимый рецептор фактора роста некроза опухоли α), S100A1, парвальбумин, аденилатциклаза типа 6, молекула, влияющая на ингибирование киназного рецептора, сопряженного с G-белком типа 2, такая как усеченная конститутивно активная bARKct, противовоспалительные факторы, такие как IRAP, антимиостатиновые белки, аспартоацилаза и моноклональные антитела (включая одноцепочечные моноклональные антитела, где репрезентативным mAb является mAb Герцептин®). Другие репрезентативные гетерологичные последовательности нуклеиновых кислот кодируют продукты генов суицида (например, тимидинкиназу, цитозиндезаминазу, дифтерийный токсин и фактор некроза опухоли), белки, сообщающие резистентность к лекарственному средству, используемому в противораковой терапии, продукты гена-супрессора опухоли (например, р53, Rb, Wt-1), TRAIL, FAS-лиганд и любой другой полипептид, который дает терапевтический эффект у индивидуума, нуждающегося в этом. Парвовирусные векторы могут быть также использованы для доставки моноклональных антител и фрагментов антител, например, антитела или фрагмента антитела, направленного против миостатина (см., например, Fang et al., Nature Biotechnol. 23:584-590 (2005)).
[0151] Гетерологичными последовательностями нуклеиновой кислоты, кодирующими полипептиды, являются последовательности, кодирующие репортерные полипептиды (например, фермент). Репортерные полипептиды известны специалистам, и включают, но не ограничиваются ими, зеленый флуоресцентный белок, β-галактозидазу, щелочную фосфатазу, люциферазу и хлорамфеникол- ацетилтрансферазу.
[0152] Альтернативно, в конкретных вариантах осуществления изобретения, гетерологичная нуклеиновая кислота может кодировать антисмысловую нуклеиновую кислоту, рибозим (например, описанный в патенте США № 5877022), РНК, которые влияют на транс-сплайсинг, опосредуемый сплайсеосомой (см., Puttaraju et al., (1999) Nature Biotech. 17:246; патент США № 6013487; патент США № 6083702), интерферирующие РНК (РНКи), включая киРНК, кшРНК или миРНК, которые опосредуют сайленсинг генов (см., Sharp et al., (2000) Science 287:2431), и другие нетранслируемые РНК, такие как «руководящие» РНК (Gorman et al., (1998) Proc. Nat. Acad. Sci. USA 95:4929; патент США № 5869248U, Yuan et al.) и т.п. Репрезентативными нетранслируемыми РНК являются РНКи против продукта гена резистентности ко многим лекарственным средствам (MDR) (например, для лечения и/или профилактики опухолей и/или для введения в сердце в целях предотвращения повреждений при химиотерапии), РНКи против миостатина (например, для лечения мышечной дистрофии Дюшенна), РНКи против VEGF (например, для лечения и/или профилактики опухолей), РНКи против фосфоламбана (например, для лечения сердечно-сосудистого заболевания, см., например, Andino et al., J. Gene Med. 10:132-142 (2008) и Li et al., Acta Pharmacol Sin. 26:51-55 (2005)); молекулы, ингибирующие фосфоламбан или доминантно-негативные молекулы, такие как фосфоламбан S16E (например, для лечения сердечно-сосудистого заболевания, см., например, Hoshijima et al., Nat. Med. 8:864-871 (2002)), РНКи против аденозин-киназы (например, для лечения эпилепсии), РНКи потив саркогликана [например, α, β, γ], РНКи против миостатина, пропептида миостатина, фоллистатина или растворимого рецептора активина типа II, РНКи против противовоспалительных полипептидов, таких как доминантный мутант Ikappa B, и РНКи против патогенных организмов и вирусов (например, вируса гепатита В, вируса иммунодефицита человека, CMV, вируса простого герпеса, вируса человеческой папилломы и т.п.).
[0153] Альтернативно, в конкретных вариантах осуществления изобретения, гетерологичная нуклеиновая кислота может кодировать ингибитор протеинфосфатазы I (1-1), serca2a, белки «цинковые пальцы», которые регулируют ген фосфоламбана, Barkct, β2-адренергического рецептора, киназу β2-адренергического рецептора (BARK), фосфоинозитид-3-киназу (PI3-киназу), молекулу, влияющую на ингибирование киназного рецептора, сопряженного с G-белком типа 2, такую как усеченная конститутивно активная bARKct, кальсарцин, РНКи против фосфоламбана; молекулы, ингибирующие фосфоламбан или доминантно-негативные молекулы, такие как фосфоламбан S16E, enos, inos или белки морфогенеза кости (включая BNP 2, 7 и т.п., RANKL и/или VEGF).
[0154] Вирусный вектор может также содержать гетерологичную нуклеиновую кислоту, которая имеет гомологию с локусом на хромосоме хозяина и подвергается рекомбинации. Такой подход может быть применен, например, для исправления генетического дефекта в клетке-хозяине.
[0155] Настоящее изобретение также относится к вирусным векторам, которые экспрессируют иммуногенный полипептид, например, для вакцинации. Нуклеиновая кислота может кодировать любой представляющий интерес иммуноген, известный специалистам, включая, но не ограничиваясь ими, иммуногены вируса иммунодефицита человека (ВИЧ), вируса обезьяньего иммунодефицита (SIV), вируса гриппа, белки ВИЧ или SIV gag, опухолевые антигены, раковые антигены, бактериальные антигены, вирусные антигены и т.п.
[0156] Применение парвовирусов в качестве вакцинных векторов известно специалистам (см., например, Miyamura et al., (1994) Proc. Nat. Acad. Sci USA 91:8507; патент США No. 5916563, Young et al., патент США No. 5905040, Mazzara et al., патент США No. 5882652, патент США No. 5863541, Samulski et al.). Антиген может присутствовать в капсиде парвовируса. Альтернативно, антиген может экспрессироваться из гетерологичной нуклеиновой кислоты, введенной в рекомбинантный векторный геном. Любой представляющий интерес иммуноген, описанный в настоящей заявке и/или известный специалистам, может быть доставлен посредством вирусного вектора согласно изобретению.
[0157] Иммуногенным полипептидом может быть любой полипептид, подходящий для вырабатывания иммунного ответа и/или защиты индивидуума от инфекции и/или заболевания, включая, но не ограничиваясь этим, микробные, бактериальные, протозойные, паразитарные, грибковые и/или вирусные инфекции и заболевания. Так, например, иммуногенным полипептидом может быть ортомиксовирусный иммуноген (например, иммуноген вируса гриппа, такой как поверхностный белок гемагглютинина вируса гриппа (HA) или нуклеопротеин вируса гриппа, или иммуноген лошадиного вируса гриппа) или лентивирусный иммуноген (например, иммуноген вируса лошадиной инфекционной анемии, иммуноген вируса обезьяньего иммунодефицита (SIV), или иммуноген вируса иммунодефицита человека (ВИЧ), такой как белок GP160 оболочки ВИЧ или SIV, белки матрикса/капсида ВИЧ или SIV, и продукты генов gag, pol и env ВИЧ или SIV). Иммуногенным полипептидом может быть также иммуноген аренавируса (например, иммуноген вируса лихорадки Ласса, такой как нуклеокапсидный белок вируса лихорадки Ласса и гликопротеин оболочки вируса лихорадки Ласса), иммуноген поксвируса (например, иммуноген вируса коровьей оспы, такой как продукты гена L1 или L8 вируса коровьей оспы), иммуноген флавивируса (например, иммуноген вируса желтой лихорадки или иммуноген вируса японского энцефалита), иммуноген филовируса (например, иммуноген вируса Эбола или иммуноген вируса Марбург, такой как продукты гена NP и GP), иммуноген буньявируса (например, иммуногены вирусов RVFV, CCHF и/или SFS) или иммуноген коронавируса (например, иммуноген инфекционного человеческого коронавируса, такой как гликопротеин оболочки человеческого коронавируса или свиной передающийся вирус гастроэнтерита, или иммуноген трансмиссивного вируса гастроэнтерита свиней или иммуноген вируса птичьего инфекционного бронхита). Иммуногенный полипептид может также представлять собой иммуноген полиомиелита, иммуноген герпесвируса (например, иммуногены CMV, EBV, HSV), иммуноген вируса паротита, иммуноген вируса кори, иммуноген вируса коревой краснухи, дифтерийный токсин или другой дифтерийный иммуноген, антиген вируса коклюша, иммуноген вируса гепатита (например, гепатита А, гепатита В, гепатита С и т.п.) и/или любой другой вакцинный иммуноген, который уже известен специалистам или будет идентифицирован в будущем.
[0158] Альтернативно, иммуногенный полипептид может представлять собой любой антиген опухолевых или раковых клеток. Опухолевый или раковый антиген экспрессируется, но необязательно, на поверхности раковых клеток. Репрезентативные антигены раковых и опухолевых клеток описаны S.A. Rosenberg (Immunity 10:281 (1991)). Другими репрезентативными раковыми и опухолевыми антигенами являются, но не ограничиваются ими, продукт гена BRCA1, продукт гена BRCA2, gp100, тирозиназа, GAGE-1/2, BAGE, RAGE, LAGE, NY-ESO-1, CDK-4, β-катенин, MUM-1, каспаза-8, KIAA0205, HPVE, SART-1, PRAME, p15, антигены меланомы (Kawakami et al., (1994) Proc. Natl. Acad. Sci. USA 91:3515; Kawakami et al., (1994) J. Exp. Med., 180:347; Kawakami et al., (1994) Cancer Res. 54:3124), MART-1, gp100 MAGE-1, MAGE-2, MAGE-3, CEA, TRP-1, TRP-2, P-15, тирозиназа (Brichard et al., (1993) J. Exp. Med. 178:489); продукт гена HER-2/neu (патент США No. 4968603), CA 125, LK26, FB5 (эндосиалин), TAG 72, AFP, CA19-9, NSE, DU-PAN-2, CA50, SPan-1, CA72-4, HCG, STN (сиалил-Tn-антиген), белки c-erbB-2, PSA, L-CanAg, рецептор эстрогена, глобулин молочного жира, белок-супрессор опухоли p53 (Levine, (1993) Ann. Rev. Biochem. 62:623); антигены муцина (публикация Международной патентной заявки No. WO 90/05142); теломеразы; белки ядерного матрикса; простатическая кислая фосфатаза; антигены вируса папилломы; и/или антигены, которые уже известны или будут идентифицированы в будущем, и которые ассоциируются со следующими раковыми заболеваниями, такими как меланома, аденокарцинома, тимома, лимфома (например, неходжкинская лимфома, лимфома Ходжкина), саркома, рак легких, рак печени, рак толстой кишки, лейкоз, рак матки, рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак мочевого пузыря, рак почки, рак поджелудочной железы, рак головного мозга и любые другие раковые или злокачественные заболевания, которые уже известны специалистам или будут идентифицированы в будущем (см., например, Розенберг (1996) Ann. Rev Med. 47: 481-91).
[0159] В качестве дополнительной альтернативы, гетерологичная нуклеиновая кислота может кодировать любой полипептид, который желательно продуцировать в клетке in vitro, ex vivo или in vivo. Так, например, вирусные векторы могут быть введены в культивированные клетки с последующей экспрессией генного продукта, который выделяют из этой клетки.
[0160] Специалисту в данной области очевидно, что представляющая(ие) интерес гетерологичная(ые) нуклеиновая(ые) кислота(ы) может (могут) быть функционально присоединена(ы) к соответствующим регуляторным последовательностям. Так, например, гетерологичная нуклеиновая кислота может быть функционально присоединена к элементам регуляции экспрессии, таким как сигналы регуляции транскрипции/трансляции, ориджины репликации, сигналы полиаденилирования, внутренние сайты связывания с рибосомой (IRES), промоторы и/или энхансеры и т.п.
[0161] Специалисту в данной области будет очевидно, что могут быть использованы различные промоторные/энхансерные элементы в зависимости от нужного уровня экспрессии и ее тканеспецифичности. Промотор/энхансер могут быть конститутивными или индуцибельными, в зависимости от желаемого паттерна экспрессии. Промотор/энхансер могут быть нативными или чужеродными и могут иметь природную или синтетическую последовательность. Если они являются чужеродными, то предполагается, что у хозяина дикого типа, которому вводят область инициации транскрипции, эта область инициации транскрипции отсутствует.
[0162] В конкретных вариантах осуществления изобретения, промоторные/энхансерные элементы могут быть нативными для клетки-мишени или индивидуума, подвергаемого лечению. В репрезентативных вариантах осуществления изобретения, промоторный/энхансерный элемент может быть нативным для гетерологичной последовательности нуклеиновой кислоты. Промоторный/энхансерный элемент обычно выбирают так, чтобы он функционировал в представляющей(их) интерес клетке(ах)-мишени(ях). Кроме того, в конкретных вариантах осуществления изобретения, промоторным/энхансерным элементом является промоторный/энхансерный элемент млекопитающих. Промоторный/энхансерный элемент может быть конститутивным или индуцибельным.
[0163] Индуцибельные элементы регуляции экспрессии обычно являяются предпочтительными в тех случаях, когда желательно регулировать экспрессию гетерологичной(ых) последовательности(ей) нуклеиновой кислоты. Индуцибельные промоторные/энхансерные элементы для доставки генов могут представлять собой тканеспецифические или предпочтительные для ткани промоторные/энхансерные элементы, и эти элементы включают промоторные/энхансерные элементы, специфичные или предпочтительные для мышц (включая сердце, скелетную мышцу и/или гладкую мышцу), специфичные или предпочтительные для нервной ткани (включая головной мозг), специфичные или предпочтительные для глаз (включая сетчатку и роговицу), специфичные или предпочтительные для печени, специфичные или предпочтительные для костного мозга, специфичные или предпочтительные для поджелудочной железы, специфичные или предпочтительные для селезенки и специфичные или предпочтительные для легких. Другими индуцибельными промоторными/энхансерными элементами являются гормон-индуцируемые и металл-индуцируемые элементы. Репрезентативными индуцибельными промоторными/энхансерными элементами являются, но не ограничиваются ими, элемент включения/отключения Tet, RU486-индуцируемый промотор, экдизон-индуцируемый промотор, рапамицин-индуцируемый промотор и промотор металлотионеина.
[0164] В тех вариантах осуществления изобретения, в которых гетерологичная(ые) последовательность(и) нуклеиновой кислоты транскрибируется(ются), а затем транслируется(ются) в клетках-мишенях, обычно включают специфические сигналы инициации для эффективной трансляции встроенных белок-кодирующих последовательностей. Эти экзогенные последовательности регуляции трансляции, которые могут включать инициирующий кодон ATG и смежные последовательности, могут иметь различное происхождение, как природное, так и синтетическое.
[0165] Вирусные векторы согласно изобретению представляют собой средство для доставки гетерологичных нуклеиновых кислот в клетки широкого ряда, включая делящиеся и неделящиеся клетки. Вирусные векторы могут быть использованы для доставки представляющей интерес нуклеиновой кислоты в клетку in vitro, например, для продуцирования полипептида in vitro или для генотерапии ex vivo. Вирусные векторы могут быть также использованы в способе доставки нуклеиновой кислоты индивидууму, нуждающемуся в этом, например, для экспрессии иммуногенного или терапевтического полипептида или функциональной РНК. Таким образом, полипептид или функциональная РНК могут продуцироваться у индивидуума in vivo. Индивидууму может быть введен полипептид, если у этого индивидуума имеется дефицит полипептида. Кроме того, указанный способ может также найти свое практическое применение, поскольку продуцирование полипептида или функциональной РНК у индивидуума может давать определенный благоприятный эффект.
[0166] Вирусные векторы могут быть также использованы для продуцирования представляющего интерес полипептида или функциональной РНК в культивированных клетках или у индивидуума (например, с использованием организма индивидуума в качестве биореактора для получения полипептида или наблюдения влияния функциональной РНК на организм индивидуума, например, в комбинации с проведением скрининга).
[0167] Вообще говоря, вирусные векторы согласно изобретению могут быть использованы для доставки гетерологичной нуклеиновой кислоты, кодирующей полипептид или функциональную РНК, в целях лечения и/или профилактики любого патологического состояния, где такая доставка терапевтического полипептида или функциональной РНК будет давать благоприятный эффект. Репрезентативными патологическими состояниями являются, но не ограничиваются ими: кистозный фиброз (трансмембранный регуляторный белок, вызывающий кистозный фиброз) и другие заболевания легких, гемофилия А (фактор VIII), гемофилия B (фактор IX), талассемия (β-глобин), анемия (эритропоэтин) и другие заболевания крови, болезнь Альцгеймера (GDF; неприлизин), рассеянный склероз (β-интерферон), болезнь Паркинсона (нейротропный фактор, происходящий от глиальной клеточной линии [GDNF]), болезнь Гентингтона (РНКи для удаления повторов), амиотрофический боковой склероз, эпилепсия (галанин, нейротропные факторы) и другие нервные расстройства, рак (эндостатин, ангиостатин, TRAIL, FAS-лиганд, цитокины, включая интерфероны; РНКи, включая РНКи против VEGF или продукта гена резистентности ко многим лекарственным средствам), сахарный диабет (инсулин), мышечные дистрофии, включая дистрофию Дюшенна (дистрофин, мини-дистрофин, инсулин-подобный фактор роста I, саркогликан [например, α, β, γ], РНКи против миостатина, пропептида миостатина, фоллистатина, растворимого рецептора активина типа II, противовоспалительные полипептиды, такие как доминантный мутант Ikappa B, саркоспан, атрофин, миниатрофин, РНКи против стыков сплайсинга в гене дистрофина для индуцирования исключения экзонов [см., например, WO/2003/095647], антисмысловая последовательность против мяРНК U7 для индуцирования исключения экзонов [см., например, WO/2006/021724], и антитела или их фрагменты против миостатина или пропептида миостатина), и болезнь Беккера, болезнь Гуше (глюкоцереброзидаза), болезнь Хеллера (α-L-идуронидаза), дефицит аденозин-дезаминазы (аденозин-дезаминаза), болезни, ассоциированные с запасанием гликогена (например, болезнь Фабри [α-галактозидаза] и болезнь Помпе [лизосомная кислая α-глюкозидаза]) и другие нарушения метаболизма, врожденная эмфизема (α1-антитрипсин), синдром Лиша-Нейена (гипоксантин-гуанин-фосфорибозил-трансфераза), болезнь Нимана-Пика (сфингомиелиназа), болезнь Тея-Сакса (лизосомная гексозаминидаза A), болезнь, проявляющаяся запахом кленового сиропа в моче (дегидрогеназа кетокислот с разветвленной цепью), дегенеративные расстройства сетчатки (и другие заболевания глаз и сетчатки; например, PDGF для лечения дегенерации желтого пятна), болезни солидных органов, таких как головной мозг (включая болезнь Паркинсона [GDNF], астроцитомы [эндостатин, ангиостатин и/или РНКи против VEGF], глиобластомы [эндостатин, ангиостатин и/или РНКи против VEGF]), болезни печени, почек, сердца, включая застойную сердечную недостаточность или заболевания периферческих артерий (ЗПА) (например, подвергаемые лечению путем доставки ингибитора протеин-фосфатазы I (I-1), serca2a, белков «цинковые пальцы», которые регулируют уровни гена фосфоламбана, Barkct, β2-адренергического рецептора, β2-адренергической киназы рецептора (BARK), фосфоинозитид-3-киназы (киназы PI3), S100A1, парвальбумина, аденилилциклазы типа 6, молекулы, которая влияет на ингибирование киназы сопряженного с G-белком рецептора типа 2, такой как усеченная конститутивно активная bARKct; кальсакрина, РНКи против фосфоламбана; молекул, ингибирующих фосфоламбан или доминантно-негативных молекул, таких как фосфоламбан S16E, и т.п.), артрит (инсулин-подобные факторы роста), заболевания суставов (инсулин-подобный фактор роста 1 и/или 2), гиперплазия внутренних органов (например, подвергаемая лечению путем доставки enos, inos, для улучшения эффективности приживления трансплантатов сердца (супероксиддисмутаза), СПИД (растворимый CD4), атрофия мышц (инсулин-подобный фактор роста I), почечная недостаточность (эритропоэтин), анемия (эритропоэтин), артрит (противовоспалительные факторы, такие как IRAP и растворимый рецептор TNFα), гепатит (α-интерферон), дефицит рецептора ЛНП (рецептор ЛНП), гипераммониемия (орнитин-транскарбамилаза), болезнь Краббе (галактоцереброзидаза), болезнь Баттена, церебральная атаксия спинного мозга, включая SCA1, SCA2 и SCA3, фенилкетонуриия (фенилаланин-гидроксилаза), аутоиммунные заболевания и т.п. Настоящее изобретение также может быть использовано после трансплантации органов для повышения выживаемости трансплантата и/или для уменьшения негативных побочных эффектов при трансплантации органов или при вспомогательной терапии (например, путем введения иммунодепрессантов или ингибирующих нуклеиновых кислот для блокирования продуцирования цитокинов). В качестве другого примера, белки морфогенеза кости (включая BNP 2, 7 и т.п., RANKL и/или VEGF) могут быть введены с помощью костного аллотрансплантата, например, после перерыва в лечении или хирургической операции у больного раком.
[0168] Перенос генов имеет важное значение для понимания природы патологических состояний и проведения их терапии. Существует ряд наследственных заболеваний, в развитии которых участвуют известные дефектные гены, и эти гены были клонированы. Вообще говоря, вышеуказанные патологические состояния подразделяются на два класса: дефицитные состояния, вызываемые, как правило, ферментами, которые обычно наследуется по рецессивному механизму, и состояния, вызываемые дисбалансом, которые могут ассоциироваться с регуляторными или структурными белками, и которые, как правило, наследуются по доминантному механизму. Что касается заболеваний, связанных с дефицитом ферментов, то перенос генов может быть использован для доставки нормального гена в пораженные ткани для заместительной терапии, а также для создания моделей заболевания на животных с использованием антисмысловых мутаций. Что касается заболеваний, вызываемых дисбалансом, то перенос генов может быть использован для создания системы с моделью патологического состояния, которая может быть затем использована для лечения такого патологического состояния. Таким образом, вирусные векторы согласно изобретению могут быть использованы для лечения и/или профилактики генетических заболеваний.
[0169] Вирусные векторы согласно изобретению могут быть также использованы для доставки функциональной РНК в клетку in vitro или in vivo. Экспрессия функциональной РНК в клетке может, например, способствовать снижению уровня экспрессии конкретного белка-мишени в клетке. В соответствии с этим, функциональная РНК может быть введена для снижения уровня экспрессии конкретного белка у индивидуума, нуждающегося в этом. Функциональная РНК также может быть введена в клетки in vitro для регуляции экспрессии генов и/или физиологии клеток, например, в целях оптимизации систем культивирования клеток или тканей, или методов скрининга.
[0170] Вирусные векторы согласно изобретению находят свое применение в методах диагностики и скрининга, где представляющая интерес нуклеиновая кислота временно или стабильно экспрессируется в системе для культивирования клеток, или альтернативно, у трансгенного животного-модели.
[0171] Вирусные векторы согласно изобретению могут быть также использованы в различных нетерапевтических целях, включая, но не ограничиваясь ими, применение в протоколах оценки таргетинга гена, клиренса, транскрипции, трансляции и т.п., как известно специалистам. Вирусные векторы могут быть также использованы для оценки безопасности (распространения, токсичности, иммуногенности и т.п.). Такие данные, например, рассматриваются специалистами Управления по контролю качества пищевых продуктов и лекарственных средств США в рамках нормативного утверждения до проведения оценки клинической эффективности.
[0172] В другом варианте осуществления изобретения, вирусные векторы согласно изобретению могут быть использованы для вырабатывания иммунного ответа у индивидуума. В соответствии с этим вариантом осуществления изобретения, вирусный вектор, содержащий гетерологичную последовательность нуклеиновой кислоты, кодирующую иммуногенный полипептид, может быть введен индивидууму с последующим вырабатыванием у него активного иммунного ответа против иммуногенного полипептида. Иммуногенные полипептиды описаны выше. В некоторых вариантах осуществления изобретения вырабатывается протективный иммунный ответ.
[0173] Альтернативно, вирусный вектор может быть введен в клетку ex vivo, а затем такая модифицированная клетка может быть введена индивидууму. Вирусный вектор, содержащий гетерологичную нуклеиновую кислоту, вводят в клетку, а затем эту клетку вводят индивидууму, где может экспрессироваться гетерологичная нуклеиновая кислота, кодирующая иммуноген, с последующим индуцированием иммунного ответа у индивидуума против иммуногена. В конкретных вариантах осуществления изобретения, клеткой является антигенпрезентирующая клетка (например, дендритная клетка).
[0174] «Активный иммунный ответ» или «активный иммунитет» характеризуется распределением тканей и клеток-хозяев после взаимодействия с иммуногеном. Такое распределение включает дифференцировку и пролиферацию иммунокомпетентных клеток в лимфоретикулярных тканях, что приводит к синтезу антител или к развитию клеточно-опосредуемой реактивности или того и другого. Herbert B. Herscowitz, Immunophysiology: Cell Function and Cellular Interactions in Antibody Formation,in IMMUNOLOGY: BASIC PROCESSES 117 (Joseph A. Bellanti ed., 1985). Альтернативно, активный иммунный ответ вырабатывается у хозяина после его контактирования с иммуногеном посредством инфицирования или путем вакцинации. Активный иммунитет может быть противопоставлен пассивному иммунитету, который приобретается посредством «передачи предварительно образованных веществ (антитела, фактора переноса, трансплантата в тимусе, интерлейкина-2) от активно иммунизированного хозяина к неиммунному хозяину», см. там же.
[0175] Используемый здесь термин «протективный» иммунный ответ или «протективный» иммунитет означает, что иммунный ответ сообщает определенный благоприятный эффект у индивидуума, заключающийся в предотвращении развития заболевания или снижении его тяжести. Альтернативно, протективный иммунный ответ или протективный» иммунитет может оказаться эффективным для лечения и/или профилактики заболевания, а в частности, рака или опухоли (например, благодаря предупреждению развития рака или опухоли, регрессии рака или опухоли и/или предупреждению метастазов и/или роста метастатических узелков). Протективные эффекты могут быть полными или частичными, при условии, что эффекты от лечения будут компенсировать любые неблагоприятные эффекты.
[0176] В конкретных вариантах осуществления изобретения, вирусный вектор или клетка, содержащие гетерологичную нуклеиновую кислоту, могут быть введены в иммуногенно эффективном количестве, как описано ниже.
[0177] Вирусные векторы согласно изобретению могут быть также введены в целях противораковой иммунотерапии путем доставки вирусного вектора, экспрессирующего один или более антигенов раковых клеток (или иммунологически подобной молекулы) или любого другого иммуногена, который продуцирует иммунный ответ против раковых клеток. Для иллюстрации, иммунный ответ может вырабатываться против антигена раковых клеток у индивидуума после введения вирусного вектора, содержащего гетерологичную нуклеиновая кислоту, кодирующую антиген раковых клеток, например, для лечения пациента с раком и/или профилактики развития рака у индивидуума. Вирусный вектор может быть введен индивидууму методами in vivo или ex vivo, как описано в настоящей заявке. Альтернативно, раковый антиген может экспрессироваться как часть вирусного капсида или каким-либо иным образом в комбинации с вирусным капсидом, как описано выше.
[0178] В качестве другой альтернативы, любая другая терапевтическая нуклеиновая кислота (например, РНКи) или полипептид (например, цитокин), известные специалистам, могут быть введены для лечения и/или профилактики рака.
[0179] Используемый здесь термин «рак» охватывает рак, образующий опухоли. Аналогичным образом, термин «раковая ткань» включает опухоли. Термин «антиген раковых клеток» включает опухолевые антигены.
[0180] Термин «рак» имеет свое общепринятое значение, например, неконтролируемый рост ткани, которая может распространяться в дистальные участки организма (то есть метастазировать). Репрезентативными видами рака являются, но не ограничиваются ими, меланома, аденокарцинома, тимома, лимфома (например, неходжкинская лимфома, лимфома Ходжкина), саркома, рак легких, рак печени, рак толстой кишки, лейкоз, рак матки, рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак мочевого пузыря, рак почек, рак поджелудочной железы, рак головного мозга и любые другие раковые или злокачественные заболевания, которые уже известны специалистам или будут идентифицированы в будущем. В своих репрезентативных вариантах, настоящее изобретение относится к способу лечения и/или профилактики рака, образующего опухоли.
[0181] Термин «опухоль» также известен специалистам и означает, например, аномальную массу недифференцированных клеток внутри многоклеточного организма. Опухоли могут быть злокачественными или доброкачественными. В репрезентативных вариантах осуществления изобретения описанные здесь способы применяются для профилактики и лечения злокачественных опухолей.
[0182] Термины «лечение рака», «терапия рака» и эквивалентные им термины означают снижение тяжести рака или, по меньшей мере, частичное его устранение и/или замедление прогрессирования заболевания и/или его предупреждение и/или стабилизацию. В конкретных вариантах осуществления изобретения, эти термины означают устранение или уменьшение метастазов рака или по меньшей мере частичное их устранение и/или профилактику или замедление или по меньшей мере частичное замедление роста метастатических узелков.
[0183] Термины «профилактика рака» или «предупреждение рака» и эквивалентные им термины означают, что такие способы способствуют по меньшей мере частичному устранению и/или ослаблению симптомов и/или замедлению развития рака и/или ослаблению его тяжести. Альтернативно, начало развития рака у индивидуума может быть с высокой степенью вероятности замедлено или отсрочено.
[0184] В конкретных вариантах осуществления изобретения, клетки могут быть взяты у индивидуума с раком и подвергнуты контактированию с вирусным вектором согласно изобретению. Затем модифицированные клетки вводят индивидууму, в результате чего у него вырабатывается иммунный ответ против антигена раковых клеток. Этот способ может быть преимущественно применен для индивидуумов с иммунодефицитом, у которых не может вырабатываться достаточный иммунный ответ in vivo (то есть, не могут продуцироваться антитела, усиливающие иммунитет в достаточном количестве).
[0185] Специалистам известно, что иммунные ответы могут усиливаться под действием иммуномодулирующих цитокинов (например, α-интерферона, β-интерферона, γ-интерферона, ω-интерферона, τ-интерферона, интерлейкина-1α, интерлейкина-1β интерлейкина-2, интерлейкина-3, интерлейкина-4, интерлейкина-5, интерлейкина-6, интерлейкина-7, интерлейкина-8, интерлейкина-9, интерлейкина-10, интерлейкина-11, интерлейкина-12, интерлейкина-13, интерлейкина-14, интерлейкина-18, фактора роста В-клеток, лиганда CD40, фактора некроза опухоли-α, фактора некроза опухоли-β, белка-хемоаттрактанта моноцитов 1, гранулоцитарного-макрофагального колониестимулирующего фактора и лимфотоксина). В соответствии с этим, иммуномодулирующие цитокины (предпочтительно, CTL-индуцирующие цитокины) могут быть введены индивидууму в комбинации с вирусным вектором.
[0186] Цитокины могут быть введены любым методом, известным специалистам. Экзогенные цитокины могут быть введены индивидууму, или, альтернативно, нуклеиновая кислота, кодирующая цитокин, может быть введена индивидууму с использованием подходящего вектора и цитокина, продуцируемого in vivo.
Индивидуумы, фармацевтические композиции и способы введения
[0187] Вирусные векторы и капсиды согласно изобретению находят свое применение в ветеринарии и в медицине. Подходящими индивидуумами являются птицы и млекопитающие. Используемый здесь термин «птицы» включает, но не ограничивается ими, кур, уток, гусей, перепелов, индеек, фазанов, попугаев, небольших попугаев и т.п. Используемый здесь термин «млекопитающее» включает, но не ограничивается ими, человека, приматов, не являющихся человеком, коров, овец, коз, лошадей, кошек, собак, зайцев и т.п. Термин человек включает новорожденных, детей, подростков и взрослых.
[0188] В своих конкретных вариантах, настоящее изобретение относится к фармацевтической композиции, содержащей вирусный вектор и/или капсид согласно изобретению в фармацевтически приемлемом носителе и, необязательно, другие лекарственные средства, фармацевтические агенты, стабилизирующие агенты, буферы, носители, адъюванты, разбавители и т.п. Для инъекции, носитель обычно представляет собой жидкость. Для других методов введения, носитель может быть либо твердым, либо жидким. Для введения путем ингаляции, носитель должен быть вдыхаемым и, необязательно, может быть приготовлен в форме твердых или жидких частиц.
[0189] Термин «фармацевтически приемлемый» означает, что материал не является токсичным или нежелательным по каким-либо иным причинам, то есть, материал может быть введен индивидууму без каких-либо нежелательных биологических эффектов.
[0190] В одном из своих аспектов, настоящее изобретение относится к способу переноса нуклеиновой кислоты в клетку in vitro. Вирусный вектор может быть введен в клетки при соответствующей множественности заражения в соответствии со стандартными методами трансдукции, подходящими для конкретных клеток-мишеней. Титры вирусного вектора для введения могут варьироваться в зависимости от типа клетки-мишени и их числа, а также от конкретного вирусного вектора, и могут быть определены специалистами без излишнего экспериментирования. В репрезентативных вариантах осуществления изобретения, в клетку вводят по меньшей мере приблизительно 103 инфекционных единиц, а более предпочтительно по меньшей мере приблизительно 105 инфекционных единиц.
[0191] Клетками, в которые вводят вирусный вектор, могут быть клетки любого типа, включая, но не ограничиваясь ими, нервные клетки (включая клетки периферической и центральной нервной системы, а в частности, клетки головного мозга, такие как нейроны и олигодендроциты), клетки легких, клетки глаз (включая клетки сетчатки, пигментного эпителия сетчатки и клетки роговицы), клетки кровеносных сосудов {например, эндотелиальные клетки, клетки внутренних органов), эпителиальные клетки (например, клетки кишечника и эпителиальные клетки дыхательной системы), мышечные клетки (например, клетки скелетной мышцы, клетки сердечной мышцы, клетки гладких мышц и/или клетки мышцы диафрагмы), дендритные клетки, клетки поджелудочной железы (включая клетки панкреатических островков), клетки печени, клетки почки, клетки миокарда, костные клетки (например, стволовые клетки костного мозга), гемопоэтические стволовые клетки, клетки селезенки, кератиноциты, фибробласты, эндотелиальные клетки, клетки предстательной железы, зародышевые клетки и т.п. В репрезентативных вариантах осуществления изобретения, клеткой может быть любая клетка-предшественник. В качестве другой альтернативы, клеткой может быть стволовая клетка (например, нервная стволовая клетка, стволовая клетка печени). В еще одном альтернативном варианте, клеткой может быть раковая или опухолевая клетка. Кроме того, клетка может происходить от источника любого вида, как указано выше.
[0192] Вирусный вектор может быть введен в клетки in vitro в целях доставки модифицированной клетки индивидууму. В конкретных вариантах осуществления изобретения, клетки были взяты у индивидуума, а затем в них был введен вирусный вектор, после чего эти клетки вводили индивидууму снова. Методы забора клеток у индивидуума для манипуляции ex vivo с последующим их введением обратно индивидууму известны специалистам (см., например, патент США N 5399346). Альтернативно, рекомбинантный вирусный вектор может быть введен в клетки индивидуума-донора, в культивируемые клетки или в клетки, происходящие от любого другого подходящего источника, и эти клетки могут быть введены индивидууму, нуждающемуся в этом (то есть, индивидууму-«реципиенту»).
[0193] Клетки, подходящие для доставки гена ex vivo, описаны выше. Дозы клеток, вводимых индивидууму, варьируются в зависимости от возраста, состояния и вида индивидуума, типа клеток, нуклеиновой кислоты, экспрессируемой этими клетками, способа введения и т.п. Обычно вводят по меньшей мере приблизительно от 102 до приблизительно 108 клеток или по меньшей мере приблизительно от 103 до приблизительно 106 клеток на дозу в фармацевтически приемлемом носителе. В конкретных вариантах осуществления изобретения, клетки, трансдуцированные вирусным вектором, вводят индивидууму в количестве, эффективном для лечения или профилактики в комбинации с фармацевтическим носителем.
[0194] В некоторых вариантах осуществления изобретения, вирусный вектор вводят в клетку, и эта клетка может быть введена индивидууму для вырабатывания иммуногенного ответа против вводимого полипептида (например, экспрессируемого в виде трансгена или в капсиде). Клетки обычно вводят в количестве, экспрессирующем иммуногенно эффективное количество полипептида, в комбинации с фармацевтически приемлемым носителем. «Иммуногенно эффективное количество» означает количество экспрессируемого полипептида, которое является достаточным для вырабатывания активного иммунного ответа против полипептида у индивидуума, которому вводят фармацевтическую композицию. В конкретных вариантах осуществления изобретения, доза является достаточной для вырабатывания протективного иммунного ответа (как определено выше). Степень защиты необязательно должна быть полной или постоянной, при условии, что благоприятный эффект от введения иммуногенного полипептида будет компенсировать любые побочные эффекты.
[0195] В другом своем аспекте, настоящее изобретение относится к способу введения вирусого вектора индивидуумам. Введение вирусных векторов и/или капсидов согласно изобретению человеку или животному, нуждающемуся в этом, может быть осуществлено любыми способами, известными специалистам. Вирусный вектор и/или капсид вводят, но необязательно, в дозе, которая является эффективной для лечения или профилактики, в фармацевтически приемлемом носителе.
[0196] Вирусные векторы и/или капсиды согласно изобретению могут быть также введены для вырабатывания иммуногенного ответа (например, в виде вакцины). Обычно иммуногенные композиции согласно изобретению содержат иммуногенно эффективное количество вирусного вектора и/или капсида в комбинации с фармацевтически приемлемым носителем. Доза является достаточной, но необязательно, для вырабатывания протективного иммунного ответа (как определено выше). Степень защиты необязательно должна быть полной или постоянной, при условии, что благоприятный эффект от введения иммуногенного полипептида будет компенсировать любые побочные эффекты. Индивидуумы и иммуногены описаны выше.
[0197] Дозы вирусного вектора и/или капсида, вводимых индивидууму, зависят от способа введения, заболевания или состояния, подлежащего лечению и/или профилактике, состояния здоровья индивидуума, конкретного вирусного вектора или капсида и доставляемой нуклеиновой кислоты и т.п., и такие дозы могут быть введены рутинным способом. Репрезентативными дозами для достижения терапевтических эффектов являются титры по меньшей мере приблизительно 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015 трансдуцирующих единиц и необязательно приблизительно 108-1013 трансдуцирующих единиц.
[0198] В конкретных вариантах осуществления изобретения, для достижения желаемого уровня экспрессии гена в течение различных интервалов времени, например, ежедневно, еженедельно, ежемесячно, ежегодно и т.п., может быть осуществлено более чем одно введение (например, два, три, четыре или более введений).
[0199] Репрезентативными способами введения являются пероральное введение, ректальное введение, введение через слизистую оболочку, интраназальное введение, введение путем ингаляции (например, с помощью аэрозоля), трансбуккальное введение (например, подъязычное введение), вагинальное введение, интратекальное введение, внутриглазное введение, трансдермальное введение, интраэндотелиальное введение, внутриутробное введение (или in ovo), парентеральное введение (например, внутривенное введение, подкожное введение, интрадермальное введение, внутричерепное введение, внутримышечное введение [включая введение в скелетную мышцу, в мышцу диафрагмы и/или в сердечную мышцу], интраплевральное введение, интрацеребральное введение и внутрисуставное введение), местное введение (например, в кожу и нанесение на поверхность слизистой, включая поверхности дыхательных путей и трансдермальное введение), введение в лимфу и т.п., а также прямая инъекция в ткань или в орган (например, в печень, глаза [включая введение в стекловидное тело и в субретинальную область], введение в скелетную мышцу, сердечную мышцу, мышцу диафрагмы или в головной мозг).
[0200] Введение может быть осуществлено в любую область организма индивидуума, включая, но не ограничиваясь ими, область, выбранную из группы, состоящей из головного мозга, скелетных мышц, гладкой мышцы, сердца, диафрагмы, эпителия дыхательных путей, печени, почек, селезенки, поджелудочной железы, кожи и глаз.
[0201] Введение может быть также осуществлено в опухоль (например, в опухоль или в область вблизи опухоли или в лимфатический узел). В любом случае, наиболее подходящий способ введения будет зависеть от природы и тяжести состояния, подвергаемого лечению и/или профилактике и от природы конкретно используемого вектора.
[0202] Введение в скелетную мышцу согласно изобретению включает, но не ограничивается ими, введение в скелетную мышцу в конечностях (например, верхнее предплечье, нижнее предплечье, верхнюю часть голени и/или в нижнюю часть голени), в спину, шею, голову (например, язык), грудную клетку, брюшную полость, таз/промежность и/или пальцы. Подходящими скелетными мышцами являются, но не ограничиваются ими, abductor digiti minimi (в руках), abductor digiti minimi (в ногах), abductor hallucis, abductor ossis metatarsi quinti, abductor pollicis brevis, abductor pollicis longus, adductor brevis, adductor hallucis, adductor longus, adductor magnus, adductor pollicis, anconeus, anterior scalene, articularis genus, biceps brachii, biceps femoris, brachialis, brachioradialis, buccinator, coracobrachialis, corrugator supercilii, deltoid, depressor anguli oris, depressor labii inferioris, digastric, dorsal interossei (в руках), dorsal interossei (в ногах), extensor carpi radialis brevis, extensor carpi radialis longus, extensor carpi ulnaris, extensor digiti minimi, extensor digitorum, extensor digitorum brevis, extensor digitorum longus, extensor hallucis brevis, extensor hallucis longus, extensor indicis, extensor pollicis brevis, extensor pollicis longus, flexor carpi radialis, flexor carpi ulnaris, flexor digiti minimi brevis (в руках), flexor digiti minimi brevis (в ногах), flexor digitorum brevis, flexor digitorum longus, flexor digitorum profundus, flexor digitorum superficialis, flexor hallucis brevis, flexor hallucis longus, flexor pollicis brevis, flexor pollicis longus, frontalis, gastrocnemius, geniohyoid, gluteus maximus, gluteus medius, gluteus minimus, gracilis, iliocostalis cervicis, iliocostalis lumborum, iliocostalis thoracis, illiacus, inferior gemellus, inferior oblique, inferior rectus, infraspinatus, interspinalis, intertransversi, lateral pterygoid, lateral rectus, latissimus dorsi, levator anguli oris, levator labii superioris, levator labii superioris alaeque nasi, levator palpebrae superioris, levator scapulae, long rotators, longissimus capitis, longissimus cervicis, longissimus thoracis, longus capitis, longus colli, lumbricals (в руках), lumbricals (в ногах), masseter, medial pterygoid, medial rectus, middle scalene, multifidus, mylohyoid, obliquus capitis inferior, obliquus capitis superior, obturator externus, obturator internus, occipitalis, omohyoid, opponens digiti minimi, opponens pollicis, orbicularis oculi, orbicularis oris, palmar interossei, palmaris brevis, palmaris longus, pectineus, pectoralis major, pectoralis minor, peroneus brevis, peroneus longus, peroneus tertius, piriformis, plantar interossei, plantaris, platysma, popliteus, posterior scalene, pronator quadratus, pronator teres, psoas major, quadratus femoris, quadratus plantae, rectus capitis anterior, rectus capitis lateralis, rectus capitis posterior major, rectus capitis posterior minor, rectus femoris, rhomboid major, rhomboid minor, risorius, sartorius, scalenus minimus, semimembranosus, semispinalis capitis, semispinalis cervicis, semispinalis thoracis, semitendinosus, serratus anterior, short rotators, soleus, spinalis capitis, spinalis cervicis, spinalis thoracis, splenius capitis, splenius cervicis, sternocleidomastoid, sternohyoid, sternothyroid, stylohyoid, subclavius, subscapularis, superior gemellus, superior oblique, superior rectus, supinator, supraspinatus, temporalis, tensor fascia lata, teres major, teres minor, thoracis, thyrohyoid, tibialis anterior, tibialis posterior, trapezius, triceps brachii, vastus intermedius, vastus lateralis, vastus medialis, zygomaticus major и zygomaticus minor, и любые другие подходящие скелетные мышцы, известные специалистам.
[0203] Вирусный вектор может быть доставлен в скелетную мышцу путем внутривенного введения, внутриартериального введения, внутрибрюшинного введения, перфузии в области конечностей (необязательно, изолированной перфузии в конечности, например, в ногу и/или в руку, см., например, Arruda et al., (2005) Blood 105: 3458-3464), и/или прямой внутримышечной инъекции. В конкретных вариантах осуществления изобретения, вирусный вектор и/или капсид вводят в конечности (в руку и/или в ногу) индивидуума {например, индивидуума с мышечной дистрофией, такой как МДД) путем перфузии в конечности, необязательно, изолированной перфузии в конечности (например, путем внутривенного или внутрисуставного введения). В некоторых вариантах осуществления изобретения, вирусные векторы и/или капсиды согласно изобретению могут быть преимущественно введены без применения «гидродинамических» методов. Доставка в ткани (например, в мышцы) известных векторов часто улучшается благодаря применению гидродинамических методов (например, внутривенного введения/внутривенного введения в большом объеме), которые способствуют повышению давления в суставах и облегчают способность прохождения вектора через барьер эндотелиальных клеток. В конкретных вариантах осуществления изобретения, вирусные векторы и/или капсиды согласно изобретению могут быть введены без применения гидродинамических методов, таких как инфузия в больших объемах и/или при повышенном внутрисосудистом давлении (например, с увеличением внутрисосудистого давления на 5%, 10%, 15%, 20%, 25% или менее по сравнению с нормальным систолическим давлением). Применение таких способов может снижать или предотвращать побочные эффекты, ассоциированные с гидродинамическими методами, такие как отек, повреждение нервов и/или синдром «отсека».
[0204] Введение в сердечную мышцу включает введение в левое предсердие, в правое предсердие, в левый желудочек, в правый желудочек и/или в перегородку. Вирусный вектор и/или капсид может быть доставлен в сердечную мышцу путем внутривенного введения, внутриартериального введения, такого как введение вовнутрь аорты, прямой инъекции в сердце (например, в левое предсердие, в правое предсердие, в левый желудочек, в правый желудочек), и/или перфузии в коронарную артерию.
[0205] Введение в мышцу диафрагмы может быть осуществлено любым подходящим способом, включая внутривенное введение, внутриартериальное введение и/или внутрибрюшинное введение.
[0206] Введение в гладкую мышцу может быть осуществлено любым подходящим способом, включая внутривенное введение, внутриартериальное введение и/или внутрибрюшинное введение. В одном варианте осуществления изобретения, введение может быть осуществлено в эндотелиальные клетки, присутствующие в гладкой мышце, поблизости от нее и/или на поверхности самой гладкой мышце.
[0207] Доставка в ткань-мишень также может быть достигнута путем введения депо-инъекции, содержащей вирусный вектор и/или капсид. В репрезентативных вариантах осуществления изобретения, депо-препарат, содержащий вирусный вектор и/или капсид, имплантируют в ткань скелетной мышцы, гладкой мышцы, сердечной мышцы и/или мышцы диафрагмы, или ткань может быть подвергнута контактированию с пленкой или другой матрицей, содержащей вирусный вектор и/или капсид. Такие имплантируемые матрицы или субстраты описаны в патенте США № 7201898.
[0208] В конкретных вариантах осуществления изобретения, вирусный вектор согласно изобретению вводят в скелетную мышцу, мышцу диафрагмы и/или в сердечную мышцу (например, для лечения и/или профилактики мышечной дистрофии или болезни сердца [например, ЗПА или застойной сердечной недостаточности]).
[0209] В своих репрезентативных вариантах, настоящее изобретение используется для лечения и/или профилактики заболеваний скелетной мышцы, сердечной мышцы и/или мышцы диафрагмы.
[0210] В своем репрезентативном варианте, настоящее изобретение относится к способу лечения и/или профилактики мышечной дистрофии у индивидуума, нуждающегося в этом, где указанный способ введение вирусного вектора согласно изобретению млекопитающему в терапевтически или профилактически эффективном количестве, где указанный вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую дистрофин, минидистрофин, микродистрофин, пропептид миостатина, фоллистатин, растворимый рецептор активина типа II, IGF-1, противовоспалительные полипептиды, такие как доминантный мутант Ikappa В, саркоспан, атрофин, микродистрофин, ламинин-α2, α-саркогликан, β-саркогликан, γ-саркогликан, δ-саркогликан, IGF-1, антитело или фрагмент антитела против миостатина или пропептида миостатина и/или РНКи против миостатина. В конкретных вариантах осуществления изобретения, вирусный вектор может быть введен в скелетную мышцу, мышцу диафрагмы и/или сердечную мышцу, как описано в настоящей заявке.
[0211] Альтернативно, настоящее изобретение может быть использовано для доставки нуклеиновой кислоты в скелетную мышцу, в сердечную мышцу и/или в мышцу диафрагмы, где указанная нуклеиновая кислота используется в качестве платформы для продуцирования полипептида (например, фермента) или функциональной РНК (например, РНКи, микроРНК, антисмысловой РНК), которачя обычно циркулирует в крови, или для системной доставки в другие ткани в целях лечения и/или профилактики расстройства (например, метаболического расстройства, такого как диабет (например, инсулин), гемофилии (например, фактор IX или фактор VIII), расстройства, ассоциированного с дефицитом мукополисахаридов (например, синдрома Слая, синдрома Хеллера, синдрома Шейе, синдрома Хеллера-Шейе, синдрома Хантера, синдрома Санфилиппо А, В, С, D, синдрома Моркио, синдрома Марото-Лэми и т.п.) или расстройства запасания лизосом (такого как болезнь Гуше [глюкоцереброзидаза], болезнь Помпе [лизосомная кислая α-глюкозидаза] или болезнь Фабри [α-галактозидаза А]) или расстройства запасания гликогена (такого как болезнь Помпе [лизосомная кислая α-глюкозидаза]). Другие белки, подходящие для лечения и/или профилактики метаболических расстройств, описаны выше. Применение мышцы в качестве платформы для экспрессии представляющей интерес нуклеиновой кислоты описано в публикации заявки на патент США № 2002/0192189.
[0212] Таким образом, в одном из аспектов, настоящее изобретение также охватывает способ лечения и/или профилактики метаболического расстройства у индивидуума, нуждающегося в этом, где указанный способ включает введение терапевтически или профилактически эффективного количества вирусного вектора согласно изобретению индивидууму (например, в скелетную мышцу индивидуума), где вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую полипептид, и где метаболическое расстройство является результатом дефицита полипептида и/или дефекта в полипептиде. Репрезентативные метаболические расстройства и гетерологичные нуклеиновые кислоты, кодирующие полипептиды, описаны в настоящей заявке. Полипептид является, но необязательно, секретируемым (например, полипептид, который представляет собой секретируемый полипептид по своей природе, или который был сконструирован так, чтобы он секретировался, например, путем функционального присоединения к секреторной сигнальной последовательности, известной специалистам). Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что в соответствии с этим вариантом осуществления изобретения, введение в скелетную мышцу может приводить к секреции полипептида в системный кровоток и к доставке в ткань(и)-мишень(и). Методы доставки вирусных векторов в скелетную мышцу более подробно описаны в настоящей заявке.
[0213] Настоящее изобретение может быть также применено в целях продуцирования антисмысловой РНК, РНКи или другой функциональной РНК (например, рибозима) для системной доставки.
[0214] Настоящее изобретение также относится к способу лечения и/или профилактики застойной сердечной недостаточности или ЗПА у индивидуума, нуждающегося в этом, где указанный способ включает введение терапевтически или профилактически эффективного количества вирусного вектора согласно изобретению млекопитающему, где указанный вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую, например, Ca2+-АТФазу саркоплазматического эндоретикулума (SERCA2a), ангиогенный фактор, ингибитор фосфатазы I (I-1), РНКи против фосфоламбана; молекулу, ингибирующую фосфоламбан, или доминантно-негативную молекулу, такую как фосфоламбан S16E, белок «цинковый палец», который регулируют ген фосфоламбана, β2-адренергический рецептор, киназу β2-адренергического рецептора (BARK), киназу PI3, кальсаркан, ингибитор киназы β-адренергического рецептора (βARKct), ингибитор 1 протеин-фосфатазы 1, S100A1, парвальбумин, аденилилциклазу типа 6, молекулу, которая влияет на ингибирование киназы сопряженного с G-белком рецептора типа 2, такую как усеченная конститутивно активная bARKct; Pim-1, PGC-1α, SOD-1, SOD-2, EС-SOD, калликреин, HIF, тимозин-β4, mir-1, mir-133, mir-206 и/или mir-208.
[0215] Инъекции могут быть приготовлены в стандартных формах, либо в виде жидких растворов или суспензий, либо в виде твердых форм, подходящих для растворения или суспендирования в жидкости перед инъекцией, либо в виде эмульсий. Альтернативно, вирусный вектор и/или вирусные капсиды согласно изобретению могут быть введены местно, но не системно, например, в виде депо-препарата или препарата с пролонгированным высвобождением. Кроме того, вирусный вектор и/или вирусный капсид могут быть присоединены к хирургически имплантируемой матрице для доставки (например, как описано в публикации патентной заявки США № 2004-0013645).
[0216] Описанные здесь вирусные векторы могут быть введены в легкие индивидуума любыми подходящими способами, необязательно, путем введения аэрозольной суспензии вдыхаемых частиц, состоящих из вирусных векторов и/или вирусных капсидов, которые вдыхаются индивидуумом. Вдыхаемые частицы могут быть жидкими или твердыми. Аэрозоли жидких частиц, содержащих вирусные векторы и/или вирусные капсиды, могут быть получены любыми подходящими способами, например, с использованием аэрозольного ингалятора под давлением или ультразвукового ингалятора, как известно специалистам. См., например, патент США № 4501729. Аэрозоли твердых частиц, содержащих вирусные векторы и/или капсиды, могут быть аналогичным образом получены с использованием любого генератора аэрозольных лекарственных средств из твердых частиц методами, известными специалистам-фармацевтам.
[0217] Вирусные векторы могут быть введены в ткани ЦНС (например, в головной мозг, в глаза), что может преимущественно приводить к более широкому распределению вирусного вектора или капсида, чем это наблюдалось бы в отсутствии векторов согласно изобретению.
[0218] В конкретных вариантах осуществления изобретения, векторы для доставки согласно изобретению могут быть введены для лечения заболеваний ЦНС, включая генетические расстройства, нейродегенеративные расстройства, психические расстройства и опухоли. Репрезентативными заболеваниями ЦНС являются, но не ограничиваются ими, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, болезнь Канавана, болезнь Лейгса, болезнь Рефсума, синдром Туретта, первичный боковой склероз, амиотрофический боковой склероз, прогрессирующая мышечная атрофия, болезнь Пика, мышечная дистрофия, рассеянный склероз, тяжелая миастения, болезнь Бинсвангера, травмы спинного мозга или черепно-мозговые травмы, болезнь Тея Сакса, болезнь Лиша-Найена, эпилепсия, церебральный инфаркт, психические расстройства, включая расстройства настроения (например, депрессия, биполярное аффективное расстройство, персистентное аффективное расстройство, вторичные расстройство настроения), шизофрения, наркотическая зависимость (например, алкоголизм и другие наркотические зависимости), неврозы (например, тревожное состояние, обсцессивное расстройство, соматоформное расстройство, диссоциативное расстройство, эмоциональное расстройство в ответ на сильный негативный внешний раздражитель, послеродовая депрессия), психоз (например, галлюцинации и бред), деменция, паранойя, дефицит внимания, психосексуальные расстройства, расстройства сна, расстройства, вызываемые болями, расстройства питания или расстройства, вызывающие изменения массы тела (например, ожирение, кахексия, нервная анорексия и булимия), раковые заболевания и опухоли (например, опухоли гипофиза) ЦНС.
[0219] Расстройства ЦНС включают офтальмические расстройства, поражающие сетчатку, задний тракт и зрительный нерв (например, пигментозный ретинит, диабетическую ретинопатию и другие дегенеративные заболевания сетчатки, увеит, возрастную дегенерацию желтого пятна, глаукому).
[0220] Большинство офтальмических заболеваний и расстройств, если не все они, ассоциируются с одним или более из трех типов признаков: (1) ангиогенезом, (2) воспалением и (3) дегенерацией. Векторы для доставки согласно изобретению могут быть использованы для введения антиангиогенных факторов; противовоспалительных факторов; факторов, которые замедляют дегенерацию клеток, стимулируют истощение клеток или рост клеток и их комбинации.
[0221] Диабетическая ретинопатия характеризуется, например, ангиогенезом. Диабетическая ретинопатия может быть подвергнута лечению путем доставки одного или более антиангиогенных факторов либо посредством внутриглазного введения (например, в стекловидное тело), либо периокулярного введения (например, в субтенонову капсулу). Один или более нейротропных факторов также могут быть совместно доставлены либо посредством внутриглазного введения (например, в стекловидное тело или в субретинальную область), либо посредством периокулярного введения.
[0222] Увеит вызывает воспаление. Один или более противовоспалительных факторов могут быть введены путем внутриглазной доставки (например, в стекловидное тело или в переднюю камеру) вектора согласно изобретению.
[0223] В противоположность этому, пигментный ретинит характеризуется дегенерацией сетчатки. В репрезентативных вариантах осуществления изобретения, пигментный ретинит может быть подвергнут лечению путем внутриглазной доставки (например, путем введения в стекловидное тело) вектора для доставки, кодирующего один или более нейротропных факторов.
[0224] Возрастная дегенерация желтого пятна включает ангиогенез и дегенерацию сетчатки. Это расстройство может быть подвергнуто лечению путем введения вектора для доставки согласно изобретению, кодирующих один или более нейротропных факторов путем внутриглазного введения (например, в стекловидное тело) и/или одного или более антиангиогенных факторов путем внутриглазного введения или периокулярного введения (например, в субтенонову капсулу).
[0225] Глаукома характеризуется увеличением глазного давления и потерей ганглиозных клеток сетчатки. Лечение глаукомы включает введение одного или более нейропротективных агентов, которые защищают клетки от цитотоксического повреждения, с использованием векторов для доставки согласно изобретению. Такими агентами являются антагонисты N-метил-D-аспартата (NMDA), цитокины и нейротропные факторы, доставляемые путем внутриглазного введения, необязательно, в стекловидное тело.
[0226] В других своих вариантах, настоящее изобретение может быть использовано для лечения эпилептических припадков, например, для замедления начала появления эпилептических припадков, уменьшения их частоты и тяжести. Эффективность терапевтического лечения эпилептических припадков может быть оценена по поведению (например, по тряске и тикам глаз или рта) и/или электрографическими методами (большинство эпилептических припадков имеют характерные электрографические аномалии). Таким образом, настоящее изобретение может быть также использовано для лечения эпилепсии, которая характеризуется множеством эпилептических припадков в течение длительного периода времени.
[0227] В одном репрезентативном варианте осуществления изобретения, соматостатин (или его активный фрагмент) вводят в головной мозг с использованием вектора для доставки согласно изобретению в целях лечения опухоли гипофиза. Согласно этому варианту изобретения, вектор для доставки, кодирующий соматостатин (или его активный фрагмент), вводят путем микроинфузии в гипофиз. Аналогичным образом, такая терапия может быть использована для лечения акромегалии (аномальной секреции гормонов роста из гипофиза). Нуклеиновокислотные последовательности (например, GenBank, рег. No. J00306) и аминокислотные последовательности (например, GenBank, No. Р01166) содержат процессированные активные пептиды соматостатина-28 и соматостатина-14, и эти последовательности соматостатинов известны специалистам в данной области.
[0228] В конкретных вариантах осуществления изобретения, вектор может содержать секреторный сигнал, описанный в патенте США № 7071172.
[0229] В репрезентативных вариантах осуществления изобретения, вирусный вектор и/или вирусный капсид вводят в ЦНС (например, в головной мозг или в глаза). Вирусный вектор и/или капсид могут быть введены в спинной мозг, в ствол головного мозга (в продолговатый мозг, в мост), средний мозг (гипоталамус, таламус, эпиталамус, гипофиз, черное вещество, шишковидную железу), мозжечок, конечный мозг (полосатое тело, мозжечок, включая затылочные, височные, теменные и лобные доли коры головного мозга, базальные ганглии, гиппокамп и ворота миндален), лимбическую систему, неокортекс головного мозга, полосатое тело, мозжечок и передний бугорок. Вирусный вектор и/или капсид могут быть также введены в различные области глаз, таких как сетчатка, роговица и/или зрительный нерв.
[0230] Вирусный вектор и/или капсид могут быть введены в спинномозговую жидкость (например, путем люмбальной пункции) для более диспергированной доставки вектора. Вирусный вектор и/или капсид могут быть также введены вовнутрь сосудов в ЦНС в случаях повреждения гематоэнцефалического барьера (например, в случае опухоли головного мозга или церебрального инфаркта).
[0231] Вирусный вектор и/или капсид могут быть введены в нужную(ые) область(и) ЦНС любым способом, известным специалистам, включая, но не ограничиваясь ими, интратекальное введение, внутриглазное введение, внутримозговое введение, внутрижелудочковое введение, внутривенное введение (например, в присутствии сахара, такого как маннит), интраназальное введение, внутриушное введение, внутриглазное введение (например, введение вовнутрь стекловидного тела, в субретинальную область, в переднюю камеру) и периокулярное пространство (например, в субтенонову капсулу), а также внутримышечное введение с обратной доставкой в двигательные нейроны.
[0232] В конкретных вариантах осуществления изобретения, вирусный вектор и/или капсид вводят в виде жидкого препарата путем прямой инъекции (например, стереотактической инъекции) в нужную область или компартмент ЦНС. В других вариантах осуществления изобретения, вирусный вектор и/или капсид могут быть доставлены путем местного введения в нужную область или путем интраназального введения в виде аэрозольного препарата. Введение в глаза может быть местным в виде жидких капель. В качестве дополнительной альтернативы, вирусный вектор и/или капсид могут быть введены в виде твердого препарата с пролонгированным высвобождением (см., например, патент США № 7201898).
[0233] В дополнительных вариантах осуществления изобретения, вирусный вектор может быть использован для обратного транспорта в целях лечения и/или профилактики заболеваний и расстройств, ассоциированных с двигательными нейронами (например, амиотрофического бокового склероза (АБС), спинальной мышечной атрофии (СМА) и т.п.). Так, например, вирусный вектор может быть доставлен в мышечную ткань, из которой он может мигрировать в нейроны.
[0234] Настоящее изобретение более подробно описано на нижеследующих примерах, которые приводятся лишь в иллюстративных целях и не рассматриваются как ограничение объема изобретения.
Пример 1
Материалы и методы
[0235] Плазмиды и вирусы. Все плазмиды были получены из Университета Северной Каролины из Центрального отдела по векторной генотерапии. Вирус получали путем тройной трансфекции клеток HEK293 и очищали путем ультрацентрифугирования в градиенте плотности хлорида цезия. Титр вируса определяли с помощью количественной ПЦР (кол.ПЦР) в реальном времени с использованием нижеследующего набора праймеров, сконструированных так, чтобы они распознавали люциферазный трансген: (прямого праймера) 5'-AAA AGC ACT CTG ATT GAC AAA TAC-3' (SEQ ID NO:9) и (обратного праймера) 5'-CCT TCG CTT CAA AAA ATG GAA C-3' (SEQ ID NO:10); или с использованием нижеследующего набора праймеров, сконструированных так, чтобы они распознавали ген человеческого α1-антитрипсина: (прямого праймера) 5'-GAA GTC AAG GAC ACC GAG GA-3' (SEQ ID NO:11) и (обратного праймера) 5'-CCC AGC TGG ACA GTC TCT TA-3' (SEQ ID NO:12). Для всех экспериментальных групп были определены титры релевантных вирусных конструкций на одном и том же планшете для проведения кол.ПЦР перед их использованием. Для делеции или замены нуклеотидов был проведен сайт-направленный мутагенез (Stratagene QuikChange). В таблице 8 перечислены праймерные последовательности, используемые для всех мутантов VR1, оцениваемых в этом исследовании. Точковые мутации rAAV1 ® rAAV6 (например, rAAV6.1 и т.п.) уже являются частью общих лабораторных штаммов. Секвенирование ДНК осуществляли на каждой плазмиде, используемой в этом исследовании для подтверждения идентичности последовательностей перед получением вируса.
Таблица 8. Праймеры, используемые для сайт-направленного мутагенеза мутантов VR1.
*конкретный праймер rAAV1/T265del был использован для получения мутантов rAAV6/T265del.
[0236] Исследования на живых животных. Все животные содержались в специальных условиях и подвергались обработке специалистами Национального Института Здравоохранения в соответствии с протоколами, утвержденными IACUC в Университете Северной Каролины, Чапел-Хилл. Варианты rAAV, упаковывающие либо CBA-люциферазу, либо CBA-hAAT-трансген, инъецировали в икроножную мышцу (GC) 6-8-недельных самок мышей BALB/с (Jackson Laboratories) в указанных количествах. Все инъекции проводили в общем объеме 50 мкл на инъекцию. Перед инъекцией, мышей анестезировали газом изофлураном. Затем проводили мониторинг экспрессии трансгена люциферазы в указанные моменты времени с использованием визуализирующей системы Xenogen IVIS Lumina (Perkin Elmer/Caliper Life Sciences) после внутрибрюшинной инъекции субстрата D-люциферина (Nanolight) при 120 мг/кг массы тела. Биолюминесцентный анализ изображений проводили с использованием компьютерной программы Living Image (Perkin Elmer/Caliper Life Sciences), и экспрессию люциферазы выражали в CPM/ROI (число импульсов в минуту по всей выбранной представляющей интерес области).
[0237] Количественная оценка ex vivo экспрессии трансгена и числа копий. Для проведения анализа на люциферазу ex vivo, мышей умерщвляли через 7 дней после инъекции 1e10 vg, и мышечную ткань, в которую вводили инъекцию, собирали. Приблизительно 50 мг каждой ткани измельчали на льду. Затем, аликвоту каждой ткани гомогенизировали в 150 мкл 2× буфера для пассивного лизиса (Promega) с использованием ткани Tissue Tearor (Cole-Parmer). 35 мкл лизатов и 100 мкл субстрата D-люциферина (Promega) переносили в 96-луночные планшеты для люминометрического анализа с использованием люминометра Victor2 (Perkin Elmer). Общую концентрацию белка в лизатах ткани определяли с помощью анализа Брэдфорда (Bio-Rad). Через 3 дня после инъекции le10 vg выделяли икроножную мышцу, в которую была введена инъекция, а затем гомогенизировали и подвергали лизису как описано выше, после чего ~25 мг аликвот ткани обрабатывали с использованием набора DNeasy (Qiagen) для экстракции геномной ДНК хозяина и геномной ДНК вектора. Количество клеток определяли с помощью кол.ПЦР с использованием нижеследующих праймеров, сконструированных так, чтобы они были специфичными к мышиному ламину (гену домашнего хозяйства): (прямого праймера) 5'-GGA CCC AAG GAC TAC CTC AAG GG-3' (SEQ ID NO:25) и (обратного праймера) 5'-AGG GCA CCT CCA TCT CGG AAA C-3' (SEQ ID NO:26). Количество вирусных геномов на клетку определяли с помощью кол.ПЦР с использованием праймеров, сконструированных так, чтобы они были специфичными к трансгену люциферазы, как описано выше.
[0238] Конкурентное связывание с гепарином. Указанные конструкции инкубировали либо в 25 мкг/мл раствора натриевой соли сульфата свиного гепарина (Sigma-Aldrich), растворенного в физиологическом растворе Рингера (RSS), либо только в физиологическом растворе Рингера в течение ночи при 4°C с вращением. Было введено 1e10 vg каждой группы на икроножную мышцу в общем объеме 50 мкл на инъекцию. Через 7 дней после инъекции проводили биолюминесцентный визуализирующий анализ на живых животных.
[0239] Молекулярное моделирование. Трехмерные структуры rAAV1, rAAV2 или rAAV6 были представлены как целые капсиды (любезно предоставленные Dr. Mavis Agbandje-McKenna) с использованием ранее опубликованных координат в PyMOL (www.pymol.org). Для выравнивания различных структур использовали команду на выравнивание PyMOL. Атомные пары, участвующие в образовании водородной связи, были вычислены по координатам кристаллических структур с использованием MolProbity и визуализированы с использованием графической компьютерной программы KiNG (kinemage.biochem.duke.edu).
[0240] Аффинная хроматография на гепарине. Указанные конструкции инкубировали с сульфатом гепарина, конъюгированным с агарозными сферами (Sigma-Aldrich), в течение ночи при 4°C с вращением. Суспензию переносили на микрохроматографическую колонку (Bio-Rad) и 3 раза промывали RSS, а затем промывали NaCl с увеличенем жесткости промывок. Растворы получали путем растворения соответствующего количества NaCl в RSS после коррекции количества NaCl, уже присутствующего в растворе. Были собраны все промывочные фракции. Процент вируса, содержащегося в каждой фракции, определяли с помощью кол.ПЦР вирусных частиц, содержащихся в каждой промывке, с использованием праймеров, сконструированных так, чтобы они были специфичными к трансгену люциферазы, как описано выше.
[0241] Детектирование человеческого ААТ с помощью ELISA. Забор мышиной крови осуществляли из ретро-орбитальной области с использованием гепаринизированных капиллярных трубок (Sigma-Aldrich). Сразу после забора крови, образцы осаждали, и сыворотку собирали и хранили при -80°С для последующего использования. Перед забором крови, мышей анестезировали газом изофлураном. 96-луночный планшет покрывали кроличьими антителом против человеческого ААТ (Sigma-Aldrich) при 10 мг/мл в течение ночи при 4°C. Затем планшет промывали и блокировали раствором для разведения сыворотки (PBS с 2,5% бычьим альбумином и 0,05% твином) в течение 1 часа при комнатной температуре. Указанные разведения сыворотки (всего 100 мкл на каждый образец) добавляли в планшет и инкубировали в течение 2 часов при комнатной температуре. После 4-кратной промывки в PBS, в планшет добавляли 100 мкл ПХ-конъюгированного козьего антитела против человеческого ААТ (10 мкг/мл; Abcam) в течение 1 часа при комнатной температуре. После дополнительной промывки, окраску проявляли путем добавления субстрата ТМВ (Pierce) и реакцию прекращали добавлением 10% H2SO4. Оптическую плотность считывали на микропланшет-ридере iMark (Bio-Rad). В этом анализе мышиный ААТ не детектировался.
Пример 2
Мутация в положении 265 на капсиде rAAV1 усиливала трансдукцию в скелетную мышцу
[0242] Поскольку инсерции аспарагиновой кислоты, глутаминовой кислоты или фенилаланина за положением 264 в капсиде rAAV2 (для создания de novo положения 265) усиливали трансдукцию в скелетную мышцу на порядок величин, то авторами изобретения была высказана гипотеза, что замена природного треонина в положении 265 в rAAV1 на D, E, F будет усиливать трансдукцию в скелетную мышцу для этого серотипа (rAAV1 на одну аминокислоту длиннее, чем rAAV2 в этой капсидной петле). В качестве контроля, T265 был делетирован из rAAV1, так, чтобы это напоминало немодифицированный rAAV2. Капсиды rAAV1, rAAV1/T265D, rAAV1/T265E, rAAV1/T265F и rAAV1/T265del, упаковывающие трансген люциферазы светляка, индуцируемый промотором куриного β-актина (CBA-Luc), вводили в мышиную икроножную (GC) мышцу в дозе 1е10 вирусных геномов (vg). Через 7 дней после инъекции (dpi) проводили биолюминесцентный визуализирующий анализ на живых животных для количественной оценки экспрессии трансгена путем измерения излучаемого света (фиг. 1А). rAAV1/T265D, rAAV1/T265E и rAAV1/T265F усиливали экспрессию трансгена в 28, 34 и 36 раз, соответственно, по сравнению с rAAV1, что подтвердило данные предыдущего анализа в капсидном остове rAAV2. Удивительно то, что rAAV1/T265del усиливал трансдукцию приблизительно в 200 раз по сравнению с rAAV1. В попытке лучше понять этот феномен, авторы использовали мутант с делецией в положении 265 в большинстве остальных анализов, проводимых в этом исследовании.
[0243] Для того, чтобы подтвердить, что метод количественной визуализации, применяемый для получения вышеуказанных данных, позволяет точно определить уровни экспрессии трансгена в ткани инъецируемой мышцы, брали инъецированные GC, а затем их гомогенизировали/лизировали, и на лизате ткани проводили ex vivo анализ на люциферазу. В этом анализе эффективность трансдукции с использованием rAAV1/T265del была в 137 раз выше по сравнению с rAAV1 при нормализации на относительные единицы излучаемого света на мг анализируемой ткани (фиг. 1B). Повышенный уровень экспрессии репортерного гена rAAV1/T265del коррелировал с повышенным уровнем доставки трансгена в мышцу, то есть было детектировано в 14,5 раза больше копий вирусных геномов на мышечные клетки по сравнению с rAAV1, как было определено с помощью количественного анализа методом ПЦР в реальном времени (кол.ПЦР) (фиг. 1C). Все результаты были подтверждены в нескольких экспериментах с использованием независимых препаратов векторов, очищенных различными методами (например, путем ультрацентрифугирования в градиенте плотности, аффинной хроматографии), для гарантии того, что измеренные эффекты не были специфическими для метода серийной очистки или для метода очистки.
[0244] Для того, чтобы определить соответствующий момент времени, была осуществлена экспрессия трансгена rAAV1 и rAAV1/T265del в течение определенного периода времени, и результаты измерений регистрировали через 7, 14, 21 и 42 дня после инъекции (фиг. 1D). Кинетика экспрессии оказалась такой же, причем, надежная экспрессия наблюдалась через 7 дней после инъекции и увеличивалась в 7,5 раза через 7-42 дня после инъекции rAAV1 и в 12 раз за тот же самый период времени после инъекции rAAV1/T265. Во все периоды времени, rAAV1/T265del превосходил rAAV1 приблизительно на два порядка величин (в 100 раз на 7-й день, в 176 раз на 14-й день, в 81 раз на 21-й день, и в 159 раз на 42-й день). Эти данные, взятые вместе, показали, что делеция аминокислоты 265 в капсидном остове rAAV1 является в высокой степени эффективной стратегией для повышения уровня доставки трансгена и экспрессии в ткани скелетной мышцы. Еще более важным является то, что такое улучшение сохраняется в течение длительного периода времени, что подтверждает полученные авторами данные о повышении числа копий векторных геномов, задокументированном с помощью кол.ПЦР-анализа.
Пример 3
Дистальные остатки в комбинации с мутацией в 265 модулируют эффективность трансдукции
[0245] Считается, что rAAV6 является еще одним из главных кандидатов на его применение в генотерапии скелетной мышцы и имеет серотип, капсидная последовательность которого имеет наибольшую гомологию (99,2%) с rAAV1. Для того, чтобы определить, сохраняется ли фенотип с повышенной трансдукцией, достигаемый путем делеции в положении 265 капсида rAAV1, в капсидах rAAV6, rAAV6 и rAAV6/T265del, были получены капсиды, упаковывающие CBA-luc. Через семь дней после инъекции каждого капсида в мышиную GC в дозе 1e10 vg была количественно оценена экспрессия трансгена. Интересно отметить, что экспрессия трансгена после инъекции rAAV6/T265del составляла только 82% от экспрессии, достигаемой с использованием rAAV6 (фиг. 2а). Если учесть тот факт, что делеция в положении 265 в rAAV1 оказывает негативное влияние на трансдукцию, и что rAAV1 и rAAV6 отличаются всего на 6 аминокислот, то было неожиданно обнаружено, что ни одно из положений, присутствующих в пространственной близости к положению 265, не является достаточным для достижения прямых взаимодействий. Кроме того, любой остаток, который отличается у rAAV1 и rAAV6, расположен по меньшей мере на расстоянии 22Å от положения 265. Для достижения прямых взаимодействий, таких как образование водородных связей, остатки должны находиться в пределах ~3Å друг от друга. Несмотря на это, существуют конформационные различия в структурах rAAV1 и rAAV6 возле положения 265 (фиг. 2B), на что указывала визуализация посредством сопоставления имеющихся кристаллографических данных для каждого из этих капсидов.
[0246] Для того, чтобы понять какие остатки в капсиде rAAV6 могут ингибировать эффективность, и может ли делеция в положении 265 повышать эффективность трансдукции, был проведен эксперимент по «спасению» варианта маркера, где капсид rAAV6 был мутирован в положении каждого остатка, которые отличаются у rAAV1 и rAAV6, путем замены на аминокислоту, присутствующую в rAAV1, в комбинации с делецией в 265. Эти мутанты были обозначены rAAV6.1 (rAAV6 с первым неконсервативным остатком (F129L), замененным на эквивалентную аминокислоту в rAAV1), rAAV6.2 (D418E), rAAV6.3 (K531E), rAAV6.4 (L584F), rAAV6.5 (V598A) и rAAV6.6 (H642N), соответственно. Большинство модификаций в капсиде rAAV6 давали минимальное изменение трансдукции (фиг. 2С). Экспрессия трансгена снижалась в ≤2 раза в случае конструкций rAAV6.1, rAAV6.1/T265del, rAAV6.2, rAAV6.2/T265del и rAAV6.3, соответственно. Экспрессия трансгена увеличивалась приблизительно в 2 раза в обоих rAAV6.4 и rAAV6.4/T265del. Мутации в положениях 598 и 642 (rAAV6.5 и rAAV6.6) снижали уровень экспрессии трансгена по сравнению с rAAV6 более существенно, чем другие мутации, а именно, уменьшали его в 3,4 и 13,1 раз, соответственно. Делеция в положении 265 в rAAV6.5 и rAAV6.6 приводила к небольшим изменениям в функции этих конструкций, то есть, уменьшала экспрессию трансгена в 4,8 и 8,7 раз в rAAV6.4/T265del и rAAV6.5/T265del, соответственно. Удивительно то, что для «спасения» фенотипа 265, наблюдаемого в случае rAAV1, требуется только одна аминокислотная модификация в положении 531 (rAAV6.3), причем, эффективность трансдукции rAAV6.3/T265del была в 23 раза выше, чем у rAAV6 (фиг. 2C).
[0247] Пространственную взаимосвязь между остатками 531 и 265 оценивали по кристаллической структуре rAAV6 (фиг. 3А-3D). Аминокислоты 265 и 531 расположены не настолько близко, чтобы образовывать прямые связи в любой из икосаэдрических осей симметрии. На оси 2-го порядка, положения 265 и 531 расположены на расстоянии приблизительно ~26,7 Å друг от друга, тогда как на оси 5-го порядка они расположены на расстоянии ~42,6 Å друг от друга. Тем не менее, на оси симметрии 3-го порядка, несмотря на то, что эти остатки расположены на расстоянии ~22,8 Å друг от друга, оба этих остатка расположены на поверхности в одной и той же плоскости (фиг. 3В). Остаток 531 находится у основания каждого «шипа» 3-го порядка, а остаток 265 находится в небольшом выступе между шипами. Все вышеуказанные данные, полученные в настоящее время, позволяют предположить, что наиболее вероятным вариантом, в котором положения 265 и 531 могут вместе модулировать эффективность трансдукции, являются выступы, образующие ось симметрии 3-го порядка.
Пример 4
Гепарин-связывающая способность капсида влияет на фенотип 265, и наоборот
[0248] rAAV1 и rAAV6 присоединяют N-связанную сиаловую кислоту в качестве первичного рецептора, однако, rAAV6 также связывается с молекулами сульфата гепарина. Ранее полученные авторами результаты показали, что K531 является единственным остатком, необходимым для взаимодействия rAAV6 с сульфатом гепарина. K531 также представляет собой единственный остаток, необходимый для «спасения» фенотипа с делецией 265, наблюдаемого в rAAV1. Для дальнейшего изучения функциональной зависимости между связыванием капсида с гепарином и повышенной трансдукцией в результате мутации в положении 265, авторами настоящего изобретения было проведено исследование rAAV2, то есть, прототипического серотипа, который как известно использует протеогликаны на основе сульфата гепарина в качестве первичных рецепторов для инфицирования. rAAV2 был мутирован в положении 585 (такая мутация, как известно, снижает уровень связывания rAAV2 с гепарином) в комбинации с инсерцией аспарагиновой кислоты с получением de novo положения 265, как описано ранее. rAAV2, rAAV2/265D, rAAV2/K585E и rAAV2/265D,K585Е вводили в мышиную GC в дозе 1e10 vg. В соответствии с полученными ранее данными, элиминация способности связываться с гепарином приводила к повышению уровня трансдукции rAAV2 в скелетную мышцу. Однако, сопутствующая мутация в положении 265 и элиминация способности связываться с гепарином приводили к наиболее сильному повышению эффективности трансдукции (фиг. 4А), то есть к повышению трансдукции в 96 раз по сравнению с rAAV2 и в 7 раз по сравнению с rAAV2/265D, что соответствовало полученным выше результатам для rAAV6 (фиг. 2С). Следует отметить, что остаток 531 был мутирован для элиминации способности связывания с гепарином в rAAV6, а остаток 585 был мутирован для элиминации способности связывания с гепарином в rAAV2. Хотя остатки 531 и 585 не расположены близко друг к другу в линейной последовательности, однако, они оба находятся в пределах перекрывающегося основного пэтча на поверхности капсида, который был подвергнут футпринтингу на связывание с гепарином (фиг. 4B).
[0249] Для того, чтобы определить, может ли прямое ингибирование связывания с гепарином повышать трансдукцию мутантов 265, перед инъекцией конструкций 265-мутанта мышам, проводили анализ на конкурентное связывание с гепарином. rAAV2 связывается с гепарином с более высокой аффинностью, чем rAAV6, и является единственным серотипом, который, как было показано ранее, эффективно снижает уровень трансдукции после ингибирования в растворе сульфата гепарина, а поэтому этот вопрос был рассмотрен в контексте rAAV2. Капсиды rAAV2 и rAAV2/265D инкубировали либо в физиологическом растворе, либо в 250 мкг/мл раствора сульфата гепарина в течение ночи. rAAV1 был включен в качестве контроля. Вирусы вводили в мышиную GC в дозе 1e10 vg, а затем мышей визуализировали через 7 дней после инъекции. Инкубирование с сульфатом гепарина приводило к снижению эффективности трансдукции приблизительно в 3 раза в rAAV2 и rAAV2/265D, и фактически не влияло на rAAV1, то есть, снижало трансдукцию в 0,3 раза (фиг. 4С). Эти результаты позволяют предположить, что элиминация способности связываться с сульфатом гепарина для мутации в положении 265 приводит к эффективному повышению трансдукции, что обусловлено структурными изменениями в капсиде, но не ингибированием связывания с гепарином per se.
[0250] Аффинная хроматография на гепарине подтвердила, что все мутации капсидов rAAV2 и rAAV6, снижали, как и ожидалось, уровень связывания с гепарином (фиг. 5A-5D). Соответствующие конструкции были инкубированы с агарозой, конъюгированной с гепарином и элюированы с возрастающим градиентом NaCl. Интересно отметить, что в капсидах с мутацией в положении 265, уровень связывания с гепарином был ниже, чем в родительских капсидах. Так, например, при проведении первой стадии промывки после загрузки вируса в колонку, rAAV2/265D элюировался на 20% больше, чем rAAV2. Аналогичным образом, в 300 мМ-фракции NaCl, rAAV2/265D элюировался на 20% меньше, чем rAAV2. Аналогичным образом, в процессе промывки колонки, rAAV6/T265del элюировался на 37% больше, чем rAAV6, в то время как в 200 мМ NaCl-промывке, rAAV6/T265del элюировался на 25% меньше, чем rAAV6, что подтверждает гипотезу о взаимосвязи между этими двумя мотивами белков (rAAV6 элюировался в промывочной фракции с меньшей жесткостью, чем rAAV2, что соответствует полученным ранее данным). rAAV2/K585E снижал уровень связывания rAAV2 с гепарином, а rAAV2/265D,K585E усиливал этот эффект. При проведении первоначальных стадий промывки наблюдалось 75% элюирование rAAV2/K585E и 96,5% элюирование rAAV2/265D,K58Е. При 200 мМ NaCl, rAAV2/265D,K585E элюировался на 10% меньше, чем rAAV2/K585E. В сочетании с данными, представленными на фигурах 3 и 4, эти результаты еще раз подтвердили, что мутации в капсидной области в положении 265 влияют на структурную конформацию этой области, несущей сайт связывания с гепарином, и наоборот.
Пример 5
Множественные дизрупции в структуре VR1 повышают трансдукцию в скелетную мышцу
[0251] Уже имеющиеся данные позволяют предположить, что модификации в структурной конформации только VR1 является движущей силой для повышения трансдукции после мутации в положении 265. Следовательно, авторы попытались определить, может ли дополнительная дизрупция в структуре VR1 давать подобный фенотип с повышенной трансдукцией. Таким образом, rAAV1 был мутирован с получением S261del, S262del, A263del, S264del, G266del, A267del, S268del и N269del, как показано на фиг. 6A. Эти конструкции были введены в мышиную GC при 1e10 vg вместе с rAAV1 и rAAV1/T265del. Экспрессия трансгена была количественно оценена через 7 дней после инъекции (фиг. 6В). Каждый мутант имел различные степени повышения эффективности трансдукции по сравнению с rAAV1. В конструкциях с делециями S261, S262 и N269, трансдукция повышалась в ≤3 раза. В конструкциях с делециями G266 и S268, трансдукция повышалась в ~5 раз, а в конструкциях A263del и A267del, она повышалась в ~10 раз по сравнению с rAAV1. Конструкции с делециями S264 и T265 давали наиболее стабильное повышение трансдукции по сравнению с rAAV1, а уровень экспрессии трансгена увеличивался в 25 и 100 раз, соответственно. Эти данные показали, что любая дизрупция, введенная в петлю VR1 посредством делеции аминокислоты, будет способствовать повышению трансдукции в rAAV1, и такое повышение будет достигать пика после делеции в положении 265 и уменьшаться по мере удаления мутации от положения 265 (фиг. 6b).
Пример 6
Мутанты с делецией в положении 265 повышают уровень экспрессии терапевтического трансгена
[0252] Для сравнения относительной эффективности панелей с делецией в положении 265, шесть капсидов были упакованы с экспрессионным кластером hAAT, который в настоящее время используется в клинических испытаниях. Капсиды rAAV1, rAAV1/T265del, rAAV6, rAAV6/T265del, rAAV6.3 и rAAV6.3/T265del вводили в мышиную GC при 1e10 vg. Концентрации hAAT в сыворотке измеряли с помощью ELISA через 5 недель после инъекции (фиг. 7). В соответствии с описанной выше процедурой, экспрессия трансгена увеличивалась после делеции в положении 265; однако, степень такого увеличения не достигала уровней, оцененных с помощью анализа на люциферазу (например, в ELISA-анализе наблюдалось 9-кратное увеличение экспрессии rAAV1/T265del по сравнению с rAAV1, в то время как в анализе на люциферазу, такое увеличение в среднем составляло >100). Тем не менее все 265-мутанты были лучше, чем их родительские серотипы, а rAAV6.3/T265del давал наибольшую концентрацию hAAT в сыворотке.
Пример 7
Повышение эффективности трансдукции в глазах
[0253] Конструкции AAV вводили либо в субретинальную область (SRI), либо в стекловидное тело (IV) мышей, анестезированных коктейлем из кетамина/ксилазина. Все капсиды AAV упаковывали репортерный ген люциферазы под контролем промотора куриного бета-актина (СВh). Оцениваемые конструкции включали AAV1 (1-CBh), AAV1/T265del (1.1-CBh), AAV6/T265del (6.1-CBh), AAV6/K531E (6.3-CBh), AAV6/T265del_K531E (6.3.1-CBh), а вариант AAV2, AAV2.5 (2.5-CBh) был ранее охарактеризован авторами в лаборатории (Bowles et al., Mol. Ther. 20(2):443 (2012)). Экспрессию трансгена определяли как люциферазную активность в указанные моменты времени после инъекции с использованием визуализирующей системы на живых животных IVIS lumina. После внутрибрюшинной инъекции субстрата D-люциферина (Nanolight) при 120 мг/кг массы тела, мышей визуализировали, и изображения количественно оценивали путем измерения фотонов в пределах данной представляющей интерес области в соответствии с инструкциями производителей IVIS. Результаты представлены на фиг. 9 и 10.
[0254] Успех применения трансляции rAAV в генотерапии был поставлен под сомнение из-за низкой эффективности трансдукции in vivo. В этом исследовании проводили структурный анализ капсида rAAV для разработки рациональной инженерной стратегии, которая явно позволяет получить новые варианты капсидов с фенотипом повышенной трансдукции в скелетную мышцу. Этот общий подход стал возможным благодаря данным, полученным ранее авторами в лаборатории, и эти данные показали, что VR1 представляет собой ключевой фактор эффективности трансдукции в rAAV2. Как было ранее обнаружено авторами, в rAAV2 наблюдалось повышенная трансдукция в результате замен различных аминокислот в положении 265 в rAAV1. Однако примечательно то, что дизрупция в VR1 в результате делеции отдельных аминокислот в клинически более релевантном rAAV1 давала новые векторы, трансдукция которых была повышена на несколько порядков величин (фиг. 1). Только одно это наблюдение оказало значительное влияние на разработку протоколов введения доз пациенту, в которых в настоящее время используется rAAV1, и это может в дальнейшем облегчить продуцирование вектора. Следует отметить, что аналогичный результат был получен и для капсида rAAV6, но только после вторых мутаций, введенных для дизрупции основных аминокислотных пэтчей, которые, как указывалось ранее, были созданы для сообщения активности связывания с сульфатом гепарина. Использование подхода для «спасения» маркеров стало возможным благодаря анализу гомологии последовательностей капсидов, причем, было определено, что две дистальных области поверхности капсида действуют в комбинации друг с другом и модулируют эффективность трансдукции, а также распознают первичный рецептор, что проливает свет на комплексную роль топологии капсида во время жизненного цикла вируса.
[0255] Антагонистическая взаимосвязь между мутацией в положении 265 и связыванием с первичным рецептором позволяет предположить, что фенотип с делецией 265 достигается в результате модификации взаимодействий «белок-белок» между капсидом и партнером по связыванию. Однако остается определить, происходит ли это на начальном этапе связывания с клеточной поверхностью или после связывания. Увеличение числа векторных геномов на клетку, обусловленное лишь корреляцией экспрессии трансгена, но не кинетикой или длительностью экспрессии, является единственным веским аргументом в пользу того, что 265-фенотип является результатом модификаций феномена доставки в клетки. VR1 участвует в связывании рецептора в rAAV2, а также в химерном векторе, генерируемом посредством направленной эволюции, хотя пока еще точно не определены структурные детали относительно природы этих взаимодействий. Пространственное соотношение положения 265 по отношению к выступам, которые включают ось симметрии 3-го порядка - основной области капсида, ответственного за связывание с рецептором, является еще одним доказательством высказанной идеи. Следует отметить, что между конструкциями дикого типа и мутантными конструкциями не наблюдалось никаких различий, на что указывают: 1) анализы методом термоденатурации для тестирования стабильности капсида, 2) вестерн-блот-анализы для оценки отношения и размера капсидных белков или 3) электронная микроскопия для поиска явных различий в топологии капсидов или в распределениях популяций между пустыми и полными капсидами. Кроме того, данные «доза-ответ» позволяют предположить, что мутация в 265, улучшающая профиль трансдукции, может быть снова использована в соответствующих клинических применениях (например, для лечения дефицита ААТ и липопротеин-липазы).
[0256] Хорошо известно, что фосфорилирование треонинвых остатков влияет на внутриклеточную динамику белка. Действительно, фосфорилирование выбранных сериновых, треониновых и тирозиновых остатков на поверхности капсида rAAV, в конечном счете, приводит к протеосомному клиренсу капсидов до доставки трансгенов, а замена этих остатков на нефосфорилируемые остатки предотвращает клиренс капсида, что приводит к повышению эффективности трансдукции. Повышение эффективности трансдукции благодаря модификации множества аминокислот различных типов в положении 265 (делеции треонина, замены фосфомиметиками или крупными гидрофобными молекулами) позволяет предположить, что фосфорилирование, очевидно, не является ответственным за повышение трансдукции, опосредуемое мутацией в положении 265. Кроме того, структура VR1 может быть нарушена во всей петле, что будет улучшать фенотип трансдукции. Вполне возможно, что эти дизрупции будут предотвращать взаимодействие капсида с ингибирующим белком, хотя это еще предстоит определить. Тем не менее, существуют доказательства подобного эффекта в rAAV2, в котором элиминация способности капсида связываться с гепарином существенно улучшает трансдукцию в мышечную ткань((null)(null)). Действительно, такие данные были воспроизведены в этой работе. При этом, утверждается, что способность rAAV2 связываться с протеогликанами на основе сульфата гепарина появляется после адаптации тканевой культуры к вирусу, и что связывание с такими рецепторами негативно влияет на эффективность трансдукции этого серотипа in vivo. Аналогичным образом, в случае аденовируса, надежная трансдукция в печень сохраняется даже тогда, когда капсид мутируют для того, чтобы исключить его связывание с первичным рецептором CAR, поскольку альтернативные области капсида способны компенсироваться за счет облегчения продуктивных взаимодействий с альтернативными рецепторами.
[0257] Интересно отметить, что эффективность трансдукции достигала своего пика после делеции, в частности, в положении 265. При анализе сети водородных связей VR1 в rAAV1 (фиг. 8А), было неожиданно обнаружено, что VR1 стабилизируется сетью водородных связей, управляемых, главным образом, положением 265. Действительно, последующие лучшие трансдукторы были получены после делеции в положениях 264 и 263, которые также участвуют в структурной стабилизации VR1 посредством этой сети. Конечно, единственный способ по-настоящему изучить влияние этих мутаций на стабильность VR1 заключается в кристаллографическом разрешении этих конструкций. Однако, важно отметить, что rAAV6, по своей природе, является менее стабильным возле положения 265 (фиг. 8В), и что, на практике, rAAV6 требует дополнительной мутации для репликации фенотипа в положении 265. Во многих исследованиях была предпринята попытка изучить несоответствия фенотипов (то есть, различия в предпочтительности рецепторов и тропизма к ткани) между близкородственными rAAV1 и rAAV6. Фактически во всех предыдущих исследованиях была проведена оценка аминокислот шести капсидов, которые отличаются у этих двух вирусов, с пониманием того, что точное определение этих положений позволяет выявить области капсидов, которые непосредственно влияют на жизненный цикл вируса. Хотя авторы в этом уверены, однако, они впервые здесь продемонстрировали дополнительный более тонкий слой капсидной архитектуры, который отличается на структурном уровне для этих двух серотипов, что позволяет регулировать биологические процессы в вирусе, наряду с рациональным подходом к конструированию для использования этих свойств.
[0258] Еще одним интересным открытием является несоответствие измеренного повышения трансдукции между rAAV1 и rAAV1/T265del при оценке экспрессии трансгена непосредственно в инъецированной ткани (то есть с помощью анализа на люциферазу ex vivo, который давал 137-кратное увеличение), и измеренного уровня экспрессии трансгена секретируемого белка (то есть, с помощью ELISA, проводимого для определения концентрации hAAT, который давал 9-кратное увеличение). Интересно отметить, что в предыдущих экспериментах, в которых сравнивали измерения hAAT, секретируемого из i.m.-инъецированных rAAV2, rAAV2.5 и AAV2/265D, никаких очевидных различий не было обнаружено с помощью ELISA, несмотря на то, что экспрессия люциферазы увеличивалась на порядок величин по сравнению с rAAV2 при использовании сконструированных капсидов. Аналогичным образом, хотя было обнаружено, что ингибитор протеосомы бортезомиб может усилить трансдукцию rAAV2 в ткань печени приблизительно в 10 раз, как показал анализ на люциферазу, однако, такое повышение снижалось менее чем в 2 раза при анализе сыворотки на экспрессию секретируемого фактора IX. Вполне вероятно, что измерение уровня экспрессии трансгена непосредственно в собранной ткани является более чувствительным методом, чем сбор и последующее измерение секретируемых факторов, из-за различий, таких как время полужизни белка во внутриклеточном окружении и в сыворотке, а также общая эффективность секреции белка по отношению к экспрессии белка. Такие данные позволяют точно определить уровень повышения трансдукции, необходимой для реализуемого применения сконструированых векторов rAAV в целях доставки трансгенов, кодируемых секретируемые белки.
[0259] Целью этих усилий является дальнейшее усовершенствование векторной технологии rAAV, так, чтобы генная терапия становилась более практичным и эффективным клиническим выбором, например, по пути уменьшения дозы вектора, необходимой для достижения терапевтически эффективных уровней трансгена. Такие усилия помогут решить клинические проблемы, связанные с дозозависимой токсичностью вектора и облегчить продуцирование вектора для клинического применения. В данной работе, авторами была представлена простая и эффективная стратегия повышения эффективности серотипов rAAV, используемых в настоящее время в клинических испытаниях для направленной доставки в скелетную мышцу путем прямой инъекции. Поскольку в этой стратегии используется область капсида, которая является уникальной для достижения других основных целей в разработке векторов rAAV (например, Tyr-Phe-мутантов капсида), то будет интересно определить, может ли эта стратегия использоваться вместе с такими технологическими достижениями в целях дальнейшей оптимизации векторов rAAV для генотерапии. Поскольку авторы продолжают оценивать потенциальную панель с мутацией в положении 265 согласно изобретению для доставки в ткань сердца и для повышения уровня экспрессии трансгена в ткани сердца, а также в скелетных мышцах всего организма после системного введения, то работа, изложенная в настоящем документе, служит отправной точкой для разработки трансляционных векторов rAAV нового поколения. Кроме того, авторами настоящей заявки был получен набор реагентов для капсида rAAV, подходящих для дальнейшего детального (например, кристаллографического) анализа, который, в конечном счете, позволит лучше понять уникальную и важную роль каждой отдельной аминокислоты в биологии векторов rAAV.
Пример 8
Материалы и методы
[0260] Плазмиды и вирусы: Все плазмиды были получены из Университета Северной Каролины из Центрального отдела по векторной генотерапии. Вирус получали путем тройной трансфекции клеток HEK293 и очищали путем ультрацентрифугирования в градиенте плотности хлорида цезия, как было описано ранее (Grieger et al., Nat. Protoc. 1(3):1412 (2006)). Титр вируса определяли с помощью количественной ПЦР (кол.ПЦР) в реальном времени с использованием нижеследующего набора праймеров, сконструированных так, чтобы они распознавали люциферазный трансген: (прямого праймера) 5'-AAA AGC ACT CTG ATT GAC AAA TAC-3' (SEQ ID NO:10) и (обратного праймера) 5'-CCT TCG CTT CAA AAA ATG GAA C-3' (SEQ ID NO:11). Для всех экспериментальных групп были определены титры релевантных вирусных конструкций на одном и том же планшете для проведения кол.ПЦР перед их использованием. Для делеций или замен нуклеотидов был проведен сайт-направленный мутагенез (Stratagene QuikChange). В таблице 9 перечислены праймерные последовательности, используемые для всех мутантов VR1, оцениваемых в этом исследовании. Перед получением вируса осуществляли секвенирование ДНК для подтверждения идентичности последовательностей каждой плазмиды, используемой в этом исследовании.
Таблица 9. Праймеры для сайт-направленного мутагенеза, используемые в этом исследовании
* означает, что для конструкций pXR1 и pXR6 была использована одна и та же праймерная последовательность.
[0261] СтруктурныЙ анализ и молекулярное моделирование: Указанные файлы pdb были обработаны с помощью компьютерной программы для подтверждения структуры MolProbity (molprobity.biochem.duke.edu) и для добавления водородных связей исходя из длин электронноплотных связей x-H путем оптимизации Н-связей посредством включения, если это необходимо, комбинаций Asn/Gln/His. Затем файлы анализировали на контакты и геометрическую структуру всех атомов, и визуализировали с помощью программы KiNG (kinemage.biochem.duke.edu) для определения атомов VR1, участвующих в образовании водородных связей. Затем PDB открывали в PyMOL (pymol.org), представляли в виде палочковых диаграмм с визуализированными водородами, и водородные связи, идентифицированные в KING, обозначали пунктирными линиями с использованием файла измерения.
[0262] Исследования на живых животных: Животные содержались в специальных условиях и подвергались обработке специалистами Национального Института Здравоохранения в соответствии с протоколами, утвержденными IACUC в Университете Северной Каролины, Чапел-Хилл. Варианты rAAV, упаковывающие CBA-люциферазный трансген, инъецировали в хвостовую вену 6-8-недельных самок мышей BALB/с (Jackson Laboratories) в указанных количествах. Все инъекции вводили в общем объеме 200 мкл на инъекцию (объем доводили до 200 мкл с использованием 1× PBS). Экспрессию трансгена люциферазы визуализировали с использованием визуализирующей системы Xenogen IVIS Lumina (Perkin Elmer/Caliper Life Sciences) после внутрибрюшинной инъекции субстрата D-люциферина (Nanolight) при 120 мг/кг массы тела. Биолюминесцентный анализ изображений проводили с помощью компьютерной программы Living Image (Perkin Elmer/Caliper Life Sciences).
[0263] Количественная оценка экспрессии трансгена и числа копий ex vivo: В целях получения образцов тканей для ex vivo анализа на люциферазу, мышей умерщвляли через 10 дней после инъекции, а затем брали органы и быстро замораживали. Ткань гомогенизировали на льду лезвием бритвы, а затем приблизительно 50 мг каждого гомогената ткани суспендировали в 250 мкл 2× буфера для пассивного лизиса (Promega) и механическим лизировали с использованием Tissue Tearor (Cole-Parmer). 35 мкл каждого лизата ткани переносили в 96-луночный планшет и смешивали со 100 мкл субстрата D-люциферина (Promega) непосредственно перед проведением люминометрического анализа с использованием люминометра Victor2 (Perkin Elmer). Общую концентрацию белка в каждом лизате ткани определяли с помощью анализа Брэдфорда (Bio-Rad). Кроме того, ~25 мг аликвот вышеуказанного гомогената ткани обрабатывали с использованием набора DNeasy (Qiagen) для экстракции геномной ДНК хозяина и геномной ДНК вектора. Количество клеток определяли с помощью кол.ПЦР с использованием нижеследующих праймеров, сконструированных так, чтобы они были специфичными для мышиного ламина (гена домашнего хозяйства): (прямого праймера) 5'-GGA CCC AAG GAC TAC CTC AAG GG-3' (SEQ ID NO:45) и (обратного праймера) 5'-AGG GCA CCT CCA TCT CGG AAA C-3' (SEQ ID NO:46). Количество вирусных геномов на клетку также определяли с помощью кол.ПЦР с использованием праймеров, сконструированных так, чтобы они были специфичными для трансгена люциферазы, как описано выше.
Пример 9
Структурный анализ капсида rAAV для идентификации сетей водородных связей в VR1
[0264] Ранее авторами было продемонстрировано, что делеция выбранных аминокислот в VR1 капсида rAAV1 приводит к логарифмическому повышению эффективности трансдукции после внутримышечной инъекции мышам (Warischalk et al., Mol. Ther. 2015). Анализ кристаллической структуры rAAVl показал, что наиболее эффективные делеционные мутации VR1 соответствовали аминокислотам, участвующим в образовании внутрипетлевых сетей водородных связей, что позволяет предположить, что дестабилизация структурных элементов VR1 приводит к улучшению фенотипов трансдукции. Целью настоящего исследования было определить: 1) могут ли мутантные капсиды rAAVl VR1 эффективно нацеливаться на мышечную ткань после внутривенной инъекции (по сравнению с обычными капсидами, имеющими фенотип с повышенной трансдукцией) и 2) является ли целевая дестабилизация структурных элементов VR1 консервативным средством повышения трансдукции в дополнительных серотипах rAAV. Для решения этих проблем, набор капсидов rAAV, включая rAAVl, rAAV2, rAAV3, rAAV4, rAAV5, rAAV6, rAAV7, rAAV8 и rAAV9 был проанализирован с помощью компьютерной программы подтверждения структуры с открытым источником MolProbity (Davis et al., Nucleic Acids Res. 35(Web Server issue):W375 (2007)), и паттерны водородных связей VR1 визуализировали с помощью программы KiNG (Chen et al., Protein Sci. 18(11):2403 (2009)) (фиг. 11A-11H). Эти серотипы были выбраны для анализа исходя из доступности данных о кристаллической структуре обоих капсидов (Govindasamy et al., J. Virol. 80(23):11556 (2006); Miller et al., Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 62(Pt 12):1271 (2006); Xie et al., Proc. Natl. Acad. Sci. USA, 99(16):10405 (2002); Lerch et al., Virology 403(1):26 (2010); Govindasamy et al., J. Virol. 87(20):11187 (2013); Xie et al., Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64(Pt 11):1074 (2008); Nam et al., J. Virol. 81(22):12260 (2007); Mitchell et al., Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 65(Pt 7):715 (2009)) и уже имеющейся информации о фенотипах трансдукции in vivo (Zincarelli et al., Mol. Ther. 16(6):1073 (2008)). В имеющихся базах данных отсутствует какая-либо информация о структуре rAAV7, однако, этот серотип был включен для полноты картины. Для простоты визуализации, идентифицированные паттерны водородных связей были затем преобразованы в изображения PyMOl (фиг. 12A-12H).
[0265] На основе этих анализов, для делеции были выбраны аминокислоты каждого серотипа, которые, как было обнаружено, участвуют в образовании внутрипетлевых сетей водородных связей VR1. В таблице 10 перечислены аминокислотные последовательности VR1 для серотипов rAAV1-rAAV9 и аминокислоты, выбранные для мутации в данном исследовании, а также количество водородных связей, которые гипотетически должны быть разорваны каждой мутацией. В случае rAAV7, замена треонина в положении 265 была выбрана исходя из предыдущих результатов, полученных для rAAVl (Warischalk et al., Mol. Ther. 2015). В случае rAAV9, структура VR1, по-видимому, стабилизируется водородными связями в двух положениях, то есть в первом положении, которое регулируется, главным образом, связями, расположенными возле остатка S263, и во втором положении, связями, расположенными возле остатка S265. Таким образом, помимо двойного мутанта rAAV9/S263del_S265del были получены мутантные капсиды, содержащие rAAV9/S263del и rAAV9/S265del. Однако мутант с двойной делецией был неспособен продуцировать интактные вирусные частицы, в результате чего была применена альтернативная стратегия замены аминокислоты в положении S263 на аланин в сочетании с делецией в положении S265 с получением rAAV9/S263A_S265del. Подробноее описание атомных соотношений водородных связей, наблюдаемых для всех серотипов, включенных в данное исследование, приводится на фиг. 11.
Таблица 10. Аминокислотные последовательности вариабельной области 1 и делеционные мутации, введенные в rAAV1-rAAV9.
+ показано количество водородных связей, которые гипотетически должны быть разорваны каждой мутацией.
Пример 10
Биологическое распределение капсидов rAAV, мутированных для дестабилизации сетей водородных связей в VR1
[0266] Для визуализации распределения в ткани и оценки эффективности трансдукции вышеприведенных капсидов дикого типа и мутантных капсидов VR1, каждый член набора был упакован с репортерным трансгеном люциферазы светляка, индуцируемым промотором куриного β-актина (CBA-luc), и введен в хвостовую вену мышей в дозе 1e11 вирусных геномов (vg) на инъекцию. Биолюминесцентную визуализацию живых животных проводили через 9 дней после инъекции (dpi). Через 10 дней после инъекции, мышей умерщвляли и брали нужные органы, которые затем гомогенизировали и лизировали. После этого биораспределение вектора количественно оценивали с помощью анализов лизатов ткани на люциферазу ex vivo для определения уровня экспрессии трансгена, и с помощью кол.ПЦР-анализа для подсчета числа копий вирусных геномов на клетку. Делеция аминокислот VR1 давала четыре фенотипа: 1) селективное и надежное нацеливание на сердечную и/или скелетную мышцу, как это наблюдалось для rAAVl и rAAV6 (фиг. 13); 2) поддержание природной эффективности трансдукции в сердечную и/или скелетную мышцу, в сочетании со значительным снижением уровня трансдукции в печень, как показано для rAAV7, rAAV8 и rAAV9 (фиг. 14); 3) повсеместное отсутствие трансдукции, как в rAAV2 и в rAAV3 (фиг. 15A-15B); и 4) неспособность продуцировать интактные вирусные частицы, как и в случае rAAV4 и rAAV5.
[0267] Мутации VR1 в капсидах rAAVl и rAAV6 приводили к значительному повышению эффективности трансдукции в ткани сердечной и скелетной мышцы (фиг. 13). Экспрессия трансгена была в 21 раз выше в образцах ткани сердца и в 26 раз выше в ткани икроножной мышцы (GC) у мышей, обработанных rAAVl/T265del, но не rAAVl. Эффективность трансдукции rAAVl/T265del была также повышенной в тканях некоторых других типов, включая диафрагму (в 26 раз), селезенку (в 3,5 раза), почки (в 5 раз), поджелудочную железу (в 6 раз) и легкие (в 8 раз) (фиг. 16A). Удивительно то, что трансдукция в печень снижалась в 3,5 раза по сравнению с трансдукцией rAAVl (фиг. 13В). Аналогичным образом, уровень трансдукция капсидов rAAV6/T265del в сердечную и икроножную мышцу (GC) был в 14 раз и в 3 раза выше, чем в случае rAAV6 дикого типа, при этом уровень трансдукции в печень был ниже в 28 раз (фиг. 13Е). Каких-либо заметных различий в измеренных уровнях экспрессии трансгенов между капсидами rAAV6 и rAAV6/T265del в любой другой протестированной ткани не наблюдалось (фиг. 16В). rAAV6/S262del давал фенотип, аналогичный фенотипу rAAV6/T265del, то есть уровень его трансдукции в сердечную и икроножную мышцу был в 3,5 раза ниже и в 6 раз выше, чем в случае rAAV6/T265del, соответственно, а уровень его трансдукции в печень был почти аналогичным уровню трансдукции rAAV6/T265del (фиг. 16С). Эти результаты свидетельствуют о том, что мутантные конструкции rAAVl и rAAV6 VR1 преимущественно трансдуцируются в мышечную ткань при их системном введении мышам.
[0268] Число векторных геномов, присутствующих в клетке-хозяине, было определено с помощью кол.ПЦР на субсерии органов, включая сердце, икроножную мышцу (GC) и печень (фиг. 13C, 13F). В образцах тканей, полученных от мышей, обработанных капсидами rAAVl/T265del и rAAV6/T265del, изменения в популяциях трансгенных клеток-хозяв, определенные с помощью кол.ПЦР, были аналогичны изменениям, которые наблюдались для экспрессии трансгенов, оцененной с помощью анализа на люциферазу (то есть большее число векторных геномов коррелировало с повышением уровней экспрессии трансгена, и наоборот). Однако различия в измерениях для популяции трансгенов были более тонкими, чем это наблюдалось в случае определения эффективности трансдукции. Так, например, у мышей, обработанных rAAV6/T265del, число векторных геномов на клетку сердца было в 4 раза выше, чем у мышей, обработанных rAAV6, тогда как трансдукция мутантного капсида в сердце была в 14 раз выше (фиг. 13F). Аналогичным образом, число геномов rAAV6/T265del на клетку печени было в 4 раза меньше, а уровень трансдукции был в 28 раз меньше. Интересно отметить, что число векторных геномов на клетку сердца было значительно ниже, чем на клетку печени в случае обоих rAAVl и rAAVl/T265del, несмотря на то, что уровень трансдукции в сердце для обеих конструкций был гораздо выше, чем в печень. В совокупности, эти данные показали, что снижение способности мутантных капсидов rAAVl и rAAV6 VR1 трансдуцироваться в печень соответствует неспособности этих капсидов к персистентной доставке трансгена в клетки печени. Кроме того, трансгены, доставляемые мутантными капсидами VR1 в мышечные ткани, по всей видимости, экспрессируются более эффективно, чем трансгены, доставляемые их аналогами дикого типа. И наконец, может показаться, что некоторые аспекты микроокружения печени блокируют способность капсида rAAV1 проникать в ядро или выходить из ядра.
[0269] Делеция аминокислот VR1 из капсидов rAAV7, rAAV8 и rAAV9 давала профили биораспределения с поразительно похожими фенотипами (фиг. 14А, 14В, 14G). Основным признаком, наблюдаемым для каждого капсида, является резкое снижение уровня трансдукции в печень (в 427 раз для rAAV7, в 23 раза для rAAV8 и в 107 раз для rAAV9 по сравнению с капсидами дикого типа), тогда как нативные уровни трансдукции в сердечную и скелетную мышцу сохранялись. Эффективность трансдукции в мышечную ткань существенно не изменялась между rAAV7 и rAAV7/T265del, однако, эффективность трансдукции rAAV8/T265del в ткань GC была приблизительно в 8 раз выше, чем для rAAV8 (фиг. 14Е). rAAV9/S263del_S265del давали переменные эффекты в мышечной ткани, и их трансдукция в сердечную ткань была в 3 раза ниже, а в ткань GC в 2 раза выше, чем для rAAV9 (Фиг. 14Н). При этом, какого-либо существенного различия в уровнях трансдукции между мутантным капсидом VR1 и капсидом дикого типа этой субсерии в любом другом образце ткани не наблюдалось (фиг. 17A-17C). Следует отметить, что для достижения нужного профиля биораспределения rAAV9 в мышце требуется введение одновременных мутаций в положения S263 и S265, и что одиночные делеции в любом из этих положений значительно снижают общую эффективность трансдукции (фиг. 14D).
[0270] Число копий векторных геномов, присутствующих в клетках-хозяевах, были количественно определены в образцах ткани сердца, GC и печени. Во всех мутантных капсидах VR1 этой субсерии, снижение уровня экспрессии трансгена в печени соответствовало снижению популяции трансгенов в клетках печени (число векторных геномов на клетку печени было в 85 раз меньше для rAAV7/T265del, в 27 раз меньше для rAAV8/T265del и в 7 раз меньше для AAV9/S263del_S265del; фиг. 14С, 14F, 14I). Соотношения между популяциями трансгенов и эффективностью трансдукции в образцах мышечной ткани были не совсем ясными. Так, например, в случае rAAV7/T265del наблюдалось 22-кратное снижение числа копий трансгенов на клетку сердца по сравнению с rAAV7, но эффективности трансдукции между этими капсидами были фактически одинаковыми. Эти данные свидетельствуют о том, что мутантные капсиды VR1 этой субсерии являются недостаточными для сообщения способности обеспечивать стабильную доставку популяции трансгена в клетки печени, в то время как трансгены, доставляемые этими капсидами в мышечные ткани, экспрессируются более эффективно, чем те, которые доставлялись их аналогами дикого типа.
[0271] Делеция аминокислот VR1 давала негативные эффекты в капсидах rAAV2, rAAV3b, rAAV4 и rAAV5. В rAAV4 и rAAV5, делеции аминокислот VR1 приводили к неспособности продуцировать интактные вирионы. Было предпринято несколько попыток продуцирования вектора с обеими конструкциями для подтверждения воспризводимости этого результата. В rAAV2 и rAAV3b, делеции аминокислот VR1 не оказывали значительного влияния на продуцирование вектора, однако, в обоих этих серотипах VR1, делеционные мутации приводили к элиминации детектируемой трансдукции у мышей после внутривенной инъекции (фиг. 15A-15B). И в этом случае, для подтверждения воспризводимости этих результатов, эти эксперименты были продублированы со свежими штаммами вектора во второй группе мышей с введением в 5 раз более высокой дозы (5e11vg/инъекцию) rAAV2 и rAAV2/S264del (фиг. 15C). В целом, поразительные эффекты, наблюдаемые в этих серотипах в ответ на делеционные мутации VR1, свидетельствуют о том, что сохранение определенной структуры VR1 играет очень важную роль в сообщении этим капсидам способности завершать продуктивный жизненный цикл вируса.
Пример 11
Идентификация мотива капсида, который повышает эффективность трансдукции в печень
[0272] Предыдущие исследования показали, что капсиды rAAV2, несущие инсерционные мутации аминокислот за положением 264 в капсидном белке (создание de novo положения 265) демонстрируют заметное повышение эффективности трансдукции в скелетную мышцу после внутримышечной инъекции (Bowles et al., Mol. Ther. 20(2):443 (2012); Li et al., J. Virol. 2012. 86(15):7752 (2012)). Было обнаружено, что введение аспарагиновой кислоты, в частности (rAAV2/265D), приводило к увеличению уровня трансдукции на несколько порядков (Li et al., J. Virol. 2012. 86(15):7752 (2012)). Поскольку делеция аминокислот VR1 сообщала капсидам rAAV2 неспособность к трансдукции, авторами было проведено дополнительное альтернативное исследование для того, чтобы определить, может ли инсерция аминокислот в VR1 улучшать фенотип биораспределения rAAV2. Капсиды rAAV2 и rAAV2/265D, упаковывающие CBA-Luc, вводили в хвостовую вену мышей и проводили биолюминесцентную визуализацию живых животных через 9 дней после инъекции (фиг. 18А). Через 10 дней после инъекции брали органы и количественно оценивали на экспрессию трансгена, как описано выше. Интересно отметить, что хотя аминокислотные делеции VR1 в других серотипах приводили к резкому снижению трансдукции в печень, однако, инсерция дополнительных аминокислот в VR1, давала противоположный фенотип. Трансдукция в печень увеличивалась в 10 раз в случае rAAV2/265D по сравнению с rAAV2 (фиг. 14В), тогда как уровни трансдукции между двумя капсидами отличались в ≤2 раза во всех других исследуемых тканях (фиг. 14В и фиг. 15A). Копии векторных геномов на клетку-хозяина почти не отличались между двумя капсидами в тканях сердца и GC, однако, у мышей, которым вводили rAAV2/265D, число копий векторых геномов на клетку печени, увеличивалось в 10 раз по сравнению с rAAV2 (фиг. 18С). Таким образом, капсиды rAAV2/265D либо обладали большей способностью к доставке и проникновению в клетки печени, чем капсид rAAV2, либо геномы, доставляемые этими мутантными капсидами, лучше сохранялись в этих клетках (либо то и другое).
[0273] Для того, чтобы определить, может ли присутствие аспарагиновой кислоты в VR1 повышать уровень трансдукции дополнительных серотипов в печень, были введены замены (таблица 11) в rAAVl (rAAVl/T265D) и rAAV6 (rAAV6/T265D), и инсерция в rAAV3b (rAAV3b/265D). Во всех случаях наблюдалось значительное увеличение уровня трансдукции в печень: уровень трансдукции rAAVl/T265D в печень был приблизительно в 212,5 раз выше, чем для rAAVl (фиг. 18H), уровень трансдукции rAAV6/T265D был в 28 раз выше, чем для rAAV6 (фиг. 18K), а уровень трансдукции rAAV3b/265D был в 9 раз выше, чем для rAAV3b (фиг. 18E). В случае rAAVl и rAAVl/T265D, уровни трансдукции между этими двумя конструкциями, отличались в 2,5 раза или менее во всех других исследованных тканях (фиг. 18H и фиг. 19C). Уровень трансдукции для rAAV6/T265D в сердечную мышцу и мыщцу GC был в 32 и 4,5 раза выше, чем для rAAV6, соответственно (фиг. 18K). Во всех остальных тканях, эффективности трансдукции двух конструкций были фактически идентичными (фиг. 19D). И наконец, при сравнении биораспределения rAAV3b и rAAV3b/265D, уровень трансдукции мутантной конструкции в ткани сердца и диафрагмы был приблизительно в 3 раза выше, а каких-либо заметных различий в уровнях трансдукции между двумя конструкциями не наблюдалось ни в одной из остальных тканей (фиг. 18Е и фиг. 19В). В целом, эти данные показали, что инсерция или замена аспарагиновой кислоты в VR1 преимущественно усиливает трансдукцию в печень после внутривенного введения rAAV.
Таблица 11. Аминокислотные последовательности вариабельной области 1 и мутации с инсерцией и заменой аспарагиновой кислоты, введенные в выбранные капсиды rAAV.
Жирным шрифтом указана консервативная первичная аминокислотная последовательность, а звездочками обозначены мутации аспарагиновой кислоты.
[0274] Для того, чтобы определить, коррелирует ли эффективность трансдукции с числом геномных копий в каждой ткани, число копий векторных геномов на клетку-хозяина количественно определяли в образцах ткани сердца, печени и GC. При этом наблюдалось увеличение числа векторных геномов, присутствующих в печени мышей, обработанных rAAVl/T265D и rAAV3b/265D по сравнению с аналогами дикого типа (в 4,5 раза и 182 раза, соответственно; фиг. 18F, 18I). В случае rAAV6, число копий векторных геномов на клетку печени было фактически идентичным для капсидов дикого типа и мутантных капсидов (фиг. 18I). Мутации аспарагиновой кислоты в VR1 также значительно повышали число копий векторных геномов на клетку GC у мышей, обработанных rAAVl/T265D или rAAV3b/T265D (число геномов увеличивалось в 60 раз и в 51 раз по сравнению с аналогами дикого типа, соответственно; фиг. 18F, 18I, 18L), хотя эффективности трансдукции между мутантными и конструкциями дикого типа в тканях этого типа были идентичными (в любом случае, измеренные значения были в 2 раза выше, чем для капсида дикого типа). Отсутствие соответствуюей корреляции между числом копий векторных геномов и эффективностью трансдукции явно указывает на то, что последующий процессинг вирусных капсидов после их проникновения в клетку по меньшей мере частично ответственен за повышение эффективности трансдукции этих мутантных капсидов в печень.
[0275] Хотя капсиды rAAV1, rAAV2, rAAV3b и rAAV6 были получены так, чтобы они содержали одну и ту же аминокислотную последовательность SSXSDGAS (SEQ ID NO: 47) VR1 после мутации в положении 265D, однако, rAAV8 и rAAV9 имели, в основном, отличающиеся аминокислотные последовательности в этой области капсида (Таблица 11). Поэтому, чтобы выяснить, является ли повышенный уровень специфической трансдукции в печень, обеспечиваемой капсидами, несущими мутацию 265D, результатом влияния некоторых электростатических или структурных эффектов, которые оказывает сама аспарагиновая кислота на первичную аминокислотную последовательность, в капсиды rAAV8 и rAAV9 были введены мутации в положении 265D. Капсиды rAAV8/T265D и rAAV9/T265D, упаковывающие CBA-luc, были получены в тандеме с rAAV8 и rAAV9, и все они были внутривенно введены мышам. Биолюминесцентную визуализацию проводили через 10 дней после инъекции. В капсидах rAAV8 и rAAV9, мутация T265D приводила к значительному снижению общей эффективности трансдукции по сравнению с капсидами дикого типа (фиг. 20). Эти результаты свидетельствуют о том, что движущей силой в повышении эффективности трансдукции релевантных капсидов rAAV в печень является аминокислотная последовательность SSXSDGAS (SEQ ID NO: 48) VR1, а не структурная особенность, сообщаемая самой аспарагиновой кислотой.
Пример 12
Влияние способности капсида связываться с гепарином на эффективность трансдукции мутантных капсидов VR1
[0276] Ранее авторами было продемонстрировано, что способность данного капсида связываться с сульфатом гепарина препятствует улучшению фенотипа трансдукции, сообщаемому мутацией VR1 в капсидах, вводимых путем внутримышечной инъекции (Warischalk et al., Mol. Ther. 2015). Ранее было показано, что связывание с гепарином может нарушаться в rAAV2, rAAV3b и rAAV6 из-за одиночных точковых мутаций в каждом капсиде (Kern et al., J. Virol. 77(20):11072 (2003); Opie et al., J. Virol. 77(12):6995 (2003); Lerch et al., Virology, 423(1):6 (2012); Wu et al., J. Virol. 80(22):11393 (2006)). Поэтому, чтобы определить, может ли эффективность трансдукции мутантного капсида VR1 еще больше повышаться, эти мутации были введены в rAAV2, rAAV3b и rAAV6 для создания rAAV2/R585E, rAAV3b/R594A и rAAV6/K531E. Неспособность этих мутантных капсидов взаимодействовать с гепарином подтверждали с помощью аффинной хроматографии на гепарине. Вышеуказанные капсиды были упакованы с CBA-Luc и внутривенно введены мышам в тандеме с rAAV2/265D_R585E, rAAV3b/265D_594A и rAAV6/T265D_K53IE и их аналогами с одной мутацией и аналогами дикого типа. Через 10 дней после инъекции, мышей умерщвляли и брали печень для количественной оценки экспрессии трансгена. Как было показано ранее (Asokan et al., Nat. Biotechnol. 28(1):79 (2010); Kern et al., J. Virol. 77(20):11072 (2003)), снижение уровня связывания гепарина с капсидом rAAV2 приводило к снижению уровня трансдукции в печень у мышей приблизительно в 6,5 раза (фиг. 21A). Однако, при объединении этого капсида rAAV2, не содержащего гепарин, но имеющего мутации 265D VR1, полученный rAAV2/265D_R585E превосходил rAAV2 и rAAV2/265D в отношении трансдукции в печень в 132 и в 11 раз, соответственно (фиг. 21 A). Снижение способности капсида связываться с гепарином в rAAV3b и rAAV6 в комбинации с мутацией 265D VR1 также приводило к повышению трансдукции по сравнению с соответствующими родительскими капсидами. Уровень трансдукции rAAV3b/265D_R594A в печень был в 53 раза выше, чем в случае rAAV3b, и 2,5 раза выше, чем в случае rAAV3b.265D, тогда как rAAV6/T265D_K531E был в 46 раз и в 4 раза более эффективным, чем rAAV6 и rAAV6/T265D, соответственно (фиг. 21B, 21C). И наконец, поскольку делеционные мутации VR1, вводимые в капсиды rAAV6, повышали эффективность трансдукции в мышечную ткань (в отличие от подобных мутаций в rAAV2 и rAAV3b, которые снижали уровень трансдукции после делеции аминокислот VR1), то авторами была предпринята попытка определить, может ли элиминация связывания rAAV6 с гепарином способствовать дальнейшему повышению уровня трансдукции в этом контексте. Отдельным мышам вводили 1e11 vg rAAV6, rAAV6/T265del, rAAV6/K531E или rAAV6/T265del_K531E. Через 10 дней после инъекции, мышей умерщвляли и брали образцы сердца и GC для определения уровня экспрессии люциферазы ex vivo. Как и в случае rAAV6/T265D, описанном выше, устранение способности капсида rAAV6 связываться с гепарином приводило к дальнейшему повышению эффективности трансдукции rAAV6/T265del. rAAV6/T265del_K531E был в 170 и в 13 раз более эффективным при трансдукции в сердечную ткань, чем rAAV6 и rAAV6/T265del, соответственно, и в 9027 и 2795 раз более эффективным при трансдукции в ткань GC, чем каждый из указанных капсидов (фиг. 21D). В целом, эти исследования показали, что для эффективности трансдукции мутантных капсидов VR1, необходимо блокировать способность существующих серотипов связываться с гепарином.
Пример 13
Трансдукция мутантных капсидов VR1 по сравнению с трансдукцией наиболее эффективных серотипов дикого типа
[0277] При внутривенной доставке мышам, наиболее эффективными обычно считается серотипы rAAV8 и rAAV9 в отношении трансдукции в ткань печени и сердца, соответственно (Bish et al., Hum. Gene Ther. 19(12):1359 (2008); Davidoff et al., Mol. Ther. 11(6):875 (2005)). Поэтому, чтобы адекватно оценить производительность рассматриваемого набора мутантных капсидов VR1 in vivo в отношении существующих реагентов, капсиды, несущие делеционные мутации VR1 и инсерционные мутации VR1, оценивали в тандеме с rAAV9 и rAAV8, соответственно. Капсиды rAAVl/T265del, rAAV6/T265del, rAAV6/T265del_K531E, rAAV7/T265del, rAAV8/T265del, rAAV9/S264del_S266del и rAAV9, упаковывающие CBA-luc, были получены одновременно и оттитрованы вместе в одном и том же реакционном планшете с помощью кол.ПЦР. Мышам отдельно инъецировали 1е11 vg каждой конструкции, и через 10 дней после инъекции мышей умерщвляли и брали образцы тканей сердца и печени для количественного анализа. Помимо этого, ткань печени была собрана еще дополнительно для оценки специфичности вектора. Уровни трансдукции каждого из rAAVl/T265del, rAAV6/T265del, rAAV6/T265del_K531E и rAAV7/T265del в сердце были идентичны уровням трансдукции rAAV9, тогда как rAAV8/T265del был приблизительно в 5 раз более эффективным, чем rAAV9, а rAAV9/S263A_S265del был приблизительно в 3 раза менее эффективным (фиг. 22А). Затем авторами настоящего изобретения была предпринята попытка определить, трандуцируются ли мутанты согласно изобретению преимущественно в сердечную ткань, а не в другие органы, такие как печень. Все мутантные капсиды VR1 показали более высокий кардиотропизм, чем rAAV9 (фиг. 22B, 22C), за исключением rAAV8/T265del, который трансдуцировался в печень на уровне, эквивалентном уровню rAAV9. rAAV6/T265del давал наиболее перспективный кардиотропный профиль, то есть, его трансдукция в сердце была приблизительно в 582 раза более эффективной, чем в печень (фиг. 22С) по сравнению с rAAV9, который трансдуцировался в сердце лишь в 2 раза более эффективно, чем в печень. В целом, эти данные представляют шесть новых реагентов с более благоприятным кардиотропизмом, чем rAAV9.
[0278] Для оценки способности панели мутантных 265D-капсидов согласно изобретению трансдуцироваться в печень по сравнению с rAAV8, были получены векторы rAAVl/T265D, rAAV2/265D_R585E, rAAV3b/265D_R594A и rAAV6/T265D_K53IE, упаковывающие CBA-luc в тандеме с rAAV8. Все конструкции были оттитрованы на одном и том же планшете для кол.ПЦР и введены мышам в дозе 1е11 vg. Через 10 дней после инъекции мышей умерщвляли и брали образцы ткани печени для анализа. Ни один из мутантных 265D-капсидов не достигал эффективности трансдукции rAAV8, хотя эффективность трансдукции rAAV2/265D_R585E была в 3 раза меньше (фиг. 22D). Эффективность трансдукции каждого из rAAVl/T265D и rAAV6/T265D_K531E в печень была приблизительно в 8 раз ниже, чем для rAAV8, а эффективность трансдукции rAAV3b/265D_R594A была приблизительно в 17 раз ниже (фиг. 22D). В целом, эти результаты показали, что хотя инсерция или замена остатка аспарагиновой кислоты в VR1 может существенно повышать эффективность трансдукции различных серотипов в печень, однако, rAAV8 пока еще является наилучшим в отношении трансдукции в печень у этой мышиной модели.
Пример 14
Кардиотропизм мутантных капсидов VR1 повышается за счет включения мутаций Y®F
[0279] Было показано, что мутация некоторых остатков тирозина на поверхности капсида rAAV приводила к повышению эффективности трансдукции rAAV благодаря блокированию фосфорилирования и конечной протеасомной деградации внутриклеточных капсидов, прежде чем они будут способны достичь ядра (Zhong et al., Virology 381(2):194 (2008)). Авторы хотели определить, могут ли эти мутации вместе с мутантными капсидами VR1 повышать эффективность трансдукции при сохранении фенотипов биораспределения, сообщаемого мутацией VR1. Поскольку rAAVl является наиболее часто используемым серотипом в исследованиях, осуществляемых с участием человека, целью которых является лечение заболевания сердечных и скелетных мышц (Flotte et al., Hum. Gene Ther. 22(10):1239 (2011); Greenberg et al., JACC Heart Fail. 2(1):84 (2014)), то был получен капсид rAAVl, в который были введены мутации Y445F и T265del. Хотя мутации с заменой тирозина на фенилаланин ранее не оценивались для rAAV1, однако, было подтверждено, что Y445F повышала эффективность трансдукции в rAAV6 после внутримышечной инъекции (Qiao et al., Hum. Gene Ther. 21(10):1343 (2010)). rAAVl и rAAV6 имеют >99% гомологию в последовательности капсидного белка (Wu et al., J. Virol. 80(22):11393 (2006)), и таким образом, разумно предположить, что эта мутация может функционировать так же, как и в rAAVl. Тем не менее, rAAV6 был также включен в этот анализ. Капсиды rAAVl и rAAV6 дикого типа, упаковывающие CBA-luc, продуцировались одновременно с капсидами, имеющими одну и две мутации T265del и Y445F. Мышами вводили в хвостовую вену 1e11 vg каждого из этих капсидов, и через 10 дней после инъекции брали образцы тканей сердца, печени и GC для анализа. В обоих серотипах, капсиды с двойной мутацией T265del_Y445F еще больше улучшали эффективность трансдукции в сердце, причем, трансдукция rAAVl/T265del_Y445F в сердце была в 66 раз и в 9 раз выше, чем rAAVl и rAAVl/T265del (фиг. 23А), соответственно, тогда как трансдукция rAAV6/T265del_Y445F была в 30 раз и в 3 раза выше, чем rAAV6 и rAAV6/T265del. Двойная мутация T265del_Y445F давала различные эффекты в ткани GC, где трансдукция была в 3,5 раза выше в rAAV6/T265del_Y445F, чем в rAAV6/T265del (фиг. 23B), и оставалась фактически такой же при достаточном разнообразии мутантов rAAVl. В обоих серотипах, отсутствие специфичности к печени, сообщаемое мутантными капсидами VR1, полностью сохранялось в случае мутации Y445F. Интересно отметить, что Y445F-мутант, взятый отдельно, не может повышать эффективность трансдукции rAAVl или rAAV6 после внутривенной доставки, несмотря на то, что в экспериментах на клеточных культурах, этот мутант имел значительно более высокий уровень трансдукции, чем капсиды дикого типа. Насколько известно авторам, эти мутанты не были ранее оценены после внутривенной инъекции мышам, а поэтому трудно предположить, почему они не превосходят своих родительских аналогов по этому пути доставки. Возможно, что остаток тирозина в положении 445 является необходимым для успешного переноса через барьеры, создаваемые кровеносной сосудистой системой. В целом, эти данные свидетельствуют о том, что включение Y445F в мутантные капсиды VR1 может еще больше повышать трансдукцию в сердце, сохраняя при этом профиль биораспределения мутантов без доставки в печень.
[0280] Авторами настоящего изобретения представлен новый способ конструирования капсидов, который может быть применен для улучшения таргетинга и трансдукции системно доставляемых rAAV в мышечную ткань. Предыдущие наблюдения показали, что нарушение стабильности капсидной петли VR1 rAAVl посредством делеции выбранных аминокислот приводило к значительному повышению трансдукции в скелетную мышцу после внутримышечной инъекции (Warischalk, J.K.a.S, Mol. Ther. 2015). Мутации, которые являются наиболее эффективными для повышения трансдукции, коррелировали с мутациями, которые были наиболее разрушительными для внутрипетлевых сетей водородных связей VR1. Эти наблюдения привели авторов к решению прозондировать, может ли целенаправленная дестабилизация VR1 в rAAVl вызывать нацеленную доставку в мышечную ткань после внутривенного введения, и может ли этот подход быть использован для конструирования дополнительных серотипов rAAV в целях получения аналогичного результата. Разработанная авторами стратегия была эффективной с точки зрения улучшения свойств биораспределения пяти из девяти изученных серотипов. В капсидах rAAVl и rAAV6 наблюдалось устойчивое улучшение функции в отношении трансдукции в ткани сердечной и/или скелетной мышцы, тогда как в капсидах rAAV7, rAAV8 и rAAV9, нативные уровни трансдукции в мышечную ткань сохранялись, а эффективность трансдукции в печень резко снижалась. Значительные негативные эффекты после мутации VR1 были отмечены и в остальных серотипах, включая неспособность продуцировать интактные вирионы в rAAV4 и rAAV5 и серьезный дефицит трансдукции rAAV2 и rAAV3b. Таким образом, разработанный авторами способ позволяет понять с функциональной точки зрения топологию капсидов, которые могут быть системно введены или исключены при конструировании новых векторов.
[0281] Внутрибелковые сети водородных связей регулируют функциональность и структурную динамику в белках фактически каждого класса, включая вирусы множества видов (см., например, Worth et al., BMC Evol. Biol. 10:161 (2010)). Однако, не считая получения структурных данных эмпирическим путем, в настоящее время существуют только корреляционные доказательства того, что дестабилизация водородной связи является движущей силой для улучшения фенотипов мутантных капсидов VR1, созданных в этом исследовании. Тем не менее, полученные данные действительно обеспечивают достаточное подтверждение этой гипотезы. Во-первых, как предполагается,такая стратегия работает для большинства тестируемых серотипов. Во-вторых, остатки S262 и T265 rAAV6 образуют пару водородных связей, которые функционируют вместе и стабилизируют остальную часть VR1 (фиг. 11F), и удаление любого одного из этих остатков приводит к вырабатыванию эквивалентных фенотипов биораспределения (фиг. 16C). В-третьих, стабильность VR1, по-видимому, зависит от двух различных серий партнеров водородных связей в rAAV9 (фиг. 11Н), а желаемый фенотип биораспределения, специфичного для мышцы, может быть получен только после мутации обоих остатков (фиг 14G); и отдельные мутации любого остатка были неэффективными (фиг. 17D). И наконец, в rAAV8 только одна водородная связь присутствует в VR1: то есть водородная связь боковой цепи аминокислоты в положении T265 присоединена к такой же связи (фиг. 11G). Хотя делеция T265 приводила к значительной элиминации специфичности к печени (фиг. 14Е), однако, удаление соседнего остатка S266 не давало такого эффекта (фиг. 24). В сочетании с деструктивным влиянием на rAAV2, rAAV3b, rAAV4 и rAAV5, вызываемым дестабилизацией VR1, имеются данные, свидетельствующие о том, что на продуктивность rAAV во время жизненного цикла вируса в значительной степени влияет точно определенная структура этой капсидной петли.
[0282] Хотя очевидно, что дизрупция в структуре VR1 позволяет получить векторы с улучшенными системными свойствами, однако, другие детали помимо механизма, регулирующего эти новые фенотипы, остаются неизвестными. Было обнаружено, что отдельные пары водородных связей регулируют стабильность капсида и инфекционную эффективность различных вирусных видов (Tipper et al., J. Virol. 88(18):10289 (2014); Tso et al., J. Mol. Biol. 426(10):2112 (2014); Rue et al., J. Virol. 77(14):8009 (2003); Speir et al., J. Virol. 80(7):3582 (2006)), и кроме того, была высказана гипотеза о модуляции сборки rAAV (Grieger et al., J. Virol. 80(11):5199 (2006)). Однако, установленный протокол термодиссоциации, предназначенный для оценки стабильности капсида rAAV (Horowitz et al, J. Virol. 87(6):2994 (2013)), не выявил каких-либо различий между капсидами дикого типа и мутантными капсидами VR1. Более того, простое повышение уровня диссоциации капсида вряд ли приведет к значительным изменениям в биораспределении вектора. Петля VR1 rAAV находится на границе раздела между мономерными субъединицами на открытой поверхности капсида, а поэтому, она может взаимодействовать с дополнительными белками. Известно, что внутрикапсидные сети водородных связей модулируют взаимодействие капсида с партнерами по связыванию, например, в процессе катализа гликана под действием нейраминидазы вируса гриппа (von Grafenstein et al., J. Biomol. Struct. Dyn. 33(1):104 (2015)), взаимодействие рецептора с человеческим полиомавирусом (Khan et al., J. Virol. 88(11):6100 (2014)), а также «ускользание» от антивирусного фактора TRIM5α под действием ВИЧ-2 (Miyamoto et al., PLoS One 6(7):e22779 (2011)). Поэтому, мутация VR1 может изменять стабильность капсида так, чтобы это предотвращало взаимодействие капсида с предпочтительным рецептором клеточной поверхности, что давало бы альтернативный путь входа в ядро. Последовательное снижение популяций векторных геномов в печени у мышей, которым вводили делеционные мутантные капсиды VR1, подтверждает это мнение, поскольку были получены данные, указывающие на то, что векторные геномы, доставляемые в клетки сердца мутантами капсидами, экспрессируются гораздо более эффективно, чем капсиды, доставляемые аналогами дикого типа. Кроме того, эта концепция не является беспрецедентной, поскольку rAAV2 продемонстрировал улучшение таргетинга в мышцу и снижение трансдукции в печень, если капсид был мутирован для блокирования связывания с гепарином (Asokan et al., Nat. Biotechnol. 28(1):79 (2010); Kern et al., J. Virol. 77(20):11072 (2003)). rAAV9 также продемонстрировал улучшенный фенотип с неспецифичной для печени системной доставкой, в случае мутации для снижения уровня связывания с галактозой (Shen et al., J. Virol. 86(19):10408 (2012)). Следует отметить, что мутации VR1, как было показано, снижают способность капсидов rAAV2 и rAAV6 связываться с сульфатом гепарина (Warischalk et al., Mol. Ther. 2015). Кроме того, N-концевая область VR1 расположена на капсиде в достаточной близости (<3Å) от связывающегося с галактозой футпринта rAAV9, что способствует прямым взаимодействиям между двумя областями (Bell et al., J. Virol. 86(13):7326 (2012)). Исходя из таких наблюдений возникают интригующие вопросы относительно того, являются ли рецепторы, идентифицированные для различных серотипов rAAV in vitro, потенциальными артефактами после пассажей через клеточную культуру, и может ли rAAV иметь гораздо больший потенциал трансдукции in vivo, чем это считалось ранее, если такие артефакты подвергались мутационной абляции.
[0283] С точки зрения структуры, преобладает мнение, что делеционные мутации VR1 делают rAAV4 и rAAV5 неспособными продуцировать интактные вирионы. В обоих из этих серотипов, VR1 образует относительно короткую петлю, которая представляет собой, главным образом, водородные связи с нижерасположенными β-складками. Таким образом, нарушение стабильности этой области капсида, вероятно, может привести к значительным структурным изменениям, которые будут предотвращать взаимодействие мономерных капсидов друг с другом. Пока еще неясно, почему делеционные мутации VR1 сообщают rAAV2 и rAAV3b дефицит трансдукции. Несмотря на неспособность к трансдукции в мышиные ткани, rAAV2/S264del и rAAV3b/S262del способны преобразовывать клетки в культуре. Таким образом, любой дефицит трансдукции мышиной ткани обусловлен некоторыми аспектами окружения in vivo. Целью дальнейших экспериментов является более подробное обоснование этих наблюдений. Однако, невозможность улучшить фенотип rAAV2 посредством делеции аминокислот VR1 имеет свои достоинства, поскольку это привело к счастливому открытию того факта, что инсерции аспарагиновой кислоты в VR1 продуцируют фенотип, противоположный фенотипу делеционных мутаций, а именно, стабильное повышение трансдукции в печень после системного введения вектора. Механистические детали, регулирующие поведение инсерционных мутантов VR1, в настоящее время неизвестны. Аспарагиновая кислота является известным фосфомиметиком, а поэтому она может потенциально перенаправлять транспорт капсидов в клетке. Действительно, для протеосомной деградации было предложено маркировать капсиды rAAV фосфорилированным серином и треонином (Gabriel et al., Hum. Gene Ther. Meth. 24(2):80 (2013)). Тем не менее компьютерная программа для предсказания сайта фосфорилирования с открытым кодом (NetPhos2.0) не показала VR1 (либо модифицированный, либо немодифицированный) как сайт фосфорилирования, и данные, полученные в результате экспериментов с клеточными культурами, в которых используется ингибитор протеосомы, не подтвердили, что фенотип мутантных 265D-капсидов является результатом уменьшения клиренса протеосом. Другая возможность состоит в том, что инсерция аспарагиновой кислоты в VR1 дает эффект, противоположный эффекту делеции этой аминокислоты, то есть это способствует стабилизации структуры VR1, в отличие от ее разрушения. Хорошо известно, что остатки аспарагиновой кислоты оказывают стабилизирующее действие на структуру белка посредством участия во внутрибелковых взаимодействиях, таких как «стэкинг» карбонилов (Deane et al., Protein Eng. 12(12):1025 (1999)), образование солевых мостиков (Speare et al., J. Biol. Chem. 278(14):12522 (2003)) и сетей водородных связей (Worth et al., BMC Evol. Biol. 10:161 (2010)). Если это утверждение справедливо, то можно предположить, что хотя делеционные мутации VR1 дестабилизируют эту область капсида, то есть, предотвращают взаимодействие с данным рецептором, однако, инсерции аспарагиновой кислоты в VR1 наоборот повышают стабильность структур обоих капсидов и конечных белок-белковых взаимодействий. Большинство мутантных 265D-капсидов увеличивают популяции векторных геномов как в печени, так и в GC, что позволяет предположть, что мутация 265D улучшает качество доставки в клетку. Однако, хотя в случае трансдукции в печень, это выглядит как преимущество, но тем не менее эффективность трансдукции в GC не увеличивается в случае мутации 265D, что указывает на то, что процессинг капсида после связывания также зависит от мутации.
[0284] В целом, проведенные авторами исследования позволяют по-новому взглянуть на структурное влияние области VR1 капсида rAAV на эффективность трансдукции и на таргетинг в ткань in vivo. Эти знания позволили разработать две консервативных рациональных стратегий конструирования, которые будут улучшать таргетинг в ткань после системного введения вектора. На первый взгляд, набор делеционных мутантных капсидов VR1 является более клинически релевантным, поскольку было разработано шесть новых векторов, которые могут осуществлять таргетинг в сердце на уровне rAAV9 или выше этого уровня. Хотя это действительно ценное достижение в векторологии rAAV, однако, набор мутантных 265D-капсидов не следует упускать из виду с точки зрения клинической значимости. Хотя rAAV8 рассматривается как лучший трансдуктор в печень в мышиных моделях (Davidoff et al., Mol. Ther. 11(6):875 (2005)), и хотя набор 265D-капсидов не смог превзойти rAAV8 в проводимом авторами исследовании, однако, примечательно то, что rAAV8 может оказаться не самым идеальным вектором для реализуемых применений в генотерапии человека. Действительно, было обнаружено, что rAAV2 и вариант rAAV3b инфицируют человеческие гепатоциты с более высокой эффективностью, чем rAAV8 (Lisowski et al., Nature, 506(7488):382 (2014)). Таким образом, оба набора мутантных капсидов VR1 позволяют расширить пул реагентов, доступных в генотерапии, нацеленной либо на мышцы, либо на печень. Авторы настоящего изобретения надеются, что такое расширение даст возможность лучше персонализировать генотерапию для конкретного пациента, а именно, пациента с уже существующим профилем нейтрализующих антител (Louis et al., Hum. Gene Ther. Meth. 24(2):59 (2013)) и выбрать наилучший серотип, который будет наиболее подходящим для данного индивидуума, а также повысить вероятность повторного введения вектора, если это необходимо.
[0285] Вышеизложенное описание приводится для иллюстрации настоящего изобретения и не должно рассматриваться как ограничение его объема. Настоящее изобретение определяется нижеследующей формулой изобретения с эквивалентами формулы изобретения, которые будут в них включены.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> The University of North Carolina at Chapel Hill
Samulski, Richard Jude
Warischalk, Jayme
<120> МОДИФИЦИРОВАННЫЕ КАПСИДНЫЕ БЕЛКИ ДЛЯ УЛУЧШЕНИЯ ДОСТАВКИ
ПАРВОВИРУСНЫХ ВЕКТОРОВ
<130> 5470-710WO
<150> US 62/266,941
<151> 2015-12-14
<160> 48
<170> PatentIn version 3.5
<210> 1
<211> 13
<212> PRT
<213> аденоассоциированный вирус 1
<400> 1
Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His Tyr
1 5 10
<210> 2
<211> 7
<212> PRT
<213> аденоассоциированный вирус 2
<400> 2
Ser Ser Gln Ser Gly Ala Ser
1 5
<210> 3
<211> 12
<212> PRT
<213> аденоассоциированный вирус 3B
<400> 3
Ser Ser Gln Ser Gly Ala Ser Asn Asp Asn His Tyr
1 5 10
<210> 4
<211> 8
<212> PRT
<213> аденоассоциированный вирус 4
<400> 4
Glu Ser Leu Gln Ser Asn Thr Tyr
1 5
<210> 5
<211> 7
<212> PRT
<213> аденоассоциированный вирус 5
<400> 5
Ser Gly Ser Val Asp Gly Ser
1 5
<210> 6
<211> 13
<212> PRT
<213> аденоассоциированный вирус 6
<400> 6
Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His Tyr
1 5 10
<210> 7
<211> 8
<212> PRT
<213> аденоассоциированный вирус 8
<400> 7
Asn Gly Thr Ser Gly Gly Ala Thr
1 5
<210> 8
<211> 9
<212> PRT
<213> аденоассоциированный вирус 9
<400> 8
Ser Asn Ser Thr Ser Gly Gly Ser Ser
1 5
<210> 9
<211> 24
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 9
aaaagcactc tgattgacaa atac 24
<210> 10
<211> 22
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 10
ccttcgcttc aaaaaatgga ac 22
<210> 11
<211> 19
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 11
aagtcaagga caccgagga 19
<210> 12
<211> 20
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 12
cccagctgga cagtctctta 20
<210> 13
<211> 34
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 13
gcaatctcca gtgcttcaga cggggccagc aacg 34
<210> 14
<211> 35
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<220>
<221> misc_feature
<222> (13)..(13)
<223> n означает a, c, g или t
<400> 14
gcaatctcca gtngcttcag agggggccag caacg 35
<210> 15
<211> 36
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 15
gcaatctcca gtgcttcatt cggggccagc aacgac 36
<210> 16
<211> 26
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 16
caagcaaatc agtgcttcaa cggggg 26
<210> 17
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 17
gcaaatctcc gcttcaacgg ggg 23
<210> 18
<211> 24
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 18
gcaaatctcc agttcaacgg gggc 24
<210> 19
<211> 30
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 19
caaatctcca gtgctacggg ggccagaaac 30
<210> 20
<211> 26
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 20
ctccagtgct tcaggggcca gcaacg 26
<210> 21
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 21
ccagtgcttc aacggccgca agc 23
<210> 22
<211> 25
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 22
gcttcaacgg ggagcaacga caacc 25
<210> 23
<211> 20
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 23
cgggggccaa cgacaaccac 20
<210> 24
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 24
cgggggccag cgacaaccac ttc 23
<210> 25
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 25
ggacccaagg actacctcaa ggg 23
<210> 26
<211> 22
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 26
agggcacctc catctcggaa ac 22
<210> 27
<211> 26
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 27
ctccagtgct tcaggggcca gcaacg 26
<210> 28
<211> 36
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 28
catcgaccag tacctgtatt tcctgaacag aactca 36
<210> 29
<211> 28
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 29
caaacaaatt tccagctcag gagcctcg 28
<210> 30
<211> 28
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 30
caaatttcca gccaaggagc ctcgaacg 28
<210> 31
<211> 27
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 31
caagcaaatc tccagctcag gagcttc 27
<210> 32
<211> 29
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 32
ctccagccaa tcagacggag cttcaaacg 29
<210> 33
<211> 30
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 33
cagctcccac gactgcaact gtcaatgatc 30
<210> 34
<211> 24
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 34
gagcctgcag tccacctaca acgg 24
<210> 35
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 35
ccgtcgacgg aaacgccaac gcc 23
<210> 36
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 36
gcaaatctcc gcttcaacgg ggg 23
<210> 37
<211> 27
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 37
caaatctcca gtgaagcagg tagtacc 27
<210> 38
<211> 21
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 38
ctccaacggg tcgggaggag c 21
<210> 39
<211> 33
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 39
caaatctcca acggggactc gggaggagcc acc 33
<210> 40
<211> 27
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 40
tctccaacgg gacaggagga gccaacc 27
<210> 41
<211> 27
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 41
caagcaaatc tccagcacat ctggagg 27
<210> 42
<211> 29
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 42
ctccaacagc acaggaggat cttcaaatg 29
<210> 43
<211> 41
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 43
caagcaaatc tccaacagcg actctggagg atcttcaaat g 41
<210> 44
<211> 37
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для сайт-направленного мутагенеза
<400> 44
gcaaatctcc aacgccacag gaggatcttc aaatgac 37
<210> 45
<211> 23
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 45
ggacccaagg actacctcaa ggg 23
<210> 46
<211> 22
<212> ДНК
<213> Искусственный
<220>
<223> Праймерная последовательность для количественной ПЦР
<400> 46
agggcacctc catctcggaa ac 22
<210> 47
<211> 8
<212> PRT
<213> Искусственный
<220>
<223> Аминокислотная последовательность мутированного капсида VR1
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa может быть любой природной аминокислотой
<400> 47
Ser Ser Xaa Ser Asp Gly Ala Ser
1 5
<210> 48
<211> 8
<212> PRT
<213> Искусственный
<220>
<223> Аминокислотная последовательность мутированного капсида VR1
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa может быть любой природной аминокислотой
<400> 48
Ser Ser Xaa Ser Asp Gly Ala Ser
1 5
<---
Реферат
Изобретение относится к биотехнологии. Представлен парвовирусный капсидный белок, содержащий аминокислотную последовательность капсидного белка, происходящего от серотипа аденоассоциированного вируса (AAV) или любого другого парвовируса с икосаэдрической капсидной структурой Т=1, где петля вариабельной области 1 (VR1), содержащая аминокислотные остатки 258-272 капсидного белка AAV1 или соответствующие аминокислотные остатки другого AAV или парвовирусного капсидного белка, модифицируют путем делеции и/или замены одного или более аминокислотных остатков, что будет приводить к дестабилизации области петли из-за нацеленной деструкции паттернов водородных связей, создаваемых этими остатками, и где капсидный белок, содержащий такую модификацию, придает вирусному вектору, содержащему капсидный белок: а) повышенную эффективность трансдукции; и/или b) измененную эффективность тканеспецифичной трансдукции, приводящую к повышенной трансдукции в одной ткани по сравнению с другой тканью; по сравнению с вирусным вектором, включающим капсидный белок, который не содержит такую модификацию. Представлены соответствующие полинуклеотид и парвовирусный капсид. Описан рекомбинантный парвовирусный вектор для доставки гена, включающий: (a) указанный парвовирусный капсид; и (b) рекомбинантную вирусную матрицу, содержащую: (i) гетерологичную нуклеиновую кислоту; и (ii) по меньшей мере один инвертированный концевой повтор; где рекомбинантная вирусная матрица инкапсидирована в парвовирусном капсиде. Кроме того, описана фармацевтическая композиция, содержащая указанный вирусный вектор в фармацевтически приемлемом носителе. Описаны способы доставки нуклеиновой кислоты в клетку и индивидууму с помощью указанного вирусного вектора или фармацевтической композиции. Также представлен способ продуцирования рекомбинантной парвовирусной частицы. Изобретение позволяет повышать трансдукцию и расширяет арсенал средств для доставки нуклеиновых кислот в клетку или индивидууму. 10 н. и 28 з.п. ф-лы, 24 ил., 11 табл., 14 пр.

Комментарии