Вариант aav, композиции и способы, в которых он используется, а также способы его применения для переноса генов в клетки, органы и ткани - RU2697444C2
Код документа: RU2697444C2
Чертежи






Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Для настоящей заявки испрашивается приоритет по предварительной заявке США № 61/985365, поданной 28 апреля 2014 г, и предварительной заявке США 61/857161, поданной 22 июля 2013, которые в полном объеме включены в настоящий документ посредством ссылки.
ВВЕДЕНИЕ
[0002] Генетические расстройства, вызванные отсутствием или дефектом желательного гена (потеря функции), или экспрессией нежелательного или дефектного гена (усиление функции), приводят к развитию разных заболеваний. Одним из примеров генетических расстройств, обусловленных потерей функции гена, является гемофилия, наследственное нарушение свертываемости крови, вызываемое дефицитом фактора свертывания VIII (FVIII, гемофилия А) или фактора свертывания IX (FIX, гемофилия В). Одним из примеров генетических расстройств, обусловленных усилением функции гена, является болезнь Хантингтона, вызываемая патологическим геном "НТТ" (кодирующим белок хантингтин), который кодирует мутантный белок, способный накапливаться внутри нейронов, в особенности нейронов базальных ганглиев и коры головного мозга, и приводить к их постепенному разрушению.
[0003] Современное лечение гемофилии включает в себя внутривенное введение рекомбинантного фактора свертывания либо при необходимости, в случае кровотечения, либо профилактически. Однако данный терапевтический подход имеет несколько недостатков, таких как необходимость повторных инфузий, стоимость лечения, риск развития иммунных реакций против фактора, используемого в качестве терапевтического средства, и риск потенциально смертельных кровотечений. Наличие указанных недостатков стимулировало разработку генетических способов лечения гемофилии. В рамках разработки таких способов гемофилия идеально подходит для терапии на основе переноса генов, поскольку 1) терапевтическое окно является очень широким, так как уровень, превышающий норму лишь на 1%, уже может привести к изменению фенотипа от тяжелого до умеренного, а уровень, соответствующий 100%, не вызывает каких-либо побочных эффектов; 2) отсутствуют жесткие ограничения по выбору ткани для специфической экспрессии терапевтического трансгена; и 3) существует значительный опыт в измерении конечных критериев терапевтической эффективности. Кроме того, показано, что экспрессия фактора свертывания в печени обуславливает иммунологическую толерантность к самому фактору свертывания, что снижает вероятность потенциально вредных иммунных реакций против фактора свертывания.
[0004] В настоящее время для переноса генов предпочитают использовать векторы на основе аденоассоциированного вируса (AAV), поскольку они имеют лучшие профили безопасности и эффективности при доставке генов in vivo. Среди выделенных на настоящий момент серотипов AAV для доставки в печень человека, страдающего от тяжелой формы гемофилии B, используют AAV2 и AAV8. Оба вектора работают эффективно и в случае применения AAV8 описана длительная экспрессия терапевтического трансгена. Результаты проведенных в последнее время испытаний на людях демонстрируют, что доставка в печень с помощью вектора AAV позволяет достичь длительной экспрессии трансгена FIX на терапевтическом уровне.
[0005] Хотя полученные результаты являются многообещающими, идентификация серотипов AAV с высоким тропизмом к печени и низкой распространенностью у людей (природных хозяев AAV дикого типа) имеет важное значение для 1) достижения терапевтических уровней экспрессии трансгена в печени при минимальной дозе вектора, позволяющей уменьшить риск возникновения иммунного ответа против капсида AAV; и 2) применения альтернативных серотипов AAV с уникальной серопревалентностью, позволяющих лечить группы пациентов, которых нельзя подвергать переносу генов посредством AAV вследствие существующего гуморального иммунитета против AAV. Настоящее изобретение позволяет решить указанные задачи и обеспечивает дополнительные преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение предлагает вектор на основе аденоассоциированного вируса (AAV) серотипа AAV-Rh74 и родственные векторы и вирусные частицы AAV. Такие векторы включают в себя AAV-Rh74, специфично распознающий клетки печени гепатоциты среди других типов клеток. Как векторы для доставки полинуклеотидной последовательности, AAV-Rh74 и родственные векторы AAV управляют экспрессией полинуклеотида в клетках. Полинуклеотиды, которые кодируют белки, такие как белки терапевтического назначения, после введения могут экспрессироваться на терапевтическом уровне.
[0007] Примеры AAV-Rh74 и родственных векторов AAV включают в себя варианты AAV-Rh74. Конкретные капсидные варианты включают в себя последовательность капсида Rh74 с аминокислотной заменой в одном из аминокислотных положений 195, 199, 201 или 202 последовательности капсида RH74 VP1 (SEQ ID NO:1). В конкретных аспектах в любом из аминокислотных положений 195, 199, 201 или 202 последовательности капсида RH74 VP1 (SEQ ID NO:1) присутствуют остатки аминокислот A, V, P или N. В более конкретных аспектах последовательность капсида содержит остаток А в аминокислотном положении 195; остаток V в аминокислотном положении 199, остаток Р в аминокислотном положении 201, или остаток N в аминокислотном положении 202 последовательности капсида RH74 VP1 (SEQ ID NO:1). В еще более конкретных аспектах последовательность капсида содержит любые два, три или все четыре из следующих остатков: остаток A в аминокислотном положении 195; остаток V в аминокислотном положении 199, остаток Р в аминокислотном положении 201, или остаток N в аминокислотном положении 202 последовательности капсида RH74 VP1 (SEQ ID NO:1).
[0008] Рекомбинантные частицы AAV настоящего изобретения содержат последовательность капсида AAV любого капсидного варианта, такого как RHM4-1 (SEQ ID NO:5), RHM15-1 (SEQ ID NO:6), RHM15-2 (SEQ ID NO:7), RHM15-3/RHM15-5 (SEQ ID NO:8), RHM15-4 (SEQ ID NO:9) или RHM15-6 (SEQ ID NO:10). В конкретных вариантах осуществления рекомбинантная частица AAV капсидирует или заключает в себе векторный геном (например, геном вирусного вектора, такой как геном вектора AAV). Такие рекомбинантные частицы AAV настоящего изобретения заключают в себе геном вирусного (например, AAV) вектора, который также содержит гетерологичную полинуклеотидную последовательность.
[0009] Уровни экспрессии белка, обусловленные переносом полинуклеотида посредством AAV-Rh74 и родственного вектора AAV, значительно превышают уровни экспрессии, обеспечиваемые несколькими другими серотипами, которые в настоящее время изучаются в доклинических и клинических исследованиях. В частности, AAV-Rh74 доставляет полинуклеотиды в печень с эффективностью, по меньшей мере, сравнимой с эффективностью золотого стандарта трансдукции печени, AAV8, или превосходящей ее, как у мышей, так и у собак с гемофилией B (см., например, фиг.1 и 2). Варианты AAV-Rh74, такие как, например, капсидный вариант RHM4-1 (SEQ ID NO:5), доставляют полинуклеотиды в печень с эффективностью, сравнимой с эффективностью AAV8, или превосходящей ее, и превышающей эффективность Rh74 AAV у мышей (см., например, фиг.5). Кроме того, результаты, полученные на отличных от человека приматах, демонстрируют, что AAV-Rh74 и варианты AAV-Rh74, такие как RHM4-1, опосредуют экспрессию hFIX в печени примерно в два раза эффективнее, чем AAV8 (см., например, фиг.4 и 6).
[0010] Таким образом, AAV-Rh74 и варианты AAV-Rh74, такие как капсидные варианты (например, RHM4-1) можно использовать для доставки таких полинуклеотидов, как кодирующие последовательности генов, обуславливающие экспрессию белков, которые обеспечивают желательное или терапевтическое улучшение, а также ингибиторных нуклеотидов, которые уменьшают или ингибируют экспрессию нежелательного или дефектного гена, обеспечивая тем самым лечение ряда заболеваний. Например, AAV-Rh74 и капсидные варианты AAV-Rh74 (например, RHM4-1) можно использовать в качестве векторов для доставки в клетки, ткани и органы, такие как печень, терапевтических генов (например, FIX, FVIII) для лечения гемофилии A, B и др. Такие векторы на основе AAV-Rh74 и капсидного варианта AAV-Rh74 (например, RHM4-1) также можно использовать для доставки генов, обеспечивающих лечение дефицитов широкого ряда других метаболических или плазматических белков, или достижение других терапевтических целей, где указанные гены включают в себя, без ограничения, гены, кодирующие нуклеазы цинковые пальцы, осуществляющие редактирование генома в печени, а также для локальной (печеночной) доставки иммуномодулирующих средств, таких как альфа-интерферон, с целью лечения инфекций вируса гепатита, или для лечения практически любого заболевания, которое требует либо трансдукции в печени, либо присутствия терапевтического трансгенного продукта в кровотоке (что может быть достигнуто путем доставки трансгенов для экспрессии в печени).
[0011] Помимо того, что векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1), осуществляют эффективную доставку полинуклеотидов в клетки in vitro, ex vivo и in vivo, встречаемость антител против AAV-Rh74 в организме человека ниже, чем антител против AAV2, и отличается от встречаемости антител против AAV8 (таблица 1). Благодаря низкой серопревалентности, AAV-Rh74 и родственные векторы AAV, такие как (капсидные) варианты AAV-Rh74 (например, RHM4-1), можно использовать у большего процента людей, которых иначе нельзя подвергать переносу генов, например, у людей, которые могут быть сероположительными по другим серотипам AAV (например, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и т.д.). Кроме того, AAV-Rh74 и родственные векторы, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1), могут эффективно продуцироваться с высокими титрами (таблица 2). Так, AAV-Rh74 и родственные векторы AAV можно получить в больших количествах для применения в случае более распространенных клинических заболеваний.
[0012] Настоящее изобретение предлагает рекомбинантные векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), которые содержат (капсидируют, заключают в себе) геномы векторов AAV. В одном варианте осуществления рекомбинантный вектор AAV содержит гетерологичную полинуклеотидную последовательность. В другом варианте осуществления геном рекомбинантного вектора AAV капсидируется капсидом AAV-Rh74, или заключается в капсид AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1).
[0013] Гетерологичная полинуклеотидная последовательность, входящая в состав рекомбинантных векторов AAV настоящего изобретения, таких как векторы AAV-Rh74 и родственные векторы AAV, такие как частицы (капсидных) вариантов AAV-Rh74 (например, RHM4-1), которые содержат (капсидируют, заключают в себе) геномы рекомбинантных векторов AAV, может транскрибироваться, или транскрибируется и затем транслируется в белок. Альтернативно гетерологичный полинуклеотид может транскрибироваться в транскрипт, который сам по себе выполняет функцию или проявляет активность (например, как ингибиторная нуклеиновая кислота).
[0014] В разных аспектах гетерологичная полинуклеотидная последовательность кодирует терапевтический белок. В конкретных аспектах белок представляет собой фактор свертывания крови (например, фактор XIII, фактор IX, фактор Х, фактор VIII, фактор VIIa или белок С), CFTR (трансмембранный регулятор муковисцидоза), антитело, белок 65 кДа, специфичный к пигментному эпителию сетчатки (RPE65), эритропоэтин, рецептор LDL, липопротеинлипазу, орнитинтранскарбамилазу, β-глобин, α-глобин, спектрин, α-антитрипсин, аденозиндезаминазу (ADA), транспортер металлов (ATP7A или ATP7), сульфамидазу, фермент, участвующий в развитии лизосомной болезни накопления (ARSA), гипоксантингуанинфосфорибозилтрансферазу, β-25-глюкоцереброзидазу, сфингомиелиназу, лизосомную гексозаминидазу, дегидрогеназу кетокислот с разветвленной цепью, гормон, фактор роста (такой как инсулиноподобные факторы роста 1 и 2, тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста нервов, нейротрофический фактор 3 и 4, нейротрофический фактор мозга, глиальный фактор роста, трансформирующий фактор роста α и β и др.), цитокин (такой как интерферон, β-интерферон, интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-12, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин и др.), продукт суицидального гена (такой как тимидинкиназа вируса простого герпеса, цитозиндезаминаза, дифтерийный токсин, цитохром Р450, дезоксицитидинкиназа, фактор некроза опухоли и др.), белок устойчивости к лекарственному средству (например, белок, обеспечивающий устойчивость к лекарственному средству, используемому в противораковой терапии), белок-супрессор опухолевого роста (такой как р53, Rb, Wt-1, NF1, белок Гиппеля-Линдау (VHL), белок, ассоциированный с аденоматозным полипозом толстой кишки (APC)), пептид с иммуномодулирующими свойствами, толерогенный или иммуногенный пептид, или белок Tregitopes или hCDR1, инсулин, глюкокиназу, гуанилатциклазу 2D (LCA-GUCY2D), белок эскорта Rab 1 (хороидермия), LCA 5 (LCA-Lebercilin), аминотрансферазу орнитин-кетокислота (гиратная атрофия), ретиношизин 1 (ретиношизис, связанный с X-хромосомой), USH1C (синдром Ашера 1С), ГТФазу, участвующую в развитии связанного с Х-хромосомой пигментного ретинита (XLRP), MERTK (AR-формы RP: пигментного ретинита), DFNB1 (глухота, ассоциированная с коннексином 26), ACHM 2, 3 и 4 (цветовая слепота), PKD-1 или PKD-2 (поликистоз почек), TPP1, CLN2, белки, дефицит генов которых является причиной лизосомальной болезни накопления (такие как сульфатазы, N-ацетилглюкозамина-1-фосфаттрансферазы, катепсин А, GM2-AP, NPC1, VPC2, белки, активирующие сфинголипиды и т.д.), одну или несколько нуклеаз цинковые пальцы, редактирующих геном, или донорные последовательности, используемые в качестве ремонтной матрицы для исправления генома.
[0015] В других аспектах гетерологичная полинуклеотидная последовательность кодирует терапевтический белок, который, в свою очередь, ингибирует экспрессию или функцию нежелательного или аберрантного (неправильно функционирующего) белка, присутствующего (эндогенного) у индивидуума. В других аспектах гетерологичная полинуклеотидная последовательность представляет собой полинуклеотид, который транскрибируется в ингибиторную нуклеиновую кислоту (например, ингибиторную РНК). В более конкретных аспектах ингибиторная нуклеиновая кислота представляет собой одноцепочечную последовательность, или образует двух- или трехцепочечную последовательность. В других более конкретных аспектах ингибиторная нуклеиновая кислота представляет собой микро-РНК (микроРНК), миРНК, короткую шпилечную РНК, РНК, образующуюся в результате транс-сплайсинга, антисмысловую РНК или триплекс-образующую РНК.
[0016] В еще более конкретных аспектах ингибиторная нуклеиновая кислота ингибирует экспрессию: гена хантингтина (HTT), гена, ассоциированного с денторубропаллидолуизиановой атрофией (такого как ген атрофина 1, ATN1); рецептора андрогенов на Х-хромосоме при спинобульбарной мышечной атрофии, человеческого атаксина-1, -2, -3 и -7, Cav2.1 P/Q потенциалзависимого кальциевого канала, кодируемого (CACNA1A), ТАТА-связывающего белка, противоположной цепи атаксина 8, также известной как ATXN80S, бета-изоформы регуляторной субъединицы B серин/треонин-специфичной протеинфосфатазы 2A размером 55 кДа при спиноцеребеллярной атаксии (типа 1, 2, 3, 6, 7, 8, 12, 17), FMR1 (умственная отсталость 1, ассоциированная с ломкой хромосомой Х) при синдроме ломкой хромосомы Х, FMR1 (умственная отсталость 1, ассоциированная с ломкой хромосомой Х) при синдроме тремора/атаксии, сцепленном с ломкой хромосомой Х, FMR1 (умственная отсталость 2, ассоциированная с ломкой хромосомой Х) или 2 члена семейства AF4/FMR2 при умственной отсталости, ассоциированной с ломкой хромосомой XE; миотонинпротеинкиназы (МТ-PK) при миотонической дистрофии; фратаксина при атаксии Фридрейха; мутантного гена супероксиддисмутазы 1 (SOD1) при боковом амиотрофическом склерозе; гена, участвующего в патогенезе болезни Паркинсона и/или болезни Альцгеймера; аполипопротеина В (APOB) и пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9), гиперхолестеринемия; Tat ВИЧ, гена трансактиватора транскрипции вируса иммунодефицита человека при ВИЧ-инфекции; TAR ВИЧ, гена элемента, отвечающего на трансактиватор, вируса иммунодефицита человека при ВИЧ-инфекции; рецептора хемокина С-С (CCR5) при ВИЧ-инфекции; нуклеокапсидного белка вируса саркомы Рауса (RSV) при инфекции RSV, печень-специфической микроРНК (микроРНК-122) при инфекции вируса гепатита C; р53 при острой почечной недостаточности, или при отсроченной функции трансплантата почки, или при повреждении почек вследствие острой почечной недостаточности; протеинкиназы N3 (PKN3) при запущенных рецидивирующих или метастатических солидных злокачественных заболеваниях; LMP2, также известной как субъединица протеасомы бета-типа 9 (PSMB 9), при метастатической меланоме; LMP7, также известной как субъединица протеасомы бета-типа 8 (PSMB 8), при метастатической меланоме; MECL1, также известной как субъединица протеасомы бета-типа 10 (PSMB 10), при метастатической меланоме; фактора роста эндотелия сосудов (VEGF) при солидных опухолях; кинезина, белка веретена, при солидных опухолях, супрессора апоптоза В-клеточной CLL/лимфомы (BCL-2) при хроническом миелолейкозе; рибонуклеотидредуктазы M2 (RRM2) при солидных опухолях; фурина при солидных опухолях; polo-подобной киназы 1 (PLK1) при опухолях печени, диацилглицеринацилтрансферазы 1 (DGAT1) при инфекции гепатита С, бета-катенина при семейном аденоматозном полипозе; адренергического рецептора бета2 при глаукоме; RTP801/Redd1, также известного как белок, индуцируемый повреждением DAN транскрипта 4, при диабетическом отеке желтого пятна (DME) или возрастной макулярной дегенерации; рецептора фактора роста эндотелия сосудов 1 (VEGFR1) при возрастной макулярной дегенерации или неоваскуляризации хориоидеи, каспазы 2 при неартериитной ишемической невропатии зрительного нерва; мутантного белка N17K кератина 6A при врожденной пахионихии; геномных/генных последовательностей вируса гриппа А при инфекции вируса гриппа; геномных/генных последовательностей коронавируса, вызывающего тяжелый острый респираторный синдром (SARS), при инфекции SARS; геномных/генных последовательностей респираторно-синцитиального вируса при инфекции респираторно-синцитиального вируса; геномных/генных последовательностей филовируса Эбола при инфекции Эбола; геномных/генных последовательностей вирусов гепатита В и С при инфекции гепатитов В и С; геномных/генных последовательностей вируса простого герпеса (HSV) при инфекции HSV, геномных/генных последовательностей вируса Коксаки В3 при инфекции вируса Коксаки B3; кроме того, ингибиторная нуклеиновая кислота обуславливает сайленсинг патогенного аллеля гена (аллель-специфический сайленсинг), такого как ген торсина A (TOR1A), при первичной дистонии, сайленсинг гена pan класса I и аллеля HLA, при трансплантации; ингибирует экспрессию мутантного гена родопсина (Rho) при аутосомном доминантно наследуемом пигментном ретините (adRP); или ингибиторная нуклеиновая кислота связывается с транскриптом любого из вышеуказанных генов или последовательностей.
[0017] Рекомбинантные векторы AAV настоящего изобретения, а также векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), содержащие (капсидирующие, заключающие в себе) геном рекомбинантного вектора AAV, также содержат дополнительные элементы, которые функционируют как цис- или транс-элементы. В конкретных вариантах осуществления рекомбинантный вирусный (например, AAV) вектор, и/или вектор AAV-Rh74, или родственный вектор AAV, такой как частица (капсидного) варианта AAV-Rh74 (например, RHM4-1), содержащая (капсидирующая, заключающая в себе) геном рекомбинантного вектора AAV, также содержит: одну или несколько последовательностей инвертированных концевых повторов (ITR), которые фланкируют 5'- или 3'-конец гетерологичной полинуклеотидной последовательности; последовательность, контролирующую экспрессию, которая управляет транскрипцией гетерологичной полинуклеотидной последовательности (например, промотор или энхансер, который способствует транскрипции гетерологичной полинуклеотидной последовательности, такой как конститутивный или индуцибельный регуляторный элемент, или элемент, контролирующий тканесецифическую экспресию); полиадениновую последовательность, расположенную на 3'-конце гетерологичной полинуклеотидной последовательности; селектируемый маркер (например, белок, который обеспечивает устойчивость к антибиотику, например, устойчивость к канамицину); и/или точку начала репликации.
[0018] Рекомбинантные векторы AAV настоящего изобретения, а также векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), содержащие (капсидирующие, заключающие в себе) геном рекомбинантного вектора AAV, также могут содержать другие элементы. В одном варианте осуществления геном рекомбинантного вектора содержит гетерологичную полинуклеотидную последовательность и последовательность-наполнитель или спейсерную полинуклеотидную последовательность. В конкретных аспектах длина гетерологичной полинуклеотидной последовательности составляет менее чем примерно 4,7 т.о. В других конкретных аспектах гетерологичная полинуклеотидная последовательность имеет длину менее 4,7 т.о. и располагается в пределах двух последовательностей ITR аденоассоциированного вируса (AAV). В других конкретных аспектах общая длина последовательности-наполнителя, или спейсерной полинуклеотидной последовательности, и гетерологичной полинуклеотидной последовательности находится в диапазоне, составляющем примерно 3,0-5,5 т.о., или примерно 4,0-5,0 т.о., или примерно 4,3-4,8 т.о.
[0019] Последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, может находиться в любом желательном положении последовательности вектора, при условии, что она не препятствует функционированию или активности вектора. В одном аспекте последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, не располагается посреди 5'- и/или 3'-ITR, которая фланкирует соответствующий 5'- и/или 3'-конец гетерологичной полинуклеотидной последовательности. В другом аспекте последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, находится в пределах 5'- и/или 3'-ITR, которая фланкирует соответствующий 5'- и/или 3'-конец гетерологичной полинуклеотидной последовательности. В следующем аспекте последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, примыкает к 5'- и/или 3'-ITR, которая фланкирует соответствующий 5'- и/или 3'-конец гетерологичной полинуклеотидной последовательности. В другом аспекте последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, находится внутри гетерологичной полинуклеотидной последовательности, например, аналогично интрону внутри геномной нуклеиновой кислоты.
[0020] Соответственно, в разных вариантах осуществления последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, примыкает к последовательности ITR AAV; находится внутри двух последовательностей ITR аденоассоциированного вируса (AAV); находится вне двух последовательностей ITR аденоассоциированного вируса (AAV); или существуют две последовательности-наполнителя, или две спейсерные полинуклеотидные последовательности, первая из которых находится внутри двух последовательностей ITR аденоассоциированного вируса (AAV), а вторая находится вне двух последовательностей ITR аденоассоциированного вируса (AAV).
[0021] В более конкретных аспектах общая длина гетерологичной полинуклеотидной последовательности и последовательности-наполнителя, или спейсерной полинуклеотидной последовательности, находится в диапазоне, составляющем примерно 3,0-5,5 т.о., примерно 4,0-5,0 т.о., или примерно 4,3-4,8 т.о., если они находятся в пределах двух последовательностей ITR аденоассоциированного вируса (AAV). В других более конкретных аспектах длина последовательности-наполнителя, или спейсерной полинуклеотидной последовательности, составляет более 4,7 т.о., например, она может находиться в диапазоне, составляющем примерно 5,0-10,0 т.о., или примерно 6,0-8,0 т.о., если она располагается вне двух последовательностей ITR аденоассоциированного вируса (AAV).
[0022] В разных дополнительных аспектах последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, содержит примерно 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100 , 100-150, 150-200, 200-250, 250-300, 300-400, 400-500, 500-750, 750-1000, 1000-1500, 1500-2000, 2000-2500, 2500-3000, 3000-3500, 3500-4000, 4000-4500, 4500-5000, 5500-6000, 6000-7000, 7000-8000 или 8000-9000 нуклеотидов в длину.
[0023] Как правило, последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, является инертной или нетоксичной и не выполняет никакой функции, или не обладает никакой активностью. В разных конкретных аспектах последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, не является бактериальной полинуклеотидной последовательностью, последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, не является последовательностью, которая кодирует белок или пептид, последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, представляет собой последовательность, отличную от любой из следующих последовательностей: гетерологичная полинуклеотидная последовательность, последовательность инвертированного концевого повтора (ITR) AAV, элемент, управляющий экспрессией, точка начала репликации, последовательность селективного маркера или полиадениновая (поли-А) последовательность.
[0024] В разных дополнительных конкретных аспектах последовательность-наполнитель, или спейсерная полинуклеотидная последовательность, представляет собой последовательность интрона, связанную или не связанную с гетерологичной полинуклеотидной последовательностью. В конкретных аспектах последовательность интрона расположена внутри гетерологичной полинуклеотидной последовательности. В других конкретных аспектах последовательность интрона связана с гетерологичной полинуклеотидной последовательностью, например, интрон может находиться в геномной ДНК, такой как геномная ДНК, которая кодирует белок, также кодируемый гетерологичной полинуклеотидной последовательностью.
[0025] Рекомбинантные векторы AAV настоящего изобретения, а также векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), содержащие (капсидирующие, заключающие в себе) геном рекомбинантного вектора AAV, могут находиться внутри клеток. В таких вариантах осуществления клетки могут включать в себя хелперные клетки, которые можно лизировать с получением вирусных (AAV) частиц (например, векторов AAV-Rh74 или родственных векторов AAV, таких как капсидные варианты AAV-Rh74 (например, RHM4-1)), или клетки-мишени, в которых желательно экспрессировать гетерологичную полинуклеотидную последовательность.
[0026] Рекомбинантные векторы AAV настоящего изобретения, а также векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), содержащие (капсидирующие, заключающие в себе) геном рекомбинантного вектора AAV, могут входить в состав фармацевтических композиций. Такие композиции можно использовать для введения индивидууму рекомбинантного вектора (например, AAV) и вирусных частиц, таких как векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1), которые содержат (капсидируют, заключают в себе) геном рекомбинантного вектора (например, AAV).
[0027] Рекомбинантные векторы AAV настоящего изобретения, а также векторы AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя частицы капсидных вариантов (например, RHM4-1), содержащие (капсидирующие, заключающие в себе) геном рекомбинантного вектора AAV, можно использовать в разных способах и вариантах применения. Соответственно, настоящее изобретение предлагает способы и варианты применения, обеспечивающие доставку или перенос гетерологичной полинуклеотидной последовательности в организм или клетку, например, в организм или клетку млекопитающего.
[0028] В одном варианте осуществления способ или вариант применения включает в себя введение вектора на основе аденоассоциированного вируса (AAV), который содержит гетерологичную полинуклеотидную последовательность (например, вектора AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)), или частицы, которая содержит (капсидирует, заключает в себе) векторный геном, в организм или клетку млекопитающего в условиях, обеспечивающих доставку или перенос гетерологичной полинуклеотидной последовательности в организм или клетку млекопитающего. В одном аспекте способ или вариант применения позволяет осуществлять перенос/доставку гетерологичного полинуклеотида в организм и/или клетку млекопитающего. В другом аспекте способ позволяет осуществлять перенос/доставку гетерологичного полинуклеотида в организм и/или клетку млекопитающего и последующую транскрипцию гетерологичного полинуклеотида с образованием транскрипта. В следующем аспекте способ позволяет осуществлять перенос/доставку гетерологичного полинуклеотида в клетку с последующей транскрипцией с образованием транскрипта и трансляцией с образованием генного продукта (белка). В частности, например, в последних двух аспектах гетерологичная полинуклеотидная последовательность функционально связана с элементом, контролирующим экспрессию, который обеспечивает транскрипцию гетерологичной полинуклеотидной последовательности и, необязательно, последующую трансляцию транскрипта.
[0029] В других вариантах осуществления способ или вариант применения используется для доставки или переноса гетерологичной полинуклеотидной последовательности в организм или клетку индивидуума (например, млекопитающего) и включает в себя введение вирусной (например, на основе AAV-Rh74 или родственного AAV, такого как капсидный вариант AAV-Rh74 (например, RHM4-1)) частицы, совокупности таких вирусных (например, AAV) частиц, или фармацевтической композиции такой вирусной (например, на основе AAV-Rh74 или родственного AAV, такого как капсидный вариант AAV-Rh74 (например, RHM4-1)) частицы, или совокупности таких вирусных (например, AAV) частиц, в организм или клетку индивидуума (например, млекопитающего), где указанное введение обуславливает доставку или перенос гетерологичной полинуклеотидной последовательности в организм или клетку индивидуума (например, млекопитающего). В другом варианте осуществления способ или вариант применения используется для лечения индивидуума (например, млекопитающего) с дефицитом экспрессии или функции белка, или нуждающегося в экспрессии или функции белка, или нуждающегося в уменьшении экспрессии или функции эндогенного белка (например, нежелательного, аберрантного или неправильно функционирующего белка), и включает в себя получение вирусной (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частицы, совокупности таких вирусных (например, AAV) частиц, или фармацевтической композиции такой вирусной (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частицы, или совокупности таких вирусных (например, AAV) частиц; и введение вирусной (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частицы, совокупности таких вирусных (например, AAV) частиц, или фармацевтической композиции такой вирусной (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частицы, или совокупности таких вирусных (например, AAV) частиц индивидууму (например, млекопитающему), в результате чего гетерологичная полинуклеотидная последовательность экспрессируется в организме млекопитающего, или гетерологичная полинуклеотидная последовательность кодирует ингибиторную последовательность, или ингибиторный белок, который уменьшает экспрессию или функцию эндогенного белка (например, нежелательного, аберрантного или неправильно функционирующего белка) в организме индивидуума (например, млекопитающего).
[0030] Способы и варианты, используемые для введения или доставки, осуществляют посредством любого режима, подходящего ддля индивидуума. В конкретных вариантах осуществления вирусную (например, на основе AAV-Rh74 и родственного AAV, такого как капсидный вариант AAV-Rh74 (например, RHM4-1)) частицу или совокупность таких вирусных (например, AAV) частиц (например, векторов AAV-Rh74 или родственных векторов AAV, таких как капсидные варианты AAV-Rh74 (например, RHM4-1)) вводят внутривенно, внутриартериально, внутримышечно, подкожно, перорально, путем интубации, через катетер, через кожу, интракраниально, путем ингаляции, внутрь полостей или через слизистую оболочку.
[0031] Индивидуумы включают в себя млекопитающих, таких как люди и отличные от людей млекопитающие (например, приматы). В конкретных вариантах осуществления индивидуум испытывает улучшение в результате экспрессии гетерологичной полинуклеотидной последовательности, или нуждается в экспрессии гетерологичной полинуклеотидной последовательности.
[0032] Настоящее изобретение предлагает способы получения плазмидных и вирусных (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частиц, которые содержат (капсидируют, заключают в себе) рекомбинантный вектор (например, AAV). В одном варианте осуществления способ получения рекомбинантных вирусных или AAV частиц включает в себя введение в упаковывающую хелперную клетку плазмиды, содержащей рекомбинантный вектор (например, AAV), с достижением продуктивной инфекции вируса (например, AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)); и культивирование хелперных клеток в условиях, обеспечивающих получение частиц рекомбинантного вируса (например, AAV-Rh74 или родственного AAV, такого как капсидный вариант ААВ-Rh74 (например, RHM4-1)). В другом варианте осуществления способ получения рекомбинантных вирусных или AAV частиц с пониженным содержанием рекомбинантных вирусных (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частиц, в состав которых входит рекомбинантный вирусный вектор, содержащий примесную нуклеиновую кислоту, включает в себя введение в упаковочную хелперную клетку плазмиды, содержащей рекомбинантный вектор (например, AAV); и культивирование хелперных клеток в условиях, обеспечивающих продукцию рекомбинантных вирусных (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частиц, причем образующиеся рекомбинантные вирусные (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частицы содержат пониженное число вирусных (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частиц с рекомбинантным векторным геномом, содержащим примесную нуклеиновую кислоту, по сравнению с числом вирусных (например, на основе AAV-Rh74 и родственного AAV, такого как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)) частиц, содержащих примесную нуклеиновую кислоту, полученных в отсутствии последовательности-наполнителя или спейсерной полинуклеотидной последовательности в рекомбинантном вирусном векторе. В конкретных аспектах примесная нуклеиновая кислота представляет собой бактериальную нуклеиновую кислоту; или последовательность, отличную от гетерологичной полинуклеотидной последовательности, или последовательности ITR, промотора, энхансера, точки начала репликации, полиадениновой последовательности, или последовательности селективного маркера.
[0033] Хелперные клетки включают в себя клетки млекопитающих. В конкретных вариантах осуществления хелперные клетки выполняют функции (например, AAV), обеспечивающие упаковку гетерологичной полинуклеотидной последовательности в вирусной частице (например, в частице AAV, такой как AAV-Rh74 и родственные векторы AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1)). В конкретных аспектах хелперная клетка продуцирует белки Rep и/или Cap AAV (например, белки Rep78 и/или Rep68); хелперная клетка стабильно или временно трансфицирована полинуклеотидом (полинуклеотидами), кодирующим белковую последовательность (белковые последовательности) Rep и/или Cap; хелперная клетка стабильно или временно трансфицирована последовательностью (последовательностями), кодирующей белок/полинуклеотид Rep78 и/или Rep68.
[0034] Плазмиды, содержащие рекомбинантный вектор (например, AAV) настоящего изобретения, могут быть получены с использованием любого штамма или серотипа, в том числе гибридов или химер разных серотипов. Рекомбинантные вирусные (например, AAV) частицы настоящего изобретения обычно получают с использованием AAV-Rh74 или родственного AAV, такого как AAV-Rh74 и родственный AAV, такой как вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1)), однако они также включают в себя гибриды или химеры, полученные с использованием разных серотипов. Типичные серотипы AAV включают в себя, без ограничения, серотипы AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и Rh10. Соответственно, рекомбинантные вирусные (например, AAV) частицы настоящего изобретения, содержащие геномы векторов, могут содержать капсидный белок, относящийся к другому серотипу, смеси серотипов, или гибридам или химерам разных серотипов, такой как капсидный белок VP1, VP2 или VP3 серотипа AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, Rh10. Кроме того, рекомбинантные векторы (например, AAV), последовательности, плазмиды, векторные геномы настоящего изобретения могут включать в себя элементы, относящиеся к одному серотипу, смеси серотипов, или гибридам или химерам разных серотипов. В разных вариантах осуществления рекомбинантный вектор AAV содержит последовательность Cap, Rep и/или ITR, полученную из серотипа AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAVl1, Rh74 или Rh10, или из смеси, гибрида или химеры любых из вышеуказанных серотипов AAV.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0035] На фигуре 1 показаны уровни человеческого фактора IX (FIX) в плазме мышей C57BL/6 (n=5 в группе), которым через хвостовую вену были введены векторы AAV, экспрессирующие трансген FIX под контролем печень-специфического промотора. Доза вектора составляет 2510 векторных геномов на мышь. Уровни продукта трансгена FIX (белка FIX) в плазме измеряют методом ELISA через 1, 2 и 4 недели после переноса гена. AAV-Rh74 обеспечивает самые высокие уровни экспрессии трансгена FIX.
[0036] На фигуре 2 показаны уровни собачьего FIX в плазме собак с гемофилией В после доставки 312 векторных геномов на килограмм (кг) массы тела. Векторы AAV вводят внутривенно (вв) через подкожную вену и уровни FIX измеряют методом ELISA. Экспрессия терапевтического трансгена FIX регулируется печень-специфическим промотором. Эффективность векторов AAV8 и AAV-Rh74 является примерно одинаковой у собак с гемофилией В и превосходит эффективность AAV6.
[0037] На фигуре 3 приведены аминокислотные последовательности VP1, VP2 и VP3 AAV-Rh74, а для VP1 также полинуклеотидная (ДНК) последовательность (SEQ ID NO:1-4).
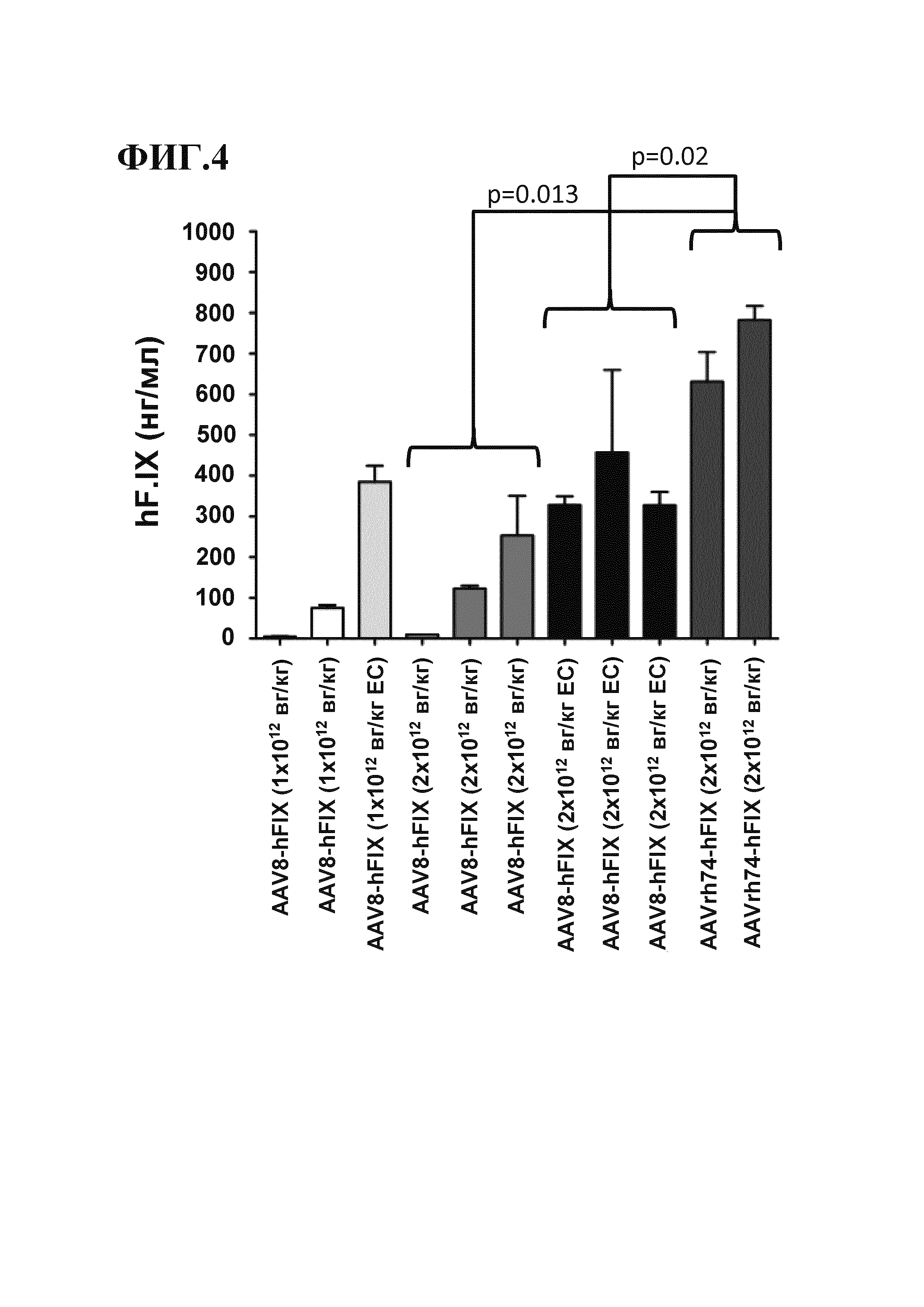
[0038] На фигуре 4 показаны результаты введения векторов AAV8 и AAVrh74, экспрессирующих человеческий фактор IX (FIX) (под контролем печень-специфического промотора), макакам-резусам, отличным от человека приматам, и экспрессия FIX в организме животных. Животные, получающие векторы AAVrh74-FIX (два последних столбика с правой стороны), экспрессируют трансген FIX на более высоких уровнях, чем животные из других групп, получающие другие векторы в той же дозе.
[0039] На фигуре 5 показаны уровни экспрессии человеческого фактора IX в плазме животных, получающих AAV вектор экспрессии человеческого фактора IX, капсидированный указанным AAV (варианты Rh74, такие как вариант RHM4-1), по сравнению с AAV вектором экспрессии человеческого фактора IX, капсидированным Rh74 и AAV8.
[0040] На фигуре 6 показаны результаты введения векторов AAV8 и варианта AAV-Rh74 RHM4-1, экспрессирующих человеческий фактор IX (FIX) (под контролем печень-специфического промотора), яванским макакам, отличным от человека приматам, и экспрессия FIX в организме животных.
ПОДРОБНОЕ ОПИСАНИЕ
[0041] Настоящее изобретение основано, по меньшей мере частично, на данных, свидетельствующих о том, что серотип AAV-Rh74 аденоассоциированного вируса (AAV) и родственные варианты AAV, такие как капсидные варианты AAV-Rh74 (например, RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), обладают высоким тропизмом к гепатоцитам, которые представляют собой клетки печени. Используемые в качестве векторов для переноса/доставки полинуклеотидов (например, генов, ингибиторных нуклеиновых кислот и т.д.) в клетки, AAV-Rh74 и родственные варианты AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), могут обеспечивать терапевтические уровни экспрессии в печени после внутривенного введения. Кроме того, векторы AAV-Rh74 и родственные варианты AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), опосредуют уровни экспрессии белка, продуцирующегося в результате переноса/доставки гена, которые значительно превышают уровни экспрессии, наблюдающиеся при применении нескольких других серотипов (см, например, фиг. 1, 2, 4, 5 и 6). В частности, вектор AAV-Rh74 и родственные капсидные варианты AAV-Rh74 (например, RHM4-1) обеспечивают доставку генов в печень собак с гемофилией B, и/или мышей, и/или макак, с эффективностью, по меньшей мере, сопоставимой с эффективностью золотого стандарта, используемого для трансдукции генов в печень, AAV8, и, как правило, превосходящей ее. Таким образом, векторы AAV-Rh74 и родственные варианты AAV, такие как капсидные варианты ААВ-Rh74 (например, RHM4-1) можно использовать для переноса/доставки гетерологичных полинуклеотидов, таких как последовательности (гены), кодирующие белки, которые обуславливают благоприятный желательный или терапевтический эффект, а также ингибиторные (например, антисмысловые) нуклеиновые кислоты, которые уменьшают или ингибируют экспрессию нежелательного или поврежденного (например, патологического) гена, обеспечивая тем самым лечение разных заболеваний. Например, геном рекомбинантного вектора (такого как AAV) может быть упакован или капсидирован в векторе AAV-Rh74, или родственном варианте AAV, таком как капсидный вариант ААВ-Rh74 (например, RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), с целью переноса/доставки гетерологичного полинуклеотида в клетку.
[0042] Как описано в данном документе, серотип AAV-Rh74 аденоассоциированного вируса (AAV) и родственные варианты AAV, такие как капсидные варианты AAV-Rh74 (например, RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), можно использовать в качестве средств доставки полинуклеотидных последовательностей в клетки ex vivo, in vitro и in vivo. Поскольку такие полинуклеотидные последовательности могут кодировать белки, клетки, в которые доставляются полинуклеотиды, экспрессируют кодируемые ими белки. Например, рекомбинантный вектор AAV может содержать гетерологичные полинуклеотиды, кодирующие нужный белок или пептид, или гетерологичный полинуклеотид, который транскрибируется в ингибиторную последовательность (например, РНК), такую как последовательность, специфичная к гену и способная ингибировать его экспрессию. Таким образом, доставка или введение вектора индивидууму (например, млекопитающему) предоставляет индивидууму не только гетерологичные полинуклеотиды, кодирующие белки и пептиды, но и ингибиторные нуклеиновые кислоты, специфичные к генам и способные ингибировать их экспрессию или функционирование в организме индивидуума.
[0043] Таким образом, настоящее изобретение предлагает векторы AAV-Rh74 и родственные варианты векторов AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), которые содержат (капсидируют или заключают в себе) векторный геном, включающий в себя полинуклеотидные последовательности, кодирующие пептиды и белки, а также полинуклеотидные последовательности, которые непосредственно представляют собой ингибиторные нуклеиновые кислоты, или транскрибируются с образованием ингибиторных нуклеиновых кислот, специфичных к генам и способных ингибировать их экспрессию или функционирование.
[0044] Рекомбинантный "вектор" или "AAV вектор" получают из генома вируса, такого как AAV, дикого типа с помощью молекулярных методов путем удаления из вируса (например, AAV) генома дикого типа и замены его неприродной нуклеиновой кислотой, такой как гетерологичная полинуклеотидная последовательность (например, кассета экспрессии терапевтического гена). Как правило, в векторе AAV оставляют одну или обе последовательности инвертированных концевых повторов (ITR) генома AAV дикого типа. Рекомбинантный вирусный вектор (например, AAV) отличается от генома вируса (например, AAV), поскольку весь вирусный геном, или его часть, заменяют неприродной по отношению к нуклеиновой кислоте вирусного (например, AAV) генома последовательностью, такой как гетерологичная полинуклеотидная последовательность. Таким образом, введение неприродной последовательности, такой как гетерологичный полинуклеотид, позволяет определять вирусный вектор (например, AAV) как "рекомбинантный" вектор, который в случае AAV можно обозначить как "вектор rAAV".
[0045] Последовательность рекомбинантного вектора (например, AAV) может быть упакована в вирус (также называемый здесь "частица" или "вирион") для последующего инфицирования (трансформации) клетки ex vivo, in vitro или in vivo. Если последовательность рекомбинантного вектора капсидируется или заключается в частице AAV, частица может обозначаться как "rAAV". Такие частицы или вирионы, как правило, включают в себя белки, которые капсидируют или заключают в себе векторный геном. Конкретными примерами являются белки вирусной оболочки, в случае AAV капсидные белки.
[0046] В конкретных вариантах осуществления рекомбинантный вектор (например, AAV) представляет собой парвовирусный вектор. Парвовирусы представляют собой небольшие вирусы, геном которых содержит одноцепочечную ДНК. "Аденоассоциированные вирусы" (AAV) относятся к семейству парвовирусов.
[0047] Парвовирусы, в том числе вирусы AAV, можно использовать в качестве векторов в способах генной терапии, поскольку они могут проникать в клетки, обеспечивая введение и стабильное поддерживание в клетках нуклеиновой кислоты/генетического материала. Кроме того, указанные вирусы позволяют вводить нуклеиновую кислоту/генетический материал в конкретные участки, такие как конкретный участок на хромосоме 19. Поскольку AAV не связан с патогенным состоянием у людей, векторы AAV могут доставлять гетерологичные полинуклеотидные последовательности (например, кодирующие терапевтические белки и агенты) пациентам-людям, не вызывая существенного патогенеза или заболевания, опосредованного AAV.
[0048] Серотипы AAV-Rh74 и родственных вариантов AAV, таких как AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1) (например, последовательности VP1, VP2 и/или VP3) необязательно могут отличаться от других серотипов AAV, включающих в себя, например, AAV1-AAV11 или Rh10 (например, они могут отличаться от последовательностей VP1, VP2 и/или VP3 одного из серотипов AAV1-AAV11 или Rh10). В данном описании термин "серотип" относится к разновидности AAV, содержащей капсид, серологически отличающийся от других серотипов AAV. Серологическое различие определяют на основании отсутствия способности антител к перекрестному взаимодействию с разными AAV. Такие различия в перекрестной реакционноспособности, как правило, обуславливаются различиями в последовательностях/антигенных детерминантах капсидных белков (например, различиями в последовательностях VP1, VP2 и/или VP3 серотипов AAV). Несмотря на то, что варианты AAV-Rh74, включающие в себя капсидные варианты, серологически могут не отличаться от Rh74 или другого AAV, они отличаются от Rh74 или другого AAV, по меньшей мере, одним нуклеотидом или аминокислотным остатком.
[0049] Согласно традиционному определению, представляющий интерес вирус относят к новому серотипу, если при его тестировании против сыворотки, специфичной ко всем существующим и охарактеризованным серотипам, на нейтрализующую активность, не обнаруживают антитела, способные нейтрализовать представляющий интерес вирус. Поскольку обнаружено большое число изолятов природного вируса и/или получено большое число капсидных мутантов, серологические различия с любым из существующих на сегодняшний день серотипов могут присутствовать или отсутствовать. Так, если новый вирус (например, AAV) не имеет серологического отличия, этот новый вирус (например, AAV) относят к подгруппе или варианту соответствующего серотипа. Зачастую серологическому тестированию на нейтрализующую активность подвергают мутантные вирусы, содержащие модификации в капсидной последовательности, чтобы определить, относятся ли они к другому серотипу в соответствии с традиционным определением серотипа. Соответственно, для удобства и во избежание повторения, термин "серотип" используют в широком смысле и относят как к серологически разным вирусам (например, AAV), так и к вирусам (например, AAV), которые не обладают серологическими различиями и могут относиться к подгруппе или варианту данного серотипа.
[0050] Плазмиды, содержащие рекомбинантный вектор (например, AAV), а также способы и варианты их применениия, относятся к любому штамму или серотипу вируса. В качестве неограничивающего примера, плазмида, содержащая рекомбинантный вектор (например, AAV), может быть получена с использованием генома любого AAV, такого как, например, AAV-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -rh74, -rh10 или AAV-218. В основе таких векторов лежать такой же или другой штамм или серотип (или подгруппа, или вариант). В качестве неограничивающего примера, плазмида, содержащая рекомбинантный вектор (например, AAV), может быть получена с использованием генома одного серотипа, к которому также относятся один или несколько капсидных белков, заключающих в себе вектор. Кроме того, плазмида, содержащая рекомбинантный вектор (например, AAV), может быть получена с использованием генома серотипа AAV (например, AAV2), отличающегося от серотипа одного или нескольких капсидных белков, заключающих в себе вектор, и в данном случае, по меньшей мере, один из трех капсидных белков может относиться к AAV-Rh74, или родственному варианту AAV, такому как AAV-Rh74, или родственный AAV, такой как, например, вариант AAV-Rh74 (например, капсидный вариант, такой как RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6).
[0051] AAV-Rh74 содержит генные/белковые последовательности, идентичные последовательностям, характерным для AAV-Rh74 (см., например, VP1, VP2, VP3 на фиг.3). В настоящем описании выражение "вектор AAV, родственный AAV-Rh74" и его грамматические варианты относятся к одному или нескольким белкам AAV (например, к последовательностям VP1, VP2 и/или VP3), которые характеризуются значительной степенью идентичности последовательности по отношению к одной или нескольким полинуклеотидным или полипептидным последовательностям AAV-Rh74. Следовательно, такие векторы AAV, родственные AAV-Rh74, могут содержать одну или несколько последовательностей, отличных от последовательностей AAV-Rh74, но при этом они могут обладать значительной степенью идентичности последовательностей по отношению к одному или нескольким генам AAV-Rh74, и/или иметь одну или несколько функциональных характеристик AAV-Rh74 (например, таких как клеточный/тканевый тропизм). Например, родственный AAV-Rh74 вариант AAV RHM4-1 содержит капсид, отличающийся от капсида Rh74 по четырем аминокислотам. Примеры последовательностей AAV-Rh74 и родственных вариантов AAV, таких как AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), включают в себя VP1, VP2 и/или VP3, описанные, например, на фиг.3. В одном неограничивающем иллюстративном варианте осуществления вектор AAV, родственный AAV-Rh74, содержит полинуклеотидную последовательность, полипептидную последовательность, или ее подпоследовательность, которая включает в себя последовательность, или состоит из последовательности, по меньшей мере, на 80% или более (например, на 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% и т.д.) идентичной одной или нескольким последовательностям VP1, VP2 и/или VP3 AAV-Rh74, приведенным на фиг.3.
[0052] В соответствии с настоящим изобретением в способах и вариантах применения используют последовательности AAV-Rh74 (полипептидные и нуклеотидные) и их подпоследовательности, которые идентичны стандартной генной или белковой последовательности AAV-Rh74 (такой как последовательности VP1, VP2 и/или VP3, приведенные на фиг. 3) менее чем на 100%, но отличаются от генов или белков известных AAV, таких как гены или белки AAV1-AAV11, AAV-Rh10, и т.д., и не являются идентичными указанным генам или белкам. В одном варианте осуществления полипептид AAV-Rh74, или его подпоследовательность, содержит последовательность, или состоит из последовательности, по меньшей мере на 80% или более, например, на 85%, 85%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% и т.д., то есть до 100%, идентичной любой стандартной последовательности AAV-Rh74 или ее подпоследовательности (включающей в себя последовательности VP1, VP2 и/или VP3, приведенные на фиг. 3). В конкретных аспектах родственный вариант AAV-Rh74 (такой как капсидный вариант RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6) содержит одну, две, три или четыре из четырех аминокислотных замен, описанных для AAV-Rh74.
[0053] Рекомбинантные векторы (например, AAV), включающие в себя AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, Rh10, Rh74 или AAV-218, а также их варианты, родственные, гибридные и химерные последовательности, можно сконструировать с помощью рекомбинантных методов, известных специалистам в данной области, таким образом, чтобы они содержали одну или несколько гетерологичных полинуклеотидных последовательностей (трансгенов), фланкированных одной или несколькими функциональными последовательностями ITR AAV. Из таких векторов можно удалить полностью или частично один или несколько генов AAV дикого типа, например, ген rep и/или cap, но при этом должна остаться, по меньшей мере, одна функциональная фланкирующая последовательность ITR, поскольку это необходимо для спасения, репликации и упаковки рекомбинантного вектора в векторной частице AAV. Следовательно, геном вектора AAV содержит в цис-конфигурации последовательности, необходимые для репликации и упаковки (например, функциональные последовательности ITR).
[0054] Термины "полинуклеотид" и "нуклеиновая кислота" используются здесь как взаимозаменяемые и относятся ко всем формам нуклеиновых кислот и олигонуклеотидов, включающих в себя дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Полинуклеотиды включают в себя геномную ДНК, кДНК и антисмысловую ДНК, а также сплайсированную или не сплайсированную мРНК, рРНК, тРНК и ингибиторную ДНК или РНК (РНКи, например, малую или короткую шпилечную (кш)РНК, микроРНК (микроРНК), малую или короткую интерферирующую (ми)РНК, РНК, образовавшуюся в результате транс-сплайсинга, или антисмысловую РНК). Полинуклеотиды включают в себя природные, синтетические и преднамеренно измененные или модифицированные полинуклеотиды, а также их аналоги и производные. Полинуклеотиды могут быть одноцепочечными, двухцепочечными или трехцепочечными, линейными или циклическими, и могут иметь любую длину. При обсуждении полинуклеотидов последовательность или структура конкретного полинуклеотида может быть описана здесь в соответствии с соглашением, предписывающим описание последовательности в направлении 5'-3'.
[0055] "Гетерологичный" полинуклеотид представляет собой полинуклеотид, вставленный в вектор (например, AAV) с целью опосредованного вектором переноса/доставки полинуклеотида в клетку. Гетерологичные полинуклеотиды, как правило, отличаются от нуклеиновой кислоты вектора (например, AAV), т.е. не являются нативными по отношению к нуклеиновой кислоте вируса (например, AAV). После переноса/доставки в клетку гетерологичный полинуклеотид, содержащийся в вирионе, может экспрессироваться (например, транскрибироваться и транслироваться, в зависимости от обстоятельств). Альтернативно содержащийся в вирионе гетерологичный полинуклеотид после переноса/доставки в клетку не экспрессируется. Хотя термин "гетерологичный" не всегда используется в данном документе в отношении к полинуклеотидам, подразумевается, что ссылка на полинуклеотид, даже в отсутствии определения "гетерологичный", включает в себя гетерологичные полинуклеотиды, несмотря на опущение определения.
[0056] "Полипептиды", "белки" и "пептиды", кодируемые "полинуклеотидными последовательностями", включают в себя полноразмерные нативные последовательности, например, природных белков, а также функциональные подпоследовательности, модифицированные формы или варианты последовательностей при условии, что подпоследовательность, модифицированная форма или вариант сохраняет некоторые функциональные свойства полноразмерного нативного белка. В способах и вариантах применения настоящего изобретения такие полипептиды, белки и пептиды, кодируемые полинуклеотидными последовательностями, могут быть, но не обязательно, идентичными эндогенному белку, который является дефектным, или экспрессия которого является недостаточной или ограниченной в организме млекопитающего, подвергающегося лечению.
[0057] Серотип AAV-Rh74 аденоассоциированного вируса (AAV) настоящего изобретения и родственные варианты AAV, такие как варианты AAV-Rh74 (например, капсидные варианты, такие как RHM4-1, RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), можно использовать для стабильного или временного введения/доставки полинуклеотидов в клетки и их потомство. Термин "трансген" используется здесь в целях удобства для обозначения такого гетерологичного полинуклеотида, введенного в клетку или организм. Трансгены включают в себя любой полинуклеотид, такой как ген, который кодирует полипептид или белок, полинуклеотид, который транскрибируется в ингибиторный полинуклеотид, или полинуклеотид, который не транскрибируется (например, вследствие отсутствия элемента, контролирующего экспрессию, такого как промотор, который управляет транскрипцией).
[0058] Например, в клетке, содержащей трансген, введенный/перенесенный посредством вектора, такого как AAV, происходит "трансформация". Термины "трансформация" и "трансфекция" относятся к введению молекулы, такой как полинуклеотид, в клетку или организм-хозяин.
[0059] Клетку, в которую введен трансген, называют "трансформированная клетка", или "трансформант". Соответственно, "трансформированная" или "трансфицированная" клетка (например, клетка млекопитающего, такая как клетка ткани или органа) представляет собой клетку, генетически измененную в результате введения в клетку экзогенной молекулы, такой как полинуклеотид или белок (например, трансген). Таким образом, "трансфицированная" или "трансформированная" клетка представляет собой клетку, в которую, или в потомство которой, введена экзогенная молекула. Клетка (клетки) может размножаться и может происходить экспрессия введенного белка, или транскрипция введенной нуклеиновой кислоты. В соответствии с методами и спообами генной терапии, трансформированная клетка может находиться в организме индивидуума.
[0060] Введенный полинуклеотид необязательно может интегрироваться в нуклеиновую кислоту клетки- или организма-реципиента. Если введенный полинуклеотид интегрируется в нуклеиновую кислоту (геномную ДНК) клетки- или организма-реципиента, он может быть стабильно удерживаться в такой клетке, или в таком организме, и затем передаваться дочерним клеткам или организмам, или наследоваться дочерними по отношению к клетке- или организму-реципиенту клетками или организмами. И наконец, введенная нуклеиновая кислота может существовать в клетке-реципиенте или организме-хозяине лишь временно.
[0061] Трансформации можно подвергать клетки любой ткани или любого органа, имеющие любое происхождение (например, мезодермальное, эктодермальное или энтодермальное). Неограничивающие примеры клеток включают в себя клетки печени (такие как гепатоциты, эндотелиальные клетки синусоидов), поджелудочной железы (например, островковые бета-клетки), легких, центральной или периферической нервной системы, например, мозга (такие как нервные, глиальные или эпендимные клетки) или позвоночника, почек, глаз (такие как клеточные компоненты сетчатки), селезенки, кожи, тимуса, семенников, легких, диафрагмы, сердца, мышцы или поясничной мышцы, или клетки кишечника (такие как эндокринные клетки), жировой ткани (белой, коричневой или бежевой), мышц (например, фибробласты), синовиоциты, хондроциты, остеокласты, эпителиальные клетки, эндотелиальные клетки, клетки слюнных желез, нервные клетки внутреннего уха или гемопоэтические клетки (например, клетки крови или лимфы). Другие примеры включают в себя стволовые клетки, такие как плюрипотентные или мультипотентные клетки-предшественники, которые развиваются или дифференцируются в печени (например, гепатоциты, эндотелиальные клетки синусоидов), поджелудочной железе (например, бета-клетки островков), легких, центральной или периферической нервной системе, такой как мозг (например, нейронные, глиальные или эпендимные клетки) или позвоночник, почках, глазах (клеточные компоненты сетчатки), селезенке, коже, тимусе, семенниках, легких, диафрагме, сердце (клетки сердечной мышцы), мышце или поясничной мышце, или кишке (например, эндокринные клетки), жировой ткани (белой, коричневой или бежевой), мышцах (например, фибробласты), а также синовиоциты, хондроциты, остеокласты, эпителиальные клетки, эндотелиальные клетки, клетки слюнных желез, нервные клетки внутреннего уха или гемопоэтические клетки (например, клетки крови или лимфы).
[0062] "Терапевтическая молекула" в одном варианте осуществления представляет собой пептид или белок, который может облегчить или уменьшить симптомы, которые являются результатом отсутствия или дефекта белка в клетке или организме индивидуума. Альтернативно "терапевтический" пептид или белок, кодируемый трансгеном, обеспечивает улучшение состояния индивидуума, например, в результате исправления генетического дефекта, коррекции дефицита гена (экспрессии или функционирования) или противоопухолевого действиям.
[0063] Конкретные неограничивающие примеры гетерологичных полинуклеотидов, кодирующих генные продукты (например, терапевтические белки), которые можно использовать в соответствии с настоящим изобретением, включают в себя, без ограничения: гены, которые содержат или кодируют CFTR (трансмембранный белок-регулятор муковисцидоза), фактор коагуляции (свертывания) крови (фактор XIII, фактор IX, фактор Х, фактор VIII, фактор VIIa, белок C и т.д.), в том числе продукт, усиливающий функцию факторов свертывания крови, антитело, белок размером 65 кДа, специфичный к пигментному эпителию сетчатки (RPE65), эритропоэтин, рецептор LDL, липопротеинлипазу, орнитинтранскарбамилазу, β-глобин, α-глобин, спектрин, α-антитрипсин, аденозиндезаминазу (АДА), транспортер металлов (ATP7A или ATP7), сульфамидазу, фермент, участвующий в лизосомной болезни накопления (ARSA), гипоксантин-гуанин-фосфорибозилтрансферазу, β-25-глюкоцереброзидазу, сфингомиелиназу, лизосомальную гексозаминидазу, дегидрогеназу кетокислот с разветвленной цепью, гормон, фактор роста (например, инсулиноподобные факторы роста 1 и 2, тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста нервов, нейротрофический фактор 3 и 4, нейротрофический фактор головного мозга, глиальный фактор роста, трансформирующий фактор роста α и β и др.), цитокин (например, интерферон, β-интерферон, интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-12, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин и т.д.), продукт суицидального гена (например, тимидинкиназу вируса простого герпеса, цитозиндезаминазу, дифтерийный токсин, цитохром Р450, дезоксицитидинкиназу, фактор некроза опухоли и др.), белок устойчивости к лекарственному средству (например, белок, обеспечивающий устойчивость к лекарственному средству, используемому в противораковой терапии), белок-супрессор опухолевого роста (например, р53, Rb, Wt-1, NF1, белок Гиппеля-Линдау (VHL), белок, ассоциированный с аденоматозным полипозом толстой кишки (APC)), пептид с иммуномодулирующими свойствами, толерогенный или иммуногенный пептид, или белок Tregitopes [de Groot et al., Blood 2008 Oct 15;112(8):3303] или hCDR1 [Sharabi et al., Proc Natl Acad Sci U S A. 2006 Jun 6;103(23):8810-5], инсулин, глюкокиназу, гуанилатциклазу 2D (LCA-GUCY2D), белок эскорта Rab 1 (хороидермия), LCA 5 (LCA-Lebercilin), аминотрансферазу орнитин-кетокислота (гиратная атрофия), ретиношизин 1 (ретиношизис, связанный с X-хромосомой), USH1C (синдром Ашера 1С), ГТФазу, участвующую в развитии связанного с Х-хромосомой пигментного ретинита (XLRP), MERTK (AR-формы RP: пигментного ретинита), DFNB1 (глухота, ассоциированная с коннексином 26), ACHM 2, 3 и 4 (цветовая слепота), PKD-1 или PKD-2 (поликистоз почек), TPP1, CLN2, белки, дефицит генов которых является причиной лизосомальной болезни накопления (например, сульфатазы, N-ацетилглюкозамин-1-фосфаттрансфераза, катепсин А, GM2-AP, NPC1, VPC2, белки, активирующие сфинголипиды и т.д.), одну или несколько нуклеаз цинковые пальцы, редактирующих геном, или донорные последовательности, используемые в качестве ремонтной матрицы для исправления генома.
[0064] Другие неограничивающие примеры гетерологичных полинуклеотидов, кодирующих генные продукты (например, терапевтические белки), которые можно использовать в соответствии с настоящим изобретением, включают в себя полинуклеотиды, которые можно использовать для лечения заболевания или расстройства, включающего в себя, без ограничения, кистозный фиброз (а также другие заболевания легких), гемофилию A, гемофилия B, талассемию, анемию и другие болезни крови, СПИД, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, эпилепсию и другие неврологические расстройства, рак, сахарный диабет, мышечную дистрофию (например, Дюшенна, Беккера), болезнь Гоше, болезнь Херлера, дефицит аденозиндезаминазы, болезни накопления гликогена и другие метаболические дефекты, дегенеративные заболевания сетчатки (и другие болезни глаз), и заболевания солидных органов (таких как мозг, печень, почки, сердце).
[0065] Все относящиеся как к млекопитающим, так и не млекопитающим, формы полинуклеотидов, кодирующих генные продукты, включающие в себя раскрытые здесь неограничивающие примеры генов и белков, однозначно включены в данный документ, независимо от того, известны они, или нет. Таким образом, изобретение включает в себя гены и белки не млекопитающих, отличных от человека млекопитающих и человека, причем указанные гены и белки функционируют, по существу, подобно описанным здесь человеческим генам и белкам. Не ограничивающим примером гена не млекопитающего является домен нуклеазы Fok бактериального происхождения. Неограничивающие примеры последовательностей FIX отличных от человека млекопитающих описаны в Yoshitake et al., 1985, выше; Kurachi et al., 1995, выше; Jallat et al., 1990, выше; Kurachi et al., 1982, Proc. Natl. Acad. Sci. USA 79:6461-6464; Jaye et al., 1983, Nucl. Acids Res. 11:2325-2335; Anson et al., 1984, EMBO J. 3: 1053-1060; Wu et al., 1990, Gene 86:275-278; Evans et al., Proc Natl Acad Sci USA 86:10095 (1989), Blood 74:207-212; Pendurthi et al., 1992, Thromb. Res. 65:177-186; Sakar et al., 1990, Genomics 1990, 6:133-143; and, Katayama et al., 1979, Proc. Natl. Acad. Sci. USA 76:4990-4994.
[0066] Как описано в данном документе, гетерологичные полинуклеотидные последовательности (трансгены) включают в себя ингибиторные и антисмысловые последовательности нуклеиновых кислот. Ингибиторные олигонуклеотиды, антисмысловые олигонуклеотиды, миРНК (малые интерферирующие РНК), микроРНК (микроРНК), кшРНК (короткие шпилечные РНК), РНКи и антисмысловые олигонуклеотиды могут модулировать экспрессию гена-мишени. Такие молекулы включают в себя последовательности, способные ингибировать экспрессию гена-мишени, участвующего в патологическом процессе, тем самым уменьшая, подавляя или облегчая один или несколько симптомов заболевания.
[0067] Антисмысловые молекулы включают в себя одно-, двух- или трехцепочечные полинуклеотиды и пептидные нуклеиновые кислоты (PNA), которые связывают РНК-транскрипт, или ДНК (например, геномную ДНК). Олигонуклеотиды, полученные из участка инициации транскрипции гена-мишени, например, содержащие нуклеотиды между положениями -10 и +10 по отношению к участку инициации транскрипции, являются другим конкретным примером. Антисмысловая последовательность, образующая триплекс, может связываться с двухцепочечной ДНК, ингибируя транскрипцию гена. "РНКи" представляет собой одно- или двухцепочечную последовательность РНК, используемую для ингибирования экспрессии гена (см., например, Kennerdell et al., Cell 95:1017 (1998); and Fire et al., Nature, 391:806 (1998)). Следовательно, последовательности двухцепочечной РНК, соответствующей кодирующему участку гена-мишени, можно использовать для ингибирования или предотвращения экспрессии/транскрипции гена в соответствии со способами и вариантами применения настоящего изобретения. Антисмысловые последовательности и РНКи можно получить с использованием нуклеиновых кислот, кодирующих последовательности гена-мишени (например, хантингтин или HTT), таких как нуклеиновая кислота, кодирующая HTT млекопитающих и человека. Например, одно- или двухцепочечная нуклеиновая кислота (например, РНК) может быть специфичной к транскрипту (например, мРНК) HTT.
[0068] Термин "миРНК" относится к терапевтической молекуле, участвующей в процессе РНК-интерференции, приводящем к последовательность-специфичному посттранскрипционному молчанию гена или нокдауну гена. Последовательность миРНК гомологична последовательности родственной мРНК гена-мишени. Малые интерферирующие РНК (миРНК), которые можно синтезировать in vitro, или получить путем расщепления рибонуклеазой III более длинной дцРНК, являются медиаторами последовательность-специфичной деградации мРНК. миРНК или другие подобные нуклеиновые кислоты настоящего изобретения можно синтезировать химически с использованием соответствующим образом защищенных фосфорамидитов рибонуклеозидов и обычного ДНК/РНК-синтезатора. миРНК можно синтезировать в виде двух отдельных комплементарных молекул РНК, или в виде одной молекулы РНК, содержащей два комплементарных участка. Коммерческие поставщики синтетических молекул РНК или реагентов для синтеза РНК включают в себя Applied Biosystems (Foster City, CA, USA), Proligo (Hamburg, Germany), Dharmacon Research (Lafayette, Colo., USA), Pierce Chemical (part of Perbio Science, Rockford, Ill., USA), Glen Research (Sterling, Va., USA), ChemGenes (Ashland, Mass., USA) и Cruachem (Glasgow, UK). Конкретные конструкции миРНК, ингибирующие мРНК гена-мишени, могут содержать 15-50 нуклеотидов в длину, более предпочтительно примерно 20-30 нуклеотидов в длину. Такие молекулы нуклеиновых кислот можно легко вставить в раскрытые здесь вирусные векторы, используя традиционные способы, известные специалистам в данной области техники.
[0069] Конкретные неограничивающие примеры генов (например, геномной ДНК) или транскриптов патогенных генов (например, РНК или мРНК), на которые могут быть направлены ингибирующие последовательности нуклеиновых кислот настоящего изобретения, включают в себя, без ограничения: гены, связанные с болезнями экспансии нуклеотидных повторов, такие как ген хантингтина (HTT), ген, ассоциированный с денторубропаллидолуизиановой атрофией (такой как ген атрофина 1, ATN1); ген рецептора андрогенов на Х-хромосоме при спинобульбарной мышечной атрофии, человеческого атаксина-1, -2, -3 и -7, Cav2.1 P/Q потенциалзависимого кальциевого канала, кодируемого (CACNA1A), ТАТА-связывающего белка, противоположной цепи атаксина 8, также известной как ATXN80S, бета-изоформы регуляторной субъединицы B серин/треонин-специфичной протеинфосфатазы 2A размером 55 кДа при спиноцеребеллярной атаксии (типа 1, 2, 3, 6, 7, 8, 12, 17), FMR1 (умственная отсталость 1, ассоциированная с ломкой хромосомой Х) при синдроме ломкой хромосомы Х, FMR1 (умственная отсталость 1, ассоциированная с ломкой хромосомой Х) при синдроме тремора/атаксии, сцепленном с ломкой хромосомой Х, FMR1 (умственная отсталость 2, ассоциированная с ломкой хромосомой Х) или 2 члена семейства AF4/FMR2 при умственной отсталости, ассоциированной с ломкой хромосомой XE; миотонинпротеинкиназы (МТ-PK) при миотонической дистрофии; фратаксина при атаксии Фридрейха; мутантный ген супероксиддисмутазы 1 (SOD1) при боковом амиотрофическом склерозе; ген, участвующий в патогенезе болезни Паркинсона и/или болезни Альцгеймера; ген аполипопротеина В (APOB) и пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9), гиперхолестеринемия; Tat ВИЧ, ген трансактиватора транскрипции вируса иммунодефицита человека при ВИЧ-инфекции; TAR ВИЧ, ген элемента, отвечающего на трансактиватор вируса иммунодефицита человека при ВИЧ-инфекции; ген рецептора хемокина С-С (CCR5) при ВИЧ-инфекции; ген нуклеокапсидного белка вируса саркомы Рауса (RSV) при инфекции RSV, печень-специфическая микроРНК (микроРНК-122) при инфекции вируса гепатита C; ген р53 при острой почечной недостаточности, или при отсроченной функции трансплантата почки, или при повреждении почек вследствие острой почечной недостаточности; ген протеинкиназы N3 (PKN3) при запущенных рецидивирующих или метастатических солидных злокачественных заболеваниях; ген LMP2, также известной как субъединица протеасомы бета-типа 9 (PSMB 9), при метастатической меланоме; LMP7, также известной как субъединица протеасомы бета-типа 8 (PSMB 8), при метастатической меланоме; MECL1, также известной как субъединица протеасомы бета-типа 10 (PSMB 10), при метастатической меланоме; ген фактора роста эндотелия сосудов (VEGF) при солидных опухолях; ген кинезина, белка веретена, при солидных опухолях, ген супрессора апоптоза В-клеточной CLL/лимфомы (BCL-2) при хроническом миелолейкозе; ген рибонуклеотидредуктазы M2 (RRM2) при солидных опухолях; ген фурина при солидных опухолях; ген polo-подобной киназы 1 (PLK1) при опухолях печени, ген диацилглицеринацилтрансферазы 1 (DGAT1) при инфекции гепатита С, ген бета-катенина при семейном аденоматозном полипозе; ген адренергического рецептора бета2 при глаукоме; ген RTP801/Redd1, также известного как белок, индуцируемый повреждением DAN транскрипта 4, при диабетическом отеке желтого пятна (DME) или возрастной макулярной дегенерации; ген рецептора фактора роста эндотелия сосудов 1 (VEGFR1) при возрастной макулярной дегенерации или неоваскуляризации хориоидеи, ген каспазы 2 при неартериитной ишемической невропатии зрительного нерва; ген мутантного белка N17K кератина 6A при врожденной пахионихии; геномных/генных последовательностей вируса гриппа А при инфекции вируса гриппа; геномные/генные последовательности коронавируса, вызывающего тяжелый острый респираторный синдром (SARS), при инфекции SARS; геномные/генные последовательности респираторно-синцитиального вируса при инфекции респираторно-синцитиального вируса; геномные/генные последовательности филовируса Эбола при инфекции Эбола; геномные/генные последовательности вирусов гепатита В и С при инфекции гепатитов В и С; геномные/генные последовательности вируса простого герпеса (HSV) при инфекции HSV, геномные/генные последовательности вируса Коксаки В3 при инфекции вируса Коксаки B3; обеспечение сайленсинга патогенного аллеля гена (аллель-специфический сайленсинг), такого как ген торсина A (TOR1A), при первичной дистонии, сайленсинга гена pan класса I и аллеля HLA, при трансплантации; или мутантный ген родопсина (Rho) при аутосомном доминантно наследуемом пигментном ретините (adRP).
[0070] Полинуклеотиды, полипептиды и их подпоследовательности включают в себя модифицированные и вариантные формы. В данном описании термины "модифицированная форма" или "вариант" и их грамматические варианты означают, что полинуклеотид, полипептид или субпоследовательность отличаются от исходной последовательности. Следовательно, модифицированные и вариантные последовательности могут обладать практически такой же, более высокой или более низкой активностью или функциональной способностью, как и исходная последовательность, однако они сохраняют, по меньшей мере, частичную активность или функцию исходной последовательности.
[0071] Соответственно, настоящее изобретение также относится к природным и неприродным вариантам. Такие варианты включают в себя варианты AAV-Rh74, например, капсидные варианты AAV-Rh74. Конкретные примеры таких капсидных вариантов AAV-Rh74 включают в себя RHM 15-1, RHM 15-2, RHM 15-3, RHM 15-4, RHM 15-5, RHM 15-6 и RHM4-1 (см, например, фиг. 5).
[0072] Такие варианты также включают в себя варианты, характеризующиеся уменьшением и утратой функции. Например, последовательности ДНК человеческого FIX дикого типа, белковые варианты или мутанты которых сохраняют активность, или обладают терапевтической эффективностью, сравнимой с эффективностью терапевтически активного инвариантного человеческого FIX, или даже превышают ее в способах и вариантах применения настоящего изобретения. В конкретном примере, поскольку коллаген IV способен улавливать FIX, после введения в мышечную ткань млекопитающего некоторая часть FIX удерживается в интерстициальном пространстве мышечной ткани и не может участвовать в свертывании крови. Путем введения в последовательность FIX мутации, приводящей к уменьшению связывания белка с коллагеном IV (т.е., к утрате функции), получают мутант, который можно использовать в способах настоящего изобретения, например, для лечения гемофилии. Пример такого мутантного гена человеческого FIX кодирует человеческий белок FIX, в котором в пятом аминокислотном положении от начала зрелого белка аминокислота лизин заменена аланином.
[0073] Неограничивающие примеры модификаций включают в себя введение в исходную последовательность одной или нескольких нуклеотидных или аминокислотных замен (например, замен 1-3, 3-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-40, 40-50, 50-100 или более нуклеотидов или остатков), таких как замена аргинина на остаток лизина (например, одна или несколько замен аргинина на лизин присутствуют в любом из RHM4-1, RHM15-1, RHM15-2, RHM15-3/RHM15-5, RHM15-4 и RHM15-6), добавлений (например, вставок 1-3, 3-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-40, 40-50, 50-100 или более нуклеотидов или остатков) и делеций (например, с получением подпоследовательностей или фрагментов). В конкретных вариантах осуществления модифицированная или вариантная последовательность сохраняет, по меньшей мере, часть функции или активности немодифицированной последовательности. Такие модифицированные формы и варианты могут обладать более низкой, такой же, или более высокой активностью по сравнению с исходной последовательностью, однако они сохраняют, по меньшей мере, часть функции или активности исходной последовательности, например, как описано в данном документе.
[0074] Вариант может содержать одно или несколько неконсервативных, или консервативных, или тех и других изменений или модификаций аминокислотной последовательности. "Консервативная замена" представляет собой замещение одной аминокислоты биологически, химически или структурно подобным остатком. Биологическое подобие означает, что замещение не нарушает биологическую активность. Структурное подобие означает, что аминокислоты имеют боковые цепи аналогичной длины, такие как аланин, глицин и серин, или аналогичного размера. Химическое подобие означает, что остатки имеют одинаковый заряд, или оба являются гидрофильными или гидрофобными. Конкретные примеры включают в себя замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой, или замену одного полярного остатка на другой, например, замену лизина на аргинин (например, в RHM15-1, RHM15-2 , RHM15-3/RHM15-5, RHM15-4 и RHM15-6), глутаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин, серина для треонин, и т.п. Конкретные примеры консервативных замен включают в себя замену гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой гидрофобный остаток, замену одного полярного остатка на другой, например, замену лизина на аргинин, глутаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин, и т.п. Например, консервативные аминокислотные замены обычно включают в себя замены в пределах следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. "Консервативная замена" также включает в себя применение замещенной аминокислоты вместо незамещенной исходной аминокислоты.
[0075] Соответственно, настоящее изобретение включает в себя генные и белковые варианты (например, полинуклеотиды, кодирующие описанные здесь белки), которые сохраняют одну или несколько биологических активностей (например, участвуют в процессе свертывания крови и т.д.). Такие белковые или полипептидные варианты включают в себя белки или полипептиды, модифицированные, или которые можно модифицировать с помощью технологии рекомбинантных ДНК таким образом, чтобы белок или полипептид обладал измененными или дополнительными свойствами, например, варианты могут иметь повышенную стабильность в плазме или повышенную активность белка. Варианты могут отличаться от исходной последовательности, такой как последовательность природного полинуклеотида, белка или пептида.
[0076] На уровне нуклеотидной последовательности природный и неприродный вариант гена, как правило, по меньшей мере, примерно на 50% идентичен, более предпочтительно примерно на 70% идентичен, еще более предпочтительно примерно на 80% идентичен (идентичность может составлять 90% или более) исходному гену. На уровне аминокислотной последовательности природный и неприродный вариант белка, как правило, по меньшей мере, примерно на 70% идентичен, более предпочтительно примерно на 80% идентичен, еще более предпочтительно примерно на 90% или более идентичен исходному белку, хотя могут присутствовать значительные неидентичные участки в неконсервативных областях (например, идентичность таких участков может составлять менее 70%, например, менее 60%, 50% или даже 40%). В других вариантах осуществления последовательности, по меньшей мере, на 60%, 70%, 75% или более идентичны (например, идентичность может составлять 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более) исходной последовательности. Способы введения нуклеотидных и аминокислотных изменений в полинуклеотид, белок или полипептид известны специалистам в данной области (см., например, Sambrook et al., Molecular Cloning:. A Laboratory Manual (2007)).
[0077] Термины "идентичность", "гомология" и их грамматические варианты означают, что две или более упомянутых последовательностей являются одинаковыми при "выравнивании". Таким образом, например, если две полипептидные последовательности являются идентичными, они имеют одинаковые аминокислотные последовательности, по меньшей мере, на протяжении определенного участка или фрагмента. Если две полинуклеотидные последовательности являются идентичными, они имеют одинаковые полинуклеотидные последовательности, по меньшей мере, на протяжении определенного участка или фрагмента. Идентичность может присутствовать в определенной области (участке или фрагменте) последовательности. "Область" или "участок" идентичности относится к фрагменту двух или более упомянутых последовательностей, на котором они являются одинаковыми. Таким образом, если две белковые или нуклеотидные последовательности идентичны на протяжении одной или нескольких областей или участков последовательностей, то они являются идентичными в пределах данного участка. "Выравнивание" последовательностей применяют к нескольким полинуклеотидным или белковым (аминокислотным) последовательностям, часто содержащим коррекции, включающие в себя пропуск или добавление оснований или аминокислот (пробелы) по сравнению со сравниваемой последовательностью.
[0078] Идентичность может наблюдаться по всей длине последовательности, или в части последовательности. В конкретных аспектах длина идентичных последовательностей составляет 2, 3, 4, 5 или более смежных полинуклеотидов или аминокислот, например, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и т.д. смежных аминокислот. В других конкретных аспектах длина идентичных последовательностей составляет 20 или более смежных полинуклеотидов или аминокислот, например, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 и т.д. смежных аминокислот. В следующих конкретных аспектах длина идентичных последовательностей составляет 35 или более смежных полинуклеотидов или аминокислот, например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 45, 47, 48, 49, 50 и т.д., смежных аминокислот. В других конкретных аспектах длина идентичных последовательностей составляет 50 или более смежных полинуклеотидов или аминокислот, например, 50-55, 55-60, 60-65, 65-70, 70-75, 75-80, 80-85, 85-90, 90-95, 95-100, 100-110 и т.д. смежных полинуклеотидов или аминокислот.
[0079] Термины "гомологичный" или "гомология" означают, что две или более сравниваемых последовательностей являются, по меньшей мере, частично идентичными на протяжении определенного участка или фрагмента. Термин "области, участки или домены" гомологии или идентичности означает, что фрагменты двух или более сравниваемых последовательностей обладают гомологией, или являются одинаковыми. Таким образом, если две последовательности идентичны на протяжении одного или нескольких участков последовательности, они являются идентичными по данным участкам. Термин "существенная гомология" означает, что молекула является структурно или функционально консервативной, так, что она обладает, или предположительно обладает, по меньшей мере, частичной структурой или функцией одной или нескольких структур или функций (например, биологической функцией или активностью) стандартной молекулы, или релевантного/соответствующего участка или фрагмента стандартной молекулы, в отношении которых он является гомологичным.
[0080] Степень идентичности (гомологии) двух последовательностей можно определить с помощью компьютерной программы и математического алгоритма. В таких алгоритмах, используемых для вычисления процента идентичности (гомологии) последовательностей, обычно учитываются пробелы и несовпадения в последовательностях на протяжении сравниваемых участков или областей. Например, в поисковом алгоритме BLAST (например, BLAST 2.0) (см., например, Altschul et al., J. Mol. Biol. 215:403 (1990), указанный алгоритм можно свободно получить через NCBI) используют следующие иллюстративные параметры поиска: несоответствие -2; открытие пробела 5; продолжение пробела 2. При сравнении полипептидных последовательностей алгоритм BLASTP обычно используют в сочетании с матрицей замен, такой как PAM100, РАМ250, BLOSUM 62 или BLOSUM 50. Для количественного определения степени идентичности также используют программы сравнения последовательностей FASTA (например, FASTA2 и FASTA3) и SSEARCH (Pearson et al., Proc. Natl. Acad. Sci. USA 85:2444 (1988); Pearson, Methods Mol Biol. 132:185 (2000); и Smith et al., J. Mol. Biol. 147:195 (1981)). Кроме того, разработаны программы для количественного определения структурного подобия белков с использованием топологического картирования по принципу Делоне (Bostick et al., Biochem Biophys Res Commun. 304:320 (2003)).
[0081] Полинуклеотиды содержат добавления и вставки, например, гетерологичных доменов. Добавление (например, гетерологичного домена) может представлять собой ковалентное или нековалентное присоединение к композиции молекулы любого типа. Обычно добавления и вставки (например, гетерологичного домена) придают комплементарность или новую функцию или активность.
[0082] Добавления и вставки включают в себя химерные и гибридные последовательности, причем полинуклеотидная или белковая последовательность содержит одну или несколько ковалентно присоединенных молекул, обычно не присутствующих в исходной нативной (дикого типа) последовательности. Термины "гибридные" или "химерные" и их грамматические вариации в применении к молекуле означают, что фрагмент или участок молекулы содержит другую последовательность, отличающуюся (гетерологичную) от последовательности молекулы, с которой они обычно не существуют вместе в природе. То есть, например, одна часть гибрида или химеры содержит или представляет собой фрагмент, который не существует в природе вместе с остальной частью молекулы, и структурно отличается от нее.
[0083] Термин "вектор" относится к плазмиде, вирусу (например, AAV вектору), космиде или другому средству, с которым можно манипулировать путем вставки или включения в него полинуклеотида. Такие векторы можно использовать для генетических манипуляций (например, "векторы клонирования"), для введения/переноса полинуклеотидов в клетки и для транскрипции или трансляции вставленного полинуклеотида в клетках. Нуклеотидная последовательность вектора обычно содержит, по меньшей мере, точку начала репликации, необходимую для размножения в клетке, и, необязательно, другие элементы, такие как гетерологичная полинуклеотидная последовательность, элемент, контролирующий экспрессию (такой как промотор, энхансер), селектируемый маркер (например, придающий устойчивость к антибиотикам), полиадениновая последовательность.
[0084] В данном описании термин "рекомбинантный", используемый в качестве определения в применении к вирусному вектору, такому как рекомбинантный вектор AAV, а также к последовательностям, таким как рекомбинантные полинуклеотиды и полипептиды, означает, что композиции (например, AAV или последовательности) подвергались изменениям (например, с использованием методов генной инженерии), которые, как правило, не существуют в природе. Конкретным примером рекомбинантного вектора, такого как вектор AAV, является вектор, содержащий вирусный геном, в который вставлен полинуклеотид, обычно отсутствующий в вирусном (например, AAV) геноме дикого типа. Примером рекомбинантного полинуклеотида может служить кодирующий белок гетерологичный полинуклеотид (например, ген), клонируемый в векторе в присутствии или в отсутствии 5'- и/или 3'-интронных участков, с которыми ген обычно связан в вирусном (например, AAV) геноме. Хотя термин "рекомбинантный" не всегда используется в данном документе в применении к вирусным векторам, таким как векторы AAV, а также к последовательностям, таким как полинуклеотидные и полипептидные последовательности, рекомбинантные формы AAV и последовательностей, включающих в себя полинуклеотиды и полипептиды, однозначно охватываются настоящим изобретением, несмотря на такие опущения.
[0085] Рекомбинантный векторный "геном" (например, геном вектора AAV) может быть капсидирован или заключен в вирус (также называемый здесь "частица" или "вирион") с целью последующего инфицирования (трансдукции или трансформации) клетки ex vivo, in vitro или in vivo. Если частица AAV капсидирует или заключает в себе рекомбинантный геном вектора AAV, ее можно обозначить "rAAV". Такие частицы или вирионы, как правило, включают в себя белки, которые капсидируют или заключают в себе векторный геном. Конкретные примеры включают в себя вирусный капсид и белки оболочки, а в случае AAV белки капсида AAV.
[0086] В случае рекомбинантной плазмиды векторный "геном" представляет собой часть рекомбинантной плазмидной последовательности, полностью упакованную или капсидированную с образованием вирусной частицы. Если рекомбинантные плазмиды используют для конструирования или получения рекомбинантных векторов, векторный геном не содержит часть "плазмиды", которая не соответствует последовательности векторного генома рекомбинантной плазмиды. Такой не являющийся векторным геномом фрагмент рекомбинантной плазмиды называют "плазмидным скелетом", который играет важную роль в клонировании и амплификации плазмиды, процессе, необходимом для размножения и продукции рекомбинантного вируса, но сам не упаковывается или не капсидируется в вирусной (например, AAV) частице.
[0087] Таким образом, векторный "геном" представляет собой фрагмент векторной плазмиды, заключенный или капсидированный в вирус (например, AAV) и содержащий гетерологичную полинуклеотидную последовательность. Не являющийся векторным геномом фрагмент рекомбинантной плазмиды включает в себя скелет, который играет важную роль в клонировании и амплификации плазмиды, но сам не упаковывается или не капсидируется в вирусе (например, AAV).
[0088] Вирусный вектор получают из одного или нескольких нуклеотидных элементов, или в основе вирусного вектора лежат один или несколько нуклеотидных элементов, которые составляют вирусный геном. Конкретные вирусные векторы включают в себя парвовирусные векторы, такие как векторы на основе аденоассоциированного вируса (AAV).
[0089] Рекомбинантные векторные последовательности изменяют путем вставки или включения полинуклеотида. Как указано в данном описании, векторная плазмида обычно содержит, по меньшей мере, один участок начала репликации, обеспечивающий размножение в клетке, и один или несколько элементов, контролирующих экспрессию.
[0090] Векторные последовательности, включающие в себя векторы AAV, могут содержать один или несколько "элементов, контролирующих экспрессию". Как правило, элементы, контролирующие экспрессию, представляют собой нуклеотидные последовательности, которые оказывают влияние на экспрессию функционально связанного с ними полинуклеотида. Регулирующие элементы, включающие в себя элементы, контролирующие экспрессию, описанные в настоящем документе, такие как промоторы и энхансеры, вводят в состав вектора, чтобы обеспечить надлежащую транскрипцию и, при необходимости, трансляцию гетерологичного полинуклеотида (например, промотор, энхансер, сигналы сплайсинга, способствующие сохранению интронов, поддержанию правильной рамки считывания гена, чтобы обеспечить трансляцию мРНК в рамке считывания, стоп-кодоны и т.п.). Такие элементы, как правило, действуют в цис-положении, но могут также действовать и в транс-положении.
[0091] Регуляция экспрессии может осуществляться на уровне транскрипции, трансляции, сплайсинга, стабильности транскрипта и т.д. Как правило, контролирующий экспрессию элемент, который модулирует транскрипцию, располагается рядом с 5'-концом транскрибируемого полинуклеотида (т.е. "выше по ходу считывания"). Элементы, контролирующие экспрессию, также могут располагаться на 3'-конце транскрибируемой последовательности (т.е. "ниже по ходу считывания") или транскрипта (например, в интроне). Элементы, контролирующие экспрессию, могут располагаться на некотором расстоянии от транскрибируемой последовательности (например, на расстоянии от полинуклеотида, составляющем от 100 до 500, от 500 до 1000, от 2000 до 5000, от 5000 до 10000 или более нуклеотидов), даже на значительном расстоянии. Однако, вследствие ограничений, связанных с длиной полинуклеотида, в AAV векторах такие элементы, контролирующие экспрессию, обычно располагаются на расстоянии от 1 до 1000 нуклеотидов от полинуклеотида.
[0092] В функциональном отношении экспрессия функционально связанного гетерологичного полинуклеотида, по меньшей мере, отчасти регулируется элементом (таким как промотор), модулирующим транскрипцию полинуклеотида и, в зависимости от ситуации, трансляцию транскрипта. Конкретным примером элемента, контролирующего экспрессию, является промотор, который обычно располагается на 5'-конце транскрибируемой последовательности. Другим примером элемента, контролирующего экспрессию, является энхансер, который может располагаться на 5'-конце, 3'-конце, или внутри транскрибируемой последовательности.
[0093] Используемый здесь термин "промотор" может относиться к последовательности ДНК, которая располагается рядом с полинуклеотидной последовательностью, кодирующей рекомбинантный продукт. Промотор обычно функционально связан с прилегающей последовательностью, такой как гетерологичный полинуклеотид. Как правило, промотор увеличивает количество экспрессируемого продукта гетерологичного полинуклеотида по сравнению к количеством продукта, экспрессируемого в отсутствии промотора.
[0094] Используемый здесь термин "энхансер" может относиться к последовательности, которая располагается рядом с гетерологичным полинуклеотидом. Энхансерные элементы обычно располагаются выше элемента промотора, но также могут функционировать, располагаясь ниже последовательности ДНК (например, гетерологичного полинуклеотида), или внутри нее. Следовательно, энхансерный элемент может располагаться на 100 пар оснований, 200 пар оснований, 300 или более пар оснований выше или ниже гетерологичного полинуклеотида. Энхансерные элементы обычно увеличивают экспрессию гетерологичного полинуклеотида по сравнению с экспрессией, обеспечиваемой промотором.
[0095] Элементы, контролирующие экспрессию (например, промоторы), включают в себя элементы, активные в определенной ткани, или в клетках определенного типа, которые называют здесь "тканеспецифичные элементы, контролирующие экспрессию/промоторы". Тканеспецифичные элементы, контролирующие экспрессию, как правило, проявляют активность в определенной клетке или ткани (такой как печень, мозг, центральная нервная система, спинной мозг, глаза, сетчатки, кости, мышцы, легкие, поджелудочная железа, сердце, клетки почек и т.д.). Элементы, контролирующие экспрессию, как правило, активны в этих клетках, тканях или органах, потому что они распознаются белками-активаторами транскрипции, или другими регуляторами транскрипции, которые являются уникальными для конкретного типа клетки, ткани или органа.
[0096] Например, если желательно провести экспрессию в скелетной мышце, можно использовать промотор, активный в мышце. Такие промоторы включают в себя промоторы генов, кодирующих скелетный α-актин, легкую цепь миозина 2А, дистрофин, мышечную креатинкиназу, а также синтетические мышечные промоторы, активность которых превышает активность природных промоторов (см, например, Li, et al., Nat. Biotech. 17:241-245 (1999)). Примеры промоторов, специфических для печени, в числе прочих включают в себя промотор альбумина, Miyatake, et al. J. Virol., 71:5124-32 (1997); промотор кора вируса гепатита B, Sandig, et al., Gene Ther. 3:1002-9 (1996); промотор альфа-фетопротеина (AFP), Arbuthnot, et al., Hum. Gene. Ther., 7:1503-14 (1996), костный промотор (остеокальцин, Stein, et al., Mol. Biol. Rep., 24:185-96 (1997); промотор костного сиалопротеина, Chen, et al., J. Bone Miner. Res. 11 :654-64 (1996)), лимфоцитарный промотор (CD2, Hansal, et al., J. Immunol., 161:1063-8 (1998); промотор тяжелой цепи иммуноглобулина; промотор a-цепи Т-клеточного рецептора), нейронный промотор (промотор нейрон-специфичной энолазы (NSE), Andersen, et al., Cell. Mol. Neurobiol., 13:503-15 (1993); промотор гена легкой цепи нейрофиламента, Piccioli, et al., Proc. Natl. Acad. Sci. USA, 88:5611-5 (1991); промотор нейрон-специфического гена vgf, Piccioli, et al., Neuron, 15:373-84 (1995).
[0097] Элементы, контролирующие экспрессию, также включают в себя повсеместно распространенные или неизбирательные промоторы/энхансеры, которые способны стимулировать экспрессию полинуклеотида в клетках разных типов. Такие элементы включают в себя, без ограничения, предранние промоторы/энхансеры цитомегаловируса (CMV), промоторные/энхансерные последовательности вируса саркомы Рауса (RSV) и другие вирусные промоторы/энхансеры, способные проявлять активность в разных типах клеток млекопитающих, или синтетические элементы, которые отсутствуют в природе (см, например, Boshart et al, Cell, 41:521-530 (1985)), промотор SV40, промотор дигидрофолатредуктазы, промотор цитоплазматического β-актина и промотор фосфоглицеринкиназы (PGK).
[0098] Элементы, контролирующие экспрессию, также могут обеспечивать экспрессию в регулируемой манере, то есть, они могут обеспечивать экспрессию функционально связанного гетерологичного полинуклеотида, которая может увеличиваться или уменьшаться под действием сигналов или стимулов. Контролирующий элемент, который увеличивает экспрессию функционально связанного полинуклеотида в ответ на сигнал или стимул, также называют "индуцибельной элемент" (т.е., индуцируемый под действием сигнала). Конкретные примеры включают в себя, без ограничения, гормон- (например, стероид-) индуцируемый промотор. Контролирующий элемент, который уменьшает экспрессию функционально связанного полинуклеотида в ответ на сигнал или стимул, называют "репрессируемый элемент" (т.е. сигнал уменьшает экспрессию и после удаления сигнала, или в отсутствии сигнала экспрессия увеличивается). Как правило, степень увеличения или уменьшения, обеспечиваемого такими элементами, пропорциональна количеству присутствующего сигнала или стимула; чем больше количество сигнала или стимула, тем больше увеличение или уменьшение экспрессии. Конкретные неограничивающие примеры включают в себя цинк-индуцируемый промотор овечьего металлотионеина (МТ); стероидный гормон-индуцируемый промотор вируса опухоли молочной железы мышей (MMTV); система промоторов полимеразы Т7 (WO 98/10088); тетрациклин-репрессируемая система (Gossen, et al., Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)); тетрациклин-индуцируемая система (Gossen, et al., Science. 268:1766-1769 (1995); см. также Harvey, et al., Curr. Opin. Chem. Biol. 2:512-518 (1998)); RU486-индуцируемая система (Wang, et al., Nat. Biotech. 15:239-243 (1997) и Wang, et al., Gene Ther. 4:432-441 (1997)); и рапамицин-индуцируемая система (Magari, et al., J. Clin. Invest. 100:2865-2872 (1997); Rivera, et al., Nat. Medicine. 2:1028-1032 (1996)). Другие регулируемые контролирующие элементы, которые можно использовать в данном контексте, включают в себя элементы, регулируемые конкертным физиологическим состоянием, например, температурой, острой фазой.
[0099] Элементы, контролирующие экспрессию, также включают в себя нативные по отношению к гетерологичному полинуклеотиду элементы. Нативный контролирующий элемент (например, промотор) можно использовать в тех случаях, когда желательно, чтобы экспрессия гетерологичного полинуклеотида имитировала природную экспрессию. Нативный элемент можно использовать в тех случаях, когда экспрессия гетерологичного полинуклеотида подлежит временной или зависящей от стадии развития регуляции, или тканеспецифичной регуляции, или регуляции в ответ на конкретные стимулы транскрипции. Также можно использовать другие нативные элементы, контролирующие экспрессию, такие как интроны, участки полиаденилирования, или консенсусные последовательности Козака.
[0100] В данном описании термин "функциональная связь", или "функционально связанный" относится к расположению компонентов, обеспечивающему физический или функциональный контакт, как описано, позволяющий им функционировать нужным образом. В примере элемента, контролирующего экспрессию, находящегося в функциональной связи с полинуклеотидом, их взаимосвязь заключается в том, что контролирующий элемент модулирует экспрессию нуклеиновой кислоты. Более конкретно, например, две последовательности ДНК являются функционально связанными, если две ДНК расположены (цис- или транс-) таким образом, что, по меньшей мере, одна из последовательностей ДНК способна оказывать физиологическое воздействие на другую последовательность.
[0101] Векторы, включающие в себя векторы AAV, могут также содержать дополнительные нуклеотидные элементы. Такие элементы включают в себя, без ограничения, одну или несколько копий последовательности ITR AAV, промоторный/энхансерный элемент, сигнал терминации транскрипции, 5'- или 3'-нетранслируемые участки (например, последовательности полиаденилирования), которые фланкируют всю последовательность полинуклеотида, или ее часть, включающую в себя интрон I. Такие элементы также необязательно включают в себя сигнал терминации транскрипции. Конкретным неограничивающим примером сигнала терминации транскрипции является сигнал терминации транскрипции SV40.
[0102] Как описано в данном документе, размер вставок ДНК в векторах AAV, как правило, варьирует в определенном диапазоне, который обычно составляет примерно от 4 т.о. до 5,2 т.о., или чуть больше. Следовательно, в случае более коротких последовательностей, во фрагмент вставки включают спейсерную последовательность, или последовательность-наполнитель, чтобы довести длину вставки до значения, близкого или равного обычному размеру геномной последовательности вируса, приемлемого для вектора AAV, упаковывающегося в вирусную частицу. В разных вариантах осуществления нуклеотидная последовательность-наполнитель/спейсерная последовательность представляет собой нетранслируемый (не кодирующий белок) сегмент нуклеиновой кислоты. В конкретных вариантах осуществления вектора AAV длина гетерологичной полинуклеотидной последовательности составляет менее 4,7 т.о., а нуклеотидная последовательность-наполнитель/спейсерная последовательность имеет длину, которая после объединения (например, путем вставки в вектор) указанной последовательности с гетерологичной полинуклеотидной последовательностью составляет общую длину в диапазоне примерно 3,0-5,5 т.о., или примерно 4,0-5,0 т.о., или примерно 4,3-4,8 т.о.
[0103] Чтобы достичь длины вектора AAV, подходящей для упаковки в вирусную частицу, в качестве полинуклеотидной последовательности-наполнителя или спейсерной последовательности также можно использовать интрон. Интроны и фрагменты интронов (например, фрагмент интрона I из FIX), функционирующие в качестве полинуклеотидной последовательности-наполнителя или спейсерной последовательности, могут также усиливать экспрессию. Например, включение интронного элемента может усилить экспрессию по сравнению с экспрессией, наблюдающейся в отсутствии интронного элемента (Kurachi et al., 1995, выше).
[0104] Применение интронов не ограничивается вставкой последовательности интрона I FIX, но также включает в себя применение других интронов, которые могут быть связаны с тем же геном (например, если гетерологичный полинуклеотид кодирует FIX, интрон может быть получен из интрона, присутствующего в геномной последовательности FIX), или с совершенно другим геном, или другой последовательностью ДНК. Соответственно, в настоящем изобретении в качестве полинуклеотидной последовательности-наполнителя или спейсерной последовательности можно использовать другие нетранслируемые (не кодирующие белок) участки нуклеиновой кислоты, такие как интроны, присутствующие в геномных последовательностей сходных (родственных) генов (гетерологичная полинуклеотидная последовательность кодирует весь белок, кодируемый геномной последовательностью, или его часть) и не сходных (не родственных) генов (гетерологичная полинуклеотидная последовательность кодирует белок, отличающийся от белка, кодируемого геномной последовательностью).
[0105] В данном описании выражение "фрагмент интрона I" используют в применении к участку интрона I, имеющему длину примерно от 0,1 т.о. до 1,7 т.о., который усиливает экспрессию FIX, как правило, примерно в 1,5 раза или более на матрице из плазмидного или вирусного вектора по сравнению с экспрессией FIX в отсутствии участка интрона I. Более конкретный участок представляет собой участок интрона I размером 1,3 т.о.
[0106] В данном описании термин "олигонуклеотид" относится к последовательностям, праймерам и зондам, определенным как молекулы нуклеиновых кислот, и состоящим из двух или более, как правило, более, чем из трех рибо- или дезоксирибонуклеотидов. Точный размер олигонуклеотида зависит от разных факторов и от конкретного применения и использования олигонуклеотида, но обычно олигонуклеотид имеет длину, составляющую примерно от 5 до 50 нуклеотидов.
[0107] В данном описании термин "праймер" относится к ДНК-олигонуклеотиду, одноцепочечному или двухцепочечному, полученному либо из биологической системы, где он образуется в результате расщепления под действием рестриктазы, или путем синтеза, где указанный олигонуклеотид, при помещении его в соответствующую окружающую среду, способен функционировать в качестве инициатора матрицезависимого синтеза нуклеиновых кислот. Если праймер находится в смеси с соответствующими нуклеотидной матрицей, нуклеозидтрифосфатными предшественниками нуклеиновых кислот, полимеразой, кофакторами, и в соответствующих условиях, таких как подходящая температура и рН, он может удлиняться по 3'-концу в результате добавления нуклеотидов под действием полимеразы или подобной активности, с получением продукта удлинения праймера. Длина праймера может варьировать в зависимости от конкретных условий и требований конкретного применения. Например, в диагностических способах применения обычно используют олигонуклеотидные праймеры длиной 15-30 или более нуклеотидов. Праймер должен иметь достаточную степень комплементарности в отношении к используемой матрице, чтобы инициировать синтез целевого продукта удлинения, то есть, чтобы при отжиге с цепью используемой матрицы в подходящих условиях 3'-гидроксильный остаток праймера приходил в непосредственное сближение, обеспечивая инициацию синтеза под действием полимеразы или подобного фермента. Однако последовательность праймера не обязательно должна быть в точности комплементарна используемой матрице. Например, некомплементарная нуклеотидная последовательность может быть присоединена к 5'-концу в остальном комплементарного праймера. Альтернативно некомплементарные основания могут быть рассеяны по последовательности олигонуклеотидного праймера, при условии, что последовательность праймера обладает достаточной степенью комплементарности с последовательностью цепи используемой матрицы, чтобы обеспечить образование комплекса матрица-праймер для синтеза продукта удлинения.
[0108] Полимеразная цепная реакция (ПЦР) описана в патентах США №№ 4683195, 4800195 и 4965188.
[0109] Фраза "специфически гибридизоваться" относится к ассоциации двух одноцепочечных молекул нуклеиновых кислот с достаточно комплементарной последовательностью, чтобы обеспечить гибридизацию в заданных условиях, обычно используемых в данной области техники (иногда такую последовательность называют "по существу комплементарной"). В частности, данный термин относится к гибридизации двух полинуклеотидных последовательностей, обладающих значительной степенью комплементарности, при отсутствии по существу гибридизации с другими одноцепочечными некомплементарными нуклеотидными последовательностями.
[0110] Термин "селектируемый маркерный ген" относится к гену, который при экспрессии придает трансформированной клетке селектируемый фенотип, такой как устойчивость к антибиотикам (например, к канамицину). "Репортерный" ген представляет собой ген, который обеспечивает детектируемый сигнал. Не ограничивающим примером репортерного гена является ген люциферазы.
[0111] Полинуклеотиды и полипептиды, включающие в себя модифицированные формы, можно получить с использованием разных стандартных методов клонирования, технологии рекомбинантных ДНК, посредством экспрессии в клетках или трансляции in vitro, а также путем химического синтеза. Чистоту полинуклеотидов можно определить путем секвенирования, гель-электрофореза и т.п. Например, нуклеиновые кислоты можно выделить с использованием методов гибридизации или компьютерного скрининга базы данных. Такие методы включают в себя, без ограничения: (1) гибридизацию геномной ДНК или библиотек кДНК с зондами для обнаружения гомологичных нуклеотидных последовательностей; (2) скрининг антител для обнаружения полипептидов, имеющих общие структурные признаки, например, с использованием экспрессионной библиотеки; (3) полимеразная цепная реакция (ПЦР) на геномной ДНК или кДНК с использованием праймеров, способных к отжигу с представляющей интерес нуклеотидной последовательностью; (4) компьютерный поиск родственных последовательностей в базах данных; и (5) дифференциальный скрининг библиотек с вычитанием нуклеиновых кислот.
[0112] Полинуклеотиды и полипептиды, включающие в себя модифицированные формы, также можно получить путем химического синтеза с помощью методов, известных специалистам в данной области, таких как автоматизированный синтез на специальном приборе (см., например, Applied Biosystems, Foster City, CA). Пептиды можно синтезировать, полностью или частично, с использованием химических методов (см, например, Caruthers (1980). Nucleic Acids Res. Symp. Ser. 215; Horn (1980); и Banga, A.K., Therapeutic Peptides and Proteins, Formulation, Processing and Delivery Systems (1995) Technomic Publishing Co., Lancaster, PA). Пептидный синтез можно проводить с использованием разных методов твердофазного синтеза (см., например, Roberge Science 269:202 (1995); Merrifield, Methods Enzymol. 289:3(1997)), а автоматизированный синтез можно проводить, например, с помощью пептидного синтезатора ABI 431 (Perkin Elmer) в соответствии с инструкциями изготовителя.
[0113] Термин "выделенный" при использовании в качестве определения композиции означает, что композиция получена искусственным путем, или отделена, полностью или, по меньшей мере, частично, от ее естественной среды, в которой она находится in vivo. Как правило, выделенные композиции практически не содержат одно или несколько веществ, с которыми они обычно находятся в природе, например, одно или несколько веществ из белков, нуклеиновых кислот, липидов, углеводов, клеточных мембран. Термин "выделенный" не исключает комбинаций, полученных искусственным путем, таких как последовательность рекомбинантного вектора (например, AAV) или вирусная частица (например, вектор AAV-Rh74 или родственный вектор AAV, такой как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1)), которая заключает в себе или капсидирует векторный геном и фармацевтический препарат. Термин "выделенный" также не исключает альтернативные физические формы композиции, такие как гибриды/химеры, мультимеры/олигомеры, формы, полученные в результате модификации (такой как фосфорилирование, гликозилирование, липидирование) или дериватизации, или формы, экспрессированные в клетках-хозяевах, полученных искусственным путем.
[0114] Способы и варианты применения изобретения предоставляют средства доставки (трансдукции) гетерологичных полинуклеотидов (трансгенов) в широкий диапазон клеток-хозяев, включающих в себя как делящиеся, так и неделящиеся клетки. Последовательности рекомбинантных векторов (например, AAV), плазмиды, векторные геномы, рекомбинантные вирусные частицы (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), способы, варианты применения и фармацевтические композиции настоящего изобретения можно дополнительно использовать в способе введения белка, пептида или нуклеиновой кислоты индивидууму, нуждающемуся в этом, как в методе лечения. Следовательно, белок, пептид или нуклеиновая кислота могут продуцироваться in vivo в организме индивидуума. У индивидуума может наблюдаться улучшение в результате введения, или индивидуум может нуждаться во введении белка, пептида или нуклеиновой кислоты, поскольку индивидуум имеет дефицит белка, пептида или нуклеиновой кислоты, или поскольку продукция белка, пептида или нуклеиновой кислоты в организме индивидуума может обеспечивать некоторый терапевтический эффект, как метод лечения или иным образом. Альтернативно можно ингибировать или уменьшать экспрессию или продукцию целевого гена, участвующего в развитии болезни, например, с целью лечения нейродегенеративного заболевания, рака или атеросклероза, например, с достижением терапевтического эффекта.
[0115] Как правило, последовательности рекомбинантных векторов (например, AAV), плазмиды, векторные геномы, рекомбинантные вирусные частицы (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), способы и варианты применения можно использовать для доставки любого гетерологичного полинуклеотида (трансгена), сопровождающейся биологическим эффектом, с целью лечения или облегчения одного или нескольких симптомов любого расстройства, связанного с недостаточной или нежелательной экспрессией гена. Последовательности рекомбинантных векторов (например, AAV), плазмиды, векторные геномы, рекомбинантные вирусные частицы (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), способы, варианты применения можно использовать для лечения разных болезненных состояний.
[0116] Существует целый ряд наследственных заболеваний, для которых определены и клонированы вызывающие их дефектные гены. Как правило, вышеуказанные болезненные состояния делят на два класса: дефицитные состояния, обычно по ферментам, которые зачастую наследуются рецессивным способом, и несбалансированные состояния, в которых участвуют, по меньшей мере, иногда регуляторные или структурные белки, которые наследуются по доминантному типу. При дефицитных состояниях перенос генов можно использовать для введения нормального гена в пораженную ткань с целью заместительной терапии, а также для создания животных моделей заболеваний с использованием антисмысловых мутаций. В случае несбалансированных состояний перенос генов можно использовать для создания болезненного состояния в модельной системе, которую затем можно использовать в попытках противодействия болезненному состоянию. Таким образом, последовательности рекомбинантных векторов (например, AAV), плазмиды, векторные геномы, рекомбинантные вирусные частицы (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), способы и варианты применения можно использовать для лечения генетических заболеваний. В соответствии с данным документом, болезненное состояние лечат путем частичного или полного устранения дефекта или дисбаланса, который вызывает заболевание или делает его более тяжелым. Также можно использовать сайт-специфическую интеграцию нуклеотидных последовательностей, позволяющую индуцировать мутации или исправлять дефекты.
[0117] Примеры болезненных состояний включают в себя, без ограничения: муковисцидоз (и другие заболевания легких), гемофилию А, гемофилию В, талассемию, анемию и другие расстройства свертывания крови, СПИД, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, эпилепсию и другие неврологические расстройства, рак, сахарный диабет, мышечную дистрофию (например, Дюшенна, Беккера), болезнь Гоше, болезнь Херлера, аденозиндезаминазную недостаточность, болезни накопления гликогена и другие метаболические дефекты, болезнь Помпе, застойную сердечную недостаточность, дегенеративные заболевания сетчатки (хороидермия, амавроз Лебера и другие заболевания глаз), заболевания солидных органов (таких как мозг, печень, почки, сердце) и т.п.
[0118] Настоящее изобретение предлагает способы лечения и варианты применения, в которых используют рекомбинантные векторы настоящего изобретения (например, AAV), векторные геномы, рекомбинантные вирусные частицы (например, векторы AAV-Rh74 или родственные векторы AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), и вирусные частицы настоящего изобретения (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), в том числе векторные геномы. Способы и варианты применения настоящего изобретения могут широко применяться для лечения заболеваний, поддающихся лечению путем введения гена, кодирующего белок, или путем увеличения или стимуляции экспрессии или функции гена, например, путем добавления или замены гена. Способы и варианты применения настоящего изобретения также могут широко применяться для лечения заболеваний, поддающихся лечению путем снижения или уменьшения экспрессии или функции гена, например, путем нокаута гена или снижения экспрессии гена (нокдауна гена).
[0119] Неограничивающие конкретные примеры заболеваний, поддающихся лечению с помощью способов настоящего изобретения, включают в себя описанные здесь заболевания, а также болезнь легких (например, кистозный фиброз), нарушение свертываемости крови или нарушение, сопровождающееся повышенной кровоточивостью (например, гемофилию А или гемофилию B в присутствии или в отсутствии ингибиторов), талассемию, заболевание крови (например, анемию), болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз (ALS), эпилепсию, лизосомальные болезни накопления, расстройства накопления меди или железа (например, болезнь Вильсона или болезнь Менкеса), недостаточность кислой лизосомной липазы, неврологическое или нейродегенеративное расстройство, рак, диабет типа 1 или типа 2, болезнь Гоше, болезнь Херлера, аденозиндезаминазную недостаточность, метаболический дефект (например, болезни накопления гликогена), дегенеративные заболевания сетчатки (такие как дефицит или дефект RPE65, хороидермия и другие заболевания глаз) и заболевания солидных органов (таких как мозг, печень, почки, сердце).
[0120] Кроме того, рекомбинантные векторы настоящего изобретения (например, AAV), векторные геномы, рекомбинантные вирусные частицы (например, векторы AAV-Rh74 или родственные векторы AAV, такие как варианты AAV-Rh74, способы и варианты применения можно использовать для доставки нуклеиновых кислот, кодирующих моноклональные антитела или их фрагменты, чтобы достичь полезных биологических эффектов, обуславливающих лечение или ослабление симптомов рака, инфекционных заболеваний, а также аутоиммунных заболеваний, таких как ревматоидный артрит.
[0121] В одном варианте осуществления способ или вариант применения настоящего изобретения включает в себя: (а) получение вирусной частицы (например, AAV-Rh74 или родственного AAV, такого как капсидный вариант AAV-Rh74 (например, RHM4-1)), содержащей векторный геном, который, в свою очередь, содержит гетерологичную полинуклеотидную последовательность (и, необязательно, последовательность-наполнитель/спейсерную полинуклеотидную последовательность), где гетерологичная полинуклеотидная последовательность функционально связана с элементом, контролирующим экспрессию, обеспечивающим транскрипцию указанной полинуклеотидной последовательности; и (b) введение млекопитающему такого количества вирусной частицы, которое обеспечивает экспрессию гетерологичного полинуклеотида в организме млекопитающего.
[0122] В другом варианте осуществления способ или вариант применения настоящего изобретения включает в себя доставку или перенос гетерологичной полинуклеотидной последовательности в организм млекопитающего, или в клетку млекопитающего, путем введения вирусной (например, AAV) частицы (например, AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1)), или совокупности вирусных (например, AAV) частиц (например, AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1)), содержащих векторный геном, который, в свою очередь, содержит гетерологичную полинуклеотидную последовательность (и, необязательно, последовательность-наполнитель/спейсерную полинуклеотидную последовательность) в организм млекопитающего, или в клетку млекопитающего, тем самым обеспечивая доставку или перенос гетерологичной полинуклеотидной последовательности в организм млекопитающего, или в клетку млекопитающего.
[0123] В другом варианте осуществления способ или вариант применения настоящего изобретения для лечения млекопитающего с дефицитом экспрессии или функции белка, или нуждающегося в экспрессии или функции белка, включает в себя получение вирусной (например, AAV) частицы (например, AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)), или совокупности вирусных (например, AAV) частиц (например, AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)), содержащих векторный геном, который, в свою очередь, содержит гетерологичную полинуклеотидную последовательность (и, необязательно, последовательность-наполнитель/спейсерную полинуклеотидную последовательность); и введение вирусной частицы или совокупности вирусных частиц млекопитающему, где гетерологичная полинуклеотидная последовательность кодирует белок, экспрессирующийся в организме млекопитающего, или где гетерологичная полинуклеотидная последовательность кодирует ингибиторную последовательность или белок, который уменьшает экспрессию эндогенного белка в организме млекопитающего.
[0124] В конкретных аспектах описанных здесь способов и вариантов применения настоящего изобретения экспрессируемый гетерологичный полинуклеотид кодирует белок или ингибиторную нуклеиновую кислоту, которые обеспечивают терапевтический эффект у млекопитающего (например, человека). В других конкретных аспектах в последовательность вектора встраивают последовательность-наполнитель/спейсерную полинуклеотидную последовательность таким образом, чтобы суммарная длина указанной последовательности и гетерологичной полинуклеотидной последовательности находилась в диапазоне примерно 3,0-5,5 т.о., или примерно 4,0-5,0 т.о., или примерно 4,3-4,8 т.о.
[0125] Способы и варианты применения настоящего изобретения включают в себя способы лечения, которые вызывают любой терапевтический или лечебный эффект. Разные способы или варианты применения настоящего изобретения также включают в себя ингибирование, уменьшение или облегчение одного или нескольких из неблагоприятных (например, физических) симптомов, расстройств, болезней, заболеваний, или осложнений, вызванных или связанных с таким заболеванием, как снижение времени свертывания крови, уменьшение вводимой дозы дополнительного белка фактора свертывания.
[0126] Следовательно, терапевтический или благоприятный эффект лечения включает в себя любое объективное или субъективное измеряемое или детектируемое улучшение или благоприятное воздействие на конкретного индивидуума. Терапевтический или благоприятный эффект может включать в себя, но не обязательно, полное устранение всех или какого-либо одного из конкретного неблагоприятного симптома, расстройства, болезни или осложнения болезни. Таким образом, удовлетворительный клинический результат достигается, если в течение короткого или длительного срока (часы, дни, недели, месяцы и т.д.) появляется постепенное улучшение, или частичное уменьшение неблагоприятного симптома, расстройства, болезни, или осложнения, вызванного или связанного с заболеванием, или ингибирование, снижение, уменьшение, подавление, предотвращение, ограничение или контролирование ухудшения или прогрессирования одного или нескольких из неблагоприятных симптомов, расстройств, болезней, или осложнений, вызванных или связанных с заболеванием.
[0127] Композиции, такие как векторные геномы, рекомбинантные вирусные частицы (например, векторы AAV-Rh74, или родственные векторы AAV, таких как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), содержащие векторные геномы, в соответствии со способами и вариантами применения настоящего изобретения, можно вводить в достаточном или эффективном количестве индивидууму, нуждающемуся в таком введении. Термин "эффективное количество" или "достаточное количество" относится к количеству, которое обеспечивает, в одной или нескольких дозах, отдельно или в сочетании с одним или несколькими другими композициями (терапевтическими средствами, такими как лекарственные препараты), процедурами, протоколами или терапевтическими режимами, детектируемый ответ в течение любого периода времени (длительного или короткого), ожидаемый или желаемый результат или улучшение у индивидуума любой измеряемой или детектируемой степени, или в течение любого периода времени (например, в течение минут, часов, дней, месяцев, лет, или излечение).
[0128] Доза векторного генома или вирусной частицы (например, AAV, такого как вектор AAV-Rh74, или родственный вектор AAV, такой как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), необходимая для достижения терапевтического эффекта, например, доза векторных геномов/на килограмм массы тела (вг/кг), может варьировать в зависимости от нескольких факторов, включающих в себя, без ограничения: способ введения, уровень экспрессии гетерологичного полинуклеотида, необходимый для достижения терапевтического эффекта, конкретное заболевание, подлежащее лечению, любой иммунный ответ хозяина на вирусный вектор, иммунный ответ хозяина на гетерологичный полинуклеотид или продукт экспрессии (белок), и стабильность экспрессируемого белка. Специалист в данной области техники может легко определить диапазон дозы вириона, подходящий для лечения пациента, имеющего конкретное заболевание или расстройство, с учетом вышеуказанных, а также других факторов. Как правило, доза, необходимая для достижения терапевтического эффекта, составляет, по меньшей мере, 1×108 или более, например, 1×109, 1×1010, 1×1011, 1×1012, 1×1013 или 1×1014 или более векторных геномов на килограмм массы тела индивидуума (вг/кг).
[0129] Например, в случае гемофилии считается, что для достижения терапевтического эффекта нужна концентрация фактора свертывания крови, превышающая 1% от концентрации фактора, присутствующей у нормального индивидуума, которая позволяет изменить тяжелый фенотип заболевания на умеренный. Тяжелый фенотип характеризуется повреждением суставов и угрожающими жизни кровотечениями. Чтобы изменить умеренный фенотип заболевания на легкий, предположительно требуется концентрация фактора свертывания крови, превышающая 5% от нормальной. При лечении индивидуума, страдающего от гемофилии, типичная доза, необходимая для достижения желаемого терапевтического эффекта, составляет, по меньшей мере, 1×1010 векторных геномов (вг) на килограмм (вг/кг) массы тела индивидуума, или примерно от 1×1010 до 1×1011 вг/кг массы тела индивидуума, или примерно от 1×1011 до 1×1012 вг/кг массы тела индивидуума, или примерно от 1×1012 до 1×1013 вг/кг массы тела индивидуума.
[0130] Дозы, составляющие "эффективное количество" или "достаточное количество" для лечения (например, для облегчения состояния или обеспечения терапевтического эффекта или улучшения), как правило, являются эффективными, обеспечивая измеряемый ответ в отношении одного, нескольких или всех неблагоприятных симптомов, последствий или осложнений болезни, одного или нескольких из побочных симптомов, расстройств, заболеваний, патологий или осложнений, например, вызванных или связанных с заболеванием, хотя уменьшение, снижение, ингибирование, подавление, ограничение или контролирование прогрессирования или ухудшения болезни также является удовлетворительным результатом.
[0131] Эффективное количество или достаточное количество можно, но не обязательно, вводить однократно, его можно вводить многократно, и можно, но не обязательно, вводить отдельно или в сочетании с другой композицией (например, средством), другим способом лечения, протоколом или терапевтическим режимом. Например, количество можно пропорционально увеличить, если этого требует состояние пациента, тип, статус и тяжесть заболевания, подлежащего лечению, или побочные эффекты (если таковые присутствуют) лечения. Кроме того, эффективное количество или достаточное количество не обязательно должно являться эффективным или достаточным, если его вводят в одной или нескольких дозах в отсутствии второй композиции (например, другого лекарственного препарата или средства), второго способа лечения, протокола или терапевтического режима, поскольку дополнительные дозы, количества или периоды продолжительности введения сверх и помимо таких доз, или дополнительные композиции (например, лекарственные препараты или средства), способы лечения, протоколы или терапевтические режимы, можно использовать для достижения эффективности или достаточности у конкретного индивидуума. Количества, считающиеся эффективными, также включают в себя количества, которые приводят к уменьшению использования другого способа лечения, терапевтического режима или протокола, такого как введение рекомбинантного белка фактора свертываемости крови для лечения расстройства свертывания (например, при гемофилии А или В).
[0132] Эффективное количество или достаточное количество не должно быть эффективным для каждого и отдельного индивидуума, подвергающегося лечению, а также для большинства индивидуумов из конкретной группы или популяции, подвергающихся лечению. Эффективное количество или достаточное количество означает эффективность или достаточность для конкретного индивидуума, но не для группы или популяции в целом. Как это обычно бывает при примении таких способов, у некоторых индивидуумов наблюдается более интенсивный, или менее интенсивный ответ, или отсутствие ответа на конкертный способ лечения или вариант применения. Таким образом, соответствующее количество будет зависеть от состояния, подлежащего лечению, желаемого терапевтического эффекта, а также особенностей конкретного индивидуума (например, биодоступность в организме индивидуума, пола, возраста индивидуума и т.д.).
[0133] Термин "облегчение" относится к детектируемому или измеримому улучшению заболевания или симптома индивидуума; или лежащего в его основе клеточного ответа. Детектируемое или измеримое улучшение включает в себя субъективное или объективное уменьшение, снижение, ингибирование, подавление, ограничение или контролирование возникновения, частоты встречаемости, тяжести, развития или длительности заболевания, или осложнения, вызванного или связанного с заболеванием, или улучшение симптома или лежащей в его основе причины, или последствия болезни, или обратный ход развития заболевания.
[0134] Таким образом, успешный результат лечения может включать в себя "терапевтический эффект" или "улучшение", заключающиеся в уменьшении, снижении, ингибировании, подавлении, ограничении, контролировании или предотвращении появления, частоты встречаемости, тяжести, развития или продолжительности болезни, или одного или нескольких неблагоприятных симптомов или причин, лежащих в их основе, или последствий заболевания у индивидуума. Таким образом, считается, что способы лечения и варианты применения, влияющие на одну или несколько причин, лежащих в основе заболевания или неблагоприятных симптомов, оказывают полезное действие. Уменьшение или ослабление ухудшения, такое как стабилизация заболевания или его неблагоприятного симптома, также является успешным результатом лечения.
[0135] Следовательно, терапевтический эффект или улучшение не обязательно означает полное устранение заболевания, или одного, большинства или всех неблагоприятных симптомов, осложнений, последствий или причин данного заболевания. Таким образом, удовлетворительный результат достигается, если наблюдается постепенное улучшение болезни индивидуума, или частичное уменьшение, снижение, ингибирование, подавление, ограничение, контролирование или предотвращение пояления, частоты встречаемости, тяжести, прогрессирования или длительности, или ингибирование или обратный ход развития заболевания (например, стабилизация одного или нескольких симптомов или осложнений), в течение короткого или длительного периода времени (часы, дни, недели, месяцы и т.д.). Эффективность способа или варианта применения, такого как лечение, которое обеспечивает потенциальный терапевтический эффект или улучшение состояния болезни, можно определить с помощью разных методов.
[0136] Способы и варианты применения настоящего изобретения можно сочетать с применением любого соединения, средства, лекарства, способа лечения или другого терапевтического режима или протокола, которые оказывают желаемое терапевтическое, благоприятное, аддитивное, синергическое или взаимодеополняющее действие. Примеры используемых в сочетании композиций и способов лечения включают в себя другие активные средства, такие как биологические препараты (белки), средства и лекарства. Такие биологические препараты (белки), средства и лекарства, процедуры и способы лечения можно вводить или проводить до, по существу одновременно или после любого другого способа или варианта применения настоящего изобретения, такого как терапевтический способ лечения нарушения свертываемости крови у индивидуума.
[0137] Соединение, средство, лекарство или другой терапевтический режим или протокол можно вводить в виде сочетанной композиции, или отдельно, например, одновременно или одно за другим, или последовательно (до или после), по отношению к доставке или введению векторного генома или вируса (например, вектора AAV-Rh74 или родственного вектора AAV, такого как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1)) настоящего изобретения. Таким образом, настоящее изобретение предлагает сочетания, в которых способ или вариант применения настоящего изобретения используется вместе с любым соединением, средством, лекарством, терапевтическим режимом, способом лечения, процессом, лечебным средством или составом, описанным в данном документе, или известным специалистам в данной области техники. Соединение, средство, лекарство, терапевтический режим, способ лечения, процесс, лечебное средство или состав, можно вводить или проводить до, по существу одновременно, или после введения индивидууму векторного генома или вируса (например, вектора AAV-Rh74 или родственного вектора AAV, такого как вариант AAV-Rh74, включающий в себя капсидный вариант (например, RHM4-1)) настоящего изобретения. Следовательно, конкретные неограничивающие примеры сочетанных вариантов осуществления включают в себя применение вышеуказанного или другого соединения, средства, лекарства, терапевтического режима, способа лечения, процесса, лечебного средства или состава.
[0138] Способы и варианты применения настоящего изобретения также включают в себя, в числе прочего, способы и варианты применения, которые приводят к уменьшению потребности в другом соединении, средстве, лекарстве, терапевтическом режиме, способе лечения, процессе, лечебном средстве, или в которых используются другие соединение, средство, лекарство, терапевтический режим, способ лечения, процесс, лечебное средство. Например, способ или вариант применения настоящего изобретения оказывает терапевтический эффект при лечении нарушения свертываемости крови, если введение конкретному индивидууму рекомбинантного белка фактора свертывания крови с целью пополнения дефицитного или дефектного (аномального или мутантного) эндогенного фактора свертывания можно осуществлять с меньшей частотой, или в более низкой дозе, или можно совсем отменить такое введение. Таким образом, настоящее изобретение также предлагает способы и варианты применения, уменьшающие потребность в другом способе лечения или терапии, или уменьшающие применение другого способа лечения или терапии.
[0139] Настоящее изобретение можно использовать в применении к животным, в том числе, в ветеринарных целях. Следовательно, подходящие индивидуумы включают в себя млекопитающих, таких как люди, а также отличные от людей млекопитающие. Термин "индивидуум" относится к животному, как правило, млекопитающему, включающему в себя людей, отличных от человека приматов (обезьян, гиббонов, горилл, шимпанзе, орангутанов, макак), домашних животных (собак и кошек), сельскохозяйственных животных (птиц, таких как куры и утки, лошадей, коров, коз, овец, свиней) и экспериментальных животных (мышей, крыс, кроликов, морских свинок). Индивидуумы-люди включают в себя эмбрионов, новорожденных, детей, несовершеннолетних и взрослых. Индивидуумы включают в себя животные модели заболеваний, например, мышиные и другие животные модели нарушений свертывания крови, а также другие известные специалистам в данной области животные модели.
[0140] Как указано в настоящем описании, векторы и вирусные частицы (например, AAV-Rh74 или родственные AAV, такие как варианты AAV-Rh74, включающие в себя капсидные варианты (например, RHM4-1)), содержащие такие векторы, можно использовать для предоставления белка индивидууму, у которого присутствует недостаточное количество белка или дефицит функционального генного продукта (белка), или для введения ингибиторной нуклеиновой кислоты или ингибиторного белка индивидууму, у которого продуцируется аберрантный, частично функциональный или нефункциональный генный продукт (белок), который может приводить к развитию заболевания. Соответственно, индивидуумы, подходящие для лечения, включают в себя индивидуумов, у которых присутствует или имеется риск продукции недостаточного количества или дефицита функционального генного продукта (белка), или у которых продуцируется аберрантный, частично функциональный или нефункциональный генный продукт (белок), который может приводить к развитию заболевания. Индивидуумы, подходящие для лечения с помощью способа настоящего изобретения, также включают в себя индивидуумов, у которых присутствует или имеется риск продукции аберрантного или дефектного (мутантного) генного продукта (белка), который может приводить к развитию заболевания, и, следовательно, уменьшение количества, экспрессии или функции аберрантного или дефектного (мутантного) генного продукта (белка) обуславливает лечение данного заболевания, или уменьшение одного или нескольких симптомов, или облегчение заболевания. Таким образом, подходящие индивидуумы включают в себя индивидуумов, у которых присутствуют такие дефекты, независимо от типа заболевания, времени или степени его проявления, развития, тяжести, частоты возникновения, или типа или продолжительности симптомов.
[0141] Термин "профилактика" и его грамматические варианты относятся к способу, в котором контакт, введение или доставку индивидууму in vivo осуществляют до появления болезни. Введение или доставку индивидууму in vivo можно проводить до развития неблагоприятного симптома, состояния, осложнения и т.п., вызванного или связанного с заболеванием. Например, для выявления таких индивидуумов, к которым можно применять способы и варианты применения настоящего изобретения, можно использовать тестирование (например, генетическое), но болезнь у индивидуума может не проявляться. Следовательно, такие индивидуумы включают в себя индивидуумов, которые по результатам скрининга являются положительными по недостаточному количеству или дефициту функционального продукта гена (белка), или которые продуцируют аберрантный, частично функциональный или нефункциональный генный продукт (белок), который может привести к развитию заболевания; а также индивидуумов, которые по результатам скрининга являются положительными по аберрантному или дефектному (мутантному) продукту гена (белку), приводящему к развитию заболевания, даже если у таких индивидуумов симптомы заболевания не проявляются.
[0142] Способы и варианты применения настоящего изобретения включают в себя доставку и введение, которые проводят системно, регионарно или локально, или любым путем, например, путем инъекции, инфузии, перорально (например, путем проглатывания или ингаляции) или местно (например, трансдермально). Такую доставку и введение можно осуществлять внутривенно, внутримышечно, внутрибрюшинно, внутрикожно, подкожно, внутрь полости, интракраниально, чрескожно (местно), парентерально, например, через слизистую оболочку, или ректально. Примеры способов введения и доставки включают в себя внутривенное (в.в.), внутрибрюшинное (в.б.), внутриартериальное, внутримышечное, парентеральное, подкожное, внутриплевральное, местное, кожное, внутрикожное, чрескожное, парентеральное, например, через слизистую оболочку, интракраниальное, интраспинальное, пероральное (алиментарное), через слизистую оболочку, респираторное, трансназальное, путем интубации, внутрилегочное, путем внутрилегочного закапывания, трансбуккальное, сублингвальное, внутрисосудистое, интратекальное, внутрь полости, ионтофоретическое, внутриглазное, офтальмологическое, оптическое, внутрижелезистое, внутриорганное, внутрилимфатическое введение.
[0143] Дозы могут варьировать в зависимости от того, является ли лечение профилактическим или терапевтическим, а также от типа, времени проявления, прогрессирования, тяжести, частоты возникновения, продолжительности или вероятности возникновения заболевания, на которое направлено лечение, желаемого клинического результата, предыдущих или одновременно проводимых схем лечения, общего состояния здоровья, возраста, пола, расы или иммунологической компетентности индивидуума и других факторов, которые может оценить специалист в данной области. Величину вводимой дозы, число введений, частоту или длительность введения можно пропорционально увеличить или уменьшить в зависимости от встречаемости неблагоприятных побочных эффектов, осложнений или других факторов риска при лечении или терапии, и состояния индивидуума. Специалист в данной области может определить факторы, способные оказывать влияние на дозировку и временной режим, необходимые для достижения количества, достаточного для обеспечения терапевтического или профилактического результата.
[0144] Описанные здесь способы и варианты применения настоящего изобретения можно осуществлять через 1-2, 2-4, 4-12, 12-24 или 24-72 часов после того, как индивидуум был идентифицирован как имеющий болезнь, подходящую для лечения, имеющий один или несколько симптомов заболевания, или был подвергнут скринингу и идентифицирован как положительный, как описано в настоящем документе, даже если у индивидуума отсутствует один или несколько симптомов заболевания. Конечно, способы и варианты применения настоящего изобретения можно осуществлять через 1-7, 7-14, 14-21, 21-48 или более дней, месяцев или лет после того, как индивидуум был идентифицирован как имеющий болезнь, подходящую для лечения, имеющий один или несколько симптомов заболевания, или был подвергнут скринингу и идентифицирован как положительный, как описано в настоящем документе.
[0145] Последовательности рекомбинантного вектора (например, AAV, такого как вектор AAV-Rh74 или родственный вектор AAV, такой как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)), плазмиды, векторные геномы рекомбинантных вирусных частиц (например, AAV, такого как вектор AAV-Rh74 или родственный вектор AAV, такой как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)) и другие составы, средства, лекарства, биологические препараты (белки) могут быть включены в состав фармацевтических композиций, например, в фармацевтически приемлемый носитель или наполнитель. Такие фармацевтические композиции можно использовать, в числе прочего, для введения и доставки индивидууму in vivo или ex vivo.
[0146] В данном описании термины "фармацевтически приемлемый" и "физиологически приемлемый" относятся к биологически приемлемой композиции, которая может находиться в виде газообразной формы, жидкой формы, твердой формы или их смеси, которая подходит для одного или нескольких способов введения при доставке или приведении в контакт in vivo. "Фармацевтически приемлемая" или "физиологически приемлемая" композиция представляет собой вещество, которое не является нежелательным с биологической или иной точки зрения, например, такое вещество можно ввести индивидууму, не вызывая существенных нежелательных биологических эффектов. Таким образом, такую фармацевтическую композицию можно использовать, например, для введения вирусного вектора, или вирусной частицы (например, AAV-Rh74 или родственного AAV, такого как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)), или трансформированных клеток индивидууму.
[0147] Такие композиции содержат растворители (водные или неводные), растворы (водные или неводные), эмульсии (например, масло-в-воде или вода-в-масле), суспензии, сиропы, эликсиры, среды для дисперсий и суспензий, покрытия, изотонические средства и средства, стимулирующие или замедляющие абсорбцию, совместимые с фармацевтическим введением или приведением в контакт или доставкой in vivo. Водные и неводные растворители, растворы и суспензии могут содержать суспендирующие средства и загустители. Такие фармацевтически приемлемые носители включают в себя таблетки (содержащие или не содержащие покрытие), капсулы (твердые или мягкие), микрогранулы, порошки, гранулы и кристаллы. В состав композиции также могут входить вспомогательные активные соединения (например, консерванты, противобактериальные, противовирусные и противогрибковые средства).
[0148] Можно получить фармацевтические композиции, подходящие для конкретного способа введения или доставки, как описано в настоящем документе, или известно специалистам в данной области техники. Так, фармацевтические композиции могут содержать носители, разбавители или наполнители, подходящие для введения разными способами.
[0149] Композиции, подходящие для парентерального введения, содержат водные и неводные растворы, суспензии или эмульсии активного соединения, которые, как правило, представляют собой стерильные препараты и могут быть изотоническими по отношению к крови предполагаемого реципиента. Неограничивающие иллюстративные примеры включают в себя воду, физиологический раствор, декстрозу, фруктозу, этанол, животные, растительные или синтетические масла.
[0150] Для введения через слизистую оболочку или трансдермального введения (например, при местном контакте), в состав фармацевтической композиции можно ввести смачивающие средства. Смачивающие средства известны в данной области техники и включают в себя, например, детергенты, соли желчных кислот и производные фусидовой кислоты, используемые для введения через слизистую оболочку. В случае чрескожного введения активный ингредиент может быть включен в состав аэрозолей, спреев, мазей, бальзамов, гелей или кремов, широко известных в данной области техники. Фармацевтические композиции, используемые для контакта с кожей, обычно включают в себя мази, кремы, лосьоны, пасты, гели, спреи, аэрозоли или масла. Носители, которые можно использовать для их получения, включают в себя вазелин, ланолин, полиэтиленгликоли, спирты, усилители чрескожной абсорбции, и их сочетания.
[0151] Композиция может содержать сорастворители и адъюванты. Неограничивающие примеры сорастворителей включают в себя растворители, содержащие гидроксильные группы или другие полярные группы, например, спирты, такие как изопропиловый спирт; гликоли, такие как пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир; глицерин; полиоксиэтиленовые спирты и эфиры полиоксиэтилена и жирных кислот. Адъюванты включают в себя, например, поверхностно-активные вещества, такие как соевый лецитин и олеиновая кислота; сложные эфиры сорбита, такие как триолеат сорбита; и поливинилпирролидон.
[0152] Фармацевтические композиции и системы доставки, подходящие для векторных геномов, вирусных частиц (например, вектор AAV-Rh74 или родственный вектор AAV, такой как вариант AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)) и способов и вариантов применения настоящего изобретения, известны в данной области (см., например, Remington: The Science and Practice of Pharmacy (2003) 20th ed., Mack Publishing Co., Easton, PA; Remington’s Pharmaceutical Sciences (1990) 18th ed., Mack Publishing Co., Easton, PA; The Merck Index (1996) 12th ed., Merck Publishing Group, Whitehouse, NJ; Pharmaceutical Principles of Solid Dosage Forms (1993), Technonic Publishing Co., Inc., Lancaster, Pa.; Ansel and Stoklosa, Pharmaceutical Calculations (2001) 11th ed., Lippincott Williams & Wilkins, Baltimore, MD; и Poznansky et al., Drug Delivery Systems (1980), R. L. Juliano, ed., Oxford, N.Y., pp. 253-315).
[0153] Термин "единичная дозированная форма" в данном описании относится к физически дискретным единицам, подходящим для введения в качестве единичных доз индивидууму, подлежащему лечению; каждая единица содержит заданное количество, необязательно в сочетании с фармацевтическим носителем (наполнителем, разбавителем, средой или наполнителем), которое при введении в виде одной или нескольких доз, в соответствии с расчетами, позволяет достичь желаемого эффекта (например, профилактического или терапевтического эффекта). Единичные дозированные формы могут находиться, например, внутри ампул и флаконов, которые могут содержать жидкую композицию, или композицию, высушенную из замороженного состояния, или лиофилизированную композицию; стерильный жидкий носитель, например, можно добавить до введения или доставки in vivo. Отдельные единичные дозированные формы могут входить в состав наборов или контейнеров, содержащих несколько доз. Последовательности рекомбинантного вектора (например, AAV), плазмиды, векторные геномы, рекомбинантные вирусные частицы (например, вектор AAV-Rh74 или родственный вектор AAV, такой как капсидный вариант AAV-Rh74 (например, RHM4-1)), и их фармацевтические композиции могут быть упакованы в единичную или множественную дозированную лекарственную форму для простоты введения и однородности дозирования.
[0154] Настоящее изобретение предлагает наборы, содержащие упаковывающий материал, который, в свою очередь, содержит один или несколько компонентов. Набор обычно включает в себя этикетку или вкладыш в упаковку, содержащие описание компонентов или инструкции по применению компонентов in vitro, in vivo, или ex vivo. Набор может содержать ряд таких компонентов, например, векторный (например, AAV) геном или вирусную частицу (например, вектор AAV-Rh74 или родственный вектор AAV, такой как варианты AAV-Rh74, включающий в себя капсидные варианты (например, RHM4-1)) и, необязательно, второй активный компонент, такой как другое соединение, другое средство, другой препарат или другая композиция.
[0155] Набор относится к физическому структурному вместилищу одного или нескольких компонентов набора. Упаковывающий материал, который может поддерживать компоненты в стерильном состоянии, может быть изготовлен из материала, обычно используемого для таких целей (такого как бумага, гофрированное волокно, стекло, пластик, фольга, ампулы, флаконы, пробирки и т.д.).
[0156] Этикетки или вкладыши могут содержать информацию, идентифицирующую один или нескольких компонентов, входящих в состав набора, величины доз, данные по клинической фармакологии активного ингредиента (ингредиентов), включающие в себя механизм действия, фармакокинетику и фармакодинамику. Этикетки или вкладыши могут содержать информацию, идентифицирующую производителя, номера партий, местоположение и дату производства, срок годности. Этикетки или вкладыши могут содержать информацию, идентифицирующую производителя, номера партий, местоположение производителя и дату. Этикетки или вкладыши могут содержать информацию о заболевании, для лечения которого можно использовать компонент набора. Этикетки или вкладыши могут включать в себя инструкции для клинициста или индивидуума по применению одного или нескольких компонентов набора в способе, варианте применения, схеме лечения или терапевтическом режиме. Инструкции могут содержать информацию о величине доз, частоте и продолжительности их введения, а также руководства по осуществлению любого из описанных здесь способов, вариантов применения, схем лечения или профилактических или терапевтических режимов.
[0157] Этикетки или вкладыши могут содержать информацию о любом эффекте, который может вызвать компонент, таком как профилактический или терапевтический эффект. Этикетки или вкладыши могут содержать информацию о возможных побочных эффектах, осложнениях или реакциях, такую как предупреждение индивидуума или клинициста о ситуациях, в которых не целесообразно использовать конкретную композицию. Неблагоприятные побочные эффекты или осложнения также могут присутствовать в тех случаях, когда индивидуум принимал, собирается принимать, или в настоящее время принимает один или несколько других препаратов, которые могут быть несовместимы с композицией, или индивидуум подвергался, будет подвергаться или в настоящее время подвергается другой схеме лечения или другому терапевтическому режиму, которые несовместимы с композицией и, следовательно, инструкция может содержать информацию о такой несовместимости.
[0158] Этикетки или вкладыши включают в себя "печатный материал", например, бумагу или картон, находящийся отдельно или прикрепленный к компоненту, набору или упаковывающему материалу (например, к коробке), или прикрепленный к ампуле, пробирке или флакону, содержащим компонент набора. Этикетки или вкладыши могут дополнительно включать в себя машиночитаемый носитель, такой как этикетка с напечатанным штрих-кодом, диск, оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитную ленту, или электрическую среду хранения информации, такую как RAM и ROM, или их гибриды, такие как магнитная/оптическая среда хранения информации, флэш-носители или карты памяти.
[0159] Если не указано иное, все используемые здесь технические и научные термины имеют традиционное значение, известное рядовым специалистам в области техники, к которой принадлежит данное изобретение. В данном документе описаны способы и материалы, подходящие для осуществлении или тестирования настоящего изобретения, хотя можно использовать способы и материалы, подобные или эквивалентные описанным здесь.
[0160] Все приведенные здесь заявки, публикации, патенты и другие ссылки, упоминания GenBank и ATCC включены в качестве ссылки во всей их полноте. В случае конфликта описание, включая определения, будет проверяться.
[0161] Все признаки, раскрытые в данном документе, можно объединять в любом сочетании. Каждый признак, раскрытый в описании, может быть заменен альтернативным признаком, который служит такой же, эквивалентной или подобной цели. Таким образом, если специально не указано иное, раскрытые признаки (например, последовательность рекомбинантного вектора (например, AAV), плазмида, векторный геном или рекомбинантная вирусная частица (например, вектор AAV-Rh74 или родственный вектор AAV, такой как капсидный вариант AAV-Rh74 (например, RHM4-1)) являются примером из рода эквивалентных или подобных признаков.
[0162] В данном описании формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылка на "полинуклеотид" включает в себя множество таких полинуклеотидов, ссылка на "вектор" включает в себя множество таких векторов, а ссылка на "вирус" или "частицу" включает в себя множество таких вирионов/частиц.
[0163] В данном описании, все числовые значения или числовые диапазоны включают в себя целые числа в пределах таких диапазонов и дробные части значений или целых чисел в пределах диапазонов, если из контекста явно не следует иное. Таким образом, в качестве примера, ссылка на идентичность, составляющую, по меньшей мере, 80%, означает, что идентичность может составлять 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91% и т.д., а также 81,1%, 81,2%, 81,3%, 81,4%, 81,5% и т.д., 82,1%, 82,2%, 82,3%, 82,4%, 82,5% и т.д.
[0164] Ссылка на целое число с добавлением более (выше) или менее чем включает в себя любое число, соответственно, большее или меньшее, чем указанное число. Так, например, ссылка на менее 1000 включает в себя 999, 998, 997 и т.д. вплоть до значения один (1); а менее 100 включает в себя 99, 98, 97, и т.д. весь путь вниз до числа один (1).
[0165] В данном описании все числовые значения или диапазоны включают в себя дробные части значений или целых чисел в пределах таких диапазонов, и дробные части целых чисел в пределах таких диапазонов, если из контекста явно не следует иное. Таким образом, в качестве примера, ссылка на числовой диапазон, такой как процентный диапазон, такой как 1-10, включает в себя значения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д. Следовательно, ссылка на интервал 1-50 включает в себя значения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и т.д., вплоть до 50, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д., 2,1, 2,2, 2,3, 2,4, 2,5, и т.д.
[0166] Ссылка на ряд диапазонов включает в себя диапазоны, которые сочетают значения границ разных диапазонов в пределах ряда. Таким образом, в качестве примера, ссылка на ряд диапазонов 11-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100, 100-150, 150-200 200-250, 250-300, 300-400, 400- 500, 500-750, 750-1000, 1000-1500, 1500-2000, 2000-2500, 2500-3000, 3000-3500, 3500-4000, 4000-4500, 4500-5000, 5500-6000, 6000-7000, 7000-8000 или 8000-9000, включает в себя диапазоны 10-50, 50-100, 100-1000, 1000-3000, 2000-4000 и т.д.
[0167] Настоящее изобретение в большинстве случаев описано здесь с использованием утвердительного языка для описания многочисленных вариантов осуществления и аспектов. Изобретение также специально включает в себя варианты осуществления, в которых, в частности, исключается, полностью или частично, конкретный объект, включающий в себя вещества или материалы, стадии способа, а также условия, схемы или процедуры. Например, в некоторых вариантах осуществления или аспектах настоящего изобретения исключаются материалы и/или стадии способа. Таким образом, несмотря на то, что изобретение в целом не выражено здесь с точки зрения того, что оно не включает в себя аспекты, которые явно не исключены из изобретения, тем не менее, такие аспекты описаны в данном документе.
[0168] Описан ряд вариантов осуществления изобретения. Тем не менее, специалист в данной области техники, не отступая от сущности и объема изобретения, может осуществить разные изменения и модификации изобретения, чтобы приспособить его к разным способам применения и условиям. Соответственно, нижеследующие примеры предназначены для иллюстрации, но не ограничения объема заявленного изобретения.
ПРИМЕРЫ
Пример 1
Данный пример включает в себя описание разных материалов и методов.
[0169] Мыши: cамцы мышей C57BL/6J (WT) возрастом 8-10 недель, n=5 в экспериментальной группе. Собака представляет собой собаку HB из колонии Университета Северной Каролины Chapel Hill, несущую миссенс-мутации в гене FIX (Evans et al., Proc Natl Acad Sci USA 86:10095 (1989)).
[0170] Векторные конструкции AAV: Исследования на мышах in vivo проводят с использованием конструкции, экспрессирующей человеческий FIX под контролем печень-специфического промотора ApoE-hAAT. В исследовании на собаках используют почти такой же промотор и собачий трансген FIX.
[0171] Методология переноса генов: Все векторы вводят внутривенно. Мышам векторы вводят через хвостовую вену (в объеме 200 мкл на мышь, вектор разводят PBS). Собакам вектор вводят через подкожную вену.
[0172] Определение экспрессии FIX: Уровни FIX измеряют методом ELISA. Пару антител (улавливающее и вторичное) для анализа уровней человеческого FIX у мышей методом ELISA получают от Affinity Biologicals. Пару антител для анализа у собак, также полученную от Affinity Biologicals, используют по способу, описанному Haurigot et al. (Mol Ther 18:1318 (2010)).
[0173] Статистический анализ: Статистический анализ проводят с использованием непарного двустороннего критерия Стьюдента, при значении р <0,05 результаты считают статистически значимыми.
[0174] Измерение уровня антител против AAV: Для измерения уровня антител in vitro используют анализ нейтрализации, описанный Manno et al. (Nat Med 12:342 (2006)) и Mingozzi et al. (Nat Med 13:419 (2007)). Вкратце, в анализе используют две векторные конструкции AAV, одноцепочечный вектор, экспрессирующий β-галактозидазу под контролем промотора CMV (ssAAV-LacZ), или самокомплементарный вектор, экспрессирующий ген-репортер Renilla, AAV-Rh74-CBA-Renilla, под контролем промотора куриного β-актина (CBA). Для повышения эффективности трансдукции векторов AAV in vitro, используют клетки 2V6.11 (ATCC), которые экспрессируют аденовирусный ген E4 под контролем индуцируемого промотора. Клетки высевают в 96-луночный планшет при плотности 1,25×104 клеток/лунку и к среде добавляют понастерон А (Invitrogen) в разведении 1:1000, чтобы индуцировать экспрессию E4. В день анализа серийные полулогарифмические разведения инактивированной нагреванием тестируемой сыворотки смешивают со средой, содержащей вирус. В случае вектора ssAAV-LacZ концентрация вируса, используемая в анализе, составляет ~1×1010 вг/мл для AAV2 и ~5,5×1010 вг/мл для AAV5, 6 или 8. При применении вектора scAAV-Luc концентрация вируса в анализе примерно в 50-150 раз ниже. Остаточную активность репортерного трансгена измеряют либо с использованием колориметрического анализа (ssAAV-LacZ), либо с помощью люминометра (scAAV-Luc).
[0175] Уровни общих IgG или подклассов Ig против капсида AAV измеряют с помощью улавливающего анализа; планшеты для ELISA покрывают пустыми капсидами AAV в концентрации 5×1010 капсидных частиц/мл. Планшеты блокируют 2% BSA, 0,05% Tween 20 в PBS в течение 2 часов при комнатной температуре, после чего в лунки загружают серийные разведения образцов и инкубируют в течение ночи при 4°С. Биотин-конъюгированные антитела против человеческих IgG1, IgG2, IgG3, IgG4 или IgM (Sigma) используют для детекции антител; стрептавидин-HRP добавляют для детекции субстрата. Концентрацию Ig определяют по стандартным кривым, полученным с использованием последовательных разведений человеческих очищенных IgG1, IgG2, IgG3, IgG4 или IgM (Sigma).
[0176] Получение AAV: Способ получения вектора подробно описан Ayuso et al. (Gene Ther 17:503 (2010)).
Пример 2
В данном примере описаны исследования по переносу человеческого гена FIX животным (мышам) и анализ экспрессии FIX после переноса гена.
[0177] Мышам C57BL/6 (n=5 на группу) вводят через хвостовую вену векторы AAV, несущие ген фактора IX (FIX) (2,510 векторных геномов на мышь) под контролем печень-специфического промотора. Уровни продукта (белка) трансгена, кодирующего человеческий FIX, в плазме мышей, которые определяют методом ELISA на 1, 2 и 4 неделе после переноса гена, показаны на фиг.1. AAV-Rh74 обеспечивает самый высокий уровень экспрессии трансгена у животных.
Пример 3
В данном примере описаны исследования на животных и результаты, свидетельствующие об эффективной AAV-Rh74-опосредованной доставке FIX на терапевтических уровнях собакам, страдающим от гемофилии.
[0178] Вкратце, собакам, страдающим от гемофилии B, векторы вводят внутривенно (в.в.), через подкожную вену, в дозе 3×1012 векторных геномов на кг массы тела. Экспрессия терапевтического трансгена FIX контролируется печень-специфическим промотором. Уровни векторов и FIX измеряют методом ELISA. Уровни FIX в плазме собак показаны на фиг.2. AAV-Rh74 и AAV8 экспрессируются примерно одинаково у собак с гемофилией B, и оба на более высоком уровне, чем AAV6.
Пример 4
В данном примере описаны исследования, демонстрирующие наличие нейтрализующих антител (NAb) против AAV в организме человека.
[0179] Результаты, приведенные в таблице 1, демонстрируют наличие у людей нейтрализующих антител (NAb) против AAV, уровень которых измеряют с помощью анализа in vitro. Индивидуумы с титром NAb менее или равным 1:1 считаются наивными, или имеющими низкий титр антител против AAV, и могут подвергаться переносу генов данного серотипа AAV (соответствующие столбики выделены серым цветом). Пациенты с титрами от 1:1 до 1:3 считаются допускающими введение AAV при условии, что в качестве средства переноса используют пустые капсиды. Считается, что индивидуумов с титрами выше 1:3 нельзя подвергать трансдукции AAV путем системной инъекции, соответствующие столбики выделены светло-серым цветом. AAV-Rh74 характеризуется самой низкой степенью встречаемости Nab против AAV по сравнению с AAV-2 и AAV-8.
Пример 5
В данном примере описаны результаты, демонстрирующие уровень продукции разных серотипов AAV, включающих в себя AAV-Rh74.
[0180] Данные, приведенные в таблице 2, демонстрируют продукцию разных серотипов AAV. Указаны размер партии вируса в роллерных бутылях, общий выход вектора и выход на бутыль. Все серотипы встраивают в одинаковые кассеты экспрессии. Выход AAV-Rh74 сравним или превышает выходы других исследуемых серотипов, а именно AAV-8, AAV-dj и AAV-2.
Пример 6
В данном примере описаны результаты, демонстрирующие, что вектор AAVrh74, экспрессирующий человеческий фактор IX (FIX) под контролем печень-специфического промотора, введенный резус-макакам, обеспечивает продукцию FIX у животных на более высоких уровнях, чем вектор AAV8, введенный в таком же количестве.
[0181] Вкратце, животным вводят AAV8 или AAVrh74 в дозе 2×1012 векторных геномов (вг)/кг массы тела. Векторы вводят либо в физиологическом растворе, либо в смеси с пустыми капсидами AAV (обозначаемыми EC).
[0182] На фигуре 4 приведена гистограмма средней (от 2 до 8 недель) и стандартной ошибки или среднего уровня человеческого FIX, измеряемого методом ELISA, который позволяет специфически детектировать человеческий FIX в плазме макаки-резус. Животные, получающие вектор AAVrh74-FIX, представлены в двух последних столбцах с правого края. Результаты показывают, что животные, получающие векторы AAVrh74 (последние два столбца с правого края), экспрессируют трансген FIX на более высоких уровнях, чем животные из других групп, получающие вектор в той же дозе (черно-серые столбцы). Средние уровни сравнивают с использованием непарного двустороннего критерия Стьюдента.
[0183] У одного из животных, получающих AAV-RHM4-1-FIX, обнаружен ингибитор продукта трансгена человеческого фактора IX, что является хорошо задокументированным явлением, встречающимся примерно у 20% макак, получающих вектор, несущий человеческий FIX. У второго животного, получающего RHM4-1, уровень экспрессии FIX примерно в 2 раза выше, чем у макак, получающих AAV8.
Пример 7
В данном примере приведено описание нескольких капсидных вариантов Rh74.
[0184] Вкратце, в последовательность капсида Rh74 вводят разные замены с получением капсидных вариантов Rh74. Разные капсидные варианты Rh74 и аминокислотные замены для каждого положения приведены ниже:

[0185] Вариант RHM4-1 содержит замену на аланин, лейцин, пролин и аспарагин в аминокислотных положениях 195, 199, 201 и 202 капсида Rh74 VP1, соответственно. Аминокислотная последовательность капсида VP1 варианта RHM4-1, содержащая замены на остатки a, v, p и n, подчеркнутые и выделенные жирным шрифтом, приведена ниже (SEQ ID NO: 5):

[0186] Нуклеотидная последовательность капсида VP1 варианта RHM4-1, содержащая кодоны, кодирующие замены на a, v, p и n, подчеркнутые и выделенные жирным шрифтом, выглядит следующим образом (SEQ ID NO: 11):


[0187] Варианты RHM15-1, 15-2, 15-3, 15-4, 1-5 и 15-6 также содержат замены на аланин, лейцин, пролин и аспарагин в аминокислотных положениях 195, 199, 201 и 202 капсида Rh74 VP1, соответственно. Кроме того, указанные варианты содержат множественные замены лизина на аргинин в разных положениях.
[0188] Аминокислотная последовательность капсида VP1 варианта RHM15-1 (SEQ ID NO: 6):

[0189] Нуклеотидная последовательность капсида VP1 варианта RHM15-1 (SEQ ID NO: 12):


[0190] Аминокислотная последовательность капсида VP1 варианта RHM15-2 (SEQ ID NO: 7):

[0191] Нуклеотидная последовательность капсида VP1 варианта RHM15-2 (SEQ ID NO: 13):


[0192] Аминокислотная последовательность капсида VP1 варианта RHM15-3/RHM15-5 (SEQ ID NO: 8):

[0193] Нуклеотидная последовательность капсида VP1 варианта RHM15-3/RHM15-5 (SEQ ID NO: 14):


[0194] Аминокислотная последовательность капсида VP1 варианта RHM15-4 (SEQ ID NO: 9):

[0195] Нуклеотидная последовательность капсида VP1 варианта RHM15-4 (SEQ ID NO: 15):


[0196] Аминокислотная последовательность капсида VP1 варианта RHM15-6 (SEQ ID NO: 10):

[0197] Нуклеотидная последовательность капсида VP1 варианта RHM15-6 (SEQ ID NO: 16):


Пример 8
В данном примере описаны исследования экспрессии человеческого фактора IX с использованием капсидных вариантов Rh74 в сравнении с Rh74 и AAV8.
[0198] Вкратце, капсидные варианты Rh74 используют для упаковки вектора AAV, экспрессирующего человеческий фактор IX, частицы AAV используют для инфицирования мышей, и определяют уровни экспрессии фактора IX у животных (в плазме). Капсидные варианты содержат следующие аминокислотные замены в указанных положениях:

[0199] На фигуре 5 показаны уровни экспрессии человеческого фактора IX в плазме животных через 2 недели после введения вектора. Как показано, вектор AAV, экспрессирующий человеческий фактор IX, капсидированный вариантным капсидом RHM4-1, обеспечивает наивысший уровень экспрессии, который существенно превышает экспрессию человеческого фактора IX, обеспечиваемую вектором AAV, капсидированным Rh74, и вектором AAV, капсидированным AAV8.
Пример 9
В данном примере описаны результаты, демонстрирующие, что вариант RHM4-1 вектора AAVrh74, экспрессирующий человеческий фактор IX (FIX) под контролем печень-специфического промотора, введенный яванским макакам, обеспечивает продукцию FIX у животных на более высоких уровнях, чем вектор AAV8, введенный в таком же количестве.
[0200] Яванских макак предварительно проверяют на присутствие нейтрализующих антител против AAV и выбирают животных с титром <1:1, чтобы обеспечить успешную трансдукцию. Затем обезьянам вводят путем вливания либо вектор AAV8, либо вариант RHM4-1 вектора AAV-Rh74, экспрессирующие трансген человеческого фактора IX, в дозе 3×1012 вг/кг. Уровни продукта (белка) трансгена человеческого FIX в плазме отличных от человека приматов, определяемые методом ELISA еженедельно на протяжении всего периода исследования, показаны на фигуре 6.
[0201] У одного из животных, получающих AAV-RHM4-1-FIX, обнаружен ингибитор продукта трансгена человеческого фактора IX, что является хорошо задокументированным явлением, встречающимся примерно у 20% макак, получающих вектор, несущий человеческий FIX, вследствие небольших аминокислотных различий между белками человека и макаки. Отсутствие экспрессии у одного животного, получающего RHM4-1, обусловлено образованием антител против человеческого трансгена. У второго животного, получающего RHM4-1, уровень экспрессии FIX примерно в 2 раза выше, чем у макак, получающих AAV8.
Реферат
Изобретение относится к области биотехнологии, конкретно к векторам на основе серотипа AAV-Rh74 аденоассоциированного вируса (AAV), содержащим полинуклеотидную последовательность, кодирующую фактор IX человека, и может быть использовано в медицине. Полученные частицы используют в составе фармацевтической композиции для эффективного лечения гемофилии B. 7 н. и 14 з.п. ф-лы, 7 ил., 4 табл., 9 пр.

Комментарии