Новые способы дисплея циклических пептидов на частицах бактериофага - RU2702087C2
Код документа: RU2702087C2
Чертежи







Описание
Область изобретения
Настоящее изобретение относится к способам дисплея циклических пептидов на поверхности частиц бактериофага на С-конце белка капсида фага.
Предпосылки изобретения
Циклические пептиды представляют собой полипептидные цепи, имеющие циклическую кольцевую структуру и, как известно, характеризуются множеством биологических активностей, таких как антибактериальная активность, иммуносупрессивная активность или противоопухолевая активность. В клинике используются несколько циклических пептидов, обнаруженных в природе, таких как антибактериальные грамицидин S, тироцидин и ванкомицин, или циклоспорин А, характеризующийся иммуносупрессивной активностью. После воодушевления природными циклическими пептидами с биологической активностью были предприняты усилия по созданию искусственных циклических пептидов с использованием как генетических, так и синтетических способов.
Возникший класс биомолекул, имеющих циклическую структуру, представляет собой рибосомально синтезированные пептиды, которые требуют обширной посттрансляционной модификации для образования биологически активного пептида. Большинство рибосомально синтезированных природных пептидов транслируются в виде предшественников, состоящих из лидерного и основного пептида. Лидер служит в качестве последовательности распознавания и привлекает ферментативный механизм для установки посттрансляционных модификаций (РТМ) на конкретных остатках основного пептида.
Таким образом, посттрансляционные модификации, такие как гетеро- или макроциклизация, дегидратирование, ацетилирование, гликозилирование, галогенирование, пренилирование и эпимеризация, не только вызывают появление биологической активности таких пептидов, но также непосредственно способствуют отличной стабильности, обнаруживаемой у многих типичных представителей этого класса пептидов, и, таким образом, делают их привлекательными кандидатами для разработки лекарственных средств.
Лантипептиды и лантибиотики образуют группу уникальных рибосомально синтезируемых и постгрансляционно модифицируемых пептидов-антибиотиков, которые вырабатываются в и действуют в основном на грамоположительные бактерии (для обзора см. Knerr and van der Donk, Annu. Rev. Biochem. 2012. 81:479-505). Природные лантибиотики, такие как, например, низин или субтилин, хорошо изучены и коммерчески используются в пищевой промышленности для производства и сохранения молочных продуктов, таких как сыр.
Лантипептиды и лантибиотики, как подкласс пептидов с противомикробной активностью, содержат внутримолекулярные тиоэфирные мостики или кольца, образованные тиоэфирными аминокислотами лантионином (Lan) и 3-металл антионином (MeLan), которые защищают такие пептиды от протеолитической деградации и придают повышенную термостабильность. Образование тиоэфирного мостика начинается с ферментативной дегидратации серина или треонина до ненасыщенного дегидроаланина (Dha) и дегидробутирина (Dhb), соответственно, за которой следует внутримолекулярное присоединение цистеиновых тиолов по типу Михаэля, которое опосредуется лантипептидсинтетазами (LanB и LanC для класса I, LanM для класса II, LanKC для класса III и LanL для класса IV). В лантипептидах класса I дегидратация серина/треонина и последующая циклизация осуществляется с помощью дегидратазы типа LanB и циклазы типа LanC, соответственно, тогда как в лантипептидах класса II один бифункциональный фермент типа LanM выполняет обе реакции. Интересно, что ненасыщенный Dha характеризуется высокой химической реакционной способностью и может при слабо щелочных условиях легко реагировать с боковой цепью цистеина или лизина с получением стереонеселективных тиоэфирных мостиков и лизиноаланиновых мостиков, соответственно. Биосинтез лантипептидов класса III и класса IV поддерживается полифункциональными ферментами LanKC и LanL, соответственно, которые характеризуются аминоконцевым фосфо-Ser/фосфо-Thr лиазным доменом, центральным киназоподобным доменом и карбоксиконцевым LanC-подобным доменом (циклазным) (van der Donk et al. 2014 Current Opinion in Structural Biology 2014, 29:58-66).
В последние годы принцип биосинтеза лантипептидов все более адаптирован для обнаружения и создания искусственных биоактивных пептидов, имеющих циклическую структуру.
Сначала в 2004 году было предложено, что ферменты, синтезирующие лантипептид, можно преимущественно использовать для введения РТМ, таких как тиоэфирные мостики, в пептиды, которые обычно не модифицируются, для улучшения стабильности пептида и/или для изменения его активности (Kuipers et al. 2004. J. Biol. Chem. 279, 22176-22182). В WO 2006/062398 было показано, что представляющий интерес пептид можно дегидратировать в клетке-хозяине при помощи выделенной лантибиотической дегидратазы, такой как LanB, которая не является частью обычного лантибиотического ферментативного комплекса. Было также продемонстрировано, что модифицированные с содержанием тиоэфирного мостика пептиды могут секретироваться с помощью системы экспорта белка, отличной от специализированных переносчиков лантибиотиков в своем естественном хозяине.
Позднее в WO 2012/005578 было продемонстрировано, что пептиды, содержащие тиоэфирный мостик, можно легко получить и "отобразить" на поверхности клетки-хозяина (например Lactococcus lactis), которая экспрессирует механизмы биосинтеза и экспорта для лантибиотиков.
Более конкретно, WO 2012/005578 обеспечивает вектор экспрессии, кодирующий гибридный пептид, содержащий N-концевую лидерную последовательность лантибиотиков, представляющую интерес аминокислотную последовательность, подлежащую посттрансляционной модификации до полипептида, содержащего дегидроостаток или тиоэфир, и С-концевой заряженный мембраносвязывающий домен. Также была предложена библиотека дисплея для скрининга циклических пептидов с желаемой активностью. Однако был обеспечен дисплей только на грамположительных клетках-хозяевах, в частности молочнокислых бактериях, которые по своей природе способны вырабатывать лантибиотики.
Другие системы дисплея, известные в данной области техники, такие как фаговый дисплей, которым необходимы грамотрицательные бактерии, характеризующиеся различными механизмами экспорта белков, не рассматривались как альтернатива и, следовательно, не были включены в уровень техники.
История фагового дисплея началась в 1985 году на основе демонстрации того, что нитчатый фаг допускает наличие чужеродных фрагментов белка, вставленных в его белок гена III (pIII), а также представляет фрагменты белка на поверхности фага (Smith, 1985). Ladner распространил эту концепцию на скрининг репертуаров (поли)пептидов и/или белков, "отображаемых" на поверхности фага (WO 1988/06630, WO 1990/02809), и с тех пор фаговый дисплей пережил значительный прогресс и привел к существенным достижениям. Разработаны различные форматы для создания и скрининга (поли)пептидных/белковых библиотек фагового дисплея, и большое количество обзорных статей и монографий охватывает и обобщает эти разработки (например, Kay et al., 1996; Dunn, 1996; McGregor, 1996). Чтобы привязать пептид или белок к поверхности нитчатого бактериофага, в основном используют генетическую гибридизацию с белками капсида фага. Предпочтительными являются гибриды с белком гена III (Parmley & Smith, 1988) или его фрагментами (Bass et al., 1990) и с белком гена VIII (Greenwood et al., 1991). В одном случае был использован ген VI (Jespers et al., 1995) и недавно была использована комбинация гена VII и гена IX для дисплея Fv-фрагментов (Gao et al., 1999).
До сих пор на фагах успешно "отображались" только линейные (поли)пептиды и циклические пептиды, стабилизированные дисульфидными связями (см. WO 2000/077194, WO 2009/098450). Совсем недавно в WO 2012/019928 на фаге "отображался" линейный предшественник микровивидрина K, гибридизированный с N-концом pIII. Посттрансляционной модификации "отображаемого" линейного предшественника добивались последующей инкубацией фагов с клеточными лизатами, содержащими родственные модифицирующие ферменты. Однако в WO 2012/019928 не предоставлено раскрытие, дающее возможность дисплея лантипептидов, а также не изложен дисплей пептидов, которые подвергались посттрансляционной модификации до сборки фага.
Соответственно, существует потребность в преобразовании дисплея циклических посттрансляционно модифицированных пептидов с бактерий в классический фаговый дисплей.
Краткое описание изобретения
В предшествующем уровне техники был успешно продемонстрирован дисплей содержащих тиоэфирные мостики пептидов на бактериях. Однако применение бактерий для дисплея сопровождается существенными недостатками. Например, грамположительные бактерии, такие как L. lactis, имеют пониженную эффективность трансформации по типу электропорации и имеют тенденцию к агрегации, что затрудняет их обработку и приводит к неустойчивости. Поэтому библиотеки, полученные посредством дисплея через L. lactis, не могут превышать более ~106 разновидностей, тогда как типичные библиотеки фагового дисплея, как известно, имеют более чем 1012 различных клонов.
Таким образом, техническая проблема, лежащая в основе настоящего раскрытия, заключается в разработке простой, надежной системы, которая позволяет представлять циклические пептиды на фаговых частицах. Решение этой технической проблемы достигается путем предоставления описанных в данном документе вариантов осуществления. В настоящем раскрытии присоединяют циклический пептид к С-концу белка капсида фага и делают возможным дисплей указанных циклических пептидов на поверхности фага. С-концевой фаговый дисплей как таковой показан для линейных пептидов на белках капсида pVIII (Held et al., 2004 & Weiss et al., 2000), а также pIII (Fuh et al., 2000), но дисплей циклического пептида или посттрансляционно модифицированного пептида на С-конце белка капсида фага не упоминалось и не предлагалось. Как правило, в обычном фаговом дисплее используют N-конец белка капсида фага для дисплея и не ожидалось, что циклические пептиды смогут эффективно "отображаться" только на С-конце белка капсида фага.
Более конкретно, настоящее раскрытие включает способ дисплея циклического пептида на частице бактериофага, при этом способ включает следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида;
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида;
(c) ферментативная дегидратация одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) образование одной или нескольких внутримолекулярных связей посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
В одном аспекте циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином. В другом аспекте циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с остатком цистеина или остатком лизина. В другом аспекте циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных аминокислотных остатков с цистеином или лизином.
Соответственно, настоящее раскрытие позволяет представлять циклические пептиды на фаге. Технический подход настоящего раскрытия, т.е. присоединение циклических пептидов к С-концу белка капсида фага, не предоставляется и не предлагается из уровня техники.
Таким образом, настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага. Кроме того, настоящее раскрытие позволяет создавать и подвергать скринингу большие библиотеки циклических пептидов, "отображаемых" на поверхности частиц бактериофага. Во многих случаях предпочтительно представлять циклические пептиды с использованием такого способа. В заявленном способе имеет место практическая ценность дисплея библиотеки, содержащей циклические пептиды.
Кроме того, имеет место практическая ценность библиотеки, содержащей циклические пептиды, "отображаемые" с использованием заявленного способа. Такие библиотеки включают широкий спектр циклических пептидов, которые можно подвергать скринингу относительно мишени, представляющей интерес.
Использование раскрытых способов позволяет вводить внутримолекулярную связь практически в любом желаемом положении в пептиде. Особый интерес представляют пептиды с биологической активностью, например пептиды, предназначенные для терапевтического применения, поскольку введение одной или нескольких внутримолекулярных связей обычно повышает биостабильность пептида. Кроме того, циклическую структуру можно использовать для изменения биологической активности, например антигенной специфичности, аффинности связывания рецептора, противомикробной активности или ферментативной специфичности пептида. Представляющий интерес пептид представляет собой, например, агонистический пептид, антагонистический пептид, амидированный пептид, гормон, ингибитор фермента, активатор фермента, лиганд рецептора, ингибирующий пептид, лантибиотический белок, вирусный белок, эукариотический белок, его мутант (например, специально разработанный для модификации в определенном положении), миметик, гомолог или эквивалент его функционального фрагмента. Такой способ можно использовать для идентификации терапевтически релевантных и терапевтически активных молекул на основе циклических пептидов или можно использовать для характеристики таких молекул.
Описание графических материалов
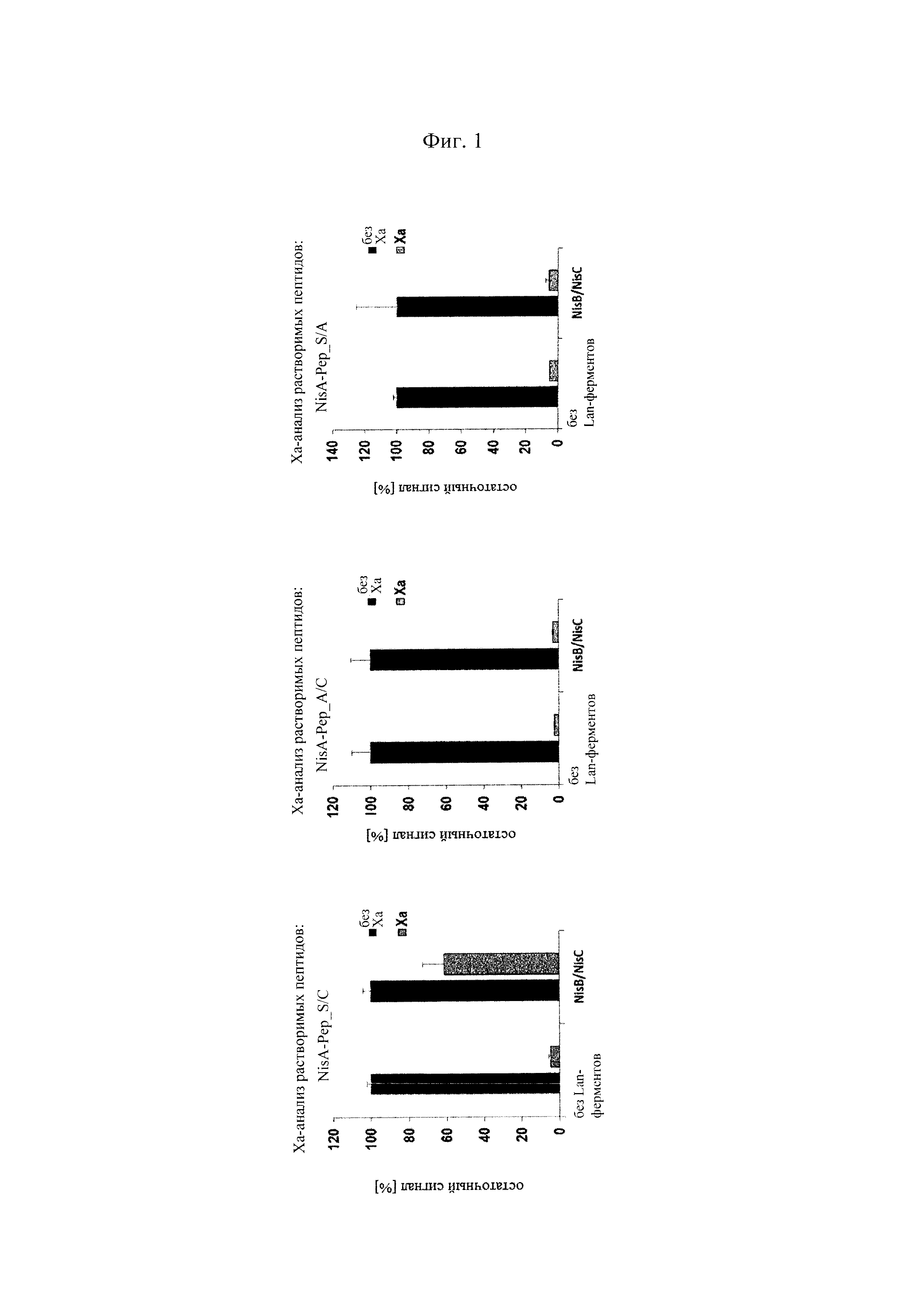
Фигура 1. Подтверждение статуса модификации циклических пептидов, экспрессированных в Е. coli посредством анализов с использованием репортерных генов и расщеплением, опосредованным фактором Ха
Статус модификации растворимых экспрессированных пептидов, несущих лидерную последовательность NisA, оценивали в лизатах клеток Е. coli в присутствии или в отсутствие совместной экспрессии с модифицирующими ферментами NisB/NisC посредством основанных на ELISA анализов с использованием репортерных генов и расщеплением, опосредованным фактором Ха. Хотя пептиды, содержащие мотив

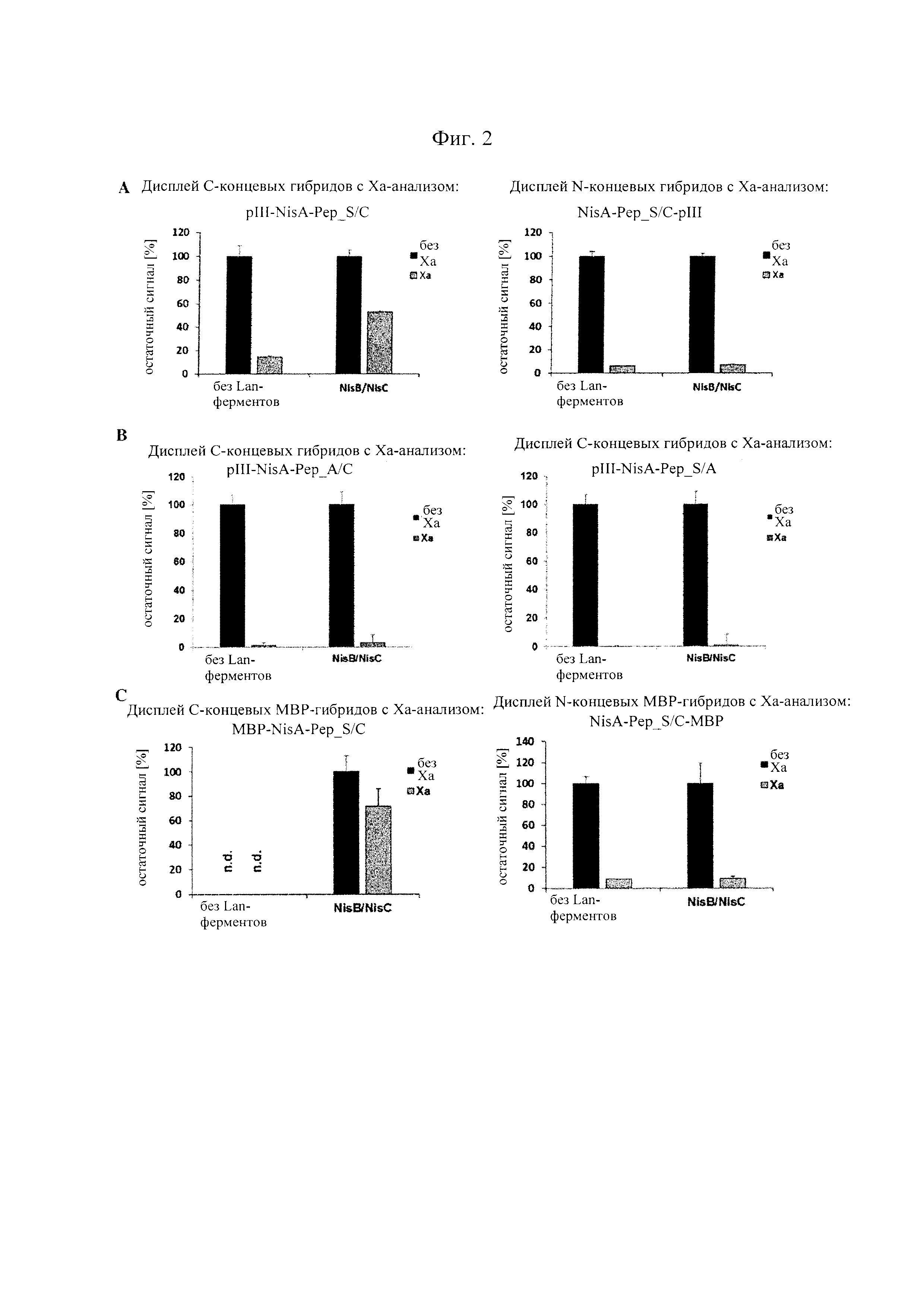
Фигура 2. Гибриды содержащих NisA-лидер пептидов-предшественников с С-концом pIII являются субстратами для ферментативной циклизации (образования тиоэфирных мостиков) и затем "отображаются" на фаговых частицах.
(А) Фаговые частицы получали с использованием фагмид, которые гибридизировали один и тот же пептид, содержащий NisA-лидер, с мотивом ASWIEGRWCN (SEQ-ID.: 1) либо с С-конца, либо с N-конца pIII и подвергали анализам с использованием репортерных генов и расщеплением, опосредованным фактором Ха. С-концевые гибриды, полученные при совместной экспрессии с NisB/NisC и "отображенные" на фаге, в значительной степени устойчивы к опосредованному фактором Ха расщеплению, что указывает на ферментативную модификацию в клетке-продуценте и последующее включение в фаговые частицы (левая панель). В отличие от этого, N-концевые гибриды того же самого пептида, "отображенные" на фаге, являются чувствительными к фактору Ха даже тогда, когда они получены при совместной экспрессии с NisB/NisC (правая панель). (В) Мутация остатков серина (левая панель) или цистеина (правая панель) до аланина в основных пептидах С-концевых гибридов pIII предупреждает ферментативное образование тиоэфирных мостиков даже при совместной экспрессии с NisB/NisC и делает "отображенные" пептиды чувствительными к фактору Ха. Устойчивость к фактору Ха (остаточный сигнал [%]) рассчитывали по отношению к необработанным образцам (без добавления Ха) из трех независимо полученных образцов фагов. (С) Получали клеточные лизаты штаммов Е. Coli, экспрессирующих один и тот же пептид-предшественник, содержащий NisA-лидер, показанный в (А), гибридизированный либо с С-концом, или с N-концом мальтозосвязывающего белка (МВР), и подвергали анализам с использованием репортерных генов и расщеплением, опосредованным фактором Ха. Гибриды пептида-предшественника с С-концом МВР в значительной степени устойчивы к опосредованному фактором Ха расщеплению, когда их получают при совместной экспрессии с NisB/NisC, подтверждающей ферментативную модификацию. В отсутствие совместной экспрессии с NisB/NisC не удалось обнаружить гибридов того же белка (n.d.), что может указывать на быстрый метаболизм (левая панель). N-концевые гибриды пептида-предшественника с МВР накапливаются до высоких уровней независимо от совместной экспрессии с NisB/NisC, но не могут ферментативно модифицироваться, как оценено в анализе с опосредованным фактором Ха расщеплением (правая панель). Полученные результаты показывают, что гибридизация пептидов-предшественников с С-концом белков-носителей широко применима и, в отличие от N-концевой гибридизации, поддерживает эффективную модификацию ферментативным механизмом.
Фигура 3. Гибриды содержащих ProcA-лидер пептидов-предшественников с С-концом pIII являются субстратами для ферментативной циклизации (образования тиоэфирных мостиков) и затем "отображаются" на фаговых частицах.
Фаговые частицы получали с использованием фагмид, которые гибридизировали пептид, содержащий ProcA-лидер, с мотивом ASWIEGRWCN (SEQ-ID.: 1; S/C или родственные Т/С и S/A производные) с С-конца pIII и подвергали анализам с использованием репортерных генов и расщеплением, опосредованным фактором Ха. С-концевые пептидные гибриды, содержащие остатки S/C (левая панель) или Т/С (средняя панель), полученные при совместной экспрессии с ферментом ProcM, показали устойчивость к опосредованному фактором Ха расщеплению, указывая на ферментативное образование тиоэфирного мостика из дегидроаланина (S/C) и дегидробутирина (Т/С), соответственно, и последующее включение в фаговые частицы. В отличие от этого гибриды с остатками S/A не являются субстратами для образования тиоэфиров и остаются чувствительными к Ха (правая панель) даже при получении в присутствии ProcM. Устойчивость к фактору Ха (остаточный сигнал [%]) рассчитывали по отношению к необработанным образцам (без добавления Ха) из трех независимо полученных образцов фагов.
Фигура 4. Аминокислотная последовательность дикого типа белков g3p (pIII) и g8p (pVIII) фага энтеробактерий М13
Последовательности pIII (SEQ-ID.: 2; UniProt-ID: Р69168) и pVIII (SEQ-ID.: 3; UniProt-ID: P69541) белков представлены с выделенными последовательностями сигнального пептида (полужирный шрифт) и трансмембранного домена (полужирный шрифт, подчеркнуто).
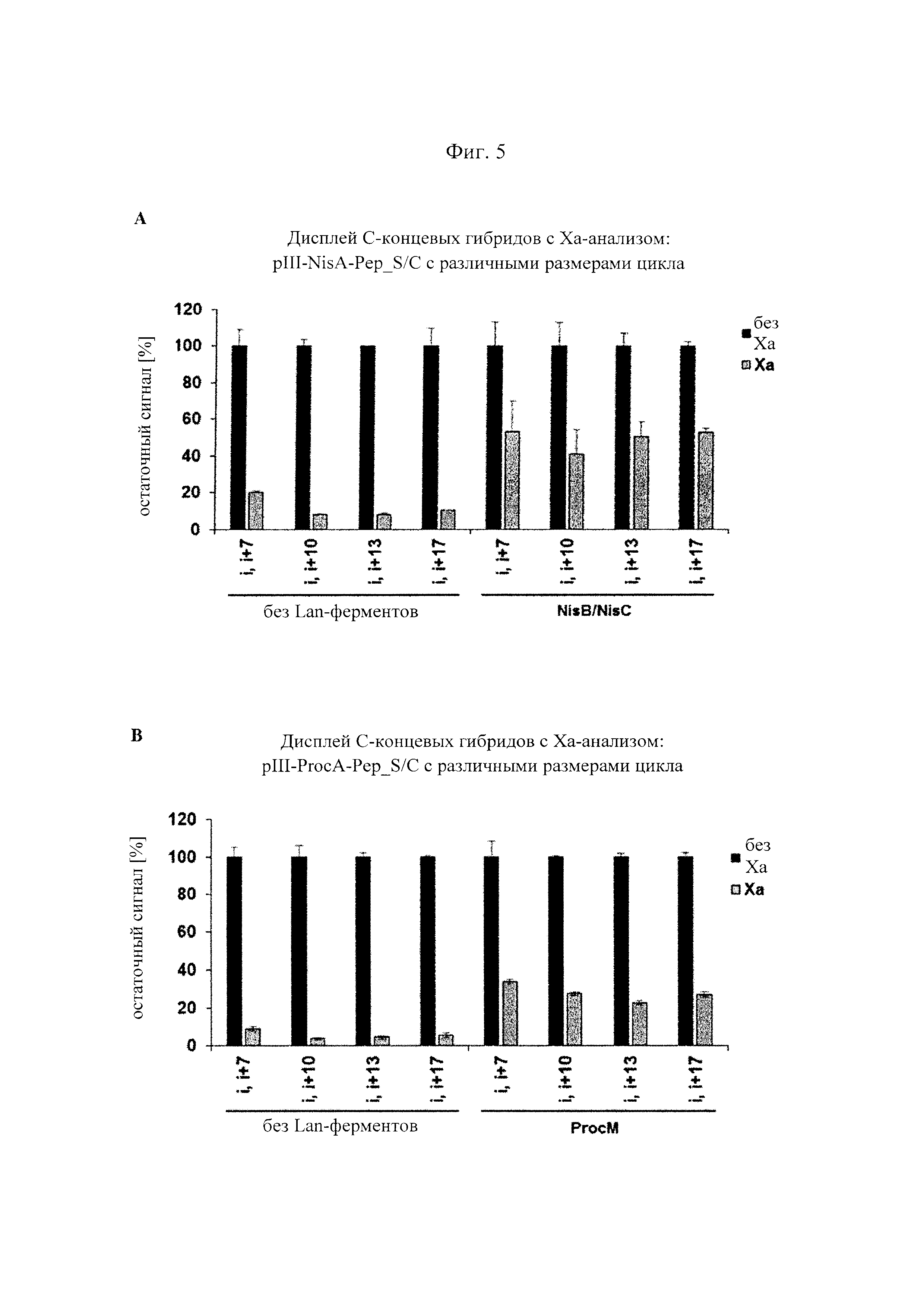
Фигура 5. Ферментативная циклизация (образование тиоэфирных мостиков) и фаговый дисплей пептидных гибридов, содержащих последовательности NisA- и ProcA-лидера и циклы различных размеров на С-конце pIII.
(А) Фаговые частицы получали с использованием фагмид, которые гибридизировали пептид, содержащий NisA-лидер, с




(В) То же, что и в (А), но pIII-пептидные гибриды, содержащие последовательность ProcA-лидера и полученные в присутствии или отсутствии совместной экспрессии с ферментом ProcM.
Определения
Термин "бактериофаг" относится к бактериальным вирусам, образующим упаковки, состоящие из белкового капсида, содержащего нуклеиновую кислоту, необходимую для репликации фагов. Нуклеиновая кислота может быть ДНК или РНК, двух- или одноцепочечной, линейной или кольцевой. Бактериофаг, такой как фаг лямбда или нитчатый фаг (такой как М13, fd или fl), хорошо известен специалисту в данной области техники. Термин "частица бактериофага" относится к частицам в соответствии с настоящим раскрытием, т.е. к частицам, "отображающим" циклический пептид. Во время сборки бактериофагов белки капсида могут упаковывать различные последовательности нуклеиновых кислот при условии, что они содержат сигнал упаковки.
Термин "нуклеиновая кислота" относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам в одно- или двухцепочечной форме. Этот термин охватывает нуклеиновые кислоты, содержащие известные нуклеотидные аналоги или модифицированные остатки или связки с основной цепью, которые являются синтетическими, встречающимися в природе и неприродного происхождения, которые имеют сходные связывающие свойства, как эталонная нуклеиновая кислота, и которые метаболизируются способом, подобным эталонным нуклеотидам. Если не указано иное, конкретная последовательность нуклеиновой кислоты также неявно охватывает ее консервативно модифицированные варианты (например, замены вырожденных кодонов) и комплементарные последовательности, как и явно указанную последовательность. В частности, как подробно описано ниже, замены вырожденных кодонов могут быть достигнуты путем генерации последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено остатками смешанного основания и/или дезоксиинозина (Batzer et al. (1991) Nucleic Acid Res. 19:5081; Ohtsuka et al. (1985) J. Biol. Chem. 260:2605-2608 и Rossolini et al. (1994) Mol. Cell. Probes 8:91-98). Конкретные последовательности нуклеиновых кислот или векторы, раскрытые в данном документе, могут упаковываться белками капсида бактериофага во время сборки бактериофагов или частиц бактериофага. Предпочтительно указанные последовательности нуклеиновых кислот или векторы получают из природных геномов бактериофага и они содержат, например, в случае нитчатого фага, фаг и фагмидные векторы. Последние представляют собой плазмиды, содержащие сигнал упаковки и начало репликации фага в дополнение к отличительным признакам плазмиды.
Термин "пептид" означает содержащую менее чем или равную 50 аминокислотам молекулу.
Термин "(поли)пептид" означает молекулу, содержащую более 50 аминокислот, состоящую из одной или нескольких цепей из множества, т.е. двух или более, аминокислот, связанных пептидными связями.
Термин "белок" относится к (поли)пептидам, где по меньшей мере часть (поли)пептида имеет или может приобрести определенную трехмерную структуру путем образования вторичных, третичных или четвертичных структур внутри и/или между ее (поли)пептидной цепью (цепями). Это определение включает белки, такие как природные или, по меньшей мере, частично искусственные белки, а также фрагменты или домены целых белков, если эти фрагменты или домены способны получить определенную трехмерную структуру, как описано выше.
Термины "тиоэфир" или "тиоэфирный мостик" относятся к атому серы, связанному с двумя разными атомами углерода или гетероатомами в соответствующей молекуле. В одном варианте осуществления тиоэфирный мостик образуется после посттрансляционной дегидратации одного или нескольких остатков серина или треонина и связывания указанных дегидратированных остатков с цистеином. В одном варианте осуществления тиоэфирный мостик представляет собой лантиониновый или метиллантиониновый мостик. Лантионин представляет собой непротеиногенную аминокислоту с химической формулой (HOOC-CH(NH2)-CH2-S-CH2-CH(NH2)-COOH), состоящую из двух остатков аланина, которые сшиты по своим 6-углеродным атомам с помощью тиоэфирного мостика. Метиллантионин представляет собой непротеиногенную аминокислоту с химической формулой (HOOC-CH(NH2)-CH(CH3)-S-CH2-CH(NH2)-COOH).
Термин "лизиноаланиновый мостик" относится к взаимодействию дегидроаланина с остатком лизина. В данном документе лизиноаланиновый мостик индуцируют ферментативно или неферментативно, например, путем регулирования рН. "Лизиноаланин" относится к модифицированной аминокислоте N6-(DL-2-амино-2-карбоксиэтил)-L-лизин.
Используемый в данном документе термин "внутримолекулярная связь" относится к ковалентной связи между боковыми цепями аминокислот внутри пептидной последовательности без включения внемолекулярных (экзогенных) структур и исключает химическую обработку, такую как образование дисульфидного мостика (например, посредством реакции восстановления), циклоприсоединение или реакции Стоудингера. В данном документе внутримолекулярная связь может образовываться посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином. В одном варианте осуществления указанный один или несколько дегидратированных остатков представляют собой остатки дегидроаланина (Dha) или дегидробутирина (Dhb). В данном документе внутримолекулярная связь может быть образована посредством лизиноаланинового мостика или тиоэфирного мостика. В одном варианте осуществления настоящего раскрытия внутримолекулярная связь образуется посредством лантионинового мостика. В другом варианте осуществления настоящего раскрытия внутримолекулярная связь образуется посредством метиллантионинового мостика. В одном из вариантов осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются внутри пептидной последовательности. В одном из вариантов осуществления настоящего раскрытия внутримолекулярные связи внутри пептидной последовательности образуют стабилизирующую кольцевую структуру. В одном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются ферментативно. В одном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются при помощи л антипептид синтетазы. В одном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются при помощи циклазы. В одном варианте осуществления указанная цикл аза представляет собой цикл азу типа LanC, или бифункциональный фермент типа LanM, или полифункциональный фермент типа LanKC или LanL. В другом варианте осуществления указанная циклаза типа LanC представляет собой NisC (номер доступа Uniprot: Q03202), SpaC, MibC, РерС, EpiC или их функциональный эквивалент. В другом варианте осуществления указанный бифункциональный фермент типа LanM представляет собой ProcM (номер доступа NP_894083), LctM, MutM, BovM, LanM1/2, CinM, HalM1/2, CyanM1-4 или их функциональный эквивалент. В другом варианте осуществления указанная одна или несколько внутримолекулярных связей образуются неферментативно. В дополнительном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются в щелочных условиях. В другом варианте осуществления указанная одна или несколько внутримолекулярных связей образуются в слабо щелочных условиях. В другом варианте осуществления указанная одна или несколько внутримолекулярных связей образуются в щелочных условиях. В другом варианте осуществления указанные щелочные условия представляют собой рН 7,5, рН 8, рН 8,5, рН 9, рН 9,5, рН 10, рН 10,5, рН 11, рН 11,5, рН 12, рН 12,5, рН 13, рН 13,5 или рН 14. В дополнительном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются ферментативно, например, при помощи лантипептидсинтетазы, и в щелочных условиях.
В данном документе термин "циклический пептид" относится к фрагменту из аминокислот, пептиду или полипептиду, имеющему вторичную структуру, образованную одной или несколькими внутримолекулярными связями. Не весь фрагмент из аминокислот или пептид или полипептид должен быть кольцевым. В одном из вариантов осуществления настоящего раскрытия циклический пептид представляет собой моноциклический или полициклический пептид. В другом варианте осуществления циклический пептид включает пептиды, такие как природные или искусственные пептиды, а также пептиды, которые являются фрагментами или доменами целых белков. В дополнительном варианте осуществления циклический пептид представляет собой амидированный циклический пептид.
Термин "полицикл" или "полициклическая структура" относится к структуре, имеющей по меньшей мере две, три, четыре или пять внутримолекулярных связей. В зависимости от длины пептида, используемого в соответствии с настоящим раскрытием, можно достичь более сложной вторичной структуры пептида.
Термин "предшественник циклического пептида" относится к фрагменту из аминокислот, пептиду или полипептиду, который способен образовывать циклический пептид в соответствии с раскрытием в данном документе. Более конкретно, предшественник циклического пептида в соответствии с настоящим раскрытием содержит по меньшей мере один или несколько остатков серина или треонина и один или несколько остатков цистеина или лизина для образования внутримолекулярной связи.
Термин "дегидратированный остаток" относится к модифицированному аминокислотному остатку, который подвергся химической реакции, связанной с потерей молекулы воды из реагирующей молекулы. В одном варианте осуществления "дегидратированный остаток" представляет собой дегидратированный серии или дегидратированный треонин. В другом варианте осуществления "дегидратированный остаток" представляет собой дегидроаланин (Dha) или дегидробутирин (Dhb). В одном варианте осуществления дегидратацию одного или нескольких остатков серина или треонина осуществляют при помощи лантипептидсинтетазы. В одном варианте осуществления дегидратацию одного или нескольких остатков серина или треонина осуществляют при помощи дегидратазы. В одном варианте осуществления указанную ферментативную дегидратацию осуществляют при помощи дегидратазы типа LanB или при помощи бифункционального фермента типа LanM или полифункционального фермента типа LanKC или LanL. В одном варианте осуществления указанная дегидратаза типа LanB представляет собой NisB (номер доступа Uniprot: Р20103), EpiB, SpaB, MibB, РерВ или их функциональный эквивалент. В другом варианте осуществления указанный бифункциональный фермент типа LanM представляет собой ProcM (номер доступа NP_894083), LctM, MutM, BovM, LanM1/2, CinM, HalM1/2, CyanM1-4 или их функциональный эквивалент.
Используемый в данном документе термин "лидер" или "лидерная последовательность" относится к мотиву распознавания для фермента системы посттрансляционной модификации (РТМ). В одном из вариантов осуществления настоящего раскрытия лидерная последовательность распознается ферментом системы посттрансляционной модификации (РТМ). В одном из вариантов осуществления настоящего раскрытия лидерная последовательность представляет собой последовательность, которая распознается лантипептидсинтетазой. В другом варианте осуществления лидерная последовательность имеет консенсусный мотив, который может быть получен из лидерных последовательностей, которые распознаются ферментом системы посттрансляционной модификации (РТМ). В другом варианте осуществления настоящего раскрытия лидерная последовательность представляет собой последовательность, полученную из пептида-предшественника LanA. В другом варианте осуществления настоящего раскрытия лидерная последовательность имеет консенсусный мотив, который можно получить из пептида-предшественника LanA. В другом варианте осуществления настоящего раскрытия лидерная последовательность представляет собой последовательность, которая распознается дегидратазой типа LanB, циклазой типа LanC и/или бифункциональным ферментом типа LanM или полифункциональным ферментом типа LanKC или LanL.
Используемый в данном документе термин "фермент посттрансляционной модификации" или "РТМ-фермент" относится к ферментам, индуцирующим структурные изменения транслированного пептида, например, специфически модифицирующим природным рибосомальным пептидам в биосинтезе биологически активных пептидов в составе обрабатывающих механизмов. Этот класс включает в себя несколько типов ферментов, в том числе карбоксилат-амин-лигазы, циклазы, дегидрогеназы, циклодегидратазы, декарбоксилазы, эпимеразы, гидроксилазы, пептидазы, дегидратазы, лиазы, киназы, трансферазы, эстеразы, оксигеназы и изомеразы, в частности ферменты, образующие лантиониновые связи, ферменты, образующие цитолизин, ферменты, образующие цианобактин, ферменты, образующие тиопептид, ферменты, образующие конопептид, ферменты, образующие микровиридин, ферменты, образующие циклотид, ферменты, образующие бактериоцин, и ферменты, образующие субтилозин. Предпочтительно, используемые в данном документе РТМ-ферменты являются лантипептидсинтетазами. Предпочтительно, используемые в данном документе РТМ-ферменты представляют собой дегидратазы, циклазы или би- или полифункциональные ферменты, имеющие дегидратазную или лиазную/киназную и циклазную активности. Более предпочтительными РТМ-ферментами, используемыми в данном документе, являются дегидратазы типа LanB, циклазы типа LanC, бифункциональные ферменты типа LanM или полифункциональные ферменты типа LanKC или LanL, или их функциональные эквиваленты.
Термин "функциональный эквивалент" пептида или белка означает нечто, что характеризуется одной или несколькими, предпочтительно по существу всеми, из функций этого пептида или белка. Предпочтительно такие функции представляют собой биологические функции, предпочтительно ферментативные функции, такие как дегидратазная и/или циклазная активность.
Термин "поверхность частицы бактериофага" относится к части частицы бактериофага, которая находится в контакте со средой, в которой содержится частица, и которая доступна. Поверхность определяется белками, входящими в капсид фага (элементы белковой капсида частицы), которая собирается во время производства фага в соответствующих клетках-хозяевах.
Фаговый дисплей описывает технику отбора, при которой библиотека вариантов пептида или белка экспрессируется снаружи вириона фага, тогда как генетический материал, кодирующий каждый вариант, находится внутри. Это создает физическую связь между каждой последовательностью вариантного белка и ДНК, кодирующей ее, что позволяет быстро фракционировать на основе аффинности связывания с данной молекулой-мишенью (антитела, ферменты, рецепторы на клеточной поверхности и т.д.) с помощью процесса отбора in vitro, называемого пэннингом. В своей простейшей форме пэннинг проводят путем инкубации библиотеки "отображаемых" на фаге пептидов на планшете (или шарике), покрытом мишенью, смыва несвязанного фага и элюирования специфически связанного фага. Затем элюированные фаги амплифицируют и проводят через дополнительные циклы связывания/амплификации, чтобы обогатить пул в пользу связывающихся последовательностей. После нескольких раундов отдельные клоны характеризуют с помощью секвенирования ДНК и ELISA.
Термин "фагмида" относится к плазмидному вектору, имеющему бактериальное начало репликации, например, CoIE 1, и копию межгенной области бактериофага. Фагмида может быть на основе любого из известных бактериофагов, включая нитчатый бактериофаг. Плазмида будет также, как правило, содержать селектируемый маркер устойчивости к антибиотикам. Сегменты ДНК, клонированные в эти векторы, можно размножать в виде плазмид. Когда клетки, несущие эти векторы, обеспечивают всеми генами, необходимыми для производства фаговых частиц, характер репликации плазмиды изменяется на репликацию по типу "катящегося кольца" с генерированием копий одной цепи плазмидной ДНК и частиц для упаковки фага. Фагмида может образовывать инфекционные или неинфекционные фаговые частицы. Этот термин включает в себя фагмиды, которые содержат ген белка капсида фага или его фрагмент, связанный с гетерологичным геном полипептида в виде гибрида генов, так что гетерологичный полипептид "отображается" на поверхности фаговой частицы (Sambrooket. al. 417).
Термин "фаговый вектор" относится к двухцепочечной репликативной форме бактериофага, содержащего гетерологичный ген и способного к репликации. Фаговый вектор имеет фаговое начало репликации, дающее возможность репликации фага и образованию фаговых частиц. Фаг представляет собой предпочтительно нитчатый бактериофаг, такой как фаг М 13, fl, fd, Pf3, или их производное, лямбдовидный фаг, такой как лямбда, 21, phi80, phi81. 82, 424. 434 и т.д. или их производное, бакуловирус или его производное, фаг Т4 или его производное, вирус фаг Т7 или его производное. Получение ДНК из клеток означает выделение плазмидной ДНК из культуры клеток-хозяев. Обычно используемые способы получения ДНК представляют собой крупномасштабное и мелкомасштабное производство плазмид, описанное в разделах 125-133 у Sambrook et al. После получения ДНК ее можно очистить способами, хорошо известными из уровня техники, такими как описанные в разделе 140 у Sambrook et al.
Термин "белок капсида" означает белок или по меньшей мере его часть, которая присутствует на поверхности частицы бактериофага. С функциональной точки зрения белок капсида представляет собой любой белок, который связан с частицей бактериофага во время процесса сборки фага в клетке-хозяине и остается связанным с собранным фагом, пока он не заразит другую клетку-хозяина. В случае нитчатого бактериофага указанные белки дикого типа представляют собой белок гена III (pIII), белок гена VI (pVI), белок гена VII (pVII), белок гена VIII (pVIII) и белок гена IX (pIX). Белок капсида может быть основным белком капсида или может быть минорным белком капсида. "Основной" белок капсида представляет собой белок капсида, который присутствует в капсиде фага в 10 копиях белка или более, например, основной белок капсида pVIII. Основной белок капсида может присутствовать в десятках, сотнях или даже тысячах копий на фаг. Минорный белок капсида присутствует в капсиде фага менее чем в 10 копиях на фаг, например, минорный белок капсида pIII.
Термин "белок капсида дикого типа" относится к белкам капсида, образующим капсид фага встречающихся в природе бактериофагов. Последовательности, включая различия между близкородственными представителями нитчатых бактериофагов, такими как fl, fd и М13, хорошо известны специалисту в данной области техники (см., например, Kay et al., 1996). В случае нитчатого бактериофага указанные белки дикого типа представляют собой, например, белок гена III (pIII), белок гена VI (pVI), белок гена VII (pVII), белок гена VIII (pVIII) и белок гена IX (pIX). В одном варианте осуществления настоящее раскрытие относится к способу, где указанный белок капсида представляет собой белок капсида дикого типа бактериофага.
В дополнительном предпочтительном варианте осуществления указанный белок капсида представляет собой усеченный вариант белка капсида дикого типа бактериофага, где указанный усеченный вариант содержит по меньшей мере ту часть указанного белка капсида дикого типа, которая вызывает включение указанного белка капсида в белковый капсид частицы бактериофага.
Термин "усеченный вариант" относится к белкам, полученным из белков дикого типа, упомянутых выше, которые модифицируются путем делеции по меньшей мере части последовательностей дикого типа. Он включает варианты, такие как усеченные варианты белка гена III (pIII) или гена VIII (pVIII), которые были обнаружены у мутантов бактериофагов (Crissman & Smith, 1984) или которые были получены в ходе стандартных способов фагового дисплея (например, Bass et al., 1990; Krebber, 1996). Например, указанный усеченный вариант может состоять из или включать в себя домен СТ белка гена III (pIII) или белка гена VIII (pVIII). Чтобы идентифицировать усеченные варианты в соответствии с настоящим раскрытием, метку для обнаружения можно гибридизировать с вариантом и можно поставить анализ, чтобы определить включается ли этот вариант в капсид фага частиц бактериофага, образованных в присутствии варианта.
В еще одном дополнительном предпочтительном варианте осуществления указанный белок капсида представляет собой модифицированный вариант белка капсида дикого типа бактериофага, где указанный модифицированный вариант способен включаться в белковый капсид частицы бактериофага.
Способы выполнения модификации белка дикого типа в соответствии с настоящим раскрытием хорошо известны специалисту в данной области техники и включают стандартные способы клонирования и/или мутагенеза. Способы для конструирования молекул нуклеиновых кислот, кодирующих модифицированный вариант белка дикого типа, используемый в способе в соответствии с настоящим раскрытием, для конструирования векторов, содержащих указанные молекулы нуклеиновой кислоты, включая конструирование фаговых и/или фагмидных векторов, для введения указанных векторов в надлежащим образом выбранные клетки-хозяева, для инициирования или предоставления возможности экспрессии указанного модифицированного белка хорошо известны в данной области техники (см., например, Sambrook et al., 1989; Ausubel et al., 1999; Kay et al., 1996). Чтобы идентифицировать модифицированные варианты в соответствии с настоящим раскрытием, метку для обнаружения можно гибридизировать с вариантом и можно поставить анализ, чтобы определить, способен к включению или включается ли этот вариант в капсид фага частиц бактериофага, образованных в присутствии варианта.
Еще более предпочтительным является способ, где указанный бактериофаг является нитчатым бактериофагом. Нитчатые бактериофаги, такие как М13, fd или fl, хорошо известны специалисту в данной области техники.
В случае нитчатого бактериофага особенно предпочтительным является способ, где указанный белок капсида частицы бактериофага представляет собой или получен из белка капсида дикого типа pIII.
Кроме того, предпочтительным является способ, в котором указанный белок капсида частицы бактериофага представляет собой или получен из белка капсида дикого типа pIII. Предпочтительно, те части модифицированного белка, которые соответствуют белку дикого типа, характеризуются идентичностью аминокислот, превышающей приблизительно 40%, предпочтительно приблизительно 50%, предпочтительно приблизительно 60%, предпочтительно приблизительно 70%, предпочтительно приблизительно 80%, наиболее предпочтительно приблизительно 90% по сравнению с соответствующей последовательностью дикого типа.
Термин "N-конец" данной полипептидной последовательности представляет собой прилегающий отрезок данной полипептидной последовательности, который начинается с N-концевого остатка данной полипептидной последовательности или вблизи него. N-конец конкретного полипептида можно определять по длине. Аналогично, термин "С-конец" данной полипептидной последовательности представляет собой прилегающий отрезок данной полипептидной последовательности, который заканчивается С-концевым остатком данной полипептидной последовательности или вблизи него. С-конец конкретного полипептида можно определять по длине. В одном варианте осуществления настоящее раскрытие относится к С-концу белка капсида. В предпочтительном варианте осуществления С-конец белка капсида представляет собой аминокислоту или аминокислотную последовательность, расположенную с С-конца от трансмембранного домена указанного белка капсида. В другом варианте осуществления С-конец белка капсида представляет собой аминокислоту или аминокислотную последовательность, расположенную с С-конца от трансмембранного домена указанного белка капсида, где указанный белок капсида представляет собой белок гена III (pIII, SEQ-ID.: 2; Uniprot: Р69168) или белок гена VIII (pVIII; SEQ-ID.: 3; Uniprot: Р69541). В одном варианте осуществления С-конец белка гена III (pIII) представляет собой аминокислотную последовательность LRNKES (SEQ-ID.: 4) или ее производное или модифицированный вариант. В другом варианте осуществления С-конец белка гена III (pIII) располагается с С-конца от трансмембранного домена и содержит одну или несколько аминокислот аминокислотной последовательности LRNKES (SEQ-ID.: 4). В другом варианте осуществления С-конец белка гена VIII (pVIII) представляет собой аминокислотную последовательность TSKAS (SEQ-ID.: 5) или ее производное или модифицированный вариант. В другом варианте осуществления С-конец белка гена VIII (pVIII) располагается с С-конца от трансмембранного домена и содержит одну или несколько аминокислот аминокислотной последовательности TSKAS (SEQ-ID.: 5). Обзорная схема белка гена III (pIII) и белка гена VIII (pVIII) показана на Фигуре 4.
В одном варианте осуществления настоящего раскрытия С-конец элемента белкового капсида присоединен к циклическому пептиду и "отображает" указанный циклический пептид на поверхности частицы бактериофага.
В предпочтительном варианте осуществления частица бактериофага, "отображающая" (поли)пептид/белок, содержит последовательность нуклеиновой кислоты, кодирующую (поли)пептид/белок.
В контексте настоящего раскрытия термин "инициировать или предоставлять возможность экспрессии" описывает культивирование клеток-хозяев в таких условиях, что последовательность нуклеиновой кислоты экспрессируется. Способы для конструирования молекул нуклеиновых кислот, кодирующих (поли)пептид/белок в соответствии с настоящим раскрытием, для конструирования векторов, содержащих указанные молекулы нуклеиновой кислоты, для введения указанных векторов в надлежащим образом выбранные клетки-хозяева, для инициирования или предоставления возможности экспрессии (поли)пептидов/белков хорошо известны в данной области техники (см., например, Sambrook et al., 1989; Ausubel et al., 1999). Дополнительно известны способы для введения генетического материала, необходимые для создания бактериофагов-потомков или частиц бактериофага в соответствующих клетках-хозяевах, а также для инициирования или предоставления возможности создания указанных бактериофагов-потомков или частиц бактериофага (см., например, Kay et al., 1996). Стадия инициирования или предоставления возможности получения частиц бактериофага может потребовать применения соответствующих вспомогательных фагов, например, в случае работы с фагмидами.
В другом варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты в соответствии с настоящим раскрытием.
В дополнительном варианте осуществления настоящее раскрытие относится к клетке-хозяину, содержащей последовательность нуклеиновой кислоты в соответствии с настоящим раскрытием или вектор в соответствии с настоящим раскрытием.
В контексте настоящего раскрытия термин "клетка-хозяин" может представлять собой любое из ряда, обычно используемого для получения гетерологичных белков, включая без ограничения бактерии, такие как Escherichia coli (Ge et al., 1995) или Bacillus subtilis (Wu et al., 1993), грибы, такие как дрожжи (Horwitz et al., 1988; Ridder et al., 1995) или нитевидный гриб (
В еще одном предпочтительном варианте осуществления настоящее раскрытие относится к модифицированному варианту белка капсида бактериофага дикого типа, кодируемого последовательностью нуклеиновой кислоты в соответствии с настоящим раскрытием, вектором в соответствии с настоящим раскрытием или получаемого клеткой-хозяином в соответствии с настоящим раскрытием. Модифицированный вариант может дополнительно содержать аминокислотные остатки, необходимые для клонирования, экспрессии или транспорта белка. Аминокислотные остатки, необходимые для клонирования, могут включать в себя остатки, кодируемые последовательностями нуклеиновых кислот, содержащие последовательности распознавания для рестрикционных эндонуклеаз, которые включены для того, чтобы обеспечить клонирование последовательностей нуклеиновых кислот в соответствующие векторы. Аминокислотные остатки, необходимые для экспрессии, могут включать в себя остатки, приводящие к повышенной растворимости или стабильности (поли)пептида/белка. Аминокислотные остатки, необходимые для транспорта белка, могут включать сигнальные последовательности, ответственные за транспорт модифицированного варианта в периплазму Е. coli, и/или аминокислотные остатки, способствующие эффективному расщеплению указанных сигнальных последовательностей. Дополнительные аминокислотные остатки, необходимые для клонирования, экспрессии, транспорта белка, целей очистки и/или обнаружения, упомянутых выше, представляют собой многочисленные группы, хорошо известные специалисту в данной области техники.
"Генетически разнообразная коллекция частиц бактериофага" также может упоминаться как "библиотека" или "множество". В контексте настоящего раскрытия каждый элемент такой библиотеки "отображает" отдельный элемент библиотеки. В контексте настоящего раскрытия термин "генетически разнообразная коллекция" относится к коллекции из по меньшей мере двух частиц или молекул, которые отличаются по меньшей мере частью их композиций, свойств и/или последовательностей. Например, генетически разнообразная коллекция циклических пептидов представляет собой набор циклических пептидов, которые различаются по меньшей мере в одном аминокислотном положении их последовательности. Такая генетически разнообразная коллекция может быть получена различными способами, например, путем случайного мутагенеза по меньшей мере одного кодона последовательности нуклеиновой кислоты, кодирующей исходный (поли)пептид/белок, с использованием PCR с внесением ошибок для амплификации последовательности нуклеиновой кислоты, кодирующей исходный (поли)пептид/белок, или с использованием штаммов-мутаторов в качестве клеток-хозяев в способе в соответствии с настоящим раскрытием. Эти и дополнительные или альтернативные способы получения генетически разнообразных коллекций пептидов хорошо известны специалисту в данной области техники.
В контексте настоящего раскрытия термин "требуемое свойство" относится к заранее определенному свойству, которым должен характеризоваться один элемент из генетически разнообразной коллекции и которое составляет основу для скрининга и/или отбора генетически разнообразной коллекции. Подобные свойства включают такие свойства, как связывание с мишенью, блокирование мишени, активация опосредованной мишенью реакции, ферментативная активность и другие свойства, известные специалисту. В зависимости от типа требуемого свойства специалист сможет определить формат и необходимые этапы для осуществления скрининга и/или отбора.
Наиболее предпочтительным является способ, где указанное требуемое свойство является связыванием с представляющей интерес мишенью.
Указанная мишень, представляющая интерес, может быть представлена указанной генетически разнообразной коллекцией циклических пептидов, "отображаемых" на частицах бактериофага, различными способами, хорошо известными специалисту, например, покрывающей поверхности для твердофазного биопэннинга, связанной с такими частицами, как магнитные гранулы для биопэннинга в растворе, или отображаемой на поверхности клеток для цельноклеточного биопэннинга или биопэннинга на срезах тканей. Частицы бактериофага, связанные с указанной мишенью, можно выделить различными способами, хорошо известными специалисту, например, путем элюирования соответствующими буферами, либо с использованием градиента рН или соли, либо путем специфического элюирования с использованием растворимой мишени.
Термин "поблизости" относится к фрагменту до 15 или, более предпочтительно, до 10 аминокислот, подсчитываемому в обоих случаях либо с N- или с С-конца указанного (поли)пептида/белка.
Подробное описание и варианты осуществления
Настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
В одном варианте осуществления настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, включающему следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, включающую в себя последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида;
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида;
(c) ферментативная дегидратация одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) образование одной или нескольких внутримолекулярных связей посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
В одном варианте осуществления настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, включающему следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида;
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида;
(c) инициирование или обеспечение возможности ферментативной дегидратации одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) инициирование или обеспечение возможности образования одной или нескольких внутримолекулярных связей посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(е) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
В одном варианте осуществления настоящего раскрытия указанная последовательность нуклеиновой кислоты дополнительно кодирует белок капсида частицы бактериофага и лидерную последовательность, которая распознается ферментом посттрансляционной модификации (РТМ).
В одном варианте осуществления настоящего раскрытия клетка-хозяин дополнительно содержит одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации (РТМ). В другом варианте осуществления настоящего раскрытия клетка-хозяин дополнительно содержит одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации (РТМ), где указанную одну или несколько последовательностей нуклеиновой кислоты искусственно вводят в клетку.
В одном варианте осуществления настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, включающему следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида, и содержащей одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации (РТМ);
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида и указанного одного или нескольких ферментов системы посттрансляционной модификации (РТМ);
(c) ферментативная дегидратация одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) образование одной или нескольких внутримолекулярных связей посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
В одном варианте осуществления настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, включающему следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида и содержащей одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации (РТМ);
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида и указанного одного или нескольких ферментов системы посттрансляционной модификации (РТМ);
(c) инициирование или обеспечение возможности ферментативной дегидратации одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) инициирование или обеспечение возможности образования одной или нескольких внутримолекулярных связей посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
В одном варианте осуществления ферментативная дегидратация на этапе с) вызывается ферментом системы посттрансляционной модификации (РТМ). В одном варианте осуществления образование одной или нескольких внутримолекулярных связей на этапе d) вызывается ферментом системы посттрансляционной модификации (РТМ). В одном варианте осуществления ферментативная дегидратация на этапе с) и образование одной или нескольких внутримолекулярных связей на этапе d) вызывается ферментом системы посттрансляционной модификации (РТМ). В одном варианте осуществления ферментативная дегидратация на этапе с) и образование одной или нескольких внутримолекулярных связей на этапе d) вызывается одним ферментом системы посттрансляционной модификации (РТМ). В другом варианте осуществления ферментативная дегидратация на этапе с) и образование одной или нескольких внутримолекулярных связей на этапе d) вызывается разными ферментами системы посттрансляционной модификации (РТМ). В другом варианте осуществления ферментативная дегидратация на этапе с) вызывается ферментом системы посттрансляционной модификации (РТМ) и одна или несколько внутримолекулярных связей на этапе d) образуются в щелочных условиях. В другом варианте осуществления ферментативная дегидратация на этапе с) вызывается ферментом посттрансляционной модификации (РТМ) и одна или несколько внутримолекулярных связей образуются в щелочных условиях после получения частиц бактериофага в клетке-хозяине.
В одном варианте осуществления настоящего раскрытия указанный фермент системы посттрансляционной модификации (РТМ) представляет собой лантипептидсинтетазу. В другом варианте осуществления настоящего раскрытия указанный фермент системы посттрансляционной модификации (РТМ) представляет собой дегидратазу, циклазу или би- или полифункциональный фермент, содержащий дегидратазную или лиазную/киназную и циклазную активность. В предпочтительном варианте осуществления РТМ-ферментами, используемыми в данном документе, являются дегидратазы типа LanB, циклазы типа LanC, бифункциональные ферменты типа LanM или полифункциональные ферменты типа LanKC или LanL, или их функциональные эквиваленты. В другом варианте осуществления настоящего раскрытия указанный фермент системы посттрансляционной модификации (РТМ) представляет собой дегидратазу или лиазу/киназу и/или циклазу.
В одном варианте осуществления настоящего раскрытия указанный один или несколько дегидратированных остатков представляют собой остатки дегидроаланина (Dha) или дегидробутирина (Dhb).
В одном варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются при помощи лантипептидсинтетазы или в слабо щелочных условиях. В другом варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются при помощи циклазы типа LanC, бифункционального фермента типа LanM или полифункционального фермента типа LanKC или LanL, или в слабо щелочных условиях. В одном варианте осуществления настоящего раскрытия дегидратация аминокислотных остатков и образование внутримолекулярной связи опосредуются ферментами, образующими лантиониновый или метиллантиониониновый мостик.
В одном из вариантов осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются внутри пептидной или полипептидной последовательности. В одном из вариантов осуществления настоящего раскрытия внутримолекулярные связи внутри пептидной или полипептидной последовательности образуют стабилизирующую кольцевую структуру В одном варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются внутри посттрансляционно модифицированных пептидов или полипептидов. В одном варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей образуются внутри пептида или полипептида, содержащего один или несколько дегидратированных остатков. В другом варианте осуществления одна или несколько внутримолекулярных связей образуются внутри пептида или полипептида, который был модифицирован лантипептидсинтетазой. В другом варианте осуществления одна или несколько внутримолекулярных связей образуются внутри пептида или полипептида, который был модифицирован дегидратазой, циклазой или би- или полифункциональным ферментом, содержащим дегидратазную или лиазную/киназную и циклазную активность. В другом варианте осуществления одна или несколько внутримолекулярных связей образуются внутри пептида или полипептида, который был модифицирован дегидратазой типа LanB, циклазой типа LanC, бифункциональным ферментом типа LanM или полифункциональным ферментом типа LanKC или LanL. В другом варианте осуществления дегидратаза типа LanB представляет собой NisB (номер доступа Uniprot: Р20103), EpiB, SpaB, MibB, РерВ или их функциональный эквивалент.В дополнительном варианте осуществления указанный бифункциональный фермент типа LanM представляет собой ProcM из Prochlorococcus MIT 9313 (номер доступа NP_894083) или его близкородственный аналог ProcM из Prochlorococcus MIT 9303 (номер доступа YP_001018107), CyanM1-4 (номера доступа YP_002485891, YP_002483601, YP_002484655, YP_002483742; из Cyanothece sp. PCC 7425), LctM, MutM, BovM, LanM1/2, CinM, HalM1/2 или их функциональный эквивалент.
В одном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются при помощи ферментов, образующих лантиониновые или метиллантиониновые мостики. В одном варианте осуществления указанная одна или несколько внутримолекулярных связей образуются при помощи циклазы. В одном варианте осуществления указанная циклаза представляет собой циклазу типа LanC, бифункциональный фермент типа LanM или полифункциональный фермент типа LanKC или LanL.
В другом варианте осуществления циклаза типа LanC представляет собой NisC (номер доступа Uniprot: Q03202), SpaC, MibC, РерС, EpiC или их функциональный эквивалент. В дополнительном варианте осуществления указанный бифункциональный фермент типа LanM представляет собой ProcM из Prochlorococcus MIT 9313 (номер доступа NP_894083) или его близкородственный аналог ProcM из Prochlorococcus MIT 9303 (номер доступа YP_001018107), CyanM1-4 (номера доступа YP_002485891, YP_002483601, YP_002484655, YP_002483742; из Cyanothece sp. PCC 7425), LctM, MutM, BovM, LanM1/2, CinM, HalM1/2 или их функциональный эквивалент.
В другом варианте осуществления указанная одна или несколько внутримолекулярных связей образуются в слабо щелочных условиях. В другом варианте осуществления указанные слабо щелочные условия представляют собой рН от 7,5 до 11, от 8 до 11, от 9 до 11, от 10 до 11, от 7,5 до 9, от 8 до 9 или от 9 до 10. В другом варианте осуществления указанные слабо щелочные условия представляют собой рН 7,5, рН 8, рН 8,5, рН 9, рН 9,5, рН 10, рН 10,5 или рН 11 или диапазон между каждым из них.
В другом варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей представляют собой тиоэфирные мостики. В другом варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей представляют собой лантиониновые мостики или метиллантиониновые мостики. В другом варианте осуществления настоящего раскрытия одна или несколько внутримолекулярных связей представляют собой лизиноаланиновые мостики.
В одном варианте осуществления настоящего раскрытия циклический пептид представляет собой посттрансляционно модифицированный пептид или полипептид. В другом варианте осуществления циклический пептид представляет собой пептид или полипептид, содержащий тиоэфирный мостик. В другом варианте осуществления циклический пептид представляет собой пептид или полипептид, содержащий лантиониновый мостик, пептид или полипептид, содержащий метиллантиониновый мостик, или пептид или полипептид, содержащий лизиноаланиновый мостик. В другом варианте осуществления настоящего раскрытия циклический пептид является моноциклическим или полициклическим.
В одном варианте осуществления настоящее раскрытие относится к способу дисплея циклического пептида на поверхности частицы бактериофага, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином, при этом способ включает следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, включающую в себя последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида;
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида;
(c) образование одной или нескольких внутримолекулярных связей и
(d) получение частиц бактериофага в указанной клетке-хозяине.
В одном варианте осуществления настоящего раскрытия указанный белок капсида представляет собой белок капсида дикого типа бактериофага. В другом варианте осуществления указанный белок капсида частицы бактериофага представляет собой или получен из белка капсида pIII дикого типа или белка капсида pVIII дикого типа.
В одном варианте осуществления настоящего раскрытия указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага. В другом варианте осуществления указанный циклический пептид и С-конец белка капсида указанной частицы бактериофага физически связаны. В другом варианте осуществления указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага посредством генетической гибридизации или через дисульфидную связь, образованную одним или несколькими искусственно введенными остатками цистеина.
В одном варианте осуществления настоящего раскрытия указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага посредством генетической гибридизации или через дисульфидную связь, образованную одним или несколькими искусственно введенными остатками цистеина. В другом варианте осуществления указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага посредством генетической гибридизации. В другом варианте осуществления настоящего раскрытия указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага через дисульфидную связь, образованную одним или несколькими искусственно введенными остатками цистеина.
В одном варианте осуществления настоящего раскрытия указанный бактериофаг представляет собой нитчатый бактериофаг.
В одном варианте осуществления настоящего раскрытия указанный циклический пептид содержит до 500, до 400, до 300, до 200, до 100, до 90, до 80, до 70, до 60, до 50, до 40, до 30, до 20 или до 10 аминокислот.
В другом варианте осуществления настоящего раскрытия указанный циклический пептид представляет собой амидированный циклический пептид. В дополнительном варианте осуществления указанный амидированный циклический пептид содержит амидный фрагмент на С-конце указанного циклического пептида. В другом варианте осуществления настоящего раскрытия указанный циклический пептид посттрансляционно модифицируют С-концевым амидированием. В другом варианте осуществления за аминокислотой, подлежащей модификации для амидирования, следует глицин, который обеспечивает амидную группу. Амидирование, например, включает первую стадию реакции, на которой глицин окисляется с образованием альфа-гидроксиглицина. Окисленный глицин расщепляется на С-концевой амидированный пептид и N-глиоксилированный пептид. С-концевое амидирование может быть существенным для биологической активности многих пептидов, таких как нейропептиды и гормоны.
В одном варианте осуществления настоящее раскрытие относится к последовательности нуклеиновой кислоты, способной "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота кодирует
(a) белок капсида указанной частицы бактериофага,
(b) лидерную последовательность, которая распознается ферментом системы посттрансляционной модификации (РТМ), и
(c) предшественник циклического пептида,
где предшественник циклического пептида расположен на С-конце белка капсида указанной частицы бактериофага и
где указанный предшественник циклического пептида способен образовывать внутримолекулярную связь посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
В одном варианте осуществления настоящего раскрытия указанная последовательность нуклеиновой кислоты, способная "отображать" циклический пептид на поверхности частицы бактериофага, дополнительно кодирует сигнальную последовательность.
В одном варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, способную "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота кодирует
(a) белок капсида указанной частицы бактериофага;
(b) лидерную последовательность, которая распознается ферментом системы посттрансляционной модификации (РТМ), и
(c) предшественник циклического пептида,
где предшественник циклического пептида расположен на С-конце белка капсида указанной частицы бактериофага и
где указанный предшественник циклического пептида способен образовывать внутримолекулярную связь посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
В одном варианте осуществления настоящее раскрытие относится к последовательности нуклеиновой кислоты, способной "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота имеет следующее расположение компонентов с N-конца к С-концу:
N-(белок капсида фага)-(лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ))-(предшественник циклического пептида)-С.
В одном варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, способную "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота имеет следующее расположение компонентов с N-конца к С-концу:
N-(белок капсида фага)-(лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ))-(предшественник циклического пептида)-С, где N представляет собой N-конец и С представляет собой С-конец.
В одном варианте осуществления настоящее раскрытие относится к последовательности нуклеиновой кислоты, способной "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота имеет следующее расположение компонентов с N-конца к С-концу:
N-(сигнальная последовательность)-(белок капсида фага)-(лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ))-(предшественник циклического пептида)-С.
В одном варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, способную "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота имеет следующее расположение компонентов с N-конца к С-концу:
N-(сигнальная последовательность)-(белок капсида фага)-(лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ))-(предшественник циклического пептида)-С, где N представляет собой N-конец и С представляет собой С-конец.
В другом варианте осуществления настоящего раскрытия вектор дополнительно содержит одну или несколько последовательностей нуклеиновой кислоты, кодирующих сигнал экспорта. В другом варианте осуществления настоящего раскрытия вектор дополнительно содержит одну или несколько последовательностей нуклеиновой кислоты, кодирующих индуцибельный промотор. В одном варианте осуществления настоящее раскрытие относится к клетке-хозяину, содержащей последовательности или векторы нуклеиновых кислот, раскрытые в данном документе.
В другом варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, способную "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота кодирует белок капсида фага, где указанный белок капсида фага кодируется поблизости лидерной последовательности, распознаваемой ферментом системы посттрансляционной модификации (РТМ).
В другом варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, способную "отображать" циклический пептид на поверхности частицы бактериофага, где лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ), кодируется поблизости предшественника циклического пептида.
В дополнительном варианте осуществления настоящее раскрытие относится к вектору, содержащему последовательность нуклеиновой кислоты, где на указанной последовательности нуклеиновой кислоты белок капсида фага кодируется поблизости от лидерной последовательности, распознаваемой ферментом системы посттрансляционной модификации (РТМ) и указанная лидерная последовательность кодируется поблизости предшественника циклического пептида. В одном из вариантов осуществления настоящего раскрытия поблизости относится к 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислоте, кодируемым соответствующими триплетами нуклеиновых кислот.
В другом варианте осуществления указанный предшественник циклического пептида содержит по меньшей мере один или несколько остатков серина или треонина и один или несколько остатков цистеина или лизина для образования одной или нескольких внутримолекулярных связей. В другом варианте осуществления указанный белок капсида частицы бактериофага, кодируемый нуклеиновой кислотой, представляет собой или получен из белка капсида pIII дикого типа или белка капсида pVIII дикого типа.
В одном варианте осуществления настоящее раскрытие относится к частице бактериофага, "отображающей" циклический пептид на своей поверхности, получаемой способом, описываемым в данном документе. В одном варианте осуществления настоящее раскрытие относится к частице бактериофага, "отображающей" циклический пептид на своей поверхности, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь. В одном варианте осуществления настоящее раскрытие относится к частице бактериофага, "отображающей" циклический пептид на своей поверхности, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
В другом варианте осуществления указанные частицы бактериофага дополнительно содержат вектор, содержащий одну или несколько последовательностей нуклеиновой кислоты, кодирующих предшественник циклического пептида, способный образовывать указанный циклический пептид. В другом варианте осуществления указанная частица бактериофага содержит вектор, раскрываемый в данном документе.
В одном варианте осуществления настоящее раскрытие относится к генетически разнообразной коллекции частиц бактериофага, как раскрыто в данном документе. В одном варианте осуществления настоящее раскрытие относится к генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид, который присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь. В другом варианте осуществления каждая из указанных частиц бактериофага "отображает" циклический пептид из генетически разнообразной коллекции циклических пептидов, где указанные циклические пептиды содержат внутримолекулярную связь. В одном варианте осуществления настоящее раскрытие относится к генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид, который присоединен к С-концу белка капсида указанной частицы бактериофага, и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином. В другом варианте осуществления каждая из указанных частиц бактериофага "отображает" циклический пептид из генетически разнообразной коллекции циклических пептидов, где указанные циклические пептиды содержат внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
В одном варианте осуществления настоящее раскрытие относится к способу получения циклического пептида, характеризующегося требуемым свойством, включающему:
(a) обеспечение генетически разнообразной коллекции частиц бактериофага, раскрываемой в данном документе; и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством.
В одном варианте осуществления настоящее раскрытие относится к способу получения циклического пептида, характеризующегося требуемым свойством, включающему:
(а) обеспечение генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид, который присоединен к С-концу белка капсида указанной частицы бактериофага, и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином; и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством.
В одном варианте осуществления настоящего раскрытия указанное требуемое свойство является связыванием с представляющей интерес мишенью.
В другом варианте осуществления настоящее раскрытие относится к способу получения циклического пептида, характеризующегося требуемым свойством, включающему:
(a) обеспечение генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид, который присоединен к С-концу белка капсида указанной частицы бактериофага, и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином; и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством, где этап (b) дополнительно включает:
(ba) приведение в контакт указанной генетически разнообразной коллекции частиц бактериофага с представляющей интерес мишенью;
(bb) элюирование частиц бактериофага, не связывающихся с представляющей интерес мишенью; и
(bc) элюирование частиц бактериофага, связывающихся с представляющей интерес мишенью.
В одном варианте осуществления настоящее раскрытие относится к способу получения циклического пептида, характеризующегося требуемым свойством, включающему:
(a) обеспечение генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид из генетически разнообразной коллекции циклических пептидов, который присоединен к С-концу белка капсида указанной частицы бактериофага, и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином; и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством.
В одном варианте осуществления настоящего раскрытия указанное требуемое свойство является связыванием с представляющей интерес мишенью.
В другом варианте осуществления настоящее раскрытие относится к способу получения циклического пептида, характеризующегося требуемым свойством, включающему:
(a) обеспечение генетически разнообразной коллекции частиц бактериофага, где указанные частицы бактериофага "отображают" циклический пептид из генетически разнообразной коллекции циклических пептидов, который присоединен к С-концу белка капсида указанной частицы бактериофага, и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином; и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством, где этап (b) дополнительно включает:
(ba) приведение в контакт указанной генетически разнообразной коллекции частиц бактериофага с представляющей интерес мишенью;
(bb) элюирование частиц бактериофага, не связывающихся с представляющей интерес мишенью; и
(bc) элюирование частиц бактериофага, связывающихся с представляющей интерес мишенью.
Lan-ферменты
В настоящее время известно несколько ферментов, образующих лантиониновые или металлантиониновые мостики, и их гены:
1. Показано, что дегидратазы типа LanB образуют С-конец фермента, предлагаемого для катализа стадии дегидратации серина и треонина.
2. Циклазы типа LanC катализируют присоединение тиолов цистеина. LanC, циклазный компонент, представляет собой металлопротеин цинка, связанный металл которого был предложен для активации тиольного субстрата для нуклеофильного присоединения.
3. Ферменты типа LanM представляют собой бифункциональные дегидратазы и циклазы. Они отвечают как за дегидратацию, так и за циклизацию пептида-предшественника во время синтеза лантибиотиков.
4. Ферменты типа оксилительной декарбоксилазы LanD катализируют удаление двух восстановительных эквивалентов из цистеинового остатка С-концевого мезолантионана эпидермина с образованием двойной связи ~С==С~.
5. Полифункциональные ферменты типа LanKC содержат лиазный, киназный и циклазный домены, но не имеют характерных цинк-лигандов в циклазном домене.
6. Полифункциональные ферменты типа LanL содержат лиазный, киназный и с металл-содержащим лигандом циклазный домен.
7. Пептидазы типа LanP отщепляют лидерный пептид от лантибиотиков.
8. Пептидаза типа LanT гибридизирована с ABC-транспортером; расщепление пептида-предшественника опосредуется транспортером как часть процесса секреции.
9. Дегидратазы и дегидрогеназы типа LtnM и LtnJ участвуют в образовании D-аланина.
10. Cin X гидроксилирует остатки аспарагина в ходе биосинтеза циннамицина.
Например, при образовании лантибиотиков (антимикробных пептидов, содержащих лантионионовый мостик или метиллантионионовый мостик) ферменты, синтезирующие лантибиотик, описаны как организующиеся в мембраносвязанный комплекс (Siegers et al. 1996. J. Biol. Chem. 271, 12294-12301; Kiesau et al. 1997. J. Bacteriol. 179, 1475-1481; Sahl et al. 1998. Annu. Rev. Microbiol. 52:41-7). Такой комплекс состоит из транспортера лантибиотиков (LanT), дегидратирующего фермента (LanB, также называемого дегидратазой) и циклазы (LanC). В случае некоторых лантибиотиков бифункциональный фермент (LanM) осуществляет обе стадии дегидратации и циклизации. N-концевой лидерный пептид лантибиотика в рибосомально синтезированных пептидах-предшественниках представляет собой сигнал распознавания для лантибиотических ферментов, начиная с дегидратирующего фермента или фермента, который осуществляет как дегидратацию, так и образование кольца. Считается, что лидерный пептид связывается с лантибиотическим комплексом, чтобы привести пептид-предшественник в непосредственную близость к лантибиотическим ферментам. В уровне техники (см., например, WO 2006/062398) раскрыто несколько лидерных пептидов лантибиотиков и их применение, например, в гибридных белках, для получения представляющего интерес пептида, который должен постгрансляционно дегидратироваться дегидратазой. Согласно WO 2006/062398 лидерному пептиду и пептиду, подлежащему модификации, предшествует нелантибиотический сигнал экспорта, подобный сигналу экспорта SEC. Сигнал экспорта и лидерный пептид могут быть разделены последовательностью для привязки в клетке, например мотивом распознавания LPTX-сортазы.
Специалисты могут использовать стратегии сбора данных о геноме для выявления новых лидерных пептидов и их родственных модифицирующих Lan-ферментов, как недавно было подробно описано (Qi Zhang, Xiao Yang, Huan Wang, Wilfred A. van der Donk (2014) ACS Chem. Biol., 2014, 9, 2686-2694). Lan-ферменты характеризуются сходством последовательностей, сходными доменными структурами и высококонсервативными мотивами. Например, некоторые из известных на сегодняшний день Lan-ферментов содержат мотив "CHG" в циклазном домене, который поддерживает связывание иона цинка в активном центре. У других идентифицировали содержание мотива "CCG", который поддерживает координацию Zn2+. С использованием последовательностей и консервативных мотивов Lan-ферментов в качестве запроса можно идентифицировать новые Lan-ферменты в других организмах при помощи поиска BlastP. Как только новый Lan-фермент идентифицирован, легко обнаружить его пептиды-предшественники LanA с родственным субстратом, поскольку они обычно кодируются поблизости в одном и том же геномном кластере и характеризуются короткими открытыми рамками считывания и сходством последовательности с другими LanA.
Лидерная последовательность
Любой тип лидерной последовательности можно использовать для осуществления настоящего раскрытия при условии, что он может распознаваться дегидратазой. В другом варианте осуществления такая лидерная последовательность также распознается циклазой, которая может образовывать лантиониновый или метиллантиониновый мостик. Аминокислотные последовательности лидерных последовательностей доступны из публичных баз данных и публикаций, включая лидерные последовательности и лидерные консенсусные последовательности, как описано в Plat A. et al. 2013 Curr. Protein Pept. Sci. 2013 Mar; 14(2):85-96 и Plat A. et al.; Appl. Environ. Microbiol. 2011 Jan; 77(2):604- 11.
В одном варианте осуществления указанная лидерная последовательность представляет собой лидерную последовательность или несет ее консенсусный мотив, который распознается дегидратазой типа LanB, циклазой типа LanC, бифункциональным ферментом типа LanM или полифункциональным ферментом типа LanKC или LanL.
В другом варианте осуществления лидерная последовательность по настоящему раскрытию несет лидерную последовательность из пептида-предшественника LanA или консенсусный мотив, который можно получить из выравнивания аминокислотной последовательности известных лидерных последовательностей, полученных из пептидов-предшественников LanA. В дополнительном варианте осуществления указанная лидерная последовательность представляет собой лидерную последовательность из пептида-предшественника LanA, или является лидерной последовательностью, полученной из пептида-предшественника LanA, или является лидерной последовательностью, которая несет консенсусный мотив из пептидов-предшественников LanA, и где указанная лидерная последовательность распознается лантипептидсинтетазой. В дополнительном варианте осуществления указанная лидерная последовательность представляет собой лидерную последовательность из пептида-предшественника LanA, или является лидерной последовательностью, полученной из пептида-предшественника LanA, или является лидерной последовательностью, которая несет консенсусный мотив из пептидов-предшественников LanA, и где указанная лидерная последовательность распознается дегидратазой типа LanB, циклазой типа LanC, бифункциональным ферментом типа LanM или полифункциональным ферментом типа LanKC или LanL.
Аминокислотные последовательности пептидов-предшественников LanA доступны из публичных баз данных и включают следующие пептиды-предшественники LanA:
NisA (низин, Lactococcus lactis)
ProcA (прохлорозин, Prochlorococcus marinus MIT9313; Prochlorococcus marinus MIT9303)
SpaS (субтилин; Bacillus subtilis ATCC 6633)
LctA (лактицин 481; Lactococcus lactis подвида lactis)
MutA (мутации II, Streptococcus mutans)
MibA (микробиспорицин, Microbispora corallina)
BovA (бовицин HJ50; Streptococcus bovis HJ50)
LanA 1/2 (лихеницидин, Bacillus licheniformis)
CinA (циннамицин, Streptomyces cinnamoneus cinnamoneus DSM 40005)
HalAl/2 (галодурацин, Bacillus halodurans)
CyanA (не назван, Cyanothece sp. PCC 7425)
Pep5 (Staphylococcus epidermidis)
EpiA (эпидермин, Staphylococcus epidermidis)
В Таблицах 1A и 1B из WO 2006/062398 показаны примерные выравнивания таких лидерных пептидов. Специалист сможет получить консенсусный мотив из выравненных последовательностей, например, используя публичное или коммерчески доступное программное обеспечение для выравнивания, такое как AlignX то Vector NTI. Предпочтительно, чтобы консенсусный мотив лидерной последовательности был получен из выравнивания по меньшей мере 5, более предпочтительно по меньшей мере 10, наиболее предпочтительно по меньшей мере 15 известных лидерных пептидных последовательностей. Полученный таким образом консенсусный мотив впоследствии можно проверить на активность лидерного пептида, т.е. на распознавание дегидратазой и дегидратацию серина или треонина с использованием способов, известных в данной области. Дегидратацию заданной последовательности-мишени можно контролировать с помощью Maldi-TOF MS.
Консенсусная последовательность лидерного пептида может включать различные консенсусные последовательности, например, консенсусный мотив X1-D/E-E-V/L-S/T-D/E-X2 -E-L-D/E, где X1 представляет собой любую гидрофобную аминокислоту и где Х2 представляет собой любую аминокислоту. Например, она включает последовательность LEEVSEQELD (SEQ-ID.: 7). В другом варианте осуществления лидерная последовательность включает консенсусный мотив F-D/E/N-L-D/E/N-X3, где Х3 представляет собой L, I или V. Например, она включает последовательность LFDLDL (SEQ-ID.: 8) или FNLDV (SEQ-ID.: 9). Лидер может, например, также содержать консенсус I/L-L/F-D/E/N-L-Q-D/N/A/S/T-L/M-D/E, включающий ILELQNLD (SEQ-ID.: 10). Лидерный пептид может состоять из консенсусной последовательности, например FNLDV (SEQ-ID.: 9), в сопровождении спейсерной последовательности между консенсусной последовательностью и пептидом-предшественником, подлежащим модификации. Эта спейсерная последовательность приводит часть, подлежащую модификации, в пределы досягаемости каталитического центра соответствующих ферментов (Annechien Plat, Leon D. Kluskens, Anneke Kuipers, Rick Rink, Gert N. Moll (2010). N-концевой домен и спейсер достаточны для функциональности лидерного пептида низина. Appl. Environ. Microbiol. 77, 604-611).
Многие лидерные пептиды LanA класса II относятся к семействам N11P, TIGR03898 и N11P на основании сходства последовательности, тогда как другие представители в настоящее время не имеют распределения по семействам. В другом варианте осуществления лидерная последовательность получена из лидера ProcA, который в настоящее время включает 29 высококонсервативных представителей, кодируемых в Prochlorococcus MIT 9313, и еще 15 представителей, кодируемых в Prochlorococcus MIT 9303, все из которых относятся к семейству лидерных пептидов N11P и являются субстратами одного модифицирующего фермента ProcM, кодируемого в родственных штаммах. Большинство лидерных последовательностей ProcA являются необычно длинными (более 60 аминокислот) и не имеют четкой минимальной консенсусной последовательности вследствие общей высокой консервативности. Однако N-концевое усечение исходной лидерной последовательности из 63 остатков ProcA2.8 до версии из 23 остатков полностью поддерживает опосредованную ProcM ферментативную модификацию пептида-предшественника, которая указывает, что большие части лидерной последовательности являются несущественными и что можно легко получить функциональные минимальные последовательности.
В другом варианте осуществления лидерная последовательность представляет собой лидерную последовательность NisA (низин, Lactococcus lactis) или лидерную последовательность ProcA (прохлорозин, Prochlorococcus marinus MIT9313 или Prochlorococcus marinus MIT9303) или несет консенсусный мотив, который можно получить из лидерной последовательности NisA или ProcA.
Дополнительные варианты осуществления, раскрытые в данном документе:
1. Способ дисплея циклического пептида на поверхности частицы бактериофага, включающий следующие этапы:
(a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида;
(b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида;
(c) ферментативная дегидратация одного или нескольких аминокислотных остатков в предшественнике циклического пептида;
(d) образование одной или нескольких внутримолекулярных связей посредством связывания указанного одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и
(e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к С-концу белка капсида указанных частиц бактериофага.
2. Способ по варианту осуществления 1, где указанная последовательность нуклеиновой кислоты дополнительно кодирует белок капсида частицы бактериофага и лидерную последовательность, которая распознается ферментом посттрансляционной модификации (РТМ).
3. Способ по любому из предыдущих вариантов осуществления, где клетка-хозяин дополнительно содержит одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации (РТМ).
4. Способ по любому из вариантов осуществления 2-3, где указанный фермент системы посттрансляционной модификации (РТМ) представляет собой лантипептидсинтетазу.
5. Способ по любому из вариантов осуществления 2-4, где указанный фермент системы посттрансляционной модификации (РТМ) представляет собой дегидратазу типа LanB, циклазу типа LanC, и/или бифункциональный фермент типа LanM, или полифункциональный фермент типа LanKC или LanL.
6. Способ по любому из вариантов осуществления 2-5, где указанная лидерная последовательность представляет собой лидерную последовательность из пептида-предшественника LanA, или является лидерной последовательностью, полученной из пептида-предшественника LanA, или является лидерной последовательностью, которая несет консенсусный мотив из пептида-предшественника LanA.
7. Способ по варианту осуществления 6, где указанная лидерная последовательность распознается дегидратазой типа LanB, циклазой типа LanC, бифункциональным ферментом типа LanM или полифункциональным ферментом типа LanKC или LanL.
8. Способ по любому из вариантов осуществления 2-7, где указанная лидерная последовательность представляет собой лидерную последовательность NisA или ProcA или несет их консенсусный мотив.
9. Способ по любому из предыдущих вариантов осуществления, где одна или несколько внутримолекулярных связей образуются при помощи циклазы или в слабо щелочных условиях.
10. Способ по любому из предыдущих вариантов осуществления, где дегидратированные остатки представляют собой дегидроаланин (Dha) или дегидробутирин (Dhb).
11. Способ по любому из предыдущих вариантов осуществления, где внутримолекулярная связь представляет собой тиоэфирный или лизиноаланиновый мостик.
12. Способ по любому из предыдущих вариантов осуществления, где указанный белок капсида представляет собой белок капсида дикого типа бактериофага.
13. Способ по варианту осуществления 12, где указанный белок капсида частицы бактериофага представляет собой или получен из белка капсида pIII дикого типа или белка капсида pVIII дикого типа.
14. Способ по любому из предыдущих вариантов осуществления, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага посредством генетической гибридизации или через дисульфидную связь, образованную одним или несколькими искусственно введенными остатками цистеина.
15. Последовательность нуклеиновой кислоты, способная "отображать" циклический пептид на поверхности частицы бактериофага, где нуклеиновая кислота кодирует
(a) белок капсида указанной частицы бактериофага;
(b) лидерную последовательность, которая распознается ферментом системы посттрансляционной модификации (РТМ), и
(c) предшественник циклического пептида,
где нуклеиновая кислота, кодирующая предшественник циклического пептида, расположена с С-конца белка капсида указанной частицы бактериофага, и где указанный предшественник циклического пептида способен образовывать внутримолекулярную связь посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
16. Последовательность нуклеиновой кислоты по варианту осуществления 15, имеющая следующее расположение компонентов от N-конца к С-концу:
N - (белок капсида фага) - (лидерная последовательность, распознаваемая ферментом системы посттрансляционной модификации (РТМ)) - (предшественник циклического пептида) - С.
17. Последовательность нуклеиновой кислоты по вариантам осуществления 15-17, где указанная лидерная последовательность представляет собой лидерную последовательность из пептида-предшественника LanA, или является лидерной последовательностью, полученной из пептида-предшественника LanA, или является лидерной последовательностью, которая несет консенсусный мотив из пептида-предшественника LanA.
18. Последовательность нуклеиновой кислоты по любому из вариантов осуществления 15-17, где предшественник циклического пептида содержит по меньшей мере один или несколько серинов или треонинов и один или несколько остатков цистеина или лизина.
19. Вектор, содержащий нуклеиновую кислоту по вариантам осуществления 15-18.
20. Клетка-хозяин, содержащая последовательность нуклеиновой кислоты по любому из вариантов осуществления 15-18 или вектор по варианту осуществления 19.
21. Частица бактериофага, "отображающая" на своей поверхности циклический пептид, получаемый способом по любому из вариантов осуществления 1-14.
22. Частица бактериофага, "отображающая" циклический пептид на своей поверхности, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага и где указанный циклический пептид содержит внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
23. Частица бактериофага по вариантам осуществления 21 или 22, дополнительно включающая вектор, содержащий одну или несколько последовательностей нуклеиновой кислоты, кодирующих предшественник циклического пептида, способный образовывать указанный циклический пептид.
24. Частица бактериофага по варианту осуществления 23, где указанный вектор представляет собой вектор по варианту осуществления 19.
25. Генетически разнообразная коллекция частиц бактериофага по любому из вариантов осуществления 21-24, где каждая из указанных частиц бактериофага "отображает" циклический пептид из генетически разнообразной коллекции циклических пептидов, где указанные циклические пептиды содержат внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином.
26. Способ получения циклического пептида, характеризующегося требуемым свойством, включающий:
(a) обеспечение генетически разнообразной коллекции частиц бактериофага по варианту осуществления 25 и
(b) скрининг указанной генетически разнообразной коллекции и/или отбор из указанной генетически разнообразной коллекции с получением по меньшей мере одной частицы бактериофага, "отображающей" циклический пептид, характеризующийся указанным требуемым свойством.
27. Способ по варианту осуществления 26, где указанное требуемое свойство является связыванием с представляющей интерес мишенью.
Демонстрационные примеры
Пример 1. Гетерологичная экспрессия растворимых пептидов с тиоэфирными мостиками в Е. coli и подтверждение статуса модификации с посредством анализов с использованием репортерных генов и расщеплением, опосредованным фактором Ха
В следующем Примере все эксперименты по молекулярной биологии осуществляют в соответствии со стандартными протоколами (Ausubel et al, 1999).
Построение векторов и растворимая экспрессия модельных пептидов (пептид, содержащий сайт расщепления для фактора Ха):
Гетерологичная экспрессия лантибиотиков с тиоэфирными мостиками в Е. coli была недавно описана и достигалась путем совместной экспрессии пептидов-предшественников с родственными модифицирующими ферментами (Shi et al., J Am Chem Soc. 2011 Mar 2; 133(8):2338-41). Авторы данного изобретения разработали репортерные пептиды, которые позволяют быстро оценивать их статус модификации в сложных биологических образцах и требуют только минимальных количеств материала. Эти пептиды состоят из лидерного пептида (например, полученного из NisA, ProcA и других), гибридизированного с искусственным основным пептидом, который содержит сайт расщепления для протеазы - фактора Ха, фланкированный остатками субстрата для ферментативной установки тиоэфирного мостика и двумя аффинными метками (такими как метки His6 и FLAG) для обнаружения.
Последовательности ДНК, кодирующие эти пептиды, клонировали под контролем индуцируемого IPTG Lac-промотора в экспрессионную плазмиду Е. coli, несущую ген устойчивости к ампициллину и начало репликации ColE1. Полученные плазмиды объединяли с совместимой второй плазмидой (устойчивость к хлорамфениколу, начало репликации RSF1030), кодирующей родственные ферменты (лантипептидсинтетазы) для посттрансляционной модификации (например, NisB/NisC, ProcM и другие) под контролем индуцируемого IPTG PLlacO1-промотора, и совместно поддерживали в одной и той же клетке штаммов Е. coli. При совместной индукции IPTG в штаммах Е. coli образуются линейные пептиды-предшественники и затем подвергаются ферментативно опосредованной РТМ-модификации, которая приводит к ковалентной связи остатков субстрата, фланкирующих сайт расщепления для фактора Ха и образованию стабильного тиоэфирного мостика.
После экспрессии обработка пептидов с помощью протеазы - фактора Ха приводит к гидролизу пептидной связи между аргинином сайта распознавания и смежным остатком. Однако вместо получения двух отдельных полипептидов, каждый из которых содержит одну из аффинных меток, фланкирующих сайт расщепления, стабильный тиоэфирный мостик удерживает два полипептида, включая обе аффинные метки, соединенными.
Соответственно, совместное обнаружение двух аффинных меток после расщепления, опосредованного фактором Ха, в фермент-связанных иммуносорбентных сэндвич-анализах (ELISA) может поэтому использоваться для подтверждения требуемой модификации (циклизации) модельных пептидов, тогда как для немодифицированных пептидов (линейных) обнаруживается только одна из двух меток.
Достоверность данного анализа с использованием репортерных генов и расщеплением, опосредованным фактором Ха при контроле статуса модификации модельных пептидов проиллюстрирована ниже (Фиг. 1). Модельный пептид, содержащий сигнальную последовательность ompA, гибридизированную с лидерным пептидом NisA и основным пептидом, содержащим метки His6 и FLAG, фланкирующие ASWIEGRWCN (SEQ-ID.: 1) последовательность (с S и С, представляющими собой субстраты для ферментативно опосредованной установки тиоэфирного мостика; IEGR: мотив распознавания для фактора Ха) экспрессировали в присутствии или в отсутствие совместной экспрессии с модифицирующими ферментами NisB и NisC в Е. coli MC1061F':
В качестве контрольной модификации непригодные мутантные пептиды (мутации S на А или С на А) с аналогичной в другом отношении последовательностью экспрессировали в присутствии или в отсутствие NisB и NisC.
Все штаммы выращивали при 37°С, 220 об./мин до ранней логарифмической фазы, экспрессию пептида и фермента индуцировали путем добавления 0,25 мМ IPTG и выращивание культур продолжали в течение ночи при 22°С. Получали клеточные лизаты и растворимую белковую фракцию каждого штамма переносили в четырех повторах на покрытые IgG против His 384-луночные планшеты для захвата экспрессируемых модельных пептидов с помощью His6-метки. После промывки (4xTBS, 1х реакционный буфер для фактора Ха) одну из дублирующих проб каждого образца гидролизовали с помощью 500 нМ протеазы - фактора Ха в течение ночи, тогда как другие дублирующие пробы оставались необработанными. После промывки планшета TBST добавляли биотинилированный IgG против FLAG и обнаруживали интактные пептиды с использованием конъюгата стреотавидин:SULFO-TAG (электрохемилюминесценцию измеряли при помощи Meso Scale Discovery SECTOR Imager 6000). Сигналы, полученные без обработки фактором Ха, устанавливали на 100% (вход) и рассчитывали соотношение сигнала для того же образца после обработки фактором Ха (сигнал, оставшийся после обработки Ха [%]). Полученные для этого значения отражают процентное содержание пептида, устойчивого к опосредованному фактором Ха расщеплению, и являются прямым показателем эффективности образования тиоэфирного мостика.
Как показано на Фигуре 1, приблизительно 60% устойчивых к расщеплению пептидов получают при совместной экспрессии с ферментами NisB и NisC, тогда как пептиды, полученные в отсутствие модифицирующих ферментов, расщепляются практически полностью (левая панель). В отличие от этого пептидные варианты, содержащие мутации S на А (средняя панель) или С на А (правая панель), которые не являются субстратами для ферментативного образования тиоэфирных мостиков, полностью расщепляются фактором Ха, даже если они получены при совместной экспрессии с NisB и NisC.
Пример 2. С-концевой гибрид пептидов-предшественников, содержащих NisA-лидер, с pIII поддерживает ферментативное образование тиоэфирных мостиков в клетке-продуценте и дисплей на фаге
В большинстве применений фагового дисплея представляющий интерес белок или пептид генетически гибридизируют с N-концами g3p (минорный белок капсида pIII) или g8p (основной белок капсида pVIII), что приводит к моновалентному или поливалентному дисплею, соответственно. N-концы pIII и pVIII направлены от тела фаговых частиц, что, как полагают, поддерживает доступность "отображаемого" белка или пептида для связывания с предполагаемым лигандом, представляющим интерес.
Однако в дополнение к широко применяемому дисплею белков, представляющих интерес, на N-концах, были описаны редкие примеры фагового дисплея на соответствующих С-концах как pIII, так и pVIII (Fuh et al., FEBS Lett. 2000 Sep 1; 480(2-3):231-4; Held et al., J Mol Biol. 2004 Jul 9; 340(3):587-97.).
Для дисплея циклизированного модельного пептида на фагах одни и те же содержащие NisA-лидер последовательности модельных пептидов-предшественников, показанные на Фигуре 1, клонировали в фагмидные векторы в виде генетических гибридов как с N-, так и с С-концами фага g3p (N-концевой усеченный вариант pIII-СТ) для проверки ферментативной модификации пептида и совместимости с дисплеем на фаговых частицах.
Авторы данного изобретения получали фаговые частицы, кодирующие эти гибриды, в присутствии, либо в отсутствие совместной экспрессии с родственными модифицирующими ферментами и подвергали их анализам с использованием репортерных генов и расщеплением, опосредованным фактором Ха.
Коротко, клетки Е. coli MC1061F', несущие экспрессионные плазмиды для N- или С-концевых гибридов модельных пептидов-предшественников (содержащих NisA-лидер) с pIII, выращивали в трех повторах в присутствии или в отсутствие второй экспрессионной плазмиды, кодирующей модифицирующие ферменты NisB и NisC. Культуры выращивали в 24-луночных планшетах до ранней логарифмической фазы при 37°С, 220 об./мин. и заражали хелперным фагом VCSM13 при множественности заражения ~10. После инфицирования клетки собирали путем центрифугирования, экспрессию pIII-гибридов и модифицирующих ферментов индуцировали средами, содержащими IPTG, и продолжали получение фага в течение 16 часов при 22°С. После удаления клеток-продуцентов путем центрифугирования супернатант, содержащий фаг, переносили в четырех повторах в покрытые IgG против М13 (Santa Cruz) 384-луночные планшеты для захвата фаговых частиц через основной белок капсида pVIII.
После промывки (4xTBS, 1х реакционный буфер для фактора Ха) образцы одной дублирующей пробы гидролизовали с помощью 500 нМ протеазы - фактора Ха в течение ночи, тогда как другие дублирующие пробы оставались необработанными.
После промывки планшета TBST добавляли биотинилированный IgG против FLAG (Sigma; для N-концевых pIII-гибридов) или биотинилированный IgG против His (R&D Systems; для С-концевых pIII-гибридов) и обнаруживали интактные пептиды с использованием конъюгата стрептавидин:SULFO-TAG (электрохемилюминесценцию измеряли при помощи Meso Scale Discovery SECTOR Imager 6000). Сигналы, полученные без обработки фактором Ха, устанавливали на 100% (вход) и рассчитывали соотношение сигнала для того же образца после обработки фактором Ха (сигнал, оставшийся после обработки Ха [%]). Полученные для этого значения отражают процентное содержание пептида, устойчивого к опосредованному фактором Ха расщеплению, и являются прямым показателем эффективности образования тиоэфирного мостика.
Как показано на Фигуре 2А, совместная экспрессия с ферментами NisB и NisC во время получения фага приводит к ферментативной модификации с тиоэфирными мостиками пептидов-предшественников, гибридизированных с С-концом pIII, и последующему дисплею циклических пептидов на поверхности фага (левая панель). В отличие от этого, гибридизация того же пептида-предшественника с N-концом pIII не приводила к опосредованной NisB/NisC модификации, и никакие циклические пептиды не могли быть обнаружены на фаге (правая панель). Этот вывод дополнительно подтверждается результатами, полученными с использованием растворимо экспрессированного мальтозосвязывающего белка (МВР) в качестве носителя гибрида пептида-предшественника, где пептидные гибриды с С-концом были ферментативно модифицированы (Фигура 2С, левая панель), тогда как NisB/NisC не могли модифицировать N-концевые гибриды (Фигура 2С, правая панель; подготовка образцов и постановка анализа по существу как описано в Примере 1). В контексте С-концевых гибридов пептидов-предшественников с pIII мутация остатков, участвующих в образовании тиоэфирных мостиков, например, серина на аланин (pIII-NisA- Рер_А/С; Фигура 2В, левая панель) или цистеина на аланин (pIII-NisA-Pep_S/A; Фигура 2В, правая панель), отменяет образование и дисплей циклических пептидов, что дополнительно подчеркивает достигнутую точность заданной пептидной модификации.
Пример 3. Фаговый дисплей на С-конце pIII для посттрансляционно модифицированных пептидов широко применим и может быть перенесен на другие ферментативные системы
Описанный подход дисплея посттрансляционно модифицированных пептидов на С-конце структурных белков фага можно легко адаптировать к другим ферментативным или полуферментативным системам модификации, как описано ниже. В другом примере модельный пептид-предшественник гибридизировали с С-концом pIII (плазмида: pL3C_P3.3_mutl0-His), который содержит лидерный пептид прохлорозин 3.3 (ProcA3.3) и последовательность основного пептида

Ген procM из Prochlorococcus MIT9313, кодирующий бифункциональную дегидратазу/циклазу, которая, как известно, модифицирует некоторые природные предшественники прохлорозина (включая ProcA3.3), амплифицировали из хромосомной ДНК и клонировали в експрессионную плазмиду Е. coli. Фаг, "отображающий" модельные пептиды-предшественники, получали в присутствии или в отсутствие совместной экспрессии с ферментом ProcM и подвергали анализам с использованием репортерных генов и расщеплением, опосредованным фактором Ха, как описано выше. Устойчивые к обусловленному Ха расщеплению пептидные гибриды обнаружены для вариантов с содержащей серин/цистеин (ProcA-Pep_S/C-pIII; Фигура 3, левая панель) и треонин/цистеин (ProcA-Рер_Т/С-pIII; Фигура 3, средняя панель) основной последовательностью при получении в присутствии биспецифического модифицирующего фермента ProcM, что указывает на образование и дисплей циклических пептидов, содержащих лантионины и метиллантионины, соответственно. Кроме того, образование/дисплей циклических пептидов отменялось, когда цистеин, участвующий в образовании тиоэфирных мостиков мутировали до аланина (ProcA-Pep_S/A-pIII; Фигура 3, правая панель).
Пример 4. Фаговый дисплей на С-конце pIII для посттрансляционно модифицированных пептидов с гибкими размерами циклов
С-концевые pIII-пептидные гибриды с заданными размерами циклов можно "отобразить" на фаге, регулируя расстояние между остатками серина и треонина относительно цистеина, требуемого для ферментативной модификации. В другом примере последовательности, кодирующие модельные пептиды-предшественники с увеличенным расстоянием между серином и цистеином, устанавливали и гибридизировали с С-концом pIII. В данном документе лидерный пептид NisA, за которым следует FLAG-метка и либо


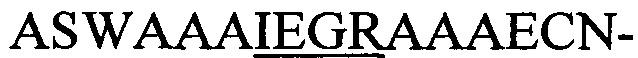




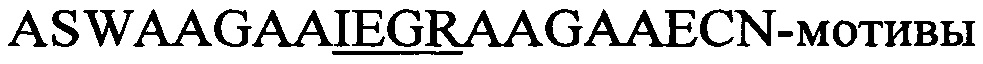
Рабочие примеры демонстрируют ферментативную посттрансляционную модификацию пептидов, содержащих лидерную последовательность, гибридизированных с С-концом pIII фага в Е. coli, и последующий дисплей на фаговых частицах. Аналогичные результаты следует ожидать для С-концевых гибридов пептидов-предшественников с основным белком капсида фага pVIII.
Широкая применимость раскрытого в данном документе подхода очевидна, так как различные пары ферментативных механизмов/лидерных пептидов, происходящих даже из отдаленно родственных видов, таких как молочнокислые и цианобактерии, можно эффективно использовать для установки посттрансляционных модификаций.
По аналогии, эту концепцию можно распространить на другие пептиды-предшественники/ферментативные системы, которые являются функционально эквивалентными.
Таким образом, посттрансляционная дегидратация сериновых и треониновых остатков до химически высоко реакционноспособного дегидроаланина и дегидробутирина, соответственно, с помощью дегидратаз, таких как NisB, или бифункциональных ферментов, таких как ProcM, и образование циклических пептидов с помощью циклаз, таких как NisC, или бифункциональных ферментов, таких как ProcM, доказали свою совместимость с фаговым дисплеем.
В качестве альтернативы, в мягких щелочных условиях отображаемые на фаге пептиды, содержащие дегидроаланины, могут быть легко подвергнуты взаимодействию с соседними остатками цистеина или лизина с образованием тиоэфирных и лизоаланиновых мостиков, соответственно, для образования множества ограниченных полипептидных структур, "отображаемых" на фаговых частицах.
Реферат
Изобретение относится к биотехнологии. Описан способ дисплея циклического пептида на поверхности частицы бактериофага, включающий следующие этапы: (a) обеспечение клетки-хозяина, содержащей последовательность нуклеиновой кислоты, кодирующую предшественник циклического пептида; последовательность нуклеиновой кислоты, кодирующую белок капсида частицы бактериофага; лидерную последовательность, которая распознается ферментом системы посттрансляционной модификации (PTM); и одну или несколько последовательностей нуклеиновой кислоты, кодирующих фермент системы посттрансляционной модификации, который представляет собой лантипептидсинтетазу; (b) инициирование или обеспечение возможности экспрессии указанного предшественника циклического пептида; (c) ферментативная дегидратация одного или нескольких аминокислотных остатков в предшественнике циклического пептида; (d) образование одной или нескольких внутримолекулярных связей посредством связывания указанного одного или нескольких дегидратированных остатков с цистеином или лизином, за счет чего образуется циклический пептид; и (e) получение частиц бактериофага в указанной клетке-хозяине, где указанные частицы бактериофага "отображают" указанный циклический пептид на поверхности, и где указанный циклический пептид присоединен к C-концу белка капсида указанных частиц бактериофага. Изобретение также относится к молекуле нуклеиновой кислоты, которая "отображает" циклический пептид на поверхности частицы бактериофага, где эта нуклеиновая кислота кодирует (a) белок капсида указанной частицы бактериофага; (b) лидерную последовательность, которая распознается ферментом системы посттрансляционной модификации (PTM), и (c) предшественник циклического пептида, где нуклеиновая кислота, кодирующая предшественник циклического пептида, расположена с С-конца белка капсида указанной частицы бактериофага, и где указанный предшественник циклического пептида способен образовывать внутримолекулярную связь посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином. Описана частица бактериофага, "отображающая" на своей поверхности циклический пептид, получаемый указанным выше способом, где указанный циклический пептид присоединен к С-концу белка капсида указанной частицы бактериофага. Кроме того, представлена генетически разнообразная библиотека частиц бактериофага по п. 11, где каждая из указанных частиц бактериофага "отображает" циклический пептид из генетически разнообразной библиотеки циклических пептидов, где указанные циклические пептиды содержат внутримолекулярную связь, образованную посредством связывания одного или нескольких дегидратированных остатков с цистеином или лизином. Изобретение расширяет арсенал фаговых дисплеев. 6 н. и 7 з.п. ф-лы, 5 ил., 4 пр.

Комментарии