Производные гликопептида или их соли, способ получения, фармацевтическая композиция - RU2145609C1
Код документа: RU2145609C1
Чертежи



























Описание
Существует постоянная потребность в новых усовершенствованных антибиотиках, в частности антибиотиков для лечения заболеваний человека. Повышенная активность, расширенный спектр ингибируемых бактерий, повышенная эффективность in vivo и улучшенные фармацевтические свойства - вот некоторые цели совершенствования антибиотиков.
В поисках новых антибиотиков, где только это было возможно, предпринимались попытки структурно модифицировать известные антибиотики. Гликопептидные антибиотики обладают столь сложным строением, что даже небольшие изменения в них затруднены. Кроме того, трудно предсказать, какой эффект окажут такие изменения на противомикробные и физиологические свойства. Таким образом, способы модификации известных антибиотиков и новые активные производные, полученные этими способами, и в настоящее время имеют большое значение.
Ранее были получены N-алкильные и N-ацильные производные таких гликопептидов, как ванкомицин, A51568A, A51568B, M43A и M43 (патенты США NN 4639433, 4643987 и 4698327). Некоторые из полученных соединений показали микробиологическую активность, в том числе активность и по отношению к устойчивым к ванкомицину изолятам. Nicas и др., Antimicrobial. Agents and Chemotherapy 33(9), 1477-1481 (1989). Кроме того, в заявке на Европейский патент, N публикации 0435503, опубликована 3 июля 1993 г. описаны определенные N-алкильные и N-ацильные производные A82846 гликопептидов, факторов A, B и C.
Соединения формулы 1 настоящего изобретения являются новыми членами группы гликопептидных антибиотиков. Эти новые соединения являются производными известных гликопептидных антибиотиков, в том числе: ванкомицина (патент США 3067099); А82846А, А82846В, А82846С (патент США 5312738, Европейская заявка, публикация 256071 A1); PA-42867 факторы A, C и D (патент США 4946941 и Европейская заявка, публикация 231,111 A2); A83850 (патент N 5187082); авопарцин (патент США 3338786 и патент США 4322343); актиноидин, известный также под шифром K288 (J. Antibiotics серия A, 14, 141 (1961)); хелевекардин (Chem. Abstracts 110, 17188 (1989) и заявка на патент Японии 89/221, 320) и M 47767 (Европейский патент, публикация 339982). Вышеперечисленные ссылки, в которых описаны указанные гликопептиды, включены в данное описание в качестве ссылок.
Enterococci относится к важным патогенам человека. Вызываемые Enterococci инфекции с трудом поддаются лечению. Гликопептиды, например: ванкомицин и тейкоплантин стали важными средствами лечения инфекций, вызванных Enterococci. Однако недавно выделены штаммы Enterococcus faecium и E. faecalis, отличающиеся устойчивостью к ванкомицину и тейкопланину. Leclercq и др., "Передаваемая плазмидой устойчивость к ванкомицину и тейкоплану у Enterococcus Faecium", The New England Journal of Medicine, 319(3), 157-161 (1988) и Uttley и др. , "Устойчивые к ванкомицину Enterococci", Lancet, 1, 57-58 (1988). Обнаружено также, что изоляты устойчивы и к другим антибиотикам. Недавними обследованиями больниц Соединенных Штатов выявлено, что в настоящее время 7,9% Enterococci обладают устойчивостью к ванкомицину. "Устойчивые к ванкомицину внутрибольничные Enterococci", Morbidity and Mortality Weekly Report, 42 (30, ), 597-598 (1993). Помимо своей широкой активности против грамположительных микроорганизмов многие гликопептидные соединения настоящего изобретения проявляют также улучшенную противомикробную активность против устойчивых к ванкомицину изолятов.
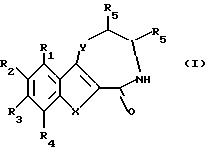
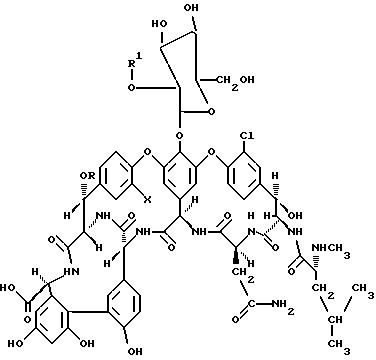
Настоящим изобретением даются соединения формулы I:

или их соли, где
X и Y каждый независимо представляет водород или хлор;
R представляет водород, 4-эпи-ванкозаминил,
R1 представляет водород
R2 представляет -NHCH3
R3 представляет -CH2CH(CH3)2,
R4 представляет -CH2(CO)NH2,
R5 представляет водород,
R6 представляет 4-эпи-ванкозаминил,
R7 представляет (C2-C16)алкенил, (C2-C12)алкинил, (C1-C12-алкил)-R8, (C1-C12 -алкил)галоген, (C2-C6)алкенил-R8, (C2-C6)-алкинил-R8, (C1-C12-алкил)OR8 и присоединен к амино-группе в R6;
R8 выбирают из группы, включающей:
a) полициклический арил, незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, включающей:
(I) гидроксигруппу,
(II) галоген,
(III) нитрогруппу,
(IV) (C1-C6)алкил,
(V) (C2-C6)алкилоксигруппу,
(VI) галоген (C1-C6)алкокси,
(VII) группу формулы -S(O)n, R9, где n = 0 и R9 представляет (C1-C6)алкил;
b) гетероарил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей:
(I) галоген,
(II) (C1-C6)алкил,
(III) (C1-C6)алкоксигруппу,
(IV) фенил,
(V) фенил, замещенный (C1-C6)алкилом, (C2-C6)алкокси,
(VI) тиенил;
с) группу формулы:
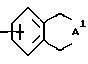
где A1 представляет -C(A2)2 - C(A2)2 - C(A2)2-, и каждый A2 заместитель независимо выбран из водорода, (C1-C6)алкила, (C4-C10)циклоалкила;
d) группу формулы:
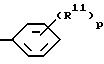
где p = 1-5, и R11 независимо выбран из группы, включающей:
(I) нитрогруппу,
(II) гидроксигруппу,
(III) галоген,
(IV) (C1-C8)алкил,
(V) (C1-C8 )алкоксигруппу,
(VI) (C2-C9)алкинил,
(VII) (C9-C12)алкоксигруппу,
(VIII) (C1-C3)алкоксигруппу, замещенную (C1-C3)алкоксигруппой, гидроксигруппой или (C1-C4)алкилтиогруппой,
(IX) (C2-C5)алкенилоксигруппу,
(X) галоген-(C1-C6)алкоксигруппу,
(XI) (C2-C6)алкилтиогруппу,
(XII) (C2-C10)алканоилоксигруппу,
(XIII) (C1-C3)алкилсульфонилоксигруппу,
(XIV) карбокси-(C1-C3)алкил,
(XV) N-/ди(C1-C3)алкил/амино- (C1-C3)алкоксигруппу,
(XVI) циано-(C1-C6)алкоксигруппу, и
(XVII) дифенил-(C1-C6)алкил,
при условии, что когда R11 представляет (C1-C8)алкил, (C1-C8)алкоксигруппу или галоген, p должно быть больше или равняться 2, или если R7 представляет (C1-C3)алкил-R8, тогда R11 отличен от водорода, (C1-C8)алкила, (C1-C8)алкоксигруппы или галогена;
e) группу формулы:
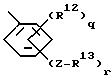
где q = 0-4;
R12 независимо выбирают из группы, включающей:
(I) галоген,
(II) нитрогруппу,
(III) (C1-C6)алкил,
(IV) (C1-C6)алкоксигруппу,
r = 1-5, при условии, что сумма q и r не превышает 5;
Z выбирают из группы, включающей:
(I) простую связь,
(II) двухвалентный (C1-C6)алкил, незамещенный или замещенный гидроксигруппой, (C1-C6)алкилом,
(III) двухвалентный (C2-C6)алкенил,
(IV) группу формулы -(C(R14)2)s-R15, где s = 0-1, где R14 = водород, R15 выбирают из -O-, -S-, -SO-, -SO2-, -SO2-O-, -OC(O)- (если s = 1),
R13 независимо выбирают из группы, включающей:
(I) (C4-C10)гетероциклил,
(II) гетероарил,
(III) (C4-C10)циклоалкил, незамещенный или замещенный (C1-C6)алкилом, или
(IV) фенил, незамещенный или замещенный 1-5 заместителями, независимо выбранными из галогена, гидроксигруппы, нитрогруппы, (C1-C10)алкила, (C1-C10)алкоксигруппы, галоген-(C1-C3)алкила, фенил-(C1-C3)алкила, (C1-C6)алкоксифенила;
f) (C4-C10 )циклоалкил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей:
(I) (C1-C6)алкил,
(II) (C1 -C6)алкинил,
(III) (C4-C10)циклоалкил,
(IV) фенил;
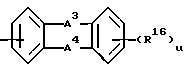
g) группу формулы:
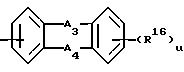
где A3 и A4 каждый независимо выбирают,
(I) простой связи,
(II) -C(R17)2-, где R17 = водород,
(III) -N(R18)2-, где R18 = водород, R16 = R12 или R13, принимающем вышеуказанные значения;
u = 0.
В другом своем аспекте изобретение относится к препаратам для лечения соответствующих бактериальных инфекций, содержащим соединение формулы I в смеси с приемлемым фармацевтическим носителем. Способы борьбы с соответствующими бактериальными инфекциями применением препаратов соединения формулы I также охватываются объемом настоящего изобретения.
Вышеупомянутые алкильные заместители относятся к незамещенным или замещенным углеводородам с нормальной или разветвленной цепью указанной длины. Термин "алкенил" относится к замещенной или незамещенной, нормальной или разветвленной алкенильной цепи указанной длины. Термин "алкинил" относится к замещенной или незамещенной, нормальной или разветвленной алкинильной цепи указанной длины.
Вышеупомянутые алкоксизаместители представлены алкильными группами, присоединенными через кислородный мостик. Термин "алкеноксигруппа" представляет алкенильную цепь указанной длины, присоединенную к атому кислорода.
Термин "полициклический арил" означает устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 9-10-членный органический конденсированный бициклический радикал; устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 12-14-членный органический трициклический конденсированный радикал или устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 14-16-членный органический конденсированный тетрациклический радикал. Бициклический радикал может иметь 0-4 заместителя, трициклический радикал может иметь 0 - 6 заместителей и тетрациклический радикал может иметь 0 - 8 заместителей. Типичные примеры полициклических арилов включают: флуоренил, нафтил, антранил, фенантранил, бифенилен и пиренил.
Термин "гетероарил" представляет устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 4-7-членный органический моноциклический радикал, содержащий гетероатом, выбранный из S, O и N; устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 9-10-членный органический конденсированный бициклический радикал, содержащий 1-2 гетероатома, выбранные из S, O и N, или устойчивый, насыщенный или ненасыщенный, замещенный или незамещенный 12-14-членный органический конденсированный трициклический радикал, содержащий гетероатом, выбранный из S, O и N. Атомы азота и серы в таких радикалах возможно окислены, а гетероатом азота возможно квотернизирован. Моноциклический радикал может иметь 0-5 заместителей. Бициклический радикал может иметь 0-7 заместителей и трициклический радикал может иметь 0-9 заместителей. Типичные примеры гетероарилов включают: хинолил, пиперидил, тиенил, пиперонил, оксафлуоренил, пиридил, бензотиенил и т.п.
Термином "(C4 -C10)циклоалкил" охватываются заместители, содержащие четыре-десять атомов углерода, например: циклобутил, циклопентил, циклогексил и циклогептил, которые могут быть незамещены или замещены такими заместителями, как алкил и фенил. Этим же термином охватываются также C5-C10-циклоалкенильные группы, например: циклопентенил и циклогексенил. Термином "(C4 -C10)циклоалкил" кроме того охватываются бициклические и трициклические циклоалкилы, например: бициклопентил, бициклогексил, бициклогептил и адамантил.
Термин "алканоилоксигруппа" представляет алканоил, присоединенный через кислородный мостик. Такие заместители могут быть замещены или незамещены и иметь нормальную или разветвленную цепь указанной длины.
Термин "циано-(C1-C6)алкоксигруппа" представляет замещенную или незамещенную, нормальную или разветвленную алкоксигруппу с одним-шестью атомами углерода и присоединенной к цепи цианогруппой.
Термин "двухвалентный (C1-C6)алкил" представляет замещенную или незамещенную, нормальную или разветвленную двухвалентную алкильную цепь с одним-шестью атомами углерода. Типичные примеры двухвалентных (C1-C6)алкильных групп включают: метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, втор-бутилен, трет-бутилен, пентилен, неопентилен и гексилен. Такие двухвалентные алкильные группы могут быть замещены такими заместителями, как алкил, алкоксигруппа и гидроксигруппа.
Термин "двухвалентный(C2-C6)алкил" представляет замещенную или незамещенную, нормальную или разветвленную двухвалентную алкенильную цепь с двумя-шестью атомами углерода. Типичные примеры двухвалентных (C2-C6)алкенилов включают: этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил и т.п.
Термин "двухвалентный (C2-C6 )алкинил" представляет нормальную или разветвленную двухвалентную алкинильную цепь с двумя-шестью атомами углерода. Типичные примеры двухвалентных (C2-C6)алкинилов включают: этинилен, 1-пропинилен, 2-пропинилен, 1-бутинилен, 2-бутинилен и т.п.
Термин "галоген" представляет хлор, фтор, бром или йод.
Термин "галоген-(C1-C6)алкил" представляет нормальную или разветвленную алкинильную цепь с одним-шестью атомами углерода, к каждому атому углерода которой присоединено 0-3 атома галогена. Типичные примеры галоген-(C1-C6)алкильных групп включают: хлорметил, 2-бромэтил, 1-хлоризопропил, 3-фторпропил, 2,3-дибромбутил, 3-хлоризобутил, йод-трет-бутил, трифторметил и т.п.
Термин "галоген-(C1-C6)алкоксигруппа" представляет нормальную или разветвленную алкокси цепь с одним-шестью атомами углерода с 0-3 атомами галогена, присоединенными к каждому атому углерода. Типичные примеры галоген-(C1-C6)-алкоксигрупп включают: хлорметокси-, 2-бромэтокси-, 1-хлоризопропокси-, 3-фторпропокси-, 2,3-дибромбутокси-, 3-хлоризобутокси, йод-трет-бутокси-, трифторметоксигруппу и т.п.
Термином "гетероциклил" охватываются насыщенные группы, содержащие в цикле три-семь элемента, и такие гетероциклы содержат гетероатом, выбранный из кислорода, серы и азота, например: пиперазинил, морфолиногруппа, пиперидил, метилпиперидил, азетидинил и азиридинил.
Изобретение включает соли соединений, определяемых формулой I. Хотя в целом нейтральные, соединения настоящего изобретения могут содержать достаточно кислотные, достаточно основные или те и другие функциональные группы, вследствие чего могут вступать в реакцию с целым рядом неорганических оснований и неорганических и органических кислот с образованием фармацевтически приемлемых солей.
Термин "фармацевтически приемлемая соль" в применяемом здесь значении относится к солям соединений вышеприведенной формулы I, по существу не ядовитых для живых организмов. Типичные фармацевтически приемлемые соли включают соли, приготовленные реакцией соединений настоящего изобретения с фармацевтически приемлемой минеральной или органической кислотой или неорганическим основанием. Подобные соли известны как соли с кислотами и соли с основаниями.
К кислотам, обычно применяемым для образования солей с кислотами, относятся неорганические кислоты, например: хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота и т.п. и органические кислоты, например: п-толуолсульфокислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примеры таких фармацевтически приемлемых солей включают: сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Рекомендуемыми фармацевтически приемлемыми солями с кислотами являются соли, образованные с минеральными кислотами, например: хлористоводородной кислотой и бромистводородной кислотой, и соли, образованные с органическими кислотами, например: малеиновой кислотой, уксусной кислотой и метансульфоновой кислотой.
Соли с основаниями включают соли, образованные неорганическими основаниями, например: гидроксидами, бикарбонатами и бикарбонатами аммония, щелочных или щелочноземельных металлов и т.п. Таким образом, основания, пригодные для получения солей настоящего изобретения, включают: гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция, карбонат кальция и т.п. Особенно рекомендуются соли калия и натрия.
Необходимо подчеркнуть, что конкретный противоион, образующий часть любой соли настоящего изобретения, особой роли не играет при условии, что соль в целом фармакологически приемлема и что противоион не придает соли в целом нежелательных свойств.
Соединения настоящего изобретения получают из соединений формулы:

Формула II
Соединения формулы II определены в таблице 1.
aПринятые для соединений формулы II сокращения: actin = актинозаминил; acos = акозаминил; 4-epi = 4-эпи-ванкозаминил; gal = галактозил; keto = 4-кетованкозаминил; man = манноза; rha = рамнозил; rha - gal = рамнозил-галактозил; risto = ристозаминил; van = ванкозаминил.
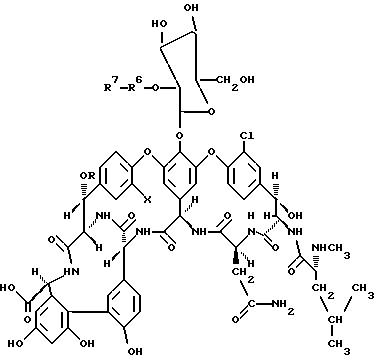
В рекомендуемом воплощении изобретения соединения формулы I получают из A82846 антибиотиков (A82846A, A82846B и A82846C) и PA-42867-A. В более предпочтительном воплощении соединения настоящего изобретения получают из A82846B ("производные A82846B"). A82846B представлен соединениями формулы I, в которой R - 4-эпи-ванкозаминил, R1 - водород, R2 - NHCH3, R3 - CH2CH(CH3)2, R4 - CH2(CO)NH2, R5 - водород, R6 - 4-эпи-ванкозаминил, X и Y - C1. Производные A82846B настоящего изобретения, имеющие заместители в положении R7 формулы I, обозначаются далее как "R7 - A82846B". К примеру, соединение "фенилбензил-A82846B" имеет фенилбензильный заместитель в положении R7 формулы I.
Рекомендуемые соединения формулы I включают те производные A82846B, в которых R7 представляет -(C1-C12-алкил)-R8, более предпочтительно -CH3-R8, где R8 представляет незамещенный полициклический арил. В этой группе соединений более предпочтительны нафтилметил-A82846B, аценафтленилметил - A82846B и флуоренилметил - A82846B.
Рекомендуемые соединения формулы I кроме того включают те производные A82846B, в которых R7 представляет -(C1-C12)-R8, более предпочтительно -CH3-R8, где R8 представляет незамещенный гетероарил или гетероарил, замещенный галогенфенил. В этой группе соединений более предпочтительны /1-окса/флуоренилметил-A82846B, хлорфенилбензоксазолметил-A82846B и фенилтиоенилметил-A82846B.
Еще одна группа рекомендуемых соединений формулы I включает те производные A82846B, в которых R7 представляет -(C1-C12
-алкил)-R8, более предпочтительно -CH3-R8, где R8 представляет группу формулы:
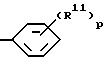
где p = 1 и R11 выбирают из (C2-C5)алкенилоксигруппы, галоген-(C1-C6)алкоксигруппы, (C2-C10)алканоилоксигруппы, (C1-C3)алкоксигруппы,
замещенной (C1-C4)алкилтиогруппой, и дифенил-(C1-C6)алкила. В этой группе соединений более предпочтительны трифторметоксибензил-A82846B, дифенилметилбензил-A82846B, тиопропилэтоксибензил-A82846B, ацетоксибензил-A82846B, нонаноилоксибензил-A82846B, и тетрафторэтоксибензил-A82846B.
И еще одна группа рекомендуемых соединений формулы I включает те производные A82846B, в которых R7 представляет -(C1-C12
-алкил)-R8, более предпочтительно -CH3-R8, где R8 представляет группу формулы:
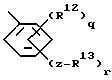
где q = 1-4, r = 1; Z выбирают из простой связи, двухвалентного (C1-C6)алкила, двухвалентного (C2-C6)алкенила, -R15-C(R14)2)s-, где R15 выбирают из -O-, -S-, -SO2 и -OC(O)-, каждый R14 заместитель представляет водород и S = 0 или 1, и R13 выбирают из (C4-C10)циклоалкила, фенила и фенила, замещенного нитрогруппой, галогеном (C1-C10)алкилом, (C1-C10 )алкоксигруппой или галоген-(C1-C3)алкилом. В этой группе соединений более предпочтительны хлорфенилбензил-A82846B, фенилбензил-A82846B, бензилбензил-A82846B, метилфенилбензил-A82846B, пентилфенилбензил-A82846B, метоксифенилбензил-A82846B, пентоксифенилбензил-A82846B, нитрофеноксибензил-A82846B, фторфенилбензил-A82846B, фенилэтинилбензил-A82846B, феноксибензил-A82846B, бензилоксибензил-A82846B, нитрофенилбензил-A82846B, хлорфеноксибензил-A82846B, хлорбензилоксибензил-A82846B, бутилфеноксибензил-A82846B, трифторметилфеноксибензил-A82846B, дихлорфеноксибензил-A82846B, нитробензилоксибензил-A82846B, бензилоксибензил-A82846B, циклогексилоксибензил-A82846B, циклогексаноилоксибензил-A82846B, тиофенилбензил-A82846B, хлорфенилсульфонилбензил-A82846B, циклогексилбензил-A82846B, циклогексилэтоксибензил-A82846B, хлорфеноксинитробензил-A82846B, бензилметоксибензил-A82846B, феноксиметоксибензил-A82846B, бензоилокси-диметоксибензил-A82846B, циклогексаноилокси-диметилбензил-A82846B, трифторметилфенилбензил-A82846B, бутилфенилтиобензил-A82846B и бромфенилбензил-A82846B.
Еще одна группа рекомендуемых соединений формулы I включает производные A82846B, в которых R7 представляет -(C1-C12)алкил-R8, более предпочтительно -CH3-R8, где R8 представляет (C4-C10)циклоалкил, замещенный (C4-C10)циклоалкилом. В этой группе соединений более предпочтительны циклогексил-циклогексилметил-A82846B, и бутилциклогексилметил-A82846B.
Для получения соединений формулы I из A83850A и A83850B могут быть использованы восстановленные формы этих соединений. Восстановленные формы соединений A83850A и A83850B могут быть получены по методике, приведенной в патенте США N 5187082, который вводится здесь в качестве ссылки.
Соединения настоящего изобретения получают реакцией соединения формулы II с альдегидом с образованием промежуточного основания Шиффа, последующим восстановлением которого боргидридом металла получают целевой N-алкиламин.
Согласно первому способу получения соединений изобретения /далее способ A (иллюстрируется примерами 1 и 2) / реакцию образования основания Шиффа проводят в инертной атмосфере, например, в азоте или аргоне в полярном растворителе, например: диметилформамиде (ДМФА) или метаноле (MeOH) или смеси полярных растворителей, например, смеси диметилформамида с метанолом при температуре 25 - 100oC. Реакцию рекомендуют проводить при температуре 60 - 70oC от 30 минут до 2 часов в смеси диметилформамида с метанолом или в метаноле. Промежуточное основание Шиффа затем восстанавливают, предпочтительно без выделения и получают соответствующее N-алкилпроизводное-(ые). Восстановление основания Шиффа осуществляют применением химического восстановителя, например, боргидрида металла, такого как боргидрид натрия или цианоборгидрид натрия. Реакция восстановления может быть проведена в полярном органическом растворителе, например: диметилформамиде, метаноле или смеси полярных растворителей, например, смеси диметилформамида с метанолом. Реакция восстановления может быть проведена при температуре 25 - 100oC в течение 1 - 5 часов. Реакцию восстановления рекомендуют осуществлять применением избытка цианоборгидрида натрия в смеси диметилформамида с метанолом или метаноле при 60 - 70oC в течение 1 - 2 часов. Способ A рекомендуется в случае применения бензиловых альдегидов.
Согласно второму способу получения соединений настоящего изобретения (далее называется способом Б, иллюстрируется примером 3) образование основания Шиффа проводят в инертной атмосфере, например, азоте или аргоне в присутствии в качестве восстановителя цианоборгидрида натрия в полярном растворителе, например: диметилформамиде, метаноле или смеси полярных растворителей, например, смеси диметилформамида с метанолом при температуре 25 - 100oC в течение 1 - 5 часов. Реакцию рекомендуется проводить при 60 - 70oC в течение 1 - 2 часов в смеси диметилформамида с метанолом. Способ B рекомендуется в случае применения небензиловых альдегидов.
Согласно третьему способу получения соединений настоящего изобретения (далее называется способом C, иллюстрируется примером 4) образование основания Шиффа осуществляют a) в инертной атмосфере, например: азоте или аргоне, b) в присутствии восстановителя, например, боргидрида металла, наиболее предпочтительно цианоборгидрида натрия или агента для проведения гомогенного или гетерогенного каталитического гидрирования, например: катализатора Крэбтри, катализатора Уилкинсона, палладия на угле, платины на угле или родия на угле, c) в полярном растворителе, например: диметилформамиде, метаноле или смеси полярных растворителей, например, смеси диметилформамида с метанолом и d) при температуре 25 - 100oC. Реакцию рекомендуют проводить при температуре 60 - 70oC в метаноле. Реакцию продолжают 20 - 28 часов с поддержанием в это время значения pH реакционной смеси в интервале 7,5 - 10, предпочтительно при 9. Регулированием pH реакцию прекращают. Поскольку продукт реакции хорошо растворим в полярных растворителях, растворитель реакции может быть заменен спиртом, например: этанолом, бутанолом или изопропанолом, из которых рекомендуется изопропанол, с осаждением продукта реакции. Способ C является предпочтительным способом настоящего изобретения, что связано с повышенным выходом продукта реакции, достигаемым данным способом. Другое преимущество данной схемы реакции состоит в повышенном отношении предпочтительного продукта реакции (продуктов, замещенных по аминогруппе сахара, соответствующего R1 в формуле II) к другим продуктам реакции (продуктам, замещенным по аминогруппе заместителями, обозначенными R и/или R3 в формуле II). Проведением реакции в течение более длительного периода, например в течение 20 - 28 часов, продукты, монозамещенные в положениях, соответствующих R и R3 в формуле II, превращают в димезащенные формы, что облегчает выделение предпочтительных монозамещенных производных.
Продукты реакции, полученные любым из способов A, B или C, могут быть очищены препаративной ЖХВД с обращением фаз с применением колонок C-18 Нова-Пак фирмы Уотерс с детектированием в ультрафиолетовом свете (УФ 235 нм или 280 нм). Обычно применяют рассчитанную на 30 минут систему градиента растворителей, состоящую из 95% водного буфера-5% CH3CN в момент = 0 минут до 20% водного буфера - 80% CH3CN в момент = 30 минут. В качестве водного буфера применяют либо ТЭАФ (0,5% водного триэтиламина с установленным фосфорной кислотой pH 3), либо ТФУ (трифторуксусная кислота в общей концентрации 0,1%).
ЖХВД анализ реакционных смесей и конечных очищенных продуктов может быть осуществлен применением колонки C 18 МикроБондаПак фирмы Уотерс (обычно стальная колонка размером 3,9 х 300 нм) или Нова-Пак C 18 RCM колонки фирмы Уотерс (8 х 100 мм) с УФ детектированием (235 нм или 280 нм). Обычно применяют рассчитанную на 30 минут систему градиента растворителей, состоящую из 95% водного буфера - 5% CH3CN в момент = 0 минут до 20% водного буфера - 80% CH3CN в момент = 30 минутам. В качестве водного буфера применяют либо ТЭАФ (0,5% водного триэтиламина с установленным фосфорной кислотой значением pH 3), либо ТФУ (трифторуксусная кислота в общей концентрации 0,1%).
Отношение альдегида к соединению формулы II и условия реакции определяют состав продуктов реакции. Монозамещенные производные - это те производные, в которых атом водорода аминогруппы в положении R1 в формуле II замещен одним из заместителей, перечисленных выше для формулы I. При использовании вышеописанных способов A и B образованию монозамещенных производных, замещенных по аминогруппе аминосахара в положении R1 формулы, благоприятствуют применение небольшого избытка альдегида, более короткое время реакции и более низкая температура. Как отмечено выше, способ C благоприятствует образованию монозамещенного производного. Большой избыток альдегида способствует образованию дизамещенных и тризамещенных производных соединений формулы II. Дизамещенные производные - это производные, в которых атомы водорода в местоположениях, выбранных из аминогруппы в положении R3 и аминогруппы аминосахаров, обозначенных как R или R1 в формуле II, замещены фрагментом восстановленного альдегида. Тризамещенные производные - это производные, в которых атомы водорода в трех местоположениях, выбранных из аминогруппы в положении R3 и аминогруппы аминосахаров, обозначенных, как R или R1 в формуле, замещены фрагментом восстановленного альдегида.
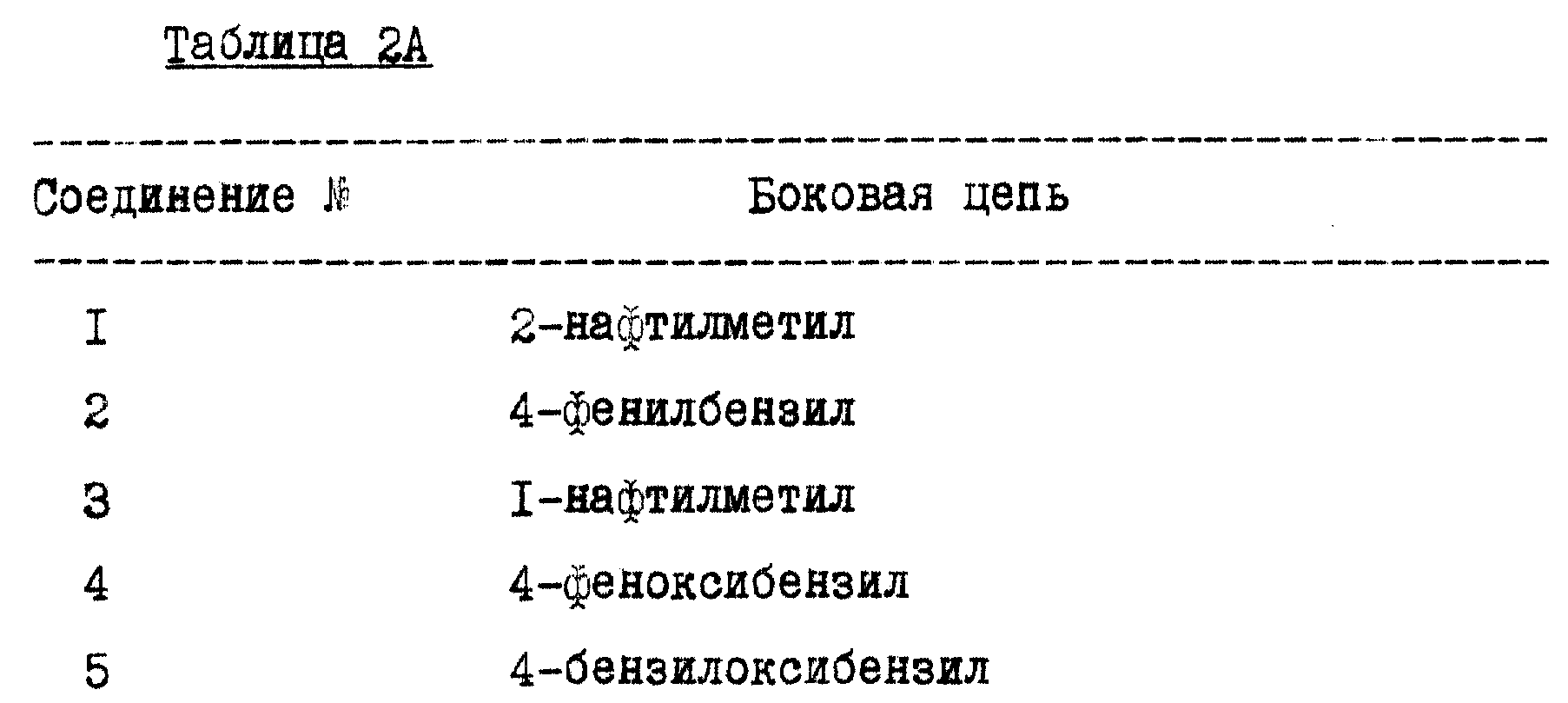
Примеры полученных соединений, иллюстрирующих соединения формулы I, перечислены в таблице 2A и таблице 2B. В таблице 2A перечислены соединения, синтезированные реакцией альдегида с гликопептидом A82846B. В таблице 2A указаны замещающие боковые цепи по аминогруппе 4-эпи-ванкозаминильном сахаре в 4-эпи-ванкозаминил-O-гликозильном дисахариде соединения A82846B. Все перечисленные соединения относятся к монозамещенным производным.
В таблице 2B перечислены те соединения, которые были синтезированы реакцией альдегида с разнообразными гликопептидными антибиотиками, отличными от A82846B. Соединения таблицы 2B монозамещены по аминогруппе аминосахара, обозначенного, как R1 в формуле II, указанной боковой цепью. Все перечисленные соединения относятся к монозамещенным производным.
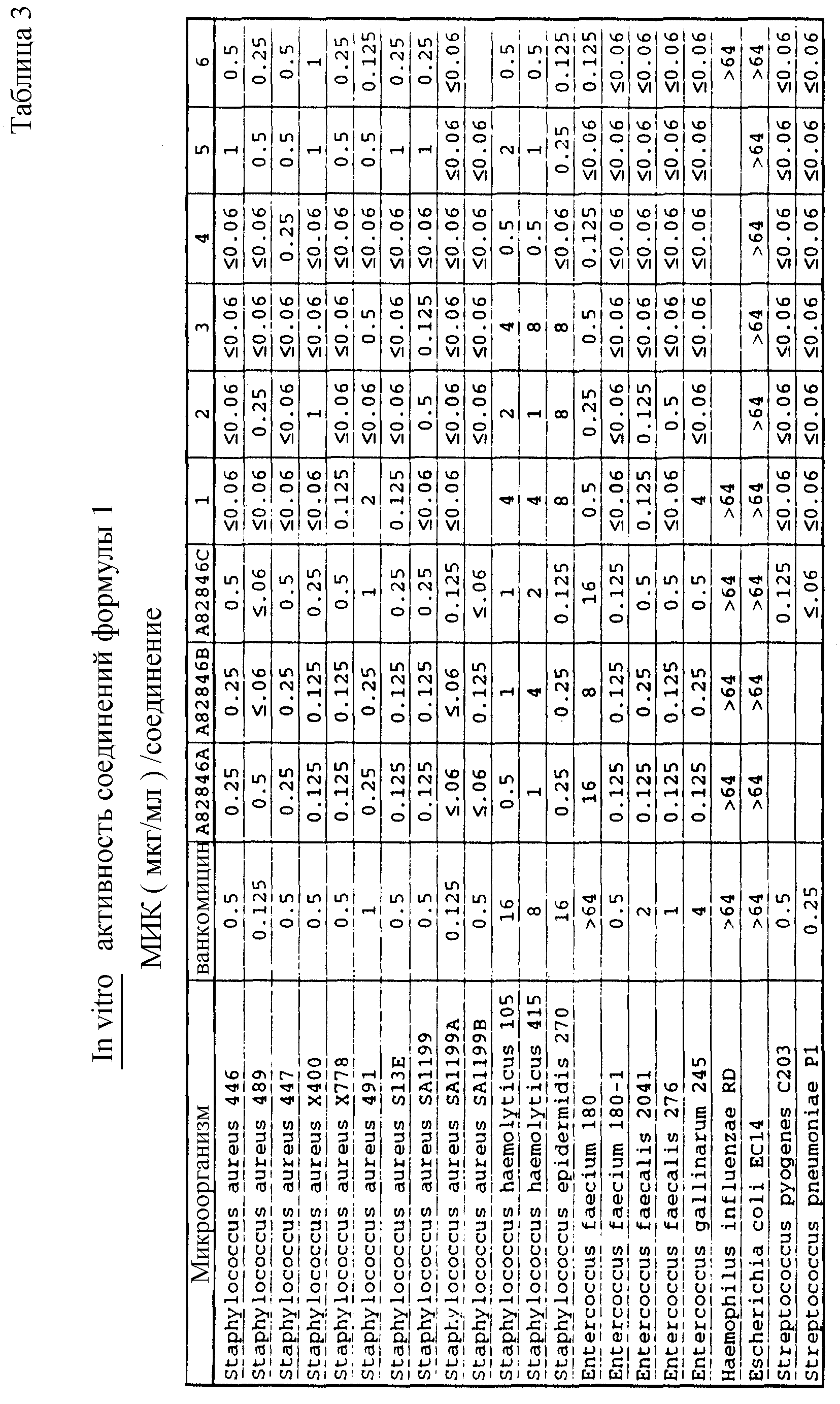
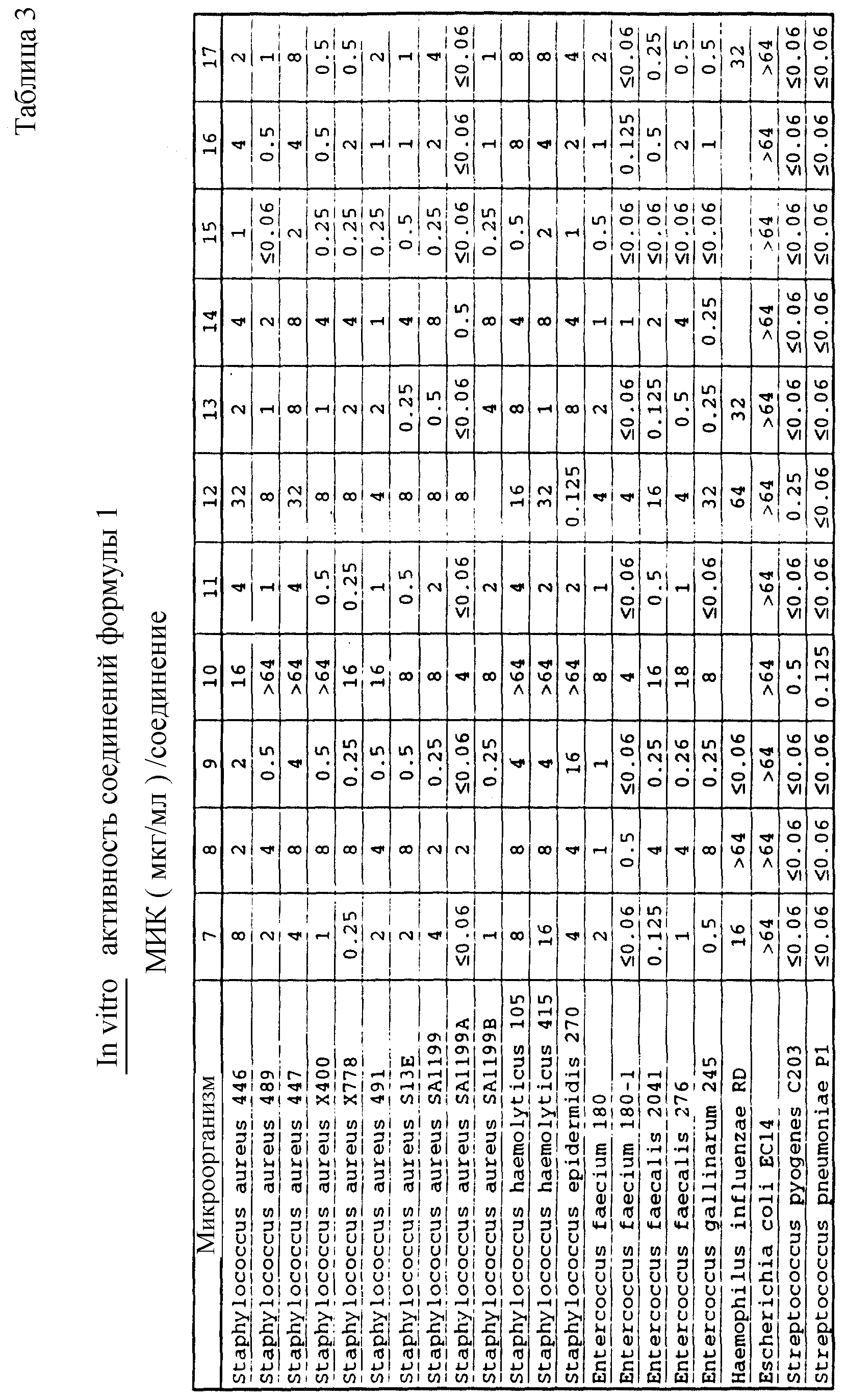
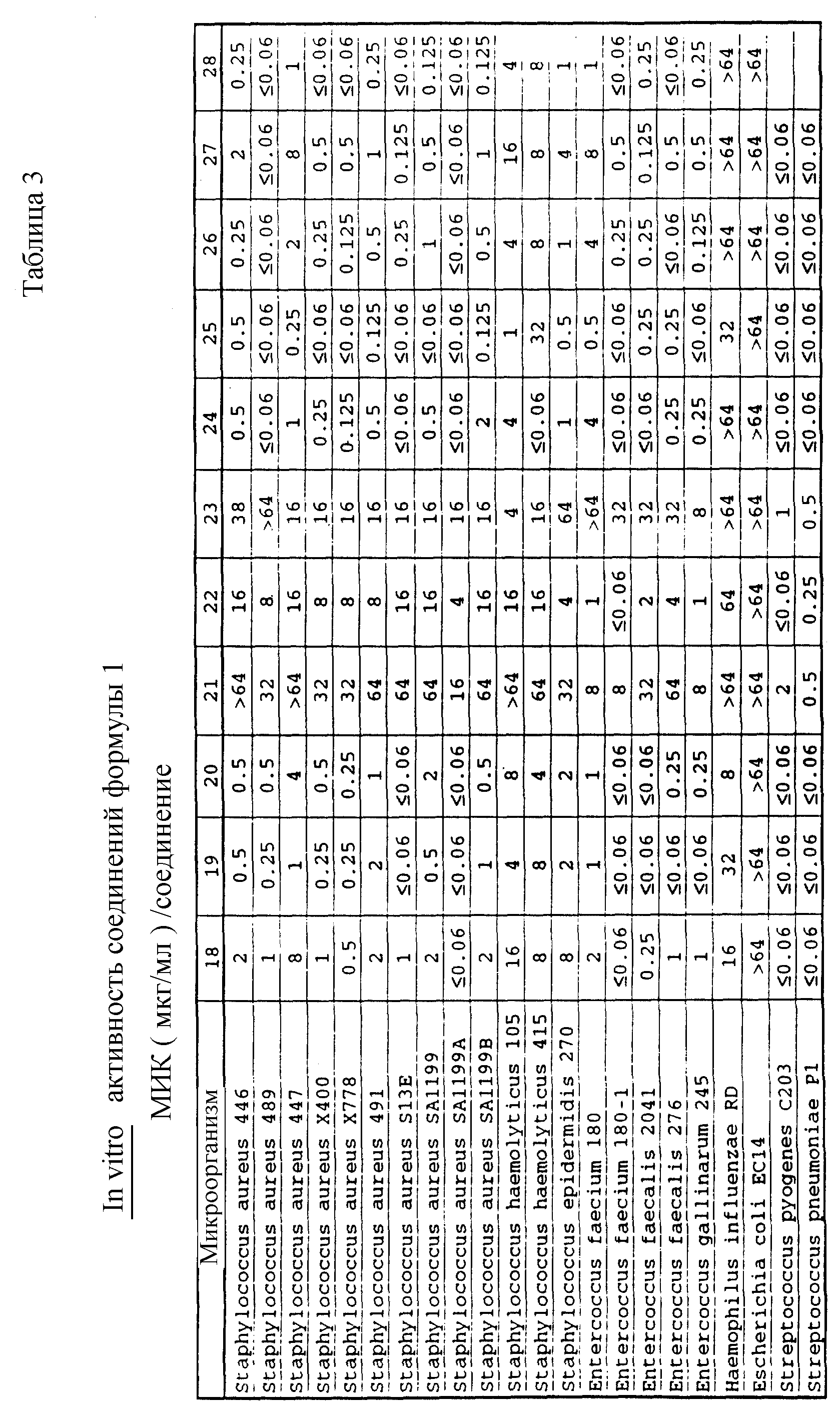
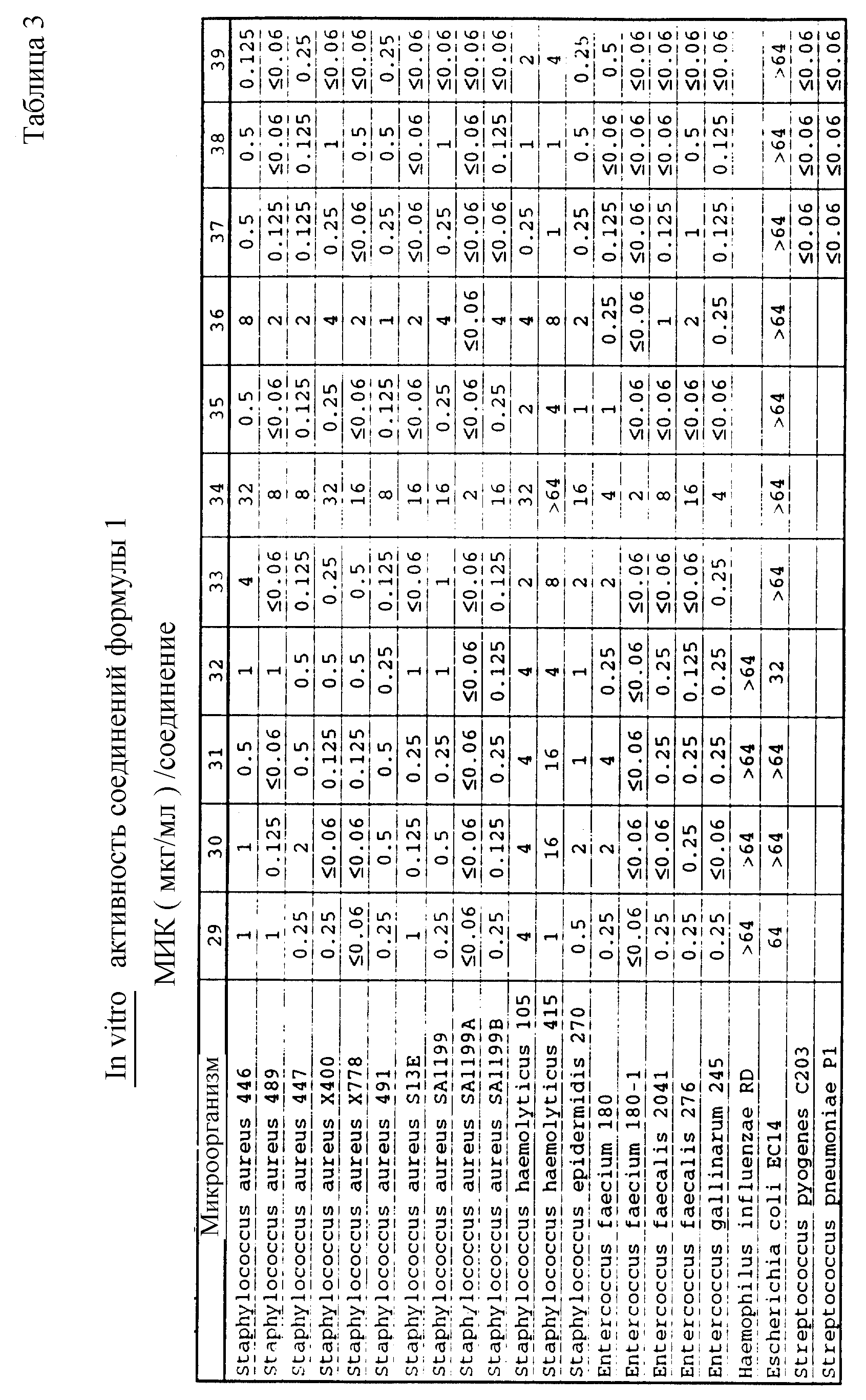
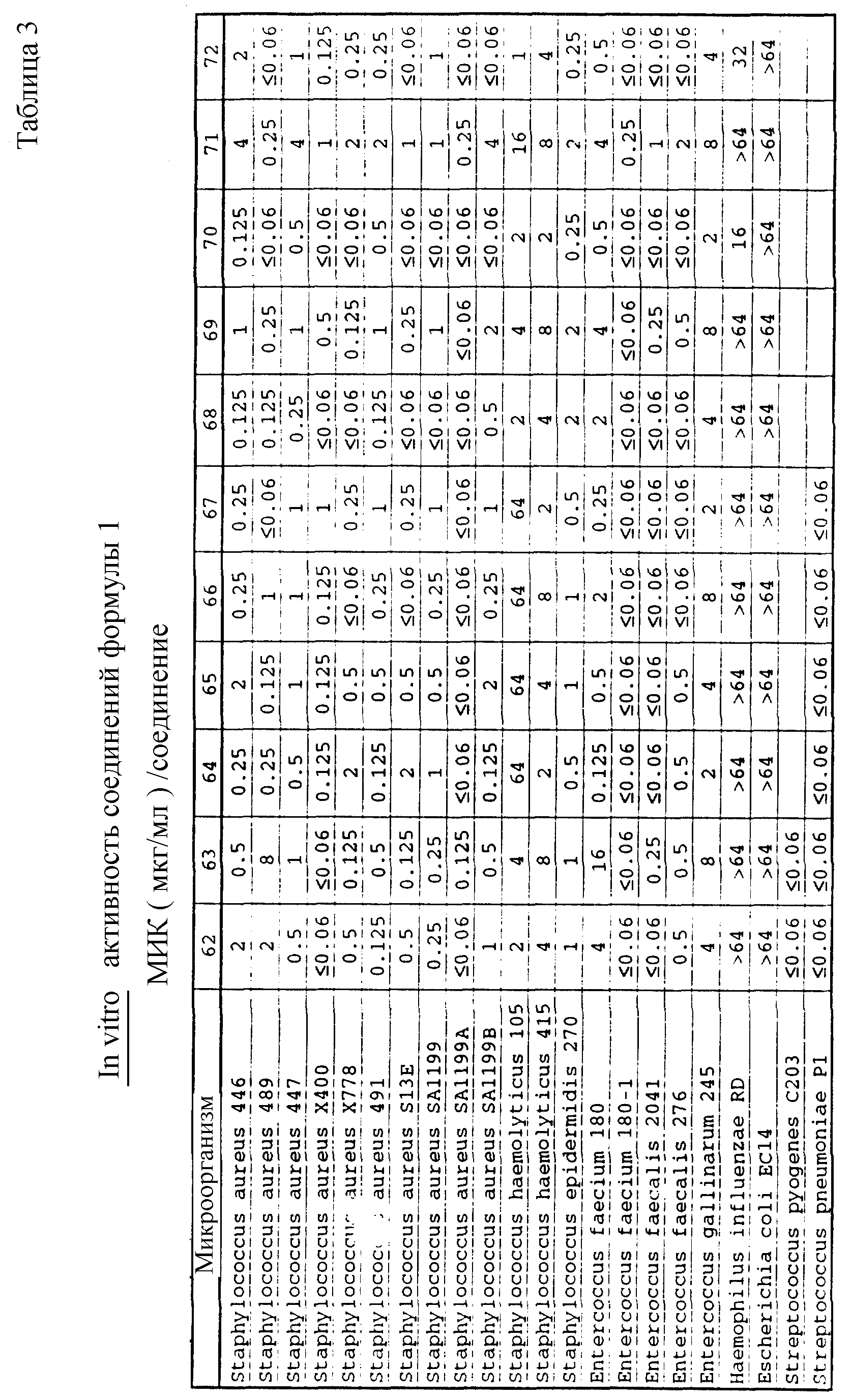
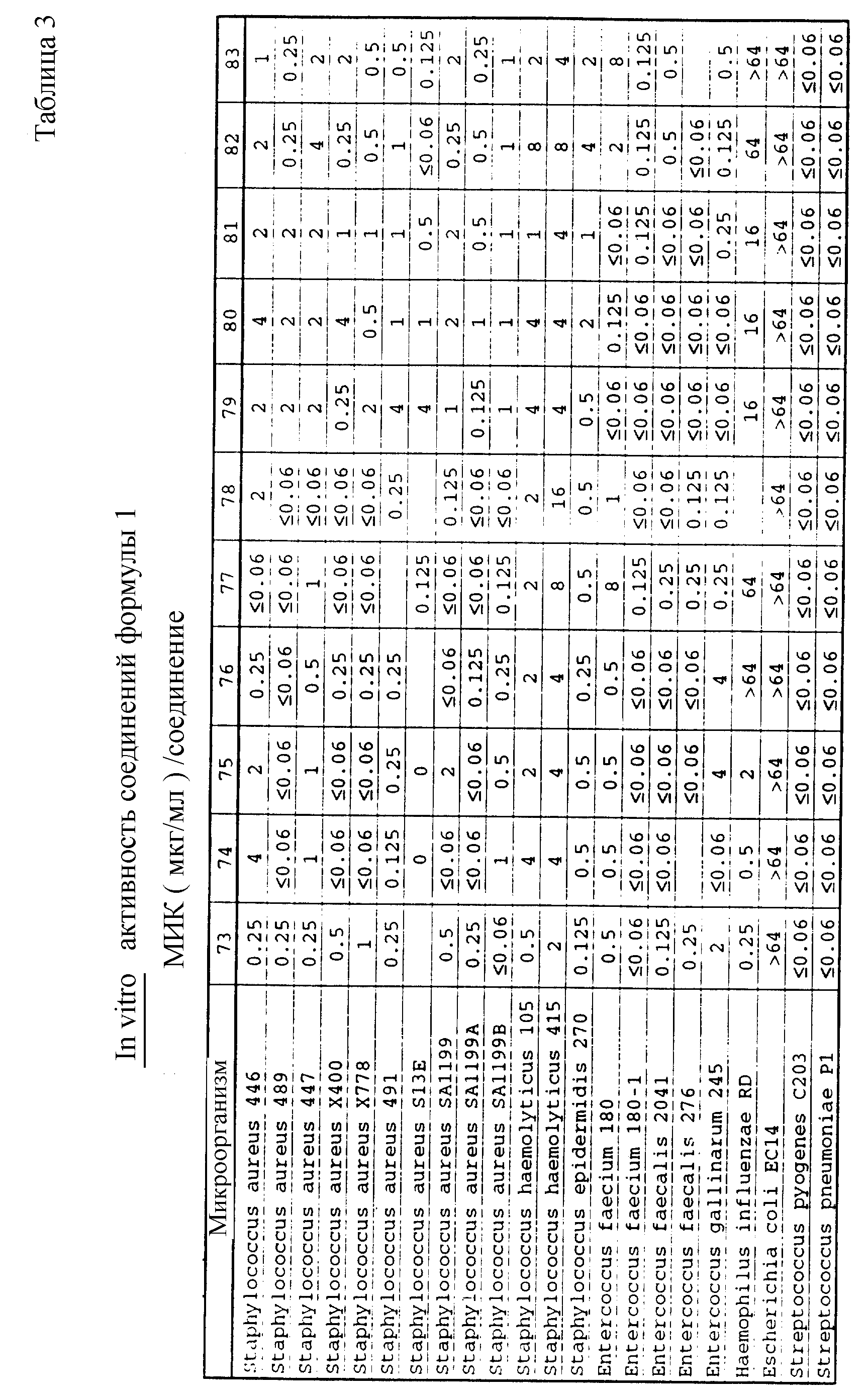
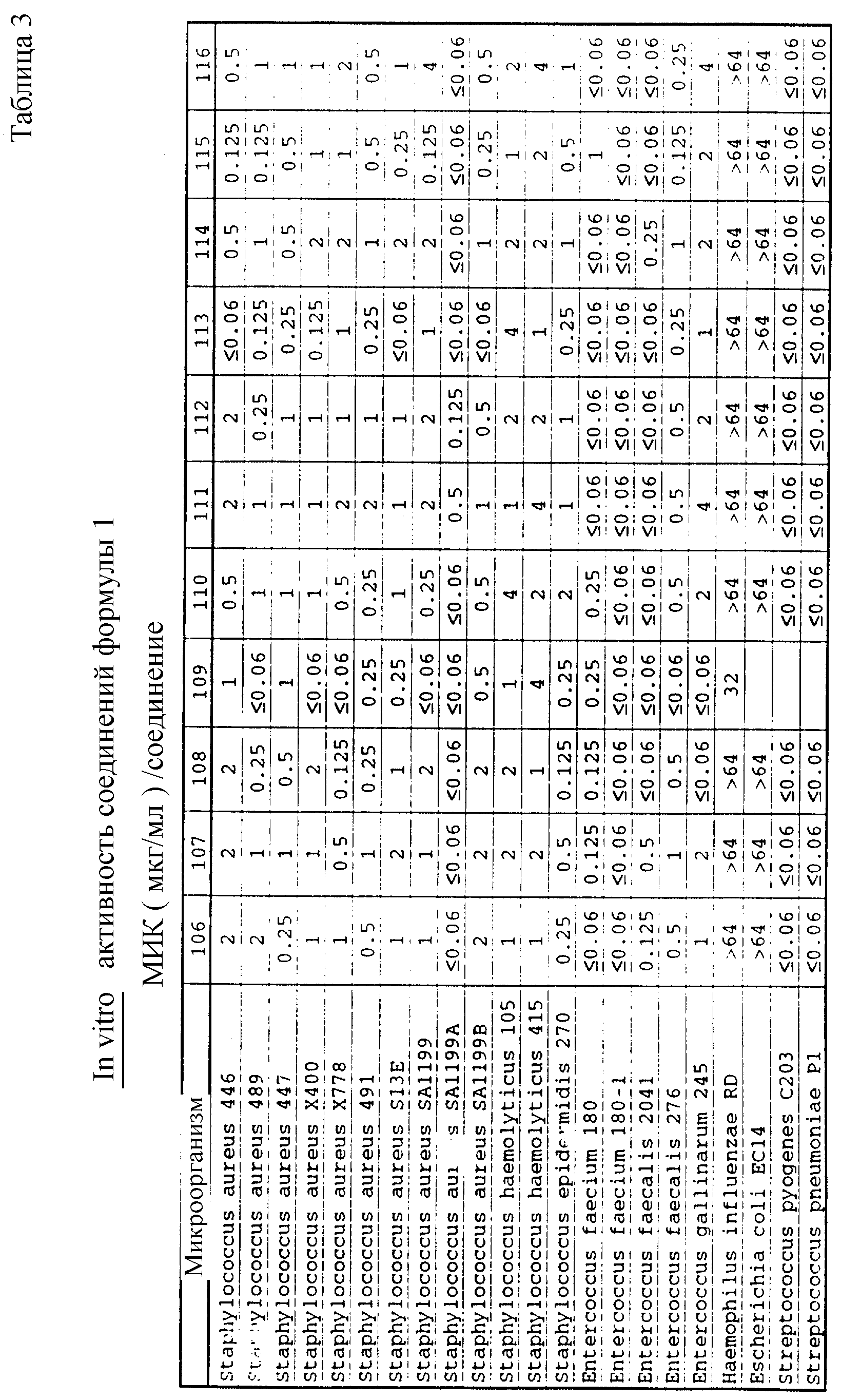
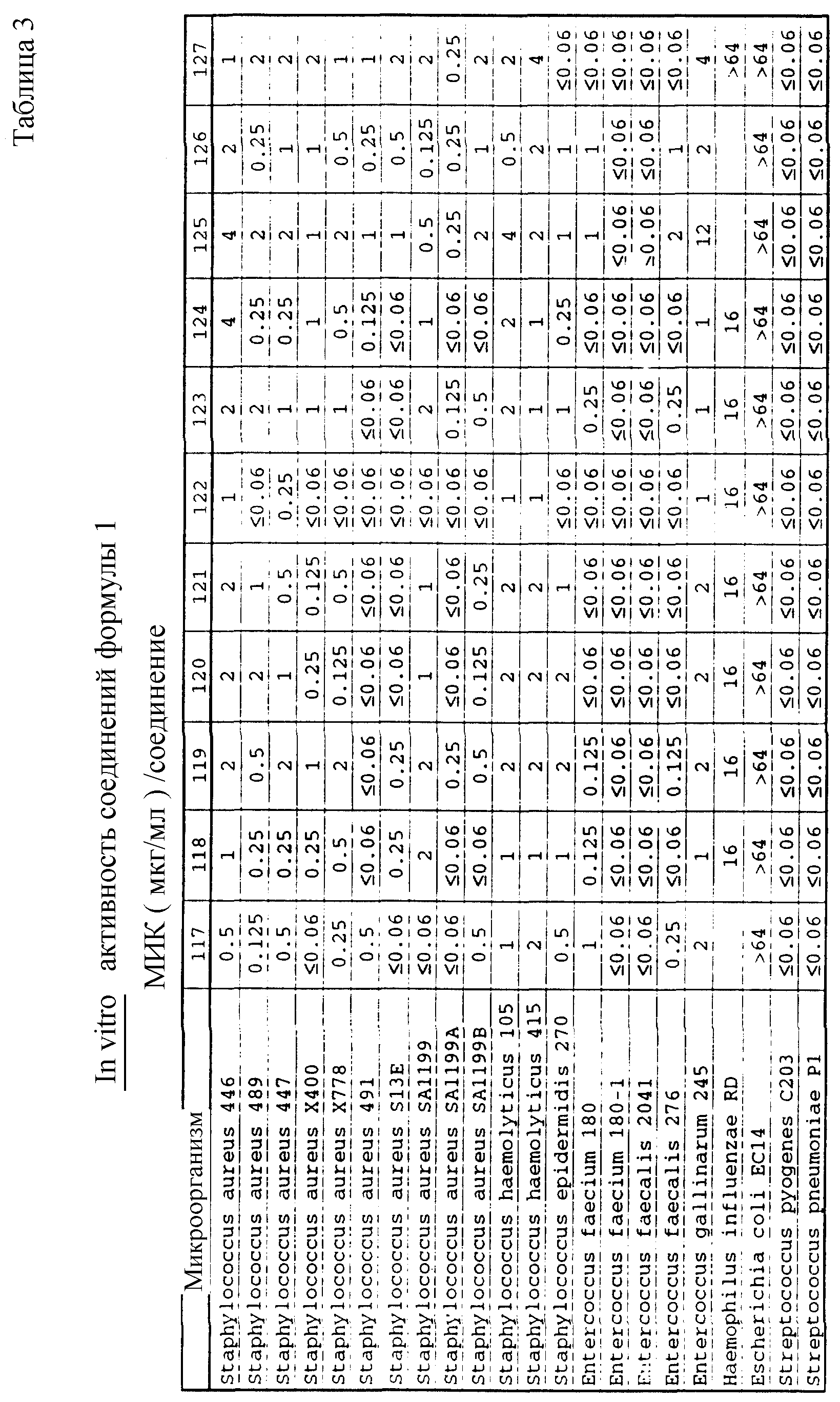
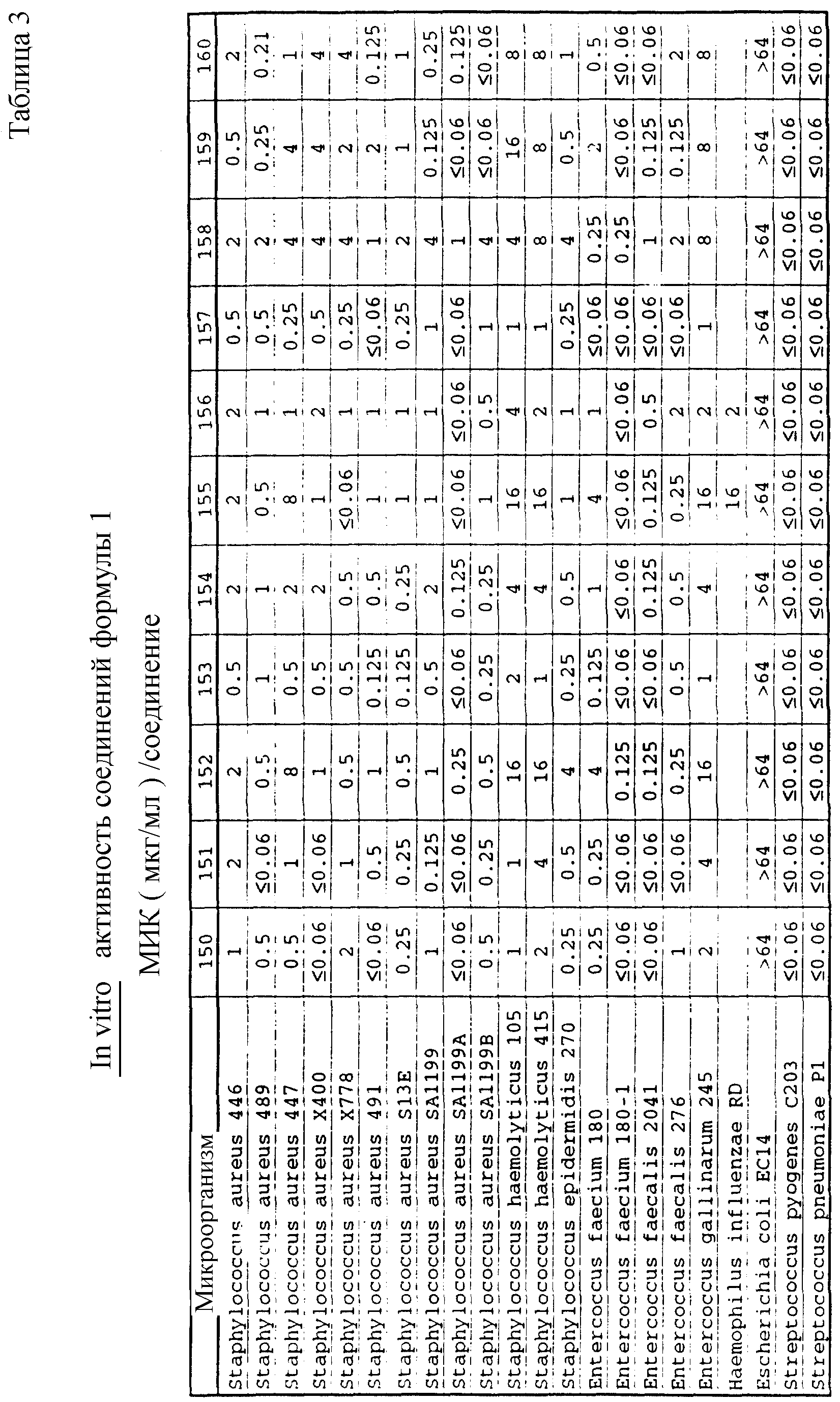
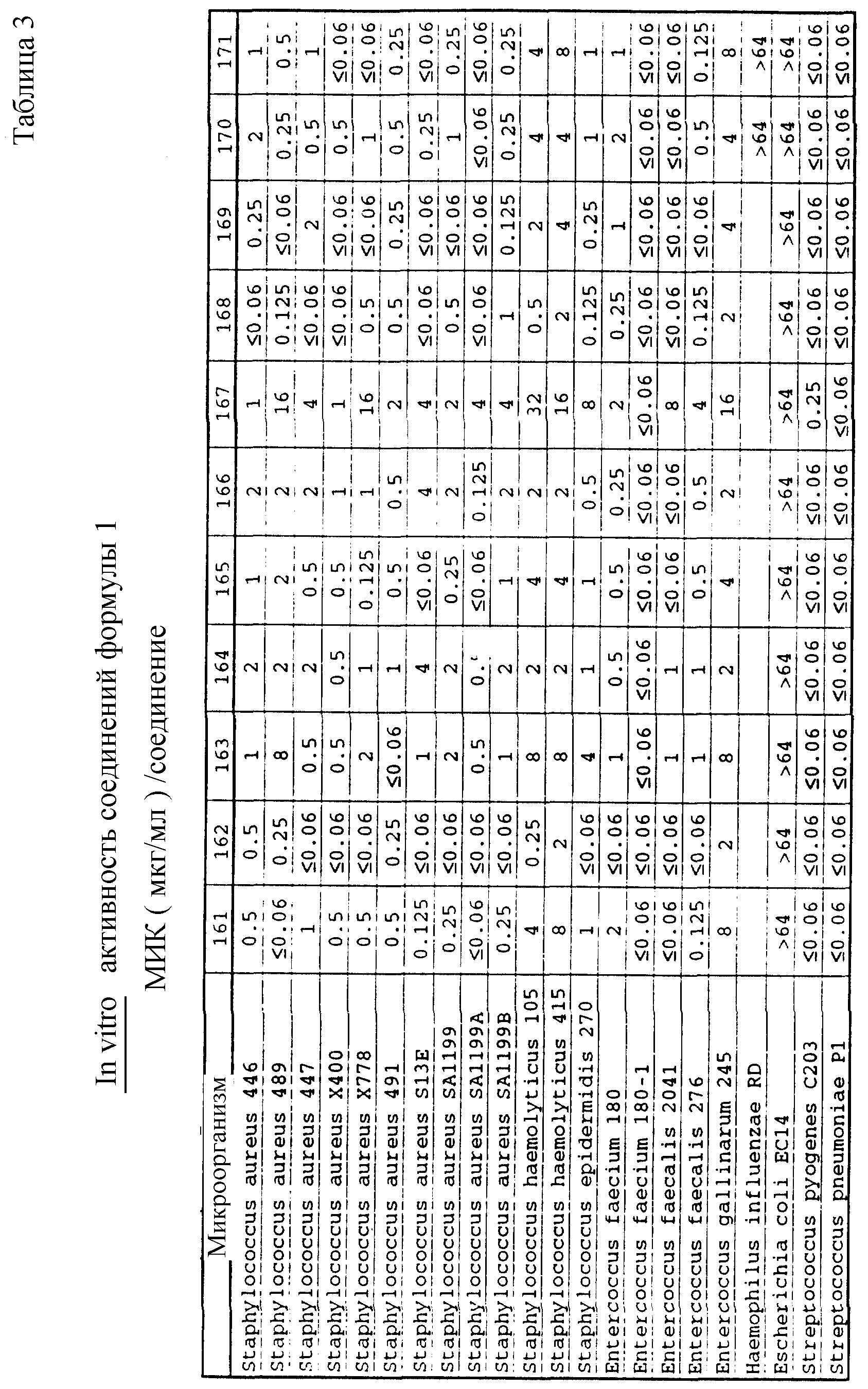
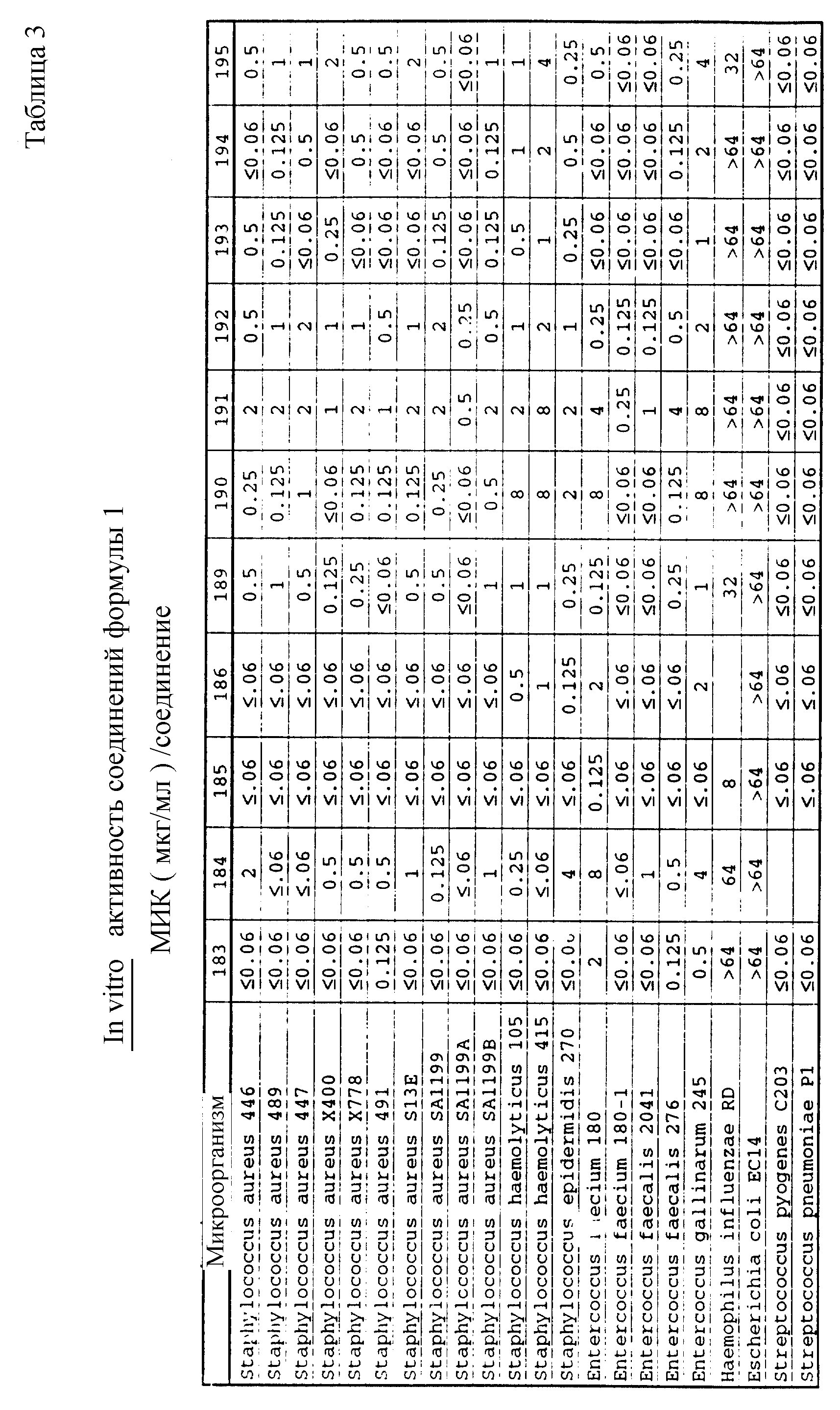
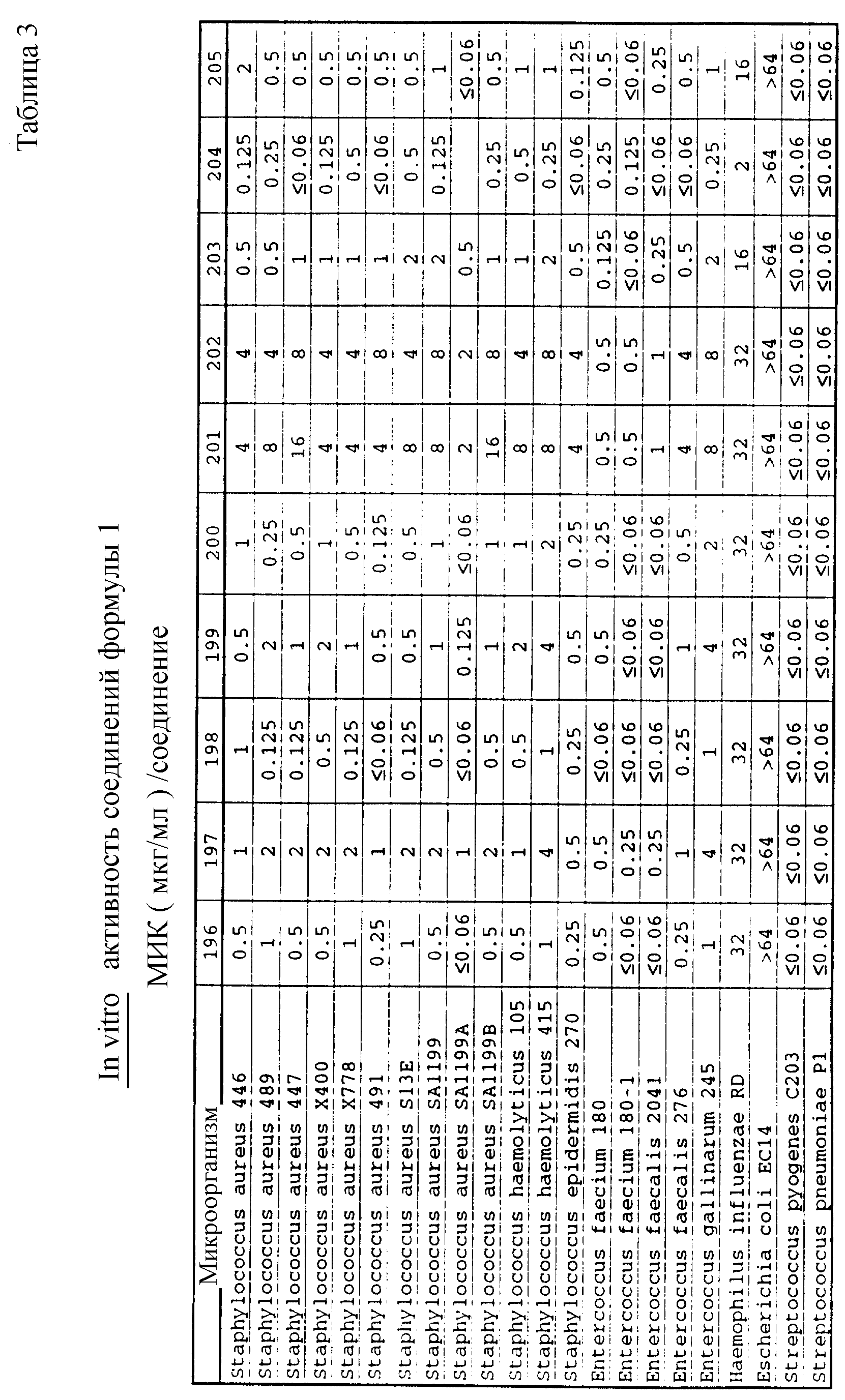
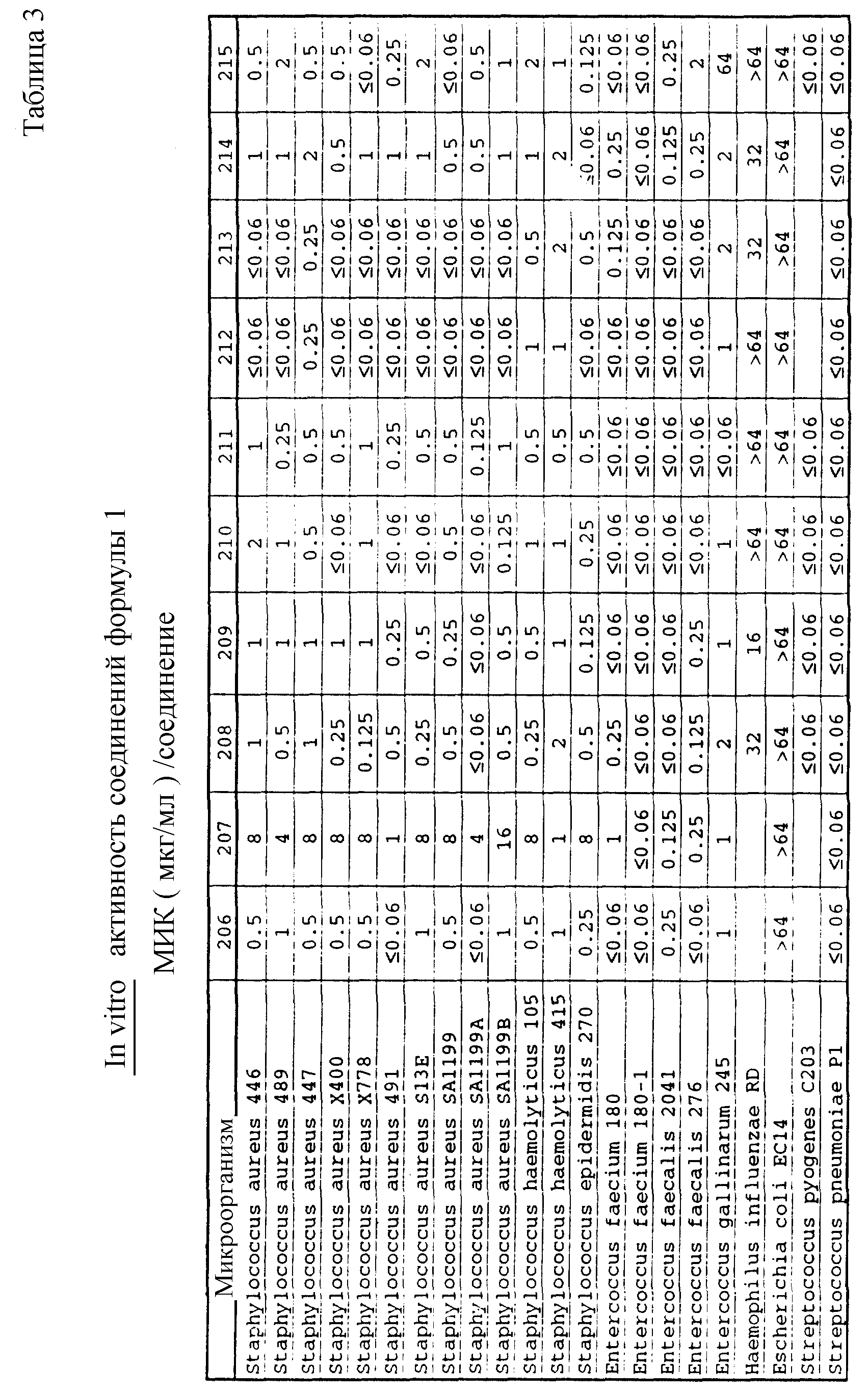
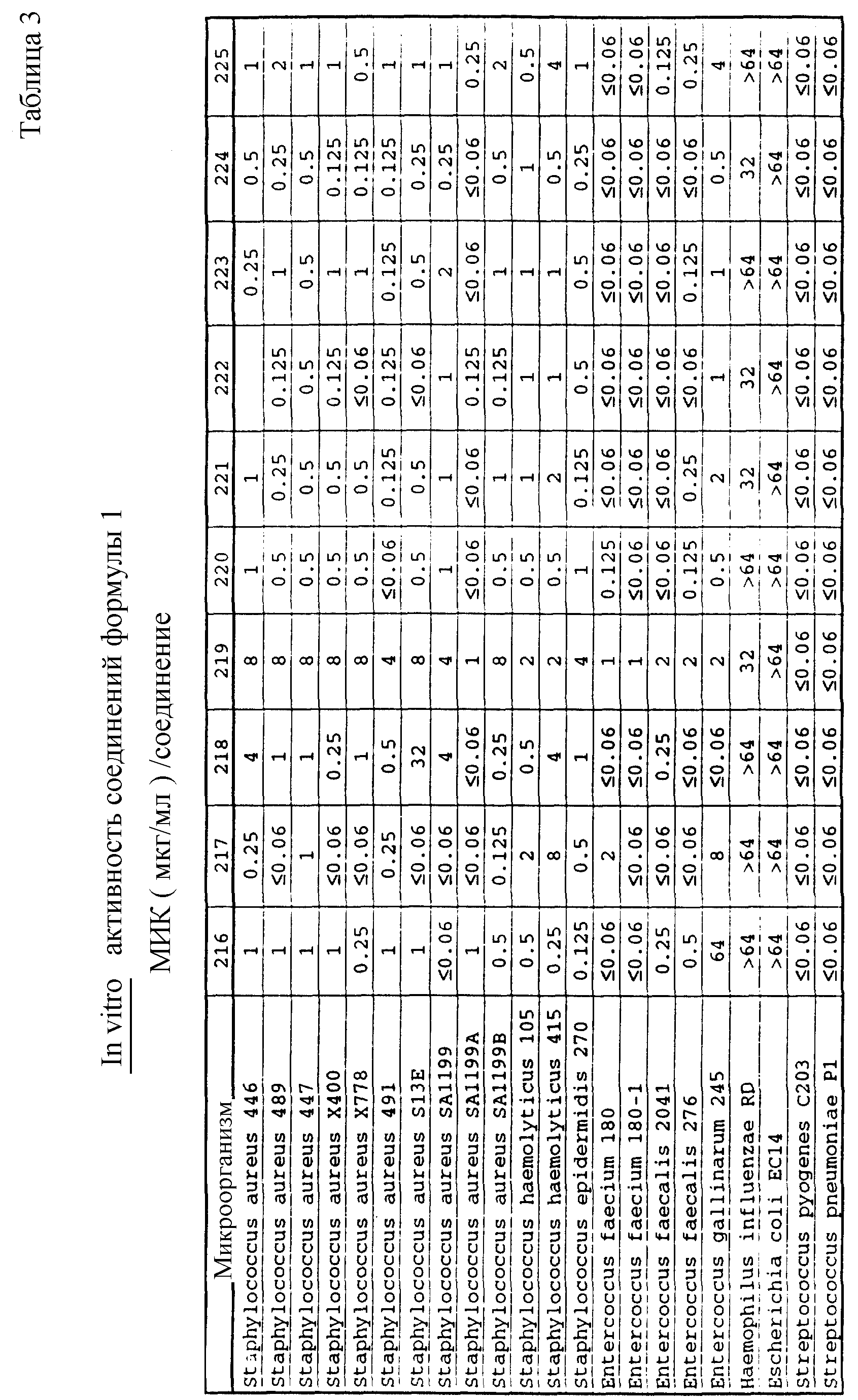
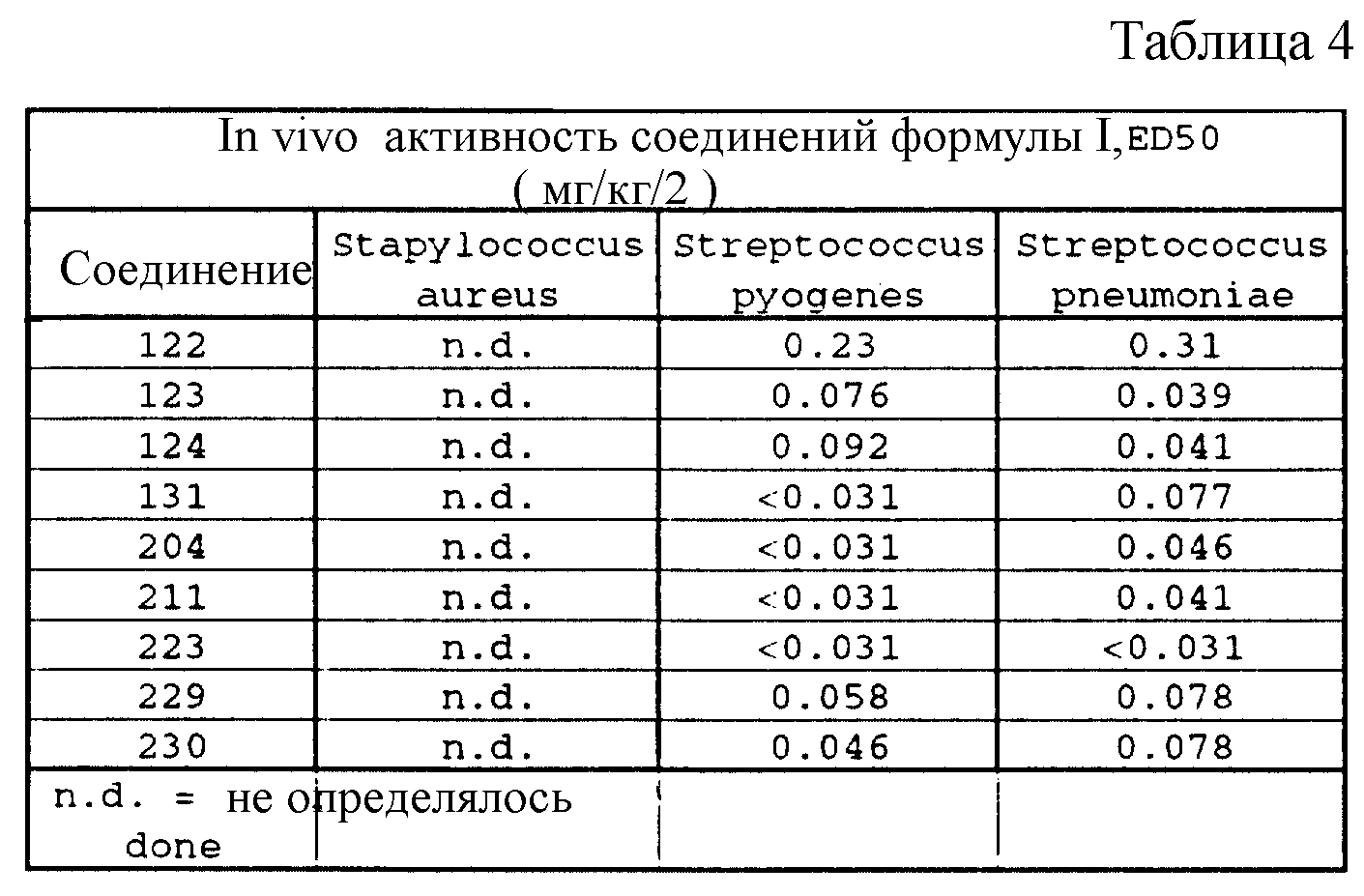
Соединения формулы I проявляются in vitro и in vivo активность против грамположительных патогенных бактерий. Минимальные ингибирующие концентрации (МИК), при которых соединения формулы I ингибируют определенные бактерии, приведены в таблице 3. Значения МИК определены с помощью стандартного анализа с микроразбавлением бульона.
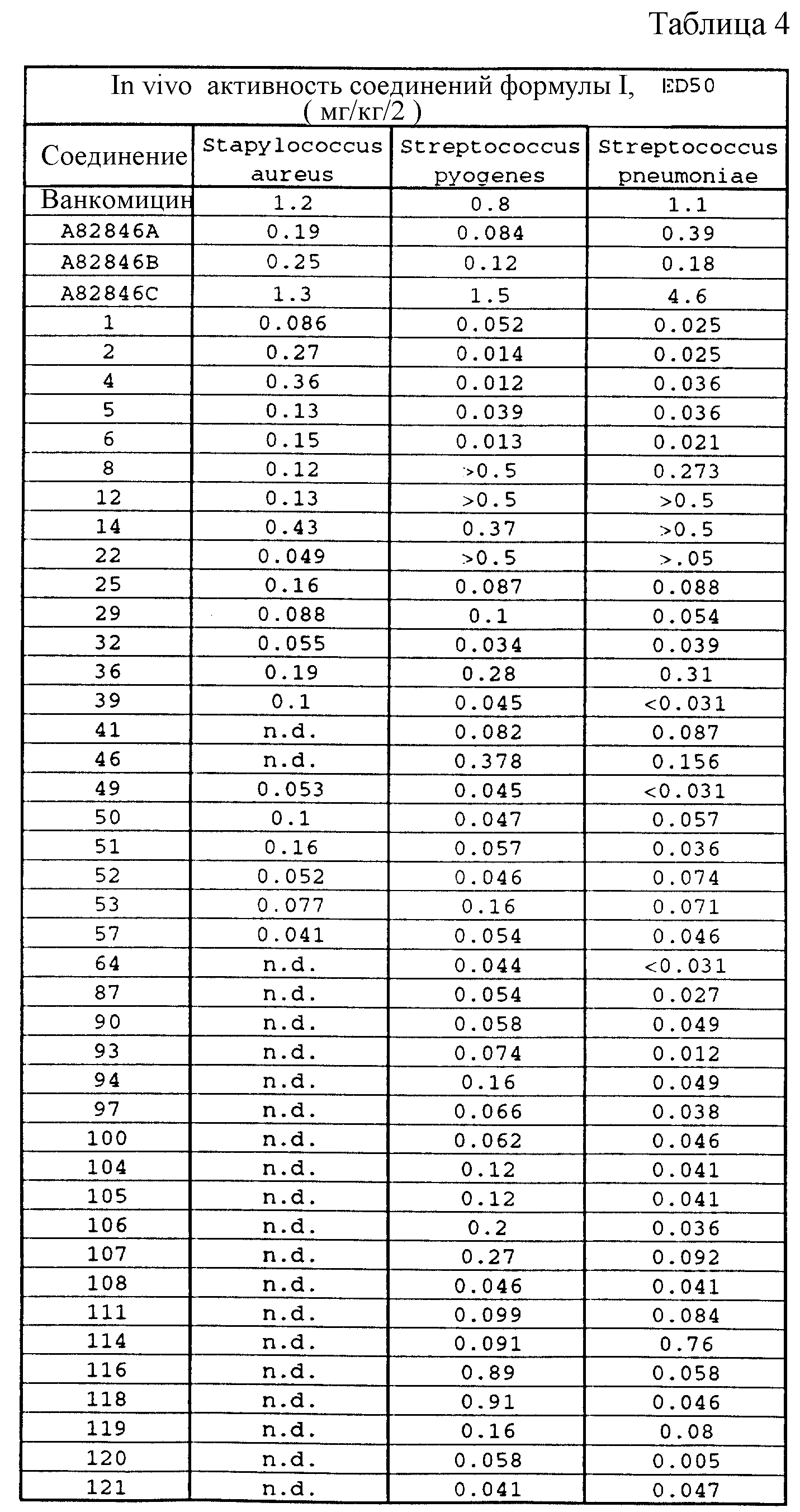
Соединения формулы I проявляют также in vivo противомикробную активность против экспериментально вызванной у лабораторных животных инфекции. Введением мыши, экспериментально инфицированной испытуемым микроорганизмом, двух доз испытуемого соединения наблюдаемую активность регистрируют в виде значений ЭД50 (эффективная доза в мг/кг, необходимая для защиты 50% испытуемых животных; см. W. Wick и др., J. Bacteriol., 81, 233-235 (1961). Значения ЭД50, наблюдаемые для испытуемых соединений, приведены в таблице 4.
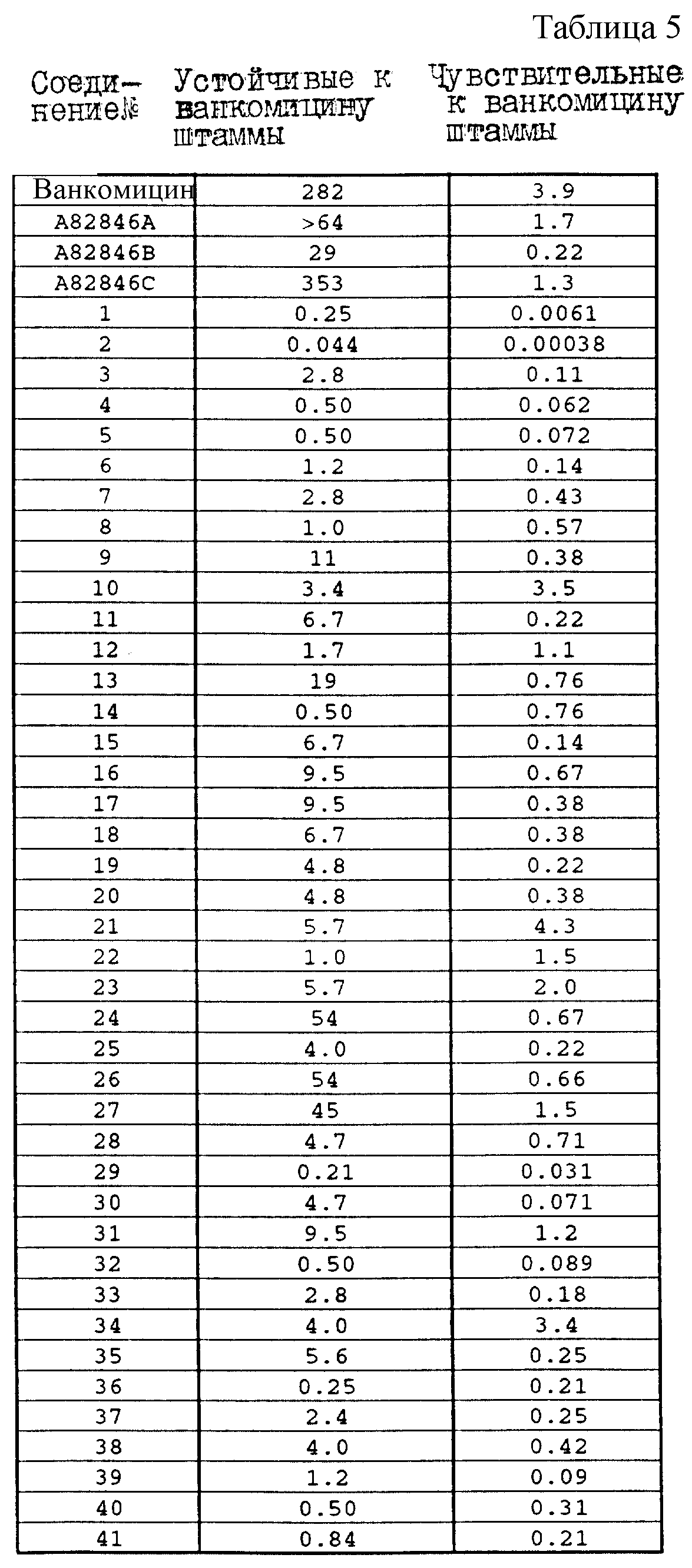
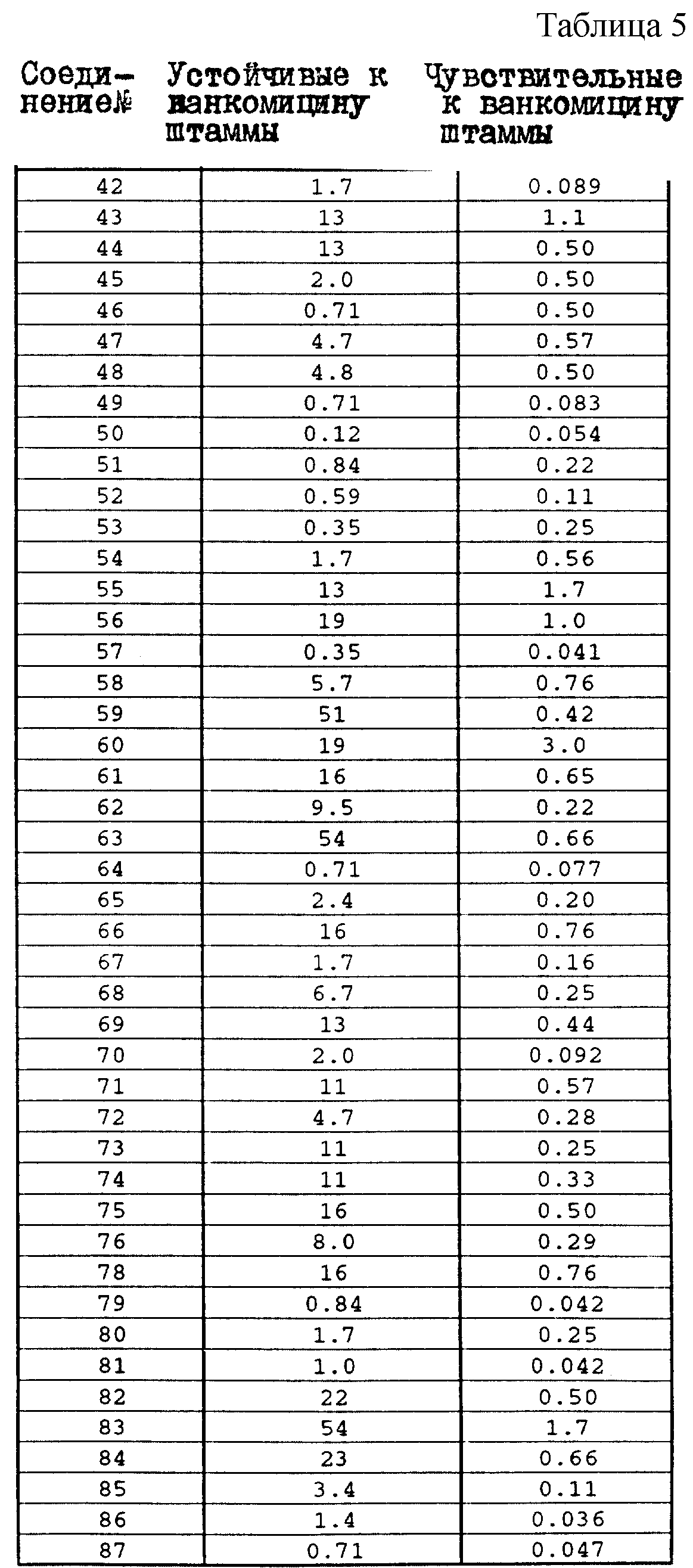
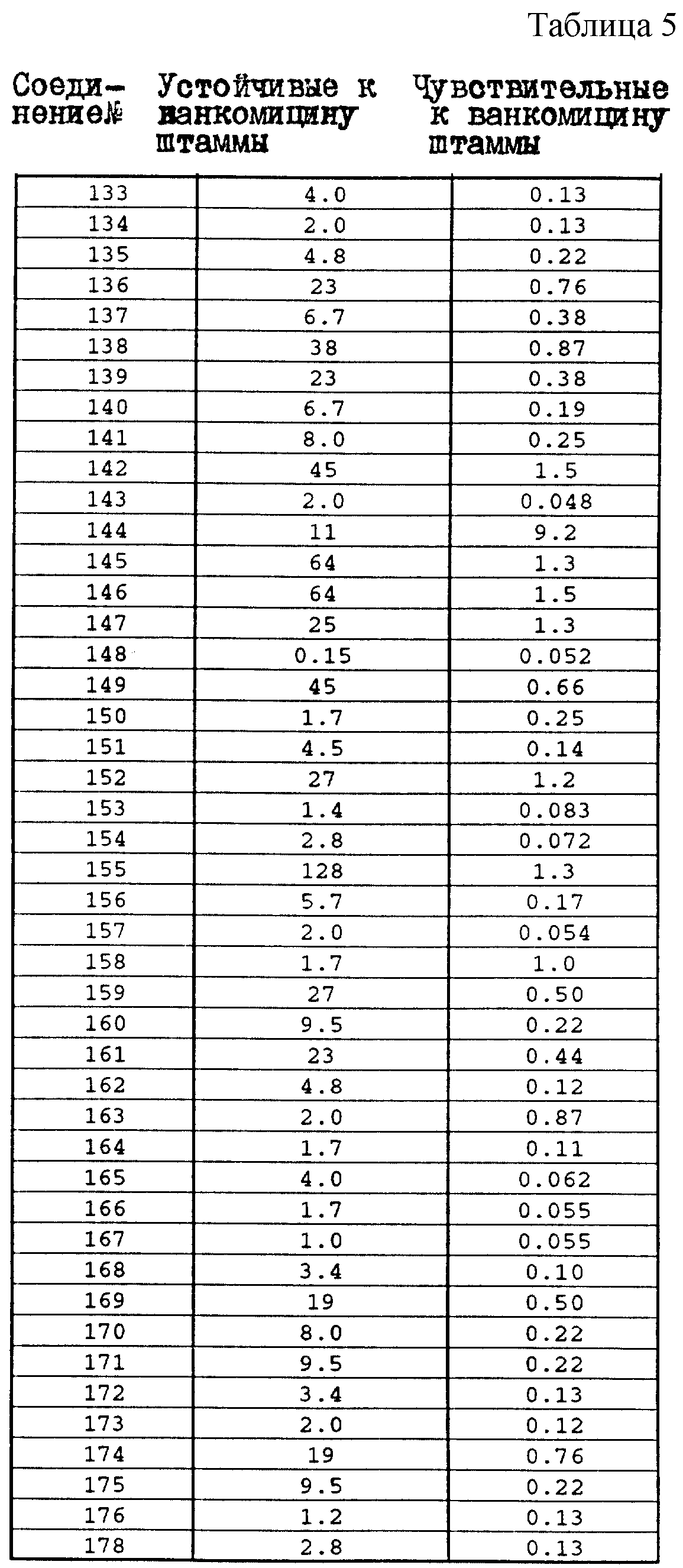
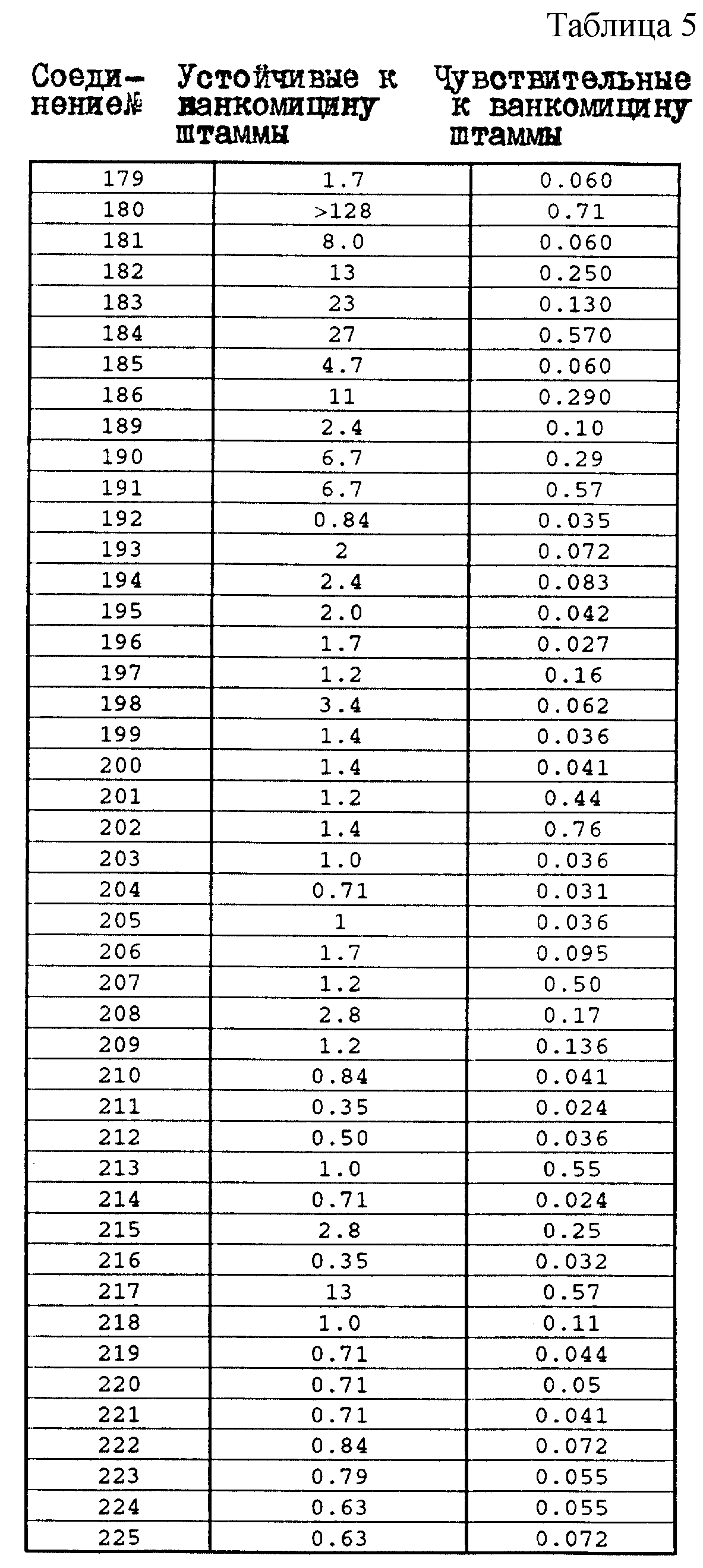
Один из важных аспектов противомикробной активности многих соединений формулы I заключается в их активности против устойчивых к ванкомицину Enterococci. Такая активность иллюстрируется таблицей 5, в которой суммированы результаты сравнения активности испытуемых соединений против представительных устойчивых к ванкомицину и подверженных действию ванкомицина Enterococci (Enterococcus faecium и Enterococcus faecalis, средне-геометрическое значение МИК (мкг/мл)), полученные применением стандартного анализа с микроразбавлением бульона. Конечные точки получают после 24-часового инкубирования. Модифицирование аминосахара в дисахаридном фрагменте приводит к улучшению активности против устойчивых к ванкомицину штаммов по сравнению с родоначальным гликопептидным антибиотиком.
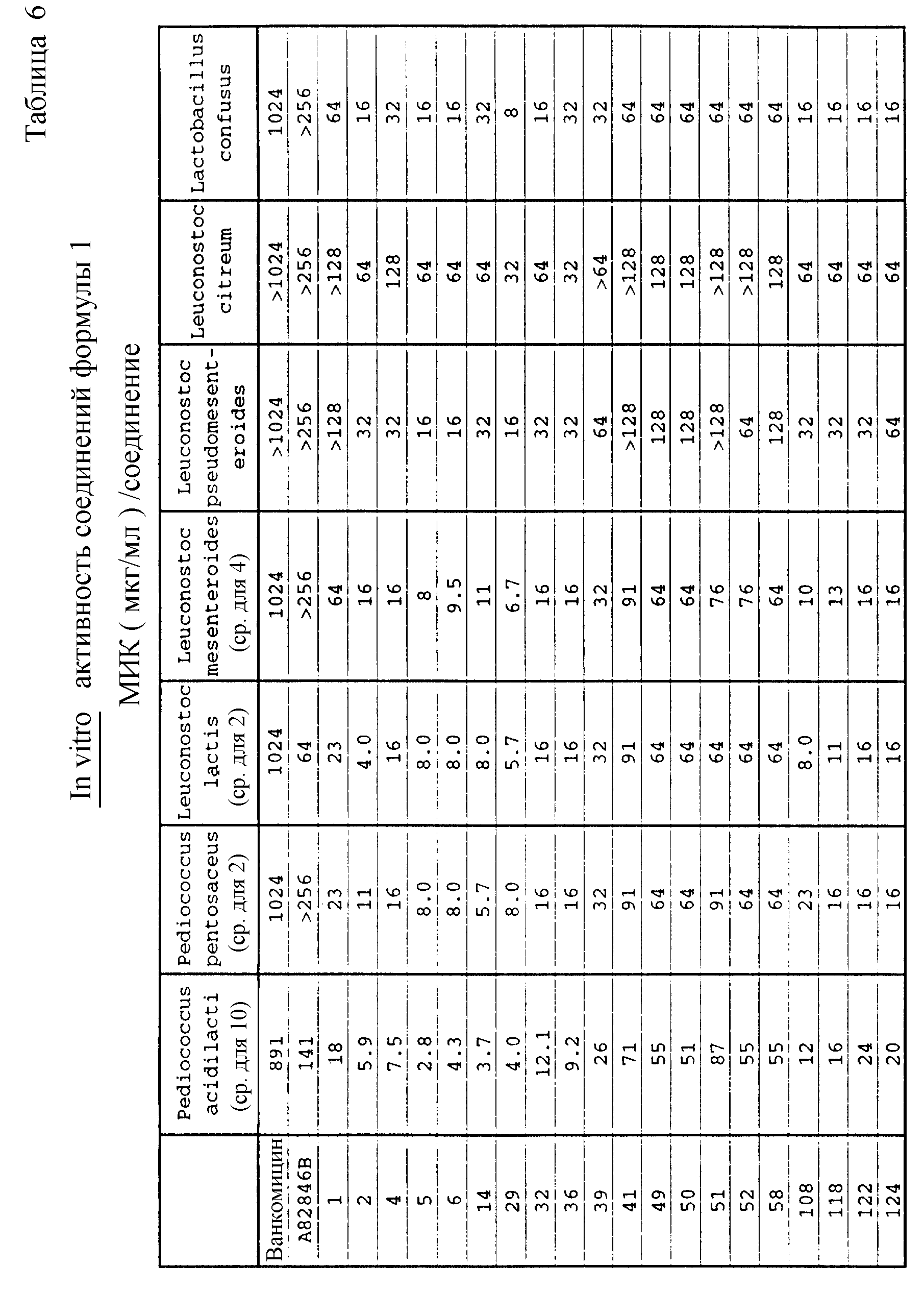
Ряд бактерий молочной кислоты, в том числе все Leuconostocs, все Pediococci и некоторые Laclobacilli изначально устойчивы к ванкомицину. При усиленном употреблении ванкомицина у больных с ослабленным иммунитетом отмечено увеличение частоты инфицирования указанными бактериями (Handwerger и др., Reviews of Infectious Disease 12, 602-610 (1990); Ruoff и др., Journal of Clinical Microbiology 26, 2064-2068 (1988)). Один из важнейших аспектов противомикробной активности соединений формулы I заключается в их активности против устойчивых к ванкомицину бактерий молочной кислоты. Соединения настоящего изобретения применимы для ингибирования роста устойчивых к ванкомицину молочных бактерий, например: Lueconostoc, Pedicocci и Lactobacilli, т. е. способны контролировать условно-патогенные инфекции, вызванные бактериями этой группы. Такого рода активность иллюстрируется таблицей 6, в которой суммированы результаты сравнения активности испытуемых соединений против представительных, устойчивых к ванкомицину бактерий молочной кислоты (Pedicoccus acidilacti, Pedicoccus pentosaceus, Lueconastoc mesenteroides, Lueconostoc pseudomesenteroides Leuconostoc lactis, Lueconostoc citreum и Laclobacillus confusus, среднегеометрические значения МИК (мкг/мл)), полученные стандартным анализом с разбавлением агара на сердечно-мозговом инфузионном агаре.
Фармацевтические препараты соединений формулы I также являются частью настоящего изобретения. Так, соединения, предпочтительно в виде фармацевтически приемлемых солей могут быть подготовлены для перорального или парентерального введения с целью терапевтического или профилактического воздействия на бактериальные инфекции.
К примеру, соединения могут быть смешаны с обычными фармацевтическими носителями или разбавителями и использованы в виде таблеток, капсул, элексиров, суспензий, сиропов, вафель и т.п. Препараты соединений формулы I содержат 0,1 - 90 мас. % активного компонента, как правило, 10 - 30мас.% Препараты могут содержать обычные носители и наполнители, например: зерновой крахмал или желатин, лактозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновую кислоту.
Размельчители, обычно применяемые в препаратах настоящего изобретения, включают: кроскармелозу, микрокристаллическую целлюлозу, зерновой крахмал, натрийкрахмалгликолят и альгиновую кислоту.
Связующие для таблеток, которые могут быть введены в препараты, включают: камедь акации, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, поливинилпирролидон (повидон), гидроксипропилметилцеллюлозу, сахарозу, крахмал и этилцеллюлозу.
Смазки, которые могут быть использованы, включают: стеарат магния или стеараты других металлов, стеариновую кислоту, силиконовую жидкость, тальк, воска, масла и коллоидную двуокись кремния.
Могут быть также использованы ароматизаторы, например: пепермент, винтергреновое масло, вишневые ароматизаторы и т.п.
Для придания препарату более привлекательного внешнего или для облегчения идентификации продукта может оказаться желательным добавление красителя.
Для внутривенного применения (ВВ) водорастворимая форма антибиотика может быть растворена в одной из обычно применяемых внутривенных жидкостей и введена вливанием. Могут быть использованы такие жидкости, как, например: физиологический солевой раствор, раствор Ринджера или 5%-ный раствор декстрозы.
В случае внутримышечных препаратов стерильный препарат приемлемой растворимой солевой формы соединения, например, гидрохлорида может быть растворен и введен в фармацевтическом разбавителе, например: свободной от пирогенов воде (перегнана), физиологическом солевом растворе, 5%-ном растворе глюкозы. Приемлемая нерастворимая форма соединения может быть приготовлена и введена в виде суспензии в водной основе или фармацевтически приемлемой масляной основе, например, в эфире длинноцепной жирной кислоты, такой как этилолеат.
Для перорального применения особенно рекомендуется стерильный препарат приемлемой солевой формы антибиотика, например, гидрохлорида в смеси с разбавителем, таким как деионизированная или дистиллированная вода.
Или же единичная дозированная форма антибиотика может представлять собой раствор антибиотика, предпочтительно в его солевой форме в приемлемом разбавителе, герметически запаянный в стерильную ампулу. Концентрация антибиотика может меняться, например, от 1 процента до 50 процентов в зависимости от конкретной формы антибиотика, его растворимости и дозы, назначаемой лечащим врачом.
В еще одном своем аспекте настоящего изобретения дается способ лечения у животных инфекционных заболеваний, особенно заболеваний, вызванных грамположительными микроорганизмами. Соединения настоящего изобретения особенно полезны для борьбы с инфекциями, вызванными устойчивыми к метициллину стафилококками. Соединения изобретения кроме того применимы для борьбы с инфекциями, вызванными энтерококками. Примеры подобных заболеваний включают: тяжкие инфекции стафилококками, например: стафилококковый эндокардит и стафилококковый сепсис. Животное может быть либо склонно к инфицированию, либо инфицировано микроорганизмом. Способ состоит во введении животному такого количества соединения формулы I, которое будет эффективно для поставленной цели. Как правило, эффективное количество соединения формулы 1 - это доза в интервале 0,5 - 100 мг/кг. Рекомендуемая доза составляет 1 - 60 мг/кг активного соединения. Типичная ежедневная доза для взрослого человека составляет от 50 мг до 5 г.
При реализации способа на практике антибиотик может быть введен единственной ежедневной дозой или в виде многих доз ежедневно. Режим лечения может потребовать введения в течение длительного периода, например, несколько дней или в течение одной-шести недель. Количество на вводимую дозу или общее введенное количество будет зависеть от таких факторов, как природа и тяжесть инфекции, возраст и общее состояние здоровья больного, толерантность больного к антибиотику и микроорганизм или микроорганизмы, участвующие в инфекции.
Удобный метод реализации на практике способа лечения состоит во введении антибиотика путем внутривенного вливания. По этой методике стерильный препарат приемлемой растворимой соли антибиотика в физиологической жидкости, например, 5% растворе декстрозы медленно вливают ВВ. Или же может быть использован метод ретроградного ВВ вливания.
Для более полной иллюстрации способов настоящего изобретения даются следующие примеры, которые не предназначены для ограничения объема изобретения.
Пример 1
Способ A
Получение соединения 2
Смесь A82846B - триацетата (2,25 г, 1,27 ммоля,
1 эквивалент (экв.)) в ДМФА-метанол (1: 1) (140 мл) в атмосфере аргона обрабатывают 4-бифенилкарбоксальдегидом (331 мг, 2,12 ммоля, 1,7 экв.). Полученную смесь нагревают до 70oC и
выдерживают при этой температуре 1,75 - 2 часа. Затем раствор обрабатывают цианоборгидридом натрия (554 мг, 8,83 ммоля, 6,9 экв.). Нагревание при 70oC продолжают еще 1,75 - 2 часа, после
чего реакционную смесь охлаждают до комнатной температуры, концентрируют в вакууме, разбавляют водой (150 мл) и лиофилизацией получают твердое вещество.
Вещество очищают препаративной высокоэффективной жидкостной хроматографией (ВЭЖХ) с обращением фаз с применением Уотерс 3 х (40 х 100 мм) C18 Нова-Пак патрона с Уотерс C18 Нова-Пак предохранительной вставки и использованием ТЭАФ буферной системы. В способе анализа применяют: 0,2% ТЭА с фосфорной кислотой (ТЭАФ), pH 3, градиентную систему 5% CH3CN - 84,8% H2O с 0,2% ТЭАФ, которую поддерживают постоянной со времени 0, и 60% CH3CN - 39,8% H2O с 0,2% ТЭАФ, которую поддерживают постоянной спустя 20 минут. Длина волны в УФ диапазоне 235 нм и скорость потока 2 мл/минуту. Анализ проводят с применением Уотерс Нова-Пак C18 RCM колонки (8 х 100 мм) с Нова-Пак C18 предохранительной вставкой. При использовании данного метода ВЭЖХ необходимо обессоливать продукт после очистки с обращением фаз.
Обессоливание осуществляют внесением очищенного продукта в 5 - 10 мл H2O. Для растворения образца при перемешивании по каплям прибавляют 1 н. HCl. Значение pH в этот момент 1 - 3. Значение pH раствора затем повышают до 8,2 добавлением 1 н. NaOH. Из раствора выпадает белый осадок. Смесь охлаждают, фильтруют и после сушки под вакуумом 8 - 15 часов получают цвитер-ион (или нейтральное соединение) целевого продукта, т.е. соединения 2 (п-фенилбензил - A82846B), 1,02 г (45%).
Пример 2
Получение соединения 4
К смеси A82846B
- триацетата (1,5 г, 0,848 ммоля, 1 экв.) с метанолом (100 мл) в атмосфере аргона добавляют п-феноксибензальдегид (298 мг, 1,51 ммоля, 1,8 экв. ). Полученную смесь нагревают до кипения и кипятят 2
часа. Затем к раствору добавляют цианоборгидрид натрия (326 мг, 5,18 ммоля, 6,1 экв. ). Кипячение продолжают еще 2 часа, после чего реакционную смесь охлаждают до комнатной температуры и испаряют
досуха в вакууме.
Продукт очищают ВЭЖХ с обращением фаз с ТФУ буфером. Аналитический метод осуществляют применением Уотерс Нова-Пак C18 PCM колонки (8 х 100 мм) с Нова-Пак C18 предохранительной вставки и элюированием со скоростью 2 мл/минуту линейным градиентом 15% ацетонитрила - 0,1% ТФУ в момент времени ноль до 80% ацетонитрила - 0,1% ТФУ через 15 минут. Содержащие продукт фракции детектируют сканированием в ультрафиолете при 234 нм. Органический растворитель в целевых фракциях удаляют и лиофилизацией смеси получают в виде белого твердого вещества 0,618 г 4-трис(трифторацетатной) соли п-феноксибензил-A82846B производного (выход 20%). Нет необходимости в обессоливании или дополнительной очистки. Данный способ кроме того особенно полезен для синтеза соединения 2, когда одним из исходных продуктов является фенилбензальдегид.
Пример 3
Способ B
Получение соединения 176
К смеси A82846B - триацетата (280 мг,
0,157 ммоля, 1 экв.) в ДМФА-метанол (1:1, 30 мл) добавляют 8-фенилоктаналь (59 мг, 0,29 ммоля, 1,8 экв.) и цианоборгидрид натрия (60 мг, 0,95 ммоля, 6,1 экв.). Полученную смесь нагревают в атмосфере
азота до 70oC и выдерживают при этой температуре 1 час. Затем реакционную смесь охлаждают до комнатной температуры и концентрированием в вакууме получают остаток. Очистку продукта
осуществляют препаративной ВЭЖХ с обращением фаз с применением Уотерс 2 х (40 х 100 мм) C18 Нова-Пак патрона с Уотерс C18 Нова-Пак предохранительной вставки. Элюирование осуществляют рассчитанным на
30 минут линейным градиентом (время = 0 минут 95% ТЭАФ (0,5% водный триэтиламин с установленным добавлением фосфорной кислоты значением pH 3) -5% CH3CN до времени = 30 минут 20% ТЭАФ - 80%
CH3CN) при скорости потока 40 мл/минуту и УФ детектировании при 280 нм. Целевые фракции концентрируют в вакууме и затем обессоливают патронами Уотерс Сеп-Пак по нижеприведенной методике. В
результате с выходом 22% (60 мг) получают соединение 176.
Полученное соединение обессоливают следующим образом. Патрон Уотерс Сеп-Пак, предварительно увлажненный метанолом (2-3 объема колонки), кондиционируют водой (2-3 объема колонки). Образец растворяют в минимальном объеме воды (2-3 объема колонки), загружают в Сеп-Пак колонку и для удаления нежелательных солей промывают водой (2-3 объема колонки). Затем продукт элюируют приемлемой системой растворителей, обычно CH3CN-H2O (1:1), CH3CN и/или метанол. Органический растворитель удаляют в вакууме и лиофилизацией водного раствора получают конечный продукт.
Пример 4
Получение соединения 229
В 3-горлую колбу на три литра, снабженную холодильником, вводом
для азота и вставляемым через горло механическим устройством для перемешивания, загружают размельченную ацетатную соль A82846B (20 г, 1,21 • 10-3 моля) и метанол (1000 мл). Загрузку
проводят в атмосфере азота. К перемешиваемой смеси добавляют 4'-хлорбифенилкарбоксальдегид (2,88 г, 1,33 • 10-2 моля, 1 экв. ) и затем метанол (500 мл). Наконец добавляют
цианоборгидрид натрия (0,84 г, 1,33 • 10-2 моля, 1,1 экв.) с последующим добавлением метанола (500 мл). Полученную смесь нагревают до кипения (примерно 65oC).
После кипячения в течение 1 часа реакционная смесь становится однородной. После кипячения 25 часов источник тепла убирают и в прозрачной реакционной смеси pH-метром определяют pH (6,97 при 58oC). Добавлением 1 н. NaOH (22,8 мл) устанавливают pH 9 (при 54,7oC). Колбу снабжают перегонной насадкой и смесь концентрируют при неполном вакууме до массы 322,3 грамма, поддерживая температуру нагревателя в интервале 40 - 45oC.
Перегонную насадку заменяют капельной воронкой, содержащей 500 мл изопропанола (ИПА). ИПА прибавляют по каплям в течение 1 часа к раствору при комнатной температуре. После добавления примерно 1/3 ИПА образуется гранулированный осадок. После начала осаждения ИПА добавляют с большей скоростью. Взвешиванием колбы определяют, что она содержит 714,4 грамма ИПА-метанольной взвеси.
В колбу вновь вставляют отгонную насадку, и остатки метанола удаляют отгонкой при пониженном давлении. Полученную взвесь (377,8 г) оставляют на ночь в холодильнике охлаждаться. Сырой продукт фильтруют через слой полипропилена и дважды ополаскивают 25 мл холодного ИПА. После сушки в воронке 5 минут объединенный продукт помещают в вакуумную печь для сушки при 40oC. Получают светло-розовое твердое вещество (22,87 г (теоретический выход 22,43 г)). ВЭЖХ анализом по стандарту выявлено содержание в сыром продукте 68 мас. % соединения 229 (4-/4-хлорфенил/бензил-A82846B), что соответствует скорректированному выходу сырого продукта в 69,3%.
Продукты реакции анализируют ВЭЖХ с обращением фаз с применением Зорбакс SB-C18 колонки и детектированием в ультрафиолетовом диапазоне (УФ, 230 нм). Применяют 20-минутную градиентную систему растворителей, состоящую из 95% водного буфера -5% CH3CN в момент времени = 0 минут до 40% водного буфера -60% CH3CN в момент времени = 20 минут, причем в качестве водного буфера используют ТЭАФ (5 мл CH3CN, 3 мл фосфорной кислоты в 1000 мл воды).
Пример 5
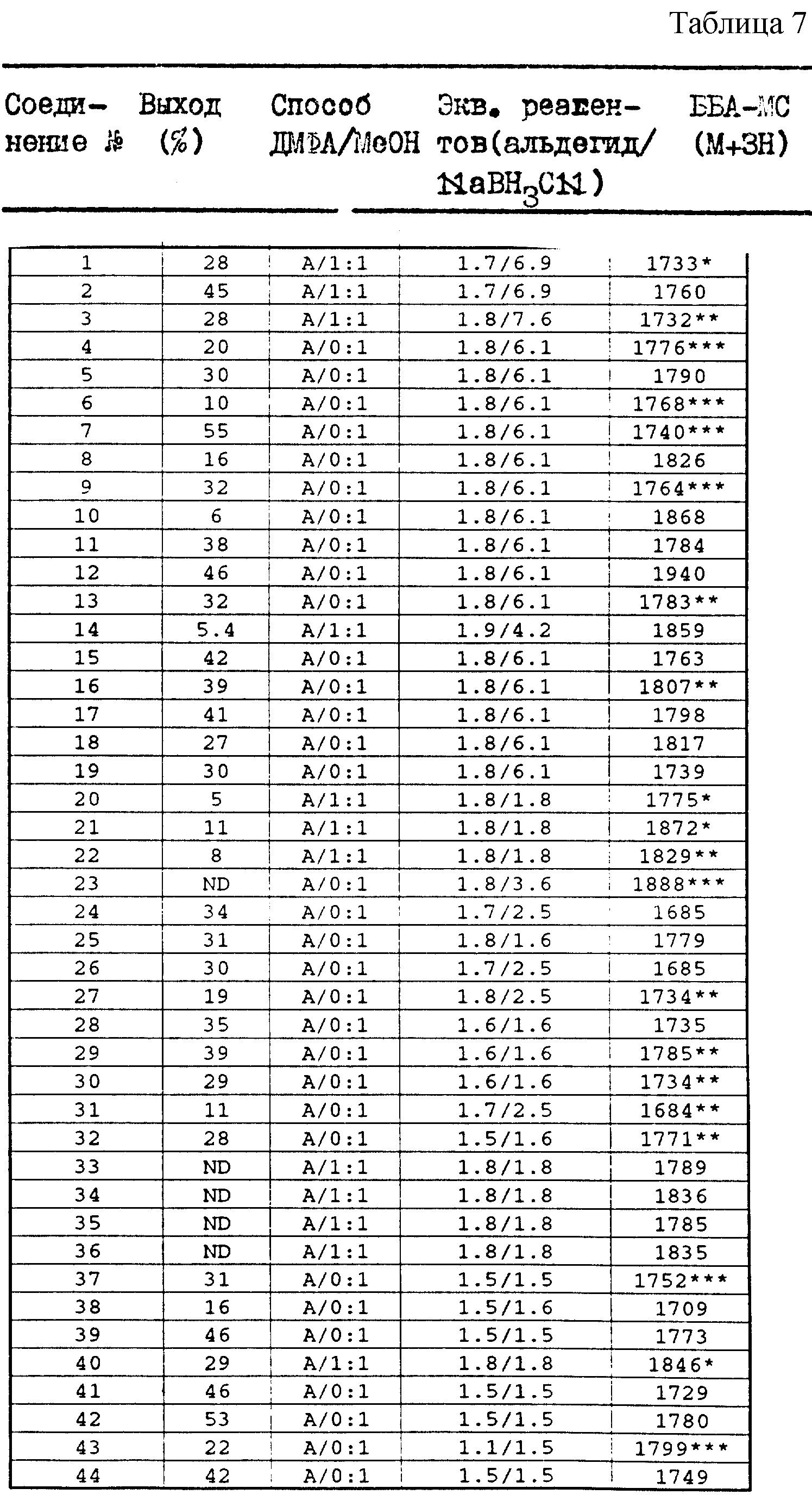
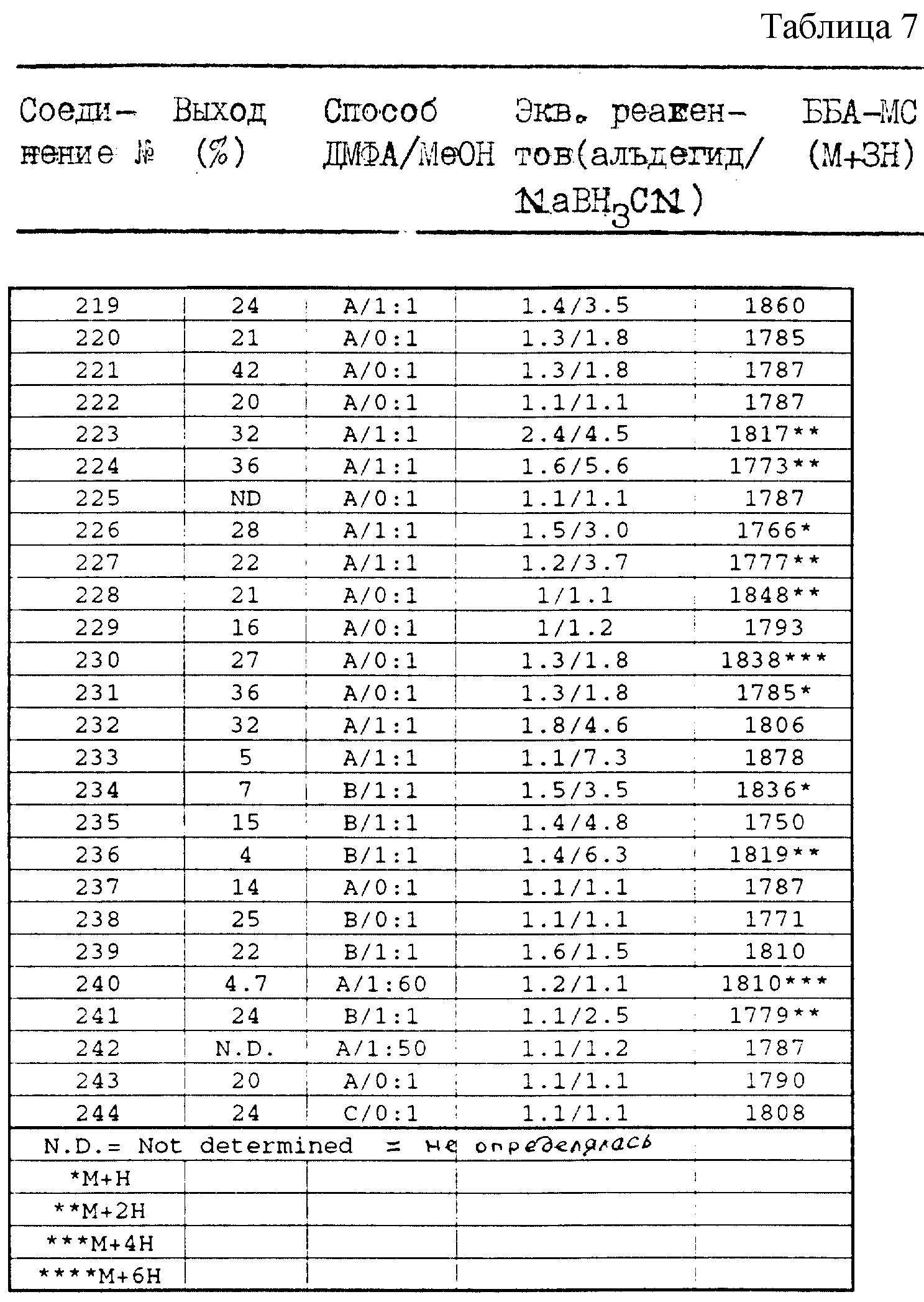
В таблице 7 суммированы способ получения и некоторые физические характеристики полученных соединений. Выход продукта
рассчитывают использованием количества соединения формулы II в качестве лимитирующего реактива. В таблице 7 можно найти определения, которые разъясняются ниже. "Способ" относится к способу синтеза,
приведенному в примерах 1 и 2 или 3. "Эквиваленты реактивов" относятся к молярным эквивалентам альдегида и восстановителя относительно соединения формулы II. Определение "ББА-МС (M+3H)" относится к
масс-спектрометрии с бомбардировкой быстрыми атомами.
Пример 6
Капсулированный препарат
Капсулы, содержащие 250 мг соединения 2, получают использованием следующих
компонентов:
Компонент - Масса
Соединение 2, HCl соль - 255,4 мг
Зерновой крахмал, текучий порошок - 150 мг
Зерновой крахмал - 144,4 мг
Соединение 2 (HCl
соль, 255,4 мг), текучий порошок зернового крахмала (150 мг) и зерновой крахмал (144,6 г) смешивают в приемлемом смесителе до гомогенного состояния. Полученную смесь применяют для заполнения твердых
желтых до чистой массы заполнения в 550 мг.
Пример 7
Капсулированный препарат
Капсулы, содержащие 250 мг соединения 229, получают использованием следующих
компонентов:
Компонент - Масса
Соединение 229, HCl соль - 255,4 мг
Текучий порошок зернового крахмала - 150 мг
Зерновой крахмал - 144,6 мг
Соединение 229
(HCl соль, 255,4 мг), текучий порошок зернового крахмала (150 мг) и зерновой крахмал смешивают в приемлемом смесителе до гомогенного состояния. Полученной смесью заполняют твердые желатиновые капсулы
до чистой массы заполнения в 550 мг.
Пример 8
Суспензионный препарат
Стерильную нерастворимую форму соединения 2 размалывают или просеивают до приемлемого для
образования суспензии размера частиц. Полученный порошок суспендируют в носителе следующего состава.
Компонент - Масса
Лецитин - 1%
Цитрат натрия - 2%
Пропилпарабен - 0,015%
Дистиллированная вода - ск. необх. до целевого объема
Пример 9
Суспензионный препарат
Стерильную нерастворимую форму соединения 229
размалывают или просеивают до приемлемого для образования суспензии размера частиц. Полученный порошок суспендируют в носителе следующего состава.
Компонент - Масса
Лецитин
- 1%
Цитрат натрия - 2%
Пропилпарабен - 0,015%
Дистиллированная вода - ск. необх. до целевого объема
Пример 10
Таблетированный препарат
Таблетки,
содержащие 250 мг соединения 2, получают использованием следующего состава:
Компонент - Масса
Лецитин - 1%
Цитрат натрия - 2%
Пропилпарабен - 0,015%
Дистиллированная вода - ск. необх. до целевого объема
Пример 11
Таблетированный препарат
Таблетки, содержащие 250 мг соединения 229, получают использованием следующего
состава:
Компонент - Масса
Лецитин - 1%
Цитрат натрия - 2%
Пропилпарабен - 0,015%
Дистиллированная вода - ск. необх. до целевого объема
Пример
12
Таблетированный препарат
Таблетки, содержащие 250 мг соединения 2, получают использованием следующего состава:
Компонент - Масса
Соединение 2, HCl соль - 255,4
мг
Микрокристаллическая целлюлоза - 101,1 мг
Кроскармелоза натрия - 12,0 мг
Провидон - 12,0 мг
Стеарат магния - 3,0 мг
Стеариновая кислота - 4 мг
Очищенная вода - 0,16 мг
Пример 13
Таблетированный препарат
Таблетки, содержащие 250 мг соединения 229, получают использованием следующего состава:
Компонент
- Масса
Соединение 229, HCl соль - 255,4 мг
Микрокристаллическая целлюлоза - 101,1 мг
Кроскармеллоза натрия - 12,0 мг
Провидон - 12,0 мг
Стеарат магния - 3
мг
Стеариновая кислота - 4 мг
Очищенная вода - 0,16 мгр
Реферат
Описываются новые производные гликопептида общей формулы (I), где значения радикалов указаны в п.1 формулы изобретения, соединения являются новыми членами группы гликопептидных антибиотиков. Они проявляют широкую активность против грамположительных микроорганизмов, а также улучшенную противомикробную активность против устойчивых к ванкомицину изолятов. Описывается также способ получения вышеуказанных соединений, а также фармацевтическая композиция на основе соединений формулы (I). 7 с. и 12 з.п. ф-лы, 7 табл.
Формула
или их соли,
где X представляет водород или хлор;
R и R6 представляют 4-эпи-ванкозаминил;
R7 представляет (C2 - C12)алкенил, (C2 - C12)алкинил, (C1 - C12алкил)R8, (C2 - C12)алкил-галоген, (C2 - C6)алкенил-R8; (C2 - C6)-алкинил-R8, (C1 - C12)-алкил-OR8,
и присоединен к аминогруппе в R6;
R8 выбирают из группы, включающей
а) полициклический арил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) гидроксигруппу, II) галоген, III) нитрогруппу, IV) (C1 - C6)-алкил, V) (C2 - C6)-алкокси, VI) галоген-(C1 - C6)-алкокси, VII) группу формулы -S(O)n'-R9, где n' = 0, R9 представляет (C1 - C6)-алкил;
в) гетероарил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) галоген, II) (C1 - C6)-алкил, III) (C1 - C6)-алкокси, IV) фенил, V) фенил, замещенный (C1 - C6)алкилом, (C2 - C6)-алкокси, VI) тиенил;
с) группу формулы
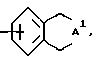
где A1 представляет -C(A2)2-C(A2)2-C(A2 )2-C(A2)2- и каждый заместитель A2 независимо выбирают из водорода, (C1 - C6)-алкила, (C4 - C10)-циклоалкила;
d) группу формулы
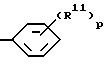
где p = 1 - 5,
R11 независимо выбирают из группы, включающей I) нитро, II) гидрокси, III) галоген, IV) (C1 - C8)-алкил, V) (C1 - C8)-алкокси, VI) (C2 - C9)алкинил, VII) (C9 - C12)-алкокси, VIII) (C1 - C3)алкоксигруппу, замещенную (C1 - C3)алкокси, гидрокси- или (C1 - C4)алкилтиогруппой, IX) (C2 - C5)-алкенилокси, X) галоген-(C1 - C6)-алкокси, XI) (C2 - C6)-алкилтио, XII) (C2 - C10)-алканоилокси, XIII) (C1 - C3)-алкилсульфонилокси, XIV) карбокси-(C1 - C3)-алкил, XV) N-[ди(C1 - C3)-алкил]амино-(C1 - C3)-алкокси, XVI) циано-(C1 - C6)-алкокси, XVII) дифенил-(C1 - C6)-алкил при условии, что когда R11 является (C1 - C8)алкилом, (C1 - C8)алкокси или галогеном, p должно превышать или быть равным 2,
или когда R7 представляет (C1 - C3)-алкил-R8, то R11 отличен от водорода, (C1 - C8)алкила, (C1 - C8)-алкокси или галогена;
е) группу формулы
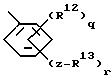
где q = 0 - 4;
R12 независимо выбран из группы, включающей I) галоген, II) нитро, III) (C1 - C6 )алкил, IV) (C1 - C6)алкокси,
r = 1 - 5 при условии, что сумма q и r не превышает 5;
z выбирают из группы, включающей I) простую связь, II) двухвалентный (C1 - C6)алкил, незамещенный или замещенный гидроксигруппой, (C1 - C6)алкилом, III) двухвалентный (C2 - C6)алкенил, IV) группу формулы -[C(R14)2]s-R15, где s = 0 и R15 представляет собой -O-, -S-, -SO-, -SO2-, -SO2-O, -OC(O)-; когда s = 1, R14 представляет собой водород;
R13 независимо выбран из группы, включающей I) (C4 - C10)-гетероциклил, II)гетероарил, III) (C4 - C10 )-циклоалкил, незамещенный или замещенный (C1 - C6)алкилом, или IV) фенил, незамещенный или замещенный 1 - 5 заместителями, независимо выбранными из галогена, гидрокси, нитро, (C1 - C10)-алкила, (C1 - C10)-алкоксигруппы, галоген-(C1 - C3)-алкила, фенил(C1 - C3)алкила, (C1 - C6)-алкоксифенила;
f) (C4 - C10)-циклоалкил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) (C1 - C6)-алкил, II) (C2 - C6)-алкил, III) (C4 - C10)-циклоалкил, IV) фенил;
g) группу формулы
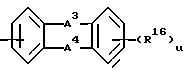
где A3 и A4 каждый независимо выбран из I) связи, II) С(R17)2, где каждый R17 представляет водород, III) N(R18)2, где R18 представляет водород;
R16 = R12 или R13, принимающем вышеуказанные значения;
u равно 0.

или его соли,
где X представляет водород или хлор;
R и R6 представляют 4-эпи-ванкозаминил;
R7 представляет (CH2)n -R8 и присоединен к аминогруппе в R6; n = 1 - 10;
R8 выбирают из группы, включающей
а) полициклический арил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) гидрокси, II) галоген, III) нитро, IV) (C1 - C6)-алкил, V) (C1 - C6)-алкоксигруппу, VI) галоген-(C1 - C6)-алкоксигруппу или группу формулы -S(O)n'-R9, где n' = 0, R9 представляет (C1 - C6)-алкил;
в) гетероарил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) галоген, II) (C1 - C6)-алкил, III) (C1 - C6)-алкокси, IV) фенил, V) фенил, замещенный (C1 - C6)-алкокси;
с) группу формулы
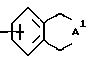
где A1 представляет -C(A2)2-C(A2)2-C(A2)2-C(A2)2- и каждый заместитель A2 независимо выбирают из водорода, (C1 - C6)-алкила, (C4 - C10)-циклоалкила;
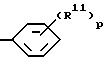
d) группу формулы

где p = 1 - 5,
R11 независимо выбирают из группы, включающей I) нитро, II) гидрокси, III) (C9 - C12)-алкил, IV) (C9 - C12)-алкокси, V) (C2 - C6)алкинил, VI) галоген-(C1 - C6)алкокси, VII) (C2 - C6)алкилтио, VIII) (C2 - C10)алканоилокси, IX) (C1 - C3)-алкилсульфонилокси, X) карбокси-(C1 - C3)-алкил, XI) N-[ди-(C1 - C3)-алкил]амино-(C1 - C3)-алкокси, XII) циано-(C1 - C6)-алкокси, и XIII) дифенил-(C1 - C6)-алкил;
е) группу формулы
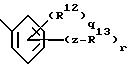
где q = 0 - 4;
R12 независимо выбран из группы, включающей I) галоген, II) (C1 - C6)-алкил, III) нитро, IV) (C1 - C6)алкокси,
r = 1 - 5 при условии, что сумма q и r не превышает 5;
z выбирают из группы, включающей I) простую связь, II) двухвалентный (C1 - C6)алкил;
f) (C4 - C10)-циклоалкил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) (C1 - C6)-алкил, II) (C2 - C6)-алкинил, III) (C4 - C10 )-циклоалкил, IV) фенил,
g) группу формулы
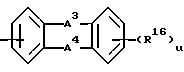
где A3 и A4 каждый независимо выбран из I) связи, II) С(R17)2-, где каждый R17 представляет водород, III) N(R18)2-, где R18 представляет водород;
R16 = R12 или R13, принимающем вышеуказанные значения;
u равно 0.
где R11 и p принимают вышеуказанные значения.

где R12, z, R13, q и r принимают определенные выше значения.
или его соль.
а) взаимодействие в метаноле в атмосфере инертного газа при температуре примерно от 25oС до примерно 100oС I) гликопептидного антибиотика формулы
где X представляет водород или хлор;
R и R1 представляет 4-эпи-ванкозамил, с II) альдегидом, соответствующим группе R7, определенной в п.1 при примерно от 25oС до примерно 100oС;
в) продолжение реакции до момента образования основания Шиффа;
с) восстановление основания Шиффа добавлением к смеси при температуре от 25oС до примерно 100oС борогидрида металла.
где X представляет водород или хлор;
R и R1 представляет 4-эпи-ванкозаминил, с II) альдегидом, соответствующим группе R7, определенной в п.1, в присутствии III) восстановителя, выбранного из группы, включающей борогидриды металлов и катализаторов гомогенного или гетерогенного каталитического гидрирования, в течение времени, достаточном для образования соединений по п.1.

или их соли,
R6 представляет ванкозаминил;
R7 представляет (C1 - C12)-алкил-R8 и присоединен к аминогруппе в R6;
R8 выбирают из группы, включающей
а) гетероарил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей I) фенил, II) фенил, замещенный (C1 - C6)-алкилом,
в) группу формулы

где q = 0 - 4;
R12 независимо выбран из группы, включающей I) галоген, II) нитро, III) (C1 - C6)-алкил, IV) (C1 - C6)-алкоксигруппу,
r = 1 - 5 при условии, что сумма q и r не превышает 5;
z выбирают из группы, включающей I) простую связь, II) двухвалентный (C1 - C6)-алкил, незамещенный или замещенный гидрокси, (C1 - C6)-алкилом, III) двухвалентный (C2 - C6)алкенил, IV) группу формулы -(C(R14)2)s-R15, где s = 0, R15 представляет собой -O-, -S-; когда s равно 1 и R14 представляет водород;
R13 независимо выбран из группы, включающей I) галоген, II) фенил, незамещенный или замещенный 1 - 5 заместителями независимо выбранными из галогена, гидрокси, нитро, (C1 - C10)-алкила, (C1 - C10)-алкоксигруппы, галоген-(C1 - C3)-алкила, фенил-(C1 - C3)алкила, (C1 - C6)-алкосифенила;
с) группу формулы
где A3 и A4 каждый независимо выбран из I) связи, II) С(R17)2-, где R17 представляет водород, III) -N(R18)2-, где R18 представляет водород;
R16 = R12 или R13, принимающем вышеуказанные значения;
u равно 0.
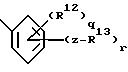
где R12, z, R13, q и r определены выше.
28.10.94 - по пп.2, 16 - 19;
15.12.94 - по пп.1, 3 - 15.

Комментарии