Способ получения производных гликопептидов - RU2041237C1
Код документа: RU2041237C1
Чертежи







Описание
Изобретение относится к способам получения новых биологически активных соединений производных гликопептидов, обладающих антимикробной активностью, которые могут найти применение в медицине и медицинской промышленности.
Способ позволяет получать новые N-алкильные производных гликопептидов, проявляющих высокую антимикробную активность против устойчивых к ванкомицину изолятов и относительно низкими уровнями связывания сывороточного белка.
Описываемый способ состоит в получении производных гликопептидов формулы I

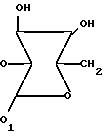
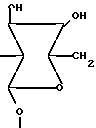
где R водород или (4-эпи-ванкозаминил)-О-глюкозильная группа формулы

H
-(CH2)
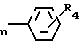
-N

-CH2-CH

где R7 водород, (4-эпи-ванкозаминил)-О-глюкозильная группа

HO
H-C


-N

Постоянно испытывается потребность в новых улучшенных антибиотиках, особенно для лечения заболеваний человека. Повышенная активность, расширенный спектр бактериального ингибирования, повышенная эффективность ин виво и улучшенные фармацевтические свойства являются некоторыми из целей улучшенных антибиотиков.
Важными патогенными организмами человека являются энтерококки, Заражения, вызываемые энтерококками, обычно трудно поддаются лечению. Гликопептиды, такие, как ванкомицин и тейкопланин, стали важными терапевтическими средствами при лечении заражений, вызываемых энтерококками. Однако были недавно выделены штаммы E.faecium u E.faecalis, которые устойчивы к ванкомицину. R.Leclercq и др. "Plasmid Mediated Resitence to vancomycin and Teicoplanin in Enterococcus Falcium, "The New England Gournal of Medicine", 319(3), 157-110 (1988) и А.Н.С. Uttley и др. "Vancomycin-Resistant Enterococci", Lancet, I, 57-58 (1988). Было найдено, что изоляты также устойчивы к другим антибиотикам.
Гликопептиды, такие как ванкомицин и тейкопланин, проявляют различные степени связывания сывороточного белка. Сообщалось, что уровень связывания белка сыворотки человека для ванкомицина и тейкомпланина составляет 55% и примерно 90% соответственно R.Moellering " Pharmacokinetics of Vancomycin in Normal Subsects and in Patients with Redused Renal Function "Revicws of Infections Disease, 3 (supp.) s. 230- s. 235 (1981) и A.Assandri u A. Bernarregi, "Binding of Teicoplanin to Human Serum Albumin, Eur. J. Clinical Pharmacol. 33, 191-195 (1987). Процент связывания сывороточного белка, проявляемый тейкомпланином, считается высоким уровнем связывания; однако, уровень связывания сывороточного белка ванкомицином является относительно низким. Свободная или несвязанная форма антибиотика является формой, которая участвует в биологической активности. Поэтому связывание антибиотиков с сывороточными белками влияет на фармацевтические свойства антибиотика.
В поиске новых антибиотиков делались попытки структурных модификаций известных антибиотиков, когда это было возможным. Гликопептидные антибиотики имеют такие сложные структуры, что даже небольшие изменения являются затруднительными. Кроме того, трудно предсказать влияние этих изменений на антимикробные и физиологические свойства, т.е. будут ли указывать влияние эти изменения на указанные свойства. Процессы модификации известных антибиотиков и новые активные производные, производимые с помощью таких процессов, продолжают представлять огромную важность.
Ранее были получены N-алкильные и N-ацильные производные гликопептидов ванкомицина, А51568А, А51568А, М43А и М43Д (патенты США 4639433, 4643987 и 4698327). Несколько из этих соединений обнаружили микробиологическую активность против устойчивых к ванкомицину изолятов. T Hiias и др. Antimicrobial Agents and Chemotherapy, 1477-1481 (1989).
Согласно изобретению представляются новые гликопептидные производные, которые обладают в высокой степени желательными свойствами антимикробной активности против устойчивых к ванкомицину изолятов и относительно низкими уровнями связывания сывороточного белка.
Соединения формулы 1 являются новыми представителями гликопептидной группы антибиотиков. Этими новыми соединениями являются N-алкильные и производные известных гликопептидов А82846, факторов А, В и С (ЕРО 265071 А1), и РА-42867-А (ЕРО 231111 А2). Представительные соединения формулы I проявляют антимикробную активность против устойчивых к ванкомицину изолятов. Новые соединения также не так сильно связываются с сывороточным белком, как другие гликопептиды. Уровни связывания белка сыворотки для соединений формулы I аналогичны уровням, обнаруживаемым ванкомицином. Данный уровень является гораздо более низким, чем уровень других высокоактивных гликопептидов, таких, как тейкопланин.
Термин N-алкильное производное означает производное А82846А, А82846В, А82846С или РА-42867-А, где атом водорода одной или более амино групп замещен алкильной или замещенной группой.
Термин "алкил" обозначает (1-12)С углеводородный радикал с прямой или разветвленной цепью, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, 2-метилгексил, 3-метилгексил, н-гептил, 2-метилпептил, Н-октил, 2-метилоктил, 3-метилоктил, н-нонил, 2-метилнонил, н-децил, 2-метилдецил, н-ундецил, 2-метилундецил, или н-додецил. Когда термин "алкил" описан как (1-8)С алкил, данный термин обозначает, например метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, н-гептил, или н-октил. Когда термин "алкил" описывается как (8-12)С алкил, данный термин обозначает, например, н-октил, 2-метилоктил, 3-метилоктил, н-нонил, 2-метилнонил, н-децил, н-ундецил, 2-метилундецил или н-додецил. Когда термин "алкил" описывается как (8-10)С алкил, он обозначает, например, н-октил, 2-метилоктил, 3-метилоктил, н-нонил, 2-метилнонил или н-децил. Когда термин "Алкил" описывается как (1-3)С алкил, данный термин обозначает метил, этил, н-пропил или изопропил.
Термин "(1-8)С алкокси" обозначает алкильную группу (1-8)С, как определена выше, присоединенную к атому кислорода, (1-8)С алкокси группа включает, например, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-вутокси, трет-бутокси, н-пентокси изопентокси, н-гексилокси, г-гептилокси и н-октилокси.
Термин "галоид" обозначает галоген группы фтор, хлор, бром и иод. Предпочтительно термин "галоид" включает фтор, хлор и бром.
Фармацевтически приемлемые аддитивные соли соединений формулы l являются частью изобретения. Фармацевтически приемлемыми аддитивными солями являются соли, полезные в хемотерапии теплокровных животных, так, чтобы токсичность солевой формы не была выше, чем токсичность несолевой формы. Соединения формулы I каждое, имеют карбоксильную группу и одну или более аминогрупп, которые могут взаимодействовать с образованием различных солей. Кислотно-аддитивными солями, образованными с помощью стандартных реакций соединений формулы I, как с органическими, так и с неорганическими кислотами, представлена предпочтительная группа солей. Примерами фармацевтически приемлемых солей являются соли, образованные при взаимодействии соединения формулы l с соляной, янтарной, лимонной, молочной, винной, фосфорной и уксусной кислотами.
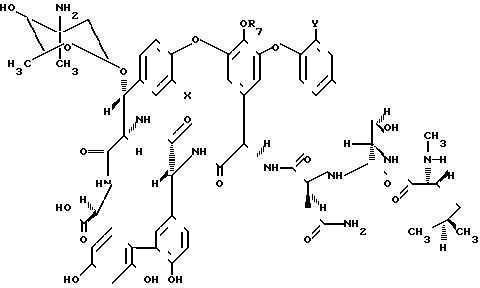
Соединения формулы I в которой R представляет собой "(4-эпиванкозаминил)-О-глюкозильную группу, получаются из А82846 антибиотиков, факторов А, В и С, и из РА-42867-А. Структуры этих антибиотиков показаны в формуле III. Способы получения А82846А, А82846В и А82846С описываются в европейской патентной публикации 265071 АI.
Способ получения РА-42867-А описан в европейской патентной публикации 231111 А2.
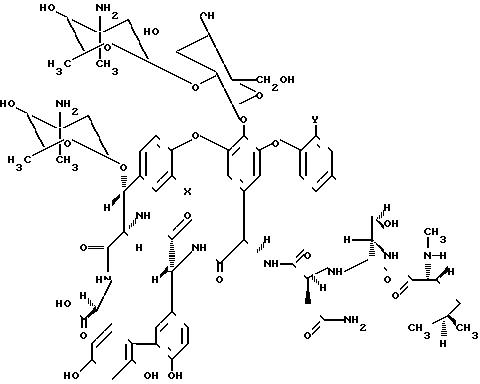
Формула III соединений:
Соединения A82846A (IIIa), где Х Н; Y Cl A82846B (III), где Х Сl; Y Cl; А82846С (IIIс), где Х Н; Y Н; РА-42867-А (III), где Х Сl; Y Н.
Соединения формулы I, где R водород или глюкозил получают кислотным гидролизом продуктов А82846А, А82846В, А82846С и РА-42867-А.
Структуры продуктов кислотного гидролиза показаны в формулах IV и V.
Способы получения продуктов кислотного гидролиза РА-42867-А, дез-(4-эпи-ванкозаминил)-РА-42867А (IV d) и дез-(4-эпи-ванкозиминил)-О-глюкозил)- РА-42867А (V d) описываются в Европейской патентной публикации 231111А2.
Дез-(4-эпи-ванкозаминил) и дез-(4-эпи-ванкозаминил-О-глюкозил) производные А82846А, В и С получаются с помощью обработки А82846А, B или С трифторуксусной кислотой (ТFА) при температуре примерно -10 до примерно 80оС в течение периода около 1-60 ч (см,патент США 4552701 в отношении описания способов селективного удаления сахарных групп из гликопептидо-образных антибиотиков). Короткие периоды реакции, например, 1-2 ч, и низкие температуры (оС) благоприятствуют образованию дез-(4-эпи-ванкозаминил) производных А82846А, В и С, формулы IVa-с.
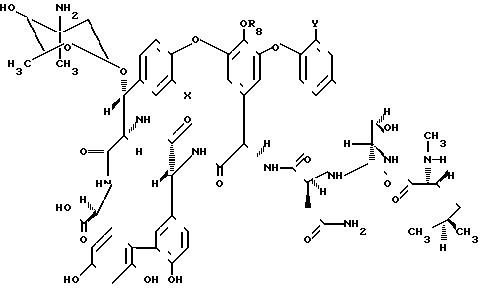
Cоединения формулы IV и V приведены в табл.1.
N-алкильные производные данного изобретения получаются с помощью реакции соединения формулы II с альдегидом с образованием промежуточного основания Шиффа. Реакция осуществляется в полярном органическом растворителе, таком, как диметилформамид, или в смеси полярных органических растворителей, такой, как смесь диметилформамида и метанола, при температуре около 25-100оС. Реакция образования Шиффона основания предпочтительно осуществляется при температуре примерно от 60 до примерно 70оС в течение от 30 мин до 2 ч в смеси диметилформамида и метанола.
Промежуточное основание Шиффа затем восстанавливается предпочтительно без выделения, давая N-алкильные производные. Восстановление основания Шиффа может проводиться с использованием химического восстанавливающего агента, такого как металлоборгидрид, например, боргидрид натрия или цианоборгидрид натрия. Реакция может осуществляться в полярном органическом растворителе, таком как диметилформамид, или смеси полярных органических растворителей, такой как диметилформамид и метанол. Восстановление может осуществляться при температуре примерно от 25 до 100оС в течение 1-5 ч. Восстановление предпочтительно осуществляется с использованием избытка цианоборгидрида натрия в смеси диметилформамида и метанола при температуре примерно 60-70оС в течение 1-2 ч.
Альдегиды, которые могут использоваться в процессе для
получения соединений настоящего изобретения, представлены следующей формулой
H

-(CH2)

CH
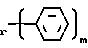
n представляет собой число от 1 до 3; m 2 или 3,
r- м и R4 представляет собой водород, галоид, (1-8)С алкил, (1-8) С алкокси, или группу формулы
-N
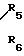
R5 и R6 независимо представляют водород или (1-3)С алкил;
р 0 2; m 2 или 3, и r 3-м.
Отношение альдегида к соединению формулы II и условия реакции определяют продукты реакции. Образованию моноалкилированных производных благоприятствует использование небольшого избытка альдегида, более короткое время реакции и более низкая температура. Моноалкилированные производные представляют собой N-алкильные производные, в которых атом водорода одной амино группы замещен алкилом или замещенной алкильной группой. Обычно амино группа (4-эпи-ванкозиминил)-О-глюкозильной группы, когда она присутствует, алкилируется первой, и получаются соединения формулы I, в которой R2 алкил или замещенный алкил, и R1 и R3 представляют водород. Большой избыток альдегида благоприятствует образованию диалкилированных и триалкилированных производных соединений формулы III и образованию диалкилированных производных соединений формулы IV и V. Диалкилированные производные представляют собой N-алкильные производные, в которых атом водорода двух амино групп замещен алкильной или замещенной алкильной группой. Обычно данная группа производных соединений формулы III включает соединения формулы I, в которой R2 или R1 или R3 представляет алкильную или замещенную алкильную группу, и R представляет (4-эпи-ванкозаминил)-О-глюкозильную группу. Диалкилированными производными соединений формулы IV и V являются соединения формулы I, в которой R1 и R2 представляют алкильные или замещенные алкильные группы, и R представляет глюкозильную группу и водород, соответственно. Триалкилированными производными являются соединения формулы I, в которой R представляет собой "(4-эпи-ванкозаминил)-О-глюкозильную группу и R1, R2 и R3 представляют алкильные или замещенные алкильные группы.
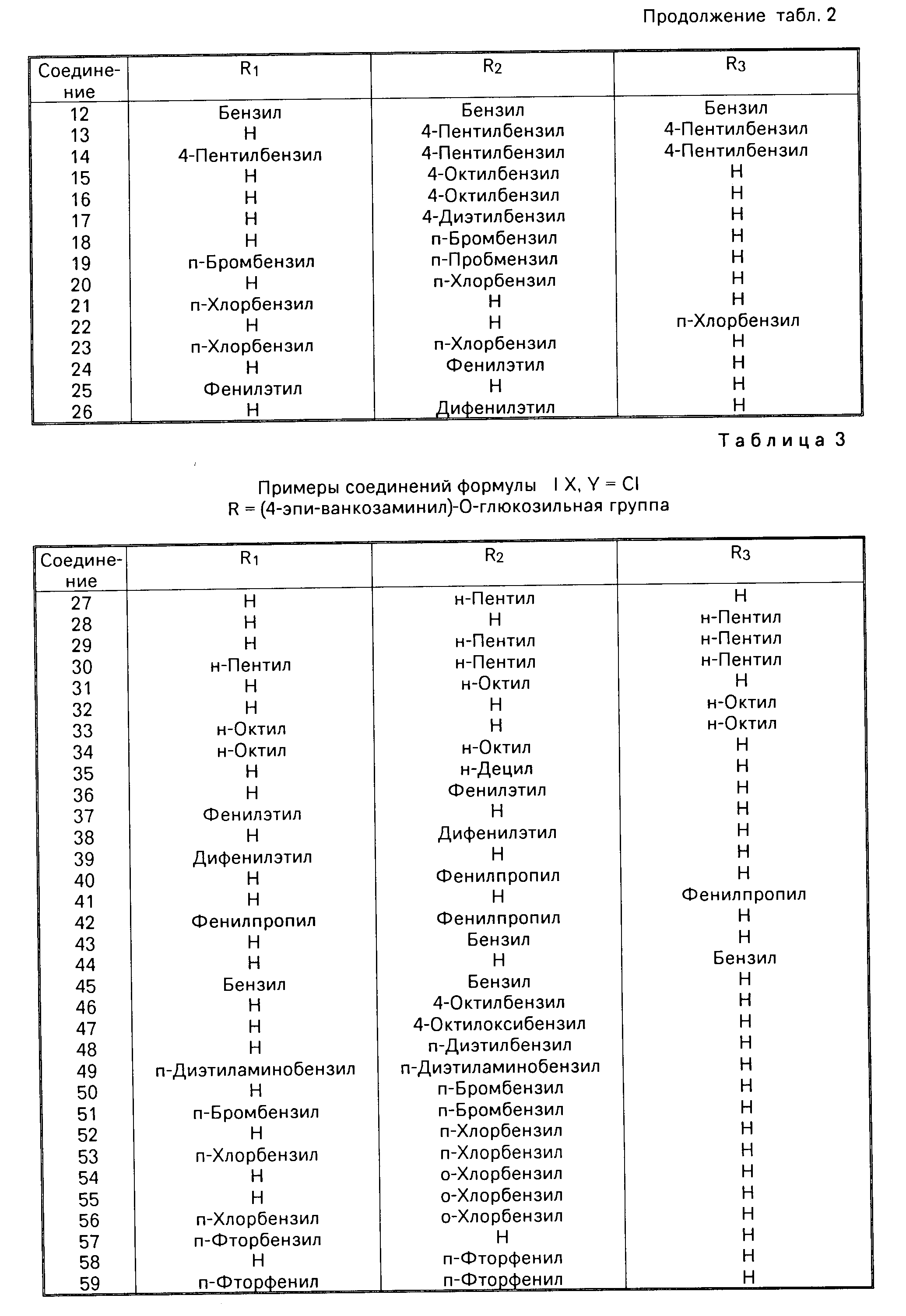
N-алкильные производные данного изобретения включают соединения формулы I, в которой R1, R2 и R3 независимо представляют собой (1-12)С алкил или водород. Предпочтительными N-алкильными производными данной группы являются соединения, в которых R представляет (4-эпи-ванкозаминил)-О-глюкозильную группу, R1 и R3 представляет водород, и R2 представляет (8-12)С алкил. Примерами предпочтительных N-алкильных производных являются соединения, в которых R2 представляет собой н-октил, 2-метилоктил, 3-метилоктил, н-нонил, 2-метилнонил, н-децил, 2-метилдецил, н-ундецил, 2-метилундецил или н-додецил. Более предпочтительно Х и Y представляют хлор, и R2 представляет н-октил, н-нонил или н-децил.
N-алкильные производные данного
изобретения также включают соединения формулы I, в которой R1, R2 и R3 независимо представляют собой водород или замещенную алкильную группу формулы:
(CH2)

Когда n представляет I, примеры данной замещенной алкильной группы включают: бензил, п-фторбензил, п-хлорбензил, п-бром-бензил, п-иодбензил, м-фторбензил, м-хлорбензил, м-бромбензил, о-иодбензил, о-фторбензил, о-хлорбензил, о-бромбензил, о-иодбензил, п-метилбензил, п-этилбензил, п-пропилбензил, п-изопропилбензил, п-бутилбензил, п-пентилбензил, п-гексилбензил, п-гептилбензил, п-октилбензил, м-метилбензил, м-этилбензил, м-пропилбензил, м-изопропилбензил, м-бутилбензил, м-пентилбензил, м-гексилбензил, м-гептилбензил, м-октилбензил, о-метилбензил, о-этилбензил, о-пропилбензил, О-изопропилбензил, о-бутилбензил, о-пентилбензил, о-гексилбензил, О-гептилбензил, о-октилбензил, п-метоксибензил, п-этоксибензил, п-пропоксибензил, п-изопропоксибензил, п-бутоксибензил, п-пентоксибензил, n-гексилоксибензил, n-гептилоксибензил, n-октилоксибензил, м-метоксибензил, м-этоксибензил, м-пропоксибензил, м-изопропоксибензил, м-бутоксибензил, м-пентоксибензил, м-гексилоксибензил, м-гептилоксибензил, м-октил-оксибензил, о-метоксибензил, о-этоксибензил, о-пропоксибензил, о-изопропоксибензил, о-бутоксибензил, о-пентоксибензил, о-гексилоксибензил, о-гептилоксибензил, о-октилоксибензил, р-аминобензил, n-метиламинобензил, n-диметиламинобензил, n-этиламинобензил, n-ди-этиламинобензил, n-пропиламинобензил, n-дипропиламинобензил, м-аминобензил, м-метиламинобензил, м-диметиламинобензил, м-этиламинобензил, м-диэтиламинобензил, м-пропиламинобензил, м-дипропиламинобензил,о-аминобензил, о-метиламинобензил, о-диметиламинобензил, о-этиламинобензил, о-диэтиламинобензил, о-пропиламинобензил, или о-дипропиламинобензил.
Предпочтительно, R4 представляет галоид, С6-С8 алкил, С6-С8 алкокси, или ди(С1-С3) алкиламино. Предпочтительными примерами данной группы являются n-бромбензил, n-хлорбензил, n-фторбензил, м-хлорбензил, о-хлорбензил, п-октилбензил, n-октилбензил, и n-диэтиламнобензил. Более предпочтительно замещенной алкильной группой является n-бромбензил, n-октилбензил, n-октилоксибензил, или n-диэтиламинобензил.
Предпочтительно, когда R4 представляет галоид, С6-С8 алкил, С6 -С8 алкокси, или ди(С1-С3)алкиламино, Х или Y представляют хлор. Более предпочтительно, Р представляет (4-эпи)ванкозаминил)-О-глюкозильная группа и R1 и R3 представляют водород. Наиболее предпочтительно R2 представляет собой п-бромбензил, п-октилбензил, п-октилоксибензил или диэтиламинобензил.
Когда n представляет 2, примеры данной замещенной алкильной группы включают фенилэтил, (п-фторфенил)этил, (п-флорфенил)этил, (п-бромфенил)этил, (п-метилфенил) этил, (п-этилфенил)этил, (п-метоксифенил)этил,и (п-диметиламинофенил)- этил.
Предпочтительно, замещенной алкильной группой является фенилэтил (R4-водород). Более предпочтительно R представляет собой (4-эпи-ванкозаминил)-О-глюкозильную группу, R2 фенилэтил, X и Y представляют хлор, и R1 и R3 представляют водород.
Когда n представляет число 3, примеры данной замещенной алкильной группы включают: фенилпропил, (п-фторфенил)пропил, (п-хлорфенил)пропил, (п-бромфенил)пропил, (п-метилфенил) пропил, (п-этилфенил)пропил, (п-метоксифенил)пропил, и (п-диметиламинофенил)пропил. Предпочтительно замещенной алкильной группой является фенилпропил (R4 водород).
N-Алкильные производные изобретения также включают соединения
формулы I, где алкильной группой является замещенная алкильная группа формулы:
-CH2-CHr-

Примерами данной группы являются дифенилэтил (m=2, r=1) и трифенилэтил (m 3, r 0). Предпочтительно Х и Y представляют хлор, R представляет собой (4-эпи-ванкозаминил)-O-глюкозильную группу, R3 водород, R1 и R2 и представляют или водород, или дифенилэтил.
Примеры соединений, которые были получены и являются частью данного изобретения, перечислены в табл.2, 3 и 4 для соединений формулы I.
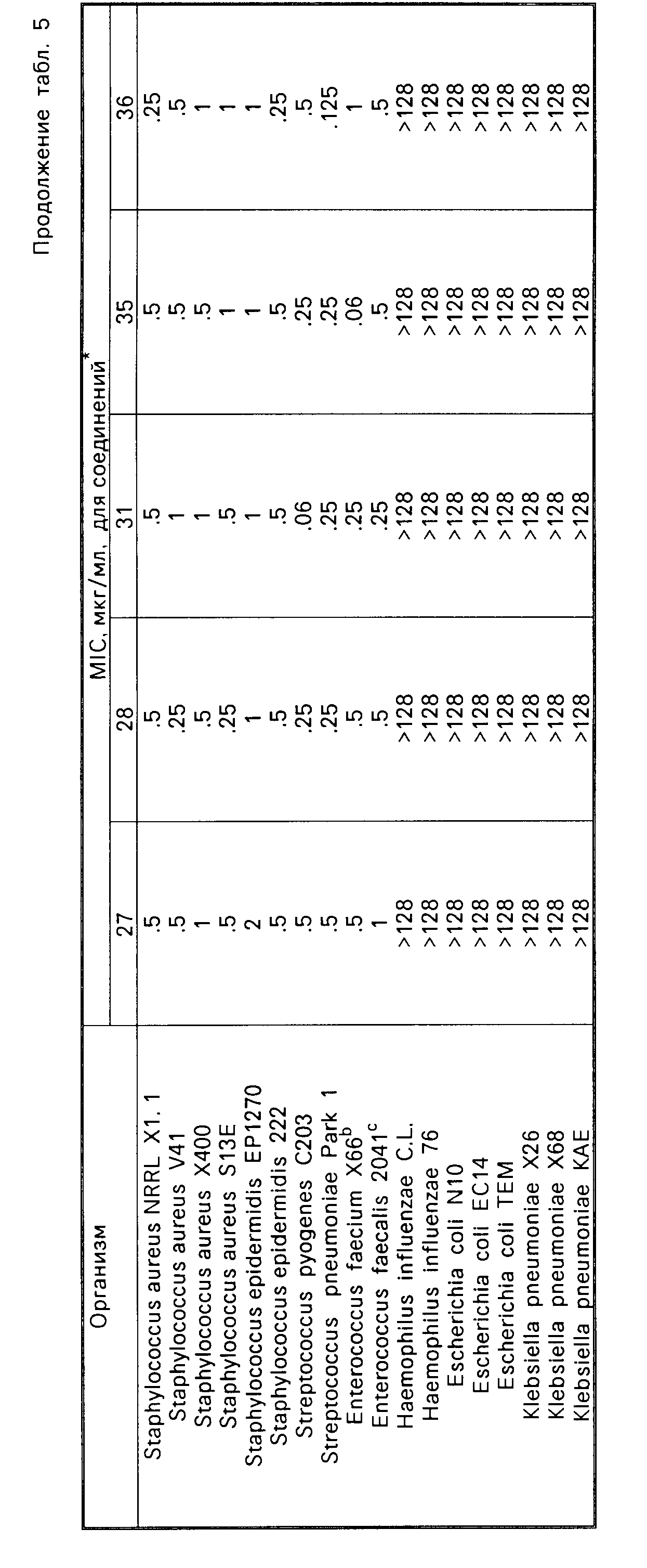
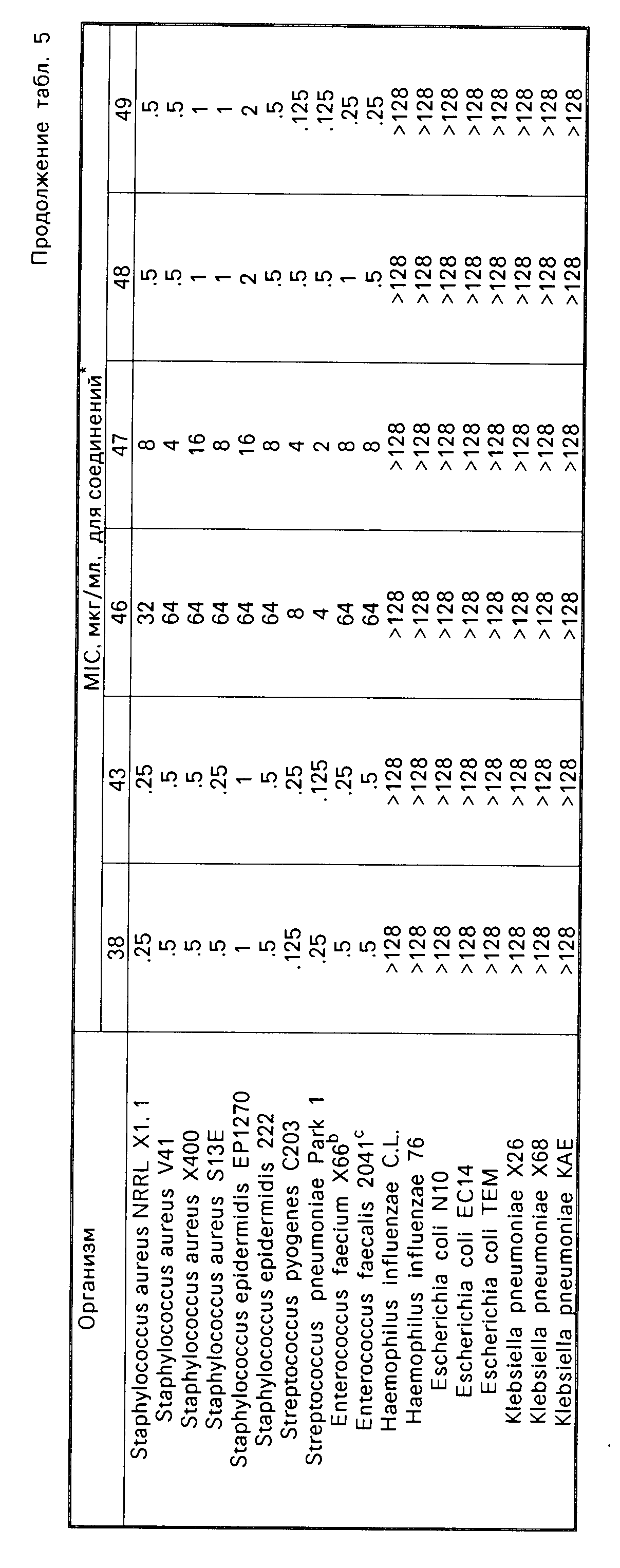
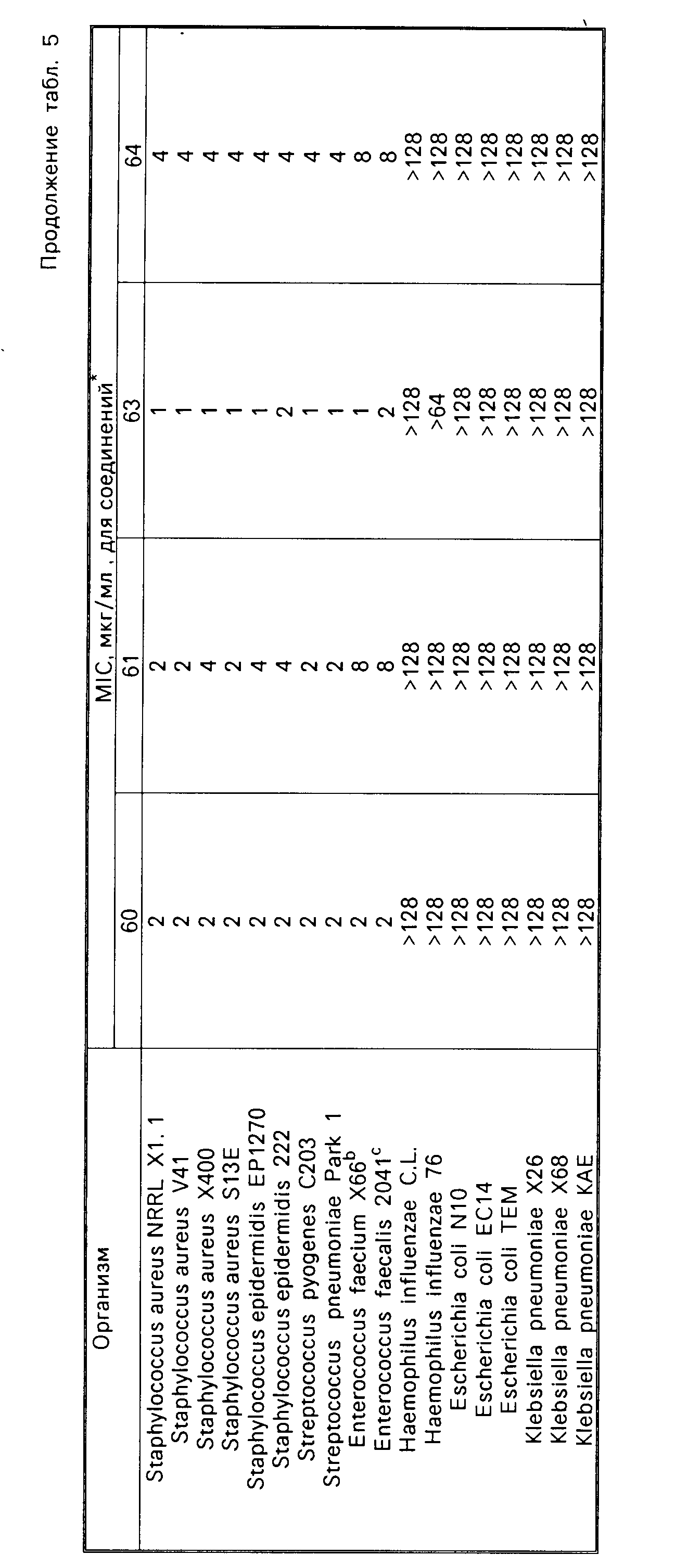
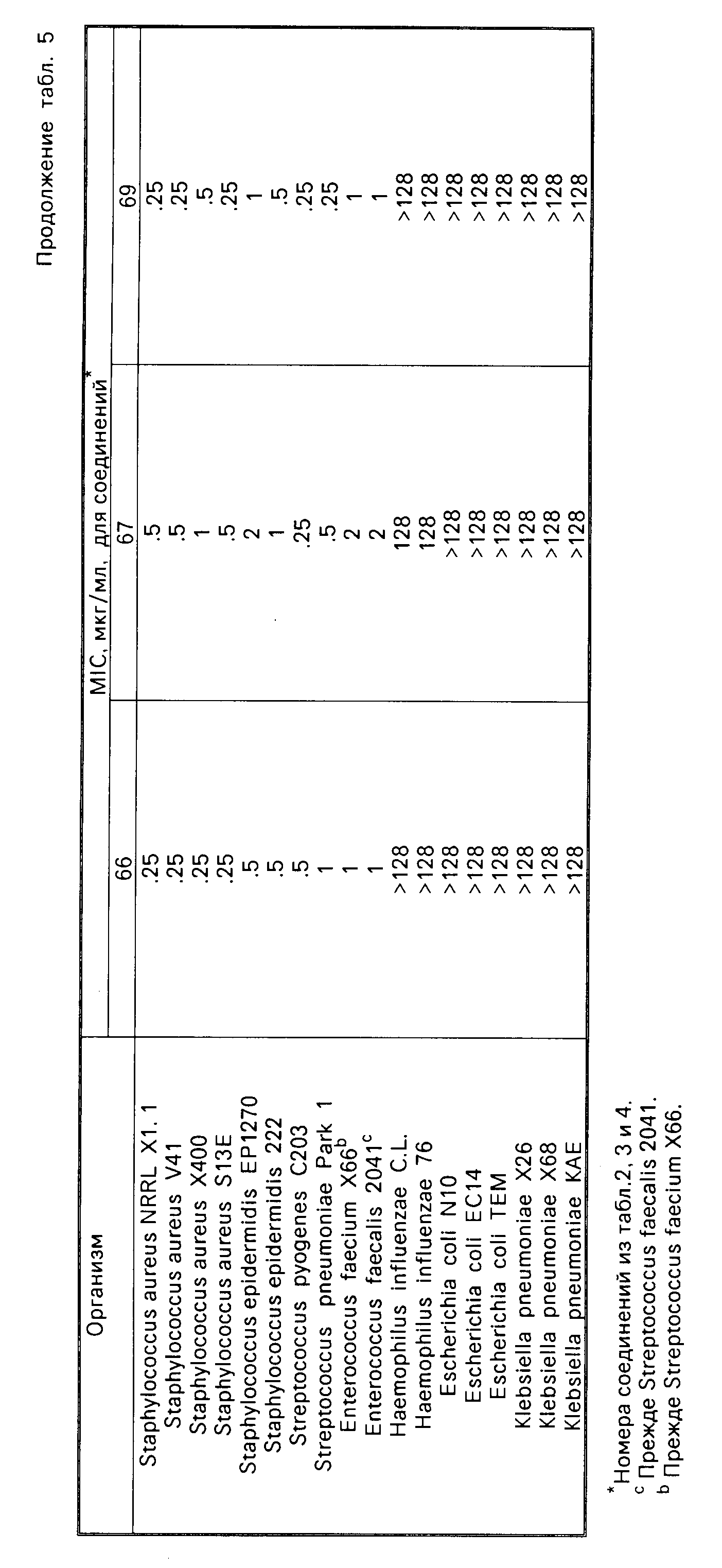
Соединения формулы I имеют активность ин виво и ин витро против грам-положительных патогенных бактерий. Минимальные ингибирующие концентрации (МIС), при которых соединения формулы I ингибируют некоторые бактерии, даются в табл.5. Величины MIC определялись с использованием стандартных методик разбавления агара.
Соединения формулы I также показали антимикробную активность ин виво против вызванных экспериментальным путем инфекций у опытных животных. Когда две дозы испытываемого соединения назначались мышам инфицированных экспериментально испытываемым организмом, измерялась наблюдаемая активность в виде величины ЕД50 (эффективная доза в кг/кг для защиты 50% подопытных животных: смотрите работу W. Wick и др. I.Bacteriol, 81, 233-235 (1961). Наблюдаемые величины ЕД50 для иллюстрированных соединений даны в табл.6.
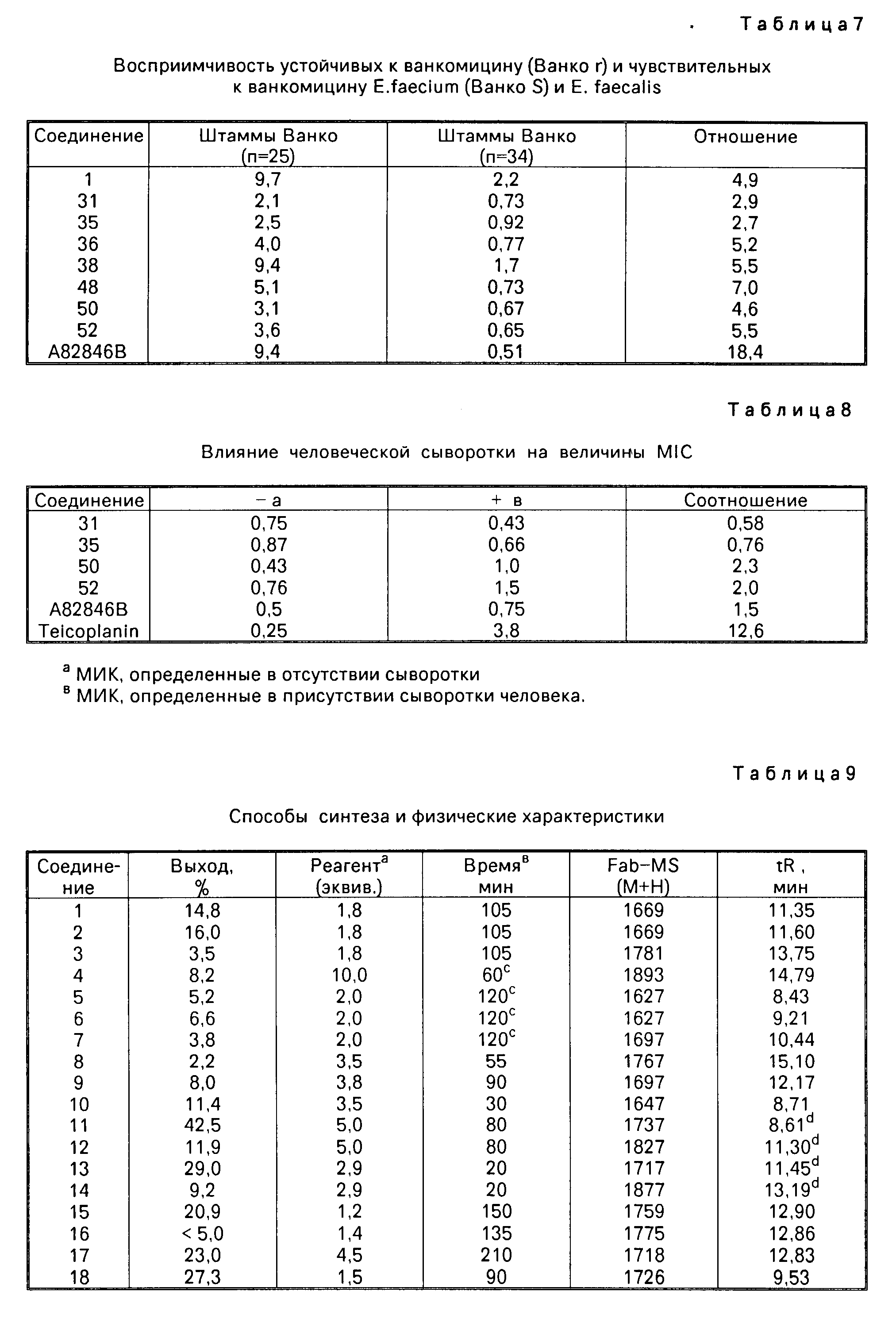
Одним из важных аспектов антимикробной активности соединений формулы I является их активность против энтерококков, устойчивых к ванкомицину. Данная активность иллюстрируется в табл.7, в которой суммируется сравнение активности иллюстративных соединений против характерных устойчивых к ванкомицину и восприимчивых к ванкомицину энтерококков, которая определялась с использованием метода разбавления агара. Конечные значения считывались после инкубации в течение 24 ч. Отношение вычислялось делением средней величины МИК соединения против устойчивых к ванкомицину штаммов на средние величины МИК соединения против штаммов, восприимчивых или чувствительных к ванкомицину. Высокое отношение указывает на то, что соединение является гораздо менее активным против устойчивых к ванкомицину штаммов по сравнению с восприимчивым к ванкомицину штаммами. Соединения формулы I являются обычно активными против устойчивых к ванкомицину штаммов, о чем свидетельствуют средние значения минимальной ингибирующей концентрации, находящиеся в интервале примерно от 2 до 10 мкг/мл.
Еще одним важным свойством соединений формулы I является низкое связывание соединений с белками сыворотки по сравнению с другими гликопептильными антибиотиками. Минимальные ингибирующие концентрации (МIC или МИК) измерялись для отобранных соединений против шести восприимчивых к ванкомицину штаммов стафилококков и энтерококков. Величины МIС измерились как в отсутствии (-), так и в присутствии (+) человеческой сыворотки, в бульоне с добавлением человеческой сыворотки до 40% Величины МIC определялись по методике серийного разбавления с использованием объемов среды в 0,2 мл с примерно 105 бактерий на миллилитр. Результаты показаны в табл.8. Соотношение МIС, измеренной в присутствии добавленной сыворотки и МIС, измеренной в отсутствии добавления сыворотки ("соотношение") является показателем степени связывания сыворотки. Соотношение примерно 1 показывает, что присутствие сыворотки не оказывает влияния на антимикробную активность ин витро, и соединение не обнаруживает высокой степени связывания с сывороткой. Соотношение, которое больше, чем 1, например, около 10, указывает, что соединение обнаруживает высокую степень связывания с сывороткой.
Соединения формулы I показали неожиданно низкий уровень связывания сыворотки. Соотношение примерно 2 (см.табл.8) указывает на то, что соединение примерно на 50% связано с сывороткой. Данный уровень связывания сходен с показателем, обнаруживаемым ванкомицином. Ранее было найдено, что N-алкильные производные ванкомицина проявляют более высокую степень связывания с сывороткой, соотношение в интервале от пяти до десяти, чем показатель, обнаруживаемый ванкомицином. Считалось, что алкилирование одной или более амино групп ванкомицина вызывает увеличение связывания с сывороточным белком. Однако соединения формулы I неожиданно проявляют тот же уровень связывания с сывороткой, что и основное соединение, т.е. А82846В.
Фармацевтические готовые формы препаратов соединений формулы I также составляют часть данного изобретения. Так, соединение, предпочтительно в форме фармацевтически приемлемой соли, может преобразовываться в препаративную форму для орального или парэнтерального назначения для терапевтической или профилактической обработки бактериальных инфекций.
Например соединение может смешиваться с обычными фармацевтическими носителями и эксципиентами и использоваться в форме таблеток, капсул, эликсиров, суспензий, сиропов, вафель и аналогичных. Композиции, включающие соединение формулы I, содержат примерно 0,1-90% по массе активного соединения, и более обычно примерно 10-30% Композиции могут содержать обычные носители и эксципиенты, такие, как кукурузный крахмал или желатин, лактозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннит, дикальций-фосфат, хлористый натрий и альгиновую кислоту.
Дезинтеграторы, обычно используемые в готовых формах препаратов или препаративных формах изобретения, включают кроскармеллозу, микрокристаллическую целлюлозу, кукурузный крахмал, крахмальный гликолят натрия и альгиновую кислоту.
Связующие для таблеток, которые могут включаться, представляют камедь акации, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, поливинилпирролидон, гидроксипропилметилцеллюлозу, сахарозу, крахмал и этилцеллюлозу.
Смазочные агенты, которые могут использоваться, включают стеарат магния или другие стеараты металлов, стеариновую кислоту, силиконовую жидкость, тальк, воски, масла и коллоидную двуокись кремния.
Могут также использоваться вкусовые или ароматизирующие агенты, такие, как мята перечная, масло грушанки, вишневый ароматизатор или аналогичные.
Может быть желательным добавлять красящий агент, чтобы сделать форму дозировки более привлекательной на вид или помочь идентифицировать продукт.
Для внутривенного (IV) использования растворимая в воде форма антибиотика может растворяться в одной из обычно используемых внутривенных жидкостей и назначаться путем инфузии или вливания. Такие жидкости, как например, физиологический раствор, раствор Рингера или 5%-ный раствор декстрозы могут использоваться.
Для получения внутримышечных препаратов стерильная готовая препаративная форма подходящей растворимой солевой формы соединения, например, гидрохлоридной соли, может растворяться и назначаться в фармацевтическом разбавителе, таком как свободная от пирогенов вода (дистиллированная), физиологический раствор или 5%-ный раствор глюкозы. Подходящая нерастворимая форма соединения может приготавливаться и назначаться в виде суспензии в водном основании или фармацевтически приемлемом масляном основании, например сложном эфире жирной кислоты с длинной цепью, таком, как этилолат.
Для орального использования особенно полезной является стерильная готовая форма подходящей солевой формы антибиотика, например, гидрохлоридной соли, приготовленной в разбавителе, таком, как дистиллированная или деионизированная вода.
Альтернативно форма дозированной единицы или единичной дозы антибиотика может быть в виде раствора антибиотика, предпочтительно, в его солевой форме, в подходящем разбавителе в стерильных герметически запаянных ампулах. Концентрация антибиотика в единичных дозах может варьировать, например, примерно от 1% до 50% в зависимости от частной формы антибиотика и его растворимости и от дозы, предназначаемой врачом.
В следующем аспекте данное изобретение представляет способ лечения инфекционных болезней, особенно болезней, вызываемых грам-положительными микроорганизмами животных.
Соединения изобретения особенно полезны при лечении болезней, вызываемых устойчивыми к метициллину стафилококками. Соединения также полезны при лечении инфекции, причиной которой являются энтерококки. Примерами таких болезней являются тяжелые или сильные стефилококковые инфекции, то есть стефилококковый эндокардит и стафилококковый сепсис. Животное может быть или восприимчивым к заражению, или зараженным микроорганизмом. Способ лечения включает назначение животному для приема количества соединения формулы I, которое эффективно для данной цели. Обычно эффективным количеством соединения формулы I является доза примерно между 0,5 и 100 мг/кг. Предпочтительную дозу составляет количество примерно от 1 до 60 мг/кг активного соединения. Типичной суточной дозой для взрослого человека является доза примерно от 50 мг до 1,0 г.
При реализации данного способа на практике антибиотик может назначаться в виде единственной суточной дозы или в виде нескольких доз в день. Режим лечения может требовать назначения на протяжении продолжительных периодов времени, например в течение нескольких дней или в течение от одной до шести недель. Количество в назначаемой дозе или общее назначаемое количество зависит от таких факторов, как природа и тяжесть инфекции, возраст и общее состояние здоровья пациента, переносимость пациентом антибиотика и микроорганизм или микроорганизмы, являющиеся причиной инфекции.
Удобным методом осуществления способа лечения на практике является назначение антибиотика с помощью внутривенного вливания. Согласно данной процедуре стерильная препаративная форма подходящей растворимой соли антибиотика вводится в физиологическую жидкость, такую как 5% раствор декстрозы, и получающийся в результате раствор вливается медленно IV. Альтернативно, может также использоваться "piggy-back" способ вливания IV.
Для того, чтобы более полно проиллюстрировать осуществление изобретения, приводятся следующие примеры. Обычно соединения формулы III или IV получаются, как описано в примерах получения 1 и 2. N-алкильные производные получаются, как описано в примерах 1 и 2.
Получение 1.
Получение соединения IIIa и IVа.
Соединение А82846А (500 мг, 0,32 ммоля) растворялось в трифторуксусной кислоте (100 мл), содержащей анизол (10 мл). Реакционная смесь перемешивалась в течение 24 ч при комнатной температуре и атмосфере азота. Летучие растворители удалялись в вакууме, давая серорыжий остаток. Остаток растирался со смесью диэтилового эфира и хлороформа (1:1, 50 мл х 2). Твердый материал, полученный таким образом, (соль трифторуксусной кислоты), растворялся в воде (примерно 50 мл), и величина рН данного раствора доводилась до 6,2 с помощью пиридина. Раствор фильтровался, и фильтрат лиофилизовался, давая 426 мг не совсем белого порошка. Анализ жидкостной хроматографии высокой разрешающей способности (HP L C) показал два главных пика (в количествах примерно 23% и 43%).
Два главных продукта разделялись с помощью обратнофазной НРLС в препаративном масштабе с использованием колонки Prep-pak (Милфорд, Ма.), с элюированием 8 л градиентом 1%-ного водного ацетата пиридиния до смеси ацетонитрил (1% -ный водный ацетат пиридиния (1:3) с последующим элюированием 2 л последнего. Фракции каждая по 250 мл собирались при скорости потока 250 мл/мин и анализировались с помощью тонко-слойной хроматографии (ТСХ) и НРLС.
Фракции, содержащие IIIa (N 10-16) объединялись и лиофилизовались, давая 82 мг соединения IIIа в виде окрашенного в кремовый цвет твердого вещества, масс спектр FAB/FAB-MS/ (M+1): 1414 (точная масса вычислена для С66 Н77 N9O24Cl1414, 4770; найдено: 1414,40).
Фракции, содержащие соединение IVа (N 27-29) также объединялись и лиофилизовались, давая 128 мг соединения IVа в виде окрашенного в кремовый цвет порошка.
(М+1) 1252, 1109 (вычислено для С60Н67 N9O19Cl 1252, 4242; найдено: 1252, 4240).
Получение 2.
Получение соединений IIIв и IVв.
А82846В (1 г) растворялось в трифторуксусной кислоте (200 мл), содержащей анизол (10 мл). Реакционная смесь перемешивалась при комнатной температуре в течение примерно 2 ч в атмосфере азота.
Реакционная смесь обрабатывалась, как описано в примере получения I, давая 1,12 г смеси продукта, FАВ-МS (М+1):1448, 1305, 1286, 1252, 1142. Анализ с помощью жидкостной хроматографии высокой разрешающей способности показал, что данный материал содержит два главных или основных пика (в количествах примерно 42% и 43% соответственно).
Препаративная НРLC в обратной фазе с использованием условий, описанных в получении I, давала 283 мг соединения IIIв.
FAB-MS (М+1): 1448 (вычислено для С66Н76N9O24Cl2 1448, 4380; найдено: 1448, 4375).
Препаративная обратно-фазная НРLC также дала 270 мг соединения IV в. FAb-MS (Р+1): 1286 (вычислено для С60Н66N9O19Cl21286, 3852, найдено: 1286, 3879).
П р и м е р 1. Получение соединений 1, 2 и 3.
Свободное основание А82746А (293,5 мг, 0,19 ммоля) растворялось в смеси диметилформамида и метанола (10 мл каждого). Данный раствор обрабатывался н-октил-альдегидом (44,8 мг, 0,35 ммоля) и перемешивался в течение 1 ч 45 мин при 70оС. Раствор обрабатывался цианоборгидридом натрия (75 мг, 1,19 ммоля) и перемешивался в течение дополнительных 2 ч при 70оС. Реакционный раствор концентрировался в вакууме, остаток разбавлялся водой 25 мл, и данный раствор лиофилизовался. Продукты разделялись с помощью обратно-фазной жидкостной хроматографии высокой разрешающей способности или высокоэффективной жидкостной хроматографии (НРLC) с использованием колонки С18 Waters (19 мм х х 150 мм), при элюировании 20 мин линейным градиентом смеси 15% ацетонитрил/0,05% водный триэтиламин фосфат (рН 3) до 60% ацетонитрил/0,05% водный триэтиламинфосфат (pH 3). Фракции, содержащие продукты, о которых свидетельствовали данные анализа НРLС, обессоливались с использованием смолы НР20SS в смеси метанол/0,1% уксусная кислота (8:2). Элюаты выпаривались досуха, обрабатывались водой и лиофилизовались, давая 36,6 мг соединения l (14,8% выход), 39,6 мг соединения 2 (выход 16,0% и 11,7 мг соединения 3 (выход 3,5%).
П р и м е р 2. Получение соединения 38.
Свободное основание А82846В (1,1 г, 0,69 ммоля) растворялось в диметилформамиде (50 мл). Данный раствор обрабатывался н-октиловым альдегидом (195 мг, 1,52 ммоля) и перемешивался в течение 30 мин при 70оС. Раствор обрабатывался цианоборгидридом натрия (162,6 мг, 2,5 ммоля) и перемешивался в течение 90 мин при 70оС. После того, как смеси давали возможность охладиться до комнатной температуры, реакционный раствор фильтровался. Остаток растворялся в 5% -ной уксусной кислоте в метаноле (50 мл), и раствор перемешивался при комнатной температуре на протяжении ночи. Данный раствор выпаривался досуха в вакууме, остаток обрабатывался водой (50 мл) и н-бутанолом (несколько капель), и лиофилизовался. Продукт очищался с помощью обратнофазной НРLC, с использованием колонки Rainin С18 (5 см х 35 см, Woburu, МА), с элюированием 20 мин линейным градиентом смеси 20% ацетонитрил) 1% водный ацетат пиридиния до 40% ацетонитрил (1% водный ацетат пиридиния, давая 120 мг соединения 38 (выход 10%).
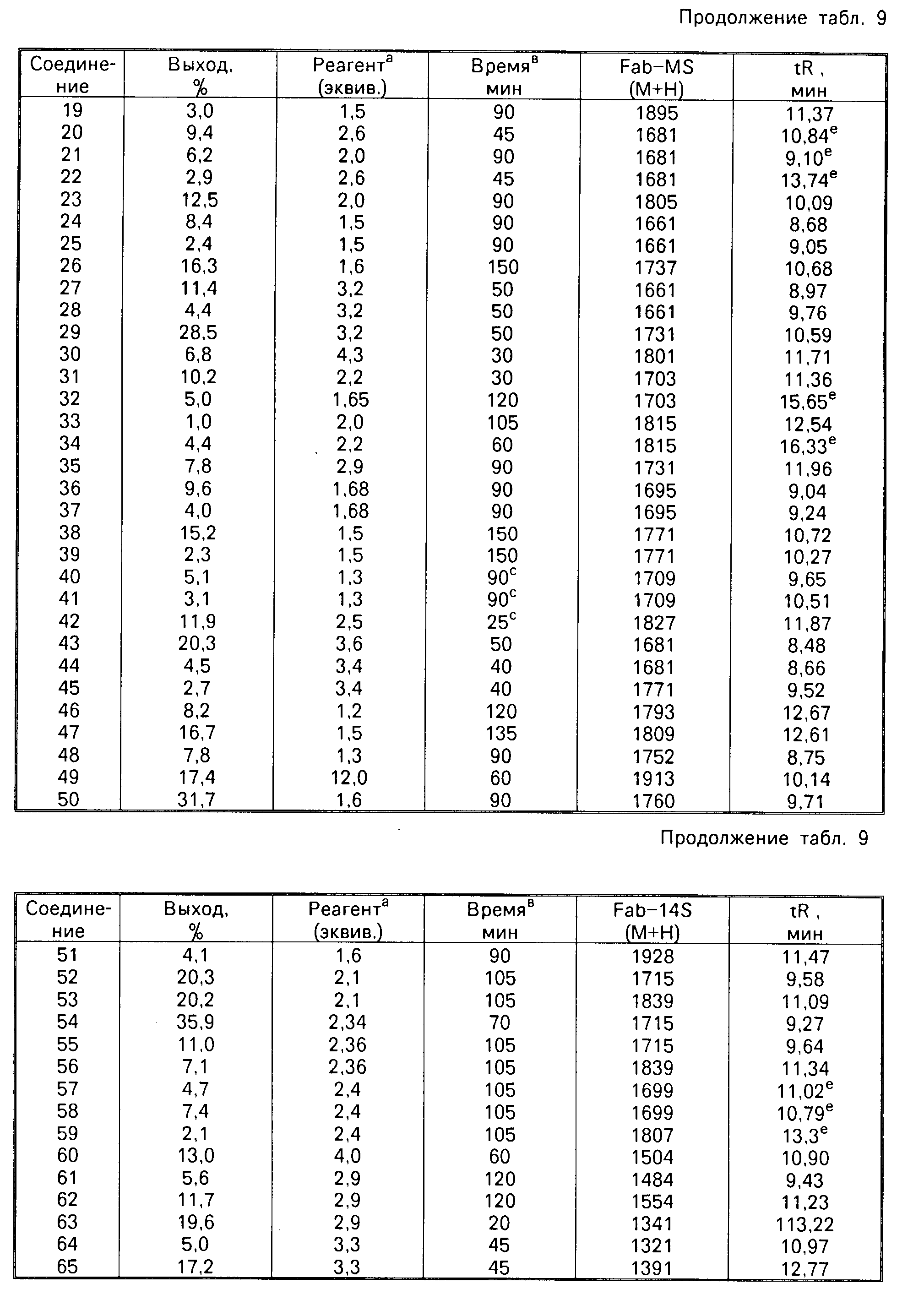
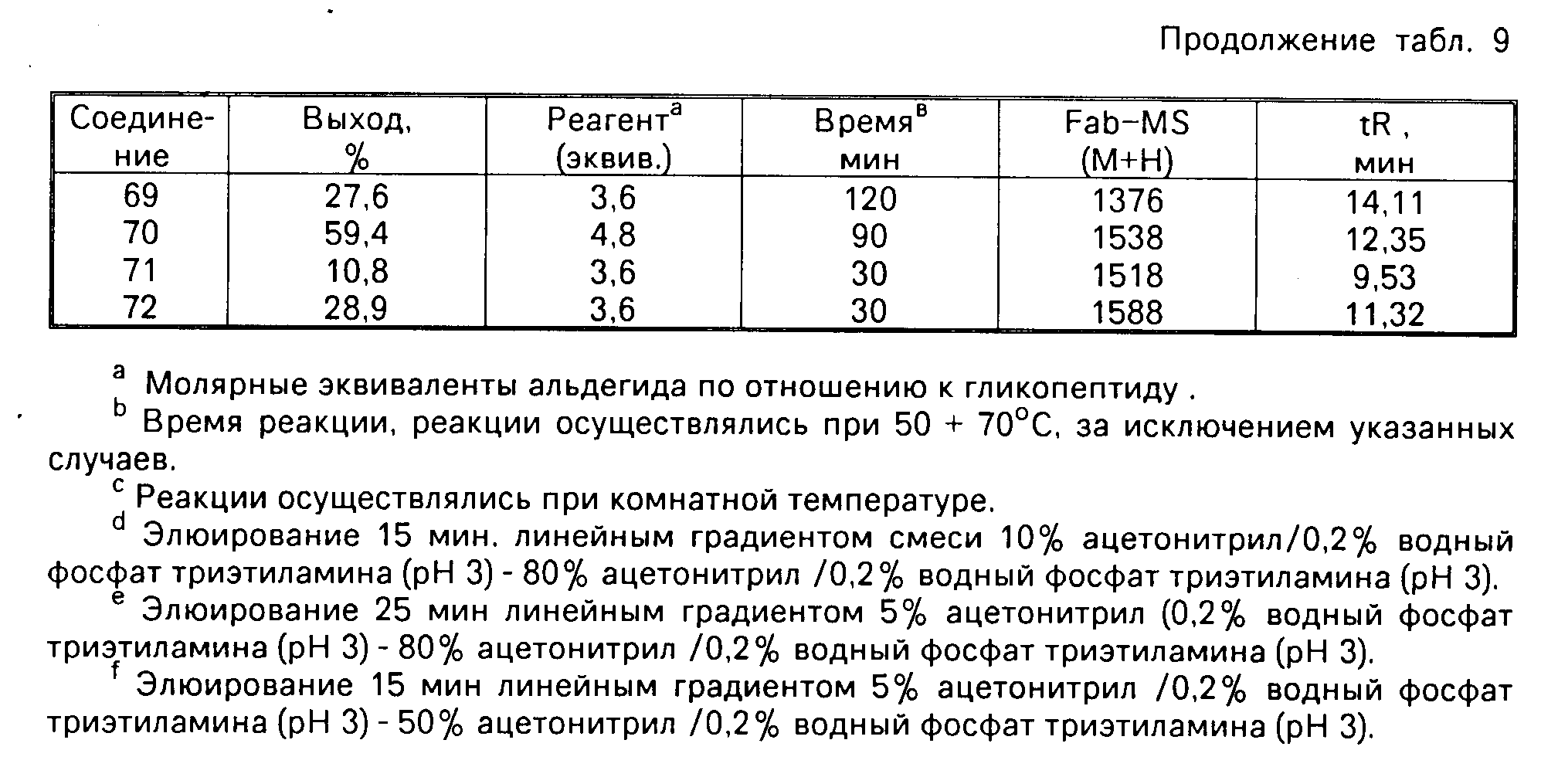
В табл. 9 суммируется получение и некоторые физические характеристики проиллюстрированных примерами соединений. Выход продукта вычислялся с использованием количества соединения формулы II, III или IV в качестве ограничительного реагента. В графе эквиваленты реагенты дается ссылка на молярные эквиваленты или альдегида, или активизированного сложного эфира для соответствующего N-алкильного производного по отношению к количеству соединения формулы II. Время удержания при высоко эффективной жидкостной хроматографии (НРLC) измерялось с использованием колонки Waters u bondopak (4 мм х 300 мм, Р (N 27324), с элюированием 15 мин линейным градиентом смеси 5% ацетонитрил (0,2% водный триэтиламинфосфатный буфер (рН= В) до 80% ацетонитрил) 0,2% водный триэтиламин-фосфатный буфер (рН=3) с использованием скорости потока 1 мл/мин, и ультрафиолетовой детекции при 280 нм.
Реферат
Использование: в медицинской промышленности как способ, позволяющий получать гликопептиды, обладающие антимикробным действием. Сущность изобретения: способ получения гликопептидов. Реагент 1: свободное основания A 82846 A или A 82846 B. Реагент 2: альдегид ф-лы HC(O)Ro где Ro алкил C1-C11 или группы CH(C6H5), (CH2)n-1C6H4R4 где n-1-3; R4-H C1-C8 C1-C8 алкокси, группа NR5R6 причем R5 и R6 независимо представляют водород или C1-C3 алкил, образовавшееся при этом основание Шиффа восстанавливают с получением N-алкильного производного 4 з.п. ф-лы, 9 табл.
Формула
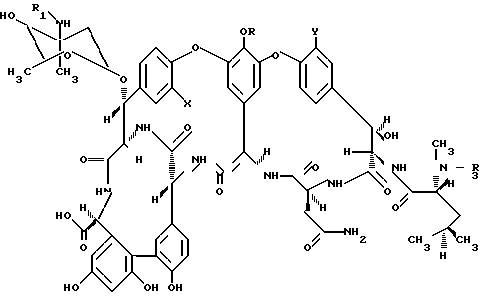
где R-водород или (4-эпи-ванкозаминил)-О-глюкозильная группа общей формулы
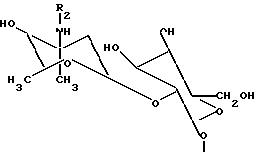
или глюкозил формулы
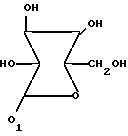
X водород или хлор;
Y водород или хлор;
R1, R2, R3 независимо водород, C1 - C12-алкил или группа общей формулы

где n=1 3;
R4 водород, галоид, C1 C8-алкил, C1 - C8-алкокси или группа общей формулы
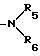
где R5 и R6 независимо водород или C1 - C3-алкил,
или R1, R2, R3 независимо друг от друга радикал формулы
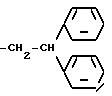
при условии, что, когда R (4-эпи-ванкозаминил)-О-гликозильная группа, R1 R3 не все являются водородом, и когда R глюкозил или водород, R1 и R3 оба не являются водородом,
отличающийся тем, что соединение общей формулы II

где R7 водород, (4-эпи-ванкозаминил)-О-глюкозильная группа формулы
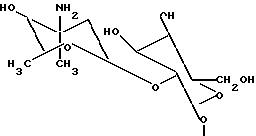
или глюкозильная группа формулы

X водород или хлор;
Y водород или хлор;
подвергают взаимодействию с альдегидом общей формулы
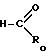
где Rо водород, C1 C11-алкил или группа формулы -CH-(C6H5)2 или общей формулы
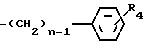
где n 1 3;
R4 водород, галоид, C1 C8-алкил, C1 - C8-алкокси или группа общей формулы
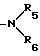
где R5 и R6 независимо водород или C1 - C3-алкил;
с образованием промежуточного Шиффова основания, которое затем восстанавливают с получением N-алкильного производного.
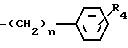
где n=1 3.

Комментарии