Конъюгаты бацитрацин-альгинатный олигомер - RU2766345C2
Код документа: RU2766345C2
Описание
В настоящем изобретении предложена новая модифицированная форма антибиотиков класса бацитрацинов, обладающая выгодными свойствами. В частности, неожиданно было обнаружено, что при представлении антибиотиков класса бацитрацинов в виде конъюгатов с альгинатными олигомерами спектр активности антибиотика, обычно ограниченный у неконъюгированной формы грамположительными бактериями, может расширяться и охватывать грамотрицательные бактерии. Соответственно, настоящее изобретение направлено на медицинское применение и способы применения конъюгатов бацитрацин-альгинатный олигомер в лечении или профилактике бактериальных инфекций. Настоящее изобретение дополнительно обеспечивает способы получения конъюгатов согласно настоящему изобретению.
Терапевтическое применение известных антибиотиков класса бацитрацинов в настоящее время ограничивается лечением инфекций, вызванных грамположительными бактериями, поскольку такие антибиотики обладают крайне ограниченной эффективностью или неэффективны против грамотрицательных бактерий. Эффективность против грамотрицательных бактерий, которую можно наблюдать в экспериментальных условиях, обычно так незначительна, что количества, требуемые для оказания терапевтического эффекта, могут вызвать неприемлемые побочные эффекты. В настоящее время обнаружено, что ковалентно конъюгированные с антибиотиками класса бацитрацинов альгинатные олигомеры расширяют спектр терапевтически применимой активности против разных видов бактерий, включая грамотрицательные бактерии. Другими словами, конъюгаты бацитрацин-альгинатный олигомер представляют собой класс новых химических структур, обладающих терапевтически применимой антибактериальной эффективностью против как грамположительных, так и грамотрицательных бактерий. Таким образом, конъюгаты бацитрацин-альгинатный олигомер согласно настоящему изобретению представляют собой улучшенные терапевтические агенты для лечения или профилактики бактериальных инфекций у субъектов-животных. Антибиотики класса бацитрацинов представляют собой хорошо известный и изученный класс циклических полипептидных антибиотиков, ингибирующих синтез клеточной стенки бактерий (Ming, L-J., et al., 2002, Journal of Inorganic Chemistry, Vol 91(1):46-58, которая полностью включена в настоящий документ посредством ссылки). Бацитрацин был исходно выделен из культур Bacillus subtilis и Bacillus licheniformis, и с тех пор было обнаружено, что это выделенное соединение представляет собой сложную смесь структурно сходных додекапептидных родственных соединений. Наиболее часто встречающиеся родственные соединения в таких изолятах в настоящее время называются бацитрацином A1, А2, B1, В2, В3, С, D1, D2, D3, Е, F, G, H1, Н2, Н3, I1, I2, I3 и X. Считается, что бацитрацин А1, А2, B1, В2, В3, С, D1, D2, D3 и Е обладают наибольшей эффективностью как антибиотики, и природные препараты бацитрацинов обычно содержат преимущественно бацитрацин А и бацитрацин В.
Антибиотики класса бацитрацинов могут быть в целом описаны как разветвленные циклические додекапептиды, конкретнее, гептациклические пептиды с пентапептидной боковой цепью, демонстрирующие эффективность в качестве антибиотиков, как считается, в первую очередь за счет ингибирования синтеза клеточной стенки бактерий. Конкретнее, считается, что антибиотики класса бацитрацинов связывают ундекапренилпирофосфат, что предотвращает вторичное использование этого углеводного носителя во время синтеза пептид о гликана, и это, в свою очередь, ингибирует синтез клеточной стенки бактерий. Грамположительные виды могут обладать клеточной стенкой, содержащей до 90% пептидогликана, в то время как у грамотрицательных видов его может быть лишь 10%. Считается, что это объясняет наблюдаемые селективные антибактериальные эффекты бацитрацина против грамотрицательных и грамположительных видов. Антибактериальная активность зависит от комплексообразования с катионами двухвалентных металлов, например, Zn2+, Mg2+, Mn2+ и Со2+. Поэтому предложены производные, несущие различные металл-хелатирующие группы (WO 97/47313).
Функционально этот класс очень эффективен против грамположительных бактерий, особенно грамположительных бацилл и кокков, в том числе Staphylococcus, Streptococcus, Bacillus, Micrococcus и Clostridium. В противоположность этому, их эффективность против грамотрицательных бактерий крайне ограничена, обычно до такой степени, что их количества, необходимые для терапевтической эффективности, ассоциированы с обычно неприемлемыми побочными эффектами. В то же время, их системное применение ассоциировано с проблемами токсичности (т.е. токсичностью для субъекта или «хозяина», которому вводят антибиотик класса бацитрацинов, а именно «токсичностью для хозяина»), в частности, нефротоксичностью. Поэтому локализованное наружное применение и пероральное применение для лечения инфекций ЖКТ (бацитрацин плохо всасывается из ЖК-тракта) является менее проблематичным.
Существует актуальная потребность в новых антибиотиках, а также способах повышения гибкости применения существующих антибиотиков.
Альгинатные олигомеры всесторонне описаны в литературе. Вкратце, альгинаты представляют собой линейные полимеры (1-4)-связанной β-D-маннуроновой кислоты (М) и/или ее С-5 эпимера α-L-гулуроновой кислоты (G). Первичная структура альгинатов может сильно меняться. Остатки М и G могут организовываться в виде гомополимерных непрерывных блоков остатков М или G, блоков чередующихся остатков М и G, и структуры этих блоков могут разделяться одиночными остатками М или G. Молекула альгината может содержать некоторые или все из этих структур, и такие структуры могут неравномерно распределяться по молекуле полимера. В крайнем случае, существуют гомополимер гулуроновой кислоты (поли гул уронат) или гомополимер маннуроновой кислоты (полиманнуронат). Альгинатные олигомеры можно получить из альгинатных полимеров, обычно выделяемых из природных источников, например, крупных высокомолекулярных полимеров (например, со средней молекулярной массой в диапазоне от 300000 до 500000 дальтон). Такие крупные альгинатные полимеры можно разрушать или расщеплять, например, путем химического или ферментативного гидролиза, с получением низкомолекулярных альгинатных структур.
Как показано в разделе «Примеры», в настоящее время обнаружено, что ковалентное конъюгирование антибиотиков класса бацитрацинов с альгинатными олигомерами позволяет создать новую химическую структуру, обладающую антибактериальной эффективностью против грамотрицательных бактерий.
Соответственно, в первом аспекте настоящего изобретения предложен конъюгат бацитрацин-альгинатный олигомер, содержащий антибиотик класса бацитрацинов, ковалентно присоединенный к по меньшей мере одному альгинатному олигомеру прямой ковалентной связью или ковалентным молекулярным линкером.
Конъюгаты бацитрацин-альгинатный олигомер также можно описать формулой I:

где В - антибиотик класса бацитрацинов, L - прямая ковалентная связь или ковалентный молекулярный линкер, - А - альгинатный олигомер, а n - целое число от 1 до 10, например, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или 2 или 1.
В соответствии с настоящим изобретением, антибиотик класса бацитрацинов определяют в широком смысле как циклический додекапептид, демонстрирующий антибактериальную эффективность, причем указанный пептид состоит из гептациклического пептида с пентапептидной боковой цепью. В настоящем документе особо рассматриваются природные бацитрацины или их функционально эквивалентные производные, сохраняющие антибактериальную эффективность, включая полностью и полу-синтетические формы. Термин «антибиотик класса бацитрацинов», таким образом, включает бацитрацин A1, А2, B1, В2, В3, С, D1, D2, D3, Е, F, G, H1, Н2, Н3, I1, I2, I3 и X, например, как описано, в числе прочего, в работах Ming, L-J., et al., supra, и Economou, NJ,. et al, 2013, Vol 110, 14207-14212. Функционально эквивалентные производные описаны, в числе прочего, в заявках WO 00/47313, WO 2011/051073 и WO 2011/051071.
Например, антибиотик класса бацитрацинов может быть представлен формулой II

где Leu - лейцин; Glu - глутаминовая кислота; Lys - лизин; Orn - орнитин; Phe - фенилаланин; His - гистидин; Asp - аспарагиновая кислота; Asn - аспарагин;
Y - валин, изолейцин, лейцин или 5-метиленизолейцин;
Z - валин, изолейцин, лейцин или 5-метиленизолейцин; и
X-W[1]-Cys[2] или V[1]-Thz[2]; где
W - валин, изолейцин, лейцин или 5-метиленизолейцин, a Cys - цистеин; и
V-

где R - α-боковая цепь валина, изолейцина, лейцина или 5-метиленизолейцина; и
Thz - тиазолиновое кольцо

В формуле II ε-амин Lys[6] присоединен к α-карбоксильной группе Asn[12] пептидной связью.
В соответствии с настоящим изобретением упоминания антибиотиков класса бацитрацинов распространяются на антибактериальные производные формулы II, т.е функционально эквивалентные производные, сохраняющие (например, обладающие по меньшей мере 70%, 80%, 90% или 95%) антибактериальную эффективность бацитрацина А1 и/или А2, причем одна или более из аминокислот Leu[3], Glu[4], Orn[7], Phe[9], His[10] или Asp[11 заменены другим аминокислотным остатком, который можно выбрать из природных или не кодируемых генетическим аппаратом аминокислот, например, лейцина, треонина, кислых аминокислот, фенилаланина, аргинина, гистидина, лизина, аспарагина, серина, цистеина, гомолизина, орнитина, диаминомасляной кислоты (например, α,γ-диаминомасляной кислоты), диаминопимелиновой кислоты, диаминопропионовой кислоты, гомоаргинина, триметиллизина, триметил орнитина, 4-аминопиперидин-4-карбоновой кислоты, 4-амино-1-карбамимидоилпиперидин-4-карбоновой кислоты и 4-гуанидинфенилаланина.
В соответствии с настоящим изобретением упоминание антибиотиков класса бацитрацинов распространяется на антибактериальные эквиваленты формулы II, т.е. функциональные эквиваленты, сохраняющие (например, обладающие по меньшей мере 70%, 80%, 90% или 95%) антибактериальнцю эффективность бацитрацина А1 и/или А2, причем Thz замещен атомом фтора, хлора или брома или линейной или разветвленной алифатической насыщенной или ненасыщенной С1-С4-алкильной или алкоксигруппой, например, метиловой, этиловой, пропиловой, изопропиловой, бутиловой, изобутиловой, втор-бутиловой, трет-бутиловой, этилновой, пропиленовой, бутиленовой, гидрокси-, метокси-, этилокси-, пропилокси-, изопропилокси-, бутилоксигруппой, изобутилокси-, втор-бутилокси-, трет-бутилоксигрупплой или их галогензамещенными версиями.
Заменяющая аминокислота предпочтительно представляет собой аминокислоту с катионной боковой цепью, т.е. аминокислоту, содержащую боковую цепь с суммарным положительным зарядом при рН внутриклеточной среды опухолевой клетки, например, в области рН 7,4. Среди аминокислот, кодируемых генетически, к таким аминокислотам относятся лизин и аргинин, однако можно использовать аминокислоты, не кодируемые генетическим аппаратом или модифицированные аминокислоты, боковая цепь которых несет такой суммарный положительный заряд, например, аминокислоты, несущие боковую цепь с гуанидиновой группой или аминогруппой или другой катионной группой, например, производные лизина или аргинина, в боковой группе которых любой атом водорода, кроме протонирующего атома водорода, замещен атомом галогена, например, фтора, хлора или брома, или линейной, разветвленной алифатической ненасыщенной или насыщенной C1-С4-алкильной или алкоксигруппой, например, метиловой, этиловой, пропиловой, изопропиловой, бутиловой, изобутиловой, втор-бутиловой, трет-бутиловой, этиленовой, пропиленовой, бутиленовой, гидрокси-, метокси-, этилокси-, пропилокси-, изопропилокси-, бутилоксигруппой, изобутилокси-, втор-будилокси-, третбутилоксигруппой или их версиями, замещенными атомами галогенов. Подходящие аминокислоты с катионными боковыми цепями, не кодируемые генетически, включают гомолизин, орнитин, диаминомасляную кислоту, диаминопроионовую кислоту и гомоаргинин, а также триметиллизин и триметилорнитин, 4-аминопиперидин-4-карбоновую кислоту, 4-амино-1-карбамимидоилпиперидин-4-карбоновую кислоту и 4-гуанидинфенилаланин.
Аминокислота - это молекула, содержащая аминогруппу, карбоксильную группу и по меньшей мере один атом углерода, разделяющий эти две группы. К разделяющему(им) атому(ам) углерода могут быть присоединены другие группы. Эти группы можно называть «боковыми группами», хотя в простейшем случае боковая группа может представлять собой атом водорода (глицин). Аминокислоты с единственным разделяющим атомом углерода называют "α-аминокислотами", их общая формула - H2NCR1R2COOH, где R1 и R2 - группы-заместители, т.е. боковые цепи. Разделяющий атом углерода называют а атомом углерода. Существуют другие виды аминокислот, в которых амино- и карбоксильная группы разделены более чем одним атомом углерода, например, в β-аминокислотах атом углерода с присоединенной аминогруппой отделен от карбоксильной группы двумя атомами углерода, а в γ-аминокислотах амино- и карбоксильная группы разделены тремя атомами углерода. Аминокислоты в антибиотиках класса бацитрацинов для применения согласно настоящему изобретению предпочтительно могут представлять собой α-, β- или γ-аминокислоты, более предпочтительно - α- или β-аминокислоты, и наиболее предпочтительно - α-аминокислоты.
Аминокислоты, за исключением глицина, могут существовать в виде двух или более стереоизомеров. В частности, α-атом углерода в аминокислотах, кроме глицина, представляет собой хиральный центр, и, таким образом, образует две энантиомерных формы каждой аминокислоты. Эти формы часто называют D- и L-формами, например, D-аланином и L-аланином. Аминокислоты с дополнительными хиральными центрами могут существовать в виде четырех или более возможных стереоизомеров, например, треонин содержит два хиральных центра и поэтому может существовать в одной из четырех стереоизомерных форм. В молекулах антибиотиков класса бацитрацинов для применения согласно настоящему изобретению может присутствовать любая стереоизомерная форма аминокислоты. Для целей описания настоящего изобретения применение термина «не кодируемые генетически» к аминокислотам не включает D-формы аминокислот, существующих в природе в L-форме.
В предпочтительных вариантах реализации антибиотик класса бацитрацинов выбран из бацитрацина A1, А2, B1, В2, В3, С, D1, D2, D3, Е, F, G, H1, Н2, Н3, I1, I2, I3 и X, более предпочтительно - выбран из А1, А2, B1, В2, В3, С, D1, D2, D3 и Е, и более предпочтительно - из бацитрацина А (А1 и/или А2) и бацитрацина В (В1 и/или В2). Указанные бацитрацины могут быть представлены формулой III:

где


В соответствии с настоящим изобретением предпочтительные антибиотики класса бацитрацинов являются функционально эквивалентными производными бацитрацинов, указанных выше, т.е. функциональными эквивалентами, сохраняющими (например, обладающими по меньшей мере 70%, 80%, 90% или 95%) антибактериальную эффективность рассматриваемого бацитрацина.
В некоторых вариантах реализации антибиотик класса бацитрацинов представлен в комплексе с катионами двухвалентных металлов, например, Zn2+, Mg2+, Mn2+ и Co2+.
В некоторых вариантах реализации одну или более из свободных аминогрупп антибиотика класса бацитрацинов можно маскировать путем модификации, например, сульфометилирования.
Как отмечалось выше, альгинаты обычно встречаются в виде полимеров со средней молекулярной массой по меньшей мере 35000 дальтон, т.е. содержащих от приблизительно 175 до приблизительно 190 мономерных остатков, хотя обычно количество остатков является намного большим. Альгинатный олигомер согласно настоящему изобретению может, с другой стороны, содержать от 2 до 100 мономерных остатков, в более типичном случае от 3, 4, 5 или 6 до 100 остатков, и может содержать от 2, 3, 4, 5 или 6 до 75, от 2, 3, 4, 5 или 6 до 50, от 2, 3, 4, 5 или 6 до 40, от 2, 3, 4, 5 или 6 до 35 или от 2, 3, 4, 5 или 6 до 30 остатков. Таким образом, альгинатный олигомер для применения согласно настоящему изобретению обычно обладает средней молекулярной массой от 350, 550, 700, 900 или 1000 до 20000 дальтон, от 350, 550, 700, 900 или 1000 до 15000 дальтон, от 350, 550, 700, 900 или 1000 до 10000 дальтон, от 350, 550, 700, 900 или 1000 до 8000 дальтон, от 350, 550, 700, 900 или 1000 до 7000 дальтон, или от 350, 550, 700, 900 или 1000 до 6000 дальтон.
В альтернативном случае альгинатный олигомер может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn) от 2 до 100, предпочтительно от 2 до 75, предпочтительно от 2 до 50, более предпочтительно от 2 до 40, от 2 до 35, от 2 до 30, от 2 до 28, от 2 до 25, от 2 до 22, от 2 до 20, от 2 до 18, от 2 до 17, от 2 до 15 или от 2 до 12.
Другие типичные диапазоны (количества остатков, DP или DPn) включают любое число от 3, 4, 5, 6, 7, 8, 9, 10 или 11 до любого числа из 50, 45, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13 или 12.
Другие типичные диапазоны (количества остатков, DP или DPn) включают любое число от 8, 9, 10, 11, 12, 13, 14 или 15 до любого числа из 50, 45, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17 или 16.
Другие типичные диапазоны (количества остатков, DP или DPn) включают любое число от 11, 12, 13, 14, 15, 16, 17 или 18 до любого числа из 50, 45, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20 или 19.
В некоторых вариантах реализации может быть выгодно выбрать более крупный альгинатный олигомер для создания конъюгата увеличенного размера. Более крупные конъюгаты могут способствовать селективной доставке антибиотиков класса бацитрацинов к сайтам и областям инфекции, поскольку проницаемость сосудов в таких областях организма субъекта обычно выше, чем в сосудах неинфицированных областей. Как следствие, крупные конъюгаты с меньшей вероятностью попадают в неинфицированные области из кровотока, но могут попасть в инфицированные области с повышенной проницаемостью. Типичные диапазоны размера такого более крупного олигомера могут составлять, например, от 20 до 100 остатков (или DP или DPn от 20 до 100), или включать любое число от 20, 21, 22, 23, 24 или 25 до любого числа из 100, 90, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35 или 30 остатков (или DP или DPn в любом из указанных диапазонов) или любое число от 30, 31, 32, 33, 34 или 35 до любого числа из 100, 90, 80, 75, 70, 65, 60, 55, 50, 45 или 40 остатков (или DP или DPn в любом из указанных диапазонов). В качестве альтернативы, этих результатов также можно достичь путем увеличения количества альгинатных олигомеров в конъюгате, даже при их меньшем размере.
Как отмечалось выше, альгинатный олигомер может содержать (или включать) остатки или единицы гулуроната или гулуроновой кислоты (G) и/или маннуроната или маннуроновой кислоты (М). Альгинатный олигомер согласно настоящему изобретению предпочтительно целиком или по существу целиком состоит (т.е. состоит главным образом из) остатков уроната/уроновой кислоты, конкретнее - полностью или по существу полностью из остатков G и/или М. Иначе говоря, в альгинатном олигомере для применения в настоящем изобретении по меньшей мере 80%, конкретнее - по меньшей мере 85, 90, 95 или 99% остатков мономера могут представлять собой остатки уроната/уроновой кислоты или, конкретнее, остатки G и/или М. Другими словами, альгинатный олигомер предпочтительно не содержит других остатков или единиц (например, других сахаридных остатков или, конкретнее, других остатков уроновой кислоты/уроната).
Альгинатный олигомер предпочтительно представляет собой линейный олигомер.
Конкретнее, альгинатные олигомеры, предложенные для применения в соответствии с настоящим изобретением, могут содержать по меньшей мере 70% остатков G (т.е. по меньшей мере 70% мономерных остатков в альгинатном олигомере являются остатками G). Так, конкретные варианты реализации включают альгинатные олигомеры с (например, содержащие) от 70 до 100% остатков G (гулуроната).
Предпочтительно по меньшей мере 75% или 80%, конкретнее - по меньшей мере 85% или 90%, еще конкретнее - по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99% остатков мономеров представляют собой гулуронат. В одном варианте реализации альгинатный олигомер может представлять собой олигогулуронат (т.е. гомоолигомер G, или 100% G).
В дополнительном предпочтительном варианте реализации вышеописанные альгинаты согласно настоящему изобретению обладают первичной структурой, в которой большинство остатков G находятся в так называемых G-блоках. Предпочтительно по меньшей мере 50%, более предпочтительно - по меньшей мере 70 или 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90, 92 или 95% остатков G находятся в G-блоках. G-блок - это непрерывная последовательность из по меньшей мере двух остатков G, предпочтительно по меньшей мере 3 последовательных остатков G, более предпочтительно - из по меньшей мере 4 или 5 последовательных остатков G, наиболее предпочтительно - из по меньшей мере 7 последовательных остатков G.
В частности, по меньшей мере 90% остатков G соединены связями 1-4 с другим остатком G. Более предпочтительно по меньшей мере 95%, более предпочтительно - по меньшей мере 98%, и наиболее предпочтительно - по меньшей мере 99% остатков G в составе альгината соединены связями 1-4 с другим остатком G. Конкретнее, по меньшей мере 70% мономерных остатков в олигомере представляют собой остатки G, соединенные связями 1-4 с другим остатком G, или, более предпочтительно, по меньшей мере 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90, 92, 93, 94, 95, 96, 97, 98, 99% мономерных остатков олигомера представляют собой остатки G, соединенные связями 1-4 с другим остатком G. Эту связь 1-4 двух остатков G можно иным образом выразить как связь гулуронового остатка с соседним гулуроновым остатком.
Специалисты часто называют альгинатные олигомеры для применения в настоящем изобретении олигомерами "с высоким содержанием G" или "G-блочными" олигомерами, т.е. олигомерами с высоким содержанием остатков G или G-блоков (например, в которых по меньшей мере 70% мономерных остатков представляют собой G, предпочтительно упорядоченные в виде G-блоков).
Альгинатный олигомер для применения в настоящем изобретении предпочтительно содержит от 3 до 35 остатков, более предпочтительно - от 3 до 28 остатков, в частности, от 4 до 25 остатков, например, от 5 до 20 остатков, в частности, от 6 до 22 остатков, в частности, от 8 до 20 остатков, конкретно, от 10 до 15 остатков, например, обладает молекулярной массой в диапазоне от 350 до 6400 дальтон или от 350 до 6000 дальтон, предпочтительно от 550 до 5500 дальтон, предпочтительно от 750 до 5000 дальтон, и, в частности, от 750 до 4500 дальтон или от 2000 до 3000 дальтон или от 900 до 3500 дальтон. Другие типичные альгинатные олигомеры включают, как упоминалось выше, олигомеры, содержащие от 5, 6, 7, 8, 9, 10, 11, 12 или 13 до 50, 45, 40, 35, 28, 25, 22 или 20 остатков.
Олигомер может представлять собой единственное соединение или смесь соединений, например, с некоторым диапазоном степени полимеризации. Как отмечалось выше, мономерные остатки альгинатного олигомера могут быть одинаковыми или различными, и не все из них должны нести электрически заряженные группы, хотя в предпочтительном случае большинство из них (например, по меньшей мере 60%, предпочтительно - по меньшей мере 80%, более предпочтительно - по меньшей мере 90%) несут такие группы. В предпочтительном случае значительное большинство, например, по меньшей мере 80%, более предпочтительно - по меньшей мере 90% заряженных групп имеют одинаковую полярность. Соотношение гидроксильных групп к заряженным группам в альгинатном олигомере предпочтительно составляет по меньшей мере 2:1, в частности, по меньшей мере 3:1.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 3-28, 4-25, 6-22, 8-20 или 10-15 или 5-18 или 7-15 или 8-12, в частности, 10.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 3-24, 4-23, 5-22, 6-21, 7-20, 8-19, 9-18, 10-17, 11-16, 12-15 или 13-14 (например, 13 или 14).
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 4-25, 5-24, 6-23, 7-22, 8-21, 9-20, 10-19, 11-18, 12-17, 13-16, 14-15 (например, 14 или 15).
альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 5-26, 6-25, 7-24, 8-23,9-22, 10-21, 11-20, 12-19, 13-18, 14-17 или 15-16 (например, 15 или 16).
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 4-50, 4-40, 4-35, 4-30, 4-28, 4-26, 4-22, 4-20, 4-18, 4-16 или 4-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 5-50, 5-40, 5-25, 5-22, 5-20, 5-18, 5-23, 5-20, 5-18, 5-16 или 5-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 6-50, 6-40, 6-35, 6-30, 6-28, 6-26, 6-24, 6-20, 6-19, 6-18, 6-16 или 6-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 8-50, 8-40, 8-35, 8-30, 8-28, 8-25, 8-22, 8-20, 8-18, 8-16 или 8-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 9-50, 9-40, 9-35, 9-30, 9-28, 9-25, 9-22, 9-20, 9-18, 9-16 или 9-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 10-50, 10-40, 10-35, 10-30, 10-28, 10-25, 10-22, 10-20, 10-18, 10-16 или 10-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 11-50, 11-40, 11-35, 11-30, 11-28, 11-25, 11-22, 11-20, 11-18, 11-16 или 11-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 12-50, 12-40, 12-35, 12-30, 12-28, 12-25, 12-22, 12-20, 12-18, 12-16 или 12-14.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 13-50, 13-40, 13-35, 13-30, 13-28, 13-25, 13-22, 13-20, 13-18, 13-16 или 13-14 (например, 13 или 14).
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 14-50, 14-40, 14-35, 14-30, 14-28, 14-25, 14-22, 14-20, 14-18 или 14-16.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 15-50, 15-40, 15-35, 15-30, 15-28, 15-25, 15-22, 15-20 или 15-18.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 18-50, 18-40, 18-35, 18-30, 18-28, 18-25, 18-22 или 18-20.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 20-100, 20-90, 20-80, 20-75, 20-70, 20-65, 20-60, 20-55, 20-50, 20-45, 20-40, 20-35, 20-30 или 20-25.
Альгинатный олигомер согласно настоящему изобретению может характеризоваться степенью полимеризации (DP) или среднечисловой степенью полимеризации (DPn), равной 30-100, 30-90, 30-80, 30-75, 30-70, 30-65, 30-60, 30-55, 30-50, 30-45, 30-40 или 30-35.
Альгинатный олигомер согласно настоящему изобретению предпочтительно по существу не содержит, предпочтительно главным образом не содержит альгинатных олигомеров со степенью полимеризации, выходящей за диапазоны, описанные в настоящем документе. Это можно выразить с точки зрения распределения молекулярной массы альгинатного олигомера согласно настоящему изобретению, например, процентной доли каждого моля альгинатного олигомера, применяемого в соответствии с настоящим изобретением и характеризующегося DP за пределами соответствующего диапазона. Распределение молекулярной массы предпочтительно является таким, что не более 10%, предпочтительно не более 9, 8, 7, 6, 5, 4, 3, 2 или 1% молей обладают значением DP на три, две или одну единицу выше соответствующего верхнего предела DPn. Аналогичным образом, в предпочтительном случае не более 10%, предпочтительно не более 9, 8, 7, 6, 5, 4, 3, 2 или 1% молей обладают значением DP на три, две или одну единицу ниже соответствующего нижнего предела DPn.
Подходящие альгинатные олигомеры описаны в заявках WO 2007/039754, WO 2007/039760, WO 2008/125828 и WO 2009/068841, описания которых явным образом полностью включены в настоящий документ посредством ссылки.
Типичные подходящие альгинатные олигомеры обладают DPn в диапазоне от 5 до 30, причем гулуронатная фракция (FG) составляет по меньшей мере 0,80, маннуронатная фракция (FM) составляет не более 0,20, и по меньшей мере 95 моль % обладают DP не более 25.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 7 до 15 (предпочтительно от 8 до 12), причем гулуронатная фракция (FG) составляет по меньшей мере 0,85 (предпочтительно по меньшей мере 0,90), маннуронатная фракция (FM) составляет не более 0,15 (предпочтительно не более 0,10), и по меньшей мере 95% молей обладают степенью полимеризации менее 17 (предпочтительно менее 14).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 18 (в частности, от 7 до 15), причем гулуронатная фракция (FG) составляет по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, в частности, по меньшей мере 0,92), маннуронатная фракция (FM) составляет не более 0,20 (предпочтительно не более 0,15, в частности, не более 0,08), и по меньшей мере 95% молей обладают степенью полимеризации менее 20 (предпочтительно менее 17).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 18, причем гулуронатная фракция (FG) составляет по меньшей мере 0,92, маннуронатная фракция (FM) составляет не более 0,08, и по меньшей мере 95% молей обладают степенью полимеризации менее 20.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 18 (предпочтительно от 7 до 15, более предпочтительно от 8 до 12, в частности, приблизительно 10), причем гулуронатная фракция (FG) составляет по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90), маннуронатная фракция (FM) составляет не более 0,15 (предпочтительно не более 0,10), и по меньшей мере 95% молей обладают степенью полимеризации менее 20 (предпочтительно менее 14).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 7 до 15 (предпочтительно от 8 до 12), причем гулуронатная фракция (FG) составляет по меньшей мере 0,92 (предпочтительно по меньшей мере 0,95), маннуронатная фракция (FM) составляет не более 0,08 (предпочтительно не более 0,05), и по меньшей мере 95% молей обладают степенью полимеризации менее 17 (предпочтительно менее 14).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 18, причем гулуронатная фракция (FG) составляет по меньшей мере 0,80, маннуронатная фракция (FM) составляет не более 0,20, и по меньшей мере 95% молей обладают степенью полимеризации менее 20.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 7 до 15, причем гулуронатная фракция (FG) составляет по меньшей мере 0,85, маннуронатная фракция (FM) составляет не более 0,15, и по меньшей мере 95% молей обладают степенью полимеризации менее 17.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 7 до 15, причем гулуронатная фракция (FG) составляет по меньшей мере 0,92, маннуронатная фракция (FM) составляет не более 0,08, и по меньшей мере 95% молей обладают степенью полимеризации менее 17.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 20, причем гулуронатная фракция (FG) составляет по меньшей мере 0,85, а маннуронатная фракция (FM) составляет не более 0,15.
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации в диапазоне от 5 до 20, причем гулуронатная фракция (FG) составляет 0,9-0,95, а маннуронатная фракция (FM) составляет 0,05-0,1, что можно описать как альгинатный олигомер, содержащий 90-95% остатков G, со средней молекулярной массой 2600 Да. Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации, равной приблизительно 13 (например, 12, 13 или 14), причем гулуронатная фракция (FG) составляет по меньшей мере приблизительно 0,80, 0,85, 0,87, 0,88, 0,90 или 0,93 (например, 0,92, 0,93 или 0,94), а соответствующая маннуронатная фракция (FM) составляет не более чем приблизительно 0,20, 0,15, 0,13, 0,12, 0,10 или 0,07 (например, 0,08, 0,07 или 0,06).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации, равной приблизительно 21 (например, 20, 21 или 22), причем гулуронатная фракция (FG) составляет по меньшей мере приблизительно 0,80 (например, 0,85, 0,87, 0,88, 0,90, 0,92, 0,94 или 0,95), а соответствующая маннуронатная фракция (FM) составляет не более чем приблизительно 0,20 (например, 0,15, 0,13, 0,12, 0,10, 0,08, 0,06, 0,05).
Дополнительные подходящие альгинатные олигомеры обладают среднечисловой степенью полимеризации, равной приблизительно 6 (например, 5, 6 или 7), причем гулуронатная фракция (FG) составляет по меньшей мере приблизительно 0,80 (например, 0,85, 0,87, 0,88, 0,90, 0,92, 0,94 или 0,95), а соответствующая маннуронатная фракция (FM) составляет не более чем приблизительно 0,20 (например, 0,15, 0,13, 0,12, 0,10, 0,08, 0,06, 0,05).
Таким образом, видно, что настоящему изобретению соответствует конкретный класс альгинатных олигомеров, представляющий собой так называемые альгинатные олигомеры "с высоким содержанием G" или "G-блочные" олигомеры, т.е. олигомеры с высоким содержанием остатков G или G-блоков (например, в которых по меньшей мере 70% мономерных остатков представляют собой G, предпочтительно упорядоченные в виде G-блоков). В то же время, можно применять и другие виды альгинатных олигомеров, включая, в частности, олигомеры «с высоким содержанием М» или «М-блочные» олигомеры, или MG-блочные олигомеры, как дополнительно описано ниже. Соответственно, особенно предпочтительные олигомеры представляют собой альгинатные олигомеры с высокой долей мономеров одного вида, причем указанные мономеры этого вида присутствуют преимущественно в виде непрерывных последовательностей мономеров этого вида, например, олигомеры, в которых по меньшей мере 70% мономерных остатков в олигомере представляют собой остатки G, соединенные связями 1-4 с другим остатком G, или, более предпочтительно, по меньшей мере 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90, 92, 93, 94, 95, 96, 97, 98, 99% мономерных остатков олигомера представляют собой остатки G, соединенные связями 1-4 с другим остатком G. Эту связь 1-4 двух остатков G можно иным образом выразить как связь гулуронового остатка с соседним гулуроновым остатком.
В дополнительных вариантах реализации по меньшей мере 50% или более мономерных остатков в альгинатном олигомере могут представлять собой остатки М (т.е. маннуронат или маннуроновую кислоту). Другими словами, альгинатный олигомер может содержать по меньшей мере, или, в альтернативном случае, более 50% остатков маннуроната (или маннуроновой кислоты). Так, конкретные варианты реализации включают альгинатные олигомеры с (например, содержащие) 50-70% остатков М (маннуроната) или, например, 70-100% остатков М (маннуроната). Дополнительные конкретные варианты реализации также включают олигомеры, содержащие 71-85% остатков М или 85-100% остатков М. Таким образом, типичные альгинатные олигомеры для применения в соответствии с данным вариантом реализации настоящего изобретения, могут содержать более 70% остатков М (т.е. более 70% мономерных остатков в альгинатном олигомере являются остатками М).
В других вариантах реализации по меньшей мере 50% или 60%, конкретнее - по меньшей мере 70% или 75%, еще конкретнее - по меньшей мере 80, 85, 90, 95 или 99% остатков мономеров представляют собой маннуронат. В одном варианте реализации альгинатный олигомер может представлять собой олигоманнуронат (т.е. гомоолигомер М, или 100% М).
В дополнительном варианте реализации вышеописанные альгинаты согласно настоящему изобретению обладают первичной структурой, в которой большинство остатков М находятся в так называемых М-блоках. В этом варианте реализации предпочтительно по меньшей мере 50%, более предпочтительно - по меньшей мере 70 или 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90 или 95% остатков М находятся в М-блоках. М-блок - это непрерывная последовательность из по меньшей мере двух остатков М, предпочтительно по меньшей мере 3 последовательных остатков М, более предпочтительно - из по меньшей мере 4 или 5 последовательных остатков М, наиболее предпочтительно - из по меньшей мере 7 последовательных остатков М.
В частности, по меньшей мере 90% остатков М соединены связями 1-4 с другим остатком М. Более предпочтительно по меньшей мере 95%, более предпочтительно - по меньшей мере 98%, и наиболее предпочтительно - по меньшей мере 99% остатков М в составе альгината соединены связями 1-4 с другим остатком М.
Другие предпочтительные олигомеры представляют собой альгинатные олигомеры, в которых по меньшей мере 70% мономерных остатков в олигомере представляют собой остатки М, соединенные связями 1-4 с другим остатком М, или, более предпочтительно, по меньшей мере 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90, 92, 93, 94, 95, 96, 97, 98, 99% мономерных остатков олигомера представляют собой остатки М, соединенные связями 1-4 с другим остатком М. Эту связь 1-4 двух остатков М можно иным образом описать как связь маннуронового остатка с соседним маннуроновым остатком.
В дополнительном варианте реализации альгинатные олигомеры согласно настоящему изобретению содержать последовательность из чередующихся остатков М и G. Последовательность из по меньшей мере трех, предпочтительно по меньшей мере четырех чередующихся остатков М и G представляет собой MG-блок. Альгинатные олигомеры согласно настоящему изобретению предпочтительно содержат MG-блок. Конкретнее, MG-блок представляет собой последовательность из по меньшей мере трех последовательных остатков, состоящую из остатков G и М, причем каждый неконцевой (внутренний) остаток G в непрерывной последовательности соединен связями 1-4 и 4-1 с остатком М, а каждый неконцевой (внутренний) остаток М в непрерывной последовательности соединен связями 1-4 и 4-1 с остатком G. MG-блок предпочтительно представляет собой по меньшей мере 5 или 6 последовательных остатков, более предпочтительно - по меньшей мере 7 или 8 последовательных остатков.
В дополнительном варианте реализации меньшая часть уронатов (т.е. маннуроната или гулуроната) в составе альгинатного олигомера находится преимущественно в MG-блоках. В этом варианте реализации предпочтительно по меньшей мере 50%, более предпочтительно - по меньшей мере 70 или 75%, и наиболее предпочтительно - по меньшей мере 80, 85, 90 или 95% меньшей части мономеров уронатов в MG-блочном альгинатном олигомере находятся в MG-блоках. В еще одном варианте реализации альгинатный олигомер организован таким образом, что по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99%, например, 100% остатков G и М в составе олигомера упорядочены в виде MG-блоков.
Хотя в наиболее широком смысле настоящее изобретение распространяется на варианты реализации, в которых по меньшей мере 1%, но менее 100% мономерных остатков в составе олигомера представляют собой остатки G (т.е. гулуронат или гулуроновую кислоту), в более конкретном случае, описанном ниже, по меньшей мере 30% мономерных остатков представляют собой остатки G. Таким образом, в наиболее широком смысле альгинатный олигомер, содержащий MG-блок, может содержать по меньшей мере 1%, но менее 100% остатков гулуроната (или гулуроновой кислоты), однако в общем случае альгинатный олигомер, содержащий MG-блок, может содержать по меньшей мере 30% (или по меньшей мере 35, 40 или 45% или 50% G), но менее 100% G. Так, конкретные варианты реализации включают альгинатные олигомеры, содержащие MG-блок, несущие (например, содержащие) от 1 до 30% остатков G (гулуроната), от 30 до 70% остатков G (гулуроната) или от 70 до 99% остатков G (гулуроната). Таким образом, типичный альгинатный олигомер, содержащий MG-блок, для применения в соответствии с настоящим изобретением может содержать более 30%, но менее 70% остатков G (т.е. более 30%, но менее 70% мономерных остатков в MG-блочном альгинатном олигомере являются остатками G).
Предпочтительно более 30%, конкретнее - более 35% или 40%, еще конкретнее -более 45, 50, 55, 60, или 65%, но в любом случае менее 70% остатков мономеров в составе альгинатного олигомера, содержащего MG-блок, представляют собой гулуронат. В качестве альтернативы, менее 70%, более предпочтительно - менее 65% или 60%, еще более предпочтительно - менее 55, 50, 45, 40, или 35%, но в любом случае более 30% остатков мономеров в составе альгинатного олигомера, содержащего MG-блок, представляют собой гулуронат. Можно выбрать любой диапазон, образованный любыми комбинациями указанных значений. Соответственно, например, альгинатный олигомер, содержащий MG блок, может содержать, например, от 35% до 65%, от 40% до 60% или от 45% до 55% остатков G.
В еще одном варианте реализации альгинатный олигомер, содержащий MG-блок, модет содержать приблизительно равные количества остатков G и М (например, соотношения между 65% G/35% М и 35% G/65% М, например, 60% G/40% М и 40% G/60% М; 55% G/45% М и 45% G/55% М; 53% G/47% М и 47% G/53% М; 51% G/49% М и 49% G/51% М; например, приблизительно 50% G и приблизительно 50% М), и эти остатки преимущественно организованы, предпочтительно полностью или в максимально возможной степени полностью, в порядке чередования MG (например, по меньшей мере 50% или по меньшей мере 60, 70, 80, 85, 90 или 95% или 100% остатков М и G находятся в составе последовательности чередующихся MG).
В некоторых вариантах реализации концевые остатки уроновой кислоты в составе олигомеров для применения в настоящем изобретении не содержат двойной связи, в частности, двойной связи между атомами C4 и С5. Такие олигомеры можно описать как олигомеры с насыщенными концевыми остатками уроновой кислоты. Специалист может получить олигомеры с насыщенными концевыми остатками уроновой кислоты без большого труда. Это можно сделать, используя методики продукции, позволяющие получить такие олигомеры, или путем преобразования (насыщения) олигомеров, продуцированных способами, позволяющими получить олигомеры с ненасыщенными концевыми остатками уроновой кислоты.
Альгинатный олигомер обычно несет заряд, и поэтому противоионы для указанного альгинатного олигомера могут представлять собой любой физиологически приемлемый ион, в частности, ионы, часто используемые с заряженными лекарственными веществами, например, ионы натрия, калия, аммония, хлорида, мезилата, меглумина и т.д. Кроме того, можно использовать ионы, стимулирующие образование альгинатного геля, например, ионы металлов 2 группы.
Хотя альгинатный олигомер может являться синтетическим материалом, полученным в результате полимеризации соответствующего количества гулуронатных и маннуронатных остатков, альгинатные олигомеры, применяемые в настоящей изобретении, удобно получать, продуцировать или выделять в качестве производных из природных источников, например, упомянутых выше, а именно природных исходных альгинатов.
Расщепление полисахаридов на олигосахариды с целью получения альгинатного олигомера, который можно применять в соответствии с настоящим изобретением, можно выполнить с использованием стандартных методик лизиса полисахаридов, например, ферментативного гидролиза и кислотного гидролиза. В одном предпочтительном варианте реализации для получения альгинатных олигомеров согласно настоящему изобретению применяют кислотный гидролиз. В других вариантах реализации применяют ферментативный гидролиз с дополнительным(и) этапом(ами) процессинга для насыщения концевых уроновых кислот олигомеров.
Затем олигомеры можно отделить от продуктов распада полисахаридов хроматографически, используя ионообменную смолу, или путем фракционного осаждения или солюбилизации или фильтрации. В заявках US 6121441 и WO 2008/125828, явным образом полностью включенных в настоящий документ посредством ссылки, описан процесс, подходящий для получения альгинатных олигомеров, применяемых в настоящем изобретении. Дополнительную информацию и обсуждение можно найти, например, в "Handbooks of Hydrocolloids", Ed. Phillips and Williams, CRC, Boca Raton, Florida, USA, 2000; этот справочник явным образом полностью включен в настоящий документ посредством ссылки.
Кроме того, альгинатные олигомеры можно химически модифицировать, включая модификацию путем добавления заряженных групп (например, карбоксилированных или карбоксиметилированных гликанов), а также модификацию с целью влияния на гибкость (например, путем окисления периодатом), но не ограничиваясь ими.
Альгинатные олигомеры (например, олигогулуроновые кислоты), подходящие для применения в соответствии с настоящим изобретением, удобно получать кислотным гидролизом альгиновой кислоты из Laminaria hyperbora и Lessonia nigrescens, но не ограничиваясь ими, растворения при нейтральном рН, добавления минеральной кислоты для снижения рН до 3,4 с целью осаждения альгинатного олигомера (олигогулуроновой кислоты), промывки слабой кислотой, ресуспендирования при нейтральном рН и лиофильной сушки.
Кроме того, альгинаты для получения альгинатных олигомеров согласно настоящему изобретению можно получить непосредственно их подходящих бактериальных источников, например, Pseudomonas aeruginosa или Azotobacter vinelandii.
В вариантах реализации, где требуются альгинатные олигомеры с первичной структурой, в которой большинство остатков G упорядочены в составе G-блоков, а не одиночных остатков, водоросли являются наиболее подходящими источниками, учитывая, что альгинаты, полученные из этих организмов, имеют тенденцию к содержанию таких структур. Бактериальные источники могут быть более подходящими для получения альгинатных олигомеров с другой структурой.
Молекулярный аппарат, вовлеченный в биосинтез альгината у Pseudomonas fluorescens к Azotobacter vinelandii, клонирован и исследован (WO 94/09124;

Содержание G в альгинатах (например, из исходного материала на основе водорослей) можно увеличить путем эпимеризации, например, с использованием маннуронан-С-5-эпимераз A. vinelandii или других ферментов-эпимераз. Так, например, можно выполнить эпимеризацию in vitro с использованием выделенных эпимераз Pseudomonas или Azotobacter, например, ферментов AlgG из Pseudomonas fluorescens или Azotobacter vinelandii или AlgE (от AlgEl до AlgE7) из Azotobacter vinelandii. Кроме того, в конкретных случаях рассматривается применение эпимераз из других организмов, способных продуцировать альгинат, в частности, водорослей. Эпимеризация in vitro альгинатов с низким содержанием G с использованием эпимераз AlgE Azotobacter vinelandii подробно описана в работах Ertesvag et al {supra) и Strugala et al (Gums and Stabilisers for the Food Industry, 2004, 12, The Royal Society of Chemistry, 84-94).
Для получения альгинатов или альгинатных олигомеров, содержащих G-блоки, предпочтительна эпимеризация с использованием одной или более из эпимераз AlgE Azotobacter vinelandii, кроме AlgE4, поскольку эти ферменты могут продуцировать структуры G-блоков. С другой стороны, эпимеразу AlgE4 можно применять для получения альгинатов или альгинатных олигомеров с чередующимися последовательностями M/G или первичной структурой, содержащей одиночные остатки G, поскольку обнаружено, что этот фермент, по-видимому, преимущественно выполняет эпимеризацию отдельных остатков М с получением одиночных остатков G, соединенных с остатками М, а не G-блоков. Конкретные первичные структуры можно получить, используя различные комбинации этих ферментов.
В конкретных случаях также рассматривается применение мутированных вариантов этих ферментов или их гомологов из других организмов. В заявке WO 94/09124 описаны рекомбинантные или модифицированные маннуронан-С-5-эпимеразы (ферменты AlgE), например, кодируемые последовательностями эпимераз, причем последовательности ДНК, кодирующие различные домены или модули эпимераз, были перекомбинированы, делетированы или рекомбинированы. В качестве альтернативы, можно применять мутанты природных ферментов-эпимераз (AlgG или AlgE), полученные, например, посредством сайт-специфического или случайного мутагенеза генов AlgG или AlgE.
Другой подход заключается в создании организмов Pseudomonas и Azotobacter, мутированных по некоторым или всем генам эпимераз таким образом, что указанные мутанты продуцируют альгинаты нужной структуры для последующей продукции альгинатного олигомера, или даже альгинатные олигомеры нужной структуры и размера (или молекулярной массы). Получение ряда организмов Pseudomonas fluoresceins с мутированными генами AlgG подробно описано в WO 2004/011628 и Gimmestad, М., et at, 2003 {supra). Получение ряда организмов Azotobacter vinelandii с мутированными генами AlgE описано в Gimmestad, М., et al, 2006 (supra).
Дополнительный подход заключается в удалении или инактивации генов эндогенных эпимераз из организма Azotobacter или Pseudomonas и последующем внедрении одного или более из генов экзогенных эпимераз, которые могут быть мутированы или не мутированы (т.е. могут быть дикого типа или модифицированными), экспрессию которых можно контролировать, например, за счет использования индуцибельных или других «управляемых промоторов». За счет выбора соответствующих комбинаций генов можно продуцировать альгинаты с заранее определенной первичной структурой.
Дополнительный подход может представлять собой внедрение некоторых или всех механизмов биосинтеза альгината Pseudomonas и/или Azotobacter в организм, не продуцирующий альгинат (например, Е. coli), и индукцию продукции альгината указанными генетически модифицированными организмами.
При использовании таких систем на основе культур на первичную структуру продуцируемого альгината или альгинатного олигомера могут влиять условия культивирования. Специалист может отрегулировать параметры культивирования, например, температуру, осмолярность, уровень питательных/исходных веществ и параметры атмосферы с целью манипуляции первичной структурой альгинатов, продуцируемых конкретным организмом.
Упоминания "G/остатков G" и "М/остатков М" или гулуроновой кислоты или маннуроновой кислоты или гулуроната или маннуроната следует на равных основаниях считать упоминаниями гулуроновой кислоты/гулуроната и маннуроновой кислоты/маннуроната (конкретно, α-L-гулуроновой кислоты/гулуроната и β-D-маннуроновой кислоты/маннуроната), и, кроме того, включают их производные, в которых одна или более из доступных боковых цепей или групп модифицирована, что не приводит к способности расширять спектр терапевтически используемой активности бацитрацина против видов бактерий, включая грамотрицательные бактерии, которая существенно ниже такой способности немодифицированного олигомера. Распространенные группы для модификации сахаридов могут включать ацетильную, сульфатную, аминогруппу, дезоксигруппу, спиртовую, альдегидную, кетоновую, сложноэфирную и ангидрогруппу. Альгинатные олигомеры можно химически модифицировать, включая модификацию путем добавления заряженных групп (например, карбоксилированных или карбоксиметилированных гликанов), а также модификацию с целью влияния на гибкость (например, путем окисления периодатом). Специалисту могут быть известны дальнейшие химические модификации, которые можно внести в моносахаридные субъединицы олигосахаридов и применить к альгинатным олигомерам, применяемым в настоящем изобретении.
Прямая ковалентная связь между альгинатным олигомером и антибиотиком класса бацитрацинов представляет собой ковалентную связь, образованную атомом альгинатного олигомера и атомом антибиотика класса бацитрацинов. Атомы, участвующие в образовании связи, могут совместно или независимо представлять собой атомы углерода, кислорода, серы, азота и/или фосфора. Связь может быть одинарной, двойной или тройной. В некоторых вариантах реализации указанная связь входит в состав органической функциональной группы. Специалист в полной мере знаком с доступными вариантами подходящих органических функциональных групп, которые могут действовать как линкеры между альгинатным олигомером и антибиотиками класса бацитрацинов. Их неограничивающие примеры могут включать сложноэфирную, карбонатно-сложноэфирную, ортоэфирную, кетоновую, кетальную, гемикетальную, кетеновую, эфирную, ацетальдегидную, гемиацетальдегидную группы, пероксигруппу, метиленпероксигруппу, карбаматную, аминную, амидную, амидоксидную группы, гидроксамовую кислоту, иминную, имидную, имидатную, азидную группы, азогруппу, оксимную, карбодиимидную, карбазоновую, гидрозоновую, сульфидную, дисульфидную, сульфинильную, сульфонильную, карбонотиоильную, тиоамидную, сложнотиоэфирную, тиоэфирную, тиокетоновую, тиокетальную, сульфонатно-эфирную, дитиокарбаматную, семикарбазоновую, фосфиновую или фосфодиэфирную функциональные группы. Как показано в разделе «Примеры», образование амидной и сложноэфирной связей может быть удобным и выгодным подходом.
Ковалентный молекулярный линкер может представлять собой любую молекулу, обычно органическую молекулу или ее часть, обладающую структурой, образованной ковалентно связанными атомами, способной ковалентно связываться с альгинатным олигомером и антибиотиком класса бацитрацинов. В составе конъюгата за счет молекулярного линкера может присутствовать непрерывная серия ковалентно связанных атомов от альгинатного олигомера до антибиотика класса бацитрацинов. В предпочтительных вариантах реализации по меньшей мере одна из ковалентных связей в указанной серии соответствует определению, приведенному выше. В то же время молекулярный линкер может также содержать в составе молекулы нековалентные, например, ионные связи, которые не вносят вклада в ковалентную связь между антибиотиком класса бацитрацинов и альгинатным олигомером.
Ковалентный молекулярный линкер может быть линейным, циклическим или разветвленным. В некоторых вариантах реализации молекулярный линкер может обладать молекулярной массой, равной или меньшей 1500 дальтон, например, равной или меньшей 1250, 1000, 900, 800, 700, 600, 500, 400, 300, 200 или 100 дальтон.
В некоторых вариантах реализации по меньшей мере одна прямая ковалентная связь между альгинатным олигомером и ковалентным молекулярным линкером соответствует определению, приведенному выше. В некоторых вариантах реализации по меньшей мере одна прямая ковалентная связь между антибиотиком класса бацитрацинов и ковалентным молекулярным линкером соответствует определению, приведенному выше. Все связи могут быть одинаковыми или различающимися. Молекула ковалентного линкера может содержать по меньшей мере одну ковалентную связь в соответствии с определением, приведенным выше, предпочтительно в составе молекулы, участвующей в образовании непрерывной серии ковалентно связанных атомов от альгинатного олигомера до антибиотика класса бацитрацинов за счет молекулярного линкера.
Ковалентный молекулярный линкер может представлять собой или содержать аминокислоту или пептид, например, содержащий 15 аминокислотных остатков или менее, например, содержащий 12, 10, 8, 6, 5, 4, 3 или 2 аминокислотных остатка или менее. Аминокислота может представлять собой, а пептид может содержать любые аминокислоты, описанные выше. Конкретные примеры пептидных линкеров, которые можно использовать, включают пептиды из остатков Gly и/или Ser (например, (Gly)2-8, (Ser)2-8, (GGGGS)1-3); (EAAAK)1-3; A(EAAAK)1-3A; Leu-Glu; (Xaa-Pro)1-6 (например, (Glu-Pro)1-6, (Lys-Pro)1-6, (Ala-Pro)1-6; VSQTSKLTR↓AETVFPDV (чувствителен к расщеплению фактором XIa/фактором VIIa); PLG↓XWA (чувствителен к расщеплению металлопротеазой-1 матрикса); RVL↓AEA (чувствителен к расщеплению протеазой ВИЧ-1; EDVVCC↓SMSY (чувствителен к расщеплению протеазой NS3; GGIEGR↓GS (чувствителен к расщеплению фактором Ха); TRHRQPR↓GWE (чувствителен к расщеплению фурином); AGNRVRR↓SVG (чувствителен к расщеплению фурином); GFLG↓, (чувствителен к расщеплению катепсином В), но не ограничиваются ими.
Ковалентный молекулярный линкер может представлять собой или содержать моносахарид или олигосахарид, не являющийся гулуронатом или маннуронатом или полимером, образованным из них, например, сахарид, содержащий 12 аминокислотных остатков или менее, например, содержащий 10, 8, 6, 5, 4, 3 или 2 аминокислотных остатка или менее. Таким образом, ковалентный молекулярный линкер может представлять собой моносахарид, дисахарид или трисахарид или производные углеводов, например, альдоновые и уроновые кислоты, дезокси- или аминосахара, сульфатированные сахара и сахароспирты. Моносахарид или один или более из моносахаридных остатков дисахарида или трисахарида может представлять собой триозу, тетрозу, пентозу, гексозу, гептозу, октозу, нонозу или декозу в пиранозной или фуранозной форме и/или, в соответствующих случаях, L- или D-форме, и/или производные этих углеводов. Предпочтительными являются пентозные или гексозные сахариды/остатки, например, маннозы (например, D-маннозы), галактозы (например, D-галактозы), глюкозы (например, D-глюкозы), фруктозы, фукозы (например, L-фукозы), N-ацетилглюкозамина, N-ацетилгалактозамина, рамнозы, галактоз амина, глюкозамина (например, D-глюкозамина), галактуроновой кислоты, глюкуроновой кислоты, N-ацетилнейраминовой кислоты, метил-D-маннопиранозида (маннозида), α-метилглюкозида, галактозида, рибозы, ксилозы, арабиноза, сахарата, маннита, сорбита, инозита, глицерина и производные этих мономеров. Примерами дисахарида могут быть акарвиозин, аллолактоза, целлобиоза, хитобиоза, галактозо-альфа-1,3-галактоза, дентиобиоза, изомальт, изомальтоза, изомальтулоза, койибиоза, лактит, лактобионовая кислота, лактоза, лакулоза, ламинарибиоза, мальтит, мальтоза, маннобиоза, мелибиоза, мелибиулоза, неогесперидоза, нигероза, робиноза, рутиноза, самбубиоза, софороза, сукральфат, сукралоза, сахароза, ацетат-изобутират сахарозы, октаацетат сахарозы, трегалоза, тураноза, ксилобиоза или производные этих дисахаридов.
Ковалентный молекулярный линкер может представлять собой или содержать нуклетид или олигонуклеотид, т.е. нуклеиновую кислоту, например, рибонуклеотид или дезоксирибонуклеотид.
Линкер также может представлять собой или содержать линейную, разветвленную или циклическую, замещенную или незамещенную алкильную, алкенильную или алкинильную группу (обычно С2-8) или ее производное, например, аминогексановую кислоту или один из ряда доступных для приобретения ПЭГ (полиэтиленгликолевых) линкеров.
Дополнительные примеры подходящих молекул ковалентных линкеров включают ацетильную, сукцинильную, аконитильную (цис- или транс-), глутарильную, метилсукцинильную группы, триметил цисте амин, пеницилламин, N-(2-меркаптопропионил)глицин, 2-меркаптопропионовую кислоту, гомоцистеин, 3-меркаптопропионовую кислоту и дезаминпеницилламиновые группы, но не ограничиваются ими.
В некоторых вариантах реализации молекула ковалентного линкера может представлять собой множество молекул и/или групп, описанных выше.
В некоторых вариантах реализации прямую ковалентную связь или молекулу ковалентного линкера (конкретнее, ковалентную связь в молекуле линкера, ковалентную связь между молекулой линкера и альгинатным олигомером и/или ковалентную связь между молекулой линкера и антибиотиком класса бацитрацинов) выбирают по ее способности лизироваться в условиях, типичных или, предпочтительно, по существу уникальных для области или местоположения-мишени в организме субъекта, например, условиях, типичных для бактериальной инфекции, дыхательных путей (особенно нижних дыхательных путей, включая легкие, конкретнее - легких пациента с муковисцидозом) или ран (в частности, хронических ран). При этом доставка антибиотика класса бацитрацинов может осуществляться более селективно по отношению к области-мишени.
В конкретных вариантах реализации можно выбрать ковалентную связь, функциональную группу, содержащую указанную ковалентную связь, или молекулу линкера, чувствительную к (неустойчивую при, разрушающуюся при, лизируемую при) рН ниже нормального физиологического значения рН (рН 7,2), т.е. кислом рН, например, рН от приблизительно 3 до приблизительно 7, 6,5, 6, 5,5, 5, 4,5, 4 или 3,5. Области или местоположения воспаления, в особенности воспаления, вызванного инфекцией, обычно характеризуются рН в указанных диапазонах. Функциональные группы, включающие сложные эфиры, цис-аконитильную группу, дисульфиды и гидразоны, могут быть чувствительны к пониженным значениям рН, т.е. их можно назвать кислото-неустойчивыми.
В конкретных вариантах реализации можно выбрать ковалентную связь, функциональную группу или молекулу линкера, чувствительную к активным формам кислорода. Области или местоположения воспаления, в особенности воспаления, вызванного инфекцией, обычно характеризуются высоким уровнем активным форм кислорода. Функциональные группы, включая тиокетали и тиоэфиры, могут быть чувствительны к активным формам кислорода
В дополнительных конкретных вариантах реализации можно выбрать ковалентную связь, функциональную группу или молекулу линкера, лизируемую ферментами, продуцируемыми или секретируемыми только в области-мишени, или сверхпродуцируемыми или сверхсекретируемыми в области-мишени. Сюда могут входить такие ферменты, как гликозидазы, нуклеазы и пептидазы, в частности, секретируемые бактериями, вызывающими инфекцию, и секретируемые воспалительными клетками хозяина, например, лизоцим, альгинатлиаза, ДНКаза I, эндонуклеазы рестрикции, эластаза нейтрофилов, катепсины, фосфолипазы и β-лактамазы. В то же время может быть выгодным выбор ковалентной связи, функциональной группы или молекулы линкера, нелизируемой ферментами, способными разрушать альгинатный олигомер или антибиотик класса бацитрацинов, и такое отделение альгинатного олигомера от антибиотика класса бацитрацинов произойдет отдельно от разрушения альгинатного олигомера или антибиотика класса бацитрацинов.
В других вариантах реализации можно выбрать прямую ковалентную связь или молекулу ковалентного линкера на основе их стабильности при типичных условиях или, предпочтительно, по существу уникальных условиях в области или местоположении-мишени в организме субъекта, например, в местоположении, описанном выше, или в местоположениях и областях, в которых может оказаться конъюгат на пути к этим местоположениям и областям после введения и/или во время распределения в организме. В данном случае подходящими могут быть, например, амидная связь, тиоэфирная связь или пептидный линкер Gly-Gly.
В предпочтительных вариантах реализации конъюгат бацитрацин-альгинатный олигомер состоит из по меньшей мере одного альгинатного олигомера, ковалентно связанного с антибиотиком класса бацитрацинов амидной связью, образованной карбоксильной группой альгината и аминогруппой молекулы бацитрацина. Антибиотик класса бацитрацинов предпочтительно выбран из бацитрацина А1, А2, B1, В2, В3, С, D1, D2, D3 и Е и, более предпочтительно, из бацитрацина А (А1 и/или А2) и бацитрацина В (В1 и/или В2). Альгинатный олигомер предпочтительно содержит от 2 до 100 мономерных остатков. Альгинатный олигомер также может содержать по меньшей мере 70% остатков G.
В предпочтительных вариантах реализации конъюгат бацитрацин-альгинатный олигомер состоит из по меньшей мере одного альгинатного олигомера, ковалентно связанного с антибиотиком класса бацитрацинов сложноэфирной связью, образованной карбоксильной группой альгината и гидроксильной группой молекулы бацитрацина. Антибиотик класса бацитрацинов предпочтительно выбран из бацитрацина А1, А2, B1, В2, В3, С, D1, D2, D3 и Е и, более предпочтительно, из бацитрацина А (А1 и/или А2) и бацитрацина В (В1 и/или В2). Альгинатный олигомер предпочтительно содержит от 2 до 100 мономерных остатков. Альгинатный олигомер также может содержать по меньшей мере 70% остатков G.
Рассматриваются поливалентные структуры, в которых более одного альгинатного олигомера ковалентно присоединены к антибиотику класса бацитрацинов. Альгинатные олигомеры могут быть одинаковыми и различными и могут присоединяться к антибиотику класса бацитрацинов ковалентной связью или ковалентным молекулярным линкером одного типа. В других структурах альгинатный олигомер может быть ковалентно присоединен к множеству молекул бацитрацина способом, описанным в настоящем документе. Молекулы бацитрацина могут быть одинаковыми или различными и могут быть ковалентно присоединены или не присоединены к другим альгинатным олигомерам.
Упоминание конъюгатов бацитрацин-альгинатный олигомер согласно настоящему изобретению распространяется на их фармацевтически приемлемые соли, сольваты или гидраты, диастереоизомеры, таутомеры, энантиомеры и активные метаболиты. Подходящие соли включают соли присоединения неорганических кислот, например, соляной, серной, фосфорной, азотной, угольной, борной, сульфаминовой и бромистоводородной кислот, или соли фармацевтически приемлемых органических кислот, например, уксусной, пропионовой, масляной, винной, малеиновой, гидроксималеиновой, фумаровой, лимонной, молочной, муциновой, глюконовой, бензойной, янтарной, щавелевой, фенилуксусной, метансульфоновой, толуолсульфоновой, бензолсульфоновой, салициловой, сульфаниловой, аспарагиновой, глутаминовой, этилендиаминтетрауксусной, стеариновой, пальмитиновой, олеиновой, лауриновой, пантотеновой, дубильной, аскорбиновой, фендизойной кислот, 4-4'-метиленбис-3-гидрокси-2-нафтойной кислоты, о-(р-гидроксибензоил)бензойной кислоты, 4-4'-дигидрокситрифенилметан-2-карбоновой кислоты и валериановой кислоты. Соли оснований включают соли, образованные фармацевтически приемлемыми катионами, например, натрия, калия, лития, кальция, магния, аммония и алкиламмония, но не ограничиваются ими.
В дополнительном аспекте настоящего изобретения предложен способ получения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению, включающий
(ia) обеспечение альгинатного олигомера и антибиотика класса бацитрацинов и образование прямой ковалентной связи между двумя их молекулярными группами; или
(ib) обеспечение альгинатного олигомера, антибиотика класса бацитрацинов и ковалентного молекулярного линкера, образование прямой ковалентной связи между двумя молекулярными группами альгинатного олигомера и молекулы линкера и образование прямой ковалентной связи между двумя молекулярными группами антибиотика класса бацитрацинов и молекулы линкера; или
(ic) обеспечение альгинатного олигомера и антибиотика класса бацитрацинов, причем один или оба из них несут молекулу ковалентного молекулярного линкера, ковалентно присоединенную к ним, и ковалентное присоединение альгинатного олигомера к антибиотику класса бацитрацинов по меньшей мере одной молекулой линкера; и, необязательно
(ii) по меньшей мере частичное отделение конъюгата бацитрацин-альгинатный олигомер от реакционной смеси.
В некоторых вариантах реализации настоящего изобретения предложен способ получения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению, включающий
(i) обеспечение водного раствора альгинатного олигомера, содержащего доступную карбоксильную группу;
(ii) приведение указанного раствора альгината в контакт с гидрохлоридом 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC) в количестве и в условиях, достаточных для активации по меньшей мере одной карбоксильной группы альгинатного олигомера;
(iii) необязательное приведение указанного альгинатного олигомера с активированными карбоксильными группами в контакт с сульфо-N-гидроксисукцинимидом (сульфо-NHS) в количестве и в условиях, достаточных для образования сложного эфира сульфо-NHS, способного реагировать с аминогруппами;
(iv) приведение указанного альгинатного олигомера с активированными карбоксильными группами с этапа (ii) или сложного эфира сульфо-NHS с этапа (iii), способного реагировать с аминогруппами, в контакт с антибиотиком класса бацитрацинов, содержащим доступную первичную аминогруппу, в количестве и в условиях, достаточных для образования амидной связи между альгинатным олигомером и антибиотиком класса бацитрацинов;и
(v) по меньшей мере частичное отделение конъюгата бацитрацин-альгинатный олигомер от реакционной смеси.
В некоторых вариантах реализации настоящего изобретения предложен способ получения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению, включающий
(i) обеспечение раствора альгинатного олигомера, содержащего доступную карбоксильную группу, предпочтительно органического раствора (например, в ДМ ФА и/или ДМСО);
(ii) приведение указанного раствора альгината в контакт с дициклогексилкарбодиимидом (DCC) в количестве и в условиях, достаточных для образования интермедиата, содержащего группу О-ацилизо мо чевины;
(iii) приведение указанного интермедиата, содержащего группу О-ацилизомочевины, в контакт с антибиотиком класса бацитрацинов, содержащим доступную гидроксильную группу, и 4-N,N-диметиламинопиридином (DMAP) в количествах и в условиях, достаточных для образования сложноэфирной связи между альгинатным олигомером и антибиотиком класса бацитрацинов; и
(iv) по меньшей мере частичное отделение конъюгата бацитрацин-альгинатный олигомер от реакционной смеси;
причем этапы (ii) и (iii) можно выполнять одновременно.
Как упоминалось выше и указано в разделе «Примеры», конъюгаты бацитрацин-альгинатный олигомер представляют собой класс новых химических структур, обладающих терапевтически применимой антибактериальной эффективностью против как грамположительных, так и грамотрицательных бактерий, т.е. спектром более широкой терапевтически применимой активности по сравнению с неконъюгированными антибиотиками класса бацитрацинов. Это дает возможность эффективного лечения бактериальных инфекций (в том числе инфекций, вызванных грамотрицательными бактериями).
Таким образом, в дополнительном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая конъюгат бацитрацин-альгинатный олигомер согласно определению в настоящем документе и фармацевтически приемлемое вспомогательное вещество, носитель или разбавитель. Описаны подходящие вспомогательные вещества, носители или разбавители, и ниже подробно описаны конкретные фармацевтические композиции.
Кроме того, настоящее изобретение относится к применению конъюгатов бацитрацин-альгинатный олигомер, описанных в настоящем документе, и фармацевтических композиций, содержащих их, при борьбе с бактериальной инфекцией, в частности, инфекцией, вызванной грамотрицательными бактериями. Термин «борьба» в настоящем документе включает как терапию, так и профилактику (например, в лечении или профилактике бактериальной инфекции).
Так, в данном аспекте настоящего изобретения предложены конъюгаты бацитрацин-альгинатный олигомер согласно настоящему изобретению, описанные в настоящем документе, и фармацевтические композиции, содержащие их, для применения при терапии или профилактике бактериальной инфекции, предпочтительно инфекции, вызванной грамотрицательными бактериями.
Конкретно, в дополнительном аспекте настоящего изобретения предложен способ лечения или профилактики бактериальной инфекции, предпочтительно бактериальной инфекции, вызванной грамотрицательными бактериями, у субъекта с бактериальной инфекцией, подозрением на нее или риском ее развития, причем указанный способ включает введение указанному субъекту эффективного количества конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению, описанного в настоящем документе.
В настоящем изобретении предложен конъюгат бацитрацин-альгинатный олигомер согласно настоящему изобретению, описанный в настоящем документе, для применения в лечении или профилактике бактериальной инфекции, предпочтительно бактериальной инфекции, вызванной грамотрицательными бактериями, у субъекта с бактериальной инфекцией, подозрением на нее или риском ее развития.
"Эффективное", конкретнее "фармацевтически эффективное» количество конъюгата бацитрацин-альгинатный олигомер представляет собой количество конъюгата, обеспечивающее измеримое лечение или профилактику целевой бактериальной инфекции, например, бактериальной инфекции, вызванной грамотрицательными бактериями.
В вышеописанных вариантах реализации основной достигаемый физиологический результат представляет собой контакт области инфекции (в частности, бактерий, присутствующих в области или местоположении инфекции, что может включать множественные области или местоположения инфекции в организме, включая также системную инфекцию) и/или области (например, поверхности), на которой может присутствовать инфекция (или подвергающейся риску ее возникновения) конъюгата бацитрацин-альгинатный олигомер.
Иначе говоря, согласно настоящему изобретению предложено применение конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению, описанного в настоящем документе, для производства медикамента для применения в лечении или профилактике бактериальной инфекции, предпочтительно бактериальной инфекции, вызванной грамотрицательными бактериями, у субъекта с бактериальной инфекцией, подозрением на нее или риском ее развития.
Термин «бактериальная инфекция» (или «инфицированный» и т.п.) используется в настоящем документе в широком смысле и означает, что организм субъекта может включать или содержать или нести рассматриваемые бактерии, т.е. что бактерии могут просто присутствовать в организме или на организме субъекта, причем этот термин может включать любую область или местоположение в организме или на организме субъекта. Инфекция у субъекта необязательно является проявлением клинического заболевания (т.е. приводит к развитию клинических симптомов у субъекта), хотя такой вариант, разумеется, рассматривается. Субъект с подозрением на инфекцию или субъект, подвергающийся риску инфекции, может представлять собой субъекта, подвергающегося воздействию бактерии или инфицированного субъекта, или субъекта с клиническими признаками или симптомами инфекции (в случае подозрения на инфекцию), или субъекта, восприимчивого к инфекции, в общем случае (например, в результате клинического состояния субъекта) или к конкретной рассматриваемой бактерии.
Кроме того, в соответствии с некоторыми аспектами настоящего изобретения, возможно наличие предшествующего этапа идентификации субъекта как субъекта с бактериальной инфекцией, подозрением на нее или риском ее возникновения, или этапа диагностики субъекта как субъекта с бактериальной инфекцией, подозрением на нее или риском ее возникновения. В частности, бактериальная инфекция может относиться к инфекциям, заведомо не поддающихся лечению или к инфекциям, которые сложно лечить в обычной клинической практике с использованием антибиотика класса бацитрацинов. В одном варианте реализации выявляют бактерии, не реагирующие или предположительно не реагирующие на (т.е. чувствительные к) антибиотику класса бацитрацинов, по меньшей мере в терапевтических дозах. В некоторых вариантах реализации можно определить устойчивость указанной инфекции (или, конкретнее, бактерии при инфекции) к антибиотику класса бацитрацинов.
В качестве альтернативы или дополнения к вышеописанному предшествующему этапу, в соответствии с настоящим изобретением, может иметь место следующий этап, во время которого выполняют оценку и, предпочтительно, сравнение клинических показателей у субъекта с бактериальной инфекцией с соответствующей оценкой, выполненной до или ранее указанного лечения, с целью определения каких-либо изменений указанных показателей.
Диагностика и мониторинг бактериальных инфекций на основе легко наблюдаемых физиологических показателях является повседневной задачей для клиницистов. Для дальнейшего подтверждения диагноза и получения дополнительной информации о возбудителях, например, таксономической информации, возможных показателях вирулентности и их чувствительности к антибиотикам можно также использовать молекулярно-биологические и микробиологические способы.
Настоящее изобретение охватывает применение конъюгата бацитрацин-альгинатный олигомер или смеси (множества/совокупности; двух или более) различных конъюгатов полимиксин-альгинатный олигомер. Такие смеси могут содержать конъюгаты, содержащие различные антибиотики класса бацитрацинов и одинаковые альгинатные олигомеры. Такие смеси могут содержать конъюгаты, содержащие одинаковые антибиотики класса бацитрацинов и различные альгинатные олигомеры. Такие смеси могут содержать конъюгаты, содержащие различные антибиотики класса бацитрацинов и различные альгинатные олигомеры..
Бактериальная инфекция, являющаяся мишенью согласно настоящему изобретению, может содержать бактерии любого рода или вида бактерий. Примеры родов или видов бактерий включают Abiotrophia, Achromobacter, Acidaminococcus, Acidovorax, Acinetobacter, Actinobacillus, Actinobaculum, Actinomadura, Actinomyces, Aerococcus, Aeromonas, Aflpia, Agrobacterium, Alcaligenes, Alloiococcus, Alteromonas, Amycolata, Amycolatopsis, Anaerobospirillum, Anaerorhabdus, Arachnia, Arcanobacterium, Arcobacter, Arthrobacter, Atopobium, Aureobacterium, Bacteroides, Balneatrix, Bartonella, Bergeyella, Bifidobacterium, Bilophila Branhamella, Borrelia, Bordetella, Brachyspira, Brevibacillus, Brevibacterium, Brevundimonas, Brucella, Burkholderia, Buttiauxella, Butyrivibrio, Calymmatobacterium, Campylobacter, Capnocytophaga, Cardiobacterium, Catonella, Cedecea, Cellulomonas, Centipeda, Chlamydia, Chlamydophila, Chromobacterium, Chyseobacterium, Chryseomonas, Citrobacter, Clostridium, Collinsella, Comamonas, Corynebacterium, Coxiella, Cryptobacterium, Delftia, Dermabacter, Dermatophilus, Desulfomonas, Desulfovibrio, Dialister, Dichelobacter, Dolosicoccus, Dolosigranulum, Edwardsiella, Eggerthella, Ehrlichia, Eikenella, Empedobacter, Enterobacter, Enterococcus, Erwinia, Erysipelothrix, Escherichia, Eubacterium, Ewingella, Exiguobacterium, Facklamia, Filifactor, Flavimonas, Flavobacterium, Francisella, Fusobacterium, Gardnerella, Globicatella, Gemella, Gordona, Haemophilus, Hafnia, Helicobacter, Helococcus, Holdemania, Ignavigranum, Johnsonella, Kingella, Klebsiella, Kocuria, Koserella, Kurthia, Kytococcus, Lactobacillus, Lactococcus, Lautropia, Leclercia, Legionella, Leminorella, Leptospira, Leptotrichia, Leuconostoc, Listeria, Listonella, Megasphaera, Methylobacterium, Microbacterium, Micrococcus, Mitsuokella, Mobiluncus, Moellerella, Moraxella, Morganella, Mycobacterium, Mycoplasma, Myroides, Neisseria, Nocardia, Nocardiopsis, Ochrobactrum, Oeskovia, Oligella, Orientia, Paenibacillus, Pantoea, Parachlamydia, Pasteurella, Pediococcus, Peptococcus, Peptostreptococcus, Photobacterium, Photorhabdus, Plesiomonas, Porphyrimonas, Prevotella, Propionibacterium, Proteus, Providencia, Pseudomonas, Pseudonocardia, Pseudoramibacter, Psychrobacter, Rahnella, Ralstonia, Rhodococcus, Rickettsia Rochalimaea Roseomonas, Rot hi a, Ruminococcus, Salmonella, Selenomonas, Serpulina, Serratia, Shewenella, Shigella, Simkania, Slackia, Sphingobacterium, Sphingomonas, Spirillum, Staphylococcus, Stenotrophomonas, Stomatococcus, Streptobacillus, Streptococcus, Streptomyces, Succinivibrio, Sutterella, Suttonella, Tatumella, Tissierella, Trabulsiella, Treponema, Tropheryma, Tsakamurella, Turicella, Ureaplasma, Vagococcus, Veillonella, Vibrio, Weeksella, Wolinella, Xanthomonas, Xenorhabdus, Yersinia и Yokenella; например, грамположительные бактерии, в том числе Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus equi, Streptococcus pyogenes, Streptococcus agalactiae, Listeria monocytogenes, Listeria ivanovii, Bacillus anthracis, B. subtilis, Nocardia asteroides, Actinomyces israelii, Propionibacterium acnes, Clostridium tetani, Clostridium perfringens, Clostridium botulinum и Enterococcus species, грамотрицательные бактерии, в том числе Pseudomonas aeruginosa, Vibrio cholerae, Actinobacillus pleuropneumoniae, Pasteurella haemolytica, Pasteurella multocida, Legionella pneumophila, Salmonella typhi, Brucella abortus, Coxiella burnetii, Escherichia coli, Neiserria meningitidis, Neiserria gonorrhea, Haemophilus influenzae, Haemophilus ducreyi, Yersinia pestis, Yersinia enterolitica, Escherichia hirae, Burkholderia cepacia, Burkholderia mallei, Burkholderia pseudomallei, Francisella tularensis, Bacteroides fragilis, Fusobascterium nucleatum, Cowdria ruminantium, Moraxella catarrhalis, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter cloacae, Serratia marcescens, Helicobacter pylori, Salmonella enteritidis, Salmonella typhi and Acinetobacter baumannii, Acinetobacter Iwofli, Providencia stuartii, Providencia rettgeri, Providencia alcalifaciens и Klebsiella oxytoca, и бактерии, не окрашивающиеся по Граму, в том числе Chlamydia trachomatis, Chlamydia psittaci и микобактерии, например, М. tuberculosis, М. bovis, M. typhi murium, М. bovis strain BCG, BCG substrains, M. avium, M. intracellulare, M. africanum, M. kansasii, M. marinum, M. ulcerans, M. avium subspecies paratuberculosis, но не ограничиваются ими.
Бактериальная инфекция, являющаяся мишенью согласно настоящему изобретению, предпочтительно содержит бактерии следующих родов: Achromobacter, Acinetobacter, Actinobacillus, Aeromonas, Agrobacterium, Alcaligenes, Alteromonas, Bacteroides, Bartonella, Borrelia, Bordetella, Brucella, Burkholderia, Campylobacter, Cardiobacterium, Chlamydia, Chlamydophila, Chromobacterium, Chyseobacterium, Chryseomonas, Citrobacter, Clostridium, Comamonas, Corynebacterium, Coxiella, Cryptobacterium, Edwardsiella, Eikenella, Enterobacter, Enterococcus, Erwinia, Kingella, Klebsiella, Lactobacillus, Lactococcus, Legionella, Leptospira, Leptotrichia, Leuconostoc, Listeria, Listonella, Mobiluncus, Moraxella, Morganella, Mycobacterium, Mycoplasma, Neisseria, Nocardia, Nocardiopsis, Pantoea, Parachlamydia, Pasteurella, Peptococcus, Peptostreptococcus, Prevotella, Propionibacterium, Proteus, Providencia, Pseudomonas, Ralstonia, Rickettsia, Salmonella, Shewenella, Shigella, Sphingobacterium, Sphingomonas, Staphylococcus, Stenotrophomonas, Streptobacillus, Streptococcus, Streptomyces, Treponem и Yersinia
Таким образом, настоящее изобретение можно применять против грамположительных или грамотрицательных бактерий, или даже грам-неопределенных бактерий, однако применение против грамотрицательных бактерий, например, указанных выше, является предпочтительным.. Эти бактерии могут включать бактерии родов или видов Achromobacter, Acidaminococcus, Acidovorax, Acinetobacter, Actinobacillus, Aeromonas, Afipia, Agrobacterium, Alcaligenes, Alteromonas, Anaerobospirillum, Anaerorhabdus, Arcobacter, Bacteroides, Balneatrix, Bartonella, Bergeyella, Bilophila, Branhamella, Borrelia, Bordetella, Brachyspira, Brevibacillus, Brevundimonas, Brucella, Burkholderia, Buttiauxella, Calymmatobacterium, Campylobacter, Capnocytophaga, Cardiobacterium, Catonella, Cedecea, Centipeda, Chlamydia, Chlamydophila, Chromobacterium, Chyseobacterium, Chryseomonas, Citrobacter, Comamonas, Coxiella, Delftia, Desulfomonas, Desulfovibrio, Dialister, Dichelobacter, Edwardsiella, Ehrlichia, Eikenella, Empedobacter, Enterobacter, Erwinia, Escherichia, Ewingella, Flavimonas, Flavobacterium, Francisella, Fusobacterium, Gardnerella, Haemophilus, Hafnia, Helicobacter, Johnsonella, Kingella, Klebsiella, Koserella, Lautropia, Leclercia, Legionella, Leminorella, Leptospira, Leptotrichia, Listonella, Megasphaera, Methylobacterium, Mitsuokella, Moellerella, Moraxella, Morganella, Mycoplasma, Myroides, Neisseria, Ochrobactrum, Oligella, Orientia, Pantoea, Parachlamydia, Pasteurella, Photobacterium, Photorhabdus, Plesiomonas, Porphyrimonas, Prevotella, Proteus, Providencia, Pseudomonas, Psychrobacter, Rahnella, Ralstonia, Rickettsia, Rochalimaea, Roseomonas, Salmonella, Selenomonas, Serpulina, Serratia, Shewenella, Shigella, Simkania, Sphingobacterium, Sphingomonas, Spirillum, Stenotrophomonas, Streptobacillus, Succinivibrio, Sutterella, Suttonella, Tatumella, Tissierella, Trabulsiella, Treponema, Ureaplasma, Veillonella, Vibrio, Weeksella, Wolinella, Xanthomonas, Xenorhabdus, Yersinia и Yokenella; например, Pseudomonas aeruginosa, Vibrio cholerae, Actinobacillus pleuropneumoniae, Pasteurella haemolytica, Pasteurella multocida, Legionella pneumophila, Salmonella typhi, Brucella abortus, Coxiella burnetti, Escherichia coli, Neiserria meningitidis, Neiserria gonorrhea, Haemophilus influenzae, Haemophilus ducreyi, Yersinia pestis, Yersinia enterolitica, Escherichia hirae, Burkholderia cepacia, Burkholderia mallei, Burkholderia pseudomallei, Francisella tularensis, Bacteroides fragilis, Fusobascterium nucleatum, Cowdria ruminantium, Moraxella catarrhalis, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter cloacae, Serratia marcescens, Helicobacter pylori, Salmonella enteritidis, Salmonella typhi и Acinetobacter baumannii, Acinetobacter Iwqffi, Providencia stuartii, Providencia rettgeri, Providencia alcalifaciens и Klebsiella oxytoca.
Грамотрицательная бактерия, являющаяся мишенью согласно настоящему изобретению, предпочтительно выбрана из следующих родов: Achromobacter, Acinetobacter, Actinobacillus, Aeromonas, Agrobacterium, Alcaligenes, Alteromonas, Bacteroides, Bartonella, Borrelia, Bordetella, Brucella, Burkholderia, Campylobacter, Cardiobacterium, Chlamydia, Chlamydophila, Chromobacterium, Chyseobacterium, Chryseomonas, Citrobacter, Comamonas, Coxiella, Edwardsiella, Eikenella, Enterobacter, Erwinia, Kingella, Klebsiella, Legionella, Leptospira, Leptotrichia, Listonella, Moraxella, Morganella, Mycoplasma, Neisseria, Pantoea, Parachlamydia, Pasteurella, Prevotella, Proteus, Providencia, Pseudomonas, Ralstonia, Rickettsia, Salmonella, Shewenella, Shigella, Sphingobacterium, Sphingomonas, Stenotrophomonas, Streptobacillus, Treponema и Yersinia.
Среди грамотрицательных бактерий особого внимания заслуживают Enterobacteriaceae и неферментирующие грамотрицательные бактерии.
Enterobacteriaceae включают бактерии родов Alishewanella, Alterococcus, Aquamonas, Aranicola, Azotivirga, Brenneria, Budvicia, Buttiauxella, Cedecea, Citrobacter, Cronobacter, Dickeya, Edwardsiella, Enterobacter, Erwinia, Escherichia, Ewingella, Grimontella, Hafnia, Klebsiella, Kluyvera, Leclercia, Leminorella, Moellerella, Morganella, Obesumbacterium, Pantoea, Pectobacterium, Phlomobacter, Photorhabdus, Plesiomonas, Pragia, Proteus, Providencia, Rahnella, Raoultella, Salmonella, Samsonia, Serratia, Shigella, Sodalis, Tatumella, Trabulsiella, Wigglesworthia, Xenorhabdus, Yersinia, Yokenella, но не ограничиваются ими. Предпочтительные роды Enterobacteriaceae включают Escherichia, Klebsiella, Salmonella, Shigella, Yersinia и Providencia.
Неферментирующие грамотрицательные бактерии включают бактерии родов Pseudomonas, Acinetobacter, Stenotrophomonas andBurkholderia, Achromobacter, Algaligenes, Bordetella, Brevundimonas, Comamonas, Elizabethkingia (ранее называвшаяся Chryseobacterium), Methylobacterium, Moraxella, Ochrobactrum, Oligella, Psychrobacter, Ralstonia, Roseomonas, Shewanella, Sphingobacterium, например, Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia и Burkholderia spp., но не ограничиваются ими
Предпочтительно бактерии можно выбрать из родов Pseudomonas, Acinetobacter, Stenotrophomonas, Burkholderia, Escherichia, Klebsiella, Providencia, например, Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, Burkholderia spp, E.coli, Klebsiella pneumoniae и Burkholderia cepacia, Burkholderia mallei, Burkholderia pseudomallei, Acinetobacter Iwoffi, Providencia stuartii, Providencia rettgeri, Providencia alcalifaciens, Klebsiella oxytoca, Pseudomonas anguilliseptica, Pseudomonas oryzihabitans, Pseudomonas plecoglossicida и Pseudomonas luteola. Более предпочтительные бактерии можно выбрать из родов Pseudomonas, Acinetobacter, Escherichia и Klebsiella, например, Pseudomonas aeruginosa, Acinetobacter baumannii, E.coli, и Klebsiella pneumoniae.
В некоторых аспектах инфекция является нозокомиальной инфекцией, инфекцией дыхательных путей пациента, например, у пациентов, страдающих муковисцидозом, хронической обструктивной болезнью легких, застойной обструктивной болезнью дыхательных путей / застойной обструктивной пневмонией (COAD/COAP), пневмонией, эмфиземой, бронхитом или синуситом; инфекцией раны, в частности, хронической раны (в том числе ожогов), инфекцией, ассоциированной с имплантируемым медицинским устройством или протезом, например, искусственным клапаном при эндокардите или инфекцией системы для вливания или катетера или искусственного сустава или эндотрахеальной или трахеотомической трубки или при пересадке ткани. Примеры бактерий, часто вызывающих такие инфекции, включают Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, Burkholderia spp (например, В. cepacia), E.coli, Klebsiella pneumoniae, Staphylococcus aureus, метициллин-устойчивый Staphylococcus aureus (MRS A), Clostridium difficile, Mycobacterium tuberculosis, Enterococcus и вапкомицип-устойчивый Enterococcus и Providencia stuartii. Другие инфекции, имеющие значение в соответствии с настоящим изобретением, включают инфекции, вызываемые Bartonella (например, Bartonella hensela), микобактериями (например, комплексом Mycobacterium avium (MAC), М. kansasii, М. marinum, М. ulcerans, М. xenopi), Haemophilus influenzae типа b (Hib) или Legionella (например, Legionella pneumophila; легионеллез), проказу (M. leprae), гранулоцитарный анаплазмоз человека (Anaplasma phagocytophilum), бруцеллез (Brucella melitensis), менингококковую инфекцию (Neisseria meningitides) и сибирскую язву (Bacillus anthracis).
Бактерии могут характеризоваться множественной лекарственной устойчивостью, например, бактерии, устойчивые к антибиотикам по меньшей мере 3, или по меньшей мере 4, 5, 6, 7, 8, 9 или 10 классов антибиотиков, например, аминогликозидам (например, амикацину, гентамицину, канамицину, капреомицину, неомицину, нетилмицину, стрептомицину, тобрамицину); β-лактамам (например, карбацефемам (например, лоракарбефу); цефалоспоринам 1-го поколения (например, цефадроксилу, цефазолину, цефалексину); цефалоспоринам 2-го поколения (например, цефаклору, цефамандолу, цефалексину, цефотоксину, цефпрозилу, цефуроксиму); цефалоспоринам 3-го поколения (например, цефиксиму, цефдиниру, цефдиторену, цефоперазону, цефотаксиму, цефподоксиму, цефтазидиму, цефтибутену, цефтизоксиму, цефтриаксону); цефалоспоринам 4-го поколения (например, цефепиму); монобактамам (например, азтреонаму)); макролидам (например, азитромицину, кларитромицину, диритромицину, эритромицину, тролеандомицину); монобактамам (например, азтреонаму); пенициллинам (например, амоксициллину, ампициллину, карбенициллину, клоксациллину, диклоксациллину, нафциллину, оксациллину, пенициллину G, пенициллину V, пиперациллину, тикарциллину); полипептидным антибиотикам (например, бацитрацину, колистину и полимиксину В, но в некоторых вариантах реализации не к бацитрацину); хинолонам (например, ципрофлоксацину. эноксацину, гатифлоксацину, левофлоксацину, ломефлоксацину, моксифлоксацину, норфлоксацину, офлоксацину, тровафлоксацину); сульфонил амидам (например, мафениду, сульфацетамиду, сульфаметизолу, сульфасалазину, сульфизоксазолу, триметоприму, сульфаметоксазолу); тетрациклинам (например, демеклоциклину, доксициклину, миноциклину, окситетрациклину, тетрациклину); глицилциклинам (например, тигециклину); карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему, панипенему/бетамипрону, биапенему, PZ-601); и другим антибиотикам, в том числе хлорамфениколу, клиндамицину, этамбутолу; фосфомицину; изониазиду; линезолиду; метронидазолу; нитрофурантоину; пиразинамиду; квинупристину/дальфопристину; спектиномицину; фосфомицину и ванкомицину.
Восприимчивость, т.е. чувствительность (и наоборот, устойчивость и переносимость) к антибиотику можно измерить любым обычным способом, например, посредством анализа восприимчивости при разбавлении и/или дискодиффузионного анализа. Восприимчивость бактериального штамма к антибиотику предпочтительно выражают посредством минимальной ингибирующей концентрации (МИК) указанного антибиотика для указанного микроорганизма (Jorgensen et al., Manual of Clinical Microbiology, 7th ed. Washington, D.C: American Society for Microbiology, 1999; 1526-43), т.е. концентрации антибиотика, полностью ингибирующей рост указанного бактериального штамма.
Специалист должен принимать во внимание, что степень различий переносимости/восприимчивости, достаточная для установления устойчивости, может меняться в зависимости от тестируемых антибиотика и бактериального штамма и используемого анализа. Многие нормативно-правовые органы, например, Европейский комитет по тестированию чувствительности к антимикробным препаратам (EUCAST), установили так называемые "пограничные значения" для конкретных антимикробных средств и микроорганизмов, которые позволяют различать концентрации антимикробного средства, используемые для интерпретации результатов анализа восприимчивости и определения изолятов как восприимчивых, промежуточных или устойчивых к тестируемому антимикробному агенту. Специалист может использовать такую информацию для выяснения устойчивости бактериальной инфекции, подвергаемой лечению в соответствии с настоящим изобретением, к рассматриваемому антибиотику согласно этим определениям.
В некоторых вариантах реализации целевая инфекция представляет собой бактерии в биопленке. В то же время в других вариантах реализации бактерии находятся не в биопленке (например, растут в виде планктона). Иными словами, бактерии могут расти в виде биопленки или не в виде биопленки.
Под «биопленкой» подразумевают сообщество микроорганизмов, характеризующееся преобладанием фиксированных клеток, прикрепленных к подложке или границе взаимодействия или друг к другу (кроме того, может присутствовать некоторое количество подвижных клеток), встроенных в матрикс из внеклеточных полимеров (конкретнее, внеклеточных полимеров, продуцируемых ими) и характеризующихся тем, что микроорганизмы в этой колонии обладают модифицированным фенотипом в отношении скорости роста и транскрипции генов (например, по сравнению с их аналогами, находящимися «не в составе биопленки», свободно плавающими или планктонными). Фраза «в биопленке» означает, что бактерия, являющаяся мишенью способа согласно настоящему изобретению, находится внутри полимерного матрикса биопленки (полностью или частично) или связана с ним. С другой стороны, бактерии, находящиеся «не в биопленке», представляют собой организмы, находящиеся в изоляции, например, в виде планктона, или в конгломерате из множества организмов, причем указанный конгломерат является неорганизованным и/или не содержит матрикса, характерного для биопленки. В каждом случае отдельные бактерии не обладают модифицированным фенотипом, наблюдающимся у их аналогов, населяющих биопленку.
В некоторых вариантах реализации бактериальная инфекция не содержит бактерий рода Acinetobacter. В некоторых вариантах реализации бактериальная инфекция, подлежащая лечению в соответствии с настоящим изобретением, не содержит бактерий, обладающих множественной лекарственной устойчивостью.
В конкретных вариантах реализации настоящего изобретения может быть предложено средство лечения или профилактики респираторных инфекций или состояний, ассоциированных с ними (например, муковисцидоза, пневмонии, ХОБЛ, COAD, СОАР, бронхита, синусита, инфекции хронической раны (в том числе ожогов), инфекции, ассоциированной с имплантируемыми или протезными медицинскими устройствами, бактериемии, септицемии, септического шока или сепсиса.
В одном предпочтительном варианте реализации бактериальная инфекция представляет собой респираторную инфекцию у субъекта, страдающего основным респираторным расстройством или состоянием, в том числе, в частности, муковисцидозом, ХОБЛ/COAD или астмой.
Термин «лечение», используемый в связи с лечением бактериальной инфекции/медицинского состояния у субъекта в соответствии с настоящим изобретением, используется в настоящем документе в широком смысле и включает любой терапевтический эффект, т.е. любой благоприятный эффект по отношению к указанной инфекции или состоянию. Таким образом, этот термин включает не только уничтожение или ликвидацию инфекции или излечивание субъекта от инфекции, но и улучшение инфекции или состояния субъекта. Так, он включает, например, улучшение любого симптома или признака указанной инфекции или состояния или любого клинически приемлемого показателя инфекции/состояния (например, уменьшение размера раны или ускорение заживления). Таким образом, лечение включает как лечебную, так и паллиативную терапию, например, существующей или диагностированной инфекции/состояния, т.е. реакционное лечение.
Термин «профилактика» в настоящем документе относится к любому профилактическому или предохранительному эффекту. Так, он включает задержку, ограничение, уменьшение или предотвращение инфекции/состояния или начального проявления инфекции/состояния или одного или более из их симптомов или показателей, например, связанных с указанной инфекцией/со стоянием или симптомом или показанием до профилактического лечения. Таким образом, профилактика явным образом включает как абсолютное предотвращение возникновения или развития инфекции/состояния или их симптома или показателя, так и задержку начального проявления или развития указанной инфекции/состояния или их симптома или показателя, или снижение или ограничение развития или прогрессирования инфекции/состояния или их симптома или показателя.
Субъект может представлять собой человека или любое животное, не являющееся человеком, однако в более конкретном случае может представлять собой человека или позвоночное, не являющееся человеком, например, млекопитающее, не являющееся человеком, птицу, земноводное, рыбу или пресмыкающееся. В предпочтительном варианте реализации субъект представляет собой субъекта-млекопитающее. Животное может представлять собой домашний скот или домашнее животное или животное, имеющее коммерческую ценность, в том числе лабораторных животных или животное в зоопарке или парке диких животных. Таким образом, представительные примеры животных включают собак, кошек, кроликов, мышей, морских свинок, хомяков, лошадей, свиней, овец, коз и коров. Таким образом, настоящее изобретение охватывает варианты применения в ветеринарии. Субъекта также можно рассматривать в качестве пациента. Субъект предпочтительно является человеком. В некоторых в некоторых вариантах реализации субъект не является млекопитающим-жвачным.
Термин «в организме субъекта» используется в настоящем документе в широком смысле и включает области или местоположения внутри или на поверхности организма субъекта, например, на внешней поверхности тела, и может включать, в частности, инфекцию медицинского устройства, например, имплантированного или «вживленного» медицинского устройства. Термин «в организме пациента» следует интерпретировать сообразно этому.
Таким образом, местоположение инфекции может представлять собой поверхность полости рта (например, зубы, десны, десневую бороздку, пародонтальный карман), половой тракт (например, шейку матки, матку, фаллопиевы трубы), брюшину, среднее ухо, предстательную железу, мочевыделительную систему, интиму сосудов, глаз, т.е. ткань глаза (например, конъюнктиву, ткань роговицы, проток слезной железы, слезную железу, веко), дыхательные пути, ткань легкого (например, бронхиальную или альвеолярную ткань), клапаны сердца, желудочно-кишечный тракт, кожу, скальп, ногти и внутреннюю часть ран, в частности, хронических и хирургических ран, которые могут быть поверхностными или глубокими ранами. Другие поверхности включают внешнюю поверхность органов, в частности, подвергающихся трансплантации, например, сердца, легких, почки, печени, клапана сердца, поджелудочной железы, кишечника, ткани роговицы, артериальных или венозных трансплантатов и кожи.
Таким образом, инфекция также может присутствовать в физиологических жидкостях (например, крови, плазме, сыворотке, цереброспинальной жидкости, содержимом ЖК-тракта, сперме, мокроте и других секретах легких) и тканях (например, надпочечников, печени, почек, поджелудочной железы, гипофиза, щитовидной железы, иммунной системы, яичников, яичек, предстательной железы, эндотелия, легких, эпидермиса, нервной, мышечной, костной ткани).
Кроме того, инфекция может находиться в любом «вживленном» медицинском или хирургическом оборудовании или устройствах. Сюда могут входить системы для транспорта жидкостей любого типа, в том числе катетеры (например, центральные венозные и мочевые катетеры), протезные устройства, например, клапаны сердца, искусственные суставы, вставные зубы, зубные коронки, стоматологические прокладки и имплантаты для мягких тканей (например, имплантаты для молочной железы, ягодиц и губ). Указанные устройства включают имплантируемые медицинские устройства любого вида (например, стенты, внутри маточные устройства, кардиостимуляторы, интубационные трубки (например, эндотрахеальные или трахеостомические трубки), протезы или протезные устройства, системы для транспорта жидкостей или катетеры). «Вживленное» медицинское устройство может включать устройство, любая часть которого содержится внутри организма, т.е. устройство может быть полностью или частично вживленным.
Инфекция может быть острой или, в альтернативном случае, хронической, например, инфекцией, сохраняющейся в течение от по меньшей мере 5 до по меньшей мере 10 дней, в частности, по меньшей мере 20 дней, конкретнее - по меньшей мере 30 дней, конкретнее - по меньшей мере 40 дней.
Бактериальная инфекция может возникнуть у любого субъекта, однако некоторые субъекты могут быть более восприимчивы к инфекции, чем другие. Субъекты, восприимчивые к бактериальной инфекции, включают субъектов с ослабленным или нарушенном эпителиальным или эндотелиальным барьером, субъектов с отказом, нарушением, ослаблением или дестабилизацией секреторной защиты от микробиологических инфекций и субъектов с нарушением иммунной системы, иммунодефицитом или иммуносупрессией (т.е. субъекта, у которого любой компонент иммунной системы работает ненадлежащим образом или неоптимально, иными словами, субъекта, у которого ослаблен или нарушен любой компонент иммунного ответа или активность иммунной системы вследствие заболевания или клинического вмешательства или по любой причине), но не ограничиваются ими.
Типичные примеры субъектов, восприимчивых к бактериальной инфекции, включают субъектов с ранее развившейся инфекцией (например, за счет бактерий, вирусов, грибков или паразитов, например, простейших), особенно субъектов с ВИЧ, субъектов с бактериемией, сепсисом м септическим шоком; субъектов с иммунодефицитом, например, субъектов, готовящихся к, подвергающихся или выздоравливающих после химиотерапии и/или лучевой терапии, субъектов после трансплантации органов (например, костного мозга, печени, легкого, сердца, клапана сердца, почки и т.д., включая пациентов с аутотрансплантатами, аллотрансплантатами и ксенотрансплантатами); субъектов со СПИД; субъектов, находящихся в учреждении здравоохранения, например, больнице, особенно субъектов в отделении интенсивной терапии или реанимации (т.е. субъектов в отделениях, где для пациентов предусмотрено использование систем искусственного жизнеобеспечения или поддержки органов); субъектов, подключенных к аппаратам искусственной вентиляции легких; субъектов с травмами, ожогами, острыми и/или хроническими ранами; новорожденных субъектов; пожилых субъектов; субъектов с раком (в настоящем документе используется широкое определение рака, включающее любое состояние, связанное со злокачественными или незлокачественными новообразованиями), в особенности со злокачественными заболеваниями иммунной системы (например, лейкозами, лимфомами и другими гематологическими злокачественными заболеваниями); субъектов, страдающих аутоиммунными состояниями, например, ревматоидным артритом, сахарным диабетом I типа, болезнью Крона, в особенности получающих иммунодепрессанты по поводу этих заболеваний; субъектов с ослаблением или отказом эпителиальной или эндотелиальной секреции (например, слизи, слезной жидкости, слюны) и/или клиренса секретов (например, субъектов с плохо функционирующими ресничками на слизистой ткани и/или пациентов с избыточно вязкой слизью (например, курильщиков и субъектов с ХОБЛ, COAD, СОАР, бронхитом, муковисцидозом, эмфиземой, раком легких, астмой, пневмонией или синуситом)) и субъектов, снабженных медицинским изделием, но не ограничиваются ими.
Конъюгаты бацитрацин-альгинатный олигомер согласно настоящему изобретению можно вводить субъекту в любой удобной форме или любым удобным способом с целью доставки их эффективного количества к бактериям целевой инфекции и/или к области, содержащей инфекцию или подвергающейся риску инфекции, например, наружно, энтерально (например, перорально, буккально, сублингвально, ректально), парентерально (например, внутривенно, интраспинально, внутримышечно, подкожно), или посредством ингаляции (в том числе назальной ингаляции). Посредством введения можно достичь системного или локализованного распределения; это подразумевает доставку к бактериям целевой инфекции и/или области, содержащей инфекцию или подвергающейся риску инфекции, при практическом отсутствии доставки к другим местоположениям в организме пациента. Специалист может выбрать соответствующие средства введения, подходящие в случае любой конкретной целевой инфекции и/или области, содержащей инфекцию или подвергающейся риску инфекции. Местное применение, в частности, достигаемое при наружном применении, может быть предпочтительным.
Специалист может составить фармацевтические композиции конъюгатов бацитрацин-альгинатный олигомер согласно настоящему изобретению, адаптированные к указанным путям введения и распределению в организме, в соответствии с любым из общепринятых способов, известных в данной области техники и широко описанных в литературе.
Конкретнее, конъюгаты бацитрацин-альгинатный олигомер согласно настоящему изобретению можно включать, необязательно вместе с другими активными агентами, с одним или более из общепринятых носителей, разбавителей или вспомогательных веществ, в целях получения традиционных галеновых препаратов, например, таблеток, пилюль, гранул (например, в свободной форме или включенных в капсулы), порошков (например, порошков для ингаляции, в том числе сухих порошков для ингаляции), леденцов, саше, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), спреев (например, назальных спреев), композиций для применения в небулайзерах, мазей, кремов, бальзамов, мягких и твердых желатиновых капсул, суппозиториев, пессариев, стерильных растворов для инъекций, стерильно упакованных порошков и т.п. Особо следует отметить твердые или жидкие композиции с энтеросолюбильным покрытием, например, таблетки с энтеросолюбильным покрытием и гранулы с энтеросолюбильным покрытием (которые могут находиться в капсуле с энтеросолюбильным покрытием или капсуле без энтеросолюбильного покрытия, т.е. в капсуле, покрытие которой может быть энтеросолюбильным или не энтеросолюбильным); стерильные композиции для ингаляций или инъекций.
Примеры подходящих носителей, вспомогательных веществ и разбавителей представляют собой лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, гуммиарабик, фосфат кальция, инертные альгинатные полимеры, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, патоку на водной основе, воду, воду/этанол, воду/гликоль, воду/полиэтилен, гипертонический водный раствор соли, гликоль, пропиленгликоль, метилцеллюлозу, метилгидроксибензоаты, пропилгидроксибензоаты, тальк, стеарат магния, минеральное масло или жировые вещества, например, твердый жир, или подходящие смеси вышеуказанных веществ. Следует отметить такие вспомогательные вещества и разбавители, как маннит и гипертонический водный раствор соли (хлорида натрия).
Композиции могут дополнительно включать смазывающие агенты, увлажнители, эмульгаторы, суспендирующие агенты, консерванты, подсластители, вкусоароматические агенты и т.п.
Для наружного применения конъюгаты бацитрацин-альгинатный олигомер можно включать в кремы, мази, гели, бальзамы, трансдермальные пластыри и т.п. Дополнительные системы для наружного применения, которые представляются подходящими для данной цели, представляют собой систем доставки лекарственных веществ in situ, например, гели, которые образуют твердые, полужидкие, аморфные или жидкокристаллические гелевые матриксы in situ и могут содержать альгинатный олигомер (который может представлять собой любой альгинатный олигомер, описанный в настоящем документе). Такие матриксы удобны при контроле высвобождения конъюгатов бацитрацин-альгинатный олигомер из матрикса, например, высвобождение может быть отсрочено и/или может продолжаться в течение выбранного времени. Такие системы могут образовывать гели только при контакте с биологическими тканями или жидкостями, например, поверхностями слизистых. Обычно такие гели являются биоадгезивными и/или муко адгезивными. Такая методика может обеспечить адресную доставку в любую область организма, которая может удерживать гелеобразующую композицию или которую можно приспособить к удерживанию гелеобразующей композиции. Такие системы описаны в заявке WO 2005/023176, явным образом полностью включенной в настоящий документ посредством ссылки.
Формы для парентерального введения, например, растворы, подходящие для внутривенной доставки, должны быть стерильными и не должны содержать физиологически неприемлемых агентов, а также должны обладать низкой осмолярностью для минимизации раздражения или других нежелательных эффектов при введении; таким образом, растворы предпочтительно должны быть изотоническими или слегка гипертоническими, например, гипертонический водный раствор соли (хлорида натрия). Подходящие среды-носители включают водные среды-носители, традиционно применяемые для введения парентеральных растворов, например, стерильную воду для инъекций, раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор хлорида натрия с декстрозой для инъекций, раствор Рингера с лактатом для инъекций и другие растворы, например, описанные в Remington's Pharmaceutical Sciences, 15th ed., Easton: Mack Publishing Co., pp. 1405-1412 и 1461-1487 (1975) и The National Formulary XIV, 14th ed. Washington: American Pharmaceutical Association (1975)), явным образом полностью включенных в настоящий документ посредством ссылки. Растворы могут содержать консерванты, антимикробные агенты, буферы и антиоксиданты, традиционно применяемые для изготовления парентеральных растворов, вспомогательные вещества и другие добавки, совместимые с конъюгатами бацитрацин-альгинатный олигомер и не мешающие производству, хранению и применению продуктов.
Простые стерильные растворы конъюгатов бацитрацин-альгинатный олигомер или простые стерильные жидкие композиции, содержащие конъюгаты бацитрацин-альгинатный олигомер, могут быть в особенности удобны при применении во время хирургических процедур и для доставки в легкие, например, с помощью небулайзера, или в околоносовые пазухи, например, с помощью устройства для впрыскивания назального спрея.
Твердые или жидкие составы конъюгатов бацитрацин-альгинатный олигомер могут быть представлены с энтеросолюбильным покрытием, предотвращающим разрушение в желудке и/или других частях верхнего ЖК-тракта, однако не мешающим разрушению в нижнем ЖК-тракте, например, тонком кишечнике. Такие покрытия в рабочем порядке изготавливают из полимеров, содержащих жирные кислоты, воска, шеллак, пластмассы и растительные волокна. Их конкретные примеры включают сополимеры метилакрилата-метакриловой кислоты, сополимеры метилметакрилата-метакриловой кислоты, сукцинат-ацетат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы (ацетат-сукцинат гипромеллозы), поливинилацетат-фталат (PVAP), ацетат-тримеллитат целлюлозы и полимер альгината натрия, но не ограничиваются ими Следует особо упомянуть таблетки с энтеросолюбильным покрытием и гранулы с энтеросолюбильным покрытием (которые могут находиться в капсуле с энтеросолюбильным покрытием или капсуле без энтеросолюбильного покрытия). Гранулы с энтеросолюбильным покрытием можно получить в соответствии с информацией изложенной в заявке WO 1989008448 и статье Al-Khedairy, Е.В.Н, 2006, Iraqi J.Pharm.Sci., Vol. 15 (1) 49, содержание которых включено в настоящий документ посредством ссылки, хотя специалист может знать о дополнительных альтернативных методиках, которые можно применять в данных целях.
Относительное содержание конъюгатов бацитрацин-альгинатный олигомер в композициях согласно настоящему изобретению может менять в зависимости от требуемой дозировки и используемой схемы приема, однако является достаточным для достижения эффективного количества в области-мишени лечения, т.е. в области нахождения бактерий целевой инфекции и/или области, содержащей инфекцию или подвергающейся риску инфекции, с учетом таких факторов, как физический размер субъекта, подвергаемого лечению, характер конкретного заболевания у субъекта и местоположение и особенности области-мишени лечения. Специалисту известно, что количество конъюгатов бацитрацин-альгинатный олигомер можно уменьшить при применении схемы с многократным введением или увеличить с целью минимизации количества введений или нанесений.
Типичный состав для наружного применения, например, крем, мазь или бальзам, который можно использовать для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в кожу или шейку матки или другие части нижних отделов женской половой системы, может содержать от 1 до 25%, от 1 до 20%, от 1 до 15%, от 1 до 10%, от 1 до 9%, от 1 до 8%, от 1 до 7%, от 1 до 6%, от 5 до 25%, от 5 до 20%, от 5 до 15%, от 5 до 10%, от 5 до 9%, от 5 до 8%, от 5 до 7%, от 5 до 6%, от 8 до 25%, от 8 до 20%, от 8 до 15%, от 8 до 10%, от 9 до 25%, от 9 до 20% или от 9 до 15% (масс/об) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ и/или других активных агентов (если они используются). Известны устройства для доставки, предназначенные для нанесения составов для наружного применения на женскую половую систему, которые можно применять для доставки вышеупомянутых составов, если это целесообразно.
Для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в нижние отделы женских половых путей можно применять пессарий. Типичный состав может содержать от 1 до 25%, от 1 до 20%, например, от 1 до 15%, от 1 до 10%, от 1 до 9%, от 1 до 8%, от 1 до 7%, от 1 до 6%, от 5 до 25%, от 5 до 20%, от 5 до 15%, от 5 до 10%, от 5 до 9%, от 5 до 8%, от 5 до 7%, от 5 до 6%, от 8 до 25%, от 8 до 20%, от 8 до 15%, от 8 до 10%, от 9 до 25%, от 9 до 20% или от 9 до 15% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ, в том числе твердых вспомогательных веществ, и/или других активных агентов (если они используются). Аналогичным образом можно составить ректальные суппозитории.
Для введения в нос или околоносовые пазухи можно использовать стерильный водный и/или масляный жидкий состав (например, эмульсию), вводимый, например, с помощью устройства для впрыскивания назального спрея, например, без пропеллента или с использованием пропеллента. Типичный состав может содержать от 1 до 25%, от 1 до 20%, например, от 1 до 15%, от 1 до 10%, от 1 до 9%, от 1 до 8%, от 1 до 7% или от 1 до 6%, от 5 до 25%, от 5 до 20%, от 5 до 15%, от 5 до 10%, от 5 до 9%, от 5 до 8%, от 5 до 7%, от 5 до 6%, от 8 до 25%, от 8 до 20%, от 8 до 15%, от 8 до 10%, от 9 до 25%, от 9 до 20% или от 9 до 15% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ, например, воды и/или других активных агентов (если они используются).
Типичный раствор для ингаляции, который планируется применять для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в верхние дыхательные пути, обычно является стерильным и может содержать от 6 до 25%, например, от 6 до 20%, от 6 до 15%, от 6 до 10%, от 8 до 25%, от 8 до 20%, от 8 до 15%, от 9 до 25%, от 9 до 20%, от 9 до 15%, от 10 до 15%, от 10 до 20%, от 10 до 25%, от 15 до 20% или от 15 до 25% (масс/об) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ, например, воды и/или других активных агентов (если они используются).
Типичный порошок для ингаляции, который планируется применять для введения конъюгатов бацитрацин-альгинатный олигомер согласно настоящему изобретению в нижние отделы дыхательных путей, может содержать до 90%, например, до 85%, 80%, 75% или 70%, например, от 50 до 90%, от 55 до 90%, от 60 до 90%, от 65 до 90%, от 70 до 90%, от 75 до 90%, от 80 до 90%, от 85 до 90%, от 50 до 85%, от 55 до 85%, от 60 до 85%, от 65 до 85%, от 70 до 85%, от 75 до 85%, от 80 до 85%, от 50 до 80%, от 55 до 80%, от 60 до 80%, от 65 до 80%, от 70 до 80%, от 75 до 80%, от 50 до 70%, от 55 до 70%, от 60 до 70% или от 65 до 70% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ и/или других активных агентов (если они используются в той же композиции).
В других вариантах реализации для доставки, например, в нос или околоносовые пазухи можно использовать составы с замедленным, отсроченным или пролонгированным высвобождением. Типичный состав может представлять собой порошок, содержащий конъюгат бацитрацин-альгинатный олигомер или суспензию указанного порошка, причем указанный порошок содержит до 90%, например, до 85%, 80%, 75% или 70%, например, от 50 до 90%, от 55 до 90%, от 60 до 90%, от 65 до 90%, от 70 до 90%, от 75 до 90%, от 80 до 90%, от 85 до 90%, от 50 до 85%, от 55 до 85%, от 60 до 85%, от 65 до 85%, от 70 до 85%, от 75 до 85%, от 80 до 85%, от 50 до 80%, от 55 до 80%, от 60 до 80%, от 65 до 80%, от 70 до 80%, от 75 до 80%, от 50 до 70%, от 55 до 70%, от 60 до 70% или от 65 до 70% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ и/или других активных агентов (если они используются). Указанный порошок может содержать покрытие, контролирующее высвобождение конъюгата бацитрацин-альгинатный олигомер.
Типичная таблетка, которую планируется применять для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в нижние отделы ЖК-тракта, может содержать до 99%, до 95%, 90%, 85% или 80%, например, от 50 до 95%, от 55 до 95%, от 60 до 95%, от 65 до 95%, от 70 до 95%, от 75 до 95%, от 80 до 95%, от 85 до 95%, от 90 до 95%, от 50 до 90%, от 50 до 90%, от 55 до 90%, от 60 до 90%, от 65 до 90%, от 70 до 90%, от 75 до 90%, от 80 до 90%, от 85 до 90%, от 50 до 90%, от 55 до 85%, от 60 до 80% или от 65 до 75% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ и/или других активных агентов (если они используются). Таблетка может представлять собой многослойную таблетку.
Эффективным средством для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в нижние отделы ЖК-тракта может являться таблетка с энтеросолюбильным покрытием. Типичная гранула с энтеросолюбильным покрытием может содержать до 95%, например, до 90%, 85% или 80%, например, от 55 до 90%, от 60 до 90%, от 65 до 90%, от 70 до 90%, от 75 до 90%, от 80 до 90%, от 85 до 90%, от 55 до 85%, от 60 до 85%, от 65 до 85%, от 70 до 85%, от 75 до 85%, от 80 до 85%, от 50 до 80%, от 55 до 80%, от 60 до 80%, от 65 до 80%, от 70 до 80%, или от 75 до 80% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ, в том числе энтеросолюбильного покрытия (например, полимеров, содержащих жирные кислоты, воска, шеллак, пластмассы и растительные волокна) и/или других активных агентов (если они используются). Таблетка может представлять собой многослойную таблетку, например, как описано выше.
Эффективным средством для введения конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению в нижние отделы ЖК-тракта могут также являться гранулы с энтеросолюбильным покрытием. Такие гранулы могут быть представлены в капсуле, которая сама по себе может быть снабжена или не снабжена энтеросолюбильным покрытием. Типичная гранула с энтеросолюбильным покрытием может содержать до 95%, например, до 90%, 85% или 80%, например, от 55 до 90%, от 60 до 90%, от 65 до 90%, от 70 до 90%, от 75 до 90%, от 80 до 90%, от 85 до 90%, от 55 до 85%, от 60 до 85%, от 65 до 85%, от 70 до 85%, от 75 до 85%, от 80 до 85%, от 50 до 80%, от 55 до 80%, от 60 до 80%, от 65 до 80%, от 70 до 80%, или от 75 до 80% (масс/об или масс/масс) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из фармацевтически приемлемых вспомогательных веществ, в том числе энтеросолюбильного покрытия (например, полимеров, содержащих жирные кислоты, воска, шеллак, пластмассы и растительные волокна) и/или других активных агентов (если они используются).
Типичный водный раствор для доставки конъюгата бацитрацин-альгинатный олигомер согласно настоящему изобретению путем инъекции (например, внутривенной, интраспинальной, внутримышечной или подкожной инъекции) является стерильным и может содержать от 6 до 25%, например, от 6 до 20%, от 6 до 15%, от 6 до 10%, от 8 до 25%, от 8 до 20%, от 8 до 15%, от 9 до 25%, от 9 до 20%, от 9 до 15%, от 10 до 15%, от 10 до 20%, от 10 до 25%, от 15 до 20% или от 15 до 25% (масс/об) конъюгата бацитрацин-альгинатный олигомер, а остальная часть состоит из воды и фармацевтически приемлемых вспомогательных веществ и/или других активных агентов (если они используются).
Конъюгаты бацитрацин-альгинатный олигомер можно применять в суточной дозе от 0,1 г до 10 г, например, от 0,5 г до 5 г, от 0,8 г до 3 г, от 1 г до 2 г, например, приблизительно 2 г, которую можно вводить за один или более раз в день (например, два раза в день) и в виде одной или более лекарственных форм или сеансов введения (например, по две таблетки два раза в день).
Конъюгаты бацитрацин-альгинатный олигомер, описанные в настоящем документе, можно применять в сочетании или комбинации с одним или более дополнительными терапевтически активными агентами, которые могут включать другие антимикробные (например, антибиотики, антибактериальные, противогрибковые и противовирусные) агенты, иммуностимуляторы, кортикостероиды, нестероидные противовоспалительные средства (НПВС), бронхорасширяющие средства, агенты, снижающие вязкость слизи (т.е. агент, который уменьшает вязкость слизи; эти термины взаимозаменяемо используют с термином "муколитик") или модуляторы CFTR (также известные как "модификаторы CFTR").
Дополнительный агент, например, антибиотик, может быть не конъюгирован с альгинатным олигомером или любой другой конъюгирующей группой.
Конъюгат бацитрацин-альгинатный олигомер и дополнительный терапевтически активный агент можно, например, вводить совместно, в одном фармацевтическом составе или композиции, или раздельно (т.е. в виде раздельного, последовательного или одновременного введения). Так, конъюгат бацитрацин-альгинатный олигомер и дополнительный терапевтически активный агент можно объединить, например, в составе фармацевтического набора или комбинированного продукта («комбинации»).
Так, в дополнительном аспекте настоящего изобретения предложен продукт (например, фармацевтическая комбинация или набор), содержащий конъюгат бацитрацин-альгинатный олигомер согласно определению в настоящем документе с дополнительным терапевтически активным агентом (например, описанным выше) в виде комбинированного препарата для раздельного, последовательного или одновременного применения в лечении или профилактике бактериальной инфекции, предпочтительно бактериальной инфекции, вызванной грамотрицательными бактериями, у субъекта.
В более общем случае в данном аспекте настоящего изобретения также предложен набор, содержащий конъюгат бацитрацин-альгинатный олигомер, соответствующий определению в настоящем документе, вместе с дополнительным терапевтически активным агентом (например, описанным выше).
Особенно предпочтительны комбинации, содержащие конъюгат бацитрацин-альгинатный олигомер, соответствующий определению в настоящем документе, и антибиотик, противогрибковый агент, модулятор CFTR и/или агент, снижающий вязкость слизи. Такие фармацевтические продукты и фармацевтические композиции предпочтительно адаптированы к применению в медицинских способах согласно настоящему изобретению.
Дополнительный терапевтически активный агент целесообразно применять до, одновременно с или после конъюгата бацитрацин-альгинатный олигомер. Дополнительный терапевтически активный агент целесообразно применять по существу в то же время, что и конъюгат бацитрацин-альгинатный олигомер, или после него. В других вариантах реализации дополнительный терапевтически активный агент целесообразно применять или вводить до конъюгата бацитрацин-альгинатный олигомер. Кроме того, дополнительный терапевтически активный агент можно применять (например, вводить или доставлять) несколько раз в моменты времени, подходящие для используемого агента. Специалист может разработать подходящую схему приема. При долгосрочном лечении конъюгат бацитрацин-альгинатный олигомер также можно применять многократно. Конъюгат бацитрацин-альгинатный олигомер можно применять так же часто, как и дополнительный терапевтически активный агент, или чаще или реже по сравнению с ним. Требуемая частота может зависеть от области или местоположения внутри или на поверхности организма пациента, которому вводят конъюгат бацитрацин-альгинатный олигомер, а также от общего характера клинического состояния конкретного пациента, подвергаемого лечению.
Таким образом, конъюгат бацитрацин-альгинатный олигомер и дополнительный терапевтически активный агент можно составить вместе друг с другом или раздельно, т.е. они могут находиться в одном или раздельных составах или фармацевтических композициях, и могут быть представлены для введения одним и тем же или разными путями. В настоящем изобретении также рассматривается применение конъюгата бацитрацин-альгинатный олигомер согласно определению в настоящем документе для производства таких фармацевтических продуктов и фармацевтических композиций для применения в медицинских способах согласно настоящему изобретению.
Типичные антибиотики, которые можно применять в сочетании или комбинации с конъюгатами полимиксин-альгинатный олигомер, соответствующими определению в настоящем документе, включают аминогликозиды (например, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин); β-лактамы (например, карбацефемы (например, лоракарбеф); цефалоспорины 1-го поколения (например, цефадроксил, цефазолин, цефалексин); цефалоспорины 2-го поколения (например, цефаклор, цефамандол, цефалексин, цефотоксин, цефпрозил, цефуроксим); цефалоспорины 3-го поколения (например, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон); цефалоспорины 4-го поколения (например, цефепим); монобактамы (например, азтреонам); макролиды (например, азитромицин, кларитромицин, диритромицин, эритромицин, тролеандомицин); монобактамы (например, азтреонам); пенициллины (например, амоксициллин, ампициллин, карбенициллин, клоксациллин, диклоксациллин, нафциллин, оксациллин, пенициллин G, пенициллин V, пиперациллин, тикарциллин); полипептидные антибиотики (например, колистин, полимиксин В, но в некоторых вариантах реализации не бацитрацин); хинолоны (например, ципрофлоксацину. эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин); сульфониламиды (например, мафенид, сульфацетамид, сульфаметизол, сульфасалазин, сульфизоксазол, триметоприм, сульфаметоксазол); тетрациклины (например, демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин); глицилциклины (например, тигециклин); карбапенемы (например, имипенем, меропенем, эртапенем, дорипенем, панипенему/бетамипрон, биапенем, PZ-601); и другим антибиотикам, в том числе хлорамфеникол, клиндамицин, этамбутол; фосфомицин; изониазид; линезолид; метронидазол; нитрофурантоин; пиразинамид; квинупристин/дальфопристин; спектиномицин; фосфомицин и ванкомицин, но не ограничиваются ими.
Типичные противогрибковые средства включают полиены (например, натамицин, римоцидин, филипин, нистатин, амфотерицин В, кандицин); имидазолы (например, миконазол, кетоконазол, клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол, сульконазол, тиоконазол); триазолы (например, флуконазол, итраконазол, изавуконазол, равуконазол, позаконазол, вориконазол, терконазол); аллиламины (например, тербинафин, аморолфин, нафтифин, бутенафин); и эхинокандины (например, анидулафунгин, каспофунгин, микафунгин), но не ограничиваются ими.
Типичные противовирусные средства включают абакавир, ацикловир, адефовир, амантадин, ампренавир, арбидол, атазанавир, атриплу, боцепревир, сидофовир, комбивир, дарунавир, делавирдин, диданозин, докозанол, эдоксудин, эфавиренц, эмтрицитабин, энфувиртид, энтекавир, фамцикловир, фомивирсен, фосампренавир, фоскарнет, фосфонет, ганцикловир, ибацитабин, имуновир, идоксуридин, имиквимод, индинавир, инозин, интерферон III типа, интерферон II типа, интерферон I типа, ламивудин, лопинавир, ловирид, маравирок, мороксидин, нелфинавир, невирапин, нексавир, осельтамивир, пенцикловир, перамивир, плеконарил, подофиллотоксин, ралтегравир, рибавирин, римантадин, ритонавир, саквинавир, ставудин, тенофовир, дизопроксилтенофовир, типранавир, трифлуридин, тризивир, тромандадин, трувада, валацикловир, валганцикловир, викривирок, видарабин, вирамидин, залцитабин, занамивир и зидовудин, но не ограничиваются ими.
Типичные иммуностимуляторы включают цитокины, например, ФНО, ИЛ-1, ИЛ-6, ИЛ-8 и иммуностимуляторы-альгинаты, например, альгинаты с высоким содержанием М, описанные, например, в заявках US 5169840, WO91/11205 и WO03/045402, явным образом полностью включенных в настояший документ посредством ссылки, а также любые альгинаты с иммуностимулирующими свойствами, но не ограничиваются ими.
Типичные примеры подходящих кортикостероидов включают преднизолон, флунизолид, триамцинолон, флутиказон, будесонид, мометазон, беклометазон, амцинонид, будесонид, десонид, флуоцинонид, флуоцинолон, галцинонид, гидрокортизон, кортизон, тиксокортол, преднизолон, метилпреднизолон, преднизон, бетаметазон, дексаметазон, флуокортолон, аклометазон, предникарбат, клобетазон, клобетазол и флупредниден, но не ограничиваются ими.
Типичные НПВС включают салицилаты (например, аспирин (ацетилсалициловую кислоту), трисалицилат холина-магния, дифлунизал, сальсалат, производные пропионовой кислоты (например, ибупрофен, дексибупрофен, декскетопрофен, фенопрофен, флурбипрофен, кетопрофен, локсопрофен, ацетоксен, напроксен, оксапрозин), производные уксусной кислоты (например, ацеклофенак, диклофенак, этодолак, индометацин, кеторолак, набуметон, толметин, сулиндак), производные енольной кислоты (например, дроксикам, изоксикам, лорноксикам, мелоксикам, пироксикам, теноксикам), производные антраниловой кислоты (например, флуфенамовую кислоту, меклофенамовую кислоту, мефенамовую кислоту, толфенамовую кислоту) и селективные ингибиторы ЦОГ-2 (коксибы; например, целекоксиб, эторикоксиб, лумиракоксиб, парекоксиб, рофекоксиб, валдекоксиб), но не ограничиваются ими. Предпочтительными являются производные пропионовой кислоты (например, ибупрофен, дексибупрофен, декскетопрофен, фенопрофен, флурбипрофен, кетопрофен, локсопрофен, напроксен, оксапрозин), причем наиболее предпочтительным является ибупрофен.
Типичные примеры подходящих бронхорасширяющих средств включают β2-агонисты (например, β2-агонисты короткого действия (например, пирбутерол, адреналин, сальбутамол, левосальбутамол, кленбутерол, тербуталин, прокатерол, метапротеренол, фенотерол, мезилат битолтерола, ритодрин, изопреналин, β2-агонисты длительного действия (например, салметерол, формотерол, бамбутерол, кленбутерол) и β2-агонисты сверхдлительного действия (например, индакатерол)), антихолинергические средства (например, ипратропий, окситропий, тиотропий) и теофиллин, но не ограничиваются ими.
В настоящем документе подразумевается, что термины «муколитик» и «агент, снижающий вязкость слизи» включают агенты, снижающие собственную вязкость слизи, и агенты, снижающие прилипание слизи к нижележащему эпителию в частности, агенты, прямо или косвенно нарушающие молекулярные взаимодействия внутри или между компонентами слизи, агенты, влияющие на набухание слизи, и агенты, модулирующие ионное микроокружение слизистого эпителия (в частности, уровень двухвалентных катионов, например, кальция). Типичные примеры подходящих агентов, снижающих вязкость слизи, включают фермент, расщепляющий нуклеиновую кислоту (наприме, ДНКазу, например, ДНКазу I или дорназу-альфа), гипертонический раствор хлорида натрия, гельсолин, восстановитель тиоловых групп, ацетил цистеин, незаряженный низкомолекулярный полисахарид (например, декстран, маннит), аргинин (или другие предшественники или стимуляторы синтеза оксида азота), агонист пуринергических рецепторов подтипа P2Y2 (например, денуфозол) или анионную полиаминокислоту (например, поли-ASP или поли-GLU), но не ограничиваются ими. Можно упомянуть конкретные муколитики амброксол, бромгексин, домиодол, эпразинон, эрдостеин, летостеин, месну, нелтенексин, собрерол, степронин, тиопронин. Предпочтительными являются ДНКаза I и гипертонический раствор хлорида натрия.
Модуляторы CFTR представляют собой низкомолекулярные соединения, которые могут, по меньшей мере частично, восстанавливать дисфункцию CFTR. Современные модуляторы CFTR делятся на три основные группы: усилители CFTR, корректоры CFTR и считывающие агенты (Derichs, N., Eur. Respir. Rev., 2013, 22(127), 58-65; Petit, R.S. and Fellner, C, Pharmacy and Therapeutics, 2014, 39(7), 500-511; содержимое этих источников включено в настоящий документ посредством ссылок). Усилители CFTR представляют собой модуляторы CFTR, увеличивающие активность ионного канала CFTR, присутствующего на поверхности эпителиальных клеток. Корректоры CFTR представляют собой модуляторы CFTR, которые увеличивают количество белка CFTR, доставляемого или удерживаемого на поверхности эпителиальных клеток. Считывающие агенты (также известные как «супрессоры преждевременных стоп-кодонов» (PSC-супрессоры) или «супрессоры преждевременных кодонов терминации» (РТС-супрессоры; эти термины используются в настоящем документе на равных основаниях) представляют собой модуляторы CFTR, которые заставляют механизм трансляции клетки проходить через преждевременный кодон терминации в мРНК CFTR, тем самым увеличивая количество по существу полноразмерного и функционального продуцируемого CFTR.
Типичные примеры подходящих усилителей CFTR включают ивакафтор (VX-770; N-(2,4-ди-трет-бутил-5-гидроксифенил)-1,4-дигидро-4-оксохинолин-3-карбоксамид) и VRT-532 (4-метил-2-(5-фенил-1Н-пиразол-3-ил)-фенол) производства Vertex Pharmaceuticals™), но не ограничиваются ими.
Типичные примеры подходящих корректоров CFTR включают прототипный люмакафтор (VX-809) и VX-661 производства Vertex Pharmaceuticals™ и N6022 (3-[1-(4-карбамоил-2-метилфенил)-5-(4-имидазол-1-илфенил)пиррол-2-ил]пропановую кислоту), но не ограничиваются ими.
Типичные примеры подходящих считывающих агентов включают аталурен (РТС 124) производства РТС Therapeutics и гентамицин.
Настоящее изобретение дополнительно описано со ссылками на следующие неограничивающие примеры.
ПРИМЕРЫ
Пример 1 - Получение конъюгатов бацитрацин-альгинатный олигомер
Получение альгинатных олигомеров кислотным гидролизом
Альгинат натрия, содержащий >60% мономеров гулуроната (PRONOVA UP MVG), растворяли в dH2O (10 мг/мл), раствор доводили 0,01 М HCl, а затем помещали на водяную баню при 80°С на 24 ч. Для остановки гидролиза кислый гидролизат охлаждали и повышали рН до 7 добавлением 10 М NaOH. Растворы лиофилизировали и ресуспендировали в минимальной dH2O.
Для получения G-фрагментов в результате кислотного гидролиза (AHG) с приемлемой среднечисловой степенью полимеризации, а также распределением молекулярной массы растворы однократно фильтровали диализом для удаления LMW-олигомеров и солей. Обычно для получения AHG с желательной молекулярной массой использовали следующее время реакции и пороговые значения для диализных мембран:

Готовый продукт лиофилизировали и исследовали с помощью ИК-спектроскопии с преобразованием Фурье и гель-фильтрации (GPC). Система GPC содержала две колонки TSK G5000PWXL и G3000PWXL (Polymer Laboratories, Великобритания), расположенные последовательно, подвижную фазу PBS (рН 7,4) и использовала скорости потока 1 мл/мин. Молекулярную массу и полидисперсность рассчитывали по отношению к пуллулановому стандарту. Альгинатные стандарты отсутствуют в продаже, что привело к необходимости использования пуллулана. Эти калибровочные стандарты не позволяли точно определить молекулярную массу альгинатов, поскольку GPC выполняла разделение по гидродинамическому объему, который зависит от архитектуры макромолекулы. Альгинаты являются более протяженными, чем пуллулан, что приводило к шестикратному завышению молекулярной массы альгината при GPC с пуллуланом. Как следствие, к кажущимся значениям молекулярной массы, рассчитанным по калибровке с пуллуланом, применяли масштабирующий коэффициент (делили на 6) для поправки на другую архитектуру макромолекулы пуллулановых стандартов молекулярной массы (Andersen Т., et al., 2012, Alginates as biomaterials in tissue engineering. Carbohydrate Chemistry: Chemical and Biological Approaches, Vol. 37, 232-233).
Образцы для GPC получали в PBS (3 мг/мл), мониторинг элюата выполняли с помощью дифференциального рефрактометра (Optilab t-Rex (Wyatt, Великобритания)). Для анализа данных использовали программное обеспечение PL Caliber Instrument версии 7.0.4 производства Polymer Laboratories (Великобритания).
Молекулярная масса G-фрагментов, полученных в результате кислотного гидролиза (AHG), составляла от 2500 до 26000 г/моль (полидисперсность 2,5-3,5). Типичные сводные характеристики AHG, использованных в этих исследованиях, приведены ниже в таблице.
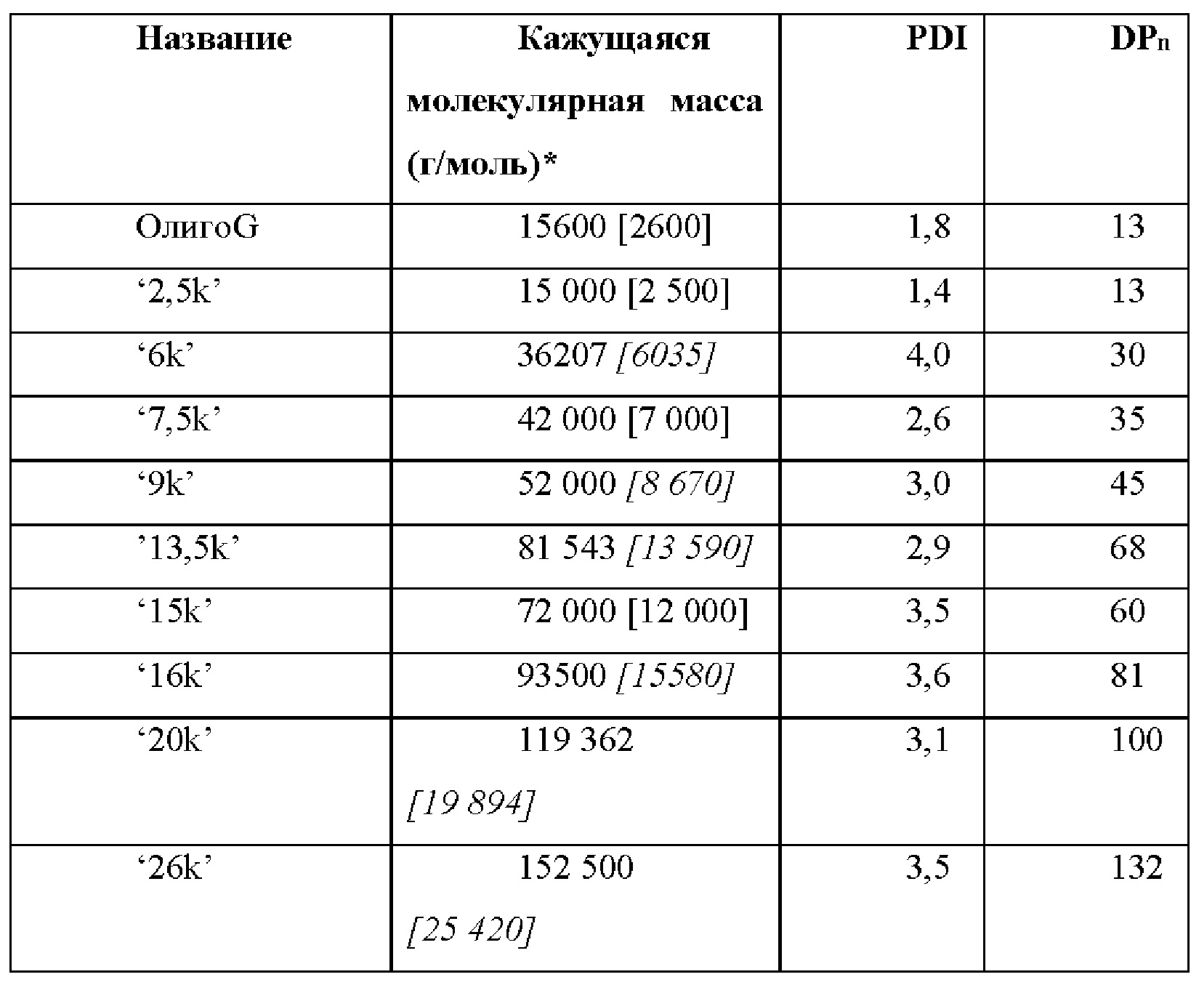

ОлигоС CF-5/20 для конъюгирования получили, как описано ранее (Khan et al. 2012, Antimicrobial Agents and Chemotherapy 56(10), 5134-5141). ОлигоО представлял собой 5-20-членный альгинатный олигомер, содержавший по меньшей мере 85% остатков G.
Сложноэфирное конъюгирование ('Е')
Вкратце, для конъюгирования 2500 г/моль AHG с бацитрацином альгинатный олигомер (200 мг, 0,08 ммоль) растворяли при перемешивании в безводном ДМФА (4 мл) (или безводном ДМСО для серии 3 и более поздних серий) в 10-мл круглодонной колбе. Для этого добавляли DCC (16,5 мг, 0,08 ммоль), DMAP (1,6 мг, 0,01 ммоль) и бацитрацин (37,5 мг, 0,03 ммоль; Sigma) и оставляли реакцию идти при комнатной температуре в течение ночи при перемешивании. Для остановки реакции в смесь вливали избыточное количество хлороформа (до 20 мл), затем полученный осадок собирали фильтрацией, повторно растворяли в дистиллированной воде (dH2O, 2 мл) и очищали с помощью ЖЭХБ (см. ниже).
Амидное конъюгирование ('А')
Вкратце, для конъюгирования 2500 г/моль AHG с бацитрацином альгинатный олигомер (200 мг, 0,08 ммоль) растворяли при перемешивании в dH2O (2 мл) в 10-мл круглодонной колбе. Для этого добавляли EDC (19,9 мг, 0,1 ммоль) и сульфоNHS (22,6 мг, 0,1 ммоль) и оставляли смесь перемешиваться в течение 15 мин. В дальнейшем добавляли бацитрацин (37,5 мг, 0,03 ммоль) и оставляли реакционную смесь перемешиваться при комнатной температуре на 2 ч, а затем хранили при -20°С до очистки с помощью ЖЭХБ (см. ниже).
Очистка конъюгатов с помощью ЖЭХБ
Конъюгаты очищали от реакционной смеси с помощью жидкостной экспресс-хроматографии белков (ЖЭХБ) (AKTA FPLC; Amersham Pharmacia Biotech, Великобритания) с использованием заранее заполненной колонки HiLoad Superdex 75 16/600 PG с УФ-детектором; анализ данных выполняли с помощью программного обеспечения Unicorn 4.0 (Amersham Pharmacia Biotech, Великобритания). Образцы реакционной смеси (2 мл) вводили в 2-мкл петлю, используя скорость потока PBS (подвижной фазы, рН 7,4) 0,5 мл/мин. Фракции (5 мл) собирали, диализовали против деионизованной воды (8 замен воды) и анализировали содержание белка (анализ ВСА) перед объединением фракций, содержавших конъюгат. Готовый конъюгат лиофилизировали и хранили при - 20°С.
Пример 2 - Изучение характеристик конъюгатов бацитрацин-альгинатный олигомер
Чистота, молекулярная масса и содержание лекарственного вещества
Конъюгаты бацитрацин-альгинатный олигомер исследовали с помощью ЖЭХБ и GPC с целью оценки чистоты и расчета молекулярной массы, а общее содержание лекарственного вещества определяли посредством анализа ВСА с использованием чистого лекарственного вещества в качестве калибратора.
Систему ЖЭХБ, использовавшуюся при очистке и описанную выше, применяли для изучения характеристик готового конъюгата с использованием заранее заполненной колонки Superdex 75 10/300 GL. Образцы (200 мкл) растворяли в PBS (рН 7,4) и вводили в 100-мл петлю при скорости потока 0,5 мл/мин. Систему GPC, описанную выше, применяли для изучения характеристик готового конъюгата с использованием тог же масштабирующего коэффициента.
Результаты
С использованием этих альгинатных олигомеров получили библиотеку конъюгатов бацитрацин-альгинатный олигомер при типичном выходе реакции ~ 40% и молекулярной массе 19500-83250 г/моль (по отношению к пуллулановым стандартам молекулярной массы); содержание загрузки лекарственного вещества составляло 1-7% (масс/масс) (что эквивалентно 3-5 олигомерам: 1 молекулу бацитрацина).

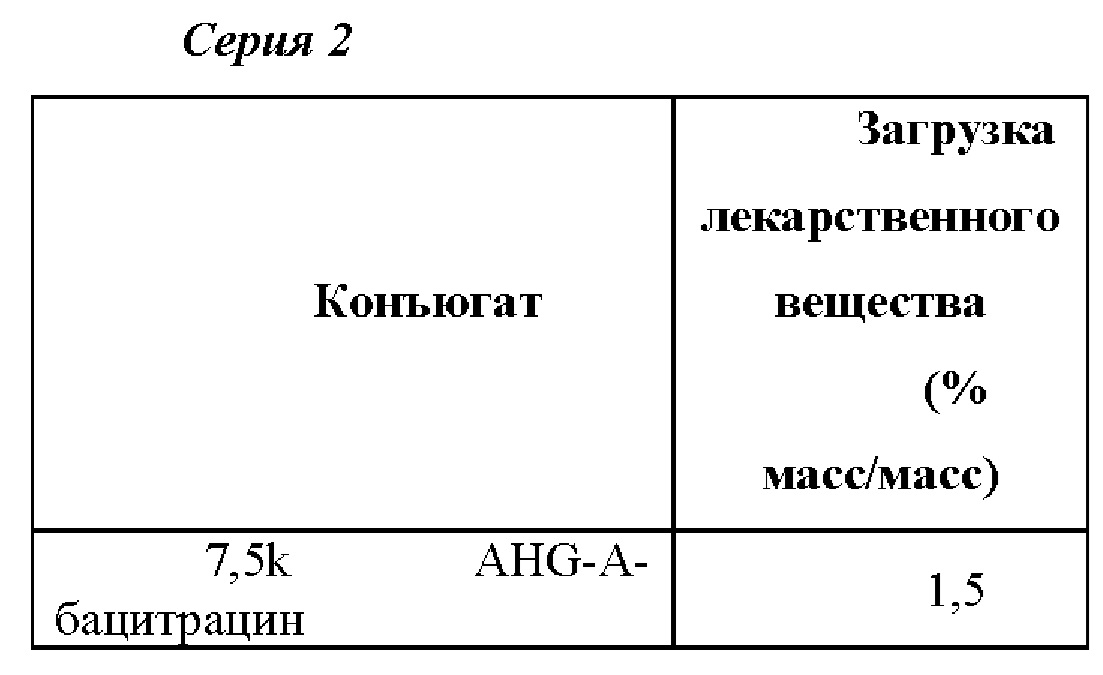


Пример 3 - Антимикробная активность
Изоляты и штаммы бактерий
Штаммы, использованные для анализа восприимчивости, включали как штаммы из коллекции культур, так и клинические изоляты, перечисленные ниже. Их известные генотипы и происхождение описаны Khan et al. supra.

Определение антимикробной активности
МИК альгинатных олигомеров, бацитрацина и его конъюгатов с альгинатными олигомерами определяли для изолятов V2, V3, V5, V19, Е68 и Е75 с использованием способа микроразбавления жидкой среды в соответствии со стандартными руководствами (CLSI 2012). Тестируемые организмы суспендировали в жидкой среде Мюллера-Хинтона (МИ) с коррекцией катионного состава (100 мкл, 1-5×104 КОЕ/мл) и инкубировали в 96-луночных титрационных микропланшетах при последовательном двукратном разбавлении тестируемых соединений. МИК по определению представляла собой минимальную концентрацию тестируемого соединения, приводившую к отсутствию видимого роста через 16-20 часов. Если не указано иное, в результатах приведены медианные значения для 3 экспериментов.
Результаты
Ни одна из фракций альгинатов или OligoG не демонстрировала антимикробной активности, в то время как неконъюгированный бацитрацин демонстрировал высокую антимикробную активность против Staphylococcus aureus (грамположительный вид), но не протестированных грамотрицательных видов (Pseudomonas aeruginosa, Klebsiella pneumonia, Escherichia coli и Acinetobacter baumannii. С другой стороны, бацитрацин, конъюгированный с альгинатным олигомером, демонстрировал хорошую антимикробную активность (пониженные значения МИК) против как грамотрицательных (в частности, штамма Е. coli), так и грамположительных штаммов.
Антимикробная активность была максимальной для конъюгатов, содержащих низкомолекулярные альгинатные олигомеры (в том числе олигоG).



Реферат
Настоящее изобретение относится к области биотехнологии, в частности к конъюгату бацитрацина и альгинатного олигомера, и может быть использовано в медицине. Изобретение позволяет получить конъюгат бацитрацин-альгинатный олигомер, содержащий антибиотик класса бацитрацинов, ковалентно присоединенный к по меньшей мере одному альгинатному олигомеру прямой ковалентной связью или ковалентным молекулярным линкером. Такой конъюгат может быть применим при лечении или профилактике бактериальной инфекции у субъекта с бактериальной инфекцией, подозрением на нее или риском ее развития. 6 н. и 19 з.п. ф-лы, 9 табл., 3 пр.
Формула



Документы, цитированные в отчёте о поиске
Хелатные амфифильные полимеры

Комментарии