Улучшенный пептид, иммуногенная композиция и вакцина с его использованием, способ иммунизации животных против гормона лгвг - RU2147307C1
Код документа: RU2147307C1
Чертежи





Описание
Данное изобретение относится к пептиду, пригодному для получения вакцины, эффективной против гормона, высвобождающего лютеинизирующий гормон, или ЛГ-рилизинг-фактора (ЛГВГ, или ЛГРФ, также называемого Гонадотропин-высвобождающим гормоном, ГнВГ). Далее данное изобретение относится к иммуногенным композициям и вакцинам или лекарственным препаратам (вакцинам и фармацевтическим препаратам) на основе такого пептида и применению такой вакцины или медицинского препарата в способе иммунизации млекопитающего против ЛГВГ и тем самым воздействия на репродуктивные или поведенческие характеристики этого млекопитающего и в способе улучшения качества мяса свиней.
ЛГВГ представляет собой небольшой, состоящий из 10 аминокислот пептид (декапептид) из гипоталамуса. Аминокислотная последовательность (как обычно, с амино-концевой аминокислотой слева и карбокси-концевой аминокислотой справа) ЛГВГ соответствует формуле, в которой аминокислоты кодируются трехбуквенным кодом: pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2, или формуле в однобуквенном коде: #EHWSYGLRPG@, где #E обозначает пироглутаминовую кислоту и G@ обозначает глицинамид.
ЛГВГ действует в гипофизе, вызывая увеличение высвобождения биологически активного ФСГ (фолликулостимулирующего гормона) и ЛГ (лютеинизирующего гормона) в кровь, что, в свою очередь, стимулирует развитие яичек в растущих самцах животных и синтез тестикулярных стероидов. В растущих самках животных стимулируется развитие яичников и развитие в них фолликулов, синтез овариальных стероидов и овуляция.
Известно, что ЛГВГ, при связывании с белком-носителем, может быть использован для вакцинации животных. Такая вакцинации может проводиться по различным причинам, которые все связаны с природной функцией ЛГВГ. Как известно, сильное уменьшение в крови ЛГ и ФСГ ингибирует продуцирование тестикулярных стероидов или андрогенов и спермы в яичках самца и образование овариальных стероидов или прогестагенов и эстрогенов и созревание фолликулов в яичнике самки. Такое снижение количеств андрогенов, прогестагенов и эстрогенов в крови до уровня, сравнимого с уровнем, получаемым путем удаления яичек или яичников посредством кастрации, может быть достигнуто эффективной иммунизацией животного против ЛГВГ. В самцах животных после этого во многих случаях семенники, по-видимому, развиваются медленно или вообще не развиваются (нет синтеза андрогенов (мужских стероидных гормонов) и нет образования сперматозоидов) и в самках животных, по-видимому, уменьшается активность яичников (синтез эстрогенов и прогестагенов (женских стероидных гормонов), ингибируются созревание фолликулов и овуляция).
В ветеринарии 100% эффективная иммунизация против ЛГВГ могла бы использоваться для стерилизации, например, небольших домашних животных, таких как кошки и коты, самцы и самки собак, или для снижения агрессивности у самцов собак и быков, просто посредством вакцинации вместо операционного вмешательства, такого как кастрация или овариэктомия. Другими мыслимыми причинами для иммунизации против ЛГВГ являются предотвращение периода течки у самок животных, таких как кошки, собаки и коровы, и беспокойного состояния у самцов животных, откармливаемых для убоя. В медико-санитарной помощи человека иммунизацию против ЛГВГ можно использовать в лечении рака предстательной железы и рака молочной железы и, если требуется, в лечении некоторых форм рака гипофиза.
Другое использование вакцины против ЛГВГ находится в области разведения скота, в частности, откармливания свиней для убоя. Мясо половозрелых свиней (хряков) имеет характерный запах, так называемый привкус хряка или запах хряка. В половозрелой свинье в семенниках образуется много C19-Δ16-стероидов, которые накапливаются в жировой ткани животного (Patterson, J. Sci. Food Agric. 19, 31-38 (1968); Brooks en Pearson, J. Anim. Sci 62, 632-645 (1986); Claus, Zeitschrift. Tierzuchtg. Zuchtungsbiol. 93, 38-47 (1976); Claus, Acta Endocrinol. (Copenh) 91, Suppl. 225, 432-433 (1979)). Эти стероиды в основном ответственны за образование неприятного запаха, подобного запаху мочи, при нагревании мяса (Fuchs, Swedish J. Agric. Res. 1, 233-237 (1971); Bonneau, Livest. Prod. Sci 9, 687-705 (1982)). Благодаря этому неприятному запаху мясо половозрелых самцов свиней с трудом пригодно или вообще непригодно для потребления и непригодно для экспорта. Поскольку примерно 10% самцов забиваемых свиней являются уже половозрелыми перед временем убоя, это потенциально влечет за собой большую потерю для сельскохозяйственного производства.
Для контроля и предотвращения этих потерь почти всех поросят-самцов кастрируют, когда они очень молодые, при помощи хирургической процедуры, которая обычно производится без какой-либо формы анестезии. Кроме аспекта плохого отношения к животным, кастрация приводит также к инфекциям, ингибированию роста и конечному качеству мяса, которое хуже качества мяса интактного животного (по крайней мере, пока интактное животное еще не развило запах хряка) (Walstra, Livest. Prod. Sci. 1, 187-96 (1974)).
Существует альтернатива, которая, кроме того, выгодна для качества мяса и состоит в снижении концентрации ЛГВГ в гипофизе молодого животного посредством иммунизации против ЛГВГ. Такое снижение уровней ЛГВГ приводит к снижению концентраций биологически активных ФСГ и ЛГ, которые, в свою очередь, будут ингибировать развитие семенников в растущих животных и ингибировать синтез тестикулярных стероидов, в том числе C19-Δ16-стероидов. Неприятная для животных кастрация становится необязательной: инфекции и ингибирование роста предотвращаются, тогда конечное качество мяса не хуже, чем после кастрации. Кроме того, этот способ предотвращает появление привкуса хряка в самцах свиней перед временем убоя.
Однако строгим требованием для хорошей вакцины против привкуса хряка является то, что во всех свиньях развитие яичек задерживается до такой степени, что ни в одном случае запах хряка не имеет места до времени убоя, даже если испытания проводятся на большой популяции свиней. Известные вакцинные препараты не удовлетворяют этому требованию.
В существующей литературе и прежних патентных заявках, касающихся противозачаточных свойств вакцин против ЛГВГ, результаты вакцинаций, по-видимому, часто были вариабельными, например, некоторые вакцинированные животные едва ли отвечали на вакцинацию или вообще не отвечали на вакцинацию, или для желаемого эффекта требовались большие дозы в коммерчески неприемлемых адъювантах (Chaffaux et al. ,

Трудность приготовления этого типа вакцин, возможно, заключается в феномене "толерантности" (переносимости). "Собственные" вещества, такие как гормоны, не узнаются, но действительно переносятся иммунной системой. Обычно против собственных веществ не образуются антитела. Следовательно, успешная вакцина должна использовать вещество, достаточно похожее на гормон, но в то же время достаточно "чужеродное" для индуцирования образования антител. Поскольку это представляет собой взаимоисключающие условия, до недавнего времени было неясно, можно ли вообще приготовить такие вещества. Одна попытка получить ЛГВГ-подобные пептидные вакцины состояла в замене Gly в положении 6 ЛГВГ-декапептида правовращающей аминокислотой (D-Tryp; Chaffaux et al.,

Однако было обнаружено, что определенно возможно вызвать эффективный ответ в виде образования антител во всех индивидуумах, вакцинированных против ЛГВГ (Meloen et al., Vaccine 12, 741-746 (1994). В этих экспериментах свиней вакцинировали дважды ЛГВГ-вакциной, которая отличается от "классического" типа ЛГВГ-вакцины (ЛГВГ, связанного с белком-носителем, в адъюванте Фрейнда), а именно тандем-ЛГВГ-вакциной (European patent N 0464124). Согласно этому изобретению тандем-ЛГВГ-вакцины предпочтителен пептид, который отличается тем, что он содержит по меньшей мере две последовательности ЛГВГ в тандеме в соответствии с общей формулой (с амино-концевой аминокислотой слева и карбокси-концевой аминокислотой справа) Z1-Glx-His-Trp1 -Ser-Tyr-Gly-Leu-Arg-Pro [-Gly-X-Gln-His-Trp2-Ser-Tyr-Gly-Leu-Arg-Pro]n -Gly-Z2, где аминокислоты обозначены согласно трехбуквенному коду, Trp1 и Trp2 обозначают триптофан (Trp) или формилированный триптофан (N(индол)-формилтриптофан), n обозначает число не менее 1, X является прямой связью или спейсерной группой между аминокислотами Gly и Gln, Z1-Glx является либо pGlu (пироглутаминовой кислотой), либо Gln, имеющим присоединенный к нему остаток, содержащий одну или несколько дополнительных аминокислот, и Glu-Z2 является либо Gly-NH2, либо Gly, имеющим присоединенный к нему остаток, содержащий одну или несколько дополнительных аминокислот. В этой общей формуле X может быть прямой связью между аминокислотами глицин и глутамин, т. е. эти аминокислоты взаимосвязаны непосредственно без промежуточной связи (через нормальную пептидную связь). Изобретение тандем-ЛГВГ-вакцины включает в себя также пептиды, в которых последовательности ЛГВГ соединены через спейсеры. Природа спейсерной группы может варьировать сильно от одной или нескольких аминокислот до более короткой или более длинной углеводородной цепи и других групп соединений или молекул. В приведенной выше общей формуле Z1-Glx предпочтительно обозначает pGlu (пироглутаминовую кислоту), но может быть также Gln, имеющим присоединенный к нему остаток, содержащий одну или несколько дополнительных аминокислот, например, для использования в соединении этого пептида с белком-носителем. В приведенной выше общей формуле Gly-Z2 обозначает, например, Gly-NH2 или Gly, имеющий присоединенный к нему остаток, содержащий одну или несколько дополнительных аминокислот, например, для использования в связывании этого пептида с белком-носителем. Предпочтительно, Gly-Z2 обозначает Gly-Cys-NH2, причем C-концевой цистеин добавлен в связи с возможным связыванием пептида с белком-носителем.
Более конкретно изобретение тандем-ЛГВГ-вакцины обеспечивает пептид, который содержит по меньшей мере две последовательности ЛГВГ в тандеме согласно общей формуле (с аминоконцевой аминокислотой слева и карбоксиконцевой аминокислотой справа) pGlu-His-Trp1-Ser-Tyr-Gly-Leu-Arg-Pro[-Gly-Gln-His-Trp2- Ser-Tyr-Gly-Leu-Arg-Pro]n-Gly-Cys-NH2, где аминокислоты указаны в соответствии с трехбуквенным кодом. Trp1 и Trp2 представляют собой либо Trp, либо N-формил-Trp и n представляет собой число, имеющее величину по меньшей мере 1.
Эта тандем-ЛГВГ-вакцина, по-видимому, полностью ингибирует рост яичек и развитие продуцирующих стероиды клеток (клеток Лейдига) в яичке. Однако эта вакцина, по-видимому, имеет ряд недостатков, которые делают ее менее пригодной для использования на практике. Одним из недостатков была необходимость использования высокой дозы при вакцинации, чтобы достичь успешной иммунокастрации, по меньшей мере 1 мг на свинью требовался для индукции желаемых ответов, что делает дорогим применение этой вакцины в широком масштабе в свиноводстве.
Другой важный недостаток этого препарата вакцины то, что эта вакцина является такой высокоэффективной только в композиции с полным адъювантом Фрейнда. Применение этого жесткого адъюванта вызывает многие нежелательные побочные эффекты, такие как трудности приготовления и применения, обусловленные его вязкой природой, кроме того, само применение может быть очень болезненным для животного и, наконец, остатки адъюванта и возможное развитие хронических воспалительных реакций на адъювант, таких как связанные с адъювантом абсцессы в мышцах в месте инъекции, могут снижать качество мяса инъецированного животного.
Однако данное изобретение обеспечивает решение проблем нежелательных побочных эффектов вышеописанной вакцинации против ЛГВГ тендем-ЛГВГ-пептидным препаратом без утраты преимуществ эффективной вакцинации тандем-ЛГВГ-пептидом по сравнению с другими существующими вакцинами, направленными против ЛГВГ.
Было показано, что мономерная форма тандем-ЛГВГ-вакцины с полным адъювантом Фрейнда, но при полном отсутствии белка-носителя KLH, была вполне эффективна в блокировании роста яичка и запаха хряка у свиней и что димерные формы тандем-ЛГВГ-вакцины, применяемые без использования полного адъюванта Фрейнда, но с более мягким неполным адъювантом Фрейнда, приводили к вполне высокой эффективности. Неожиданно также оказалось, что принцип тандема, примененный в варианте молекулы ЛГВГ, а именно с заменой шестой аминокислоты Gly декапептида правовращающей аминокислотой (D-), D-Lys, после чего полученный пептид связывали с обычным соединением-носителем (здесь использовали овальбумин), приводил к получению вакцины, которая была очень эффективна в некоторых мягких адъювантах, а именно Спеколе и двойной масляной эмульсии, и, кроме того, была также эффективна в низких дозах. Таким образом, в то время как вакцина с использованием D-аминокислотных замен Gly в положении 6 исходного одиночного декапептида ЛГВГ D-аминокислотой действительно снижала иммуногенность по сравнению с исходной последовательностью ЛГВГ, такие замены D-аминокислотой, примененные к тандем-ЛГВГ-вакцине, были способны генерировать даже более иммуногенные ЛГВГ-вакцинные препараты. Далее можно ожидать, что замены Gly в положении 6 одного или каждого декапептида ЛГВГ, составляющих единицу тандема, другой правовращающей аминокислотой может также приводить к улучшению вакцины. Кроме того, при использовании, например, D-Lys в качестве заменяющей аминокислоты можно достичь димеризации или мультимеризации тандемного пептида без потери возможности конъюгирования пептидной композиции с соединением-носителем. Хотя C-концевые цистеины могут теперь использоваться для димеризации через образование дисульфидной связи и, следовательно, будут недоступными для конъюгации с соединением-носителем, боковые цепи аминокислотных замен все еще могут использоваться для связывания с соединениями-носителями. Конечно, замены другими аминокислотами, которые содержат подходящие боковые цепи (такими как D-Glu, но другие возможные заменяющие аминокислоты, несущие подходящие боковые цепи, также известны среднему эксперту), также позволили бы дополнительные возможности связывания с соединением-носителем.
[D-Lys6] -ЛГВГ был описан в качестве сверхактивного агониста ЛГВГ (Seprodi et al. , J. Med. Chem. 21, 276-280 (1978) и был среди других использован в радиоиммуноанализах ЛГВГ (Heber en Odell, Proc. Soc. Exp. Biol. Med. 158, 643-646 (1978)), в качестве флуоресцирующего лиганда в исследовании ЛГВГ-рецептора (Conn et al., J. Biol. Chem. 256, 1098-1100 (1981); Naor et al., J. Biol. Chem. 256, 3049-3052 (1981); Childs et al., Peptides 4, 549-555 (1983)) и связан с цитотоксическими радикалами для борьбы с ростом раковых опухолей (Szoke et al., Peptides 15, 359-366 (1994). [D-Lys6]-ЛГВГ прежде не использовали в качестве ЛГВГ-вакцины.
Данное изобретение относится к пептиду или пептидной композиции, состоящей по меньшей мере из двух последовательностей ЛГВГ в тандеме, где шестая аминокислота Gly исходной декапептидной последовательности ЛГВГ заменена D-аминокислотой. Gly в положении 6 может быть заменен функциональной аминокислотой, которая, кроме того, содержит боковую цепь, при помощи которой тандемная единица ЛГВГ может связываться с соединением-носителем. Этот пептид может быть или может не быть амидированным на C-конце, в зависимости от используемых способов пептидного синтеза. Кроме того, этот пептид может быть димеризованным или мультимеризованным, и затем по меньшей мере одна из тандемных последовательностей ЛГВГ-пептида в димере или мультимере будет содержать функциональную аминокислотную замену в положении 6 исходного декапептида ЛГВГ.
Пептид или пептидная композиция согласно данному изобретению содержит последовательность, которая может быть описана следующей общей формулой:
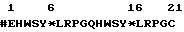
где * указывает возможную замену Gly правовращающей аминокислотой, которая, кроме того, содержит боковую цепь, при помощи которой тандемная единица ЛГВГ может быть связана с соединением-носителем.
Первой особенностью этого изобретения является то, что в этом пептиде или в пептидной композиции может быть произведена замена, например, шестая аминокислота в каждом декапептиде ЛГВГ внутри тандемной единицы, Gly, (следовательно, в положении 6 и/или 16 приведенной выше общей формулы) заменена D-аминокислотой для образования пептида, который достаточно отличается от нормальной последовательности ЛГВГ, чтобы узнаваться иммунной системой без потери надлежащей иммуногенности.
Кроме того, второй особенностью данного изобретения является то, что индивидуальные тандемные единицы димеризованы для дальнейшего усиления их иммуногенности без потери способности связывания пептида или пептидной композиции с белковым соединением-носителем. В этом пептиде или пептидной композиции такая димеризация тандемных единиц может, например, иметь место с использованием карбоксил-конца или амино-конца, две тандемные единицы могут, например, димеризоваться посредством дисульфидного или тиоэфирного мостика. Для этой цели может быть использован Gys в положении 21 или Gys может быть синтезирован перед глутаминовой кислотой в положении 1, но и другие способы димеризации или полимеризации ЛГВГ-тандемных единиц также могут быть найдены в предшествующем уровне знаний. В случае, когда димеризация или полимеризация приводит к потере доступных сайтов, с которыми мог бы конъюгироваться белок-носитель, достаточно ограничить выбор D-аминокислот, заменяющих Gly в положение 6 и/или 16, аминокислотой с подходящей боковой цепью. Такой заменяющей аминокислотой может быть, например, D-Lys, D-Glu или другая правовращающая аминокислота, содержащая боковую цепь, которая делает возможным связывание с соединением-носителем.
Более конкретно примером такого предпочтительного пептида согласно данному изобретению является D-Lys6
-тандем-ЛГВГ-димер следующей формулы:

*=D-Lys
Другим конкретным примером такого предпочтительного пептида согласно данному изобретению является D-Glu6-тандем-ЛГВГ-димер следующей формулы:

* = D-Glu
Но другие пептиды или пептидные композиции, в которых мономеризованные, димеризованные или полимеризованные тандемные ЛГВГ-единицы содержат D-аминокислотные замены в положениях 6 и/или 16 (как в последних двух примерах, касающихся димерных форм) и в положениях 27 и/или 37, являются также частью данного изобретения.
Далее данное изобретение раскрывает композицию, которая содержит эффективное количество пептида в иммуногенной форме. Специалистам известно, что существуют различные способы приведения вещества, которое само по себе не является иммуногенным, в иммуногенную форму. Первой возможностью является связывание пептида данного изобретения с подходящим белком-носителем. В тандемном пептиде для химического связывания можно использовать цистеин при N-конце или C-конце. В тандем-димерном пептиде связывание может быть осуществлено с использованием обыкновенной или модифицированной боковой цепи D-лизина, D-глутамина или любой другой модифицированной аминокислоты, заменяющей глицин в положении 6 и/или 16 и/или 27, и/или 37. Специалисты в данной области прекрасно знают, какие способы связывания и какие белки-носители являются подходящими. Согласно данному изобретению предпочтительна композиция, которая содержит иммуногенный конъюгат белка, такого как овальбумин, и пептида или пептидной композиции согласно данному изобретению. Конечно, вакцинный препарат данного изобретения может быть объединен по меньшей мере с одним адъювантом. Подходящие иммуноадъюванты известны специалистам в данной области. Предпочтительным адъювантом согласно данному изобретению может быть Спекол или двойная масляная эмульсия, но также могут использоваться другие адъюванты, которые не проявляют побочных действий или проявляют лишь мягкие побочные действия. Данное изобретение можно использовать в способах иммунизации индивидуумов, выбранных из широкого диапазона позвоночных, но, более конкретно, млекопитающих, против ЛГВГ. Иммунизацию против ЛГВГ можно было бы, например, использовать для стерилизации, например, домашних животных, таких как самцы и самки кошек и собак, или для лечения агрессивности у самцов-собак и быков. Другими мыслимыми причинами для иммунизации против ЛГВГ согласно данному изобретению являются предотвращение течки у самок животных, таких как собаки, кошки и коровы, и предотвращение или лечение беспокойного поведения в самцах животных, откармливаемых на убой. В медико-санитарной помощи человека, иммунизацию против ЛГВГ можно использовать в лечении рака предстательной железы и рака молочной железы и, если требуется, в лечении некоторых форм рака гипофиза.
Предпочтительным вариантом является способ улучшения качества мяса свиней, в котором свиней вакцинируют вакцинным препаратом в соответствии с данным изобретением. Далее изобретение иллюстрируется следующей экспериментальной частью.
Примеры.
Вакцинацию хряков считают успешной, если вес яичка при забое меньше 150 граммов. Целью является явно небольшие яички у всех животных в группе, получившей вакцинацию. Вес яичка, по-видимому, прямо коррелирует с продуцированием тестостерона и стероидов привкуса хряка. Когда вес яичка меньше 60 граммов, яички были полностью неактивными (Meloen et al., Vaccine 12, 741 - 746 (1994)) и в сыворотке нельзя было определить тестостерон. Мы сообщали, что существует превосходная корреляция между размером и особенно весом яичек и уровнем андростенона в хребтовом шпике (Oonk et al., Livest. Prod. Sci. 42, 63 - 71 (1995)). По-видимому яички иммунизированных животных с весом менее 150 граммов являются ясным указанием на отсутствие привкуса хряка.
Андростенон в хребтовом шпике обычно присутствует в недетектируемых низких концентрациях, но, если он присутствует, то всегда в концентрации, меньшей 0,5 мкг/г хребтового шпика. Эту величину в литературе называют безопасным нижним пределом для возможного восприятия привкуса хряка, хотя другие исследователи сообщают 1 мкг/г хребтового шпика как достаточно низкий показатель. Мы принимаем самую низкую величину в качестве нижнего предела, ниже которого мы считаем свинью достаточно иммунокастрированной. Это основано на измерениях у более, чем 100 свиней. Веса яичек контрольных животных в наших экспериментах были, по-видимому, в пределах 200 - 350 граммов. Наконец, превращение корма и отношение мясо/жир, по-видимому, улучшены в иммунокастратах по сравнению с боровами (хирургически кастрированными в молодом возрасте).
Способы.
Синтез пептидов проводили на пептидном синтезаторе ABI 430A с использованием циклов FastMoc на шкале 0,25 ммоль с временами циклов приблизительно 60 минут (Fields CG, Lloyd DH, Мacdonald RL, Otteson KM, Noble RL HBTU activation for automated Fmoc solid-phase peptide synthesis. Peptide Research 4, 95 - 101 (1991); User Bulletin N 32, Applied Biosystems (1990)).
Очистка пептидов. Очистки проводили с использованием системы Waters PrepLC4000, снабженной Waters PrepPak Cartridge (25 мм х 100 мм), заполненной Delta-Pak C18 (15 мкм, 100А), и предохранительной колонкой.
Для аналитической ВЭЖХ мы использовали два насоса Waters model 510, регулятор градиента Waters model 680, автоинжектор Waters model WISP 712 и Waters фотодиодный детектор проб model 991. Продукты анализировали в линейном градиенте от воды с 0,1% ТФК до 60% ацетонитрила в воде с 0,1% ТФК в течение 60 минут на колонке Waters Delta Pak C18-100A (3,9 x 150 мм, 5 мкм) при 1 мл/мин, при 215 нм. Все продукты имели чистоту более 95% согласно площади пика.
Аминокислотный анализ выполняли при помощи системы Waters PicоTag. Результаты согласовались с ожидаемыми величинами в соответствии с аминокислотными последовательностями.
Процедура димеризации. Продукт димеризовали растворением продукта в 20% диметилсульфоксиде в воде. pH должен быть доведен до 5-6 1% или 2% NH4HCO3. Раствор должен оставаться прозрачным. Слишком высокий pH можно корректировать 1 - 10% уксусной кислотой. Раствор перемешивают при комнатной температуре в течение по меньшей мере 5 часов. Продукт очищали сразу при помощи ВЭЖХ.
Конъюгирование D-Lys6-тандем-димера с овальбумином: (Используемые эквиваленты масс: 1 мг овальбумина и 1 мг D-Lys6-тандем-димера сопрягали с использованием 10 мг ECDI в milliQ-water). Сначала как пептид, так и овальбумин растворяли в milliQ-воде (A = раствор пептида; B = раствор овальбумина). A и B хорошо смешивали. Затем растворяли в milliQ-воде 10-кратный избыток, на основе весовых эквивалентов, карбодиимида ( C = раствор ECDI). Затем медленно добавляли C к раствору A + B при постоянном перемешивании. После 6 часов продукт диализовали (отсечение мол. массы 10000) против воды.
Определение нагрузки. Нагрузку рассчитывают из сравнительного аминокислотного анализа конъюгата и отдельно пептида и белка-носителя. Согласно аминокислотным анализам конъюгаты содержат приблизительно 0,5 мг пептида на мг овальбумина.
Приготовление вакцины. Вакцины готовили смешиванием пептида с адъювантом (см. детали в Specol).
Адъюванты, которые были испытаны: полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IFA), Specol-масло и двойная масляная эмульсия (д. м. э.).
- CFA или IFA смешивали 1:1 с раствором пептида до получения стабильной эмульсии. - Двойная
масляная эмульсия (W/O/W):
10 частей первой водной фазы: антигена в PBS (забуференном фосфатом физиологическом растворе);
11 частей масляной фазы: Marcol 52 (Esso) с 10% моноолеатом
маннида ("Arlacel");
10 частей второй водной фазы: PBS с 2% Montanox 80 (=Твин 80).
- Specol (cпециальная масляная фаза) представляет собой продукт, пригодный для получения эмульсий типа вода в масле для целей исследования. Состав: на 10 мл: 0,453 г Твина 85 (ICI), 0,532 г Span 85 (ICI), 9 мл Marcol 52 (Esso Belgium).
Приготовление эмульсий в Specol. Смешать 4 части водной фазы, содержащей антиген, с 5 частями Specol (об./об.), добавляя водную фазу очень медленно к масляной фазе (Specol) при интенсивном перемешивании, например, ультратурраксом (перемешивание вортексом является слишком мягким). По возможности не допускать введения воздуха. Использовать чистую стеклянную посуду, не содержащую детергентов. Хранение: Specol предпочтительно хранят между 4 - 8oC (B. A. Bokhout et al., Vet. Immunol. Immunopathol. 2, 491 - 500 (1981); W. Hall et al. , Vet. Immunol. Immunopathol. 22, 175 - 186 (1989); W. J. A. Boersma et al., Res. Immunol. 143, 503 - 511 (1992)).
Протокол вакцинации. Для каждой вакцины и на одно животное 1 мг пептида (рассчитанного из нагрузки) или меньшее количество, как указано, приготовленного, как описано выше, растворяли в 1 мл забуференного фосфатом физиологического раствора и эмульгировали с указанным адъювантом. Интактные самцы свиней имели возраст приблизительно 10 недель в начале эксперимента, когда они получали первую вакцинацию. Бустер-инъекция спустя 8 недель после первой вакцинации имела тот же самый состав.
Оценка. Размер яичек свиньи измеряли наружно при помощи циркуля. Начиная приблизительно с 12 недель после первой вакцинации, размер яичек не увеличивается далее (или даже уменьшается) у свиней с пониженной концентрацией ДГВГ. Брали пробы сыворотки для определения титров антител против ЛГВГ и тестостерона. Антитела против ГнВГ определяли путем связывания серийных разведений антисывороток свиней с125ЛГВГ. Животных забивали через 16 недель после первой вакцинации. После убоя яички взвешивали и брали пробу хребтового шпика для определения вызывающего привкус хряка стероида андростенона при помощи ELISA (Ridascreen). Кроме того, оценивали качество мяса.
Эксперимент 1 (см. табл. 1)
В этих экспериментах различные пептидные конструкции испытывали в неконъюгированной форме.
Каждый пептид вводили дважды при возрасте свиней 10 и 18 недель в количестве 1 мг с применением IFA в качестве адъюванта. Испытанными конструкциями были карбокси-концевой димеризованный ЛГВГ-мономер,
карбокси-концевой димеризованный ЛГВГ-тандем, амино-концевой димеризованный ЛГВГ-тандем, карбокси-концевой димеризованный [D-Nal(2)6]-ЛГВГ (Nafarelin®)-мономер,
карбокси-концевой димеризованный [D-Nal(2)6] -ЛГВГ(Nafarelin®) тандем, карбокси-концевой димеризованный [D-Lys6]-ЛГВГ-мономер и карбокси-концевой
димеризованнывй [D-Lys6]-ЛГВГ-тандем.
1) Пептидная формула C-мономер-ЛГВГ-димера:

2) Пептидная формула C-тандем-ЛГВГ димера:
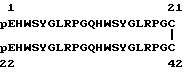
3) Пептидная формула N-тандем-ЛГВГ-димера:

4) Пептидная формула [D-Nal(2)6]-мономер-ЛГВГ-димера:

*=[3-(2-нафталенил)-D-аланин]
5) Пептидная формула [D-Nal(2)6 ]-тандем-ЛГВГ-димера:

*=[3-(2-нафталенил)-D-аланин]
6) Пептидная формула [D-Lys6]-мономер-ЛГВГ-димера:

*=[D-лизин]
7) Пептидная формула [D-Lys6]-тандем-ЛГВГ-димера:
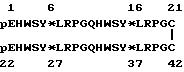
*=[D-лизин]
В группах 2, 3 и 7 70-80% животных, по-видимому, были успешно иммунокастрированы. В этих респондерах наибольший вес измеренного яичка был 86 г, тогда как не отвечающие на иммунизацию животные имели вес яичка 193 г или более. Из этих результатов видно, что замена полного адъюванта Фрейнда неполным адъювантом Фрейнда в формуле с неконъюгированным пептидом приводит к потере эффективности. Кроме того, особенно очевидно, во-первых, что принцип тандема является существенным для активности вакцины, и, во-вторых, что димеризация может иметь место через карбокси- или через амино-конец, и, в-третьих, что не всякая аминокислотная замена допустима, в связи с отсутствием эффективности Nafarelin®-аналога в качестве вакцины.
Эксперимент 2 (см. табл. 2)
Уже известную удачную
вакцину на основе тандем-ЛГВГ-пептида, соединенного с гемоцианином лимфы улитки (KLH), в CFA для первой и в IFA для второй вакцинации испытывали без конъюгирования с белком-носителем, в одиночной и
димеризованной форме, в CFA/IFA и в 2 х IFA, и в дозе 1 мг и 100 мкг. Свиней вакцинировали дважды в возрасте 10 и 18 недель.
1) Пептидная формула тандем-ЛГВГ:

2) Пептидная формула тандем-ЛГВГ-димера:

Вакцина тандем-ЛГВГ в одиночной или димеризованной форме является фактически, по-видимому, вполне эффективной, даже при полном отсутствии белка-носителя KLH в ингибировании роста яичек и привкуса хряка у свиней. Однако важным недостатком этой вакцины является то, что очень высокая эффективность достигается только в композиции с полным адъювантом Фрейнда и в высокой дозе. Кроме того, разумные титры антител против ЛГВГ (выраженные как % связывания сывороток, взятых при 8 неделях после вакцинации) достигались только с тандем-ЛГВГ или тандем-ЛГВГ-димером в CFA/IFA при дозе 1 мг.
Эксперимент 3 (см. табл. 3)
Влияние конъюгации с белком-носителем испытывали в сочетании с заменой IFA более мягкими адъювантами Спеколом и двойной
масляной эмульсией (д.м.э. ). Димеризованный тандем-ЛГВГ-пептид с заменой глицина D-лизином в положениях 6, 16, 27 и 37 конъюгировали с овальбумином и эмульгировали в двух различных адъювантах,
Спеколе и двойной масляной эмульсии. Свиней вакцинировали дважды, в возрасте 10 и 18 недель, 1 мг пептид-конъюгата в адъюванте. Эффективность сопряжения равна 50%, следовательно, количество введенного
антигена фактически равно 500 мкг.
Пептидная формула [D-Lys6]-тандем-ЛГВГ-димера

*=[D-лизин]
Эксперимент 4 (см. табл. 4)
После этого в ряде экспериментов мы исследовали, до какой степени можно было бы снизить вводимую дозу. Пептидным антигеном был [D-Lys6]-тандем-ЛГВГ-димер. Он был связан с овальбумином и этот конъюгат вводили в виде эмульсии в адъюванте Specol. Свиней вакцинировали дважды в возрасте 10 и 18 недель.
С использованием конъюгата [D-Lys6]-тандем-ЛГВГ-димер-овальбумин в Спеколе может быть достигнуто заметное снижение дозы вакцины, требующейся для положительного эффекта. Для 43 свиней, вакцинированных 125 мкг конъюгата (что равно 62,5 мкг пептида), эффективность была 100%. В хребтовом шпике свиней с яичками весом менее 150 г ни в одном случае не измеряли более 0,5 мкг андростенона/г хребтового шпика (Oonk et al., Livest. Prod. Sci. 42, 63-71 (1995)); в большинстве случаев концентрации адростенона даже ниже уровня детектирования в ELISA (0,111 мкг/г хребтового шпика). С дозами 10-100 мкг конъюгата существует повышенный риск для не отвечающих на вакцинацию животных, и дозы менее 10 мкг не являются эффективными. Титры антител против ЛГВГ сравнимы только внутри эксперимента. Результаты ясно показывают, что низкие дозы вакцины способны индуцировать сходные титры относительно титров при высоких дозах, в противоположность результатам, полученным с использованием тандем-ЛГВГ или тандем-ЛГВГ-димера. В эксперименте более низкие средние титры и более высокие стандартные квадратичные отклонения объясняются присутствием в группе свиней, не полностью отвечающих или не отвечающих на вакцину.
Эксперимент 5 (см. табл. 5)
В контрольных группах интактных хряков определяли вес яичек и андростенон.
Как сообщалось ранее Oonk et al., Livest. Prod. Sci. 42, 63-71 (1995), концентрация андростенона сильно варьирует в отдельных интактных взрослых самцах свиней.
Реферат
Изобретение относится к вакцинному препарату модифицированного тандем-ЛГВГ-пептида. Тандемный ЛГВГ-пептид может быть переведен в тандем-димерную форму. Обе формы пригодны для производства вакцины, эффективной против ЛГВГ (лютеинизирующий гормон высвобождающего гормона), также называемого ГнВГ (гонадотропин высвобождающим гормоном), для иммунологической кастрации, для ингибирования репродуктивных функций или для воздействия на репродуктивные функции, или для воздействия на поведение позвоночных в целом и, в частности, домашних животных и человека. Описывается пептид, который содержит, по меньшей мере, две смежные тандемные декапептидные последовательности ЛГВГ согласно общей формуле (где N-концевая аминокислота расположена слева, а С-концевая - справа): Z1-Glx-His-Trp1-Ser-Tyr-Gly-Leu-Arg-Pro[-Gly-X-Gln-His-Trp2-Ser-Tyr-Gly-Leu-Arg-Pro]n-Gly-Z2, в которой аминокислоты обозначаются соответственно трехбуквенному коду, Trp1 и Trp2 соответствуют триптофану (Trp) или формилированному триптофану (N-(индoл)-фopмил-тpиптoфaн), n означает число, имеющее значение, по меньшей мере 1, Х представляет собой либо прямую связь, либо спейсерную группу между аминокислотами Gly и Gln, Z1-Glx представляет собой либо pGlu (пируглутаминовая кислота), либо Gln, привязанный, кроме того, к хвосту, включающему в себя одну или более добавочных аминокислот. Аминокислота глицин в положении 6, по меньшей мере, одного из составляющих декапептидов ЛГВГ заменен правовращающей аминокислотой. Описываются также иммуногенная композиция и вакцина на основе пептида, способ иммунизации животных против гормона ЛГВГ. 4 с. и 9 з.п. ф-лы, 5 табл.
Формула
Z1-Glx-His-Trp1-Ser-Tyr-Gly-Leu-Arg-Pro[-Gly-X-Gln-His-Trp2-Ser-Tyr-Gly-Leu-Arg-Pro]n-Gly-Z2,
в которой аминокислоты обозначаются соответственно трехбуквенному коду;
Trp1 и Trp2 соответствуют триптофану (Trp) или формилированному триптофану (N-(индол)-формил-триптофан);
n означает число, имеющее значение, по меньшей мере, 1;
X представляет собой либо прямую связь, либо спейсерную группу между аминокислотами Gly и Gln;
Z1-Glx представляет собой либо pGlu (пироглутаминовая кислота), либо Gln, привязанный, кроме того, к хвосту, включающему в себя одну или более добавочных аминокислот,
отличающийся тем, что аминокислота глицин в положении 6, по меньшей мере, одного из составляющих декапептидов ЛГВГ заменен правовращающей аминокислотой с боковой цепью, которая может быть связана с соединением-носителем.

в которой аминокислоты обозначаются соответственно однобуквенному коду, где аминокислота * в положениях 6 или 16 является правовращающей аминокислотой, такой как D-лизин или D-глутамин, которая может быть связана с соединением-носителем.

где аминокислота * в положениях 6, или 16, или 27, или 37 является D-лизином или D-глутамином, которая может быть связана с соединением-носителем.

где аминокислота * в положениях 6, или 16, или 27, или 37 является D-лизином или D-глутамином, которая может быть связана с соединением-носителем.

Комментарии