Антисмысловые олигонуклеотиды андрогенового рецептора - RU2753966C2
Код документа: RU2753966C2
Чертежи
















Описание
Изобретение относится к производным пептид-нуклеиновых кислот, направленно взаимодействующим с пре-мРНК андрогенового рецептора, для лечения дерматологических показаний или состояний, опосредованных андрогенной активностью, и по нему испрашивается приоритет временной заявки на патент США 62/372035, поданной 8 августа 2016 года, которая полностью включена в настоящее описание посредством отсылки.
Уровень техники
Алопеция является заболеванием, характеризующимся первоначальным выпадением волос и поредением волос на голове. Андрогенная алопеция, также называемая "облысением по мужскому типу", вызвана выраженной андрогенной активностью в волосяных фолликулах и окружающей ткани.
Хотя андрогенная алопеция поражает как мужчин, так и женщин, нарушение часто проявляется у мужчин и женщин по-разному. Мужчины обычно подвержены точечному облысению, а у женщин с более высокой вероятностью наблюдается полное поредение волос на волосистой части головы. Распространенность андрогенной алопеции у мужчин в возрасте 30-50 составляет приблизительно 58% [J. Invest. Dermatol. vol 9, 296-300 (1997)]. Андрогенная алопеция вызвана изменениями мужских стероидных гормонов, известных как андрогены [New Engl. J. Med. vol 341, 491-7 (1999); Mol. Cell Endocrinol. vol 198, 89-95 (2002)].
Андрогены системно регулируют выделение кожного сала в сальных железах, рост волос в волосяных фолликулах, либидо и так далее. Андрогены стимулируют постепенную трансформацию мелких пушковых фолликулов, превращая непигментированные, тонкие и короткие волосы в некоторых областях в более крупные терминальные фолликулы (например, на лице). В отличие от этого действия андрогенов на терминальные фолликулы, тем не менее, постепенная регрессия терминальных волосяных фолликулов в пушковые фолликулы происходит на висках и макушке головы, что часто называют 'андрогенным парадоксом' [Expert Opin. Drug Discov. vol 10, 269-292 (2015)]
Андрогенная алопеция и ДГТ: 5α-редуктаза восстанавливает тестостерон в 5α-дигидротестостерон (ДГТ), более активный и эффективный андроген, чем тестостерон. Существенное увеличение продукции ДГТ в лобных анагенных волосяных фолликулах наблюдали у молодых лысеющих мужчин по сравнению с нелысеющими мужчинами [(Ind. J. Dermatol. Vene. Leprol. vol 79, 613-625 (2013)]. Мужчины с андрогенной алопецией обычно имеют более низкий уровень "общего тестостерона", чем мужчины без андрогенной алопеции. С другой стороны, уровень ДГТ у мужчин с андрогенной алопецией выше, чем у мужчин без андрогенной алопеции. ДГТ образуется из тестостерона под действием 5α-редуктазы. У мужчин с андрогенной алопецией 5α-редуктаза в волосяных фолликулах экспрессируется на более высоком уровне, чем у мужчин без андрогенной алопеции. ДГТ в высокой степени ответственен за миниатюризацию волосяных фолликулов и, следовательно, андрогенную алопецию [Endocrinology, vol 151, 2373-2380 (2010)].
Финастерид и дутастерид ингибируют 5α-редуктазу, и таким образом, снижают уровень ДГТ, доступный для андрогеновых рецепторов в волосяных фолликулах и окружающей ткани. Эти два низкомолекулярных ингибитора применяли для лечения облысения по мужскому типу, несмотря на нежелательные явления, вызванные снижением системной андрогенной активности. Неблагоприятные явления включают половую дисфункцию, головокружение, слабость, головную боль, насморк, кожную сыпь и так далее [New Engl. J. Med. vol 362, 1237-8 (2010)].
Антагонист АР для наружного применения: Андрогены проявляют свою фармакологическую активность при связывании с андрогеновым рецептором (АР). Антагонисты АР связываются с АР и ингибируют физиологическую функцию андрогенов и, следовательно, могут применяться для лечения андрогенной алопеции при правильной доставке в волосяные фолликулы и окружающую ткань. Чтобы избежать побочных эффектов, вызванных ингибированием системной андрогенной активности, антагонисты АР наносят топически, непосредственно на ткань волосистой кожи головы.
Кетоконазол обладает слабой антагонистической активностью в отношении АР, в дополнение к его известной противогрибковой активности. Шампунь, содержащий 2% кетоконазола (под коммерческим зарегистрированным патентованным названием Низорал®), использовали для наружного лечения андрогенной алопеции [J. Dermatol. Sci. vol 45(1), 66-68 (2007)].
Топилутамид представляет собой антагонист АР, известный как флуридил. Топилутамид выпускается в виде 2% топического состава, предназначенного для лечения андрогенной алопеции, в ряде европейских стран под товарным наименованием "Эвкапил" [Dermatol. Surg. vol 28 (8), 678-685 (2002)]
Белок или мРНК АР в волосяных фолликулах: У участвующих в исследовании мужчин и женщин с андрогенной алопецией обнаружили, что экспрессия АР была выше в лобных волосяных фолликулах, чем в затылочных волосяных фолликулах [J. Investig. Dermatol. vol 109, 296-300 (1997)]. Если средство селективно снижает экспрессию АР в волосяных фолликулах и окружающей ткани, такое средство может безопасно лечить андрогенную алопецию, не приводя к нежелательным явлениям, вызванным системным снижением андрогенной активности. В других источниках женщины с андрогенной алопецией, как было установлено, показали более высокий уровень мРНК АР в лобных и теменных волосяных фолликулах, чем в затылочных волосяных фолликулах [Genetics Mol. Res. vol 12 (2), 1834-1840 (2013)].
Рибосомный синтез белка: Белки кодируются ДНК (нуклеиновой кислотой, содержащей 2-дезоксирибозу). В ответ на клеточную стимуляцию, ДНК транскрибируется с получением пре-мРНК (пре-матричной рибонуклеиновой кислоты) в ядре. Интроны пре-мРНК ферментативно вырезаются с получением мРНК (матричной рибонуклеиновой кислоты), которая затем перемещается в цитозольный компартмент. В цитозоле комплекс аппарата трансляции, называемый рибосомой, связывается с мРНК и производит синтез белка при считывании генетической информации, кодируемой в мРНК [Biochemistry vol 41, 4503-4510 (2002); Cancer Res. vol 48, 2659-2668 (1988)].
Олигонуклеотид, связывающийся с РНК сиквенс-специфическим образом (т.е. комплементарно), называют антисмысловым олигонуклеотидом (АСО). АСО может прочно связываться с мРНК и ингибировать синтез белка рибосомой с мРНК в цитозоле. АСО должен присутствовать в клетке, чтобы ингибировать рибосомный синтез белка своего белка-мишени.
Процесс сплайсинга: ДНК транскрибируется с получением пре-мРНК (пре-матричной рибонуклеиновой кислоты) в ядре. Затем пре-мРНК процессируется в мРНК после удаления интронов в последовательности сложных реакций, совокупно называемых "сплайсингом", как схематично представлено на диаграмме ниже [Ann. Rev. Biochem. 72(1), 291-336 (2003); Nature Rev. Mol. Cell Biol. 6(5), 386-398 (2005); Nature Rev. Mol. Cell Biol. 15(2), 108-121 (2014)].
Сплайсинг инициируется при образовании "E-комплекса сплайсомы" (т.е. раннего комплекса сплайсомы) между пре-мРНК и адаптерными факторами сплайсинга. В "E-комплексе сплайсомы", U1 связывается с соединением экзона N и интрона N, а U2AF35 связывается с соединением интрона N и экзона (N+1). Таким образом, соединения экзона/интрона или интрона/экзона очень важны для формирования раннего комплекса сплайсомы. "E-комплексе сплайсомы" трансформируется в "комплекс сплайсомы" после дополнительного связывания комплекса с U2. "A-комплекс сплайсомы" подвергается ряду сложных реакций с удалением или вырезанием интрона для соединения соседних экзонов.

Антисмысловое ингибирование сплайсинга: В ядре АСО может прочно связываться с определенным положением в пре-мРНК и может препятствовать процессу сплайсинга пре-мРНК в мРНК, с образованием полноразмерной мРНК или варианта(ов) мРНК, не содержащих целевой экзон. Такая мРНК, называемая "сплайс-вариантом(ами)", кодирует белок(ки) меньшего размера, чем белок, кодируемый полноразмерной мРНК.
В принципе, сплайсинг может быть прерван при ингибировании образования "E-комплекса сплайсомы". Если АСО прочно связывается с соединением (5'→3') экзон-интрона, т.е. "5'-сайтом сплайсинга", АСО блокирует образование комплекса между пре-мРНК и фактором U1, и, следовательно, образование "E-комплекса сплайсомы". Аналогичным образом, "E-комплекс сплайсомы" не может образовываться, если АСО прочно связывается с соединением (5'→3') интрона-экзона, т.е. "3'-сайтом сплайсинга".
Неприродные олигонуклеотиды: ДНК или РНК олигонуклеотид подвержен деградации эндогенными нуклеазами, что ограничивает их терапевтическое применение. На сегодняшний день было разработано и подробно изучено большое количество неприродных олигонуклеотидов [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)]. Было обнаружено, что некоторые из них демонстрируют долговременную метаболическую стабильность по сравнению с ДНК и РНК. Ниже представлены химические структуры нескольких типичных неприродных олигонуклеотидов. Такой олигонуклеотид предсказуемо связывается со своей комплементарной нуклеиновой кислотой, как ДНК или РНК.
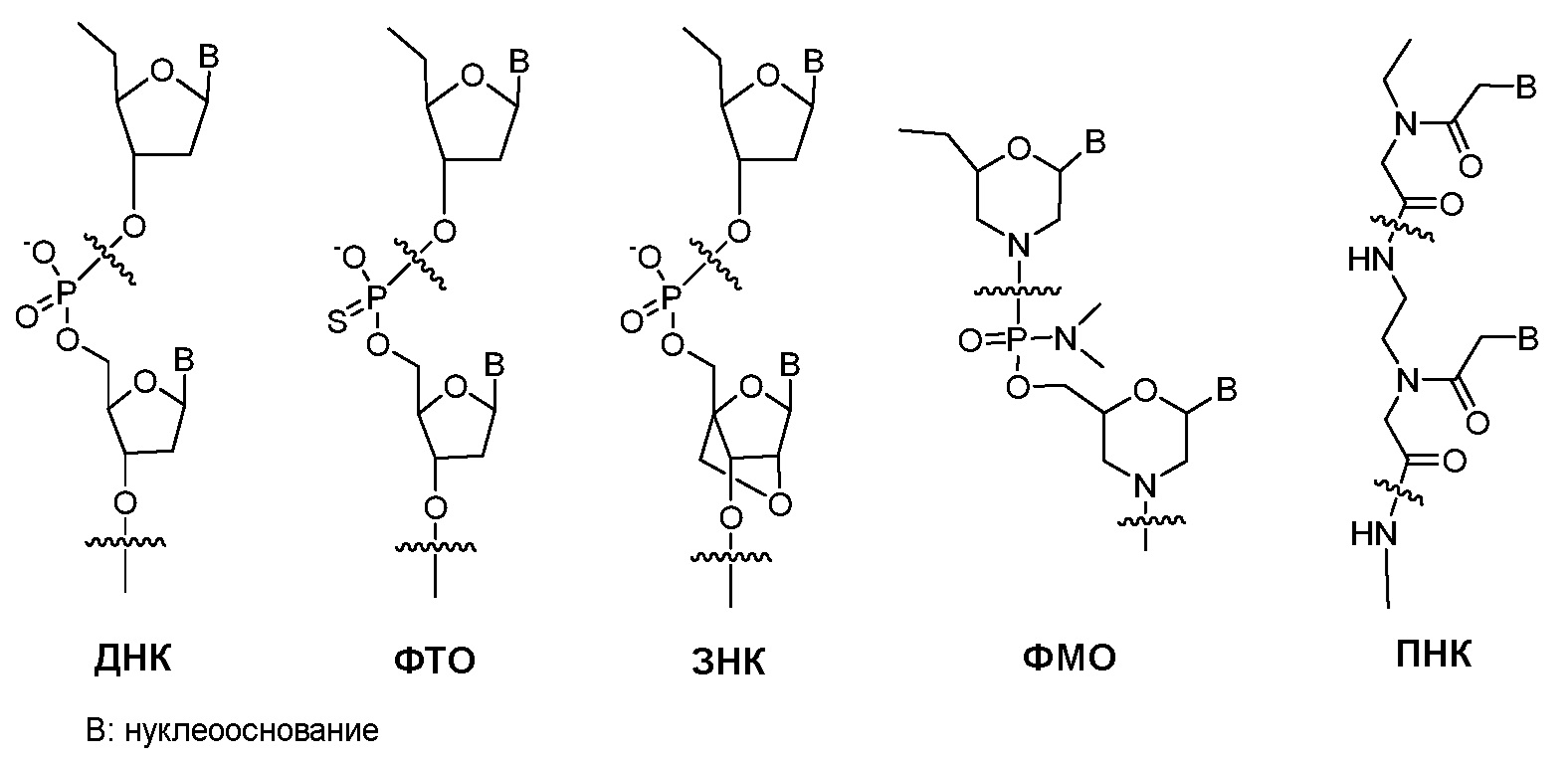
Фосфотиоатный олигонуклеотид: Фосфотиоатный олигонуклеотид (ФТО) является аналогом ДНК, в котором один из атомов кислорода фосфатного скелета заменен атомом серы на каждый мономер. Такое небольшое структурное изменение делает ФТО сравнительно устойчивым к деградации нуклеазами [Ann. Rev. Biochem. vol 54, 367-402 (1985)].
Отражая структурное подобие скелета ФТО и ДНК, они плохо проникают через клеточную мембрану в большинство типов клеток млекопитающих. Однако в некоторых типах клеток с высокой экспрессией переносчика(ов) ДНК, ДНК и ФТО показывают хороший захват клеткой. При системном введении ФТО, как известно, легко распределяются в печени и почках [Nucleic Acids Res. vol 25, 3290-3296 (1997)].
Чтобы повысить проницаемость клеточной мембраны для ФТО in vitro, широко использовали липофектин. Однако липофектин физически изменяет мембрану клеток, вызывая цитотоксичность, и поэтому не был бы безопасным при длительном терапевтическом применении.
За последние 30 лет антисмысловые ФТО и варианты ФТО проходили клиническую оценку для лечения онкологических заболеваний, иммунологических нарушений, нарушений обмена веществ и так далее [Biochemistry vol 41, 4503-4510 (2002); Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)]. Многие из таких кандидатных антисмысловых лекарственных средств не удалось успешно внедрить, отчасти из-за плохой проницаемости клеточной мембраны для ФТО. Чтобы преодолеть плохую проницаемость мембраны, ФТО требуется вводить в более высокой дозе для терапевтической активности. Однако ФТО, как известно, связаны с дозолимитирующей токсичностью, включающей увеличение времени коагуляции, активацию комплемента, канальцевую нефропатию, активацию клеток Купфера и иммунную стимуляцию, в том числе спленомегалию, лимфоидную гиперплазию, инфильтрацию мононуклеарных клеток [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)].
Было обнаружено, что многие антисмысловые ФТО демонстрировали надлежащую клиническую активность в отношении заболеваний со значительным вкладом печени или почек. Мипомерсен является аналогом ФТО, который ингибирует синтез апоB-100, белка, участвующего в транспорте холестерина ЛПНП. Мипомерсен показал достаточную клиническую активность в определенной группе пациентов с атеросклерозом, скорее всего из-за своего предпочтительно распределения в печени [Circulation vol 118(7), 743-753 (2008)]. ISIS-113715 является антисмысловым ФТО аналогом, ингибирующим синтез протеинтирозинфосфатазы 1B (PTP1B), и, как было обнаружено, демонстрировал терапевтическую активность у больных диабетом II типа [Curr. Opin. Mol. Ther. vol 6, 331-336 (2004)].
Запертая нуклеиновая кислота: В запертой нуклеиновой кислоте (ЗНК) кольцо рибозы скелета РНК структурно затруднено для увеличения аффинности связывания с РНК или ДНК. Таким образом, ЗНК может рассматриваться как высокоаффинный аналог ДНК или РНК [Biochemistry vol 45, 7347-7355 (2006)]. Как и ФТО, ЗНК также демонстрирует низкую способность проникать через клеточную мембрану.
Фосфодиамидатный морфолиновый олигонуклеотид: В фосфодиамидатном морфолиновом олигонуклеотиде (ФМО) скелетный фосфат и 2-дезоксирибоза ДНК заменены фосфоамидитом и морфолином, соответственно [Appl. Microbiol. Biotechnol. vol 71, 575-586 (2006)]. Тогда как скелет ДНК отрицательно заряжен, скелет ФМО не заряжен. Таким образом, связывание между ФМО и мРНК исключает электростатическое отталкивание между скелетами и является более сильным, чем между ДНК и мРНК. Так как ФМО структурно сильно отличается от ДНК, ФМО не распознается переносчиком(ами) в печени, распознающими ДНК или РНК. Однако ФМО также не способен с легкостью проникать через клеточную мембрану.
Пептидо-нуклеиновая кислота: Пептидо-нуклеиновая кислота (ПНК) представляет собой полипептид с N-(2-аминоэтил)глицином в качестве звеньев скелета и была открыта доктором Нильсеном с коллегами [Science vol 254, 1497-1500 (1991)]. Химическая структура и сокращенная номенклатура прототипа ПНК показана на изображении, предоставленном ниже. Как ДНК и РНК, ПНК также селективно связывается с комплементарной нуклеиновой кислотой [Nature (London) vol 365, 566-568 (1992)]. При связывании с комплементарной нуклеиновой кислотой, N-конец ПНК рассматривается как эквивалент "5'-конца" ДНК или РНК, а C-конец ПНК - как эквивалент "3'-конца" ДНК или РНК.
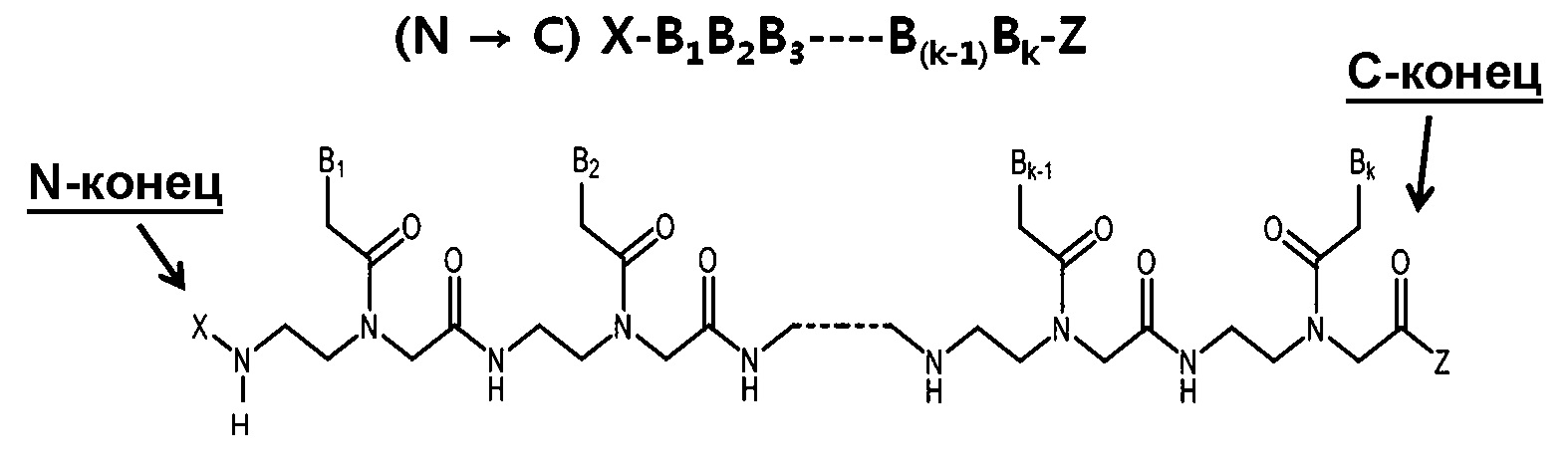
Как и у ФМО, скелет ПНК не заряжен. Таким образом, связывание между ПНК и РНК обычно более сильное, чем между ДНК и РНК. Так как ПНК сильно отличается от ДНК по химической структуре, ПНК не распознается переносчиком(ами) ДНК в печени и демонстрирует профиль распределения в тканях, отличающийся от ДНК или ФТО. Однако ПНК также плохо проникает через мембрану клеток млекопитающих (Adv. Drug Delivery Rev. vol 55, 267-280, 2003).
Модифицированные нуклеиновые основания для улучшения мембранной проницаемости ПНК: ПНК придавали высокую способность проникать через мембрану клеток млекопитающих путем введения модифицированных нуклеиновых оснований, к которым присоединен катионный липид или его эквивалент. Химические структуры таких модифицированных нуклеиновых оснований представлены выше. Такие модифицированные нуклеиновые основания цитозина, аденина и гуанина, как обнаружили, ожидаемо и комплементарно гибридизовались с гуанином, тимином и цитозином, соответственно [заявка PCT PCT/KR2009/001256; EP2268607; US8680253].

Включение такого модифицированного нуклеинового основания в ПНК напоминает ситуации с липофектином. В случае с липофектином молекулы олигонуклеотидов обернуты молекулами катионного липида, такого как липофектамин, при этом такие комплексы липофектамина/олигонуклеотида способны проникать через клеточную мембрану довольно легко по сравнению с голыми молекулами олигонуклеотидов.
Было обнаружено, что, в дополнение к хорошей мембранной проницаемости, такие производные ПНК обладали сверхвысокой аффинностью к комплементарной нуклеиновой кислоте. Например, введение 4-5 модифицированных нуклеиновых оснований в 11-13-мерные производные ПНК легко давало повышение Тп 20°C или выше при образовании дуплекса с комплементарной ДНК. Такие производные ПНК очень чувствительны к ошибочному спариванию одной пары оснований. Ошибочное спаривание одной пары оснований приводит к падению Тп на 11-22°C в зависимости от типа модифицированного основания, а также последовательности ПНК.
АР антисмысловой олигонуклеотид (АР АСО): В принципе направленное взаимодействие АСО с мРНК АР может ингибировать рибосомный синтез белка андрогенового рецептора. Описаны случаи, когда АР АСО ингибировали экспрессию АР в клетках. Например, EZN-4176, ЗНК/ДНК гапмер, комплементарно взаимодействующий с мРНК АР, снижал экспрессию АР в опухолевых клетках, а также в опухолях моделей рака предстательной железы на животных [Mol. Cancer. Ther. vol 10 (12), 2309-2319 (2011)].
АСО, направленные на экзон 1 или экзон 8 мРНК АР, ингибировали экспрессию АР в клетках рака предстательной железы, а также в опухолях моделей рака предстательной железы на животных, устойчивых к химиотерапии энзалутамидом, антагонистом АР [Clin. Cancer. Res. vol 21 (7), 1675-1687 (2015)].
Даун-регуляция АР в волосяных фолликулах при наружном применении АР АСО: Даун-регуляция андрогенной активности в волосяных фолликулах и окружающей ткани может быть достигнута при ингибировании экспрессии АР в волосяных фолликулах и окружающей ткани. Экспрессия АР в волосяных фолликулах может быть снижена с помощью АР АСО при доставке АСО в волосяные фолликулы и окружающую ткань.
Чтобы избежать побочных эффектов при даун-регуляции системной андрогенной активности, желательно локально снижать экспрессию АР в волосяных фолликулах и окружающей ткани для лечения андрогенной алопеции. Наружное применение АР АСО на волосистую часть кожи головы может быть наиболее безопасным способом ингибирования экспрессии АР локально в волосяных фолликулах и окружающей ткани, если АСО получен или изготовлен в форме, подходящей для удобной доставки в волосяные фолликулы. До настоящего времени АР АСО практически не применяли для наружного лечения андрогенной алопеции. АР АСО главным образом исследовали для системного введения с целью лечения рака предстательной железы, резистентного к терапии методом андрогенной абляции.
Краткое описание чертежей
Фигуры 1(A)-(C). Примеры природных или неприродных (модифицированных) нуклеиновых оснований, которые могут быть выбраны для производного пептидо-нуклеиновой кислоты Формулы I.
Фигуры 2(A)-(E). Примеры заместителей, которые могут быть выбраны для производного пептидо-нуклеиновой кислоты Формулы I.
Фигура 3. Химические структуры мономеров ПНК с природным или модифицированным нуклеиновым основанием.
Фигура 4. Химические структуры для обозначений N- или C-концевых заместителей.
Фигура 5(A). Химическая структура производного ПНК "(N→C)Fethoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2".
Фигура 5(B). Химическая структура производного ПНК "(N→C)Бензоил-Lys-Val-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2".
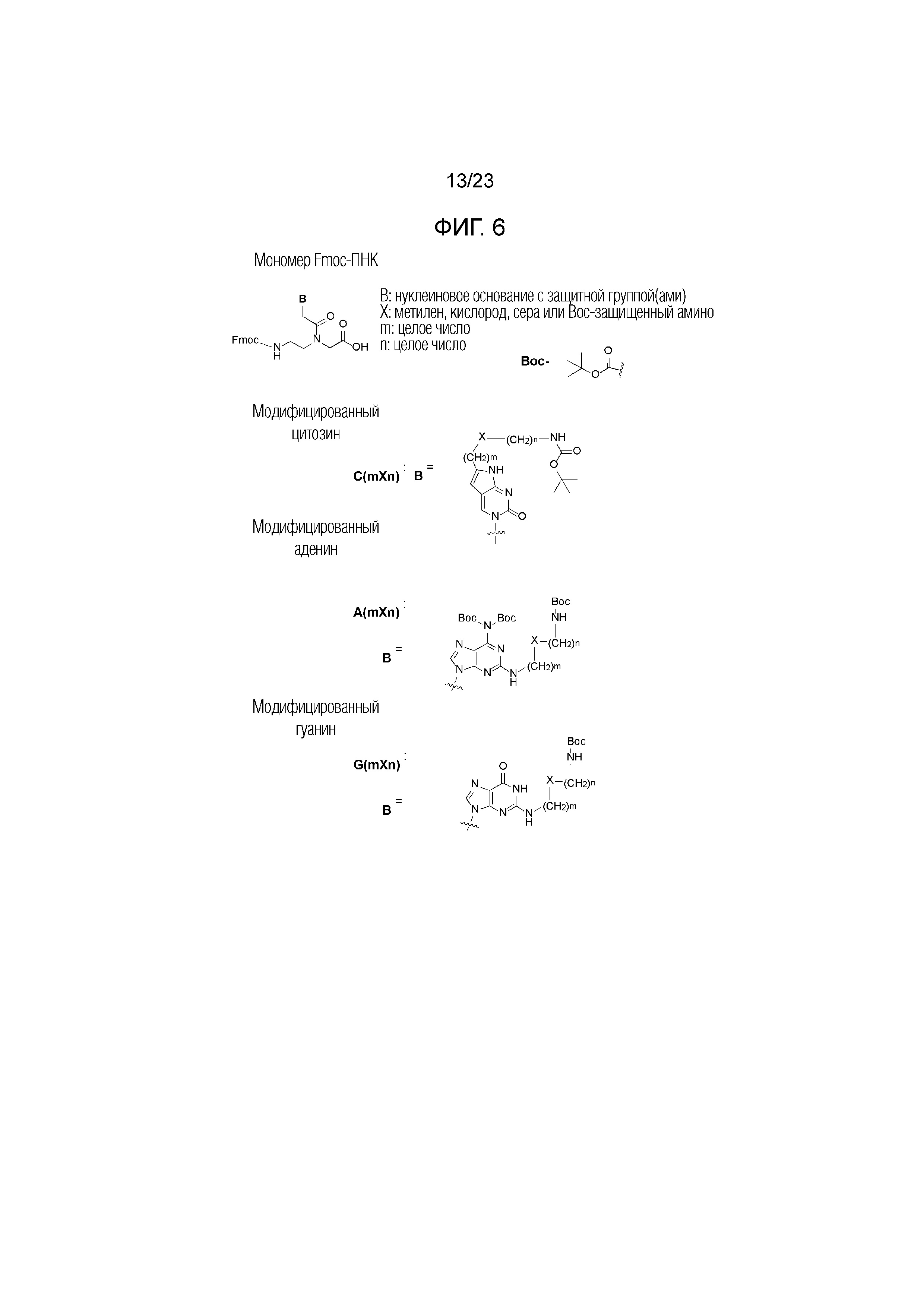
Фигура 6. Химические структуры мономеров Fmoc-ПНК, используемых для синтеза производных ПНК настоящего изобретения.
Фигуры 7(A)-(B). Хроматограммы C18-обращенно-фазовой ВЭЖХ "ASO 1" до и после очистки ВЭЖХ, соответственно.
Фигура 8(A). Электрофоретический анализ продуктов вложенной ПЦР клеток MCF7, обработанных 0 аМ (отрицательный контроль), 3 аМ, 30 аМ, 300 аМ или 3 фМ "ASO 5".
Фигура 8(B). Схематическое изображение полосы ПЦР с пропуском экзонов 4-5 вместе с данными секвенирования.
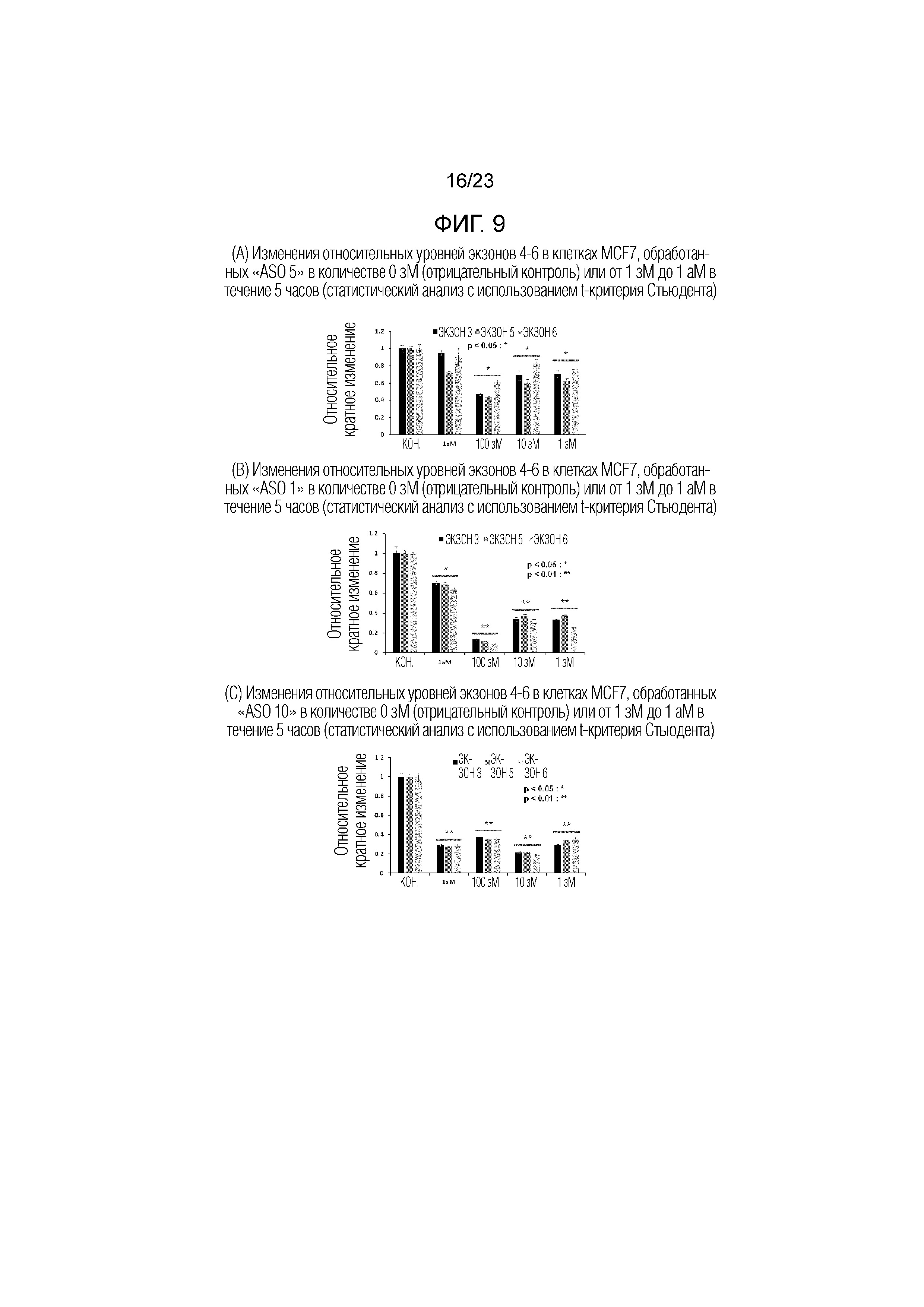
Фигура 9(A). Изменения относительных уровней экзонов 4-6 в клетках MCF7, обработанных "ASO 5" в количестве 0 зМ (отрицательный контроль) или от 1 зМ до 1 аМ в течение 5 часов (статистический анализ с использованием t-критерия Стьюдента).
Фигура 9(B). Изменения относительных уровней экзонов 4-6 в клетках MCF7, обработанных "ASO 1" в количестве 0 зМ (отрицательный контроль) или от 1 зМ до 1 аМ в течение 5 часов (статистический анализ с использованием t-критерия Стьюдента).
Фигура 9(C). Изменения относительных уровней экзонов 4-6 в клетках MCF7, обработанных "ASO 10" в количестве 0 зМ (отрицательный контроль) или от 1 зМ до 1 аМ в течение 5 часов (статистический анализ с использованием t-критерия Стьюдента).
Фигура 10(A). Данные Вестерн-блоттинга для клеток MCF7, обработанных "ASO 1" в количестве 0 зМ (отрицательный контроль) или от 100 зМ до 300 аМ.
Фигура 10(B). Данные Вестерн-блоттинга для клеток MCF7, обработанных "ASO 5" в количестве 0 зМ (отрицательный контроль) или от 10 зМ до 30 аМ.
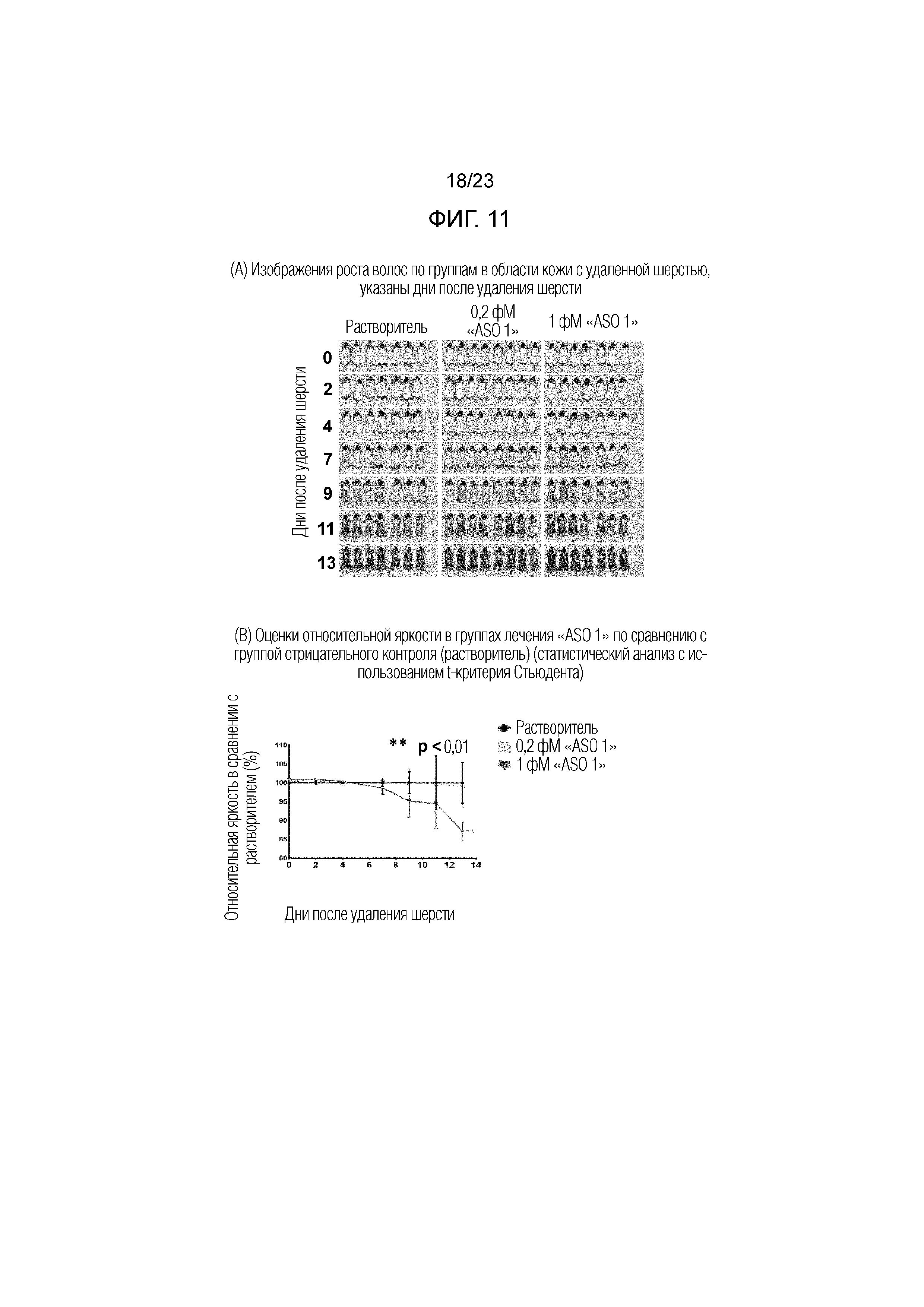
Фигура 11(A). Изображения роста волос по группам на участке после удаления шерсти, указаны дни после удаления волос.
Фигура 11(B). Оценки относительной яркости в группах лечения "ASO 1" по сравнению с группой отрицательного контроля (растворитель) (статистический анализ с использованием t-критерия Стьюдента).
Фигура 12. Репрезентативные наборы изображений флуоресцентной ИГХ (красный) и DAPI (синий) АР для образцов кожи, полученных у животных, обработанных "ASO 1" в количестве 0 фМ (отрицательный контроль, растворитель), 0,2 фМ или 1 фМ.
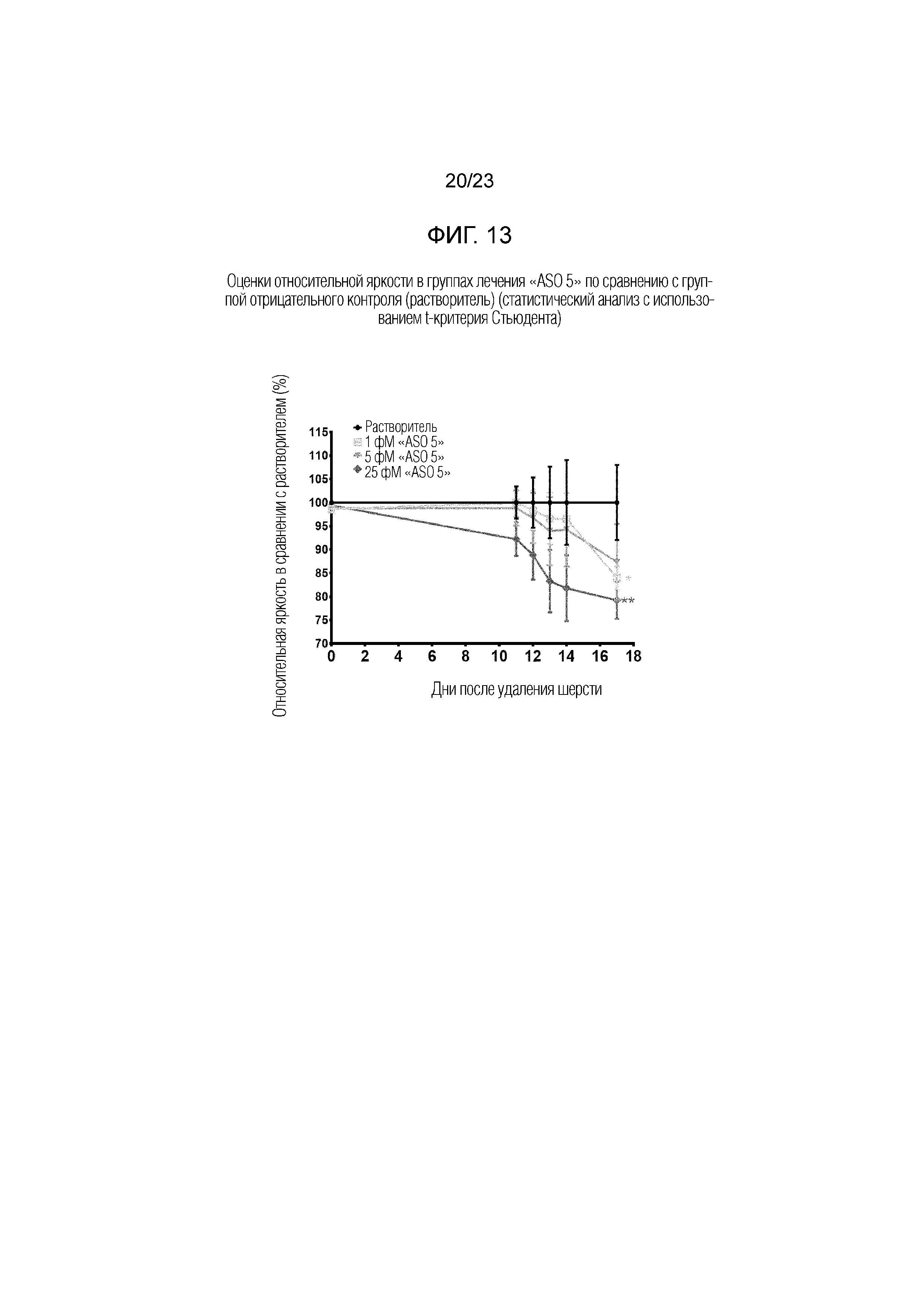
Фигура 13. Оценки относительной яркости в группах лечения "ASO 5" по сравнению с группой отрицательного контроля (растворитель) (статистический анализ с использованием t-критерия Стьюдента).
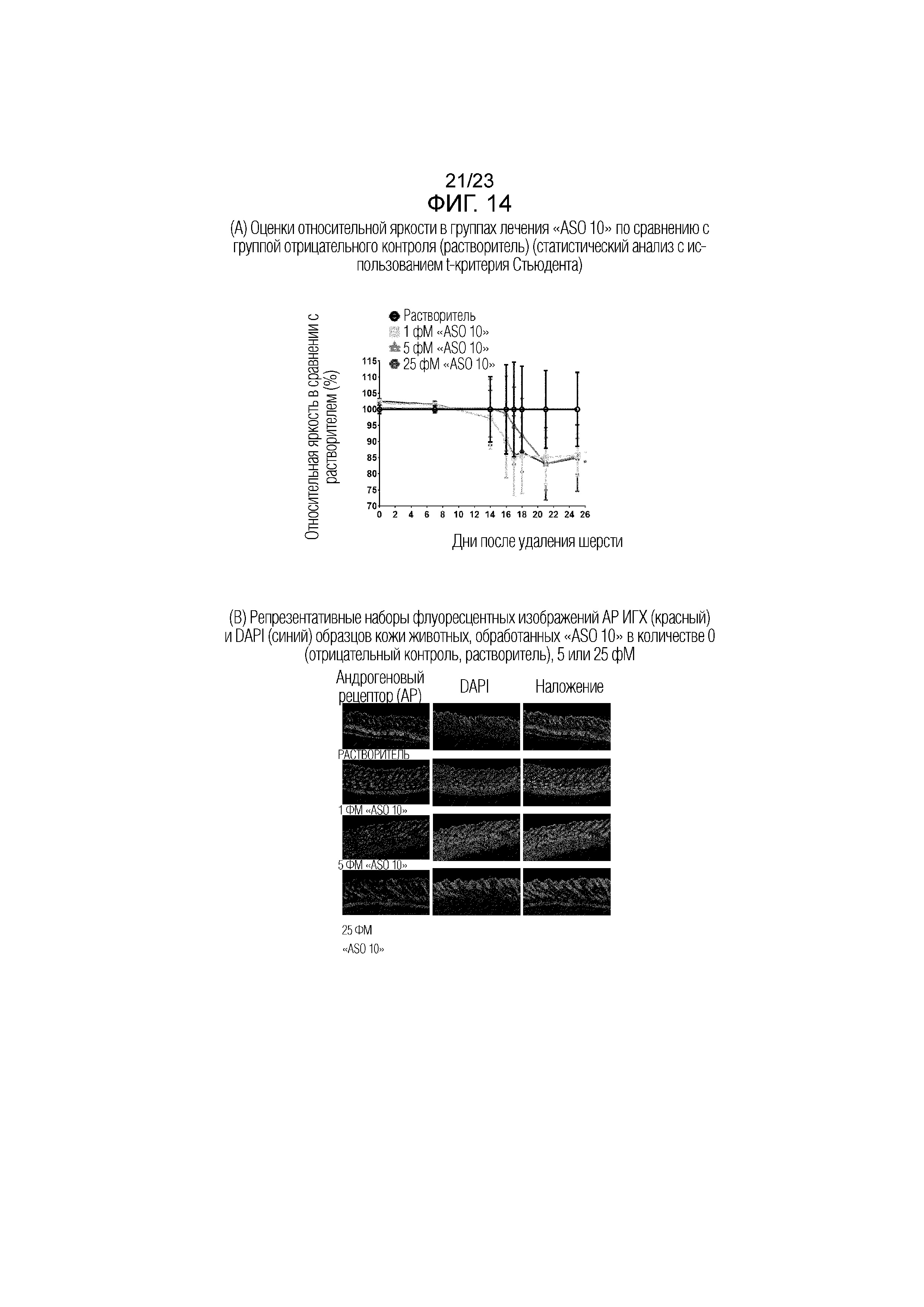
Фигура 14(A). Оценки относительной яркости в группах лечения "ASO 10" по сравнению с группой отрицательного контроля (растворитель) (статистический анализ с использованием t-критерия Стьюдента).
Фигура 14(B). Репрезентативные наборы изображений флуоресцентной ИГХ (красный) и DAPI (синий) АР для образцов кожи, полученных у животных, обработанных "ASO 10" в количестве 0 (отрицательный контроль, растворитель), 1, 5 или 25 фМ.
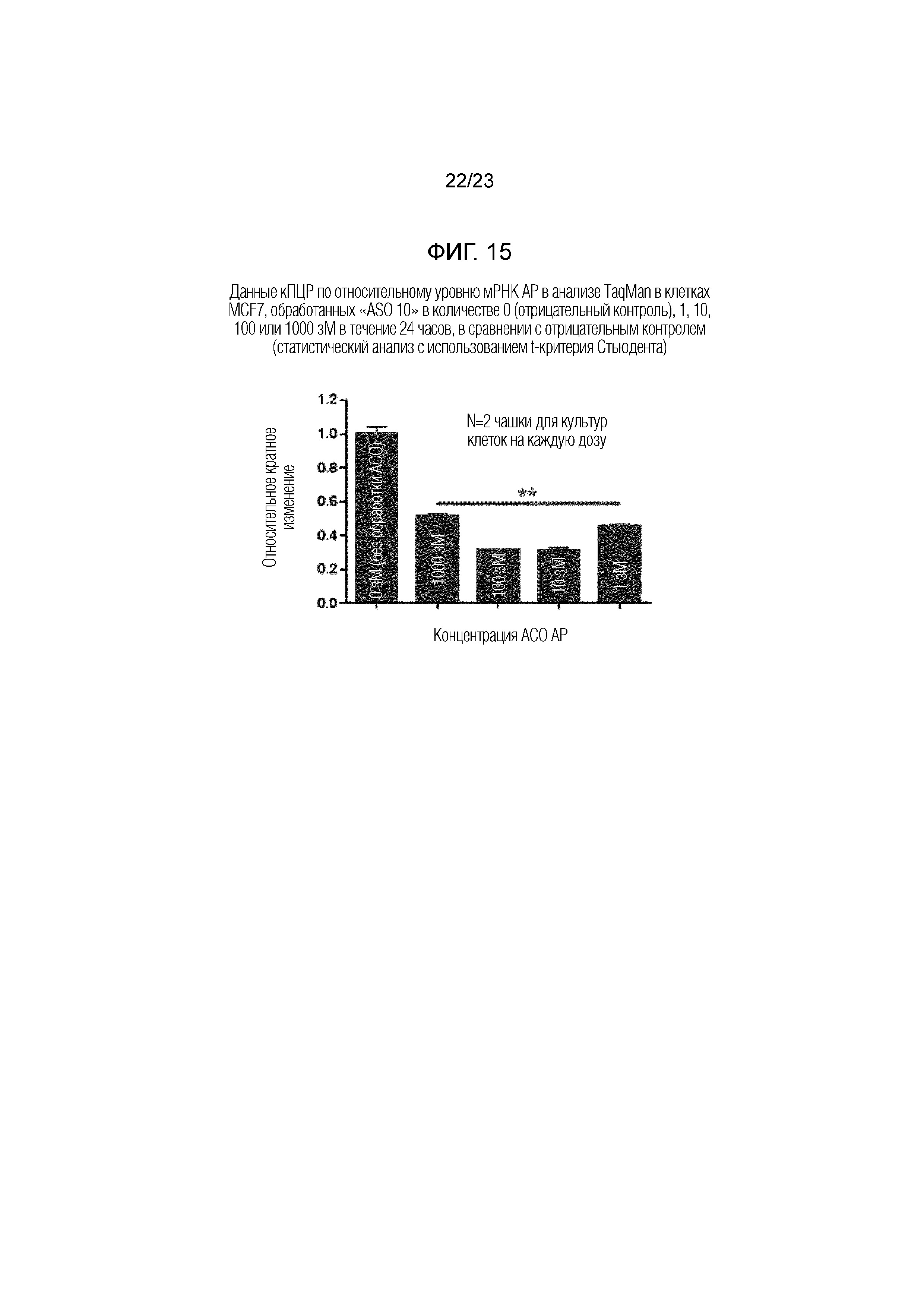
Фигура 15. Данные кПЦР по относительному уровню мРНК АР в анализе TaqMan в клетках MCF7, обработанных "ASO 10" в количестве 0 (отрицательный контроль), 1, 10, 100 или 1000 зМ в течение 24 часов, в сравнении с отрицательным контролем (статистический анализ с использованием t-критерия Стьюдента).
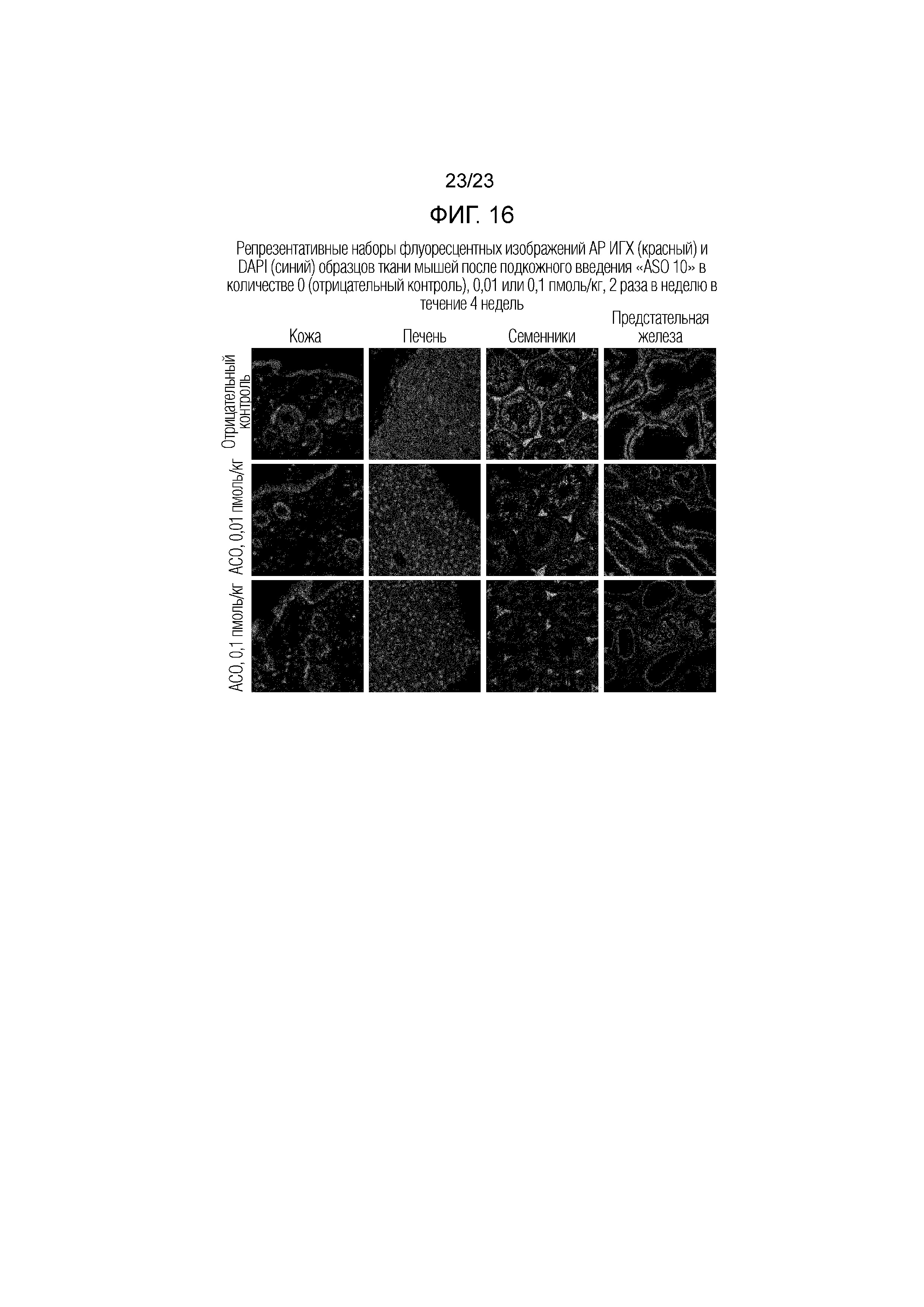
Фигура 16. Репрезентативные наборы изображений флуоресцентной ИГХ (красный) и DAPI (синий) АР для образцов ткани, полученных у мышей после подкожного введения "ASO 10" в количестве 0 (отрицательный контроль), 0,01 или 0,1 пмоль/кг, 2 раза в неделю в течение 4 недель.
Сущность изобретения
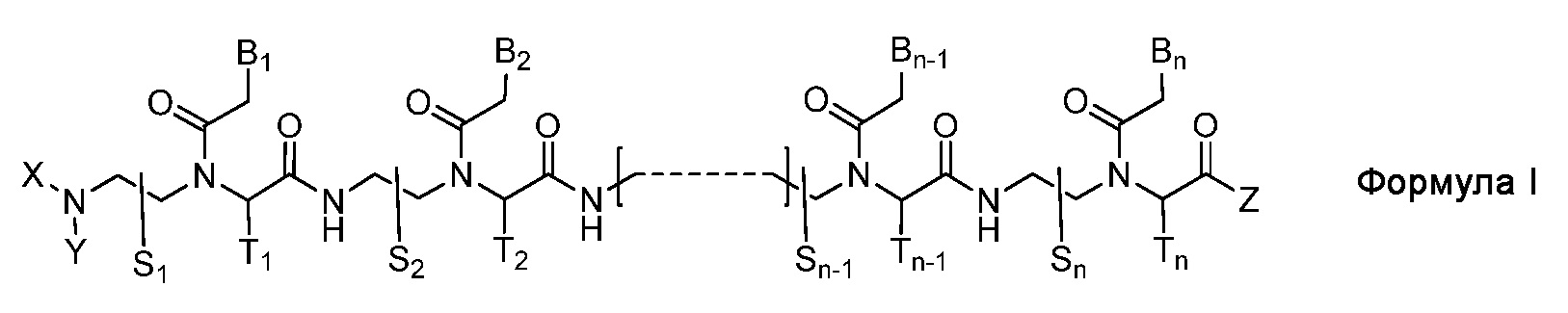
Настоящее изобретение относится к производному пептидо-нуклеиновой кислоты, представленному Формулой I, или его фармацевтически приемлемой соли:
где
n является целым числом от 10 до 21;
соединение Формулы I обладает по меньшей мере 9-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК человеческого андрогенового рецептора;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn независимо представляют собой дейтеридо, гидридо, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо [H], формильный [H-C(=O)-], аминокарбонильный [NH2-C(=O)-], замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкилсульфонильный или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой гидридо, гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере четыре из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, где замещенный или незамещенный аминорадикал ковалентно связан с группой нуклеинового основания.
Соединение Формулы I индуцирует альтернативный сплайсинг человеческой пре-мРНК АР, дает вариант(ы) сплайсинга мРНК АР без "экзона 5", и таким образом, может использоваться для безопасного лечения дерматологических показаний или состояний, включающих андрогенную активность, при топическом нанесении.
Описание изобретения
Настоящее изобретение относится к производному пептидо-нуклеиновой кислоты, представленному Формулой I, или его фармацевтически приемлемой соли:

где
n является целым числом от 10 до 21;
соединение Формулы I обладает по меньшей мере 9-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК андрогенового рецептора человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn независимо представляют собой дейтеридо, гидридо, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо [H], формильный [H-C(=O)-], аминокарбонильный [NH2-C(=O)-], замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкилсульфонильный или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой гидридо, гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере четыре из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, где замещенный или незамещенный аминорадикал ковалентно связан с группой нуклеинового основания.
Соединение Формулы I индуцирует альтернативный сплайсинг человеческой пре-мРНК АР, дает вариант(ы) сплайсинга мРНК АР без "экзона 5" и, таким образом, может применяться для безопасного лечения дерматологических показаний или состояний, включающих андрогенную активность, при местном применении.
Условие, что "n является целым числом от 10 до 21", буквально означает, что n является целым числом, которое может быть выбрано из группы целых чисел 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20.
Соединение Формулы I прочно связывается с 5'-сайтом сплайсинга "экзона 5" пре-мРНК АР человека, транскрибированной с гена АР человека [Референсная последовательность NCBI: NC_000023.11]. 40-мерная последовательность пре-мРНК АР, состоящая из 20-мера из "экзона 5" и 20-мера из "интрона 5", определенно читается [(5'→3') GUGGGCCAAGGCCUUGCCUG-GUAAGGAAAAGGGAAGUGGG], хотя номер экзона и интрона могут изменяться в зависимости от транскрипта мРНК АР. 40-мерная последовательность пре-мРНК может быть альтернативно указана как [(5'→3') GUGGGCCAAGGCCUUGCCUG|guaaggaaaagggaaguggg], где последовательности экзона и интрона показаны "заглавными" и "строчными" буквами, соответственно, а соединение экзона/интрона показано знаком "|".
17-мерная последовательность пре-мРНК [(5'→3') CCUUGCCUGGUAAGGAA], принятая для описания соединения Формулы I в настоящем изобретении, состоит из 9-мера в "экзоне 5" АР и 8-мера в "интроне 5" АР. Таким образом, 17-мерная последовательность пре-мРНК может быть альтернативно прочитана как [(5'→3') CCUUGCCUG|guaaggaa].
Соединение Формулы I прочно связывается с целевым 5'-сайтом сплайсинга экзона 5 в пре-мРНК АР человека и препятствует образованию "раннего комплекса сплайсомы", включающего целевой экзон соединения. Поскольку соединение согласно настоящему изобретению стерически ингибирует образование "раннего комплекса сплайсомы", "экзон 5" АР вырезается с получением варианта или вариантов сплайсинга мРНК АР без "экзона 5". Следовательно, соединение согласно настоящему изобретению индуцирует пропуск "экзона 5".
Соединение Формулы I прочно связывается с комплементарной ДНК, как показано в предшествующем уровне техники [PCT/KR2009/001256]. Дуплекс между производным ПНК Формулы I и его комплементарной полноразмерной ДНК или РНК демонстрирует слишком высокое значение Тп, чтобы его можно было достоверно определить в водном буфере. Соединение ПНК Формулы I также дает высокие значения Тп с более короткими комплементарными ДНК, например, 10-мерными.
Вследствие высокой аффинности связывания производное ПНК согласно настоящему изобретению мощно индуцирует пропуск "экзона 5" в клетках даже с комплементарным перекрывающимся участком не больше 9-мера с 5'-сайтом сплайсинга "экзона 5", хотя такая малая длина перекрывающегося участка может увеличивать риск перекрестной реактивности с другими пре-мРНК. Если производное ПНК согласно настоящему изобретению используется в целях наружного применения, можно прогнозировать, что риск перекрестной реактивности будет значительно снижен.
Химические структуры природных или неприродных нуклеиновых оснований в производном ПНК Формулы I представлены на Фигурах 1(A)-(C). Природные (т.е. природного происхождения) или неприродные (т.е. искусственные) нуклеиновые основания согласно настоящему изобретению включают, без ограничения перечисленными, нуклеиновые основания, представленные на Фигурах 1(A)-(C). Представление таких неприродных нуклеиновых оснований служит для иллюстрации разнообразия допустимых нуклеиновых оснований и, следовательно, не должно интерпретироваться как ограничение объема настоящего изобретения. Специалист в данной области может легко выяснить, что вариации неприродных нуклеиновых оснований возможны для определенных положений в соединении ПНК Формулы I, при условии, что такие вариации соответствуют требуемой комплементарности с последовательностью их пре-мРНК-мишени.
Заместители, используемые для описания производного ПНК Формулы I, представлены на Фигурах 2(A)-(E). На Фигуре 2(A) представлены примеры замещенных или незамещенных алкильных радикалов. Замещенные или незамещенные алкилацильные, замещенные или незамещенные алкилацил арилацильные радикалы представлены на Фигуре 2(B). На Фигуре 2(C) представлены примеры замещенных или незамещенных алкиламино, замещенных или незамещенных ариламино, замещенных или незамещенных арильных, замещенных или незамещенных алкилсульфонильных, замещенных или незамещенных арилсульфонильных и замещенных или незамещенных алкилфосфонильных или арилфосфонильных радикалов. На Фигуре 2(D) представлены примеры замещенных или незамещенных алкилоксикарбонильных, замещенных или незамещенных арилоксикарбонильных, замещенных или незамещенных алкил-аминокарбонильных или ариламинокарбонильных радикалов. На Фигуре 2(E) представлены примеры замещенных или незамещенных алкиламинотиокарбонильных, замещенных или незамещенных ариламинотиокарбонильных, замещенных или незамещенных алкилокситиокарбонильных и замещенных или незамещенных арилокситиокарбонильных радикалов. Представление таких примерных заместителей служит для иллюстрации разнообразных допустимых заместителей, и таким образом, не должно интерпретироваться как ограничение объема настоящего изобретения. Специалист в данной области может легко выяснить, что олигонуклеотидная последовательность является более важным фактором для сиквенс-специфического связывания олигонуклеотида с последовательностью пре-мРНК-мишени по сравнению с заместителями на N-конце или C-конце.
Соединение Формулы I обладает хорошей клеточной проницаемостью и может быть с легкостью доставлено в клетку при обработке в виде "голого" олигонуклеотида, как показано в предшествующем уровне техники [PCT/KR2009/001256]. Таким образом, соединение согласно настоящему изобретению индуцирует пропуск "экзона 5" в пре-мРНК АР человека с получением варианта(ов) сплайсинга мРНК АР без "экзона 5" АР в клетках, обработанных соединением Формулы I в виде "голого" олигонуклеотида. Соединение Формулы I не требует каких-либо средств или композиций для доставки в клетку с целью мощной индукции пропуска экзона-мишени в клетках. Соединение Формулы I с легкостью индуцирует пропуск "экзона 5" АР в клетках, обработанных соединением настоящего изобретения в виде "голого" олигонуклеотида при субфемтомолярной концентрации.
Вследствие хорошей клеточной или мембранной проницаемости, производное ПНК Формулы I может наноситься топически в виде "голого" олигонуклеотида для индукции пропуска "экзона 5" АР в целевом участке кожи. Соединение Формулы I не требует включения в композицию для увеличения чрескожной доставки для наружной терапевтической или биологической активности. Обычно соединение Формулы I растворяют в воде и сорастворителе, и вводят топически или чрескожно в субпикомолярной концентрации, чтобы вызвать требуемую терапевтическую или биологическую активность в целевом участке кожи. Соединение согласно настоящему изобретению не требуется включать в высокоактивную или инвазивную композицию, чтобы вызывать терапевтическую активность при наружном применении.
Соединение Формулы I может использоваться в комбинации с фармацевтически приемлемой кислотой или основанием, включающими, без ограничения перечисленными, гидроксид натрия, гидроксид калия, соляную кислоту, метансульфоновую кислоту, лимонную кислоту, трифторуксусную кислоту и так далее.
Производное ПНК Формулы I или его фармацевтически приемлемую соль могут вводить пациенту в комбинации с фармацевтически приемлемым адъювантом, включающим, без ограничения перечисленными, лимонную кислоту, соляную кислоту, винную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, изопропанол, бикарбонат натрия, дистиллированную воду, консервант(ы) и так далее.
Соединение согласно настоящему изобретению может тоопически вводиться пациенту в терапевтически или биологически эффективной концентрации в пределах от 1 аМ до более чем 1 нМ, которая может варьировать в зависимости от схемы введения, условий или ситуаций у пациента, и так далее.
Предпочтельным является производное ПНК Формулы I или его фармацевтически приемлемая соль:
где
n является целым числом от 10 до 21;
соединение Формулы I обладает по меньшей мере 9-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК андрогенового рецептора человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn независимо представляют собой дейтеридо, гидридо, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо [H], формильный [H-C(=O)-], аминокарбонильный [NH2-C(=O)-], замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкилсульфонильный или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой гидридо, гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкильный или замещенный или незамещенный арильный радикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере три из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV:
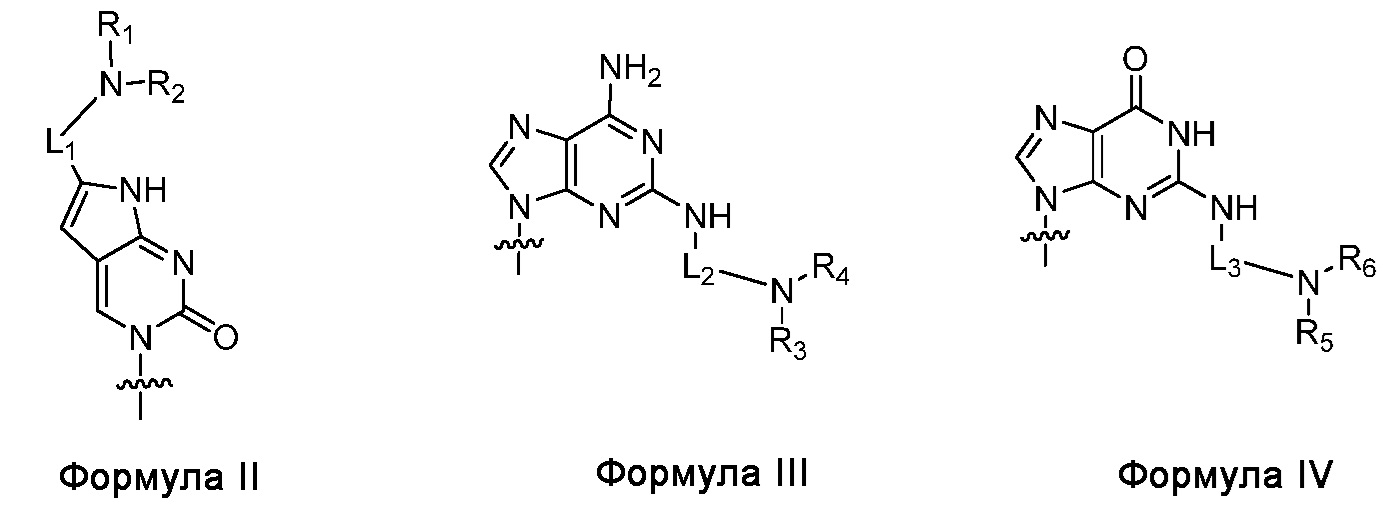
где
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо и замещенного или незамещенного алкильного радикала;
L1, L2 и L3 являются ковалентным линкером, представленным Формулой V, ковалентно связывающим основную аминогруппу с группой нуклеинового основания:

где
Q1 и Qm являются замещенным или незамещенным метиленовым (-CH2-) радикалом, и Qm непосредственно связан с основной аминогруппой;
Q2, Q3,... и Qm-1 независимо выбраны из замещенного или незамещенного метилена, кислорода (-O-), серы (-S-) и замещенного или незамещенного аминорадикала [-N(H)- или -N(заместитель)-]; и
m является целым числом от 1 до 15.
Представляет интерес олигомер ПНК Формулы I или его фармацевтически приемлемая соль:
где
n являются целым числом от 10 до 18;
соединение Формулы I обладает по меньшей мере 9-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК АР человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn являются гидридорадикалом;
X и Y независимо представляют собой гидридо, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный или замещенный или незамещенный арилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо и замещенного или незамещенного алкильного радикала;
Q1 и Qm являются замещенным или незамещенным метиленовым радикалом, и Qm непосредственно связан с основной аминогруппой;
Q2, Q3,... и Qm-1 независимо выбраны из замещенного или незамещенного метиленового, кислородного и аминорадикала; и
m является целым числом от 1 до 11.
Особый интерес представляет производное ПНК Формулы I или его фармацевтически приемлемая соль:
где
n является целым числом от 11 до 16;
соединение Формулы I обладает по меньшей мере 11-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью пре-мРНК АР [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК АР человека;
соединение Формулы I полностью комплементарно последовательности пре-мРНК в пре-мРНК АР человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn являются гидридорадикалом;
X и Y независимо выбраны из гидридо, замещенного или незамещенного алкилацильного или замещенного или незамещенного алкилоксикарбонильного радикала;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо и замещенного или незамещенного алкильного радикала;
Q1 и Qm являются метиленовым радикалом, и Qm непосредственно связан с основной аминогруппой;
Q2, Q3,... и Qm-1 независимо выбраны из метиленового, кислородного и аминорадикала; и
m является целым числом от 1 до 10.
Высокий интерес представляет олигомер ПНК Формулы I или его фармацевтически приемлемая соль:
где
n является целым числом от 11 до 16;
соединение Формулы I обладает по меньшей мере 12-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК АР человека;
соединение Формулы I полностью комплементарно последовательности пре-мРНК в пре-мРНК АР человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn являются гидридорадикалом;
X и Y независимо выбраны из гидридо, замещенного или незамещенного алкилацильного или замещенного или незамещенного алкилоксикарбонильного радикала;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV;
R1, R3 и R5 являются гидридорадикалом, и R2, R4 и R6 независимо представляют собой гидридо или замещенный или незамещенный алкильный радикал;
Q1 и Qm являются метиленовым радикалом, и Qm непосредственно связан с основной аминогруппой;
Q2, Q3,... и Qm-1 независимо выбраны из метилена, кислородного радикала; и
m является целым числом от 1 до 10.
Более высокий интерес представляет производное ПНК Формулы I или его фармацевтически приемлемая соль:
где
n является целым числом от 11 до 16;
соединение Формулы I обладает по меньшей мере 12-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК АР человека;
соединение Формулы I полностью комплементарно последовательности пре-мРНК в пре-мРНК АР человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn являются гидридорадикалом;
X и Y независимо выбраны из гидридо, замещенного или незамещенного алкилацильного или замещенного или незамещенного алкилоксикарбонильного радикала;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV;
R1, R2, R3, R4, R5 и R6 являются гидридорадикалом;
Q1 и Qm являются метиленовым радикалом, и Qm непосредственно связан с основной аминогруппой;
Q2, Q3,... и Qm-1 независимо выбраны из метиленового и кислородного радикала; и
m является целым числом от 1 до 8.
Наиболее высокий интерес представляет производное ПНК Формулы I или его фармацевтически приемлемая соль:
где
n является целым числом от 11 до 15;
соединение Формулы I обладает по меньшей мере 11-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК АР человека;
соединение Формулы I полностью комплементарно последовательности пре-мРНК в пре-мРНК АР человека;
S1, S2,..., Sn-1, Sn, T1, T2,..., Tn-1 и Tn являются гидридорадикалом;
X является гидридорадикалом;
Y представляет собой замещенный или незамещенный алкилацильный или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2,..., Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2,..., Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных Формулой II, Формулой III или Формулой IV;
R1, R2, R3, R4, R5 и R6 являются гидридорадикалом;
L1 представляет собой -(CH2)2-O-(CH2)2-, -CH2-O-(CH2)2-, -CH2-O-(CH2)3-, -CH2-O-(CH2)4- или -CH2-O-(CH2)5-, правый конец которого непосредственно связан с основной аминогруппой; и
L2 и L3 независимо выбраны из -(CH2)2-O-(CH2)2-, -(CH2)3-O-(CH2)2-, -(CH2)2-O-(CH2)3-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7- и -(CH2)8-, правый конец которых непосредственно связан с основной аминогруппой.
Особый интерес представляет производное ПНК Формулы I, которое выбрано из группы соединений, представленных ниже, или их фармацевтически приемлемой соли:
(N→C) Fmoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Ac-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Бензоил-GA(5)A-GC(1O2)C-A(2O2)GG-C(1O2)AA(5)-G-NH2;
(N→C) Piv-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Метил-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) н-Пропил-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fmoc-Lys-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fmoc-Lys-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) Fmoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) Fmoc-Gly-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fmoc-Lys-Gly-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) Fmoc-Val-Gly-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fmoc-GA(6)A-GC(1O2)C-A(6)GG-C(1O2)AA(6)-G-NH2;
(N→C) Fmoc-G(6)AA(5)-GC(1O3)C-A(7)GG(5)-CA(5)A-G-NH2;
(N→C) Fmoc-GA(5)A-GC(2O2)C-A(6)GG-C(1O5)AA(6)-G-NH2;
(N→C) Fmoc-TG(6)C(1O5)-GGA(6)-AG(6)C-CA(6)G-GC(1O2)A-A(6)GG(6)-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-Lys-Lys-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(6)CC-A(5)GG-C(1O3)AA(5)-G-Val-Lys-NH2;
(N→C) Ac-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)TA(5)-G-NH2;
(N→C) Piv-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) H-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) H-CTT-A(5)C(1O3)C-A(5)G(3)G-C(1O2)AA(5)-G-NH2;
(N→C) н-Пропил-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) н-Пропил-CTT(5)C(2O2)C-A(3)G(2O3)G-C(1O2)AA(5)-G-NH2;
(N→C) п-Толуолсульфонил-CTT(5)C(1O2)C-A(8)G(5)G-C(1O2)AA(5)-G-NH2;
(N→C) Бензоил-Lys-Val-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Бензоил-CTT(5)C(1O5)C-A(5)G(2O2)G-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-Lys-Leu-CTT(5)C(1O2)C-A(2O2)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O5)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GT-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)TA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)А(5)A-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-AG(5)G-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(7)GG-C(1O2)AA(3)-G-NH2;
(N→C) Fethoc-CTT-A(5)C(1O2)C-A(5)GT-C(1O2)TA(5)-G-NH2;
(N→C) Fethoc-CTT-A(5)C(1O2)C-A(5)GT-C(1O2)TA(5)-G-Arg-NH2;
(N→C) Fethoc-TC(1O2)C-TTA(6)-CCA(6)-GGC(1O2)-AA(6)G-G(6)-NH2;
(N→C) Fethoc-TC(1O2)C-TTA(5)-CCA(5)-GGC(1O2)-AA(5)G-G(6)-NH2;
(N→C) Fethoc-GA(5)T-AC(1O2)C-A(5)GG(6)-CAA(5)-G-NH2;
(N→C) Fethoc-TA(5)C-CAG(6)-GC(1O2)A-A(5)GG(6)-C-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Бензил-C(1O2)TT-A(2O2)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Фенил-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(7)GG(5)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(6)GG(2O2)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)А-Val-Lys-NH2;
(N→C) Piv-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Fmoc-Lys-Val-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Ac-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) H-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-Lys-NH2;
(N→C) Piv-Arg-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-Lys-NH2;
(N→C) N-Фенил-N-метил-CTT(5)C(1O2)C-A(5)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) [N-(2-Фенилэтил)амино]карбонил-CTT-(5)C(1O2)C-A(4)G(5)G-C(1O2)AA(5)-G-NH2;
(N→C) Бензоил-Leu-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-Lys-NH2;
(N→C) Fethoc-C(1O3)TT-A(5)CC-A(5)GG(5)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(6)CC-A(6)GG(6)-CA(6)A-NH2;
(N→C) Fethoc-TTT-TCC(1O2)-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2;
(N→C) Fethoc-TTT-TCC(1O2)-TTA(6)-CC(1O3)А(6)-G-Lys-NH2;
(N→C) Fethoc-TC(2O2)C-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2;
(N→C) Me-Gly-TC(2O2)C-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2;
(N→C) Fethoc-Lys-TTT-TCC(1O2)-TTA(6)-CCA(6)-GG(6)C-NH2; и
(N→C) Fethoc-Arg-TCC(1O2)-TTA(5)-CCA(6)-GG(5)C-Lys-NH2:
где
A, G, T и C являются мономерами ПНК с природным нуклеиновым основанием, аденином, гуанином, тимином и цитозином, соответственно;
C(pOq), A(p), A(pOq), G(p) и G(pOq) являются мономерами ПНК с неприродным нуклеиновым основанием, представленным Формулой VI, Формулой VII, Формулой VIII, Формулой IX и Формулой X, соответственно;

где
p и q являются целыми числами; и
сокращенные обозначения N- и C-концевых заместителей являются такими, как конкретно описано следующим образом: "Fmoc-" представляет собой сокращенное обозначение "[(9-флуоренил)метилокси]карбонила-"; "Fethoc-" - "[2-(9-флуоренил)этил-1-окси]карбонила"; "Ac-" - "ацетила-"; "Бензоил-" - "бензолкарбонила-"; "Piv-" - "пивалила-"; "Метил-" - "метила-"; "н-Пропил-" - "1-(н-пропила)-"; "H-" - "гидридо-" группы; "п-Толуолсульфонил" - "(4-метилбензол)-1-сульфонила"; "-Lys-" - остатка аминокислоты "лизина"; "-Val-" - остатка аминокислоты "валина"; "-Leu-" - остатка аминокислоты "лейцина"; "-Arg-" - остатка аминокислоты "аргинина"; "-Gly-" - остатка аминокислоты "глицина"; "[N-(2-Фенилэтил)амино]карбонил-" - "[N-1-(2-фенилэтил)амино]карбонила-"; "Бензил-" - "1-(фенил)метила-"; "Фенил-" - "фенила-"; "Me-" - "метила-"; и "-NH2" - незамещенной "-амино" группы.
На Фигуре 3 коллективно и определенно представлены химические структуры мономеров ПНК, сокращенно обозначенных A, G, T, C, C(pOq), A(p), A(pOq), G(p) и G(pOq). Как обсуждается в предшествующем уровне техники [PCT/KR2009/001256], C(pOq) рассматривается как "модифицированный цитозиновый" мономер ПНК из-за его гибридизации с "гуанином". A(p) и A(pOq) взяты в качестве "модифицированных адениновых" мономеров ПНК из-за их гибридизации с "тимином". Аналогичным образом, G(p) и G(pOq) считаются "модифицированными гуаниновыми" мономерами ПНК из-за спаривания их оснований с "цитозином".
На Фигуре 4 определенно представлены химические структуры различных сокращенных обозначений заместителей, используемых для модификации N-конца или C-конца производного ПНК Формулы I в настоящем изобретении.
Для иллюстрации сокращенных обозначений производных ПНК, химическая структура производного ПНК, сокращенно обозначенного как "(N→C) Fethoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2", представлена на Фигуре 5(A). В качестве другой иллюстрации, химическая структура производного ПНК, сокращенно обозначенного как "(N→C) Бензоил-Lys-Val-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-g-NH2", представлена на Фигуре 5(B).
13-мерная последовательность ПНК "(N→C) Fethoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2" эквивалентна последовательности ДНК "(5'→3') GAA-GCC-AGG-CAA-G" по связыванию с ее комплементарной последовательностью, связывающейся с пре-мРНК. 13-мерная ПНК имеет 9-мерный комплементарный участок, перекрывающийся с 9-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCUUGCCUG|g"uaag"gaaaa], охватывающей соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека. Следует отметить, что четыре одиночных неспаривающихся нуклеотида в "интроне 5" отмечены как "uaag".
13-мерная последовательность ПНК "(N→C) Бензоил-Lys-Val-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2" эквивалентна последовательности ДНК "(5'→3') CTT-ACC-AGG-CAA-G", которая имеет 13-мерный комплементарный участок, перекрывающийся с 13-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCUUGCCUG|guaaggaaaa], охватывающей соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека.
13-мерная последовательность ПНК "(N→C) Ac-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)TA(5)-G-NH2" эквивалентна последовательности ДНК "(5'→3') CTT-ACC-AGG-CTA-G", которая имеет 12-мерный комплементарный участок, перекрывающийся с 12-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCU"U"GCCUG|guaaggaaaa], охватывающей соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека. Следует отметить, что одиночный неспаривающийся нуклеотид в экзоне 5 отмечен как "U".
17-мерная последовательность ПНК "(N→C) Fethoc-TTT-TCC(1O2)-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2" эквивалентна последовательности ДНК "(5'→3') TTT-TCC-TTA-CCA-GGC-AA", которая имеет 17-мерный комплементарный участок, перекрывающийся с 17-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCUUGCCUG|guaaggaaaa], охватывающей соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека.
Настоящее изобретение относится к производному ПНК Формулы I, которое выбрано из группы особенно предпочтительных соединений, перечисленных ниже, или его фармацевтически приемлемой соли:
(N→C) Fmoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-GA(5)A-GC(1O2)C-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fmoc-GA(6)A-GC(1O2)C-A(6)GG-C(1O2)AA(6)-G-NH2;
(N→C) Fmoc-G(6)AA(5)-GC(1O3)C-A(7)GG(5)-CA(5)A-G-NH2;
(N→C) Fmoc-GA(5)A-GC(2O2)C-A(6)GG-C(1O5)AA(6)-G-NH2;
(N→C) Fethoc-TG(6)C(1O2)-GGA(6)-AG(6)C-CA(6)G-GC(1O2)A-A(6)GG(6)-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(6)CC-A(5)GG-C(1O3)AA(5)-G-Val-Lys-NH2;
(N→C) Ac-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)TA(5)-G-NH2;
(N→C) Piv-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) H-CTT-A(5)C(1O3)C-A(5)G(3)G-C(1O2)AA(5)-G-NH2;
(N→C) н-Пропил-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2;
(N→C) н-Пропил-CTT(5)C(2O2)C-A(3)G(2O3)G-C(1O2)AA(5)-G-NH2;
(N→C) п-Толуолсульфонил-CTT(5)C(1O2)C-A(8)G(5)G-C(1O2)AA(5)-G-NH2;
(N→C) Бензоил-CTT(5)C(1O5)C-A(5)G(2O2)G-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-Lys-Leu-CTT(5)C(1O2)C-A(2O2)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O5)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(7)GG-C(1O2)AA(3)-G-NH2;
(N→C) Fethoc-CTT-A(5)C(1O2)C-A(5)GT-C(1O2)TA(5)-G-NH2;
(N→C) Fethoc-TC(1O2)C-TTA(6)-CCA(6)-GGC(1O2)-AA(6)G-G(6)-NH2;
(N→C) Fethoc-TC(1O2)C-TTA(5)-CCA(5)-GGC(1O2)-AA(5)G-G(6)-NH2;
(N→C) Fethoc-GA(5)T-AC(1O2)C-A(5)GG(6)-CAA(5)-G-NH2;
(N→C) Fethoc-TA(5)C-CAG(6)-GC(1O2)A-A(5)GG(6)-C-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(7)GG(5)-CA(5)A-NH2;
(N→C) Fethoc-C(1O2)TT-A(5)CC-A(6)GG(2O2)-CA(5)A-NH2;
(N→C) Piv-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) Ac-C(1O2)TT-A(5)CC-A(5)GG(6)-CA(5)A-NH2;
(N→C) N-фенил-N-метил-CTT(5)C(1O2)C-A(5)GG-C(1O2)AA(5)-G-Lys-NH2;
(N→C) [N-(2-Фенилэтил)амино]карбонил-CTT-(5)C(1O2)C-A(4)G(5)G-C(1O2)AA(5)-G-NH2;
(N→C) Fethoc-C(1O2)TT-A(6)CC-A(6)GG(6)-CA(6)A-NH2;
(N→C) Fethoc-TTT-TCC(1O2)-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2;
(N→C) Fethoc-TTT-TCC(1O2)-TTA(6)-CC(1O3)А(6)-G-Lys-NH2; и
(N→C) Fethoc-TC(2O2)C-TTA(6)-CCA(6)-GG(6)C-A(6)A-NH2.
Подробное описание изобретения
Общие методики получения олигомеров ПНК
Олигомеры ПНК синтезировали с помощью твердофазного синтеза пептидов (ТФСП) на основе Fmoc-химии, согласно способу, раскрытому в предшествующем уровне техники [US6,133,444; WO96/40685], с небольшими, но важными модификациями. В этом исследовании в качестве твердой подложки использовали H-Rink Amide-ChemMatrix, приобретенную в PCAS BioMatrix Inc. (Quebec, Canada). Мономеры Fmoc-ПНК с модифицированным нуклеиновым основанием синтезировали, как описано в предшествующем уровне техники [PCT/KR 2009/001256], или с небольшими модификациями. Такие Fmoc-ПНК мономеры с модифицированным нуклеиновым основанием и мономеры Fmoc-ПНК с природным нуклеиновым основанием использовали для синтеза производных ПНК настоящего изобретения. Олигомеры ПНК очищали с помощью C18-обращенно-фазовой ВЭЖХ (вода/ацетонитрил или вода/метанол с 0,1% ТФУ) и исследовали с помощью масс-спектрометрии.
На Схеме 1 представлен типичный цикл элонгации мономера, применяемый в ТФСП согласно настоящему изобретению, соответствующие детали методики предоставлены ниже. Впрочем, специалисту в данной области будет очевидно, что множество небольших изменений можно сделать при эффективном проведении таких реакций ТФСП на автоматическом синтезаторе пептидов или ручном синтезаторе пептидов. Каждая стадия реакции на Схеме 1 коротко представлена следующим образом.
Схема 1
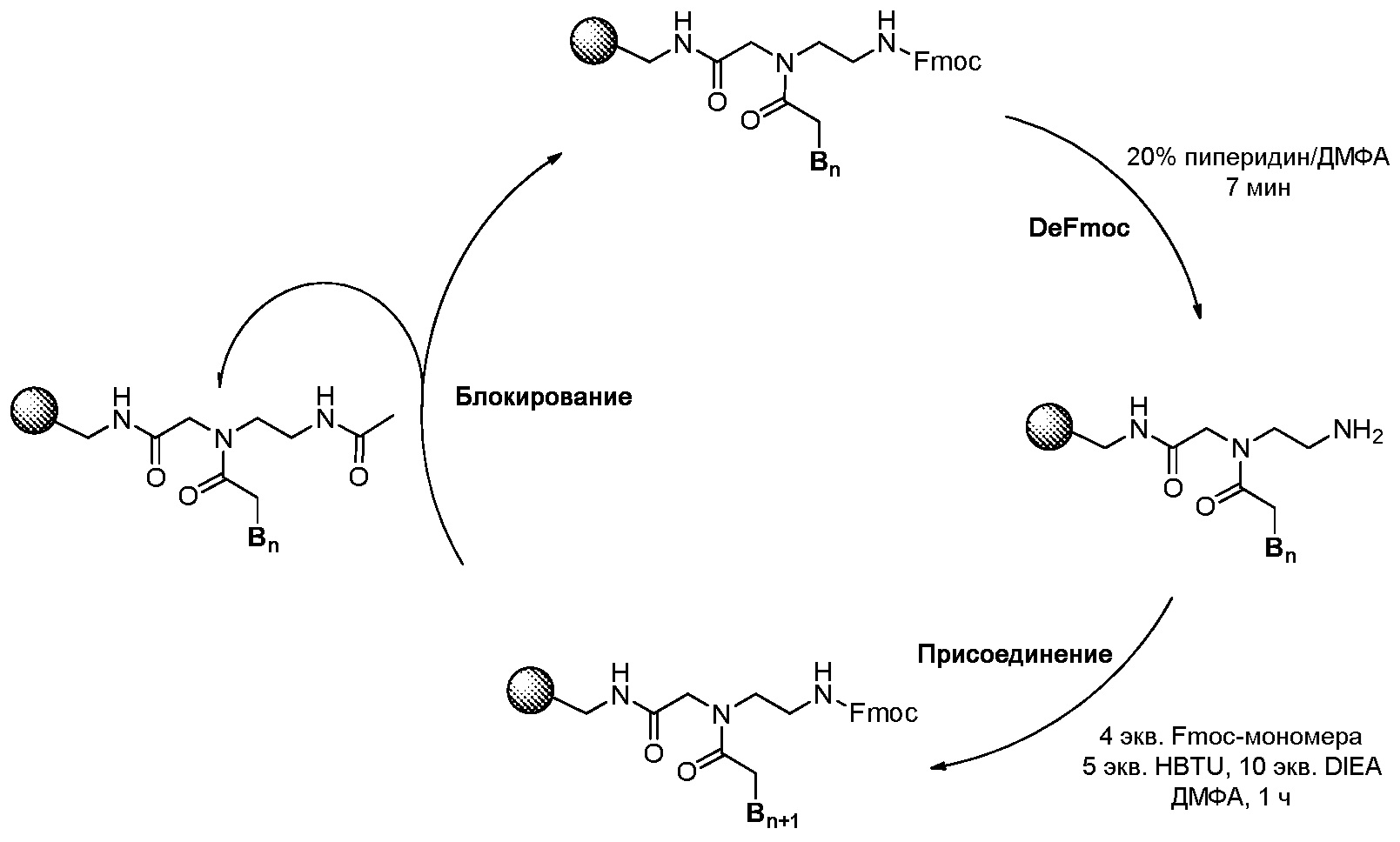
[Активация смолы H-Rink-ChemMatrix] 0,01 ммоль (приблизительно 20 мг смолы) смолы ChemMatrix в 1,5 мл 20% пиперидине/ДМФА обрабатывали на вортексе в пробирке LibraTube в течение 20 мин, и раствор DeFmoc удаляли при фильтровании. Смолу последовательно каждый раз промывали по 30 секунд 1,5 мл метиленхлорида (МХ), 1,5 мл диметилформамида (ДМФА), 1,5 мл МХ, 1,5 мл ДМФА и 1,5 мл MC. Полученные свободные амины на твердой подложке подвергали связыванию либо с мономером Fmoc-ПНК, либо с Fmoc-защищенным производным аминокислоты.
[DeFmoc] смолу обрабатывали на вортексе в 1,5 мл 20% пиперидина/ДМФА в течение 7 мин, и раствор DeFmoc удаляли при фильтровании. Смолу последовательно каждый раз промывали по 30 секунд 1,5 мл МХ, 1,5 мл ДМФА, 1,5 мл МХ, 1,5 мл ДМФА и 1,5 мл МХ. Полученные свободные амины на твердой подложке непосредственно подвергали связыванию с мономером Fmoc-ПНК.
[Связывание с мономером Fmoc-ПНК] Свободные амины на твердой подложке связывали с мономером Fmoc-ПНК следующим образом. 0,04 ммоль мономера ПНК, 0,05 ммоль HBTU и 10 ммоль DIEA инкубировали в течение 2 мин в 1 мл безводного ДМФА и добавляли к смоле со свободными аминами. Раствор смолы обрабатывали на вортексе в течение 1 часа, и реакционный раствор удаляли при фильтровании. Затем смолу последовательно промывали по 30 секунд 1,5 мл МХ, 1,5 мл ДМФА и 1,5 мл МХ. Химические структуры мономеров Fmoc-ПНК с модифицированным нуклеиновым основанием, используемым в настоящем изобретении, приведены на Фигуре 6. Мономеры Fmoc-ПНК с модифицированным нуклеиновым основанием, представленные на Фигуре 6, следует рассматривать в качестве примеров, и поэтому не следует рассматривать как ограничение объема настоящего изобретения. Специалист в данной области сможет легко представить множество изменений в мономерах Fmoc-ПНК для синтеза производного ПНК Формулы I.
[Блокирование] После реакции присоединения непрореагировавшие свободные амины блокировали путем перемешивания в течение 5 мин в 1,5 мл блокирующего раствора (5% уксусного ангидрида и 6% 2,6-лутидина в ДМФА). Затем блокирующий раствор удаляли с помощью фильтрования и последовательно промывали по 30 секунд 1,5 мл МХ, 1,5 мл ДМФА и 1,5 мл МХ.
[Введение "Fethoc-" радикала на N-конец] Радикал "Fethoc-" вводили на N-конец при взаимодействии свободного амина на смоле с "Fethoc-OSu" при основных условиях связывания. Химическая структура "Fethoc-OSu" [номер CAS 179337-69-0, C20H17NO5, мол. масса 351,36] представлена ниже.

[Снятие со смолы] Олигомеры ПНК, связанные на смоле, снимали со смолы путем перемешивания в течение 3 часов в 1,5 мл раствора для снятия (2,5% триизопропилсилана и 2,5% воды в трифторуксусной кислоте). Смолу удаляли при фильтровании и выпаривали фильтрат при пониженном давлении. Остаток растирали с диэтиловым эфиром и собирали полученный осадок при фильтровании для очистки с помощью обращенно-фазовой ВЭЖХ.
[ВЭЖХ анализ и очистка] После снятия со смолы неочищенный продукт производного ПНК очищали с помощью C18-обращенно-фазовой ВЭЖХ при элюировании в воде/ацетонитриле или воде/метаноле (градиентный метод), содержащих 0,1% ТФУ. Фигуры 7(A) и 7(B) являются примерами хроматограмм ВЭЖХ для "ASO 1" до и после очистки ВЭЖХ, соответственно. Последовательность олигомера "ASO 1" представлена в Таблице 1.
Примеры синтеза производных ПНК Формулы I
Производные ПНК настоящего изобретения получали согласно методикам синтеза, представленным выше, или с небольшими модификациями. В Таблице 1 представлены примеры АСО АР настоящего изобретения наряду с данными структурных исследований, полученными с помощью масс-спектрометрии. Предоставление АСО АР в Таблице 1 служит в качестве примеров производных ПНК Формулы I и не должно интерпретироваться как ограничение объема настоящего изобретения.
Таблица 1. Производные ПНК Формулы I и определение их структуры с помощью масс-спектрометрии.
Аффинность связывания ПНК в отношении 10-мерной комплементарной ДНК
Производные ПНК в Таблице 1 оценивали на их аффинность связывания в отношении 10-мерной ДНК при комплементарном взаимодействии либо с N-концом, либо с C-концом. Аффинность связывания оценивали по значению Тп для дуплекса между ПНК и 10-мерной комплементарной ДНК. Дуплекс между производными ПНК в Таблице 1 и полностью комплементарными ДНК показывает, что значение Тп слишком высокое, чтобы его можно было достоверно определить в водном буферном растворе, так как при измерении Тп может происходить выпаривание буферного раствора.
Значения Тп определяли на УФ/ВИД спектрометре следующим образом. Смешанный раствор 4 мкМ ПНК олигомера и 4 мкМ комплементарной 10-мерной ДНК в 4 мл водного буфера (pH 7,16, 10 мМ фосфата натрия, 100 мМ NaCl) в пробирке Falcon объемом 15 мл инкубировали при 90°C в течение минуты и медленно охлаждали до температуры окружающей среды в течение нескольких минут. Затем раствор переносили в кварцевую УФ кювету на 3 мл, снабженную герметичной пробкой, и проводили измерение Тп при 260 нм на спектрофотометре Agilent 8453 для УФ/видимой области спектра, или подобном, как описано в предшествующем уровне техники [PCT/KR2009/001256] или с небольшими модификациями. 10-мерные комплементарные ДНК для измерения Тп приобретели в Bioneer (www.bioneer.com, Dajeon, Republic of Korea) и использовали без дополнительной очистки.
Наблюдаемые значения Тп производных ПНК Формулы I очень высокие для комплементарного связывания с 10-мерной ДНК и представлены в Таблице 2. Например, "ASO 5" показал значение Тп 86,1°C для дуплекса с 10-мерной комплементарной ДНК, направленно взаимодействующей с N-концевым 10-мером в ПНК, выделенным "полужирным" шрифтом и "подчеркнутым" в [(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2]. В то же время, "ASO 5" показал Тп 81,3°C для дуплекса с 10-мерной комплементарной ДНК, направленно взаимодействующей с C-концевым 10-мером в ПНК, выделенным "полужирным" шрифтом и "подчеркнутым" в [(N→C) Fethoc-C(1O2)TT-A(5)CC-A(5)GG-C(1O2)AA(5)-G-NH2].
Таблица 2. Значения Тп между различными ПНК в Таблице и 10-мерной комплементарной ДНК, направленно взаимодействующей либо с N-концом, либо C-концом ПНК.
Примеры биологической активности производных ПНК Формулы I
Производные ПНК Формулы I оценивали на их биологическую активность in vitro и in vivo. Биологические примеры, приведенные ниже, представлены в качестве примеров для иллюстрации биологических профилей таких производных ПНК Формулы I и, таким образом, не должны интерпретироваться как ограничение объема настоящего изобретения.
Пример 1. Пропуск экзона, вызванный "ASO 5".
"ASO 5", указанный в Таблице 1, представляет собой 13-мерный антисмысловой олигонуклеотид, который имеет 13-мерный полностью комплементарный участок, перекрывающийся с 13-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCUUGCCUG|guaaggaaaa], охватывающей соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека.
"ASO 5" оценивали с помощью вложенной ПЦР АР на его способность индуцировать пропуск "экзона 5" АР в клетках MCF7 (номер по кат: HTB-22, ATCC). Используемые процедуры подробно описаны следующим образом.
[Культивирование клеток и обработка АСО] Клетки MCF7 выращивали в среде EMEM с добавкой 10% FBS, 1% стрептомицина/пенициллина и 0,01 мг/мл бычьего инсулина в атмосфере с 5% CO2 при 37°C. Клетки субкультивировали в чашке для культур клеток диаметром 60 мм перед обработкой "ASO 5" в концентрации от 3 аМ до 3 фМ.
[Выделение РНК] Клетки MCF7 инкубировали с или без "ASO 5" в течение 3 часов. Суммарную РНК выделяли из клеток в чашке для культур клеток диаметром 60 мм при использовании набора "Universal RNA Extraction Kit" (номер по кат. 9767, Takara) согласно инструкциям производителя.
[Синтез кДНК с помощью ПЦР One-step] 100 нг РНК матрицы использовали в 25 мкл реакциях обратной транскрипции с использованием набора ОТ-ПЦР Super Script® One-Step с Taq-полимеразой Platinum® (номер по кат. 10928-042, Invitrogen) против набора геноспецифических праймеров [exon 3_forward: (5'→3') TGGGTGTCACTATGGAGC и exon 9_reverse: (5'→3') GGGTGT-GGAAATAGATGGG] согласно следующим параметрам циклов: 50°C в течение 30 мин и 94°C в течение 2 мин, затем 39 циклов по 30 сек при 94°C, 30 сек при 55°C и 1 мин при 72°C.
[Амплификация методом вложенной ПЦР] В ходе процесса амплификации использовали уникальную методику амплификации (с коррекцией при увеличении температуры отжига с каждым циклом), которая эффективно работала и особенно в диапазоне температур, а не при одной определенной температуре отжига (т.е. как в стандартном методе ПЦР). Затем 1 мкл кДНК амплифицировали в 20 мкл реакции вложенной ПЦР (Invitrogen) против набора праймеров [exon 3_forward: (5'→3') TGGGTG-TCACTATGGAGC и exon 7n_reverse: (5'→3') GGGGTGATTTGGAGCCAT] согласно следующим параметрам циклов: начальные 10 циклов [94°C в течение 30 сек, 47°C в течение 40 сек (+0,5°C каждый цикл), 72°C в течение 40 сек], затем 20 циклов [94°C в течение 30 сек, 50°C в течение 30 сек и 72°C в течение 40 сек].
[Идентификация продуктов с пропуском экзона] Продукты ПЦР подвергали электрофоретическому разделению в 2% агарозном геле. Полосы требуемого размера собирали и анализировали методом секвенирования по Сэнгеру. На Фигуре 8(A) показано три полосы связанного с обработкой продукта ПЦР, которые могут быть отнесены к вариантам сплайсинга мРНК АР без "экзона 5". Было обнаружено, что "ASO 5" индуцировал пропуск "экзона 5", "экзонов 4-5" и "экзонов 4-6", хотя отношение продуктов с пропуском, как оказалось, зависело от концентрации АСО. На Фигуре 8(B) приведены фактические данные секвенирования для полосы с пропуском "экзонов 4-5" на Фигуре 8(A) в качестве примера секвенирования по Сэнгеру.
Пример 2. Оценка с помощью кПЦР уровня мРНК АР в клетках MCF7, обработанных "ASO 5".
"ASO 5" оценивали на его способность даун-регулировать мРНК АР человека при помощи кПЦР с детектированием SYBR Green.
Клетки MCF7 субкультивировали в 5 мл среды в чашке для культур клеток диаметром 60 мм и обрабатывали либо "ASO 5" в количестве от 0 зМ (отрицательный контроль) до 1 аМ (по 2 чашки для культур клеток на каждую концентрацию). Через 5 часов суммарную РНК выделяли при использовании набора "MiniBEST Universal RNA Extraction Kit" согласно инструкциям производителя (номер по кат. 9767, Takara). 500 нг РНК матрицы использовали для синтеза кДНК для 50 мкл реакций обратной транскрипции при использовании олиго-dT согласно инструкциям производителя (номер по кат. 6110A, Takara). Затем кДНК подвергали 1-ой ПЦР против набора праймеров, охватывающих "экзон 3" - "экзон 9" [Exon 3_forward: (5'→3') TGGGTGTCACTATGGAGC и Exon 9_reverse: (5'→3') GGGTG-TGGAAATAGAT-GGG] согласно следующим параметрам циклов: 94°C в течение 2 мин, затем 15 циклов по 15 сек при 94°C, 30 сек при 55°C, и 2 мин при 72°C.
Продукты 1-ой ПЦР разбавляли в 2000 раз и по 1 мкл каждого разбавленного продукта ПЦР подвергали реакциям ПЦР в реальном времени в 20 мкл против наборов экзонспецифических праймеров [Exon 4_forward(q): (5'→3') GACCATGTTTTGCCCATTG и Exon 4_reverse(q): (5'→3') GGCTCTTTTGAAGAAGACC для экзона 4; Exon 5_forward(q): (5'→3') GAAACAGAAGTA-CCTGTGC и Exon 5_reverse(q): (5'→3') GTCATCCCTGCTTCATAAC для экзона 5; и Exon 6_forward(q): (5'→3') CGGAAGCTGAAGAAACTTG и Exon 6_reverse(q): (5'→3') CACTTGACCACGTGTACAAG для экзона 6]. Реакции ПЦР контролировали с использованием SYBR Green (Takara, Japan). Параметры циклов: 95°C в течение 3 мин, затем 40 циклов по 5 сек при 95°C, и 30 сек при 60°C.
На Фигуре 9(A) представлены полученные данные кПЦР. Относительный уровень экспрессии экзонов 4-6 значительно снижался при увеличении концентрации АСО с 0 зМ до 100 зМ. При 100 зМ уровни информационных экзонов снижались приблизительно на 50-60%. Однако при 1 аМ уровни информационных экзонов почти возвращались к уровням отрицательного контроля (без обработки АСО). Такой необычный характер зависимости эффекта от дозы согласно данным кПЦР мог быть связан с апрегуляцией транскрипции "экзон-интронной кольцевой РНК (EIciRNA)", накапливающейся в ходе пропуска экзонов под действием "ASO 5" [Nature Struc. Mol. Biol. vol 22 (3), 256-264 (2015)]
Пример 3. Оценка с помощью кПЦР уровня мРНК АР в клетках MCF, обработанных "ASO 1".
Хотя "ASO 1", указанный в Таблице 1, представляет собо 13-мерный антисмысловой олигонуклеотид, первоначально разработанный для комплементарного взаимодействия с соединением "экзона 5" и "экзона 6" в мРНК АР человека. "ASO 1" имеет 9-мерный комплементарный участок, перекрывающийся с 9-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности РНК [(5'→3') GCCUUGCCUG|g"uaag"gaaaa], охватывющией соединение "экзона 5" и "интрона 5" в пре-мРНК АР человека. Следует отметить, что четыре одиночных неспаривающихся нуклеотида в интроне 5 указаны как "uaag". Таким образом, "ASO 1" может рассматриваться как антисмысловый олигонуклеотид, направленно взаимодействующий с пре-мРНК АР человека, хотя и только с 9-мерным комплементарный участком, перекрывающимся с 13-мерной последовательностью.
"ASO 1" оценивали на его способность даун-регулировать мРНК АР человека при помощи кПЦР согласно методике, описанной в "Примере 2".
На Фигуре 9(B) приведены полученные данные кПЦР. Относительный уровень экспрессии "экзонов 4-6" значительно снижался при увеличении концентрации АСО с 0 зМ до 100 зМ. При 100 зМ уровни информационных экзонов снижались более чем на 80%. Однако при 1 аМ уровни информационных экзонов восстанавливались приблизительно до 60% от отрицательного контроля (без обработки АСО). Такой необычный характер зависимости эффекта от дозы данных кПЦР мог быть связан с апрегуляцией транскрипции " экзон-интронной кольцевой РНК (EIciRNA)", накапливающейся в ходе пропуска экзонов под действием "ASO 5" [Nature Struc. Mol. Biol. vol 22 (3), 256-264 (2015)].
Пример 4. Оценка с помощью кПЦР уровня мРНК АР в клетках MCF, обработанных "ASO 10".
"ASO 10", указанный в Таблице 1, представляет собой 12-мерный антисмысловой олигонуклеотид, который имеет 12-мерный полностью комплементарный участок, перекрывающийся с 12-мерной последовательностью, выделенной "полужирным" шрифтом и "подчеркнутой" в 20-мерной последовательности пре-мРНК [(5'→3') GCCUUGCCUG|guaaggaaaa], охватывающей соединение "экзона 5" и "интрона 5" пре-мРНК АР человека.
"ASO 10" оценивали на его способность даун-регулировать мРНК АР человека (полноразмерную) с помощью кПЦР согласно методике, описанной в "Примере 2".
На Фигуре 9(C) приведены полученные данные кПЦР. Относительный уровень экспрессии "экзонов 4-6" значительно снижался на 60~80% в клетках MCF7, обработанных "ASO 10" в количестве от 1 зМ до 1000 зМ.
Пример 5. Вестерн-блотинг даун-регуляции АР под действием "ASO 1".
Клетки MCF7 субкультивировали в чашке для культур клеток диаметром 60 мм, содержащей 5 мл среды, и обрабатывали "ASO 1" в количестве 0 зМ (отрицательный контроль) или от 100 зМ до 300 аМ. 4 чашки для культур клеток использовали в качестве 4 отрицательных контролей. Через 48 часов клетки промывали 2 раза холодным PBS и затем подвергали лизису при использовании 200 мкл 1× буфера для лизиса клеток (номер по кат. 9803, Cell Signaling Tech) с добавкой 1× ингибитора протеаз (номер по кат. P8340, Sigma). Лизаты собирали в 1,5 мл пробирку e-tube. По 200 мкл каждого лизата смешивали с 100 мкл 3× буфера для образца и кипятили в течение 5 мин при 100°C. По 20 мкл каждого лизата (всего 12 лизатов), 4 отрицательных контроля и 8 образцов (обработанных АСО) подвергали электрофоретическому разделению в 8% геле ДСН-ПААГ с последующим переносом на 0,2 мкм ПВДФ мембрану. Мембрану детектировали антителом к АР (номер по кат. 5153, Cell Signaling Tech) и антителом против β-актина (номер по кат. sc4778, Santa Cruz). На Фигуре 10(A) представлены полученные данные Вестерн-блоттинга АР. Несколько образцов (отрицательного) контроля использовали для исключения технических артефактов процедур Вестерн-блоттинга. За исключением полосы АР для (отрицательного) "контроля 4", интенсивность полосы АР лизатов после обработки АСО была значительно более слабой, чем у лизатов без обработки ASO, что однозначно указывает на то, что "ASO 1" ингибирует экспрессию полноразмерного белка АР в клетках MCF7.
Пример 6. Вестерн-блоттинг даун-регуляции АР под действием "ASO 5".
"ASO 5" оценивали на его способность ингибировать экспрессию белка АР в количестве от 10 зМ до 30 аМ в клетках MCF7 согласно методикам, описанным в "Примере 5".
На Фигуре 10(B) приведены данные Вестерн-блоттинга АР, полученные с клетками MCF7, обработанными "ASO 5" в количестве 0 зМ (отрицательный контроль, без обработки АСО) или от 10 зМ до 30 аМ. Несколько образцов (отрицательного) контроля использовали для устранения технических артефактов процедур Вестерн-блоттинга. Интенсивность полосы АР лизатов после обработки АСО была значительно более слабой, чем у соседних лизатов без обработки ASO, что однозначно указывает на то, что "ASO 1" ингибирует экспрессию полноразмерного белка АР в клетках MCF7.
Пример 7. Рост волос, вызванный наружным применением "ASO 1" у мышей.
"ASO 1" оценивали на его способность вызывать рост волос у мышей C57BL/6 при наружном применении следующим образом. Последовательность-мишень "ASO 1" в пре-мРНК АР человека сохраняется в пре-мРНК АР мыши. Таким образом, результаты терапевтических исследований in vivo на мышах можно с достаточной точностью экстраполировать в отношении случаев у человека.
[Удаление волос и распределение в группы] В День 0, самкам мышей C57BL/6 возрастом 7 недель делали анестезию золетилом/ромпуном, состригали шерсть со спины и удаляли волосы с помощью машинки для стрижки и воска, соответственно. Мышей с идеальным (т.е. чистым) удалением волос отбирали и рандомизированно распределяли в три группы (по 7 животных в группе).
[Наружное применение] Растворы "ASO 1" для наружного применения подготавливали путем разбавления исходного стокового раствора "ASO 1" до 0,2 фМ или 1 фМ в водном 30% (об/об) этаноле с добавкой 3% (об/об) глицерина. Приблизительно 100 мкл 0 (отрицательного контроля), 0,2 или 1 фМ "ASO 1" наносили на спину каждого животного при помощи ватного тампона в Дни 3, 7, 10 и 14.
[Оценка роста волос по цифровым изображениям] Для оценки роста волос животным делали анестезию и фотографировали по группам, как показано на Фигуре 11(A), при использовании цифрового фотоаппарата с фиксированной выдержкой и освещенностью. Цифровое изображение области с удалением шерсти у каждого животного выбирали и оценивали в цифровой форме на среднюю яркость в выбранной области при использовании программы "ImageJ". Более низкую оценку яркости принимали в качестве более быстрого роста волос. Оценки яркости отдельных животных объединяли по группам и подвергали статистическому анализу при использовании t-критерия Стьюдента. На Фигуре 11(B) приведены оценки относительной яркости в группах лечения АСО в сравнении с контрольной группой. Относительная оценка яркости уменьшалась с течением времени по дням в контрольных группах. В День 13, группа 1 фМ имела значительно более низкую оценку яркости, чем необработанная группа. Таким образом, сделали вывод, что "ASO 1" вызывал рост волос при наружном применении в количестве 1 фМ.
[Оценка по весу волос] В День 21, животным делали анестезию и состригали шерсть со спины машинкой для стрижки. Образцы волос отдельных животных объединяли по группам и взвешивали для оценки роста волос со Дня 0 до Дня 21. Средний вес волос составлял 70,5 мг/животное в контрольной группе, 90,8 мг/животное в группе лечения 0,2 фМ и 94,4 мг/животное в группе 1 фМ. Таким образом, сделали вывод, что "ASO 1" вызывал рост волос при наружном применении как в дозе 0,2 фМ, так и 1 фМ.
[ИГХ АР образца кожи] После стрижки в День 21, мыши получали одно наружное применение растворителя или "ASO 1" в зависимости от группы. В День 24, кожу в области с удаленной шерстью выбирали для иммуногистохимического (ИГХ) анализа против андрогенового рецептора. Образцы кожи использовали для изготовления криосрезов, которые последовательно подвергали иммуноокрашиванию первичным антителом против АР (номер по кат. sc-816, Santa Cruz) в разведении 1:100, вторичным антителом против IgG (номер по кат. BA-1100, Vector) в разведении 1:200, а затем Dylight 594-стрептавидином (номер по кат. SA-5594, Vector, Калифорния, США) в разведении 1:200 для красного флуоресцентного мечения. Изображения ИГХ регистрировали на флуоресцентном микроскопе Olympus для обнаружения изменений уровня экспрессии АР после наружного применения "ASO 1".
Фигура 12 является репрезентативным набором изображений ИГХ АР, демонстрирующих, что экспрессия АР в волосяных фолликулах была заметно ингибирована в волосяных фолликулах при наружном применении "ASO 1" в количестве 0,2 фМ или 1 фМ. Получали изображения окрашивания DAPI для определения положения волосяных фолликулов на изображениях ИГХ. Интересно отметить, что экспрессия АР уменьшалась даже в мышечном слое под кожей при наружном применении "ASO 1" в количестве 0,2 фМ или 1 фМ. Таким образом, "ASO 1" легко проникал в дерму, а также подкожный мышечный слой при наружном применении, и мощно ингибировал экспрессию АР.
Пример 8. Рост волос, вызванный наружным применением "ASO 5" у мышей.
"ASO 5" оценивали на его способность вызывать рост волос у мышей C57BL/6 при наружном применении, как подробно описано ниже. Последовательность-мишень "ASO 5" в пре-мРНК АР человека сохраняется в пре-мРНК АР мыши. Таким образом, результаты терапевтических исследований in vivo у мышей с достаточной точностью можно экстраполировать в отношении случаев у человека.
[Удаление волос и распределение в группы] В День 0, самкам мышей C57BL/6 возрастом 7 недель делали анестезию золетилом/ромпуном, шерсть со спины состригали и удаляли с помощью машинки для стрижки и воска, соответственно. Мышей с идеальным (т.е. чистым) удалением волос отбирали и рандомизированно распределяли в три группы (по 10 животных в группе).
[Наружное применение] Растворы для наружного применения "ASO 5" приготавливали путем разбавления исходного стокового раствора "ASO 5" до 1, 5 или 25 фМ в водном 30% (об/об) этаноле с добавкой 3% (об/об) глицерина. Приблизительно 100 мкл каждого раствора АСО или растворителя (отрицательный контроль) наносили на спину животного при помощи ватного тампона в Дни 3, 7, 10, 14 и 21.
[Оценка роста волос по цифровым изображениям] На Фигуре 13 приведены оценки относительной яркости в группах лечения АСО в сравнении с группой отрицательного контроля. Относительная оценка яркости уменьшалась с течением времени по дням в группах лечения АСО. В День 17, группы лечения 1 фМ и 25 фМ имели значительно более низкую оценку яркости, чем необработанная группа. Таким образом, сделали вывод, что "ASO 5" вызывал рост волос при наружном применении в количестве 1-25 фМ.
[Оценка по весу волос] В День 21, животным делали анестезию и состригали и собирали шерсть со спины машинкой для стрижки. Образцы волос отдельных животных объединяли по группам и взвешивали для оценки роста волос со Дня 0 до Дня 21. Группы лечения показали заметное увеличение веса волос по сравнению с контрольной группой. Средние значения веса волос в группах 1 фМ, 5 фМ и 25 фМ составили 293%, 306% и 278% от уровня в группе отрицательного контроля, соответственно. Таким образом, сделали вывод, что "ASO 5" вызывал рост волос при наружном применении в дозе 1-25 фМ.
После стрижки в День 21, животные получали однократное наружное применение растворителя или "ASO 5" в количестве 1 фМ, 5 фМ или 25 фМ. В День 53, волосы на спине собирали, состригая их машинкой для стрижки, для определения общего уровня роста волос в Дни 21-53. Средние значения веса волос в группах 1 фМ, 5 фМ и 25 фМ составили 1630%, 1450% и 771% от уровня в необработанной группе, соответственно. Таким образом, сделали вывод, что "ASO 5" вызывал рост волос при наружном применении в дозе 1-25 фМ.
Пример 9. Рост волос, вызванный наружным применением "ASO 10" у мышей.
"ASO 10" оценивали на его способность вызывать рост волос у мышей C57BL/6 при наружном применении, как подробно описано ниже. Последовательность-мишень "ASO 10" в пре-мРНК АР человека сохраняется в пре-мРНК АР мыши. Таким образом, результаты терапевтических исследований in vivo у мышей с достаточной точностью можно экстраполировать в отношении случаев у человека.
[Удаление волос и распределение в группы] В День 0, самкам мышей C57BL/6 возрастом 7 недель делали анестезию золетилом/ромпуном, и шерсть на спине состригали и удаляли с помощью машинки для стрижки и воска, соответственно. Мышей с идеальным (т.е. чистым) удалением волос отбирали и рандомизированно распределяли в три группы (по 9 животных в группе).
[Наружное применение] Растворы "ASO 10" для наружного применения приготавливали путем разбавления исходного стокового раствора "ASO 10" до 1, 5 или 25 фМ в водном 30% (об/об) этаноле с добавкой 3% (об/об) глицерина. Приблизительно 100 мкл каждого раствора АСО или растворителя (отрицательного контроля) наносили на спину животного при помощи ватного тампона в День 2.
[Оценка роста волос по цифровым изображениям] На Фигуре 14(A) приведены оценки относительной яркости в группах лечения АСО в сравнении с контрольной группой. Оценка относительной яркости снижалась в течение времени по дням в группах лечения. В День 27, группы лечения 1 фМ и 5 фМ имели значительно более низкую оценку яркости, чем необработанная группа. Таким образом, сделали вывод, что "ASO 10" вызывал рост волос при наружном применении в дозе 1-5 фМ.
[Оценка по весу волос] В День 27 животным делали анестезию, и шерсть на спине состригали и собирали. Образцы волос отдельных животных объединяли по группам и взвешивали для оценки роста волос со Дня 0 до Дня 27. Группы лечения показали умеренное увеличение веса волос по сравнению с контрольной группой. Средние значения веса волос в группах 1 фМ, 5 фМ и 25 фМ составляли 115%, 114% и 119% от уровня в необработанной группе, соответственно. Таким образом, сделали вывод, что "ASO 10" вызывал рост волос при наружном применении в дозах 1-25 фМ.
[Иммуногистохимия АР образцов кожи] После удаления волос в День 27, животным наружно применяли либо растворитель, либо "ASO 10" в 1, 5 или 25 фМ в Дни 27 и 29. Образцы кожи спины собирали в День 30 для иммуногистохимического анализа против андрогенового рецептора. Образцы кожи подвергали иммуноокрашиванию против андрогенового рецептора, как описано в "Примере 7". Изображения ИГХ регистрировали на сканере микропрепаратов Zeiss. Фигура 14(B) представляет собой репрезентативный набор изображений ИГХ АР. Интересно отметить, что количество волосяных фолликулов заметно увеличилось в группах лечения АСО по сравнению с группой отрицательного контроля. Было сложно четко определить, что экспрессия АР в волосяных фолликулах снижалась в группах лечения вследствие заметного увеличения числа волосяных фолликулов в группах лечения. Тем не менее, экспрессия АР в подкожном мышечном слое заметно снизилась в группах лечения по сравнению с контрольной группой. Наиболее заметное снижение наблюдали в группе лечения 5 фМ. В совокупности с данными ИГХ у животных, которых обрабатывали "ASO 10", "ASO 10" способствовал росту волос, вызывая ингибирование экспрессии АР с увеличением количества волосяных фолликулов во всех протестированных дозах, но наиболее заметно при 5 фМ.
Пример 10. Оценка с помощью кПЦР уровня мРНК АР в анализе TaqMan в клетках MCF7, обработанных "ASO 10".
"ASO 10" оценивали на его способность даун-регулировать мРНК АР человека с помощью кПЦР при использовании зонда TaqMan.
Клетки MCF7 субкультивировали в 5 мл среды в чашке для культуры клеток диаметром 60 мм и обрабатывали "ASO 10" в количестве от 0 зМ (отрицательный контроль) до 1 аМ (по 2 чашки для культуры клеток на каждую концентрацию). Через 24 часа суммарную РНК выделяли с помощью набора "MiniBEST Universal RNA Extraction Kit" согласно инструкциям производителя (номер по кат. 9767, Takara).
400 нг РНК матрицы использовали для синтеза кДНК для 20 мкл реакции обратной транскрипции при использовании набора для ОТ-ПЦР One-Step (Invitrogen) против набора экзонспецифических праймеров [exon 3_forward: (5'→3') TGGGTGTCACTATGGAGC; и exon 9_reverse: (5'→3') GGGTGT-GGAAATAGATGGG] согласно следующим параметрам циклов: 50°C в течение 30 мин и 94°C в течение 2 мин, затем 15 циклов по 30 сек при 94°C, 30 сек при 50°C, и 1 мин при 72°C.
Растворы кДНК разбавляли в 50 раз и по 1 мкл каждого разбавленного продукта ПЦР подвергали реакции ПЦР в реальном времени в 20 мкл против набора экзонспецифических праймеров [exon 4_forward: (5'→3') TTGTCCATCTTGTCGTCTT; и exon 5_reverse: (5'→3') CCTCTC-CTTCCTCCTGTA] согласно следующим параметрам циклов: 95°C в течение 3 мин, затем 40 циклов по 15 сек при 95°C, и 30 сек при 60°C. Реакцию кПЦР контролировали с использованием зонда TaqMan [(5'→3') TTTCTTCAG-ZEN-CTTCCGGGCTC-3IABkFQ].
На Фигуре 15 приведены полученные данные кПЦР. Относительный уровень экспрессии экзонов 4-6 значительно снижался приблизительно на 50-70% в клетках MCF7, обработанных "ASO 10" в количестве от 1 зМ до 1 аМ.
Пример 11. Даун-регуляция экспрессии АР согласно ИГХ у мышей после подкожного введения "ASO 10".
"ASO 10" оценивали на его способность ингибировать экспрессию АР у мышей следующим образом.
Самцов мышей C57BL/6 возрастом 12 недель рандомизированно распределяли в 3 группы отрицательного контроля (без обработки ASO), 0,01 пмоль/кг "ASO 10" и 0,1 пмоль/кг "ASO 10" (3 животных в группе). Мышам подкожно вводили либо растворитель, либо ASO, растворенный в растворителе (PBS), 2 раза в неделю в течение 4 недель в зависимости от группы лечения. Через три дня после последнего введения животным делали анестезию золетилом/ромпуном и забирали образцы ткани или органов для ИГХ АР при использовании парафинового блока.
Белок АР последовательно детектировали первичным антителом (номер по кат. sc-816, Santa Cruz) в разведении 1:100, вторичным антителом против IgG кролика (номер по кат. BA-1100, VECTOR) в разведении 1:200 и Dylight 594-стрептавидином (номер по кат. SA-5594, VECTOR) при 1:200. Ядра окрашивали DAPI. Флуоресцентные изображения ИГХ регистрировали на сканере микропрепаратов Zeiss.
На Фигуре 16 представлены изображения АР ИГХ (красный), полученные при использовании тканей с известной высокой экспрессией белка АР. Следует отметить, что изображения ИГХ представлены с колокализацией DAPI (синий). При длительном подкожном воздействии "ASO 10", экспрессия АР заметно снижалась в эпидермисе, дистальном к участку инъекции, в печени, семеннике и предстательной железе, при увеличении дозы АСО от 0,01 пмоль/кг до 0,1 пмоль/кг. Таким образом, "ASO 10" определенно ингибирует экспрессию белка АР у мышей после системного воздействия.
Реферат
Группа изобретений относится к биотехнологии и медицине, в частности к производным пептидо-нуклеиновых кислот (ПНК), направленно взаимодействующим с пре-мРНК андрогенового рецептора. Предложено производное ПНК формулы I или его фармацевтически приемлемая соль для лечения андрогенной алопеции, где ПНК обладает по меньшей мере 9-мерным комплементарным участком, перекрывающимся с 17-мерной последовательностью РНК [(5'→3') CCUUGCCUGGUAAGGAA] в пре-мРНК андрогенового рецептора (АР) человека, и полностью комплементарно последовательности пре-мРНК в пре-мРНК АР человека или частично комплементарно последовательности пре-мРНК в пре-мРНК АР человека с одним ошибочным спариванием. Производные ПНК индуцируют альтернативный сплайсинг человеческой пре-мРНК АР, ингибируют экспрессию АР, обладают хорошей клеточной проницаемостью и могут быть с легкостью доставлены в клетку при обработке в виде "голого" олигонуклеотида. Производные ПНК применимы для безопасного лечения андрогенной алопеции при топическом нанесении. 4 н. и 7 з.п. ф-лы, 16 ил., 2 табл., 11 пр.
Формула
























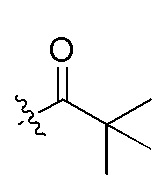
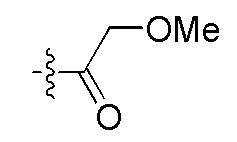
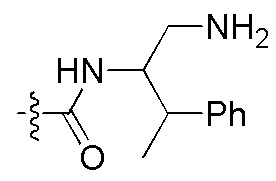











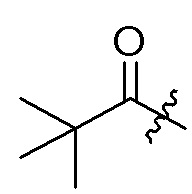









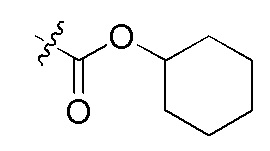
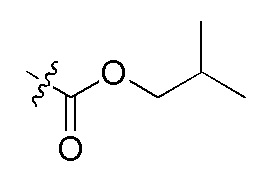
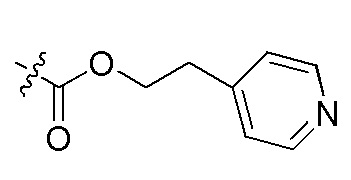
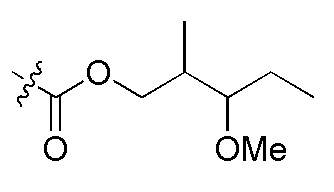
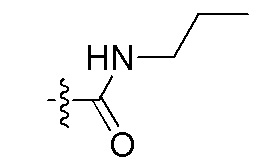
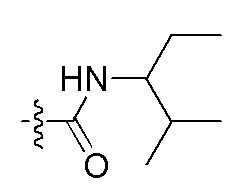







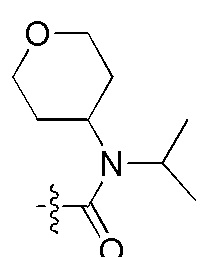




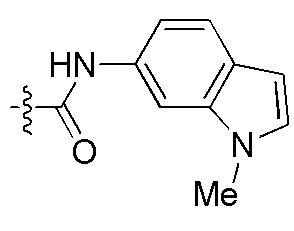


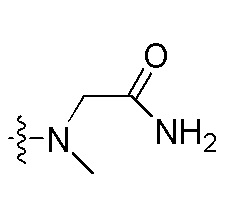



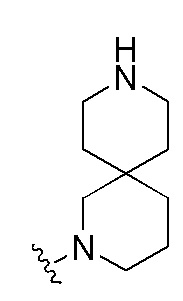

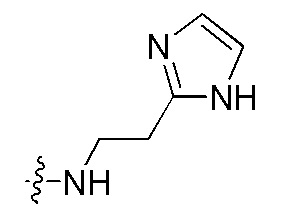

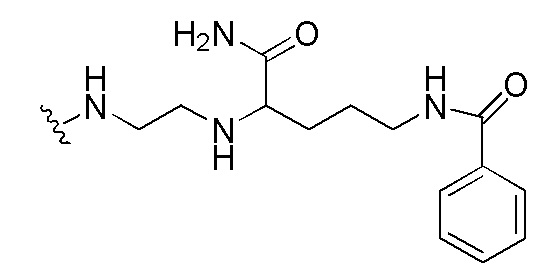
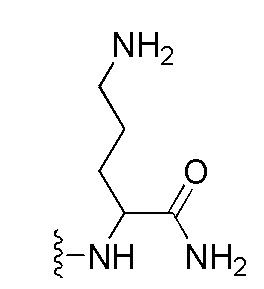







Комментарии