Пептиды направленного действия на vegfr-1/nrp-1 - RU2488592C2
Код документа: RU2488592C2
Чертежи





Описание
Настоящее изобретение создано при финансовой поддержке правительства США за счет грантов CA103056 и CA100632 Национального Института Здоровья. Таким образом, правительство США имеет определенные права на настоящее изобретение.
По данной заявке испрашивается приоритет предварительной заявки США №60/954750, зарегистрированной 8 августа 2007 года, описание которой включено в настоящий документ в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение затрагивает области молекулярной медицины и мишень-ориентированной доставки терапевтических средств. В частности, настоящее изобретение имеет отношение к идентификации новых пептидных последовательностей, которые селективно воздействуют на VEGFR-1 и NRP-1 как на терапевтические мишени для лечения и выявления неоваскулярных и ангиогенных VEGF-ассоциированных нарушений, включая, в числе прочего, рак, ожирение, диабет, астму, артрит, цирроз и глазные болезни.
ПРЕДПОСЫЛКИ
Кровеносные сосуды являются неотъемлемой частью организма, доставляющей кислород и питательные вещества почти ко всем органам и тканям. Большинство сосудов образуется во время эмбриогенеза, а во взрослом организме формирование новых кровеносных сосудов (процесс, названный ангиогенезом) ограничено и, в основном, происходит во время заживления раны и нормального менструального цикла у женщин. Это благоприятствует проведению терапии, поскольку ряд заболеваний прогрессирует только в случае индуцирования ими формирования новых кровеносных сосудов; рак, ожирение, диабет, астма, артрит, цирроз и глазные болезни причисляются к большинству заболеваний, течение которых, по-видимому, можно замедлить или остановить с помощью ингибиторов ангиогенеза.
Сосудистый эндотелиальный ростовой фактор (VEGF) является основной молекулой, контролирующей ангиогенез, и три анти-VEGF лекарственных препарата были утверждены Управлением по контролю продуктов питания и лекарственных средств США для лечения определенных типов рака с хорошим, но не идеальным, терапевтическим эффектом (Kamba and McDonald, 2007). Таким образом, разработка лекарственных средств нового поколения, избирательно воздействующих на VEGF-опосредованный сигнальный путь, очевидно, внесет значительный вклад в регламентацию методов лечения различных заболеваний. VEGF является ключевым регулятором ангиогенеза и стимулирует деление и миграцию эндотелиальных клеток путем связывания с тирозинкиназным рецептором VEGF (VEGFR-1 и -2) на клеточной поверхности и с нейрофилинами (NRP). Поскольку VEGFR-2 является основным медиатором внутриклеточной митогенной активности VEGF, большинство лекарственных препаратов в клинике на сегодняшний день нацелены на прямое или опосредованное воздействие на этот специфический рецептор. С другой стороны, VEGFR-1 и NRP-1 первоначально рассматривались в качестве ловушки или акцептора VEGF (VEGFR-1) или модулятора активности VEGFR-2 (NRP-1). Однако исследования последних нескольких лет свидетельствуют об обратном. Оба рецептора играют значительную роль в ангиогенезе (Carmeliet et al., 2001; Autiero et al., 2003; Luttun et al., 2004; Kaplan et al., 2005; Wu et al., 2006; Pan et al., 2007) и являются важными мишенями при терапии ангиогенеза. Например, моноклональные антитела, направленные против VEGFR-1 и NRP-1, демонстрируют выдающиеся результаты при их использовании в качестве противоопухолевых средств, особенно в сочетании с химиотерапией (Wu et al., 2006; Pan et al., 2007).
Многие анти-VEGF лекарственные препараты, такие как бевацизумаб (Авастин®) и ранибизумаб (Люцентис®), используются в клинической практике и обладают определенной долей эффективности при лечении и управлении течением неоваскулярных нарушений, включая различные типы рака, а также неоваскулярные возрастные нарушения, возрастную дегенерацию желтого пятна. К сожалению, при проведении такой неспецифической анти-VEGF терапии были выявлены значительные побочные эффекты, включая, в частности, токсический эффект на сердечную мышцу (например, боль в груди, приступ стенокардии, микроинсульты, острая сердечная недостаточность и инфаркт миокарда, кровоизлияние, протеинурия, гипертензия, застойная сердечная недостаточность, артериальная тромбоэмболия и перфорация желудочно-кишечного тракта). Исследования связывают данные побочные эффекты с тем фактом, что лекарственные средства этого класса, то есть лекарственные препараты, которые напрямую воздействуют на сосудистый эндотелиальный ростовой фактор (VEGF-A; VEGF165) в отличие от селективного воздействия на рецепторы, могут отрицательно воздействовать на нормальные VEGF-опосредованные сигнальные пути (Betsholtz et al., 2006). VEGF-A занимает особое положение среди многих молекул, вовлеченных в регуляцию образования кровеносных сосудов. Во время эмбриогенеза этот фактор контролирует множество процессов, начиная от распространения недифференцированных клеток-предшественников сосудов до контроля пролиферации и миграции эндотелиальных клеток, реструктурирования сосудов, артериовенозного разграничения (Ferrara, 2004). Должный уровень белка VEGF-A абсолютно критичен для развития сосудов, поскольку уменьшение его экспрессии наполовину или увеличение таковой в два раза фатальны для эмбриона мыши.
Токсичность, связанная с VEGF-ориентированной терапией, по-видимому, обусловлена исчезновением нормального капиллярного русла и клеток сердца наравне с VEGF, который необходим для нормальной функции клеток и васкуляризации. Примечательно, что VEGF-зависимые капилляры схожи по своим характеристикам в том, что они проявляют высокую экспрессию рецепторов VEGF, таких как рецепторы типа 2 и 3 (VEGFR-2 и VEGFR-3, соответственно), и имеют небольшую экспрессию рецептора VEGFR-1 или она вовсе отсутствует. Однако, VEGFR-1 рецепторы экспрессируются в тканях, являющихся соответствующими мишенями при определенном заболевании, включая сосуды сетчатки глаза и сосуды опухоли. Таким образом, было бы целесообразным разработать лекарственные анти-VEGF препараты, избирательно воздействующие на рецепторы VEGFR-1, со сниженной токсичностью, но сохраняющие желаемую терапевтическую активность. Настоящее изобретение нацелено на создание пептидных лигандов селективно направленных на VEGFR-1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение преодолевает недостатки предыдущего уровня техники путем предоставления способов и композиций для селективного воздействия на VEGFR-1 и NRP-1 (в дальнейшем именуемые «VEGFR-1/NRP-1») путем использования мотива LPR (Leu-Pro-Arg) и более предпочтительногоD(LPR). Селективное направленное действие на VEGFR-1/NRP-1 путем использования мотива LPR пригодно, например, для лечения рака или других заболеваний, ассоциированных с ангиогенезом или ростом сосудов, таких как ожирение, диабет, астма, артрит, цирроз и глазные болезни.
В определенных вариантах осуществления изобретение касается выделенных LPR пептидов, а именно пептидов направленного действия, в состав которых входит непрерывная LPR-последовательность, например, расположенная на амино- или карбокси-конце пептида или внутри него. Хотя расположение LPR-последовательности в конце пептида является наиболее предпочтительным, предполагается, что внутреннее расположение LPR обеспечит, тем не менее, возможность направленного действия на VEGFR-1/NRP-1. Для удобства в приготовлении и использовании такой вариант осуществления изобретения нацелен на выделенные пептиды из 10 или менее аминокислот, содержащие как минимум непрерывную аминокислотную последовательности Leu Pro Arg. Ввиду этого, даже более короткие пептиды размером в 7 или 5 аминокислот или еще меньше и даже сам по себе LPR трипептид наиболее предпочтительны. Таким образом, пептиды направленного воздействия по настоящему изобретению могут содержать 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, в которых непрерывная LPR последовательность или таковая в SEQ ID NO:1 расположена внутри.
В других вариантах осуществления изобретения авторы предлагают на рассмотрение специфические пептиды, содержащие LPR последовательности, которые могут быть созданы в циклической форме как, например, пептиды, имеющие цистеиновый остаток («С») на обоих концах и превращающиеся, где это необходимо, в циклическую форму путем образования дицистеина (т.е. цистина). Примером такого пептида является Cys Leu Pro Arg Cys (SEQ ID NO:1). Такие циклические пептиды могут иметь огромное значение, поскольку дисульфидная связь в пептидах придает им выраженную устойчивость к химическому, температурному или ферментативному распаду. Такие циклические пептиды могут иметь особое значение в терапевтических и диагностических способах применения, где имеет место сниженная доступность, подверженность протеолизу и короткое время полу-жизни in vivo.
В других вариантах осуществления изобретения рассматривается использование D-аминокислот для приготовления всех или части вышеупомянутых пептидов. Пептиды, состоящие из D-аминокислот, имеют определенные преимущества перед теми, которые содержат L-аминокислоты, в том, что использование D аминокислот придает пептидам направленного действия, в большинстве случаев, устойчивость к действию протеаз и пептидаз. В частности, с этой точки зрения, предпочтительны пептиды направленного действия, состоящие целиком из D-аминокислот, такие какD(Leu Pro Arg) иD(Cys Leu Pro Arg Cys) (SEQ ID NO:1).
В определенных вариантах осуществления изобретения вышеупомянутые LPR молекулы могут быть функционально связанными со второй молекулой или веществом. В предпочтительных вариантах осуществления изобретения связь между молекулами является ковалентной, примерами которой являются химический конъюгат (образован посредством химического линкера) или слитые конструкты (образованы путем слияния кодирующей области вышеупомянутого пептида с кодирующей областью целевого белка или пептида, необходимого для взаимодействия с VEGFR-1/NRP-1, без сдвига рамки считывания). В случае мишень-ориентированных пептидов или белков, пептиды направленного действия могут быть расположены вблизи или непосредственно на амино- или карбокси-конце (то есть в пределах первых или последних 20 аминокислот) белка или пептида, подлежащего взаимодействию с мишенью.
В различных вариантах осуществления изобретения вторая молекула или вещество является диагностическим средством, лекарственным средством, химиотерапевтическим средством, радиоизотопом, анти-ангиогенным средством, про-апоптотическим средством, цитотоксическим средством, пептидом, белком, гормоном, ростовым фактором, цитокином, антибиотиком, антителом или его фрагментом или одноцепочечным антителом, визуализирующим веществом, фактором выживаемости, анти-апоптотическим средством, антагонистом гормона или антигеном. Эти молекулы или вещества представляют собой практически любую молекулу, которая может оказывать терапевтический или диагностический эффект при лечении рака, может быть присоединена к LPR молекуле направленного действия и/или назначена пациенту в рамках изобретения.
Исходя из этого, в случае, если молекулы, подлежащие, взаимодействию, являются про-апоптотическими веществами, типичными их представителями являются этопозид, церамид, сфингомиелин, Bcl-2, Bax, Bid, Bik, Bad, каспаза-3, каспаза-8, каспаза-9, fas, fas лиганд, fadd, fap-1, tradd, faf, rip, рипер, апоптин, интерлейкин-2 превращающий фермент, аннексин V, (KLAKLAK)2 (SEQ ID NO:2); (KLAKKLA)2 (SEQ ID NO:3); (KAAKKAA)2 (SEQ ID NO:4); или (KLGKKLG)3 (SEQ ID NO:5). Следует отметить, что как и для всех пептидов по настоящему изобретению, вышеупомянутые последовательности могут быть представлены либо в D-, либо в L-форме. Например, для проапоптотических пептидов (например, SEQ ID NO:2-5) обе D- и L-формы, по-видимому, имеют схожую проапоптотическую активность, при этом D-форма имеет значительно более продолжительное время полу-жизни вследствие ее относительной протеиназной устойчивости. Хотя на практике в некоторых случаях, преимущественной является L-форма в связи с потенциально сниженными токсическими побочными эффектами (вследствие ее более короткого времени полужизни).
Кроме того, в вариантах осуществления изобретения, где молекулы, подлежащие взаимодействию, являются анти-ангиогенными веществами, типичными их представителями являются тромбоспондин, ангиостатин как, например, ангиостатин 5, ангиотензин, пептиды ламинина, пептиды фибронектина, ингибиторы активатора плазминогена, ингибиторы тканевой металлопротеиназы, интерфероны, цитокин как, например, интерлейкин 12, тромбоцитарный фактор 4, IP-10, Gro-β, 2-метоксиэстрадиол, белок, связанный с пролиферином, карбоксиамидотриазол, CM101, маримастат, пентозанполисульфат, ангиопоэтин 2 (Регенерон), гербимицин А, PNU145156E, фрагмент пролактина 16K, линомид, талидомид, пентоксифиллин, генистеин, TNP-470, эндостатин как, например, эндостатины XVII и XV, паклитаксел, доцетаксел, полиамины, протеасомный ингибитор, ингибитор киназ, сигнальный пептид, аккутин, цидофовир, винкристин, блеомицин, AGM-1470, миноциклин, C-концевой гемопексиновый домен матриксной металлопротеиназы-2, крингл домен 5 плазминогена человека, слитый белок эндостатина и ангиостатина, слитый белок эндостатина и крингл домена 5 плазминогена человека, монокин, индуцируемый интерфероном гамма (Mig), слитый белок Mig и IP10, растворимый FLT-1 (fins-подобный тирозинкиназный рецептор 1), киназный инсерционный домен-содержащий рецептор (KDR), фактор пигментного эпителия, интерферон-альфа, ингибитор сигнального пути (SU5416, SU6668, SUGEN, Южный Сан-Франциско, Калифорния).
В других предпочтительных вариантах осуществления изобретения, где молекулы, подлежащие взаимодействию, являются цитокинами, типичными их представителями являются интерлейкин 1 (IL-1), IL-2, IL-5, IL-10, IL-11, IL-12, IL-18, IL-24, интерферон-γ (INF-γ), INF-α, INF-β, фактор некроза опухолей как, например, TNF-α, или GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор).
Вышеупомянутые примеры являются только репрезентативными и не предполагают исключение других проапоптотических веществ, анти-ангиогенных веществ или цитокинов, известных в данной области техники.
В других вариантах осуществления изобретения выделенные пептиды могут быть присоединены к макромолекулярному комплексу. В предпочтительных вариантах осуществления изобретения макромолекулярным комплексом является вирус, бактериофаг, бактерия, липосома, микрочастица, наночастица (например, золотая наночастица), магнитный шарик, дрожжевая клетка, клетка млекопитающих или бактериальная клетка. В случае вирусов особенно предпочтительны бактериофаг, лентивирус, паповавирус, аденовирус, ретровирус, AAV, вирус осповакцины, вирус герпеса. Эти примеры являются только репрезентативными и макромолекулярные комплексы в рамках настоящего изобретения могут включать фактически любой комплекс, который может быть присоединен к пептиду направленного действия и назначен пациенту. В других предпочтительных вариантах осуществления изобретения выделенный пептид может быть присоединен к эукариотическим экспрессионным векторам, среди которых более предпочтительным является вектор для генной терапии.
В следующем варианте осуществления изобретения выделенный пептид может быть присоединен к твердым носителям, среди которых более предпочтительны магнитные шарики, шарики сефарозы, агарозные шарики, нитроцеллюлозная мембрана, нейлоновая мембрана, матрикс колоночной хроматографии, матрикс высокоэффективной жидкостной хроматографии (HPLC), матрикс высокоскоростной жидкостной хроматографии (FPLC), пластины микротитратора или микрочип.
В следующих вариантах осуществления изобретения рассматриваются слитые конструкты белков, включающие любой вышеупомянутый LPR пептид направленного действия, соединенный с выбранным белком, с образованием слитого конструкта белка, в котором образующийся слитый конструкт белка, благодаря дополнительному включению LPR молекулы направленного действия, который является искусственно созданным, а не является природным белком. В целом, в таких предпочтительных вариантах осуществления изобретения такие слитые конструкты белков могут быть созданы с использованием любого вышеупомянутого класса молекул.
В следующих вариантах осуществления изобретения рассматривается создание конструкта, нацеленного на взаимодействие с VEGFR-1/NRP-1, включающего полученный LPR пептид направленного действия, как описано выше, и соединяющий пептид с молекулой, с созданием конструкта преимущественно путем ковалентной сшивки. Как упоминалось выше, когда молекула, подлежащая взаимодействию, является белком или пептидом, предпочтительными мишень-ориентированными конструктами будут те, в которых пептид направленного действия присоединен вблизи или непосредственно на амино- или карбокси-конце такой молекулы.
Настоящее изобретение также нацелено на способ мишень-ориентированной доставки молекулы или белка к клеткам, экспрессирующим VEGFR-1 или NRP-1, где способ заключается в получении LPR пептида направленного действия или конструкта слитых белков, как описано выше, или мишень-ориентированного конструкта, как описано выше, и введение пептида или слитого конструкта белков в клеточную популяцию, которая содержит клетки, экспрессирующие VEGFR-1 или NRP-1, с целью доставки, тем самым, молекулы или белка к указанным клеткам. В целом, если конъюгат или слитый конструкт белков планируется использовать в диагностических или терапевтических целях у субъекта, например человека, конъюгат или слитый конструкт белков создают в виде фармацевтически приемлемой композиции, которая вводится субъекту.
Предполагается, что в случае терапевтического лечения пациентов, имеющих заболевание или нарушения, субъект будет, как правило, нуждаться в проведении анти-ангиогенной терапии. К таким заболеваниям или нарушениям относятся гиперпролиферативные заболевания, нарушение веса, ожирение, диабет, астма, артрит, цирроз или глазные болезни. Типичными гиперпролиферативными заболеваниями, рассматриваемыми для проведения терапии с использованием терапевтических конъюгатов в соответствии с изобретением, являются ревматоидный артрит, воспалительное заболевание кишечника, остеоартрит, лейомиома, аденома, липома, гемангиома, фиброма, окклюзия сосудов, рестеноз, атеросклероз, пре-неопластические поражения (такие как железистая гиперплазия, внутриэпителиальная неоплазия предстательной железы), рак in situ, волосатая лейкоплакия рта или псориаз.
Изобретение также рассматривает, что конъюгаты данного изобретения будут пригодными для лечения различных видов рака, в частности, тех видов, которые чрезвычайно ангиогенны. Типичными видами рака являются рак десны, языка, легких, кожи, печени, почек, глаз, мозга, лейкемия, мезотелиома, нейробластома, рак головы, шеи, молочной железы, поджелудочной железы, предстательной железы, почек, кости, яичек, яичников, шейки матки, пищевода, матки, мочевого пузыря, желудочно-кишечного тракта, лимфома, рак толстой кишки, саркома, рак желудка.
В следующих аспектах изобретения рассматривается то, что субъект, подлежащий лечению, имеет глазные болезни или нарушения, характеризующиеся внутриглазной клеточной пролиферацией или неоваскуляризацией. Типичными нарушениями являются возрастная дегенерация желтого пятна, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных, глаукома, пролиферативная витреоретинопатия, неоваскуляризация вследствие глазного ишемического синдрома, неоваскуляризация вследствие окклюзии разветвления вены сетчатки, неоваскуляризация вследствие окклюзии центральной вены сетчатки или неоваскуляризация вследствие ретинопатии при серповидно-клеточной анемии.
В других аспектах изобретения рассматривается то, что конъюгаты по настоящему изобретению будут пригодными для лечения нарушений веса, таких как ожирение.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1A, 1B.D(LPR) ингибирует неоваскуляризацию in vivo. Репрезентативные иллюстрации матрикса матригеля, содержащего 500 мкг/млD(LPR) или контрольного пептида после 7-дневной имплантации (а, нижняя панель). Матрикс матригеля был отделен и ангиогенез был количественно оценен путем измерения содержания гемоглобина в матриксе матригеля. Гистограмма построена для репрезентативных животных из того же эксперимента (а, верхняя панель). (b) Количество сосудов, положительных по фактору Виллебранда человека (Р<0,01).
Фиг.2А, 2B, 2C. Ингибирование ангиогенеза сетчатки, индуцированного ишемией, под действиемD(LPR). (а) Неоваскуляризация сетчатки была индуцирована у новорожденных мышей C57B6 под воздействием 75% кислорода с последующей терапиейD(LPR) (ежедневные инъекции в дозировке 20 мг/кг). (b) Окрашенные гематоксилином и эозином срезы сетчатки (день Р19) демонстрировали значительное снижение образования новых кровеносных сосудов на внутренней поверхности сетчатки (отмечено стрелками) по сравнению с контрольными животными. (с) Количественное определение ядер эндотелиальных клеток внутренней поверхности на Р19 день.
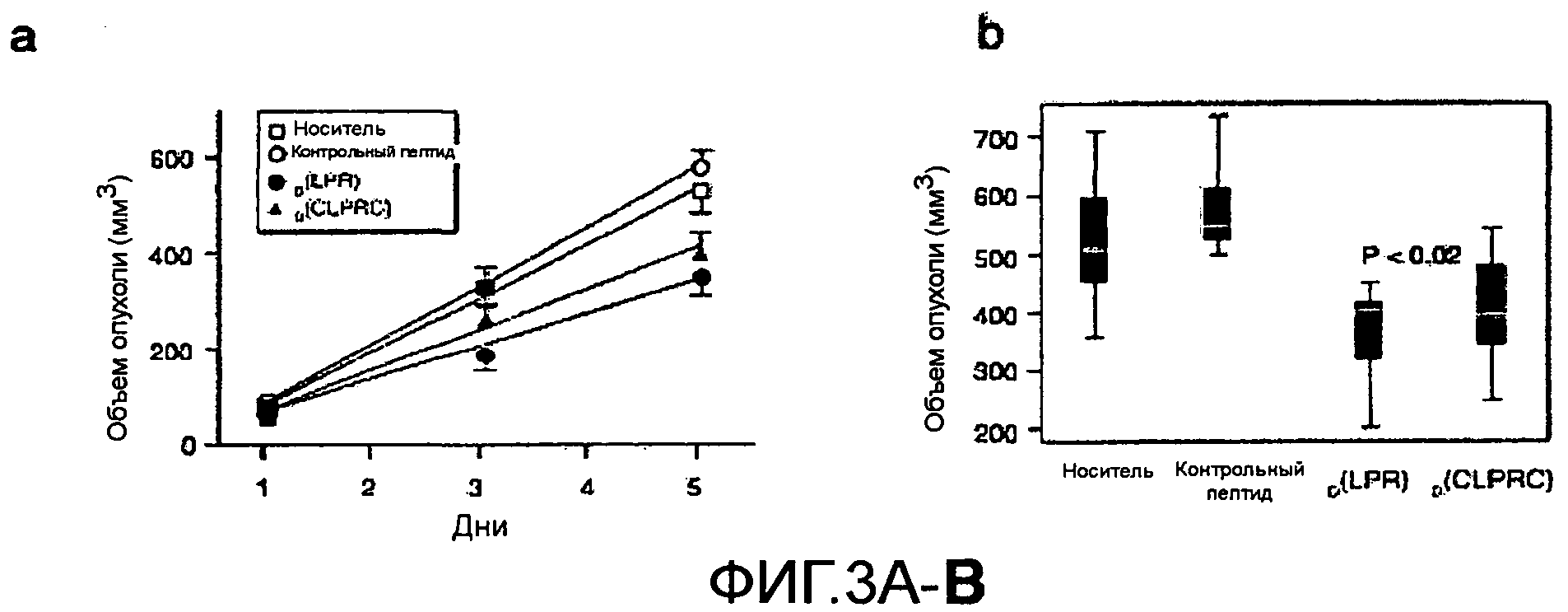
Фиг.3А, 3В. Лечение мышей, имеющих опухоль, с использованиемD(LPR) замедляет опухолевый рост. Мыши Balb/c, имеющие опухоль, происходящую из EF43.fgf4, были сгруппированы (N=7) и ежедневно получали 50 мг/кгD(LPR) или его циклическую формуD(CLPR), контрольный пептид или только носитель. (а) После пяти дней лечения животные, получавшиеD(LPR) или его циклическую формуD(CLPRC), демонстрировали сниженный объем опухоли по сравнению с контрольными животными. (b) На гистограмме показаны медиана и дисперсия. Различие в объеме опухоли между животными, получавшимиD(LPR) или его циклическую формуD(CLPRC), было статистически значимо (Р<0,02). Два независимых эксперимента были выполнены со схожими результатами.
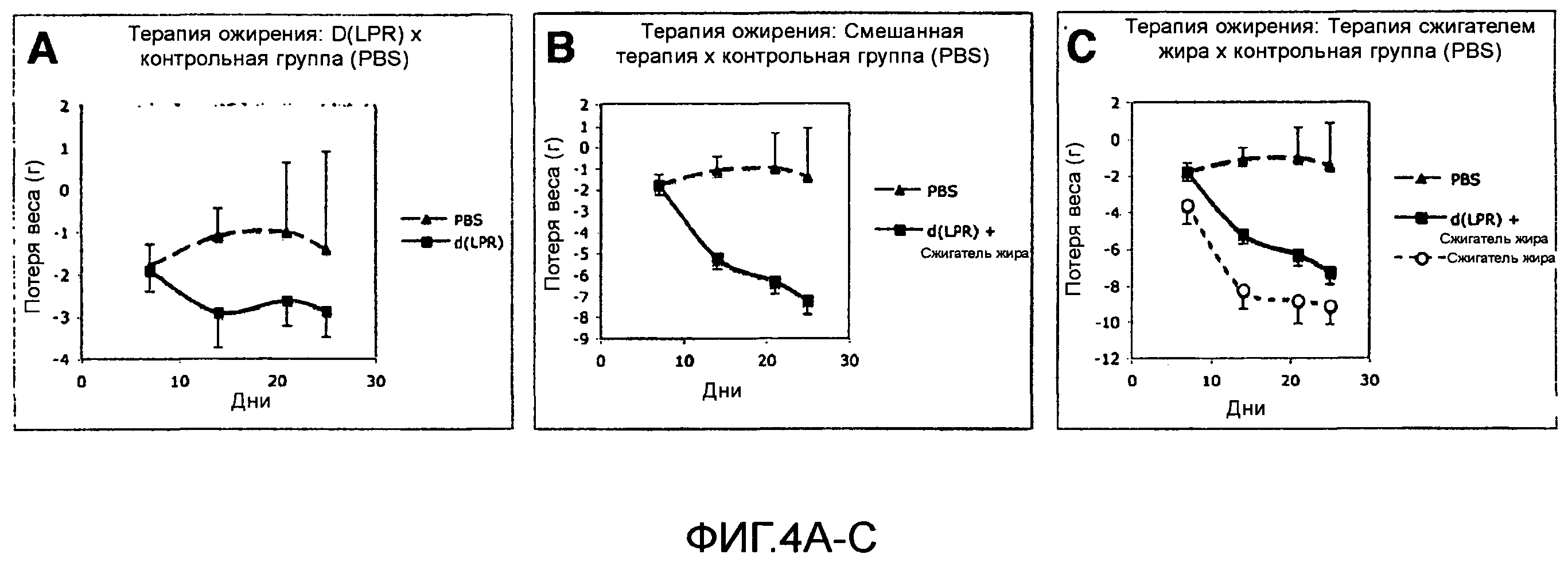
Фиг.4А, 4В, 4С. Лечение ожирения с использованием VEGF-подобного соединенияD(CLPRC). Страдающих ожирением мышей (C57BL/6), вскормленных на высококалорийной и богатой жирами диете (вес от 40 до 50 граммов), использовали в этом исследовании. Животных разделили на четыре группы и проводили ежедневную терапию с помощью (а) VEGF-подобного пептидаD(CLPRC), инъецируемого интраперитонеально (50 мг/кг); (b) пептидного сжигателя жира (CKGGRAKDC-GG-D(KLAKLAK)2; Kolonin et al., 2004), инъецируемого подкожно в дозировке 1 мг/кг в сочетании с VEGF-подобным пептидомD(CLPRC) в дозировке 50 мг/кг; или (с) сжигателя жира в дозировке 3 мг/кг. Животным в контрольной группе инъецировали только носитель (фосфатно-солевой буферный раствор, PBS).
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
1. Обзор
Пептиды, идентифицированные с помощью комбинаторных библиотек, лидируют в области разработки и синтеза лекарственных средств. Они могут быть быстро синтезированы и легко модифицированы с большим разнообразием функциональных групп, обеспечивая науку и медицину эффективными средствами для создания и направленного действия лекарственных средств. Ввиду их небольшого молекулярного веса по сравнению с макромолекулами, такими как антитела, пептиды имеют преимущество в тканевой проницаемости и биораспределении, что делает их исключительными ведущими веществами в области открытия и разработки лекарственных средств (обзорная статья Falciani et al., 2005). Действительно, пептиды, идентифицированные методом фагового дисплея, были успешно использованы in vivo в мишень-ориентированной терапии с целью доставки химиотерапевтических препаратов (Arap, 1998#10), проапоптотических пептидов (Ellerby, 1999#69) или доставки вирусов для визуализации и генной терапии (Hajitou, 2006#6744). Однако их использование в разработке лекарственных препаратов было затруднено из-за наличия проблем.
Пептиды сами по себе не подходят для использования в качестве лекарственных средств, поскольку они быстро распадаются протеазами и удаляются из плазмы. Экспрессия протеаз зачастую повышена в тех биологических процессах, в которых необходимы клеточная пролиферация, миграция и тканевая перестройка (общие для большинства патологических процессов, таких как ангиогенез), приводя к повышенной локальной протеолитической активности и деградации пептида. С точки зрения создания лекарственного препарата, пептиды часто демонстрируют значительную конформационную вариабельность, обуславливая трудоемкость и сложность структурных исследований (Giordano et al., 2005). Таким образом, создание пептидомиметиков на основе пептидов, идентифицированных методом фагового дисплея, может оказаться сложной задачей и обычно ограничивается фармацевтическими компаниями или лабораториями с синтетическими возможностями и доступом к большим химическим библиотекам.
Ангиогенезом называется прорастание новых кровеносных сосудов из предсуществующих, и он является неотъемлемым компонентом роста и метастаза опухоли (Folkman, 1971) так же, как и ряда патологических нарушений, таких как диабет, псориаз, ожирение и ревматоидный артрит (Carmeliet, 2005). В период половой зрелости ангиогенез происходит при заживлении ран, беременности и менструального цикла, и, таким образом, лекарственные средства, нацеленные на ангиогенные кровеносные сосуды, по-видимому, имеют важное клиническое применение при многих заболеваниях (Carmeliet et al., 2005). Сосудистый эндотелиальный ростовой фактор (VEGF) и его рецепторы были в центре внимания в данной отрасли науки вследствие их ведущей роли в образовании сосудов. VEGF оказывает свое действие посредством связывания с тирозинкиназными рецепторами (VEGFR-1, VEGFR-2) и с нейрофилином-1 (NRP-1) (Olsson et al., 2006). Большинство внутриклеточных сигнальных путей и митогенных воздействий VEGF опосредованы VEGFR-2, и несколько лекарственных препаратов, нацеленных на данный метаболический путь, находятся в настоящее время в стадии исследований в клинике (Cardones & Banez, 2006; Schneider & Sledge, 2007). Хотя VEGFR-1 и NRP-1 играют важную роль в данном процессе, вначале их воспринимали без энтузиазма в качестве возможных терапевтических средств. Все изменилось, и исследования, проведенные за последние несколько лет, предполагают, что оба рецептора играют значительную роль в ангиогенезе (Luttun et al., 2004; Wu et al., 2006; Pan et al., 2007). Исследования генных делеций показали, что VEGFR-1 и NRP-1 необходимы во время образования сосудов. Обе молекулы являются рецепторами для VEGF и плацентарного ростового фактора (PlGF), и последний совместно с VEGFR-1 вовлечен в патологический ангиогенез (Carmeliet et al., 2001), опухолевый рост (Luttun et al., 2002), увеличивая прохождение сигнала в клетке посредством перекрестной активации VEGFR-1/VEGFR-2 (Autiero et al., 2003) и рекрутирование клеток-предшественников из костного мозга во время неоваскуляризации (Jin et al, 2006; Li et al., 2006). Недавние исследования также предположили, что рекрутирование VEGFR1+ гематопоэтических клеток-предшественников важно для инициации метастазирования опухоли (Kaplan et al., 2005). Кроме того, NRP-1 не только усиливает связывание VEGF с VEGFR-2 (Soker et al., 2002), но также индуцирует контактирование и миграцию эндотелиальных клеток независимо от активации VEGFR-2 (Wang et al., 2003; Murga et al., 2005). Моноклональные антитела, направленные против VEGF-связывающего домена NRP-1 и против VEGFR-1, уменьшают как ангиогенез, так и опухолевый рост (Wu et al., 2006; Pan et al., 2007). Из этого следует, что лекарства, нацеленные на сигнальные пути через VEGFR-1 и NRP-1, по-видимому, найдут важное применение в клинике.
Настоящее изобретение представляет уникальные ингибиторы ангиогенеза и вещества направленного действия на VEGFR-1, LPR иD(LPR), которые демонстрируют значительное снижение ангиогенеза в трех различных испытаниях.D(LPR) также ингибировал неоваскуляризацию в двух животных моделях после системного применения. Принимая во внимание устойчивостьD(LPR) к деградации под действием смеси панкреатических ферментов, эти данные указывают на то, что это соединение и более длинные структуры пептидов, содержащие данную последовательность, вероятно, уцелеют в желудочно-кишечном тракте и могут быть введены орально пациентам. Таким образом, настоящее изобретение преодолевает недостатки предыдущего уровня техники путем идентификации LPR мотива для приготовления соединений направленного действия на VEGFR-1/NRP-1, терапевтических и/или диагностических средств, например, для лечения и/или выявления неоваскулярных или ангиогенных VEGF-ассоциированных нарушений, включая, без ограничения, рак, ожирение, диабет, астму, артрит, цирроз и глазные болезни.
В определенных вариантах осуществления изобретения рассматриваются специфические молекулы направленного действия, подлежащие взаимодействию с клетками, экспрессирующими VEGFR-1/NPR-1, включая, в более общем смысле, пептиды, полипептиды и белки с модификациями в виде вставки LPR мотива либо внутри, либо, что более предпочтительно, на N- или C-конце такого пептида или белка, либо вблизи этих концов. Примечательно, что хотя D-форма аминокислоты более предпочтительна вследствие ее значительной устойчивости к деградации протеазами, настоящее изобретение не исключает использование менее предпочтительной L-формы или смеси D- и L-аминокислот. Определенные варианты осуществления изобретения касаются молекул направленного действия на VEGFR-1/NPR-1, которые функционально связаны с терапевтическими или диагностическими средствами. В определенных вариантах осуществления изобретения терапевтическим средством является вирус, который можно сконструировать для экспрессии, либо вставить или соединить пептиды направленного действия на VEGFR-1/NPR-1 с белками вирусной оболочки или файбер-белок. Мишень-ориентированные вирусы затем могут быть использованы для генной терапии с целью лечения различных заболеваний, включая рак. Способность селективно действовать на VEGFR-1/NPR-1 в сосудистой системе около опухоли и/или в ней самой с помощью пептидов, модифицированных пептидов, антител, вирусов и/или других аффинных реагентов обеспечивает значительное преимущество при лечении рака, что может обусловливать повышенную эффективность и результативность.
2. Определения
Используемая в данном описании изобретения форма единственного числа может означать один или более. Используемые в настоящем описании формул(ы) изобретения слова в единственном числе в сочетании со словом «содержащий» могут означать один или более одного. Применяемое в настоящем документе слово «другой» может означать, по крайней мере, второй или более.
Термин «молекула направленного действия» охватывает различные типы аффинных реагентов, которые могут быть использованы для улучшения локализации или связывания вещества в определенном очаге у животных, включая органы, ткани, определенные типы клеток, пораженные ткани или опухоли. Молекулами направленного действия могут быть пептиды, пептидные миметики, полипептиды, антитела, подобные антителам молекулы, нуклеиновые кислоты, аптамеры и фрагменты вышеуказанного. Молекулами направленного действия также являются небольшие молекулы. В определенных вариантах осуществления изобретения молекулы направленного действия могут улучшить локализацию вещества в клетках, экспрессирующих VEGFR-1/NRP-1 внеклеточно, то есть VEGFR-1/NRP-1, связанные с клеточной поверхностью или связанные с окружающим внеклеточным матриксом. Селективным связыванием молекулы направленного действия по настоящему изобретению, например, пептида направленного действия, а также вариантов и фрагментов вышеуказанного, называется связывание молекулы направленного действия с молекулой-мишенью (например, VEGFR-1/NRP-1) при отсутствии значительного связывания с посторонними белками. Считается, что молекула направленного действия селективно связывается, даже если она также связывается с другими белками, которые в значительной степени не гомологичны мишени при условии, что такие белки имеют гомологию с фрагментом или доменом мишени пептида антитела. В этом случае будет понятно, что связывание молекулы направленного действия с мишенью является селективным, несмотря на некоторую степень перекрестной реактивности. Как правило, можно оценить степень перекрестной реактивности и дифференцировать ее от связывания с мишенью.
«Пептид направленного действия» - это пептид, состоящий из непрерывной последовательности аминокислот LPR и характеризующийся селективной локализацией в органе, ткани или типе клеток, заключающейся в специфическом связывании с внеклеточным белком или молекулой, которые специфически экспрессируются или образуются в специфической ткани или типе(ах) клеток. Селективная локализация может быть определена, например, методами, представленными ниже, в которых очищенная пептидная последовательность направленного действия встроена в белок, представленный на внешней поверхности фага.
Термин «субъект» означает, главным образом, млекопитающее. В определенных вариантах осуществления изобретения, субъектом является мышь, кролик, свинья, лошадь, корова, кошка, собака, овца, козел или обезьяна. В одном из аспектов осуществления изобретения субъектом является человек.
3. Белки и пептиды
В определенных вариантах осуществления настоящее изобретение касается новых композиций, включающих, по крайней мере, один белок или пептид. Используемые в данном описании изобретения белок или пептид, в основном, представляют собой в числе прочего белок размером более 200 аминокислот вплоть до полноразмерной последовательности, транслируемой с гена; полипептид размером приблизительно более чем 100 аминокислот; и/или пептид размером от приблизительно 3 до приблизительно 100 аминокислот. Для удобства термины "белок", "полипептид" и "пептид" используются в данном документе взаимозаменяемо.
В определенных вариантах осуществления изобретения размер, по крайней мере, одного белка или пептида составляет, в числе прочего, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 150, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190, приблизительно 200, приблизительно 210, приблизительно 220, приблизительно 230, приблизительно 240, приблизительно 250, приблизительно 275, приблизительно 300, приблизительно 325, приблизительно 350, приблизительно 375, приблизительно 400, приблизительно 425, приблизительно 450, приблизительно 475, приблизительно 500, приблизительно 525, приблизительно 550, приблизительно 575, приблизительно 600, приблизительно 625, приблизительно 650, приблизительно 675, приблизительно 700, приблизительно 725, приблизительно 750, приблизительно 775, приблизительно 800, приблизительно 825, приблизительно 850, приблизительно 875, приблизительно 900, приблизительно 925, приблизительно 950, приблизительно 975, приблизительно 1000, приблизительно 1100, приблизительно 1200, приблизительно 1300, приблизительно 1400, приблизительно 1500, приблизительно 1750, приблизительно 2000, приблизительно 2250, приблизительно 2500 или более аминокислотных остатков, или любой другой ряд аминокислотных остатков, получаемый из вышеуказанного (например, от приблизительно 200 до приблизительно 2500 аминокислотных остатков).
Используемый в данном описании изобретения термин «аминокислотный остаток» относится к любой встречающейся в природе аминокислоте, любой производной аминокислоты или любому миметику аминокислоты, известным в данной области техники. В определенных вариантах осуществления изобретения аминокислотные остатки белка или пептида последовательны без какого-либо прерывания аминокислотной последовательности не аминокислотами. В других вариантах осуществления последовательность может включать одну или более не аминокислотные группы. В определенных вариантах осуществления последовательность аминокислотных остатков белка или пептида может быть прервана одной или более не аминокислотной группой.
Таким образом, термин «белок или пептид» означает аминокислотную последовательность, включающую, по крайней мере, одну из 20 типичных аминокислот, встречающихся в природе, или, по крайней мере, одну модифицированную или не типичную аминокислоту, включая, помимо прочего, Aad, 2-аминоадипиновую кислоту; EtAsn, N-этиласпарагин; Baad, 3-аминоадипиновую кислоту; Hyl, гидроксилизин; Bala, β-аланин, β-аминопропионовую кислоту; AHyl, алло-гидроксилизин; Abu, 2-аминобутириновую кислоту; 3Hyp, 3-гидроксипролин; 4Abu, 4-аминобутириновую кислоту, пиперидиновую кислоту; 4Hyp, 4-гидроксипролин; Acp, 6-аминокапроиновую кислоту; Ide, изодесмозин; Ahe, 2-аминогептановую кислоту; AIle, алло-изолейцин; Aib, 2-аминоизобутириновую кислоту; MeGly, N-метилглицин, саркозин; Baib, 3-аминоизобутириновую кислоту; MeIle, N-метилизолейцин; Apm, 2-аминопимелиновую кислоту; MeLys, 6-N-метиллизин; Dbu, 2,4-диаминобутириновую кислоту; MeVal, N-метилвалин; Des, десмозин; Nva, норвалин; Dpm, 2,2'-диаминопимелиновую кислоту; Nle, норлейцин; Dpr, 2,3-диаминопропионовую кислоту; Orn, орнитин; и EtGly, N-этилглицин.
Белки или пептиды могут быть получены с использованием любой методики, известной специалистам данной области, включая стандартные молекулярно-биологические методики по экспрессии белков, полипептидов или пептидов, выделение белков или пептидов из природных источников или химический синтез белков или пептидов. Нуклеотидная и белковая, полипептидная и пептидная последовательности, соответствующие различным генам, были ранее выявлены и могут быть обнаружены в компьютерных базах данных, известных специалистам в данной области техники. Одними из таких баз данных являются информационные Genbank и GenPept базы данных Национального Центра Биотехнологии (система поиска Интернет ncbi.nlm.nih.gov). Кодирующие области известных генов могут быть амплифицированы и/или экспрессированы, используя методики, представленные в настоящем документе или известные специалистам в данной области. Альтернативно, различные коммерческие препараты белков, полипептидов и пептидов известны специалистам в данной области техники.
4. Слитые белки
Другие аспекты вариантов осуществления изобретения белковых конъюгатов касаются слитых белков. Эти молекулы, в основном, имеют всю или значительную часть белка направленного действия (например, LPR пептида направленного действия), соединенного на N- или C-конце с целым полипептидом или белком или их частью. Например, слитые белки могут содержать лидерную последовательность из других биотипов для обеспечения возможности рекомбинантной экспрессии белка в гетерологичном хозяине. В состав другого используемого слитого белка входит иммунологически активный домен, такой как эпитоп антитела, для, например, облегчения очистки слитого белка. Присоединение сайта расщепления к месту соединения химер или рядом с ним будет облегчать удаление инородного полипептида после очистки. В составе других используемых слитых белков встречаются присоединенные функциональные домены, такие как активные сайты ферментов, домены гликозилирования, сигналы направленного действия на клетку или трансмембранные области. В предпочтительных вариантах осуществления слитые белки по настоящему изобретению состоят из LPR пептида, соединенного с терапевтическим белком или пептидом. Примерами белков или пептидов, которые могут быть в составе слитого белка, являются цитостатические белки, цитотоксические белки, проапоптотические вещества, антиангиогенные вещества, гормоны, цитокины, ростовые факторы, пептидные лекарственные вещества, антитела, Fab фрагменты антител, антигены, рецепторные белки, ферменты, лектины, белки MHC, белки клеточной адгезии и белки связывания. Список этих примеров не лимитирован и считается, что в рамках настоящего изобретения фактически любой белок или пептид мог бы быть включенным в слитый белок, имеющий в составе белок направленного действия. Методы получения слитых белков хорошо известны специалистам в данной области техники. Такие белки могут быть образованы, например, путем химического соединения с использованием бифункциональных перекрестно-сшивающих реагентов, путем синтеза de novo целого слитого белка или путем соединения последовательности ДНК, кодирующей пептид направленного действия, и последовательности ДНК, кодирующей второй пептид или белок, с последующей экспрессией интактного слитого белка.
5. Очистка белков
В определенных вариантах осуществления изобретения белок или пептид может быть выделен или очищен. Методики белковой очистки хорошо известны специалистам в данной области техники. Эти методики включают, на первом этапе, гомогенизацию и грубое фракционирование клеток, ткани или органа до полипептидных и не полипептидных фракций. Интересующий белок или полипептид может быть дополнительно очищен хроматографическим и электрофоретическим способом для достижения частичной или полной очистки (или гомогенной очистки). К аналитическим методам, которые особенно подходят для приготовления очищенных белков, относятся ионообменная хроматография, гель-фильтрационная хроматография, электрофорез в полиакриламидном геле, аффинная хроматография, иммуноаффинная хроматография и изоэлектрическое фокусирование. Пример очистки рецепторного белка аффинной хроматографией рассматривается в патенте США №5206347, содержание которого в полном объеме включено в данный документ ссылкой. Наиболее эффективным методом очистки пептидов является высокоскоростная жидкостная хроматография (FPLC) или даже высокоэффективная жидкостная хроматография (HPLC).
Очистка белка или пептида нацелена на создание композиции, очищенной от других компонентов, в которой белок или пептид очищают до любой степени относительно его состояния, встречаемого в природе. Выделенный или очищенный белок или пептид, таким образом, также относится к белкам или пептидам, свободным от окружения, в котором он может существовать в природе. В основном, «очищенный» будет относиться к композиции белка или пептида, который был подвергнут фракционированию для удаления различных других компонентов, и композиция которого существенно сохраняет свою выраженную биологическую активность. Используемый термин «существенно очищенный» будет относиться к композиции, в которой белок или пептид составляет основной компонент композиции как, например, составляющий приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95% или более от белков в композиции.
Различные методы количественного определения степени очистки белка или пептида известны специалистам в данной области техники в свете настоящего изобретения. Они включают, например, определение специфической активности активной фракции или оценку количества полипептидов во фракции методом SDS/PAGE анализа. Предпочтительным методом оценки чистоты фракции является вычисление специфической активности данной фракции, ее сравнение со специфической активностью исходного экстракта и, таким образом, вычисление степени чистоты в ней, оцениваемой «числом кратности очистки». Фактические единицы измерения, используемые для выражения количества активности, будут, безусловно, зависеть от метода анализа, выбранного для проведения очистки, и от того, будет или нет экспрессируемый белок или пептид проявлять определяемую активность.
Различные методики, подходящие для использования при очистке белка, хорошо известны специалистам в данной области техники. Они включают, например, преципитацию сульфатом аммония, PEG, антителами и т.п., или денатурацией нагреванием, за которыми следует: центрифугирование; этапы хроматографии, такие как ионнообменная хроматография, гель-фильтрация, хроматография в обращенных фазах, хроматография с гидроксилапатитом и аффинная хроматография; изоэлектрическое фокусирование; гель-электрофорез; и комбинация этих и других методик. Насколько известно в данной области техники, считается, что порядок проведения различных этапов очистки может быть изменен или что определенные этапы могут быть опущены, и, тем не менее, в результате будет получен подходящий метод для приготовления существенно очищенного белка или пептида.
Не существует основного требования того, чтобы белок или пептид предоставлялся в его наиболее очищенной форме. Действительно, предусматривается использование менее очищенных продуктов в определенных вариантах осуществления изобретения. Частичная очистка может быть выполнена с использованием меньшего сочетания этапов очистки или путем использования различных вариантов основного протокола очистки. Например, принимается во внимание то, что катионообменная колоночная хроматография, выполненная с использованием HPLC оборудования, будет, как правило, иметь своим результатом большую «кратность» очистки нежели подобная методика с использованием системы хроматографии низкого давления. Методики, демонстрирующие более низкую степень относительной очистки, могут иметь преимущества в выделении общего количества белкового продукта или в сохранении активности экспрессируемого белка.
Аффинная хроматография представляет собой способ хроматографии, в основе которого лежит специфическая аффинность между веществом, подлежащим выделению, и молекулой, с которой оно может специфически связаться. Это является лиганд-рецепторным типом взаимодействия. Материал колонки синтезируется путем ковалентных сшивок одного из участников комплексообразования с нерастворимым матриксом. Материал колонки затем способен специфически адсорбировать вещество из раствора. Элюция достигается сменой условий по сравнению с таковыми, в которых не происходит связывания (например, смена рН, ионной силы, температуры и др.). Матрикс должен быть веществом, которое само по себе не адсорбирует молекулы в какой-либо значительной степени, и которое имеет широкий диапазон химической, физической и термической стабильности. Лиганд должен быть соединен с матриксом таким образом, чтобы это не оказывало влияния на связывающую активность. Лиганд должен также обеспечивать относительно тесное связывание. И должна быть обеспечена возможность элюции вещества без разрушения образца или лиганда.
6. Синтетические пептиды
Из-за относительно небольшого размера пептиды направленного действия по настоящему изобретению могут быть синтезированы в растворе или на твердой подложке в соответствии с общепринятыми методиками. Различные автоматические синтезаторы коммерчески доступны и могут быть использованы в соответствии с известными протоколами. Смотри, например, Stewart and Young, 1984; Tam et al., 1983; Merrifield, 1986; Barany and Merrifield, 1979, содержание каждого включено в качестве ссылки. Короткие пептидные последовательности, обычно размером от приблизительно 6 до приблизительно 35-50 аминокислот, могут быть легко синтезированы такими методами. Альтернативно, может быть применен метод рекомбинантной ДНК, в котором нуклеотидная последовательность, кодирующая пептид по настоящему изобретению, вставляется в экспрессионный вектор, трансформируется или трансфецируется в подходящую клетку-хозяина и культивируется в условиях, подходящих для экспрессии.
7. Терапевтические или диагностические конъюгаты
Молекулы направленного действия, идентифицированные с использованием этих методов, могут быть соединены или прикреплены к различным веществам, включая терапевтические или диагностические средства, для селективной доставки конъюгата в необходимые орган, ткань или клеточный тип в мышиной модельной системе. Например, мишень-ориентированная доставка химиотерапевтических средств и проапоптотических пептидов к рецепторам, расположенным в опухолевой ангиогенной сосудистой системе, приводит к заметному увеличению эффективности терапии и уменьшению системной токсичности в содержащей опухоль мышиной модели (Arap et al., 1998; Ellerby et al., 1999).
Варианты осуществления изобретения направлены на лечение неоваскуляризации, ассоциированной с различными заболеваниями, как, например, сосудистой системы опухоли. Помимо опухолевого роста ангиогенез является важной составляющей при других заболеваниях. Неконтролируемый ангиогенез вносит вклад в прогрессирование ревматоидного артрита, диабетической ретинопатии, эндометриоза, возрастной дегенерации желтого пятна и псориаза. Рост кровеносных сосудов приводит к образованию гемангиом и артериовенозных мальформаций, вызывая различные клинические проявления, начиная от косметических осложнений до угрожающих жизни геморрагий. Дополнительные варианты осуществления изобретения направлены на лечение этих типичных заболеваний, а также других ассоциированных с неоваскуляризацией заболеваний.
Альтернативно, повышенная экспрессия VEGFR-1/NRP-1 или стимулирующих ангиогенез соединений или веществ может быть использована для стимуляции ангиогенеза. Повышенная экспрессия VEGFR-1/NRP-1 может быть достигнута доставкой трансгенов VEGFR-1 (т.е. Flt-1) или NRP-1, которые, в свою очередь, могут быть доставлены различными векторами для генной терапии, известными специалистам в данной области техники.
А. Цитокины и хемокины
В определенных вариантах осуществления изобретения было бы желательно соединить специфическое биоактивное вещество с одной или более молекулами направленного действия для мишень-ориентированной доставки к органу, ткани или типу клеток. Такие вещества включают, без ограничения, цитокины, хемокины, проапоптотические факторы и антиангиогенные факторы. Термин «цитокин» является общим термином для белков, высвобождаемых одной клеточной популяцией и действующих на других клетки в качестве межклеточных медиаторов.
Примерами таких цитокинов являются лимфокины, монокины, ростовые факторы и классические полипептидные гормоны. К цитокинам относятся гормоны роста как, например, гормон роста человека, N-метионил человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны как, например, фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); печеночный ростовой фактор; простагландин; фибробластный ростовой фактор; пролактин; плацентарный лактоген, ОВ белок; фактор некроза опухолей -α и -β; мюллерова ингибирующая субстанция; мышиный связанный с гонадотропином пептид; ингибин; активин; сосудистый эндотелиальный ростовой фактор; интегрин; тромбопоэтин (ТРО); фактор роста нервов, такой как NGF-β; тромбоцитарный ростовой фактор; трансформирующие ростовые факторы (TGF) типа TGF-α и TGF-β; инсулиноподобный ростовой фактор-I и -II; эритропоэтин (EPO); стимулирующий рост костной ткани фактор; интерфероны как, например, интерферон-α, -β, и -γ; колониестимулирующие факторы (CSF) как, например, макрофагальный-CSF (М-CSF), гранулоцитарно-макрофагальный-CSF (GM-CSF); и гранулоцитарный-CSF (G-CSF); интерлейкины (IL) как, например, IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, LIF, G-CSF, GM-CSF, M-CSF, EPO, kit-лиганд или FLT-3, ангиостатин, тромбоспондин, эндостатин, фактор некроза опухолей и LT. Используемый здесь термин «цитокин» включает в себя белки из природных источников или из рекомбинантной клеточной линии и биологически активные эквиваленты нативных последовательностей цитокинов.
Хемокины обычно действуют в качестве хемоаттрактантов для рекрутирования эффекторных клеток к сайту экспрессии хемокина. Предпочтительной является экспрессия гена определенного хемокина в сочетании, например, с геном цитокина с целью повышения рекрутирования других компонентов иммунной системы к сайту лечения. Хемокины включают, в числе прочего, RANTES, MCAF, MIP1-альфа, MIP1-бета и IP-10. Специалист в данной области признает, что определенные цитокины также обладают хемоаттрактантными свойствами и могли бы быть классифицированы под термином хемокины.
B. Визуализирующие вещества и радиоизотопы
В определенных вариантах осуществления молекулы направленного действия по настоящему изобретению могут быть присоединены к используемым визуализирующим веществам для визуализации и диагностики различных пораженных органов, тканей или типов клеток. Многие подходящие визуализирующие вещества известны в данной области техники как и методы для их присоединения к белкам или пептидам (см., например, патент США №№5021236 и 4472509, содержание каждого включено в качестве ссылки в настоящий документ). Некоторые методы для образования соединений заключаются в использовании металл-хелатного комплекса с применением, например, органического хелатирующего агента, такого как DTPA, прикрепленного к белку или пептиду (патент США №4472509). Белки или пептиды также могут вступать в реакцию с ферментом в присутствии связующего агента, такого как глутаральдегид или периодат. Конъюгаты с флуоросцеиновыми маркерами готовят в присутствии этих связующих агентов или в ходе реакции с изотиоцианатом.
Неограниченные примеры парамагнитных ионов, используемых в качестве визуализирующих агентов, включают хром(III), марганец(II), железо(III), железо(II), кобальт(II), никель(II), медь(II), неодим(III), самарий(III), иттербий(III), гадолиний(III), ванадий(II), тербий(III), диспрозий(III), гольмий(III) и эрбий(III), с наиболее предпочтительным использованием гадолиния. Ионы, используемые в других методах, как например рентгенография, включают, помимо прочего, лантан(III), золото(III), свинец(II) и, особенно, висмут(III).
Радиоизотопы потенциального использования в качестве визуализирующего или терапевтического вещества включают211астат,14углерод,51хром,36хлор,57кобальт,58кобальт,67медь,152Eu,67галлий,3водород,123йод,125йод,131йод,111индий,59железо,32фосфор,186рений,188рений,75селен,35сера,99mтехнеций и90иттрий.125I часто предпочтителен для использования в определенных вариантах осуществления изобретения, а99mтехнеций и111индий также часто предпочитают использовать вследствие их низкой энергии и возможности применения в течение длительного времени.
Радиоактивно меченые белки или пептиды по настоящему изобретению могут быть получены в соответствии с общеизвестными методами в данной области техники. Например, они могут быть иодированы путем взаимодействия с йодистым натрием или йодистым калием и химического оксиданта, такого как гипохлорид натрия, или ферментативного оксиданта, такого как лактопероксидаза. Белки или пептиды в соответствии с настоящим изобретением могут быть помечены99mтехнецием в ходе реакции обмена лигандами, например, путем восстановления пертехнетата раствором, содержащим двухвалентное олово, хелатирования восстановленного технеция на колонку с Сефадексом и нанесения пептида на данную колонку, или методом прямого мечения, например, путем инкубации пертехнетата, восстановителя, как например SNCl2, буферного раствора, как например фталата натрия-калия, и пептида. Промежуточными функциональными группами, которые обычно используются для связывания радиоизотопов, существующих в виде ионов металлов, с пептидами, являются диэтилентриаминпентауксусная кислота (DTPA) и этилендиаминтетрауксусная кислота (EDTA). Также рассматривается использование флуоресцентных меток, включая родамин, флуоресцеин изотиоцианат и ренографин.
В определенных вариантах осуществления изобретения заявленные белки или пептиды могут быть соединены со вторым связывающим лигандом или ферментом (фермент tag), который будет образовывать окрашенный продукт при контакте с хромогенным субстратом. Примерами применяемых ферментов являются уреаза, щелочная фосфатаза, перекись водорода (хрена) и глюкооксидаза. Предпочтительными вторыми связывающими лигандами являются соединения биотина и авидина или стрептавидина. Использование таких меток хорошо известно специалистам в данной области техники и описано, например, в патентах США №№3817837; 3850752; 3939350; 3996345; 4277437; 4275149 и 4366241; содержание каждого включено в настоящий документ ссылкой.
В других вариантах осуществления изобретения молекула направленного действия может быть без труда соединена с наночастицей. К наночастицам относятся, в числе прочего, коллоидное золото и наночастицы серебра. Металл наночастиц проявляет окраску в видимой части спектра. Очевидно, что эти цвета появляются в результате резонансного возбуждения поверхностных плазмонов в металлических частицах и чрезвычайно чувствительны к размеру, форме и агрегатному состоянию частиц; диэлектрическим свойствам окружающей среды; адсорбции ионов на поверхности частиц (смотри, например, заявку на патент США №20040023415, содержание которого включено в настоящий документ ссылкой).
C. Кросс-линкеры
Бифункциональные перекрестно-сшивающие реагенты широко использовались для различных целей, включая приготовление аффинных матриц, модификацию и стабилизацию разнотипных структур, идентификацию сайтов связывания лиганда и рецептора, и структурные исследования. Гомобифункциональные реагенты, несущие две идентичные функциональные группы, оказались высоко эффективными в индуцировании перекрестного сшивания между идентичными и различными макромолекулами или субъединицами макромолекулы, и в соединении лигандов полипептида к их специфическим сайтам связывания. Гетеробифункциональные реагенты содержат две различные функциональные группы. Путем использования различной реактивности двух разных функциональных групп, перекрестное сшивание может контролироваться как селективно, так и последовательно. Бифункциональные перекрестно сшивающие реагенты могут быть классифицированы относительно специфичности их функциональных групп, например, амино, сульфгидрил, гуанидино, индол, карбоксил-специфичных групп. Среди них, реагенты, направленные на свободные аминогруппы, стали особенно популярными из-за их коммерческой доступности, легкого синтеза и мягких условий реакции, в которых они применяются. Большинство гетеробифункциональных перекрестно сшивающих реагентов содержат первичную амино-реактивную группу и тиол-реактивную группу.
Типичные методы по использованию перекрестно-сшивающих лигандов на липосомах описаны в патентах США №№5603872 и 5401511, содержание каждого включено в настоящий документ ссылкой. Различные лиганды могут быть ковалентно связанными с поверхностью липосом через перекрестное сшивание аминных остатков. Липосомы, в частности, мультиламелярные везикулы (MLV) или однородные ламелярные везикулы, такие как микроэмульгированные липосомы (MEL) и большие однородные ламелярные липосомы (LUVET), каждые содержащие фосфатидилэтаноламин (РЕ), были приготовлены общепринятыми методиками. Включение РЕ в липосому обеспечивает наличие активного функционального остатка, первичного амина, на липосомальной поверхности для перекрестного сшивания. Лиганды как, например, эпидермальный ростовой фактор (EGF), были успешно соединены с РЕ-липосомами. Лиганды ковалентно связываются с дискретными сайтами на липосомальных поверхностях. Количество и плотность распределения этих сайтов по поверхности определяется липосомальным составом и типом липосомы. Липосомальные поверхности могут также иметь сайты для не ковалентных связей. Для образования ковалентных конъюгатов лигандов и липосом, перекрестно сшивающие реагенты были изучены на эффективность и биосовместимость. К перекрестно-сшивающим лигандам относятся глютаральдегид (GAD), бифункциональный оксиран (OXR), эфир диглицидил-этиленгликоля (EGDE), и водорастворимый карбодиимид, предпочтительно 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC). Посредством сложной химии перекрестного сшивания была установлена связь аминных остатков распознаваемого вещества и липосом.
В другом примере описаны гетеробифункциональные перекрестно-сшивающие реагенты и методы использования перекрестно-сшивающих реагентов (Патент США №5889155, содержание которого включено в настоящий документ ссылкой). Перекрестно-сшивающие реагенты связывают нуклеофильный остаток гидразида с электрофильным остатком малеимида, обеспечивая связывание альдегидов со свободными тиолами в одном из примеров. Перекрестно сшивающий реагент может быть модифицирован для перекрестной сшивки различных функциональных групп.
8. Нуклеиновые кислоты
Нуклеиновые кислоты согласно настоящему изобретению могут кодировать пептид направленного действия, антитело направленного действия, фрагмент антитела направленного действия, терапевтический полипептид, слитый белок или другой белок или пептид. Нуклеиновая кислота может быть получена из геномной ДНК, комплементарной ДНК (кДНК) или синтетической ДНК.
Под термином «нуклеиновая кислота», используемым в настоящем документе, понимают одноцепочечную и двухцепочечную молекулы, а также ДНК, РНК, химически модифицированные нуклеиновые кислоты и аналоги нуклеиновой кислоты. Предполагается, что нуклеиновая кислота в рамках настоящего изобретения может быть почти любого размера, определяемого отчасти длиной кодируемого белка или пептида.
Предполагается, что пептиды направленного действия и слитые белки могут кодироваться любой последовательностью нуклеиновой кислоты, которая кодирует соответствующую аминокислотную последовательность. Дизайн и синтез нуклеиновых кислот, кодирующих необходимую аминокислотную последовательность, хорошо известны специалистам в данной области техники, используя стандартные таблицы кодонов. В предпочтительных вариантах осуществления изобретения выбранные кодоны для кодирования каждой аминокислоты могут быть модифицированы для оптимизации экспрессии нуклеиновой кислоты в интересующей клетке-хозяине.
9. Мишень-ориентированная доставка векторов генной терапии
Существует несколько способов, с помощью которых векторы генной терапии могут быть доставлены в клетки. В определенных вариантах осуществления изобретения вектор генной терапии состоит из вируса. Способность определенных вирусов проникать в клетку через рецептор-опосредованный эндоцитоз, встраиваться в геном клетки-хозяина или сохраняться эписомально и экспрессировать вирусные гены стабильно и эффективно делает их приемлемыми кандидатами для передачи чужеродных генов в клетки млекопитающих (Ridgeway, 1988; Nicolas and Rubinstein, 1988; Baichwal and Sugden, 1986; Temin, 1986). Предпочтительными векторами генной терапии являются в основном вирусные вектора. К ДНК-вирусам, используемым в качестве векторов генной терапии, относятся паповавирусы (например, вирус обезьян 40, бычий вирус папилломы и полиомавирус) (Ridgeway, 1988; Baichwal and Sugden, 1986) и аденовирусы (Ridgeway, 1988; Baichwal and Sugden, 1986).
Один из предпочтительных методов доставки in vivo включает использование аденовирусного экспрессионного вектора. Хотя известно, что у аденовирусных векторов низкая способность интеграции в геномную ДНК, это свойство компенсируется высокой эффективностью передачи гена, свойственной этим векторам. «Аденовирусный экспрессионный вектор» означает конструкт, содержащий, помимо прочего, аденовирусные последовательности, достаточные для (а) обеспечения упаковки конструкта и (b) экспрессии антисмыслового или смыслового полинуклеотида, который был клонирован в нем.
Аденовирусные вектора были использованы для экспрессии эукариотических генов (Levrero et al., 1991; Gomez-Foix et al., 1992) и создания вакцин (Grunhaus and Horwitz, 1992; Graham and Prevec, 1991). Исследования по применению рекомбинантных аденовирусов в различных тканях включают инстилляцию трахеи (Rosenfeld at al., 1991; Rosenfeld at al., 1992), мышечную инъекцию (Ragot et al., 1993), периферические внутривенные инъекции (Herz and Gerard, 1993) и стереотаксическую инокуляцию в мозг (Le Gal La Salle et al., 1993).
В предпочтительных вариантах осуществления изобретения можно получить определенные преимущества от присоединения терапевтических молекул или веществ к LPR молекулам направленного действия, нацеленных на сосудистую сеть пораженных тканей, например, опухолей или неоваскулярного русла. В частности, молекулы, нацеленные на сосудистую сеть опухоли, были соединены с цитоксическими лекарственными средствами или проапоптотическими пептидами для получения соединений, более эффективных и менее токсичных по сравнению с исходными соединениями в экспериментальных мышиных моделях, несущих опухолевый ксенотрансплантант (Arap et al., 1998; Ellerby et al., 1999). Вставка RGD-4C пептида в поверхностный белок аденовируса образует аденовирусный вектор, который может быть использован для мишень-ориентированной генной терапии опухоли (Arap et al., 1998).
Термин «файбер-белок» в соответствии с настоящим изобретением означает предпочтительно аденовирусный файбер-белок. Любой из серотипов человеческого или не относящегося к человеку аденовируса (например, химерный файбер-белок) может быть использован в качестве источника файбер-белка или гена файбер-белка. Оптимальными аденовирусами, тем не менее, являются Ad2 или Ad5 аденовирусы (см. патент США №6649407, содержание которого включено в настоящий документ ссылкой).
Файбер-белок является «химерным» вследствие того, что он включает аминокислотные остатки, которые обычно не обнаруживают в белке при выделении из аденовируса дикого типа (то есть, имеющего в составе нативный белок или белок дикого типа). Файбер-белок, таким образом, включает «ненативную аминокислотную последовательность». «Ненативная аминокислотная последовательность» означает последовательность любой подходящей длины предпочтительно от приблизительно 3 до приблизительно 200 аминокислот, оптимально от приблизительно 3 до приблизительно 30 аминокислот. Желательно, чтобы ненативная аминокислотная последовательность была вставлена в файбер-белок на уровне экспрессии гена (то есть, путем введения «последовательности нуклеиновой кислоты, кодирующей ненативную аминокислотную последовательность»). Такая ненативная аминокислотная последовательность либо вводится в аденовирусную последовательность или в дополнение к аденовирусным последовательностям. Независимо от природы введения, ее интеграция в аденовирусный файбер-белок на уровне либо ДНК, либо белка приводит к образованию пептидного мотива (то есть, пептидного мотива связывания) в получаемом химерном файбер-белке.
Пептидный мотив позволяет прицельно воздействовать на клетку-мишень, например, вследствие наличия в своем составе молекулы направленного действия по настоящему изобретению и/или лиганда для сайта связывания клеточной поверхности. Оптимально, пептидный мотив может включать другие элементы направленного действия на клетку (например, одноцепочечной последовательности антитела). Пептидный мотив связывания может включать вставку или, например, из нативных и ненативных последовательностей, или может быть полностью сконструирован из ненативных последовательностей. Пептидный мотив, созданный путем вставки ненативной аминокислотной последовательности в химерный файбер-белок, может быть либо высокоаффинным пептидом (то есть, который связывает узнаваемый им сайт связывания, например, VEGFR-1/NRP-1, при использовании в относительно низких концентрациях) или низкоаффинным пептидом (то есть, который связывает узнаваемый им сайт связывания, например, VEGFR-1/NRP-1, при использовании в относительно высоких концентрациях). Предпочтительно, однако, когда получаемый пептидный мотив является высокоаффинным мотивом, в частности, который имеет высокую аффинность к узнаваемому сайту связывания вследствие его заключения в аденовирусный файбер-белок.
Другие векторы для передачи гена могут быть сконструированы на основе ретровирусов (Coffin, 1990). Чтобы сконструировать ретровирусный вектор, нуклеиновую кислоту, кодирующую интересующий белок, вставляют в вирусный геном в месторасположение определенных вирусных последовательностей, чтобы создать вирус с нарушением репликации. Для того, чтобы создать вирионы, конструируется упаковочная клеточная линия, содержащая гены gag, pol и env, но без LTR и упаковочных компонентов (Mann et al., 1983). Когда рекомбинантная плазмида, содержащая кДНК, вместе с ретровирусной LTR и упаковочными последовательностями вводятся в эту клеточную линию (путем кальций-фосфатного осаждения, например), упаковочная последовательность позволяет РНК-транскрипту рекомбинантной плазмиды быть упакованным в вирусные частицы, которые затем секретируются в культуральную среду (Nicolas and Rubenstein, 1988; Temin, 1986; Mann et al., 1983). Среда, содержащая рекомбинантные ретровирусы, затем собирается, при желании концентрируется и используется для переноса гена. Ретровирусные векторы способны к заражению широкого разнообразия типов клеток. Однако интеграция и устойчивая экспрессия требуют разделения клеток-хозяев (Paskind et al., 1975).
Другие вирусные векторы могут быть использованы в качестве векторов для мишень-ориентированной генной терапии. Могут использоваться векторы, полученные из вирусов как, например, вируса коровьей оспы (Ridgeway, 1988; Baichwal and Sugden, 1986), адено-ассоциированного вируса (AAV) (Ridgeway, 1988; Baichwal and Sugden, 1986; Hermonat and Muzycska, 1984) и вирусов герпеса.
В другом варианте изобретения конструкт для генной терапии может быть заключен в липосому. Липосомо-опосредованная доставка нуклеиновой кислоты и экспрессия чужеродной ДНК in vitro оказались очень успешными. Wong et al. (1980) продемонстрировали осуществимость липосомо-опосредованной доставки и экспрессии чужеродной ДНК в культивированных клетках зародыша цыпленка, HeLa и гепатоме. Nicolau et al., (1987) успешно выполнили липосомо-опосредованный перенос гена в крысах после внутривенной инъекции.
Векторы для генной терапии по настоящему изобретению могут содержать различные трансгены, которые обычно кодируются ДНК или РНК экспрессионного вектора. Генная терапия может быть использована для экспрессии терапевтического гена, экспрессии VEGFR-1/NRP-1 для увеличения неоваскуляризации или для ингибирования экспрессии VEGFR-1/NRP-1 с целью лечения заболеваний, ассоциированных с неоваскуляризацией. ДНК может быть в форме кДНК, синтезированной in vitro ДНК, плазмидной ДНК, частей плазмидной ДНК, генетического материала, полученного из вируса, линейной ДНК, векторов (P1, PAC, BAC, YAC, искусственная хромосома), экспрессионных кассет, химерных последовательностей, рекомбинантной ДНК, хромосомной ДНК, олигонуклеотида, антисмысловой ДНК или производных этих групп. РНК может быть в форме олигонуклеотидной РНК, тРНК (транспортной РНК), snРНК (малой ядерной РНК), rРНК (рибосомальной РНК), мРНК (матричной РНК), синтезированной in vitro РНК, рекомбинантной РНК, химерных последовательностей, антисмысловой РНК, siРНК (малых интерферирующих РНК), рибозимов или производных этих групп. Антисмысловой полинуклеотид представляет собой полинуклеотид, который препятствует функции ДНК и/или РНК. К антисмысловым полинуклеотидам относятся, в числе прочего, морфолины, 2'-О-метилполинуклеотиды, ДНК, РНК и т.п. SiРНК состоят из двухцепочечной структуры, обычно содержащей 15-50 пар оснований и, предпочтительно, 21-25 пар оснований и имеющей нуклеотидную последовательность, идентичную или почти идентичную экспрессируемому гену-мишени или РНК внутри клетки. Интерференция может приводить к подавлению экспрессии. Кроме того, ДНК и РНК могут быть одноцепочечными, двухцепочечными, трехцепочечными или четырехцепочечными.
10. Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению содержат эффективное количество одной или нескольких композиций, включающих группу направленного действия, как описано в настоящем документе, растворенных или диспергированных в фармацевтически приемлемом носителе. Фразы «фармацевтический» или «фармакологически приемлемый» относятся к молекулярным соединениям и композициям, которые не приводят к противоположной, аллергической или другой нежелательной реакции при назначении животному, такому как, например, человеку. Приготовление фармацевтической композиции, которая содержит, по крайней мере, одну композицию по настоящему изобретению (например, LPR молекулы направленного действия) или дополнительный активный ингредиент, известны специалистам в данной области техники в свете настоящего описания изобретения, пример которого приведен в "Remington's Pharmaceutical Sciences", 18th Ed. Mack Printing Company, 1990, содержание которого включено в настоящий документ ссылкой. Более того, при назначении животному (например, человеку) необходимо понимать, что композиции должны отвечать стандартам стерильности, пирогенности, общей безопасности и чистоты как требует отдел FDA биологических стандартов.
Используемый в настоящем документе «фармацевтически приемлемый носитель» включает все без исключения растворители, диспергенты, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (антибактериальные средства, противогрибковые средства), изотонические вещества, препятствующие всасыванию вещества, соли, лекарства, стабилизаторы лекарств, гели, связующие вещества, эксципиенты, дезинтеграторы, лубриканты, подсластители, ароматизаторы, красители, подобного рода материалы и их комбинации, известные специалистам в данной области техники (смотри, например, Remington's Pharmaceutical Sciences, 18th Ed., 1990, содержание которого включено в настоящий документ ссылкой). За исключением случаев, когда любой общепринятый носитель несовместим с активным ингредиентом, рассматривается его использование в терапевтических или фармацевтических композициях.
Терапевтические и диагностические композиции по настоящему изобретению могут содержать различные типы носителей в зависимости от того, будут ли они применяться в твердой, жидкой или аэрозольной формах и есть ли необходимость быть стерильными для таких способов применения. Предусмотрено, что композиции по настоящему изобретению могут быть применены любым методом, известным специалистам в данной области техники, как, например, орально, внутривенно, внутрикожно, внутриартериально, спинально, интраокулярно, субконъюктивально, субретинально, интравитреально, в переднюю камеру глазного яблока, в надсклеральное пространство глаза, местно, интраперитонеально, внутрь пораженной ткани, интракраниально, интраартикулярно, интраплеврально, интратрахеально, внутрь опухоли, внутримышечно, подкожно, интравезикулярно, ингаляцией (например, аэрозольной ингаляцией), инъекцией, инфузией, непрерывной инфузией, локальной перфузией для обработки клетки-мишени напрямую, через катетер, через лаваж, в липидных композициях (например, липосомах) или другим методом или комбинацией вышеуказанного, о которых известно специалистам в данной области техники (смотри, например, Remington's Pharmaceutical Sciences", 18th Ed. Mack Printing Company, 1990, содержание включено в качестве ссылки в настоящий документ).
Фактическое дозированное количество композиции по настоящему изобретению, назначенное субъекту, может определяться физическими или физиологическими факторами, такими как вес тела, тяжесть состояния, тип заболевания, подлежащий лечению, предыдущие или сопутствующее лечебные мероприятия, индивидуальные особенности пациента и способ введения лекарства. Практикующий врач, ответственный за лечение, будет, в любом случае, определять концентрацию активного ингредиента(ов) в композиции и подходящую дозу(ы) для индивидуального субъекта.
В определенных вариантах осуществления изобретения фармацевтические композиции могут содержать, например, по крайней мере, приблизительно 0,1% активного вещества. В других вариантах осуществления, активное вещество может составлять от приблизительно 2% до приблизительно 75% весовых единиц или от приблизительно 25% до приблизительно 60%, например, и любой другой получаемый в этом отношении диапазон. В других неограниченных примерах: приблизительно 1 мг белка/кг массы тела, приблизительно 5 мг/кг массы тела, приблизительно 10 мг/кг массы тела, приблизительно 50 мг/кг массы тела, приблизительно 100 мг/кг массы тела, приблизительно 200 мг/кг массы тела или более на один прием и любой другой получаемый в этом отношении диапазон. В неограниченных примерах диапазона, получаемого из вышеперечисленных цифр, предпочтителен диапазон от приблизительно 1 мг/кг массы тела до приблизительно 100 мг/кг массы тела, и особенно предпочтителен диапазон от 20 до 50 мг/кг при многократном ежедневном применении (подобно ибупрофену, аспирину и т.п., каждые 4-8 часов).
В любом случае, композиция может содержать различные антиоксиданты для замедления окисления одного или более компонентов. Кроме этого, предотвращение действия микроорганизмов может быть обусловлено консервантами как, например, антибактериальными и противогрибковыми веществами, включая, в числе прочего, парабены (например, метилпарабены, пропилпарабены), хлоробутанол, фенол, сорбиновую кислоту, тимеросал или их комбинации.
В вариантах осуществления изобретения, где композиция представлена в жидкой форме, носителем может быть растворитель или дисперсионная среда, состоящие, помимо прочего, из воды, этанола, полиола (например, глицерина, пропиленгликоля, жидкого полиэтиленгликоля), липидов (например, триглицеридов, растительных масел, липосом) и их комбинаций. Во многих случаях, предпочтительнее было бы включение изотонических веществ как, например, сахаров, хлорида натрия или их комбинаций.
Стерильные инъецируемые растворы готовят путем растворения LPR молекул направленного действия или их конъюгатов в необходимом количестве подходящего растворителя с различными, по мере необходимости, другими ингредиентами, перечисленными выше, с последующей стерилизацией фильтрованием. Обычно дисперсии готовят путем смешивания различных стерилизованных активных ингредиентов в стерильном наполнителе, содержащем основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков, для приготовления стерильных инъецируемых растворов, суспензий или эмульсий, предпочтительным методом приготовления является методика вакуумной сушки или лиофилизации, что позволяет получать порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из ранее отфильтрованной вышеуказанной жидкой среды. Жидкая среда, при необходимости, должна быть надлежащим образом забуферена, а жидкий растворитель до инъекции сначала превращен в изотонический при помощи достаточного количества соли или глюкозы. Приготовление композиций для непосредственных инъекций также рассматривается, при котором использование DMSO в качестве растворителя обусловливает чрезвычайно быстрое проникновение, доставляя высокие концентрации активных веществ в небольшие участки.
Композиция должна быть стабильной в условиях производства и хранения, защищена от контаминирующего действия микроорганизмов, таких как бактерии и грибы. Принимается во внимание то, что загрязнение эндотоксином должно поддерживаться на минимальном, безопасном уровне, например, менее 0,5 нг/мг белка.
Вышеупомянутые композиции оптимально могут включать одно или более вспомогательных терапевтических веществ, направленных на лечение или предотвращение любого вышеупомянутого заболевания.
11. Терапевтические вещества
В определенных вариантах осуществления изобретения терапевтические вещества могут быть функционально связанными с пептидом направленного действия или слитым белком для селективной доставки, например, в сосудистую сеть опухоли, экспрессирующую VEGFR-1/NRP-1. Вещества или факторы, подходящие для использования, могут включать любое химическое соединение, которое индуцирует апоптоз, клеточную гибель, состояние покоя клетки и/или анти-ангиогенез.
А. Регуляторы программируемой клеточной гибели
Апоптоз, или программируемая клеточная гибель, является неотъемлемым процессом нормального эмбриогенеза, поддержания гомеостаза взрослых тканей и подавления карциногенеза (Kerr et al., 1972). Белки семейства Bcl-2 и ICE-подобные протеазы, как было показано, являются важными регуляторами и эффекторами апоптоза в других системах. Bcl-2 белок, открытый в связи с фолликулярной лимфомой, играет значительную роль в контроле апоптоза и увеличении клеточной выживаемости в ответ на различные апоптотические стимулы (Bakhshi et al., 1985; Cleary and Sklar, 1985; Cleary et al., 1986; Tsujimoto et al., 1985; Tsujimoto and Croce, 1986). По общему признанию, эволюционно консервативный белок Bcl-2 является членом семейства родственных белков, которые могут быть классифицированы как агонисты гибели или антагонисты гибели.
После его открытия было показано, что Bcl-2 действует в качестве супрессора клеточной гибели, инициируемой различными стимулами. Кроме того, сейчас стало очевидным, что существует семейство Bcl-2 белков-регуляторов клеточной гибели, которые обладают общими гомологиями в структуре и последовательности. Эти различные члены семейства, как оказалось, обладают схожими с Bcl-2 функциями (например, BclXL, BclW, BclS, Mcl-1, A1, Bfl-1) или препятствуют действию Bcl-2 и стимулируют клеточную гибель (например, Bax, Bak, Bik, Bim, Bid, Bad, Harakiri).
B. Ангиогенные ингибиторы
В определенных вариантах осуществления настоящее изобретение касается назначения молекул направленного действия, функционально связанных с анти-ангиогенными веществами, такими как ангиотензин, пептиды ламинина, пептиды фибронектина, ингибиторы активатора плазминогена, ингибиторы тканевой металлопротеиназы, интерфероны, интерлейкин 12, тромбоцитарный фактор 4, IP-10, Gro-β, тромбоспондин, 2-метоксиэстрадиол, пролиферин-связанный белок, карбоксиамидотриазол, СМ101, маримастат, пентосан полисульфат, ангиопоэтин 2 (Регенерон), интерферон-альфа, гербимицин А, PNU145156E, фрагмент пролактина 16K, линомид, талидомид, пентоксифиллин, генистеин, TNP-470, эндостатин, паклитаксел, аккутин, ангиостатин, сидофовир, винкристин, блеомицин, AGM-1470, тромбоцитарный фактор 4 или миноциклин.
Пролиферация клеток опухолей сильно зависит от экстенсивной васкуляризации опухоли, которая сопровождает развитие рака. Таким образом, ингибирование образования новых кровеносных сосудов с помощью анти-ангиогенных веществ и направленное разрушение существующих кровеносных сосудов были взяты на рассмотрение в качестве эффективного и относительно не токсичного подхода к лечению опухолей (Arap et al., 1998; Arap et al., 1998; Ellerby et al., 1999). Известны разнообразные анти-ангиогенные вещества и/или ингибиторы кровеносных сосудов (например, Folkman, 1997; Eliceiri and Cheresh, 2001).
C. Цитотоксические вещества
Химиотерапевтические (цитотоксические) вещества могут быть использованы для лечения различных заболеваний, включая рак. Химиотерапевтические (цитотоксические) вещества возможного применения включают, в числе прочего, 5-фторурацил, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин (CDDP), циклофосфамид, дактиномицин, даунорубицин, доксорубицин, вещества, связывающие эстрогеновый рецептор, этопозид (VP16), ингибиторы фарнезил-протеин трансферазы, гемцитабин, ифосфамид, мехлоретамин, мелфалан, митомицин, навелбин, нитросурея, пликомицин, прокарбазин, ралоксифен, тамоксифен, таксол, темозоломид (водный раствор DTIC), трансплантинум, винбластин и метотрексат, винкристин или любой аналог или производное вышеперечисленного. Большинство химиотерапевтических веществ попадает под категорию алкилирующих веществ, антиметаболитов, противоопухолевых антибиотиков, кортикостероидных гормонов, митотических ингибиторов и нитрозомочевины, гормональных веществ, смешанных веществ и любого аналога или производного вышеперечисленного.
Химиотерапевтические вещества и способы применения, дозировки и т.д. хорошо известны специалистам в данной области техники (смотри в качестве примера «Physicians Desk Reference», Goodman & Gilman's «The Pharmacological Basis of Therapeutics» и «Remingthon's Pharmaceutical Sciences» 15th ed., стр.1035-1038 и 1570-1580, содержание которых включено в соответствующих частях настоящего документа ссылкой) и могут быть соотнесены с данным изобретением в свете раскрытия представленной здесь информации. Некоторую коррекцию дозировки необходимо будет вносить в зависимости от состояния подлежащего лечению субъекта. Человек, ответственный за назначение препарата, будет, в любом случае, подбирать подходящую дозу для индивидуального субъекта. Конечно, все дозировки и вещества, описанные в данном документе, являются скорее иллюстративными нежели лимитирующими, и другие дозировки или вещества могут быть использованы квалифицированным специалистом для определенного пациента или сферы применения. Любая дозировка в заданном интервале или полученном здесь диапазоне также подлежит использованию в изобретении.
D. Алкилирующие вещества
Алкилирующие вещества являются лекарственным средством, которое напрямую взаимодействует с геномной ДНК для предотвращения клеточной пролиферации. Эта категория химиотерапевтических лекарственных средств представляет собой вещества, действующие на все фазы клеточного цикла, то есть они не являются фазоспецифичными. Алкилирующее вещество может включать, в числе прочего, азотистый иприт, этиленимин, метилмеламин, алкилсульфонат, нитрозомочевину или триазины. Они включают, помимо прочего: бисульфан, хлорамбуцил, цисплатин, циклофосфамид (цитоксан), дакарбазин, ифосфамид, мехлорэтамин (мустарген) и мелфалан.
E. Антиметаболиты
Антиметаболиты прерывают синтез ДНК и РНК. В отличие от алкилирующих веществ, они специфически влияют на клеточный цикл во время S-фазы. Антиметаболиты могут быть разделены на различные категории, такие как аналоги фолиевой кислоты, аналоги пиримидина и аналоги пурина и соответствующие ингибиторы. Антиметаболиты включают, в числе прочего, 5-фторурацил (5-FU), цитарабин (Ara-C), флударабин, гемцитабин и метотрексат.
F. Природные продукты
Природные продукты обычно относят к соединениям, первоначально выделенным из природного источника и обладающим фармакологической активностью. Такие соединения, аналоги и их производные могут быть выделены из природного источника, химически синтезированы или рекомбинантно созданы любой методикой, известной специалисту в данной области. Природные продукты включают такие категории, как митотические ингибиторы, противоопухолевые антибиотики, ферменты и модификаторы биологического ответа.
Митотические ингибиторы включают растительные алкалоиды и другие природные вещества, которые могут ингибировать либо синтез белка, необходимый для клеточного деления, либо митоз. Они действуют в период определенной фазы во время клеточного цикла. Митотические ингибиторы включают, например, доцетаксел, этопозид (VP16), тенипозид, паклитаксел, таксол, винбластин, винкристин и винорелбин.
Таксоиды представляют собой класс родственных соединений, выделенных из коры ясеня, Taxus brevifolia. Таксоиды включают, помимо прочего, такие соединения, как доцетаксел и паклитаксел. Паклитаксел связывается с тубулином (в сайте, отличном от такового, используемого алкалоидом барвинка) и запускает сборку микротрубочек.
Алкалоиды барвинка - это тип растительного алкалоида, у которого выявлена фармакологическая активность. Они включают такие соединения, как винбластин (VLB) и винкристин.
G. Антибиотики
Определенные антибиотики имеют как антимикробную, так и цитотоксическую активности. Эти лекарственные средства также интерферируют с ДНК, химически ингибируя ферменты и митоз или изменяя клеточные мембраны. Эти вещества не являются фазоспецифичными, поскольку они работают во всех фазах клеточного цикла. Примеры цитотоксических антибиотиков включают, в числе прочего, блеомицин, дактиномицин, даунорубицин, доксорубицин (Адриамицин), пликамицин (митрамицин) и идарубицин.
H. Смешанные вещества
Смешанные цитотоксические вещества, не попадающие в предыдущую категорию, включают, в числе прочего, координирующие комплексы платины, антрацендионы, замещенные мочевины, производные метилгидразина, амсакрин, L-аспарагиназа и третиноин. Координирующие комплексы платины включают такие соединения, как карбоплатин и цисплатин (cis-DDP). Типичным антрацендионом является митоксантрон. Типичной замещенной мочевиной является гидроксимочевина. Типичным производным метилгидразина является прокарбазин (N-метилгидразин, MIH). Эти примеры не являются лимитирующими, и предусматривается, что любое известное цитотоксическое, цитостатическое или разрушающее клетки вещество может быть соединено с пептидами направленного действия и введено в целевой орган, ткань или тип клетки в рамках настоящего изобретения.
ПРИМЕРЫ
Следующие примеры включены для демонстрации предпочтительных вариантов изобретения. Специалистам в данной области изобретения следует признать, что методики, представленные в примерах, следует считать методиками, разработанными авторами для лучшего их использования на практике настоящего изобретения, и, таким образом, могут быть рассмотрены в качестве предпочтительных способов для их практического использования. Однако специалистам в данной области изобретения следует признать в свете настоящего описания изобретения, что многочисленные изменения могут быть внесены в определенные варианты осуществления изобретения, которые здесь представлены, и, тем не менее, будут получены такие же или сходные результаты, не отклоняясь от сущности и объема изобретения.
Пример 1: Анти-ангиогенные соединения, нацеленные на VEGF сигнальные пути
1. Материалы и методы
Реактивы и пептиды. Пептиды были синтезированы и очищены на HPLC согласно нашим техническим условиям с чистотой более чем 95%: L-Arg-L-Pro-L-Leu (RPL), D-Leu-D-Pro-D-Arg [D(LPR)], D-Cys-D-Ala-D-Pro-D-Ala-D-Cys [D(CAPAC); SEQ ID NO:6] в Лаборатории Полипептидов (Torrence, CA) и D-Ala-D-Pro-D-Ala [D(APA)] в Genemed Synthesis Inc. (San Francisco, CA). Рекомбинантные рецепторы (VEGFR-1 и NPR-1) и ростовые факторы (человеческий VEGF165) были получены из R&D Systems (Minneapolis, MN). Гепарин, реактив Драбкина, человеческий гемоглобин, brij-35 были получены из (Sigma-Aldrich, St. Louis, MO).
Животные. Эксперименты на мышах были одобрены Комитетом по защите и использованию животных Онкологического центра Андерсона Университета Техаса. Мыши C57BL/6 и Balb/c были приобретены коммерческим способом (Harlan, Indianapolis). Это исследование придерживается декларации Ассоциации по исследованию в области зрения и офтальмологии для использования животных в исследовании зрения и офтальмологии.
Фаговый анализ. Фаги были приготовлены путем инфицирования K91kan культуры E.coli во время log-фазы, ночного выращивания в среде Лурия-Бертани (LB) с добавлением канамицина (100 мкг/мл) и тетрациклина (20 мкг/мл) при 37°С и 250 об/мин. Фаги были осаждены из супернатанта среды методом PEG/NaCl, и фаговый титр определяли серийным разведением и подсчетом колоний (Giordano, 2001). Для метода по связыванию фага и конкурентного анализа VEGFR-1, NRP-1 или BSA (10 мкг/мл в PBS) были иммобилизованы на микротитровальные планшеты в течение ночи при 4°С. Планшеты были отмыты дважды, блокированы PBS 3% BSA в течение 2 ч при комнатной температуре и инкубированы в PBS 3% BSA в присутствии 109 TU CPQPRPLC или фага (Fd-tet) с отсутствующей вставкой, служащего отрицательным контролем. После 1 ч при комнатной температуре планшеты были отмыты 10 раз в PBS, и фаг, связанный с иммобилизованными рецепторами, извлекали с помощью бактериальной инфекции (Giordano, 2001).
Анализ устойчивости к протеазам.D(LPR) и RPL пептиды были разведены до 500 мкг/мл в PBS и инкубированы с повышающимися концентрациями панкреатина (Sigma-Aldrich, St. Louis, MO) в течение 2 ч при 37°С. Затем образцы были проанализированы масс-спектроскопией (MALDI-TOF).
Анализ ангиогенеза. Авторы использовали метод анализа ангиогенеза in vivo на матригеле, в котором ростовой фактор уменьшал матрикс матригеля (BD Biosciences, Bedford, MA), пропитанный рекомбинантным человеческим VEGF165 (1 мкг/мл) и гепарином (10 ед/мл), содержащий или не содержащий пептидомиметики (500 мкг), имплантированный in vivo подкожно (0,5 мл) в дорсальную часть мыши Balb-c.D(CAPAC) был использован в качестве контрольного пептидомиметика. После 7 дней мышь умерщвляли, иссекали уплотнения с матригелем, фотографировали, гомогенизировали в растворе Brij 0,35% с помощью гомогенизатора Dounce, центрифугировали 5 мин при 13000 g. Супернатант был использован дважды: для измерения гемоглобина (Hb) реактивом Драбкина и концентрации Hb, вычисленной по одновременно измеренному стандарту Hb.
Мышиная модель SCID ангиогенеза человека. В мышей имплантировали 106 микроэндотелиальных клеток кожи человека (HDMEC) в матриксе матригеля в расчете на одну подложку, по 2 подложки на мышь, по одной с каждой стороны мыши. На 12 день после имплантации мышам вводили ежедневноD(LPR) или контрольный пептидомиметикD(APA) (100 мкл внутрибрюшинных инъекций из раствора 2 мг/мл). Лекарства были приготовлены как разведением в DMSO до основной концентрации 20 мг/мл для последующих разведений, так и путем приготовления свежих разведений (1/10) в PBS перед каждой инъекцией. Подложки были забраны и фиксированы в 10% формалине/PBS. Срезы тканей были окрашены антителами к фактору Виллебранда (Neomarkers, Freemont, CA), визуализированы с помощью AEC (DABCO) и контрастированы гематоксилином. Подсчеты были выполнены в световом микроскопе, по шесть полей зрения на подложку при 200х увеличении (n=6 дляD(LPR) и n=4 для контрольного пептидомиметика). Статистический анализ был выполнен с помощью Sigmastat.
Анализ неоваскуляризационного ангиогенеза сетчатки глаза. Для анализа неоваскуляризационного ангиогенеза сетчатки глаза авторы использовали мышат C57BL/6 и их кормящих матерей. Мыши (Р7) подвергались действию 75% кислорода в течение 5 дней, затем комнатного воздуха (20,8% О2)(Р12) и им вводились ежедневно инъекцииD(LPR), контрольного пептидомиметикаD(CAPAC; SEQ ID NO:6) (20 мг/кг в фосфатно-солевом буфере, используемого в качестве растворителя) или растворителя в течение семи дней (Р12-Р18). Для гистологического анализа мыши были умерщвлены на пике ангиогенеза (Р19), глаза энуклеированы, фиксированы, приготовлены серийные срезы и окрашены гематоксилином и эозином (H&E). Ядра эндотелиальных клеток на витреальной поверхности внутренней пограничной мембраны были посчитаны. Минимум 10 H&E-окрашенных срезов одного глаза были проанализированы и было посчитано среднее количество ядер, приходящихся на 4-6 глаз, для каждого эксперимента.
Опухолевый рост. Клетки EF43.fgf4 культивировали в среде Dulbecco Modified Eagle Medium с добавлением эмбриональной сыворотки крупного рогатого скота, глутамина и антибиотиков. Клетки были собраны перед достижением конфлюэнтного слоя и инъецированы подкожно в инфрапателлярное жировое тело молочной железы мыши Balb/c. После 10 дней опухоль достигала ~50-80 мм3 и животные были разделены на четыре группы по семь животных (N=7). Животные в каждой группе были лечены либо только растворителем (фосфатно-солевым буфером), либо контрольным пептидомD(CAPAC) (SEQ ID NO:6), либоD(LPR) (50 мг/кг), либо циклической формойD(CLPRC)(SEQ ID NO:7) (25 мг/кг). Объем опухоли был вычислен путем измерения длины длинной (L) и короткой (S) сторон каждой опухоли (V=S2×L×0,04).
Статистический анализ. Для экспериментов in vivo статистическая значимость различий была вычислена с использованием теста Краскела-Уоллиса (непараметрический однофакторный метод ANOVA), p<0,05 для каждого дня лечения. Ранговый тест Вилкоксона был использован для дальнейших вычислений различий при попарном сравнении групп в день лечения, проявляющие статистическую значимость по тесту Крускала-Уоллиса. Множественные сравнения были выполнены с использованием метода Benjamini & Hochberg. Весь статистический анализ был выполнен с использованием программы R Project для статистических вычислений (версия 2.4.1).
2. Экспериментальные результаты
Чтобы оценить участвуют ли пептидомиметикиD(LPR) в связывании с VEGFR-1 и NRP-1, были выполнены эксперименты по конкурентному связыванию. Связывание родительского фага CPQPRPLC (SEQ ID NO:8) c иммобилизованными рецепторами VEGF, NRP-1 и VEGFR-1, было выполнено в присутствии возрастающих концентраций пептида RPL или пептидомиметикаD(LPR) по настоящему изобретению. Как ожидалось из предыдущих работ авторов (Giordano et al., 2005), пептид RPL полностью предотвращал связывание фага CPQPRPLC (SEQ ID NO:8) с обоими рецепторами. Интересно, что пептидомиметикD(LPR) также ингибировал связывание фага при очень схожих концентрациях при сравнении с RPL. Оба пептида, RPL иD(LPR) ингибировали связывание фага доза-зависимым способом, в то время как контрольный пептид, используемый в наивысшей концентрации (100 мкМ) не оказывал никакого действия на связывание фага CPQPRPLC (SEQ ID NO:8). Поскольку концентрация пептида, требуемая для ингибирования 50% связывания фага (IC50), обратно пропорциональна аффинности пептида к рецептору, наши данные позволяют предположить, что как RPL, так иD(LPR) имеют более высокую аффинность к VEGFR-1 и NRP-1 при сравнении с пептидом CPQPRPLC (SEQ ID NO:8) (Giordano et al., 2001). IC50 D(LPR) для обоих рецепторов значительно ниже (1-10 пМ) при сравнении с IC50 CPQPRPLC (SEQ ID NO:8), как было описано ранее, для VEGFR-1 (~1 нМ) или NRP-1 (~50-100 нМ) (Giordano et al., 2001).
Затем была протестирована устойчивостьD(LPR) к протеолитической деградации. Как RPL, так иD(LPR) были инкубированы с возрастающими концентрациями панкреатина (смесь различных расщепляющих ферментов из поджелудочной железы), и продукты деградации были проанализированы масс-спектроскопией. Никаких продуктов расщепления не наблюдали у пептидомиметикаD(LPR) при наибольшем исследованном соотношении концентрации фермента и пептида (400 пг/нмоль). Однако пептид RPL демонстрировал значительную деградацию в присутствии продуктов расщепления дипептида PL. Подводя итог вышесказанному, эти данные показывают, чтоD(LPR) подобен RPL в том, что менее подвержен протеолитической деградации, связывается с высокой аффинностью с VEGFR-1 и NRP-1 и является лучшим кандидатом среди ведущих лекарственных средств для изучения действия мотива RPL в ангиогенезе.
После идентификации и характеристики пептидомиметикаD(LPR) было исследовано действиеD(LPR) на образование новых сосудов. С этой целью были использованы две животные модели ангиогенеза: in vivo с матригелем и рост эндотелиальных клеток человека в мыши-хозяине (Nor et al., 2001). Сначала были выполнены исследования с использованием модели анализа с матригелем in vivo, в которой мышам подкожно инъецировали матригель, содержащиий VEGF165 и пептидомиметикD(LPR). После 7 дней имплантации матрикс матригеля, пропитанныйD(LPR), демонстрировал сниженную васквуляризацию по сравнению с матриксом матригеля, содержащим только VEGF165 и служащим положительным контролем; никакого действия на неоваскуляризацию не наблюдали в матрицах, содержащих контрольный пептидомиметик (фиг.1А).
Затем было исследовано действиеD(LPR) в мышиной модели SCID ангиогенеза человека. В этой модели эндотелиальные клетки человека культивировали in vivo в полимерных имплантах и выращивали с целью образования микрососудов, которые затем объединяли с мышиными капиллярами. Новообразованные сосуды были функциональны, выстраивались в линию с эндотелиальными клетками человека, экспрессирующими маркеры ангиогенеза, и транспортировали клетки крови мыши. Для оценки действияD(LPR) в данной животной модели ангиогенеза в мышей имплантировали подложки, содержащие эндотелиальные клетки человека, и выращивали их 12 дней. Во время 12-дневного периода эндотелиальные клетки образовывали нефункциональные тубулярные структуры, содержащие пустые просветы и которые медленно созревали до функционирующих в полном объеме сосудов, содержащих клетки крови мыши (Nor et al., 2001). Начиная с 12 по 21 день, мышам вводилиD(LPR) или контрольный пептидомиметик (25 мг/кг/день). Пептидомиметики инъецировали ежедневно интраперитонеально, и в конце лечения подложки были удалены, и было определено число эндотелиальных клеток, образующих функциональные кровеносные сосуды. На 21 день у всех животных сформировались функциональные сосуды с ожидаемой плотностью клеток; эти сосуды были функциональны и положительны на маркеры ангиогенеза. Авторы наблюдали уменьшение образования сосудов на 36,7% в группе животных, получавших лечение пептидомD(LPR), по сравнению с животными, получавшими лечение контрольным пептидомиметиком (32,1 сосудов в поле зрения увеличенного изображения против 20,3 в присутствииD(LPR). (фиг.1B). Вместе взятые эти данные показывают, что пептидомиметикD(LPR) ингибирует образование и созревание кровеносных сосудов in vivo в двух различных животных моделях ангиогенеза.
Затем были выполнены исследования с целью выяснения, могут ли пептидомиметикиD(LPR) быть использованы в качестве лекарственного средства для лечения патофизиологического ангиогенеза. С этой целью были выбраны животные модели двух заболеваний, в которых ангиогенез, как известно, играет важную роль в прогрессировании заболевания: ретинопатия недоношенных (ROP) и рак. Для изучения ROP была использована мышиная модель кислород-индуцированной ретинопатии (Smith et al., 1994; Lahdenranta et al., 2001). В этом случае новорожденных мышей (в возрасте 7 дней) подвергали воздействию высоких уровней кислорода (75%) в течение 5 дней и возвращали в комнатные условия (20,8% кислорода в воздухе). Изменения уровня кислорода вызывало относительную гипоксию у животных, на что эндотелиальные клетки отвечали активацией кислород-чувствительных элементов, таких как гипоксия-индуцибельный фактор-1 (HIF-1) и VEGF (Smith et al., 1994; Lahdenranta et al., 2001). После возвращения на комнатный воздух (12 день) животным ежедневно вводилиD(LPR) или контрольный пептидомиметик в течение 7 дней (20 мг/кг). В конце лечения (19 день) глаза были энуклеированы и исследованы с целью определения уровня неоваскуляризации путем подсчета числа сосудов и эндотелиальных клеток, выступающих из сетчатки глаза (фиг.2А). Значительное уменьшение ангиогенеза (68,5%) наблюдали у животных, получавших лечениеD(LPR), по сравнению с животными, получавшими лечение только носителем или контрольным пептидомиметиком (фиг.2В, 2С) (29,8±3,8 ядер/сетчатка у животных, получавших лечение только носителем; 29,3±6,0 ядер/сетчатка у животных, получавших лечение контрольным пептидомиметиком; 9,4±1,0 ядер/сетчатка у животных, получавших лечениеD(LPR)).
Затем были выполнены исследования, чтобы выяснить, будет ли пептидD(LPR) оказывать влияние на неоваскуляризацию, индуцированную опухолью. Для этих исследований была выбрана высоко ангиогенная мышиная модель рака молочной железы EF43.fgf4 (Deroanne et al., 1997; Hajitou et al., 1998). В этой модели раковые клетки синтезируют и секретируют фибробластный ростовой фактор-4 (FGF-4), который индуцирует аутокринную продукцию VEGF, приводя к образованию высоко васкуляризованных опухолей. Животным инъецировали клетки рака молочной железы подкожно в инфрапателлярное жировое тело молочной железы и давали возможность вырасти опухоли до небольших размеров (50-80 мм3). Животным, имеющим опухоль, затем ежедневно вводили интраперитонеально инъекцииD(LPR) (50 мг/кг), контрольный пептидомиметик или один носитель. После 5 дней лечения было отмечено отчетливое уменьшение объема опухоли у животных, получавших лечениеD(LPR) (фиг.3). Для этих исследований была использована циклическая форма пептидомиметикаD(LPR),D(CLPRC). У животных, имеющих опухоль и получавших лечениеD(CLPRC) (25 мг/кг), также было выявлено значительное уменьшение объема опухоли (фиг.3). Никакого действия на опухолевый рост не наблюдали у животных, получавших лечение контрольным пептидомиметиком.
Вместе взятые эти данные демонстрируют, что пептидомиметикD(LPR) и его циклическая форма являются новым классом ингибиторов ангиогенеза и мишень-ориентированными средствами, которые должны найти важное применение в клинике, а также на более поздней стадии, такой как образование и созревание сосудов (мышиная модель SCID ангиогенеза).D(LPR) при системном введении у мыши значительно снижало образование сосудов во время патологического ангиогенеза (мышиная модель ROP), а также ангиогенеза, индуцированного опухолью.
Пример 2: Целенаправленное действие на жировую ткань/Исследования ожирения
Рацион питания и стиль жизни вносят вклад в высокую заболеваемость ожирением в развитом мире. В Соединенных Штатах приблизительно 65% взрослого населения имеют избыточный вес с индексом массы тела большим или равным 25 кг/м2, и свыше 30% имеют ожирение (индекс массы тела больше или равен 30 кг/м2). Ожирение ассоциировано с повышенным риском развития сахарного диабета, рака и сердечных заболеваний и обычно вызывает сокращение продолжительности жизни человека. Достижения в области лечения ожирения до сих пор были весьма ограничены использованием некоторых лекарственных средств для контроля аномального накопления жира (Clapham et al., 2001). Большинство средств против ожирения основано на изменении энергетического баланса и аппетита путем воздействия на рецепторы мозга. Некоторые лекарственные вещества этого класса (такие как фенфлюрамин) были сняты с продаж из-за непредвиденной токсичности. Современные попытки по разработке соединений, ингибирующих абсорбцию жира в желудочно-кишечном тракте (таких как орлистат, продаваемый Roche под торговой маркой Xenical®), могут улучшить лечение ожирения. До сих пор, даже самые эффективные лекарственные средства могут снизить вес только на 5%, и для дальнейшей потери веса необходима строгая диета (Clapham et al., 2001; Padwal & Majumdar, 2007).
Было показано, что не относящийся к неоплазии рост тканей (например, жировой ткани) также зависит от образования новых кровеносных сосудов (ангиогенеза). Например, у мышей из различных моделей ожирения, получавших анти-ангиогенные вещества, было обнаружено зависящее от дозы лечения обратимое снижение веса и потеря жировой ткани (Rupnick et al., 2002). Эти исследования демонстрируют, что масса жировой ткани чувствительна к ингибиторам ангиогенеза.
Таким образом, авторы провели исследование по оценке способности LPR пептидов направленного действия на VEGFR-1 по настоящему изобретению целенаправленно воздействовать на жировую ткань и, тем самым, снижать вес у страдающих алиментарным ожирением мышей. С этой целью, страдающие алиментарным ожирением мыши были разделены на группы и получали лечение пептидом направленного действия на VEGFR-1/NRP-1. Мыши C57BL/6 J-60% DIO (в возрасте 36 недель) были приобретены в Лаборатории Джексона. Эти животные вскармливались на высококалорийной диете (J-60%) для получения фенотипа алиментарного ожирения (DIO). Животные были разделены на группы и ежедневно принимали следующее лечение: [Группа 1]D(CLPRC) (SEQ ID NO:7) (N=5); [Группа 2] CKGGRAKDC-GG-D(KLAKLAK)2(SEQ ID NO:9) (N=3); [Группа 3]D(CLPRC) в сочетании с CKGGRAKDC-GG-D(KLAKLAK)2(SEQ ID NO:10) (N=4); [Группа 4] только носитель (N=4). Все животные были гидратированы интраперитонеальным введением 1 мл солевого раствора (0,9% раствор хлорида натрия, качество USP) в течение 30 минут перед лечением. Мышей ежедневно подвергали лечению путем введенияD(CLPRC), растворенного в фосфатно-солевом буферном носителе (PBS), (общий объем инъекции 100 мкл) в дозировке 50 мг/кг/масса тела (Группы 1 и 3); CKGGRAKDC-GG-D(KLAKLAK)2(SEQ ID NO:9) в PBS был введен подкожно (общий объем инъекции 100 мкл) в дозировке 3 мг/кг (Группа 2) или 1 мг/кг в сочетании сD(CLPRC) (Группа 3) 5 дней в неделю (с понедельника по пятницу). Мышей взвешивали один раз в неделю.
Результаты исследований представлены на фиг.4А-4С. В группе страдающих ожирением мышей, получавших лечениеD(CLPRC) путем ежедневных интраперитонеальных инъекций (50 мг/кг), можно видеть, что за период лечения происходила довольно значительная потеря веса величиной приблизительно 3 грамма (приблизительно 6% от массы тела), в то время как у контрольных мышей наблюдали относительное увеличение веса (фиг.4А). Затем, для подтверждения эффекта потери веса под действиемD(CLPRC), был спланирован эксперимент по смешанной терапии. Мышам, страдающим ожирением, вводили пептид направленного действия на VEGFR-1/NRP-1 совместно со средством от ожирения, сжигающего жир. В предыдущих исследованиях авторы показали, что сжигание белого жира может быть достигнуто путем селективного целенаправленного воздействия на сосудистую сеть жировой клетчатки с использованием целевого пептида CKGGRAKDC (SEQ ID NO:11), конъюгированного с проапоптотическим пептидомD(KLAKLAK)2(SEQ ID NO:2) (Kolonin et al., 2004). Это соединение, названное «сжигателем жира» (последовательность CKGGRAKDC-GG-D(KLAKLAK)2) (SEQ ID NO:9), индуцирует аблацию жира в терапевтических дозах, равных или превышающих 3 мг/кг/массы тела. Однако, для смешанного эксперимента пептид направленного действияD(CLPRC) (SEQ ID NO:7) к VEGFR-1/NRP-1 был объединен с субтерапевтической дозой сжигателя жира (1 мг/кг), ожидая то, что анти-ангиогенный эффектD(CLPRC) будет синергичен с эффектом тканевой аблации сжигателя жира.
Действительно, наблюдали значительную потерю веса величиной приблизительно 8 граммов (до 16% массы тела), когда животным вводили оба лекарственных средства (фиг.4В). Животные, получавшие смешанную терапию, демонстрировали потерю веса, подобную таковой в группе мышей, получавших один только сжигатель жира в оптимальной терапевтической дозе 3 мг/кг (фиг.4С), и составляющую приблизительно 10 граммов (20% массы тела). Вместе взятые эти данные демонстрируют, что пептиды направленного действия на VEGFR-1/NRP-1 индуцируют потерю веса у мышей, страдающих ожирением, и что они могут синергично действовать с другими препаратами от ожирения. Пептиды направленного действия на VEGFR-1/NRP-1 могут найти важное применение в лечении ожирения человека.
Все композиции и методы, рассматриваемые и заявленные в данном документе, могут быть сделаны и выполнены с надлежащим проведением экспериментов в свете настоящего изобретения. Хотя композиции и методы по настоящему изобретению были описаны в рамках предпочтительных вариантов осуществления, специалистам в данной области техники очевидно то, что изменения могут быть внесены в композиции и методы и в этапы или в последовательность этапов методов, описанных в настоящем документе, без отклонения от концепции, сущности и объема изобретения. В частности, очевидно, что определенные вещества, которые как химически, так и физиологически связаны, могут быть заменены на вещества, рассматриваемые в данном документе, при том, что будут получены такие же или подобные результаты. Все подобного рода замены и модификации, очевидные специалистам в данной области техники, воспринимаются в соответствии с сущностью, объемом и концепцией данного изобретения как определено в прилагаемой формуле изобретения.
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
Следующий список литературных источников, в той степени, в которой он обеспечивает типовой порядок действий или другие данные, дополняющие положения, изложенные в настоящем документе, особым образом включен в настоящий документ в качестве ссылок.



Реферат
Изобретение относится к области молекулярной медицины и мишень-ориентированной доставки терапевтических средств. Предложены новые пептидные последовательности размером 10 или менее аминокислот, содержащие в своем составе по крайней мере непрерывную аминокислотную последовательность D(LPR), которые селективно воздействуют на клетки, экспрессирующие VEGFR-1 и NRP-1. Мишень-ориентированные молекулы в соответствии с данным изобретением пригодны для лечения и выявления неоваскулярных и ангиогенных VEGF-ассоциированных нарушений, например, таких как рак, ожирение, диабет, астма, артрит, цирроз и глазные болезни. 5 н. и 11 з.п. ф-лы, 4 ил, 2 пр.
Формула
(a) белком, и пептид конъюгирован с белком с образованием белкового конъюгата; или
(b) молекулой, которая является лекарственным средством, химиотерапевтическим средством, диагностическим средством, радиоизотопом, про-апоптотическим средством, анти-ангиогенным средством, гормоном, цитокином, фактором роста, цитотоксическим средством, пептидом, белком, антибиотиком; антителом, его фрагментом или одноцепочечным антителом; визуализирующим веществом, фактором выживаемости, анти-апоптотическим средством, антагонистом гормона или антигеном.
(a) про-апоптотическим средством, выбранным из группы, состоящей из грамицидина; магаинина; меллитина; дефензина; цекропина; (KLAKLAK)2 (SEQ ID NO: 2); (KLAKKLA)2 (SEQ ID NO: 3); (КААККАА)2 (SEQ ID NO: 4); (KLGKKLG)3 (SEQ ID NO: 5); Bcl-2; Bad; Bak; Bax и Bik; или
(b) анти-ангиогенным средством, выбранным из группы, состоящей из тромбоспондина, ангиостатина, фактора пигментного эпителия, ангиотензина, пептидов ламинина, пептидов фибронектина, ингибиторов активатора плазминогена, ингибиторов тканевой металлопротеиназы, интерферонов, интерлейкина 12, тромбоцитарного фактора 4, IP-10, Gro-β, 2-метоксиэстрадиола, белка, связанного с пролиферином, карбоксиамидотриазола, СМ101, маримастата, пентозанполисульфата, ангиопоэтина 2, гербимицина A, PNU145156E, фрагмента пролактина 16К, линомида, талидомида, пентоксифиллина, генистеина, TNP-470, эндостатина, паклитаксела, доцетаксела, полиаминов, протеасомного ингибитора, ингибитора киназ, сигнального пептида, аккутина, цидофовира, винкристина, блеомицина, AGM-1470, миноциклина, эндостатина XVIII, эндостатина XV, С-концевого гемопексинового домена матриксной металлопротеиназы-2, крингл-домена 5 плазминогена человека, слитого белка эндостатина и ангиостатина, слитого белка эндостатина и крингл-домена 5 плазминогена человека, монокина, индуцируемого интерфероном гамма (Mig), слитого белка Mig и IP 10, растворимого FLT-1 (fins-подобного тирозинкиназного рецептора 1) и киназного инсерционного домен-содержащего рецептора (KDR); или
(c) цитокином, выбранным из группы, состоящей из интерлейкина 1 (IL-1), IL-2, IL-5, IL-10, IL-11, IL-12, IL-18, интерферона-γ (IF-γ), IF-α, IF-β, фактора некроза опухолей и GM-CSF (гранулоцитарно-макрофагального колониестимулирующего фактора).
где слитая белковая конструкция не является природным белком, и выбранный белок является про-апоптотическим средством, анти-ангиогенным средством, гормоном, цитокином, ростовым фактором, цитотоксическим средством, белковым антибиотиком, антителом, или его фрагментом, или его одной цепью, анти-апоптотическим средством, антагонистом гормона или антигенами
для лечения заболевания или нарушения, составляющей частью которых является ангиогенез, у индивида.
(a) про-апоптотическим средством, выбранным из группы, состоящей из грамицидина; магаинина; меллитина; дефензина; цекропина; (KLAKLAK)2 (SEQ ID NO: 2); (KLAKKLA)2 (SEQ ID NO: 3); (KAAKKAA)2 (SEQ ID NO: 4); (KLGKKLG)3 (SEQ ID NO: 5); Bcl-2; Bad; Bak; Bax и Bik; или
(b) анти-ангиогенным средством, выбранным из группы, состоящей из тромбоспондина, ангиостатина, фактора пигментного эпителия, ангиотензина, пептидов ламинина, пептидов фибронектина, ингибиторов активатора плазминогена, ингибиторов тканевой металлопротеиназы, интерферонов, интерлейкина 12, тромбоцитарного фактора 4, IP-10, 2-метоксиэстрадиола, белка, связанного с пролиферином, ангиопоэтина 2, фрагмента пролактина 16K, эндостатина XVIII, эндостатина XV, С-концевого гемопексинового домена матриксной металлопротеиназы-2, крингл-домена 5 плазминогена человека, слитого белка эндостатина и ангиостатина, слитого белка эндостатина и крингл-домена 5 плазминогена человека, монокина, индуцируемого интерфероном гамма (Mig), слитого белка Mig и IP10, растворимого FLT-1 (fins-подобного тирозинкиназного рецептора 1), киназного инсерционного домен-содержащего рецептора (KDR); или
(c) цитокином, выбранным из группы, состоящей из интерлейкина 1 (IL-1), IL-2, IL-5, IL-10, IL-11, IL-12, IL-18, интерферона-γ (IF-γ), IF-α, IF-β, фактора некроза опухолей и GM-CSF (гранулоцитарно-макрофагального колониестимулирующего фактора).

Комментарии