Кристалл белка, сшитого многофункциональным сшивающим агентом (варианты), устройство, содержащее этот кристалл, и способ получения аспартама - RU2124052C1
Код документа: RU2124052C1
Чертежи

















Описание
Изобретение касается иммобилизации ферментов, а также использования иммобилизованных ферментов. В частности, изобретение касается белковых кристаллов, сшитых многофункциональным сшивающим агентом, а также устройства, содержащего этот кристалл, и способа получения аспартама, использующего сшитый белковый кристалл.
Данное изобретение выделено из заявки США Сер. N 07/562280, поданной 3 августа 1990 г., с названием "Структурированные кристаллы в качестве нового вида ферментной иммобилизации".
Ферменты используются в качестве промышленных катализаторов для широкомасштабного и лабораторного производства чистых и специальных коммерческих химикатов (Jones J.B., Tetrahedron, 42: 3351 - 3403 (C986), для производства пищевых веществ (Zaks и др., Trends in Biotechnology, 6: 272 - 275 (1988), а также в качестве средств для синтеза органических соединений (Wong, C.-H. Science 244: 1145 - 1152 (1969), Chemtrasts-Org. Chem. Res. 23: 114 - 120 (1990); Klibanov A.M., Acc. Chem. Res. 23: 114 - 120 (1990)).
Ферментативное производство может существенно уменьшить загрязнение окружающей среды снятием бремени широкомасштабного производства неиспользуемых иным образом промежуточных химикалиев, таких как нитрил-гидратаза в производстве акриламида (Nagacawa, T., и Yamada, H., Trends in Biotechology 7 : 153 - 158 (1989).
Ферменты используют также в качестве биодатчиков для обнаружения различных веществ, представляющих клинический, промышленный и проч. интерес (Hall, E. , "Biosensors", Open University Press, 1990). В области медицины ферменты могут использоваться для экстракорпоральной терапии, такой как гемодиализ и гемофильтрация, при которых ферменты селективно удаляют из крови выделяемые и токсические вещества (Klein, M., и Zanger, R., Trends in Biotechnology 4: 179 - 185 (1986). В данных областях ферменты используют потому, что они эффективно работают в качестве катализаторов многих типов реакций при умеренных температурах, при субстратной специфичности и стереоселективности. Тем не менее имеются проблемы, связанные с использованием растворимых ферментных катализаторов, которые ограничивают их применение в промышленных и лабораторных химических процессах (Akiyama и др. CHEMTECH 627 - 634 (1988)).
Ферменты являются дорогими и относительно нестабильными по сравнению с большинством промышленных и лабораторных катализаторов, даже когда их используют в водной среде, в которой ферменты обычно работают. В обычной практике многие из наиболее экономически важных химических реакций несовместимы с водной средой, в которой, например, субстраты и продукты часто нерастворимы или нестабильны и в которой может оказывать существенное влияние гидролиз. Кроме того, выделение растворимого ферментного катализатора из продукта и непрореагировавшего субстрата в сырье часто требует применения сложной и дорогой технологии сепарации. Наконец, ферменты трудно сохранять таким образом, чтобы поддерживать их активность и функциональную целостность в течение коммерчески разумных периодов времени (от месяцев до нескольких лет) без того, чтобы прибегать к их замораживанию (от 4 до -80oC и до температур жидкого азота), или трудно поддерживать в водных растворителях подходящей ионной силы, pH и т.д.
Методы ферментной иммобилизации во многих случаях обходят эти проблемы. Иммобилизация может улучшить стабильность ферментных катализаторов и защитить их функциональную целостность в грубой среде растворителя и высоких температурах, характерных для промышленных и лабораторных химических процессов (Hartmeier, W., Trends in Biotechnology 3: 149 - 153 (1985)).
Процессы непрерывного потока могут осуществляться с иммобилизованными ферментными частицами в колонах, например, где растворимое сырье проходит через эти частицы и постепенно превращается в продукт. В настоящем описании, выражение "ферментная иммобилизация" относится к переведению ферментного катализатора в нерастворимое состояние посредством его присоединения к, или инкапсуляцией, или агрегацией в макроскопические (10-1 мм) частицы.
В литературе имеется несколько полезных обзоров методов ферментной иммобилизации (Maugh, T.H. Science 223: 474 - 476 (1984), Tramper J., Trends in Biotechnology, 3: 45 - 50 (1985)). Maugh описывает пять основных подходов к иммобилизации ферментов. Они включают адсорбцию на твердых подложках (таких, как ионообменные смолы), ковалентное присоединение к подложкам (таким, как ионообменные смолы, пористые керамические или стеклянные шарики), захватывание в полимерные гели, инкапсулирование и осаждение растворимых белков посредством их структурирования с бифункциональными реагентами беспорядочным и неопределенным образом. Заявка EP-A-367302 (Соэджима и др.) описывает водорастворимую структурированную протеазу 1 Ахромобактера для ее использования в процессе полусинтезирования человеческого инсулина. EP-A-341503 (Висури) описывает водонерастворимую гликозоизомеразу, которая образована кристаллическим ферментом, превращенным в твердую форму посредством его сшивания с диальдегидом (глютаральдегидом) в присутствии аминосодержащего соединения. Кроме того, можно иммобилизовать целые клетки (обычно неживые и сделанные проницаемыми), которые проявляют желательную ферментную активность на высоком уровне (например, упомянутая на 1 стр. статья Нагасавы и Ямалы в "Тенденциях в биотехнологии" 7: 153 - 158 (1989).
Каждая из этих процедур иммобилизации имеет свои преимущества и ограничения, и ни одну из них нельзя считать оптимальной или доминирующей. В большинстве из них ферментный катализатор в конечном счете представляет собой только небольшую фракцию (часть) от общего объема материала, присутствующего в химическом реакторе. Следовательно, основная масса иммобилизованной среды выполнена из инертного, но зачастую дорогостоящего материала-носителя. Во всех из них иммобилизирующее взаимодействие молекул ферментного катализатора друг с другом и/или с материалом-носителем имеет тенденцию к неупорядоченности и неопределенности. В результате, хотя эти взаимодействия и придают некоторое увеличение стабильности молекулам ферментного катализатора, их относительная неспецифичность и нерегулярность делают эту стабилизацию неоптимальной и неравномерной. В большинстве случаев доступ к активному сайту ферментного катализатора остается неясным. Кроме того, вышеописанные иммобилизационные методы не могут решить проблем, связанных с хранением и охлаждением. Также, как правило, эти методы не могут иметь дело с обычно иммобилизуемыми (традиционными) ферментами, например при замене одного растворителя на другой выбранный растворитель, без риска повредить структурную и функциональную целостность фермента. На практике, за исключением присоединенной к ним связующей группы для связывания их с материалом-носителем традиционно иммобилизируемые ферменты имеют тесное сходство с растворимыми ферментами и разделяют вместе с ними чувствительность к денатурации и утрату функциональных свойств в грубой окружающей среде. В общем, методы иммобилизации ведут к снижению наблюдаемых скоростей катализируемых ферментами реакций по сравнению с таковыми, полученными в растворе. Это главным образом является следствием пределов внутренней диффузии субстрата и внешней (то есть направленной наружу) диффузии продукта внутри иммобилизованных ферментных частиц (Qniocho, F. A. и Richards, F.M., Biochemistry 5: 4062 - 4076 (1967)). Необходимое присутствие инертного носителя в частицах с иммобилизованным ферментом увеличивает средний свободный путь между растворителем извне частицы с иммобилизованным ферментом и активным сайтом ферментного катализатора, и этим усугубляет диффузионные проблемы. Когда имеют дело с иммобилизованными клетками, то диффузионные проблемы особенно ужесточаются, даже если клеточные стенки и мембраны сделаны проницаемыми для субстрата и продукта каким-либо образом. Далее, следует также учитывать множество побочных ферментных активностей, метоболиты и токсины, содержащиеся в клетках, а также стабильность клеток в грубых растворителях или высоких температурах рабочей среды. Совершенствование технологии иммобилизации, которое бы избегало недостатков используемых в настоящее время способов, требуется для использования ферментов в качестве промышленных катализаторов, особенно при производстве в большом масштабе (Daniels M.J., "Methods in Enzymology", 136: 371 - 379 (1987).
Изобретение касается иммобилизации фермента путем образования кристалла фермента, в общем случае посредством структурирования кристаллов многофункциональным (бифункциональным) сшивающим агентом, а именно сшитых кристаллов иммобилизованного фермента, которые далее сокращенно называются CLEC или CLIEC, устройства, содержащего такой кристалл и используемого, например, в качестве биосенсора, а также способа получения желаемого продукта (здесь - конкретно аспартама), с использованием сшитого белкового кристалла по изобретению.
По изобретению небольшие, размером 10-1 мм, кристаллы белка выращивают из водных растворов, или водных растворов, содержащих органические растворители, в которых ферментный катализатор является структурно и функционально стабильным. В предпочтительном выполнении кристаллы затем структурируют посредством бифункционального реагента, такого как глютаральдегид. Это структурирование приводит к стабилизации контактов в кристаллической решетке между отдельными молекулами ферментного катализатора, составляющими этот кристалл. В результате этой дополнительной стабилизации, структурированные кристаллы иммобилизованного фермента могут работать при повышенной температуре, крайних pH и в грубой водной, органической и почти безводной средах, включая их смеси. Иными словами, CLEC по настоящему изобретению может функционировать в средах, несовместимых с функциональной целостностью соответствующих некристаллизованных, неструктурированных, нативных ферментов или иммобилизованных традиционными методами ферментных катализаторов.
Кроме того, CLEC могут быть подвергнуты лиофилизации с получением лиофилизованных CLEC, которые могут храниться в этом лиофилизированном виде при непониженных (комнатных) температурах в течение длительных периодов времени и которые могут быть легко восстановлены в водных, органических или смешанных водно-органических растворителях по выбору, без образования аморфных суспензий и с минимальным риском денатурации.
Изобретение относится также к их использованию в лабораторном и широкомасштабном промышленном производстве желаемых веществ, таких как хиральные органические молекулы, пептиды, углеводы, жиры или другие химические вещества. В настоящее время эти вещества обычно получают традиционными химическими методами, которые могут требовать грубых условий (например, водных, органических или почти безводных растворителей, смешанных водно-органических растворителей или повышенных температур), которые несовместимы с функциональной целостностью некристаллизованных, неструктурированных, нативных ферментных катализаторов. В предлагаемую CLEC-технологию также могут быть введены другие макромолекулы с каталитической активностью. Эти молекулы могут включать каталитические антитела (Lerner, R.A., Benkovic, S.J., и Schultz, P.G. Science 252: 659-667 (1991)) и каталитические полинуклеотиды (Cech, T.R., Cell 65: 667 - 669 (1991). Celander. D. W. и Cech, T.R., Science, 251: 401 - 407 (1991)).
Изобретение также относится к способу изготовления выбранного продукта посредством реакции, катализованной CLEC по настоящему изобретению.
В практическом примере выполнения способа по настоящему изобретению фермент термолизин, -цинк-металлопротеазу-, использовали для синтезирования хирального предшественника дипептидильного искусственного подсластителя - аспартама. Фермент термолизин кристаллизовали из исходного водного раствора, состоящего из 45% диметилсульфоксида и 55% 1,4 М ацетата кальция, 0,05М накодилата натрия с pH 6,5. Полученные кристаллы структурировали глютаральдегидом с образованием CLEC термолизина. CLEC термолизина затем переносили из водного кристаллизационного раствора, в котором они изготавливались, в раствор этилацетата, содержащий субстраты, -N-/бензилоксикарбонил/-L-аспартовую кислоту Z-(L-Asp) и L-фенилаланин метиловый эфир (L-Phe)-OMe. CLEC термолизина затем использовали для катализирования реакции конденсации двух субстратов для синтезирования N-/бензилоксикарбонил/-L-аспартил-L-фенилаланин метилового эфира Z-(L-Asp)-(L-Phe)-OMe, который является дипептидильным предшественником искусственного подсластителя - аспартама. С использованием одной из многих известных технологий (см. например, Lindeberg, G. J. Chem. Ed. 64: 1062 - 1064 (1987)). L-аспартовая кислота в синтезированном дипептидильном предшественнике может быть лишена защиты путем удаления бензилоксикарбонильной (Z-) группы для получения аспартама (L-Asp)-(L-Phe)-OMe.
Во втором примере практического выполнения настоящего изобретения фермент термолизин использовали для получения CLEC термолизина. Активность и стабильность CLEC термолизина сравнивали с этими характеристиками растворимого термолизина при оптимальных условиях, а также при условиях экстремальных pH и температуры, с последующей инкубацией в присутствии органических растворителей и последующей инкубацией в присутствии экзогенной протеазы.
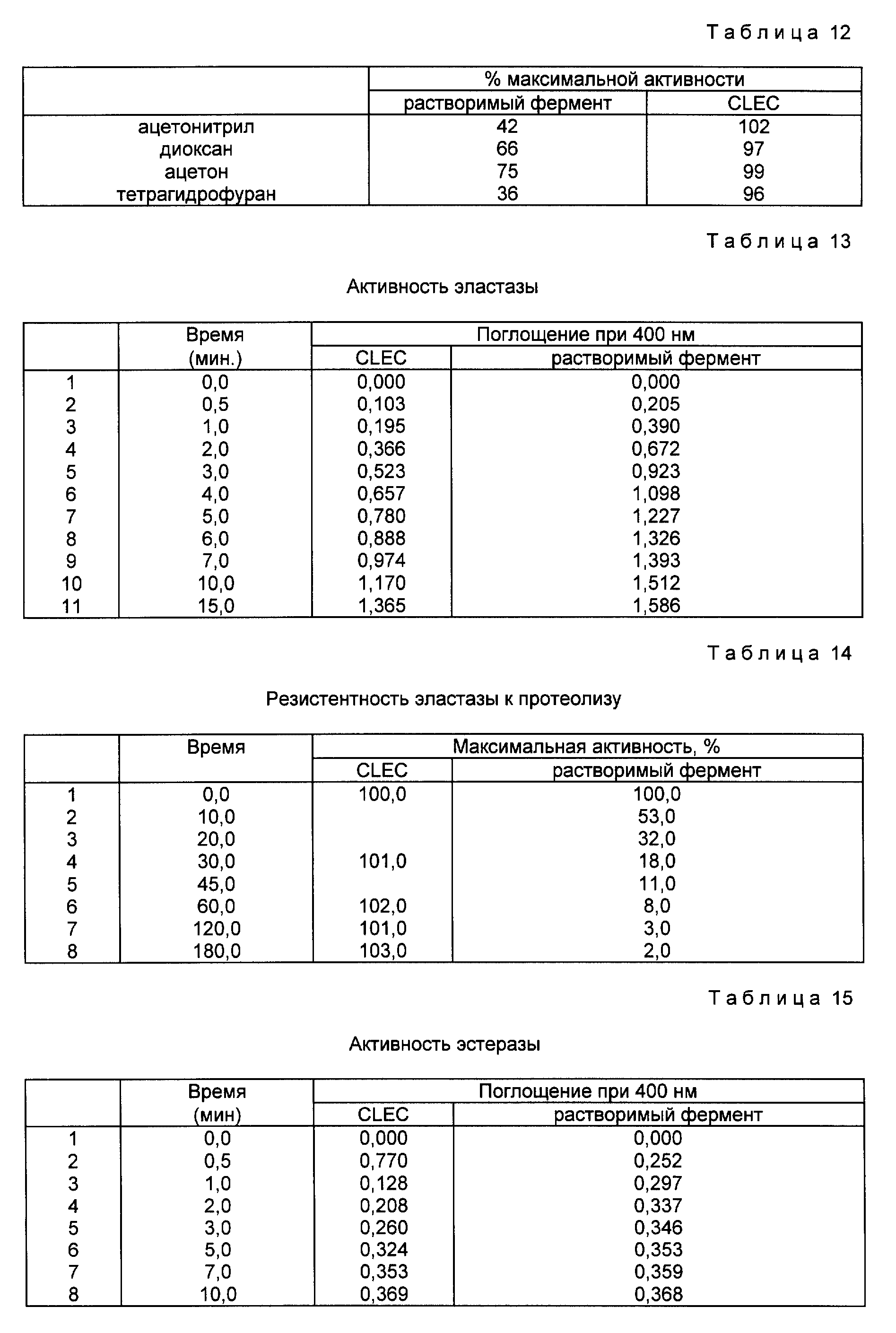
Фермент термолизин кристаллизовали из раствора 1,2 M ацетата кальция и 30% диметил-сульфоксида, с pH 8.0. Полученные кристаллы структурировали глютаральдегидом при концентрации 12,5% с образованием CLEC термолизина. CLEC термолизина затем лиофилизировали стандартной процедурой (Cooper, T.G., The Tools of Biochemistry. стр. 379 - 380 (изд. Джон Уилей и Сыновья, Нью-Йорк, 1977) с образованием лиофилизированного фермента CLEC термолизина. Этот лиофилизированный CLEC трансформировали непосредственно в различных водных, органических и смешанных водно-органических растворителях по выбору, без промежуточной процедуры замены растворителя, без образования аморфных суспензий, и с минимальным риском денатурации. Эти растворители включают ацетонитрил, диоксан, ацетон и тетрагидрофуран, но не отключая и другие. После инкубирования активность исследовали спектрофотометрически посредством расщепления дипептидного субстрата FAGIA (фурилакрилоил-глицил-L-лейцин-амид).
В третьем примере практического выполнения изобретения фермент эластазу (из свиной поджелудочной железы) кристаллизовали из водного раствора 5,5 мг/мл белка в 0,1 М натрий-ацетата с pH 5,0 при комнатной температуре (Сойер Л. и др. Ж. Мол. Биол. 118: 137 - 208). Полученные кристаллы структурировали глютаральдегидом с концентрацией 5% для образования CLEC эластазы. CLEC эластазы лиофилизировали, как описано в примере 2.
В четвертом примере практического выполнения настоящего изобретения, как раскрыто здесь, фермент эстеразу (свиная печень) кристаллизовали из водного раствора 15 мг/мл белка в 0,25 М ацетата кальция с pH 5,6 при комнатной температуре. Полученные кристаллы структурировали глютаральдегидом с концентрацией 12,5% для образования CLEC эстеразы. CLEC эстеразу лиофилизировали, как описано в примере 2.
В пятом примере раскрытого здесь практического выполнения настоящего изобретения фермент липазу (Geotrichum candidum) кристаллизовали из водного раствора 20 мг/мл белка в 50 мМ Трис с pH 7 при комнатной температуре. Полученные кристаллы структурировали глютаральдегидом с концентрацией 12,5% с образованием CLEC липазы. CLEC липазы лиофилизировали как описано в примере 2.
В шестом примере практического выполнения настоящего изобретения фермент лизоцим (белок куриного яйца) кристаллизовали из водного раствора 40 мг/мл белка в 40 мМ натрий-ацетатного буфера, содержащего 5% натрия хлорида с pH 7,4 при комнатной температуре (Blake, C. C. F. и др., Nature 196: 1173 (1962)). Полученные кристаллы структурировали глютаральдегидом с концентрацией 20% для образования CLEC лизоцима. CLEC лизоцима лиофилизировали, как описано в примере 2.
В седьмом примере практического выполнения настоящего изобретения фермент аспарагиназу (Escherichia сoli) кристаллизовали из водного раствора 25 мг/мл белка в 50 мМ натрия ацетата и 33% этанола с pH 5,0 при 4oC. Эта кристаллизация является модификацией процедуры, описанной Грабнером и др. в патенте США N 3664926 (1972). Как раскрыто здесь, полученные кристаллы структурировали глютаральдегидом концентрации 7,5% с получением CLEC аспарагиназы. CLEC аспарагиназы лиофилизировали, как описано в примере 2.
Другие ферменты, которые могут иммобилизироваться подобным образом и использоваться в качестве катализаторов в соответствующей реакции, включают люциферазу и уреазу. Другие ферменты, такие как перечисленные в таблицах 1-5, также могут быть кристаллизованы и структурированы с использованием настоящего способа, с получением желательных CLEC, которые могут быть, в свою очередь, использованы для катализа реакции, которая приводит к получению требуемого продукта или для катализа реакции, являющейся промежуточной стадией (то есть одной реакцией в ряде секций) в производстве выбранного продукта. Признано, что хотя структурирование способствует стабилизированию большинства кристаллов, оно не во всех случаях является необходимым или желательным. Некоторые кристаллические ферменты сохраняют свою функциональную и структурную целостность в грубых условиях окружающей среды даже при отсутствии структурирования. Хотя в предпочтительном выполнении кристалл является структурированным, структурирование не всегда необходимо для получения ферментного кристалла, используемого по настоящему способу.
CLEC-ферменты имеют несколько ключевых характеристик, которые сообщают им существенные преимущества над традиционными методами иммобилизации ферментов, используемыми в настоящее время. CLEC не нуждаются в отдельной инертной подложке. Отсутствие инертной подложки улучшит диффузию субстрата и продукта внутри CLEC и обеспечит внутри кристалла концентрацию фермента, близкую к теоретическому пределу загрузки для молекул такого размера. Высокие концентрации фермента могут привести к значительной рабочей экономии благодаря повышенной эффективной активности данного объема катализатора, снижению времени контакта субстрата с ферментом и общему уменьшению размера завода и капиталовложений (Daniels, M.J., Methods in Enzymol. 136: 371 - 379 (1987)). Равномерное распределение по объему кристалла и повышенная стабильность составляющего его фермента в CLEC создают новые возможности применения ферментных катализаторов в сложных условиях, таких как повышенная температура, а водные, органические и почти безводные растворители, а также их смеси. Кроме того, ограниченный доступ растворителя и постоянное белковое окружение в кристаллической решетке должно привести к улучшенному удержанию металлических ионов и ко-факторов CLEC по сравнению с традиционными системами иммобилизованных ферментов.
Фиг. 1 графически представляет результаты оценки ферментной активности растворимого термолизина и CLEC термолизина.
Фиг. 2 графически представляет результаты сравнения зависимостей pH CLEC термолизина и растворимого термолизина.
Фиг. 3 графически представляет измерения активности растворимого и кристаллического термолизина после инкубирования при 65oC.
Фиг. 4 графически представляет результаты оценки сопротивления растворимого и CLEC термолизина внешней протеолитической деградации.
Фиг. 5 графически представляет результаты оценки ферментной активности для растворимой эластазы и соответствующей CLEC -эластазы.
Фиг. 6 графически представляет сопротивление растворимой эластазы и соответствующей CLEC -эластазы внешней (экзогенной) протеолитической деградации.
Фиг. 7 графически представляет результаты оценки ферментной активности для растворимой эстеразы и соответствующей CLEC-эстеразы.
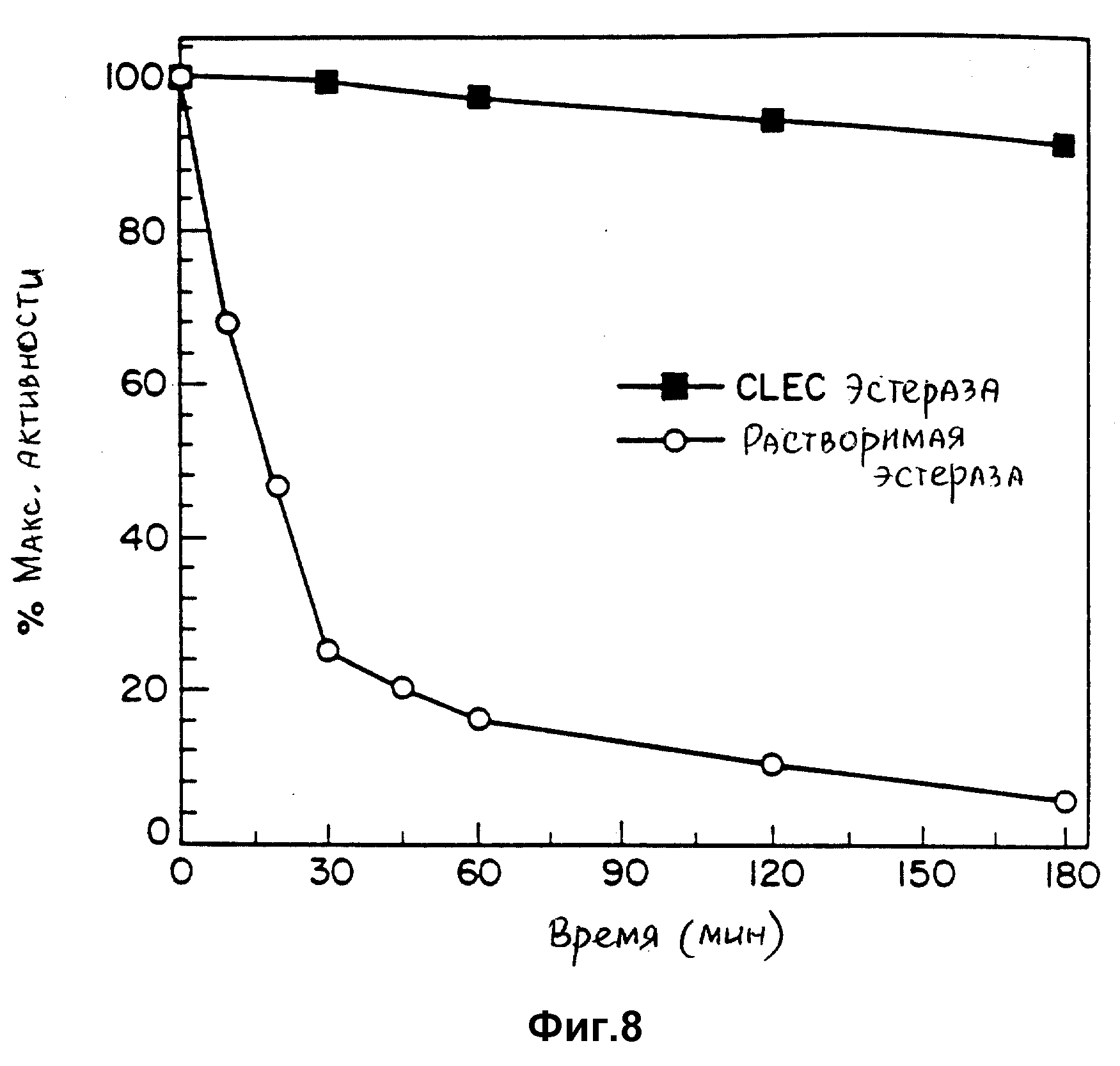
Фиг. 8 графически представляет сопротивляемость растворимой эстеразы и соответствующей CLEC-эстеразы экзогенной протеолитической деградации.
Фиг. 9 графически представляет результаты оценки ферментной активности для растворимой липазы и соответствующей CLEC-липазы.
Фиг. 10 графически представляет результаты оценки ферментной активности растворимого лизоцима и соответствующего CLEC-лизоцима.
Фиг. 11 графически представляет результаты оценки ферментной активности растворимой аспарагиназы и соответствующей CLEC-аспарагиназы.
Очень полезной была бы простая, общая процедура, обеспечивающая стабильность и функционирование конкретного фермента или их набора при условиях, представляющих интерес для химика, занимающегося синтезом, и которые чересчур грубы для использования с ферментами по известным до сих пор методам. Структурированные кристаллы иммобилизованных ферментов (упоминаемые как CLEC или CLIEC), как описано здесь, могут использоваться для этой цели. Стабилизация кристаллической решетки и составляющих ее ферментных катализаторов в кристалле путем структурирующей реакции позволяет использовать CLEC в таких средах, как водные, органические или почти безводные растворители, смеси этих растворителей, крайних значениях pH и повышенных температурах, которые несовместимы с функционированием ферментов, полученных традиционными методами. Кроме того, стабилизирование кристаллической решетки в CLEC позволяет осуществлять лиофилизацию CLEC стандартными методами. Лиофилизированные CLEC могут храниться в течение коммерчески привлекательных периодов времени (от месяцев до лет) в отсутствие охлаждения, и способствуют быстрому и простому использованию CLEC в процессах лабораторного и промышленного масштаба посредством простого добавления желаемых растворителей, без необходимости промежуточных процедур замены растворителей. CLEC также обладают высокой резистентностью к их перевариванию экзогенными протеазами. Способ по настоящему изобретению облегчает применение универсальных ферментных катализаторов в основных промышленных химических процессах, а также в лабораторном синтезе новых соединений для исследований.
Хотя структурирование повышает стабильность кристаллического фермента, оно не является необходимым или желательным во всех случаях. Некоторые кристаллические ферменты сохраняют свою функциональную и структурную целостность в тяжелых условиях даже при отсутствии структурирования. Предпочтительное выполнение настоящего изобретения предусматривает структурирование кристаллического фермента и подробно описано в следующих разделах. Однако следует понимать, что кристаллические ферменты, не структурированные в последующем, также могут использовать в некоторых выполнениях настоящего изобретения.
Регулярные взаимодействия между составляющими ферментными молекулами в кристаллической решетке CLEC приводят к хорошо определенным порам ограниченного размера, ведущим к ферментным молекулам внутри тела CLEC. В результате субстраты большего размера, чем размер пор, не смогут проникнуть в тело CLEC частицы.
Как следствие ограниченного размера пор, многие ферментативные реакции, представляющие коммерческий и научный интерес, включающие субстраты больше размера пор CLEC, будут находиться вне объема настоящего изобретения. Они могут включать большинство реакций с использованием крупных полимеров, таких как белки, полинуклеотиды, полисахариды и другие органические полимеры, а также другие органические полимеры, у которых количество полимерных субъединиц будет таким, что полимер станет больше размера пор CLEC. В таких примерах, однако, катализ все-таки будет иметь место на поверхности CLEC.
Настоящим изобретением является способ иммобилизации выбранного белка, в частности фермента, путем кристаллизации и структурирования этого белка, приводящим к производству структурированного кристалла иммобилизованного фермента (CLEC), который может использоваться для катализного производства желаемого продукта, такого как пептид, углевод, липид или хиральная органическая молекула. Настоящее изобретение далее качается таких CLEC, а также способа изготовления выбранного продукта посредством CLEC - катализированной реакции или CLEC - катализированной стадии в серии реакций. В одном из выполнений настоящего изобретения дипептидильный предшественник аспартама был получен в реакции конденсации, катализированной посредством структурированного иммобилизированного термолизина, полученного по настоящему способу. В другом выполнении изобретения индикаторный субстрат, FAGLA, расщепили с получением колориметрического продукта, присутствие которого указывает на ферментативную активность у CLEC - термолизина. FAGLA - гидролиз использовали в качестве модельной реакции для установления устойчивости CLEC - термолизина в некоторых средах, которые обычно несовместимы с активностью этого фермента.
В других выполнениях настоящего изобретения ферменты эластаза, эстераза, липаза, аспарагиназа и лизоцим использовали для расщепления различных указанных веществ, таких как p-нитрофенил ацетат (эстеразой и липазой), сукцинил-(ала)-3-p-нитроанилид (эластазой), 4-метилумбеллиферил N-ацетил-хитриозида (лизоцимом) и NADH (аспарагиназой).
Используя способ по настоящему изобретению, средний специалист в данной области может приспособить протокол способа для изготовления желаемого продукта с помощью реакции, катализируемой иммобилизированным ферментом. Интересующий фермент, будучи кристаллизован из подходящего раствора, может быть структурирован глютаральдегидом или другим пригодным бифункциональным реагентом в кристаллизационном растворе для получения CLEC этого фермента. В последующем CLEC фермента может быть лиофилизирован, как описано в примере 2.
Использование CLEC предлагает несколько преимуществ по сравнению с доступными в настоящее время методами ферментативного катализа. Например, структурированная кристаллическая матрица CLEC обеспечивает ему свою собственную опору. Чтобы связать ферментный катализатор, дорогие носители - шарики, стекла, гели и пленки, - как в известных методах иммобилизации, теперь не нужны. В результате концентрация фермента в CLEC близка к теоретическому пределу загрузки, который может быть достигнут для молекул данного размера, значительно превышающих плотности, доступные даже в концентрированных растворах. Весь CLEC состоит из активного фермента (а не нейтрального носителя), и таким образом, связанное с ухудшением диффузии снижение скорости ферментативной реакции, обычно наблюдаемое с ферментами, иммобилизированными традиционными методами по сравнению с ферментами в растворе, будет сведено до минимума, поскольку средний размер свободного пути для субстрата и продукта между активным ферментом и свободным растворителем будет в значительной степени сокращен для CLEC (по сравнению с ферментом, иммобилизованными традиционными методами на частицах носителях). Эти высокие плотности белка будут особенно полезны в биодатчиках, при аналитических и других применениях, требующих больших количеств белка в малом объеме. В промышленных процессах превосходящая производительность и компактность CLEC приводит к значительным производственным экономиям посредством повышения эффективной активности данного объема катализатора, позволяя при этом уменьшить размер завода, а также капиталовложения (Daniels, M.J. Methods in Enzymol. 136:371-379 (1987). CLEC - ферменты являются относительно монодисперсными, микроскопического размера и с формой, отражающей естественные характеристики роста кристалла отдельного ферментного катализатора. Замена имеющейся среды иммобилизированного на носителе фермента на CLEC - ферменты не вызовет затруднений, поскольку обе системы сравнимы по размеру и форме, и обе могут быть аналогичным образом восстановлены из сырья путем любого количества простых методов, включая основные применяемые экономичные процедуры, такие как фильтрование, центрифугирование, декантация растворителя и др.
Кроме того, использование лиофилизированных CLEC - ферментов позволяют простое обращение и хранение этих материалов перед их использованием (сухое хранение при комнатной температуре без охлаждения в течение продолжительных периодов времени). Лиофилизированные CLEC - ферменты также обеспечивают простое составление рецептур путем непосредственного добавления растворителей и субстратов, представляющих интерес, без длительных процедур замены растворителей или образования аморфных суспензий. Лиофилизированная форма CLEC расширяет область общего применения ферментов в качестве катализаторов до более широкого спектра ферментов и условий их функционирования.
Вторым преимуществом CLEC является то, что структурирование кристаллизированного фермента стабилизирует и укрепляет кристаллическую решетку и составляющие ферментные молекулы, как механически, так и химически. В результате, CLEC может быть единственным средством достижения значительных концентраций активного ферментного катализатора в тяжелых условиях водных, органических, почти безводных растворителей или в смесях водно-органических растворителей. Использование ферментов в качестве катализаторов в реакциях органического синтеза было затруднительно вследствие их тенденции к денатурации в присутствии неводных растворителей, и особенно, в смесях водных и неводных растворителей (Klibanov, A.M., Trends in Biochemical Sciences, 14: 141-144 (1989)). У CLEC - ферментов ограничение конформационной мобильности, приводящей к стабильности, обеспечивается посредством межмолекулярных контактов и поперечных связей между составляющих ферментных молекул, создавая ферментную кристаллическую решетку, а не вследствие почти полного отсутствия воды в среде. В результате промежуточные концентрации воды могут переноситься (выдерживаться) ферментами, составленными в виде CLEC, что ранее было невозможно (см. табл. 12). В коммерческих применениях водно-органические смеси растворителей позволяют манипулировать образованием продукта посредством использования преимуществ относительной растворимости продуктов и субстратов. Даже в водных средах ферментные катализаторы, иммобилизированные или растворимые, подвергаются в химическом реакторе механическим усилиям, которые могут приводить к денатурации и сокращению их полупериода разложения. Химические поперечные связи внутри CLEC - ферментов обеспечивают необходимую механическую прочность (Quiocho u Richards, Proc. Natl. Acad. Sci (США) 52: 833-839 (1964)), что приводит к повышению срока работы в реакторе ферментного катализатора.
Третье преимущество CLEC происходит из его кристаллической природы, и состоит в том, что CLEC может достичь однородности по всему объему структурированного кристалла. Описанные здесь кристаллические ферменты выращивают и структурируют в водной среде, и поэтому расположение (порядок) молекул внутри кристаллической решетки остается правильным и равномерным. Эта равномерность поддерживается межмолекулярными контактами и химическими поперечными связями между молекулами фермента, составляющими кристаллическую решетку, даже когда осуществляют перенос в другую водную, органическую или почти безводную среду, или смешанные водные/органические растворители. Во всех этих растворителях молекулы фермента поддерживают равномерную дистанцию друг от друга, образуя хорошо определенные стабильные поры в кристаллах CLEC, которые облегчают доступ субстрата к ферментному катализатору, а также удаление продукта. Постоянство ферментативной активности является крайне важным (критическим) условием для промышленных, медицинских и аналитических применений, когда первостепенное значение имеют воспроизводимость и постоянство результата.
Четвертым преимуществом использования CLEC является то, что кристаллический фермент проявляет повышенный срок работы и хранения. Решеточные взаимодействия даже в отсутствие поперечных связей, как известно, стабилизируют белки отчасти благодаря ограничению конформационнных степеней свободы, необходимых для денатурации белка. В CLEC - ферментах взаимодействия в решетке, будучи фиксированными химическими поперечными связями, особенно важны для предотвращения ненатурации, особенно в смесях водных и безводных растворителей (Klibanov, A. M., Trends in Biochemical Sciences 14: 141-144 (1989). Ферменты, находившиеся в кристаллическом состоянии месяцы и годы, обычно сохраняют высокий процент их каталитической активности. Структурированные кристаллы иммобилизированного фермента, сохраняемые в безводных растворителях, будут еще больше защищены от микробиального загрязнения и повреждения, что является серьезной проблемой при хранении больших количеств белка в водной среде, богатой питательными веществами. В случае лиофилизированного CLEC - фермента он хранится в отсутствии растворителя. Это, а также стабилизация, достигнутая структурированием, позволяет осуществлять хранение без охлаждения в течение длительных периодов времени.
Пятым преимуществом использования CLEC является то, что он проявляет повышенную температурную стабильность вследствие поперечных связей, стабилизирующих кристаллическую решетку. Проведение реакций при более высоких температурах, чем используемые при традиционных методах, повысит скорости химических реакций, представляющих интерес, как термодинамически, так и ввиду повышения скорости диффузии вещества в и из кристаллической решетки CLEC. В сочетании эти эффекты представляют значительное улучшение эффективности реакции, потому что они могут увеличить до максимума производительность данного количества ферментного катализатора, который как правило является наиболее дорогостоящим компонентом реакционного процесса (Daniels, M.J. Methods in Enzymol. 136:371-379 (1987)). Температурная стабильность CLEC - ферментов значительна вследствие того, что большинство ферментных систем требует мягких условий реакции. CLEC - ферменты будут также стабилизированы против денатурации при временном повышении температуры при хранении.
Последним преимуществом использования CLEC является то, что в нижележащей кристаллической решетке между отдельными ферментными молекулами образованы поры правильного размера и формы. Это ограничение доступа растворителя существенно повышает характеристики удерживаемости CLEC - ферментами ионов металла и ко-фактора по сравнению с традиционными иммобилизированными ферментами и ферментами в растворе. Это свойство CLEC позволит использовать более выгодные экономически процессы непрерывного потока (см., например, Оуaма и др. Methods in Enzymol. 136: 503-516 (1987)) в ситуациях, когда ферменты иначе были бы инактивированы посредством утечки иона металла или кофактора. Например, в осуществляемом с помощью термолизина синтезе дипептидильного предшественника аспартама - Z - L - Asp - L - Phe - OMe известно, что традиционно иммобилизированный фермент теряет каталитическую активность в процессах постоянного потока, проходящих в колоннах, отчасти вследствие утечки ионов кальция, необходимых для активности фермента термолизина. На практике, утечка ионов кальция приводит к тому, что приходится использовать менее эффективные периодические процессы (Наканиши и др., Биотехнология, 3: 459-464 (1985)). Утечка происходит, когда комплексы ионов кальция образованы субстратом Z - L - Asp, в конкуренции с природными сайтами связывания кальция на поверхности фермента, приводящей к потере каталитической активности. Высокая плотность фермента в кристаллах CLEC и соответственно ограниченное пространство, доступное для растворителя в промежуточных пустотах кристаллов, мешает образованию конкурирующих L - Asp - Ca++ комплексов, ответственных за утечку ионов металла.
CLEC - кристаллизация фермента
Кристалл
иммобилизованного фермента (CLEC) приготавливают следующим образом.
Кристаллы фермента выращивают путем контролируемого осаждения белка из водного раствора, или из водного раствора, содержащего органические растворители. Условия, подлежащие контролю, включают, например, скорость выпаривания растворителя, присутствие соответствующих растворенных веществ и буферов, в также pH и температуру. Подробный обзор различных факторов, затрагивающих кристаллизацию белков, был опубликован МакФерсоном в Methods Enzymol. 114: 112 (1985). Кроме того, и МакФерсон, и Гиллиланд (см. J. Cristal Growth 90: 51-59 (1988)) составили обширные списки всех белков и нуклеиновых кислот, о которых сообщалось как о кристаллизуемых, а также условия, ведущие к их кристаллизации. Коллекция кристаллов и рецептов кристаллизации, а также хранилище данных о растворимых белках и нуклеиновых кристаллических структурах содержится в Белковом Банке Данных (Protein Data Bank, см. Bernstein и др. , J. Mol. Biol. 112: 535-542 (1977) в Брукхэвенской национальной лаборатории. Эти ссылки могут быть использованы для установления условий, необходимых для кристаллизации данного белка или ранее кристаллизованного фермента, в качестве предпосылки для образования соответствующего CLEC, и могут дать указания по составлению кристаллизационной стратегии для белков, которые ранее не кристаллизовались. Альтернативно, во многих случаях, продуманная стратегия поиска путем проб и ошибок (см., например, Картер и Картер, J. Biol.Chem. 254: 12219-12223 (1979)) может дать подходящие условия кристаллизации большинства белков, включая, но не только, белки, обсуждавшиеся выше, при том условии, что для них может быть достигнута приемлемая степень чистоты. Требуемая степень чистоты может значительно различаться у разных белков. В случае лизоцима, например, фермент кристаллизовали непосредственно из его неочищенного источника - белка куриного яйца (Гиллиланд, J. Cristal Growth 90: 51-59 (1988).
Для использования в качестве CLEC в способе по настоящему изобретению не требуются крупные отдельные кристаллы, которые необходимы для дифракции рентгеновских лучей, а фактически могут быть нежелательны вследствие диффузионных проблем, связанных с размером кристалла. Мелкокристаллические материалы (с кристаллами порядка 10-1 мм размера в поперечном сечении) пригодны для CLEC и часто наблюдались, хотя о них редко сообщалось в литературе по рентгеновской кристаллографии. Микрокристаллы очень полезны в способе по настоящему изобретению для сведения к минимуму проблем, связанных с диффузией (см. , например, Quiocho F. A. и Richards F.M., Biochemistry 5: 4062-4076 (1967).
В общем кристаллы получают путем соединения белка, подлежащего кристаллизации, с соответствующим водным растворителем или водным растворителем, содержащим осадители (приципитирующие агенты), такие как соли или органические вещества. Растворитель соединяют с белком при температуре, которую определяют экспериментально, чтобы она подходила для вызывания кристаллизации и была приемлемой для поддержания стабильности и активности белка. Растворитель по желанию может включать дополнительные растворенные вещества, такие как двухвалентные катионы, ко-факторы и хаотропы, а также виды буферов для контролирования уровня pH. Необходимость дополнительно (совместно) растворенных веществ и их концентрации определяют экспериментально для того, чтобы облегчить кристаллизацию. В процессе промышленного масштаба, контролируемое осаждение (преципитация), ведущее к кристаллизации, лучше всего проводить путем простого соединения белка, осадителя, растворенных веществ и, возможно, буферов в периодическом процессе. Также могут быть приспособлены альтернативные лабораторные методы кристаллизации, такие как диализ или паровая диффузия. МакФерсон (Methods Enzymol. 114: 112 (1985)) и Гиллиланд (J. Cristal Growth. 90: 51-59(1988)) включают в свои обзоры в литературе по кристаллизации подробные списки пригодных параметров. В некоторых случаях несовместимость между сшивающим реагентом и средой для кристаллизации может потребовать перенос кристаллов в более подходящую систему растворителя.
Многие из белков, для которых ранее уже были описаны условия кристаллизации, обладают значительным потенциалом в качестве практических ферментных катализаторов в промышленных и лабораторных химических процессах, и непосредственно относятся к веществам типа CLEC в объеме настоящего изобретения. Табл. 1 представляет образцы ферментов, которые уже кристаллизовали ранее. Следует заметить, что условия, сообщаемые в большинстве из этих ссылок, были оптимизированы для выращивания крупных кристаллов дифракционного качества, часто с большим трудом. В некоторых случаях для изготовления меньших кристаллов для получения CLEC необходима некоторая подгонка параметров.
Получение CLEC - реакция
структурирования
Если кристаллы выращивали в подходящей среде, то они могут быть структурированы. Структурирование приводит к стабилизации кристаллической решетки посредством введения в нее
ковалентных связей между составляющими кристалл молекулами фермента. Это позволяет осуществлять перенос фермента в другую реакционную среду, которая иначе была не несовместимой с существованием
кристаллической решетки, или даже с существованием интактного нативного белка. Структурирование может быть достигнуто с помощью большого разнообразия бифункциональных реагентов, хотя на практике был
выбран недорогой реагент - глютаральдегид.
(С целью ознакомления со списком представителей доступных структурирующих реагентов, см., например, каталог 1990 г. компании Pierce Chemical.).
Структурирование с помощью глютаральдегида образует сильные ковалентные связи, в первую очередь, между лизиновыми аминокислотными остатками и между молекулами фермента в кристаллической решетке, составляющей кристалл. Структурные взаимодействия предотвращают обратный выход в раствор составляющих кристалл молекул фермента, эффективно иммобилизуя (или делая нерастворимыми) молекулы фермента в микрокристаллических частицах (в идеале размером 10-1). Эти макроскопические, иммобилизованные, нерастворимые кристаллы могут затем легко отделяться от сырья и непрореагировавшего субстрата посредством простых приемов, таких как фильтрование, декантация и др. Эти кристаллы также могут использоваться в колоннах, заполняемых CLEC в непрерывных поточных процессах, в которых они демонстрируют улучшенные свойства удерживать металлические ионы и ко-факторы.
CLEC - ферменты получают с целью их использования в качестве ферментных катализаторов в известных и новых средах. Повышенная стабильность CLEC-ферментов, происходящая от реакции структурирования, позволяет переносить CLEC в растворитель (например, водный, органический или почти безводный, или в их смесь), который иначе был бы несовместимым с этим ферментом, и проводить химические процессы в реакторе при высоких температурах и экстремальном pH. Макроскопические частицы CLEC - катализаторы позволяют легко с ними обращаться, восстанавливать их из сырья простыми методами, такими как фильтрование, центрифугирование или декантация растворителя. Кроме того, они могут использоваться для заполнения колонн непрерывных химических процессов.
Получение CLEC - лиофилизация
Суспензию одного объема структурированных кристаллов термолизина в десяти
объемах деминерализованной воды при pH 7,0 лиофилизировали до утра с использованием лиофилизатора ВирТис (VirTir) Модель # 24. Лиофилизированные кристаллы хранили при комнатной температуре или при
4oC перед их реконституцией (восстановлением содержания жидкости), которую осуществляли посредством добавления десяти объемов выбранного растворителя непосредственно на кристаллы, взятые
после хранения. Регидратированные кристаллы восстанавливали в 10 мМ кальциево-ацетатном буфере с pH 7,0 для экспериментов по FAGLA - расщеплению. Восстановленные лиофилизированные кристаллы обычно
хранили при комнатной температуре. Напротив, растворимый фермент требует хранения при -70oC для поддержания его специфичной активности в течение периода, превышающего неделю. Этот порядок
(протокол) использовали для всех ферментов, описанных в нижеприводимых примерах, включенных в описание.
Синтез предшественника аспартама с помощью CLEC - термолизина
Способ по
настоящему изобретению, согласно которому получают структурированные кристаллические ферменты, описывается далее на примерах производства структурированных кристаллов иммобилизованного термолизина для
использования в процессе получения дипептидильного предшественника аспартама в среде этил-ацетата, который является почти безводным растворителем. Термолизин - белок, который был кристаллизован ранее,
и структура которого была разрешена при

Оценка CLEC-термолизина
Вышеописанные процедуры использовали для получения CLEC-термолизина, которые оценивали в отношении их pH-зависимости и
стабильности, стабильности при повышенных температурах, резистентности к экзогенному протеолизу и стабильности в присутствии органического растворителя. CLEC-термолизина сравнивали с растворимым
термолизином, как подробно описано в примере 2 и на фиг. 1-4. Результаты оценки показали следующее.
1. Что касается pH-зависимости и стабильности, обе формы продемонстрировали максимальную активность при pH 7 и продемонстрировали аналогичную активность в кислом диапазоне. В щелочном диапазоне CLEC сохраняет свою максимальную активность до pH 10; растворимый термолизин обладает 75%-ной активностью при pH 8,5, только 25%-ной активностью при pH 9, и неактивен совершенно - при pH 9,5.
2. Дополнительная стабилизация, достигнутая у CLEC-фермента, приводит к ферментативной активности при более высоких температурах, чем это возможно с растворимым термолизином. Повышенная стабильность CLEC-термолизина при более низких температурах позволяет упростить его хранение по сравнению с хранением растворимого фермента. Температурная стабильность и резистентность к автолизу были также продемонстрированы для CLEC-термолизина, кристаллы которого сохраняли максимальную активность через пять после их инкубирования при 65oC. Напротив, растворимый термолизин утратил 50% своей активности через 2 часа инкубирования и продемонстрировал незначительную активность через 24 часа инкубирования при 65oC.
3. Ферментативная активность CLEC термолизина осталась без изменений после четырехдневного инкубирования в присутствии мощной стрептококковой протеазы - Проназы. Напротив, растворимый термолизин быстро деградировал и утратил всю свою активность через 90 минут такой инкубации.
4. CLEC-термолизин и растворимый термолизин продемонстрировали заметно различную стабильность в присутствии органических растворителей, как показано в табл. 12. CLEC термолизина сохранили более чем 95% своей максимальной активности после инкубирования со всеми органическими растворителями, с которыми проводилась оценка.
Эти характеристики CLEC термолизина и других ферментов делают их особенно полезными, поскольку их легче хранить, они более стабильны и труднее теряют активность или деградируют, чем соответствующие растворимые ферменты.
Оценка CLEC-эластазы
Также получали CLEC-эластазу, которую оценивали в отношении ее активности и резистентности к экзогенному протеолизу. CLEC-ферменты эластазы сравнивали с растворимой эластазой, как описано подробно в
примере 3 и на фиг. 5 и 6. Результаты оценки продемонстрировали следующее.
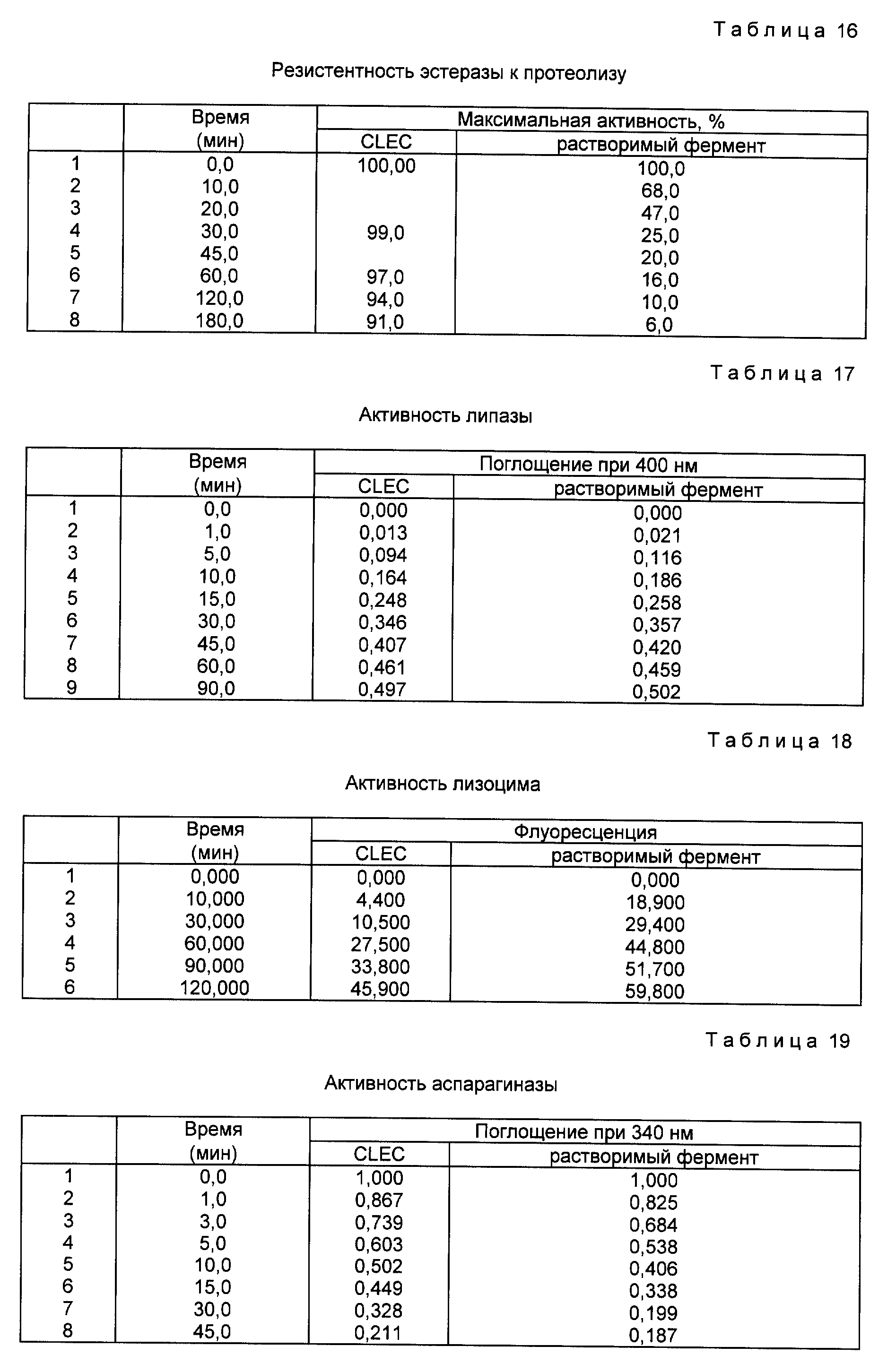
1. CLEC-эластаза сохраняет приблизительно 50% активности по сравнению с растворимым ферментом.
2. Растворимая эластаза быстро разрушалась протеазой. Активность растворимой эластазы была снижена до 50% исходной активности после 10 минут инкубирования в присутствии протеазы. Через час инкубирования растворимый фермент утратил более 90% своей первоначальной активности. Напротив, ферментативная активность эластазных структурированных кристаллов осталась незатронутой инкубированием с протеазой.
Оценка CLEC-эстеразы
Также получали CLEC-эластазу, которую оценивали в отношении ее активности и резистентности к экзогенному протеолизу. CLEC-эстеразу сравнивали с
растворимой эстеразой, как детально описано в примере 4 и табл. 7 и 8. Результаты оценки продемонстрировали следующее.
1. CLEC-эстераза сохраняет примерно 50% активности по сравнению с растворимым ферментом.
2. Растворимая эстераза была высокочувствительной к протеолитической деградации. Активность растворимой эстеразы снизилась до 50% исходной активности через десять минут инкубирования в присутствии протеазы. После часа инкубирования растворимого фермента он утратил более 90% исходной активности. Напротив, ферментативная активность CLEC-эстеразы не пострадала от инкубирования в присутствии протеазы.
Оценка CLEC-липазы
Также получали CLEC-липазу, которую оценивали в отношении ее активности, CLEC-липазу сравнивали с
растворимой липазой, как детально описано в примере 5 и на фиг. 9. Результаты этой оценки продемонстрировали, что CLEC-липаза сохраняет приблизительно 90% активности по сравнению с растворимой
липазой.
Оценка CLEC-лизоцима
Также получали CLEC-лизоцим, который оценивали в отношении его активности и резистентности к экзогенному протеолизу. CLEC-лизоцим сравнивали с
растворимым лизоцимом, как детально описано в примере 6 и на фиг. 10. Результаты этой оценки продемонстрировали, что CLEC-лизоцим сохраняет приблизительно 50% активности по сравнению с растворимым
ферментом.
Оценка CLEC-аспарагиназы
Также получали CLEC-аспарагиназу, которую оценивали в отношении ее активности. CLEC-аспарагиназу сравнивали с растворимой аспарагиназой,
как детально описано в примере 7 и на фиг. 11. Результаты оценки продемонстрировали следующее: CLEC-аспарагиназа сохраняла приблизительно 77% активности по сравнению с растворимым ферментом.
Общая применимость CLEC-ферментов
Как раскрыто в настоящем описании, CLEC-ферменты представляют собой новую технологию с широким применением во многих областях, включая, но не
только, синтезы промышленного масштаба, лабораторные методики, биодатчики и медицинские применения. В табл. 2-5 ниже приведены примеры различных систем, использующих при их осуществлении традиционные
методы иммобилизации ферментов. Специалист в данной области сможет приспособить эти и подобные им системы к CLEC-технологии, раскрытой в настоящей заявке. Для иллюстрации этого ниже обсуждаются
конкретные примеры более подробно для каждой из этих категорий применения.
Табл. 2 ниже приводит список примеров, использующих ферменты, иммобилизованные традиционными методами, в промышленных процессах, которые (примеры) могут быть легко адаптированы к раскрытой здесь CLEC-технологии.
Производство акриламида с использованием CLEC-технологии
Ниже
приводится описание использования изобретения: а именно приспосабливание производства акриламида из иммобилизованных клеток, которые перепроизводят фермент нитрил-гидразу (Нагасава T. и Ямада X.
Trends in Biotechnology 7: 153-158 (1989)), к CLEC-технологии, описанной выше.
Производство акриламида в промышленном масштабе, этого важного в химии вещества, описано Ямадой и его сотрудниками (Нагасава Т. и Ямада Х. Trends in Biotechnology 7: 153-158 (1989)). Тысячи тонн акриламида в год производятся в химических реакторах, загруженных иммобилизованными клетками, выбранными в качестве перепроизводителей фермента нитрилгидратазы. Нитрилгидратаза, как сообщалось ранее, очищалась и кристаллизовалась из двух источников. - Brevibakterium R 312 (Нагасава и др. Biochem. Biophis. Res. Commun. 139: 1305-1312 (1986) и P. Chlororaphis B23 (Нагасава и др., Eur. J. Biochem. 162: 691-698 (1987)). Как здесь раскрыто, эти кристаллические ферменты, каждый, могут быть иммобилизированы посредством их структурирования глютаральдегидом или другим подходящим сшивающим реагентом для получения CLEC-фермента. CLEC нитрилгидратазы могут быть затем использованы в традиционном реакторе вместо иммобилизованных клеток, используемых в настоящее время. Приспособление этого процесса к CLEC-технологии ведет к немедленным преимуществам. Эти преимущества включают уменьшение размера завода и повышенный выход вследствие увеличения активности на единицу объема вследствие более высокой концентрации фермента в CLEC-ферментах и улучшенной диффузии субстрата и продукта, снижение нежелательного загрязнения микроорганизмами и побочными реакциями вследствие более высокой чистоты CLEC-фермента, а также благодаря более низкой чувствительности к микробиальному загрязнению из-за отсутствия клеток. Кроме того, имеются и другие преимущества, присущие только технологии CLEC. Эти преимущества включают более высокую рабочую температуру для повышения скорости реакции; способность работы в водных, органических и почти безводных растворителях, позволяющих оптимизировать реакцию получения акриламида; а также продление срока хранения им работы вследствие более высокой химической стабильности и механической прочности CLEC, что особенно заметно в нетрадиционных растворителях.
Применение CLEC-технологии в медицине для экстракорпорального лечения
Соответственно
выбранный CLEC-фермент или набор CLEC-ферментов также могут использоваться для медицинского применения. Такой фермент или набор ферментов могут использоваться, например, для удаления компонента
жидкости, такой как кровь, обычно путем изменения компонента и, таким образом, превращая его в вещество, не оказывающее вредного воздействия на пациента, которое может выводиться из организма
нормальными процессами (например, посредством детоксикации, или разложения в печени, почечной экскрецией). В таком применении соответствующим образом выбранный CLEC-фермент или их набор приводится в
контакт с тканевой жидкостью, содержащей компонент, подлежащий изменению, или содержащей реагент (продукт или субстрат) реакции, в которой участвует такой компонент, на который (компонент или реагент)
действует данный фермент. В результате, фермент способен воздействовать на компонент, подлежащий изменению, или реагировать с другим веществом, которое является продуктом реакции, в которой участвует
компонент, подлежащий изменению. Активность фермента приводит либо к непосредственному изменению компонента, подлежащего удалению, либо к изменению продукта реакции, в которой такой компонент
участвует, делая таким образом невозможным продолжение этой реакции. Это может быть осуществлено посредством использования экстракорпорально (то есть "вне тела") устройства, которое включает
соответствующим образом выбранный CLEC-фермент или их набор и удерживающее средство из некоего материала, такого как пористый материал, на котором удерживается CLEC, или трубка, в которой может
находиться CLEC, позволяющее (средство) осуществить контакт между самим компонентом или веществом в жидкости, являющимся продуктом реакции, в которой данный компонент, подлежащий изменению, принимает
участие.
Это также может быть достигнуто посредством введения соответствующего CLEC в пригодную полость тела, такую как брюшина или лимфатический узел, где CLEC мог бы иметь доступ к жидкостям организма. Такое введение может быть выполнено хирургическим путем, либо посредством инъекции суспензии CLEC. Введение CLEC непосредственно в кровь было бы неподходящим, учитывая высокий риск эмболии (закупорки сосудов).
Использование соответствующих CLEC в этой области могло бы послужить альтернативой генетическим методам, применяемым в терапии заменой фермента для исправления врожденного дефекта, такого как, например, фенилкетонурия.
Табл. 3 иллюстрирует некоторые из медицинских применений, в которых может быть использован CLEC. Для большинства их этих случаев экстра-корпоральное лечение находится еще в стадии исследований, но преимущества, предлагаемые CLEC, могли бы предложить новые методы лечения в тех областях, в которых ранее не было альтернативного лечения.
Конкретным примером применения настоящего способа является система гепарин-лиазы для удаления гепарина из крови (Берштейн и др., Methods in Enzymology 137: 515-529 (1987), обсуждаемая ниже.
Все экстракорпоральные устройства, через которые перекачивается кровь, такие как устройство для почечного диализа, фильтры артериовенозной крови непрерывного действия или экстракорпоральные мембранные оксигенаторы, требуют введения гепарина пациенту для предотвращения свертывания крови. Однако гепаринизациия пациента к геморрагическим осложнениям и остается угрозой для здоровья человека. Эти проблемы возрастают по мере увеличения времени перекачивания крови, например в случае мембранного оксигенатора, и могут привести к серьезной потере крови. После экстракорпоральной терапии гепарин может быть удален из крови с помощью гепариназного устройства (т.е. содержащего гепариназу) на выходе этого экстракорпорального устройства, которое устраняет весь гепарин из крови, возвращаемой пациенту, и избегает таким образом имеющиеся в настоящее время проблемы, связанные с гепаринизацией.
Опубликованные исследования (Лангер и др., Science 217: 261 -263 (1982); Бернштейн и др., Methods in Enzymology 137: 515 - 529 (1987); подробно излагают проблемы, возникающие при использовании в экстракорпоральных устройствах ферментов, иммобилизованных традиционными методами. Главная проблема состоит в том, что традиционная иммобилизация приводит к плохому удержанию ферментативной активности на единицу объема, что требует больших объемов иммобилизованного фермента для осуществления необходимой гепаринизации. Этот слишком велик, чтобы иметь практическое значение для лечения человека. Напротив, высокая удерживаемость активности на единицу объема у CLEC - фермента благодаря отсутствию инертных подложек позволяет обойти эту проблему и предлагает практическое решение проблемы удаления гепарина у человека. Повышенная стабильность CLEC понизит скорость вымывания (диссассоциации) фермента из структурированного кристалла. Это превосходит менее стабильные ферменты, иммобилизированные традиционными методами, также вследствие того, что иммунные реакции, происходящие из-за утечки фермента, будут меньше (ослаблены). Температурная стабильность CLEC - фермента предотвращает денатурацию фермента при временном повышении температуры во время хранения; представляется возможным хранить CLEC при комнатной температуре с сохранением высокой активности фермента. Кроме того, CLEC будет дешевле и удобнее использовать, чем аналогичные ферменты, иммобилизованные традиционными методами вследствие их более длительного периода работы и хранения.
Дополнительные применения CLEC - технологии:
биодатчики
CLEC или набор CLEC-ферментов могут использоваться в качестве компонента сенсора (датчика), называемого здесь "биодатчиком", который может использоваться для обнаружения и/или
количественного анализа интересующего вещества (аналита) в жидкости, такой как тканевая жидкость (например, кровь, моча), промышленная и лабораторная среда для химической реакции, органические среды,
вода, культуральная среда и напитки. В некоторых случаях интересующей текучей средой может быть газ, как, например, в анализаторе для обнаружения алкоголя в выдыхаемом воздухе. (Барзана, Клибанов и
Карелл, NASA Tech. Brief 13:104 (1989)). В этом применении соответствующим образом выбранный CLEC или их набор приводят в контакт с текучей средой (т.е. с жидкостью или газом), подлежащей исследованию
в качестве аналита. Интересующий аналит может быть измерен непосредственно (например, уровень содержания глюкозы в крови) или непрямым образом (например, посредством обнаружения или количественного
определения вещества, являющегося реактантом (продуктом или субстратом) в реакции, в которой участвует интересующий аналит. В любом из них CLEC способен оказывать свое действие на аналит или вещество,
являющееся реактантом в реакции, в которой также участвует аналит. Активность фермента приводит к обнаружимым изменениям (например, изменению pH, производству света, тепла, изменению электрического
потенциала), которое обнаруживается или количественно измеряется соответствующими средствами детекции (например, электродами pH-метра, световыми или тепловыми датчиками, средствами для измерения
изменений электричества) (Яната и др., Anal. Chem. 63:33P-44P (1990)). Могут использоваться любые средства, которые могут обнаруживать изменения, происходящие в процессе ферментного катализа.
Биодатчики по настоящему изобретению включают CLEC или их набор и средства для удерживания CLEC, которые позволяют осуществлять контакт между CLEC и интересующим аналитом или веществом в текучей среде,
которое является реактантом в реакции, в которой участвует интересующий аналит
Табл. 4 иллюстрирует некоторые из применений биодатчиков, в которых могут использоваться CLEC - ферменты.
В настоящее время в некоторых применениях используются иммобилизованные ферменты, но при этом возникают проблемы, связанные с низкой стабильностью, низкой плотностью фермента, коротким периодом его жизни и отсутствием воспроизводимости результатов. Эти примеры могут быть легко адаптированы к раскрытой здесь CLEC - технологии.
В способе по настоящему изобретению, используемом для проведения анализа образцов в биодатчике, особенно желательно получить обнаружимый сигнал максимально возможной силы от наименьшего возможного количества субстрата и катализатора. В этом отношении раскрытая здесь CLEC - технология является особенно притягательной, поскольку она позволяет достичь наивысшей возможной концентрации ферментного катализатора в данном объеме.
Часто предпринимаются значительные усилия для того, чтобы совместить интересующую конечную ферментативную реакцию, осуществляемую непосредственно или через подходящие промежуточные соединения, с производством света ферментами типа люциферазы (Куркиярви и др., Methods in Enzymol. 137:171 - 181 (1988)). Это делается, чтобы использовать чувствительность и эффективность оборудования, обнаруживающего фотоны, что при соответствующих условиях позволяет обнаруживать фемто-молярные концентрации продуктов ферментативной реакции. Следуя этому принципу, ранее были созданы биосенсорные системы с использованием ферментов, иммобилизованных традиционными методами для обнаружения различных субстратов, представляющих медицинский и др. интерес. Реакции, производящие свет, могут быть совмещены с реакциями в экспериментах по обнаружению таких субстратов, как D-глюкоза, L-лактат, L-глютамат и этанол, среди прочих, при крайне низких концентрациях субстрата.
Что касается вышеупомянутого применения, фермент люциферазу из Vibrio harvevii уже кристаллизовали, как сообщалось Свансоном и др., J. Biol. Chem. 260:1287 - 1289 (1985). Кристаллы этой люциферазы могут быть структурированы глютаральдегидом или другим пригодным реагентом с образованием CLEC - люциферазы. Для аналитического и биосенсорного применений CLEC - люцифераза предлагает много преимуществ по сравнению с ферментами, иммобилизованными традиционными методами. У CLEC весь объем будет состоять из излучающего свет фермента люциферазы. У иммобилизованного традиционным методом фермента, однако, 95% общего объема занято "инертным" носителем, который действует скорее как поглотитель света, излучаемого ферментом. Кроме того, повышенная стабильность CLEC - фермента облегчит его хранение при комнатной температуре, и также сделает возможными новые сенсорные применения в жестких условиях и при повышенных температурах.
Дополнительные применения CLEC - технологии
- лабораторные реакции
CLEC - ферменты могут использоваться в качестве лабораторных реагентов в маленьких колонках или в периодических процессах, которые могут использоваться для проведения
лабораторных реакций. Некоторые из широких категорий реакций показаны в табл. 5.
Шнейдер и др. Agnew. Chem. Int. Ed. Engl. 23 (N 1): 64 - 68 (1984) иллюстрирует как можно использовать ферменты в процессах органического синтеза. Эстеразу печени свиньи применяли в процессе трансформирования мезо-эфира в хиральный мезо-эфир в водном фосфатном буфере.
Преимущество использования в лаборатории реакций, катализируемых посредством CLEC, является тройным. Во-первых, CLEC сохраняет высокую активность в жестких условиях (например, в водных, органических, почти безводных растворителях и их смесях, и при высоких температурах), типичных для лабораторных опытов по химическому синтезу. Во-вторых, CLEC проявляет высокую стабильность при работе и хранении, что подходит для периодически прерывающихся лабораторных опытов. В-третьих, высокая активность CLEC на единицу объема позволит сократить время реакции и уменьшить необходимые объемы фермента (на единицу активности). Таким образом, преимущества, которыми обладают CLEC-ферменты по сравнению со свободными или иммобилизованными ферментами, дают химикам-органикам альтернативу, представляющую собой высоко избирательный, искусственный инструмент.
Во всех вышеописанных примерах, но не только, способ по настоящему изобретению может быть приспособлен специалистом в данной области для преобразования способа, использующего катализатор в виде иммобилизованного традиционным методом фермента, для использования CLEC соответствующего фермента. CLEC - ферменты не только могут заменить ферменты, иммобилизованные традиционными методами, но также могут использоваться в преобразованиях, вызываемых клетками. Далее настоящее изобретение будет проиллюстрировано следующими примерами, которые никоим образом не предназначены для ограничения объема изобретения.
Пример 1. Кристаллизация и структурирование термолизина для синтеза предшественника аспартама. -Z-Asp-Phe-OMe Кристаллизация. 250 мг термолизина от Bacillus thermoproteolyticus, закупленного у компании Берингер-Мангейм ГмбХ, растворили в 4 мл 45%-ного диметил-сульфоксида (ДМСО) и 55%-ного 1,40 М ацетата кальция, 0,50 М какодилата натрия при pH 6,5. Эти исходные условия аналогичны описанным Мэттьюзом и др. для производства крупных кристаллов термолизина (дифракционного качества), см. , например, Холм и Мэттьюз. J. Mol. Biol. 160: 623 - 639 (1982). Раствор белка затем концентрировали до 1 мл в микро-концентраторе "Центрикон"-10. Хороший выход микрокристаллов был получен способом мгновенной кристаллизации, теперь раскрытом в этом описании, по которому 1 мл воды, или 1,40 М ацетата кальция, 0,50 М какодилата натрия с pH 6,5, быстро вводили в тот или иной ДМСО-термолизиновый раствор, описанный выше. Этим способом получают множество гексагональных микрокристаллов примерно одинаковых размеров (длиной примерно 10-1 мм).
Структурирование микрокристаллов термолизина.
Процедуры, использованные в этом конкретном примере выполнения способа по изобретению, являются приспособлением протокола, описанного Наканиши и др., Biotechnology 3: 459 - 464 (1985), согласно которому термолизин сначала адсорбировали на гранулированный носитель, составленный из ионообменной смолы Амберлит XAD-7, а затем иммобилизировали посредством его структурирования глютаральдегидом (Квичо и Ричардс, - Proc. Natl. Acad. Sci (США) 52: 833 - 839 (1964). В этом примере микрокристаллы полученного термолизина центрифугировали и пеллетировали (осаждали), а надосадочную жидкость выбрасывали. Затем к микрокристаллам добавляли 5 мл 17,5%-ного технического глютаральдегида в 2,5% ДМСО, 0,05 М ацетата кальция и 0,025 М какодилата натрия с pH 6,5. Смесь инкубировали при легком перемешивании в течение 4 ч при 37oC. Реакцию структурирования прекращали повторной промывкой кристаллов 10 мл для аликвотами воды для удаления раствора глютаральдегида. Промытые структурированные кристаллы термолизина и составляют тот CLEC - термолизин, который использовали ниже в качестве катализатора.
Синтез Z - Asp - Phe - OMe в водном растворе.
5 мл суспензии CLEC - термолизина добавляют в периодический раствор с постоянным перемешиванием, инкубируемый при 37oC. После центрифугирования и декантации надосадочной жидкости к CLEC добавляли водную реакционную среду. Этот раствор приготавливали путем смешивания 80 мг Z - (L - Asp) и 80 мг (L - Phe) - OMe - HCl в 1 мл воды, с добавлением уксусной кислоты для получения pH 7,0. Образцы анализировали посредством HPLC. Ниже таблица 6 показывает высоту результатов по HPLC - исследованию субстрата Z - (L - Asp), нормализованных к 1 при времени t = 0. Поскольку Z - (L - Asp) ограничивает скорость этой реакции, то измерение уменьшения количества этого вещества эквивалентно измерению появления продукта - Z - (L - Asp) - (L - Phe) - OMe (Наканиши и др. , Biotechnology 3: 459 - 464 (1985). Кроме нормализованной высоты результатов HPLC по субстрату Z - (L - Asp) табл. 6 включает также оценку степени завершенности реакции. Ясно, что реакция выходит на уровень приблизительно 20% завершенности в течение первых 30 с и затем стабилизируется на этом уровне. Эти результаты согласуются с наблюдениями Наканиши и др. , Biotechnology 3: 459 - 464 (1985), полученными с использованием термолизина, иммобилизованного традиционным методом в водной реакционной среде, аналогичной вышеуказанной, и могут быть объяснены плохой растворимостью продукта, -Z - (L - Asp) - (L - Phe) - OMe, в воде.
Синтез Z - Asp - Phe - OMe в почти безводном растворе.
5 мл суспензии CLEC - термолизина добавляют в реактор периодического действия с постоянным перемешиванием, который инкубируют при 37oC. После центрифугирования и декантации надосадочной жидкости к CLEC добавляли почти безводную органическую реакционную среду. Этот раствор приготавливали путем смешивания 80 мг Z - (L - Asp) и 240 мг (L - Phe) - OMe в 1 мл 99% этил-ацетата с 1% воды. Образцы анализировали посредством HPLC. Табл. 7 ниже представляет нормализованные по высоте результаты по содержанию Z - (L - Asp) в зависимости от длительности реакции, которые нормализованы к 1 при времени t = 0. Поскольку Z - (L - Asp) ограничивает скорость этой реакции, измерение уменьшения этого вещества эквивалентно измерению возникновения продукта Z - (L - Asp) - (L - Phe) - OMe (Наканиши и др., Biotechnology 3: 459 - 464 (1985)). Табл. 7 включает нормализованное остающееся количество ограничивающего Z - (L - Asp) субстрата и оценку степени завершенности реакции. В данном случае реакция прошла до 70%-ной завершенности в течение первых 30 секунд и стабилизировалась на этом уровне. Эти результаты также согласуются с наблюдениями Наканиши и др. , Biotechnology 3: 459 - 464 (1985), полученными с использованием термолизина, иммобилизованного традиционным методом, в почти безводной реакционной смеси, и могут быть объяснены с ингибированием фермента получаемым продуктом.
Пример 2. Кристаллизация, структурирование и лиофилизация термолизина и оценка характеристик полученного продукта.
Кристаллизация термолизина
Термолизин (компании
Диава Казеи К.К., Япония) растворяют в 10 мМ ацетата кальция (Сигма), с pH 10,0, до концентрации 10% (вес/об.) pH раствора поддерживают на уровне 10,0 посредством его титрования 2 М раствором NaOH.
После полной солюбилизации (растворения) раствор белка титруют до pH 8,0 2 М раствором HCl. Добавляют сухой ацетат кальция до 1,2 М. Затем добавляют до 30% диметил сульфоксид (Сигма). Белок
концентрируют до 100 мг/мл посредством ультрафильтрации в приборе Амикон (мембрана 10,000 MWCO). Концентрированный фермент затем делили на аликвоты и хранили при -70oC. Термолизин
кристаллизуют путем добавления 9 объемов деминерализованной воды к 1 мл концентрированного (100 мг/мл) белкового раствора. Раствор кратковременно встряхивают и оставляют до утра при комнатной
температуре. Кристаллы промывают 10 объемами 10 мМ ацетата кальция с pH 7,0 и выделяют посредством центрифугирования малой скорости (10 мин, при 1500 • G, центрифуга Бекман GPR).
Быстрое добавление воды к концентрированному (100 мг/мл) раствору термолизина вызывает образование кристаллов, которые становятся видимыми при небольшом увеличении в течение 10 минут. Размер кристаллов воспроизводимым образом зависит от конечной концентрации белка. Три объема воды на один объем концентрата термолизина (100 мг/мл) дают 0,5 миллиметровые по длине гексагональные палочки-кристаллы качества для рентгенографии, которые соответствуют кристаллам, описанным ранее Колманом с сотр. (Колман, Янсониус и Мэттьюз, J. Mol. Biol. 70: 701 - 724 (1972), что подтверждено нами с помощью дифракционного анализа. Добавление десяти объемов воды к одному объему белкового концентрата уменьшает длину получаемых кристаллов до 0,05 мм. Эти микрокристаллы являются предпочтительными в применениях CLEC, поскольку у них уменьшаются диффузионные проблемы, связанные с размерами кристаллов (см. Квиочо и Ричардс, Biochemistry 5: 4062 - 4076 (1967). В одной конкретной партии белка размер кристаллов выдерживается постоянным. (В этом исследовании использовали кристаллы размером 0,05 - 0,10 мм длины для того, чтобы облегчить точное отмеривание пипеткой суспензий кристаллов.). Денситометрическое сканирование SDS - PAGE показало шестикратную очистку фермента при кристаллизации, что существенно повышает специфичную активность CLEC. Кристаллизация привела к 20%-ному снижению общей активности CLEC - белка по сравнению с растворимым термолизином, когда его исследовали посредством спектрофотометрического расщепления дипептидного субстрата фурил-акрилоил-глицил-L-лейцин-амид (FAGLA), как описано ниже.
Структурирование кристаллов термолизина.
Кристаллы термолизина структурировали в течение 3 часов при комнатной температуре в растворе 12, 5%-ного глютаральдегида (Сигма), 5% ДМСО и 50 мМ Трис с pH 6,5. Структурированные кристаллы промывали трижды деминерализованной водой и выделяли центрифугированием малой скорости, как описано в отношении кристаллизации термолизина. Химическое структурирование кристаллов фермента стабилизирует кристаллическую решетку и составляющие ее молекулы фермента в кристалле достаточным образом для того, чтобы позволить практическое использование CLEC в средах, которые иначе несовместимы с функционированием фермента. При спектрофотометрическом исследовании посредством мониторинга расщепления дипептидного субстрата FAGLA, описанного ниже, не было обнаружено заметного различия в ферментативной активности между структурированными и неструктурированными кристаллами. Кроме того, структурирование стабилизирует CLEC до такой степени, что они могут быть лиофилизированы, с сохранением полной ферментной активности при их восстановлении в водных, органических и смешанных водно-органических растворителях, как показано в табл. 1 и табл. 8. Хотя кристаллизация приводила к 30%-ному снижению специфичной активности у CLEC - фермента по сравнению с растворимым термолизином, структурирование и лиофилизация CLEC в дальнейшем не уменьшали его специфичную активность.
Ферментативная активность растворимого и CLEC-термолизина
Каталитическую активность
растворимого и CLEC-термолизина оценивали (Федер и Шук, Biochemistry 9:2784-2791 (1970) посредством гидролиза блокированного дипептидного субстрата фурилакрилоил-глицил-L-лейцин-амида (FAGLA)
(Швейцерхолл). Расщепление амидных связей измеряли спектрофотометрически посредством уменьшения поглощения при длине волны 345 нм. Исходная концентрация фермента составила 10-7 М согласно
определению содержания белка по Брэдфорду и денситометрическому сканированию (Фармация LKB UltroScan XL) окрашенных Кумасси гелей SDS-PAGE. CLEC-фермент был определен как восстановленные
лиофилизированные структурированные кристаллы термолизина. Растворимый фермент был определен как термолизин, концентрированный до 100 мг/мл. Фермент добавляли к 5 мл реакционного объема, содержащего
субстрат. В указанные моменты брали аликвоты реакционной смеси и измеряли из поглощение при 345 нм. CLEC - термолизин отделяли от реакционной смеси путем кратковременного центрифугирования (Бекман,
микроцентрифуга серии E) перед считыванием поглощения. Поглощение использовали в уравнении скорости псевдо-первого порядка и рассчитывали путем деления этого подогнанного значения на концентрацию
фермента (Программа "Мультифит 2.0 Подгонка Кривой" для компьютера Эппл Макинтош, Day Computing Р.О. Вох 327, Милтон, Кембридж, СВ4 6W1, Великобритания (1990).
pH-зависимость и
стабильность
Оптимальный уровень pH и стабильность растворимого фермента сравнивали с этими характеристиками CLEC - термолизина посредством расщепления дипептидного субстрата FAGLA.
Результаты показаны на фиг. 2 и в табл. 9. Как растворимый, так и кристаллический фермент продемонстрировал максимальную активность при pH 7,0 CLEC и растворимый термолизин также продемонстрировали
сходную активность в кислом диапазоне, и колоколообразный pH-профиль, полученный у растворимого фермента, хорошо согласовался с опубликованными данными (Федер и Шук, Biochemistry 9:2784-2791 (1970).
Однако в щелочном диапазоне кристаллический фермент сохраняет максимальную активность до pH 10,0, тогда как растворимый фермент имеет 75%-ную активность при pH 8,5, и только 25%-ную активность при pH
9. При pH 9,5 растворимый фермент совершенно неактивен.
Стабильность при повышенных температурах
При осуществлении определенных химических процессов при более высоких
температурах могут быть достигнуты более высокие скорости реакции и более короткое время диффузии для субстратов и продуктов, которые обычно ограничиваются температурной стабильностью субстратов и
продуктов. Однако при ферментном катализе на температуру проводимого процесса накладывает на практике ограничение, связанное с утратой фермента его активности. Дополнительная стабилизация, достигаемая
у CLEC, позволяет им проявлять ферментативную активность при значительно более высоких температурах, чем это возможно для растворимых ферментов.
Повышенная стабильность при более низких температурах упрощает обычное долговременное хранение CLEC - катализаторов. Например, растворы растворимого термолизина, концентрированные до более чем 50 мг/мл, необходимо хранить при -80oC, чтобы сохранить максимальную ферментативную активность. При комнатной температуре активность обычно утрачивается в течение дня. Напротив, регидратированный CLEC - термолизин может храниться обычным образом при комнатной температуре в течение месяцев без заметной потери активности. Представляется, что невосстановленный лиофилизированный CLEC - термолизин может сохранять жизнеспособность в течение неограниченных периодов времени.
Температурная стабильность и резистентность к автолизу были продемонстрированы у CLEC - термолизина после инкубирования его при 65o C в течение пяти последовательных дней (см. фиг. 3 и табл. 10). CLEC - термолизин сохраняет максимальную активность после пятидневного инкубирования при повышенной температуре. Напротив, растворимый термолизин теряет 50% своей исходной активности после всего лишь двух часов инкубирования и демонстрирует незначительную активность после 24-часового инкубирования при 65oC.
Активность растворимого и CLEC - термолизина измеряли после его инкубирования при 65oC. Растворимый термолизин инкубировали в 10 мМ ацетате кальция, 50 мМ Трис с pH 7,0 в водяной бане 65oC. Реакционный объем составлял 500 μл. Конечная концентрация белка составляла 10 мг/мл. Аликвоты брали через 0, 1, 2, 4, 6, 10 и 18 часов. Образцы исследовали SDS-PAGE или расщеплением FAGLA при комнатной температуре, как описано выше. Для CLEC - термолизина 250 μл суспензии кристаллов в 10 мМ ацетата кальция и 50 мМ Трис также инкубировали в 65oC водяной бане. Активность исследовали через 0, 1, 6, 24, 48, 72, 96 и 120 часов посредством FAGLA - расщепления.
Резистентность к экзогенному протеолизу
Также проводили оценку
резистентности CLEC - термолизина к действию экзогенной протеазы. SDS-PAGE анализ (электрофорез на полиакриламидном геле с додецил-сульфатом натрия) предполагает, что коммерческие ферменты могут
содержать значительный процент загрязняющих веществ, некоторые из которых могут обладать протеолитической активностью против основных видов растворимых ферментов. Имея упаковку молекул фермента в
кристаллическую решетку, можно предположить, что внутренние молекулы фермента у CLEC будут защищены от протеолиза. Чтобы проверять эту возможность, CLEC - термолизин и препарат растворимого фермента
инкубировали в присутствии стрептококковой протеазы, -Проназы, -неспецифичной протеазы, способной переваривать большинство белков до свободных аминокислот (Каталог 1990, Calbiochem; La Jolla,
Канада).
Растворимый и CLEC - термолизин инкубировали в 50 мМ Трис с pH 7,5 при 40oC в присутствии Проназы (Калбиохем). Соотношение Проназы и термолизина составляло 1: 40. Для ингибирования автолиза термолизина и предотвращения протеолитического разрушения проназы термолизином к реакционной среде растворимого фермента добавляли ЭДТК до ее конечной концентрации 100 мМ (ЭДТК ингибирует активность термолизина, но не проназы). В указанное время из реакционной смеси брали аликвоты и исследовали спектрофотометрически активность фермента путем расщепления дипептидного субстрата FAGLA. Чтобы устранить ингибирование термолизина присутствием ЭДТК, спектрофотометрическое исследование активности растворимого фермента осуществляли в 0,5 М кальциево-ацетатном буфере с pH 7,0 и концентрацию фермента повышали вдвое. Структурированный кристаллический фермент исследовали, как было описано выше.
Как можно видеть на фиг. 4 и табл. 11, растворимый термолизин быстро разрушался и терял всю свою активность через 90 минут инкубирования. Напротив, активность CLEC - термолизина осталась той же после четырехдневного инкубирования в присутствии протеазы. Эта почти неуязвимость к протеолизу представляет особый интерес в диагностических применениях биосенсорного типа, когда может потребоваться работа подходящего CLEC в присутствии неизвестного коктейля встречающихся в природе протеолитических ферментов.
Стабильность в присутствии органического растворителя
Для того, чтобы ферменты приобрели идеальную приемлемость в качестве
жизнеспособных промышленных катализаторов, они должны быть способны функционировать без избыточного воздействия на фактическую окружающую среду производственных процессов. В частности, эта среда
должна включать использование водных, полярных и неполярных органических растворителей, а также смесей. В коммерческих применениях водно-органические смеси растворителей позволяют управлять
образованием продукта путем использования относительной растворимости продуктов и субстратов.
Растворимый термолизин и термолизиновые CLEC проявляют существенно отличающуюся стабильность в присутствии органических растворителей (табл. 12). Концентрации растворимого фермента, которые могли инкубироваться в органическом растворителе, были ограничены до максимум 10 мг/мл. Концентрации выше этого значения приводили к немедленному осаждению (преципитации) термолизина при добавлении органического растворителя. Напротив, концентрации CLEC - термолизина были ограничены только объемом, занимаемым кристаллами. Растворимый термолизин сохраняет свою наибольшую активность (75%) после инкубирования в ацетоне и наименьшую (36%) - в тетрагидрофуране. Через 1 час инкубирования в присутствии ацетонитрила или диоксана растворимый фермент утрачивает приблизительно 50% своей исходной активности. CLEC - термолизин сохраняет более 95% своей максимальной активности после инкубирования со всеми испытанными органическими растворителями.
Стабильность в органических растворителях
CLEC - термолизина или препараты растворимого термолизина
инкубировали в 50% (об/об) растворах указанных органических растворителей. 100μл суспензии CLEC - термолизина (10 μг/мл) в 10 мМ Трис pH 7 помещали в стеклянный сосуд емкостью около 2 мл
(1/2 dram). Затем к белковому раствору добавляли 100 мл органического растворителя и кратковременно встряхивали. CLEC и растворимый фермент инкубировали в присутствии органического растворителя в
течение одного часа при 40oC. После инкубирования активность фермента исследовали посредством расщепления дипептидного субстрата FAGLA, как уже описано.
Предположительно, низкое содержание воды мешает развертыванию белковой молекулы на промежуточных этапах пути к ее денатурации. У CLEC, это ограничение конформационной мобильности обеспечивается межмолекулярными связями и контактами составляющих фермент молекул, создающих кристаллическую решетку, скорее, чем почти полным отсутствием воды в среде. В результате, промежуточные концентрации водно-органического растворителя легко переносятся ферментами в виде CLEC, что ранее у ферментов не наблюдалось (см. табл. 12). Это открытие открывает целые новые области химии синтеза для их разработки с использованием ферментного катализа.
Даже в почти безводных органических растворителях, однако, обычное использование ферментов было затруднено вследствие их тенденции образовывать неопределенные суспензии с проблемами образования комков и других явлений агрегации. Это свойство делает такие препараты в сущности непривлекательными для широкомасштабных промышленных процессов. Например, CLEC и составляющие ферменты в кристаллической решетке сохраняют монодисперсию во всех этих растворителях.
Сравнение с другими методами иммобилизации
В литературе было опубликовано
несколько полезных обзоров на тему методов иммобилизации (Maugh, T.H., Science 223: 474-476 (1984); Tramper, J. Trends in Biotechnology 3: 45-50 (1985)). В этих источниках фермент всегда представляет
собой небольшую часть от общего объема иммобилизованных частиц, основную массу которых составляет инертный материал носителя. Носитель увеличивает средний свободный путь между внешней средой
растворителя вокруг частиц иммобилизованного фермента и активными сайтами этого фермента, усугубляя диффузионные проблемы (Квиочо и Ричардс, Biochemistry 5: 4062-4076 (1967).
У CLEC структурированная матрица кристалла обеспечивает себе свою собственную опору, устраняя необходимость в носителе. В результате, концентрация фермента в CLEC близка к теоретическому пределу загрузку, который может быть достигнут для молекул данного размера, значительно превышая плотности, достижимые даже в концентрированных растворах. Весь CLEC состоит из активного фермента и таким образом уменьшается до минимума, связанное с проблемами диффузии снижение скорости ферментативной реакции, которое обычно наблюдают с ферментами, иммобилизованными традиционными методами по сравнению с ферментами в растворе (см. фиг. 1), поскольку средний свободный путь для субстрата и продукта между активным ферментом и свободным растворителем будет значительно укорочен у CLEC (по сравнению с частицами носителя с традиционно иммобилизованным ферментом). Важно, что составляющий CLEC фермент является, в сущности, монодисперсным, и может быть выделен простыми приемами с CLEC-частицами, такими как фильтрование, центрифугирование или декантация растворителя.
Пример 3. Кристаллизация, структурирование и лиофилизация эластазы, и оценка характеристик получаемого продукта.
Кристаллизация эластазы
Лиофилизированную эластазу из поджелудочной железы свиньи растворяли в 0,1 М ацетата натрия с pH 5,0 до концентрации 5 мг/мл (вес/об) при комнатной
температуре. Палочкообразные кристаллы эластазы становились видимыми в течение одной минуты полного растворения белка. Кристаллизационный раствор переносили в холодильник с 4oC и отставляли
до утра для завершения кристаллизации. Кристаллы выделяли центрифугированием, как уже было описано.
Структурирование кристаллов эластазы
200 μл объема кристаллов
эластазы добавляли к 1,3 мл раствора 5,77% глютаральдегида и 1,5 М ацетата натрия с pH 5,0. Кристаллы структурировали в течение одного часа при мягком перемешивании (перемешивающая чашка). После
структурирования кристаллы промывали тремя объемами по 15 мл 0,2 М Трис с pH 8,0. CLEC-эластазу лиофилизировали, как описано в примере 2.
Ферментативная активность растворимой и
CLEC-эластазы
Каталитическую активность растворимой и CLEC-эластазы исследовали спектрофотометрически посредством измерения гидролиза субстрата-сукцинил-(Ala)3 р-нитроанилида
(Bachem) (Бит и др., Biochem. Med. 11:350-357 (1974) (см. табл. 13, фиг. 5). Расщепление исследовали на повышении поглощения при 410 нм. Исходная концентрация субстрата составляла 2•10-4. Концентрация фермента была 2,8•10-7 М. CLEC или растворимый фермент добавляли к 5 мл реакционному объему, содержащему субстрат в 0,2 Трис с pH 8,0. Как описано выше,
CLEC-фермент удаляли из реакционной смеси перед измерением поглощения.
Резистентность к экзогенному протеолизу
Также проводили оценку резистентности CLEC-эластазы к действию
протеазы и при условиях, идентичных тем, которые использовали для термолизина (см. пример 2). Активность растворимого и CLEC-фермента после их инкубирования с протеазой оценивали посредством гидролиза
нитроанилидного субстрата, как описано выше (табл. 14 и фиг. 6).
Пример 4. Кристаллизация, структурирование и лиофилизация эстеразы, и оценка характеристик полученного продукта
Кристаллизация эстеразы
Как раскрыто в настоящем описании, 30 мг/мл суспензии сульфата аммония эстеразы из печени свиньи (Fluka) растворили в 0,25 М ацетата кальция с pH 5,6 при
комнатной температуре. Кристаллы эстеразы становились видимыми через несколько минут после добавления раствора ацетата кальция. Кристаллизационный раствор оставляли стоять при комнатной температуре и
кристаллизацию завершали на следующее утро. Кристаллы выделяли посредством центрифугирования, как описано выше, в примере 2.
Структурирование кристаллов эстеразы
Как раскрыто
здесь, 300 μл кристаллов эстеразы добавляли к 5 мл раствора из 12,5% глютаральдегида и 0,5 М ацетата натрия с pH 5,5. Кристаллы структурировали в течение одного часа при легком помешивании
(перемешивающая чашка). После структурирования кристаллы трижды промывали 15 мл 0,5 М ацетата кальция с pH 6,3. CLEC-эстеразу лиофилизировали, как описано выше, в примере 2.
Ферментативная активность растворимой и CLEC-эстеразы
Каталитическую активность растворимой и CLEC-эстеразы оценивали спектрофотометрически посредством мониторинга гидролиза субстрата,
- р-нитрофенилацетата (Fluka) (табл. 15 и фиг. 7). Расщепление изучали по усилению поглощения при 400 нм. Исходная концентрация субстрата составляла 0,001%. Концентрация фермента была 1•10-8 М. CLEC или растворимый фермент добавляли к 5 мл реакционной среды, содержащей субстрат в 0,25 ацетата кальция с pH 6,3. Как описано выше в примере 2, CLEC-фермент удаляли из реакционной
смеси посредством центрифугирования перед измерением поглощения.
Резистентность к экзогенному протеолизу
Оценку резистентности CLEC-эстеразы к действию протеазы осуществляли
при условиях, идентичных описанным для термолизина в примере 2. Активность растворимого и CLEC-фермента после их инкубирования с протеазой оценивали с помощью гидролиза субстрата,
- р-нитрофенилацетата, как описано выше (см. табл. 16 и фиг. 8).
Пример 5. Кристаллизация, структурирование и лиофилизация липазы и оценка характеристик полученного продукта
Кристаллизация липазы
Как здесь раскрыто, фермент липазу (Geotrichum candidum) кристаллизовали паровой диффузией из водного раствора 20 мг/мл белка в 50 мМ Трис с pH 7, содержащего 8%
сульфата аммония. Кристаллы в виде двойных пирамид становились видимыми через 20-30 дней инкубирования при комнатной температуре. Кристаллы выделяли посредством центрифугирования, как описано выше в
примере 2.
Структурирование кристаллов липазы
Как здесь раскрыто, кристаллы липазы добавляли к раствору 12,5% глютаральдегида и 50 мМ Трис pH 5,6. Кристаллы структурировали в
течение одного часа. После структурирования кристаллы промывали трижды 15 мл объемами 50 мМ Трис с pH 7,0. CLEC-липазы лиофилизировали, как описано выше в примере 2.
Ферментативная
активность растворимой и CLEC-липазы
Каталитическую активность растворимой и CLEC-липазы исследовали спектрофотометрически путем мониторинга гидролиза субстрата, - р-нитрофенилацетата (табл.
17 и фиг. 9). Расщепление изучали по увеличению поглощения при 400 нм. Исходная концентрация субстрата составляла 0,005%. Концентрация фермента была 1,5 • 10-8 М. CLEC или
растворимый фермент добавляли в 5 мл объем реакционной среды, содержащей субстрат в 0,2 М Трис с pH 7,0 при комнатной температуре. Как описано выше в примере 2, CLEC-фермент удаляли из реакционной
смеси посредством центрифугирования перед измерением поглощения.
Пример 6. Кристаллизация, структурирование и лиофилизация лизоцима, и оценка характеристик полученного продукта
Кристаллизация лизоцима
Следуя методу Блейка с сотр., Natuve, 196: 1173 (1962), 200 мг лиофилизированного лизоцима из белка куриного яйца (Берингер, Мангейм) растворяли в 2,5 мл 0,04 М
натриево-ацетатном буфере с pH 4,7 при комнатной температуре. После растворения белка к раствору лизоцима по каплям при помешивании добавляли 2,5 мл 10%-ного хлорида натрия. Кристаллизационный раствор
оставляли стоять до утра при комнатной температуре и кристаллизацию завершали через 48 часов. Кристаллы выделяли посредством центрифугирования, как описано выше в примере 2.
Структурирование кристаллов лизоцима
Как описано здесь, 500 μл объем кристаллов лизоцима добавляли к 10 мл 24%-ного глютаральдегида и 50 мМ трис с pH 5,6, содержащим 20% хлорида
натрия. Кристаллы структурировали в течение 20 минут при легком перемешивании (перемешивающая чашка). После структурирования кристаллы промывали трижды 50 мл объемами 20 М ацетата кальция и 50 мМ
хлорида калия с pH 5,3. CLEC-лизоцим лиофилизировали, как описано выше в примере 2,
Ферментативная активность растворимого и CLEC-лизоцима
Каталитическую активность растворимого и
CLEC-лизоцима исследовали посредством измерения скорости гидролиза субстрата - 4-метилумбеллиферил-N-ацетил-хитриозида (Fluka) Янг и Хамагучи, J. Biochem., 8:1003-1014 (1980) (табл. 18 и фиг. 10).
Освобождение 4-метилумбеллиферона устанавливали флуорометрически (Perkin Elmer, модель LS-50). Исходная концентрация субстрата составляла 1,42 • 10-3. Концентрация фермента была 3
• 10-7. CLEC или растворимый фермент добавляли к 2 мл реакционной среды, содержащей субстрат в 20 мМ ацетата кальция и 50 мМ
хлорида калия с pH 5,3 при 42oC. Количество
4-метилумбеллиферона определяли флуорометрически, путем измерения флуоресценции при 450 нм с возбуждением при 360 нм. Ширина щели как для возбуждения, так и эмиссии была 10 мм. Как описано выше в
примере 2, CLEC-фермент удаляли из реакционной смеси посредством центрифугирования перед измерением флуоресценции.
Пример 7. Кристаллизация, структурирование и лиофилизация
аспарагиназы, и оценка характеристик полученного продукта
Кристаллизация аспарагиназы
В качестве модификации процедуры, описанной Грабнером с сотр., см. патент США N 3664926 (1972),
25 мг лиофилизированной аспарагиназы (Worthington) растворяли в 500 мл 50 мМ натриево-фосфатного буфера с pH 7,2. Раствор охлаждали до 4oC и pH доводили до 5,0 с помощью 1 М уксусной
кислоты. Затем к раствору аспарагиназы по каплям добавляли холодный (-20oC) этанол до конечной концентрации 33%. Раствор инкубировали при 4oC. Кристаллизацию завершали через 48
ч. Кристаллы выделяли посредством центрифугирования, как описано выше.
Структурирование кристаллов аспарагиназы
Как раскрыто здесь, кристаллы аспарагиназы структурировали в
растворе из 7,5% глютаральдегида в 50 мМ натриево-фосфатного буфера с pH 5,6. После структурирования кристаллы промывали пять раз 15 мл объемами 50 мМ Трис с pH 7,0. CLEC аспарагиназу лиофилизировали,
как описано выше в примере 2.
Ферментативная активность растворимой и CLEC-аспарагиназы
Каталитическую активность растворимой и CLEC-аспарагиназы исследовали
спектрофотометрически посредством измерения эфолюции иона аммония в сопряженной ферментативной реакции, описываемой ниже (все реагенты были закуплены у фирмы Берингер Майгейм) (табл. 19 и фиг. 11).

Окисление NADH измеряли по уменьшению поглощения при 340 нм Исходная концентрация NADH составляла 1,4 мг/мл. Концентрация аспарагина была 10-3 М. Концентрация альфа-кетоглютарата была 10-4 М. Концентрация глютамат-дегидрогеназы составляла 10-7. Концентрация аспарагиназы была 2,3 • 10-8 М. Как описано выше в примере 2, CLEC-фермент удаляли из реакционной смеси посредством центрифугирования перед измерением поглощения.
Реферат
Изобретение относится к области биотехнологии, в частности к области иммобилизации ферментов. Растворимую форму белка переводят в форму сшитого кристалла действием многофункционального сшивающего агента. В качестве белка обычно используют фермент, предпочтительно гидролазу. Сшитый кристалл может быть использован в качестве основы устройств, преимущественно предназначенных для использования в качестве биосенсора. Сшитые кристаллы могут быть использованы в биотехнологическом синтезе для иммобилизации фермента, использующегося в реакции. Использование сшитых подобным образом кристаллов позволяет белкам повысить срок их активности относительно несшитых форм белка. 7 с. и 33 з.п. ф-лы, 11 ил., 19 табл.


Комментарии