Производные дипептидов и способ их получения - RU2055078C1
Код документа: RU2055078C1
Чертежи

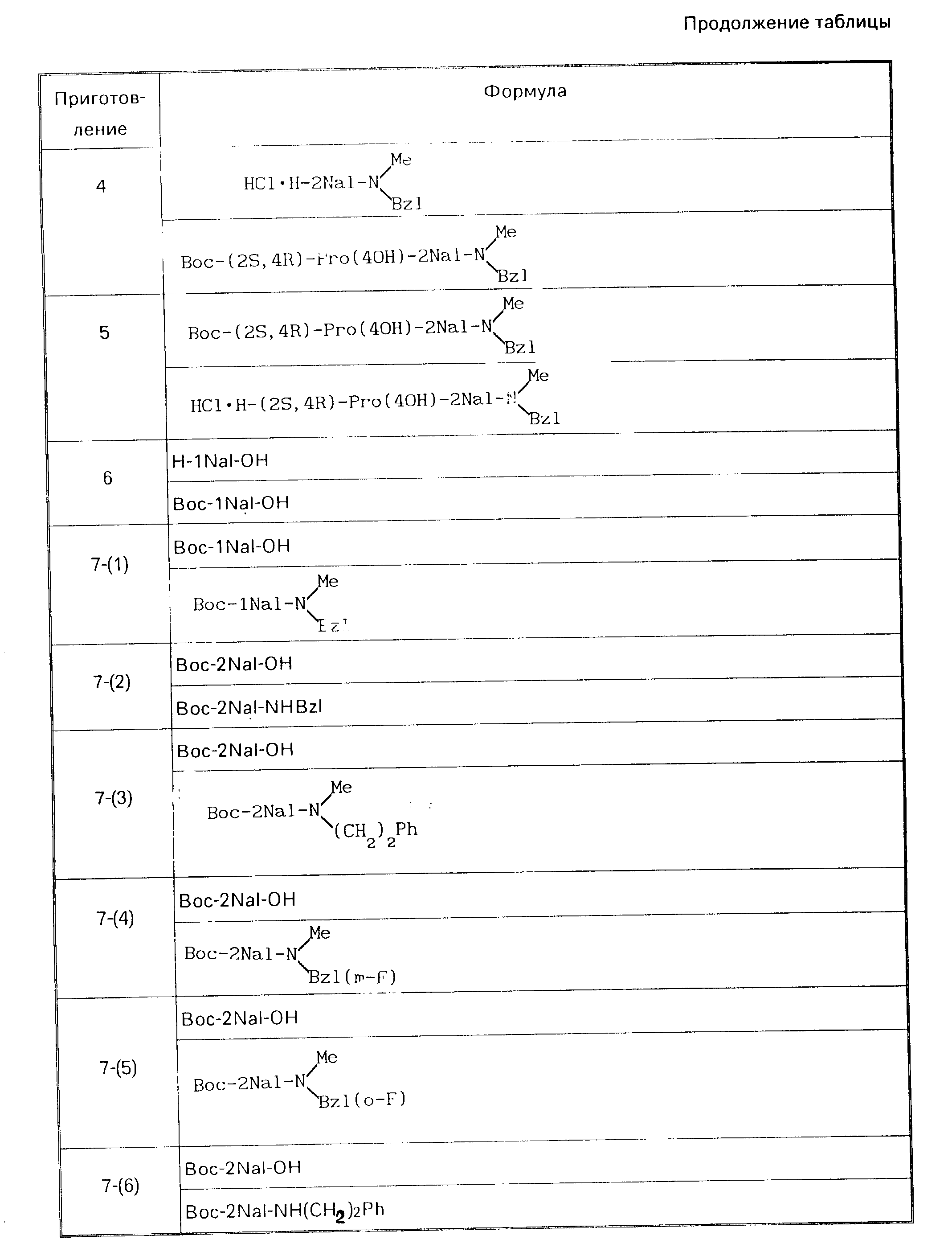







Описание
Изобретение относится к новым производным дипептидов, обладающих фармакологической активностью, и способу их получения, и может найти применение в медицине.
Указанные дипептидные соединения могут быть использованы в медицине в качестве антагониста тахикинина, особенно антагониста вещества "Р", антагониста нейрокинина "А" или антагониста нейрокинина "В" для лечения и профилактики вызванных тахикинином болезней, например, респираторных заболеваний, таких как астма, бронхит, ринит, кашель, мокрота и т.п. офтальмологических заболеваний, таких как конъюнктивит, весенний конъюнктивит и т.п. кожных заболеваний, например контактных дерматит, атопический дерматит, крапивная лихорадка и другие экзематоидные дерматиты; воспалительных болезней, таких как ревматический артрит, остеоартрит и т.п. боли, например мигрень, головная боль, зубная боль, боли от опухолей, боли в спине и т.п. и других подобных болезней у людей и животных.
Целевое соединение изобретения может быть представлено следующей общей формулой (I):
R





Z 0 или N R5, где R5 водород или низший алкил;
R2 гидрокси или низший алкокси;
R3 водород или низший алкил необязательно замещенный гидрокси или ацилокси;
R4 ар(низший)алкил, необязательно замещенный галогеном;
А карбонил или сульфонил;
Y связь или низший алкенилен.
В соответствии с изобретением новые пептидные соединения (I) могут быть получены способами, представленными следующими схемами.
Способ I
H


R Y A OH (III) или его производное по карбокси или сульфогруппе или его соль
R




Способ
2


R




R3a замещенный ацилокси (низший) алкил;
R3b гидрокси низший алкил.
Что касается исходного соединения (II), то это новое соединение и оно может быть получено способами, показанными в следующих схемах.
Способ А


HN




Удаление аминозащитной группы
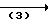


R



Удаление аминозащитной группы



R6 и R7 каждый аминозащитная группа.
В описании аминокислота, пептиды, защитные группы, конденсирующие агенты и т.д. указаны с помощью аббревиатуры, которая обычно используется в данной области. Если не указано иначе аминокислоты и их остатки, когда они указаны с помощью аббревиатуры, являются соединениями и остатками с L-конфигурацией.
Подходящими фармацевтически приемлемыми солями исходного и целевого соединения являются обычные нетоксичные соли и включают кислые соли добавления, например органическая кислая соль (ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, формиат, толуолсульфонат и т.д.), неорганические кислые соли (гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат и т. д. ) или соль с аминокислотой (аргинин, аспарагиновая кислота, глутаминовая кислота и т.д.), металлическая соль, такая как соль щелочного металла (соль натрия, соль калия и т.д.) и соль щелочно-земельного металла (соль кальция, соль магния и т.д.), соль аммония, соль органического основания (соль триметиламина, соль триэтиламина, соль пиридина, боль пиколина, соль дициклогексиламина, N,N-дибензилэтилендиамина и т.д.) или аналогичные.
В описании изобретения термин "низший" означает 1-6, предпочтительно 1-4 атома углерода, если не указано иначе.
Подходящий "низший алкил" может включать прямой или разветвленный, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил и т.п. среди которых предпочтение отдается метилу.
Подходящим "низшим алкениленом" является имеющий 2-6 атомов углерода и может включать винилен, пропенилен и т.п. где предпочтение отдается винилену.
Подходящим "низшим алкилом", необязательно замещенным гидрокси или ацилокси, может быть обычная группа, используемая в данной области, например указанный выше низший алкил, гидрокси/низший/алкил (например, гидроксиметил, гидроксиэтил и т. п. ), ацилокси/низший/алкил, например низший алкансилокси/низший/алкил (например, ацетилоксиэтил, ацетилоксипропил, ацетилоксибутил, ацетилоксипентил, пропионилоксиметил, бутирилоксиметил, гексаноилоксиметил и т.п.) и им подобные.
Подходящий "ар/низший/алкил", необязательно замещенный галогеном, может включать обычные группы, которые используются в области аминокислот и пептидной химии, такие как ар/низший/алкил (например, тритил, бензгидрил, бензил, фенэтил и т. д. ), моно- или ди- или тригалофенил/ низший/алкил (например, о-фторбензил, м-фторбензил, р-фторбензил, о-трифторметилбензил и т.п.) и им подобные.
Подходящими "аминозащитными группами" могут быть обычные защитные группы, которые используются в области аминокислот в пептидной химии, т.е. могут включать ацил, такой как низший алканоил (например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и т. п. ), низший алкокси карбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, т-бутоксикарбонил и т.п.) и другие.
Подходящие "низшие алкокси" могут включать прямые или разветвленные соединения, такие как метокси, этокси, пропокси, изопропокси, бутокси, гексилокси и т.п.
Подходящие "гидрокси/низший/алкил, ацилокси(низший)алкил" соответствуют описанным выше.
В частности, предпочтительными R1, R2, R3, R4, A и Y могут быть
следующие:
R1 фенил, бензофурил, индазолил; или индолил (например, 1Н-индол-3-ил, и т. п. ), 1-низший алкил индолил (например, 1-метил-1Н-индолил-2-ил, 1-метил (1Н-индол-3-ил,
1-изопропил-1Н-индол-3-ил и т.д.);
R2 гидрокси; или низший алкокси (например, метокси и т.п.);
R3 водород, низший алкил (например, метил и т.п.) или
гидрокси/низший/алкил (например, гидроксиметил, гидрокси этил и т.п.);
R4 фенил/низший/алкил (например, бензил, фенетил и т.п.) или галофенил(низший) алкил (например, о-фторбензил,
м-фторбензил, р-фторбензил и т.п. );
А карбонил или сульфонил;
Y связь или низший алкенилен (например, винилен и т.п.).
Далее детально описаны способы полу-чения целевого соединения (I).
Способ 1.
Целевое соединение (I) или его соль может быть получено реакцией соединения (II) или его производного в аминогруппе или его соли с соединением (III) или его производным в карбокси или сульфогруппе или его солью.
Подходящими реагирующими производными в аминогруппе соединения (II) могут быть имины типа основания Шиффа или его таутомерные енаминовые изомеры, образованные реакцией соединения (II) с карбониловым соединением, таким как альдегид, кетон и т.п. производные силила, полученные реакцией соединения (II) с силиловым соединением, таким как бис/триметилсилил/ацетамид, монотриметил- силил/ацетамид, бис/триметилсилил/мочевина и т.п. производное, образованное реакцией соединения (II) с фосфористым трихлоридом или фосгеном и т. п.
К подходящим солям соединения (II) и его реагирующим производным могут относиться соли, указанные для соединения (I).
Подходящее реагирующее производное в карбокси или сульфогруппе соединения (III) может включать галогенангидрид, ангидрид карбоновой кислоты, активированный амид, активированный сложный эфир и т.п. Подходящими примерами производных могут быть хлорангидрид, азид кислоты, ангидрид кислоты в кислоте, такой как фосфорная кислота (например, диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галогенированная фосфорная кислота и т.п.), диалкилфосфорная кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфоновая кислота (например, метансульфоновая кислота и т.п.), алифатическая карбоновая кислота (например, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, пивалиновая кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и т.п.) или ароматическая карбоновая кислота (например, бензойная кислота и т.п.); симметричный ангидрид кислоты; активированный амид с имидазолом, 4-замещенный имидазол, диметилпиразол, триазол или тетразол; или активированный сложный эфир (например, цианометиловый сложный эфир, метоксиметиловый сложный эфир, диметилиминометил [(CH3)N= CH-] сложный эфир, виниловый сложный эфир, пропаргиловый сложный эфир, р-нитрофениловый сложный эфир, 2,4-динитрофениловый сложный эфир, трихлорфениловый сложный эфир, пентахлорфениловый сложный эфир, мезилфениловый сложный эфир, фенилазофениловый сложный эфир, фенил тиоэфир, р-нитрофенил тиоэфир, р-крезил тиоэфир, карбоксиметил тиоэфир, пираниловый сложный эфир, пиридиловый сложный эфир, пиперидиловый сложный эфир, 8-хинолиновый тиоэфир и т.п.), или сложный эфир с N-гидрокси соединением (например, N, N-диметилгидроксиламин, 1-гидрокси-2-(1Н)-пиридон, N-гидроксисукцинимид, N-гидроксифталимид, 1-гидрокси-1Н-бензо- триазол и т.п.) и другие. Эти реагирующие производные могут быть произвольно выбраны в зависимости от используемого соединения (III).
Подходящими солями соединения (III) и его реагирующего производного могут быть соль основания, такая как соль щелочного металла (например, соль натрия, соль калия и т.п.), соль щелочноземельного металла (например, соль кальция, соль магния и т.п.), соль аммония, соль органического основания (например, триметиламиновая соль, триэтиламиновая соль, пиридиновая соль, пиколиновая соль, дициклогексиламиновая соль, N,N'-дибензилэтилендиаминовая соль и т.п.) или аналогичные или кислая соль добавления, как указано для соединения (I).
Реакция обычно проходит в обычном растворителе, таком как вода, спирт (например, метанол, этанол и т.п.), ацетон, диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин или любой другой органический растворитель, который отрицательно не влияет на реакцию. Эти обычные растворители также могут использоваться в смеси с водой.
В этой реакции, когда соединение (III) используется в форме свободной кислоты или ее соли, реакция предпочтительно проходит в присутствии конденсирующего вещества, такого как N,N-дициклогексилкарбодиимид, N-циклогексил-N'-морфолинэтилкарбодиимид, N-циклогексил-N'-(4- диэтиламинциклогексил)карбодиимид; N,N'-диэтилкарбодиимид, N,N'-диизопропилкарбодиимид; N-этил-N'-(3-метиламинопропил)карбодиимид, N,N'-карбонилбис- (2-метилимидазол); пентаметиленкетен-N-циклогексилимин, дифенилкетен-N-циклогексилимин, этоксиацетилен; 1-алкокси-1- хлорэтилен, триалкилфосфит, этилполифосфит; изопропилполифосфат; фосфористый оксихлорид(фосфорилхлорид), фосфористый трихлорид; дифенилфосфорилазид; тионилхлорид, оксалилхлорид, низший алкилгалоформат (например, этилхлороформат, изопропилхлороформат и т.п.); трифенилфосфин; 2-этил-7-гидроксибензизоксазоливая соль; 2-этил-5-(м-сульфофенил)изо- ксазоливая гидрооксидная внутримолекулярная соль; бензотриазол-1-ил-окси-трис-(диметиламин)фосфонийгексафторфосфат; 1-(р-хлорбензолсульфонилокси)-6-хлор-1Н- бензотриазол; так называемый реагент Вильсмаера, полученный реакцией N,N-диметилформамида с тионилхлоридом, фосгеном, трихлорметил хлорформатом, фосфористым оксихлоридом и т.п. или аналогичными.
Реакция также может проходить в присутствии неорганического или органического основания, такого как бикарбонат щелочного металла, три(низший)алкиламин, пиридин, N-(низший)алкилморфолин, N,N-ди(низший)алкилбензиламин и аналогичные.
Температура реакции значения не имеет, и она обычно осуществляется при охлаждении-нагревании.
Способ 2.
Целевое соединение (I-б) или его соль может быть получено реакцией удаления гидроксизащитной группы в R3a соединения (I-a) или его соли.
В настоящей реакции удаления применяются все методы реакции удаления гидроксизащитной группы, например гидролиз, восстановление, элиминирование с использованием кислоты Льюиса и т.п.
Далее детально объясняется способ получения исходного соединения (II).
Способ А.
Способ (I).
Соединение (VI) или его соль может быть получено реакцией соединения (IV) или его реагирующего производного в аминогруппе или его соли с соединением (V) или его реагирующим производным в карбоксигруппе или его солью.
Подходящими солями соединения (V) могут быть соли, указанные для соединения (III).
Подходящими солями соединения (VI) могут быть соли, указанные для соединения (I).
Эта реакция может проходить также, как и в способе 1, поэтому ее характер и условия аналогичны реакции способа 1.
Способ (2).
Соединение (VIII) или его соль может быть получено реакцией соединения (VI) или его соли с соединением (VII) или его реагирующим производным в аминогруппе или его солью.
Подходящими солями соединения (VII) могут быть соли, указанные для соединения (II).
Подходящими солями соединения (VIII) могут быть соли, указанные для соединения (I).
Эта реакция может проходить также, как и в способе 1, поэтому ее характер и условия аналогичны реакции способа 1 (реагирующие производные, растворители, температура и т.д.).
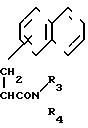
Способ (3).
Соединение (IX) или его соль может быть получено реакцией соединения (VIII) или его соли, такой как реакция элиминирования аминозащитной группы.
Подходящими солями соединений (VIII) и (IX) могут быть соли, указанные для соединения (I).
Эта реакция осуществляется в соответствии с обычными способами, такими как гидролиз, восстановление и т.п.
Реакция гидролиза преимущественно проходит в присутствии основания или кислоты, включая кислоту Льюиса.
Подходящее основание может включать неорганическое основание и органическое основание, такие как щелочной металл (например, магний, кальций и т.п. ), гидроокись или карбонат, или бикарбонат, гидразин, триалкиламин (например, триметиламин, триэтиламин, и т. п.), пиколин, 1,5-диазабицикло(4.3.0)-нон-5-ен, 1,4-диазабицикло(2.2.2)октан, 1,8-диазабицикло(5,4,0)ундец-7-ен или аналогичные.
Подходящие кислоты могут включать органическую кислоту (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифтор-уксусная кислота и т.д.), неорганическую кислоту (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, хлористый водород, бромистый водород, фтористый водород и т.п.) и соединения кислой соли присоединения (например, гидрохлорид пиридина и т.д.).
Удаление с использованием кислоты Льюиса, такой как тригалоуксусной кислоты (например, трихлоруксусная кислота, трифторуксусная кислота и т.д.), или аналогичной предпочтительно осуществляется в присутствии улавливающего катионы вещества (например, анизол, фенол и т.д.).
Реакция обычно проходит в растворителе, таком как вода, спирт (например, метанол, этанол и т.д.), хлористый метилен, хлороформ, тетрахлорметан, тетрагидрофуран, их смесь или любой другой растворитель, который не влияет отрицательно на реакцию. Жидкое основание или кислота также могут использоваться в качестве растворителя. Температура реакции особой роли не играет, и реакция обычно протекает при охлаждении нагревании.
Способ восстановления, применяемый для реакции удаления, может включать химическое восстановление и каталитическое восстановление.
Подходящими веществами восстановления, применяемыми при химическом восстановлении, являются соединения металла (например, тин, цинк, железо и т.д.) или металлического соединения (например, хлорид хрома, хромацетат и т.д.) и органической или неорганической кислоты (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трифторуксусная кислота, р-толуолсульфоновая кислота, хлористоводородная кислота, бромистоводородная кислота и т.д. ).
Подходящими катализаторами, применяемыми в реакции каталитического восстановления, являются обычные катализаторы, такие как платиновые катализаторы (например, платиновая пластина, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.п.), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на углероде, коллоидальный палладий, палладий на сульфате бария, палладий на карбонате бария и т.п.), никелевые катализаторы (например, восстановленный никель, оксид никеля и т.д.), железные катализаторы (например, скелетный катализатор и т.п.), медные катализаторы (например, восстановленная медь, скелетный медный катализатор и т.д.) и аналогичные.
Восстановление обычно проходит в общепринятом растворителе, который не влияет отрицательно на реакцию, таком как вода, метанол, этанол, пропанол, N, N-диметилформамид или их смесь. Кроме того, вышеупомянутая кислота, применяемая в химическом восстановлении в жидкости, также может быть использована в качестве растворителя. Подходящим растворителем используемым в реакции каталитического восстановления, может быть вышеупомянутый растворитель или другой обычный растворитель, такой как диэтиловый эфир, диоксан, тетрагидрофуран и т.п. или их смесь.
Температура реакции этого восстановления особой роли не играет, и она обычно проходит при охлаждении нагревании.
Способ (4).
Соединение (XI) или его соль могут быть получены реакцией соединения (IX) или его соли с соединением (X) или его реагирующим производным в карбоксигруппе или его солью.
Подходящими солями соединения (X) могут быть соли, указанные для соединения (III).
Подходящими солями соединения (XI) могут быть соли, указанные для соединения (I).
Эта реакция может проходить таким же образом, как и в способе 1, поэтому характер реакции и ее условия (например, реагирующие производные, растворители, температура реакции и т.д.), такие как в способе 1.
Способ (5).
Соединение (II) или его соль могут быть получены реакцией соединения (XI) или его соли, удаления аминозащитной группы.
Эта реакция может протекать таким же образом, как в способе (3), поэтому характер реакции и ее условия (например, основания, кислоты, восстанавливающие вещества, катализаторы, растворители, температура реакции и т.д.) такие же, как в способе (3).
Полученные вышеуказанными способами соединения могут быть выделены и очищены обычным способом, таким как пульверизация, перекристаллизация, хроматография в колонне, переосаждение и т.п.
Необходимо отметить, что соединение (I) и другие соединения могут включать один или несколько стереоизомеров благодаря асимметричным атомам углерода и все эти изомеры и их смеси включены в объем настоящего изобретения.
Целевые соединения (I) и их фармацевтически приемлемая соль обладают фармакологической активностью, такой как антагонизм к тахикинину, особенно антагонизм к веществу Р, антагонизм к нейрокинину А или антагонизм к нейрокинину В, и поэтому используются для лечения или профилактики вызванных тахикинином болезней, в частности болезней, вызванных веществом Р, например распираторных заболеваний, таких как астма, бронхит, ринит, кашель, мокрота и т.п. офтальмологических болезней, таких как конъюнктивит, весенний конъюнктивит и т.п. кожных заболеваний, например контактный дерматит, атонический дерматит, крапивная лихорадка и другие экзематоидные дерматиты; воспалительных болезней, таких как ревматический атрит, остеоатрит и т.п. боли (например, мигрень, головная боль, зубная боль, боли от опухолей, боли в спине и т.д.) и других аналогичных болезней.
Целевое соединение (I) может применяться при лечении или профилактике таких офтальмологических заболеваний, как глаукома, увеит и т.п. таких желудочно-кишечных заболеваний, как язва, неспецифический язвенный колит, слизистый колит, аллергия на продукты и т.п. воспалительных болезней, например нефрит и т.п. таких заболеваний органов кровообращения, как гипертония, стенокардия, сердечная недостаточность, тромбоз и т.п. эпилепсия, паралич, поллакиурия, слабоумие, болезнь Альцгеймера, шизофрения, хорея, карциноидный синдром и т.п. а также в качестве иммуноподавляющего вещества.
Для терапевтических целей соединения (I) и их фармацевтически приемлемые соли могут применяться в виде фармацевтического препарата, содержащего одно из указанных соединений в качестве активного ингредиента с фармацевтически приемлемым носителем, таким как органический или неорганический твердый или жидкий наполнитель, подходящим для перорального, парентерального, внешнего и ингаляционного применения. Указанный фармацевтический препарат может быть в виде капсул, таблеток, драже, гранул, раствора, суспензии, эмульсии и т.п. По желанию в препарат могут входить вспомогательные вещества, стабилизаторы, смачивающие вещества, эмульгаторы и другие обычно применяемые добавки.
Доза соединений (I) будет зависеть от возраста и состояния пациента, обычно средняя доза около 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг, 1000 мг соединения (I) может быть эффективной для лечения астмы и подобных заболеваний. Как правило, количество от 0,1 мг/человека до около 1000 мг/человека может применяться в день.
Далее приводятся фармацевтические данные некоторых соединений (I), чтобы показать полезные свойства целевого соединения (I).
Опытные соединения:
(a)

(b)

(c)

(d)


Методика проведения опыта.
а) Необработанный препарат оболочки легкого.
Умертвляли самцов морских свинок путем декапитации. Удаляли трахею и легкое и гомогенизировали в буферном растворе (0,25 М сахарозы, 500 мМ трис-HCl, pH 7,5, 0,1 мМ этилендиаминтетрауксусной кислоты) с использованием Политорона (кинематика). Затем гомогенат центрифугировали (1000 хг, 10 мин) для удаления аггрегации тканей и центрифугировали супернатант (14000хг, 20 мин) для получения пилюли. Пилюли вновь суспендировали в буферном растворе (5 мМ Трис-HCl, pH 7,5), гомогенизировали с тифлоновым гомогенизатором и центрифугировали (14000хг, 20 мин), чтобы получить выход пилюль, которые относятся к необработанным фракциям оболочки. Полученные пилюли до употребления хранили при температуре -70оС.
б) Связывание Н-вещества П с препаратом оболочки.
Замороженные необработанные фракции оболочки размораживали и суспендировали в среде I (50 мМ Трис-HCl pH 7,5, 5 мМ MnCl, 0,02% бычьего сыворотного альбумина, 2 мг/мл химостатина, 4 мг/мл лейпентина, 40 мг/мл бацитрацина). 3-Н вещество II (1 нМ) инкубировали до 100 мл препарата оболочки в среде I при 4оС в течение 30 мин в конечном объеме 500 мл. По окончании периода инкубации реагирующую смесь быстро профильтровывали через стеклянный Ватман ГФ/Б фильтр (который перед употреблением обрабатывали 3 ч 0,1% полиэтиленимином) при аспирации. Затем фильтры промывали 4 раза 5 мл буферного раствора (50 мМ Трис-HCl, pH 7,5). Измеряли радиоактивность в 5 мл Агвазола-2 в счетчике сцинциляции Паккарда (Packard Tri-Carb 4530).
Результаты опыта.
Опытные Ингибирование,
соединения
(0,1 μ/мл)
(а) 96
(б) 94
(в) 100
(г) 96
(2) Воздействие
перорального применения на бронхиальный отек у морских свинок, вызванный веществом Р.
Методика проведения опыта.
Самцам морских свинок (300-400 г) вводили внутривенно голубой раствор Иванса (20 мг/кг), содержащий гепарин (2000 МЕ/кг) и вещество II (ммолей/кг). Каждое опытное соединение (100 мг/кг), растворенное в диметилсульфоксиде, вводили перорально за 30 мин до инъекции. Через 10 мин животных умертвляли и перфузировали легкие с 50 мл солевого раствора. Отрезали трахею и бронхи, которые затем растворяли в 0,5 мл раствора 1N KOH при 37оС в течение 6 ч. После экстрагирования с 4,5 мл раствора ацетона фосфата (0,6 NH3PO4: ацетон:5:13) подсчитывали содержание ткани в голубом растворе Иванса колориметрическим анализом, которое было равно 620 нм.
Результаты опыта.
Опытные соединения Ингибирование,
(100 мг/кг)
(а) 94
(б) 82
(в) 60
(г) 96
Следующие примеры даются для детальной иллюстрации настоящего изобретения. В этих примерах употребляются следующие сокращения в дополнение к аббревиатуре, принятой ИЮПАК:
Ac ацетил;
Вос т-бутоксикарбонил;
BSA бистриметилсилидацетамид;
Bzl бензил;
Bzl (O-F) o-фторбензил;
Bzl (m-F) м-фторбензил;
Bzl (p-F) p-фторбензил;
НОВТ
N-гидроксибензотриазол;
IPE изопропиловый эфир;
Ме метил;
1 Nal 3-(1-нафтил)аланин;
2 Nal 3-(2-нафтил)аланин;
NMM N-метилморфолин;
4N-HCl/DOX
4N-хлористый водород в 1,4-диоксане;
Ph фенил;
Pri изопропил;
Pro (40H) 4-гидроксипролин;
Pro (40 Me) 4-метоксипролин;
ТЕА триэтиламин;
IFA
трифторуксусная кислота;
THF тетрагидрофуран;
WSC 1-этил-3-(3-диметиламинопропил)-карбодиимид.
В таблице даны исходные соединения и целевые соединения, полученные в следующих способах получения и примерах, где верхняя формула формула исходного вещества, а нижняя формула целевого соединения.
Приготовление 1. К суспендированной смеси исходного соединения (2,0 г) в смешанном растворителе воды (30 мл) и ацетона (30 мл) добавляли при охлаждении льдом триэтиламин (1,94 мл). К раствору добавляли раствор ди-трет-бутилдикарбоната (2,43 г) в ацетоне (10 мл) и раствор перемешивали при той же температуре в течение 2 ч и еще 2 ч при комнатной температуре, добавляли ди-трет-бутилдикарбонат (0,4 г). После удаления ацетона добавляли воду и водный раствор промывали один раз этилацетатом. Водный слой затем подкисляли до рН добавлением 6Н хлористоводородной кислоты и экстрагировали с этилацетатом. Экстракт промывали водным раствором хлорида натрия и высушивали над сульфатом магния. После выпаривания кристаллизировали остаток из смеси растворителя диизопропилового эфира и н-гексана, собирали фильтрацией и высушивали, что дало целевое соединение (2,46 г).
Т.пл. 91-93оС.
ИКС (Nujol): 3390, 1720, 1690, 1520, 1274, 1250, 1170 (см-1).
ЯМР (DMCO-d6, )δ: 1,28 (9H, c), 3,00 (1H, д, ABg, J 13,7 и 10,1 Гц), 3,20 (1Н, д, ABg, J 13,7 и 4,7 Гц), 4,20 (1Н, м), 7,16 (1Н, д, J 8,5 Гц), 7,4-7,6 (3Н, м), 7,7-7,9 (1Н, м).
Приготовление 2. К охлажденному льдом раствору исходного соединения (1,34 г), N-метилбензиламина (0,49 мл) и N-гидроксибензотриазола (0,51 г) в метиленхлориде (30 мл) добавляли 1-этил-3-(3-диметиламинопропил)-карбодиимид HCl (0,95 г). Раствор перемешивали при той же температуре 4 ч и всю ночь при комнатной температуре. После выпаривания реагирующую смесь экстрагировали с этилацетатом и промывали органический слой последовательно водой и водным раствором карбоната натрия, 0,5 N хлористоводородной кислотой, водой и водным раствором хлорида натрия, затем высушивали над сульфатом натрия. Выпаривание дало целевое соединение в виде масла (1,74 г).
ИКС (CHCl3): 3300, 1710, 1640, 1490, 1170 (см-1).
ЯМР (DMCO-d6, δ): 1,22 и 1,32 (9Н, с), 2,76 и 2,87 (3Н, с) 2,9-3,2 (2Н, м), 4,6-4,8 (3Н, м), 6,9-8,0 (13Н, м).
Приготовление 3. К охлажденному льдом раствору исходного соединения (1, 74 г) в хлориде метилена (17 мл) добавляли 4N-хлористый водород в 1,4-диоксане (17 мл). Раствор перемешивали при той же температуре 5 мин. Затем удаляли охлаждающую ванну и раствор перемешивали при комнатной температуре 30 мин, в это же время добавляли 4N-хлористый водород в 1,4-диоксане (8,4 мл). После выпаривания остаток растирали в порошок и высушивали над гидроокисью натрия в вакууме, что дало целевое соединение (1,54 г).
Т.пл. 141-145оС.
ИКС (Nujol): 3320, 2700, 1660, 1605, 1580, 1495, 1280 (см-1).
ЯМР (DMCO-d6, δ): 2,65 и 2,71 (3Н, с), 3,1-3,4 (2Н, м), 4,09, 4,59, и 4,35, 4,56 (2Н, два ABq, J 16,2 и 14,9 Гц соответственно), 4,7-4,8 (1Н, м), 7,0-7,25 (5Н, м), 7,35-7,6 (3Н, м), 7,8-8,0 (4Н, м), 8,51 (3Н, с).
Приготовление 4. К охлажденному льдом раствору исходного соединения (1,5 г), т-бутоксикарбонил-(2,2Р)-4-гидроксипролин-ОН (0,98 г) и N-гидроксибензотриазола (0,57 г) в смешанном растворителе хлорида метилена (40 мл) и диметилформамида (5 мл) добавляли 1-этил-3-(3-диметиламинопропил)-карбодиимид (0,77 мл). Раствор перемешивали при той же температуре 1 ч и при комнатной температуре в течение ночи. После выпаривания реакционную смесь экстрагировали с этилацетатом и промывали органический слой последовательно водным раствором гидрогенкарбоната натрия, водой, 0,5 N хлористоводородной кислотой, водой и водным раствором хлорида натрия, а затем высушивали над сульфатом магния. После выпаривания остаток очищали на силикагелевой колонне (75 г), используя в качестве растворителя смешанный растворитель хлороформа и метанола (50: 1) и получили целевое соединение (1,74 г) в виде аморфного твердого вещества.
ИКС (CHCl3): 3320, 3250, 1690, 1680, 1640, 1500, 1160 (см-1).
ЯМР (DMCO-d6, δ): 1,19 и 1,39 (9Н, с), 1,75-2,05 (2Н, м) 2,5-2,9 (3Н, м), 3,0-3,5 (4Н, м), 4,1-5,2 (6Н, м), 6, 95-7,3 (5Н, м), 7,4-7,6 (3Н, м), 7,75-7,95 (4Н, м), 8,6-8,7 (1Н, м).
Приготовление 5. К охлажденному льдом раствору исходного вещества (1,07 г) в метиленхлориде (11 мл) добавляли 4N-хлористый водород в 1,4-диоксана (8,2 мл). Раствор перемешивали при той же температуре 5 мин и при комнатной температуре 55 мин. После выпаривания остаток растирали в порошок с диизопропиловым эфиром, собирали фильтрацией и высушивали, после чего получили целевое соединение (0,90 г).
ИКС (Nujol): 3330, 2700, 1670, 1640, 1550 (см-1).
ЯМР (DMCO, d6, δ): 1,7-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,78 и 2,85 (3Н, с), 3,0-3,4 (4Н, м), 4,2-4,6 (4Н, м), 5,0-5,2 (1Н, м), 5,55-5,6 (1Н, м), 6,9-8,0 (13Н, м), 9,24 (1Н, д, J 7,6 Гц).
Приготовление 6. Целевое соединение было получено способом, аналогичным способу получения 1.
Т.пл. 90-91оС.
ИКС (Nujol): 3370, 1730, 1660, 1400, 1250, 1165 (см-1).
ЯМР (DMCO-d6, δ): 1,28 (9H, c), 3,20 (1H, дд, J 2,4 и 10,4 Гц), 3,59 (1Н, дд, J 17,8 и 3,9 Гц), 4,16-4,27 (1Н, м), 7,26 (1Н, д, J 8,4 Гц), 7,38-8,13 (7Н, м), 12,75 (1Н, ш.с.).
Приготовление 7. Целевые соединения были получены способом приготовления 2.
(1) ИКС (CHCl3): 3310, 2995, 1705, 1640, 1490, 1365, 1250 (см-1).
ЯМР (DMCO-d6, δ): 1,21 и 1,34 (9Н, с), 2,53 и 2,71 (3Н, с), 3,3-3,45 (2Н, м), 4,2-4,55 (2Н, м), 4,75-4,95 (1Н, м), 6,95-8,2 (13Н, м).
(2) Т.пл. 161-163оС.
ИКС (Nujol): 3360, 1650, 1660, 1305, 1245, 1185 (см-1).
ЯМР (DMCO-d6, δ): 1,28 (9H, c), 2,99 (1H, дд, J 13,1 и 5,5 Гц), 4,2-4,4 (3Н, м), 7,05-7,25 (6Н, м), 7,4-7,55 (3Н, м), 7,7-7,9 (4Н, м), 8,45 (1Н, д, J 5,8 Гц).
Масса: M+1 404.
(3) ИКС (CHCl3): 3450, 3310, 1705, 1635, 1605, 1365 (cм-1).
ЯМР (DMCO-d6, δ): 1,1-1,35 (9H, м), 2,53-3,0 (4Н, м), 2,77 и 2,84 (3Н, с), 3,2-3,7 (2Н, м), 4,5-4,7 (1Н, м), 7,05-7,95 (13Н, м).
(4) ИКС (CHCl3): 3320, 1705, 1640, 1595 (см-1).
ЯМР (DMCO-d6, δ): 1,15-1,4 (9H, м), 2, 75-3,2 (5Н, м), 4,3-4,85 (3Н, м), 6,8-7,65 (8Н, м), 7,7-7,9 (4Н, м).
(5) ИКС (CHCl3): 3450, 3320, 1710, 1640, 1590, 1365 (см-1).
ЯМР (DMCO-d6, ): 1,1-1,4 (9H, м), 2,79 и 2,94 (3Н, с), 2,8-3,15 (2Н, м), 4,45-4,85 (3Н, м), 6,8-7,6 (8Н, м), 7,65-7,95 (4Н, м).
(6) Т.пл. 122-123оС.
ИКС (Nujol): 3350, 1690, 1650, 1525, 1320, 1270 (см-1).
ЯМР (DMCO-d6, δ): 1,26 (9H, c), 2,66 (2H, т, J 7,0 Гц), 2,8-3,1 (2Н, м), 3,2-3,4 (2Н, м), 4,15-4,3 (1Н, м), 6,92 (1Н, д, J 8,48 Гц), 7,15-7,35 (5Н, м), 7,4-7,5 (3Н, м), 7,7-7,9 (4Н, м), 7,95-8,1 (1Н, м).
(7) ИКС (CHCl3): 3470, 3330, 1710, 1645, 1610, 1370 (см-1).
ЯМР (DMCO-d6, δ): 1,15-1,14 (9H, м), 2,7-3,2 (5Н, м), 4,35-4,85 (3Н, м), 6,85-8,0 (12Н, м).
Приготовление 8. Исходное соединение растворяли в метиленхлориде (35 мл) и к раствору добавляли N-метилфорфолин (0,90 мл). Раствор охлаждали до приблизительно (-22)-(-20)оС и при той же температуре добавляли по каплям изобутилхлорформат (1,04 мл), растворенный в метиленхлориде (2 мл). Раствор перемешивали 15 мин, а температуру поддерживали на уровне от -25 до -20оС. Затем раствор охлаждали до -30оС и добавляли N-бензилэтаноламин (1,21 г), растворенный в метиленхлориде (3 мл). Раствор перемешивали 2 ч, в то время как температуру подняли до 20оС. После концентрации остаток экстрагировали с этилацетатом и органический слой последовательно промывали водой, раствором карбоната натрия, водой, 0,5N хлористоводородной кислотой и раствором хлорида натрия и высушивали над сульфатом магния. После концентрации сырой продукт очищали на силикагелевой колонне (50 г), используя в качестве растворителя сначала хлороформ, а затем смесь хлороформа и метанола (1,5%) и получили целевое соединение (2,69 г).
ИКС (CHCl3): 3430, 3300, 1700, 1630 (cм-1).
Масса: 448.
Приготовление 9. К раствору исходного соединения (2,65 г) и пиридина (4,67 г) в тетрагидрофуране добавляли ацетилхлорид (0,928 г) при охлаждении льдом. После добавления смесь перемешивали 1 ч при той же температуре. После концентрации остаток экстрагировали с этилацетатом, последовательно промывали органический слой водой, 0,5N хлористоводородной кислотой, раствором карбоната натрия, раствором хлорида натрия и высушивали сульфатом магния. Концентрация дала целевое соединение (2,82 г) в виде масла.
ИКС (СHCl3): 3330, 1742, 1710, 1640 (см-1).
Приготовление 10. Целевое соединение получали в соответствии со способом 3.
(1) ИКС (Nujol): 3495, 1645, 1625, 1510, 1495, 1265 (cм-1).
ЯМР (DMCO-d6, )δ: 3,2-3,45 (1H, м), 3,36 (3Н, с), 3,87 (1Н, дд, J 8,6 и 4,3 Гц), 4,28 (2Н, с), 4,64 (1Н, дд, J 7,4 и 4,4 Гц), 6,75-8,15 (12Н, м), 8,73 (2Н, ш.с.).
(2) Т.пл. 183-185оС.
ИКС (Nujol): 3430, 1675, 1600, 1575, 1545, 1250, 1160 (см-1).
ЯМР (DMCO-d6, δ): 3,26 (2H, д, J 7,1 Гц), 4,1-4,25 (2Н, м), 4,36 (1Н, дд, J 15,1 и 6,4 Гц), 6,9-7,2 (5Н, м), 7,4-7,6 (3Н, м), 7,
7-7,95 (4Н, м), 8,48 (3Н, ш.с.), 9,05 (1Н, т, J 5,7 Гц)
(3) ИКС (CHCl3): 3500-3350, 1650, 1600, 1500 (см-1).
ЯМР (DMCO-d6, )δ: 2,3-2,8 (5H, м), 3,05-3,70 (4Н, м), 4,55-4,7 (1Н, м), 7,1-7,6 и 7,7-8,0 (12Н, м), 8,42 (3Н, ш.с.).
(4) ИКС (CHCl3): 3420, 1785, 1655, 1640, 1620, 1595 (см-1).
ЯМР (DMCO-d6, δ): 2,67 и 2,71 (3Н, с), 3,15-3,4 (2Н, м), 4,05-4,85 (3Н, м), 6,8-8,0 (11Н, м), 8,51 (3Н, ш.с.).
(5) ИКС (CHCl3): 3500-3350, 1785, 1655-1645, 1600, 1585, 1370 (см-1).
ЯМР (DMCO-d6, δ): 2,71 (3H, c), 3,1-3,4 (2H, м), 4,1-4,9 (3Н, м), 6,85-8,0 (11Н, м), 8,52 (3Н, ш.с.).
(6) ИКС (CHCl3): 3450-3150, 1665, 1600, 1455, 1370, 1120 (см-1).
ЯМР (DMCO-d6, δ): 2,45-2,7 (2H, м), 3,1-3,5 (4Н, м), 4,07 (1Н, т, J 6,7 Гц), 7,05-7,6 (8Н, м), 7,7-7,95 (4Н, м), 8,38 (3Н, ш.с.), 8,7-8,8 (1Н, м).
(7) Т.пл. 145оС (распад).
ИКС (Nujol): 3450, 1650, 1605, 1510, 1285, 1225 (см-1).
ЯМР (DMCO-d6, δ): 2,64 и 2,69 (3Н, с), 3,1-3,4 (2Н, м), 4,05-4,85 (3Н, м), 6,85-7,1 и 7,35-8,0 (11Н, м), 8,53 (3Н, ш.с.).
(8) ИКС (CHCl3): 3450-3370, 1740, 1650, 1600, 1365 (см-1).
ЯМР (DMCO-d6, δ): 1,89 и 1,96 (3Н, м), 3,0-3,8 (6Н, м), 3,9-4,9 (3Н, м), 7,0-7,6 (8Н, м), 7,
7-8,0 (4Н, м), 8,55 (2Н, ш.с.)
Cпособ приготовления 11. Целевые соединения были получены в соответствии со способом приготовления 4.
(1) ИКС (Neat): 3300, 1690, 1640 (см-1).
ЯМР (DMCO-d6, δ): 1,18 (c) и 1,39 (с) (9Н), 1,5-1,8 (1Н, м), 1,9-2,3 (1Н, м), 2,7-2,9 (3Н, м), 2,9-3,3 (2Н, м), 3,3-3,5 (2Н, м), 3,7-3,9 (1Н, м), 4,0-5,2 (4Н, м), 6, 8-7,3 (5Н, м), 7,3-7,6 (3Н, м), 7,6-7,94 (4Н, м), 8,4-8,5 (1Н, м).
(2) ИКС (CHCl3): 3420, 3300, 1680, 1630, 1520, 1490, 1400 (см-1).
ЯМР (DMCO-d6, δ): 1,32 и 1,41 (9Н, с), 1,6-1,8 (1Н, м), 1,8-2,0 (1Н, м), 2,44 и 2,66 и 2,74 (3Н, м), 3,2-3,5 (4Н, м), 4,15-4,60 и 4,9-5,3 (6Н, м), 6,70-8,60 (13Н, м).
(3) Т.пл. 205оС (распад).
ИКС (Nujol): 3400, 3350, 3280, 3100, 1680, 1645, 1570, 1540, 1290, 1170 (см-1).
ЯМР (DMCO-d6, δ): 1, 08 и 1,34 (9Н, с), 1,5-1,8 (1Н, м), 1,8-2,05 (1Н, м), 2,95-3,5 (4Н, м), 4,05-4,4 и 4,45-4,8 и 4,9-5,0 (6Н, м), 7,0-7,25 (5Н, м), 7,35-7,5 (3Н, м), 7,7-7,9 (4Н, м), 8,1-8,3 (1Н, м), 8,5-8,6 (1Н, м).
Масса: M+1 517.
(4) ИКС (CHCl3): 3420, 3300, 1690-1670, 1630, 1370 (см-1).
ЯМР (DMCO-d6, δ): 1,1-1,25 и 1,3-1,5 (9Н, м), 1,55-1,75 (1Н, м), 1,75-2,0 (1Н, м), 2,5-3,1 и 3,2-3,8 (11Н, м), 4,0-4,25 (2Н, м), 4,9-5,05 (2Н, м), 7,05-7,6 и 7,6-7,9 (12Н, м), 8,2-8,4 (1Н, м).
(5) ИКС (CHCl3): 3450-3250, 1700-1655, 1595 (см-1).
ЯМР (DMCO-d6, δ): 1,1-1,4 (9H, м), 1,55-1,75 (1Н, м), 1,8-2,0 (1Н, м), 2,7-3,5 (7Н, м), 4,1-5,2 (6Н, м), 6, 7-7,3 и 7,4-7,6 и 7,7-7,9 (11Н, м), 8,4-8,5 (1Н, м).
(6) ИКС (CHCl3): 3450-3300, 1690-1630, 1640, 1370, 1160 (см-1).
ЯМР (DMCO-d6, δ): 1,1-1,45 (9H, м), 1,6-1,8 (1Н, м), 1,85-2,05 (1Н, м), 2,7-3,5 (7Н, м), 4,1-4,7 и 4,9-5,2 (6Н, м), 6,7-7,94 (11Н, м), 8,35-8,5 (1Н, м).
(7) Т.пл. 202-203оС.
ИКС (Nujol): 3360, 3270, 3070, 1665, 1635, 1535, 1420, 1285, 1170 (cм-1).
ЯМР (DMCO-d6, δ): 1,07 и 1,40 (9Н, с), 1,5-1,75 (1Н, м), 1,8-2,0 (1Н, м), 2,55-2,7 (2Н, м), 2,9-3,4 (6Н, м), 4,0-4,2 и 4,25-4,65 (3Н, м), 4,93 (1Н, д.д. J 9,78 и 6,43 Гц), 7,1-7,55 и 7,65-8,2 (14Н, м).
(8) ИКС (CHCl3): 3450-3300, 1690-1670, 1640, 1370, 1160 (см-1).
ЯМР (DMCO-d6, δ): 1,0-1,5 (9H, м), 1,6-1,8 (1Н, м), 1,85-2,05 (1Н, м), 2,7-2,9 (3Н, м), 3,0-3,5 (4Н, м), 4,1-5,2 (6Н, м), 6,8-7, 05 и 7,4-7,95 (11Н, м), 8,35-8,5 (1Н, м).
(9) ИКС (СHCl3): 3450-3430, 1740, 1695-1680, 1365, 1160 (см-1).
ЯМР (DMCO-d6, δ): 1, 1-1,5 (9Н, м), 1,5-1,75 (1Н, м), 1,8-2,0 (4Н, м), 2,9-3,9 (8Н, м), 3,9-5,2 (6Н, м), 6,95-8,0 (12Н, м), 8,4-8,5 (1Н, м).
Способ приготовления 12. Целевые соединения были получены в соответствии со способом приготовления 5.
(1) ИКС (CHCl3): 3350-3200, 3050, 1685, 1645-1630, 1550, 1495, 1450 (см-1).
ЯМР (DMCO-d6,
δ): 1,60-1,90 (1H, м), 2,15-2,40 (1Н, м), 2,39 и 2,69 (3Н, м), 3,0-3,6 (4Н, м), 4,1-4,5 и 5,1-6,75 (6Н, м), 6,9-8,35 и 9,3-9,4 (12Н, м), 8,71 (1Н, ш.с), 10,18 (1Н, ш.с).4
(2) Т.пл.
250оС (распад).
ИКС (Nujol): 3300, 2700, 1665, 1650, 1560, 1295, 1255 (см-1):
ЯМР (DMCO-d6, δ): 1,75-1,95 (1H, м), 2,25-2,4 (1Н, м), 3,
0-3,5 (4Н, м), 4,15-4,45 (4Н, м), 4,65-4,8 (1Н, м), 5,52 (1Н, ш.с.), 7,0-7,2 (5Н, м), 7,45-7,55 (3Н, м), 7,75-7,9 (4Н, м), 8,56 (1Н, ш.с.), 8,74 (1Н, т, J 5,9 Гц), 9,04 (1Н, д, J 8,1 Гц), 9,83 (1Н,
ш.с).
(3) ИКС (CHCl3): 3400-3200, 1680, 1630 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,5-2,75 (2Н, м), 2, 79 и 2,83 (3Н, с), 2,95-3,2 и 3,2-4,7 (6Н, м), 4,2-4,45 и 4,9-5,1 (4Н, м), 7,05-7,55 и 7,65-8,0 (12Н, м), 8,6 (1Н, ш.с.), 9,1-9,25 (1Н, м), 9,97 (1Н, ш.с).
(4) ИКС (CHCl3): 3400-3200, 1680, 1640, 1590 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,78 и 2,88 (3Н, м), 3,0-3,4 (4Н, м), 4,2-4,75 и 5,0-5,2 и 5,5-5,7 (6Н, м), 6,8-7,95 (11Н, м), 8,6 (1Н, ш.с), 9,26 (1Н, д, J 7,6 Гц), 9,95 (1Н, ш.с).
(5) ИКС (CHCl3): 3350-3200, 1680, 1640, 1550 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,8 и 2,92 (3Н, с), 3,0-3,5 (4Н, м), 4,2-4,85 и 5,0-5,2 (6Н, м), 6,7-7,95 (11Н, м), 8,6 (1Н, ш. с), 9,26 (1Н, д, J 7,72 Гц), 10,05 (1Н, ш.с).
(6) Т.пл. 259-261оС.
ИКС (Nujol): 3300, 2700, 1670, 1645, 1555, 1290, 1250 (см-1).
ЯМР (DMCO-d6, δ): 1, 7-1,9 (1H, м), 2,25-2,4 (1Н, м), 2,65 (2Н, т, J 7,12 Гц), 2,9-3,45 (6Н, м), 4,2-4,7 (3Н, м), 5,54 (1Н, д, J 2,91 Гц), 7,1-7,55 и 7,7-7,9 (12Н, м), 8,5-8,7 (2Н, м), 8,97 (1Н, д, J 8,24 Гц), 9,9 (1Н, с).
(7) ИКС (CHCl3): 3400-3220, 1680, 1640, 1610, 1225 (см-1).
ЯМР (DMCO-d6, δ): 1,75-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,75 и 2, 84 (3Н, с), 3,0-3,4 (4Н, м), 4,2-4,65 и 5,1-5,7 (6Н, м), 6,8-7,1 и 7,3-7,95 (11Н, м), 8,62 (1Н, ш.с), 9,25 (1Н, J 7,47 Гц), 9,93 4(1Н, ш.с).
(2) Т.пл. 213-215оС.
ИКС (Nujol): 3280, 1660, 1635, 1590, 1570, 1535, 1340, 1250, 1225 (см-1).
ЯМР (DMCO-d6, δ): 1,65-1,85 (1Н, м), 1,85-2,05 (1Н, м), 3,0-3,4 (2Н, м), 3,6-4,4 (5Н, м), 3,86 (3Н, с), 4,5-4,7 (2Н, м), 5,04 (1Н, д, J 3,3 Гц), 7,0-7,3 (7Н, м), 7,3-7,6 (4Н, м), 7,7-8,0 (5Н, м), 8,09 (1Н, д, J 7,7 Гц), 8,2-8,45 (2Н, м).
(3) Т.пл. 130-134оС.
ИКС (Nujol): 3400, 3270, 3070, 1650, 1630, 1600, 1565, 1535, 1320 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1H, м), 1,9-2, 1 (1Н, м), 2,5-2,74 (2Н, м), 2,72 и 2,78 (3Н, с), 2,9-3,7 (6Н, м), 3,84 (3Н, м), 4,15-4,3 (1Н, м), 4,6-4,8 (1Н, м), 4,95-5,05 (2Н, м), 7,0-7,55 (11Н, м), 7,75-7,9 (5Н, м), 8,0-8,1 (1Н, м), 8,3-8,5 (1Н, м).
(4) Т.пл. 129оС (распад).
ИКС (Nujol): 3420, 3290, 3060, 1655, 1625, 1600, 1560, 1535, 1320 (см-1).
ЯМР (DMCO-d6 , δ): 1,7-1,9 (1H, м), 1,9-2,1 (1Н, м), 2,71 и 2,82 (3Н, с), 3,0-3,4 (2Н, м), 3,6-3,7 (1Н, м), 3,85 (3Н, с), 3,8-4,0 (1Н, м), 4,2-5,2 (6Н, м), 6,8-8,1 (16Н, м), 8,5-8,6 (1Н, м).
(5) Т.пл. 134-136оС.
ИКС (Nujol): 3380, 3060, 1685, 1655, 1590, 1545, 1335, 1250 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1Н, м), 1, 9-2,1 (1Н, м), 2,72 и 2,87 (3Н, с), 3,1-3,45 (2Н, м), 3,6-3,75 (1Н, м), 3,8-4,0 (1Н, м), 3,85 (3Н, с), 4,2-5,2 (6Н, м), 6,8-8,2 (16Н, м), 8,53 (1Н, ш.с).
(8) ИКС (CHCl3): 3320-3180, 1740, 1685, 1640, 1365 (см-1).
ЯМР (DMCO-d6, δ): 1,7-2,0 (4H, м), 2,1-2,4 (1Н, м), 3,0-3,7 и 4,0-4,2 (8Н, м), 4,25-5,7 (6Н, м), 7,0-8,0 (12Н, м), 8,6 (1Н, ш.с), 9,2-9,35 (1Н, м), 9,94 (1Н, ш.с).
Способ приготовления 13. К раствору исходного соединения (10,0 г) в метиленхлориде (20 мл) добавляли трифторуксусную кислоту (50 мл) при охлаждении льдом. Раствор перемешивали 30 мин при той же температуре и выпаривали под вакуумом. Остаток кристаллизовали добавлением эфира (50 мл) и фильтровали, промывали эфиром и высушивали, после чего получили целевое соединение (9,26).
Т.пл. 157-159оС.
ИКС (нуйол): 3400, 3330, 3150, 1670, 1625, 1565, 1495, 1200 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,95 (1Н, м), 2,2-2,45 (1Н, м), 2,79 и 2,87 (3Н, с), 3,0-3,4 (4Н, м), 4,2-4,7 и 5,0-5,15 (6Н, м), 6,9-8,0 и 9,15-9,3 (12Н, м), 8,65 (1Н, ш.с.), 9,71 (1Н, ш.с.).
П р и м е р 1. К охлажденному льдом раствору 1 метилиндол-3-карбоновой кислоты (0,33 г), исходного соединения (0,88 г) и N-гидроксибензотриазола (0,25 г) добавляли 1-этил-3-(3-диметиламинопропил)-карбодиимид (0,34 мл). Раствор перемешивали при той же температуре 1 ч и при комнатной температуре в течение ночи. После выпаривания реагирующую смесь экстрагировали с этилацетатом и последовательно промывали органический слой водным раствором карбоната натрия, водой, 0,5 N хлористоводородной кислотой, водой и водным раствором хлорида натрия, затем высушивали над сульфатом магния. После выпаривания остаток очищали на силикагелевой колонне (50 г), используя в качестве элюента смесь хлороформа и метанола (50:1). Собирали содержащие желаемое соединение фракции и выпаривали. Остаток затем кристаллизировали из этилацетата, собирали фильтрацией и высушивали для получения целевого соединения (0,66 г).
Т.пл. > 115оС.
ИКС (нуйол): 3430, 3300, 1656, 1640, 1600, 1574, 1535 (cм-1).
ЯМР (DMCO-d6, δ): 1,7-2,2 (2Н, м), 2,71 и 2,80 (3Н, с), 3,0-3,25 (2Н, м), 3,6-3,7 (1Н, м), 3,85 (3Н, с), 3,8-4,0 (1Н, м), 4,2-4,55 (3Н, м), 4,65-4,8 (1Н, м), 5,0-5,2 (2Н, м), 6,9-7,3 (7Н, м), 7,4-7,55 (4Н, м), 7,7-7,9 (5Н, м), 8,08 (1Н, q, J 7,4 Гц), 8,5-8,6 (1Н, м).
Элементный анализ расчетный для C36H36N4O4 ·H2O:
C 72,27, H 6,31, N 9,23.
Экспериментальный С 72,17, Н 6,42, N 9,04.
П р и м е р 2. Целевые соединения были получены способом, аналогичным способу примера 1.
(1) ИКС (CHCl3): 3420-3300, 3005, 1645, 1630, 1595, 1530, 1470, 1370 (см-1).
ЯМР (DMCO-d6, δ): 1,6-1,9 (1H, м), 1,9-2,15 (1Н, м), 2,42 и 2,63 (3Н, с), 3,35-4,0 (4Н, м), 3,87 (3Н, с), 4,2-4,4 (3Н, м), 4,6-5, 3 (3Н, м), 6,7-8,15 (17Н, м), 8,54 (1Н, ш.с).
(6) Т.пл. 195-197оС.
ИКС (нуйол): 3350, 3270, 3100, 1660, 1630, 1590, 1570, 1535, 1310, 1245 (см-1 ).
ЯМР (DMCO-d6, δ): 1,65-1,85 (1H, м), 1,85-2,0 (1Н, м), 2,45-2,6 (2Н, м), 3,0-3,35 (4Н, м), 3,65-4,1 (2Н, м), 3,88 (3Н, с), 4,25-4,6 (3Н, м), 5,05 (1Н, q, J 3,13 Гц), 7,0-7,6 (11Н, м), 7,45-8,05 (6Н, м), 8,15-8,25 (2Н, м).
(7) ИКС (CHCl3): 3450-3320, 1745, 1650-1635, 1375 (cм-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (4H, м), 1,9-2,1 (1Н, м), 3,0-4,1 (11Н, м), 4,2-5,2 (6Н, м), 6,9-7,95 (16Н, м), 8,0-8,15 (1Н, м), 8,5-8,65 (1Н, м).
(8) Т.пл. 105оС (распад).
ИКС (нуйол): 3450, 3270, 1665, 1640, 1605, 1575, 1535, 1510, 1245 (см-1).
ЯМР (DMCO-d6, δ): 1,7-1,9 (1H, м), 1,9-2,1 (1Н, м), 2,68 и 2,80 (3Н, м), 3,0-3,3 (2Н, м), 3,6-4,0 (2Н, м), 3,86 (3Н, с), 4,2-5,15 (6Н, м), 6,65-8,15 (16Н, м), 8,4-8,6 (1Н, м).
П р и м е р 3. К суспендированной смеси 1-метилиндол-2 карбоновой кислоты (225 мг) и N-гидроксибензотриазола (173 мг) в метиленхлориде (10 мл) добавляли 1-этил-3-(3-диметиламинопропил HCl (246 мг) при комнатной температуре. Раствор перемешивали при той же температуре 1 ч.
В другом реакционном сосуде растворяли в метиленхлориде (10 мл) исходное соединение (700 мг) и добавляли к раствору при охлаждении льдом триэтиламина (0,20 мл). После перемешивания при комнатной температуре в течение 15 мин к раствору добавляли вышеуказанный раствор. Раствор перемешивали 6 ч, затем добавляли триэтиламин и перемешивали в течение ночи. После концентрации остаток экстрагировали этилацетатом, органический слой последовательно промывали насыщенным раствором карбоната натрия, водой, 0,5 N хлористоводородной кислотой и раствором хлорида натрия и высушивали над сульфатом магния. После концентрации остаток кристаллизовали добавлением ацетона, фильтровали, промывали ацетоном и высушивали при 40оС в вакууме, получили целевое соединение (0,47 г).
Т.пл. 183,0-184,0оС.
ИКС (нуйол): 3350, 3275, 3110, 1670, 1640, 1577, 1530, 1495, 1465, 1355, 1340, 1318, 813, 735, 693 (см-1).
ЯМР (DMCO-d6, δ): 1,65-2,20 (2H, м), 2,730, 2,822 (3Н, с), 3,00-3,40 (2Н, м), 3,50-3,95 (2Н, м), 3,756, 3,827 (3Н, с), 4,05-5,20 (6Н, м), 6,05-7,90 (17Н, м), 8,50-8,65 (1Н, м).
Элементный анализ расчетный для C36H36N4O4: C 73,34, H 6,16, N 9,52.
Экспериментальный: C 73,44, H 6,17, N 9,50.
П р и м е р 4. Целевые соединения были получены способом примера 3.
(1) ИКС (CHCl3): 3300, 3000, 1630, 1560, 1450, 1420 (см-1)
ЯМР (DMCO-d6,
δ): 1,7-1,9 (1H, м), 2,2-2,4 (1Н, м), 2,6-2,8 (3Н, м), 3,0-3,3 (2Н, м), 3,36 (1Н, м), 3,67 (1Н, м), 3,8-5,2 (6Н, м), 6,8-7,9 (17Н, м), 8,65-8,85 (1Н, м).
(2) Т.пл. 111-114оС.
ИКС (нуйол): 3420, 3280, 1655, 1630, 1600, 1530, 1225 (см-1).
ЯМР (DMCO-d6, δ): 1,51 (6H, ш.с), 1,7-2,1 (2Н, м), 2,7-2,9 (3Н, м), 3,0-3,3 (2Н, м), 3,6-3,75 (1Н, м), 3,9-4,1 (1Н, м), 4,2-4,55 (3Н, м), 4,7-5,2 (4Н, м), 6,9-7,3 (7Н, м), 7,4-7,95 (9Н, м), 8,07 (1Н, м), 8,55 (1Н, м).
Элементный анализ для C38H40N4O4:
С 74,00, Н 6,54, N 9,08.
Экспериментальный: C 73,53, H 6,48, N 8,95.
(3) Т.пл. 219-222оС.
ИКС (нуйол): 3460, 3250, 3100, 1678, 1640, 1570 (см-1).
ЯМР (DMCO-d6, δ): 1,8-2,1 (2H, м), 2,6-2,9 (3Н, м), 3,1-3,3 (2Н, м), 3,7-4,2 (2Н, м), 4, 2-4,8 (3Н, м), 5,0-5,4 (3Н, м), 6,7-7,9 (15Н, м), 8,2 (1Н, м), 8,65 (1Н, м), 13,6 (1Н, ш.с).
П р и м е р 5. Целевое соединение было получено в соответствии со способом приготовления 5 и примером 1.
ИКС (нуйол): 3300, 1635, 1610, 1535 (см-1).
ЯМР (DMCO-d6, δ): 1,7-2,0 (1H, м), 2,0-2,3 (1Н, м), 2,71 (s) и 2,81 (с) (3Н), 2, 9-3,3 (2Н, м), 3,13 (s) и 3,15 (с) (3Н), 3,7-4,0 (6Н, м), 4,3-4,7 (3Н, м), 4,9-5,2 (1Н, м), 6,8-7,3 (7Н, м), 7,3-7,6 (4Н, м), 7,6-8,0 (5Н, м), 8,0-8,1 (1Н, м), 8,4-8,7 (1Н, м).
П р и м е р 6. К охлаждаемому льдом раствору исходного соединения (0,5 г) в метиленхлориде (15 мл) последовательно добавляли бис-триметилсилилацетамид (0,68 мл) и индол-3-карбонилхлорид (0,20 г). Раствор перемешивали при той же температуре 1 ч и в течение этого времени добавляли тремя порциями индол-3 карбонилхлорид (0,20, 0,08 и 0,20 г) и бистриметилсилилацетамид (0,3 мл). После концентрации остаток растворяли в тетрагидрофуране (10 мл) и добавляли при охлаждении льдом N-хлористоводородную кислоту (1 мл). Раствор перемешивали при той же температуре 15 мин. После концентрации остаток экстрагировали с этилацетатом. Органический слой последовательно промывали водным раствором карбоната натрия и насыщенным раствором хлорида натрия, высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией с силикагель, используя в качестве элюента сначала этилацетат, а затем смесь хлороформа, метанола и этилацетата (4:1:1), после чего получили целевое соединение в виде аморфного твердого вещества (0,28 г).
ИКС (нуйол): 3275, 1630, 1530 (см-1).
ЯМР (DMCO-d6, δ): 1,65-2,00 (2H, м), 2,708, 2,809 (3Н, с), 3,00-3,25 (2Н, м), 3,60-4,00 (2Н, м), 4,20-5,20 (6Н, м), 6,80-8,10 (17Н, м), 8,40-8,60 (1Н, ш.с), 11,60 (1Н, с).
П р и м е р 7. К суспендированной смеси исходного соединения (1,0 г) в метиленхлориде (20 мл) добавляли триэтиламин (0,51 мл) и циннамоилхлорид (0,31 г) при охлаждении льдом. Раствор перемешивали при этой же температуре 3 ч и в течение ночи при комнатной температуре. После выпаривания реакционную смесь экстрагировали с этилацетатом и последовательно промывали органический слой водным раствором карбоната натрия, водой, 0,5N хлористоводородной кислотой, водой и водным раствором хлорида натрия, высушивали над сульфатом магния. После выпаривания остаток очищали на силикагелевой колонне (50 г), используя в качестве элюента смесь хлороформа и метанола (40:1). Собирали фракции, содержащие целевое соединение, и выпаривали. Затем остаток кристаллизировали из изопропилового эфира, собирали фильтрацией, высушивали, получили целевое соединение (0,66 г).
ИКС4 (CHCl3): 3400, 3300, 3000, 1640, 1600, 1545, 1495, 1450, 1420 (см-1).
ЯМР (DMCO-d6, δ): 1,6-2,3 (2H, м), 2,6-2, 9 (3Н, м), 2,9-3,3 (2Н, м), 3,5-3,9 (2Н, м), 4,2-5,2 (6Н, м), 6,65-7,9 (19Н, м), 8,45-8,6 и 8,9-9,05 (1Н, м).
П р и м е р 8. Целевое соединение было получено в соответствии со способом примера 7.
ИКС (CHCl3): 3400, 1635, 1510, 1490, 1450, 1340, 1145 (см-1).
ЯМР (DMCO-d6, δ): 1,6-1,8 (1H, м), 1,8-2,0 (1Н, м), 2,77 и 2,86 (3Н, с), 3,0-3,35 (3Н, м), 3,45-3,65 (1Н, м), 4,1-4,7 и 4,95-5,2 (6Н, м), 6,95-7,9 (19Н, м), 8,4-8,55 (1Н, м).
П р и м е р 9. К охлажденному льдом раствору исходного соединения (0,72 г) в метаноле (15 мл) добавляли 1N гидрооксид натрия (1,1 мл). Раствор перемешивали 3 ч при комнатной температуре. После концентрации вещество экстрагировали с этилацетатом и последовательно промывали органический слой водой и раствором хлорида натрия, высушивали над сульфатом магния. После выпаривания растворителя твердый остаток промывали этилацетатом, фильтровали, высушивали, получили целевое соединение (0,60 г).
Т.пл. 115оС (распад).
ИКС (нуйол): 3470, 3290, 1665, 1620, 1605, 1575, 1535, 1250 (см-1).
Реферат
Использование: в медицине, как соединения, обладающие антогонистической активностью к тахикинину, веществу Г, неирокинину А. Сущность изобретения: производные дипептидов ф-лы (I), где R1-фенил, бензофурил, индазолил, индолил, н-низший алкилиндолил; Y - связь или низший алкенилен; А - карбонил или сульфонил; R2 - гидрокси или низший алкокси; R3 - водород, низший алкил, возможно замещенный гидроксилом или ацилоксигруппой; R4 - ар (низший) алкил, возможно замещенный галоидом. Способ получения рецепторов. Реагент 1: производное дипептида ф-лы (II) или его реакционноспособное производное, Реагент 2: R-Y-A-OH, или его реакционноспособное производное или его соль с последующим, в случае необходимости, деацилированием соединений ф-лы (I), где R - ацилокси (низший) алкил, с получением целевого продукта, где R - гидрокси (низший) алкил. Структура соединений (I) и (II) приведена в тексте описания. 2 с. и 7 з. п. ф-лы, 1 табл.
Формула
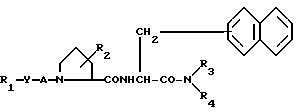
где R1 - фенил или группа

X - СН или N;
Z-кислород или NR5, где R5 - низший алкил или водород;
Y - связь или низший алкенилен;
A - карбонил, сульфонил;
R2 - гидрокси или низший алкокси;
R3 - водород, низший алкил, возможно замещенный гидроксилом или ацилоксигруппой;
R4 - ар(низший)алкил, возможно замещенный галоидом.



6. Производные дипептидов по п.1, отличающиеся тем, что R1 - фенил, А - карбонил, сульфонил, Y-низший алкенилен.

9. Способ получения дипептидов общей формулы I

где R1 - фенилен или группа:

X - СН или N;
Z - кислород или NR5, где R5 - низший алкил или водород;
Y - связь или низший алкенилен;
A - карбонил, сульфонил;
R2 - гидрокси или низший алкокси;
R3 - водород, низший алкил, возможно замещенный гидроксилом или ацилоксигруппой;
R4 - ар(низший)алкил, возможно замещенный галоидом,
отличающийся тем, что производное дипептида общей формулы II

или его реакционноспособное производное по иминогруппе подвергают взаимодействию с соединением формулы III
R1 - Y - A - OH,
где R1 - фенил или группа формулы

X - СН или N;
Z - кислород или NR5, где R5 - низший алкил или водород;
Y - связь или низший алкенилен;
A - карбонил, сульфонил или его реакционноспособное производное,
или его соль с последующим, в случае необходимости, деацилированием соединений формулы I, где R3 - ацилокси (низший)алкил с получением целевого продукта, где R3 - гидрокси(низший) алкил.

Комментарии