Способ получения вирусоподобных частиц растений - RU2579903C2
Код документа: RU2579903C2
Чертежи


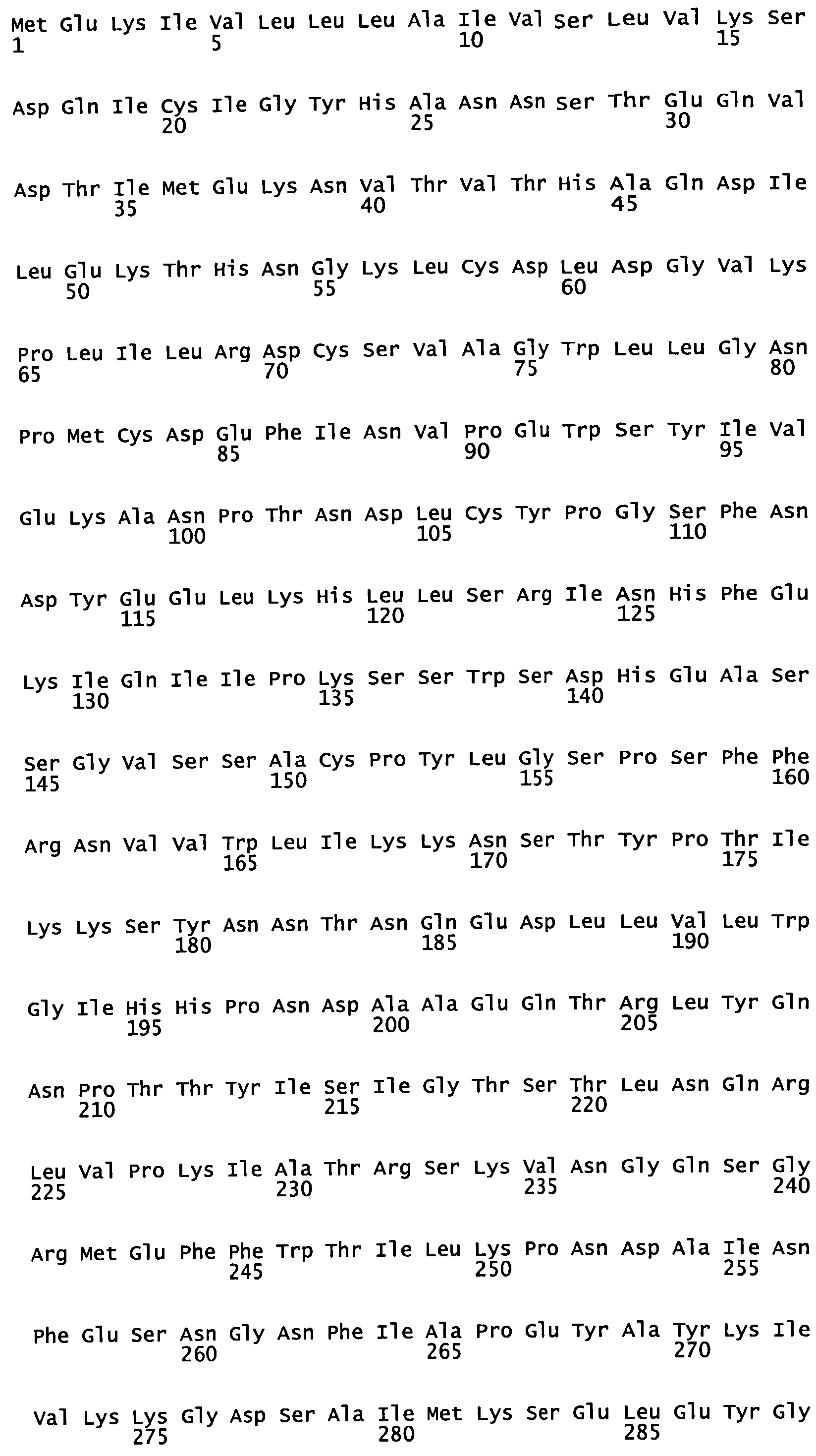

















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам получения вирусоподобных частиц (VLP).
Уровень техники
Современные методы рекомбинантной экспрессии в клетках- хозяевах, таких как Е. coli, культура клеток насекомых и культура клеток млекопитающих, позволяют достигать высоких уровней экспрессии и секреции белков в культуральной среде. При использовании этих систем достигаются высокие уровни экспрессии, правильный фолдинг (укладка) и соответствующая посттрансляционная модификация белков. Помимо этого, упрощается очистка экспрессируемого белка, так как внутриклеточные белки могут легко отделяться от других компонентов (ДНК, везикул, мембран, пигментов и т.д.). В случае систем экспрессии растительного происхождения и дрожжевой системы экспрессии клеточная стенка предупреждает секрецию экспрессируемого белка в культуральную среду.
Одним из основных методов борьбы с вирусными инфекциями является вакцинация. В ответ на вспышку эпидемии или для удовлетворения сезонных потребностей (например, ежегодное наступление "периода заболеваний гриппом", или недавние вспышки "свиного гриппа", наблюдаемые во всем мире) необходимо получать достаточное количество вакцины за короткий период времени. Современный мировой объем производства вакцин гриппа может быть недостаточен перед лицом пандемии гриппа. Помимо этого, доминирующие штаммы гриппа год от года изменяются, так что создание запасов в периоды низкой потребности в вакцине нецелесообразно. Экономичное массовое производство эффективной вакцины против гриппа имеет существенно важное значение.
Для приготовления противогриппозных вакцин можно применять вирусоподобные частицы (VLP). Сверхструктуры, такие как VLP, имитируют структуру вирусного капсида, но не содержат генов и поэтому не могут реплицироваться или обеспечивать механизм вторичной инфекции. VLP предлагают улучшенную альтернативу для выделенных (растворимых) рекомбинантных антигенов стимулировать мощный иммунный ответ.VLP собираются после экспрессии специфических вирусных белков и находятся на внешней поверхности, напоминая внешнюю поверхность соответствующего вируса, но в отличие от истинной вирусной частицы, не включают генетический материал. Презентация антигенов в частичной и мультивалентной структуре, аналогично презентации нативного вируса, обеспечивает усиленную стимуляцию иммунного ответа со сбалансированными гуморальным и клеточным компонентами. Полагают, что такое улучшение по сравнению со стимуляцией изолированными антигенами особенно верно для оболочечных вирусов, таких как оболочечные VLP, представляющие поверхностные антигены в их естественном мембраносвязанном состоянии (Grgacic and Anderson, 2006, Methods 40, 60-65). Помимо этого, показано, что VLP гриппа, с их организацией в виде наночастиц, являются лучшими кандидатами по сравнению с рекомбинантным гемагглютинином (НА) (т.е. мономерным НА, или НА, организованным в виде "розеток": сборки из 3-8 тримеров НА), и они способны активировать как гуморальный, так и клеточный иммунный ответ.(Bright, R.A., et. al.,. 2007, Vaccine 25, 3871-3878).
Подавляющее большинство вакцин гриппа, имеющихся в настоящее время на рынке, состоят из вирусных частиц или вирусных антигенов, полученных из вирионов, выращенных в яйцах. Получение аллантоисных вакцин основано на культивировании живых вирусов на аллантоисной оболочке куриных эмбрионов. "Сплит"- вакцины гриппа (вакцины из расщепленных вирусов гриппа) получают после химической дезактивации и разрушения очищенных вирионов с помощью детергента. Рекомбинантные антигены вирусов гриппа являются эффективной альтернативой вирусных антигенов в качестве "вакцинных продуктов". Рекомбинантные антигены можно получать, используя информацию о генетическом составе нового штамма, как только она становится доступной и позволяет быстро инициировать процесс производства. Однако, по- видимому, очищенные рекомбинантные НА субъединицы менее эффективны, чем инактивированные "сплит"- вакцины гриппа, и для того, чтобы вызвать мощный иммунный ответ, требуется повышенное содержание антигенов (Treanor et al., 2007, J. Am. Med. Assoc. 297, 1577-1582).
VLP гриппа получены в культивированных клетках млекопитающих при совместной экспрессии (коэкспрессии) всех 10 белков гриппа (Меnа et al., 1996, J. Virol. 70, 5016-5024). Некоторые вирусные белки необязательны для продуцирования VLP, и VLP гриппа в программах разработки вакцин получали при совместной экспрессии 2 основных антигенных оболочечных белков (НА и NA) с M1 или при совместной экспрессии только НА и M1 (Kang et al., 2009, Virus Res. 143, 140-146). Chen et al. (2007, J. Virol. 81, 7111-7123) показали, что один НА способен обусловливать образование и отпочковывание VLP, и в их системе совместную экспрессию с Ml можно опустить. Однако, так как найдено, что НА связывается с сиалилированными белками на поверхности клеток млекопитающих, продуцирующих VLP, совместно экспрессируется вирусная сиалидаза, обеспечивая высвобождение VLP из экспрессирующих клеток после отпочковывания.
Для ускорения разработки вакцин желательна более простая система продуцирования VLP, например, система, не требующая экспрессии неструктурных вирусных белков. Получение вирусных антигенов, включающих VLP, в системах растений обеспечивает преимущество продуцирования тем, что их можно выращивать в теплице или в поле и не требуется методов культивирования и обработки тканевых культур в асептических условиях.
В опубликованной Международной заявке РСТ WO 2006/119516 (выданной Williamson and Rybicki) раскрывается экспрессия полноразмерного и усеченного человеческого, оптимизированного по кодону Н5 НА вируса гриппа A/Vietnam/1194/2004 в растениях. В усеченной конструкции отсутствует мембранозаякоренный домен. Наивысшую аккумуляцию белка НА получают при использовании конструкций, нацеленных на ER. Конструкции, в которых отсутствует домен, нацеливающий на мембрану, не дают детектируемых количеств НА. О продуцировании VLP не сообщалось.
Продуцирование НА VLP вируса гриппа, которые содержит липидную оболочку, описывалось заявителями ранее в Международных патентных заявках WO 2009/009876 и WO 2009/076778 (принадлежащих D'Aoust et al.; обе эти заявки вводятся в данное описание посредством отсылки). В случае оболочечных вирусов может быть предпочтительным, чтобы липидный слой или мембрана удерживались вирусом. Состав липида может меняться в зависимости от системы (например, оболочка продуцируемого в растении оболочечного вируса будет включать растительные липиды или фитостеролы) и может способствовать усиленному иммунному ответу.
Сборка оболочечных VLP в трансгенном табаке, экспрессирующем HBV поверхностный антиген (HBsAg) HBV, описана Mason et al. (1992, Proc. Natl. Acad. Sci. USA 89, 11745-11749). Было показано, что продуцируемые в растениях HBV VLP, при парентеральном введении, вызывают мощный В- и Т- клеточный иммунный ответ (Huang et al., 2005, Vaccine 23, 1851-1858), но пероральная иммунизация в исследованиях с введением их с пищей вызывает умеренный иммунный ответ (Smith et al., 2003, Vaccine 21, 4011-4021). Greco (2007, Vaccine 25, 8228-8240) показал, что эпитопы вируса иммунодефицита человека (ВИЧ, HIV) при слиянии с HBsAg накапливаются (аккумулируются) в виде VLP при экспрессии в трансгенном табаке и в Arabidopsis (арабидопсисе), давая бивалентную VLP вакцину.
Экспрессия вирусного капсидного белка (NVCP) в трансгенных растениях табака и картофеля приводит к сборке безоболочечных VLP (Mason et al., 1996, Proc. Natl. Acad. Sci. USA 93, 5335- 5340). NVCP VLP продуцировались в листьях агроинфильтрованного Nicotiana benthamiana (семейство пасленовые) (Huang et al. 2009, Biotechnol. Bioeng. 103, 706-714), и их иммуногенность при пероральном введении продемонстрирована на мышах (Santi et al., 2008, Vaccine 26, 1846-1854). Введение взрослым добровольцам 2 или 3 доз сырого картофеля, содержащих 215-751 мкг NVCP в виде VLP, привело к проявлению иммунного ответа у 95% иммунизированных добровольцев (Tacket et al. 2000, J. Infect. Dis. 182, 302-305). Также получали безоболочечные VLP при экспрессии HBV корового антигена (HBcAg; Huang et al., 2009, Biotechnol. Bioeng. 103, 706-714), и основного капсидного белка L1 вируса папилломы человека (HPV) (Varsani et al., 2003, Arch. Virol. 148,1771-1786).
Перед тем, как использовать VLP в составе вакцины, может быть целесообразным отделить VLP от некоторых, или всех белков, углеводов и т.д., имеющихся в растении или растительном материале. Метод экстракции (извлечения) белка из внутриклеточного пространства, включающий процесс вакуумирования и центрифугирования для получения экстракта интерстициальной жидкости, содержащей целевой белок, описан в опубликованной Международной заявке РСТ WO 00/09725 (выданной Turpen et al.). Такой подход пригоден для малых белков (длиной 50 кДа или менее), которые проходят через поры при вакуумировании и центрифугировании, но не пригодны для белков с суперструктурами большего размера или белковых комплексов, таких как VLP.
McCormick et al 1999 (Proc Natl Acad Sci USA 96:703- 708) раскрывают применение сигнального пептида амилазы зерна риса, слитого с одноцепочечным Fv (scFv) эпитопом, для нацеливания экспрессируемого белка на внеклеточный компартмент с последующей вакуум-инфильтрацией тканей листа и стебля для извлечения scFv полипептидов. Moehnke et al., 2008 (Biotechnol Lett 30: 1259-1264) описывают применение вакуум-инфильтрации по McCormick для получения рекомбинантного растительного аллергена из растения табака методом экстракции апопласта. В опубликованной Международной заявке РСТ WO 2003/025124 (выдана Zhang et al.) раскрывается экспрессия scFv иммуноглобулинов в растениях, нацеливающих на апопластическое пространство, с применением мышиных сигнальных последовательностей.
Принимая во внимание сложность VLP и растительной ткани, в которой их можно продуцировать, все еще остается потребность в способах получения VLP, которые по существу не содержат растительных белков или могут быть легко отделены от них, с сохранением структурных и иммуногенных характеристик оболочечного вируса.
Раскрытие изобретения
Настоящее изобретение относится к способам получения вирусоподобных частиц Ha(VLP) основе растений. Более конкретно, настоящее изобретение относится к способам получения VLP, содержащих антигены вируса гриппа.
Целью данного изобретения является предоставление усовершенствованного способа получения вирусоподобных частиц на основе растений.
Настоящее изобретение предусматривает способ (А) получения VLP на основе растений, включающий получение растения или растительного материала, содержащего VLP на основе растений, локализованных в апопласте (во внеклеточной структуре); получение фракции протопластов и фракции апопласта, причем фракция апопласта содержит VLP на основе растений; и регенерацию (выделение) фракции апопласта. Помимо этого, способ может включать стадию очистки VLP на основе растений от фракции апопласта. VLP на основе растений может представлять собой химерную VLP на основе растений. VLP на основе растений можно выбирать из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса. VLP на основе растений могут содержать гемагглютинин вируса гриппа. Фракции апопласта и протопластов можно получать, обрабатывая растение или растительный материал с помощью ферментной композиции. Ферментная композиция может содержать одну или более пектиназ, одну или более целлюлаз или одну или более пектиназ и одну или более целлюлаз. Далее, при необходимости, ферментная композиция не включает липазу или протеазу, или композиция не включает дополнительную липазу или протеазу.
Растение или растительный материал можно получать выращиванием, сбором или выращиванием и сбором растения. Растительный материал может представлять собой некоторую часть растения или целое растение, одну или более растительных клеток, листья, стебли, корни растения или культивируемые клетки растения.
Настоящее изобретение включает способ получения VLP на основе растений, как описано выше (Метод А), отличающийся тем, что нуклеиновую кислоту, кодирующую VLP, выбранный из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса, временно (транзиторно) вводят в растение. Или же нуклеиновую кислоту стабильно интегрируют в растительный геном.
Настоящее изобретение включает способ получения VLP на основе растений, описанный выше (Метод А), дополнительно включающий стадию очистки VLP на основе растений от фракции апопласта. Стадия очистки может включать фильтрование фракции апопласта глубинной фильтрацией, при этом получают осветленный экстракт, с последующей хроматографией осветленного экстракта на катионообменной смоле.
Не желая связывать себя какой-либо теорией, можно сказать, что белки, полученные из апопласта, являются более гомогенными, так как промежуточные формы посттрансляционных модифицированных белков или белки, включающие другие типы процессирования, которое происходит в различных внутриклеточных компартментах, не экстрагируются совместно. Повышенная степень гомогенности рекомбинантного белка, как правило, позволяет в результате получать препарат, содержащий белок, более высокого качества, и в конце концов можно получать продукт с более благоприятными свойствами, включая более высокую эффективность, более продолжительный период полужизни или лучшие иммуногенные свойства. Например, белки крови с высокой степенью гликозилирования маннозой элиминируют в кровотоке быстрее, чем белки со сложным гликозилированием. В гликозилированном белке, продуцированном во фракции апопласта, наблюдается гликозилирование более сложного типа. Поэтому у белка из апопласта, полученного методами по данному описанию, включая разрушение (гидролиз, расщепление) клеточной стенки, продолжительность полужизни в кровотоке выше.
Настоящее изобретение предусматривает также способ (В) получения VLP на основе растений, содержащих оболочку из растительных липидов, причем этот способ включает получение растения или растительного материала, содержащего VLP, локализованные в апопласте; обработку растения или растительного материала ферментной композицией с получение фракции протопластов и одной или более одной композиции белка апопласта; выделение одного или более белковых комплексов апопласта из фракции протопластов, причем один или более белковых комплексов апопласта содержат VLP. Ферментная композиция может содержать одну или более пектиназ, одну или более целлюлаз или одну или более пектиназ и одну или более целлюлаз. Далее, при необходимости, ферментная композиция не включает липазу или протеазу, или композиция не включает дополнительную липазу или протеазу. VLP на основе растений может представлять собой химерную VLP на основе растений. VLP на основе растений можно выбирать из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса. VLP на основе растений могут содержать гемагглютинин вируса гриппа.
Настоящее изобретение включает способ получения VLP, описанный выше (Метод В), отличающийся тем, что нуклеиновую кислоту, кодирующую VLP, выбранную из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса, вводят в растение транзиторно (временно). Или же, нуклеиновую кислоту стабильно интегрируют в геном растения.
Настоящее изобретение охватывает способ получения VLP на основе растений, описанный выше (Метод В), дополнительно включающий стадию очистки VLP на основе растений от фракции апопласта. Стадия очистки может включать фильтрование фракции апопласта глубинной фильтрацией, при этом получают осветленный экстракт, с последующей хроматографией осветленного экстракта на катионообменной смоле.
VLP на основе растений могут включать VLP, содержащие один или более НА полипептидов вируса гриппа. НА полипептид вируса гриппа может также представлять собой химерный НА полипептид. Кроме того, VLP на основе растений могут содержать гемагглютинирующую активность. Растения или растительный материал можно получать выращиванием, сбором или выращиванием и сбором или выращиванием и сбором растения. Растительный материал может представлять собой некоторую часть растения или целое растение, или одну или более растительных клеток, листья, стебли, корни растения или культивированные клетки растения.
Настоящее изобретение охватывает также способ (С) получения VLP на основе растений, включающий получение растения или растительного материала, содержащего VLP на основе растений, расщепление (гидролиз) растительного материала с помощью ферментной композиции, разрушающей клеточную стенку, с образованием обработанной (расщепленной) фракции и фильтрование обработанной (расщепленной) фракции, в результате чего получают отфильтрованную фракцию, и извлечение VLP на основе растений из отфильтрованной фракции.
Ферментная композиция может содержать одну или более пектиназ, одну или более целлюлаз или одну или более пектиназ и одну или более целлюлаз. Далее, при необходимости, ферментная композиция не включает липазу или протеазу, или композиция не включает дополнительную липазу или протеазу. VLP на основе растений может представлять собой химерную VLP на основе растений. VLP на основе растений можно выбирать из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса. VLP на основе растений могут содержать гемагглютинин вируса гриппа.
Настоящее изобретение включает способ получения VLP, описанный выше (Метод С), отличающийся тем, что нуклеиновую кислоту, кодирующую VLP, выбранную из группы вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков и белков оболочки вируса, вводят в растение транзиторно (временно). Или же, нуклеиновую кислоту стабильно интегрируют в геном растения.
Настоящее изобретение охватывает способ получения VLP на основе растений, описанный выше (Метод С), дополнительно включающий стадию очистки VLP в отфильтрованной фракции (фракции после фильтрации) от клеточного осадка и нерастворимых материалов. Стадию отделения (выделения) можно осуществлять центрифугированием, глубинной фильтрацией или как центрифугированием, так и глубинной фильтрацией, получая осветленную фракцию. VLP на основе растений можно далее очищать хроматографией, например, осветленный экстракт можно очищать хроматографией на катионообменной смоле.
VLP на основе растений могут включать VLP, содержащие один или более НА полипептидов вируса гриппа. НА полипептид вируса гриппа может также представлять собой химерный НА полипептид. Кроме того, VLP на основе растений могут содержать гемагглютинирующую активность. Растения или растительный материал можно получать выращиванием, сбором или выращиванием и сбором или выращиванием и сбором растения. Растительный материал может представлять собой некоторую часть растения или целое растение, или одну или более растительных клеток, листья, стебли, корни растения или культивированные клетки растения.
Не желая связывать себя какой- либо теорией, можно сказать, что VLP на основе растений, содержащие липиды растительного происхождения, могут вызывать более сильный иммунный ответ, чем VLP, полученные в других системах, и что иммунная реакция, вызванная этими VLP, сильнее иммунной реакции, вызванной живой или аттенюированной вакциной на основе целых вирусных частиц.
Композиция белкового экстракта, полученного при использовании клетки-хозяина, является сложной и, как правило, содержит межклеточные и внутриклеточные компоненты наряду с белком или целевой супраструктурой, которую нужно выделять. Получение фракции апопласта с последующей стадией разделения внутриклеточных белков и компонентов является предпочтительным, так как может происходить обогащение белком или целевой супраструктурой и повышаться эффективность процесса производства. Более простой процесс, включающий меньше эффективных стадий, может иметь результатом значительное повышение выхода и уменьшение стоимости. Обнаружено также, что процесс разрушения клеточной стенки под действием ферментов, разрушающих клеточную стенку, повышает выход VLP белка, даже если протопласты не остаются интактными в процессе экстракции. Не желая связывать себя какой- либо теорией, можно сказать, что на стадии разрушения клеточных стенок полимерные компоненты клеточных стенок могут освобождаться и способствовать высвобождению VLP, иначе ассоциированных с клеточной стенкой. Этот протокол позволяет также свести к минимуму загрязнение VLP во внутриклеточных компонентах.
Методы разрушения стенок растительных клеток известны, и смеси для ферментных коктейлей, которые разрушают клеточные стенки, могут меняться. Настоящее изобретение не ограничивается используемым методом разрушения клеточных стенок.
Методы по данному описанию вызывают меньшее разрушение и загрязнение экстракта VLP на основе растений по сравнению с методами получения VLP на основе растений, включающими гомогенизацию, смешение или измельчение. Методы по данному описанию предоставляют фракцию апопласта растительной ткани, это может сохранять целостность протопластов и их компонентов. Метод по данному описанию позволяет эффективно очищать VLP, даже если протопласты, или часть протопластов, утрачивают свою целостность и более не являются интактными.
Эти методы обеспечивают более высокий выход VLP по сравнению с методами экстракции VLP, включающими стандартные методики разрушения ткани, например, гомогенизацию, смешение или измельчение. Повышенный выход может быть достигнут, частично, вследствие уменьшения напряжения сдвига, которое нарушает структурную целостность VLP и/или липидной оболочки. Получение VLP из фракции апопласта может быть предпочтительным, так как фракции апопласта содержат значительно меньше, или совсем не содержат, цитоплазматических белков. Следовательно, отделение VLP от других белков и материала, включая НА мономеры, тримеры или фрагменты НА, во фракции апопласта осуществляется просто. Однако, повышенные выходы VLP можно также получать методами по данному описанию, даже если препарат протопластов, или часть препарата протопластов, не являются интактными.
VLP по настоящему изобретению характеризуются также более высокой гемагглютинирующей активностью, чем VLP, полученные стандартными методами разрушения тканей. Эта повышенная гемагглютинирующая активность может являться результатом более высокого выхода интактных VLP (меньше свободных НА мономеров или тримеров в растворе), более высокого выхода интактных VLP с интактными липидными оболочками, или их сочетания.
Преимущество вакцин, приготовленных с применением VLP, по сравнению с вакцинами, приготовленными из целых вирусов, заключаются в том, что они не являются инфицирующими. Следовательно, меры предосторожности при работе с биологическим материалом не являются актуальными и не требуются для продуцирования. Другим преимуществом VLP на основе растений является то, что они позволяют выращивать систему экспрессии в теплице или в поле, являясь поэтому значительно более экономичными и подходящими для промышленных масштабов.
Кроме того, растения не содержат ферментов, участвующих в синтезе и присоединении остатков сиаловой кислоты к белкам. VLP можно продуцировать в отсутствие нейраминидазы (NA), и отсутствует необходимость в том, чтобы совместно экспрессировать NA, или обрабатывать продуцирующие клетки, или экстрагировать с применением сиалидазы (нейраминидазы), чтобы гарантировать продуцирование VLP в растениях.
В этом кратком изложении изобретения необязательно описываются все признаки изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Эти и другие признаки изобретения станут более очевидными из нижеприведенного описания, в котором даются ссылки на прилагаемые фигуры:
На Фигуре 1 схематически представлена кассета экспрессии на основе CPMVHT (конструкция 685) для экспрессии Н5 A/Indonesia/5/05 гемагглютинина.
На Фигуре 2А показаны нуклеотидная последовательность (SEQ ID NO: 1) участка конструкции для экспрессии H5/Indo (конструкции номер 685) от РасI (в направлении 3'-5' от 35S промотора) до AscI (сразу же 5'-3' от NOS терминатора транскрипции). Последовательность, кодирующая Н5 из A/Indonesia/5/2005, подчеркнута. На Фигуре 2 В показана аминокислотная последовательность (SEQ ID NО: 2) Н5 A/Indonesia/5/05 гемагглютинина, кодируемая конструкцией номер 685.
На Фигуре 3 показана эксклюзионная хроматография (SEC) гемагглютинин (НА)- содержащих структур. После центрифугирования расщепленного растительного экстракта осадок ресуспендируют и фракционируют методом SEC. На Фигуре 3А показано содержание тотального растворимого белка во фракции (черные треугольники; % от максимума, слева от оси Y; определяют методом Бредфорд). Также показана гемагглютининовая активность собранных фракций (закрашенные столбцы; справа от оси Y). На Фигуре 3 В представлено изучение SEC- элюированных фракций методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия SDS- PAGE. Перед анализом Фракции осаждают ацетоном и перед анализом ресуспендируют в объеме 1/40 восстанавливающего буфера для образцов. Гель окрашивают 0.1% раствором Кумасси R- 250. Очищенные VLP используют в качестве контроля. Полоса, соответствующая НАО мономеру, показана стрелкой. MW - стандарты молекулярной массы (кДа); С - Очищенные VLP (контроль); дорожки от 7 до 10 и от 14 до 16 соответствуют номерам фракций, элюированных в ходе SEC, показанным на Фигуре ЗА.
На Фигуре 4 сравниваются профили белков, полученных ферментативным расщеплением и механической гомогенизацией с применением гомогенизатора Comitrol™. Образцы обрабатывают в денатурирующем буфере для образцов и белки разделяют методом SDS- PAGE элюированных фракций. Гели окрашивают 0.1% раствором Кумасси R- 250. MW - Стандарты молекулярной массы (кДа); дорожка 1 -25 мкл смеси ферментов; дорожка 2-25 мкл продуктов ферментативного расщепления растительной ткани и дорожка 3-5 мкл экстракта, полученного на гомогенизаторе Comitrol.
На Фигуре 5 показана нуклеотидная последовательность (SEQ ID NO: 9) кассеты экспрессии НА, включающая промотор и 5' UTR (нетранслируемую область) пластоцианина люцерны, гемагглютинин- кодирующую область Н5 из A/Indonesia/5/2005 (Конструкция # 660), 3' UTR и терминаторную последовательность пластоцианина люцерны.
На Фигуре 6 показано, что нанесение (захват) НА-VLP на катионообменную смолу непосредственно приводит к отделению НА-VLP во фракции апопласта. Образцы обрабатывают невосстанавливающим буфером для образцов и белки разделяют методом SDS- PAGE. Гели окрашивают 0.1% раствором Кумасси R-250. Дорожка 1: Фракция апопласта после центрифугирования. Дорожка 2- 3: Фракция апопласта после последующей микрофильтрации; Дорожка 4: Загрузка на катионообменную смолу; Дорожка 5: Проточная фракция с катионообменной колонки. Дорожка 6; элюция с катионообменной колонки, концентрировано 10Х; Дорожка 7:
Стандарты молекулярной массы (кДа).
На Фигуре 7 показан полученный способом анализа Nanoparticle Tracking analysis, (NTA) профиль H5/Indo VLP (А) и Hl/Cal VLP (В) после осветления без добавления NaCl к буферу для расщепления и Hl/Cal VLP (С) с таким добавлением. Эксперименты NTA проводят на приборе NanoSight LM20 (NanoSight, Amesbury, UK). Прибор снабжен голубым лазером (405 нм), камерой для образцов и уплотнителем о-ring из фторэластомера Viton. Видеоизображения регистрируют при комнатной температуре и анализируют с помощью программы NTA 2.0. Образцы регистрируют в течение 60 сек. Затвор и усилитель выбирают вручную таким образом, чтобы получить оптимальное разрешение для частиц.
На Фигуре 8 показан Вестерн-блоттинг экстракта Н3/Brisbane VLP, получаемого ферментативным расщеплением с применением различных буферов. Дорожка 1) Стандартный чистый рекомбинантный НА (5 мкг, от Immune Technology Corp.IT-003-0042p) Дорожки со.2 до 5 содержат 7 мкл центрифугированного ферментативного экстракта, применяют следующие буферы: Дорожка 2) 600 мМ маннита +125 мМ цитрата+75 мМ NaPO4+25 мМ ЭДТА+0.04% бисульфита рН6.2, Дорожка 3) 600 мМ маннита +125 мМ цитрата+75 мМ NaPO4+50 мМ ЭДТА+0.04% бисульфита рН 6.2, Дорожка 4) 200 мМ маннита+125 мМ цитрата+75 мМ NaPO4+25 мМ ЭДТА+0.03% бисульфита рН 6.2, Дорожка 5) 200 мМ маннита+125 мМ цитрата+75 мМ NaPO4+50 мМ ЭДТА+0.03% бисульфита рН 6.2. Стрелкой показан сигнал иммунодетекции НАО.
Осуществление изобретения
Настоящее изобретение относится к способам получения вирусоподобных частиц (VLP) на основе растений. Более конкретно, настоящее изобретение относится к способам получения VLP, содержащих гемагглютинин вируса гриппа (НА).
Ниже представлено описание предпочтительного варианта изобретения.
Настоящее описание включает способ получения целевого белка или целевой белковой супраструктуры. Целевой белок может находиться в апопласте или внеклеточном компартменте, соответствующем участку растительной клетки, за исключением компартмента протопластов/сферопластов. Этот способ включает извлечение, разрушение или как разрушение, так и извлечение целлюлозной клеточной стенки, окружающей растительные клетки. При разрушении клеточной стенки полимерные компоненты клеточной стенки разрыхляются и целевой белок или целевая белковая супраструктура может легче высвобождаться. Этим способом происходит обогащение целевым белком или целевой белковой супраструктурой, так как компартмент протопластов/сферопластов, который содержит основные белки и компоненты клеток- хозяев, отделяется от апопласта. Как отмечается ниже, способ по данному изобретению эффективен также при получении целевого белка или целевой белковой супраструктуры, если в ходе процесса утрачивается целостность компартмента протопластов/сферопластов, если компартмент протопластов/ сферопластов не является интактным и если часть белков и компонентов клеток-хозяев из компартмента протопластов/сферопластов присутствует во фракции апопласта.
Примерами белковых супраструктур являются структуры, состоящие из двух или более полипептидов; полипептиды могут быть одинаковьми или различными;
будучи различными, они могут присутствовать в примерном соотношении от 1:1 до 10:1 или выше. Белковая супраструктура может дополнительно содержать один или более липидов, фосфолипидов, нуклеиновых кислот, мембран и т.п.Два или более полипептидов могут быть связаны ковалентной связью, дисульфидным мостиком, за счет взаимодействия зарядов, за счет гидрофобного взаимодействия, за счет сил ван дер Ваальса, за счет водородной связи и т.п.Примером белковой супраструктуры является вирусоподобная частица (VLP), которая может быть оболочечной или безоболочечной, например, вирусный оболочечный белок, вирусный структурный белок, вирусный капсидный белок или белок вирусной оболочки.
Настоящее изобретение включает также способ получения вирусоподобных частиц (VLP) на основе растений. Способ включает получение растения или растительного материала, содержащего VLP, локализованные в апопласте; получение фракции протопластов/сферопластов и фракции апопласта из растительного материала, фракции апопласта, содержащей VLP на основе растений и извлечение фракции апопласта.
Настоящее изобретение включает также способ получения VLP, содержащих растительную липидную оболочку. Способ включает получение растения или растительного материала, содержащего VLP, обработка растения или растительного материала ферментной композицией с целью получения одного или более комплексов белков апопласта и фракции протопластов/сферопластов, и выделение одного или более комплексов белков апопласта из фракции протопластов. Один или более комплексов белков апопласта содержит VLP, включающие растительную липидную оболочку.
Настоящее изобретение включает также способ получения VLP на основе растений, включающий получение растения или растительного материала, которые содержат VLP на основе растений, расщепление растительного материала с использованием разрушающей ферментной композиции с получением расщепленной фракции и фильтрование расщепленной фракции с получением отфильтрованной фракции (фильтрата) и выделение из отфильтрованной фракции (из фильтрата) VLP на основе растений. В этом способе целостность протопластов может быть необязательной.
Протопласт представляет собой растительную клетку, у которой клеточная стенка полностью или частично удалена. У сферопласта клеточная стенка может быть частично удалена. Протопласт, сферопласт или как протопласт, так и сферопласт (протопласт/сферопласт) можно использовать по данному описанию и эти термины, применяемые в данном описании, являются эквивалентными. Клеточную стенку можно разрушать и удалять механическим способом (например, гомогенизацией, смешением), клеточную стенку можно полностью или частично разрушить ферментативным способом, или клеточную стенку можно удалять комбинируя механические и ферментативные методы, например, применять гомогенизацию с последующей обработкой ферментами для разрушения клеточной стенки. Протопласты можно также получать с применением культивируемых растительных клеток, например, культур растительных клеток на жидких или твердых средах.
Стандартные справочные издания, в которых излагаются общие принципы культур растительных тканей, культивируемых растительных клеток и получения протопластов, сферопластов и т.п., включают: Introduction to Plant Tissue Culture, by MK Razdan 2nd Ed. (Science Publishers, 2003; вводится в данное описание посредством отсылки), или см., например, следующий URL (адрес ресурса в Интернете): molecular-plant-biotechnology.info/plant-tissue-culture/protoplast-isolation.htm. Обзор методов и оборудования, относящихся к получению протопластов (или сферопластов) и работе с ними, представлен, например, в Davey MR et al., 2005 (Biotechnology Advances 23: 131-171; вводится в данное описание посредством отсылки). Стандартные справочные издания, в которых излагаются общие методы и принципы биохимии белков, молекулярной биологии и т.п., включают, например, Ausubel et al. Current Protocols In Molecular Biology, John Wiley & Sons, New York (1998 and Supplements to 2001;
вводится в данное описание посредством отсылки); Sambrook et al., Molecular Cloning:
A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, Plainview, New York, 1989 (вводится в данное описание посредством отсылки); Kaufman et al, Eds., Handbook Of Molecular And Cellular Methods In Biology And Medicine, CRC Press, Boca Raton, 1995 (вводится в данное описание посредством отсылки); McPherson, Ed., Directed Mutagenesis: A Practical Approach, IRL Press, Oxford, 1991 (вводится в данное описание посредством отсылки).
Ферменты, применимые для расщепления или разрушения клеточных стенок с целью высвобождения либо протопластов, либо сферопластов, известны специалисту в данной области техники и могут включать целлюлазу (ЕС 3.2.1.4), пектиназу (ЕС 3.2.1.15), ксиланазу (ЕС 3.2.1.8), хитиназы (ЕС 3.2.1.14), гемицеллюлазу или их комбинацию. Неограничивающие примеры подходящих ферментов включают многокомпонентную смесь ферментов, содержащую целлюлазу, гемицеллюлазу и пектиназу, например MACEROZYME™ (эта смесь имеет примерный состав:
целлюлаза: 0.1 Ед/мг, гемицеллюлаза: 0.25 Ед/мг и пектиназа: 0.5 Ед/мг). Другие примеры продажных ферментов, смесей ферментов и фирм- поставщиков приводятся в Таблице 1 (см.: Introduction to Plant Tissue Culture, by MK Razdan 2nd Ed.., Science Publishers, 2003).
Другие названия и типы целлюлаз включают следующие: эндо-1,4-β- D-глюканаза; β-1,4- глюканаза; β-1,4- эндоглюкан гидролаза; целлюлаза А; целлюлозин АР; эндоглюканаза D; щелочная целлюлаза; целлюлаза А 3; целлюдекстриназа; 9.5 целлюлаза; авицелаза; панцеллаза SS и 1,4- (1,3;1,4)-β- D- глюкан 4-глюканогидролаза. Другие названия и типы пектиназ (полигалоктуроназ) включают следующие: пектин деполимераза; пектиназа; эндополигалактуродаза; эндолаза; пектин гидролаза; пектин полигалактуроназа; эндо- полигалактуроназа; поли- α- 1,4-галактуронид гликаногидролаза; эндогалактуроназа; эндо- D- галактуроназа и поли (1,4- α- D- галактуронид) гликаногидролаза. Другие названия и типы ксиланаз включают следующие: гемицеллюлаза, эндо- (1→4)-β- ксилан 4- ксиланогидролаза; эндо- 1,4- ксиланаза; ксиланаза; β- 1,4- ксиланаза; эндо- 1,4- ксиланаза; эндо-β- 1,4-ксиланаза; эндо- 1,4- β- D- ксиланаза; 1,4-β- ксилан ксиланогидролаза; Р- ксиланаза; β-1,4- ксилан ксиланогидролаза; endo-1,4-β- ксиланаза; β- D- ксиланаза. Другие названия и типы хитиназ включают следующие: хитодекстриназа; 1,4- β- поли- N-ацетилглюкозаминидаза; поли- β- глюкозаминидаза; β- 1,4- поли- N- ацетил глюкозаминидаза; поли[1,4- (N- ацетил- β- D- глюкозаминид)] гликаногидролаза.
Выбор конкретного фермента или комбинации ферментов и концентрации и условий реакции может зависеть от типа используемой ткани растения, из которой получают фракцию протопластов и апопласта, содержащую VLP. Смесь целлюлазы, гемицеллюлазы и пектиназы, например, пектиназы MACEROZYME™ или Multifect, можно применять в интервале концентраций от 0.01% до 2.5% (об/об), например, 0.01, 0.02, 0.04, 0.06, 0.08, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.1..1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 2.0, 2.1, 2.2, 2.3, 2.4 или 2.5% (об/об), или в любом промежуточном количестве между этими значениями. MACEROZYME или Multifect можно применять самостоятельно или в комбинации с другими ферментами, например, целлюлазой, пектиназой, гемицеллюлазой или их комбинацией. Целлюлазу можно применять в интервале концентраций от 0.1% до 5%, например, 0.1, 0.25, 0.5, 0.75, 1.0, 1.25, 1.5, 1.75, 2.0, 2.25, 2.5, 2.75. 3.0. 3.25, 3.5, 3.75, 4.0, 4.25, 4.5, 4.75, 5.0% (вес/об) или в любом промежуточном количестве между этими значениями.
Ферментный раствор (иначе называемый композицией для разрушения клеточных стенок, раствор для расщепления, гидролиза), как правило, содержит буфер или буферную систему, осмотик и одну или более солей, двухвалентные катионы и другие добавки. Буфер или буферную систему выбирают таким образом, чтобы поддерживать рН в интервале, соответствующем активности фермента и стабильности белка (белков), или VLP, чтобы очищать, например, в интервале около рН 5.0 - 8.0, или при любом промежуточном значении рН. Выбор рН может меняться в зависимости от VLP, которую следует выделять, например, значение рН может быть 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.2, 6.4, 6.6, 6.8, 7.0, 7.2, 7.4, 7.6, 7.8, 8.0 или любое промежуточное значение рН. Примеры буферов или буферных систем включают, но без ограничения, MES, фосфатный, цитратный и т.п.. Один или более буферов или буферных систем можно комбинировать в ферментном растворе (растворе для гидролитического расщепления);
один или более буферов могут присутствовать в примерной концентрации от 0 мМ до 200 мМ, или в любом промежуточной концентрации, например, в концентрации 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180 или 190 мМ или в любом промежуточной концентрации. В зависимости от растворимости при необходимости можно добавлять осмотический агент. Осмотик и его концентрацию выбирают с целью повысить осмотическую активность ферментного раствора. Примеры осмотических агентов включают маннит, сорбит или другие сахарные спирты (высокоатомные спирты), полиэтиленгликоль (ПЭГ, PEG) различной длины и т.п.Интервалы концентраций осмотика могут меняться в зависимости от вида растения, типа применяемого осмотика и типа выбранной ткани растения (вида или части растения, из которой она получена, например, из листа или стебля (ствола)) - как правило, интервал концентраций составляет от 0 М, примерно, до 0.8 М, например, 0.05, 0.1, 0.15, 0.2, 0.25, 0.3. 0.35, 0.4, 0.5, 0.6, 0.7 или 0.75 М, или любую промежуточную концентрацию, например, 0, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600 нМ маннита или любую промежуточную концентрацию. Концентрацию осмотика можно также выражать в процентах (вес/об). Для некоторых типов растений или тканей может быть целесообразным использовать слабо гипертонический препарат, что может способствовать отделению плазматической мембраны растительной клетки от клеточной стенки. Также в процессе гидролитического расщепления осмотик можно исключить.
Другим параметром, который задается в процессе гидролитического расщепления растения, является температура. При необходимости, в процессе расщепления температуру можно контролировать. Температурный интервал должен быть в пределах от 4°С до 40°С или температура должна иметь любое промежуточное значение, например, температура должна быть равной, примерно, от 4°С до 15°С, или любому промежуточному значению, или, примерно, от 4°С до 22°С, или любому промежуточному значению. В зависимости от выбранной температуры можно корректировать другие экспериментальные параметры, чтобы сохранить оптимальные условия экстракции.
Для повышения устойчивости плазматической мембраны можно добавлять катионы, соли, или и те, и другие, например, двухвалентные катионы, такие как Са2+ или Mg2+, в количестве 0.5-50 мМ, или в любом промежуточном количестве, соли, например, такие как CaCl2, NaCl, CuSO4, КNО3 и т.п., примерно, от 0 до 750 мМ, или любое промежуточное количество, например, 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700 или 750 мМ. Можно также вводить другие добавки, включая хелатирующее вещество, например, но без ограничения, ЭДТА, EGTA, примерно, от 0 до 200 мМ, или любое промежуточное количество, например, 5, 10, 15,20,25, 50, 75, 100, 125, 150, 175, 200 мМ, или любое промежуточное количество, восстановитель для предупреждения окисления, например, но без ограничения, бисульфит натрия или аскорбиновую кислоту, в концентрации 0.005 - 0.4% или в любой промежуточной концентрации, например, 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.1, 0.15, 0.2, 0,25, 0.3, 0.35, 0.4%, или в любой промежуточной концентрации, специфические ингибиторы ферментов (см. ниже), и, при необходимости, вещество, замедляющее увядание (старение) листьев, например, циклогексимид, кинетин или один или более полиаминов.
Раствор для расщепления может также содержать одно или более из нижеприведенных веществ: маннит, примерно, от 0 до 600 мМ, NaCl, примерно, от 0 до 500 мМ, ЭДТА, примерно, от 0 до 50 мМ, целлюлазу, примерно, от 1% до 2% об/об, пектиназу, примерно, от 0 до 1% об/об, метабисульфит натрия, примерно, от 0.03 до 0.04%, цитрат, примерно, от 0 до 125 мМ или NaPO4, примерно, от 0 до 75 мМ.
Растительный материал можно обрабатывать, чтобы повысить доступ ферментов или ферментной композиции к клеточной стенке растительной клетки. Например, эпидермис листа можно удалять или 'снимать кожицу' перед обработкой ферментной композицией. Растительный материал можно разрезать на мелкие части (вручную или с помощью измельчителя или устройства для резки, такого как слайсер Urschel); нарезанный растительный материал можно затем пропитывать ферментной композицией под небольшим вакуумом (Nishimura and Beevers 1978, Plant Physiol 62: 40- 43; Newell et al., 1998, J. Exp Botany 49: 817- 827). Также до или во время обработки ферментной композицией осуществляют механическое возмущение (перемещение) тканей растения (Giridhar et al., 1989. Protoplasma 151: 151- 157). Помимо этого, культивируемые клетки растений, культуры на жидких или твердых средах, можно использовать для получения протопластов или сферопластов.
Может быть необходимо применять ферментную композицию, в которой не содержатся липазы или протеазы или содержатся инактивированные липазы или протеазы. В некоторых вариантах изобретения в ферментную композицию могут быть включены один или более ингибиторов протеаз или липаз. Примеры ингибиторов липаз включают RHC80267 (Sigma - Aldrich); примеры ингибиторов протеаз включают Е- 64, Na2, ЭДТА, пепстатин, апротинин, PMSF, Pefabloc, лейпептин, бестатин и т.п.
Можно применять любой подходящий метод смешения или встряхивания растительного материала в ферментной композиции. Например, растительный материал можно осторожно кружить в водовороте или встряхивать в ванне или вметаллическом сосуде или на ротационном шейкере, или во вращающемся или вибрирующем барабане. Следует принимать меры предосторожности, чтобы свести к минимуму повреждение протопластов (и/или сферопластов) до момента удаления их из "гидролизующего раствора (супа) ". Следует соответствующим образом подбирать сосуд для гидролитического расщепления.
Например, но без ограничения, ферментную композицию, содержащую 1.5% целлюлазы (Onozuka R-10) и 0.375% MACEROZYME™ в 500 мМ маннита, 10 мМ CaCk и 5 мМ MES (рН 5.6), можно применять для получения протопластов (или сферопластов) из некоторых тканей Nicotiana. Как указывается в данном описании, концентрация маннита может варьироваться, примерно, от 0 до 500 мМ, или иметь любое промежуточное значение. Специалист в данной области техники, снабженный информацией, раскрываемой в данном описании, сможет определить ферментную композицию, подходящую для данного возраста и штамма Nicotiana sp, или для другого вида, применяемого для получения VLP.
После разрушения клеточной стенки или частичного расщепления (разрушения, гидролиза) клеточной стенки получают фракцию протопластов (содержащую протопласты и/или сферопласты) и "фракцию апопласта". Или же можно получать "гидролизованную (расщепленную) фракцию". Как отмечается ниже, для получения белков с высоким выходом по данному описанию может не потребоваться целостность фракции протопластов, поэтому можно использовать фракцию апопдаста или гидролизованную фракцию для экстракции белков, например, но без ограничения, VLP, вирусных оболочечных белков, вирусных структурных белков, вирусных капсидных белков, белков вирусной оболочки.
Под "фракцией апопласта" понимают фракцию, которую получают после ферментативного гидролиза (расщепления), или частичного ферментативного гидролиза, с применением ферментов, разрушающих клеточные стенки растительного материала в присутствии осмотика и/или других ингредиентов, которые можно использовать, чтобы способствовать сохранению целостности протопластов. Фракция апопласта может содержать некоторые компоненты из разрушенных протопластов (или сферопластов). Например, фракция апопласта может содержать, примерно, от 0 до 50% (об/об) или любое промежуточное количество, компонентов из фракции протопластов или 0, 0.1, 0.5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% (об/об) или любое промежуточное количество компонентов из фракции протопластов.
Под "расщепленной фракцией" понимают фракцию, которая остается после ферментативного гидролиза (расщепления) или частичного ферментативного расщепления с применением ферментов, разрушающих клеточные стенки растительного материала, однако, целостность протопластов не требуется, и расщепленная фракция может содержать как интактные, так и разрушенные протопласты. Композиция, содержащая ферменты, разрушающие клеточные стенки, применяемая для получения расщеплено фракции, может содержать осмотик, или осмотик может содержаться в меньшем количестве по сравнению с количеством осмотика, применяемым в стандартных методах получения протопластов, или осмотик в композиции может отсутствовать. Расщепленная фракция содержит фракцию апопласта и фракцию протопластов/сферопластов, однако, фракция протопластов/сферопластов может быть, или не быть, интактной. Расщепленная фракция содержит внутриклеточные компоненты и внеклеточные компоненты. Внутриклеточные компоненты могут находиться в виде протопластов/сферопластов, если для сохранения интактных протопластов/сферопластов применяют осмотик. Если в растворе для расщепления не используют осмотик, тогда протопласты/сферопласты могут быть разрушены и внутриклеточные и внеклеточные компоненты могут быть объединены (смешаны) в гидролизованной фракции. Как указано в данном описании, VLP можно отделять от компонентов гидролизованной фракции любым подходящим методом. Не желая связывать себя какой- либо теорией, можно отметить, что стадия расщепления (разрушения) клеточных стенок может разрыхлять полимерные компоненты клеточных стенок и способствовать высвобождению VLP, которые в ином случае улавливались бы клеточной стенкой. Этот протокол также позволяет свести к минимуму загрязнение VLP внутриклеточными компонентами. После ферментативного расщепления VLP можно отделять от клеточного осадка центрифугированием на низкоскоростной центрифуге с последующими фильтрацией, глубинной фильтрацией, седиментацией, осаждением, например, но без ограничения, осаждением сульфатом аммония, или их комбинацией, получая отделенную фракцию, содержащую целевые белки или белки целевых супраструктур.
Если используют осмотик, фракцию протопластов/сферопластов, или фракцию, содержащую протопласты, можно отделять от фракции апопласта любым подходящим методом, например, но без ограничения, центрифугированием, фильтрацией, глубинной фильтрацией, седиментацией, осаждением или их комбинацией, получая отделенную фракцию, содержащую VLP и/или содержащую протопласты/сферопласты, которые содержат VLP.
Фракцию протопластов (и сферопластов) или фракцию, содержащую протопласты, можно отделять от фракции апопластов любым подходящим методом, например, но без ограничения, центрифугированием, фильтрацией, глубинной фильтрацией, седиментацией, осаждением или их комбинацией, получая отделенную фракцию.
Отделенная фракция может представлять собой, например, супернатант (после центрифугирования, седиментации или осаждения) или фильтрат (после фильтрации), и она обогащена VLP. Отделенную фракцию можно обрабатывать далее с целью выделения, очистки, концентрации или комбинации этих действий, VLP, например, с применением дополнительных стадий центрифугирования, осаждения, хроматографии (например, эксклюзионной, ионообменной хроматографии), тангенциальной проточной фильтрации или их комбинации. Присутствие очищенных VLP можно подтвердить, например, обычным или SDS-PAGE, Вестерн-блоттингом с применением соответствующего детектирующего антитела, капиллярным электрофорезом или любым другим методом, известным специалисту в данной области техники.
Апопласт представляет собой часть растительной клетки с наружной стороны плазматической мембраны и включает клеточную стенку и межклеточное пространство растения. Хотя является предпочтительным, чтобы в процессе гидролиза и дальнейшей обработки сохранялась целостность протопластов (и/или сферопластов), для обогащения по VLP не требуется, чтобы протопласты оставались интактными.
В процессе синтеза VLP секретируются с наружной стороны плазматической мембраны. VLP имеют средний размер, примерно, от 20 нм до 1 мкм, или любое промежуточное значение, например, 60, 65,70, 75, 80, 85, 90, 95,100, 105,110, 120,130, 140, 150 160, 170, 180,190 или 200 нм, или любое промежуточное значение, например 100 нм, и могут включать липидную мембрану. Благодаря своей величине, после синтеза VLP могут оставаться заключенными между плазматической мембраной и клеточной стенкой и могут быть недоступны для дальнейшей очистки стандартными механическими методами, применяемыми для получения растительных белков. Чтобы добиться максимальных выходов, минимального загрязнения фракции VLP клеточными белками, сохранить целостность VLP и, в некоторых вариантах изобретения, ассоциированной липидной оболочки или мембраны, могут применяться методы разрушения клеточных стенок для высвобождения VLP, которые сводят к минимуму механическое повреждение протопластов (и/или сферопластов), такие как ферментативные методы по данному описанию. Однако, необязательно, чтобы в ходе процесса сохранялась целостность всех протопластов.
VLP, продуцируемая в растении в соответствии с некоторыми аспектами изобретения, может образовывать комплекс с растительными липидами. VLP включать форму НАО предшественника, или форму НА1 или НА2 доменов, удерживаемых вместе за счет дисульфидных мостиков. Растительные липиды могут быть в виде липидного бислоя и могут, помимо этого, включать оболочку, окружающую VLP. Растительные липиды могут содержать липидные компоненты плазматической мембраны растения, в котором продуцируется VLP, включая, но без ограничения, фосфатидилхолин (PC), фосфатидилэтаноламин (РЕ), гликосфинголипиды, фитостеролы или их комбинацию. Растительный липид имеет другое название 'липид из растения'. Примеры фитостеролов известны в уровне техники и включают, например, стигмастерол, ситостерол, 24- метилходестерол и холестерол (Mongrand et al., 2004, J. Biol Chem 279:36277-86).
Для сборки VLP необходим корректный фолдинг (укладка) вирусных структурных белков, таких как НА. VLP, и, в частности, VLP, включающие растительную липидную оболочку, при введении их субъекту могут обеспечивать повышенный иммунный ответ по сравнению с мономерным структурным белком.
В некоторых вариантах изобретения экспрессию полипептидов можно нацеливать на любое внутриклеточное или внеклеточное пространство, любую органеллу или ткань растения. Чтобы локализовать экспрессируемый полипептид в определенном месте, нуклеиновую кислоту, кодирующую полипептид, можно связывать с нуклеотидной последовательностью, кодирующей сигнальный пептид. Сигнальный пептид можно по- другому называть транзитный пептид или сигнальная последовательность. Сигнальные пептиды или пептидные последовательности, управляющие локализацией экспрессируемого полипептида в апопласте, включают, но без ограничения сигнальный пептид амилазы риса (McCormick 1999, Proc Nati Acad Sci USA 96: 703- 708), сигнальный пептид белка дисульфид- изомеразы (PDI), имеющий аминокислотную последовательность;
MAKNVAIFGLLFSLLLLVPSQIFAEE; SEQ ID NO. 10,
белок, связанный с патогенезом растений (PRP; Szyperski et al. PNAS 95: 2262- 2262), например, белок, связанный с патогенезом растения табака 2 (PRP), сигнальный пептид человеческого моноклонального антитела (SP), или сигнальный пептид любого нативного агглютинина.
В некоторых примерах экспрессируемый полипептид может накапливаться в определенном межклеточном или внеклеточном пространстве (таком как апопласт), органелле или ткани, например, когда полипептид экспрессируется и секретируется в отсутствие сигнального пептида или транзитного пептида.
Термин "вирусоподобная частица" (VLP), или "вирусоподобные частицы" или "VLP" относится к структурам, которые способны к самосборке и содержат вирусные поверхностные белки, например, белок НА вируса гриппа или химерный НА белок вируса гриппа. VLP и химерные VLP, как правило, морфологически и по своим антигенным свойствам аналогичны вирионам, вырабатываемым при инфицировании, но в них отсутствует генетическая информация, достаточная для репликации, и поэтому они не являются инфекционными. VLP и химерные VLP могут продуцироваться в соответствующей клетке- хозяине, включая растительные клетки-хозяева, и, при необходимости, их можно очищать дополнительно.
Хотя в качестве примера в данном описании приводятся VLP вируса гриппа и химерные VLP вируса гриппа, методы по данному описанию можно применять для любых VLP на основе растений, которые локализуются в апопласте или секретируются в апопласт.
Под терминами "химерный белок" или "химерный полипептид" понимают белок или полипептид, который содержит аминокислотные последовательности из двух или более источников, например, но без ограничения, белки (или полипептиды) двух или более типов (или подтипов), которые сливаются в виде единого полипептида. Химерный белок или полипептид может включать сигнальный пептид, одинаковый с (т.е. нативный) другим полипептидом или белком или гетерологичный другому полипептиду или белку. Химерный белок или химерный полипептид может продуцироваться в виде транскрипта при использовании химерной нуклеотидной последовательности и остается интактным, или, при необходимости, химерный белок или химерный полипептид может расщепляться после синтеза. Интактный химерный белок, или полученные в результате расщепления участки химерного белка, могут ассоциировать с образованием мультимерного белка. Химерный белок или химерный полипептид может также включать белок или полипептид, содержащий субъединицы, которые связываются через дисульфидные мостики (т.е. мультимерный белок). Например, химерный полипептид, содержащий аминокислотные последовательности из двух или более источников, может процессировать в субъединицы, а субъединицы, связанные через дисульфидные мостики, могут процессировать в химерный белок или химерный полипептид.
Полипептид может представлять собой гемагглютинин (НА) вируса гриппа, а каждую из двух или более аминокислотных последовательностей, которые составляют полипептид, можно получать из различных НА с образованием химерного НА или химерного НА вируса гриппа (НА "химерного вируса"). Химерный НА может также включать аминокислотную последовательность, содержащую гетерологичную сигнальную последовательность (химерный НА пре- белок), которая отщепляется после синтеза. Примеры НА белков, которые можно использовать в изобретении по данному описанию, можно найти в Международных патентных заявках WO 2009/009876; WO 2009/07'67')'8; WO 2010/003225 (которые вводятся в данное описание посредством отсылки). Нуклеиновую кислоту, кодирующую химерный полипептид, можно описать как "химерную нуклеиновую кислоту" или как "химерную нуклеотидную последовательность ". Вирусоподобную частицу, состоящую из химерного НА, можно описать как "химерную VLP". Химерные VLP подробнее описаны в Международной патентной заявке РСТ No. PCT/CA2010/000983, поданной 25 июня 2010 года, и в предварительной заявке США No. 61/220161 (поданной 24 июня 2009 года; обе заявки вводятся в данное описание посредством отсылки). VLP можно получать с помощью экспрессии нативного и химерного НА.
НА вирусоподобных частиц (VLP), полученных способом, представленным в данном изобретении, включают известные последовательности и вариантные НА последовательности, которые могут быть разработаны или идентифицированы.= Далее, VLP, полученные по данному описанию, не содержат нейраминидазы (NA) или других компонентов, например, M1 (М белка), М2, NS и т.п.Однако, NA и M1 можно совместно экспрессировать (коэкспрессировать) с НА, если нужны VLP, содержащие НА и NA.
Как правило, термин "липид" относится к жирорастворимым (липофильным) природным молекулам. Химерная VLP, продуцируемая в растении согласно некоторым аспектам изобретения, может давать комплекс с растительными липидами. Растительные липиды могут быть в виде липидного бислоя и могут дополнительно содержать оболочку, окружающую VLP. Растительные липиды могут содержать липидные компоненты плазматической мембраны растения, в котором продуцируется VLP, включая фосфолипиды, три-, ди- и моноглицериды, а также жирорастворимый стерол (стерин, стероидный спирт) или стерол, содержащий метаболиты. Примеры включают фосфатидилхолин (PC), фосфатидилэтаноламин (РЕ), фосфатидилинозит, фосфатидилсерин, гликосфинголипиды, фитостеролы или их комбинацию. Растительный липид можно по- другому называть 'липидом, полученным из растения' или 'липидом на основе растения'. Примеры фитостеролов включают кампестерол, стигмастерол, эргостерол, брассикастерол, дельта- 7- стигмастерол, дельта- 7-авенастерол, дауностерол, ситостерол, 24- метилхолестерол, холестерол или бета-ситостерол (Mongrand et al., 2004, J. Biol Chem 279: 36277- 86). Как легко поймет специалист в данной области техники, липидная композиция плазматической мембраны клетки может меняться в зависимости от культуры или условий выращивания клетки или организма, или вида, из которого эта клетка получена.
Клеточные мембраны обычно содержат липидные бислои, а также белки для различных функций. Локализованные концентрации конкретных липидов можно обнаружить в липидном бислое, их называют 'липидными рафтами'. Эти микродомены липидных рафтов могут быть обогащены сфинголипидами и стеролами. Без связи с какой- либо теорией можно сказать, что липидные рафты играют значительную роль в эндо- и экзоцитозе, входе или выходе вирусов или других инфицирующих агентов, внутриклеточной сигнальной трансдукции, взаимодействии с другими структурными компонентами клетки или организма, такими как внутриклеточный и внеклеточный матриксы.
VLP, содержащие липидную оболочку, были ранее описаны в Международных патентных заявках WO 2009/009876; WO 2009/076778 и WO 2010/003225 (которые вводятся в данное описание посредством отсылки). Что касается вируса гриппа, термин "гемагглютинин" или "НА" по данному описанию относится к структурному гликопротеину частиц вируса гриппа. НА по настоящему изобретению можно получать из любого субтипа. Например, НА может быть субтипа H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15 или Н16 или типов вируса гриппа В или С. Рекомбинантные НА по настоящему изобретению могут также содержать аминокислотную последовательность на основе последовательности гемагглютинина. Структура гемагглютинина вируса гриппа хорошо изучена и демонстрирует высокую степень консервативности вторичной, третичной и четвертичной структур. Эта консервативность структуры наблюдается, даже если аминокислотная последовательность может меняться (см., например, Skehel and Wiley, 2000 Ann Rev Biochem 69:531-69; Vaccaro et al 2005; которые вводятся в данное описание посредством отсылки). Нуклеотидные последовательности, кодирующие НА, хорошо известны и доступны, например, в базе данных BioDefense and Public Health Database (в настоящее время Influenza Research Database; Squires et al., 2008 Nucleic Acids Research 36: D497- D503), например, по URL-адресу: biohealthbase.org/GSearch/home.do?decorator=Influenza), или в базах данных, поддерживаемых Национальным Центром биотехнологической информации (National Center for Biotechnology Information (NCBI; например, по адресу URL: ncbi.nlm.nih.gov/sites/entrez?db=nuccore&cmd=search&term=influenza), все они вводятся ссылкой в данное описание.
Настоящее изобретение также относится к способам получения, выделения, или как получения, так и выделения VLP, включая VLP вирусов гриппа, которые инфицируют людей или животных- хозяев, например, приматов, лошадей, свиней, птиц, овец, водоплавающих птиц, перелетных птиц, куропаток, уток, гусей, домашнюю птицу, кур, верблюдов, псовых, собак, кошачьих, кошек, тигра, леопарда, виверровых, норок, каменных куниц, африканских хорьков, домашних животных, домашний скот, мышей, крыс, тюленей, китов и т.п.Некоторые вирусы гриппа могут инфицировать более чем одного животного- хозяина.
В гемагглютининах вирусов гриппа допускаются варианты аминокислот. Такое варьирование дает новые штаммы, которые постоянно идентифицируются. Инфекционность новых штаммов может варьироваться. Однако, образование тримеров гемагглютинина, которые затем образуют VLP, сохраняется. Настоящее изобретение включает также способы получения VLP на основе растений вне зависимости от субтипа или последовательности НА, или химерного НА- содержащего VLP, или вида, из которого они происходят.
Корректный фолдинг гемагглютининов может быть важен для стабильности белка, образования мультимеров, образования VLP и функции НА (способности гемагглютинировать), помимо других характеристик гемагглютининов вируса гриппа. На фолдинг белка может влиять один или более факторов, включая, но без ограничения, последовательность белка, относительное содержание белка, степень скопления внутри клетки, доступность кофакторов, которые могут связываться или транзиторно ассоциироваться с белком со складчатой, частично складчатой структурой или с неструктурированным белком, присутствие одного или более белков-шаперонов и т.п.
Белки теплового шока (Hsp), или стресс-белки, являются примерами белков-шаперонов, которые могут принимать участие в различных процессах в клетке, включая синтез белка, внутриклеточный график, предупреждение мисфолдинга (неправильного фолдинга), предупреждение агрегации белков, сборку и разборку белковых комплексов, фолдинг белков и деагрегацию белков. Примеры таких белков-шаперонов включают, но без ограничения, Hsp60, Hsp65, Hsp70, Hsp90, Hsp 100, Hsp20-30, Hsp10, Hsp100-200, Hsp100, Hsp90, Lon, TF55, FKBPs, циклофилины, CIpP, GrpE, убиквитин, калнексин и протеин (белок) дисульфид- изомераза (см., например, Macario, A.J.L., Cold Spring Harbor Laboratory Res. 25:59-70. 1995; Parsell, D.A. & Lindquist, S. Ann. Rev. Genet. 27:437-496 (1993); патент США No. 5232833). Белки-шапероны, например, но без ограничения, Hsp40 и Hsp70, можно применять, чтобы гарантировать фолдинг химерного НА (Международная патентная заявка РСТ No. РСТ/СА2010/000983, поданная 25 июня 2010 года, и предварительная заявка США No. 61/220161, поданная 24 июня 2009 года; Международные патентные заявки WO 2009/009876 и WO 2009/076778, каждая из которых вводится в данное описание посредством отсылки). Можно также применять протеин дисульфид- изомеразу (PDI; Регистрационный No. Z11499).
После выделения можно определять структуру, размер, эффективность и активность VLP с помощью реакции гемагглютинации, электронной микроскопии, рассеяния света, эксклюзионной хроматографии, ВЭЖХ, Вестерн-блоттинга или электрофореза. Эти и другие методы определения размера, концентрации и состава VLP известны в уровне техники.
Для препаративной эксклюзионной хроматографии можно получать препарат, содержащий VLP, методами по данному описанию и нерастворимый материал удалять центрифугированием. Также может быть целесообразным осаждать с помощью ПЭГ (PEG). Можно получать количественные характеристики выделенного белка (квалифицировать) обычными методами (например, методом Бредфорд, ВСА) и пропускать экстракт через колонку для эксклюзионной хроматографии, используя в качестве насадки, например, Сефакрил™, Сефадекс™ или аналогичную среду, и отбирать фракции. В качестве калибровочного стандарта можно использовать Blue Dextran 2000 или подходящий белок. Экстракт можно также пропускать через колонку для катионообменной хроматографии и отбирать при этом активные фракции. После хроматографии фракции можно далее анализировать электрофорезом белков, иммуноблоттингом или и тем и другим, чтобы подтвердить присутствие VLP и белков комплемента в составе фракции.
Реакцию гемагглютинации можно использовать для определения гемагглютинирующей активности VLP- содержащих фракций. Без связи с какой- либо теорией можно сказать, что способность НА связываться с RBC (эритроцитами) различных животных, обусловленная сродством НА к сиаловым кислотам α2,3 или α2.6, и присутствием этих сиаловых кислот на поверхности RBC. НА лошадиного и птичьего вирусов гриппа агглютинируют эритроциты всех отдельных видов, включая индеек, уток, морских свинок, человека, овцы, лошадей и крупного рогатого скота; тогда как HAs человека связываются с эритроцитами индейки, кур, уток, морских свинок, человека и овцы (Ito Т. et al, 1997, Virology, 227: 493- 499; Medeiros R et al, 2001. Virology 289: 74-85).
Ингибирование гемагглютинации (HI или HAI) можно также использовать для демонстрации эффективности антител, индуцируемых вакциной, или вакцинная композиция, содержащая химерный НА или химерную VLP, может ингибировать агглютинацию эритроцитов (RBC) рекомбинантным НА. Титры антител, ингибирующих гемагглютинин сывороточных образцов можно определять с помощью HAI в микротитрационном планшете (Aymard et al 1973). Можно использовать эритроциты любого из нескольких видов - например, лошади, индейки, кур и т.п. Этот анализ дает непрямую информацию о сборке НА тримера на поверхности VLP, подтверждающую соответствующую презентацию антигенных сайтов на HAs.
Титры перекрестной реактивности HAI также можно использовать для демонстрации эффективности иммунного ответа на другие штаммы вируса, родственные субтипу вакцины. Например, сыворотку субъекта, иммунизированного композицией, содержащую HDC первого типа вируса гриппа, можно использовать в HAI анализе со вторым штаммом вируса или вирусных частиц и определять титр HAI.
Методы трансформации и регенерации трансгенных растений, растительных клеток, растительного материала или семян, содержащих VLP, установлены в уровне техники и известны специалисту. Метод получения трансформированных и регенерированных растений неважен для настоящего изобретения.
Под термином "трансформация" понимают межвидовой перенос генетической информации (нуклеотидной последовательности), которая проявляется генотипически, фенотипически или и так, и так. Межвидовой перенос генетической информации от химерной конструкции хозяину может быть наследуемым (т.е. интегрироваться в геном хозяина) и тогда перенос генетической информации считается стабильным или перенос генетической информации не является наследуемым.
Под термином "растительный материал" понимают любой материал растительного происхождения. Растительный материал может включать целые растение, ткань, клетки, или любую их часть. Помимо этого, растительный материал может содержать внутриклеточные растительные компоненты, внеклеточные растительные компоненты, жидкие и твердые экстракты растения или их комбинацию. Далее, растительный материал может включать растения, растительные клетки, ткань, жидкий экстракт или их комбинацию, из листьев, стеблей (стволов), плодов, корней растения или их комбинацию. Растительный материал может включать растение или его часть, которая не подвергалась какой- либо обработке. Часть растения может представлять собой растительный материал. Растения или растительный материал можно собирать или получать любым методом, например, можно использовать целое растение или листья или другие ткани, специально отбираемые для применения в методах по данному описанию.
Конструкции по настоящему изобретению можно вводить в клетки растения, используя Ti плазмиды, Ri плазмиды, вирусы- векторы растений, непосредственную трансформацию ДНК, микроинъекцию, электропорацию, инфильтрацию и т.п.Обзоры по этим методам см., например, в Weissbach and Weissbach, Methods/or Plant Molecular Biology, Academy Press, New York VIII, pp.421- 463 (1988); Geierson and Corey, Plant Molecular Biology, 2d Ed. (1988); и Miki and lyer, Fundamentals of Gene Transfer in Plants. In Plant Metabolism, 2d Ed. DT. Dennis, DH Turpin, DD Lefebrve, DB Layzell (eds), Addison-Wesley, Langmans Ltd. London, pp.561-579 (1997). Другие методы включают прямое введение ДНК, применение липосом, электропорацию, например, с применением протопластов, микроинъекцию, бомбардировку микрочастицами или вискерсами и вакуум- инфильтрацию. См., например, Bilang, et al. (Gene 100: 247-250 (1991), Scheid et al. (Mol. Gen. Genet. 228: 104-112, 1991), Guerche et al. (Plant Science 52: 111-116, 1987), Neuhause et al. (Theor. Appi Genet. 75:30-36, 1987), Klein et al. Nature 327: 70-73 (1987); Howell et al. (Science 208: 1265, 1980), Horsch et al. (Science 227: 1229-1231, 1985), DeBlock et al. Plant Physiology 91: 694-701, 1989), Methods for Plant Molecular Biology (Weissbach and Weissbach, eds., Academic Press Inc., 1988), Methods in Plant Molecular Biology (Schuler and Zielinski, eds., Academic Press Inc., 1989), Liu and Lomonossoff (J. Virol Meth, 105:343-348, 2002), патенты США No. 4945050; 5036006; 5100792; 6403865; 5625136, (каждый из этих мдокументов вводится в данное описание посредством отсылки).
Для экспрессии конструкций по настоящему изобретению можно применять методы транзиторной экспрессии (см. Liu and Lomonossoff, 2002, Journal of Virological Methods, 105:343-348; статья вводится в данное описание посредством отсылки). Или же можно применять метод вакуумной транзиторной экспрессии, описанный в опубликованных Международных заявках РСТ WO 00/063400, WO 00/037663 (вводимых в данное описание посредством отсылки). Эти методы могут включать, например, но без ограничения, метод Agro- инокуляции или Agro- инфильтрации, однако, как отмечается выше, можно применять другие методы транзиторной экспрессии. В случае Agro-инокуляции или Agro- инфильтрации смесь Agrobacteria, содержащая нужную нуклеиновую кислоту, входит в межклеточное пространство ткани, например, листьев, надземной части растения (включая стебель, листья и цветок), другой части растения (включая стебель, корень, цветок) или цельного растения. После прохождения через эпидермис Agrobacterium инфицирует и переносит копии т- ДНК в клетки, т- ДНК транскрибируется эписомально, и мРНК транслируется, в результате в инфицированных клетках продуцируется целевой белок, однако, перенос тДНК внутрь клетки является временным (транзиторным).
VLP вируса гриппа, полученные методами по настоящему изобретению, можно применять в сочетании с существующей вакциной против гриппа, чтобы дополнить вакцину, сделать ее более эффективной, или для того, чтобы уменьшить предписанные вводимые дозы. Как известно специалисту в данной области техники, вакцина может быть против одного или более вирусов гриппа. Примеры подходящих вакцин включают, но без ограничения, имеющиеся в продаже вакцины от Sanofi-Pasteur, ID Biomedical, Merial, Sinovac, Chiron, Roche, Medlmmune, GlaxoSmithKline, Novartis, Sanofi-Aventis, Serono, Shire Pharmaceuticals и т.п.
Как известно специалисту в данной области техники, при необходимости VLP по настоящему изобретению можно смешивать с подходящим адъювантом. Кроме того, VLP можно использовать в вакцинной композиции, содержащей эффективную дозу VLP, для лечения целевого организма по определению выше. Помимо этого, VLP, полученную по данному изобретению, можно коэкспрессировать с другими белковыми компонентами или восстанавливать с другими VLP или белковыми компонентами вируса гриппа, например, нейраминидазой (NA), Ml и М2. Ее можно также коэкспрессировать или восстанавливать с другой VLP из вакцинных белков, таких как антигены малярии, антигены ВИЧ, антигены респираторно- синцитиального вируса (RSV) и т.п.
Последовательности по данному описанию представлены ниже.
Далее настоящее изобретение иллюстрируется с помощью нижеприведенных примеров. Однако, понятно, что эти примеры приводятся только для иллюстрации, но никоим образом не для ограничения объема настоящего изобретения.
Сборка кассет экспрессии
Конструкции, которые можно применять для продуцирования VLP, описаны в предварительной патентной заявке США No. 61/220161 (поданной 24 июня 2009 года), Международных патентных заявках WO 2009/009876, WO 2009/076778 и WO 2010/003225, каждая из которых вводится в данное описание посредством отсылки. Конструкции могут также включать конструкции, перечисленные в Таблице 2. Сборка этих конструкций описана в Международных патентных заявках WO 2009/009876, WO 2009/076778, WO 2010/003225 и в патентной заявке США 61/220161. Однако, для получения VLP по данному описанию могут применяться другие конструкции, содержащие известные НА белки, включая, но без ограничения, конструкции, приведенные в Таблице 2, и связанные с аналогичными или другими регуляторными элементами и промоторами.
Кассеты экспрессии CPMV-.W включают 35S промотор для регуляции экспрессии мРНК, содержащей целевую кодирующую последовательность, фланкированную на 5'конце нуклеотидами 1-512 из РНК2 мозаичного вируса Коровьего гороха (Cowpea mosaic virus, CPMV) с мутантными ATG в положениях 115 и 161, и на 3'конце нуклеотидами 3330-3481 РНК2 CPMV (соответствующими 3' UTR) с последующим NOS терминатором. Плазмиду pBD-C5-lLC (Sainsbury et al. 2008;
Plant Biotechnology Journal 6: 82- 92 и опубликованная заявка РСТ WO 2007/135480), используют для сборки кассет для экспрессии агглютинина на основе CPMV-ЯГ. Мутацию ATG в положении 115 и 161 РНК2 CPMV осуществляют методом лигирования с помощью ПЦР, представленным в Darveau et al. (Methods in Neuroscience 26: 77- 85 (1995)). Две отдельных ПЦР проводят, используя в качестве матрицы pBD- С5- 1LC. Праймерами для первой амплификации являются pBinPlus.2613c (SEQ ID NO: 3) и Mut- ATG115.r (SEQ ID NO: 4). Праймерами для второй амплификации являются Mut- ATG 161.с (SEQ ID NO: 5) и LC-C5-1.110r (SEQ ID NO: 6). Затем два фрагмента смешивают и используют в качестве матрицы для третьей амплификации, используя в качестве праймеров pBinPlus.2613c (SEQ ID NO: 3) и LC-C5-1.110r (SEQ ID NO: 6) Полученный в результате фрагмент расщепляют с помощью РасI и ApaI и клонируют в pBD-C5-lLC, расщепляемую тем же ферментом. Полученная кассета экспрессии названа 828.
Сборка Н5 A/Indonesia/5/2005 в CPMV-ЯТ кассете экспрессии (Конструкция номер 685).
Сборка этой кассеты описана в Международных патентных заявках WO 2009/009876, WO 2009/076778 и WO 2010/003325, которые вводятся в данное описание посредством отсылки.
Кратко, последовательность, кодирующую Н5 из A/Indonesia/5/2005, клонируют в CPMV-ЯГ следующим образом: сайты рестрикции Apal (сразу же 5' от начального кодона ATG) и StuI (сразу же 3' от стоп-кодона) добавляют к последовательности, кодирующей гемагглютинин, осуществляя ПЦР- амплификацию с помощью праймеров Apal- Н5 (A-Indo).1c (SEQ ID NO: 7) и Н5 (A-Indo)- StuI.1707r (SEQ ID NO: 8), в качестве матрицы используя конструкцию номер 660 (D'Aoust et al., Plant Biotechnology Journal 6: 930- 940 (2008)). Конструкция 660 содержит пластоцианиновый промотор люцерны и 5' UTR, последовательность, кодирующую агглютинин Н5 из A/Indonesia/5/2005 (конструкция # 660), люцерны фталоцианин 3' UTR и терминаторные последовательности (SEQ ID NO:9; Фиг.5). Полученный фрагмент расщепляют рестриктазами Apal и StuI и клонируют в конструкцию номер 828, предварительно расщепленную теми же ферментами. Полученная кассета названа конструкцией номер 685 (Фиг.1, 2).
Супрессоры сайленсинга
Пострансляционный сайленсинг генов (PTGS) может быть включен в ограничение экспрессии трансгенов в растения, и коэкспрессию супрессора сайленсинга из вируса картофеля Y (НсРrо) можно использовать для того, чтобы противодействовать расщеплению мРНК трансгенов (Brigneti et al., 1998).
Альтернативные супрессоры сайленсинга хорошо известны в уровне техники и могут применяться по данному описанию (Сhibа et al., 2006, Virology 346: 7-14; вводится в данное описание посредством отсылки), например, но без ограничения, TEV- pl/HC-Pro (Вирус гравировки табака-pl/HC-Pro), BYV -р21, р19 из Вируса кустистой карликовости томата (TBSV р19), капсидный белок из вируса морщинистости томатов (TCV -СР), 2b из Вируса мозаики огурца; CMV-2b), p25 из Вируса картофеля Х (PVX- p25), р11 из Вируса картофеля М (PVM-p11), p11 из Вируса картофеля S (PVS-p11), p16 из Вируса ожога голубики, (Bask -pl6), p23 из вируса тристецы цитрусовых (CTV- p23), р24 из Вируса скручивания листьев винограда- 2, (GLRaV- 2 р24), pi 0 из Вируса винограда A, (GVA- р10), р14 из Вируса винограда В (GVB- р14), р10 из Heracleum латентного вируса (HLV- р10) или pl6 из общего латентного вируса чеснока (GCLV-pl6). Следовательно, супрессор сайленсинга, например, но без ограничения, HcPro, TEV -p1/HC- Pro, BYV- p21, TBSV р19, TCV- СР, CMV- 2b, PVX- p25, PVM- p11, PVS- p11, BScV-pl6, CTV-p23, GLRaV-2 р24, GBV- р14, HLV- р10, GCLV- p16 или GVA- р10, можно коэкспрессировать наряду с нуклеотидной последовательностью, кодирующей целевой белок, чтобы дополнительно гарантировать высокие уровни белковой продукции в растении.
Конструкция р19 описана в Международной патентной заявке WO 2010/0003225 (которая вводится в данное описание посредством отсылки). Коротко говоря, последовательность, кодирующую белок р19 вируса кустистой карликовости томата (TBSV), связывают с кассетой экспрессии фталоцианина люцерны лигированием с помощью ПЦР, как описано у Darveau et al. (Methods in Neuroscience 26: 77- 85(1995)). В первом цикле ПЦР сегмент промотора фталоцианина амплифицируют с помощью праймеров Plasto- 443 с:
GTATTAGTAATTAGAATTTGGTGTC (SEQ ID NO: 11)
HSUpP19-plasto.r
CCTTGTATAGCTCGTTCCATTTTCTCTCAAGATG (SEQ ID NO: 12) с конструкцией 660 (описанной в Международной патентной заявке WO 2010/0003225, которая вводится в данное описание посредством отсылки) в качестве матрицы. Параллельно другой фрагмент, содержащий кодирующую последовательность р19, амплифицируют с применением праймеров supP19-1c
ATGGAACGAGCTATACAAGG (SEQ ID NO: 13)
и SupP19-SacIr
AGTCGAGCTCTTACTCGCTTTCTTTTTCGAAG (SEQ ID NO: 14) используя в качестве матрицы 35S:pl9, описанную у Voinnet et al. (The Plant Journal 33:949-956 (2003)). Затем продукты амплификации смешивают и используют в качестве матрицы для второго цикла амплификации (реакции сборки) с помощью праймеров Plasto- 443 с и SupP19- SacLr. Полученный фрагмент расщепляют с помощью BamHI (в пластоцианиновом промоторе) и Sad (на конце последовательности, кодирующей р19) и клонируют в конструкцию номер 660, предварительно расщепленную теми же самыми рестриктазами, с образованием конструкции номер R472. Плазмиды используют для трансформации Agrobacteium tumefaciens (AGL1; ATCC, Manassas, VA 20108, USA) электропорацией (Mattanovich et al., 1989). Целостность всех штаммов А. tumefaciens подтверждают рестрикционным картированием. Штамм A. tumefaciens, содержащий R472, называется "AGL1/R472 ".
Конструкцию НсРго (35НсРго) получают как описано Hamilton et al. (2002). Все клоны секвенируют, чтобы подтвердить целостность конструкций. Плазмиды используют для трансформации Agrobacteium tumefaciens (AGL1; ATCC, Manassas, VA 20108, USA) электропорацией (Mattanovich et al., 1989). Целостность всех штаммов А. tumefaciens подтверждают рестрикционным картированием.
Получение растительной биомассы, инокулят, агроинфильтрация и сбор
Растения Nicotiana benthamiana выращивают из семян в поддонах, заполненных продажным субстратом сфагнума. Растения оставляют расти в теплице при световом дне 16/8 и температурном режиме 25°С днем/20°С ночью. Через три недели после засевания отдельные ростки собирают, пересаживают в цветочные горшки и оставляют расти в теплице еще в течение трех недель в тех же самых условиях. Через шесть недель средний вес растения составляет 80 г, а высота равна 30 см.
Штамм агробактерий Agrobacterium AGL1 трансфицируют (электропорация) с помощью конструкций, идентифицированных ниже, методами, описанными D'Aoust et al 2008 (Plant Biotechnology Journal 6:930-940). Трансфецированные агробактерий (Agrobacterium) выращивают в среде YEB, дополненной 10 мМ 2-(N-морфолино) этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина рН5.6, до OD600 между 0.6 и 1.6. Суспензии агробактерий {Agrobacterium) центрифугируют перед употреблением и ресуспендируют в среде для инфильтрации (10 мМ MgCl и 10 мМ MES рН 5.6).
Проводят агроинфильтрацию растений как описано у D'Aoust et al (см. выше). Коротко говоря, для вакуум- инфильтрации суспензии A. tumefaciens центрифугируют, ресуспендируют в среде для инфильтрации и хранят в течение ночи при 4°С. В день инфильтрации партии культуры разводят в 2.5 объемах культуры и оставляют нагреваться перед употреблением. Целые растения N. benthamiana помещают на 2 мин. в перевернутом положении в бактериальную суспензию в герметичный сосуд из нержавеющей стали под вакуумом 20-40 Торр (2666.44-5332.88 кПа). Если не указано иначе, все инфильтрации проводят как совместную инфильтрацию (коинфильтрацию) бактериями, трансформированными с помощью R472 (штамм AGL1/R472) в соотношении 1:1. После вакуум-инфильтрации растения возвращают в теплицу на 4-6 дневную инкубацию до момента сбора.
Отбор образцов листьев и экстракция тотального белка (механическая гомогенизация)
После инкубации в течение 4, 5, 6, 7 и 8 дней надземную часть растений собирают и сразу же используют. Тотальные растворимые белки экстрагируют гомогенизацией растительной ткани в 3 объемах холодного раствора 50 мМ Tris pH 8.0, 0.15 М NaCl, содержащего 1% Тритона Х-100 и 0.004% метабисульфита натрия. Растительную ткань гомогенизируют механически, используя POLYTRON™, измельчение в ступке пестиком, или с COMITROL в 1 объеме холодного раствора 50 мМ Tris pH 8, 0.15 М NaCl. Буфер, используемый с COMITROL™, также содержит 0.04% метабисульфита натрия. После гомогенизации кашицу измельченного растительного материала центрифугируют при 5,000 g в течение 5 мин при 4°С и сырые экстракты (супернатант) хранят для анализа. Содержание тотального белка осветленных поглощенных экстрактов определяют методом Бредфорд (Bio-Rad, Hercules, CA) с альбумином бычьей сыворотки в качестве стандарта.
Экстракция VLP разрушением клеточных стенок
Листья (ткань) собирают у растений Nicotiana benthamiana и разрезают на части размером ~1 см2. Части листьев вымачивают в растворе 500 мМ маннита в течение 30 минут при комнатной температуре (RT). Затем раствор маннита отбрасывают и заменяют ферментной смесью (смесь циллюлаз из Trichoderma viride (Onozuka R-10; 3% об/об) и смесь пектиназ из Rhizopus sp.(MACEROZYME™; 0.75% об/об; обе от Yakult Pharmaceuticals) в растворе для получения протопластов (500 мМ маннита, 10 мМ СаСl и 5 мМ MES/KOH (pH 5.6)). Отношение составляет 20 листовых обрезков (частей) на 100 мл раствора. Этот препарат равномерно распределяют в мелком сосуде (~11×18 см) и инкубируют в течение 16 часов на ротационном шейкере при 40 об/мин и 26°С.
Или же экстракцию VLP можно проводить следующим образом: проводят агроинфильтрацию растений с помощью AGL1/#685 как описано в Примере 1. Листья (ткань) собирают у растений N. benthamiana на 6 день после инфильтрации и разрезают на части размером ~1 см2. Multifect Пектиназу FE, Multifect CX CG и Multifect CX В (Genencor) добавляют до 1.0% каждую (об/об) в буферный раствор 600 мМ маннита, 75 мМ цитрата, 0.04% бисульфита натрия рН 6.0 при соотношении 1:2.5 (вес/об) свежей биомассы; буфер для расщепления образцов. Биомассу расщепляют (разрушают) в течение 15 час. при комнатной температуре на орбитальном шейкере.
После инкубации остаток от листьев удаляют фильтрованием (найлоновый фильтр 250 или 400 мкм). Протопласты в суспензии центрифугируют при 200xg (15 мин) с последующим центрифугированием супернатанта при 5000xg (15 мин) для дополнительного осветления супернатанта. Или же можно применять одну стадию центрифугирования при 5000xg в течение 15 минут. Семьдесят мл супернатанта затем центрифугируют при 70,000xg в течение 30 минут. Полученный осадок ресуспендируют в 1.7 мл PBS и сразу же анализируют или замораживают.
Анализ белков
Определение гемагглютинирующей активности Н5 проводят методом, описанным Nayak and Reichi (2004). Коротко говоря, серийные двойные разведения тестируемых образцов (100 мкл) готовят в 96- луночных титрационных планшетах с V-образным дном, содержащих 100 мкл PBS, оставляя 100 мкл разведенного образца на лунку. Сто микролитров 0.25% суспензии эритроцитов индейки (Bio Link Inc., Syracuse, NY) добавляют в каждую лунку и планшеты инкубируют в течение 2 часов при комнатной температуре. Величину, обратную наибольшему разведению, при котором наблюдается полная гемагглютинация, регистрируют как гемагглютинирующую активность. Параллельно рекомбинантный НА5 стандарт (A/Vietnam/I 203/2004 H5N1) (Protein Science Corporation, Meriden, CT) разводят в PBS и используют в качестве контроля для каждого планшета.
Твердофазный иммуноферментный анализ (ELISA)
НА5 стандарт готовят с очищенными вирусоподобными частицами, которые разрушались обработкой 1% Triton X-100 с последующим механическим встряхиванием на диспергаторе Tissue Lyser™ (Qiagen) в течение 1 мин. В 96-луночные микротитрационные планшеты с U- образным дном помещают 10 мкг/мл иммобилизованного антитела (Immune Technology Corporation, #IT-003-005I) в 50 мМ карбонат- бикарбонатного буфера для иммобилизации (рН 9.6) на 16-18 часов при 4°С. Все отмывки проводят 0.01 М раствором PBS (фосфатно-солевым буфером), рН 7.4 содержащим 0.1% Tween- 20. После инкубации планшеты отмывают трижды и блокируют 1% раствором казеина в PBS в течение 1 часа при 37°С. После стадии блокирования планшеты трижды отмывают. Стандарт НА5 разводят в проверочном экстракте (приготовленном из тканей листьев, пропитанных (инфильтрованных) только AGL1/R472), чтобы получить стандартную кривую в диапазоне от 500 до 50 нг/мл. Образцы для количественного определения обрабатывают 1% раствором Triton Х-100 перед загрузкой микропланшета. Планшеты дополнительно инкубируют 1 час при 37°С. После отмывки прибавляют овечьи поликлональные антитела против НА5 (CBER/FDA) в разведении 1:1000, и планшеты инкубируют 1 час при 37°С. После отмывки добавляют конъюгат кроличьих антител против овечьего иммуноглобулина с пероксидазой хрена в разведении 1: 1000 и планшеты инкубируют 1 час при 37°С. После конечной отмывки планшеты инкубируют с субстратом пероксидазы SureBlue ТМВ (KPL) в течение 20 минут при комнатной температуре. Реакцию прекращают, добавляя IN HCl и значения A450 определяют на планшет-ридере Multiskan Ascent (Thermo Scientific).
Пример 1: Ферментативная экстракция растительной ткани высвобождает большие количества НА с повышенной относительной активностью.
Количество и относительную активность НА, получаемого настоящим методом ферментативной экстракции, сравнивают с количеством и относительной активностью НА, получаемого обычными методами механической экстракции. Растения N. benthamiana пропитывают (инфильтрация) AGL 1/685 и листья собирают после пятишестидневного периода инкубации. Гомогенаты листьев готовят следующим образом:
Два грамма листьев гомогенизируют с помощью гомогенизатора Polytron; 4 г листьев измельчают пестиком в ступке; и 25 кг листьев гомогенизируют на приборе COMITROL™ (Urschel Laboratories) в буфере для экстракции (50 мМ Tris, 150 мМ Nad pH 8.0, отношение 1:1 вес/об). Ферментативную экстракцию проводят следующим образом: Двадцать грамм собранных листьев расщепляют пектиназами Macerozyme и целлюлазами Onozuka R- 10 по данному описанию После расщепления остатки листьев удаляют фильтрованием (найлоновый фильтр, 250 мкм). Протопласты в суспензии удаляют центрифугированием при 200xg (15 мин), а супернатант дополнительно осветляют центрифугированием при 5000xg (15 мин).
Количество и относительная активность НА в каждом из этих растительных экстрактов показана в Таблице 3. Количество НА, полученного методом ферментативной экстракции, значительно больше, чем количество НА, полученного методами механической экстракции.
Количество определяют методом ИФА (ELISA)
Пример 2: Ферментативное расщепление высвобождает НА, организованный в VLP.
растительной ткани
Комбинацию дифференциального центрифугирования и эксклюзионной хроматографии (SEC) используют для того, чтобы продемонстрировать, что НА, полученный методом ферментативной экстракции по данному описанию, организован в виде VLP. Агроинфильтрацию растений N. benthamiana при использовании AGL1/685 проводят как описано в Примере 1. Листья собирают у растений через 6 дней после инфильтрации, разрезают на части размером ~1 см, а затем расщепляют, отфильтровывают крупные частицы и центрифугируют, как описано в Примере 1.
Затем осветленные образцы центрифугируют при 70000 х g, чтобы содействовать выделению VLP. Осадок после центрифугирования, содержащий VLP, осторожно ресуспендируют в 1/50 объеме фосфатно- солевого буфера (PBS; 0.1M фосфата натрия, 0.15М Nad pH 7.2) перед тем, как загрузить на колонку SEC.
Колонки SEC с насадкой 32 мл SEPHACRYL™ S- 500 гранул с высокой степенью разделения (S-500 HR: GE Healthcare, Uppsala, Sweden, Cat. No. 17-0613-10) готовят, используя уравновешивающий/элюирующий буфер (50 мМ Tris, 150 мМ NaCl, рН8). Хроматографию SEC осуществляют, нанося 1.5 мл VLP образца на уравновешенную колонку и элюируя 45 мл буфера для уравновешивания/элюции. Элюат отбирают в виде фракций по 1.7 мл, а содержание белка в каждой фракции определяют, смешивая 10 мкл фракции элюата с 200 мкл разведенного красителя для анализа белков, реагента Bio-Rad (Bio-Rad, Hercules, CA). Перед каждым разделением проводят калибровку с помощью Blue Dextran 2000 (GE Healthcare Bio-Science Corp., Piscataway, NJ, USA). Сравнение профилей элюции белков Blue Dextran 2000 и белков хозяина проводят для каждого разделения, чтобы гарантировать единообразие разделений.
Анализ белков фракций, элюированных в результате SEC
Содержание тотального белка в осветленных сырых экстрактах определяют методом Бредфорд (Bio-Rad, Hercules, CA), в качестве эталона используя альбумин бычьей сыворотки. Белки, присутствующие во фракциях SEC элюата, осаждают ацетоном (Bollag et al., 1996), ресуспендируют буфере для нанесения образца либо в 0.25 от объема, либо в 0.05 от объема в буфере для нанесения образца (0.1М Tris pH 6.8, 0.05% бромфенола голубого, 12.5% глицерина, 4% SDS и 5% бета-меркаптоэтанола) для анализа SDS- PAGE или иммуноблоттинга, соответственно. Разделение методом SDS- PAGE проводят в восстанавливающих условиях, а для окрашивания белка используют Кумасси (Бриллиантовый голубой) R- 250.
Изучение гемагглютинирующей активности (реакции гемагглютинации) для Н5 проводят, основываясь на методе, описанном Nayak и Reichi (2004). Коротко говоря, последовательные двухкратные разведения тестируемых образцов (100 мкл) готовят в 96- луночных титрационных планшетах с V- образным дном, содержащих 100 мкл PBS, оставляя 100 мкл разведенного образца на лунку. Сто микролитров 0.25% суспензии эритроцитов индейки (Bio Link Inc., Syracuse, NY) добавляют в каждую лунку и планшеты инкубируют в течение 2 часов при комнатной температуре. Величину, обратную наибольшему разведению, при котором наблюдается полная гемагглютинация, регистрируют как гемагглютинирующую активность. Параллельно рекомбинантный НА5 стандарт (A/Vietnam/1203/2004 H5N1) (Protein Science Corporation, Meriden, CT) разводят в PBS и используют в качестве контроля для каждого планшета.
На Фигуре ЗА показано, что гемагглютинирующая активность концентрируется во фракциях, соответствующих свободному объему колонки, это подтверждает, что гемагглютинирующая активность возникает в результате структурной организации с высокой молекулярной массой. Анализ SDS- PAGE (Фиг.3В) показывает, что те же самые фракции из свободного объема (фракции 7-10) также имеют наивысшее содержание НА с полосой, соответствующей НАО мономеру, детектируемой, примерно, при 75 кДа.
Пример 3: При ферментативном расщеплении растительной ткани НА-VLP высвобождаются с меньшим содержанием примесей
Агроинфильтрацию растений N. benthamiana при использовании AGL1/685 проводят как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см2, расщепляют, проводят грубую фильтрацию и центрифугируют, как описано в Примере 1.
При контролируемом ферментативном расщеплении листьев удаляются клеточные стенки, по меньшей мере, частично, что способствует высвобождению в экстрагирующую среду белков и компонентов, присутствующих в пространстве между клеточной стенкой и плазматической мембраной. Так как основная часть внутриклеточных белков и компонентов все еще остается неповрежденной и содержит в себе по большей части интактные протопласты, для их удаления проводят начальную стадию центрифугирования, при этом получают результирующий раствор, содержащий ферменты, разрушающие клеточные стенки, помимо внеклеточных растительных белков и компонентов (фракция апопласта), как показано на Фигуре 4.
На Фигуре 4 представлен анализ результирующего раствора, полученного после контролируемого ферментативного расщепления ткани листьев методом SDS- PAGE, описанным выше: дорожка 1: представлена используемая смесь ферментов; и дорожка 2: результирующий раствор после ферментативного расщепления. Для сравнения на 3 дорожке показано содержание белков в сыром экстракте из гомогенизатора Comitrol™. Отношение биомасса: буфер в экстракте, представленном на дорожке 2, составляет 1:5 (вес/об), тогда как на дорожке 3 оно составляет 1:1 (вес/об). Соответственно, образцы, представленные на дорожках 2 и 3, содержат белки из эквивалентного количества исходного материала. При примерно одинаковом соотношении буфер: растение концентрация белка в растительном экстракте, полученном механическим образом, составляет около 3.5-4 мг/мл, тогда как в ферментативном экстракте растения, полученном по настоящему изобретению, концентрация белка составляет около 1 мг/мл.
Найдено, что основную примесь на дорожке 3 составляет фермент рубиско (RubisCo, рибулозо- 1,5-бифосфат- карбоксилаза/оксигеназа), который состоит из двух типов белковых субъединиц: длинная (большая) цепь (L, около 55 кДа) и короткая (малая) цепь (S, около 13 кДа). Обычно всего восемь длинноцепных димеров и восемь короткоцепных димеров собираются вместе в комплекс большего размера RubisCo 540 кДа. Хотя эта белковая примесь находится в растительных экстрактах, полученных механическим путем, в большом количестве (см. стрелку на Фигуре 4), в растительных экстрактах, полученных ферментативным путем методом по данному описанию, она фактически отсутствует. Следовательно, метод по данному изобретению позволяет исключить эту основную белковую примесь на ранней стадии процесса.
Пример 4: При ферментативном расщеплении растительной ткани НА-VLP высвобождается в условиях, в которых она может непосредственно захватываться катионообменной смолой.
Агроинфильтрацию растений N. benthamiana при использовании AGL 1/685 проводят как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см2 и расщепляют в течение 15 час при комнатной температуре на орбитальном шейкере. Буфер для (гидролитического) расщепления содержит 1.0% (об/об) Multifect Пектиназы FE, 1.0% (об/об) Multifect CX CG orand и 1.0% (об/об) Multifect CX В (все от Genencor) каждый в буферном растворе 600 мМ маннита, 75 мМ цитрата, 0.04% бисульфита натрия рН 6.0 при соотношении 1:2.5 (вес/об) свежей биомассы; используют соотношение биомасса: буфер для расщепления 1:2.5 (вес/об).
После расщепления фракцию апопласта фильтруют через найлоновый фильтр 400 мкм для удаления крупных частиц нерасщепленной растительной ткани (<5% от исходной биомассы). Профильтрованный экстракт затем центрифугируют при комнатной температуре в течение 15 мин при 5000xg для удаления протопластов и внутриклеточных примесей (белков, ДНК, мембран, везикул, пигментов и т.д.). Затем, прежде чем проводить хроматографическую очистку, супернатант подвергают глубинной фильтрации (для осветления), используя фильтр из стеклянного волокна 0.65 мкм (Sartopore2/Sartorius Stedim) и фильтр 0.45/0.2 мкм.
Осветленную фракцию апопласта помещают на катионообменную колонку (Poros HS Applied Biosystems), уравновешенную с помощью буфера для уравновешивания/элюции (50 мМ NaPO4, 100 мМ NaCl, 0.005% Tween 80 рН 6.0). После возвращения УФ снова до нуля проводят ступенчатую элюцию экстракта буфером для уравновешивания/элюции (уравновешивающим/элюирующим буфером), содержащим увеличивающиеся концентрации NaCl (500 мМ). При необходимости фракции, полученные при хроматографии, упаривают в 10 раз на ультрафильтрационных установках Amicon™, снабженных 10 кДа MWCO. Анализ белков проводят как описано в предыдущих примерах.
В вышеописанных условиях большинство ферментов и растительных белков не связываются с катионообменной смолой, тогда как НА- VLP связывается, тем самым обеспечивая значительное обогащение элюированной фракции комплексами НА-VLP (Фигура 6). Помимо этого, как показано на Фигуре 6, дорожки 4 и 5, целлюлазы и пектиназы не связываются с катионообменной смолой в колонке при рН ниже 7. Поэтому выделение НА-VLP, на основании НА гемагглютинирующей активности, составляет 92% перед загрузкой на колонку для катионообменной хроматографии, и 66% в элюированной фракции. Фактор очистки, определенный во фракции, элюированной с катионообменной смолы, составляет 194.
Пример 5: Добавление NaCl к буферу для расщепления
Агроинфильтрацию растений N. benthamiana проводят при использовании штаммов AGL1, несущих конструкцию, экспрессирующую целевой агглютинин (Hl/Cal WT, В/По, H5Ando или Hl/Cal X179A), как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см2 и расщепляют как описано в Примере 4, за исключением отмеченного ниже. Фильтрацию, центрифугирование и осветление проводят как описано в Примере 4.
К буферу для расщепления прибавляют NaCl, чтобы оценить его потенциальное действие на степень извлечения (выделения) НА- VLP. Предполагаемые преимущества включают возможное предупреждение неспецифической ассоциации НА с растительными клетками или с частицами в суспензии, которые удаляются в процессе осветления, и возможное действие на достижение и/или сохранение и/или улучшения коллоидной стабильности НА- VLP.
Добавление 500 мМ NaCl к расщепляющему буферу приводит к повышению выхода HA-VLP на грамм биомассы после удаления протопластов и клеточного осадка центрифугированием. Однако, это повышение замечено только для штаммов Hl/Cal WT и В/Flо, тогда как выход для Н5 увеличивается незначительно при таком подходе (Таблица 4).
Далее, добавление 500 мМ NaCl при расщеплении приводит к увеличению высвобождения НА-VLP в процессе расщепления, что, в свою очередь, дает повышенную степень извлечения после осветления как для штамма Hl/Cal WT, так и для штамма Hl/Cal X-179A (Таблица 5), но не для штамма H5/Indo.
Выход (извлечение, выделение) выражают в процентах гемагглютинирующей активности, получаемой после глубинной фильтрации, по сравнению с активностью в центрифугированном расщепленном экстракте.
Ассоциированное состояние НА- VLP, с добавлением или без добавления NaCl в процессе ферментативного расщепления, изучают анализом траекторий наночастиц (Nanoparticle Tracking Analysis (NTA)) для H5/Indo и Hl/Cal WT (Фигура 7А и 7В, соответственно). Монодисперсный препарат частиц наблюдают для Н5, когда расщепление проводят в отсутствие NaCl, тогда как в препарате Hl/Cal наблюдается значительно большая совокупность размеров частиц. Добавление NaCl к расщепляющему буферу снижает самоассоциацию НА- VLP в случае H1/Cal, как показано достаточно монодисперсным распределением частиц, наблюдаемым на Фигуре 7С.Число частиц при 150 нм для H1/Cal WT- VLP повышается (примерно, в 5 раз) при добавлении 500 мМ NaCl к расщепляющему буферу.
Пример 6: Регуляция высвобождения пигментов
Агроинфильтрацию растений N. benthamiana проводят при использовании штаммов AGL1, несущих конструкцию, экспрессирующую целевой агглютинин (H5/Indo), как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см и расщепляют как описано в Примере 4, с добавлением к расщепляющему буферу 500 мМ NaCl или 500 мМ NaCl и 25 мМ ЭДТА. Фильтрацию, центрифугирование и осветление проводят как описано в Примере 4.
Высвобождение компонентов, имеющих зеленый цвет, на стадии ферментативного расщепления, дает очищенный препарат VLP, имеющий зеленоватую окраску. Поэтому изучают композицию раствора, расщепляющего клеточные стенки, и корректируют его, чтобы получить очищенный препарат VLP, имеющий более слабое зеленое окрашивание и, следовательно, повышенную степень чистоты. Не желая связывать себя теорией, можно сказать, что так как Са2+ играет важнейшую роль в удержании вместе составляющих ламелл - слоев клеточных стенок, и учитывая тот факт, что в клеточных стенках растительных клеток концентрация Са2+ обычно высока, добавление вещества, хелатирующего Са2+(хелатора), ЭДТА, могло бы способствовать ферментативной деполимеризации клеточной стенки, тем самым сохраняя интактными внутриклеточные органеллы, такие как хлоропласты, и предупреждая высвобождение компонентов зеленых пигментов.
Как показано в Таблице 6, добавление 25 мМ ЭДТА к буферу для расщепления позволяет уменьшить зеленое окрашивание очищенного Н5- VLP препарата, по определению разницы поглощения (абсорбции) препарата (OD672nm - OD650nm). Когда зеленые составляющие высвобождаются в большом количестве, или недостаточно удаляются, AOD VLP препарата >0.040.
Пример 7: Альтернативные композиции буфера для расщепления
Агроинфильтрацию растений N. benthamiana проводят при использовании штаммов AGL1, несущих конструкцию, экспрессирующую целевой агглютинин (H5/Indo), как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см2 и расщепляют как описано в Примере 4, с модификацией расщепляющего буфера, который включает 0%, 0.25%, 0.5%, 0.75% или 1% об/об Multifect Пектиназы FE, Multifect CX-CG целлюлозы и Multifect CX В целлюлазы, как указывается в Таблицах 7- 9. Фильтрацию, центрифугирование и осветление проводят как описано в Примере 4.
Как показано в нижеприведенных таблицах 7 и 8, показано, что пектиназа не является незаменимой в расщепляющем буфере. Аналогичные уровни H5/Indo или Hl/Cal WT VLP можно экстрагировать методом по настоящему изобретению в присутствии, или в отсутствие пектиназы. Кроме того, обнаружено, что уменьшение концентрации целлюлазы по сравнению с предыдущими примерами не оказывает значительного влияния на качество экстракции (Таблица 9).
Пример 8: Ферментативное расщепление при рН, близком к нейтральному
Контроль рН в процессе расщепления может быть чрезвычайно важен для экстракции некоторых VLP. Принимая во внимание то, что деполимеризация клеточной стенки, происходящая в ходе стадии расщепления, может высвобождать сахара, содержащие кислотные группы, которые могут подкислять раствор (т.е. от рН 6 до 5) в присутствии соответствующих буферов, и то, что некоторые VLP (такие как VLP, содержащие НЗ/Bris и B/Flo НА) уже продемонстрировали значительную восприимчивость к слабокислой среде, предпринято исследование влияния такого возможного подкисления на выход образующихся VLP.
Агроинфильтрацию растений N. benthamiana агробактериями Agrobacterium AGL1 штаммов, несущих конструкцию, экспрессирующую целевой агглютинин (B/Flo, H5/Indo, Н3/Bris), как описано в Примере 1. Листья собирают на 6 день после инфильтрации, режут на части размером ~1 см2 и расщепляют как описано в Примере 4, за исключением модификаций, а именно, среда для расщепления включает 500 мМ NaCl; 25 или 50 мМ ЭДТА; 0.03 или 0.04% бисульфита натрия; 0, 100,200 или 600 мМ маннита, 75, 125 или 150 мМ цитрата; и/или 75 мМ NaPO4; значение рН расщепляющего буфера корректируют как указано в Таблицах 10- 14. Фильтрацию, центрифугирование и осветление проводят как описано в Примере 4.
Проверяют различные составы расщепляющего буфера с целью достичь рН около 5.5 к концу ферментативного расщепления, включающие повышенную концентрацию цитрата (буферный эффект между рН 3.0 и 5.4) и добавление фосфата натрия (буферный эффект при рН выше 6.0). В Таблице 10 показано, что VLP из штамма В экстрагируются более активно, когда величина рН после расщепления близка к рН 6.0.
Далее изучают влияние инициации расщепления при повышенном значении рН, чтобы достичь конечного значения рН, близкого рН 6.0. Как показано в Таблице 11, расщепление растительной клетки в таких почти нейтральных условиях возможно и не уменьшает выход H5/Indo VLP при экстракции.
Также показано, что можно модифицировать другие компоненты, не оказывая негативного влияния на выход VLP при экстракции. В Таблице 12 иллюстрируются модификации, которые можно применять к расщепляющему раствору, чтобы повысить выход при экстракции B/Flo VLP, причем рН после расщепления достигает значения 5.4 -5.7, Такие модификации включают повышение концентрации цитрата и добавление Р04 буфера. Найдено, что увеличение концентрации ЭДТА, как правило, дает более кислый экстракт и пониженные выходы VLP при экстракции.
Далее состав буфера модифицируют таким образом, чтобы повысить выход при экстракции Н3/Brisbane VLP (Таблица 13)
Как показано в Таблицах 12 и 13, концентрацию маннита можно понизить до 200 мМ, и это не оказывает заметного влияния на выход VLP при экстракции. Дальнейшее уменьшение концентраций маннита до 100 мМ и даже полное исключение маннита из расщепляющего раствора не оказывает заметного влияния на уровень полученных НА-VLP (Таблица 14).
Пример 9: Пригодность ферментативного расщепления для широкого ряда НА- VLP
Метод ферментативного расщепления растительной биомассы по данному описанию можно применять для экстракции большого разнообразия НА-VLP. Как показано, в дополнение к экстракции НА-VLP, включающих H5/Indo, Hl/Cal WT VLP, Н3/Bris и B/Flo, иллюстрированной на вышеприведенных примерах, метод по данному описанию также пригоден для экстракции HA-VLP из сезонных Hl/Bris и H1/NC, что видно из Таблицы 15.
Все цитированные материалы вводятся в данное описание в посредством отсылок, как если бы указывалось, что каждая индивидуальная публикация конкретно и в индивидуальном порядке вводится в данное описание посредством отсылки, и как если бы она была полностью изложена в данном описании. Цитрирование ссылок не следует ни толковать, ни рассматривать как допущение, что такие ссылки представляют собой предшествующий уровень техники для настоящего изобретения.
На примере описан один или более предпочтительных вариантов настоящего изобретения. Изобретение включает практически все способы воплощения, модификации и варианты изобретения, указанные выше в данной заявке и со ссылкой на примеры и фигуры. Для специалиста в данной области техники очевидно, что можно сделать ряд изменений и модификаций, не отступая от объема изобретения, определяемого Формулой изобретения. Примеры таких модификаций включают замену известных эквивалентов для любого аспекта изобретения с целью достичь такого же результата практически тем же самым путем.
Реферат
Изобретение относится к биотехнологии, а именно к способу выделения вирусоподобных частиц VLP. Получают растения или растительный материал, содержащий VLP, локализованные в апопласте. Получают смесь протопластов/сферопластов и апопластов посредством обработки растения или растительного материала мультикомпонентной ферментной смесью, разрушающей клеточные стенки, содержащей целлюлазу. Получают фракцию протопласта/сферопласта и фракцию апопласта из смеси протопластов/сферопластов и апопластов. Выделяют фракцию апопласта, причем фракция апопласта содержит VLP. Выделяют VLP из фракции апопласта. Предложенное изобретение позволяет с высокой эффективностью выделить вирусоподобные частицы. 3 н. и 40 з.п. ф-лы, 12 ил., 15 табл., 9 пр.
Формула
а. получение растения или растительного материала, содержащего VLP, локализованные в апопласте;
б. получение смеси протопластов/сферопластов и апопластов посредством обработки растения или растительного материала мультикомпонентной ферментной смесью, разрушающей клеточные стенки, содержащей целлюлазу;
в. получение фракции протопласта/сферопласта и фракции апопласта из смеси протопластов/сферопластов и апопластов;
г. выделение фракции апопласта, причем фракция апопласта содержит VLP; и
д. выделение VLP из фракции апопласта.
а. получение растения или растительного материала, содержащего VLP, локализованных в апопласте;
б. обработку растения или растительного материала мультикомпонентной ферментной смесью, содержащей целлюлазу, с продуцированием смеси протопластов/сферопластов и одного или более комплексов белков апопласта, содержащих VLP;
в. отделение одного или более комплексов белков апопласта от протопластов/сферопластов; и
г. выделение VLP из комплекса белка апопласта.
а. получение растения или растительного материала, содержащего VLP;
б. расщепление растения или растительного материала с использованием разрушающей клеточные стенки мультикомпонентной ферментной смеси, содержащей целлюлазу, с получением расщепленной фракции;
в. фильтрацию расщепленной фракции с получением отфильтрованной фракции и выделение VLP из отфильтрованной фракции.

Комментарии