Эпитопы, образованные нековалентным связыванием конъюгатов - RU2259194C2
Код документа: RU2259194C2
Чертежи

Описание
Описание
Настоящее изобретение относится к композиции для взаимодействия с лигандом, способу получения такой композиции и способу получения молекулы на основе композиции.
Известный уровень техники
Известно, что рецепторы белков обычно взаимодействуют со своими лигандами-мишенями через эпитопы, которые составляют небольшую часть суммарной молекулы белка. Для максимального связывания или взаимодействия необходимо, чтобы структура эпитопа поддерживалась в строго закрепленной конформации для образования связывающего сайта, содержащего в непосредственной близости все необходимые компоненты эпитопа. Попытки получения пептидного аналога, созданного исключительно из аминокислот, составляющих связывающий сайт, часто оканчивались неудачей, так как такие пептиды не обладают той же биологической активностью, что и белковый рецептор. Это связано с тем, что пептид имеет в свободном растворе конформацию, отличную от таковой целого белкового рецептора. Кроме того, когда связывающий сайт белка создают из олигопептидов из различных, несоприкасающихся частей белковой цепи, смешивание выделенных олигопептидов в свободном растворе не ведет к воссозданию активного связывающего сайта.
Вынужденная необходимость использовать такие большие белки для представления эпитопов со связывающими сайтами ведет к возникновению нескольких проблем при разработке новых стратегий в рецептор-специфическом лечении. Одна проблема состоит в том, что такие большие белки легко могут вызывать иммунный ответ. Вторая проблема заключается в том, что длинные пептидные цепи восприимчивы к действию эндопептидаз, таких как те, которые находятся в просвете пищеварительного тракта. Наконец, указанные большие белки могут быть дорогостоящими для производства, очистки и поддержания в стабильной форме.
Краткое изложение существа изобретения
Целью настоящего изобретения является преодоление недостатков предшествующего уровня техники.
В первом варианте в изобретении предлагается композиция для взаимодействия с лигандом, причем композиция включает в себя нековалентный ассоциат множества отдельных конъюгатов, причем каждый конъюгат содержит головную группу и хвостовую группу, где хвостовые группы конъюгатов образуют гидрофобный агрегат, и конъюгаты имеют свободу движения в отношении друг друга внутри ассоциата, такую, что в присутствии лиганда по меньшей мере две головные группы (которые являются одинаковыми или отличающимися) располагаются подходящим образом для образования эпитопа, способного взаимодействовать с лигандом более прочно, чем каждая из головных групп по отдельности. Головные группы являются обычно гидрофильными, а хвостовые группы являются обычно гидрофобными, например, липофильными, состоящими из углеводородных цепей, галоидофильными, созданными из фторкарбоновых цепей, или созданными на основе силанов.
При конструировании конъюгатов с головной и хвостовой группой в соответствии с настоящим изобретением хвостовые группы могут ассоциировать с образованием гидрофобного агрегата, который представляет собой обычно надмолекулярный ассоциат, такой как мицелла, многослойная структура, липосома или другая липидная структура, причем конъюгат ориентирован таким образом, что головные группы находятся в тесном соседстве при существовании в водной фазе. Так как конъюгаты способны двигаться внутри ассоциата, головные группы способны адаптироваться к большому числу различных положений внутри ассоциата. Головные группы, которые обычно не идентичны, следовательно, свободны двигаться внутри ассоциата и неожиданно взаимодействовать кооперативно, вызывая биологические последствия, которые головные группы не способны вызвать по отдельности. Другой неожиданный результат заключается в том, что ассоциаты, состоящие из сочетаний различных головных групп, способны вызывать биологические ответы или участвовать в связывании с биологическими рецепторами, в то время как ассоциаты, состоящие из одинаковых головных групп, не способны действовать таким способом.
Как указывалось выше, данные надмолекулярные комплексы обычно являются состоящими из частиц или коллоидными по природе, причем обычно включают в себя многие сотни субъединиц (конъюгатов), причем все ориентированы головными группами по направлению кнаружи от центра частицы, как показано на фигуре 1а. Каждый из конъюгатов может менять свою локализацию в ассоциате, будучи свободным менять места по отношению к соседним конъюгатам в процессе броуновского движения, и, делая это, может мигрировать через всю поверхность ассоциата. Другими проявлениями надмолекулярных ассоциатов являются объемные фазы и покрытые поверхности.
Каждый конъюгат в ассоциате может иметь головную группу, выбранную из одного химического или биологического класса или из ряда различных классов, таких как аминокислота или пептид; пептидный аналог; моно-, ди- или полисахарид; моно-, ди- или полинуклеотид; стерин; алкалоид; изопреноид; производное инозита; единичное или слитое ароматическое ядро; водорастворимый витамин; порфирин или ядро гема; фталоцианин; хелат иона металла; водорастворимое лекарство; гормон или субстрат фермента.
В одном предпочтительном осуществлении каждая головная группа включает в себя аминокислоту или олигопептид, который может быть концевой частью пептидной цепи. Желательным является сведение длины пептида к минимуму, так чтобы избежать индукции иммунного ответа при использовании композиции in vivo. Соответственно, предпочтительно, чтобы пептид состоял в длину не более чем из шести аминокислот.
Применяемые аминокислоты могут быть природными аминокислотами, замещенными производными, аналогами и их D-формами.
Хвостовые группы конъюгатов могут быть все одними и теми же или могут представлять собой смесь различных хвостовых групп, каждая из которых предпочтительно содержит гидрофобную группу, выбранную из линейного, разветвленного, циклического, полициклического, насыщенного или ненасыщенного конструкта в присутствии или в отсутствие гетероатомов, включенных в структуру, которая может быть насыщенной или ненасыщенной, например, липидный аналог аминокислоты; простагландин; лейкотриен; моно- или диглицерид; стерин; производное сфингозина или керамида; и кремний- или галоген-замещенное производное такой гидрофобной группы. Хвостовая группа предпочтительно имеет от 6 до 24 атомов углерода и - более предпочтительно - включает в себя от 10 до 14 атомов углерода. В каждом конъюгате может присутствовать более одной хвостовой группы. Например, один или более липидных аналогов аминокислот с углеводородными боковыми цепями могут формировать часть каждого конъюгата, соединенную с одной или более аминокислотами в головной группе.
Любой химический способ может быть применен для связывания головной группы с хвостовой группой. Например, каждый конъюгат может дополнительно включать в себя спейсерную группу, соединяющую головную группу с хвостовой группой, так, чтобы ускорять представление головной группы на поверхности нековалентного ассоциата. Такие спейсерные группы хорошо известны и содержит, например, аминокислоты, оксикислоты, сахара и полиэтиленгликоль.
В другом варианте в настоящем изобретении предлагается композиция, определяемая выше, для применения в качестве лекарства, профилактического или диагностического средства.
Преимущество изобретения состоит в том, что может быть достигнуто сильное специфическое связывание с конъюгатами, в которых головные группы являются маленькими по сравнению с обычными биологическими рецепторами. Если, например, головная группа представляет собой олигопептид, тогда длина пептидной цепи обычно не должна превышать десяти аминокислот и должна предпочтительно составлять шесть или менее аминокислот. Соответственно, композиции согласно настоящему изобретению могут быть намного менее иммуногенными, чем их белковые варианты.
В соответствии с данным вариантом изобретения композиция согласно изобретению может быть составлена не только для взаимодействия с лигандом in vitro, но также композиция может быть применена in vivo, необязательно в составе с подходящими разбавителем, наполнителем или носителем, в соответствии с подходящим способом доставки.
В еще одном варианте в настоящем изобретении предлагается применение конъюгата, включающего в себя головную группу и хвостовую группу, для получения композиции, определяемой выше.
Дополнительно предлагается способ получения композиции для взаимодействия с лигандом, при этом данный способ включает в себя
(а) обеспечение множественности различных конъюгатов, причем каждый конъюгат включает в себя головную группу и хвостовую группу; и (b) образование из множества конъюгатов путем их нековалентной ассоциации ассоциата, в котором хвостовые группы агрегируют гидрофобным образом и в котором конъюгаты проявляют свободу движения по отношению друг к другу так, что в присутствии лиганда по меньшей мере две головные группы размещаются способом, соответствующим формированию эпитопа, способного взаимодействовать с лигандом сильнее, чем каждая из головных групп по отдельности. Каждый конъюгат является предпочтительно таким, как определено выше.
Конъюгаты могут быть диспергированы в водной фазе множеством из известных методологий для получения липидных везикул, включая механическое смешивание, обработку высокими усилиями сдвига, сонификацию, дисперсию в растворителе или сорастворение с детергентами. Обычно образованные таким образом нековалентные надмолекулярные ассоциаты должны состоять из нескольких различных конъюгатов, смешанных вместе. Необязательно могут быть добавлены дополнительные липидные материалы для изменения поверхностных свойств, как вспомогательные средства для дисперсии конъюгатов, для стабилизации нековалентно связанного ассоциата конъюгатов, для способствования презентации головных групп конъюгатов или для возможности создания везикул, которые могут направляться эпитопами, образованными в результате случайного движения конъюгатов и соответствующего позиционирования головных групп в ассоциате.
Важный аспект способа в соответствии с настоящим изобретением включает в себя стадию идентификации множества конъюгатов, которые имеют желаемую биологическую активность. В предпочтительном осуществлении данная стадия включает в себя
(i) выбор набора конъюгатов с набором головных групп;
(ii) образование из них нековалентного ассоциата, в котором хвостовые группы агрегируют гидрофобным образом и в котором конъюгаты проявляют свободу движения по отношению друг к другу;
(iii) анализ достаточности взаимодействия между некова-лентным ассоциатом и лигандом;
(iv) необязательное повторение стадий с (i) по (iii) с применением набора конъюгатов с модифицированным набором головных групп; и
(v) отбор набора конъюгатов в качестве множества конъюгатов стадии (а) при выявлении достаточного взаимодействия на стадии (iii).
Примеры тестов на "достаточное взаимодействие" могут включать в себя анализ связывания, наподобие анализа с применением принципа ИФА (ELISA) для определения взаимодействия между антителом и антигеном. Другие подходящие тесты in vitro включают в себя модификацию флуоресценции чувствительных к окружению связанных мембраной флуоресцентных зондов, реакции преципитации, увеличение или торможение активности ферментов и т.п. Подходящими также могут быть тесты, основанные на способности материалов изменять поведение клеток, культивируемых in vitro, такие как тесты на клеточную смерть, клеточную пролиферацию, апоптоз, торможение или стимуляцию межклеточных контактов, секрецию цитокинов или других растворимых продуктов, синтез специфических мРНК, внутриклеточный везикулярный транспорт, изменение процессов клеточной сигнализации и т.п. Могут выполняться также тесты in vivo на целых животных или человеке, например, по включению радиоактивной метки в надмолекулярные ассоциаты, за которым следует изучение ее последующего распределения после введения различными способами.
В соответствии с данным способом применяют комбинаторный подход, в котором получают диапазон различных надмолекулярных ассоциатов (или "зондов"), каждый из которых содержит различное сочетание конъюгатов, выбранных из банка предварительно синтезированных. Выбор подходящих конъюгатов может быть основан на известных свойствах лиганда-мишени или может просто включать в себя применение очень широкого спектра головных групп для увеличения вероятности того, что две или более головные группы будут образовывать эпитоп для лиганда. Таким образом, после теста на достаточное взаимодействие между зондом и лигандом, как описано выше, сочетание конъюгатов, определяемое как наиболее эффективное, может быть модифицировано путем добавления дополнительных головных групп, удаления некоторых головных групп, или обоими способами, и полученные зонды тестируют еще раз на достаточное взаимодействие. В конечном счете, может быть идентифицировано и выбрано для применения в композиции наиболее благоприятное сочетание головных групп.
Настоящее изобретение, следовательно, имеет весьма явное преимущество по сравнению с традиционной комбинаторной химией. В комбинаторной химии идентификация наиболее благоприятной последовательности для связывания со специфическим рецептором должна быть осуществлена с помощью синтеза сотен возможных сочетаний различных групп, таких как аминокислоты, в различном порядке, каждое из которых должно быть протестировано в отношении эффективности. Данный процесс требует времени, дорог и ограничен природой химических подходов, которые могут быть выполнены для присоединения различных компонентов друг к другу. В отличие от этого, настоящее изобретение просто полагается на близость головных групп для обеспечения эпитопов ассоциативного происхождения. Как только синтезирован набор конъюгатов, никакой дополнительной химии синтеза не требуется, только простое смешивание конъюгатов для образования различных зондов путем нековалентной ассоциации.
В предпочтительном простом осуществлении настоящий способ использует конъюгаты, имеющие единственную аминокислоту, соединенную через спейсер с липидной хвостовой группой, которые могут легко сочетаться путем смешивания в водной среде с образованием мицелл, в которых боковые цепи различных аминокислот должны быть представлены вместе во множестве различных конфигураций. Соответственно, отпала необходимость представлять аминокислоты в конкретном порядке или со специфическим спейсером, или в специфической ориентации. На основании статистики правильное соотношение индивидуальных аминокислотных субъединиц всегда должно приводить к ассоциации с идеальной конфигурацией.
В одном приготовлении каждый из конъюгатов должен иметь линейную структуру: Х-спейсер-спейсер-липид-липид, где Х представляет собой единственную аминокислоту, отличную для каждого из отдельно применяемых конъюгатов.
При желании создать эпитопы, состоящие из природных аминокислот, возможно дополнительно упростить число головных групп для отбора. Можно систематизировать аминокислотные остатки, найденные в природных белковых материалах, как шесть основных классов, предпочтительно применяя в любом одном классе одну аминокислоту, наиболее предпочтительную по сравнению со всеми членами данного класса, благодаря повышенной пространственной гибкости аминокислот в концевом положении головной группы. Это создает эффект значительного снижения суммарного количества аминокислот, требуемых для создания предварительно синтезированного банка конъюгатов, и в результате этого суммарного числа применяемых головных групп. Главные классы аминокислот представлены ниже в таблице 1.
Для выявления активных сочетаний содержащих аминокислоты конъюгатов пригоден ряд подходов.
В одном из осуществлении ограниченное количество конъюгатов применяют для образования набора из отдельных зондов, в котором каждый зонд представляет собой водную суспензию надмолекулярных ассоциатов, причем каждый надмолекулярный ассоциат состоит из смешанных вместе отобранных конъюгатов и отличается от других за счет включения дополнительного различающегося конъюгата как показано ниже, где каждая данная буква представляет собой конъюгат с различными концевыми аминокислотами:
Каждый из зондов тестировали отдельно с помощью биологических тестов на предмет достаточного связывания, как описано выше.
Во втором простом осуществлении для определения того, какие из головных групп из имеющегося набора являются существенными, а какие из них являются избыточными для исследуемого биологического взаимодействия, можно сконструировать исходный зонд, содержащий большое количество различных конъюгатов из имеющегося набора, и его эффективность может быть сопоставлена с зондами, каждый из которых не содержит отдельный конъюгат. Данный подход проиллюстрирован ниже:
Допустимы сочетания описанных выше альтернативных подходов.
Созданию подходящего исходного набора могут способствовать знания о лигандемишени. Например, если известно, что лиганд является основным, имело бы смысл придать конъюгатам кислые свойства путем их предоставления в форме, в которой экспонирована свободная карбоксильная группа концевой аминокислоты. Повышенную специфичность может также обеспечить введение дополнительной функциональной группы путем применения конкретной аминокислоты в виде спейсерной группы по соседству с концевой аминокислотой. В тех случаях, когда, например, участие короткой олигопептидной последовательности с известной структурой в связывании с лигандом-мишенью уже было показано, такую последовательность можно включать в конъюгат, входящий в набор конъюгатов, составляющих композицию.
В последнем варианте в настоящем изобретении предлагается способ получения молекулы для взаимодействия с лигандом. Способ включает в себя получение композиции, в соответствии с одним из способов, определяемых выше; выявление по меньшей мере двух головных групп, которые образуют эпитоп для лиганда в композиции; и создание молекулы, включающей в себя функциональные группы по меньшей мере двух головных групп, не обязательно в пространственно отделенных друг от друга одной или более линкерными группами, таким образом, что молекула способна взаимодействовать с лигандом сильнее, чем каждая из головных групп по отдельности.
В то время как композиции согласно настоящему изобретению могут быть сами по себе полезны в системах in vitro или in vivo для возможной индукции биологического ответа в лечебном, профилактическом или диагностическом способе, в некоторых случаях молекула может быть получена на основе структуры указанных выше композиций. Путем выявления функциональных групп, по меньшей мере двух головных групп, которые образуют эпитоп для лиганда, может быть получена новая, аналогичная композиции молекула, содержащая тот же самый или сходный эпитоп. Функциональные группы могут, например, быть включены в единственный неразветвленный олигопептид, возможно, с помощью одной или более линкерных групп для пространственного разделения функциональных групп.
Краткое описание чертежей
Теперь изобретение будет описано с дополнительными подробностями лишь с помощью примера со ссылкой на примеры и прилагаемые чертежи, на которых:
фиг.1 дает схематическое изображение поверхности надмолекулярного ассоциата и то, каким образом такая композиция в соответствии с изобретением связывается с лигандом-мишенью; и
фиг.2 дает схематическое изображение поверхности надмолекулярного ассоциата, состоящего из двух неодинаковых конъюгатов, головные группы которых состоят из короткоцепочечных неразветвленных пептидов.
Подробное описание изобретения
Ссылаясь на фиг.1, часть 1 композиции в соответствии с настоящим изобретением изображена в форме мицелл, в которых головные группы 2 и хвостовые группы 3 совместно образуют конъюгаты 4 (фиг.1А). Лиганд-мишень 5 представлен композиции 1. Поскольку конъюгаты подвижны, происходит реорганизация (фиг.1В), обеспечивающая позиционирование головных групп 2 для связывания лиганда-мишени 5. Ссылаясь на фиг.2, часть композиции согласно настоящему изобретению изображена в форме надмолекулярного ассоциата, в котором связывание лиганда с поверхностью ассоциата вызывается созданием эпитопа, возникающего посредством нековалентной ассоциации двух конъюгатов, состоящих из короткоцепочечных пептидов (А), причем данный эпитоп способен взаимодействовать с лигандом сильнее, чем любой из индивидуальных конъюгатов по отдельности (В). Тот же принцип применим к головным группам, содержащим структуры, отличные от аминокислот.
Примеры
В представленных ниже примерах применяется стандартное однобуквенное обозначение аминокислот, за исключением того, что во всех случаях буква относится к описанным выше конъюгатам, в которых данная конкретная аминокислота находится на конце пептидной цепи. В описанных здесь примерах липид содержит две аминокислоты, соединенные посредством пептидной связи, где обе аминокислоты представляют собой аналоги глицина, в которых в каждом случае водород в положении альфа был заменен неразветвленной углеводородной цепью, содержащей 12 или 14 атомов углерода. Все связи между головной группой и спейсером и между спейсером и липидом осуществляются посредством пептидных связей. Головная группа содержит свободную аминогруппу, а свободный конец липида несет группу CONH2. Структура каждого конъюгата является следующей: NH2-головная группа-спейсер-аминокислота (боковая цепь C14)-аминокислота (боковая цепь C12)-CONH2.
Пример 1. Стимуляция секреции TNF макрофагами
1. Индивидуальные конъюгаты Е, Y, Q, S и Н (присоединенные к липиду посредством серин-глицинового спейсера) были получены в виде растворов в смеси метанол/дихлорметан 1:1 с концентрацией 5 мг/мл.
2. Растворы конъюгатов разливали в 7-мл стеклянные сосуды в равных соотношениях для получения конечного объема 400 мкл (2 мг твердого вещества) во всех сосудах, как показано в таблице к примеру 1. В случаях, когда объем имеющегося органического раствора был незначительным, доведение объема проводили на более поздней стадии, когда, как показано, соответственно снижали объем воды, добавляемой для восстановления.
3. Содержимое всех сосудов высушивали под струей азота, после чего экспонировали в вакууме, составляющем по меньшей мере 1 мбар, в течение ночи в лиофилизаторе.
4. На следующий день добавляли дистиллированную воду в объемах, указанных в таблице к примеру 1, для получения конечной концентрации во всех сосудах 1 мг/мл. Сосуды закрывали крышками, нагревали до 37°С и озвучивали до достижения прозрачности.
5. После этого образцы вносили в лунки 24-луночных кластерных планшет, в которые предварительно помещали клетки клеточной линии макрофагов J774A-1 (5× 104 клеток/мл/лунку). В отдельные лунки добавляли образец в объеме 100 мкл и 10 мкл, и клетки инкубировали в течение ночи при 37°С в атмосфере 5% СО2/воздух.
6. На следующий день отбирали дважды по 50 мкл супернатанта из каждой лунки и измеряли в них концентрацию TNF с помощью тестирования ИФА с поглощением. Полученные результаты показаны в таблице ниже.


Можно видеть, что некоторые, хотя и не все, сочетания различных головных групп вызывают сильные биологические ответы, что указывает на то, что ответ специфичен по отношению к данным конкретным сочетаниям. Пример иллюстрирует направление, в котором описанные конъюгаты могут быть применены в комбинаторном подходе для выявления эффективных сочетаний с целью индукции желаемого биологического ответа.
Пример 2. Секреция TNF макрофагами
Сравнение надмолекулярных ассоциатор, содержащих смесь конъюгатов, со смесью надмолекулярных ассоциатов, каждый из которых содержит один конъюгат.
Образцы готовили, как описано в примере 1 с включением или без него дополнительных липидных материалов, как описано ниже. Сочетание конъюгатов Y, S и L было выбрано потому, что данное сочетание давало хороший ответ в эксперименте, описанном в примере 1.
Образцы, содержащие фосфатидилхолин, получали при соотношении фосфолипида к конъюгату, равном 2:1 вес/вес.
Образцы, содержащие октилглюкозид, получали при соотношении гликолипида к конъюгату, равном 1:1 вес/вес.
Показанные в таблице ниже результаты представляют собой оптическую плотность при 450 нм ИФА TNF, проведенного на супернатантах 18-часовой культуры. Концентрация конъюгата в лунках составляла 10 мкг/мл
Данный пример показывает, что сочетания конъюгатов могут вызывать биологические ответы как в отдельности, так и при их сочетании с другими липидами, такими как фосфолипиды или липосахара. Пример также показывает, что для проявления эффективности важно, чтобы все конъюгаты находились в сочетании в одном надмолекулярном ассоциате, и что активность не наблюдается в том случае, если те же самые конъюгаты присутствуют вместе в одно и то же время, но в разных надмолекулярных ассоциатах. Это позволяет предполагать важность нахождения конъюгатов в близком соседстве друг с другом для обеспечения образования эпитопов, формируемых путем нековалентной ассоциации конъюгатов, которые могут участвовать в специфическом связывании с рецепторами клеточной поверхности.
Пример 3. Повышение перорального захвата
1. Индивидуальные конъюгаты L, S, Е и Q (присоединенные к липиду посредством тирозин-глицинового спейсера) были получены в виде растворов в бензиловом спирте с концентрацией 10 мг/мл.
2. В 7-мл стеклянные сосуды с закручивающимися крышками вносили по 75 мкл14С-холестеринолеата (3,7 MBq/мл в толуоле) и высушивали под струей азота.
3. 400 мкл каждого из растворов (1) добавляли в один из сосудов (2) и встряхивали в течение ночи при комнатной температуре.
4. Растворы конъюгатов переносили в 7-мл стеклянные сосуды в равных соотношениях для получения конечного объема 80 мкл (0,8 мг твердого вещества) во всех сосудах, как показано в примере ниже

5. В каждый из сосудов добавляли по 2 мл дистиллированной воды при перемешивании. Сосуды затем закрывали крышками и озвучивали в течение 20 минут.
6. После этого образцы замораживали в жидком азоте и лиофилизировали в течение ночи.
7. На следующий день каждый сосуд восстанавливали 2 мл дистиллированной воды и вновь озвучивали до получения прозрачных дисперсий.
8. Образцы вводили с помощью перорального желудочного зонда самкам мышей Balb/c (масса тела 20-25 г - по четыре мыши на группу) в дозе 0,3 мл на животное.
9. Через 45, 90 и 180 минут после введения с помощью пункции хвостовой вены отбирали 75-мкл образцы гепаринизированной крови.
10. Каждый образец разводили в 0,5 мл ЗФР, после чего центрифугировали/ и 0,4 мл супернатанта переносили в сцинтилляционный сосуд, в который при перемешивании добавляли 2 мл Optiphase Hisafe 3 (Wallac).
11. Активность в образцах измеряли на сцинтилляционном счетчике.
Процент захвата определяли, основываясь на объеме крови 2 мл, из которых 1 мл принимался за объем плазмы.
Результаты показаны в таблице ниже.
Можно видеть, что некоторые, хотя и не все, сочетания различных головных групп повышают захват метки при применении перорального пути, что указывает на то, что ответ специфичен по отношению к данным конкретным сочетаниям. Пример иллюстрирует направление, в котором описанные конъюгаты могут быть применены в комбинаторном подходе для выявления эффективных сочетаний, способных действовать в качестве направляющих для лигандов.
Пример 4. ИФА связывания Fc
1. К 20 мкл ЗФР добавляли 100 мкл IgG козы (1 мг/мл) и 100 мкл переносили в каждую лунку планшета для микротитрования с плоским дном.
2. Планшет инкубировали в течение нескольких дней при 4°С.
3. В 1-мл стеклянных сосудах отвешивали по 2 мг каждого из конъюгатов Y, F, W, L, S, Е, Q и R (каждый из которых был присоединен к липиду посредством серин-глицинового спейсера), и добавляли 200 мкл бензилового спирта для получения растворов каждого конъюгата с концентрацией 10 мг/мл.
4. Растворы переносили в 7-мл стеклянные сосуды с завинчивающимися крышками следующим образом:
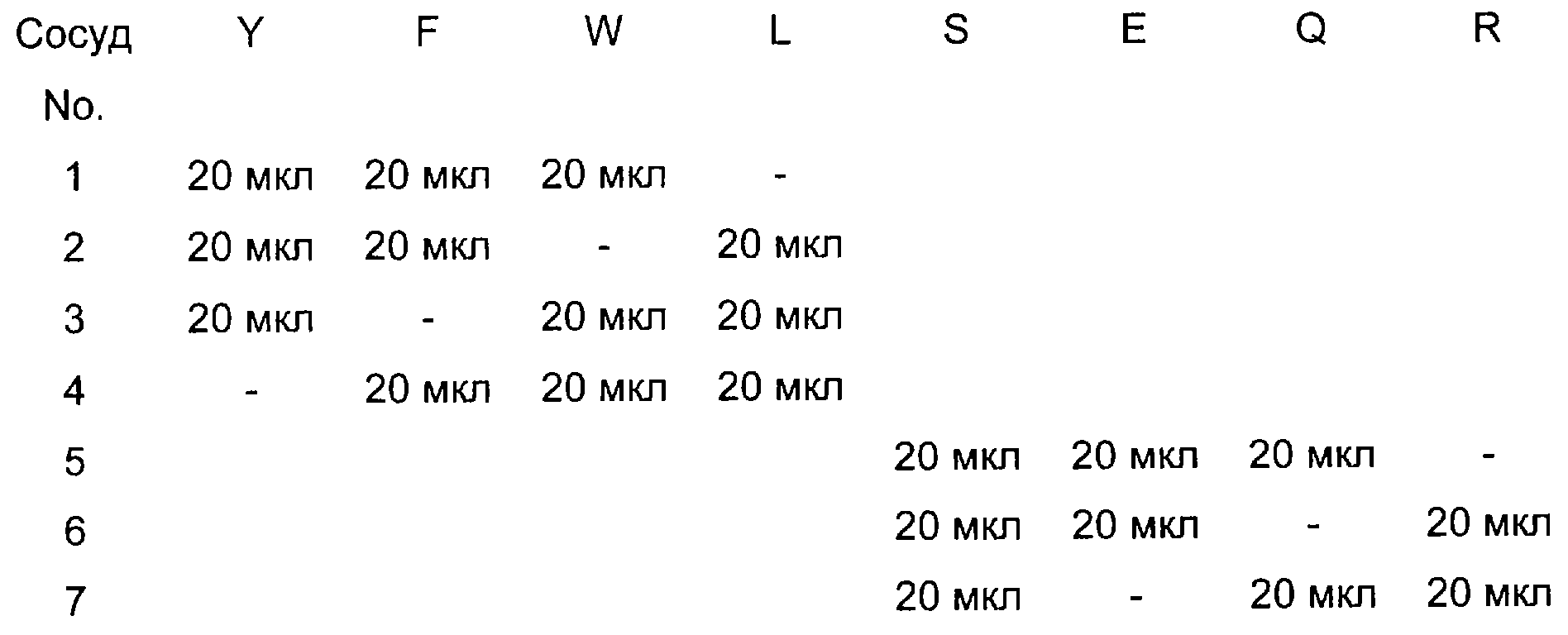
5. Содержимое каждого сосуда тщательно перемешивали встряхиванием, после чего в каждый сосуд добавляли 1,5 мл дистиллированной воды.
6. Сосуды закрывали крышками и озвучивали в течение пяти минут для получения полностью прозрачных дисперсий.
7. Планшет стадии (2) промывали ЗФР/0,02% Твин 20, после чего проводили блокирование путем инкубации в течение одного часа с 1% БСА в ЗФР (300 мкл/лунку).
8. После этого планшет промывали, как указано выше, и добавляли 100 мкл образца из каждого сосуда стадии (6) в лунки колонки (1), ряды с (1) по (7). Ряд (8) оставляли в качестве контроля в виде холостой пробы.
9. В планшете готовили двойные разведения путем переноса 100 мкл из лунок колонки (1) в соседние лунки того же ряда колонки (2) и перемешивания с последующим переносом 100 мкл в следующую колонку как описано выше, и т.д.
10. Планшет далее инкубировали в течение ночи при 4°С.
11. На следующий день планшет промывали, как описано выше, и в каждую лунку добавляли 100 мкл имеющегося в продаже конъюгата пероксидаза хрена-IgG (разведенного 1/1000 в ЗФР), и инкубировали при комнатной температуре в течение 40 минут.
12. Затем планшет вновь промывали и в каждую лунку добавляли 100 мкл OPD субстрата пероксидазы, и инкубировали при комнатной температуре в течение 30 минут.
13. В каждую лунку добавляли 20 мкл ЗМ серной кислоты для остановки реакции.
14. Оптическую плотность каждой лунки измеряли при 450 нм на планшетном ридере, и полученные результаты после вычитания фона представлены ниже.
Можно видеть, что максимальное связывание достигается в образцах 2, 3 и 4 (т.е. при сочетаниях YFL, YWL и FWL).
Можно видеть, что некоторые, хотя и не все, сочетания различных головных групп вступают в сильные взаимодействия связывания, что указывает на то, что ответ специфичен по отношению к данным конкретным сочетаниям. Пример иллюстрирует направление, в котором описанные конъюгаты могут быть применены в комбинаторном подходе для выявления эффективных сочетаний с целью индукции желаемого взаимодействия связывания.
Реферат
Изобретение относится к фармацевтической химии, в частности к композиции для взаимодействия с лигандом, причем композиция включает в себя нековалентный ассоциат множества отдельных конъюгатов, каждый из которых содержит головную группу и хвостовую группу, где хвостовые группы конъюгатов образуют гидрофобный агрегат, и конъюгаты подвижны в пределах ассоциата, так что в присутствии лиганда по меньшей мере две из головных групп размещаются способом, соответствующим формированию эпитопа, способного взаимодействовать с лигандом сильнее, чем каждая из головных групп по отдельности. Изобретение обеспечивает применение конъюгатов в комбинаторном подходе для выявления эффективных сочетаний с целью индукции желаемого взаимодействия связывания в рецептор-специфическом лечении. 4 н. и 27 з.п. ф-лы, 2 ил., 10 табл.


Комментарии