Иммунная модуляция - RU2662927C2
Код документа: RU2662927C2
Чертежи







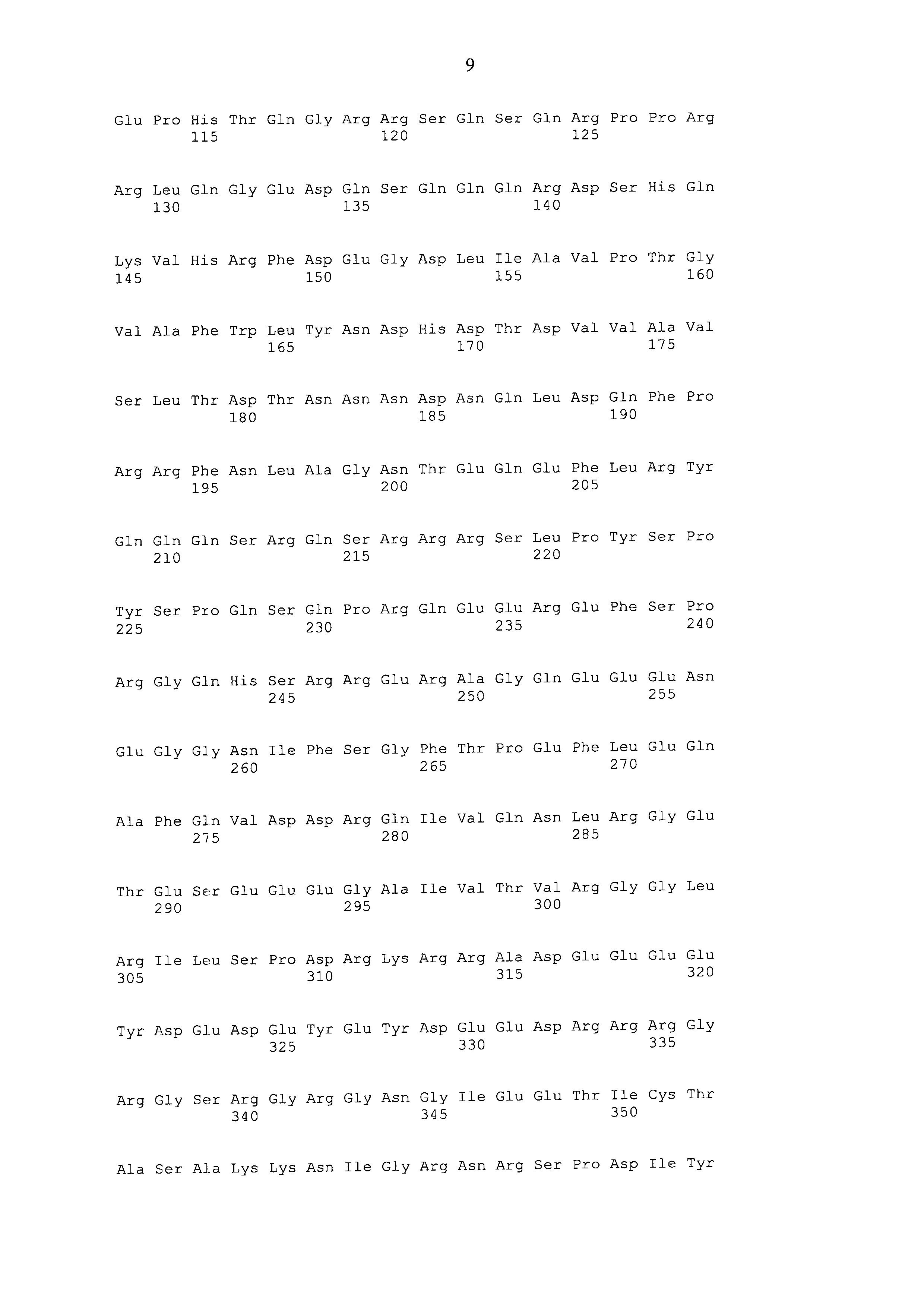





























Описание
Область техники
Изобретение относится, главным образом, к области профилактических или терапевтических вакцин. В частности описание относится к вакцине для лечения аллергий на арахис путем подавления аллергической реакции на него.
Уровень техники
В принципе аллергические заболевания представляют собой расстройства иммунной системы, связанные с дисрегуляцией субпопуляций лимфоцитов TH1 и TH2 [de Vries et al., 1999, Parronchi et al., 1999, Singh et al., 1999]. Постулировано, что со снижением частоты инфекционных заболеваний вследствие вакцинации, применения антибиотиков и других методов здравоохранения утерян основной источник иммунной провокации TH1 с последующим возрастанием смещения иммунных реакций TH2 на окружающие аллергены [Holgate 1999, Shaheen et al., 1996].
Из различных аллергических заболеваний, которые поражают значительную часть населения, вызываемая арахисом анафилаксия является особенно тяжелой и представляет наиболее распространенного участника госпитализаций в отделения неотложной помощи для лечения анафилактических реакций.
Аллергии на арахис являются результатом аберрантной иммунной реакции, направленной против другого безвредного антигена окружающей среды. Аллергия на и анафилаксия к арахису концентрируются вокруг иммунной реакции типа 2, характеризующейся генерацией клеток TH2 и В-клеток, секретирующих антитела IgE. Напротив, иммунная реакция типа 1 может характеризоваться антителами преимущественно IgG (изотип IgG2 у мышей), активацией клеток NK и фагоцитов и развитием цитотоксических Т-лимфоцитов (CTL). Реакции как типа 1, так и 2 координируются хелперными Т-клетками, которые дифференцируют до нескольких функционально различных субпопуляций, включая лимфоциты TH1 и TH2. Такие субпопуляции характеризуются по их профилю секреции цитокинов [Mosmann et al., 1989], где клетки TH1 продуцируют IFN-гамма, и клетки TH2 типично секретируют IL-4, IL-5 и IL-13.
Поглощаемые перорально аллергены арахиса сначала сталкиваются с иммунной системой слизистой оболочки кишечника. Складчатые (М) клетки являются специализированными фолликул-ассоциированными клетками, которые выстилают эпителий желудочно-кишечного тракта и находятся в непосредственной близости к пейеровым бляшкам. Они ответственны за индукцию толеризации и/или защитные ассоциированные с кишечником иммунные реакции. Чувствительность к пищевым аллергенам имеет место, когда экзогенные пищевые антигены поглощаются М-клетками и затем представляются макрофагам и дендритным клеткам (DC) [DeLong et al., 2011]. После интернализации макрофагами и DC антигены претерпевают эндоцитоз, затем денатурируются и разрушаются до пептидов длиной примерно в 12-20 аминокислот. Затем небольшая фракция таких небольших пептидных фрагментов переносится внутриклеточно и представляется молекулам класса II ГКС на поверхности клеток для специфического взаимодействия с CD4+ Т-клетками. Затем такие активированные CD4+ Т-клетки увеличиваются в числе и высвобождают цитокины TH2. Клетки TH2, IL-4 и IL-5 промотируют дифференцировку В-клеток, которые включают аллергены, связанные с поверхностными иммуноглобулиновыми (Ig) рецепторами, до клеток, которые секретируют аллергенспецифические антитела IgE [Turcanu et al., 2010]. Такие продуцирующие IgE В-клетки увеличиваются в числе и становятся клетками плазмы, которые непрерывно секретируют аллергенспецифические антитела IgE. Воздействие окружающей среды на арахис приводит к связыванию аллергенов арахиса со специфическим слоем IgE на тучных клетках и базофилах. Затем перекрестное сшивание с Fc-рецептором дает сильный активирующий стимул, что приводит к дегрануляции базофилов и тучных клеток, которые быстро высвобождают различные предварительно образовавшиеся провоспалительные и вазоактивные соединения, такие как простагландины, лейкотриены, серинпротеазы, гистамин и цитокины, во внеклеточную жидкость с продуцированием воспалительной реакции [Sicherer et al., 2010], которые все достигают кульминации в клиническом проявлении острой аллергической реакции [Long 2002].
Локальные симптомы аллергии на арахис включают боль в животе, рвоту, судороги и диарею и являются обычными даже в случаях умеренной аллергии на арахис. Такая острая неопасная для жизни реакция вызывает временное возрастание интестинальной проницаемости, которая затем допускает системное распространение макромолекул, таких как цельные аллергены арахиса, обострение аллергической реакции на аллергены арахиса, что может вызвать опасные для жизни анафилактические реакции [Sanderson et al., 1993].
В отличие от традиционной иммунотерапии против аллергических реакций на пыльцу растений, пылевого клеща и пчелиный яд, подкожные десенсибилизирующие инъекции арахисовых экстрактов имеют неприемлемые опасные благоприятные действия [Oppenheimer et al., 1992]. Поэтому в настоящее время единственным доступным способом предотвращения дополнительных реакций является избегать арахис. Однако строгое избегание часто является нереальной стратегией для многих индивидуумов, в частности, в свете случайного воздействия арахиса, которое часто происходит через поглощение обработанных пищевых продуктов или продуктов, приготовленных в некоторой близости от продуктов, содержащих арахис, например, в ресторанах, школах, предприятиях питания и рабочих столовых. Поэтому сохраняется потребность в эффективной терапевтической стратегии для лечения и предупреждения аллергии на арахис.
Сущность изобретения
В одном аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, два аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В одном аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, два аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, три аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, три аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к применению поксвирусного вектора, раскрытого в данном описании, для лечения или для изготовления лекарственного средства для лечения аллергии на арахис.
В другом аспекте настоящее изобретение относится к способу индукции переносимости или подавления аллергической реакции у субъекта или пациента, причем способ включает введение субъекту или пациенту эффективного количества поксвирусного вектора, раскрытого в данном описании, в течение времени и в условиях, достаточных для того, чтобы добиться подавления/переносимости.
В другом аспекте настоящее изобретение относится к способу вакцинации субъекта для индукции переносимости аллергена арахиса, включающему введение поксвирусного вектора, раскрытого в данном описании.
В другом аспекте настоящее изобретение относится к набору, включающему поксвирусный вектор, раскрытый в данном описании.
Изложенную выше сущность изобретения не следует рассматривать как исчерпывающую все воплощения настоящего изобретения.
Краткое описание чертежей
Фиг. 1 показывает расположение антигена PHAV согласно воплощению настоящего изобретения, включающего метку деградации протеасомой и несколько аллергенов арахиса (фиг. 1А и 1В), и антигена PHAV согласно воплощению настоящего изобретения без метки деградации протеасомой (фиг. 1С).
Фиг. 2 показывает нуклеотидную последовательность экспрессирующей кассеты UBc.PHAV.
Фиг. 3 показывает нуклеотидную последовательность экспрессирующей кассеты конструкции PHAVag без последовательности убиквитина.
Фиг. 4 является схематическим представлением встраивания экспрессирующих кассет PHAV в ORF A39R вируса коровьей оспы, штамм Копенгаген, методом гомологичной рекомбинации.
Фиг. 5 перечисляет особенности кассеты гомологичной рекомбинации, схематически представленной на фиг. 4.
Фиг. 6 показывает нуклеотидную последовательность кассеты гомологичной рекомбинации UBc.PHAV.
Фиг. 7 показывает нуклеотидную последовательность кассеты гомологичной рекомбинации PHAV.
Фиг. 8 является схематическим представлением рТС11 (UBc.PHAV) и рТС12 (PHAV). На фиг. 8 показаны плазмиды.
Фиг. 9 является схематическим представлением пути протеасомальной деградации в клетке.
Фиг. 10 показывает уровни сывороточных антител IgE (фиг. 10А) и IgG2a (фиг. 10В), специфических к белкам арахиса, до и после вакцинации (17 дней после вакцинации) с пустым вектором (SCV000) или вектором UBc.PHAV (SCV201C); *=р<0,05.
Фиг. 11 показывает уровни IFN-гамма (IFN-g; цитокин TH1; фиг. 11А), IL4 (цитокины TH2; фиг. 11В) и IL5 (цитокины TH2; фиг. 11С), секретированных культивированными лимфоцитами, полученными из селезенок мышей, вакцинированных SCV000 и SCV201C.
Подробное описание
Ссылка на любой уровень техники в данном описании не является и не должна приниматься как признание или какая-либо форма утверждения, что данный уровень техники образует часть общедоступных сведений в любой стране.
В данном описании, если контекст не требует иного, слова «включать», «включает» и «включающий» следует понимать как означающие включение определенной стадии или элемента или группы стадий или элементов, но без исключения любой другой стадии или элемента или группы стадий или элементов. Таким образом, применение термина «включающий» и подобных показывает, что перечисленные элементы являются требуемыми или обязательными, но что другие элементы являются необязательными и могут присутствовать или не могут. «Состоящий из» подразумевает включение и ограничивается тем, что следует за выражением «состоящий из». Таким образом, выражение «состоящий из» показывает, что перечисленные элементы требуются или являются обязательными, и что никакие другие элементы не могут присутствовать. «Состоящий по существу из» подразумевает включение любых элементов, перечисленных после указанного выражения и ставит предел другим элементам, которые не влияют на или не вносят вклад в активность или действие, конкретизированные в раскрытии для перечисленных элементов. Таким образом, выражение «состоящий по существу из» показывает, что перечисленные элементы требуются или являются необходимыми, но что другие элементы являются необязательными и могут присутствовать или не могут, в зависимости от того, влияют ли они или нет на активность или действие перечисленных элементов.
Используемые в данном описании формы единственного числа включают множественные аспекты, если контекст не требует четко иного. Таким образом, например, ссылка на «композицию» включает одну композицию, а также две или больше композиций; ссылка на «агента» включает одного агента, а также два или больше агентов; ссылка на «изобретение» включает один и несколько аспектов изобретения; и так далее.
Если не указано иное, все технические термины, используемые в данном описании, имеют значения, которые им обычно придаются специалистами в области техники, к которой относится данное изобретение. Любые материалы и способы, схожие с или эквивалентные способам, описанным в данном описании, могут быть использованы для осуществления на практике или проверки настоящего изобретения.
Настоящее изобретение делает возможным «вакцинный» подход к разработке терапевтического средства для лечения или предупреждения аллергии на арахис. В частности, описывается средство, способное предоставить терапию в контексте основных аллергенов арахиса, например, по меньшей мере, одного, по меньшей мере, двух, по меньшей мере, трех и т.д. наиболее распространенных или опасных аллергенов арахиса.
Настоящее изобретение основано на неожиданном открытии авторов изобретения, что ДНК-вакцина, включающая нуклеотидную конструкцию, оперативно кодирующую слитый белок, причем слитый белок включает аллерген арахиса (такой, как ara h 1), соединенный с меткой деградации протеасомой (такой, как убиквитин), способна индуцировать иммунную реакцию у субъекта, которая смещена к фенотипу TH1, что ведет таким образом к секреции специфических IgG-антител к аллергенам арахиса как противодействующих специфическим IgE-антителам к аллергенам арахиса, которые в противном случае облегчают аллергическую реакцию при воздействии аллергена арахиса.
Соответственно в одном аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, два аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, два аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, три аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, включающему нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере, три аллергена арахиса, выбранных из перечня, состоящего из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11, и их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, который экспрессирует в клетке субъекта слитый белок, включающий (i) аллерген аллергена арахиса, выбранный из перечня, состоящего из, (а) по меньшей мере, двух аллергенов арахиса из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7 или их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, или (b), по меньшей мере, трех аллергенов арахиса из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7 или их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
В другом аспекте настоящее изобретение относится к поксвирусному вектору, который экспрессирует в клетке субъекта слитый белок, включающий (i) аллерген аллергена арахиса, выбранный из перечня, состоящего из, (а) по меньшей мере, двух аллергенов арахиса из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11 или их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, или (b), по меньшей мере, трех аллергенов арахиса из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11 или их производных или частей, имеющих, по меньшей мере, 70% идентичность последовательностей с ними, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка.
Аллергены арахиса
Аллергены арахиса хорошо известны специалистам в данной области техники и включают любой пептид вида Arachis hypogaea, который может воздействовать на субъекта, например, при контакте, вдыхании, заглатывании, инъекции или подобным образом. В одном воплощении, по меньшей мере, два аллергена арахиса выбирают из группы, состоящей из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7. В другом воплощении, по меньшей мере, два аллергена арахиса выбирают из группы, состоящей из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11.
Слитый белок может включать любые два или больше аллергенов арахиса ara h 1 - ara h 11. Например, слитый белок может включать следующие аллергены арахиса:
(i) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11;
(ii) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(iii) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(iv) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(iv)) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7;
(vi) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5 и ara h 6;
(vii) ara h 1, ara h 2, ara h 3, ara h 4 и ara h 5;
(viii) ara h 1, ara h 2, ara h 3 и ara h 4;
(ix) ara h 1, ara h 2, ara h 3 и ara h 6;
(x) ara h 1, ara h 2 и ara h 3;
(xi) ara h 1 и ara h 2;
(xii) ara h 1 и ara h3;
(xiii) ara h 1 и ara h 4;
(xiv) ara h 1 и ara h 5;
(xv) ara h 1 и ara h 6;
(xvi) ara h 1 и ara h 7;
(xvii) ara h 1 и ara h 8;
(xviii) ara h 1 и ara h 9;
(xix) ara h 1 и ara h 10;
(xx) ara h 1 и ara h 11;
(xxi) ara h 2 и ara h 3;
(xxii) ara h 2 и ara h 4; и т.д.
За счет использования метки деградации протеасомой (например, убиквитина) как компонента слитого белка синтезированный слитый белок является мишенью для протеасомальной деградации, приводящей к генерации небольших пептидных фрагментов, которые вступают в эндоплазматический ретикулум (ER), где они образуют комплекс с белками класса I ГКС и затем переносятся к поверхности клетки для представления Т-лимфоцитам. Как следствие, имеет место усиленное представление фрагментов белков классу I ГКС. Таким образом, специалистам в данной области техники следует иметь в виду, что когда нуклеотидная последовательность кодирует слитый белок, включающий два или больше аллергенов арахиса, два или больше аллергенов арахиса могут оказаться в слитом белке в любом определенном порядке, когда экспрессированный слитый белок будет подвергаться протеасомальной деградации.
Специалистам в данной области техники следует иметь в виду, что выбор аллергена или аллергенов арахиса вероятно зависит от определенного терапевтического и/или профилактического применения. Например, когда вакцина должна использоваться для индукции переносимости у субъекта, который имеет аллергию на аллерген арахиса Ara h 1, тогда желательно, чтобы слитый белок включал ara h 1; когда вакцина должна использоваться для индукции переносимости у субъекта, который имеет аллергию на аллерген арахиса ara h2, тогда желательно, чтобы слитый белок включал ara h2; когда вакцина должна использоваться для индукции переносимости у субъекта, который имеет аллергию на аллергены арахиса ara h 1 и ara h 2, тогда желательно, чтобы слитый белок включал ara h 1 и ara h2; и т.д.
В одном воплощении аллерген арахиса выбирают из группы, включающей клон Р41В ara h 1 (GenBank, инвентарный номер L34402, или Swiss-Prot: Р43238.1); клон Р17 ara h 1 (GenBank, инвентарный номер L38853); кДНК ara h 2 (GenBank, инвентарный номер L7797, или UniProtKB/TrEMBL: Q8GV20); кДНК ara h 3 (GenBank, инвентарный номер AF093541 или АСН91862); кДНК ara h 4 (GenBank, инвентарный номер AF086821); кДНК ara h 5 (GenBank, инвентарный номер AF059616); кДНК ara h 6 (GenBank, инвентарный номер AF092846, или UniProtKB/TrEMBL: Q647G9), кДНК ara h 7 (GenBank, инвентарный номер AF091737), ara h 8 (GenBank, инвентарный номер AY328088, EF436550), ara h 9 (GenBank, инвентарный номер EU159429, EU161278), ara h 10 (AY722694, AY722695) и ara h 11 (DQ097716).
В одном воплощении слитый белок включает, по меньшей мере, четыре аллергена арахиса, предпочтительно, по меньшей мере, четыре из наиболее распространенных аллергенов, влияющих на субъектов с аллергией на арахис. В одном воплощении слитый белок включает аллергены арахиса ara h 1, ara h 2, ara h 3 и ara h 6.
Используемый в данном описании термин «аллерген арахиса», включающий конкретные примеры, такие как ara h 1, ara h 2 и т.д., следует понимать как включающий также его гомолог или вариант. Термин «гомолог», используемый в данном описании с обращением к гомологам нуклеотидных последовательностей или полипептидов, описанных в данном описании (включая, например, любую из SEQ ID NO: 1-12), следует понимать как включающий, например, ортологи, паралоги, мутанты и варианты нуклеиновых кислот или полипептидов, описанных в данном описании. В некоторых воплощениях гомолог включает нуклеотидную или аминокислотную последовательность, которая включает, по меньшей мере, 70% идентичность последовательностей, по меньшей мере, 75% идентичность последовательностей, по меньшей мере, 80% идентичность последовательностей, по меньшей мере, 85% идентичность последовательностей, по меньшей мере, 90% идентичность последовательностей, по меньшей мере, 95% идентичность последовательностей, по меньшей мере, 96% идентичность последовательностей, по меньшей мере, 97% идентичность последовательностей, по меньшей мере, 98% идентичность последовательностей или, по меньшей мере, 99% идентичность последовательностей с нуклеотидной или аминокислотной последовательностью, описанной в данном описании.
Так, в одном воплощении ara h 1 имеет аминокислотную последовательность SEQ ID NO: 4 или аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность с нею, ara h 2 включает аминокислотную последовательность SEQ ID NO: 6 или аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность с нею, ara h 3 включает аминокислотную последовательность SEQ ID NO: 8 или аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность с нею, и ara h 6 включает аминокислотную последовательность SEQ ID NO: 10 или аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность с нею,
В другом воплощении ara h 1 кодирован нуклеотидной последовательностью SEQ ID NO: 3 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность с нею, ara h 2 кодирован нуклеотидной последовательностью SEQ ID NO: 5 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность с нею, ara h 3 кодирован нуклеотидной последовательностью SEQ ID NO: 7 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность с нею, и ara h 6 кодирован нуклеотидной последовательностью SEQ ID NO: 9 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность с нею.
Термин «идентичность последовательностей», используемый в данном описании, относится к степени, в которой последовательности идентичны на основе нуклеотид-нуклеотид или аминокислота-аминокислота в окне сравнения. Так, «процент идентичности последовательностей» вычисляют путем сравнения двух оптимально выровненных последовательностей в окне сравнения, определяя число позиций, в которых идентичное нуклеотидное основание (например, А, Т, С, G, I) или идентичный аминокислотный остаток (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) имеет место в обеих последовательностях, что дает число соответственных позиций, путем деления числа соответственных позиций на общее число позиций в окне сравнения (т.е. размер окна), и умножая результат на 100, что дает процент идентичности последовательностей. Для целей настоящего изобретения «идентичность последовательностей» следует понимать как обозначение «процента соответствий», вычисленного соответствующим способом. Например, анализ идентичности последовательностей можно выполнить с использованием компьютерной программы DNASIS (версия 2.5 для окон; доступна от Hitachi Software engineering Co., Ltd., South San Francisco, California, США) с использованием стандартных значений по умолчанию, как описано в справочном руководстве, прилагаемом к программному обеспечению. Идентичность последовательностей заключенной в аллергене арахиса аминокислотной или нуклеотидной последовательности в некоторых воплощениях возрастает до, по меньшей мере, 75% или по меньшей мере, 80% или по меньшей мере, 85% или, по меньшей мере, 90% или по меньшей мере, 95% или, по меньшей мере, 98% идентичности последовательностей.
В некоторых воплощениях термин «аллерген» может также включать фрагмент любого одного из вышеуказанных пептидов. Как таковая, нуклеиновая кислота может включать нуклеотид, который кодирует фрагмент одного из вышеуказанных аллергенов арахиса.
В некоторых воплощениях аллерген арахиса включает модифицированный аллерген арахиса, посредством чего повтор последовательностей из 8 или больше оснований удаляется из последовательности нативного аллергена арахиса. В некоторых воплощениях слитый белок включает 2 или больше аллергенов арахиса. В некоторых воплощениях слитый белок включает два или больше аллергенов арахиса, по меньшей мере, один из которых выбран из группы, состоящей из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11. В некоторых воплощениях слитый белок включает ara h 1, ara h 2, ara h 3 и ara h 6 или их гомологи.
В некоторых воплощениях для облегчения экспрессии слитого белка нуклеиновую кислоту лишают стоп-кодонов между двумя последовательностями, кодирующими аллергены арахиса.
Метка деградации протеасомой
Авторы настоящего изобретения неожиданно обнаружили, что использование метки деградации протеасомой (такой как убиквитин) как компонента слитого белка дает возможность преодолеть явное токсичное и/или ингибирующее действие, которое пептидная конструкция аллергена арахиса без убиквитина оказывает на рекомбинантную экспрессию. Использование метки деградации протеасомой делает экспрессированный слитый белок мишенью для протеасомальной деградации. В результате нацеленной убиквитином протеасомальной деградации небольшие пептидные фрагменты слитого белка (например, пептиды длиной примерно в 8-12 аминокислот) входят в эндоплазматический ретикулум (ER), где они образуют комплекс с белками класса I ГКС и затем переносятся к поверхности клетки для представления Т-лимфоцитам. В результате имеет место усиленное представление фрагментов слитого белка с классом I ГКС, приводящее к более сильной иммунной реакции TH1 на аллергены арахиса. Таким образом, метка деградации протеасомой неожиданно предохраняет интактную пептидную конструкцию аллергена арахиса от ингибирования рекомбинантной экспрессии в клетке-хозяине и сдвигает иммунную реакцию к фенотипу TH1.
Метка деградации протеасомой может представлять собой любую метку, которая делает слитый белок мишенью для протеасомальной деградации. В некоторых воплощениях метка деградации протеасомой может включать молекулу убиквитина или связывающий домен убиквитина. В одном воплощении метка деградации протеасомой представляет собой мономер убиквитина, пояснительным примером которого является убиквитин С. В некоторых воплощениях мономер убиквитина включает аминокислотную последовательность SEQ ID NO: 2 или включает аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность нуклеотидной последовательности к ней.
В некоторых воплощениях C-конец мономера убиквитина представляет собой аланиновый остаток.
В другом воплощении мономер убиквитина кодирован нуклеотидной последовательностью SEQ ID NO: 1 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность нуклеотидной последовательности с нею.
Последовательность, кодирующая метку деградации протеасомой, может размещаться до или после последовательности, кодирующей, по меньшей мере, один аллерген арахиса (т.е. метка деградации белка может являться C-концом или N-концом слитого белка).
Молекулы убиквитина могут быть получены из любого подходящего вида. Для вакцины, предназначенной для лечения людей, молекула убиквитина может быть молекулой убиквитина человека или молекулой убиквитина животного другого вида, который может иметь кодон, оптимизированный для экспрессии в клетках человека. В некоторых воплощениях молекула убиквитина может представлять собой мономер убиквитина С. Сразу после экспрессии молекула убиквитина может притягиваться и связываться с другими молекулами убиквитина с образованием полиубиквитиновой цепи на слитом белке. Молекула убиквитина и/или полиубиквитиновая цепь могут направлять слитый белок для протеасомальной деградации.
В некоторых воплощениях нуклеотидная конструкция операбельно кодирует несколько молекул убиквитина или одну или несколько последовательностей, кодирующих укороченную или модифицированную молекулу убиквитина. Если кодированы несколько молекул убиквитина, один или несколько стартовых и стоп-кодонов могут быть удалены для создания возможности трансляции полного слитого белка.
В некоторых воплощениях укороченная молекула убиквитина может включать исключение лизина, ближайшего к C-концу нативной молекулы убиквитина. В некоторых воплощениях модифицированная молекула убиквитина может иметь один или несколько удаленных из последовательности или замененных (например, аргинином) лизиновых остатков нативной последовательности. В некоторых воплощениях молекула убиквитина может иметь только один лизин.
В некоторых воплощениях C-концевая молекула убиквитина может быть модифицирована. Например, C-концевой глицин нативной молекулы может быть заменен аланином. Замена глицина на аланин или другую аминокислоту может предотвратить отщепление метки деградации протеасомой от аллергена. Замена глицина на аланин также может создать возможность для образования ковалентной связи между меткой деградации протеасомой и аллергеном. Ковалентная связь может быть устойчива к расщеплению протеазой.
В некоторых воплощениях метка деградации протеасомой может включать связывающий домен убиквитина. Метка деградации протеасомой может являться членом семейства UbL (убиквитинподобных)-UBA (убиквитинассоциированных) доменсодержащих белков. В этом отношении экспрессированный слитый белок может способствовать связыванию молекул убиквитина со связывающим доменом, что ведет к протеасомальной деградации слитого белка.
Слитый белок
В некоторых воплощениях нуклеотидная последовательность кодирует слитый белок, который оптимизирован для экспрессии у субъекта. Например, последовательность слитого белка аллергена арахиса может быть оптимизирована для экспрессии в клетке человека. Подобным образом, в некоторых воплощениях метка деградации протеасомой оптимизирована для экспрессии у субъекта и/или может представлять собой метку деградации протеасомой, клонированную из того же вида, что и нужный субъект. В некоторых воплощениях оптимизация кодона включает замену кодона другим кодоном, который кодирует ту же аминокислоту, но более эффективно или точно транслируется в видах-мишенях (например, у людей).
В некоторых воплощениях оптимизация последовательности для экспрессии у субъекта также включает удаление повторных последовательностей. Например, в некоторых воплощениях из последовательности аллергена арахиса удаляют повторные последовательности из 8 или более оснований. Это может быть важно, в частности, если последовательность сконструирована синтетически обратной трансляцией. Синтетические последовательности обычно утрачивают преимущество оптимизации кодона через эволюцию. Поэтому разрыв случайно встречающихся дестабилизирующих повторных последовательностей в последовательности путем замены нуклеотидных оснований без изменения аминокислотной последовательности может улучшить экспрессию последовательности.
В некоторых воплощениях метка деградации протеасомой кодирована нуклеотидной последовательностью, соответствующей SEQ ID NO: 1 или ее гомологу. В некоторых воплощениях аллергены арахиса слитого белка кодированы нуклеотидной последовательностью, соответствующей SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 и/или SEQ ID NO: 9, или гомологу одной из вышеуказанных последовательностей.
В некоторых воплощениях метка деградации протеасомой включает аминокислотную последовательность, соответствующую SEQ ID NO: 2. В некоторых воплощениях аллергены арахиса слитого белка включает аминокислотную последовательность, соответствующую SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8 и/или SEQ ID NO: 10.
Так как конформационные эпитопы не требуются для представления КГС-1 и в некоторых отношениях нежелательны для того, чтобы предотвратить связывание аллергенспецифических IgE-антител, не требуется, чтобы аллергены, экспрессированные как часть слитого белка, находились в своей нативной структурной форме. Это может создать возможность для использования слитых белков, включающих несколько аллергенов арахиса, и дает маневренность при создании слитого белка.
Соответственно в некоторых воплощениях нуклеотидная конструкция операбельно кодирует 2 или больше аллергенов арахиса. Например, слитый белок может кодировать 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше аллергенов арахиса. Для некоторых нуклеиновых кислот, по меньшей мере, один из аллергенов можно выбрать из следующих аллергенов арахиса или их гомологов: ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 или ara h 11. В примере для пояснения нуклеотидная конструкция операбельно кодирует ara h 1, ara h 2, ara h 3 и ara h 6 или их гомологи. Например, нуклеотидная конструкция может включать нуклеотидную последовательность, соответствующую SEQ ID NO: 11, или может кодировать белок с аминокислотной последовательностью, соответствующей SEQ ID NO: 12.
Каждый аллерген может быть слит со своей собственной меткой деградации протеасомой и может быть операбельно соединен со своим собственным промотором (например, могут экспрессироваться несколько слитых белков). С другой стороны, последовательности для метки деградации протеасомой и аллергенов могут располагаться, допуская экспрессию слитого белка, включающего метку деградации протеасомой и несколько аллергенов. Такой последний подход может предотвратить дифференциальную экспрессию различных аллергенов и/или предотвратить внутримолекулярную рекомбинацию, если используют несколько экспрессирующих кассет с идентичными промоторами.
Для того чтобы создать возможность трансляции слитого белка с 2 или больше аллергенами, нуклеиновую кислоту можно лишить стоп-кодонов между двумя последовательностями, кодирующими аллергены арахиса. В некоторых воплощениях нуклеотидная последовательность может быть лишена стоп-кодонов между любыми последовательностями, кодирующими аллергены арахиса, и/или может быть лишена стоп-кодонов между последовательностью, кодирующей метку деградации протеасомой, и последовательностью, кодирующей аллерген.
Для того чтобы провести трансляцию, последовательность, кодирующая первую часть слитого белка, может включать стартовый кодон на 5'-конце последовательности. Стартовые кодоны могут отсутствовать в последовательности, кодирующей остальную часть слитого белка. В этом отношении аллергены, которые не слиты с меткой деградации протеасомой, могут быть сведены к минимуму или предотвращены. Это может минимизировать или предотвратить секрецию интактных аллергенов арахиса из клетки или представление на поверхность клетки, что в ином случае может стимулировать иммунную реакцию TH2 против аллергена.
В одном воплощении слитый белок включает аминокислотную последовательность SEQ ID NO: 12 или аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичность с нею.
В другом воплощении слитый белок кодирован нуклеотидной последовательностью SEQ ID NO: 11 или нуклеотидной последовательностью, имеющей, по меньшей мере, 70% идентичность с нею.
В некоторых воплощениях, и для того, чтобы облегчить экспрессию слитого белка в виде интактного белка и уменьшить дифференциальную экспрессию каждого аллергена, вектор включает регулярную последовательность транскрипции (такую, как промотор) и единичный стартовый кодон для облегчения экспрессии интактного слитого белка.
В некоторых аспектах настоящее изобретение относится к нуклеотидной кассете для десенсибилизации или индукции переносимости у субъекта аллергена арахиса, причем кассета включает i) вакцину, описанную в данном описании, и ii) концевой рестриктазный линкер на каждом конце последовательности кассеты. В некоторых воплощениях, по меньшей мере, один рестриктазный линкер включает последовательность узнавания/расщепления рестриктазой Pac1. В некоторых воплощениях кассета представляет собой кассету вирусного вектора.
Нуклеотидная конструкция может выгодно включать транскрипционную регулярную последовательность, операбельно соединенную с нуклеотидной последовательностью, кодирующей слитый белок.
Термин «транскрипционная регулярная последовательность» следует понимать как включающий любую нуклеотидную последовательность, которая влияет на транскрипцию операбельно соединенной нуклеиновой кислоты. Подходящие транскрипционные регулярные последовательности могут быть известны специалистам в данной области техники. Пояснительные примеры включают лидерную последовательность, последовательность полиаденилирования, промотор, энхансер или активирующую последовательность и терминатор транскрипции. Типично транскрипционная регулярная последовательность, по меньшей мере, включает промотор. Термин «промотор», используемый в данном описании, описывает любую нуклеиновую кислоту, которая предоставляет, активирует или усиливает экспрессию молекулы нуклеиновой кислоты в клетке.
В некоторых воплощениях, по меньшей мере, одна транскрипционная регулярная последовательность операбельно соединена с нуклеиновой кислотой, кодирующей слитый белок. Для целей настоящего изобретения транскрипционная регулярная последовательность рассматривается как «операбельно соединенная» с данным геном или нуклеотидной последовательностью, когда транскрипционная регулярная последовательность способна промотировать, ингибировать или иначе модулировать транскрипцию гена или другой нуклеотидной последовательности.
Промотор может регулировать экспрессию операбельно соединенной нуклеотидной последовательности конститутивно или дифференциально в отношении клетки, ткани, органа или стадии развития, на которой происходит экспрессия, в ответ на внешние раздражители, такие как, среди прочих, психологический стресс, патогены или ионы металлов, или в ответ на один или несколько активаторов транскрипции. Как таковой, промотор, используемый в соответствии с вакциной и/или способами по настоящему изобретению, может включать, например, конститутивный промотор, индуцируемый промотор, тканеспецифический промотор или активирующий промотор. Настоящее изобретение предполагает использование любого промотора, который мог бы быть активным в клетке, представляющей интерес.
«Тканеспецифические промоторы» включают промоторы, которые преимущественно или специфически экспрессируются в одной или нескольких специфических клетках, тканях или органах в организме и/или на одной или нескольких стадиях развития организма. Следует иметь в виду, что тканеспецифический промотор также может быть конститутивным или индуцируемым.
Промотор также может представлять собой промотор, который может активироваться одним или несколькими транскрипционными активаторами, называемый в данном описании «активируемым промотором». Например, активируемый промотор может включать минимальный промотор, операбельно соединенный с активирующей последовательностью (UAS), который включает, среди прочего, ДНК-связывающий сайт для одного или нескольких транскрипционных активаторов.
Упоминаемый в данном описании термин «минимальный промотор» следует понимать как включающий любой промотор, который включает, по меньшей мере, сайт связывания РНК-полимеразы и, необязательно, ТАТА-бокс и сайт инициации транскрипции и/или один или несколько СААТ-боксов.
Как указано выше, активируемый промотор может включать минимальный промотор, слитый с активирующей последовательностью (UAS). UAS может представлять собой любую последовательность, которая может связывать транскрипционный активатор для активации минимального промотора. Примеры транскрипционных активаторов включают, например, транскрипционные активаторы, полученные из дрожжей, такие как Gal4, Pdr1, Gcn4 и Ace1; транскрипционный активатор, полученный из вирусов, VP16; Hap1 (Hach et al., J. Biol. Chem., 278: 248-254, 2000); Gaf1 (Hoe et al., Gene, 215(2): 319-328, 1998); E2F (Albani et al., J. Biol. Chem., 275: 19258-19267, 2000); HAND2 (Dai and Cserjesi, J. Biol. Chem., 277: 12604-12612, 2002); NRF-1 и EWG (Herzig et al., J. Cell Sci., 113: 4263-4273, 2000); P/CAF (Itoh et al., Nucl. Acids Res., 28: 4291-4298, 2000); MafA (Kataoka et al., J. Biol. Chem., 277: 49903-49910, 2002); человеческий активирующий фактор 4 (Liang and Hai, J. Biol. Chem., 272: 24088-24095, 1997); Bc110 (Liu et al., Biochem. Biophys. Res. Comm., 320(1): 1-6, 2004); CREB-H (Omori et al., Nucl. Acids Res., 29: 2154-2162, 2001); ARR1 и ARR2 (Sakai et al., Plant J., 24(6): 703-711, 2000); Fos (Szuts and Bienz, Proc. Natl. Acad. Sci. USA, 97: 5351-5356, 2000); HSF4 (Tanabe et al., J. Biol. Chem., 274: 27845-27856, 1999); MAML1 (Wu et al., Nat. Genet, 26: 484-489, 2000).
Транскрипционная регулярная последовательность также может включать терминатор. Термин «терминатор» относится к последовательности ДНК на конце транскрипционной единицы, которая передает сигналы терминации транскрипции. Терминаторы представляют собой 3'-нетранслируемые последовательности ДНК, обычно содержащие сигнал полиаденелирования, который облегчает присоединение последовательности полиаденилата к 3'-концу первичного транскрипта. Как и в случае промоторных последовательностей, терминатор может представлять собой любую последовательность-терминатор, которая способна работать в клетках, тканях или органах, для использования в которых он предназначен. В некоторых воплощениях нуклеотидная последовательность может включать вирусную последовательность прекращения ранней транскрипции 3' последовательности, кодирующей слитый белок.
Векторы
В одном воплощении нуклеотидная конструкция операбельно включена в вектор.
В некоторых воплощениях вектор может представлять собой экспрессирующий вектор, адаптированный для экспрессии в эукариотной клетке. Используемый в данном описании «вектор» может представлять собой любую из нуклеиновых кислот, в которые может быть встроена нужная последовательность. Векторы включают, но не ограничиваются перечисленным, плазмиды, фагемиды и вирусные геномы. В некоторых воплощениях экспрессирующий вектор также способен к репликации в клетке-хозяине (например, бактериальной клетке) и также может дополнительно включать один или несколько сайтов рестрикции эндонуклеазами, в которых вектор может быть разрезан нужным образом, и в которые можно лигировать нужную последовательность ДНК таким образом, что рекомбинантный вектор сохраняет свою способность к репликации в клетке-хозяине. В случае плазмид репликация нужной последовательности может происходить несколько раз, когда увеличивается число копий плазмиды в хозяине-бактерии, или только один раз на хозяина, прежде чем хозяин репродуцируется путем митоза. В случае фага репликация может происходить активно во время литической фазы или пассивно во время лизогенной фазы.
Экспрессирующие векторы могут содержать транскрипционные регулярные последовательности для проведения экспрессии встроенных нуклеиновых кислот в клетках-мишенях (например, в клетке человека). Транскрипционные регулярные последовательности включают последовательности, описанные выше, и включают, например, промоторы.
Векторы также могут содержать одну или несколько селектируемых маркерных последовательностей, подходящих для применения при идентификации клеток, которые трансформированы или нет или трансфицированы или нет вектором. Маркеры включают, например, гены, кодирующие белки, которые повышают или снижают любую резистентность или чувствительность к антибиотикам или другим соединениям, гены, которые кодируют ферменты, активность которых детектируется стандартными анализами, известными в технике (например, β-галактозидазы, люциферазы), и гены, которые явно влияют на фенотип трансформированных или трансфицированных клеток, хозяев, колоний или бляшек (например, различные флуоресцентные белки, такие как зеленый флуоресцентный белок, GFP). Некоторые векторы могут быть способны к автономной репликации, и их также обычно относят к эписомным векторам. С другой стороны, векторы можно адаптировать для встраивания в хромосому - так называемые интегрирующие векторы. Вектор может быть предоставлен с регулярными последовательностями транскрипции (промоторными последовательностями), которые опосредуют клеточно/тканеспецифическую экспрессию. Такие промоторные последовательности могут быть клеточно/тканеспецифическими, индуцируемыми или конститутивными.
В некоторых воплощениях вектор может представлять собой вирусный вектор. Подходящие вирусные векторы должны быть известны специалистам в данной области техники. Пояснительные примеры вирусных векторов включают ретровирусный вектор, лентивирусный вектор, аденовирусный вектор, аденоассоциированный вирусный вектор или поксвирусный вектор. Поксвирусные векторы могут включать, например, вектор на основе птичьей оспы (например, оспы домашней птицы или оспы канареек). В некоторых воплощениях поксвирусный вектор может представлять собой вирусный вектор с ограниченной репликацией, например, модифицированный вирус коровьей оспы Ankara (MVA), вирус птичьей оспы или ослабленный вирус коровьей оспы. Использование вирусных векторов может быть благоприятным при дополнительном смещении реакции TH1 против клеток, экспрессирующих пептидные фрагменты разрушенных аллергенов арахиса на молекулах класса I ГКС, так как сам вирусный вектор может промотировать экспрессию рецепторов IL-12 на клетках. Кроме того, активация иммунных клеток вирусными векторами может инициировать комплексную сеть взаимодействий клетка-клетка и каскады продуцирования цитокинов, что приводит к сверхусилению иммунных функций TH1 по антигензависимому типу.
В одном воплощении вирусный вектор представляет собой поксвирусный вектор.
В некоторых воплощениях нуклеотидная последовательность включает последовательность прекращения ранней транскрипции 3' последовательности, кодирующей слитый белок.
Для облегчения клонирования нуклеотидная конструкция может быть включена в нуклеотидную кассету (т.е. экспрессирующую кассету). Соответственно в некоторых воплощениях настоящее изобретение относится к нуклеотидной кассете для десенсибилизации субъекта к аллергену арахиса, причем кассета включает нуклеотидную конструкцию, операбельно кодирующую слитый белок, нужный в данном случае, и концевой рестриктазный линкер на каждом конце последовательности кассеты.
Термин «нуклеотидная кассета», используемый в данном описании, предназначен для обозначения нуклеотидной последовательности, созданной для введения молекулы нуклеиновой кислоты (например, нуклеотидной конструкции, описанной в данном описании), в вектор или геном.
Кассета типично будет включать концевой рестриктазный линкер на каждом конце последовательности кассеты. Концевые рестриктазные линкеры на каждом конце могут быть одинаковыми или различными концевыми рестриктазными линкерами. В некоторых воплощениях с одинаковыми концевыми рестриктазными линкерами на каждом конце может быть выгодно, если желательна репликация кассеты в бактериальных клетках (и кассета включает начало репликации), так как кассета может быть замкнута в кольцо путем гидролиза кассеты соответствующей рестриктазой и лигирования концов вместе. Подобным образом, циклическая кассета может быть линеаризована путем гидролиза кассеты отдельной рестриктазой.
В некоторых воплощениях концевые рестриктазные линкеры могут включать последовательности узнавания/расщепления редкими рестриктазами, так что непредусмотренный гидролиз нуклеиновой кислоты или вектора или генома, в которые следует ввести кассету, не происходит. В некоторых воплощениях концевые рестриктазные линкеры включают последовательность узнавания/расщепления рестриктазой Pac1.
Кассету можно клонировать в экспрессирующий вектор млекопитающего, бактериальный экспрессирующий или клонирующий вектор, экспрессирующий вектор насекомого, растительный экспрессирующий вектор или вирусный вектор. Соответственно кассета может представлять собой кассету вектора млекопитающего, кассету бактериального вектора, кассету вектора насекомого, кассету растительного вектора или кассету вирусного вектора.
Лечение и предупреждение аллергии на арахис
Авторы настоящего изобретения неожиданно обнаружили, что вакцина по настоящему изобретению вызывает смещенную иммунную реакцию TH1 против белка арахиса, которая будет доминировать над имеющейся аллергенспецифической иммунной реакцией TH2 и в силу этого будет десенсибилизировать индивидуума к последующему воздействию аллергена арахиса. Более того, экспрессия цитокинов TH1 (например, IFNγ, IL-12, TGF-β, IL2 и т.д.) может уменьшить экспрессию цитокинов TH2 (например, IL-3, IL-4, IL-5, IL6, IL10 и т.д.), смещая иммунную реакцию против аллергена в сторону иммунной реакции TH1, результатом чего является ингибирование или уменьшение интенсивности активации и/или рекруитмента продуцирующих IgE-антитела В-клеток, тучных клеток и эозинофилов, причем посредством этого ослабляется или предупреждается аллергическая реакция на последующее воздействие аллергена (например, анафилактическая реакция). Соответственно вакцина по настоящему изобретению подходит для использования при лечении у субъекта аллергии на арахис.
Авторы настоящего изобретения также неожиданно обнаружили, что вакцина по настоящему изобретению продуцирует смещенную иммунную реакцию TH1 на аллерген арахиса, которая не зависит от прежде имеющейся аллергии на арахис. Соответственно вакцина по настоящему изобретению подходит для использования при предупреждении аллергии на арахис у субъекта, который может иметь опасность такой аллергии.
Таким образом, другой аспект относится к применению поксвирусного вектора, раскрытого в данном описании, или при изготовлении лекарственного средства для вызывания переносимости у субъекта аллергии на арахис.
В одном воплощении поксвирусный вектор, раскрытый в данном описании, используют как профилактическое средство для предупреждения или уменьшения интенсивности аллергии на арахис у субъекта в опасности развития аллергии на арахис (т.е. у субъекта в опасности развития аллергии на арахис может быть вызвана переносимость). Субъекты в опасности развития аллергии на арахис могут включать людей, уже страдающих от аллергии, такой как сенная лихорадка, астма, или других пищевых аллергий, или людей, которые имеют семейный анамнез аллергий.
Другой аспект относится к способу индукции переносимости у субъекта аллергии на арахис, причем способ включает введение субъекту, нуждающемуся в этом, эффективного количества поксвирусного вектора, раскрытого в данном описании, в течение времени и в условиях, достаточных для появления супрессии и/или переносимости, например, путем индукции аллергенспецифической реакции TH1 у субъекта.
Термины «аллергическая реакция», «аллергия», «аллергическое расстройство» и т.п., используемые в данном описании, следует понимать как обозначающие иммунное расстройство, при котором иммунная система является гиперчувствительной к другим безвредным веществам окружающей среды. Такие вещества окружающей среды, которые вызывают аллергии, называют «аллергенами». Обычные аллергии включают сезонный риноконъюнктивит (например, аллергии на травы и пыльцу, такие как амброзия, темофеевка луговая), аллергии на опасность от домашних животных, такую как опасность от кошек или опасность от собак, пищевые аллергии, такие как аллергия на арахис, молочные продукты и пшеницу, анафилаксию к ядам насекомых и астму. Аллергическое расстройство типично характеризуется выработкой IgE.
Аллергические заболевания являются результатом иммунных реакций против иных безвредных антигенов окружающей среды, характеризующихся генерацией клеток TH2, которые продуцируют IL-4 и IL-5 и промотируют дифференцировку В-клеток в клетки, секретерующие антитела IgE. Антитела IgE связываются с высокоаффинными рецепторами на базофилах и тучных клетках. Воздействие аллергена ведет к связыванию молекул аллергена поверхностью IgE и сшивает рецепторы, вызывая таким образом активацию и дегрануляцию базофилов и тучных клеток. Последние высвобождают ряд предварительно образовавшихся провоспалительных и вазоактивных соединений, таких как гистамин, простагландины, лейкотриены и цитокины, что ведет к воспалительной реакции. Связывание аллергена арахиса с антителами IgE, которые связаны с поверхностью тучных клеток и базофилов, является инициирующим событием, которое в итоге достигает кульминации в аллергической реакции. Предотвращение связывания аллергена с IgE, связанным с тучными клетками и/или базофилами, будет предотвращать начало аллергической реакции. Предотвращение продуцирования аллергенспецифического IgE после воздействия аллергена арахиса будет вызывать переносимость арахиса.
Термин «переносимость», используемый в данном описании, принят для обозначения ингибирования (частичного или полного) аллергической реакции на воздействие аллергена арахиса. Ингибирование может представлять собой предотвращение, замедление, ослабление, отмену или иное препятствование аллергической реакции. Такое ингибирование по характеру может быть значительным и/или быть временным. В определенном контексте термины «ингибировать» и «предотвращать» и их варианты могут быть использованы взаимозаменяемо. Переносимость можно оценить любыми средствами, известными специалистам в данной области техники. Как пояснительный пример, тест с прокалыванием кожи может быть использован для измерения реакции субъекта на аллерген или несколько аллергенов до и/или после лечения поксвирусным вектором, раскрытым в данном описании. Например, у субъекта, который имеет аллергию на арахис, тест с прокалыванием кожи с использованием одного или нескольких аллергенов арахиса типично будет продуцировать наблюдаемую локализованную аллергическую реакцию, характеризующуюся местным высыпанием, язвой и/или отеком. Переносимость у того же индивидуума после лечения поксвирусным вектором, раскрытым в данном описании, типично будет проявляться сама как ослабленная локализованная аллергическая реакция при тесте с прокалыванием. Такое ослабление можно измерить, например, по различию в размере (например, диаметре) локализованной аллергической реакции до и после лечения.
В другом пояснительном примере переносимость оценивают по предотвращению, замедлению, ингибированию, ослаблению, отмене или препятствованию тяжести аллергической реакции после случайного воздействия аллергена арахиса. Например, когда субъект имеет историю болезни с анафилактическими реакциями на воздействие аллергена арахиса, переносимость как результат лечения поксвирусным вектором по настоящему изобретению можно определить по отсутствию анафилактической реакции после последующего воздействия аллергена арахиса, даже если субъект может показывать другие признаки аллергической реакции, такие как сыпь.
В другом пояснительном примере переносимость оценивают, определяя в кровотоке у субъекта уровень специфических к аллергену арахиса антител IgE. Например, субъект, который имеет в истории болезни аллергические реакции (включая анафилактические реакции) на воздействие аллергена арахиса, типично будет иметь более высокий уровень специфических к аллергену арахиса антител IgE по сравнению, например, с субъектом, у которого нет аллергии на арахис. У таких индивидуумов переносимость можно определить по снижению уровня специфических к аллергену арахиса антител IgE в кровотоке после лечения вакциной по настоящему изобретению. С другой стороны, переносимость можно определить по более высокому уровню в кровотоке специфических к аллергену арахиса антител IgG после лечения поксвирусным вектором по настоящему изобретению, которое характеризуется иммунной реакцией TH1 и типично показательным толерантным состоянием.
С другой стороны или кроме того, переносимость можно определить, оценивая профиль цитокинов в образце, взятом у субъекта (например, образце крови, включая образец плазмы или сыворотки). Например, более высокий уровень IFN-гамма является показателем смещения в сторону аллергенспецифической реакции TH1, в то время как более высокий уровень IL-4 и/или IL-5 является показателем смещения в сторону аллергенспецифической реакции TH2.
С другой стороны или кроме того, переносимость можно определить, получая образец Т-лимфоцитов субъекта, которого лечат поксвирусным вектором по настоящему изобретению, раскрытым в данном описании, и измеряя профиль цитокинов лимфоцитов ex vivo. Например, более высокий уровень продуцирования Т-лимфоцитами IFN-гамма является показателем смещения в сторону аллергенспецифической реакции TH1, в то время как более высокий уровень продуцирования Т-лимфоцитами IL-4 и/или IL-5 является показателем смещения в сторону аллергенспецифической реакции TH2. Способы измерения уровня специфических к аллергену арахиса антител IgE и/или IgG и цитокинов, которые способны к дифференцировке между реакцией TH1 и TH2, должны быть известны специалистам в данной области техники. Пояснительные примеры включают радиоиммуноанализ (РИА) и твердофазный иммуноферментный анализ (ELISA).
Специалистам в данной области техники следует иметь в виду, что поксвирусный вектор, раскрытый в данном описании, следует вводить или в одной дозе или как часть ряда доз, которые обеспечивают нужное терапевтическое или профилактическое действие у субъекта, нуждающегося в этом, а именно, индукцию переносимости аллергена арахиса. Нежелательное действие, например, побочное действие, иногда может проявляться вместе с желательным терапевтическим или профилактическим действием; поэтому на практике при определении соответствующего эффективного количества обычно приходится балансировать между возможным благоприятным действием и возможными рисками. Точное требуемое количество вакцины будет изменяться от субъекта к субъекту в зависимости от вида и общего состояния субъекта, способа введения и т.п. Таким образом, невозможно конкретизировать точное количество. Однако соответствующее эффективное количество в любом отдельном случае специалист в данной области техники может определить с использованием обычных приемов или экспериментов. Специалист в данной области техники сможет определить требуемые количества на основании таких факторов, как объем и масса субъекта, тяжесть симптомов у субъекта и предполагаемый способ введения.
Термин «лечение» относится к любому поддающемуся измерению или статистически значимому ингибированию или уменьшению интенсивности у, по меньшей мере, некоторых субъектов одного или нескольких симптомов аллергии на арахис.
В некоторых воплощениях поксвирусный вектор, раскрытый в данном описании, используют для десенсибилизации субъекта с аллергией на арахис (т.е. субъекта, который гиперчувствителен к одному или нескольким аллергенам арахиса) к одному или нескольким аллергенам арахиса. Предполагается, что термин «десенсибилизация субъекта», используемый в данном описании в отношении аллергена арахиса, означает, что чувствительность субъекта к аллергену арахиса снижается, уменьшается ее интенсивность или она устраняется. В этом отношении симптомы аллергии на арахис у субъекта после повторного воздействия одного или нескольких аллергенов арахиса ослабевают частично или полностью.
С другой стороны или кроме того, в некоторых воплощениях для вызывания переносимости у субъекта к одному или нескольким аллергенам арахиса используют нуклеотидную последовательность. Индукцию переносимости к одному или нескольким аллергенам арахиса осуществляют у субъекта с аллергией на арахис или у субъекта, который может находиться в опасности развития аллергии на арахис (т.е. нуклеотидная последовательность может быть использована как часть профилактического лечения аллергии на арахис).
Хотя поксвирусный вектор, раскрытый в данном описании, используют для сенсибилизации или индукции переносимости у субъекта с аллергией на арахис различными путями (как раскрыто в данном описании), общий принцип, согласно которому действует поксвирусный вектор, является одним и тем же. Когда слитый пептид экспрессируется в клетке, он является мишенью для протеасомальной деградации в силу метки деградации протеасомой, что предотвращает секрецию интактного слитого белка из клетки.
В одном воплощении предлагается способ вакцинации субъекта для индукции переносимости аллергена арахиса, включающий введение поксвирусного вектора, раскрытого в данном описании. В отдельном воплощении способ является способом индукции переносимости, по меньшей мере, двух или, по меньшей мере, трех аллергенов арахиса.
Настоящее изобретение распространяется на наборы, включающие поксвирусный вектор, раскрытый в данном описании.
Поксвирусный вектор по настоящему изобретению может быть доставлен к клетке in vivo или ex vivo (например, в виде голой ДНК или в векторе) способом, известным в технике. Пояснительные примеры включают вирусную доставку, микроинъекцию, генную пушку, прокалывание, гидростатическое давление, электропорацию, ультразвук и/или липофекцию. Поксвирусный вектор также может быть доставлен в клетку в виде фармацевтической композиции.
Липосомы могут служить в качестве носителя для поксвирусного вектора. Липосомы представляют собой везикулы на основе липидов, которые инкапсулируют выбранное терапевтическое средство (например, вектор), которое затем вводят пациенту. Липосому можно получить или из чистого фосфолипида или из смеси фосфолипида и фосфоглицерида. Типично можно получить липосомы диаметром менее 200 нм, что делает возможным инъецировать их внутривенно и позволяет им проходить через слой легочных капилляров. Кроме того, биохимический характер липосом предоставляет проникание через мембраны кровеносных сосудов для приобретения доступа к выбранным тканям.
Поксвирусный вектор может быть голым, иными словами, неассоциированным с какими-либо белками или другими агентами, которые могут влиять на иммунную систему реципиента. В таком случае желательно, чтобы поксвирусный вектор находился в физиологически приемлемом растворе, таком как, но без ограничения, стерильный физиологический раствор или стерильный забуференный физиологический раствор. С другой стороны, вакцина может ассоциироваться с липосомами, такими как лецитиновые липосомы, известные в технике. Также можно использовать средства, которые способствуют клеточному поглощению молекул нуклеиновой кислоты, такие как, но без ограничения, ионы кальция.
В случае невирусных векторов количество нуклеиновой кислоты, вводимой реципиенту, будет иметь очень широкий интервал и может зависеть, например, от силы используемых транскрипционных и трансляционных промоторов. Кроме того, величина иммунной реакции может зависеть от уровня экспрессии белка и от иммуногенности экспрессированного продукта слитого белка. Эффективный дозовый интервал может включать примерно 1 нг - 5 мг, примерно 100 нг - 2,5 мг, примерно 1 мкг - 750 мкг или примерно 10 мкг - 300 мкг нуклеиновой кислоты (например, как части поксовирусного вектора).
Поксвирусный вектор можно вводить или инокулировать подкожно, внутримышечно, интрадермально или другими путями, такими как интраперитонеальный, внутривенный или ингаляция, в присутствии адъювантов или других веществ, которые имеют способность промотировать поглощение ДНК или рекрутинг клеток иммунной системы к сайту инокуляции. Выбранный путь введения будет зависеть от композиции и статуса заболевания пациентов. Релевантные рассмотрения включают типы иммунных клеток, которые активируются, время, за которое антиген воздействует на иммунную систему, и график иммунизации. Также учитывается, что может быть предоставлено бустерное лечение.
Как описано в данном описании, поксвирусный вектор способен к десенсибилизации (т.е. вызывать переносимость у) субъекта путем экспрессии в клетке слитого белка. Слитый белок разрушается в клетке, и фрагменты разрушенного аллергена арахиса экспрессируются на клеточной поверхности в ассоциации с молекулами класса I ГКС. В некоторых воплощениях во время выполнения способов по настоящему изобретению на иммунную систему субъекта воздействует неинтактный экспрессированный аллерген арахиса. Это имеет место из-за метки деградации протеасомой, которая управляет протеасомальной деградацией экспрессированного слитого белка.
Способ десенсибилизации или индукции переносимости у субъекта аллергена арахиса может включать введение субъекту поксвирусного вектора или фармацевтической композиции, включающей поксвирусный вектор. Соответственно настоящее изобретение относится к способу десенсибилизации субъекта в отношении аллергена арахиса, при этом способ включает экспрессию слитого белка в клетке субъекта, при этом метка деградации протеасомой экспрессированного слитого белка делает слитый белок мишенью для внутриклеточной протеасомальной деградации и ассоциации разрушенных пептидов аллергена арахиса с молекулами класса I ГКС для промотирования генерации реакции TH1 на аллерген арахиса, таким образом сенсибилизируя субъекта к или индуцируя переносимость у субъекта аллергена арахиса.
Настоящее изобретение также относится к способу профилактического лечения для индукции переносимости аллергена арахиса у субъекта, при этом способ включает экспрессию слитого белка в клетке субъекта, при этом метка деградации протеасомой экспрессированного слитого белка делает слитый белок мишенью для внутриклеточной протеасомальной деградации и ассоциации разрушенных пептидов аллергена арахиса с молекулами класса I ГКС для промотирования генерации реакции TH1 на аллерген арахиса, таким образом предотвращая чувствительность субъекта к аллергену арахиса.
Хотя указанные способы могут включать экспрессию слитого белка в клетке in vivo, другие способы могут включать экспрессию слитого белка в клетке ex vivo. Как таковое, настоящее изобретение также относится к клетке, экспрессирующей слитый белок. В этом отношении клетка может использоваться в эксперименте in vitro, лечении in vivo и/или лечении ex vivo.
Субъект
Термины «субъект», «индивидуум» и «пациент» используются в данном описании как взаимозаменяемые и относятся к любому субъекту, для которого настоящее раскрытие может быть приемлемо, в частности, позвоночному субъекту, и даже конкретнее, субъекту-млекопитающему. Подходящие позвоночные животные, которые попадают в объем изобретения, включают, но не ограничиваются перечисленным, любой ряд подтипа хордовых, включая приматов, грызунов (например, мышей, крыс, морских свинок), свиней (например, домашних свиней), лошадиных (например, лошадей), собачьих (например, собак), кошачьих (например, кошек), птиц (например, кур, индюков, уток, птиц-компаньонов, таких как канарейки, волнистые попугайчики и т.д.), морских млекопитающих (например, дельфинов, китов), рептилий (змей, лягушек, ящериц и т.д.) и рыб. В некоторых воплощениях субъектом является примат (например, человек, обезьяна, мартышка, шимпанзе).
В предпочтительном воплощении субъектом является человек. Соответственно в некоторых воплощениях нуклеотидная последовательность, кодирующая слитый белок, представляет собой кодон, оптимизированный для экспрессии в человеческих клетках.
Фармацевтические композиции
Поксвирусный вектор по настоящему изобретению может быть предоставлен в форме, включающей фармацевтически или физиологически приемлемый носитель и/или разбавитель.
Таким образом, в другом аспекте изобретение относится к фармацевтической композиции для десенсибилизации или индукции переносимости у субъекта с аллергией на арахис, причем композиция включает поксвирусный вектор, раскрытый в данном описании, и фармацевтически приемлемый носитель.
Фармацевтические композиции обычно получают согласно общепринятым методам составления фармацевтических композиций (см., например, Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing, Company, Easton, PA, U.S.A., 1990). Такие композиции могут включать, кроме одного или нескольких активных веществ, фармацевтически приемлемый эксципиент, носитель, буфер, стабилизатор или другие материалы, хорошо известные в технике. Такие материалы не должны быть токсичными и не должны влиять на эффективность активного ингредиента. Носитель может принимать самые разные формы, в зависимости от формы препарата, нужного для введения, например, внутривенного или парентерального.
В некоторых воплощениях настоящее изобретение относится к способу десенсибилизации или индукции переносимости у субъекта с аллергией на арахис, причем способ включает экспрессию слитого белка, описанного в данном описании, в клетке субъекта, при этом метка деградации протеасомой экспрессированного слитого белка делает слитый белок мишенью для внутриклеточной протеасомальной деградации и ассоциации разрушенных пептидов аллергена арахиса с молекулами класса I ГКС для промотирования генерации реакции TH1 на аллерген арахиса, таким образом десенсибилизируя или вызывая у субъекта переносимость аллергена арахиса.
В некоторых воплощениях настоящее изобретение относится к способу профилактического лечения для индукции переносимости аллергена арахиса у субъекта, причем способ включает экспрессию слитого пептида, описанного в данном описании, в клетке субъекта, при этом метка деградации протеасомой экспрессированного слитого белка делает слитый белок мишенью для внутриклеточной протеасомальной деградации и ассоциации разрушенных пептидов аллергена арахиса с молекулами класса I ГКС для промотирования генерации реакции TH1 на аллерген арахиса, таким образом предотвращая чувствительность субъекта к аллергену арахиса.
Авторы настоящего изобретения неожиданно обнаружили, что поксвирусный вектор, включающий нуклеотидную последовательность, кодирующую слитый белок, включающий аллергены арахиса и метку деградации протеасомой, может, после вакцинации, производить иммунную реакцию специфических к арахису TH1 при измерении по продуцированию антител IgG2, специфических к аллергену арахиса, и вызванной аллергеном арахиса секреции цитокинов TH1 из лимфоцитов. Так как такой поксвирусный вектор стимулирует иммунную реакцию специфических к арахису TH1, из этого следует, что поксвирусный вектор, раскрытый в данном описании, можно использовать для десенсибилизации (т.е. индукции переносимости у) субъектов, у которых имеется аллергия на аллергены арахиса.
Настоящее изобретение также относится к нуклеотидной последовательности для десенсибилизации или индукции переносимости у субъекта аллергена арахиса, причем нуклеотидная последовательность включает последовательность, кодирующую слитый белок, включающий метку деградации протеасомой аллергена арахиса. Нуклеиновую кислоту можно использовать в качестве генетической вакцины.
Как описано в данном описании, в некоторых воплощениях нуклеиновая кислота включена в экспрессирующий вектор (например, вирусный вектор) или фармацевтическую композицию, которые можно вводить субъекту для возможности экспрессии включающего убиквитин слитого белка в клетке in vivo. С другой стороны, нуклеиновая кислота экспрессируется в клетке ex vivo (например, антигенпредставляющей клетке), которую затем можно ввести субъекту. С другой стороны или кроме того, можно использовать трансфицированную клетку для стимуляции и распространению популяции лимфоцитов TH1 ex vivo, которую затем вводят субъекту.
В некоторых воплощениях установление памяти TH1 на представленные пептиды аллергена арахиса может предотвратить или ослабить иммунные реакции TH2 против аллергена арахиса после последующего воздействия аллергена арахиса. В некоторых воплощениях память TH1 на аллерген арахиса устанавливают путем активации и поддержания CD8+Т-клеток, специфических к аллергену арахиса.
Клетки
В другом аспекте настоящее изобретение относится к клетке, экспрессирующей слитый белок, описанный в данном описании, такой как клетка-хозяин или антигенпредставляющая клетка (например, дендритная клетка). Затем трансфицированную клетку, экспрессирующую слитый белок, можно использовать для генерации и/или расширения популяции реактивных к аллергену арахиса лимфоцитов TH1 in vivo или ex vivo. Так, в одном воплощении настоящее раскрытие делает возможным способ генерации и/или расширения популяции реактивных к аллергену арахиса лимфоцитов TH1 ex vivo, причем способ включает культивирование клеток (т.е. трансфицированных клеток, экспрессирующих слитый белок), как описано в данном описании, с одним или несколькими Т-лимфоцитами. В другом воплощении настоящее раскрытие делает возможным способ генерации и/или расширения популяции реактивных к аллергену арахиса лимфоцитов TH1 in vivo, причем способ включает введение трансфицированной клетки, описанной в данном описании, субъекту, нуждающемуся в этом, при этом введенная трансфицированная клетка активирует наивные Т-клетки у субъекта, которые становятся клетками TH1, специфическими к аллергену арахиса.
В некоторых воплощениях настоящее изобретение относится к способу десенсибилизации или индукции переносимости у субъекта аллергена арахиса, причем способ включает i) сбор лимфоцитов субъекта; ii) совместное культивирование лимфоцитов с клетками, описанными в данном описании (т.е. трансфицированными клетками, экспрессирующими слитый белок, раскрытый в данном описании), для генерации и/или расширения популяции лимфоцитов TH1, которые узнают деградированный протеасомой слитый белок аллергена арахиса, ассоциированный с молекулами класса I ГКС на клетках; и iii) введение лимфоцитов TH1 из (ii) субъекту.
В некоторых воплощениях клетка может включать прокариотную клетку (например, бактериальную клетку). Прокариотную клетку можно использовать для репликации нуклеотидной конструкции (например, в форме вектора) и/или на различных стадиях клонирования. В некоторых воплощениях клетка может включать эукариотную клетку (например, клетку млекопитающего). В этом отношении настоящее изобретение также включает клетку, экспрессирующую нуклеотидную конструкцию, опереабельно кодирующую слитый белок.
Поксвирусный вектор, раскрытый в данном описании, также можно использовать для активации наивных антигенпредставляющих клеток, которые затем можно повторно ввести субъекту для активации наивных Т-клеток, которые становятся клетками TH1, специфическими к аллергену арахиса. Таким образом, в некоторых воплощениях настоящее изобретение относится к способу десенсибилизации или индукции переносимости у субъекта аллергена арахиса, причем способ включает: i) сбор антигенпредставляющих клеток субъекта; ii) совместное культивирование антигенпредставляющих клеток с клетками, описанными в данном описании (т.е. трансфицированными клетками, экспрессирующими слитый белок, раскрытый в данном описании), для генерации и/или расширения популяции активированных антигенпредставляющих клеток TH1; и iii) введение активированных антигенпредставляющих клеток TH1 из (ii) субъекту для активации Т-лимфоцитов в отношении аллергенспецифического фенотипа TH1. Подходящие наивные антигенпредставляющие клетки должны быть известны специалистам в данной области техники. Пояснительные примеры включают дендритные клетки и фибробласты.
Тип клеток, экспрессирующих слитый белок, ограничивается только тем, что клетка должны быть содержащей ядро клеткой, которая экспрессирует молекулу класса I ГКС. В этом отношении клетка может представлять собой клетку из клеточной линии (например, клеточной линии СНО, клеточной линии НЕК, клеточной линии фибробластов и т.д.) или первичную клетку (например, фибробласт, дендритную клетку). В воплощениях, где в соответствии с этим клетка предназначена как аутогенное лечение ех vivo, клетка может представлять собой клетку, которую можно легко взять у субъекта (например, клетку крови, лимфы, костного мозга) и/или легко культивировать из образца ткани (например, фибробласты). В некоторых воплощениях клетка может представлять собой специлизированную антигенпредставляющую клетку (например, дендритную клетку, макрофаг, В-клетку, эпителиальную клетку и т.д.) или может представлять собой неспецилизированную антигенпредставляющую клетку (например, фибробласт, тимусную эпителиальную клетку, эпителиальную клетку щитовидной железы, глиальную клетку, панкреатическую бета-клетку, клетку сосудистого эндотелия и т.д.).
Экспрессия слитого белка в клетке ex vivo (например, трансфекция клетки поксвирусным вектором, раскрытым в данном описании) может быть выгодна в том отношении, что можно регулировать число клеток, экспрессирующих нуклеиновую кислоту. Кроме того, для клеток ex vivo доступен широкий ряд систем доставки нуклеиновой кислоты. Затем клетки, экспрессирующие слитый белок (т.е. трансфицированные клетки) можно ввести субъекту для активации наивных Т-клеток у субъекта к специфическому к аллергену арахиса фенотипу TH1, которые затем могут десенсибилизировать или вызвать переносимость у субъекта одного или нескольких аллергенов арахиса. С другой стороны, клетки, экспрессирующие слитый белок, можно культивировать с лимфоцитами ex vivo для генерации реактивных к аллергену арахиса лимфоцитов TH1, которые затем можно ввести субъекту.
Соответственно настоящее изобретение также относится к способу ex vivo генерации и/или расширения реактивных к аллергену арахиса лимфоцитов TH1, при этом способ включает культивирование клеток, экспрессирующих слитый белок, с одним или несколькими Т-лимфоцитами. Т-Лимфоциты могут быть включены в смешанную популяцию лимфоцитов или могут представлять собой изолированные Т-лимфоциты. Смешанные популяции лимфоцитов могут быть легко получены из периферической крови, лимфы или костного мозга способами, известными в технике. Т-Клетки могут быть выделены из таких смешанных популяций лимфоцитов способами, известными в технике, включая, например, выделение клеток с помощью нейлонового волокна, сортинг FACS, разделение на магнитных гранулах и т.д. В некоторых воплощениях отдельные субпопуляции Т-лимфоцитов могут быть выделены для культивирования с клетками, экспрессирующими нуклеиновую кислоту.
Специалистам в данной области техники следует иметь в виду, что когда клетки трансфицируют ex vivo для экспрессии слитого белка, и/или когда получают и/или расширяют популяцию лимфоцитов TH1 ex vivo, как раскрыто в данном описании, часто желательно использовать аутологичные клетки (т.е. клетки, полученные от субъекта, которого лечат), причем посредством этого избегают или минимизируют иммунную реакцию, которая может происходить, когда используют и вводят субъекту аутогенные клетки (т.е. клетки, полученные от другого субъекта).
Расширение реактивных к аллергену арахиса лимфоцитов TH1 ex vivo можно использовать для генерации большого числа реактивных к аллергену арахиса лимфоцитов TH1, которые затем можно вводить субъекту как профилактическое или терапевтическое лечение аллергии на арахис. В некоторых случаях расширение ex vivo может ускорить активацию и увеличение числа реактивных к аллергену арахиса лимфоцитов TH1 по сравнению с активацией и расширением in vivo. Кроме того, расширение ex vivo позволяет регулировать число и реактивность реактивных к аллергену арахиса лимфоцитов TH1, которые расширяются. В некоторых воплощениях реактивные к аллергену арахиса лимфоциты TH1 могут быть аутологичными для субъекта.
Соответственно настоящее изобретение также относится к способу десенсибилизации субъекта к аллергену арахиса, причем способ включает: (i) сбор лимфоцитов у субъекта; (ii) совместное культивирование лимфоцитов с клетками, экспрессирующими слитый белок, для генерации и/или увеличения числа лимфоцитов TH1, которые узнают пептидные фрагменты деградированного протеасомой слитого белка, ассоциированные с молекулами класса I ГКС на клетках; и (iii) введение субъекту лимфоцитов TH1 с (ii). В некоторых воплощениях лимфоциты собирают у субъекта для введения поксвирусного вектора, раскрытого в данном описании.
В некоторых воплощениях способ может включать выделение лимфоцитов со стадии (ii) перед введением субъекту. Выделение лимфоцитов со стадии (ii) может включать выделение всех лимфоцитов из клеток, экспрессирующих нуклеиновую кислоту, и/или может включать выделение одного или нескольких типов лимфоцитов (например, всех Т-лимфоцитов, всех лимфоцитов TH1 и т.д.). С другой стороны, лимфоциты TH1 со стадии (ii) можно ввести субъекту, не выделяя лимфоциты из клеток, экспрессирующих слитый белок, и в таком случае введенные клетки, экспрессирующие слитый белок, могут продолжать активировать другие лимфоциты TH1 in vivo. Способы выделения лимфоцитов у субъекта, способы выделения Т-клеток и субпопуляций Т-клеток включают способы, описанные выше.
По данному описанию также возможны способы, которыми получают выделенные или нет Т-лимфоциты у субъекта, которого лечат согласно настоящему изобретению, и определение, смещаются ли лимфоциты в сторону фенотипа TH1, как раскрыто в данном описании (например, определение профиля экспрессии цитокинов ex vivo). Такой подход добавляет преимущество определения, индуцирует ли введение поксвирусного вектора смещенную к TH1 аллергенспецифическую иммунную реакцию у субъекта. Таким образом, в некоторых воплощениях способ включает определение, смещаются ли лимфоциты, выделенные со стадии (ii), к фенотипу TH1, до их введения субъекту.
В некоторых воплощениях десенсибилизация или индукции переносимости у субъекта аллергена арахиса может предотвратить или снизить реакции гиперчувствительности при последующем воздействии арахиса на субъекта. Как таковые, способы, описанные выше, могут уменьшить опасность анафилактических реакций на арахис у субъектов, имеющих ранее аллергию на арахис, при последующем воздействии на субъекта арахиса и/или уменьшить опасность анафилактических реакций на арахис у субъектов в опасности развития аллергии на арахис.
Настоящее изобретение дополнительно описывается приведенными далее примерами. Следует иметь в виду, что последующее описание приводится только с целью описания отдельных воплощений и не предназначено для ограничения приведенного выше описания.
Примеры
Материалы и методы
Получение антигена PHAV. Нуклеотидную последовательность слитого белка (антигена PHAV), включающую мономер человеческого убиквитина С (Ubc) и четыре аллергена арахиса, создают так, как указано ниже и поясняется на фиг. 1А.
Аминокислотную последовательность для Ubc (NM_021009), ara h 1 (Swiss-Prot ввод P43238), ara h 2 (TrEMBL ввод Q8GV20), ara h 3 (Genbank Protein ACH91862) и ara h 6 (UniProtKB/TrEMBL ввод Q647G9) получают из базы данных последовательностей белков онлайн. Аминокислоту Met (М) стартового кодона удаляют из последовательностей белков ara h 1, ara h 2, ara h 3 и ara h 6 перед соединением последовательностей с образованием непрерывной последовательности белка в порядке Ubc + ara h1 + ara h2 + ara h3 + ara h6. Последовательность ДНК, кодирующую такой белок PHAVag, получают обратной трансляцией с использованием предпочтительной таблицы кодонов Homo Sapeins.
Аминокислотную последовательность PHAVag в обратном порядке транслируют в нуклеотидную последовательность с использованием Gene Designer (DNA2.0 Inc) и используют набор для оптимизации кодонов Homo Sapeins при 10% пороге. Также отделяют повторные последовательности из 8 оснований или более. Полученную последовательность дополнительно скринируют на возможность образования вторичной структуры и дестабилизирующие элементы с помощью DNA2.0 Inc. Конечную нуклеотидную последовательность последовательности белка PHAVag скринируют на мотив ранней трансляции поксвируса «TTTTTNT». Однако ничего не находят.
К концу нуклеотидной последовательности, кодирующей антиген PHAV, добавляют стоп-кодон «ТАА». Сразу же после кодона также добавляют последовательность прекращения ранней трансляции поксвируса ТТТТТАТ. Экспрессирующую кассету фланкируют линкерами Рас I. Так как сайты узнавания Рас I в кассете отсутствуют, такую кассету можно клонировать в плазмиды и целиком вырезать из плазмиды путем гидролиза рестриктазой Рас I.
Как видно из таблицы 1, Ubc, ara h 1, ara h 2, ara h 3 и ara h 6 в антигене PHAV имеют примерно 75% идентичность нуклеотидных последовательностей с нативными последовательностями.

Совокупность нуклеотидных и аминокислотных последовательностей конструкции антигена PHAV приводится в таблице 2.

Получение альтернативного антигена PHAV. Получают включающий убиквитин антиген арахисгипоаллергенной вакцины (UBc.PHAVag), включающий белковую последовательность антигена PHAV, полученную слиянием следующих кодирующих белок последовательностей - мономера убиквитина С, аллергена арахиса ara h 1, аллергена арахиса ara h 2, аллергена арахиса ara h 3 и аллергена арахиса ara h 6, последовательности прекращения ранней транскрипции поксвируса и наконец еще одного линкера Рас 1.
Мономер убиквитина С модифицируют по C-концу для замены концевого остатка Gly (G) на Ala (А). Модифицированный убиквитин С делает антиген PHAV после синтеза мишенью для каскада протеасомальной деградации в клетке-хозяине (см. фиг. 9). Это гарантирует, что интактный белок не представлен к продуцированию антител, и что полученные пептидные фрагменты процессированы каскадом класса I ГКС, запускающим иммунную реакцию TH1 на антиген PHAV.
Конфигурация и особенности экспрессирующих PHAV кассет показаны схематично на фиг. 1В и включают рестриктазные ликеры Рас I на 5'- и 3'-концах, а также вакцинный ранний/поздний промотор на 5'-конце.
Аминокислотную последовательность для UBc, ara h 1, ara h 2, ara h 3 и ara h 6 получают из баз данных или Swit-Prot или EMBL. Стартовый кодон, кодирующий остаток Met (М), удаляют из нуклеотидных последовательностей ara h 1, ara h 2, ara h 3 и ara h 6 перед их соединением с образованием непрерывной нуклеотидной последовательности, кодирующей белковую последовательность UBc + h1 + h2 + h3 + h6 в указанном порядке.
Последовательность ДНК для кодирования такого UBc.PHAVag, получают обратной трансляцией с использованием предпочтительной таблицы кодонов Homo Sapeins. Аминокислотную последовательность UBc.PHAVag обратно транслируют в нуклеотидную последовательность с использованием Gene Designer (DNA2.0 Inc), с использованием набора для оптимизации кодонов Homo Sapeins при 10% пороге, и очищая повторные последовательности из 8 оснований или более. Полученную последовательность дополнительно скринируют на возможность образования вторичной структуры и дестабилизирующие элементы с помощью DNA2.0 Inc. Конечную нуклеотидную последовательность, кодирующую UBc.PHAVag, скринируют на мотив ранней трансляции поксвируса «TTTTTNT», но ничего не находят. К концу нуклеотидной последовательности, кодирующей UBc.PHAVag, добавляют стоп-кодон «ТАА». Также сразу после кодона добавляют последовательность прекращения ранней трансляции поксвируса ТТТТТАТ. Экспрессирующую кассету фланкируют линкерами Рас I, и так как сайты узнавания Рас I в кассете отсутствуют, такую кассету можно клонировать в плазмиды и целиком вырезать из плазмиды путем гидролиза рестриктазой Рас I. Последовательность ДНК экспрессирующей UBc.PHAVag кассеты можно найти на фиг. 2.
Также конструируют антиген гипоаллергенной вакцины против арахиса, в который не включают мономер убиквитина на 5'-конце. Такая конструкция идентична конструкции UBc.PHAVag, описанной выше, но без последовательности убиквитина. Такую конструкцию относят к PHAVag, и схематичное представление конфигурации и особенностей PHAVag можно найти на фиг. 1С, а последовательность ДНК на фиг. 3.
Экспрессирующие кассеты как UBc.PHAVag, так и PHAVag клонируют в бактериальные плазмиды таким образом, что указанные экспрессирующие кассеты можно получить обратно после клонирования гидролизом PacI/Sbf I и очисткой в геле.
Можно получить другие антигены гипоаллергенной вакцины против арахиса, содержащие убиквитин, которые включают следующие аллергены арахиса:
(i) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11;
(ii) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(iii) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(iv) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(v) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7;
(vi) ara h 1, ara h 2, ara h 3, ara h 4, ara h 5 и ara h 6;
(vii) ara h 1, ara h 2, ara h 3, ara h 4 и ara h 5;
(viii) ara h 1, ara h 2, ara h 3 и ara h 4;
(ix) ara h 1, ara h 2 и ara h 3;
(x) ara h 1 и ara h 2;
(xi) ara h 1;
(xii) ara h 2;
(xiii) ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10, и ara h 11;
(xiv) ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(xv) ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(xvi) ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(xvii) ara h 2, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7;
(xviii) ara h 2, ara h 3, ara h 4, ara h 5 и ara h 6;
(xix) ara h 2, ara h 3, ara h 4 и ara h 5;
(xx) ara h 2, ara h 3 и ara h 4;
(xxi) ara h 2 и ara h 3;
(xxii) ara h 3;
(xxiii) ara h 1, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11;
(xxiv) ara h 1, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(xxv) ara h 1, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(xxvi) ara h 1, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(xxvii) ara h 1, ara h 3, ara h 4, ara h 5, ara h 6 и ara h 7;
(xxviii) ara h 1, ara h 3, ara h 4, ara h 5 и ara h 6;
(xxix) ara h 1, ara h 3, ara h 4 и ara h 5;
(xxx) ara h 1, ara h 3 и ara h 4;
(xxxi) ara h 1 и ara h 3;
(xxxii) ara h 1, ara h 2, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11;
(xxxiii) ara h 1, ara h 2, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(xxxiv) ara h 1, ara h 2, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(xxxv) ara h 1, ara h 2, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(xxxvi) ara h 1, ara h 2, ara h 4, ara h 5, ara h 6 и ara h 7;
(xxxvii) ara h 1, ara h 2, ara h 4, ara h 5 и ara h 6;
(xxxviii) ara h 1, ara h 3, ara h 4 и ara h 5;
(xxxix) ara h 1, ara h 2 и ara h 4;
(x1) ara h 1, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h 10 и ara h 11;
(x1i) ara h 1, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9 и ara h 10;
(x1ii) ara h 1, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8 и ara h 9;
(x1iii) ara h 1, ara h 4, ara h 5, ara h 6, ara h 7 и ara h 8;
(x1iv) ara h 1, ara h 4, ara h 5, ara h 6 и ara h 7;
(x1v) ara h 1, ara h 4, ara h 5 и ara h 6;
(x1vi) ara h 1, ara h 4 и ara h 5;
(x1vii) ara h 1 и ara h 4;
(x1viii) ara h 4; и т.д.
Аминокислотные последовательности для ara h 1, h 2, h 3, h 4, h 5, h 6, h 7, h 8, h 9, h 10 и h 11 легко получают из баз данных белков или Swit-Prot или EMBL. Стартовый кодон, кодирующий остаток Met (М), а также стоп-кодон могут быть удалены из нуклеотидных последовательностей ara h до их соединения с образованием непрерывной нуклеотидной последовательности, кодирующей слитый белок из любых двух или большего числа белков ara h и в любом определенном порядке. Однако стартовый кодон может потребоваться как начало последовательности, кодирующей слитый белок, а стоп-кодон для терминации экспрессии кодированного слитого белка.
Конструирование гомологичной рекомбинантной плазмиды на основе вируса коровьей оспы. Кассета гомологичной рекомбинации состоит из следующих элементов, которые все получены синтетически Gene Art GmbH of Life Technologies: (i) левого гомологичного рекомбинантного плеча в 500 п.о., которое фланкирует ORF штамма Копенгаген выше VACV-A39R, (ii) экспрессирующей кассеты EGFP под контролем вакцинного раннего/позднего промотора и терминирующей в последовательности прекращения ранней транскрипции поксвируса (TTTTTNT), (iii) экспрессирующей кассеты Ecogpt под контролем вакцинного раннего/позднего промотора и терминирующей в последовательности прекращения ранней транскрипции поксвируса (TTTTTNT); (iv) экспрессирующей кассеты антигена гипоаллергенной вакцины против арахиса (UBc.PHAVag), описанной выше, (v) правого гомологичного рекомбинантного плеча в 500 п. о., которое фланкирует ORF штамма Копенгаген ниже VACV-A39R. Схематическое представление таких кассет можно найти на фигуре 4, и их последовательности ДНК можно найти на фиг. 6 и 7.
Кассеты гомологичной рекомбинации как UBc.PHAVag, так и PHAV фланкированы сайтами рестриктаз Not I и клонированы в плазмиды с образованием клонов рТС11 (UBc.PHAVag) и рТС12 (PHAV). Плазмиды показаны на фиг. 8. Так как такие плазмиды получены синтетически, любые последовательности TTTTTNT, встречающиеся с белковыми кодирующими последовательностями EGFP и Ecogpt, разрушаются молчащими мутациями без воздействия на кодированные аминокислотные последовательности.
Конструирование вируса коровьей оспы, экспрессирующего гипоаллергенные вакцинные антигены против арахиса. Экспрессирующие кассеты PHAV встраивают в ORF A39R вируса коровьей оспы штамма Копенгаген путем гомологичной рекомбинации. Фиг. 4 показывает карту, иллюстрирующую сайт вставки в ORF A39R. Коротко, это осуществляют, инфицируя клетки ВНК21 при низкой множественности заражения (moi) 0,01 бое на клетку в течение 45 минут и затем трансфицируя клетки линеаризированными Not I рТС11 или рТС12 плазмидными векторами. Затем инфицированные/трансфицированные клетки собирают, как только заражение достигает почти слияния. Затем собранные клетки обрабатывают ультразвуком для получения вирусных экстрактов, и эти вирусные экстракты подвергают одному циклу очистки бляшек при положительном отборе с микофеноловой кислотой (MPA) в присутствии ксантина, гипоксантина, аминоптерина и тимидина. Затем клоны очищенных бляшек последовательно амплифицируют при МРА-положительном отборе, и получают посевной штамм вируса. Рекомбинантный вирус коровьей оспы, содержащий экспрессирующую кассету UBc.PHAVag, обозначают SCV201C, и рекомбинантный вирус коровьей оспы, содержащий экспрессирующую кассету PHAVag, обозначают SCV202C.
Подробные протоколы получения рекомбинантного вируса коровьей оспы с использованием метода отбора Ecogpt можно найти в работе Smith, 1993. Способ, используемый для получения SCV201C и SCV202C, описан ниже.
Гомологичная рекомбинация. Для конструирования каждого вируса в три колбы Т25, содержащие среду для выращивания (RPMI-1640/10% FCS/2 мМ глютамакса/пен-стрепт), высевают клетки ВНК21 и выращивают до субслияния при 37°C/5% СО2. В день заражения две колбы инифицируют VACV-COP при moi 0,01 бое/клетка, и другие колбы не инфицируют (неинфицированный контроль). После заражения колб 1 и 2 в течение 45 мин при комнатной температуре вирусные инокуляты удаляют, и монослой клеток дважды промывают PBS. После промывки в каждую колбу добавляют 4 мл поддерживающей среды (MM: RPMI-1640/2% FCS/2 мМ глютамакса/пен-стрепт), включая колбу 3, в которой также осуществляют такую же стадию промывки.
Трансфекцию выполняют с использованием реагента Effectene Transfection (Qiagen, Cat No 301425), следуя инструкциям изготовителя. Коротко, 16 мкл энхансера добавляют к 2 мкг линеаризированного рТС11 или рТС12 в 150 мкл буфера ЕС и после тщательного перемешивания оставляют стоять в течение 5 минут при комнатной температуре. К полученной смеси добавляют 25 мкл реагента Effectene Transfection, тщательно перемешивают и оставляют стоять при комнатной температуре в течение 10 минут. Наконец, добавляют 1 мл MM (RPMI-1640/2% FCS/2 мМ глютамакса/пен-стрепт) и тщательно и осторожно все перемешивают. Затем такую смесь для трансфекции добавляют в колбу 1, которая предварительно инфицирована VACV-COP.
Колбу 1 (гомологичная рекомбинация), колбу 2 (только контроль заражения) и колбу 3 (неинфицированный контроль) инкубируют в течение ночи при 37°C/5% СО2, на следующий день в каждой колбе заменяют среду на свежую ММ, содержащую 25 мкг/мл микофеноловой кислоты (MPA), 250 мкг/мл ксантина и 1×HAT (Sigma, кат. № Н0262-10VL) - 5 мл на колбу, и дополнительно инкубируют 37°C/5% CO2 до тех пор, пока сильный СРЕ можно видеть только в колбе 1. В колбе 2 имеются слабые признаки сильного СРЕ или его отсутствие, так как обработка МРА ингибирует распространение инфекции VACV-COP, и в колбе 3 монослой выглядит здоровым.
Клетки в колбе 1 собирают, соскребая клетки в культуральную среду, затем осаждают центрифугированием при малой скорости (500 g в течение 5 минут при комнатной температуре) и затем ресуспендируют клеточный осадок в 1 мл 10 мМ трис-HCl, pH 8. Вирусный экстракт получают несколькими циклами замораживания и оттаивания и затем хранят при -80°C готовым для фазы очистки бляшек. Вирусные конструкции называют SCV201C (вставка UBc.PHAVag) и SCV202C (вставка PHAV).
Процесс очистки бляшек. Экстракт от гомологичной рекомбинации серийно разводят, и каждое разведение используют для инфицирования ряда клеток ВНК21, культивированных в 48-луночном планшете в присутствии МРА. Целью является разведение вируса до заражения 1 бое на лунку и, перед харвестированием, поиск лунок, которые содержат только 1 флуоресцентную бляшку приблизит, через 30 час после заражения.
Клетки ВНК21 высевают в каждую лунку 48-луночного планшета и культивируют до 100% в среде для выращивания (RPMI-1640/10% FCS/2 мМ глютамакса/пен-стрепт) при 37°C/5% CO2. Затем среду заменяют ММ, содержащей 25 мкг/мл микофеноловой кислоты (МРА), 250 мкг/мл ксантина и 1×HAT (Sigma, кат. № H0262-10VL), и инкубируют дополнительно в течение ночи.
Для заражения экстракты от гомологичной рекомбинации (SCV201C и SCV202C) оттаивают и кратковременно обрабатывают ультразвуком для разрушения комков и агрегатов. Выполняют десятикратное серийное разведение каждого вирусного экстракта до 10-5 с использованием MM (RPMI/2% FCS/глютамакс/пен-стрепт) в объемах 1 мл. Для каждого разведения засевают один ряд 48-луночного планшета 100 мкл разведенного вируса после удаления среды для выращивания из каждой лунки и промывки один раз PBS. Оставляют 48-луночный планшет при комнатной температуре на 45 минут для того, чтобы произошла адсорбция вируса. После адсорбции вируса вирусный инокулят осторожно удаляют из каждой лунки, и остаточный инокулят удаляют на стадии промывки, включающей использование 500 мкл PBS на лунку. После промывки в каждую лунку добавляют 500 мкл MM (RPMI/2% FCS/глютамакс/пен-стрепт), содержащей 25 мкг/мл МРА, 250 мкг/мл ксантина и 1×HAT (Sigma, кат. № H0262-10VL), и затем инкубируют при 37°C/5% CO2 до тех пор, пока во флуоресцентном микроскопе можно будет ясно увидеть зеленые флуоресцентные очаги заражения.
Для харвестирования отбирают только лунки, содержащие один очаг флуоресценции при наивысшей возможной степени разведения. Среду из выбранных лунок осторожно удаляют, и добавляют 100 мкл 10 мМ трис-HCl, pH 8. Планшет замораживают-оттаивают три раза, и извлекают содержимое из выбранных лунок.
Затем один выбранный клон далее амплифицируют, инфицируя 1 лунку 6-луночного планшета, содержащего клетки ВНК21 при 100% слиянии, которые предварительно в течение ночи обрабатывали 25 мкг/мл МРА, 250 мкг/мл ксантина и 1×HAT (Sigma, кат. № H0262-10VL), удаляя культуральную среду из лунки и добавляя 10 мкл вирусного экстракта, разведенного до 500 мкл в PBS. Через 45 мин при комнатной температуре в лунку добавляют 2 мл ММ, содержащей 25 мкг/мл МРА, 250 мкг/мл ксантина и 1×HAT (Sigma, кат. № H0262-10VL), и затем инкубируют при 37°C/5% CO2 в течение 3 суток до преобладания зеленых флуоресцентных клеток во флуоресцентном микроскопе. Клетки в инфицированной лунке соскребают в культуральную среду и затем осаждают при 500 g в течение 5 минут. Осажденные клетки ресуспендируют в 500 мкл 10 мМ трис-HCl, pH 8 и быстро обрабатывают ультразвуком для получения вирусного экстракта.
Часть такого экстракта используют для дальнейшей амплификации путем инфицирования ВНК21 в пяти колбах Т175 при отборе с МРА. Инфицированные клетки извлекают и затем осаждают при 500 g в течение 5 мин. Осажденные клетки из всех пяти колб ресуспендируют в 5 мл 10 мМ трис-HCl, pH 8, и быстро обрабатывают ультразвуком для получения вирусного экстракта. Затем удаляют нерастворимый материал путем осаждения при 500 g в течение 5 мин. Затем супернатант (вирусный экстракт) титруют на клетки ВНК21 с использованием процедуры, описанной ниже, и присутствие встроенного UBc.PHAV в ORF A39R подтверждают анализом ПЦР.
Титрование. Титрование выполняют с использованием формата 24-луночного планшета. Бляшки можно отчетливо различить в виде контрастно окрашенных фиолетовым кристаллическим ямок в монослое (бляшках), видных невооруженным глазом.
Для каждого рекомбинантного вируса, который титруют, один 24-луночный планшет засевают клетками ВНК21 и культивируют до слияния в среде для выращивания (RPMI/10% FCS/глютамакс/пен-стрепт). В день титрования каждый вирусный штамм оттаивают и обрабатывают ультразвуком для разрушения комков и скоплений. Каждый вирус серийно разводят в PBS до 10-8. Удаляют среду из каждой лунки, и, начиная с разведения 10-8, 500 мкл каждого разведения добавляют в каждую лунку вертикального ряда в 24-луночном планшете (4 лунки на разведение) и оставляют для инкубации при комнатной температуре на 45 мин для адсорбции вируса на клетках. После этого вирусный инокулят удаляют из каждой лунки, и затем каждую лунку промывают один раз PBS. После промывки в каждую лунку добавляют 1 мл MM (RPMI/2% FCS/глютамакс/пен-стрепт), и планшеты инкубируют при 37°C/5% CO2 до тех пор, пока в монослоях можно увидеть бляшки. Для контрастного окрашивания бляшек среду из каждой лунки удаляют, и в каждую лунку добавляют раствор кристаллического фиолетового (0,4%, масс./об. в 20% этаноле). Окрашивание осуществляют при комнатной температуре в течение 15-30 мин, после чего краситель кристаллический фиолетовый удаляют из каждой лунки, и каждую лунку оставляют сушиться на воздухе перед подсчетом бляшек. Для разбавления, которое дает возрастание до 10-30 точек на лунку, вычисляют среднее. Затем полученную величину умножают на обратное серийное разведение и затем еще умножают на 2 (т.е. 2×500 мкл = 1 мл), и получают титр в бое/мл.
Проверка иммуногенности SCV201C на мышах С3Н/HeJ. Для того, чтобы проверить иммуногенность SCV201C и определить, может ли антиген PHAV вызывать специфическую иммунную реакцию ТН1 на белок арахиса, 3 группы мышей С3Н/HeJ вакцинируют следующим: (i) 106 бое SCV201C, введенными интраперитонеально (IP), (ii) 106 бое SCV000C, введенными интраперитонеально (IP), и (iii) PBS, введенным интраперитонеально (IP). Образцы крови берут непосредственно перед вакцинацией (prebleed) и через 17 дней после вакцинации. Селезенки для определения профиля цитокинов собирают через 9 недель после вакцинации.
Получение растворимого экстракта белка арахиса. Способ, используемый для экстрагирования растворимого белка арахиса из жареного несоленого арахиса, получают из процедур, описанных Sachs et al. (1981) и Burks et al. (1992). Жареный несоленый арахис закупают в местном бакалейном магазине. Затем орехи измельчают в блендере в муку и затем обезжиривают реагентом гексаном. Для этого н-гексан добавляют к арахисовой массе и энергично встряхивают для перемешивания. Смесь переносят в стеклянный стакан и оставляют расслаиваться на фазы растворителя и твердого вещества. Фазу растворителя (которая содержит экстрагированные липиды/жиры) отделяют от твердой фазы. Твердую фазу сушат на воздухе до кека. Полученный кек растворяют в 0,1 М NH4HCO3 (2 мл на грамм) при 4°C в течение 36 часов при перемешивании для экстрагирования твердых белков. Взвесь центрифугируют в течение 15 мин при 10000 g для удаления твердых веществ. Супернатант диализуют против 5 мМ фосфатного буфера (pH 7 - pH 8) или PBS с использованием мембраны/трубки 3500 MWCO. Диализованный раствор центрифугируют при 10000 g в течение 15 мин при 4°C для осветления экстракта. Общую концентрацию белка в растворимом экстракте измеряют с использованием стандартных методов. Полученный растворимый экстракт белка (10 мг/мл) хранят при -20°C и оттаивают перед использованием.
Количественное определение арахисспецифических сывороточных IgE и IgG2a. Сенсибилизируют 96-луночные планшеты с плоскодонными лунками для EIA/RIA ELISA (Costar) 2 мкг/лунка очищенного экстракта арахиса в PBS и инкубируют при 37°C в течение 1 часа и затем в течение ночи при 4°C. Планшеты три раза промывают PBS, 200 мкл/лунка, перед блокировкой 5% снятым молоком с PBS и 0,05% твина (SM+PBS+TW). Неспецифическое связывание блокируют при 37°C в течение, по меньшей мере, одного часа и затем осуществляют три промывки 200 мкл/лунка PBS с 0,05% твина (PBS+TW). После промывки образцы сыворотки сначала разбавляют 1:100 для анализов на IgE или 1:500 для анализов на IgG2a в SM+PBS+TW. Образцы сыворотки серийно разводят в трех вертикальных рядах. Некоторые лунки оставляют без сыворотки как фоновый контроль. Планшеты инкубируют при 37°C в течение одного часа.
Планшеты промывают пять раз 200 мкл PBS, и добавляют вторичные антитела (1:500, конъюгат козьего антимышиного IgE и HRP, Alpha Diagnostic; 1:1000 HRP крысиный антимышиный IgG2a, BD Biosciences-BD Pharmingen), разведенные в SM+PBS+TW (100 мкл/лунка). Планшеты инкубируют в течение одного часа и затем промывают пять раз, как описано выше, и добавляют 100 мкл/лунка раствора субстрата гидрохлорида о-фенилендиамина (OPD), полученного согласно указаниям изготовителя (SigmaFAST™ OPD, Sigma-Aldrich). Реакции останавливают 20 мкл/лунка 1 М HCl, когда начинает появляться окраска в лунках-пустышках (время колеблется от пяти минут для анализов на IgG1 и IgG2a до 45 минут для анализа на IgE). Оптическую плотность измеряют при 450 нм планшет-ридером (EL808 Ultra Microplate Reader, Bio-tek Instruments Inc).
Строят графики оптической плотности для серийных разведений в каждый соответствующий момент времени в зависимости от фактора разведения в логарифмической шкале с использованием GraphPadPrisim V5.01 (GraphPad Software, San Diego, CA, USA). Конечный титр для каждого момента времени определяют как показатель разведения, при котором кривая отсекает вычисленный порог оптической плотности (минимум трехкратной величины среднеквадратической ошибки (SEM) образцов до вакцинации, но больше самой высокой величины оптической плотности, измеренной для всех образцов до вакцинации).
Статистический анализ. Статистические сравнения выполняют с использованием GraphPad Prism V5.01 (GraphPad Software, San Diego, CA, USA). Двусторонний дисперсионный анализ (ANOVA) с постпроверкой по Бенферрони используют для заключения о значимых различиях в результатах ELISA.
Пример 1. Убиквитинизация антигена PHAV, облегченная успешной экспрессией SCV201C, но не SCV202C
Экспрессия SCV201C после встраивания экспрессирующей кассеты UBc.PHAVag в A39R вируса коровьей оспы является успешной. После гомологичной рекомбинации и во время стадии очистки бляшек МРА-резистентные бляшки можно четко идентифицировать и амплифицировать в присутствии МРА для получения посевного штамма, который дает достаточные титры для протекания следующей стадии проверки иммуногенности на мышах.
Напротив, экспрессия SCV202C затруднена для развития из-за стадии очистки бляшек, так как при высокой степени разведения нельзя четко обнаружить различимые бляшки. Флуоресцирующие инфицированные клетки можно обнаружить в небольшом интервале разведений, и при таких разведениях 100% СРЕ видно только в инфицированных лунках в противоположность различимым бляшкам. Когда собирают содержимое таких лунок и подвергают дальнейшей амплификации в присутствии МРА, получают очень низкий вирусный титр, большая часть которого состоит из исходного вируса, что определяют анализом ПЦР и анализом бляшек, показывающим отсутствие флуоресцирующей бляшки в отсутствие МРА.
Экспрессия PHAVag после заражения оказывает ингибирующее или токсичное действие на размножение вируса, которое преодолевается конструкцией SCV201C. Без связи с какой-либо теорией или определенным типом применения, постулируют, что ингибирующее или токсичное действие синтезированного PHAVag преодолевается путем применения метки деградации протеасомой, такой как убиквитин, для того, чтобы экспрессированный PHAVag стал мишенью протеасомальной деградации.
Ингибирующее действие на размножение вируса путем экспрессии интактного PHAVag также подтверждается, поскольку конструкция рекомбинантной вакцины, содержащая только экспрессирующие кассеты Ecogtp и EFGR, встроенные в ORF A39R, является легко достижимой (обозначена как SCV000).
Пример 2. Антигенспецифические антитела реагируют на вакцинацию
На фиг. 10 представлены результаты по уровню в сыворотке специфических к белку арахиса антител как IgE (фиг. 10А), так и IgG2a (фиг. 10В) до и после вакцинации (17 день после вакцинации). Можно ясно видеть, что вакцинация SCV201C вызывает значительные уровни специфических к белку арахиса антител IgG2a через 17 дней после вакцинации. Такие уровни значимо выше, чем для контроля с вектором (SCV000) и контроля PBS, что показывает, что SCV201C вызывает реакцию антител, специфических к белку арахиса. Отмечается, что SCV201C вызывает более слабую реакцию IgE по сравнению с реакцией IgG2a; иными словами, при сравнении конечное разведение для IgE 1:2500, а конечное разведение для IgG2a приближается к 1:1000000. Более того, реакция IgE не намного выше реакций, вызываемых контролями пустым вектором (SCV000) и PBS.
Такие результаты показывают, что SCV201C вызывает реакцию IgG2a на белки арахиса, но очень слабую реакцию IgE, что показывает, что SCV201C в ответ на PHAVag инициирует специфическую иммунную реакцию на арахис, смещенную к TH1.
Пример 3. Профиль цитокинов лимфоцитов у мышей после вакцинации SCV201C Селезенки мышей собирают и хранят в полной RPMI, а затем переносят в 60-мм чашку для культивирования. Затем селезенки рассекают на три секции и разрушают до одноклеточной суспензии. Затем клетки фильтруют и промывают 5% RPMI (300 g × 5 минут). Затем эритроциты лизируют в 5 мл щелочного буфера для лизиса в течение 5 минут, затем разбавляют до 20 мл 5% RPMI и центрифугируют при 200 g в течение 5 минут. Затем клетки ресуспендируют и считают. Тем временем, подготавливают лунки 96-луночных планшетов с контролем RPMI, растворимым антигеном к арахису (100 мкг/мл) и ConA (5 нг/мл). Затем добавляют лимфоциты по 400000 клеток на лунку и инкубируют при 37°C в течение 96 часов.
После инкубации в течение 96 часов собирают супернатант каждого типа и замораживают при -80°C. Затем количественно определяют цитокины Th1/Th2 проточной цитометрией согласно инструкциям изготовителя (BD Biosciences # 551287). Затем образцы пропускают через проточный цитометр BD FACSCanto II. Концентрацию цитокинов определяют с использованием программы Soft Flow FCAP Array. Весь дополнительный анализ проводят в Graph Pad 6.0.
Результаты, представленные на фиг. 11, ясно показывают, что вакцинация SCV201C вызывает смещенную к TH1 иммунную реакцию на воздействие белка арахиса. Это иллюстрируется значимо более высоким уровнем IFN-гамма (IFN-g; цитокин TH1; фиг. 11А) по сравнению с уровнями IL4 и IL5 (цитокины TH2; фиг. 11В и 11С), секретированными культивированными лимфоцитами, полученными из селезенок мышей, вакцинированных SCV201C.
Выводы
Вакцинация мышей SCV201C вызывает смещенную к TH1 иммунную реакцию против белка арахиса. Аллергенспецифическая иммунная реакция TH1 будет доминировать над имеющейся аллергенспецифической иммунной реакцией TH2, и в силу этого будет десенсибилировать индивидуума к последующему воздействию аллергена. Исследования, раскрытые в данном описании, показывают, что убиквитинизированный антиген гипоаллергенной вакцины против арахиса (UBc.PHAVag) стимулирует иммунную реакцию TH1, специфическую против белка арахиса. Таким образом, вакцины, содержащие убиквитинизированный антиген гипоаллергенной вакцины, описанный в данном описании, можно использовать для десенсибилизации индивидуумов к аллергенам арахиса и, следовательно, можно использовать для лечения и/или предупреждения аллергических реакций у индивидуумов, которые запускаются воздействием аллергенов арахиса.
Как отмечалось выше, экспрессия конструкции SCV201C является успешной после заражения, в то время как экспрессия конструкции без убиквитина SCV202C затруднена для развития после стадии очистки бляшек. Поэтому оказывается, что экспрессия PHAVag после заражения оказывает ингибирующее или токсичное действие на размножение вируса, которое преодолевается конструкцией SCV201C. Без связи с какой-либо теорией или определенным типом применения, постулируют, что ингибирующее или токсичное действие синтезированного PHAVag преодолевается путем применения убиквитина, который делает экспрессированный PHAVag мишенью для протеасомальной деградации. В результате нацеленной убиквитином протеасомальной деградации PHAVag небольшие пептидные фрагменты PHAVag поступают в эндоплазматический ретикулум (ER), где они образуют комплекс с белками класса I ГКС и затем переносятся к поверхности клетки для представления Т-лимфоцитам (см., например, фиг. 9). Следствием этого является то, что имеет место усиленное представление фрагментов PHAVag с классом I ГКС, приводящее к более сильной иммунной реакции TH1 на аллергены арахиса. Таким образом, метка деградации протеасомой (например, убиквитин) неожиданно предохраняет искусственный интактный слитый белок PHAVag от ингибирования репликации вируса.
Ara h 1, ara h 2, ara h 3 являются тремя основными аллергенами, которые, как показано, вызывают специфические аллергические реакции на арахис у чувствительных индивидуумов. Ara h 6 вовлекается в восприимчивость детей к аллергии на арахис (Flinterman et al., 2007). Ara h 7 узнается у 43% индивидуумов с аллергией на арахис, ara h 8 узнается у 85% индивидуумов с аллергией на арахис, ara h 4 узнается у 54% индивидуумов с аллергией на арахис, и ara h 5 узнается у 13% индивидуумов с аллергией на арахис
Каждые патент, заявка на патент и публикация, цитированные в данном описании, включены в него в качестве ссылок.
Для специалистов в данной области техники очевидны многие модификации без отступления от объема настоящего изобретения.
Библиография
Burks W.A., Williams L.W., Connaughton C., Cockrell G., O'Brien T.J., Helm R.M., 1992. Identification and characterization of a second major peanut allergen, Ara h II, with use of the sera of patients with atopic dermatitis and positive peanut challenge. J. Allergy Clin. Immunol., 90: 962-969.
DeLong J.H., Simpson K.H., Wambre E., James E.A., Robinson D., Kwok W.W., 2011. Ara h 1-reactive T cells in individuals with peanut allergy. J. Allergy Clin. Immunol, 127 (5): 1211-1218.e3.
Dudek Т., Knipe D.M., 2006. Replication-defective viruses as vaccines and vaccine vectors. Virology, 344 (1): 230-239.
Flinterman A.E., van Hoffen E., den Hartog Jager C.F., Koppelman S., Pasmans S.G., Hoekstra M.O., Bruijnzeel-Koomen C.A., Knulst A.C., Knol E.F., 2007. Children with peanut allergy recognize predominantly Ara h2 and Ara h6, which remains stable over time. Clin. Exp. Allergy, 37(8): 1221-8.
Heath W.R., Carbone F.R., 1999. Cytotoxic T lymphocyte activation by cross-priming. Curr. Opin. Immunol, 11 (3): 314-318.
Hartl A., Kiesslich J., Weiss R., Bernhaupt A.,

Hartl A., Hochreiter R., Stepanoska Т., Ferreira F., Thalhamer J., 2004. Characterization of the protective and therapeutic efficiency of a DNA vaccine encoding the major birch pollen allergen Bet v 1a. Allergy, 59: 65-73.
Holgate S.T., 1999. The epidemic of allergy and asthma. Nature, 402 (6760 Suppl), B2-B4
Hsu C.H., Chua K.Y., Tao M.H., Lai Y.L., Wu H.D., Huang S.K., Hsieh K.H., 1996. Immunoprophylaxis of allergen-induced immunoglobulin E synthesis and airway hyperresponsiveness in vivo by genetic immunization. Nat. Med., 2 (5): 540-544.
Jilek S., Barbey C, Spertini F., Corthesy В., 2001. Antigen-independent suppression of the allergic immune response to bee venom phospholipase A(2) by DNA vaccination in CBA/J mice. J. Immunol, 166: 3612-21.
Kumaraguru U., Rouse R.J., Nair S.K., Bruce B.D., Rouse В.Т., 2000. Involvement of an ATP-dependent peptide chaperone in cross-presentation after DNA immunization. J. Immunol., 165 (2): 750-759.
Leitner W.W., Hammerl P., Thalhamer J., 2001. Nucleic acid for treatment of cancer: genetic vaccines and DNA adjuvants. Curr. Pharm. Des., 7(16): 1641-1667.
Long A., 2002. The nuts and bolts of peanut allergy. N. Engl. J. Med., 346 (17): 1320-1322.
Lu Z, Yuan L, Zhou X, SotE, Levitsky HI, Pardoll DM. 2000. CD4040-independent pathways of T cell help for priming of CD8(+) cytotoxic T lymphocytes. J. Exp. Med. 191 (3): 541-550.
Mosmann T.R., Coffman R.L., 1989. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu. Rev. Immunol, 7: 145-173.
Oppenheimer J.J., Nelson H.S., Bock S.A., Christenson F., Leung D.Y., 1992. Treatment of peanut allergy with rush immunotherapy. J. Allergy Clin. Immunol, 90 (2): 256-262.
Parronchi P., Maggi E., Romagnani S., 1999. Redirecting Th2 responses in allergy. Curr. Top. Microbiol. Immunol, 238: 27-56.
Polo J.M., Dubensky T.W. Jr., 2002. Virus-based vectors for human vaccine applications. Drug Discov. Today, 7 (13): 719-727.
Raz E., Tighe H., Sato Y., Corr M., Dudler J.A., Roman M., Swain S.L., Spiegelberg H.L., Carson D.A., 1996. Preferential induction of a Th1 immune response and inhibition of specific IgE antibody formation by plasmid DNA immunization. Proc. Natl. Acad. Sci. USA, 93 (10): 5141-5145.
Ridge J.P., Di Rosa F., Matzinger P., 1998. A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and a T-killer cell. Nature, 393 (6684): 474-478.
Rocha C.D., Caetano B.C., Machado A.V., Bruna-Romero O., 2004. Recombinant viruses as tools to induce protective cellular immunity against infectious diseases. Int. Microbiol,. 7 (2): 83-94.
Roy K., Mao H.Q., Huang S.K., Leong K.W., 1999. Oral gene delivery with chitosan-DNA nanoparticles generates immunologic protection in a murine model of peanut allergy. Nat. Med., 1999; 5: 387-91.
Sachs M.I., Jones R.T., Yunginger J.W., 1981. Isolation and partial characterization of a major peanut allergen. J. Allergy Clin. Immunol., 67: 27-34.
Sanderson I.R., Walker W.A., 1993. Uptake and transport of macromolecules by the intestine: possible role in clinical disorders (an update). Gastroenterology, 104 (2): 622-639.
Shaheen S.O., Aaby P., Hall A.J., Barker D.J., Heyes C.B., Shiell A.W., Goudiaby A., 1996. Measles and atopy in Guinea-Bissau. Lancet, 347 (9018): 1792-1796.
Sicherer S.H. and Leung D.Y., 2010. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2009. J. Allergy Clin. Immunol, 125 (1), 85-97.
Singh V.K., Mehrotra S., Agarwal S.S., 1999. The paradigm of Th1 and Th2 cytokines: its relevance to autoimmunity and allergy. Immunol. Res., 20 (2): 147-161.
Slater J.E., Colberg-Poley A., 1997. A DNA vaccine for allergen immunotherapy using the latexallergen Hev b 5.Arb. Paul Ehrlich Int. Bundesamt Sera ImpfstoffeFrankf A.M., 91: 230-235.
Smith G.L., 1993. Expression of genes by vaccinia virus vectors. In Molecular Virology: A practical approach. Edited by A.J. Dawson and R.M. Elliott. IRL Press at Oxford University Press, Oxford UK.
Spiegelberg H.L., Orozco E.M., Roman M., Raz E., 1997. DNA immunization: a novel approach to allergen-specific immunotherapy. Allergy, 52 (10): 964-970.
Srivastava K.D., Qu C., Zhang Т., Goldfarb J., Sampson H.A., Li X.M., 2009. Food allergy herbal formula-2 silences peanut-induced anaphylaxis for a prolonged posttreatment period via IFN-gamma-producing CD8+ T cells. J. Allergy Clin. Immunol, 123 (2), 443-451.
Toda M., Sato H., Takebe Y., Taniguchi Y., Saito S., Inouye S., Takemori Т., Sakaguchi M., 2000. Inhibition of immunoglobulin E response to Japanese cedar pollen allergen (Cry j 1) in mice by DNA immunization: Different outcomes dependent on the plasmid DNA inoculation method. Immunology, 99: 179-86.
Turcanu V., Stephens A.C., Chan S.M., Ranee F., Lack G., 2010. IgE-mediated facilitated antigen presentation underlies higher immune responses in peanut allergy. Allergy, 65 (10), 1274-1281.
deVries J.E., Carballido J.M., Aversa G., 1999. Receptors and cytokines involved in allergic TH2 cell responses. J. Allergy Clin. Immunol, 103 (5 Pt 2), S492-S496.
Реферат
Изобретения относятся к области биотехнологии и касаются поксвирусного вектора, композиции, включающей такой вектор, способу десенсибилизации, индукции переносимости или подавления аллергической реакции, способу вакцинации субъекта и набору. Представленный вектор включает нуклеотидную последовательность, кодирующую слитый белок, включающий (i) по меньшей мере два аллергена арахиса, выбранных из группы, состоящей из ara h 1, ara h 2, ara h 3, ara h 4, ara h 5, ara h 6, ara h 7, ara h 8, ara h 9, ara h10 и ara h 11, и (ii) метку деградации протеасомой для усиления внутриклеточной деградации слитого белка, где вектор включает последовательность контроля транскрипции и старт-кодон для облечения экспрессии слитого белка и где метка деградации протеосомой включает мономер убиквитина. Изобретения могут быть использованы для предупреждения аллергии на арихис и облегчения ее переносимости. 8 н. и 17 з.п. ф-лы, 11 ил., 2 табл., 2 пр.

Комментарии