Выделенный полипептид, выделенный слитый белок (варианты) и выделенный белок (варианты) для получения наноструктуры - RU2162856C2
Код документа: RU2162856C2
Чертежи













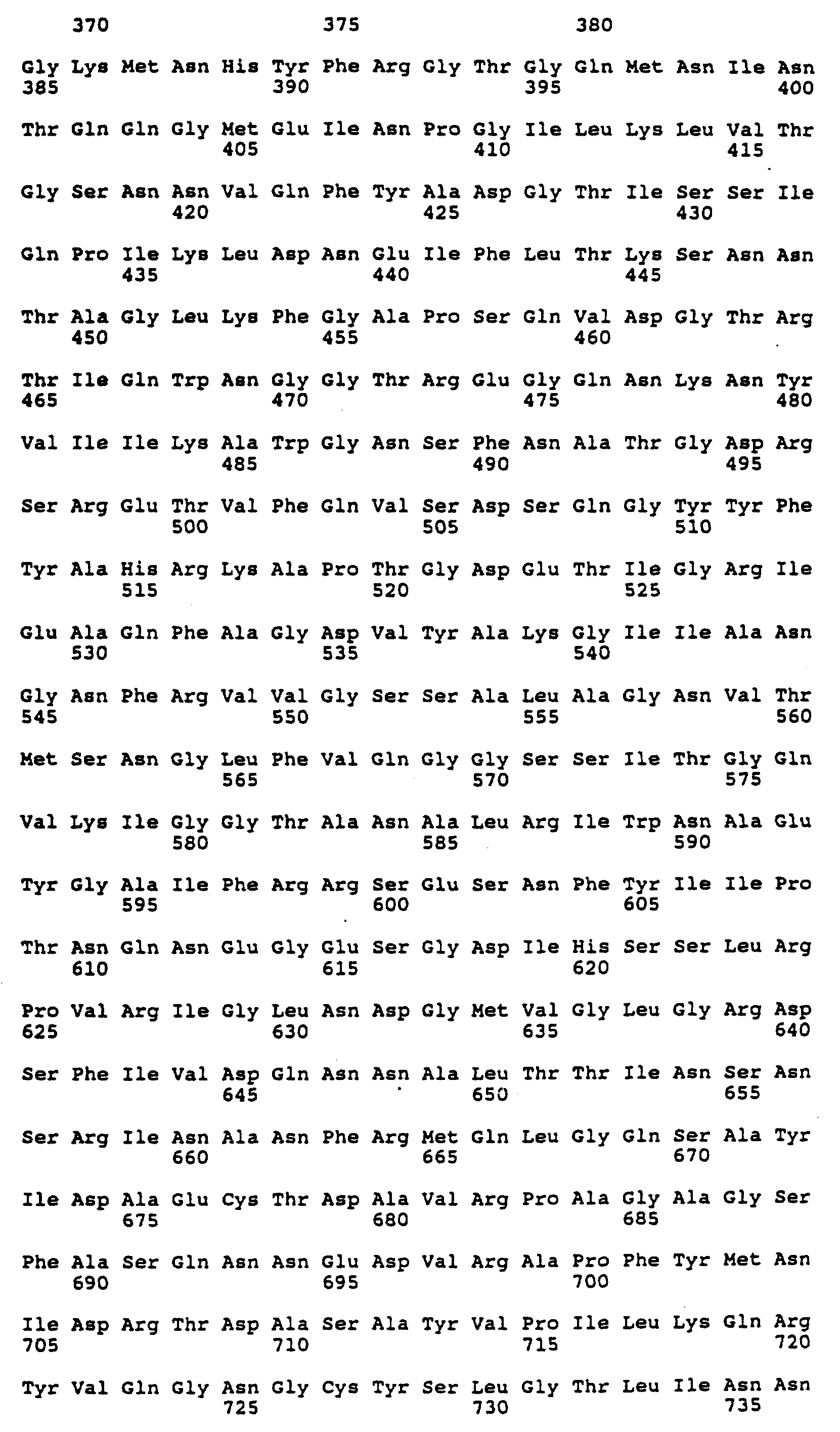
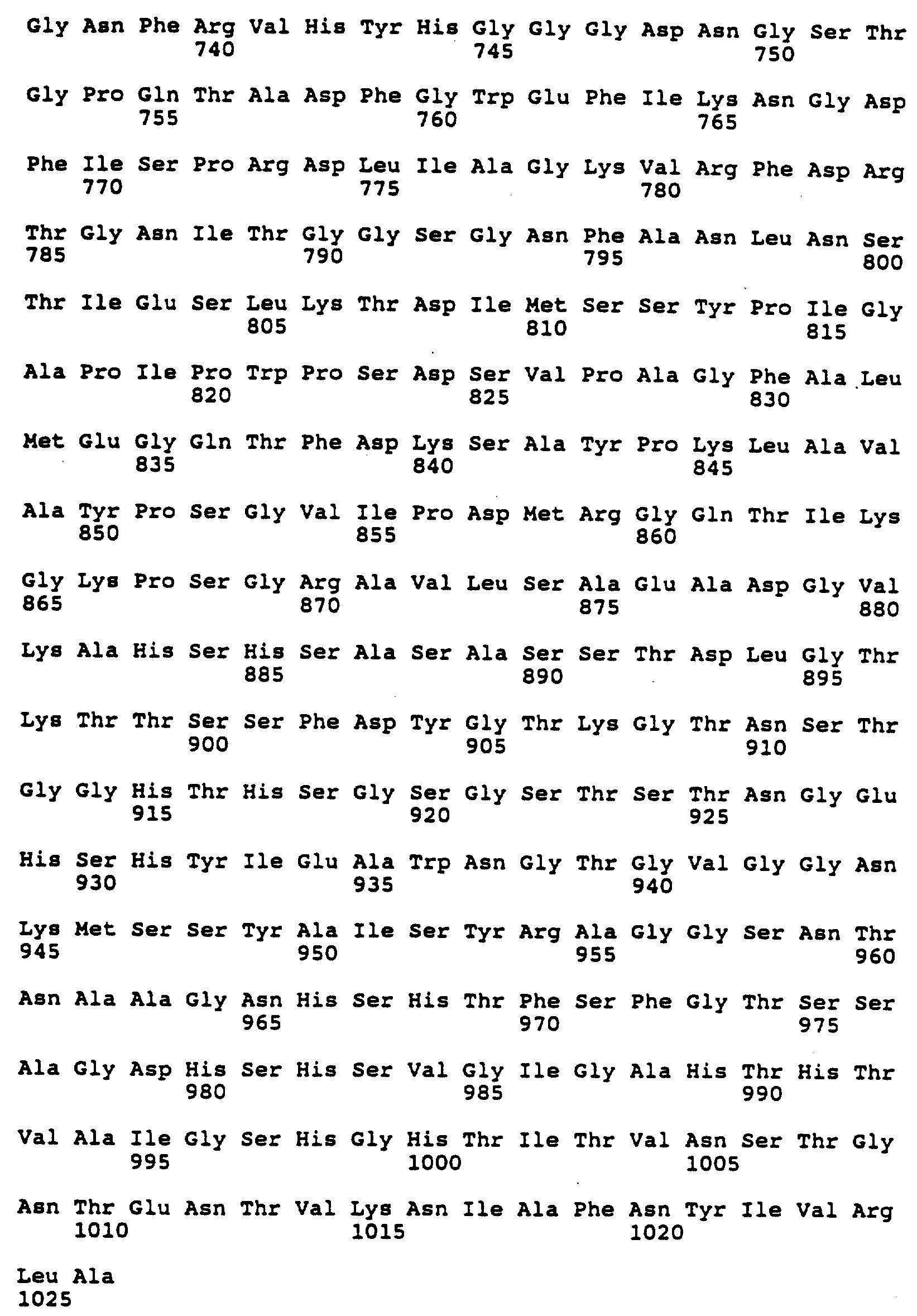





























Описание
Изобретение относится к наноструктурам, т.е. структурам нанометрового размера, используемым для конструирования микроскопических и макроскопических структур. Главным образом, настоящее изобретение имеет отношение к наноструктурам на основе белков нитевидного отростка бактериофага T4 и их вариантам.
Хотя в соответствии с теоретическими предпосылками прочность большинства материалов на основе металлов и керамики является следствием прочности связей между молекулами их компонентов и поверхностями кристаллитов, такая прочность существенно ограничена дефектами в их кристаллической и стеклоподобной структурах. Такие дефекты обычно присущи самим исходным материалам или возникают в ходе производства и часто распространяются вследствие воздействия окружающих нагрузок.
Развивающаяся область нанотехнологии повысила ограничения, касающиеся традиционных материалов. Возможность конструирования и производства очень мелких структур (т.е. структур нанометровых размеров), способных выполнять сложные функции, зависит от использования соответствующих материалов, на которые можно воздействовать предсказуемыми и воспроизводимыми методами и которые обладают свойствами, требуемыми для каждого нового применения.
Биологические системы служат образцом сложных наноструктур. Живые клетки производят белки и объединяют их в структуры, которые сформированы совершенно и обладают устойчивостью к повреждениям в их нормальной окружающей среде. В некоторых случаях сложные структуры создаются в результате процесса самосборки, инструкции для которого заложены в компонентные полипептиды. Наконец, белки подвергаются процессам коррекции, обеспечивающим высокую степень контроля качества.
В связи со сказанным выше, в данной области техники имеется потребность в способах и композициях, использующих такие уникальные особенности белков, для образования составных частей синтетических наноструктур. Указанная потребность заключается в создании материалов, свойства которых могут быть приспособлены к конкретным требованиям технологии нанометрового масштаба. Кроме этого, поскольку субъединицы большинства макроструктурных материалов, керамики, металлов, волокон и т.п. основаны на связывании наноструктурных субъединиц, изготовление соответствующих субъединиц без дефектов, обладающих точными размерами и однородностью, должно улучшить прочность и консистенцию макроструктур, поскольку поверхности становятся более упорядоченными и могут взаимодействовать более плотно на обширных участках, чем более крупный гетерогенный материал.
В соответствии с одним из аспектов настоящее изобретение предусматривает получение изолированных белковых строительных блоков для наноструктур, содержащих модифицированные белки нитевидного отростка бактериофага T4. Белки gp34, 36 и 37 модифицируют различными методами с образованием новых стержневых структур с различными свойствами. Специфические внутренние пептидные последовательности могут быть подвергнуты делеции без влияния на их способность образовывать димеры и ассоциироваться с их естественными партнерами нитевидного отростка. С другой стороны, они могут модифицироваться таким образом, что: они будут взаимодействовать только с другими модифицированными, а не нативными партнерами нитевидного отростка; проявлять термолабильные взаимодействия с их партнерами; или содержать дополнительные функциональные группы, позволяющие осуществлять их взаимодействие с гетерологичными связующими фрагментами.
Настоящее изобретение также охватывает слитые белки, которые содержат последовательности из двух или более различных белков нитевидного отростка. Белок gp35, который образует угловое соединение, модифицируют таким образом, чтобы образовывались средние углы, отличные от природного среднего угла в 137o (± 7o) или 156o (± 12o), и осуществлялись термолабильные взаимодействия с его партнерами.
В соответствии с другим аспектом настоящего изобретения предлагаются наноструктуры, содержащие нативные и модифицированные белки нитевидного отростка бактериофага T4. Такие наноструктуры могут представлять собой одномерные стержни, двухмерные многоугольники либо открытые или закрытые слои, или открытые трехмерные камеры, или закрытые твердые объекты.
На фиг. 1A и 1B представлено схематическое изображение частицы бактериофага T4 (фиг. 1A) и схематическое изображение нити отростка бактериофага T4 (фиг. 1B).
На фиг. 2 представлено схематическое изображение элементарного блока.
Фиг. 3A-3D изображают схематический вид: одномерного многозвенного стержня, соединенного вдоль оси x (фиг. 3A); замкнутых простых слоев (фиг. 3B); замкнутых слоев в виде кирпичной кладки (фиг. 3C); и открытых слоев в виде кирпичной кладки (фиг. 3D).
На фиг. 4 представлено схематическое изображение двух элементарных единиц, используемых для конструирования пористых и твердых слоев (верхнего и нижнего), которые при попеременном нанесении образуют многоярусный набор камер, изображенный на чертеже.
Фиг. 5 изображает схематический вид угловой структуры с углом 120o .
Фиг. 6 изображает последовательность ДНК (SEQ 1A N:1) генов 34, 35, 36 и 37 бактериофага T4.
Фиг. 7 изображает аминокислотные последовательности (представленные однобуквенными кодами) генных продуктов генов 34 (SEQ 1D N:2, ORFX SEQ 1D N:3), 35 (SEQ 1D N:4), 36 (SEQ 1D N:5) и 37 (SEQ 1D N:6) бактериофага T4. Аминокислотные последовательности (нижняя линия каждой пары) выстроены в линию относительно нуклеотидных последовательностей (верхняя линия каждой пары). Следует отметить, что выведенная белковая последовательность гена 35 (из базы данных NCB1), по-видимому, не может считаться точной.
На фиг. 8A-8B представлено схематическое изображение: образования P37 димерного инициатора из молекулы, превратившейся путем самосборки в димер (фиг. 8A); и образование P37 тримерного инициатора из молекулы, превратившейся в результате самосборки в тример (фиг. 8B).
На фиг. 9 представлено схематическое изображение образования полимера (P37-36)n с помощью инициатора, представляющего собой димер, образовавшийся в ходе самосборки.
Детальное описание изобретения.
Все патенты, заявки на патенты и литературные ссылки, цитированные в описании, полностью охватываются ссылками на них, содержащимися в настоящем документе. В случае противоречий предпочтение отдается, включая определения, настоящему описанию.
Хотя настоящее изобретение описано со ссылкой, главным образом, на белки нитевидного отростка бактериофага T4, следует иметь в виду, что изобретение также применимо к белкам нитевидного отростка другого фага, подобного T-четному фагу, например, семейства T4 (например, T4, Tu1a, Th1b) и семейства T2 (T2, T6, K3, Ox2, M1 и т.п.).
Обозначения.
Используемый в тексте термин "наноструктуры" относится к структурам различных размеров и форм, которые собраны из белковых компонентов нанометрового размера.
Термином "химеры" в тексте обозначаются химерные белки, в которых по крайней мере, амино- и карбокси-терминальные области являются производными различных исходных полипептидов независимо от того, являются ли исходные полипептиды полипептидами естественного происхождения или модифицированными в результате мутагенеза.
Используемый в тексте термин "гомодимеры" относится к совокупностям практически идентичных белковых субъединиц, образующих выраженную трехмерную структуру.
Обозначение "gp" относится к мономерному полипептиду, тогда как обозначение "P" относится к гомоолигомерам. P34, P36 и P37, предположительно, представляют собой гомодимеры или гомотримеры.
Упоминание в тексте изолированного полипептида, который "в основном состоит из" специфической аминокислотной последовательности, относится к полипептиду со специфической последовательностью или к полипептиду, содержащему консервативные замены в такой последовательности. Как должно быть понятно специалисту в данной области, консервативные замены представляют собой такие замены, в которых кислый остаток замещают на кислый остаток, основной остаток заменяют на основной остаток или гидрофобный остаток заменяют гидрофобным остатком. Сферой изобретения также охватывается полипептид, у которого отсутствуют одна или более аминокислот на амино-конце или карбокси-конце, вплоть до пяти на любом конце, когда отсутствие конкретных остатков не оказывает заметного влияния на структуру или функцию полипептида при практической реализации настоящего изобретения.
Настоящее изобретение относится к новому классу белковых строительных блоков, размеры которых измеряются в нанометрах, которые используются в конструировании микроскопических и макроскопических структур. Не ограничиваясь конкретной теорией, предполагается, что основное звено представляет собой гомодимер, состоящий из двух идентичных белковых субъединиц, имеющих кросс-β -конформацию, хотя возможны также и трехмерные структуры. Таким образом, должно быть ясно, что ссылки на "гомодимер" или "димеризацию", используемые в тексте, во многих случаях могут рассматриваться как относящиеся также к гомотримеру или тримеризации. Такие длинные, жесткие и устойчивые стержнеобразные единицы могут объединяться с другими стержнями с использованием сшивающих устройств, которые могут присоединяться генетически или in vitro. Концы одного стержня могут присоединяться к различным концам других стержней или аналогичных стержней. Вариации в длине стержней, углах присоединения и их характеристиках гибкости делают возможной самосборку разнопрофильных структур in situ. Таким образом, элементарные ячейки могут подвергаться самосборке в заранее определенные более крупные структуры, имеющие одно, два или три измерения. Самосборка может осуществляться с образованием структур с точными размерами и однородной прочностью в результате бездефектного биологического производства компонентов. Стержни могут также модифицироваться генетическими и химическими методами с образованием определенных специфичных участков присоединения для других химических объектов, что обеспечивает формирование сложных структур.
Важным аспектом настоящего изобретения является тот факт, что белковые звенья могут конструироваться таким образом, что они включают стержни различной длины и могут дополнительно модифицироваться таким образом, чтобы они включали отличительные признаки, изменяющие их поверхностные свойства определенным образом и/или влияющие на их способность к соединению с другими идентичными или различными звеньями. Кроме этого, возможности самосборки могут быть расширены путем получения химерных белков, объединяющих свойства двух различных представителей данного класса. Такой конструкционный отличительный признак достигается путем манипулирования со структурой генов, кодирующих такие белки.
Как будет подробно описано ниже, композиции и способы настоящего изобретения используют свойства натуральных белков, т.е. полученные в результате структуры являются жесткими, прочными, устойчивыми в водной среде, термостойкими, протеаза-устойчивыми и могут быть биодеградируемыми. Большое число звеньев может быть легко создано в микроорганизмах. Кроме этого, для облегчения автоматизации большие количества частей и субагрегатов могут храниться и использоваться по мере необходимости.
Последовательности белковых субъединиц основаны на компонентах нитевидного отростка бактериофага T4 E.coli. Следует понимать, что изложенные принципы и методы могут быть применены к нитевидным отросткам других T-четных фагов или других родственных бактериофагов с аналогичными отростковыми и/или нитевидными структурами.
Структура нитевидного отростка бактериофага T4 (проиллюстрированного на фиг. 1) схематически может быть представлена следующим образом (N =амино-конец, C= карбокси-конец): N[P34]C - N[gp35]C - N[P36]C - N[P37]C. P34, P36 и P37 представляют собой жесткие, стержнеобразные белковые гомодимеры, в которых две идентичные β-складки, ориентированные в одинаковом направлении, сливаются в ориентации поверхность - к поверхности в результате гидрофобных взаимодействий между наложенными друг на друга пластами при вращательной оси симметрии в 180o по длинной оси стержня. (Такая структура будет изменяться, если P34, P36 и P37 представляют собой гомотримеры). В отличие от этого, gp35 представляет собой мономерный полипептид, который специфически присоединяется к N-окончанию P36 и затем к C-окончанию P34 и образует угловое соединение между двумя стержнями. В ходе инфицирования E.coli бактериофагом T4 два gp37 мономера димеризуются с образованием P37 гомодимера; предполагается, что процесс димеризации инициируется вблизи C-конца P37 и требует наличия двух белков-чаперонов E. coli. (Вариантный gp37 с температурно-чувствительной мутацией вблизи C-окончания, используемый в настоящем изобретении, требует для димеризации наличия лишь одного чаперона, gp57). В ходе димеризации N-конец P37 инициирует димеризацию двух P36 мономеров в P36 стержень. Соединение между C-концом P36 и N-концом P37 является плотным и жестким, но нековалентным. Затем N-конец P36 присоединяется к gp35 мономеру; такое взаимодействие стабилизирует P36 и образует колено нитевидного отростка. Наконец, gp35 присоединяется к C-концу P34 (который использует gp57 для димеризации). Таким образом, самосборка нитевидного отростка регулируется определенным порядком взаимодействия специфических субъединиц, в результате чего структурное созревание, вызванное образованием первого субагрегата, обеспечивает взаимодействие с новыми (ранее запрещенными) субъединицами. В результате этого образуется структура с точной спецификацией из случайной смеси компонентов.
В соответствии с настоящим изобретением гены, кодирующие такие белки, могут модифицироваться таким образом, что образуются стержни различных длин с различными комбинациями окончаний. В этом отношении свойства нативных белков обладают особыми преимуществами. Во-первых, β-складка состоит из антипараллельных β- цепей с β-изгибами по левому (L) и правому (R) краям. Во-вторых, аминокислотные боковые цепочки чередуются и выходят вниз из плоскости пласта. Первое свойство обеспечивает удлинение изгибов с образованием симметричных и специфичных сайтов присоединения между L и R поверхностями, а также с образованием сайтов присоединения для других структур. Кроме этого, стержневые секции β-складки могут укорачиваться или удлиняться в результате генетических манипуляций, например путем сплайсинга ДНК областей, кодирующих β-изгибы на том же краю пласта, с образованием новых изгибов, исключающих наличие мешающих пептидов, или инсерцией сегментов пептида, осуществляемой аналогичным образом путем сплайсинга на углах изгиба. Второе свойство позволяет аминокислотным цепочкам удлиняться над и под поверхностью β-складки, модифицируемой методом генетического замещения или химического сшивания. Важно отметить, что все перечисленные выше модификации достигаются без ущерба для структурной целостности стержня. Как должно быть ясно специалисту в данной области, такие свойства обеспечивают большую гибкость при конструировании единиц, которые могут собираться с образованием большого числа разнообразных структур, некоторые из которых подробно обсуждаются ниже.
Структурные единицы.
Стержни настоящего изобретения выполняют функции, аналогичные функциям деревянных 2 х 4 штифтов или стальных брусков, используемых для конструирования. В этом случае поверхности точно воспроизводимы на молекулярном уровне и вследствие этого подходят для специфических присоединений к одинаковым или различным стержням ячеек на фиксированных участках соединения. Такие поверхности также модифицируют таким образом, чтобы они были более или менее гидрофильными, включая положительно или отрицательно заряженные группы, и имели выступы, встроенные для специфического связывания с другими ячейками или с промежуточным соединением с двумя рецепторными сайтами. Поверхности стержня и схема элемента стержня проиллюстрированы на фиг. 2. Три измерения стержня обозначены следующим образом: x, измерение от обратной стороны (B) к фронтальной части (F); Y, измерение снизу (D) вверх (U); и Z, измерение слева (L) направо (R).
Одномерные многоединичные стержни могут быть наиболее легко собраны из единичных элементарных стержней, соединенных вдоль оси x (фиг. 3A), однако регулярное соединение субъячеек в любом из двух других измерений будет также формировать удлиненную структуру, но с различными сечениями относительно структуры по измерению x.
Двухмерные конструкции представляют собой пласты, сформированные в результате взаимодействия стержней вдоль двух любых осей.
1) Замкнутые простые пласты образуются из поверхностей, которые точно перекрываются вдоль двух любых осей (фиг. 3B). 2) Замкнутые пласты типа кирпичной кладки образуются в результате взаимодействия между единицами, имеющими точно перекрывающиеся поверхности в одном измерении и специальный тип перекрывания в другом измерении (фиг. 3C). В этом случае может существовать два различных ряда дополнительных соединений, расположенных на расстоянии точно в 1/2 единицы ячейки между ними. Если они отцентрованы (т.е. каждый ряд на 1/4 от конца, то каждое соединение окажется в центре ячеек, расположенных сверху и снизу. Если они сдвинуты, то соединение также окажется сдвинутым. В такой конструкции дополнительно взаимодействующие сайты схематически обозначены, как.и... Если каждый из взаимодействующих сайтов симметричен, то чередующиеся ряды могут взаимодействовать со стержнями в любом направлении. Если они не симметричны и могут взаимодействовать лишь с взаимодействующими рядами, расположенными в одном или противоположных направлениях, получают пласт из однонаправленных стержней или слоев стержней в переменных направлениях.
3) Открытые пласты типа кирпичной кладки (или сетки) образуются в том случае, когда ячейки отделены друг от друга на расстояние больше половины ячейки (фиг. 3D). Размеры отверстий (или пор) зависят от расстояния (dx), разделяющего взаимодействующие сайты и расстояния (dy), на которое эти сайты отделяют одну поверхность от другой.
Трехмерные конструкции требуют осуществления стерически совместимых взаимодействий между всеми тремя поверхностями с образованием твердых веществ. 1) Замкнутые твердые системы могут быть собраны из ячеек, которые точно перекрываются во всех трех измерениях (например, в случае точного перекрывания замкнутых простых пластов). Аналогичным образом, замкнутые пласты типа кирпичной кладки могут образовывать замкнутые твердые системы в результате точного перекрывания пластов или в результате перемещения с переносом кирпичной кладки в третье измерение. Такой вариант требует соответствующего набора соединений во всех трех парах параллельных лицевых поверхностей ячейки. 2) Пористые твердые системы получают путем соединения открытых пластов типа кирпичной кладки различными способами. Так например, если ячейки точно перекрываются в третьем измерении, то образуется твердая система с множеством отверстий точных размеров, проходящих перпендикулярно к плоскости листа. Если же вместо этого требуется материал с замкнутыми пространственными элементами со слоями ширины dz (т.е. в измерении U--->D), то простой замкнутый пласт наносят слоем на открытый пласт типа кирпичной кладки с целью закрытия отверстий. Если перекрывание открытого пласта типа кирпичной кладки составляет, например, 1/4 ячейки, то для получения пласта используют стержень длиной 3/4 ячейки. Затем требуются соединения в измерении Z. Две такие ячейки используют для полимеризации таких чередующихся слоев, и сами слои схематично изображены на фиг. 4.
Все описанные выше структуры состоят из простых линейных стержней. Вторая ячейка, угловая ячейка, расширяет тип и пространственную конфигурацию возможных структур. Угловая ячейка соединяет два стержня под углом, отличным от 180o, подобно углу железа. Средний угол и степень его жесткости встраиваются в такую соединительную структуру. Так например, структура, изображенная на фиг. 5, имеет угол 120o и различные специфические сайты соединения в позициях a и b. Далее приведены примеры структур, полученных с использованием угловых соединений.
1) Открытые пласты типа кирпичной кладки удлиняются и упрочняются в направлении, перпендикулярном направлению стержня путем добавления углов, перпендикулярных к пласту. В этом случае образуется трехмерная сетчатая структура. Присоединение углов величиной 90o к концам стержней образует угол, лежащий почти в плоскости пласта, что позволяет добавлять новые стержни к таким углам (которые должны иметь некоторый зазор вне плоскости исходного пласта для присоединения в первую очередь) с образованием нового пласта, почти параллельного первому с ориентацией, нормальной в отношении его верхнего или нижнего соседа.
2) Шестиугольники получают из смеси стержней и угловых связок, образующих углы 120o. В этом случае имеется два исключительных набора соединений. Каждый набор собирают из одного из двух концов стержня и одного из двух комплементарных сайтов при угле. Полученная структура является линейной в том смысле, что шестиугольник имеет направление (либо по часовой, либо против часовой стрелки). Она может быть превращена в двухмерную открытую сетку (т. е. двухмерную соту) путем соединения сторон шестиугольника. Она может образовывать шестигранные трубки в результате соединения вершины нижнего шестиугольника с нижней лицевой поверхностью верхнего шестиугольника. Если такие трубки соединяются по их сторонам, то они образуют открытую трехмерную составную шестигранную трубку.
3) Спиральные шестигранные трубки получают аналогично шестиугольникам, но шестую ячейку не соединяют с первой для закрытия шестиугольника. Вместо этого конец перемещают из плоскости шестиугольника и добавляют седьмую и следующую ячейки с образованием шестигранной трубки, которая может представлять собой пружину, если между ячейками спирали действуют незначительные или отсутствуют силы адгезии, либо они может представлять собой жесткий стержень, если такая сила существует в непосредственной близости от соединяемых ячеек.
Специалисту в данной области должно быть ясно, что композиции и способы настоящего изобретения также охватывают другие многоугольные структуры, такие как восьмиугольник, а также открытые твердые системы, такие как тетраэдр и двадцатигранники, сформированные из трехугольников, и кубов, полученных из квадратов и прямоугольников. Круг структур ограничен лишь типами угловых ячеек и заместителями, которые могут быть сооружены по различным осям стержневых ячеек. Так например, другие встречающиеся в природе углы обнаружены в нитях бактериофага T7, имеющего угол 90o (Steven с сотр., J.Mol.Biol. 200:352-365, 1988).
Конструкция и получение стержневых белков.
Белковые субъячейки, используемые для конструирования наноструктур настоящего изобретения, основаны на четырех полипептидах, которые входят в состав нитевидных отростков бактериофага T4, т.е. gp34, gp35, gp36 и gp37. Гены, кодирующие такие белки, были подвергнуты клонированию и были установлены их ДНК и белковые последовательности (для генов 36 и 37 см. статью Oliver с сотр. , J. Mol. Biol. 153: 545-568, 1981). ДНК и аминокислотные последовательности генов 34, 35, 36 и 37 представлены на следующих ниже фиг. 6 и 7.
Gp34, gp35, gp36 и gp37 получали естественным путем после инфицирования клеток E. coli частицами интактного T4-фага. После синтеза в цитоплазме бактериальной клетки gp34, 36 и 37 мономеры образуют гомодимеры, которые достаточны для сборки в зреющие фаговые частицы. Таким образом, E.coli служит эффективной и удобной фабрикой для синтеза и димеризации белковых субъячеек, описанных ниже.
При практической реализации настоящего изобретения гены, кодирующие рассматриваемые белки (нативные, модифицированные или рекомбинантные), внедряют в векторы экспрессии ДНК, которые хорошо известны в данной области. Такие кольцевые плазмиды обычно содержат селектируемые гены-маркеры (обычно придающие антибиотическую устойчивость трансформированным бактериям), последовательности, позволяющие осуществлять репликацию плазмиды с большим числом копий в E.coli, и множественный клонирующий сайт, расположенный сразу в прямом направлении относительно индуцибельного промотора, а также сайт связывания с рибосомой. Примерами выпускаемых промышленностью векторов, подходящих для использования в настоящем изобретении, могут служить pET система (Новаген, Инк., Мэдисон, W1) и векторы Суперлинкер pSE380 и pSE280 (Инвитроген, Са-Диего, CA).
Используемая стратегия состоит в 1) конструировании интересующего гена и его клонировании в множественный клонирующий сайт; 2) трансформации клеток E. coli с помощью рекомбинантной плазмиды; 3) индуцировании экспрессии клонированного гена; 4) тестировании на синтез белкового продукта; и, наконец, 5) тестировании на образование функциональных гомодимеров. В некоторых случаях дополнительные гены также клонируют в ту же плазмиду, когда их функция требуется для димеризации интересующего белка. Так например, при экспрессии gp37 дикого типа или его версий подключают также бактериальный чапероновый ген 57; при экспрессии gp36 дикого типа или модифицированного gp36 подключают версию дикого типа или модифицированную версию гена gp37. Модифицированный gp37 должен обладать способностью к димеризации и содержать N-конец, который может сопровождать димеризацию gp36. Такой метод позволяет осуществлять образование мономерных генных продуктов и, в некоторых случаях, способствует созреванию мономеров в гомодимерные стержни в отсутствии других фагиндуцированных белков, обычно присутствующих в T4-инфицированной клетке.
Стадии 1-4 описанной выше стратегии осуществляются с помощью методов, хорошо известных в области технологии рекомбинантной ДНК и экспрессии белка в бактериях. Так например, на стадии 1 расщепление рестриктазами в множественных сайтах с последующим лигированием фрагментов используется для конструирования делеций во внутреннем стержневом сегменте gp34, 36 и 37 (см. ниже, Пример 1). С другой стороны, расщепление единственной или множественными рестриктазами с последующим экзонуклеазным перевариванием (EXO - SIZE, New England, Biolabs, Beverly, MA) используются для делеции ДНК-последовательностей в одном или обоих направлениях от исходного сайта расщепления; при объединении с последующей стадией лигирования такой метод обеспечивает образование гнездовой серии делеций с увеличивающимися размерами. Аналогичным образом стандартные способы используются для перестройки сегментов ДНК из двух различных генов нитевидного отростка с образованием химерных генов, кодирующих слитые белки (называемые в данном описании "химерами"). Как правило, последний способ используется для обеспечения чередования N- и C-концов, и, таким образом, для создания новых комбинаций концов, что обеспечивает новые примеры соединения различных стержневых сегментов. Представитель химер такого типа, слияние gp37-36, представлен и описан в Примере 2. Предпочтительными хозяевами для продуцирования таких белков (Стадия 2) являются E.coli штамм BL21 (DE3) и BL21 (DE3/pLysS) (полученные коммерческим путем от Novagen, Madison, Wl), хотя могут также использоваться другие совместимые recA штаммы, такие как HMS 174 (DЕ3) и HMS 174 (DE3/pLysS). Трансформация с помощью рекомбинантной плазмиды (Стадия 2) осуществляется стандартными способами (Sambrook J., Molecular Cloning, Cold Spring Harbor Laboratories, Cold Spring Harbor, N, V; эта книга также является источником стандартных методов с использованием рекомбинантной ДНК, применяемых в настоящем изобретении). Трансформированные бактерии выбирают с учетом их устойчивости к действию антибиотиков, например, ампициллина и канамицина. Способ, с помощью которого индуцируется экспрессия клонированных генов нитевидного отростка (Стадия 3), зависит от конкретной природы используемого промотора. Предпочтительным промотором является plac (с Iaciq на векторе для уменьшения фоновой экспрессии), который может регулироваться добавлением изопропилтиогалактозида (IPTG). Второй предпочтительный промотор представляет собой pT7/10, являющийся специфичным по отношению к T7 РНК полимеразе и не распознаваемый E.coli РНК полимеразой. T7 РНК полимераза, которая устойчива к рифамицину, закодирована на дефектном лямбда DE лизогене на ВL21 хромосоме E. coli. T7 полимераза на BL21 (DE3) суперрепрессирована Iaciq геном в плазмиде и индуцируется и регулируется с помощью IPTG.
Обычно культуру трансформированных бактерий инкубируют в присутствии индуктора в течение нескольких часов, осуществляя при этом мониторинг синтеза интересующего белка. В данном случае готовят экстракты бактериальных клеток и белки нитевидного отростка T4 детектируют, например, методом гель-электрофореза в системе додецилсульфат натрия (SDS) - полиакриламид.
После обнаружения модифицированного белка в бактериальных экстрактах необходимо выяснить, образует ли он соответствующие гомодимеры (Стадия 4). Вначале такую стадию осуществляют путем тестирования на предмет распознавания такого белка антисывороткой, специфичной к зрелой димеризованной форме белка.
Антисыворотку, специфичную к хвостовому волокну, готовят в соответствии с известным способом (Edgar R.S. u Lielausis I., Genetics 52:1187, 1965; Ward с сотр. J.Mol.Biol. 54:15, 1970). Вкратце, такой метод состоит в том, что целый T4 фаг используют в качестве иммуногена; необязательно, полученную в результате антисыворотку далее адсорбируют безотростковыми фаговыми частицами, удаляя, таким образом, все антитела за исключением тех, что направлены против белков нитевидного отростка. На последующей стадии различные аликвоты антисыворотки индивидуально адсорбируют экстрактами, в каждом из которых отсутствует конкретный белок нитевидного отростка. Например, если экстракт, содержащий только компоненты нитевидного отростка P34, gp35 и gp36 (произведенные из клетки, инфицированной мутантным T4, у которого отсутствует функциональный gp37 ген) используется для адсорбции, то полученная в результате антисыворотка будет распознавать лишь зрелый P37 и димеризованный P36-P37. Аналогичный подход может использоваться для приготовления индивидуальных антисывороток, распознающих лишь зрелые (т.е. гомодимеризованные) P34 и P36 путем адсорбции экстрактами, содержащими дистальные половинные нити отростка или P34, gp35 и P37, соответственно. Альтернативой может служить индуцирование антитела против половинок очищенного нитевидного отростка, например, P34 и gp35-P36-P37. Затем анти-gp35-P36-P37 могут адсорбироваться P36-P37 с получением анти-gp35, а анти-P36 можно получить адсорбцией с помощью P37 и gp35. Анти-P37, анти-gp35 и анти-P34 также могут быть непосредственно получены с использованием очищенных P37, gp35 и P34 в качестве иммуногенов. Другой подход состоит в выработке специфичных моноклональных антител к различным хвостовым волоконным компонентам нитевидного отростка или их сегментам.
Специфичные антитела на субъячейки или части отростка используются любым из следующих способов для обнаружения соответствующим образом гомодимеризованных белков нитевидного отростка: 1) Бактериальные колонии подвергают скринингу с целью установления тех систем, которые экспрессируют зрелые белки нитевидного отростка путем непосредственного перенесения колоний, или, выборочно, образцов лизированных или нелизированных культур, на нитроцеллюлозные фильтры, осуществлением, если необходимо, лизиса бактериальных клеток на фильтре и инкубации в присутствии специфичных антител. Образование иммунных комплексов затем детектируют с помощью методов, широко используемых в данной области (например, с помощью вторичных антител, конъюгированных с хромогенным энзимом или радиомеченным стафилококковым белком A). Такой способ особенно полезен для отбора большого числа колоний, например, тех, что получают методом EXO - SIZE делеции, в соответствии с описанным выше). 2) Бактериальные клетки, экспрессирующие белок, вначале метаболически метят35S-метионином, после чего готовят экстракты и проводят инкубацию в присутствии антисыворотки. Затем иммунные комплексы регенерируют путем инкубации с иммобилизованным белком A с последующим центрифугированием, после которого они могут быть разделены методом гель-электрофореза в системе SDS-полиакриламид.
Альтернативный конкурентный анализ на тестирование сохранения внутренне делетированными белками нитевидного отростка, препятствующими тем не менее инфицированию фагом, способности к димеризации и ассоциации с их соответствующими партнерами, включает использование in vitro комплементарной системы. 1) Бактериальный экстракт, содержащий интересующий модифицированный белок, в соответствии с описанным выше, смешивают со вторым экстрактом, приготовленным из клеток, инфицированных T4-фагом, представляющим собой мутант в интересующем гене.
2) Через несколько часов инкубации добавляли третий экстракт, который содержал версию дикого типа, подлежащего тестированию белка, и инкубацию продолжали еще в течение нескольких часов. 3) Наконец, экстракт титровали на инфекционные фаговые частицы путем инфицирования E.coli и количественно определяли число образовавшихся в результате стерильных пятен. Модифицированный белок нитевидного отростка, правильно димеризованный и способный соединяться с его партнерами, включали в нити отростка нефункциональным образом на стадии 1, в результате чего предотвращали включение версии дикого типа такого белка на стадии 2; результатом этой операции было уменьшение титра полученного в результате фагового образца. В отличие от этого, если модифицированный белок не способен димеризоваться и таким образом образовывать надлежащие N - и/или C-концы, то он не будет включаться в фаговые частицы на стадии 1 и вследствие этого не будет конкурировать со сборкой интактных фаговых частиц на стадии 2; таким образом, титр фага должен быть равен титру, наблюдаемому без добавления модифицированного белка на стадии 1 (отрицательный контроль).
Другой путь тестирования сохранения химерами и внутренне делетированными белками нитевидного отростка способности к димеризации и ассоциации с их соответствующими партнерами заключается в проведении эксперимента in vivo. Такой анализ позволяет определять способность таких химер и делетированных белков к конкуренции с частями нормального фага за сборку, таким образом уменьшая размер области дифференцировки фага дикого типа, инфицирующего ту же клетку-хозяина, в которой осуществляется рекомбинантная экспрессия химер или подвергнутых делеции белков. Таким образом, экспрессия из вектора экспрессии, кодирующего химеру или делетированный белок, индуцируется внутри клетки, которую далее инфицируют фагом дикого типа. Ингибирование продуцирования фага дикого типа демонстрирует способность рекомбинантной химеры или белка к ассоциации с соответствующими белками нитевидного отростка такого фага.
Описанные выше способы, как таковые или в комбинациях, используются в конструировании и получении различных типов модифицированных белков нитевидного отростка. Так например, предварительный скрининг большого числа бактериальных колоний с целью отбора таких, которые экспрессируют надлежащим образом димеризованный белок, позволяет идентифицировать положительные колонии, которые далее могут быть индивидуально тестированы путем in vitro комплементации.
Примеры новых белков, охватываемых сферой
настоящего изобретения без ее ограничения, включают:
1) Внутренне делетированные gp34, 36 и 37 полипептиды (см. ниже пример 1);
2) C-терминально укороченный gp36, слитый с N-концом
N-терминально укороченного gp37;
3) Слияние между gp36 и gp37, в котором gp37 представляет собой N-конец относительно gp36 (т.е. противоположно естественному порядку), обозначенное в тексте
термином "gp37-36 химера" (см. ниже пример 2);
4) Слияние между gp34 и gp36, в котором gp36 представляет собой N-конец к gp34 (т. е. в направлении, противоположном естественному порядку),
обозначенное в тексте термином "gp36-34 химера";
5) Вариант gp36, в котором C-конец мутирован таким образом, что он теряет способность к взаимодействию (и ответной димеризации) с N-концом
gp37 дикого типа, обозначенный в тексте, как "gp36*";
6) Вариант gp37, в котором N-конец мутирован таким образом, что он образует P37, теряющий способность к взаимодействию с
C-концом gp36 дикого типа, обозначенный в тексте, как "*P37";
7) Варианты gp36* и*P37, которые могут взаимодействовать друг с другом, но не с gp36 или P37;
8) Вариант "P37-36-химера", в котором gp36 фрагмент является произведенным из варианта в соответствии с 5), т.е. "P37-36*". (Относительно пунктов 5-8 см. приведенный ниже пример
3).
9) Вариант "P37-36-химера", в котором gp37 фрагмент является произведенным из варианта в соответствии с 6), приведенным выше, т.е. "*P37-36".
10) Вариант P37-36 химеры,*P37-P36*, в котором фрагменты gp36 и gp37 являются произведенными из вариантов в соответствии с пунктом 7).
11) Слияние между gp36 и gp34, в
котором gp36 последовательности помещены N-терминально относительно gp34, димер которого в тексте обозначен как "P36-34 химера";
12) Варианты gp35, которые образуют средние углы, отличные от
137o или 158o /нативный угол/, например, угол, меньший 125o или больший 145o, в условиях, когда белок gp35 дикого типа образует угол в 137o при
соединении с P34 и P36-P37 димерами, и/или и проявляет большую или меньшую гибкость, чем нативный полипептид;
13) Варианты gp34, 35, 36 и 37. которые проявляют термолабильные взаимодействия
или другие вариант-специфичные взаимодействия с их родственными партнерами; и
14) Варианты gp37, в которых C-терминальный домен полипептида модифицируют таким образом, чтобы он включал
последовательности, придающие специфические связующие свойства всей молекуле, например, последовательности, произведенные из авидина, который распознает биотин, последовательности, произведенные из
иммуноглобулиновой тяжелой цепи, распознающей белок A стафилококка, последовательности, произведенные из Fab части тяжелой цепи моноклональных антител, к которым могут присоединяться соответствующие
копии легкой цепи Fab и образовывать сайт связывания антигена, иммуноактивные последовательности, распознающие специфические антитела, или последовательности, связывающие специфические ионы металлов.
Такие лиганды могут быть иммобилизованы для облегчения очистки и/или сборки.
В соответствии со специальными техническими решениями, химеры изобретения содержат часть, состоящую из, по крайней мере, первых 10 (N-терминальных) аминокислот первого белка нитевидного отростка, слитого посредством пептидной связи с частью, состоящей из, по крайней мере, последних 10 (C-концевых) аминокислот второго белка нитевидного отростка. Первый и второй белки нитевидного отростка могут быть одинаковыми или различными белками. В соответствии с другим техническим решением, химеры содержат аминокислотную часть в области первых 10-60 аминокислот из белка нитевидного отростка, слитую с аминокислотной частью в области последних 10-60 аминокислот из второго белка нитевидного отростка. Согласно еще одному техническому решению, каждая аминокислотная часть составляет, по крайней мере, 20 аминокислот белка нитевидного отростка. Такие химеры содержат части, т.е. неполноразмерные белки нитевидного отростка, слитые друг с другом. В соответствии с предпочтительным аспектом первая белковая часть нитевидного отростка химеры берется из gp37, а вторая белковая часть нитевидного отростка - из gp36. Такая химера (gp37-36 химера), после олигомеризации с образованием P37-36, способна полимеризоваться в другие идентичные олигомеры. gp36-34 химера, после олигомеризации с образованием P36-34, может связываться с gp35, и такая единица может далее полимеризоваться.
В соответствии с другим техническим решением, первая часть берется из gp37, а вторая часть - из gp34. Согласно предпочтительному аспекту, химеры изобретения получают инсерциями или делециями в области β-поворота β-структуры белков нитевидного отростка. Наиболее предпочтительно, когда вставки в последовательность нитевидного отростка или слияние с другой последовательностью белка нитевидного отростка (предпочтительно, в результате манипулирования на уровне рекомбинантной ДНК с получением желаемого закодированного белка) осуществляются таким образом, что последовательности в β-изгибах на том же краю β-складки соединяются.
Помимо описанных выше химер, наноструктуры изобретения могут также содержать делеционные конструкции белков нитевидного отростка, которые укорочены с одного конца, например, не имеют амино- или карбокси-конца (из, по крайней мере, 5 или 10 аминокислот) в молекуле. Такие молекулы, укороченные на амино-конце, например укороченные gp37, gp34 или gp36, могут использоваться в качестве "вершины" ("cap") наноструктуры, поскольку сразу после введения они обрывают полимеризацию. Такие молекулы, предпочтительно, содержат фрагмент белка нитевидного отростка, у которого отсутствуют, по крайней мере, первые 10, 20 или 60 аминотерминальных аминокислот.
Для изменения длины стержневого компонента белков, если это желательно, части одинаковых или различных белков нитевидного отростка могут вставляться в химеру нитевидного отростка для удлинения стержня или подвергаться делеции из химеры с целью укорочения стержня.
Сборка индивидуальных стержневых компонентов в наноструктуры.
Экспрессия белков настоящего изобретения в E.coli, в соответствии с описанным выше, приводит в результате к синтезу больших количеств белка и способствует одновременной экспрессии и сборке различных компонентов в тех же клетках. Способы масштабирования производства рекомбинантного белка просты и широко известны в данной области, и многие стандартные схемы могут использоваться для выделения нативного и модифицированного белков нитевидного отростка из бактериальной культуры.
В соответствии с предпочтительным техническим решением нативный (нерекомбинантный) gp35 выделяют для использования путем выращивания бактериофага T4 с амбер-мутацией в гене 36, в su0 бактериальном штамме (не являющимся амбер-супрессором) и выделения gp35 из полученной в результате культуры стандартными способами.
P34, P36-P37, P37 и химеры, произведенные из них, очищают из культур E. coli как зрелые димеры. gp35 и его варианты очищают в виде мономеров. Очистка достигается с использованием следующих методов или их комбинаций с применением стандартных способов: 1) хроматографии на молекулярных ситах, ионнообменных материалах и/или гидрофобных матрицах; 2) препаративного ультрацентрифугирования; и 3) аффинной хроматографии с использованием в качестве иммобилизованного лиганда специфичных антител или других специфичных связующих фрагментов. Так например, C-терминальный домен P37 связывается с липополисахаридом E. coli В. Другие T4-подобные фаги имеют P37 аналоги, которые связывают другие компоненты поверхности клетки, такие как OmpF или TSX белок. С другой стороны, если белки были получены методами генной инженерии таким образом, чтобы они содержали гетерологические домены, действующие как лиганды или сайты связывания, то близкий партнер иммобилизуют на твердой матрице и используют в аффинной очистке. Так например, таким гетерологическим доменом может служить биотин, который связывается с покрытой стрептавидином твердой фазой.
С другой стороны, некоторые компоненты коэкспрессируются в тех же бактериальных клетках, и субансамбли более крупных наноструктур очищают после ограниченной in vivo сборки с использованием перечисленных выше способов.
Затем очищенные компоненты соединяли in vitro в таких условиях, при которых сборка желаемой наноструктуры осуществляется при температурах в интервале от примерно 4oC до примерно 37oC и значениях pH в интервале от примерно 5 до примерно 9. Для данной наноструктуры оптимальные условия сборки (т. е. тип и концентрация солей и ионов металлов) легко определяются рутинными экспериментами, например, изменением каждой переменной по отдельности и мониторингом образования соответствующих продуктов.
С другой стороны может быть приготовлен один или более сырых бактериальных экстрактов, проведено их смешивание и до очистки проведены реакции сборки.
В некоторых случаях один или более очищенных компонентов спонтанно собираются в желаемую структуру без необходимости в использовании инициаторов. В других случаях требуется использование инициатора в качестве активного центра полимеризации стержней и пластов. Такой подход предполагает преимущества в локализации процесса сборки (т.е. если инициатор иммобилизуют или локализуют как-либо иначе) и регулировке размера конечной структуры. Так например, стержневые компоненты, содержащие функциональный P36 C-конец требуют наличия функционального P37 N-конца для инициирования стехиометрического образования стержня; таким образом, изменение относительного количества инициатора и стержневого компонента будет оказывать влияние на среднюю длину стержневого полимера. Если такое соотношение равно n, то средний стержень будет иметь следующую примерную структуру (P37-36)n-N-конец P37-P37 C-конец.
В других случаях конечная наноструктура состоит из двух или более компонентов, которые не
способны самособираться по отдельности, а лишь в комбинации друг с другом. В такой ситуации чередующиеся циклы сборки могут осуществляться
с получением конечных продуктов точно определенной
структуры (см. приведенный ниже пример 6B).
При использовании иммобилизованного инициатора может быть желательным удаление полимеризованной единицы из матрицы после осуществления
сборки. Для этих целей методами генной инженерии были созданы специальные инициаторы, в присутствии которых взаимодействие с первым стержневым компонентом становится обратимо термолабильным (см.
приведенный ниже пример 5). Таким способом полимер может быть легко отделен от связанного с матрицей инициатора, в результате чего обеспечивается:
1) легкое получение исходных растворов
однородных частей или субансамблей и 2) повторное использование связанного с матрицей инициатора для осуществления многократных циклов инициирования полимеризации, роста полимера и его выделения.
В соответствии с техническим решением, согласно которому наноструктура собрана так, что она присоединена к твердой матрице через gp34 /или P34/, одним из путей отделения наноструктуры с переводом ее в раствор является использование мутантного (термолабильного) gp34, который может быть использован для отсоединения при воздействии повышенной температуры /например, 40oC/. Такой мутантный gp34, названный T4 tsB45, имеющий мутацию на его C-конце так, что P34 присоединяется к дистальной половинке нитевидного отростка при 30oC, но может отделяться от нее in vitro в результате инкубации при 40oC в присутствии 1% SDS (в отличие от T4 дикого типа, который устойчив в этих условиях), был описан ранее (Seed, 1980, Исследование проксимального половинного хвостового волокна бактериофага T4, реферат диссертации на соискание степени доктора философии, Калифорнийский технологический институт) и может использоваться.
Белки, которые катализируют образование правильной (с наименьшим значением энергии), устойчивой вторичной (2o) структуры белков, называют белками-чаперонами. Часто, особенно в глобулярных белках, такая стабилизация достигается с помощью третичной структуры, например, стабилизация β-складок в результате их взаимодействия в β-полостях или в результате взаимодействия с α -спиралями). Обычно чапероны предотвращают внутрицепное и межцепное взаимодействия, которые могут приводить к образованию нежелательных метастабильных складчатых интермедиатов и предотвращают или замедляют соответствующую укладку. Известны два дополнительных белка, gp57 и gp38, в морфогенезе нитевидных отростков T4 фага, которые иногда называют чаперонами, поскольку они являются существенными системами для надлежащего созревания белковых олигомеров, но отсутствуют в конечных структурах.
Обычная система чаперонов (например, groEl/ES) взаимодействует с некоторыми олигопептидными фрагментами генного продукта для предотвращения нежелательных взаимодействий с олигопептидными фрагментами в каком-либо другом месте того же полипептида или другого пептида. Это может приводить к образованию метастабильных складчатых интермедиатов, которые замедляют или препятствуют надлежащей укладке полипептида в его нативное (низкоэнергетическое) состояние.
Gp57, вероятно, совместно с некоторыми мембранными белками, играет определенную роль в наложении (и выравнивании) и/или инициировании укладки 2 или идентичных молекул gp37. Затем выровненные пептиды связываются (застегиваются) (взаимно стабилизируя при этом их возникающие β-структуры) с образованием ствола без дополнительного взаимодействия с gp57. Gp57 выполняет функции в сборке T4 не только как система, участвующая в олигомеризации gp37, но также gp34 и gp12.
Структурные компоненты для самосборки стволов in vitro
С другой стороны, для начала полимеризации
химер с использованием предварительно полученной химерной или естественной олигомерной единицы, называемой инициатором, полученным in vivo, молекулы (предпочтительно пептиды), способные к самосборке,
могут быть получены в виде слитых белков, слитых с N-или C-концами вариантов нитевидных отростков настоящего изобретения (химерами, делеционно/инсерционными конструкциями) для выравнивания их концов и
облегчения их последующего самостоятельного изгибания в олигомерные, устойчивые β-складчатые стержнеподобные (стволовые) ячейки in vitro, в отсутствии обычно требующихся для этого процесса
белков чаперонов (например, gp57) и мембранных белков клетки-хозяина.
В качестве иллюстрации рассмотрим P37 ячейку как инициатор gp37-36 олигомеризации и полимеризации. Обычно надлежащая укладка gp37 с P37 инициатором требует наличия инфицированной фагом клеточной мембраны и двух сопровождающих белков-чаперонов gp38 и gp57. В соответствии с предпочтительным техническим решением можно избежать необходимости в использовании qp38 в результате применения мутации, ts3813 (дупликации из 7 остатков сразу в прямом направлении от переходной зоны gp37), которая подавляет ген 38 (Wood, W.B., F. A. Eiserlinq, R. A. Crowther 1994, "Long Tait Fibers; Genes, Proteins, Structure, and Assembly" in Molecular Biology of Bacteriophage T4 (Jim D.Karam, Editor), American Society for Microbiology, Washington, D.C. p. 282-290). Если фрагмент самособирающийся в димер или тример или другой олигомер ("самособирающийся фрагмент") сливается с C-терминальной делецией gp37 в прямом или обратном направлении от переходной области (переходная область представляет собой консервативную область из 17 аминокислотных остатков в T4-подобных белках нитевидного отростка, в которых структура белка сужается в тонкую нить; см. Henning et al., 1994, "Receptor recognition by T-even-type coliphages" in Molecular Biology of Bacteriophage T4, Karam (ed.), American Society for Microbiology, Washington, D.C., p. 291- 298; Wood et al., 1994, "Long tail fibers; Genes, proteins, structure and assembly" in Molecular Biology of Bacteriophage T4, Karam (ed.), American Society for Microbiology, Washington, D. C., p. 282-290), то при его экспрессии самособирающийся фрагмент будет олигомеризоваться параллельным маршрутом и таким образом выравнивать слитые gp37 пептиды, что позволяет им складываться in vitro в отсутствии других белков-чаперонов.
Если P37 представляет собой димер /фиг. 8A/, то самособирающийся фрагмент может представлять собой самодимеризующий пептид, такой как лейциновая "застежка", полученная из остатков 250-281 дрожжевого транскрипционного фактора, GCN4 (Е.К. O'Shea, R.Rutkowski u P.S. Kim, Science 243:538, 1989), или самодимеризующийся мутантный лейциновый "застегивающийся" пептид, p1L в котором положения "a" замещены изолейцином, а положения "d" - лейцином (Harbury P. В. , T.Zhang, P. S. Kim, T.Alper 1993. A. Switch Between Two-, Three and Four-Stranded Coiled Coils in GC N 4 Leucine Zipper Mutants, Science, 262:1401-1407). Если P37 представляет собой тример (фиг. 8B), то самособирающийся фрагмент может представлять собой самотримеризующийся мутантный лейциновый пептид типа застежки-молнии, p11, в котором позиции "a" и "d" замещены изолейцином (Harbury P.В. с сотр., там же). С другой стороны, коллагеновый пептид может использоваться в качестве самособирающегося фрагмента подобно тому, что описан Bella с сотр. (J.Bella, М.Baton, B.Brodsky, Н.М., Berman. 1994. Crystal and Molecular Structure of Collagen-Like Peptide at

Самособирающиеся фрагменты могут применяться для получения инициаторов полимеризации в отсутствие обычных инициаторов. Так например, для создания инициатора олигомеризации и полимеризации химерного мономера могут использоваться gp37-36, gp37-36-C2, как проиллюстрировано на фиг. 9 (символ C2 означает, что димер-образующий пептид слит с C-концом фрагмента gp36. Это используется в том случае, если стержень представляет собой димерную структуру. В другом случае C3-тример-образующий пептид, слитый с C-концом может использоваться для такой операции). Кроме этого, использование N-конца lac репрессора E.coli, например, такого, который ассоциируется в виде тетрамера, с двумя спиралями, направленными в каждом направлении, может обеспечивать соединение двух димеров (или полимеров димеров) концом к концу, либо по их N- или C-концам в зависимости от того, на каком конце расположены самособирающиеся пептиды. Они способны также соединять N- и C-концы. В любом случае по отдельности они способны образовывать лишь димер, каждый конец которого может удлиняться путем добавления соответствующего химерного мономера (как изображено для простого случая на фиг. 9).
В соответствии с альтернативным техническим решением самособирающийся фрагмент может быть слит с N-концом химеры. Согласно специальному техническому решению самособирающийся фрагмент сливается с, по крайней мере, 10-аминокислотной частью белка нитевидного отростка подобных T-четных фагов. Может также использоваться самособирающийся фрагмент, который собирается в гетероолигомер. Так например, если полимеризация между двумя пучками направляется поверхностью димерной β-сшивки, добавление гетеродимерной единицы, одна из поверхностей которой не промотирует дальнейшей полимеризации, может оказаться очень полезным для перекрывания предпоследней единицы и в результате этого обрыва полимеризации. Если два типа скрученных областей самособирающегося фрагмента в значительно большей степени притягиваются друг к другу, чем сами по себе, то все димеры будут представлять собой гетеро-димеры. Такая ситуация имеет место для N-терминальных Jun и Fos лейциновых областей типа "застежки молнии".
Другое преимущество таких гетеродимерных единиц заключается в способности осуществлять полимеризацию и таким образом, со временем, создавать одну ячейку (или одну поверхность в 2D ряду). Так, например, предположим, что поверхность A прикрепляется к B, но не соединяется сама с собой ([A<->B] используется для обозначения такого типа взаимодействия). Смешаем A/A и B/B0 (B0 присоединена к матрице для облегчения очистки). Образуется система B0/B - A/A. Теперь отмоем A/A и добавим B/B. Полученная конструкция имеет вид B0/B-A/A-B/B. Добавим A/A0. Получаем конструкцию B0 /B-A/A-B/B-A/A0 и больше не добавляем блоков. Разумеется, существует много других возможностей.
Применения
Наноструктуры настоящего изобретения могут использоваться
в разнообразных областях, которые требуют применения высокорегулярных, строго определенных рядов нитей, клеток или твердых систем, которые могут включать специфические участки прикрепления,
позволяющие осуществлять связывание с другими материалами.
В соответствии с одним из технических решений, трехмерная гексагональная система трубок используется в качестве молекулярного сита или фильтра с регулярными вертикальными порами точного диаметра, предназначенного для селективного разделения частиц по размеру. Такие фильтры могут применяться для стерилизации растворов (т.е. для удаления микроорганизмов или вирусов) или применяться в виде серий фильтров с ограниченным молекулярно-весовым пропусканием. В этом случае белковые компоненты пор могут модифицироваться таким образом, чтобы обеспечивать специфические поверхностные свойства (т.е. гидрофильность или гидрофобность, способность к связыванию специфичных лигандов и т.п.). К преимуществам фильтрационных устройств такого типа относятся однородность и линейность пор и высокое соотношение между порами и матрицей.
В соответствии с другим техническим решением, длинные одномерные волокна вводятся, например, в бумагу или цемент, либо в пластик в ходе производства для обеспечения дополнительной прочности на растяжение в сухом и влажном состоянии.
В соответствии с еще одним техническим решением осуществляют пропитку бумаги и ткани различными наноструктурными системами в качестве маркеров на подделку. В этом случае простая реакция связанного с красителем антитела (например, в наборах, выпускаемых промышленностью) может использоваться для проверки происхождения материала. С другой стороны, такие наноструктурные системы могут связывать красители или другие вещества до или после введения для придания цвета бумаге или ткани, либо модифицировать их внешний вид или свойства другими путями.
Наборы
Настоящее изобретение также
предусматривает наборы для получения наноструктур, содержащие в одном или более контейнеров химеры и делеционные конструкции настоящего изобретения. Так например, один такой набор содержит в одном или
более контейнеров очищенный gp35 и очищенную gp36-34 химеру. Другой такой набор содержит очищенную gp37-36 химеру.
Следующие ниже примеры приведены для иллюстрации настоящего изобретения и не ограничивают его сферу.
В приведенных ниже примерах все ограничительные энзимы, нуклеазы, лигазы и т.п. являются коммерчески доступными веществами из различных коммерческих источников, таких как Нью Инглэнд Биолабс (NEB), Беверли, MA; Лайф Технолоджиз (GIBCO-BRL), Гайтерсбург, MD; и Боэрингер Манхейм Корп. (ВМС), Индианаполис, IN.
Пример 1
Дизайн, конструкция и экспрессия внутренне делетированного P37.
Ген, кодирующий gp37, содержит два сайта для рестриктазы Bgl II, причем первое расщепление происходит после нуклеотида 293 и второе после нуклеотида 1486 (нуклеотиды пронумерованы от инициирующего метионинового кодона ATG). Таким образом, расщепление ДНК-фрагмента, кодирующего gp37 с помощью Bgl II, вырезание мешающего фрагмента (нуклеотиды 294-1485) и религирование 5' и 3' фрагментов приводит в результате к образованию внутренне делетированного gp37, обозначенного как ΔP37, в котором аргинин-98 соединен с серином-497.
Реакционная смесь для рестрикционного переваривания содержит:
Gp37 плазмидная ДНК (1 мкг/мкл) - 2 мкл
NEB буффер # 2 (10X) - 1
мкл
H2O - 6 мкл
Bgl II (10 ед./мкл) - 1 мкл
Gp37 плазмида обозначает плазмиду pT7-5, в которую ген 37 вставлен в сайте множественного клонирования в прямом
направлении от сайта связывания рибосомы и гена 57 для сопровождения димеризации. Реакционную смесь инкубировали в течение 1 часа при 37oC. Затем добавляли 89 мкл T4 ДНК лигазного буфера и
1 мкл T4 ДНК-лигазы и реакцию продолжали при 16oC в течение 4 часов. Затем добавляли 2 мкл рестриктазы StuI и инкубирование продолжали при 37oC в течение 1 часа. (Рестриктаза
StuI переваривает остаточные плазмиды, которые не разрезались с помощью Bgl II на первой стадии, понижая их способность к трансформации примерно в 100 раз).
Затем реакционную смесь трансформировали в E.coli штамм BL 21, полученный от Новаген с использованием стандартных способов. Трансформированную смесь высеивали на питательный агар, содержащий 100 мкг/мл ампициллина, и платы инкубировали в течение ночи при 37oC.
Колонии, появившиеся после инкубации в течение ночи, сортировали и плазмидную ДНК экстрагировали и переваривали с помощью Вgl II, как описано выше. Рестрикционные перевары разделяли на 1% агарозных гелях. Об успешной делеции свидетельствует появление после гельэлектрофореза нового ДНК-фрагмента размером 4,2 kbp, представляющего собой неделетированную часть гена 37, которая все еще присоединена к плазмиде и которая повторно образует сайт Bgl II путем лигирования. Фрагмент ДНК размером 1.2 kbp, связанный сайтами Bgl II в исходном гене, больше не присутствует в плазмиде и таким образом теряется из геля.
Плазмиды, отобранные для предсказанной делеции в соответствии с описанным выше, трансформировали в E.coli штамм BL21 (ДЕЗ). Трансформанты выращивали при 30oC до тех пор, пока плотность (A600) культуры не достигала значения 0,6. Затем IPTG добавляли до конечной концентрации 0,4 мМ и инкубирование продолжали при 30oC в течение 2 часов, после чего культуры замораживали на льду. Затем 20 мкл культуры отбирали и добавляли к 20 мкл двукратно концентрированного "крекирующего (cracking) буфера", содержащего 1% додецилсульфата натрия, глицерин и маркирующий краситель. 15 мкл такого раствора загружали на 10% полиакриламидный гель; вторую аликвоту в 15 мкл вначале инкубировали на бане с кипящей водой в течение 3 минут и затем помещали на тот же гель. После электрофореза гель фиксировали и окрашивали. Об экспрессии делетированного gp37 судили по появлению видов белков, мигрирующих при значениях кажущейся молекулярной массы 65-70,000 дальтонов в прокипяченном образце. Степень димеризации подтверждали по интенсивности фрагментов с высокой молекулярной массой в некипяченном образце и/или по исчезновению полосы соответствующей белку с массой 65-70,000 дальтонов.
Способность делетированного полипептида к димеризации непосредственно оценивали тестированием его способности к распознаванию анти-P37 антисывороткой, которая реагирует только со зрелыми P37 димерами с использованием стандартного метода белкового иммуноблоттинга.
Альтернативный анализ на функциональную димеризацию делетированного P37 полипептида (обозначаемого так же, как ΔP37) основывается на его способности к комплементации in vivo T4 37- фага путем начального индуцирования экспрессии ΔP37, затем инфицирования T4 мутантом и детекции фага-потомка.
P37 готовили как описано выше, и было обнаружено, что он способен к комплементации T4 37- фага in vivo.
Пример 2
Дизайн, конструкция и экспрессия gp37-36 химеры.
Исходная плазмида для такой конструкции представляет собой систему, в которой ген, кодирующий gp37, клонируют сразу в обратном направлении (т.е. 5') от гена, кодирующего gp36. Такую плазмиду переваривали Hae III, которая делетирует полную 3' область gp37 ДНК в прямом направлении от нуклеотида 724 до 3'-конца, а также удаляет 5'-конец gp36 ДНК от 5'-конца до нуклеотида 349. Реакционная смесь идентична смеси, описанной в примере 1 за исключением того, что использовали другую плазмидную ДНК, а энзим представлял собой Hae III. Лигирование с использованием T4 ДНК лигазы, бактериальную трансформацию и рестрикционный анализ осуществляли в соответствии с описанным в Примере 1. В данном случае вырезание центральной части генной 37-36 вставки и религирование обнаруживает новую вставку из 346 внутрирамочных кодонов, которая разрезана лишь раз под действием Hae III (после нуклеотида 725). Затем полученную в результате конструкцию экспрессировали в E.coli BL21 (DE3), как описано в Примере 1.
Об успешной экспрессии gp37-36 химеры судили по появлению белкового продукта массой 35,000 дальтонов. Такой белок будет содержать первые 242 N-терминальные аминокислоты gp37, слитые с конечными 104 C-терминальными аминокислотами gp36 (пронумерованными, как 118-221). Применимость такой химеры зависит от ее способности димеризоваться и прикрепляться по типу конец к концу. Другими словами, карбокси- конец указанного полипептида обладает способностью к взаимодействию с амино-концом P37 белкового димера бактериофага T4 и образованию прикрепленного димера, а амино-конец димера указанного полипептида будет обладать способностью к взаимодействию с другими указанными химерными полипептидами. Такое свойство может быть тестировано проведением анализа на инициирование димеризации и полимеризации в результате введения ΔP37. С другой стороны, поликлональные антитела, специфичные к P36 димеру, могут использоваться для детекции P36 после инициирования димеризации с помощью ΔP37.
Химеру gp37-36 готовили аналогично описанным выше способам, за исключением того, что рестрикционный энзим TagI использовали вместо HaeIII. Вкратце, 5'-фрагмент, полученный в результате переваривания под действием TagI гена 37, лигировали с 3'-фрагментом, полученным в результате TagI переваривания гена 36. Таким образом, получали конструкцию, кодирующую gp37-36 химеру, в которой аминокислоты 1-48 gp37 слиты с аминокислотами 100-221 gp36. Такую конструкцию экспрессировали в E. coli BL21 (DE3) и химеру детектировали в виде белка массой 18КД. Было обнаружено, что такая gp37-36 химера ингибирует рост T4 дикого типа в том случае, когда экспрессию gp37-36 химеры индуцируют до инфицирования (в соответствии с анализом на ингибирование фага in vitro.
Пример 3.
Мутация GP37-36 химеры с получением комплементарных супрессоров.
Назначение такой конструкции состоит в продуцировании двух вариантов димеризуемой P37-36 химеры: одного, в котором мутирован N-конец полипептида (A, обозначенный как*P37-36) и варианта, в котором мутирован C-конец полипептида (B, обозначенный как P37-36*). Требование состоит в том, что мутированный*P37 N-конец не может образовывать соединение с C-концом P36 дикого типа, а только с N-концом мутированного*P36. Основная причина такого требования состоит в том, что каждый из A и B не способен к независимой полимеризации (что возможно для родственного P37-36 белка), но может лишь последовательно ассоциироваться друг с другом (т.е. P37-36* +*P37-36 ---> P37-36* --*P37-36).
Вторая конструкция,*P37-P36*, образуется в результате рекомбинации*P37-36 и P37-36* in vitro. В том случае, когда мономеры*gp37-36* и gp37-36 смешивают в присутствии инициатора P37, gp37-36 будут димеризоваться и полимеризоваться в (P37-36)n; аналогичным образом*P37 способен лишь катализировать полимеризацию*gp37-36* в (* P37-36*)n. В этом случае две такие химеры могут иметь различные размеры и различные первичные последовательности с различными потенциальными взаимодействиями боковых групп и способны инициировать прикрепление на различных поверхностях в зависимости от фиксирующей специфичности P37.
Исходный бактериальный штамм представляет собой Su0 штамм E. coli /который теряет способность к супрессии амбер-мутаций/. В том случае, когда такой штамм инфицируют мутантным T4 бактериофагом, содержащим амбер-мутации в генах 35, 36 и 37, репликация фага является неполной, поскольку не могут быть синтезированы белки нитевидного отростка. Если такой штамм вначале трансформируют с помощью плазмиды, которая направляет экспрессию генов gp35, gp36 и gp37 дикого типа и индуцируют с помощью IPTG и далее инфицируют мутантным фагом, то образуются частицы инфекционного фага; об этом судят по появлению "обкусанных" колоний. Обкусанные колонии не выглядят круглыми с гладкими краями, а, напротив, представляют собой системы с пропущенными секторами. Это вызывается воздействием на микроколонию единичного фага, который реплицируется и препятствует росту бактерий в недостающем секторе.
С целью создания такой конструкции 3'-терминальную область гена g36 (соответствующую C-терминальной области gp36) подвергают мутагенезу со случайно полученными олигонуклеотидами. Случайно полученные олигонуклеотиды готовят в ходе химического синтеза олигонуклеотидов путем добавления следового количества /до нескольких процентов/ трех других нуклеотидов в данном положении так, что полученная в результате олигонуклеотидная смесь содержит небольшое процентное количество неправильных нуклеотидов в этом положении. Включение таких олигонуклеотидов в плазмиду приводит в результате к случайным мутациям /Hutchison с сотр., Methods. Enzymol., 202:356, 1991/.
Мутагенная популяция плазмид /содержащих, однако, немодифицированные гены 36 и 37/ далее трансформируется в su0 бактерии с последующим инфицированием мутантным T4 фагом, как описано выше. В таком случае появление не-"обкусанных" колоний указывает на то, что C-конец мутированного gp36 больше не взаимодействует с P37 дикого типа с образованием функциональных нитей отростков. Предполагаемые gp36* фенотипы, обнаруженные в таких не-обкусанных колониях, проверяли на отсутствие димерных N-концов по соответствующей иммуноспецифичности, как описано выше, и положительные колонии использовали в качестве источника плазмиды на следующей стадии.
Несколько таких мутантных плазмид извлекали и подвергали второму циклу мутагенеза, используя при этом полученные олигонуклеотиды, которые вводят случайные мутации в N-терминальную область gp37, присутстствующего на той же плазмиде. Снова /теперь двукратно/ мутагенезированные плазмиды трансформировали в suро штамм E.coli и трансформанты инфицировали мутантным T4 фагом. На этой стадии бактериальные планшеты подвергали скринингу на повторное появление "обкусанных" колоний. Появление таких колоний на этой стадии указывает на то, что фаг подвергнут репликации посредством супрессии не-функциональных gp36* мутаций за счет*P37 мутации. Другими словами, такие колонии должны содержать новые*P37 полипептиды, которые теперь приобрели способность взаимодействовать с P36* белками, закодированными на той же плазмиде.
*P37-36 и P37-36* спаренные супрессорные химеры /A и B, как обозначено выше/ конструируются тем же способом, что описан в примере 2. Однако в этом случае*P37 используют вместо P37 дикого типа, а P36* используют вместо P36 дикого типа. Теперь*P37-36* химера может быть получена рестрикцией*P37-36 и P37-36* и религированием в рекомбинированном порядке.*P37-36* может смешиваться с P37-36 химерой, и полимеризация каждой из них может осуществляться независимо в присутствии другой системы. Это может оказаться полезным в том случае, когда стержнеобразная центральная часть таких химер модифицируется различными путями.
Дизайн, конструкция и экспрессия химеры gp36-34
Исходная плазмида для такой конструкции представляет собой систему, в
которой вектор, содержащий ген 57 и ген, кодирующий gp36, клонирован непосредственно в обратном направлении (т. е. 5') от гена, кодирующего gp34. Плазмиду переваривали с помощью NdeI, которая
осуществляет разрез после пары оснований (bp) 219 гена 36 и после пары оснований 2594 гена 34, тем самым осуществляя делецию концевых 148 C-терминальных кодонов из gp36 фрагмента и первых 865
N-терминальных кодонов из фрагмента gp34. Реакционная смесь идентична той, что описана в примере 1, за исключением того, что использовали другую плазмидную ДНК, а используемый энзим представлял собой
NdeI /NEB/. Лигирование с использованием T4 ДНК лигазы, бактериальное трансформирование и рестрикционный анализ также осуществляли в соответствии с описанным в Примере 1. В результате этого получали
новый гибридный ген, кодирующий белок из 497 аминокислот (73 N-терминальных аминокислот gp36 и 424 C-терминальных аминокислот gp34, пронумерованных как 866-1289).
В качестве альтернативы исходную плазмиду разрезали с помощью SphI на паре оснований 648 в гене 34 и делеционный набор Exo-Size /NEB/ применяли для осуществления описанных выше делеций.
Полученную в результате конструкцию затем экспрессировали в E.coli B21 /ДЕЗ/ в соответствии с методикой, описанной в Примере 1. Об успешной экспрессии gp36-34 химеры судили по появлению белкового продукта примерно 55.000 дальтонов. Предпочтительно, чтобы амино-концы полипептидного гомодимера обладали способностью к взаимодействию с белком gp35, и тогда карбокси-концы будут обладать способностью к взаимодействию с другими присоединенными gp35 молекулами. Успешное образование димера может детектироваться по реакции с анти-P36 антителами, или присоединением gp35, или анализом на ингибирование фага in vitro, описанным в Примере 2.
Пример 5.
Выделение термолабильных белков для самосборки.
Термолабильные структуры могут
применяться в наноструктурах для:
a) инициирования полимеризации химеры /например, gp37-36/ при низкой температуре и инактивации и отделения от инициатора при высокой температуре; b)
иниицирования образования угла между P36 и gp35 /например, варианты gp35, имеющие термолабильные сайты прикрепления для P36 N-концов или P34 C-концов, вариант P36, образующий термолабильное
присоединение к gp35, и вариант P34 с термолабильным C-терминальным сайтом присоединения/. Термолабильность может быть обратимой, позволяющей осуществлять повторное присоединение соответствующих
окончаний при восстановлении пониженной температуры, или она может быть необратимой.
Для создания варианта gp37, обеспечивающего термоиндуцированную сепарацию P36-P37 соединения, 5'-конец gp37 ДНК подвергают рандомизированному мутагенезу с использованием полученных олигонуклеотидов в соответствии с описанным выше. Затем фрагмент мутагенизированной ДНК рекомбинировали в T4 фаг путем инфицирования клетки, содержащей мутагенизированную ДНК, T4 фагом, содержащим две амбер-мутации, фланкирующие область мутагенеза. После низкомножественного инфицирования неамберный фаг подвергали селекции при низкой температуре на E. coli при 30o. Потомство таких бляшек ресуспендировали в буфере и подвергали стимуляции путем нагревания при 60oC. При такой температуре нити отростка дикого типа остаются интактными и функциональными, тогда как термолабильные версии выделяют терминальные P37 ячейки и тем самым делают такой фаг неинфекционным.
На этой стадии фаг дикого типа удаляют: 1) адсорбцией фага дикого типа на чувствительной бактерии и осаждением (или отфильтровыванием) бактерий с адсорбированным фагом дикого типа; или 2) реакцией лизата с анти-P37 антителом и далее с иммобилизованным белком А и удалением адсорбированного фага дикого типа. В результате осуществления любого способа частицы неинфекционного мутантного фага остаются в супернатантной жидкости или в фильтрате, из которых они могут быть выделены. Heинфекционный фаг с недостатком терминальных P37 фрагментов /и, вероятно, также остатка отростков/ далее обрабатывают 6М мочевиной и смешивают с бактериальными сферопластами с целью обеспечения инфицирования низкой множественности, в результате чего они реплицируются при низкой температуре, и выделяют потомство. С другой стороны, инфекционные фаги реконструируют путем in vitro инкубации мутантного фага в присутствии P37 дикого типа при 30oC; после этого осуществляют инфицирование интактных бактериальных клеток с использованием стандартных процедур. В результате осуществления последнего из описанных способов инфицирования осуществляют специфическую селекцию мутантного фага, в котором термолабильность соединения P36-P37 является обратимой.
При использовании любого метода фаговые популяции подвергают многократной селекции в соответствии с описанным выше, после чего индивидуальные фаговые частицы выделяют тромбоцитной очисткой при 30oC. Наконец, предполагаемые мутанты индивидуально оценивают по следующим характеристикам: 1) по потере зараженности после инкубации при высоких температурах /40-60oC/, которую измеряют по понижению титра; 2) по потере P37 после инкубации при высокой температуре, измеренной по уменьшению связывания P37-специфичного антителала с частицами фага; и 3) по морфологическим изменениям в нитях отростков после инкубации при высокой температуре, которые оценивали методом электронной микроскопии.
После выделения мутантов и подтверждения их фенотипов ген P37 подвергали секвенированию. Если мутации локализованы в конкретных областях или остатках, то такие последовательности являются целевыми для сайтнаправленного мутагенеза с целью оптимизации желаемых характеристик.
Наконец, мутантный ген 37 клонируют в экспрессионные плазмиды и индивидуально экспрессируют в E.coli в соответствии с описанным в Примере 1. Затем мутантные P37 димеры очищают от бактериальных экстрактов и используют в реакциях сборки in vitro.
Аналогичным образом могут быть выделены такие мутантные gp35 полипептиды, которые проявляют термолабильное взаимодействие с N-концом P36 или C-концом P34. Для термолабильного взаимодействия с P34 фаг инкубируют при высокой температуре, в результате чего происходит потеря всей дистальной половинки нити отростка /т. е. gp35-P36-P37/. В данном случае отличие в экспериментальной процедуре состоит в следующем: 1) рандомизированный мутагенез осуществляют на полном gp35 гене; 2) фаг дикого типа (и дистальные полунити термолабильных мутантов) отделяют от термолабильного мутантного фага инактивированного при высокой температуре (но все еще содержащего прикрепленные ближние полунити отростка) путем осаждения как дистальных полунитей, так и фаговых частиц, содержащих интактные нитевидные отростки, с любым из антител антидистальной половинки нити отростка, за которыми следуют гранулы стафилококкового A-белка; 3) мутантный фаг, оставшийся в супернатанте, реактивируют путем инкубации при низкой температуре в присутствии бактериальных экстрактов, содержащих интактные дистальные полунити дикого типа; и 4) серии термолабильных мутантов гена 35, выращенных при 30o C могут быть тестированы на обратимую термолабильность путем инактивации при 60oC и реинкубации при 30oC. Инактивацию осуществляют на концентрированной суспензии фага, а реинкубацию при 30oC проводят до или после разбавления. Если фаг успешно реактивируется до, но не после разбавления, то это указывает на то, что его gp35 является обратимо термолабильным.
Для получения мутации гена 36 с термолабильной связью gp35-P36 C-конец гена 36 подвергают описанному выше мутагенезу и мутант подвергают селекции на обратимость. Альтернативой такой операции является мутагенез gp35 для получения мутанта гена 35, в котором связь gp35-P36 диссоциирует при 60oC. В этом случае инкубация в присутствии анти-gp35 антител может использоваться для осаждения фага без P36-P37, и таким образом, для его отделения от фага дикого типа и дистальных полунитей отростка /P36-P37/, поскольку вариантный gp35 остается прикрепленным к P34.
Пример 6.
Сборка одномерных стержней.
A. Простая сборка: P37-36 димера, описанная в Примере 2, способна к самосборке, но требует присутствия P37 инициатора для связывания первой единицы стержня. Поэтому P37 или ΔP37 димер либо присоединяют к твердой матрице, или они находятся в свободном виде в растворе для выполнения функций инициатора. Если применяется инициатор, прикрепленный к твердой матрице, то предпочтительно использовать термолабильный P37 димер. Добавление экстракта, содержащего gp37-36, или очищенной gp37-36 химеры приводило в результате к сборке линейных мультимеров увеличивающейся длины. В случае связывания с матрицей конечные стержни высвобождаются в результате кратковременной инкубации при высокой температуре /40-60oC/ в зависимости от характеристик конкретного термолабильного P37 варианта/.
Соотношение между инициатором и gp37-36 может изменяться и распределение
стержней по размеру измеряют любым из следующих способов:
1/ методом гель-хроматографии;
2/ измерением повышения вязкости раствора; и
3/ прямым измерением методом
электронной микроскопии.
B. Стадийная сборка: P37-36 варианты*P37-36 и P37-36, описанные в Примере 3, не способны к самополимеразации. Это позволяет осуществлять стадийную
сборку стержней определенной длины согласно следующей процедуре:
1. Инициатор P37 /предпочтительно термолабильный/ присоединяют к матрице.
2. Добавляют избыток* p37-36 для присоединения и олигомеризации в виде P37-36 гомоолигомеров к N-концу P37.
3. Отмывают непрореагировавший р37-36* и систему заливают избыточным количеством*p37-36.
5. Повторяют стадии 2-4 n-1 раз.
6. Освобождают сборку от матрицы кратковременным инкубированием при высокой температуре, как описано выше.
Линейные размеры белковых стержней в партии будет зависеть от длин единичных гетерохимер и числа циклов / n / присоединения. Преимуществом такого способа является обеспечение абсолютной воспроизводимости длины стержня и гомогенного, монодисперсного распределения по размеру при переходе от одного препарата к другому.
Пример 7.
Стадийная сборка многоугольников.
В следующей стратегии сборки используют gp35 в качестве углового соединения, обеспечивающего образование многоугольников. Для целей данного примера предполагается, что угол, образованный gp35, составляет 137o. Стержневая ячейка содержит P36-34 химеру, описанную в Примере 4, которая не способна к самополимеризации. P36-34 гомодимер получают из бактериального клона, в котором gp36-34 и gp57 подвергнуты экспрессии, gp57 может сопровождать гомодимеризацию р36-34 в P36-34.
1. Инициатор: Неполный дистальный полунитевой P36-37 присоединяли к твердой матрице с помощью P37 C-конца. Затем добавляли термолабильный gp35 в соответствии с описанным в Примере 5 с образованием интактного инициатора.
2. Избыточную P36-34 химеру добавляли для присоединения единичного P36-34. После связывания с матрицей через gp35 несвязанную химеру отмывали.
3. Затем в избытке добавляли gp35 дикого типа /т.е. нетермолабильный/. После инкубации несвязанный материал отмывали.
4. Стадии 2 и 3 повторяли 7-8 раз.
5. Сборку освобождали от матрицы путем кратковременной инкубации при высокой температуре.
Высвобожденный полимерный стержень длиной в 8 единиц будет образовывать регулярный 8-сторонний многоугольник, стороны которого содержат P36-34 димер, а его соединения содержат мономер gp35 дикого типа. Однако среди этих 8 единиц, связанных в виде спиралей, имеется несколько мультимеров. Если единица не замыкается, а вместо этого присоединяет другую к своему концу, то она больше не способна замыкаться и спираль может создаваться в любом направлении. Направление первого перекрывания также определяет хиральную диссиметрию спирали. Стержни из десяти /или семи/ звеньев могут образовывать спирали чаще, чем многоугольники, поскольку их естественные углы составляют 144o /или 128.6o/. Вероятность замыкания регулярного многоугольника зависит не только от среднего угла gp35, но также от его гибкости, которой можно дополнительно управлять с помощью генетического модифицирования или модифицирования окружающей среды.
Тип многоугольника, который образуется с использованием такой процедуры, зависит от длины стержневых ячеек и угла, образованного угловым соединением. Так например, чередующиеся стержневые звенья различных размеров могут использоваться на стадии 2. Кроме этого, могут использоваться вариантные gp35 полипептиды, образующие углы, отличные от естественного угла в 137o, что позволяет получать различные регулярные /правильные/ многоугольники. Кроме этого, для данного многоугольника с четным числом сторон и равными углами, стороны на любой половине могут иметь любой размер при условии симметричности двух этих половин.
Реферат
Изобретение относится к структурам нанометрового размера, используемым для конструирования микроскопических и макроскопических структур. Выделенный полипептид представляет собой вариант gp36 белка бактериофага Т4. Аминокислотная последовательность приведена в описании. Выделенный слитый белок состоит из первой части gp37 белка Т-четно-подобного бактериофага и последних 10 - 60 С-терминальных аминокислот gp36 белка или первой части gp36 белка и второй части gp34 белка Т-четно-подобного бактериофага. Аминокислотные последовательности приведены в описании. Выделенный белок включает 20 смежных аминокислот gp37 белка, или gp36 белка, или gp34 белка Т-четно-подобного бактериофага. Аминокислотные последовательности приведены в описании. Изобретение позволяет создавать материалы, свойства которых могут быть приспособлены к конкретным требованиям технологии нанометрового масштаба, улучшить прочность и консистенцию макроструктур. 6 с.п. ф-лы, 9 ил.

Комментарии