Слитой белок и способ выделения слитого белка - RU2114119C1
Код документа: RU2114119C1
Чертежи







Описание
Изобретение относится к слитым полипептидам, которые не встречаются в природе и содержат N-концевые части, расщепляемые дипептидилпептидазой IV (DPP IV).
Техника молекулярной биологии, в частности техника рекомбинантных ДНК, позволяет получать относительно большие количества нужных биологически активных полипептидов. Кроме того, посредством модификации генетической информации, кодирующей эти полипептиды, могут быть получены относительно большие количества модифицированных полипетидов. Модификации этих полипетидов часто используют для улучшения их активности или облегчения их продуцирования и/или синтеза. В соответствии с этим было предпринято много попыток определить, какие именно модификации необходимы для увеличения, усиления или других изменений биологической активности нужных полипептидов. Кроме того, была проведена большая работа по модификации нужных полипептидов для облегчения их синтеза и очистки.
Природные полипептиды часто сначала биологически синтезируют в виде более крупных предшественников, которые затем усекают рядом протеолитических расщеплений с продуцированием конечных продуктов. Так, например, существует несколько протеаз, которые распознают и расщепляют специфические аминокислоты и/или аминокислотные последовательности. Эти протеазы участвуют в превращение белка-предшественника в конечный полипептидный продукт.
Одной из таких протеаз является дипептидилпептидаза IV (DPP IV) (EC 3.4.14.5). Впервые DPP была описана Hopsu-Havu, V.K. и G.G. Glenner, Histo. Chenue 3: 197-201 (1966), и, как было показано, она присутствует во многих тканях и млекопитающих. DPP IV является коммерчески доступной и выпускается Enzyme Systems Products (Дублин, Калифорния). DPP IV распознает специфические аминокислотные последовательности на N-концах белков. В частности, DPP IV будет отщеплять дипептид от N-конца, если второй аминокислотой от N-конца является пролин (Pzo), гидроксипролин (Hyp), аланин (Ala), серин (Ser) и треонин (Thr), а в положении N-концевого остатка находится любая аминокислота при условии, что пролин или гидроксипролин не являются третьим аминокислотным остатком от N-конца. Активность DPP IV является более эффективной, если пролин или аланин являются второй аминокислотой от N-конца, а особенно эффективной, если это положение занимает пролин. Широко описана активность DPP IV в поэтапном расщеплении "PRO"-частей предшественников природных пептидов.
Современные технологии дают возможность получить высокий уровень продуцирования биологически активных белков. Важные полипептиды могут быть получены с использованием пептидных синтезаторов или могут быть продуцированы в хозяйских клетках с использованием техники рекомбинантных ДНК. Часто биологически активные белки используют в качестве лекарственных средств. Существует множество примеров, в которых активные белки используют в качестве терапевтических или профилактических средств, либо для усиления или подавления каких-либо определенных признаков. Поскольку DPP IV и другие протеазы расщепляют белки, то эти лекарственные средства являются восприимчивыми к деградации. Таким образом, недостаток использования биологически активных полипептидов в качестве лекарственных средств заключается в том, что время их присутствия в организме должно быть минимизировано, а поэтому они должны вводиться более часто.
Быстрое развитие техники рекомбинантных ДНК, которая позволяет продуцировать полипептиды, белки и их аналоги в больших количествах и в очень короткий период времени, требует разработки высокоэффективного и предсказуемого способа выделения этих белков из комплексных смесей, включающих в себя полное количество белка, продуцируемого хозяйской клеткой, и белка в культуральной среде. Очистка гетерологических полипептидов, продуцированных хозяйскими клетками, может быть очень дорогостоящей процедурой, и может вызывать денатурацию самого белкового продукта. Обзор способов очистки белков приводится в патенте США 4782137 в главе "Известный уровень техники", выданном 1 ноября 1988 Hopp и др. и вводимым в настоящее описание посредством ссылки.
Для устранения вышеуказанных ограничений предшествующего уровня техники и получения более совершенных методов техника рекомбинантных ДНК может быть использована для получения нужных полипептидов в виде синтетических белков, содержащих линкерный пептид, который может быть использован в качестве лиганда или другой мишени в способах очистки. Например, в патенте США N 4782137 описан синтез не встречающегося в природе пептида, содержащего антигенный линкерный пептид. Этот синтетический пептид может быть пропущен через колонну, содержащую иммобилизованные антитела, которые связываются с антигенным линкером и способствуют тем самым выделению синтетического белка. В патенте США N 4569794 раскрывается способ очистки синтетических белков, которые содержат N-концевые удлиняющие сегменты, обладающие сродством к иммобилизованным металлам. Синтетические белки связываются с иммобилизованными металлическими ионами в колонке. Эти способы имеют тот недостаток, что использование линкерного пептида часто является нежелательным, а его удаление может представлять определенные трудности.
Изобретение относится к синтетическим гибридным белкам, которые состоят из центральной части белка и N-концевой части, которая отщепляется DPP IV. В соответствии с настоящим изобретением синтезируемый белок представляет собой гибридный белок, в котором удлиняющая часть, присоединенная к центральной части белка, не является природной N-концевой удлиняющей частью, связанной с сердцевиной белка, то есть, синтезируемый белок не является натуральным. Настоящее изобретение относится к пролекарствам, которые являются ненатуральными DPP-IV-расщепляемыми белками, где центральная часть белка представляет собой биологически активный белок. Настоящее изобретение относится к DPP-IV-расщепляемым белкам, не встречающимся в природе, которые могут быть использованы в способах очистки, поскольку присутствующий в них N-концевой удлиняющий сегмент сообщает этим белкам отличительную особенность или свойство, облегчающие их очистку.
Настоящее изобретение относится к синтетическим белкам, имеющим N-концевые удлиняющие сегменты, отщепляемые DPP IV, так что под действием DPP IV, эти синтетические белки превращаются в нужные белки. При использовании этих ненатуральных белков в качестве пролекарства они подвергаются in vivo-процессингу с помощью DPP IV, присутствующей в целевых видах, в результате чего образуется биологически активный белок. При использовании такого ненатурального белка в процессе очистки он может быть очищен с помощью специфически сконструированных N-концов, используемых в качестве лиганда и удаляемых затем посредством процессинга с участием DPP IV, в результате которого высвобождается нужный белок.
Изобретение позволяет продуцировать нужные белки в виде синтетических белков, которые затем превращаются в нужные белки под действием DPP IV. Пролекарство превращается в лекарственное средство в течение определенного периода времени с использованием эндогенной DPP IV пациента, в результате чего достигается длительное присутствие активного лекарственного средства в организме пациента и, следовательно, снижается частота введения этого средства пациенту. В соответствии с настоящим изобретением чистые нужные белки могут быть получены путем продуцирования и очистки синтезированных белков с последующим их in vitro-процессированием с помощью DPP IV, в результате чего образуется нужный белок.
Изобретение относится к слитому (гибридному) белку, не
встречающемуся в природе
и содержащему удлиняющую пептидную часть, которая своим C-концом ковалентно связана с N-концом центральной части белка и которая имеет следующую формулу:
A-X-Y(X'-Y)n
где
A является необязательным, а в случае его присутствия, он является метионином;
n=0-7;
X выбирают из группы Ala, Arg, Gly, Lys, Pro, Phe,
Ser, Tyr, Val;
X' = Ala,
Gly, Ile, His, Lys, Phe, Tyr;
Y выбирают из группы, состоящей из пролина, аланина, серина и треонина, при условии, что если n=0, то Y выбирают из группы,
состоящей из аланина, серина и
треонина.
Изобретение также относится к использованию указанных синтетических белков в изготовлении лекарственных препаратов и к способу выделения нужных белков из смеси, содержащей указанные ненатуральные белки и примеси, который включает стадии избирательного взаимодействия указанного ненатурального белка с материалом, иммобилизующим этот белок; удаления указанных примесей; выделения указанных ненатуральных белков из указанного материала; взаимодействия указанных ненатуральных белков с DPP IV и выделения указанных нужных белков.
Патент США 4569794, выданный Smith и др. 11 февраля 1986, относится к способу очистки белков и к соединениям, используемым в этом способе. В этом изобретении описывается способ выделения гибридных белков, которые в своем C-конце имеют биоактивные полипепетиды, а в N-конце- N-концевой удлиняющий линкер, который образует хелатный комплекс с ионом металла. Этот гибридный пептид обладает сродством к иммобилизованным ионам металла. Примеси могут быть удалены путем пропускания смеси, содержащей гибридный белок, через колонку, содержащую иммобилизованные ионы металла. Этот гибридный белок связывается с ионами металла, и в результате элюируются лишь примеси. Затем путем изменения условий гибридный белок освобождает от иммобилизованных ионов металла, получая таким образом очищенный гибридный белок.
В патенте США N 4782137, выданном Hopp и др. 1 ноября 1988, раскрывается синтез гибридного белка, имеющего высоко антигенную N-концевую часть и нужный полипептид в своей C-концевой части. Согласно Hopp и др., гибридные белки выделяют из сырого супернатанта путем пропускания этого сырого супернатанта через колонку, содержащую иммобилизованные антитела, которые распознают антигенную часть гибридного белка. Эти иммобилизованные антитела удерживают белок в колонке, в то время как нежелательные компоненты надосадочной жидкости элюируются. Затем путем изменения условий в колонке способствуют диссоциации комплекса "антиген-антитело". После этого гибридный белок элюируют и собирают.
Патент США 4734399, выданный Felix и др. 29 марта 1988, относится к аналогам фактора высвобождения гормона роста. В этом патенте раскрываются несколько аналогов, которые имеют концевые Tyr-Ala и His-Ala. Однако эти молекулы являются не гибридными белками, а лишь белками с центральным полипептидом. N-концевые дипептиды Felix и др. являются частью сердцевины молекулы bGRF-аналога.
В публикации европейской патентной заявки 0220958, опубликованной 6 мая 1987, описано селективное химическое удаление N-концевых остатков. Это изобретение относится к способу удаления N-концевых остатков из нужных полипетидов и к соединениям, используемым в этом способе. Нужный полипептид присутствует в виде гибридного белка, имеющего желаемый полипептид, который в N-конце соединен с линкером, имеющим формулу X-Pro. При воздействии на гибридный белок специфическим буфером образуется дикетопиперазин X-Pro-части гибридного белка, после отщепления которого из гибридного предшественника продуцируется нужный полипептид. Гибридные белки указанной заявки EPO 220958 ('958) не могут быть включены в настоящее изобретение, поскольку согласно настоящему изобретению в том случае, если N-концевой удлиняющий фрагмент является всего лишь дипептидом, т.е. если A отсутствует, n=0, а X является природной аминокислотой, то Y представляет собой либо аланин, либо серин, либо треонин. Таким образом, всегда, когда удлиняющий фрагмент является дипептидом, он имеет формулу X-Ala, X-Ser или X-Thr. В заявке '958 описано химическое, не ферментативное, отщепление дипептида X-Pro. Дипептид X-Ala, X-Ser и X-Thr является невосприимчивым к отщеплению химического типа, указанного в заявке '958, где удлиняющий сегмент X-Pro отрезают от центральной части белка.
В документе по патентной заявке Австралии AU-A-12709/88 раскрываются гибридные белки, которые содержат аффинные пептиды, используемые в аффинной хроматографии с иммобилизованным металлом (IMAC). Афинные пептиды, которые раскрываются в этом документе, содержали по крайней мере два соседних гистидиновых остатка. Описываемый способ IMAC-очистки требует специальной химической технологии синтеза полимеров нитрилотриуксусной кислоты (NTA).
Статья Tallon и др. в Biochem. 26:7767-7774 (1987) относится к удлиненным аналогам тридекапептидного α-фактора от Saccharomyces cerevisiae. Эти синтезированные аналоги представляют собой удлиненные α-факторы, которые имеют последовательности природного про-α-фактора, кодированного структурным геном MPαI.
В статье Kriel и др. в Eur. J. Biochem. III: 49-58 (1980) описывается постадийное отщепление N-концевой части предшественника мелиттина (промелиттина) дипептидилпептидазой IV. Промелиттин является основной составной частью пчелиного яда. В аминокислотной последовательности N-концевой части предшественника каждый второй остаток является либо пролином, либо аланином. Подвергая промелиттин воздействию DPP IV, выделенной из почки свиньи, постадийно осуществляют отщепление N-концевой области предшественника, получая таким образом зрелый белок. В отличие от гибридных белков настоящего изобретения промелиттин является натуральным белком.
Статья Julius, D. и др. в Cell, т. 32:838-852 (март 1983) относится к роли связанной с мембраной DPP IV в процессинге дрожжевого α-фактора из более крупного полипептида-предшественника. В отличие от гибридных белков настоящего изобретения дрожжевой α-фактор является натуральным белком.
Mollay, C. и др. в Eur. J. Biochem. 160:31-35 (1986) описывает выделение DPP IV из кожного серкета Xenopus laevis. Обсуждается также активность DPP IV.
В статье Mentlein, R. в FEB т. 234, 2, с. 251-256 (июль 1988) обсуждаются пролиновые остатки при созревании и деградации пептидных гормонов и нейропептидов. Сообщается, что у млекопитающих пролин-специфические протеазы, такие как DPP IV, не участвуют в биосинтезе регуляторных пептидов, но могут играть важную роль в их расщеплении. Так, например, делается вывод, что хотя у позвоночных и низших позвоночных конверсия белков-предшественников в зрелые формы происходит в основном с помощью DPP IV, однако в процессинге регуляторных белков у млекопитающих DPP IV в основном используются в качестве протеолитических ферментов, осуществляющих деградацию белка.
Frohman L. A. и др. в J.Clin. Invest. 78:906-913 (1986) указывают, что фактор высвобождения гормона роста человека (hGRF) и их аналоги быстро разлагаются in vivo в организме человека и in vitro под воздействием DPP IV плазмы.
Frohman L.A. и др. в J. Clin. Invest. 83:1533-1540 (1989) указывают, что фактор высвобождения гормона роста человека (hGRF) и их аналоги быстро разлагаются in vivo в организме человека и in vitro под действием DPP IV плазмы.
Статья Kubiak Т.М. и др. Drug Metabolism and Disposition, т.17, N 4, с. 393-397 (1989) относится к метаболическому разложению аналога фактора высвобождения бычьего гормона роста в бычьей и свиной плазме и к корреляции этого разложения посредством DPP IV-активности в плазме. Рассматриваемые bGRF-аналоги имели AIa-остаток в 2-положении N-конца. При этом указывается, что метаболическое разложение bGRF в плазме происходит благодаря присутствию в плазме DPP IV.
Hong W. и др. Biochemistry, 28:8474-8479 (1989) описывают экспрессию ферментно активной DPP IV в клетках яичника китайского хомячка после трансфекции.
Kreil G., TIBS 15:23-26 (январь 1990) описывает постадийное расщепление дипептидов с помощью DPP при конверсии предшественников до конечных продуктов. Предшественники, описанные Kreil, являются натуральными белками. Гибридные белки настоящего изобретения являются ненатуральными гибридными белками.
Boman и др. J. Biol. Chem. 264:5852-5860 (1989) показали, что дипептидилпептидаза, выделенная из cecropia pupae с аналогичной специфичностью к DPP IV, обладает способностью к отщеплению натуральных N-концевых последовательностей Ala-Pro-GIu-Pro от N-концевых синтетических копий натуральных предшественников cecropia A и B. Препрокекропин, раскрытый Boman, является натуральным белком.
Dalboge H. , и др. Bio/technology, 5:161-164 (February 1987) раскрывают превращение E. coIi - продуцируемого предшественника гормона роста человека (hGH) в аутентичный hGH in vitro. N-концевой удлиняющий сегмент предшественника удаляют с помощью дипептидилпептидазы I.
Dalboge H и др. FEBS, Vol. 246 (1,2):89-93 (март 1989) раскрывают клонирование и экспрессию IL-I β -предшественника и его конверсию в IL-I β путем удаления N-концевого сегмента указанного предшественника с помощью дипептидилпептидазы I.
Dalboge H. и др. FEBS, Vol. 266 (1,2):1-3 (июнь 1990) описывают in vivo - процессинг N-концевого метионина в E. coli. При этом указывается, что удаление N-концевого метионина на удлиненного гормона роста человека зависит от того, какая аминокислота является соседней с метионином.
Hopp T. P. и др. Bio/Technol. 6:1204-1210 (октябрь 1988) раскрывают добавление пептида из восьми аминокислот к N-концу нужного рекомбинатного лимфокина в целях сообщения ему антигенного N-конца, который может быть использован при иммуногенной очистке. Эта публикация относится к патенту США N 4782137, описанному выше.
Smith M.C. и др. J. Biol. Chem. Vol. 263, 15:7211-7215 (1988) раскрывают экспериментальные результаты, подтверждающие гипотезу относительно того, что пептиды, образующие специфические хелатные комплексы с металлами на NH2-конце небольшого пептида, могут быть использованы для очистки белка с помощью аффинной хроматографии на ионах металлов. В этой работе представлены конкретные данные, относящиеся к примерам в вышеописанном патенте США N 4569794. В частности, использование хелатного комплекса металла с пептидом His-Trp, связанным либо с гормоном высвобождения лютеинизирующего гормона, либо с проинсулином, позволяет осуществлять очистку этого химерного пептида с помощью IMAC, тогда как контрольные молекулы, не содержащие His-Trp-линкер, не могли быть выделены аналогичным способом.
Hochuli E. и др. J. Chromat. 411:177-184 (1987) раскрывают абсорбент на основе нитрилотриуксусной кислоты, используемый для аффинной хроматографии металло-хелатного комплекса. При этом указывается, что раскрываемый абсорбент, заряженный ионом Ni2+, может быть использован для связывания пептидов и белков, содержащих соседние гистидиновые остатки.
Ljungquist C. и др. Eur. J.Biochem. 186:563-569 (1989) раскрывают использование пептида Ala-His-Gly-His-Arg-Pro, образующего хелатный комплекс с металлом в ряде колонок, состоящем из двух, четырех и восьми колонок, содержащий иммобилизованные ионы Zn2+. Согласно Ljungquist C., использование этого пептида, образующего хелатный комплекс с цинком в колонках, дает неожиданно хорошие результаты при очистке гибридных белков.
Используемые в настоящем описании термины "ненатуральный слитый белок", "ненатуральный слитый полипептид", "слитые полипептиды" и "слитые белки" относятся соответственно к белкам и полипептидам, которые обычно не встречаются в природе и которые включают в себя центральный фрагмент белка и его удлиняющий фрагмент (или удлиняющую часть белка).
Используемые в настоящем описании термины "сердцевина белка", "центральный фрагмент белка" и "полипептидный фрагмент" относятся к области гибридного полипептида, которая расположена у C-конца молекулы и не включает в себя удлиняющую часть и которая является нужным полипептидом и/или биологически активным белком, включая натуральные биологические активные белки и полипептиды, а также их аналоги и мутанты.
Используемый в настоящем описании термин "N-концевой удлиняющий сегмент" относится к первым от N-конца приблизительно 45 аминокислотам, которые не являются частью центральной области белка.
Используемый в настоящем описании термин "пролекарство" относится к гибридным белкам, где нужной частью является биологически активный белок, используемый в качестве лекарственного средства.
Используемые в настоящем описании термины "биологически активный белок" и "биологически активные полипептиды" относятся соответственно к белкам и полипептидам, обладающим биологической активностью.
Используемые в настоящем описании термины "нужный белок" и "желательный белок" относятся к белкам или полипептидам, которые необходимо получить в чистом виде.
Используемый в настоящем описании термин "удлиняющий фрагмент" относится к той части гибридного белка, которая является N-концевым удлиняющим сегментом и которая не является частью биологически нужной области белка.
Используемый в настоящем описании термин "DPP IV-отщепляемая N-концевая удлиняющая часть" относится к удлиняющей части гибридного белка, имеющей аминокислотную последовательность, которая может быть удалена постадийным отщеплением с помощью DPP IV.
В списке последовательностей, представленном в конце настоящего описания, некоторые аминокислотные остатки последовательностей SegID обозначены Xaa. Это обозначение означает следующее.
В SegID N 3 Xaa29 означает C-терминально амидированный аргининиловый остаток.
В SegID N 4 Xaa29 означает C-терминально амидированный аргининиловый остаток.
В SegID N 5 Xaa29 означает C-терминально амидированный аргининиловый остаток.
В SegID N 14 Xaa29 означает C-терминально амидированный аргининиловый остаток.
В SegID N 18 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 19 Xaa33 означает C-терминально амидированный аргининиловый остаток.
В SegID N 20 Xaa39 означает C-терминально амидированный аргининиловый остаток.
В SegID N 21 Xaa45 означает C-терминально амидированный аргининиловый остаток.
В SegID N 24 Xaa27 означает C-терминально амидированный аргининиловый остаток.
В SegID N 25 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 26 Xaa33 означает C-терминально амидированный аргининиловый остаток.
В SegID N 27 Xaa35 означает C-терминально амидированный аргининиловый остаток.
В SegID N 28 Xaa37 означает C-терминально амидированный аргининиловый остаток.
В SegID N 29 Xaa33 означает C-терминально амидированный аргининиловый остаток.
В SegID N 30 Xaa35 означает C-терминально амидированный аргининиловый остаток.
В SegID N 31 Xaa37 означает C-терминально амидированный аргининиловый остаток.
В SegID N 32 Xaa39 означает C-терминально амидированный аргининиловый остаток.
В SegID N 33 Xaa45 означает C-терминально амидированный аргининиловый остаток.
В SegID N 34 Xaa43 означает C-терминально амидированный аргининиловый остаток.
В SegID N 35 Xaa45 означает C-терминально амидированный аргининиловый остаток.
В SegID N 36 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 37 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 38 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 39 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 40 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 41 Xaa33 означает C-терминально амидированный аргининиловый остаток.
В SegID N 43 Xaa31 означает C-терминально амидированный аргининиловый остаток.
В SegID N 43 Xaa33 означает C-терминально амидированный аргининиловый остаток.
Изобретение относится к улучшенным белкам и полипептидам. Согласно настоящему изобретению биологически активные полипептиды сначала получают в виде гибридных белков, содержащих две части: первую часть, которая представляет собой центральную часть белка; и вторую часть, которая представляет собой N-концевой удлиняющий фрагмент, который у своего карбокси-конца является ковалентно связанным с амино-концом первой части. N-концевая удлиняющая часть гибридного полипептида имеет аминокислотную последовательность, которая затем подвергается отщеплению дипептидилпептидазой IV (DPP IV).
Слитой белок настоящего
изобретения имеет следующую формулу:
Удлиняющая часть - Центральная часть белка
где "Удлиняющая часть" представляет собой DPP
IV-отщепляемую N-концевую удлиняющую часть"; "-"
представляет собой ковалентную пептидную связь; а "центральная часть белка" представляет собой любой нужный белок, который отделяется от "удлиняющей
части" в результате процессинга с помощью DPP
IV.
Удлиняющий фрагмент имеет аминокислотную последовательность формулы
A-X-Y-(X'-Y)n,
где
A
является необязательным, а если он присутствует, то
является метионином;
n представляет собой число последовательно связанных X' - Y - групп, количество которых составляет от 0 до 20, а
предпочтительно от 0 до 10;
X выбирают из
группы, включающей в себя все природные аминокислоты;
Y выбирают из группы, включающей в себя пролин, аланин, серин и треонин, за
исключением того, что если n = 0, то Y выбирают из группы,
включающей в себя аланин, серин и треонин;
X выбирают из группы, включающей в себя все природные аминокислоты за исключением пролина
и гидроксипролина.
Согласно вышеуказанной формуле если n = 1, то имеются два остатка Y. Кроме того, возможно присутствие до двадцати одного остатка Y и двадцати остатков X' в одном варианте осуществления изобретения. Отдельные Y-остатки и X'-остатки могут быть соответственно любыми остатками группы, из которой они выбираются. То есть, все отдельные остатки Y не должны быть одинаковыми в данном варианте осуществления изобретения. Аналогично в каком-либо варианте с более чем одним остатком X': каждый отдельный присутствующий остаток X' может быть любым аминокислотным остатком за исключением пролина и гидроксипролина независимо от того, каким остатком будет другой X'-остаток. Каждый отдельный Y и X' - остаток, соответственно, должен удовлетворять правилам для данной конкретной группы, то есть различные отдельные остатки в конкретных положениях должны подчиняться правилам, определенным выше.
Слитые белки, в которых (A) присутствует в виде метионина (Met), представляют собой последовательности, используемые для продуцирования биологически активных белков в E.coli с помощью техники рекомбинантных ДНК. Met-последовательность, присутствующая в этих предшественниках, обычно процессируется ферментной системой E.coli или каким-либо другим способом, который может быть осуществлен любым специалистом. Синтез белка в E.coli в нормальных условиях начинается с кодона инициации трансляции AUG, кодирующего Met. В результате этого вновь синтезированные полипептиды имеют метиониновый остаток в своей N-концевой аминокислоте. E.coli обладает ферментной активностью, способной к эффективному удалению N-концевого Met, если метиониновый N-концевой остаток является смежным с аминокислотой, имеющей относительно небольшую боковую цепь, такой как Gly, Ala или Ser, а также Pro. Высокоспецифичное удаление N-концевого Met может быть осуществлено путем бромциан-опосредованного отщепления Met. Однако для успешного осуществления этой процедуры необходимо, чтобы N-концевой Met был лишь одним Met во всей последовательности белка; в противном случае отщепление будет происходить после каждого Met в последовательности. В соответствии с этим в гибридных белках, содержащих внутренние Met-последовательности, второй аминокислотой от N-конца должна быть Pro, Gly или Ser, если необходимо, чтобы Met был удален ферментной системой E.coli.
Помимо слитых полипептидов, настоящее изобретение относится к рекомбинантным ДНК-молекулам, содержащим ДНК-последовательности, кодирующие гибридные полипептиды; к способам использования рекомбинантных ДНК-молекул; к способам использования гибридных полипептидов, включая способы очистки нужных полипептидов, и к способам доставки в организм лекарственного средства, которые заключаются во введении пациенту предшественника указанного лекарственного средства, который превращается в биологически активную форму под действием последовательного протеолитического отщепления in vivo N-концевой удлиняющей части.
Продуцирование слитых полипептидов может быть осуществлено с помощью стандартного пептидного синтеза или с помощью техники рекомбинантных ДНК, хорошо известной любому специалисту. Пептидный синтез является предпочтительным способом продуцирования полипептидов, которые состоят приблизительно из 50 аминокислот или менее. Для более крупных молекул предпочтительней проводить продуцирование в хозяйских клетках с использованием техники рекомбинантных ДНК.
Слитые полипептиды, содержащие N-концевые части, которые являются распознаваемыми и отщепляемыми DPP IV, обладают большими преимуществами, чем немодифицированные полипептиды, содержащие только одну центральную часть белка. В настоящем изобретении описываются две области применения указанных полипептидов. Одно из таких применений относится к гибридным полипептидам, так называемым "пролекарствам", которые включают в себя биологически активные полипептиды, представляющие собой нужное лекарственное средство и являющиеся ковалентно связанными с DPP IV - отщепляемыми N-концевыми удлиняющими сегментами. Эти пролекарства, т.е. предшественники лекарственного средства, могут быть превращены в биологически активные формы посредством расщепления DPP IV в организме человека или другого животного, которому было введено указанное пролекарство. В соответствии с этим настоящее изобретение относится к гибридным полипептидам, используемым в качестве пролекарства; к использованию гибридных полипептидов в изготовлении лекарственных препаратов и к способу доставки биологически активных полипептидов в организм пациента. Вторым применением гибридных полипептидов настоящего изобретения является способ очистки белка, в котором N-концевая удлиняющая часть, являющаяся компонентом полипептида, благодаря своей способности к отщеплению посредством DPP IV способствует эффективной очистке нужного полипептида. В соответствии с этим настоящее изобретение относится к гибридным полипептидам, используемым в процедурах очистки, и к способам очистки нужных полипептидов. Указанные примеры применения настоящего изобретения приведены лишь в целях иллюстрации и не должны рассматриваться как некое ограничение настоящего изобретения.
В двух указанных вариантах применения настоящего изобретения центральная часть белка отделяется от удлиняющей части посредством DPP IV-активности. В том случае, когда гибридные белки используются в способах очистки, нежелательно, чтобы центральная часть белка служила субстратом для DPP IV-расщепления. То есть предпочтительно, чтобы DPP IV не обладала способностью расщеплять центральную часть белка после того, как будет удалена удлиняющая часть. Часто бывает более предпочтительно, в том случае, когда центральная часть белка является субстратом для DPP IV, использовать слитой белок в качестве пролекарства. В этом случае указанный предшественник лекарственного средства может способствовать продолжительному присутствию сердцевины белка в организме, поскольку DPP IV, присутствующая in vivo (например, в плазме, тканях почки и печени), будет использована для процессинга N-концевых удлиняющих участков, и тем самым способствовать задержке разложения центральной части белка. То есть удлиняющая часть гибридного белка может действовать в качестве субстрата для DPP IV и конкурентного ингибитора, замедляющего воздействие DPP IV на центральную часть белка, тем самым одновременно защищая указанную центральную часть белка.
Используемый в настоящем описании термин "пролекарство" означает гибридный белок, содержащий DPP IV-отщепляемую N-концевую удлиняющую часть, ковалентно связанную с центральной частью белка, которая является биологически активным полипептидом, используемым в качестве лекарственного средства. Согласно настоящему изобретению пролекарство может быть введено как отдельная предшествующая форма лекарственного средства либо в сочетании с другими соединениями. В предпочтительном варианте осуществления настоящего изобретения используют отдельную форму в качестве пролекарства. В любом случае указанная предшествующая форма лекарственного средства подвергается процессингу посредством природной DPP IV, обычно присутствующей в организме пациента.
Преимущество введения лекарственного препарата, содержащего предшествующую лекарственную форму, заключается в том, что этот препарат способствует задержке активности и/или обеспечивает присутствие в организме биологически активного белка в более продолжительный период времени. Указанный предшественник лекарственного средства может оставаться активным дольше, чем немодифицированные молекулы. Пролекарство может существовать в неактивном состоянии в течение определенного промежутка времени, пока не будет отщеплена удлиняющая часть, после чего молекула становится активной. Следовательно, пролекарство может служить системой доставки лекарственного средства с пролонгированным высвобождением. Кроме того, различные N-концевые удлиняющие сегменты отщепляются с различными скоростями в зависимости от их длины и конкретных остатков, присутствующих в их аминокислотной последовательности. Могут быть также использованы различные формы предшественников лекарственного средства, имеющих различные N-концевые удлиняющие сегменты, которые могут обеспечивать продолжительный постоянный уровень активного лекарственного средства в течение определенного промежутка времени в организме пациента. Следовательно, пролекарство может служить системой доставки лекарственного средства с пролонгированным высвобождением.
Как указывалось выше, DPP IV отщепляет дипептид от N-конца полипептида при условии, что определенные остатки занимают определенные положения. Используемый в настоящем описании термин "положение один" относится к положению аминокислотного остатка в N-конце. Термин "положение два" относится к положению аминокислотного остатка, который является непосредственно смежным с аминокислотным остатком в положении один, т.е. является вторым остатком от N-конца. Термин "положение три" относится к положению аминокислотного остатка, который является непосредственно смежным с аминокислотным остатком в положении два, т.е. третьим остатком от N-конца. Отщепление N-концевого пептида происходит между положением два и положением три при условии, что аминокислота в положении три не является пролином или гидроксипролином, а аминокислота в положении два является одной из следующих пяти аминокислот: пролин (Pro), гидроксипролин (Hyp), аланин (Ala), серин (Ser) или треонин (Thr).
DPP IV отщепляет N-концевые остатки с различной скоростью в зависимости от того, какой из этих четырех аминокислотных остатков присутствует в положении 2. В большинстве случаев наибольшая эффективность расщепления DPP IV достигается, когда во 2-положении находится Pro, а после него наибольшая эффективность достигается, когда положение два занимает Ala. Если положение один занимает тирозин, фенилаланин или гистидин, то DPP IV действует почти с такой же скоростью, как и в случае, когда в положении два находится Pro или Ala. Затем в отношении наибольшей эффективности идет случай, когда положение два занимает Ser. И уже наименее эффективным является случай, когда во 2-положении находится Thr.
С учетом указанной информации может быть сконструирован ряд N-концевых удлиняющих сегментов, которые подвергаются процессингу с различными скоростями. Так, например, может быть введен препарат, который состоит либо из конкретного предшественника лекарственного средства, либо из комбинации предшественников. Эти предшественники с подобранными соответствующим образом N-концевыми удлиняющими сегментами будут, каждый из них, процессироваться со скоростью, зависящей от их аминокислотных последовательностей. Комбинация этих предшествующих лекарственных форм может быть составлена из серии предшественников, процессируемых в активные полипептиды в течение различных периодов времени.
Длина и состав аминокислотной последовательности являются регулируемыми факторами в отношении скорости DPP-IV-расщепления. Удлиняющие части, содержащие все или почти все чередующиеся Y= Pro, будут процессироваться быстрее, чем те части, которые содержат Y=Thr. Кроме того, известно, что дипептидиловые единицы X - Pro, где X является либо GIu, либо Asp, расщепляются гораздо медленнее, чем их противочасти, где X является нейтральным или основным аминокислотным остатком. Поскольку удлиняющие части могут содержать различные остатки (из указанных четырех) в каждом положении расщепления, то может существовать очень большое число вариаций и пермутаций.
В качестве полипептидного лекарственного средства может быть использован любой активный полипептид. В патентной заявке PCT N PCT/US 90/02923, в патентной заявке PCT N PCT/US91/08248 и в патентной заявке США рег. N 07/368231 (которые включены в настоящее описание как ссылки) раскрываются аналоги фактора высвобождения бычьего гормона роста, которые могут быть использованы в лекарственном препарате в качестве пролекарства настоящего изобретения. Любой из аналогов, описываемый в этих заявках, может быть использован в качестве центральной части пептида гибридного белка в соответствии с настоящим изобретением. Гибридные белки, содержащие указанные центральные части, связанные с удлиняющими частями, могут быть продуцированы стандартными способами, известными каждому специалисту.
В качестве других вариантов настоящего изобретения могут быть использованы гормоны, рецепторы, ферменты, запасные белки и белки крови. Конкретными примерами могут служить: вазоактивный кишечный пептид (GIP); β -казоморфин человека; желудочный ингибирующий пептид (GIP); гастро-высвобождающий пептид (GRP), пептид человека HI, пептид человека YY; фрагмент 7-37 глюкагонподобного пептида 1; глюкагон-подобный пептид 2; субстанция P; нейропептид Y; полипептид поджелудочной железы человека; инсулин-подобный фактор роста 1 (IGF-I); гормон роста человека (hGH); бычий гормон роста (bGH); свиной гормон роста (pGH); пролактин (PPL); фактор высвобождения человеческого, бычьего, свиного или овечьего гормона роста (GPF); интерлейкин-I β (IL-I β ); EGF; IGF-2; глюкагон; кортикотропин-высвобождающий фактор (CPF); динорфин; соматостатин-14; эндотелин; фактор-альфа трансформации роста (TGF- α ); фактор-бета трансформации роста (TGF- β ); интерлейкин-4; интерлейкин-6; фактор роста нервов (NGF); фактор некроза опухоли (TNF); инсулин; фактор роста фибропласта (FGF); интерферон; CD4 и интерлейкин-2 (IL-2) или их синтетические или биосинтетические аналоги. Эти полипептиды могут быть также использованы для формирования центральной части гибридных белков настоящего изобретения. Указанные полипептиды служат лишь для примера осуществления настоящего изобретения и не должны рассматриваться как некое ограничение объема настоящего изобретения.
Согласно настоящему изобретению более мелкие гибридные белки могут быть синтезированы, например, путем твердофазной технологии с использованием пептидного синтезатора (Applied Biosystems 430 A, Foster City, Калифорния), который подробно описан в PCT/US90/02923 и 07/368231.
Более крупные молекулы предпочтительно продуцировать в хозяйских клетках с использованием техники рекомбинантных ДНК. Имеется несколько различных способов, которые может использовать любой специалист для продуцирования гибридных белков с помощью техники рекомбинантных ДНК. Обычно гены, кодирующие нужные полипетиды, вставляют в экспрессирующие векторы, которые затем используют для трансформации или трансфекции соответствующих хозяйских клеток. Затем инсертированный ген экспрессируют в хозяйской клетке и продуцируют нужный полипептид. Для продуцирования гибридных полипептидов настоящего изобретения указанным способом в ген-вставку включают дополнительную ДНК-последовательность. В частности, ДНК, кодирующую остатки N-концевой удлиняющей части, надлежащим образом сшивают с 5'-концом гена, кодирующего нужный полипептид. Этот дополнительный генный материал должен располагаться ниже (5'-> 3') от промотора экспрессирующего вектора так, чтобы он находился под контролем промотора. Кроме того, он должен находиться в надлежащей рамке считывания с геном, так чтобы экспрессированный белковый продукт содержал остатки N-концевой удлиняющей части, ковалентно связанные с нужным полипептидом.
Следовательно, для продуцирования гибридных белков настоящего изобретения с использованием техники рекомбинантных ДНК должны быть сконструированы олигонуклеотиды, которые кодируют аминокислотную последовательность нужной N-концевой удлиняющей части и которые должны быть вставлены надлежащим образом, т.е. они должны располагаться выше 5'-конца гена, кодирующего центральную часть белка, так чтобы они генерировали химерный ген. Техника конструирования олигонуклеотидов и техника продуцирования химерного гена хорошо известны каждому специалисту.
Помимо использования слитых белков в качестве пролекарства, настоящее изобретение может быть использовано для очистки и процессинга биологически активных рекомбинантных полипептидов. Нужные биологически активные рекомбинантные полипептиды наиболее предпочтительно получать в растворимой форме или секретировать из клеток хозяев. Согласно настоящему изобретению удлиняющая часть гибридного белка может быть выявлена путем очистки. Гибридный белок очищают от материала, присутствующего в секретирующей среде или экстрагирующем растворе, в котором он содержится, а затем подвергают процессингу для удаления удлиняющей части из центральной части белка, получая тем самым нужный очищенный белок. В соответствии с этим нужными белками, наиболее подходящими для процессинга в качестве гибридных белков настоящего изобретения, являются такие биологически активные полипептиды, которые сами по себе не являются субстратами для DPP IV-расщепления.
В соответствии с настоящим изобретением генную последовательность, кодирующую нужный белок, выделяют, синтезируют или получают каким-либо другим способом и надлежащим образом сшивают с ДНК-последовательностью, кодирующей удлиняющую часть. Гибридный ген, содержащий ген нужного белка и сшитый надлежащим образом с ДНК-последовательностью, кодирующей удлиняющую часть, относится к химерным генам.
Методы и материалы для получения химерных генов и рекомбинантных векторов, трансформации или трансфекции хозяйских клеток с использованием этих материалов; репликации в хозяйских клетках векторов и экспрессии биологически активных чужеродных полипептидов и белков описаны в Principles of Gene Manipulation, by Old and Primrose, 2-ое изд., 1981 и Sambrook et al., Molecular Cloning, 2-ое изд., Cold Spring Harbor Laboratory Press, N 4, 1989 (обе эти работы вводятся в настоящее описание посредством ссылки).
Изобретение относится к рекомбинантным химерным генам, кодирующим гибридные белки; к векторам экспрессии, содержащим указанные химерные гены; к хозяевам, трансформированным или трансфецированным указанными векторами экспрессии; и к способам получения указанных генов, экспрессирующих векторов и хозяйских клеток, трансформированных или трансфецированных этими векторами.
Изобретение может быть использовано для очистки любого прокариотического или эукариотического белка, который может быть экспрессирован в виде продукта техники рекомбинантных ДНК в трансформированных или трансфецированных хозяйских клетках. Этими рекомбинантными белковыми продуктами могут быть гормоны, рецепторы, ферменты, запасные белки, белки крови, мутантные белки, полученные с использованием техники белковой инженерии, или синтетические белки. Полипептидами, желательными для продуцирования, могут быть ВИЧ-РНКаза-H, tPA, IL-I, IL-I-рецептор, CD4, фактор роста нервных клеток человека, SCD4-PE40, FG-химерный гликопротеин респираторно-синцитиального вируса P (см. заявку на патент США рег. N 07/543780, вводимую в настоящее описание посредством ссылки), EGF, IGF-1, IGF-2, глюкагон, кортикотропин-высвобождающий фактор (CRF), динорфин, эндотелин, фактор-альфа трансформации роста (TGF- α ), эндотоксин 40 Pseudomonas, фактор- β трансформации роста (TGF- β ), инсулин и его аналоги.
Примерами способов очистки являются IMAC или иммуноаффинность. В объем настоящего изобретения входят другие способы очистки, которые предусматривают использование пептидов с удлиняющими частями, которые могут быть удалены с помощью DPP IV.
В одном из вариантов осуществления настоящего изобретения гибридные белки, содержащие биологически активную полипептидную часть и удлиняющую часть, которая представляет собой металло-пептидный хелатный комплекс, могут быть использованы в хроматографической системе на основе сродства к иммобилизованным металлам.
Аффинная хроматография на иммобилизованных металлах IMAC для фракционирования белков была впервые описана Porath J. и др., Nature 258:598-599 (1975). Porath раскрывает дериватизацию смолы иминодиуксусной кислоты (IDA) и образование хелатного комплекса ионов металла с IDA-деривтизированной смолой. Porath раскрывает также белки, которые могут быть иммобилизованы в колонке, содержащей иммобилизованные ионы металла. Этот способ предусматривает связывание обычно используемой иминодиуксусной кислоты (IDA) с матрицей с последующим образованием хелатного комплекса ионов металла с IDA-содержащей смолой. Белки связываются с ионами металла посредством функциональных групп аминокислотных остатков, способных к передаче электронов. Потенциальными донорами электронов являются такие аминокислотные остатки, как цистеин, гистидины и триптофан. Белки взаимодействуют с ионами металлов посредством одной или нескольких из этих аминокислот, имеющих электрон-донорные боковые цепи.
Smith и др. в патенте США N 4569794, вводимом в настоящее описание посредством ссылки, показали, что некоторые аминокислотные остатки являются ответственными за связывание белка с иммобилизованными ионами металлов. Однако эти связанные белки могут быть элюированы путем понижения pH или путем использования конкурентных противолигандов, таких как имидазол, в случае, если в связывании участвуют боковые цепи гистидина. Для того чтобы продемонстрировать, что IMAC является способом избирательной очистки, были использованы гистидин-содержащие ди- или три-пептиды в белках. В соответствии с этим Smith и др. описали использование техники рекомбинантной ДНК для продуцирования гибридного белка, содержащего пептид, образующий хелатный комплекс с металлом и ковалентно связанный с нужным полипептидом. Пептид, образующий хелатный комплекс с металлом, представляет собой удлиняющую часть, которая является эффективной в отношении нужного полипептида. Этот факт может быть использован для очистки белка.
Использование IMAC-техники с хелатными металло-пептидными комплексами, имеющими чередующиеся гистидиновые остатки, раскрывается в патентной заявке США рег. N 07/506605, которая вводится в настоящее описание посредством ссылки. В патентной заявке США рег. N 07/506605 описываются конкретные пептиды, образующие хелатные комплексы с металлом, использование которых в IMAC-очистке гибридного белка дает неожиданно высокие результаты в том случае, когда указанный металло-пептидный халатный комплекс содержит от трех до шести чередующихся His-остатков. В соответствии с описанием патентной заявки США рег. N 07/507605 и патента США N 4569794 может быть использована обычная IDA-смола в IMAC для очистки гибридных белков, имеющих хелатную металло-пептидную часть по крайней мере с тремя чередующимися гистидиновыми остатками, которые являются составной частью DPP-IV-распознаваемых последовательностей. Конструирование слитых белков и их использование в IMAC-системе описываются в патенте США N 4569794. Конструирование и использование хелатной металло-пептидной части, содержащей чередующиеся гистидиновые остатки, описано в заявке на патент США рег. N 07/506605. В соответствии с настоящим изобретением гибридный белок, обеспеченный DPP-IV-распознаваемыми остатками, располагающимися между чередующимися гистидиновыми остатками, может быть очищен с использованием IMAC-технологии с последующим процессингом с помощью DPP-IV, в результате которого образуется нужный полипептид.
Другой системой очистки белка, в которой используются гибридные белки, и которая хорошо подходит для применения техники DPP IV-процессинга, является иммуноаффинная очистка. В патенте США N 4 782 137, выданном 1 ноября 1988 Hopp и др., который вводится в настоящее описание посредством ссылки, раскрывается синтез гибридного белка, обладающего высоко антигенной N-концевой частью и нужным полипептидом в своей C-концевой части. Согласно Hopp и др., гибридные белки очищают от надосадочной жидкости путем пропускания этой надосадочной жидкости через колонку, содержащую иммобилизованные антитела, которые распознают антигенную часть гибридного белка. Эти иммобилизованные антитела удерживают белок в колонке, тогда как ненужные компоненты надосадочной жидкости элюируются. Затем условия в колонке меняют и тем самым стимулируют диссоциацию комплекса "антиген-антитело".
В соответствии с настоящим изобретением такой высоко антигенной N-концевой частью гибридного белка является удлиняющая часть, которая содержит DPP-IV-распознаваемые остатки. После сбора в соответствии с процедурой, описанной в патенте Hopp, гибридный белок настоящего изобретения может быть подвергнут воздействию фермента DPP IV, в результате чего удлиняющая часть удаляется. Таким образом, любой специалист может на практике использовать систему иммуноаффинной очистки Hopp с применением N-концевых удлиняющих частей настоящего изобретения.
Представленные в настоящем описании варианты и примеры осуществления настоящего изобретения служат лишь для иллюстрации изобретения и не должны рассматриваться как некое его ограничение. В качестве эквивалентов могут быть рассмотрены гибридные белки, обладающие N-концевыми удлиняющими частями и обладающие способностью к процессингу по крайней мере еще одним способом, так чтобы удаление удлиняющих частей было обусловлено комбинацией этих способов. В качестве возможных эквивалентов могут быть также рассмотрены гибридные полипептиды, содержащие химически модифицированные аминокислотные остатки.
Пример 1. Синтетические предшественники лекарственного средства, которые представляют собой слитые пролекарства, содержащие центральные части белков, являющиеся субстратами для DPP IV.
Слитые полипептиды, которые могут быть синтезированы и введены в качестве пролекарств, имеют DPP
IV расщепляющую N-концевую удлиняющую
часть, ковалентно связанную с N-концом биологически активного полипептида. Эти предшественники лекарственных средств могут быть представлены следующей
формулой:
Удлиняющая часть-центральная
часть белкового лекарственного средства
где "удлиняющая часть" представляет собой DPP IV-расщепляемую N-концевую удлиняющую часть; "-"
представляет собой ковалентную пептидную связь; а
"центральная часть белка" представляет собой любой нужный пептид, который отщепляется от удлиняющей части посредством DPP-IV-процессинга. В этом
примере центральная часть гибридного белка является
потенциальным субстратом для DPP IV после удаления этой удлиняющей части.
Синтетические предшественники лекарственного средства могут быть получены с использованием техники пептидного синтеза, хорошо известной специалистам.
В одном из вариантов осуществления настоящего изобретения центральной частью белка
является эпидермальный фактор роста (EGF), а
удлиненной частью белка является Gly-Pro-Phe-Ala
Gly4-Pro-3-Phe-2-Ala-1-[EGF].
В
другом из вариантов осуществления настоящего
изобретения центральной частью белка является глюкагон, а удлиняющей частью является Ala-Pro-Phe-Ala
Ala-4-Pro-3-Phe-2-Ala-1-(GLUGAGON).
В следующем варианте осуществления настоящего изобретения центральной частью белка является [Ala15Leu27]-bGRF (1 - 29)
NH2(Seg.ID N3), а удлиняющей частью
является Tyr-Ala
Tyr-2-Ala-1{[Ala15Leu27] - bGRF (1 - 29) NH2}.
Пример 2. Синтетические предшественники лекарственного средства, которые представляют собой гибридные пролекарства, содержащие центральные части белков, не являющиеся субстратами для DPP IV.
Гибридные полипептиды, которые могут быть
синтезированы и введены в качестве пролекарств, имеют DPP IV-расщепляемую N-концевую удлиняющую часть, ковалентно связанную с N-концом биологически активного
полипептида. Эти предшественники
лекарственных средств могут быть представлены следующей формулой:
Удлиняющая часть - центральная часть белкового лекарственного средства
где
"удлиняющая часть" представляет собой
DPP IV-рассщепляемую N-концевую удлиняющую часть; "-" представляет собой ковалентную пептидную связь; а "центральная часть белка" представляет собой любой нужный
пептид, который отщепляется от
удлиняющей части посредством DPP IV-процессинга.
Синтетические предшественники лекарственного средства могут быть получены с использованием техники пептидного синтеза, хорошо известной специалистам.
В одном из вариантов осуществления настоящего изобретения центральной частью белка является аналог bGRF, [Val2, Ser8,
28, Leu27
] - bGRF (1 - 33) OH (Посл. II N I), а удлиняющей частью является Gly-Pro-Tyr-Ala
Gly-4-Pro-3-Tyr-2-Ala-1- {[Val2Ser8,28
Ala15Leu27]bGRF(1 - 33)OH}.
В другом из вариантов осуществления настоящего изобретения центральной частью белка является фактор
высвобождения кортикотропнина
CRF, а удлиняющей частью является Gly-Pro-Phe-Ala
Gly-4-Pro-3-Phe-2-Ala-1-[CRF].
В следующем
варианте осуществления настоящего
изобретения центральной частью белка является динорфин, а удлиняющей частью является Phe-Pro-Phe-Ala
Phe-4-Pro-3-Phe-2
-Ala-1-[DYNORFIN].
В еще одном варианте осуществления настоящего изобретения центральной частью белка является соматостатин-28, а удлиняющей частью является
Gly-Pro-Phe-Pro
Gly-4-Pro-3-Phe-2-Pro-1- [SOMATOSTATIN-28].
В другом варианте осуществления настоящего изобретения центральной
частью белка является эндотелин, а удлиняющей частью
является Ala-Pro-Phe-Ala
Ala-4-Pro-3-Phe-2-Ala-1- [ENDOTHELIN].
В следующем
варианте осуществления настоящего изобретения
центральной частью белка является bGRF-аналог [Ile2Ser8,28Ala15Leu27] - bGRF(1 - 40)OH(SerID2), удлиняющей
частью является Phe-Ala
Phe-2
-Ala-1-{[Ile2Ser8,28Ala15 Leu27]-bGRF(1 - 40)OH}.
В другом варианте
осуществления настоящего изобретения центральной частью
белка является [Ile2Ala15Leu27] -bGRF(1 - 29)NH2 (SeqID 4), а удлиняющей частью является Tyr-Ser
Tyr-2-Ser-1-{[Ile2
Ala15Leu27] -bGRF(1 - 29)NH2}.
Пример 3. Пролонгированное присутствие аналога bGRE Leu27 - bGRF (1 - 29)NH2.
bGRF - Аналог, Leu27 - bGRF - (1 - 29) NH2 (его последовательность показана как SeqID N 5) может быть введен в качестве лекарственного средства, содержащего центральную часть белка, показанную в SeqID 5, и ряд предшественников с N-концевыми удлиняющими частями.
Несколько вариантов предшественников
могут быть получены хорошо известными способами с
использованием SeqID 5 в качестве центральной части белка. Удлиняющими частями для этих предшественников, полученных на основе SeqID 5, являются
Ile-Ala, Gly-Pro-Ile-Pro, SeqID 6, SeqID 7,
Tyr-Ala, Gly-Pro-Tyr-Ala, SeqID 8, SeqID 9, SegID 10, SegID 11, SeqID 12, SegID 13, Tyr-Ala-Tyr-Ala и Val-Ala.
Пример 4. Пролонгированное присутствие bGRF-аналога [Thr2 Ala15Leu27]-bGRF (1 - 29) NH2.
bGRF -аналог, [Thr2Ala15Leu27 ] - bGRF(1 - 29) NH2 (его последовательности показаны как SeqID 14) может быть введен в качестве лекарственного средства, содержащего центральную часть белка, показанную в SegID 14, и ряд предшественников с N-концевыми удлиняющими частями. Были изготовлены три варианта предшественников, имеющих удлиняющие части Tyr-Thr, Tyr-Ser и Tyr-Thr-Tyr-Thr соответственно.
Пример 5. Гибридные белки, которые содержат ВИЧ-РНКазу H и N - концевые удлиняющие части.
Техника очистки химерных белков из рекомбинантной E. coli основана на доменах пептида, образующего хелатный комплекс с металлом, которые содержат чередующиеся гистидины и которые обладают сродством к иммобилизованным ионам металла. Векторы конструировали для осуществления синтеза гибридных белков с использованием ВИЧ-РНКазы H в качестве центральной части белка. Как указано ниже, были сконструированы гибридные белки, содержащие чередующиеся гистидины, в целях очистки с использованием афинной хроматографии на иммобилизованных ионах металла (IMAC), а также чередующиеся пролины или чередующиеся аланины для DPP IV-отщепления в целях выделения пептида, (mcp), образующего хелатный комплекс с металлом.
В соответствии с настоящим изобретением предпочтительные DPP IV-расщепляемые N-концевые удлиняющие части указаны ниже.
Слитой белок ВИЧРН/mcp N 1 включает в
себя N-концевую удлиняющую часть
последовательности Seg ID 15, связанную с ВИЧ-РНКазой H
Met-11-Pro-10-Ala-9-His-8- Pro-7-His-6-Pro-5-His-4-Pro-3- His-2-Ala-1-[ВИЧ-РНКаза H].
Гибридный белок ВИЧРН/ mcp N 2 включает в себя N-концевую удлиняющую
часть последовательности Seg ID 16,
связанную с ВИЧ-РНКазой H
Met-11-Ala-10-Pro-9-His-8- Ala-7-His-6-Ala-5-His-4-Ala-3- His-2-Ala-1-[ВИЧ-РНКаза H].
Гибридный белок ВИЧРН/mср N 3 включает в себя N-концевую удлиняющую часть последовательности Seg ID 17,
связанную с ВИЧ-РНКазой H
Met-11-Gly-10-Pro-9-His-8- Pro-7-His-6Pro-5-His-4-Pro-3- His-2-Ala-1
-[ВИЧ-РНКаза H].
Эти гибридные белки клонировали и экспрессировали в E. coli и очищали с использованием DEAE-хроматографии и обращенно-фазовой ВЭЖХ. Для характеризации гибридных белков использовали N-концевое секвенирование. Применение гибридных белков с чередующимися гистидинами для очистки рекомбинантных белков с помощью IMAC и с последующим удалением N-концевых удлиняющих частей посредством DPP IV подтверждает ценность настоящего изобретения.
Конструирование химерных генов, содержащих ген РНКазы H ВИЧ.
Все рекомбинантные ДНК были получены с помощью стандартной техники. Олигонуклеотиды, соответствующие последовательности пептида, образующего хелатный комплекс с металлом, и отщепляемой последовательности, конструировали, очищали, отжигали и легировали с геном, кодирующим ВИЧ-РКазу-H для образования химерного гена.
Для получения векторов экспрессии, кодирующих чередующиеся гистидины /DPP IV-распознаваемые отщепляемые остатки/ ВИЧ-РНКазу-H, в окончательный экспрессирующий вектор вводили химерный ген. Экспрессирующие векторы, содержащие сконструированный ген использовали для трансформации E. coli с помощью стандартной техники. В результате экспрессии этих генов в E. coli получают гибридные белки, кодированные химерными генами, эти гибридные белки содержат аминокислоты ВИЧ-РНКазы-H и N-концевые удлиняющие части с чередующимися гистидинами (пептид, образующий хелатный комплекс с металлом) и чередующимися пролинами или аланинами.
Получение исходного E. coli-экстракта и выделение гибридных белков для секвенирования.
Приблизительно 3 г E. coli-клеточной пасты суспендировали в 30 мл 0,25 М фосфата калия, pH 7,2, содержащего 1 мМ дитиотреитола (ДТТ), ЭДТК, фенилметилсульфонилфосфата (PMSF), и бензамидина HCl, 10 мг/л апротинина, лейцептина и бестаина. Эту суспензию пропускали три раза через French-пресс для разрушения клеток. Клеточные лизаты центрифугировали 1 ч при 12000 об/мин. Затем надосадочную жидкость удаляли и добавляли сульфат аммония до 70% насыщения. После 1-часового размешивания суспензию центрифугировали 1 ч при 12000 об/мин. Надосадочную жидкость отбрасывали, а осадок снова растворяли в 2,25 мл 50 мМ Триса pH 7,5, содержащего 1 мМ ДТТ, PMSF и бензамидина. Затем полученный раствор диализовали в течение ночи в 20 мМ Триса, 50 мМ NaCl, 1 мМ ДТТ, 10% глицерина, и 0,1 мМ ЭДТК, pH 7,5 (Буфер A) при 4oC. Диализат собирали, разводили одним объемом Буфера A и вводили в 10 мл-колонку с промытой DEAE-целлюлозой, уравновешенной в Буфере A. Этот процесс осуществляли партиями и после каждой партии колонку промывали 50 мл Буфера A. Полученные растворы собирали, объединяли и концентрировали путем осаждения 70%-ным сульфатом аммония, а затем ресуспендировали в 2 мл Буфера A и диализовали, как описано выше. Концентрированные PH использовали для характеризации с помощью N-концевого секвенирования.
Очистка гибридных белков с помощью IMAC.
Возможность использования пептида, образующего хелатный комплекс с металлом, для очистки рекомбинантных белков из сырых экстрактов была проиллюстрирована с помощью следующих химерных соединений, экспрессированных в рекомбинантной E. coli с ВИЧ-PHКазой H, взятой в качестве модели белка. Каждый из гибридных белков: ВИЧ-РНКазы-H/mcp N 1; ВИЧ-РНКазы H/mcp N 2 и ВИЧ-РНКазы-H/mcp N 3 был очищен.
IMAC-колонки подготавливали следующим образом. Быстрый поток хелатообразующей сефарозы Pharmacia тщательно промывали водой (Milli-Q) на фильтре из закаленного стекла. Затем гель ресуспендировали в воде с образованием суспензии. Эту суспензию осторожно выливали в стеклянную колонку (Pharmacia) до объема 6 мл (1 х 7 см). После осаждения геля колонку промывали 5 объемами 50 мМ ЭДТК (этилендиаминтетрауксусной кислоты) (pH 8,0). После этого колонку промывали 5 объемами 0,2 NaOH и 5 объемами Milli-Q воды. Затем колонку загружали 5 объемами 50 мМ NiSO4 (или ZnCl2 или CuSO4). И, наконец, колонку промывали 5 объемами уравновешивающего буфера. Уравновешивающий буфер получали из 20 мМ Триса (pH 8,0), содержащего 500 мМ NaCl, 1 мМ PMSF, 1 мМ бензамидина, 10 мг/л лейпептина и 10 мг/л апротинина.
Колонку уравновешивали по крайней мере 5 объемами уравновешивающего буфера. 5 - 10 мл исходного экстракта рекомбинантных E. coli вводили в колонку самотеком. После того как весь исходный материал был введен в колонку, эту колонку промывали 10 объемами (по отношению к объему колонки) уравновешивающего буфера, содержащего 1,0 NaCl (вместо 500 мМ NaCl) pH 8,0.
Затем колонку элюировали возрастающими концентрациями имидазола в уравновешивающем буфере при pH 8,0. В более ранних экспериментах, в каждом из них, осуществляли большое число элюций для определения концентрации, при которой элюируется химерный материал. Затем число этих элюций было уменьшено и в результате использовали всего лишь три концентрации имидазола: 35 мМ, 100 мМ и 300 мМ имидазола в уравновешивающем буфере, pH 8,0. Использовали 10 объемов слоя каждого имидазолового буфера. Между элюциями колонку промывали 10 объемами уравновешивающего буфера. И, наконец, колонку промывали 5 объемами слоя 50 мМ ЭДТК pH 8,0 для определения связывается ли еще какой-нибудь белок с колонкой. Скорости потока для колонок составляли 1,0 мл/мин. Собирали 5-миллиметровые фракции. Работа с колонками проводилась при комнатной температуре.
Для определения содержания белка в образцах использовали коммерчески доступный набор для анализа белка Pierce.
Активность ВИЧ-РНКазы-H определяли способом, описанным в FEBS 270 (1,2): 76 - 80 (сентябрь 1990), Becerra S.P. и др. (эта работа вводится в настоящее описание посредством ссылки).
Превращение гибридных белков с N-концевыми удлиняющими сегментами в зрелые белки.
Для этих целей использовали коммерчески доступные DPP IV, выделенные из плаценты человека (Enzyme Systems, Product Дублин, Ca), со специфической активностью 5200 м ед. /мг белка. Одна единица эквивалента гидролизу 1 мМ синтетического субстрата (Ala-Pro-7-амино-4-2-трифторометилкумарина) за одну минуту при pH 7,8. Ферментную конверсию осуществляли путем инкубирования гибридного белка (около 1 - 100 мг) при концентрации 1 - 10 мг/мл с DPP IV при 25oC в течение 30 мин и при отношении фермента к субстрату 1:100 (по массе). Нужный полипептид выделяли из нерасщепленного гибридного белка с помощью IMAC. Аутентичность полученного продукта подтверждали с помощью N-концевого секвенирования.
Пример 6. Процессинг предшественников аналога bGRF в бычьей плазме in vitro.
В табл. 1 систематизированы типичные эксперименты для иллюстрации генерирования центральной части пептида [Leu27]-bGRF (1 - 29)NH2(SeqLD 5) из трех аналогов с N-концевыми удлиняющими участками Tyr-4-Ala-3- Tyr-2-Ala-1-{ [Leu27] -bGRF(1 - 29)NH2} (SeqID 19), Ile-2-Ala-1-{[Leu27]-bGRF(1 - 29) NH2} (SeqID 18) и Tyr-2-Ala-1-{[Leu27]- bGRF(1 - 29)NH2}(SeqID 25) путем инкубирования с бычьей плазмой in vitro. В инкубационной смеси обнаруживали лишь те метаболиты, которые были продуктами DPP-IV-ассоциированного расщепления.
Tyr-4-Ala-3-Tyr-2-Ala-1- {[Leu27}-bGRF(1 - 29)NH2}(SeqID 19) последовательно превращали в Tyr-2-Ala-1 -{ [Leu27] -bGRF(1 - 29) NH2}(SeqID 25), [Leu27] - bGRF(1 - 29)NH2 (центральная часть пептида, SeqID 5) и, наконец, в [Leu27]- bGRF(3 - 29)NH2(SeqID 24).
Tyr-2-Ala-1-{ [Leu27] -bGRF(1 - 29)NH2}(SeqID 25) превращали в [Leu27]-bGRF(1 - 29)NH2 (центральная часть белка, SeqID 5), а затем в [Leu27]-bGRF(3 - 29)NH2(SeqID 24). Сама центральная часть белка [Leu27] - bGRF (1 - 29)NH2(SeqID 5) была превращена в [Leu27] - bGRF (3 - 29)NH2(SeqID 24) с использованием DPP-IV плазмы.
Даже если в ВЭЖХ-условиях, используемых в экспериментах, не наблюдалось других метаболитов, пептид [Leu27] -bGRF(3-29)NH2 (SeqID 24) с течением времени исчезал, что указывает на то, что должны иметь место также и другие протеолитические реакции, не связанные с DPP-IV и имеющие значительно меньшие скорости. Было не только показано, что из DPP-IV-расщепляемых предшественников bGRF генерировался центральный bGRF-пептид, но также и то, что время полужизни центрального белка, генерированного из гибридного белка, является значительно более продолжительным in vitro, чем время полужизни центрального пептида (SeqID 5), инкубированного с бычьей плазмой (табл. 1). Более того, время, при котором центральный пептид высвобождается из предшественника, очевидно, хорошо коррелирует с длиной удлиняющей части предшественника: время полужизни последовательности (SeqID 5), генерированной из предшественника с 4 аминокислотными остатками в удлиняющей части (SeqID 19), является значительно более продолжительным, чем время полужизни центрального пептида, происходящего от проGRF, имеющего только две аминокислоты в своей удлиняющей части, как в SeqID18 или 25.
Пример 7. In vivo и in vitro - биоактивность предшественников аналога bGRF.
Как показано в табл. 2, уровни гормона роста (GH) в плазме бычков Holstein повышались при инъецировании этим бычкам внутривенно SeqID 18 аналога. При дозе 0,2 нМ на 1 кг веса тела уровни индуцированного гормона роста в плазме сравнивали с уровнями, генерированными после инъекции i. v. той же самой дозы центрального пептида (SeqID 5). Важно отметить, что удлиненный пептид SeqID 18 имел лишь около 5% свойственной ему активности по сравнению с центральным белком SeqID 5 в соответствии с анализом, проводимом in vitro для клеток гипофиза на GH-высвобождение. Поэтому сравнение in vivo-активности для этих двух пептидом, очевидно, указывает на то, что центральный пептид был выделен из удлиненного пептида in vivo.
Та же самая картина высвобождения GH in vivo наблюдалась также при обработке bGRF-предшественниками, имеющими 4 аминокислотных остатка в удлиняющей части (SeqID 19) (см. табл. 3). Как показали результаты, не наблюдалось какого-либо значительного различия в in vivo-индуцированном высвобождении GH после обработки предшественниками, имеющими 4 или 2 аминокислоты в своей удлиняющей части (пептиды SeqID 19 и SeqID 18 соответственно), несмотря на значительное различие в полужизни in vitro центрального пептида, генерированного из этих двух bGRF-предшественников in virto, как показано в табл. 1. In vivo-высвобождение гормона роста было быстрым и одинаковым для центрального пептида SeqID 5, а также для SeqID 19 и 18, при этом никакого различия в GH-пиках по времени после введения bGRF-аналогов не наблюдалось.
В качестве интерпретации этих результатов можно предположить, что вероятнее всего указанное быстрое высвобождение GH из предшественников in vivo обусловлено, в целом, высокими DPP IV-уровнями в тканях и органах, которые примерно в 100 раз превышают концентрации DPP-IV в плазме. Это предположение также объясняет различие в скорости процессинга предшественников in vivo по сравнению с протеолизом, наблюдаемом в in vivo - экспериментах, систематизированных в табл. 1. Возможно также, что время полужизни центрального пептида, генерированного из его предшественников, было продолжительным in vivo, но недостаточным для выявления измененного (продленного) высвобождения гормона роста. Известно, что высвобождение GH in vivo моделируется с помощью стимулирующего действия bGRF и ингибирующего действия соматостатина (фактор, ингибирующий высвобождение соматотропина, SRIF). Для модели бычков, откармливаемых на мясо Moseley и др. (J. Endocr. 17, 253 - 259, 1988), животным вводили внутривенно GRF за два часа до кормления, поскольку до кормления гипофиз более восприимчив к GRF-стимулированию, чем после кормления. Факторы, связанные с кормлением, такие как SRIF кишки/поджелудочной железы, могут препятствовать способности гипофиза к высвобождению GH. Другими словами, если имеется хоть какое-либо количество SRIF, то GH не будет высвобождаться из гипофиза даже в присутствии GRF. Обычно в модели бычка, откармливаемого на мясо, которому не вводилось стимулирующего средства, концентрация GH в сыворотке падает до исходных уровней в течение 3 - 6 ч после кормления (так называемый период минимума), при этом другой импульс экзогенного эпизодического GH имеет место через 5 - 8 ч после кормления. При инъекции за 2 ч до кормления GH-ответ наступает очень быстро, уже через 5 - 20 мин, и GH-уровень остается повышенным в течение 120 - 240 мин, а затем возвращается до исходного уровня. До сих пор, в случае испытуемых GRF-предшественников, только первый пик экзогенного GH был повышенным, а второй не обнаруживал какого-либо влияния вводимой дозы. Возможно, что время полужизни центрального GRF, генерированного из предшественников в данных экспериментах, не было достаточно продолжительным для того, чтобы центральный пептид присутствовал в кровотоке в концентрациях, достаточных для воздействия на второй выброс экзогенного GH, который обычно имеет место через 4 - 6 ч после первого.
Резюмируя вышесказанное, можно утверждать, что полученные результаты служат доказательством основной концепции использования предшественников лекарственного средства, раскрываемой в настоящей заявке, поскольку (I) bGRF-предшественники, имеющие DPP-IV-отщепляемые N-концевые удлиняющие участки, были успешно процессированы с образованием центрального пептида в бычьей плазме in vitro с помощью DPP-IV-опосредованного протеолиза; (II) время in vitro -полужизни центрального пептида, генерированного из его предшественника, было достаточно продолжительным и зависело от длины N-концевой удлиняющей части в предшественнике; (III) тот факт, что bGRF-предшественник с очень низкой природной активностью является таким эффективным, как и центральный пептид в in vivo высвобождении GH, свидетельствует о том, что, по всей вероятности, центральный белок генерируется in vivo, как и предполагалось.
Пример 8. Получение Gly-4-Pro-3-Ile-2- Pro-1{[Leu27]bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида Seq ID 26 GRF-аналога, имеющего формулу Gly-Pro-Ile-Pro-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys- Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg- NH2 (как соль CF3COOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/029-23, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,16 (4); Thr 1,07 (1); Ser 1,81 (2); Glu 2,07 (2); Pro 0,98 (2); Gly 1,99 (2); Ala 2,99 (3); Val 1,13 (1); Ile 2,84 (3); Leu 5, 08 (5); Tyr 1,93 (2); Phe 0,96 (1); Lys 2,04 (2); Arg 2,97 (3).
Пример 9. Получение Tyr-6-Ala-5-Gly-4- Pro-3-Ile-2-Pro-1{[Leu27 ]bGRF (1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 27 GRF-аналога, содержащего SeqID 6 в виде удлиняющей части и имеющего формулу 3H-Tyr-Ala-Gly-Pro-Ile-Pro- Tyr-Ala-Asp-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser- Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (в виде соли CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,04 (4); Thr 1,03 (1); Ser 1,74 (2); Glu 2,05 (2); Pro 1,99 (2); Gly 2,00 (2); Ala 4,01 (4); Val 1,28 (1); Ile 2,84 (3); Leu 5,09 (5); Tyr 2,94 (3); Phe 0,97 (1); Lys 2,07 (2); Arg 3,00 (3).
Пример 10. Получение Lys-8-Pro-7-Tyr-6- Ala-5-Gly-4-Pro-3-Ile-2 -Pro-1 { [Leu27]bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 28 GRF-аналога, содержащего SeqID 7 в виде удлиняющей части и имеющего формулу Lys-Pro-Tyr-Ala-Gly-Pro-Ile-Pro-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser- Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile- Leu-Asn-Arg-NH2 (как соль CF3COOH) проводили постадийно, аналогично процедуре A описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,04 (4); Thr 0,95 (1); Ser 1,78 (2); Gly 2,04 (2); Pro 2,91 (3); Gly 1,98 (2); Ala 3,91 (4); Val 0,96 (1); Ile 2,86 (3); Leu 5,08 (5); Tyr 3,06 (3); Phe 0,97 (1); Lys 3,06 (3); Arg 3,08 (3).
Пример 11. Получение Gly-4-Pro-3-Tyr-2- Ala-1{[Leu27]bGRF(1-29)NH2}, соли трифторуксусной кислоты.
Синтез пептида Seq ID 29 GRF-аналога, имеющего формулу N 6 Gly-Pro-Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg- NH2 (как соль CF3COOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/029-23, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,01 (4); Thr 0,96 (1); Ser 1,80 (2); Gln 2,02 (2); Pro 0,97 (1); Gly 1,98 (2); Ala 3,91 (4); Val 0,99 (1); Ile 1,89 (2); Leu 5,08 (5); Tyr 3,05 (3); Phe 0,98 (1); Lys 2,03 (2); Arg 3, 06 (3).
Пример 12. Получение Tyr-6-Aka-5-Gly-4- Pro-3-Tyr2-Ala-1{ [Leu27] bGRF(1-29) NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 30 GRF-аналога, содержащего SeqID 8 в виде удлиняющей части и имеющего формулу # 7 Tyr-Ala-Gly-Pro-Tyr- Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly- Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02-923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,07 (4); Thr 0,96 (1); Ser 1,79 (2); Glu 2,02 (2); Pro 0,99 (1); Gly 1,95 (2); Ala 4,80 (5); Val 0,96 (1); Ile 1,87 (2); Leu 5,09 (5); Tyr 4,11 (4); Phe 0,97 (1); Lys 2,06 (2); Arg 3,08 (3).
Пример 13. Получение Lys-8-Pro-7-Tyr-6- Ala-5-Gly-4-Pro-3-Tyr-2-Ala-1 { [Leu27] bGRF(1-29)NH2}, соли трифторуксусной кислоты.
Синтез пептида SeqID 31 GRF-аналога, содержащего SeqID 9 в виде удлиняющей части и имеет формулу N 8 Lys-Pro-Tyr-Ala-Gly-Pro-Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser- Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile- Leu-Asn-Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,06 (4); Thr 0,95 (1); Ser 1,78 (2); Glu 2,01 (2); Pro 1,95 (2); Gly 1,96 (2); Ala 4,81 (5); Val 0,95 (1); Ile 1,87 (2); Leu 5,09 (5); Tyr 4,12 (4); Phe 0,96 (1); Lys 3,08 (3); Arg 3,10 (3).
Пример 14. Получение Phe-10-Ala-9-Lys-8- Pro-7-Tyr-6-Ala-5-Gly-4 Pro-3 - Tyr-2-Ala-1{[Leu27]bGRF(1-29)NH2}, соли трифторуксусной кислоты.
Синтез пептида Seq ID 32 GRF-аналога, содержащего Seq ID 10 в виде удлиняющей части, имеющего формулу N 9 Phe-Ala-Lys-Pro-Tyr-Ala- Gly-Pro-Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Asn-Arg-NH2 (как соль CF2COOH) проводили постадийно аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,16 (4); Thr 1,01 (1); Ser 1,89 (2); Glu 2,08 (2); Pro 1,91 (2); Gly 1,93 (2); Ala 5,72 (6); Val 0,97 (1); Ile 1,90 (2); Leu 5,09 (5); Tyr 4,09 (4); Phe 1,99 (2); Lys 3,08 (3); Arg 3,04 (3).
Пример 15. Получение Gly-12-Pro-11-Phe-10- Ala-9-Lys-8-Pro-7-Tyr-6-Ala-5- Gly-4-Pro-3-Tyr-2-Ala-1{ [Leu27] bGRF(1-29)NH2}, соли трифторуксусной кислоты.
Синтез пептида Seq ID 33 GRF-аналога, содержащего Seq ID 11 в виде удлиняющей части, имеющего формулу N 10 Gly-Pro-Phe-Ala-Lys-Pro-Tyr-Ala-Gly-Pro-Tyr-Ala-Tyr-Ala-Asp-Ala- Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg- Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках: Asp 4,08 (4); Thr 0,96 (1); Ser 1,79 (2); Gln 2,07 (2); Pro 2,88 (3); Gly 2,94 (3); Ala 5,74 (6); Val 0,96 (1); Ile 1,88 (2); Leu 5,13 (5); Tyr 4,11 (4); Phe 1,99 (2); Lys 3,10 (3); Arg 3,09 (3).
Пример 16. Получение Val-14-Pro-13-Gly-12- Pro-11-Phe-10-Ala-9-Lys-8
-Pro-7- Tyr-6-Ala-5-Gly-4-Pro-3-Tyr-2- Ala-1{ [Leu27]bGRF(1-29)NH2}, соли трифторуксусной
кислоты
Синтез пептида SeqID 34 GRF-аналога, содержащего SeqID 12 в виде удлиняющей части и имеющего формулу N 11
Val-Pro-Gly-Pro-Phe- Ala-Lys-Pro-Tyr-Ala-Gly-Pro-Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr- Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu- Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль
CF3COOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный
анализ (теоретические значения указаны в скобках): Asp 4,04 (4); Thr 0,96 (1); Ser 1,81 (2); Glu 2,04 (2); Pro 3,80 (4); Gly 2,99 (3); Ala 5,92 (6); Val 1,98 (2); Ile 1,89 (2); Leu 5,10 (5); Tyr 4,09
(4); Phe 1,99 (2); Lys 3,06 (3); Arg 3,08 (3).
Пример 17. Получение Arg-16-Pro-15-Val-14-Pro-13-Gly-12- Pro-11 -Phe-10-Ala-9-Lys-8-Pro-7- Tyr-6-Ala-5-Gly-4-Pro-3-Tyr-2- Ala-1{ [Leu27 ]bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида Seq ID 35 GRF-аналога, содержащего Seq ID 13 в виде удлиняющей части и имеющего формулу N 12 Arg-Pro-Val-Pro-Gly-Pro-Phe-Ala-Lys-Pro-Tyr-Ala-Gly-Pro-Tyr-Ala-Tyr- Ala-Asp-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala- Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOH) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT (PCT/US90/02923), которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,10 (4); Thr 0,98 (1); Ser 1,84 (2); Glu 2,03 (2); Pro 4,82 (5); Gly 2,97 (3); Ala 5,91 (6); Val 1,99 (2); Ile 1,88 (2); Leu 5, 09 (5); Tyr 4,10 (4); Phe 1,98 (2); Lys 3,03 (3); Arg 4,09 (4).
Пример 18. Получение Val-2-Ala-1{[Leu27]bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида Seq ID 36 GRF-аналога, имеющего формулу N 14 Val-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln- Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 3,98 (4); Thr 0,89 (1); Ser 1,76 (2); Gln 1,05 (1); Ala 3,87 (4); Val 1,85 (2); Ile 1,77 (2); Leu 5,17 (5); Tyr 2,04 (2); Phe 0,97 (1); Lys 2,07 (2); Arg 3,06 (3).
Пример 19. Получение Tyr-2-Thr-1{[Ala15Leu27]bGRF(1-29) NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 37 GRF-аналога, имеющего формулу N 15 Tyr-Thr-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Arg-Lys-Val-Leu-Ala- Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3 COOH), проводили постадийной, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,06 (4); Thr 1,86 (2); Ser 1,77 (2); Gln 2,07 (2); Ala 3,98 (4); Val 1,08 (1); Ile 1,89 (2); Leu 5,14 (5); Tyr 2,94 (3); Phe 0,96 (1); Lys 1,99 (2); Arg 3,04 (3).
Пример 20. Получение Tyr-2-Thr-1{[Ile2Ala15Leu27]bGRF (1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 38 GRF-аналога, имеющего формулу N 16 Tyr-Thr-Tyr-Ile-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu- Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (соль трифтороуксусной кислоты) проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,06 (4); Thr 1,87 (2); Ser 1,75 (2); Gln 2,07 (2); Ala 2,94 (3); Val 1,09 (1); Ile 2,87 (3); Leu 5,12 (5); Tyr 2,92 (3); Phe 0,96 (1); Lys 2,00 (2); Arg 3,05 (3).
Пример 21. Tyr-2-Thr-1{[Thr2Ala15Leu27] bGRF(1-29)NH2}. Получение соли трифтороуксусной кислоты.
Синтез пептида SegID 39 GRF-аналога, имеющего формулу N17 Tyr-Thr-Tyr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Ala-Gln- Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,05 (4); Thr 2,68 (3); Ser 1,77 (2); Gln 2,07 (2); Ala 2,90 (3); Val 1,08 (1); Ile 1,89 (2); Leu 5,20 (5); Tyr 2,87 (3); Phe 0,93 (1); Lys 2,01 (2); Arg 3,07 (3).
Пример 22. Получение Tyr-2-Ser-1{[Thr2Ala15Leu27] bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида SegID 40 GRF-аналога, имеющего формулу N18 Tyr-Ser-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Ala-Gln- Leu-Leu-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3 COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,11 (4); Thr 1,82 (2); Ser 2,64 (3); Glu 2,05 (2); Ala 2,90 (3); Val 1,04 (1); Ile 1,87 (2); Leu 5,16 (5); Tyr 2,92 (3); Phe 0,94 (1); Lys 2,01 (2); Arg 3,04 (3).
Пример 23. Получение Tyr-4-Thr-3Tyr-2- Thr-1{[Thr2Ala15Leu27] bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида Seg ID 41 GRF-аналога, имеющего формулу N19 Tyr-Thr-Tyr-Thr-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn- Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,06 (4); Thr 3,66 (4); Ser 1,85 (2); Glu 2,05 (2); Ala 2,93 (3); Val 1,09 (1); Ile 1,91 (2); Ser 5,15 (5); Tyr 3,91 (4); Phe 0,95 (1); Lys 2,00 (2); Arg 3,04 (3).
Пример 24. Получение Tyr-2-Ala-1{[Leu27] bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида Seg ID 42 GRF-аналога, имеющего формулу Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly- Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT/US90/02923, которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 4,01 (4); Thr 0,97 (1); Ser 1,88 (2); Glu 2,00 (2); Gly 1,02 (1); Ala 3,88 (4); Val 0,97 (1); Ile 1,86 (2); Leu 5,03 (5); Tyr 3,03 (3); Phe 0,96 (1); Lys 2,18 (2); Arg 3,03 (3).
Следующие соединения получены по методике A, приведенной в описании, в виде их трифторацетатных солей и подтвержденные данными аминокислотного и масс-спектрального анализов
N- α -(Tyr-Thr)-[Thr2Ala15, Leu27]bGRF(1-29)NH2, трифторацетат.
H-Tyr-Thr-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asp-Arg-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа (в скобках приведены теоретические значения): Asp 4.06 (4); Thr 2.69 (3); Ser 1.77 (2); Glu 2.07 (2); Ala 2.90 (3); Val 1.08 (1); Ile 1.89 (2); Leu 5.20 (5); Tyr 2.87 (3); Phe 0.93 (1); Lys 2.01 (2); Arg 3.07 (3).
N- α -(Tyr-Thr-Tyr-Thr)-[Thr2Ala15, Leu27]bGRF(1-29)NH2, трифторацетат.
H-Tyr-Thr-Tyr-Thr-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys- Val-Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа; в скобках приведены теоретические значения: Asp 4.06 (4); Thr 3.66 (4); Ser 1.85 (2); Glu 2.05 (2); Ala 2.93 (3); Val 1.09 (1); Ile 1.91 (2); Leu 5.15 (5); Tyr 3.91 (4); Phe 0.95 (1); Lys 2.00 (2); Arg 3.04 (3).
N- α -(Tyr-Thr)-[Ile2Ala15, Leu27]bGRF(1-29)NH2, трифторацетат.
H-Tyr-Thr-Tyr-Ile-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 4.07 (4); Thr 1.87 (2); Ser 1.75 (2); Glu 2.07 (2); Ala 2.94 (3); Val 1.09 (1); Ile 2.87 (3); Leu 5.12 (5); Tyr 2.92 (3); Phe 0.96 (1); Lys 2.00 (2); Arg 3.05 (3).
N- α -(Tyr-Ser)-[Thr2Ala15, Leu27]bGRF(1-29)NH2, трифторацетат.
H-Tyr-Ser-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn-Arg-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 4.11 (4); Thr 1.82 (2); Ser 2.64 (3); Glu 2.05 (2); Ala 2.90 (3); Val 1.04 (1); Ile 1.87 (2); Leu 5.16 (5); Tyr 2.92 (3); Phe 0.94 (1); Lys 2.01 (2); Arg 3.04 (3).
[Val2,Ser8Ala15, Leu27,Hse28]bGRF(1-28)NH2, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Hse-NH2 (CF3COOH).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 2.05 (2); Thr 0.99 (1); Ser 2.46 (3); Hse 0.25 (1); Glu 2.06 (2); Ala 3.09 (3); Val 2.02 (2); Ile 1.86 (2); Leu 5.01 (5); Tyr 1.96 (2); Phe 0.96 (1); Lys 2.00 (2); Arg 2.01 (2).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках 3213.5 (3213.8).
[Val2,Ser8Ala15, Leu27,Ser28Hse30]bGRF(1-30)NH2, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 2.03 (2); Thr 0.95 (1); Ser 3.24 (4); Hse 0.61 (1); Glu 2.06 (2); Ala 3.28 (3); Val 1.98 (2); Ile 1.84 (2); Leu 4.97 (5); Tyr 1.89 (2); Phe 0.90 (1); Lys 1.98 (2); Arg 2.92 (3).
Масс-спектр; теоретические значения (M+H)+ указаны в скобках 3456.6 (3457.0).
[Val2,Ser8Ala15, Leu27,Ser28,Hse33]bGRF(1-33)NH2, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Gln-Gln- Gly-Hse-NH2(CF3COOH, соль).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 2.04 (2); Thr 0.93 (1); Ser 3.23 (4); Hse 0.22 (1); Glu 4.19 (4); Gly 0.95 (1); Ala 3.21 (3); Val 1.93 (2); Ile 1.82 (2); Leu 4.96 (5); Tyr 1.91 (2); Phe 0.91 (1); Lys 1.99 (2); Arg 3.03 (3).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках 3770.1 (3770.4).
[Val2,Ser8,Ala15, Leu27,Ser28,Hse45]bGRF(1-45)NH2, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Gln-Gln-Gly- Glu-Arg-Asn-Gln-Glu-Gln-Gly-Ala-Lys-Val-Arg-Leu-Hse-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 3.05 (3); Thr 0.93 (1); Ser 3.20 (4); Hse 0.21 (1); Glu 8.41 (8); Gly 2.04 (2); Ala 4.17 (4); Val 2.83 (3); Ile 1.79 (2); Leu 5.96 (6); Tyr 1.88 (2); Phe 0.83 (1); Lys 2.94 (3); Arg 4.93 (5).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках 5179.3 (5179.9).
[Val2,Ser8Ala15, Leu27,Hse28]bGRF(1-28)NHC2H5, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Hse- NHC2H5(CF3COOH, соль).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках: 3241.8 (3241.8).
[Val2,Ser8Ala15, Leu27,Ser28,Hse33 ]bGRF(1-33)NHC2H5, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Gln-Gln-Gly- Hse-NHC2H5(CF3COOH, соль).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках: 3797.9 (3798.4).
[Val2,Ser8Ala15, Leu27,Ser28 ,Hse30]bGRF(1-30)NHC2H5, трифторацетат.
H-Tyr-Val-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NHC2H5(CF3COOH, соль).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 1.93 (2); Thr 0.87 (1); Ser 3.20 (4); Hse 0.42 (1); Glu 2.00 (2); Ala 3.08 (3); Val 1.98 (2); Ile 1.85 (2); Leu 4.99 (5); Tyr 1.96 (2); Phe 0.97 (1); Lys 2.19 (2); Arg 3.03 (3).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках 3485.4 (3485.1).
[Thr2 , Ser8,Ala15, Leu27,Ser28,Hse30]bGRF(1-30)NH2, трифторацетат.
H-Tyr-Thr-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NH2 (CF3COOH, соль).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках: 3458.7 (3459.0).
[Ile2,Ser8,Ala15, Leu27,Ser28,Hse30 ]bGRF(1-30)NH2, трифторацетат.
H-Tyr-Ile-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NH2 (CF3COOH, соль).
Результаты аминокислотного анализа, в скобках указаны теоретические значения: Asp 2.04 (2); Thr 0.93 (1); Ser 3.41 (4); Hse 0.56 (1); Glu 2.04 (2); Ala 3.01 (3); Val 1.13 (1); Ile 2.93 (3); Leu 5.11 (5); Tyr 2.00 (2); Phe 0.96 (1); Lys 1.99 (2); Arg 2.93 (3).
Масс-cпектр, теоретические значения (M+H)+ указаны в скобках: 3470.4 (3471.1).
[Ile2,Ser8,Ala15, Leu27,Ser28,Hse30]bGRF(1-30)NHC2H5, трифторацетат.
H-Tyr-Ile-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NHC2 H5(CF3COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 2.01 (2); Thr 0.94 (1); Ser 3.35 (4); Hse 0.47 (1); Glu 2.01 (2); Ala 3.03 (3); Val 1.14 (1); Ile 2.89 (3); Leu 5.12 (5); Tyr 1.99 (2); Phe 0.97 (1); Lys 1.97 (2); Arg 3.00 (3).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках: 3498.7 (3499.2).
[Ile2,Ser8,Ala15, Leu27,Ser28,Hse30]bGRF(1-30)NHC2H5, ацетат.
H-Tyr-Ile-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NHC2 H5(CH3COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 2.16 (2); Thr 0.93 (1); Ser 3.31 (4); Hse 0.62 (1); Glu 1.98 (2); Ala 3.01 (3); Val 1.04 (1); Ile 2.79 (3); Leu 4.97 (5); Tyr 1.94 (2); Phe 0.96 (1); Lys 2.18 (2); Arg 3.63 (3).
Масс-спектр, теоретические значения (M+H)+ указаны в скобках: 3499.9 (3499.2).
[His1 ,Ile2,Ser8, Leu27,Ser28,Hse30]bGRF(1-30)NHC2H5, трифторацетат.
H-His-Ile-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NHC2 H5(CF3COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 1.94 (2); Thr 0.91 (1); Ser 3.23 (4); Hse 0.91 (1); Glu 1.97 (2); Gly 0.96 (1); Ala 1.93 (2); Val 0.97 (1); Ile 2.80 (3); Leu 4.90 (5); Tyr 0.96 (1); Phe 0.96 (1); His 0.94 (1); Lys 1.93 (2); Arg 3.70 (3).
Масс-спектр, в скобках указаны теоретические значения (M+H)+: 3460.3 (3459.1).
[His1, Ile2, Ser8,Ala15, Leu27,Ser28,Hse30]bGRF(1-30)NHC2H5, трифторацетат.
H-His-Ile-Asp-Ala-Ile-Phe-Thr-Ser-Ser-Tyr-Arg-Lys-Val- Leu-Ala-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Ser-Arg-Hse-NHC2 H5(CF3 COOH, соль).
Результаты аминокислотного анализа, в скобках приведены теоретические значения: Asp 1.91 (2); Thr 0.88 (1); Ser 3.39 (4); Hse 0.26 (1); Glu 1.90 (2); Ala 2.86 (3); Val 0.99 (1); Ile 2.79 (3); Leu 5.02 (5); Tyr 0.95 (1); Phe 0.95 (1); His 0.92 (1); Lys 1.96 (2); Arg 3.73 (3).
Масс-спектр, в скобках указаны теоретические значения (M+H)+: 3473.0 (3473.1).
Пример 25. Получение Tyr-4-Ala-3Tyr-2- Ala-1{[Leu27] bGRF(1-29)NH2}, соли трифтороуксусной кислоты.
Синтез пептида SeqID 43 GRF-аналога, имеющего формулу N13 Tyr-Ala-Tyr-Ala-Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val- Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Leu-Asn- Arg-NH2 (как соль CF3COOH), проводили постадийно, аналогично процедуре A, описанной в опубликованной заявке на патент PCT (PCT/US90/02923), которая вводится в настоящее описание посредством ссылки. Аминокислотный анализ (теоретические значения указаны в скобках): Asp 3,97 (4); Thr 0,90 (1); Ser 1,74 (2); Gln 1,98 (2); Gly 1,04 (1); Ala 4,85 (5); Val 0,91 (1); Ile 1,77 (2); Leu 5,13 (5); Tyr 4,14 (4); Phe 0,99 (1); Lys 2,07 (2); Arg 3,05 (3).
В табл. 4-6 приведены результаты исследований ответной реакции на введение бычкам инъекции производных пептидов ряда GRF.
Список последовательностей
(I) Общая информация:
(I) Заявитель
(II) Название изобретения: гибридные полипептиды
(III) Число последовательностей: 42
(IV) Почтовый адрес:
(А)
Адрес:
(B) Улица:
(C) Город:
(C) Штат:
(E) Страна: США
(F) Почтовый индекс: 49001
(V) Форма машинного
считывания:
(A) Тип носителя:
дискета (3М 3,5, двусторонняя DS - 1,0 МВ)
(B) Компьютер: совместимый IBM PC
(C) Операционная система: PC-DOS/MS - DOS
(D) Программное
обеспечение: WordPerfect 5,1
(VI) Текущие данные заявки:
(A) Номер заявки:
(B) Дата подачи:
(С) Классификация:
(VII) Данные предшествующей заявки:
(A) Номер заявки: US 07/626, 727
(B) Дата подачи: 13/12/90
(VII) Данные предшествующей заявки:
(A) Номер заявки: US 07/614, 170
(B) Дата подачи: 14/11/90
(VII) Данные предшествующей
заявки:
(A) Номер заявки: PCT/US90/02923
(B) Дата подачи: 30/05/90
(VII) Данные предшествующей заявки:
(A) Номер заявки: US 07/368,
231
(B) Дата подачи:
16/06/89
(VII) Данные предшествующей заявки:
(A) Номер заявки: US 07/506, 605
(B) Дата подачи: 09/04/90
(VIII) Информация и
поверенном/агенте:
(A) Имя;
фамилия:
(B) Регистрационный номер: 33229
(C) Номер документа/досье: 4595
(IX) Телекоммуникационная информация:
(A) Телефон:
616 385 5210
(B) Телефакс:
616 385 6897
(2) Данные последовательности ID N 1:
(1) Характеристики последовательности:
(A) Длина: 33
(B) Тип:
аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 1:

(3) Данные последовательности ID N 2;
(1) Характеристики последовательности:
(A) Длина: 40
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 2:

(4) Данные последовательности ID N 3:
(1) Характеристики последовательности:
(A) Длина: 29
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 3:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 29
(XI) Описание последовательности ID N 3:

(5) Данные последовательности ID N 4:
(1) Характеристики последовательности:
(A) Длина: 29
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 29
(XI) Описание последовательности ID N 4:

(6) Данные последовательности ID N 5:
(1) Характеристики последовательности:
(A) Длина: 29
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C- терминально амидированный аргининиловый остаток.
(B) Локализация: Xaa 29
(XI) Описание последовательности ID N 5:

(7) Данные последовательности ID N 6:
(1) Характеристики последовательности:
(A) Длина: 6
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 6:

(8) Данные последовательности ID N 7:
(1) Характеристики последовательности:
(A) Длина: 8
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 7:

(9) Данные последовательности ID N 8:
(1) Характеристики последовательности:
(A) Длина: 6
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 8:

(10) Данные последовательности ID N 9:
(1) Характеристики последовательности:
(A) Длина: 8
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 9:

(II) Данные последовательности ID N 10:
(I) Характеристики последовательности:
(A) Длина: 10
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 10:

(12) Данные последовательности ID N 11:
(1) Характеристики последовательности:
(A) Длина: 12
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности: ID N 11:

(13) Данные последовательности ID N 12:
(1) Характеристики последовательности:
(A) Длина: 14
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 12:

(14) Данные последовательности ID N 13:
(I) Характеристики последовательности:
(A) Длина: 16
(B) Тип: аминокислотная
(D): Топология: линейная
(XI) Описание последовательности ID N 13:

(15) Данные последовательности ID N 14:
(I) Характеристики последовательности:
(A) Длина: 29
(B) Тип: аминокислотная
(D): Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 29
(XI) Описание последовательности ID N 14:

(16) Данные последовательности ID N 15:
(I) Характеристики последовательности:
(A) Длина: 11
(B) Тип: аминокислотная
(D): Топология: линейная
(XI) Описание последовательности ID 15:
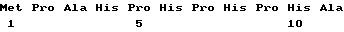
(17) Данные последовательности ID N 16:
(I) Характеристики последовательности:
(A) Длина: 11
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID 16:

(18) Данные последовательности ID N 17:
(I) Характеристики последовательности:
(A) Длина: 11
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID 17:

(19) Данные последовательности ID N 18:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 31
(XI) Описание последовательности ID 18:

(20) Данные последовательности ID N 19:
(I) Характеристики последовательности:
(A) Длина: 33
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 33
(XI) Описание последовательности ID 19:

(21) Данные последовательности ID N 20:
(I) Характеристики последовательности:
(A) Длина: 39
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 39
(XI) Описание последовательностей ID N 20:

(22) Данные последовательности ID N 21:
(I) Характеристики последовательности:
(A) Длина: 45
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 45
(XI) Описание последовательностей ID N 21:

(23) Данные последовательности ID N 22:
(I) Характеристики последовательности:
(A) Длина: 10
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 22:

(24) Данные последовательности ID N 23:
(I) Характеристики последовательности:
(A) Длина: 16
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Описание последовательности ID N 23:

(25) Данные последовательности ID N 24:
(I) Характеристики последовательности:
(A) Длина: 27
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 27
(XI) Описание последовательности ID N 24:

(26) Данные последовательности ID N 25:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 31
(XI) Описание последовательности ID N 25:

(27) Данные последовательности ID N 26:
(I) Характеристики последовательности:
(A) Длина: 33
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 33
(XI) Описание последовательности ID N 26:

(28) Данные последовательности ID N 27:
(I) Характеристики последовательности:
(A) Длина: 35
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 35
(XI) Описание последовательности ID N 27:

(29) Данные последовательности ID N 28:
(I) Характеристики последовательности:
(A) Длина: 37
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 37
(XI) Описание последовательности ID N 28:

(30) Данные последовательности ID N 29:
(I) Характеристики последовательности:
(A) Длина: 33
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa 33
(XI) Описание последовательности ID N 29:

(31) Данные последовательности ID N 30:
(I) Характеристики последовательности:
(A) Длина: 35
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа35
(XI) Описание последовательности ID N 30:

(32) Данные последовательности ID N 31:
(I) Характеристики последовательности:
(A) Длина: 37
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа37
(XI) Описание последовательности ID N 31:

(33) Данные последовательности ID N 32:
(A) Длина: 39
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа39
(XI) Описание последовательности ID N 32:

(34) Данные последовательности ID N 33:
(I) Характеристики последовательности:
(A) Длина: 41
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа41
(XI) Описание последовательности ID N 33:

(35) Данные последовательности ID N 34:
Характеристики последовательности:
(A) Длина: 43
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа43
(XI) Описание последовательности ID N 34:

(36) Данные последовательности ID N 35:
(I) Характеристики последовательности:
(A) Длина: 45
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название ключ/: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа45
Описание последовательности ID N 35:
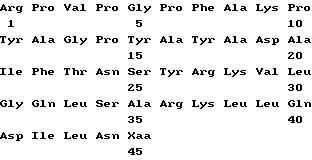
(37) Данные последовательности ID N 36:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название ключ/: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа31 (XI) Описание последовательности ID N 36:

(38) Данные последовательности ID N 37:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа31
(XI) Описание последовательности ID N 37:

(39) Данные последовательности ID N 38:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа31
(XI) Описание последовательности ID N 38:

(40) Данные последовательности ID N 39:
(I) (A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(XI) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа31
(XI) Описание последовательности ID N 39:

(41) Данные последовательности ID N 40:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа31
(XI) Описание последовательности ID N 40:

(42) Данные последовательности ID N 41:
(I) Характеристики последовательности:
(A) Длина: 33
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Хаа33
(XI) Описание последовательности ID N 41:

(43) Данные последовательности ID N 42:
(I) Характеристики последовательности:
(A) Длина: 31
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa31
(XI) Описание последовательности ID N 42:

(44) Данные последовательности ID N 43:
(I) Характеристики последовательности:
(A) Длина: 33
(B) Тип: аминокислотная
(D) Топология: линейная
(IX) Отличительные особенности:
(A) Название/ключ: C-терминально амидированный аргининиловый остаток
(B) Локализация: Xaa33
(XI) Описание последовательности ID N 43:

Реферат
Применение: в биологии и
медицине для создания лекарств пролонгированного действия. Сущность изобретения: слитой
белок, не встречающийся в природе, содержащий удлиняющий пептидный фрагмент, ковалентно-связанный своим C-концом
с N-концом центральной части белка, общей формулы I:
A - X - Y - (X1 - Y)n - белок,
где A = H, Met; причем, если A = H, то белок - аналог bGRA, если A = Met, то
белок Bur - PHказа4; X = Ala, Ser, Tyr, Val, Arg, Gly, Lys, Pro, Phe; y = Ala,
Ser, Pro; X1 = Ala, Gly, Jle, His, Lys, Phe, Tys; n = 0 - 4, причем если n = 0, а A = H, y = Ala, Ser, Thr.
Способ выделения слитого белка формулы I, где A = Met; n = 4; X = Ala, Gly, Pro;
y = Ala, Pro, X1 = His; "белок" = BUR - PH; путем колоночной хроматографии на сефарозе Pharmacia, включающей
иммобилизованные ионы металла. 2 с. и 7 з.п. ф-лы, 6 табл.
Формула
A-X-Y-(X'-Y)n-белок,
где A - водород или Met, причем если A - водород, то белок - аналог bGRF,
если A - Met, то белок Bur-PHказаH;
X - аминокислотный остаток, выбранный из группы Ala, Arg, Gly, Lys, Pro, Phe, Ser, Tyr, Val;
Y - аминокислотный остаток, выбранный из группы Ala, Ser, Thr, Pro;
X' - аминокислотный остаток, выбранный из группы Ala, Gly, Ile, His, Lys, Phe, Tyr;
n = 0 - 7, причем если n = 0, а A - водород, то Y - Ala, Thr, Ser.
Tyr - Ala, Gly - Pro - (Ile - Pro), Gly - Pro - (Tyr - Ala), Tyr - Ala - (Tyr - Ala), Val - Ala.
A-X-Y-(X'-Y)n-белок,
где A - Met;
n = 4;
X = Ala, Gly, Pro;
Y = Ala, Pro;
X' - His;
белок - Bur - PHказа H,
путем колоночной хроматографии на сефарозе, включающей иммобилизованные ионы металла.

Комментарии