Ротавирусные частицы с химерными поверхностными белками - RU2698049C2
Код документа: RU2698049C2
Чертежи





Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет на основании Европейской заявки на выдачу патента № 13175637.1, поданной 8 июля 2013. Полное содержание указанной выше заявки включено в настоящее описание в виде ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
С настоящим документом подана электронная копия списка последовательностей, которая включена в настоящее описание в виде ссылки и составляет часть поданной заявки.
ПОДДЕРЖКА ПРАВИТЕЛЬСТВА
Настоящее изобретение осуществлено при поддержке правительства США по грантам № P01-GM062580 и AI-89618, присужденным Национальными институтами здоровья. Правительство США обладает определенными правами на изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к применению ротавирусных частиц для дисплея гетерологичного белка, отдельно или в комплексе с другой молекулой. Кроме того, изобретение относится к способам, в которых применяют такие модифицированные ротавирусные частицы для быстрого определения структуры гетерологичного белка или комплекса с использованием криоэлектронной микроскопии (крио-ЭМ). Изобретение также относится к способу иммунизации пациента, при этом указанный способ включает в себя введение пациенту модифицированных ротавирусных частиц согласно изобретению.
УРОВЕНЬ ТЕХНИКИ
Семейство Reoviridae включает в себя структурно родственную группу вирусов. Представители данного семейства вирусов могут вызывать инфекции желудочно-кишечного тракта и дыхательных путей у млекопитающих и птиц. Некоторые вирусы данного семейства также могут инфицировать растения.
Reoviridae представляют собой не покрытые оболочкой двунитевые РНК-вирусы, состоящие из икосаэдрического капсида, который обычно состоит из внешнего белкового слоя и одного или нескольких внутренних белковых слоев. Род Rotavirus составляет часть семействаReoviridae. Ротавирусы образуют трехслойные вирусные частицы. Наружный слой ротавирусной частицы состоит из белка оболочки, VP7, и белка шипа, VP4; средний слой состоит из VP6; и внутренний слой образован VP2. Трехслойная вирусная частица становится инфекционной после активации трипсином. Во время проникновения ротавируса в клетку наружный слой вирусных частиц удаляется за счет механизма, названного «декапсидацией», и двухслойная частица проникает в цитоплазму. Во время проникновения в клетку ротавирус проникает через клеточную мембрану, возможно эндосомную мембрану. Двухслойная ротавирусная частица является транскрипционно активной. В цитоплазме она транскрибирует геном, выталкивая мРНК через поры на своей поверхности. Новые транскрипты используются для получения ротавирусных белков и новых участков генома в виде двунитевой РНК, которые упаковываются в новообразованные вирусные частицы.
В случае некоторых Reoviridae процесс декапсидации может быть имитирован in vitro с использованием очищенных вирусных частиц. В случае ротавирусов хелатирование кальция или тепловой шок вызывают декапсидацию вирусных частиц in vitro. После удаления наружного слоя белка полученные в результате двухслойные ротавирусные частицы могут быть повторно покрыты («рекапсидированы») рекомбинантно экспрессированными вариантами белков, которые образуют наружный слой. При повторном покрывании рекомбинантными VP4 и VP7 могут быть образованы инфекционные рекапсидированные ротавирусные частицы, которые очень похожи на зрелые вирионы. При повторном покрывании (рекапсидации) только VP7 могут быть образованы трехслойные не содержащие шипа частицы, которые минимально инфекционны. Посредством генетической модификации кодирующих областей индивидуальных белков наружного слоя и их рекомбинантной экспрессии можно исследовать свойства белков, составляющих наружный слой, в экспериментах по рекапсидации без необходимости в получении полностью рекомбинантных вирусов. Для описания таких типов экспериментов был придуман термин «генетика рекапсидации».
В случае реовирусов метастабильное состояние инфекционно субвирусной частицы позволило использовать криоэлектронную микроскопию (крио-ЭМ) для выяснения структурной основы механизма инициации, который используется реовирусами для проникновения в их клетки-хозяева. Подобным образом, рекапсидированные in vitro ротавирусные частицы были использованы для исследования молекулярных взаимодействий при сборке и декапсидации ротавирусов с использованием крио-ЭМ. Настоящее изобретение опирается на технологические преимущества, которые были обусловлены указанными исследованиями по рекапсидации и крио-ЭМ-исследованиями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Сочетание крио-ЭМ высокого разрешения и генетики рекапсидации сделало возможным расширить применение ротавирусной модели за рамки исследования самих ротавирусов. Авторы изобретения обнаружили, что ротавирусные частицы могут быть применены для быстрого определения структуры гетерологичных тримерных белков, которые представлены в виде дисплея на поверхности модифицированных ротавирусных частиц. Ротавирусные частицы, модифицированные для дисплея гетерологичных тримерных белков на их поверхности, также применимы для получения широкого диапазона новых вакцин.
Настоящее изобретение относится к ротавирусным частицам, содержащим химерный поверхностный белок, состоящий из поверхностного белка ротавируса, связанного с гетерологичным белком. В одном аспекте изобретения поверхностный белок ротавируса связан с гетерологичным белком через линкерную последовательность. В другом аспекте изобретения поверхностный белок ротавируса связан с гетерологичным белком через адаптерную систему. В предпочтительном аспекте изобретения гетерологичный белок нековалентно связан с поверхностным белком ротавируса состоящей из двух частей адаптерной системой, при этом одна часть адаптерной системы связана с поверхностным белком ротавируса, а другая часть адаптерной системы связана с гетерологичным белком, при этом обе части адаптерной системы образуют стабильный комплекс, таким образом нековалентно связывая гетерологичный белок с поверхностным белком ротавируса. Химерный поверхностный белок может стать частью наружного слоя ротавирусной частицы при повторном покрывании им (рекапсидации) двухслойных ротавирусных частиц (DLP) in vitro.
Изобретение, кроме того, относится к первой нуклеиновой кислоте, содержащей открытую рамку считывания, кодирующую модифицированный ротавирусный поверхностный белок, содержащий поверхностный белок ротавируса, первый адаптерный полипептид и, необязательно, линкерную последовательность. Изобретение также относится ко второй нуклеиновой кислоте, содержащей открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок, второй адаптерный полипептид и, необязательно, линкерную последовательность. Первый адаптерный полипептид и второй адаптерный полипептид способны образовывать стабильный комплекс. Обычно открытая рамка считывания в нуклеиновых кислотах согласно изобретению оперативно связана с последовательностью промотора. В некоторых вариантах адаптерный полипептид содержит гептадную повторяющуюся последовательность. Также предлагается клетка, содержащая нуклеиновую кислоту согласно изобретению. Нуклеиновые кислоты и клетки, содержащие такие нуклеиновые кислоты, можно применять для получения химерных поверхностных белков согласно изобретению.
Изобретение, кроме того, относится к набору, содержащему первую и вторую последовательности нуклеиновых кислот согласно изобретению. В некоторых вариантах набор согласно изобретению может содержать первую нуклеиновую кислоту, кодирующую модифицированный ротавирусный поверхностный белок, содержащий поверхностный белок ротавируса и первый адаптерный полипептид, и вторую нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую второй адаптерный полипептид и сайт множественного клонирования, при этом инсерция кодирующей области гетерологичного белка в сайт множественного клонирования дает открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок и второй адаптерный полипептид, при этом первый адаптерный полипептид и второй адаптерный полипептид способны образовывать стабильный комплекс. Наборы согласно изобретению дополнительно могут содержать ротавирусную частицу. Ротавирусная частица может быть получена из того же вида ротавируса, из которого был получен ротовирусный поверхностный белок, или из другого вида. Например, можно использовать VP7 ротавируса макаки-резус для повторного покрывания DLP, полученных из бычьего ротавируса, и наоборот.
Ротавирусные частицы, содержащие химерный поверхностный белок, могут быть получены различными способами. Предпочтительный способ согласно изобретению заключается в размножении нативной ротавирусной частицы, содержащей наружный слой, в клетке, выращенной в культуральной среде, очистке частиц из культуральной среды, удалении наружного слоя из частицы с получением ротавирусной DLP, и повторного покрывании (рекапсидации) ротавирусной DLP одним или несколькими химерными поверхностными белками с образованием ротавирусной частицы, содержащей химерный поверхностный белок или белки. Нативная ротавирусная частица представляет собой трехслойную частицу, при этом самый наружный слой образует внешнюю оболочку ротавирусной частицы.
В конкретном аспекте изобретение относится к первому слитому белку, содержащему образующий тример ротавирусный поверхностный белок, гептадную повторяющуюся последовательность и необязательно линкерную последовательность. Изобретение, кроме того, относится ко второму слитому белку, содержащему образующий тример гетерологичный белок, гептадную повторяющуюся последовательность и необязательно линкерную последовательность. Первый слитый белок и второй слитый белок способны образовывать стабильный комплекс за счет гептадных повторяющихся последовательностей, имеющихся в каждом из них. В некоторых вариантах изобретение относится к химерному поверхностному белку, образованному первым слитым белком и вторым слитым белком. Химерный поверхностный белок может быть представлен в виде дисплея на поверхности ротавирусной частицы.
В одном аспекте изобретения ротавирусные частицы, содержащие химерный поверхностный белок, применяют для определения структуры гетерологичного белка, который образует часть химерного поверхностного белка. Например, изобретение относится к способу получения трехмерной модели химерного поверхностного белка, при этом способ включает в себя стадии (i) повторного покрывания (рекапсидации) ротавирусной DLP химерным поверхностным белком, содержащим весь или часть гетерологичного белка, с получением суспензии ротавирусных частиц, на которых представлен химерный поверхностный белок, (ii) замораживания суспензии, (iii) визуализации ротавирусных частиц с использованием крио-ЭМ с получением множества микрофотографий, и (iv) анализа множества микрофотографий с получением трехмерной модели химерного поверхностного белка. В некоторых вариантах стадия (i) может быть подразделена на две стадии, а именно (a) стадию рекапсидации, на которой ротавирусную DLP повторно покрывают ротавирусным поверхностным белком, содержащим первый адаптер, с получением ротавирусных частиц и (b) стадию связывания, на которой ротавирусную DLP инкубируют в присутствии гетерологичного белка, содержащего второй адаптер, при этом образуется комплекс между первым адаптером и вторым адаптером с образованием в результате химерного поверхностного белка, представленного в виде дисплея на ротавирусных частицах. В некоторых случаях способ может быть модифицирован для определения структуры гетерологичного белка, связанного с молекулой, которая специфично связывается с гетерологичным белком. Модифицированный способ включает в себя стадии (i) рекапсидации ротавирусной DLP химерным поверхностным белком, содержащим весь или часть гетерологичного белка, с получением суспензии ротавирусных частиц, на которых представлен химерный поверхностный белок, (ii) добавления к суспензии молекулы, которая специфично связывается с гетерологичным белком, при этом молекула образует комплекс с химерным поверхностным белком, (iii) замораживания суспензии, (iv) визуализации ротавирусных частиц с использованием крио-ЭМ с получением множества микрофотографий, и (v) анализа множества микрофотографий с получением трехмерной модели химерного поверхностного белка в комплексе с молекулой. Молекула может представлять собой белковую молекулу. Например, белковая молекула может представлять собой весь или часть рецептора или антитела, которое специфично связывает гетерологичный белок. Альтернативно, белковая молекула может представлять собой полипептид или пептид, который специфично связывается с гетерологичным белком. В других вариантах молекула является небелковой молекулой. Например, небелковой молекулой может быть нуклеиновая кислота.
В следующем аспекте ротавирусные частицы, полученные согласно изобретению, применяют в качестве лекарственного средства. В одном варианте изобретение относится к иммуногенной композиции, содержащей ротавирусную частицу, которая содержит химерный поверхностный белок согласно изобретению. Изобретение, кроме того, относится к способу лечения пациента, нуждающегося в таком лечении, включающему в себя введение указанному пациенту ротавирусной частицы согласно изобретению, например, в форме иммуногенной композиции согласно изобретению.
Принцип, лежащий в основе изобретения, может быть распространен на другие (тримерные или нетримерные) гетерологичные белки и другие вирусы (в частности, реовирусы) или сборные структуры (например, вирусоподобные частицы, ферритиновые клетки и т.д.) благодаря адаптации способов, описанных в настоящей публикации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Вирусные частицы
Ротавирусы представляют собой род вирусов, содержащих двунитевую РНК, в семействе Reoviridae, включающий в себя пять известных типов (ротавирусы A-E). Ротавирусы являются основной причиной гастроэнтерита у детей. Ротавирус представляет собой не покрытую оболочкой трехслойную икосаэдрическую частицу. Инфекционная трехслойная частица (TLP) или вирион образуется из неинфекционной двухслойной частицы (DLP) в результате покрывания DLP белком оболочки VP7 и белком шипа VP4. VP7 является тримером, и 260 таких тримеров нанесены на наружную поверхность покрытой частицы. DLP, которая состоит из концентрических икосаэдрических слоев белков VP2 и VP6, имеет диаметр около 700 Å и заключает в капсид 11 двунитевых фрагментов геномной РНК, вирусную полимеразу (VP1), и фермент кэпирования (VP3). Во время инфекции клетки белки VP4 и VP7, которые образуют наружный слой ротавирусной частицы, диссоциируют из DLP в среде с низким содержанием кальция (вероятно в эндосомном компартменте) – в процессе, называемом «декапсидацией» – и происходит доставка DLP, содержащей механизм транскрипции вирусной РНК, в цитоплазму. В цитоплазме DLP синтезирует, кэпирует и высвобождает копии 11 видов мРНК.
Диссоциация или «декапсидация» VP4 и VP7 из ротавирусной частицы может быть осуществлена in vitro в результате инкубации ротавирусных частиц в присутствии хелатора кальция, такого как EDTA или EGTA, или под действием теплового шока. Полученные в результате DLP могут быть повторно покрыты in vitro рекомбинантно экспрессированными VP4 и VP7 с образованием полностью инфекционных ротавирусных частиц. Частицы, повторно покрытые таким образом, очень хорошо упорядочены и позволяют получать изображения крио-ЭМ с высоким разрешением и карты плотности. В случае использования реконструированных in vitro TLP применяли крио-ЭМ для исследовании молекулярных взаимодействий при сборке и декапсидации ротавирусов при разрешении, сравнимом с разрешением рентгеновской кристаллографии (смотри публикации 1 и 2).
В настоящем описании авторы изобретения демонстрируют, что гетерологичный тримерный белок (такой как гемагглютинин вируса гриппа) может быть связан с тримерным белком VP7 с образованием таким образом химерного поверхностного белка, который может выступать с поверхности соответствующим образом рекапсидированной ротавирусной DLP, что соответственно делает возможным определение структуры гетерологичного белка с использованием таких же способов крио-ЭМ, которые ранее позволили получить структуры ротавируса и его субчастиц почти с атомарным разрешением. Способ впервые позволяет разработать высокопроизводительный анализ для определения структуры комплексов антиген-антитело. Ранее это не представлялось возможным вследствие ограничений рентгеновской кристаллографии, которая была предпочтительным способом определения структуры комплексов антиген-антитело.
В принципе, любую не имеющую оболочки икосаэдрическую вирусную частицу, содержащую внутренний слой и наружный слой, можно использовать при практическом осуществлении способов согласно изобретению. Например, представление в виде дисплея химерного поверхностного белка, содержащего весь или часть гетерологичного белка, легко возможно с использованием любого икосаэдрического вируса, для которого разработана обратная генетическая система для получения вирусных частиц. Основанная на плазмиде обратная генетическая система, состоящая из десяти конструкций реовирусной кДНК была разработана для реовирусов млекопитающих (смотри публикацию 3). Октамерная симметрия ферритиновых клеток также имеет оси симметрии 3-го порядка и подходит для практического осуществления настоящего изобретения. Другие белки, которые собираются в имеющие форму частиц регулярные структуры с осями симметрии 3-го порядка, могут быть подходящими для практического осуществления настоящего изобретения.
В идеальном варианте наружный слой вирусной частицы не покрытого оболочкой икосаэдрического вируса может быть удален или сорван, например, с использованием обработки протеазой или в условиях низкого содержания кальция с получением субвирусных частиц, которые содержат только внутренний слой(слои) и могут быть повторно покрыты рекомбинантно полученными белками наружного слоя. Повторная сборка или рекапсидация in vitro субвирусных частиц до полных вирусных частиц в результате добавления рекомбинантно экспрессированного белка(белков) наружного слоя является особенно предпочтительной в случаях, когда присутствие химерного поверхностного белка может мешать правильной сборке вируса, размножаемого в культуре клеток, с использованием способа обратной генетики. Кроме того, необходимо сконструировать только экспрессирующие векторы для белков наружного слоя, при этом исключается необходимость в использовании вместо этого эффективной основанной на плазмиде обратной генетической системе. Нативный вирус может быть просто размножен в клетках в культуре ткани, и с вирусных частиц может быть сорван наружный слой и они могут быть повторно собраны in vitro с использованием рекомбинантно экспрессированных белков наружного слоя. Таким образом, применение способа, который основан на рекапсидации in vitro субвирусных частиц до получения полных вирусных частиц, исключает необходимость в трансфекции больших количеств плазмид и исключает дополнительную стадию размножения, обычно необходимую для получения больших количеств вирусных частиц в основанной на плазмидах обратной генетической системе, что делает такой способ более привлекательным для высокопроизводительных применений.
Насколько известно авторам изобретения, все известные не покрытые оболочкой икосаэдрические вирусы, в случае которых наружный слой вирусной частицы может быть сорван и субвирусная частица может быть повторно покрыта рекомбинантно экспрессированными белками наружного слоя с образованием инфекционных вирусных частиц, относятся к семейству Reoviridae. Указанное семейство подразделяют на два подсемейства, Sedoreovirinae и Spinareovirinae, которые включают в себя шесть и девять родов, соответственно. Надсемейство Sedoreovirinae включает в себя роды Cardoreovirus, Mimoreovirus, Orbivirus, Phytoreovirus, Rotavirus и Seadornavirus. Надсемейство Spinareovirinae включает в себя роды Aquareovirus, Coltivirus, Cypovirus, Dinovernavirus, Fijivirus, Idnoreovirus, Mycoreovirus, Orthoreovirus и Oryzavirus.
Кроме ротавирусов, ортореовирусы млекопитающих могут быть применимы при практическом осуществлении изобретения. Для таких вирусы хорошо установлены подходящие условия для полной сборки in vitro наружного капсида и применения крио-ЭМ (смотри публикации 1, 2, 4 и 5). Другие ортореовирусы (например, ортореовирусы бабуинов или птиц), оризавирус (например, вирус лохматой карликовости риса) и аквареовирусы, в случае которых использовали крио-ЭМ и в отношении которых уже доступна структурная информация (смотри публикации 6, 7 и 8) также могут быть подходящими для практического осуществления изобретения.
Циповирусы и диновернавирусы имеют эквивалент только внутреннего капсида и поэтому обычно не считаются подходящими для практического осуществления изобретения и, следовательно, считаются менее предпочтительными. В некоторых вариантах не покрытые оболочкой икосаэдрические вирусы для применения в изобретении не включают циповирусы и диновернавирусы. В предпочтительном варианте с вирусами согласно изобретению можно работать на уровне биологической безопасности 2 или ниже (смотри публикацию 9).
Предпочтительно вирусная частица, применяемая при практическом осуществлении изобретения, имеет три или меньше белков наружного слоя. Более предпочтительно наружный слой вирусной частицы может быть образован одним белком наружного слоя, который представляет собой наружный поверхностный белок, используемый для получения химерного поверхностного белка. Небольшое количество белков наружного слоя является предпочтительным, поскольку нужно рекомбинантно экспрессировать меньше белков для повторного покрывания субвирусных частиц после срывания.
Например, ротавирус имеет два белка наружного слоя, VP4 и VP7, то только VP7 является белком капсида, который необходим для образования наружного слоя ротавирусной частицы. В большинстве случаев рекапсидация ротавирусных DLP только одним белком наружного слоя, VP7, достаточна для практического осуществления изобретения.
Химерный поверхностный белок
В одном аспекте изобретение относится к химерному поверхностному белку, содержащему поверхностный белок ротавируса, ковалентно связанный с гетерологичным белком. Поверхностный белок ротавируса может быть связан с гетерологичным белком через линкерную последовательность. В конкретном варианте гетерологичный белок встроен в гибкую петлю поверхностного белка ротавируса, которая является экспонируемой на наружной поверхности частью. В некоторых случаях части поверхностного белка ротавируса делетируют для лучшего размещения линкерной последовательности и/или гетерологичного белка. Например, короткие N-концевые и C-концевые укорочения (≤10 аминокислот) обычно не влияют на способность ротавирусного белка VP7 повторно покрывать ротавирусные DLP. Кроме того, аминокислотные последовательности, которые образуют поверхностные петли, которые выступают из вирусной частицы, в случае использования белка VP7 для повторного покрывания DLP не обязательны. Оказывает ли делеция влияние на способность белка VP7 повторно покрывать DLP, можно оценить, инкубируя рекомбинантно экспрессированный белок VP7 в присутствии DLP и наблюдая образование повторно покрытых вирусных частиц.
В другом аспекте изобретения поверхностный белок ротавируса нековалентно связан с гетерологичным белком через адаптерную систему. В предпочтительном аспекте изобретения гетерологичный белок нековалентно связан с поверхностным белком ротавируса состоящей из двух частей адаптерной системой, при этом одна часть адаптерной системы связана с поверхностным белком ротавируса, а другая часть адаптерной системы связана с гетерологичным белком, при этом обе части адаптерной системы образуют стабильный комплекс, таким образом нековалентно связывая гетерологичный белок с поверхностным белком ротавируса. Адаптерная система обычно состоит из первого адаптерного полипептида и второго адаптерного полипептида. Первый адаптерный полипептид слит с поверхностным белком ротавируса, необязательно через линкерную последовательность. Второй адаптерный полипептид слит с гетерологичным белком, необязательно через линкерную последовательность. Первый и второй адаптерные полипептиды взаимодействуют друг с другом с образованием стабильного комплекса, таким образом нековалентно связывая поверхностный белок ротавируса с гетерологичным белком, тем самым образуя химерный поверхностный белок.
Вирусный поверхностный белок
Наружный слой вирусной частицы, подходящей для практического осуществления изобретения, обычно содержит несколько разных наружных поверхностных белков. Основной поверхностный белок является особенно подходящим для дисплея гетерологичного белка, так как он покрывает большую часть поверхности вирусной частицы. Например, наружная поверхность ротавируса (за исключением шипов) образована 780 копиями белка VP7, который образует гомотримеры. Выбор вирусной частицы с большим поверхностным белком, который образует гомотримеры, является особенно предпочтительным для практического осуществления изобретения.
В одном конкретном варианте вирусный поверхностный белок представляет собой поверхностный белок ротавируса. В другом конкретном варианте вирусный поверхностный белок является гликопротеидом.
Примеры других вирусов с вирусными поверхностными белками, которые могут быть подходящими для практического осуществления изобретения, включают ортореовирусы. Например, наружный вирусный капсид аквареовируса образован 200 тримерами белка, называемого VP5. У ортореовирусов млекопитающих наружный слой инфекционной реовирусной частицы содержит 600 копий тримерного белка проникновения через мембрану μ1, который соединен с белком шапероном σ3 (также присутствующем в 600 копиях) с образованием при этом гетерогексамера.
Гетерологичный белок
Многие гетерологичные белки могут быть представлены в виде дисплея с использованием тримерного ротавирусного поверхностного белка, при условии выбора линкера подходящей длины и/или подходящего сайта инсерции в поверхностном белке, чтобы избежать стерических помех между мономерами во время сборки тримера. Не существует верхнего предела размера гетерологичного белка, при условии, что гетерологичный белок не создает объем, которые перекрывается с соседними объемами других связанных гетерологичных белков. Предпочтительно используют адаптерную систему для дисплея гетерологичного белка на тримерном ротавирусном поверхностном белке. Гетерологичные белки, которые являются нерастворимыми, образуют олигомеры более высокого порядка или агрегируют, обычно считают не подходящими для практического осуществления изобретения.
Любые ограничения по размеру вследствие стерических помех могут быть преодолены за счет выбора подходящего линкера или адаптерной системы.
В контексте гетерологичного белка термин «гетерологичный» обычно означает, что белок не является ротавирусным белком. В некоторых вариантах выражение «гетерологичный белок» может означать, что белок не получен из того же штамма ротавируса, который использован для дисплея белка.
Тримерные поверхностные белки являются особенно подходящими для дисплея тримерных гетерологичных белков. Примеры тримерных гетерологичных белков включают тримерные белка проникновения вирусов в клетки и другие тримерные вирусные поверхностные белки, в частности, белки, которые являются мишенями нейтрализующих антител. Конкретными примерами являются гемагглютинин вируса гриппа (HA), gp140 вируса иммунодефицита человека (ВИЧ), гликопротеид вируса Эбола, гликопротеид вируса бешенства (RVG), белок Env вируса артрита-энцефалита коз, белок F респираторно-синцитиального вируса (RSV), белок gB и его комплексы, обнаруженные в вирусах простого герпеса человека и цитомегаловирусе человека (HCMV), и т.д.
В некоторых вариантах поверхностный белок ротавируса и/или гетерологичный белок содержат (содержит) маркер тримеризации, способствующий сборке гетерогексамерного комплекса, образуемого тримерным ротавирусным поверхностным белком и тримерным гетерологичным белком. Маркеры тримеризации, особенно основанные на двойной спирали маркеры тримеризации (например, GCN4, [10]), также могут служить в качестве структурных модулей для расширения пространства, доступного для гетерологичного белка, который представляют в виде дисплея на поверхности ротавирусной частицы, повторно покрытой модифицированным ротавирусным белком VP7. Другой подходящий маркер тримеризации может быть получен из фибритина бактериофага T4 [11].
В некоторых вариантах гетерологичные белки, которые не являются тримерными, могут взаимодействовать с маркером тримеризации, присутствующим на поверхностных ротавирусных белках. В качестве примера, если гетерологичный белок имеет доступную α спираль, которая может взаимодействовать с α-спиралями основанного на двойной спирали маркера тримеризации, такой гетерологичный белок может связывать маркер тримеризации. Если нет стерических помех, то одновременно с маркером тримеризации могут связываться три таких гетерологичных белка, образуя шестиспиральный пучок. Если связывается меньше трех таких гетерологичных белков, то шестиспиральный пучок может быть неполным и может содержать три внутренних спирали, которые создаются маркером тримеризации, присутствующим на ротавирусном белке, но только одну или две наружных спирали пучка. Нетримерный гетерологичный белок может иметь 1, 2, 4 или больше субъединиц (т.е., может быть мономером, димером, тетрамером или другим олигомером), при условии, что, по меньшей мере, одна из субъединиц имеет α-спираль, которая может взаимодействовать с маркером тримеризации, присутствующей на поверхностном ретровирусном белке.
В некоторых вариантах мономерный гетерологичный белок может содержать множество α-спиралей, распределенных так, что более одной спирали могут взаимодействовать с α-спиралями маркера тримеризации, присутствующего на поверхностном белке ротавируса, образуя полный или частичный шестиспиральный пучок. В некоторых вариантах тетрамеры (или структуры более высокого порядка), в которых, по меньшей мере, три мономера содержат соответствующим образом распределенные α-спирали, могут ассоциировать с маркером тримеризации, связанным с поверхностным белком ротавируса, с образованием шестиспирального пучка. В некоторых вариантах тетрамеры (или структуры более высокого порядка), в которых, по меньшей мере, два мономера содержат соответствующим образом распределенные α-спирали, могут ассоциировать с маркером тримеризации, ассоциированным с поверхностным белком ротавируса, с образованием частичного шестиспирального пучка, в котором отсутствует одна из наружных спиралей. Субъединицы гетерологичного белка могут быть идентичными (т.е. гомодимер, гомотример, гомотетрамер и т.д.) или могут быть не идентичными (т.е. гетеродимер, гетеротример, гетеротетрамер и т.д.).
Если маркер тримеризации, присутствующий на поверхностном белке ротавируса не является двойной α-спиралью, взаимодействующий структурный элемент на гетерологичном белке может иметь вторичную структуру, которая связывает маркер тримеризации, не является α-спиральной.
Предпочтительно гетерологичный белок не является антителом, которое специфично связывает ротавирусный поверхностный белок.
Адаптерная система
В некоторых вариантах изобретения применяют адаптерную систему для дисплея гетерологичного белка на ротавирусной частице. Адаптерная система обычно состоит из двух адаптерных молекул. Первая адаптерная молекула ковалентно связана с поверхностным белком ротавируса, который выбран для дисплея гетерологичного белка. Вторая адаптерная молекула ковалентно связана с гетерологичным белком. Первая адаптерная молекула и вторая адаптерная молекула взаимодействуют друг с другом с образованием стабильного комплекса.
Адаптерные системы обычно состоят из двух адаптерных полипептидов. Первый адаптерный полипептид слит с поверхностным белком ротавируса, который выбран для дисплея гетерологичного белка. Второй адаптерный полипептид слит с гетерологичным белком. Первый адаптерный полипептид и второй адаптерный полипептид могут взаимодействовать друг с другом с образованием стабильного комплекса.
Известно множество полипептидов, которые вступают в ассоциацию друг с другом с образованием стабильного комплекса. В некоторых случаях такие полипептиды могут быть получены из разных белков, например, рецептора и лиганда или антитела и антигена. В других случаях такие полипептиды могут быть получены из одного и того же белка, например, две гептадные повторяющие последовательности gp41 ВИЧ.
Также могут быть предусмотрены подходящие адаптерные системы, которые не основаны на взаимодействиях между двумя адаптерными полипептидами. Например, поверхностный белок ротавируса может быть модифицирован так, чтобы он содержал специфичный сайт гликозилирования, и гетерологичный белок может быть модифицирован так, чтобы он содержал домен лектина, который специфично распознает гликан в сайте гликозилирования. Примеры лектинов, которые распознают специфичные структуры гликанов, хорошо известны в данной области.
Другой подходящей адаптерной системой, которая не основана на взаимодействиях между двумя адаптерными полипептидами, является система стрептавидин-биотин. Предпочтительно используют мономерный стрептавидин, который был подвергнут мутации, чтобы предотвратить образование тетрамеров и чтобы повысить растворимость [12]. Мономерный стрептавидин может быть слит с поверхностным белком ротавируса, который выбран для дисплея гетерологичного белка. Для того чтобы происходило образование комплекса, гетерологичный белок биотинилируют. Ферментативное биотинилирование является предпочтительным, так как оно позволяет связывать биотин специфично с аминокислотным остатком, присутствующем в белке, который необходимо биотинилировать. Например, гетерологичный белок может быть модифицирован встраиванием «AviTag» или «акцепторного пептида» (AP), который может быть специфично биотинилирован биотинлигазой (например,BirA) в присутствии биотина и АТФ (подробности смотри в публикации 13).
Другая адаптерная система, которая не основана на взаимодействиях между двумя адаптерными полипептидами, может включать антитело, связанное с гаптеном (например, диэтилентриаминпентауксусной кислотой (DTPA), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислотой (DOTA)). Альтернативно, хелатирующие агенты DTPA и DOTA могут взаимодействовать с ионами металлов с образованием координационных комплексов.
Применение адаптерной системы не является существенным для практического осуществления изобретения. Однако применение адаптерной системы может быть предпочтительным для оптимального сохранения структурных признаков гетерологичного белка, в частности тримерных поверхностных белков других вирусов, которые необходимо представить в виде дисплея на ротавирусной частице. Применение адаптерной системы дает особые преимущества, так как ротавирусный поверхностный белок, который был модифицирован так, чтобы он содержал первый адаптер, нужно получить только один раз, и затем он может быть использован с любым гетерологичным белком, который был модифицирован так, чтобы он содержал совместимый второй адаптер.
Следующим преимуществом применения адаптерной системы является тот факт, что экспрессия и очистка могут быть оптимизированы отдельно для каждого из компонентов химерного поверхностного белка. В большинстве случаев инсерция адаптерной полипептидной последовательности не будет изменять такие характеристики вирусного поверхностного белка или гетерологичного белка, которые относятся к их экспрессии или очистке. Таким образом, существующие системы экспрессии и способы очистки обычно можно применять без модификации для получения больших количеств вирусного поверхностного белка, содержащего первый адаптерный полипептид, и гетерологичного белка, содержащего второй адаптерный полипептид. Напротив, химерный поверхностный белок, состоящий из вирусного поверхностного белка, ковалентно связанного с гетерологичным белком, вероятно будет иметь характеристики, которые существенно отличаются от характеристик вирусного поверхностного белка или гетерологичного белка, каждого в отдельности.
Поверхностные белки ротавирусов и многие реовирусные поверхностные белки образуют тримеры. Таким образом, в одном аспекте изобретения выбранная адаптерная система предпочтительно образует тримерный комплекс. Особенно предпочтительными являются адаптерные системы, в которых первый адаптерный полипептид и второй адаптерный полипептид содержат гептадные повторяющиеся последовательности и образуют α-спиральные структуры, которые обеспечивают возможность образования шестиспиральных пучков. Наиболее предпочтительно три копии второго адаптерного полипептида образуют внутренний двуспиральный тример, тогда как три копии первого адаптерного полипептида упакованы в бороздки на поверхности такого триммера, завершая образование шестиспирального пучка. Однако также может быть возможной инверсия, и в таком случае три копии первого адаптерного полипептида образуют внутренний двуспиральный тример, тогда как три копии второго адаптерного полипептида упакованы в бороздках на поверхности такого тримера. Различные пары полипептидов, которые содержат гептадные повторяющиеся последовательности и образуют шестиспиральные пучки, известны в данной области. Обычно их получают из вирусных слитых белков. Вследствие ротационной симметрии и стабильности их шестиспиральных пучков вирусные слитые белки являются предпочтительным источником адаптерных полипептидных последовательностей.
Одним из наиболее тщательно исследованных вирусных слитых белков является гликопротеид оболочки вируса иммунодефицита человека 1 (ВИЧ-1). Эктодомен гликопротеида оболочки ВИЧ-1 состоит из gp120 и gp41. gp41 опосредует слияние между вирусной и клеточной мембранами. gp41 содержит две гептадных повторяющихся последовательности, «спиральную область 1» (HR1) и «спиральную область 2» (HR2), которые могут образовывать шестиспиральный пучок в нативном белке [14]. В предпочтительном варианте первый адаптерный полипептид и второй адаптерный полипептид адаптерной системы соответствует HR2 gp41 (SEQ ID NO:1) и HR1 gp41 (SEQ ID NO:2), соответственно. В следующем предпочтительном варианте первый адаптерный полипептид и второй адаптерный полипептид адаптерной системы соответствуют HR2 (SEQ ID NO:3) и HR1 (SEQ ID NO:4) белка F вируса Нипах, соответственно. Однако известны различные другие вирусные слитые белки, которые могут быть источником взаимодействующих полипептидов HR1 и HR2, которые можно использовать для получения первого и второго адаптерных полипептидов. Такие белки включают гемагглютинин 2 вируса гриппа (HA2), трансмембранную (TM) субъединицу вируса лейкоза мышей Молони (Mo-MLV), белок F парамиксовируса (включая белок F парамиксовируса птиц, например, белок F вируса Хендра), например, из респираторно-синцитиального вируса (RSV) и вируса болезни Ньюкасла (NDV), белок шипа коронавируса (например, белки шипа вируса гепатита мыши и SARS-CoV), белок ZEBRA вируса Эпштейн-Барр, слитый белок вируса обезьян 5 и т.д.(смотри публикации 14, 15, 16 и 17).
В том случае, когда гетерологичный белок сам по себе содержит гептадные повторяющиеся последовательности, и такие последовательности совместимы с гептадной повторяющейся последовательностью, входящей в состав модифицированного ротавирусного поверхностного белка, может не требоваться добавление гептадных повторяющихся последовательностей к гетерологичному белку. В таком случае нативные гептадные повторяющиеся последовательности гетерологичного белка могут образовывать шестиспиральный пучок с гептадной повторяющейся последовательностью модифицированного ротавирусного поверхностного белка, и может не требоваться модификация гетерологичного белка добавлением гептадной повторяющейся последовательности, которая является чужеродной для гетерологичного белка.
Например, любой из перечисленных выше вирусных слитых белков содержит взаимодействующие гептадные повторяющиеся последовательности, и такие нативные гептадные повторяющиеся последовательности могут быть способны взаимодействовать с гептадными повторяющимися последовательностями в ротавирусном поверхностном белке, модифицированном так, чтобы он содержал гептадные повторяющиеся последовательности. В некоторых вариантах может быть предпочтительным основываться на гептадных повторяющихся последовательностях, гетерологичных по отношению к вирусному слитому белку, в частности, в том случае, когда выбрана состоящая из двух частей адаптерная система для обеспечения модульного принципа, и когда один и тот же модифицированный ротавирусный поверхностный белок используют для дисплея различных гетерологичных белков.
Известны другие домены белков, содержащие гептадные повторяющиеся последовательности, которые образуют шестиспиральные пучки. Такие домены включают домен CARD Apaf-1 человека и RAIDD, эффекторный домен смерти FADD, и домен смерти p75 и Fas. Другие источники образующих шестиспиральные пучки пептидных последовательностей включают SNARE и GCN4-pII. Любой из указанных доменов или пептидных последовательностей подобным образом может быть адаптирован для применения в настоящем изобретении. Например, три N-концевых спирали и три C-концевых спирали домена CARD могут быть использованы для первого адаптерного полипептида и второго адаптерного полипептида, соответственно, с образованием адаптерной системы, подходящей для мономерных или димерных поверхностных белков.
Также можно использовать другие основанные на пептидах адаптерные системы. Например, антитело или его антигенсвязывающую часть (например, Fab-фрагмент, scFv, доменное антитело (DAb)), которая связывает гетерологичный белок, который требуется представить в виде дисплея на поверхности вируса, можно встроить в поверхностный белок ротавируса. Антитело или его антигенсвязывающая часть могут распознавать специфичный эпитоп, который либо может быть встроен в гетерологичный белок (например, в форме пептидной метки), либо может природно присутствовать в гетерологичном белке.
В некоторых вариантах подходящая состоящая из двух частей адаптерная система требует модификации только гетерологичного белка. Например, в одном варианте осуществления изобретения поверхностный белок ротавируса представляет собой гликопротеид. В таком случае гетерологичный белок может быть модифицирован так, чтобы он содержал домен лектина, который специфично связывает гликан в гликопротеиде. Например, белок VP7 ротавируса может быть модифицирован введением единичных сайтов гликозилирования в экспонируемую на поверхности часть так, чтобы домен лектина модифицированного гетерологичного белка специфично связывался с гликаном в модифицированном белке VP7.
Альтернативно гетерологичный белок может быть модифицирован так, чтобы он содержал антигенсвязывающий домен антитела, который специфичен по отношению к эпитопу поверхностного антигена ротавируса. Например, гетерологичный белок может быть слит с Fab-фрагментом антитела, который связывает поверхностный антиген ротавируса с высокой аффинностью.
Линкерная последовательность
Линкерные последовательности разделяют домены, полученные из разных белков, и позволяют таким доменам подвергаться правильному фолдингу. В данной области известно множество линкерных последовательностей (смотри публикацию 18). Линкерная последовательность может быть включена для отделения поверхностного белка ротавируса и/или гетерологичного белка от адаптерной последовательности. Альтернативно, в том случае, когда поверхностный белок ротавируса и гетерологичный белок образуют две части одного и того же белка, обе части могут быть отделены друг от друга линкерной последовательностью.
Известны как жесткие, так и гибкие линкеры. Типичная последовательность гибкого линкера состоит из повторов аминокислот G и S. Например, линкер может иметь следующую последовательность: GS, GSG, SGG, GGSGG (SEQ ID NO:5) или GSGSGSGT (SEQ ID NO:6). В некоторых вариантах одну и ту же последовательность повторяют несколько раз (например, два, три, четыре, пять или шесть раз), чтобы создать более длинный линкер. В других вариантах в качестве линкера может быть использована одна аминокислота, такая как S или G. Жесткий линкер может состоять из нескольких повторов аминокислотной последовательности EAAAR (SEQ ID NO:7).
При выборе линкерной последовательности следует заботиться о том, чтобы выбрать гидрофильный линкер, чтобы избежать агрегации модифицированного ротавирусного поверхностного белка или гетерологичного белка.
Обычно линкер является нечувствительным к протеазам, но в некоторых вариантах линкер содержит сайт расщепления протеазой. Сайты расщепления протеазами могут быть применимы для удаления меток, который включают для выявления/очистки, например, модифицированного ротавирусного поверхностного белка согласно изобретению. Сайты расщепления протеазами также могут быть применимы для экспонирования аминокислотной последовательности, которая была встроена в модифицированный ротавирусный поверхностный белок, для того, чтобы аминокислотная последовательность стала более доступной на наружной поверхности модифицированного ротавирусного поверхностного белка после расщепления сайт-специфичной протеазой. Например, сайт расщепления протеазой можно использовать для экспозиции адаптерного полипептида с целью улучшения его связывания с соответствующим адаптерным полипептидом состоящей из двух частей адаптерной системы, который был слит с гетерологичным белком, который необходимо представить в виде дисплея на поверхности ротавирусной частицы. В некоторых случаях использованием расщепления протеазами для того, чтобы экспонировать адаптерный полипептид, который образует часть модифицированного ротавирусного поверхностного белка, может избавить от необходимости в дополнительных линкерных последовательностях и, следовательно, уменьшить количество дополнительных аминокислотных последовательностей, которые необходимо встраивать в модифицированный ротавирусный поверхностный белок для образования стабильного комплекса с гетерологичным белком.
Сайты протеазного расщепления для специфичной протеазы можно найти во многих белках. Например, каскад свертывания крови и каскад комплемента содержат ряд очень специфичных протеаз, которые распознают сайты расщепления в белках, расположенных далее в каскаде. Обычно ферменты на ранних стадиях каскада являются более специфичными, чем на поздних стадиях. Например, фактор X является более специфичным, чем тромбин. Если используют тромбин, то наиболее предпочтительными чувствительными к тромбину сайтами расщепления являются сайты, имеющиеся в фибриногене, факторе XIII и протромбине. Другие примеры протеаз каскада свертывания крови, их белки-мишени и специфичные сайты расщепления перечислены в таблице 1 ниже. Подчеркнутая часть последовательности, показанной в таблице ниже, представляет минимальный сайт расщепления, который необходимо включить для того, чтобы протеаза узнавала мишень.
Другие протеазы, которые были использованы для расщепления слитых белков, включают энтерокиназу, коллагеназу, химозин, урокиназу, ренин, протеазу риновируса 3C, протеазу вируса гравировки табака (TEV), фактор Xa, тромбин, фурин и некоторые сигнальные пептидазы (смотри, например, публикацию 19).
Предпочтительно сайт расщепления расположен в конечной конструкции таким образом, что любую метку, который был добавлен к поверхностному белку ротавируса или гетерологичному белку, можно легко удалить.
В некоторых вариантах линкер содержит метку для выявления и/или очистки. В данной области известно множество меток для облегчения выявления белков. Часто используемые пептидные метки включают FLAG-метку (DYKDDDDK; SEQ ID NO:12), HA-метку (YPYDVPDYA; SEQ ID NO:13), His-метку (например,HHHHHH; SEQ ID NO:14), Myc-метку (EQKLISEEDL; SEQ ID NO:15), Strep-метку I (AWRHPQFGG; SEQ ID NO:16), Strep-метку II (NWSHPQFEK; SEQ ID NO:17) и метку в виде белка C (EDQVDPRLIDGK; SEQ ID NO:18). His-метки являются предпочтительными, так как они обеспечивают легкое выявление с использованием анти-His-антител и позволяют очищать меченый белок с использованием колонки с никелем. Метка Strep II обеспечивает возможность простой и легкой очистки рекомбинантно экспрессированных белков с использованием колонок со стрептавидином. В некоторых случаях используют белковые метки. Например, может быть включена глутатион-S-трансферазная метка, чтобы обеспечить легкую очистку белка согласно изобретению с использованием колонки, содержащей иммобилизованный глутатион. Можно использовать метку зеленым флуоресцирующим белком, если требуется легкое выявление с использованием флуоресцентной микроскопии.
В некоторых вариантах осуществления изобретения метку (например, метку в виде белка C) включают в виде части линкерной последовательности, поскольку метки, обычно используемые, например, для выявления и очистки белков, не мешают функции и укладке белка-мишени и обычно экспонированы на поверхности. Таким образом, метка может обеспечивать преимущественные свойства по сравнению с другими искусственно сконструированными линкерными последовательностями.
В других вариантах линкерная последовательность может содержать последовательность эпитопа. Включение последовательности эпитопа может быть применимо для упаковки фрагментов антител, узнающих указанный эпитоп с целью дополнительной стабилизации комплекса, образованного модифицированным ротавирусным поверхностным белком и гетерологичным белком посредством состоящей из двух частей адаптерной системы. Стабилизация комплекса может быть особенно важной для получения изображения с высоким разрешением для структурных исследований.
Сигнальный пептид
В некоторых вариантах осуществления изобретения поверхностный белок ротавируса и гетерологичный белок дополнительно модифицированы так чтобы они содержали гетерологичную последовательность сигнального пептида, предпочтительно заменяющую нативную последовательность сигнального пептида. Применение гетерологичного сигнального пептида может давать преимущества в отношении достижения более высоких уровней экспрессии в системе экспрессии, используемой для получения больших количеств модифицированного ротавирусного поверхностного белка и гетерологичного белка для рекапсидации ротавирусных DLP. Соответственно, гетерологичный сигнальный пептид может быть получен из белка, о котором известно, что он экспрессируется на высоких уровнях в выбранной системе экспрессии. Например, консенсусная сигнальная последовательность ВИЧ или сигнальный пептид тканевого активатора плазминогена человека (tPA) являются особенно подходящими для экспрессии в клетках человека. Для экспрессии в клетках насекомых можно использовать сигнальный пептид gp64 бакуловируса или сигнальную последовательность мелиттина медоносной пчелы. Обычно линкер помещают после гетерологичной последовательности сигнального пептида, чтобы обеспечить эффективное отщепление сигнального пептида. Обычно сигнальный пептид удаляется сигнальной пептидазой, эндогенной по отношению к выбранной системе экспрессии, так что он не присутствует в конечном белке (т.е. ротавирусной поверхностном белке и гетерологичном белке, извлекаемых из системы экспрессии).
Нуклеиновые кислоты
Изобретение также относится к нуклеиновым кислотам, содержащим открытую рамку считывания, кодирующую химерный поверхностный белок согласно изобретению, оперативно связанную с последовательностью промотора, так что химерный поверхностный белок экспрессируется в больших количествах в системе экспрессии.
Изобретение также относится к конструкции нуклеиновой кислоты, которая кодирует модифицированный ротавирусный поверхностный белок, который содержит весь или часть ротавирусного поверхностного белка, первый адаптерный полипептид и, необязательно, линкерную последовательность. Изобретение, кроме того, относится к нуклеиновой кислоте, содержащей открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок, второй адаптерный полипептид и, необязательно, линкерную последовательность, при этом открытая рамка считывания оперативно связана с последовательностью промотора, так что слитый белок экспрессируется в больших количествах в системе экспрессии. В одном варианте изобретение относится к конструкции нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую второй адаптерный полипептид, необязательно линкерную последовательность и сайт множественного клонирования, при этом инсерция кодирующей области для гетерологичного белка в сайт множественного клонирования создает открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок и второй адаптерный полипептид. Конструкция нуклеиновой кислоты дополнительно содержит последовательность промотора, которая может управлять экспрессией слитого белка, содержащего гетерологичный белок и второй адаптерный полипептид, в системе экспрессии.
Первый адаптерный полипептид и второй адаптерный полипептид образуют части состоящей из двух частей адаптерной системы, так что слитый белок, содержащий гетерологичный белок и второй адаптерный полипептид, иe модифицированный ротавирусный поверхностный белок, содержащий первый адаптерный полипептид, образуют стабильный комплекс друг с другом.
Системы экспрессии
Изобретение также относится к системам экспрессии для экспрессии белков, кодируемых нуклеиновыми кислотами согласно изобретению.
В одном варианте первую систему экспрессии используют для экспрессии модифицированного ротавирусного поверхностного белка, содержащего весь или часть ротавирусного поверхностного белка, первый адаптерный полипептид и, необязательно, линкерную последовательность. Вторую систему экспрессии используют для экспрессии слитого белка, содержащего гетерологичный белок, второй адаптерный полипептид и, необязательно, линкерную последовательность. Необязательно используют третью систему экспрессии для экспрессии одного или нескольких ротавирусных белков, которые вместе с поверхностным белком ротавируса образуют наружный слой ротавирусной частицы. Первый и второй адаптерные полипептиды взаимодействуют друг с другом с образованием стабильного комплекса. Первая система экспрессии содержит первую конструкцию нуклеиновой кислоты, содержащую открытую рамку считывания, кодирующую модифицированный ротавирусный поверхностный белок, при этом открытая рамка считывания оперативно связана с последовательностью промотора. Вторая система экспрессии содержит вторую конструкцию нуклеиновой кислоты, содержащую открытую рамку считывания, кодирующую слитый белок, при этом открытая рамку считывания оперативно связана с последовательностью промотора. Третья система экспрессии содержит один или несколько экспрессирующих векторов для одного или нескольких ротавирусных белков. Модифицированный ротавирусный поверхностный белок и слитый белок и необязательно один или несколько ротавирусных белков затем очищают. Модифицированный ротавирусный поверхностный белок и слитый белок могут быть смешаны в соответствующих соотношениях для образования химерного поверхностного белка. Химерный поверхностный белок и необязательно один или несколько ротавирусных белков затем используют для повторного покрывания ротавирусных DLP с образованием ротавирусных частиц, представляющих гетерологичный белок в виде дисплея на своей поверхности. Альтернативно ротавирусные DLP повторно покрывают модифицированным ротавирусным поверхностным белком и необязательно одним или несколькими ротавирусными белками с образованием ротавирусных частиц. Затем ротавирусные частицы могут быть смешаны со слитым белком, чтобы обеспечить образованием комплекса между первым адаптерным полипептидом и вторым адаптерным полипептидом, получая химерный поверхностный белок так, что гетерологичный белок представлен в виде дисплея на поверхности ротавирусных частиц.
В другом варианте изобретение относится к системе экспрессии, содержащей (i) первую конструкцию нуклеиновой кислоты, содержащую открытую рамку считывания, кодирующую модифицированные ротавирусный поверхностный белок, который содержит весь или часть ротавирусного поверхностного белка, первый адаптерный полипептид и, необязательно, линкерную последовательность, при этом открытая рамка считывания оперативно связана с последовательностью промотора, и (ii) вторую конструкцию нуклеиновой кислоты, содержащую открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок, второй адаптерный полипептид и, необязательно, линкерную последовательность, при этом открытая рамка считывания оперативно связана с последовательностью промотора. В некоторых случаях система экспрессии дополнительно содержит экспрессирующий вектор для одного или нескольких ротавирусных белков, которые вместе с поверхностным белком ротавируса образуют наружный слой ротавирусной частицы.
Системой экспрессии может быть бактериальная клетка, дрожжевая клетка, клетка простейшего, клетка насекомого или клетка млекопитающего. Применение бактериальных клеток или дрожжевых клеток в качестве систем экспрессии менее предпочтительно, в частности, в том случае, когда требуется правильное гликозилирование экспрессированных белков.
Наборы
Изобретение, кроме того, относится к наборам, содержащим первую конструкцию нуклеиновую кислоту, кодирующую модифицированный ротавирусный поверхностный белок, который содержит весь или часть ротавирусного поверхностного белка и первый адаптерный полипептид, и вторую конструкцию нуклеиновой кислоты, при этом вторая конструкция нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую второй адаптерный полипептид и сайт множественного клонирования, и при этом инсерция кодирующей области для гетерологичного белка в сайт множественного клонирования дает открытую рамку считывания, кодирующую слитый белок, содержащий гетерологичный белок и второй адаптерный полипептид, при этом первый адаптерный полипептид химерного слитого белка и второй адаптерный полипептид слитого белка взаимодействуют друг с другом с образованием стабильного комплекса.
Изобретение, кроме того, относится к наборам, содержащим первую конструкцию нуклеиновой кислоты, кодирующую модифицированный ротавирусный поверхностный белок, который содержит весь или часть ротавирусного поверхностного белка и первый адаптерный полипептид, и вторую конструкцию нуклеиновой кислоты, кодирующую слитый белок, содержащий весь или часть гетерологичного белка и второй адаптерный полипептид, при этом первый адаптерный полипептид модифицированного ротавирусного поверхностного белка и второй адаптерный полипептид слитого белка взаимодействуют друг с другом с образованием стабильного комплекса, с получением таким образом химерного поверхностного белка.
Наборы могут дополнительно содержать ротавирусную частицу. Ротавирусная частица может быть либо того же вида, из которого получен поверхностный белок ротавируса, либо другого вида. Например, VP7 ротавируса макак-резус можно использовать для повторного покрывания DLP, полученных из бычьего ротавируса и наоборот. Ротавирус может быть подвергнут декапсидации и повторно покрыт химерным поверхностным белком. Альтернативно наборы могут содержать DLP для рекапсидации химерным поверхностным белком. Ротавирусные DLP могут быть получены посредством декапсидации нативных ротавирусных частиц или в результате рекомбинантно экспрессии белков внутренней оболочки ротавируса VP2 и VP6.
Рекомбинантная экспрессия белков наружного слоя
Рекапсидация ротавирусных DLP требует только одного или двух рекомбинантных вирусных белков, белка наружного слоя VP7 или белка наружного слоя VP7 вместе с белком шипа наружного слоя VP4. Экспрессия и очистка VP4 и VP7 подробно описана в публикациях 20 и 21, соответственно.
Белки наружного слоя, включая химерный поверхностный белок согласно изобретению, могут быть получены с использованием обычных систем экспрессии, известных специалисту. Чтобы обеспечить правильный фолдинг и в некоторых случаях правильное гликозилирование предпочтительными являются системы экспрессии, отличные от прокариотических или дрожжевых систем экспрессии. Например, клетки млекопитающих, такие как клетки CHO или клетки 293, можно использовать для сверхэкспрессии белков наружного слоя, необходимых для рекапсидации ротавирусных DLP. Альтернативно можно использовать простейших Leishmania tarentolae, чтобы экспрессировать белки наружного слоя. Системы клеток насекомых также подходят для экспрессии белков наружного слоя. Например, линии клеток насекомых Sf9, Sf21 и Hi-5 подходят для сверхэкспрессии гликозилированных белков. В некоторых случаях предпочтительными являются основанные на бакуловирусах системы клеток насекомых. Системы экспрессии, описанные в публикациях 2, 4 и 5, особенно подходят для практического осуществления изобретения.
В данной области известны различные способы извлечения и очистки сверхэкспрессированных белков наружного слоя. Обычно используют серию стадий хроматографии для очистки сверхэкспрессированных белков из цитоплазматических экстрактов или надосадков клеток, которые применяют в качестве системы экспрессии. Например, можно использовать аффинную хроматографию на лектинах, иммуноаффинную и эксклюзионную хроматографию по размеру. Если белок наружной оболочки был мечен пептидной или белковой меткой, такая метка предпочтительно может быть использована для очистки. Если присутствует сайт расщепления протеазой в последовательности, предшествующей метке, то метка может быть удалена после очистки с использованием протеазы, которая специфично узнает сайт расщепления протеазой.
В некоторых случаях для реакции рекапсидации можно использовать неочищенный препарат рекомбинантно экспрессированных белков наружного слоя. Например, лизаты клеток, используемых для экспрессии белков наружного слоя, можно получить, используя лизирующий буфер и/или механическое разрушение клеток (например, при соскабливании или обработке клеток ультразвуком). Любые клеточные остатки удаляют центрифугированием, и надосадок, содержащий неочищенный препарат рекомбинантных белков наружного слоя, можно использовать в реакции рекапсидации. Неочищенный препарат можно концентрировать, используя ультрафильтрацию, перед применением в реакции рекапсидации.
В тех аспектах изобретения, в случае которых гетерологичный белок нековалентно связан с ротавирусным поверхностным белком состоящей из двух частей адаптерной системой, содержащей первый адаптерный полипептид и второй адаптерный полипептид, поверхностный белок ротавируса, слитый с первым адаптерным полипептидом, и гетерологичный белок, слитый со вторым адаптерным полипептидом, экспрессируют отдельно в разных клетках. Раздельная экспрессия может быть предпочтительной, так как оба белка могут очищены отдельно с использованием известных протоколов очистки для каждого из белков. После очистки белки можно смешать в подходящих соотношениях, необходимых для рекапсидации ротавирусных DLP. Например, молярное соотношение VP7 и VP4 в наружном слое ротавируса составляет 13:1. Молярное соотношение между модифицированным белком VP7, содержащим первый адаптерный полипептид, и гетерологичным белком, содержащим второй адаптерный полипептид, обычно составляет 1:1. Альтернативно DLP подвергают рекапсидации белком наружного слоя ротавируса с образованием ротавирусных частиц. Ротавирусные частицы затем смешивают с гетерологичным белком, чтобы обеспечить возможность образования комплекса между первым адаптерным полипептидом и вторым адаптерным полипептидом, так чтобы гетерологичный белок был представлен в виде дисплея на поверхности ротавирусных частиц.
Альтернативно оба белка, и поверхностный белок ротавируса и гетерологичный белок, могут быть экспрессированы в одной и той же клетке. Коэкспрессия приводит к образованию стабильного комплекса поверхностного белка ротавируса и гетерологичного белка, опосредованного состоящей из двух частей адаптерной системой (подробности смотри выше). В том случае, когда линкерная последовательность, соединяющая адаптерную последовательность с поверхностным белком ротавируса или с гетерологичным белком, содержит метку, такая метка может быть использована для очистки комплекса из клеток/надосадка клеток системы экспрессии.
Чтобы иметь возможность повторно покрыть сердцевинную частицу реовируса химерным поверхностным белком, содержащим весь или часть гетерологичного белка, не нужно иметь все белки для образования наружного слоя. Например, наружный слой реовируса млекопитающих образован μ1, σ1 и σ3. Для повторного покрывания реовирусных сердцевинных частиц в целях изобретения обычно достаточно получить рекомбинантный вариант μ1 для образования вирусных частиц. Необязательно также могут быть получены рекомбинантные варианты σ1 и σ3. Рекомбинантные белки могут быть получены с использованием одной из систем экспрессии, упомянутых выше, и затем могут быть очищены с использованием известных протоколов.
Размножение вирусных частиц
Ротавирусы были обнаружены в большом количестве видов животных, включая крупный рогатый скот, свиней, лошадей, кроликов, мышей, собак, кошек, птиц и экзотические виды животных, такие как антилопа мендес, сайгак, белохвостый гну, медведь гризли и рыжий кенгуру. Соответственно, применимость определенного типа клеток для их размножения зависит от диапазона хозяев выбранного вируса. Предпочтительно выбирают вирус, который обеспечивает возможность размножение с высоким выходом в системах постоянных культур клеток.
Например, линия клеток MA104 может быть использована для размножения ротавируса макак-резус. Ротавирус может быть извлечен при лизировании инфицированных клеток, например, замораживанием-размораживанием инфицированных клеток MA104 в среде. Лизаты очищают от остатков клеток центрифугированием с низкой скоростью, и вирусные частицы концентрируют, осаждая их с использованием ультрацентрифугирования или ультрафильтрации. Концентрированную суспензию вирусных частиц затем можно очистить, используя центрифугирование в градиенте CsCl [2]. Подходящим буфером для приготовления градиента CsCl является буфер TNC (20 мМ трис pH 8,0, 100 мМ NaCl, 1 мМ CaCl2).
Предпочтительно для размножения ротавируса используют хорошо охарактеризованную клетку. Ротавирусы человека, быка и макака-резус могут быть размножены в клетках Vero. Подходящая линия клеток Vero (CCL81) может быть получена из Американской коллекции культур клеток (ATCC).
Подобным образом, представители семейства Reoviridae были выделены из широкого круга млекопитающих, птиц, рептилий рыб, ракообразных, насекомых, клещей, паукообразных, растений и грибов. Системы культивирования также были разработаны для других вирусов семейства Reoviridae. Например, вирус лохматой карликовости риса (RRSV) может быть получен в достаточных количествах из инфицированных листьев риса [7]. Клетки C6/36 можно использовать для размножения вируса Banna (BAV) [22]. L-клетки мышей, в частности, линию клеток L929, и клетки эритролейкоза мышей (MEL) можно использовать для размножения штаммов реовирусов млекопитающих типа 1 Lang (T1L) и типа 3 Dearing (T3D) [5]. Аквареовирус белого амура (GCRV) можно размножать в культуре клеток почки Ctenopharyngodon idellus (CIK) [8].
Вирусные частицы обычно можно извлекать из надосадков клеток или лизированных клеток. Например, любые клеточные остатки могут быть удалены центрифугированием с низкой скоростью, и вирусные частицы осаждают из надосадка, используя ультрацентрифугирование. Осадки содержат вирусные частицы, которые, при необходимости, могут быть дополнительно очищены.
Получение DLP
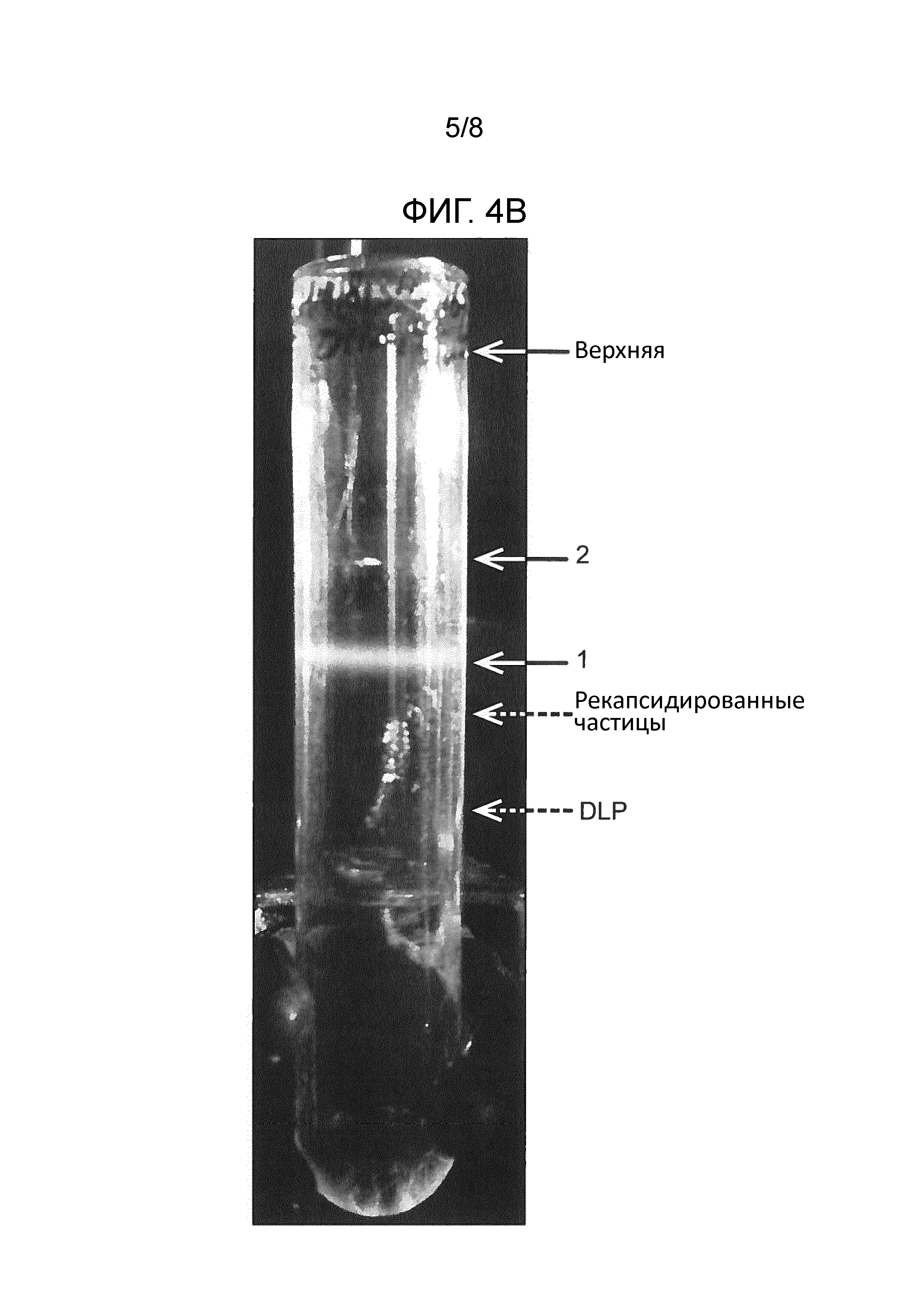
Ротавирусные DLP получают, удаляя белки наружного слоя с очищенных ротавирусных частиц. Ротавирусные частицы могут быть подвергнуты декапсидации при инкубации вирусных частиц в присутствии хелатирующего кальций агента, такого как EDTA или EGTA. Подходящий буфер для декапсидация ротавирусных частиц содержит 20 мМ трис, pH 8, 100 мМ NaCl и 1 мМ EDTA [2]. Ротавирусные частицы также могут быть подвергнуты декапсидации под действием теплового шока. Полученные в результате DLP могут быть очищены за счет создания слоев из двух последовательно приготовленных градиентов CsCl (ρ=1,25-1,50 г/см3).
Выбираемый способ удаления белков наружного слоя зависит выбранной вирусной частицы. Например, реовирусные частицы млекопитающих можно обнажить до сердцевины в результате инкубации частицы с α-химотрипсином (CHT) в течение двух часов при 37°C [4].
Описанные выше способы могут быть адаптированы для других вирусов семейства Reoviridae в зависимости от чувствительности белков их наружного слоя к обработке протеазами или условиям низкого содержания кальция.
В некоторых случаях субвирусная частица может быть извлечена в результате лизиса клеток, которые были использованы для размножения вируса. Затем субвирусную частицу можно извлечь из клеточных лизатов, например, в градиенте CsCl, как описано для вируса Banna [22].
Альтернативно DLP или субвирусные частицы могут быть получены в результате рекомбинантной экспрессии соответствующих вирусных белков в одной из систем экспрессии, описанных выше. Например, белки внутренней оболочки ротавируса VP2 и VP6 могут быть рекомбинантно экспрессированы с образованием вирусоподобных частиц, которые напоминают DLP.
Повторное покрывание (рекапсидация)
Рекапсидация ротавирусных DLP происходит в диапазоне pH от pH 4,5 до 6,5, включительно, но наиболее эффективно она происходит в диапазоне pH от 5 до 5,5 (предпочтительно pH 5,2). Рекапсидация происходит в температурном диапазоне от 4°C до 37°C, включительно, но более эффективно в диапазоне от 4°C до 30°C, чем при 37°C.
Рекапсидация сердцевинных частиц реовирусов, как правило, может быть осуществлена в условиях, которые имитируют условия, при которых происходит сборка вирусных частиц в клетке. Например, сердцевинные частицы ортореовирусов млекопитающих могут быть рекапсидированы при 37°C. Однако индивидуальные параметры, такие как pH и температура, могут требовать дополнительной оптимизации для эффективной повторной сборки вирусных частиц из очищенных сердцевин вирусов и рекомбинантно экспрессированных белков наружного слоя.
Рекапсидированные вирусные частицы можно извлечь центрифугированием в градиенте CsCl. Очистку в градиенте CsCl можно повторить второй раз, чтобы повысить чистоту извлеченных вирусных частиц.
В том случае, когда используют адаптерную систему для дисплея гетерологичного белка на поверхности рекапсидированной ротавирусной частицы, ротавирусные DLP могут быть рекапсидированы ротавирусным поверхностным белком, содержащим первый адаптерный полипептид. Затем к рекапсидированным вирусным частицам может быть добавлен гетерологичный белок, содержащий второй адаптерный полипептид, который образует стабильный комплекс с первым адаптерным полипептидом. Такой способ может быть предпочтительным в том случае, когда рекапсидация комплексом, образованным гетерологичным белком и поверхностным белком ротавируса может быть менее эффективной, например, из-за размера гетерологичного белка. Альтернативно, сначала может быть образован комплекс между гетерологичным белком и поверхностным белком ротавируса посредством адаптерных полипептидов, и такой комплекс может быть добавлен к ротавирусным DLP для рекапсидации.
Образование комплекса
В некоторых аспектах изобретения химерный поверхностный белок используют для исследования структуры комплексов, образованных между гетерологичным белком, который образует часть химерного поверхностного белка (например, будучи нековалентно связанным с ротавирусным поверхностным белком через состоящую из двух частей адаптерную систему), и молекулой, которая специфично связывается с гетерологичным белком.
В одном аспекте изобретения молекула является белковой молекулой. Белковая молекула обычно представляет собой другой белок, такой как рецептор или лиганд, который взаимодействует с гетерологичным белком, или антитело или фрагмент антитела, который узнает эпитоп, находящийся на поверхности гетерологичного белка.
Например, гексамерный комплекс тримерного ротавирусного поверхностного белка, связанного с тримерным вирусным белком проникновения в клетку (например, белком gp140 ВИЧ или белком F RSV), который представлен в виде дисплея на поверхности ротавирусной частицы, можно использовать для исследования взаимодействия между вирусным белком проникновения в клетку и его рецептором на поверхности клетки-хозяина.
Оптимальные условия образования комплекса между гетерологичным белком и белковой молекулой зависят от природы взаимодействия. Взаимодействия рецептор-лиганд могут требовать других условий, отличных от условий взаимодействий антитело-антиген. Обычно образование комплекса осуществляют при комнатной температуре в забуференном растворе (например, в фосфатно-солевом буфере).
В одном варианте белковую молекулу добавляют к суспензии рекапсидированных ротавирусных частиц, на которых в виде дисплея представлен химерный поверхностный белок. Забуференный раствор может содержать дополнительные компоненты, такие как Ca2+,чтобы предотвратить декапсидацию ротавирусных частиц, и необязательно один или несколько ингибиторов протеаз, чтобы блокировать разрушение белков. После инкубации белковой молекулы в присутствии рекапсидированных ротавирусных частиц новообразованные комплексы белковых молекул, связанных с ротавирусными частицами, могут быть отделены от любых несвязанных белковых молекул центрифугированием или ультрафильтрацией. Однако удаление несвязанных белковых молекул может быть необязательным, если рекапсидированные ротавирусные частицы используют для крио-ЭМ-анализа.
Альтернативно, белковую молекулу и химерный поверхностный белок инкубируют вместе, обеспечивая возможность образования комплекса. Сначала гетерологичный белок и ротавирусный поверхностны антиген можно инкубировать вместе для образования химерного поверхностного белка. После образования химерного поверхностного белка добавляют белковую молекулу. Затем комплекс белковой молекулы и химерного поверхностного белка может быть добавлен к ротавирусным DLP, чтобы образовались ротавирусные частицы, необязательно в присутствии любых дополнительных ротавирусных белков, которые вместе с поверхностным белком ротавируса образуют наружный слой нативной ротавирусной частицы.
В конкретном аспекте изобретения химерный поверхностный белок согласно изобретению применяют для определения структуры комплекса антиген-антитело. В данном аспекте изобретения гетерологичный белок может быть получен из патогена, такого как вирус или бактерия. Например, иммунодоминантный антиген может быть выбран в качестве гетерологичного белка для исследования того, какие части белка являются мишенями антител во время иммунного ответа против антигена. Предпочтительно гетерологичный белок представляет собой тримерный вирусный поверхностный белок, такой как гемагглютинин вируса гриппа, F респираторно-синцитиального вируса или gp140 ВИЧ. Для определения структуры комплекса антиген-антитело обычно предпочтительным является использование Fab-фрагмента вместо полноразмерного антитела, чтобы избежать стерических помех между соседними химерными поверхностными белками и чтобы гарантировать максимальную занятость эпитопа, находящегося на гетерологичном белке.
В другом аспекте изобретения может быть исследовано образование комплекса между гетерологичным белком и небелковой молекулой. Небелковой молекулой может быть нуклеиновая кислота (например, РНК или ДНК), полисахарид или олигосахарид (например, гликан). Например, гетерологичный белок может представлять собой фактор транскрипции или другой ДНК-связывающий белок, который образует комплекс со специфичной последовательностью ДНК. Альтернативно гетерологичным белком может быть лектин, который образует комплекс с гликаном.
Крио-ЭМ
Применение крио-ЭМ для определения структуры имеет несколько преимуществ по сравнению с традиционными способами, такими как рентгеновская кристаллография. В частности, крио-ЭМ предъявляет менее жесткие требования к анализируемому образцу в отношении чистоты, гомогенности и количества. Важно, что крио-ЭМ можно применять по отношению к мишеням, которые не образуют подходящих кристаллов для определения структуры.
Суспензию очищенных или неочищенных рекапсидированных ротавирусных частиц, либо отдельно, либо в комплексе с белковой молекулой, такой как антитело, или небелковой молекулой, такой как нуклеиновая кислота, можно нанести на углеродные сетки для визуализации с помощью крио-ЭМ. Покрытые сетки мгновенно замораживают, обычно в жидком этане, чтобы сохранить частицы в суспензии в замороженном гидратированном состоянии. Более крупные частицы могут быть переведены в стекловидное состояние в результате криофиксации. Стекловидны образец можно разрезать на тонкие срезы (обычно толщиной от 40 до 200 нм) в крио-ультрамикротоме, и срезы можно поместить на сетки для визуализации с помощью электронной микроскопии.
Качество данных, полученных на основе изображений, можно улучшить с использованием параллельного пучка света и улучшенной настройкой микроскопа для получения разрешений до ~3,3 Å. При таком высоком разрешении возможно модельное построение ab initio полноатомных структур. Однако визуализация при более низком разрешении может быть достаточной в том случае, когда имеются структурные данные, полученные при атомарном разрешении, для выбранной или близкородственной ротавирусной частицы и выбранного гетерологичного белка или близкого гомолога, для ограниченного сравнительного моделирования (смотри ниже).
Чтобы дополнительно улучшить качество данных, микроскоп может быть тщательно настроен так, чтобы выявлять видимые кольца частотно-контрастной функции (CTF) за пределами 1/3 Å-1 в случае применения преобразования Фурье в отношении изображений углеродных пленок, регистрируемых в тех же условиях, которые используют для визуализации. Затем могут быть определены значения расфокусировки для каждой микрофотографии с использованием компьютерной программы, такой как CTFFIND [23]. Конечный размер пикселя на карте плотности можно калибровать, используя, например, вирус мозаики табака (TMV).
Полезное описание применения крио-ЭМ для структурных исследований ротавирусных частиц можно найти в публикациях 24 и 25.
Анализ изображений и определение структуры
Изображения, полученные с использованием крио-ЭМ, анализируют, выявляя микрофотографии отдельных частиц. Отбор отдельных частиц можно осуществить с помощью программных средств, таких как SIGNATURE [26]. Астигматическую расфокусировку, ось наклона образца и угол наклона для каждой микрофотографии можно определить, используя компьютерную программу CTFTILT [23].
Получение отдельных значений расфокусировки для каждой частицы в соответствии с ее координатой на исходном изображении повышает качество данных крио-ЭМ-карты плотности, которую получают в результате усреднения микрофотографий отдельных частиц, полученных для частиц ротавирусов.
Подгонка известных атомарных моделей к крио-ЭМ-крате плотности является общим способом моделей построения сложных структур, таких как вирусные частицы. Имеется ряд компьютеризованных средств подгонки в диапазоне от определения координат для белковых структур как простых твердых тел, такой как Situs [27], Foldhunter [28] и Mod-EM [29], до сложных и динамичных гибких алгоритмов подгонки, подобных NMFF [30], Flex-EM [31], MDFF [32] и DireX [33, 34], которые преобразуют картины известных структур в карту плотности.
В том случае, когда неизвестна атомарная модель, крио-ЭМ-карты плотности можно использовать для построения и/или оценки структурных моделей из галереи потенциальных моделей, которые конструируют in silico (смотри публикации 29, 35, 36, 37 и 38). Должна быть известна структура родственной матрицы для ограниченного сравнительного моделирования или для ограниченного моделирования ab initio, моделируемая укладка должна быть относительно небольшой. Например, начальная структура может быть получена с использованием IMIRS [39]. Дополнительное выравнивание и реконструирование можно осуществить, применяя FREALIGN [40] и используя известную структуру ротавируса и известную структуру гетерологичного белка или близкого гомолога в качестве матрицы.
Значимая структурная и функциональная информация может быть получена непосредственно из самой карты плотности. Например при разрешениях 5-10 Å некоторые элементы вторичной структуры видны на крио-ЭМ-крате плотности: α-спирали выглядят в виде цилиндров, тогда как β-слои выглядят в виде тонких, согнутых платин. Такие элементы вторичной структуры могут быть достоверно идентифицированы и количественно оценены с использованием средств распознавания характерных признаков, чтобы описать структуру белка или предположить функцию индивидуальных белков. При почти атомарных разрешениях (3-5 Å) шаг α-спиралей, разделение β-нитей, а также плотности, которые их соединяют, могут быть однозначно визуализированы (смотри, например, публикации 41, 42, 43 и 44).
Построение модели de novo model в случае крио-ЭМ включает в себя распознавание характерных признаков, анализ последовательности, совмещение элементов вторичной структуры, распределение Cα и оптимизацию модели. Можно использовать различные компьютерные приложения, например, EMAN для сегментации и обработки карты плотности [45], SSEHunter [46], чтобы выявить элементы вторичной структуры, визуализацию в UCSF's Chimera [47] и манипуляции с атомами в Coot [48, 49].
Программы для идентификации вторичной структуры, подобные SSEHunter, обеспечивают полуавтоматический механизм для выявления и представления визуально наблюдаемых элементов вторичной структуры на карте плотности [46]. Регистрация элементов вторичной структуры в последовательности и структуре, вместе с геометрической и биофизической информацией можно использовать для заякоривания остова белка на карте плотности [41, 43]. Такое соответствие последовательности структуре позволяет связывать наблюдаемые по плотности элементы вторичной структуры с элементами, предполагаемыми в последовательности. Пакет для моделирования GORGON увязывает основанное на последовательности прогнозирование вторичной структуры со способами выявления характерных признаков и геометрического моделирования с целью создания начальных моделей остова белка [50]. Автоматизированные способы моделирования, такие как EM-IMO (электронная микроскопия-итерационная модульная оптимизация), можно применять для построения, модификации и уточнения локальных структур белковых моделей с использованием крио-ЭМ-карт в качестве ограничения [51].
После определения соответствия с использованием элемента вторичной структуры атомы Cα могут быть отнесены к определенной плотности, начиная с αα-спиралей с последующими β-нитями и петлями. Например, с использованием преимущества явных выпуклых изображений атомов Cα, могут быть построены Cα-модели с использованием утилиты Baton_build в кристаллографических программах O [52] и/или Coot [48]. Положения Cα могут быть интерактивно скорректированы так, чтобы они оптимально соответствовали плотности при сохранении надлежащей геометрии и исключении накладок в модели. Грубые полноатомные модели могут быть уточнены псевдокристаллографическим способом с использованием CNS [53]. Модели могут быть дополнительно оптимизированы с использованием программы компьютерного моделирования, такой как Rosetta [36]. Полноатомные модели также могут быть построены с помощью других компьютерных средств, таких как REMO [54]. Качество модели может быть подтверждено посредством визуального сравнения модели с картой плотности. Псевдокристаллографический анализ R-фактор/Rfree [55] обеспечивает меру соответствия между наблюдаемыми и рассчитанными с помощью компьютера амплитудами структурных факторов, и он может быть использован для подтверждения того, что полученная атомарная модель обеспечивает хорошую подгонку к крио-ЭМ-картам плотности. Геометрия модели белка может быть проверена с использованием PROCHECK [56].
Способы скрининга для конструирования иммуногенов
Использование крио-ЭМ вместо рентгеновской кристаллографии способствует быстрому определению структуры. По сравнению с рентгеновской кристаллографией крио-ЭМ предъявляет менее жесткие требования к чистоте, гомогенности и количеству анализируемого образца. Такие характеристики делают крио-ЭМ привлекательной в контексте конструирования иммуногенов для вакцин, особенно против патогенов, которые подвергаются антигенному дрейфу.
Наличие более полной структурной информации, особенно об эпитопах, общих для разных вариантов одного и того же патогена или близкородственных патогенов, может обеспечить возможность рационального конструирования иммуногенов, которые можно использовать в вакцинах, которые обеспечивают широкую защиту от большого количества вариантов одного и того же патогена или близкородственных патогенов. Полагают, что такие так называемые «универсальные» вакцины являются более экономически целесообразными, чем традиционные вакцины, поскольку они могут делать излишним включение различных вариантов одного и того же патогена или близкородственных патогенов в одну и ту же композицию вакцины (как в случае, например, имеющихся в настоящее время противополиомиелитных вакцин, а также вакцин на основе конъюгатов стрептококков и менингококков) или каждый год создавать новые вакцинные композиции, чтобы учесть антигенный дрейф, который произошел в популяции патогена в предыдущем сезоне (как в случае вакцин против гриппа).
Рациональное конструирование иммуногена для вакцинации против другого патогена заключается в идентификации таких областей иммунодоминантного белка, которые являются консервативными среди различных вариантов/подтипов одного и того же патогена или среди близкородственных патогенов. Применение ротавирусных частиц для дисплея гетерологичных белков на химерных ротавирусных поверхностных белках делает возможным быстрое определение большого количества структур за относительно короткий период времени. Таким образом, способы согласно изобретению могут быть особенно применимы для идентификации консервативных эпитопов иммуногенных белков.
Благодаря определению структуры иммуногенов в комплексе с антителами или соответствующими антигенсвязывающими фрагментами, которые, как было выяснено, вырабатываются против ряда вариантов/подтипов одного и того же патогена и/или против близкородственных патогенов, могут быть идентифицированы консервативные области в иммунодоминантном иммуногена такого патогена и/или близкородственных патогенов. Таким образом, в одном варианте изобретение относится к способу получения трехмерной модели иммуногена в комплексе с антителом, при этом указанный способ включает в себя стадии (i) рекапсидации ротавирусной DLP химерным поверхностным белком, содержащим иммуноген, с получением суспензии ротавирусных частиц, представляющих в виде дисплея химерный поверхностный белок, (ii) добавления к иммуногену суспензии антитела или фрагмента антитела, который специфично связывается с иммуногеном, при этом антитело или фрагмент образует комплекс с химерным поверхностным белком, (iii) замораживания суспензии, (iv) визуализации ротавирусных частиц с использованием крио-ЭМ с получением множества микрофотографий, и (vi) анализа множества микрофотографий для получения трехмерной модели иммуногена в комплексе с антителом. Иммуноген обычно является гетерологичным по отношению к ротавирусной частице. Трехмерную модель иммуногена в комплексе с антителом можно использовать для определения эпитопа на поверхности иммуногена, который распознается антителом.
Указанный способ можно применять для идентификации эпитопа, связанного антителом, которое обладает широкой нейтрализующей активностью против ряда родственных патогенов или вариантов патогенов, которые возникли в результате дрейфа антигенов. Альтернативно, указанный способ можно применять для идентификации эпитопа, связанного антителом, которое может узнавать эпитоп, которые мешает, например, функции вирусного белка для проникновения в клетку, и может быть использовано для предотвращения или ингибирования размножения вируса. Антитело, которое связывается со специфичной трехмерной конфигурацией белка, также может быть применимо в качестве реагента для контроля качества во время производства белка, например, чтобы исключать партии произведенного белка, которые содержат большое количество денатурированных или подвергнутых неправильному фолдингу копий такого белка. Кроме того, указанный способ можно применять для идентификации эпитопов, которые особенно применимы в случае связывания антителом, которое используют в качестве диагностического реагента (например, эпитопы, которые являются специфичными для конкретного патогена в группе близкородственных патогенов).
При повторении способа получения трехмерной модели иммуногена в комплексе с антителом для панели антител или их соответствующих антигенсвязывающих фрагментов, которые, как было обнаружено, вырабатываются в ответ на инфекцию рядом вариантов/подтипов одного и того же патогена и/или против близкородственных патогенов, может быть идентифицирован эпитоп каждого антитела на поверхности иммуногена. После идентификации эпитопа каждого антитела в панели такая информация может быть использована для рационального конструирования иммуногена. Например, способ можно применять для идентификации эпитопов для панели антител, которые, как было обнаружено, обладают нейтрализующей активностью против ряда вариантов/подтипов одного и того же патогена и/или против близкородственных патогенов, чтобы сконструировать иммуноген, который обеспечивает широкую нейтрализующую активность против большого количества вариантов/подтипов одного и того же патогена и/или близкородственных патогенов.
Альтернативно, описанный выше способ можно применять для картирования репертуара эпитопов, распознаваемых антителами, которые вырабатываются в ответ на иммунизацию существующей вакциной. При картировании эпитопов, наиболее часто распознаваемых такими антителами, могут быть идентифицированы иммунодоминантные эпитопы. Такая информация преимущественно может быть использована для дополнительной оптимизации существующей вакцины. Например, в том случае, когда существующая вакцина состоит из инактивированного патогена, оптимизированный вариант вакцины может содержать только иммунодоминантные части указанного патогена (например, в форме субъединичной вакцины, которая содержит рекомбинантные варианты идентифицированных иммунодоминантных антигенов или эпитопов). Выяснение структурных детерминант иммунодоминантных эпитопов антител с использованием таких способов, может быть применимо для получения антигенов, которые были сконструированы так, чтобы получить наиболее полезные иммунодоминантные эпитопы (такие как эпитопы широко нейтрализующих антител).
Примеры картирования эпитопов для облегчения конструирования иммуногенов, известны в данной области, но обычно ограничены небольшим количеством эпитопов на иммуногене, из-за усилий, которые необходимо прилагать для получения структурных данных относительно комплексов иммуноген-антитело с помощью рентгеновской кристаллографии. Часто тестируют только одно антитело (смотри публикации 57,58 и 59). Настоящее изобретение впервые позволяет получать структурную информацию о комплексах иммуноген-антитело с использованием способа с высокой пропускной способностью. Изобретение особенно применимо в отношении антител, которые только слабо ассоциируют с иммуногеном, и поэтому представляют собой большую проблему для кристаллизации.
В данной области известны различные способы конструирования иммуногенов, которые являются защитными против широкого множества вариантов одного и того же патогена или близкородственных патогенов. В последние годы было предпринято много попыток сконструировать «универсальные» вакцины против вируса гриппа и ВИЧ (смотри публикации 1, 2 и 3). Рациональному конструированию модифицированного иммуногена препятствовало отсутствие структурных данных для того, чтобы ориентироваться в процессе конструирования. Применение ротавирусных частиц для дисплея гетерологичных белков на химерных ротавирусных поверхностных белках делает возможным быстрое определение того, как модификации аминокислотной последовательности белка влияют на его трехмерную структуру. Модификации аминокислот, которые изменяют структуру белка, могут влиять на его способность образовывать кристаллы. Таким образом, структурную информацию для оценки влияния таких модификаций трудно получить, так как модифицированный белок может не кристаллизоваться в тех же условиях, что и немодифицированный белок. Так как применение крио-ЭМ не основано на образовании кристаллов для определения белковых структур, и, кроме того, не требует какой-либо адаптации основных условий эксперимента для разных типов белков, то возможная быстрая структурная характеристика модифицированных белков.
После идентификации эпитопа на иммуногеном белке патогена, который присутствует в нескольких вариантах/подтипах одного и того же патогена и/или во многих близкородственных патогенах, полученная информация может быть использована для конструирования универсальной вакцины. В некоторых случаях это может потребовать модификации иммуногена, особенно, когда консервативная область, которая содержит общий эпитоп, труднодоступна для антител в нативном белке, так как плохая доступность эпитопа обычно преобразуется в плохую иммуногенность. Путем модификации иммуногена таким образом, при котором сохраняется нативный эпитоп, который распознается антителом, но эпитоп делается более доступным, модифицированный иммуноген может вызывать гуморальный ответ в виде антител, которые защищают от широкого круга вариантов/подтипов одного и того же патогена или близкородственных патогенов. В дополнение к картированию эпитопов аффинно-созревших антител таким способом могут быть картированы эпитопы, узнаваемые незрелыми предшественниками таких антител, после расчет на основании экспериментов по клонированию репертуара B-клеток. Полученная информация может помочь в конструировании иммуногенов, чтобы избирательно усилить продукцию требуемого немутантного антитела-предшественника и затем направить созревание его аффинности в сторону широко и сильнодействующего нейтрализующего антитела.
Иммуногены-кандидаты, которые были получены в результате модификации нативного иммуногена (либо в целях получения универсальной вакцины, либо по другим причинам), могут быть подвергнуты тестированию в отношении присутствия представляющего интерес нативного эпитопа с применением способов согласно изобретению. Поэтому в конкретном варианте изобретение относится к способу определения структурных различий между двумя вариантами гетерологичного белка, при этом способ включает в себя стадии (i) рекапсидации ротавирусной DLP первым химерным поверхностным белком, содержащим первый вариант гетерологичного белка, с получением суспензии первых ротавирусных частиц, представляющих в виде дисплея первый химерный поверхностный белок, (ii) замораживания суспензии, (iii) визуализации первой ротавирусной частицы с использованием крио-ЭМ с получением множества микрофотографий, (iv) анализа множества микрофотографий с получением трехмерной модели первого химерный поверхностный белок, (v) повторения стадий (i)-(iv) со вторым химерным поверхностным белком, содержащим второй вариант гетерологичного белка, при этом первый и второй химерные поверхностные белки являются идентичными друг другу помимо различия между первым вариантом и вторым вариантом, и (vi) сравнения трехмерной модели первого химерного поверхностного белка с трехмерной моделью второго химерного поверхностного белка для определения структурных различий между первым вариантом и вторым вариантом гетерологичного белка. Такой способ может быть повторен для следующих вариантов того же гетерологичного белка, чтобы провести скрининговый анализ для идентификации варианта с определенными необходимыми структурными характеристиками.
В некоторых случаях могут быть определены структуры нативного иммуногена и множества модифицированных иммуногенов, в каждом случае в комплексе с антителом, узнающим эпитоп. Сравнение структуры модифицированных иммуногенов с нативным иммуногеном будет способствовать отбору иммуногенов-кандидатов, в которых лучше сохраняется нативный эпитоп, для дальнейшего тестирования in vivo.
Иммуногенные композиции
В следующем аспекте настоящее изобретение относится к применению ротавирусных частиц, содержащих химерный поверхностный белок согласно изобретению, для получения лекарственного средства. В частности, ротавирусные частицы, содержащие химерный поверхностный белок согласно изобретению, можно применять в иммуногенных композициях, подходящих для вакцинации человека. Например, может быть сконструирован химерный поверхностный белок для дисплея гетерологичного белка, который вызывает защитный иммунный ответ при введении пациенту.
Применение химерных вирусов для того, чтобы вызвать иммунный ответ на полученных из патогена антиген, хорошо известно в данной области. Традиционно такой способ требует конструирования с перестройкой генома вируса-хозяина, который выбран в качестве вектора для полученного из патогена антигена. Такой способ имеет ряд ограничений. Обычно вирусный геном модифицируют так, чтобы он содержал полученный из патогена ген, кодирующий антиген. Поэтому размер генома выбранного вируса может ограничивать размер полученного из патогена антигена, который может быть экспрессирован. Подобным образом, инсерция гена, кодирующего полученный из патогена антиген, может мешать размножению вируса и ограничивать выходы, которые могут быть достигнуты. Поэтому получение химерных вирусов необходимо оптимизировать для каждого полученного из патогена антигена.
Создание химерного вируса с новым поверхностным белком с использованием основанной на рекомбинации генетики для изменения генома вируса-хозяина путем встраивания области, кодирующей полученный из патогена антиген, потенциально может изменять диапазон хозяев химерного вируса и поэтому имеет непредвиденные последствия для патогенности вновь созданного вируса. Поэтому необходимы дополнительные стадии для получения достаточно аттенуированного химерного вируса, который не способен реплицироваться у вакцинированного субъекта.
Настоящее изобретение преодолевает проблемы, связанные с традиционным способом, поскольку оно позволяет получать любой вид химерного поверхностного белка, который можно использовать для рекапсидации ротавирусных DLP. Рекапсидированные ротавирусные частицы не содержат какой-либо генетической информации для полученного из патогена антигена. Таким образом после начальной инфекции клетки-хозяина рекапсидированными ротавирусными частицами не образуются вирусы-потомки, которые несут полученный из патогена антиген.
Применение состоящей из двух частей адаптерной системы дополнительно уменьшает количество стадий оптимизации. После получения слияния модифицированного ротавирусного белка с первым адаптерным полипептидом любой известный полученный из патогена антиген может быть слит со вторым адаптерным полипептидом, который образует стабильный комплекс с первым адаптерным полипептидом. Это исключает любую необходимость в генетической инженерии ротавируса. В большинстве случаев на экспрессию и очистку полученного из патогена антигена не влияет присутствие второго адаптерного полипептида в полученном из патогена антигена, так что не требуется модификация существующих способов экспрессии и очистки антигена. Существующие протоколы рекапсидации ротавирусных DLP химерным поверхностным белком, содержащим модифицированный ротавирусный белок, связанный с полученным из патогена антигеном через состоящую из двух частей адаптерную систему, можно применять для получения ротавирусных частиц, содержащих химерный поверхностный белок. Затем такие ротавирусные частицы могут быть включены в иммуногенные композиции для того, чтобы вызвать иммунный ответ против полученного из патогена антигена.
Платформа для вакцин особенно применима для получения иммуногенных композиций, в которых ротавирусные частицы содержат тримерный химерный поверхностный белок, который включает в себя гетерологичный тримерный вирусный белок для проникновения в клетку. Тримерные вирусные белки для проникновения в клетку представляют собой иммунодоминантные поверхностные антигены многих вирусов. За исключением поверхностного антигена гепатита B и белка L1 вируса папилломы человека, которые оба образуют вирусоподобные частицы, и HA вируса гриппа, который образует розетки, субъединичные вакцины, основанные на иммунодоминантных вирусных поверхностных антигенах, в результате обычно не приводили к клинически эффективным вакцинам. В результате дисплея таких вирусных поверхностных антигенов в их нативной конформации на ротавирусных частицах могут быть получены иммуногенные композиции, которые вызывают защитный иммунный ответ против вируса, из которого исходно был получен поверхностный антиген.
Конкретные примеры тримерного вирусного белка проникновения в клетку включают HA вируса гриппа, gp140 ВИЧ, гликопротеид вируса Эбола, гликопротеид вируса бешенства, белок Env вируса артрита-энцефалита коз, белок F RSV, gB и необязательно его комплекс с другими белками вирусов простого герпеса человека и HCMV.
Ротавирусные частицы
Ротавирусы особенно применимы, поскольку существуют различные штаммы вирусов животных, которые имеют определенный круг хозяев. Например, некоторые штаммы специфичны для коров, а другие для обезьян. Большинство штаммов вирусов животных антигенно отличаются от тех штаммов, которые обычно инфицируют людей, и поэтому, в основном, не способны вызывать заболевания у людей. Поэтому люди обычно не имеют какого-либо предварительно существующего иммунитета к таким ротавирусным штаммам, который может мешать иммунному ответу против химерного поверхностного белка, когда такие штаммы вирусов животных применяют в качестве векторов в иммуногенных композициях для вакцинации людей. Кроме того, такие вирусы являются природно аттенуированными у человека.
Кроме того, в настоящее время на рынке имеются две лицензированных аттенуированных ротавирусных вакцины: Rotarix™ и RotaTeq™. Rotarix™ содержит аттенуированный штамм ротавируса человека RIX4414, который пересевался 26 раз в первичных клетках почки зеленого макака (AGMK) и размножался в клетка Vero. RotaTeq™ содержит сочетание пяти штаммов реассортантных ротавирусов человека (HRV)-ротавирусов быка (BRV), названных G1, G2, G3, G4 и P1, соответственно, которые также размножали в клетках Vero. Все реассортанты имели фоновый генотип штамма BRV WC3 (G6P7[5]), экспрессирующий белки VP7 или VP4 человека.
Ранее лицензированная основанная на ротавирусе макак-резус (RRV) вакцина РотаShield™ состоит из RRV (G3P5B[3]) и 3 реассортантных ротавирусов RRV-HRV. Каждый реассортант получает 10 генов из RRV и один ген HRV, кодирующий белок VP7 специфичности G-серотипа 1, 2 или 4 (G1P5B[3], G2P5B[3], и G4P5B[3]).
Кроме того, была установлена безопасность моновалентных ротавирусных штаммов быка (NCDV RIT4237 G6P6) и обезьян (штамм RRV MMU18006 G3P5B) для применения в качестве вакцин.
Опыт по иммунизации, клинической безопасности и производству таки вакцинных штаммов можно прямо применять по отношению к ротавирусным частицам согласно изобретению. Например, любой из ротавирусов, входящих в состав лицензированных ротавирусных вакцин, можно использовать для получения DLP для рекапсидации химерным поверхностным белком согласно изобретению.
Получение
Модифицированные ротавирусные частицы, входящие в состав иммуногенных композиций могут быть получены с использованием любого из способов, описанных выше. Нативные ротавирусные частицы могут быть размножены и очищены. Затем очищенные ротавирусные частицы могут быть рекапсидированы с получением DLP, которые затем рекапсидируют химерным поверхностным белком, содержащим полученный из патогена антиген.
Обычно модифицированный ротавирусный белок, слитый с первым адаптерным полипептидом, добавляют к DLP с образованием ротавирусных частиц. Добавление дополнительных ротавирусных белков, которые вместе с поверхностным белком ротавируса образуют наружный слой нативной ротавирусной частицы, является необязательным. Затем ротавирусные частицы инкубируют с полученным из патогена антигеном, слитым со вторым адаптерным полипептидом, который образует стабильный комплекс с первым адаптерным полипептидом с получением химерного поверхностного белка.
Препараты
Иммуногенная композиция согласно изобретению может быть получена в форме набора, содержащего первую емкость, содержащую лиофилизированные ротавирусные частицы, и вторую емкость, содержащую раствор для экстемпорального ресуспендирования лиофилизированных ротавирусных частиц. Лиофилизированные ротавирусные частицы могут содержать один или несколько лиопротекторов, таких как сахароза, декстран, сорбит и аминокислоты для стабилизации ротавирусных частиц во время лиофилизации.
Альтернативно предлагаются иммуногенные композиции в одной емкости, содержащей ротавирусные частицы в суспензии. В том случае, когда иммуногенная композиция предназначена для инъекции, она может поставляться в шприце.
Любой раствор может содержать один или несколько эксципиентов.
Растворы обычно готовят на основе воды. Поэтому очищенная вода может являться основным эксципиентом. Например, разбавление ротавирусных частиц с получением требуемой конечной концентрации, как правило, будет осуществляться с использованием воды для инъекции (WFI).
Раствор обычно содержит буфер. Поэтому дополнительные эксципиенты включают средства для забуферивания и регуляторы pH, такие как цитрат натрия, моногидрат однозамещенного фосфата натрия и гидроксид натрия. Могут быть добавлены антациды, такие как карбонат кальция, чтобы предотвратить инактивацию вируса во время прохождения через желудок, если иммуногенную композицию вводят перорально. Также может быть включен регулятор кислотности, такой как адипат динатрия, предпочтительно вместо антацида.
В некоторых случаях в качестве дополнительного эксципиента может присутствовать загуститель, такой как ксантан.
Также может присутствовать поверхностно-активное вещество, в частности неионогенное поверхностно-активное вещество, такое как полисорбат 80.
Другие эксципиенты включают сахарозу, сорбит, неорганические соли, аминокислоты и витамины.
Композиции обычно будут иметь осмоляльность от 200 мОсм/кг до 400 мОсм/кг, предпочтительно от 240 до 360 мОсм/кг, и более предпочтительно будут в диапазоне 280-320 мОсм/кг.
Значение pH композиции согласно изобретению обычно будет от 5,0 до 7,5, и более часто от 5,0 до 6,0 для оптимальной стабильности.
Композиции согласно изобретению предпочтительно содержат <1 EU (единица эндотоксина, стандартная мера; 1 EU равна 0,2 нг эталонного FDA-стандарта эндотоксина EC 2 «RSE») на дозу, и предпочтительно <0,1 EU на дозу.
Композиции согласно изобретению предпочтительно не содержат глутена. Кроме того, композиции согласно изобретению предпочтительно являются стерильными.
Введение
Иммуногенные композиции могут применяться для стимуляции мукозального иммунного ответа. Поэтом иммуногенные композиции могут быть введены перорально или интратрахеально. Могут быть выбраны другие пути введения, такие как внутримышечная инъекция, в зависимости от полученного из патогена антигена, представленного на поверхности модифицированной ротавирусной частицы, включенной в иммуногенную композицию согласно изобретению.
Общее
Термин «содержащий» охватывает «включающий в себя», а также «состоящий из», например, композиция, «содержащая» X может состоять исключительно из X или может включать в себя что-то дополнительное, например,X+Y.
Слово «по существу» не исключает «полностью», например, композиция, которая «по существу не содержит» Y, может совсем не содержать Y. При необходимости слово «по существу» может быть не включено в определение изобретения.
Термин «примерно» в отношении числового значения x означает, например, x±10% или x+два стандартных отклонения значения. В некоторых вариантах «примерно» понимают как приемлемую вариацию и допустимые отклонения в конкретной области. Если не ясно из контекста, подразумевается, что все числовые термины в настоящем описании являются модифицированными как «примерные». Термин «антитело» включает фрагменты антител, такие как антигенсвязывающие фрагменты (Fab), одноцепочечные вариабельные фрагменты (scFv) и т.д. Термин «антигенсвязывающая часть» антитела (или «часть антитела») включает фрагменты антитела, которые сохраняют способность специфично связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может быть осуществлена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, подпадающих под термин «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv- фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент [63], который состоит из домена VH; и (vi) изолированную определяющую комплементарность область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть связаны с использованием способов рекомбинации синтетическим линкером, который позволяет получить их в виде одной белковой цепи, в которой области VL и VH спарены с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); смотри, например, публикации 64 и 65. Подразумевается, что такие одноцепочечные антитела также подпадают под термин «антигенсвязывающая часть» антитела.
В используемом в настоящем описании смысле подразумевают, что «или» является включающим и взаимозаменяемым с «и/или», если иной ясно не указано в контексте.
В используемом в настоящем описании смысле подразумевают, что форма единственного числа включает как единственное число, так и множественной число, если иное ясно не указано в контексте.
Если конкретно не указано иное, способ, включающий в себя стадию смешивания двух или более компонентов, не требует какого-либо конкретного порядка смешивания. Таким образом, компоненты могут быть смешаны в любом порядке. В том случае, когда имеется три компонента, два компонента могут быть объединены друг с другом и затем их сочетание можно объединить с третьим компонентом и т.д.
В том случае, когда используют материалы животного происхождения (и, в частности, бычьего) в культуре клеток для получения материала для введения животным, особенно человеку, такие материалы необходимо получать из источников, которые не заражены трансмиссивными губчатыми энцефалопатиями (TSE), и в частности, не имеют бычьей губчатой энцефалопатии (BSE). В общем, когда продукты готовят для введения животным, и особенно человеку, предпочтительно культивируют клетки вообще в отсутствие полученного от животных материалов.
В случае использования клеточного субстрата для осуществления способов реассортации или обратной генетики, предпочтительным является клеточный субстрат, который был одобрен для применения при получения вакцин для человека, например, описанный в Европейской фармакопее в общей главе 5.2.3 [66].
Идентичность полипептидных последовательностей предпочтительно определяют с использованием алгоритма поиска гомологии Смита-Ватермана, который применен в программе MPSRCH (Oxford Molecular), используя аффинный поиск пробелов со следующими параметрами: штраф за открытие пробела=12 и штраф за удлинение пробела=1.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1: Схематичное представление модификаций, осуществленных в (A) ротавирусном белке VP7 и в (B) гетерологичном белке. HR1 и HR2 образуют часть состоящей из двух частей адаптерной системы для нековалентного связывания гетерологичного белка с ротавирусным белком VP7. Последовательности гетерологичных сигнальных пептидов служат для достижения высоких уровней экспрессии в выбранных системах экспрессии. Аффинные метки облегчают очистку. Сайт узнавания протеазой P1 может быть использован для удаления аффинной метки A1 после очистки. Второй набор сайтов аффинности и узнавания протеазой (A2 и P2) могут быть заменены подходящими линкерными последовательностями и могут служить в качестве спейсерной последовательности, которая может быть необходима для дисплея крупного гетерологичного белка. Маркер тримеризации является необязательным и может быть использован для облегчения образования триммера некоторых гетерологичных белков, который затем способствует связыванию с тримерным ротавирусным белком VP7. Маркер тримеризации, особенно основанный на двойной спирали маркер тримеризации (например, GCN4), также может служить в качестве структурных модулей для расширения пространства, доступного для гетерологичного белка, который представляется в виде дисплея на поверхности ротавирусной частицы, рекапсидированной модифицированным ротавирусным белком VP7.
Фиг. 2: Схематичное представление комплекса, образуемого модифицированным тримерным ротавирусным белком VP7 и тримерным гетерологичным белком. Ротавирусный белок VP7 нековалентно связан с гетерологичным белком через состоящую из двух частей адаптерную систему, при этом одна часть адаптерной системы (HR2) связана с ротавирусным белком VP7, а другая часть адаптерной системы (HR1) связана с гетерологичным белком. HR1 и HR2 образуют шестиспиральный узел, приводящий к образованию стабильного комплекса для нековалентного связывания гетерологичного белка с ротавирусным белком VP7. Химерный поверхностный белок может стать частью наружного слоя ротавирусной частицы при рекапсидации DLP in vitro.
Фиг. 3: Электронные микрофотографии (A) очищенных DLP, (B) DLP, рекапсидированных ротавирусным белком VP7, и (C) DLP, рекапсидированных белком VP7, представляющих в виде дисплея HA вируса гриппа в качестве гетерологичного белка. Частицы негативно красили перед получением изображений.
Фиг. 4: (A) окрашенный Кумасси акриламидный гель после SDS-ПААГ. На дорожке 1 показан маркер молекулярной массы (М.м.). На дорожку 2 загружали очищенные DLP, используемые в реакции рекапсидации (DLP). На дорожку 3 загружали очищенный белковый комплекс VP7-HA (pro), используемый для рекапсидации DLP. На дорожку 4 загружали вводимую смесь DLP, модифицированного белка VP7 и белка HA для реакции рекапсидации (inp). На дорожки 5-7 загружали материал полос, наблюдаемых после очистки рекапсидированных частиц в градиенте CsCl (полосы 1 и 2 и верхняя полоса). На дорожки 8-14 загружали такие же образцы и в том же порядке, как и на дорожки 1-7, но к образцам добавляли восстановитель перед SDS-ПААГ. (B) Ротавирусные DLP, рекапсидированные белковым комплексом VP7-HA, в градиенте CsCl. Полосы 1 и 2 и верхняя полоса соответствуют образцам, загружаемым на дорожки 5-7 на панели A. Положения, в которые рекапсидированные частицы и DLP обычно могут мигрировать, указаны пунктирными стрелками.
Фиг. 5: Поперечный срез трехмерной реконструкции ротавирусной DLP, рекапсидированной модифицированным белком VP7 (A), представляющей в виде дисплея HA, (B) представляющей в виде дисплея HA со связанными ScFv-фрагментами антитела CR6261, и (C) представляющей в виде дисплея HA со связанными Fab-фрагментами антитела CR6261. CR6261 узнает высоко консервативную спиральную область в проксимальном относительно мембраны стебле HA1/HA2. Реконструкция основана на изображениях, полученных при осуществлении крио-ЭМ рекапсидированных DLP.
Фиг. 6: Наложение DLP (белая) на трехмерную реконструкцию DLP, рекапсидированной модифицированным ротавирусным белком VP7 и HA вируса гриппа в качестве модифицированного гетерологичного белка. Реконструкция основана на изображениях, полученных при осуществлении крио-ЭМ рекапсидированных DLP.
Фиг. 7: Деталь трехмерной реконструкции ротавирусной частицы, представляющей в виде дисплея HA вируса гриппа, связанный с Fab-фрагментами антитела CR6261. Ротавирусные частицы получали посредством рекапсидации DLP модифицированным белком VP7, содержащим адаптерную последовательность (HR2). Белок HA был нековалентно связан с модифицированным белком VP7 гептадной повторяющейся последовательностью HR1, слитой на C-конце, которая образует шестиспиральный узел с гептадными повторяющимися последовательностями HR2 белка VP7. CR6261 связывается на проксимальном по отношению к мембране конце каждой субъединицы HA (HA1 и HA2). Реконструкция основана на изображениях, полученных при осуществлении крио-ЭМ рекапсидированных DLP.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1: Конструирование экспрессирующего вектора для модифицированных рекомбинантных белков VP7, HA и gp140 ВИЧ
Ген VP7 дикого типа штамма G3 ротавируса макак-резус (RRV) клонировали в векторе pFastBacDual (Invitrogen™) между сайтами рестрикции BamH I и Not I стандартными способами. Конструировали последовательность Козака (GCCACC; SEQ ID NO: 19) на 5’-конце стартового кодона последовательности, кодирующей VP7. Модификации последовательности, кодирующей VP7, осуществляли с использованием инвертированной ПЦР. Конструировали праймеры для соответствующих температур отжига, содержащие необходимые модификации на концах праймеров. На фигуре 1A показаны различные модификации, которые добавляли к ротавирусной кодирующей последовательности.
Конечный белок, кодируемый модифицированной кодирующей последовательностью VP7, имеет следующие признаки: Первые 21 аминокислота кодируют сигнальную последовательность мелиттина медоносной пчелы для экспрессии модифицированного белка в клетках насекомых. Сигнальный пептид белка VP7 был удален. При необходимости могут быть использованы другие сигнальные последовательности, такие как консенсусная сигнальная последовательности ВИЧ или сигнальный пептид тканевого активатора плазминогена человека (htPA) для экспрессии в клетках человека. (b) Аминокислотные остатки 22-33 образуют необязательную аффинную метку (метка Strep II плюс линкер для более эффективного отщепления сигнального пептида) в целях очистки белка, и они могут быть заменены другими аффинными метками, такими как His-метка, HA-метка, FLAG-метка и т.д.(c) Аминокислотные остатки 34-40 образуют последовательности узнавания протеазой TEV для отщепления аффинной метки, и они могут быть заменены последовательностями узнавания для любых других протеаз, таких как протеаза PreScission™ (т.е., протеаза риновируса 3C), фактор Xa, энтерокиназа, тромбин, фурин и т.д. (d) Аминокислотные остатки 41-136 представляют собой последовательности N-концевой части VP7 ротавируса макак-резус (аминокислотные остатки VP7 с 51 по 146). (e) Аминокислотный остаток 137 является состоящим из одной аминокислоты линкером и может быть заменен другой подходящей линкерной последовательностью. (f) Аминокислотные остатки 138-165 являются частью C-гептадного повтора gp41 ВИЧ штамма HXB2 и могут быть заменены гептадными повторяющимися последовательностями из другого ретровируса, парамиксовируса и т.д., при условии, что заменяющая последовательность совместима с гептадными повторяющимися последовательностями, используемыми в конструкциях модифицированного HA или белка gp140 (смотри ниже). (g) Аминокислотные остатки 166-187 представляют собой последовательность узнавания протеазой фактором Xa, за которой следует метка в виде белка C, фланкированная линкерами; такая модификация является необязательной и может быть заменена другими последовательностями, такими как сконструированный эпитоп или просто линкерная последовательность, такая как GGSGGSGGSGGSGGS (SEQ ID NO:20) или GGSGGSGGSGGSGGSGG (SEQ ID NO:21). Презентация эпитопа может быть полезна для упаковки фрагментов антитела, узнающих эпитоп, для дополнительной стабилизации представленных в виде дисплея собранных структур (включая гетерологичный белок) для структурных исследований. Как было сказано, конструирование для структурных исследований является более сложным путем, чем конструирование для презентации антигенов. (h) Аминокислотные остатки 188-367 представляют собой C-концевую часть VP7 ротавируса макак-резус (аминокислотные остатки VP7 147-326). Модифицированный белок VP7, кодируемый такой модифицированной кодирующей последовательностью, имеет аминокислотную последовательность SEQ ID NO:22.
Получают альтернативные конструкции, содержащие некоторые модификации, описанные в предыдущем абзаце. Например, некоторые из таких конструкций содержат дополнительную эпитопную метку, которая распознается анти-ВИЧ-антителом 2F5 (например, SEQ ID NO:29 и 31). В других конструкциях C-гептадный повтор gp41 ВИЧ штамма HXB2 заменяли C-гептадным повтором вируса Нипах (например,SEQ ID NO:32-41). Длина гептадной повторяющейся последовательности варьировала в некоторых конструкциях (например, SEQ ID NO:27 и 28). Подобным образом, линкер, соединяющий C-гептадную повторяющуюся последовательность и остальную часть последовательности, кодирующей белок VP7, в некоторых конструкциях укорачивали (смотри, например, SEQ ID NO:24-26). Разные варианты суммированы в таблице 1. Модифицированная последовательность белка VP7 SEQ ID NO:22 включена в качестве эталонной последовательности. Последовательности в таблице 1 показаны в направлении от N-конца к C-концу.
ДНК, состоящие из вектора и модифицированных генов, создавали, используя ПЦР. Продукты ПЦР очищали в геле и подвергали обработке полинуклеотидкиназой T4 для создания фосфорилированных концов. Затем осуществляли лигирование тупых концов для получения конечной ДНК посредством инкубации ДНК с соответствующими количествами лигазы T4 в течение 2 часов или в течение ночи при комнатной температуре. Затем продукты лигирования обрабатывали Dpn I в течение 30 минут при 37°C и затем использовали для трансформации клеток DH5α в соответствии со стандартными протоколами.
Обычно собирали три-четыре колонии и выращивали ночные культуры клеток для получения плазмидной ДНК с использованием набора Miniprep (Qiagen™). Плазмиды исследовали с помощью электрофореза в агарозном геле и правильные последовательности подтверждали секвенированием ДНК. Плазмиды с правильными последовательностями использовали для трансформации компетентных клеток DH10Bac, используя стандартные способы. Отбирали две-три белых колонии для каждой конструкции и выращивали ночные культуры клеток для экстракции рекомбинантной бакмидной ДНК посредством преципитации в изопропаноле/этаноле (раствор I: 15 мМ трис, pH 8,0, 10 мМ EDTA и 100 мкг/мл РНК-азы A; раствор II: 0,2 М NaOH и 1% SDA; и раствор III: 3 М ацетат калия, pH 5,5; все растворы стерилизовали фильтрованием). Очищенные бакмиды исследовали в ПЦР, используя праймеры M13, и корректные ДНК использовали для трансфекции монослоя клеток sf9 в 6-луночных чашках, в каждую лунку высевали 1 миллион клеток. Вирусы P1 собирали через 5 дней после трансфекции, и вирусы P2 получали в результате инфекции клеток sf9 (плотность 1,5~2 миллиона/мл) 0,05~0,1% вирусами P1. Вирусы P2 собирали через 5~7 дней после инфекции и использовали для экспрессии белка.
Модифицированные конструкции белка VP7, описанные выше, можно применять для дисплея образующих тримеры гетерологичных белков с соответствующим образом модифицированным образующим тримеры гетерологичным белком (смотри фигуру 1B, схематично представляющую подходящие модификации). Как показано на фигуре 2, гептадные повторяющиеся последовательности HR2 модифицированного белка VP7 и гептадные повторяющиеся последовательности HR1 соответствующим образом модифицированного образующего тримеры гетерологичного белка образуют стабильный комплекс посредством образования шестиспирального узла, который служит в качестве адаптера для нековалентного закрепления гетерологичного белка на ротавирусном белке VP7. Белок гемагглютинин (HA) вируса гриппа A и слитый белок gp140 ВИЧ-1 были выбраны в качестве примеров образующих тримеры гетерологичных белков.
Ген HA вируса гриппа A H1N1 «Соломоновы острова» 2006 клонировали в векторе pFastBac LIC™ (Life TechnologiesTM) способом независимого от лигирования клонирования (LIC). Вектор pFastBac LIC™ создавали путем встраивания сайта LIC в вектор pFastBac1 (Invitrogen). Последовательность Козака (SEQ ID NO:19) конструировали на 5’-конце стартового кодона перед кодирующей последовательностью. Модификация в кодирующую последовательность гена HA была введена с использованием инвертированной ПЦР.
Конечный белок, кодируемый модифицированной кодирующей HA последовательностью, имел следующие признаки: (a) Первые 38 аминокислот кодируют сигнальный пептид gp64 бакуловируса для экспрессии модифицированного белка в клетках насекомых. Сигнальный пептид белка HA был удален. В подходящих случаях могут быть использованы другие сигнальные последовательности, такие как консенсусная сигнальная последовательность ВИЧ или сигнальный пептид tPA человека для экспрессии в клетках человека. (b) Аминокислотные остатки 42-47 образуют необязательную аффинную метку (His-метка плюс линкер для более эффективного отщепления сигнального пептида) в целях очистки белка и могут быть заменены любыми другими аффинными метками, такими как метка strep, HA-метка, FLAG-метка и т.д. (c) Аминокислотные остатки 48-54 образуют последовательность узнавания протеазой TEV для отщепления аффинной метки. Также включали линкерную последовательность. Последовательность узнавания протеазой TEV может быть заменена последовательностью узнавания любыми другими протеазами, такими как протеаза PreScission™(т.е. протеаза риновируса 3C, GE Healthcare™, Life Sciences), фактор Xa, энтерокиназа, тромбин, фурин и т.д. (d) Аминокислотные остатки 55-381 представляют собой последовательности HA1-части гемагглютинина вируса гриппа A штамма «Соломоновы острова» 2006, которые при необходимости могут быть модифицированы/мутированы или заменены последовательностями любых других штаммов вируса гриппа, как показано ниже. (e) Аминокислотные остатки 382-386 представляют собой последовательность узнавания энтерокиназой, сконструированную между HA1 и HA2 в целях расщепления. Такой сайт является необязательным и при необходимости может быть заменен последовательностями узнавания фактором Xa, протеазой TEV или другими протеазами. (f) Аминокислотные остатки 387-565 представляют собой последовательность HA2-части HA. (g) Аминокислотные остатки 566-595 являются маркером тримеризации из фибритина бактериофага T4 (фолдон), который является необязательным и может быть заменен любым другим маркером тримеризации или линкерными последовательностями. (h) Аминокислотные остатки 596-629 являются частью N-гептадного повтора gp41 ВИЧ штамма HXB2 и могут быть заменены другими подходящими гептадными повторяющимися последовательностями, например, из любого другого ретровируса, парамиксовируса и т.д. нумерация аминокислотных последовательностей HA, используемая в описании модифицированных последовательностей, кодирующих HA, приведена в соответствии с GenBank ID ABU50586.1 (включен в настоящее описание в виде ссылки в версии, доступной на дату подачи заявки, обеспечивающей приоритет). Аминокислота последовательность такой конструкции показан в SEQ ID NO:46.
Получали альтернативные конструкции, содержащие некоторые из модификаций, описанных в предыдущем абзаце. Например, домен тримеризации исключали из альтернативных конструкций (например, SEQ ID NO:48 и 49). В некоторых конструкциях последовательность узнавания энтерокиназой заменяли последовательностью узнавания фактором Xa (например, SEQ ID NO:52). Такая конструкция также не содержала линкера между последовательностью, кодирующей HA, и C-гептадной повторяющейся последовательностью. В других конструкциях удаляли и домен тримеризации и последовательность узнавания энтерокиназой (SEQ ID NO:51). N-гептадный повтор вируса Нипах иногда использовали вместо N-гептадного повтора gp41 ВИЧ штамма HXB2 (смотри, например,SEQ ID NO:47 и 49). Длина гептадной повторяющейся последовательности варьировали в некоторых конструкциях (например, SEQ ID NO:54, 56 и 58). В других конструкциях варьировала длина линкера, соединяющего последовательность, кодирующую HA, с N-гептадной повторяющейся последовательностью (смотри, например,SEQ ID NO:56 и 58). Модифицированные гены HA H3 Wisconsin 2005 (смотри SEQ ID NO:60 и 61) и H5 Vietnam 2004 (смотри SEQ ID NO:62 и 63) были оптимизированы по кодонам и синтезированы в GeneArt™ (Life Technologies™), и затем включены в модифицированные конструкции. Нумерация аминокислотных последовательностей HA, используемая в описаниях таких конструкций, приведена в соответствии с GenBank ID AAT73274.1 и ACV49644.1 (оба включены в виде ссылки в версиях, доступных на дату подачи заявки, обеспечивающей приоритет), соответственно. Структуры таких модифицированных кодирующих последовательностей HA суммированы в таблице 2. Модифицированная последовательность белка HA SEQ ID NO:46 включена в качестве эталонной последовательности. Последовательности в таблице 2 показаны в направлении от N-конца к C-концу.
Каждый из трех модифицированных генов HA субклонировали в pFastBacDual™ (Life Technologies™) между сайтами Sal I и Not I. Рекомбинантные бакуловирусы, несущие модифицированные гены HA, создавали после осуществления способов, сходных со способами, описанными для VP7.
Модифицированные гены gp140 ВИЧ-1 клады A 1992 Уганда серотипа 037.8 и клады C 1997 оптимизировали по кодонам и синтезировали в GeneArt™(Life Technologies™). Модифицированные гены субклонировали в pFastBacDual™ (Life Technologies™) между сайтами Sal I и Not I.
Конечный белок, кодируемый модифицированной кодирующей последовательностью gp140 штамма ВИЧ-1 клады A, имел следующие признаки: (a) Первый 21 аминокислота кодируют сигнальный пептид мелиттина медоносной пчелы для экспрессии модифицированного белка в клетках насекомых. Сигнальный пептид gp140 удаляли. В соответствующих случаях могут быть использованы другие сигнальные последовательности, такие как консенсусная сигнальная последовательность ВИЧ или сигнальный пептид tPA человека для экспрессии в клетках млекопитающих/человека. (b) Аминокислотные остатки 22-29 образуют необязательную аффинную метку (His-метка плюс линкер для более эффективного отщепления сигнального пептида) в целях очистки белка и могут быть заменены любыми другими аффинными метками, такими как метка strep, HA-метка, FLAG-метка и т.д. (c) Аминокислотные остатки 30-36 образуют последовательность узнавания протеазой TEV для отщепления аффинной метки и могут быть заменены последовательностями узнавания любыми другими протеазами, такими как протеаза PreScission™(т.е. протеаза 3C риновируса, GE Healthcare™, Life Sciences), фактор Xa, энтерокиназа, тромбин, фурин и т.д. (d) Аминокислотные остатки 37-685 представляют собой кодирующую последовательность gp140 ВИЧ штамма 1992 Уганда 037.8, которая в соответствующих случаях может быть модифицирована/мутирована или может быть заменена последовательностью из любых других штаммов ВИЧ/SIV. (e) Аминокислотные остатки 686-694 представляют собой линкер и могут быть заменены любыми другими подходящими линкерными последовательностями. (f) Аминокислотные остатки 695-721 являются маркером тримеризации из фибритина бактериофага T4 (фолдон), который является необязательным или может быть заменен любым другим маркером тримеризации или линкерными последовательностями. (g) Аминокислотные остатки 722-755 являются частью N-гептадного повтора gp41 ВИЧ штамма HXB2 и могут быть заменены другими подходящими гептадными повторяющимися последовательностями, например, из любого другого ретровируса, парамиксовируса и т.д. Аминокислотная последовательность такой конструкции показана в SEQ ID NO:64.
Получали альтернативные конструкции, содержащие некоторые из возможных модификаций, указанных в предыдущем абзаце. Например, некоторые из таких конструкций не содержат маркер тримеризации, и линкерная последовательность между кодирующей областью gp140 и N-гептадным повтором была укорочена (например, SEQ ID NO:66 и 67). Другие конструкции адаптировали для экспрессии в клетках млекопитающих, заменяя сигнальный пептид (например, SEQ ID NO:65 и 67). В некоторых конструкциях N-гептадный повтор gp41 ВИЧ штамма HXB2 заменяли N-гептадным повтором вируса Нипах (SEQ ID NO:68-71 и 76-79), в других кодирующую последовательность gp140 из ВИЧ-1 клады A 1992 Уганда серотипа 037.8 заменяли кодирующей последовательностью gp140 из ВИЧ-1 клады C 1997 (SEQ ID NO:72-79). Нумерация для gp140 клады A и C приведена в соответствии с GenBank ID AAB05027.1 и AF286227.1 (которые включены в виде ссылки в версиях, доступных а дату подачи заявки, обеспечивающей приоритет), соответственно.
Разные варианты суммированы в таблице 3. Модифицированная последовательность белка gp140 SEQ ID NO: 64 также включена в качестве эталонной последовательности. Последовательности в таблице 3 показаны в направлении от N-конца к C-концу.
Пример 2: Получение стабильных комплексов VP7-HA
Чтобы получить комплексы HA-VP7, клетки Hi5 при плотности 2×106/мл инфицировали 0,5% VP7-бакуловирусом и 1,0% HA-бакуловирусом в присутствии 5,0% инактивированной нагреванием FBS (Sigma-Aldrich). Среду собирали через 5 дней после инфекции, осаждая клетки центрифугированием при 4000×g в течение 45 минут. Надосадок подвергали диафильтрации против 8 литров 1x TNC (20 мМ трис, pH 8,0, 100 мМ NaCl и 1,0 мМ CaCl2; с добавлением 0,02% азида натрия), используя фильтр с отсечением 10 кД в системе фильтрации в тангенциальном потоке Cogent M (Millipore). В образцы с замененным буфером добавляли 1,0 мМ PMSF и осветляли центрифугированием в течение 1 часа при 10000 об./мин в роторе JA10 (Beckman™). Белковые комплексы очищали из надосадка на колонке StrepTactin® (IBA™), затем на колонке NiNTA (QiagenTM) и колонке Superose 6 (Amersham™).
Очищенные комплексы HA-VP7 обрабатывали 0,002% (масс./масс.) энтерокиназой при 4°C в течение 48 часов. Расщепление HA0 на HA1 и HA2 исследовали в SDS-ПААГ. Энтерокиназу инактивировали добавлением таблетки 1x не содержащей EDTA полной смеси ингибиторов протеаз. К образцу добавляли редокс-буфер (GSH и GSSG в молярном соотношении 10:1) в конечной концентрации 0,2~0,5 мМ и обрабатывали протеазой TEV (1/50~200, масс./масс.) либо при комнатной температуре в течение 4 часов, либо при 4°C в течение ночи. Удаление меток также исследовали в SDS-ПААГ.
Пример 3: Получение стабильных комплексов gp140 ВИЧ-VP7
Модифицированные гены VP7 и gp140, кодирующие белки с последовательностями SEQ ID NO:22, 26, 32 и 36 и SEQ ID NO:64, 66, 68 и 70, соответственно, субклонировали в векторах pVRC8400 и pVRC-IRES-Puro между Sal I и Not I для экспрессии в клетках млекопитающих. Сигнальный пептид для гена VP7 заменяли на сигнальный пептид tPA человека, а сигнальный пептид для гена gp140 заменяли на консенсусную последовательность сигнального пептида ВИЧ. Полученные в результате модифицированные белки VP7 и модифицированные белки gp140 имели аминокислотные последовательности SEQ ID NO:42-45 и SEQ ID NO:65, 67, 69 и 71, соответственно. Коэкспрессию и образование комплексов тестировали для следующих сочетаний модифицированного белка VP7 и модифицированного белка gp140: SEQ ID NO:42+65, SEQ ID NO:42+67, SEQ ID NO:43+65, SEQ ID NO:43+67, SEQ ID NO:44+69, SEQ ID NO:44+71, SEQ ID NO:45+69, SEQ ID NO:45+71.
Комплексы gp140 ВИЧ-VP7 экспрессировали посредством котрансфекции клеток 293T плазмидой, содержащей ген gp140-HR1, и другой плазмидой, содержащей ген VP7-HR2. Временную трансфекцию осуществляли, следуя стандартным протоколам, с использованием полиэтиленимина (PEI, 25 кД, линейный или разветвленный). Для более высокого выхода белка отбирали стабильные клеточные линии против пуромицина. Кратко, клетки 293T в виде слоя, слитого на 70%, трансфицировали смесью Lipofectoamine® 2000 (Invitrogen®) и версией pVRC-IRES-puro двух плазмид (массовой соотношение 2:1 липофектамина к суммарной ДНК), следуя стандартным способам. Через 20 часов после трансфекции среду заменяли средой DMEM (Gibco®) с добавлением 10% фетальной сыворотки теленка (Atlas), 1% GlutaMAX™ (Gibco®), 100 единиц/мл пенициллина/стрептомицина (Gibco®) и 2 мкг/мл пуромицина (Gibco®). Среду поддерживали свежей, заменяя ее каждые три-четыре дня вплоть до образований колоний (видимых невооруженным глазом). Отдельные колонии собирали и культивировали в 24-луночных планшетах для тестирования экспрессии в небольшом масштабе. Колонии, несущие оба гена, отбирали на основе выявления обоих белков на Вестерн-блотах. Колонии с наиболее высоким выходом комплекса получали в большем масштабе и сохраняли в качестве маточных культур в жидком азоте. Клетки получали в большем масштабе в среде, содержащей пуромицин, и экспрессию белка можно было осуществить, используя либо прикрепленные, либо суспензионные клеточные культуры в среде 293 Freestyle (Gibco®) с добавлением 5% инактивированной нагреванием FBS (Sigma-Aldrich®). Среду собирали через 5 дней, осаждая клетки центрифугированием при 4000×g в течение 45 минут. Диафильтрацию и очистку белка осуществляли, следуя таким же способам, которые описаны для комплексов HA-VP7.
Пример 4: Получение Fab и Fv
Моноклональное антитело CR6261 узнает высоко консервативную спиральную область в проксимальном по отношению к мембране стебле белка вируса гриппа HA [67]. Структурные факторы и координаты для Fab-фрагмента sHgL CR6261 депонировали в банке данных о белках (Protein Data Bank) с номером доступа 4EVN (включен в настоящее описание в виде ссылки в версии, доступной на дату подачи заявки, обеспечивающей приоритет) и они были описаны ранее [68].
Кодирующую последовательность для антигенсвязывающего фрагмента (Fab) и одноцепочечного вариабельного фрагмента (scFv) моноклонального антитела CR6261 клонировали в векторе pVRC-IRES-Puro между Sal I и Not I, следуя стандартным способам, как описано выше. Сигнальный пептид tPA человека использовали в таких конструкциях для эффективной секреции в системах экспрессии млекопитающих. Аминокислотные последовательности конечных конструкций показаны в SEQ ID NO:81-83. Также получали scFv моноклонального антитела CR6261 для экспрессии в бактериальных клетках (смотри SEQ ID NO:80).
Fab экспрессировали в результате временной трансфекции клеток 293T во вращающихся флаконах. В случае каждого вращающегося флакона по 125 мкг каждой плазмидной ДНК, содержащей гены тяжелой и легкой цепи, смешивали в 12,5 мл DMEM (Gibco®) без добавок и инкубировали в ламинарном боксе в течение 15 минут. PEI (500 мкг, линейный или разветвленный) также разбавляли в 12,5 мл DMEM без добавок и инкубировали в ламинарном боксе в течение 15 минут перед добавлением по каплям и тщательно перемешивали со смесью ДНК. Всего 25 мл смеси инкубировали в ламинарном боксе еще в течение 15 минут, чтобы обеспечить возможность для образования комплекса ДНК-PEI, а затем добавляли к клеткам, слитым в слой на 50~70% во вращающихся флаконах. Клетки инкубировали в течение более 5 часов с комплексом DNA-PEI при 37°C, и среду заменяли на 250 мл среды 293 FreeStyle™ (Gibco®) с добавлением 100 единиц/мл пенициллина/стрептомицина. Среду собирали через 5 дней после трансфекции, и Fab очищали, используя аффинную смолу CaptureSelect® Lc Kappa или Lc Lambda, с последующей эксклюзионной хроматографией по размеру на колонке S200 (Amersham™).
ScFv экспрессировали либо в клетках 293T в виде секретируемых белков, либо в E.coli в виде телец включения, из которых белок затем экстрагировали и подвергали рефолдингу. Использовали такие же способы временной трансфекции, как и описанные выше, в случае экспрессии в клетках млекопитающих. В случае экспрессии в E.coli экспрессию белка индуцировали в течение примерно 5 часов, используя 1 мМ IPTG при плотности клеток 0,6~0,8 OD600 нм. Клетки собирали, промывали 1 x PBS и лизировали обработкой ультразвуком на льду. Тельца включения экстрагировали после удаления растворимых фракций клеток центрифугированием в течение 15 минут при 20000×g. Тельца включения растворяли в 100 мМ трис pH 7,5, 8 М мочевине и 10 мМ β-меркаптоэтаноле, осветляли центрифугированием (20 минут при 40000×g), и надосадок очищали на колонке NiNTA. Элюированный образец, также в денатурированной форме, разбавляли в буфере для рефолдинга (100 мМ трис pH 7,5, 1 М аргинин, 500 мМ NaCl, 10% глицерин и 1 мМ EDTA) по каплям при 4°C до конечной концентрации белка меньше 0,1 мг/мл. Подвергнутый рефолдингу образец диализовали против 20 мМ трис, pH 7,5, 100 мМ NaCl четыре раза, каждый раз используя 20 объемов. Затем диализованный образец осветляли центрифугированием при 10000 об/мин в роторе JA10 (Beckman™) и надосадок пропускали через колонку NiNTA, чтобы сконцентрировать белок. Затем элюированные фракции объединяли, концентрировали и дополнительно очищали на колонке для эксклюзионной хроматографии по размеру S200 (Amersham™).
Пример 5: Получение DLP
Ротавирус макак-резус серотипа G3 размножали, инфицируя клетки MA-104. Кратко, клетки MA104 выращивали в среде M199 (Gibco®) с добавлением 10% фетальной сыворотки теленка (HyClone™ Laboratories), 10 мМ HEPES, pH 7,0, 2 мМ L-глутамин и 100 единиц/мл пенициллина/стрептомицина. Клетки поддерживали и выращивали в большом масштабе в камере для культивирования клеток с 10 расположенными друг над другом отсеками (Corning™) или вращающихся флаконах. Когда слой клеток сливался, среду заменяли не содержащей сыворотки средой MA199 с добавлением 1 мкг/мл трипсина поджелудочной железы свиньи (Sigma-Aldrich®) для инокуляции и размножения ротавирусов. Среду инфицированных клеток MA104 собирали примерно через 36~42 часов после инфекции и хранили при -80°C для применения в будущем.
Замороженную среду от инфицированных клеток MA104 размораживали при 4°C в течение ночи. Обломки клеток осаждали низкоскоростным центрифугированием при 3000×g в течение примерно 10 минут. Полученный в результате надосадок фильтровали через фильтровальную бумагу Whatman®, чтобы удалить оставшиеся обломки клеток, затем его пропускали через фильтровальную установку ExpressPlus 0,45 мкм (Millipore™) под действием вакуума. Затем вирусные частицы осаждали при 45000 об/мин в течение 1 часа при 4°C в роторе 45Ti (BeckmanTM).
Осадок ресуспендировали в общем объеме 10 мл 1x TNE-буфера (20 мМ трис, pH 8,0, 100 мМ NaCl и 1 мМ EDTA), кратковременно обрабатывали ультразвуком и дважды экстрагировали, используя Freon 113 (Sigma-Aldrich®). Водную фазу извлекали и концентрировали примерно до 1 мл в центрифужном фильтрующем устройстве Amicon® (предел отсечения 100 кД) при 3000×g в течение примерно 10 минут. Концентрированный образец ресуспендировали пипетированием несколько раз вверх и вниз и наслаивали на предварительно приготовленный градиент CsCl в 1x TNE (плотность 1,26-1,45 г/ил, которую определяли с использованием рефрактометрии). Образцы центрифугировали при 55000 об./мин в роторе SW 55Ti (Beckman™) при 4°C в течение примерно 2 часов. Полосу с DLP собирали и диализовали в течение ночи при 4°C против 1x TN-буфера (20 мМ трис, pH 8,0, 100 мМ NaCl) с добавлением 0,02% азида натрия.
DLP негативно красили и визуализировали, используя электронную микроскопию (ЭМ; фигура 3A).
Пример 6: Рекапсидация DLP комплексом HA-VP7
DLP, полученные в примере 5, и модифицированный ротавирусный белок VP7, полученный в примере 1, смешивали и инкубировали при 4°C в течение, по меньшей мере, 1 часа в присутствии 5~10 мМ CaCl2. Полученные в результате частицы негативно красили и визуализировали, используя ЭМ. Наблюдали один слой VP7, покрывающий каждую частицу, что подтверждает, что модифицированный белок VP7 способен рекапсидировать DLP (фигура 3B).
Рекапсидацию DLP комплексом HA-VP7, полученным в примере 2, осуществляли при 4°C в течение, по меньшей мере, 1 часа, смешивая их в молярном соотношении от 1:1,5 до 1:2 в присутствии 5~10 мМ CaCl2. Рекапсидированные ротавирусные частицы негативно красили и визуализировали, используя ЭМ. В дополнение к одному слою VP7, покрывающему DLP, наблюдали следующий слой, окружающий рекапсидированные частицы, что подтверждает, что комплекс HA-VP7 правильно собран на поверхности DLP (фигура 3C).
Чтобы подтвердить, что дополнительный слой был образован белком HA, рекапсидированные частицы нагружали на предварительно приготовленный градиент CsCl в 1x TNC (плотность от 1,25 г/мл до 1,45 г/мл) и центрифугировали в роторе SW60 (Beckman™) при 58000 об/мин в течение 2 часов. Полученные в результате полосы собирали, диализовали против 1x TNC и исследовали в SDS-ПААГ. В качестве контроля, DLP, комплекс HA-VP7 и их смесь, которую использовали в реакции рекапсидации, также нагружали на гель на отдельные дорожки. После разделения наблюдали отдельные полосы, соответствующие белкам VP2 и VP6 DLP, белку VP7 и белку HA, в правильном стехиометрическом соотношении в образце, что соответствовало рекапсидированным частицам (фигура 4). Полученные данные подтвердили, что дополнительный слой, окружающий рекапсидированные частицы, состоял из белка HA при полной занятости.
Пример 7: Реконструкция трехмерного изображения комплекса HA-VP7-антитело
Крио-ЭМ высокого разрешения может заменять рентгеновскую кристаллографию в качестве предпочтительного способа для анализа больших молекулярных комплексов, в частности, в таких областях, в которых необходимо быстрое выяснение структур большого количества молекулярных комплексов. Одной из таких областей является конструирование вакцин против вируса гриппа, в случае которого дрейф антигенов приводит к быстрым изменениям в последовательности иммунодоминантного поверхностного антигена, белка HA. Ранее были идентифицированы защитные моноклональные антитела широкого спектра действия, и многие из таких антител узнают консервативные эпитопы, которые не подвергаются быстрым изменениям. Чтобы исследовать их применимость в качестве защитных средств против вновь возникающих штаммов вируса гриппа, необходим скрининг таких нейтрализующих анти-HA-антител широкого спектра действия против разных вариантов белка HA.
Проверяли осуществимость такого способа с использованием крио-ЭМ-анализа. DLP рекапсидировали модифицированным белком VP7 отдельно или с использованием комплекса HA-VP7, как описано в примере 6. Частицы, рекапсидированные HA-VP7-антителом, получали, смешивая очищенные комплексы HA-VP7 с Fab или scFv моноклонального антитела CR6261, полученными в примере 4, в молярном соотношении 1:1,5~2,0. Смесь инкубировали при 4°C в течение 30 минут. Комплексы очищали, загружая смесь после окончания периода инкубации на колонку Superose 6. Затем очищенные комплексы использовали для рекапсидации DLP, следуя таким же способам, которые описаны в примере 6. Альтернативно, фрагменты антител добавляли непосредственно к частицам, рекапсидированным комплексами HA-VP7, в молярном соотношении 1:1,2~1,5 либо до, либо после стадии очистки в градиенте CsCl.
Крио-сетки получали с использованием автоматизированного погружающего устройства Vitrobot™ (FEI). Перфорированные углеродные сетки Quantifoil обрабатывали в тлеющем разряде и оставляли при комнатной температуре в течение ночи перед применением. В случае каждой сетки 4 мкл образца в концентрации, эквивалентной ~5 мг/мл ротавирусных DLP, наносили на поверхность с одной стороны сетки. Во время погружения влажность в камере поддерживали около 100% и температуру около 22°C. Затем сетку промокали в течение 4 секунд с обеих сторон фильтровальной бумагой, сразу после этого погружали в жидкий этан для превращения в стекловидное вещество. Затем сетки хранили в жидком азоте до использования с целью сбора данных.
Сбор данных осуществляли, используя электронный микроскоп Tecnai™ F30 (FEI), работающий при 300 кВ. Оптическую систему настраивали, используя стандартные способы (смещение луча, наклон луча, высота эуцентрического положения, точки поворота, центр вращения, астигматизм и т.д.). Способы получения изображений включали в себя нахождение требуемой области визуализации, корректировку расфокусировки (от 0,6 до 3,0 мкм), тестирование скорости дрейфа сетки (менее 2 Å в секунду) и конечную экспозицию изображения. Такие процедуры осуществляли полуавтоматически, используя программу SerialEM (Cryo-electron Microscopy Facility, University of Colorado - Boulder). Данные регистрировали в виде кинофильмов на камере прямой детекции K2 Summit™ (Gatan™), используя режим сверхвысокого разрешения (размер пикселей: 0,99 Å). Использовали протокол «фильма», описанный в публикации 24. Мощность дозы на образце составляла ~3 электрона/Å2 в секунду. Каждый кадр регистрировал экспозицию 0,5 секунды, и конечный фильм состоял из 24 кадров с накопленной дозой ~36 электронов/Å2.
Кадры каждого фильма совмещали, используя скрипты IMOD (Cryo-electron Microscopy Facility, University of Colorado - Boulder) на основе перекрестной корреляции изображений. Совмещенные кадры просто усредняли для начальной обработки изображений. Однако, поскольку разрешение позже улучшилось, использовали усредненные изображения первых 13 кадров (или лучшую серию кадров) каждого фильма, которые соответствовали дозе ~20 электронов. Изображения частиц получали, используя e2boxer.py пакета программ для обработки изображений EMAN2 [69]. Изображения с очевидными дефектами, искажениями, аномальным фокусов, загрязнением, перекрыванием или большим дрейфом образца исключали вручную после визуальной проверки. Координаты частиц использовали для вырезания стеков изображений отдельных частиц с размерами 1600×1600 пикселей, используя proc2d из пакета программ для обработки изображений EMAN2 [69]. Значения расфокусировки определяли, используя программу CTFFIND3 [23].
Уточнение структуры и реконструкции осуществляли, используя программу FREALIGN [40]. Поиск исходной ориентации осуществляли, используя 4x-сгруппированные данные и ранее рассчитанную карту VP7-рекапсидированных частиц (7RP) (смотри публикацию 1) в качестве 3-мерного эталона. Параметры исходного совмещения вырезанных частиц, определенные при системном поиске (режим 3) с угловым интервалом в 1°, дополнительно уточняли по сравнению с самыми последними реконструкциями (режим 1) вплоть до тех пор, пока больше не происходило улучшения разрешения. Во время совмещения накладывали радиальную маску оболочки от 220 до 400 Å, чтобы сохранить плотность, соответствующую ротавирусной части, и чтобы исключить плотность, соответствующую шипам РНК и HA. Изображения также подвергали низкочастотной фильтрации (до 15 Å), чтобы избежать возможной излишней подгонки в процессе совмещения. Затем параметры совмещения использовали для расчета реконструкций полных частиц (в радиальной оболочке 600 Å или с радиусом от 220 до 600 Å для белкового содержимого).
Затем, 2x-сгруппированные и затем несгруппированные изображения использовали для дальнейшего уточнения параметров совмещения, следуя методикам, сходным с методиками, используемыми для 4x-сгруппированных данных, т.е. используя начальный системный поиск (режим 3) с последующими множественными циклами уточнения углов и положений (режим 1) вплоть до тех пор, пока больше не наблюдалось улучшения разрешения. На каждой стадии уточнения накладывали маску оболочки от 220 до 400 Å, и данные ограничивали наиболее надежным разрешением (до 10 Å в случае 2x-сгруппированных данных и до 8 Å для несгруппированных данных). Реконструкции вычисляли для полной частицы в радиальной оболочке 600 Å.
На фигуре 5A показан поперечный срез трехмерной реконструкции ротавирусной DLP, рекапсидированной только модифицированным белком VP7. На фигуре 5B показан поперечный срез трехмерной реконструкции ротавирусной DLP, рекапсидированной комплексом HA-VP7, как описано в примере 6. На фигуре 6 показано наложение DLP на трехмерную реконструкцию рекапсидированной частицы, показанной на фигуре 5B. На фигуре 5C показан поперечный срез трехмерной реконструкции ротавирусной DLP, рекапсидированной модифицированным белком VP7, представляющей в виде дисплея HA со связанными фрагментами ScFv антитела CR6261.
Чтобы оценить надежность уточнения, получали разные наборы уточнения, маскируя разные области частицы, и параметры совмещения использовали для расчета реконструкций для исключенных областей, которые не были включены во время уточнения. Например, параметры совмещения, полученные при уточнении HA-части (при нанесении маски оболочки от 425 до 600 Å), использовали для расчета реконструкции ротавирусной части (при нанесении маски оболочки от 220 до 400 Å). Полученная в результате карта содержала плотности, четком представляющие VP2, VP6 и VP7, что свидетельствовало о минимальных отклонениях модели. Квазиэквивалентное T=13 расположение слоев VP6 и VP7 ротавируса очевидно распространялось на адаптер и HA-часть частицы. Локальное 13-кратное усреднение не применяли, но оно может быть осуществлено для дальнейшего улучшения разрешения. Подгонку твердых тел: ротавирусных VP2, VP6 и VP7, шестиспирального узла, HA и Fab к электронным картам плотности осуществляли, используя UCSF chimera [47].
Пример уровня подробностей, который может быть достигнут в результате дополнительного уточнения реконструкций, полученных с использованием крио-ЭМ, как описано в предыдущем абзаце, показан на фигуре 7. Показано детальное изображение трехмерной реконструкции ротавирусной частицы, представляющей в виде дисплея HA вируса гриппа, связанный с Fab-фрагментами антитела CR6261. На рассчитанной карте могут быть визуализированы некоторые вторичные структуры. Как ожидалось, видно, что вариабельный домен CR6261 взаимодействует и с HA1 и с HA2.
Пример 8: Исследования иммунизации белковыми комплексами HA-VP7, закрепленными на ротавирусных DLP
Самок мышей BALB/c 6-8-недельного возраста иммунизировали внутримышечно (в/м) три раза с трехнедельными интервалами одним из трех разных препаратов, каждый из которых готовили в 100 мкл буфера, содержащего кальций. Группа 1 получала приготовленные в виде препарата комплексы белков HA-VP7, закрепленные на ротавирусных DLP, группа 2 получала очищенный HA, и группа 3 получала HA, смешанный с VP7-рекапсидированными DLP. Четвертой группе мышей проводили мнимую инъекцию 100 мкл буфера. Эксперименты могут включать разные дозы для каждой из групп. Эквивалентные количества антигена можно использовать для сравнения иммунного ответа на эквивалентные дозы антигена в разных формах. Альтернативно, можно использовать эквивалентные количества белка, чтобы сравнить иммунные ответы на разные количества общего белка.
Одна или несколько групп могут получать адъювант. Адъюванты могут быть особенно применимы при стимуляции иммунного ответа у мышей в группе 2, получающих очищенный антиген HA.
Каждая группа исследования вакцины содержит восемь мышей, и контрольная группа, получающая «только буфер», содержит пять мышей. Кровь берут в -1, 20, 41, 56 и 84 дни после введения первой инъекции.
За мышами проводят наблюдение после иммунизации в отношении изменения массы тела, реакций в месте инъекции и других клинических наблюдений. Гуморальные ответы на вводимые антигены анализируют, используя способы, известные в данной области для анализа специфичности антител (например, анализ ELISA и конкурентный анализ ELISA против HA и ротавирусных белков, включая белок VP7) и нейтрализующей активности (например, анализ ингибирования гемагглютинации вируса гриппа, смотри, например, публикации 70 и 71).
Результаты показывают значимо более высокий иммунный ответ на комплексы белков HA-VP7 на ротавирусных DLP по сравнению с очищенным HA, включая очищенный HA, приготовленный с адъювантом. Конкурентный ELISA показывает, что гуморальные ответы на комплексы белков HA-VP7 происходят преимущественно на HA-часть комплекса, а не на VP7 или ротавирусную часть комплекса. Результаты показывают значимо более высокие тиры нейтрализующих антител в результате иммунизации комплексами белков HA-VP7, находящимися на ротавирусных DLP, по сравнению с очищенным HA, включая очищенный HA, приготовленный с адъювантом. Полученные результаты показывают повышенную иммуногенность антигенов гриппа, закрепленных на ротавирусных покрытых белком VP7 DLP, по сравнению с антигенами вируса гриппа, не закрепленными на покрытых VP7 DLP.
Все эксперименты на животных осуществляли в соответствии с протоколами Институционального комитета по содержанию и использованию лабораторных животных.
Пример 9: Исследования иммунизации комплексами белков HA-VP7, закрепленными на ротавирусных DLP с адъювантом и без адъюванта
Самок мышей BALB/c иммунизировали, используя две двусторонних внутримышечных инъекции по 50 мкл в четырехглавые мышцы бедра в 0, 21 и 42 дни с 0,3-15 мкг белковых комплексов очищенного антигена гемагглютинина (HA) H1N1, которые указаны в таблице 4 ниже.
Комплексы готовят с PBS или адъювантов за 1-2 часа перед иммунизацией. Приготовленные субъединичные вакцины хранят на льду вплоть до введения.
За мышами наблюдали после иммунизации в отношении изменения массы тела, реакций в месте инъекции и других клинических наблюдений. Образцы сыворотки получали от животных путем взятия крови из ретроорбитального синуса на 20 день (через 3 недели после первой иммунизации) и на 41 день (через 3 недели после второй иммунизации) и взятия крови у животных, подвергнутых эвтаназии, на 63 день (через 3 недели после третьей иммунизации).
Гуморальные ответы на вводимые антигены анализировали, применяя способы, известные в данной области (например, анализ ELISA, анализ нейтрализации). Результаты демонстрируют значимо более высокий иммунный ответ на комплексы белков HA-VP7, находящихся на ротавирусных DLP, по сравнению с очищенным HA, включая очищенный HA, приготовленный с адъювантом, или очищенный HA, приготовленный с VP7-покрытыми DLP, но не находящийся на них.
Все эксперименты на животных осуществляли в соответствии с протоколами Институционального комитета по содержанию и использованию лабораторных животных.
A/Sol monobulk означает олигомеризованный с липидами тримеризованный рекомбинантный HA.
7RP означает рекапсидированные VP7 частицы без HA.
HA+7RP означает рекапсидированные VP7 частицы, на которых HA не может быть закреплен+тримеризованный рекомбинантный HA.
HA-7RP означает рекапсидированные VP7 частицы, на которых закреплен тримеризованный рекомбинантный HA.
A/Sol HA означает тримеризованный рекомбинантный HA.
Каждая из публикаций, патентов и заявок на выдачу патентов, цитированных в настоящем описании и перечисленных ниже, по отдельности включены в виде ссылки в полном объеме. Каждый номер доступа, указанный в настоящем описании, включен в настоящее описание в виде ссылки в версии, доступной на дату подачи заявки, обеспечивающей приоритет, на которой основана настоящая заявка.
Будет понятно, что изобретение было описано только в качестве примера, и могут быть осуществлены модификации, не выходя при этом за рамки объема и не отходя от сути изобретения.
СПИСОК ЛИТЕРАТУРЫ
[1] Chen et al. (2009) Proc Natl Acad Sci U S A 106(26):10644-8
[2] Trask & Dormitzer (2006) J Virol 80(22):11293-304
[3] Kobayashi et al. (2007) Cell Host Microbe 1(2):147-157
[4] Chandran et al. (1999) J Virol 73(5):3941-50
[5] Chandran et al. (2001) J Virol 75(11):5335-42
[6] Yan et al. (2011) J Virol 85(15):7483-95
[7] Miyazaki et al. (2008) J Virol 82(22):11344-53
[8] Zhang et al. (2010) Cell 141(3):472-82
[9] Biosafety in Microbiological and Biomedical Laboratories (BMBL) 5th Edition, CDC, 2009
[10] Yang et al. (2000) J Virol 74(10):4746-54
[11] Meier et al. (2004) J Mol Biol 344(4):1051-69
[12] Wu & Wong (2005) J Biol Chem 280(24):23225-31
[13] Beckett et al. (1999) Protein Sci 8(4):921-9
[14] Chen et al. (1997) Cell 89(2):263-73
[15] Zhu et al. (2003) Protein Eng 16(5):373-9
[16] Yu et al. (2002) J Gen Virol 83(Pt 3):623-9
[17] Xu et al. (2004) J Biol Chem 279(29):30514-22
[18] http://partsregistry.org/Protein_domains/Linker
[19] US 4769326
[20] Dormitzer et al. (2001) J Virol 75(16):7339-50
[21] Dormitzer et al. (2000) Virology 277(2):420-8
[22] Mohd Jaafar et al. (2005) J Gen Virol 86(Pt 4):1147-57
[23] Mindell & Grigorieff (2003) J Struct Biol 142(3):334-47
[24] Campbell et al. (2012) Structure 20(11):1823-8
[25] Settembre et al. (2011) EMBO J. 30(2):408-16
[26] Chen & Grigorieff (2007) J Struct Biol 157(1):168-73
[27] Wriggers et al. (1999) J Struct Biol 125(2-3):185-95
[28] Jiang et al. (2001) J Mol Biol 308(5):1033-44
[29] Topf et al. (2005) J Struct Biol 149(2):191-203
[30] Tama et al. (2004) J Struct Biol 147(3):315-2
[31] Topf et al. (2008) Structure 16(2):295-307
[32] Trabuco et al. (2009) Methods 49(2):174-80
[33] Schröder et al. (2007) Structure 15(12):1630-41
[34] Zhang et al. (2010) Nature 463(7279):379-83
[35] Baker et al. (2006) PLoS Comput Biol 2(10):e146
[36] DiMaio et al. (2009) J Mol Biol 392(1):181-90
[37] Topf et al. (2006) J Mol Biol 357(5):1655-68
[38] Zhu et al. (2010) J Mol Biol 397(3):835-51
[39] Liang et al. (2002) J Struct Biol 137(3):292-304
[40] Grigorieff (2007) J Struct Biol 157(1):117-25
[41] Cheng et al. (2010) J Mol Biol 397(3):852-63
[42] Jiang et al. (2008) Nature 451(7182):1130-4
[43] Ludtke et al. (2008) Structure 16(3):441-8
[44] Yu et al. (2008) Nature 453(7193):415-9
[45] Ludtke et al. (1999) J Struct Biol 128(1):82-97
[46] Baker et al. (2007) Structure 15(1):7-19
[47] Pettersen et al. (2004) J Comput Chem 25(13):1605-12
[48] Emsley & Cowtan (2004) Acta Crystallogr D Biol Crystallogr 60(Pt 12 Pt 1):2126-32
[49] Emsley et al. (2010) Acta Crystallogr D Biol Crystallogr 66(Pt 4):486-501
[50] Baker et al. (2011) J Struct Biol 174(2):360-73
[51] Zhu et al. (2010) J Mol Biol 397(3):835-51
[52] Jones et al. (1991) Acta Crystallogr A 47 ( Pt 2):110-9
[53] Brünger et al. (1998) Acta Crystallogr D Biol Crystallogr 54(Pt 5):905-21
[54] Li & Zhang (2009) Proteins 76(3):665-76
[55] Brünger (1992) Nature 355(6359):472-5
[56] Laskowski et al. (1993) J Appl Cryst 26:283-91
[57] Whittle et al. (2011) Proc Natl Acad Sci USA 108(34):14216-21
[58] Aoki et al. (2009) Science 324(5933):1444-7
[59] Krause et al. (2011) J Virol 85(20):10905-8
[60] Bommakanti et al. (2010) Proc Natl Acad Sci USA 107(31):13701-6
[61] Chakraborty et al. (2006) Biochem J 399(3):483-91
[62] Bhattacharyya et al. (2010) J Biol Chem 285(35):27100-10
[63] Ward et al. (1989) Nature 341:544-546
[64] Bird et al. (1988) Science 242:423-426
[65] Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883
[66] Council of Europe (2014) European pharmacopoeia
[67] Ekiert et al. (2009) Science 324(5924): 246–251
[68] Lingwood et al. (2012) Nature 489(7417):566-70
[69] Tang et al. (2007) J Struct Biol 157(1):38-46
[70] Salk et al. (1945) Am J Hyg 42:57–93
[71] de Jong et al., Haemagglutination-inhibiting antibody to influenza virus. In Brown et al. (eds.) (2003) Laboratory Correlates of Immunity to Influenza- A Reassessment. Basel, Switzerland: Karger, 63–73.
Реферат
Изобретение относится к биотехнологии и представляет собой комплекс химерного поверхностного белка для определения структуры гетерологичного белка, содержащий образующий тример поверхностный белок ротавируса VP7, связанный с гетерологичным белком, где поверхностный белок ротавируса VP7 связан с указанным гетерологичным белком нековалентно состоящей из двух частей адаптерной системой, где одна часть адаптерной системы образована первым адаптерным полипептидом, который слит с поверхностным белком ротавируса VP7, необязательно посредством линкерной последовательности, а другая часть адаптера образована вторым адаптерным полипептидом, который слит с гетерологичным белком, необязательно посредством линкерной последовательности, где первый адаптерный полипептид и второй адаптерный полипептид содержат гептадную повторяющуюся последовательность, где обе части адаптерной системы образуют стабильный комплекс друг с другом, и где указанный комплекс химерного поверхностного белка способен становиться частью внешнего слоя ротавирусной частицы путем рекапсидациис его помощью двухслойных ротавирусных частиц. 8 н. и 3 з.п. ф-лы, 4 табл., 9 пр., 7 ил.

Комментарии