Мутанты индуцируемой активацией цитидиндеаминазы (aid) и способы их применения - RU2537264C2
Код документа: RU2537264C2
Чертежи





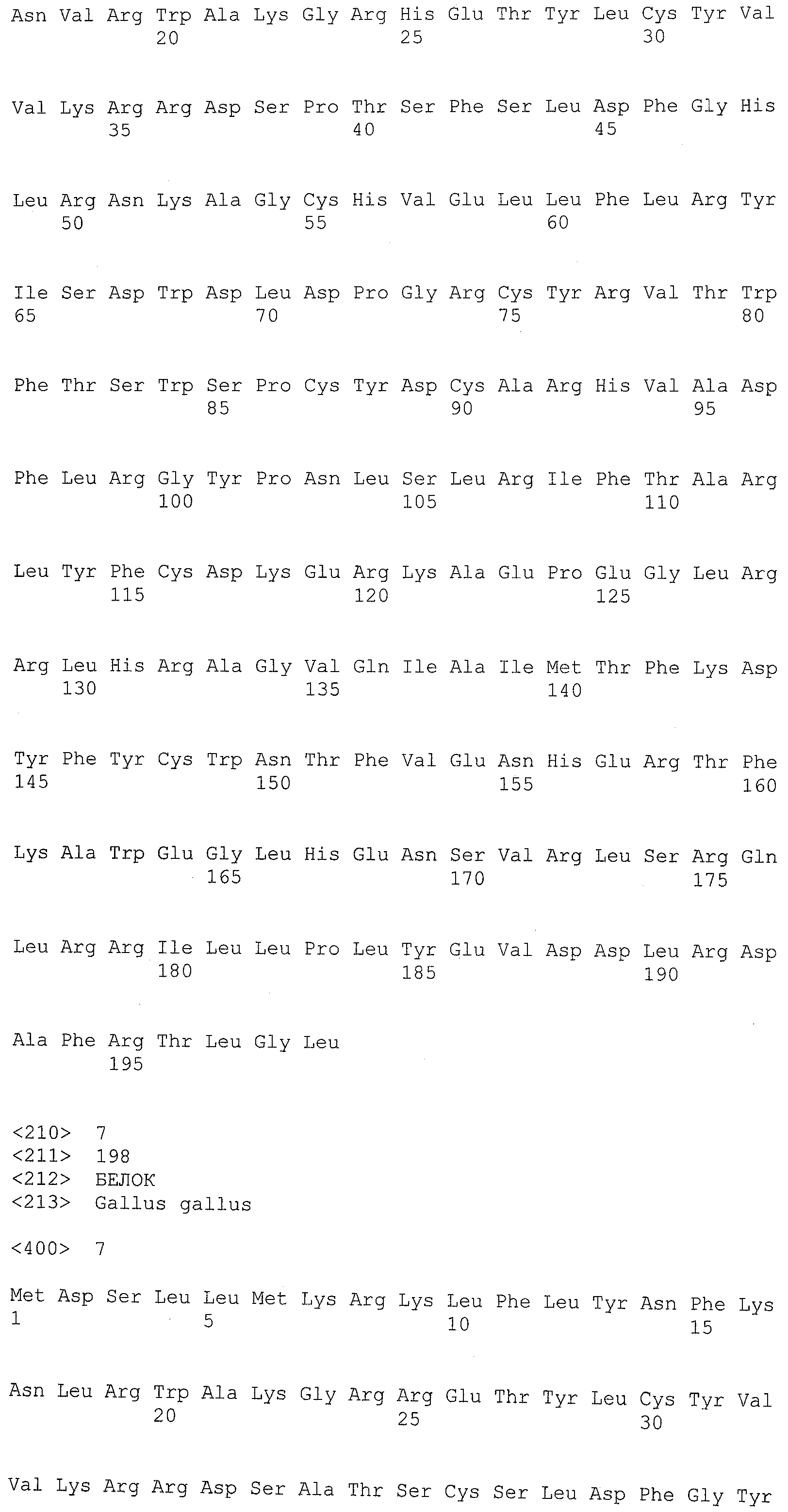












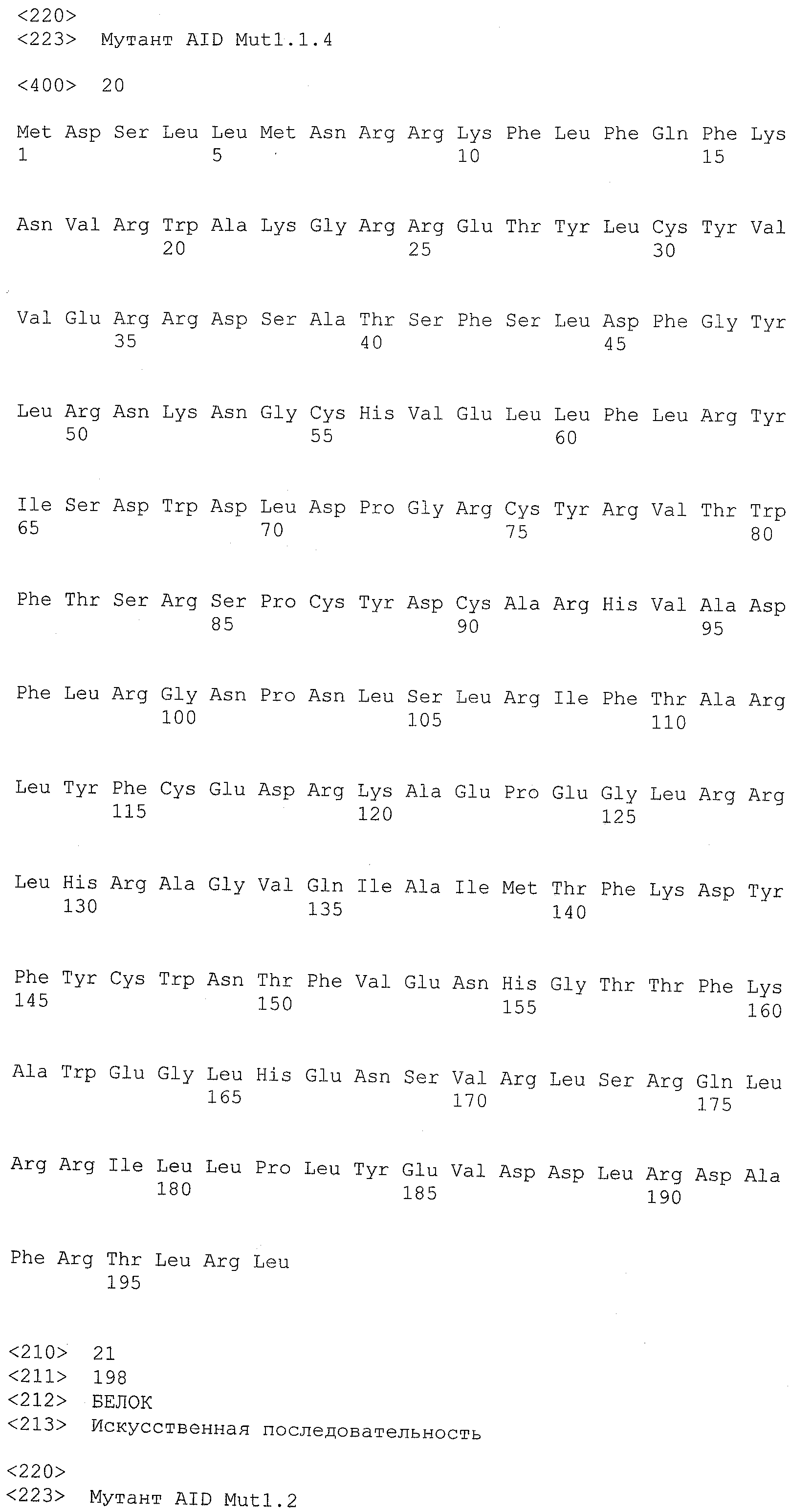






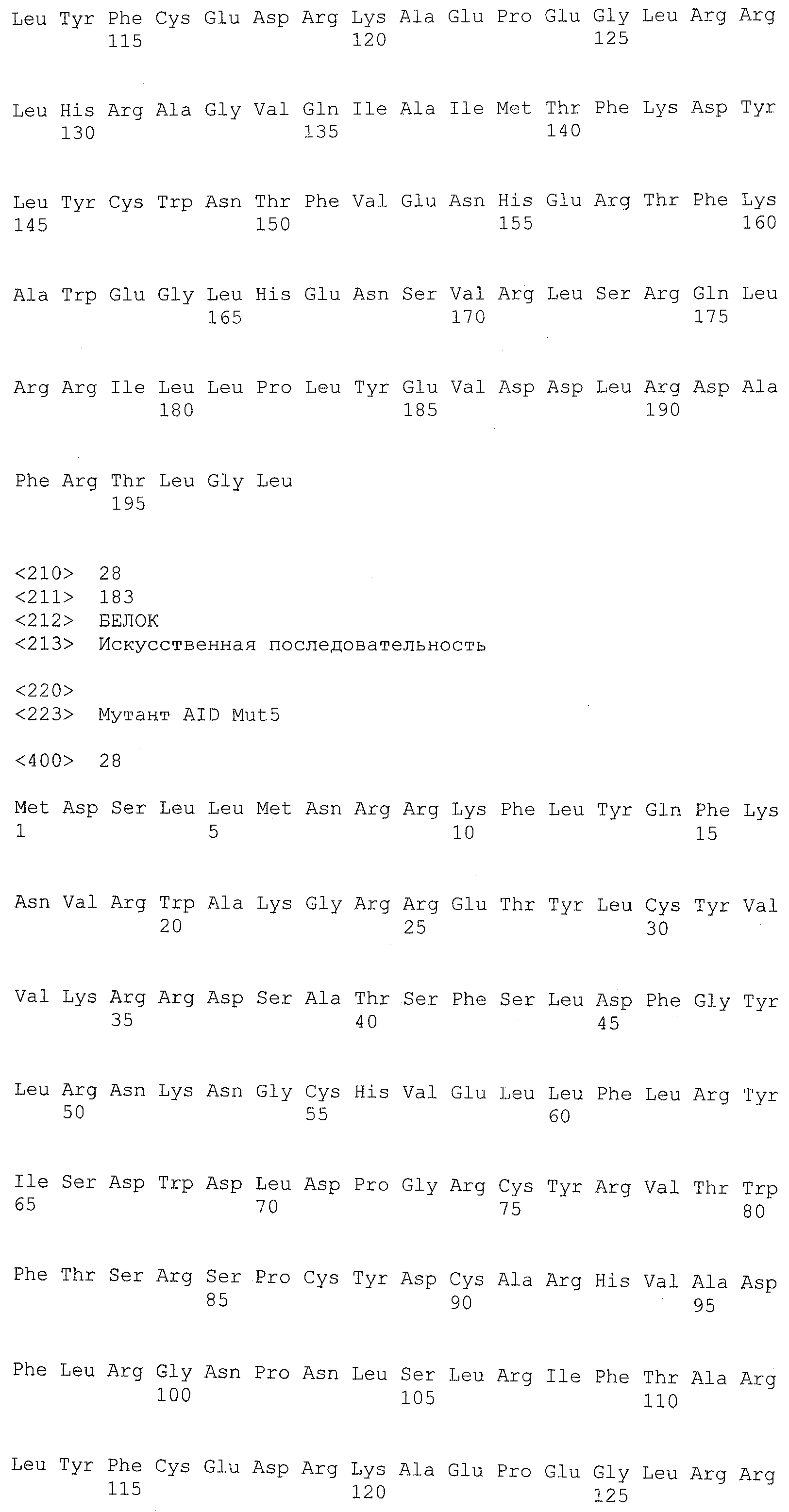






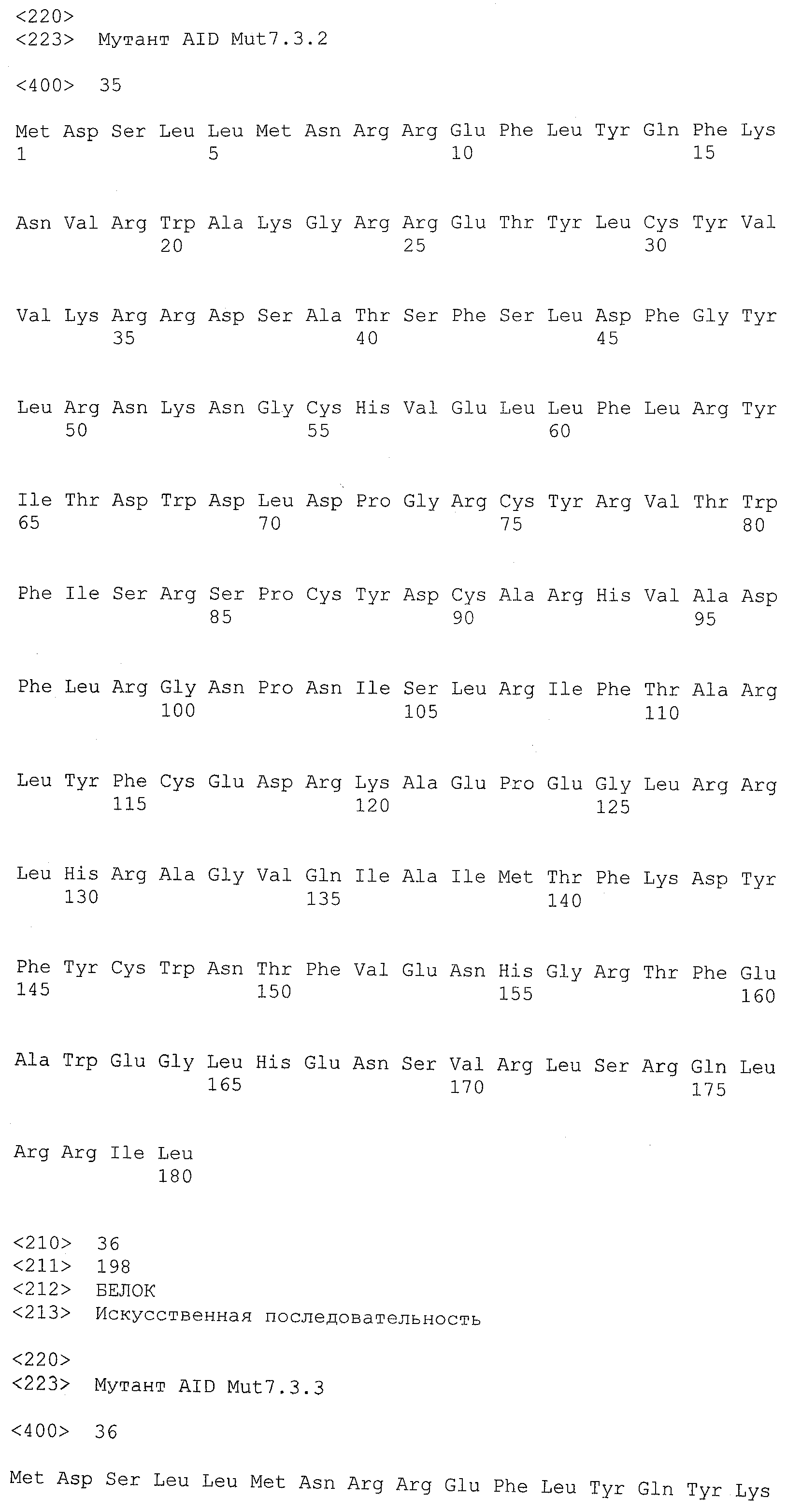



















































Описание
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США 61/166349, поданной 3 апреля 2009 г., которая включена в настоящее описание посредством ссылки.
Включение посредством ссылки материалов, предоставленных по электронной почте
В настоящее описание посредством ссылки включен считываемый компьютером полный список нуклеотидных/аминокислотных последовательностей, предоставленный одновременно с данной заявкой и идентифицированный следующим образом: один файл размером 140103 байта в коде ASCII (текстовый), озаглавленный ”Sequence Listing.TXT”, созданный 1 апреля 2010 г.
Уровень техники
В основе природных механизмов создания разнообразных антител лежит процесс соматической гипермутации (SHM), который запускает изменение вариабельных областей иммуноглобулина, в результате чего образуется спектр вторичных антител, ассоциированных с гуморальным иммунным ответом. SHM является высокоэффективным процессом in vivo, способным быстро исследовать продуктивные складчатые структуры и образовывать высокоаффинные антитела в соответствии с естественным процессом оптимизации антител. Таким образом, весьма интересно воссоздать SHM in vitro с целью создания простого и надежного способа, позволяющего имитировать природные процессы созревания аффинности непосредственно в клетке млекопитающего для отбора и получения антител, иммунологически толерантных и высоко экспрессированных в клетках млекопитающих (Cumbers et al., Nat Biotechnol., 20(11):1129-1134 (2002); Wang et al., Prot. Eng. Des. Sel, 17(9):569-664 (2004); Wang et al., Proc. Natl. Acad. Sci. USA., 101(48):16745-16749 (2004); Ruckerl et al., Mol. Immunol., 43 (10):1645-1652 (2006); Todo et al., J. Biosci. Bioeng., 102(5):478-81 (2006); Arakawa et al., Nucleic Acids Res., 36(1): el (2008)).
Однако у нативных антител, выделенных у человека или животного, часто отсутствуют оптимальные свойства аффинности из-за того, что предельный уровень аффинности, присущий иммунной системе, препятствует распознаванию in vivo и, следовательно, отбору антител с аффинностью более примерно 100 пМ (Batista and Neuberger, Immunity, 8(6):751-91998 (1998) и EMBO J., 19(4):513-20 (2000).
Использование библиотек отображения на фаге позволяет решить некоторые из указанных вопросов, при этом было установлено, что методы отображения на фаге позволяют получить высокоаффинные антитела. Однако с теоретической точки зрения такие статические библиотеки имеют ограниченный размер и объем, так как даже самые большие (1012) библиотеки позволяют исследовать только небольшую часть возможного природного иммунного спектра. Кроме того, невозможно одновременно создавать антитела при помощи методов отображения на фаге на основе хорошей экспрессии и высокой аффинности у млекопитающего в связи с возможными проблемами образования антител в нижней области, которые возникают в результате плохой экспрессии в клетках-хозяевах млекопитающих. При использовании неспецифического мутагенеза в комбинации с отображением на фаге отсутствует врожденное профилирование избирательности, присущее природным процессам созревания аффинности антител, что часто вызывает проблемы, связанные с иммунитетом против антител человека или нежелательными профилями перекрестной реактивности.
Использование культивируемой линии клеток для создания антитела к специфическому антигену-мишени при помощи соматической гипермутации in vitro было впервые продемонстрировано при использовании линии клеток RAMOS лимфомы Беркита у человека (Cumbers et al., Nat. Biotechnol., 20(11):1129-1134 (2002)). Линии клеток RAMOS и другие линии В-клеток были также успешно использованы для создания генов, не являющихся антителами, которые были произвольно встроены в хромосомную ДНК клетки-хозяина (Wang et al., Prot. Eng. Des. Sel., 17(9):569-664 (2004) and Proc. Natl. Acad. Sci. USA., 101(48):16745-16749 (2004)). Кроме того, эффективная соматическая гипермутация была продемонстрирована на генах, не являющихся антителами, в линиях В-клеток с использованием эписомных векторов с Ig-специфическими цис-регуляторными элементами или без них (Ruckerl et al., Mol. Immunol., 43(10):1645-1652 (2006)). Несмотря на то, что некоторые линии клеток RAMOS характеризуются достаточно высокой частотой конститутивной гипермутации, линии В-клеток, как правило, отличаются относительно медленными скоростями деления клеток и с трудом поддаются высокоэффективной трансфекции, что ограничивает их практическое применение для направленного создания антител.
В линии клеток куриного бурсита, DT40, реаранжированный ген легкой цепи Ig изменяется в результате конверсии матричного V-псевдогена. Однако при блокировании конверсии гена путем удаления паралога Rad51, XRCC2 (Sale et al., Nature, 412:921-6 (2001)) или удаления доноров конверсии псевдогена (Arakawa et al., Nucleic Acids Res., 36(1): e1 (2008)), указанная линия клеток характеризуется конститутивной гипермутацией в культуре. По сравнению с клетками RAMOS клетки DT40 отличаются значительно более коротким временем образования (12 часов), восприимчивы к направленному воздействию генов и были успешно использованы для направленного создания как эндогенных антител (Seo et al., Nat. Biotechnol., 23(6):731-5 (2005); Nat. Protoc., 1(3):1502-6 (2006); Biotechnol. Genet. Eng. Rev., 24:179-93 (2007); Todo et al., J. Biosci. Bioeng., 102(5):478-81 (2006), так и белков, не являющихся антителами (Arakawa et al., Nucleic Acids Res., 36(1): e1 (2008)).
Несмотря на то, что производные В-клеток, такие как клетки RAMOS и DT40, были успешно использованы для направленного создания антител, надежное использование указанных клеток в процессе направленного создания антител осложнено рядом факторов, включающих: (i) необходимость введения представляющего интерес гена в определенный сайт локуса Ig клетки-хозяина для достижения мутагенеза на высоком уровне (Parsa et al., Mol. Immunol., 44(4):567-75 (2007) и (ii) сложную природную биологию соматической гипермутации, имеющую место в локусах эндогенного иммуноглобулина в указанных клетках. Кроме того, такие искусственно созданные линии клеток характеризуются значительной клональной неустойчивостью в процессах соматической гипермутации (SHM) (Zhang et al., Int. Immunol., 13:1175-1184 (2001), Martin et al., Proc. Natl. Acad. Sci. USA., 99(19):12304-12308 (2002) and Nature, 415(6873):802-806 (2002); Ruckerl et al., Mol. Immunol., 41:1135-1143 (2004)) и не обладают каким-либо простым механизмом регулирования или контролирования гипермутации, то есть выключения мутагенеза после отбора требуемого фенотипа.
Успешное использование клеток, отличных от В-клеток, для инициации направленной соматической гипермутации в представляющем интерес гене было описано в ряде научных публикаций (Martin et al., Proc. Natl. Acad. Sci. USA., 99(19):12304-12308 (2002) и Nature, 415(6873): 802-806 (2002); McBride et al., Proc. Natl. Acad. Sci. USA, 103(23):8798-803 (2006); Jovanic et al., PLoS ONE, 23;3(1): e1480 (2008); публикация патентной заявки США 09/0075378; публикации международных патентных заявок WO 08/103474A1 и WO 08/103475A1), причем указанные линии клеток обеспечивают эффективный перенос генов, экспрессию белка на высоком уровне, обладают оптимальными характеристиками роста и легко реагируют на суспензионную культуру и проточную цитометрию.
Индуцируемая активацией цитидиндеаминаза (AID) принадлежит к семейству APOBEC ферментов цитидиндеаминазы. AID экспрессирована в активированных В-клетках и необходима для инициации соматической гипермутации (Muramatsu et al., Cell, 102(5):553-63 (2000); Revy et al., Cell, 102(5):565-75 (2000); Yoshikawa et al., Science, 296(5575):2033-6 (2002)) путем создания точковых мутаций в ДНК, кодирующей гены антител (Martin et al., Proc. Natl. Acad. Sci. USA., 99(19):12304-12308 (2002) и Nature, 415(6873):802-806 (2002); Petersen-Mart et al., Nature, 418(6893):99-103 (2002)). AID является также важным белковым фактором для рекомбинации класса и конверсии генов (Muramatsu et al., Cell, 102(5): 553-63 (2000); Revy et al., Cell, 102(5):565-75 (2000)).
Открытие того, что AID отвечает за инициацию соматической гипермутации, сделало возможным использование линий клеток, отличных от В-клеток, для создания более определенных, стабильных и контролируемых систем для соматической гипермутации.
Несмотря на указанные достижения, все еще остаются проблемы, связанные с созданием практической системы для соматической гипермутации, которые включают (1) обеспечение направленной соматической гипермутации в представляющем интерес гене без затрагивания структурных генов, (2) относительно низкую частоту и природу мутаций, достигаемых с использованием эндогенной AID по сравнению с соматической гипермутацией in vivo, и (3) относительно длинные периоды удвоения клеток, необходимые для роста популяции клеток из единичного клона клеток между циклами мутагенеза.
Таким образом, существует потребность в улучшенных композициях и способах повышения эффективности систем соматической гипермутации. Настоящее изобретение относится к таким композициям и способам.
Сущность изобретения
Настоящее изобретение относится к выделенной или очищенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую функциональный мутант белка индуцируемой активацией цитидиндеаминазы (AID), аминокислотная последовательность которого отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты.
В одном варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка, выбранного из группы, состоящей из остатка 34, остатка 82 и остатка 156.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 10 и, по меньшей мере, одной заменой аминокислоты в положении остатка 156.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 35 и, по меньшей мере, одной заменой аминокислоты в положении остатка 145.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 34 и, по меньшей мере, одной заменой аминокислоты в положении остатка 160.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 43 и, по меньшей мере, одной заменой аминокислоты в положении остатка 120.
Настоящее изобретение также относится к выделенной или очищенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую функциональный мутант белка AID, аминокислотная последовательность которого отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, двумя заменами аминокислот, из которых, по меньшей мере, одна замена находится в положении остатка 57, и, по меньшей мере, одна замена находится в положении остатка 145 или 81, при этом функциональный мутант белка AID характеризуется, по меньшей мере, 10-кратным увеличением активности по сравнению с белком AID человека в анализе образования бактериальных папилл.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 82.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 34.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 157.
В другом варианте осуществления изобретения аминокислотная последовательность функционального мутанта белка AID отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты в положениях остатков 10, 82 и 156.
Настоящее изобретение также относится к выделенной или очищенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую функциональный мутант белка индуцируемой активацией цитидиндеаминазы (AID), аминокислотная последовательность которого отличается от аминокислотной последовательности, выбранной из белка AID собаки (SEQ ID NO:3), белка AID мыши (SEQ ID NO:4) белка AID крысы (SEQ ID NO:5), белка AID коровы (SEQ ID NO:6) и белка AID курицы (SEQ ID NO:7), по меньшей мере, одной заменой аминокислоты в положении остатка, выбранного из группы, состоящей из остатка 34, остатка 82 и остатка 156, при этом функциональный мутант белка AID характеризуется, по меньшей мере, 10-кратным увеличением активности по сравнению с белком AID человека в анализе образования бактериальных папилл.
Настоящее изобретение также относится к экспрессионному вектору, содержащему молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, кодирующую функциональный мутант индуцируемой активацией цитидиндеаминазы (AID).
Настоящее изобретение также относится к выделенной клетке, содержащей молекулу нуклеиновой кислоты, кодирующую функциональный мутант белка AID.
Настоящее изобретение также относится к трансгенному животному, содержащему молекулу нуклеиновой кислоты, кодирующую функциональный мутант белка AID.
Настоящее изобретение также относится к способу получения генного продукта, обладающего требуемым свойством, который включает экспрессию нуклеиновой кислоты, кодирующей данный генный продукт, в популяции клеток, которая экспрессирует или может в результате индукции экспрессировать функциональный мутант белка AID, при этом экспрессия функционального мутанта белка AID вызывает мутацию в нуклеиновой кислоте, кодирующей указанный генный продукт.
Настоящее изобретение далее относится к способу мутации организма с достижением требуемого фенотипа, который включает экспрессию или индукцию экспрессии функционального мутанта белка AID в организме, при этом экспрессия функционального мутанта белка AID вызывает мутацию в хромосомной ДНК организма.
Краткое описание фигур
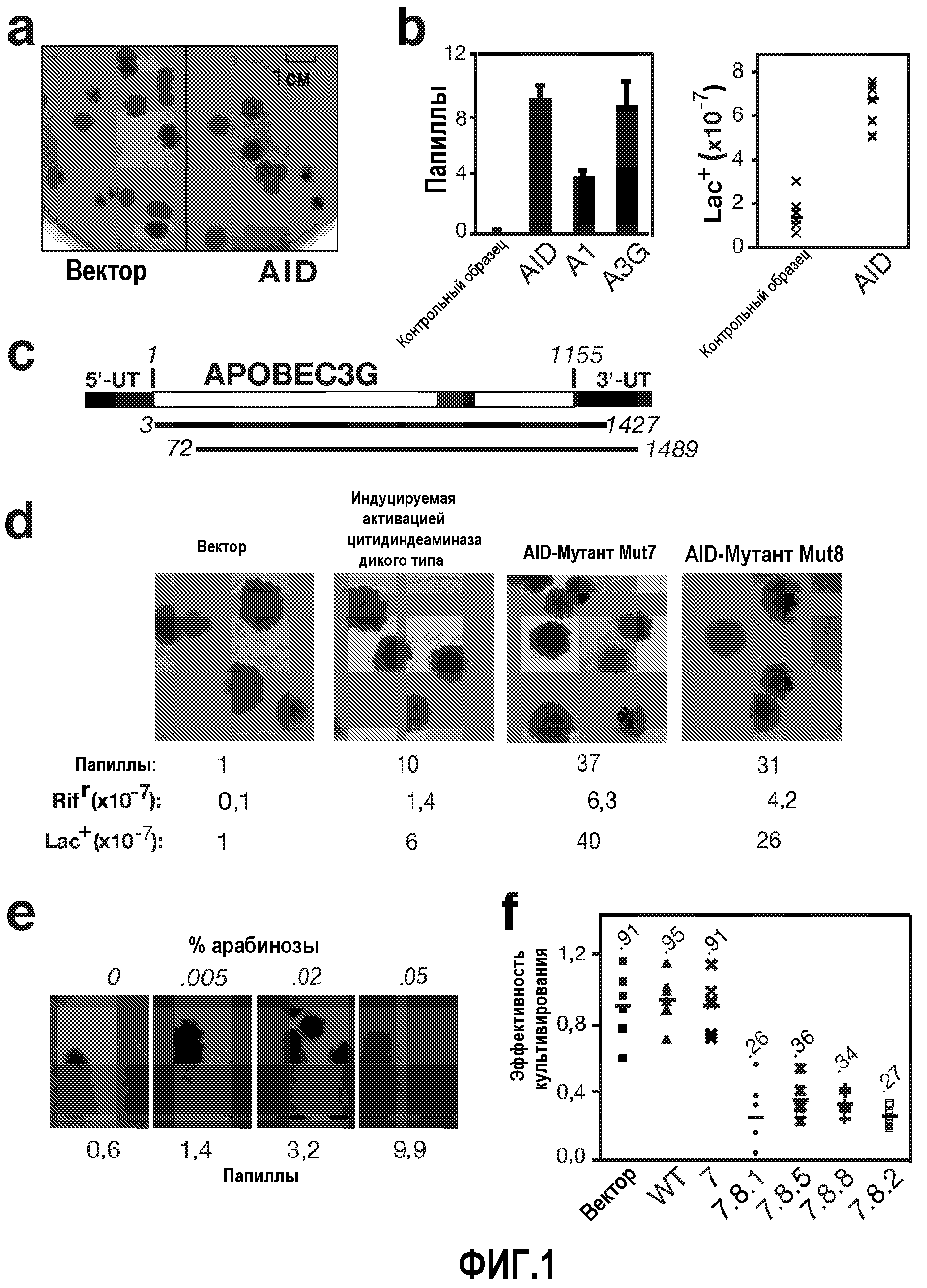
На фиг.1 изображены папиллы в бактериальных колониях, экспрессирующих или не экспрессирующих AID человека. На фиг.1b изображена столбчатая диаграмма, показывающая количественное содержание папилл в бактериальных колониях, экспрессирующих AID человека, APOBEC1 (A1) или APOBEC3G (A3G). На фиг.1с изображена диаграмма, показывающая две кДНК APOBEC3G, полученные в результате скрининга папилл в библиотеке кДНК селезенки человека. На фиг.1d изображены папиллы в бактериальных колониях, экспрессирующих указанный белок AID и показана частота мутаций по отношению к вектору. На фиг.1е показано образование папилл мутантом AID Mut1.1 в зависимости от концентрации арабинозы. На фиг.1f изображен график, показывающий эффективность получения мутантов AID человека.
На фиг.2 показана схема, иллюстрирующая отбор функциональных мутантов AID человека, идентифицированных в процессе скрининга папилл. Числа означают среднюю частоту мутаций в Riff каждого мутанта AID человека по отношению к вектору.
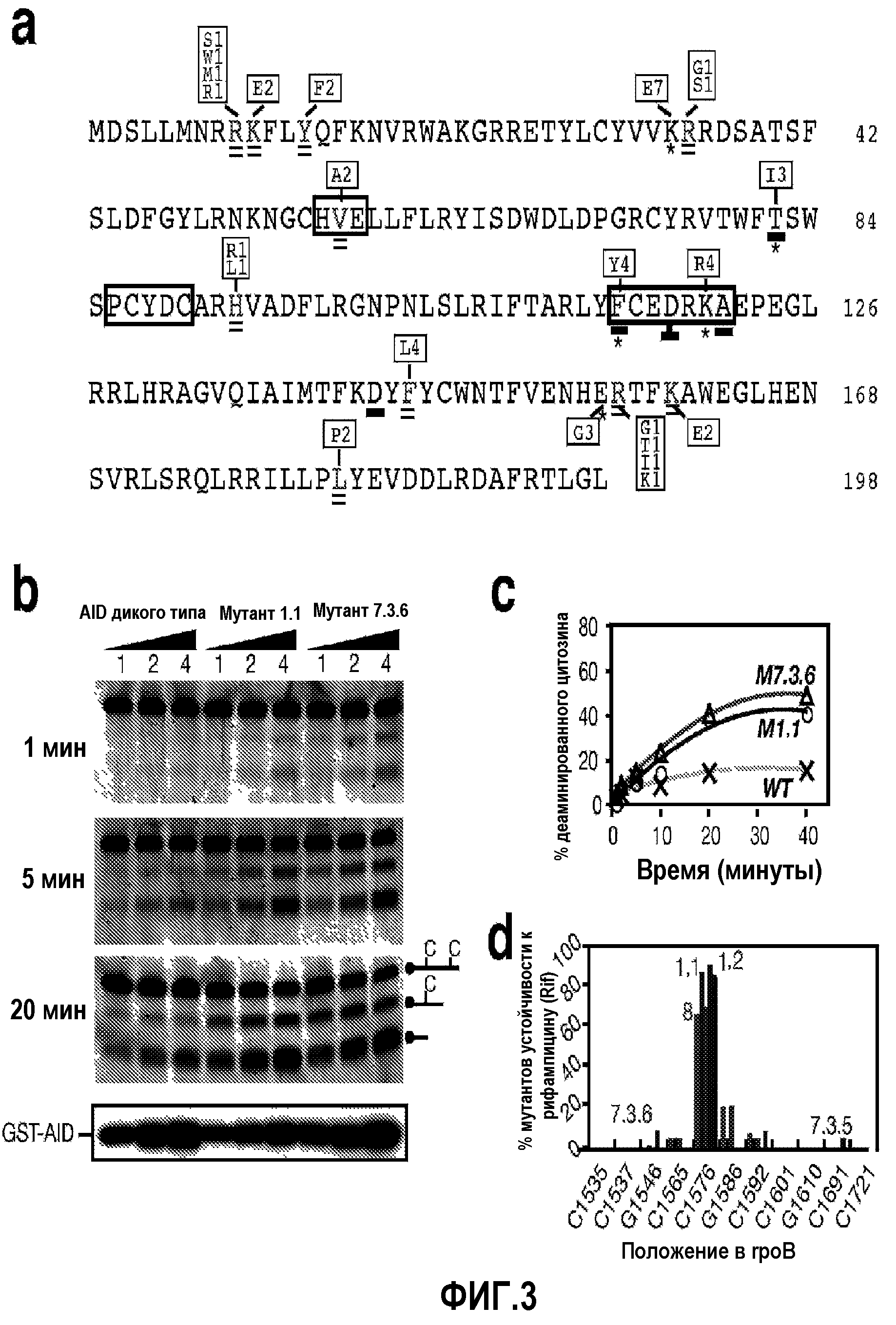
На фиг.3а показана последовательность AID человека, иллюстрирующая положения и типы функциональных мутаций, идентифицированных в AID человека и иглобрюха. На фиг.3b представлено сравнение уровня экспрессии мутантов слитых белков GST-AID, выполненное методом вестерн-блоттинга. На фиг.3с,d изображены графики, количественно определяющие активность деаминазы и специфичность в отношении мишени мутантов слитых белков GST-AID.
На фиг.4а показана схема, иллюстрирующая отбор мутантов AID иглобрюха, идентифицированных в процессе скрининга папилл. На фиг.4b изображена столбчатая диаграмма, сравнивающая относительную частоту мутаций мутантов AID иглобрюха в RIFf при 18°С и 37°С.
На фиг.5а показаны графики экспрессии IgM и GFP в отдельных клонах DT40, экспрессирующих указанный белок AID, которые были получены методом проточной цитометрии. На фиг.5а также показан график утраты IgM в 12 независимых клональных трансфектантах, экспрессирующих указанный белок. На фиг.5b показана схема распределения мутаций IgVλ, обнаруженных в трансфицированных клетках DT40. На фиг.5b также изображены круговые диаграммы, показывающие число мутаций IgVλ после сортировки в отношении утраты IgM. На фиг.5b также показана экспрессия AID, определенная методом вестерн-блоттинга. На фиг.5с изображены графики переключения на IgC1 в В-клетках с отсутствием AID, трансдуцированных указанным ретровирусом, которые были получены методом проточной цитометрии. Столбчатая диаграмма, показанная на фиг.5с, дает количественное определение переключения на IgC1 по сравнению с AID дикого типа, и на фиг.5с показана экспрессия AID, определенная методом вестерн-блоттинга.
На фиг.6а изображена схема, иллюстрирующая реципрокную транслокацию между с-myc и локусом IgH, и показаны праймеры (стрелки) и зонды (Р), используемые для обнаружения указанной транслокации. На фиг.6b показаны обнаруженные методом саузерн-блоттинга транслокации с-myc-IgH, выделенные из хромосом 15 и 12 после амплификации при помощи ПЦР геномной ДНК из В-клеток с отсутствием AID, трансдуцированных указанным ретровирусом.
На фиг.7 представлен сравнительный анализ LOGO, показывающий, что функциональные мутации, идентифицированные в процессе скрининга бактериальных папилл, приближают последовательность AID к последовательности APOBEC3.
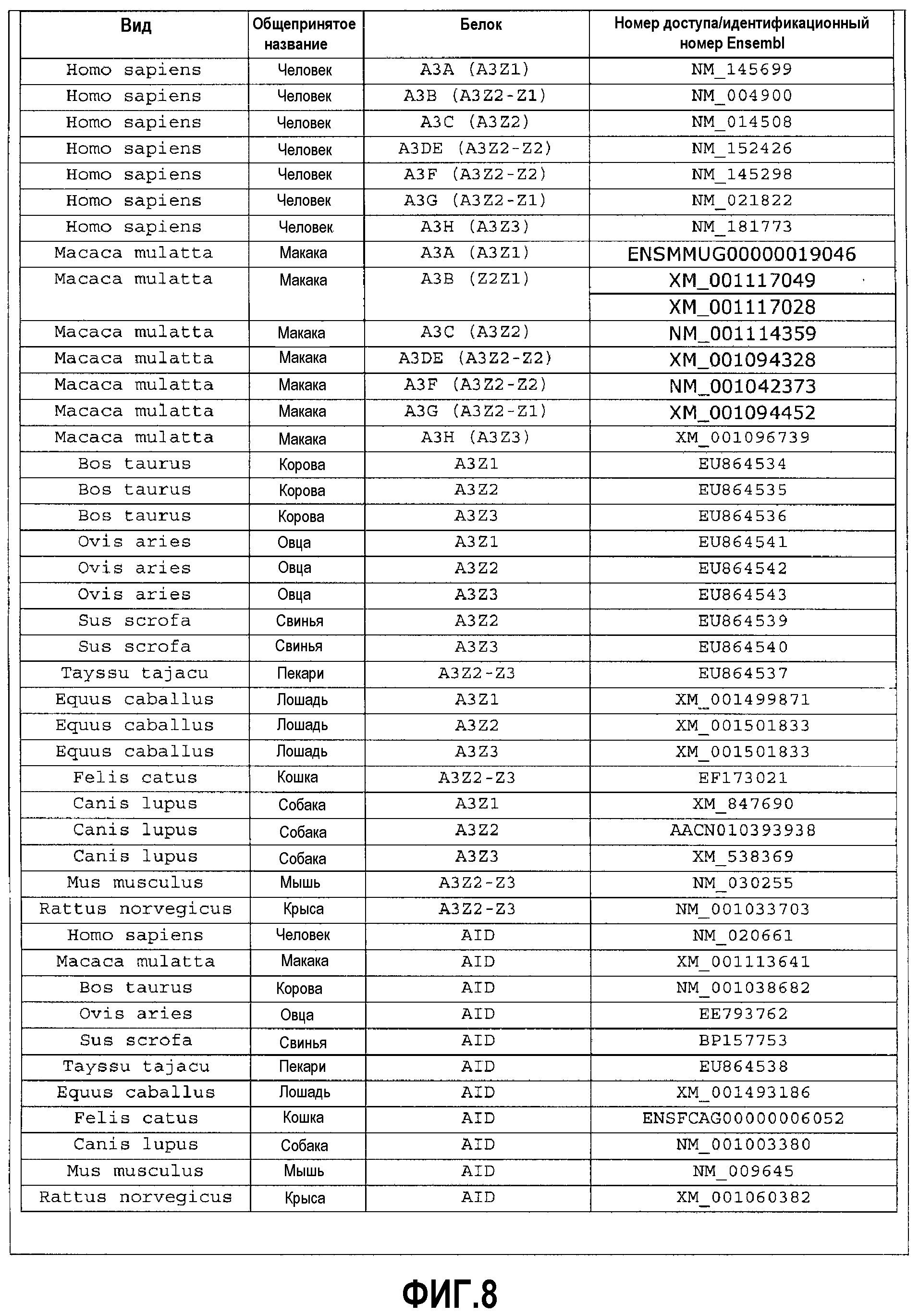
На фиг.8 указаны номера доступа GenBank/Ensembl последовательностей AID и APOBEC3 млекопитающих, использованных для выполнения сравнительного анализа, показанного на фиг.7.
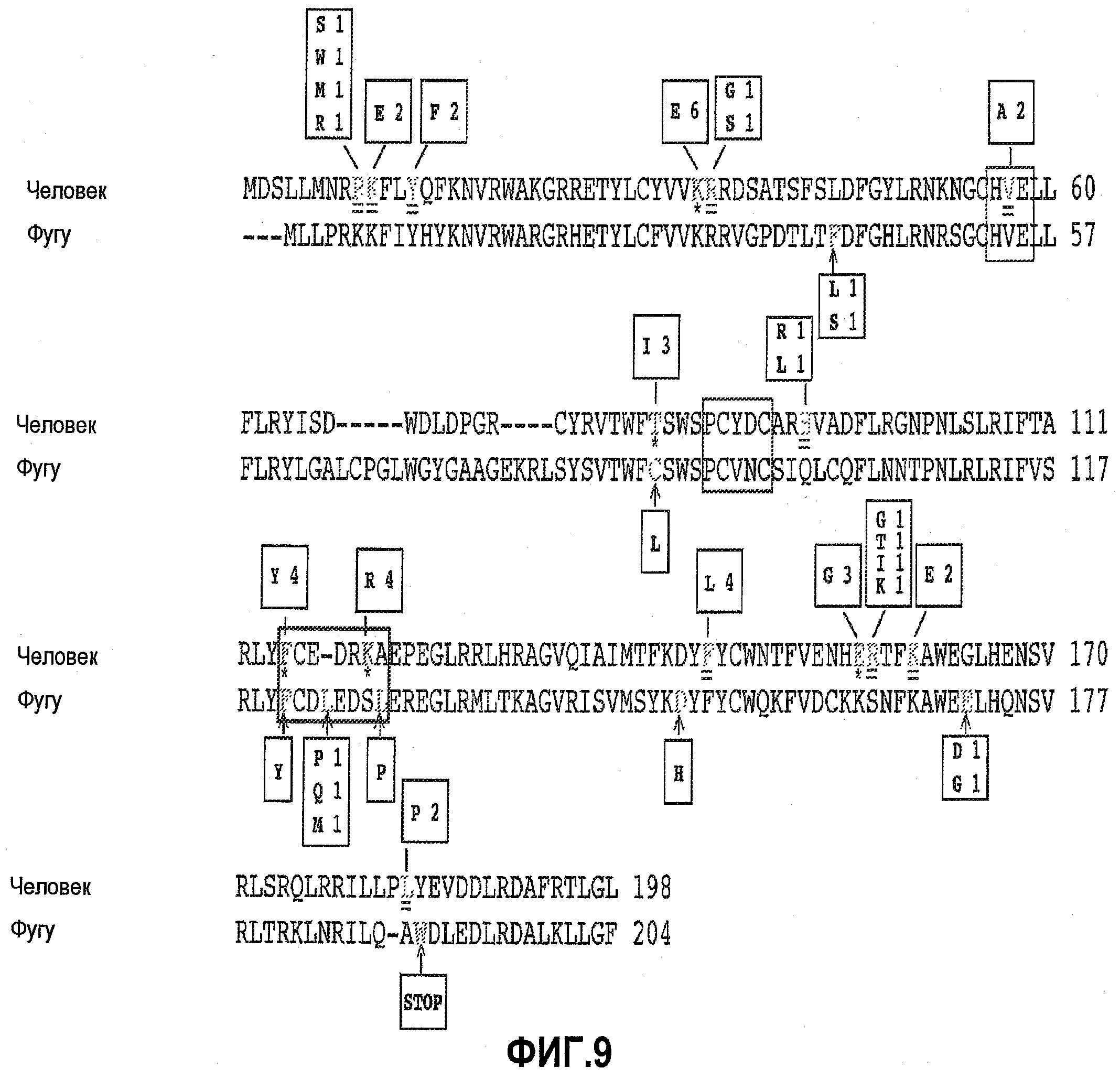
На фиг.9 показана схема последовательности AID человека и AID иглобрюха (фугу), иллюстрирующая положения и типы обнаруженных функциональных мутаций.
На фиг.10а показан сравнительный анализ последовательностей нуклеиновых кислот AID, использованных в экспериментах с клетками 293-с18, описанных в примере 14. Указанные в рамках остатки показывают изменения между последовательностями дикого типа и мутанта 7.3. На фиг.10b показан сравнительный анализ аминокислотных последовательностей AID, использованных в экспериментах с клетками 293-с18, описанных в примере 14. Указанные в рамках остатки показывают изменения между последовательностями дикого типа и мутантом 7.3. Мутация L в А в мутантах MutE и Mut7.3 выключает функцию сигнала экскреции из ядра. Точка означает терминирующий кодон, и тире означает положения, в которых отсутствует соответствующая аминокислота.
Подробное описание изобретения
Настоящее изобретение относится к выделенной или очищенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую функциональный мутант белка AID, аминокислотная последовательность которого отличается от аминокислотной последовательности белка AID человека (SEQ ID NO:1 или SEQ ID NO:2), по меньшей мере, одной заменой аминокислоты, при этом функциональный мутант белка AID характеризуется, по меньшей мере, 10-кратным увеличением активности по сравнению с белком AID человека в анализе образования бактериальных папилл.
Термин ”молекула нуклеиновой кислоты” означает полимер ДНК или РНК, то есть полинуклеотид, который может быть одноцепочечным или двухцепочечным и может содержать неприродные или измененные нуклеотиды. Термины ”нуклеиновая кислота” и “полинуклеотид” в использованном в данном описании значении означают полимерную форму нуклеотидов любой длины, в частности, рибонуклеотидов (РНК) или дезоксирибонуклеотидов (ДНК). Указанные термины служат для обозначения первичной структуры молекулы и, таким образом, включают двухцепочечную и одноцепочечную ДНК и двухцепочечную и одноцепочечную РНК. В определение указанных терминов входят в качестве эквивалентов аналоги РНК или ДНК, полученные из аналогов нуклеотидов и модифицированных полинуклеотидов, которые включают, но, но, не ограничиваясь ими, метилированные и/или кэппированные полинуклеотиды.
Термин ”нуклеотид” в использованном в данном описании значении означает мономерное звено полинуклеотида, состоящее из гетероциклического основания, сахара и одной или нескольких фосфатных групп. Природные основания (гуанин (G), аденин (А), цитозин (С), тимин (Т) и урацил (U)) обычно являются производными пурина или пиримидина, хотя следует отметить, что в определение данного термина также входят природные и неприродные аналоги оснований. Природным сахаром является пентоза (сахар с пятью атомами углерода), дезоксирибоза (образующая ДНК) или рибоза (образующая РНК), хотя следует отметить, что в определение данного термина также входят природные и неприродные аналоги сахара. Нуклеиновые кислоты обычно связаны фосфатными связями с образованием нуклеиновых кислот или полинуклеотидов, хотя в данной области известны многие другие связи (например, фосфортиоаты, боранофосфаты и подобные).
Термины ”синтетический полинуклеотид”, “синтетический ген” или “синтетический полипептид” в использованном в данном описании значении означают соответствующую полинуклеотидную последовательность или ее часть, или аминокислотную последовательность или ее часть, выделенную из вновь созданной или синтезированной de novo последовательности либо модифицированную по сравнению с эквивалентной природной последовательностью. Синтетические полинуклеотиды или синтетические гены могут быть получены методами, известными в данной области, которые включают, но, не ограничиваясь ими, химический синтез последовательностей нуклеиновых кислот или аминокислот либо амплификацию при помощи ПЦР (или при помощи аналогичных систем ферментативной амплификации). Синтетические гены обычно отличаются от немодифицированных или природных генов либо уровнем аминокислот, либо уровнем полинуклеотидов (либо и тех и других) и обычно находятся в синтетических последовательностях, регулирующих экспрессию. Например, последовательности синтетических генов могут включать аминокислотные или полинуклеотидные последовательности, которые были изменены, например, путем замены, делеции или добавления одной или нескольких аминокислот или нуклеотидов, в результате чего образуется аминокислотная последовательность или полинуклеотидная последовательность, отличающаяся от исходной последовательности. Последовательности синтетических генов или полинуклеотидные последовательности необязательно могут кодировать белки с другими аминокислотами по сравнению с природным геном. Например, указанные последовательности могут также включать синтетические полинуклеотидные последовательности, включающие другие кодоны, но кодирующие такую же аминокислоту, то есть изменения нуклеотидов представляют собой молчащие мутации на уровне аминокислоты. В одном варианте осуществления изобретения синтетические гены характеризуются измененной чувствительностью к SHM по сравнению с природным или немодифицированным геном. Синтетические гены могут быть итеративно модифицированы методами, рассмотренными в настоящем описании, и при каждой последующей итерации соответствующую полинуклеотидную или аминокислотную последовательность полностью или частично получают из вновь созданной или синтезированной de novo последовательности по сравнению с эквивалентной немодифицированной последовательностью.
В использованном в данном описании значении термин ”кодон” означает три нуклеотида, которые, будучи транскрибированными и транслированными, кодируют один аминокислотный остаток; или в случае UUA, UGA или UAG кодируют сигнал терминации. В данной области хорошо известны кодоны, кодирующие аминокислоты.
Оптимальное использование кодонов определяется частотой их использования для экспрессированных генов, например, как показано на схеме использования кодонов в программы “Human-High.cod” из пакета программ анализа последовательностей Wisconsin, версия 8.1, Genetics Computer Group, Madison, Wisc. Использование кодонов также описано, например, в публикации R. Nussinov, ”Eukaryotic Dinucleotide Preference Rules and Their Implications for Degenerate Codon Usage,” J. Mol. Biol., 149:125-131 (1981). Кодоны, наиболее часто используемые в высокоэкспрессированных человеческих генах, предположительно являются оптимальными кодонами для экспрессии в клетках-хозяевах человека и, таким образом, образуют основания для создания синтетической кодирующей последовательности.
Термин “выделенный” означает, что нуклеиновая кислота удалена из природной окружающей среды. Термин ”очищенный” означает, что данная нуклеиновая кислоты, в частности, нуклеиновая кислота, удаленная из природной окружающей среды (включая геномную ДНК и мРНК) или синтезированная (включая кДНК) и/или амплифицированная в лабораторных условиях, характеризуется более высокой чистотой, при этом термин ”чистота” является относительным термином, не означающим ”абсолютную чистоту”. Однако следует отметить, что нуклеиновые кислоты и белки могут быть получены с разбавителями или адъювантами и, при этом, все же считаются выделенными в практических целях. Например, нуклеиновые кислоты смешивают с приемлемым носителем или разбавителем при использовании для введения в клетки.
Термин ”индуцируемая активацией цитидиндеаминаза” или (“AID”) служит для обозначения членов семейства AID/APOBEC цитидиндеаминаз, изменяющих РНК/ДНК, которые способны опосредовать деаминирование цитозина в урацил в последовательности ДНК. (См., например, публикацию Conticello et al., Mol. Biol. Evol., 22:367-377 (2005) и патент США 6815194).
Термин ”AID дикого типа” означает природную аминокислотную последовательность белка AID. Приемлемые белки AID дикого типа включают все формы AID позвоночных, включая, например, приматов, грызунов, птиц и костных рыб. Конкретные примеры аминокислотных последовательностей AID дикого типа включают, но, не ограничиваясь ими, AID человека (SEQ ID NO:1 или SEQ ID NO:2), AID собаки (SEQ ID NO:3), AID мыши (SEQ ID NO:4), AID крысы (SEQ ID NO:5), AID коровы (SEQ ID NO:6), AID курицы (SEQ ID NO:7), AID свиньи (SEQ ID NO:8), AID шимпанзе (SEQ ID NO:9), AID макаки (SEQ ID NO:10), AID лошади (SEQ ID NO:11), AID вида Xenopus (SEQ ID NO:12), AID иглобрюха (фугу) (SEQ ID NO:13) и AID полосатой перцины (SEQ ID NO:14).
Термин ”гомолог AID” означает ферменты семейства Apobec, которые включают, например, Apobec-1, Apobec3C или Apobec3G (описанные, например, в публикации Jarmuz et al., Genomics, 79: 285-296 (2002)). Термин ”активность AID” означает активность, опосредованную AID и гомологами AID.
Термин ”мутант AID” в использованном в данном описании значении означает аминокислотную последовательность AID, отличающуюся от аминокислотной последовательности AID дикого типа, по меньшей мере, одной аминокислотой. Аминокислотная последовательность дикого типа может быть мутирована с образованием мутанта AID любым приемлемым методом, известным в данной области, таким как, например, инсерция, делеция и/или замена. Например, в последовательность нуклеиновой кислоты, кодирующую AID дикого типа, могут быть введены неспецифические или сайтспецифические мутации. Неспецифические мутации могут быть созданы, например, при помощи подверженной ошибкам ПЦР матричной последовательности AID. Предпочтительным способом введения неспецифических мутаций является использование набора для неспецифического мутагенеза Genemorph II (Stratagene, LaJolla, CA). Сайтспецифические мутации могут быть введены, например, путем лигирования в экспрессионный вектор синтезированного олигонуклеотида, включающего модифицированный сайт. Альтернативно, могут быть использованы методы сайтспецифического мутагенеза с использованием олигонуклеотидов, описанные в публикациях Walder et al., Gene, 42:133 (1986); Bauer et al., Gene, 37:73 (1985); Craik, Biotechniques, 12-19 (January 1995) и в патентах США 4518584 и 4737462. Предпочтительным способом введения сайтспецифических мутаций является использование набора для сайтнаправленного мутагенеза QuickChange (Stratagene, LaJolla, CA).
Термины ”функциональный мутант AID” или “функциональный мутант белка AID” означают мутант белка AID, который полностью или частично сохраняет биологическую активность AID дикого типа или характеризуется более высокой биологической активностью по сравнению с белком AID дикого типа. Биологическая активность AID дикого типа включает, но, не ограничиваясь ими, деаминирование цитозина в урацил в последовательности ДНК, образование папилл в анализе бактериального мутагенеза, соматическую гипермутацию гена-мишени и переключение класса иммуноглобулина. Мутант белка AID может сохранять любую часть биологической активности белка AID дикого типа. Желательно, чтобы мутант белка AID сохранял, по меньшей мере, 75% (например, 75%, 80% или больше) биологической активности AID дикого типа. Мутант белка AID предпочтительно сохраняет, по меньшей мере, 90% (например, 90%, 95%, 100% или больше) биологической активности AID дикого типа.
В предпочтительном варианте осуществления изобретения мутант белка AID характеризуется более высокой биологической активностью по сравнению с белком AID дикого типа. Функциональный мутант AID характеризуется, по меньшей мере, 10-кратным увеличением активности по сравнению с белком AID дикого типа при измерении с помощью анализа образования бактериальных папилл. В данной области известны анализы образования бактериальных папилл, используемые для скрининга мутантов E. Coli, в которых отсутствует репарация ДНК (Nghiem et al., Proc. Natl. Acad. Sci. USA, 85:2709-2713 (1988) and Ruiz et al., J. Bacteriol., 175:4985-4989 (1993)). В анализе образования бактериальных папилл могут быть использованы клетки СС102 Eschetichia coli, содержащие миссенс-мутацию в гене lacZ. Клетки СС102 E. Coli образуют белые колонии на чашках с лактозой MacConkey. В таких белых колониях часто можно обнаружить небольшое количество красных микроколоний или ”папилл” (обычно 0-2 в одной колонии), которые представляют собой спонтанно возникающие ревертанты Lac+. Бактериальные колонии, характеризующиеся более высокой частотой спонтанных мутаций (например, ”клоны-мутаторы”), можно определить по более высокому числу папилл. Анализы образования бактериальных папилл могут быть использованы для скрининга функциональных мутантов AID, обладающих более высокой активностью по сравнению с AID дикого типа. Анализы образования бактериальных папилл подробно описаны в разделе ”Примеры”.
В одном варианте осуществления изобретения функциональный мутант AID характеризуется, по меньшей мере, 10-кратным (например, 10-кратным, 30-кратным, 50-кратным или большим) увеличением активности по сравнению с белком AID дикого типа в анализе образования бактериальных папилл. Функциональный мутант AID предпочтительно характеризуется, по меньшей мере, 100-кратным (например, 100-кратным, 200-кратным, 300-кратным или большим) увеличением активности по сравнению с AID дикого типа. Более предпочтительно функциональный мутант AID характеризуется, по меньшей мере, 400-кратным (например, 400-кратным, 500-кратным, 1000-кратным или большим) увеличением активности по сравнению с AID дикого типа.
Функциональный мутант белка AID включает аминокислотную последовательность, отличающуюся от аминокислотной последовательности белка AID дикого типа, по меньшей мере, одной заменой аминокислоты. Белок AID дикого типа может быть белком AID любых позвоночных, включающих виды, указанные в настоящем описании. Белком AID дикого типа желательно является белок AID человека, имеющий, по меньшей мере, два известных варианта (то есть SEQ ID NO:1 и SEQ ID NO:2). Дополнительные белки AID позвоночных включают, но, не ограничиваясь ими, AID собаки (SEQ ID NO:3), AID мыши (SEQ ID NO:4), AID крысы (SEQ ID NO:5), AID коровы (SEQ ID NO:6), AID курицы (SEQ ID NO:7), AID свиньи (SEQ ID NO:8), AID шимпанзе (SEQ ID NO:9), AID макаки (SEQ ID NO:10), AID лошади (SEQ ID NO:11), AID вида Xenopus (SEQ ID NO:12), AID иглобрюха (фугу) (SEQ ID NO:13) и AID полосатой перцины (SEQ ID NO:14).
Специалисту в данной области будет очевидно, что несмотря на высокую степень гомологии между белками AID позвоночных, каждый белок AID позвоночных содержит разное число замен, делеций и инсерций аминокислот по сравнению с AID человека (SEQ ID NO:1 или SEQ ID NO:2). Таким образом, в объем настоящего изобретения входят мутации, рассмотренные в настоящем описании, которые находятся в аналогичном положении белка AID любого позвоночного. Специалист в данной области может определить аналогичное положение мутации в белке AID любого позвоночного, путем сравнения последовательности гомологичного белка AID позвоночного с белком AID человека (SEQ ID NO:1 или SEQ ID NO:2) при помощи любой компьютерной программы сравнительного анализа, известной в данной области (например, BLAST или ClustalW2).
Белок AID дикого типа обычно содержит последовательность экскреции из ядра около С-конца белка. В одном варианте осуществления изобретения может быть мутирован один или несколько остатков, опосредующих экскрецию из ядра AID дикого типа, при этом может быть получен функциональный мутант белка AID, включающий аминокислотную последовательность, отличающуюся от аминокислотной последовательности белка AID, имеющего мутированную последовательность экскреции из ядра, по меньшей мере, одной дополнительной заменой аминокислоты. Примеры белков AID собаки, содержащих мутированную последовательность экскреции из ядра, которая может служить в качестве эталонной последовательности, в которую может быть введена одна или несколько мутаций, образующих функциональный мутант AID, включают мутант L198A (SEQ ID NO:70) и мутант D187E, D188E, D191E, T195I и L198A (SEQ ID NO:71).
“Замена” аминокислоты означает замену одной аминокислоты в данном положении или остатке другой аминокислотой в том же положении или остатке полипептидной последовательности.
Аминокислоты широко классифицированы как ”ароматические” или “алифатические”. Ароматическая аминокислота включает ароматическое кольцо. Примеры ”ароматических” аминокислот включают гистидин (Н или His), фенилаланин (F или Phe), тирозин (Y или Tyr) и триптофан (W или Trp). Неароматические аминокислоты широко классифицированы как ”алифатические”. Примеры ”алифатических” аминокислот включают глицин (G или Gly), аланин (А или Ala), валин (V или Val), лейцин (L или Leu), изолейцин (I или Ile), метионин (М или Met), серин (S или Ser), треонин (Т или Thr), цистеин (С или Cys), пролин (Р или Pro), глутаминовую кислоту (Е или Glu), аспарагиновую кислоту (А или Asp), аспарагин (N или Asn), глутамин (Q или Gln), лизин (К или Lys) и аргинин (R или Arg).
Алифатические аминокислоты могут быть подразделены на четыре подгруппы. “Большая подгруппа алифатических неполярных аминокислот” состоит из валина, лейцина и изолейцина, ”подгруппа алифатических слабо полярных аминокислот” состоит из метионина, серина, треонина и цистеина, ”подгруппа алифатических полярных/заряженных аминокислот” состоит из глутаминовой кислоты, аспарагиновой кислоты, аспарагина, глутамина, лизина и аргинина, и ”подгруппа аминокислот с небольшим числом остатков” состоит из глицина и аланина. Группа заряженных/полярных аминокислот может быть подразделена на три подгруппы: ”подгруппа положительно заряженных аминокислот”, состоящая из лизина и аргинина, “подгруппа отрицательно заряженных аминокислот”, состоящая из глутаминовой кислоты и аспарагиновой кислоты, и ”подгруппа полярных аминокислот”, состоящая из аспарагина и глутамина.
Ароматические аминокислоты могут быть подразделены на две подгруппы: ”подгруппа аминокислот с азотным кольцом”, состоящая из гистидина и триптофана, и ”подгруппа фенилзамещенных аминокислот”, состоящая из фенилаланина и тирозина.
Фраза ”консервативная замена аминокислоты” или “консервативная мутация” означает замену одной аминокислоты другой аминокислотой с общим свойством. Функциональным способом определения общих свойств у отдельных аминокислот является анализ нормализованных частот изменения аминокислот у соответствующих белков гомологичных организмов (Schulz, G.E. and R.H. Schirmer, Principles of Protein Structure, Springet-Verlag, New York (1979)). При помощи таких анализов можно определить группы аминокислот, в которых аминокислоты могут быть предпочтительно заменены друг другом и поэтому характеризуются одинаковым воздействием на общую структуру белка (Schulz, G.E. and R.H. Schirmer, см. выше).
Примеры консервативных мутаций включают замены аминокислот в вышеуказанных подгруппах, например, замену аргинина лизином и наоборот, с сохранением положительного заряда; замену аспарагиновой кислоты глутаминовой кислотой и, наоборот, с сохранением отрицательного заряда; замену треонина серином с сохранением свободной группы -ОН и замену аспарагина глутамином с сохранением свободной группы -NH2.
“Полуконсервативные мутации” включают замены аминокислот в вышеуказанных группах, не относящихся к одной подгруппе. Например, замену аспарагина аспарагиновой кислотой или лизина аспарагином, которые включают аминокислоты из одной группы, но из разных подгрупп.
“Неконсервативные мутации” включают замены аминокислот из разных групп, например, замену триптофана лизином или серина фенилаланином и т.д.
В предпочтительном варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка, выбранного из группы, состоящей из остатка 34, остатка 82 и остатка 156. Указанные остатки могут быть заменены отдельно или в любой комбинации. В вариантах осуществления изобретения, предполагающих замену остатка 34, лизина (К), указанный остаток предпочтительно заменяют остатком глутаминовой кислоты (Е) или аспарагиновой кислоты (D). В вариантах осуществления изобретения, предполагающих замену остатка 82, треонина (Т), указанный остаток предпочтительно заменяют остатком изолейцина (I) или лейцина (L). В вариантах осуществления изобретения, предполагающих замену остатка 156, глутаминовой кислоты (Е), указанный остаток предпочтительно заменяют остатком глицина (G) или аланина (А). Кроме того, при замене аминокислотного остатка 156 (заменяемого отдельно или в комбинации с заменой остатка 34 и/или остатка 82) может быть желательно получить функциональный мутант белка AID с заменами аминокислот в положении остатков 9, 13, 38, 42, 96, 115, 132, 157, 180, 181, 183, 197, 198 или их комбинаций. В частности, (а) заменой аминокислоты в положении остатка 9 может быть метионин (М) или лизин (К), (b) заменой аминокислоты в положении остатка 13 может быть фенилаланин (F) или триптофан (W), (с) заменой аминокислоты в положении остатка 38 может быть глицин (G) или аланин (А), (d) заменой аминокислоты в положении остатка 42 может быть изолейцин (I) или лейцин (L), (е) заменой аминокислоты в положении остатка 96 может быть глицин (G) или аланин (А), (f) заменой аминокислоты в положении остатка 115 может быть тирозин (Y) или триптофан (W), (g) заменой аминокислоты в положении остатка 132 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (h) заменой аминокислоты в положении остатка 180 может быть изолейцин (I) или аланин (А), (i) заменой аминокислоты в положении остатка 181 может быть метионин (М) или валин (V), (j) заменой аминокислоты в положении остатка 183 может быть изолейцин (I) или пролин (Р), (k) заменой аминокислоты в положении остатка 197 может быть аргинин (R) или лизин (К), (l) заменой аминокислоты в положении остатка 198 может быть валин (V) или лейцин (L), и (m) заменой аминокислоты в положении остатка 157 может быть треонин (Т) или лизин (К).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 10 и, по меньшей мере, одной заменой аминокислоты в положении остатка 156. Указанные остатки могут быть заменены отдельно или в любой комбинации. В вариантах осуществления изобретения, предполагающих замену аминокислотного остатка 10 (лизина), указанный остаток предпочтительно заменяют остатком глутаминовой кислоты (Е) или аспарагиновой кислоты (D). В вариантах осуществления изобретения, предполагающих замену остатка 156 (глутаминовой кислоты), указанный остаток предпочтительно заменяют остатком глицина (G) или аланина (А). В вариантах осуществления изобретения, предполагающих замену аминокислот в положениях остатков 10 и 156, может быть также желательно произвести замены аминокислот в положении остатков 13, 34, 82, 95, 115, 120, 134, 145 или их комбинаций. В частности, (а) заменой аминокислоты в положении остатка 13 может быть фенилаланин (F) или триптофан (W), (b) заменой аминокислоты в положении остатка 34 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (с) заменой аминокислоты в положении остатка 82 может быть изолейцин (I) или лейцин (L), (d) заменой аминокислоты в положении остатка 95 может быть серин (S) или лейцин (L), (е) заменой аминокислоты в положении остатка 115 может быть тирозин (Y) или триптофан (W), (f) заменой аминокислоты в положении остатка 120 может быть аргинин (R) или аспарагин (N) и (g) заменой аминокислоты в положении остатка 145 может быть лейцин (L) или изолейцин (I).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 35 и, по меньшей мере, одной заменой аминокислоты в положении 145. Аминокислоты в положении остатков 35 и 145 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 35 предпочтительно заменяют глицином (G) или аланином (А). Аминокислоту в положении остатка 145 предпочтительно заменяют лейцином (L) или изолейцином (I).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 34 или, по меньшей мере, одной заменой аминокислоты в положении остатка 160. Аминокислоты в положении остатков 34 и 160 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 34 предпочтительно заменяют глутаминовой кислотой (Е) или аспарагиновой кислотой (D). Аминокислоту в положении остатка 160 предпочтительно заменяют глутаминовой кислотой (Е) или аспарагиновой кислотой (D).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 43 и, по меньшей мере, одной заменой аминокислоты в положении остатка 120. Аминокислоты в положении остатков 43 и 120 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 43 предпочтительно заменяют пролином (Р). Аминокислоту в положении остатка 120 предпочтительно заменяют аргинином (R).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, двумя заменами аминокислот, при этом, по меньшей мере, одна замена находится в положении остатка 57, и, по меньшей мере, одна замена находится в положении остатка 145 или 81. Указанные остатки могут быть заменены отдельно или в любой комбинации (например, может быть произведена замена остатков 57 и 145 или замена остатков 57 и 81). Аминокислоту в положении остатка 57 предпочтительно заменяют глицином (G) или аланином (А). Аминокислоту в положении остатка 145 предпочтительно заменяют лейцином (L) или изолейцином (I). Аминокислоту в положении остатка 81 предпочтительно заменяют тирозином (Y) или триптофаном (W).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 82. Аминокислоты в положении остатков 156 и 82 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 156 предпочтительно заменяют глицином (G) или аланином (А). Аминокислоту в положении остатка 82 предпочтительно заменяют лейцином (L) или изолейцином (I).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 34. Аминокислоты в положении остатков 156 и 34 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 156 заменяют глицином (G) или аланином (А). Аминокислоту в положении остатка 34 предпочтительно заменяют глутаминовой кислотой (Е) или аспарагиновой кислотой (D).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатка 156 и, по меньшей мере, одной заменой аминокислоты в положении остатка 157. Аминокислоты в положении остатков 156 и 157 могут быть заменены любой приемлемой аминокислотой. Аминокислоту в положении остатка 156 предпочтительно заменяют глицином (G) или аланином (А). Аминокислоту в положении остатка 120 предпочтительно заменяют аргинином (R) или аспарагином (N).
В другом варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа, по меньшей мере, одной заменой аминокислоты в положении остатков 10, 82 и 156. Указанные остатки могут быть заменены отдельно или в любой комбинации. В предпочтительном варианте осуществления изобретения молекула нуклеиновой кислоты кодирует функциональный мутант AID, аминокислотная последовательность которого отличается от аминокислотной последовательности AID дикого типа заменами аминокислот в положении остатков 10, 82 и 156. В вариантах осуществления изобретения, предполагающих замену аминокислот в положении остатков 10, 82 и 156, может быть также желательно произвести замену аминокислот в положении остатков 9, 15, 18, 30, 34, 35, 36, 44, 53, 59, 66, 74, 77, 88, 93, 100, 104, 115, 118, 120, 142, 145, 157, 160, 184, 185, 188, 192 или их комбинаций. В частности, (а) заменой аминокислоты в положении остатка 9 может быть серин (S), метионин (М) или триптофан (W), (b) заменой аминокислоты в положении остатка 10 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (с) заменой аминокислоты в положении остатка 15 может быть тирозин (Y) или лейцин (L), (d) заменой аминокислоты в положении остатка 18 может быть аланин (А) или лейцин (L), (е) заменой аминокислоты в положении остатка 30 может быть тирозин (Y) или серин (S), (f) заменой аминокислоты в положении остатка 34 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (g) заменой аминокислоты в положении остатка 35 может быть серин (S) или лизин (K), (h) заменой аминокислоты в положении остатка 36 может быть цистеин (С), (i) заменой аминокислоты в положении остатка 44 может быть аргинин (R) или лизин (K), (j) заменой аминокислоты в положении остатка 53 может быть тирозин (Y) или глутамин (Q), (k) заменой аминокислоты в положении остатка 57 может быть аланин (А) или лейцин (L), (l) заменой аминокислоты в положении остатка 59 может быть метионин (М) или аланин (А), (m) заменой аминокислоты в положении остатка 66 может быть треонин (Т) или аланин (А), (n) заменой аминокислоты в положении остатка 74 может быть гистидин (Н) или лизин (К), (о) заменой аминокислоты в положении остатка 77 может быть серин (S) или лизин (К), (р) заменой аминокислоты в положении остатка 82 может быть изолейцин (I) или лейцин (L), (q) заменой аминокислоты в положении остатка 88 может быть серин (S) или треонин (Т), (r) заменой аминокислоты в положении остатка 93 может быть лейцин (L), аргинин (R) или лизин (К), (s) заменой аминокислоты в положении остатка 100 может быть глутаминовая кислота (Е), триптофан (W) или фенилаланин (F), (t) заменой аминокислоты в положении остатка 104 может быть изолейцин (I) или аланин (А), (u) заменой аминокислоты в положении остатка 115 может быть тирозин (Y) или лейцин (L), (v) заменой аминокислоты в положении остатка 118 может быть глутаминовая кислота (Е) или валин (V), (х) заменой аминокислоты в положении остатка 120 может быть аргинин (R) или лейцин (L), (y) заменой аминокислоты в положении остатка 142 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (z) заменой аминокислоты в положении остатка 145 может быть лейцин (L) или тирозин (Y), (аа) заменой аминокислоты в положении остатка 156 может быть глицин (G) или аланин (А), (bb) заменой аминокислоты в положении остатка 157 может быть глицин (G) или лизин (К), (сс) заменой аминокислоты в положении остатка 160 может быть глутаминовая кислота (Е) или аспарагиновая кислота (D), (dd) заменой аминокислоты в положении остатка 184 может быть аспарагин (N) или глутамин (Q), (ее) заменой аминокислоты в положении остатка 185 может быть глицин (G) или аспарагиновая кислота (D), (ff) заменой аминокислоты в положении остатка 188 может быть глицин (G) или глутаминовая кислота (Е), и (gg) заменой аминокислоты в положении остатка 192 может быть треонин (Т) или серин (S).
Функциональный мутант белка AID может отличаться от белка AID дикого типа заменами аминокислот по настоящему изобретению, выполняемыми отдельно или в любой комбинации. Альтернативно, функциональный мутант белка AID может включать дополнительные замены аминокислот по сравнению с аминокислотной последовательностью AID дикого типа (например, аминокислотная последовательность AID человека SEQ ID NO:1 или SEQ ID NO:2). Например, функциональный мутант белка AID может включать любую одну замену или комбинацию следующих замен аминокислот в SEQ ID NO:1 или SEQ ID NO:2: N7K, R8Q, Q14H, R25H, Y48H, N52S, H156R, R158K, L198A, R9K, G100W, A138G, S173T, T195I, F42C, A138G, H156R, L198F, M6K, K10Q, A39P, N52A, E118D, K10L, Q14N, N52M, D67A, G100A, V135A, Y145F, R171H, Q175K, R194K, инсерцию K после остатка 118 и D119E.
Настоящее изобретение также относится к молекулам нуклеиновых кислот, кодирующим функциональные мутанты AID, включающие мутацию в виде усечения С-конца. Специалистам в данной области известны методы создания мутации в виде усечения С-конца, которая может быть выполнена методами, описанными выше для получения мутантов AID. Например, мутация в виде усечения С-конца может быть создана путем введения терминирующего кодона вблизи или вдали от остатка 181 аминокислотной последовательности AID.
Примеры предпочтительных замен аминокислот, позволяющих получить функциональные мутанты белка AID по настоящему изобретению, показаны на фиг.2.
В контексте настоящего изобретения функциональный мутант AID также включает последовательность нуклеиновой кислоты, кодирующую белок AID дикого типа, в котором часть последовательности нуклеиновая кислоты удалена или заменена последовательностью нуклеиновой кислоты из гомолога AID (например, Apobec-1, Apobec3C или Apobec3G). В данной связи, белки АРОВЕС3 человека, подобно AID человека, способны деаминировать цитозин (С) в ДНК, но, поскольку AID предпочтительно направленно воздействует на остатки цитозина (С), фланкированные 5'-фланкирующим пурином, то АРОВЕС3 предпочитает фланкирование 5'-пиримидином, при этом отдельные АРОВЕС3 отличаются с точки зрения предпочтения специфического 5'-фланкирующего нуклеотида. Сравнение последовательностей гена АРОВЕС3 человека позволяет предположить, что фрагмент, состоящий примерно из восьми аминокислот, расположенных на расстоянии около 60 остатков от карбоксильного конца домена белка, играет важную роль в определении предпочтения фланкирующего нуклеотида. С учетом кристаллической структуры АРОВЕС2 и кристаллической структуры TadA тРНК-аденозиндеаминазы в комплексе с олигонуклеотидным субстратом указанная аминокислотная последовательность, состоящая из 60 остатков, одинаково контактируют с субстратом ДНК в AID и АРОВЕС3. Поэтому в одном варианте осуществления функциональный мутант AID может включать последовательность нуклеиновой кислоты, кодирующую белок AID дикого типа, в котором аминокислотные остатки 115-223 AID человека удалены и заменены соответствующей последовательностью из белков АРОВЕС3 (например, АРОВЕС3С, АРОВЕС3F и АРОВЕС3G).
Настоящее изобретение далее относится к молекулам нуклеиновых кислот, кодирующих слитый белок, включающий функциональный мутант AID и второй полипептид, слитый в рамке считывания. Получение слитых белков известно специалистам в данной области и может включать использование рестрикционных ферментов или методов рекомбинационного клонирования.
В одном варианте осуществления изобретения второй полипептид слитого белка может включать ”сигнал ядерной локализации” или ”NLS”. Термины ”сигнал ядерной локализации” или ”NLS” означают домен или домены, опосредующие приток белка или полинуклеотида или их сохранение в ядре клетки. Термин ”сильный сигнал притока в ядро” означает домен или домены, способные опосредовать более 90% субклеточной локализации в ядре при функциональном связывании с представляющим интерес белком. Репрезентативные примеры NLS включают, но, не ограничиваясь ими, однораздельные сигналы ядерной локализации, двураздельные сигналы ядерной локализации и Т- и С-концевые мотивы. N-концевые основные домены обычно соответствуют консенсусной последовательности К-К/R-X-K/R, которая впервые была обнаружена в большом Т-клеточном антигене SD40 и представляет собой однораздельный NLS. Одним неограничивающим примером N-концевого основного домена NLS является PKKKRKV (SEQ ID NO:76). Также известны двураздельные сигналы ядерной локализации, которые содержат два кластера основных аминокислот, разделенных спейсером длиной около 10 аминокислот, и примером которых является NLS из нуклеоплазмина: KR[PAATKKAGQA]KKKK (SEQ ID NO:77). N- и С-концевые фрагменты включают, например, кислотный домен М9 hnRNP A1, последовательность KIPIK (SEQ ID NO:78) в дрожжевом репрессоре транскрипции Matα2 и сложные сигналы U snRNP. Большинство указанных NLS можно обнаружить при помощи специфических рецепторов семейства β-импортинов.
В другом варианте осуществления изобретения второй полипептид может быть слитым партнером, который, как известно в данной области, облегчает очистку и улучшает растворимость полипептида, с которым данный партнер слит, таким как, например, полигистидиновые метки, NusA, бактериоферритин (BFR), GrpE, тиоредоксин (TRX) или глутатион-S-трансфераза (GST). Специалистам в данной области известны методы очистки слитых белков.
В другом варианте осуществления второй полипептид может быть репортерным полипептидом, таким как автофлуоресцентный белок (например, GFP, EGFP). Автофлуоресцентные белки позволяют легко идентифицировать экспрессию представляющего интерес полинуклеотида (и полипептидного продукта). Поскольку активность репортерного полипептида (и уровень экспрессии) можно контролировать количественно с помощью проточного сортера, то многие независимые трансфектанты можно анализировать последовательно или в популяции. Клетки, характеризующиеся лучшей экспрессией, затем можно исследовать или выделить из популяции. Данный метод является полезным при отборе рекомбинантной клетки, содержащей функциональный мутант AID по настоящему изобретению.
В другом варианте осуществления изобретения молекулы нуклеиновых кислот, кодирующих функциональные мутанты AID по настоящему изобретению, могут быть кодон-оптимизированы с целью уменьшения или увеличения числа мотивов соматической гипермутации (SHM). В использованном в данном описании значении термин ”соматическая гипермутация” или ”SHM” означает мутацию полинуклеотидной последовательности, инициируемую AID или ассоциированную с действием AID, функционального мутанта AID, урацилгликозилазы и/или подверженных ошибкам полимераз в полинуклеотидной последовательности. В определение данного термина входит мутагенез, возникающий вследствие репарации исходного поражения, включая мутагенез, опосредованный механизмом репарации ошибочно спаренных оснований и соответствующими ферментами.
Термин ”субстрат для SHM” означает синтетическую или полусинтетическую полинуклеотидную последовательность, действие которой может быть активировано AID и/или подверженными ошибкам ДНК-полимеразами с целью изменения последовательности нуклеиновой кислоты синтетической или полусинтетической полинуклеотидной последовательности.
В использованном в данном описании значении термин ”горячая точка SHM” или ”горячая точка” означает полинуклеотидную последовательность или мотив, состоящий из 3-6 нуклеотидов, которая в большей степени подвержена соматической гипермутации при определении с помощью статистического анализа мутаций SHM в генах антитела. Аналогичным образом, термин ”холодная точка SHM” или “холодная точка” в использованном в данном описании значении означает полинуклеотид или мотив, состоящий из 3-6 нуклеотидов, который в меньшей степени подвержен соматической гипермутации при определении с помощью статистического анализа мутаций SHM в генах антитела. Относительное ранжирование разных мотивов SHM, а также канонические горячие и холодные точки в генах антитела описаны в публикации патентной заявки США 09/0075378 и публикации международной патентной заявки WO 08/103475, при этом статистический анализ может быть экстраполирован на анализ мутаций SHM в генах, не являющихся антителами, (например, гены AID), которые рассмотрены в настоящем описании.
Термин ”мотив соматической гипермутации” или “мотив SHM” означает полинуклеотидную последовательность, которая включает или может быть изменена с целью включения одной или нескольких горячих или холодных точек и которая кодирует определенный набор аминокислот. Мотивы SHM могут быть любой длины, но обычно являются полинуклеотидами, состоящими примерно из 2-20 нуклеотидов или примерно из 3-9 нуклеотидов. Мотивы SHM могут включать любую комбинацию горячих и холодных точек, или в них могут отсутствовать как горячие точки, так и холодные точки.
Термины ”предпочтительный кодон с горячей точкой SHM”, “предпочтительный мотив с горячей точкой SHM”, “предпочтительный кодон с горячей точкой SHM” и “предпочтительный мотив с горячей точкой SHM” означают кодон, который включает, но, не ограничиваясь ими, кодоны ААС, ТАС, ТАТ, AGN или AGC. Такие последовательности могут входить в состав более крупного мотива SHM, вызывать SHM-опосредованный мутагенез и направленно увеличивать разнообразие аминокислот в указанном кодоне.
Как использовано в данном описании, последовательность нуклеиновой кислоты ”оптимизирована в отношении SHM”, если указанная последовательность или ее часть была изменена с целью увеличения или уменьшения частоты и/или локализации горячих точек и/или холодных точек. Последовательность нуклеиновой кислоты сделана ”чувствительной к SHM”, если указанная кислота или ее часть была изменена с целью увеличения частоты и/или локализации горячих точек или уменьшения частоты (плотности) и/или локализации холодных точек в последовательности нуклеиновой кислоты. И наоборот, последовательность нуклеиновой кислоты сделана ”устойчивой к SHM”, если указанная последовательность или ее часть была изменена с целью уменьшения частоты (плотности) и/или локализации горячих точек в открытой рамке считывания данной последовательности нуклеиновой кислоты. Как правило, может быть получена последовательность с большей или меньшей подверженностью SHM-опосредованному мутагенезу в результате изменения кодона и/или аминокислот, кодированных последовательностью нуклеиновой кислоты.
Оптимизация последовательности нуклеиновой кислоты означает модификацию примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 10%, примерно 20%, примерно 25%, примерно 50%, примерно 75%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 100% нуклеотидов или любого числа нуклеотидов в указанном диапазоне в последовательности нуклеиновой кислоты. Оптимизация полинуклеотидной последовательности также означает модификацию примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 10, примерно 20, примерно 25, примерно 50, примерно 75, примерно 90, примерно 95, примерно 96, примерно 97, примерно 98, примерно 99, примерно 100, примерно 200, примерно 300, примерно 400, примерно 500, примерно 750, примерно 1000, примерно 1500, примерно 2000, примерно 2500, примерно 3000 или более нуклеотидов или любого числа нуклеотидов в указанном диапазоне в последовательности нуклеиновой кислоты, в результате чего некоторые или все нуклеотиды оптимизированы в отношении SHM-опосредованного мутагенеза. Уменьшение частоты (плотности) горячих точек и/или холодных точек означает сокращение примерно на 1%, примерно на 2%, примерно на 3%, примерно на 4%, примерно на 5%, примерно на 10%, примерно на 20%, примерно на 25%, примерно на 50%, примерно на 75%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, примерно на 100% горячих или холодных точек или на любое число горячих или холодных точек в указанном диапазоне в последовательности нуклеиновой кислоты. Увеличение частоты (плотности) горячих точек и/или холодных точек означает увеличение примерно на 1%, примерно на 2%, примерно на 3%, примерно на 4%, примерно на 5%, примерно на 10%, примерно на 20%, примерно на 25%, примерно на 50%, примерно на 75%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, примерно на 100% горячих или холодных точек или на любое число горячих или холодных точек в указанном диапазоне в последовательности нуклеиновой кислоты.
Положение или рамка считывания горячей или холодной точки также является фактором, определяющим SHM-опосредованный мутагенез, который может создать молчащую мутацию в полученной аминокислотной последовательности или вызвать консервативные, полуконсервативные или неконсервативные изменения на уровне аминокислот. Структурные параметры можно изменять с целью дальнейшего усиления относительной чувствительности или устойчивости нуклеотидной последовательности к SHM. Таким образом, степень рекрутинга SHM и рамка считывания мотива определяют SHM-чувствительные и SHM-устойчивые последовательности нуклеиновых кислот.
Настоящее изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты, кодирующей функциональный мутант AID. Термин “вектор” или “клонирующий вектор” означает репликон, такой как плазмида, фаг или космида, в который может быть введен сегмент другого полинуклеотида с достижением репликации вставленного сегмента. Векторы обычно существуют в виде кольцевых, двухцепочечных ДНК длиной от нескольких тысяч пар оснований (т.п.о.) до сотен тысяч пар оснований. Предпочтительные клонирующие векторы были модифицированы из природных плазмид для облегчения клонирования и рекомбинантной манипуляции полинуклеотидными последовательностями. Многие такие векторы хорошо известны в данной области; см., например, публикации Sambrook et al., “Molecular Cloning: A Laboratory Manual”, second edition, Cold Spring Harbor Laboratory, (1989), и Maniatis et al., Cell Biology: A Comprehensive Treatise, Vol.3, Gene Sequence Expression, Academic Press, NY, pp.563-608 (1980).
Термин ”экспрессионный вектор” в использованном в данном описании значении означает вектор, используемый для экспрессии определенных полинуклеотидов в клетке-хозяине или системе экспрессии in vitro. В определение данного термина входят плазмиды, эписомы, космиды, ретровирусы или фаги. Экспрессионный вектор может быть использован для экспрессии последовательности ДНК, кодирующей требуемый белок, и содержит единицу транскрипции, включающую совокупность контролирующих экспрессию последовательностей. Выбор промотора и других регуляторных элементов обычно изменяется в зависимости от предполагаемой клетки-хозяина или системы экспрессии in vitro.
В использованном в данном описании значении термин ”система экспрессии in vitro” означает бесклеточные системы, которые делают возможной транскрипцию или совместную транскрипцию и трансляцию матриц ДНК. Такие системы включают, например, систему ретикулоцитов кролика, а также новые бесклеточные системы синтеза (J. Biotechnol., 110:257-63 (2004); Biotechnol. Annu. Rev., 10:1-30 (2004)).
“Контролирующие экспрессию последовательности” являются регуляторными последовательностями ДНК, такими как промоторы, энхансеры, сигналы полиаденилирования, терминаторы транскрипции, внутренние сайты входа рибосом (IRES) и подобные, которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. В данной области известны типичные контролирующие экспрессию последовательности, которые описаны в публикации Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990).
“Промотор” является последовательностью ДНК, способной связываться с РНК-полимеразой в клетке и инициировать транскрипцию нижней области (3'-направление) кодирующей последовательности. Промоторная последовательность присоединена у своего 3'-конца к сайту инициации транскрипции и проходит в верхнюю область (5'-направление), включая минимальное число оснований или элементов, необходимых для инициации транскрипции на уровнях, обнаруживаемых по сравнению с фоном. Промоторная последовательность включает сайт инициации транскрипции (обычно определяемый путем картирования при помощи нуклеазы S1), а также домены связывания белка (консенсусные последовательности), отвечающие за связывание РНК-полимеразы. Эукариотические промоторы часто, но не всегда, содержат блоки ”ТАТА” и блоки ”САТ”. Прокариотические промоторы содержат последовательности Шайна-Дальгарно помимо 10 и 35 консенсусных последовательностей.
В данной области хорошо известно большое число промоторов, включая конститутивные, индуцибельные и репрессируемые промоторы, получаемых из разных источников. Примеры источников промоторов, включающих, например, вирусные клетки, клетки млекопитающих, клетки насекомых, растительные, дрожжевые и бактериальные клетки, легко доступны, могут быть синтезированы на основе опубликованных последовательностей или получены из депозитариев, таких как АТСС, а также из других коммерческих или частных источников. Промоторы могут быть однонаправленными (то есть инициирующими транскрипцию в одном направлении) или двунаправленными (то есть инициирующими транскрипцию в 3'- или 5'-направлении). Неограничивающие примеры промоторов включают, например, бактериальную экспрессирующую систему Т7, бактериальную экспрессирующую систему pBAD (araA), цитомегаловирусный промотор (CMV), промотор SV40, промотор RSV. Индуцибельные промоторы включают систему Tet (патенты США 5464758 и 5814618), индуцибельную систему Экдисона (No et al., Proc. Natl. Acad. Sci., 93:3346-3351 (1996); систему T-REx™ (Invitrogen, Carlsbad, CA), LacSwitch® (Stratagene, San Diego, CA) и индуцируемую тамоксифеном систему на основе рекомбиназы Cre-ERT (Indra et al., Nuc. Acid. Res., 27:4324-4327 (1999); Nuc. Acid. Res., 28:e99 (2000); патент США 7112715). См. публикацию Kramer & Fussenegger, Methods Mol. Biol., 308:123-144 (2005)), или любой промотор, известный в данной области и приемлемый для экспрессии в желаемых клетках.
В случае использования индуцибельной системы, такой как Tet-контролируемая система, в среду может быть добавлен доксициклин, индуцирующий экспрессию нуклеиновой кислоты, кодирующей функциональный мутант AID, за определенное время (например, за 1 час, 2 часа, 4 часа, 6 часов, 8 часов, 10 часов, 15 часов, 20 часов, 24 часа или любое другое время) до выполнения соответствующего анализа. Клетки можно выращивать в течение определенного времени для обеспечения постоянного размножения клеток, например, на протяжении 1-3 поколений клеток, в определенных случаях на протяжении 3-6 поколений, в некоторых случаях на протяжении 6-10 поколений или дольше.
В использованном в данном описании значении термин ”минимальный промотор” означает неполную промоторную последовательность, которая определяет сайт инициации транскрипции, но сама по себе не может эффективно инициировать транскрипцию. Активность таких минимальных промоторов зависит от связывания с активаторами, такими как контролируемый тетрациклином трансактиватор, для функционального связывания со связывающими сайтами.
Термины ”IRES” или ”внутренний сайт входа рибосом” означает элемент полинуклеотида, усиливающий трансляцию кодирующей последовательности, кодированной полицистронной матричной РНК. Элементы IRES опосредуют инициацию трансляции путем прямого рекрутинга и связывания рибосом с молекулой матричной РНК (мРНК) в обход кэпа 7-метилгуанозина в процессе обычного сканирования рибосом. Наличие последовательности IRES может повысить уровень кэп-независимой трансляции требуемого белка. В ранних публикациях последовательности IRES описывались как ”энхансеры трансляции”. Например, ”энхансеры трансляции” кардиовирусной РНК описаны в патентах США 4937190 и 5770428.
Термин ”энхансер” в использованном в данном описании значении означает последовательность ДНК, способную усиливать транскрипцию гена или кодирующей последовательности, с которыми функционально связана. Энхансеры могут быть расположены на расстоянии многих тысяч пар оснований от кодирующей последовательности и могут опосредовать связывание регуляторных факторов, паттерны метилирования ДНК или изменения структуры ДНК. В данной области хорошо известно большое число энхансеров, получаемых из разных источников или в клонированных полинуклеотидах (например, из депозитариев, таких как АТСС, а также из других коммерческих или частных источников). Ряд полинуклеотидов, включающих промоторы (такие как обычно используемый промотор CMV), также содержат энхансерные последовательности. Функционально связанные энхансеры могут быть расположены сверху, внутри или снизу от кодирующих последовательностей. Термин ”энхансеры Ig” означает энхансеры, выделенные из областей, картированных в локусе Ig (такие энхансеры включают, например, 5'-концевые энхансеры тяжелой цепи (мю), 5'-концевые энхансеры легкой цепи (каппа), интронные энхансеры каппа- и мю-цепей и 3'-концевые энхансеры (см. публикацию Paul W.E. (ed) Fundamental Immunology, 3rd Edition, Raven Press, New York (1993) pages 353-363; патент США 5885827).
“Терминаторные последовательности” представляют собой последовательности, обеспечивающие терминацию транскрипции. Терминаторные последовательности известны в данной области и включают, но, не ограничиваясь ими, терминаторы поли А (например, Bgh поли А и SV40 поли А). Сигнал терминации транскрипции обычно включает 3'-концевую нетранслированную область (или ”3' ut”), необязательный интрон (также определяемый как вставочная последовательность или ”IVS”) и один или более сигналов полиаденилирования (”p(A)” или “рА”). Терминаторные последовательности могут быть также определены как ”IVS-pA”, “IVS+p(A)”, “3' ut+p(A)” или “3' ut/p(A)”. В качестве области терминации могут быть использованы природные или синтетические терминаторы.
Термины ”полиаденилирование”, “последовательность полиаденилирования” и “сигнал полиаденилирования”, “поли А”, “р(А)” или “рА” означают последовательность нуклеиновой кислоты, присутствующую в транскрипте РНК, которая обеспечивает полиаденилирование транскрипта в присутствии фермента полиаденилтрансферазы. В данной области известны многие сигналы полиаденилирования. Неограничивающие примеры включают сигнал полиаденилирования гормона роста человека, поздний сигнал полиаденилирования SV40 и сигнал полиаденилирования гормона роста крупного рогатого скота.
“Эписомный экспрессионный вектор” способен реплицировать в клетке-хозяине и существует в виде внехромосомного сегмента ДНК в клетке-хозяине при наличии соответствующего давления отбора (см., например, публикацию Conese et al., Gene Therapy 11: 1735-1742 (2004)). Примеры коммерчески доступных эписомных экспрессионных векторов включают, но, не ограничиваясь ими, эписомные плазмиды, в которых использован ядерный антиген 1 Эпштейна-Барра (EBNA1) и ориджин репликации вируса Эпштейна-Барра (EBV) (oriP). Неограничивающими примерами эписомного вектора, в котором использован Т-клеточный антиген и ориджин репликации SV40 вместо EBNA1 и oriP, являются векторы pREP4, pCEP4, pREP7 компании Invitrogen, pcDNA3.1 компании Invitrogen и pBK-CMV компании Stratagene.
“Интегрирующий экспрессионный вектор” может произвольно интегрировать в ДНК клетки-хозяина и может включать сайт рекомбинации, делающий возможной специфическую рекомбинацию между экспрессионным вектором и хромосомой клетки-хозяина. В таких интегрирующих экспрессионных векторах могут быть использованы эндогенные контролирующие экспрессию последовательности хромосом клетки-хозяина для достижения экспрессии требуемого белка. Примеры векторов, интегрирующих сайтспецифическим образом, включают, например, компоненты системы flp-in компании Invitrogen (например, pcDNA™5/FRT) или системы cre-lox, присутствующие в векторах pExchange-6 Core компании Stratagene. Примеры векторов, произвольно интегрирующих в хромосомы клетки-хозяина, включают, например, pcDBA3.1 (при введении в отсутствии Т-клеточного антигена) компании Invitrogene, pCI или pFN10A (ACT) Flexi® компании Promega.
Примеры коммерчески доступных вирусных экспрессионных векторов включают, но, не ограничиваясь ими, систему Per.C6 на основе аденовируса компании Crucell, Inc., pLP1 на основе лентивируса компании Invitrogene и ретровирусные векторы pFB-ERV и pCFB-EGSH компании Stratagene.
Альтернативно, экспрессионный вектор может быть использован для введения и интеграции последовательностей сильного промотора или энхансера в локус клетки с целью модуляции экспрессии представляющего интерес эндогенного гена (Capecchi M.R., Nat. Rev. Genet., 6(6): 507-12 (2005); Schindehutte et al., Stem. Cells, 23(1):10-5 (2005)). Данный подход может быть также использован для введения индуцибельного промотора, такого как промотор Tet-On (патенты США 5464758 и 5814618), в геномную ДНК клетки для обеспечения индуцибельной экспрессии представляющего интерес эндогенного гена. Активирующая конструкция может также включать направленно воздействующую последовательность, делающую возможной гомологичную или негомологичную рекомбинацию активирующей последовательности в требуемый локус, специфичный для представляющего интерес гена (см., например, публикацию Garcia-Otin and Guillou, Front. Biosci., 11:1108-36 (2006)). Альтернативно, для активации трансгена в присутствии 4-гидрокситамоксифена может быть использована индуцибельная система на основе рекомбиназы, такая как система Cre-ER (Indra et al., Nuc. Acid. Res., 27(22):4324-4327 (1999); Nuc. Acid. Res., 28(23): e99 (2000); патент США 7112715).
Вектор по настоящему изобретению может включать ”селектируемый маркерный ген”. Термин ”селектируемый маркерный ген” в использованном в данном описании значении означает полинуклеотиды, которые позволяют специфически отбирать клетки, несущие указанный полинуклеотид, в присутствии соответствующего селективного агента. Селектируемые маркеры могут быть позитивными, негативными или бифункциональными. Позитивные селектируемые маркеры позволяют отбирать клетки, несущие маркер, в то время как негативные селектируемые маркеры позволяют избирательно удалять клетки, несущие указанный маркер. Полинуклеотид селектируемого маркера может быть прямо связан с экспрессируемыми полинуклеотидами или может быть введен в клетку путем котрансфекции. В научной литературе описан целый ряд таких полинуклеотидов маркеров, которые включают, например, бифункциональные (то есть позитивные/негативные) маркеры (см., например, публикации международных патентных заявок WO 92/08796 и WO 94/28143), гены устойчивости к лекарственным средствам (например, ампициллин) и белки, сообщающие устойчивость к цитостатическим и цитоцидным лекарственным средствам (например, белок DHFR) (см., например, публикации Wigler et al., Proc. Natl. Acad. Sci. USA, 77:3567 (1980), O'Hare et al., Proc. Acad. Sci. USA, 78:1527 (1981), Mulligan & Berg. Proc. Natl. Sci. USA, 78:2072 (1981), Colberre-Garapin et al., J. Mol., 150:1(1981), Santerre et al., Gene, 30:147 (1984), Kent et al., Science, 237:901-903 (1987), Wigler et al., Cell, 11:223(1977), Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA, 48:2026 (1962), Lowy et al., Cell, 22:817 (1980) и патенты США 5122464 и 5770359).
Вектор может включать ”ген-репортер”. Термин ”ген-репортер” означает полинуклеотид, который может быть специфически обнаружен (или отобран), будучи экспрессированным в представляющей интерес клетке. В данной области известны многие системы генов-репортеров, которые включают, например, щелочную фосфатазу (Berger, J. et al., Gene, 66:1-10 (1988); Kain, S.R., Methods Mol. Biol., 63:49-60 (1997)), бета-галактозидазу (патент США 5070012), хлорамфеникол-ацетилтрансферазу (Gorman et al., Mol. Cell. Biol., 2:1044-51 (1982)), бета-глюкуронидазу, пероксидазу, бета-лактамазу (патенты США 5741657 и 5955604), каталитические антитела, люциферазы (патенты США 5221623, 5683888, 5674713, 5650289 и 5843746) и природные флуоресцентные белки (Tsien, R.Y., Annu. Rev. Biochem., 67:509-544 (1998)). Термин “ген-репортер” также означает любой пептид, который может быть специфически обнаружен благодаря использованию одного или нескольких антител, эпитопов, партнеров связывания, субстратов, модифицирующих ферментов, рецепторов или лигандов, которые могут взаимодействовать (или не взаимодействовать) с представляющим интерес пептидом с образованием детектируемого сигнала. Гены-репортеры также включают гены, способные модулировать фенотип клетки. Репортерный белок, используемый с целью такого обнаружения, не должен быть гибридизирован с мутантом белка AID. Указанный белок может быть кодирован полинуклеотидом (например, вектором), который также кодирует мутант белка AID и может быть совместно введен и коэкспрессирован в клетке-мишени.
Экспрессионные векторы могут также включать антисмысловые рибозимы или полинуклеотиды siPHK для уменьшения экспрессии последовательностей-мишеней (см., например, публикации Sioud M, & Iversen, Curr. Drug. Targets, 6:647-53 (2005); Sandy et al., Biotechniques, 39:215-24 (2005)).
Настоящее изобретение также относится к клетке, содержащей молекулу нуклеиновой кислоты, кодирующую функциональный мутант AID, или вектор, включающий молекулу нуклеиновой кислоты, кодирующую функциональный мутант AID. Термины ”клетки”, “культуры клеток”, “линия клеток”, “рекомбинантные клетки-хозяева”, “реципиентные клетки” и “клетки-хозяева” часто имеют взаимозаменяемые значения и означают первичные клетки субъекта и любое их потомство независимо от числа переносов. Следует отметить, что не все потомство является полностью идентичным материнской клетке (вследствие намеренных и случайных мутаций или различий в окружающей среде). Однако такое измененное потомство входит в определение вышеуказанных терминов при сохранении функциональности, присущей первоначально трансформированной клетке. Например, таким признаком, хотя и не ограниченным им, может быть способность продуцировать определенный рекомбинантный белок. “Позитивная линия клеток-мутаторов” представляет собой линию клеток, содержащую клеточные факторы, достаточные для действия в комбинации с другими векторными элементами для достижения гипермутации. Указанная линия клеток может быть любой линией клеток, известной в данной области или рассмотренной в настоящем описании изобретения. “Клон” является популяцией клеток, полученной из одной клетки или общего предшественника путем митоза.
Клеточные системы экспрессии и гипермутации включают любые приемлемые прокариотические или эукариотические экспрессионные системы. Предпочтительными системами являются такие системы, которые могут быть легко и надежно выращены, характеризуются обоснованно высокими скоростями роста, имеют хорошо исследованные экспрессирующие системы и могут быть легко и эффективно трансформированы или трансфицированы.
Пригодные микробные клетки включают, но, не ограничиваясь ими, клетки родов Bacillus, Escherichia (такого как E. coli), Pseudomonas, Streptomyces, Salmonella, Erwinia, Bacillus subtilis, Bacillus brevis. Особенно пригодные прокариотические клетки включают разные штаммы Escherichia coli (например, К12, НВ101 (АТСС № 33694), DH5α, DH10, MC1061 (ATCC № 53338) и СС102).
Многие штаммы дрожжевых клеток, известные специалистам в данной области, которые также могут быть использованы в качестве клеток-хозяев для экспрессии полипептидов, включают клетки родов Hansenula, Kluyveromyces, Pichia, Rhino-sporidium, Saccharomyces и Schizosaccharomyces, и другие грибы. Предпочтительными дрожжевыми клетками являются, например, Saccharomyces cerivisae и Pichia pastoris.
Кроме того, при осуществлении способов по настоящему изобретению при желании могут быть использованы системы клеток насекомых. Такие системы описаны, например, в публикациях Kitts et al., Biotechniques, 14:810-817 (1993); Lucklow, Curr. Opin. Biotechnol., 4:564-572 (1993); и Lucklow et al., J. Virol., 67:4566-4579 (1993). Предпочтительными клетками насекомых являются Sf-9 и Н15 (Invitrogen, Carlsbad, Calif.).
Клетка, включающая нуклеиновую кислоту, кодирующую функциональный мутант AID, предпочтительно является клеткой млекопитающего. В данной области известен целый ряд приемлемых клеток-хозяев млекопитающих, при этом многие клетки могут быть получены из Американской коллекции типовых культур (АТСС, Manassas, VA). Примеры приемлемых клеток млекопитающих включают, но, не ограничиваясь ими, клетки яичника китайского хомячка (СНО) (АТСС № CCL61), клетки DHFR СНО (Urlaub et al., Proc. Natl. Acad. Sci. USA, 97:4216-4220 (1980)), эмбриональные клетки почки человека (НЕК) 293 или 293Т (АТСС № CRL1573) и клетки 3Т3 (АТСС № CCL92). В данной области известны методы отбора приемлемых клеток-хозяев млекопитающих, трансформации, культивирования, амплификации, скрининга, продуцирования и очистки продукта. Другими приемлемыми линиями клеток млекопитающих являются линии клеток обезьяны COS-1 (АТСС № CRL1650) и COS-7 (АТСС № CRL1651) и линия клеток CV-1 (АТСС № CCL70). Другие типичные клетки-хозяева млекопитающих включают линии клеток приматов и линии клеток грызунов, включая трансформированные линии клеток. Могут быть также использованы нормальные диплоидные клетки, клеточные штаммы, полученные из культуры первичной ткани in vitro, а также первичные эксплантаты. У клеток-кандидатов может быть генотипически отсутствовать селективный ген или такие клетки могут содержать доминантно действующий селективный ген. Другие приемлемые линии клеток млекопитающих включают, но, не ограничиваясь ими, клетки нейробластомы мыши N2A, HeLa, клетки L-929 мыши, линии клеток 3Т3, выделенные у мышей Swiss, Balb-c или NIH, линии клеток хомячка ВНК или НаК, которые могут быть приобретены в АТСС.
В объем настоящего изобретения также входят лимфоидные клетки или линии клеток, выделенные из лимфоидных клеток, такие как линия клеток пре-В-лимфоцитов. Конкретные примеры включают, но, не ограничиваясь ими, RAMOS (CRL-1596), Daudi (CCL-213), EB-3 (CCL-85), DT40 (CRL-2111), 18-81 (Jack et al., Proc. Natl. Acad. Sci. USA, 85:1581-1585 (1988)), клетки Raji (CCL-86) и их производные.
Функциональный мутант AID по настоящему изобретению может быть введен в клетку путем ”трансфекции”, “трансформации” или “трансдукции”. Термины “трансфекция”, “трансформация” или “трансдукция” в использованном в данном описании значении означают введение одного или нескольких экзогенных полинуклеотидов в клетку-хозяина физическими или химическими методами. Многие методы трансфекции, известные специалистам в данной области, включают, но, не ограничиваясь ими, копреципитацию ДНК с помощью фосфата кальция (см. публикацию Methods in Molecular Biology, Vol.7, Gene Transfer and Expression Protocols, Ed. E. J. Murray, Humana Press (1991)); использование DEAE-декстрана; электропорацию; трансфекцию, опосредуемую катионными липосомами; бомбардировку микрочастицами, облегченную частицами вольфрама (Johnston, S.A., Nature, 346:776-777 (1990); и копреципитацию ДНК с помощью фосфата стронция (Brash D.E. et al., Molec. Cell. Biol. 7:2931-2034 (1987). Фаговые или ретровирусные векторы могут быть введены в клетки-хозяева после выращивания инфекционных частиц в упаковочных клетках, которые являются коммерчески доступными.
Настоящее изобретение также относится к способу получения генного продукта, обладающего требуемым свойством, который включает экспрессию нуклеиновой кислоты, кодирующей генный продукт, в популяции клеток, которая экспрессирует или может экспрессировать функциональный мутант белка AID по настоящему изобретению, при этом в результате экспрессии функционального мутанта белка AID возникает мутация в нуклеиновой кислоте, кодирующей генный продукт. Описание функционального мутанта AID, клеток и способов трансфекции и экспрессии молекул нуклеиновых кислот в клетках, приведенное выше в связи с другими вариантами осуществления изобретения, применимо также к аналогичным аспектам вышеуказанного способа.
Функциональный мутант белка AID предпочтительно вызывает мутацию в нуклеиновой кислоте, кодирующей генный продукт, путем соматической гипермутации (SHM). Использование AID в системах SHM подробно описано в публикации патентной заявки США 09/0075378 и публикациях международных патентных заявок WO 08/103474 и WO 08/103475. В использованном в данном описании значении термин ”представляющий интерес генный продукт” или ”представляющий интерес белок” означает белки или их части, для которых нуклеиновую кислоту, кодирующую генный продукт, желательно оптимизировать в отношении SHM при помощи функционального мутанта AID с целью быстрого создания, отбора и идентификации улучшенных вариантов данного генного продукта. Такие оптимизированные последовательности нуклеиновой кислоты могут быть сделаны более чувствительными к SHM в результате использования кодона (рассмотренного в настоящем описании) с достижением изменений аминокислот вследствие воздействия на полинуклеотид функционального мутанта AID и выявления улучшенной функции. И наоборот, такие оптимизированные последовательности нуклеиновых кислот могут быть сделаны более устойчивыми к SHM (рассмотренной в настоящем описании) с уменьшением изменений аминокислот вследствие воздействия на полинуклеотид функционального мутанта AID в результате использования кодона и выявления улучшенной функции.
Любой белок, для которого известна или доступна аминокислотная или соответствующая нуклеотидная последовательность (например, может быть клонирована в вектор по настоящему изобретению) и может быть улучшен фенотип или функция, является кандидатом для использования в способе по настоящему изобретению. Примеры приемлемых белков включают, например, поверхностные белки, внутриклеточные белки, мембранные белки и секретированные белки из любого немодифицированного или синтетического источника. Генным продуктом предпочтительно является тяжелая цепь антитела или ее часть, легкая цепь антитела или ее часть, фермент, рецептор, структурный белок, кофактор, полипептид, пептид, интратело, селектируемый маркер, токсин, фактор роста, пептидный гормон или любой другой белок, который может быть оптимизирован.
Генный продукт может быть любым приемлемым ферментом, включая ферменты, ассоциированные с микробиологической ферментацией, созданием пути обмена, получением белка, биовосстановлением, ростом и развитием растений (см., например, публикации Olsen et al., Methods Mol. Biol., 230:329-349 (2003); Turner, Trends Biotechnol., 21(11):474-478 (2003); Zhao et al., Curr. Opin. Biotechnol., 13(2):104-110 (2003); и Mastrobattista et al., Chem. Biol. 12(12):1291-300 (2005)).
Рецепторы, пригодные для использования в способе по настоящему изобретению, включают, но, не ограничиваясь ими, рецепторы, связанные с клеткой, такие как антитела (В-клеточные рецепторы), Т-клеточные рецепторы, Fc-рецепторы, рецепторы связанного белка G, рецепторы цитокина, рецепторы углеводов и рецепторы на основе Avimer™. Такие рецепторы могут быть изменены при помощи SHM для улучшения одного или нескольких признаков: аффинности, авидности, избирательности, термостойкости, протеолитической устойчивости, растворимости, димеризации, складчатости, иммунотоксичности, связывания с путями сигнальной трансдукции и экспрессии.
Генные продукты, пригодные для использования в способе по настоящему изобретению, включают молекулы, способные изменять фармакокинетику и/или фармакодинамику других биологически активных белков, например, липидов и полимеров, таких как полиамины, полиамиды, полиэтиленгликоль и другие простые полиэфиры. Другие примеры генных продуктов, пригодных для использования в способе по настоящему изобретению, включают полипептиды, такие как VEGF, рецептор VEGF, субъединица А дифтерийного токсина, токсин B. pertussis, хемокины СС (например, CCL1-CCL28), хемокины СХС (например, СХСL1-CXCL16), хемокины С (например, XСL1 и XСL2) и хемокины СХ3С (например, СХ3CL1), IFN-гамма, IFN-альфа, IFN-бета, TNF-альфа, TNF-бета, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, IL-13, IL-15, TGF-бета, TGF-альфа, GM-CSF, G-CSF, M-CSF, TPO, EPO, фактор роста человека, фактор роста фибробластов, ядерные кофакторы, члены семейства Jak и Stat, сигнальные молекулы белка G, такие как рецепторы хемокинов, JNK, Fos-Jun, NF-κB, I-κB, CD40, CD4, CD8, B7, CD28 и CTLA-4. Методы отбора представляющего интерес генного продукта (например, белка) в качестве приемлемого кандидата для мутации и оптимизации посредством SHM, а также соответствующие методы скрининга более подробно описаны в публикации патентной заявки США 09/0075378 и публикациях международных патентных заявок WO 08/103474 и WO 08/103475.
В предпочтительном варианте осуществления настоящего изобретения последовательность нуклеиновой кислоты, подвергаемая мутации под воздействием функционального мутанта белка AID, кодирует антитело или его часть. В настоящем изобретении могут быть использованы последовательности нуклеиновых кислот, кодирующие все природные зародышевые антитела, антитела с созревшей аффинностью, синтетические или полусинтетические антитела, а также их фрагменты. Как правило, последовательности, кодирующие такие антитела, могут быть изменены посредством SHM с целью улучшения одного или нескольких следующих функциональных признаков: аффинности, авидности, избирательности, термостойкости, протеолитической устойчивости, растворимости, складчатости, иммунотоксичности и экспрессии. В зависимости от формы антитела могут быть созданы библиотеки, включающие отдельные библиотеки тяжелых и легких цепей, которые могут быть коэкспрессированы в клетке-хозяине. В определенных вариантах осуществления изобретения непроцессированные антитела могут быть секретированы (или выделены) и/или отображены на поверхности плазматической мембраны клетки-хозяина. В других вариантах осуществления изобретения библиотеки тяжелых и легких цепей могут быть введены в один экспрессионный вектор или в разные экспрессионные векторы для одновременного создания обеих цепей антитела.
Таким образом, способ по настоящему изобретению делает ненужной иммунизацию in vivo для отбора антител, связывающихся с основными поверхностными эпитопами, оказывающими наиболее надежное биологическое воздействие на функцию белка-мишени. Кроме того, антитела млекопитающих воздействуют на оптимальные паттерны использования кодонов для направленной SHM, что значительно упрощает процесс создания матрицы. В случае определенных антигенов иммунизация in vivo ведет к выбору эпитопа, который не влияет на функцию мишени, что препятствует отбору сильных и эффективных антител-кандидатов. В других вариантах осуществления способ по настоящему изобретению позволяет быстро создать сайтнаправленные антитела, обладающие сильной активностью с учетом роли данного эпитопа в определении функции белка-мишени. Таким образом обеспечивается возможность сканировать белки-мишени в отношении положения оптимального эпитопа и получать лучшие в данном классе лекарственные средства на основе антител, предназначенные для использования в клинике.
Способ по настоящему изобретению может быть использован для увеличения плотности горячих точек в специфических субдоменах антител или их фрагментов (например, F(ab')2, Fab', Fab, Fv, scFv, dsFv, dAb или одноцепочечного связывающего полипептида), что позволяет улучшить определенную характеристику (например, более высокую аффинность связывания, более высокую авидность связывания и/или более низкое неспецифическое связывание). Способ по настоящему изобретению может быть также использован для создания синтетических антител с большим числом горячих точек в константном домене (например, Fc), что позволяет увеличить аффинность связывания с Fc-рецептором (FcR) и модулировать, таким образом, сигнальные пути. С помощью способов по настоящему изобретению можно также одновременно модифицировать тяжелые и легкие цепи или их части.
Интратела могут быть модифицированы способом по настоящему изобретению с целью улучшения или увеличения складчатости тяжелой и/или легкой цепи в восстановительной среде цитоплазмы. Альтернативно или дополнительно, интратело sFv может быть модифицировано для стабилизации остовов, которые могут образовывать правильную складчатую структуру при отсутствии внутридоменных дисульфидных связей. Интратела могут быть также модифицированы с целью улучшения, например, одной или нескольких следующих характеристик: аффинности связывания, авидности связывания, доступности эпитопа, конкуренции с эндогенными белками за связывание с эпитопом-мишенью, времени полужизни, секвестрации мишени, посттрансляционной модификации белка-мишени и т.д. Поскольку интратела действуют в клетке, их активность в большей степени аналогична активности ферментов.
В данной области известны методы создания библиотек антител, а также методы идентификации оптимальных эпитопов, обеспечивающие отбор антител с более высокой избирательностью, перекрестной реактивностью и блокирующей активностью (см., например, публикацию патентной заявки США 09/0075378 и публикации международных патентных заявок WO 08/103474 и WO 08/103475). В данной области хорошо известны методы специфического скрининга для обнаружения и отбора отображенных на поверхности или секретированных антител с улучшенными характеристиками. Такие методы скрининга могут включать несколько циклов отбора на основе одновременной оценки нескольких параметров, например, аффинности, авидности, избирательности и термостойкости, с целью получения лучшего антитела.
Следует отметить, что существует целый ряд других нуклеотидных последовательностей, таких как кодирующие последовательности и генетические элементы, в которых желательно не допустить мутации функционального мутанта белка AID для сохранения целостности системы. Такие нуклеотидные последовательности, рассмотренные в настоящем описании, включают, но, не ограничиваясь ими, (i) селектируемые маркеры, (ii) гены-репортеры, (iii) генетические регуляторные сигналы, (iv) ферменты или дополнительные факторы, используемые для усиления, регуляции или измерения SHM (например, AID или функциональный мутант AID, факторы транскрипции и MSH2), (v) компоненты сигнальной трансдукции (например, киназы, рецепторы, факторы транскрипции) и (vi) домены и субдомены белков (например, сигналы ядерной локализации, трансмембранные домены, каталитические домены, домены белок-белкового взаимодействия и другие консервативные фрагменты, домены и субдомены семейства белков).
В зависимости от характера представляющего интерес генного продукта и количества информации о представляющем интерес генном продукте специалист в данной области может испробовать любую комбинацию следующих методов до или одновременно с осуществлением способа по настоящему изобретению для получения представляющего интерес генного продукта с требуемым свойством.
1. Отсутствие оптимизации SHM. Несмотря на то, что может быть желательно увеличить число горячих точек в последовательности нуклеиновой кислоты, кодирующей представляющий интерес генный продукт, следует отметить, что в любой немодифицированной последовательности нуклеиновой кислоты происходит определенное число соматических гипермутаций (SHM), поэтому такие последовательности могут быть использованы при осуществлении способа по настоящему изобретению без оптимизации или каких-либо специальных сведений о действительной последовательности. Кроме того, определенные белки (например, антитела) в природных условиях включают последовательности нуклеиновых кислот, в которых имеется приемлемый кодон, поэтому такие белки не требуют модификации кодона. Альтернативно, может быть желательно увеличить число холодных точек в последовательности нуклеиновой кислоты, кодирующей представляющий интерес генный продукт (например, остовные области антител или их фрагментов).
2. Глобальная оптимизация горячих точек SHM. В некоторых случаях может быть увеличено число горячих точек в последовательности нуклеиновой кислоты, кодирующей генный продукт, как подробно описано в публикации патентной заявки США 09/0075378 и публикации международной патентной заявки WO 08/103475. Данный подход может быть применен ко всей кодирующей области последовательности нуклеиновой кислоты, в результате чего вся последовательность нуклеиновой кислоты становится более чувствительной к SHM. Указанный подход может быть предпочтительным при наличии недостаточной информации об активности структуры генного продукта или между родственными изотипами.
3. Избирательная модификация горячих точек SHM. Альтернативно, последовательность нуклеиновой кислоты, кодирующая представляющий интерес белок, может быть избирательно и/или системно модифицирована в результате целенаправленной замены представляющих интерес областей синтетическими вариабельными областями, описанными в публикации патентной заявки США 09/0075378 и публикации международной патентной заявки WO 08/103475, что обеспечивает высокую плотность горячих точек и вызывает максимальное разнообразие SHM в определенных локусах.
Специалисту в данной области будет понятно на основе вышеизложенного, что любые или все указанные выше подходы могут быть осуществлены вместе со способом по настоящему изобретению. Однако методы глобальной оптимизации горячих точек SHM и избирательной модификации горячих точек SHM, по-видимому, вызывают более быструю и более эффективную оптимизацию функции белка.
Созданная SHM-оптимизированная последовательность нуклеиновой кислоты, кодирующая представляющий интерес генный продукт, может быть синтезирована стандартными методами и секвенирована для подтверждения правильности синтеза. После подтверждения правильности последовательности нуклеиновой кислоты указанная последовательность нуклеиновой кислоты может быть введена в вектор по настоящему изобретению, затем вектор может быть введен в клетку-хозяина методом, рассмотренным в настоящем описании. В вектор могут быть введены энхансеры (например, энхансеры Ig) для повышения экспрессии и/или направленного воздействия SHM, инициированного функциональным мутантом белка AID в отношении последовательности нуклеиновой кислоты, кодирующей представляющий интерес генный продукт.
В соответствии со способом по настоящему изобретению любые векторы, рассмотренные в настоящем описании, могут быть котрансфицированы в клетку-хозяина вместе с отдельным вектором, содержащим последовательность нуклеиновой кислоты, кодирующую функциональный мутант AID по настоящему изобретению. В одном объекте изобретения векторы по настоящему изобретению могут быть трансфицированы в клетку-хозяина, содержащую (и экспрессирующую) белок эндогенной AID. В другом объекте изобретения векторы по настоящему изобретению могут быть котрансфицированы в клетку-хозяина, содержащую белок эндогенной AID, вместе с отдельным вектором, содержащим последовательность нуклеиновой кислоты функционального мутанта AID, в результате чего функциональный мутант AID сверхэкспрессирован в клетке. В другом объекте изобретения векторы по настоящему изобретению могут быть модифицированы с возможностью включения последовательности нуклеиновой кислоты, кодирующей функциональный мутант AID, для трансфекции в клетку-хозяина, которая содержит или не содержит белок эндогенной AID. В предпочтительном варианте осуществления изобретения функциональный мутант AID является синтетической AID, кодированной последовательностью нуклеиновой кислоты, устойчивой к SHM.
Экспрессионный вектор после введения в него одной или нескольких нуклеиновых кислот может быть амплифицирован, очищен, введен в клетку-хозяина стандартными методами трансфекции и исследован стандартными методами молекулярной биологии. Очищенную плазмидную ДНК можно ввести в клетку-хозяина при помощи стандартных методов трансфекции/трансформации, затем полученные трансформанты/трансфектанты выращивают в соответствующей среде, содержащей антибиотики, селектируемые агенты и/или сигналы активации/трансактивации (например, индуцибельные агенты, такие как доксициклин) для экспрессии последовательности нуклеиновой кислоты, кодирующей представляющий интерес генный продукт.
Способ по настоящему изобретению может дополнительно включать введение в клетку или популяцию клеток одного или нескольких следующих элементов: (i) по меньшей мере, одной последовательности нуклеиновой кислоты, которая была полностью или частично изменена из соответствующей последовательности нуклеиновой кислоты дикого типа с целью положительного влияния на частоту SHM данной последовательности нуклеиновой кислоты, или последовательности нуклеиновой кислоты, содержавшей от природы большое процентное значение горячих точек до любой модификации, и/или (ii) последовательности нуклеиновой кислоты, которая была полностью или частично изменена с целью отрицательного влияния на частоту SHM.
В соответствии с одним объектом изобретения способ по настоящему изобретению может дополнительно включать введение в клетку или популяцию клеток одной или нескольких последовательностей нуклеиновых кислот, которые были изменены из соответствующей последовательности нуклеиновой кислоты дикого типа с целью отрицательного влияния на частоту SHM. Последовательность нуклеиновой кислоты может кодировать, например, один или несколько факторов для SHM (например, AID, Pol eta, UDG), один или несколько селектируемых маркерных генов или один или несколько генов-репортеров.
В соответствии с другим объектом изобретения способ по настоящему изобретению может дополнительно включать введение в клетку или популяцию клеток одной или нескольких последовательностей нуклеиновых кислот, которые были полностью или частично изменены из соответствующей последовательности нуклеиновой кислоты дикого типа с целью положительного влияния на частоту SHM. Последовательность нуклеиновой кислоты может кодировать, например, фермент, рецептор, фактор транскрипции, структурный белок, токсин, кофактор или представляющий интерес специфический связывающий белок.
В соответствии с другим объектом изобретения способ по настоящему изобретению может дополнительно включать введение в клетку или популяцию клеток последовательности нуклеиновой кислоты, имеющей от природы высокую частоту SHM, например, последовательности нуклеиновой кислоты, кодирующей тяжелую или легкую цепь иммуноглобулина или гипервариабельный участок гена антитела.
Клетка или популяция клеток, используемая в способе по настоящему изобретению, может дополнительно включать один или несколько следующих дополнительных элементов: (i) индуцибельную систему, регулирующую экспрессию AID, гомолога AID или функционального мутанта AID по настоящему изобретению, (ii) один или несколько энхансеров Ig, (iii) один или несколько Е-блоков, (iv) один или несколько дополнительных факторов для SHM, (v) один или несколько факторов устойчивой экспрессии в эписоме, такой как EBNA1, EBP2 или ori-P, (vi) один или несколько селектируемых маркерных генов, (vii) один или несколько вторичных векторов, содержащих ген для AID, гомолога AID или функционального мутанта AID по настоящему изобретению, или (viii) комбинацию указанных элементов.
В соответствии с другим объектом изобретения указанный способ включает экспрессию двух последовательностей нуклеиновых кислот, каждая из которых кодирует представляющий интерес генный продукт, в котором обе последовательности нуклеиновых кислот расположены рядом с промотором и одновременно экспрессированы в одной клетке. Промотор может быть двунаправленным промотором, таким как двунаправленный промотор CMV. В другом варианте осуществления изобретения две представляющие интерес последовательности нуклеиновых кислот расположены перед двумя однонаправленными промоторами. Два указанных промотора могут быть одинаковыми или различными промоторами. Две представляющие интерес последовательности нуклеиновых кислот могут находиться в одном векторе или в разных векторах.
Клетка или популяция клеток конститутивно экспрессирует или может экспрессировать функциональный мутант белка AID по настоящему изобретению. Экспрессия функционального мутанта белка AID вызывает мутацию в последовательности нуклеиновой кислоты, кодирующей генный продукт. Клетка или популяцию клеток может также экспрессировать другие факторы, усиливающие AID-опосредованную мутацию последовательности нуклеиновой кислоты. В результате осуществления способа по настоящему изобретению достигается постоянная вариабельность последовательности нуклеиновой кислоты, кодирующей представляющий интерес генный продукт. По истечении соответствующего периода времени (например, 2-10 делений клетки) полученные клетки-хозяева, содержащие варианты представляющего интерес генного продукта, могут быть исследованы, при этом улучшенные мутанты могут быть идентифицированы и выделены из популяции клеток. Клетки могут быть итеративно выращены, исследованы и отобраны методами, рассмотренными в настоящем описании, с целью избирательного обогащения клеток, экспрессирующих последовательность нуклеиновой кислоты, кодирующую представляющий интерес генный продукт, обладающий требуемым свойством. В данной области известны приемлемые методы анализа и обогащения (например, сортировка клеток с возбуждением флуоресценции (FACS), аффинное разделение, анализ ферментной активности, токсичности, связывания с рецептором, стимулирования роста и т.д.) и описаны, например, в публикации патентной заявки США 09/0075378 и публикациях международных патентных заявок WO 08/103475 и WO 08/103474.
В одном варианте осуществления изобретения последовательность нуклеиновой кислоты, кодирующая представляющий интерес генный продукт, может быть создана с отображением представляющего интерес генного продукта на поверхности клетки. Белок, отображенный на поверхности клетки, может быть получен в результате создания химерной молекулы представляющего интерес белка, связанного в рамке считывания с соответствующим трансмембранным белком. В случае экспрессии в клетке млекопитающего может быть использован трансмембранный домен МНС типа 1, например, из Н2kk (включая перитрансмембранный домен, трансмембранный домен и цитоплазматический домен; номер доступа гена NCBI AK153419). Аналогичным образом в данной области хорошо известна поверхностная экспрессия белков в прокариотических клетках (таких как E. coli и Staphylococcus), клетках насекомых и дрожжах (см., например, публикации (Winter et al., Annu. Rev. Immunol, 12:433-55 (1994); Priickthun A. Bio/Technology, 9:545-551 (1991); Gunneriusson et al., J. Bacteriol, 78:1341-1346 (1996); Ghiasi et al., Virology, 185:187-194 (1991); Boder and Wittrup, Nat. Biotechnol, 15:553-557 (1997); и Mazor et al., Nat. Biotechnol, 25(5):563-565 (2007)).
Отображаемые на поверхности антитела или белки могут быть получены в результате секреции и последующего связывания (или ассоциации) секретированного белка на поверхности клетки. Конъюгация антитела или белка с клеточной мембраной может происходить во время синтеза белка или после секреции белка из клетки. Конъюгация может происходить при помощи ковалентной связи, связывающего взаимодействия (например, опосредованного специальными связывающими элементами) или комбинации ковалентной и нековалентной связи. Белки также могут быть связаны с клеткой в результате создания белка, слитого с антителом или связывающим белком, который включает первый специальный связывающий элемент, специфически связывающийся с представляющей интерес мишенью, слитой со вторым связывающим элементом, обеспечивающим отображение на поверхности клетки (например, в случае связывания белка А и Fc-домена: белок А экспрессирован на поверхности клетки и связан с секретированным антителом (или с представляющим интерес белком, экспрессированным в виде белка, слитого с Fc-доменом)).
В некоторых случаях может быть желательно превратить отображенный на поверхности белок в белок, который может быть отсоединен от клетки для дальнейшего исследования. Такое превращение может быть достигнуто при использовании специального линкера, который может быть отщеплен в результате инкубации с селективной протеазой, такой как фактор Х, тромбин или любой другой селективный протеолитический агент. Можно также использовать последовательности нуклеиновых кислот, делающие возможной генетическую манипуляцию кодированным белком в векторе (то есть позволяют удалять сигнал присоединения к поверхности из рамки считывания белка). Такая генетическая манипуляция может быть осуществлена с помощью системы рекомбинации. Термин ”система рекомбинации” в использованном в данном описании значении означает систему, которая делает возможной рекомбинацию между вектором и хромосомой с целью введения представляющего интерес гена. Системы рекомбинации известны в данной области и включают, например, системы Cre/Lox и системы FLP-IN (см., например, публикацию Abremski et al., Cell, 32:1301-1311 (1983) и патенты США 4959317, 5654182 и 5677177). Системы рекомбинации, например, обеспечивают введение одного или нескольких сайтов рестрикции, элементов cre/lox или других элементов рекомбинации, которые делают возможным избирательное удаление сигнала присоединения и последующее накопление (или секрецию) представляющего интерес белка внутри клетки. Другие примеры включают введение фланкирующих сайтов loxP вокруг сигнала присоединения (такого как трансмембранный домен), что делает возможной эффективную экспрессию представляющего интерес белка на поверхности клетки. Однако в случае экспрессии cre рекомбиназы в клетке рекомбинация происходит между сайтами LoxP, что вызывает потерю сигнала присоединения и, таким образом, высвобождение или удаление представляющего интерес белка.
Представляющий интерес генный продукт, полученный способом по настоящему изобретению, может быть исследован в отношении наличия требуемого свойства (например, избирательный или улучшенный фенотип) с помощью различных стандартных физиологических, фармакологических и биохимических методов. Такие методы включают, например, биохимические анализы, в частности, анализы связывания, анализы флуоресцентной поляризации, анализы растворимости, анализы складчатости, анализы термостойкости, анализы протеолитической стабильности и анализ ферментной активности (см. публикации Glickman et al., Biomolecular Screening, 7(1):3-10 (2002); Salazar et al., Methods Mol. Biol., 230:85-97 (2003)), а также целый ряд клеточных анализов, включающих анализы сигнальной трансдукции, подвижности, связывания целых клеток, проточной цитометрии и сортировки клеток с возбуждением флуоресценции (FACS). Когда генный продукт является антителом или его фрагментом, фенотип/функцию антитела или его фрагмента можно далее исследовать с помощью анализов, известных в данной области (например, твердофазного иммуноферментного анализа (ELISA), иммуноферментного спот-анализа (ELISPOT), гелевого обнаружения и флуоресцентного обнаружения мутированных цепей IgH, анализа Скатчарда, анализа BIACOR, вестерн-блоттинга, электрофореза в полиакриламидной геле (PAGE), радиоиммуноанализов и т.д., которые позволяют определить аффинность связывания, авидность связывания и т.д.).
Клетки, экспрессирующие представляющий интерес белок, кодируемый синтетической или полусинтетической библиотекой по настоящему изобретению, могут быть обогащены при помощи любых известных в данной области анализов, которые включают, но, не ограничиваясь ими, методы связывания пептидов с микрочастицами.
Многие системы для анализа FACS и высокопроизводительные исследовательские системы коммерчески доступны (см., например, компании Zymark Corp., Hopkinton, Mass.; Air Technical Industries, Mentor, Ohio; Beckman Instruments Inc., Fullerton, Calif,; Precision Systems, Inc., Natick, Mass.), которые позволяют выполнять указанные анализы в высокопроизводительном режиме. В указанных системах все процессы обычно автоматизированы, включая пипетирование всех образцов и реагентов, инкубацию с дозированием жидкости в течение определенного периода времени и конечное считывание микропланшета в детекторе, соответствующем данному анализу. Указанные конфигурируемые системы обеспечивают высокую производительность, быстрый пуск и высокую степень гибкости и адаптации. Производители таких систем предоставляют подробные инструкции для разных высокопроизводительных систем. Так, например, компания Zymark Corp. предоставляет технические бюллетени с описанием систем скрининга, предназначенных для обнаружения модуляции транскрипции гена, связывания с лигандом и тому подобное. Примеры анализов, которые могут быть использованы при осуществлении способа по настоящему изобретению, описаны в публикации патентной заявки США 09/0075378 и публикациях международных патентных заявок WO 08/103475 и WO 08/103474.
После получения представляющий интерес популяции клеток можно сохранить представляющие интерес последовательности нуклеиновых кислот, а также секвенировать и идентифицировать соответствующие мутации. Например, полную мРНК или внехромосомную плазмидную ДНК можно амплифицировать путем коэкспрессии с Т-клеточным антигеном SV40 (J. Virol., 62(10):3738-3746 (1988) и/или экстрагировать из клеток и использовать в качестве матрицы для полимеразной цепной реакции (ПЦР) или ПЦР с обратной транскриптазой (RT)-ПЦР для клонирования модифицированной последовательности нуклеиновой кислоты с использованием соответствующих праймеров. Мутантные последовательности нуклеиновых кислот могут быть субклонированы в вектор и экспрессированы в E. coli. К карбоксильному концу может быть добавлена метка (например, метка His-6) для облегчения очистки белка с помощью хроматографии. Полученные данные могут быть использованы для внесения в базу данных, связывающую специфические замены аминокислот с изменениями одного или нескольких требуемых свойств. Такие базы данных затем могут быть использованы для рекомбинации благоприятных мутаций или для создания библиотеки полинуклеотидов следующего поколения с целенаправленной вариабельностью во вновь идентифицированных представляющих интерес областях, например, последовательностях нуклеиновых кислот, кодирующих функциональную часть белка.
Когда представляющий интерес генный продукт является антителом или его фрагментом, ДНК может быть экстрагирована при помощи ПЦР с использованием смысловых праймеров, специфичных к вариабельной области тяжелой цепи (VН) лидерной последовательности и/или вариабельной области легкой цепи (VL) лидерной последовательности и антисмысловых праймеров, специфичных к изотипу. Альтернативно, полную РНК можно выделить из выбранных популяций сортированных клеток при помощи RT-ПЦР, используя смысловые праймеры, специфичные к вариабельной области тяжелой цепи (VН) лидерной последовательности и/или вариабельной области легкой цепи (VL) лидерной последовательности, и антисмысловые праймеры, специфичные к изотипу. Клоны могут быть секвенированы стандартными методами, и полученные последовательности могут быть подвергнуты анализу в отношении частоты инсерций и делеций нуклеотидов, ревизии рецепторов и выбора V-гена.
Затем клетки могут быть снова выращены, вновь подвергнуты SHM и исследованы на протяжении нескольких циклов с достижением итеративных улучшений требуемой функции. В любой момент времени последовательность нуклеиновой кислоты, кодирующая представляющий интерес генный продукт, может быть сохранена и/или секвенирована для контроля продолжающегося мутагенеза.
Настоящее изобретение дополнительно относится к способу мутирования организма с достижением требуемого фенотипа, который включает экспрессию или экспрессию в результате индукции функционального мутанта белка AID в указанном организме, при этом экспрессия функционального мутанта белка AID вызывает мутацию в хромосомной ДНК организма. Указанный организм желательно является прокариотическим организмом (например, бактериями) или эукариотическим организмом. Эукариотический организм может быть беспозвоночным или позвоночным, но предпочтительно является позвоночным. Более предпочтительно такой организм представляет собой млекопитающее. Еще предпочтительнее такой организм представляет собой мышь.
В описанном выше способе мутирования организма могут быть использованы векторы по настоящему изобретению, включающие последовательность нуклеиновой кислоты, кодирующую функциональный мутант белка AID. Такие векторы могут быть использованы для создания мышей, трансгенных в отношении функционального мутанта белка AID, стандартными методами, известными в данной области (см., например, публикацию Methods Mol. Med., 99:255-67 (2004)). В одном варианте осуществления изобретения вектор, включающий нуклеиновую кислоту, кодирующую функциональный мутант белка AID, может быть использован для создания трансгенной мыши, у которой не разрушен ген эндогенной AID. В другом варианте осуществления изобретения вектор, включающий нуклеиновую кислоту, кодирующую функциональный мутант белка AID, может быть использован для создания трансгенной мыши, у которой последовательность нуклеиновой кислоты, кодирующая функциональный мутант AID, введена в локус эндогенной (то есть хромосомной) AID с целью получения мыши с ”вставленным” геном, предотвращающим экспрессию эндогенной AID. В определенных вариантах осуществления изобретения трансгенная мышь содержит функциональный мутант белка AID, экспрессию которого можно регулировать, например, тканеспецифическими промоторами или другими индуцибельными промоторами (например, доксициклином или тетрациклином (см., например, публикацию Curr. Opin. Biotechnol., 13(5):448-52 (2002)). В другом варианте осуществления изобретения указанный организм включает, по меньшей мере, одну последовательность нуклеиновой кислоты, которую кодон-оптимизировали в отношении SHM с целью увеличения числа мотивов SHM описанными выше способами.
Независимо от способа, используемого для создания трансгенной мыши, экспрессия функционального мутанта белка AID вызывает мутацию в хромосомной ДНК мыши. После возникновения мутагенеза в организме, вызванного способом по настоящему изобретению, клетку или клетки данного организма предпочтительно отбирают и/или исследуют в отношении требуемого фенотипа методами, известными в данной области и рассмотренными в настоящем описании.
Способы по настоящему изобретению могут быть также использованы для создания трансгенного животного, продуцирующего антитело против представляющего интерес антигена или его эпитопа. В соответствии с одним объектом изобретения способы по настоящему изобретению предпочтительно используют для создания трансгенной мыши, продуцирующей моноклональные антитела. Методы получения моноклональных антител известны в данной области и описаны, например, в публикациях Kohler and Milstein, Eur. J. Immunol., 5:511-519 (1976), Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988), и C.A. Janeway et al., (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)).
Требуемое антитело может быть любым природным или синтетическим антителом, рассмотренным в настоящем описании, или любым его антигенсвязывающим фрагментом. Кроме того, антитело может быть антителом, отличным от человеческого, гуманизированным антителом или полностью человеческим антителом. Антитело предпочтительно является гуманизированным антителом. ”Гуманизированные” формы антител, отличных от человеческих, (например, мышиных) антител являются химерными антителами, содержащими минимальную последовательность, выделенную из иммуноглобулина, отличного от человеческого. В большинстве случаев гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в котором остатки гипервариабельного участка реципиента заменены остатками гипервариабельного участка вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат кроме человека, обладающими требуемой специфичностью, аффинностью и потенциалом. В некоторых случаях остатки остовной области (FR) человеческого иммуноглобулина заменены остатками, отличными от человеческих. Кроме того, гуманизированные антитела могут включать остатки, отсутствующие в реципиентном антителе или в донорском антителе. Указанные модификации могут быть произведены для дальнейшего улучшения характеристик антитела. Гуманизированное антитело может включать по существу все или, по меньшей мере, один и в некоторых случаях два вариабельных домена, в которых все или по существу все гипервариабельные участки соответствуют гипервариабельным участкам иммуноглобулина, отличного от человеческого, и все или по существу все остовные области являются остовными областями последовательности человеческого иммуноглобулина. Гуманизированное антитело может также необязательно включать, по меньшей мере, часть константной области (Fc) иммуноглобулина, обычно константную область человеческого иммуноглобулина. Более подробно указанные антитела описаны в публикациях Jones et al., Nature, 321:522-525 (1986), Reichmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992). В другом варианте осуществления изобретения моноклональное антитело может быть гуманизировано путем введения CDR-областей мыши в остов человеческого антитела, что не оказывает существенного влияния на способность антитела связываться с антигеном. Методы получения гуманизированных антител хорошо известны в данной области и могут быть легко использованы для антител, полученных способами по настоящему изобретению.
В предпочтительном варианте осуществления изобретения гуманизированные или полностью человеческие антитела получают, используя трансгенных мышей, включающих функциональный мутант белка AID, которые были скрещены с трансгенным видом мышей, у которых экспрессия гена эндогенного антитела мыши подавлена и эффективно заменена экспрессией гена человеческого антитела. Примеры трансгенных мышей, у которых гены эндогенного антитела эффективно заменены генами человеческого антитела, включают, но, не ограничиваясь ими, HuMAb-Mouse®, Kirin TC Mouse TM и KM-Mouse® (см., например, публикации Lonberg N., Nat. Biotechnol., 23(9):1117-25 (2005) и Lonberg N., Handb. Exp. Pharmacol., 181:69-97 (2008)).
Приведенные ниже примеры иллюстрируют изобретение, но не ограничивают объем настоящего изобретения.
Пример 1
В данном примере описан способ скрининга активных мутаторов ДНК при помощи анализа образования папилл.
Анализы образования папилл использовали для скрининга мутантов E. coli, у которых отсутствует репарация ДНК (Nghiem et al., Proc. Natl. Acad. Sci. USA, 85:2709-17 (1988) и Ruiz et al., J. Bacteriol., 175:4985-89 (1993)).
Для выполнения анализов образования папилл кДНК AID/APOBEC в плазмиде pTrc9944 трансформировали в штамм Escherichia coli K12 CC102 ara∆(lacproB)XIII, содержащий эписому F' lacI Z proAB+, в которой ген lacZ несет миссенс-мутацию GAG→GGG в кодоне 461 (Cupples et al., Proc. Natl. Acad. Sci. USA, 86:5345-49 (1989)), и высевали на лактозный агар МасКонки (BD Biosciences), содержащий ампициллин (100 мкг/мл) и изопропил-β-D-1-тиогалактопиранозид (IPTG; 1 мМ). Чашки инкубировали при 37°С в течение 4 дней, при этом папиллы становились видимыми через 3 дня.
Частоту реверсии трансформантов СС102 [pTrc99-AID/APOBEC] в Lac+ определяли, выращивая культуры в течение ночи до насыщения в среде LB, содержащей ампициллин (100 мкг/мл) и IPTG (1 мМ) на М9+0,2% лактозного агара. Частоту мутаций измеряли, определяя среднее число колониеобразующих клеток после отбора из 107 жизнеспособных клеток, при этом каждое среднее значение определяли для 12 независимых культур. Мутации идентифицировали, секвенированием ПЦР-амплифицированных частей lacZ (5'-AGAATTCCTGAAGTTCAGATGT (SEQ ID NO:79) и 5'-GGAATTCGAAACCGCCAAGAC (SEQ ID NO:80)).
Клетки E. coli, содержащие миссенс-мутацию в lacZ, образуют белые колонии на чашках с лактозой МасКонки; внутри таких белых колоний часто можно различить небольшое число красных микроколоний (папиллы; обычно 0-2 в колонии), которые отображают спонтанно возникающие ревертанты Lac+. Бактериальные клоны-мутаторы, характеризующиеся более высокой частотой спонтанной мутации, можно идентифицировать по увеличенному числу папилл.
Штамм E. Coli СС102 несет миссенс-мутацию в кодоне 461 lacZ в результате замены глутамата глицином благодаря переходу мутации А:Т в G:C (Cupples et al., Proc. Natl. Acad. Sci. USA, 86:5345-49 (1989)). Если экспрессия AID в СС102 была вызвана для увеличения скорости деаминирования цитозина в кодоне 461, можно ожидать увеличения частоты ревертантов Lac+. AID-экспрессирующие трансформанты СС102 привели к увеличению частоты образования папилл на чашках с лактозой МасКонки (фиг.1а, b). Число папилл в колонии, как проанализировано после инкубации в течение 6 дней, увеличилось в колонии с 0-2 до 8-10, что соответствует трехкратному увеличению частоты ревертантов Lac+ в культурах, выращенных в течение ночи на чашках с минимальной лактозной средой. Анализ последовательностей шести таких ревертантов Lac+ подтвердил, что они действительно возникли в результате реверсии в кодоне 461. AID-родственные деаминазы APOBEC1 (A1) и APOBEC3G (A3G) также запускали повышенное образование папилл при экспрессии в клетках СС102 (фиг.1b).
Данный анализ также использовали для определения возможности выделения активных мутаторов изо всей библиотеки кДНК селезенки. Библиотеку кДНК селезенки человека вводили в клетки СС102 и исследовали пятьдесят тысяч колоний в отношении более сильного образования папилл. Было идентифицировано тридцать шесть возможных кандидатов, которых повторно исследовали, производя посев штрихом на чашки с лактозой МасКонки. Только в двух колониях было подтверждено более сильное образование папилл. Анализ последовательности показал, что указанные папиллы содержали кДНК, выделенную из APOBEC3G. На фиг.1с показана непроцессированная мРНК APOBEC3G дикого типа и две кДНК APOBEC3G, полученные в результате скрининга библиотеки кДНК селезенки человека, в которых нуклеотидные остатки пронумерованы от начала открытой рамки считывания (+1).
Данный пример показывает, что анализ образования папилл в E. Coli может быть использован в качестве высокопроизводительного метода скрининга активных мутаторов.
Пример 2
В данном примере описан анализ для идентификации мутантов AID.
Библиотеки мутантов AID человека первого и второго поколения создавали при помощи подверженной ошибкам ПЦР с использованием Taq-полимеразы (2,5 ед.; Bioline) на 1 нг матричной ДНК с 1 мкМ прямых и обратных праймеров (5'-ATGGAATTCATGGACAGCCTCTTG (SEQ ID NO:81); 5'-CTGAAGCTTTCAAAGTCCCAAAGTA (SEQ ID NO:82)), 250 мкМ dNTP, 10 мМ MgCl2 в буфере Taq при 94°С (2 мин) с последующим проведением 30 циклов при 94°С (30 сек), 65°С (30 сек) и 72°С (1 мин). Библиотеки мутантов AID человека третьего поколения создавали при помощи набора для неспецифического мутагенеза Genemorph II (Stratagene) на 0,1 мг матричной ДНК в соответствии с инструкциями производителя.
Анализы образования папилл выполняли так же, как в примере 1, за исключением того, что чашки инкубировали при 37°С в течение 3-6 дней, при этом папиллы становились видимыми через 3 дня и их число увеличивалось до 7-го дня. Для анализа индуцируемой арабинозой экспрессии цитидиндеаминазу (AID) экспрессировали в плазмиде pBAD30 (Guzman et al., J. Bacteriol., 177:4121-30 (1995)).
Частоту реверсии трансформантов СС102 [pTrc99-AID] в Lac+ определяли, как описано в примере 1, при этом мутацию в устойчивость к рифампицину (Riff) оценивали после трансформации в штамм E. Coli KL16 (Hfr(PO-45) relAI spoT1 thi-1) и роста колонии в присутствии рифампицина (50 мкг/мл) и арабинозы (0%-0,5%). Частоту мутаций измеряли, как описано в примере 1, и мутации идентифицировали путем секвенирования ПЦР-амплифицированных фрагментов lacZ, как описано в примере 1, или ПЦР-амплифицированных фрагментов rpoB (5'-TTGGCGAAATGGCGGAAAACC-3' (SEQ ID NO:83) и 5'-CACCGACGGATACCACCTGCTG-3' (SEQ ID NO:84)).
Результаты, представленные на фиг.1d и фиг.2, показывают, что данный анализ позволяет идентифицировать позитивные мутанты AID. В общей сложности, шестьдесят тысяч колоний из четырех независимых экспериментов по осуществлению мутагенеза с помощью ПЦР позволили получить 13 клонов, которые характеризовались повышенным образованием папилл на чашках с лактозой МакКонки. Девять из указанных мутантов затем исследовали в повторно трансфицированном штамме E. Coli KL16 в отношении частоты образования устойчивых к рифампицину колоний, при этом все девять мутантов характеризовались более высокой частотой мутации в локусе rpoB.
кДНК AID из двух позитивных мутантов первого поколения, то есть Mut1 и Mut7, затем подвергали мутагенезу с помощью ПЦР, при этом были получены мутанты второго поколения, характеризовавшиеся повышенным образованием папилл (фиг.2). Более высокое образование папилл, характерное для указанных мутантов второго поколения, затрудняло визуальное определение дополнительного увеличения папилл. Для исследования дальнейшего усиления активности мутаторов в третьем цикле мутации/отбора кДНК, кодирующие Mut1.1 и Mut7.3 AID, клонировали в индуцируемом арабинозой экспрессионном векторе с возможностью регулирования числа папилл, полученных в трансформантах СС102, путем изменения концентрации арабинозы в среде (фиг.1е). Третье поколение позитивных мутантов AID получали в результате скрининга папилл при низкой концентрации (0,02%) арабинозы, при этом некоторые из указанных мутантов характеризовались частотой мутаций, которая почти в 400 раз была выше, чем у AID дикого типа при определении на основании частоты мутаций в устойчивость к рифампицину (фиг.2).
На фиг.2 показаны позитивные мутанты AID, отобранные путем скрининга образования папилл. Позитивные мутанты, полученные в трех последовательных циклах мутагенеза, сгруппировывали вместе с мутантами, полученными в отдельных экспериментах по мутагенезу методом ПЦР, в виде семейств сибсов. Дополнительные замены аминокислот, произведенные в каждом цикле мутагенеза, обозначали цифрами под указанными заменами, показывающими среднюю частоту мутации в Riff относительно вектора. Символ * означает усечение С-конца, вызванное введением предраннего терминирующего кодона в положение указанного кодона. Отдельные мутанты пронумерованы в соответствии с их династическим происхождением: так, например, Mut7 (K10E/E156G) является предшественником Mut7.1 (K10E/E156G/F115Y).
Несколько мутантов третьего поколения были токсичными в E. Coli, о чем свидетельствует меньший размер колонии, выращенной в условиях индуцируемой токсичности; данный процесс сопровождался меньшим числом жизнеспособных клеток в бактериальных культурах, выращенных до насыщения. Полученный результат представлен на фиг.1f, где показаны бактериальные титры в трансформантах СС102, экспрессирующие разные позитивные мутанты AID, выращенные до насыщения в среде LB/Amp в условиях индукции IPTG, по сравнению с титрами, полученными в культурах, выращенных при отсутствии индукции. Указанная токсичность может быть причиной возникновения некоторых мутантов с высоким образованием папилл, характеризующихся аномально низкой частотой мутаций в Riff (например, Mut7.3.4; фиг.2) и, по-видимому, пониженной экспрессией AID в культуре, выращенной в течение ночи.
Данный пример показывает, что анализ образования папилл в E. Coli может быть использован для идентификации функциональных мутантов белков AID, которые характеризуются, по меньшей мере, 10-кратным увеличением активности по сравнению с белком AID дикого типа.
Пример 3
В данном примере показано, что анализ образования бактериальных папилл может быть использован для идентификации горячих точек для мутантов AID, обладающих более высокой активностью.
На фиг.3а показано сравнение первичной последовательности AID человека (SEQ ID NO:2), содержащей специфические мутации, сообщающие повышенную активность, с позитивными мутациями в последовательности AID иглобрюха (фугу, fugu). Мутации в остатках, отмеченных звездочками, удаляли для увеличения активности мутатора, так как указанные мутации представляют собой единственное отличие, по меньшей мере, одной пары последовательностей AID, характеризующихся более чем 2-кратной разницей частоты мутаций в rpoB. Остатки, подчеркнутые двумя линиями, обозначают сайты, в которых были идентифицированы замены в нескольких независимых позитивных мутантах, но в присутствии одной или более других замен. Рамки над обозначенными звездочкой или подчеркнутыми двумя линиями остатками или под ними отображают замены и частоту обнаружения каждой замены в девяти независимых библиотеках. Одной жирной линией подчеркнуты остатки, в которых соответствующее положение в AID фугу также, по-видимому, является местом выбранной позитивной мутации на основании того, что данная мутация является единственной мутацией, идентифицированной в позитивном мутанте фугу, или того, что данная замена была идентифицирована (наряду с другими) в нескольких позитивных мутантах фугу. В рамки заключены координирующие цинк мотивы (HVE и PCYDC (SEQ ID NO:86) и области предполагаемого контактирования полинуклеотидов (FCEDRKA (SEQ ID NO:87) (Cupples et al., Proc. Natl. Acad. Sci. USA, 86:5345-49 (1989); Conticello et al., Nat. Struct. Mol. Biol., 14:7-9 (2007); and Chen et al., Nature, 452:116-119 (2008)).
Помимо мутаций предраннего терминирующего кодона, обнаруженных в трех позитивных мутантах AID (Mut5, Mut1.3 и Mut1.5), анализ последовательностей разных позитивных мутантов AID выявил предпочтение определенных замен аминокислот. Например, в независимых экспериментах были выбраны замены К34Е, Т82I и Е156G (каждая из которых является достаточной для повышения активности AID). Указанные мутации не были обнаружены в последовательностях 48 неспецифических (то есть неотобранных) клонов из библиотек, созданных методом ПЦР, где был выявлен широкий спектр мутаций без определения основных горячих точек самого мутагенеза. Таким образом, повторная идентификация небольшого числа замен аминокислот позволяет предположить, что существует ограниченное число отдельных замен аминокислот в AID, вызывающих более высокое образование папилл.
Хотя в некоторых случаях (особенно в третьем поколении) множество мутаций, введенных в одном цикле, препятствует четкой идентификации мутаций, отвечающих за более высокое образование папилл, во многих случаях можно совершенно точно определить соответствующую позитивную мутацию, так как данная мутация представляет собой единственное различие между парой последовательностей AID, по-разному образующих папиллы, или (менее определенно) такая мутация была независимо получена при выполнении нескольких ПЦР. Расположение таких позитивных мутаций показано на фиг.3а, где видно, что, хотя некоторые мутации расположены вокруг координирующего цинк мотива рядом с каталитическим сайтом (V57A; T82I), другие мутации находятся в области, эквивалентной части APOBEC3, которая, как ранее было предположено, участвует в связывании полинуклеотидов (F115Y; K120R) (Conticello et al., Nat. Struct. Mol. Biol., 14:7-9 (2007); Chen et al., Nature, 452:116-119 (2008); и Holden et al., Nature, 456:121-124 (2008)), при этом несколько мутаций образуют кластеры в областях, функция которых не известна.
В данном примере рассмотрен способ идентификации мутантов AID, обладающих повышенной активностью.
Пример 4
В данном примере показано, что позитивные мутации, обнаруженные в анализе образования бактериальных папилл, повышают удельную активность AID.
Слитые белки GST-AID очищали от трансформантов pOPTG-AID штамма E. coli Rosetta (DE3) pLysS (вектор pOPTG предоставлен O. Perisic, Cambridge, UR). Клетки выращивали при 37°С в среде 2XTY, содержащей 100 мкг/мл ампициллина и 100 нМ ZnCl2, до достижения культурой оптической плотности, равной 0,8 при 600 нм и индуцировали 1 мМ IPTG в течение 16 часов при 18°С, затем гранулированные клетки лизировали инкубированием на льду в течение 30 минут в буфере для лизиса (20 мМ трис-буфера, рН 7,4, 100 мМ NaCl, 0,1% тритона Х-100, 5 мМ DTT, 4 мкг/мл РНКазы А и полный ингибитор протеазы без EDTA (Roche)), и обрабатывали ультразвуком. Клеточные лизаты очищали центрифугированием (95000 g; 1 час), GST-AID очищали от указанных лизатов абсорбцией на глутатион-сефарозе (Amersham Pharmacia) при 4°С в течение 5 часов и элюированием после обильной промывки буфером для лизиса, содержащим 50 мМ тритона Х100 без восстановленного глутатиона. Элюированные образцы хранили при 4°С в течение одной недели.
Содержание слитого белка GST-AID контролировали при помощи вестерн-блоттинга (фиг.3b). Первоначальный скрининг обработанных ультразвуком экстрактов большого числа позитивных мутантов не выявил мутантов, характеризующихся значительным увеличением фракции растворимого белка при определении методом вестерн-блоттинга.
Активность деаминазы полуочищенного гибрида GST-AID (100-400 нг) определяли при 37°С в 10 мкл реакционного буфера (8 мМ трис-буфера, рН 8,0, 8 мМ KCl, 10 мМ NaCl, 2,5 мМ EDTA, 0,2 мМ дитиотреитола, 5 мкг РНКазы А и 0,4 единицы урацил-ДНК-гликозилазы (NEB) с 0,5 пмоль олигодезоксирибонуклеотида (флуоресцеин-5'-ATATGAATAGAATAGAGGGGTGAGCTGGGGTGAGCTGGGGTGAG-3'-биотин (SEQ ID NO:85)). Реакции прекращали в указанные моменты времени добавлением одинакового объема заполняющего красителя (формамид, 0,5 мМ EDTA) и нагреваем при 98°С в течение 3 минут. Полученные расщепленные олигонуклеотиды подвергали электрофорезу в 10% мочевинном геле для PAGE и обнаруживали при помощи флуоресценции в приборе Typhoon Phosphoimager (Molecular Dynamics). Степень деаминирования определяли на основании сканированных изображений, показывающих объем полос расщепленного продукта в пикселях (после вычитания фона) в виде процентного значения объединенного объема продукта в пикселях и полос остаточного субстрата.
При образовании слитых белков GST из позитивных мутантов человека Mut1.1 и Nut7.3.6 было выявлено четко выраженное повышение удельной активности при определении с помощью анализов деаминирования in vitro, выполняемых на олигонуклеотидном субстрате (фиг.3b,c). При выполнении анализа начальной частоты мутаций было обнаружено, что удельная активность деаминирования указанных позитивных мутантов увеличилась в пять раз по сравнению с белком дикого типа.
Переход мутации в любой из 11 пар С:G в rpoB могут вызывать устойчивость к рифампицину (Riff). Распределение таких мутаций в колониях Riff показано для позитивных мутантов AID Mut8, 1.1, 1.2, 7.3.5 и 7.3.6 на фиг.3d. Повышенная удельная активность, по-видимому, не сопровождается каким-либо значительным изменением специфичности в отношении мишени, так как анализ мутаций rpoB, полученных с использованием нескольких мутантов AID человека, не выявил каких-либо больших различий в спектре мутаций (фиг.3d).
Данный пример показывает, что мутации, идентифицированные при выполнении анализа образования бактериальных папилл, повышают удельную активность AID.
Пример 5
В данном примере описано создание мутаций в AID иглобрюха (fugu), вызывающих увеличение активности AID.
Библиотеки, содержащие мутанты AID фугу, создавали с использованием набора для неспецифического мутагенеза Genemorph II (Stratagene) на 0,1 нг матричной ДНК в соответствии с инструкциями производителя. Скрининг бактериальных папилл в библиотеке мутантов фугу выполняли, как описано в примере 1. Частота мутаций в Riff по сравнению с трансформантами вектора при 18°С или 37°С показана на фиг.4b для штамма E. coli К16, трансформированного плазмидами, кодирующими AID дикого типа или мутированную AID фугу. Были созданы производные Mut4.3 и 4.10, в которых нонсенс-мутация в кодоне 190 была восстановлена с образованием С-конца дикого типа.
AID иглобрюха (который живет при температуре около 26°С) характеризуется незначительной активностью бактериального мутатора при выполнении анализа при 37°С, при этом активность мутатора можно обнаружить при 18°С (Conticello et al., Mol. Biol. Evol., 22:367-377 (2005)). При выполнении анализа образования бактериальных папилл были идентифицированы мутанты AID фугу, которые устойчиво образовывали папиллы при 37°С. Как показано на фиг.4а, все выделенные мутанты первого поколения содержали мутации усечения С-конца (обозначенные “*”, в то время как символы ”а” и “b” обозначают разные единичные замены нуклеотидов в кодоне 190, вызывающие образование предраннего терминирующего кодона), при этом шесть полученных мутантов содержали 5 четко выраженных мутаций усечения. Также были идентифицированы мутации, вызывающие считывание С-концевой области вне рамки считывания, которые обозначены ”Ins200a” и “Ins200b” на фиг.4а и определяют разные единичные мутации инсерции нуклеотидов в кодоне 200.
Однако разные замены аминокислот могут привести к большему образованию папилл в мутантах второго поколения (фиг.4а), при этом некоторые мутации возникли в положениях, аналогичных позитивным мутациям, идентифицированным в AID человека (фиг.3а и 4а). Таким образом, мутация (C88L), отвечающая за более высокую активность Mut1.3 AID фугу, находится в таком же положении, что и мутация Т82I в AID человека. Аналогичным образом остатки F121, L124 и L128 в AID фугу (каждый из которых является мишенью для мутации в двух или трех позитивных мутантах фугу) находятся во фрагменте AID фугу, соответствующем остаткам 115-121 в AID человека, где также были получены позитивые мутации.
Хотя усечения С-конца были обнаружены почти во всех позитивных мутантах AID человека и ранее было показано, что такие усечения вызывают более высокую активность мутатора в E. coli (Barreto et al., Mol. Cell, 12:501-508 (2003); Ta et al., Nat. Immunol., 4:843-848 (2003)), все мутанты первого поколения AID фугу, отобранные при 37°С, имели усечения С-конца. Одним правдоподобным объяснением указанного наблюдения является то, что выявленные мутации С-конца повышают термостойкость и что замены аминокислот, увеличивающие образование папилл в позитивных мутантах фугу второго поколения, не могут быть обнаружены при 37°С при отсутствии мутации усечения С-конца. Однако такое объяснение кажется вполне вероятным. Замены С88L и L128P увеличили частоту мутации в Riff при выполнении анализа при 18°С в присутствии или отсутствии усечения С-конца. Однако при выполнении анализа при 37°С указанные замены аминокислот не вызывали какого-либо заметного увеличения частоты мутаций при отсутствии усечения С-конца (фиг.4b).
Данный пример показывает, что мутации в AID иглобрюха (фугу), повышающие ее активность, аналогичны определенным мутациям, обнаруженным в AID человека.
Пример 6
В данном примере рассмотрен способ увеличения разнообразия антител в клетках с использованием функционального мутанта белка AID по настоящему изобретению.
Соматическую мутацию IgV анализировали, контролируя утрату поверхностного IgM в клетках DT40 AID-/- φV-/- sIgM+ (Teng et al., Immunity, 28:621-629 (2008)), которые были стабильно трансфицированы AID-кодирующими векторами на основе pExpressPuro2, методом проточной цитометрии. Процентное значение клеток sIgM- контролировали для каждой конструкции в 12-24 независимых трансфектантах, которые размножали при одновременном отборе (0,25 мкг/мл пуромицина) в течение 3 недель до выполнения проточной цитометрии.
Мутации в области IgVλ исследовали путем секвенирования геномной ДНК, которая была амплифицирована при помощи ПЦР из 100000 несортированных клеток или из эквивалентов (GFP+; sIgM-)-сортированных клеток (Sale et al., Nature, 412:921-926 (2001)).
Для исследования переключения класса методом проточной цитометрии анализировали экспрессию поверхностного IgG1 в В-клетках, которые выделяли у мышей AID-/- и культивировали в присутствии LPS+IL4 (48 часов) после инфицирования в течение 24 часов AID-кодирующими ретровирусами, как было описано ранее (Di Noia, J. Exp. Med., 204:3209-3219 (2007)). Для облегчения уменьшения сверхэкспрессии AID в трансдуцированных В-клетках использовали ретровирусный вектор с мутированной последовательностью Козака (McBride et al., J. Exp. Med., 205:2199-2206 (2008)). Содержание AID в экстрактах, полученных при нагревании клеток (106) в 50 мкл восстанавливающего буфера для образца с SDS, контролировали после анализа SDS/PAGE методом вестерн-блоттинга, используя антисыворотку против AID кролика (Abcam); GFP обнаруживали, используя пероксидазу из хрена (HRP), конъюгированную с антисывороткой против GFP козы (Abcam).
Мутанты 3 (Т82I), 8 (K34E, K160E) и 7.3 (К10Е, Е156G, T82I) были экспрессированы в линии куриных В-клеток DT40 с отсутствием AID, в которых соматическая мутация IgV может быть выведена из частоты образования вариантов с утратой sIgM (Arakawa et al., PLoS Biol., 2:E179 (2004)). Мутанты Mut3 и Mut7.3 характеризовались значительно более сильной соматической мутацией по результатам анализа утраты sIgM (фиг.5а). Кроме того, анализ последовательности показал, что после одного месяца клональной экспансии мутационное давление в гене IgGλ клеток, экспрессирующих указанные мутанты AID, превышало аналогичный показатель контрольных клеток, экспрессирующих фермент дикого типа (фиг.5b). Большая часть последовательностей не только имела мутации, но также отличалась более высоким мутационным давлением. Данный эффект является особенно выраженным с учетом того, что мутант AID экспрессирован в указанных трансфектантах в меньшем количестве по сравнению с AID дикого типа. В отличие от этого, в мутанте 8 отсутствовала более высокая соматическая мутация, из чего следует, что замены К34Е и/или К160Е, по-видимому, ослабляют функцию AID в В-клетках. Интересно отметить, что полипептид Мut8 был обнаружен в большем количестве в трансфектантах DT40, чем в полипептидах Mut3 или 7.3. Данный результат совместим с приведенными в другой публикации (например, Conticello et al., Mol. Cell. 31:474-484 (2008)) выводами о том, что мутанты AID, обладающие аномальной активностью в случае разнообразия антител/геномной мутации в клетках DT40, могут быть экспрессированы в большем количестве без какого-либо видимого изменения внутриклеточной локализации. Одним возможным объяснением указанных различий в уровнях экспрессии является то, что в клеточных трансфектантах происходит отбор клеток, экспрессирующих высокие уровни белков AID, являющихся активными в хромосомной мутации.
Анализ на основе ретровирусной трансдукции мутантных ферментов в В-клетки мыши с отсутствием AID использовали для исследования активности мутантов AID в рекомбинации с переключением класса. Для ограничения степени сверхэкспрессии AID, которая в противном случае могла вызвать насыщение в случае анализа переключения, данный анализ выполняли, используя стандартный вирус pMX-Ig, а также вариант, в котором трансдуцированная AID экспрессирована на более низких уровнях в результате мутации последовательности Козака (McBride et al., J. Exp. Med., 2005:2585-2594 (2008)). Как показано на фиг.5с, на которой изображены репрезентативные графики переключения на IgG1, полученные методом проточной цитометрии, где ”mK” означает трансдукцию, выполненную с использованием векторов, содержащих мутированную последовательность Козака, мутант Mut7.3 более эффективно стимулировал рекомбинацию с переключением класса по сравнению с AID дикого типа, хотя и был экспрессирован на более низких уровнях.
Данный пример демонстрирует использование функционального мутанта белка AID для увеличения разнообразия антител способом по настоящему изобретению.
Пример 7
В данном примере показано, что мутанты AID увеличивают хромосомные транслокации.
Анализ на основе ПЦР (Janz et al., Proc. Natl. Acad. Sci. USA., 90:7361-7365 (1993)) использовали для обнаружения транслокаций с-myc/IgH в В-клетках. В-клетки, полученные у мышей с отсутствием AID, трансдуцировали AID-экспрессирующим ретровирусом и культивировали в среде, содержащей LPS (20 мкг/мл) и IL4 (50 нг/мл), аналогично анализам переключения класса, описанным в примере 6, высевая 8×105 клеток/мл на 6-луночные планшеты. Геномную ДНК из 2×105 клеток, полученных при помощи набора для ПЦР DirectPCR (Viatech) из сортированных клеток GFP+ после трансдукции в течение 36 часов, подвергали двум циклам вложенной ПЦР в системе Expand Long Template PCR (Roche) с последующим выполнением саузерн-блоттинга для амплификации и обнаружения транслокаций der12 c-myc/Igµ и der15 c-myc/Igµ и специфических продуктов (Ramiro et al., Nature, 440:105-109 (2006)). На фиг.6 (вверху) изображена схема реципрокной транслокации между локусами с-myc и IgH, на которой указаны праймеры, использованные для амплификации с помощью ПЦР (стрелки), и зонды (Р), использованные для гибридизации методом саузерн-блоттинга.
В-клетки, полученные у мышей с отсутствием AID, трансдуцировали ретровирусом для экспрессии AID и культивировали в течение 1-2 дней in vitro. Мутант AID Mut7.3 вызвал образование значительно большего числа культур, содержащих транслокации c-myc/IgH, по сравнению с ферментом дикого типа (фиг.6 (внизу)).
Данный пример демонстрирует способ увеличения хромосомных транслокаций с использованием функционального мутанта белка AID.
Пример 8
В данном примере показано, что последовательности нуклеиновых кислот, кодирующие мутанты AID с более высокой активностью, ближе к последовательностям нуклеиновых кислот деаминаз APOBEC3, чем AID дикого типа.
Был выполнен сравнительный анализ на языке LOGO в Web (Crooks et al., Genome Research, 14:1188-1190 (2004)) (фиг.7), результаты которого свидетельствуют о сохранении аминокислот вокруг основных сайтов позитивной мутации AID и гомологичных областей в доменах Z1, Z2 и Z3 APOBEC3 млекопитающих (корова, овца, свинья, собака, пекари, лошадь, кошка, мышь, крыса, человек и макак: номера доступа последовательностей указаны на фиг.8). Любую последовательность, в которой более 90% аминокислот были идентичны любой другой последовательности, не использовали для создания профилей на языке LOGO. Позитивные мутации AID показаны в рамке над нумерованными остатками. Стрелками под сравниваемыми последовательностями отмечены гомологичные остатки в APOBEC3.
На фиг.7 показано, что белки семейства АРОВЕС3 быстро образуются и присутствуют во многих копиях у высших животных: их координирующие цинк домены могут быть отнесены по гомологии последовательностей к одной из трех подгрупп (Z1, Z2 и Z3) (Conticello et al., Mol. Biol. Evol., 22:367-377 (2005)). Сравнительный анализ последовательностей AID с последовательностями АРОВЕС3 показал, что большинство часто отбираемых позитивных мутаций в AID человека служили для сближения последовательности AID с родственными последовательностями АРОВЕС3 (фиг.7). Действительно, когда позитивная мутация AID в положении F115 заменяет аминокислоту, предпочтительную в соответствующем положении в доменах Z2 (Y) АРОВЕС3, позитивные мутации в положениях К34, Т82 и Е156 заменяют предпочтительную аминокислоту в соответствующем положении в доменах Z1 АРОВЕС3. Интересно отметить, что именно домены Z1 были признаны каталитически наиболее активными доменами АРОВЕС3 (LaRue et al., J. Virol., 83:494-497 (2009)). Таким образом, несмотря на то, что деаминирование активности AID может быть искусственно увеличено с помощью специфических позитивных мутаций, такие позитивные мутации могут быть отобраны во время образования AID, но не во время образования АРОВЕС3.
Данный пример показывает, что последовательности нуклеиновых кислот, кодирующие мутанты AID с повышенной активностью, ближе к последовательностям нуклеиновых кислот деаминаз АРОВЕС3, чем к AID дикого типа.
Пример 9
В данном примере произведено сравнение позитивных мутаций AID человека (SEQ ID NO:2) и иглобрюха (фугу) (SEQ ID NO:13).
Первичные последовательности AID человека и фугу сравнивали, используя программу ClustalW2 (см., например, публикацию Larkin et al., Bioinformatics, 23:2947-2948 (2007)) (фиг.9). Позитивные мутации AID человека отмечены звездочкой или двойным подчеркиванием, как показано в примере 3 (фиг.3а). Позитивные мутации AID фугу отмечены символом (”^”) и были идентифицированы благодаря тому, что являются единственной мутацией в позитивном мутанте фугу, либо благодаря тому, что указанный остаток мутировал в несколько позитивных мутантов фугу. Характер замен указан в рамках, расположенных выше или ниже выделенных остатков на фиг.3а. Координирующие цинк мотивы (HVE, PCYDC) и области предполагаемого контактирования олигонуклеотидов (FCEDRKA) указаны в рамках.
В данном примере выполнено сравнение позитивных мутаций AID человека и иглобрюха (фугу).
Пример 10
В данном примере описан способ создания функционального мутанта AID, который включает замену аминокислотной последовательности белка AID дикого типа соответствующей аминокислотной последовательностью гомолога AID.
Мутанты AID человека, в которых аминокислотные остатки 115-123 заменены эквивалентными областями из APOBEC3C (AID/3C), APOBEС3F (AID/3F) и APOBEC3G (AID/3G), клонировали в бактериальной экспрессирующей плазмиде. Активность мутатора указанных модифицированных последовательностей AID анализировали, контролируя частоту образования колоний, устойчивых к рифампицину, после трансформации в E. coli. В частности, штамм KL16 E. coli [Hfr (PO-45) relA1 spoT1 thi-1], трансформированный плазмидами pTrc99/AID, выращивали в течение ночи до насыщения в среде LB, содержащей ампициллин (100 мкг мл-1) и изопропил-β-D-1-тиогалактопиранозид (IPTG; 1 мМ), и высевали на слабосоленый агар с LB, содержащий ампициллин (100 мкг/мл-1) и рифампицин (50 мкг/мл-1). Частоту мутаций измеряли, определяя среднее число выживших колониеобразующих клеток на 107 культивируемых жизнеспособных клеток в 12 независимых культурах. Мутации идентифицировали путем секвенирования соответствующего фрагмента rpoB (обычно в 25-200 отдельных колоний) после амплификации при помощи ПЦР с использованием олигонуклеотидов 5'-TTGGCGAAATGGCGGAAAACC (SEQ ID NO:88) и 5'-CACCGACGGATACCACCTGCTG-3' (SEQ ID NO:89). В то время как белки AID/3C и AID/3F сохраняли хорошую активность мутатора, AID/3G образовывал устойчивые к рифампицину колонии с частотой, соответствующей фоновой. Устойчивость к рифампицину сообщается одной из ограниченного числа мутаций в rpoB, при этом характер полученных мутаций позволяет определить специфичность деаминазы в отношении мишени (Harris et al., Mol. Cеll., 10:1247-1253 (2002)). AID дикого типа предпочтительно деаминирует остатки С в положении rpoB 1576 (C1576), который имеет 5'-фланкирующий остаток пурина (G). В отличие от этого, варианты AID, в которых остатки 115-123 были заменены соответствующими областями из APOBEC3C/F/G, предпочтительно деаминировали пиримидины в -1 положении (аналогично самим АРОВЕС3). Таким образом, AID/3C и AID/3F характеризовались сдвигом в спектре мутаций rpoB в отношении мишеней с 5'-Т (С1535, С1565 и С1592), в то время как трансформанты AID/3G направленно воздействовали только на С1691 с 5'-C.
Результаты, полученные в данном примере, показывают, что замена аминокислотных остатков 115-123 AID человека соответствующими последовательностями из белков АРОВЕС3 изменяет удельную активность AID.
Пример 11
В данном примере описан способ создания функционального мутанта AID, который включает замену аминокислотной последовательности белка AID дикого типа соответствующей аминокислотной последовательностью гомолога AID.
Хотя в примере 10 показано, что активность мутатора AID/3G является достаточной для сдвига в распределении мутаций rpoB, наблюдаемого в устойчивом к рифампицину штамме E. coli, активность мутатора мутанта AID/3G является значительно ниже, чем у AID дикого типа, так как в данном случае не достигается полная частота мутации в устойчивость к рифампицину выше фоновой. Для повышения активности мутатора мутанта AID/3G создавали два позитивных мутанта AIF/3G (AID1/3G и AID2/3G), в которых в указанных белках были произведены три дополнительные замены аминокислот (то есть AID1: K10E, T82I, E156G; AID2: K34E, E156G, R157T). Оба указанных позитивных мутанта AID/3G сохранили присущее исходному белку AIG/3G предпочтение в отношении 5'-фланкирующего остатка С, определенного спектром мутаций rpoB.
Также создавали варианты AID (обозначенные AID*, AID*/3F, AID1*/3G и т.д.), в которых была удалена С-концевая часть AID (которая включает последовательность экскреции из ядра). Усечение С-конца не оказывает обнаруживаемого влияния на предпочтение в отношении мишени мутанта AID при выполнении анализов бактериальной мутации.
Для более глубокого анализа биохимической специфичности к мишени вышеуказанных мутантов AID разные ферменты AID частично очищали от экстрактов E. coli в виде рекомбинантных белков, слитых с GST, и использовали для деаминирования одноцепочечной ДНК-мишени lacZ, выполняя анализ дуплекса с разрывом М13 (Bebenek and Kunkel, Methods Enzymol., 262:217-232 (1995); Pham et al., Nature, 424:103-107 (2003)). При выполнении данного анализа рекомбинантный гибрид GST-AID инкубировали с ДНК lacZ, включающего дуплекс с разрывом М13, которую затем трансформировали в E. coli.
При выполнении анализа 30-50 мутированных клонов lacZ с М13 в каждом эксперименте получали базы данных, состоящие из 471-685 мутаций, которые были транзициями в парах С:G. В случае AID1 74% мутаций остатка С произошло в сайтах, франкированных 5'-пурином. В отличие от этого, мутанты AID, несущие трансплантированные фрагменты из белков АРОВЕС3, характеризовались сдвигом в сторону предпочтения фланкирующего пиримидина, что было особенно заметно в случае белков AID/3C и AID/3G (соответственно 85% и 77% пиримидина). Указанное изменение в отношении предпочтения фланкирующего нуклеотида сопровождалось изменением распределения мутаций в lacZ. С учетом такого положения дел для большинства вариантов AID мутированные последовательности содержали в среднем 10-16 транзиций в анализируемом фрагменте из 475 нуклеотидов одноцепочечного субстрата, при этом выявленные мутации отражали главным образом присущее им предпочтение в отношении процесса мутации без значительного отклонения в результате отбора клеток, характеризующихся инактивацией lacZ.
Результаты, полученные в данном примере, показывают, что замена аминокислотных остатков 115-123 AID человека соответствующими последовательностями из белков АРОВЕС3 изменяет удельную активность AID.
Пример 12
В данном примере показано, что мутанты белков AID характеризуются измененным спектром мутаций в В-клетках.
Чтобы установить, приводит ли изменение каталитической специфичности AID к изменению распределения замен нуклеотидов, выполненных во время SHM в В-клетках, мутанты AID, описанные в примерах 10 и 11, экспрессировали в линии куриных В-клеток DТ40 с отсутствием AID и удаленным ψV. В линии В-клеток DT40 мутации в значительной степени ограничены заменами нуклеотидов в парах С:G с возможностью гипермутации, запускаемой полимеразой η (Arakawa et al., PLoS Biol., 2:E179 (2004); Di Noia and Neuberger, Nature, 419:43-48 (2002); Sale et al., Nature, 412:921-926 (2001)), из чего следует, что мутации в парах С:G в значительной степени могут быть связаны с прямым воздействием AID и скорее не являются следствием второй фазы мутации. Частота SHM в IgV может быть связана с частотой образованием вариантов с отсутствием sIgM (Buerstedde et al., EMBO J., 9:921-927 (1990); Sale et al., Nature, 412:921-926 (2001)). Данный анализ показывает, что SHM возможна как в AID/3C, так и в AID/3F. Действительно, AID/3C даже оказывает боле сильное воздействие, чем фермент дикого типа, особенно с учетом более низкого содержания полипептида AID/3C в экстрактах В-клеток. Низкое содержание AID/3C было выявлено во многих независимых трансфектантах. Причиной такой низкой экспрессии может быть цитотоксичность активности избыточной ДНК-деаминазы.
В отличие от мутантов AID/3C и AID/3F мутант AID1/3G характеризовался очень низкой частотой вариантов с утратой sIgM. Однако указанная частота была значительно увеличена в результате удаления С-концевой части AID.
Для исследования спектра гипермутаций гена IgV в трансфектантах В-клеток DT40, экспрессирующих разные модифицированные белки AID, сегмент IgVλ из нескольких независимых трансфектантов для каждой экспрессируемой конструкции амплифицировали при помощи ПЦР и секвенировали после клональной экспансии в течение восьми недель. Результаты показали, что модификации активного центра AID вызвали значительное изменение спектра мутаций. Так, AID/3C и AID1*/3G в значительной степени направленно воздействовали на остатки С с 5'-фланкирующим остатком пиримидина (соответственно 68% и 75%) в отличие от фермента дикого типа, в котором только 19% мутаций направленно воздействовали на остатки С с 5'-фланкирующим пиримидином. Такое значительное изменение спектра мутаций хорошо видно в совокупности данных, а также в каждом из указанных независимых клонов. В отличие от этого, AID/3F сохранил способность исходного фермента предпочтительно воздействовать на фланкирующий остаток пурина, но, как обнаружено при выполнении анализа in vitro с использованием субстрата lacZ, включающего дуплекс с разрывом (пример 11), происходит сдвиг в сторону предпочтительного воздействия на фланкирующий гуанин, а не на аденин.
Изменение мутационного воздействия в зависимости от характера 5'-фланкирующего нуклеотида в значительной степени соответствует измененному спектру мутаций, определенному на основании распределения замен нуклеотидов во фрагменте IgVλ. Так, например, горячие точки мутаций IgVλ были обнаружены в положениях, отличающихся от положений, выявленных при сравнении AID дикого типа с AID1*/3G. В AID дикого типа (а также в позитивном мутанте AID1) кластеры горячих точек были обнаружены в CDR1, в направлении 5'-стороны CDR2, а также в CDR3, при этом указанные горячие точки соответствовали в основном консенсусной последовательности WRC, как было отмечено ранее (Arakawa et al., PLoS Biol., 2:E179 (2004); Sale et al., Nature, 412:921-926 (2001); Saribasak et al., J. Immunol., 176:365-371 (2006); Wang et al., Nat. Struct. Mol. Biol., 16:769-76 (2009)). В отличие от этого, мутации IgVλ, полученные с использованием AID1*/3G, характеризовались меньшим образованием кластеров в CDR1 и CDR3 при наличии большого числа горячих точек в положении 5'-фланкирующего пиримидина и в областях (FR1 и FR3), на которые относительно редко воздействует фермент дикого типа.
Результаты, полученные в данном примере, показывают, что изменение активного центра AID изменяет спектр мутаций, полученный в результате деаминирования ДНК in vitro или гипермутации антитела в трансфектантах В-клеток.
Пример 13
В данном примере описана идентификация ”горячих точек” мутантов AID.
Несмотря на то, что модификации активного центра в AID/3C и AID1*/3G вызывали сдвиг предпочтительного воздействия с 5'-фланкирующего пурина в сторону 5'-фланкирующего пиримидина при выполнении анализов мутации как in vivo (IgVλ клеток DT40), так и in vitro (lacZ, включающий дуплекс с разрывом), характер указанного сдвига является различным в двух указанных анализах. Так, при выполнении анализа in vitro фланкирующий остаток С является предпочтительным для AID/3G, хотя Т является выбранным фланкирующим пиримидином в спектре мутаций IgVλ клеток DT40. Такое расхождение в основном связано с эффектом удаления нескольких основных горячих точек в спектре IgVλ клеток DT40, из чего следует, что некоторая гипермутация в В-клетках может вызвать создание доминантных горячих точек, которые не рекапитулируют в анализе дуплекса с разрывом in vitro.
Для подтверждения данного вывода анализ мутаций в дуплексе с разрывом выполняли в отношении последовательности-мишени IgVλ (а не lacZ), и спектр мутаций, полученный in vitro, сравнивали со спектром мутаций, наблюдаемым в такой же цепи (нетранскрибированной) ДНК IgVλ в В-клетках DT40. Были отмечены значительные отличия мутационного воздействия. Указанные отличия были аналогичным образом отмечены в сильно мутированных последовательностях, выделенных из базы данных, использованной для удаления паттернов мутационного воздействия in vitro.
Чтобы выяснить, действительно ли различия в направленном воздействии отражают тот факт, что мутация in vivo возникает в процессе транскрипции двухцепочечной ДНК, в то время как в анализе дуплекса с разрывом использована одноцепочечная ДНК-мишень, выполняли анализ мутационного воздействия, описанный в публикации Bransteitter et al., J. Biol. CVhem., 279:51612-21 (2004). Указанный анализ мутационного воздействия включает инкубацию рекомбинантной AID с двухцепочечной ДНК при одновременной транскрипции гена-мишени (lacZ) в субстрате из связанного промотора полимеразы Т7. При выполнении данного анализа AID1*/3G действительно отличалась от AID дикого типа, предпочитая воздействовать на 5'-пиримидин, особенно на 5'-С, а не на 5'-Т, как было отмечено в В-клетках DT40. Для оценки мутационного воздействия в субстрате IgVλ при выполнении анализа in vitro в сочетании с транскрипцией Т7-связанный анализ модифицировали для создания субстрата, в котором неотобранные мутации в коротких сегментах IgVλ можно было оценивать в клонах, которые испытывали мутационную инактивацию близко связанного гена-репортера CFP. Однако при выполнении таких анализов было обнаружено, что так же, как в анализе дуплекса с разрывом, отсутствовало относительное преобладание основных горячих точек в положениях IgVλ 141 (AID дикого типа) и 252 (AID1*/3G), которое наблюдалось во время гипермутации в клетках DT40. Действительно, мутационное воздействие в анализе, объединенном с транскрипцией, по-видимому, в большей степени подобно воздействию, наблюдаемому в анализе дуплекса с разрывом, чем паттерну мутационного воздействия, происходящего в В-клетках DT40. Таким образом, при выполнении анализа in vitro не был полностью воспроизведен паттерн преобладания горячих точек IgV, наблюдаемый в В-клетках.
Результаты, полученные в данном примере, показывают, что В-клетки, экспрессирующие белки модифицированной AID, характеризуются измененным использованием горячих точек.
Пример 14
В данном примере описан эффект переноса мутации Mut7.3 в AID собаки и AID человека.
Действие AID в клетках НЕК293-с18 измеряли путем секвенирования совместно экспрессируемой матрицы антитела. Клетки котрансфицировали тремя эписомными векторами, содержащими однозначные селектируемые маркеры, из которых один экспрессировал тяжелую цепь антитела с выбором пуромицина, второй экспрессировал легкую цепь антитела с выбором гигромицина и третий экспрессировал AID с выбором бластицидина. После трансфекции клетки постоянно культивировали с пуромицином и гигромицином и дифференцированно обрабатывали бластицидином. Для клеток, ”периодически стимулируемых” AID, бластицидин в культуру не добавляли и временную трансфекцию вектора AID повторяли каждую неделю. Для клеток, ”постоянно стимулируемых” AID, в культуральную среду добавляли бластицидин, и ”постоянно+периодически стимулируемые” клетки культивировали с бластицидином дополнительно к еженедельной трансфекции вектором AID. Три разных мутанта AID исследовали в следующих экспериментах: AID собаки (“MutE”), AID собаки, содержащая Mut7.3 (“Mut7.3 E”), и AID человека, содержащая Mut7.3 (“7.3 человека”) (SEQ ID NO:88-93 и фиг.10а и 10b), и две разные векторные конструкции испытывали в отношении экспрессии AID (то есть вектор IRES и вектор pEpi). В векторе IRES экспрессию AID и бластицидина контролировали с помощью одного промотора, содержащего элемент IRES между генами. В векторах pЕpi экспрессию бластицидина контролировали с помощью отдельного промотора.
После культивирования в течение примерно одного месяца вариабельные области тяжелой цепи выделяли при помощи ПЦР для секвенирования. Для каждого отдельного эксперимента по трансфекции клеток секвенировали девяносто четыре матрицы, при этом в каждом эксперименте было возвращено в среднем 88 полных последовательностей. Хроматограммы секвенирования исследовали для проверки качества наблюдаемых мутаций и частоту мутаций вычисляли путем деления числа мутаций на общее число секвенированных нуклеотидов с последующим делением на число дней культивирования. Время удвоения клеток НЕК293-с18 равно примерно 24 часам, поэтому число дней культивирования использовали для нормализации частоты мутаций в одном поколении.
Не было выявлено существенного различия в частоте мутаций в периодически стимулируемых, постоянно стимулируемых или постоянно+периодически стимулируемых группах для каждого вектора AID. Кроме того, не было обнаружено осуществленного различия между векторами IRES и pEpi для AID MutE и между Mut7.3E и 7.3 человека. Однако различие в частоте мутаций для Mut7.3E в векторе pEpi было статистически значимым (р=0,0003) по сравнению с Mut7.3E в векторе IRES.
Данный пример показывает, что Mut7.3 может быть транслирована в AID собаки и AID человека.
Все материалы, включая публикации, патентные заявки и патенты, приведенные в настоящем изобретении, включены в настоящее описание посредством ссылки, как если бы каждый материал был указан отдельно и полностью представлен в настоящем описании.
Термины, использованные при описании настоящего изобретения (особенно в контексте нижеследующей формулы изобретения), включают как единственную, так и множественную форму за исключением особо оговоренных случаев или случаев, противоречащих контексту изобретения. Термины ”включающий”, “имеющий” и “содержащий” следует рассматривать как открытые термины (то есть означающие “включающий, но не ограниченный”), если не указано иное. Указание диапазонов значений в настоящем описании изобретения является кратким способом обозначения каждого отдельного значения, входящего в указанный диапазон, если не указано иное, при этом каждое отдельное значение входит в описание изобретения, как если бы оно было указано отдельно. Все способы, рассмотренные в настоящем описании, могут быть осуществлены в любом приемлемом порядке за исключением особо оговоренных случаев и случаев, противоречащих контексту изобретения. Использование всех примеров или пояснительных выражений (например, ”такой как”) в настоящем описании служит для лучшей иллюстрации изобретения и не ограничивает объем изобретения, если не указано иное. В тексте настоящего описания отсутствует упоминание элементов, важных для осуществления изобретения, но не являющихся предметом притязания.
В настоящем описании рассмотрены предпочтительные варианты осуществления изобретения, включая лучший способ осуществления изобретения, известный авторам настоящего изобретения. При ознакомлении с приведенным выше описанием изобретения специалистам в данной области могут стать очевидными модификации предпочтительных вариантов осуществления изобретения. Авторы настоящего изобретения предполагают возможность использования таких модификаций и осуществления изобретения другими способами, не рассмотренными в настоящем описании. Таким образом, в объем настоящего изобретения входят все модификации и эквиваленты предмета изобретения, представленного в прилагаемой формуле изобретения в соответствии с действующим законом. Кроме того, в объем настоящего изобретения входит любая комбинация указанных выше элементов во всех возможных вариантах за исключением случаев, указанных в настоящем описании изобретения или каким-либо образом противоречащих контексту изобретения.
Реферат
Настоящее изобретение относится к функциональным мутантам белка индуцируемой активацией цитидиндеаминазы (AID), которые обладают более высокой активностью по сравнению с белком AID дикого типа. Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим функциональные мутанты AID, к векторам и клеткам, включающим указанные нуклеиновые кислоты. Настоящее изобретение далее относится к способам применения функциональных мутантов белка AID. 9 н. и 30 з.п. ф-лы, 11 ил., 14 пр.
Формула
(a) по меньшей мере, одной аминокислотной заменой в остатке 10 и, по меньшей мере, одной аминокислотной заменой в остатке 156;
(b) по меньшей мере, одной аминокислотной заменой в остатке 35 и, по меньшей мере, одной аминокислотной заменой в остатке 145;
(c) по меньшей мере, одной аминокислотной заменой в остатке 34 и, по меньшей мере, одной аминокислотной заменой в остатке 160;
(d) по меньшей мере, одной аминокислотной заменой в остатке 43 и, по меньшей мере, одной аминокислотной заменой в остатке 120;
(e) по меньшей мере, двумя аминокислотными заменами, где, по меньшей мере, одна аминокислотная замена имеет место в остатке 57 и, по меньшей мере, одна аминокислотная замена имеет место в остатке 81 или 145;
(f) по меньшей мере, одной аминокислотной заменой в остатке 156 и, по меньшей мере, одной аминокислотной заменой в остатке 82;
(g) по меньшей мере, одной аминокислотной заменой в остатке 156 и, по меньшей мере, одной аминокислотной заменой в остатке 34;
(h) по меньшей мере, одной аминокислотной заменой в остатке 156 и, по меньшей мере, одной аминокислотной заменой в остатке 157;
(i) по меньшей мере, одной аминокислотной заменой в остатке, выбранном из группы, состоящей из остатков 10, 82 и 156;
(j) по меньшей мере, одной аминокислотной заменой в остатке 115 и,
(k) по меньшей мере, одной аминокислотной заменой в остатке 120;
(l) аминокислотной заменой в любом из или любой комбинации из остатков 9, 13, 15, 18, 30, 36, 38, 42, 44, 53, 59, 66, 74, 77, 88, 93, 96, 100, 104, 115, 118, 132, 142, 180, 181, 183, 184, 185, 188, 192, 197 или 198.
(a) аминокислотная замена в остатке 9 представляет собой метионин (М) или лизин (K),
(b) аминокислотная замена в остатке 13 представляет собой фенилаланин (F) или триптофан (W),
(c) аминокислотная замена в остатке 38 представляет собой глицин (G) или аланин (А),
(d) аминокислотная замена в остатке 42 представляет собой изолейцин (I) или лейцин (L),
(e) аминокислотная замена в остатке 96 представляет собой глицин (G) или аланин (А),
(f) аминокислотная замена в остатке 115 представляет собой тирозин (Y) или триптофан (W),
(g) аминокислотная замена в остатке 132 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D),
(h) аминокислотная замена в остатке 180 представляет собой изолейцин (I) или аланин (А),
(i) аминокислотная замена в остатке 181 представляет собой метионин (М) или валин (V),
(j) аминокислотная замена в остатке 183 представляет собой изолейцин (I) или пролин (Р),
(k) аминокислотная замена в остатке 197 представляет собой аргинин (R) или лизин (K) и
(l) аминокислотная замена в остатке 198 представляет собой валин (V) или лейцин (L).
(a) аминокислотная замена в остатке 13 представляет собой фенилаланин (F) или триптофан (W),
(b) аминокислотная замена в остатке 34 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D),
(c) аминокислотная замена в остатке 82 представляет собой изолейцин (I) или лейцин (L),
(d) аминокислотная замена в остатке 95 представляет собой серин (S) или лейцин (L),
(e) аминокислотная замена в остатке 115 представляет собой тирозин (Y) или триптофан (W),
(f) аминокислотная замена в остатке 120 представляет собой аргинин (R) или аспарагин (N) и
(g) аминокислотная замена в остатке 145 представляет собой лейцин (L) или изолейцин (I).
(a) аминокислота в положении остатка 35 заменена глицином (G) или аланином (А);
(b) аминокислота в положении остатка 43 заменена пролином (Р);
(c) аминокислота в положении остатка 81 заменена тирозином (Y) или триптофаном (W);
(d) аминокислота в положении остатка 120 заменена аргинином (R) или аспарагином (N);
(e) аминокислота в положении остатка 145 заменена лейцином (L) или изолейцином (I);
(f) аминокислота в положении остатка 157 заменена лизином (K) или аспарагином (N) или
(g) аминокислота в положении остатка 160 заменена глутаминовой кислотой (Е) или аспарагиновой кислотой (D).
(a) аминокислотная замена в положении остатка 9 представляет собой серин (S), метионин (М) или триптофан (W),
(b) аминокислотная замена в положении остатка 10 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D),
(c) аминокислотная замена в положении остатка 15 представляет собой тирозин (Y) или лейцин (L),
(d) аминокислотная замена в положении остатка 18 представляет собой аланин (А) или лейцин (L),
(e) аминокислотная замена в положении остатка 30 представляет собой тирозин (Y) или серин (S),
(f) аминокислотная замена в положении остатка 35 представляет собой серин (S) или лизин (K),
(g) аминокислотная замена в положении остатка 36 представляет собой цистеин (С),
(h) аминокислотная замена в положении остатка 44 представляет собой аргинин (R) или лизин (K),
(i) аминокислотная замена в положении остатка 53 представляет собой тирозин (Y) или глутамин (Q),
(j) аминокислотная замена в положении остатка 59 представляет собой метионин (М) или аланин (А),
(k) аминокислотная замена в положении остатка 66 представляет собой треонин (Т) или аланин (А),
(l) аминокислотная замена в положении остатка 74 представляет собой гистидин (H) или лизин (K),
(m) аминокислотная замена в положении остатка 77 представляет собой серин (S) или лизин (K),
(n) аминокислотная замена в положении остатка 82 представляет собой изолейцин (I) или лейцин (L),
(о) аминокислотная замена в положении остатка 88 представляет собой серин (S) или треонин (Т),
(p) аминокислотная замена в положении остатка 93 представляет собой лейцин (L), аргинин (R) или лизин (K),
(q) аминокислотная замена в положении остатка 100 представляет собой глутаминовую кислоту (Е), триптофан (W) или фенилаланин (F),
(r) аминокислотная замена в положении остатка 104 представляет собой изолейцин (I) или аланин (А),
(s) аминокислотная замена в положении остатка 115 представляет собой тирозин (Y) или лейцин (L),
(t) аминокислотная замена в положении остатка 118 представляет собой глутаминовую кислоту (Е) или валин (V),
(u) аминокислотная замена в положении остатка 120 представляет собой аргинин (R) или лейцин (L),
(v) аминокислотная замена в положении остатка 142 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D),
(w) аминокислотная замена в положении остатка 145 представляет собой лейцин (L) или тирозин (Y),
(x) аминокислотная замена в положении остатка 156 представляет собой глицин (G) или аланин (А),
(y) замена аминокислоты в положении остатка 157 представляет собой глицин (G) или лизин (K),
(z) замена аминокислоты в положении остатка 160 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D),
(аа) замена аминокислоты в положении остатка 184 представляет собой аспарагин (N) или глутамин (Q),
(bb) замена аминокислоты в положении остатка 185 представляет собой глицин (G) или аспарагиновую кислоту (D),
(cc) замена аминокислоты в положении остатка 188 представляет собой глицин (G) или глутаминовую кислоту (Е),
(dd) замена аминокислоты в положении остатка 192 представляет собой треонин (Т) или серин (S).
(a) аминокислотную замену в остатке 115 и
(b) аминокислотную замену в остатке 120.

Комментарии