Способ трансфекции и трансдукции растительных клеток - RU2485180C2
Код документа: RU2485180C2
Чертежи









Описание
Настоящее изобретение относится к новым способам и композициям трансформации растений с использованием интернализуемых пептидов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Традиционные стратегии культивирования растений для получения новых линий, обладающих определенными свойствами, трудоемки и иногда дают непредсказуемые результаты. Недавно разработки методов генетической трансформации растений, а также идентификация все большего числа и доступность полезных генов и их продуктов открыли путь к быстрому выведению растений, обладающих желаемыми свойствами. Однако сохраняется потребность в совершенствовании способов. Существующие стратегии, такие как трансформация, опосредованная Agrobacterum, и бомбардировка частицами сильно зависят от типа ткани и генотипа. Интернализуемые пептиды (ИНП) - новый и быстро растущий класс коротких пептидов, которые, как известно, играют важную роль в транслокации обширного ряда переносимых комплексов, включая белки и ДНК, через биомембраны клеточных линий млекопитающих и человека (Schwartz, Zhang, 2000; Lange), 2002; Vives, 2002).
Домен белковой трансдукции (ДБТ) ТАТ ВИЧ-1 представляет собой самые изученные транслоцирующие пептиды. В недавних публикациях описан потенциал ТАТ-ДБТ и его олигомеров в переносе плазмид за счет образования комплекса с отрицательно заряженной ДНК в клетках млекопитающих (Ignatovich с соавт., 2003;
Rudolph с соавт., 2003; Siprashvili с соавт., 2003; Hellgren с соавт., 2004). Другие пептиды, которые, как показано, имеют транслоцирующие свойства, включают pVEC, транспортан, пенетратин, рер-1-пептиды и фрагменты вышеуказанных соединений.
Некоторые данные из предыдущего уровня техники, относящиеся к транслокации, опосредованной ИНП, обсуждаются ниже. В заявке на патент США 20040121325 описан способ получения рекомбинантных растений или клеток растений, где экспрессируется последовательность, кодирующая белок, который обладает ксилосилтрансферазной активностью или усиливает ее.
В заявке на патент РСТ W02005117992 описана композиция, предназначенная для контролируемого переноса какого-либо соединения в клетку-мишень. Данная композиция включает интернализуемый пептид, ингибитор интернализуемого пептида, соединение и сайт расщепления, в котором ингибитор интернализуемого пептида тормозит транслокационную активность интернализуемого пептида. Расщепление в сайте расщепляющим веществом нейтрализует торможение интернализуемого пептида, и расторможенный интернализуемый пептид приобретает способность транслоцировать какое-либо соединение в клетку-мишень. Однако в этой заявке не описана трансформация растительных клеток.
В заявке на патент США №2005/0260756 описан проникающий через мембрану комплекс, предназначенный для облегчения переноса молекулы двухцепочечной РНК в клетку. Этот комплекс включает молекулу двухцепочечной РНК и интернализуемый пептид с ковалентной связью между двухцепочечной РНК и интернализуемым пептидом. Это изложение сущности изобретения относится только в трансформации нейронов.
Unnamalai с соавт. (FEBS Letters 566 (2004) 307) описывают применение катионного олигопептида полиаргинина для переноса двухцепочечной РНК для посттранскрипционного выключения генов.
Если, как показано, ИНП облегчают доставку переносимого материала в клетки млекопитающих, применение ИНП в клетках растений при исследованиях трансфекции затруднено рядом факторов. Главное препятствие применению этой технологии у растений заключается в том, что в отличие от животных клеток, клетки растений имеют систему двойного барьера (клеточную стенку и плазматическую мембрану) на пути интернализации ИНП и переносимых ими соединений. Таким образом, для того, чтобы транслокация была эффективной, ИНП должны преодолеть эти два барьера.
С учетом постоянно накапливающейся информации из проектов секвенирования геномов растений имеется насущная необходимость в разработке быстрого, универсального (независимого от типа ткани или генотипа) способа, применимого у растений, для функциональных исследований генома различных генов и для выведения трансгенных растений, проявляющих желаемые свойства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение отвечает потребности в новых методиках переноса генов и (или) белков в клетки растений. Интернализуемые пептиды применяются для переноса нужного переносимого материала внутрь растительной клетки.
В одном аспекте настоящее изобретение относится к способу доставки переносимого материала в клетку растения. Этот способ включает воздействие на клетку растения комплексом, состоящим по крайней мере из одного переносимого соединения, связанного с носителем. Растительная клетка предпочтительно представляет собой соматическую клетку или гаметофит.
В одном предпочтительном варианте компонент-носитель является полипептидом, обладающим способностью проникать в клетку и связывать нуклеиновые кислоты. В другом предпочтительном варианте этот носитель включает сигнал ядерной локализации.
Компонент-носитель может быть выбран из группы, состоящей из tat ВИЧ-1, pVEC, транспортина, пенетратина, пептидов Рер-1 и их фрагментов. Другие носители, способные проникать в клетку, также можно использовать в способе изобретения. В предпочтительном варианте носитель состоит из домена белковой трансдукции (ДБТ) tat или его фрагмента, предпочтительно из аминокислот от 49-й до 57-й tat ВИЧ.
В одном аспекте настоящего изобретения переносимый материал является нуклеиновой кислотой. Нуклеиновая кислота может представлять собой мРНК, tmPHK, тРНК, рРНК, siPHK, shPHK, ПНК, ssPHK, dsPHK, ssДНК, dsДНК, гибриды ДНК:РНК; плазмиды, искусственные хромосомы, конструктивные элементы для генной терапии, кДНК, продукты ПЦР, рестрикционные фрагменты, рибосомы, антисмысловые последовательности или комбинации всех вышеуказанных соединений. В одном предпочтительном варианте нуклеиновой кислотой является ДНК. В другом предпочтительном варианте нуклеиновой кислотой является РНК.
В другом аспекте настоящего изобретения переносимым компонентом является полипептид. В одном предпочтительном варианте полипептид кодирует белок, который меняет метаболизм клетки. Этот белок может быть белком, связанным с эмбриогенезом, или активным доменом вышеуказанного белка. Этот белок может быть полипептидом, связанным с гомологичной рекомбинацией, или активным доменом вышеуказанного полипептида.
В другом аспекте настоящего изобретения переносимый материал также включает комбинацию дополнительного полипептида и (или) нуклеиновой кислоты.
В предпочтительном варианте настоящего изобретения соматическую растительную клетку подвергают предварительной обработке агентом, пермеабилизирующим клетку, для облегчения интернализации комплекса. Предпочтительным пермеабилизирующим агентом является толуол.
Помимо способов, являющихся предметом настоящего изобретения, изобретение также включает комплекс, обеспечивающий транспорт активного вещества в растительную клетку. Этот комплекс включает переносимый материал, связанный с компонентом-носителем, где компонент-носитель может переносить комплекс в растительную клетку.
В предпочтительных вариантах переносимый компонент является нуклеиновой кислотой, а компонент-носитель включает сигнал ядерной локализации. В другом варианте этот комплекс включает гибридный белок, состоящий из переносимого материала и компонента-носителя. Может быть включен маркерный белок для отслеживания интернализации данного комплекса. В данный комплекс могут быть включены различные другие типы белков, такие как белок, ассоциированный с интеграцией, направляемой сайтом, или эмбриогенный белок или активный домен вышеуказанных соединений.
В другом предпочтительном варианте данный способ включает добавление трансфицируюшего агента, такого как липофектамин.
Настоящее изобретение также включает семена трансгенных растений и изолированные растительные клетки, полученные с помощью способов и конструктивных элементов, являющих предметом настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Эти и другие детали настоящего изобретения будут более понятными из следующего описания, где приведены ссылки на приложенные фигуры:
ФИГ.1 иллюстрирует эффект пермеабилизации в отношении транслокации комплекса, меченого флуоресцеином, согласно одному из вариантов настоящего изобретения;
ФИГ.2 демонстрирует поглощение Tat микроспорами;
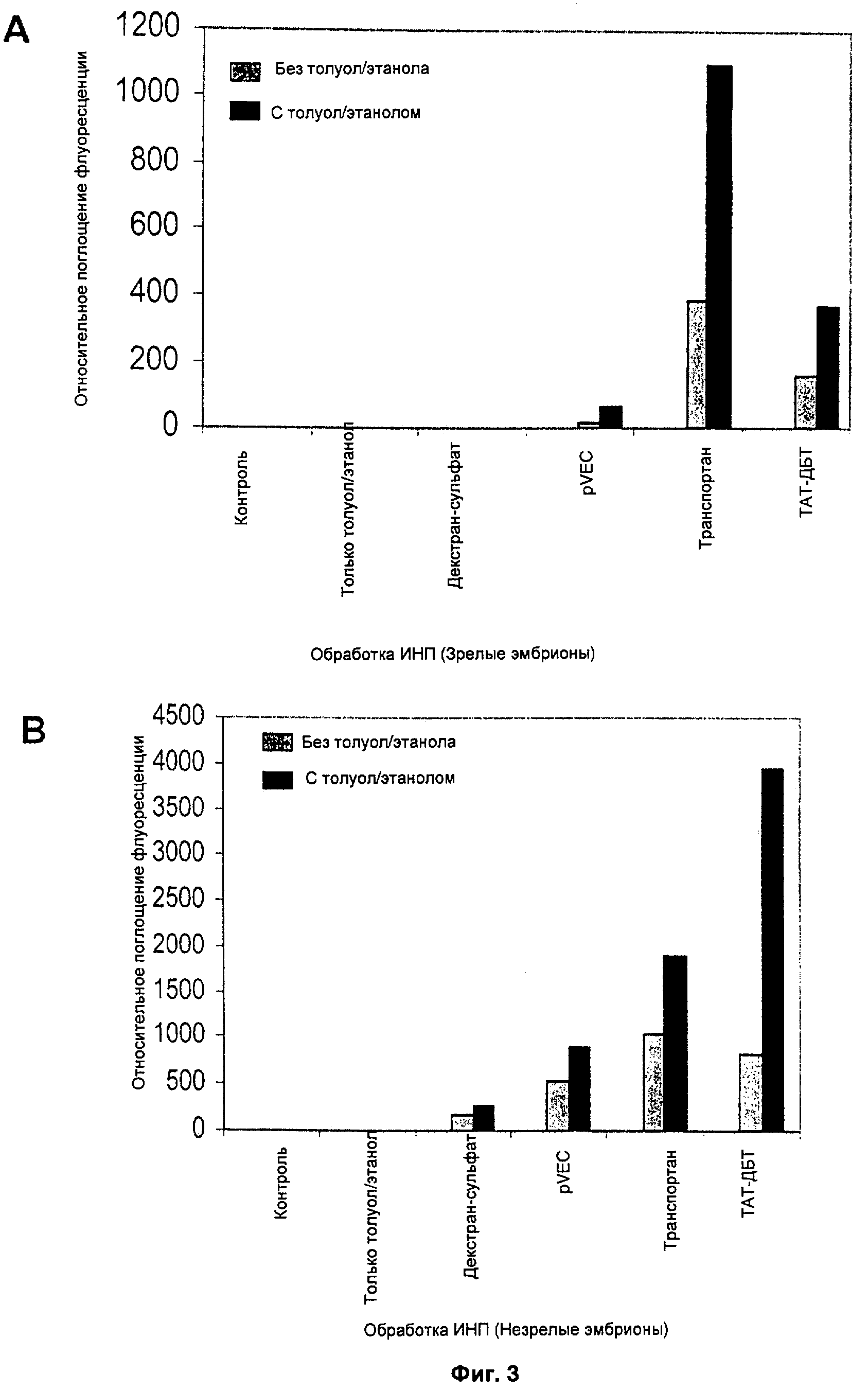
ФИГ.3 демонстрирует эффективность различных ИНП в пермеабилизованных зародышах;
ФИГ.4 иллюстрирует поглощение комплекса Tat-GUS в пермеабилизованных зародышах;
ФИГ.5 иллюстрирует поглощение комплекса Tat2-GUS в пермеабилизованных зародышах;
ФИГ.6 иллюстрирует поглощение комплекса Pep-1-GUS в пермеабилизованных зародышах;
ФИГ.7 иллюстрирует поглощение комплекса Pep-1-GUS микроспорами;
ФИГ.8 демонстрирует экспрессию гена gus в пермеабилизованных зародышах;
ФИГ.9 демонстрирует растения, полученные из микроспор, обработанных комплексом Tat-ДНК; и
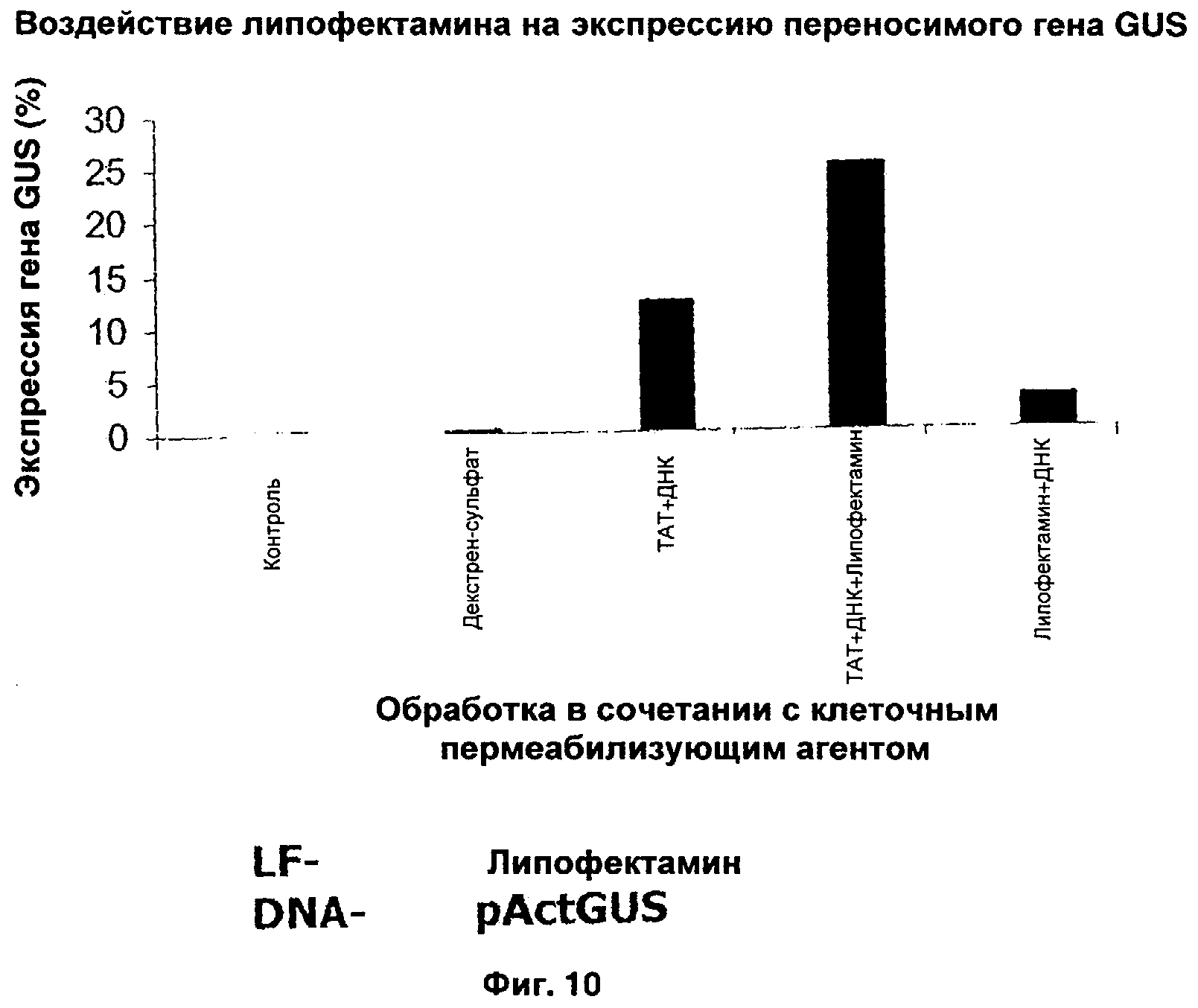
ФИГ.10 иллюстрирует влияние липофектамина на экспрессию гена gus;
ФИГ.11А демонстрирует влияние обработки ИНП и ДНК различными соединениями;
ФИГ.11В демонстрирует эффект различных комбинаций ДНК и RecA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перенос инородных нуклеиновых кислот или полипептидов через клеточные входные барьеры растительной клетки является трудной задачей. Шансы на успех можно повысить благодаря обработке растительных тканей клеточными пермеабилизирующими агентами, такими как толуол (Mahalakshmi с соавт., 2000); однако частота трансформации остается низкой.
Настоящее изобретение относится к новому способу доставки переносимого материала в растительные клетки. Этот переносимый материал может быть молекулой нуклеиновой кислоты, которая должна экспрессироваться в клетке-мишени, или он может быть полипептидом. Этот переносимый материал может включать маркер для отслеживания переноса в растительные клетки.
В способах настоящего изобретения переносимый материал связан с интернализуемым пептидом (ИНП), также именуемым в данном тексте как «носитель» или «компонент-носитель». Этот носитель связан с переносимым материалом в единый комплекс, и он переносит переносимый материал в клетку.
Вкратце, получают комплекс, включающий компонент-носитель и переносимый материал. Компонент-носитель представляет собой агент, способный проникать через мембрану растительной клетки и (или) клеточную стенку.
Предпочтительными носителями для применения в настоящем изобретении являются интернализуемые пептиды (ИНП). ИНП, используемые в способах и комплексах настоящего изобретения, включают, но не ограничиваются tat ВИЧ, pVEC, транспортан, пенетратин, Рер-1 и фрагментами всех вышеуказанных соединений.
Переносимый материал может быть нуклеиновой кислотой или полипептидом. Примеры нуклеиновых кислот, которые могут быть связаны с носителем, включают мРНК, tmPHK, тРНК, рРНК, siPHK, shPHK, ПНК, ssPHK, dsPHK, ssДНК, dsДНК, гибриды ДНК:РНК; плазмиды, искусственные хромосомы, конструктивные элементы для генной терапии, кДНК, продукты ПЦР, рестрикционные фрагменты, рибосомы, антисмысловые последовательности или комбинации всех вышеуказанных соединений. В одном предпочтительном варианте нуклеиновой кислотой является ДНК. В другом предпочтительном варианте нуклеиновой кислотой является РНК. Примеры полипептидов, которые могут быть связаны с носителем, включают любой белок или его полипептидный фрагмент. Например, белок может быть агентом, который изменяет фенотип растения или растительной клетки. Это может быть белок, который обеспечивает устойчивость к некоторым вредителям или гербицидам. Полипептид также может нести информацию о белке, который меняет метаболизм клетки, такой как белок, связанный с эмбриогенезом, или белок, участвующий в интеграции, направляемой сайтом.
Комплекс носитель - переносимый материал, являющийся предметом настоящего изобретения, может быть образован различными путями за счет ковалентной связи и (или) электростатического взаимодействия. Также этот комплекс может быть получен из комбинации ИНП и переносимых материалов, например, ДНК, покрытой RecA, связанного в комплекс с Рер-1.
В предпочтительном варианте настоящего изобретения клетки сначала обрабатывают пермеабилизирующим агентом. Переноса с поразительно высокой частотой можно добиться с помощью комбинированных методик с использованием ИНП. Пермеабилизация приводит к образованию временных пор в плазматической мембране, облегчающих транслокацию ИНП в отдельности или в виде комплекса носитель - переносимый материал за счет устранения ограничения размеров, обусловленных клеточной стенкой и мембраной. Однако следует четко понимать, что предварительная обработка пермеабилизирующим агентом требуется не у всех типов растительных клеток. Например, микроспоры можно успешно трансформировать с помощью комплексов носитель - переносимый материал без этапа предварительной пермеабилизации.
Для облегчения транслокации комплекса носитель - переносимый материал можно использовать различные типы пермеабилизирующих агентов. Показано, что особенно эффективен пермеабилизирующий раствор, включающий толуол и этанол.
Результаты нескольких типовых экспериментов представлены на приложенных фигурах, где демонстрируется эффективность способов и композиций настоящего изобретения.
Что касается Фиг.1, то на ней представлена серия микрофотографий, демонстрирующих эффект пермеабилизации. Транслокация ТАТ-ИНП, меченого флуоресцеином, в незрелые зародыши Triticale cv AC Alta визуализирована с помощью флуоресцентной микроскопии. Результаты демонстрируют, что в контрольных зародышах, инкубированных только в пермеабилизирующем буфере А, и зародышах, обработанных пермеабилизирующим буфером с толуолом (В), флуоресценция отсутствует. Зародыши, обработанные только декстран-сульфатом с меченым изотиоцианатом флуоресцеина (ИТЦФ) (С) не проявляют сколько-либо значимого поглощения меченого декстран-сульфата. С другой стороны, в зародышах, обработанных декстран-сульфатом с меченым ИТЦФ в присутствии клеточного пермеабилизирующего агента (D), выявлена некоторая флуоресценция, как и в зародышах, обработанных только ТАТ-ИНП, меченых флуоресцеином (Е). Однако самое значимое поглощение выявлено в зародышах, обработанных ТАТ-ИНП, меченых флуоресцеином, в присутствии клеточного пермеабилизирующего агента. Это демонстрирует высокую эффективность транспорта в условиях, когда пермеабилизацию клетки сочетают с интернализуемым пептидом, таким как ТАТ-ИНП. Результаты, показанные на Фиг.1, демонстрируют, что пермеабилизация незрелых зародышей способствует эффективной транслокации интернализуемых пептидов.
Однако пермеабилизация не является необходимой во всех типах клеток. Фиг.2 иллюстрирует поглощение Tat, меченого флуоресцеином, изолированными микроспорами. Эти результаты указывают, что Tat ИНП способны проникать в клетки.
В способах настоящего изобретения применяются различные типы интернализуемых пептидов. В Таблице 1 приведены некоторые из изученных ИНП.
У каждого из этих пептидов N-концевая группа мечена флуоресцеином, на что указывает «FI». Пептид транспортан представляет собой химерный пептид, включающий 12 аминокислот из нейропептида галанина на N-конце, связанных в положении Lys13 с 14 аминокислотами из осиного яда мастопарана на С-конце. Пептид pVEC получен из кадгерина мышиного эндотелия сосудов (аминокислоты 615-632). Пептид ТАТ-ДБТ включает домен белковой трансдукции ТАТ ВИЧ-1.
В Таблице 2 представлена относительная интенсивность флуоресценции после обработки незрелых и зрелых зародышей различными интернализуемыми пептидами.
Аналогичные результаты представлены графически на Фиг.3. Результаты указывают, что транслокация различных пептидов произошла и у незрелых, и у зрелых зародышей. Эффективность транслокации повышается, когда клетки обрабатывают пермеабилизирующим агентом, таким как толуол. В то время, как толуол использован как типичный агент для иллюстрации эффекта пермеабилизации, само собой разумеется, что для достижения такого же эффекта можно применять другие пермеабилизирующие агенты. Результаты в Таблице и на Фиг.3 после применения трех различных ИНП означают, что в способах настоящего изобретения с высокой вероятностью будут применимы и другие ИНП.
Результаты указывают, что клеточные барьеры, существующие в зародышах-зиготах, можно преодолеть за счет пермеабилизации ткани с помощью толуола, что ведет к заметному увеличению транслокации всех трех исследованных пептидов.
Декстран-сульфат, меченый ИТЦФ, служил отрицательным контролем, так как он не обладает способностью проникать в клетку. Другой отрицательный контроль, M-tat, также дал гораздо меньшую флуоресценцию, и это указывает, что проникновение ИНП сильно зависит от последовательности аминокислотных остатков.
Репортерная система GUS (GUS:бета-глюкуронидаза) - это репортерная система, хорошо известная специалистам в области молекулярной биологии растений. Эта репортерная система использована для того, чтобы продемонстрировать эффекты пермеабилизации клетки и применение ИНП для повышения эффективности белковой трансдукции и трансфекции генов.
Фиг.4 иллюстрирует поглощение ферментного комплекса Tat-GUS в пермеабилизованных зародышах. На микрофотографии четко продемонстрирован высокоэффективный способ белковой трансдукции. Для еще большего усиления поглощения был специально синтезирован Tat2 ИНП, где Tat 2-димер ДБТ Tat ВИЧ, состоящий из 18 аминокислот. Результаты применения Tat2 в качестве ИНП представлены на Фиг.5. Чтобы вновь продемонстрировать, что в способах настоящего изобретения можно использовать другие ИНП, получен ферментный комплекс Рер-1-GUS. Микрофотографии, представленные на Фиг.6, иллюстрируют, что с помощью этого комплекса осуществлена эффективная трансдукция белка в пермеабилизованные незрелые зародыши. Фиг.6А отображает контрольный зародыш, Фиг.6 В демонстрирует доставку фермента глюкуронидазы (GUS), опосредованную Рер-1. Чтобы дополнительно продемонстрировать эффективность Рер-1 в качестве ИНП для доставки переносимого белка, микроспоры обработали таким же комплексом; результаты показаны на Фиг.7.
Как обсуждалось выше, транслокация изученных ИНП была больше в пермеабилизованных зрелых и незрелых зародышах. ТАТ-ДБТ продемонстрировал четкое накопление в герминативной зоне незрелых зародышей, и поглощение ТАТ-ДБТ увеличилось до максимального уровня (4,7 раз) после пермеабилизации незрелых зародышей. Кроме того, ТАТ-ДБТ богат аргинином и способен связываться с ДНК, что делает его подходящим носителем для переноса генов в растительные клетки и (или) ткани.
При дальнейших исследованиях изучен комплекс ТАТ-ДБТ-плазмидная ДНК в отношении способности индуцировать экспрессию гена gus, кодируемого в плазмиде пермеабилизованных зародышей. Результаты представлены на Фиг.8, и они четко свидетельствуют, что комплекс ИНП-плазмидная ДНК можно использовать для переноса гена для экспрессии в растительной клетке. Трансгенная экспрессия GUS в пермеабилизованных зародышах была статистически значимо выше, чем экспрессия в непермеабилизованных зародышах. Это убедительно свидетельствует в пользу того, что клеточная пермеабилизация играет важную роль в опосредованной ИНП транслокации комплекса, включающего переносимый материал. Результаты также указывают, что образование комплекса и пермеабилизация не нарушают биологическую активность транслоцированных переносимых компонентов.
Эффективность способов настоящего изобретения в отношении трансфекции гена доказана дополнительно с использованием комплекса Tat/Tat2-ДНК. ДНК является носителем гена устойчивости к гербицидам. Микроспоры трансфицированы, и выращены растения. Фиг.9 иллюстрирует, что трансгенные растения можно получить, используя способы настоящего изобретения.
Эффективность трансфекции гена растения можно еще больше повысить путем включения других известных агентов, способствующих трансфекции, таких как липофектамин. Когда липофектамин добавили к пермеабилизованным клеткам, обработанным комплексом ИНП-ДНК, эффективность возросла еще больше. Результаты, представленные на Фиг.10, иллюстрируют, что при образовании комплекса частота трансфекции выше, чем при использовании липофектамина в качестве трансфицирующего агента. Однако комбинация липофектамина с комплексом ИНП-ДНК оказалась самой эффективной.
В то время как для демонстрации эффективности системы были использованы ген gus и белковая репортерная система, совершенно очевидно, что если способами настоящего изобретения можно переносить такую крупную молекулу, как GUS, и экспрессировать комплексный продукт гена, тогда можно трансдуцировать и другие белки, и трансфицировать другие гены.
Способы настоящего изобретения также использованы для трансдукции белков, связанных с эмбриогенезом, в растительные клетки. Это запускает эмбриогенез и может действовать как маркер. Также это обеспечивает новый и универсальный способ доставки белка в растительные клетки. Одновременная доставка белков, связанных с эмбриогенезом, и нужного гена представляет собой новый способ в генной инженерии растений.
Также включены подробно описанные различия способов. Например, в комплексы ИНП-переносимый материал можно встраивать пептид с ядерным доменом локализации или доменом локализации другой органеллы.
Один или несколько вариантов, предпочтительных в настоящее время, описаны с помощью примеров. Специалистам в данной области техники будет понятно, что можно внести ряд изменений и модификаций, не выходя за область настоящего изобретения, как описано в формуле изобретения.
Приведенное выше изложение сущности изобретения описывает настоящее изобретение в целом. Считается, что специалист в данной области техники может с помощью предшествующего описания получать и использовать композиции и применять способы настоящего изобретения. Более глубокого понимания можно добиться с помощью ссылок на следующие конкретные примеры. Эти примеры описаны только для того, чтобы иллюстрировать предпочтительные варианты осуществления настоящего изобретения и не предназначены для ограничения объема изобретения. Ожидаются изменения формы и замены эквивалентов, так как обстоятельства могут предполагать или диктовать их целесообразность. Другие конфигурации будут очевидны для специалиста в данной области техники. Документы, такие как патенты или заявки на патенты, на которые ссылается настоящий документ, включены в него в виде ссылок.
ПРИМЕРЫ
Хотя в примерах использованы специальные термины, такие термины намеренно употреблены в описательном смысле, но они не налагают никаких ограничений. Способы из микробиологии и физики, на которые имеются ссылки, но отсутствует их точное описание в данном изложении и этих примерах, имеются в научной литературе и хорошо известны специалисту в данной области техники.
Пример 1. Подготовка растительных клеток
Зрелые зародыши
Зрелые зародыши (Т. aestivum cv AC Superb) выделены и подвергнуты поверхностной стерилизации согласно описанию Mahalakshmi с соавт.(2000). Стерилизованные зародыши высушены в потоке воздуха в ламинарном вытяжном шкафу за 1 час до использования.
Незрелые зародыши
Зародыши выделены из колосьев через две недели после цветения (щиток зародыша диаметром 1-2 мм). Незрелые семена подвергнуты поверхностной стерилизации 70% этанолом в течение 30 с, после чего обработаны 10% гипохлоритом (Хлорекс) и каплей Tween 20, 3 мин. Проведено четыре отмывания стерильной водой по 1 мин каждое. Зародыши препарированы вручную в стерильных условиях. Изолированные зародыши помещены на среду GEM (Eudes с соавт., 2003) на 24 ч в темном помещении при комнатной температуре до исследования транслокации с ИНП.
Изолированные микроспоры приготовлены, как описано Amundsen и Eudes, 2005.
Пример 2. Транслокация интернализуемых пептидов, меченых флуоресцеином, в зародыши-зиготы с использованием пермеабилизирующих агентов.
Пептиды синтезированы в лаборатории и помечены флуоресцеином в N-концевой аминокислоте (Alberta Peptide institute, Канада) (Таблица 1). В качестве отрицательного контроля использованы ИТЦФ-декстран-сульфат и мутировавший Tat.
Изолированные и стерилизованные зародыши (20-25) погружены в пермеабилизирующий буфер общим объемом 420 мкл (15 мМоль хлорида натрия, 1,5 мМоль цитрата натрия, рН 7,1), содержащий клеточный пермеабилизирующий агент толуол/этанол (1:4) в соотношении 1:20 с пермеабилизирующим буфером. К этой смеси добавлено 2,1 мкл 1-мМоль ИНП, меченого флуоресцеином, до конечной концентрации 5 мкМоль. В отрицательном контроле зародыши обрабатывали ИТЦФ-декстран-сульфатом или M-Tat. Зародыши инкубировали с пермеабилизирующей смеси в течение 1 ч в темноте при комнатной температуре, после чего дважды отмывали пермеабилизирующим буфером. Затем зародыши обрабатывали трипсином: ЭДТК (0,25% раствор, Sigma-Aldrich) в соотношении 1:2 с пермеабилизирующим буфером в течение 5 мин при комнатной температуре для удаления свободных пептидных молекул. После двукратной отмывки пермеабилизирующим буфером зародыши изучали под флуоресцентным микроскопом или подвергали спектрофотометрическому анализу.
Флуоресцентая микроскопия
После обработки интернализуемыми пептидами и ферментативного разрушения свободных внеклеточных пептидов зародыши изучали под флуоресцентным микроскопом для визуализации флуоресценции (фильтр GFP, возбуждение - 470 нм, эмиссия - 525 нм, Leica Inc., Германия).
Транслокация пептидов, меченых флуоресцеином, заметно усилилась в присутствии пермеабилизирующего агента (толуол) в зрелых и незрелых зародышах, что наблюдали под флуоресцентным микроскопом (Фиг.1 и Таблица 2). Отрицательный контроль, включая обработанный ИТЦФ-декстран-сульфатом и M-Tat, дал очень слабую флуоресценцию или не дал ее вовсе (Фиг.1 A-D). В целом флуоресценция в незрелых зародышах была больше, чем в незрелых зародышах как в условиях пермеабилизации, так и без пермеабилизации (Таблица 2; Фиг.3). Среди трех исследованных пептидов pVEC проявил наименьшее поглощение даже в зародышах, обработанных клеточным пермеабилизирующим агентом. Любопытно, что в пермеабилизованных незрелых зародышах, обработанных ТАТ-ДБТ, выявлен четкий слой накопления щитка зародыша и ограниченное накопление в герминативной области зародыша (Фиг.1F), в то время как после обработки пермеабилизованных зародышей двумя другими пептидами выявлено равномерное распределение флуоресценции.
Флуориметрический анализ
Для флуориметрического анализа зародыши обрабатывали 500 мкл 1% Triton X-100 (приготовленного в пермеабилизирующем буфере), 30 мин при 4°С. Надосадочную жидкость собирали в чистую пробирку и с помощью флуориметра измеряли относительное поглощение флуоресценции зародышами с различными ИНП (Biorad, Versafluor, США, возбуждение - 490, эмиссия - 520).
Флуориметрический анализ также выявил заметное увеличение транслокации интернализуемого пептида в зародыши, обработанные клеточным пермеабилизирующим агентом - толуолом (Фиг.3А, В). В незрелых зародышах выявлены более высокие уровни относительного поглощения флуоресценции в отношении всех пептидов в пермеабилизованных и непермеабилизованных незрелых зародышах. В частности, ТАТ-ДБТ в незрелых зародышах проявил относительное поглощение флуоресценции в пермеабилизованных зародышах в 4,7 раза выше, чем в непермеабилизованных зародышах. Транслокация транспортана и pVEC тоже увеличилась в 1,8 и 1,7 раза соответственно в пермеабилизованных незрелых зародышах (Фиг.3В). Однако флуориметрический анализ выявил относительно большую транслокацию транспортана при сравнении визуальному наблюдению ТАТ-ДБТ в пермеабилизованных и непермеабилизованных зародышах.
Пример 3. Поглощение комплекса ИНП-плазмидная ДНК пермеабилизованными незрелыми зародышами
Для изучения комплекса ИНП-ДНК для образования комплекса с ДНК ((pAct-1GUS) использован ТАТ-ДБТ без флуоресцеиновой метки. Плазмидную ДНК и ТАТ-ДБТ смешали в соотношении 1:10 (5 мкг ДНК : 50 мкг ТАТ-ДБТ, маточные растворы обоих приготовили в потребном количестве воды, доведя общий объем до 100 мкг пермеабилизирующим буфером. Эту смесь инкубировали при комнатной температуре в течение 1 ч до добавления к зародышам, пропитанным пермеабилизирующим буфером. Пермеабилизирующий агент (толуол) с буфером в соотношении 1:20 добавляли тотчас перед добавлением комплекса к зародышам. Зародыши инкубировали с комплексом ТАТ-ДБТ и ДНК в присутствии пермеабилизирующего агента в течение 1 ч, после чего дважды отмывали пермеабилизирующим буфером. Зародыши культивировали на плашке со средой GEM, содержащей цефотаксим, 250 мкг/мл, при 25°С в течение трех суток.
Гистохимический анализ GUS
Незрелые зародыши инкубировали в гистохимическом буфере GUS (Jefferson, 1987) при 37°С на протяжении ночи с добавлением 20% метанола для предотвращения какой-либо экспрессии эндогенного GUS. Процент экспрессии GUS рассчитывали как число обработанных зародышей, экспрессирующих GUS/общее число обработанных зародышей × 100.
В незрелых зародышах, инкубированных с комплексом ТАТ-ДБТ-плазмидная ДНК в присутствии клеточного пермеабилизирующего агента, выявлена преходящая экспрессия GUS (12%, Фиг.8), в то время как в необработанном отрицательном контроле какая-либо экспрессия GUS отсутствовала. В зародышах, обработанных только комплексом ТАТ-ДБТ-ДНК без добавления пермеабилизирующего агента, тоже не выявлено никакой экспрессии GUS, что указывает на роль пермеабилизирующего агента, облегчающего поглощение комплекса ТАТ-ДБТ-ДНК в незрелых зародышах.
Пример 4. Поглощение ИНП различными растительными тканями
Семена тритикале промывали детергентом и проращивали на влажной хлопчатобумажной ткани в течение недели. Кончик корня, кончик листа, основание листа и колеоптиль отрезали и инкубировали с 5 мкМоль pVEC, меченого флуоресцеином, pVEC с измененной аминокислотной последовательностью и транспортаном. Поглощение оказалось максимальным в кончиках корней и основании листа и менее выраженным в колеоптиле и кончике листа. Максимальная флуоресценция выявлена для транспортана, а затем в порядке убывания для pVEC, pVEC с измененной аминокислотной последовательностью и в контроле, куда ИНП не добавляли.
Пример 5. Опосредованный ИНП перенос фермента GUS в незрелые зародыши
Незрелые зародыши тритикале, пермеабилизированные толуолом, обрабатывали комплексом ИНП-(Tat или Tat2 или R9)-фермент GUS (4:1 вес./вес.) в течение одного часа в пермеабилизирующем буфере. В отношении Рер-1 следовали инструкциям, как описано в разделе об активном мотиве в наборе Chariot для белковой трансдукции в клеточных линиях млекопитающих. Комплекс ИНП-фермент GUS готовили в соотношении 4:1 соответственно и инкубировали при комнатной температуре в течение одного часа. Обработанные зародыши обрабатывали трипсином (1:1 трипсин:пермеабилизирующий буфер) в течение пяти минут при комнатной температуре, что приводило к разрушению избыточного и неинтернализованного комплекса ИНП-фермент GUS. После трех отмываний пермеабилизирующим буфером зародыши инкубировали в буфере для гистохимического определения GUS с 20% метанолом (Kosugi с соавт., 1990) при 37°С с 15:00 и до утра до появления синей окраски у обработанных незрелых зародышей.
Пример 6. Опосредованный ИНП перенос фермента GUS в микроспоры
Микроспоры тритикале обрабатывали комплексом ИНП (Рер-1, Tat, Tat2, R9) с ферментом GUS (4:1) в течение одного часа в среде NPB-99. Комплекс ИНП-фермент GUS готовили, как описано в примерах выше. После двукратного отмывания проводили обработку трипсином (1:1 со средой NPB-99) в течение пяти минут при комнатной температуре. Микроспоры инкубировали в буфере для гистохимического определения GUS с 20% метанолом (Kosugi et al., 1990) при 37°С с 15:00 до утра до появления синей окраски микроспор. В положительных микроспорах выявляли накопление GUS преимущественно в вакуолях.
Пример 7. Опосредованный ИНП перенос фермента GUS в эпидеомальные клетки лука
Способность переносить функционально активный фермент GUS с помощью ИНП R9 также изучена на эпидермальных клетках лука. Комплекс R9-GUS готовили, как описано в примерах выше, в соотношении 1-4:1. Эпидермальные клетки лука инкубировали с этим комплексом в течение одного часа и трижды с фосфатным солевым буфером с рН 7,2. Клетки, обработанные комплексом, окрашивались в синий цвет после инкубации с буфером для гистохимического определения GUS в течение трех часов при 37°С. Максимальная интенсивность окраски наблюдалась при соотношении 4:1.
Пример 8. Опосредованный ИНП перенос гена bar в микроспоры зародышей
Микроспоры тритикале обрабатывали комплексом ИНП (Tat/Tat2) и фрагментом, кодирующим ген устойчивости к гербицидам (bar) и включающим промотор «tap» и терминирующий кодон nos, в течение одного-двух часов при комнатной температуре. Комплекс готовили в соотношении 4:1 из tat/tat2 и ДНК (вес./вес.), инкубировали в течение одного часа и добавляли 5-10 мкг реагента липофектамина 2000. Клетки дважды отмывали NPB-99 и снова культивировали для эмбриогенеза в среде NPB-99 с 10% Фиколлом в присутствии завязей (Eudes, Amundsen, 2005).
ПЦР-положительные каллюсы, обработанные комплексом tat/tat2-ДНК+Липофектамин, получала, как показано ниже в Таблице 3.
Пример 9. Гены РНВ у тритикале
Ростки тритикале, предназначенные для выделения микроспор, хранили в холодильнике (4°С) в течение 3 недель с корнями в дистиллированной воде и головками, обернутыми алюминиевой фольгой. Через 3 недели ±3 суток подтверждали стадию одноядерной микроспоры от средней до поздней по срединному цветку с помощью окраски ацетокармином, предшествующей экстракции. Выделенную микроспору переносили в тритикале, как описано у Eudes и Amundsen (2005) в отношении получения очищенной взвеси микроспор, доведенной средой NPB-99 до концентрации 2,5 × 105 клеток на миллилитр.
Два транзитных пептида хлоропласта или митохондрий клонировали в рамке с тремя генами, кодирующими ферменты, участвующие в метаболизме PNB. Для котрансфекции использовали одинаковые молярные количества трех генетических кассет с одинаковым транзитным пептидом. 1 мкг ДНК, растворенной в 100 мкл стерильной воды, добавляли к 4 мкг Tat2, растворенного в 100 мкл, и аккуратно перемешивали, что давало в смеси соотношение ДНК и интернализуемого пептида (ИНП) 1:4. После инкубации с комплексом в течение 30 минут при комнатной температуре добавляли 5 мкл Липофектамина на 5 минут при комнатной температуре. Эту смесь добавляли к микроспорам без надосадочной жидкости в центрифужной пробирке емкостью 2 мл. Микроспоры инкубировали с комплексом носитель-переносимый материал в течение 15 минут и добавляли 100 мкл NPB-99, а затем инкубировали в течение 45 мин при комнатной температуре. Трансфицированные микроспоры отмывали NPB-99, затем центрифугировали и удаляли надосадочную жидкость. В центрифужную пробирку емкостью 2 мл добавляли 1000 мкг NPB-99, осторожно перемешивали, а затем пипеткой переносили 500 мл на чашку Петри диаметром 35 мм, содержащую 3 мл NPB-99+10% Фиколл (Sigma F4375) (NPB-99-10F), содержащий цефотаксим.
Четыре из пяти завязей из одинаковых стерилизованных колосьев, взятых прямо из растения, добавляли на каждую чашку, содержащую микроспоры. Чашки герметично покрывали пленкой Parafilm и помещали на чашку Петри диаметром 150 мм вокруг открытой чашки Петри диаметром 50 мм, содержащей стерильную дистиллированную воду. Затем чашки диаметром 150 мм тоже покрывали пленкой Parafilm и инкубировали в темноте при 28°С в течение 20-30 суток. Никакой селекции при культивировании микроспор, зародышей и ростков не проводили.
Перерожденные растения исследовали с помощью ПЦР на наличие трех трансгенов. Из растений извлекали РНК, положительную на эти три изучаемых гена. По отобранным растениям получали кДНК, и проводили ПЦР, чтобы подтвердить экспрессию этих трех трансгенов. Результаты представлены в Таблице 4.
Пример 10. Одновременный переноси ДНК-белка в микроспоры тритикале
Ростки тритикале, предназначенные для выделения микроспор, хранили в холодильнике (4°С) в течение 3 недель с корнями в дистиллированной воде и головками, обернутыми алюминиевой фольгой. Через 3 недели ±3 суток подтверждали стадию одноядерной микроспоры от средней до поздней по срединному цветку с помощью окраски ацетокармином, предшествующей экстракции. Выделенную микроспору переносили в тритикале, как описано у Eudes и Amundsen (2005) в отношении получения очищенной взвеси микроспор, доведенной средой NPB99 до концентрации 2,5×105 клеток на миллилитр.
Плазмиду (pAct-1 GUS, ~7,2 kb) линеаризировали с помощью рестрикционного фермента Pstд и ДНК очищали с использованием набора для очистки ПЦР-продукта (QlAquick, Qiagen, США). ДНК GUS переносили после 7 различных обработок (Т). Эти эксперименты повторяли пять раз.
Т1) Контроль. Обработка контроля - 200 мкл стерильной воды.
Т2) Только ДНК GUS: 1 мкг ДНК GUS (Sigma Aldrich), разведенный в 200 мкл стерильной воды.
Т3) ДНК GUS-RecA: 1 мкг ДНК, разведенной в 100 мкл стерильной воды, добавляли к 4 мкг RecA, разведенного в 100 мкл, и осторожно перемешивала, что давало смесь белка и ДНК в соотношении 1:4.
Т4) ДНК-Tat2: 1 мкг ДНК, разведенные в 100 мкп стерильной воды, добавляли к 4 мкг Tat2, разведенного в 100 мкл, и осторожно перемешивали, что давало смесь ДНК и интернализуемого пептида (ИНП) в соотношении 1:4.
Т5) Набор ДНК-Chariot: ДНК GUS с набором для белковой трансдукции Chariot трансформирована согласно протоколу производителя (Active Motif, США). 1 мкг ДНК GUS растворяли в 100 мкл стерильной воды и 6 мкл Chariot растворяли в 100 мкл стерильной воды. Раствор ДНК GUS добавляли к раствору Chariot в микроцентрифужной пробирке емкостью 2 мл до конечного объема 200 мкл.
Т6) Набор ДНК-RecA-Chariot: ДНК-RecA переносили в микроспоры с помощью набора для белковой трансдукции Chariot, следуя протоколу производителя. 4 мкг RecA растворяли в 50 мкл стерильной воды и 1 мкг ДНК GUS растворяли в 50 мкл стерильной воды. Раствор RecA добавляли к раствору ДНК и инкубировали в течение 15 мин. 6 мкг раствора Chariot растворяли в 100 мкл стерильной воды. Раствор Chariot пипеткой переносили в раствор ДНК-RecA до конечного объема 200 мкл в микроцентрифужной пробирке емкостью 2 мл.
Т7) ДНК-RecA-Tat2: Перенос ДНК-RecA с микроспоры за счет Tat2. 4 мкг RecA растворяли в 50 мкл стерильной воды и 1 мкг ДНК GUS растворяли в 50 мкл стерильной воды. Раствор RecA добавляли к раствору ДНК и инкубировали в течение 15 мин. 4 мкг Tat2 растворяли в 100 мкг стерильной воды. Раствор Tat2 пипеткой переносили в раствор ДНК-RecA до конечного объема 200 мкл в микроцентрифужной пробирке емкостью 2 мл.
После инкубации комплекса в течение 15 мин при комнатной температуре добавляли 5 мкг липофектамина в течение 5 мин при комнатной температуре. Смесь добавляли только к микроспорам без надосадочной жидкости в микроцентрифужной пробирке емкостью 2 мл. Микроспоры инкубировали с комплексом носитель - переносимый материал в течение 15 мин и добавляли 100 мкл NPB-99 и затем инкубировали в течение еще 45 мин при комнатной температуре. Трансфицированные макроспоры отмывали NPB-99, центрифугировали и сливали надосадочную жидкость. 1000 мкг NPB-99 добавляли в микроцентрифужную пробирку емкостью 2 мл. 500 мл пипеткой переносили на чашки Петри диаметром 35 мм, содержащие 3 мл NPB-99+10% Фиколл ((Sigma F4375) (NPB-99-10F), содержащий цефотаксим.
Четыре из пяти завязей из аналогичных стерилизованных колосьев, взятых прямо из растения, добавляли на все чашки Петри, содержащие микроспоры. Затем чашки Петри покрывали пленкой Parafilm и помещали на чашки Петри диаметром 150 мм вокруг открытой чашки Петри диаметром 50 мм, содержащей стерильную дистиллированную воду. Чашку Петри диаметром 150 мм тоже покрывали пленкой Parafilm и инкубировали в темноте при 28°С в течение 20-3 суток.
Зародыши размером больше 0,5 мм брали с чашек Петри и сеяли на среду GEM (20 мл в чашках Петри диаметром 10 см; Eudes et al. 2003). Чашки Петри покрывали пленкой Parafilm и помещали на 30 см ниже ламп широкого спектра Sylvania Gro-lux (40 Вт), освещающих 80 мкМоль м-2 с-1 (период освещения 16 ч) при комнатной температуре при 16°С. Как только зародыши становились зелеными, их переносили на 50 мл среды на укоренения в асептических условиях в емкости с фуксином при тех же условиях. Как только растения достигало стадии 2-3 листьев и имело достаточный рост корней, его переносили на Spencer-Lemaire roottrainer 4×8 (Spencer-Lemaire Industries Lte., Эдмонтон) и помещали в ростовую камеру при тех условиях, как и материнские растения. Через две недели после цветения оценивали плоидию по набору в семенах.
К 4-5 неделям зародыши подвергали гистохимическому анализу на GUS. Анализ проводили, добавляя 200 мл буфера для гистохимического определения GUS (500 мМоль NaH2PO4, 100 мМоль ЭДТК, 0,3 Моль маннитола, 2 мМоль X-gluc, pH 7.0) к микропорам и затем инкубировали при 37°С в темноте на протяжении ночи. Раствор с красителем сливали и отмывали зародыши фосфатным солевым буфером. Микроспоры синего цвета указывали на активность экзогенного фермента GUS, перенесенного ИНП. Процент синих зародышей при каждой обработке рассчитывали с помощью стереомикроскопа.
Четкую транслокацию Tat2 и Chariot в зародышах наблюдали через 2 месяца после трансфекции (Таблица 5). В отрицательном контроле - необработанных микроспорах - GUS не выявлялась. Максимальная доля зародышей, в которых выявлена GUS после обработки Tat2 и Chariot, составила 25,8 и 26,4% соответственно (Таблица 5). Вторая по значению частота синих зародышей наблюдалась после обработки ДНК-RecA-Chariot и ДНК-RecA-Tat2. В присутствии липофектамина обработка ДНК и ДНК-RecA давала трансфекцию в микропоры с меньшей частотой. Эти исследования демонстрируют, что различные комплексы ДНК и белков интернализировались в микроспорах тритикале.
Пример 11. Тест с защитой от ДНКазы I и анализ с задержкой в геле
Комплексы ИНП-ДНК GUS готовили, как описано в отношении переноса в примере 10 комплекса ДНК и ИНП в микроспоры тритикале при обработке ДНК (Т2) и ДНК-RecA (Т3). Тест с защитой от ДНКазы) проведен, как описано в отношении переноса комплекса ДНК и ИНП в микроспоры тритикале при обработке ДНК (Т2) и ДНК-RecA (Т3), но без липофектамина. Сразу после инкубации пептида-ДНК в течение 20 мин 4 мкл ДНКазы) (набор с ДНКазой, не содержащий РНКазы; Qiagen, США) добавляли к смеси (200 мкл) и инкубировали при комнатной температуре в течение 15 минут, после чего инкубировали в течение 5 мин на льду. Диссоциацию пептида и плазмиды и очистку плазмиды проводили с помощью набора для очистки ДНК (набор для ПЦР-очистки QtAquick).
Тест с защитой от ДНКазы I показал, что ДНК, ДНК-RecA, ДНК-Tat2, ДНК-Chahot, ДНК-RecA-Chahot и ДНК-RecA-Tat2 с липофектамином были достаточно защищены, так как четко визуализировалась полоса (7,2 kb), соответствующая ДНК, в то время как в случае ДНК и комплексом ДНК-RecA без липофектамина происходило разрушение ДНК под воздействием нуклеазы (Фиг.11А).
Комплексы RecA-ДНК GUS готовили, как описано в отношении переноса комплекса ДНК и ИНП в микроспоры тритикале. 1 мкл ДНК GUS перемешивали с различными концентрациями белка RecA для получения соотношений 1:0, 1:4, 1:8, 1:12, 1:16, 1:20 и 1:24. После инкубации в течение 20 мин без липофектамина 20 мкл комплекса переносили на 1% гель с агарозой.
Анализ с задержкой в геле на комплекс ДНК-RecA показывает, что размазанная флуоресценция наблюдалась при соотношениях RecA и ДНК GUS 1:8 и выше, что указывает на влияние более высоких концентраций RecA на сниженную мобильность линейной плазмидной ДНК (Фиг.11 В). RecA связывался с dsДНК при соотношениях 1:8 и выше.
На Фиг.11А изображено образование комплекса ИНП-ДНК (А). В тесте с защитой от ДНКазы I исследованы различные комбинации ИНП и ДНК. Т1) контроль, Т2) ДНК, и Т3) ДНК-RecA без липофектамина; Т4) ДНК, Т5) ДНК-RecA, Т6) ДНК-Tat2, Т7) ДНК-Chariot, Т8) ДНК-RecA-Chariot, и Т9) ДНК-RecA-Tat2 с липофектамином. На Фиг.11В отображен эффект различных концентраций ДНК и RecA.
Пример 12. Генетический конструктивный элемент «шпилечная петля» трансфицированный в микроспоры
Ген TaAOS (AY196004) выбран для выключения обмена жасмоновой кислоты (JA) в пшенице с помощью технологии «шпилечной петли». В качестве смысловой последовательности выбран фрагмент 27 mer ggccatccgcgaccgcctcgacttcta. Полная последовательность гена, клонированная между промотором актина и терминирующим кодоном NOS, была
TCTCGGCCATCCGCGACCGCCTCGACTTCTACTTCCTGTCATAGAAGT CGAGGCGGTCGCGGATGGCCCT.
1 мкг ДНК, растворенной в 100 мкл стерильной воды, добавляли к 4 мкг Tat2, растворенного в 100 мкл, и осторожно перемешивали, что давало смесь ДНК и интернализуемого пептида (ИНП) в соотношении 1:4. После инкубации этого комплекса в течение 30 мин при комнатной температуре добавляли 5 мкл липофектамина в течение 5 мин при комнатной температуре. Эту смесь добавляли только к микроспорам без надосадочной жидкости в микроцентрифужной пробирке емкостью 2 мл.
Микроспоры из культуры пшеницы Fielder брали, как описано в предыдущих примерах, и инкубировали с комплексом носитель-переносимый материал в течение 15 мин. Добавляли 100 мкл NPB-99 и инкубировали смесь в течение 45 мин при комнатной температуре. Трансфицированные микроспоры отмывали NPB-99, центрифугировали и сливали надосадочную жидкость. 1000 мкл NPB-99 добавляли в микроцентрифужную пробирку емкостью 2 мл и осторожно перемешивали. 500 мл пипеткой переносили на чашки Петри диаметром 35 мм, содержащие 3 мл NPB-99+10% Фиколл ((Sigma F4375) (NPB-99-10F), содержащий цефотаксим. Микроспоры и зародыши культивировали, как описано в предыдущих примерах.
Из культуры после двух экстракций микроспор получено всего 90 всходов. За первые дни привыкания к почве 55 всходов погибли. Такая необычно высокая частота гибели после контакта с почвой и воздушными контаминантами объяснялась выключением JA. Регенерирующие растения (35) проанализированы на трансген с помощью ПЦР. Три из этих растений оказались ПЦР-положительными на трансген.
Реферат
Изобретение относится к способу получения генно-инженерного растения. Способ включает обработку растительных клеток с интактными клеточными барьерами комплексом носитель - переносимый материал, состоящим по крайней мере из одного переносимого полипептидного и/или полинуклеотидного компонента, связанного с носителем - положительно заряженным интернализуемым пептидом (ИНП), и предназначенным для получения трансдуцированных клеток и размножения растительных клеток для выращивания растения. При этом растительные клетки представляют собой соматические клетки, предварительно обработанные пермеабилизирующим клетки агентом, или гаметофиты. Изобретение позволяет эффективным образом получать генно-инженерные растения в условиях интенсивного поглощения клетками комплекса носитель-переносимый материал. 12 з.п. ф-лы, 11 ил., 5 табл., 12 пр.

Комментарии