Композиции и способы для лечения цитомегаловируса - RU2737530C1
Код документа: RU2737530C1
Чертежи

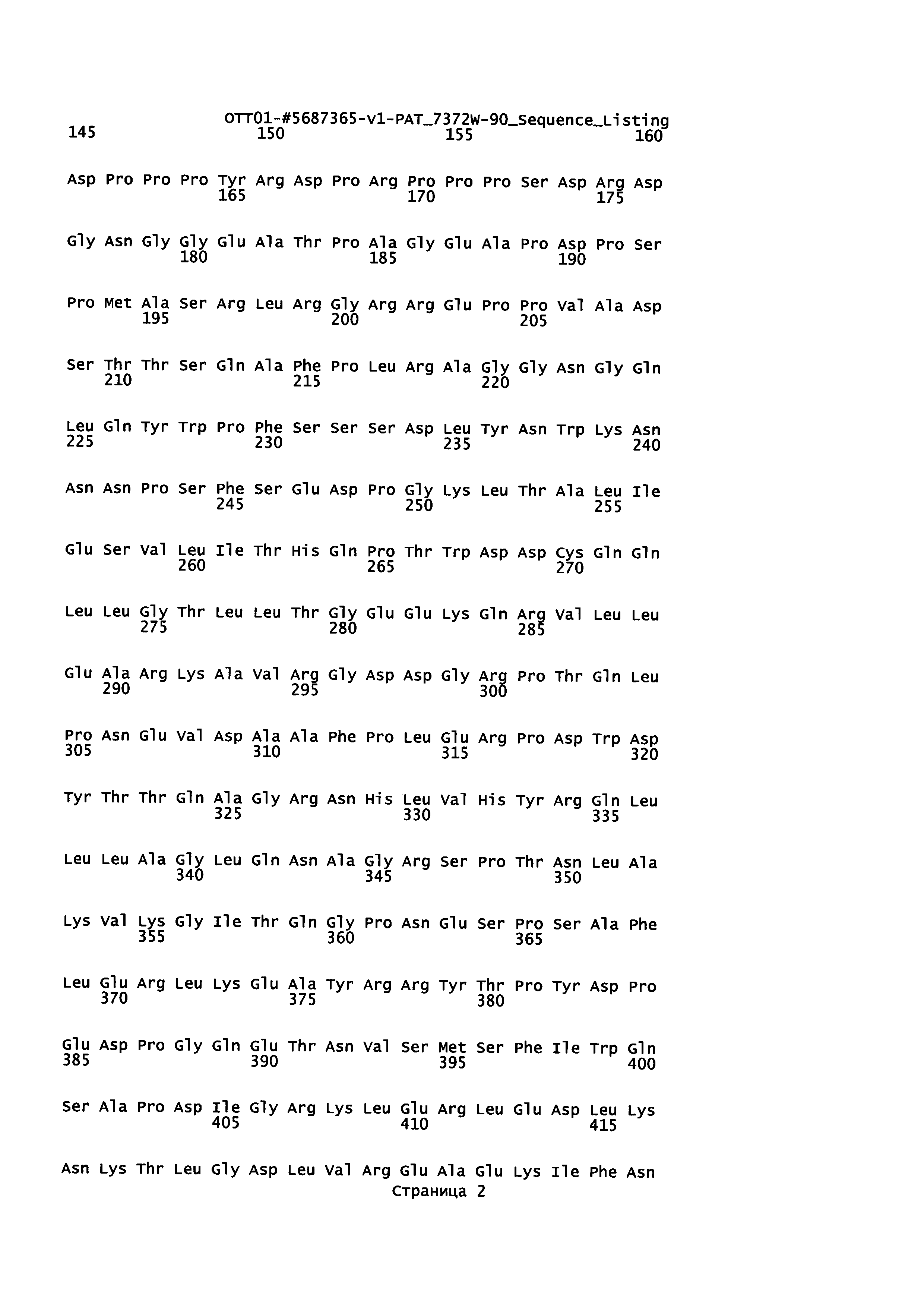













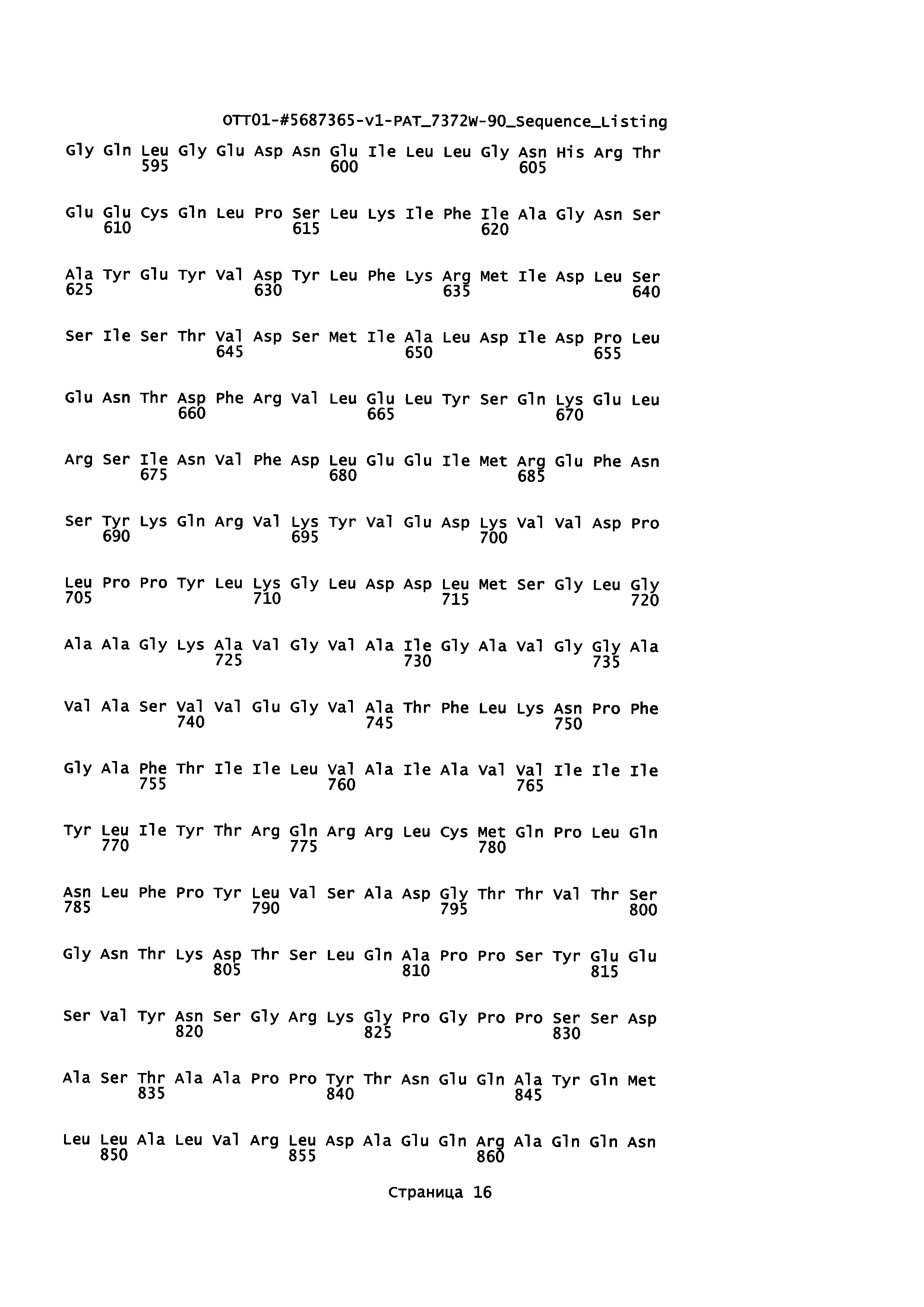












































Описание
Перекрестная ссылка на родственные заявки
Данная заявка претендует на преимущество перед предварительной заявкой США №61/558,800, поданной 11 ноября 2011 года, и предварительной заявкой США №61/654,157, поданной 1 июня 2012 года, содержание которых, таким образом, настоящим упоминанием считается включенным в данное описание во всей полноте.
Предшествующий уровень техники
Цитомегаловирус человека (ЦМВЧ), β-герпесвирус, является повсеместно распространенным патогеном. У иммунокомпетентного индивида инфекция ЦМВЧ, как правило, остается незамеченной, характеризуясь в основном слабо выраженными и неспецифическими симптомами. В отличие от этого, у определенных групп риска, например, у пациентов с ослабленным иммунитетом, таких как больные СПИДом или реципиенты трансплантатов, а также после внутриутробной инфекции, инфицирование ЦМВЧ характеризуется серьезными проявлениями (Staras SA et al., 2006 Clin Infect Dis 43(9):1143-51; Hebart H et al., 2004 Hum Immunol 65(5):432-6; Rowshani AT et al., 2005 Transplantation 79(4):381-6). Существующие способы терапии включают использование иммуноглобулинов и антивирусных агентов, таких как ганцикловир и его производные, которые наиболее эффективны при профилактическом или очень раннем использовании во время инфекции в группах риска. Однако существующие методы лечения характеризуются значительной токсичностью и ограниченной эффективностью, особенно на поздних стадиях заболевания (Boeckh М., 2004 Pediatr Transplant 8 (Suppl. 5):19-27; Limaye АР., 2004 Transplantation 78(9):1390-6), и они не оказали влияния на врожденное заболевание ЦМВЧ. Разработка эффективной вакцины для защиты от заболевания ЦМВЧ считается важным приоритетом общественного здравоохранения (Arvin AM et al., 2004 Clin Infect Dis 39(2):233-9).
Краткое описание изобретения Помимо прочего, настоящее изобретение предлагает способы и композиции, полезные для профилактики, лечения, и/или исследования инфекции цитомегаловируса человека (ЦМВЧ). В некоторых вариантах осуществления, данное изобретение предлагает вирусоподобные частицы (ВПЧ), которые содержат один или более коровых белков вируса лейкемии мышей Молони (ВЛММ) и включают в себя один или более эпитопов ЦМВЧ, таких как, например, гликопротеины В (gB) и/или гликопротеины H (gH) оболочки ЦМВЧ и/или белок тегумента рр65. Среди прочего, настоящее изобретение охватывает установление того, что комбинирование антигенов (например, гликопротеинов оболочки и структурных белков) может привести к полезным иммунным ответам, например, к таким, которые включают и гуморальный ответ (например, производство нейтрализующих антител), и клеточный ответ (например, активация Т-клеток). Предлагаемые ВПЧ можно охарактеризовать тем, что они не содержат вирусной ДНК и не являются инфекционными. В некоторых вариантах осуществления, предлагаемые ВПЧ, окружены липидной мембраной, возможно, содержащей один или несколько эпитопов гликопротеинов вирусной оболочки (например, gB и/или gH), которые являются антигенами, играющими роль в индукции антител, нейтрализующих вирус.
В некоторых вариантах осуществления, предлагаемые ВПЧ содержат один или более эпитопов структурных вирусных белков (например, рр65), которые являются антигенами, играющими роль в индукции клеточного иммунного ответа (например, Т-клеточный ответ). В некоторых вариантах осуществления, используемые структурные вирусные белки (например, рр65) стимулируют образование Т-хелперов, а также индуцируют цитотоксические Т-лимфоциты (ЦТЛ) против ЦМВЧ.
В некоторых вариантах осуществления настоящее изобретение предлагает варианты гликопротеинов вирусной оболочки (например, gB и/или gH). В некоторых вариантах осуществления вариант гликопротеина вирусной оболочки представляет собой или включает в себя гибридный белок. В некоторых вариантах осуществления вариант вирусного гликопротеина содержит гетерологичный белковый домен (например, трансмембранный и/или цитоплазматический домен из другого белка). В некоторых вариантах осуществления вариант структурного вирусного белка содержит гетерологичный антиген или эпитоп. В некоторых вариантах осуществления данное изобретение предлагает ВПЧ, содержащие варианты структурных вирусных белков. В некоторых вариантах осуществления вариант структурного вирусного белка представляет собой или включает в себя гибридный белок.
В контексте настоящей заявки термины «примерно» и «приблизительно» используются в качестве эквивалентов. Любые числа, используемые в настоящей заявке вместе с «примерно»/«приблизительно» или без «примерно»/«приблизительно» предназначены для покрытия любых нормальных флуктуаций, согласно оценке обычного специалиста в данной области техники.
Другие свойства, цели и преимущества настоящего изобретения становятся очевидными из подробного описания, которое следует далее. Следует понимать, однако, что подробное описание, указывающее варианты осуществления настоящего изобретения, дается только в качестве иллюстрации, но не для ограничения. Различные изменения и модификации, входящие в объем настоящего изобретения, станут очевидны специалистам в данной области техники из подробного описания.
Краткое описание графических материалов
Графические материалы предназначены только для иллюстрации, но не для ограничения.
На фигуре 1 показана карта плазмидной ДНК (дезоксирибонуклеиновой кислоты) для экспрессии (А) и конструирование типичных рекомбинантных плазмид для экспрессии (В).
На фигуре 2 показан анализ типичных гетерологичных поверхностных антигенов на упаковывающих клетках НЕК (клетки почки эмбриона человека) 293 с помощью метода проточной цитометрии (FACS) (А) и вестерн-блот анализ экспрессии гетерологичных антигенов в типичных композициях ВПЧ (В).
На фигуре 3 (А) и (В) показано определение размера частицы и индекса полидисперсности для двух типичных композиций ВПЧ.
На фигуре 4 показаны титры ИФА (иммуноферментный анализ) у мышей, на которых воздействовали типичными композициями ВПЧ gB/рр65 (А), gH-G/pp65 (В) или gB/gH-G/pp65 (С).
На фигуре 5 показана нейтрализующая активность антител у мышей, на которых воздействовали типичными композициями ВПЧ (ее оценивали в клетках фибробластов человека).
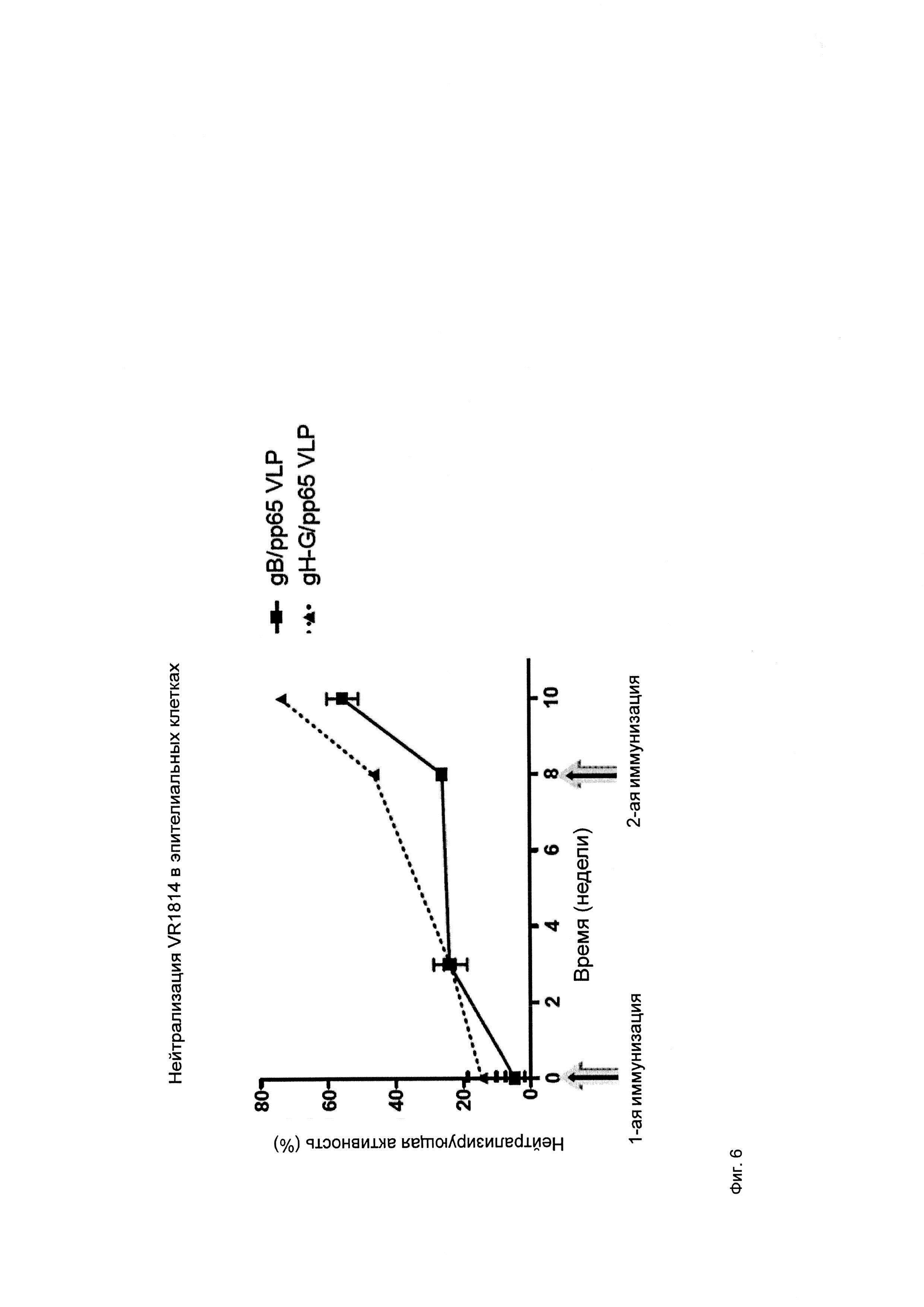
На фигуре 6 показана нейтрализующая активность антител у мышей, на которых воздействовали типичными композициями ВПЧ (ее оценивали в эпителиальных клетках человека).
На фигуре 7 показана нейтрализующая активность антител у мышей, на которых воздействовали типичными композициями ВПЧ, против рекомбинантного белка gB (ее оценивали в клетках фибробластов человека).
На фигуре 8 показаны антиген-специфические ответы ЦТЛ у мышей, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках НЕК 293, изображенные как частота встречаемости ЦТЛ, вычисленная на основании распада CFSE (сукцинилимидный эфир эфиркарбоксифлюоресцеин ацетат), при гейтировании Т-клеток CD3+ CD8+ (А) или как частота встречаемости пролиферирующих рр65-специфических ЦТЛ (В).
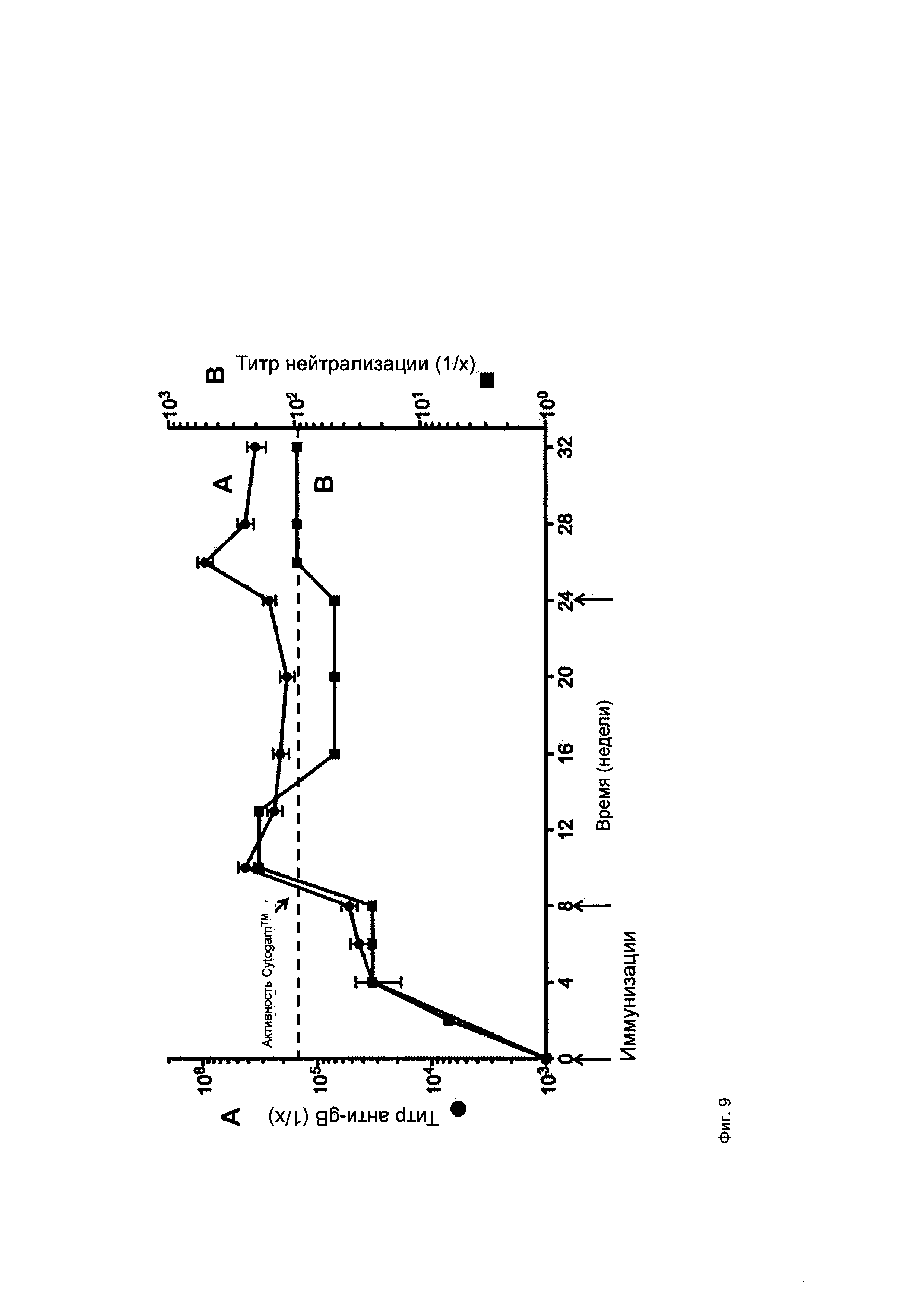
На фигуре 9 показаны титры антител против gB и нейтрализующих антител у кроликов, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках НЕК 293 (оценивали в клетках фибробластов человека).
На фигуре 10 показаны титры нейтрализующих антител у кроликов, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках НЕК 293 (оценивали в эпителиальных клетках человека).
На фигуре 11 показаны полученные с помощью электронной микроскопии (ЭМ) с негативным окрашиванием изображения типичных композиций ВПЧ, экспрессирующихся в клетках линии СНО (клетки яичника китайского хомячка), очищенных с помощью (А) тангенциальной поточной фильтрации (ТПФ) или (В) анионообменной хроматографии (АОХ).
На фигуре 12 показаны титры нейтрализующих антител у кроликов, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках линии СНО и очищенными с помощью ТПФ или АОХ (оценивали в клетках фибробластов человека).
На фигуре 13 показаны титры нейтрализующих антител у кроликов, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках линии СНО, очищенными с помощью ТПФ или АОХ (оценивали в эпителиальных клетках человека).
На фигуре 14 показан индекс авидности антител, продуцируемых у кроликов, на которых воздействовали типичными композициями ВПЧ, экспрессирующимися в клетках линии СНО и очищенными с помощью ТПФ или АОХ.
Определения
В первую очередь, для лучшего понимания настоящего изобретения, ниже мы приводим определения некоторых терминов. Дополнительные определения следующих терминов и других терминов изложены далее в настоящем описании.
Аминокислота: в данном контексте термин «аминокислота» в его самом широком смысле относится к любому соединению и/или веществу, которое может быть включено в полипептидную цепь. В некоторых вариантах осуществления аминокислота имеет общую структуру H2N-C(H)(R)-COOH. В некоторых вариантах осуществления аминокислота представляет собой встречающуюся в природе аминокислоту. В некоторых вариантах осуществления аминокислота представляет собой синтетическую аминокислоту; в некоторых вариантах осуществления аминокислота представляет собой d-аминокислоту; в некоторых вариантах осуществления аминокислота представляет собой I-аминокислоту. Термин «стандартная аминокислота» относится к любой из двадцати стандартных I-аминокислот, которые обычно присутствуют в природных пептидах. Термин «нестандартная аминокислота» относится к любой аминокислоте, не являющейся стандартной аминокислотой, независимо от того, создана ли она синтетическим путем или получена из природного источника. Используемый в данном контексте термин «синтетическая аминокислота» включает химически модифицированные аминокислоты, в том числе, помимо прочих, соли, производные аминокислот (такие как амиды) и/или замены. Аминокислоты, в том числе карбокси- и/или аминоконцевые аминокислоты в пептидах, могут быть модифицированы путем метилирования, амидирования, ацетилирования, присоединения защитных групп и/или замены другими химическими группами, которые могут изменить период полужизни пептидов в кровотоке без ущерба их активности. Аминокислоты могут участвовать в дисульфидной связи. Аминокислоты могут содержать одну или несколько посттрансляционных модификаций, таких как ассоциации с одним или более химическими объектами (например, метильные группы, ацетатные группы, ацетильные группы, фосфатные группы, формильные фрагменты, изопреноидные группы, сульфатные группы, фрагменты полиэтиленгликолевых групп, липидные фрагменты, углеводные фрагменты, фрагменты биотина и т.д.). Термин «аминокислота» используется взаимозаменяемо с термином «аминокислотный остаток» и может относиться к свободной аминокислоте и/или к аминокислотному остатку пептида. Из контекста, в котором используется термин, будет очевидно, относится ли он к свободной аминокислоте или остатку пептида.
Антиген: в данном контексте термин «антиген» относится к веществу, содержащему один или несколько эпитопов (линейных или конформационных или оба вида), которые распознаются антителами. В некоторых вариантах осуществления антиген представляет собой или включает в себя вирус или вирусный полипептид. В некоторых вариантах осуществления термин «антиген» относится к субъединичному антигену (т.е., антиген, который является дискретным и отдельным от целого вируса, с которым антиген связан в природе; например, антиген, который связан с вирусоподобной частицей). В качестве альтернативы или дополнительно, в некоторых вариантах осуществления термин «антиген» относится к убитым, ослабленным или инактивированным вирусам. В некоторых вариантах осуществления антиген является «иммуногеном».
Приблизительно или примерно: в данном контексте термин «приблизительно» или «примерно» применительно к одному или многим представляющим интерес значениям, относится к значению, которое похоже на указанное заданное значение. В некоторых вариантах осуществления термин «приблизительно» или «примерно» относится к диапазону значений, попадающих в пределы 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любом направлении (больше или меньше) от указанного опорного значения, если не указано иное или если иное не очевидно из контекста (за исключением случаев, когда такое число превышает 100% от возможного значения).
Улучшение состояния: в данном контексте термин «улучшение состояния» подразумевает под собой предотвращение, сокращение или временное облегчение состояния или повышение состояния субъекта. Улучшение состояния включает в себя, помимо прочего, полное выздоровление или полное предотвращение заболевания, расстройства или состояния (например, инфекции ЦМВЧ). Термин «профилактика» относится к задержке начала заболевания, расстройства или состояния. Профилактика может считаться завершенной, когда начало заболевания, расстройства или состояния было отложено на предварительно определенный период времени.
Характерная часть: в данном контексте термин «характерная часть» вещества в самом широком смысле представляет собой часть, которая имеет обозначенную степень структурной идентичности с исходным веществом. В некоторых вариантах осуществления характерная часть разделяет по меньшей мере одну функциональную характеристику с исходным веществом. Например, «характерной частью» белка или полипептида является часть, которая содержит непрерывную цепь аминокислот или коллекцию непрерывных цепей аминокислот, которые в совокупности являются характерными для белка или полипептида. В некоторых вариантах осуществления каждая такая непрерывная цепь обычно содержит по меньшей мере 2, 5, 10, 15, 20, 50 или более аминокислот. В целом, характерной частью вещества (например, белка, антитела и т.д.) является такая часть, которая, в дополнение к последовательности и/или структурной идентичности, указанным выше, разделяет, по меньшей мере, одну функциональную характеристику с соответствующим исходным веществом. В некоторых вариантах осуществления характерная часть может быть биологически активной.
Характерная последовательность: «характерная последовательность» представляет собой последовательность, которая присутствует во всех членах семейства полипептидов или нуклеиновых кислот, и, следовательно, может быть использована обычным специалистом в данной области техники для того, чтобы определить членов семейства.
Цитоплазматический домен: как известно специалистам в данной области техники, в некоторых случаях полипептиды имеют трансмембранные, цитоплазматические и/или внеклеточные домены. В целом, термин «цитоплазматический домен» в данном контексте относится к домену, характеристикой которого является его нахождение в цитоплазме. Как будет в дальнейшем понятно, не требуется, чтобы каждая аминокислота цитоплазматического домена находилась в цитоплазме. Например, в некоторых вариантах осуществления цитоплазматический домен характеризуется тем, что обозначенная цепь или часть белка в основном находится в цитоплазме. Как хорошо известно специалистам в данной области, последовательности аминокислот или нуклеиновых кислот могут быть проанализированы с использованием различных алгоритмов для прогнозирования внутриклеточной локализации белка (например, цитоплазматической локализации). Примеры таких программ включают, среди прочих, psort (PSORT.org), Prosite (prosite.expasy.org).
Лекарственная форма: в данном контексте термины «лекарственная форма» и «единичная лекарственная форма» относятся к физически дискретной единице терапевтического агента, предназначаемой для пациента, подлежащего лечению. Каждая единица содержит заранее определенное количество активного материала, рассчитанное на получение желаемого терапевтического эффекта. Следует понимать, однако, что общая дозировка композиции будет определяться лечащим врачом по результатам тщательной медицинской оценки.
Режим дозирования: «Режим дозирования» (или «терапевтический режим»), согласно тому, как этот термин используется в данном контексте, представляет собой набор единичных доз (обычно более одной), которые вводят по отдельности в организм субъекта, обычно отделенных друг от друга временными промежутками. В некоторых вариантах осуществления данное терапевтическое средство имеет рекомендованный режим дозирования, который может включать в себя одну или несколько доз. В некоторых вариантах осуществления режим дозирования включает в себя множество доз, которые отделены друг от друга временными промежутками одинаковой длины; в некоторых вариантах осуществления режим дозирования включает в себя множество доз и по меньшей мере два различных периода времени, разделяющих отдельные дозы.
Экспрессия: в данном контексте, «экспрессия» последовательности нуклеиновой кислоты относится к одному или более из следующих событий: (1) синтез матрицы РНК (рибонуклеиновая кислота) на основе последовательности ДНК (например, путем транскрипции); (2) процессинг транскрипта РНК (например, путем сплайсинга, редактирования, формирования 5'-кэпа и/или формирование 3'-конца); (3) трансляция РНК с синтезом полипептида или белка и/или (4) посттрансляционная модификация полипептида или белка.
Внеклеточный домен: как известно специалистам в данной области техники, в некоторых случаях полипептиды имеют трансмембранные, цитоплазматические и/или внеклеточные домены. В целом, термин «внеклеточный домен» в данном контексте относится к домену, характеристикой которого является его нахождение снаружи клетки. Как будет в дальнейшем понятно, не требуется, чтобы каждая аминокислота внеклеточного домена находилась снаружи клетки. Например, в некоторых вариантах осуществления внеклеточный домен характеризуется тем, что обозначенная цепь или составляющая белка в основном находится снаружи клетки. Как хорошо известно специалистам в данной области, последовательности аминокислот или нуклеиновых кислот могут быть проанализированы с использованием различных алгоритмов для прогнозирования внутриклеточной локализации белка (например, цитоплазматической локализации). Примеры таких программ включают, среди прочих, psort (PSORT.org), Prosite (prosite.expasy.org).
Гибридный белок: в данном контексте термин «гибридный белок» в целом относится к полипептиду, включающему в себя по меньшей мере два сегмента, каждый из которых демонстрирует высокую степень идентичности аминокислотной последовательности к пептидному фрагменту, который (1) встречается в природе и/или (2) представляет собой функциональный домен полипептида. Как правило, полипептид, содержащий по меньшей мере два таких сегмента, представляет собой гибридный белок, если два сегмента являются фрагментами, которые (1) не включены в природе в такой же пептид и/или (2) ранее не были связаны друг с другом в одном полипептиде и/или (3) были связаны друг с другом с помощью действий человека.
Ген: в данном контексте термин «ген» имеет значение, понимаемое специалистами данной области техники. Обычным специалистам в данной области техники следует иметь в виду, что термин «ген» может включать в себя регуляторные последовательности гена (например, промоторы, энхансеры и т.д.) и/или интронные последовательности. Кроме того, следует принимать во внимание, что определения гена относятся также к нуклеиновым кислотам, которые кодируют не белки, а функциональные молекулы РНК, такие как тРНК (транспортные РНК), вещества, индуцирующие интерференцию РНК и т.д. Для ясности отметим, что термин «ген», используемый в настоящей заявке, в целом относится к части нуклеиновой кислоты, которая кодирует белок; термин может необязательно включать регуляторные последовательности, как будет ясно из контекста обычным специалистам в данной области. Это определение предназначено не для исключения применения термина «ген» для единиц экспрессии, не кодирующих белки, а, скорее, для уточнения того, что в большинстве случаев этот термин, согласно тому, как он используется в настоящем документе, относится к нуклеиновой кислоте, кодирующей белок.
Генный продукт или продукт экспрессии: в данном контексте термин «генный продукт» или «продукт экспрессии» в целом относится к РНК, транскрибированной с гена (до и/или после процессинга), или к полипептиду (до и/или после модификации), кодируемому РНК, транскрибированной с гена.
Гетерологичный: используемый в настоящей заявке, термин «гетерологичный» по отношению к белку или полипептиду относится к белку или полипептиду, который не встречается в природе в конкретном организме, такому как ретровирус или ВПЧ. В некоторых вариантах осуществления гетерологичный белок или полипептид не встречаются природе в вирионе конкретного ретровируса. В данном контексте термин «гетерологичный» по отношению к белковому домену в целом относится к домену белка, который не встречается в природе в конкретном белке.
Иммуногенный: в данном контексте термин «иммуногенный» означает «способный вызывать иммунный ответ у животного-хозяина, направленный против объекта, не относящегося к хозяину» (например, антиген ЦМВЧ). В некоторых вариантах осуществления этот иммунный ответ лежит в основе защитного иммунитета, вызываемого вакциной против конкретного инфекционного организма (например, ЦМВЧ).
Иммунный ответ: в данном контексте термин «иммунный ответ» относится к ответу, вызываемому у животного. Иммунный ответ может относиться к клеточному иммунитету, гуморальному иммунитету или может включать их обоих. Иммунный ответ может быть также ограничен частью иммунной системы. Например, в некоторых вариантах осуществления иммуногенная композиция может вызвать усиленный ответ с продукцией IFNγ (интерферон-гамма). В некоторых вариантах осуществления иммуногенная композиция может индуцировать иммунный ответ слизистой оболочки с продукцией IgA (иммуноглобулин А) (например, как было измерено в носовых и/или ректальных промываниях). В некоторых вариантах осуществления иммуногенная композиция может индуцировать системный иммунный ответ с продукцией IgG (иммуноглобулин G) (например, как было измерено в сыворотке). В некоторых вариантах осуществления иммуногенная композиция может индуцировать ответ с продукцией нейтрализующих вирус антител или ответ с продукцией нейтрализующих антител.
Улучшить, увеличить или уменьшить: в данном контексте термины «улучшить», «увеличить» или «уменьшить» или их грамматические эквиваленты указывают на значения относительно базового измерения, такого как измерения у того же индивида до начала воздействия, описанного в настоящей заявке, или измерения у контрольного индивида (или у нескольких контрольных индивидов) в отсутствие воздействия, описанного в настоящей заявке.
Индивид, субъект, пациент: в данном контексте термины «субъект», «индивид» или «пациент» относятся к человеку или к субъекту, являющемуся млекопитающим, но не человеком. В некоторых вариантах осуществления индивид (также называемый «пациент» или «субъект»), подлежащий лечению, является индивидом (плодом, младенцем, ребенком, подростком или взрослым) страдающим от заболевания, например, инфекции ЦМВЧ. В некоторых вариантах осуществления субъект подвержен риску развития инфекции ЦМВЧ. В некоторых вариантах осуществления субъект является субъектом с подавленным иммунитетом. Например, в некоторых вариантах осуществления субъект с подавленным иммунитетом выбран из группы, состоящей из ВИЧ-инфицированных субъектов, больных СПИДом, реципиентов трансплантатов, субъектов детского возраста и беременных. В некоторых вариантах осуществления субъект был инфицирован ЦМВЧ. В некоторых вариантах осуществления субъект является человеком.
Выделенный: используемый в настоящей заявке термин «выделенный» относится к веществу и/или объекту, которое (1) было отделено от, по меньшей мере, некоторых из компонентов, с которыми оно было связано, когда появилось изначально (в природе и/или в экспериментальных условиях), и/или (2) произведено, получено и/или выработано человеком. Выделенные вещества и/или объекты могут быть отделены от примерно 10%, примерно 20%, примерно 30%, примерно 40%, примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, примерно 91%, примерно 92%, примерно 93%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, или более чем примерно 99% других компонентов, с которыми они были связаны изначально. В некоторых вариантах осуществления выделенные вещества являются чистыми примерно на 80%, примерно на 85%, примерно на 90%, примерно на 91%, примерно на 92%, примерно на 93%, примерно на 94%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99%, или более чем примерно на 99%. В данном контексте вещество является «чистым», если оно в целом не содержит других компонентов. В данном контексте расчет процента чистоты выделенных веществ и/или объектов не должен учитывать наполнители (например, буфер, растворитель, воду и т.д.).
Линкер: в данном контексте термин «линкер» относится, например, в гибридном белке, к аминокислотной последовательности соответствующей длины, отличной от той, которая находится в определенном положении в природном белке и, как правило, предназначенной для того, чтобы быть гибкой и/или для того, чтобы вставить структуру, такую как α-спираль, между двумя белковыми фрагментами. В целом, линкер позволяет двум или более доменам гибридного белка сохранить 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более биологической активности для каждого из доменов. Линкер также может называться спейсером.
Нуклеиновая кислота: используемый в настоящей заявке термин «нуклеиновая кислота» в его самом широком смысле относится к любому соединению и/или веществу, которое включено либо может быть включено в олигонуклеотидную цепь. В некоторых вариантах осуществления нуклеиновая кислота представляет собой соединение, и/или вещество, которое включено или может либо включено в олигонуклеотидную цепь посредством фосфодиэфирной связи. В некоторых вариантах осуществления термин «нуклеиновая кислота» относится к отдельным остаткам нуклеиновых кислот (например, к нуклеотидам и/или нуклеозидам). В некоторых вариантах осуществления «нуклеиновая кислота» относится к олигонуклеотидной цепи, содержащей отдельные остатки нуклеиновых кислот. Используемые в настоящей заявкетермины «олигонуклеотид» и «полинуклеотид» могут использоваться взаимозаменяемо. В некоторых вариантах осуществления термин «нуклеиновая кислота» охватывает РНК, а также одно- и/или двухцепочечную ДНК и/или кДНК (комплементарная дезоксирибонуклеиновая кислота). Кроме того, термины «нуклеиновая кислота», «ДНК», «РНК» и/или подобные термины включают в себя аналоги нуклеиновых кислот, т.е. аналоги, имеющие не фосфодиэфирный остов. Например, в рамках настоящего изобретения рассматриваются так называемые «пептидные нуклеиновые кислоты», которые известны специалистам в данной области техники и которые содержат пептидные связи вместо фосфодиэфирных связей в основной цепи. Термин «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает в себя все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и/или кодируют одну и ту же аминокислотную последовательность. Нуклеотидные последовательности, кодирующие белки и/или РНК, могут включать в себя интроны. Нуклеиновые кислоты могут быть выделены из природных источников, получены с использованием рекомбинантных систем экспрессии и, возможно, очищены, синтезированы химическим путем и т.д. При необходимости, например, в случае химически синтезированных молекул, нуклеиновые кислоты могут включать в себя аналоги нуклеозидов, такие как аналоги, содержащие химически модифицированные основания или сахара, модификации остова и т.д. Последовательность нуклеиновой кислоты представляют в направлении 5'-3', если не указано иное. Термин «фрагмент нуклеиновой кислоты» используется в настоящей заявке для обозначения последовательности нуклеиновой кислоты, которая представляет собой часть более длинной последовательности нуклеиновой кислоты. Во многих вариантах осуществления фрагмент нуклеиновой кислоты содержит по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10 или более остатков. В некоторых вариантах осуществления нуклеиновая кислота представляет собой или содержит природные нуклеозиды (например, аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин); нуклеозидные аналоги (например, 2-аминоаденозин, 2-тиотимидин, инозин, пирролопиримидин, 3-метиладенозин, 5-метилцитидин, С5-пропинилцитидин, С5-пропинилуридин, 2-аминоаденозин, С5-бромоуридин, С5-фторуридин, С5-йодуридин, С5-пропинилуридин, С5-пропинилцитидин, С5-метилцитидин, 2-аминоаденозин, 7-деазааденозин, 7-деазагуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин и 2-тиоцитидин); химически модифицированные основания; биологически модифицированные основания (например, метилированные основания); интернированные основания; модифицированные сахара (например, 2'-фосфорибоза, рибоза, 2'-дезоксирибоза, арабиноза и гексоза) и/или модифицированные фосфатные группы (например, фосфотиоаты и 5'-N-фосфорамидитные связи). В некоторых вариантах осуществления настоящее изобретение направлено специфически на «немодифицированные нуклеиновые кислоты», то есть на нуклеиновые кислоты (например, полинуклеотиды и остатки нуклеиновых кислот, включая нуклеотиды и/или нуклеозиды), которые не были химически модифицированны с целью облегчения доставки или ее обеспечения.
Фармацевтически приемлемый: термин «фармацевтически приемлемый» в данном контексте относится к веществам, которые, в рамках здравого медицинского суждения, подходят для применения в контакте с тканями человека и животных без чрезмерного токсического воздействия, раздражения, аллергической реакции или других проблем или осложнений, соразмерно с разумным соотношением польза/риск.
Полипептид: В данном контексте термин «полипептид» в целом представляет собой цепь из по меньшей мере двух аминокислот, соединенных друг с другом пептидной связью. В некоторых вариантах осуществления полипептид может включать в себя по меньшей мере 3-5 аминокислот, каждая из которых присоединена к остальным посредством по меньшей мере одной пептидной связи. Обычным специалистам в данной области техники будет понятно, что полипептиды иногда, возможно, включают в себя «неприродные» аминокислоты или другие объекты, которые, тем не менее, способны к интеграции в полипептидную цепь.
Полипротеин: используемый в настоящей заявке термин «полипротеин», как правило, относится к белку, который может разрезаться после синтеза для того, чтобы образовать несколько полипептидов с разными функциями. Полипротеин обычно кодируется одной аминокислотной последовательностью. В некоторых вариантах осуществления неразрезанный полипротеин сохраняет биологическую активность его составных частей. Некоторые вирусы продуцируют такие полипротеины, например, полипротеин Gag, который может оставаться в качестве функционального полипротеина или может быть подвергнут процессингу, с образованием нескольких полипептидов с разными функциями. Функционально полипротеин Gag делится на три домена: домен мембранной локализации, который направляет полипротеин Gag к клеточной мембране; домен взаимодействия, который способствует полимеризации Gag; и поздний домен, который облегчает высвобождение формирующихся вирионов из клетки-хозяина. В целом, форма белка Gag, которая опосредует сборку вирусной частицы, является полипротеином.
Самособирающаяся часть: В целом, термин «самособирающаяся часть», используемый в настоящей заявке, относится к соответствующему участку объекта, который принимает определенную конфигурацию без направления или контроля внешнего источника. В некоторых вариантах осуществления объект представляет собой белок. В некоторых вариантах осуществления объект является полипротеином. В некоторых таких вариантах осуществления соответствующий участок содержит по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или более остатков. Самосборка может происходить, например, внутри клетки (например, in vivo). В качестве альтернативы или дополнительно к этому варианту, самосборка может осуществляться вне клеточного контекста (например, in vitro). Самосборка может быть внутримолекулярной (например, фолдинг) и/или межмолекулярной. В некоторых вариантах осуществления самосборка может быть макромолекулярной, в ходе такой самосборки объекты самостоятельно собираются в сложную и/или протяженную макромолекулярную структуру. Самособирающиеся объекты могут демонстрировать широкий спектр структурных мотивов, включая, помимо прочего, частицы, фибриллы, складки и ленты. В некоторых вариантах реализации самосборка объекта важна для выполнения его биологической функции. Например, в некоторых вариантах осуществления самосборка липида приводит к образованию структуры клеточной мембраны. В некоторых вариантах осуществления самосборка белка (например, структурного белка вируса) внутри клетки приводит к образованию структуры частицы (например, структуры вирусных частиц). Например, вирусный структурный полипротеин может содержать наводящую последовательность, которая способна направлять его к клеточной мембране его клетки-хозяина (например, к плазматической мембране, мембране эндосомы и т.д.), от которой вирусный структурный полипротеин может отпочковываться, чтобы сформировать ВПЧ, которая содержит материал клеточной мембраны хозяина, окружающий структурный полипротеин вируса.
Гомология по существу: Фраза «гомология по существу» используется в данном контексте для обозначения сравнения между аминокислотными последовательностями или последовательностями нуклеиновых кислот. Как будет понятно обычным специалистам в данной области техники, две последовательности, как правило, считаются «гомологичными по существу», если они содержат гомологичные остатки в соответствующих позициях. Гомологичные остатки могут быть идентичными остатками. В качестве альтернативы, гомологичные остатки могут быть неидентичными остатками с соответствующим образом сходными структурными и/или функциональными характеристиками. Например, как хорошо известно обычным специалистам в данной области техники, некоторые аминокислоты обычно классифицируют как «гидрофобные» или «гидрофильные» аминокислоты и/или как имеющие «полярные» или «неполярные» боковые цепи. Замену одной аминокислоты на другую того же типа часто можно рассматривать как «гомологичную» замену.
Как хорошо известно в данной области техники, аминокислотные последовательности или последовательности нуклеиновых кислот можно сравнивать с применением любого из множества алгоритмов, в том числе и тех, которые доступны в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, gapped BLAST и PSI-BLAST для аминокислотных последовательностей. Примеры таких программ описаны у Altschul, et al., Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al, Methods in Enzymology 266:460-480 (1996); Altschul, et al., "Gapped BLAST и PSI-BLAST: a new generation protein database search programs", Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis, et al., Bioinformatics: Practical Guide to Analysis Genes и Proteins, Wiley, 1998; и Misener, et al., (eds.), Bioinformatics Methods и Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. Помимо выявления гомологичных последовательностей, программы, упомянутые выше, как правило, обеспечивают идентификацию степени гомологии. В некоторых вариантах осуществления две последовательности считаются гомологичными по существу, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более из их соответствующих остатков гомологичны в исследуемой цепи остатков. В некоторых вариантах осуществления исследуемая цепь является полной последовательностью. В некоторых вариантах реализации исследуемая цепь содержит по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или более остатков.
Идентичность по существу: Фраза «идентичность по существу» используется в данном контексте для обозначения сравнения между аминокислотными последовательностями или последовательностями нуклеиновых кислот. Как будет понятно обычным специалистам в данной области техники, две последовательности, как правило, считаются «идентичными по существу», если они содержат идентичные остатки в соответствующих позициях. Как хорошо известно в данной области техники, аминокислотные последовательности или последовательности нуклеиновых кислот можно сравнивать с использованием любого из множества алгоритмов, в том числе и тех, которые доступны в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, gapped BLAST и PSI-BLAST для аминокислотных последовательностей. Примеры таких программ описаны у Altschul, et al., Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al., Methods in Enzymology 266:460-480 (1996); Altschul, et al., "Gapped BLAST и PSI-BLAST: a new generation protein database search programs", Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis, et al., Bioinformatics: Practical Guide to Analysis Genes и Proteins, Wiley, 1998; и Misener, et al, (eds.), Bioinformatics Methods и Protocols (Methods in Molecular Biology, Vol.132), Humana Press, 1999. Помимо выявления гомологичных последовательностей, программы, упомянутые выше, как правило, обеспечивают идентификацию степени идентичности. В некоторых вариантах осуществления две последовательности считают идентичными по существу, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более из их соответствующих остатков идентичны в исследуемой цепи остатков. В некоторых вариантах осуществления исследуемая цепь является полной последовательностью. В некоторых вариантах осуществления исследуемая цепь содержит по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или более остатков.
Страдающий от: индивиду «страдающему от» заболевания, расстройства или состояния (например, от инфекции ЦМВЧ) поставлен диагноз, говорящий о заболевании, расстройстве или состоянии, и/или у него проявляются один или несколько симптомов заболевания, расстройства или состояния.
Восприимчивый к: индивид, «восприимчивый к» болезни, расстройству или состоянию (например, от инфекции ЦМВЧ) подвержен риску развития заболевания, расстройства или состояния. В некоторых вариантах осуществления у индивида, восприимчивого к болезни, расстройству или состоянию, не проявляется никаких симптомов заболевания, расстройства или состояния. В некоторых вариантах осуществления индивиду, восприимчивому к заболеванию, расстройству или состоянию, не поставлен диагноз, говорящий о заболевании, расстройстве и/или состоянии. В некоторых вариантах осуществления индивид, восприимчивый к заболеванию, расстройству или состоянию, подвергся условиям, связанным с развитием заболевания, расстройства или состояния (например, индивид контактировал с ЦМВЧ).
Симптомы уменьшаются: в соответствии с настоящим изобретением, «симптомы уменьшаются», когда один или более симптомов конкретного заболевания, расстройства или состояния уменьшается по величине (например, интенсивности, тяжести и т.д.) или по частоте. Для ясности, задержка в возникновении конкретного симптома считается одной из форм снижения частоты этого симптома. Не предполагается, что настоящее изобретение ограничено только теми случаями, при которых симптомы устраняются. Настоящее изобретение, в частности, предусматривает такое воздействие, при котором один или более симптомов уменьшается/уменьшаются (и состояние субъекта, таким образом «улучшается»), хотя и не полностью устраняются.
Терапевтически эффективное количество: в данном контексте термин «терапевтически эффективное количество» относится к количеству, достаточному для того, чтобы оказать терапевтический эффект на подвергаемого воздействию субъекта, в разумном соотношении польза/риск, применимом к любому медицинскому лечению. Терапевтический эффект может быть объективным (т.е., измеримым с помощью какого-либо теста или маркера) или субъективным (т.е., субъект указывает на эффект или чувствует его). В частности, термин «терапевтически эффективное количество» относится к количеству терапевтического белка или композиции, эффективного для лечения, улучшения состояния или предотвращения выбранного заболевания или состояния или для достижения детектируемого терапевтического или профилактического эффекта, например, путем симптомов улучшения состояния, связанных с заболеванием, путем профилактики или задержки начала заболевания и/или также уменьшения тяжести или частоты симптомов заболевания. Терапевтически эффективное количество обычно вводят в режиме дозирования, который может содержать несколько единичных доз. Для любой конкретной иммуногенной композиции терапевтически эффективное количество (и/или соответствующая единичная доза в пределах эффективного режима дозирования) может варьировать, например, в зависимости от способа введения, сочетания с другими фармацевтическими агентами. Кроме того, конкретное терапевтически эффективное количество (и/или единичная доза) для любого конкретного пациента может зависеть от множества факторов, включая расстройство, подлежащее лечению, тяжесть заболевания; активность конкретного используемого фармацевтического агента; используемый специфический состав; возраст, массу тела, общее состояние здоровья, пол и диету пациента; время введения, способ введения и/или скорость выведения или метаболизма конкретной иммуногенной композиции; продолжительность лечения и другие подобные факторы, которые хорошо известны в области медицины.
Трансмембранный домен: как известно в данной области техники, в некоторых случаях полипептиды имеют трансмембранные, цитоплазматические и/или внеклеточные домены. В целом, термин «трансмембранный домен» в данном контексте относится к домену, который располагается в мембране (например, он охватывает часть клеточной мембраны или всю клеточную мембрану). Как будет в дальнейшем понятно, не требуется, чтобы каждая аминокислота трансмембранного домена находилась в мембране. Например, в некоторых вариантах осуществления трансмембранный домен характеризуется тем, что обозначенная цепь или часть белка в основном находится в мембране. Как хорошо известно в данной области техники, последовательности аминокислот или нуклеиновых кислот могут быть проанализированы с использованием различных алгоритмов для прогнозирования внутриклеточной локализации белка (например, цитоплазматической локализации). Примеры таких программ включают, среди прочих, psort (PSORT.org), Prosite (prosite.expasy.org).
Лечение: в данном контексте термин «лечение» (а также «лечить») относится к любому введению иммуногенной композиции, которое частично или полностью успокаивает, улучшает состояние, снимает, подавляет, задерживает начало, снижает серьезность и/или снижает частоту одного или нескольких симптомов или признаков конкретного заболевания, расстройства и/или состояния (например, инфекции ЦМВЧ) или предрасположенность к заболеванию. Такое лечение может быть направлено на индивида, который не проявляет признаков соответствующего заболевания, расстройства и/или состояния и/или на индивида, который проявляет только первые признаки заболевания, расстройства и/или состояния. В качестве альтернативы или дополнительно, такое лечение может быть направлено на индивида, который проявляет один или несколько установленных признаков соответствующего заболевания, расстройства и/или состояния. В некоторых вариантах осуществления термин «лечить» относится к вакцинации пациента.
Вакцинация: в данном контексте термин «вакцинация» относится к введению композиции, предназначенной для образования иммунного ответа, например, к патогенным агентам (например, ЦМВЧ). Для целей настоящего изобретения вакцинирование может быть проведено до, во время и/или после контакта с патогенным агентом, а в некоторых вариантах осуществления - до, во время и/или вскоре после контакта с патогенным агентом. В некоторых вариантах осуществления вакцинация включает в себя несколько введений композиции вакцины, соответствующим образом распределенных во времени.
Вектор: в данном контексте термин «вектор» относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. В некоторых вариантах осуществления векторы способны к внехромосомной репликации и/или к экспрессии нуклеиновых кислот, с которыми они связаны, в клетке-хозяине, такой как эукариотическая и/или прокариотическая клетка. Векторы, способные направлять экспрессию функционально связанных генов, называются в данном контексте «векторы для экспрессии».
Подробное описание некоторых вариантов осуществления
Кроме всего прочего, настоящее изобретение обеспечивает способы и композиции, полезные для профилактики, лечения, и/или исследования инфекции ЦМВЧ. В некоторых вариантах осуществления данное изобретение предлагает вирусоподобные частицы (ВПЧ), которые содержат один или более коровых белков ВЛММ и включают в себя один или более эпитопов ЦМВЧ, таких как, например, из гликопротеинов gB и/или gH оболочки ЦМВЧ и/или белка тегумента рр65. Среди прочего, настоящее изобретение охватывает установление того, что комбинирование антигенов (например, гликопротеинов оболочки и структурных белков) может привести к полезным иммунным ответам, например, к таким, которые включают и гуморальный ответ (например, производство нейтрализующих антител), и клеточный ответ (например, активация Т-клеток). Прелагаемые ВПЧ можно охарактеризовать тем, что они не содержат вирусной РНК или ДНК и не являются инфекционными. В некоторых вариантах осуществления предлагаемые ВПЧ, действительно, содержат вирусную РНК или ДНК и являются инфекционными. В некоторых таких вариантах осуществления предлагаемые ВПЧ можно использовать в качестве ДНК-вакцины.
В некоторых вариантах осуществления гуморальный иммунный ответ у субъекта поддерживается по меньшей мере примерно 1 месяц, по меньшей мере примерно 2 месяца, по меньшей мере примерно 3 месяца, по меньшей мере примерно 4 месяца, по меньшей мере примерно 5 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 7 месяцев, по меньшей мере примерно 8 месяцев, по меньшей мере примерно 9 месяцев, по меньшей мере примерно 10 месяцев, по меньшей мере примерно 11 месяцев, по меньшей мере примерно 12 месяцев, по меньшей мере примерно 13 месяцев, по меньшей мере примерно 14 месяцев, по меньшей мере примерно 15 месяцев, по меньшей мере примерно 16 месяцев, по меньшей мере примерно 17 месяцев, по меньшей мере примерно 18 месяцев, по меньшей мере примерно 19 месяцев, по меньшей мере примерно 20 месяцев, по меньшей мере примерно 21 месяц, по меньшей мере примерно 22 месяца, по меньшей мере примерно 23 месяца, по меньшей мере примерно 24 месяца, по меньшей мере примерно 28 месяцев, по меньшей мере примерно 32 месяца, по меньшей мере примерно 36 месяцев, по меньшей мере примерно 40 месяцев, по меньшей мере примерно 44 месяца, по меньшей мере примерно 48 месяцев или более. В некоторых вариантах осуществления клеточный иммунный ответ у субъекта поддерживается по меньшей мере примерно 1 месяц, по меньшей мере примерно 2 месяца, по меньшей мере примерно 3 месяца, по меньшей мере примерно 4 месяца, по меньшей мере примерно 5 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 7 месяцев, по меньшей мере примерно 8 месяцев, по меньшей мере примерно 9 месяцев, по меньшей мере примерно 10 месяцев, по меньшей мере примерно 11 месяцев или по меньшей мере примерно 12 месяцев.
В некоторых вариантах осуществления, предлагаемые ВПЧ, окружены липидной мембраной, возможно, содержащей один или более эпитопов из гликопротеинов оболочки вируса (например, gB и/или gH), которые являются антигенами, играющими роль в индукции антител, нейтрализующих вирус.
В некоторых вариантах осуществления, предлагаемые ВПЧ содержат один или более эпитопов из структурных вирусных белков (например, рр65), которые являются антигенами, играющими роль в индукции клеточного иммунного ответа (например, T-клеточного ответа). В некоторых вариантах осуществления, используемые структурные вирусные белки (например, рр65) стимулируют образование Т-хелперов (TH, T-helper), а также индуцируют ЦТЛ против ЦМВЧ.
В некоторых вариантах осуществления, настоящее изобретение предлагает варианты гликопротеинов оболочки вируса (например, gB и/или gH). В некоторых вариантах осуществления вариант гликопротеина оболочки вируса представляет собой или содержит гибридный белок. В некоторых вариантах осуществления вариант вирусного гликопротеина содержит гетерологичный домен белка (например, трансмембранный и/или цитоплазматический домен из другого белка). В некоторых вариантах осуществления вариант структурного вирусного белка содержит гетерологичный антиген или эпитоп. В некоторых вариантах осуществления данное изобретение предлагает ВПЧ, содержащие варианты структурных вирусных белков. В некоторых вариантах осуществления вариант вирусного структурного белка представляет собой или содержит гибридный белок.
I. Вирусоподобные частицы (ВПЧ)
Ретровирусы представляют собой оболочечные РНК-содержащие вирусы, которые принадлежат к семейству Retroviridae.
После заражения ретровирусом клетки-хозяина, РНК транскрибируется в ДНК с помощью фермента обратной транскриптазы. ДНК затем включается в геном клетки-хозяина с помощью фермента интегразы и впоследствии реплицируется как часть ДНК клетки-хозяина. Семейство Retroviridae включает в себя следующие рода: Alpharetrovirus, Betaretrovirus, Gammearetrovirus, Deltaretrovirus, Epsilonretrovirus, Lentivirus и Spumavirus. Хозяевами у этого семейства ретровирусов, как правило, являются позвоночные. Ретровирусы продуцируют инфекционный вирион, содержащий сферический нуклеокапсид (геном вируса в комплексе со структурными вирусными белками), окруженный липидным бислоем, полученным из мембраны клетки-хозяина.
Векторы на основе ретровирусов могут быть использованы для создания оболочечных вирионов, которые являются инфекционными и либо способны к репликации, либо не способны к репликации. Инфекционные ретровирусные векторы, способные к репликации, содержат все необходимые гены для синтеза вириона и продолжают размножаться после того, как произошло инфицирование клетки-хозяина. Инфекционные ретровирусные векторы, не способные к репликации, не распространяются после первичного инфицирования. Это достигается путем замены большей части кодирующих участков ретровируса генами или нуклеотидными последовательностями, которые необходимо перенести; таким образом, вектор не способен синтезировать белки, необходимые для повторных раундов репликации.
В качестве альтернативы или дополнительно ретровирусные векторы могут быть использованы для создания ВПЧ, у которых утерян геном ретровируса и которые являются и неинфекционными, и нереплицирующимися. Из-за выгодных особенностей ВПЧ они могут быть использованы в качестве систем доставки антигена. Кроме того, так как ВПЧ не являются инфекционными, их можно безопасно вводить в качестве иммуногенной композиции (например, вакцины). ВПЧ в целом структурно сходны с оболочечными вирионами, описанными выше, но не содержат ретровирусный геном, что делает маловероятным прохождение репликации вируса. Экспрессия белков капсида (например, Gag) некоторых вирусов (например, вируса лейкемии мышей Молони, ВЛММ) приводит к самосборке частиц, аналогичных соответствующему природному вирусу, чьи частицы не содержат вирусный генетический материал.
Создано широкое разнообразие ВПЧ. Например, были созданы ВПЧ, включающие в себя, в том числе один или несколько белков капсида, или же включающие или не включающие в себя белки оболочки и/или поверхностные гликопротеины. В некоторых случаях ВПЧ не покрыты оболочкой и собираются за счет экспрессии лишь одного основного белка капсида, как показано для ВПЧ, созданных на основе гепаднавирусов (например, Engerix™, GSK и Recombivax НВ™, Merck), папилломавирусов (например, Cervarix™, GSK и Gardasil™, Merck), паровирусов или полиомавирусов. В некоторых вариантах осуществления ВПЧ окружены капсулой и могут содержать несколько антигенных белков, обнаруженных в соответствующем нативном вирусе. ВПЧ обычно напоминают соответствующий им природный вирус и могут являться комбинированными дисперсными структурами. В некоторых вариантах осуществления антигенные белки могут быть представлены внутри ВПЧ, в качестве компонента структуры ВПЧ, и/или на поверхности ВПЧ. Настоящее изобретение охватывает установление того, что презентация антигена в составе ВПЧ имеет преимущества для индукции нейтрализующих антител против антигена по сравнению с другими формами презентации антигена, например, по сравнению с растворимыми антигенами, не связанными с ВПЧ. Нейтрализующие антитела чаще всего распознают третичные или четвертичные структуры; для этого часто требуется презентация антигеных белков, таких как гликопротеины оболочки, в нативной вирусной конформации. В качестве альтернативы или дополнительно ВПЧ можно использовать для презентации антигенов в контексте, который индуцирует клеточный иммунитет (например, Т-клеточный ответ). Настоящее изобретение дополнительно охватывает открытие того, что использование комбинаций антигенов в системах ВПЧ может вызывать улучшенную иммунную реакцию.
А. Структурные Белки
В некоторых вариантах осуществления настоящее изобретение использует ВПЧ, состоящие из одного или нескольких структурных ретровирусных белков (например, Gag). В некоторых вариантах осуществления структурный белок для применения в соответствии с настоящим изобретением представляет собой Alpharetrovirus (например, вирус лейкоза птиц), Betaretrovirus (вирус опухоли молочной железы мышей), Gammearetrovirus (вирус лейкемии мышей), Deltaretrovirus (вирус коровьего лейкоза), Epsilonretrovirus (вирус дермальной саркомы светоперого судака), Lentivirus (вирус иммунодефицита человека 1) или Spumavirus (вирус пенистости шимпанзе). В некоторых вариантах осуществления структурным полипротеином является структурный белок вируса лейкемии мышей (ВЛМ). Геномы этих ретровирусов полностью доступны в базах данных. Гены Gag всех этих ретровирусов имеют общее структурное сходство, и в каждой группе ретровирусов являются консервативными на аминокислотном уровне. Ретровирусные белки Gag в первую очередь функционируют в ходе сборки вируса. Ген Gag в форме полипротеина дает начало основным структурным белкам ВПЧ. Ген Gag ВЛМ кодирует полипротеинового предшественника с молекулярной массой 65 кДа, который протеолитически расщепляется протеазой ВЛМ на 4 структурных белка (белок матрикса (MA); р12; белок капсида (СА); и белок нуклеокапсида (NC)) в зрелом вирионе. Ретровирусы собирают незрелый капсид, состоящий из полипротеина Gag, сформированного из полипептида Gag, но лишенный других вирусных элементов, таких как вирусная протеаза, с Gag в качестве структурного белка незрелой вирусной частицы. Функционально полипротеин Gag делится на три домена: домен мембранной локализации, который направляет полипротеин Gag к клеточной мембране; домен взаимодействия, который способствует полимеризации Gag; и поздний домен, который облегчает высвобождение формирующихся вирионов из клетки-хозяина. Форма белка Gag, которая опосредует сборку вирусной частицы, является полипротеином.
В некоторых вариантах осуществления структурный ретровирусный белок, предназначенный для использования в соответствии с настоящим изобретением, представляет собой полипептид Gag. В данном контексте термин «полипептид Gag» означает структурный полипептид ретровирусного происхождения, который отвечает за формирование ВПЧ, описанных в настоящее заявке, и относится к последовательности полипептида, аминокислотная последовательность которого содержит по меньшей мере одну последовательность, характерную для Gag. Широкое разнообразие последовательностей Gag из различных ретровирусов известно в данной области техники, и обычные специалисты в данной области техники, пользуясь такими поледовательностями, могут легко идентифицировать последовательности, которые характерны для белков Gag в целом и/или для отдельных полипептидов Gag.
Пример полипептида Gag, предназначенного для применения в соответствии с настоящим осуществления, приведен ниже как SEQ ID NO: 1. В некоторых вариантах осуществления подходящий полипептид Gag по существу гомологичен известному ретровирусному полипептиду Gag. Например, полипептид Gag может являться модифицированным ретровирусным полипептидом Gag, содержащим одну или более аминокислотных замен, делеций и/или инсерций по сравнению с полипептидом Gag дикого типа или природным (например, SEQ ID NO: 1), при сохранении существенной активности, необходимой для самосборки. Таким образом, в некоторых вариантах осуществления полипептид Gag, подходящий для настоящего изобретения, является гомологичным по существу полипептиду Gag ВЛММ (SEQ ID NO: 1). В некоторых вариантах осуществления полипептид Gag, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 1. В некоторых вариантах осуществления полипептид Gag, подходящий для настоящего изобретения является идентичным по существу полипептиду Gag ВЛММ (SEQ ID NO: 1). В некоторых вариантах осуществления полипептид Gag, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 1. Аминокислотная Последовательность Gag ВЛММ (SEQ ID NO: 1)

Нуклеотидная Последовательность Gag ВЛММ (SEQ ID NO: 2)


Нуклеотидная последовательность Gag ВЛММ с оптимизированным составом кодонов (SEQ ID NP: 3)


Нуклеотидная последовательность Gag ВЛММ с оптимизированным составом кодонов (SEQ ID NO: 21)


Как правило, в природе белок Gag включает в себя дополнительный большой C-концевой участок, который может иметь ферментативные активности ретровирусной протеазы, обратной транскриптазы и интегразы. Сборка ВПЧ, однако, как правило, не требует присутствия таких компонентов. В некоторых случаях один лишь ретровирусный белок Gag (например, без дополнительного C-концевого участка, без одного или нескольких компонентов, таких как геномная РНК, обратная транскриптаза, вирусная протеаза или белок оболочки) может самостоятельно собраться в ВПЧ, как in vitro, так и in vivo vivo (Sharma S et al., 1997 Proc. Natl. Acad. Sci. USA 94: 10803-8). Ретровирусный полипротеин Gag может самостоятельно олигомеризоваться и собираться в ВПЧ.
В некоторых вариантах осуществления полипептид Gag, предназначенный для применения в соответствии с настоящим изобретением не имеет дополнительного C-концевого участка и/или содержит модифицированный дополнительный C-концевой участок. Полипептид Gag, возможно, может включать в себя один или более дополнительных полипептидов (например, гетерологичный антиген). В некоторых вариантах осуществления полипептид Gag коэкспрессируется совместно с гетерологичным антигеном (например, под отдельными промоторами и/или в виде отдельных белков). В некоторых вариантах осуществления полипептид Gag экспрессируется в виде гибридного белка, слитого с гетерологичным антигеном. Полипептид Gag может быть связан с гетерологичным антигеном для создания гибридного белка без изменения функции Gag. Например, кодирующая последовательность для гетерологичного антигена может быть соединена посредством сплайсинга с кодирующей последовательностью для полипептида Gag, например, через 3'-конец кодирующей последовательности полипептида Gag. В некоторых вариантах осуществления последовательность, кодирующая гетерологичный антиген, может быть соединена посредством сплайсинга с кодирующей последовательностью для полипептида Gag без нарушения рамки считывания. В некоторых вариантах осуществления кодирующая последовательность полипептида Gag и гетерологичный антиген могут экспрессироваться под контролем одного промотора. В некоторых вариантах осуществления гетерологичный антиген вставляют (например, путем слияния) на С-конце полипептида Gag. Вне связи с какой-либо теорией, полагают, что при слиянии самособирающегося полипептида Gag с гетерологичным антигеном образуется гибридный белок, который действует как немодифицированный Gag и в результате становится возможным включение антигена в структурные компоненты образующейся ВПЧ. В некоторых вариантах осуществления структурные компоненты ВПЧ служат эффективными иммуногенами (например, для индукции клеточного иммунного ответа). Например, предлагаемые ВПЧ могут содержать ретровирусный полипептид Gag (например, Gag ВЛММ) и структурный компонент ЦМВЧ (например, рр65). В некоторых таких вариантах осуществления рр65 включен в состав ВПЧ и служит антигеном для индукции иммунного ответа против ЦМВЧ.
Типичный гибридный полипептид Gag-pp65, предназначенный для применения в соответствии с настоящим изобретением, приведен ниже как SEQ ID NO: 4. В некоторых вариантах осуществления подходящий гибридный белок полипептида Gag включает в себя весь полипептид Gag или часть полипептида Gag, которая гомологична по существу известному ретровирусному полипептиду Gag и весь полипептид рр65 или же часть полипептида рр65, которая гомологична по существу известному полипептиду рр65. Например, гибридный белок полипептида Gag-pp65 может содержать одну или более аминокислотных замен, делеций и/или вставок по сравнению с полипептидом Gag и/или полипептидом рр65 дикого типа или природного происхождения при сохранении существенной активности, необходимой для самосборки. Таким образом, в некоторых вариантах осуществления гибридный белок полипептида Gag-pp65, подходящий для настоящего изобретения, является гомологичным по существу SEQ ID NO: 4. В некоторых вариантах осуществления гибридный белок полипептида Gag-pp65, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 4. В некоторых вариантах осуществления гибридный белок полипептида Gag-pp65, подходящий для настоящего изобретения, идентичен по существу SEQ ID NO: 4. В некоторых вариантах осуществления гибридный белок полипептида Gag-pp65, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 4.
Аминокислотная последовательность ВЛММ Gag - ЦМВ рр65 (SEQ ID NO: 4)

Нуклеотидная последовательность ВЛММ Gag - ЦМВ pp65 (SEQ ID NO: 5)



Нуклеотидная последовательность ВЛММ Gag - ЦМВ рр65 с оптимизированным составом кодонов (SEQ ID NO: 6)



Нуклеотидная последовательность ВЛММ Gag - ЦМВ рр65 с оптимизированным составом кодонов (SEQ ID NO: 22)



В некоторых вариантах осуществления настоящее изобретение предлагает нуклеиновые кислоты, которые кодируют полипептид Gag или характерную часть полипептида Gag. В некоторых вариантах осуществления нуклеиновые кислоты могут быть ДНК или РНК, и могут быть одноцепочечными или двуцепочечными. В некоторых вариантах осуществления оригинальные нуклеиновые кислоты могут включать один или более неприродных нуклеотидов; в других вариантах осуществления оригинальные нуклеиновые кислоты включают только природные нуклеотиды.
В. Белки оболочки
В некоторых вариантах осуществления настоящее изобретение использует вирусоподобные частицы, состоящие из одного или нескольких полипептидов оболочки ЦМВЧ (например, gB и/или gH). В данном контексте термин «полипептид оболочки» относится к последовательности полипептида, аминокислотная последовательность которого содержит по меньшей мере одну характерную последовательность гликопротеина оболочки. Широкое разнообразие последовательностей гликопротеинов оболочки из различных вирусов, включая, помимо прочего, ЦМВЧ, известно в данной области техники, и обычные специалисты в данной области техники, пользуясь такими последовательностями, могут легко идентифицировать последовательности, которые характерны для гликопротеинов оболочки в целом и/или для отдельных гликопротеинов оболочки. В некоторых вариантах осуществления полипептид оболочки содержит цитоплазматический, трансмембранный и/или внеклеточный участок или домен.
В некоторых вариантах осуществления полипептид оболочки ЦМВЧ включает в себя трансмембранный и цитоплазматический домен, который не встречается в природе в белке ЦМВЧ. Например, в некоторых вариантах осуществления полипептид оболочки ЦМВЧ включает трансмембранный и цитоплазматический домен от другого белка ЦМВЧ (например, gB или gH). В некоторых вариантах осуществления полипептид оболочки ЦМВЧ включает в себя трансмембранный домен и цитоплазматический домен, которые встречаются в природе у вируса везикулярного стоматита (ВВС). Как известно в данной области техники, в некоторых случаях полипептиды имеют трансмембранные, цитоплазматические и/или внеклеточные домены. В целом, термин «трансмембранный домен» в данном контексте относится к домену, находящемуся в мембране (например, домен охватывает часть клеточной мембраны или всю клеточную мембрану). Как будет в дальнейшем понятно, не требуется, чтобы каждая аминокислота трансмембранного домена находилась в мембране. Например, в некоторых вариантах осуществления трансмембранный домен характеризуется тем, что обозначенная цепь или часть белка в основном находится в мембране. Как хорошо известно в данной области техники, последовательности аминокислот или нуклеиновых кислот могут быть проанализированы с использованием различных алгоритмов для прогнозирования внутриклеточной локализации белка (например, трансмембранной локализации). Примеры таких программ включают, среди прочих, psort (PSORT.org), Prosite (prosite.expasy.org). В целом, термин «цитоплазматический домен» в данном контексте относится к домену, находящемуся в цитоплазме. Как будет в дальнейшем понятно, не требуется, чтобы каждая аминокислота цитоплазматического домена находилась в цитоплазме. Например, в некоторых вариантах осуществления цитоплазматический домен характеризуется тем, что обозначенная цепь или часть белка в основном находится в цитоплазме. Как хорошо известно в данной области техники, последовательности аминокислот или нуклеиновых кислот могут быть проанализированы с использованием различных алгоритмов для прогнозирования внутриклеточной локализации белка (например, цитоплазматической локализации). Примеры таких программ включают, среди прочих, psort (PSORT.org), Prosite (prosite.expasy.org).
Функцией трансмембранного домена BBC-G является направление вирусного гликопротеина к клеточной мембране (Compton Τ et al., 1989 Proc Natl Acad Sci USA 86:4112-4116). Замену трансмембранного и цитоплазматического доменов BBC-G на трансмембранный и цитоплазматический домены другого белка использовали для того, чтобы направить белок к клеточной мембране, тогда как нативный белок в норме этого не делает или же для совершения этого требуются дополнительные коэкспрессирующиеся белки (Garrone Ρ et al., 2011 Sci Transi Med 94:).
Кроме всего прочего, настоящее изобретение охватывает установление того, что ВПЧ, содержащие структурный компонент вируса (например, ВЛМ) и один или несколько гетерологичных поверхностных антигенов (например, белок оболочки) являются особенно эффективными для доставки антигена и индукции иммунного ответа против гетерологичного антигена.
С. Гетерологичные Антигены
Белки оболочки ЦМВЧ, такие как гликопротеины gB и gH, являются важными мишенями для синтеза нейтрализующих антител против ЦМВЧ, поскольку нейтрализующие антитела, как правило, способны предотвратить развитие инфекции. Способы терапии для инфекции ЦМВЧ, такие как вакцины на основе субъединицы gB, были разработаны и испытаны на лабораторных животных и в клинических исследованиях. Результаты таких исследований показали, однако, что у людей, антительный ответ был недолговечным и недостаточно эффективным для лечения ЦМВЧ во всех случаях. Причинами, которые были предложены для объяснения ограниченной эффективности субъединичных вакцин, основанных исключительно на gB ЦМВЧ, являются штамм-специфические изменения в иммунных ответах, неадекватная индукция клеточного иммунного ответа и структурные ограничения, накладываемые на используемый антиген, чьи эпитопы, как полагают, являются конформационно-зависимыми. Авторы настоящего изобретения установили, что разработка вакцины ЦМВЧ, содержащей один или более полипептидных антигенов оболочки, представленных в их нативной конформации на поверхности ВПЧ, ведет к индукции нейтрализующих антител (например, с помощью гуморального иммунного ответа) и вакцина против ЦМВЧ, содержащая один или более структурных белковых антигенов (например, белок тегумента рр65) приводит к индукции Т-хелперов (TH) и ЦТЛ (например, через клеточно-опосредованный иммунный ответ). Нейтрализующие антитела обычно образуются против вирусных белков оболочки и особенно против гликопротеинов gB и gH ЦМВЧ. TH клетки стимулируются структурными белками тегумента вируса, такими как, например, рр65 (ppUL83) ЦМВЧ. Кроме того, рр65 играет важную роль в индукции ответа ЦТЛ против ЦМВЧ.
Следует понимать, что предлагаемые ВПЧ могут содержать любой гетерологичный антиген, в том числе гетерологичные антигены из ЦМВЧ. Например, в некоторых вариантах осуществления ВПЧ, соответствующая настоящему изобретению, включает в себя один или более полипептидов оболочки ЦМВЧ. В некоторых вариантах осуществления ВПЧ, соответствующая настоящему изобретению, включает в себя один или более структурных полипептидов ЦМВЧ. В некоторых вариантах осуществления ВПЧ, соответствующая настоящему изобретению, включает в себя один или более полипептидов оболочки ЦМВЧ, а также один или более структурных полипептидов ЦМВЧ. Неограничивающий перечень типичных антигенов ЦМВЧ приводится ниже.
gB - гликопротеиновый комплекс (gc)
Наиболее полно охарактеризованным гликопротеиновым комплексом ЦМВЧ является комплекс gB (gB; UL55). Было показано, что сыворотки от индивидов, серопозитивных к ЦМВ, содержат антитела к gB, и до 70% ответа нейтрализующих антител в сыворотке выздоравливающих пациентов являются gB-специфическими (Marshall GS et al., 1994 J Med Virol 43:77-83).
Примеры аминокислотной и нуклеотидной последовательностей полипептида gB ЦМВЧ приведены ниже как SEQ ID NO: 7 и SEQ ID NO: 8, соответственно. В некоторых вариантах осуществления подходящий полипептид gB гомологичен по существу известному полипептиду gB ЦМВЧ. Например, полипептид gB может являться модифицированным полипептидом gB ЦМВЧ, содержащим одну или более аминокислотных замен, делеций и/или вставок по сравнению с полипептидом gB дикого типа или природным (например, SEQ ID NO: 7). Таким образом, в некоторых вариантах осуществления полипептид gB, подходящий для настоящего изобретения, является гомологичным по существу полипептиду gB ЦМВЧ (SEQ ID NO: 7). В некоторых вариантах осуществления полипептид ЦМВЧ, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 7. В некоторых вариантах осуществления полипептид gB, подходящий для настоящего изобретения, идентичен по существу полипептиду gB ЦМВЧ (SEQ ID NO: 7). В некоторых вариантах осуществления полипептид gB, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 7.
Аминокислотная последовательность gB ЦМВЧ (SEQ ID NO: 7)


Нуклеотидная последовательность gB ЦМВЧ (SEQ ID NO: 8)


(SEQ ID NO: 8) (TM и CD подчеркнуты)
Нуклеотидная последовательность gB ЦМВЧ с оптимизированным составом кодонов (SEQ ID NO: 9)



В некоторых вариантах осуществления полипептид gB, предназначенный для применения в соответствии с настоящим изобретением, не имеет трансмембранного домена и/или цитоплазматического домена. Полипептид gB, возможно, может включать в себя один или более дополнительных полипептидов (например, гетерологичный трансмембранный домен и/или цитоплазматический домен). В некоторых вариантах осуществления полипептид gB экспрессируется в виде гибридного белка, слитого с гетерологичным полипептидом. Полипептид gB может быть связан с гетерологичным полипептидом для создания гибридного белка без изменения функции и/или антигенности gB. Например, кодирующая последовательность для гетерологичного полипептида может быть соединена посредством сплайсинга с кодирующей последовательностью для полипептида gB, например, через 3'-конец кодирующей последовательности полипептида gB. В некоторых вариантах осуществления последовательность, кодирующая гетерологичный полипептид, может быть соединена посредством сплайсинга с кодирующей последовательностью для полипептида gB без нарушения рамки считывания. В некоторых вариантах осуществления кодирующая последовательность полипептида gB и гетерологичный полипептид могут экспрессироваться под контролем одного промотора. В некоторых вариантах осуществления гетерологичный полипептид вставляют (например, путем слияния) на С-конце полипептида gB.
В некоторых вариантах осуществления гетерологичный полипептид представляет собой или включает в себя трансмембранный домен и/или цитоплазматический домен, обнаруженный у вируса везикулярного стоматита (ВВС). В некоторых вариантах осуществления gB, у которого отсутствует трансмембранный домен и/или цитоплазматический домен, сливают с трансмембранным доменом и/или цитоплазматическим доменом ВВС. Типичный гибридный полипептид gB-ВВС, предназначенный для использования в соответствии с настоящим изобретением, приведен ниже как SEQ ID NO: 10. В некоторых вариантах осуществления подходящий гибридный полипептид gB-ВВС включает в себя весь полипептид gB или его часть, которая по существу гомологична известному полипептиду gB, а также весь полипептид ВВС или его часть, которая по существу гомологична известному полипептиду ВВС. Например, гибридный белок gB-ВВС может содержать одну или несколько аминокислотных замен, делеций и/или инсерций по сравнению с gB и/или ВВС дикого типа или природного происхождения. Таким образом, в некоторых вариантах осуществления гибридный белок с полипептидом gB-ВВС, подходящий для настоящего изобретения, является по существу гомологичным SEQ ID NO: 10. В некоторых вариантах осуществления гибридный белок с полипептидом gB-ВВС, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 10. В некоторых вариантах осуществления гибридный белок с полипептидом gB-ВВС, подходящий для настоящего изобретения, идентичен по существу полипептиду gB ЦМВЧ (SEQ ID NO: 10). В некоторых вариантах осуществления гибридный белок с полипептидом gB-ВВС, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 10. В данном контексте «gB-G» относится к гибридному белку gB ЦМВЧ - TM/CTD ВВС.
Аминокислотная последовательность ЦМВЧ gB-G (SEQ ID NO: 10)

Нуклеотидная последовательность ЦМВЧ gB-G (SEQ ID NO: 11)


Нуклеотидная последовательность ЦМВЧ gB-G с оптимизированным составом кодонов (SEQ ID NO: 12)


gH - гликопротеиновый комплекс (gc) III
Комплекс gcIII содержит гликопротеины gH (UL75), gL (UL115) и gO (UL74)) (Urban М et al., 1996 J Gen Virol 77:1537 - 47). Как и gB, gH консервативен в патогенных вирусах герпеса человека и играет важную роль в ряде этапов в ходе репликации ЦМВЧ. ЦМВЧ кодирует два комплекса: gH/gL: gH/gL/gO и комплекс gH/gL/UL128/UL130/UL131 (Wang D и Shenk Т 2005 Proc Natl Acad USA 102:18153-8). gO-содержащий комплекс, как правило, достаточен для инфицирования фибробластов ЦМВЧ, в то время как комплекс, содержащий UL128/UL130/UL131, необходим для того, чтобы ЦМВЧ мог инфицировать эндотелиальные и эпителиальные клетки (Wang D и Shenk Т 2005 J Virol 79 10330-8). Природная инфекция ЦМВЧ обычно взывает появление высокого титра нейтрализующих антител, специфичных для проникновения в эпителиальные клетки, и было показано, что антитела против эпитопов gH/gL/UL128/UL130/UL131 могут иметь значительную долю этой активности (Macagnoet al., 2010 J Virol 84:1005-13). Иммунологические исследования gH показали, что в клетках млекопитающих этому белку требуются дополнительные полипептиды (такие как gL) для правильного процессинга и транспорта к клеточной мембране (Urban М et al., 1996 J Gen Virol 77:1537-1547). Если он экспрессируется один, gH обнаруживается исключительно в цитоплазме и/или ядерной мембране (Cranage MP et al., 1988 J Virol 62: 1416-1422)
Примеры аминокислотной и нуклеотидной последовательностей полипептида gH ЦМВЧ приведены ниже как SEQ ID NO: 13 и SEQ ID NO: 14, соответственно. В некоторых вариантах осуществления подходящий полипептид gH гомологичен по существу известному полипептиду gH ЦМВЧ. Например, полипептид gH может являться модифицированным полипептидом gH ЦМВЧ, содержащим одну или более аминокислотных замен, делеций и/или инсерций по сравнению с полипептидом gH дикого типа или природного происхождения (например, SEQ ID NO: 13). Таким образом, в некоторых вариантах осуществления полипептид gH, подходящий для настоящего изобретения, является гомологичным по существу полипептиду gH ЦМВЧ (SEQ ID NO: 13). В некоторых вариантах осуществления полипептид ЦМВЧ, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 13. В некоторых вариантах осуществления полипептид gH, подходящий для настоящего изобретения, идентичен по существу полипептиду gH ЦМВЧ (SEQ ID NO: 13). В некоторых вариантах осуществления полипептид gH, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 13.
Аминокислотная последовательность gH ЦМВЧ (SEQ ID NO: 13)


Нуклеотидная последовательность gH ЦМВЧ (SEQ ID NO: 14)


Нуклеотидная последовательность gH ЦМВЧ с оптимизированным составом кодонов (SEQ ID NO: 15)


В некоторых вариантах осуществления полипептид gH, предназначенный для применения в соответствии с настоящим изобретением, не имеет трансмембранного домена и/или цитоплазматического домена. Полипептид gH, возможно, может включать в себя один или более дополнительных полипептидов (например, гетерологичный трансмембранный домен и/или цитоплазматический домен). В некоторых вариантах осуществления полипептид gH экспрессируется в виде гибридного белка, слитого с гетерологичным полипептидом. Полипептид gH может быть связан с гетерологичным полипептидом для создания гибридного белка без изменения функции и/или антигенности gH. Например, кодирующая последовательность для гетерологичного полипептида может быть соединена посредством сплайсинга с кодирующей последовательностью полипептида gH, например, через 3'-конец кодирующей последовательности полипептида gH. В некоторых вариантах осуществления последовательность, кодирующая гетерологичный полипептид, может быть соединена посредством сплайсинга с кодирующей последовательностью полипептида gH без нарушения рамки считывания. В некоторых вариантах осуществления кодирующая последовательность полипептида gH и гетерологичный полипептид могут экспрессироваться под контролем одного промотора. В некоторых вариантах осуществления гетерологичный пептид вставляют (например, путем слияния) на С-конце пол и пептида gH.
В некоторых вариантах осуществления гетерологичный полипептид представляет собой или включает в себя трансмембранный домен и/или цитоплазматический домен, обнаруженный у вируса везикулярного стоматита (ВВС). В некоторых вариантах осуществления gH, у которого отсутствует трансмембранный домен и/или цитоплазматический домен, сливают с трансмембранным доменом и/или цитоплазматическим доменом ВВС. Типичный гибридный полипептид gH-ВВС, предназначенный для применения в соответствии с настоящим изобретением, приведен ниже как SEQ ID NO: 16. В некоторых вариантах осуществления подходящий гибридный полипептид gH-ВВС включает в себя весь полипептид gH или его часть, которая гомологична по существу известному полипептиду gH, а также весь полипептид ВВС или его часть, которая гомологична по существу известному полипептиду ВВС. Например, гибридный белок gH-ВВС может содержать одну или более аминокислотных замен, делеций и/или инсерций по сравнению с gH и/или ВВС дикого типа или природного происхождения. Таким образом, в некоторых вариантах осуществления гибридный белок с полипептидом gH-ВВС, подходящий для настоящего изобретения, является гомологичным по существу SEQ ID NO: 16. В некоторых вариантах осуществления гибридный белок с полипептидом gH-BBC, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную последовательности SEQ ID NO: 16. В некоторых вариантах осуществления гибридный белок с полипептидом gH-BBC, подходящий для настоящего изобретения, идентичен по существу полипептиду gH ЦМВЧ (SEQ ID NO: 16). В некоторых вариантах осуществления гибридный белок с полипептидом gH-BBC, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную последовательности SEQ ID NO: 16. В данном контексте «gH-G» относится к гибридному белку gH ЦМВЧ - TM/CTD ВВС.
Аминокислотная последовательность ЦМВЧ gH - G (SEQ ID NO: 16)

(SEQ ID NO: 16) (TM и CTD подчеркнуты)
Нуклеотидная последовательность ЦМВЧ gH - G (SEQ ID NO: 17)



Нуклеотидная последовательность ЦМВЧ gH - G с оптимизированным составом кодонов (SEQ ID NO: 18)


В некоторых вариантах осуществления полипептид gH включает в себя трансмембранный домен и/или цитоплазматический домен, обнаруженный в gB. Типичная нуклеотидная последовательность, кодирующая гибридный полипептид gH ЦМВЧ - gB TM/CTD ЦМВЧ, предназначенный для применения в соответствии с настоящим изобретением, приведена ниже как SEQ ID NO: 20. В некоторых вариантах осуществления полипептид gH ЦМВЧ - gB TM/CTD ЦМВЧ, подходящий для настоящего изобретения, гомологичен по существу полипептиду, кодируемому SEQ ID NO: 20. В некоторых вариантах осуществления полипептид gH ЦМВЧ - gB TM/CTD ЦМВЧ, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологичную полипептиду, кодируемому SEQ ID NO: 20. В некоторых вариантах осуществления полипептид gH ЦМВЧ - gB TM/CTD ЦМВЧ, подходящий для настоящего изобретения, идентичен по существу полипептиду, кодируемому SEQ ID NO: 20. В некоторых вариантах осуществления полипептид gH ЦМВЧ - gB TM/CTD ЦМВЧ, подходящий для настоящего изобретения, имеет аминокислотную последовательность, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичную полипептиду, кодируемому SEQ ID NO: 20.
Нуклеотидная последовательность gH ЦМВЧ - gB TM/CTD ЦМВЧ (SEQ ID NO: 20)


Другие (включая gN и gM - гликопротеиновый комплекс (gc) II
Помимо gB и gH, в разработке вакцин могут быть полезны и другие гликопротеины оболочки. Например, представляет особый интерес комплекс gcII, содержащий gN (UL73) и gM (UL100). Протеомный анализ вирионов ЦМВЧ продемонстрировал, что gcII является наиболее интенсивно экспрессирующимся гликопротеином в вирусных частицах, что указывает на его потенциальное значение в защитном иммунитете (Varnum SM et al., 2005 Human Gene r 16:1143-50). Инфекция ЦМВЧ вызывает gcII-специфический антительный ответ у большинства серопозитивных индивидов (Shimamura М et al., 2006 J Virol 80:4591-600), и было показано, что ДНК-вакцины, содержащие антигены gcII gM и gN вызывают ответы с образованием нейтрализующих антител у кроликов и у мышей (Shen S et al., 2007 Vaccine 25:3319-27).
pp65
Клеточный иммунный ответ на ЦМВЧ включает в себя МНС (главный комплекс гистосовместимости) II класса, ограниченный CD4+ и МНС I класса, ограниченный CD8+ цитотоксическими Т-клеточными ответами на ряд вирусных антигенов, многие из которых обнаружены в тегументе вируса, области вирусной частицы, которая находится между оболочкой и нуклеокапсидом. Например, белок рр65 (UL83) ЦМВЧ, как было показано, вызывает значительный CD8+ T-клеточный ответ после инфицирования ЦМВЧ (McLaughlin-Taylor Ε 1994 J Med Virol 43:103-10). Этот вирусный белок с молекулярной массой 65 кДа является одним из наиболее интенсивно экспрессирующихся структурных белков ЦМВЧ. Примеры последовательностей рр65 описаны в настоящей заявке.
Другие (включая IE1, ppΙ50)
Другие белки, которые вызывают T-клеточные ответы, включают белок IE1 (предранний-1) (UL123) и ppI50 (UL32) (Gibson L et al., 2004 J Immunol 172:2256-64; La Rosa С et al., 2005 Human Immunol 66:116-26).
Как описано выше, полипептид Gag, возможно, включает один или более дополнительных полипептидов (например, гетерологичный антиген). В некоторых вариантах осуществления полипептид Gag коэкспрессируется совместно с гетерологичным антигеном (например, под отдельными промоторами и/или в виде отдельных белков). Полипептид Gag может коэкспрессироваться совместно с гетерологичным антигеном без изменения функции Gag. Вне связи с какой-либо теорией полагают, что коэкспрессия самособирающегося полипептида Gag совместно с гетерологичным антигеном оболочки позволит антигену быть включенным в оболочку или липидный бислой образующейся ВПЧ. В некоторых вариантах осуществления компоненты оболочки ВПЧ служат эффективными иммуногенами (например, для индукции гуморального иммунного ответа). В некоторых вариантах осуществления полипептид Gag экспрессируется в виде гибридного белка, слитого с гетерологичным антигеном. Например, кодирующая последовательность гетерологичного антигена может быть соединена посредством сплайсинга с кодирующей последовательностью полипептида Gag, например, через 3'-конец кодирующей последовательности полипептида Gag. В некоторых вариантах осуществления последовательность, кодирующая гетерологичный антиген, может быть соединена посредством сплайсинга с кодирующей последовательностью полипептида Gag без нарушения рамки считывания. В некоторых вариантах осуществления кодирующая последовательность полипептида Gag и гетерологичный антиген могут экспрессироваться под контролем одного промотора. В некоторых вариантах осуществления гетерологичный антиген вставляют (например, путем слияния) на С-конце полипептида Gag. Вне связи с какой-либо теорией полагают, что слияние самособирающегося полипептида Gag с гетерологичным антигеном позволит этому антигену быть включенным в структурные компоненты образующейся ВПЧ. В некоторых вариантах осуществления структурные компоненты ВПЧ служат эффективными иммуногенами (например, для индукции клеточного иммунного ответа). Например, предлагаемые ВПЧ могут содержать ретровирусный полипептид Gag (например, Gag ВЛМ) и структурный компонент ЦМВЧ (например, рр65). В некоторых таких вариантах осуществления рр65 включен в ВПЧ и служит антигеном для индукции иммунного ответа против ЦМВЧ.
Предлагаемые ВПЧ могут содержать структурный ретровирусный белок (например, полипептид Gag), который расположен и сконструирован таким образом, что он собирается самостоятельно с образованием ВПЧ и помещается внутри ВПЧ. В некоторых вариантах осуществления, предлагаемые ВПЧ содержат белок оболочки (например, gB и/или gH), который расположен и сконструирован таким образом, что один или более эпитопов белка оболочки (например, gB и/или gH) расположен на поверхности ВПЧ. В некоторых вариантах осуществления, предлагаемые ВПЧ, содержат гибридный структурный белок (например, Gag/pp65), который расположен и сконструирован таким образом, что один или более эпитопов структурного белка (например, рр65) расположен внутри ВПЧ.
II. Получение ВПЧ
Следует понимать, что композиция, содержащая ВПЧ, как правило, включает в себя смесь ВПЧ с размерами в каком-либо диапазоне. Должно быть понятно, что величины диаметров, перечисленные ниже, соответствуют наиболее часто встречающейся величине диаметра в смеси. В некоторых вариантах осуществления > 90% везикул в композиции будут иметь диаметр, который лежит в пределах 50% от наиболее часто встречающейся величины (например, 1000±500 нм). В некоторых вариантах осуществления распределение может быть более узким, например, > 90% везикул в композиции могут иметь диаметр, который лежит в пределах 40, 30, 20, 10 или 5% от наиболее часто встречающейся величины. В некоторых вариантах осуществления обработка звуком или ультразвуком могут быть использованы для облегчения формирования ВПЧ и/или изменения размера ВПЧ. В некоторых вариантах осуществления фильтрация, диализ и/или центрифугирование могут быть использованы для регулирования распределения ВПЧ по размеру.
В целом, ВПЧ, полученные в соответствии со способами, описанными в настоящей заявке, могут быть любого размера. В некоторых вариантах осуществления композиция может включать в себя вирусоподобные частицы с диаметром в интервале от примерно 20 нм до примерно 300 нм. В некоторых вариантах осуществления ВПЧ характеризуется тем, что она имеет диаметр в диапазоне, ограниченном нижним пределом 20, 30, 40, 50, 60, 70, 80, 90 или 100 нм и ограниченном верхним пределом 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, или 170 нм. В некоторых вариантах осуществления ВПЧ в популяции демонстрируют средний диаметр в диапазоне, ограниченном нижним пределом 20, 30, 40, 50, 60, 70, 80, 90 или 100 нм и ограниченном верхним пределом 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, или 170 нм. В некоторых вариантах осуществления ВПЧ в популяции имеют индекс полидисперсности меньше 0,5 (например, меньше 0,45, меньше 0,4 или меньше 0,3). В некоторых вариантах осуществления диаметр ВПЧ определяется способами, предназначенными для наноразмеров. В некоторых вариантах осуществления диаметр ВПЧ определяется с помощью электронной микроскопии.
А. Получение ВПЧ in vitro/ex vivo
Предлагаемые ВПЧ, в соответствии с настоящим изобретением, могут быть получены на основании общих методик, известных специалистам в данной области. Например, различные молекулы нуклеиновых кислот, геномы или восстановленные векторы или плазмиды могут быть получены с использованием последовательностей известных вирусов. Такие последовательности можно получить из банков, и материал может быть получен из различных коллекций, опубликованных плазмид и т.д. Эти элементы могут быть выделены и обработаны с помощью техник, хорошо известных специалистам в данной области, или выделены из плазмид, доступных в данной области. Различные синтетические или искусственные последовательности также могут быть получены с помощью компьютерного анализа или с помощью (высокопроизводительного) скрининга библиотек. Рекомбинантная экспрессия полипептидов для ВПЧ требует конструирования вектора экспрессии, содержащего полинуклеотид, который кодирует один или более полипептид(ов). После того, как полинуклеотид, кодирующий один или более полипептидов, был получен, вектор для синтеза полипептида может быть создан за счет технологии рекомбинантной ДНК с применением техник, известных в данной области техники. Векторы экспрессии, которые могут быть использованы в соответствии с настоящим изобретением, включают, помимо прочего, векторы экспрессии у млекопитающих, бакуловирусные векторы экспрессии, векторы экспрессии у растений (например, вирус мозаики цветной капусты (ВМЦК), вирус табачной мозаики (ВТМ)), плазмидные векторы экспрессии (например, Ti-плазмида) и другие.
Пример плазмиды экспрессии ВПЧ, которая может быть использована в соответствии с настоящим изобретением, показан ниже как SEQ ID NO: 19:
Плазмида для экспрессии Propol II (SEQ ID NO: 19)




Предлагаемые ВПЧ можно получить в соответствии со способами, известными в данной области техники. Например, в некоторых вариантах осуществления, предлагаемые ВПЧ могут быть получены в любой доступной системе экспрессии белка. Как правило, вектор экспрессии переносят в клетку-хозяина с помощью обычных методик и трансфицированные клетки затем культивируют с помощью обычных методик для получения ВПЧ. В некоторых вариантах осуществления ВПЧ получают с использованием временной трансфекции клеток. В некоторых вариантах осуществления ВПЧ получают с использованием стабильно трансфицированных клеток. Типичные клеточные линии, которые могут быть использованы для производства ВПЧ, включают, помимо прочего, клеточные линии млекопитающих, такие как клетки почки эмбриона человека (НЕК) 293, WI 38, яичника китайского хомячка (СНО), почки обезьяны (COS), НТ1080, C1O, HeLa, почки детеныша хомячка (ВНК), 3Т3, С127, CV-1, HaK, NS/О и L- 929. Конкретные неограничивающие примеры включают, помимо прочего, линию миеломы мыши BALB/C (NSO/1, ЕСАСС No: 85110503); ретинобласты человека (PER.C6 (CruCell, Лейден, Нидерланды)); линию почек обезьяны CV1, трансформированную SV40 (COS-7, АТСС CRL 1651); линию клеток почки эмбриона человека (293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol, 36:59 (1977)); клетки почки детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка +/- DHFR (СНО, Urlaub и Chasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod., 23:243-251 (1980)); клетки почки обезьяны (CV1 АТСС CCL 70); клетки почки африканской зеленой мартышки (VERO-76, АТСС CRL-1 587); клетки карциномы шейки матки человека (HeLa, АТСС CCL 2); клетки почки собаки (MDCK, АТСС CCL 34); клетки печени крысы линии Буффало (BRL 3А, АТСС CRL 1442); клетки легкого человека (W138, АТСС CCL 75); клетки печени человека (Hep G2, НВ 8065); опухоль молочной железы мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci., 383:44-68 (1982)); клетки MRC 5; клетки FS-4 и линия гепатомы человека (Hep G2). В некоторых вариантах осуществления клеточные линии, которые могут быть использованы для получения ВПЧ, включают клетки насекомых (например, Sf-9, Sf-21, Tn-368, Hi5) или растений (например, бобовых, злаков или табака). Следует понимать, что в некоторых вариантах осуществления, особенно в тех случаях, когда гликозилирование важно для функции белка, клетки млекопитающих являются предпочтительными для экспрессии белка и/или производства ВПЧ (see, e.g., Roldao A et al., 2010 Expt Rev Vaccines 9:1149-76).
Следует понимать, что может быть выбран клеточный штамм, который изменяет экспрессию внесенных последовательностей или определенным образом модифицирует и процессирует генный продукт. Такие модификации белковых продуктов (например, гликозилирование) и процессинг (например, рарезание или транспорт к мембране) могут быть важными для получения ВПЧ или для функционирования полипептида ВПЧ или дополнительного полипептида (например, адъюванта или дополнительного антигена). Различные клетки имеют характерные и специфические механизмы посттрансляционного процессинга и модификации белков и генных продуктов. Для обеспечения правильных модификации и процессинга экспрессирующегося чужеродного белка могут быть выбраны подходящие клеточные линии или системы клеток-хозяев. В соответствии с настоящим изобретением, как правило, могут быть использованы эукариотические клетки-хозяева, также называемые упаковывающими клетками (например, клетки 293Т почки эмбриона человека), которые обладают соответствующим клеточным аппаратом для правильного процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта.
ВПЧ могут быть очищены в соответствии с известными методиками, такими как, среди прочего, центрифугирование, градиенты, ультрацентрифугирование в градиенте сахарозы, тангенциальня поточная фильтрация и хроматография (например, ионообменная (анионо- и катионообменная), аффинная и эксклюзионная колоночная хроматография или дифференциальная растворимость. В качестве альтернативы или дополнительно, клеткочный супернатант может быть использован непосредственно, без стадии очистки. Дополнительные объекты, такие как дополнительные антигены или адъюванты, могут быть добавлены к очищенным ВПЧ.
В некоторых вариантах осуществления, предлагаемые полинуклеотидные последовательности имеют оптимизированный состав кодонов. Оптимизация состава кодонов хорошо известна в данной области техники и включает в себя модификацию кодонов, направленную на производство более высоких уровней белка.
B. Получение ВПЧ in vivo
Предлагаемые ВПЧ, в соответствии с настоящим изобретением, могут быть получены как ДНК-вакцины в соответствии с методами, хорошо известными в данной области техники. Например, в некоторых вариантах осуществления один или более векторов или плазмид, например, таких как те, что описаны выше, вводят субъекту таким образом, что клетки-реципиенты экспрессируют полипептиды, кодируемые вектором или плазмидой. В некоторых вариантах осуществления клетки-реципиенты, экспрессирующие такие полипептиды, производят ВПЧ, содержащие полипептиды.
C. Моно-, би -, трехвалентные еВПЧ
В соответствии с настоящим изобретением, клетки могут быть трансфицированы одним вектором экспрессии, как описано в настоящей заявке. В некоторых вариантах осуществления один вектор экспрессии кодирует более чем один элемент ВПЧ (например, больше одного структурного полипротеина, полипептида тегумента ЦМВ, гликопротеина ЦМВ и т.д.). Например, в некоторых вариантах осуществления один вектор экспрессии кодирует два или более элементов ВПЧ. В некоторых вариантах осуществления один вектор экспрессии кодирует три или более элемента ВПЧ.
В некоторых вариантах осуществления клетки трансфицируют двумя или более векторами эксперессии. Например, в некоторых вариантах осуществления клетки трансфицируют первым вектором, кодирующим полипептид Gag, и вторым вектором, кодирующим гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых таких вариантах осуществления производят «моновалентные» ВВС, содержащие гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых вариантах осуществления клетки трансфицируют первым вектором, кодирующим полипептид Gag, вторым вектором, кодирующим гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G) и третьим вектором, кодирующим другой гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых таких вариантах осуществления производят «бивалентные» ВПЧ, содержащие два гликопротеина оболочки ЦМВЧ (например, gB и gH-G или gB-G и gH-G). В некоторых вариантах осуществления клетки трансфицируют первым вектором, кодирующим гибридный полипептид Gag-pp65, и вторым вектором, кодирующим гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых таких вариантах осуществления производят «бивалентные» ВПЧ, содержащие структурный белок ЦМВЧ и гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых вариантах осуществления клетки трансфицируют первым вектором, кодирующим гибридный полипептид Gag-pp65, вторым вектором, кодирующим гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G), и третьим вектором, кодирующим другой гликопротеин оболочки ЦМВЧ (например, gB или gB-G или gH-G). В некоторых таких вариантах осуществления производят «трехвалентные» ВПЧ, содержащие структурный белок ЦМВЧ и два гликопротеина оболочки ЦМВЧ (например, gB и gH-G или gB-G и gH-G).
В некоторых вариантах осуществления моновалентные, бивалентные или трехвалентные ВПЧ смешивают. Например, в некоторых вариантах осуществления моновалентные и бивалентные ВПЧ смешивают с образованием трехвалентной смеси ВПЧ. В некоторых вариантах осуществления две бивалентных ВПЧ смешивают с образованием трехвалентной смеси ВПЧ.
III. Инфекция ЦМВЧ и ее лечение
Цитомегаловирус человека, (ЦМВЧ), β-герпесвирус, является повсеместно встречающимся патогеном. В целом, проникновение герпесвирусов в клетки представляет собой сложный процесс, который начинается с адсорбции и связывания с рецептором, за которым следует слияние вирусной оболочки с клеточной мембраной. Слияние обычно происходит либо на плазматической мембране, либо на мембране эндосомы. ЦМВЧ заражает множество типов клеток в живом организме, в том числе эпителиальные клетки, эндотелиальные клетки и фибробласты (Plachter В et al., 1996 Adv Virus Res 46:195-261). Он сливается с плазматической мембраной фибробластов (Compton Τ et al., 1992 Virology 191:387-395), но в пигментные эпителиальные клетки сетчатки и эндотелиальные клетки пупочной вены он проникает посредством эндоцитоза (Bodaghi В et al., 1999 J Immunol 162:957-964; Ryckman BJ et al., 2006 J Virol 80:710-722). Механизм, посредством которого герпесвирусы выбирают свой путь проникновения, остается неясным. Принято считать, что пути проникновения в основном определяются клеткой-хозяином, но существует доказательство функций тропизма гликопротеинов вириона (Wang X et al., 1998 J Virol 72:5552-5558). Как упоминалось ранее, ЦМВЧ кодирует два комплекса gH/gL: gH/gL/gO и gH/gL/UL128/UL130/UL131. gO-содержащий комплекс достаточен для инфицирования фибробластов, в то время как pUL128/UL130/UL131 - содержащий комплекс имеет важное значение для инфицирования ЦМВЧ эндотелиальных и эпителиальных клеток.
ЦМВЧ заражает 50-85% взрослых к 40 годам (Gershon АА et al., 1997 in Viral Infections Humans, 4th edition, New York; Plenum Press:229-251). У большинства здоровых индивидов, которые приобретают ЦМВЧ после рождения, развивается мало симптомов, если таковые вообще имеются. Тем не менее, заболевание ЦМВЧ является причиной значительной заболеваемости и смертности среди лиц с ослабленным иммунитетом, таких как реципиенты трансплантатов гемопоэтических клеток (НСТ, hematopoietic cell transplants) и трансплантатов цельных органов (SOT, solid-organ transplants) (Pass RF 2001 Cytomegalovirus. In Fields Virology. 4th edition, Philadelphia; Lippincott Williams & Wilkens:2675-2705). В популяциях с SOT или НСТ заболевание ЦМВЧ может либо развиваться из новой инфекции, передаваемой от донорского органа или НСТ, либо повторяться в результате реактивации латентного вируса у реципиента. У ВИЧ-инфицированных индивидов инфекция ЦМВЧ ускоряет развитие СПИДа и смертельный исход, несмотря на доступность антиретровирусной терапии (Deayton JR et al., 2004 Lancet 363:2116-2121). Кроме того, в США ЦМВЧ является наиболее распространенной внутриутробной инфекцией и вызывает врожденные аномалии, приводящие к гибели или тяжелым врожденным дефектам, в том числе к глухоте и умственной отсталости, примерно у 8000 детей каждый год (Stagon S et al., 1986 JAMA 256:1904-1908).
Иммунные реакции, которые контролируют ЦМВЧ, изучены не полностью. По аналогии с другими человеческими вирусами герпеса можно предположить, что важную роль играет и клеточный, и гуморальный иммунные ответы (Kohl S 1992 Current topics in Microbiology и Immunology 179:75-88). Для ЦМВ мышей было показано, что ответ цитотоксических Т-клеток или пассивный перенос нейтрализующих антител достаточны для защиты от летального инфицирования (Rapp M et al., 1993 Multidisciplinary Approach to Understanding Cytomegalovirus Disease:327-332; Reddehase MJ et al., 198 J Virology 61:3102-3108).
Контроль ЦМВ у лиц с ослабленным иммунитетом связан прежде всего с клеточным иммунным ответом; и CD8+, и CD4+ Т-лимфоциты, как представляется, важны для защиты от инфекции ЦМВ (Gamadia LE et al., 2003 Blood 101:2686-2692; Cobbold M et al., 2005 J Exp Med 202:379-386). Клеточный иммунный ответ к ЦМВ включает в себя ответы с активацией CD4+-хелперных Т-лимфоцитов и CD8+-цитотоксических Т-лимфоцитов на ряд антигенов, обнаруженных в тегументе вируса, области вирусной частицы между оболочкой и капсидом. В недавнем исследовании ЦМВ-специфичных CD4+ и CD8+ Т-клеток от здоровых доноров использовали перекрывающиеся пептиды из серий открытых рамок считывания ЦМВ для выявления антигенов, которые распознаются после инфекции ЦМВЧ (Sylwester AW et al., 2005 J Exp Med 202:673-685). Фосфопротеин 65 тегумента ЦМВ (рр65) и поверхностный гликопротеин gB были антигенами, наиболее часто распознаваемыми CD4+ Т-клетками, а рр65 также был одним из антигенов, наиболее часто распознаваемым CD8+ Т-клетками.
В отличие от случаев с пересадкой трансплантата, материнский гуморальный иммунный ответ против вируса, как представляется, играет важную роль в предотвращении заболеваний ЦМВЧ у новорожденных. Антитела к поверхностным гликопротеинам, особенно gB, по-видимому, имеют решающее значение для защиты от передачи ЦМВЧ от матери плоду (Fowler KB et al., 2003 JAMA 289:1008-1011). Кроме того, в более раннем исследовании вакцинирования было показано, что защита от повторного инфицирования связана с нейтрализующими антителами (Adler SP et al., 1995 J Infectious Diseases 171:26-32). В гуморальном иммунном ответе на ЦМВ преобладают ответы на гликопротеины вирусной оболочки, присутствующие во внешней оболочке вирусной частицы (например, gB и gH).
В случае ЦМВЧ прямая оценка функций иммунологических эффекторов затруднена, так как вирус строго видоспецифичен и не существует системы с модельным животным. Тем не менее, ЦМВ мыши и ЦМВ морской свинки были использованы для оценки стратегий по применению вакцины у этих видов хозяев.
Вакцина от ЦМВ, которая индуцирует иммунные ответы и с активацией защитных Т-клеток, и с повышением титра нейтрализующих антител, имеет потенциал, чтобы предотвратить инфекцию или облегчить заболевание ЦМВ, возникшее в результате врожденной инфекции или трансплантации.
Первая предполагаемая живая ослабленная вакцина от ЦМВЧ, протестированная на людях, была основана на лабораторно адаптированном штамме AD169. Последующие испытания с другим лабораторно адаптированным клиническим изолятом, штаммом Towne, подтвердили, что живые ослабленные вакцины могут вызвать продукцию нейтрализующих антител, а также ответы с активацией Т-лимфоцитов CD4+ и CD8+. Эффективность вакцины Towne оценивалась в серии исследований реципиентов почечных трансплантатов. Хотя вакцина Towne и оказала защитное воздействие при заболевании ЦМВЧ, она не смогла предотвратить инфицирование ЦМВЧ после трансплантации (Plotkin SA et al., 1984 Lancet 1:528-530). Вакцина Towne также была оценена в плацебо-контролируемом исследовании серонегативных матерей, имевших детей, которые посещали группы детского сада, и в этом исследовании вакцина не смогла предотвратить получение этими женщинами инфекции от своих инфицированных ЦМВЧ детей (Adler SP et al., 1995 J Infectious Diseases 171:26-32). Интерпретация этих исследований заключалась в том, что вакцина Towne была слишком ослабленной. Чтобы исследовать эту возможность, был создан ряд генетических рекомбинантов, в которых области генома неослабленного штамма ЦМВ «Toledo» были заменены на соответствующие области генома Towne, что привело к конструированию «химер» Towne/Toledo, которые содержат некоторые, хотя и не все, мутации, способствующие ослаблению вакцины Towne (Heineman ТС et al. 2006 J Infect Disease 193:1350-1360). В настоящее время проводится I фаза испытания четырех «химер» Towne/Toledo на их безопасность и переносимость. Беспокойство о долгосрочной безопасности, т.е. о потенциальном риске развития латентной инфекции ЦМВЧ, тормозит дальнейшее развитие живых ослабленных вакцин.
Основной кандидат на роль субъединичной вакцины от ЦМВ основан на гликопротеине оболочки gB (очищенная рекомбинантная вакцина gB производится компанией Sanofi-Pasteur Vaccines) из-за способности этого белка вызывать ответы с высоким титром вирус-нейтрализующих антител при естественной инфекции. Рекомбинантная вакцина gB вызывает ответ с продукцией нейтрализующих антител и имеет превосходные показатели безопасности, однако она исключает другие гликопротеины из возможных мишеней ответа с продукцией нейтрализующих антител и, что еще более важно, из возможных мишеней Т-лимфоцитов. Для этой вакцины требуется адъювант MF59 для оптимизации иммуногенности. По результатам самого последнего испытания эта вакцина обеспечивает 50% общую эффективность для профилактики инфекции ЦМВЧ в фазе 2 клинического испытания на молодой женщине (Pass RF et al., 2009 N Engl J Med 360:1191-1199). Другие вирусные белки, которые в настоящее время рассматриваются как кандидаты на роль субъединичных вакцин, включают рр65 и IE1, оба из которых вызывают ответы с активацией Т-клеток.
ДНК-вакцины вызывают устойчивые клеточные и гуморальные иммунные реакции у животных и хорошо соответствуют требованиям по параметрам специфичности и точности в разработке вакцин. ДНК-вакцины были разработаны для ЦМВЧ, и они были направлены на белки gB, IE1 и рр65 в качестве кандидатов на роль иммуногенов-мишеней. Кандидат на роль бивалентной ДНК вакцины от ЦМВ (Wloch МК 2008 J Infectious Diseases 297: 1634-1642), с использованием плазмидной ДНК, кодирующей рр65 и gB, и кандидат на роль трехвалентной вакцины (Jacobson MA 2009 Vaccine 27:1540-1548), который также включает в себя третью плазмиду, кодирующую генный продукт IE1, были разработаны компанией Vical Vaccines (патент US 7,410,795). Отдельно взятая трехвалентная ДНК-вакцина имела минимальную иммуногенность, независимо от способа введения. Однако вакцина ДНК против ЦМВ, как оказалось, безопасно активирует вторичный иммунный ответ на антигены ЦМВ, наблюдаемый после введения живого ослабленного ЦМВ (Towne).
В векторном подходе к вакцинам продукт гена интереса экспрессируется в контексте нереплицируемого (как правило, вирусного) носителя. Одним из примеров этого является вектор на основе вируса канарипокс, называемый ALVAC, который разработан компаниями Virogenetics и Sanofi-Pasteur Vaccines, и который является ослабленным поксвирусом и реплицируется абортивно в клетках млекопитающих. ALVAC, экспрессирующий gB ЦМВ и ALVAC, экспрессирующий рр65 (US 6,267,965) были протестированы в ходе клинических испытаний. ALVAC-ЦМВ(gB) не вызывал продукцию нейтрализующих антител, способствовал более высокому титру нейтрализующих антител после последующего инфицирования штаммом ЦМВ Towne (Adler SP et al. 1999 J Infectious Diseases 180:843-846), хотя он, как оказалось, не повышал титры нейтрализующих антител после последующей иммунизации субъединичной вакциной gB/MF59 (Bernstein DI et al. 2002 J Infectious Diseases 185:686-690). Вектор на основе канарипокса, экспрессирующий рр65, ALVAC-ЦМВ (рр64), индуцировал долгосрочные ответы с активацией цитотоксических лимфоцитов (ЦТЛ) у всех исходно серонегативных добровольцев, с частотами, сопоставимыми с таковыми у физических лиц, ставших серопозитивными из-за естественных причин (Berencsi K et al. 2001 J Infectious Diseases 183:1171-1179). Другой подход, используемый для экспрессии gB в качестве векторной вакцины, представляет собой применение системы репликона альфавируса компанией AlphaVax Inc (US 7,419,674). Этот подход использует векторную систему репликона РНК дефектную в размножении и способную лишь к одному циклу репликации, которая была получена из ослабленного штамма альфавируса, вируса венесуэльского конского энцефалита (VEE), для получения вирусоподобных репликонных частиц (VRPs), экспрессирующих белки рр65, IE1 или gB (Berstein et al., 2010 Vaccine 28:484-493). Двукомпонентная альфавирусная репликонная вакцина, использованная для экспрессии трех белков ЦМВ в виде растворимой формы gB ЦМВ (штамм Towne) и гибридного белка pp65/IE1 (Reap ЕА et al. 2007 Vaccine 25:7441-7449), как было обнаружено, являлась безопасной и индуцировала высокие уровни нейтрализующих антител и полифункциональные антиген-специфические CD4+ и CD8+ Т-клеточные ответы. Среднее геометрическое значение титра (GMT) для группы с высокой дозой, равнялось приблизительно половине GMT для 12 естественно зараженных, серопозитивных по ЦМВЧ индивидов, проверенных в этом анализе.
Новым кандидатом для вакцинации против ЦМВЧ, который в настоящее время находится на стадии доклинической разработки, является вакцина на основе «плотных телец». Плотные тельца (DB) представляют собой окруженные оболочкой, дефектные по репликации частицы, которые образовались в процессе репликации ЦМВ в клеточной культуре. Они содержат и гликопротеины оболочки, и, в больших количествах, белок рр65. Плотные тельца являются неинфекционными и иммуногенными, но они не в состоянии развить латентную инфекцию инфекции ЦМВЧ у реципиента вакцины. Плотные тельца, как было показано, способны индуцировать ответы с продукцией вирусных нейтрализующих антител и активацией Т-клеток у мышей в отсутствие экспрессии вирусных генов (Pepperl S et al., 2000 J Virol 74:6132-6146 - WO 00/53729 и US 6,713,070).
IV. Фармацевтические композиции
Настоящее изобретение предлагает фармацевтические композиции, содержащие предлагаемые ВПЧ и/или предлагаемые варианты гликопротеинов. В некоторых вариантах осуществления настоящее изобретение предлагает ВПЧ и, по меньшей мере, один фармацевтически приемлемый наполнитель. Такие фармацевтические композиции могут, возможно, содержать и/или вводиться в комбинации с одним или более дополнительными терапевтически активными веществами. В некоторых вариантах осуществления, предложенные фармацевтические композиции применимы в медицине. В некоторых вариантах осуществления предложенные фармацевтические композиции применимы как профилактические агенты (т.е. вакцины) в лечении или профилактике ЦМВЧ или негативных последствий, связанных или коррелирующих с инфекцией ЦМВЧ. В некоторых вариантах осуществления предложенные фармацевтические композиции применимы для терапевтических назначений, например, у индивидов, страдающих от инфекции ЦМВЧ или восприимчивых к ней. В некоторых вариантах осуществления создают фармацевтические композиции для введения людям.
Например, фармацевтические композиции, предлагаемые в настоящей заявке, могут быть предложены в форме стерильных инъекциий (например, в форме, пригодной для подкожной инъекции или внутривенного вливания). Например, в некоторых вариантах осуществления фармацевтические композиции предложены в виде жидкой лекарственной формы, пригодной для инъекции. В некоторых вариантах осуществления фармацевтические композиции представлены в виде порошков (например, лиофилизированные и/или стерилизованные), возможно, под вакуумом, которые восстанавливают с помощью водного разбавителя (например, вода, буфер, солевой раствор и т.д.) перед инъекцией. В некоторых вариантах осуществления фармацевтические композиции разбавляют и/или восстанавливают в воде, в растворе хлорида натрия, в растворе ацетата натрия, в растворе бензилового спирта, в забуференном фосфатом физиологическом растворе и т.д. В некоторых вариантах осуществления порошок следует осторожно перемешивать с водным разбавителем (например, не встряхивать).
В некоторых вариантах осуществления, предложенные фармацевтические композиции содержат один или более фармацевтически приемлемых наполнителей (например, консервант, инертный разбавитель, диспергирующий агент, поверхностно-активное вещество и/или эмульгатор, буферный агент и т.д.). Подходящие наполнители включают, например, воду, физиологический раствор, декстрозу, сахарозу, трегалозу, глицерин, этанол или подобные наполнители и их комбинации. Кроме того, если желательно, вакцина может содержать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, буферные агенты для поддержания pH или адъюванты, которые усиливают эффективность вакцины. В некоторых вариантах реализации, фармацевтические композиции содержат один или несколько консервантов. В некоторых вариантах реализации фармацевтические композиции не содержат консервантов.
В некоторых вариантах осуществления фармацевтические композиции представлены в форме, которая может быть охлаждена и/или заморожена. В некоторых вариантах осуществления фармацевтические композиции представлены в форме, которая не может быть охлаждена и/или заморожена. В некоторых вариантах осуществления восстановленные растворы и/или жидкие лекарственные формы могут храниться в течение определенного периода времени после восстановления (например, 2 часа, 12 часов, 24 часа, 2 дня, 5 дней, 7 дней, 10 дней, 2 недели, месяц, два месяца или дольше). В некоторых вариантах осуществления хранение состава ВПЧ дольше указанного времени приводит к деградации ВПЧ.
Жидкие лекарственные формы и/или восстановленные растворы могут содержать твердые частицы и/или обесцвечиваться до введения. В некоторых вариантах осуществления раствор не должен применяться, если он обесцвечен или мутный и/или, если после фильтрации остаются твердые частицы.
Составы фармацевтических композиций, описанные в настоящей заявке, могут быть получены любым способом, известным или разработанным в дальнейшем в данной области фармакологии. В некоторых вариантах осуществления такие способы получения включают стадию приведения активного ингредиента в ассоциацию с одним или несколькими наполнителями и/или одним или несколькими другими дополнительными ингредиентами, а затем, если это необходимо и/или желательно, формирование и/или упаковку продукта в виде однократной или многократной единицы дозы.
Фармацевтическая композиция в соответствии с настоящим изобретением, может быть получена, упакована и/или продана без упаковки, в виде разовой единичной дозы и/или в виде множества единичных доз. В данном контексте термин «единичная доза» представляет собой отдельное количество фармацевтической композиции, содержащее заданное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозе, которую нужно ввести субъекту и/или удобной доле дозы, как, например, половина или одна треть такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемый наполнитель, и/или любые дополнительные ингредиенты в фармацевтической композиции, в соответствии с настоящим изобретением, могут изменяться в зависимости от особенностей, размера и/или состояния субъекта, подвергаемого лечению, и/или в зависимости от того, как композиция должна быть введена. В качестве примера, композиция может содержать от 0,1 до 100 масс./масс. % активного ингредиента.
Фармацевтические композиции настоящего изобретения могут дополнительно содержать фармацевтически приемлемый наполнитель, который, в данном контексте, может представлять собой или включать в себя растворители, дисперсионные среды, разбавители или другие жидкие носители, средства для диспергирования или суспендирования, поверхностно-активные агенты, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие вещества, смазывающие вещества и тому подобное, в соответствии с конкретной желаемой лекарственной формой. В работе Remington's The Science и Practice of Pharmacy, 21st Edition, A.R. Gennaro, (Lippincott, Williams & Wilkins, Baltimore, MD, 2006) раскрываются различные наполнители, используемые в составлении фармацевтических композиций, и известные способы их получения. За исключением случаев, когда любая обычная среда для наполнения несовместима с веществом или его производными, например, из-за развития любого нежелательного биологического эффекта или иного вредоносного взаимодействия с любым другим компонентом (-ами) фармацевтической композиции, предполагается, что ее применение находится в рамках настоящего изобретения.
В некоторых вариантах осуществления фармацевтическая композиция является достаточно иммуногенной, как вакцина (например, в отсутствие адъюванта). В некоторых вариантах осуществления иммуногенность фармацевтической композиции усиливается с помощью включения адъюванта. Любой адъювант может быть применен в соответствии с настоящим изобретением. Известно большое количество адъювантов; полезный сборник, содержащий много таких соединений, подготовлен Национальными Институтами Здоровья (США) и может быть найден по ссылке (www.niaid.nih.gov/daids/vaccine/pdf/compendium.pdf). См. также Allison (1998, Dev. Biol. Stand., 92:3-11; ссылка включена в настоящую заявку), Unkeless et al. (1998, Annu. Rev. Immunol., 6:251-281; ссылка включена в настоящую заявку) и Phillips et al. (1992, Vaccine, 10:151-158; ссылка включена в настоящую заявку). В данной области техники известны сотни различных адъювантов и они могут быть использованы в практике настоящего изобретения. Примеры адъювантов, которые могут быть использованы в соответствии с изобретением, включают, помимо прочего, цитокины, адъюванты на основе геля (например, гидроксид алюминия, фосфат алюминия, фосфат кальция, и т.д.); микробные адъюванты (например, иммуномодулирующие последовательности ДНК, которые включают CpG мотивы; эндотоксины, такие как монофосфорил липид А; экзотоксины, такие как холерный токсин, термолабильный токсин E. coli и токсин коклюша; мурамилдипептид и т.д.); адъюванты на основе масляных эмульсий и эмульгаторов (например, адъюванты Freund's Adjuvant, MF59 [Novartis], SAF и т.д.); адъюванты на основе частиц (например, липосомы, биоразлагаемые микросферы, сапонины и др.); синтетические адъюванты (например, неионные блоковые сополимеры, аналоги мурамилпептида, полифосфазен, синтетические полинуклеотиды и т.д.); и/или их комбинации. Другие примеры адъювантов включают некоторые полимеры (например, полифосфазены; описаны в патенте U.S. Patent 5,500,161, ссылка включена в настоящую заявку), Q57, QS21, сквален, тетрахлородекаоксид и т.д. Фармацевтически приемлемые наполнители были ранее описаны более подробно в приведенном выше разделе, озаглавленном «Фармацевтические композиции».
V. Введение
Предлагаемые композиции и способы настоящего раскрытия являются применимыми для профилактики и/или лечения инфекции ЦМВЧ у субъекта, в том числе у взрослых людей и у детей. В целом, однако, они могут быть использованы для любого животного. В некоторых вариантах осуществления способы из настоящей заявки могут использоваться для ветеринарных задач, например, для кошек и собак. При желании способы из настоящей заявки могут быть также использованы для сельскохозяйственных животных, таких как породы овец, птиц, коров, свиней и лошадей.
В данном контексте термины «субъект», «индивид» или «пациент» относятся к человеку или к субъекту, являющемуся млекопитающим, но не человеком. Индивид (также называемый «пациент» или «субъект»), подлежащий лечению, является индивидом (плодом, младенцем, ребенком, подростком или взрослым), страдающим от заболевания, например, инфекции ЦМВЧ. В некоторых вариантах осуществления субъект подвержен риску развития инфекции ЦМВЧ. В некоторых вариантах осуществления субъект является субъектом с подавленным иммунитетом. Например, в некоторых вариантах осуществления субъект с подавленным иммунитетом выбран из группы, состоящей из ВИЧ-инфицированных субъектов, больных СПИДом, реципиентов трансплантатов, субъектов детского возраста и беременных. В некоторых вариантах осуществления субъект был инфицирован ЦМВЧ. В некоторых вариантах осуществления субъект является человеком.
Композиции, описанные в настоящей заявке, обычно будут вводить в таких количествах и в течение такого времени, которое необходимо или достаточно для того, чтобы вызвать иммунный ответ. Режимы дозирования могут состоять из одной дозы или из множества доз в течение определенного периода времени. Точное количество иммуногенной композиции (например, ВПЧ) которое нужно ввести, может варьировать от субъекта к субъекту и может зависеть от нескольких факторов. Таким образом, следует иметь в виду, что, в целом, точная используемая доза будет такой, как определит лечащий врач, и будет зависеть не только от веса субъекта и способа введения, но также и от возраста субъекта и тяжести симптомов и/или риска инфицирования. В некоторых вариантах осуществления конкретное количество композиции ВПЧ вводят в виде однократной дозы. В некоторых вариантах осуществления конкретное количество композиции ВПЧ вводят в виде более чем одной дозы (например, 1-3 дозы, разделенных временными промежутками в 1-12 месяцев). В некоторых вариантах осуществления конкретное количество композиции ВПЧ вводят в виде однократной дозы несколько раз (например, 1-3 доз, разделенных временными промежутками в 1-12 месяцев).
В некоторых вариантах осуществления предлагаемую композицию вводят в виде начальной дозы и по меньшей мере одной бустерной дозы. В некоторых вариантах осуществления предлагаемую композицию вводят в виде начальной дозы и двух бустерных доз. В некоторых вариантах осуществления предлагаемую композицию вводят в виде начальной дозы и трех бустерных доз. В некоторых вариантах осуществления предлагаемую композицию вводят в виде начальной дозы и четырех бустерных доз. В некоторых вариантах осуществления предлагаемую композицию вводят в виде начальной дозы и по меньшей мере одной бустерной дозы через примерно один месяц, примерно два месяца, примерно три месяца, примерно четыре месяца, примерно пять месяцев или примерно шесть месяцев после первоначальной дозы. В некоторых вариантах осуществления предлагаемую композицию вводят в виде второй бустерной дозы через примерно шесть месяцев, примерно семь месяцев, примерно восемь месяцев, примерно девять месяцев, примерно десять месяцев, примерно одиннадцать месяцев или примерно один год после первоначальной дозы. В некоторых вариантах осуществления предлагаемую композицию вводят в виде бустерной дозы каждый 1 год, 2 года, 3 года, 4 года, каждые 5 лет, 6 лет, 7 лет, 8 лет, 9 лет или 10 лет.
В некоторых вариантах осуществления предлагаемые композиции могут быть приготовлены для доставки парентерально, например, в виде инъекций. В таких вариантах осуществления введение может быть, например, внутривенным, внутримышечным, внутрикожным или подкожным, или с помощью вливания или инъекции безыгольным способом. В некоторых вариантах осуществления композиции могут быть приготовлены для оральной доставки, пероральной доставки, интраназальной доставки, буккальной доставки, сублингвальной доставки, трансдермальной доставки, чрескожной доставки, внутрибрюшинной, доставки интравагинальной доставки, ректальной доставки или внутричерепной доставки.
Примеры
Следующие примеры описывают некоторые типичные способы изготовления и применения на практике определенных композиций, описанных в настоящей заявке. Следует понимать, что эти примеры приведены только для иллюстративных целей и не предназначены для ограничения объема композиций и способов, описанных в настоящей заявке.
Пример 1: Конструирование плазмид экспрессии ДНК
Этот пример описывает разработку плазмид экспрессии и конструкций для экспрессии рекомбинантных генных последовательностей ЦМВЧ (например, gB, gB-G, gH-G и Gag/pp65 гибридных последовательностей генов). Стандартная плазмида экспрессии обычно состоит из промоторной последовательности млекопитающих, интронной последовательности, сигнальной последовательности полиаденилирования (Поли(А)), последовательности ориджина репликации pUC (pUC - pBR322 представляет собой ориджин/сайт colE1 инициации репликации и используется для репликации плазмиды в бактериях, таких как Е. coli (DH5α)), и гена резистентности к антибиотику в качестве селективного маркера для отбора колоний с плазмидой. Внутри плазмиды за интроном находятся различные сайты рестрикции, которые могут быть использованы для вставки в ген или часть гена интересующей последовательности.
Последовательность плазмиды экспрессии Propol II содержит пЦМВЧ (ранний промотор для ЦМВЧ), интрон бета-глобина, сигнальную последовательность Поли(А) глобина кролика, последовательность ориджина репликации pUC (pUC - pBR322 представляет собой ориджин/сайт colE1 инициации репликации и используется для репликации плазмиды в бактериях, таких как E. coli, (DH5α)) и ген устойчивости к ампициллину, кодирующий β-лактамазу (AmpR - селективный маркер плазмид, придает устойчивость к ампициллину) (100 мкг/мл) (Фигура 1А).
На Фигуре 1 В изображены типичные рекомбинантные плазмиды экспрессии. Например, для разработки конструкции для экспрессии пЦМВЧ-Gag ВЛММ («ВЛМ-Gag»), последовательность комплементарной ДНК (кДНК), кодирующая полипротеин Gag ВЛММ (Gag без C-концевой последовательнсоти Pol), была клонирована в вектор для экспрессии Propol II (пЦМВЧ). Для разработки конструкции для экспрессии gB («gB»), у полноразмерной последовательности gB был оптимизирован состав кодонов для экспрессии у человека (GenScript), и она была клонирована в вектор для экспрессии Propol II, включая внеклеточную часть, трансмембранный домен (ТМ) и цитоплазматическую часть (Цито) gB. Для разработки конструкции для экспрессии gH-G («gH-G»), укороченную последовательность gH, кодирующую только внеклеточную часть, слили с частями ТМ и Цито BBC-G, оптимизировали у нее состав кодонов для экспрессии у человека (GenScript) и клонировали в вектор для экспрессии Propol II. Сходным образом, для разработки конструкции для экспрессии gB-G («gB-G»), укороченную последовательность gB, кодирующую только внеклеточную часть, слили с частями ТМ и Цито BBC-G, оптимизировали у нее состав кодонов для экспрессии у человека (GenScript) и клонировали в вектор для экспрессии Propol II. Для разработки конструкции для экспрессии Gag/pp65 («Gag/pp65») последовательность, кодирующую полипротеин Gag ВЛММ (Gag без C-концевой последовательности Pol) слили с полноразмерной последовательностью из рр65, оптимизировали у нее состав кодонов для экспрессии у человека (GenScript) и клонировали в вектор для экспрессии Propol II.
Плазмиды ДНК амплифицировали в компетентных E. coli (DH5α) и очищали с помощью китов для подготовки без эндоксинов в соответствии со стандартными протоколами.
Пример 2: Получение вирусоподобных частиц (ВПЧ)
В данном примере описаны способы производства вирусоподобных частиц (ВПЧ), содержащих различные рекомбинантные антигены ЦМВЧ, описанные в Примере 1.
Клетки HEK 293Т (АТСС, CRL-11268) временно трансфицировали, с применением кальций-фосфатных способов, плазмидой экспрессии ДНК ВЛММ-Gag и совместно трансфицировали либо gB, либо gB-G (данные не показаны), либо gH-G плазмидой экспрессии ДНК. В качестве альтернативы клетки трансфицировали плазмидой экспрессии ДНК Gag/pp65 и совместно трансфицировали либо gB, либо gB-G (данные не показаны), либо gH-G плазмидой экспрессии ДНК. Следует иметь в виду, что клетки могут быть трансфицированы плазмидой экспрессии ДНК ВЛММ-Gag и совместно трансфицированы плазмидой экспрессии ДНК, как gB и gH-G, так и gB-G и gH-G. Экспрессия различных антигенов ЦМВЧ клетками НЕК 293 была подтверждена с помощью метода проточной цитометрии (Фигура 2А). Через 48-72 часов после трансфекции, супернатанты, содержащие ВПЧ, собирали и фильтровали через мембраны с размером пор 0,45 мкм и далее концентрировали и очищали с помощью ультрацентрифугирования в 20% сахарозе в роторе SW32 Beckman (25000 об./минуту, 2 часа, 4°С). Осадки ресуспендировали в стерильном фосфатно-солевом буфере (PBS) без эндотоксинов (GIBCO) с получением стоков ВПЧ, сконцентрированных в 500 раз. Общий белок определяли на аликвоту с использованием кита для количественного определения на основе анализа Бредфорд (BioRad). Очищенные ВПЧ хранили при -80°С до использования. Каждая партия очищенных ВПЧ была проанализирована на предмет наличия экспрессии ВЛММ-Gag, gB, gH-G и/или ВЛММ-Gag/рр65 гибридного белка с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестернблоттинга со специфическими антителами к gB (мышиные моноклональные антитела к gB СН 28; Virusys Corporation; Pereira, L et al. 1984 Virology 139:73-86), gH-G (мышиные моноклональные антитела к антителам Anti-BBC-G tag P5D4; Abeam plc) и pp65 (мышиные моноклональные антитела СН12 к UL83/pp65; Virusys Corporation; Pereira, L. et al. 1982 Infect Immun 36:924-932) (Фигура 2B). Антитела детектировали с использованием усиленной хемилюминесценции (ECL).
Пример 3: Физико-химическая характеристика вирусоподобных частиц (ВПЧ)
Физико-химический анализ ВПЧ включал определение размера частиц и оценку индекса полидисперсности с помощью прибора Malvern Instrument Zeta-Sizer Nano series (ZEN3600). Типичные результаты, полученные с использованием наносайзера, показаны на Фигурах 3А и 3В. Типичная композиция ВПЧ (бивалентная композиция ВПЧ gH-G/pp65) была получена в двух разных лабораториях с использованием одинаковых рекомбинантных векторов для экспрессии, и оба препарата ВПЧ продемонстрировали средний размер частиц 150-180 нм в диаметре. Это согласуется с размером вириона ЦМВ, который, как сообщается, имеет размер 150-200 (1997 J Pathol 182:273-281). Низкий индекс полидисперсности (ИПД), равный 0.214-0.240, указывает на однородность продукта или на узкий диапазон распределения по размерам.
Пример 4: Иммуногенность и нейтрализационная активность ВПЧ у мышей
Композиции ВПЧ, полученные, как описано в Примере 2, были испытаны на самках мышей BALB/C в возрасте 6-8 недель (минимум 6 животных на опытную группу). Мышей иммунизировали внутрибрюшинно 200 мкл композиций ВПЧ дважды, один раз на 0 день (первая доза) и один раз на 56-й день (бустерная доза на неделе 8). На мышей воздействовали 10 мкг, 25 мкг или 50 мкг (общий белок) бивалентной композиции ВПЧ gB/Gag/pp65, бивалентной композиции ВПЧ gH-G/Gag/pp65 или трехвалентной композиции ВПЧ gB/gH-G/Gag/pp65. Для оценки гуморального иммунного ответа брали кровь у всех мышей в изучаемых группах перед иммунизацией, а затем после первой и после второй иммунизаций на 0, 2, 3, 4, 6, 8, 9, 10, 12 и 14 неделях. Дизайн исследования суммирован в Таблице 1.


ИФА проводили с использованием коммерчески доступных плашек для ИФА (IBL International) с покрытием из лизатов, полученных из клеток MRC-5, инфицированных штаммом ЦМВЧ AD 169. Неочищенный коммерческий лизат ЦМВЧ, который содержит все антигены, соответствующие ЦМВ и применим для детекции иммунных ответов с продукцией IgG, был использован в качестве положительного контроля для определения содержания IgG к ЦМВЧ в сыворотке мыши с помощью ИФА. Серийные разведения мышиной сыворотки (разведение в TBS-T/BCA/DMEM 10% FCS) (TBS-T - трис-буфер солевой с Tween; БСА - бычий сывороточный альбумин, DMEM - модифицированная по способу Дульбекко среда Игла, FSC - свободный секреторный компонент) инкубировали в планшетах с покрытием в течение 2 часов при комнатной температуре. После отмывания планшетов добавляли вторичные антимышиные антитела, конъюгированные с пероксидазой хрена (HRP) в разведении 1/10 000 и инкубировали в течение 1 часа с последующим добавлением раствора субстрата Тетраметилбензидин (ТМВ). Реакцию останавливали добавлением однонормального (1Н, Н - нормальность) раствора HCl и измеряли оптическую плотность при 450 нм в микролуночном планшет-ридере ИФА. На Фигуре 4 показаны доказательства наличия персистирующих антител и сильного бустинга у мышей после второй иммунизации на 8 неделях для каждой из бивалентных и трехвалентных композиций ВПЧ.
Ответы на ЦМВЧ с продукцией нейтрализующих антител определяли с помощью реакции микронейтрализации. Стандартное количество штамма ЦМВЧ VR1814 (эндотелиальный клеточнотропный штамм ЦМВ - Revello MG et al. J Gen Virol 82:1429-1438) разводили средой для инфицирования (DME, содержащей 1% инактивированный нагреванием FBS, 1% смесь аминокислот, 1% пенициллин-стрептомицин и PBS без Са+2 и Mg+2) (DME - среда Дульбекко, FBS - эмбриональная сыворотка крупного рогатого скота), добавляли к равному объему серийных разведений инактивированной нагреванием тестовой сыворотки и инкубировали в течение 1 часа при 37°С на ротаторе. Смеси сыворотка/ЦМВЧ добавляли в фибробласты крайней плоти человека (HFF) или в пигментные эпителиальные клетки сетчатки (клетки ARPE-19), выращенные на покровных стеклах в 24-луночных планшетах для культур тканей, и инкубировали в течение 2 часов при 37°С, 5% С02. Планшеты промывали PBS два раза и затем культивировали в течение 48 часов при 37°С, 5% С02. Клетки фиксировали 4% параформальдегидом, подвергали взаимодействию с моноклональными антителами против IE1 (мышиные моноклональные антитела к IE1/2 СН160 или моноклональные антитела к IE1 СН443; Virusys Corporation) в течение 1 часа при комнатной температуре, а затем - с мечеными FITC (флуоресцеин изотиоцианат) козьими антимышиными антителами в течение 45 минут при комнатной температуре. Количество клеток, экспрессирующих IE1, определяли с помощью флуоресцентной микроскопии. Объединенные сыворотки мышей (разведение 1:6) тестировали на нейтрализующую активность в каждой временной точке отбора (0, 3, 6, 8 и 9 недель) дважды. На Фигуре 5 показана индукция нейтрализующих антител у мышей (анализировали в клетках фибробластов) после второй иммунизации на 8 неделях для каждой из бивалентных и трехвалентных композиций ВПЧ. На Фигуре 6 показана индукция нейтрализующих антител у мышей (анализировали в эпителиальных клетках) после второй иммунизации на 8 неделях для каждой из бивалентных композиций ВПЧ.
В другом исследовании моновалентные композиции ВПЧ gB-G, полученные, как описано в Примере 2 были испытаны на самках мышей BALB/C в возрасте 6-8 недель (минимум 8 животных на тестируемую группу). Мышей иммунизировали внутрибрюшинно 200 мкл композиций ВПЧдважды, один раз в 0 день (первая доза) и один раз на 56-й день (бустерная доза на 8 неделе). На мышей воздействовали эквивалентными количествами, составляющими 20 мкг gB (определяли с помощью ИФА) на инъекцию. Для оценки гуморального иммунного ответа у мышей брали кровь у всех мышей в исследуемых группах перед первой иммунизацией, а затем после первой иммунизации на 3 и 6 неделе, перед второй иммунизацией на 8 неделе и затем после второй иммунизации на 9 неделе от начала исследования. Дизайн исследования суммирован в Таблице 2.

Ответы с продукцией нейтрализующих антител к ЦМВЧ определяли с использованием реакции микронейтрализации в фибробластах, основанного на вирусе ЦМВЧ, экспрессирующего зеленый флуоресцентный белок (GFP) (ТВ40) и методом проточной цитометрии инфицированных клеток HFF (GFP+). Чтобы оценить присутствие нейтрализующих антител в образцах сыворотки, сыворотку предварительно инкубировали с ЦМВЧ, экспрессирующим GFP, в течение периода времени, достаточного для того, чтобы нейтрализующие антитела снизили инфекционность ЦМВЧ. Серийные разведения предварительно инкубированной смеси сыворотки ЦМВЧ использовали, подвергая контакту с ними клетки-хозяева (фибробласты или эпителиальные клетки), восприимчивые к инфекции ЦМВЧ. Число клеток, которые экспрессировали репортерную генную конструкцию (GFP) определяли с помощью метода проточной цитометрии, чтобы вычислить инфекционный титр вирусного препарата. На Фигуре 7 изображены титры нейтрализующих антител для мышей, иммунизированных дважды на 0 и 8 неделях моновалентными ВПЧ gB-G в сравнении с рекомбинатным gB. Сыворотки собирали до и после иммунизации, как описано, объединяли и тестировали, сравнивая с положительным контролем, гиперглобулином ЦМВ, Cytogam ™, в присутствии 10% комплемента морских свинок. Как показано на Фигуре 7, моновалентная композиция gB-G вызвала более быструю и мощную нейтрализацию инфекции клеток фибробластов, чем та, которую вызвал рекомбинантный белок gB,
Как можно видеть (или как будет понятно специалистам в данной области после прочтения этого описания), данные показывают, среди прочего, неожиданно хорошую активность ВПЧ, например, ВПЧ, которые включают gB-G, по сравнению с рекомбинантным gB.
В другом исследовании, бивалентные композиции ВПЧ gB/Gag/pp65, полученные, как описано в Примере 2 были испытаны на самках мышей BALB/C в возрасте 6-8 недель (минимум 4 животных на тестируемую группу). Мышей иммунизировали внутрибрюшинно 200 мкл композиций ВПЧ дважды, один раз в 0 день (первая доза) и один раз на 56-й день (бустерная доза на 8 неделе). На мышей воздействовали бивалентными ВПЧ gB/Gag/pp65 и спленоциты собирали через 14 дней. Обогащенные CD8+ Т-клетки стимулировали (в соотношении 1:5) спленоцитами, трансфицированными в течение 24 часов плазмидой, кодирующей Gag/pp65 или Gag, чтобы определить частоты встречаемости ЦТЛ, направленных против рр65 или Gag. Частоты ЦТЛ определяли на основе распада CFSE (сукцинилимидный эфир эфиркарбоксифлюоресцеин ацетат) при гейтировании Т-клеток CD3+CD8+ (Фигура 8(A)). Точечная диаграмма показывает частоту пролиферирующих, специфичных к рр65 ЦТЛ после вычитания ответов, направленных против Gag (Фигура 8(B)). Как показано на Фигуре 8, бивалентные ВПЧ gB/Gag/pp65 активировали ЦТЛ, специфические к рр65 у иммунизированных мышей.
Пример 5: Иммуногенность и нейтрализация активности ВПЧ у кроликов
Бивалентные композиции ВПЧ gB/Gag/pp65 и gH-G/Gag/pp65, полученные, как описано в Примере 2, испытывали на новозеландских белых кроликах в возрасте 6-8 недель (минимум 6 животных на тестируемую группу). Кроликов иммунизировали внутримышечно 0,5 мл композиций ВПЧ композиций трижды, один раз в 0 день (первая доза), один раз на 56-й день (бустерная доза на 8 неделе) и один раз на 168 день (бустерная доза на 24 неделе). На кроликов воздействовали 25 мкг или 50 мкг или 100 мкг (общий белок) либо бивалентной композицией ВПЧ gB/Gag/pp65, либо бивалентной композицией ВПЧ gH-G/Gag/pp65, либо трехвалентной композицией ВПЧ gB/gH-G/Gag/pp65 (бивалентные gB/Gag/pp65 и gH-G/Gag/pp65, смешанные вместе в соотношении 1:1). Для оценки гуморального иммунного ответа, брали кровь у всех кроликов в исследуемых группах перед первой иммунизацией, затем после первой иммунизации на 2, 4, 6 и 8 неделях и после второй иммунизации на 10, 13, 16, 20 и 24 неделях от начала исследования, а затем после третьей иммунизации на 26 и 28 неделях после начала исследования. Дизайн исследования суммирован в Таблице 3.

Сыворотки кроликов тестировали на реактивность против рекомбинантного антигена gB с помощью ИФА (нанесены на левую ось, Фигура 9(A)). Ответы к ЦМВЧ с продукцией нейтрализующих антител определяли с помощью реакции микронейтрализации в клетках фибробластов на основе вируса ЦМВ, экспрессирующего GFP (ТВ40) и анализа инфицированных клеток HFF (GFP+) методом проточной цитометрии, как описано в Примере 4 (нанесены на правую ось, Фигура 9(B)). Сыворотки кроликов, собранные до иммунизации и после нее, как описано, объединяли и тестировали на нейтрализующую активность в присутствии комплемента против ЦМВЧ, экспрессирующего GFP, в фибробластах HFF в сравнении с положительным контролем - гиперглобулином ЦМВ, Cytogam™. Титры конечных точек нанесены и демонстрируют 50% уменьшение в клетках, инфицированных ЦМВ, по отношению к соответствующей сыворотке перед иммунизацией (нанесены на левую ось, Фигура 9(A)). 50000 клеток собрали в ходе анализа инфицированных (GFP+) клеток методом проточной цитометрии (нанесены на правую ось, Фигура 9(B)). Как показано на Фигуре 9, бивалентная композиция ВПЧ gB/Gag/pp65 вызывала ответы с высоким титром связывающих (А) и высоким титром нейтрализующих антител (В) против инфекции клеток фибробластов у кроликов.
Объединенные сыворотки кроликов также тестировали на предмет ответов на ЦМВЧ с продукцией нейтрализующих антител с помощью реакции микронейтрализации в эпителиальных клетках на основе вируса ЦМВЧ, экспрессирующего GFP (Towne TS15-rR) и анализа инфицированных клеток APRE-19 (GFP+) методом проточной цитометрии. Сыворотки кроликов, собранные до иммунизаций и после них, как описано, объединяли и тестировали на нейтрализующую активность в присутствии комплемента против ЦМВЧ, экспрессирующего GFP в эпителиальных клетках APRE-19 в сравнении с положительным контролем - гиперглобулином ЦМВ, Cytogam™. Как показано на Фигуре 10, неожиданно, комбинация бивалентной композиции ВПЧ gB/Gag/pp65 и бивалентной композиции ВПЧ gH-G/Gag/pp65 вызвала синергетический и более быстрый ответ с продукцией нейтрализующих антител против инфекции эпителиальных клеток у кроликов по сравнению с gB/Gag/pp65 or gH/Gag/pp65.
Как можно видеть (или как будет понятно специалистам в данной области техники после прочтения этого описания), данные показывают, среди прочего, неожиданно хорошую активность ВПЧ при использовании комбинации ВПЧ, которые включают в себя gB/Gag/pp65 и ВПЧ, которые включают в себя gH-G/Gag/pp65, даже по сравнению с ВПЧ, которые включают в себя gB/Gag/pp65 или ВПЧ, которые включают в себя gH-G/Gag/pp65.
Пример 6: Расширение масштабов производства и очистка вирусоподобных частиц (ВПЧ)
ВПЧ получали и очищали следующим образом. Клетки СНО трансфицировали выбранными плазмидами (подготовленными, как описано в Примере 1) в заданных концентрациях и соотношениях при плотности клеток между 1,5Е06 и 2,0Е06 клеток/мл в заданных концентраций и соотношений. Добавляли балластную ДНК, чтобы довести общую концентрацию ДНК до 1 мкг/мл клеточной культуры. Плазмиды, используемые для трансфекции, сначала очищали китами для очистки MaxiPrep или GigaPrep (Qiagen). PEIMAX, применяемый в трансфекции для доставки ДНК в клетки, использовали в соотношении 6:1 (PEI : ДНК, масс./масс.). Клетки культивировали в течение 72 часов, а затем культуры центрифугировали при 4000 об./мин в течение 20 минут с использованием ротора JS-4,2A, Beckman Coulter, в однолитровых флаконах. Супернатант фильтровали через фильтр 0,8/0,45 мкм (AcroPak 500 Capsule, Pall). Отфильтрованный супернатант затем концентрировали путем тангенциальной поточной фильтрации (ТПФ) и подвергали диафильтрации против гистидин-содержащего буфера. Диафильтрованный материал загружали на колонку для анионообменной хроматографии (АОХ), где собирали фильтрат. Фильтрат затем фильтровали в стерильных условиях через 0,45 мкм для разделения на ал и квоты разных объемов.
Процедура ТПФ включала дезинфекцию двух мембран ТПФ в течение ночи (Pellicon 2 Mini, предел 500 кДа, площадь поверхности 0,1 м2) в 0,5 M NaOH, при этом их параллельно фиксировали в корпусе из нержавеющей стали. После промывания водой до нейтрального pH на стороне ретентата, а также на стороне пермеата, использовали PBS для уравновешивания мембраны. Отфильтрованный супернатант затем загружали в рециркуляционную петлю для ретентата ТПФ. Исходное давление на входе равнялось 10,5 фунт-сила на квадратный дюйм при пропускающей способности 400 мл/мин, которая снизилась примерно до 200 мл/мин в конце процесса концентрации. После концентрации примерно до 10-20 раз была проведена диафильтрация с 5 объемами 20 мМ гистидина + 150 мМ NaCl, pH 5,5. Диафильтрованный материал собирали и промывали после рециркуляции равным объемом his-буфера в течение еще 5 минут при закрытом потоке пермеата. Ретентат затем собирали и объединяли с ранее собранным ретентатом. Для поддержания функциональности, мембраны промывали PBS в течение 10 минут; 0,5 M NaOH в течение 40 минут (после промывки 200 мл через пермеат и ретентат); и, наконец, водой до нейтрального pH в ретентате и пермеате. Мембраны затем хранили в 0,1 M растворе NaOH в холодильнике.
Хроматографию АОХ на колонках использовали для уменьшения содержания ДНК, с использованием 20 мл колонки HiLoad 16/10 Sepharose HP при скорости потока 1,6 мл/мин для уравновешивания с уравновешивающим буфером (20 мМ гистидин + 150 мМ NaCl, pH 5,5), и при скорости потока 3,2 мл/мин для этапов загрузки, промывания и погрузки, промывки и снятия. Процедуры очистки проводили при 0,8 мл/мин. Для контроля поглощения УФ при 280 нм использовали регистрирующее записывающее устройство. Была использована система для хроматографии Gradifrac (GE Healthcare), которую перед использованием дезинфицировали. Вначале этанол (20 об./об.%, присутствует в колонке в качестве буфера для хранения) удаляли из колонки с использованием Super Q Water (пониженное содержание эндотоксинов) в количестве 5 объемов колонки. Уравновешивающий буфер пропускали в количестве 5 объемов колонки, а затем пропускали буфер снятия (20 мМ гистидин + 1000 мМ NaCl, pH 5,5) в количестве 5 объемов колонки для кондиционирования колонки. Уравновешивающий буфер снова пропускали в количестве 5 объемов колонки, чтобы подготовить колонку для загрузки. Загрузку проводили при 3,2 мл/мин, после чего колонку промывали 5 объемами колонки уравновешивающего буфера, или до тех пор, пока не наблюдали нулевую линию. Фильтрат собирали от начала УФ-пика до падения УФ-пика до уровня, составляющего примерно 10% от максимальной высоты пика поглощения УФ при загрузке материала. Затем колонку промывали буфером снятия (20 мМ гистидин + 1000 мМ NaCl, pH 5,5) в количестве 5 объемов колонки и этот пик собирали. Затем использовали другой буфер снятия (20 мМ гистидин + 2000 мМ NaCl, pH 5,5) в количестве 5 объемов колонки, для того, чтобы удалить любые сильно связанные белки и нуклеиновые кислоты, и этот пик собирали. Колонку затем очищали с помощью 1М NaOH в количестве 4 объемов колонки при 0,8 мл/мин, чтобы удалить любые осажденные белки. Затем колонку промывали водой при 0,8 мл/мин до нейтрального pH (обычно требовалось 4-5 объемов колонки). Затем через колонку пропускали 20%-ный этанол (4 объема колонки при 0,8 мл/мин), чтобы удалить любые липопротеины или липиды (2 объема колонки). На этом этапе колонку либо оставляли на хранение, либо промывали водой (4 объема колонки), чтобы начать цикл заново для следующей пробы.
На Фигуре 11 показаны изображения очищенной моновалентной ВПЧ gB-G, которую получили из клеток СНО, затем подвергли очистке с помощью способов ТПФ (Фигура 11(A)) и АОХ (Фигура 11(B)) с последующим применением аналитических методов электронной микроскопии с негативным окрашиванием. Как показано на Фигуре 11, исходные моновалентные ВПЧ gB-G присутствуют после очистки с помощью ТПФ (Фигура 11(A)) и АОХ (Фигура 11(B)).
Пример 7: Иммуногенность и нейтрализационная активность очищенных ВПЧ у кроликов
Моновалентные композиции ВПЧ gB-G, полученные, как описано в Примере 6, испытывали на новозеландских белых кроликах в возрасте 6-8 недель (минимум 6 животных на тестируемую группу). Кроликов иммунизировали внутримышечно 0,5 мл композиций ВПЧ трижды, один раз в 0 день (первая доза), один раз на 56-й день (бустерная доза на 8 неделе) и один раз на 168 день (бустерная доза на 24 неделе). Для оценки гуморальных иммунных ответов, брали кровь у всех кроликов в исследуемых группах перед первой иммунизацией, затем после первой иммунизации на 2, 4, 6 и 8 неделях и после второй иммунизации на 10, 13, 16, 20 и 24 неделях от начала исследования. Дизайн исследования суммирован в Таблице 4.


На Фигуре 12 показана интенсивная нейтрализация инфекции клеток фибробластов, которую вызвала сыворотка от кроликов, иммунизированных моновалентными ВПЧ gB-G, полученными из клеток линии СНО и очищенными с помощью ТПФ/АОХ (на Фигуре 12 - «gB еВПЧ»). Такая нейтрализация более интенсивна, чем та, которая достигается с использованием положительного контроля - гиперглобулина ЦМВ, Cytogam™. Фигура 12 также включает в себя опубликованные данные, демонстрирующие титр нейтрализации для вакцины Towne и усиленной субъединичной вакцины gB (gB+MF59™) (Cui X et al. 2008 Vaccine 26:5760-5766).
На Фигуре 13 показана интенсивная нейтрализация инфекции эпителиальных клеток, которую вызвала сыворотка от кроликов, иммунизированных моновалентными ВПЧ gB-G, полученными из клеток линии СНО и очищенными с помощью ТПФ/АОХ (на Фигуре 13 - «gB еВВС»). Такая нейтрализация была сравнима с той, которая достигалась с использованием положительного контроля - гиперглобулина ЦМВ, Cytogam™. Фигура 13 также включает в себя опубликованные данные, демонстрирующие титр нейтрализации для вакцины Towne и усиленной субъединичной вакцины gB (gB+MF59™) (Cui X et al. 2008 Vaccine 26:5760-5766).
На Фигуре 14 показан индекс авидности антител, продукцию которых вызывали у кроликов за счет иммунизации моновалентными композициями ВПЧ gB-G, полученными из клеток линии СНО и очищенными с помощью ТПФ/АОХ. Объединенные кроличьи сыворотки и положительный контроль, гиперглобулин ЦМВ, Cytogam™ разводили в концентрации 1:600000 и испытывали против рекомбинантного полноразмерного антигена gB с помощью ИФА в присутствии или в отсутствие 5М мочевины. Авидность антител определяли, как описано ранее (Marshall ВС и Adler S 2003 Viral Immunol 16:491-500). Как показано на Фигуре 14, иммунизация кроликов моновалентными ВПЧ gB-G, полученными из клеток линии СНО и очищенными с помощью ТПФ/АОХ, вызывает у кроликов быструю индукцию нейтрализующих антител высокой авидности. Максимальная авидность антител было достигнута после двух иммунизации ВПЧ gB-G.
Другие варианты осуществления
Другие варианты осуществления изобретения будут очевидны для специалистов в данной области из рассмотрения описания или применения на практике изобретения, раскрытого в настоящей заявке. Предполагается, что описание и примеры следует рассматривать только как иллюстративные, при том, что истинный объем изобретения указан далее в формуле изобретения. Содержание каких-либо ссылок, которые относятся к настоящей заявке, включено, в данный документ во всей полноте.
Краткое описание списка последовательностей
SEQ ID NO: 1 представляет аминокислотную последовательность ВЛММ Gag.
SEQ ID NO: 2 представляет нуклеотидную последовательность ВЛММ Gag.
SEQ ID NO: 3 представляет нуклеотидную последовательность ВЛММ Gag с оптимизированным составом кодонов.
SEQ ID NO: 4 представляет аминокислотную последовательность ВЛММ Gag-ЦМВ рр65.
SEQ ID NO: 5 представляет нуклеотидную последовательность ВЛММ Gag-ЦМВ рр65.
SEQ ID NO: 6 представляет нуклеотидную последовательность ВЛММ Gag-ЦМВ рр65 с оптимизированным составом кодонов.
SEQ ID NO: 7 представляет аминокислотную последовательность ЦМВЧ gB.
SEQ ID NO: 8 представляет нуклеотидную последовательность ЦМВЧ gB.
SEQ ID NO: 9 представляет нуклеотидную последовательность ЦМВЧ gB с оптимизированным составом кодонов.
SEQ ID NO: 10 представляет аминокислотную последовательность ЦМВЧ gB-G.
SEQ ID NO: 11 представляет нуклеотидную последовательность ЦМВЧ gB-G.
SEQ ID NO: 12 представляет нуклеотидную последовательность ЦМВЧ gB-G с оптимизированным составом кодонов.
SEQ ID NO: 13 представляет аминокислотную последовательность ЦМВЧ gH.
SEQ ID NO: 14 представляет нуклеотидную последовательность ЦМВЧ gH.
SEQ ID NO: 15 представляет нуклеотидную последовательность ЦМВЧ gH с оптимизированным составом кодонов.
SEQ ID NO: 16 представляет аминокислотную последовательность ЦМВЧ gH-G.
SEQ ID NO: 17 представляет нуклеотидную последовательность ЦМВЧ gH-G.
SEQ ID NO: 18 представляет ЦМВЧ gH-G с оптимизированным составом кодонов.
SEQ ID NO: 19 представляет нуклеотидную последовательность плазмиды для экспрессии Propol II.
SEQ ID NO: 20 представляет ЦМВЧ gH-ЦМВЧ gB TM/CTD.
SEQ ID NO: 21 представляет нуклеотидную последовательность ВЛММ Gag с оптимизированным составом кодонов.
SEQ ID NO: 22 представляет нуклеотидную последовательность ВЛММ Gag-ЦМВ рр65 с оптимизированным составом кодонов.
Реферат
Изобретение относится к биотехнологии. Описана вирусоподобная частица (ВПЧ) для применения в получении иммуногенной композиции для защиты от заболевания, вызванного человеческим цитомегаловирусом, включающая в себя: первый полипептид, который представляет собой полипептид gag вируса лейкемии мышей (ВЛМ), аминокислотная последовательность которого демонстрирует по меньшей мере 85% идентичность с самособирающейся частью исходного белка gag ВЛМ, имеющего аминокислотную последовательность SEQ ID NO: 1; и второй полипептид, включающий белок гликопротеина B (gB) человеческого цитомегаловируса (ЦМВЧ), имеющего трансмембранный домен, который не обнаружен в природе в gB; при этом указанный второй полипептид имеет аминокислотную последовательность SEQ ID NO: 10. Также описана фармацевтическая композиция для защиты от заболевания, вызванного человеческим цитомегаловирусом, содержащая терапевтически эффективное количество описанной ВПЧ и фармацевтически приемлемый наполнитель. Изобретение расширяет арсенал средств для борьбы с цитомегаловирусом. 2 н. и 3 з.п. ф-лы, 14 ил., 4 табл., 7 пр.

Комментарии