Способ получения гетерологичного белка - RU2143495C1
Код документа: RU2143495C1
Чертежи




























Описание
Данное изобретение касается конструкции ДНК, содержащей сигнальный пептид дрожжевой аспарагиновой протеазы 3 (YAP3), для секреции гетерологичного полипептида, клетки дрожжей, содержащей эту конструкцию ДНК, и способа получения гетерологичных полипептидов в дрожжах с применением этой конструкции ДНК.
Предпосылки изобретения
Дрожжевые организмы
продуцируют ряд белков, которые синтезируются внутриклеточно, но проявляют свою функцию вне клетки. Такие внеклеточные (экстрацеллюлярные) белки называют секретируемыми белками. Секретируемые белки
экспрессируются исходно внутри клетки в виде предшественника или пре-белка, содержащего пре-последовательность, обеспечивающую эффективное направление экспрессируемого продукта через мембрану
эндоплазматического ретикулума (ER). Пре-последовательность, обычно называемая сигнальным пептидом, отщепляется от остальной части белка во время транслокации. После вступления в секреторный путь
белок транспортируется к аппарату Гольджи. Из аппарата Гольджи белок может следовать различными путями, которые ведут к таким компартментам, как клеточная вакуоль или клеточная мембрана, или он может
направляться из клетки для секреции в окружающую внешнюю среду (Pfeffer, S.R. and Rothman, J. E. Ann. Rev. Biochem 56 (1987), 829-852).
Были предложены некоторые подходы для экспрессии и секреции в дрожжах белков, гетерологичных для дрожжей. European published patent application N 88 632 описывает способ, по которому гетерологичные для дрожжей белки экспрессируются, процессируются и секретируются путем трансформации организма дрожжей экспрессирующим вектором, несущим ДНК, кодирующую желаемый белок и сигнальный пептид, получения культуры трансформированного организма, выращивания этой культуры и извлечения белка из культуральной среды. Сигнальным пептидом может быть сигнальный пептид самого желаемого (целевого) белка, гетерологичный сигнальный пептид или гибрид нативного и гетерологичного сигнального пептида.
Проблема, с которой сталкиваются при использовании сигнальных пептидов, гетерологичных для дрожжей, может заключаться в том, что гетерологичный сигнальный пептид не обеспечивает эффективной транслокации и/или последующего отщепления сигнального пептида.
MFα1 (α-фактор) S. cerevisiae синтезируется и в виде пре-проформы из 165 аминокислот, содержащей сигнальный или пре-пептид из 19 аминокислот, после которого следует "лидерный" пептид, или пропептид, из 64 аминокислот, охватывающий три соединенных с N-концом сайта гликозилирования, после которого следует (LysArg(Asp/Glu, Ala)2-3α-фактор)4 (Kurjan, J. and Herskowitz, J. Cell 30 (1982), 933-943). Сигнальная лидерная часть пре-промMF α1 широко применялась для достижения синтеза и секреции гетерологичных белков в S. cerevisiae.
Применение сигнальных/лидерных пептидов, гомологичных для дрожжей, известно, например, из US. patent specification N 4 546 082, European published patent application NN 116 201, 123 294, 123 544, 163 529, 123 289, и DK patent application N 3614/83.
В EP 123 289 описано использование предшественника α-фактора S. cerevisiae, тогда как WO 84/01153 описывает использование сигнального пептида инвертазы Saccharomyces cerevisiae и DK 3614/83 использование сигнального пептида PHO5. S. cerevisiae для секреции чужеродных белков.
US patent specification N 4 546 082, EP 16 201, 123 294, 123 544 и 163 529 описывают способы, по которым сигнальный-лидерный пептид α-фактора из Saccharomyces cerevisiae (MFα1 или MFα2) применяют в процессе секреции экспрессируемых гетерологичных белков в дрожжах. Посредством слияния последовательности ДНК, кодирующей сигнальную/лидерную последовательность MFα1 S. cerevisiae на 5'-конце гена целевого белка, были продемонстрированы секреции и процессинг целевого белка.
Ряд секретируемых белков направляются таким образом, чтобы они могли быть подвергнуты действию протеолитической системы процессинга, которая может расщеплять пептидную связь на карбокси-конце двух последовательных основных аминокислот. Такая ферментативная активность кодируется в S. cerevisiae геном KEX 2 (Julius, D.A. et al., Cell 37 (1984 b), 1075). Процессинг продукта продуктом гена КЕХ 2 необходим для секреции активного фактора спаривания α (MFα или α-фактора) S. cerevisiae, но он не участвует в секреции активного фактора спаривания a S. cerevisiae.
Применение сигнального пептида (или его мутанта) амилазы слюны мышей для обеспечения секреции гетерологичных белков, экспрессируемых в дрожжах, было описано в WO 89/02463 и WO 90/10075. Целью данного изобретения является обеспечение более эффективной экспрессии и/или секреции в дрожжах гетерологичных белков.
Краткое изложение
существа изобретения
Неожиданно было обнаружено, что сигнальный пептид дрожжевой аспарагиновой протеазы 3 способен обеспечивать улучшенную секрецию белков, экспрессируемых в дрожжах, по
сравнению с сигнальным пептидом
амилазы слюны мышей.
Таким образом, данное изобретение касается конструкции ДНК, содержащей следующую последовательность
5'-P-SP-(LР)n-PS-HP-3'
где
P обозначает промоторную последовательность,
SP обозначает последовательность ДНК, кодирующую сигнальный пептид (YAP3) дрожжевой аспарагиновой протеазы
3, LP обозначает последовательность
ДНК, кодирующую лидерный пептид, n обозначает 0 или 1,
PS обозначает последовательность ДНК, кодирующую пептид, определяющий дрожжевой сайт процессинга,
и
HP обозначает
последовательность ДНК, кодирующую полипептид, который является гетерологичным для выбранного организма-хозяина.
Термин "сигнальный пептид" обозначает пре-последовательность, которая преобладающим образом гидрофобна по ее природе и присутствует в виде N-концевой последовательности формы предшественника внеклеточного (экстрацеллюлярного) белка, экспрессируемого в дрожжах. Функция сигнального пептида заключается в том, чтобы обеспечить вхождение гетерологичного белка, который должен секретироваться, в эндоплазматический ретикулум. Сигнальный пептид отщепляется в ходе этого процесса. Ранее сообщалось о сигнальной последовательности YAP3, слитой с его нативным геном (ср. M. Egel-Mitani et al. , Yeast 6, 1990, pp. 127-137). Конструкция ДНК, в которой сигнальная последовательность УАР3 слита с последовательностью ДНК, кодирующей гетерологичный полипетид, является, по-видимому, новой. Ранее не было сообщений о том, что сигнальный пептид YAP3 обеспечивает эффективную секрецию гетерологичных полипептидов в дрожжах.
В данном контексте выражение "лидерный пептид" обозначает пептид, функцией которого является обеспечение направления гетерологичного полипептида из эндоплазматического ретикулума к аппарату Гольджи и далее к секреторному носителю для секреции в среду (т.е. экспорта экспрессированного полипептида через клеточную стенку или по меньшей мере через клеточную мембрану в пространство периплазмы клетки).
Выражение "гетерологичный полипептид" предназначено для обозначения полипептида, который в природе не продуцируется дрожжевым организмом-хозяином.
В другом аспекте данное изобретение касается рекомбинантного экспрессирующего вектора, содержащего конструкцию ДНК этого изобретения.
В дальнейшем аспекте данное изобретение касается клетки, трансформированной рекомбинантным экспрессирующим вектором этого изобретения.
Еще в одном аспекте данное изобретение касается способа получения гетерологичного полипептида, предусматривающего культивирование клетки, способной экспрессировать гетерологичный полипептид и трансформированной конструкцией ДНК изобретения, в подходящей среде для получения экспрессии и секреции гетерологичного полипептида, после чего гетерологичный полипептид извлекают из среды.
Подробное
описание изобретения
В характерном варианте сигнальный пептид дрожжевой аспарагиновой протеазы 3 (УАР3) кодируется следующей последовательностью ДНК
ATG AAA CTG AAA ACT GTA AGT TCT
GCG GTC CTT TCG TCA CTC TTT GCA TCT CAG GTC CTT GGC (SEQ 1D N:1)
или ее подходящей модификацией, кодирующей пептид с высокой степенью гомологии (по меньшей мере 60%, более предпочтительно по
меньшей мере 70% идентичности последовательности) относительно сигнального пептида YAP3. Примерами "подходящих модификаций" являются нуклеотидные замены, которые не вызывают появления другой
аминокислотной последовательности этого пептида, но которые могут соответствовать использованию кодонов дрожжевым организмом, в которые введена эта последовательность, или нуклеотидные замены,
которые
приводят к отличающейся аминокислотной последовательности этого пептида (хотя аминокислотная последовательность не должна модифицироваться до такой степени, что она больше не способна
функционировать
в качестве сигнального пептида). Другими примерами возможных модификаций являются инсерции трех или множеств из трех нуклеотидов на любом конце или внутри этой последовательности или
делеции трех или
множеств из трех нуклеотидов на любом конце или внутри этой последовательности.
В последовательности 5'-P-SP-(LP)n-PS-HP-3' n обозначает предпочтительно 1. Другими словами, хотя сигнальный пептид YAP3 в некоторых случаях сам может обеспечить секрецию и/или процессинг гетерологичного пептида, предпочтительно должна присутствовать лидерная или пропептидная последовательность. Лидерная последовательность может быть лидерным пептидом MFα1 дрожжей или синтетическим лидерным пептидом, например, одним из лидерных пептидов, описанных в WO 89/02463 или WO 92/11378, или его производным, способным способствовать секреции гетерологичного полипептида в дрожжах. Термин "синтетический" предназначен для указания, что такие лидерные пептиды не обнаружены в природе. Например, синтетические дрожжевые лидерные пептиды могут быть сконструированы согласно процедурам, описанным в WO 89/02463 или WO 92/11378.
Сайт процессинга дрожжей, кодируемый последовательностью ДНК PS, может быть любой парной комбинацией Lys и Arg, такой как Lys-Arg, Arg-Lys, Lys-Lys или Arg-Arg, которая делает возможным процессинг гетерологичного полипептида протеазой KEX2 Saccharomyces cerevisiae или равноценной протеазой в другом виде дрожжей (D. A. Julius et al., Cell 37, 1984, 1075ff). Если процессинг при помощи KEX2 неудобен, например, если он привел бы к расщеплению полипептидного продукта, то может быть выбран сайт процессинга для другой протеазы вместо сайта для KEX2, содержащий комбинацию аминокислот, которая не обнаружена в полипептидном продукте, например сайт процессинга для FXa, Ile-Glu-Gly-Arg (срав. Sambrook, Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual, Cold spring Harbor, New York, 1989).
Гетерологичным белком, получаемым по способу этого изобретения, может быть любой белок, который может выгодно продуцироваться в дрожжах. Примерами таких белков являются апротинин, ингибитор пути тканевого фактора или другие протеазные ингибиторы, инсулин или предшественники инсулина, гормон роста человека или коров, интерлейкин, глюкагон, тканевый активатор плазминогена, трансформирующий фактор роста α или β, тромбоцитарный фактор роста, ферменты или их функциональные аналоги. В данном контексте термин "функциональный аналог" обозначает полипептид с функцией, подобной функции нативного белка (под этим понимают скорее природу, чем уровень биологической активности нативного белка). Полипептид может быть структурно похожим на нативный белок и может быть получен из нативного белка добавлением одной или нескольких аминокислот к любому или к обоим из C- и N-концов нативного белка, заменой одной или нескольких кислот в одном или в ряде различных сайтов в нативной аминокислотной последовательности, делецией одной или нескольких аминокислот на любом конце или на обоих концах нативного белка или в одном или нескольких сайтах в аминокислотной последовательности или инсерцией одной или нескольких аминокислот в одном или нескольких сайтах в нативной аминокислотной последовательности. Такие модификации хорошо известны для некоторых из упомянутых выше белков.
Конструкцию ДНК этого изобретения можно получить синтетически установленными стандартными способами, например фосфоамидитным способом, описанным S. L. Beaucage and M.H. Caruthers, Tefrahedron Letters 22, 1981, pp. 1859-1869, или способом, описанным Matthes et al., EMBO Journal 3, 1984, pp. 801-805. Согласно фосфоамидитному способу олигонуклеотиды синтезируются, например, в автоматизированном синтезаторе ДНК, очищаются, отжигаются, лигируются и клонируются в дрожжевом экспрессирующем векторе. Следует заметить, что последовательность 5'P-SP(LP)n-PS-HP-3' не должна быть обязательно получена в одной операции, но может быть собрана из двух или более олигонуклеотидов, полученных синтетически указанным образом.
Одна или более частей последовательности ДНК 5'-P-SP-(LP)n-PS-HP-3' могут быть также геномного происхождения или происходящими из кДНК, например полученными путем получения геномной библиотеки или библиотеки кДНК и скрининга на последовательности ДНК для этих частей (обычно HP) посредством гибридизации с применением синтетических олигонуклеотидных зондов в соответствии со стандартными способами (срав. Sambrook, Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, New York 1989). В этом случае последовательность геномной ДНК или кДНК, кодирующая сигнальный пептид, может быть соединена с геномной или кДНК последовательностью, кодирующей гетерологичный белок, после чего эта последовательность ДНК может быть модифицирована инсерцией синтетических олигонуклеотидов, кодирующих последовательность 5'-P-SP-(LP)n-PS-HP-3' в соответствии с хорошо известными способами.
Наконец, последовательность ДНК 5'-P-SP-(LP)n-PS-HP-3' может быть смешанной синтетической и геномной, смешанной синтетической и кДНК или смешанной геномной и кДНК, полученной отжигом (гибридизацией) синтетических, геномных или кДНК фрагментов (как удобно), соответствующих различным частям целой последовательности ДНК, в соответствии со стандартными способами. Таким образом, можно предусмотреть, чтобы последовательность ДНК, кодирующая сигнальный пептид или гетерологичный полипептид, была геномного происхождения или происходила из кДНК, тогда как последовательность 5'-P-SP-(LP)n-PS может быть получена синтетически.
Рекомбинантным экспрессирующим вектором, несущим последовательность 5'-P-SP-(LP)n-PS-HP-3', может быть любой вектор, который способен реплицироваться в дрожжевых организмах. В этом векторе промоторной последовательности (Р) может быть любая последовательность ДНК, которая обнаруживает транскрипционную активность в дрожжах и может быть получена из генов, кодирующих белки, гомологичные или гетерологичные для дрожжей. Предпочтительно промотор получают из гена, кодирующего белок, гомологичный для дрожжей. Примерами подходящих промоторов являются промоторы MFα1, TP1, ADH 1, ADH 11 или PGK Saccharomyces сerevisiae или соответствующие промоторы из других видов дрожжей, например Schizosaccharomyces pombe. Примеры подходящих промоторов описаны, например, Russel and Hall, J. Biol. Chem 258, 1983, pp. 143 - 149; Russel Nature 301, 1983, pp. 167 - 169; Ammerer, Meth Entymol 101, 1983, pp. 192 - 201; Russel et al., J. Biol Chem 258, 1983, pp. 2674 - 2682; Hitzeman et al. , J. Biol Chem. 225, 1980, pp. 12073 - 12080; Kawasaki and Fraentet, Biochem. Biophys. Res. Comm. 108, 1982, and T. Alber and G. Kawasaki, J. Mol. Appl. Genet. 1, 1982, pp. 419-434.
Последовательности, указанные выше, должны быть также оперативно соединены с подходящим терминатором, например ТР1 терминатором (срав. T. Alber and G. Kawasaki, J. Mol. Appl. Genet 1, 1982, pp. 419-434) или дрожжевым СУС1 терминатором.
Рекомбинатный экспрессирующий вектор изобретения содержит также последовательность ДНК, позволяющую вектору реплицироваться в дрожжах. Примерами таких последовательностей являются гены репликации REP 1-3 и начало репликации дрожжевой плазмиды 2μ. Вектор может также содержать селектируемый маркер, например TP1 ген Schitosaccheromyces pomle, описанный P.R. Russel Gene 40, 1985, pp. 125-130, или ген дрожжей URA3.
Процедуры, применяемые для встраивания последовательности 5'-P-SP-(LP)n -PS-HP-3' в подходящий дрожжевой вектор, содержащий информацию, необходимую для репликации в дрожжах, хорошо известны лицам с квалификацией в данной области (срав. , например, Sambrook, Fritsch and Maniatis, цитир. выше). Должно быть понятно, что вектор может быть сконструирован либо путем первоначального приготовления конструкции ДНК, содержащей полную последовательность, и последующего встраивания этого фрагмента в подходящий экспрессирующий вектор, либо путем последовательного встраивания фрагментов ДНК, содержащих генетическую информацию для отдельных элементов (таких как промоторная последовательность, сигнальная последовательность, лидерная последовательность или ДНК, кодирующая гетерологичный полипептид) с последующим лигированием.
Дрожжевым организмом, трансформированным вектором изобретения, может быть любой подходящий дрожжевой организм, который при культивировании продуцирует большие количества гетерологичного полипептида, представляющего интерес. Примерами подходящих дрожжевых организмов могут быть штаммы Saccharomyces, такие как Saccharomyces cerevisiae, saccharomyces kluyveri или Saccharomyces uvarum, Schizosaccharomyces, такие как Schizosaccharomyces pomle, Kluyveromyces, такие как Kluyveromyces lactis, Yarrowia, такие как Yarrowia lipolytica, или Hansenula, такие как Hansenula polymorpha. Трансформация дрожжевых клеток может, например, выполняться путем образования протопластов с последующей трансформацией известными per se способами.
Средой для культивирования клеток может быть любая общепринятая среда, подходящая для выращивания дрожжевых организмов. Секретируемый гетерологичный белок, значительная часть которого будет присутствовать в среде в правильно процессированной форме, может быть извлечен из среды обычными способами, включающими отделение дрожжевых клеток от среды центрифугированием или фильтрованием, осаждение белковых компонентов супернатанта или фильтрата с применением соли, например сульфата аммония, с последующей очисткой различными хроматографическими процедурами, например ионообменной хроматографией, аффинной хроматографией или т.п.
Краткое описание фигур
Изобретение описывается далее в следующих ниже примерах со ссылками на прилагаемые фигуры.
Фиг. 1A и 1B схематически изображают конструкцию плазмиды pLaC257.
Фиг. 2 изображает последовательность ДНК и произведенную из нее аминокислотную последовательность инсерции EcoR1-Xba1 в pLaC257 (SEQ 1D N:2).
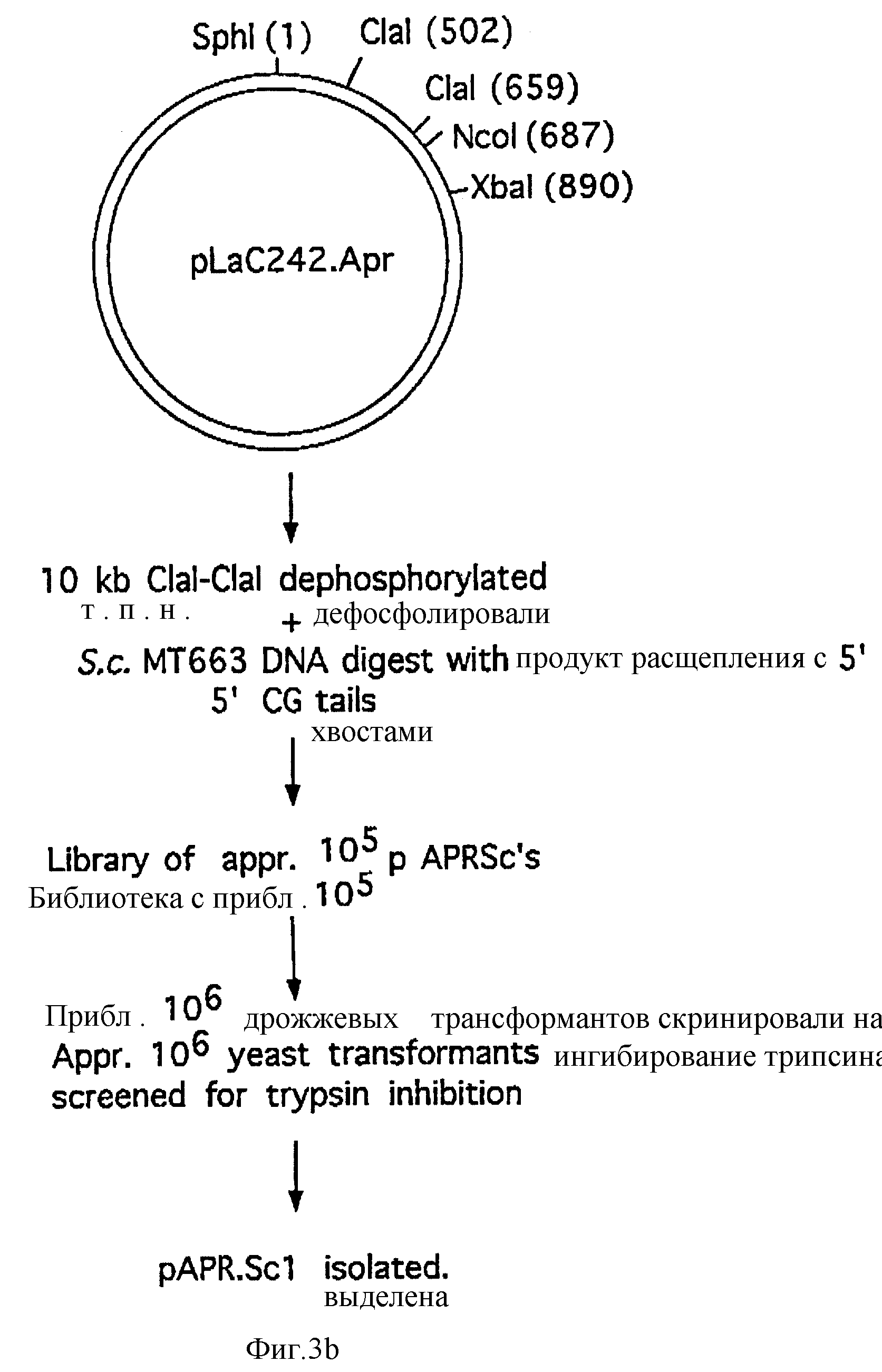
Фиг. 3A и 3B схематически изображают конструкцию плазмиды pLaC242Apr.
Фиг. 4 показывает последовательность ДНК и произведенную из нее аминокислотную последовательность фрагмента EcoR1-Xba1, причем последовательность белка, показанная курсивом, получена из фрагмента ДНК, клонированного произвольной экспрессией (SEQ 1D N:4).
Фиг. 5 показывает схематически конструкцию плазмиды pLaC263.
Фиг. 6 показывает последовательность ДНК и произведенную аминокислотную последовательность фрагмента EcoR1-Xba1 pLaC263 (SEQ 1D N 6).
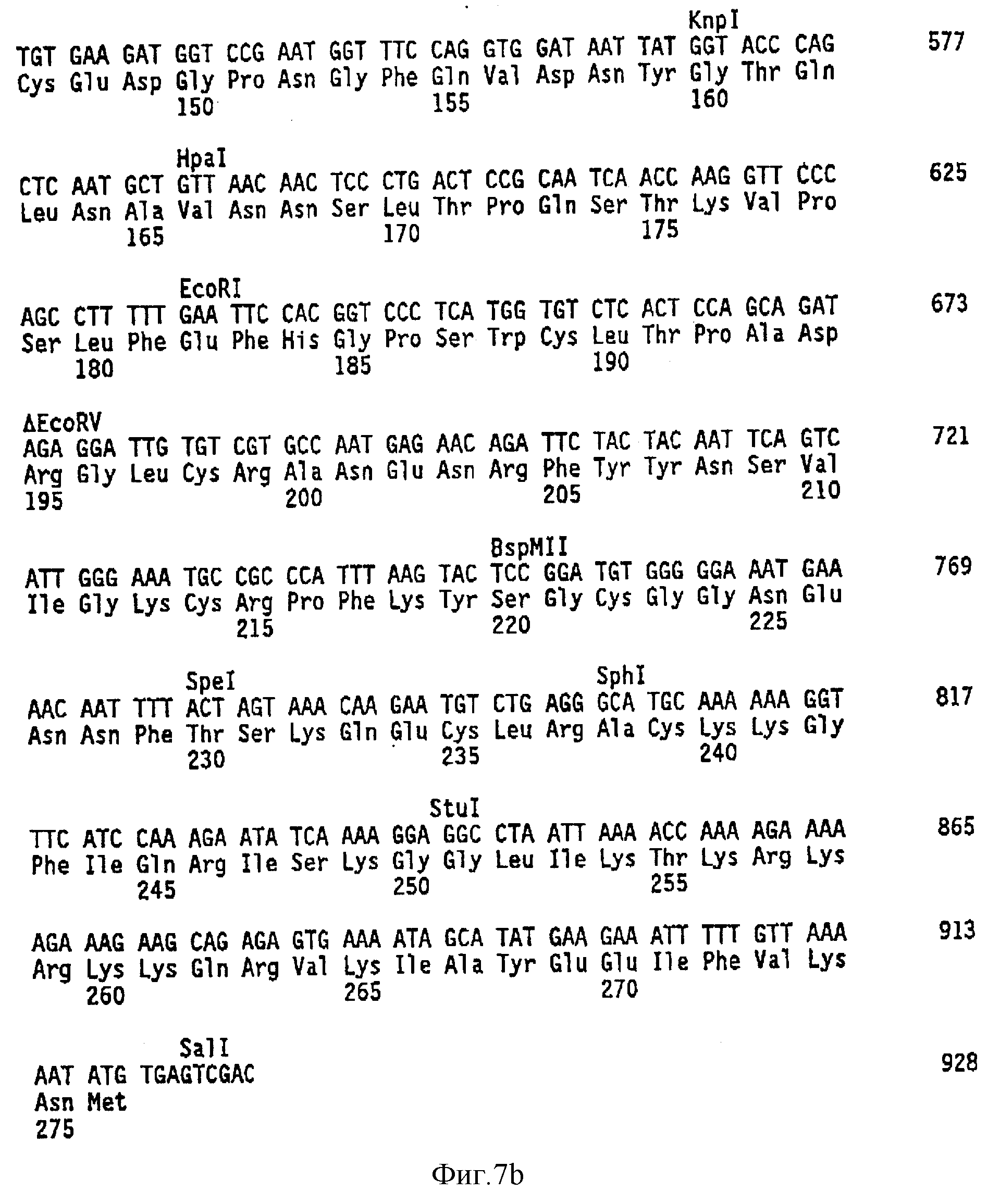
Фиг. 7A и 7B показывают последовательность ДНК и произведенную аминокислотную последовательность ингибитора пути тканевого фактора человека (TFP1), в том числе нативного сигнального пептида (SEQ 1D N:8).
Фиг. 8A показывает последовательность ДНК и произведенную аминокислотную последовательность сигнального пептида spx3 и лидерного пептида 212 (показанных в WO 89/02463), соединенных на N-конце с последовательностью TFP1 в плазмиде pYES-212 TFP1161-117Q (SEQ 1D N: 10).
Фиг. 8B показывает последовательность ДНК и произведенную аминокислотную последовательность сигнального пептида YAP3 и лидерного пептида 212, соединенного на N-конце с последовательностью TFP1 в плазмиде pYES-yк TFP1161-117Q (SEQ 1D N: 12).
Фиг. 9 показывает рестрикционные карты плазмид pYES21, pP-212TFP-1161-117Q; pYES-212TFP1161-117Q и pYES-yк TFP1161-117Q.
Изобретение далее иллюстрируется примерами, которые не предназначены для какого бы то ни было ограничения сферы действия изобретения, описанной в формуле изобретения.
Примеры
Плазмиды и ДНК материалы
Все
экспрессирующие
плазмиды содержат последовательности ДНК 2 μ для репликации в дрожжах и используют либо ген URA3 S. cerevisiae, либо ген триозофосфатизомеразы Schizosaccharomyces pomle (POT) в
качестве
селектируемых маркеров в дрожжах. POT плазмиды описаны в EP Patent application N 171 142. Плазмида, содержащая POT ген, доступна из депонированного штамма. E. coli (ATCC 39685). POT плазмиды,
кроме
того, содержат промотор и терминатор (PTR1 и TTP1) триозофосфатизомеразы S. cerevisiae. Они идентичны pMT742 (M. Egel-Mitani et al., Gene 73, 1988, pp. 113 - 120) (см.
фиг. 1),
за исключением района, определяемого сайтами рестриктаз Sph-Xba1, охватывая PTP1 и район, кодирующий сигнальный пептид/лидерный пептид/продукт.
PTP1 был модифицирован относительно последовательности, обнаруженной в pMT742, только для облегчения конструирования плазмиды. Внутренний сайт расщепления Sph1 был исключен расщеплением при помощи Sph1, удалением одноцепочечных хвостов и повторным лигированием. Кроме того, последовательности ДНК слева от промотора, не влияющие на него, удаляли обработкой экзонуклеазой Ва131 с последующим добавлением линкера сайта рестрикции Sph1. Эту промоторную конструкцию, присутствующую на фрагменте из 373 п.н. Sph1-EcoR1 обозначали PTP1δ и при использовании в уже описанных плазмидах эта модификация промотора указывалась добавлением δ к названию плазмиды.
Наконец, использовали ряд синтетических фрагментов ДНК, которые синтезировали на автоматизированном синтезаторе ДНК (Applied Biosystems model 380A) с применением фосфорамидитного способа и коммерчески доступных реагентов (S. L. Beaucage and M. H. Caruthers (1981) Tetrahedron Letters 22, 1859-1869). Олигонуклеотиды очищали при помощи электрофореза в полиакриламидном геле при денатурирующих условиях. Перед отжигом комплементарных пар таких одноцепочечных цепей ДНК их обрабатывали T4 полинуклеотидкиназой и АТФ.
Все другие примененные способы и материалы известны и обычны для данной области знаний (J. Sambrook et al., Molecylar Cloning, A. Laboratory, Manual, Cold
Spring Harbor Laboratory Press) Cold spring Harbor N.Y. (1989)
Пример 1
Модифицированный сигнальный пептид амилазы слюны мышей (MSA3SP) (описанный в WO 89/02463)
экспрессионной кассеты плазмиды pLS C6315D3 (описанной в примере 3 WO 92/11378), которая содержит последовательность ДНК, кодирующую предшественник инсулина M13 (B(1-29)-Ala-Ala-Lys-A(1-21)), был
заменен сигнальным пептидом УАР3 при помощи следующих стадий.
Была приготовлена конструкция для легкой замены сигнальных пептидов. При помощи сайт-направленного мутагенеза сайт Asp718
вводили непосредственно перед кодоном сигнала инициации (инициирующим кодоном) в pL aC196 δ (срав. WO 89/02463, фиг. 5) при помощи способа двойных праймеров, применяющего мутагенный праймер
NOR494:

где буквы, подчеркнутые волнистой чертой, указывают мутации, а подчеркнутая последовательность указывает инициирующий кодон.
Полученную плазмиду назвали pL aC196 δ -Asp718 (см. фиг. 1).
Нуклеотидную последовательность
района,
охватывающего соединение между сигнальным пептидом и лидерным пептидом экспрессионной кассеты в pLSC6315D3, модифицировали заменой фрагмента рестрикции Apa1-HgiA1 синтетическим отрезком ДНК,
NOR
2521/2522:
NOR2521; 5'-CAA CCA ATA GAC ACS CGT AAA GAA GGC CTA CAG CAT GAT TAC GAT ACA GAG ATC TTG GAG (SEQ 1D N:15)
NOR2522: 5'-C CAA GAT CTC TGT ATC GTA ATC ATG CTG TAG GCC
TTC TTT
ACG CGT GTC TAT TGG TTG GGC C (SEQ 1D N:16)
Полученную плазмиду назвали pLSC6315D3R (см. фиг. 1).
Фрагмент Sph1-A p718 pL aC196 δ -Asp718 лигировали с
разрезанной
Sph1-Mlu 1 плазмидой pLSC6315D3R и синтетическим отрезком ДНК, кодирующей сигнальный пептид YАР3:
YAP-Sp1: 5'-GТ ACC AAA ATA ATG AAA CTG, AAA ACT GTA AGA TCT GCG GTC CTT TCG TCA
CTC TTT GCA
TCT CAG GTC CTT GGC CAA CCA ATA GAC A (SEQ 1D N:17)
YAP-Sр2: 5'-CG CGT GTC TAT TGG TTG GCC AAG GAC CTC AGA TGC AAA GAG TGA CGA AAG GAC CGC AGA TCT TAC AGT TTT CAG TTT CTA TAT TTT
G (SEQ 1D
N:18)
Полученная плазмида pL aC257 по существу состоит из
pLSC6315D3, в которой сигнальный пептид MSA3 был заменен сигнальным пептидом YAP3 (см. фиг. 2).
Трансформация дрожжей: Штамм MT663 S. cerevisiae (E2-7B XEll-36 a/α Δtpi/Δtpi pep 4-3/pep 4-3) (этот штамм дрожжей MT663 был депонирован в Немецкой коллекции микроорганизмов и клеточных культур в связи с подачей WO 92/11378 и получил номер депозита DSM 6278) выращивали на YPGa1 (1% Бактодрожжевой экстракт, 2% бактопептон, 2% галактоза, 1% лактат) до O.D. при 600 нм 0,6.
100 мл культуры собирали центрифугированием, промывали 10 мл воды, повторно центрифугировали и ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбит, 25 мМ Na2ЭДТА, pH 8, 0, и 6,7 мг/мл дитиотреитола. Суспензию инкубировали при 30oC в течение 15 минут, центрифугировали и клетки ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбит, 10 мМ Na2 ЭДТА, 0,1 М цитрат натрия, pH 5,8, и 2 мг Novozym® 234. Суспензию инкубировали при 30oC в течение 30 минут, клетки собирали центрифугированием, промывали в 10 мл раствора, содержащего 1,2 C сорбит, и 10 мл CAS (1,2 М сорбит, 10 мМ CaCl2, 10 мМ Трис-HCl (Трис = Трис(гидроксиметил)аминометан) pH 7,5) и ресуспендировали в 2 мл CAS. Для трансформации 1 мл суспендированных в CAS клеток смешивали с приблизительно 0,1 мкг плазмиды pL aC257 и оставляли при комнатной температуре в течение 15 минут. 1 мл (20% полиэтиленгликоля 4000, 20 мМ CaCl2, 10 мМ CaCl2, 10 мМ Трис-HCl, pH 7,5) добавляли и смесь оставляли еще на 30 минут при комнатной температуре. Смесь центрифугировали и осадок ресуспендировали в 0,1 мл SOS (1,2 М сорбит, 33% об./об. YPD, 6,7 мМ CaCl2, 14 мкг/мл лейцина) и инкубировали при 30oC в течение 2 часов. Затем суспензию центрифугировали и осадок ресуспендировали в 0,5 мл 1,2 C сорбита. Затем 6 мл верхнего агара (SC среда Sherman et al., Methods in Yeast Geneties Cold Spring Harbor Laboratory (1982)), содержащего 1,2 М сорбит плюс 2,5% агар) при 52oC добавляли и суспензию выливали на верхнюю часть чашек, содержащих ту же самую среду с отвержденным агаром, содержащую сорбит.
Колонии трансформанта выковыривали спустя 3 дня выдерживания при 30o C, повторно изолировали и использовали для засева жидких культур. Один трансформант отбирали для дальнейшей характеристики.
Ферментация: Дрожжевой штамм МТ663, трансформированный плазмидой pL aC257, выращивали на среде YPD (1% дрожжевой экстракт, 2% пептон (из Difco Laboratories) и 3% глюкоза). 1 литр культуры этого штамма качали при 30oC до оптической плотности (OD) при 650 нм 24. После центрифугирования выделяли супернатант.
Клетки MT663, трансформированные плазмидой pL SC6315D 3 и культивированные, как описано выше, использовали для сравнения выходов предшественника инсулина M13. Выходы M13 определяли непосредственно на культуральных супернатантах по способу Snel, Damgaard and Mollerup, Chromatographia, 24, 1987, pp. 329-332. Результаты показаны ниже.
Плазмида - Выход M13
pSLC63.15D3 (MSA3SP) - 100%
pLaC257 (YAP3) - 120%
Пример 2
Плазмиду pLSC6315D3
модифицировали в двух стадиях. Сначала сигнальный пептид MSA3 заменяли сигнальным пептидом Spx3 посредством замены фрагмента Sph1-Apa1 аналогичным фрагментом из pLaC212Spx3 (срав. WO 89/02463). Из
полученной плазмиды pSL C63.15Spx3 выделяли фрагмент EcoR1-D 302 п.н. и сливали с фрагментом Nco1-Xba1 204 п.н. pKFN1003 (WO 90/10075), содержащим последовательность ДНК, кодирующую апротинин, через
синтетический ДНК-линкер, NOR2101/2100 (см. фиг. 3).
NOR2101: 5'-T AAC GTC GC (SEQ 1D N:19)
NOR2100: 5'-CAT GGC GAC G (SEQ 1D N:20)
Полученную плазмиду, pL aC242-Apr
(см. фиг. 3), расщепляли при помощи Cla1, дефосфорилировали и применяли в клонировании произвольных фрагментов ДНК с 5'-CG- свешивающихся хвостами, выделенных из штамма MT663 S. cerevisiae, согласно
описанию в WO 92/11278. Трансформацию и ферментацию дрожжевого штамма MT663 проводили, как описано в примере 1.
Из полученной библиотеки дрожжей трансформанты, несущие плазмиду
pAPR-Sc1 (полученную по способу, описанному в WO 92/11378), содержащую лидер, последовательность которого дана на фиг. 4, выбирали посредством скрининга. Сигнальный пептид px3SpAPR-Sc1 заменяли
сигнальным пептидом YAP3 путем слияния фрагмента Sph1-Sty1 из pL aC257 с фрагментом из 300 п.н. Nhe1-Xba1 pAPR-Sc1 через синтетический ДНК-линкер МН1338/1339 (см. фиг. 5):
МН 1338: 5'-CTT
GGC CAA TCG AAA TTG AAA CCA G (SEQ 1D N:21)
МН 1339: 5'-CT AGC TGG TTT CAA TTT CGA TGG TTG GC (SEQ 1D N:22)
Полученную плазмиду назвали pL aC263 (см. фиг. 5). Последовательность ДНК
и произведенная аминокислотная последовательность фрагмента EcoR1-Xba1 плазмиды pL aC263 даны на фиг. 6.
Плазмида - Выход апротинина
pAPR-Sc1 (Spx3SP) - 100%
pL aC263 - 136%
Пример 3
Синтетический ген, кодирующий человеческий TFP1, последовательность ДНК которого была получена из опубликованной последовательности кДНК, кодирующей
ингибитор пути тканевого фактора человека (TFP1) (Wunet al., J. Biol Chem 263 (1988), 6001-6004) получали ступенчатым клонированием синтетических фрагментов рестрикции в плазмиду pBS(+). Полученный
ген находился в рестрикционном фрагменте из 928 п.н. Sal1. Этот ген имел 26 молчащих нуклеотидных замен в вырожденных кодонах по сравнению с этой кДНК, что приводит к 14 уникальным сайтам рестриктаз.
Последовательность ДНК фрагмента Sal1 из 928 п. н. и соответствующая аминокислотная последовательность TFP1 человека (пре-форма) показаны в фиг. 7 (SEQ 1D N:8).
Эту последовательность ДНК затем укорачивали для кодирования разновидности TFP1, состоящей из первых 161 аминокислот. Негликозилированную разновидность, TFP11-161-117 Gln, в которой AAT-кодон для Asn 117 был заменен CAA-кодоном, кодирующим Cln, конструировали сайт-специфическим мутагенезом способом, известным per Se, с применением синтетических олигонуклеотидов. Перед последовательностью ДНК, кодирующей TFP11-161-117 Gln, помещали синтетическую сигнальную-лидерную последовательность 212 Spx3 (срав. WO 89/02463), см. фиг. 8A. Эту конструкцию встраивали в плазмиду pP-212TFP1161-117Q (основанную на векторе POT-типа (G. Kawasaki and L. Bell, US patent 4 931 373), срав. фиг. 8).
Фрагмент Sph1-Xba1 1,1 т.п., содержащий кодирующий район для 212 Spx3-TFP11-161
-117C Gln, выделяли и клонировали в плазмиду pYES21, полученную из коммерчески доступного (stratagene) вектора pYES2.0 (срав. фиг. 8). Эта плазмида содержит последовательность 2 μ
для
репликации в дрожжах, дрожжевой ген URA3 для отбора плазмиды в ura3 штаммах, ген β -лактамазы для отбора в E.coli, ColEl начало репликации для репликации в Е.coli, 1 начало ("ориджин") для
извлечения одноцепочечной ДНК-плазмиды из сверхинфицированных штаммов E. coli и дрожжевой CYC1 терминатор транскрипции. Фрагмент Sph1-Xbal клонировали в pYES2.0 впереди CYC1 терминатора. Полученную
плазмиду pYES- 212TFP1-161-117Q (ср. фиг. 9) расщепляли при помощи Pfl M1 и EcoR1 для удаления кодирующего района для сигнального пептида амилазы слюны мышей, который заменяли двухцепочечной
синтетической олигонуклеотидной последовательностью, кодирующей сигнальный пептид YAP3:
MHJ 1131 5' AAT TCA AAC TAA AAA ATG AAG CTT AAA ACT GTA AGA TCT GCG GTC CTT TCG TCA CTC TTT GCA TCG
CAG
GTC CTA GGT CAA CCA GTC A (SEQ 1D N:23).
MHJ 1132 5' CTG GTT GAC CTA GGA CCT GCG ATG CAA AGA GTG ACG AAA GGA CCG CAG ATC TTA CAG TTT TAA GCT TCA TTT TTT AGT TTG (SEQ 1D N:24)
Таким образом получили плазмиду pYES-укTFP1-161-117Q (ср. фиг. 8B и фиг. 9).
Плазмиды pYES-212TFP1-161-117Q и pYES-укTFP1-161-117Q трансформировали в гаплоидный штамм дрожжей YNG318 (MAT α nr a3-52-Leu2- Δ2 pep4- Δ1 his 4-539 [сir+] . Отбор плазмид выполняли для ura + клеток. Выделенные трансформанты выращивали в 50 мл синтетической полной среды без урацила (SC-ura) в течение 3 дней при 30oC. После измерения плотности клеток (OD6O0) культуры центрифугировали и полученные супернатанты анализировали на уровень секретируемой FXa/TF/FV 11a-зависимой хромогенной TFPl-активности (P.M. Sandset et al., Thromb. Res. 47', 1987, pp. 389-400). Средняя активность, измеренная для супернатантов штаммов, содержащих плазмиду pYES-212TFP1-161-117Q (т.е. плазмиду, содержащую сигнальную последовательность амилазы слюны мышей), была 0,65 Е/мл OD. Средняя активность, измеренная для супернатантов от штаммов, содержащих плазмиду yYES-укTFP1-161-117Q, была 1,00 Е/мл OD.
Реферат
Изобретение относится к биотехнологии. Способ получения гетерологичного белка осуществляют культивированием дрожжевых клеток, трансформированных конструкцией ДНК , содержащей следующую последовательность: 5'-Р-SP-(LP)n-PS-НР-3', где Р представляет собой промоторную последовательность, SР представляет собой последовательность ДНК, кодирующую сигнальный пептид дрожжевой аспарагиновой протеазы 3 (YAP3), LР представляет собой последовательность ДНК, кодирующую лидерный пептид, n представляет собой 0 или 1, РS представляет собой последовательность ДНК, кодирующую пептид, определяющий сайт процессинга дрожжей, и HP представляет собой последовательность ДНК, кодирующую полипептид, являющийся гетерологичным для выбранного организма-хозяина. Сигнальный пептид YAP3 обеспечивает эффективную секрецию гетерологичных белков в дрожжах. 5 з.п. ф-лы, 9 ил.
Формула
5'-P-SP-(LP)n - PS - HP - 3',
где Р является промоторной последовательностью;
SP является ДНК-последовательностью, кодирующей сигнальный пептид аспартиновой протеазы 3 дрожжей (YAP3);
LP является ДНК-последовательностью, кодирующей лидерный пептид;
n является 0 или 1;
PS является ДНК-последовательностью, кодирующей пептид, определяющий сайт процессинга дрожжей;
НР является ДНК-последовательностью, кодирующей полипептид, явлющийся гетерологичным для дрожжей.
ATG AAA CTG AAA ACT GTA AGA TCT GCG GTC CTT TCG TCA CTC TTT GCA TCT CAG GTC CTT GGC (SEQ 1D N1)
или подходящей модификацией ее, кодирующей пептид с высокой степенью гомологии с сигнальным пептидом YАР3.

Комментарии