Фрагмент днк, кодирующий промотор, обеспечивающий регулируемую кальцием экспрессию полипептидов, рекомбинантный вектор экспрессии pulad 50, рекомбинантный вектор экспрессии pulad 51, рекомбинантный штамм streptomyces lividans - продуцент аминогликозидфос - RU2112802C1
Код документа: RU2112802C1
Чертежи






Описание
Изобретение относится к биотехнологии. Более конкретно, оно относится к новому регулируемому кальцием промотору, который может быть использован для увеличения продуцирования внеклеточных ферментов или гетерологических полипептидов, рекомбинантному вектору, который включает ДНК-последовательность этого промотора, оперативно связанную с ДНК, кодирующей вышеупомянутый фермент или полипептид, и организму-хозяину, трансформированному рекомбинантным вектором, который включает промотор, оперативно соединенный с ДНК, кодирующей вышеупомянутый фермент или полипептид. Изобретение, кроме того, относится к системам экспрессии Streptomyces и способам для экспрессии чужеродных ДНК-последовательностей в Streptomyces и секретирования в окружающую среду полипептидов и протеинов, кодируемых такими чужеродными ДНК-последовательностями.
Streptomyces являются хорошо известными продуцентами самых разнообразных внеклеточных ферментов, включая протеазы, фосфатазы, ксиланазы, пеллулазы, амилазы, липазы и нуклеазы.
Кроме того, члены семейства Streptomyces продуцируют большое число антибиотиков, пигментов и других вторичных метаболитов и имеют сложную структуру дифференциации, приводящей к образованию спор. В емкостях по выращиванию Streptomyces имеется в общем случае совпадение в продуцировании внеклеточных ферментов и начале антибиотического продуцирования и биосинтеза пигментов и формировании спор. Все эти процессы репрессируются питательными условиями, которые благоприятствуют высоким скоростям роста, и инициируются изъятием источников P, C или N, маловероятно, что секретирование ферментов, образование вторичных метаболитов и дифференциация являются совершенно независимыми, а отвечают похожим механизмам переключения.
Клонировали несколько генов из Streptomyces, кодирующих внеклеточные ферменты. К ним относятся агараза из Streptomyces coelicolor, эндогликозидаза H из Streptomyces plicatus, ксиланаза из Streptomyces lividans, альфа-амилаза из Streptomyces hygroscopicus, целлулаза из Strep. spA2, бета-галактозидаза из Strep. lividans и бета-лактамаза из Strep. cacaoi, badius и fradiae.
Однако регулирующие механизмы, которые контролируют экспрессию этих генов, почти неизвестны. В дополнение к специфическим регулирующим механизмам, таким как индукция амилазы при помощи декстринов или малтотриозы и регулирование углеродных метаболитов амилазы или агаразы, видимо имеют место общие механизмы депрессии нескольких внеклеточных ферментов, так как в Streptomyces после сокращения подачи питательных веществ наблюдали одновременное продуцирование нескольких, разрушающих полимерный субстрат ферментов. Такие "сквозные" регулирующие гены были обнаружены в Bacillus subtilis /J.Bacteriol. , t. 169 с. 324-333, 1987/, Bacillus natto/J. Bacteriol., т. 166, с. 20-28, 1986/ Bacillus licheniformis.
Положительные регулирующие гены, нарушающие синтез и/или секретирование фермента, могут быть клонированы в результате поиска более "скоростного" секретирования внеклеточных ферментов в штамме со слабым секретированием, таком как S. lividans.
Системы для экспрессии чужеродных ДНК-последовательностей в Streptomyces ранее были описаны, например в ЕП 148552 и WO 88/07079/ Эти системы используют эндогенные промоторы внеклеточных ферментов, продуцируемых клетками Streptomyces.
Замена эндогенных промоторов чужеродными промоторами описана в WO 90/14426, где также предложено клонирование и характеризация вновь изолированного гена, гена saf, кодирующего новый полипептид, именуемый как saf-полипептид, который модулирует непосредственно или косвенно экспрессию генов внеклеточных ферментов в Streptomyces при помощи взаимодействия с регулирующей областью структурных генов для внеклеточных ферментов.
Было установлено, что промотор гена saf является более мощным, чем натуральный промотор внеклеточных ферментов. Например, ген амилазы экспрессирует гораздо большие количества амилазы, когда промотор saf заменен натуральным промотором амилазы. Таким образом, промотор saf можно использовать для протеина вместо натурального промотора этого протеина.
Для клонирования и характеризации гена saf плазмиду pIJ 702/Katz и др., J. Gen. Microbiol, т.129 с. 2703-2714, 1983/ использовали в качестве клонирующего вектора. Эта плазмида содержит ген тирозиназы, фермента, отвечающего за образование меламина из триозина в нескольких видах Streptomyces. Анализировали локус mel в pIJ 702 и были идентифицированы два открытых для считывания участка /ORF/: первым является ORF, соответствующий гену mel, который кодирует полипептидную цепь тирозиназы, второй ORF, расположенный в направлении вверх от гена mel, именовали ORF 438/ Bernan и др., Gene, т. 37, с. 101 - 110, 1985/, и его роль еще неясна.
Во время этого исследования, осуществляемого для того, чтобы точно расположить ген saf, фрагмент SstI-KpnI/432 нуклеотида - ген saf без промотора/ вставляли в сайт Bgl 11 в pIJ 702. Удивительный эффект этого исследования состоял в отсутствии экспрессии этого фрагмента, когда он был вставлен с правильной ориентацией, и в его экспрессии, когда он был вставлен с противоположной ориентацией /в направлении по часовой стрелке/ относительно ORF 438. Из этого открытия следовало присутствие фрагмента с активностью промоторов перед геном mel и в сайте клонирования Bgl 11, расположенного внутри ORF 438 с противоположной ориентацией.
Основная
цель настоящего изобретения состоит в том, чтобы предложить новый промотор, который был идентифицирован в ДНК-фрагменте, содержащемся внутри ORF 438 плазмиды pIJ 702, имеющий следующую нуклеотидную
последовательность:

Активность этого промотора положительно регулируется ионами кальция, и экспрессия генов внеклеточных ферментов в Streptomyces, оперативно связанных с вышеупомянутым промотором, значительно увеличивается в присутствии растворов CaCl2.
Еще в одном аспекте настоящего изобретения предлагаются клонирующие носители (векторы), которые включают вышеупомянутый промотор, оперативно соединенный с эндогенной или чужеродной ДНК-последовательностью, кодирующей полипептид или протеин, а также организмы-хозяева или клетки-хозяева, трансформированные такими клонирующими носителями, при этом осуществляется экспрессия и секретирование полипептида, кодируемого вышеупомянутой ДНК-последовательностью.
В еще одном аспекте в соответствии с настоящим изобретением предлагается интегрирование такого клонирующего носителя, несущего чужеродную ДНК-последовательность, в хромосомную ДНК из Streptomyces.
В еще одном аспекте в соответствии с настоящим изобретением предлагается способ получения внеклеточного фермента, целевого полипептида или протеина при помощи культивирования трансформированного организма-хозяина в соответствии с настоящим изобретением и выделения продукта из культурного бульона.
Новый промотор, содержащийся в ORF 438, обладает активностью промотора с противоположной ориентацией относительно ориентации ORF 438, и в дальнейшем именуется как po 438 /промотор, противоположный ORF 438/. Знание его промоторной активности по часовой стрелке в PIJ 702 очень важно для того, чтобы избежать ошибочных интерпретаций в исследованиях по экспрессии гена ДНК-фрагментов, клонированных в этом векторе.
Промотор Po 438 является первым известным, регулируемым кальцием промотором, который был охарактеризован в Streptomyces и может быть использован для ускорения экспрессии в Streptomyces выбранных гетерологических протеинов при помощи вставки ДНК-фрагмента, содержащего промотор Po 438, в соответствующий сайт расщепления, расположенный в направлении вверх от гена, кодирующего целевой протеин, в соответствующем клонирующем носителе, трансформации хозяина - Streptomyces такими клонирующими носителями и культивирования трансформированных бактерий в присутствии раствора Ca2+, чтобы секретировать выбранный протеин или его порцию.
Активность промотора Po 438 была обнаружена с использованием двух различных векторов зондов промоторов. ДНК-фрагмент, содержащий промотор Po 438, субклонировали в двух различных плазмидах, несущих ген аминогликозид фосфотрансферазы /neo/ без промотора и ген катехол диоксигеназы /XY1E/ без промотора соответственно /фиг. 1/. Оба гена экспрессировали значительные количества каждого фермента в присутствии возрастающих концентраций ионов кальция, что, таким образом, указывает на регулируемую кальцием активность промотора Po438.
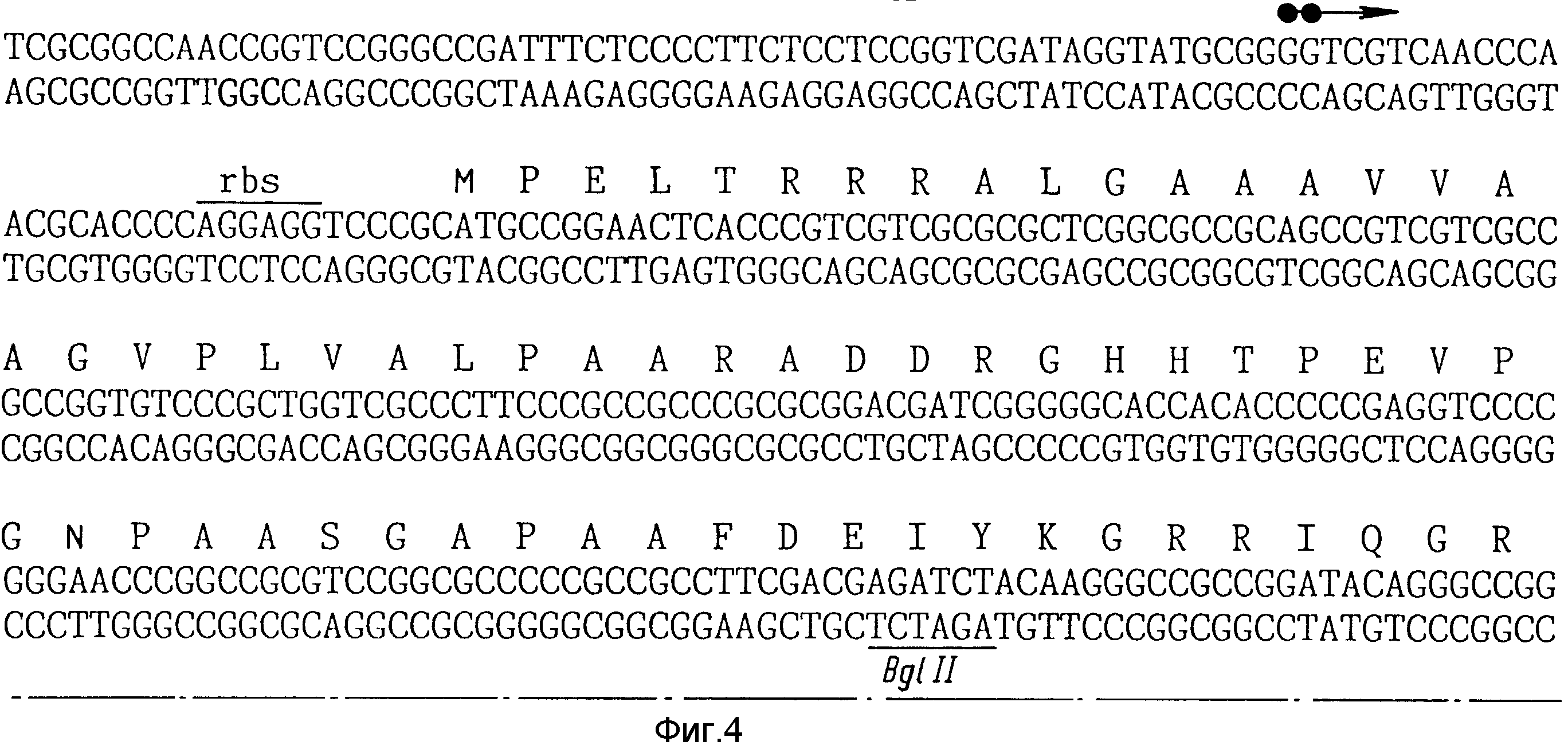
Точку начала транскрипции в Po438 определяли при помощи эксперимента с построением карты нуклеазы S1, который находил эту точку начала вблизи C 24nt от сайта SstI /фиг. 4, 5/.
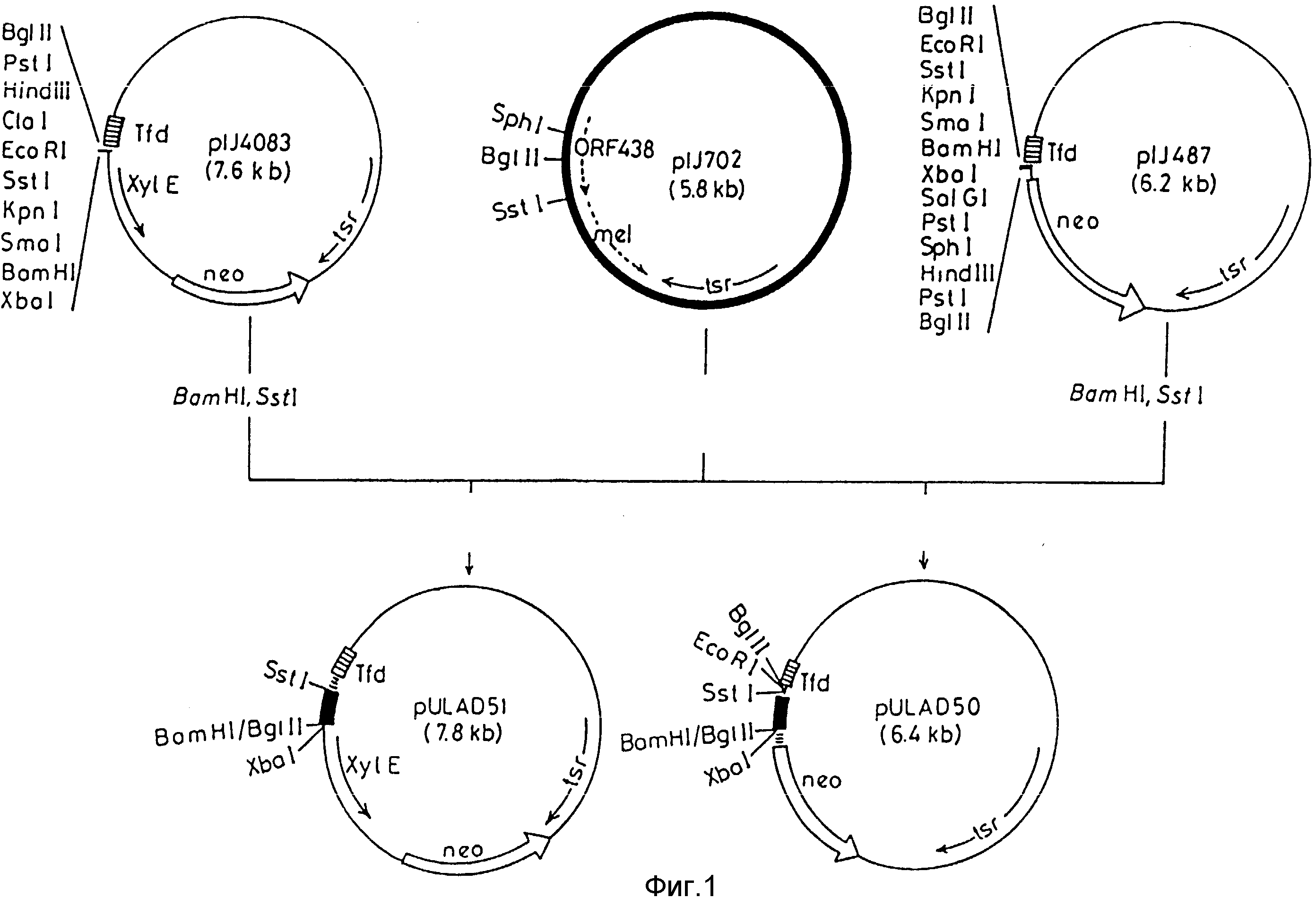
На фиг. 1 приведена конструкция плазмид pULAD50 и pULAD51, несущих фрагмент SstI-BglII в 242 по из pIJ702 /содержащей Po438/, клонированный в векторах PIJ487 /Ward и др., 1986/ и pIJ4083 зонда промотора.
На фиг. 2 приведена промоторная активность фрагмента SstI-BglII в 242 по из pIJ 702. Градиент канамицина /0 - 180 уг/мл/ устанавливали на твердой среде ММ /Hopwood, 1967/ и на него наносили полосами S. lividans, несущую плазмиду pULAD 50 /A/ или pIJ 487 /B/.
На фиг. 3 показаны схематическое представление области из pULAD 50, несущее фрагмент SstI-BglII в 242 по из pIJ 702, и стратегия, которой следовали при получении S1-карты. В диаграмме полоса, отмеченная звездочкой, представляет меченый фрагмент, а полоса, обозначенная через S1, представляет полученный защищенный фрагмент. Полосы A-C-G-T показывают четыре последовательные реакции для однонитевой ДНК M13mp18 /справа/ и для фрагмента SstI-BglII в 242 по из pIJ 702 /слева/.
1-защищенный фрагмент в гибридизации между фрагментом 270nt Hind III-SstI из pULAD50 и nРНК из S. lividans /pULAD50/.
2 - зонд Hind III-SstI 270nt.
3 - зонд Bgl II-SstI 242nt.
4 - защищенный фрагмент в гибридизации между фрагментом Bgl II-SstI в 242nt из pIJ 702 и nРНК из S. lividans /pIJ 702/.
Стрелками указаны полосы гибридизации, соответствующие защищенным фрагментам.
На фиг. 4, 5 показана нуклеотидная последовательность ДНК-области в кластере mel, который содержит ORP 438, представленный своей амиокислотной последовательностью. Сайты рестрикции Bgl II и SstI, которые расположены по бокам ДНК-фрагмента, клонированного в PIJ 487, для того, чтобы построить pULAD50, также указаны. Приведены также две первые аминокислоты тирозиназы.
•• - инициирование транскрипта mel в соответствии с Geistlich и др. /1989/ и Leu и др. /1989/.
∞ - инициирование транскрипции из Po438 в соответствии с экспериментами с построением S1-нуклеазы-карты /фиг. 3/.
rbs - сайт связывания рибосомы.
На фиг. 6 показана фосфатная репрессия экспрессии из промотора Po438. Градиент неомицина /O - 180 уг/мл/ получали на твердом буфере MM+TES 825 мМ, pH 7,2 /верхняя пластинка/ и на той же среде, дополненной буфером фосфата натрия 20 мМ, pH 7,2 /нижняя пластинка/. На обе пластинки наносили полосками одно и то же количество спор S. Iividans /pULAD 50/.
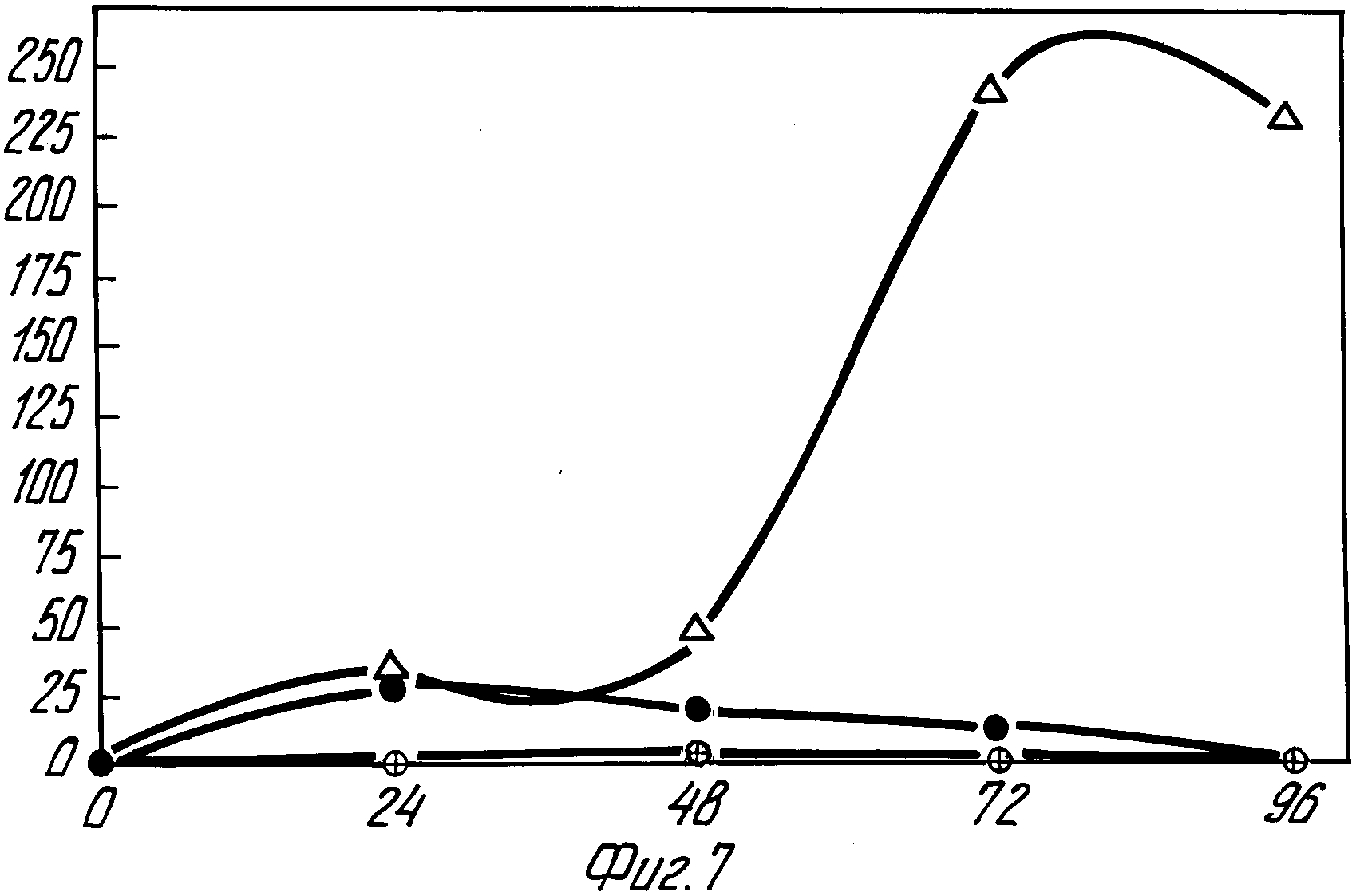
На фиг. 7 показана индукция кальцием в Streptomyces гена XY1E без промотора из Pseudomonas putida, когда он помещен в направлении вниз от промотора Po438. S. lividans /pULAD 51/ выращивали в жидкой среде R2YE, не содержащей кальция /•/, и среде R2YE, дополненной дополнительным CaCl2 до 60 мМ
Работу, описанную здесь, осуществляли с использованием следующих материалов и приемов.
Бактериальные штаммы и плазмиды. Штаммы Streptomyces и плазмиды, используемые в этом исследовании, перечислены в табл.1.
Среда и условия выращивания. Трансформация протопластов. Штаммы Streptomyces выращивали в R2YE, минимальной среде /ММ/ или YEME, дополненной 34% сахарозы и 5 мМ MgCl2 /Hopwood и др. Genectic manipulation of Streptomyces. A LABORATORY MANUAL. The John Innes Foundation, Norwich, U.K., 1985/.
Жидкие культуры Streptomyces выращивали в колбах с тремя перегородками при 28oC на роторном вибраторе при перемешивании со скоростью 220 об/мин.
Трансформация и получение протопластов S. lividans осуществляли, как это описано в /Thomposon и др., J. Bacterid, т. 151, с. 668 - 677, 1982/.
ДНК-изоляции, манипуляции и анализ ДНК-последовательности. ДНК плазмиды изолировали, следуя процедуре Кизера /Kieser и др., Plasmid, т. 12, с. 19 - 36, 1984/. За перевариваниями и лигациями наблюдали с использованием электрофореза на агарозовом геле. Условия для переваривания эндонуклеазой рестрикции и реакции лигации использовали те, что рекомендованы производителями. Субклонирование ДНК-фрагментов осуществляли при помощи переваривания 1 - 2 уг ДНК плазмиды адекватным ферментом /ферментами/ рестрикции, а реакционные продукты отделяли при помощи гелевого электрофореза на агарозе с низкой точкой температуры плавления /LMPA/.
Нуклеотидную последовательность определяли при помощи процедуры обрыва цепи Сэнгера /Sanger и др. , PROC. NATL. ACAD. SCI. USA т. 74, с. 5463 - 5467, 1977/, используя М13-клоны /Messing и др., NUKL. ACID RES, т. 9, с. 309 - 321, 1981/.
Изоляция РНК и построение карты S1-нуклеазы. РНК изолировали в соответствии с процедурой, предложенной Керби /Kirby и др., BIOCHEM. J. т. 104, с. 258 - 262, 1967/, из 50-часовой культуры в ММ-среде. При построении S1-карты у ДНК-зондов метили концы /Maxam и Gilbert, METHODS ENZYMOL, т. 65, с. 499 - 560, 1980/. РНК /40 уг/ смешивали с 105 отсчетами в минуту ДНК-фрагмента с [32P]-меченными концами и денатурировали при 85oC в течение 15 мин /Favalora и др., METHODS ENZYMOL, т. 65, с. 718 - 749, 1980/. Гибридизацию осуществляли при 60oC в течение 3 ч, обрабатывали 60 единицами нуклеазы S1 и продукт S1-переваривания загружали на 7% /м/о/ полиакриламидный гель, содержащий 7М мочевины, и осуществляли параллельный эксперимент с фагом M13mp18, а затем фрагмент Bgl II-SstI в 242 по из pIJ702 анализировали на состав последовательности по методу Сэнгера.
Обнаружение активности катехол диоксигеназы. Для анализа на планшетах трансформированные колонии Streptomyces выращивали при 28oC в течение 3 дн, и над планетами разбрызгивали водный раствор 0,5 М катехола. Для жидких анализов штаммы Streptomyces выращивали при 28oC в 50 мл жидкой среды R2YE CaCl2 или дополненной CaCl2 /60 мМ/. В различные моменты времени брали образцы и определяли активности катехол диоксигеназы, как это описано в /Ingram и др., J. Bacterial, т. 171, с. 6617 - 6624, 1989/. Концентрации протеина определяли по методу Брэдфорда, используя альбумин бычьей сыворотки в качестве стандарта /Brandford, Anal. Biochem, т. 72, с. 248 - 254, 1976/.
Следующее подробное описание будет иллюстрировать настоящее изобретение.
Активность
промотора Po438
Активность промотора Po438 определяли через экспрессию гена аминогликозид фосфотрансферазы и гена катехол диоксигеназы, содержащихся в двух различных векторах зондов
промоторов.
Экспрессия гена аминогликозид фосфотрансферазы. Фрагмент Bgl II-SstI в 242 по из плазмиды pIJ 702 субклонировали в pIJ 487 /Ward и др., Mol. Gen. Genet., т. 203, с. 468 - 478, 1986/, которая несет ген аминогликозид фосфотрансферазы /neo/ без промотора. Экспрессия этого гена наделяет Streptomyces lividans стойкостью к канамицину /Km/ и неомицину. Таким образом, получали плазмиду pULAD 50 /фиг.1/. S.lividans, трансформированная при помощи pULAD 50, способна расти на ММ, содержащей более чем 150 уг/мл Km, в то время как S. lividans, трансформированная при помощи pIJ 487 /вектор зонда промотора без вставленного промотора/ не растет на ММ с 10 уг/мл Km, как это показано на фиг.2. Этот результат очевидно указывает, что фрагмент Bgl II-SstI из pIJ 702 обладает активностью промотора в Streptomyces с ориентацией от сайта SstI к сайту Bgl II.
Экспрессия гена катехол диоксигеназы. Фрагмент BglII-Sst I в 242 по, описанный в приведенном выше примере, сублокировали в другой вектор зонда промотора, плазмиду pIJ 4083, которая несет ген XY1E из Pseudomonas patida, кодирующий фермент катехол диоксигеназы. Гибридную плазмиду именовали pULAD 51 /фиг. 1/. Streptomyces lividans, трансформированные при помощи pULAD 51, выращивали в среде R2YE, дополнительной CaCl2 до концентрации 60 мм. Квантование активности катехол диоксагеназы указывало на то, что Po438 осуществляет активность промотора также в том случае, если его вставляли в направлении вверх от гена XY1E /фиг.7/.
Регулирование экспрессии от Po438 ионами кальция.
Анализировали эффект различных ионов на промоторную активность Po438. Так как уровень стойкости к канамицину зависит от количества соли в среде для выращивания /Hopwood и др., Genetic Manipulation of Streptomyces. A Laboratory Manual. The John Innes Foundation, Norwich, U.K., 1985/, неомицин /Neo/ использовали в ММ для этого исследования. Во всех случаях ММ дополняли буфером TES/25 мМ, pH 7,2/ для того, чтобы избежать изменений pH. Mg2+, Fe2+, Zn2+, Cu2+ катионы не оказывали влияния на силу Po438 /стойкость к 170 уг/мл NeO на ММ-пластинках/ в то время как несколько одновалентных катионов /Na+, K+, Li+, Cs+, 10 мМ/ осуществляли слабое восстановление промоторной активности, и на ММ, содержащей более чем 100 уг/мл Neo, рост отсутствовал. Восстановление промоторной активности также отмечали, когда ММ дополняли буфером фосфата натрия /20 мМ, pH 7,2/, как показано на фиг.5.
Ионы кальция положительно регулируют промоторную активность Po438 Ca2+ значительно увеличивают стойкость к Neo у S.lividans, трансформированной плазмидой pULAD 50, и была показана /табл. 2/ строгая корреляция между концентрацией CaCl2 и уровнем стойкости к Neo.
Плазмида pULAD 60 представляет пример аналогичной плазмиды с тем же геном neo, связанным в другим промотором, saf-промотором, как это было описано в WO 90/14426. Стойкость к Neo у S.lividans, трансформированной при помощи pULAD 60, однако не модифицируется, когда выращивание осуществляют на ММ, содержащей другие концентрации CaCl2/0, 10, 20, 30, 40 мМ/, что наводит на мысль, что отсутствует как пост-трансляционная стимуляция продукта гена neo, так и дезактивация кальцием неомицина. Если бы эффект Ca2+ не был специфическим, стимулирующий эффект должен был наблюдаться при всех этих концентрациях. Это подтверждает, что активность промотора Po438 специфически регулируется ионами кальция.
Кальциевая индукция была также отмечена при экспрессии XY1E в S.lividans, трансформированной плазмидой pULAD 51, как это показано на фиг.7. Активность катехол диоксигеназы /CatO2ase/ значительно увеличивается, если культурная среда R2YE дополняется CaCl2 до концентрации 60 мМ. Активность катехол диоксигеназы S. lividans, трансформированной при помощи pIJ 4038 /вектора зонда промотора без промотора Po438/, напротив не изменялась, когда ее выращивали в среде R2YE с хлоридом кальция или без него.
Определение точки начала транскрипции в Po438.
Эксперименты с картой S1 - нуклеазы осуществляли для того, чтобы определить точку начала транскрипции и последовательности промотора Po438. Фрагмент HindIII - SstI в 270 п.о., изолированный из pULAD 50, метили в 5'-конце Hind III и гибридизировали с nРНК, выделенной из S.lividans, несущей pUlad 50. Показывали, что защищенный фрагмент по размеру был примерно на 24nt (nt - сокр. нуклеотид-пер. ) короче, чем контрольный зонд /фиг.3/, который содержит точку начала транскрипции в области C на расстоянии 24 nt от сайта SstI /фиг.4, 5/.
Второй эксперимент с картой S1-нуклеазы осуществляли с первоначальной плазмидой pIJ 702, которая также содержит область ДНК. Фрагмент Bgl II-SstI в 242 по из pIJ 702 использовали в качестве зонда. Этот фрагмент метили в 5'-конце BglII и гибридизировали с nРНК, выделенной из S.lividans, трансформированной при помощи pIJ 702. На фиг.3 показано, что защищенный фрагмент был по-прежнему на 24 nt короче, чем зонд, указывая на то, что начало транскрипции имеет место в pIJ 702 в том же нуклеотиде, что в pULAD 50.
На фиг.4, 5 показана область промотора гена mel в ORF 438, расположенная на примерно 30nt от старт-кодона в ORF 438 /Geistlich и др., Molecular Microbiology, т. 3, с.1061 - 1069, 1989; Leu и др. Gene, т.84, с.267 - 277, 1989/, а также промотор Po438, расположенный с противоположной ориентацией относительно ориентации ORF438 и его точки начала транскрипции в соответствии с экспериментами с картой S1-нуклеазы, выполненными в соответствии с настоящим описанием.
В то время, как в примерах были специально упомянуты ген аминогликозид фосфотрансферазы и ген катехол диоксигеназы, необходимо иметь в виду, что для целей усиления экспрессии через использование промотора Po438 ген любого полипептида или протеина, продуцируемого используемыми видами Streptomyces, может быть модифицирован при помощи удаления нативного промотора и замещения промотора Po438. Аналогично, чужеродная ДНК, кодирующая полипептид или протеин, может быть вставлена в любой такой эндогенный ген. В предпочтительном варианте, однако, выбранным эндогенным геном будет ген, который экспрессирует протеин через стенку клеток и в культурную среду, при этом важно сохранить сигнальную последовательность секретирования. Поэтому в предпочтительном варианте чужеродную ДНК вставляют таким образом, чтобы сохранить сигналы секретирования в максимальной степени из гена внеклеточного фермента. В то время как эти сигналы расположены главным образом на последовательности лидера, очевидно относительно эндогенных генов для внеклеточных ферментов, что терминальный карбоксильный конец также важен для секретирования. Таким образом, может оказаться наилучшим вариантом создать протеин слияния при помощи вставки чужеродной ДНК в эндогенную ДНК, чем удалять переписываемую часть эндогенной ДНК и вставлять чужеродную ДНК.
Необходимо иметь в виду, что последовательностью чужеродной ДНК может быть любая ДНК-последовательность, полученная не из Streptomyces, кодирующая протеин или полипептид, в частности, ДНК эукариотного или вирусного происхождения. Примерами таких эукариотных и вирусных ДНК-последовательностей являются последовательности, кодирующие человеческий и животный лейкоцитный интерферон /IFN-альфа/, интерферон фибробластов /IFN-бета/ и иммунный интерферон /IFN-гамма/, человеческий инсулин, человеческие и животные гормоны роста, и другие гормоны, такие как фактор высвобождения кортикотропина /CRF/, альбумин человеческой сыворотки и различные факторы человеческой крови, и плазминогенные активаторы как тканевые, так и урокиназа, поверхностные антигены и антигены ядра вируса гепатита B, антигены вируса FMD, и другие человеческие, животные и вирусные полипептиды и протеины.
Ссылки, цитируемые на чертежах и в табл. 1.
Geistlich M., Irniger S. and Hutter R.: Localization and functional analysis of the regulated promoter from the Streptomyces glaucescens mel operon. Molecular Microbiology. 3 (1989) 1061 - 1069.
Hopwood D.A.: Genetic analysis and genome structure in Streptomyces coelicolor. Bacterial. Rev. 31 (1967) 373 - 403.
Katz, E. , Thompson, C.J. and Hopwood, D.A.: Cloning and expression of the tyrosinase gene from Streptomyces antibioticus in Streptomyces lividans. J. Gen. Microbiol. 129 (1983) 2703 - 2714.
Leu, W.-M., Wu, S.-Y., Lin, J.-J., Lo, S.J. and Wu Lee, Y.-H.: Analysis of the promoter region of the melanin locus from Streptomyces antibioticus. Gene 84 (1989) 267 - 277.
Ward, J.M., Janssen, G.R., Kieser, T., Bibb, M.J., Buttner, M.J. and Bibb, M.J.: Construction and characterization of a series of multi-copy promoter-probe plasmid vectors for Streptomyces using the aminoglycoside phosphotransferase gene from Tn5 as indicator, Mol. Gen. Genet. 203 (1986) 468 - 478.
Реферат
Фрагмент ДНК кодирует промотор, обеспечивающий регулируемую кальцием экспрессию полипептидов, в частности ферментов в клетках Streptomyces. Нуклеотидная последовательность фрагмента установлена. Рекомбинантный вектор экспрессии pUL AD 50 включает фрагмент ДНК промотора, ген аминогликозидфосфотрансферазы и гены резистентности к канамицину и неомицину. Рекомбинантный вектор экспрессии pULAD 51 содержит фрагмент ДНК промотора и ген катехолдезоксигеназы. Рекомбинантный штамм Streptomyces lividans JI 1326/pULAD 50, трансформированный вектором экспрессии pULAD 50, продуцирует аминогликозидфосфотрансферазу. Рекомбинантный штамм Streptomyces lividans JI 1326/pULAD 51, трансформированный вектором экспрессии pULAD 51, продуцирует катехолдезоксигеназу. Способ экспрессии чужеродной ДНК-последовательности в клетках Streptomyces предусматривает оперативное связывание указанной ДНК-последовательности с последовательностью, контролирующей экспрессию в Streptomyces. Последовательность, контролирующая экспрессию, включает промотор, которым является фрагмент ДНК, обеспечивающий регулируемую кальцием экспрессию полипептидов и сигнальную последовательность. 6 с.п. ф-лы, 7 ил., 2 табл.

Комментарии