Вектор для переноса и вакцина против туберкулеза - RU2453603C2
Код документа: RU2453603C2
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому вектору для переноса, рекомбинантному бакуловирусу, получаемому гомологичной рекомбинацией вектора для переноса и ДНК бакуловируса, а также к способам их получения.
Также настоящее изобретение относится к фармацевтическим веществам (например, вакцинам, профилактическим или терапевтическим лекарственным средствам против инфекционных заболеваний, таких как малярия и грипп), содержащим рекомбинантный бакуловирус в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Бакуловирус используется в качестве вектора в способе промышленного получения заданного белка с использованием клеток насекомых. В последние годы было открыто, что посредством бакуловируса можно вводить чужеродный ген не только в клетки насекомых, но также и в клетки млекопитающих, и кроме того, была открыта возможность получения вектора, в который вводят ген для терапии. В патентном документе 1 раскрыт рекомбинантный бакуловирусный вектор экспрессии с многочисленными независимыми промоторами, который включает участок ДНК, содержащий ген, кодирующий вирусный неструктурный белок, при промоторе, который получен из раннего гена из бакуловируса, а также включает участок ДНК, содержащий ген, который кодирует вирусный структурный белок, при промоторе, полученном из позднего гена.
В патентном документе 2 раскрыт способ, где в клетку вводят не относящийся к млекопитающим ДНК-вирус, содержащий промотор, контролируемый таким образом, что экзогенный ген экспрессируется из вектора, в котором желаемые экзогенные гены связаны с многочисленными независимыми промоторами, и где экзогенный ген экспрессируется в клетке млекопитающих.
Кроме того, в патентном документе 3 раскрыт способ получения белка посредством технологии рекомбинации генов с использованием бакуловируса, а также раскрыт способ получения белка в результате экспрессии слитого гена, получаемого связыванием гена gp64 из бакуловируса с геном, кодирующим желаемый белок, с получением желаемого белка в том виде, в котором желаемый белок слит с вирусными частицами, сбором слитых с желаемым белком вирусных частиц и отщеплением желаемого белка от вирусных частиц для получения желаемого белка.
В патентном документе 4 для бакуловирусной системы экспрессии раскрыт рекомбинантный бакуловирусный вектор экспрессии с многочисленными независимыми промоторами, который содержит первую последовательность нуклеиновой кислоты, кодирующую маркер для регистрации, связанный в способном к функционированию виде с первым промотором, который активен в клетке-хозяине и не активен в несоответствующей клетке, а также вектор содержит вторую последовательность нуклеиновой кислоты, которая включает чужеродную последовательность нуклеиновой кислоты, связанную в способном к функционированию виде со вторым промотором, который активен в несоответствующей клетке.
В патентном документе 5 раскрыто, что экспрессирующий антиген гемагглютинина (НА) вируса гриппа рекомбинантный бакуловирусный вектор, который связан с полученным из β-актина цыпленка промотором CAG, является эффективным в качестве препарата вакцины, поскольку вектор оказывает профилактический эффект в отношении инфицирования вирусом гриппа.
В патентном документе 6 раскрыт способ получения бакуловирусного вектора, включающий стадию совместной трансфекции, при которой в клетку насекомого совместно трансфицируют плазмиду, в которой гены, кодирующие экспрессирующиеся на клеточной поверхности белки, были связаны с бакуловирусным промотором, а промотор получен из клетки млекопитающего, соответственно, а также трансфицируют плазмиду, в которой гены, кодирующие экспрессирующиеся на клеточной поверхности белки, были связаны с двумя бакуловирусными промоторами, соответственно.
Кроме того, в патентном документе 7 раскрыто исследование активности против вируса гриппа в отношении инфицирования вирусом гриппа, где использовали рекомбинантный бакуловирус, в котором кДНК из НА вируса гриппа была встроена в промотор CAG, a также в этом документе раскрыто, что активностью обладает не только рекомбинантный бакуловирус, но и бакуловирус дикого типа.
Таким образом, в последние годы были сконструированы различные рекомбинантные бакуловирусы и было исследовано получение с их использованием фармацевтических веществ для млекопитающих при применении рекомбинантного бакуловируса в качестве активного ингредиента.
В связанной с данной области являются желаемыми рекомбинантный бакуловирусный вектор с новой структурой и получение фармацевтического препарата, в частности препарата вакцины, с использованием рекомбинантного бакуловируса в качестве активного ингредиента, где препарат эффективен против инфекционных заболеваний, таких как малярия и грипп, или против таких заболеваний, как рак.
Патентный документ 1: японский патент №3366328, "Бакуловирусная система экспрессии с многочисленными промоторами и продукты с дефектными частицами".
Патентный документ 2: WO 98/011243, "Не относящийся к млекопитающим ДНК-вирус с модифицированным белком оболочки".
Патентный документ 3: JP №2002-235236-А, "Способы получения белков".
Патентный документ 4: JP №2003-284557-А, "Новый бакуловирусный вектор для трансфекции и рекомбинантный бакуловирус для экспрессии чужеродного гена".
Патентный документ 5: WO 02/062381, "Вакцина из бакуловирусного вектора".
Патентный документ 6: WO 04/029259, "Бакуловирусный вектор, способ получения бакуловирусного вектора и способ введения гена".
Патентный документ 7: JP №2005-15346-А, "Противовирусное средство, содержащее бакуловирус".
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ С ИСПОЛЬЗОВАНИЕМ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в обеспечении нового рекомбинантного вектора для переноса, рекомбинантного бакуловируса, получаемого гомологичной рекомбинацией рекомбинантного вектора для переноса и бакуловирусной ДНК, а также в обеспечении способов их получения.
Другая цель настоящего изобретения состоит в обеспечении фармацевтического вещества, в частности препарата вакцины, с использованием рекомбинантного бакуловируса в качестве активного ингредиента.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
Авторами настоящего изобретения был открыт обладающий новой структурой вектор для переноса, способный к экспрессии белка с желаемой иммуногенностью или слитого белка, состоящего из неполноценного белка или белка, обладающего иммуногенностью, и цитокина, в клетках насекомых и клетках позвоночных (в частности, млекопитающих, птиц и рыб), отличных от клеток насекомых, а также был открыт рекомбинантный бакуловирус, получаемый гомологичной рекомбинацией вектора для переноса и бакуловирусной ДНК. В результате обеспечения рекомбинантного бакуловируса было тщательно исследовано фармацевтическое вещество, содержащее рекомбинантный бакуловирус в качестве активного ингредиента, которое оказывает эффективные профилактические и/или терапевтические эффекты в отношении инфекционных заболеваний. В результате авторами изобретения было сделано новое открытие, что рекомбинантный бакуловирус оказывает эффект как желаемое фармацевтическое средство.
Кроме того, согласно настоящему изобретению были подтверждены обладающий новой структурой рекомбинантный вектор для переноса, рекомбинантный бакуловирус, получаемый гомологичной рекомбинацией вектора для переноса и бакуловирусной ДНК, и способы их получения, а также было подтверждено, что рекомбинантный бакуловирус сам по себе был эффективным в качестве фармацевтического средства, являясь способным к экспрессии белка с желаемой иммуногенностью в клетках-мишенях, и был эффективным в качестве профилактического фармацевтического средства против инфекционных заболеваний, таких как малярия и грипп, и на этом настоящее изобретение было завершено.
Настоящее изобретение относится к изобретению, представленному в следующих ниже [1]-[31].
[1] Способ получения вектора для переноса, содержащего структуру, в которую встроены сдвоенный промотор и слитый ген, характеризующуюся тем, что слитый ген, который содержит, по меньшей мере, один ген, кодирующий белок, способный быть компонентом вирусной частицы, и, по меньшей мере, один иммуногенный чужеродный ген связаны в нижестоящем положении относительно сдвоенного промотора, связывающего один промотор позвоночных, способный функционировать в позвоночных, и другой бакуловирусный промотор.
[2] Способ по [1], где промотор позвоночных, способный функционировать в позвоночных, представляет собой промотор млекопитающих, способный функционировать в млекопитающих.
[3] Способ по [1] или [2], характеризующийся тем, что ген, кодирующий, по меньшей мере, один белок, способный быть компонентом вирусной частицы, представляет собой любой из бакуловирусного гена gp64, гена гликопротеина вируса везикулярного стоматита, гена гликопротеина вируса иммунодефицита человека типа I, гена мембранного гликопротеина респираторно-синцитиального вируса человека, гена белка гемагглютинина вируса гриппа типа А, гена белка гемагглютинина вируса гриппа типа В, гена гликопротеина вируса простого герпеса и гена белка S вируса гепатита мыши.
[4] Способ по [1] или [2], где промотор позвоночных, способный функционировать в позвоночных, выбирают из любого из промотора цитомегаловируса, промотора SV40, ретровирусного промотора, промотора металлотионеина, промотора белка теплового шока, промотора CAG, промотора фактора элонгации 1α, промотора актина, промотора убиквитина, промотора альбумина и промотора МНС класса II.
[5] Способ по любому из [1]-[4], где бакуловирусный промотор выбирают из промотора полиэдрина, промотора р10, промотора IE1, промотора IE2, промотора р35, промотора р39 и промотора gp64.
[6] Способ по любому из [1]-[5], где иммуногенный чужеродный ген выбирают из любого из антигена малярии, антигена гриппа, антигена М.tuberculosis, антигена вируса SARS, антигена вируса лихорадки Западного Нила, антигена вируса лихорадки денге, антигена ВИЧ, антигена HCV, антигена лейшмании, антигена трипаносомы, антигена лейкоцитозоона по отдельности или слитого антигена, состоящего, по меньшей мере, из одного антигена, выбранного из этой группы генов антигенов, и цитокина.
[7] Способ по любому из [1]-[6], где вектор для переноса представляет собой любой из pDual-Hsp65-gp64, pDual-PbCSP-gp64, pDual-H1N1/HA1-gp64, pDual-PbTRAMP-gp64, pDual-PbAMA1D123-gp64, pDual-PbMSP119-gp64, pDual-PfCSP-gp64, pDual-PfAMA1-gp64, pDual-Pfs25-gp64, pDual-H5N1/HA1-gp64, pDual-SARS/S-gp64, pCP-H1N1/HA1-gp64, pCAP-H1N1/HA1-gp64, pCU-H1N1/HA1-gp64, pDual-H1N1/M2-gp64, pDual-H1N1/NAe-gp64, pDual-M2e-gp64, pCP-HA1/NC99-gp64, pCP-H1N1/HA0-gp64, pCP-H1N1/HA2-gp64 и pCP-H1N1/HA1-vp39.
[8] Способ получения рекомбинантного бакуловируса, включающий стадию получения вектора для переноса, содержащего структуру, в которую встроены сдвоенный промотор и слитый ген, характеризующуюся тем, что слитый ген, который содержит, по меньшей мере, один ген, кодирующий белок, способный быть компонентом вирусной частицы, и, по меньшей мере, один иммуногенный чужеродный ген связаны в нижестоящем положении относительно сдвоенного промотора, связывающего один промотор позвоночных, способный функционировать в позвоночных, и другой бакуловирусный промотор; стадию совместной трансфекции вектора для переноса и бакуловирусной ДНК в клетку-хозяина насекомого; и стадию выделения рекомбинантного бакуловируса.
[9] Способ по [8], характеризующийся тем, что ген, кодирующий, по меньшей мере, один белок, способный быть компонентом вирусной частицы, представляет собой любой из бакуловирусного гена gp64, гена гликопротеина вируса везикулярного стоматита, гена гликопротеина вируса иммунодефицита человека типа I, гена мембранного гликопротеина респираторно-синцитиального вируса человека, гена белка гемагглютинина вируса гриппа типа А, гена белка гемагглютинина вируса гриппа типа В, гена гликопротеина вируса простого герпеса и гена белка S вируса гепатита мыши.
[10] Способ по [9], где промотор позвоночных, способный функционировать в позвоночных, выбирают из любого из промотора цитомегаловируса, промотора SV40, ретровирусного промотора, промотора металлотионеина, промотора белка теплового шока, промотора CAG, промотора фактора элонгации 1α, промотора актина, промотора убиквитина, промотора альбумина и промотора МНС класса II.
[11] Способ по любому из [8]-[10], где бакуловирусный промотор выбирают из промотора полиэдрина, промотора р10, промотора IE1, промотора р35, промотора р39 и промотора gp64.
[12] Способ по любому из [8]-[11], где иммуногенный чужеродный ген выбирают из любого из антигена малярии, антигена гриппа, антигена М.tuberculosis, антигена вируса SARS, антигена вируса лихорадки Западного Нила, антигена вируса лихорадки денге, антигена ВИЧ, антигена HCV, антигена лейшмании, антигена трипаносомы, антигена лейкоцитозоона по отдельности или слитого антигена, состоящего из одного антигена, выбранного из этой группы генов антигенов, и цитокина.
[13] Способ по любому из [8]-[12], где рекомбинантный бакуловирус представляет собой любой из AcNPV-Dual-Hsp65, AcNPV-Dual-PbCSP, AcNPV-Dual-H1N1/HA1, AcNPV-Dual-PbTRAMP, AcNPV-Dual-PbAMA1D123, AcNPV-Dual-PbMSP119, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-H5N1/HA1, AcNPV-Dual-SARS/S, AcNPV-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39 и AcNPV-CP-H1N1/NP-vp39.
[14] Вектор для переноса, содержащий структуру, в которую встроены слитый ген, содержащий, по меньшей мере, один ген, кодирующий белок, способный быть компонентом вирусной частицы, и, по меньшей мере, один иммуногенный чужеродный ген, связанные в нижестоящем положении относительно сдвоенного промотора, связывающего один промотор позвоночных, способный функционировать в позвоночных, и другой бакуловирусный промотор.
[15] Вектор для переноса по [14], характеризующийся тем, что ген, кодирующий, по меньшей мере, один белок, способный быть компонентом вирусной частицы, представляет собой любой из бакуловирусного гена gp64, гена гликопротеина вируса везикулярного стоматита, гена гликопротеина вируса иммунодефицита человека типа I, гена мембранного гликопротеина респираторно-синцитиального вируса человека, гена белка гемагглютинина вируса гриппа типа А, гена белка гемагглютинина вируса гриппа типа В, гена гликопротеина вируса простого герпеса и гена белка S вируса гепатита мыши.
[16] Вектор для переноса по [14], где промотор позвоночных, способный функционировать в позвоночных, выбирают из любого из промотора цитомегаловируса, промотора SV40, ретровирусного промотора, промотора металлотионеина, промотора белка теплового шока, промотора CAG, промотора фактора элонгации 1α, промотора актина, промотора убиквитина, промотора альбумина и промотора МНС класса II.
[17] Вектор для переноса по любому из [14]-[16], где бакуловирусный промотор выбирают из промотора полиэдрина, промотора р10, промотора IE1, промотора IE2, промотора р35, промотора р39 и промотора gp64.
[18] Вектор для переноса по любому из [14]-[17], где иммуногенный чужеродный ген выбирают из любого из антигена малярии, антигена гриппа, антигена М.tuberculosis, антигена вируса SARS, антигена вируса лихорадки Западного Нила, антигена вируса лихорадки денге, антигена ВИЧ, антигена HCV, антигена лейшмании, антигена трипаносомы, антигена лейкоцитозоона по отдельности или слитого антигена, состоящего из одного антигена, выбранного из этой группы генов антигенов, и цитокина.



[30] Вакцина против инфицирования вирусом гриппа по [29], где средство вводят внутримышечно, интраназально или ингаляцией.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому рекомбинантному вектору для переноса, рекомбинантному бакуловирусу, получаемому гомологичной рекомбинацией рекомбинантного вектора для переноса и бакуловирусной ДНК, а также к способам их получения. Фармацевтические вещества, содержащие в качестве активного ингредиента рекомбинантный бакуловирус согласно настоящему изобретению, являются эффективными в качестве терапевтических или профилактических лекарственных средств против инфекционных заболеваний, таких как малярия, грипп, туберкулез и гепатит, вариантов рака и аутоиммунных заболеваний или в качестве медицинского средства на клеточном уровне, а также в качестве препаратов вакцин.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
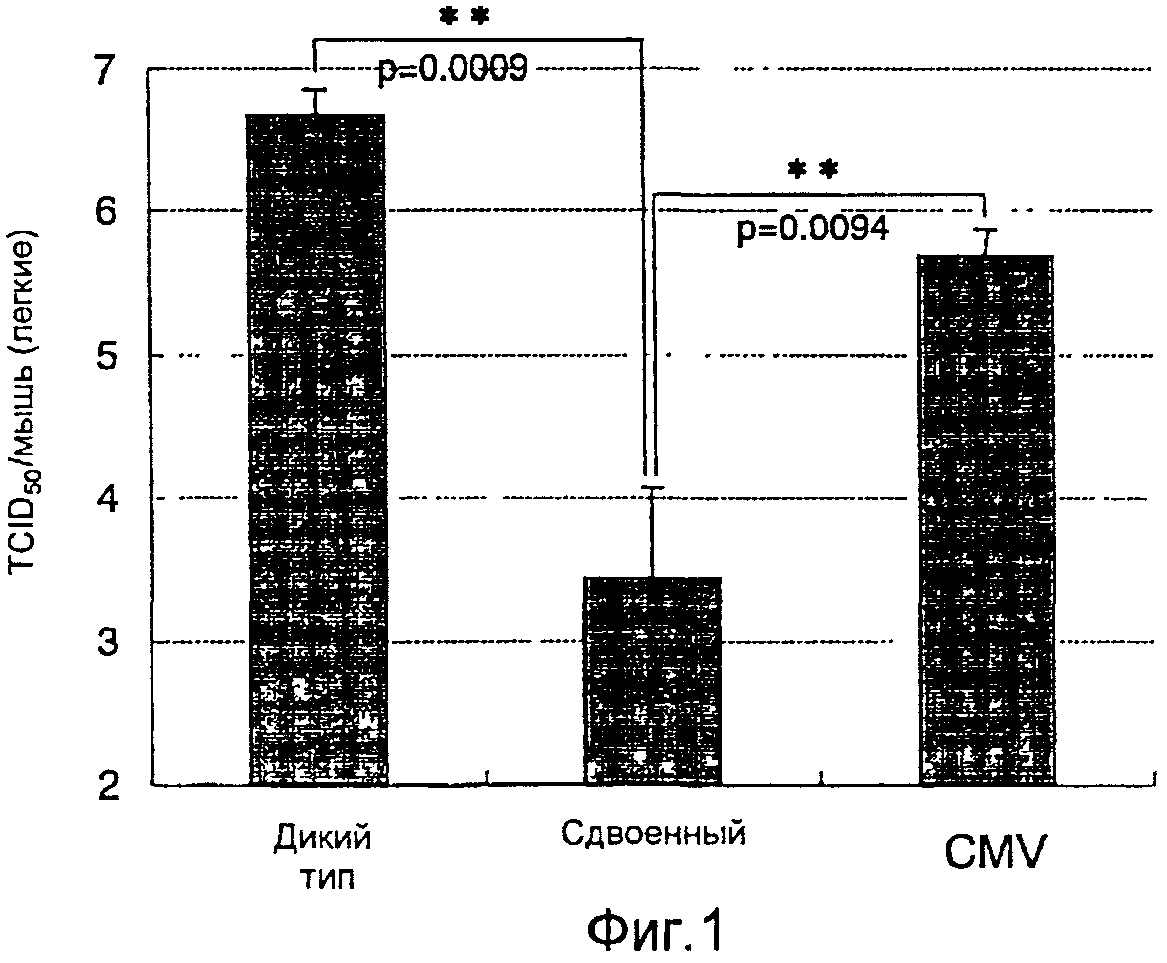
На фиг.1 представлен профилактический эффект (титр инфекционности вируса) рекомбинантного бакуловируса AcNPV-Dual-H1N1/HA1 в отношении инфицирования вирусом гриппа;
На фиг.2 представлен профилактический эффект (период выживания) рекомбинантного бакуловируса AcNPV-Dual-H1N1/HA1 в отношении инфицирования вирусом гриппа;
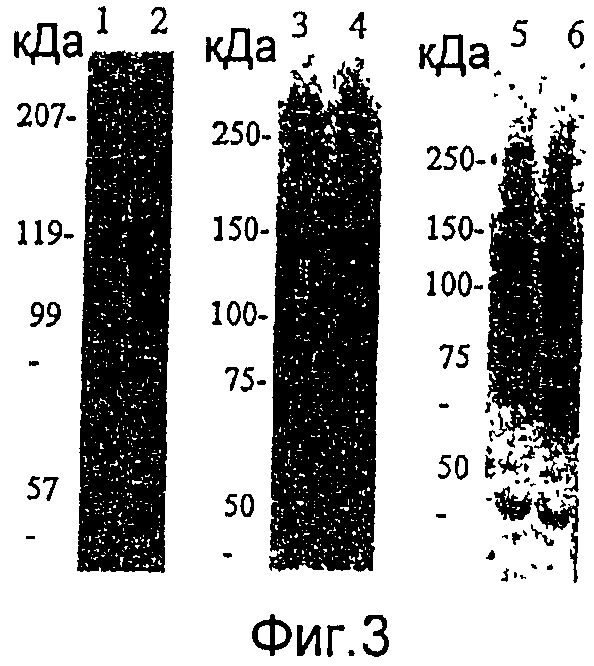
На фиг.3 представлен анализ Вестерн-блоттингом экспрессии слитого продукта в клетке насекомого, инфицированной с использованием рекомбинантного бакуловируса, полученного из вектора для переноса, посредством гена НА вируса гриппа (H1N1/HA1), гена Hsp65 M.tuberculosis (Hsp65) или гена CSP малярийного паразита (PbCSP).
Дорожка 1: AcNPV-WT
Дорожка 2: AcNPV-Dual-H1N1/HA1
Дорожка 3: AcNPV-WT
Дорожка 4: AcNPV-Dual-Hsp65
Дорожка 5: AcNPV-WT
Дорожка 6: AcNPV-Dual-PbCSP;
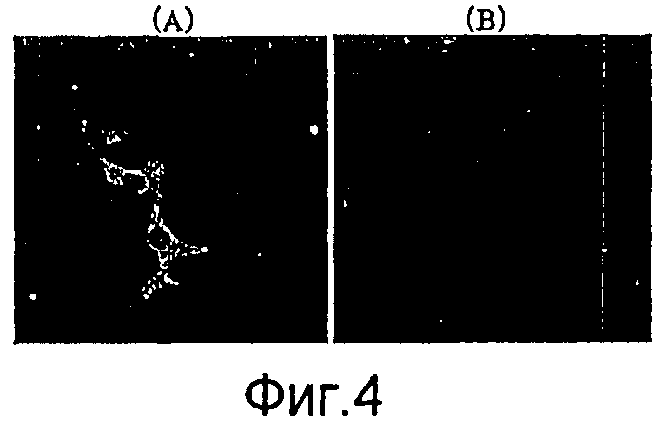
На фиг.4 представлено изображение окрашивания с флуоресцентной меткой, где рекомбинантный бакуловирус, полученный из рекомбинантного вектора для переноса, экспрессировал в клетках позвоночных слитый продукт гена HSP65 туберкулеза и гена gp64.
(A): клетки HepG2, трансдуцированные посредством AcNPV-Dual-Hsp65;
(B): клетки HepG2, трансдуцированные посредством AcNPV-WT.
На фиг.5 представлено изображение, на котором в результате иммунопреципитации показано, что рекомбинантный бакуловирус, полученный из рекомбинантного вектора для переноса в относящихся к млекопитающим клетках животных, экспрессировал слитый белок который кодируется геном антигена НА вируса гриппа и геном gp64. Иммунопреципитация клеток HepG2, в которые были введены рекомбинантные бакуловирусы. Клетки HepG2 были трансдуцированы с использованием AcNPV-WT (дорожка 1), полного AcNPV-CMV-H1N1/HA (дорожка 2) или AcNPV-Dual-H1N1/HA1 (дорожка 3). Через 3 часа после трансдукции клетки в течение 12 часов метили радиоактивной меткой с использованием [35S]метионина. Проводили иммунопреципитацию клеточных лизатов вместе с сывороткой от мышей, инфицированных вирусом гриппа H1N1.
На фиг.6 представлен анализ посредством Вестерн-блоттинга, где показана экспрессия слитой структуры из гена CSP малярийного паразита и гена gp64 в вирусных частицах рекомбинантного бакуловируса, полученного из рекомбинантного вектора для переноса в клетках насекомых.
Дорожка 1: AcNPV-WT
Дорожка 2: AcNPV-CMV-PbCSP
Дорожка 3: AcNPV-PbCSPsurf
Дорожка 4: AcNPV-Dual-PbCSP.
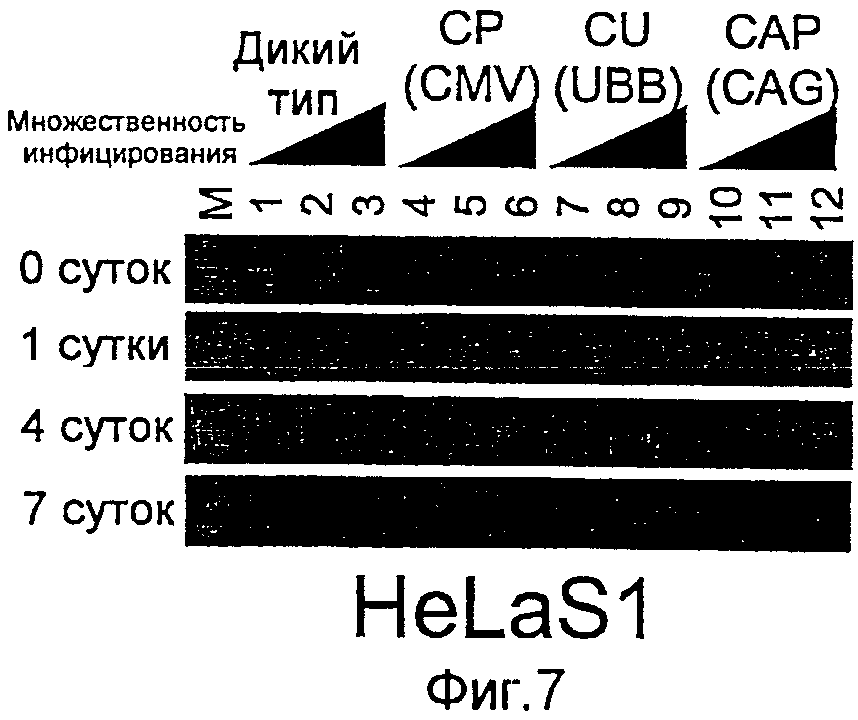
На фиг.7 представлены результаты RT-PCT, указывающие на то, что содержащий антиген НА1 рекомбинантный бакуловирус, полученный заменой промотора позвоночных, экспрессировал в клетках HeLa слитый продукт НА1 и gp64.
На фиг.8 представлена продукция антитела IgG, специфичного в отношении антигена PbCSP, в сыворотке от мышей, которых инокулировали с использованием рекомбинантного бакуловируса.
На фиг.9 представлено количество продуцирующих IFN-γ клеток, реакционноспособных в отношении эпитопа CTL из PbCSP в клетках селезенки от мышей, которых инокулировали с использованием рекомбинантного бакуловируса.
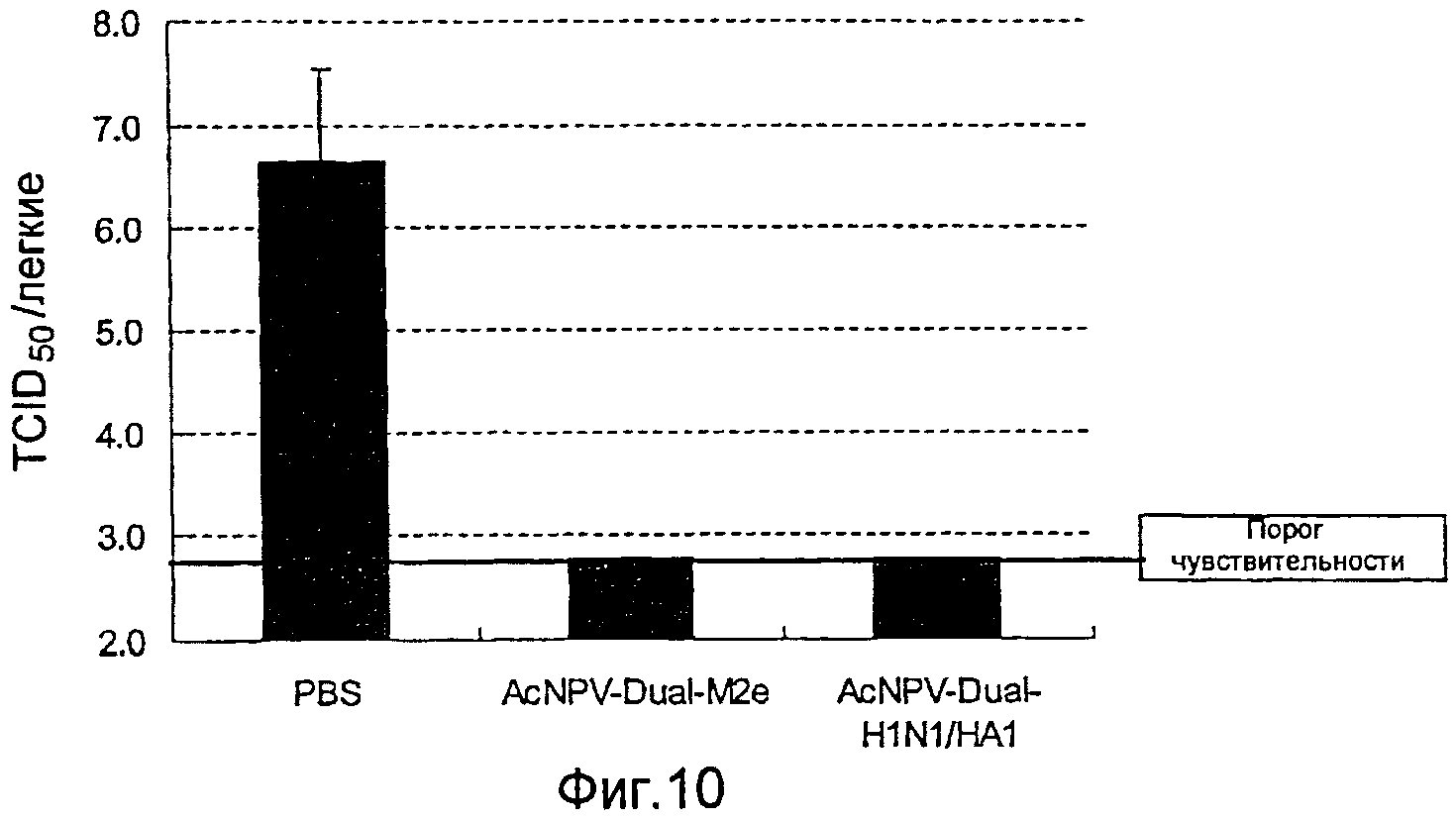
На фиг.10 представлены профилактические эффекты (титр инфекционности вируса) рекомбинантного бакуловируса AcNPV-Dual-М2е в отношении инфицирования вирусом гриппа.
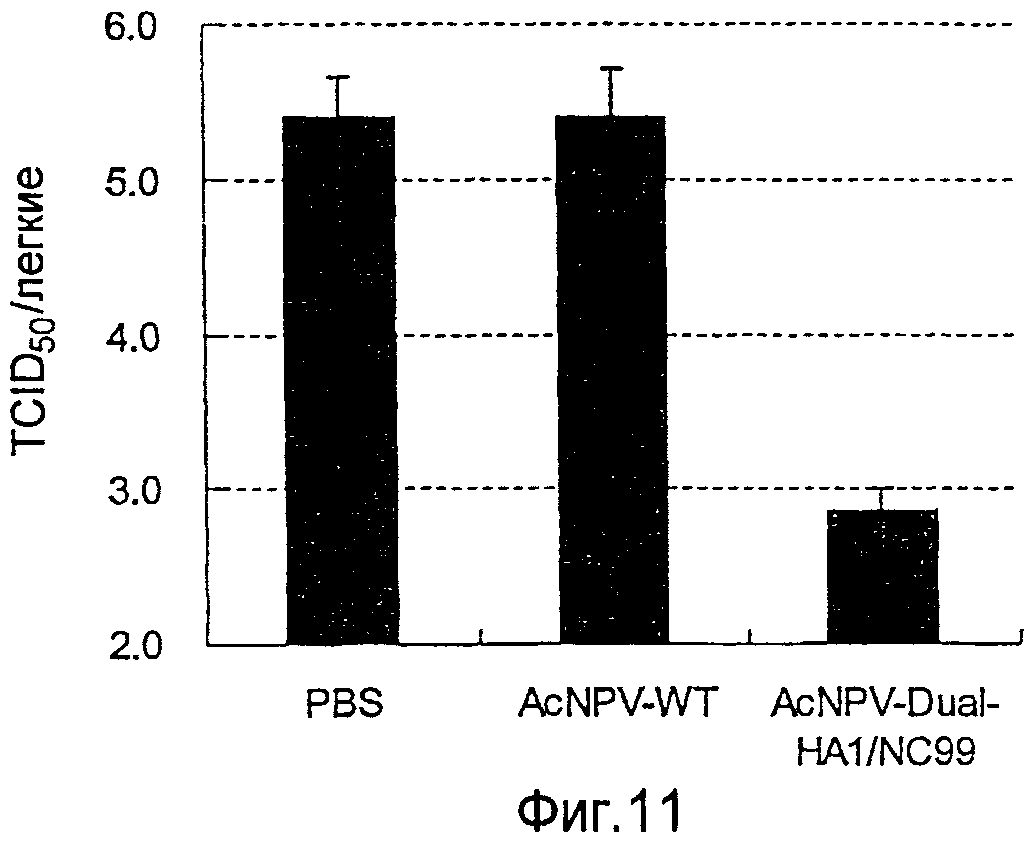
На фиг.11 представлены профилактические эффекты (титр инфекционности вируса) рекомбинантного бакуловируса AcNPV-CP-HA1/NC99 в отношении инфицирования вирусом гриппа.
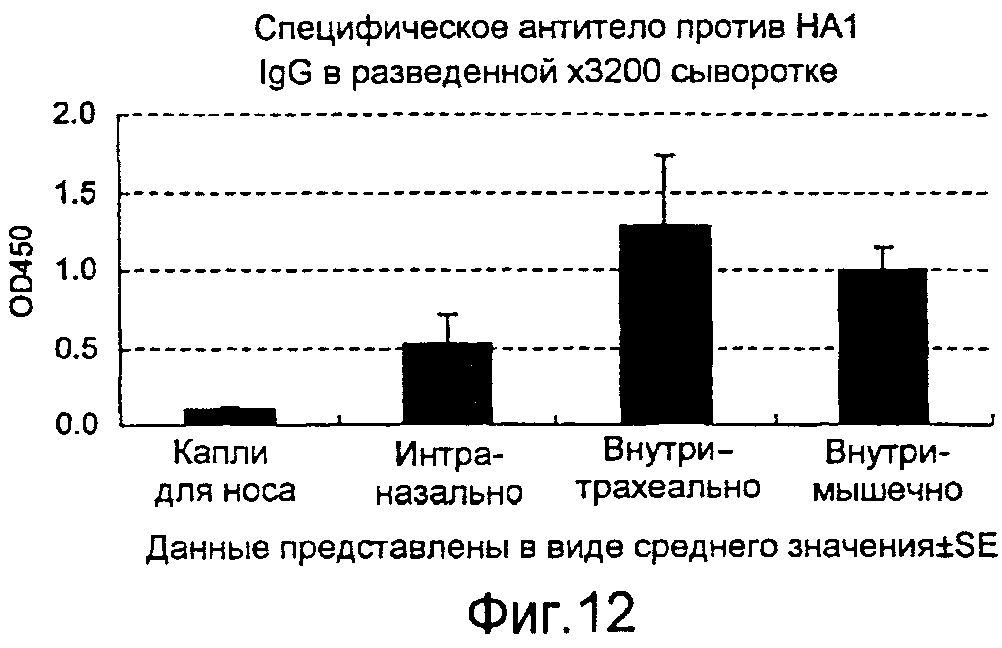
На фиг.12 представлена продукция в крови антитела IgG, специфичного в отношении вируса гриппа, которая индуцируется рекомбинантным бакуловирусом AcNPV-Dual-H1N1/HA1, вводимым четырьмя различными способами.
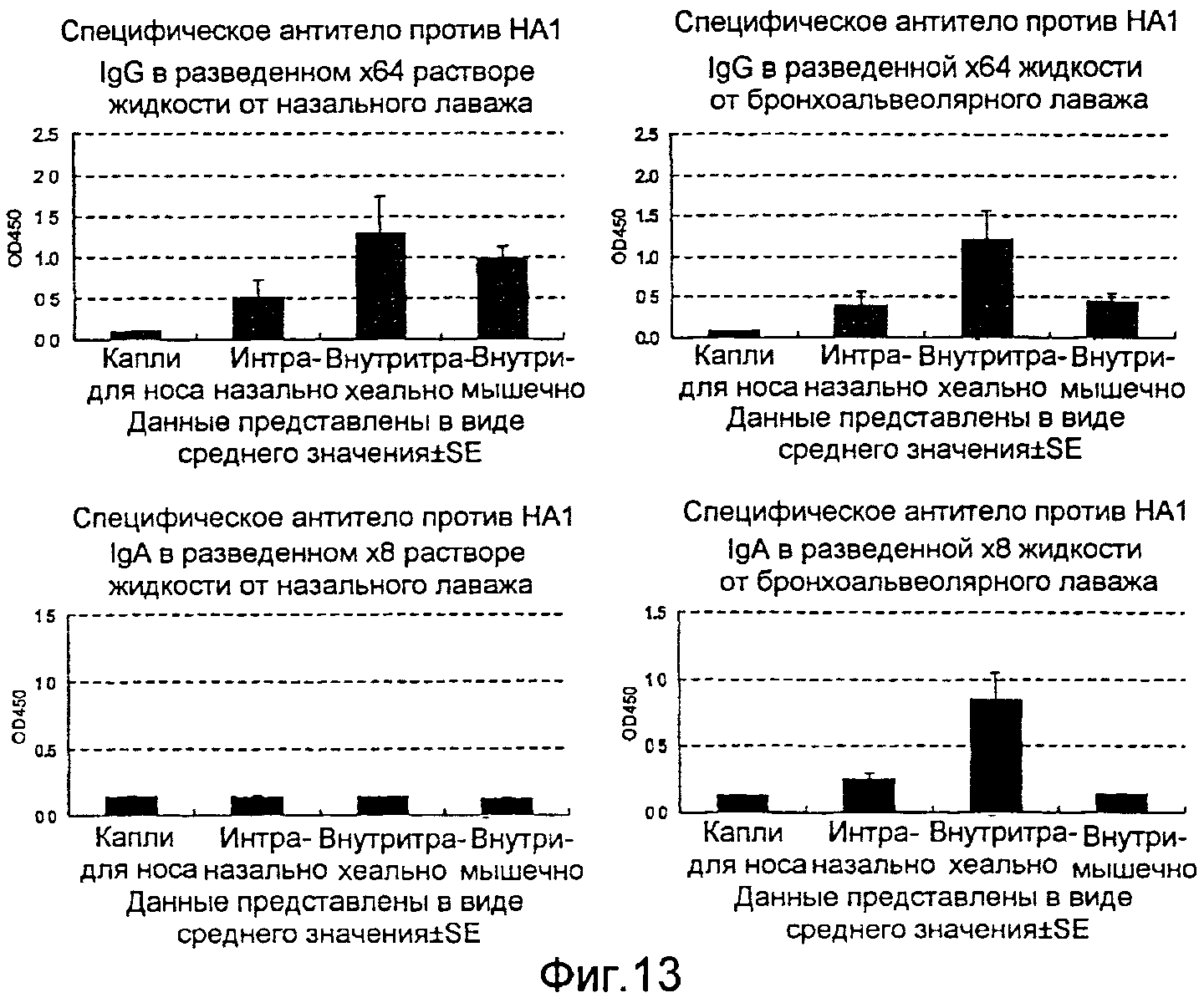
На фиг.13 представлена продукция в жидкости от назального лаважа и жидкости от альвеолярного лаважа антитела IgG и антитела IgA, специфичных в отношении вируса гриппа, где продукция индуцирована рекомбинантным бакуловирусом AcNPV-Dual-H1N1/HA1, вводимым четырьмя различными способами.
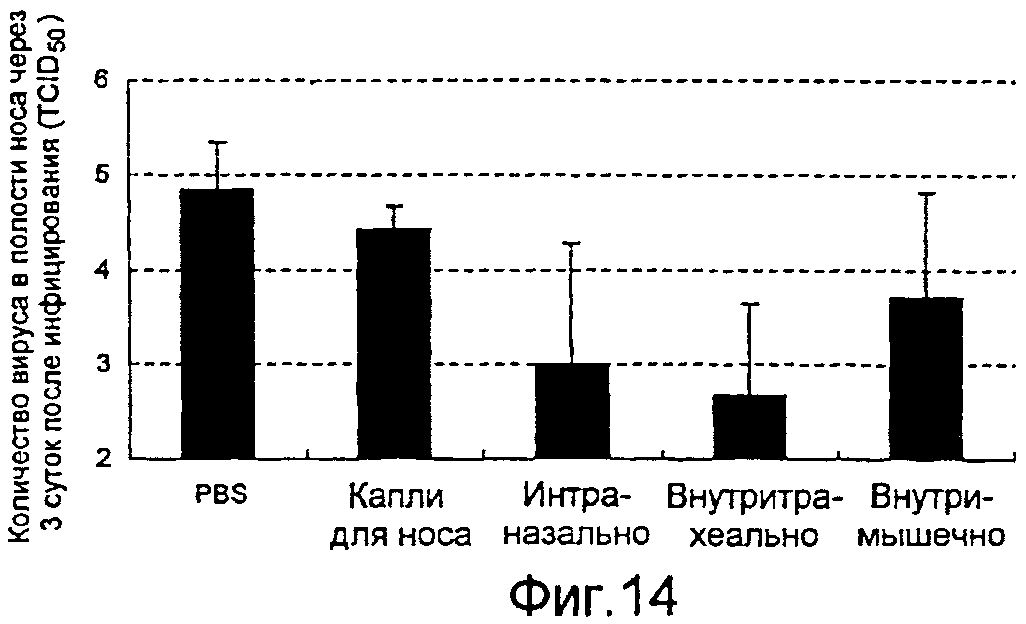
На фиг.14 представлены профилактические эффекты (титр инфекционности вируса) вводимого четырьмя различными способами рекомбинантного бакуловируса AcNPV-Dual-H1N1/HA1 в отношении вируса гриппа в полости носа.
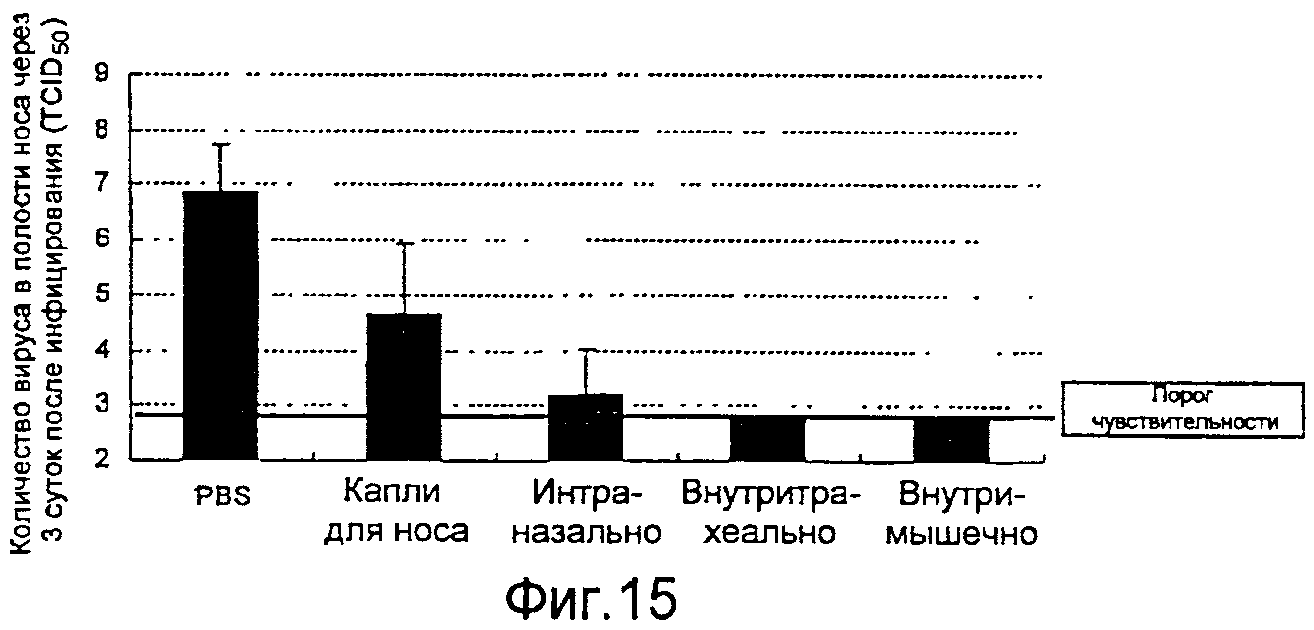
На фиг.15 представлены профилактические эффекты (титр инфекционности вируса) вводимого четырьмя различными способами рекомбинантного бакуловируса AcNPV-Dual-H1N1/HA1 в отношении внутрилегочного вируса гриппа.
ЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Представленное в настоящей заявке обозначение посредством сокращенных названий аминокислот, пептидов, последовательностей оснований и нуклеиновых кислот удовлетворяет IUPAC-IUB Communication on Biological Nomenclature, Eur. J. Biochem., 138:9(1984), определяемому IUPAC-IUB, "Руководством по созданию описаний, включающих последовательности оснований и аминокислотные последовательности" (патентное бюро) и обычно используемыми указаниями в данной области.
В рамках настоящей заявки молекула ДНК включает не только двухцепочечную ДНК, но также и одноцепочечную ДНК, в том числе составляющие их смысловые цепи и антисмысловые цепи, и не ограничена по своей длине. Таким образом, если не указано иначе, полинуклеотид (молекула ДНК), кодирующий иммуногенный чужеродный ген согласно настоящему изобретению, включает двухцепочечную ДНК, в том числе геномную ДНК, и одноцепочечную ДНК (смысловую цепь), в том числе кДНК, а также одноцепочечную ДНК (антисмысловую цепь) с последовательностью, комплементарной смысловой цепи, а также их синтетические фрагменты ДНК.
В рамках настоящей заявки полинуклеотид или молекула ДНК не заданы функциональным участком и могут включать, по меньшей мере, один из участка подавления экспрессии, кодирующего участка, лидерной последовательности, экзона и интрона.
Также полинуклеотид включает РНК и ДНК. Полипептид состоит из определенной последовательности аминокислот, а полинуклеотид состоит из определенной последовательности ДНК, включая их фрагменты, гомологи, производные и мутантные формы.
Мутантные формы полинуклеотида, например мутантная ДНК, включают природные аллельные мутанты, не встречающиеся в природе мутанты и мутанты с делецией, заменой, добавлением и вставкой. При этом эти мутанты кодируют полипептид, обладающий практически той же самой функцией, что и функция полипептида, кодируемого до мутации.
Согласно настоящему изобретению вектор для переноса относится к плазмиде для получения рекомбинантного бакуловируса, содержащего структуру, в которой слитый ген, связывающий, по меньшей мере, один ген, кодирующий белок, способный быть компонентом вирусной частицы, с, по меньшей мере, одним иммуногенным чужеродным геном, был встроен в нижестоящем положении относительно сдвоенного промотора, где связаны один промотор позвоночных (промотор млекопитающих, промотор птиц, промотор рыб) и другой бакуловирусный промотор.
Предпочтительно, в одном из предпочтительных вариантов осуществления изобретения иммуногенный чужеродный ген расположен ниже сдвоенного промотора и выше гена, кодирующего белок, который способен быть компонентом вирусной частицы.
Рекомбинантный бакуловирус согласно настоящему изобретению используют для позвоночных в качестве активного ингредиента фармацевтических веществ или вакцин. В качестве позвоночных примерами млекопитающих, включая человека, могут быть лошади, свиньи, овцы, козы, обезьяны, мыши, собаки и кошки, птицы, такие как цыплята, перепелки, гуси, водоплавающие, голуби, индейки, цесарки и попугаи, а также рыбы, такие как желтохвосты, взрослые желтохвосты, морские караси, сериолы, ставриды, полосатые щуки, полосатый бычок, лососи, нерки, карпы, обыкновенные караси, радужные форели, ручьевые форели и форели амаго.
В одном из вариантов осуществления настоящее изобретение относится к вектору для переноса, содержащему новую структуру, в которой слитый ген, содержащий ген, который кодирует вирусный мембранный белок, экспрессируемый в клетке насекомого, и содержащий один иммуногенный чужеродный ген, был встроен под контролем сдвоенного промотора, в котором один промотор позвоночных связан с другим бакуловирусным промотором. Посредством совместной трансфекции этого вектора для переноса вместе с бакуловирусной ДНК в клетку насекомого для индукции гомологичной рекомбинации можно получать рекомбинантный бакуловирус, в который был встроен находящийся под контролем бакуловирусного промотора слитый ген, экспрессирующийся в клетке насекомого и способный продуцировать слитый белок, который может быть компонентом активно реплицирующейся вирусной частицы.
Согласно настоящему изобретению в случае введения рекомбинантного бакуловируса позвоночному, слитый белок, состоящий из белка, способного быть компонентом активно реплицирующейся вирусной частицы, и иммуногенного белка, предположительно функционирует как компонент вакцины. Вводимый в позвоночных рекомбинантный бакуловирус встраивается в клетку позвоночного, в клетке позвоночных продуцируется слитый антиген с заданным иммуногенным чужеродным антигеном из вирусного генома, и происходит функционирование в качестве вакцины ДНК.
Соответственно, в случае млекопитающего, при введении млекопитающему рекомбинантного бакуловируса согласно настоящему изобретению слитый белок, состоящий из белка, способного быть компонентом вирусной частицы, и иммуногенного белка, презентируется в качестве антигена, слитый белок, состоящий из белка, способного быть компонентом вирусной частицы, и иммуногенного белка, продуцируется в клетке млекопитающего и, предположительно, вследствие своего иммунопотенциального действия функционирует в качестве профилактического или терапевтического средства в отношении инфицирования вирусом, простейшими и бактериями.
Бакуловирусная ДНК, подлежащая совместной трансфекции с вектором для переноса, может представлять собой любую из дикого типа, мутанта и рекомбинантной бакуловирусной ДНК. Подлежащие совместной трансфекции клетки-хозяева включают, например, клетки от насекомого, такого как Spodoptera frugiperda.
Согласно настоящему изобретению иммуногенным чужеродным геном назван ген, кодирующий аминокислотную последовательность антигенного белка, который является иммуногеном в иммунотерапии, включающей лечение вакцинами для профилактики и лечения инфекционных заболеваний, таких как малярия, грипп и туберкулез, аутоиммунных заболеваний и вариантов рака, например, ген, кодирующий аминокислотную последовательность такого белка, как антиген малярии, антиген вируса гриппа и антиген М.tuberculosis.
В рамках настоящей заявки "чужеродный" ген обозначает ген, вводимый извне, что соответствует "чужеродному" гену, даже если тот же самый ген присутствует в клетке.
Согласно настоящему изобретению ген, который кодирует аминокислотную последовательность белка, являющегося указанным выше иммуногеном, не ограничен конкретно геном, который кодирует аминокислотную последовательность антигенного белка при условии, что ген представляет собой ген, кодирующий аминокислотную последовательность антигенного белка, которая обладает иммуногенностью в отношении вещества, вызывающего такие заболевания, как инфекционные заболевания, варианты рака и аутоиммунные заболевания. Примеры таких генов, которые кодируют обладающую иммуногенностью аминокислотную последовательность антигенного белка, включают следующие ниже.
В качестве примеров гена, кодирующего аминокислотную последовательность малярийного антигена, могут быть представлены, например, гены, которые кодируют аминокислотные последовательности таких белков, как поверхностный антиген CSP (белок, покрывающий спорозоит) поверхности спорозоита малярийного паразита, MSP1 (белок поверхности мерозоита 1) из мембранного белка поверхности мерозоита, малярийный антиген S, секретируемый из инфицированных малярией эритроцитов, белок PfEMPI, присутствующий в выпуклом утолщении инфицированных малярией эритроцитов, белок SERA, белок TRAMP и белок АМА1.
В качестве примеров гена, кодирующего аминокислотную последовательность антигена вируса гриппа, могут быть представлены гены, кодирующие аминокислотные последовательности таких белков, как антиген НА (антиген гемагглютинина), антиген NA (антиген нейраминидазы), антиген М2 (антиген белка матрикса) и антиген NP (антиген ядерного белка).
В качестве примеров гена, кодирующего аминокислотную последовательность антигенного белка для туберкулеза, могут быть представлены гены, кодирующие аминокислотные последовательности таких белков, как HSP65 (белок теплового шока 65 кДа), α-антиген (антиген 85А, антиген 85В, антиген 85С), Mtb72f, MDP-1, ESAT-6, МРВ51, Mtb8.8, Mtb9.9, Mtb32, Mtb39 и Mtb11.
В отношении генов позвоночных, например генов млекопитающих, в качестве примеров могут быть представлены гены, кодирующие аминокислотные последовательности антигенных белков при инфекционных заболеваниях у человека, крупного рогатого скота, лошадей, свиней, овец, обезьян, мышей, собак и кошек. В качестве генов птиц для примера могут быть представлены гены антигенов (например, антиген птичьего гриппа S) при инфекционных заболеваниях у цыплят, водоплавающих, голубей, индеек, цесарок и попугаев. В качестве генов рыб рассмотрены гены антигенов при инфекционных заболеваниях у желтохвостов, взрослых желтохвостов, морских карасей, сериол, ставрид, полосатых щук, полосатого бычка, лососей, нерок, карпов, обыкновенных карасей, радужных форелей, ручьевых форелей и форелей амаго.
Патогенные гены, о чьей связи с инфекционными заболеваниями у описанных выше млекопитающих, птиц и рыб было указано, являются легко доступными в учреждениях, где хранились такие общедоступные данные, как банк генов, в котором регистрируют патогенные гены.
Согласно настоящему изобретению в случае иммуногенных чужеродных генов в дополнение к указанным выше иммунным антигенам, присутствующим вне организма человека, в качестве иммуногенных чужеродных генов согласно настоящему изобретению также могут быть рассмотрены, например, гены цитокинов из организма человека, например, ген IL-12, ген IL-6, ген рецептора IL-6, ген IL-2, ген IL-18, ген IFN-γ и ген M-CSF, или слитые гены, получаемые слиянием заданного иммуногенного антигена с указанным выше антигенным белком с использованием способа рекомбинации, при условии, что эти гены вводят извне.
Согласно настоящему изобретению можно обеспечивать вектор для переноса, содержащий такие иммуногенные чужеродные гены, и рекомбинантный бакуловирус, получаемые их гомологичной рекомбинацией, а также обеспечивать фармацевтическую композицию, содержащую в качестве активного ингредиента рекомбинантный бакуловирус с иммуногенным чужеродным геном, и препарат вакцины, содержащий фармацевтическую композицию.
Используемый согласно настоящему изобретению бакуловирус представляет собой патогенный вирус насекомых, вызывающий у насекомых инфекционное заболевание, и он относится к одной из групп (Baculoviridae) ДНК-вирусов с генами в виде кольцевой двухцепочечной ДНК. Из них одна группа вирусов, называемая вирусом ядерного полиэдроза (NPV), приводит к образованию включения, названного полиэдром, в ядре инфицированной клетки на поздней стадии инфекционного заболевания. Даже если подлежащий экспрессии чужеродный ген вставлен на место гена полиэдра, вирус инфицирует, растет и продуцирует в большом количестве желаемый продукт чужеродного гена в отсутствие каких-либо проблем. Таким образом, в последние годы этот способ часто использовали на практике для получения желаемого белка.
В качестве примеров бакуловируса, используемого согласно настоящему изобретению, могут быть представлены вирус ядерного полиэдроза Autographa californica: AcNPV, вирус ядерного полиэдроза Bombyx mori: BmNPV, вирус ядерного полиэдроза Orgyla pseudotsugata: OpNPV и вирус ядерного полиэдроза Lymantria disper: LdNPV.
Бакуловирусная ДНК может представлять собой любую ДНК, для которой возможно осуществление гомологичной рекомбинации с вектором для переноса согласно настоящему изобретению. Конкретно, могут быть вставлены вирусный ген из бакуловирусной ДНК, способный к осуществлению гомологичной рекомбинации с вектором для переноса согласно настоящему изобретению, составляющий 130 т.п.о., что является большой величиной, а также иммуногенный чужеродный ген величиной 15 т.п.о. Сам по себе бакуловирусный ген почти не экспрессируется в клетках позвоночных. Таким образом, практически нет необходимости учитывать его цитотоксичность, и, соответственно, предполагают, что индукция неблагоприятной иммунной реакции отсутствует.
(1) Вектор для переноса и получение вектора для переноса согласно настоящему изобретению
Получение ДНК иммуногенного чужеродного гена
ДНК иммуногенного чужеродного гена, способную к слиянию с вирусным геном, являющимся одним из компонентов бакуловирусного вектора для переноса, можно легко получать и производить с использованием синтеза на основе данных по последовательности нуклеиновой кислоты для полинуклеотида, кодирующего аминокислотную последовательность антигенного белка с заданной иммуногенностью, описанной в настоящей заявке, или с использованием прямого синтеза ДНК (способом химического синтеза ДНК), которая соответствует последовательности нуклеиновой кислоты из кодирующего участка иммуногенного чужеродного гена, на основе данных по последовательности нуклеиновой кислоты для иммуногенного чужеродного гена. Для такого получения можно использовать общепринятые способы генной инженерии (например, см. Molecular Cloning 2d Ed, Cold Spring Harbor Lab. Press (1989); Zoku Seikagaku Jikken Kouza, "Idenshi Kenkyuho I, II, III" под редакцией Японского биохимического общества, 1986).
В качестве примеров способов синтеза ДНК могут быть представлены способы химического синтеза ДНК, такие как фосфотриэфирный способ и фосфатамидитный способ (J. Am. Chem. Soc., 89, 4801(1967); ibid., 91, 3350(1969); Science, 150, 178(1968); Tetrahedron Lett., 22, 1859(1981); ibid., 24, 245(1983)), а также сочетания таких способов. Более конкретно, ДНК можно также химически синтезировать фосфорамидитным способом или триэфирным способом, а также ее можно синтезировать с использованием коммерчески доступного автоматического синтезатора олигонуклеотидов. Двухцепочечный фрагмент можно получать синтезом комплементарной цепи и отжигом комплементарной цепи с химически синтезированной одиночной цепью в соответствующих условиях или добавлением комплементарной цепи с соответствующими последовательностями праймеров к химически синтезированной одиночной цепи с использованием ДНК-полимеразы.
В качестве примера одного из конкретных аспектов ДНК иммуногенного чужеродного гена, получаемой согласно настоящему изобретению, может быть представлена ДНК, состоящая из последовательности ДНК, кодирующей аминокислотную последовательность антигенного белка М.tuberculosis последовательности ДНК, кодирующей аминокислотную последовательность антигенного белка малярии, или последовательности ДНК, кодирующей аминокислотную последовательность антигенного белка вируса гриппа.
Используемая согласно настоящему изобретению ДНК не ограничивается полноразмерной последовательностью ДНК из последовательности ДНК, кодирующей аминокислотную последовательность полипептида из обладающего иммуногенностью антигенного белка, и она может представлять собой последовательность ДНК, кодирующую часть последовательности, при условии, что белок с аминокислотной последовательностью, кодируемой последовательностью ДНК, обладает иммуногенностью.
Используемая согласно настоящему изобретению ДНК может представлять собой последовательность ДНК, которую получают слиянием последовательности ДНК, кодирующей аминокислотную последовательность обладающего антигенными свойствами антигенного белка, с геном цитокина, присутствующим в организме человека, например, геном IL-12, геном IL-1, геном IL-6, геном рецептора IL-6, геном IL-2, геном IL-18, геном IFN-α, геном IFN-β, геном IFN-γ, геном TNF, геном TGF-β, геном GM-CSF и геном М-CSF.
Слитая последовательность ДНК не ограничивается полноразмерным кодирующим участком последовательности ДНК, которая кодирует аминокислотную последовательность полипептида из обладающего антигенными свойствами антигенного белка, и последовательностью ДНК для гена цитокина, но также может представлять собой часть последовательности ДНК.
Используемая согласно настоящему изобретению ДНК иммуногенного чужеродного гена не ограничивается молекулой ДНК, содержащей такую конкретную последовательность ДНК, но также может содержать последовательность ДНК, получаемую сочетанием и отбором желаемого кодона для каждого аминокислотного остатка. Выбор кодона можно проводить в соответствии с общепринятыми способами. В то же время, например, можно учитывать частоту применения кодона в используемом организме-хозяине. (Nucleic Acids Res., 9, 43 (1981)).
Способ получения ДНК иммуногенного чужеродного гена, используемой согласно настоящему изобретению, с использованием способов генной инженерии можно более конкретно осуществлять посредством получения общепринятыми способами библиотеки кДНК из соответствующего источника, экспрессирующей ДНК иммуногенного чужеродного гена, и выбором желаемого клона из библиотеки с использованием соответствующего зонда или антитела против экспрессируемого продукта, который свойственен для иммуногенного чужеродного гена (см. Proc. Natl. Acad. Sci., USA., 78, 6613(1981); Science, 222, 778(1983)).
Как указано выше, в качестве примера источника геномной ДНК могут быть представлены различные клетки, ткани и получаемые из них культивируемые клетки, которые экспрессируют ДНК иммуногенного чужеродного гена. В частности, в качестве источника предпочтительно использовать экстракт эритроцитов, инфицированных малярийным паразитом, экстракт клеток, инфицированных вирусом гриппа, или экстракт М.tuberculosis. Экстрагирование и выделение тотальной ДНК и РНК из источника, выделение и очистку мРНК, а также получение и клонирование кДНК можно проводить в соответствии с общепринятыми способами.
Также получение ДНК иммуногенного чужеродного гена можно осуществлять выделением мРНК каждого иммуногена, а затем добавлением к РНК поли(А)-последовательности, получением РНК с добавленной поли(А)-последовательностью, получением кДНК с использованием обратной транскриптазы, добавлением участков для ферментов рестрикции к обоим концевым участкам кДНК и использованием фаговой библиотеки, которую получают встраиванием кДНК в фаг, в дополнение к получению с использованием библиотеки кДНК для каждого иммуногена, получаемой экстракцией, отделением и очисткой мРНК из иммуногенной ткани или клетки с применением экстракта в качестве источника.
Способ скрининга ДНК иммуногенного чужеродного гена в библиотеке кДНК не ограничен чем-либо конкретным, и его можно проводить в соответствии с общепринятыми способами. Например, в качестве примера конкретного способа может быть представлен способ отбора соответствующего клона кДНК посредством иммунологического скрининга с использованием специфического антитела (например, антитела против малярии, антитела против вируса гриппа, антитела против М.tuberculosis) против белка, продуцируемого с кДНК; способ гибридизации бляшек с использованием зонда, специфически связывающегося с заданной последовательностью ДНК; способ гибридизации колоний; а также их сочетания.
В качестве зондов, используемых в способах гибридизации, общепринятыми являются фрагменты ДНК, химически синтезированные на основе данных по последовательности ДНК иммуногенного чужеродного гена. Преимущественно в качестве указанного выше зонда можно использовать уже полученный иммуногенный чужеродный ген и последовательности ДНК его фрагментов. Кроме того, в качестве зонда для указанного выше скрининга можно также использовать смысловой праймер и антисмысловой праймер, сконструированные на основе данных по последовательности ДНК иммуногенного чужеродного гена.
Используемая в качестве зонда ДНК (нуклеотиды) представляет собой часть ДНК (нуклеотидов), соответствующей последовательности ДНК иммуногенного чужеродного гена, и она содержит, по меньшей мере, 15 последовательных остатков ДНК, предпочтительно - по меньшей мере 20 последовательных остатков ДНК, а более предпочтительно - по меньшей мере 30 последовательных остатков ДНК. Также в качестве зонда можно сам по себе использовать положительный клон для получения указанной выше ДНК.
При получении ДНК иммуногенного чужеродного гена можно эффективно использовать способ амплификации ДНК/РНК посредством PCR (Science, 230, 1350 (1985)). В частности, если из библиотеки сложно получить полноразмерную кДНК, то соответственно используют способ RACE [Rapid amplification of cDNA ends; Jikken Igaku 12(6), 35(1994)], в частности, способ 5'-RACE [M.A.Frohman, et al., Proc. Natl. Acad. Sci., USA., 8, 8998(1988)].
Используемый для PCR праймер можно конструировать на основе данных по последовательности ДНК иммуногенного чужеродного гена и синтезировать в соответствии с общепринятыми способами. В качестве такого праймера, как представлено в описанных ниже примерах, можно также использовать участки ДНК (праймер из промотора SP6 и праймер из терминатора Т7), добавляемые к обоим концевым участкам векторной плазмиды, в которую была встроена ДНК иммуногенного чужеродного гена.
Выделение/очистку фрагмента ДНК/РНК, амплифицируемого посредством PCR, можно проводить в соответствии с общепринятыми способами, например гель-электрофорезом.
В случае получаемой, как указано выше, ДНК иммуногенного чужеродного гена или различных фрагментов ДНК их последовательности ДНК можно определять в соответствии с общепринятыми способами, например дидезокси-способом (Proc. Natl. Acad. Sci., USA., 74, 5463(1977)) или способом Максама-Гилберта (Methods in Enzymology, 65, 499(1980)), или простым использованием коммерчески доступного набора для секвенирования.
Ген, который кодирует аминокислоты белка, способного быть компонентом вирусной частицы, может представлять собой любой ген при условии, что он является геном, кодирующим белок, который экспрессируется в виде белка, способного быть компонентом вирусной частицы в клетке насекомого, и в виде слитого белка, получаемого при слиянии с иммуногенным чужеродным геном в заданной клетке.
В качестве примера гена, кодирующего аминокислоты белка, способного быть компонентом вирусной частицы, могут быть представлены, например, гены белка gp64 (уникальный идентификатор банка генов № L22858), гликопротеина вируса везикулярного стоматита (уникальный идентификатор банка генов № М21416), гликопротеина вируса простого герпеса (KOS; уникальный идентификатор банка генов № К01760), др120 вируса иммунодефицита человека типа I (уникальный идентификатор банка генов № U47783), мембранного гликопротеина респираторно-синцитиального вируса человека (уникальный идентификатор банка генов № М86651), белка гемагглютинина вируса гриппа типа А (уникальный идентификатор банка генов № U38242) или ген белков оболочки вирусов, близкородственных бакуловирусу. Согласно настоящему изобретению в качестве предпочтительного примера может быть приведен ген gp64, представленный в описанных ниже примерах.
ДНК гена, который кодирует аминокислоты белка, способного быть компонентом вирусной частицы, можно легко продуцировать и получать посредством синтеза на основе данных по последовательности нуклеиновой кислоты для полинуклеотида, кодирующего аминокислотную последовательность полипептида, из гена, который кодирует аминокислоты заданного белка, способного быть компонентом вирусной частицы, или посредством прямого синтеза ДНК, которая соответствует нуклеотидной последовательности, кодирующей последовательность аминокислот, на основе данных по аминокислотной последовательности для гена, кодирующего аминокислоты белка, способного быть компонентом вирусной частицы (химический синтез ДНК), как в случае с получением ДНК иммуногенного чужеродного гена.
Последовательность ДНК, соответствующая последовательности нуклеиновой кислоты, которая кодирует аминокислоты белка, способного быть компонентом вирусной частицы, не ограничивается полноразмерным кодирующим участком и может представлять собой ДНК, содержащую часть последовательности ДНК.
Как и в случае с получением молекулы ДНК иммуногенного чужеродного гена, ДНК гена, кодирующего аминокислоты белка, способного быть компонентом вирусной частицы, можно получать общепринятыми способами генной инженерии (например, см. Molecular Cloning 2d Ed, Cold Spring Harbor Lab. Press (1989); Zoku Seikagaku Jikken Kouza, "Idenshi Kenkyuho I, II, III" под редакцией Японского биохимического общества, 1986).
Согласно настоящему изобретению можно также использовать коммерчески доступную векторную плазмиду, в которую уже была встроена часть промотора, контролирующая экспрессию описанного ниже иммуногенного чужеродного гена, и был предварительно введен ген (участок), кодирующий аминокислоты белка, способного быть компонентом вирусной частицы.
Промоторы позвоночных
В качестве примера промотора позвоночных (способного функционировать у позвоночных), который является одним из компонентов вектора для переноса, используемого согласно настоящему изобретению, могут быть представлены такие промоторы, как промоторы млекопитающих, промоторы птиц и промоторы рыб.
Промоторы млекопитающих
В качестве примера промотора млекопитающих (способного функционировать у млекопитающих), который является одним из компонентов вектора для переноса, используемого согласно настоящему изобретению, могут быть представлены промотор цитомегаловируса, промотор SV40, ретровирусный промотор, промотор металлотионеина, промотор белка теплового шока, промотор CAG, промотор фактора элонгации 1α, промотор актина, промотор убиквитина, промотор альбумина и промотор МНС класса II.
Промоторы птиц
В качестве примера промоторов птиц могут быть представлены промотор актина, промотор белка теплового шока, промотор фактора элонгации, промотор убиквитина и промотор альбумина.
Промоторы рыб
В качестве примера промоторов рыб могут быть представлены промотор актина, промотор белка теплового шока и промотор фактора элонгации.
Промоторы бакуловируса
В качестве примера промотора бакуловируса, который является одним из компонентов бакуловирусного вектора для переноса, используемого согласно настоящему изобретению, могут быть представлены промотор полиэдрина, промотор р10, промотор IE1, промотор р35, промотор р39 и промотор gp64.
Получение рекомбинантного вектора для переноса
Настоящее изобретение относится к новому вектору для переноса, содержащему структуру, которая способна экспрессировать в клетке насекомого и клетке позвоночного, в частности клетке млекопитающего, заданный иммуногенный чужеродный ген в виде антигенного белка. Согласно настоящему изобретению структура полученного нового вектора для переноса характеризуется тем, что последовательность ДНК, кодирующая аминокислотную последовательность желаемого иммуногенного белка, и последовательность ДНК, кодирующая аминокислотную последовательность белка, способного быть компонентом вирусной частицы, являются связанными в нижестоящем положении относительно связанных промоторов, где один представляет собой промотор позвоночных, в частности промотор млекопитающих, а другой является бакуловирусным промотором. Участки ДНК, содержащие последовательности ДНК двух промоторов, из которых один представляет собой промотор позвоночных, в частности промотор млекопитающих, а другой является бакуловирусным промотором, могут быть связаны непосредственно, или между последовательностями ДНК двух промоторов может присутствовать промежуточная последовательность ДНК (однако в таком случае соответствующие промоторы должны обладать активностью в клетке насекомого и клетке позвоночного, в частности клетке млекопитающего). Подлежащий связыванию промотор позвоночных, в частности промотор млекопитающих, или бакуловирусный промотор можно располагать на более близком расстоянии к гену, который следует экспрессировать в их промоторной области. В описанных ниже примерах бакуловирус расположен на более близком расстоянии к подлежащему экспрессии гену, чем промотор млекопитающих.
В структуре, где слитый ген содержит ген, кодирующий белок, способный быть компонентом вирусной частицы, и желаемый иммуногенный чужеродный ген, эти два гена могут быть связаны непосредственно, или между ними может присутствовать промежуточная последовательность ДНК (однако необходимо располагать ДНК так, чтобы не вызвать сдвиг рамки считывания). Предпочтительно антигенпрезентирующий участок обладающего желаемой иммуногенностью белка, кодируемый чужеродным геном, слит с белком, который способен быть компонентом вирусной частицы. Таким образом, необходимо использовать слитую форму, в которой обладающий желаемой иммуногенностью белок, кодируемый чужеродным геном, не отсечен от белка, способного быть компонентом вирусной частицы.
Слитый ген, содержащий эти два гена, можно получать заранее, и его можно встраивать в вектор. Альтернативно в вектор можно заранее встраивать любой ген, а затем в вектор можно встраивать другой ген для получения слитого гена в векторе.
Для указанных выше способов можно использовать коммерчески доступные векторы экспрессии, которые уже содержат промоторные участки из описанного выше промотора позвоночных, в частности, промотора млекопитающих, а также бакуловирусный промотор и участки гена, кодирующие аминокислотную последовательность, способную быть компонентом вирусной частицы, где все это представляет собой участки структуры, необходимой в качестве вектора для переноса согласно настоящему изобретению. С их использованием необходимые компоненты можно вставлять посредством вставки последовательности ДНК, в которой желаемый иммуногенный чужеродный ген был слит в участке для клонирования вектора с геном, кодирующим аминокислотную последовательность белка, который способен быть компонентом вирусной частицы, посредством расщепления ферментами рестрикции или встраивания в другой вектор, или посредством вставки желаемого иммуногенного чужеродного гена в N-концевой участок области ДНК уже встроенного в плазмиду гена, кодирующего аминокислотную последовательность белка, который способен быть компонентом вирусной частицы.
Для выявления белка можно добавлять His-метку или HVS-метку перед поли(А)-участком к С-концевому участку последовательности ДНК, посредством которой осуществляют слияние желаемого иммуногенного чужеродного гена с геном, кодирующим аминокислотную последовательность белка, способного быть компонентом вирусной частицы. Альтернативно, для экспрессии, очистки и выявления рекомбинантного слитого белка можно вставлять последовательность ДНК, которая кодирует содержащую 8 аминокислот последовательность FLAG, в качестве пептидной метки между промоторным участком и участком, в котором желаемый иммуногенный чужеродный ген был слит с геном, кодирующим аминокислотную последовательность белка, способного быть компонентом вирусной частицы. Согласно настоящему изобретению плазмидный вектор со структурой, способной экспрессировать желаемый иммуногенный чужеродный белок в виде антигенного белка в клетке насекомого и клетке позвоночного, в частности, клетке млекопитающего, можно получать с использованием коммерчески доступной плазмиды со структурой, уже содержащей его участок. Для расщепления ферментом слитого белка в клетке позвоночного можно вставлять аминокислотную последовательность пептида. В вектор для переноса согласно настоящему изобретению в вышестоящее положение относительно двух промоторов можно помещать энхансер для повышения транскрипционной активности в клетке позвоночного, в частности, клетке млекопитающего, или с геном, подлежащим слиянию и экспрессии, можно связывать последовательность ДНК, кодирующую аминокислотную последовательность сигнального пептида, для способствования внеклеточной секреции экспрессируемого белка в организме-хозяине. Для терминации транскрипции в нижестоящее положение относительно гена, подлежащего слиянию и экспрессии, можно помещать участок терминатора позвоночного, например, эффективный в клетке позвоночного терминатор β-глобулина кролика.
Как указано выше, можно получать вектор для переноса, способный экспрессировать слитый ген, который состоит из иммуногенного чужеродного гена, способного экспрессировать желаемое иммуногенное вещество в бакуловирусной частице, и гена, кодирующего аминокислотную последовательность белка, способного быть компонентом вирусной частицы.
В качестве конкретных примеров вектора для переноса и способа его получения, как указано в описанных ниже примерах, можно представить пример вектора для переноса, состоящего из структуры, в которую были встроены слитые с энхансером CMV промотор цитомегаловируса (CMV), промотор CAG, модифицированный из промотора CMV, и промотор убиквитина (UBB) в качестве промотора позвоночных, в частности, промотора млекопитающих, связанные с промотором полиэдрина (Polh) в качестве бакуловирусного промотора, а также последовательность ДНК, в которой ген антигена вируса гриппа, ген антигена малярии и ген антигена М.tuberculosis в качестве чужеродных генов были слиты с геном антигена gp64 в качестве гена, кодирующего аминокислотную последовательность белка, способного быть компонентом вирусной частицы, где таким примером являются pDual-Hsp65-gp64, pDual-PbCSP-gp64, pDual-H1N1/HA1-gp64, pDual-PbTRAMP-gp64, pDual-PbAMA1Dl23-gp64, pDual-PbMSP119-gp64, pDual-PfCSP-gp64, pDual-PfAMA1-gp64, pDual-Pfs25-gp64, pDual-H5N1/HA1-gp64 и pDual-SARS/S-gp64, pCP-H1N1/HA1-gp64, pCAP-H1N1/HA1-gp64, pCU-H1N1/HA1-gp64, pDual-H1N1/NP-gp64, pDual-H1N1/M2-gp64, pDual-H1N1/NAe-gp64, pDual-M2e-gp64, pCP-HA1/NC99-gp64, pCP-H1N1/HA0-gp64, pCP-H1N1/HA2-gp64, pCP-H1N1/HA1-vp39, pCP-H1N1/NP-vp39.
(2) Получение рекомбинантного бакуловируса
Настоящее изобретение относится к способу получения рекомбинантного бакуловируса, включающему стадию получения вектора для переноса, состоящего из структуры, в которую был встроен слитый ген, содержащий, по меньшей мере, один ген, который кодирует белок, способный быть компонентом вирусной частицы, и, по меньшей мере, один иммуногенный чужеродный ген, связанные в нижестоящем положении относительно сдвоенного промотора, в котором связаны один промотор позвоночных и другой бакуловирусный промотор, стадии совместной трансфекции вектора для переноса и бакуловирусной ДНК в клетку-хозяина и выделения рекомбинантного бакуловируса.
В указанном выше способе получения рекомбинантного бакуловируса можно использовать способы введения желаемой рекомбинантной ДНК (вектор для переноса) в организм-хозяин и способы трансформации, а кроме того, не ограничиваясь чем-либо конкретным, различные хорошо известные и общепринятые способы, и их можно осуществлять в соответствии с общепринятым способом рекомбинации генов (например. Science, 224, 1431 (1984); Biochem. Biophys. Res. Comm., 130, 692 (1985); Proc. Natl. Acad. Sci. USA, 80, 5990 (1983). Рекомбинантную ДНК (вектор для переноса) можно экспрессировать и получать согласно Ohno et al., "Tanpaku Jikken Protocol 1 Functional analysis, Saibo Kogaku Bessatu Jikken Protocol Series, 1997, Shujunsha". В случае общих способов использования клеток насекомых, рекомбинации генов и совместной трансфекции можно использовать такие же способы, как хорошо известные способы получения рекомбинантного вируса в клетках насекомых (Yoshiharu Matsuura, Proteins, Nucleic acids and Enzymes, 37: 211-222, 1992; Yoshiharu Matsuura, Saibo 33(2): 30-34, 2001).
Получаемый рекомбинантный бакуловирус можно культивировать в соответствии с общепринятыми способами. Сконструированный желаемым образом слитый продукт (экспрессируемый продукт), в котором были слиты ДНК иммуногенного чужеродного гена и ДНК, кодирующая аминокислотную последовательность белка, способного быть компонентом вирусной частицы согласно настоящему изобретению, в результате культивирования экспрессируют, получают (накапливают) и секретируют внутрь, вовне клеток или на клеточной мембране.
В качестве используемой для культивирования среды можно соответствующим образом выбирать и применять различные общепринятые среды в зависимости от используемых клеток-хозяев, а культивирование можно проводить в условиях, приемлемых для роста клеток-хозяев.
Более конкретно, способ получения рекомбинантного бакуловируса включает стадию получения бакуловирусной ДНК для осуществления гомологичной рекомбинации с вектором для переноса, полученным, как указано выше, и стадию совместной трансфекции вектора для переноса и бакуловирусной ДНК в клетки насекомых, такие как клетки Sf-9, клетки Sf-21, получаемые из Spodoptera frugiperda, клетки Tn5 (клетки High-Five, предоставляемые Invitrogen), получаемые из Trichoplusia ni как клеток-хозяев.
Полученная, как указано выше, бакуловирусная ДНК для проведения гомологичной рекомбинации с вектором для переноса может представлять собой любое из дикого типа, мутанта или рекомбинантной бакуловирусной ДНК.
Бакуловирусная ДНК может повышать вероятность гомологичной рекомбинации при условии, что она имеет структуру ДНК, гомологичную в отношении ДНК, получаемой из бакуловирусной ДНК, которая расположена выше относительно используемого для вектора для переноса сдвоенного промотора таким образом, чтобы осуществить гомологичную рекомбинацию с вектором для переноса согласно настоящему изобретению, за исключением случая получаемой из бакуловируса ДНК, в промежутке которой расположен слитый ген, в котором были слиты ДНК в участке сдвоенного промотора, иммуногенный чужеродный ген и ген, кодирующий белок, способный быть компонентом вирусной частицы.
Для индукции гомологичной рекомбинации лучше смешивать вектор для переноса и бакуловирусную ДНК в массовом соотношении приблизительно от 1:1 до 10:1.
После введения в клетку насекомого посредством стадии одновременной совместной трансфекции и культивирования клетки получают из супернатанта культуры вирусные бляшки, затем суспендируют в среде, а потом вирус элюируют из агара с использованием встряхивающего устройства для получения раствора, содержащего рекомбинантный вирус.
При указанном выше можно использовать коммерчески доступную бакуловирусную ДНК, и, например, можно использовать ДНК BacVector-1000 и ДНК BacVector-2000 (получаемую из Novagen), в которых из AcNPV был удален ген полиэдрина.
Совместную трансфекцию вектора для переноса и полученной, как указано выше, бакуловирусной ДНК в клетку насекомого для гомологичной рекомбинации можно проводить с использованием описанного выше коммерчески доступного набора векторов для трансфекции (наборы для трансфекции BacVector, предоставляемые в Novagen) в соответствии с указаниями, прилагаемыми к набору векторов для трансфекции. Как указано выше, получаемый, как описано выше, вектор для переноса можно совместно трансфицировать вместе с бакуловирусной ДНК в клетку насекомого, такую как клетка Sf-9, для получения рекомбинантного бакуловируса.


Также можно получать такие рекомбинантные бакуловирусы, как AcNPV-Dual-HSNI/HA1 и AcNPV-Dual-SARS/S.
Кроме указанного выше способа получения рекомбинантного бакуловируса, в качестве другого способа получения рекомбинантного бакуловируса можно использовать способ эффективной вставки чужеродного гена в Escherichia coli с применением транспозона для фагмиды (бакмиды), в который был встроен полный геном бакуловируса. В соответствии со способом рекомбинантный бакуловирус можно легко получать и собирать всего лишь посредством выделения из микробных клеток бакмиды, несущей вирусный ген, и трансфекции бакмиды в клетку насекомого.
Очистку рекомбинантного бакуловируса согласно настоящему изобретению, получаемого указанным выше способом получения рекомбинантного бакуловируса, можно проводить с использованием общеизвестного способа очистки вирусов.
Например, для очистки рекомбинантного бакуловируса в клетки насекомых (1×107 клеток/планшет 10 см), такие как клетки Sf-9, инокулируют 0,5-1,0 мл исходного источника вируса (как правило, 1×107-8 бляшкообразующих единиц/мл), полученного указанным выше способом получения рекомбинантного бакуловируса, собирают в течение нескольких суток (4 суток) после инфекции супернатант культуры, и полученный центрифугированием осадок из вирусов суспендируют в таком буфере, как PBS. Получаемую суспензию наносят на градиент сахарозы 10-60%, который затем центрифугируют (25000 об/мин, 60 минут, 4°С) для сбора полосы с вирусом. Затем полученный вирус суспендируют в PBS, a после этого центрифугируют (при тех же условиях, как указано выше), и получаемый очищенный осадок рекомбинантного вируса хранят в буфере, таком как PBS, при 4°С.
Титр инфекционности указанного выше полученного очищенного рекомбинантного вируса можно измерять анализом бляшкообразования (Fields VIROLOGY 4th Edition p29-32 2001) с использованием таких клеток насекомых, как клетки Sf-9.
В рекомбинантном вирусе, представленном в качестве примера согласно настоящему изобретению, N-концевой участок бакуловирусного белка gp64 расположен вне частицы, а его С-концевой участок расположен внутри частицы. Таким образом, если белок, кодируемый желаемым иммуногенным чужеродным геном, слит с N-концевым участком gp64, то его структура, как компонент вирусной частицы, расположена вне вирусной белковой частицы в клетке насекомого, и, соответственно, антиген является более легко презентируемым, что эффективно в отношении цели препарата вакцины согласно настоящему изобретению.
(3) Фармацевтическая композиция согласно настоящему изобретению (фармацевтическое вещество, содержащее в качестве активного ингредиента рекомбинантный бакуловирус согласно настоящему изобретению)
Рекомбинантный бакуловирус согласно настоящему изобретению, являющийся активным ингредиентом в фармацевтической композиции согласно настоящему изобретению, можно получать способами генной инженерии, представленными выше в (2).
Важно, чтобы фармацевтическая композиция согласно настоящему изобретению содержала в качестве активного ингредиента рекомбинантный бакуловирус, полученный гомологичной рекомбинацией бакуловирусной ДНК и вектора для переноса, который сконструирован таким образом, что слитый ген, в котором иммуногенный чужеродный ген согласно настоящему изобретению слит с геном, кодирующим аминокислотную последовательность белка, способного быть компонентом вирусной частицы, может экспрессироваться в клетках насекомых и клетках позвоночных, в частности, клетках млекопитающих, в том числе человека.


являющийся активным ингредиентом в фармацевтической композиции согласно настоящему изобретению, действует, усиливая противоинфекционный профилактический эффект в отношении инфекционного антигена и снижая титр инфекционности, и такое действие или активность можно использовать для процедур при заболеваниях, связанных с инфицированием клеток- или тканей-мишеней. Такие поражаемые инфекцией клетки-мишени включают, например, клетки крови, а другие клетки-мишени включают клетки печени, клетки почки, клетки головного мозга, клетки легких, эпителиальные клетки и мышечные клетки. Ткани, содержащие эти клетки, включают легкие, печень, почки, артерии и вены, желудок, кишечник, уретру, кожу и мышцы.
Фармацевтическая композиция усиливает противоинфекционный профилактический эффект в отношении инфекционных антигенов, таких как поверхностный антиген CSP поверхности спорозоита малярийного паразита, MSP1 из мембранного белка поверхности мерозоита, малярийный антиген S, секретируемый из инфицированных малярией эритроцитов, белок PfEMPI, присутствующий в выпуклом утолщении инфицированных малярией эритроцитов, белок SERA, белок TRAMP и белок АМА1, а также антигены гриппа, например антиген НА, антиген NA, антиген М2 и антиген NP, и снижает титр инфекционности (например, титр инфекционности вируса). Таким образом, период выживания и уровень выживания млекопитающих, в том числе человека, которым вводят фармацевтическую композицию согласно настоящему изобретению, являются повышенными в сравнении с таковыми при отсутствии введения. Таким образом, фармацевтическая композиция согласно настоящему изобретению эффективна в качестве профилактического или терапевтического средства особенно в отношении инфицирования малярией и вирусом гриппа.
Фармацевтическая композиция согласно настоящему изобретению эффективна в качестве профилактического или терапевтического средства в отношении вызываемых патогеном инфекционных заболеваний и их осложнений, например вирусных заболеваний, вызываемых вирусом гриппа, вирусом папилломы, вирусом герпеса, вирусом СПИД, вирусом гепатита С, вирусом SARS, вирусом лихорадки Западного Нила и вирусом лихорадки денге, паразитических заболеваний, вызываемых малярийными паразитами, трипаносомой и лейшманией, а также бактериальных заболеваний, вызываемых такими бактериями, как дизентерийная, бактерия брюшного тифа, холерная, пневмококк, MRSA, VRE, Neissena gonorrhoeae и Chlamydia, бактерия сифилиса и туберкулезная, где используют действие композиции, заключающееся в усилении противоинфекционного профилактического эффекта в отношении инфекционного антигена и снижении титра инфекционности.
В результате использования иммуногенного чужеродного гена для позвоночного, отличного от человека, в векторе для переноса для получения рекомбинантного бакуловируса, который является активным ингредиентом в фармацевтической композиции согласно настоящему изобретению, фармацевтическую композицию согласно настоящему изобретению можно применять для процедур при заболеваниях, связанных с инфицированием клеток- и тканей-мишеней, в виде вакцины от гриппа цыплят, вакцины трипаносомы быка и вакцины от холодноводной болезни японской форели, где применение основано на действии, заключающемся в усилении противоинфекционного профилактического эффекта в отношении инфекционного антигена и снижении титра инфекционности.
Фармацевтическую композицию согласно настоящему изобретению можно получать в виде композиции, содержащей фармацевтически эффективное количество рекомбинантного бакуловируса и фармацевтически приемлемый носитель.
Например, для оказания противоинфекционного профилактического эффекта рекомбинантного бакуловируса согласно настоящему изобретению у позвоночного, в частности млекопитающих, в том числе человека или клеток млекопитающих, фармацевтическую композицию, получаемую с использованием рекомбинантного бакуловируса согласно настоящему изобретению, и композицию, которую можно добавлять для фармацевтического применения, вводят внутримышечно, интраназально или ингаляцией позвоночному, в частности млекопитающему, в том числе человеку, которого затем многократно иммунизируют посредством фармацевтической композиции, содержащей в качестве активного ингредиента рекомбинантный бакуловирус согласно настоящему изобретению. В частности, фармацевтическую композицию согласно изобретению вводят ингаляцией.
Кроме того, профилактический эффект в отношении инфекции можно оценивать после многократной иммунизации фармацевтической композицией согласно настоящему изобретению, вводя патоген, которым подлежит воздействовать на позвоночного, в частности, млекопитающего, в том числе человека, и сравнивая после прохождения определенного периода уровень выживаемости позвоночных, в частности млекопитающих, в том числе человека, которым вводили рекомбинантный бакуловирус, являющийся активным ингредиентом фармацевтической композиции согласно настоящему изобретению, с уровнем выживаемости для тех, кому не вводили рекомбинантный бакуловирус.
(4) Вакцина согласно настоящему изобретению Являющийся активным ингредиентом в фармацевтической композиции согласно настоящему изобретению рекомбинантный бакуловирус, такой как AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-H5N1/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39 или AcNPV-CP-H1N1/NP-vp39, очищают из клетки насекомого в виде реплицирующейся вирусной частицы, содержащей экспрессируемый продукт слитой последовательности ДНК, в которой слит ген, кодирующий аминокислотную последовательность белка, способного быть компонентом вирусной частицы, и иммуногенный чужеродный ген согласно настоящему изобретению, обладающий желаемой иммуногенностью для усиления профилактического эффекта в отношении инфицирующего патогена и для проявления действия, заключающегося в снижении титра инфекционности. Таким образом, предполагают, что чужеродный антигенный белок, который стал компонентом вирусной частицы, способствует приобретенному иммунитету (гуморальному иммунитету и клеточному иммунитету) при введении фармацевтической композиции в виде вирусной частицы позвоночному, в частности млекопитающим, в том числе человеку, а кроме того, антигенный белок, представляющий собой экспрессируемый продукт слитой последовательности ДНК, дополнительно способствует приобретенному иммунитету (гуморальному иммунитету и клеточному иммунитету) в клетках позвоночных, в частности, в клетках у млекопитающих, в том числе человека. Таким образом, рекомбинантный бакуловирус согласно настоящему изобретению является эффективным в качестве вакцины.
В частности, настоящее изобретение относится к вакцине, содержащей в качестве активного ингредиента любой из таких конкретных рекомбинантных бакуловирусов, как AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-H5N1/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39.
Как и в случае с фармацевтической композицией из указанного выше (3), вакцина усиливает профилактический эффект на инфекцию и снижает титр инфекционности (например, титр инфекционности вируса) для патогенных организмов, таких как малярийные антигены, например поверхностный антиген (CSP) поверхности спорозоита малярийного паразита, MSP1 из мембранного белка поверхности мерозоита, малярийный антиген S, секретируемый из инфицированных малярией эритроцитов, белок PfEMPi, присутствующий в выпуклом утолщении инфицированных малярией эритроцитов, белок SERA, белок TRAMP и белок АМА1, или антиген вируса гриппа НА, антиген вируса гриппа NA, антиген вируса гриппа М2 и антиген вируса гриппа NP. Таким образом, при сравнении периода выживаемости и уровня выживаемости для инфицированных млекопитающих, в том числе человека, и для тех, кому не вводили фармацевтическую композицию согласно настоящему изобретению, вакцина оказывается особенно эффективной в качестве профилактического или терапевтического средства в отношении инфицирования малярией и вирусом гриппа.
Вакцина согласно настоящему изобретению эффективна в качестве профилактического или терапевтического средства в отношении вызываемых патогеном инфекционных заболеваний и их осложнений, например вирусных заболеваний, вызываемых вирусом гриппа, вирусом папилломы, вирусом герпеса, вирусом СПИД, вирусом гепатита С, вирусом SARS, вирусом лихорадки Западного Нила и вирусом лихорадки денге, паразитических заболеваний, вызываемых малярийными паразитами, трипаносомой и лейшманией, а также бактериальных заболеваний, вызываемых такими бактериями, как дизентерийная, бактерия брюшного тифа, холерная, пневмококк, MRSA, VRE, Nelsseria gonorrhoeae и Chlamydia, бактерия сифилиса и туберкулезная, где используют действие вакцины, заключающееся в усилении противоинфекционного профилактического эффекта в отношении инфекционного антигена и снижении титра инфекционности.
В результате использования иммуногенного чужеродного гена для позвоночного, отличного от человека, в векторе для переноса для получения рекомбинантного бакуловируса, который является активным ингредиентом в вакцине согласно настоящему изобретению, фармацевтическую композицию согласно настоящему изобретению можно применять для процедур при заболеваниях, связанных с инфицированием клеток- и ткани-мишени, в виде вакцины от гриппа цыплят, вакцины трипаносомы быка и вакцины от холодноводной болезни японской форели, где применение основано на действии композиции, заключающемся в усилении противоинфекционного профилактического эффекта в отношении инфекционного антигена и снижении титра инфекционности.
Рекомбинантный бакуловирус согласно настоящему изобретению, такой как AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-H5N1/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-HINl/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, ACNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39, являющийся активным ингредиентом в вакцине согласно настоящему изобретению, действует, усиливая противоинфекционный профилактический эффект в отношении инфекционного антигена и снижая титр инфекционности, и такое действие или активность можно использовать для процедур при заболеваниях, связанных с инфицированием клеток- или тканей-мишеней. Такие поражаемые инфекцией клетки-мишени включают, например, клетки крови, а другие клетки-мишени включают клетки печени, клетки почки, клетки головного мозга, клетки легких, эпителиальные клетки и мышечные клетки. Ткани, содержащие эти клетки, включают легкие, печень, почки, артерии и вены, желудок, кишечник, уретру, кожу и мышцы.
Вакцину согласно настоящему изобретению, как и фармацевтическую композицию из указанного выше (3), можно получать в виде композиции, содержащей фармацевтически эффективное количество рекомбинантного бакуловируса (AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-HSNI/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, ACNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39) и фармацевтически приемлемый носитель.
Вакцину можно получать общепринятыми способами в виде фармацевтической композиции, используя такое же приемлемое фармацевтическое вещество, как для фармацевтической композиции в указанном выше (3). Например, носитель может включать физиологически приемлемые растворы, такие как стерильный солевой раствор и стерильный забуференный солевой раствор.
Вакцину (здесь и далее препарат является таким же, как в фармацевтической композиции) можно получать в виде препарата липосомы, содержащего в качестве активного ингредиента рекомбинантный бакуловирус (AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-HSNi/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39), и ее можно сочетать с адъювантом. Конкретные примеры вакцины (фармацевтической композиции) согласно настоящему изобретению могут включать препарат липосомы. Препарат липосомы может представлять собой препарат, в котором рекомбинантный бакуловирус согласно настоящему изобретению был зафиксирован в липосоме с использованием в качестве компонента мембраны кислого фосфолипида или с использованием в качестве компонента мембраны нейтрального фосфолипида и кислого фосфолипида.
Используемые в качестве компонента мембраны нейтральный фосфолипид и кислый фосфолипид не ограничены чем-либо конкретным, а различные липиды, обычно используемые для препарата липосомы, можно применять по отдельности или в смеси из двух или более.
Мембрану липосомы получают общепринятыми способами с использованием кислого фосфолипида по отдельности или сочетая нейтральный фосфолипид и кислый фосфолипид. В случае сочетания с нейтральным фосфолипидом доля подлежащего сочетанию кислого фосфолипида в компонентах мембраны липосомы может составлять приблизительно от 0,1 до 100 молярных %, предпочтительно - от 1 до 90 молярных %, а более предпочтительно - приблизительно от 10 до 50 молярных %.
При получении указанной выше липосомы можно, например, добавлять холестерин. Посредством этого можно контролировать текучесть фосфолипида и облегчать получение липосомы. Как правило, холестерин добавляют в количестве, эквивалентном количеству фосфолипида, и, предпочтительно, его предпочтительно добавлять и сочетать в количестве от 0,5-кратного до эквивалентного количеству фосфолипида.
Что касается количества активного ингредиента и кислого фосфолипида в препарате липосомы, количество кислого фосфолипида составляет приблизительно от 0,5 до 100 эквивалентов, предпочтительно - приблизительно от 1 до 60 эквивалентов, а более предпочтительно - приблизительно от 1,5 до 20 эквивалентов относительно активного ингредиента.
Количество рекомбинантного бакуловируса согласно настоящему изобретению, представляющего собой подлежащий использованию активный ингредиент, может составлять от нескольких молярных % до нескольких десятков молярных %, предпочтительно - приблизительно от 5 до 10 молярных %, а как правило - приблизительно 5 молярных %.
Контроль над получением, концентрацией и диаметром частиц указанного выше препарата липосомы можно выполнять в соответствии с общепринятыми способами. Кроме того, по желанию, с препаратом липосомы можно сочетать различные описанные выше добавки. Также с препаратом можно связывать и использовать жирную кислоту (например, бегеновую кислоту, стеариновую кислоту, пальмитиновую кислоту, миристиновую кислоту, олеиновую кислоту), алкильную группу, холестерильную группу и т.п. Получение препарата липосомы, составляемого посредством связывания с этими веществами, можно также осуществлять в соответствии с общепринятыми способами (см. Long Circulating Liposomes: old drugs. New therapeutics., M.C. Woodle, G. Storm, Eds: Springer-Verlag Berlin (1998)).
Предпочтительно вакцину (фармацевтическую композицию) согласно настоящему изобретению можно использовать в качестве композиции вакцины. Предпочтительно при использовании вакцины ее сочетают с адъювантом в фармацевтически эффективном количестве для усиления противоинфекционного (противомалярийного или противогриппозного) эффекта.
В качестве адъюванта можно без ограничения использовать любой адъювант, обычно применяемый для вакцины этого типа. В качестве примеров адъюванта могут быть представлены полный адъювант Фрейнда, дипептид мурамила, гидроксид алюминия, BCG, IL-12, N-ацетилмурамин-L-аланил-D-изоглутамин, тимозин α1 и QS-21. Количество подлежащего сочетанию адъюванта можно соответственно определять в зависимости от размягчения, покраснения кожи, лихорадки, головной боли и мышечной боли, которые могут проявляться как составляющая иммунной реакции у человека или животного после введения адъюванта. Вакцину (фармацевтическую композицию) согласно настоящему изобретению можно сочетать с другими общеизвестными фармацевтическими веществами, такими как пептид, способствующий иммунной реакции, и противобактериальные средства (синтетические противобактериальные средства).
Кроме того, в вакцине (фармацевтической композиции) могут содержаться выбранные по желанию лекарственные средства и добавки. В качестве примеров таких веществ может быть представлено такое лекарственное средство, как ион кальция, способствующий внутриклеточному захвату рекомбинантного бакуловируса согласно настоящему изобретению. Можно использовать лекарственные средства и добавки, облегчающие проведение трансфекции, например липосому, а также, например, фторуглеродный эмульгатор, улиткообразные структуры на основе липидов, трубкообразные структуры на основе липидов, частицы золота, биоразлагаемую микросферу и катионные полимеры.
Количество активного ингредиента, содержащегося в вакцине (фармацевтической композиции) (препарате) согласно настоящему изобретению, не ограничено чем-либо конкретным и может быть выбрано из широкого диапазона при условии, что оно является фармацевтически эффективным количеством. Доза вакцины (фармацевтической композиции) не ограничена чем-либо конкретным и может быть выбрана соответствующим образом из широкого диапазона в зависимости от желаемого терапевтического эффекта, способа введения (пути введения), периода лечения, возраста и пола пациента, а также от других условий.
В случае введения человеку рекомбинантного бакуловируса, являющегося активным ингредиентом вакцины (композиции) согласно настоящему изобретению, исходя из значений бляшкообразующих единиц для рекомбинантного вируса, вводят рекомбинантный бакуловирус в количестве, соответствующем от 102 до 1012бляшкообразующих единиц, предпочтительно - от 105 до 1010бляшкообразующих единиц, а более предпочтительно - от 106 до 109бляшкообразующих единиц на пациента.
Дозу рекомбинантного бакуловируса (AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-HSNI/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, AcNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39), являющегося активным ингредиентом вакцины (фармацевтической композиции) согласно настоящему изобретению, выбирают из очень широкого диапазона как количество способной к экспрессии ДНК, введенной в вакцину-хозяина, или как количество транскрибируемой РНК. Также их количества зависят от силы промоторов для транскрипции и трансляции, используемых в векторе для переноса.
Вакцину (фармацевтическую композицию) согласно настоящему изобретению вводят инъекцией суспензии рекомбинантного бакуловируса, в которой вектор был суспендирован в PBS (забуференном фосфатом физиологическом растворе) или физиологическом растворе, непосредственно в местный участок (например, в ткань легких, в печень, в мышцы и в головной мозг), вводят ингаляцией через нос или интубационную трубку, или вводят в кровеносный сосуд (например, внутриартериально, внутривенно и в воротную вену). Предпочтительно вакцину согласно изобретению вводят ингаляцией.
Предпочтительно вакцину (фармацевтическую композицию) согласно настоящему изобретению вводят не один раз, а от одного до множества раз, наблюдая состояние после исходного введения и вводя дополнительную вакцину(ы). Это делает возможным усиление желаемого эффекта. После введения вакцины (фармацевтической композиции) можно дополнительно иммунизировать посредством фармацевтической композиции, состоящей из рекомбинантного бакуловируса согласно настоящему изобретению (AcNPV-Dual-H1N1/HA1, AcNPV-Dual-Hsp65, AcNPV-Dual-PfCSP, AcNPV-Dual-PfAMA1, AcNPV-Dual-Pfs25, AcNPV-Dual-H5N1/HA1, AcNPV-Dual-SARS/S, AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1, AcNPV-CU-H1N1/HA1, AcNPV-Dual-H1N1/NP, AcNPV-Dual-H1N1/M2, AcNPV-Dual-H1N1/NAe, AcNPV-Dual-M2e, ACNPV-CP-HA1/NC99, AcNPV-CP-H1N1/HA0, AcNPV-CP-H1N1/HA2, AcNPV-CP-H1N1/HA1-vp39, AcNPV-CP-H1N1/NP-vp39). Сочетание указанных выше различных лекарственных средств, подлежащих сочетанию, также может усиливать терапевтический эффект при введении вакцины (фармацевтической композиции).
В одном из вариантов осуществления вакцины (фармацевтической композиции) согласно настоящему изобретению рекомбинантный бакуловирус, который является одним из активных ингредиентов вакцины (фармацевтической композиции) согласно настоящему изобретению, можно составлять смешиванием рекомбинантного бакуловируса, получаемого гомологичной рекомбинацией бакуловирусной ДНК и вектора для переноса, в который был введен слитый ген, полученный слиянием желаемого иммуногенного чужеродного гена и гена, кодирующего белок, способный быть компонентом вирусной частицы, в форме, пригодной для инъекции разовой дозы (раствор, суспензия или эмульсия), вместе с фармацевтически приемлемым носителем (т.е. нетоксичным для позвоночных, в том числе человека, и совместимым с другими ингредиентами в препарате). Например, препарат предпочтительно не содержит антиоксиданта и других соединений, для которых известно неблагоприятное воздействие на рекомбинантный бакуловирус.
Соответственно, носитель содержит в малых количествах такие добавки, как вещества, улучшающие изотонические свойства и химическую стабильность. Такие вещества в подлежащих введению дозе и концентрации являются нетоксичными для млекопитающих, в том числе человека, и могут содержать такие буферы, как фосфорная кислота, лимонная кислота, янтарная кислота, уксусная кислота и другие органические кислоты или их соли, антиоксиданты, такие как аскорбиновая кислота, полипептиды с низкой молекулярной массой (например, приблизительно менее чем 10 остатков) (например, полиаргинин или трипептид), белки (например, сывороточный альбумин, желатин или иммуноглобулин), аминокислоты (например, глицин, глутаминовая кислота, аспарагиновая кислота или аргинин), моносахариды, дисахариды и другие углеводы (в том числе целлюлоза или ее производные, глюкоза, манноза или декстрин), хелатообразующие средства (например, EDTA), сахарные спирты (например, маннит или сорбит), противоионы (например, натрий) и/или неионные поверхностно-активные вещества (например, полисорбат, полоксамер).
Содержащую рекомбинантный бакуловирус фармацевтическую вакцину (композицию) можно типичным образом хранить в контейнере для разовой дозы или многократных доз, например, в виде водного раствора или лиофилизированного продукта в герметично запечатанной ампуле или флаконе.
Фармацевтическую композицию, содержащую вакцину (композицию) согласно настоящему изобретению, вводят способом, соответствующим надлежащей медицинской практике, с учетом клинического состояния конкретного пациента (например, состояния, которое следует предотвратить или лечить), участка, в который доставляют содержащую рекомбинантный бакуловирус вакцину (композицию), ткани-мишени, способа введения, схемы введения и других общеизвестных специалистам в данной области факторов. Таким образом, в рамках настоящей заявки надлежащую дозу вакцины (композиции) определяют с учетом указанного выше.
ПРИМЕРЫ
Настоящее изобретение более подробно описано ниже со ссылкой на примеры. Эти примеры предназначены только для иллюстрации и не ограничивают настоящее изобретение.
[Пример 1] Векторная плазмида для переноса и способ ее получения согласно настоящему изобретению
(1) Конструирование векторной плазмиды для переноса pDual-Hsp65-gp64 согласно настоящему изобретению
(1.1) Конструирование плазмиды pBACsurf-CSP
Плазмиду pcDNA-CS87 конструировали посредством получения фрагмента Nhel-NotI, содержащего последовательность, в которой слиты геномная ДНК из Plasmodium berghei штамма ANKA, сигнальная последовательность для секреции Igk мыши и последовательность FLAG в соответствии со способом Yoshida et al. (Yoshida, S., et al., B.B.R.C., 271, 107-115 (2000), и посредством вставки фрагмента NheI-NotI в участок NheI-NotI в pcDNA3.1 (полученном из Invitrogen).
Получали образец крови от мыши BALB/c, инфицированной малярийным паразитом Р.berghei ANKA, и выделяли геномную ДНК Р.berghe-L с использованием набора для выделения ДНК в среднем объеме QIAamp (предоставляемого из Qiagen). После этого геномную ДНК Р.berghei ANKA амплифицировали посредством PCR с использованием праймера pbCSPl-Fl:
5'-
GGAGGGCTAGCATGGAGACAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGGTTC CACTGGTGACGCGGATCCACTGCAGGACTACAAGGACGTAGACAAGGGATATGGACAAAATAAAGCATCCAAGCCC-3' (SEQ ID №:1) (полученный заново участок NheI представлен подчеркиванием, сигнальная последовательность для секреции Igk мыши представлена курсивом, а последовательность FLAG представлена двойным подчеркиванием) и PbCSP-R1:
GGAGGGCGGCCGCATCCCGGGTTTTCTTATTTGAACCTTTTCGTTTTCTAACTCTTATAC CAGAACC-3' (SEQ ID №:2) (полученный заново участок NotI представлен подчеркиванием). PCR проводили с использованием полимеразы PfuDNA (предоставляемой из Stratagene), применяя 30 циклов (денатурация при 94°С в течение 30 секунд, отжиг при 55°С в течение одной минуты и удлинение при 72°С в течение 2 минут). Продукт PCR не содержит гликозилфосфатидилинозитольный (GPI) фиксирующий фрагмент и кодирует PbCSP, слитый с сигнальной последовательностью для секреции Igk мыши в участке его исходной сигнальной последовательности.
Продукт PCR очищали, расщепляли ферментами рестрикции NheI/NotI, затем получаемое вставляли в участки NheI/NotI в PCDNA3.1 (+) (предоставленную из Invitrogen) и обозначали полученную плазмиду как pcDNA-CS87. Плазмида pcDNA-CS87 содержит промотор CMV, сигнальную последовательность для секреции Igk мыши, кодируемый геном PbCSP белок (соответствующий аминокислотам от 21 до 305), поли(А)-сигнальную последовательность, полученную из гена гормона роста быка, и поли(А)-последовательность.
Фрагмент гена, кодирующий аминокислотную последовательность в положениях 21-305 в пептиде из PbCSP, получали расщеплением pcDNA-CS87 ферментами рестрикции PstI и SmaI, фрагмент ДНК вставляли в участки PstI и SmaI в pBACsurf-1 (предоставляемый из Novagen), а сконструированную плазмиду обозначали как pBACsurf-CSP.
(1.2) Конструирование плазмиды pBACsurf-Hsp65
Ген Hsp65 получали посредством выделения геномной ДНК из штамма М.tuberculosis H37Rv с использованием набора для выделения ДНК в среднем объеме QIAamp (предоставляемого из Qiagen) и посредством клонирования с применением PCR. Таким образом, выделенную из штамма М.tuberculosis H37Rv ДНК амплифицировали посредством PCR с использованием праймера phsp65-F1:
5'-AATAATAGATCTAATGGCCAAGACAATTGCGTACGACGAAGA-3 (SEQ ID №:3) (участок BglII представлен подчеркиванием) и phsp65-R1:
AATCCAATGCGGCCGCGGGAATTCGATTCCTGCAGGTCAGAAATCCATGCCACCCATGTCGCC-3 (SEQ ID №:4) (участок NotI представлен подчеркиванием).
Продукт PCR очищали, расщепляли ферментами рестрикции BglII/NotI, лигировали в участки BamHI/NotI в pcDNA-CS87, а получаемую плазмиду обозначали как pcDNA-Ighsp65.
Плазмида pcDNA-Ighsp65 представляет собой конструкт, в котором сигнальная последовательность для секреции Igk мыши была слита с геном hsp65.
PCR проводили с использованием pcDNA-Ighsp65 в качестве образца, применяя праймер phsp65-F2:
5'-CACCCCTGCAGGACTACAAGGACGACGATGACAAGGAATTCATGGCCAAGACAATTGCGTACGA
CGAAGAGGCC-3' (SEQ ID №:5) (участки Sse8387I, EcoRI представлены подчеркиванием, а последовательность FLAG представлена курсивом), а также phsp65-R2:
(5'-CCCGGGCGAAATCCATGCCACCCATGTCGCCGCCACC-3' (SEQ ID №:6) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК гена Hsp65 (приблизительно 1660 п.о.) клонировали в pENTR/D-ТОРО (предоставляемый из Invitrogen), после этого расщепляли посредством Sse8387I/Cfr9I, а затем полученное вставляли в участки Psti/Cfr9I в pBACsurf-CSP (Yoshida et al. Virology 316:
161-70, 2003), полученную, как указано выше.
Плазмиду, сконструированную, как указано выше, обозначали как pBACsurf-Hsp65.
(1.3) Конструирование плазмиды pENTR-gp64
PCR проводили с использованием pBACsurf-1 (предоставляемого из Novagen) в качестве образца, применяя праймер pPolh-F2:
5'-CACCCGGACCGGATAATTAAAATGATAACCATCTCGCAAATAAATAAG-3' (SEQ ID №:7) (участок RsrII представлен подчеркиванием), и pgp64-R2: 5'-GGTACCATATTGTCTATTACGGTTTCTAATCATAC-3' (SEQ ID №:8) (участок KpnI представлен подчеркиванием). Получаемый фрагмент ДНК гена gp64 (приблизительно 1700 п.о.) вставляли в pENTR/D-TOPO для конструирования плазмиды pENTR-gp64.
Плазмиду, сконструированную, как указано выше, обозначали как pENTR-gp64.
(1.4) Конструирование вектора для переноса pDual-Hsp65-gp64 согласно настоящему изобретению
Расщепляли pBACsurf-Hsp65 посредством PstI/Cfr9I и фрагмент ДНК гена hsp65 (приблизительно 1660 п.о.) вставляли в участки PstI/Cfr9I в pENTR-gp64 для конструирования плазмиды pENTR-hsp65-gp64.
Кроме того, pENTR-hsp65-gp64 расщепляли посредством RsrII/KpnI, а фрагмент ДНК (приблизительно 3360 п.о.), состоящий из промотора полиэдрина и гена hsp65-gp64, вставляли в RsrII/KpnI в pTriEx-3 (предоставляемый из Novagen) для конструирования векторной плазмиды для переноса pDual-Hsp65-gp64, в которой экспрессия контролировалась желаемым сдвоенным промотором.
(2) Конструирование вектора для переноса pDual-PbCSP-gp64 согласно настоящему изобретению
Полученную в (1.1.1) плазмиду pBACsurf-CSP расщепляли посредством PstI/Cfr9I, и фрагмент ДНК гена PbCSP (приблизительно 890 п.о.) вставляли в участки PstI/Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual-PbCSP-gp64.
(3) Конструирование вектора для переноса pDual-H1N1/HA1-gp64 согласно настоящему изобретению
Выделяли РНК из супернатанта культуры клеток MDCK, инфицированных штаммом вируса гриппа PR/8/34, с использованием набора QIAamp MiniElute Virus Spin (QIAGEN) и амплифицировали посредством RT-PCR с использованием праймера HA-f: 5'-CCTGCAGGTATGAAGGCAAACCTACTGGTC-3' (SEQ ID №:9) (участок SbfI представлен подчеркиванием) и НА-r: 5'-GCCCGGGCGATGCATATTCTGCA-3' (SEQ ID №:10) (участок Cfr9I представлен подчеркиванием). Получаемый полноразмерный фрагмент гена НА вируса гриппа величиной 1700 п.о. клонировали в pCR-Blunt II-TOPO (предоставляемую из Invitrogen).
Получаемую плазмиду обозначали как pCR-Blunt-HA. PCR проводили с использованием pCR-Blunt-HA в качестве образца, применяя праймер pHA-F1: 5'-CACCGAATTCGACACAATATGTATAGGCTACCATGCG-3' (SEQ ID №:11) (участок EcoRI представлен подчеркиванием) и pHA-R1: 5'-CCCGGGCACCTCTGGATTGGATGGACGGAATG-3' (SEQ ID №:12) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК гена H1N1/HA1 (приблизительно 1000 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством EcoRI/Cfr9I, а затем полученное вставляли в участки EcoRI/Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual-H1N1/HA1-gp64.
(4) Конструкт вектора для переноса pDual-PbTRAMP-gp64 согласно настоящему изобретению
Получали образец крови от мыши BALB/c, инфицированной малярийным паразитом Р.berghei ANKA, и выделяли геномную ДНК Р.berghei с использованием набора для выделения ДНК в среднем объеме QIAamp (предоставляемого из Qiagen).
Ген PbTRAMP клонировали посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, PCR проводили с использованием праймера pTRAMP-F1: 5'-CACCGAATTCAAAATTGATACGAAAAAAAATGAAG-3' (SEQ ID №:13) (участок EcoRI представлен подчеркиванием) и pTRAMP-R1: CCCGGGCTTTTAATTTTGAGGAGTCTTTATTTTC-3' (SEQ ID №:14) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК PbTRAMP (приблизительно 800 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством EcoRI/Cfr9I, а затем полученное вставляли в участки EcoRI/Cfr9I в pBACsurf-Hsp65. Сконструированную плазмиду обозначали как pBACsurf-PbTRAMP.
Затем pBACsurf-PbTRAMP расщепляли посредством EcoRI/Cfr9I, а фрагмент ДНК гена PbTRAMP (приблизительно 860 п.о.) вставляли в участки EcoRI/Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual-PbTRAMP-gp64.
(5) Конструирование вектора для переноса pDual-PbAMA1D123-gp64 согласно настоящему изобретению
Получали образец крови от мыши BALB/c, инфицированной малярийным паразитом Р.berghei ANKA, и выделяли геномную ДНК Р.berghei с использованием набора для выделения ДНК в среднем объеме QIAamp (предоставляемого из Qiagen).
Домен 123 (D123) гена PbAMA1 клонировали посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, проводили PCR с использованием праймера pAMA1-F1: 5'-CACCGAATTCAATCCATGGGAAAAGTATACGGAAAAATAT-3' (SEQ ID №:15) (участок EcoRI представлен подчеркиванием) и pAMA1-R1: 5'-CCCGGGCTTCTCTGGTTTGATGGGCTTTCATATGCAC-3' (SEQ ID №:16) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК PbAMA1D123 (приблизительно 1280 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством EcoRI/Cfr9I, а затем полученное вставляли в участки EcoRI/Cfr9I в pBACsurf-Hsp65. Сконструированную плазмиду обозначали как pBACsurf-PbAMA1D123.
После этого pBACsurf-PbAMA1D123 расщепляли посредством EcoRI/Cfr9I и фрагмент ДНК гена PbAMA1D123 (приблизительно 1280 п.о.) вставляли в участки EcoRI/Cfr9I в pDual-Hsp65-gp64, полученной в указанном выше (1.4), для конструирования плазмиды pDual-PbAMA1D123-gp64.
(6) Конструирование вектора для переноса pDual- PbMSP119-gp64 согласно настоящему изобретению
Получали образец крови от мыши BALB/c, инфицированной малярийным паразитом Р.berghei ANKA, и выделяли геномную ДНК Р. berghei. с использованием набора для выделения ДНК в среднем объеме QIAamp (предоставляемого из Qiagen).
Клонировали ген PbMSP119 посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, проводили PCR с использованием праймера pMspl-Fl: 5'-CACCCTGCAGGACTACAAGGACGACGATGACAAGCACATAGCCTCAATAGCTTTAAATAACTTA AATAAATCTGG-3' (SEQ ID №:17) (участок PstI представлен подчеркиванием) и pMsp1-R1: 5'-CCCGGGTTCCCATAAAGCTGGAAGAGCTACAGAATACACC-3' (SEQ ID №:18) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК PbMSP119 (приблизительно 450 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством PstI/Cfr9I, а затем полученное вставляли в участки PstI/Cfr9I в pBACsurf-Hsp65. Сконструированную плазмиду обозначали как pBACsurf-PbMSP119.
После этого pBACsurf-PbMSP119 расщепляли посредством PstI/Cfr9I, и фрагмент ДНК гена PbMSP119 (приблизительно 450 п.о.) вставляли в участки PstI/Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual- PbMSP119-gp64.
(7) Конструирование вектора для переноса pDual-PfCSP-gp64 согласно настоящему изобретению
Геномную ДНК паразита тропической малярии Р.falciparum выделяли из эритроцитов человека, инфицированных штаммом Р.falciparum 3D7, с использованием набора для выделения ДНК в среднем объеме QIAamp (QIAGEN). Ген PfCSP клонировали посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, проводили PCR с использованием праймера pPfCSP-F1: 5'-CACCGAATTCTTATTCCAGGAATACCAGTGCTATGGAAGT-3' (SEQ ID №:19) (участок EcoRI представлен подчеркиванием) и pPfCSP-R1: 5'-CCCGGGCTTTTTCCATTTTACAAATTTTTTTTTC-3' (SEQ ID №:20) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК PfCSP (приблизительно 1100 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством EcoRI/Cfr9I, а затем полученное вставляли в участки EcoRI/Cfr9I в pDual-PbAMA1D123-gp64. Сконструированную плазмиду обозначали как pDual-PfCSP-gp64.
(8) Конструирование вектора для переноса pDual-PfAMA1-gp64 согласно настоящему изобретению
Геномную ДНК паразита тропической малярии Р.falciparum выделяли из эритроцитов человека, инфицированных штаммом Р.falciparum 3D7, с использованием набора для выделения ДНК в среднем объеме QIAamp (QIAGEN). Ген PfAMA1 клонировали посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, проводили PCR с использованием праймера pPfAMA1-F1: 5'-CACCCTGCAGGACTACAAGGACGACGATGACAAGCAGAATTATTGGGAACATCCATATCAAAAT AGTGATGTG-3'' (SEQ ID №:21) (участок PstI представлен подчеркиванием, последовательность FLAG представлена курсивом) и pPfAMA1-R1: 5'-CCCGGGCTTTCATTTTATCATAAGTTGGTTTATG-3' (SEQ ID №:22) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК PfAMA1 (приблизительно 3500 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством PstI/Cfr9I, а затем полученное вставляли в участки PstI/Cfr9I в pDual-PbAMA1D123-gp64. Сконструированную плазмиду обозначали как pDual-PfAMA1-gp64.
(9) Конструирование вектора для переноса pDual-Pfs25-gp64 согласно настоящему изобретению
Геномную ДНК паразита тропической малярии Р.falciparum выделяли из эритроцитов человека, инфицированных штаммом Р.falciparum 3D7, с использованием набора для выделения ДНК в среднем объеме QIAamp (QIAGEN). Ген Pfs25 клонировали посредством PCR с использованием этой геномной ДНК в качестве образца в соответствии со следующим способом. А именно, проводили PCR с использованием праймера pPfs25-Fl: 5'-CACCGAATTCAAAGTTACCGTGGATACTGTATGCAAAAGAGGA-3' (SEQ ID №:23) (участок EcoRI представлен подчеркиванием) и pPfs25-R1: 5'-CCCGGGCAGTACATATAGAGCTTTCATTATCTAT-3' (SEQ ID №:24) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент ДНК Pfs25 (приблизительно 530 п.о.) клонировали в pENTR/D-TOPO (предоставляемую из Invitrogen), после этого расщепляли посредством EcoRI/Cfr9I, а затем полученное вставляли в участки EcoRI/Cfr9I в pDual-PbAMA1D123-gp64. Сконструированную плазмиду обозначали как pDual-Pfs25-gp64.
(10) Конструирование вектора для переноса pDual-HSNI/HA1-gp64 согласно настоящему изобретению
Ген НА1 синтезируют из вируса птичьего гриппа H5N1 и вставляют в участки EcoRI/'Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual-H5N1/HA1-gp64.
(11) Конструирование вектора для переноса pDual-SARS/S-gp64 согласно настоящему изобретению
Синтезируют ген S из вируса SARS и вставляют в участки EcoRI/Cfr9I в pDual-Hsp65-gp64 для конструирования плазмиды pDual-SARS/S-gp64.
(12) Конструирование вектора для переноса pCP-H1N1/HA1-gp64 согласно настоящему изобретению
Проводили PCR с использованием pDual-H1N1/HA1-gp64 в качестве образца, применяя Polh-f RsrII (5'-GGGCGGACCGGATAATTAAAATGATAACCATCTCG-3': SEQ ID №:25) (участок RsrII представлен подчеркиванием) и GP64-r DraIII (5'-GGGCACTTAGTGATATTGTCTATTACGGTTTCTAATC-3': SEQ ID №:26) (участок DraIII представлен подчеркиванием). Получаемый фрагмент ДНК 2700 п.о. связывали с вектором, полученным расщеплением pDual-H1N1/HA1-gp64 посредством ферментов рестрикции RsrII и DraIII, для конструирования pCP-H1N1/HA1-gp64.
(13) Конструирование вектора для переноса pCAP-H1N1/HA1-gp64 согласно настоящему изобретению
Для конструирования плазмиды pCAP-H1N1/HA1-gp64 в вектор, получаемый расщеплением pTriEx-1.1 (предоставляемой из Novagen) посредством ферментов рестрикции RsrII и DraIII, вставляли НА1, получаемый расщеплением pCP-H1N1/HA1-gp64 ферментами рестрикции RsrII и DraIII, и фрагмент гена gp64.
(14) Конструирование вектора для переноса pCU-H1N1/HA1-gp64 согласно настоящему изобретению
Проводили PCR с использованием pTriEx3.1 в качестве образца, применяя CMVenh-f Fsel (5'-GGGGGCCGGCCCTAGTTATTAATAGTAATCAATTAC-3': SEQ ID №:27) (участок Fsel представлен подчеркиванием) и CMVenh-r KpnI (5'-GGGGGTACCCATGGTAATAGCGATGACTAATACG-S': SEQ ID №:28) (участок KpnI представлен подчеркиванием) для амплификации участка энхансера CMV. Кроме того, проводили PCR с использованием геномной ДНК человека в качестве образца, применяя UBBp-f KpnI (5'-GGGGGTACCTCGAGGAAGGTTTCTTCAACTC-3': SEQ ID №:29) (участок KpnI представлен подчеркиванием) и UBBp-r RsrII (5'-GGGCGGTCCGGACCTAGTTTAAAAGTAAAACATAAG-3': SEQ ID №:30) (участок RsrII представлен подчеркиванием) для амплификации промоторного участка UBB. Полученные два фрагмента связывали с вектором, получаемым посредством расщепления pCP-H1N1/HA1-gp64 ферментами рестрикции FseI и RsrII, для конструирования pCU-H1N1/HA1-gp64.
(15) Конструирование вектора для переноса pDual-H1N1/NP-gp64 согласно настоящему изобретению
Проводили RT-PCR с использованием в качестве образца геномной РНК из штамма вируса гриппа PR/8/34, применяя NP-f EcoRI (5'-ACGGAATTCCATTCAATTCAAACTGGA-3': SEQ ID №:31 (участок EcoRI представлен подчеркиванием) и NP-r Cfr9I (5'-GATCCCGGGCCTTGTCAATGCTGAATGGCAA-3': SEQ ID №:32) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент расщепляли ферментами рестрикции EcoRI и Cfr9I и вставляли в pDual-H1N1/HA1-gp64, расщепленную ферментами рестрикции EcoRI и Cfr9I, для получения pDual-H1N1/NP-gp64.
(16) Конструирование вектора для переноса pDual-H1N1/M2-gp64 согласно настоящему изобретению
Проводили RT-PCR с использованием в качестве образца геномной РНК из штамма вируса гриппа PR/8/34, применяя M2-f EcoRI (5'-CGGAATTCATGAGTCTTCTAACCGAGG-3': SEQ ID №:33) (участок EcoRI представлен подчеркиванием) и М2-r Cfr9I (5'-GATCCCGGGCCTCCAGCTCTATGCTGAC-3': SEQ ID №:34) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент расщепляли ферментами рестрикции EcoRI и Cfr9I и вставляли в pDual-H1N1/HA1-gp64, расщепленную ферментами рестрикции EcoRI и Cfr9I, для получения pDual-H1N1/M2-gp64.
(17) Конструирование вектора для переноса pDual-H1N1/NAe-gp64 согласно настоящему изобретению
Проводили RT-PCR с использованием в качестве образца геномной РНК из штамма вируса гриппа PR/8/34, применяя NAe-f EcoRI (5'-ACGGAATTCCATTCAATTCAAACTGGA-3': SEQ ID №:35) (участок EcoRI представлен подчеркиванием) и NAe-r Cfr9I (5'-GATCCCGGGCCTTGTCAATGCTGAATGGCAA-3': SEQ ID №:36) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент расщепляли ферментами рестрикции EcoRI и Cfr9I и вставляли в pDual-H1N1/HA1-gp64, расщепленную ферментами рестрикции EcoRI и Cfr9I, для получения pDual-H1N1/NAe-gp64.
(18) Конструирование вектора для переноса pDual-M2e-gp64 согласно настоящему изобретению
Проводили PCR с использованием pDual-H1N1/M2-gp64 в качестве образца, применяя M2-f EcoRI (5'-CGGAATTCATGAGTCTTCTAACCGAGG-3': SEQ ID №:37) (участок EcoRI представлен подчеркиванием) и М2е-r Cfr9I (5'-GATCCCGGGCATCACTTGAACCGTTGCA-3': SEQ ID №:38) (участок Cfr9I представлен подчеркиванием). Получаемый фрагмент расщепляли ферментами рестрикции EcoRI и Cfr9I и вставляли в pDual-H1N1/HA1-gp64, расщепленную ферментами рестрикции EcoRI и Cfr9I, для получения pDual-M2e-gp64.
(19) Конструирование вектора для переноса pCP-HA1/NC99-gp64 согласно настоящему изобретению
Выделяли РНК из замороженного исходного источника вируса гриппа NewCaledonia/20/99 (NC99) с использованием набора QIAamp MiniElute Virus Spin (QIAGEN) и проводили RT-PCR с применением праймеров HA1-f EcoRI (5'-GATGAATTCGACACAATATGTATAGGCTACC-3': SEQ ID №:39) (участок EcoRI представлен подчеркиванием) и HA1-r Cfr9I (NC99) (5'-GATCCCGGGCTCTGGATTGAATGGATGGGATG-3': SEQ ID №:40) (участок Cfr9I представлен подчеркиванием) для амплификации фрагмента гена НА1. Получаемый фрагмент и рСР-H1N1/HA1-gp64 обрабатывали ферментами рестрикции EcoRI и Cfr9I для того, чтобы заново вставить получаемый из NC99 фрагмент гена НА1 в участок для введения НА1 в pCP-H1N1/HA1-gp64. Полученную плазмиду обозначали как pCP-HA1/NC99-gp64.
(20) Конструирование вектора для переноса pCP-H1N1/HA0-gp64 согласно настоящему изобретению
Проводили PCR с использованием pCR-Blunt-HA в качестве образца, применяя HA0-f EcoRI (5'-GGGGAATTCATGAAGGCAAACCTACTGG-3': SEQ ID №:41) (участок EcoRI представлен подчеркиванием) и НА2-r Cfr9I (5'-GATCCCGGGCGATGCATATTCTGCA-3': SEQ ID №:42) (участок Cfr9I представлен подчеркиванием) для амплификации полноразмерного гена НА. Получаемый фрагмент и pCP-H1N1/HA1-gp64 обрабатывали ферментами рестрикции EcoRI и Cfr9I, чтобы заново вставить фрагмент гена НА0 в участок для введения НА1 в pCP-H1N1/HA1-gp64. Полученную плазмиду обозначали как pCP-H1N1/HA0-gp64.
(21) Конструирование вектора для переноса pCP-H1N1/HA2-gp64 согласно настоящему изобретению
Проводили PCR с использованием pCR-Blunt-HA в качестве образца, применяя HA2-f EcoRI (5'-GATGAATTCATATTTGGAGCCATTGCCG-3': SEQ ID №:43) (участок EcoRI представлен подчеркиванием) и НА2-r Cfr9I (5'-GATCCCGGGCGATGCATATTCTGCA-3': SEQ ID №:44) (участок Cfr9I представлен подчеркиванием) для амплификации участка НА2 гена НА. Получаемый фрагмент и pCP-H1N1/HA1-gp64 обрабатывали ферментами рестрикции EcoRI и Cfr9I, чтобы заново вставить фрагмент гена НА2 в участок для введения НА1 в pCP-H1N1/HA1-gp64. Полученную плазмиду обозначали как pCP-H1N1/HA2-gp64.
(22) Конструирование вектора для переноса pCP-H1N1/HA1-vp39 согласно настоящему изобретению
Проводили PCR с использованием в качестве образца бакуловирусной ДНК, предоставленной в наборе для трансфекции BacVector-2000 (Novagen), применяя vp39-f (5'-CTTACTAGTATGGACTACAAGGACGACGATGACAAGGAATTCGGCGGCGGCGGCTCGGCGCTAGTGCCCGTGGGT-3': SEQ ID №:45) (участок SpeI представлен подчеркиванием, а участок EcoRI представлен двойным подчеркиванием) и vp39-r (5'-CTTCACTTAGTGATGGTGATGATGGTGGTGCCCGGGGCTTTAAAGCTTGACGGCTATTCCTCCACC-3': SEQ ID №:46) (участок DraIII представлен подчеркиванием, а участок SmaI представлен двойным подчеркиванием) для амплификации участка гена vp39. Амплифицированный фрагмент и pDual-H1N1/HA1-gp64 расщепляли ферментами рестрикции SpeI и DraIII и лигировали друг с другом для конструирования pDual-vp39. Кроме того, проводили PCR с использованием в качестве образца pDual-H1N1/HA1-gp64, применяя Polh-Sl (5'-GCTAACCATGTTCATGCC-3': SEQ ID №:47) и HA1-r EcoRI (5'-GGGGAATTCACCTCTGGATTGGATGGAC-3': SEQ ID №:48) (участок EcoRI представлен подчеркиванием). Получаемый фрагмент расщепляли посредством EcoRI для получения гена НА1. Полученный фрагмент вставляли в pDual-vp39, расщепленный посредством EcoRI, для конструирования pCP-H1N1/HA1-vp39.
(23) Конструирование вектора для переноса pCP-H1N1/NP-vp39 согласно настоящему изобретению
Проводили PCR с использованием pDual-H1N1/NP-gp64 в качестве образца, применяя f5 EcoRI EcoRI (5'-ACGGAATTCATGGCGTCCCAAGGCACC-3': SEQ ID №:49) (участок EcoRI представлен подчеркиванием) и NP-r EcoRI (5'-ACGGAATTCATTGTCGTACTCCTCTGCATTG-3': SEQ ID №:50) (участок EcoRI представлен подчеркиванием). Получаемый фрагмент расщепляли посредством EcoRI. Полученный фрагмент вставляли в pDual-vp39, расщепленный посредством EcoRI, для конструирования pCP-H1N1/NP-vp39.
[Справочный пример 1] Конструирование pBACgus-CMV-PbCSP
(1.1) Конструирование pcDNA-GL3 (luc)
Расщепляли pCL3-энхансер (Promega) ферментами рестрикции HindIII/XbaI, лигировали фрагмент ДНК гена люциферазы (приблизительно 1690 п.о.) в участки HindIII/XbaI в pcDNA3.1 (предоставляемой из Invitrogen), а получаемую плазмиду обозначали как pcDNA-GL3(luc).
(1.2) Конструкт pBACgus-CMV-IgHsp65
pcDNA-IgHsp65 расщепляли посредством Bg2II/SphI и в участки BglII/SphI в pBACgus-1 (Novagen) вставляли кассету гена (приблизительно 2850 п.о.), состоящую из промотора CMV, гена Hsp65, несущего сигнальную последовательность для Igk мыши, и сигнальную поли(А)-последовательность, полученную из гормона роста быка. Сконструированную плазмиду обозначали как pBACgus-CMV-IgHsp65.
(1.3) Конструирование pBACgus-CMV-GL3
Полученную, как указано выше, плазмиду pcDNA-GL3(luc) расщепляли ферментами рестрикции NheI/XbaI, вставляли фрагмент ДНК гена люциферазы (приблизительно 1690 п.о.) в участки NheI/XbaI плазмиды pBACgus-CMV-IgHsp65, а получаемую плазмиду обозначали как pBACgus-CMV-GL3.
(1.4) Конструирование pBACgus-CMV-PbCSP
Получали фрагмент гена, кодирующий аминокислотную последовательность, которая соответствует положениям 21-305 в пептиде PbCSP, посредством расщепления плазмиды pBACsurf-CSP ферментами рестрикции PstI и SmaI, фрагмент ДНК (приблизительно 858 п.о.) вставляли в участки PstI и SmaI в pBACgus-CMV-GL3, полученной, как указано выше, а получаемую плазмиду обозначали как pBACgus-CMV-PbCSP.
(1.5) Конструирование pBACgus-CMV-HA-full
Расщепляли pCR-Blunt-HA посредством BamHI/Sse8387I и вставляли фрагмент ДНК гена НА (приблизительно 1750 п.о.) в участок BamHI/PstI в pBluescript II (KS-) для конструирования плазмиды pBluescript-HA.
Кроме того, расщепляли pBluescript-HA посредством HindiII/XbaI и вставляли фрагмент ДНК гена НА (приблизительно 1800 п.о.) в участки HindIII/XbaI в pBACgus-CMV-GL3, полученной в (1.3), для конструирования плазмиды pBACgus-CMV-HA-full.
[Пример 2] Рекомбинантный бакуловирус и способ его получения согласно настоящему изобретению


Клетки Sf-9 культивировали таким образом, чтобы получить 2×107 клеток на культуральный планшет 150 мм (Sumilon, предоставляемый из Akita Sumitomo Bakelite Co., Ltd.), и каждый описанный выше бакуловирус инфицировали при множественности инфицирования, составляющей приблизительно 5. Через 5-6 суток среду центрифугировали при 10000×g в течение 25 минут при 4°С для получения супернатанта, который затем центрифугировали с использованием ультрацентрифуги Beckman (плавающий ротор SW28) при 25000 об./минута в течение 90 минут при 4°С для получения вирусных частиц.
(2) Рекомбинантный бакуловирус можно получать с использованием набора (набор для трансфекции BacVector-2000, предоставляемый из Novagen) для получения рекомбинантного бакуловируса, применяя совместную трансфекцию клеток Sf-9 посредством ДНК из BacVector-2000 вместе с каждым из векторов для переноса: pDual-H5N1/HA1-gp64 и pDual-SARS/S-gp64, сконструированных в указанном выше примере 1. Подлежащие получению рекомбинантные бакуловирусы обозначают как AcNPV-Dual-HSNi/HA1 и AcNPV-Dual-SARS/S, соответственно.
Клетки Sf-9 культивировали таким образом, чтобы получить 2×107 клеток на культуральный планшет 150 мм (Sumilon, предоставляемый из Akita Sumitomo Bakelite Co., Ltd.), и каждый описанный выше бакуловирус инфицировали при множественности инфицирования, составляющей приблизительно 5. Через 5-6 суток среду центрифугировали при 10000×g в течение 25 минут при 4°С для получения супернатанта, который затем центрифугировали с использованием ультрацентрифуги Beckman (плавающий ротор SW28) при 25000 об/мин в течение 90 минут при 4°С для получения вирусных частиц.
[Пример 3] Тестирование фармакологического эффекта рекомбинантного бакуловируса согласно настоящему изобретению
(Тестирование фармакологического эффекта как вакцины против малярии)
(Тест на предмет предотвращения малярийной инфекции)
3. Экспериментальные способы
3.1 Вакцинация
Иммунизировали самку мыши BALB/c раствором рекомбинантного вируса для вакцины три раза с трехнедельными интервалами. В случае инъекции в бедренную мышцу количество составляло 0,2 мл/организм, а раствор вируса получали таким образом, чтобы количество вируса составляло 5×106 бляшкообразующих единиц/организм.
3.2 Инфицирование мышей малярией
Через 3 недели после третьей вакцинации мышей в каждой группе обезболивали раствором для обезболивания мышей и инфицировали малярией посредством осуществления укуса мышей видом Anopheles stephensi SDA 500, инфицированным клоном Plasmodium berghei ANKA 2.34.
3.3 Расчет уровня выживаемости мышей в каждой группе
После инфицирования малярией подсчитывали в каждой группе смертные случаи и вычисляли уровень выживаемости мышей в каждой группе.
3.4 В случае профилактического эффекта в отношении малярийной инфекции для фармацевтической композиции согласно настоящему изобретению, рассматриваемой в качестве вакцины, результаты тестирования фармакологического эффекта представлены в таблице 1. Уровень выживаемости в каждой группе представлен в правых столбцах таблицы 1.
Как представлено в таблице 1, все мыши, у которых в периферической крови были выявлены инфицированные малярией эритроциты, погибли в течение 38 суток после инфицирования. В случае рекомбинантного вируса, в который на стадии спорозоита был вставлен ген антигена (CSP), наблюдали 100% эффект предотвращения инфекции для группы (группа №4), которую внутримышечно иммунизировали рекомбинантным бакуловирусом (пример 1 (2)), содержащим вектор для переноса: AcNPV-Dual-PbCSP, полученный в примере 2.
Для бакуловируса дикого типа (группа №2) отличий от контрольной группы (группа №1) не наблюдали. Для группы (группа №3), в которую был включен рекомбинантный бакуловирус, полученный в примере 2 с использованием промотора млекопитающих (AcNPV-CMV-PbCSP, в том числе вектор из справочного примера 1), наблюдали незначительно более высокий уровень выживаемости в сравнении с контрольной группой, что позволяет предположить вероятность проявления эффекта иммунизации вирусом, хотя эффект был слабым.
[Пример 4] Тестирование фармакологического эффекта рекомбинантного бакуловируса согласно настоящему изобретению
(Тестирование фармакологического эффекта как вакцины против вируса гриппа)
(Тест на предмет предотвращения инфицирования вирусом гриппа)
4. Экспериментальные способы
4.1 Вакцина
Иммунизировали раствором вируса для вакцины два раза с двухнедельными интервалами. Вакцину из вируса вводили инъекцией в бедренную мышцу при 106'5 бляшкообразующих единиц на мышь с использованием шприца для инъекции инсулина 29G.
4.2 Получение раствора вируса для иммунизации
Хранящийся вирусный раствор штамма вируса гриппа A/PR/8/34 размораживали при комнатной температуре самопроизвольным образом в сутки проведения инфицирования вирусом гриппа. Для получения раствора вируса для иммунизации разводили размороженный хранящийся раствор вируса до 1000 TCID50/0,05 мл для инфицирования нижних дыхательных путей и до 1000 TCID50/0,005 мл для инфицирования верхних дыхательных путей, используя забуференный фосфатом физиологический раствор Дульбекко: (D-PBS), содержащий стерильный 0.1% BSA: бычий сывороточный альбумин.
4.3 Интраназальная иммунизация раствором вируса
Через две недели после второй вакцинации мышей обезболивали внутримышечным введением 0,05 мл обезболивающего раствора для мышей. Полученный в 4.2 раствор вируса гриппа вводили мышам в нос в объеме 0,005 мл для инфицирования верхних дыхательных путей или 0,05 мл для инфицирования нижних дыхательных путей.
4.4 Получение образца легких
Через трое суток после вакцинации каждой из 4 мышей в каждой группе внутримышечно вводили 0,1 мл раствора для обезболивания мышей и умерщвляли посредством выпуска крови из брюшной аорты при обезболивании. После этого мышей вскрывали и в стерильных условиях извлекали легкие.
4.5 Регистрация уровня выживаемости мышей после иммунизации вирусом гриппа
Уровень выживаемости мышей удостоверяли и регистрировали раз в сутки в течение 11 суток после иммунизации вирусом гриппа.
4.6 Получение гомогената легких и разведение раствора
Гомогенат легких получали добавлением 3 мл 0,1% BSA, 10 мМ HEPES, минимальной эссенциальной среды (MEM, GIBCO), содержащей антибиотики, и гомогенизацией с использованием гомогенизатора Polytron. Гомогенат легких распределяли по криопробиркам и хранили в морозильной камере для сверхнизких температур.
Проводили последовательные 10-кратные или 100,5-кратные разведения с использованием среды MEM, в которую были добавлены указанные выше антибиотики и трипсин (SIGMA, Т-4549, 2 мкг/мл).
4.7 Получение среды для роста клеток
Среду для роста клеток (MEM + 10% FBS) получали добавлением 50 мл эмбриональной бычьей сыворотки: FBS к 500 мл MEM и хранили в холодильном устройстве до использования.
4.8 Культивирование MDCK (клеток почки собаки Madin-Darby), полученных из почки собаки
Замороженные и хранящиеся клетки MDCK быстро размораживали в нагретой воде, затем суспендировали в 10 мл среды для роста клеток, а супернатант удаляли центрифугированием (1000 об/мин, 5 минут, 4°С). Полученный центрифугированием осадок клеток суспендировали в среде для роста клеток. Клетки высевали в культуральный флакон и культивировали в инкубаторе при 5% СО2 при 37°С. После начала культивирования наблюдали с использованием микроскопа морфологию и рост клеток, а непосредственно перед достижением смыкания монослоя клеток MDCK промывали клетки посредством D-PBS(-), обрабатывали клетки трипсином + EDTA для рассредоточения и суспендировали клетки в среде для клеточного роста. Суспензию клеток высевали в культуральный флакон, а для проведения пересева клеток добавляли свежую среду для клеточного роста.
4.9 Получение среды для роста вируса (поддерживающая среда)
Среду, в которой BSA в концентрации 0,1% был добавлен к 500 мл MEM (с добавлением 10 мМ буфера HEPES), использовали в качестве среды для роста вируса (MEM + 0,1% BSA) и после получения хранили в холодильном устройстве до использования. При использовании добавляли антибиотики.
4.10 Измерение титра инфекционности вируса (цитопатический эффект, способ СРЕ)
Непосредственно перед достижением клетками MDCK в культуральном флаконе смыкания монослоя проводили обработку клеток трипсином + EDTA для рассредоточения клеток, подсчитывали количество клеток и получали суспензию клеток MDCK при 6×105клеток/мл с использованием поддерживающей среды. Суспензию распределяли по 0,05 мл в каждую лунку 96-луночного планшета и культивировали в течение ночи в инкубаторе CO2 при 5% CO2 при 37°С.
На следующие сутки удостоверялись, что клетки прикрепились, и распределяли по 0,05 мл каждого полученного ранее разведения гомогената легких в каждую лунку для 6 лунок в 96-луночном планшете, а затем культивировали в течение 3 суток в инкубаторе CO2 при 5% CO2 при 37°С.
На 3-и сутки культивирования удостоверялись, что клетки в лунке разрушены, после этого для фиксации и окрашивания клеток в каждую лунку 96-луночного планшета добавляли по 0,05 мл 30% раствора кристаллического фиолетового, содержащего формалин, и с использованием способа Рида-Менча рассчитывали титр инфекционности вируса в легких.
4.11 Эффекты каждой группы вакцин на титр инфекционности вируса in vivo у мыши
Сравнивали титры инфекционности в гомогенатах легких мышей в контрольной группе (иммунизируемой посредством AcNPV-WT) и в тестируемых группах (иммунизируемых посредством рекомбинантного бакуловируса [включая вектор для переноса: AcNPV-Dual-H1N1/HA1, получаемый в примере 1(3)] и посредством рекомбинантного бакуловируса [содержащего вектор: AcNPV-CMV-H1N1/HA-full, получаемый в справочном примере 1]). Каждую величину титра инфекционности вируса подвергали логарифмическому преобразованию. Терапевтический эффект для групп анализировали тестом Tukey (выпуск 8.1, SAS Institute Japan Ltd), принимая во внимание его многозначность.
Результаты представлены на фиг.1.
Эффект каждой вакцины на период выживаемости после инфицирования вирусом гриппа
Периоды выживаемости в контрольной группе (иммунизируемой посредством AcNPV-WT) и группах вакцин (в которых иммунизируют посредством AcNPV-Dual-H1N1/HA1 или AcNPV-CMV-H1N1/HA-full) сравнивали с использованием логарифмического рангового критерия а результаты представлены на фиг.2.
Статистический анализ проводили с использованием системы SAS (SAS Institute Japan, R.8.1). Уровень значимости составлял 5%. 4.12 Титр инфекционности вируса в легких
В группе, в которой внутримышечно иммунизировали посредством AcNPV-Dual-H1N1/HA1, титр инфекционности вируса в легких на 6 сутки после инфицирования был значимо подавлен (р=0,0009) в сравнении с контрольной группой (иммунизируемой посредством AcNPV-WT). При этом в группе, в которой внутримышечно иммунизировали посредством AcNPV-Dual-H1N1/HA1, титр инфекционности вируса в легких на 6 сутки после инфицирования был значимо подавлен (р=0,0094) в сравнении с группой, в которой иммунизировали посредством AcNPV-CMV-H1N1/HA-full.
4.13 Период выживаемости
В группе, в которой внутримышечно иммунизировали посредством AcNPV-Dual-H1N1/HA1, период выживаемости был значимо более продолжительным (р=0,0031) в сравнении с контрольной группой (иммунизируемой посредством AcNPV-WT). При этом период выживаемости в группе, в которой иммунизировали посредством AcNPV-CMV-H1N1/HA-full, значимо не отличался (р=0,7851) от такового в контрольной группе (иммунизируемой посредством AcNPV-WT). В группе, в которой внутримышечно иммунизировали посредством AcNPV-Dual-H1N1/HA1, период выживаемости был значимо более продолжительным (р=0,0031) в сравнении с группой, в которой иммунизировали посредством AcNPV-CMV-H1N1/HA-full.
В этой оценочной системе вирус гриппа вызывает у мыши воспаление легких, и она погибает. Таким образом, можно предположить, что внутримышечная иммунизация посредством AcNPV-Dual-H1N1/HA1 ингибировала рост вируса в легких, снижая смертность мышей от воспаления легких.
[Пример 5] Тестирование экспрессии в клетках насекомых антигена вакцины из рекомбинантного бакуловируса согласно настоящему изобретению
Клетки Sf-9 культивировали в 12-луночном планшете при 3×106клеток в лунке, и инфицировали бакуловирусными частицами из AcNPV-Dual-PbCSP, AcNPV-Dual-Hsp65 или AcNPV-Dual-H1N1/HA1, полученными в примере 2, или бакуловирусом дикого типа, AcNPV-WT, в качестве контроля при множественности инфицирования, составляющей приблизительно 5. Через 3-4 суток удаляли супернатант культуры, планшет трижды промывали посредством PBS, а затем для полного лизиса клеток в каждую лунку добавляли 0,2 мл раствора Leamuli (Tris-гидрохлорид рН 6,8, 2% SDS, 10% глицерин, 0,1% бромфеноловый синий), содержащего 2% 2-меркаптоэтанол. Образец кипятили в течение 5 минут при 95°С и подвергали электрофорезу в SDS-PAGE. После электрофореза белок переносили на мембрану PVDF (Immobilon-P, предоставляемую из Millipore) и проводили блокирование посредством погружения мембраны в Block Асе (предоставляемый из Dai Nippon Pharmaceutical Co., Ltd.) в течение 12 часов при 4°С. Вестерн-блоттинг проводили следующим способом. Мембраны, на которые были перенесены белки из клеток Sf-9, инфицированных каждым бакуловирусом, инкубировали с моноклональным антителом мыши против FLAG (предоставляемым из Sigma) в качестве первичного антитела, а затем инкубировали с меченным биотином козьим антителом против IgG (H+L) мыши в качестве вторичного антитела (предоставляемого из Vector). После этого добавляли меченную авидином щелочную фосфатазу (предоставляемую из GIBCO-BRL) и получали окраску с использованием NBT/BCIP (предоставляемого из GIBCO-BRL) для выявления полос белка.
Результаты представлены на фиг.3.
На фиг.3 представлен анализ посредством Вестерн-блоттинга, в котором показана экспрессия слитого антигена из гена НА вируса гриппа, гена Hsp65 M.tuberculosis и гена CSP малярийного паразита из рекомбинантного вектора для переноса в рекомбинантном бакуловирусе в клетках насекомых. На фигуре на дорожке 1 представлены полосы для бакуловируса дикого типа (AcNPV-WT), на дорожке 2 представлены полосы для рекомбинантного бакуловируса (AcNPV-Dual-H1N1/HA1), в котором ген НА вируса гриппа был вставлен под управление сдвоенного промотора согласно настоящему изобретению, на дорожке 3 представлены полосы для бакуловируса дикого типа (AcNPV-WT), на дорожке 4 представлены полосы для рекомбинантного бакуловируса (AcNPV-Dual-Hsp65), в котором ген Hsp65 M.tuberculosis был вставлен под управление сдвоенного промотора согласно настоящему изобретению, на дорожке 5 представлены полосы для бакуловируса дикого типа (AcNPV-WT), a на дорожке 6 представлены полосы для рекомбинантного бакуловируса (AcNPV-Dual-PbCSP), в котором ген CSP малярийного паразита был вставлен под управление сдвоенного промотора согласно настоящему изобретению.
Как представлено на фигуре на дорожках 2, 4 и 6, полосу, соответствующую экспрессируемому слитому продукту иммуногенного чужеродного гена антигена и гена gp64, наблюдают для рекомбинантного бакуловируса, в котором каждый ген антигена и ген gp64 были слиты и экспрессировались под управлением сдвоенного промотора согласно настоящему изобретению.
На основании этого было установлено, что можно осуществлять слияние и экспрессию в клетках насекомых иммуногенного чужеродного гена антигена и гена gp64.
[Пример 6] Тестирование экспрессии в млекопитающих антигена вакцины из рекомбинантного бакуловируса согласно настоящему изобретению
Инфицировали клетки HepG2 посредством AcNPV-Dual-Hsp65 или
AcNPV-WT в качестве контроля при множественности инфицирования, составляющей приблизительно 1. Через 24 часа удаляли супернатант культуры, планшет трижды промывали посредством PBS, а затем добавляли охлажденный при -20°С раствор ацетон:этанол (7:3) для фиксации клеток в течение 5 минут при -20°С. Блокирование проводили при комнатной температуре посредством добавления 5% обычной козьей сыворотки (предоставляемой из Sigma). После этого добавляли антитело мыши против Hsp65 (Yoshida et al., Vaccine 2005) в качестве первичного антитела, а затем меченное FITC козье антитело против IgG (H+L) (BIOSOURCE) мыши и инкубировали. Прореагировавшие клетки выявляли с использованием флуоресцентного микроскопа.
Также культивировали клетки HepG2 при 1×107 клеток на планшет для культивирования клеток 100 мм и инфицировали посредством бакуловирусных частиц AcNPV-Dual-H1N1/HA1 или AcNPV-CMV-H1N1/HA-full, или AcNPV-WT в качестве контроля при множественности инфицирования, составляющей приблизительно 5. Через 2 часа удаляли супернатант культуры, планшет трижды промывали посредством PBS, а затем клетки культивировали в течение 3 часов в среде, не содержащей метионин и цистеин (среда, в которой к модифицированной по способу Дульбекко среде Игла (Invitrogen) был добавлен 10% FBS, диализированный против PBS). Добавляли раствор меченных изотопом метионина и цистеина (TRANS35S-LABEL MP Biomedicals, Inc.) в конечной концентрации 5 мкКи/мл. Через 12 часов удаляли супернатант культуры, планшет трижды промывали посредством PBS, а затем для получения образца лизировали клетки с использованием 0,5 мл буфера RIPA (1% дезоксихолат натрия, 1% Triton X-100, 0,1% SDS, 10 мМ Tris-HCl [pH 7,5]). Образец добавляли к носителю белок А-сефароза CL-4B (Pharmacia), на который предварительно была абсорбирована сыворотка от мыши, инфицированной вирусом гриппа, и инкубировали во льду в течение 2 часов. Носитель 5 раз промывали буфером RIPA, добавляли раствор Leamuli, содержащий 2% 2-меркаптоэтанол, образец кипятили в течение 5 минут при 95°С и подвергали электрофорезу в 6% SDS-PAGE. После электрофореза гель сушили, а белок, прореагировавший с антителом, регистрировали посредством авторадиографии.
Результаты представлены на фиг.4 и 5.
На фиг.4(А) представлены клетки, окрашенные с использованием меченного флуоресцентной меткой антитела, показывая экспрессию гена Hsp65 M.tuberculosis в рекомбинантном бакуловирусе в клетках HepG2.
На фиг.4(В) представлен случай, в котором к клеткам HepG2 добавляли бакуловирус дикого типа.
Как очевидно из фигуры (А), открыто, что рекомбинантный бакуловирус при использовании вектора для переноса со сдвоенным промотором согласно настоящему изобретению может экспрессировать заданный антиген в клетках млекопитающих.
Это позволяет предположить, что при введении млекопитающему, в том числе человеку, рекомбинантный бакуловирус, получаемый из рекомбинантного вектора для переноса согласно настоящему изобретению, встраивается в клетки млекопитающих, промотор млекопитающих функционирует, а ген заданного чужеродного антигена и ген gp64 оказываются слитыми в клетках млекопитающих, индуцируя приобретенный иммунитет.
На фиг.5 представлен иммунопреципитационный анализ экспрессии в клетках млекопитающих слитого антигена в рекомбинантном бакуловирусе, в котором ген антигена НА вируса гриппа был встроен под управление сдвоенного промотора. На фигуре на дорожке 1 представлен бакуловирус дикого типа (AcNPV-WT), на дорожке 2 представлен рекомбинантный бакуловирус (AcNPV-CMV-H1N1/HA-full), в котором ген антигена НА вируса гриппа был встроен под управление промотора CMV, а на дорожке 3 представлен рекомбинантный бакуловирус (AcNPV-Dual-H1N1/HA1), в котором ген антигена НА вируса гриппа был встроен для слияния с геном gp64 и экспрессии под управлением сдвоенного промотора.
В случае рекомбинантного бакуловируса AcNPV-CMV-H1N1/HA-full), в котором ген антигена НА вируса гриппа был встроен под управление промотора CMV, и рекомбинантного бакуловируса (AcNPV-Dual-H1N1/HA1), в котором ген антигена НА вируса гриппа был встроен для слияния с геном gp64 и экспрессии под управлением сдвоенного промотора, является очевидным, что белок, специфически реагирующий с инфицированной вирусом гриппа сывороткой, т.е. белок, содержащий антиген НА, был заново синтезирован в клетках HepG2.
На основании этого предполагают, что рекомбинантный бакуловирус согласно настоящему изобретению даже в клетках млекопитающих экспрессирует антигенный белок, кодируемый геном желаемого иммуногенного чужеродного антигена, и что при введении рекомбинантного вируса млекопитающим, в том числе человеку, в результате экспрессии слитого антигена в клетках человека может быть индуцирован специфичный в отношении антигена приобретенный иммунитет.
[Пример 7] Тест на выявление слитого антигена в антигене вакцины, презентируемом на вирусной частице (вирионе) рекомбинантного бакуловируса согласно настоящему изобретению
Добавляли 0,005 мл раствора Leamuli (2х) к 0,005 мл раствора получаемых ультрацентрифугированием бакуловирусных частиц AcNPV-WT, AcNPV-CMV-PbCSP, AcNPV-PbCSPsurf или AcNPV-Dual-PbCSP для каждой концентрации вируса, а затем полученное кипятили в течение 5 минут при 95°С и подвергали электрофорезу в 6% SDS-PAGE. После электрофореза белки переносили на мембрану PVDF (Immobilon-P, предоставляемую из Millipore) и проводили блокирование посредством погружения мембраны в Block Асе (предоставляемый из Dai Nippon Pharmaceutical Co., Ltd.) в течение 12 часов при 4°С. Вестерн-блоттинг проводили следующим способом. Мембрану, на которую были перенесены белки вирусных частиц, инкубировали с моноклональным антителом мыши против FLAG (предоставляемым из Sigma) в качестве первичного антитела, а затем инкубировали с меченным биотином козьим антителом против IgG (H+L) мыши в качестве вторичного антитела (предоставляемого из Vector). После этого добавляли меченную авидином щелочную фосфатазу (предоставляемую из GIBCO-BRL) и получали окраску с использованием NBT/BCIP (предоставляемого из GIBCO-BRL) для выявления полос белка.
Результаты представлены на фиг.6.
На фиг.6 представлен анализ посредством Вестерн-блоттинга, в котором показана экспрессия гена CSP малярии (PbCSP) в вирусных частицах рекомбинантного бакуловируса, полученного из рекомбинантного вектора для переноса. На фигуре на дорожке 1 представлен бакуловирус дикого типа, на дорожке 2 представлен рекомбинантный бакуловирус, полученный из вектора для переноса, в котором ген антигена PbCSP был вставлен под управление промотора млекопитающих, на дорожке 3 представлен рекомбинантный бакуловирус, полученный из вектора для переноса, в котором ген антигена PbCSP был вставлен для слияния с геном gp64 и экспрессии под контролем бакуловирусного промотора полиэдрина, а на дорожке 4 представлен рекомбинантный бакуловирус, полученный из вектора для переноса, в котором ген антигена PbCSP был вставлен для слияния с геном gp64 и экспрессии под контролем сдвоенного промотора. Бакуловирусы подвергали электрофорезу и выявляли продукт экспрессии слитых гена PbCSP и гена gp64.
Как представлено на дорожках 3 и 4, в случае AcNPV-PbCSPsurf и AcNPV-Dual-PbCSP для рекомбинантных вирусных частиц выявляли сильно выраженную полосу, указывающую на наличие слитого антигена.
Таким образом, из примера 7 было открыто, что в случае рекомбинантного бакуловируса, получаемого из рекомбинантного вектора для переноса согласно настоящему изобретению, в рекомбинантных вирусных частицах может присутствовать продукт экспрессии гена gp64, слитого с желаемым иммуногенным чужеродным геном.
Пример 8: устойчивая экспрессия гена в результате замены промотора
1) Устойчивая экспрессия гена в результате замены промотора Для выявления того, поддерживает ли рекомбинантный вирус экспрессию антигена в культивируемых клетках, клетки HeLa инфицировали посредством AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1 или AcNPV-CU-H1N1/HA1 и выявляли экспрессию антигена. Клетки высевали на 24-луночный планшет при 1,0×104 клеток/лунка, а затем инфицировали вирусом при множественности инфицирования = 10, 20, 100, воздействуя в течение одного часа. Затем вирус удаляли из супернатанта клеточной культуры, а клетки культивировали в инкубаторе. Клетки собирали с течением времени и выделяли РНК. Проводили RT-PCR с использованием выделенной РНК в качестве образца, применяя праймер HA1_F01 (5'-GAGCTGAGGGAGCAATTGAG-3' (последовательность: SEQ ID №:51) и праймер НА1_R01 (5'-GGGTGATGAATACCCCACAG-3' (последовательность: SEQ ID №:52). Амплифицируемую ДНК анализировали электрофорезом.
В результате экспрессию выявили для всех трех типов, подтвердив, что промотор CMV может быть заменен другим эукариотическим промотором в отношении рекомбинантного бакуловируса согласно настоящему изобретению.
На фиг.7 представлены результаты регистрации посредством RT-PCR экспрессии гена в клетках HeLa. М представляет собой ДНК-маркеры для электрофореза. Образцы являются следующими:
1. РНК из клеток, инфицированных вирусом дикого типа при множественности инфицирования = 10;
2. РНК из клеток, инфицированных вирусом дикого типа при множественности инфицирования = 20;
3. РНК из клеток, инфицированных вирусом дикого типа при множественности инфицирования = 100;
4. РНК из клеток, инфицированных посредством AcNPV-CP-H1N1/HA1 при множественности инфицирования = 10;
5. РНК из клеток, инфицированных посредством AcNPV-CP-H1N1/HA1 при множественности инфицирования = 20;
6. РНК из клеток, инфицированных посредством AcNPV-CP-H1N1/HA1 при множественности инфицирования = 100;
7. РНК из клеток, инфицированных посредством AcNPV-CU-H1N1/HA1 при множественности инфицирования = 10;
8. РНК из клеток, инфицированных посредством AcNPV-CU-H1N1/HA1 при множественности инфицирования = 20;
9. РНК из клеток, инфицированных посредством AcNPV-CU-H1N1/HA1 при множественности инфицирования = 100;
10. РНК из клеток, инфицированных посредством AcNPV-CAP-H1N1/HA1 при множественности инфицирования = 10;
11. РНК из клеток, инфицированных посредством AcNPV-CAP-H1N1/HA1 при множественности инфицирования = 20;
и
12. РНК из клеток, инфицированных посредством AcNPV-CAP-H1N1/HA1 при множественности инфицирования = 100.
Образец получали через 0 часов, одни сутки, 4 суток и 7 суток после инфицирования, амплифицировали посредством RT-PCR, а амплифицированную ДНК подвергали электрофорезу.
Пример 9; титр антител и клеточный иммунитет, индуцированный антигеном PbCSP из рекомбинантного вируса
1. Вакцинация
Самку мыши BALB/c трижды с трехнедельными интервалами иммунизировали раствором рекомбинантного вируса для вакцинации. Вводимую дозу получали при 0,2 мл/организм, что соответствует количеству вируса, составляющему 1×108 бляшкообразующих единиц/организм, для внутримышечной инъекции в бедренную мышцу. В качестве вакцины вводили инъекцию вируса дикого типа (AcNPV-WT), AcNPV-PbCSPsurf (Yoshida et al. Virology 316: 161-70, 2003) или AcNPV-Dual-PbCSP.
2. Вскрытие мышей
Мышь умерщвляли через три недели после последней иммунизации и извлекали из мыши сыворотку и селезенку. Сыворотку использовали для измерения титра специфического антитела, а селезенку использовали для анализа ELISPOT.
3. Измерение титров антител
Титр антител измеряли посредством ELISA с использованием планшета, на котором был зафиксирован принудительно экспрессированный в Escherichia coil и очищенный/выделенный рекомбинантный белок PbCSP. ELISA проводили в соответствии с общепринятыми способами. В результате, хотя для групп, которые не иммунизировали вирусом или которые иммунизировали вирусом дикого типа, не было выявлено повышения титра антител, повышение титра специфического антитела могло быть выявлено для группы, которую иммунизировали посредством AcNPV-PbCSPsurf, и для группы, которую иммунизировали посредством AcNPV-Dual-PbCSP.
На фиг.8 представлены титры специфичного в отношении PbCSP антитела IgG для группы без иммунизации, группы с иммунизацией вирусом дикого типа, группы с иммунизацией посредством AcNPV-PbCSPsurf и группы с иммунизацией посредством AcNPV-Dual-PbCSP.
4. Оценка клеточного иммунитета с использованием анализа ELISPOT
Анализ ELISPOT проводили с использованием клеток селезенки от иммунизированных мышей. Получали клетки селезенки от мыши и добавляли надлежащее число клеток в MultiScreen-IP (Millipore). К этому добавляли пептид (аминокислотная последовательность: SYIPSAEKI SEQ ID №:53), известный как эпитоп CD 8 из PbCSP, a затем полученное культивировали в течение ночи. После этого проводили реакцию с использованием набора ELISPOT IFN-γ мыши ELISPOT (BD Sciences) и получали окрашивание с использованием набора субстратов АЕС (BD Sciences). Количество клеток, специфически прореагировавших на антиген, выявляли определением окрашенных областей. В результате в группе, которую не иммунизировали вирусом, которую иммунизировали вирусом дикого типа или AcNPV-PbCSPsurf, нельзя было выявить антиген-специфические клетки, однако в группе, которую иммунизировали посредством AcNPV-Dual-PbCSP, выявили приблизительно 350 прореагировавших клеток на 106 клеток селезенки. Это показало, что AcNPV-Dual-PbCSP может значимо сильнее индуцировать клеточный иммунитет, чем AcNPV-PbCSPsurf.
На фиг.9 представлены количества IFN-γ-продуцирующих клеток, специфичных в отношении эпитопа CTL из PbCSP, в группе без иммунизации, группе с иммунизацией вирусом дикого типа, группе с иммунизацией посредством AcNPV-PbCSPsurf и группе с иммунизацией посредством AcNPV-Dual-PbCSP.
Пример 10: тест для подтверждения противовирусных эффектов вакцины, содержащей в качестве активного ингредиента рекомбинантный бакуловирус
(Тест для подтверждения эффектов рекомбинантного бакуловируса М2е)
Рекомбинантный бакуловирус М2е (AcNPV-Dual-M2e) в количестве 3,4×108 бляшкообразующих единиц на мышь вводили в бедренную мышцу два раза с двухнедельным интервалом. Мышей инфицировали вирусом гриппа A/PR/8/34 посредством интраназального введения 0,005 мл раствора, содержащего 1000 TCID50 вируса, через две недели после конечной вакцинации. На 6 сутки после инфицирования мышей умерщвляли, извлекали легкие и регистрировали количество вируса в легких с использованием клеток MDCK. В результате у всех мышей, иммунизированных посредством AcNPV-Dual-M2e, нельзя было обнаружить вирус гриппа. В то же время это был тот же самый эффект, что и в группе, в которой в бедренную мышцу вводили вакцину из рекомбинантного бакуловируса НА1 (AcNPV-Dual-H1N1/HA1) (1,0×107 бляшкообразующих единиц на мышь).
На фиг.10 представлены количества вируса внутри легких через 6 суток после инфицирования вирусом гриппа для группы PBS группы с иммунизацией посредством AcNPV-Dual-M2e и группы с иммунизацией посредством AcNPV-Dual-H1N1/HA1.
Пример 11. Исследование для выявления профилактического эффекта фармацевтического вещества, содержащего в качестве активного компонента рекомбинантный бакуловирус HA1/NC99
В бедренную мышцу дважды с двухнедельным интервалом вводили рекомбинантный бакуловирус HA1/NC99 (AcNPV-CP-HA1/NC99) при 1,0×108 бляшкообразующих единиц на мышь. Через две недели после конечной иммунизации мышь инфицировали вирусом гриппа A/NewCaledonia/20/99 посредством введения в полость носа 0,05 мл раствора, содержащего вирус при 1000 TCID50. Через трое суток после инфицирования мышь умерщвляли, извлекали легкие и регистрировали количество вируса внутри легких с использованием клеток MDCK. В результате у трех из четырех мышей, иммунизированных посредством AcNPV-CP-HA1/NC99, нельзя было обнаружить вирус гриппа.
На фиг.11 представлены количества вируса внутри легких через 3 суток после инфицирования вирусом гриппа в группе PBS, группе с иммунизацией вирусом дикого типа (AcNPV-WT) и группе с иммунизацией посредством AcNPV-CP-HA1/NC99.
Пример 12. Исследование для выявления специфического антитела в зависимости от способов введения фармацевтической композиции, содержащей в качестве активного компонента рекомбинантный бакуловирус
Рекомбинантный бакуловирус НА1 (AcNPV-Dual-H1N1/HA1) при 2,0×107 бляшкообразующих единиц на мышь вводили два раза с двухнедельным интервалом посредством введения 0,005 мл раствора вируса в обе ноздри (капли для носа), введения 0,05 мл раствора вируса в нос (риновакцинация), введения 0,05 мл раствора вируса в дыхательные пути (через дыхательные пути) и введения 0,05 мл раствора вируса в бедренную мышцу (мышечная инъекция). Через две недели после конечной иммунизации получали жидкость от назального лаважа, жидкость от альвеолярного лаважа и сыворотку и определяли экспрессию антитела, специфичного в отношении вируса гриппа. Титр антител измеряли посредством ELISA с использованием планшета, на котором был зафиксирован экстракт клеток MDCK, инфицированных вирусом гриппа A/PR/8/34. ELISA проводили в соответствии с общепринятыми способами. В результате в крови от группы с риновакцинацией, группы с внутритрахеальной вакцинацией и группы с внутримышечной вакцинацией было выявлено специфическое антитело IgG. В частности, было выявлено, что образование антитела в значительной степени индуцируется в группе с внутритрахеальной вакцинацией. Сходным образом, антиген-специфическое антитело IgG было также выявлено в жидкости от назального лаважа и жидкости от альвеолярного лаважа, и, в частности, образование антитела в значительной степени индуцировалось в группе с внутритрахеальной вакцинацией. Кроме того, для группы с внутритрахеальной вакцинацией в жидкости от альвеолярного лаважа также выявляли продукцию антиген-специфического антитела IgA.
На фиг.12 представлены результаты ELISA для измерения в крови антитела IgG, специфичного в отношении вируса гриппа, для группы с каплями для носа, группы с риновакцинацией, группы с внутритрахеальной вакцинацией и группы с внутримышечной вакцинацией.
На фиг.13 представлены результаты ELISA для измерения в жидкости от назального лаважа и жидкости от альвеолярного лаважа антител IgG и IgA, специфичных в отношении вируса гриппа, для группы с каплями для носа, группы с риновакцинацией, группы с внутритрахеальной вакцинацией и группы с внутримышечной вакцинацией.
Пример 13. Исследование для выявления эффектов в зависимости от способов введения фармацевтической композиции, содержащей в качестве активного компонента рекомбинантный бакуловирус
Рекомбинантный бакуловирус HA1 (AcNPV-Dual-H1N1/HA1) при 1,0×107 бляшкообразующих единиц на мышь вводили два раза с двухнедельным интервалом посредством введения с использованием капель для носа, риновакцинацией, через дыхательные пути или мышечной инъекцией. Через две недели после конечной иммунизации мышь инфицировали вирусом гриппа A/PR/8/34 посредством введения в полость носа 0,005 мл раствора, содержащего вирус при 1000 TCID50. Через трое суток после инфицирования получали жидкость от назального лаважа, через 6 суток после инфицирования извлекали легкие и регистрировали количество вируса внутри легких с использованием клеток MDCK. В результате количество вируса в полости носа через 3 суток после инфицирования было значительно снижено в группе с риновакцинацией и группе с внутритрахеальной вакцинацией. Кроме того, в группе с внутритрахеальной вакцинацией, а также в группе с внутримышечной вакцинацией количество вируса внутри легких через 6 суток после инфицирования было снижено до порога чувствительности или до более низкого уровня.
На фиг.14 представлены количества вируса в жидкости от назального лаважа через 3 суток после инфицирования вирусом гриппа для группы с каплями для носа, группы с риновакцинацией, группы с внутритрахеальной вакцинацией и группы с внутримышечной вакцинацией.
На фиг.15 представлены количества вируса внутри легких через 6 суток после инфицирования вирусом гриппа для группы с каплями для носа, группы с риновакцинацией, группы с внутритрахеальной вакцинацией и группы с внутримышечной вакцинацией.
ОТКРЫТОЕ ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID №№:1 и 2 представляют собой последовательности праймеров PbCSP-F и PbCSP-R1 для PCR для геномной ДНК из штамма Р.berghei ANKA;
SEQ ID №№:3 и 4 представляют собой последовательности праймеров phsp65-F1 и phsp65-R1 для PCR для геномной ДНК из М.tuberculosis H37Rv;
SEQ ID №№:5 и 6 представляют собой последовательности праймеров phsp65-F2 и phsp65-R2 для PCR с использованием pcDNA-IgHsp65 в качестве образца;
SEQ ID №№:7 и 8 представляют собой последовательности праймеров pPolh-F2 и pgp64-R2 для PCR с использованием pBACsurf-1 (предоставляемой из Novagen) в качестве образца для получения фрагмента ДНК гена gp64;
SEQ ID №№:9 и 10 представляют собой последовательности праймеров HA-f и НА-r для PCR для получения фрагмента гена НА вируса гриппа; и
SEQ ID №№:11 и 12 представляют собой последовательности праймеров pHA-F1 и pHA-R1 для PCR с использованием pCR-Blunt-НА в качестве образца.
SEQ ID №№:13 и 14 представляют собой последовательности праймеров pTRAMP-F1 и pTRAMP-R1 для PCR для гена PbTRAMP.
SEQ ID №№:15 и 16 представляют собой последовательности праймеров pAMA1-F1 и pAMA-R1 для PCR для домена 123 (D123) гена PbAMA1.
SEQ ID №№:17 и 18 представляют собой последовательности праймеров pMspl-F1 и pMsp1-R1 для PCR для гена PbMSP119.
SEQ ID №№:19 и 20 представляют собой последовательности праймеров pPfCSP-F1 и pPfCSP-R1 для PCR для гена PfCSP.
SEQ ID №№:21 и 22 представляют собой последовательности праймеров pPfAMA1-F1 и pPfAMA1-R1 для PCR для гена PfAMA1 из Р.falciparum 3 D7.
SEQ ID №№:23 и 24 представляют собой последовательности праймеров pPfs25-F1 и pPfs25-R1 для PCR для гена Pfs25 из Р.falciparum.
SEQ ID №№:25 и 26 представляют собой последовательности праймеров Polh-f RsrII и GP64-r DraIII для PCR с использованием pDual-H1N1/HA-gp64 в качестве образца.
SEQ ID №№:27 и 28 представляют собой последовательности праймеров CMVenh-f FseI и CMVenh-r KpnI для PCR для энхансерного участка CMV.
SEQ ID №№:29 и 30 представляют собой последовательности праймеров UBBp-f KpnI и UBBp-r RsrII для PCR для промоторного участка UBB.
SEQ ID №№:31 и 32 представляют собой последовательности праймеров NP-f EcoRI и NP-r Cfr9I для RT-PCR для геномной РНК из штамма вируса гриппа PR/8/34;
SEQ ID №№:33 и 34 представляют собой последовательности праймеров M2-f EcoRI и M2-r Cfr9I для RT-PCR для геномной РНК из штамма вируса гриппа PR/8/34;
SEQ ID №№:35 и 36 представляют собой последовательности праймеров NAe-f EcoRI и NAe-r Cfr9I для RT-PCR для геномной РНК из штамма вируса гриппа PR/8/34;
SEQ ID №№:37 и 38 представляют собой последовательности праймеров M2-f EcoRI и M2e-r Cfr9I для PCR с использованием pDual-H1N1/M2-gp64 в качестве образца;
SEQ ID №№:39 и 40 представляют собой последовательности праймеров HA1-f EcoRI и HA1-r Cfr9I(NC99) для RT-PCR для геномной РНК из NewCaledonia/20/99 (NC99);
SEQ ID №№:41 и 42 представляют собой последовательности праймеров HA0-f EcoRI и НА2-Г Cfr9I для PCR с использованием pCR-Blunt-HA в качестве образца;
SEQ ID №№:43 и 44 представляют собой последовательности праймеров HA2-f EcoRI и НА2-r Cfr9I для PCR с использованием pCR-Blunt-HA в качестве образца;
SEQ ID №№:45 и 46 представляют собой последовательности праймеров vp39-f и vp39-r для PCR для участка гена vp39.
SEQ ID №№:47 и 48 представляют собой последовательности праймеров Polh-Sl и HA1-r EcoRI для PCR для фрагмента гена НА1.
SEQ ID №№:49 и 50 представляют собой последовательности праймеров NP-f 5 EcoRI и NP-r EcoRI для PCR с использованием pDual-H1N1/NP-gp64 в качестве образца;
SEQ ID №№:51 и 52 представляют собой последовательности праймеров для выявления экспрессии AcNPV-CP-H1N1/HA1, AcNPV-CAP-H1N1/HA1 и AcNPV-CU-H1N1/HA1.
SEQ ID №:53 представляет собой полипептид, известный как эпитоп CD8 из PbCSP.
Реферат
Изобретение относится к области биотехнологии, генной инженерии и вирусологии. Вектор для переноса содержит слитую ДНК под контролем слитого промотора. Слитая ДНК состоит из фрагмента ДНК, кодирующего белок-антиген М.tuberculosis, и фрагмента ДНК гена, кодирующего аминокислотную последовательность с номером доступа GenBank № L22858. Сдвоенный промотор состоит из промотора полиэдрина и промотора CMV. Также описана вакцина против туберкулеза, содержащая рекомбинантный вирус ядерного полиэдроза Autographa californica (AcNPV) в качестве активного агента. При этом, рекомбинантный AcNPV содержит последовательность, входящую в вышеописанный вектор. Изобретение может быть использовано в медицине. 2 н. и 4 з.п. ф-лы, 15 ил., 1 табл., 13 пр.
Формула
отличающийся тем, что слитая ДНК, содержащая
(A) фрагмент ДНК, кодирующий белок-антиген М.tuberculosis, и
(B) фрагмент ДНК гена, кодирующего аминокислотную последовательность с номером доступа GenBank № L22858,
присоединена ниже сдвоенного промотора, содержащего промотор полиэдрина и промотор CMV, связанные друг с другом.
фрагмент ДНК из (А) можно получить посредством ПЦР с геномной ДНК, выделенной из штамма М.tuberculosis H37Rv, в качестве матрицы с использованием праймеров SEQ ID NO: 5 и SEQ ID NO: 6, и последующим расщеплением Sse8387I и Cfr9I; и
фрагмент ДНК из (В) представляет собой фрагмент, присутствующий во фрагменте ДНК, который можно получить посредством ПЦР с pBACsurf-1 в качестве матрицы с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8, и последующим расщеплением RsrII и KpnI (pDual-Hsp65-gp64).
(a) фрагмента ДНК, кодирующего белок-антиген М.tuberculosis; и
(b) фрагмент ДНК гена, кодирующего аминокислотную последовательность с номером доступа в GenBank № L22858, под контролем сдвоенного промота, содержащего промотор полиэдрина и промотор CMV, связанные друг с другом.
фрагмент ДНК из (а) можно получить получить посредством ПЦР с геномной ДНК, выделенной из штамма М.tuberculosis H37Rv, в качестве матрицы с использованием праймеров SEQ ID NO: 5 и SEQ ID NO: 6, и последующим расщеплением Sse8387I и Cfr9I; и
фрагмент ДНК из (b) представляет собой фрагмент, присутствующий во фрагменте ДНК, который можно получить посредством ПЦР с pBACsurf-1 в качестве матрицы с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8, и последующим расщеплением RsrII и KpnI (pDual-Hsp65-gp64).

Комментарии