Способ скрининга ингибиторов гамма-секретазы - RU2373284C2
Код документа: RU2373284C2
Чертежи































Описание
Настоящее изобретение относится к усовершенствованным способам определения активности γ-секретазы, отдельным стадиям таких способов и применению указанных способов. Данное изобретение основано на положениях заявки WO 00/34511 A2, которая включена в данное описание в качестве ссылки.
Болезнь Альцгеймера (AD) является нейродегенеративным заболеванием головного мозга, которое сопровождается на клеточном уровне массовой утратой нейронов в конечностях и коре головного мозга. В пораженных участках головного мозга на молекулярном уровне могут быть обнаружены отложения белка, так называемые бляшки, которые являются основным признаком болезни Альцгеймера. Белок, наиболее часто встречающийся в указанных бляшках, является пептидом, содержащим 40-42 аминокислоты, который получил название Аβ-пептид. Аβ-пептид является продуктом расщепления гораздо большего белка, содержащего 695-770 аминокислот, так называемого амилоидного белка-предшественника (АРР).
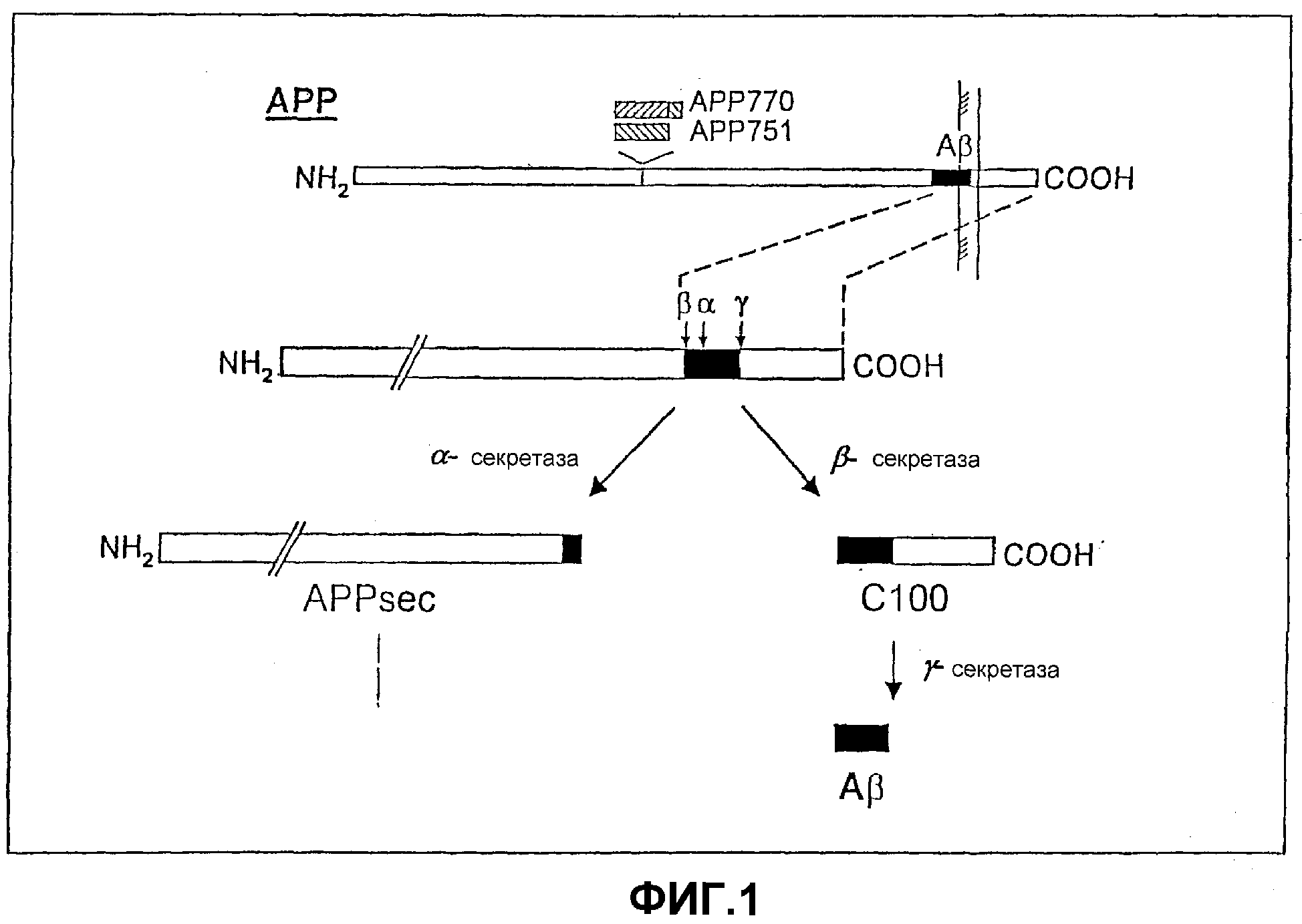
АРР является интегральным трансмембранным белком, который сначала пересекает двойной слой липида. Таким образом, большая часть данного белка является внеклеточной, в то время как более короткий С-концевой домен направлен в сторону цитозоля (фиг.1). Аβ-пептид закрашен темно-серым цветом на фиг.1. Примерно две трети Аβ-пептида находится во внеклеточном домене и примерно одна треть находится в трансмембранном домене АРР.
Помимо мембранного АРР, можно обнаружить секретированную форму амилоидного белка-предшественника, которая состоит из большого эктодомена АРР и определяется как АРРsec (“секретированный АРР”). АРРsec образуется из АРР в результате протеолитического расщепления, опосредованного α-секретазой. Протеолитическое расщепление происходит на сайте аминокислотной последовательности АРР, который находится в аминокислотной последовательности Аβ-пептида (после аминокислотного остатка 16 Аβ-пептида). Протеолиз АРР под действием α-секретазы исключает образование Аβ-пептида.
Таким образом, Аβ-пептид может образовываться из АРР только в результате альтернативного процессинга. Теоретически обосновано, что в таком процессинге участвуют две другие протеазы, первая протеаза, именуемая β-секретазой, которая отщепляет N-конец Аβ-пептида в АРР, и вторая протеаза, именуемая γ-секретазой, которая высвобождает С-конец Аβ-пептида (Kang, J. et al., Nature, 325, 733) (фиг.1).
Секретазы (α-секретаза, β-секретаза, γ-секретаза) представляют большой интерес, в частности, в связи с исследованиями болезни Альцгеймера, например, для идентификации секретаз или факторов, участвующих в регулировании активности секретаз и образовании Аβ-пептида (Wolfe, M.S. (2001), J. Med. Chem., 44(13), 2039-2060). Ингибирование β-секретазы и, в частности, γ-секретазы позволяет сократить продуцирование Аβ-пептида, с другой стороны, активация α-секретазы может увеличить процессинг АРР в АРРseс и одновременно уменьшить образование Аβ-пептида. Трансгенный организм C. elegans, который был обнаружен в ходе таких исследований, описан в заявке на патент Германии DE № 19849073 A1.
Существует много свидетельств того, что Аβ-пептид (Аβ) играет важную роль в возникновении болезни Альцгеймера. Наряду с прочим, теоретически обоснована нейротоксичность Аβ-фибрилл в культуре клеток (Yankner, B.A. et al., (1990) Proc. Natl. Acad. Sci. USA, 87, 9020). У субъектов с синдромом Дауна, признаком которого является наличие дополнительной копии гена, кодирующего АРР, нейропатология, характерная для болезни Альцгеймера, возникает даже в возрасте 30 лет. Предполагается, что сверхэкспрессия АРР приводит к повышенному превращению в Аβ-пептид (Rumble, B., et al., (1989), N. Engl. J. Med., 320, 1446).
Наиболее значимым показателем центральной роли Аβ-пептида, по-видимому, являются семейные формы болезни Альцгеймера. Обнаружены мутации гена АРР рядом с сайтами расщепления β- и γ-секретазой или мутации двух других AD-ассоциированных генов (пресенилины), которые в культуре клеток значительно увеличивают продуцирование Аβ-пептида (Scheuner, D. et al., (1996), Nature Medicine, 2, 864).
Существует много свидетельств того, что во время процессинга АРР сначала расщепляется с образованием Аβ-пептида под действием β-секретазы и в дальнейшем служит субстратом для γ-секретазы. Поэтому γ-секретаза играет важную роль в образовании Аβ-пептида (Wolfe, M.S. (2001), loc. cit).
Как правило, Аβ-пептид трудно обнаружить, так как в него превращается лишь небольшое количество АРР (Simons M., et al., Neurosci (1996) 1;16(3):899-908). Кроме того, Аβ-пептид является очень небольшим фрагментом длиной около 4 кДа, который характеризуется значительной тенденцией к аутоагрегации вследствие гидрофобной природы. Поэтому Аβ-пептид легко осаждается в физиологических условиях (Hilbich, C., et al., (1991) J. Mol. Biol., 218, 149) и в осажденной форме не поддается обнаружению.
Аβ-пептид обнаруживают в эукариотических клетках иммунобиологическими методами, такими, например, как ELISA, иммунопреципитация и вестерн-блоттинг (Suzuki, N. et al., Science 1994, 27, 264(5163) 1336; Haass, C. et al., (1992) Nature, 359, 322). Кроме того, Вульф и др. (1999) описали анализ in vitro, предназначенный для определения активности γ-секретазы из очищенных мембранных фракций, содержащих PS1 (пресенилин 1). Указанные методы требуют больших затрат времени, так как они включают в себя стадии инкубации с соответствующими антителами, стадии лизиса клеток, полученных из приемлемой культуры клеток, или использование моделей организмов (например, C. elegans). Указанные методы не пригодны для выполнения в автоматизированной системе анализа, например, для высокопроизводительного скрининга с целью идентификации соединений, которые специфически ингибируют или снижают активность γ-секретазы. Частично из-за того, что активность γ-секретазы зависит от сборки белков (Mattson, (2003) Nature 422, 385), причем, как было известно до сих пор, она является активной только в среде комплексного мембранного липида.
Активность γ-секретазы можно обнаружить способом, описанным в заявке WO 00/34511A2, который предназначен для определения активности γ-секретазы и обнаружения γ-секретазы путем выявления Аβ-пептида. В способе, описанном в заявке WO 00/34511A2, использован трансген, который кодирует слитый белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1) в качестве ферментативного сайта-мишени γ-секретазы, сигнальный пептид (SP) у 5'-конца, промотор и при необходимости дополнительные кодирующие и/или некодирующие нуклеотидные последовательности, которые вводят в клетку для экспрессии указанного слитого белка.
В результате специфического расщепления слитого белка γ-секретазой, присутствующей в клетке, образуется первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3). Вышеуказанный первый и/или второй неполный белок обнаруживают, например, при помощи соответствующего репортера, например, гена-репортера, активируемого высвобождаемым активатором транскрипции, связанным с первым и/или вторым неполным белком.
С учетом известных проблем, связанных с обнаружением Аβ-пептида, целью настоящего изобретения является усовершенствование способа, описанного в заявке WO 00/34511A2, например, путем ослабления фонового сигнала и/или увеличения специфичности сигнала для улучшения отношения сигнал - шум при выполнении анализа согласно изобретению.
Весьма удивительным является то, что отношение сигнал - шум в способе, описанном в заявке WO 00/34511A2, можно улучшить, уменьшая неспецифическое высвобождение первого и/или второго неполного белка вследствие неспецифической активности протеазы. Подобный результат, например, достигается в слитом пептиде по заявке WO 00/34511A2 путем исключения/удаления всех других последовательностей/фрагментов сайтов расщепления протеазой и/или интернализирующих последовательностей, кроме сайта расщепления γ-секретазой. Поэтому настоящее изобретение относится к усовершенствованному способу определения активности γ-секретазы и обнаружения белка, обладающего активностью γ-секретазы.
Конкретные варианты осуществления данного изобретения относятся к способам идентификации γ-секретазы, кДНК, кодирующей γ-секретазу, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы и к способам идентификации фармацевтически активного соединения, которое может модулировать, например, уменьшать или ингибировать активность белка, обладающего активностью γ-секретазы. Такие вещества представляют особый интерес, если они являются фармацевтически приемлемыми и пригодными для лечения болезни Альцгеймера.
Настоящее изобретение относится к способу обнаружения γ-секретазы, который заключается в том, что:
1) используют трансген, кодирующий слитый белок и содержащий:
а) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
с) промотор и
d) при необходимости дополнительные кодирующие и/или некодирующие нуклеотидные последовательности;
2) данный трасген вводят в клетку и экспрессируют слитый белок;
3) слитый белок расщепляют внутри аминокислотной последовательности SEQ ID NO:1 γ-секретазой, присутствующей в клетке, в результате чего образуется первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3); и
4) обнаруживают первый неполный белок и/или второй неполный белок при условии, что за исключением SEQ ID NO:1 указанный слитый белок не содержит ни одного пептида, действующего в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
При осуществлении данного способа указанный слитый белок предпочтительно не содержит ни одного (то есть ни одного пептида кроме SEQ ID NO:1) пептида, действующего в качестве сигнала для эндо- или экзоцитоза, и сайта расщепления протеазой за исключением SEQ ID NO:1.
Данное изобретение относится также к способу обнаружения активности γ-секретазы, который заключается в том, что:
1) получают/используют трансген, кодирующий слитый белок и содержащий нижеследующие элементы:
а) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
с) промотор и
d) при необходимости дополнительные кодирующие и/или некодирующие нуклеотидные последовательности;
2) данный трасген вводят в клетку и экспрессируют слитый белок;
3) слитый белок расщепляют внутри аминокислотной последовательности SEQ ID NO:1 γ-секретазой, присутствующей в клетке, в результате чего образуется первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3); и
4) определяют количество второго неполного белка и активность γ-секретазы на основании количества образовавшегося второго неполного белка при условии, что за исключением SEQ ID NO:1 указанный слитый белок не содержит ни одного пептида, действующего в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
Способы согласно изобретению (“анализ методом скрининга Аβ-пептида”, “анализ γ-секретазы”) пригодны для обнаружения in vivo γ-секретазы (белка, обладающего активностью γ-секретазы) или активности γ-секретазы, что делает возможным универсальное применение указанных способов даже, например, при выполнении высокопроизводительных методов скрининга (“HTS”). В данных способах отсутствуют вышеуказанные недостатки известных способов обнаружения, в частности, трудоемкие стадии выделения и обнаружения, и значительно улучшен специфический сигнал активности γ-секретазы. Более специфический сигнал достигается в результате значительного ослабления фонового сигнала и устранения или уменьшения выделения первого и второго неполных белков под действием неспецифических протеаз.
Важным элементом способов согласно изобретению является то, что при расщеплении С-концевого фрагмента АРР γ-протеазой на два фрагмента, а именно первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3), происходит диффузия второго неполного белка, содержащего аминокислотную последовательность VIVITLVML (SEQ ID NO:3), в цитозоль клетки (фигура 2). Указанный второй неполный белок, который может быть легко обнаружен в цитозоле клетки, например, в виде слитого белка с фактором активации транскрипции (TAF) при помощи гена-репортера, служит в качестве инструмента обнаружения присутствия γ-секретазы или количественного определения активности γ-секретазы. Сайт расщепления γ-секретазой расположен в трансмембранном домене АРР (Kang, J. et al., (1987) Nature, 325, 733). Указанный трансмембранный домен АРР имеет аминокислотную последовательность GAIIGLMVGGVV40IA42TVIVITLVML. γ-Секретаза расщепляет сайт после V40, A42 или Т43. Аβ-Пептид, продуцируемый эукариотическими клетками в культуре клеток, секретируется в супернатант среды.
С помощью приемлемой репортерной системы (например, ТAF и соответствующего гена-репортера) выделение второго неполного белка может активировать экспрессию репортерного белка, который можно обнаружить в эукариотических клетках. В результате обнаружения репортерного белка можно продемонстрировать, что произошло расщепление АРР γ-секретазой. Таким образом, можно произвести качественное и/или количественное определение активности γ-секретазы.
Составные элементы данного способа можно более подробно охарактеризовать следующим образом:
Первая нуклеотидная последовательность кодирует амилоидный белок-предшественник (АРР) или его часть, содержащую SEQ ID NO:1, причем указанный АРР или его часть не содержит других пептидных фрагментов, действующих в качестве сигнала для эндо- или экзоцитоза, и/или сайтов расщепления протеазой. Указанная первая нуклеотидная последовательность предпочтительно кодирует белок, содержащий аминокислотную последовательность, включающую SEQ ID NO:1, например SEQ ID NO:6 или SEQ ID NO:14. В других вариантах осуществления изобретения первая нуклеотидная последовательность кодирует процессированный или модифицированный АРР, например, полученный в результате сайтнаправленного мутагенеза, во избежание кодирования пептидного фрагмента, действующего в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой, кроме SEQ ID NO:1. В другом варианте осуществления изобретения указанный АРР или его часть, кодированная указанной первой нуклеотидной последовательностью, является белком, выделенным из АРР человека или мыши (например, APLP1 или APLP2).
Вторая нуклеотидная последовательность предпочтительно кодирует любой приемлемый сигнальный пептид (“SP”). Сигнальный пептид содержит, например, сигнальные пептиды, соответствующие SEQ ID NO:5 (сигнальный пептид АРР человека), SEQ ID NO:12 (сигнальный пептид SUC2 дрожжей, “SP2”), SEQ ID NO:13 (сигнальный пептид ВМ40, “SP3”), или любой другой сигнальный пептид, например, описанный в публикации Heijne et al., Nucl. Acids Res. (1986), 14(11) 4683-4690.
В качестве промотора можно использовать любой регулируемый или конститутивный промотор. Данный промотор может быть пригоден, например, для экспрессии в клетках млекопитающих, C. elegans, дрожжах или дрозофиле. Приемлемыми промоторами для клеток млекопитающих являются, например, CMV, HSV, TK, SV40, LTR (все производятся компанией Clontech, Heidelberg, Germany) и RSV (например, Invitrogen™ life technologies, NV Leek, Netherlands). Промоторы, которые можно использовать для экспрессии в С. elegans, включают, например, unc-119, unc-54, hsp16-2, goa-1 и sеl-12. Для экспрессии в дрожжах пригодны промоторы ADH1 (конститутивный) (Vlckova et al. (1994) Gene, 25(5), 472-4), GAL1 (условно индуцибельный) (Selleck et al. (1987) Nature 325, 173-7), MET3 (условный) (Cherest et al. (1987) Mol. Gen. Genet. 210, 307-13) и МЕТ25 (например, Kerjan et al. (1986) Necleic Acids Res. 14(20), 7861-71). Для экспрессии в дрозофиле можно использовать, например, промоторы МТ (металлотионин), Ас5 или Ds47 (все производятся компанией Invitrogen™ life technologies).
При осуществлении данного способа предпочтительно используют эукариотические клетки, например, клетки человека, или клетки, отличные от человеческих, например, клетки обезьяны, хомячка, мыши, дрозофилы, полосатой перцины или дрожжей. Например, можно использовать клетки HeLa, HEK293, H4, SH-SY5Y, H9, Cos, CHO, N2A, SL-2 или Saccharomyces cerevisiae. В конкретном варианте осуществления изобретения можно использовать клетки C. elegans. Указанные клетки могут принадлежать трансгенному животному, отличному от человека. В конкретном варианте осуществления изобретения трансгенные клетки могут принадлежать трансгенному организму C. elegans. В частности, данное изобретение относится к способам, при осуществлении которых могут быть использованы дрожжевые клетки, например, из штамма MaV203 (Invitrogen™ life technologies, Rockville, MD, USA) или EGY48 (OriGene Technologies, Inc. Rockville, MD, USA).
Трансген кодирует слитый белок, который состоит из неполных белков, кодированных первой и второй нуклеотидной последовательностью и при необходимости дополнительными нуклеотидными последовательностями. Таким образом, слитый белок содержит первый неполный белок и второй неполный белок и при необходимости дополнительный неполный белок. Однако важно, чтобы слитый белок не содержал пептидных фрагментов, действующих в качестве сигнала для эндо- или экзоцитоза, и/или сайтов расщепления протеазой за исключением SEQ ID NO:1. Сайты расщепления протеазой известны специалистам в данной области из баз данных протеаз, например, MEROPS (Rawling et al. (2002) MEROPS: the protease database, Nucleic Acids Res. 30, 343-346).
Слитый белок по настоящему изобретению предпочтительно не содержит сайт расщепления протеазой, который является сайтом расщепления каспазой, например, (IVL)ExD, в частности, VEVA, VEVD, и в другом варианте осуществления изобретения слитый белок по настоящему изобретению не содержит сигнальный пептид для эндо- или экзоцитоза, который является сигналом для интернализации АРР, например, NpxY или Di-лейцин, в частности, NPTY.
В одном конкретном варианте осуществления изобретения слитый белок имеет аминокислотную последовательность SEQ ID NO:14. Кроме SEQ ID NO:1 указанный слитый белок не содержит других (одного или несколько) пептидных фрагментов, действующих в качестве сигнала для эндо- или экзоцитоза (например, сигнал интернализации АРР), и/или сайтов расщепления протеазой (например, каспазой).
В частности, при осуществлении данного способа можно использовать трансген, имеющий нуклеотидную последовательность, соответствующую SEQ ID NO:15 (SPC55GV TAG). В особенно предпочтительных вариантах осуществления данного способа трансген вводят в вектор. Данный конкретный вариант осуществления изобретения именуется также SP-C55-Gal4-VP16 (то есть SPC55GV). В данном случае экcпрессируют слитый белок, содержащий сигнальный пептид АРР, фрагмент С55 АРР, GAL4 и VP16. Указанный белок, расположенный в трансмембранном домене, расщепляют во фрагменте С55, и второй неполный белок, то есть часть слитого белка, который содержит одну часть фрагмента С55, GAL4 и VP16, обнаруживают с помощью репортерной плазмиды.
Помимо трансгенной конструкции SPC55GV возможны другие репортерные конструкции, в которых домен, активирующий транскрипцию, например, может быть вставлен между трансмембранным доменом и цитозольным доменом SPC55 или меткой (например, MYC, FLAG) у N- и С-конца и между трансмембранным и цитозольным доменом SPC55.
Дополнительная кодирующая нуклеотидная последовательность может кодировать, например, белок, который может быть использован для обнаружения второго неполного белка. Дополнительная кодирующая нуклеотидная последовательность может быть расположена у 3'-конца первой нуклеотидной последовательности. Дополнительная кодирующая нуклеотидная последовательность кодирует, например, химерный белок или другой белок, созданный из ряда доменов, например, белок, содержащий ДНК-связывающий домен и домен, активирующий транскрипцию. В конкретном варианте осуществления изобретения дополнительная кодирующая нуклеотидная последовательность кодирует белок, который включает GAL4-связывающий домен и домен, активирующий транскрипцию, VP16 (GAL4-VP16, “GV”), и дополнительный неполный белок предпочтительно имеет аминокислотную последовательность SEQ ID NO:7. В дрожжевых клетках дополнительный неполный белок может также содержать LexA-связывающий домен (например, LexA-VP16). Данный дополнительный неполный белок особенно пригоден для осуществления способов с использованием клеток дрожжевого штамма EGY48.
В частности, настоящее изобретение относится к способам с использованием клеток, котрансфицированных репортерной плазмидой. Репортерная плазмида содержит ген-репортер под контролем регулируемого промотора. Например, ген-репортер может кодировать GFP и его производные, например, EGFP (усиленный зеленый флуоресцирующий белок), EBFP, EYFP, d2EGFP, GFPuv или люциферазу (например, Promega, Mannheim, Germany), CAT (например, Promega), SEAP (например, Clontech), βGal (например, Clontech), флуоресцирующий белок коралловых рифов (RCFP, Clontech) или индукторы апоптоза, например, Fas, TNF-R1, домен гибели клетки и гомологи (Tartaglia et al. (1993) Cell 74, 845-53), ced3, ced4, ced9. В качестве регулируемого промотора репортерная плазмида может содержать минимальный промотор, например, GAL4-связывающий сайт в комбинации с минимальным промотором ВИЧ промотора CD4 или промотора mec7. Выбор приемлемого регулируемого промотора зависит от используемого домена, активирующего транскрипцию.
Конкретный вариант осуществления изобретения относится к способу с использованием дрожжевых клеток. В качестве альтернативы дрожжевому экспрессирующему вектору pDBTrp (Invitrogen™ life technologies, the Netherlands, № по каталогу 10835023), в который вводят промотор МЕТ-25 (SEQ ID NO:10), существует большое число других экспрессирующих векторов с разными промоторами (например, индуцибельный промотор GAL1, конститутивно активный промотор ADH1) и разными селектируемыми маркерами (ADE, LEU, TRP, HIS, LYS, PHE).
Конкретный вариант осуществления изобретения относится к использованию дрожжевых клеток, содержащих GAL4- или LexA-индуцибельные гены, которые устойчиво интегрированы в их геном или находятся вне хромосомы. В указанных вариантах осуществления изобретения предпочтительно используют дрожжевые штаммы MaV203 (Invitrogen™ life technologies Inc., Rockville, MD, USA) или EGY48 (OriGene Technologies, Inc., Rockville, MD, USA).
Конкретный вариант осуществления способов согласно изобретению относится к использованию клеток, которые дополнительно трансфецированы еще одним рекомбинантным вектором. Клетки, используемые в указанных вариантах осуществления изобретения, предпочтительно не имеют эндогенной γ-секретазы или не обладают активностью эндогенной γ-секретазы и поэтому не могут быть обнаружены вышеуказанными способами. Такие клетки могут быть трансформированы дополнительным вектором, содержащим нуклеотидную последовательность, предпочтительно кДНК, которая кодирует γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу. Например, можно использовать библиотеку кДНК. Указанный вариант осуществления способа по настоящему изобретению можно наряду с прочим использовать для идентификации γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, а такде кДНК, кодирующей γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу. Библиотеки кДНК, которые можно сканировать с целью поиска γ-секретазы, субъединичный белок γ-секретазы или γ-секретаза-подобной протеиназы могут быть получены из клеток или тканей любого организма, например, В-клеток, нейронов, глиоцитов, гиппокампа, цельного мозга, плаценты, почки. кДНК предпочтительно получают из клеток позвоночных (таких как хомячок, крыса, мышь, собака, обезьяна, человек), в частности, из клеток или тканей человека.
В случае клеток, которые без трансфекции не обладают активностью γ-секретазы, но после трансфекции библиотекой кДНК начинают проявлять активность γ-секретазы, можно сделать вывод, что кДНК, присутствующая в таких клетках, кодирует γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу. Указанную кДНК можно выделить известными способами из клеток, обладающих такой активностью, и затем исследовать известными методами.
Настоящее изобретение относится к трансгену, который кодирует слитый белок и содержит нижеследующие элементы:
а) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
с) промотор и
d) по крайней мере одну дополнительную нуклеотидную последовательность у 3'-конца первой нуклеотидной последовательности, которая кодирует ДНК-связывающий домен и домен, активирующий транскрипцию;
причем кроме SEQ ID NO:1 указанный слитый белок не содержит пептидов, действующих в качестве сигнала для эндо- или экзоцитоза, и/или сайтов расщепления протеазой.
Первая нуклеотидная последовательность предпочтительно кодирует АРР или его часть, которые кроме SEQ ID NO:1 не содержат других пептидных фрагментов, действующих в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
Трансген, например, может иметь нуклеотидную последовательность SEQ ID NO:15.
Трансген может находиться в приемлемом векторе, таком как pcDNA 3.1+ или pDBTrp.
Другой вариант осуществления изобретения относится к способу применения трансгена и/или вектора по настоящему изобретению для получения трансгенной клетки, причем указанную трансгенную клетку необязательно вводят в организм, отличный от человеческого, пригодный для использования в качестве репортерного организма in vivo. Например, указанный трансген и/или вектор можно использовать для получения трансгенного организма C. elegans. В другом варианте осуществления изобретения указанный трансген и/или вектор используют для получения трансгенных дрожжевых клеток, например, S. cerevisiae.
Настоящее изобретение относится также к способу получения трансгенного организма, отличного от человеческого, например, трансгенного организма C. elegans, в соответствии с которым указанный трансген и/или вектор, содержащий указанный трансген, микроинъецируют в гонады организма, например, C. elegans. Настоящее изобретение относится также к клетке, содержащей трансген согласно изобретению, и трансгенному организму C. elegans, содержащему указанный трансген. Настоящее изобретение относится также к клетке, в частности, к дрожжевой клетке, содержащей трансген согласно изобретению, предпочтительно находящийся в приемлемом векторе. Настоящее изобретение далее относится к клеткам, предпочтительно дрожжевым клеткам, содержащим трансген согласно изобретению и библиотеку кДНК, которые могут быть объектом библиотеки экспрессируемых последовательностей кДНК (библиотеки кДНК).
Настоящее изобретение относится к применению указанных трансгенных или рекомбинантных клеток, предпочтительно клеток дрожжей или C. elegans, в способе определения или идентификации γ-секретазы, кДНК, кодирующей γ-секретазу, кДНК, кодирующей субъединичный белок γ-секретазы, кДНК, кодирующую γ-секретаза-подобную протеиназу, или активности γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, к применению указанных клеток в способе идентификации ингибиторов активности γ-секретазы (γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы) и к способу использования указанных клеток.
Настоящее изобретение, в частности, относится к способам идентификации веществ (эффекторов), которые модулируют (то есть ингибируют, снижают, повышают или изменяют) активность γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, которые включают нижеследующие стадии:
1) получение трансгенного организма, отличного от человеческого, например, трансгенного организма C. elegans или Saccharomyces cerevisiae, или трансгенной клетки, причем
указанный трансгенный организм, отличный от человеческого, или трансгенная клетка содержит трансген по настоящему изобретению;
трансгенный организм, отличный от человеческого, или трансгенная клетка далее содержит репортерную плазмиду, которая имеет сайт связывания белка, минимальный промотор и ген-репортер; и
при необходимости кДНК, кодирующую γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу;
при этом трансгенный организм, отличный от человеческого, или трансгенная клетка экспрессирует трансген и при необходимости γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу, кодированную кДНК;
2) культивирование трансгенного организма, отличного от человеческого, или трансгенной клетки с испытуемым веществом, подлежащим исследованию;
3) определение количества второго неполного белка.
Настоящее изобретение относится также к способу идентификации эффекторов γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, который заключается в том, что:
1) получают и используют трансген согласно изобретению;
2) указанный трансген, репортерную плазмиду и при необходимости кДНК, кодирующую γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу, вводят в геном клетки и слитый белок, кодированный указанным трансгеном и при необходимости γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу, кодированную кДНК, экспрессируют в присутствии исследуемого вещества;
3) слитый белок
а) расщепляют внутри аминокислотной последовательности SEQ ID NO:1 γ-секретазой, присутствующей в клетке, в результате чего
b) образуется первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3); и
4) производят качественное или количественное определение вышеуказанного второго неполного белка.
Настоящее изобретение относится также к способам идентификации веществ, ингибирующих активность γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, при осуществлении которых трансген, кодирующий белок, содержащий сигнальный пептид и SEQ ID NO:1, экспрессируют в присутствии исследуемого вещества и репортернорй плазмиды и определяют действие указанного вещества на количество образовавшегося второго неполного белка, содержащего аминокислотную последовательность VIVITLVML (SEQ ID NO:3).
Настоящее изобретение относится также к ингибиторам γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, идентифицированным способами согласно изобретению.
Указанные способы можно использовать вместе с системой С55-Gal4-VP16 (то есть со слитым белком, содержащим С55, GAL4 и VP16, или с нуклеиновой кислотой, кодирующей соответствующий слитый белок) для:
1) идентификации и определения (качественного и/или количественного) активности γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы;
2) идентификации γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы в разных тканях, клетках и организмах или видах, а также для идентификации и выделения соответствующих кДНК, кодирующих γ-секретазу, субъединичный белок γ-секретазы или γ-секретаза-подобную протеиназу, и последующего использования указанных кДНК;
3) скрининга in vivo, например, в дрожжевых клетках (таких как Saccharomyces cerevisiae), C. elegans или культуре клеток, позволяющего определить активность γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы без применения иммунобиологических методов:
4) идентификации и исследования веществ, например, фармакологически активных соединений, модулирующих ферментативную или биологическую активность γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, таких как эффекторы (ингибиторы, активаторы, модуляторы) γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы. В частности, данный способ можно использовать для выполнения высокопроизводительного скрининга (HTS). Благодаря использованию систем анализа методом HTS можно идентифицировать вещества, которые могут быть использованы для лечения болезни Альцгеймера и/или для профилактического лечения;
5) исследования или в случае болезни Альцгеймера более глубокого изучения мутированного АРР или его фрагментов либо функции мембранных протеаз;
6) замены описанных слитых белков/трансгенов, например, С55 в SP-C55-Gal4-VP16, другими фрагментами согласно изобретению и исследования с помощью указанных способов γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, их активности и возможности регулирования такой активности.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей фармацевтически активное соединение, ингибирующее активность γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, которые были идентифицированы способом согласно изобретению.
Другой вариант осуществления настоящего изобретения относится к способу получения фармацевтической композиции, который включает осуществление способа согласно изобретению и получение препарата, содержащего вышеуказанное идентифицированное фармацевтически активное соединение.
Другой вариант осуществления настоящего изобретения относится к способу получения фармацевтической композиции, который включает а) способ согласно изобретению и b) смешивание идентифицированного фармацевтически активного соединения с фармацевтически инертными неорганическими и/или органическими наполнителями.
Другой вариант осуществления настоящего изобретения относится к тест-набору для обнаружения активности γ-секретазы, субъединичного белка γ-секретазы или γ-секретаза-подобной протеиназы, который включает трансген, вектор или клетку согласно изобретению.
Фигура 1: на фигуре 1 показан амилоидный белок-предшественник (изоформа АРР695 и изоформы АРР770 или АРР751) и продукты расщепления секретазой.
Фигура 2: схематическое изображение принципа, лежащего в основе способов согласно изобретению: сайт расщепления β-секретазой у N-конца; сайт расщепления γ-секретазой в трансмембранной области; С100 = фрагмент С100 амилоидного белка-предшественника (АРР); GAL4-VP16 = ДНК-связывающий домен, активирующий транскрипцию домен (включающий ДНК-связывающий домен и активатор транскрипции), который связывается с доменом, связывающим белок, в ДНК репортерной плазмиды.
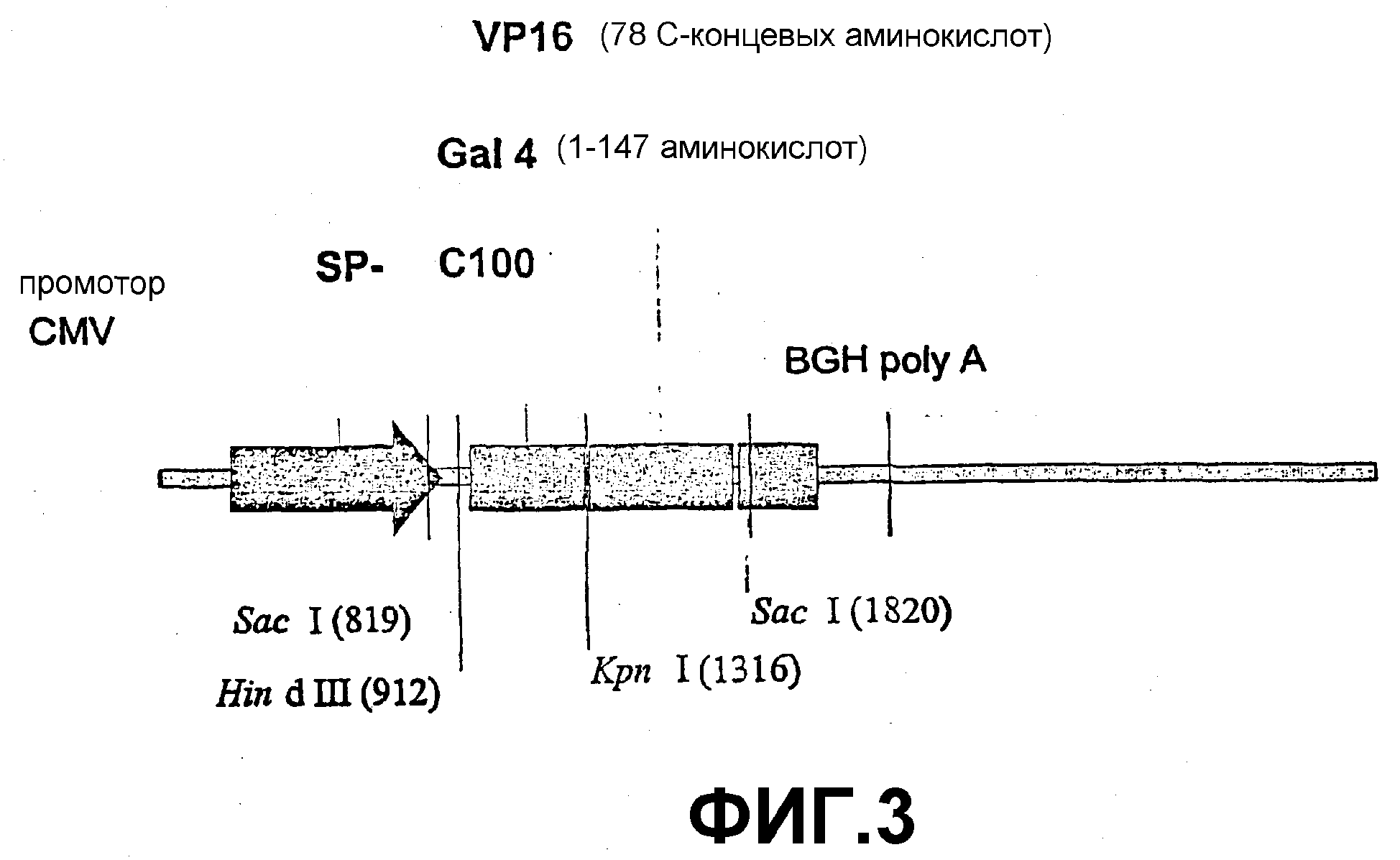
Фигура 3: конструкция экспрессирующих плазмид SP-C100-GAL4-VP16: аа = аминокислоты; рестрикционные сайты расщепления SacI, Hind III и Kpn I, показывающие расположение сайта расщепления в плазмиде.
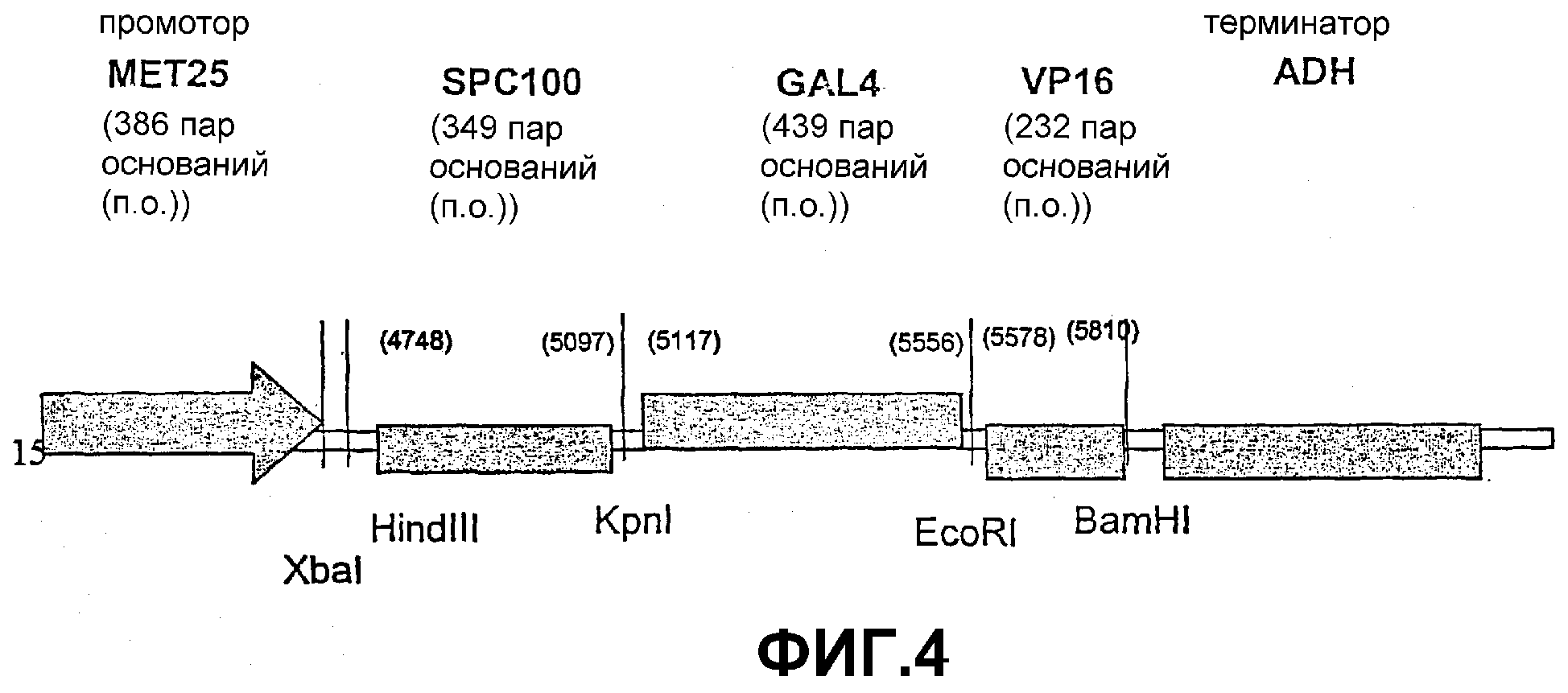
Фигура 4: экспрессирующая плазмида pDBTrp-MET25-SP-C100-GAL4-VP16: конструкция экспрессирующей плазмиды, предназначенной для экспрессии трансгена в дрожжах.
Нижеследующие примеры иллюстрируют настоящее изобретение, не ограничивая его объем.
Примеры
Пример 1. Создание экспрессирующей плазмиды pcDNA3.1+, содержащей SP-C100-GAL4/VP16
Данная плазмида кодирует сигнальный пептид (SP) АРР, который слит со 100 С-концевыми аминокислотными остатками АРР (С100). Остатки С100 начинаются у N-конца Аβ-пептида и заканчиваются у С-конца АРР. Указанная плазмида должна быть дополнительно расщеплена γ-секретазой для выделения Аβ-пептида.
GAL4/VP16 (SEQ ID NO:7) сливали с С-концом SP-C100 (SEQ ID NO:6).
GAL4/VP16 содержит первые 147 аминокислотных остатков дрожжевого активатора транскрипции GAL4 и 78 С-концевых аминокислотных остатков VP16, активатор транскрипции из вируса простого герпеса. В качестве слитого белка фрагмент GAL4 начинает выполнять функцию связывания ДНК, в то время как фрагмент VP16 активирует транскрипцию (Sadowski et al., 1988).
pcDNA3.1+ (Invitrogen™ life technologies, The Netherlands, № по каталогу V79020) служит в качестве плазмидного вектора.
Пример 2. Создание репортерной плазмиды pGL2-MRG5-EGFP
Репортерной плазмидой pGL2-MRG5 для клеток млекопитающих является pGL2 (Promega), в которой фрагмент ДНК из pMRG5 (Ikeda et al., 1998), содержащий пять ДНК-связывающих сайтов GAL4 вверху от центрального промотора вируса иммунодефицита человека (ВИЧ) (Kretzschmar et al., 1994), вставляют вверху от гена-репортера люциферазы pGL2. Для более легкого обнаружения в культуре клеток ген-репортер люциферазы был заменен геном для EGFP (усиленный зеленый флуоресцирующий белок), полученным из вектора pEGFP-N1 (Clontech Laboratories, Heidelberg).
Пример 3. Котрансфекция клеток нейробластомы человека
Клетки нейробластомы человека SH-SY5Y (АТСС CRL-2266) котрансфецировали обеими плазмидами по примерам 1 и 2 и затем исследовали под микроскопом в лучах света с длиной волны 480 нм, под действием которого происходило возбуждение EGFP. Таким образом, можно было обнаружить EGFP-экспрессирующие клетки, отличающиеся сильной зеленой флуоресценцией. Для гарантии того, что зеленая флуоресценция специфически зависит от экспрессии EGFP репортерной плазмидой, клетки SH-SY5Y трансфецировали только репортерной плазмидой pGL2-MRG5-EGFP. В указанных клетках не была обнаружена зеленая флуоресценция. Экспрессию активировали GAL4-VP16, которая предполагала протеолитическое выделение GAL4/VP16 из С-конца SP-C100-GAL4/VP16.
Пример 4. Использование системы С100-Gal4/VP16 для обнаружения кДНК, кодирующей активность γ-секретазы, в библиотеках кДНК
SP-C100-Gal4/VP16 клонировали в дрожжевом экспрессирующем векторе pDBTrp (Invitrogen™ life technologies, The Netherlands, № по каталогу 10835023) под контролем промотора МЕТ25, заменяя часть вектора pDBTrp, содержащего промотор ADH и домены GAL4DB (расположенные между геном CYH2 и несколькими сайтами клонирования), фрагментом ДНК, содержащим промотор МЕТ25 из р415МЕТ25 (Mumberg et al., 1994), вверху от SP-C100-Gal4-VP16. Данной конструкцией трансформировали дрожжевой штамм MaV203 (Invitrogen™ life technologies). Штамм MaV203 генетически модифицирован и содержит три GAL4-индуцибельных гена-репортера (URA3, HIS3, lacZ), которые устойчиво встроены в геном (Vidal et al., 1996). Протеолитическое выделение домена GAL4/VP16 в штамме MaV203 из SP-C100-Gal4-VP16 вызывало активацию считывания URA3 и HIS3, благодаря чему рост происходит на планшетах без урацила или гистидина.
Экспрессия кДНК белка SP-C100-Gal4-VP16 в штамме MaV203 вызывала настолько незначительную активность репортеров, что данная функционально активная in vivo система анализа пригодна для скрининга и обнаружения экспрессии кДНК γ-секретазы в библиотеке кДНК.
Пример 5. Идентификация γ-секретаз методом скрининга библиотеки кДНК В-клеток человека
Рекомбинантный дрожжевой штамм MaV203 по примеру 4 использовали для скрининга библиотеки кДНК В-клеток человека (АТСС 87286; Американская коллекция типовых культур, Manassas, VA, U.S.A.; Elledge et al., 1991) с целью поиска кДНК, кодирующей белок с активностью γ-секретазы. Альтернативно, для скрининга кДНК, кодирующей γ-секретазу или белок, обладающий γ-секретаза-подобной активностью, можно использовать библиотеку кДНК из гиппокампа человека, введенную в дрожжевые экспрессирующие векторы р415-МЕТ25 (Mumberg et al., 1994) или р415-ADH1 (Mumberg et al., 1995).
Пример 6. Клонирование SP2-C100 и SP2-C100-GAL4/VP16
Кодирующую область сигнального пептида человека SP-C100-GAL4/VP16 (описанного в примере 1) заменяли сигнальным пептидом, выделенным из гена SUC2 дрожжей (SP2; SEQ ID NO:12), в результате чего была получена конструкция, кодирующая SP2-C100-GAL4/VP16 (SEQ ID NO:19).
SP2-C100 создавали, амплифицируя кодирующую область зрелой формы С100 (без сигнальной последовательности, сравни SEQ ID NO:4) при помощи 5'-концевой затравки, которая включала кодирующую последовательность для сигнального пептида SUC2 (SEQ ID NO:12), и 3'-концевой затравки, соответствующей естественному терминирующему кодону (Kang et al., (1987)). Для облегчения замены сигнального пептида затравки ЕН47 (SEQ ID NO:23) и ЕН49 (SEQ ID NO:24) были созданы таким образом, чтобы полученный продукт PCR содержал дополнительный сайт NheI, соединяющий кодирующие области сигнального пептида и зрелого пептида.

Белок SP2-C100-GAL4/VP16 был получен путем расщепления EcoRI, в результате которого был вырезан фрагмент С100 из SP2-C100 и заменен фрагментом С100-GAL4/VP16.
Указанные фрагменты клонировали в дрожжевом экспрессирующем векторе pDBTrp (Invitrogen™ life technologies, The Netherlands, № по каталогу 10835023), содержащем промотор МЕТ25, описанный в примере 4.
Пример 7. Клонирование SP2-C-GAL4/VP16-100
Для получения конструкции SP2-C-GAL4/VP16-100 (SEQ ID NO:17) выполняли три независимые реакции PCR, используя нижеследующие затравки:
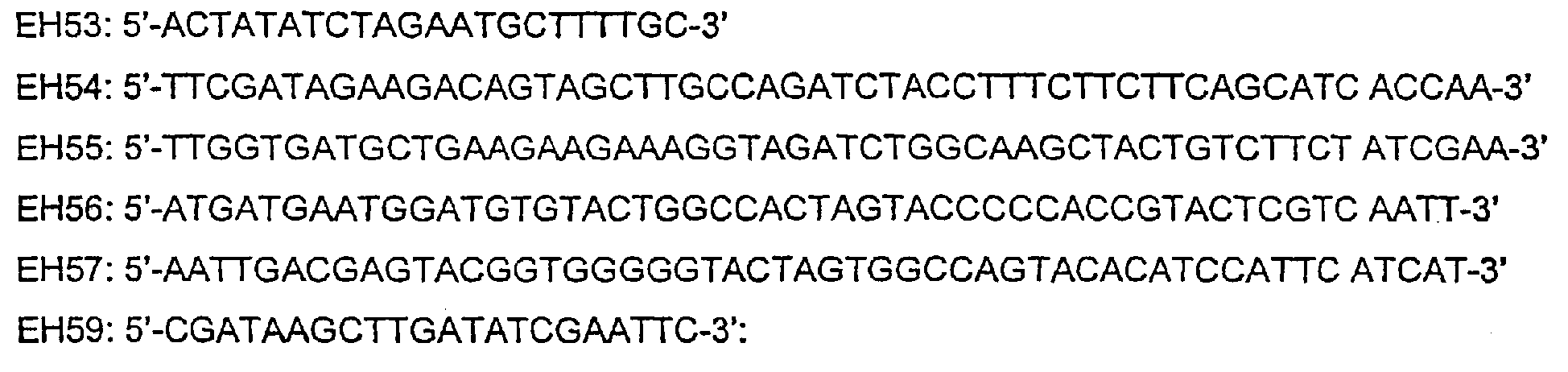
1. Используя SP2-C100 в качестве матрицы, с помощью затравок ЕН53 (SEQ ID NO:25) и ЕН54 (SEQ ID NO:26) амплифицировали эктодомен и трансмембранный домен С100 таким образом, чтобы продукт PCR содержал также 3'-концевую фланкирующую область, которая перекрывает кодирующую область GAL4/VP16.
2. Используя затравки ЕН55 (SEQ ID NO:27), ЕН56 (SEQ ID NO:28) и GAL4/VP16 в качестве матричной ДНК, выполняли реакцию PCR для амплификации кодирующей области 5'- и 3'-концевыми фланкирующими областями, соответствующими каждой стороне SP2-C100.
3. 3'-концевой сегмент SP2-C100, кодирующий цитоплазматический домен С100, амплифицировали с помощью затравок ЕН57 (SEQ ID NO:29) и ЕН59 (SEQ ID NO:30), в результате чего 5'-конец был перекрыт кодирующей областью GAL4/VP16. Полученные продукты PCR (около 200 п.о., 720 п.о. и 100 п.о.) очищали и использовали для выполнения последней PCR в присутствии затравок ЕН53 и ЕН59, соответствующих 5'- и 3'-концам SP2-C100. Продукт последней PCR длиной около 100 п.о. клонировали в дрожевом экспрессирующем векторе, полученном из pDBTrp (Invitrogen™ life technologies, The Netherlands, № по каталогу 10835023), который содержал промотор МЕТ25, описанный в примере 4.
Пример 8. Клонирование SP3-C100, SP3-C100-GAL4/VP16 и SP3-C-GAL4/VP16-100
Для создания трех плазмидных векторов, предназначенных для экспрессии SP3-C100, SP2-C100-GAL4/VP16 (SEQ ID NO:21) и SP3-C-GAL4/VP16-100 (SEQ ID NO:32) в клеточных системах млекопитающих, С100, С100-GAL4/VP16 или С-GAL4/VP16-100 субклонировали из дрожжевых экспрессирующих векторов по примеру 6 или 7 в экспрессирующем векторе pRc/CMV для клеток млекопитающих (Invitrogen, № по каталогу V75020), содержащем кодирующую область для сигнального пептида ВМ40 (SP3, SEQ ID NO:13). Кодирующие области C100, C100-GAL4/VP16 или С-GAL4/VP16-100 лигировали в рамке считывания с кодирующей областью SP3 на единственном сайте рестрикции NheI, описанном в примере 6.
Пример 9. Повышение экспрессии С100-GAL4/VP16 в дрожжах
Количественное определение уровня экспрессии разных конструкций в неочищенных лизатах из трансформированных дрожжей показало, что экспрессия SP-C100-GAL4/VP16 была очень низкой по сравнению с лизатами из дрожжевых клеток, трансформированных векторами, кодирующими слияния с сигнальным пептидом SUC2 дрожжей. Например, экспрессия SP2-C100-GAL4/VP16 вызывала сильную экспрессию специфической полосы ожидаемой величины. Однако методом иммуноблоттинга можно было также обнаружить полосы с более высокой электрофоретической подвижностью, что свидетельствует о неспецифическом разрушении рекомбинантного белка в дрожжах. Устойчивость белка была повышена в случае C-GAL4/VP16-100 (см. ниже) при введении домена GAL4/VP16 в рамке считывания в С100 рядом с сайтом расщепления γ-секретазой. Оба слитых белка характеризовались уровнями экспрессии, сравнимыми с конструкцией, кодирующей С100 без GAL4/VP16, свидетельствуя о том, что два разных слияния между С100 и GAL4/VP16 не мешали экспрессии белка.
Пример 10. Улучшение фонового сигнала в дрожжах
Повышенная экспрессия С100-GAL4/VP16 вследствие замены сигнальных пептидов соответствовала сильному увеличению неспецифической активации репортерных систем URA3, HIS3 и lacZ в дрожжевом штамме МаV203. Так как в дрожжах отсутствует активность γ-секретазы, подобный эффект, по-видимому, был результатом неспецифического процессинга С100-GAL4/VP16 клеточными протеазами и выделения активного GAL4/VP16.
При перемещении домена GAL4/VP16 ближе к сайту расщепления γ-секретазой было по существу полностью устранено неспецифическое протеолитическое расщепление, обнаруженное в С100-GAL4/VP16 на сайтах между трансмембранным доменом С100 и аминоконцом домена GAL4/VP16.
Расщепление разных конструкций испытывали в штамме МаV203 путем исследования GAL4/VP16-зависимой активации репортерных систем.
В результате трансформации штамма MaV203 при помощи SP-C100-GAL/VP16 был получен фенотип Ura+, His- (сравни пример 4). Увеличение уровней экспрессии вследствие замены сигнального пептида SP пептидом SP2 (с образованием SP2-C100-GAL4/VP16) вызвало сильную активацию всех показателей до уровня, аналогичного обнаруженному в положительном контрольном образце, причем штамм MaV203 конститутивно экспрессировал непроцессированный (полноразмерный) белок GAL4 (кодированный плазмидой pCL1; Clontech Laboratories).
В отличие от этого клетки MaV203, экспрессирующие SP2-C-GAL4/VP16-100 на уровне, сравнимом с SP2-C100-GAL4/VP16, создавали фенотип Ura-, His-, который также был образован штаммом MaV203, трансформированным пустым контрольным вектором.
Поэтому SP2-C-GAL4/VP16-100 может быть высоко экспрессирован в дрожжах, но по-прежнему характеризуется очень низкой неспецифической активацией GAL4-зависимых репортеров. Высокая экспрессия белка SP2-C-GAL4/VP16-100 в сочетании со слабым фоновым сигналом неспецифического расщепления/активации репортера является отличительной особенностью системы считывания с оптимизированным отношением сигнал - шум.
Пример 11. Процессинг белка SP3-C-GAL4/VP16-100 γ-секретазой в клетках млекопитающих
Для подтверждения того, что белок SP3-C-GAL4/VP16-100, экспрессированный в клетках млекопитающих, правильно процессирован γ-секретазой, белок SP3-C-GAL4/VP16-100 трансфецировали в клетки млекопитающих, которые, как было установлено, эндогенно экспрессируют γ-секретазу (Haass et al., 1992). Для экспрессии в клетках млекопитающих сигнальный пептид в SP2-C-GAL4/VP16-100 был заменен аналогично примеру 8 сигнальным пептидом млекопитающих, выделенным из белка базальной мембраны ВМ40, который известен высоким уровнем экспрессии (SP3; SEQ ID NO:13). Процессинг γ-секретазой контролировали путем количественного определения секреции Аβ в культуральную среду. Секретированный Аβ обнаруживали методом многослойного анализа ELISA с использованием моноклональных антител 6Е10 и биотинилированных антител 4G8 (Senetek PLC, Napa, California, USA; сравни Kim et al., 1990) соответственно в качестве иммобилизованных и идентифицирующих антител.
После трансфекции SP3-C100 наблюдалось восьмикратное увеличение секреции Аβ по сравнению с пустым контрольным вектором. Клетки, трансфецированные SP3-C100-GAL4/VP16 или SP3-C-GAL4/VP16-100, секретировали аналогичные количества Аβ, из чего следует, что ни С-концевое, ни околомембранное слияние GAL4/VP16 не влияет на протеолитический процессинг γ-секретазой.
Пример 12. Активация транскрипции GAL4/VP16-зависимого гена-репортера белком С-GAL4/VP16-100, экспрессированным в клетках млекопитающих
Процессинг С100-GAL4/VP16 и С-GAL4/VP16-100 γ-секретазой вызывает выделение полипептида, содержащего GAL4/VP16 и дополнительные аминокислоты, из фланкирующих частей С100. Белки SP3-C100-GAL4/VP16 и SP3-C-GAL4/VP16-100 котрансфецировали репортерной плазмидой pGL2-MRG5-EGFP для клеток млекопитающих (Ikeda et al., 1998), описанной в примере 2, которая содержит пять ДНК-связывающих сайтов GAL4 вверху от центрального промотора вируса иммунодефицита человека (ВИЧ) и кДНК, кодирующей ЕGFP. Котрансфекция pGL2-MRG5-EGFP в GAL4/VP16-содержащие слитые белки в обоих случаях вызывала появление GFP-положительных клеток.
Пример 13. Создание экспрессирующей плазмиды SP3-C55-GAL4/VP16 для клеток млекопитающих
Конструкции, содержащие последовательность С100 АРР и GAL4/VP16, включают сайт расщепления γ-секретазой и сайт расщепления каспаза-подобными протеазами. Во избежание расщепления SP3-C100-GAL4/VP16 неспецифической каспаза-подобной протеазой между аутентичным сайтом γ-секретазы и доменом GAL4/VP16 с выделением GAL4/VP16 и активацией репортерной системы в клетках млекопитающих, удаляли находящийся в SP3-C100-GAL4/VP16 С-концевой сегмент С100, включающий 45 аминокислот и кодирующий цитоплазматический домен АРР. Удаление 45 С-концевых аминокислот в С100 позволяет также устранить “сигнальный пептид интернализации” у С-конца АРР, который направляет эндоцитоз АРР после введения в плазматическую мембрану.
Таким образом, экспрессирующая плазмида SP3-C55-GAL4/VP16 для клеток млекопитающих содержит сигнальный пептид ВМ40 (SEQ ID NO:13), 55 N-концевых аминокислотных остатков (С55; SEQ ID NO:6) АРР-С100 и GAL4/VP16. С55 начинается у N-конца Аβ-пептида и заканчивается у трансмембранного домена АРР. В белке SP3-C55-GAL4/VP16 имеется только сайт расщепления γ-секретазой. С55 включает сайт расщепления γ-секретазой и должен быть расщеплен γ-секретазой для выделения Аβ-пептида и GAL4/VP16. Кроме того, поскольку эндоцитический сигнальный пептид интернализации отсутствует в SP3-C55-GAL4/VP16, только катализируемое γ-секретазой расщепление С55-GAL4/VP16, связанного с плазматической мембраной, вызывает выделение Аβ-пептида и активацию GAL4/VP16-зависимой транскрипции репортерной системы.
Данная экспрессирующая плазмида была получена из вектора SP3-C-GAL4/VP16-100 путем введения терминирующего кодона (TAG) после последовательности GAL4/VP16. Такую операцию выполняют, заменяя фрагмент HpaI-ClaI белка SP3-C-GAL4/VP16-100, фрагментом ДНК, полученным методом PCR с использованием SP3-C-GAL4/VP16-100 в качестве матричной ДНК, 5'-концевой затравки вверху от единственного сайта HpaI в GAL4/VP16 и 3'-концевой затравки (5'-CCATCGATTTTCTAACCCCCACCGTA-3'; SEQ ID NO:31), которая вводит терминирующий кодон TAG (подчеркнут) и сайт рестрикции ClaI у С-конца открытой рамки считывания GAL4/VP16.
Пример 14. Устойчиво трансфецированные клетки НЕК293
Клетки НЕК293 (линия эмбриональных клеток почки человека, (АТСС)) котрансфецировали плазмидой SP3-C55-GAL4/VP16 и репортерной плазмидой на основе люциферазы PGL2-MRG5 (описанной в примере 2). Затем отбирали линии устойчивых клеток, для чего указанные клетки инкубировали с 400 мкг/мл генетицина (GibcoBRL), отбирали клоны, устойчивые к неомицину, и исследовали в отношении устойчивой экспрессии SP3-C55-GAL4/VP16 и люциферазы.
Пример 15. Временная трансфекция клеток НЕК293
Клетки НЕК293 котрансфецировали вектором SP3-C55-GAL4/VP16 (0,03 мкг) и репортерным вектором на основе люциферазы pGL2-MRG5 (1 мкг) на 12 многолуночных планшетах.
Соединения DPAT (компании Elan Pharmaceuticals; Dovey et al., 2001) и L-685458 (компании Merck Pharmaceuticals; Shearman et al., 2000), известные как ингибиторы γ-секретазы, независимо от дозы ингибировали активность люциферазы и продуцирование Аβ и имели значения IC50, равные соответственно 14 нМ (DAPT) и 19 нМ (L-685458).
Количественное определение активности люциферазы производили при помощи набора для анализа люциферазы Bright-Glo (Promega). Количественное определение Аβ в клеточной среде производили методом ELISA, описанным в примере 11, используя антитела 4G8 и 6Е10 (компании Senetek). Указанные антитела являются специфичными к аминокислотам 17-24 (4G8) и 1-17 (6E10) Аβ-пептида.
В экспериментах по временной трансфекции Аβ также идентифицировали методами иммунопреципитации и иммуноблоттинга. Обоими методами была обнаружена полоса 4 кДа, соответствующая Аβ-пептиду.
Пример 16. Фармакологическое исследование устойчиво трансфецированных клеток НЕК293
Клон клеток НЕК293, устойчиво экспрессирующих SP3-C55-GAL4/VP16 и конструкции MRG5-люцифераза, идентифицировали в соответствии с примером 14. Данный клон клеток использовали для исследования реакции анализируемой системы устойчиво трансфецированных клеток млекопитающих на DAPT (компании Elan Pharm.; Dovey et al., 2001) и L-685458 (компании Merck Pharm.; Shearman et al., 2000). Оба соединения ингибировали активность люциферазы (24-часовая обработка) независимо от дозы при значениях IC50, равных соответственно 230 нМ (DAPT) и 130 нМ (L-685458).
Пример 17. Идентификация ингибиторов γ-секретазы
Для идентификации ингибиторов γ-секретазы дважды устойчиво трансфецированные клетки НЕК293 (см. пример 14) инкубировали на 96-многолуночных планшетах в присутствии одного или нескольких исследуемых соединений (например, скрининг библиотеки соединений) при создаваемой в анализе концентрации, равной 10 мкМ или ниже, и через 24 часа определяли активность люциферазы. Количественное определение активности люциферазы можно произвести при помощи набора для анализа люциферазы (Promega), набора для анализа люциферазы Bright-Glo (Promega) или любого другого метода количественного определения люциферазы. Снижение активности люциферазы отражает снижение активности γ-секретазы.
Ссылки
Dovey et al. (2001) J. Neurochem. 76, 173.
Elledge et al. (1991) Proc. Natl. Acad. Sci. USA 88. 1731.
Estus et al. (1992) Science 255, 726.
Haass et al. (1992) Nature 359. 322.
Heijne et al. (1986) Nucl. Acids Res. 14(11), 4683-4690.
Hilbich et al. (1991) J. Mol. Biol. 218, 149.
Ikeda et al. (1998) Mol. Cell. Biol. 18, 10.
Kang et al. (1987) Nature 325, 733.
Kim et al. (1990) Neurosci Res. Comm. 7, 113.
Kretzschmar et al. (1994) Mol. Cell. Biol. 14. 3927.
Maruyama et al. (1994) Biochem. Biophys. Res. Commun. 202, 1517.
Mattson (2003) Nature 422, 385.
Mumberg et al. (1994) Nucl. Acids Res. 22, 5767.
Mumberg et al. (1995) Gene 156, 119.
Rumble et al. (1989), N. Engl. J. Med. 320, 1446.
Sadowski et al. (1988) Nature 335, 563.
Scheuner et al. (1996), Nature Medicine 2, 864.
Shearman et al. (2000) Biochemistry 39, 8698.
Simons et al. (1996) J. Neurosci. 16(3), 899-908.
Suzuki et al. (1994) Science 264(5163), 1336-1340.
Vidal et al. (1996) Proc. Natl. Acad. Sci. USA 93, 10315.
Yankner et al.(1990) Proc. Natl. Acad. Sci. USA 87, 9020.
Для общей работы с рекомбинантной ДНК:
Sambrook, J., Fritsch, E. F., and Maniatis, T. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
Для работы с дрожжами (трансформация ДНК):
Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Seidman, J. G., Smith, J. A. and Struhl, K. (1994) Current Protocols in Molecular Biology, pp. 13.7.1-13.7.2. Greene Publishing Associates/Wiley-Interscience, New York.
Для работы с организмом C. elegans (трансгенные организмы):
Mello, C. and Fire, A. (1995) DNA transformation. In: Epstein, H.F. and Shakes. D.C., ed. Caenorhabditis elegans: Modern Biological Analysis of an Organism. Methods in Cell Biology, Vol. 48. Academic Press, San Diego, CA, pp. 451-482.
SEQ ID NO:1 (фрагмент АРР)
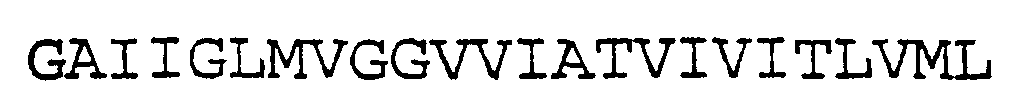
SEQ ID NO:2 (фрагмент АРР (первый неполный белок))
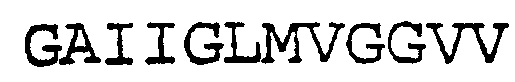
SEQ ID NO:3 (фрагмент АРР (второй неполный белок))

SEQ ID NO:4 (фрагмент С100)
SEQ ID NO:5 (сигнальный пептид АРР человека (SP))

SEQ ID NO:6 (фрагмент С55)
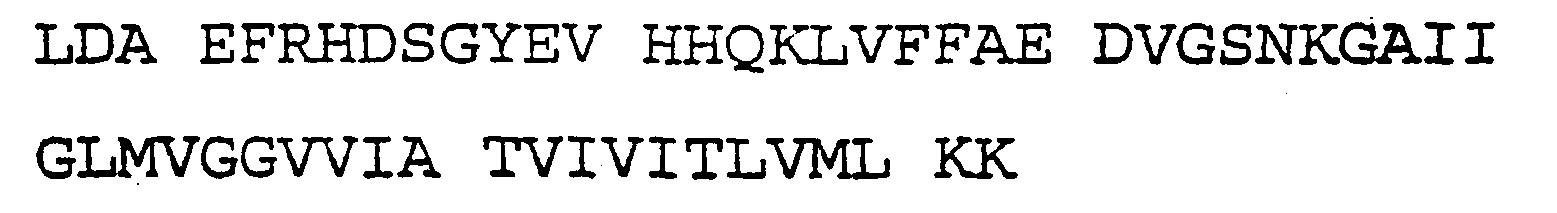
SEQ ID NO:7 (GAL4-VP16)

SEQ ID NO:8 (SP-C100-GAL4-VP16)

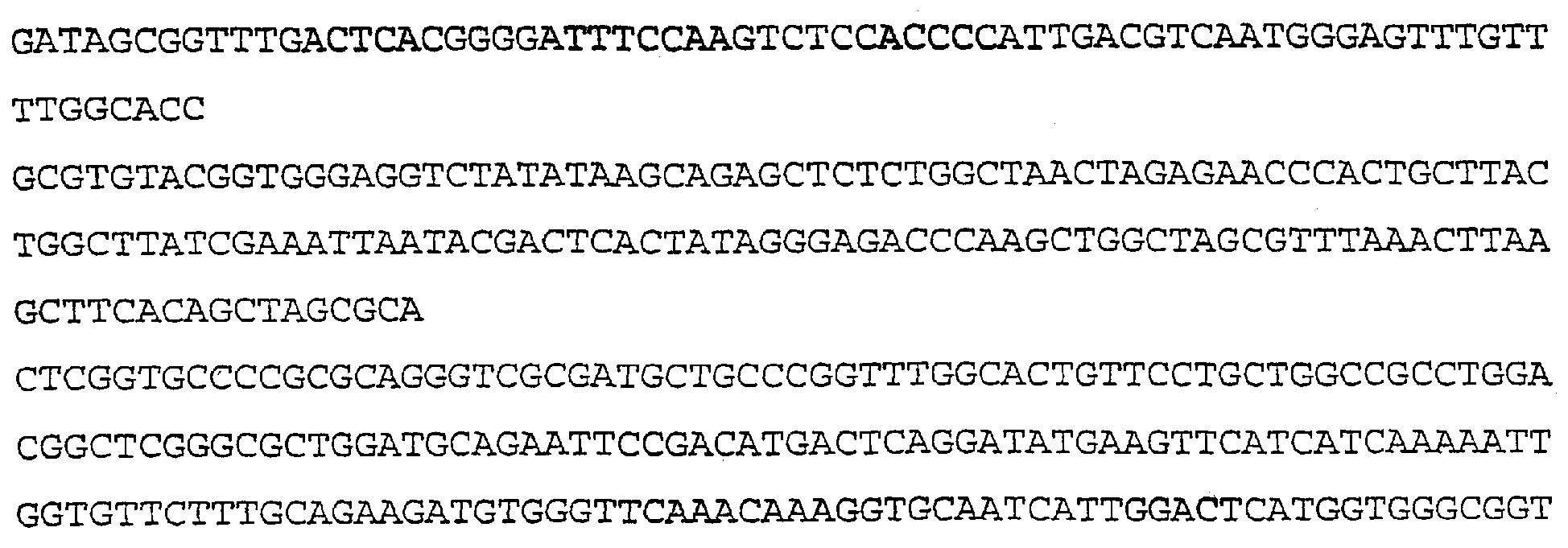

SEQ ID NO:9 (АРР человека)
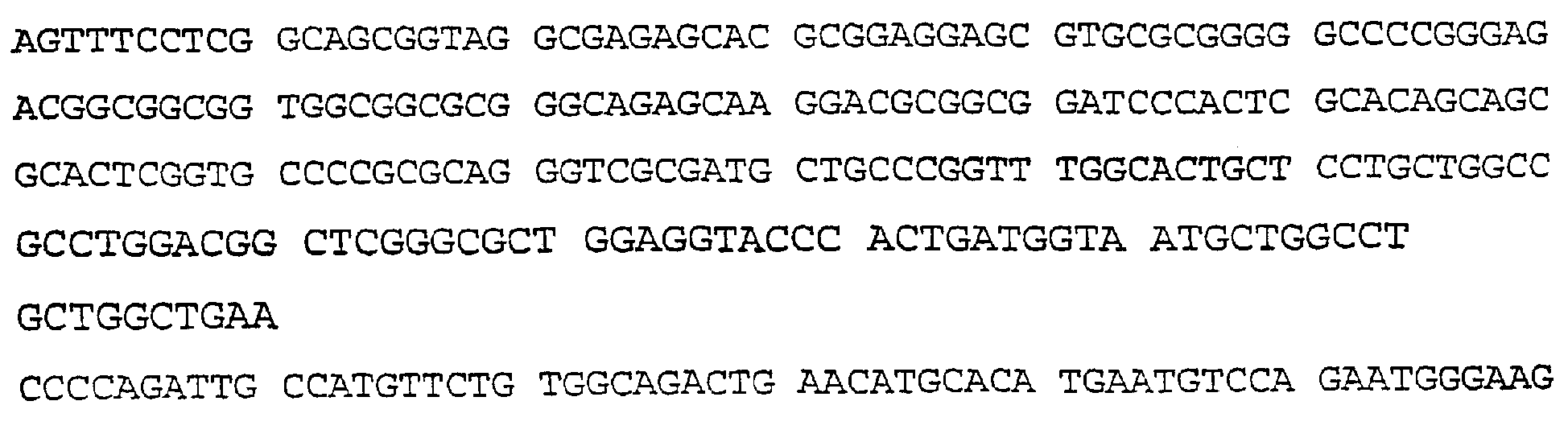


SEQ ID NO:10 (Рекомбинантная плазмида pDBTrp-MET25-SP-C100-GAL4-VP16)





SEQ ID NO:11 (слитый белок SP-C100-GAL4-VP16)

SEQ ID NO:12 (сигнальный пептид гена SUC2 дрожжей (SP2))
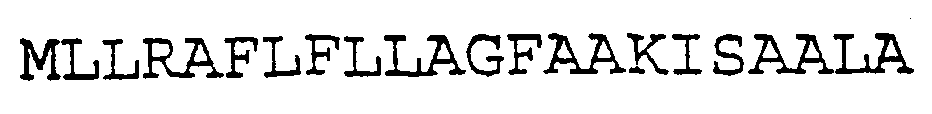
SEQ ID NO:13 (сигнальный пептид белка базальной мембраны млекопитающих ВМ40 (SP3))

SEQ ID NO:14 (SP-C55-GAL4-VP16)

SEQ ID NO:15 (SP-C55-GAL4/VP16-TAG)




SEQ ID NO:16 (Рекомбинантная плазмида pDBTrp-MET25-SP-C-Gal4/VP16-100)




SEQ ID NO:17 (SP2-C-GAL4/VP16-100)
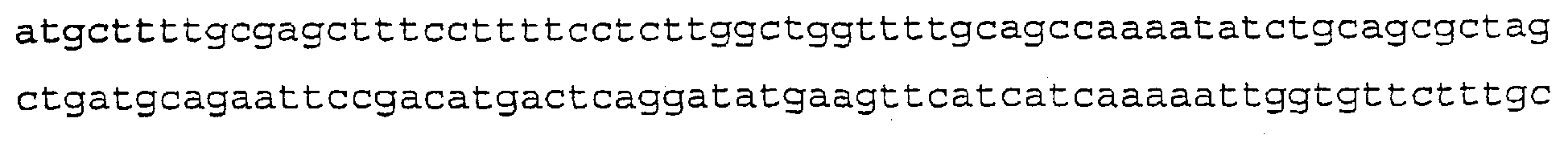
SEQ ID NO:18 (SP2-C-GAL4/VP16-100)

SEQ ID NO:19 (SP2-C100-GAL4/VP16)

SEQ ID NO:20 (SР2-C100-GAL4/VP16)

SEQ ID NO:21 (SP3-C100-GAL4/VP16)

SEQ ID NO:22 (SP3-C100-GAL4/VP16)

SEQ ID NO:23 (Затравка ЕН47)

SEQ ID NO:24 (Затравка ЕН49)
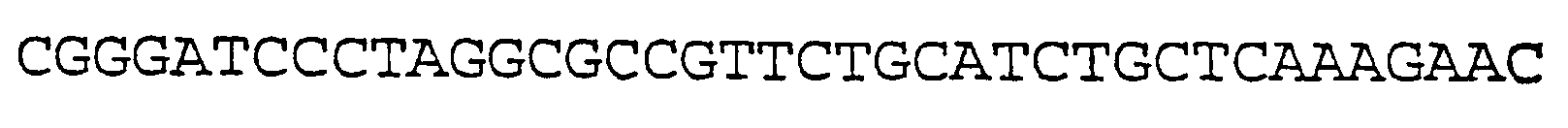
SEQ ID NO:25 (Затравка ЕН53)
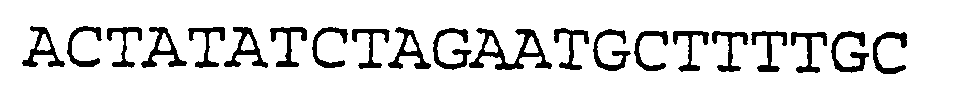
SEQ ID NO:26 (Затравка ЕН54)

SEQ ID NO:27 (Затравка ЕН55)

SEQ ID NO:28 (Затравка ЕН56)
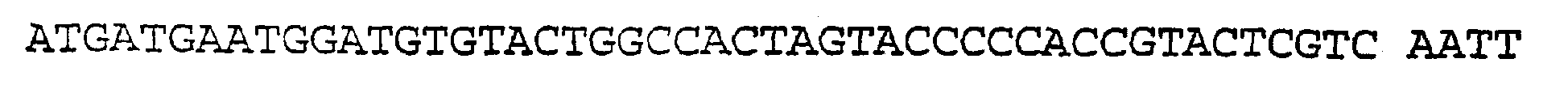
SEQ ID NO:29 (Затравка ЕН57)

SEQ ID NO:30 (Затравка ЕН59)

SEQ ID NO:31 (3'-концевая затравка С55)

SEQ ID NO:32 (Плазмида SP3-C-GAL4/VP16-100)




Реферат
Изобретение относится к области биотехнологии, конкретно к способу идентификации γ-секретазы и ее ингибиторов, и может быть использовано в медицине при поиске активных соединений для лечения болезни Альцгеймера. Создают генетическую конструкцию, кодирующую слитый белок, содержащий сигнальный пептид и аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML. В полученном слитом белке, за исключением последовательности GAIIGLMVGGVVIATVIVITLVML, исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой. Изобретение позволяет с большей эффективностью идентифицировать γ-секретазу или вещества, ингибирующие ее активность за счет уменьшения фонового сигнала и увеличения специфичности сигнала. 13 н. и 28 з.п. ф-лы, 4 ил.
Формула
А. используют генетическую конструкцию, кодирующий слитый белок, содержащий
a) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
c) промотор и
d) при необходимости, дополнительные кодирующие и/или не кодирующие нуклеотидные последовательности;
В. указанную генетическую конструкцию вводят в клетку, и в ней эксперессируется ген, кодирующий слитый белок, который
i) расщепляется в результате активности γ-секретазы с образованием первого неполного белка, содержащего аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO: 2), и второго неполного белка, содержащего аминокислотную последовательность VIVITLVML (SEQ ID NO: 3);
ii) не расщепляется в случае отсутствия в клетке активной γ-секретазы;
С. по образованию первого неполного белка и/или второго неполного белка определяют присутствие в клетке активной γ-секретазы;
и который отличается тем, что генетическая конструкция, кодирующая слитый белок, подобрана с учетом того, что за исключением SEQ ID NO:1 в указанном слитом белке исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
А. используют генетическую конструкцию, кодирующую слитый белок, содержащий
a) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
c) промотор и
d) при необходимости, дополнительные кодирующие и/или не кодирующие нуклеотидные последовательности;
В. указанную генетическую конструкцию вводят в клетку, и в ней эксперессируется ген, кодирующий слитый белок, который
i) расщепляется в результате активности γ-секретазы с образованием первого неполного белка, содержащего аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второго неполного белка, содержащего аминокислотную последовательность VIVITLVML (SEQ ID NO:3);
ii) не расщепляется в случае отсутствия в клетке активной γ-секретазы;
С. по наличию второго неполного белка в цитозоле клетки, определяют присутствие в клетке активной γ-секретазы;
и который отличается тем, что генетическая конструкция, кодирующая слитый белок, подобрана с учетом того, что за исключением SEQ ID NO:1 в указанном слитом белке исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
a) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
c) промотор и
d) по крайней мере одну дополнительную нуклеотидную последовательность у 3'-конца первой нуклеотидной последовательности, которая кодирует ДНК-связывающий домен и домен, активирующий транскрипцию,
отличающаяся тем, что генетическая конструкция, кодирующая слитый белок, подобрана с учетом того, что, за исключением SEQ ID NO:1, в указанном слитом белке исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза и/или сайта расщепления протеазой.
а) получают клетку по п.34, которую трансформируют способом по пп.25 и 26; и
b) идентифицируют клетку, в которой образовался второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3) в соответствии со способом по любому или нескольким из пп.2-26;
c) выделяют из указанной клетки кДНК, кодирующую γ-секретазу.
А. получение трансгенного организма, отличного от человеческого, или трансгенной клетки, которые содержат генетическую конструкцию, содержащую следующие элементы:
a) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
c) промотор и
d) при необходимости дополнительные не кодирующие и/или кодирующие нуклеотидные последовательности;
репортерную плазмиду, имеющую сайт связывания белка, минимальный промотор, ген-репортер и, при необходимости, кДНК, кодирующую γ-секретазу, субъединичный белок γ-секретазы или γ-секретазоподобную протеиназу,
при этом трансгенный организм, отличный от человеческого, или трансгенная клетка экспрессирует генетическую конструкцию и, при необходимости, γ-секретазу, субъединичный белок γ-секретазы или γ-секретазоподобную протеиназу, кодируемую указанной кДНК;
В. культивирование трансгенного организма, отличного от человеческого, или трансгенной клетки с исследуемым веществом и
С. определение количества второго неполного белка с помощью указанной репортерной плазмиды, где высвобождение второго неполного белка активирует экспрессию указанного репортерного гена, который обнаруживается в трансгенном организме, отличном от человеческого, или в трансгенной клетке, отличной от человеческой, причем количество второго неполного белка определяют в присутствии и отсутствии исследуемого вещества;
отличающийся тем, что генетическая конструкция, кодирующая слитый белок, подобрана с учетом того, что за исключением SEQ ID NO:1 в указанном слитом белке исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.
А. используют генетическую конструкцию, содержащую следующие элементы:
a) первую нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность GAIIGLMVGGVVIATVIVITLVML (SEQ ID NO:1);
b) вторую нуклеотидную последовательность, кодирующую сигнальный пептид, у 5'-конца первой нуклеотидной последовательности;
c) промотор и
d) при необходимости дополнительные кодирующие и/или не кодирующие нуклеотидные последовательности;
В. указанную генетическую конструкцию, репортерную плазмиду, которая содержит сайт связывания белка, минимальный промотор и ген репортер, и, при необходимости кДНК, кодирующую γ-секретазу, субъединичный белок γ-секретазы или γ-секретазоподобную протеиназу, вводят в клетку, и в ней синтезируется слитый белок, кодируемый указанной генетической конструкцией, и, при необходимости, γ-секретазу, субъединичный белок γ-секретазы или γ-секретазоподобную протеиназу, кодируемую указанной кДНК, в присутствии исследуемого вещества;
С. слитый белок
a) расщепляется внутри аминокислотной последовательности SEQ ID NO:1 γ-секретазой, субъединичным белком γ-секретазы или γ-секретазоподобной протеиназой, присутствующей в клетке, в случае, если исследуемое вещество не является ингибитором активности γ-секретазы, субъединичного белка γ-секретазы или γ-секретазоподобной протеиназы, в результате чего образуется первый неполный белок, содержащий аминокислотную последовательность GAIIGLMVGGVV (SEQ ID NO:2), и второй неполный белок, содержащий аминокислотную последовательность VIVITLVML (SEQ ID NO:3), или
b) не расщепляется внутри аминокислотной последовательности SEQ ID NO:1 γ-секретазой, субъединичным белком γ-секретазы или γ-секретазоподобной протеиназой, присутствующей в клетке, в случае, если исследуемое вещество является ингибитором активности γ-секретазы, субъединичного белка γ-секретазы или γ-секретазоподобной протеиназы, в результате чего не образуется обнаруживаемое количество первого и/или второго неполного белка;
D. определяют количество второго неполного белка с помощью указанной репортерной плазмиды, где высвобождение второго неполного белка активирует экспрессию указанного репортерного гена, который обнаруживается в трансгенном организме, причем количество второго неполного белка определяют в присутствии и отсутствии исследуемого вещества;
отличающийся тем, что генетическая конструкция, кодирующая слитый белок, подобрана с учетом того, что за исключением SEQ ID NO:1 в указанном слитом белке исключены все сайты, действующие в качестве сигнала для эндо- или экзоцитоза, и/или сайта расщепления протеазой.

Комментарии