Вектор (варианты), основанный на рекомбинантном дефектном вирусном геноме, и его применение для создания препаратов вакцин - RU2199584C2
Код документа: RU2199584C2
Чертежи















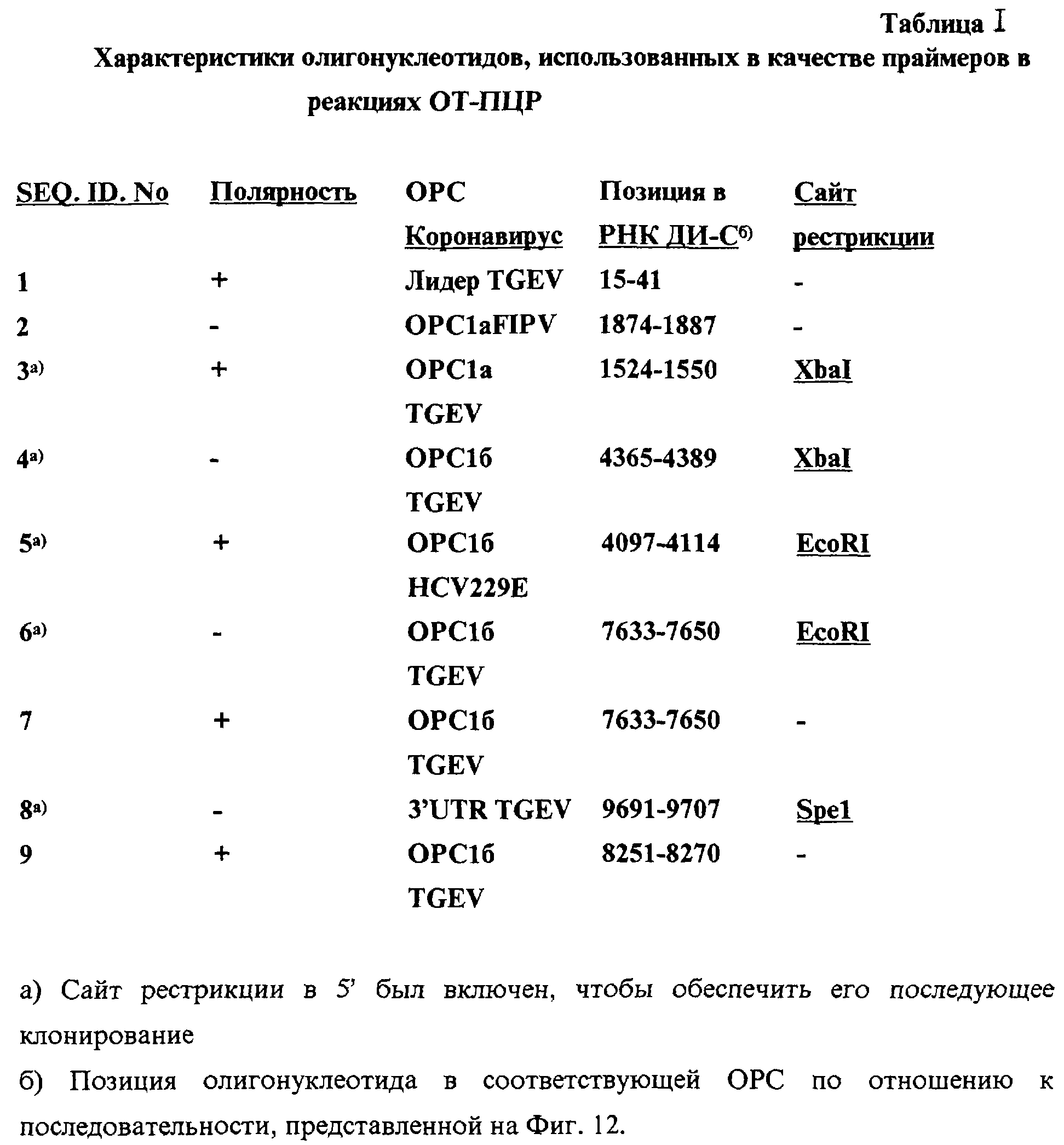











Описание
Такие векторы содержат рекомбинантный дефектный вирусный геном, экспрессирующий по меньшей мере один антиген, пригодный для индукции системного и секреторного иммунных ответов. Дефектный вирусный геном содержит геном родительского вируса, имеющий сигналы для узнавания вирусной репликазой, локализованные на 3' и 5'-концах, кроме того, содержащий внутренние делеции, и в котором указанный дефектный вирусный геном зависит от хелперного вируса для его репликации. Эти векторы пригодны для создания рекомбинантной системы, включающей в себя: (а) вышеуказанный вектор экспрессии, и (б) хелперный вирус, который дает функциональные и структурные белки для репликации и капсидирования дефектного генома. Эта система является пригодной для производства моно- и поливалентных вакцин против инфекционных агентов различных видов животных, в особенности свиней, собак и кошек.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к ряду векторов, основанных на рекомбинантных дефектных
вирусных геномах, экспрессирующих антигены, пригодные для индукции системного и секреторного иммунных ответов для предупреждения инфекций слизистой оболочки, и к их применению в целях вакцинирования
вместе с соответствующим хелперным вирусом.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Создание рекомбинантных белков с использованием векторов экспрессии является хорошо известным фактом. Как
правило, прокариотические и дрожжевые системы экспрессии являются высокоэффективными и простыми в применении, тогда как в используемых системах экспрессии, содержащих клетки высших эукариот, имеет
место ряд недостатков, относящихся к низким уровням продукции белка и ограничениями круга хозяев. Из существующих систем экспрессии для клеток высших эукариот наиболее эффективными в отношении
продукции белка являются векторы, основанные на бакуловирусах. Однако их можно использовать только в клетках насекомых, которые, как известно, гликозилируют белки иным путем, чем клетки животных.
Кроме того, конструирование рекомбинантного вируса осуществляется посредством гомологичной рекомбинации, которая представляет собой трудоемкую методику, особенно если приходится анализировать
многочисленные генетические варианты.
С другой стороны, известны векторы, пригодные для экспрессии гетерологичных генов, основанные на ДНК-содержащих вирусах. Однако в применении вирусов на основе ДНК имеет место ряд недостатков, так как они не надежны в связи с тем, что реплицируются в ядре клетки-хозяина и могут интегрировать в ее геном. Напротив, применение векторов на основе РНК позволяет преодолеть недостатки, связанные с применением ДНК-содержащих вирусов, так как то, что векторы на основе РНК-содержащих вирусов реплицируются не в геноме клетки-хозяина, а в цитоплазме, а их репликация осуществляется посредством РНК, а не ДНК, поэтому возможности их интеграции в геном очень малы, что делает эти векторы более надежными.
Хорошо известными являются также дефектные интерферирующие частицы (ДИ), которые содержат капсид вириона и дефектный геном и представляют собой делеционные субгеномные мутанты, образованные большей частью из инфекционных вирусных геномов посредством ошибки репликации. Как правило, термин "ДИ частица" относится к дефектным вирусам, у которых отсутствует район РНК или ДНК генома, содержащий белки и антигены вируса, и которым требуется коинфекция инфекционным родительским вирусом (хелперным вирусом) для их репликации, и специфически интерферируют с гомологичным хелперным вирусом, поскольку они реплицируются за счет него [Huang and Baltimore, Nature, 226, 325-327 (1970)] . ДИ геномы образуются вследствие геномных перестроек в результате сдвигов РНК-полимеразы от одной РНК матрицы к другой или от одного сегмента РНК матрицы к другому сегменту той же молекулы. Эти ДИ геномы, однажды образовавшись, амплифицируются самостоятельно за счет родительского генома или амплифицирующегося вируса, кодирующего белки, вовлеченные в репликацию и капсидирование, который должен конкурировать с дефектными геномами за такие продукты.
ДИ частицы были получены и охарактеризованы у некоторых коронавирусов, таких как мышиный вирус гепатита (MHV), вирус инфекционного бронхита (IBV) и бычий коронавирус (BCV), хотя ДИ частицы, происходящие от вируса трансмиссивного гастроэнтерита свиней (TGEV), не были описаны. Одна из природных ДИ частиц MHV была использована в качестве основы для конструирования вектора экспрессии, в котором экзогенный ген встроен под контролем внутренней последовательности промотора транскрипции [Lin and Lai, J. Virol., 6110-6118, Oct. (1993)].
Как правило, известные векторы экспрессии гетерологичных генов на основе ДИ частиц обладают некоторыми недостатками, связанными с видоспецифичностью и органоспецифичностью их мишени и с их ограниченной емкостью для клонирования, что ограничивает возможность их применения как в фундаментальных исследованиях, так и в прикладных исследованиях для создания таких векторов в терапевтических целях, включая вакцины.
Следовательно, до сих пор существует потребность в векторах экспрессии гетерологичных генов, которые могут позволить успешно преодолеть упомянутые недостатки. Конкретно, было бы очень полезно иметь в распоряжении несколько векторов экспрессии гетерологичных генов с высоким уровнем безопасности и емкости клонирования, которые были бы сконструированы таким образом, чтобы их видоспецифичность и тропизм можно было легко контролировать.
Настоящее изобретение предлагает решение существующей проблемы, включающее в себя вектор, основанный на рекомбинантном дефектном вирусном геноме, экспрессирующем антигены, пригодные для индукции иммунного ответа и для предупреждения инфекций, вызванных различными инфекционными агентами, у разных видов животных. Векторы экспрессии гетерологичных генов (или последовательности ДНК), предлагаемые данным изобретением, обладают высоким уровнем безопасности, так же как и высокой емкостью клонирования, и могут быть сконструированы таким образом, что их видоспецифичность и тропизм можно легко контролировать, что делает такие векторы пригодными для создания препаратов вакцин, способных обеспечить защиту от инфекций, вызванных рядом инфекционных агентов, у различных видов животных.
Таким образом, объектом настоящего изобретения является вектор, основанный на рекомбинантном дефектном вирусном геноме, экспрессирующий по меньшей мере один антиген, пригодный для индукции иммунного ответа, особенно системного и секреторного иммунного ответа против инфекционных агентов у разных видов животных, или антитело, обеспечивающее защиту против инфекционного агента, обладающий высоким уровнем безопасности и высокой емкостью клонирования, и который можно сконструировать таким образом, чтобы его видоспецифичность и тропизм можно было легко контролировать.
Дефектный вирусный геном, который служит основой для конструкции указанного вектора, является также дополнительным объектом данного изобретения.
Другим дополнительным объектом данного изобретения является рекомбинантная система экспрессии гетерологичных белков, включающая в себя: (а) вектор, описанный выше и (б) хелперный вирус, который должен дать белки, вовлеченные в репликацию и капсидирование рекомбинантного дефектного вирусного генома.
Еще одним дополнительным объектом данного изобретения являются вакцины, способные индуцировать защиту против инфекций, вызванных рядом инфекционных агентов, у различных видов животных, включающие в себя рекомбинантную систему, описанную выше, вместе с фармацевтически приемлемым эксципиентом. Эти векторы могут быть уни- или мультивалентными, в зависимости от того, экспрессируют ли векторы экспрессии, присутствующие в рекомбинантной системе, один или более чем один антиген, способный индуцировать иммунный ответ против одного или более чем одного инфекционного агента, либо одно или более чем одно антитело, обеспечивающее защиту против одного или более чем одного инфекционного агента.
Другие объекты, предлагаемые данным изобретением, включают в себя способ иммунизации животных, состоящий во введении указанной рекомбинантной системы или вакцины, также как и способ защиты новорожденных животных от инфекционных агентов, которые инфицируют упомянутые виды.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
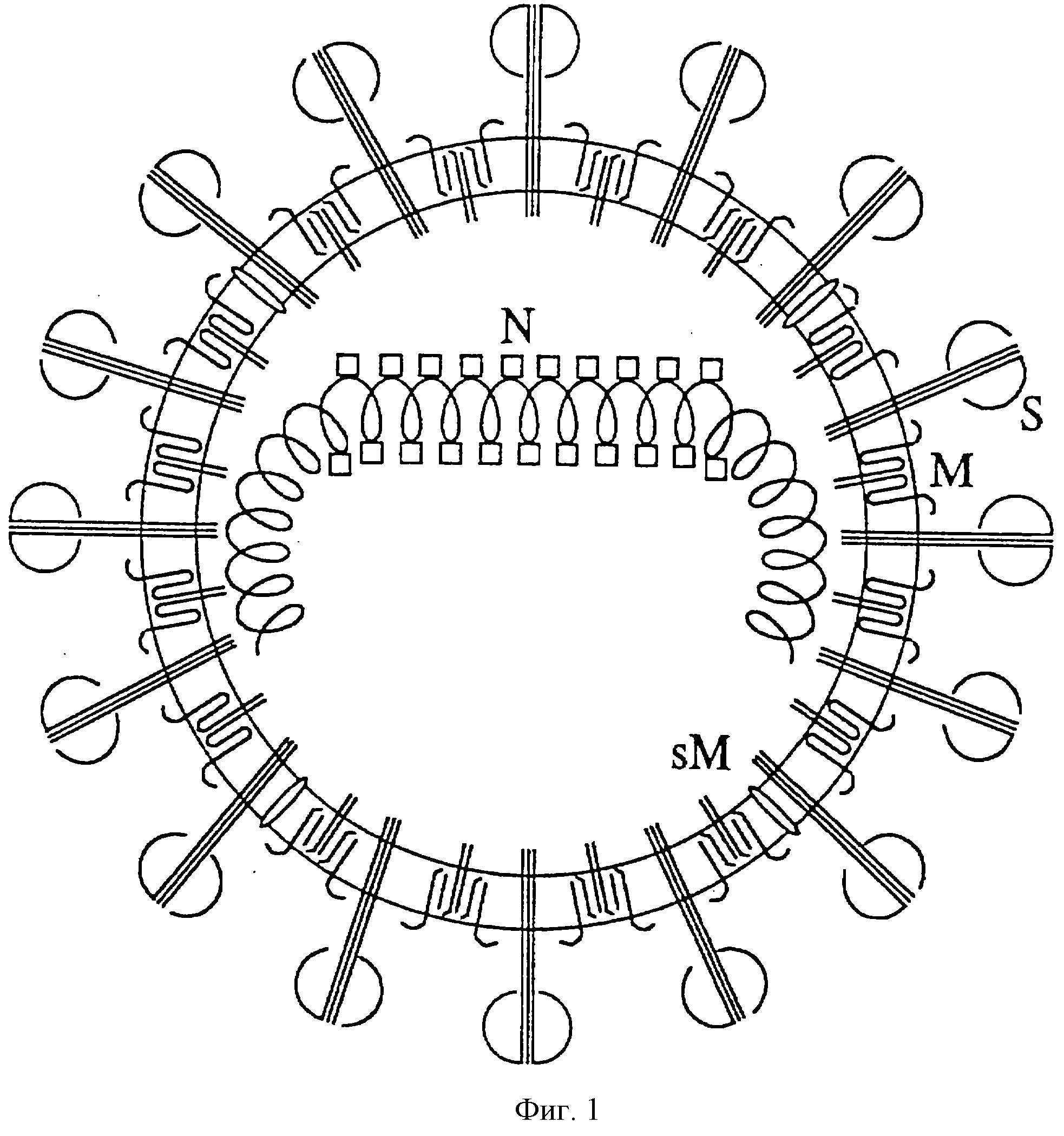
На фиг.1 показана
структура TGEV. Вирион представляет собой сферическую частицу, состоящую из липидной оболочки, внутри которой находится одноцепочечная молекула РНК положительной полярности размером 28,5 тысяч
оснований (т.о.). Эта РНК ассоциирована с белком N, формирующим нуклеокапсид. Структурные белки М и sM включены в мембрану. Белок S группируется в тримеры и встроен во внешнюю часть оболочки, образуя
пепломеры.
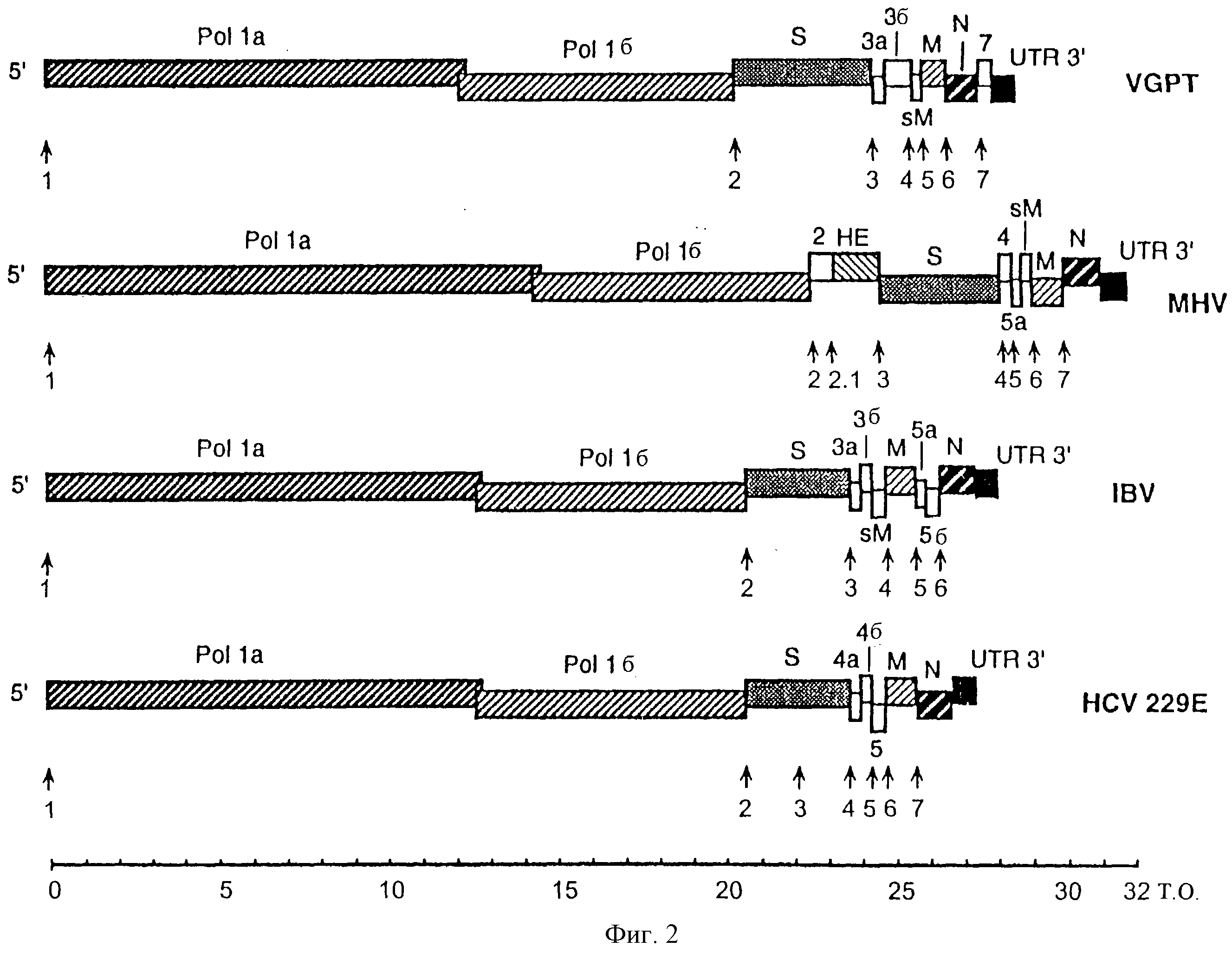
На фиг. 2 показана геномная организация четырех секвенированных коронавирусов: MHV, IBV, HCV229E (человеческий коронавирус 229Е) и TGEV. Открытые рамки считывания, кодирующие каждый белок, указаны по масштабу. В каждом геноме начало РНК, которая экспрессируется каждым вирусом, указано стрелкой. Число мессенджер-РНК (мРНК), экспрессируемых вирусами MHV или TGEV, может варьировать в зависимости от штамма вируса. На данной фигуре TGEV стрелки соответствуют мРНК, экспрессируемым штаммом THER-1. мРНК котерминальны по 3' концу и пронумерованы в порядке уменьшения размера.
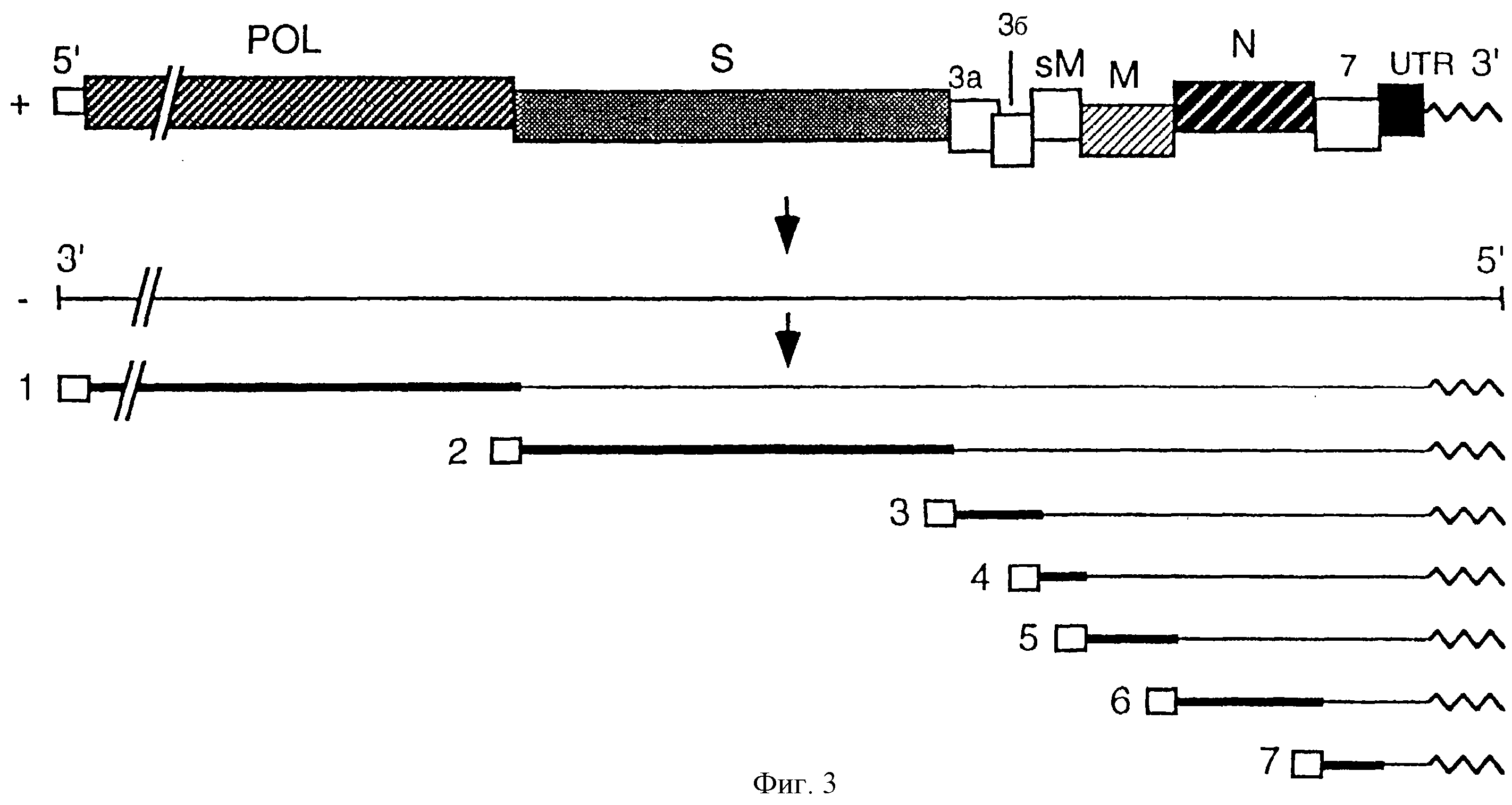
На фиг. 3 показана экспрессия генома TGEV, штамма THER-1. Расположение открытых рамок считывания (ОРС) в геноме указано: Pol - полимераза; S, sM, M и N - структурные белки; nsp 3а, 3b и 7 - неструктурные белки (белок 3b не продуцируется этим вирусом). Геном транскрибируется на РНК равной длины, но отрицательной полярности (-), которая будет служить матрицей для синтеза семи мРНК (от 1 до 7). В каждой мРНК представлена общая последовательность, лидер, на 5' конце (прямоугольник), участок полиаденилирования на 3' конце и зона, которая транслируется в каждой из них (толстые линии).
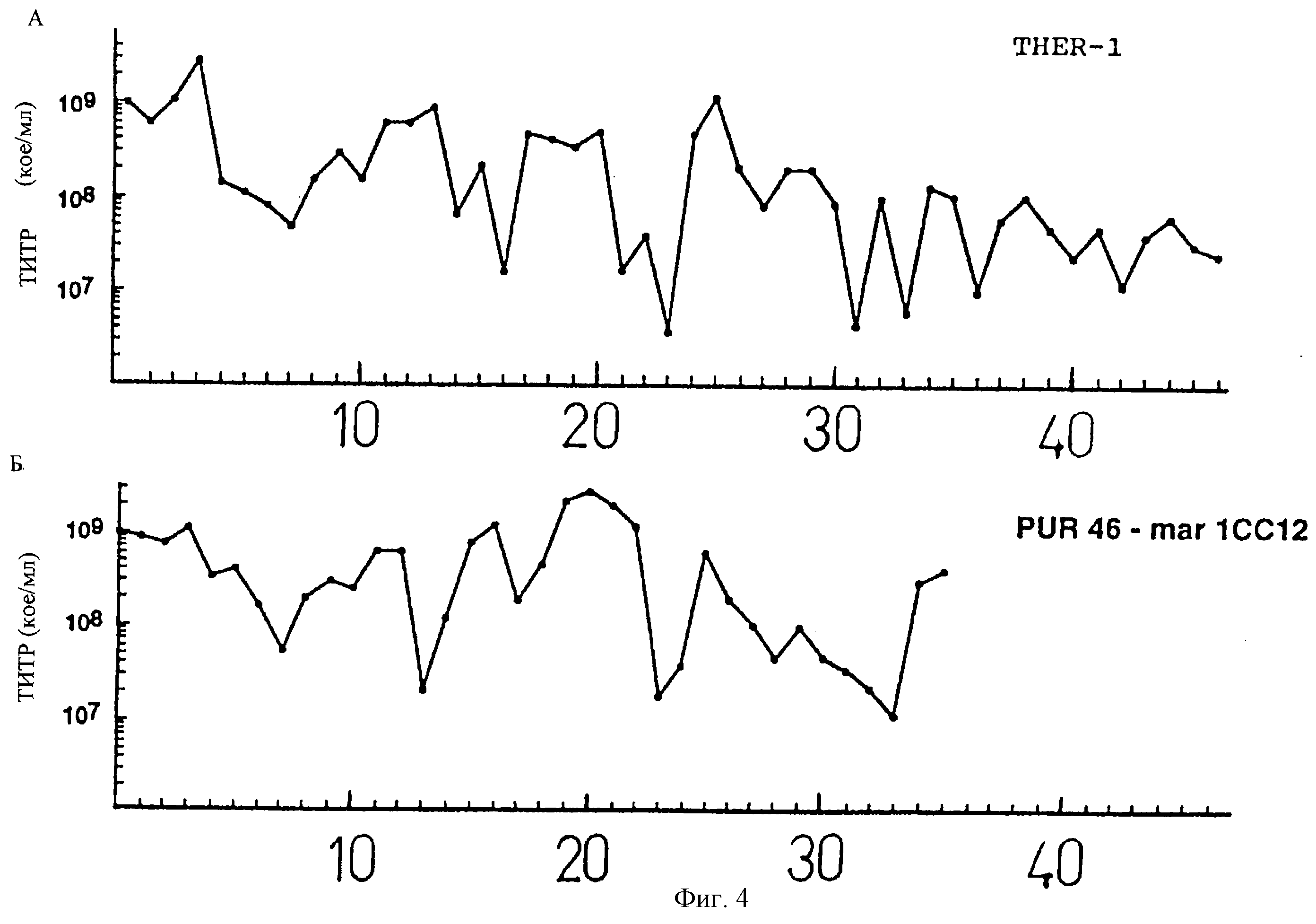
На фиг. 4 показано изменение титра изолятов TGEV THER-1 (А) и PUR46-mar 1СС12 (Б) с числом пассажей при высокой множественности инфекции (м. и.) в клетках ST.
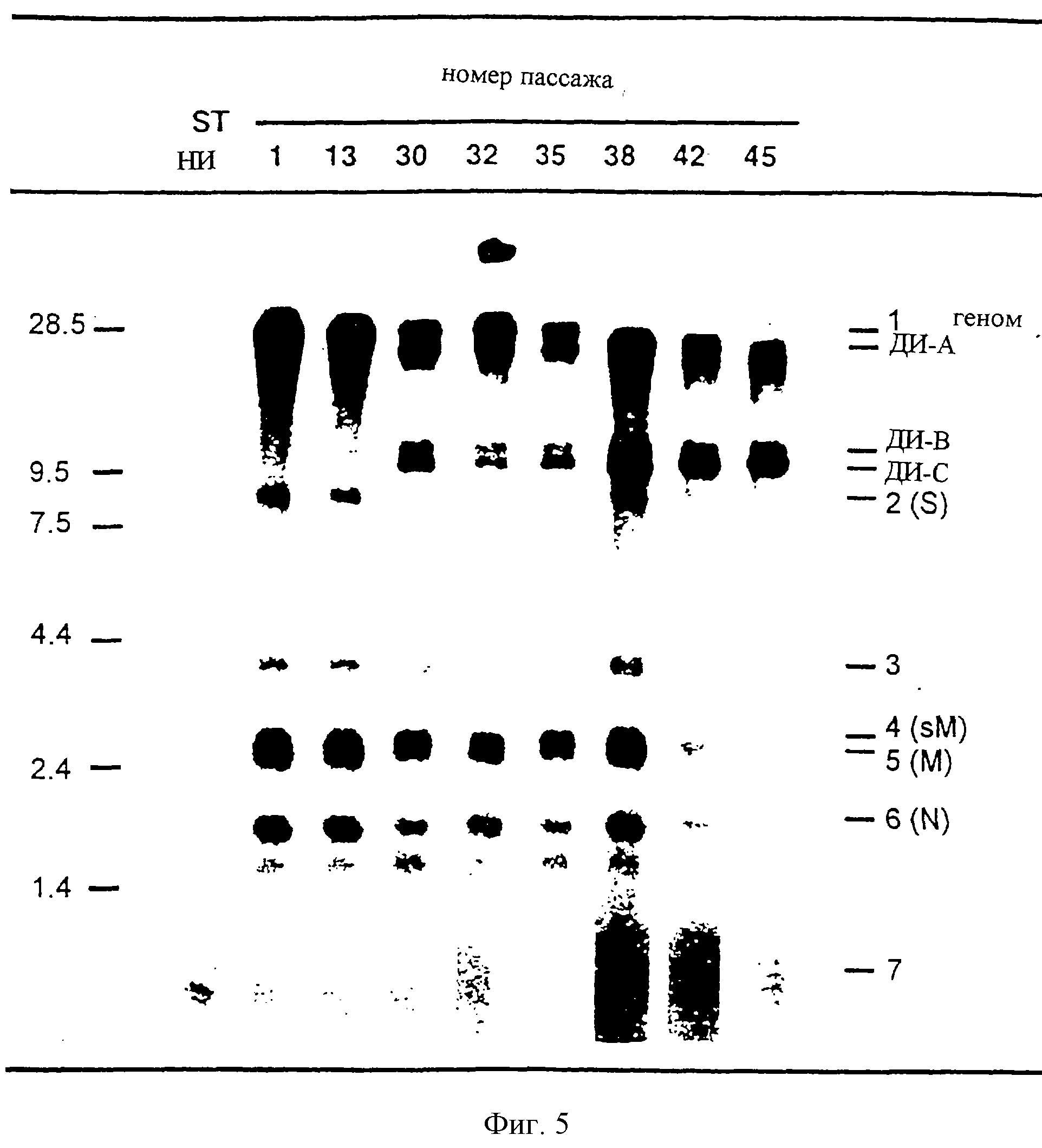
На фиг. 5 показаны результаты электрофоретического анализа РНК, продуцируемых клетками ST, инфицированными вирусом THER-1, после 46 пассажей при высокой м. и. Число пассажей указано над каждой дорожкой, а полосы слева указывают положение маркеров молекулярной массы (геномная РНК TGEV и маркеры от GibcoBRL), выраженное в т. о. Полосы справа указывают мРНК TGEV и дефектные интерферирующие РНК (ДИ). НИ - не инфицированы.
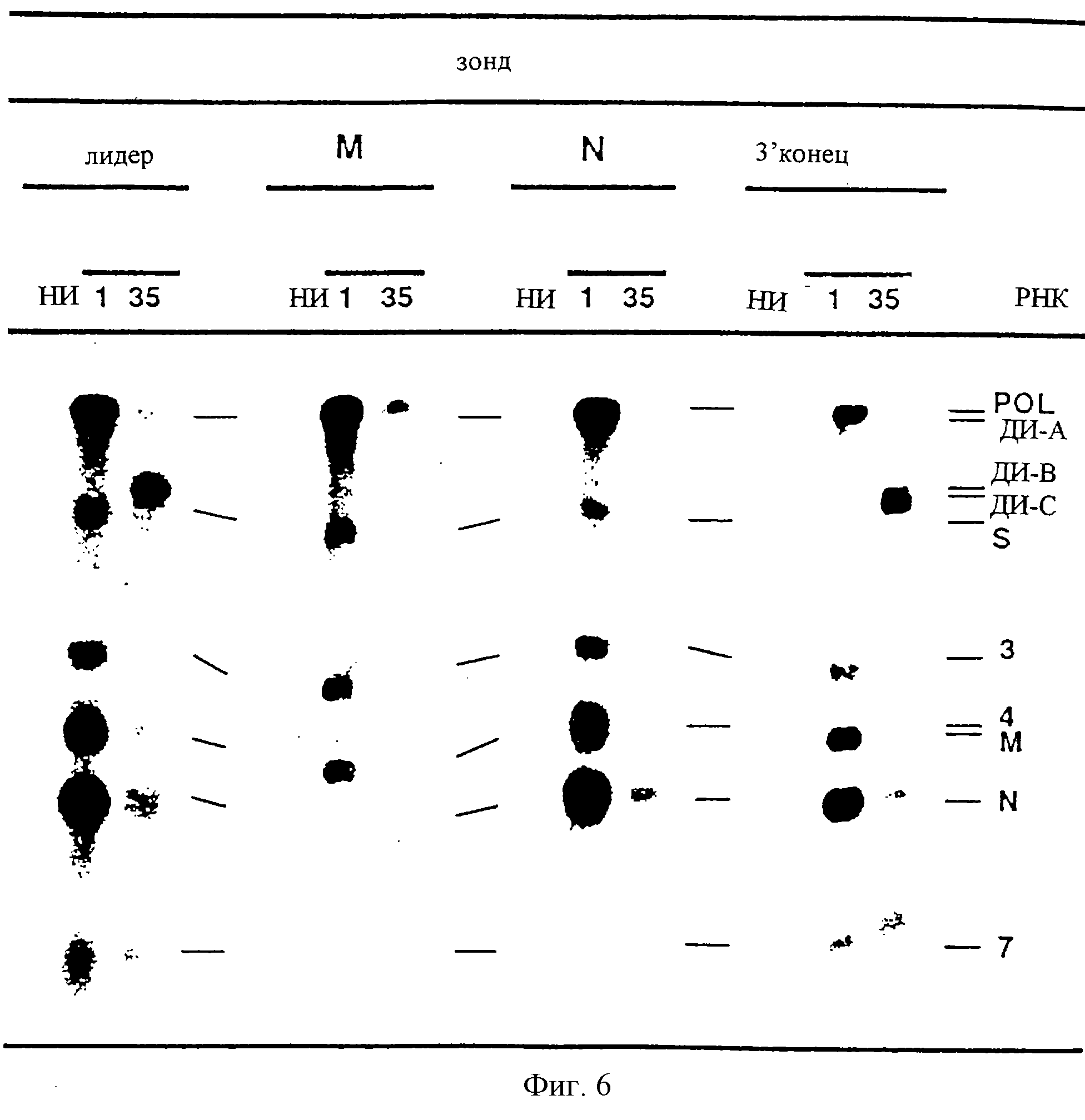
На фиг. 6 показаны результаты Норзерн-блот-анализа РНК клеток ST, инфицированных вирусом THER-1 р35.
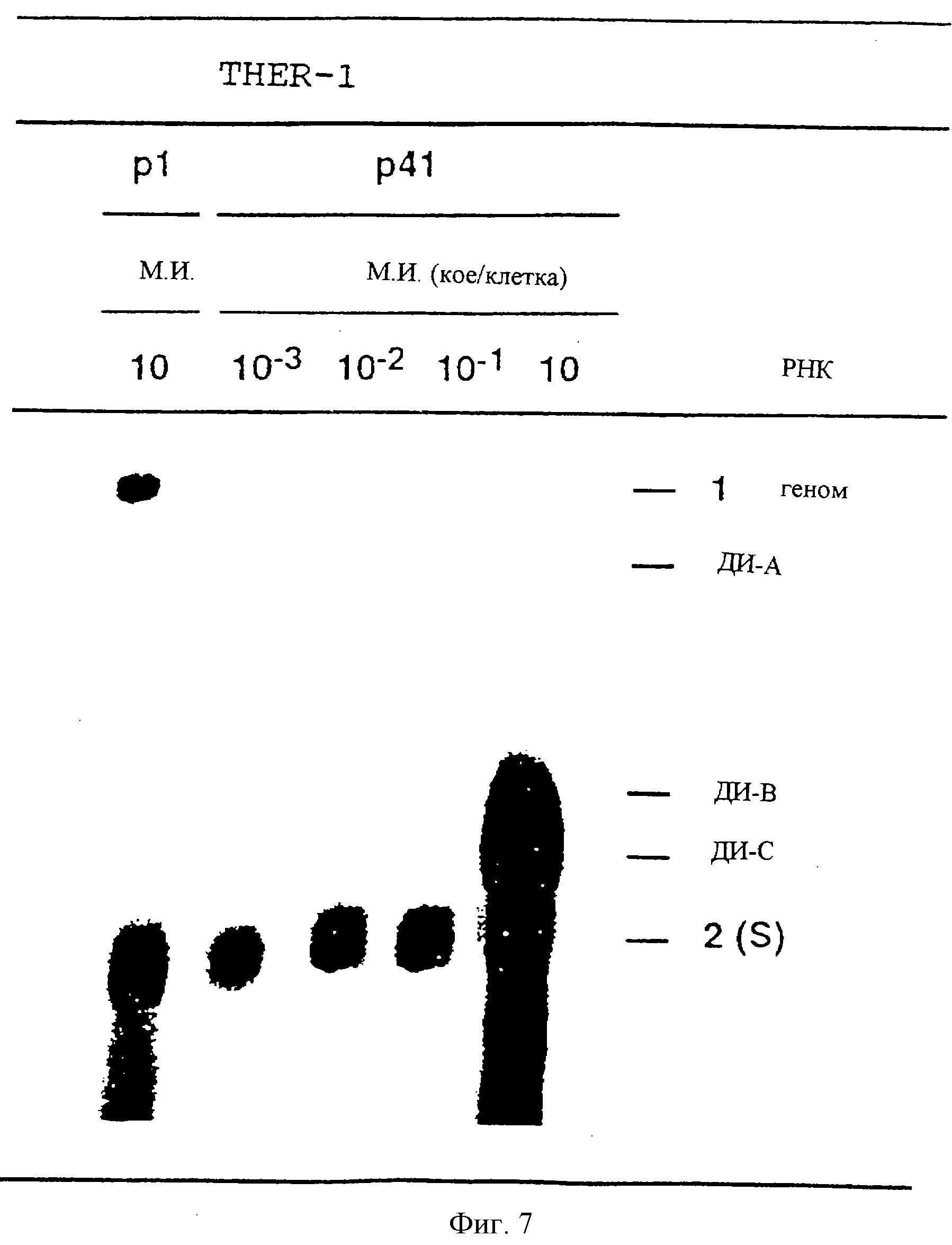
На фиг.7 показаны результаты Норзерн-блот-анализа РНК, полученной из пассажей разведенного вируса THER-1 р41 в клетках ST.
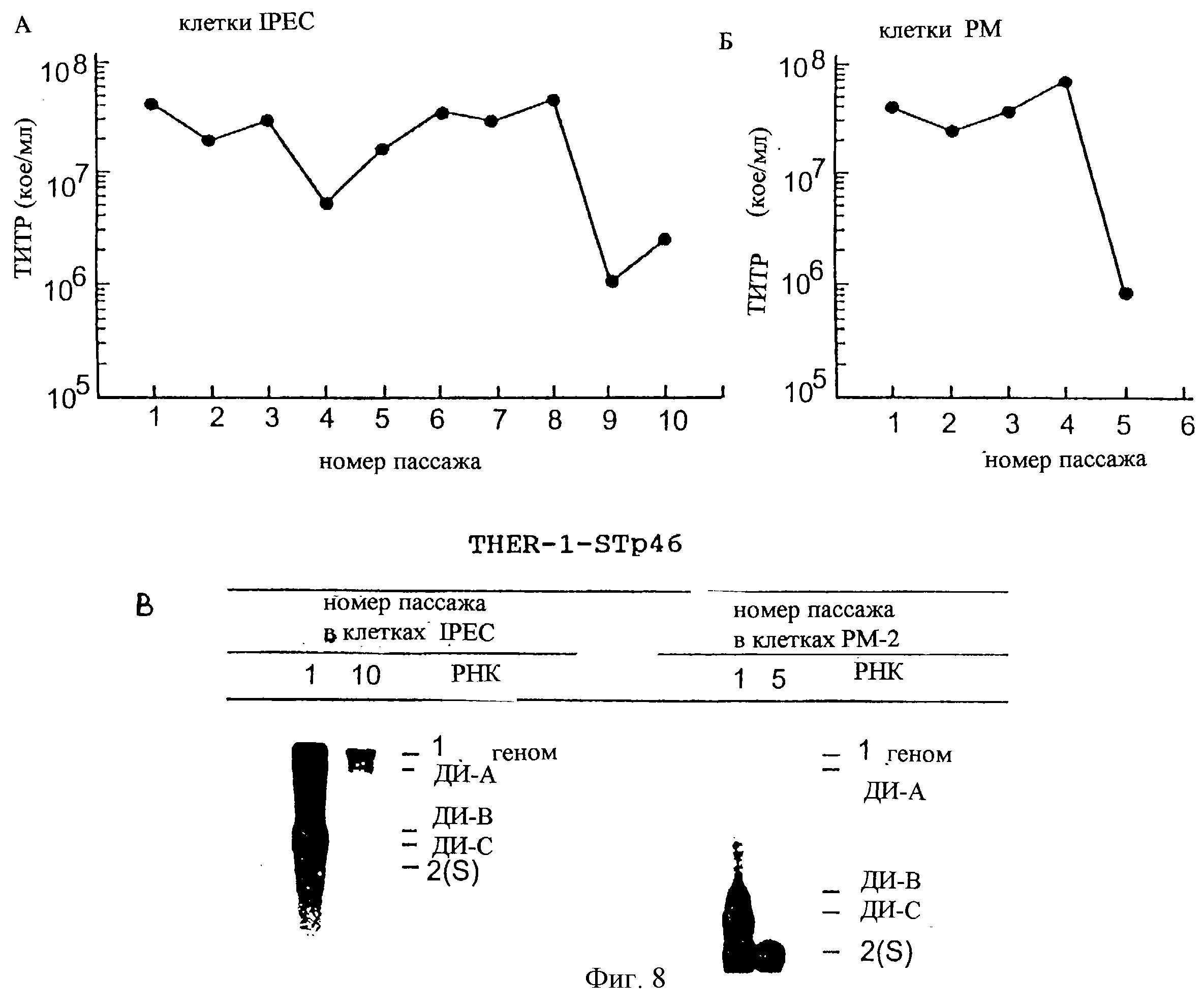
На фиг.8 показано влияние смены клеточной линии на размножение дефектных РНК А, В и С. Провели 10 пассажей без разведения вируса THER-1-ST-р46 в клетках IPEC (клетки кишечного эпителия свиньи) и 5 пассажей в клетках РМ (макрофаги свиньи). Фиг.8А и 8Б: изменение титра вируса с числом пассажей в IPEC и РМ, соответственно. Фиг.8В: анализ РНК клеток ST, инфицированных вирусом из пассажей 1 и 10 в IPEC (метаболическим мечением32Рi) или из пассажей 1 и 5 в клетках РМ (гибридизацией с одним олигонуклеотидом, комплементарным лидерной РНК).
На фиг. 9 показано капсидирование дефектных геномов А, В и С. На фиг.9А показан агарозный гель, окрашенный бромистым этидием, на котором РНК, выделенную из очищенных вирионов из пассажей 1 и 41, анализировали методом центрифугирования через 15%-ную сахарозную "подушку". На дорожке, соответствующей пассажу 41, можно наблюдать как РНК А, В и С, так и родительский геном. Полосы слева указывают подвижность маркеров в т.о. На фиг.9Б показаны результаты анализа РНК вирионов из пассажа 41, очищенной центрифугированием через сахарозные "подушки" или непрерывный градиент, Норзерн-блот анализом с олигонуклеотидом, комплементарным лидерной РНК. В качестве маркеров использовали фирменные РНК от GibcoBRL и РНК из вирионов пассажа 1 (дорожка а). Дорожки б и в: РНК, выделенная из вирионов, осажденных через 31% и 15% сахарозные "подушки" (вес/объем) соответственно. Дорожки г и д: РНК, выделенная из вируса, очищенная через непрерывный сахарозный градиент, фракции плотности 1,20 и 1,15 г/мл, соответственно.
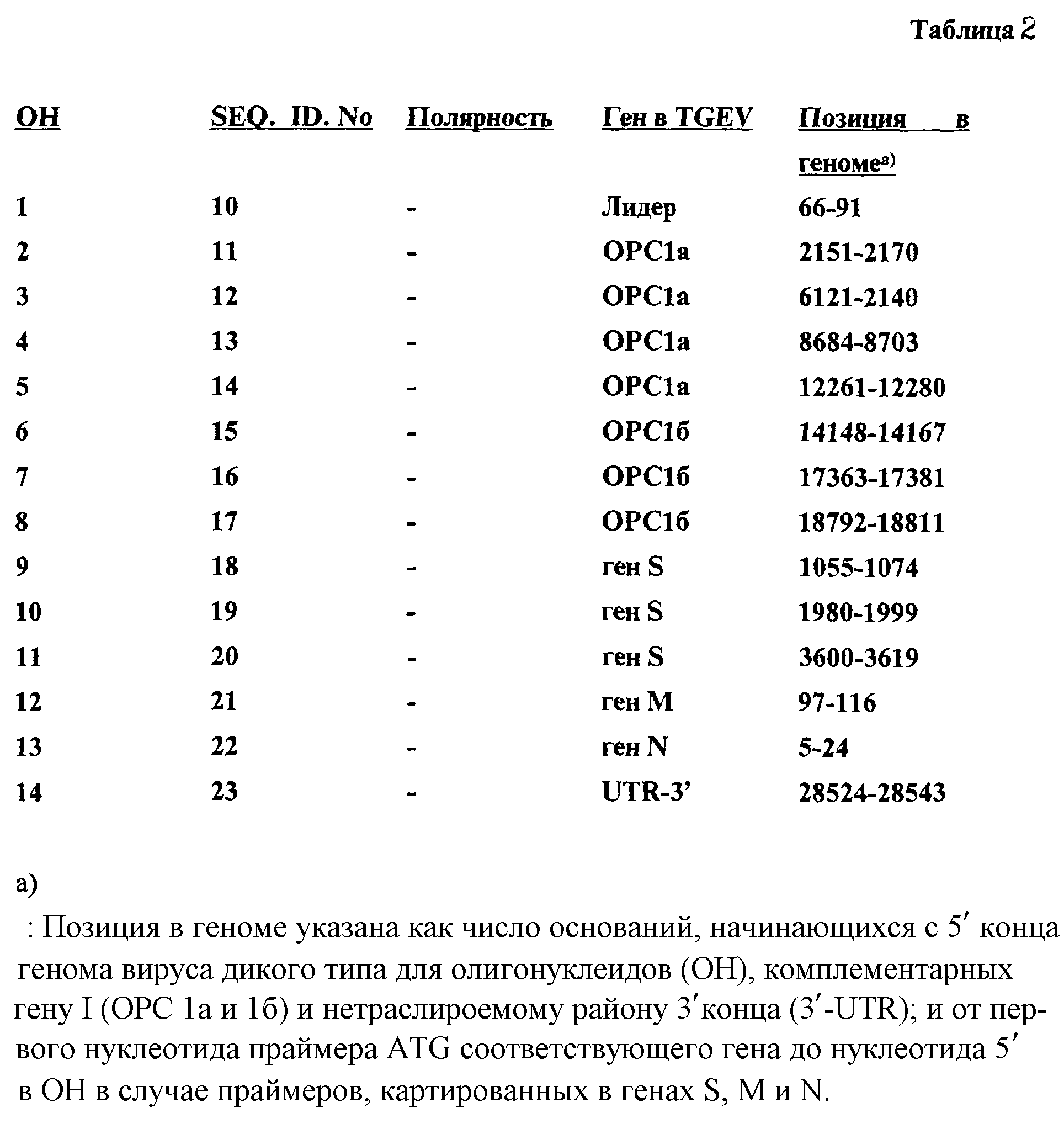
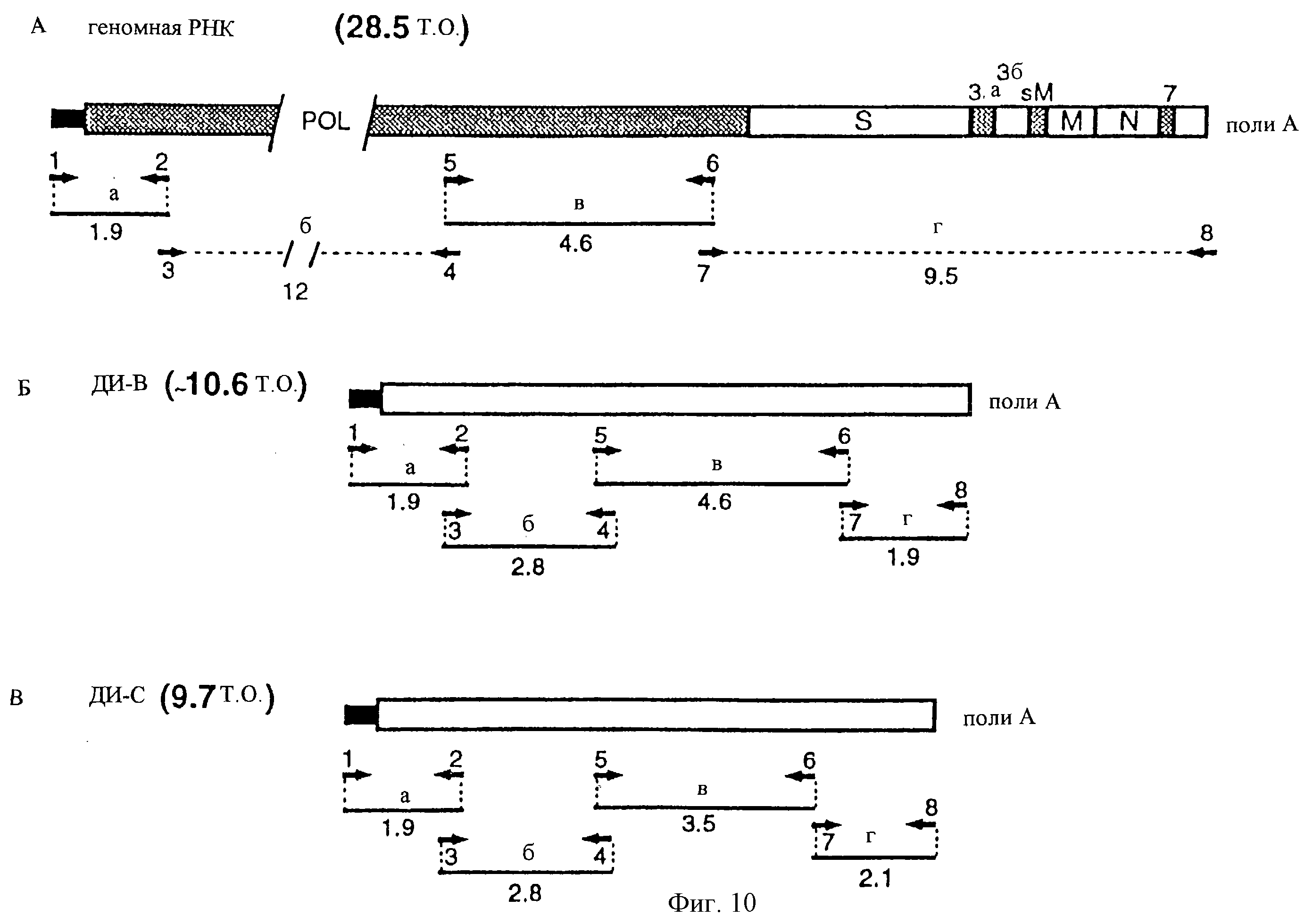
На фиг. 10 показана стратегия клонирования дефектных РНК ДИ-В и ДИ-С, в которой можно наблюдать схематическое представление фрагментов комплементарной ДНК (кДНК), полученной посредством ОТ-ПЦР (обратная транскрипция - полимеразная цепная реакция), использующей в качестве матрицы полноразмерную геномную РНК (А), ДИ-В (Б) и ДИ-С (В). Пунктирные линии указывают отсутствие ожидаемого фрагмента в связи с его большим размером. Дефектные РНК клонировали как четыре перекрывающихся фрагмента (а, б, в и г), представленных линиями; цифры под этими линиями указывают размер фрагмента, определенный в агарозных гелях. Олигонуклеотиды, использованные в качестве праймеров, и их полярность указаны с помощью стрелок и цифр. Олигонуклеотидная последовательность приведена в Таблице 2. Заштрихованные и открытые прямоугольники в (А) указывают относительное положение вирусных генов: ро1 - полимераза; S, М и N - структурные гены; 3а, 3b, sM и 7 - малые ОРС. Темные узкие прямоугольники указывают лидерную последовательность.
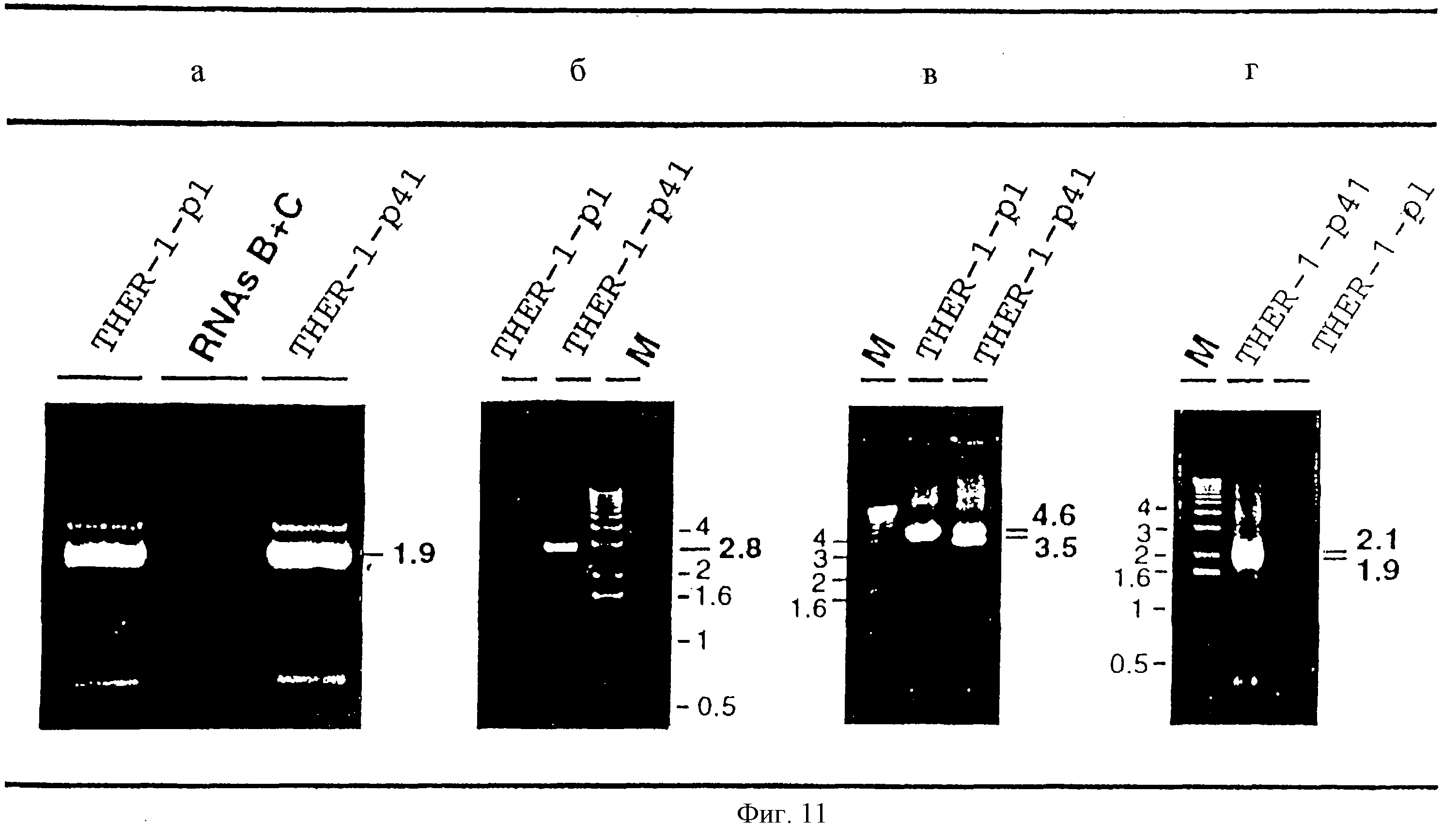
На фиг. 11 показаны результаты электрофоретического анализа продуктов ПЦР, полученных при амплификации дефектных РНК. РНК очищенных вирионов THER-1p1 или THER-1p41 использовали в качестве матрицы в реакции ОТ-ПЦР с олигонуклеотидами 1 и 2 (а), 3 и 4 (б), 5 и 6 (в) или 7 и 8 (г), последовательность и положение которых в родительском геноме указаны в Таблице 2. Дорожка, соответствующая РНК-матрице пассажа 1 (родительская геномная РНК) или пассажа 41 (родительская РНК, ДИ-А, ДИ-В и ДИ-С), и дорожка маркеров подвижности ДНК (М, GibcoBRL) указаны в каждом случае. Цифры жирным шрифтом указывают размер в т.о. продуктов амплификации, специфичных для дефектных РНК. РНК В+С, РНК В и С: четкие полосы в эксперименте, где РНК вируса THER-lSTp41 фракционировали в геле. РНК В и С мигрируют очень близко и были вырезаны как одна полоса.
На фиг.12 показана полная последовательность кДНК РНК ДИ-С (см. SEQ. ID No. 24), полученная определением нуклеотидной последовательности перекрывающихся фрагментов клонирования а, б, в и г. РНК ДИ-С содержала четыре прерывающихся района родительского генома: I, II, III и IV. Фланкирующие сайты этих районов указаны стрелками. Трансляция трех ОРС, присутствующих в геноме ДИ-С, указана: химерная ОРС 6,7 т.о., получающаяся при слиянии прерывающихся районов I и II в фазе; мини-ОРС из трех аминокислот, предшествующая ей в фазе, и ОРС, которая инициируется в AUG гена S. Высокогомологичные районы - с белковыми доменами, описанными для других коронавирусов как ответственные за активности полимеразы и геликазы, и сайты связывания ионов металлов - выглядят затененными. Последовательности промоторов транскрипции СТАААС выглядят затененными. Перекрывающаяся область между ОРС 1а и 1б (41 нуклеотид) выглядит затененной, последовательность сдвига рибосомы выглядит подчеркнутой, и кодон терминации ОРС 1а находится в прямоугольнике. В положениях 637, 6397 и 6485 указаны специфические замены по отношению к родительскому геному. Указаны нуклеотиды, присутствующие в этих положениях в родительском геноме.
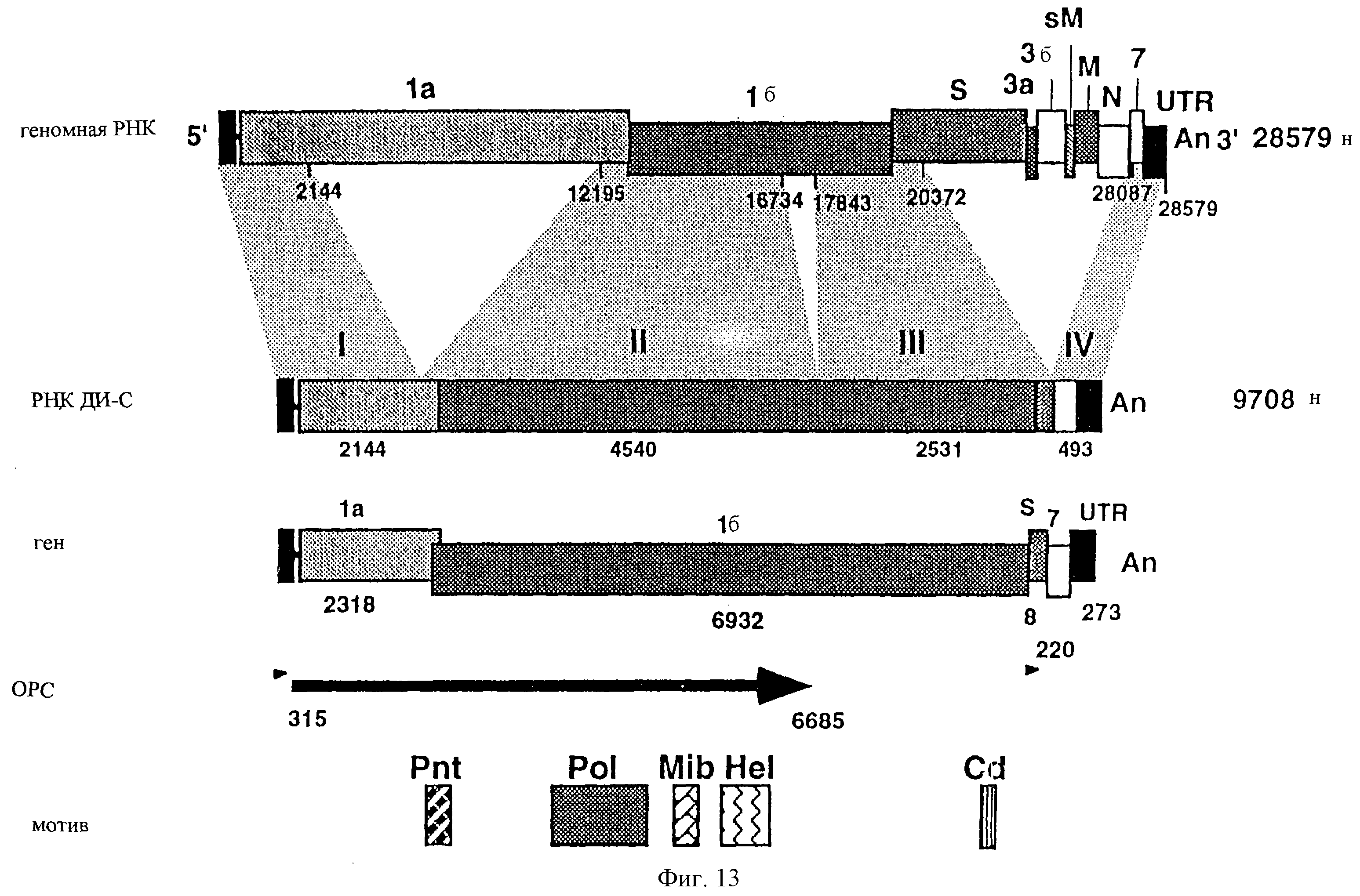
На фиг.13 показана диаграмма структуры РНК ДИ-С. Суммарный размер генома находится справа от прямоугольников. РНК ДИ-С содержит четыре прерывающихся района генома TGEV (I, II, III и IV). Эти районы включают в себя 2,1 т.о. 5' конца генома, почти полную ОРС 1б, включая перекрывающуюся область между ОРС 1а и 1б, начало гена S, неполную ОРС 7 и 3' нетранслируемый район. Буквы и цифры над прямоугольником родительского генома указывают вирусные гены. Цифры под прямоугольником указывают положение нуклеотидов, фланкирующих прерывающиеся районы родительского генома, на основании последовательности изолята TGEV PUR46-PAR. В прямоугольнике, соответствующем РНК ДИ-С, указана длина четырех прерывающихся районов в нуклеотидах. В третьем прямоугольнике указано число нуклеотидов, происходящих от каждого вирусного гена, принимая во внимание, что ОРС 1а и 1б перекрываются друг с другом в родительском геноме на 43 нуклеотида. ОРС, предсказанные компьютерным анализом, указаны стрелками или наконечниками стрелок. Pnt - псевдоузел; Pol - полимераза; Mib - связывание ионов металлов; Не1 - геликаза; Cd - консервативный домен.
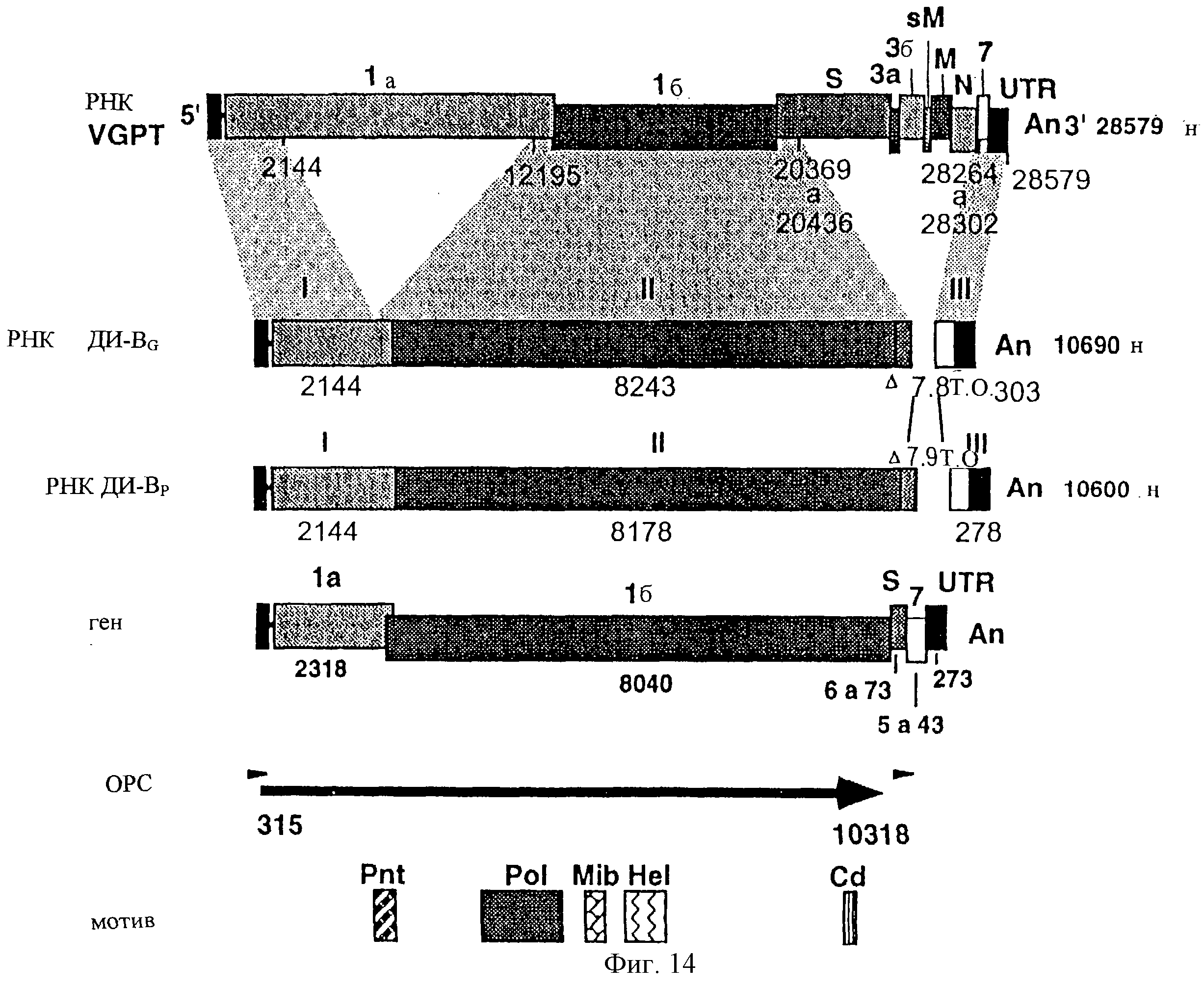
На фиг. 14 показана структура РНК ДИ-В. РНК ДИ-В содержит три прерывающихся района (I, II и III) генома TGEV, включающих в себя 2,1 т.о. 5' конца генома, полную ОРС 1б, включая перекрывающуюся область между ОРС 1а и 1б, начало гена S, конец ОРС7 и нетранслируемый район 3' конца. Буквы и цифры над прямоугольником родительского генома указывают вирусные гены. Цифры под прямоугольником указывают положение нуклеотидов, фланкирующих прерывающиеся районы родительского генома, на основании последовательности изолята TGEV PUR46-PAR. Гетерогенность размеров делеций, появляющихся между прерывающимися районами II и III, ответственна за действительное существование популяции генома ДИ-В. Во втором и третьем прямоугольниках указана длина в нуклеотидах трех прерывающихся районов для геномов самого большого и самого маленького размеров, соответственно. В третьем прямоугольнике указано число нуклеотидов, происходящих от каждого вирусного гена, принимая во внимание, что ОРС 1а и 1б перекрываются друг с другом в родительском геноме на 43 нуклеотида. Pnt - псевдоузел; Pol - полимераза; Mib - связывание ионов металлов; Не1 - геликаза; Cd - консервативный домен.
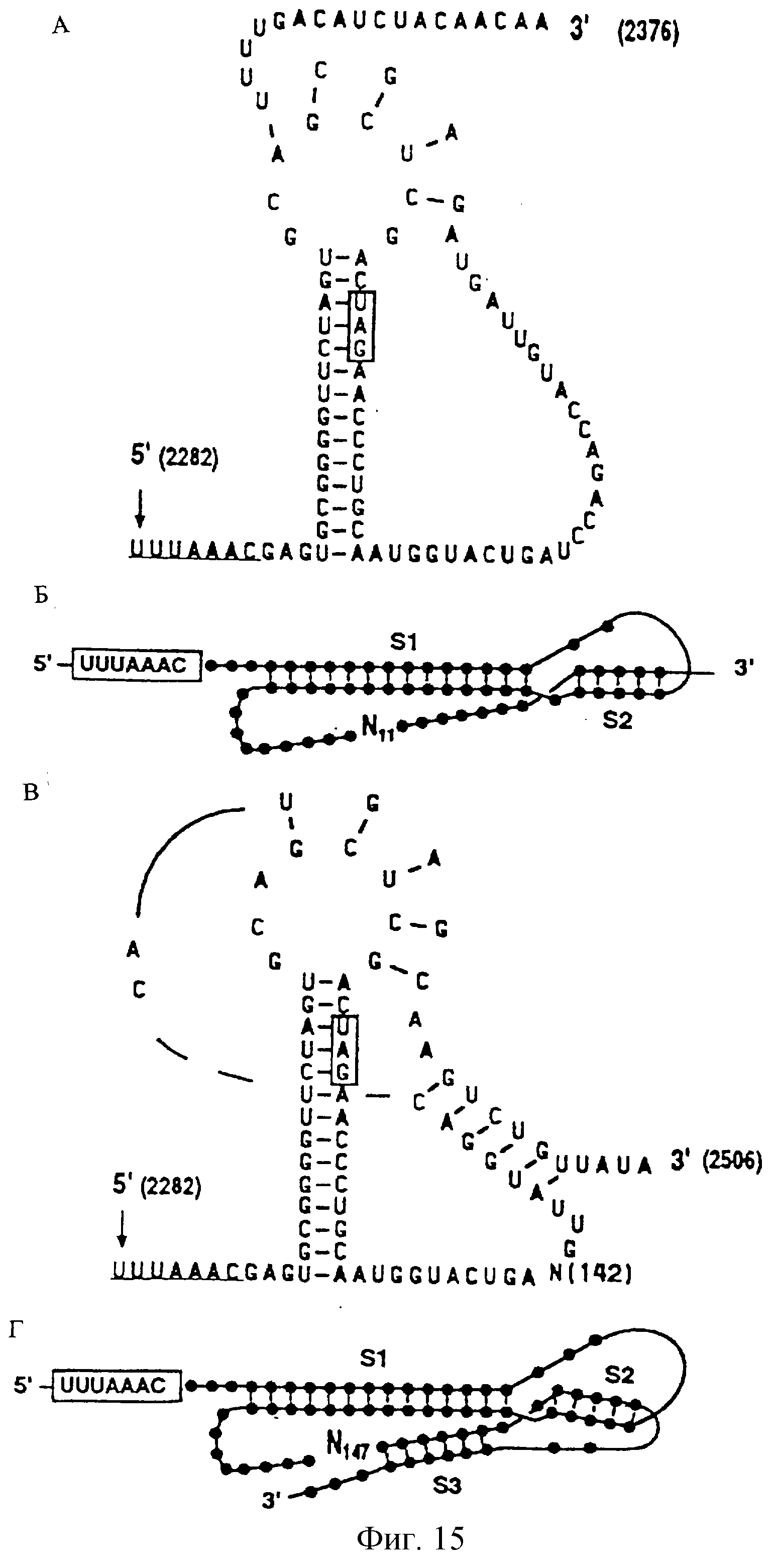
На фиг. 15 показана вторичная и третичная структуры РНК перекрывающейся зоны между ОРС 1а и 1б в РНК ДИ-С. (А) Структура, предсказанная при рассмотрении района, ближайшего к структуре вилки, комплементарного нуклеотидам узла, и таким образом составляющего псевдоузел (нуклеотиды 2354-2358). Последовательность сдвига UUUAAAC подчеркнута. Кодон терминации ОРС 1а указан в прямоугольнике. (Б) Схематическое представление этого псевдоузла, в который вовлечены два участка комплементарности последовательности (стволы: S1 и S2). Последовательность сдвига представлена в прямоугольнике. (В) Альтернативная модель, рассматривающая последовательность от нуклеотида 2489 до нуклеотида 2493 в складке псевдоузла. Эта структура содержит дополнительный участок комплиментарности последовательности (ствол). (Г) Схематическое представление псевдоузла, в котором три ствола обозначены: S1, S2 и S3.
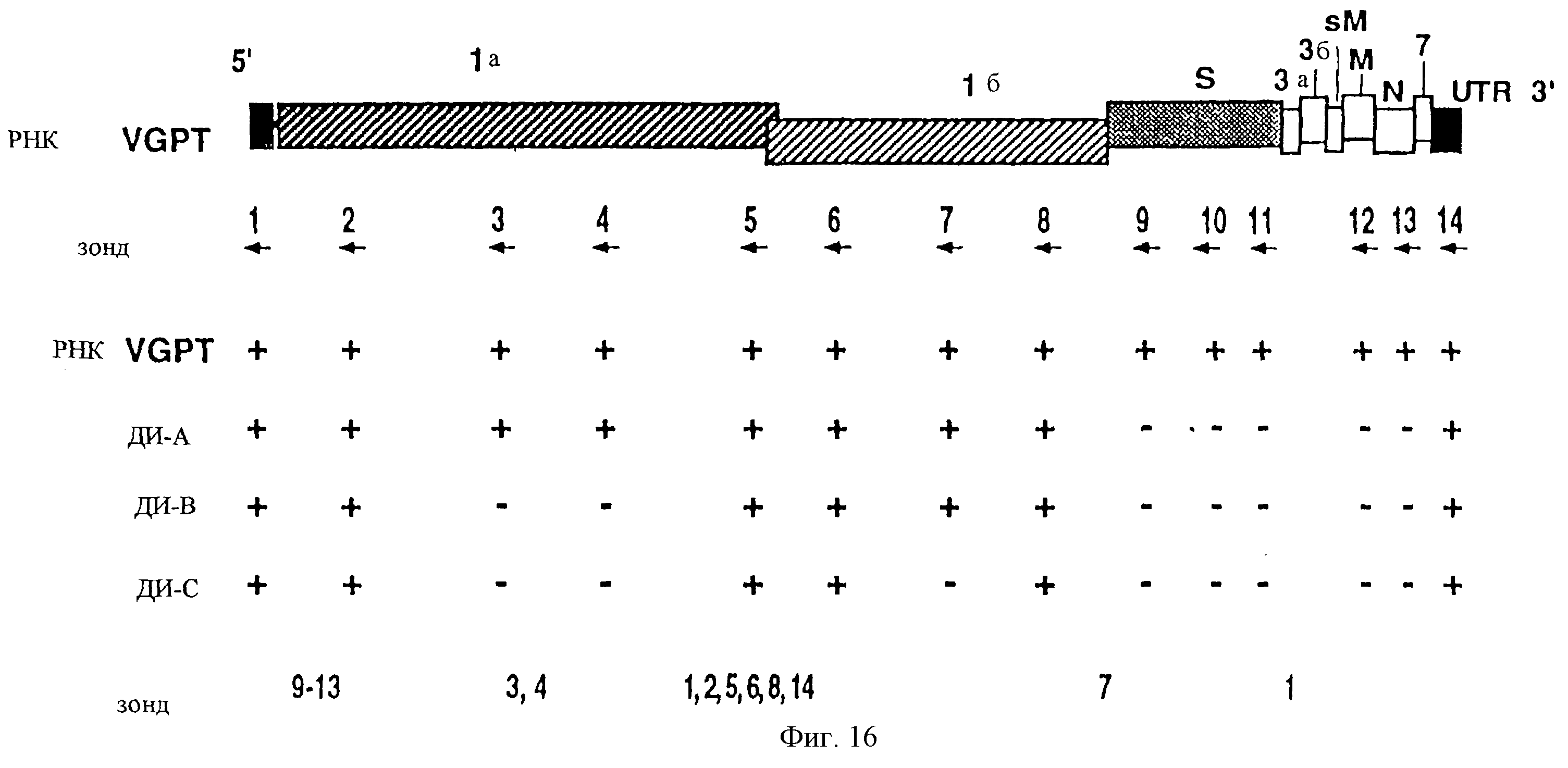
На фиг. 16 показано картирование РНК ДИ посредством гибридизации с олигонуклеотидами, специфичными для вируса, в Норзерн-блот-анализах. РНК вируса THER-1-STp41 фракционировали в агарозных гелях до тех пор, пока не получили четкое разделение РНК родительского генома и ДИ А, В и С. РНК, перенесенная на нейлоновые фильтры, которые гибридизовали с несколькими олигонуклеотидами, мечеными32Pi, гибридизующимися с родительским геномом (+), и гибридизующимися (+) или нет (-) с дефектными геномами. Приблизительная локализация последовательностей, комплементарных олигонуклеотидам, в родительском геноме указана стрелками. Их точная последовательность и положение указаны в Таблице 3. Все олигонуклеотиды гибридизовались с родительским геномом и давали ожидаемые результаты с РНК В и С.
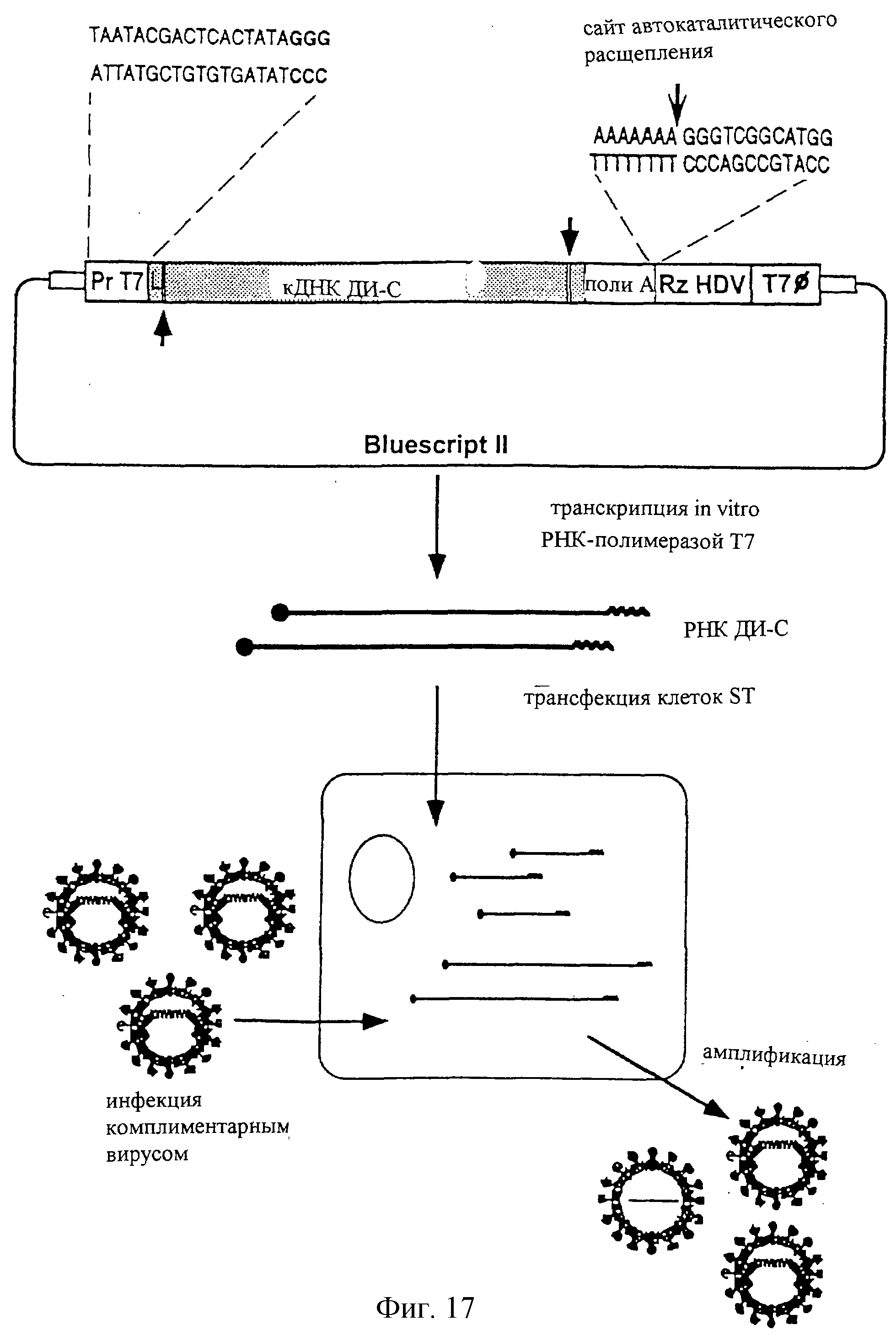
На фиг.17 показана схема способа получения вакцинных вирусов путем трансфекции инфицированных клеток РНК ДИ-С. Прототип схемы иллюстрирован конструкцией, которая обеспечивала продукцию РНК ДИ-С посредством транскрипции in vitro, сохраняющей 5' и 3' концы, присутствующие в исходной дефектной частице. Последовательность промотора Т7 [РrТ7] и последовательность автокаталитического рибозима вируса гепатита дельта (HDV) [Rz HDV] клонировали, фланкируя последовательность РНК ДИ-С. Положение автокаталитического расщепления, введенное рибозимом, обозначено над последовательностью. Стрелки указывают положения внутренних последовательностей промоторов транскрипции, сохраненные в природной форме в РНК ДИ-С. L - лидер; Т7 ⌀ - сигналы терминации транскрипции бактериофага Т7. Вирионы, капсидирующие как хелперный вирус, так и дефектные геномы, в которые были клонированы гетерологичные гены, восстанавливались, когда РНК, транскрибированными in vitro, трансфицировали клетки ST, инфицированные соответствующим хелперным вирусом.
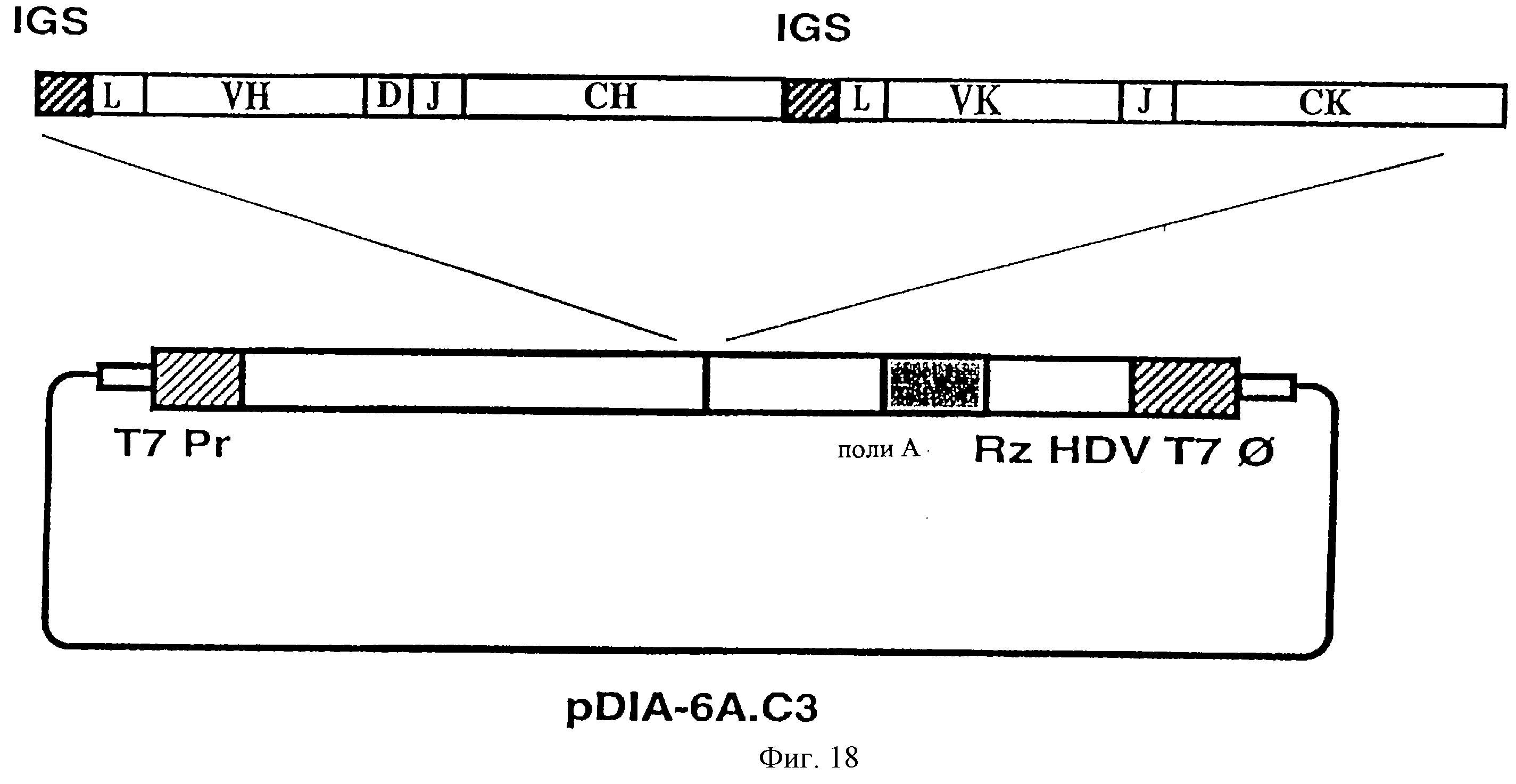
На фиг. 18 показан прототип схемы конструкции, которая обеспечивала продукцию pDIA-6А.С3 посредством транскрипции in vitro, сохраняющей 5' и 3' концы, присутствующие в исходной дефектной частице. Последовательность промотора бактериофага Т7 [РrТ7] и последовательность автокаталитического рибозима вируса гепатита дельта (HDV) [Rz HDV] клонировали, фланкируя последовательность кДНК, кодирующую авторепликативную РНК. Плазмида pDIA-6A,C3 содержит ген, кодирующий моноклональное антитело 6А.С3, которое нейтрализует TGEV [см. Пример 4]. Клонирование гетерологичного гена делали после ОРС 1б, за кодоном инициации (AUG) гена S и в рамке считывания с этим геном (IGS - межгенная последовательность; L - лидерная последовательность; D - район различия; J - район присоединения; VH -вариабельный модуль тяжелой цепи иммуноглобулина; СН - константный модуль тяжелой цепи иммуноглобулина; VK - вариабельный модуль легкой цепи иммуноглобулина; СК - константный модуль легкой цепи иммуноглобулина polyA - полиА последовательность; Т7 ⌀ - терминатор транскрипции Т7].
ДЕТАЛЬНОЕ ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
Данное изобретение предлагает векторы экспрессии гетерологичной ДНК, основанные на рекомбинантных дефектных вирусных геномах, экспрессирующих по меньшей мере один антиген,
пригодный для индукции иммунного ответа против ряда инфекционных агентов у различных видов животных, или антитело, обеспечивающее защиту против инфекционного агента, обладающих высокой безопасностью и
емкостью клонирования, и которые можно сконструировать таким образом, чтобы их видоспецифичность и тропизм можно было легко контролировать.
Термин "инфекционный агент" в том смысле, в котором он используется в данном описании, включает в себя любой вирусный, бактериальный или паразитический инфекционный агент, который может инфицировать животное и вызывать патологию.
Термин "виды животных" включает в себя животных любых видов, обычно млекопитающих, в частности свиней, собак или кошек.
В конкретной реализации данного изобретения, вектора экспрессии получены на основе рекомбинантных дефектных вирусных геномов, экспрессирующих антигены, пригодные для индукции системного и секреторного иммунных ответов, для предупреждения инфекций слизистой оболочки, сконструированные так, чтобы обеспечить легкость контроля их видоспецифичности и тропизма для инфекции кишечных или респираторных слизистых, что делает их совершенно адекватными для индукции иммунитета слизистой оболочки и лактогенного иммунитета, в частности с целью защиты новорожденных животных от инфекций кишечного тракта. В другой конкретной реализации данного изобретения предлагается вектор экспрессии на основе рекомбинантного дефектного вирусного генома, экспрессирующий по меньшей мере одно антитело, которое обеспечивает защиту против инфекционного агента.
Векторы экспрессии, полученные посредством данного изобретения, содержат дефектный вирусный геном, происходящий от вируса, предпочтительно вируса с РНК геномом и положительной полярностью, который сохраняет 3' и 5' концы родительского вируса, имеет внутренние делеции и зависит от хелперного вируса для его репликации. Следовательно, изобретение предлагает, дополнительно, дефектный вирусный геном, содержащий геном родительского вируса, имеющий сигналы для узнавания вирусной репликазой, локализованные на 3' и 5' концах, кроме того, содержащий внутренние делеции, и в котором вышеуказанный дефектный вирусный геном зависит от хелперного вируса, дающего функциональные и структурные белки для репликации и капсидирования рекомбинантного дефектного вирусного генома. В конкретной реализации дефектный вирусный геном содержит, дополнительно, полную последовательность, кодирующую репликазу родительского вируса. В этом случае, если это желательно, хелперный вирус может давать только структурные белки, требующиеся для капсидирования рекомбинантного дефектного вирусного генома или, альтернативно, функциональные и структурные белки для репликации и капсидирования рекомбинантного дефектного вирусного генома. Когда вирус, от которого происходит рекомбинантный дефектный вирусный геном, представляет собой вирус с РНК геномом, вектор экспрессии содержит кДНК, комплементарную вышеуказанной дефектной РНК, или кДНК, в основном комплементарную вышеуказанной дефектной РНК.
Векторы, которые предлагает данное изобретение, обладают высокой емкостью клонирования - по меньшей мере 18 т.о. - которая является самой высокой емкостью клонирования, описанной для вектора, основанного на эукариотических РНК вирусах. Кроме того, эти векторы обладают высоким уровнем безопасности, поскольку они (а) основаны на дефектных геномах, (б) содержат РНК геномы и не используют ДНК в качестве посредника репликации и (в) основаны на вирусах, растущих в цитоплазме инфицированных клеток - все это предохраняет дефектный геном от рекомбинации с хромосомой клетки.
В конкретной реализации данного изобретения описывается получение дефектных РНК геномов, происходящих от коронавирусов, в частности от TGEV. Эти геномы обладают дополнительным преимуществом очень низкой частоты рекомбинации TGEV (<1•109), что предотвращает свободную рекомбинацию дефектного генома с геномом хелперного вируса. Однако, даже хотя эта рекомбинация может в действительности иметь место, то будет получаться ослабленный вирус, поскольку изобретение предполагает удобство использования одного и того же ослабленного вируса как в качестве хелперного вируса, так и в качестве исходного материала для получения дефектного генома.
Дефектные геномы, составляющие основу таких векторов, можно получить в различных клеточных системах посредством серийных пассажей без разведения вируса, от которого они происходят. Частота генерации ДИ частиц может сильно варьировать в различных системах вирус-клетка; по этой причине следует делать пассажи с различными вирусными изолятами в различных клеточных линиях с целью отобрать пригодный изолят и клеточную линию. После определенного числа пассажей вирусы выделяют и затем используют для анализа внутриклеточных РНК, продуцируемых при инфекции, с целью наблюдения за возможным появлением полос, не соответствующих какой-либо вирусной мРНК, и в этом случае, чтобы проанализировать природу этих новых РНК - субгеномных или дефектных - продолжают серийные пассажи без разведения с родительским вирусом. После нескольких пассажей анализируют изменение характера РНК во всех серийных пассажах, и с этой целью клетки подходящей клеточной системы инфицируют вирусами, происходящими из различных пассажей, и продуцируемые РНК анализируют по стандартным методикам, например метаболическим мечением32Pi или гибридизацией с соответствующим олигонуклеотидом. Детальное описание получения и характеристики некоторых дефектных РНК, производных от TGEV, дается в Примере 1.
С дефектных РНК возможно получить соответствующую кДНК - комплементарную или в основном комплементарную - вышеуказанным дефектным РНК посредством реакции обратной транскрипции (ОТ) и полимеразной цепной реакции амплификации (ПЦР), в дальнейшем ОТ-ПЦР. После этого возможно клонировать кДНК в подходящие плазмиды, например Bluescript II, под контролем эффективных промоторов. Полученные плазмиды содержат дефектный вирусный геном под контролем нескольких регуляторных элементов, содержащих сигналы для регуляции и контроля репликации и для инициации и терминации транскрипции и трансляции. Таким образом, эти плазмиды могут включать в себя полиА последовательности, последовательности для автокаталитического расщепления или для узнавания ферментами рестрикции, позволяющие встраивать гетерологичную ДНК, и соответствующие сигналы регуляции, контроля и терминации.
С полученными таким образом плазмидами, содержащими дефектный геном или соответствующую кДНК, можно манипулировать посредством стандартных методик генной инженерии, чтобы клонировать с повышенной эффективностью по меньшей мере одну последовательность гетерологичной ДНК, кодирующую специфическую активность, под контролем промотора гена, присутствующего в дефектных геномах, или какого-либо другого промотора вируса, от которого происходит дефектный геном или вариант этих промоторов, и под контролем регуляторных последовательностей, содержащихся в полученном векторе экспрессии. Пример 2 описывает создание векторов экспрессии, кодирующих антигены, индуцирующие защиту против различных вирусов.
Векторы экспрессии, полученные по этому изобретению, могут экспрессировать одну или более чем одну активность, такую как один или более чем один антиген, способный индуцировать иммунные ответы против различных инфекционных агентов, или одно или более чем одно антитело, обеспечивающее защиту против одного или более чем одного инфекционного агента. В одной конкретной и предпочтительной реализации эти векторы экспрессируют по меньшей мере один антиген, способный индуцировать системный иммунный ответ или иммунный ответ слизистой оболочки против различных инфекционных агентов, которые размножаются в респираторной или кишечной слизистой оболочке. В другой конкретной и предпочтительной реализации указанные векторы экспрессии экспрессируют по меньшей мере один ген, кодирующий тяжелую и легкую цепи антитела какого-либо изотипа (например, IgG1, IgA и так далее), которое обеспечивает защиту против инфекционного агента. В специфичном случае экспрессируемое антитело представляет собой моноклональное антитело, определенное как 6А.С3 (см. Пример 4), которое нейтрализует TGEV, экспрессируемое с изотипами IgG1 или IgA, в которых константная часть иммуноглобулина свиного происхождения.
В конкретной реализации данного изобретения клонирование гетерологичных генов в плазмиду, содержащую кДНК, производную от дефектной РНК, осуществляли после ОРС 1б, за кодоном инициации гена S (AUG) и в рамке считывания с этим геном (Пример 2). Альтернативно, последовательности гетерологичных ДНК можно клонировать в другие области генома, например в зоны, соответствующие ОРС 1, 2 или 3 TGEV. С полученных плазмид РНК экспрессировали с использованием подходящей полимеразы и этой РНК трансформировали соответствующие клетки, предварительно инфицированные ослабленным хелперным вирусом, обеспечивая восстановление вирионов, содержащих геном хелперного вируса, и другие вирионы с дефектным геномом (фиг.17).
Альтернативно, векторы экспрессии по данному изобретению позволяют экспрессировать один или несколько генов, используя описанную выше стратегию. С этой целью можно использовать один или несколько промоторов, или промотор и несколько внутренних сайтов посадки рибосомы (IRES) или, альтернативно, несколько промоторов и один внутренний сайт посадки рибосомы.
Данное изобретение также предлагает рекомбинантную систему
для экспрессии гетерологичных белков, включающую в себя: (а) вектор, описанный выше и (б) хелперный вирус, который дает белки, вовлеченные в репликацию и капсидирование рекомбинантного дефектного
вирусного генома. Таким образом, предлагается рекомбинантная система для экспрессии гетерологичных белков, основанная на рекомбинантных дефектных вирусных геномах, экспрессирующих белки по меньшей
мере с одной специфической активностью, включающая в себя:
(а) рекомбинантный вектор, содержащий дефектный вирусный геном, для которого в этом случае была получена кДНК, с которой можно
манипулировать посредством стандартной генной инженерии, содержащая сигналы узнавания вирусной репликазы, локализованные на 3' и 5' концах, содержащая, дополнительно, внутренние делеции и по меньшей
мере одну внутреннюю последовательность ДНК, кодирующую одну активность, например антиген, способный обеспечивать системный иммунитет и иммунитет слизистой оболочки; или антитело, обеспечивающее
защиту против инфекционного агента; и
(б) хелперный вирус, обеспечивающий функциональные и структурные белки для репликации и капсидирования дефектного генома.
Альтернативно, вышеуказанная рекомбинантная система для экспрессии гетерологичных белков включает в себя вектор экспрессии описанного выше типа, содержащий полную последовательность, кодирующую репликазу родительского вируса, и хелперный родительский вирус, который предоставляет структурные белки для капсидирования дефектного генома и, факультативно, функциональные белки (репликазу) для репликации дефектного вирусного генома.
Эти системы обеспечивают экспрессию либо антигенов, способных индуцировать иммунный ответ, либо антител, которые дают защиту против инфекционных агентов, в связи с чем они являются пригодными для применения в целях вакцинирования и для защиты против инфекций.
Данное изобретение также предлагает вакцины, способные индуцировать защиту против инфекций, вызванных рядом инфекционных агентов у различных видов животных, включающие в себя: (1) рекомбинантную систему, описанную выше, содержащую: (а) вектор экспрессии на основе дефектного вирусного генома, в который клонирована последовательность гетерологичной ДНК, и (б) хелперный вирус, способствующий репликации дефектного генома вместе с ним, факультативно, (2) фармацевтически приемлемый эксципиент. Вакцины, предлагаемые данным изобретением, являются, следовательно, пригодными для обеспечения иммунитета против ряда инфекционных агентов, поражающих различные виды животных.
"Обеспечивать иммунитет" в смысле, использованном в данном описании, в котором следует его понимать, означает запускать в рецепторном организме (животном, подлежащем лечению) посредством рекомбинантной системы, такой как описанная выше, соответствующие механизмы, такие как антигенпредставляющие клетки, В и Т лимфоциты, антитела, вещества, повышающие клеточный иммунный ответ (интерлейкины, интерфероны и так далее), факторы некроза клеток и подобные вещества, которые производят у животных защиту против инфекций, вызванных патогенными агентами.
Вакцины, предлагаемые данным изобретением, могут быть моновалентными или мультивалентными, в зависимости от того, один или более чем один антиген, способный индуцировать иммунный ответ против одного или более чем одного инфекционного агента, экспрессируется с вектора экспрессии, присутствующего в рекомбинантной системе. Вектора эскпрессии могут быть одновалентными или поливалентными в зависимости от того, экспрессируют ли они одно или более чем одно антитело, обеспечивающее защиту против одного или более чем одного инфекционного агента.
Видоспецифичность контролируют таким путем, что хелперный вирус будет экспрессировать белок оболочки, подходящий для узнавания клеточными рецепторами соответствующих видов. Конкретная группа вакцин, полученных по данному изобретению, в качестве хелперного вируса содержит коронавирус, предпочтительно свиной, собачий или кошачий коронавирусы.
Эти вакцины особенно показаны против инфекционных агентов, которые поражают виды свиней, собак и кошек, инфицирующие слизистые оболочки или использующие слизистые оболочки как путь проникновения.
Конкретная реализация данного изобретения предлагает моновалентные вакцины, способные к защите свиней, собак и кошек против ряда свиных, собачьих и кошачьих инфекционных агентов, тропизм которых контролируется посредством экспрессии гликопротеина S коронавируса.
Моновалентные вакцины против свиных инфекционных агентов могут содержать вектор экспрессии, экспрессирующий антиген, выбранный из группы, состоящей в основном из антигенов следующих свиных патогенов: Actinobacillus pleuropneumoniae, Actinobacillus suis, Haemophilus parasuis, свиной парвовирус, лептоспира, Escherichia coli, Erysipelothrix rhusiopathiae, Pasteurella multocida, Bordetella bronchiseptica, Clostridium sp., Serpulina hyodisenteriae, Mycoplasma hyopneumoniae, свиной вирус эпидемической диарреи (PEDV), свиной респираторный коронавирус, ротавирус, или против патогенов, которые вызывают свиной репродуктивный и респираторный синдром, болезнь Ауески (ложное бешенство), свиную инфлюэнцу, трансмиссивный гастроэнтерит, и этиологического агента атрофического ринита и пролиферативного илеита.
Моновалентные вакцины против собачьих инфекционных агентов могут содержать вектор экспрессии, экспрессирующий антиген, выбранный из группы, состоящей в основном из антигенов следующих собачьих патогенов: собачий вирус герпеса, собачий аденовирус типов 1 и 2, собачий парвовирус типов 1 и 2, собачий реовирус, собачий ротавирус, собачий коронавирус, собачий вирус параинфлюэнцы, собачий вирус инфлюэнцы, вирус собачьей чумы, вирус бешенства, ретровирус и собачий каликовирус.
Моновалентные вакцины против кошачьих инфекционных агентов могут содержать вектор экспрессии, экспрессирующий антиген, выбранный из группы, состоящей в основном из антигенов следующих кошачьих патогенов: кошачий каликовирус, кошачий вирус иммунодефицита, кошачий герпесвирус, кошачий вирус панлейкопении, кошачий реовирус, кошачий ротавирус, кошачий коронавирус, кошачий вирус инфекционного перитонита, вирус бешенства, кошачья Chlamydia psittaci и кошачий вирус лейкемии.
Векторы могут экспрессировать антитело, которое обеспечивает защиту против инфекционного агента, например свиного, собачьего или кошачьего инфекционного агента, такого как описанные выше. В конкретной реализации производили некоторые вектора, экспрессирующие рекомбинантное моноклональное антитело, идентифицированное как 6А.С3. которое нейтрализует TGEV.
Вакцины, полученные по данному изобретению, способны к защите поросят посредством индукции лактогенного иммунитета, который представляет особый интерес для защиты новорожденных поросят
против инфекций кишечного тракта,
Как правило, вакцины, полученные по данному изобретению, могут содержать количество антигена, способное к введению животному, которое нужно иммунизировать,
хелперного вируса титра, по меньшей мере, 108 колониеобразующих единиц (КОЕ).
В качестве эксципиента можно использовать разбавитель, такой как сыворотка на физиологическом растворе или других подобных солевых растворах. Подобным образом, эти вакцины могут также содержать адъювант, такой как адъювант, стандартно применяемый в препаратах вакцин: водный (гидроксид алюминия, QuilA, суспензии геля окиси алюминия и подобные), или масляный [основанный на минеральных маслах, глицеридах и побочных продуктах жирных кислот и их смеси, например Marcol 52(ESSO Espanola S. A.), Simulsol 5100 (SEPIC) and Montanide 888 (SEPIC)].
Эти вакцины могут также содержать вещества-усилители клеточного ответа (CRP), то есть вещества-усилители субпопуляции Т-хелперных клеток (Th1 и Th2), такие как интерлейкин 1 (ИЛ-1), ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-12, г-ИФН (гамма-интерферон), фактор некроза клеток и подобные вещества, которые могут, теоретически, провоцировать клеточный иммунитет у вакцинированных животных. Эти CRP вещества можно было бы применять в препаратах вакцин с водными или масляными адъювантами. Можно также применять другие типы адъювантов, которые модулируют и стимулируют клеточный ответ, такие как МДП (мурамил дипептид), ИСКОМ (иммуностимулирующий комплекс) или липосомы.
Данное изобретение предлагает мультивалентные вакцины, способные к предохранению и защите животных от различных инфекций. Эти мультивалентные вакцины можно получить из векторов экспрессии, в которых различные последовательности, кодирующие соответствующие антигены, встроены в один и тот же рекомбинантный вектор, или посредством конструирования независимых рекомбинантных векторов, которые затем будут смешиваться для их совместной инокуляции вместе с хелперным вирусом.
Таким образом, эти мультивалентные вакцины включают в себя рекомбинантную систему, в которой вектор экспрессии сам по себе содержит более чем одну последовательность ДНК, кодирующую более чем один инфекционный агент или, альтернативно, рекомбинантная система, применяемая в препарате вакцины, может содержать различные векторы экспрессии, каждый из которых экспрессирует по меньшей мере один отличный от других антиген. Действительное ограничение этого типа мультивалентных вакцин состоит в том, что упомянутые векторы экспрессии должны экспрессировать антигены инфекционных агентов одного и того же вида животных и что хелперный вирус должен быть подходящим для данного конкретного вида. Аналогично, можно получить мультивалентные вакцины, которые включают в себя мультивалентные векторы, в которых использованы последовательности, кодирующие антитела, которые обеспечивают защиту против инфекционных агентов, вместо последовательностей, кодирующих антигены. Эти векторы могут содержать рекомбинантную систему, включающую в себя либо вектор экспрессии, содержащий более чем одну последовательность ДНК, кодирующую более чем одно антитело, либо различные векторы экспрессии, каждый из которых экспрессирует по меньшей мере одно отличное от других антитело.
Конкретная реализация данного изобретения предлагает вакцины, способные к защите свиней, собак и кошек против ряда свиных, собачьих и кошачьих инфекционных агентов, соответственно. С этой целью векторы экспрессии, которые содержатся в рекомбинантной системе вакцины, должны экспрессировать различные антигены упомянутых свиных, собачьих и кошачьих патогенов.
Вакцины по данному изобретению могут быть представлены в жидкой или сухой замороженной форме и могут быть получены путем суспендирования рекомбинантных систем в эксципиенте. Если указанные системы находятся в сухой замороженной форме, сам по себе эксципиент может являться разбавителем.
Альтернативно, вакцины, полученные по данному изобретению, можно применять в сочетании с другими стандартными вакцинами, либо в качестве их части, либо как разбавителя сухой замороженной фракции, которую разбавляют другой, стандартной или рекомбинантной вакциной.
Вакцины, предлагаемые данным изобретением, можно вводить животным посредством орального, назального, подкожного, внутрикожного, внутрибрюшинного или внутримышечного курсов, или посредством аэрозоля.
Изобретение также предлагает способ иммунизации животных, в особенности свиней, собак и кошек, против ряда инфекционных агентов одновременно, включающий в себя введение оральным, назальным, подкожным, внутрикожным, внутрибрюшинным или внутримышечным путем или посредством аэрозоля (или их комбинированных форм) вакцины, содержащей иммунологически эффективное количество рекомбинантной системы, предлагаемой настоящим изобретением.
Дополнительно, изобретение предлагает также способ защиты новорожденных животных против инфекционных агентов, которые инфицируют указанных животных, состоящий во введении оральным, назальным, подкожным, внутрикожным, внутрибрюшинным или внутримышечным путем или посредством аэрозоля (или их комбинированных форм) матерям до или во время периода беременности или их потомству вакцины, содержащей иммунологически эффективное количество рекомбинантной системы, предлагаемой настоящим изобретением.
Изобретение иллюстрируется следующими примерами, которые подробно описывают получение дефектных вирусных геномов, их характеристику, конструкцию плазмид и манипуляции с ними с целью получения векторов экспрессии и индукцию нейтрализующих антител против различных инфекционных агентов разных видов.
ПРИМЕР 1
ПОЛУЧЕНИЕ ДЕФЕКТНЫХ ЧАСТИЦ, ПРОИСХОДЯЩИХ ОТ TGEV
1.1 Серийные пассажи без разведения штаммов TGEV при высокой
множественности инфекции (м.и.)
Чтобы способствовать генерированию дефектных частиц или увеличить число частиц, уже существующих в малой пропорции в вирусной популяции, делали серийные
пассажи без разведения различных изолятов TGEV в различных клеточных системах. Поскольку частота, с которой образуются ДИ частицы, может варьировать в различных системах вирус-клетка, пассажи делали с
различными изолятами TGEV (THER-1 и PUR46-war 1CC12) в клеточных линиях ST (свиной семенник, свиные тестикулярные эпителиальные клетки).
Штамм THER-1 (Transmissible gastroenteritis Helper Enteric and Respiratory coronavirus, то есть хелперный кишечный и респираторный коронавриус трансмиссивного гастроэнтерита, штамм 1) представляет собой мутант, ослабленный посредством 20 пассажей в клеточных культурах ST, производный от штамма PUR46-MAD [Sanchez et al., Virology 174, 410-417 (1990)]. Штамм PUR46-mar 1CC12 также описан Sanchez et al. (см. выше).
Каждый штамм TGEV переносили без разведения 35 раз в клетках ST. M. и. первого пассажа в каждом из трех случаев составляла 100 КОЕ на клетку. Супернатант из каждого пассажа собирали между 20 и 48 часами после инфекции (ч. п.и.) при выявлении четкого цитопатического эффекта - обычно если указанный эффект составлял поражение более чем половины клеток монослоя - и половину объема этого супернатанта использовали в следующем пассаже инфекции. Варьирование титра вируса от числа пассажей показано на Фиг.4. Титр вируса находился в пределах между двумя логарифмическими единицами по всем серийным пассажам каждого вируса. В случае штамма THER-1 титр в пассажах от 30 до 46 был ниже, чем в первых тридцати пассажах.
Вирусы, которые были перенесены 35 раз в клетках ST, использовали для анализа внутриклеточных РНК, продуцируемых при инфекции. Анализировали РНК, метаболически меченые32Pi, между 6 и 9 часами после инфекции [Maniatis et al. , Molecular cloning^ A Laboratory Manual, Cold Spring Harbor Laboratory, (1982)] . При инфекции THER-1-p35 (штамм THER-1, перенесенный 35 раз при высокой м.и.) наблюдали три интенсивных полосы, которые не соответствовали какой-либо вирусной мРНК. Эти полосы были локализованы между геномной РНК и мРНК гена S (фиг.5). Чтобы проанализировать природу этих новых субгеномных РНК, продолжили серийные пассажи без разведения штамма THER-1. После 46 пассажей анализировали развитие картины РНК во всех серийных пассажах. С этой целью клетки ST инфицировали вирусом из различных пассажей, и продуцируемые РНК, метаболически меченые, анализировали в денатурирующем агарозном геле (фиг. 5). В пассаже 30 определили три новых РНК размером 22, 10,6 и 9,7 т.о. (РНК А, В и С, показанные на фиг.5 как ДН-А. ДИ-В и ДИ-С соответственно), тогда как в первых пассажах определяли только геномные РНК и субгеномные вирусные мРНК. Эти субгеномные РНК оставались в стабильной форме во всех следующих 15 пассажах, заметно интерферируя с репликацией геномной РНК и синтезом мРНК хелперного вируса (фиг.5, дорожки с 30 по 45). Эти результаты указывают на то, что три РНК, генерированные или амплифицированные в серийных пассажах без разведения, являются стабильными и что по меньшей мере одна из них является интерферирующей.
1.2 Характеристика субгеномных РНК
1.2.1. Анализ концов и внутренних
районов
Чтобы определить, обладают ли субгеномные РНК А, В и С стандартной структурой коронавирусной дефектной РНК, и, особенно, сохраняют ли они 5' и 3' концы генома дикого типа и связан ли
их малый размер с внутренними делениями, провели несколько гибридизационных анализов с зондами, специфичными для вируса. С этой целью выделяли РНК из клеток, инфицированных THER-1-ST-p35 (вирусы
штамма THER-1, перенесенного 35 раз в клетках ST), и анализировали ее гибридизацию со специфическими вирусными зондами в Норзерн-блот-анализе (Maniatis et al., см. выше), используя олигонуклеотиды,
комплементарные лидерной РНК (позиции 66-91, 5' конца родительского генома), нетранслируемому району 3' конца (нуклеотиды 28524-28543 5' конца родительского генома) и структурным генам М и N (позиции
97-116 и 5-24, начинающиеся с праймера AUG каждого гена, соответственно). Полосы справа указывают позиции вирусных мРНК и субгеномных РНК А, В и С.
Как показано на фиг.6, два олигонуклеотида гибридизовались с мРНК родительского вируса, и они также определяли РНК А, В и С, что указывает на то, что эти РНК претерпели внутренние делеции и сохранили свои концы. Как при исходном подходе к анализу, рассматривающем, какие геномные последовательности присутствуют в этих РНК, РНК инфицированных клеток гибридизовали с олигонуклеотидами, комплементарными генам структурных вирусных белков S, М и N. Ни один из них не гибридизовался с дефектными РНК, что позволило предположить, что гены структурных белков были делегированы. Таким образом, субгеномные РНК А, В и С сохраняют концы родительского вируса и имеют внутренние делеции.
1.2.2. Размножение РНК А. В и С
Чтобы подтвердить, что РНК А, В и С представляют собой дефектные геномы,
зависимые от родительского вируса для их размножения в культуре, клетки ST инфицировали вирусом THER-1-ST-p41 (штамм вируса THER-1, перенесенный 41 раз в клетках ST) при различных м.и.: 10, 0,1, 0,01
и 0,001 КОЕ/клетку. Вирус, полученный из этого пассажа, собранный при 10 ч.п.и., титровали и амплифицировали во втором пассаже в клетках ST, который, в свою очередь, использовали для инфекции новых
клеток, из которых выделяли цитоплазматическую РНК (Maniatis et а1., см. выше). РНК анализировали Норзерн-блот-анализом с использованием олигонуклеотида, комплементарного лидерной РНК.
На фиг.7 показаны полученные результаты. М.и. указана над каждой дорожкой (10-3, 10-2, 10-1 и 10 КОЕ/клетку). В качестве отрицательного контроля включили РНК из инфекции клеток ST вирусом THER-1-р1, который не содержит субгеномных РНК, при м. и. 10 КОЕ/клетку (первая дорожка). На дорожке, соответствующей инфекции вирусом THER-l-ST-p41 при м.и. 10 КОЕ/клетку, отмечен положительный контроль, геномные РНК (мРНК 1), а также дефектные РНК А, В и С (представленные как ДИ-А, ДИ-В, ДИ-С) и соответствующий ген S (мРНК 2).
Когда м. и. первого пассажа ("горлышко бутылки" в данном эксперименте, так как последующие пассажи являются амплификационными) составляет 0,1 КОЕ/клетку, наблюдается потеря РНК А, В и С при условиях, в которых геномная РНК и мРНК вируса определяются в ожидаемых соотношениях (фиг.7). Три дефектных РНК сохраняются, если м.и. составляет 10 КОЕ/клетку. Поскольку в вирусе THER-l-ST-p41, использованном для инфекции, обнаруживается более высокая доля РНК А, В и С, чем геномной РНК, эти результаты показывают, что для репликации или размножения этих РНК требуется, чтобы клетки были инфицированы дефектным вирусом, а также хелперным вирусом. Следовательно, РНК А, В и С требуются функции хелперного вируса, которые обеспечиваются in trans. Таким образом, РНК А, В и С представляют собой дефектные геномы, зависимые от хелперного вируса для их размножения.
1.2.3. Генерация, амплификация, размножение и интерференция ДИ РНК in vitro в другой клеточной линии.
Генерация, амплификация, размножение и интерференция РНК ДИ in vitro являются специфичными для клеточной линии, и по этой причине изучали влияние, которое может оказывать смена клеточной линии на дефектные РНК. С этой целью вирус THER-l-ST-p46 (вирус THER-1, перенесенный 46 раз в клетках ST) подвергали новой серии пассажей без разведения в свиных клетках кишечного эпителия (IPEC) и свиных макрофагах (РМ). На фиг.8 показана вариация титра и число пассажей во всех 10 пассажах в IPEC (Фиг.8А) и 5 пассажах в РМ (Фиг. 8Б). Выход вируса- в обеих клеточных линиях был ниже, чем полученный в клетках ST, и оценка такова, что наблюдается вариация в м.и. для каждого пассажа между 20 и 0,2 КОЕ/клетку.
РНК, продуцируемую в клетках ST, инфицированных THER-l-ST-p46-IPEC р1 (вирус THER-l-ST-p46, перенесенный в клетках IPEC один раз) и THER-1-ST-p46-IPEC р10 (вирус THER-l-STp46, перенесенный в клетках IPEC 10 раз) метили32Pi и анализировали в денатурирующем агарозном геле (Фиг.8В).
РНК клеток ST, инфицированных THER-1-ST-p46-РМр1 (вирус THER-1-STp46, перенесенный в клетках РМ один раз) и THER-1-ST-p46-РМр5 (вирус THER-1-ST-p46, перенесенный в клетках РМ 5 раз), анализировали Норзерн-блот-анализом с олигонуклеотидом, комплиментарным лидерной РНК (фиг.8В).
Результаты, которые видны из фиг.8В, показывают, что три дефектные РНК сохранялись в первом пассаже в обеих клеточных линиях, но только РНК А персистировала по меньшей мере во всех пяти пассажах в РМ и во всех 10 пассажах в IPEC. В обоих случаях отмечены положения РНК, соответствующих геному дикого типа (1), РНК А, В и С (ДИ-А, ДИ-В и ДИ-С, соответственно) и мРНК 2 (белок S). На дорожке, соответствующей РНК вируса THER-1-ST-p46-РМ р5 указано положение геномной РНК, наблюдаемой только тогда, когда период экспозиции авторадиографа в 10 раз превышал указанный на Фиг.8В.
1.3. Капсидирование дефектных геномов
Чтобы изучить, обладают ли
дефектные РНК способностью к капсидированиюе, делали частичную очистку одновременно на вирусах THER-1-STpl (вирус THER-1, перенесенный один раз в клетках ST) и THER-l-ST-p41 (вирус THER-1,
перенесенный 41 раз в клетках ST) посредством центрифугирования через 15% вес/объем (в/о) сахарозную подушку. РНК выделяли из очищенных вирионов и анализировали в агарозном геле посредством
окрашивания бромистым этидием (фиг. 9А). В вирионах пассажа 41 РНК А, В и С определялись с той же интенсивностью, что и геномная РНК, что указывает на то, что три дефектные РНК упаковываются
эффективно.
Чтобы определить, упаковываются ли дефектные геномы вместе с полным геномом, или, наоборот, они упаковываются независимо, вирус THER-l-STp41 очищали центрифугированием через сахарозные подушки варьирующей плотности или через непрерывные сахарозные градиенты. РНК из очищенных вирионов в каждом случае анализировали Норзерн-блот-анализом с олигонуклеотидом, комплементарным лидерной РНК (фиг.9Б). Когда центрифугирование делали через 31% (в/о) сахарозную подушку (d=l,19 г/мл), в осажденных вирионах определялся только геном дикого типа. Однако, когда использовали сахарозную подушку более низкой плотности, 15% (в/о) (d=1,11 г/мл), определялись три дефектные РНК дополнительно к полному геному. В непрерывном сахарозном градиенте (15-42%, в/о) было возможно обогащение дефектными вирионами в верхних фракциях градиента (плотность, близкая к 1,15 г/мл) и стандартными вирионами в нижних фракциях (плотность, близкая к 1,20 г/мл), как показано на дорожках г и е фиг.9Б. Верхняя полоса на каждой дорожке соответствует геномам дикого типа и дефектному геному А (ДИ-А), а нижняя полоса соответствует дефектным геномам В и С (ДИ-В и ДИ-С). Эти результаты указывают на то, что РНК А, В и С упаковываются эффективно, и что геномы ДИ-В и ДИ-С (10,6 и 9,7 т.о.) делают это независимо от генома дикого типа, в дефектных вирионах, которые являются более легкими, чем стандартные вирионы.
1.4 Клонирование и определение нуклеотидной последовательности дефектных РНК В и С. Определение их первичной структуры.
1.4.1 Синтез комплиментарной ДНК и амплификация РНК В и С.
Размер дефектных РНК В и С был установлен на основании их подвижности в электрофорезных гелях как 10,6 и 9,7 т.о., соответственно. В связи с их большим размером было невозможно амплифицировать дефектные РНК в одной обратно-транскриптазной и полимеразной цепной реакции (ОТ-ПЦР) с использованием праймеров, комплиментарных концам генома. Чтобы преодолеть это ограничение, дефектные геномы амплифицировали в четырех независимых реакциях с использованием пар праймеров, позволяющих четырем перекрывающимся фрагментам покрыть общую длину генома в каждом случае. Эти перекрывающиеся фрагменты обозначили как а, б, в и г, расположенные от 5' до 3' конца (Фиг.10). РНК вируса THER-1-ST-p41, выделенную из очищенных вирионов, использовали в качестве матрицы. Эта РНК содержала три дефектные РНК А, В и С дополнительно к родительскому геному. В качестве контроля одновременно проводили амплификацию геномной РНК вируса дикого типа THER-1.
Последовательность и позиции олигонуклеотидов, использованных в качестве праймеров в реакции ОТ-ПЦР, указаны в Таблице 1.
Амплификация с помощью ОТ-ПЦР с праймерами 1 и 2 РНК вируса THER-1-ST-p41 и РНК родительского вируса THER-1 имела результатом доминантный продукт ПЦР 1,9 т.п.о. (Фиг.11, фрагмент а). Минорные полосы, наблюдаемые в этой реакции, связаны с неспецифической гибридизацией, как они выглядят на двух дорожках. Ту же самую реакцию ОТ-ПЦР проводили, начиная с агарозной фракции, содержащей пул РНК ДИ-В и ДИ-С, выделенных с помощью очистки из геля, с такими же результатами. Это указывает на то, что фрагмент а является общим для всех РНК ДИ и соответствует району 1,9 т.о. 5' конца генома дикого типа TGEV.
Амплификация с нуклеотидами 3 и 4, начинающаяся с РНК вируса THER-1-STp41, имела результатом уникальный продукт ПЦР 2,8 т.п.о. (Фиг.11, фрагмент б). С контрольной вирусной РНК THER-1 не получили никакого продукта, поскольку размер ожидаемого продукта был 12 т.п.о. Основываясь на этих данных, можно сделать вывод, что по меньшей мере один дефектный геном содержит один фрагмент б 2,8 т.п.о., и что другие содержат такой же или больший фрагмент, который не определяется в реакциях ПЦР в связи с его большим размером.
Олигонуклеотиды 5 и 6, разделенные 4,6 т.о. В родительском геноме, имели результатом два различных продукта 3,5 и 4,6 т.п.о. с РНК вируса THER-1-ST-p41 (Фиг.11, фрагмент в). Продукт 4,6 т.п.о. получали также с РНК вируса дикого типа, использованной в качестве контроля. Эти результаты позволяют предположить, что фрагмент в содержит одну делецию по меньшей мере в одном дефектном геноме (вероятно, в ДИ-С, наиболее представленном дефектном геноме), имея результатом фрагмент ПЦР 3,5 т.п.о. Фрагмент 4,6 т.п.о. происходит от родительского генома, присутствующего в популяции вирусной РНК THER-1-ST-p41, и с тех дефектных геномов, которые сохранили данный район генома.
Амплификация с помощью ОТ-ПЦР с праймерами 7 и 8 геномной РНК родительского вируса не образовала никаких полос (фиг.11, фрагмент г), поскольку расстояние между этими олигонуклеотидами в полном геноме составляет 9,5 т.о. (фиг.10). Напротив, две очень интенсивные полосы 1,9 и 2,1 т.п.о. наблюдали, когда в качестве матрицы использовали РНК вируса THER-1-ST-p41. Эти полосы выглядят широкими и прерывающимися, соответствуя фрагменту г (фиг.11), вероятно, в связи с тем, что они мигрируют совместно с группой минорных полос около 1,9 т. п.о., не позволяя их разделения в гелях. Наблюдали гетерогенность в размере клонированного фрагмента г (см. ниже).
1.4.2 Определение принадлежности продуктов амплификации (а, б, в, и г) к различным дефектным РНК.
Чтобы определить принадлежность фрагментов г размеров, варьирующих между 1,9 и 2,1 т.п.о., к различным дефектным геномам, РНК вируса THER-1-ST-p41, которую использовали в качестве матрицы, фракционировали в агарозном геле, пока не достигли четкого разделения полос, соответствующих РНК генома дикого типа, ДИ-А, ДИ-В и ДИ-С. Полосы, соответствующие каждой из этих четырех РНК, независимо вырезали и использовали в качестве матрицы в реакции амплификации ОТ-ПЦР с олигонуклеотидами 8 и 9. При старте с очищенной полосы геномной РНК не получили никакого продукта ПЦР. С РНК ДИ-В получили преобладающий продукт ПЦР 1,9 т.п.о., хотя получили также менее избыточную ДНК варьирующего размера около 1,9 т. п. о., что указывает на некоторую гетерогенность в этой зоне. Амплификация РНК ДИ-С имела результатом доминирующий продукт 2,1 т.п. о. Эти результаты позволили прикрепить фрагмент 1,9 т.п.о. к дефектной РНК В, а фрагмент 2,1 т.п.о. прикрепить к дефектной РНК С.
Поскольку была определена принадлежность фрагментов г, принадлежность фрагментов 3,5 и 4,6 т.п.о., полученных с праймерами 5 и 6, определили к дефектным РНК С и В, соответственно, поскольку сумма фрагментов от а до г, полученная от этого определения, в каждом случае совпадала с размерами РНК В и С, установленных по подвижности.
Поскольку определили полную последовательность геномов В и С, принадлежность фрагментов подтвердили посредством амплификации каждой очищенной полосы РНК, используя олигонуклеотиды, фланкирующие специфические делеции. Принадлежность фрагментов также подтвердили Норзерн-блот-анализом с использованием олигонуклеотидов, картирующих районы ДИ-В, которые не представлены в ДИ-С, и наоборот.
1.4.3 Клонирование и определение нуклеотидной последовательности перекрывающихся фрагментов а, б, в и г.
Четыре перекрывающихся фрагмента ДНК а (1,9 т.п.о.), б (2,8 т.п.о.), в (3,5 т.п.о.) и г (2,1 т.п.о.), комплементарных РНК С, клонировали в векторе Bluescript SK-. По меньшей мере для двух клонов, происходящих из независимых реакций ОТ-ПЦР, определили нуклеотидную последовательность. Последовательности позиций, которые не совпадают в различных клонах (возможно, ошибки Taq-полимеразы), определяли независимо непосредственно с соответствующих не клонированных продуктов ПЦР. После этой процедуры определили единую последовательность РНК ДИ-С. В среднем 1 ошибку Taq-полимеразы получили при копировании каждых 1,2 т.п.о. Полная последовательность генома ДИ-С показана на Фиг.12.
Полная последовательность РНК ДИ-С, полученную этим путем, сравнили с последовательностями ОРС 1а и 1б вируса PUR46-PAR [Eleouet et al., Virology 206, 817-822 (1995)] и с последовательностью, определенной в данной лаборатории для ОРС другого вируса THER-1. В полной последовательности РНК ДИ-С обнаружили различия 14 нуклеотидов по сравнению с последовательностью штамма PUR46-PAR. Для этих позиций определили нуклеотидную последовательность у штамма THER-1, родительского вируса дефектного генома, чтобы определить специфические замены в геномной дефектной РНК ДИ-С. В полной последовательности РНК ДИ-С присутствовали только три нуклеотидных различия по сравнению с соответствующей последовательностью родительского вируса, и одна вставка в позиции 9189, которая не влияет ни на одну ОРС (фиг.12).
1.4.4 Первичная структура геномов ДИ-С и ДИ-В.
Данные нуклеотидной последовательности, указанные для генома ДИ-С, составили из четырех прерывающихся районов родительского генома (Фиг.13), включающих в себя: а) 2144 нуклеотида 5' конца генома; б) 4540 нуклеотидв, соответствующих району между позициями 12195 и 16734 родительского, который включает в себя перекрывающуюся область между ОРС 1а и 1б, и приблизительно 5' половину ОРС 1б; в) район 2531 нуклеотидов, соответствующий позициям 17843-20372 генома дикого типа, который содержит 3' половину ОРС 1б и первые 8 нуклеотидов гена S; и г) 493 нуклеотида 3' конца.
Первичную структуру генома ДИ-В определяли посредством определения нуклеотидной последовательности клонированных фрагментов а и б (общие с геномом ДИ-С), в (как в родительском геноме) и г (специфичный для генома ДИ-В). Геном ДИ-В составлен из трех прерывающихся районов генома (Фиг.14): а) 2144 нуклеотида 5' конца генома, общие для всех клонов ДИ-В и идентичные району I РНК ДИ-С; б) район, варьирующий в размерах, 8178-8243 нуклеотида, соответствующий позициям от 12195-20369 до 20436 родительского генома, который включает в себя перекрывающуюся зону между двумя ОРС гена 1, полную ОРС 1б и первые нуклеотиды гена S; и в) нуклеотиды от 278 до 303 3' района генома.
Клоны, составляющие популяцию, установленную для геномов ДИ-В, различаются в размерах делеции, которая имела место между районами II и III, которые начинаются на старте гена S (между нуклеотидами 6 и 73) и заканчиваются в конце гена 7 (между нуклеотидами 195 и 233).
Последовательность 5' конца родительской РНК THER-1 была установлена путем прямого определения нуклеотидной последовательности РНК и представляет собой 5'-NCUUUUAAAG-3'. Природу первого нуклеотида "N" последовательности не определили. Последовательность же 5' конца трех изолятов TGEV, PUR46-PAR, PUR46-BRI и FS772/70 была описана [Eleouet et al., см. выше; Page et al., Virus Genes 4, 289-301 (1990); Sethna et al., J. Virol, 65, 320-325 (1991)], и все они различаются по первому нуклеотиду. Последовательность лидера дефектных РНК должна быть такой же, как последовательность лидера родительского генома, с точки зрения смены лидеров, которая имеет место при коронавирусной инфекции [Makino et al., J. Virol, 57, 729-737 (1986)].
Три дефектные РНК содержат полиА, поскольку они присоединяются к олигоdТ колонкам (результаты не представлены).
1.4.5 РНК В и С
сохраняют перекрывающийся район между ОРС 1а и 1б, который включает в себя мотив, ответственный за транслокацию (-1) рибосомы
В соответствии с последовательностями, определенными для геномов
ДИ-С и ДИ-В, возможно предсказать ОРС 6370 и 10003 нуклеотидов, соответственно, начинающихся с нуклеотида 315, считая от 5' конца генома. ОРС РНК ДИ-С заканчивается в кодоне терминации, образованном в
сайте соединения прерывающихся районов II и III, где внутренняя делеция имела место в ОРС 1б, в позиции 6685 генома ДИ-С. ОРС генома ДИ-В заканчивается в природном кодоне терминации ОРС 1б.
Две дефектные РНК сохраняют перекрывающуюся зону между ОРС 1а и 1б, которая включает в себя "скользящую" последовательность и мотив псевдоузла в третичной структуре, ответственный за транслокацию (-1) рибосомы в этой зоне (Eleouet et al., см. выше). На Фиг.15 показаны возможные вторичная и третичная структуры РНК в этой зоне. Структура, предполагаемая Eleouet et al. для псевдоузла в этой зоне, представляет собой такую, как указано в С и D; однако существуют другие возможные структуры (как указано в А и Б), хотя неизвестно, какая является правильной.
Описано, что транслокация осуществляется с эффективностью 20% в TGEV (Eleouet et al., см. выше) и обеспечивает непрерывную трансляцию гена 1. Тот факт, что РНК ДИ-В и ДИ-С (а возможно и ДИ-А РНК) сохраняют этот район родительского генома, позволяет предположить, что он должен быть необходим для репликации РНК или для размножения генома.
В дефектных геномах ДИ-С и ДИ-В есть две другие малые ОРС. Одна из них, предшествующая длинной рамке считывания, кодирует пептид из трех аминокислот, который также обнаружен в геноме дикого типа и функция которого неизвестна. Другая ОРС начинается в обоих случаях с AUG гена S и кодирует пептид из 16 аминокислот в ДИ-С и пептид варьирующего размера в ДИ-В. Неизвестно, являются ли эти ОРС функциональными. Только две единые последовательности промоторов транскрипции вируса (CUAAAC), которые сохраняются в дефектных РНК В и С, точно представляют собой те, которые предшествуют гену 1 и гену S. Эти последовательности отмечены на Фиг.12.
На фиг.16 показано картирование РНК А, В и С посредством гибридизации с олигонуклеотидами, специфичными для вируса, в Норзерн-блот-анализе. РНК вируса THER-l-ST-p41 фракционировали в агарозных гелях до тех пор, пока не получили четкое разделение РНК родительского генома и ДИ А, В и С. РНК переносили на нейлоновые фильтры, которые гибридизовали с различными олигонуклеотидами, мечеными32Pi, гибридизующимися с родительским геномом (+) и гибридизующимися (+) или нет(-) с дефектными геномами. Приблизительное расположение последовательностей, комплементарных олигонуклеотидам в родительском геноме, указаны маркированными срелками. Их точная последовательность и положение видны из таблицы 2. Все олигонуклеотиды гибридизовались с родительским геномом, и были получены ожидаемые результаты для РНК В и С.
ПРИМЕР 2
ОБРАЗОВАНИЕ ВЕКТОРОВ ЭКСПРЕССИИ
кДНК, кодирующая РНК ДИ-С, была клонирована в плазмиду
Bluescript II под контролем промотора фага Т7. Эта кДНК включает в себя полиА последовательности, рибозим вируса гепатита дельта (HDV) и сигналы терминации фага Т7. Одна из этих плазмид, конструкция
которой видна из Фиг.17, была обозначена pDIC-1. Этими плазмидами можно манипулировать для клонирования в них гетерологичных генов под контролем промотора гена S, присутствующего в дефектном геноме,
или другого промотора TGEV, или их варианта с повышенной эффективностью.
Клонирование этих гетерологичных генов делали после OPC 1б, следуя за кодоном инициации (AUG) гена S, и в рамке считывания с этим геном.
С этих кДНК РНК экспрессировали с использованием полимеразы фага Т7, и этой РНК трансформировали клетки ST, которые были предварительно инфицированы ослабленным хелперным вирусом THER-1, что давало возможность восстанавливать вирионы, содержащие геном хелперного вируса, и другие вирионы, содержащие соответствующий дефектный геном. Эти вирусы, высушенные замораживанием в присутствии 2%-ной фетальной сыворотки теленка, использовали в качестве вакцины для индукции специфических антител против агентов, которые инфицируют желудочно-кишечный и респираторный тракты свиней, собак и кроликов.
Тропизм векторов был специфически направлен на виды свиней, собак и кошек с использованием соответствующих ослабленных хелперных вирусов.
ПРИМЕР 3
ИНДУКЦИЯ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ
3.1 Индукция защиты против свиного коронавируса эпидемической диарреи (PEDV)
Свиней иммунизировали с
использованием рекомбинантной системы, состоящей из хелперного вируса (THER-1) и плазмиды pDIC-1, в которую был клонирован ген гликопротеина S вируса PEDV.
Иммунизации делали посредством введения 109 КОЕ на поросенка оральным путем.
Присутствие нейтрализующих антител анализировали в сыворотке вакцинированных животных на 15, 30, 45 и 60 день после иммунизации; присутствие антител, специфичных для PEDV, определяли с использованием радиоиммунологического анализа (RIA) (Maniatis et al., см. выше}.
Сывороткой, собранной на 45 день после иммунизации, обеспечивалась полная защита против инфекции PEDV (штамм SEG86-1) у 10-дневных поросят, когда эту сыворотку преинкубировали с вирулентным вирусом перед оральным введением.
3.2 Индукция защиты против собачьего коронавируса.
Собак иммунизировали с использованием рекомбинантной системы, состоящей из хелперного вируса (собачий коронавирус штамма Fort Dodge) и плазмиды pDIC-1, в которую был клонирован ген гликопротеина S собачьего коронавируса (штамм Fort Dodge).
Иммунизации делали посредством введения 109 КОЕ на собаку оральным путем.
Присутствие нейтрализующих антител анализировали в сыворотке вакцинированных животных на 15, 30, 45 и 60 день после иммунизации; присутствие антител, специфичных для собачьего коронавируса, определяли с использованием RIA.
Сывороткой, собранной на 45 день после иммунизации, обеспечивалась полная защита против инфекции собачьим коронавирусом (штамм Fort Dodge) у 10-дневных щенков, когда эту сыворотку преинкубировали с вирулентным вирусом перед анальным введением.
3.3 Индукция защиты против инфекций,
вызванных артеривирусом PRRSV
Свиней иммунизировали с использованием рекомбинантной системы, состоящей из хелперного вируса (THER-1) и плазмиды pDIC-1, в которую были клонированы ОРС3 и ОРС5
артеривируса PRRSV (штамм Fort Dodge).
Иммунизации делали посредством введения 109 КОЕ на поросенка оральным путем.
Присутствие нейтрализующих антител анализировали в сыворотке животных, вакцинированных на 15, 30, 45 и 60 день после иммунизации; присутствие антител, специфичных для PRRSV, определяли с использованием RIA.
Сывороткой, собранной на 45 день после иммунизации, обеспечивалась полная защита против инфекции PRRSV (штамм Fort Dodge) у 10-дневных поросят, когда эту сыворотку проинкубировали с вирулентным вирусом перед оральным введением.
ПРИМЕР 4
ПОЛУЧЕНИЕ ВЕКТОРОВ ЭКСПРЕССИИ
Следуя методике, сходной с той, которая описана в Примере 2, кДНК, кодирующая самореплицирующуюся РНК,
клонировали в плазмиду Bluescript II, под контролем промотора фага Т7. Эта кДНК включает в себя полиА последовательности, рибозим вируса гепатита дельта (HDV) и сигналы терминации фага Т7. Одна из
этих плазмид, конструкция которой показана на Фиг.18, определена как 6А. СЗ. Эта плазмида содержит ген, кодирующий моноклональное антитело 6А.СЗ, которое нейтрализует TGEV. Характеристики
моноклонального антитела 6А.СЗ и его конструкция описана в докторской диссертации Dr. Joaquin Castilla Carrion's под заглавием "Construccion de animales transgenicos secrelores de aniicuerpos
neutralizantes para coronavirus". Universidad Autonoma, Madrid, Faculty of Science, December 1996, Pages 43-52, 65-79.
Клонирование гетерологичного гена делали после ОРС 1б, следуя за кодоном инициации (AUG) гена S, и в рамке считывания с этим геном.
С этой кДНК экспрессировали РНК с использованием полимеразы фага Т7, которой трансформировали клетки ST, предварительно инфицированные ослабленным хелперным вирусом THER-1, что приводило к восстановления вирионов, содержащих геном хелперного вируса и другие вирионы с соответствующим дефектным геномом. Эти вирусы, высушенные замораживанием в присутствии 2%-ной фетальной сыворотки теленка, можно использовать в качестве векторов для экспрессии рекомбинантного моноклонального антитела 6А.С3. Тропизм векторов делали специфичным для видов свиней с использованием соответствующего ослабленного хелперного вируса.
ПРИМЕР 5
ИНДУКЦИЯ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ
Свиней
иммунизировали с использованием рекомбинантной системы, состоящей из хелперного вируса (THER-1) и плазмиды pDIA-6А.С3 (Пример 4), содержащей последовательность, кодирующую рекомбинантное
моноклональное антитело 6А.С3, которое нейтрализует TGEV.
Иммунизации делали посредством введения 109 КОЕ на поросенка оральным путем.
Присутствие нейтрализующих антител 6А.С3 анализировали в сыворотке животных, вакцинированных на 15, 30, 45 и 60 день после иммунизации с использованием RIA (Maniatis et al., см. выше). Рекомбинантные антитела характеризовались титром RIA выше чем 103 и были способны редуцировать титр инфекционного вируса более чем в 104 раз.
ДЕПОНИРОВАНИЕ МИКРООРГАНИЗМОВ
Плазмида, обозначенная pDIC-1, введенная в бактерию DH-5, производную от Е. coli, [DH5/pDIC-l] , была депонирована 6 марта 1996 в Европейской Коллекции Культур Клеток Животных (ЕСАСС), Porton Down,
Salisbury, Wiltshire SP4 OJG, United Kingdom, с соответствующим номером по каталогу Р96030641.
Дополнительно, ослабленный хелперный вирус, определенный THER-1, был депонирован в ЕСАСС 6 марта 1996 с соответствующим номером по каталогу V96030642.
Реферат
Изобретение относится к генной инженерии и касается векторов, содержащих дефектный вирусный геном, который экспрессирует антиген, пригодный для индукции секреторного и системного иммунных ответов, или антитело, обеспечивающее защиту против инфекционного агента. Представленный дефектный вирусный геном получен от родительского генома свиного вируса трансмиссивного гастроэнтерита (TGEV) путем делегирования части родительского генома и сохраняет 3' и 5' концы родительского генома с локализованными на них сигналами узнавания вирусной репликазой и, по меньшей мере, промотор. Указанные векторы пригодны для создания рекомбининтной системы, которая включает в себя указанный вектор экспрессии и хелперный вирус. Такая система используется для получения моно- и поливалентных вакцин против инфекционных агентов различных видов животных. Представленное изобретение предлагает векторы экспрессии гетерологичных генов с высоким уровнем безопасности и емкости клонирования, сконструированные таким образом, что их видоспецифичность и тропизм можно легко контролировать. 6 с. и 8 з.п.ф-лы, 2 табл., 30 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ встраивания гетерологичной днк в геном аденовируса celo и рекомбинантный аденовирусный вектор celo/рuc19

Комментарии