Молекула адгезии т-клеток и антитело, направленное против молекулы - RU2396275C2
Код документа: RU2396275C2
Чертежи



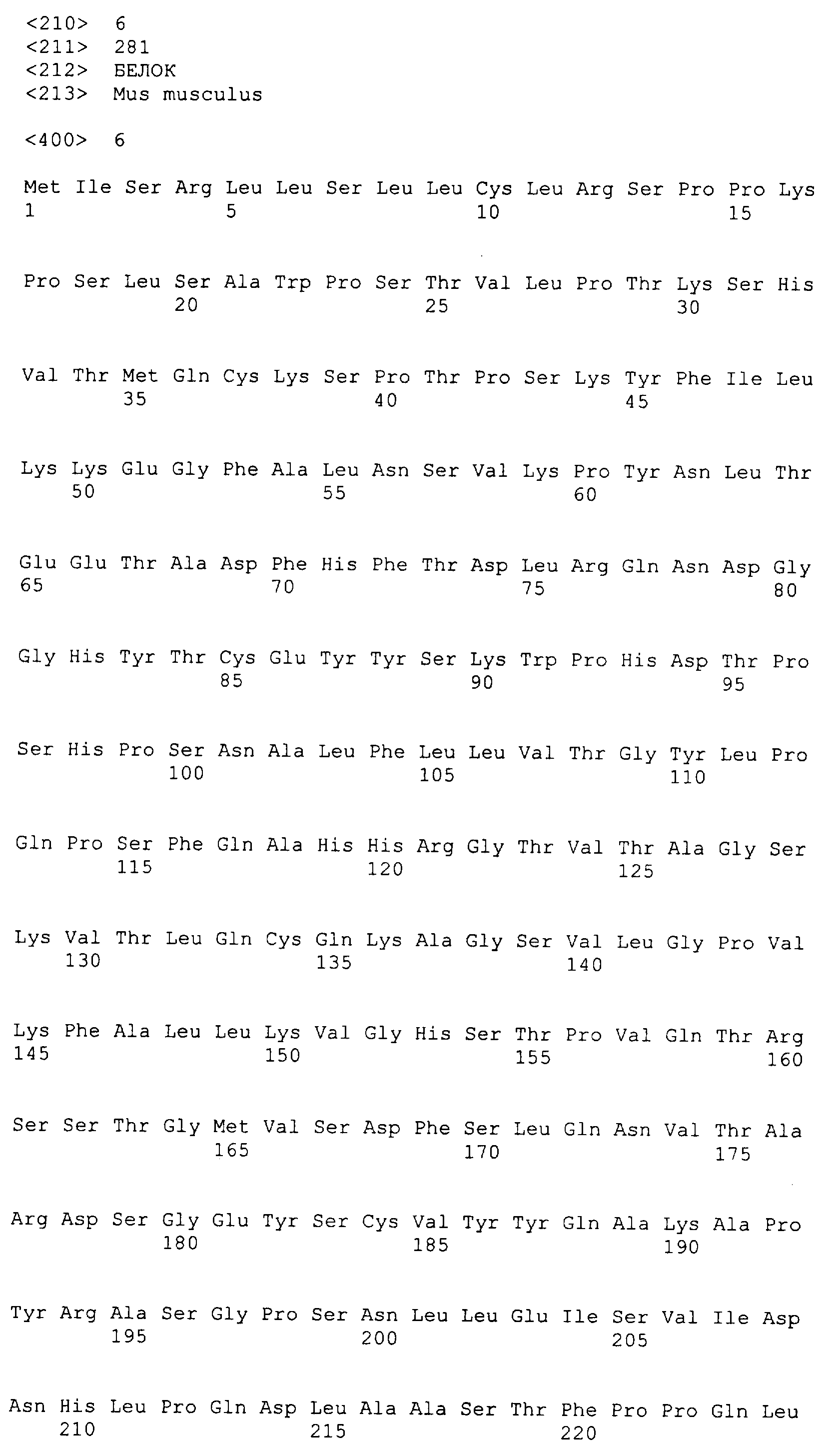





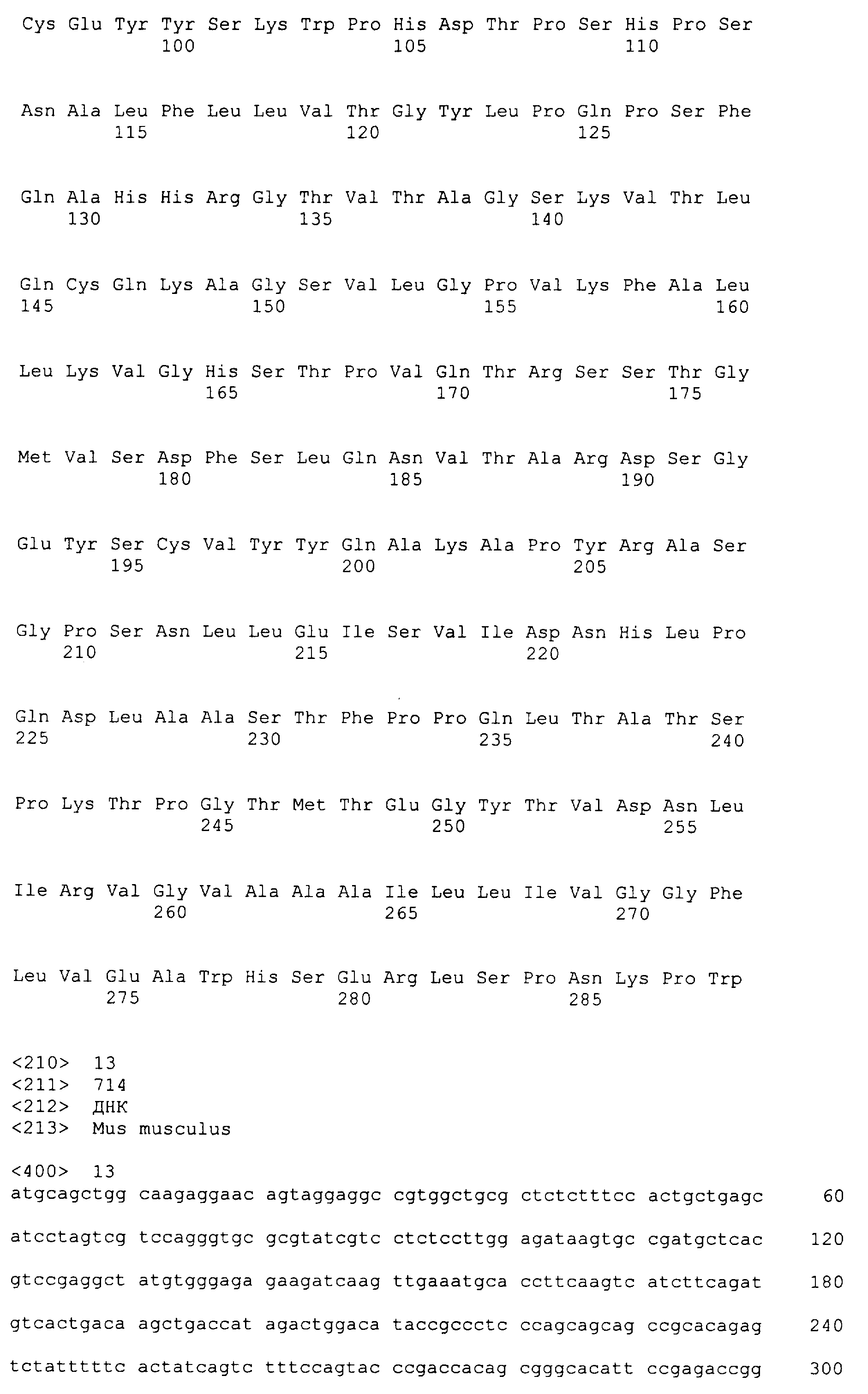


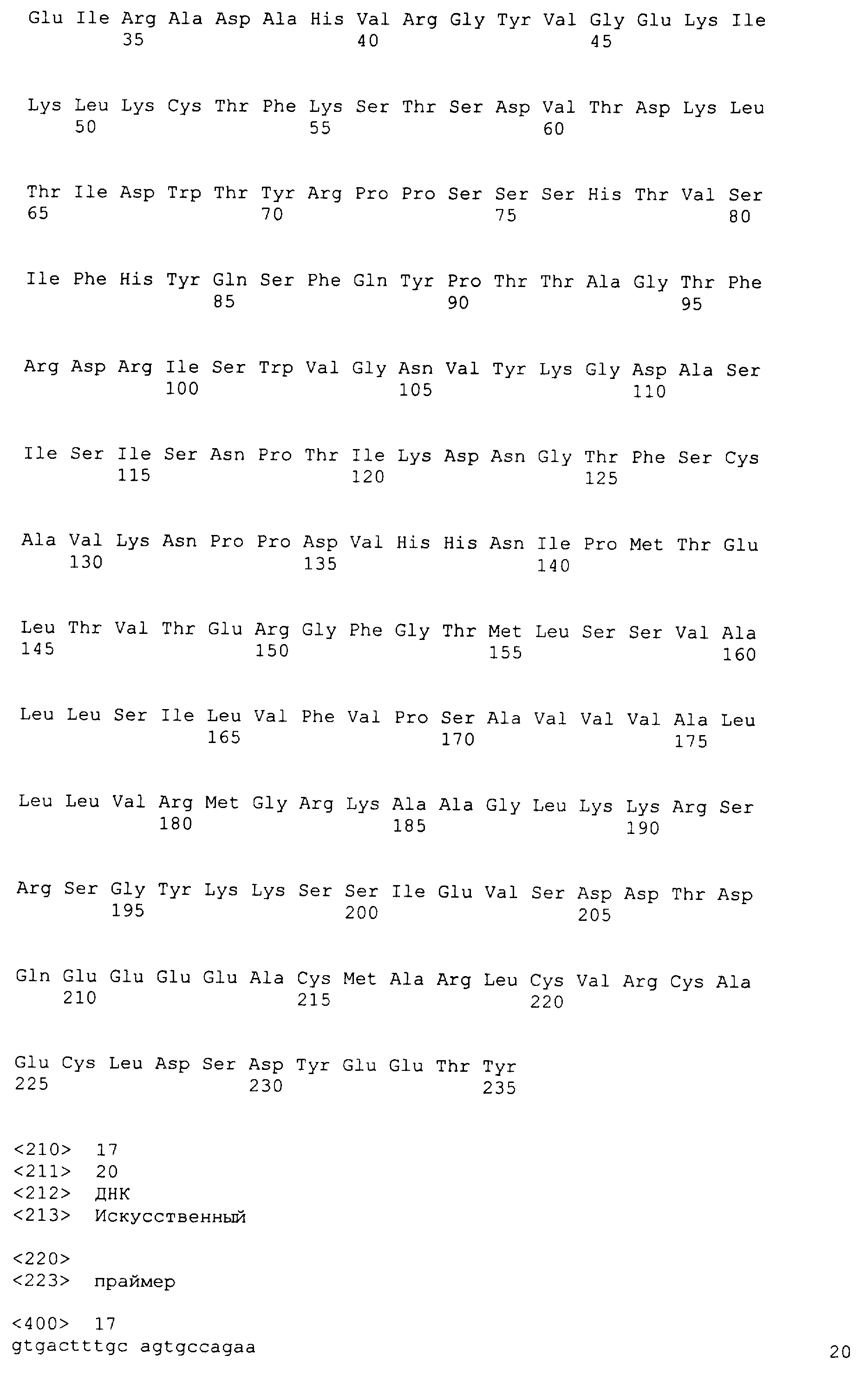








Описание
Описание
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к молекуле адгезии T-клеток, которая экспрессируется на дендритных клетках, происходящих из костного мозга, и ее гену, и лиганду для молекулы адгезии (рецептору), который экспрессируется на T-клетках, и его гену. Настоящее изобретение также относится к антителам против молекулы адгезии или лиганда и их применению. Более того, настоящее изобретение также относится к способу скрининга с использованием молекулы адгезии.
УРОВЕНЬ ТЕХНИКИ
В последние годы сообщалось, что молекула, клонированная как активатор дендритных клеток, которая экспрессируется на T-клетках, является основным цитокином для регуляции дифференцировки остеокластов (Yasuda, H., et al. (1998) Proc Natl Acad Sci USA 95:3597-3602). Таким образом, стало ясно, что иммунная система тесно связана с метаболизмом костей.
Исследования регуляции метаболизма костей посредством молекул, регулирующих иммунную систему, быстро развивались и передача сигнала, связанная с регуляцией дифференцировки остеокластов, стала очевидной.
Например, в качестве молекулы, вовлеченной в дифференцировку остеокластов, стал известен Oscar (ассоциированный с остеокластами рецептор). К настоящему времени получены данные, что Oscar является иммуноглобулинподобным рецептором, который ассоциирован с цепью FcRγ и передает сигнал на фосфолипазу Cγ посредством мотива ITAM цепи FcRγ (Kim, N., et al. (2002) J Exp Med 195:201-209).
Кроме того, сообщалось о различных взаимодействиях, таких как CD80-CD28, CD40-CD40L или ICAM1-LFA1, для молекул, которые экспрессируются на дендритных клетках и связываются с T-клетками, таким образом, оказываясь вовлеченными во взаимодействие между T-клетками и дендритными клетками, связанное с иммунным ответом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения способом вычитания идентифицировали ген, который специфически экспрессируется на дендритных клетках, происходящих из костного мозга. Также авторы настоящего изобретения обнаружили, что белок, кодируемый вышеупомянутым геном, связывается с цепью FcRγ, составляющей рецептор IgE, что экспрессию вышеупомянутого белка усиливает стимуляция с помощью LPS, что дендритные клетки активируются перекрестной стимуляцией антителами к вышеупомянутому белку, что вышеупомянутый белок обладает функцией связывания с T-клетками и что антитела против вышеупомянутого белка обладают терапевтическим эффектом на модели индуцированного коллагеном артрита, которая является моделью заболевания ревматоидного артрита. Авторы настоящего изобретения далее идентифицировали ген лиганда для вышеупомянутого белка, который экспрессируется на T-клетках. Настоящее изобретение основано на этих открытиях.
Настоящее изобретение относится к мембранному или секреторному белку, содержащему аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6 или SEQ ID № 8, или аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6 или SEQ ID № 8, которая содержит одну или несколько консервативных замен (в дальнейшем обозначенному как новый белок первого варианта осуществления согласно настоящему изобретению).
Настоящее изобретение относится к мембранному или секреторному белку, выбранному из следующего (i), (ii), (iii) и (iv) (в дальнейшем обозначенному как новый белок второго варианта осуществления согласно настоящему изобретению):
(i) мембранный или секреторный белок, содержащий аминокислотную последовательность SEQ ID № 10;
(ii) мембранный или секреторный белок, который содержит аминокислотную последовательность SEQ ID № 10, в которой одна или несколько аминокислот вставлены, заменены или удалены, или одна или несколько аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 10;
(iii) мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, который кодирует аминокислотную последовательность SEQ ID № 10 и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 10; и
(iv) мембранный или секреторный белок, который содержит аминокислотную последовательность, обладающую 90% или большей идентичностью с аминокислотной последовательностью SEQ ID № 10, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 10.
Настоящее изобретение относится к полинуклеотиду, кодирующему новые белки первого и второго вариантов осуществления согласно настоящему изобретению.
Настоящее изобретение также относится к полинуклеотиду, выбранному из следующего (v), (vi), (vii) и (viii):
(v) полинуклеотид, содержащий нуклеотидную последовательность SEQ ID № 9;
(vi) полинуклеотид, который содержит нуклеотидную последовательность SEQ ID № 9, в которой один или несколько нуклеотидов вставлены, заменены или удалены, или один или несколько нуклеотидов добавлены к одному или обоим концам, и который кодирует мембранный или секреторный белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 10;
(vii) полинуклеотид, который гибридизуется в жестких условиях с полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID № 9 и который кодирует мембранный или секреторный белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 10; и
(viii) полинуклеотид, который обладает 90% или большей идентичностью с полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID № 9, и который кодирует мембранный или секреторный белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 10.
Настоящее изобретение также относится к антителам против мембранного или секреторного белка, выбранного из следующего (ix), (x), (xi) и (xii) (в дальнейшем иногда обозначенного как белок TARM (взаимодействующий с T-клетками активирующий рецептор на миелоидных клетках)), и их функциональному фрагменту (в дальнейшем обозначенным как антитела первого варианта осуществления согласно настоящему изобретению):
(ix) мембранный или секреторный белок, содержащий аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12;
(x) мембранный или секреторный белок, который содержит аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, в которой одна или несколько аминокислот вставлены, заменены или удалены, или одна или несколько аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12;
(xi) мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, который кодирует аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12; и
(xii) мембранный или секреторный белок, который содержит аминокислотную последовательность, обладающую 70% или большей идентичностью с аминокислотной последовательностью SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12.
Настоящее изобретение относится к новому белковому лиганду, который является лигандом для нового белка согласно настоящему изобретению, который выбран из следующего (xiii), (xiv), (xv) и (xvi) (в дальнейшем иногда обозначается как новый белковый лиганд согласно настоящему изобретению или белок TARM-L (лиганд TARM)):
(xiii) белок, содержащий аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16;
(xiv) белок, который содержит аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16, в которой одна или несколько аминокислот вставлены, заменены или удалены, или одна или несколько аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16;
(xv) белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, который кодирует аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16; и
(xvi) белок, который содержит аминокислотную последовательность, обладающую 70% или большей идентичностью с аминокислотной последовательностью SEQ ID № 14 или SEQ ID № 16, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16.
Настоящее изобретение относится к полинуклеотиду, кодирующему новый белковый лиганд согласно настоящему изобретению.
Настоящее изобретение также относится к полинуклеотиду, выбранному из следующего (xvii), (xviii), (xix) и (xx):
(xvii) полинуклеотид, содержащий нуклеотидную последовательность SEQ ID № 13 или SEQ ID № 15;
(xviii) полинуклеотид, который содержит нуклеотидную последовательность SEQ ID № 13 или SEQ ID № 15, в которой один или несколько нуклеотидов вставлены, заменены или удалены, или один или несколько нуклеотидов добавлены к одному или обоим концам, и который кодирует белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16;
(xix) полинуклеотид, который гибридизуется в жестких условиях с полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID № 13 или SEQ ID № 15, и который кодирует белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16; и
(xx) полинуклеотид, который обладает 70% или большей идентичностью с полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID № 13 или SEQ ID № 15, и который кодирует белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16.
Настоящее изобретение относится к антителам против нового белкового лиганда согласно настоящему изобретению и их функциональному фрагменту (в дальнейшем обозначенным как антитела второго варианта осуществления согласно настоящему изобретению).
Настоящее изобретение относится к лекарственному средству при аутоиммунных заболеваниях и средству для ингибирования адгезии T-клеток, содержащему в качестве активных ингредиентов антитела первого и второго вариантов осуществления согласно настоящему изобретению (в дальнейшем оба вида антител можно обозначить как «антитела согласно настоящему изобретению»), или их функциональные фрагменты.
Настоящее изобретение относится к следующим способам скрининга.
Согласно способу скрининга по первому варианту осуществления согласно настоящему изобретению предложен способ скрининга вещества или его соли, или его сольвата, которое ингибирует адгезию T-клетки к белку TARM, который включает стадии:
(a) контактирование T-клетки с белком TARM в присутствии или в отсутствие тестируемого вещества; и
(b) измерение активности связывания T-клетки с указанным белком TARM.
Согласно способу скрининга по второму варианту осуществления согласно настоящему изобретению предложен способ скрининга вещества или его соли, или его сольвата, которое ингибирует активацию дендритной клетки, который включает стадии:
(d) контактирование антител или их функционального фрагмента согласно настоящему изобретению с дендритной клеткой в присутствии или в отсутствие тестируемого вещества; и
(e) измерение уровня активации указанной дендритной клетки.
Согласно способу скрининга по третьему варианту осуществления согласно настоящему изобретению предложен способ скрининга вещества или его соли, или его сольвата, которое ингибирует образование комплекса между белком TARM и цепью FcRγ, который включает стадии:
(g) контактирование антител или их функционального фрагмента согласно настоящему изобретению с дендритной клеткой в присутствии или в отсутствие тестируемого вещества; и
(h) измерение уровня экспрессии цепи FcRγ в указанной дендритной клетке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлены аминокислотные последовательности генов TARM мыши (m1-m4 и s1), в которых подчеркивание указывает на область структуры петли иммуноглобулина (IG), и жирный шрифт указывает на трансмембранную область.
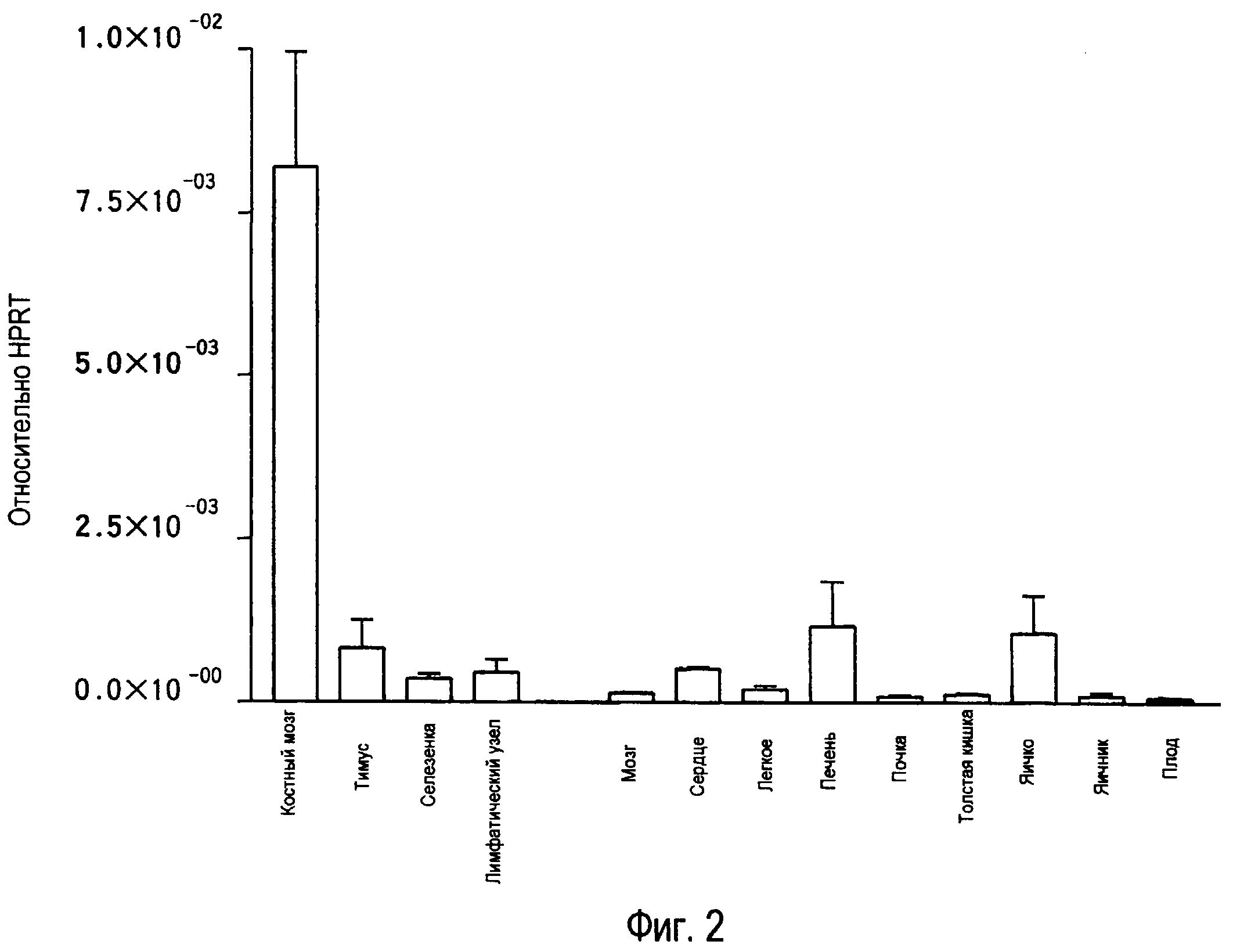
На фиг.2 представлены результаты, полученные анализом экспрессии мРНК TARM в тканях мыши с помощью PCR в реальном времени с использованием набора праймеров 1.
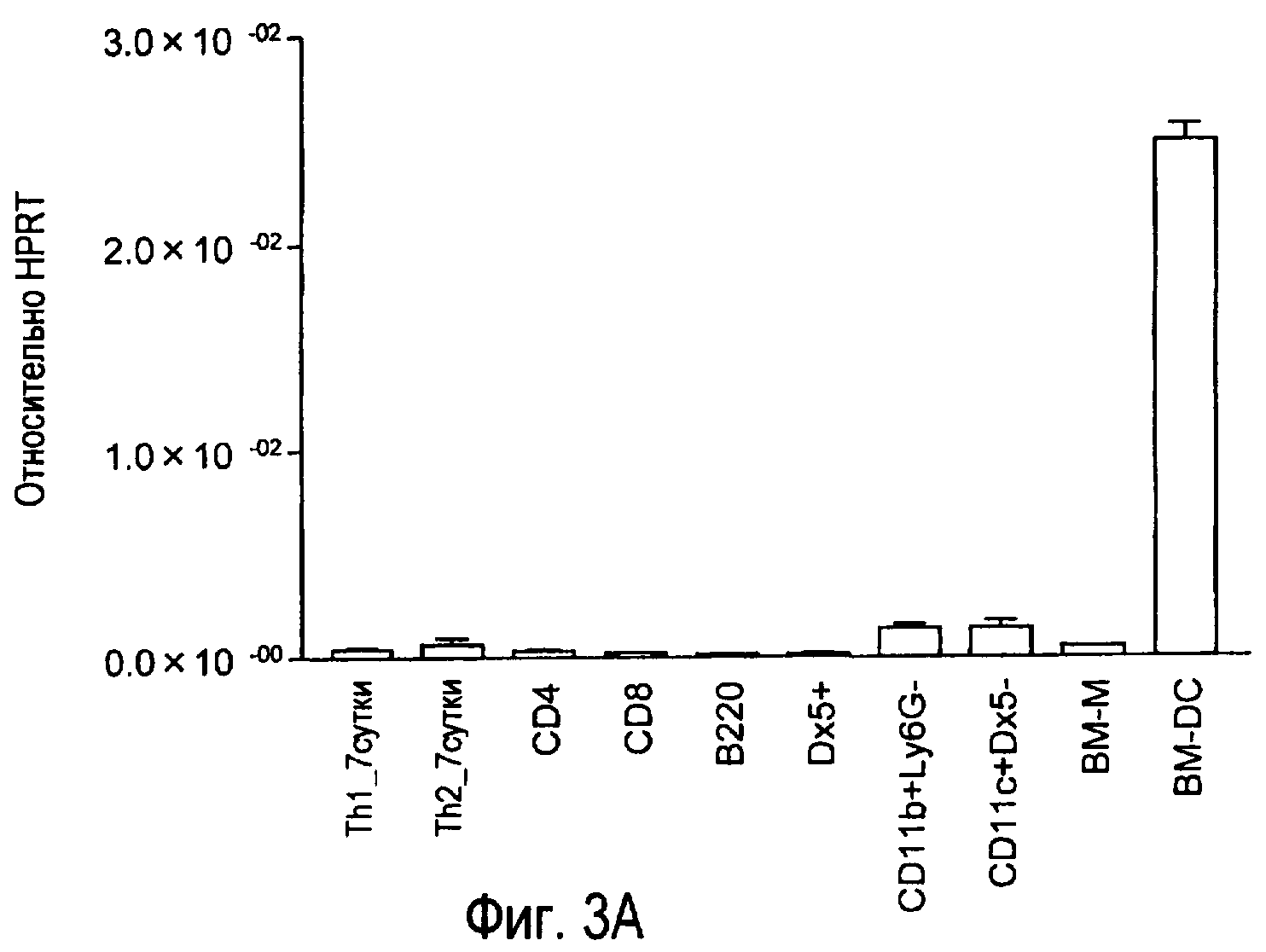
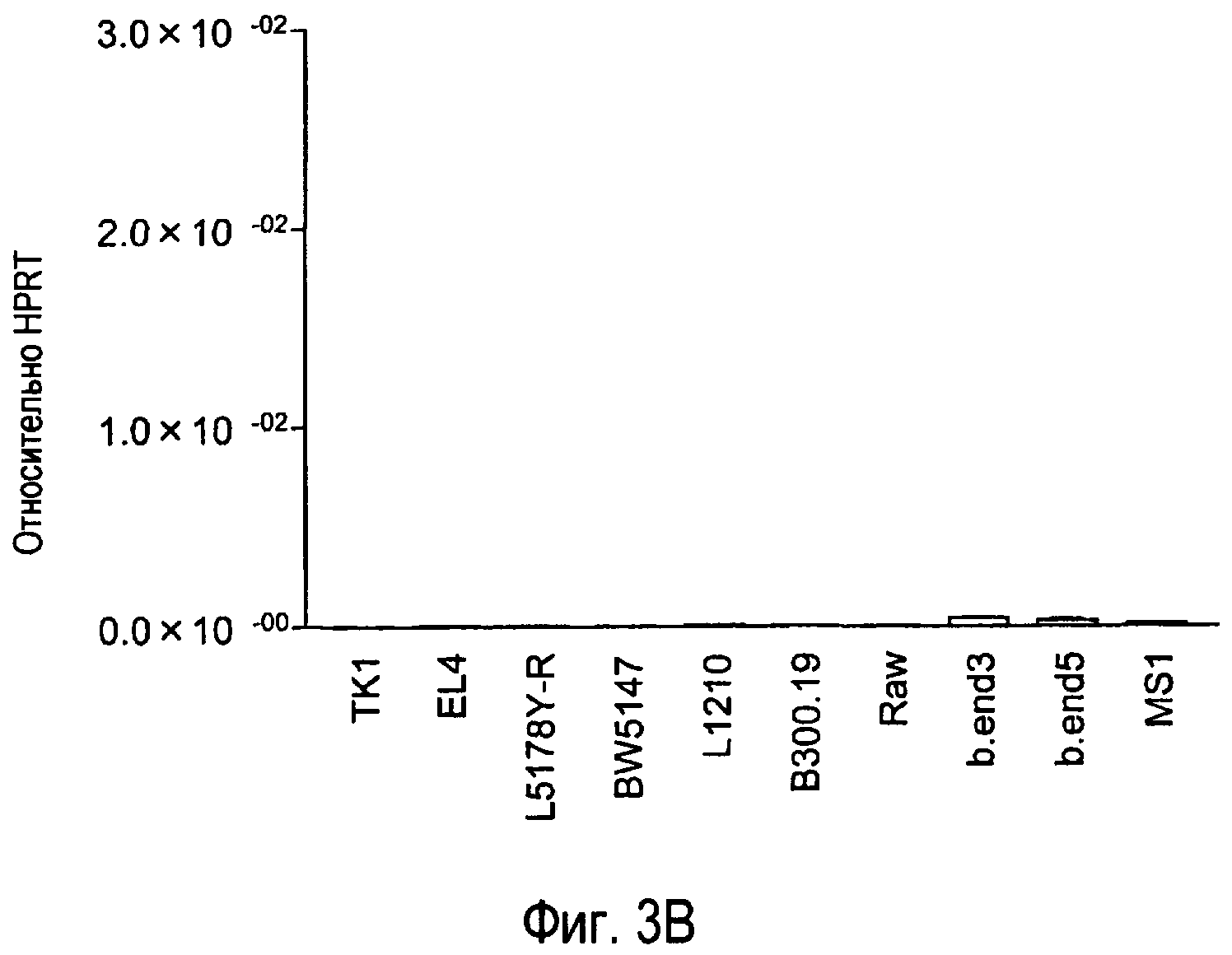
На фиг.3 представлены результаты, полученные анализом экспрессии мРНК TARM в различных типах клеток с помощью PCR в реальном времени с использованием набора праймеров 1.
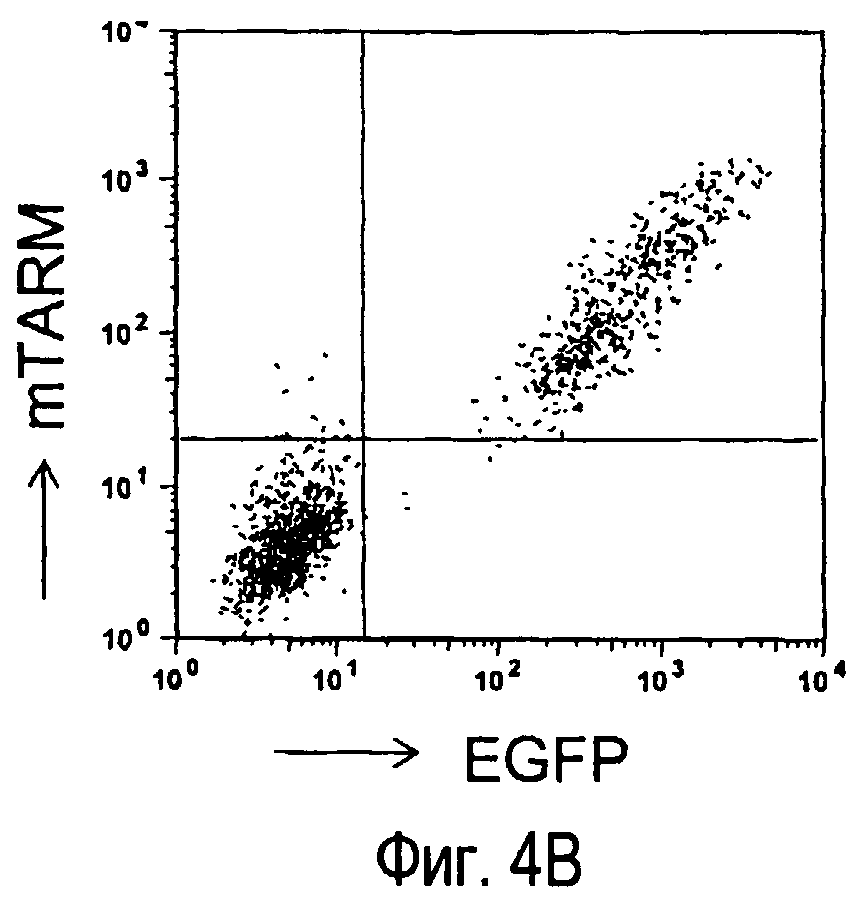
На фиг.4A представлены структура и номера аминокислот внеклеточной области, используемой при получении антител анти-TARM. На фиг.4B представлены результаты, полученные при изучении специфичности вышеупомянутых антител к белку TARM.
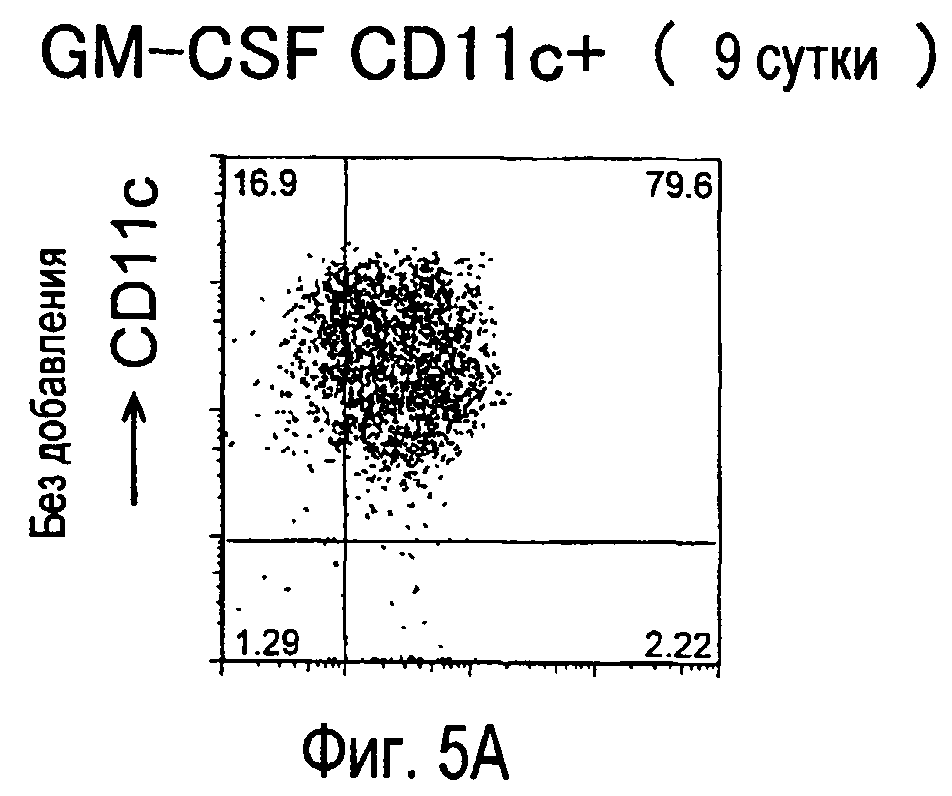
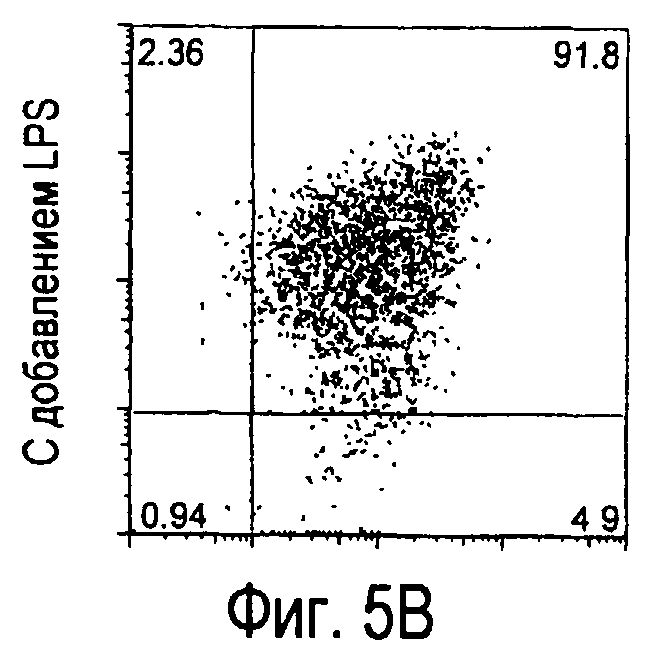
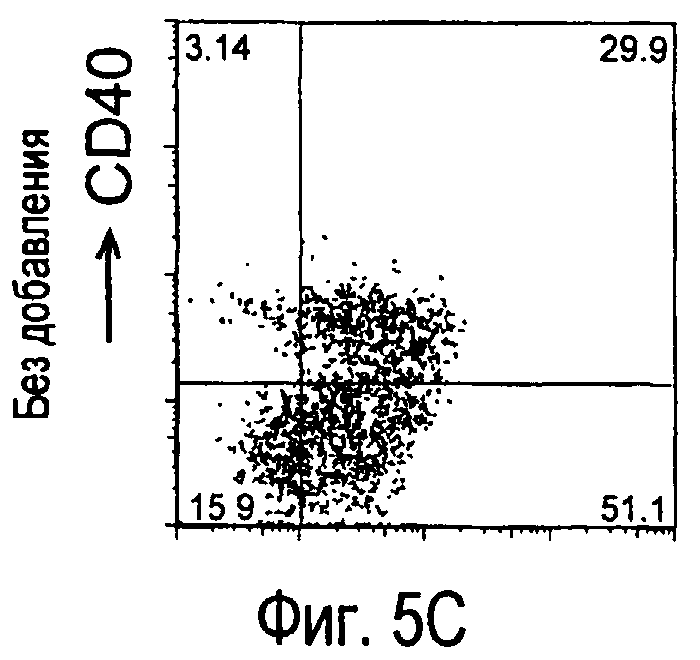
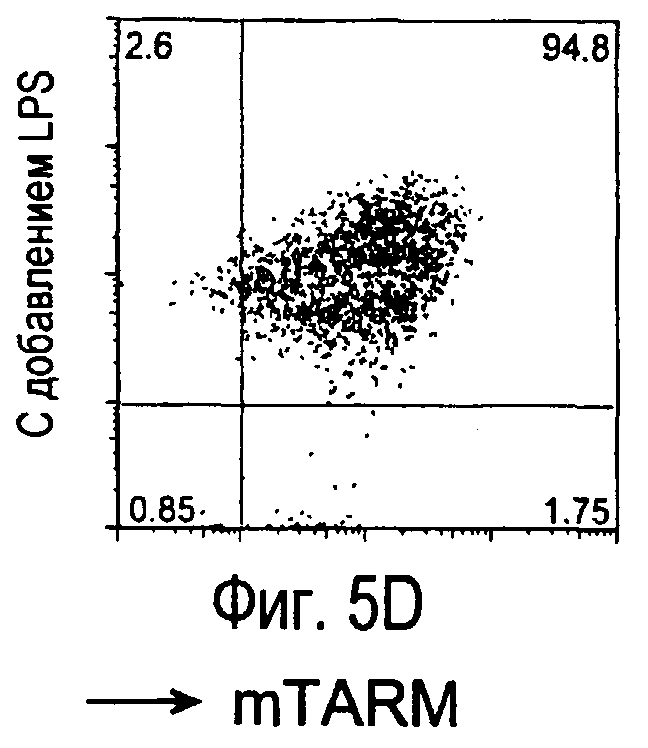
На фиг.5 представлены результаты, полученные анализом экспрессии белков мыши на дендритных клетках, происходящих из костного мозга.
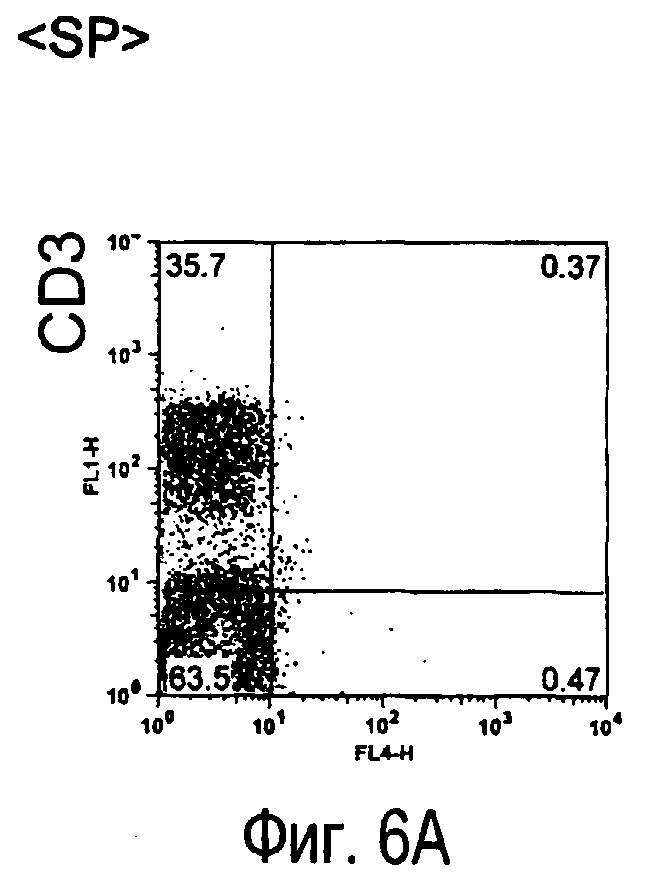
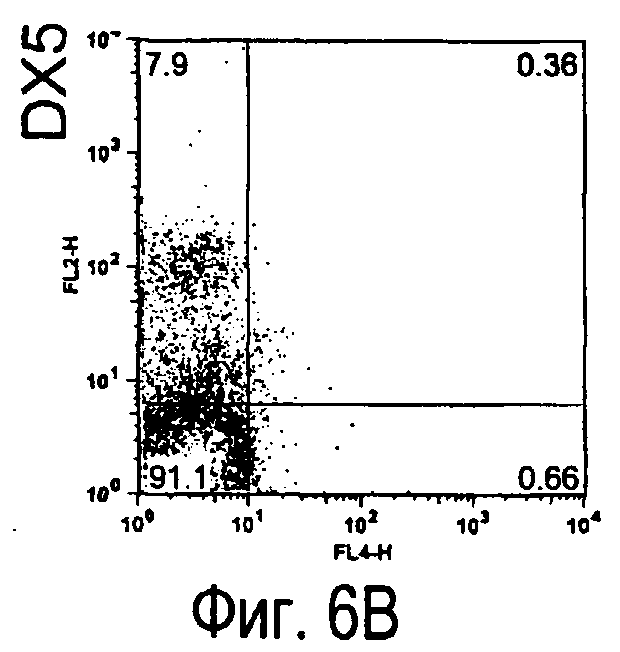
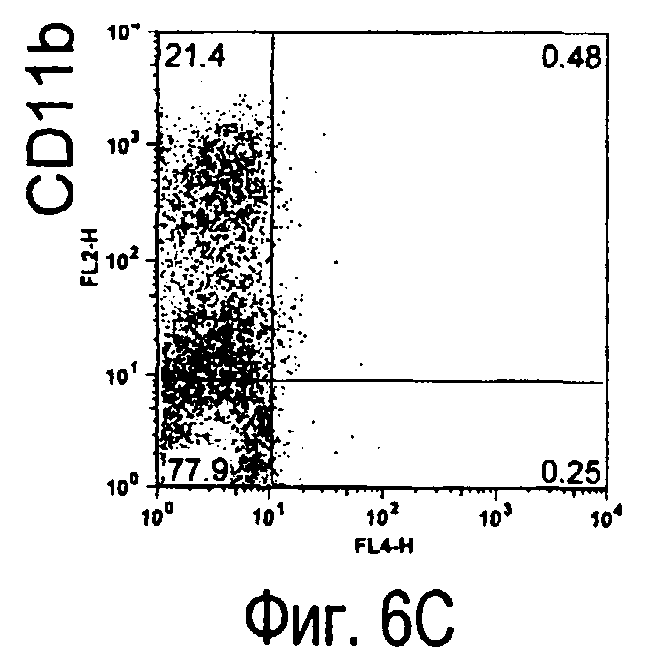
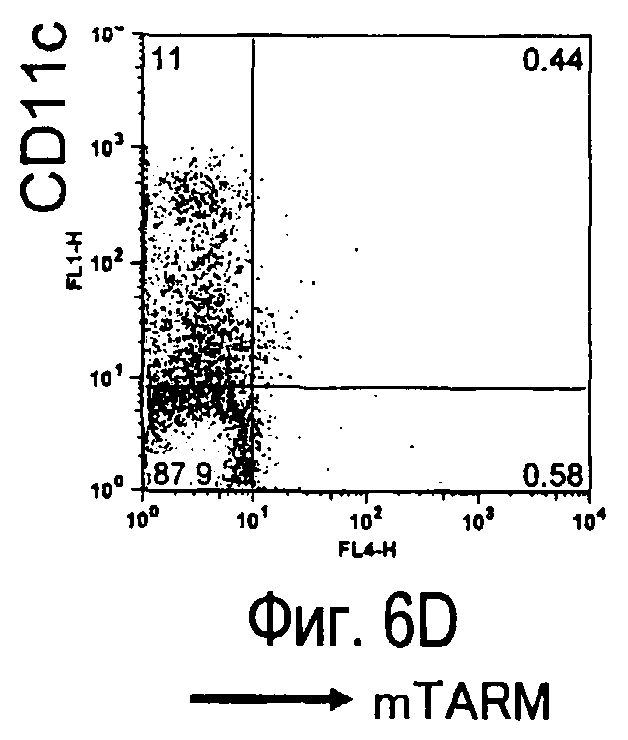
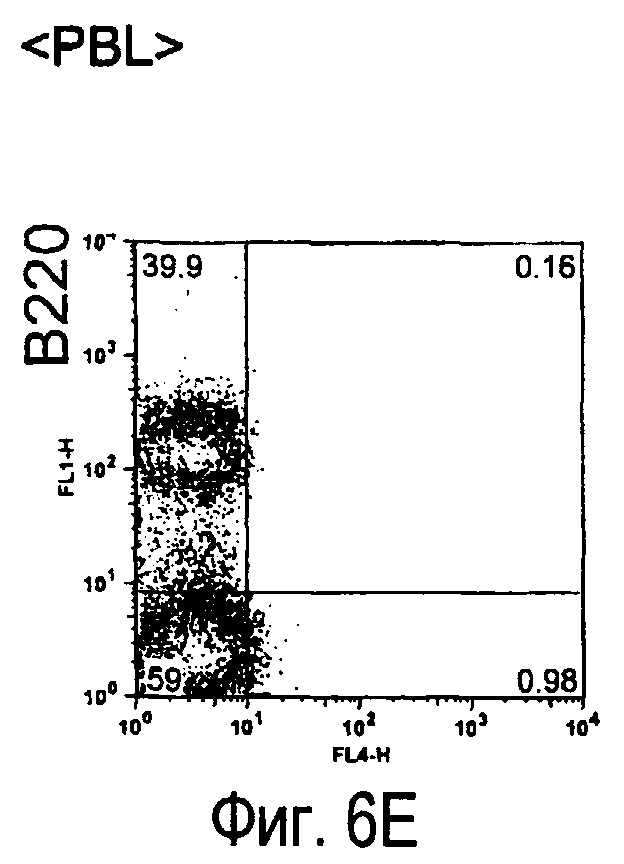
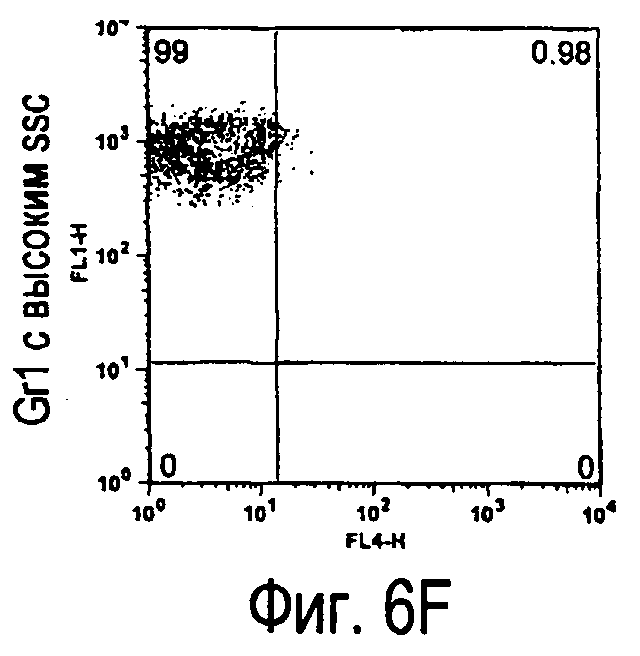
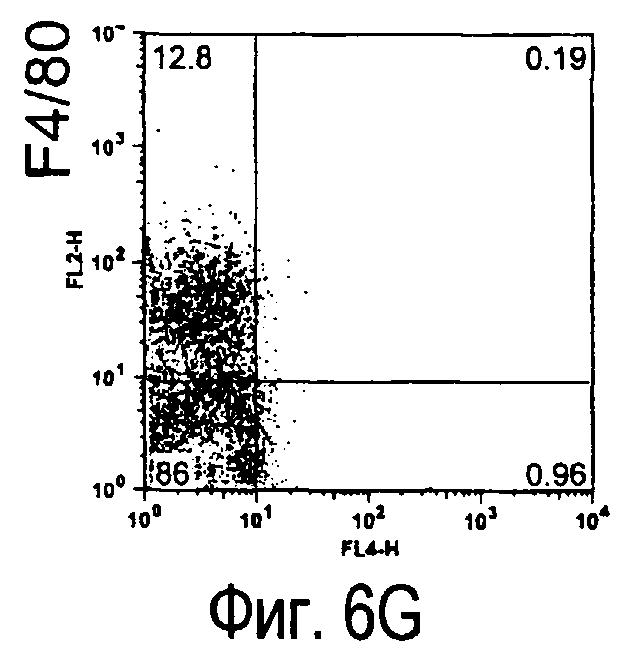
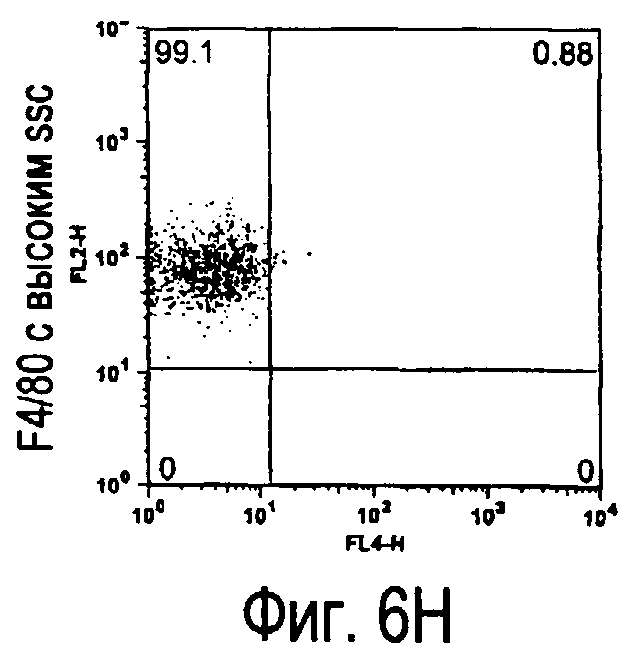
На фиг.6 представлены результаты, полученные анализом экспрессии белков мыши на клетках, происходящих из нормальных иммунных тканей мыши.
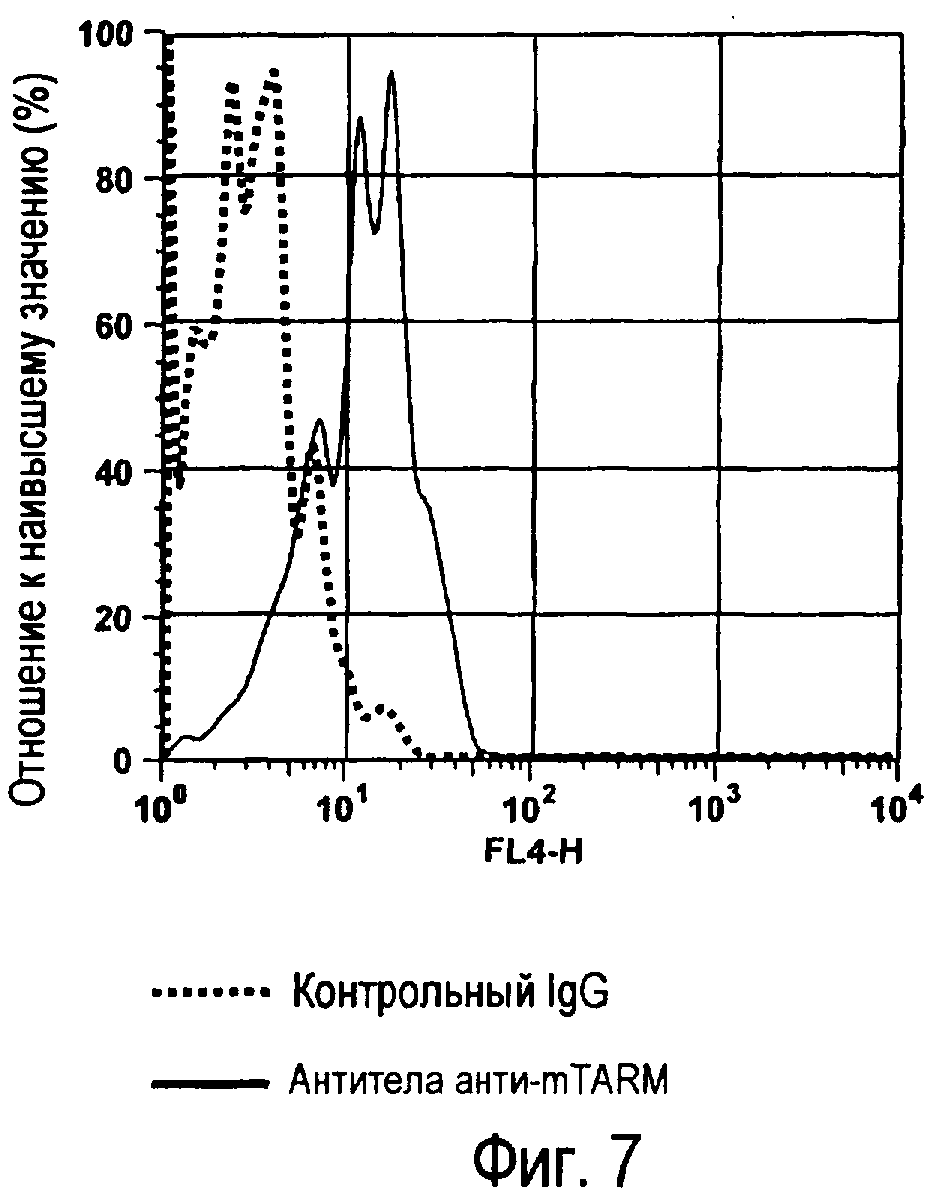
На фиг.7 представлены результаты, полученные анализом экспрессии белка мыши на c-kit-положительных перитонеальных тучных клетках.
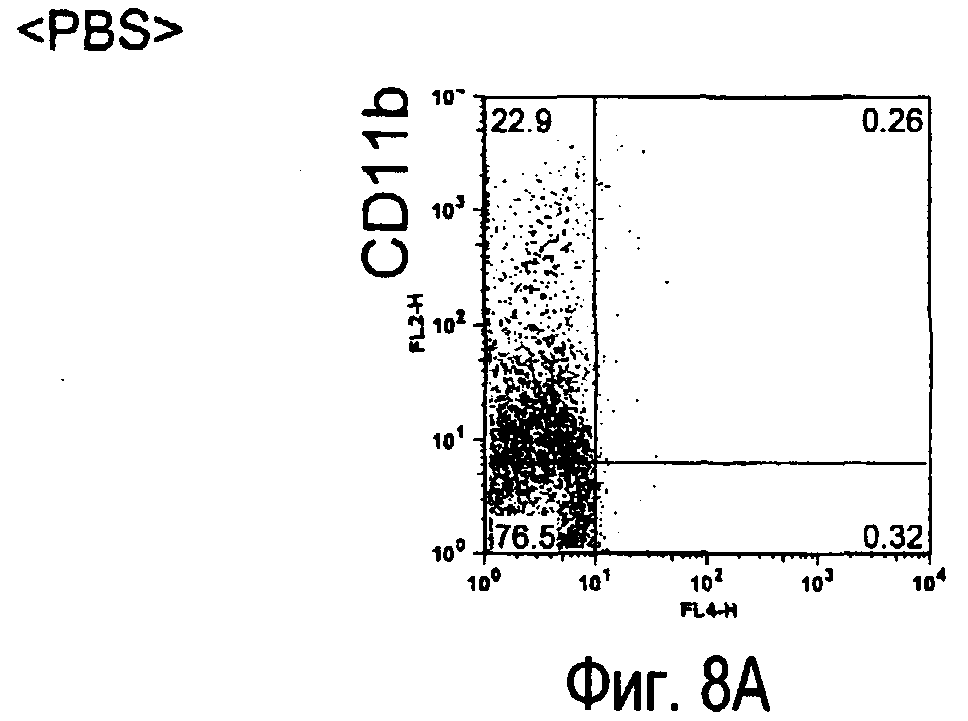
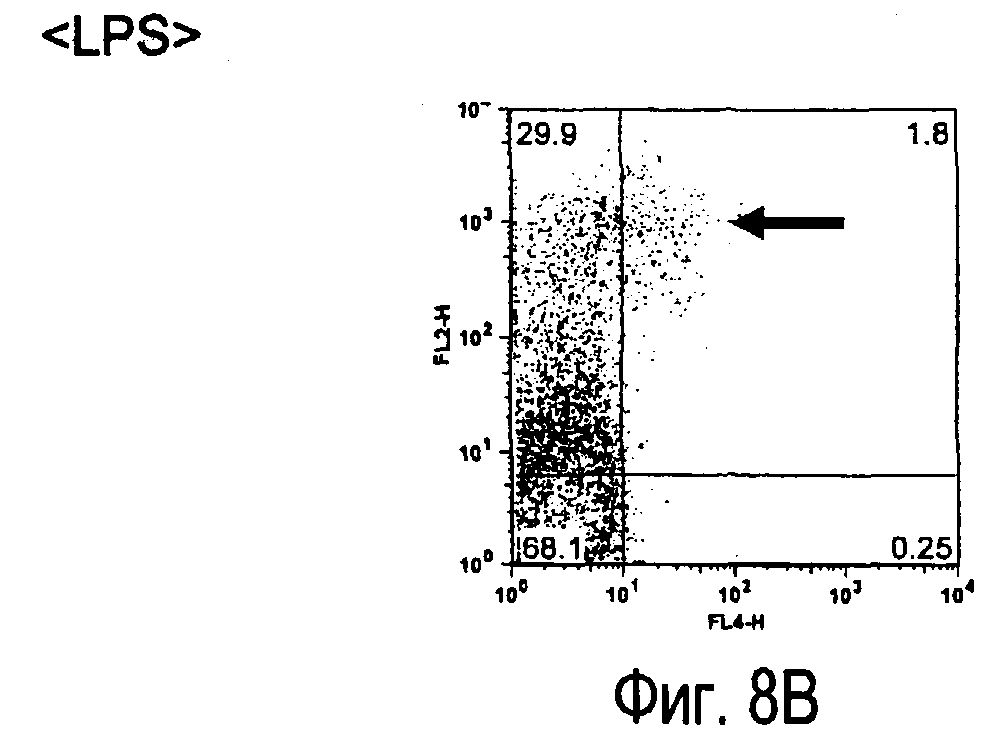
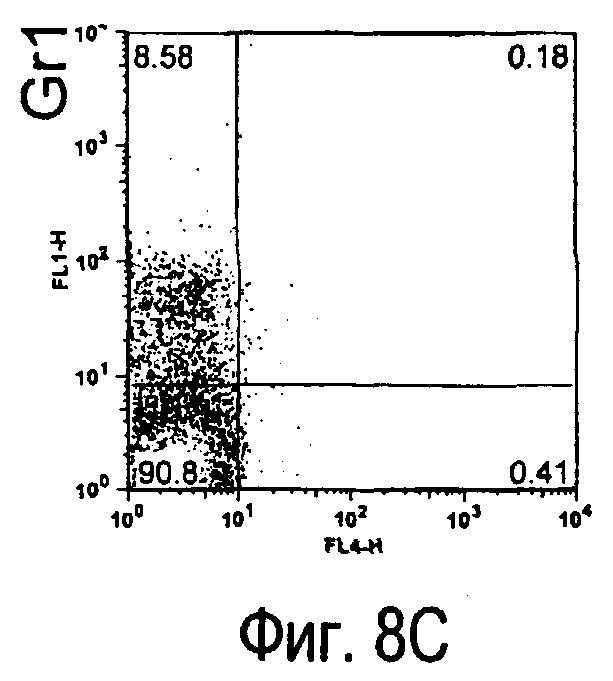
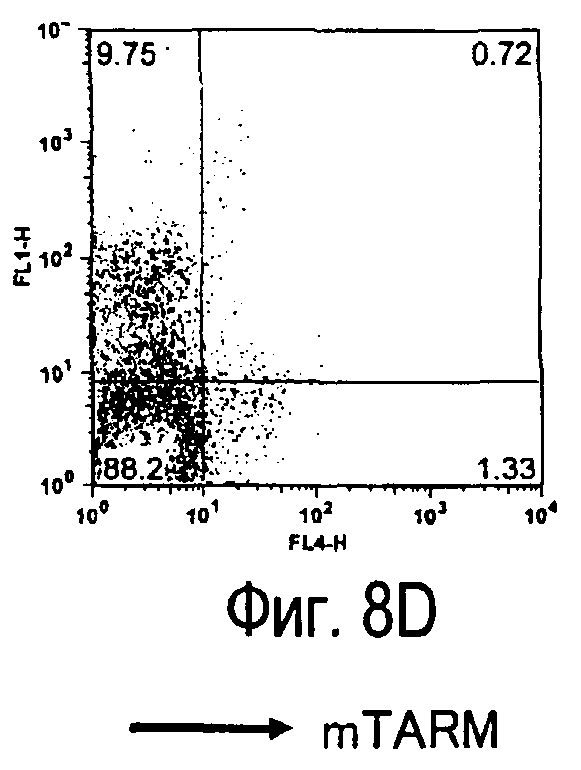
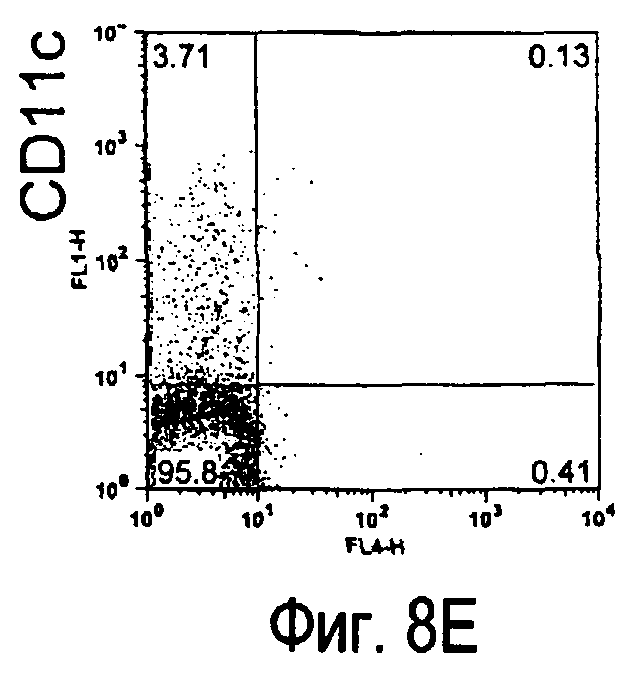
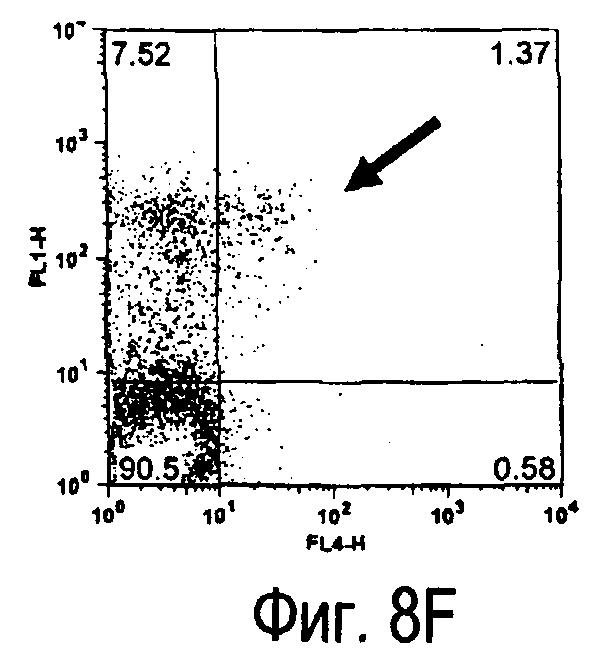
На фиг.8 представлены результаты, полученные анализом экспрессии белка TARM мыши в клетках лимфатических узлов мыши при помощи воспалительной стимуляции посредством LPS, где стрелки указывают на экспрессию белка TARM мыши.
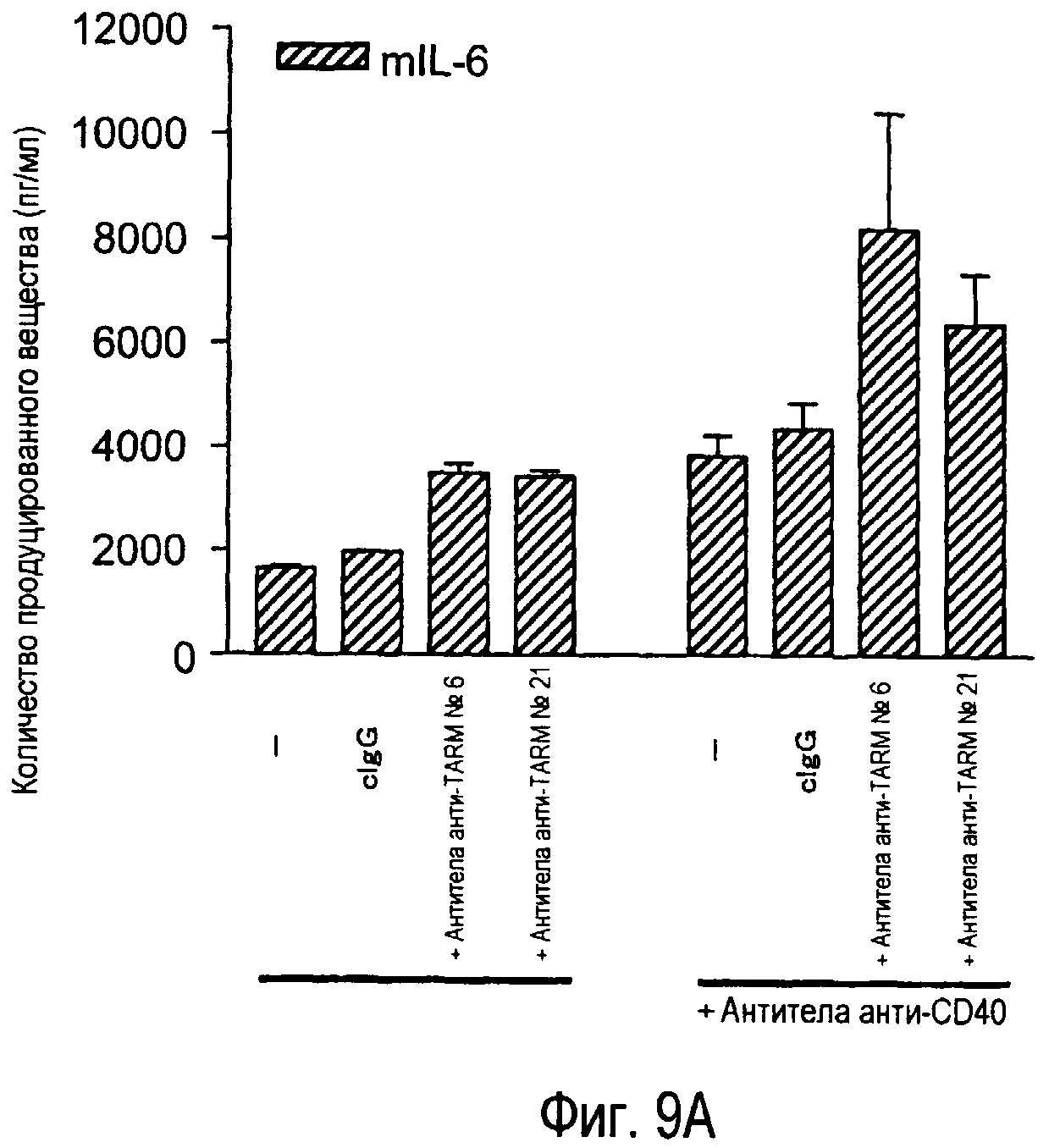
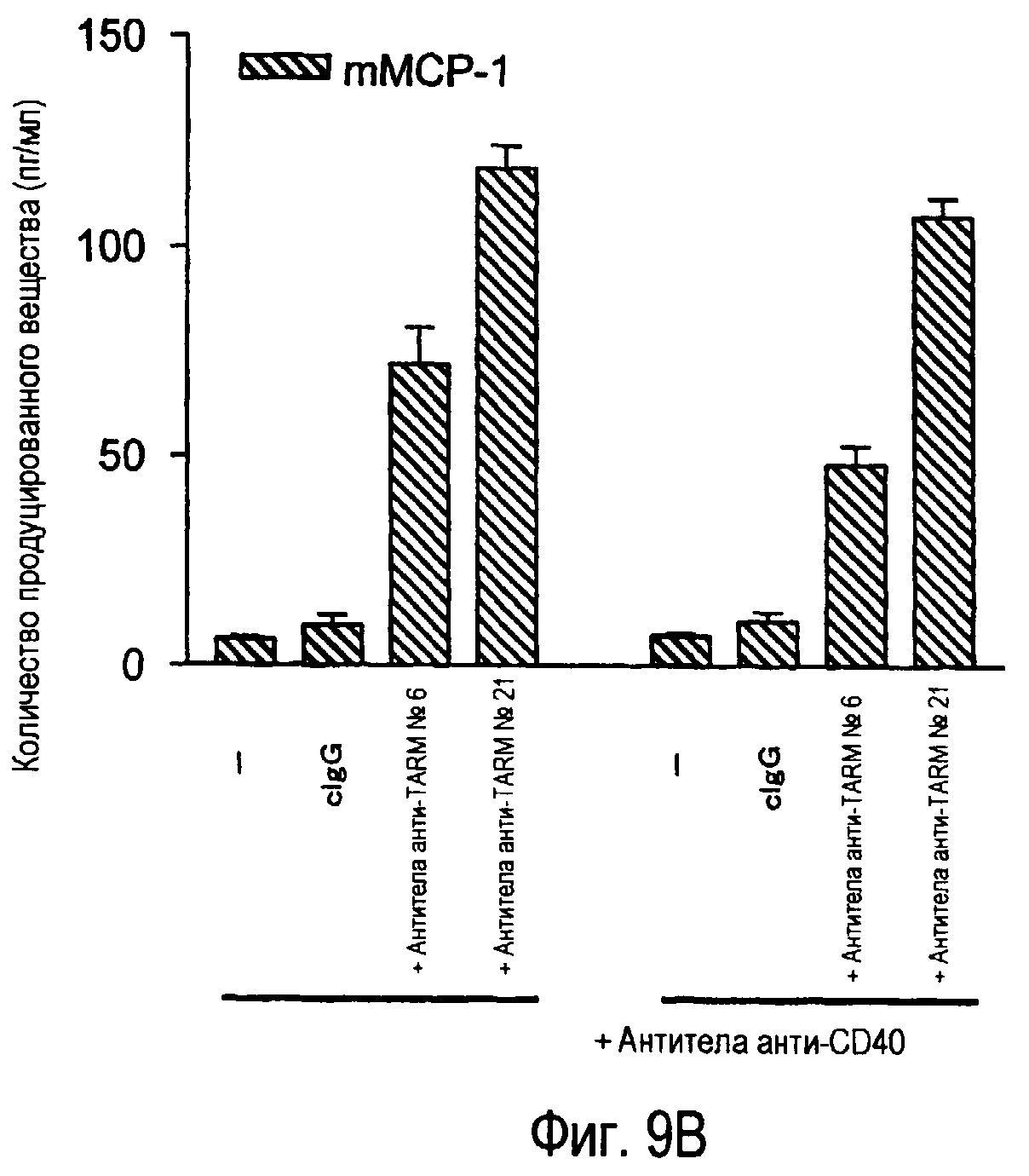
На фиг.9A представлена индукция продукции IL-6 зрелыми дендритными клетками из костного мозга при помощи стимуляции антителами анти-TARM. На фиг.9B представлена индукция продукции MCP-1 незрелыми дендритными клетками из костного мозга при помощи стимуляции антителами анти-TARM.
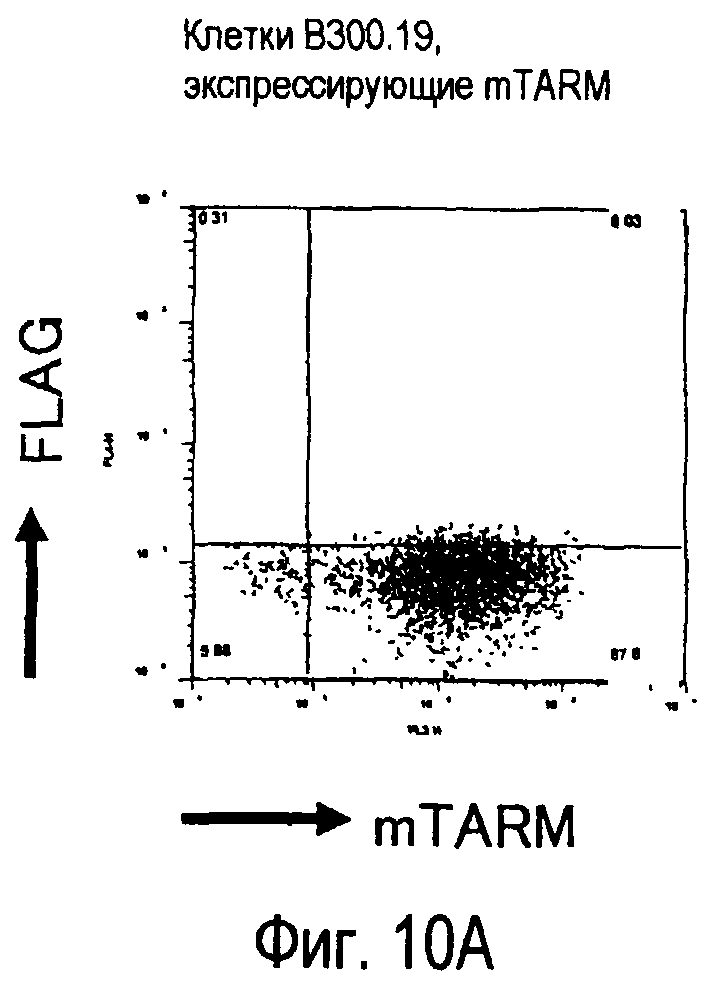
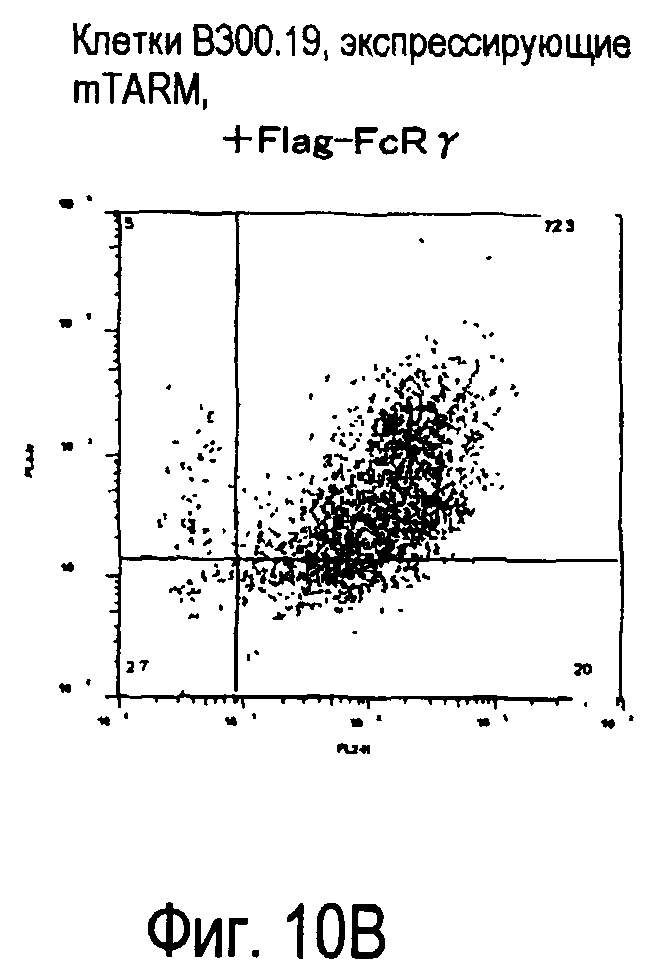
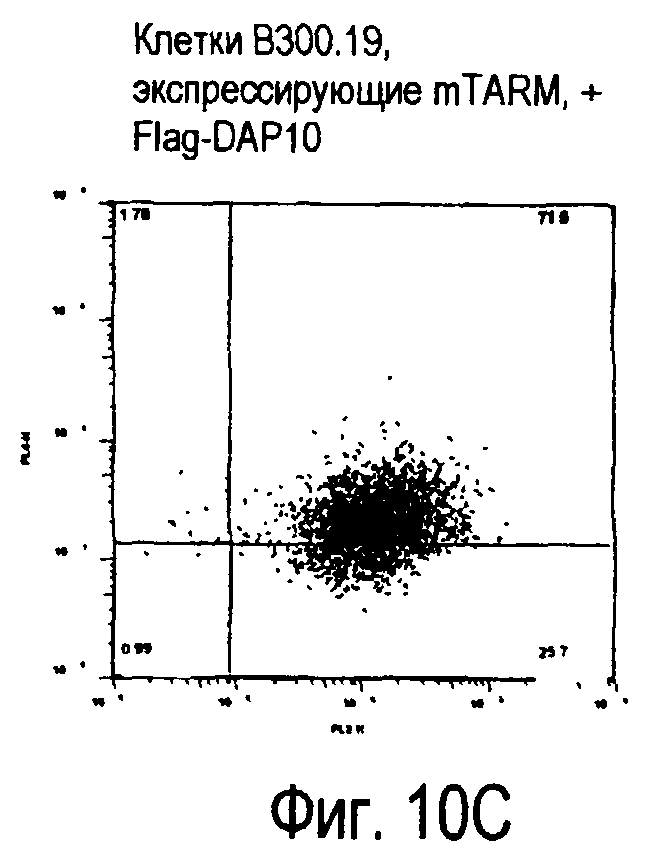
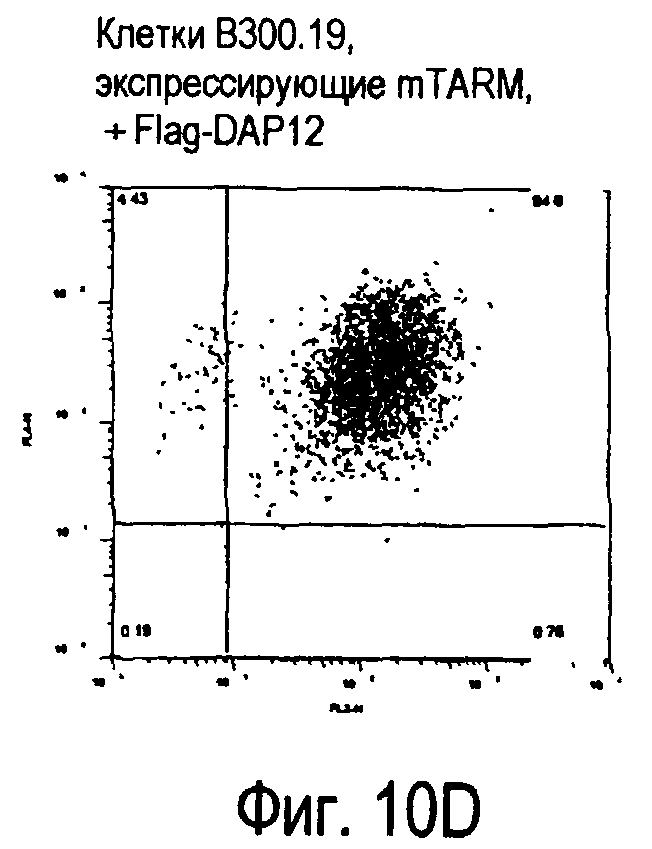
На фиг.10 представлены увеличения количества цепи FcRγ, связанные с возрастаниями экспрессии белка TARM мыши на поверхности клеток.
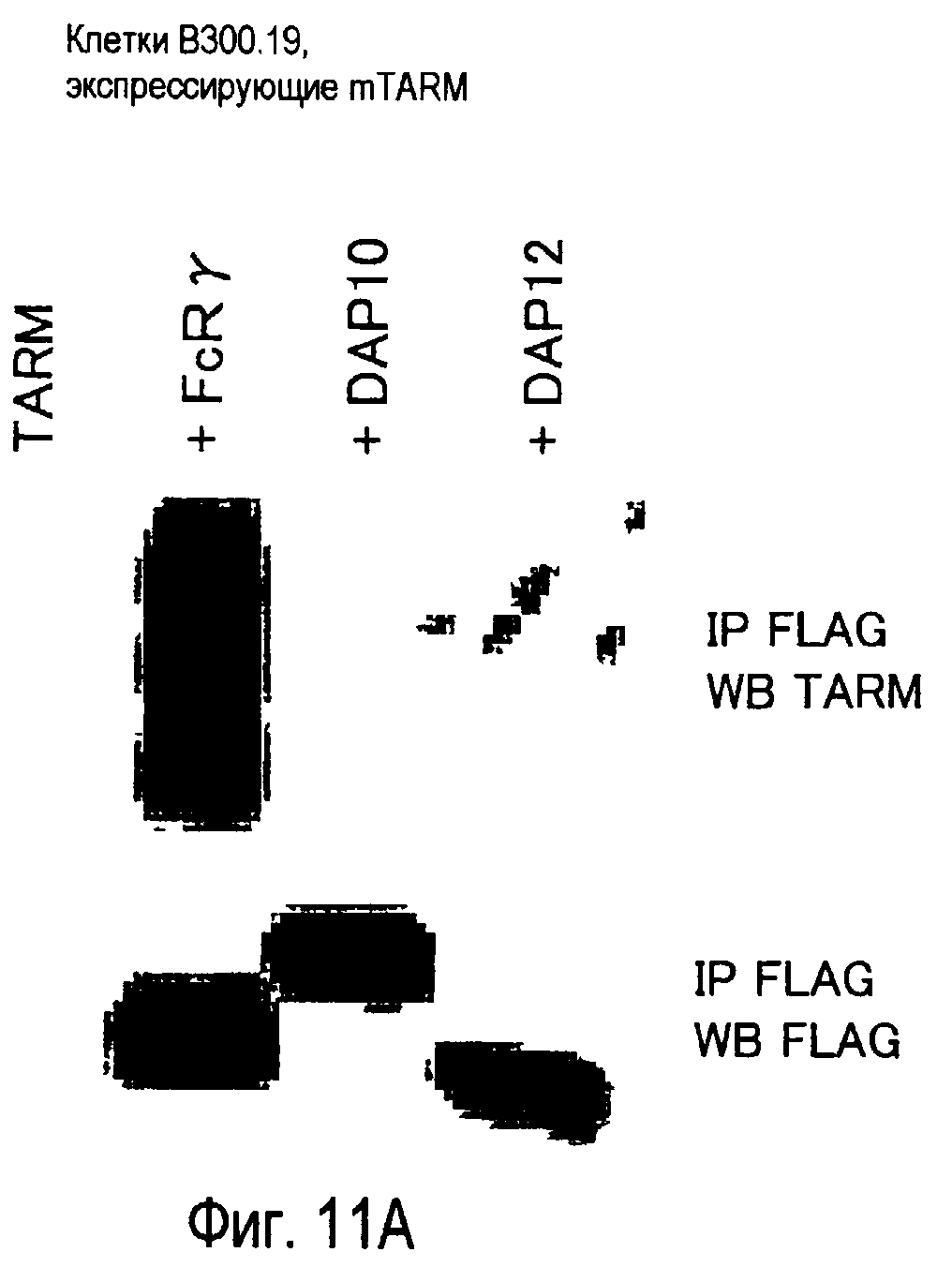
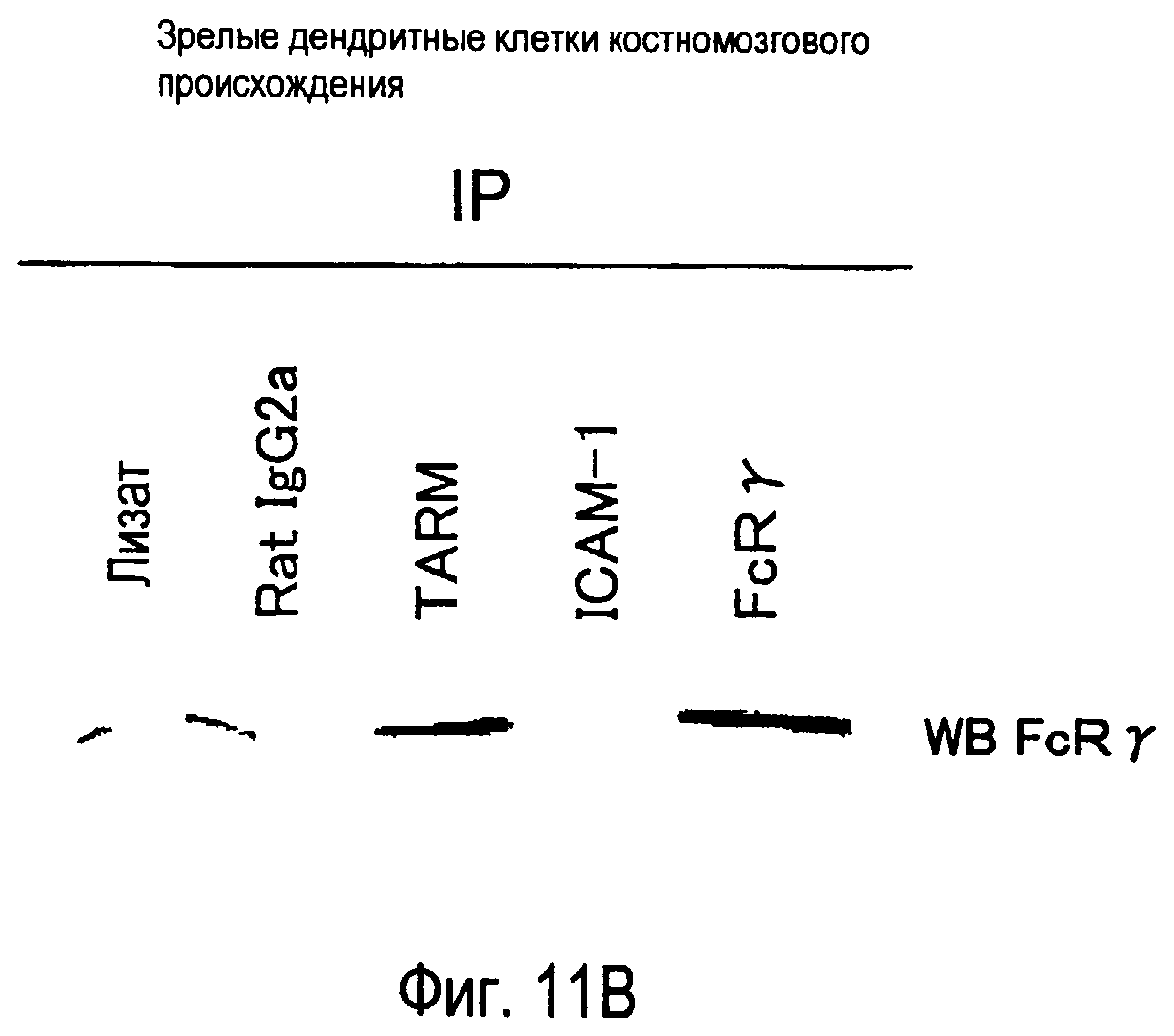
На фиг.11 представлены результаты, полученные анализом образования комплекса между белком TARM мыши и цепью FcRγ с помощью способа иммунопреципитации.
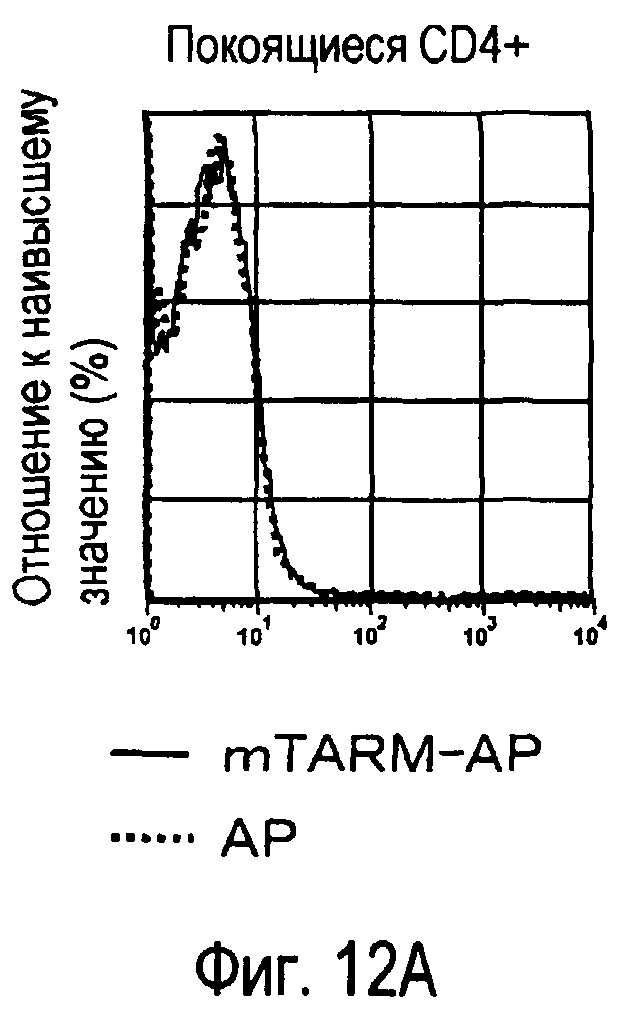
На фиг.12 представлены результаты, полученные анализом экспрессии молекул, связывающихся с белком TARM мыши, на активированных T-клетках.
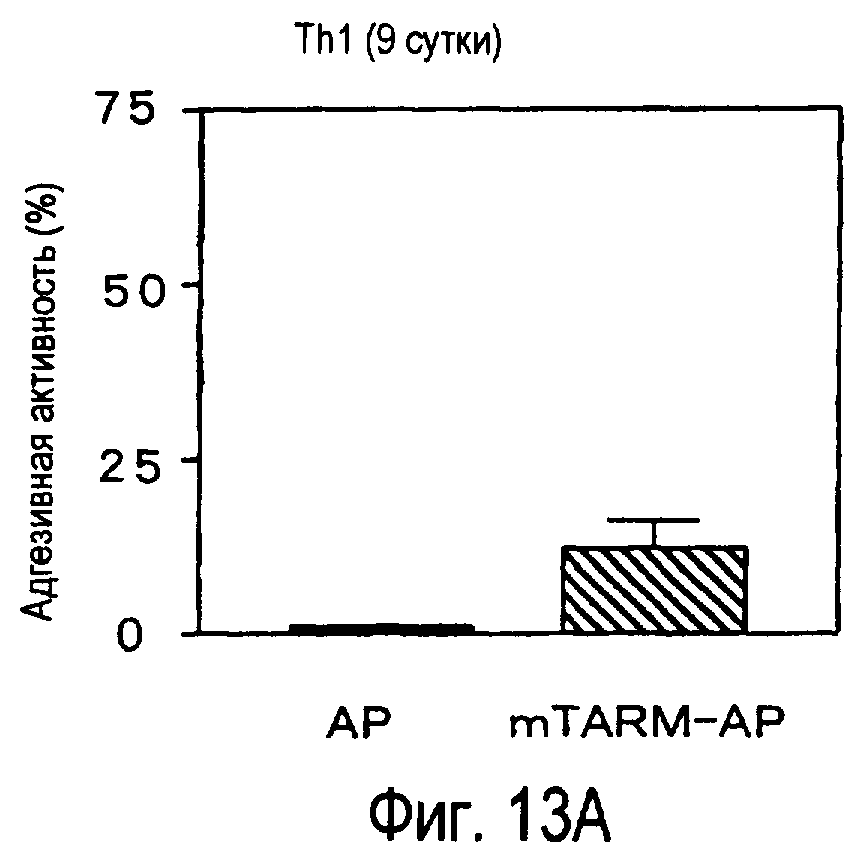
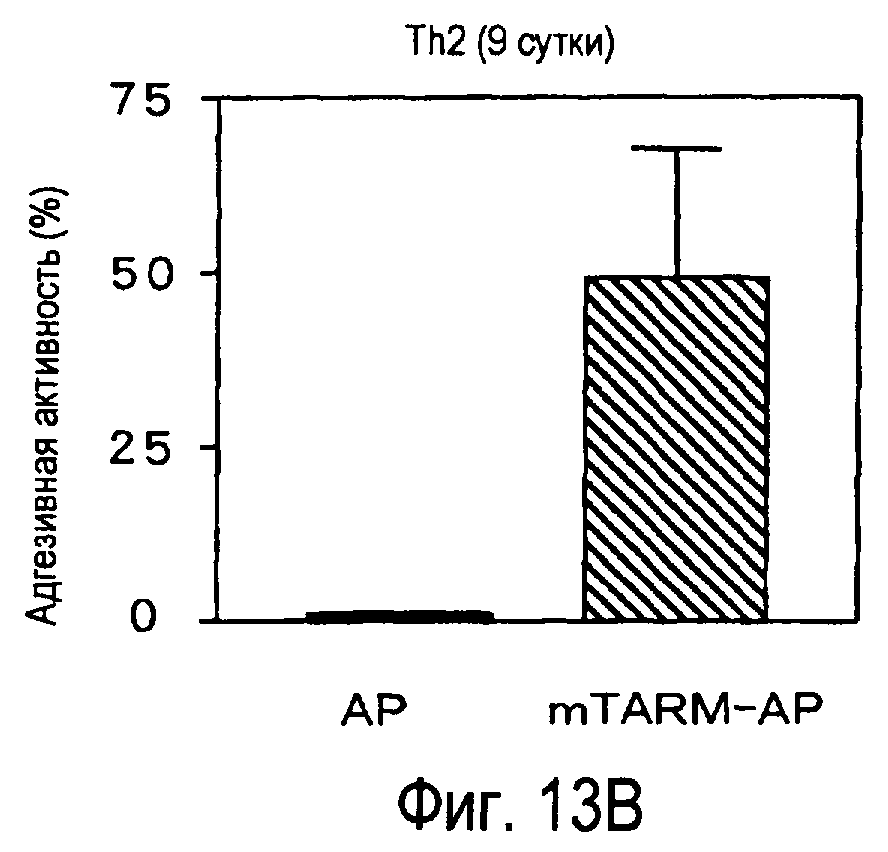
На фиг.13 представлена способность активированных T-клеток связываться с белком TARM мыши.
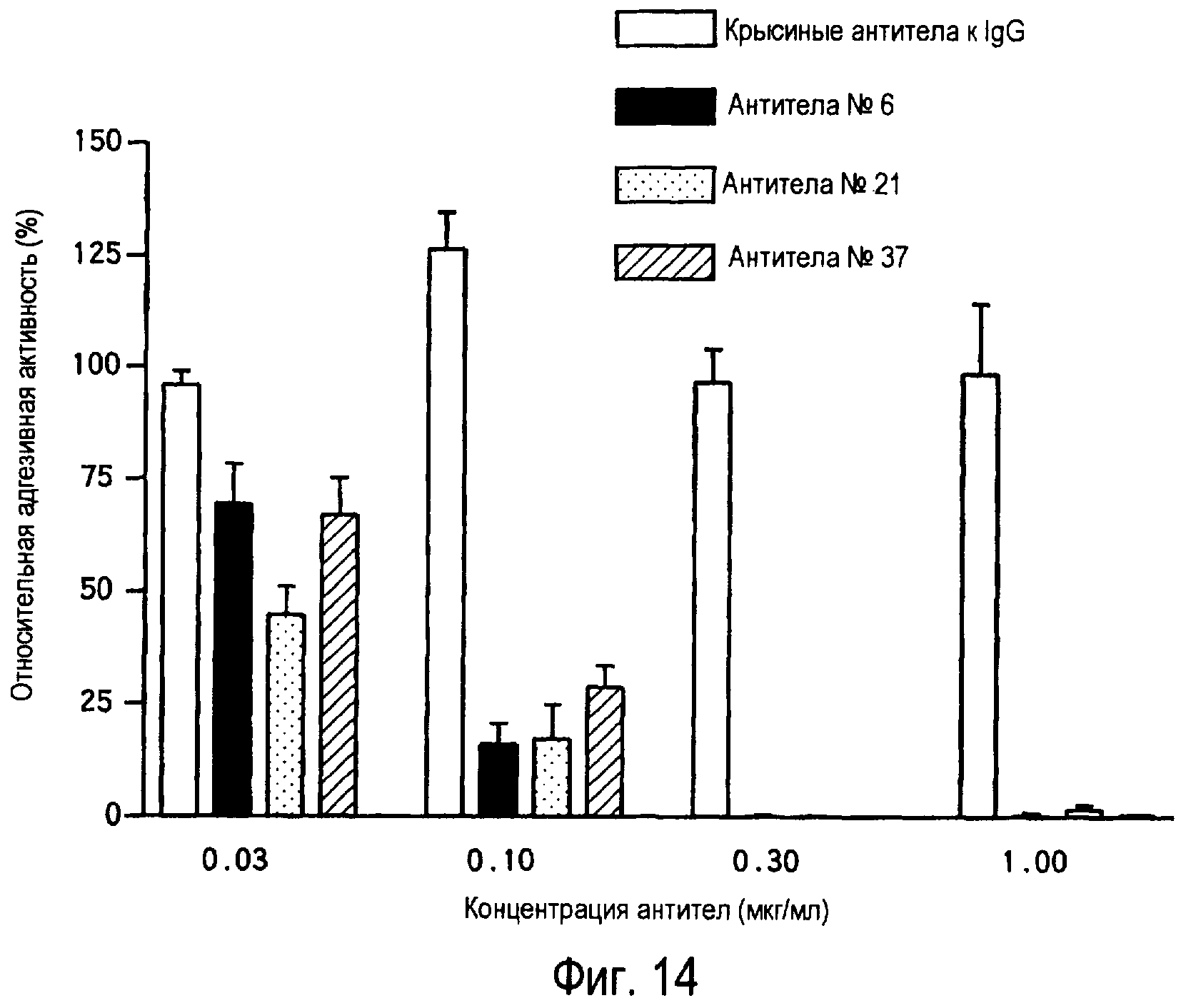
На фиг.14 представлено ингибирование адгезии клеток Th2 к белку TARM мыши с помощью антител к TARM мыши.
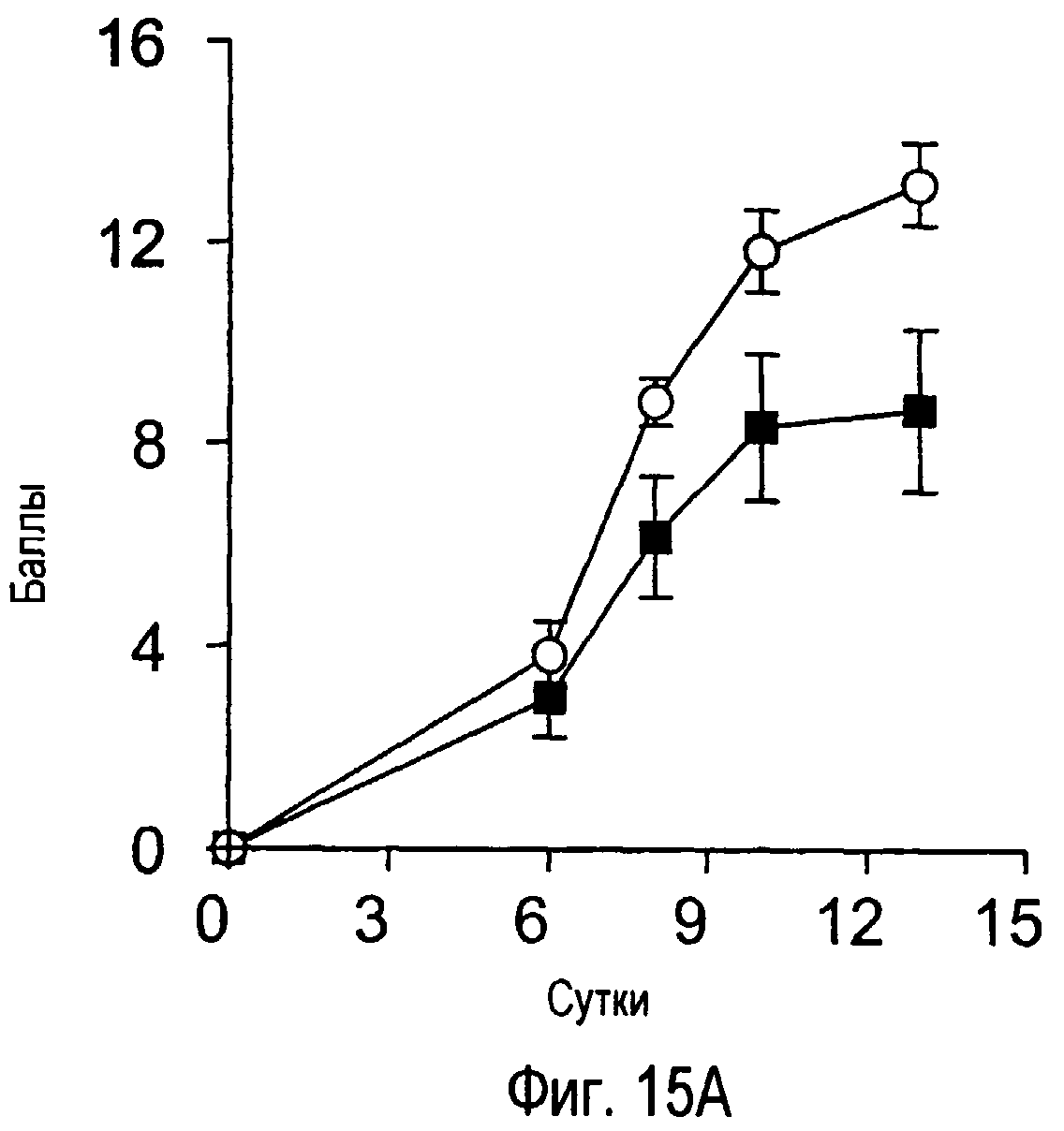
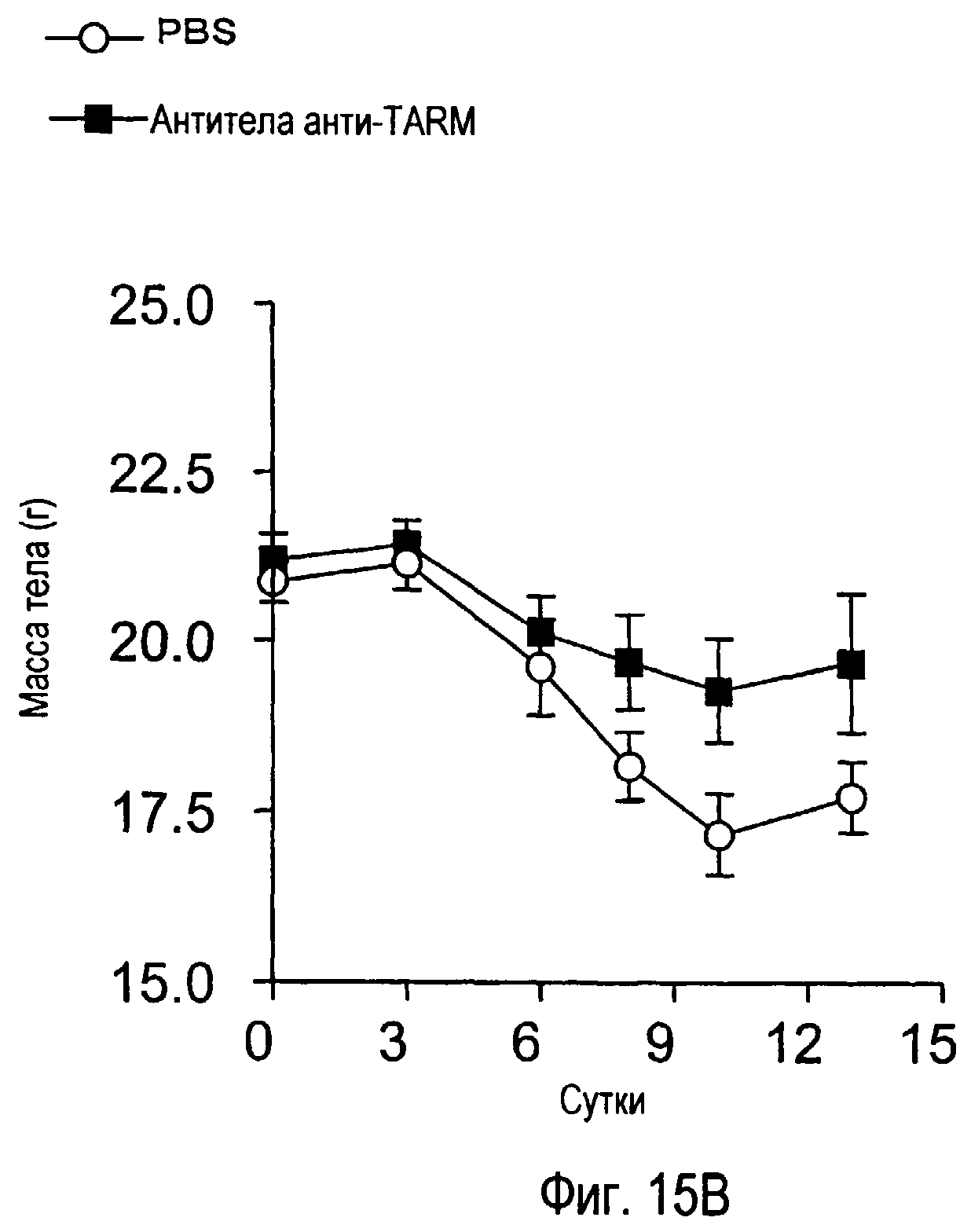
На фиг.15 представлены внешние показатели и изменения в массе тела с течением времени у модельного животного для индуцированного коллагеном артрита, которому вводили антитела TARM мыши.
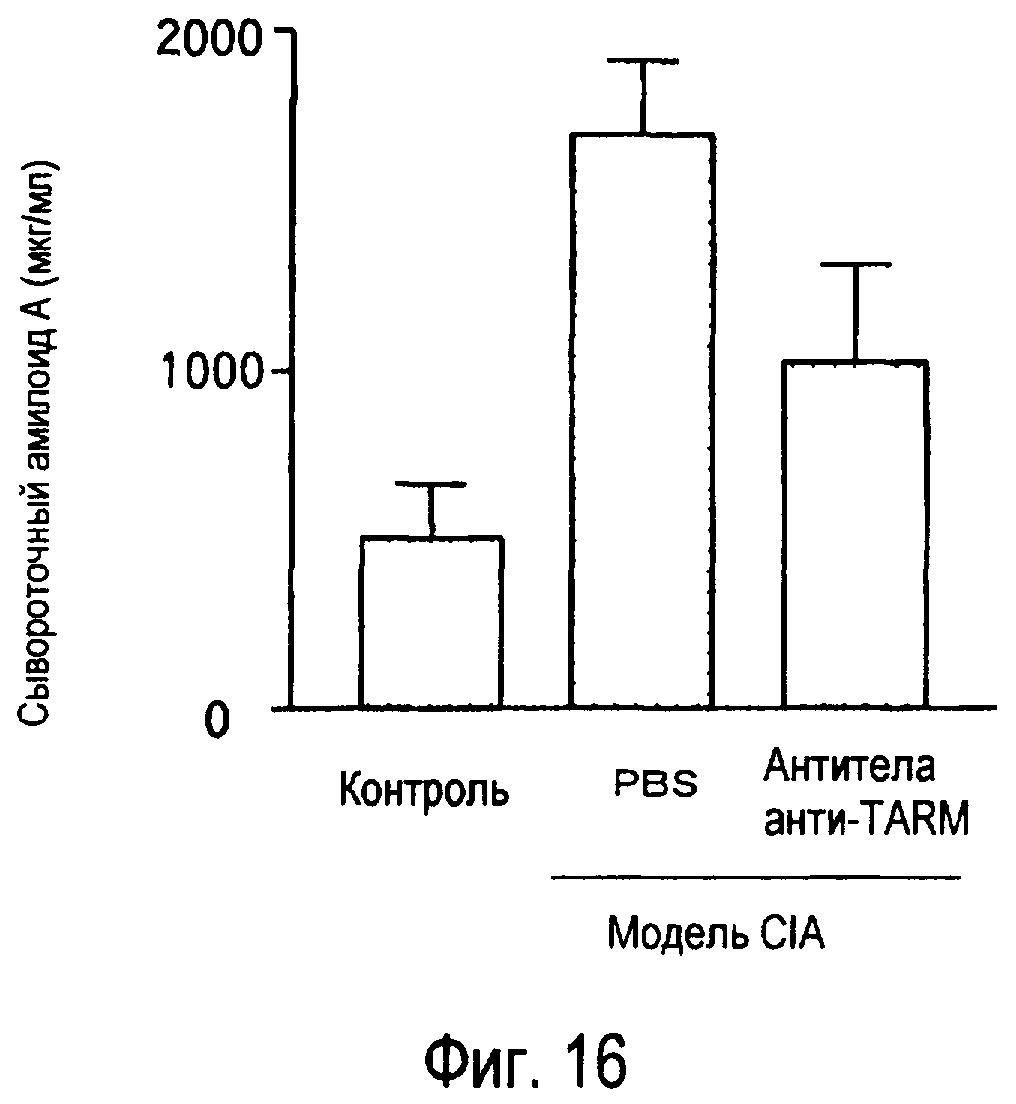
На фиг.16 представлен эффект введения антител к TARM мыши модельному животному для индуцированного коллагеном артрита на концентрации сывороточного амилоида A в его плазме.
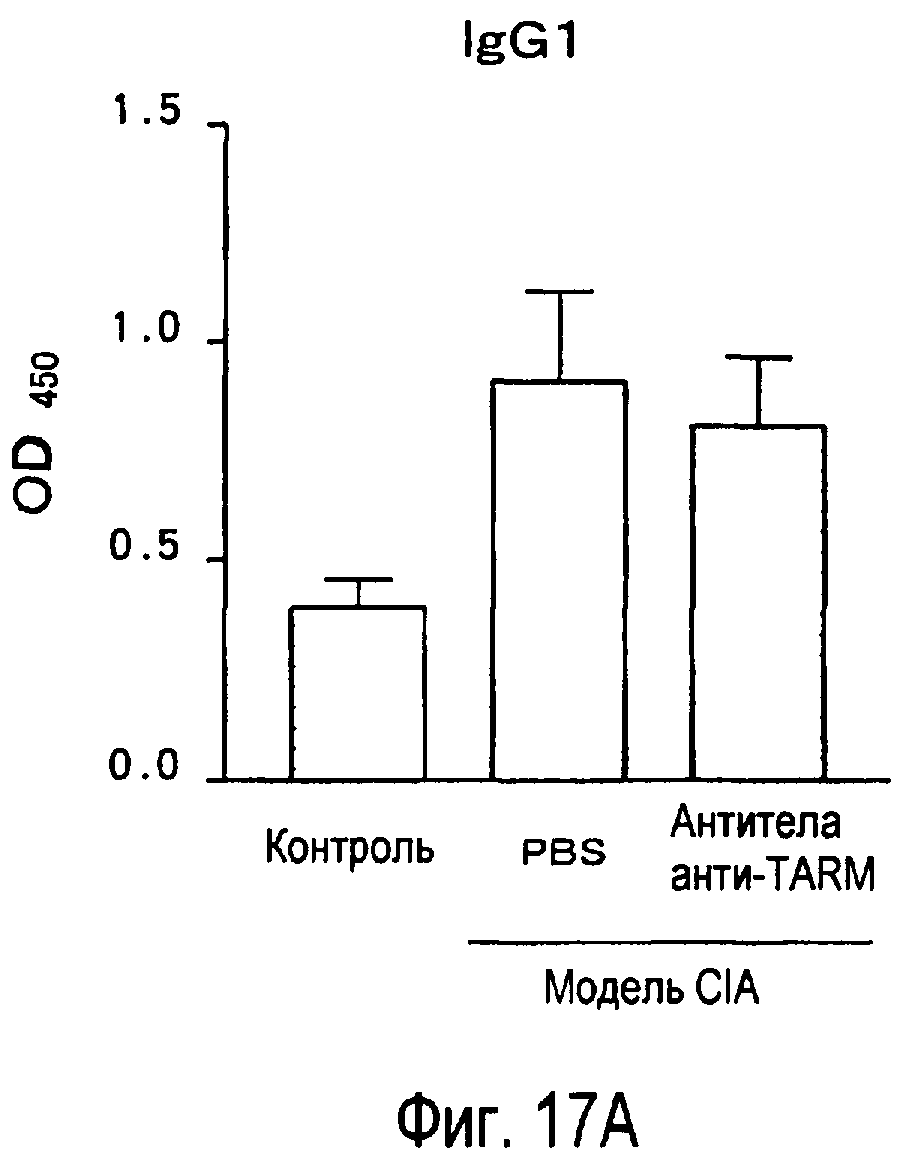
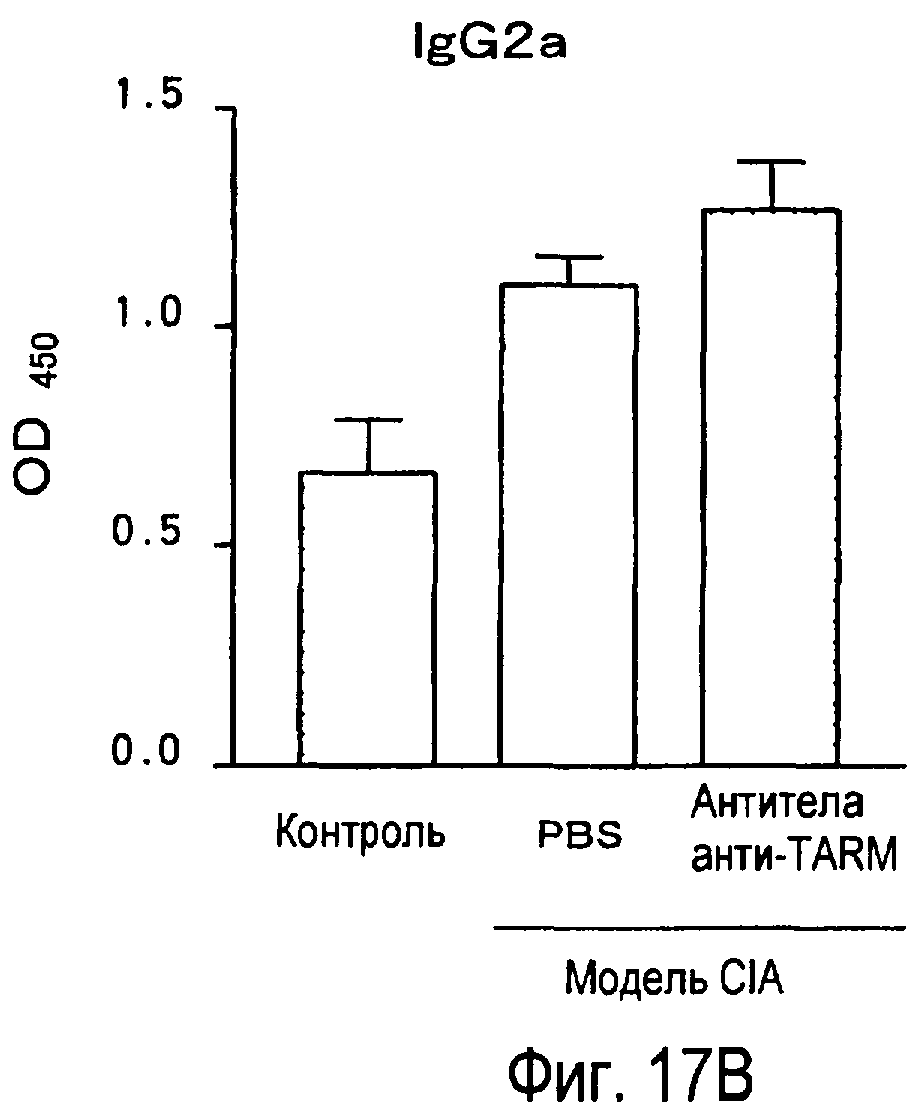
На фиг.17 представлен эффект введения антител к TARM мыши модельному животному для индуцированного коллагеном артрита на титры антител к коллагену в его плазме.
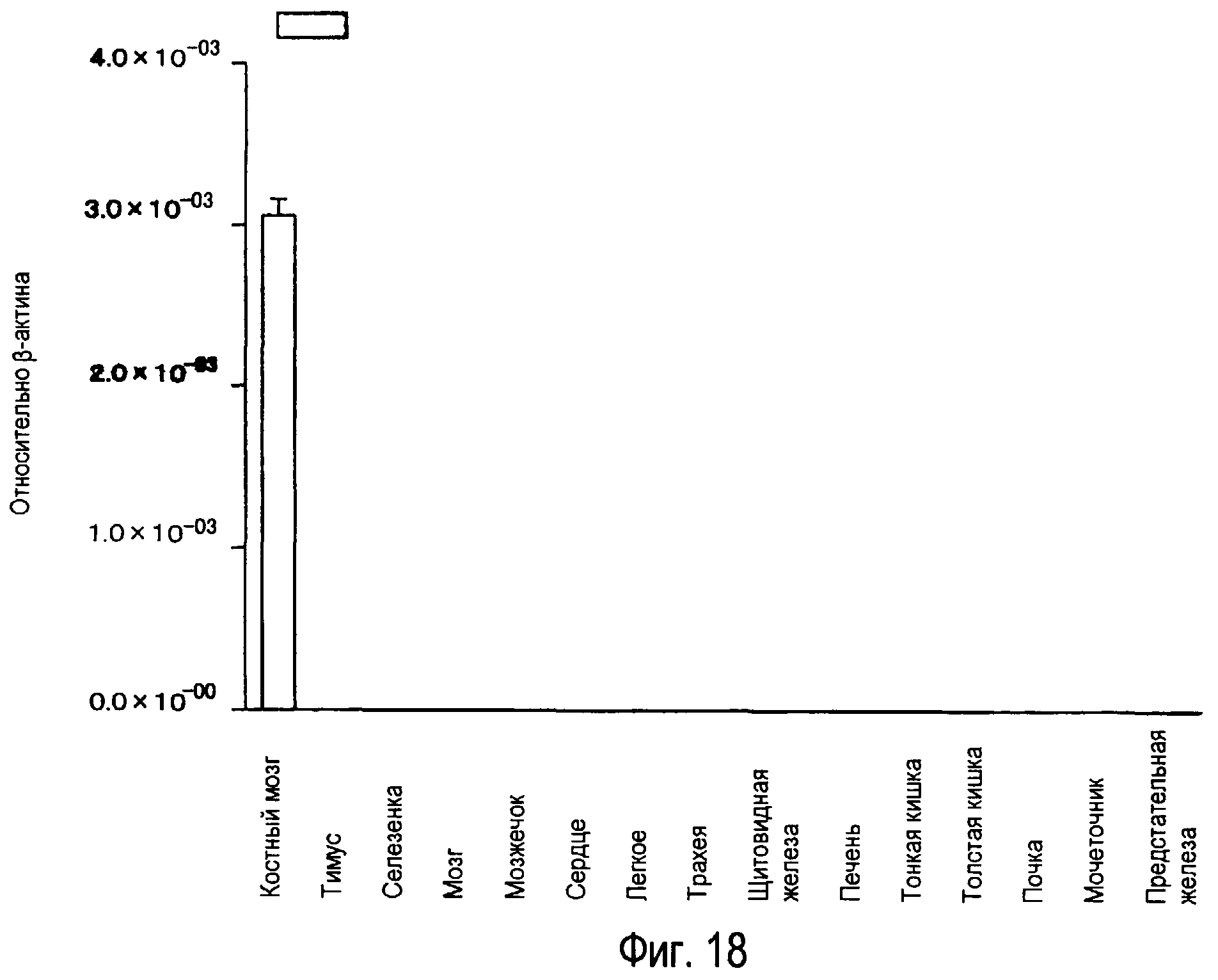
На фиг.18 представлены результаты, полученные анализом экспрессии мРНК белка TARM в тканях человека с помощью PCR в реальном времени.
На фиг.19 представлены аминокислотные последовательности белка TARM человека, где подчеркивание указывает на область структуры петли иммуноглобулина (Ig), жирный шрифт указывает на трансмембранную область и обведенная часть указывает на последовательности, отличающиеся между hTARM и LOC441864.
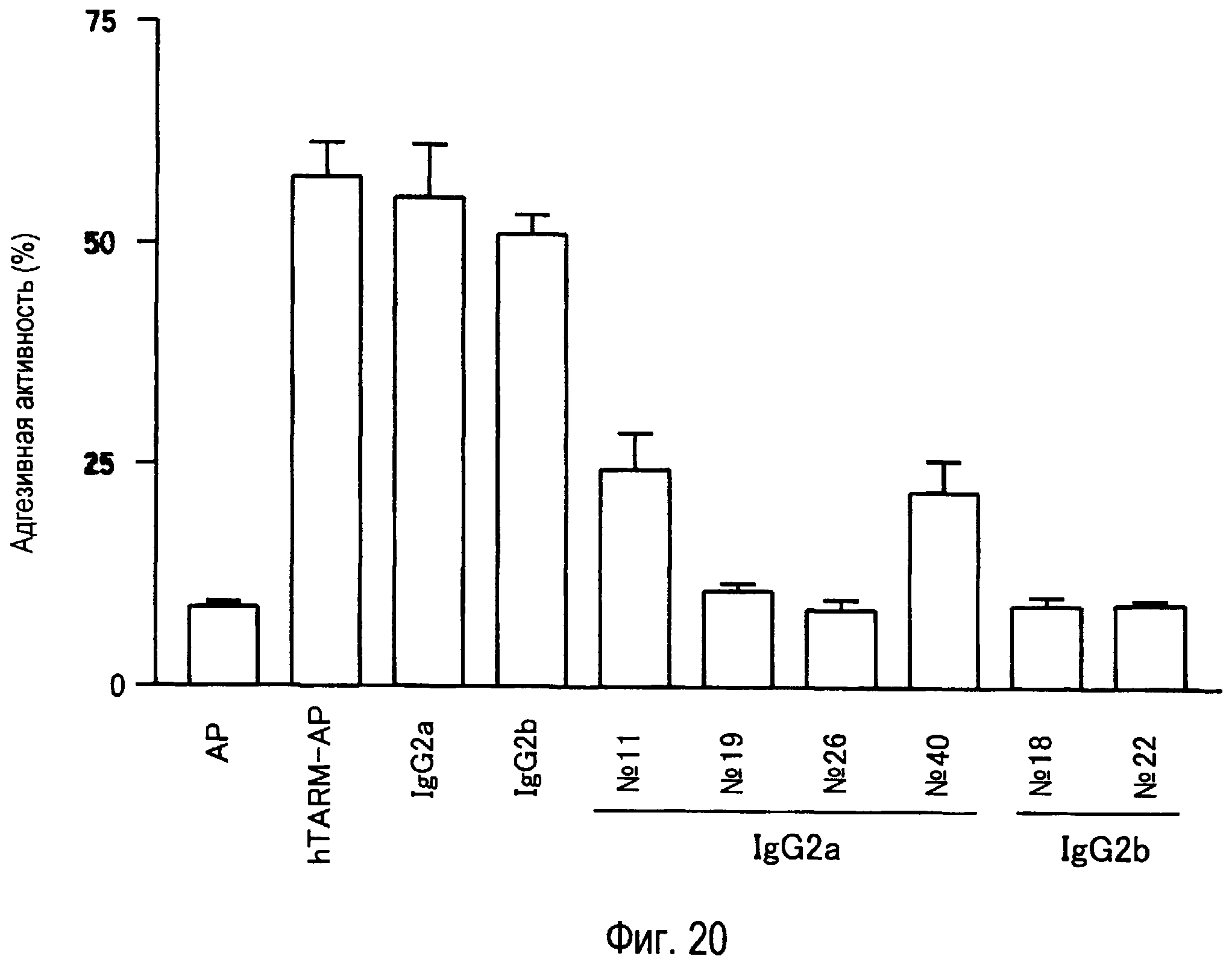
На фиг.20 представлена способность активированных T-клеток связываться с белком TARM человека и ингибирование адгезии T-клеток к белку TARM человека с помощью антител к TARM человека.
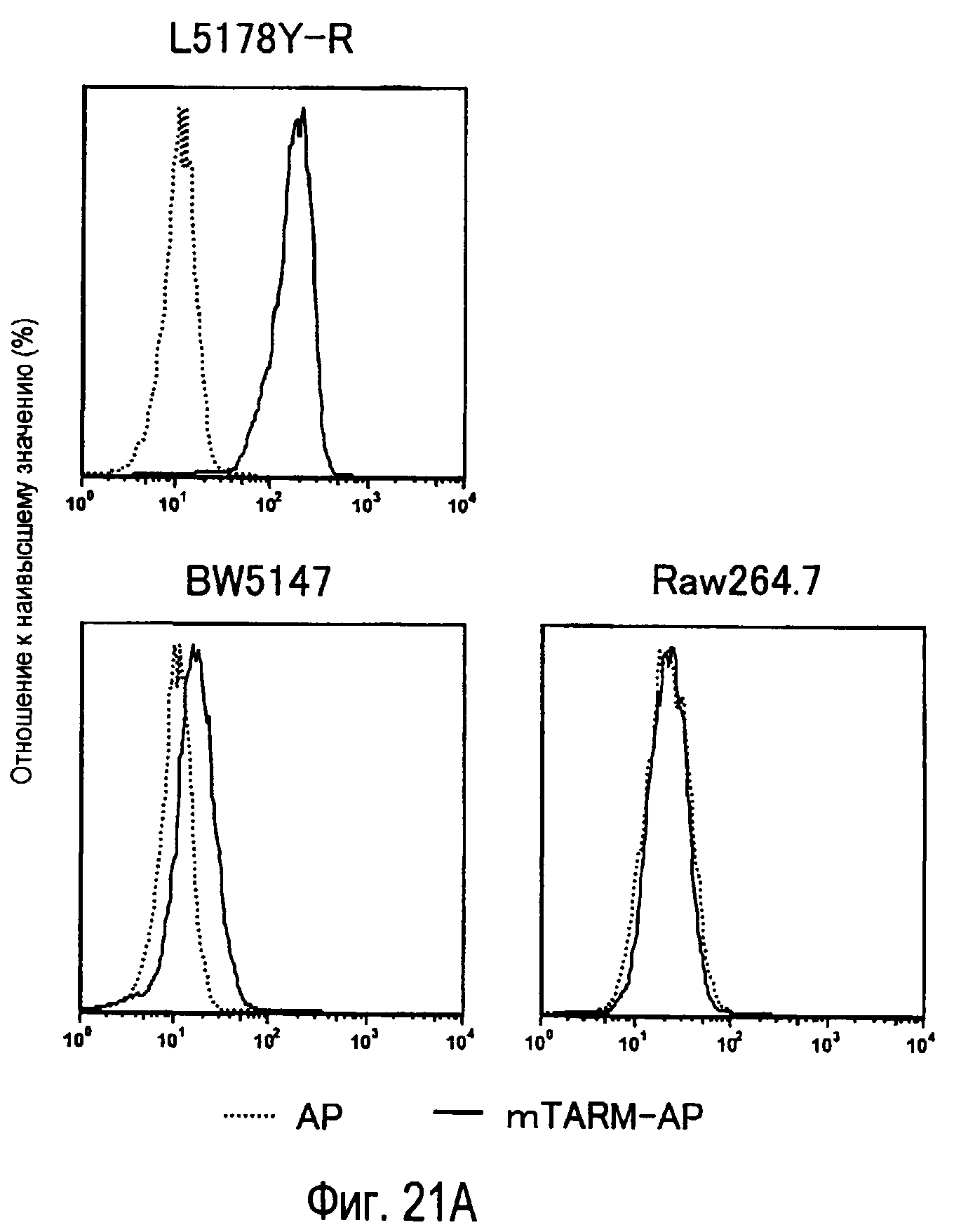
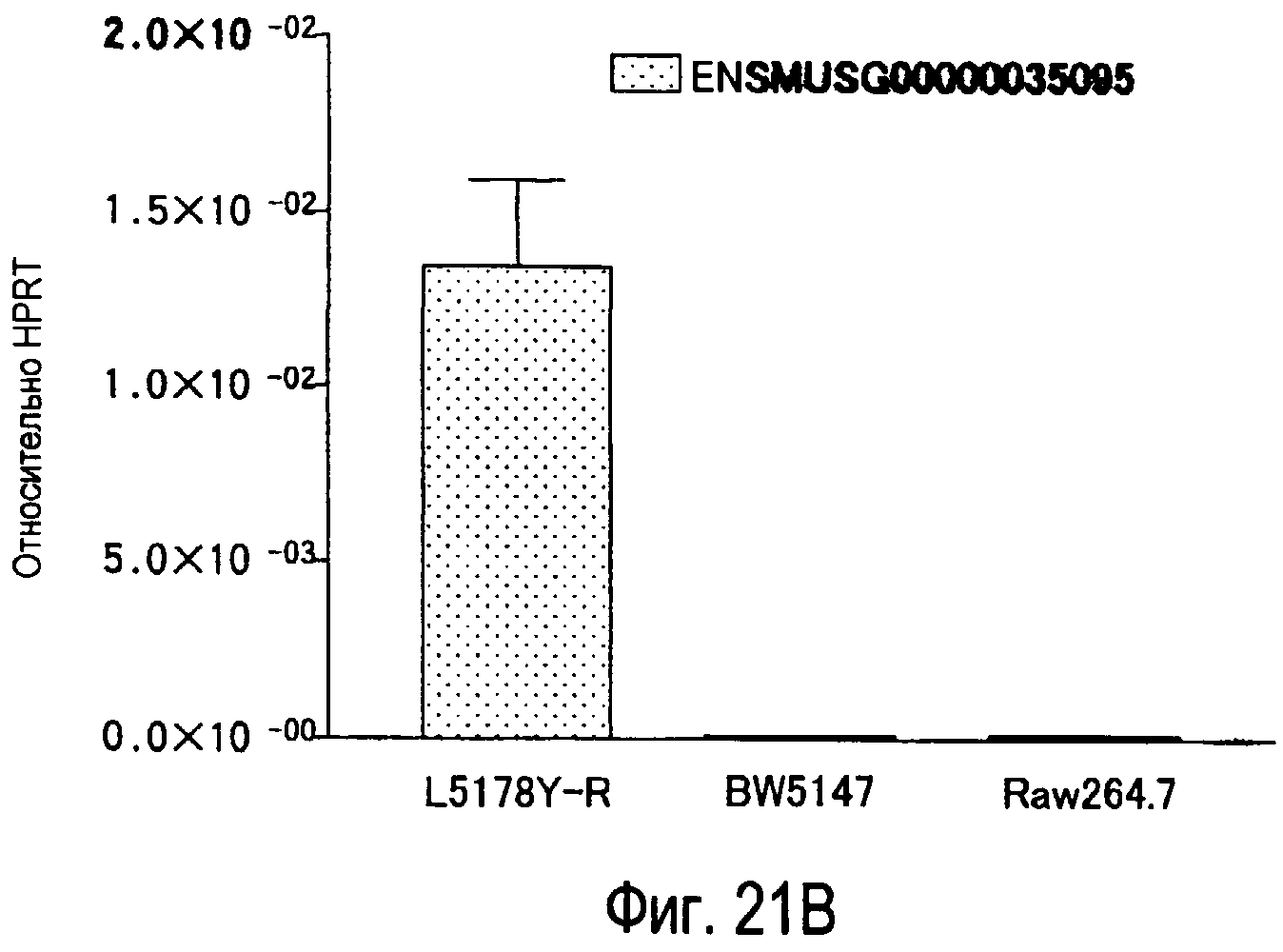
На фиг.21A представлены результаты, полученные анализом экспрессии молекул, связывающихся с белком TARM мыши в линиях клеток мыши. На фиг.21B представлены результаты, полученные анализом экспрессии мРНК ENSMUSG00000035095, молекулы-кандидата для mTARM-L в линиях клеток мыши с помощью PCR в реальном времени.
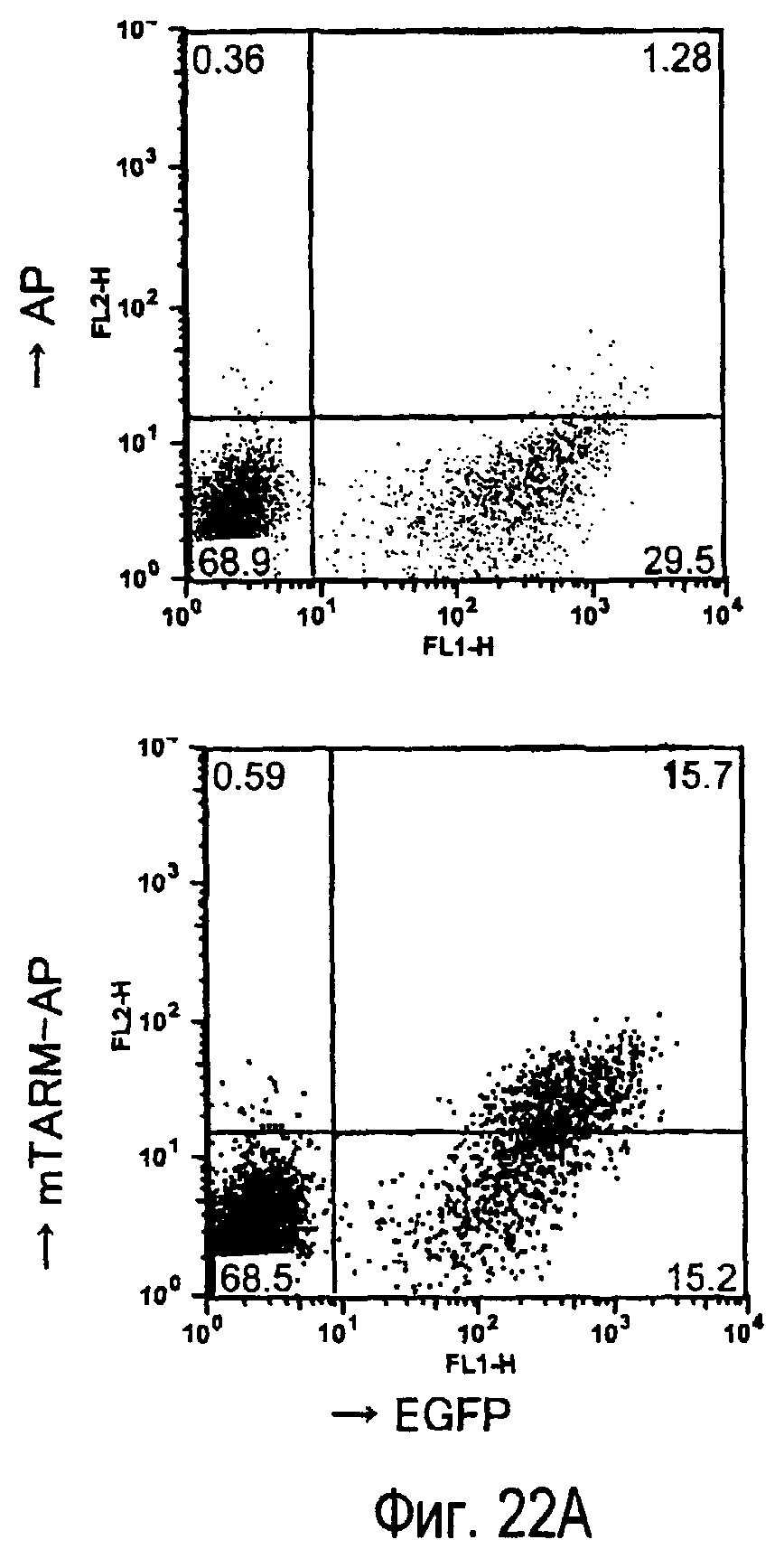
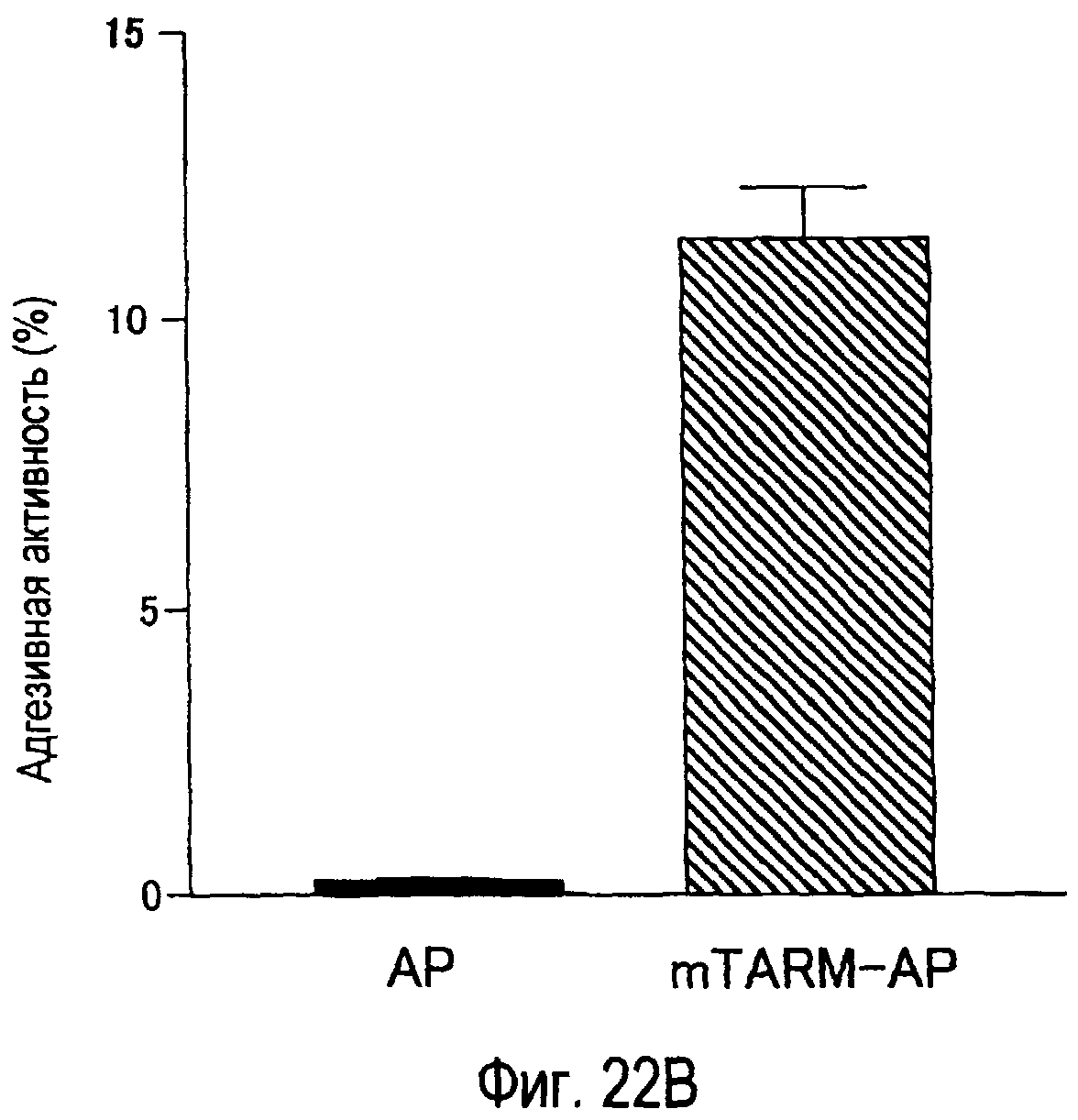
На фиг.22A представлено специфическое связывание химерного белка TARM-AP мыши с клетками B300.19, экспрессирующими mTARM-L. На фиг.22B представлена специфическая клеточная адгезия клеток B300.19, экспрессирующих mTARM-L, к химерному белку TARM-AP мыши.
На фиг.23 представлены результаты, полученные анализом гомологии между белками TARM-L человека и мыши.
На фиг.24 представлены результаты, полученные анализом гомологии между белком TARM человека и белком TARM мыши (m3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет подробно описано ниже. Следующие описания даны только в качестве примеров для объяснения настоящего изобретения, и, таким образом, такие примеры не предназначены для ограничения настоящего изобретения только вариантами осуществления настоящего изобретения. Все технологические термины, научные термины и технические термины, используемые в настоящем описании, обладают едиными значениями с теми, которые обычно используют специалисты в данной технической области, для которых предназначено настоящее изобретение. Такие термины используют только с целью объяснения конкретных вариантов осуществления, и, таким образом, они не предназначены для ограничения настоящего изобретения. Настоящее изобретение можно осуществлять в различных вариантах осуществления, если только оно не отклоняется от своей сущности. Все ссылки на предшествующий уровень техники и патентная документация, такая как патентные заявки или патентные публикации, цитированные здесь, приведены здесь в качестве ссылки в полном объеме, и их можно использовать для осуществления настоящего изобретения.
[Новые белки и полинуклеотиды]
Среди генов, которые идентифицировали в настоящем изобретении, которые специфически экспрессируются в дендритных клетках, происходящих из костного мозга, ген мышиного происхождения обладает 5 типами изоформ. Такие изоформы гена мышиного происхождения включают m1, m2, m3 и m4, которые являются генами мембраносвязанных белков (мембранных белков), и s1, который является геном белка секреторного типа (секреторного белка). Нуклеотидные последовательности и аминокислотные последовательности таких изоформ соответствуют последовательностям следующих номеров:
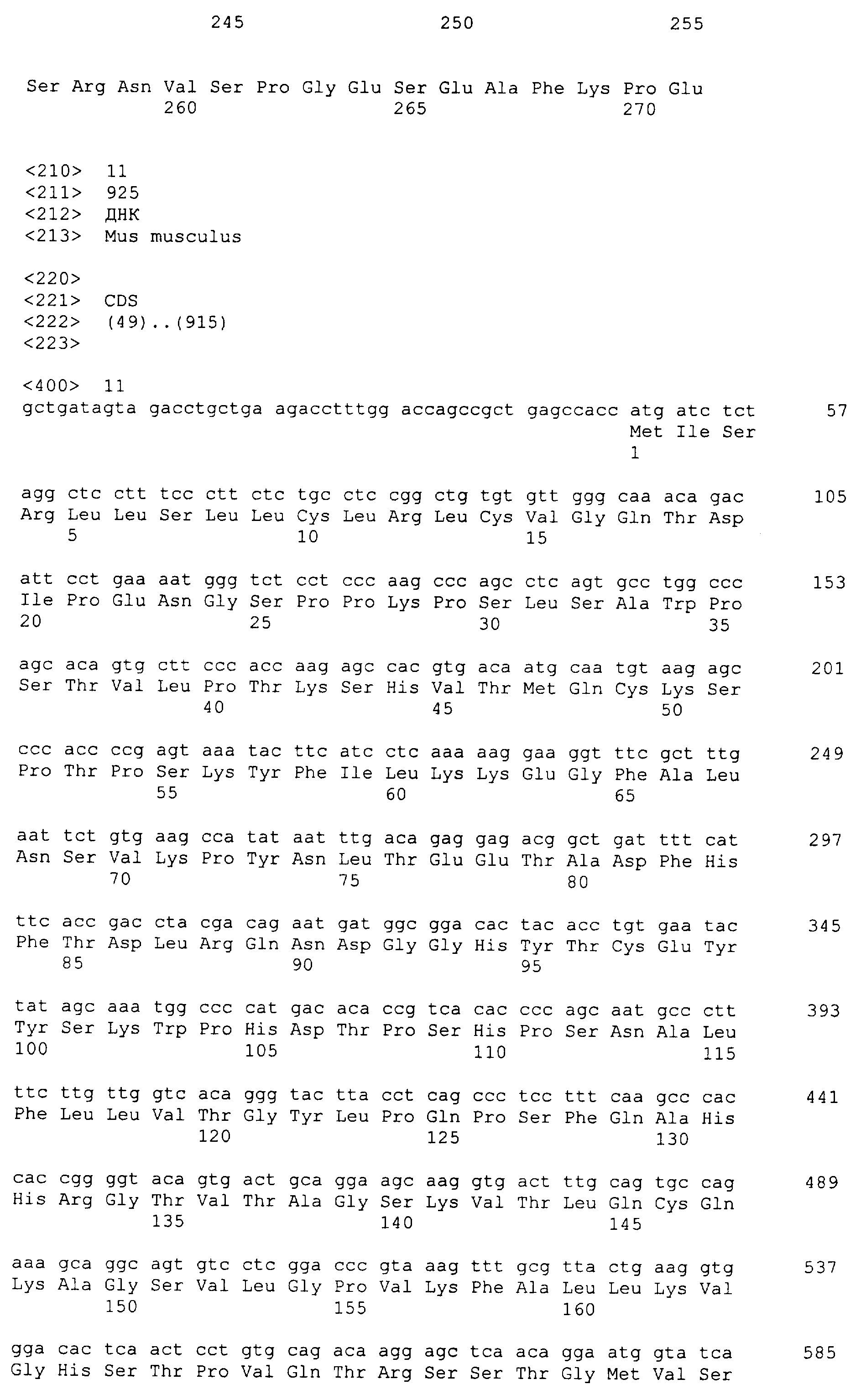
m1 SEQ ID № 11 и 12
m2 SEQ ID № 1 и 2
m3 SEQ ID № 3 и 4
m4 SEQ ID № 5 и 6
s1 SEQ ID № 7 и 8
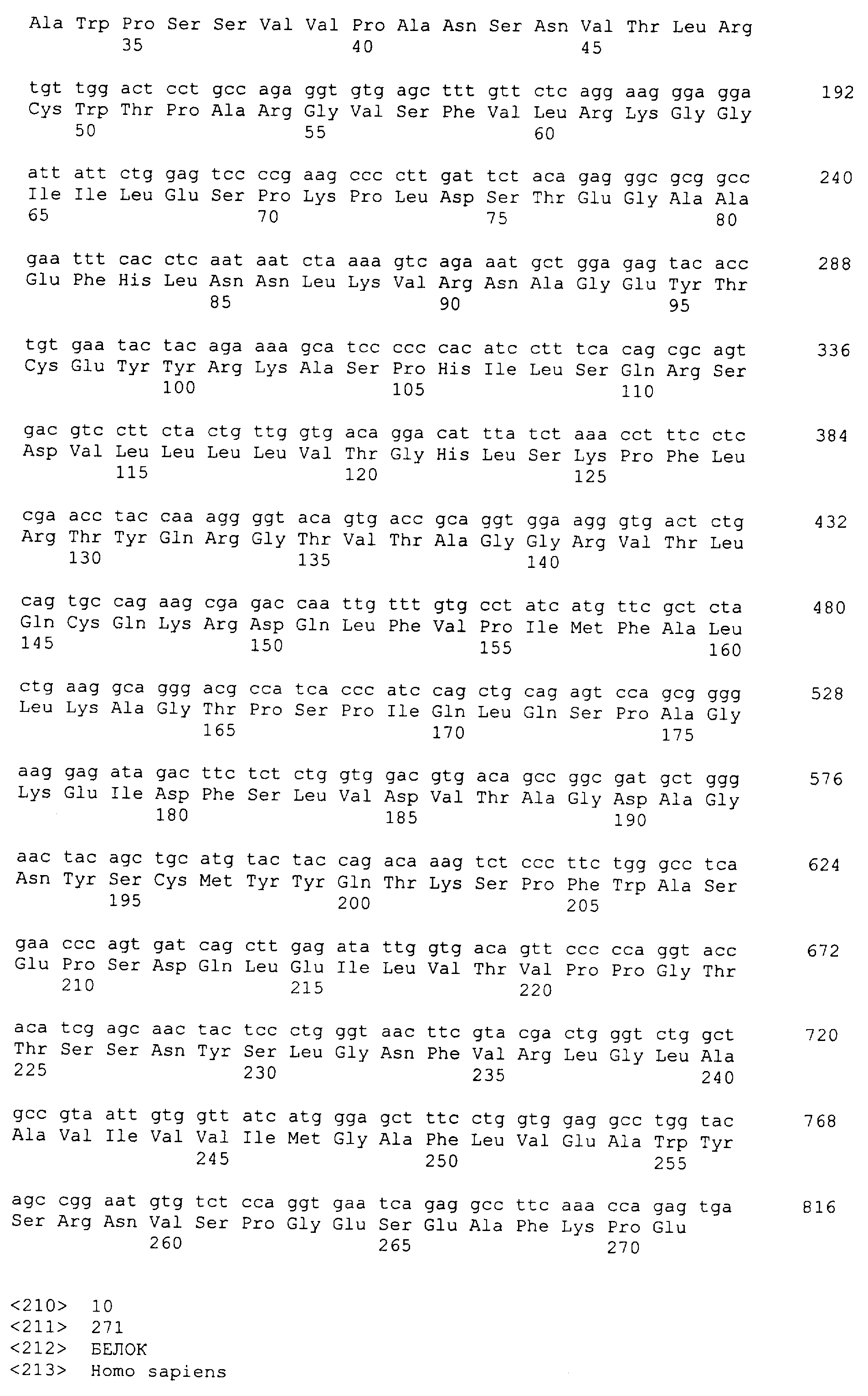
Среди генов, которые идентифицировали в настоящем изобретении, которые специфически экспрессируются в происходящих из костного мозга дендритных клетках, один тип гена мембранного белка можно упомянуть в качестве гена человеческого происхождения. Нуклеотидная последовательность этого гена и аминокислотная последовательность белка, кодируемого геном, соответствуют представленным на SEQ ID № 9 и 10 соответственно.
Так как нуклеотидная последовательность гена, идентифицированного в настоящем изобретении, кодирует сигнальный пептид, белок, кодируемый вышеупомянутым геном, образует мембранный белок или секреторный белок. C-конец мембранного белка согласно настоящему изобретению модифицирован (например, удалением трансмембранной части) для того, чтобы получить секреторный белок. C-конец секреторного белка согласно настоящему изобретению модифицирован (например, добавлением к нему трансмембранной части) для того, чтобы получить мембранный белок.
В настоящем описании выражения «одна или несколько аминокислот вставлены, заменены или удалены или добавлены к одному или обоим концам» и «один или несколько нуклеотидов вставлены, заменены или удалены, или один или несколько нуклеотидов добавлены к одному или обоим концам» означают, что модификацию осуществляли согласно хорошо известным техническим способам, таким как сайт-специфический мутагенез, или заменой нескольких аминокислот или нуклеотидов до такой степени, чтобы получать их естественным образом. Количество аминокислот или нуклеотидов, которые следует модифицировать, может составлять, например, от 1 до 30, предпочтительно от 1 до 20, более предпочтительно от 1 до 10, более предпочтительно от 1 до 5, и особенно предпочтительно 1 или 2.
Модифицированная аминокислотная последовательность может предпочтительно являться аминокислотной последовательностью, обладающей одной или несколькими (предпочтительно одной или несколькими, или 1, 2, 3 или 4) консервативными заменами в аминокислотной последовательности.
Модифицированная нуклеотидная последовательность может предпочтительно являться нуклеотидной последовательностью, обладающей одной или несколькими (например, от одной до нескольких, или 1, 2, 3 или 4) мутациями, которые не нарушают функции белка, состоящего из аминокислотной последовательности SEQ ID № 10.
В настоящем описании термин «консервативная замена» означает, что один или несколько аминокислотных остатков заменены другими химически сходными аминокислотными остатками так, что функции белка, по существу, не модифицированы. Примеры таких консервативных замен включают случай, где гидрофобный остаток заменен другим гидрофобным остатком, и случай, где определенный полярный остаток заменен другим полярным остатком, обладающим таким же электрическим зарядом. Для каждого типа аминокислот в настоящей технической области известны функционально сходные аминокислоты, которые можно заменить таким образом. Примеры неполярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин и метионин. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин и цистеин. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин и лизин. Примеры отрицательно заряженных (кислых) аминокислот включают аспарагиновую кислоту и глутаминовую кислоту.
В настоящем описании термин «гибридизировать» означает гибридизацию с целевым полинуклеотидом в жестких условиях. Конкретно, можно привести в качестве примера полинуклеотид, обладающий, по меньшей мере, 70% или большей, предпочтительно, 80% или большей, более предпочтительно, 85% или большей, более предпочтительно, 90% или большей, более предпочтительно, 95% или большей, особенно предпочтительно, 98% или большей, и, наиболее предпочтительно, 99% или большей идентичностью с целевой нуклеотидной последовательностью, если такую идентичность вычисляют с использованием параметра по умолчанию (инициализации) посредством программного обеспечения для поиска гомологии, такого как FASTA, BLAST или Smith-Waterman [Meth. Enzym., 164, 765 (1988)]. Кроме того, термин «в жестких условиях» означает условия, в которых реакцию осуществляют в гибридизационном буфере, который обычно могут использовать специалисты в данной области при температуре от 40°C до 70°C, и, предпочтительно, от 60°C до 65°C, и продукт реакции затем отмывают отмывочным раствором, обладающим концентрацией соли от 15 до 300 ммоль/л и, предпочтительно, от 15 до 60 ммоль/л. Такую температуру и концентрацию соли можно соответствующим образом подобрать в зависимости от длины используемого зонда. Более того, условия для отмывки продукта, полученного гибридизацией, могут представлять собой 0,2 или 2·SSC, 0,1% SDS, и температуру от 20°C до 68°C. Возможно определить жесткие условия (высокая жесткость) или мягкие условия (низкая жесткость) с помощью создания разных условий посредством концентрации соли или температуры, используемых в ходе отмывки. Если такое различие в условиях гибридизации получают посредством концентрации соли, то 0,2·SSC, 0,1% SDS можно использовать в качестве буфера для жесткой отмывки (буфер для отмывки в условиях высокой жесткости), и 2·SSC, 0,1% SDS можно использовать в качестве буфера для мягкой отмывки (буфер для отмывки в условиях низкой жесткости). С другой стороны, если такое различие получают при помощи температуры, то температуру 68°C используют в случае высокой жесткости, температуру 42°C используют в случае умеренной жесткости и комнатную температуру (от 20°C до 25°C) используют в случае низкой жесткости. Во всех трех вышеописанных случаях реакцию можно осуществлять в 0,2·SSC, 0,1% SDS.
Как правило, предгибридизацию осуществляют в тех же условиях, что и гибридизацию. Однако гибридизацию и предварительную отмывку не всегда осуществляют в одинаковых условиях.
Гибридизацию можно осуществлять согласно известному способу. В случае использования коммерчески доступной библиотеки гибридизацию можно осуществлять согласно способу, описанному в прилагаемых инструкциях.
В настоящем описании термин «идентичность» (иногда обозначаемый как «гомология») по отношению к аминокислотным последовательностям и нуклеотидным последовательностям означает степень совпадения между сравниваемыми последовательностями в терминах аминокислотных остатков или нуклеотидных остатков, которые составляют такие последовательности. В то же время принимают во внимание наличие пропуска и свойства аминокислот (Wilbur, Natl. Acad. Sci. U.S.A. 80:726-730 (1983)). Для вычисления гомологии можно использовать коммерчески доступные программные продукты для поиска гомологии, такие как BLAST (Altschul: J. Mol. Biol. 215:403-410 (1990)), FASTA (Peasron: Methods in Enzymology 183:63-69 (1990)) или Smith-Waterman [Meth. Enzym., 164, 765 (1988)].
Количественное значение такой «идентичности» можно вычислить с использованием программы поиска гомологии, известной специалистам в данной области. Например, такое количественное значение, как идентичность, можно вычислить с использованием параметра по умолчанию (инициализации) в алгоритме для поиска гомологии BLAST ((инструмент для базового поиска локального выравнивания) http://www.ncbi.nlm.nih.gov/BLAST/), National Center for Biotechnology Information (NCBI).
В новом белке по второму варианту осуществления согласно настоящему изобретению аминокислотная последовательность, обладающая 90% или большей идентичностью с аминокислотной последовательностью SEQ ID № 10, может являться аминокислотной последовательностью, обладающей предпочтительно 95% или большей, особенно предпочтительно 98% или большей и наиболее предпочтительно 99% или большей идентичностью с вышеупомянутой аминокислотной последовательностью.
В полинуклеотиде, кодирующем новый белок по второму варианту осуществления согласно настоящему изобретению, нуклеотидная последовательность, обладающая 90% или большей идентичностью с нуклеотидной последовательностью SEQ ID № 9, может являться нуклеотидной последовательностью, обладающей предпочтительно 95% или большей, особенно предпочтительно, 98% или большей, и, наиболее предпочтительно, 99% или большей идентичностью с вышеупомянутой нуклеотидной последовательностью.
В антителах по первому варианту осуществления согласно настоящему изобретению аминокислотная последовательность, обладающая 70% или большей идентичностью с аминокислотной последовательностью SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, может являться аминокислотной последовательностью, обладающей предпочтительно 80% или большей, более предпочтительно, 85% или большей, более предпочтительно, 90% или большей, более предпочтительно, 95% или большей, особенно предпочтительно, 98% или большей, и, наиболее предпочтительно, 99% или большей идентичностью с вышеупомянутой аминокислотной последовательностью.
В настоящем изобретении, если дана аминокислотная последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, то можно легко определить кодирующую ее нуклеотидную последовательность. Таким образом, можно выбрать различные нуклеотидные последовательности, кодирующие аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12.
Соответственно полинуклеотид, кодирующий белок, содержащий аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, содержит не только полную последовательность ДНК SEQ ID № 1, SEQ ID № 3, SEQ ID № 5, SEQ ID № 7, SEQ ID № 9 или SEQ ID № 11, или ее часть, но также последовательность ДНК, кодирующую те же аминокислоты, которая содержит кодон, находящийся с полинуклеотидом в отношении вырожденности в качестве последовательности ДНК. Настоящее изобретение дополнительно включает последовательность РНК, соответствующую такой последовательности ДНК.
Предпочтительный пример полинуклеотида, кодирующего белок, содержащий аминокислотную последовательность SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, представляет собой полинуклеотид, содержащий нуклеотидную последовательность SEQ ID № 1, SEQ ID № 3, SEQ ID № 5, SEQ ID № 7, SEQ ID № 9 или SEQ ID № 11.
В настоящем описании тот факт, функционально эквивалентен или нет конкретный белок белку, состоящему из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, можно определить оценкой биологического признака или функций, связанных с экспрессией белка, состоящего из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12. Например, это можно определить, обеспечивая экспрессию конкретного белка генно-инженерным способом и затем, оценивая, функционирует или нет вышеупомянутый белок в качестве рецептора, активирующего дендритные клетки. Белок, состоящий из аминокислотной последовательности SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 8, SEQ ID № 10 или SEQ ID № 12, взаимодействует с T-клетками и обладает функцией активации дендритных клеток. Таким образом, для вышеупомянутой оценки можно использовать следующие функции в качестве индикатора:
Функция посредника при адгезии T-клеток (примеры 5, 6, 10 и 11);
Функция активации дендритных клеток перекрестной стимуляцией антителами (пример 3);
Функция образования комплекса с цепью FcRγ (пример 4); или
Совместное использование нескольких или всех вышеупомянутых функций.
[Новый белковый лиганд и полинуклеотид]
Среди генов, которые идентифицировали в настоящем изобретении, которые специфически экспрессируются в активированных T-клетках в виде лигандов для белков TARM, один тип гена мембранного белка можно упомянуть в качестве гена мышиного происхождения. Нуклеотидная последовательность этого гена и аминокислотная последовательность белка, кодируемого геном, являются такими, как представлено на SEQ ID № 13 и 14 соответственно. Кроме того, среди генов, которые специфически экспрессируются на активированных T-клетках в виде лигандов для белков TARM, один тип гена мембранного белка можно упомянуть в качестве гена человеческого происхождения. Нуклеотидная последовательность этого гена и аминокислотная последовательность белка, кодируемого геном, являются такими, как представлено на SEQ ID № 15 и 16 соответственно.
В новом белковом лиганде согласно настоящему изобретению аминокислотная последовательность, обладающая 70% или большей идентичностью с аминокислотной последовательностью SEQ ID № 14 или SEQ ID № 16, может являться аминокислотной последовательностью, обладающей предпочтительно 80% или большей, более предпочтительно, 85% или большей, более предпочтительно, 90% или большей, более предпочтительно, 95% или большей, особенно предпочтительно, 98% или большей, и, наиболее предпочтительно, 99% или большей идентичностью с вышеупомянутой аминокислотной последовательностью.
В полинуклеотиде, кодирующем новый белковый лиганд согласно настоящему изобретению, нуклеотидная последовательность, обладающая 70% или большей идентичностью с нуклеотидной последовательностью SEQ ID № 13 или SEQ ID № 15, может являться нуклеотидной последовательностью, обладающей, предпочтительно, 80% или большей, более предпочтительно, 85% или большей, более предпочтительно, 90% или большей, более предпочтительно, 95% или большей, особенно предпочтительно, 98% или большей, и, наиболее предпочтительно, 99% или большей идентичностью с вышеупомянутой нуклеотидной последовательностью.
В настоящем изобретении, если дана аминокислотная последовательность SEQ ID № 14 или SEQ ID № 16, то можно легко определить кодирующую ее нуклеотидную последовательность. Таким образом, можно выбрать различные нуклеотидные последовательности, кодирующие аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16.
Соответственно полинуклеотид, кодирующий белок, содержащий аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16, содержит не только полную последовательность ДНК SEQ ID № 13 или SEQ ID № 15 или ее часть, но также последовательность ДНК, кодирующую те же аминокислоты, которая содержит кодон, находящийся с полинуклеотидом в отношении вырожденности в качестве последовательности ДНК. Настоящее изобретение дополнительно включает последовательность РНК, соответствующую такой последовательности ДНК.
Предпочтительным примером полинуклеотида, кодирующего белок, содержащий аминокислотную последовательность SEQ ID № 14 или SEQ ID № 16, является полинуклеотид, содержащий нуклеотидную последовательность SEQ ID № 13 или SEQ ID № 15.
В настоящем описании тот факт, функционально эквивалентен или нет конкретный белок белку, состоящему из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16, можно определить оценкой биологического признака или функций, связанных с экспрессией белка, состоящего из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16. Например, это можно определить, обеспечивая экспрессию конкретного белка генно-инженерным способом и затем оценивая, функционирует или нет вышеупомянутый белок в качестве лиганда на T-клетках для рецептора, активирующего дендритные клетки. Белок, состоящий из аминокислотной последовательности SEQ ID № 14 или SEQ ID № 16, связывается с белком TARM. Таким образом, для вышеупомянутой оценки функцию связывания с таким белком TARM (пример 12) можно использовать в качестве индикатора.
Новый белковый лиганд согласно настоящему изобретению содержит единственную трансмембранную область, и он экспрессируется на поверхности клеток в том направлении, в котором его N-концевая часть может располагаться во внеклеточном пространстве. Соответственно можно получить антитела против вышеупомянутого белка с использованием вышеупомянутого белка.
Настоящее изобретение относится к белку, содержащему полипептид, состоящий из, по меньшей мере, 6 аминокислотных остатков или всей аминокислотной последовательности из аминокислот с 1 по 159 для SEQ ID № 14 или аминокислот с 1 по 158 для SEQ ID № 16. Вышеупомянутый белок содержит часть, соответствующую внеклеточной области аминокислотной последовательности белка TARM-L, и, таким образом, его можно использовать в качестве антигена для получения антител против вышеупомянутого белка.
Настоящее изобретение относится к применению нового белкового лиганда по настоящему изобретению для получения антител против вышеупомянутого нового белкового лиганда по настоящему изобретению.
[Антитела]
Антитела согласно настоящему изобретению могут специфически узнавать белок TARM или белок TARM-L. Соответственно предпочтительно, чтобы белок TARM или белок TARM-L, используемый для получения антител согласно настоящему изобретению, обладал антигенностью TARM или TARM-L. Такой белок TARM или белок TARM-L включает белок, обладающий аминокислотной последовательностью белка TARM или белка TARM-L, в котором удалены, вставлены, заменены или добавлены один или несколько аминокислотных остатков. Известно, что такой белок сохраняет ту же биологическую активность, как и исходный белок (Mark et al. (1984) Proc. Natl. Acad. Sci. USA 81:5662-6; Zoller and Smith (1982) Nucleic Acids Res. 10:6487-500; Wang et al. (1984) Science 224:1431-3; Dalbadie-McFarland et al. (1982) Proc. Natl. Acad. Sci. USA 79:6409-13). Известен способ получения конкретного белка удалением, вставкой, замещением или добавлением одной или нескольких аминокислот по сравнению с исходным белком при сохранении антигенности исходного белка. Например, полинуклеотид, кодирующий мутантный белок, получают сайт-специфическим мутагенезом и затем обеспечивают соответствующим образом экспрессию белка (Molecular Cloning, A Laboratory Manual 2nd ed., Cold Spring Harbor Press (1989); Current Protocols in Molecular Biology, John Wiley & Sons, (1987-1997), Section 8.1-8.5; Hashimoto-Goto et al. (1995) Gene 152: 271-5; Kinkel (1985) Proc. Natl. Acad. Sci. USA 82:488-92; Kramer and Fritz (1987) Method. Enzymol 154:350-67; Kunkel (1988) Method. Enzymol. 85:2763-6).
Антитела согласно настоящему изобретению также включают антитела, специфические для части белка TARM или белка TARM-L.
Таким образом, такой белок TARM или белок TARM-L, применяемый для получения антител согласно настоящему изобретению, включает не только полипептид, обладающий полноразмерной аминокислотной последовательностью белка TARM или белка TARM-L, но также полипептидный фрагмент, обладающий, по меньшей мере, 6 аминокислотными остатками (например, 6, 8, 10, 12, 15 или большим количеством аминокислотных остатков) белка TARM или белка TARM-L. В настоящем описании тип полипептидного фрагмента белка TARM или белка TARM-L особым образом не ограничен при условии, что он обладает антигенностью белка TARM или белка TARM-L.
Предпочтительным полипептидным фрагментом может являться полипептидный фрагмент, как, например, N-конец или C-конец белка TARM или белка TARM-L. Участок антигенного детерминанта полипептида оценивают способом анализа гидрофобности/гидрофильности по аминокислотной последовательности белка (Kyte-Doolittle (1982) J. Mol. Biol. 157:105-22) или способом анализа вторичной структуры (Chou-Fasman (1978) Ann. Rev. Biochem. 47:251-76). Соответственно такой участок антигенного детерминанта можно подтвердить с использованием компьютерной программы (Anal. Biochem. 151:540-6 (1985)) или с использованием способов, таких как способ PEPSCAN синтеза короткого пептида и подтверждения его антигенности (японская патентная выложенная публикация № 500684/1985).
Антитела согласно настоящему изобретению являются, предпочтительно, антителами, которые обладают влиянием на функции белка TARM или белка TARM-L. Например, значения выражения «обладающий влиянием на функции белка TARM» включают: активацию дендритных клеток перекрестной стимуляцией белка TARM антителами согласно первому варианту осуществления настоящего изобретения (пример 3); ингибирование адгезии T-клеток к белку TARM посредством связывания вышеупомянутых антител с белком TARM (примеры 6 и 11); и ингибирование образования комплекса между белком TARM и цепью FcRγ посредством связывания вышеупомянутых антител с белком TARM (пример 4). Например, значения выражения «обладающий влиянием на функции белка TARM-L» включают ингибирование связывания белка TARM-L с белком TARM посредством связывания антител по второму варианту осуществления согласно настоящему изобретению с белком TARM-L.
Антитела согласно настоящему изобретению включают: моноклональные антитела, полученные с использованием белка TARM или белка TARM-L в качестве антигена и иммунизацией млекопитающего, такого как мышь, вышеупомянутым антигеном; химерные антитела и гуманизированные антитела, полученные с помощью генетической рекомбинации; и человеческие антитела, полученные с использованием трансгенного животного, продуцирующего человеческие антитела, или т.п. Если антитела согласно настоящему изобретению вводят в виде лекарственного средства человеку, предпочтительно используют человеческие антитела с точки зрения побочных эффектов.
«Человеческие антитела» означают антитела, в которых все области обладают человеческим происхождением. Такие человеческие антитела можно получать введением гена человеческих антител в мышь. Такие человеческие антитела можно получать на основании способов, описанных, например, в Nature Genetics, Vol. 7, pp. 13-21, 1994; Nature Genetics, Vol. 15, pp. 146-156, 1997; японской патентной выложенной публикации № 504365/1992; японской патентной выложенной публикации № 509137/1995; международной публикации WO94/25585; Nature, Vol. 368, pp. 856-859, 1994; и японской патентной выложенной публикации № 500233/1994. Кроме того, такие человеческие антитела можно также получать способом фагового дисплея. Их можно получать, например, на основании способа, описанного в Marks, J. D. et al.: J. Mol. Biol., Vol. 222, pp. 581-597, 1991.
«Гуманизированные антитела» представляют собой антитела, полученные пересадкой (CDR-привитием) только генной последовательности антигенсвязывающего участка (CDR; область, определяющая комплементарность) мышиных антител в ген человеческих антител. Такие гуманизированные антитела можно получить, например, на основании способов, описанных в японской патентной выложенной публикации № 506458/1992 и японской патентной выложенной публикации № 296890/1987.
«Химерные антитела» представляют собой антитела, полученные лигированием вариабельной области мышиных антител с константной областью человеческих антител. В частности, мышь иммунизируют антигеном, и вариабельную область антител (V-область), которая связывается с антигеном, выделяют из гена мышиных моноклональных антител. Таким образом полученную V-область затем лигируют с геном константной области антител (C-области), происходящим из костного мозга человека, таким образом, получая химерные антитела. Такие химерные антитела можно получить, например, на основании способа, описанного в японской патентной публикации № 73280/1991.
Моноклональные антитела согласно настоящему изобретению можно получить с использованием способа, хорошо известного специалистам в данной области (например, «Current Protocols in Molecular Biology», John Wiley & Sons (1987)), Antibodies: A Laboratory Manual, Ed. Harlow and David Lane, Cold Spring Harbor Laboratory (1988)).
В качестве иммуногена можно использовать фрагмент белка TARM или белка TARM-L. В противном случае можно также использовать антиген, синтезированный на основе вышеупомянутой аминокислотной последовательности. Такой антиген можно использовать в виде комплекса с белком-носителем. Для получения комплекса антигена с белком-носителем можно использовать различные типы связующих веществ. Можно использовать глутаральдегид, карбодиимид, активный сложный эфир малеинимида и т.п. В качестве белка-носителя можно, как правило, использовать такие продукты, как бычья сыворотка, альбумин, тироглобулин или гемоцианин, и, как правило, осуществлять присоединение в отношении 1 к 5.
Примеры животного, подлежащего иммунизации, включают мышь, крысу, кролика, морскую свинку и хомяка. Способ инокуляции включает подкожное введение, внутримышечное введение и внутрибрюшинное введение. Для введения антиген можно смешать с полным адъювантом Фрейнда или неполным адъювантом Фрейнда. Введение, как правило, осуществляют один раз каждые 2-5 недель.
Продуцирующие антитела клетки, полученные из селезенки или лимфатического узла иммунизированного животного, подвергают клеточному слиянию с миеломными клетками, и их выделяют в виде гибридом. В качестве таких миеломных клеток можно использовать клетки мышиного, крысиного, человеческого происхождения или т.п., и, предпочтительно, происходящие из того же вида, что и продуцирующие антитела клетки. Однако существуют также случаи, в которых такое клеточное слияние можно осуществлять даже между клетками разных видов.
Клеточное слияние можно осуществлять известным способом, таким как способ, описанный в Nature, 256, 495, 1975.
Примеры активатора слияния включают полиэтиленгликоль и вирус Сендай. Как правило, клеточное слияние можно осуществить, обеспечивая взаимодействие продуцирующих антитела клеток с миеломными клетками с использованием полиэтиленгликоля (средняя молекулярная масса 1000-4000), обладающего концентрацией, приблизительно, 20%-50% при температуре между 20°C и 40°C, и, предпочтительно, между 30°C и 37°C, при соотношении количества продуцирующих антитела клеток к количеству миеломных клеток, которое составляет, как правило, приблизительно, от 1:1 до 10:1, в течение, приблизительно, от 1 до 10 минут.
Можно использовать различные типы иммунохимических способов для скрининга продуцирующих антитела гибридом. Примеры такого иммунохимического способа включают: способ ELISA с использованием микропланшетов, покрытых белком TARM или белком TARM-L; способ EIA с использованием микропланшетов, покрытых антителами к иммуноглобулину; и способ иммуноблоттинга, включающий электрофорез образца, содержащего белок TARM, и затем использование нитроцеллюлозной мембраны.
Кроме того, для скрининга таких продуцирующих антитела гибридом можно использовать вместо вышеупомянутого иммунохимического способа способ скрининга гибридом, основанный на том, обладают или нет вышеупомянутые антитела влиянием на функции белка TARM или белка TARM-L. Можно осуществлять скрининг продуцирующих антитела гибридом на основе влияния антител по первому варианту осуществления согласно настоящему изобретению на функции белка TARM, например, на основе того, активируются или нет дендритные клетки перекрестной стимуляцией белка TARM антителами по первому варианту осуществления согласно настоящему изобретению (пример 3), или можно, или нельзя ингибировать функцию белка TARM в опосредовании адгезии T-клеток посредством связывания вышеупомянутых антител с белком TARM (примеры 6 и 11), или можно, или нельзя ингибировать образование комплекса между белком TARM и цепью FcRγ посредством связывания вышеупомянутых антител с белком TARM (пример 4). Можно также осуществлять скрининг продуцирующих антитела гибридом на основе влияния антител по второму варианту осуществления согласно настоящему изобретению на функции белка TARM-L, например, на основе того, можно или нельзя ингибировать функцию белка TARM в связывании с белком TARM-L посредством связывания антител по второму варианту осуществления согласно настоящему изобретению с белком TARM-L. С помощью этого способа скрининга можно селектировать антитела, которые обладают влиянием на функции белка TARM или белка TARM-L, которые представляют собой предпочтительный вариант антител по настоящему изобретению. Более того, этот способ скрининга можно также осуществлять в качестве способа вторичного скрининга, который осуществляют после вышеупомянутого иммунохимического способа скрининга, в котором осуществляют селекцию продуцирующей антитела гибридомы на основе того, продуцирует она или нет антитела, которые связываются с белком TARM или белком TARM-L.
Более того, для того чтобы получить клоны, клонирование осуществляют в такой лунке, например, с помощью способа ограниченного разведения. Селекцию и культивирование таких гибридом, как правило, осуществляют в среде для животных клеток (например, RPMI1640), содержащей от 10% до 20% эмбриональной бычьей сыворотки, к которой добавлен HAT (гипоксантин, аминоптерин и тимидин). Клоны, полученные таким образом, трансплантируют в перитонеальную полость мышей SCID, которым предварительно ввели пристан. 10-14 суток спустя собирают асцитическую жидкость, содержащую высокую концентрацию моноклональных антител, и ее можно использовать в качестве исходного материала для очистки антител. В противном случае вышеупомянутые клоны культивируют, и полученную культуру можно также использовать в качестве исходного материала для очистки антител.
Моноклональные антитела можно очищать известным способом очистки иммуноглобулинов. Например, такую очистку моноклональных антител можно легко получить посредством способов, таких как способ фракционирования сульфатом аммония, способ фракционирования с помощью PEG, способ фракционирования этанолом, использование анионообменной или аффинной хроматографии с использованием колонки с белком A, колонки с белком G и белка TARM.
«Функциональный фрагмент» по настоящему изобретению означает часть антител (частичный фрагмент), который специфически узнает белок по настоящему изобретению. Конкретные примеры такого функционального фрагмента включают Fab, Fab', F(ab')2, фрагмент вариабельной области (Fv), связанный дисульфидной связью Fv, одноцепочечные антитела (scFv) и их полимер.
Предпочтительные примеры антител по первому варианту осуществления согласно настоящему изобретению включают антитела против нового белка по первому варианту осуществления согласно настоящему изобретению и их функциональный фрагмент.
Такие предпочтительные примеры антител по первому варианту осуществления согласно настоящему изобретению также включают антитела против нового белка по второму варианту осуществления согласно настоящему изобретению и их функциональный фрагмент.
Такие предпочтительные примеры антител по первому варианту осуществления согласно настоящему изобретению дополнительно включают антитела против следующих белков:
(ix') мембранный или секреторный белок, содержащий аминокислотную последовательность SEQ ID № 12;
(x') мембранный или секреторный белок, который содержит аминокислотную последовательность SEQ ID № 12, в которой одна или несколько аминокислот вставлены, заменены или удалены, или одна или несколько аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 12;
(xi') мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, который кодирует аминокислотную последовательность SEQ ID № 12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 12; и
(xii') мембранный или секреторный белок, который содержит аминокислотную последовательность, обладающую 70% или большей идентичностью с аминокислотной последовательностью SEQ ID № 12 и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID № 12.
Более предпочтительный пример антител по первому варианту осуществления согласно настоящему изобретению представляет собой антитела против мембранного или секреторного белка, содержащего аминокислотную последовательность SEQ ID № 12 или аминокислотную последовательность SEQ ID № 12, которая содержит одну или несколько консервативных замен, или их функциональный фрагмент.
Конкретный пример представляет собой моноклональные антитела, продуцируемые гибридомой, депонированной под инвентарным № FERM BP-10376.
Соответственно настоящее изобретение относится к гибридоме (@TARM#6.11), депонированной в National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary (AIST Tsukuba Central 6, Higashi 1-1-1, Tsukuba, Ibaraki, 305-8566, Japan), под инвентарным № FERM BP-10376 15 июля 2005.
Другой более предпочтительный пример антител по первому варианту осуществления согласно настоящему изобретению представляет собой антитела против мембранного или секреторного белка, содержащего аминокислотную последовательность SEQ ID № 10 или аминокислотную последовательность SEQ ID № 10, которая содержит одну или несколько консервативных замен, или их функциональный фрагмент.
Предпочтительный пример антител по второму варианту осуществления согласно настоящему изобретению представляет собой антитела против мембранного или секреторного белка, содержащего аминокислотную последовательность SEQ ID № 14 или аминокислотную последовательность SEQ ID № 14, которая содержит одну или несколько консервативных замен, или их функциональный фрагмент.
Другой предпочтительный пример антител по второму варианту осуществления согласно настоящему изобретению представляет собой антитела против мембранного или секреторного белка, содержащего аминокислотную последовательность SEQ ID № 16 или аминокислотную последовательность SEQ ID № 16, которая содержит одну или несколько консервативных замен, или их функциональный фрагмент.
Более предпочтительный пример антител по второму варианту осуществления согласно настоящему изобретению представляет собой антитела, узнающие полипептидную область белка TARM-L, которая экспрессируется во внеклеточном пространстве, или их функциональный фрагмент. Пример таких антител представляет собой антитела против белка, содержащего полипептид, состоящий, по меньшей мере, из 6 аминокислотных остатков или всей аминокислотной последовательности из аминокислот с 1 по 159 SEQ ID № 14 или аминокислот с 1 по 158 SEQ ID № 16, или их функциональный фрагмент.
[Применение антител и фармацевтической композиции]
Аутоиммунные заболевания
Так как T-клетки, которые являются лимфоцитами, связанными с иммунными ответами, действуют совместно с дендритными клетками, обладающими функцией презентации антигена таким T-клеткам, T-клетки принимают участие в различных иммунных ответах (Kroczek, R.A., et al. (2004) Current Opinion in Immunology 16:321-327). Как описано далее в примерах, выявлено, что экспрессия белка TARM на дендритных клетках усиливалась воспалительным стимулом (пример 2) и что дендритные клетки контактировали с T-клетками посредством белка TARM (примеры 5 и 10). Кроме того, подтверждено, что дендритные клетки активировались белком TARM, подвергаемым стимуляции перекрестным связыванием, и что индуцировалась выработка IL-6 (пример 3). Сообщалось, что избыточная выработка IL-6 связана с аутоиммунными заболеваниями (Ishihara, K., et al. (2002) Cytokine & Growth Factor Reviews 13:357-368). Более того, адгезия T-клеток к дендритным клеткам в значительной степени подавлялась антителами против белка TARM (примеры 6 и 11).
Более того, в вышеупомянутых примерах подтверждено, что антитела согласно настоящему изобретению действительно обладали терапевтическим эффектом на модели индуцированного коллагеном артрита (пример 7). Модель индуцированного коллагеном артрита является моделью ревматоидного артрита, который является аутоиммунным заболеванием.
Соответственно антитела по первому варианту осуществления согласно настоящему изобретению пригодны для лечения аутоиммунных заболеваний.
Примером такого аутоиммунного заболевания является ревматоидный артрит.
Аналогичным образом, принято считать, что адгезия T-клеток к дендритным клеткам подавляется антителами против белка TARM-L. Соответственно антитела по второму варианту осуществления согласно настоящему изобретению пригодны для лечения аутоиммунных заболеваний.
Настоящее изобретение относится к применению антител согласно настоящему изобретению для получения лекарственного средства для лечения аутоиммунных заболеваний.
Настоящее изобретение относится к способу лечения аутоиммунных заболеваний, включающему стадию введения терапевтически эффективного количества антитела согласно настоящему изобретению млекопитающим, включая человека.
Средство для ингибирования адгезии T-клеток
Как описано далее в примерах, адгезия T-клеток к дендритным клеткам в значительной степени подавлялась антителами против белка TARM (примеры 6 и 11). Соответственно антитела по первому варианту осуществления согласно настоящему изобретению можно применять в качестве средства для ингибирования адгезии T-клеток.
Аналогичным образом, принято считать, что адгезия T-клеток к дендритным клеткам подавляется антителами против белка TARM-L. Соответственно антитела по второму варианту осуществления согласно настоящему изобретению можно применять в качестве средства для ингибирования адгезии T-клеток.
В настоящем описании термин «адгезия T-клеток» означает адгезию T-клеток к дендритным клеткам, а именно связывание белка TARM, экспрессируемого на дендритных клетках, с белком TARM-L, экспрессируемым на T-клетках. При ингибировании связывания белка TARM, экспрессируемого на дендритных клетках, с белком TARM-L, экспрессируемым на T-клетках, с использованием средства для ингибирования адгезии T-клеток согласно настоящему изобретению, можно супрессировать иммунный ответ, вызываемый в результате взаимодействия между дендритными клетками и T-клетками, такой как активация, рост и дифференцировка дендритных клеток и T-клеток и выработка цитокина/хемокина.
Фармацевтическая композиция
Способ введения антител согласно настоящему изобретению особым образом не ограничен. Вышеупомянутые антитела можно вводить млекопитающим, включая человека, с помощью перорального введения или парентерального введения (например, внутривенной инъекции, внутримышечной инъекции, подкожного введения, ректального введения, чрескожного введения и местного введения). Среди них предпочтительны парентеральное введение и, в частности, внутривенная инъекция.
Лекарственная форма для перорального введения и парентерального введения и способ ее получения хорошо известны специалистам в данной области. Лекарственную форму для перорального введения и парентерального введения можно получить общепринятым способом, например, смешиванием антител согласно настоящему изобретению, например, с фармацевтически приемлемым носителем.
Как таковой используют фармацевтически приемлемый носитель, вещество, которое обычно используют в области изготовления лекарственных средств и которое не взаимодействует с антителами согласно настоящему изобретению. Фармацевтически приемлемые носители включают, например, обычно используемые эксципиент, связующее вещество, дезинтегратор, лубрикант, краситель и флаворант; и, при необходимости, стабилизатор, эмульгатор, стимулятор абсорбции, поверхностно-активное вещество, средство для доведения pH, антисептик, антиоксидант, разбавитель, увлажняющее вещество, поверхностный активатор, диспергирующее вещество, буфер, консервант, солюбилизатор и успокаивающее средство, и их можно составить согласно общепринятому способу смешиванием ингредиентов, обычно используемых в качестве исходных веществ для фармацевтических препаратов.
Примеры лекарственных форм для парентерального введения включают препараты для инъекций (например, продукт для капельной инъекции, продукт для внутривенной инъекции, продукт для внутримышечной инъекции, продукт для подкожной инъекции и продукт для чрескожной инъекции), препараты для наружного применения (например, мазь, припарка, примочка), суппозиторий, средство для ингаляции, глазные капли, глазную мазь, капли для носа, ушные капли и липосомальное средство.
Препарат для инъекций получают растворением антител согласно настоящему изобретению, например, в дистиллированной воде, используемой для инъекций. При необходимости можно добавить к такому препарату для инъекций солюбилизатор, буфер, средство для доведения pH, средство для поддержания изотонического состояния, успокаивающее средство, консервант, стабилизатор и т.д. Кроме того, такой препарат для инъекций можно получить в виде лиофилизированного продукта, который можно приготовить при использовании.
Примеры лекарственных форм для перорального введения включают твердые и жидкие лекарственные формы, такие как таблетки, таблетки, покрытые оболочкой, драже, небольшие драже, гранулы, порошок, капсулы, сироп, эмульсию, суспензию, инъекцию или пастилки.
Фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать другие терапевтически эффективные средства. Более того, при необходимости можно также добавлять компоненты, такие как стимулятор кровообращения, антибактериальный препарат, противовоспалительное средство, клеточный активатор, витамины, аминокислоты, увлажнитель или кератолитическое лекарственное средство. При этом отношение активного ингредиента к носителю можно изменять в пределах диапазона от 1 до 90% по массе.
Дозировку антител согласно настоящему изобретению может определять лечащий врач на основе различных факторов, таких как способ введения, тип заболевания, степень выраженности симптомов, возраст, пол и масса тела пациента, тяжесть заболевания, фармацевтические показатели, такие как фармакокинетика и токсикологические характеристики, наличие или отсутствие использования системы доставки лекарственного средства и возможность введения в качестве компонента сочетания с другими средствами, и она может, как правило, составлять от 1 до 5000 мг/сутки, предпочтительно, от 10 до 2000 мг/сутки, и, более предпочтительно, от 50 до 2000 мг/сутки для перорального введения, и от 1 до 5000 мг/сутки, предпочтительно, от 5 до 2000 мг/сутки, и, более предпочтительно, - от 50 до 2000 мг/сутки для введения с помощью инъекции, каждая - для взрослого (массой 60 кг), которые вводят один или несколько раз в сутки. При введении ребенку доза может быть меньше, чем при введении взрослому. Способ введения, который фактически используют, можно изменить по решению лечащего врача, и, таким образом, используемая дозировка может отклоняться от вышеупомянутого диапазона.
[Способ скрининга]
Способ скрининга вещества, которое ингибирует адгезию T-клеток к белку TARM
Согласно способу скрининга по первому варианту осуществления настоящего изобретения предложен способ скрининга для скрининга вещества, которое ингибирует адгезию T-клеток к белку TARM.
Белок TARM экспрессируется на дендритных клетках, и он ассоциирован с взаимодействием между дендритными клетками и T-клетками, которые вовлечены в иммунный ответ. Кроме того, в качестве результата стимуляции перекрестным связыванием белка TARM, может индуцироваться продукция IL-6, которая может вызывать аутоиммунное заболевание. Соответственно способ скрининга по первому варианту осуществления настоящего изобретения можно применять для скрининга вещества, которое ингибирует адгезию T-клеток к белку TARM, и, предпочтительно, можно применять для скрининга вещества, эффективного при лечении аутоиммунного заболевания и, более предпочтительно, ревматоидного артрита.
Способ скрининга по первому варианту осуществления согласно настоящему изобретению может дополнительно включать после стадии (b) стадию (c) сравнения активности связывания в присутствии тестируемого вещества с активностью связывания в отсутствие тестируемого вещества.
Если на стадии (c) активность связывания в присутствии тестируемого вещества ниже, чем активность связывания в отсутствие тестируемого вещества, и, предпочтительно, если она ниже 50%, то можно установить, что тестируемое вещество ингибирует связывание T-клеток с белком согласно настоящему изобретению.
Термин «контактирование» на стадии (a) особым образом не ограничен при условии, что белок TARM может непосредственно вступать в контакт с T-клетками. Например, ее можно осуществлять способом добавления меченных T-клеток на планшет, на котором иммобилизован белок TARM, или способом добавления меченного белка TARM на планшет, содержащий T-клетки.
T-клетки предпочтительно являются активированными T-клетками и, более предпочтительно, активированными Th2-клетками.
На стадии (b) активность связывания можно измерять известным способом. Например, меченые T-клетки добавляют на планшет, на котором иммобилизован белок TARM, и их можно культивировать определенный период времени. Далее неприкрепившиеся клетки удаляют промывкой или т.п. и затем измеряют уровень прикрепившихся клеток, таким образом, измеряя активность связывания.
Для вышеупомянутого мечения, например, можно использовать радиоизотоп, фермент, флуоресцентное вещество (включая флуоресцентный белок), люминесцентное вещество и т.п. Примеры используемых здесь радиоизотопов включают [3H], [14C], [125I] и [35S]. Примеры используемых здесь ферментов включают β-галактозидазу, щелочную фосфатазу, пероксидазу и люциферазу. Примеры используемых здесь флуоресцентных веществ включают флуоресцеин-изотиоцианат, BODIPY и кальцеин-AM (Dojindo Laboratories). Также в качестве флуоресцентного белка можно использовать GFP и т.п. Что касается таких ферментов и флуоресцентных белков, их гены можно вводить в клетку и можно затем экспрессировать в ней. Примеры используемых здесь люминесцентных веществ включают люциферин и люцигенин. В некоторых случаях можно использовать систему биотин-авидин, чтобы обеспечить связывание вышеупомянутого лиганда с метящим веществом.
Более того, добавляют немеченые T-клетки, и прикрепившиеся T-клетки можно затем детектировать антителами, которые специфичны для T-клеток, такими как антитела к CD3, или антителами, которые специфичны для хелперных T-клеток, такими как антитела к CD4.
Что касается активности связывания, то добавленные клетки предварительно измеряют, и ее можно выражать в виде отношения прикрепившихся клеток к добавленным клеткам.
Способ скрининга вещества, которое ингибирует активацию дендритных клеток
Согласно способу скрининга по второму варианту осуществления настоящего изобретения предложен способ скрининга для скрининга вещества, которое ингибирует активацию дендритных клеток.
Дендритные клетки можно активировать белком TARM, подвергнутым стимуляции перекрестным связыванием (примеры 3 и 4). Соответственно, систему дендритных клеток, которая подвергнута перекрестной стимуляции антителами к TARM, можно применять для скрининга вещества, которое ингибирует активацию дендритных клеток.
Как указано выше, показано, что аутоиммунное заболевание вызывается активацией дендритных клеток. Таким образом, способ согласно настоящему изобретению для скрининга вещества, которое ингибирует активацию дендритных клеток, можно применять для скрининга вещества, эффективного при лечении, предпочтительно, аутоиммунного заболевания и, более предпочтительно, ревматоидного артрита.
Если перекрестная стимуляция приложена к белку TARM, который экспрессируется на дендритных клетках, то дендритные клетки становятся активированными. В то же время белок TARM образует комплекс с цепью FcRγ, известной как передающая сигнал молекула, и индуцируется продукция IL-6, который вызывает аутоиммунные заболевания, или MCP-1, который действует как хемотаксический фактор для моноцитов. Соответственно на стадии (e) способа скрининга по второму варианту осуществления согласно настоящему изобретению уровень активации дендритных клеток можно измерять с использованием в качестве индикатора количества IL-6 и/или MCP-1, вырабатываемых дендритными клетками. В противном случае уровень активации дендритных клеток можно измерять с использованием, в качестве индикатора, уровня экспрессии цепи FcRγ в дендритных клетках.
В способе скрининга по второму варианту осуществления согласно настоящему изобретению, если уровень активации дендритных клеток измеряют с использованием, в качестве индикатора, количества IL-6 и/или MCP-1, вырабатываемых дендритными клетками, то способ скрининга может дополнительно включать после стадии (e) стадию (f-1) сравнения количества IL-6 и/или MCP-1, вырабатываемых в присутствии тестируемого вещества, с количеством IL-6 и/или MCP-1, вырабатываемых в отсутствие тестируемого вещества. Если на стадии (f-1) количество IL-6 и/или MCP-1, вырабатываемых в присутствии тестируемого вещества, меньше количества IL-6 и/или MCP-1, вырабатываемых в отсутствие тестируемого вещества, и, предпочтительно, если оно меньше 50%, то можно установить, что тестируемое вещество ингибирует активацию дендритных клеток.
В способе скрининга по второму варианту осуществления согласно настоящему изобретению, если уровень активации дендритных клеток измеряют с использованием, в качестве индикатора, уровня экспрессии цепи FcRγ в дендритных клетках, то способ скрининга может дополнительно включать после стадии (e) стадию (f-2) сравнения уровня экспрессии цепи FcRγ в присутствии тестируемого вещества с уровнем экспрессии цепи FcRγ в отсутствие тестируемого вещества.
Если на стадии (f-2) уровень экспрессии цепи FcRγ в присутствии тестируемого вещества ниже уровня экспрессии цепи FcRγ в отсутствие тестируемого вещества, и, предпочтительно, если он ниже 50%, то можно установить, что тестируемое вещество ингибирует активацию дендритных клеток.
На стадии (d) термин «контактирование» особым образом не ограничен при условии, что белок TARM на дендритных клетках подвергают перекрестной стимуляции антителами согласно настоящему изобретению. Например, ее можно осуществлять культивированием дендритных клеток в среде, которая содержит антитела согласно настоящему изобретению.
На стадии (e) количество вырабатываемого белка или уровень экспрессии можно измерять согласно известному способу. Также можно использовать коммерчески доступный набор.
Способ скрининга вещества, которое ингибирует образование комплекса между белком TARM и цепью FcRγ
Согласно способу скрининга по третьему варианту осуществления согласно настоящему изобретению, предложен способ скрининга вещества, которое ингибирует образование комплекса между белком TARM и цепью FcRγ.
Белок TARM экспрессируется на дендритных клетках и образует комплекс с цепью FcRγ, которая хорошо известна в качестве передающей сигнал молекулы. Более того, предполагают, что цепь FcRγ образует комплекс с белком TARM так, что усиливается его экспрессия на поверхности клеток. Соответственно, способ скрининга согласно настоящему изобретению можно применять для скрининга вещества, которое ингибирует образование комплекса между белком TARM и цепью FcRγ, и, предпочтительно, можно применять для скрининга вещества, эффективного при лечении, предпочтительно, аутоиммунных заболеваний и, более предпочтительно, ревматоидного артрита.
Способ скрининга согласно настоящему изобретению может дополнительно включать после стадии (h) стадию (i) сравнения уровня экспрессии цепи FcRγ в присутствии тестируемого вещества с уровнем экспрессии цепи FcRγ в отсутствие тестируемого вещества.
Если на стадии (i) уровень экспрессии цепи FcRγ в присутствии тестируемого вещества ниже уровня экспрессии цепи FcRγ в отсутствие тестируемого вещества, и, предпочтительно, если он ниже 50%, то можно установить, что тестируемое вещество ингибирует образование комплекса между белком согласно настоящему изобретению и цепью FcRγ.
На стадии (g) термин «контактирование» особым образом не ограничен при условии, что дендритные клетки, на которых экспрессируются белок TARM и цепь FcRγ, могут непосредственно вступать в контакт с антителами согласно настоящему изобретению. Например, ее можно осуществлять культивированием дендритных клеток в среде, которая содержит антитела согласно настоящему изобретению.
На стадии (h) уровень экспрессии можно измерять согласно известному способу. Например, уровень экспрессии можно измерять с использованием проточной цитометрии.
В настоящем описании примеры «тестируемого вещества» включают синтетическое низкомолекулярное соединение, белок, синтетический пептид, очищенный или частично очищенный полипептид, антитела, вещество, выделяемое из бактерий (включая бактериальный метаболит), и нуклеиновую кислоту (антисмысловую, рибозим, РНКi и т.д.). Предпочтительные примеры включают соединение или его соль, или его сольват (например, гидрат), но примеры этим не ограничены. «Тестируемое вещество» может являться или новым веществом, или известным веществом.
Примеры
Настоящее изобретение будет описано подробно в следующих примерах. Однако примеры, описанные ниже, не предназначены для ограничения объема настоящего изобретения. В примерах «белок TARM» и «белок TARM-L» могут иногда просто обозначаться как «TARM» и «TARM-L» соответственно. Более того, белок TARM мышиного происхождения и белок TARM человеческого происхождения могут иногда просто обозначаться как «mTARM» и «hTARM» соответственно.
[Пример 1] Выделение гена TARM мыши и анализ экспрессии
(1) Выделение гена mTARM
CD4-T-клетки, выделенные из селезенки мыши, разделяли на Th1 или Th2 культивированием in vitro. Фрагмент кДНК для использования в качестве драйвера или зонда получали из Th1 или Th2. Далее поиск с помощью Blast осуществляли с использованием последовательности фрагментов кДНК, полученных в ходе стадии проведения высокочувствительного способа вычитания (N-RDA). В результате получен ген, кодирующий белок клеточной мембраны, обладающий неизвестными функциями (инвентарный № в GenBank™ NM_177363).
Следующие праймеры сконструировали на основе последовательности GenBank™ (NM_177363) и анализировали экспрессию гена mTARM в различных органах мыши.
mTARM F1: GTGACTTTGCAGTGCCAGAA (SEQ ID №: 17)
mTARM R1: TGCACAGGAGTTGAGTGTCC (SEQ ID №: 18)
Одноцепочечную кДНК синтезировали, исходя из суммарной РНК каждого органа (Promega), с использованием набора для PCR РНК (TAKARA). С использованием такой одноцепочечной кДНК в качестве матрицы PCR в реальном времени осуществляли с использованием ABI7700 (Applied Biosystems). PCR осуществляли с использованием реакционного раствора следующего состава (12,5 мкл QuantiTect SYBR Green PCR Master Mix (QIAGEN), 0,25 мкл урацил-ДНК-гликозилазы (Invitrogen), 0,125 мкл 100 мкМ праймера mTARM F, 0,125 мкл 100 мкМ праймера mTARM R, 2,5 мкл матричной кДНК (10-кратное разведение) и 7,25 мкл дистиллированной воды). Для такой PCR, после обработки при 94°C в течение 10 минут, реакционный цикл, состоящий из 94°C-30 секунд и 60°C-1 минута, повторяли 35 раз. В результате обнаружили, что mTARM экспрессировался в почках.
Таким образом, с использованием суммарной РНК из почек осуществляли 5'-RACE (быстрая амплификация концов кДНК) и З'-RACE в попытке определить последовательность полноразмерного гена mTARM.
Сначала двухцепочечную кДНК синтезировали, исходя из суммарной РНК почки мыши, с использованием набора для синтеза кДНК (TAKARA), и кДНК затем очищали с использованием набора для очистки продуктов PCR Qiaquick (QIAGEN). Затем к ней добавляли адаптер ad29 (продукт, полученный отжигом ad29S (acatcactccgt; SEQ ID № 19) и ad29A (acggagtgatgtccgtcgacgtatctctgcgttgatacttcagcgtagct; SEQ ID № 20)) для того, чтобы получить матрицу для RACE.
1-ую PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера ExTaq, 4 мкл 2,5 мМ dNTP, 0,25 мкл ExTaq, 0,5 мкл 100 мкМ праймера (5'PCR4), 0,5 мкл 100 мкМ геноспецифического праймера, 1 мкл кДНК с добавленным адаптером ad29 (25-кратное разведение) и 38,75 мкл дистиллированной воды).
mTARM_RACE_5'_4: CTTCTGGCACTGCAGAGTCACCCT (SEQ ID №: 22), или
mTARM_RACE_3'_4: GGAGAGTACACCTGTGAATACTAC (SEQ ID №: 23)
Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-1 минута и 72°C-5 минут, повторяли 30 раз. В заключение реакцию осуществляли при 72°C в течение 5 минут.
2-ую PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера ExTaq, 4 мкл 2,5 мМ dNTP, 0,25 мкл ExTaq, 0,5 мкл 100 мкМ праймера (5'PCR1), 0,5 мкл 100 мкМ геноспецифического праймера, 1 мкл продукта 1-ой PCR (100-кратное разведение) и 38,75 мкл дистиллированной воды).
Следующие последовательности использовали в качестве праймеров.
5'PCR1: GTATCAACGCAGAGATACGTCGACGG (SEQ ID №: 24) mTARM_RACE_5'_3: TCCACCTGCGGTCACTGTACCCCT (SEQ ID №: 25), или
mTARM_RACE_3'_3: CTACAGAAAAGCATCCCCCCACATCCTTTC (SEQ ID №: 26)
Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 25 раз. В заключение реакцию осуществляли при 72°C в течение 5 минут. Амплифицированный фрагмент кДНК клонировали в pCR2.1 (Invitrogen), и его нуклеотидную последовательность определяли с использованием анализатора последовательностей ABI3100 (Applied Biosystems).
В результате 2 типа кДНК получены в 5'RACE, и 3 типа кДНК получены в 3'RACE и, таким образом, выяснено наличие сплайсинг-изоформ.
Праймеры для амплификации сплайсинг-изоформ сконструировали с использованием информации о нуклеотидной последовательности, полученной посредством RACE. Двухцепочечную кДНК синтезировали, исходя из суммарной РНК костного мозга мыши, с использованием набора для синтеза кДНК (TAKARA), и кДНК затем очищали с использованием набора для очистки продуктов PCR Qiaquick (QIAGEN). PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера ExTaq, 4 мкл 2,5 мМ dNTP, 0,25 мкл ExTaq, 0,5 мкл 100 мкМ 5'-праймера, 0,5 мкл 100 мкМ 3'-праймера, 1 мкл кДНК (25-кратное разведение) и 38,75 мкл дистиллированной воды).
Следующие последовательности использовали в качестве праймеров.
mTARM_5'UTR: GCTGATAGTAGACCTGCTGAAGAC (SEQ ID №:27)
mTARM_3'UTR-l: GTCCAGATATGTCCAGGCCTCTG (SEQ ID №: 28), или
mTARM_3'UTR-2: TTCAGTTATTTTACCAGGGTTTA (SEQ ID №: 29)
Для PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 35 раз. В заключение реакцию осуществляли при 72°C в течение 5 минут. 6 типов сплайсинг-изоформ можно подтвердить с помощью 2 типов праймеров. В результате, продукты амплификации получены в 5 типах из 6 сочетаний гипотетических сплайсинг-изоформ. Амплифицированный фрагмент кДНК клонировали в pCR2.1 (Invitrogen), и его нуклеотидную последовательность определяли с использованием анализатора последовательностей ABI3100.
В результате выявлено, что присутствуют сплайсинг-изоформы, кодирующие 4 типа мембраносвязанных генов TARM (m1, m2, m3 и m4) и один тип гена TARM секреторного типа (s1) (фиг.1).
(2) Анализ экспрессии генов mTARM
Анализировали экспрессию генов mTARM в нормальных тканях мыши. Как описано выше, вследствие присутствия сплайсинг-изоформ сконструированы 3 типа наборов праймеров.
Набор 1 (Праймеры сконструировали так, что с их помощью можно специфически амплифицировать изоформы m1 и m2.)
mTARM_qF2: TCTGTGATAGACAACCATCT (SEQ ID №: 30)
mTARM_qR2: GTCATTGTACCCGGGGTCTT (SEQ ID №: 31)
Набор 2 (Праймеры сконструировали так, что с их помощью можно специфически амплифицировать изоформы m3 и m4.)
mTARM_qF4: ATGACAGAAGGCTACACTGTGGATAA (SEQ ID №: 32)
mTARM_qR3: TCATTTTTCTCCTGGGGCAC (SEQ ID №: 33)
Набор 3 (Праймеры сконструировали так, что с их помощью можно специфически амплифицировать изоформу s1.)
mTARM_qF3: GATCTCTGTGATAGATGCAAG (SEQ ID №: 34)
mTARM_qR2: GTCATTGTACCCGGGGTCTT (SEQ ID №: 35)
С использованием набора для PCR РНК (TAKARA) одноцепочечную кДНК синтезировали, исходя из суммарной РНК, полученной из каждого органа мыши, с использованием мининабора RNeasy (QIAGEN), или исходя из коммерческой суммарной РНК из каждого органа (Promega). Используя таким образом синтезированную одноцепочечную кДНК в качестве матрицы, PCR в реальном времени осуществляли с использованием ABI7700. PCR осуществляли с использованием реакционного раствора следующего состава (12,5 мкл QuantiTect SYBR GreenPCR Master Mix (QIAGEN), 0,25 мкл урацил-ДНК-гликозилазы (Invitrogen), 0,125 мкл 100 мкМ F-праймера, 0,125 мкл 100 мкМ R-праймера, 2,5 мкл матричной кДНК (10-кратное разведение) и 7,25 мкл дистиллированной воды).
Для такой PCR, после обработки при 94°C в течение 10 минут, реакционный цикл, состоящий из 94°C-30 секунд и 60°C-1 минута, повторяли 35 раз.
В результате обнаружено, что mTARM сильно экспрессируется в костном мозге (фиг.2).
Затем анализировали экспрессию mTARM в различных типах клеток.
С использованием мининабора RNeasy (QIAGEN) суммарную РНК получали из каждых типов клеток, выделенных и очищенных из селезенки мыши, клеток, культивируемых in vitro, и из различных типов клеточных линий. Далее одноцепочечную кДНК синтезировали, исходя из суммарной РНК, с использованием набора для PCR РНК (TAKARA). Используя одноцепочечную кДНК в качестве матрицы, PCR в реальном времени осуществляли с использованием ABI7700 так же, как и PCR для анализа экспрессии в нормальных тканях мыши.
В результате обнаружено, что mTARM сильно экспрессируется в дендритных клетках, происходящих из костного мозга (фиг.3).
[Пример 2] Получение антител против TARM мыши и анализ экспрессии
(1) Получение клеток, экспрессирующих mTARM
Вектор для экспрессии гена mTARM получали, как указано далее.
Праймеры сконструировали на основе нуклеотидной последовательности изоформы m1.
mTARM F2: cgcgtcgacgccaccATGATCTCTAGGCTCCTTTCCCTT (SEQ ID №: 36)
mTARM R2: gcgggcggccgcTTACCAGGGTTTATTTGGAGACAG (SEQ ID №: 37)
С использованием набора для PCR РНК (TAKARA) одноцепочечную кДНК синтезировали, исходя из суммарной РНК костного мозга. Таким образом, синтезированную одноцепочечную кДНК использовали в качестве матрицы. PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера, 4 мкл 2,5 мМ dNTP, 0,5 мкл полимеразы Pyrobest (TAKARA), 0,5 мкл каждого из 100 мкМ праймеров, 1 мкл кДНК, 2,5 мкл DMSO и 36 мкл дистиллированной воды). Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 35 раз. В заключение реакцию осуществляли при 72°C в течение 2 минут. Амплифицированную кДНК клонировали в pBlueScriptII SK(+) (Stratagene), и его нуклеотидную последовательность затем подтверждали с использованием анализатора последовательностей ABI3100. Полученный фрагмент кДНК вставляли в экспрессирующий вектор pMXII IRES EGFP (Oncogene (2000) 19(27):3050-3058) так, чтобы получить экспрессирующий вектор для гена mTARM.
Рекомбинантный ретровирус получали, как указано далее.
3×106 клеток 293/EBNA-1 (Invitrogen) суспендировали в среде (D-MEM/10% FBS), помещали на 10-см чашку и затем культивировали в термостате с CO2 в течение 24 часов. На следующие сутки среду заменяли на свежую, и раствор для трансфекции, полученный, как описано ниже, затем добавляли к среде, чтобы осуществить трансфекцию. Раствор для трансфекции получали добавлением 600 мкл OPTI-MEM (GIBCO BRL) и 24 мкл TransIT LT1 (TaKaRa) в 5 мл пробирку для их смешивания, затем инкубируя смесь при комнатной температуре в течение 5 минут и затем добавляя 9 мкг экспрессирующего вектора и 9 мкг pCL-Eco (Imgenex), используемого в качестве упаковывающего вектора, к реакционной смеси с последующей инкубацией смеси при комнатной температуре в течение 5 минут. 48 часов спустя отбирали супернатант культуры и затем, чтобы получить раствор рекомбинантного вируса, осуществляли фильтрацию через 0,45 мкм фильтр.
Чтобы получить клетки, экспрессирующие mTARM, клетки B300.19 (EMBO J. (1984) 3:1209-1219) инфицировали этим рекомбинантным вирусом, как описано ниже. 1×106 клеток B300.19 добавляли в 15 мл пробирку, и их затем центрифугировали при 1200 об/мин при 25°C в течение 5 минут. Далее супернатант культуры удаляли отсасыванием. Раствор, полученный добавлением смеси 2 мкл полибрена (10 мг/мл) и 2 мкл 55 мкМ 2-меркаптоэтанола к 2 мл раствора рекомбинантного вируса, добавляли к клеткам. Полученную смесь затем центрифугировали при 2500 об/мин при 30°C в течение 2 часов для того, чтобы инфицировать клетки рекомбинантным вирусом. После окончания инфицирования раствор рекомбинантного вируса удаляли и туда добавляли среду (RPMI-1640/10% FBS/55 мкМ 2-меркаптоэтанола) с последующим культивированием. Чтобы получить клетки, экспрессирующие mTARM, EGFP-положительные клетки выделяли с помощью сортировки клеток.
(2) Получение химерного белка слиянием внеклеточной области mTARM с SEAP или Fc
Сначала получали вектор pcDNA3.1(+)-SEAP(His)10-Neo, как указано далее.
Для удаления эндогенного участка SalI вектора pcDNA3.1(+)-Neo (Invitrogen) его расщепляли SalI с последующим получением тупых концов и повторным лигированием. Фрагмент кДНК SEAP(His)10 амплифицировали посредством PCR с использованием pDREF-SEAP His6-Hyg (J. Biol. Chem., 1996, 271, 21514-21521) в качестве матрицы, и также с использованием 5'-праймера с добавленным участком для HindIII и 3'-праймера с добавленным участком для XhoI. Полученный фрагмент кДНК расщепляли HindIII и XhoI и затем его вставляли в вектор pcDNA3.1(+)-Neo, в котором удален участок SalI.
Затем внеклеточную область mTARM амплифицировали посредством PCR с использованием полноразмерной кДНК mTARM в качестве матрицы, и также с использованием 5'-праймера с добавленным участком для SalI (mTARM_F2: (SEQ ID № 36)) и 3'-праймера с добавленным участком для NotI (mTARM_R3: cgcggcggccgcattatccacagtgtagccttctgtcat (SEQ ID № 38)). PCR осуществляли в реакционном растворе следующего состава (5 мкл 10×буфера, 4 мкл 2,5 мМ dNTP, 0,5 мкл полимеразы Pyrobest (TAKARA), 0,5 мкл каждого из 100 мкМ праймеров, 1 мкл кДНК, 2,5 мкл DMSO и 36 мкл дистиллированной воды). Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 35 раз. В заключение реакцию осуществляли при 72°C в течение 2 минут. Амплифицированную кДНК клонировали в pBlueScriptII SK(+) (Stratagene), и его нуклеотидную последовательность затем определяли с использованием анализатора последовательностей ABI3100. Полученный фрагмент кДНК расщепляли SalI и NotI и затем вставляли в вышеупомянутый экспрессирующий вектор pcDNA3.1(+)-SEAP(His)10-Neo, чтобы получить вектор для экспрессии mTARM-AP.
Таким образом, осуществили слияние внеклеточной области mTARM посредством 3-аминокислотного линкера (Ala-Ala-Ala) с щелочной фосфатазой плаценты человека секреторного типа, обладающей 10-гистидиновой меткой (His)10 на своем C-конце, для экспрессии в качестве секреторного химерного белка (в дальнейшем обозначаемого как химерный белок AP). Полученный вектор для экспрессии химерного белка AP вводили в клетки 293/EBNA-1 с использованием TransIT LT1 (TAKARA), и их затем культивировали в течение 4 или 5 суток. Далее супернатант культуры отбирали центрифугированием, и химерный белок AP, секретируемый в супернатант, затем фильтровали через 0,22 мкм фильтр. Далее к нему добавляли Hepes (pH 7,4) и азид натрия до конечных концентраций 20 мМ и 0,02% соответственно, и полученный продукт хранили при 4°C. Концентрацию химерного белка AP вычисляли измерением активности щелочной фосфатазы с использованием хемилюминесцентного анализа репортерного гена Aurora AP (ICN).
(3) Получение моноклональных антител против mTARM
Для использования в качестве антигена в иммунизации сначала очищали химерный белок mTARM-AP.
Такую очистку осуществляли с использованием гистидиновой метки, присутствующей на C-конце химерного белка AP, и с использованием набора His Trap (Amersham Biosciences). Супернатант культуры, содержащий химерный белок mTARM-AP, добавляли к 1 мл хелатной HP-колонки HiTrap (Amersham Biosciences) с последующей промывкой раствором 10 мМ имидазола. Далее химерный белок mTARM-AP элюировали с колонки с использованием раствора 500 мМ имидазола. Концентрацию химерного белка mTARM-AP вычисляли измерением ферментативной активности с использованием хемилюминесцентного анализа репортерного гена Aurora AP (ICN) и с помощью количественного определения белка с использованием набора Protein Assay II (BIO-RAD).
Полученный химерный белок mTARM-AP смешивали с TiterMax и затем иммунизировали им крыс WKY (Japan SLC, Inc.). Из таким образом иммунизированных крыс выделяли лимфоциты. Лимфоциты смешивали с миеломными клетками P3 (ATCC) так, что отношение миеломных клеток P3 к лимфоцитам становилось 1:5. Далее слияние клеток осуществляли с использованием раствора PEG1500 (Boehringer). Гибридомы селектировали в среде HAT (Invitrogen), и супернатант культуры полученных гибридом подвергали скринингу с помощью сандвич-ELISA с использованием химерного белка mTARM-Fc. Осуществляли клонирование и из положительных лунок получили 3 типа клонов (№ 6, № 21 и № 37). Клеткам B300.19, в которые вводили mTARM-IRES-EGFP, давали возможность взаимодействовать с антителами к mTARM с последующим анализом FACS. В результате полученные антитела взаимодействовали только с клетками B300.19, в которых экспрессировался EGFP (фиг.4B), и это подтвердило, таким образом, специфичность антител к mTARM.
Гибридомы, продуцирующие полученные моноклональные антитела анти-mTARM № 6, № 21 и № 37, инокулировали в перитонеальную полость «голых» мышей, и затем получали асцитическую жидкость. Далее антитела очищали с использованием колонки с G-белком. Гибридому, продуцирующую моноклональные антитела анти-mTARM № 6, депонировали в National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary под инвентарным № FERM BP-10376.
(4) Экспрессия белка TARM на культивируемых дендритных клетках, происходящих из костного мозга
С использованием полученных моноклональных антител (mAb) анализировали экспрессию белка TARM на клеточных поверхностях культивируемых дендритных клеток, происходящих из костного мозга.
Такие культивируемые дендритные клетки, происходящие из костного мозга, получали следующим способом. Костномозговые клетки самцов мышей C57BL/6 (Japan SLC, Inc.) суспендировали в среде (RPMI1640/10% FBS/1 мМ пирувата натрия/55 мкМ 2-меркаптоэтанола), которая содержала GM-CSF мыши (20 нг/мл) (R & D system), в концентрации 2×106 клеток/10 мл. Клетки помещали в 10-см непокрытые чашки и затем культивировали. 3 суток спустя добавляли 10 мл среды, которая содержала GM-CSF мыши (20 нг/мл), и далее продолжали культивирование. Далее 3 суток спустя 10 мл культурального раствора отбирали и затем центрифугировали. Далее скопления клеток суспендировали в 10 мл свежей среды, которая содержала GM-CSF мыши (20 нг/мл), и полученную суспензию затем возвращали в исходные непокрытые 10-см чашки с последующим культивированием в течение 2 суток. Таким образом полученные незрелые дендритные клетки суспендировали в среде, которая содержала LPS (100 нг/мл) (Sigma), в концентрации 1×107 клеток/10 мл. Чтобы получить зрелые дендритные клетки, клетки помещали в 10-см чашки и затем культивировали в течение 1 суток.
Незрелые дендритные клетки, происходящие из костного мозга, суспендировали в буфере для FACS (PBS/1% FBS/1 мМ EDTA), который содержал 5% мышиной сыворотки, и осуществляли их взаимодействие с антителами № 6 или антителами № 21 (10 мкг/мл). Далее клетки инкубировали с PE-меченными ослиными вторичными антителами против IgG крысы (Jackson), с последующим измерением на FACSCalibur (BectonDickinson). В результате как антитела № 6, так и антитела № 21 обладали положительными реакциями, которые оказались сильнее, чем реакции, полученные с помощью IgG крысы, использованного в качестве отрицательного контроля.
Таким образом, чтобы подробно анализировать клетки, экспрессирующие mTARM, антитела № 6 флуоресцентно метили набором для мечения моноклональными антителами Alex647 (Molecular Probe). Затем незрелые дендритные клетки или зрелые дендритные клетки, полученные стимуляцией LPS, суспендировали в буфере для FACS (PBS/1% FBS/1 мМ EDTA), который содержал 5% мышиной сыворотки и 5% крысиной сыворотки. Раствор для забивки FcR (BD Pharmingen) добавляли к суспензии и инкубировали на льду в течение 10 минут. Далее реакционную смесь подвергали реакции на льду в течение 30 минут с флуоресцентно-меченными антителами к mTARM, антителами к маркеру CD11c на дендритных клетках и антителами к маркеру активации CD40, и уровень экспрессии белка mTARM затем измеряли с использованием FACSCalibur.
В результате выявлено, что белок mTARM экспрессируется как в незрелых, так и в зрелых дендритных клетках, что экспрессия белка mTARM усиливается скорее в зрелых дендритных клетках из костного мозга, чем в незрелых дендритных клетках, и что белок mTARM сильно экспрессируется на клетках, в которых экспрессируется маркер активации CD40 (фиг.5).
(5) Экспрессия белка TARM у нормальных мышей
Поскольку экспрессия mTARM была подтверждена в дендритных клетках, происходящих из костного мозга, анализировали экспрессию белка mTARM в иммунных тканях нормальных мышей.
Клетки получали из костного мозга, периферической крови, селезенки, брыжеечного лимфатического узла и пейеровой бляшки самцов мышей C57BL/6. Таким образом полученные клетки суспендировали в буфере для FACS (PBS/1% FBS/1 мМ EDTA), который содержал 5% мышиной сыворотки и 5% крысиной сыворотки. Раствор для забивки FcR добавляли к суспензии и инкубировали на льду в течение 10 минут. Далее реакционную смесь подвергали реакции на льду в течение 30 минут с флуоресцентно-меченными антителами к mTARM и различными типами флуоресцентно-меченных антител к маркерам линий клеток, и уровень экспрессии белка mTARM затем измеряли с использованием FACSCalibur.
В результате в иммунных тканях нормальных мышей экспрессию белка mTARM не наблюдали во всех T-клетках CD3+, NK-клетках DX5+, миелоидных клетках CD11b+ и дендритных клетках CD11c+ в селезенке (SP), и В-клетках B220+, моноцитах/макрофагах F4/80+, нейтрофилах Grl+ с высоким SSC и эозинофилах F4/80+ с высоким SSC в периферической крови (PBL) (фиг.6).
Таким образом, экспрессию белка mTARM в периферических тканях нормальных мышей анализировали с использованием клеток, полученных из перитонеальной полости мышей.
В результате экспрессию белка mTARM не наблюдали в T-клетках CD3+, NK-клетках DX5+, дендритных клетках CD11c+, В-клетках B220+, моноцитах/макрофагах F4/80+ и нейтрофилах Grl+ с высоким SSC из перитонеальной полости. Однако такую экспрессию наблюдали у части миелоидных клеток CD11b+. Таким образом, осуществляли дальнейший анализ. В результате выявлено, что белок mTARM экспрессируется на тучных клетках c-kit+ (фиг.7).
(6) Индукция экспрессии белка TARM на дендритных клетках при воспалительной стимуляции LPS
Белок mTARM экспрессировался на культивируемых дендритных клетках, но такую экспрессию белка mTARM не наблюдали на дендритных клетках, полученных из лимфоидных и периферических тканей мышей. Таким образом, предположили, что экспрессия белка mTARM индуцируется воспалительной стимуляцией in vivo. Таким образом, самцам мышей C57BL/6 вводили 100 мкг LPS внутрибрюшинно. 14-18 часов спустя клетки отбирали из брыжеечного лимфатического узла и затем анализировали экспрессию белка mTARM.
В результате экспрессию белка mTARM наблюдали на миелоидных дендритных клетках CD11c+/CD11b+, которые мигрировали в брыжеечный лимфатический узел при воспалительной стимуляции LPS (фиг.8). Соответственно, выявлено, что белок mTARM не экспрессируется на клеточной поверхности дендритных клеток in vivo в нормальных условиях, но что он избирательно экспрессируется на дендритных клетках, и, в частности, на миелоидных дендритных клетках в ходе воспаления. Таким образом, сделано предположение, что белок mTARM функционирует на дендритных клетках в ходе воспаления.
[Пример 3] Активация культивируемых дендритных клеток костномозгового происхождения антителами анти-TARM
mTARM избирательно экспрессируется на дендритных клетках. Таким образом, анализировали активацию таких дендритных клеток перекрестной стимуляцией mTARM.
Незрелые дендритные клетки или зрелые дендритные клетки костномозгового происхождения суспендировали в концентрации 1×108клеток в 350 мкл буфера для MACS (PBS/1% FBS/2 мМ EDTA). 50 мкл раствора для забивки FcR (Miltenyi) добавляли к суспензии и инкубировали при 4°C в течение 10 минут. Далее 100 мкл микробус с CD11c (Miltenyi) добавляли к реакционной смеси и инкубировали при 4°C в течение 30 минут. Далее клетки CD11c+ выделяли и очищали с использованием Auto MACS (Miltenyi). Антитела F(ab)'2 к IgG крысы (10 мкг/мл) (Jackson) иммобилизовали на 96-луночном планшете при 37°C в течение 2 часов, и планшет затем промывали PBS. Далее антитела к mTARM № 6, № 21 или IgG крысы (10 мкг/мл), используемые в качестве отрицательного контроля, иммобилизовали на планшете при 37°C в течение 1 часа. Планшет затем промывали PBS, и очищенные дендритные клетки CD11c+ культивировали в среде, или в среде, которая содержала агонистические антитела анти-CD40 (BD Pharmingen) в конечной концентрации 2 мкг/мл. 24 или 48 часов спустя супернатант культуры отбирали, и цитокины затем детектировали с использованием набора DuoSet ELISA Development (R & D).
В результате выявлено, что антитела к mTARM индуцируют продукцию IL-6 зрелыми дендритными клетками костномозгового происхождения на уровне, сходном с уровнем антител анти-CD40, и обладали аддитивным эффектом с антителами анти-CD40 (фиг.9A). Сходным образом, вышеупомянутые антитела обладали тенденцией индуцировать продукцию IL-6 также у незрелых дендритных клеток. Более того, антитела анти-mTARM индуцировали продукцию MCP-1 незрелыми дендритными клетками из костного мозга, но антитела анти-CD40 не индуцировали такую продукцию MCP-1 (фиг.9B). Индукцию продукции MCP-1 антителами к mTARM не наблюдали в зрелых дендритных клетках из костного мозга. Более того, также анализировали индукцию продукции IL-12, TNFα, IL-1β, IL-10 и КС, но антитела анти-mTARM не обладали значимыми эффектами как на незрелые дендритные клетки, так и зрелые дендритные клетки.
Исходя из вышеизложенных результатов подтверждено, что mTARM на дендритных клетках связан с продукцией специфических цитокинов и хемокинов (например, IL-6 и MCP-1).
[Пример 4] Образование комплекса между TARM и цепью FcRγ
Выявлено, что mTARM функционирует в качестве рецептора, активирующего дендритные клетки. Далее исследовали молекулу, передающую сигнал. mTARM обладает трансмембранной областью, сходной с трансмембранной областью Oscar, который принимает участие в дифференцировке остеокластов. Известно, что Oscar образует комплекс с цепью FcRγ, передающей сигнал молекулой, хорошо известной в качестве компонента рецептора IgE. Это позволило предположить, что взаимодействие между основной аминокислотой в клеточной трансмембранной области Oscar и кислой аминокислотой цепи FcRγ принимает участие в вышеупомянутой ассоциации. mTARM также содержит основную аминокислоту в своей трансмембранной области. С другой стороны, DAP10 и DAP12 известны в качестве молекул, передающих сигнал активации, обладающих кислой аминокислотой в своей трансмембранной области, как и цепь FcRγ. Таким образом, анализировали возможность образования комплекса между цепью FcRγ, DAP10 или DAP12 и mTARM.
Каждый из экспрессирующих векторов для цепи FcRγ, DAP10 и DAP12 получали вставкой фрагмента кДНК, амплифицированного с использованием следующих праймеров, сконструированных на основе нуклеотидных последовательностей, которые представлены в виде NM_010185, AF072846 и NM_011662 в GenBank™, в экспрессирующий вектор pMXII IRES-Puro, сконструированный так, что последовательность метки Flag, присоединенная на N-конце, может экспрессироваться на клеточной поверхности.
FcR
FcR
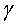
DAP10 F: cgcgtcgacCAGACATCGGCAGGTTCCTGCTCC (SEQ ID №: 41)
DAP10 R: gcgggcggccgcTCAGCCTCTGCCAGGCATGTTGAT (SEQ ID №: 42)
DAP12 F: cgcgtcgacTTAAGTCCCGTACAGGCCCAGAGT (SEQ ID №: 43)
DAP12 R: gcgggcggccgcTCATCTGTAATATTGCCTCTGTGT (SEQ ID №: 44)
Далее рекомбинантный ретровирус получали способом, сходным с тем, который использовали для получения клеток, экспрессирующих mTARM, и клетки B300.19, экспрессирующие mTARM, затем инфицировали рекомбинантным ретровирусом. Далее клетки культивировали в присутствии пуромицина и затем отбирали инфицированные клетки. Полученные трансфектанты B300.19 суспендировали в буфере для FACS (PBS/1% FBS/1 мМ EDTA) и подвергали взаимодействию с антителами № 6 и мышиными антителами анти-Flag (Sigma) в конечной концентрации 10 мкг/мл. Далее их подвергали взаимодействию с PE-меченными ослиными вторичными антителами к IgG крысы (Jackson) и Cy5-меченными ослиными вторичными антителами к IgG мыши (Jackson) с последующим измерением уровня экспрессии с использованием FACSCalibur (Becton Dickinson).
В результате выявлено, что если mTARM и цепь FcRγ одновременно экспрессируются, то повышается уровень экспрессии цепи FcRγ на клеточной поверхности при повышении уровня экспрессии mTARM на клеточной поверхности. Уровни экспрессии DAP10 и DAP12 на клеточной поверхности не зависели от уровня экспрессии mTARM. Соответственно это позволило предположить, что уровень экспрессии цепи FcRγ на клеточной поверхности повышается при образовании ею комплекса с mTARM (фиг.10).
Затем mTARM-связыващие белки анализировали биохимически.
Трансфектанты B300.19 суспендировали в буфере для лизиса клеток, содержащем 1% дигитонина (1% дигитонин/50 мМ Tris-HCl (pH 7,5)/150 мМ NaCl/5 мМ NaF/1 мМ ортованадата/Complete™ (Roche)). Иммунопреципитацию осуществляли с использованием антител анти-Flag, и анализ с помощью иммуноблоттинга затем осуществляли с использованием антител к mTARM № 6.
В результате обнаружено, что mTARM иммунопреципитировал совместно с цепью FcRγ, но ни DAP10, ни DAP12 не иммунопреципитировали совместно с mTARM (фиг.11A). Иммунопреципитацию цепи FcRγ, DAP10 и DAP12 антителами анти-Flag подтвердили анализом с помощью иммуноблоттинга с антителами анти-Flag. Кроме того, экспрессию mTARM, меченных посредством Flag цепи FcRγ, DAP10 и DAP12 в трансфектантах B300.19, подтвердили анализом с помощью иммуноблоттинга лизатов клеток с использованием антител к mTARM № 6 или антител анти-Flag. Соответственно выявлено, что цепь FcRγ образует комплекс с mTARM в трансфектантах B300.19.
Более того, зрелые дендритные клетки костномозгового происхождения суспендировали в буфере для лизиса клеток, содержащем 1% дигитонин. Иммунопреципитацию осуществляли с использованием IgG крысы в качестве отрицательного контроля, антител к mTARM № 21, антител анти-CD54 и антител к цепи FcRγ, и анализ с помощью иммуноблоттинга затем осуществляли с использованием антител к цепи FcRγ.
В результате обнаружено, что цепь FcRγ иммунопреципитировала совместно с mTARM и что другой белок клеточной мембраны CD54 и цепь FcRγ не со-иммунопреципитировали (фиг.11B). Соответственно выявлено, что цепь FcRγ и mTARM образуют комплекс в зрелых дендритных клетках.
Эти результаты позволили предположить, что активация дендритных клеток перекрестной стимуляцией с помощью mTARM опосредована передачей сигнала от цепи FcRγ.
[Пример 5] Адгезия активированных лимфоцитов к иммобилизованному TARM
(1) Экспрессия mTARM-связывающих молекул на активированных T-клетках
Известно, что дендритные клетки действуют в качестве антигенпрезентирующих клеток и взаимодействуют с T-клетками. Таким образом, можно предположить, что молекулы, которые связываются с mTARM, экспрессируются на T-клетках и что активация дендритных клеток регулируется посредством таких молекул. Соответственно анализировали наличие или отсутствие mTARM-связыващих молекул на T-клетках.
4×107 клеток селезенки самцов мышей C57BL/6 суспендировали в 70 мкл буфера для MACS (PBS/1% FBS/2 мМ EDTA), и 10 мкл раствора для забивки FcR (Miltenyi) добавляли к суспензии. Смесь затем инкубировали при 4°C в течение 10 минут. 100 мкл микробус CD4 (Miltenyi) затем добавляли к реакционной смеси и инкубировали при 4°C в течение 15 минут. Далее Auto MACS использовали для получения покоящихся T-клеток CD4+. Клетки CD4+, которые очищали посредством MACS, суспендировали в среде (RPMI1640/10% FBS/1 мМ пирувата натрия/55 мкМ 2-меркаптоэтанола) в концентрации 1×106 клеток/мл. Далее суспензию добавляли к планшету, на котором иммобилизовали антитела анти-CD3 (eBioscience) в растворе 1 мкг/мл при 37°C в течение 2 часов и стимулировали в присутствии 2 мкг/мл антител анти-CD28 (Pharmingen). Если T-клетки CD4+ дифференцировались в Th1, то такую стимуляцию антителами анти-CD3 осуществляли в присутствии IL-12 мыши (10 нг/мл) (Peprotech) и антител к IL-4 мыши (10 мкг/мл) (MP4-25D2; Pharmingen). Если T-клетки CD4+ дифференцировались в Th2, то такую стимуляцию антителами анти-CD3 осуществляли в присутствии IL-4 мыши (15 нг/мл) (Genzyme) и антител к IL-12 мыши (15 мкг/мл) (24910.1; Pharmingen). Двое суток после стимуляции, в случае Th1, добавляли IL-2 мыши (20 нг/мл) (Genzyme) и IL-12 мыши (10 нг/мл) с последующим культивированием. В случае Th2 добавляли IL-2 мыши (20 нг/мл) и IL-4 мыши (15 нг/мл) с последующим культивированием. Дифференцировку в Th1 и Th2 подтверждали продукцией IFN-γ и IL-4 соответственно.
Покоящиеся T-клетки CD4+ сразу после очистки посредством MACS и активированные T-клетки CD4+ на 2 и 8 сутки после стимуляции посредством CD3 использовали для анализа активности связывания химерного белка mTARM-AP на клеточной поверхности. Эти клетки суспендировали в буфере для FACS (PBS/1% FBS) и подвергали взаимодействию на льду в течение 30 минут с химерным белком mTARM-AP или белком AP, используемым в качестве отрицательного контроля, в конечной концентрации 30 мкг/мл. Далее добавляли кроличьи антитела анти-PLAP (6000-кратное разведение) (COSMO BIO Co., Ltd.) и затем осуществляли взаимодействие с ними на льду в течение 30 минут. Далее добавляли PE-меченные ослиные антитела к IgG кролика (H + L) (50-кратное разведение) (Jackson) и затем осуществляли взаимодействие с ними на льду в течение 30 минут. Активность связывания химерного белка mTARM-AP измеряли с использованием FACSCalibur.
В результате выявлено, что mTARM-связыващие молекулы не экспрессируются на покоящихся T-клетках CD4+, но что такая экспрессия индуцируется в активированных T-клетках CD4+ (фиг.12). mTARM-связывающие молекулы, которые уже экспрессировались 2 суток после их стимуляции и экспрессии, также сохранялись 8 суток после стимуляции. Такие mTARM-связывающие молекулы экспрессировались в условиях дифференцировки как Th1, так и Th2. 8 суток спустя экспрессия mTARM-связывающей молекулы в Th2-клетках обладала тенденцией превышать эту экспрессию в Th1-клетках (фиг.12).
(2) Адгезия активированных T-клеток к рекомбинантному белку mTARM
Далее анализировали возможность функционирования mTARM в качестве молекулы адгезии на активированных T-клетках.
Сначала 50 мкл антител против щелочной фосфатазы (10 мкг/мл) (Seradyn) добавляли к каждой лунке 96-луночного планшета для ELISA (Nunc) и инкубировали при 37°C в течение 30 минут для иммобилизации. После промывки PBS неспецифические участки связывания забивали посредством Block Ace (Dainippon Pharma Co., Ltd.). Химерный белок AP (10 нМ) добавляли к каждой лунке и инкубировали при комнатной температуре в течение 30 минут для иммобилизации. Через 6-9 суток после стимуляции активированные T-клетки суспендировали в буфере для адгезии клеток (RPMI1640/0,5% BSA/20 мМ HEPES (pH 7,4)) с последующим флуоресцентным мечением посредством Calcein-AM (Dojindo Laboratories). Далее 1×105клеток добавляли к каждой лунке и инкубировали при 37°C в течение 1 часа. Неприкрепившиеся клетки удаляли промывкой и затем в лунки добавляли буфер для лизиса клеток (10 мМ Tris-HCl (pH 8,0)/1% TritonX-100). Далее измерение осуществляли при длине волны возбуждения 485 нм и длине волны детекции 535 нм с использованием Wallac ARVO SX 1420 MULTILABEL COUNTER (PerkinElmer), и затем количественно определяли прикрепившиеся клетки. Относительно уровня адгезии клеток отношение прикрепившихся клеток к добавленным клеткам выражали в виде процентной доли.
В результате выявлено, что mTARM функционирует в качестве молекулы адгезии на активированных T-клетках (фиг.13). Как Th1-, так и Th2-клетки обладают адгезивной активностью по отношению к mTARM. Адгезивная активность Th2-клеток по отношению к mTARM обладает тенденцией превышать активность Th1-клеток по отношению к mTARM.
[Пример 6] Активность по ингибированию адгезии клеток у антител анти-TARM
Анализировали эффект антител анти-TARM на клеточную адгезию Th2-клеток к mTARM.
10 мкг/мл антител к mTARM добавляли к Th2-клеткам и предварительно обрабатывали при комнатной температуре в течение 10 минут. Далее полученные клетки добавляли в планшет с иммобилизованным химерным белком mTARM-AP и анализировали активность клеточной адгезии в присутствии антител.
В результате адгезия Th2-клеток к химерному белку mTARM-AP в значительной степени подавлялась любыми из антител к mTARM № 6, № 21 и № 37 (фиг.14).
[Пример 7] Терапевтический эффект антител анти-TARM на модели индуцированного коллагеном артрита
Модель индуцированного коллагеном артрита (CIA) представляет собой модель заболевания аутоиммунного ревматоидного артрита. Так как детектируют T-клетки CD4+ и антитела, которые реагируют с коллагеном II типа, то предполагают, что и те и другие действуют совместно при вызывании артрита. Кроме того, сообщалось, что восприимчивость в модели CIA связана с молекулами MHC класса II. TARM является активирующей молекулой, которая экспрессируется на дендритных клетках и индуцирует клеточную адгезию активированных T-клеток посредством TARM-связывающих молекул. Соответственно предположили, что взаимодействие между такими дендритными клетками и активированными T-клетками ингибируется антителами анти-TARM, таким образом, возможно, супрессируя иммунный ответ, связанный с дендритными клетками или активированными T-клетками. Таким образом, анализировали терапевтический эффект антител анти-TARM на модели CIA.
3% раствор бычьего коллагена II типа суставного происхождения (Collagen Gijutsu Kenshukai) и полный адъювант Фрейнда (Difco) смешивали в равных количествах до получения эмульсии. Далее 100 мкл эмульсии (150 мкг/мышь) подкожно вводили в основание хвоста мыши DBA/1J в возрасте 5 недель (Charles River Laboratories Japan, Inc.) так, что мышь иммунизировали на 21 сутки (начальная иммунизация) и на 0 сутки (повторная иммунизация). После повторной иммунизации антитела к mTARM № 6 вводили внутривенно в дозировке 500 мкг два раза в неделю. Через 3 суток после повторной иммунизации осуществляли измерение массы тела и внешнюю оценку. На 13 сутки мышей забивали. Внешние показатели оценивали с использованием следующей шкалы. А именно, 0: нормальные; 1: эритема и легкая припухлость, ограниченная серединой стопы (предплюсна) или голеностопным суставом; 3: эритема и умеренная припухлость, простирающаяся от голеностопного до метатарзального сустава; 4: эритема и сильная припухлость на всей части, простирающаяся от голеностопного сустава, стопы и пальцев.
Следовательно, в результате введения антител к mTARM наблюдали отчетливое облегчение симптомов и задержку уменьшения массы тела (фиг.15).
Более того, гепаринизированную кровь отбирали из нижней полой вены забитых мышей и измеряли концентрацию в плазме сывороточного амилоида A (SAA) и титр антител к коллагену. SAA представляет собой белок плазмы, вырабатываемый клетками печени под действием цитокинов, образующихся при воспалительной стимуляции. Концентрацию SAA в плазме используют в качестве индикатора воспаления. Титр антител к коллагену используют в качестве индикатора антигенспецифического иммунного ответа.
Концентрацию SAA в плазме измеряли с помощью набора для ELISA (BioSource) с использованием плазмы, разведенной в 8000 раз.
Более того, титр антител к коллагену в плазме измеряли, как указано далее.
Сначала 50 мкл раствора 5 мкг/мл бычьего коллагена II типа суставного происхождения добавляли к каждой лунке 96-луночного планшета для ELISA (Nunc) и инкубировали при 4°C в течение ночи для иммобилизации. Далее лунки промывали T-PBS (0,02% твин-20/PBS), и участки неспецифического связывания забивали 1% BSA/PBS. Лунки промывали T-PBS 3 раза и 50 мкл плазмы, которую разводили в 100000 раз T-PBS, затем добавляли в каждую лунку с последующей инкубацией при комнатной температуре в течение 2 часов. Далее лунки промывали T-PBS 3 раза, и биотинилированные IgG1 против мыши (BD) и биотинилированные IgG2a против мыши (BD) по 50 мкл каждых, которые разводили в 1000 раз T-PBS, затем добавляли в каждую лунку с последующей инкубацией при комнатной температуре в течение 2 часов. Лунки промывали T-PBS 3 раза, и 50 мкл HRP-меченного стрептавидина (Pierce), который разводили в 5000 раз T-PBS, затем добавляли в каждую лунку с последующей инкубацией при комнатной температуре в течение 30 минут. Далее добавляли хромогенный субстрат, и развивалось окрашивание.
В результате концентрация SAA в плазме снижалась при введении антител к mTARM (фиг.16). Однако титр антител к коллагену в плазме не изменялся при введении антител к mTARM (фиг.17).
[Пример 8] Определение полноразмерной последовательности гена TARM человека
Чтобы идентифицировать ген TARM человека, поиск BLAST осуществляли с использованием последовательности гена TARM мыши. В результате обнаружена последовательность, обладающая высокой степенью гомологии с последовательностью кДНК TARM мыши (инвентарный № в GenBank XM_497642). Однако сигнальные последовательности отсутствуют в аминокислотной последовательности (LOC441864), кодируемой такой XM_497642, и, таким образом, это не позволяет предположить, что вышеупомянутая последовательность функционирует в качестве белка клеточной мембраны. Предположили, что XM_497642 представляет собой гипотетическую последовательность и что определение последовательности кДНК, исходя из геномной последовательности, является неправильным. Таким образом, приложены усилия для определения полноразмерной последовательности гена TARM человека. Идентифицировали ткани с экспрессией TARM и полноразмерную последовательность кДНК TARM определили осуществлением 5'- и З'-RACE. Соответственно на основе последовательности области, кодирующей белок TARM, сконструировали праймеры, и затем выделили полноразмерную кДНК.
(1) Анализ экспрессии гена TARM человека
Сначала анализировали экспрессию hTARM в тканях человека. Праймеры конструировали на основе инвентарного № GenBank XM_497642.
hTARM F1: TGTGAATACTACAGAAAAGCATCC (SEQ ID №: 45)
hTARM R1: TCCACCTGCGGTCACTGTACCCCT (SEQ ID №: 46)
Одноцепочечную кДНК синтезировали исходя из суммарной РНК каждого органа человека (Clontech), с использованием набора для PCR РНК (TAKARA). Используя такую одноцепочечную кДНК в качестве матрицы, PCR в реальном времени осуществляли с использованием ABI7700. PCR осуществляли с использованием реакционного раствора следующего состава (12,5 мкл QuantiTect SYBR Green PCR Master Mix (QIAGEN), 0,25 мкл урацил-ДНК-гликозилазы (Invitrogen), 0,125 мкл 100 мкМ F-праймера, 0,125 мкл 100 мкМ R-праймера, 2,5 мкл матричной кДНК (10-кратное разведение) и 7,25 мкл дистиллированной воды). Для такой PCR после обработки при 94°C в течение 10 минут, реакционный цикл, состоящий из 94°C-30 секунд и 60°C-1 минуты, повторяли 35 раз.
В результате обнаружено, что ген hTARM, как и в случае гена mTARM, сильно экспрессируется в костном мозге (фиг.18).
(2) Выделение гена TARM человека
Так как ген hTARM экспрессируется в костном мозге, то суммарную РНК костного мозга использовали для осуществления 5'-RACE и 3'-RACE, чтобы попытаться определить последовательность полноразмерного гена hTARM.
Сначала двухцепочечную кДНК синтезировали, исходя из суммарной РНК костного мозга, с использованием набора для синтеза кДНК (TAKARA), и кДНК затем очищали с использованием набора для очистки продуктов PCR Qiaquick (Qiagen). Затем туда добавляли адаптер ad29, и таким образом полученный продукт использовали в качестве матрицы для RACE. 1-ую PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера ExTaq, 4 мкл 2,5 мМ dNTP, 0,25 мкл ExTaq, 0,5 мкл 100 мкМ праймера (5'PCR4), 0,5 мкл 100 мкМ геноспецифического праймера, 1 мкл кДНК с добавленным адаптером ad29 (25-кратное разведение) и 38,75 мкл дистиллированной воды).
Следующие последовательности использовали в качестве праймеров.
5'PCR4: AGCTACGCTGAAGTATCAACGCAGAG (SEQ ID №: 21)
hTARM_RACE_5'_4: CTTCTGGCACTGCAGAGTCACCCT (SEQ ID №: 47), или
hTARM_RACE_3'_4: GGAGAGTACACCTGTGAATACTAC (SEQ ID №: 48)
Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-1 минута и 72°C-5 минут, повторяли 30 раз. В заключение, реакцию осуществляли при 72°C в течение 5 минут.
2-ую PCR осуществляли с использованием реакционного раствора следующего состава (5 мкл 10×буфера ExTaq, 4 мкл 2,5 мМ dNTP, 0,25 мкл ExTaq, 0,5 мкл 100 мкМ праймера (5'PCR1), 0,5 мкл 100 мкМ геноспецифического праймера, 1 мкл продукта 1-ой PCR (100-кратное разведение) и 38,75 мкл дистиллированной воды).
Следующие последовательности использовали в качестве праймеров.
5'PCRl: (SEQ ID №: 24),
h29B140 F1: TGTGAATACTACAGAAAAGCATCC (SEQ ID №: 49),
или
h29B140 R1: TCCACCTGCGGTCACTGTACCCCT (SEQ ID №: 50)
Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 25 раз. В заключение реакцию осуществляли при 72°C в течение 5 минут. Амплифицированный фрагмент кДНК клонировали в pCR2.1 (Invitrogen), и его нуклеотидную последовательность определяли с использованием анализатора последовательностей ABI3100.
В результате получили (SEQ ID № 9) 5'- и 3'-нуклеотидные последовательности, которые полностью отличались от последовательности, представленной как XM_497642.
Следующие праймеры сконструировали с использованием информации о нуклеотидной последовательности, полученной с помощью RACE:
h29B140_Sall-Kozac_F:
cgcgtcgacGCCACCATGATCCCTAAGCTGCTTTCCCTC (SEQ ID №: 51)
h29B140_NotI-R: cgcgcggccgcCTAGCGCATGCTACCCTTGGCAGC (SEQ ID №: 52)
С этих праймеров осуществляли PCR с использованием одноцепочечной кДНК в качестве матрицы, синтезированной, исходя из суммарной РНК костного мозга с использованием набора для PCR РНК (TAKARA). PCR осуществляли в реакционном растворе следующего состава (5 мкл 10×буфера, 4 мкл 2,5 мМ dNTP, 0,5 мкл полимеразы Pyrobest (TAKARA), 0,5 мкл каждого из 100 мкМ праймеров, 1 мкл кДНК, 2,5 мкл DMSO и 36 мкл дистиллированной воды). Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 35 раз. В заключение реакцию осуществляли при 72°C в течение 2 минут. Амплифицированную кДНК клонировали в pBlueScriptII SK(+) (Stratagene), и ее нуклеотидную последовательность затем определяли с использованием анализатора последовательностей ABI3100. Полученная нуклеотидная последовательность кДНК hTARM оказалась идентична последовательности, которую определили с помощью RACE (SEQ ID № 9). Аминокислотная последовательность (SEQ ID № 10), кодируемая кДНК hTARM, обладала сигнальной последовательностью на своем N-конце, которая необходима для ее функционирования в качестве белка клеточной мембраны. hTARC и аминокислотная последовательность, кодируемая XM_497642 (LOC441864), обладали разными N-концом и C-концом. Соответственно выявлено, что такая гипотетическая последовательность кДНК, XM_497642, предполагаемая, исходя из геномной последовательности, в действительности не существовала, и что кДНК hTARM оказалась действительным геном, кодирующим белок hTARM клеточной мембраны (фиг.19).
[Пример 9] Получение антител против TARM человека
(1) Получение клеток, экспрессирующих TARM человека
Вектор, экспрессирующий ген TARM человека, получали вставкой кДНК hTARM, полученной в примере 8, в экспрессирующий вектор pMXII IRES EGFP (Oncogene (2000) 19(27):3050-3058).
Рекомбинантный ретровирус получали, как указано далее.
Клетки 293/EBNA-1 (Invitrogen) в количестве 3×106 клеток суспендировали в среде (D-MEM/10% FBS) и помещали в 10-см культуральные чашки, и культивировали в термостате с CO2 в течение 24 часов. На следующие сутки среду заменяли на свежую, и затем туда, чтобы осуществить трансфекцию, добавляли раствор для трансфекции, полученный, как описано ниже. Раствор для трансфекции получали добавлением 600 мкл OPTI-MEM (GIBCO BRL) и 24 мкл TransIT LT1 (TaKaRa) в 5 мл пробирку для их смешивания, затем инкубировали смесь при комнатной температуре в течение 5 минут, и затем добавляли в реакционную смесь 9 мкг экспрессирующего вектора и 9 мкг pCL-Eco (Imgenex), используемого в качестве упаковывающего вектора, с последующей инкубацией смеси при комнатной температуре в течение 5 минут. 48 часов спустя супернатант культуры отбирали и, чтобы получить раствор рекомбинантного вируса, затем осуществляли фильтрацию через 0,45 мкм фильтр.
Чтобы получить клетки, экспрессирующие hTARM, клетки B300.19 инфицировали этим рекомбинантным вирусом, как описано ниже. 1×106 клеток B300.19 добавляли в 15 мл пробирку, и их затем центрифугировали при 1200 об/мин при 25°C в течение 5 минут. Далее супернатант культуры удаляли отсасыванием. Раствор, полученный добавлением 2 мкл полибрена (10 мг/мл) и 2 мкл 55 мкМ 2-меркаптоэтанола к 2 мл раствора рекомбинантного вируса, добавляли к клеткам. Полученную смесь затем центрифугировали при 2500 об/мин при 30°C в течение 2 часов для того, чтобы инфицировать клетки рекомбинантным вирусом. После окончания инфицирования раствор рекомбинантного вируса удаляли и туда добавляли среду (RPMI-1640/10% FBS/55 мкМ 2-меркаптоэтанола) с последующим культивированием. Чтобы получить клетки, экспрессирующие mTARM, EGFP-положительные клетки выделяли с помощью сортировки клеток.
(2) Получение химерного белка, образованного слиянием внеклеточной области hTARM с SEAP или Fc
Внеклеточную область hTARM амплифицировали посредством PCR с использованием полноразмерной кДНК hTARM в качестве матрицы, и также с использованием 5'-праймера с добавленным участком для SalI (h29B140_SalI-Kozac_F: cgcgtcgacGCCACCATGATCCCTAAGCTGCTTTCCCTC (SEQ ID № 51)) и 3'-праймера с добавленным участком для NotI (h29B140_NotI_SEAP_R: gcgggcggccgcACCCAGGGAGTAGTTGCTCGATGT (SEQ ID № 53)). PCR осуществляли в реакционном растворе следующего состава (5 мкл 10×буфера, 4 мкл 2,5 мМ dNTP, 0,5 мкл полимеразы Pyrobest (TAKARA), 0,5 мкл каждого из 100 мкМ праймеров, 1 мкл кДНК, 2,5 мкл DMSO и 36 мкл дистиллированной воды). Для такой PCR, после обработки при 94°C в течение 5 минут, реакционный цикл, состоящий из 94°C-30 секунд, 65°C-30 секунд и 72°C-5 минут, повторяли 35 раз. В заключение, реакцию осуществляли при 72°C в течение 2 минут. Амплифицированную кДНК клонировали в pBlueScriptII SK(+) (Stratagene), и его нуклеотидную последовательность затем подтверждали с использованием анализатора последовательностей ABI3100. Полученный фрагмент кДНК расщепляли SalI и NotI и затем вставляли в вектор pcDNA3.1(+)-SEAP(His)10-Neo, описанный в примере 2, чтобы получить вектор для экспрессии hTARM-AP.
Таким образом, осуществили слияние внеклеточной области hTARM посредством трехаминокислотного линкера (Ala-Ala-Ala) с щелочной фосфатазой плаценты человека секреторного типа, обладающей 10-гистидиновой меткой (His)10 на своем C-конце, для экспрессии в качестве секреторного химерного белка (в дальнейшем обозначаемого как химерный белок AP). Полученный вектор для экспрессии химерного белка AP вводили в клетки 293/EBNA-1 с использованием TransIT LT1 (TAKARA), и их затем культивировали в течение 4 или 5 суток. Далее супернатант культуры отбирали центрифугированием, и химерный белок AP, секретируемый в супернатант, затем фильтровали через 0,22 мкм фильтр. Далее к нему добавляли Hepes (pH 7,4) и азид натрия до конечных концентраций 20 мМ и 0,02% соответственно и полученный продукт хранили при 4°C. Концентрацию химерного белка AP вычисляли измерением активности щелочной фосфатазы с использованием хемилюминесцентного анализа репортерного гена Aurora AP (ICN).
(3) Получение моноклональных антител против hTARM
Для использования в качестве антигена в иммунизации сначала очищали химерный белок hTARM-AP.
Такую очистку осуществляли с использованием гистидиновой метки, присутствующей на C-конце химерного белка AP, и с использованием набора His Trap (Amersham Biosciences). Супернатант культуры, содержащий химерный белок hTARM-AP, добавляли к 1 мл хелатной HP-колонки HiTrap (Amersham Biosciences) с последующей промывкой раствором 10 мМ имидазола. Далее химерный белок hTARM-AP элюировали с колонки с использованием раствора 500 мМ имидазола. Концентрацию химерного белка hTARM-AP вычисляли измерением ферментативной активности с использованием хемилюминесцентного анализа репортерного гена Aurora AP (ICN) и с помощью количественного определения белка с использованием набора Protein Assay II (BIO-RAD).
Затем полученный химерный белок hTARM-AP использовали в качестве антигена и мышей Balb/c иммунизировали вышеупомянутым белком с помощью Kohjin Bio Co. Ltd. Лимфоциты выделяли из иммунизированных мышей, и выделенные лимфоциты затем смешивали с миеломными клетками P3U1. Далее слияние клеток осуществляли способом с PEG. Используя супернатант культуры полученных гибридом, осуществляли скрининг посредством ELISA с использованием химерного белка hTARM-Fc. Клонирование осуществляли из положительных лунок и получили 6 типов клонов (№ 11, № 18, № 19, № 22, № 26 и № 40). В результате анализа специфичности с помощью FACS обнаружено, что все клоны реагировали только с клетками B300.19, экспрессирующими hTARM, и что они не реагировали с родительскими клетками B300.19. Гибридомы, которые продуцировали моноклональные антитела анти-hTARM № 11, № 18, № 19, № 22, № 26 и № 40, инокулировали в перитонеальную полость «голых» мышей, и от них получали асцитическую жидкость. Далее антитела очищали с использованием колонки с A-белком.
[Пример 10] Адгезия активированных T-клеток человека к рекомбинантному белку hTARM
Периферическую кровь человека собирали с использованием гепарина, и Ficoll-Paque PLUS (Amersham Biosciences) добавляли к ней в равном количестве с периферической кровью человека, и мононуклеарные клетки выделяли центрифугированием в градиенте плотности при 400×g в течение 30 минут. Выделенные клетки суспендировали в буфере для MACS (PBS/1% FBS/2 мМ EDTA), и раствор для забивки FcR (Miltenyi) добавляли в суспензию из расчета 5 мкл/1×107клеток. Полученную смесь подвергали взаимодействию при 4°C в течение 15 минут. Набор Treg (Miltenyi) для выделения CD25+CD4+ человека и Auto MACS использовали для получения покоящихся T-клеток CD4+. PE-меченные мышиные антитела к CD25 человека (Miltenyi) и FITC-меченные мышиные антитела к CD4 человека (Miltenyi), каждые в количестве 1/11 раствора, добавляли к клеткам CD4+, которые очищали посредством MACS. Их затем подвергали взаимодействию при 4°C в течение 20 минут. Далее FACS Aria (BD Biosciences) использовали для получения T-клеток CD4+CD25-. T-клетки CD4+CD25- активировали с использованием набора активации/размножения T-клеток человека (Miltenyi). Через 3 суток после стимуляции к клеткам добавляли IL-2 человека (2 нг/мл). Возможность функционирования химерного белка hTARM-AP в качестве молекулы адгезии для активированных T-клеток анализировали с использованием активированных CD4-положительных T-клеток, полученных на 6-ые и 8-ые сутки после стимуляции.
Сначала 50 мкл антител против щелочной фосфатазы (10 мкг/мл) (Seradyn) добавляли к каждой лунке 96-луночного планшета для ELISA (Nunc) и инкубировали при 37°C в течение 30 минут для иммобилизации. После промывки PBS неспецифические участки связывания забивали посредством Block Ace (Dainippon Pharma Co., Ltd.). Химерный белок AP (10 нМ) добавляли к каждой лунке и инкубировали при комнатной температуре в течение 30 минут для иммобилизации. Активированные T-клетки суспендировали в буфере для адгезии клеток (RPMI1640/0,5% BSA/20 мМ HEPES/55 нМ 2ME (pH 7,4)) с последующим флуоресцентным мечением посредством Calcein-AM (Dojindo Laboratories). Далее 5×104клеток добавляли к каждой лунке и затем инкубировали при 37°C в течение 1 часа. Неприкрепившиеся клетки удаляли промывкой, и затем в лунки добавляли буфер для лизиса клеток (10 мМ Tris-HCl (pH 8,0)/1% TritonX-100). Далее измерение осуществляли при длине волны возбуждения 485 нм и длине волны детекции 535 нм с использованием Wallac ARVO SX 1420 MULTILABEL COUNTER (PerkinElmer) и количественно определяли прикрепившиеся клетки. Относительно уровня адгезии клеток, отношение прикрепившихся клеток к добавленным клеткам выражали в виде процентной доли.
В результате выявлено, что hTARM функционирует в качестве молекулы адгезии к активированным T-клеткам человека (фиг.20).
[Пример 11] Активность антител анти-TARM в ингибировании адгезии клеток
Анализировали эффект антител анти-TARM на адгезию клеток активированных T-клеток человека к hTARM.
Химерный белок AP добавляли к каждой лунке и затем инкубировали при комнатной температуре в течение 30 минут для иммобилизации. Далее 10 мкг/мл для каждых антител анти-hTARM (№ 11, № 18, № 19, № 22, № 26 и № 40) добавляли к каждой лунке и предварительно обрабатывали при комнатной температуре в течение 30 минут. Далее туда добавляли флуоресцентно-меченные активированные T-клетки и анализировали адгезивную активность клеток в присутствии каждых антител. Следует отметить, что антитела анти-IgG2a использовали в качестве контроля для № 11, № 19, № 26 и № 40, и антитела анти-IgG2b использовали в качестве контроля для № 18 и № 22.
В результате обнаружено, что адгезия активированных T-клеток к химерному белку hTARM-AP значительно подавлялась в присутствии антител к hTARM № 18, № 19, № 22 и № 26 и что частичное подавление такой адгезии наблюдали в присутствии антител к hTARM № 11 и № 40 (фиг.20).
[Пример 12] Идентификация нового лиганда mTARM-L для mTARM
(1) Селекция молекул-кандидатов для mTARM-L (лиганд mTARM)
mTARM-связывающие молекулы присутствуют на активированных T-клетках (пример 5). Таким образом, присутствие или отсутствие mTARM-связывающих молекул на мышиных клеточных линиях (L5178Y-R, BW5147 и Raw264.7), происходящих из иммунных клеток, анализировали способом, описанным в примере 5.
В результате выявлено, что mTARM-связывающие молекулы сильно экспрессируются на клетках L5178Y-R, но что они слабо экспрессируются на клетках BW5147 и клетках Raw264.7 (фиг.21A).
Затем исходя из предположения, что неизвестный лиганд для mTARM принадлежит к суперсемейству иммуноглобулинов (IgSF), осуществляли поиск в базе данных Mouse Ensemble. Фокусируя внимание на 47 кандидатах из IgSF, экспрессию в иммунных клетках исследовали с помощью PCR в реальном времени. Суммарную РНК выделяли из клеток L5178Y-R, клеток BW5147 и клеток Raw264.7 с использованием мининабора RNeasy (Qiagen, Hilden, Germany). PCR в реальном времени осуществляли в присутствии SYBR-green с использованием системы детекции последовательностей ABI7700 (PE Applied-Biosystems).
В результате для экспрессии мРНК ENSMUSG00000035095 (A530065I17Rik, NM_176953) (с использованием праймера № 2558: CAGCTGGCAAGAGGAACAGT (SEQ ID № 54) и праймера № 2559: GAGCATCGGCACTTATCTCC (SEQ ID № 55)) показали корреляцию с активностью связывания химерного белка mTARM-AP с клетками (фиг.22B). Однако трансмембранная область отсутствовала в аминокислотной последовательности, кодируемой ENSMUSG00000035095, и, таким образом, это не позволило рассматривать ее функционирование в качестве белка клеточной мембраны. Эта аминокислотная последовательность являлась гипотетической последовательностью, и, таким образом, это позволило предположить, что оценка последовательности кДНК из геномной последовательности оказалась неправильной. Таким образом, сначала осуществили попытку идентифицировать гомологичный генный продукт человека. С использованием аминокислотной последовательности, кодируемой ENSMUSG00000035095, осуществляли поиск в базе данных. В результате обнаружили аминокислотную последовательность человека LOC196264, обладающую высокой степенью гомологии с аминокислотной последовательностью, кодируемой ENSMUSG00000035095. Эта аминокислотная последовательность относилась к белку клеточной мембраны, содержащему одну область структуры петли иммуноглобулина. Соответственно это позволило предположить, что LOC196264 является полноразмерной аминокислотной последовательностью кандидата для TARM-L человека. Затем с использованием аминокислотной последовательности LOC196264 осуществляли в базе данных поиск tblastn. В результате область, кодирующая последовательность, обладающую гомологией с аминокислотной последовательностью LOC196264, обнаружили в геномной нуклеотидной последовательности клона ВАС мыши AC122305. Последовательность кДНК и аминокислотная последовательность кандидата для TARM-L мыши оценивали исходя из этой последовательности, таким образом, конструируя следующие праймеры и выделяя кДНК, кодирующую полноразмерный белок.
#2693: CGCGTCGACGCCACCATGCAGCTGGCAAGAGGAACAGTA (SEQ ID №: 56)
#2694: GCGGGCGGCCGCTCAGTACGCCTCTTCTTCGTAGTC (SEQ ID №: 57)
Суммарную РНК Th1 на 2 сутки использовали в качестве матрицы, и кДНК амплифицировали способом, описанным в примере 1. Амплифицированную кДНК вставляли в экспрессирующий вектор pMXII IRES EGFP (Oncogene (2000) 19(27):3050-3058), и затем получали вектор, экспрессирующий ген кандидата для mTARM-L. Анализатор последовательностей ABI3100 использовали для определения его нуклеотидной последовательности (SEQ ID № 13).
(2) Идентификация mTARM-L
Далее, чтобы исследовать, является или нет кандидат для mTARM-L неизвестным лигандом для TARM, клетки, в которых эту молекулу следовало экспрессировать, получали способом, описанным в примере 2. Активность связывания химерного белка mTARM-AP на клеточной поверхности клеток, экспрессирующих кандидат для mTARM-L, и адгезивную активность клеток, экспрессирующих кандидат для mTARM-L, к иммобилизованному mTARM измеряли способом, описанным в примере 5.
В результате mTARM-AP специфически связывался с mTARM-L-экспрессирующими клетками EGFP+ B300.19, но не связывался с клетками B300.19, в которые вводили контрольный вектор EGFP+ (фигура 22A). AP, используемая в качестве отрицательного контроля, не связывалась с такими mTARM-L-экспрессирующими клетками EGFP+ B300.19 (фиг.22A).
Более того, исследовали адгезивную активность клеток B300.19, экспрессирующих mTARM-L, по отношению к AP и химерному белку mTARM-AP. В результате обнаружено, что вышеупомянутые клетки связывались только с химерным белком mTARM-AP (фиг.22B).
Таким образом, вышеупомянутые результаты показали, что молекула-кандидат для mTARM-L действительно является новым лигандом для TARM. Этот лиганд обозначили как mTARM-L (лиганд для TARM).
Что касается hTARM-L, то следующие праймеры сконструированы на основе нуклеотидной последовательности NM_198275, кодирующей аминокислотную последовательность LOC196264, и выделена кДНК, кодирующая полноразмерный белок.
#2721: CGCGTCGACGCCACCATGCAGCAGAGAGGAGCAGCTGGA (SEQ ID №: 58)
#2722: GCGGGCGGCCGCTCAATATGTCTCTTCATAGTCTGA (SEQ ID №: 59)
С использованием суммарной РНК костного мозга в качестве матрицы кДНК амплифицировали способом, описанным в примере 1. Амплифицированную кДНК вставляли в экспрессирующий вектор pMXII IRES EGFP (Oncogene (2000) 19(27):3050-3058) для получения вектора, экспрессирующего ген TARM-L, и его нуклеотидную последовательность (SEQ ID № 15) затем определяли с использованием анализатора последовательностей ABI3100.
TARM-L человека и мыши подвергали анализу гомологии посредством ClustalW. Результаты представлены на фиг.23. hTARM-L состоял из 235 аминокислот, и mTARM-L состоял из 237 аминокислот. Они обладают 86% гомологией. С другой стороны, mTARM m3 (293 аминокислоты) обладал наивысшей степенью гомологии с hTARM (271 аминокислота) на уровне 50% (фиг.24).
Реферат
Изобретение относится к биотехнологии. Описано антитело, которое специфически распознает мембранный или секреторный белок, выбранный из нескольких белков, с последовательностями, представленными в материалах заявки, или его функциональный фрагмент. Раскрыта гибридома, продуцирующая описанное антитело, депонированная под инвентарным № FERM BP-10376. Преложено лекарственное средство, используемое при аутоиммунном заболевании, включающее описанное антитело или его функциональный фрагмент в качестве активного ингредиента. А также средство для ингибирования адгезии Т-клеток, включающее описанное антитело или его функциональный фрагмент в качестве активного ингредиента. Представлен способ скрининга вещества, которое ингибирует активацию дендритной клетки, или его соли, или его сольвата, который включает стадии: приведение описанного антитела или его функционального фрагмента в контакт с дендритной клеткой в присутствии или в отсутствие тестируемого вещества; и измерение уровня активации указанной дендритной клетки. Изобретение расширяет арсенал средств лечения ревматоидного артрита. 6 н. и 12 з.п. ф-лы, 24 ил.
Формула
(ix) мембранный или секреторный белок, имеющий последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12;
(x) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, в которой одна или более аминокислот вставлены, заменены или удалены, или одна или более аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12;
(xi) мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего аминокислотную последовательность SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12; и
(xii) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности, обладающей 70% или большей идентичностью с аминокислотной последовательностью SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12.
(i) мембранный или секреторный белок, имеющий последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №10;
(ii) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №10, в которой одна или более аминокислот вставлены, заменены или удалены, или одна или более аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №10;
(iii) мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего аминокислотную последовательность SEQ ID №10, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №10; и
(iv) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности, обладающей 90% или большей идентичностью с аминокислотной последовательностью SEQ ID №10, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №10.
(ix') мембранный или секреторный белок, имеющий последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №12;
(х') мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №12, в которой одна или более аминокислот вставлены, заменены или удалены, или одна или более аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №12;
(xi') мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего аминокислотную последовательность SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №12; и
(xii') мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности, обладающей 70% или большей идентичностью с аминокислотной последовательностью SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №12.
(d) приведение антитела или его функционального фрагмента по любому из пп.1-7 в контакт с дендритной клеткой в присутствии или в отсутствие тестируемого вещества; и
(e) измерение уровня активации указанной дендритной клетки.
(g) приведение антитела или его функционального фрагмента по любому из пп.1-7 в контакт с дендритной клеткой в присутствии или в отсутствие тестируемого вещества; и
(h) измерение уровня экспрессии цепи FcRγ на указанной дендритной клетке,
где указанный белок TARM является мембранным или секреторным белком, выбранным из следующего (ix), (x), (xi) и (xii):
(ix) мембранный или секреторный белок, имеющий последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12;
(x) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, в которой одна или более аминокислот вставлены, заменены или удалены, или одна или более аминокислот добавлены к одному или обоим концам, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12;
(xi) мембранный или секреторный белок, который кодируется полинуклеотидом, который гибридизуется в жестких условиях с полину клеотидом, состоящим из последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего аминокислотную последовательность SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12; и
(xii) мембранный или секреторный белок, который имеет последовательность, по существу, соответствующую аминокислотной последовательности, обладающей 70% или большей идентичностью с аминокислотной последовательностью SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12, и который функционально эквивалентен белку, состоящему из аминокислотной последовательности SEQ ID №2, SEQ ID №4, SEQ ID №6, SEQ ID №8, SEQ ID №10 или SEQ ID №12.

Комментарии