Способ массового производства области fc иммуноглобулина с удаленными начальными метиониновыми остатками - RU2428430C2
Код документа: RU2428430C2
Чертежи





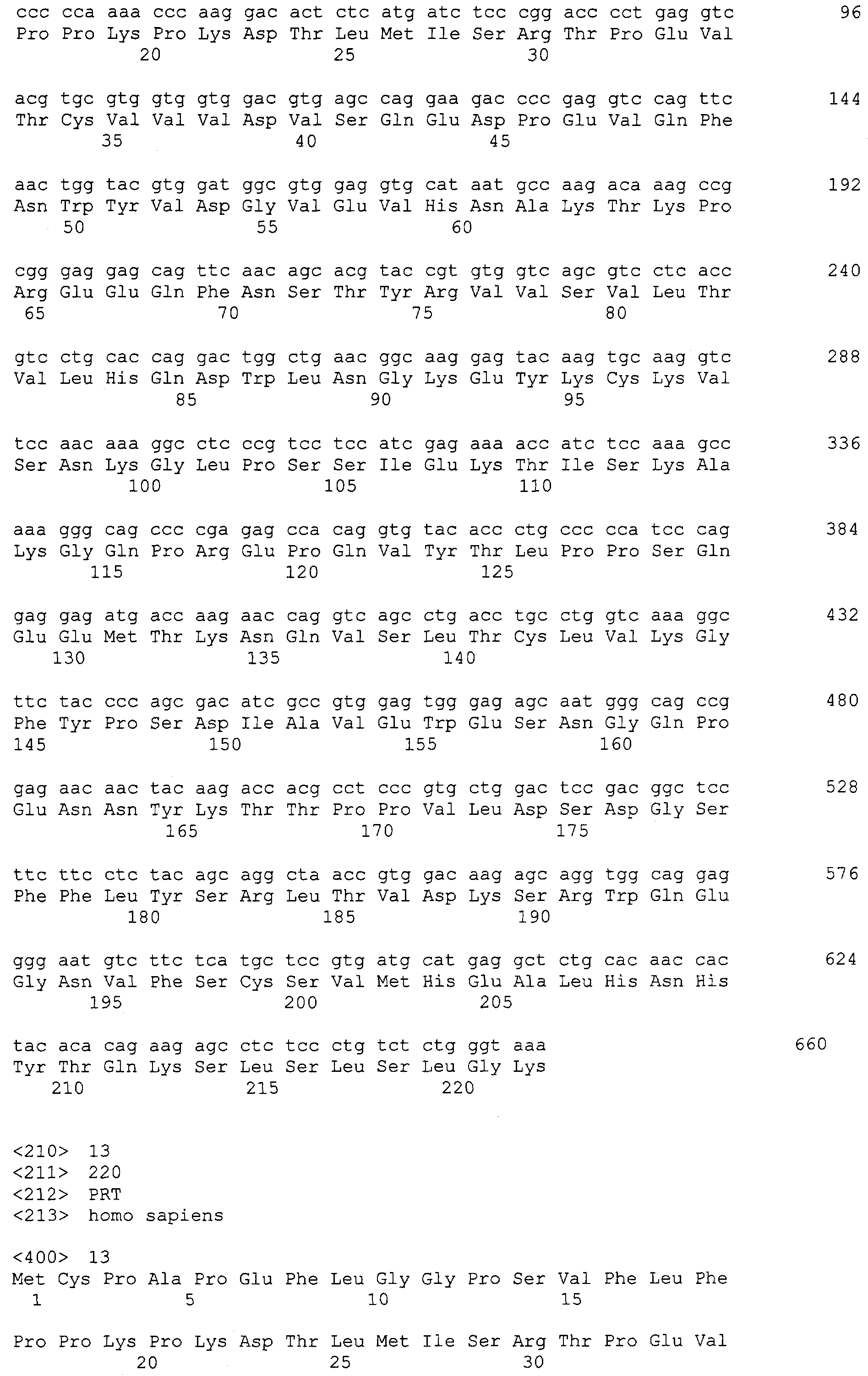

































Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способу производства мономерной или димерной области Fc иммуноглобулина, лишенной начальных метиониновых остатков, в массовом масштабе, путем использования рекомбинантного экспрессирующего вектора, включающего в себя нуклеотидную последовательность, кодирующую рекомбинантную область Fc иммуноглобулина, включая шарнирную область иммуноглобулина.
УРОВЕНЬ ТЕХНИКИ
С прогрессом генной инженерии было разработано и использовано большое число белковых лекарственных препаратов. Чувствительные к денатурации или протеолитическому расщеплению в теле, белковые лекарственные препараты, тем не менее, сложно удерживать в постоянной концентрации in vivo и в титрах в течение долгого периода времени. Улучшение стабильности белков in vivo, что может привести к сохранению концентрации белкового лекарственного препарата in vivo на подходящем уровне, является важным не только для повышения эффективности терапии, но и для помощи пациентам, которым необходимо делать частые инъекции белковых лекарственных препаратов, в плане удобства и стоимости.
Много попыток было сделано для увеличения стабильности in vivo белковых лекарственных препаратов в течение долгого периода времени, например, изменением состава белка, слиянием белка с другим белком, или химическим или биологическим присоединением подходящего полимера к поверхности белка.
Одним таким способом является изготовление слитого белка с областью Fc иммуноглобулина.
Область Fc иммуноглобулина опосредует эффекторные функции, такие как комплемент-зависимая цитотоксичность (CDC) или антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), так же как и антигенсвязывающая способность, которая является уникальной функцией иммуноглобулинов. Также, область Fc содержит последовательность, участвующую в связывании с рецептором Fc новорожденного (FcRn), который играет роль в регуляции уровней сыворотки IgG путем увеличения переноса материнского IgG к новорожденным и времени полужизни IgG (Ghetie and Ward, Immunology Today 18: 592-598, 1997), и эта последовательность регулирует взаимодействие между белком А и белком G. Многочисленные исследования были проведены с целью повышения стабильности терапевтического белка путем слияния этого фрагмента Fc с терапевтическим белком.
Например, патент Кореи № 249572 раскрывает слитый белок, который получают присоединением тяжелой цепи области Fc (Fc) с ее амино-конца к карбоксильному концу белка, такого как рецептор IL4, рецептор IL7, рецептор G-CSF или EPO рецептор, и продуцирование полученного слитого белка в клетках млекопитающих. Патент США № 5605690 описывает слитый белок, включающий рецептор фактора некроза опухолей, слитый своим карбоксильным концом с производным Fc человеческого IgG1, причем слитый белок продуцируется в клетках животных. Также, Tanox Inc. сообщила в патентах США № 5723125 и 5908626 о гибридной молекуле, включающей человеческий интерферон альфа или бета, который присоединен со своего карбоксильного конца к нативному человеческому Fc IgG4 при помощи пептидного линкера, и произведенной в клетках животных. Lexigen Inc., как описано в международной публикации заявки РСТ WO 00/69913, получила нативный IgG1 Fc, присоединенный своим карбоксильным концом к аминному концу человеческого интерферона генетической рекомбинацией без использования линкера, и изготовила слитый белок в клетках животных. Патентная публикация США № 20030082679 раскрывает слитый белок с увеличенным временем полужизни в сыворотке, который включает человеческий G-CSF, присоединенный со своего карбоксильного конца к амино-концу IgG1 Fc, и который изготовлен в клетках животных. Патентная публикация США № 20010053539, патент США № 6030613, международная публикация заявки РСТ WO 99/02709 и WO 01/03737 и европейский патент № 0464533B1 раскрывают Fc-слитый белок с большим временем полужизни в сыворотке, чем нативный белок, который включает IgG1 Fc, или его производное, присоединенные своим амино-концом, при помощи пептидного линкера, или без пептидного линкера, к карбоксильному концу человеческого EPO, TPO, человеческого гормона роста или человеческого бета интерферона, причем Fc-слитый белок произведен в клетках животных.
Эти Fc-слитые белки, как описано выше, увеличивают время полужизни в сыворотке целевых белков, но влекут за собой проблемы, связанные с опосредованием эффекторных функций фрагментом Fc (патент США № 5349053). Через эффекторные функции фрагмента Fc они фиксируют комплементы или связываются с клетками, экспрессирующими FcγRs, что приводит к лизису специфических клеток и стимулирует выработку и выделение нескольких цитокинов, вызывающих воспаление, что приводит к нежелательному воспалению. Также слияние создает новую аминокислотную последовательность в области соединения между фрагментом Fc и партнером-белком, которая может потенциально вызывать иммунные ответы, если белки вводились в течение долгого времени.
В этом отношении было предпринято много попыток получить иммуноглобулин или фрагмент иммуноглобулина, который имеет большое время полужизни в сыворотке, но лишен эффекторных функций. Cole et al. сообщили, что, когда аминокислотные остатки области CH2 в положениях 234, 235 и 237, которые, как известно, играют важную роль в связывании с Fc рецепторами, заменяются аланином, что, таким образом, дает Fc производное, имеющее уменьшенную аффинность к Fc рецепторам, активность ADCС ингибируется (Cole et al., J. Immunol. 159: 3613-3621, 1997). Однако во всех этих вариантах Fc может иметь увеличенную иммуногенность или антигенность по сравнению с нативным человеческим Fc-фрагментом, вследствие присутствия неподходящих аминокислот, и может потерять желаемые Fc функции.
Среди способов делеции или уменьшения нежелаемых эффекторных функций, с сохранением высокой концентрации иммуноглобулина в сыворотке, один основан на удалении сахаров из иммуноглобулина. Как описано в патенте США № 5585097, агликолизированное производное антитела, анти-CD3 антитело, может быть получено заменой гликозилированного остатка антител, аспарагинового остатка в положении 297 СН2 домена, другой аминокислотой. Это производное агликолизированного антитела проявляет уменьшенные эффекторные функции, но все же сохраняет аффинность к связыванию с FcRn рецептором без изменений во времени полужизни в сыворотке. Однако это производное также является проблематичным, в том смысле, что потенциально распознается как чужеродный материал и отторгается иммунной системой, вследствие продуцирования новой рекомбинантной структуры, имеющей аномальную последовательность. Патентная публикация США № 20030073164 раскрывает способ продуцирования производного Fc с использованием E. coli, которая лишена способности к гликозилированию, с тем, чтобы получить антитела для лечебных целей, лишенные эффекторных функций.
Американская компания Amgen Inc. описала в патенте США № 6660843 и в патентных публикациях США № 20040044188 и 20040053845 производное человеческого IgG1 Fc, имеющее делеции аминокислот, первых пяти аминокислотных остатков шарнирной области, которые присоединены к амино- или карбоксильному концу терапевтического белка или имитации терапевтического белка пептидом, и его производство, с использованием E. Coli-хозяина. Однако этот слитый белок, не имеющий сигнальной последовательности, экспрессируется как «тела включения», и, таким образом, должен быть подвергнут дополнительному процессу рефолдинга. Этот процесс рефолдинга белка уменьшает выходы, и, особенно если белок присутствует в качестве гомодимера или гетеродимера, разительно уменьшает производство димера. Также, когда белок, не имеющий сигнальной последовательности, экспрессируется в E. Coli, остаток метионина присоединяется к N-концу продукта экспрессии из-за особенности системы экспрессии белка E. coli. Вышеупомянутые продукты экспрессии Amgen Inc. имеют N-концевой остаток метионина, который может вызывать иммунные ответы при повторном или чрезмерном введении в организм. Также, поскольку эти слитые молекулы экспрессированы в форме слитого белка в E. Coli присоединением гена, кодирующего терапевтический белок, к Fc-гену, они с трудом экспрессируются в E. coli, либо терапевтический белок сложно изготовить в E. coli, если его экспрессия в E. coli в слитой форме приводит к значительному уменьшению или потере активности. Более того, поскольку слияние двух молекул приводит к не встречающейся в природе аномальной аминокислотной последовательности в области соединения двух белков, слитый белок может потенциально быть распознан иммунной системой как «не свой», и, таким образом, вызвать иммунные ответы.
Чтобы решить эти проблемы, авторы настоящего изобретения заранее получили Fc-фрагмент и белковый лекарственный препарат как отдельные полипептиды, не используя способ слияния, основанный на генетической рекомбинации, но используя лучшие системы экспрессии и ковалентно связывая два полипептида вместе, для использования Fc-фрагмента как носителя лекарственного препарата. В этом случае возможно получить конъюгат гликолизированного полипептидного лекарственного препарата и агликолизированного Fc, который не вызывает нежелаемые иммунные ответы, но имеет удовлетворительные свойства физиологической активности лекарственного препарата, длительности жизни и стабильности in vivo.
В вышеупомянутом случае, поскольку предпочтительной является агликолизированная форма Fc, используется прокариотическая система экспрессии, такая как E. coli. Методы производства белка, использующие систему экспрессии E. coli, имеют несколько преимуществ над традиционными способами, которые используют клетки животных, как изложено ниже. Экспрессирующий вектор E. coli может быть легко сконструирован, что, таким образом, позволяет быстро оценивать экспрессию белка. Из-за своего быстрого роста E. coli делает возможным массовое производство белков, представляющих интерес, при низкой цене. Также может быть использован относительно простой способ экспрессии. Таким образом, E. coli более полезна для коммерческого производства, чем другие клетки-хозяева.
Большинство областей Fc присутствуют как «тела включения» в результате сверхэкспрессии в E. coli. По этой причине промышленные требования заключаются в том, чтобы области Fc были экспрессированы в водорастворимой форме в E. coli. В европейском патенте № 0227110 описано получение области Fc IgG1, с использованием только продукта (клеточного лизата), который экспрессирован в водорастворимой форме в результате сверхэкспрессии области Fc IgG1. Однако выход иммуноглобулина, экспрессированного в водорастворимой форме, составляет только лишь не более 15 мг/л, что не имеет значения в смысле промышленной полезности. Патентная заявка Кореи № 0092783, преодолевающая проблему, с которой столкнулись в уровне техники, представляет новый способ экспрессии области Fc иммуноглобулина не как «тела включения», но в водорастворимой форме в E. Coli, при помощи слияния нуклеотидной последовательности соответствующей области Fc с сигнальной последовательностью E. coli. При экспрессии в E. coli, представляющий интерес белок присутствует в растворимой форме, лишенной сигнального пептида, с выходом продукта, увеличенным вплоть до 600 мг/л.
Приводящее к настоящему изобретению, интенсивное и тщательное исследование способа продуцирования активной агликозилированной области Fc иммуноглобулина, не имеющей иммунного ответа, проведенное авторами настоящего изобретения, имеющее цель увеличить производственный выход до уровня, подходящего для индустриализации, привело к открытию, что, когда нуклеотидная последовательность, кодирующая область Fc иммуноглобулина, экспрессирована в форме, слитой N-концом со специфической шарнирной областью, область Fc иммуноглобулина экспрессируется как «тела включения», которые в конечном итоге являются димерами или мономерами области Fc иммуноглобулина, лишенными начальных метиониновых остатков, при помощи процессов солюбилизации и рефолдинга.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следовательно, целью данного изобретения является обеспечить способ массового производства области Fc иммуноглобулина, лишенной начального метионинового остатка, включающий в себя конструирование вектора, включающего нуклеотидную последовательность, кодирующую рекомбинантную область Fc иммуноглобулина, содержащую шарнирную область иммуноглобулина; трансформирование прокариотической клетки вектором; культивирование получающегося трансформанта; и выделение и очистка области Fc иммуноглобулина, экспресированной в «теле включения» из трансформанта.
Другой целью данного изобретения является обеспечить димер или мономер области Fc иммуноглобулина, полученные вышеуказанным способом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеперечисленные и другие цели, особенности и другие преимущества настоящего изобретения будут, безусловно, более понятны из последующего детализированного описания, данного в объединении с сопроводительными чертежами, в которых:
Фиг.1 представляет собой фотографию гель-электрофореза, показывающую образование мономерных и димерных фрагментов области Fc из экспрессированных «тел включения» с использованием экспрессирующего вектора, имеющего нуклеотидную последовательность, кодирующую область Fc человеческого иммуноглобулина IgG4;
Фиг.2 показывает результаты ELISA способности области Fc человеческого иммуноглобулина IgG4 связываться с C1q;
Фиг.3 показывает результаты ELISA способности области Fc человеческого иммуноглобулина IgG связываться с FcγRI;
Фиг.4 показывает результаты ELISA способности области Fc человеческого иммуноглобулина IgG связываться с FcγRIII;
Фиг.5 показывает результаты ELISA способности области Fc человеческого иммуноглобулина IgG связываться с FcRnαβ2;
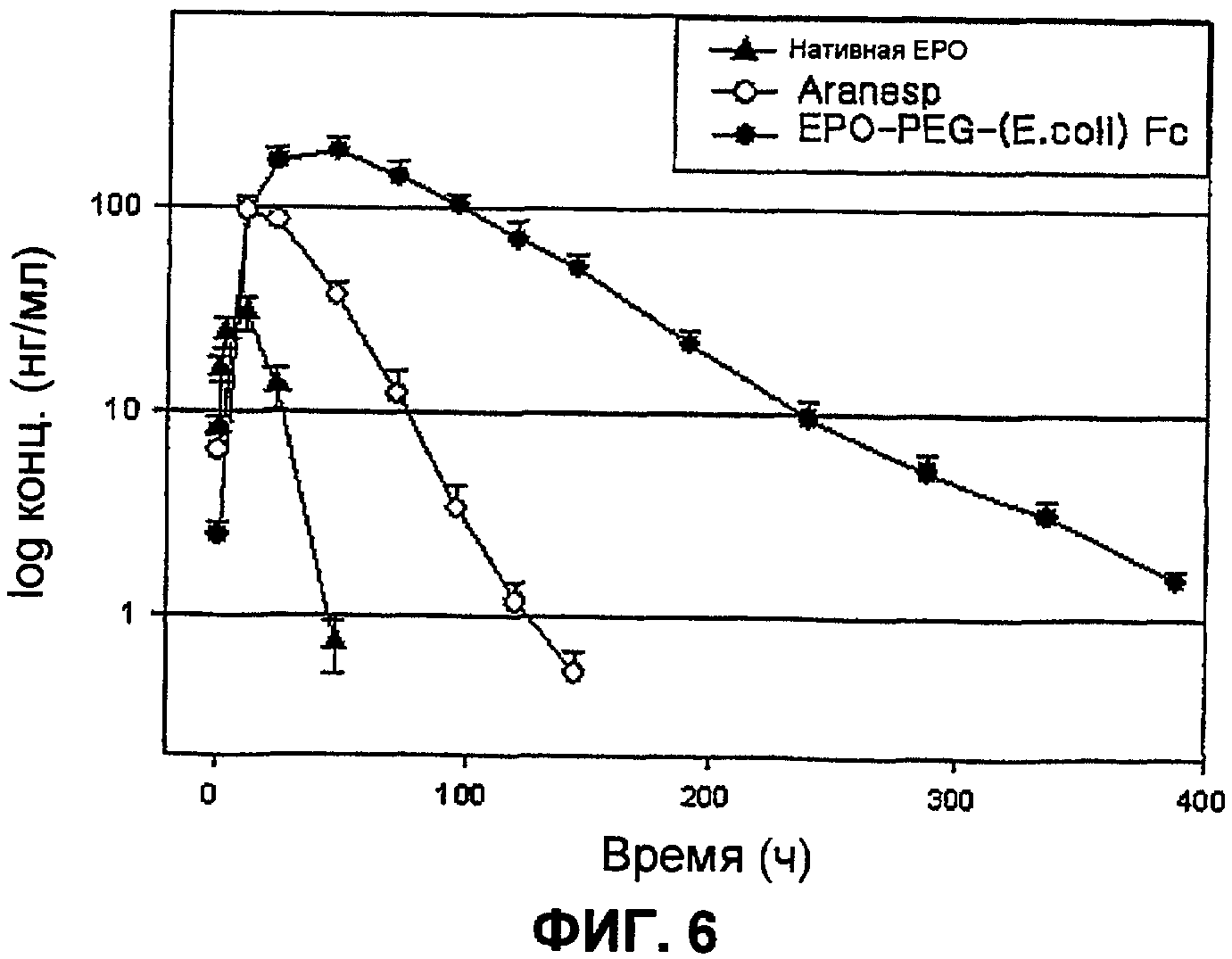
Фиг.6 показывает результаты в плане времен полужизни в сыворотке конъюгата EPO-PEG-Fc, полученные использованием области Fc человеческого иммуноглобулина IgG в качестве переносчика;
Фиг.7 представляет собой фотографию 15%-SDS-PAGE-геля, на котором, после смешения с эквивалентными объемами 2× буфера белкового образца, пропущены части ферментированных растворов, полученные выращиванием микробных трансформантов примера 2 в ферментерах в условии экспрессии;
Фиг.8 представляет собой фотографию SDS-PAGE-геля, на котором разделены и визуализированы как полосы белки, подвергнутые рефолдингу из экспрессированных «тел включения» трансформированных клеток примера 2;
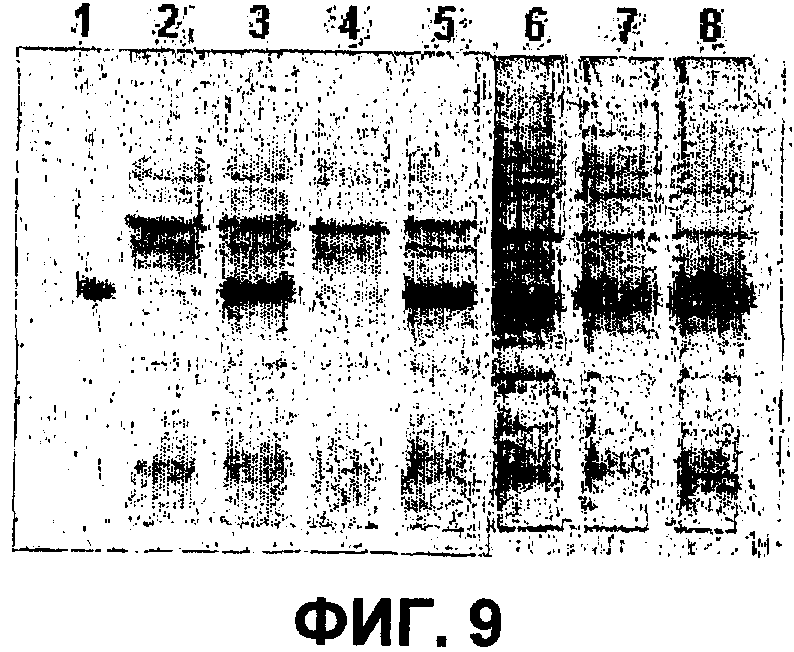
Фиг.9 представляет собой фотографию 15%-SDS-PAGE-геля, на котором, после смешения с эквивалентными объемами 2х буфера белкового образца, пропущены части ферментированных растворов, полученные выращиванием микробных трансформантов примера 3 в ферментерах в условии экспрессии; и
Фиг.10 представляет собой фотографию 15%-SDS-PAGE-геля, на котором, после смешения с буфером белкового образца, лишенного восстановителя, такого как DTT или бета-меркаптоэтанол, пропущены соответствующие экспрессированные и очищенные продукты примера 3.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к способу массового производства области Fc иммуноглобулина, включающему в себя конструирование вектора, включающего нуклеотидную последовательность, кодирующую рекомбинантную область Fc иммуноглобулина, содержащую шарнирную область иммуноглобулина; трансформирование прокариотической клетки с вектором; культивирование получающегося трансформанта; и выделение и очистка области Fc иммуноглобулина, экспрессированной в форме «тела включения» из трансформированной клетки.
Настоящее изобретение относится к способу массового производства области Fc иммуноглобулина, полезной в качестве переносчика белковых лекарственных препаратов. Найдено, что когда область Fc иммуноглобулина присоединена N-концом к шарнирной области, образующаяся рекомбинантная область Fc иммуноглобулина экспрессирована в виде «тел включения», и затем ее растворяют и подвергают рефолдингу в димер или мономер в активной форме, лишенной начального метионинового остатка, кодируемого инициирующим кодоном. Настоящее изобретение имеет огромную значимость как открытие того, что присоединенная к области Fc иммуноглобулина шарнирная область играет важную роль в обработке и рефолдинге рекомбинантной области Fc иммуноглобулина в форму нативной последовательности, лишенной начального метионинового остатка, кодируемого инициирующим кодоном.
Шарнирная область, обеспечивающая возможность получения рекомбинантной Fc-области иммуноглобулина в больших количествах, может быть получена из IgG, IgA, IgM, IgE или IgD людей и других животных, включая коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, предпочтительно из IgG, например, IgG1, IgG2, IgG3 или IgG4 (SEQ ID NO: 14-17). Шарнирная область, полезная в настоящем изобретении, может быть непроцессированной шарнирной областью или ее фрагментом. Предпочтительной формой является фрагмент шарнирной области, имеющий две или более упорядоченных аминокислотных последовательности, которые, более предпочтительно, содержат в себе, по меньшей мере, один цистеиновый остаток. Практичными для использования в настоящем изобретении являются фрагменты шарнирной области, полученные из IgG4 SEQ ID NO: 17, которые представлены SEQ ID NO: 18, 19, 20 и 21. Когда используются шарнирные области SEQ ID NO: 18, 19, 20 и 21, область Fc иммуноглобулина может быть получена в димерной или мономерной форме. Шарнирная область SEQ ID NO: 21 позволяет эффективно получать мономер области Fc иммуноглобулина. В других осуществлениях настоящего изобретения фрагменты, представленные SEQ ID NO: 48-55 шарнирной области, полученной из IgG1 SEQ ID NO: 14, и представленные SEQ ID NO: 56-60 шарнирной области, полученной из IgG2 SEQ ID NO: 15, были использованы для производства димера области Fc иммуноглобулина.
Область Fc иммуноглобулина, способная производиться по настоящему изобретению, может быть нативной формой, выделенной из людей и других животных, включая коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или может быть ее рекомбинантом или производным, полученными из трансформированных клеток животных или микроорганизмов. Предпочтительной может быть область Fc IgG, IgA, IgM, IgE и IgD людей или их комбинация или гибрид. Термин «комбинация», использующийся в данном описании, означает, что полипептиды, кодирующие одноцепочечные фрагменты Fc иммуноглобулина одинакового происхождения, присоединены к одноцепочечным полипептидам различного происхождения с образованием димера или многомера. Термин «гибрид», использующийся в данном описании, означает, что последовательности, кодирующие два или более фрагмента Fc иммуноглобулина различного происхождения, присутствуют в одноцепочечном фрагменте Fc иммуноглобулина. Иммуноглобулин может предпочтительно быть областью Fc IgG1, IgG2, IgG3 или IgG4 или ее комбинацией или гибридом. Пригодные в настоящем изобретении нуклеотидные последовательности, кодирующие области Fc человеческого иммуноглобулина и аминокислотные последовательности, ограниченные указанным, могут кодироваться нуклеотидными последовательностями из банков данных GenBank и/или EMBL.
Область Fc иммуноглобулина настоящего изобретения включает производное аминокислотной последовательности. Термин «производное аминокислотной последовательности» означает последовательность, в которой один или несколько аминокислотных остатков отличны от аминокислотной последовательности дикого типа, и может встречаться естественно или быть изготовленной искусственно. Область Fc иммуноглобулина включает производные, получающиеся от делеции, инсерции, неконсервативного или консервативного замещения или их комбинации. Инсерция обычно осуществляется присоединением упорядоченной аминокислотной последовательности приблизительно 1-20 аминокислот, или может быть осуществлена более длинной последовательностью. Делеция обычно осуществляется в диапазоне приблизительно 1-30 аминокислотных остатков. Аминокислотные замены в белках и пептидах, которые обычно не изменяют активность белков и пептидов, известны в данной области техники (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly в обоих направлениях. Такие производные могут быть получены при помощи способа химического синтеза пептида или способа, основанного на рекомбинации последовательности ДНК, которые известны в данной области техники (Sambrook et al., Molecular Cloning, Cold Spring Harbor Laboratory Press, New York, USA, 2d Ed., 1989).
Кроме того, область Fc иммуноглобулина, при желании, может быть модифицирована с использованием фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и т.п.
Производное иммуноглобулина настоящего изобретения предпочтительно является функциональным эквивалентом в своей натуральной форме, таким образом, имея схожую биологическую активность, или, при желании, может быть сделано изменением свойства натуральной формы. Предпочтительно, производные области Fc иммуноглобулина являются белками, у которых увеличена структурная устойчивость к нагреванию, pH, и т.д. или растворимость, или у которых были улучшены характеристики в отношении образования дисульфидной связи, совместимости с экспрессионным хозяином, связывания комплемента, связывания Fc рецептора и антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC), при условии, что изготовленные производные не сильно отличаются от натуральных форм, встречающихся у людей, и которые производят нежелаемые иммунные ответы в людях и животных. Предпочтительными производными являются области Fc IgG1, которые изменены в таком специфичном остатке, что имеют уменьшенную аффинность к Fc рецепторам, которые служат посредником антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Изготовленное производное может содержать делецию или замену другой аминокислотой в лейциновом остатке в положении 234 СН2 последовательности IgG1 (см. последовательность из базы данных Kobat для нумерации аминокислотных остатков). Более предпочтительно, Leu234 заменяется фенилаланином, аминокислотным остатком в соответственном положении в IgG4.
В соответствии с настоящим изобретением, получена нуклеотидная последовательность, кодирующая рекомбинантную область Fc иммуноглобулина, в которой область Fc иммуноглобулина соединена с шарнирной областью иммуноглобулина. Термин «рекомбинантная область Fc иммуноглобулина», использующийся здесь, означает область Fc иммуноглобулина, присоединенную N-концом к шарнирной области посредством пептидной связи.
В зависимости от области Fc иммуноглобулина, шарнирная область для присоединения может быть выбрана. Предпочтительной является шарнирная область, которая идентична в происхождении с областью Fc иммуноглобулина. В фактическом применении настоящего изобретения была получена нуклеотидная последовательность, кодирующая рекомбинантную область Fc иммуноглобулина, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 7, 9, 11 или 13, в которых область Fc IgG4 присоединена к шарнирной области, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 18, 19, 20 или 21. Нуклеотидные последовательности, кодирующие рекомбинантные области Fc иммуноглобулина, представлены SEQ ID NO: 6, 8, 10 и 12, соответственно.
В другом варианте осуществления была получена нуклеотидная последовательность, кодирующая рекомбинантную область Fc иммуноглобулина, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 23, 25, 27, 29, 31, 33, 35 или 37, в которой область Fc из IgG1 присоединена к шарнирной области, состоящей из аминокислотной последовательности, представленной одной из SEQ ID NO: 48-55. Получающиеся нуклеотидные последовательности, кодирующие рекомбинантные области Fc иммуноглобулина, представлены SEQ ID NO: 22, 24, 26, 28, 30, 32, 34 или 36.
В дополнительном варианте осуществления была получена нуклеотидная последовательность, кодирующая рекомбинантную область Fc иммуноглобулина, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 39, 41, 43, 45 или 47, в которой область Fc из IgG2 присоединена к шарнирной области, состоящей из аминокислотной последовательности, представленной одной из SEQ ID NO: 56-60. Получающиеся нуклеотидные последовательности, кодирующие рекомбинантные области Fc иммуноглобулина, представлены SEQ ID NO: 38, 40, 42, 44 или 46.
В соответствии с настоящим изобретением, предоставлены рекомбинантные экспрессирующие векторы, в которых функционально связаны нуклеотидные последовательности, кодирующие рекомбинанты областей Fc иммуноглобулина.
Термин «рекомбинантный экспрессирующий вектор», использующийся здесь, который описывает вектор, способный к экспрессии целевого белка в подходящей клетке-хозяине, относится к генетической структуре, которая включает в себя основные регуляторные элементы, в которых вставка функционально связанного гена осуществляется таким способом, что он экспрессируется в клетке-носителе.
Термин «функционально связанный», использующийся здесь, относится к функциональной связи между последовательностью нуклеиновой кислоты, контролирующей экспрессию, и второй нуклеотидной последовательностью, кодирующей целевой белок таким способом, что предоставляет основные функции. Функциональное связывание с рекомбинантным вектором может быть получено, используя рекомбинантную генную инженерию, хорошо известную в области техники, и сайт-специфическое расщепление ДНК и лигирование могут быть проведены с использованием общеизвестных в области техники ферментов. Подходящий экспрессирующий вектор включает регуляторные элементы экспрессии, такие как промотор, инициирующий кодон, стоп-кодон, сигнал полиаденилирования и энхансер. Инициирующий кодон и стоп-кодон необходимы для функционирования в индивидууме, в который вводился генетический конструкт, и должны быть в рамках кодирующей последовательности. Промотор вектора может быть конститутивным или индуцибельным. Кроме того, экспрессирующие векторы включают маркер селекции, который делает возможным отбор клеток носителя, содержащих в себе вектор, и воспроизводимые экспрессирующие векторы включают участок начала репликации. В подробном осуществлении настоящего изобретения получены следующие рекомбинантные экспрессирующие векторы: pmSCPFc, pmPSCFc, pmCPSFc, pmCPFc, pMEPKFc1, pMSCKFc1, pMDKTFc1, pMCPAFc1, pMPKSFc1, pMCPPFc1, pMPPCFc, pMPCPFc, pmPPCG2Fc, pmPCPG2Fc, pmCPG2Fc, pmCCVG2Fc и pmCVE2Fc.
Рекомбинантные экспрессирующие векторы, экспрессирующие белки, трансформируются в клетки-хозяева.
Что касается цели настоящего изобретения, клетками-хозяевами являются прокариотические клетки, в которых не осуществляется гликозилирование. Примеры таких прокариотических клеток включают Escherichia coli, Bacillus subtilis, Streptomyces, Pseudomonas, Proteus mirabilis и Staphylococcus с предпочтением E. coli. Иллюстрирующие, не лимитирующие, примеры штаммов E. coli включают BL21 (DE3), JM109, DH серии, TOP10 и HB101. Более предпочтительным является штамм BL21 (DE3). Из-за отсутствия системы гликозилирования белка E. coli может быть использована как клетка-хозяин, в которой область Fc иммуноглобулина продуцируется в форме, лишенной сахарных фрагментов, которые присутствуют в домене СН2 нативного иммуноглобулина. Сахарные фрагменты домена СН2 иммуноглобулина не оказывают влияния на структурную стабильность иммуноглобулинов, но являются причиной того, что иммуноглобулины служат связующим звеном антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) при объединении с клетками, экспрессирующими Fc рецепторы, и иммунными клетками, чтобы секретировать цитокины для вызова воспаления. Также, фрагменты сахаров связываются с C1q частью первого компонента комплемента С1, приводя к фиксации комплемента. Таким образом, когда область Fc иммуноглобулина продуцирована в агликолизированной форме и присоединена к терапевтическому белку, терапевтический белок присутствует в сыворотке в течение удлиненного периода времени без нежелательных эффекторных функций иммуноглобулинов.
Трансформация рекомбинантных экспрессирующих векторов в прокариотические клетки может быть достигнута любым способом, который дает возможность вводить нуклеиновые кислоты в клетки, и, как известно в данной области техники, может быть осуществлена выбором подходящих стандартных способов в соответствии с клетками-хозяевами. Эти способы включают, но не ограничиваются ими, электропорацию, слияние протопластов, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), встряхивание волокном карбида кремния, и трансформацией, опосредованной PEG, декстрансульфатом и липофектамином.
В подробном осуществлении настоящего изобретения рекомбинантные экспрессирующие векторы по отдельности вводятся в E. coli, таким образом, образуя следующие трансформанты: BL21/pmSCPFc(HM11200), BL21/pmPSCFc(HM11201), BL21/pmCPSFc(HM11204), BL21/pmCPАFc(HM11205), BL21/pMEPKFc1(HM11206), BL21/pMSCDFc1(HM11207), BL21/pMDKTFc1(HM11208), BL21/pMCPAFc1(HM11209), BL21/pMPKSFc1(HM11210), BL21/pMCPPFc1(HM11211), BL21/pMPPCF1c(HM11212), BL21/pMPCPF1c(HM11213), BL21/pmPPCPG2Fc(HM11214), BL21/pmPCPG2Fc(HM11215), BL21/pmCPG2Fc(HM11216), BL21/pmCCVG2Fc(HM11217) и BL21/pmCVEG2Fc(HM11218).
Трансформанты, фиксирующие рекомбинантные экспрессирующие векторы, культивируются при помощи общего метода.
Условия культивирования могут легко регулироваться, в соответствии с бактериальным штаммом, специалистом в данной области техники. Обычно среда, используемая для культивирования, должна содержать все питательные вещества, необходимые для выживания и роста клеток. Среда должна содержать различные источники углерода, азота и микроэлементов. Примеры доступных источников углерода включают глюкозу, сахарозу, лактозу, фруктозу, мальтозу, крахмал, углеводы, такие как целлюлоза, жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти источники углерода могут быть использованы поодиночке или в комбинации двух или более. Примеры доступных источников азота включают органические источники азота, такие как пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, ликер кукурузного экстракта (CSL) и соевую сыворотку, и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота могут быть использованы поодиночке или в комбинации двух или более. В среде может содержаться источник фосфора, который включает дигидрофосфат калия, гидрофосфат калия, и соответствующие натрийсодержащие соли. В добавление к этому среда может содержать соль металла, такую как сульфат магния или сульфат железа. Среда может дополнительно включать аминокислоты, витамины, подходящие предшественники и т.п. pH культуры можно регулировать добавлением к культуре соединения, такого как гидроксид аммония, гидроксид калия, аммиака, фосфорной кислоты и серной кислоты подходящим способом. Также в течение культивирования для предотвращения образования пузырей могут быть использованы пеногасители, такие как сложные эфиры полигликоля и жирной кислоты. Для поддержания культуры в желаемом состоянии, в нее вводятся кислород или кислородсодержащие газы (например, воздух). Температура культивирования обычно составляет 20°С-45°С, и предпочтительно 25°С-45°С. Также для производства белка в крупном масштабе может быть использован ферментер. Производство белка с использованием ферментера следует проводить, принимая во внимание несколько факторов, включая скорость роста клеток-хозяев и уровни экспрессии белка. Экспрессию белка можно индуцировать посредством добавления, например, IPTG в среду при подходящих условиях культивирования.
Область Fc иммуноглобулина, сверхэкспрессированная как «тела включения», может быть очищена при помощи общей методики. Области Fc иммуноглобулина, изготовленные в трансформантах, могут быть получены разрушением клеток, с использованием «французского пресса», ультразвукового аппарата, и т.д., сбором только водонерастворимых «тел включений», содержащих область Fc иммуноглобулина, при помощи центрифугирования, солюбилизации и денатурации собранной фракции с агентами рефолдинга, такими, как мочевина, гуанидин, аргинин, цистеин, бета-меркаптоэтанол и т.д. для ее рефолдинга, и очисткой подвергнутого рефолдингу слитого белка при помощи диализа, различных хроматографий, таких как гель-хроматография, ионообменная и обращенно-фазовая колоночная хроматография, или ультрафильтрацией, поодиночке или в комбинации. Известно, что в большинстве случаев этот процесс рефолдинга - очень сложный и приводит к очень низкому выходу рефолдинга и дает рефолдированный белок более низкой активности, чем растворимый в воде белок.
Однако способом настоящего изобретения можно преодолеть вышеупомянутые проблемы и изготовить активную область Fc иммуноглобулина, лишенную начального метионинового остатка, в массовом масштабе. В целом, экспрессированный и продуцируемый в E. coli экзогенный белок имеет начальный метиониновый остаток, кодируемый инициирующим кодоном. Повторное или избыточное введение белкового продукта, имеющего начальный метиониновый остаток, может вызвать иммунный ответ в человеческом организме, достаточный, чтобы уменьшить его терапевтический эффект, или чтобы он был токсичным. Однако, когда рекомбинантная область Fc иммуноглобулина настоящего изобретения экспрессирована в E. coli, найдено, что начальный метиониновый остаток отщеплен аминопептидазой, природным ферментом цитоплазмы, как измерено анализом по установлению N-концевой последовательности (Adams et al., J. Mol. Biol. 33:571-589, 1968, Takeda, Proc. Natl. Acad. Sci. USA 60:1487-1494, 1968). Известно, что активность таких аминопептидаз зависит от последовательности и структуры интересующего белка (Moerschell et al., J. Mol. Biol. Chem. 265:19638-19643, 1990, James et al., Protein Expression and Purification 41:45-52, 2005). Шарнирная область, прикрепленная к области Fc иммуноглобулина, находится под влиянием аминопептидазы, так что начальный метионин обрабатывается в степени, зависящей от ее аминокислотной последовательности.
Так как свойства шарнирной области определяют посттрансляционную модификацию протеаз, отношение димеров к мономерам можно эффективно регулировать выбором подходящих шарнирных областей. В добавление к этому, когда «тела включения» подвергнуты рефолдингу, образование правильных димеров затруднено за счет ошибочного сочетания цистеинов в дисульфидных связях. Однако способ в соответствии с настоящим изобретением обеспечивает образование правильных дисульфидных связей, что, таким образом, приводит к образованию активных димеров.
В добавление к этому, настоящее изобретение может производить области Fc иммуноглобулина в более крупном масштабе, чем это могут традиционные способы. Например, область Fc иммуноглобулина производится с выходом 15 мг/л в соответствии со способом европейского патента № ЕР0227110, где область Fc G1 сверхэкспрессирована и очищена только от клеточного лизата, содержащего ее водорастворимую форму, и с выходом 15-600 мг/л в соответствии с патентной заявкой Кореи № 0092783, где область Fc иммуноглобулина, присоединенная к сигнальной последовательности E. Coli, экспрессирована в водорастворимой форме, но не как «тело включения». Однако настоящее изобретение может производить область Fc иммуноглобулина с выходом до 3-6 г/л очисткой «тел включения» рекомбинантной области Fc иммуноглобулина, содержащей шарнирную область. Таким образом, способ настоящего изобретения обеспечивает высокоэффективную систему для производства областей Fc иммуноглобулина в промышленном масштабе с более высоким выходом, чем в традиционных способах.
В другом аспекте настоящее изобретение относится к области Fc иммуноглобулина, полученной в соответствии с вышеупомянутым способом.
Область Fc иммуноглобулина, продуцированная в прокариотических клетках, таких как E. coli, в соответствии с настоящим способом, не имеет специфических ограничений для промышленного применения. Одним характерным применением является использование в качестве переносчика для образования конъюгата с определенным лекарственным препаратом. Конструкция конъюгата, состоящая из области Fc иммуноглобулина, присоединенной к лекарственному препарату, специально не лимитирована. Например, область Fc иммуноглобулина может быть соединена вместе с лекарственным препаратом в различных пропорциях, и связь может быть опосредована, например, через линкер.
Лекарственный препарат включает полипептиды, соединения, экстракты и нуклеиновые кислоты. Предпочтительным является полипептидный лекарственный препарат (что раньше было тождественно слову «белок»). Примеры линкеров, полезных в настоящем изобретении, включают белковые и небелковые линкеры, с предпочтением небелкового линкера и крайним предпочтением небелкового полимера. Предпочтительным примером тяжелой цепи иммуноглобулина является Fc.
Если необходимо увеличить время полужизни в сыворотке, любой физиологически активный полипептид может быть использован без особых ограничений в качестве белкового партнера области Fc иммуноглобулина, полученной в соответствии с настоящим способом, с образованием конъюгата. Такие физиологически активные полипептиды включают те, что используются для лечения и предотвращения болезней человека, и включают цитокины, интерлейкины, интерлейкин-связывающий белок, ферменты, антитела, факторы роста, факторы, регулирующие транскрипцию, факторы коагуляции, вакцины, структурные белки, лиганды белков или рецепторов, антигены клеточной поверхности, антагонисты рецепторов и производные, и их аналоги.
В частности, неограничивающие примеры физиологически активных полипептидов включают человеческий гормон роста, релизинг-гормон гормона роста, релизинг-пептид гормона роста, интерфероны и рецепторы интерферона (например, интерферон-α, -β и -γ, водорастворимый рецептор интерферона типа I, и т.д.), колониестимулирующие факторы, интерлейкины (например, интерлейкин-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30 и т.д.) и рецепторы интерлейкина (например, рецептор IL-1, рецептор IL-4 и т.д.), ферменты (например, глюкоцереброзидаза, идуронат-2-сульфатаза, альфа-галактозидаза-А, агалзидаза альфа и бета, альфа-L-идуронидаза, бутирилхолинэстераза, хитиназа, глутамат-дикарбоксилаза, имиглуцераза, липаза, уриказа, тромбоцит-активирующий фактор ацетилгидролаза, нейтральная эндопептидаза, миелопероксидаза, и т.д.), интерлейкин- и цитокин-связывающие белки (например, IL-18bp, TNF-связывающий белок и т.д.), фактор активации макрофагов, пептид макрофага, фактор B-клетки, фактор Т-клетки, белок А, ингибитор аллергии, гликопротеины некроза клетки, иммунотоксин, лимфотоксин, фактор некроза опухоли, супрессоры опухоли, фактор роста метастаза, антитрипсин альфа-1, альбумин, альфа-лактальбумин, аполипопротеин-Е, эритропоэтин, высокогликозилированный эритропоэтин, ангиопоэтины, гемоглобин, тромбин, белок-активирующий тромбиновый рецептор, тромбомодулин, фактор VII, фактор VIIа, фактор VIII, фактор IX, и фактор XIII, фактор, активирующий плазминоген, белок, связывающий фибрин, урокиназа, стрептокиназа, гирудин, белок С, C-реактивный белок, ингибитор ренина, ингибитор коллагеназы, супероксиддисмутаза, лептин, тромбоцитарный фактор роста, эпителиальный фактор роста, эпидермальный фактор роста, ангиостатин, ангиотензин, фактор роста кости, белок, стимулирующий кость, кальцитонин, инсулин, атриопептин, хрящевой стимулирующий фактор, элкатонин, фактор, активирующий соединительную ткань, ингибитор пути тканевого фактора, фолликулостимулирующий гормон, лютеинизирующий гормон, релизинг-гормон лютеинизирующего гормона, факторы роста нервов (например, фактор роста нервов, цилиарный нейротрофический фактор, фактор-1 аксогенезиса, мозговой натрий-уретический пептид, глиоцитарный нейротрофический фактор, нетрин, фактор, ингибирующий нейрофил, нейротрофический фактор, неутурин и т.д.), паратиреоидный гормон, релаксин, секретин, соматомедин, фактор роста инсулинового типа, гормон коры надпочечников, глюкагон, холецистокинин, панкреатический полипептид, гастриновысвобождающий пептид, кортикотропин-высвобождающий фактор, гормон, стимулирующий деятельность щитовидной железы, аутотоксин, лактоферрин, миостатин, рецепторы (например, TNFR(P75), TNFR(P55), рецептор IL-1, рецептор VEGF, рецептор, активирующий фактор B-клеток и т.д.), антагонисты рецепторов (например, IL1-Ra и т.д.), антигены клеточной поверхности (например, CD 2, 3, 4, 5, 7, 11а, 11b, 18, 19, 20, 23, 25, 33, 38, 40, 45, 69 и т.д.), моноклональные антитела, поликлональные антитела, фрагменты антител (например, scFv, Fab, Fab', F(ab')2, и Fd), и вирусные антигены, используемые для получения вакцин. Физиологически активный полипептид, пригодный в настоящем изобретении, может быть нативной формы, может быть продуцирован генетической рекомбинацией с использованием прокариотических клеток, таких как E. coli, или эукариотических клеток, таких как дрожжевые клетки, клетки насекомых и клетки животных, или может быть производным, имеющим одну или несколько аминокислотных мутаций, но показывающий биологическую активность такую же, как и у нативной формы.
В предпочтительном варианте осуществления настоящего изобретения фрагмент области Fc иммуноглобулина изготовлен с использованием трансформанта HM11201, присоединенного к человеческому эритропоэтину (ЕРО), с использованием полиэтиленгликоля, что, таким образом, обеспечивает белковый конъюгат EPO-PEG и области Fc иммуноглобулина. Было найдено, что этот белковый конъюгат показывает удлиненное время полужизни в сыворотке по сравнению не только с нативной EPO, но также по отношению к Aranesp (Amgen), известному как второе поколение EPO, имеющее улучшенное время полужизни в сыворотке. Таким образом, область Fc иммуноглобулина, лишенная начального метионинового остатка, полученная из внутриклеточных включений, с использованием шарнирной области, в соответствии с настоящим изобретением, может быть использована для увеличения времени полужизни в сыворотке и физиологической активности полипептида, присоединенного к ней, при отсутствии риска возникновения иммунного ответа.
Лучшее понимание настоящего изобретения может быть достигнуто при помощи следующих примеров, которые излагаются в иллюстративных целях, и не должны восприниматься как ограничение настоящего изобретения.
ПРИМЕР 1
Конструирование экспрессирующего вектора области Fc человеческого иммуноглобулина IgG4 экспрессия и очистка области IgG4, и анализ N-концевой последовательности
<1-1> Конструирование экспрессирующего вектора области Fc IgG4
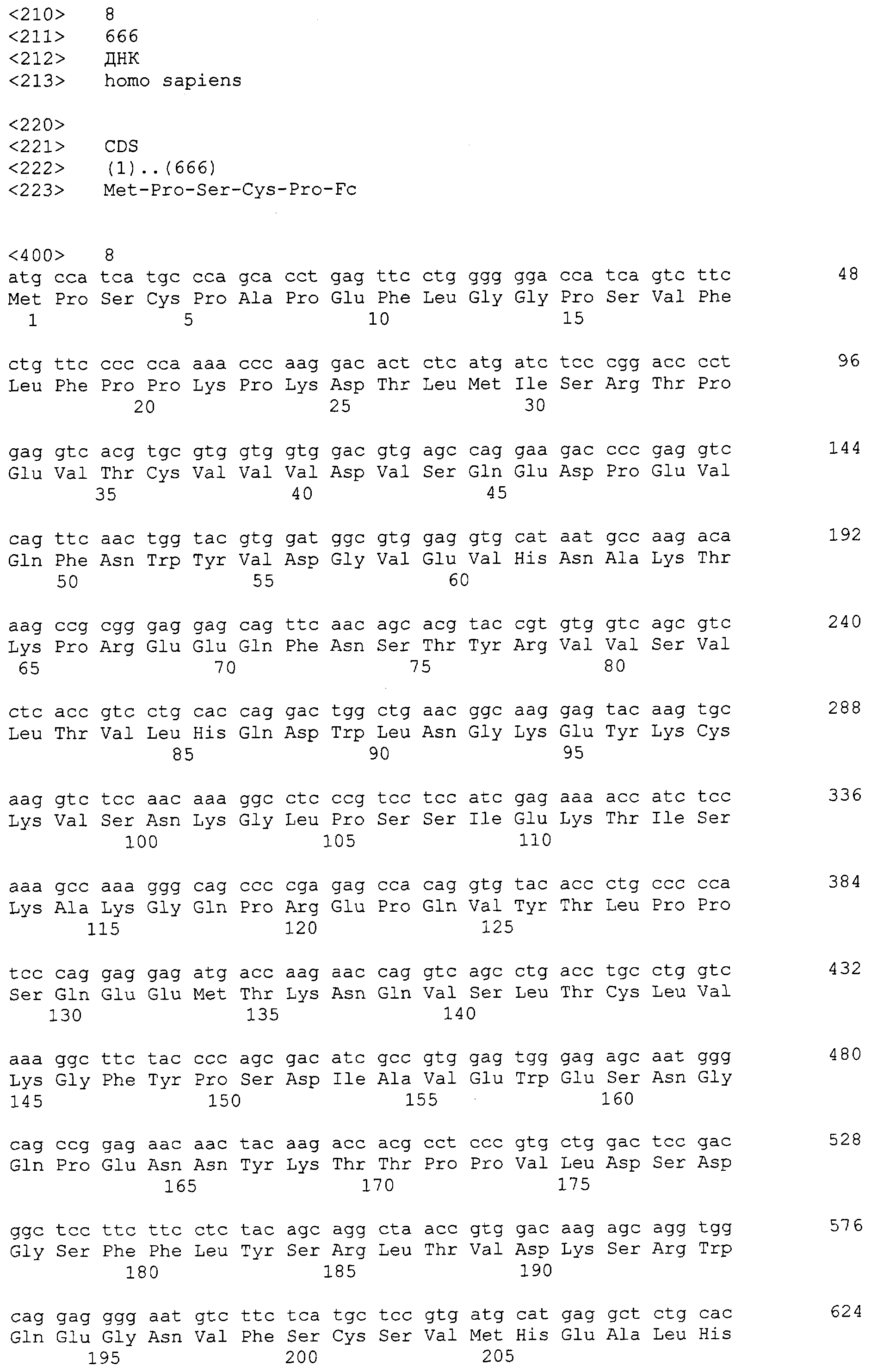
Чтобы клонировать тяжелую цепь области Fc, включающую шарнирную область человеческого иммуноглобулина IgG4, была проведена RT-PCR с РНК из клеток человеческой крови, служащими как образец, как изложено ниже. Сначала вся РНК была выделена из приблизительно 6 мл крови набором Qiamp RNA blood (Qiagen), и амплификация гена была проведена с использованием всей РНК, как образца, при помощи набора One-Step RT-PCP (Qiagen). Чтобы амплифицировать гены, имеющие различные N-концевые последовательности, были использованы пары праймеров, представленные SEQ ID NO: 1 и 2, 3 и 2, 4 и 2, и 5 и 2. Чтобы облегчить последующую процедуру клонирования гена, участок распознавания Nde I и инициирующий кодон ATG, необходимые для экспрессии белка, были введены в 5'-праймеры SEQ ID NO: 1, 3, 4 и 5, и участок распознавания BamHI, содержащий стоп кодон в 3'-праймерах SEQ ID NO: 2. Продукты амплификации областей Fc были расщеплены с Nde I и Hind III и вставлены в pET22b (Novagen), обработанную тем же рестрикционным ферментом, что дало, таким образом, соответственно рекомбинантные плазмиды. Эти плазмиды были сконструированы как имеющие части общей аминокислотной последовательности Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro шарнирной области IgG4, как изложено ниже.
Плазмида, которая содержит амплифицированный ген с SEQ ID NO: 1 и 2, была названа mpSCPFc и была прикреплена к последовательности ДНК, кодирующей N-концевую аминокислотную последовательность, начинающуюся с Met-Ser-Cys-Pro, как определено при помощи секвенирования нуклеотидов, SEQ ID NO: 6, соответствующую аминокислотной последовательности SEQ ID NO: 7. Плазмида, которая содержит амплифицированный ген SEQ ID NO: 3 и 2, была названа pmPSCFc и была прикреплена к последовательности ДНК, кодирующей N-концевую аминокислотную последовательность, начинающуюся с Met-Pro-Ser-Cys-Pro, как определено при помощи секвенирования нуклеотидов, SEQ ID NO: 8, соответствующую аминокислотной последовательности SEQ ID NO: 9. Плазмида, которая содержит амплифицированный ген SEQ ID NO: 4 и 2, была названа pmCPSFc и была прикреплена к последовательности ДНК, кодирующей N-концевую аминокислотную последовательность, начинающуюся с Met-Cys-Pro-Ser-Cys-Pro, как определено при помощи секвенирования нуклеотидов, SEQ ID NO: 10, соответствующую аминокислотной последовательности SEQ ID NO: 11. Плазмида, которая содержит амплифицированный ген SEQ ID NO: 5 и 2, была названа pmCPFc и была прикреплена к последовательности ДНК, кодирующей N-концевую аминокислотную последовательность, начинающуюся с Met-Cys-Pro, как определено при помощи секвенирования нуклеотидов, SEQ ID NO: 12, соответствующую аминокислотной последовательности SEQ ID NO: 13.
Экспрессирующие векторы были трансформированы в E. coli BL21 (DE3) чтобы получить трансформанты, обозначенные BL21/pmSCPFc(HM11200), BL21/pmPSCFc(HM11201), BL21/pmCPSFc(HM11204) и BL21/pmCPFc(HM11205). Трансформанты BL21/pmSCPFc(HM11200) и BL21/pmPSCFc(HM11201) поместили на хранение в Korean Culture Center of Microorganisms (KCCM) 20 июня 2005 под номерами доступа KCCM-10659Р и KCCM-10660Р, соответственно, и трансформанты BL21/pmCPSFc(HM11204) и BL21/pmCPFc(HM11205) в KCCM 28 июля 2005 под номерами доступа KCCM-10665Р и KCCM-10666Р, соответственно.
<1-2> Экспрессия и очистка IgG4 Fc
Бактериальные трансформанты, полученные в примере <1-1>, были инокулированы в соответствующие ферментеры (Marubishi Company) и им обеспечили условия роста, с последующим определением, экспрессировали ли они фрагменты области Fc иммуноглобулина.
Сначала каждый трансформант был выращен в 100 мл среды LB при перемешивании в течение ночи, и инокулирован в ферментер для крупномасштабного культивирования. Ферментер был выдержан при температуре 28°С или 35°С. Для предотвращения перехода от аэробной к анаэробной окружающей среде культуры вентилировали воздухом при 20 об./об./мин и перемешивали при 500 об/мин. Чтобы скомпенсировать неэффективные для роста бактерий питательные вещества, в течение ферментации к культурам были добавлены экстракты глюкозы и дрожжей в соответствии с ферментационными состояниями бактерий. Когда культуры достигли значения OD600 = 80, индуктор, IPTG, был добавлен к культурам, чтобы вызвать экспрессию белка. Культуры дополнительно культивировали в течение 40-45 часов, до увеличения значения OD600 до 100-120.
Экспрессию иммуноглобулина Fc, образование «тел включений» и образование димера экспрессированного иммуноглобулина Fc в трансформированных клетках E. coli исследовали как изложено ниже. Чтобы исследовать всю внутриклеточную экспрессию областей Fc иммуноглобулина, части ферментированных растворов были смешаны с эквивалентными объемами 2× буфера белкового образца и подвергнуты электрофорезу на 15% SDS-PAGE геле (Criterion Gel, Bio-Rad). Как результат, было замечено, что иммуноглобулин Fc сверхэкспрессируется во всех продуцированных трансформированных клетках. Затем клетки были разрушены с использованием ультразвукового аппарата (Misonix Company). Клеточный лизат, полученный таким образом, был центрифугирован, чтобы отделить водорастворимые соединения от водонерастворимых соединений. Было найдено, что большинство сверхэкспрессированных соединений существует как «тела включения», как измерено электрофорезом на 15% SDS-PAGE геле. «Тела включения» были подвергнуты последующему процессу рефолдинга, для того, чтобы исследовать, до какой степени Fc была подвергнута рефолдингу и в какой степени образованы димерные области Fc. 10 г ферментативного раствора подвергли ультразвуковой обработке в 100 мл лизисного буфера (10 мМ Трис, pH 9,0, 1 мМ ЭДТА, 0,5% Тритона Х-100, 0,2M NaCl) чтобы разрушить клетки. Центрифугирование при 10000 об/мин в течение 20 мин разделяет клеточный лизат на водорастворимую фракцию и водонерастворимую фракцию как «тела включения». 2 г этих «тел включения» были солюбилизированы в смеси 20 мл 1 М Триса (pH 9,0) и 20 мл растворяющего буфера (6 М гуанидина, 50 мМ Триса) и дали возможность реагировать при слабом перемешивании при 4°С в течение 30 мин. При последующем завершение реакции раствор внутриклеточного включения смешивали в течение ночи с 10 объемами буфера для рефолдинга (2 М мочевины, 50 мМ Триса, 0,25 М аргинина, 3 мМ цистеина, pH 9,0) при слабом перемешивании. К этой смеси был добавлен буфер протеинового образца, лишенный любого восстановителя, такого как DTT или бета-меркаптоэтанол, с последующим электрофорезом на 15%-SDS-PAGE геле (Criterion Gel, Bio-Rad). Области локализации белка были визуализированы с помощью красителя, такого как кумасси бриллиантовый. Фиг.1 представляет собой сделанную фотографию геля, на котором белки, подвергнутые рефолдингу из внутриклеточных включений, экспрессированы трансформантом HM11201 при 32°С (дорожка 1) и 28°С (дорожка 2), HM11200 при 28°С (дорожка 3) и 32°С (дорожка 4), HM11204 при 28°С (дорожка 5) и 32°С (дорожка 6) и HM11205 при 32°С (дорожка 7) и 28°С (дорожка 8) пропущены в присутствии электрического поля, вместе с белком Fc, в качестве стандарта, очищенного от E. coli, в соответствии с традиционным способом (дорожка С). Как видно на фиг.1, значительная часть всех белков приписана белку Fc, значительная часть которого существует в димерной форме после рефолдинга. Однако белки Fc отличаются в соотношении димеров к мономерам от одного трансформанта к другому, т.е. в соответствии с N-концевой аминокислотной последовательностью, экспрессированной трансформантом. Например, значительная часть белков Fc HM11201, которые начинаются с Met-Pro-Ser-Cys-Pro-CH2-CH3, существует в димерной форме. Почти все белки Fc HM11205, которые начинаются с Met-Cys-Pro-CH2-CH3, существует как мономеры, но ни один не существует в димерной форме. Полагается, что это приписывается к факту, что специфичность обработки аминопептидазы в клетках носителя меняется в зависимости от Fc N-концевой последовательности.
<1-3> Анализ N-концевой последовательности
Фрагменты димерной области Fc иммуноглобулина, подвергнутые рефолдингу из внутриклеточных включений, отличаются аминокислотной последовательностью от дикого типа из-за присутствия начального метионинового остатка. Для того чтобы определить, преобразуется ли метиониновый остаток протеазами E. coli, N-концевые аминокислотные последовательности были проанализированы Basic Science Research Institute, Seoul, Korea. Образцы, используемые в анализе аминокислотной последовательности, были получены, как изложено ниже.
Сначала PVDF мембрана (Bio-Rad) была погружена в метанол приблизительно на 2-3 сек для активации и была достаточно смочена блокирующим буфером (170 мМ глицина, 25 мМ Трис-HCl, (pH 8,0), 20% метанола). Образцы белка, отделенные на не восстановленном SDS-PAGE геле, полученные в примере <1-2>, были впитаны в PVDF мембрану приблизительно на один час, с использованием блоттинг-набора (Hoefer Semi-Dry Transfer Unit, Amersham). Белки, перенесенные на PVDF мембрану, были окрашены белковым красителем кумасси голубым R-250 (Amnesco) на мгновение (3-4 сек) и промыты обесцвечивающим раствором (вода: уксусная кислота: метанол = 5:1:4). Затем фрагменты мембраны, содержащие белки, были вырезаны ножницами и подвергнуты анализу N-концевой последовательности.
Как результат, было найдено, что белки Fc IgG4, включая шарнирную область, имеют N-концевую последовательность Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys Pro-Ser-Cys-Pro-CH2-CH3. Аминокислотные последовательности и N-концевые последовательности белков, экспрессированные в трансформанты, представлены в следующей таблице 1.
Из данных анализа секвенирования белков следует, что подвергнутые рефолдингу фрагменты Fc из внутриклеточных включений, продуцируемые трансформированными клетками E. coli настоящего изобретения, были подвергнуты процессингу и обладают точной N-концевой аминокислотной последовательностью, лишенной начального аминокислотного остатка. Белковый продукт, который остается в мономерной форме даже после рефолдинга, лишен цистеиновых остатков, и, таким образом, не может образовывать димеры. В добавление к этому, как видно из фиг.1, часть мономера в подвергнутых рефолдингу фрагментах Fc отличается от одного трансформанта к другому, и не существует никаких димеров в HM11205. Эти результаты показывают, что аминокислотная последовательность N-концевого участка имеет большое влияние на трансформирование N-конца, так что белок, имеющий желаемую N-концевую последовательность, может быть получен модулированием N-концевой последовательности. Белки, даже если они имеют одинаковую аминокислотную последовательность, могут быть по-разному трансформированы в зависимости от условий культивирования клеток носителя E. coli, особенно от температуры культивирования, как раскрыто при помощи следующих тестов. HM11200, выращенный при низких температурах (28°С~32°С), экспрессировал слитый белок Fc, в растворимой форме в тех же количествах, что и в форме «тел включения». Растворимая форма слитого белка Fc существовала как мономер, лишенный N-концевой аминокислотной последовательности Met-Ser-Cys. Таким образом, авторы настоящего изобретения обнаружили, что регулируемое соотношение мономерных и димерных фрагментов Fc иммуноглобулина может быть получено модулированием N-концевой аминокислотной последовательности слитого белка Fc и условий культивирования клеток носителей.
Чтобы количественно определить экспрессию областей Fc иммуноглобулина в трансформированных клетках E. coli, области Fc иммуноглобулина раствора рефолдинга были очищены с использованием колонки протеин-А для аффинной хроматографии, которая, как известно, имеет сильную аффинность к иммуноглобулинам, как изложено ниже.
«Тела включения», собранные центрифугированием, были подвергнуты рефолдингу и затем очищены колоночной хроматографией. После пропускания 5 мл колонка протеин-А для аффинной хроматографии (Pharmacia) была сбалансирована PBS, клеточные лизаты были загружены в колонку при скорости потока 5 мл/мин. Несвязанные белки были смыты PBS, а связанные белки элюировали 100 мМ цитрата (pH 3,0). Собранные фракции были обессолены с использованием высаливающей колонки HiPrep 26/10 (Pharmacia) 10 мМ Трис буфера (pH 8,0). Затем вторая анионообменная колоночная хроматография была проведена с использованием 50 мл колонки Q HP 26/10 (Pharmacia). Первично очищенные рекомбинантные области Fc иммуноглобулина были загружены в Q-Сефароза-колонку HP 26/10 (Pharmacia) и колонку элюировали с линейным градиентом (0-0,2М NaCl) в 10 мМ Трис буфера (pH 8,0), что дало, таким образом, высокочистые фракции. После частичной очистки с использованием колонки протеин-А для аффинной хроматографии были определены уровни экспрессии рекомбинированных областей Fc иммуноглобулина, и результаты представлены в таблице 2 ниже.
ПРИМЕР 2
Конструирование экспрессирующего вектора области Fc человеческого иммуноглобулина IgG1. Экспрессия и очистка области Fc IgG1, и анализ N-концевой последовательности
<2-1> Конструирование экспрессирующего вектора области Fc IgG1
Чтобы клонировать тяжелую цепь области Fc, включая шарнирную область человеческого иммуноглобулина IgG1, была проведена RT-PCR тем же способом, как и в примере <1-1>. Чтобы амплифицировать гены, имеющие различные N-концевые последовательности, были использованы следующие праймеры.
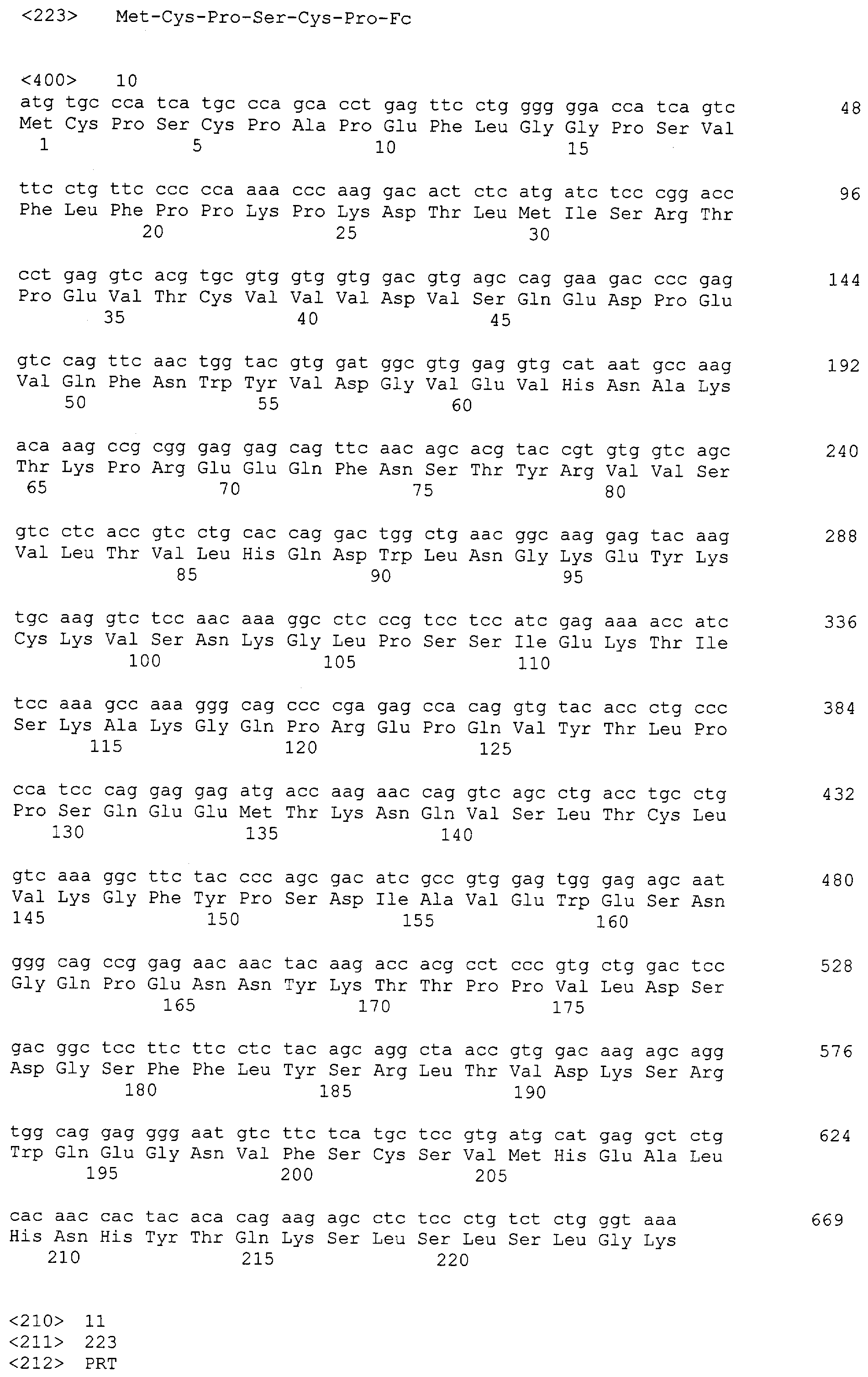
Что касается 3'-праймера, он имел последовательность 5'-CGC GGA TCC TCA TTT ACC CGG AGA СAG GGA GAG GСT CTT C-3' и был использован для амплификации всех генов, имеющих различные N-концевые последовательности. Для облегчения последующей процедуры клонирования генов, участок распознавания Nde I был введен в каждый 5'-праймер, а участок распознавания BamHI в каждый 3'-праймер. Продукты области Fc, амплифицированные парами праймеров, были вставлены в вектор, что, таким образом, дало соответствующие рекомбинантные плазмиды, сконструированные, чтобы иметь в своем составе части общей аминокислотной последовательности Glu-Pro-Lys-Ser-Cys-Asp-Lys-Thr-His-Thr-Cys-Pro-Pro-Cys-Pro шарнирной области IgG1, как изложено ниже. Плазмида, которая содержит ген, амплифицированный MEPK-праймером, была названа pMEPKFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Glu-Pro-Lys, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 22, соответствующую аминокислотной последовательности SEQ ID NO: 23. Плазмида, которая содержит ген, амплифицированный MSCD-праймером, была названа pMSCKFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Ser-Cys-Asp, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 24, соответствующую аминокислотной последовательности SEQ ID NO: 25. Плазмида, которая содержит ген, амплифицированный MDKT-праймером, была названа pMDKTFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Asp-Lys-Thr, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 26, соответствующую аминокислотной последовательности SEQ ID NO: 27. Плазмида, которая содержит ген, амплифицированный MCPA-праймером, была названа pMCPAFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 28, что соответствует SEQ ID NO: 29. Плазмида, которая содержит ген, амплифицированный MPKS праймером, была названа pMPKSFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Pro-Lys-Ser, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 30, что соответствует SEQ ID NO: 31. Плазмида, которая содержит ген, амплифицированный MCPP-праймером, была названа pMCPPFc1 и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Cys-Pro-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 32, что соответствует SEQ ID NO: 33. Плазмида, которая содержит ген, амплифицированный MPPC-праймером, была названа pMPPCFc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Pro-Pro-Cys, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 34, что соответствует SEQ ID NO: 35. Плазмида, которая содержит ген, амплифицированный MPCP праймером, была названа pMPCPFc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG1, начинающуюся с Met-Pro-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 36, соответствующую SEQ ID NO: 37. Экспрессирующие векторы были трансформированы в E. coli BL21 (DE3), чтобы получить трансформанты, обозначенные, соответственно, как BL21/pMERKFc1(HM11206), BL21/pMSCDFc1(HM11207), BL21/pMDKTFc1(HM11208), BL21/pMCPAFc1(HM11209), BL21/pMPKSFc1(HM11210), BL21/pMCPPFc1(HM11211), BL21/pMPPCFc1(HM11212) и BL21/pMРСРFc1(HM11213).
<2-2> Экспрессия и очистка Fc IgG1
Как и в случае IgG4, бактериальные трансформанты, полученные в примере <2-1>, были инокулированы в соответствующие ферментеры (Marubishi Company), и им обеспечили условия роста, с последующим определением, экспрессировали ли они фрагменты области Fc иммуноглобулина.
Сначала каждый трансформант вырастили в 100 мл среды LB при перемешивании в течение ночи и инокулировали в ферментер для крупномасштабного культивирования. Ферментер был выдержан при температуре 28°С или 35°С. Для предотвращения перехода от аэробной к анаэробной окружающей среде, культуры вентилировали воздухом при 20 об./об./мин и перемешивали при 500 об/мин. Чтобы скомпенсировать неэффективные для роста бактерий питательные вещества, в течение ферментации к культурам были добавлены экстракты глюкозы и дрожжей в соответствии с ферментационными состояниями бактерий. Когда культуры достигли значения OD600 = 80, индуктор, IPTG, был добавлен к культурам, чтобы вызвать экспрессию белка. Культуры дополнительно культивировали в течение 40-45 часов, до увеличения значение OD600 до 100-120.
Экспрессию иммуноглобулина Fc, образование «тел включения» и образование димера экспрессированного иммуноглобулина Fc в трансформированных клетках E. coli, исследовали, как изложено ниже. Чтобы исследовать всю внутриклеточную экспрессию областей Fc иммуноглобулина, были взяты аликвоты ферментированных растворов до и после введения.
Части ферментированных растворов были смешаны с эквивалентными 2× объемами буфера белкового образца и подвергнуты электрофорезу на 15% SDS-PAGE геле (Criterion Gel, Bio-Rad) в следующих восстановительных условиях. Результаты электрофореза представлены на фиг.7. Стандарт Fc IgG4 был пропущен по дорожке 1, в то время как уровни экспрессии трансформанта HM11208 по времени показаны на дорожках 2-4, и уровни экспрессии трансформанта HM11206 по времени показаны на дорожках 5-7. Уровни экспрессии в трансформантах HM11207, HM11212, HM11209, HM11210, HM11213 и HM11211 показаны на дорожках 8-13, соответственно. Как видно на фиг.7, одиночная полоска 30 кДа (область Fc), которая не наблюдалась до введения IPTG, очень отчетливо появляется во всех образцах, которые подверглись введению IPTG, что показывает, путем сопоставления с образцом G4Fc, что рекомбинантные области Fc IgG1 были экспрессированы. Также, области Fc были сверхэкспрессированы, что составляет, по меньшей мере, приблизительно 30% от общего количества экспрессированных белков.
Чтобы количественно определить экспрессию областей Fc иммуноглобулина в трансформированных клетках E. coli, области Fc иммуноглобулина раствора рефолдигна были очищены аналогичным образом тому, как были очищены Fc IgG4 с использованием колонки протеин-А для аффинной хроматографии, которая, как известно, имеет сильную аффинность к иммуноглобулинам.
Было обнаружено среди трансформантов, что плазмида pMSCDFc имеет наивысшую степень экспрессии, которая достигает 340 мг на 10 г "тела включения", в то время как трансформанты pMDKTFc, pMEPKFc, pMPPCFc и pMPCPFc показали степени экспрессии 133,3 мг, 159 мг, 110 мг и 120 мг, соответственно.
Содержания димерной Fc IgG1 в продуктах экспрессии было измерено тем же способом, который использовался для определения содержания димерной Fc IgF4. Клетки ферментированных растворов были разрушены с использованием ультразвукового аппарата (Misonix Company). Клеточный лизат, полученный таким образом, был центрифугирован, чтобы отделить водорастворимые соединения от водонерастворимых соединений. Было найдено, что большинство сверхэкспрессированных соединений существует как «тела включения», как измерено электрофорезом на 15% SDS-PAGE. «Тела включения» были подвергнуты последующему процессу рефолдинга, для того чтобы исследовать, до какой степени Fc была подвергнута рефолдингу, и образованы ли, и в какой степени, димерные области Fc. Подвергнутые рефолдингу белки Fc были очищены с использованием колонки протеин-А для аффинной хроматографии и смешаны с буфером белкового образца, лишенного любого восстановителя, такого как DTT или бета-меркаптоэтанол, с последующим электрофорезом на 15% SDS-PAGE (Criterion Gel, Bio-Rad). Области локализации белка были визуализированы с помощью красителя, такого как Кумасси Бриллиантовый.
Фиг.8 представляет собой фотографию геля, на котором выходы белков с колонки протеин-А, подвергнутые рефолдингу из «тел включения», экспрессированных реформантом HM11208 (дорожка 1), реформантом HM11206 (дорожка 2), реформантом HM11207 (дорожка 4), реформантом HM11212 (дорожка 5) и реформантом HM11213 (дорожка 7), были пропущены в присутствии электрического поля, в условиях отсутствия восстановителей, вместе с белком Fc IgG4 в качестве стандарта (дорожки 3, 6 и 8). Как видно на фиг.8, было найдено, что все фрагменты Fc IgG1, используемые в тесте, образуют димеры, хотя их количество различается в некоторой степени.
<2-3> Анализ N-концевой последовательности
Как идентифицировано в случае Fc IgG4, N-концевая аминокислотная последовательность определяла посттрансляционный процессинг в отношении того, остался ли начальный метиониновый остаток, или был ли начальный метиониновый остаток аккуратно процессирован, или вместе с другими аминокислотными остатками образует аминокислотную последовательность, отличную от желаемой. Для того чтобы определить, процессирован ли метиониновый остаток протеазами E. coli, были проанализированы различные N-концевые аминокислотные последовательности областей IgG1 Fc Basic Science Research Institute, Seoul, Korea. Результаты анализа суммированы ниже в таблице 4.
Как видно из таблицы 4, начальный метиониновый остаток остается непроцессированным в трансформантах HM11208 и HM11206, в которых области Fc IgG1 были сверхэкспрессированы в димерных формах, в то время как продукты ферментации HM11207, HM11212 и HM11213 не имеют начальных метиониновых остатков в результате точного посттрансляционного процессинга.
Взятые вместе, данные, полученные при помощи вышеперечисленных экспериментов, показывают, что, когда область Fc IgG1 экспрессирована в E. coli, ее N-концевая аминокислотная последовательность определяет экспрессию, уровень экспрессии, долю димера и ее N-концевую процессию, и что области Fc, лишенные начальных метиониновых остатков могут быть изготовлены в массовом масштабе с использованием N-концевой последовательности. Области Fc IgG1, полученные в соответствии с настоящим изобретением, могут быть использованы для увеличения времени полужизни в сыворотке и физиологической активности физиологически активного полипептида, присоединенного к ней, без возникновения иммунного ответа вследствие добавления внешних аминокислотных остатков.
ПРИМЕР 3
Конструирование экспрессирующего вектора области Fc человеческого иммуноглобулина IgG2
<3-1> Конструирование экспрессирующего вектора области Fc IgG2
Чтобы клонировать тяжелую цепь области Fc, включая шарнирную область IgG2, RT-PCR была проведена тем же способом, что использовался для области Fc IgG4. Чтобы амплифицировать гены, имеющие различные N-концевые последовательности, были использованы следующие праймеры.
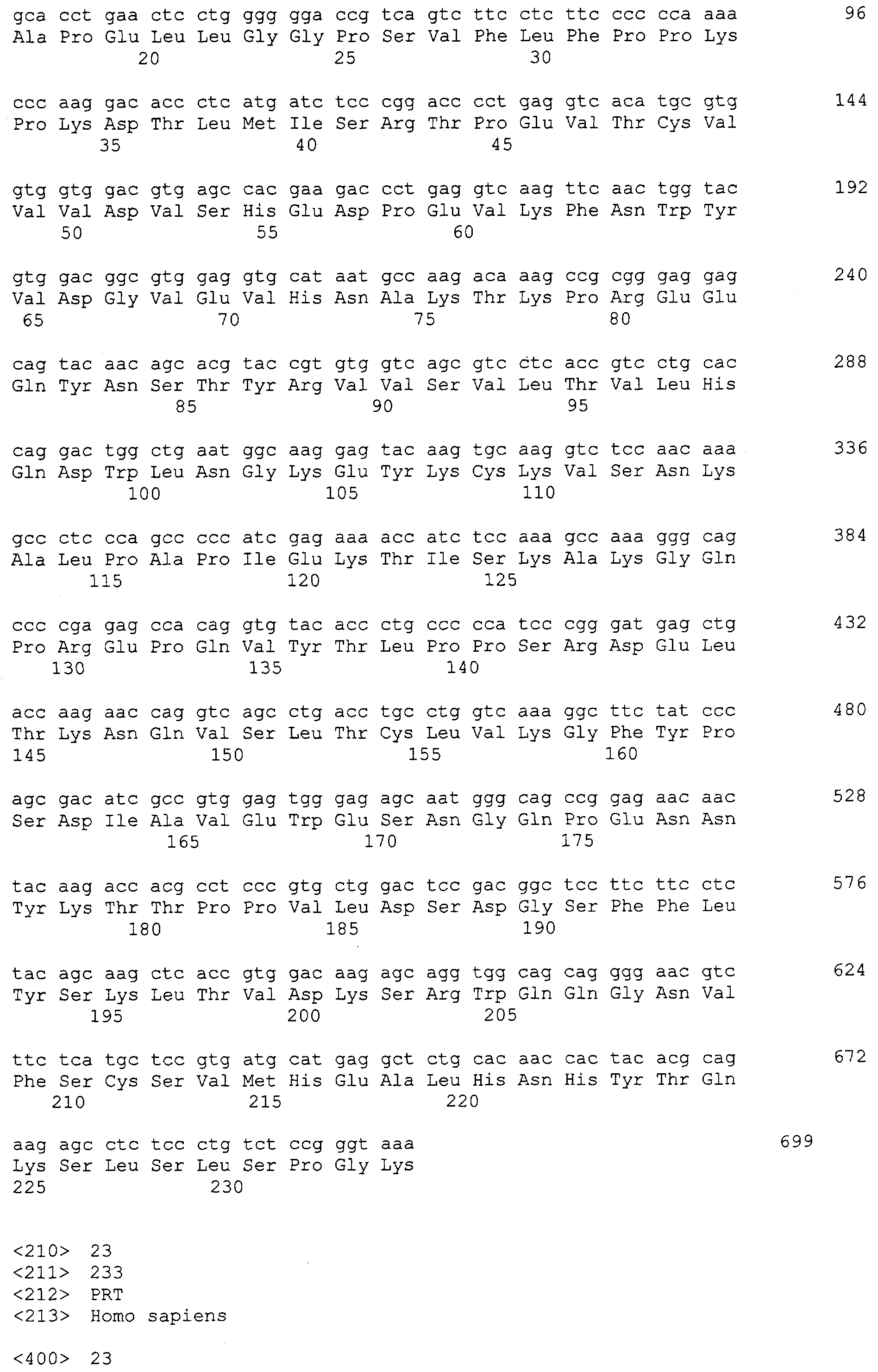
3'-праймер имел последовательность 5'-CGC GGA TCC TCA TTT ACС CGG AGA CAG GGA GAG GCT CTT C-3' и был использован для амплификации всех генов, имеющих различные N-концевые последовательности. Для облегчения последующей процедуры клонирования генов, участок распознавания NdeI был введен в каждый 5'-праймер, и участок распознавания BamHI - в каждый 3'-праймер. Продукты области Fc, амплифицированные парами праймеров, были вставлены в вектор, что, таким образом, предоставляло соответственные рекомбинантные плазмиды, сконструированные, чтобы иметь части общей аминокислотной последовательности Glu-Arg-Lys-Cys-Cys-Val-Glu-Cys-Pro-Pro-Cys-Pro шарнирной области IgG1, как изложено ниже. Плазмида, которая содержит ген, амплифицированный праймером G2MPPCSS, была названа pmPPCG2Fc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG2, начинающуюся с Met-Pro-Pro-Cys, которое, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 38, что соответствует аминокислотной последовательности SEQ ID NO: 39. Плазмида, которая содержит ген, амплифицированный праймером G2MPCPSS, была названа pmPCPG2Fc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG2, начинающуюся с Met-Pro-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 40, что соответствует аминокислотной последовательности SEQ ID NO: 41. Плазмида, которая содержит ген, амплифицированный праймером G2MCPSS, была названа pmCPG2Fc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG2, начинающуюся с Met-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 42, что соответствует аминокислотной последовательности SEQ ID NO: 43. Плазмида, которая содержит ген, амплифицированный праймером G2MСCVSS, была названа pmCCVG2Fc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG2, начинающуюся с Met-Cys-Cys-Val-Glu-Cys-Pro-Pro-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 44, что соответствует аминокислотной последовательности SEQ ID NO: 45. Плазмида, которая содержит ген, амплифицированный праймером G2MСVESS, была названа pmCVEG2Fc и была прикреплена к последовательности ДНК, кодирующей СН2 или СН3 IgG2, начинающуюся с Met-Cys-Val-Glu-Cys-Pro-Pro-Cys-Pro, которая, как проанализировано путем секвенирования нуклеотидов, имеет SEQ ID NO: 46, что соответствует SEQ ID NO: 47. Экспрессирующие векторы были трансформированы в E. coli BL21 (DE3) чтобы получить трансформанты, обозначенные соответственно как BL21/pmPPCPG2Fc (HM11214), BL21/pmPCPG2Fc (HM11215), BL21/pmCPG2Fc (HM11216), BL21/pmССVG2Fc (HM11217) и BL21/pmCVEG2Fc (HM11218).
<3-2> Экспрессия, очистка и анализ N-концевой последовательности Fc IgG2
Как и в случае IgG4, бактериальные трансформанты, полученные в примере <3-1>, были инокулированы в соответствующие ферментеры (Marubishi Company), и им обеспечили условия роста, с последующим определением, экспрессировали ли они фрагменты области Fc иммуноглобулина. Условия культивирования незначительно отличались от тех, что использовались для Fc IgG4. Было найдено, что фрагменты областей Fc IgG2 сверхэкспрессируются в различных условиях, включая температуру, состав среды, концентрацию индуктора и т.д., как измерено SDS-PAGE в восстанавливающих условиях. Фиг.9 показывает результаты 15%-SDS-PAGE ферментированных растворов, смешанных с эквивалентными объемами 2× буфера белкового образца. Фрагмент Fc IgG4 был использован в качестве стандарта на дорожке 1, в то время как фрагменты, экспрессированные с помощью HM11214, HM11215, HM11216, HM11217 и HM11218 пропущены на дорожках 2-6, соответственно. Как видно на фиг.9, все пять трансформантов, использовавшиеся в эксперименте, сверхэкспрессировали фрагменты Fc.
Содержания димерной Fc IgG4 в продуктах экспрессии было измерено тем же способом, что и описанный выше. Клетки ферментированных растворов были разрушены, и водонерастворимые соединения клеточного лизата были подвергнуты рефолдингу, после чего только фрагменты области Fc были очищены с использованием колонки протеин-А для аффинной хроматографии. Очищенные продукты экспрессии были смешаны с буфером белкового образца, лишенным восстановителя, такого как DTT или бета-меркаптоэтанол, и разделены на 15%-SDS-PAGE (Criterion Gel, Bio-Rad). Области локализации белка были визуализированы с помощью красителя, такого как кумасси бриллиантовый. Фиг.10 показывает результаты электрофореза. Фрагмент Fc IgG4 был использован как стандарт на дорожках 1 и 7, в то время как димерные фрагменты из HM11214, HM11215, HM11216, HM11217 и HM11218 наблюдались на дорожках 2-6. Как понятно из данных фиг.10, продукты экспрессии трансформантов, хотя отличаются друг от друга, в плане N-концевой последовательности или условий экспрессии, могут все формировать димеры.
Для того чтобы определить обрабатывается ли метиониновый остаток протеазами E. coli, различные N-концевые аминокислотные последовательности были проанализированы Basic Science Research Institute, Seoul, Korea. Начальный метиониновый остаток был удален из продукта трансформантов HM11214 и HM11215, оба из которых имеют остаток пролина в положении 2.
Как видно из этих экспериментов, области Fc IgG2 могут быть экспрессированы в крупном масштабе в E. coli. В добавление к этому, данные, полученные в вышеперечисленных экспериментах, показывают, что N-концевая последовательность области Fc IgG1 определяет экспрессию, уровень экспрессии, долю димера, и ее N-концевую процессию, и что области Fc, лишенные начальных метиониновых остатков, могут быть изготовлены в массовом масштабе с использованием N-концевой последовательности. Области Fc IgG1, полученные в соответствии с настоящим изобретением, могут быть использованы для увеличения времени полужизни в сыворотке и физиологической активности физиологически активного полипептида, присоединенного к ней, без возникновения иммунного ответа из-за добавления внешних аминокислотных остатков.
ПРИМЕР 4
Связывание С1q с использованием анализа ELISA
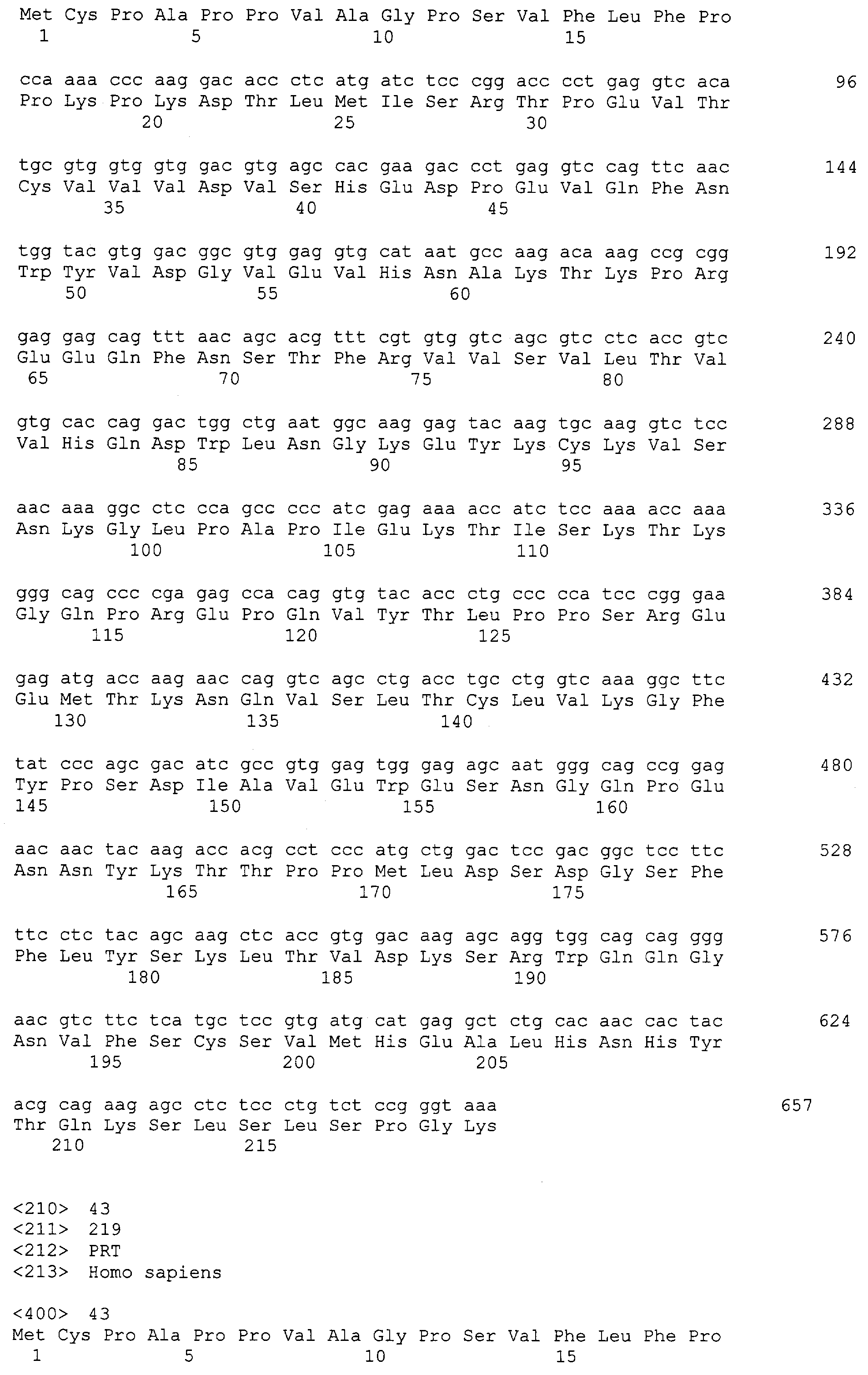
Чтобы определить, могут ли производные, полученные в примере <1-2>, и белки, соответствующие областям Fc иммуноглобулинов, экспрессированные в трансформантах E. coli и очищенные, связываться с человеческим С1q, был проведен твердофазный иммуноферментный анализ (ELISA), как описано ниже. В качестве тестовых групп были использованы области Fc иммуноглобулина, продуцированные трансформантами HM11200 и HM11201, полученные в вышеперечисленных примерах. В качестве стандартов был использован гликозилированный иммуноглобулин (IVIGG-globulin S, Green Cross PBM). Тестовые образцы и стандарты были получены в 10 мМ карбонатного буфера (рН 9,6) в концентрации 1 мкг/мл. Аликвоты образцов были помещены в 96-луночный планшет (Nunc) в количестве 200 нг в каждую лунку, и планшет был покрыт пленкой всю ночь при 4°С. После этого каждая лунка была промыта PBS-T (137 мМ NaCl, 2 мМ KCl, 10 мМ Na2HPO4, 2 мМ KH2PO4, 0,05% Твина 20) три раза, блокирована 250 мкл блокирующего буфера (1% бычий сывороточный альбумин в PBS-T) при комнатной температуре в течение 1 часа, и снова промыта тем же самым PBS-T три раза. Стандарт и тестовые образцы были разбавлены в PBS-T до заданной концентрации и добавлены к лункам, покрытым пленкой из антител, и планшет был выдержан при комнатной температуре в течение 1 часа и промыт PBS-T три раза. После этого 2 мкг/мл С1q (R&D Systems) было добавлено к планшету, и реакция протекала при комнатной температуре 2 часа, после чего планшет был промыт PBS-T шесть раз. 200 мкл 1:1000 разбавленного конъюгата человеческого антитела против С1q человека/пероксидазы (Biogenesis, USA) в блокирующем буфере было добавлено к каждой лунке, и реакция протекала при комнатной температуре 1 час. После того как каждая лунка была промыта PBS-T три раза, эквивалентные объемы цветных реагентов А и B (красящее вещество А: стабилизированный пероксид, красящее вещество В: стабилизированный хромоген; DY 999, R&D Systems) были смешаны, и 200 мкл смеси было добавлено к каждой лунке, с последующим выдерживанием в течение 30 минут. После этого 50 мкл окончательного реакционного раствора, 2М серная кислота была добавлена к каждой лунке. Планшет был считан микропланшет-ридером (Molecular Device). Оптическая плотность стандарта и тестовых образцов была измерена при 450 нм, и результаты представлены на фиг.2.
Как показано на фиг.2, белки области Fc иммуноглобулина, процессированные в E. coli в соответствии с настоящим изобретением, показывают значительно уменьшенную аффинность к С1q. Эти результаты показывают, что белки области Fc иммуноглобулина настоящего изобретения почти никогда не имеют риска вызвать иммунные ответы, такие как цитотоксичность и воспаление в организме, когда используются как переносчик для физиологически активных полипептидов в форме конъюгата.
ПРИМЕР 5
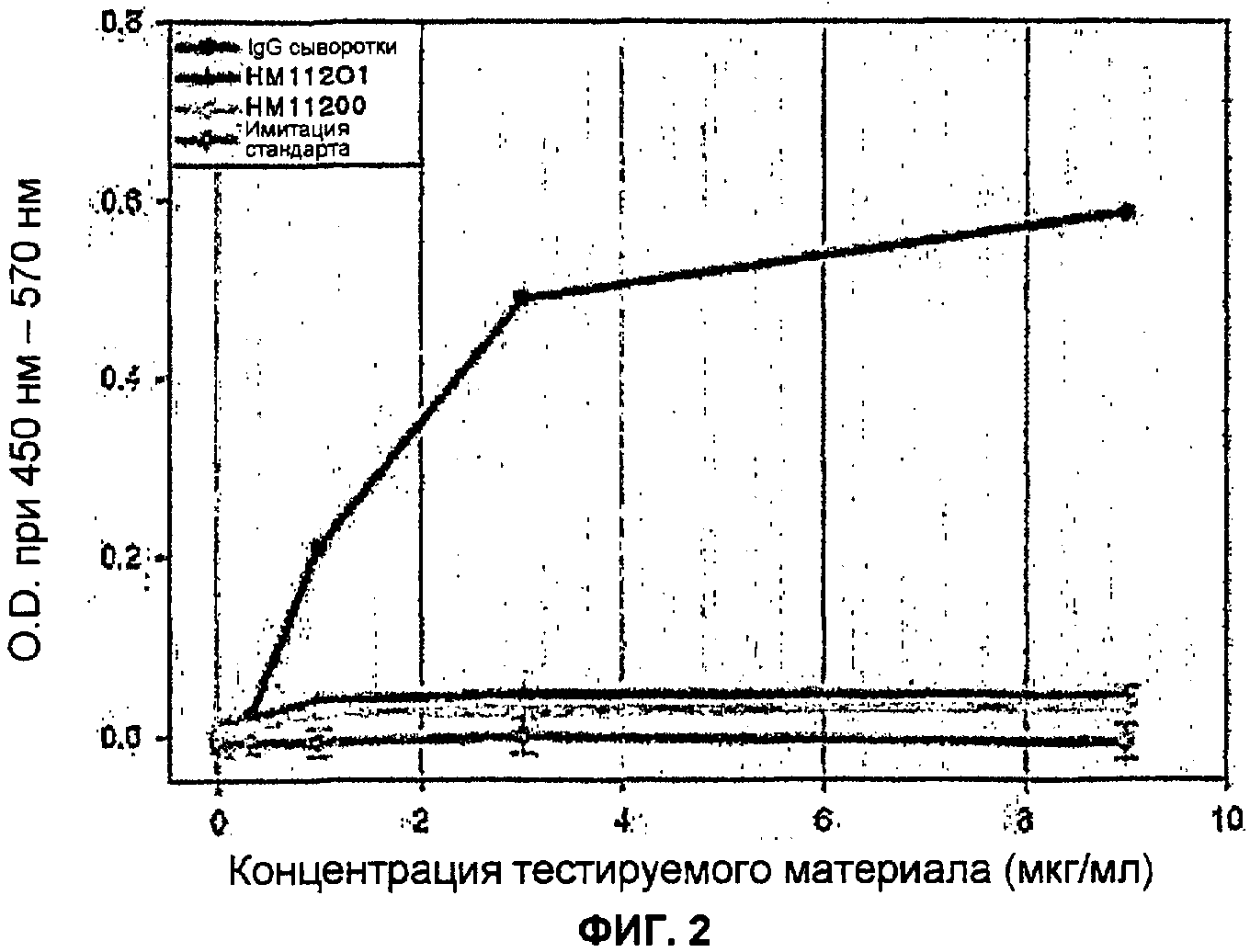
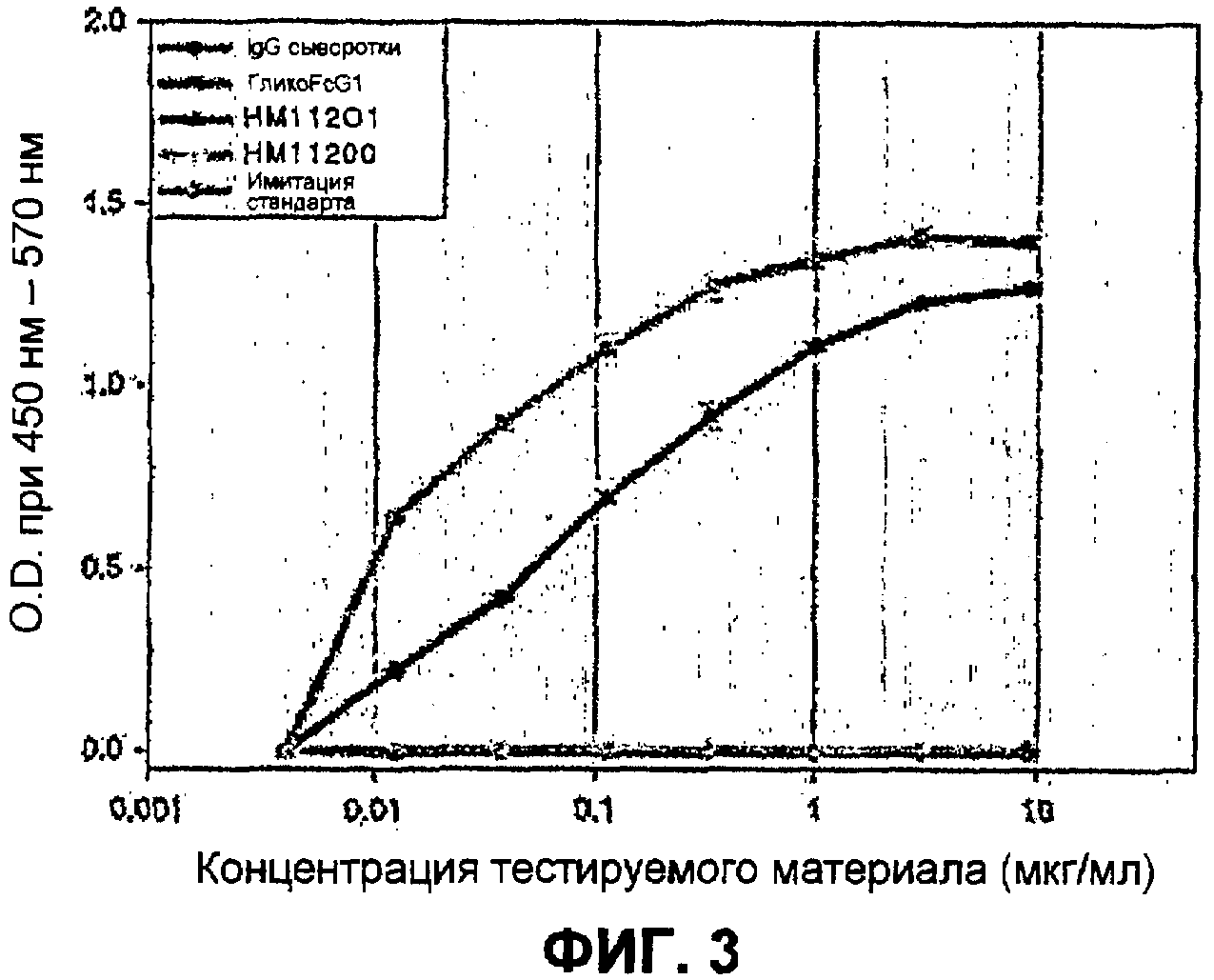
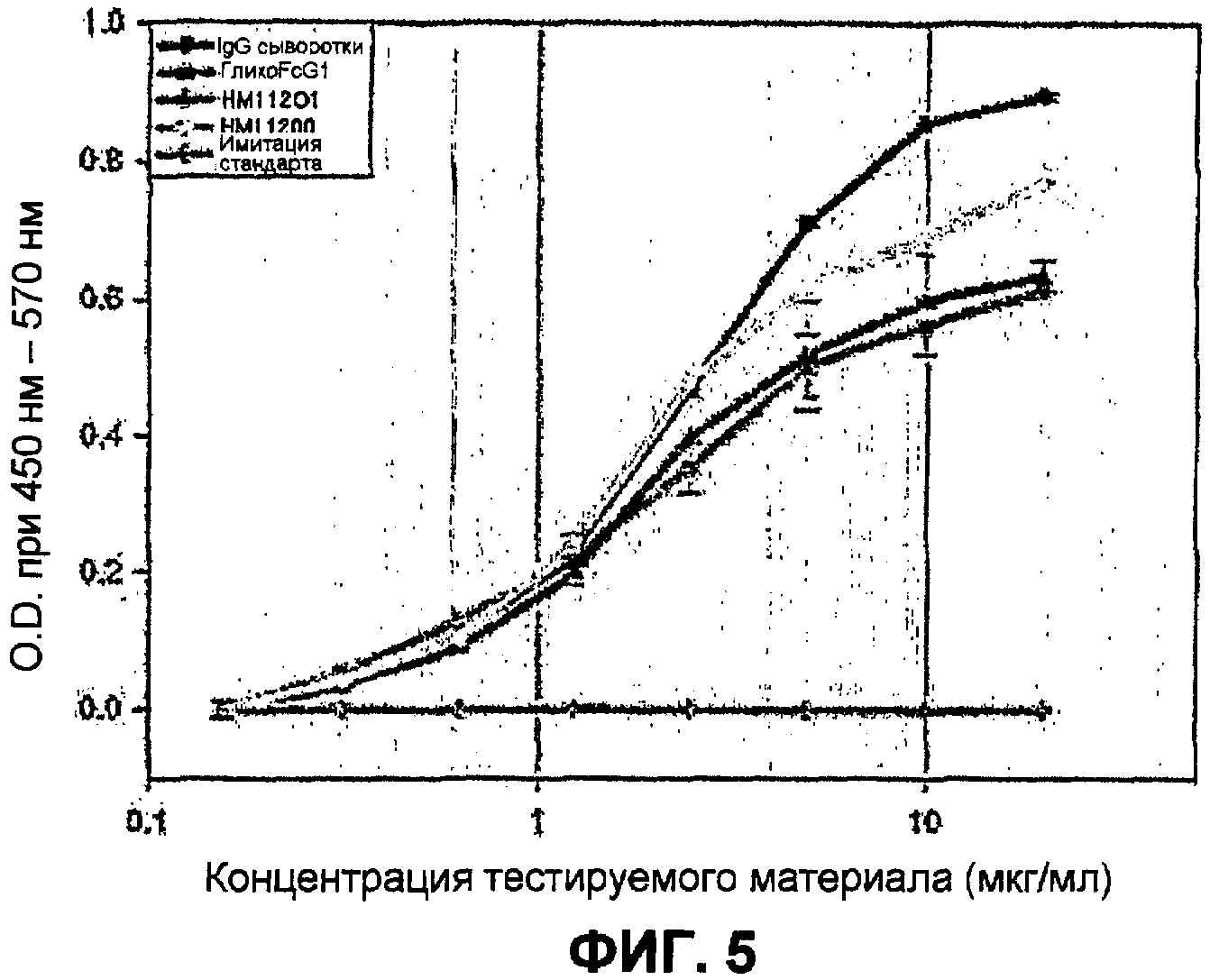
Анализ связывания с FcγRI, FcγRIII и FcRnαβ2 с использованием ELISA
Известно, что иммуноглобулин Fc связывает гематоцитные рецепторы с FcγRI и FcγRIII, что служит связующим звеном эффекторных функций, таких как антитело-зависимая цитотоксичность. Чтобы определить, служит ли иммуноглобулин Fc, изготовленный в E. Coli, связующим звеном таких эффекторных функций, каждый из рецепторов был получен и проанализирован на связывающую способность при помощи ELISA. Также, иммуноглобулин Fc был проанализирован на связывающую способность с рецептором FcRn, который, как известно, имеет влияние на метаболизм иммуноглобулина в организме, аналогичным образом.
<5-1> Конструирование штаммов экспрессии человеческого FcγRI, FcγRIII и FcRnαβ2
Вся РНК была выделена из человеческих мононуклеарных клеток периферической крови, используя набор (Qiagen, Cat. No. ???) чтобы «выловить» гены, кодирующие внеклеточные области связывания лигандов человеческих FcγRI, FcγRIII и FcRnαβ2 при помощи RT-PCR и PCT. Гены были слиты с геном GST (Глутатион S-трансфераза) и клонированы в соответствующие экспрессирующие векторы клетки животного, прикрепляя к нему ген дегидрофолатредуктазы. Рекомбинантная плазмида pHM000, полученная таким образом, трансфицирована в СНО-клетки. В этом отношении, СНО-клетки были инокулированы в расчете 1×106 клеток на 6-см чашку для культивирования, выдержаны при 37°С в течение 24 часов в 5%-СО2-инкубаторе, и дважды промыты Opti-MEM (Gibco., Cat. № 31985-070). 1 мл Opti-MEM, содержащий 10 мкг pHM000, был смешан с 1 мл реагента ЛипофектаминТМ (Invitrogen, Cat. № 18324-020). После стояния в течение 20 минут образовавшаяся смесь была добавлена к полученным СНО-клеткам. Эти клетки были выдержаны при 37°С в течение 18 часов в 5%-СО2-инкубаторе и восстановлены DMEM/F12, дополнены 10% эмбриональной телячьей сывороткой и 1%-пенициллин-стрептомицином перед дополнительным выдерживанием в течение 48 часов. Для того чтобы отобрать трансформированные штаммы, клетки были обработаны 0,5% трипсином (Gibco., Cat. № 15400-054) в выбранной среде α-МЕМ (Welgene, Cat. № LM008-02), которая включает 10%-бычью сыворотку, диализированную эмбрионально, 1%-пенициллин-стрептомицин, и 800 мкг/мл генетицина (Mediatech, Cat. № 61-234RG), с последующим центрифугированием. Клетки, трансформированные таким образом, были перенесены в Т25-чашку для культивирования (Nunc) и выдержаны при 37°С в 5%-СО2-инкубаторе до 90% или более высокой конфлюентности. Для того, чтобы определить уровни экспрессии FcγRI, FcγRIII и FcRnαβ2, выбранные штаммы были выдержаны при 37°С в 5%-СО2-инкубаторе с увеличением концентраций MTX (Sigma, Cat. № M-8407) от 20 нМ с увеличением на 20 нМ каждые две недели.
<5-2> Изготовление и очистка человеческих FcγRI, FcγRIII и FcRnαβ2
FcγRI, FcγRIII и FcRnαβ2 были очищены, как изложено ниже. Выбранные клеточные штаммы были инокулированы в Cell Factory (Nunc, Cat. № 170009) в расчете 3,5×108 клеток на реактор, и выращены при 37°С в течение 48 часов в 5%-СО2-инкубаторе, и затем дважды промыты 1 литром PBS на каждый реактор. Клетки были дополнены 1 литром производственной среды CHO-A-SFM, содержащей 0,3 мМ бутирата натрия (Sigma, Cat. № В-5887) и выращивались при 33°С в 5% СО2 инкубаторе, в течение чего экспрессированный супернатант извлекался каждый день, в сумме 7 раз. Собранный супернатант был центрифугирован, отфильтрован при помощи 0,22 мкм системы фильтрования (Corning), концентрирован с использованием системы концентрирования (PALL, Cat. № PN OS010C70) и загружен на смолу хелатирующей сефарозы FF (Amersharm pharmacia, Cat. № 17-0575-02) наполненной 0,1М сульфидом никеля (Sigma, Cat. № N4887), так что GST FcγRI, FcγRIII и FcRnαβ2 были присоединены к никелю. Связанные FcγRI, FcγRIII и FcRnαβ2 были разделены и очищены с колонки 50 мМ NaPi (pH 8,0), 300 mM NaCl и 250 мМ имидазола.
<5-3> Анализ связывания с FcγRI
FcγRI, очищенный в примере <5-2>, был разбавлен до концентрации 0,75 мкг/мл в PBS (pH 7,4), аликвоты были помещены в 96-луночный планшет (Nunc, Maxisorp) в количестве 100 мкл в каждую лунку, и выдерживались в течение 18 часов при 4°С, так чтобы рецептор был прикреплен ко дну 96-луночного планшета. Каждая лунка 96-луночного планшета была промыта три раза 300 мкл промывного буфера PBS (pH 7,4), содержащего 0,05% Твин 20 (Amresco, Cat. № 0777). Затем 300 мкл PBS (pH 7,4) содержащего 0,1% Твина 20 и 3% BSA (телячий сывороточный альбумин, Amresco, Cat. № 0332) добавили к каждой лунке, чтобы предотвратить нежелательное присоединение других соединений ко дну лунки, и выдерживали при 37°С в течение 1 часа, после чего реакционный раствор был полностью удален из лунки. С сывороточным человеческим IgG и Fc, разделенные обработкой сывороточного человеческого IgG папаином, служащим в качестве стандартов, продукты HM11200 и HM11201, очищенные в примере 2, были разбавлены до концентрации 9 мкг/мл соответствующими анализирующими буферами, с последующими повторяющимися серийными разбавлениями 1:3 анализирующим буфером семь раз. 100 мкл разбавленного раствора поместили в каждую лунку 96-луночного планшета, и реакция протекала при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности, и лунки были промыты шесть раз промывающим буфером. Для того чтобы исследовать, все ли продукты HM11200 и HM11201 и стандарты, прикрепленные ко дну 96-луночного планшета, были присоединены к FcγRI, 1:100000 - разбавленный раствор козьего HRP-конъюгированного антитела против человеческой тяжелой цепи (Chemicon, AP309P) в анализирующем буфере был помещен в объеме 100 мкл в каждую лунку и реагировал при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности. После промывания шесть раз промывающим буфером 100 мкл субстрата (BD bioscience, Cat. № 555214), который был способен реагировать с HRP, конъюгированным с антителом, было помещено в каждую лунку, и реакция протекала при 25°С в течение 20 минут. Реакция была прекращена 2н серной кислотой, и оптическая плотность была измерена с помощью ELISA-ридера (Molecular Devices, микропланшет-ридер) при 450 нм. Как видно на фиг.3, почти ни один из белков Fc, изготовленных в E. Coli, не связывается с FcγRI, в то время как человеческий IgG и Fc, оба гликозилированные, были прочно связаны с FcγRI.
<5-4> Анализ связывания с FcγRIII
С сывороточным человеческим IgG и Fc, разделенными обработкой сывороточного человеческого IgG папаином, служащим в качестве стандарта, продукты HM11200 и HM11201, очищенные в примере <1-2>, были разбавлены до концентрации 9 мкг/мл в соответствующем карбонатном буфере (рН 9,0), с последующими повторяющимися серийными разбавлениями 1:3 карбонатным буфером семь раз. 100 мкл разбавленного раствора помещали в каждую лунку 96-луночного планшета, и выдерживали при 4°С в течение 18 часов, так чтобы они прикрепились ко дну 96-луночного планшета. Каждая лунка 96-луночного планшета была промыта три раза 300 мкл промывного буфера, состоящего из PBS (pH 7,4), содержащего 0,05% Твина-20 (Amresco, Cat. № 0777). После этого 300 мкл анализирующего буфера, состоящего из PBS (pH 7,4) содержащего 0,1% Твина-20 и 5% обезжиренного сухого молока (Difco, Cat. № 232100) добавили к каждой лунке, чтобы предотвратить нежелательное присоединение других соединений ко дну лунки, и выдерживали при 37°С в течение 1 часа, после чего реакционный раствор был полностью удален из лунки. FcγRIII, очищенный в примере <4-2>, был разбавлен до концентрации 1 мкг/мл в анализируемом растворе. 100 мкл разбавленного раствора поместили в каждую лунку 96-луночного планшета, и реакция протекала при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности. Лунки были промыты шесть раз промывающим буфером. Кроличье антитело против GST (Chemicon, AB3282), которое было способно связываться с GST (глутатион S-трансфераза) FcγRIII, соединенное с продуктом HM11200, HM11201 и стандартами, было разбавлено 1:10000 в анализирующем буфере, и 100 мкл разбавленного раствора поместили в каждую лунку, и реакция протекала при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности. Затем, после промывания ячеек шесть раз промывающим буфером, 100 мкл 1:7500 разбавленного раствора антитела по отношению к антителу кролика в анализирующем буфере было помещено в каждую лунку.
После реакции при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности, 96-луночный планшет был промыт шесть раз промывающим буфером. Субстрат был добавлен аналогичным, как в примере <5-3> образом, и оптическая плотность была измерена с помощью ELISA-ридера. Как видно на фиг.4, почти ни один из белков FcγRIII, изготовленных в E. Coli, не связывается с FcγRI, в то время как человеческий иммуноглобулин G и Fc, оба гликозилированные, были прочно связаны с FcγRIII.
<5-5> Анализ связывания с FcRnαβ2
С сывороточным человеческим иммуноглобулином G и Fc, разделенными обработкой сывороточного человеческого IgG папаином, служащими в качестве стандарта, продукты HM11200 и HM11201, очищенные в примере <1-2>, были разбавлены до концентрации 20 мкг/мл соответствующим карбонатным буфером (рН 9,0), с последующими повторяющимися серийными разбавлениями 1:3 карбонатным буфером семь раз. 100 мкл разбавленного раствора помещали в каждую лунку 96-луночного планшета, и выдерживали при 4°С в течение 18 часов, так что они прикрепились ко дну 96-луночного планшета. Каждая лунка 96-луночного планшета была промыта три раза 300 мкл промывного буфера состоящего из PBS (pH 7,4) содержащего 0,05% Твин-20 (Amresco, Cat. № 0777). После этого 300 мкл анализирующего буфера, состоящего из PBS (pH 7,4), содержащего 0,1% Твина-20 и 0,5% BSA (Amresco, Cat. № 0332), добавили к каждой лунке, чтобы предотвратить нежелательное присоединение других соединений ко дну лунки, и выдержали при 37°С в течение 1 часа, после чего реакционный раствор был полностью удален. FcRnαβ2, очищенный в примере <5-2>, был разбавлен до концентрации 3 мкг/мл в анализируемом растворе. 100 мкл разбавленного раствора помещали в каждую лунку 96-луночного планшета и реакция протекала при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности. Лунки были промыты шесть раз промывающим буфером. Кроличье антитело анти-GST (Chemicon, AB3282), способное связываться с GST (глутатион S-трансфераза) FcRnαβ2, соединенное с продуктом HM11200, HM11201 и стандартами, было разбавлено 1:10000 в анализирующем буфере, и 100 мкл разбавленного раствора помещали в каждую лунку и реакция протекала при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности. Затем, после промывания ячеек шесть раз промывающим буфером, 100 мкл 1:7500 разбавленного раствора антитела в отношении антитела кролика в анализирующем буфере было помещено в каждую лунку.
После реакции при 25°С в течение 2 часов, со встряхиванием при постоянной интенсивности, 96-луночный планшет был промыт шесть раз промывающим буфером. Субстрат был добавлен аналогичным образом, как в примере 5-2, и оптическая плотность была измерена с помощью ELISA ридера. Подобно человеческому IgG и гликозилированному Fc, как видно на фиг.5, белки Fc, продуцированные в E. Coli, прочно связаны с FcRnαβ2.
ПРИМЕР 6
Получение и фармокинетический анализ конъюгата человеческого EPO
<6-1> Получение человеческого EPO
Чтобы получить конъюгат человеческого EPO (эритропоэтин), сначала ген EPO был амплифицирован при помощи RT-PCR с использованием общей РНК, выделенной из клеток человеческой крови, и клонирован в вектор pBluscript II (Stratagen), таким образом, с образованием вектора pBlueEP. Чтобы перенести клонированный ген EPO в экспрессирующий вектор клетки животного pCMV/dhfr-(pCDNA3.1 (Invitrogen Company), содержащий dhfr-ген), pBlueEP был расщеплен с HindIII и BamHI, и EPO ген-содержащий фрагмент, полученный таким образом, вставлен в экспрессирующий вектор клетки животного, обработанного теми же самыми рестрикционными ферментами, с обеспечением, таким образом, pcmvEP. Этот экспрессирующий вектор, несущий EPO ген, был перемещен в CHO клетки, штамм экспрессии белка с использованием реагента Липофектамина (Gibco). Клетки были обработаны MTX с концентрацией постепенно возрастающей до 120 нМ, чтобы повысить его уровни экспрессии. EPO был экспрессирован на высоких уровнях, выше, чем 100 мг на литр.
<6-2> Получение комплекса человеческого EPO-PEG
ALD-PEG-ALD (Shearwater), 3,4-кДа полиэтиленгликоль, имеющий активные альдегидные группы на обоих концах, был смешан с некоторыми количествами 100 мМ фосфатного буфера, содержащего EPO, полученный в <6-1> в концентрации 5 мг/мл, подходящей для формирования мольного отношения EPO: PEG 1:1, 1:2,5, 1:5, 1:10 и 1:20. К этой смеси был добавлен восстановитель - цианборгидрид натрия (NaCNBH3, Sigma), до конечной концентрации 20 мМ, и реакция протекала при 4°С в течение 2 часов, со слабым перемешиванием, чтобы позволить PEG селективно присоединиться к концевой аминогруппе EPO. Чтобы получить комплекс PEG и EPO в пропорции 1:1, реакционная смесь была подвергнута гель-хроматографии с использованием колонки Superdex® (Pharmacia). Комплекс EPO-PEG элюировали с колонки 10 мМ буфер фосфата калия (рН 6,0) в качестве элюирующего буфера, при этом был удален EPO, не присоединенный к PEG, непрореагировавший PEG и димерные побочные продукты, в которых PEG присоединен к двум молекулам EPO. Очищенный комплекс EPO-PEG был сконцентрирован до 5 мг/мл. При помощи этого эксперимента было найдено оптимальное мольное отношение EPO к PEG, которое обеспечивает высочайшую реакционную способность и образование наименьшего количества побочных продуктов, таких как димеры, и которое составляет от 1:2,5 до 1:5.
<6-3> Получение конъюгата человеческого комплекса EPO-PEG и рекомбинантной области Fc иммуноглобулина
Комплекс EPO-PEG, полученный в примере <6-2>, был присоединен к области Fc иммуноглобулина, продуцированной с использованием HM11201 в примере <1-3>. Более подробно, фрагмент области Fc иммуноглобулина (приблизительно 53 кДа), полученной в примере <1-3>, был растворен в 10 мМ фосфатном буфере и смешан с EPO-PEG комплексом при молярном соотношении комплекса EPO-PEG: область Fc, равном 1:1, 1:2, 1:4 и 1:8. После подгонки концентрации фосфатного буфера реакционного раствора до 100 мМ, был добавлен восстановитель - цианборгидрид натрия (NaCNBH3, Sigma) до конечной концентрации 20 мМ, и реакция протекала при 4°С в течение 20 часов, при слабом перемешивании. При помощи этого эксперимента было найдено оптимальное мольное отношение EPO-PEG комплекса к фрагменту области Fc, которое обеспечивает высочайшую реакционную способность и образование наименьших количеств побочных продуктов, таких как димеры, и которое составляет 1:2.
После реакции спаривания реакционная смесь подверглась жидкостной хроматографии высокого давления для того, чтобы удалить непрореагировавшие вещества и побочные продукты. Раствор реакции спаривания был обессолен с использованием обессоливающей колонки HiPrep 26/10 (Pharmacia) 10 мМ буфером Трис (рН 8,0). Затем реакционный раствор был загружен в 50 мл колонку Q HP 26/10 (Pharmacia) со скоростью потока 8 мл/мин, и эта колонка элюировалась NaCl линейного градиента 0М-0,2М, чтобы получить желаемые фракции. Собранные фракции были снова загружены на колонку polyCAT 21,5×250, сбалансированную 10 мМ ацетатным буфером (рН 5,2) со скоростью потока 15 мл/мин, и эта колонна элюировалась NaCl линейного градиента 0,1М-0,3М, что, таким образом, обеспечивало высокочистые фракции.
<6-4> Фармокинетический анализ
Нативная EPO, полученная в примере <5-1>, Aranesp (Amgen), имеющая большее содержание сиаловой кислоты для того, чтобы увеличить свое время полужизни, и конъюгат EPO-PEG-Fc (тестовая группа), полученный в примере <5-3>, были подкожно введены в дозе 100 мкг/кг пяти SD-крысам. После подкожной инъекции были собраны образцы крови после 0,5, 1, 2, 4, 6, 12, 24 и 48 часов в контрольных группах и после 1, 12, 24, 30, 48, 72, 96, 120, 144, 168, 192, 240, 288, 336 и 384 часа в тестовых группах. Образцы крови были собраны в 1,5-мл-пробирки, коагулированы и центрифугированы в течение 10 мин с использованием высокоскоростной микроцентрифуги Eppendorf для удаления кровяных клеток. Уровни сывороточного белка были измерены ELISA с использованием антитела, специфичного к EPO.
Таблица 6, приведенная ниже, и фиг.6 показывают времена полужизни в сыворотке нативного белка и белкового конъюгата. Белковый конъюгат EPO-PEG-Fc (E. coli), полученный с использованием области Fc иммуноглобулина, продуцированной в соответствии с настоящим изобретением как переносчик, показал значительно более долгое время полужизни в сыворотке, чем в случае нативной EPO. Было найдено, что это увеличенное время полужизни выше, чем у Aranesp, который, как известно, является вторым поколением EPO, имеющим долгое время полужизни в сыворотке.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Как описано для этой цели, способ в соответствии с настоящим изобретением делает возможным массовое производство области Fc иммуноглобулина в «телах включения», формирующихся в E. coli, с использованием рекомбинантной области Fc иммуноглобулина, содержащей шарнирную область. Присоединенная к физиологически активному белку, полученная область Fc иммуноглобулина может быть эффективно использована для увеличения времени полужизни в сыворотке и физиологической активности физиологически активного белка без риска возникновения иммунных ответов.
Реферат
Настоящее изобретение относится к иммунологии и биотехнологии. Предложен способ массового производства Fc-фрагмента иммуноглобулина, свободного от начального метионинового остатка, с использованием рекомбинантного экспрессирующего вектора без сигнальной последовательности в клетках E.coli. Вектор включает нуклеотидную последовательность, кодирующую рекомбинантную область Fc иммуноглобулина, включающую в себя область Fc иммуноглобулина, соединенную своим N-концом с шарнирной областью иммуноглобулина посредством пептидной связи. Трансформант культивируют и экспрессируют Fc как «тело включения», а затем проводят выделение и очистку Fc-фрагмента иммуноглобулина из «тела включения». Солюбилизируют и проводят рефолдинг Fc-фрагмента иммуноглобулина. Шарнирная область в качестве начальной аминокислоты N-конца содержит цистеин, серин или пролин. Описан Fc-фрагмент, полученный указанным способом. Использование изобретения обеспечивает выход экспрессии после очистки с помощью протеина А около 5 г/л, что может облегчить получение конструкций на основе Fc-фрагмента. 2 н. и 11 з.п. ф-лы, 10 ил., 6 табл.
Формула
получение рекомбинантного экспрессирующего вектора, включающего нуклеотидную последовательность, кодирующую рекомбинантный Fc-фрагмент иммуноглобулина, составленный из Fc-фрагмента иммуноглобулина, связанного своим N-концом с шарнирной областью иммуноглобулина посредством пептидной связи;
трансформирование клетки E.coli рекомбинантным экспрессирующим вектором с получением трансформанта;
культивирование трансформанта для того, чтобы экспрессировать Fc-фрагмент иммуноглобулина как «тело включения»;
выделение и очистку Fc-фрагмента иммуноглобулина из «тела включения»; и
солюбилизацию и рефолдинг Fc-фрагмента иммуноглобулина,
где указанная шарнирная область имеет цистеин, серин или пролин в качестве начальной аминокислоты N-конца, а указанный рекомбинантный экспрессирующий вектор не содержит сигнальной последовательности, и где указанная шарнирная область имеет аминокислотную последовательность, представленную SEQ ID NO:18, 19, 20, 21, 49, 53, 54, 55, 59 или 60.

Комментарии