Экстракт недифференцированных клеток mimosa pudica и его применение в дермокосметике - RU2747479C2
Код документа: RU2747479C2
Чертежи




Описание
Предшествующий уровень техники
Настоящее изобретение относится к препарату, полученному из in vitro культуры недифференцированных клеток Mimosa pudica (мимозы стыдливой), и к способу его получения; к косметической или дерматологической композиции, содержащей указанный препарат; и к их применению для лечения воспалительных заболеваний кожи, в качестве антиоксиданта, включая лечение окислительного стресса из-за загрязнения окружающей среды, и в качестве агента против старения.
Mimosa pudica - лекарственное растение, которое в течение нескольких столетий использовали в Азии для лечения воспаления. Mimosa pudica Linn, (семейство бобовых) известна своим антидиабетическим (Maries 1995), антидепрессантным (Molina, 1999), противовоспалительным (Patel 2014), антиоксидантным (Patro 2016) и антибактериальным (Bhakuni 1969) свойствами. Она также используется для заживления ран (Paul et al., 2010. Int J Bio Med Res 1 (4): 223-227).
Метанольный экстракт листьев Mimosa pudica содержит активные молекулы, такие как терпены, флавоноиды, гликозиды, алкалоиды, хинины, фенолы, танины, сапонины и кумарины (Gandhiraja et al., 2009). Имеющиеся фенольные молекулы проявляют сильную антиоксидантную активность (Zhang et al., 2011. Pharmacogn. Mag 4: 35-39). Однако основная молекула, выделенная из растения, особо известна своей токсичностью: мимозин. Он является небелковой аминокислотой (бета-N(3-гидрокси-4-пиридон)-альфа-аминопропионовой кислотой). Было показано, что он вызывает побочные эффекты у животных, такие как потеря аппетита, выпадение волос, репродуктивные расстройства (Kulp K.S. 1996. Toxicology and applied pharmacology. 139: 356-364). Было также показано, что он ингибирует прорастание семян и синтез ДНК в культивируемых клетках (Williams RD et al., 2007. Allelopathy J. 19 (2): 423-430, Stuenzi et al., 1979). Представляется, что мимозин синтезируется растением для защиты от жвачных животных, которые его поедают: это вызывает проблемы с пищеварением у животных. Присутствие мимозина в экстрактах Mimosa pudica является ограничивающим фактором для использования этого лекарственного растения. Один из подходов состоит в том, чтобы найти средства для очистки, чтобы удалить его, но этот подход усложняет процессы и требует более жесткого контроля и, следовательно, более высоких издержек производства.
Существует обширная литература о получении экстрактов с использованием полярных и неполярных растворителей. В документе KR 10-1064848 описаны экстракты растения, полученные с использованием органических растворителей, таких как этанол и этилацетат, для лечения аутоиммунных заболеваний.
В контексте настоящего изобретения заявитель продемонстрировал новое использование сырья Mimosa pudica посредством альтернативного пути: использование in vitro культуры недифференцированных тотипотентных клеток. Действительно, было с удивлением замечено, что культура этих клеток из биореактора позволяет получить препарат, значительно обедненный мимозином; причем указанный препарат обладает очень привлекательными свойствами для лечения воспалительных кожных заболеваний, окислительного стресса и старения кожи. Эти свойства были особенно неожиданными, когда при осуществлении способа проводили стадию биоконверсии, на которой получали новые метаболиты, которые особенно усиливают антиоксидантную активность. Неожиданно заявитель заметил, что эти метаболиты являются частью N-фенилпропеноил-L-аминокислот (NPA). NPA как таковые известны и пользуются большой популярностью из-за их полезной фармакологической активности (Hensel et al., Planta Med., 2007; 73: 142-150, Zeng et al. J. Agric. Food Chem., 2011; 59: 5342-5350). До сих пор не было известно, что растение Mimosa pudica содержит антиоксиданты, такие как NPA.
При воспалительных дерматозах, при поражениях кожи у пациентов с атопическим дерматитом эпидермиса наблюдается избыточная экспрессия цитокина TSLP (тимусного стромального лимфопоэтина), который играет решающую роль в патогенезе аллергических заболеваний, опосредованных клеточным ответом Th2-типа (Takai et al., 2012. Allergology Int., 61: 3-17). Описывают, что TSLP является ответственным за зуд, который часто присутствует при атопическом дерматите и псориазе. Мы впервые демонстрируем, что экстракт растительной клеточной культуры (РКК) Mimosa pudica, полученный способом согласно изобретению, обладает антиоксидантной и противовоспалительной активностью и, в частности, демонстрирует очень сильное ингибирование TSLP в модели атопического дерматита in vitro. Мы также демонстрируем, что в отсутствие мимозина в наших экстрактах экстракт РКК Mimosa pudica в соответствии с изобретением сохраняет противовоспалительную фармакологическую активность.
Способ получения препарата, задача настоящего изобретения, состоит в дедифференцировки клеток из растительного материала, полученного из Mimosa pudica, а затем в культивировании суспендированных клеток в недифференцированном состоянии с быстрым получением тонкоизмельченной, обильной, гомогенной и стерильной биомассы этого растения. Культура клеток делает пути биосинтеза этого растения более универсальными на клеточном уровне.
Таким образом, настоящее изобретение относится к препарату, полученному из in vitro культуры недифференцированных клеток Mimosa pudica, к косметической или дерматологической композиции, содержащей указанный препарат, и к их применению в косметологии и/или дерматологии, и более предпочтительно, для лечения воспалительных заболеваний кожи в качестве антиоксиданта, включая лечение окислительного стресса из-за загрязнения окружающей среды (табак, загрязнение воздуха в помещении и на открытом воздухе химическими агентами или аллергенами), и в качестве агента против старения.
Таким образом, настоящее изобретение относится к способу получения in vitro экстракта клеток Mimosa pudica с содержанием мимозина менее 5 нг/г сухой массы, включающему следующие стадии:
- a. Обеспечение стерильного растительного материала Mimosa pudica,
- b. Дедифференцировка клеток из указанного растительного материала,
- c. Суспендирование культуры недифференцированных клеток в жидкой среде для поддержания их в недифференцированном состоянии,
- d. Выращивание культуры биомассы недифференцированных клеток в культуральной среде,
- e. Остановку выращивания и получение клеточного экстракта с содержанием мимозина менее 5 нг/г сухой массы.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что растительный материал Mimosa pudica выбирают из группы, состоящей из листьев, стеблей, черешков, корней, семян, цветов и бутонов.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что стадию b) дедифференцировки осуществляют на твердой среде, содержащей один или более факторов роста.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что один или более факторов роста включают гормон, выбранный из группы, состоящей из ауксинов, цитокинов, гиббереллинов и их смесей.
В конкретном варианте осуществления способ в соответствии с изобретением характеризуется тем, что стадию b) дедифференцировки повторяют с получением каллуса дедифференцированных клеток.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что стадию с) проводят в жидкой среде, содержащей один или более факторов роста.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что указанные один или более факторов роста являются такими же, как факторы роста из среды дедифференцировки.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что стадию d) выращивания культуры осуществляют посредством последовательных субкультур или разведений в жидкой культуральной среде до получения постоянной плотности клеток.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что он включает следующие дополнительные стадии:
- f. разделение жидкости и твердого вещества,
- g. извлечение клеточного экстракта, состоящего из биомассы, отделенной от культуральной среды с содержанием мимозина менее 5 нг/г сухой массы.
В другом конкретном варианте осуществления способ согласно изобретению характеризуется тем, что он включает следующие дополнительные стадии:
- f. разделение жидкости и твердого вещества,
- g. извлечение клеточного экстракта, состоящего из жидкой фазы культуральной среды с содержанием мимозина менее 5 нг/г сухой массы.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что он включает дополнительную стадию измельчения экстракта и извлечения измельченного клеточного материала с содержанием мимозина менее 5 нг/г сухой массы.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что полученный измельченный материал подвергают разделению жидкости и твердого вещества с последующим извлечением жидкой фазы в качестве клеточного экстракта с содержанием мимозина менее 5 нг/г сухой массы.
В другом конкретном варианте осуществления способ согласно изобретению характеризуется тем, что полученный измельченный материал подвергают разделению жидкости и твердого вещества с последующим извлечением твердой фазы клеточных остатков в качестве клеточного экстракта с содержанием мимозина менее 5 нг/г сухой массы.
В другом конкретном варианте осуществления способ согласно изобретению характеризуется тем, что культуральная среда стадии с) и/или стадии d) содержит субстрат фениламмоний-лиазы.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что субстрат фениламмоний-лиазы выбирают из группы, состоящей из фенилаланина, в частности L-фенилаланина, коричной кислоты, аспарагиновой кислоты, глутаминовой кислоты и их смесей.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что полученный экстракт содержит по меньшей мере одну N-фенилпропеноиламинокислоту.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что N-фенилпропеноиламинокислоту выбирают из группы, состоящей из:
P1: 1-O-(4-кумароил)-β-D-глюкозы
C15H18O8

Р2: N-п-кумароиласпарагиновой кислоты или аспарагиновой кислоты; (S)-формы, N-(4-гидроксициннамоила)
C13H13NO6

Р3: N-цис-(пара-кумароил)глутаминовой кислоты или глутаминовой кислоты; (S)-формы, N-(4-гидрокси-Z-циннамоила)
C14H15NO6
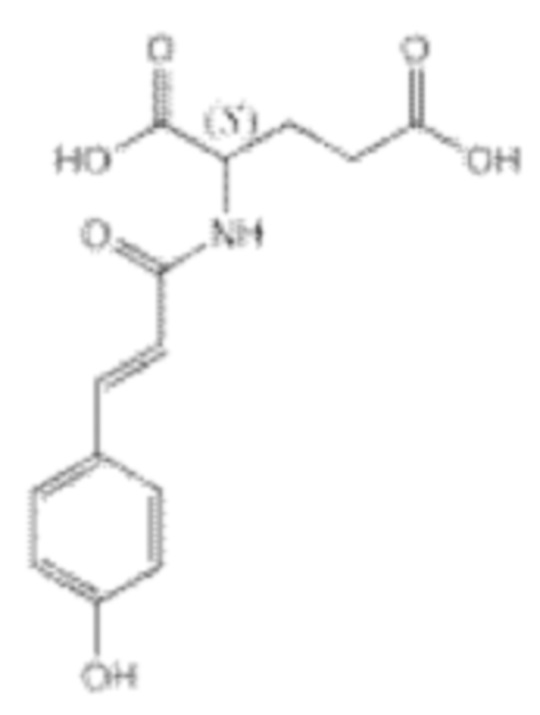
P5: 4-гидроксициннамида
C9H9NO2

Р6: глутаминовой кислоты; (S)-формы, N-циннамоила
C14H14NO5

Также задачей настоящего изобретения является получение экстракта in vitro культуры клеток Mimosa pudica, получаемого способом по настоящему изобретению и имеющего содержание мимозина менее 5 нг/г сухой массы.
Изобретение также относится к экстракту in vitro культуры клеток Mimosa pudica, который характеризуется тем, что содержание в нем мимозина составляет менее 5 нг/г сухой массы.
В конкретном варианте осуществления изобретения экстракт in vitro культуры клеток Mimosa pudica согласно изобретению характеризуется тем, что он содержит по меньшей мере одну N-фенилпропеноиламинокислоту.
В конкретном варианте осуществления экстракт согласно изобретению также характеризуется тем, что по меньшей мере одна N-фенилпропеноиламинокислота выбрана из группы, состоящей из:
P1: 1-O-(4-кумароил)-β-D-глюкозы
C15H18O8

Р2: N-п-кумароиласпарагиновой кислоты или аспарагиновой кислоты; (S)-формы, N-(4-гидроксициннамоила)
C13H13NO6

Р3: N-цис-(п-кумароил)глутаминовой кислоты или глутаминовой кислоты; (S)-формы, N-(4-гидрокси-Z-циннамоила)
C14H15NO6

P5: 4-гидроксициннамида
C9H9NO2

Р6: глутаминовой кислоты; (S)-формы, N-циннамоила
C14H14NO5

В соответствии с конкретным вариантом осуществления экстракт согласно изобретению характеризуется тем, что общее содержание в экстракте по меньшей мере одной N-фенилпропеноиламинокислоты составляет от 1 до 50 мкг/г сухой биомассы, а более предпочтительно - от 10 до 40 мкг/г сухой биомассы.
В соответствии с конкретным вариантом осуществления экстракт согласно изобретению характеризуется тем, что клетки являются недифференцированными клетками.
Другой объект изобретения относится к экстракту, как описано здесь, для применения при лечении воспалительных заболеваний кожи.
Другой объект изобретения относится к экстракту, как описано здесь, для применения в качестве ингибитора тимусного стромального лимфопоэтина.
В конкретном варианте осуществления изобретения воспалительные заболевания кожи выбраны из атопического дерматита, зуда и псориаза.
Композиция для применения в качестве ингибитора тимусного стромального лимфопоэтина, содержащая экстракт согласно изобретению, также является объектом изобретения.
Дерматологическая композиция для лечения воспалительного заболевания кожи, выбранного из атопического дерматита, зуда и псориаза, содержащая экстракт в соответствии с изобретением в эффективном количестве и по меньшей мере один дерматологический эксципиент, также является объектом настоящего изобретения.
Настоящее изобретение также относится к применению экстракта в соответствии с изобретением и, как описано здесь, для косметического лечения старения кожи и заболеваний кожи, связанных с окислительным стрессом кожи, включая окислительный стресс из-за загрязнения окружающей среды.
Настоящее изобретение также относится к косметической композиции, содержащей экстракт согласно изобретению в комбинации с косметически приемлемым эксципиентом.
Изобретение также относится к дерматологической композиции, содержащей экстракт согласно изобретению, как описано, в комбинации с дерматологически приемлемым эксципиентом.
Наконец, настоящее изобретение также относится к применению композиции согласно изобретению для косметического лечения старения кожи и заболеваний кожи, связанных с окислительным стрессом кожи, таким как окислительный стресс из-за загрязнения окружающей среды.
Определения
Выражение «дедифференцировка» относится к возвращению клеток в меристематическое состояние, то есть в состояние недифференцированных клеток, то есть клеток, которые утратили свои морфологические характеристики и физиологически отличаются от клеток исходной ткани, частью которой они были.
В одном варианте осуществления изобретения экстракт имеет содержание мимозина менее 5 нг/г сухой массы, более конкретно - менее 4 нг/г сухой массы, еще более конкретно - менее 3 нг/г сухой массы, еще более конкретно - менее 2 нг/г сухой массы или еще более конкретно - менее 1 нг/г сухой массы.
Поэтому особенно примечательно и удивительно, что культивирование в соответствии с изобретением клеток Mimosa pudica в недифференцированном состоянии позволяет получить экстракт, практически лишенный мимозина, и в этом весь смысл настоящего изобретения из-за токсичности этого соединения.
В контексте настоящего изобретения термин «экстракт» в равной степени относится к культуральной среде после остановки выращивания культуры, в основном состоящей из недифференцированных клеток Mimosa pudica, погруженных в жидкую культуральную среду. Такой экстракт содержит от 100 до 500 г сухой массы на литр, в частности от 150 до 350 г/л. Этот материал, в основном, состоит из биомассы недифференцированных клеток.
Экстракт согласно изобретению также относится к твердой фракции указанной культуральной среды, то есть к биомассе, состоящей из недифференцированных клеток Mimosa pudica, выделенных из культуральной среды.
Экстракт согласно изобретению также относится к жидкой фракции указанной культуральной среды, то есть к культуральной среде, очищенной от недифференцированных клеток Mimosa pudica.
Эти твердые и жидкие фракции могут быть легко получены способом разделения жидкости и твердого вещества, хорошо известным специалисту, который может быть выбран, например, из центрифугирования, отстаивания, фильтрации.
Экстракт согласно изобретению может также состоять из измельченных недифференцированных клеток Mimosa pudica. Такой измельченный материал может быть получен непосредственно путем измельчения культуральной среды после остановки выращивания. Таким образом, такой измельченный материал содержит остатки мембран и клеточных стенок, внутриклеточное содержимое, а также культуральную среду и захваченные соединения и молекулы.
Такой измельченный материал, составляющий экстракт в соответствии с конкретным вариантом осуществления изобретения, может быть получен путем измельчения твердой фракции культуральной среды, состоящей из недифференцированных клеток Mimosa pudica, полученных выше, а также захваченных соединений и молекул.
Экстракт в соответствии с изобретением может также состоять из твердой фракции измельченного материала, как определено выше. Такой экстракт включает фрагменты клеточных стенок и мембран, а также некоторые захваченные соединения и молекулы.
Наконец, экстракт согласно изобретению может быть представлен жидкой фракцией измельченного материала после ресуспендирования и измельчения твердой фракции культуральной среды, содержащей недифференцированные клетки Mimosa pudica.
Измельчение может быть выполнено любым способом, известным специалисту, например, с использованием смесителя типа Utra-Turrax, или путем встряхивания со стеклянными шариками, например, при помощи ультразвука.
Таким образом, следует, что экстракт согласно изобретению может иметь несколько форм.
Предпочтительно экстракт согласно изобретению содержит цельные недифференцированные клетки Mimosa pudica или измельченные недифференцированные клетки Mimosa pudica. Этот экстракт характеризуется содержанием мимозина менее 5, предпочтительно - менее 4, предпочтительно - менее 3, более конкретно - менее 2, еще более конкретно - менее 1 нг/г сухой массы.
В контексте экстракта согласно изобретению, состоящего из жидкой фракции, не содержащей твердой фракции (цельных клеток или клеточных фрагментов), количество мимозина составляет менее 5, предпочтительно - менее 4, предпочтительно - менее 3, более конкретно - менее 2, еще более конкретно - менее 1 нг/мл экстракта.
В более общем смысле, in vitro культуры суспендированных растительных тканей можно использовать для получения активных органических соединений, полученных непосредственно в результате первичного или вторичного метаболизма клеток.
Суспендированные растительные клетки поддерживаются тотипотентными в недифференцированном состоянии, сходном с состоянием стволовых клеток для культур клеток животных. Следовательно, эти растительные клетки теоретически способны продуцировать все метаболиты, наблюдаемые в целом растении.
Дедифференцировка вызывает нарушение путей биосинтеза генетической или эпигенетической природы, так что химические профили различаются количественно и качественно между целым растением и полученными клеточными линиями. Таким образом, теоретически реакционные промежуточные соединения, не наблюдаемые в целом растении, могут появиться в клеточной суспензии. Это обеспечивает новые возможности, так что, может быть достигнуто "спящее" химическое биологическое разнообразие.
Один из объектов настоящего изобретения относится к препарату, полученному из in vitro культуры недифференцированных клеток Mimosa pudica.
Понятие «недифференцированные» или «дедифференцированные» растительные клетки означает любую растительную клетку, не имеющую какого-либо признака определенной специализации, то есть в физиологическом состоянии, подобном меристематическим тканям растения в природном состоянии. Эти клетки способны жить сами по себе и вне зависимости от других клеток.
Первоначальную дедифференцировку клеток Mimosa pudica получают из живого растительного материала, взятого из растения или молодого побега, будь то лист, черешки, стебель, корень, семя, цветок или его органы или бутон, в частности из семян или листьев.
Процесс культивирования дедифференцированных клеток осуществляют in vitro любым способом, известным специалисту в данной области, например, согласно Murashige, Т., Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant 15: 473-496/Plant Culture Media, Vol-1 Formulations and Uses E.F. George, D.J.M. Puttock, and H.J. George (1987) Exegetics Ltd. Edington, Westbury, Wilts, BA134QG England.
Экстракт согласно изобретению можно получить путем осуществления следующих последовательных стадий:
a) дедифференцировка клеток,
b) получение клеточной суспензии с культуральной средой, поддерживающей клетки в недифференцированном физиологическом состоянии,
с) выращивание культуры и продуцирование биомассы в культуральной среде,
d) в конкретном варианте осуществления, обогащение внутриклеточного компартмента культуры интересующими метаболитами путем биоконверсии,
е) получение экстракта.
Получение можно проводить в колбе Эрленмейера, если целью является получение небольших количеств биомассы, или в биореакторе для больших количеств. Например, среднее количество, выращенное в колбе Эрленмейера из 500 мл клеточной суспензии, составляет 175 г сухой биомассы (или 350 г биомассы на литр клеточной суспензии), в то время как среднее количество, выращенное в 10-литровом биореакторе, составляет 3000 г сухой биомассы (300 г/л биомассы).
В зависимости от культивируемых видов и их чувствительности к стрессу культивирования можно использовать различные типы биореакторов для улучшения роста тканей и продуцирования вторичных метаболитов. Существуют три основных способа культивирования растительных клеток в биореакторе:
1. прерывистое или периодическое культивирование,
2. культивирование отъемно-доливным способом или с подпиткой, и
3. непрерывное культивирование.
Стадия стерилизации растительного материала:
Экспланты Mimosa pudica и, в частности семена, собирают и обеззараживают 70%-ными растворами этанола, затем растворами гипохлорита натрия или кальция, или растворами хлорида ртути при комнатной температуре в течение нескольких минут. Ткани промывают стерильной дистиллированной водой, затем по меньшей мере один раз промывают стерильной дистиллированной водой по окончании обеззараживания.
Стадия дедифференцировки клеток
Если используют семена, их обеззараживают и проращивают в питательной агаровой среде Мурасиге и Скуга (Murashige & Skoog), дополненной сахарозой и факторами роста. Последние будут контролировать клеточный механизм эксплантатов таким образом, чтобы стимулировать деление клеток и продуцировать дедифференцированные клеточные кластеры или каллусы (каллогенез). Полученный каллус будут переносить в свежую питательную среду для дедифференцировки каждые 3-4 недели. Действительно, некоторые компоненты этой агаровой среды могут претерпевать метаболизм за счет каллусов или разрушаться под действием воздуха.
Специалист в данной области может также использовать дифференцированные ткани, такие как экспланты из листьев, например, для получения недифференцированных клеток.
В общем, для того, чтобы обеспечить быструю дедифференцировку и интенсивное размножение клеток в форме рыхлого каллуса (каллогенез), что будет способствовать переносу в жидкую среду, была успешно протестирована композиция гормонов на основе факторов роста, таких как ауксины (пиклорам или 4-амино-3,5,6-трихлор-2-пиридинкарбоновая кислота) и цитокинины (кинетин). Стерилизованные семена можно помещать в контакт с агаровой средой, состоящей из среды 30 г/л сахарозы, 8 г/л агара, с добавлением 1,5 мг/л кинетина и 2 мг/л 4-амино-3,5,6-трихлор-2-пиридинкарбоновой кислоты (пиклорама), и доводить рН до 6 перед автоклавированием в течение 20 мин при 121°С (1 бар). Чашки Петри, содержащие семена, инкубируют в темноте при 28°С. Первый каллус появляется через несколько дней, в частности через 2 недели. Полученный каллус переносят на свежую среду примерно каждые 3-4 недели путем деления каллуса скальпелем, чтобы поддерживать размер примерно от 2 до 3 см. Эти переносы продолжают в течение нескольких недель или даже нескольких месяцев, например от 6 до 8 месяцев, чтобы получить рыхлый каллус.
Стадия получения клеточной суспензии в культуральной среде
Дедифференцировка клеток путем последовательных переносов каллуса на агаровую среду приводит к образованию рыхлых каллусов. Это снижение когезии между клетками является следствием дедифференцировки, которая может происходить от двух до шести месяцев в зависимости от растения. Это состояние является благоприятным для переноса в жидкую среду, поскольку оно гарантирует дезинтеграцию каллуса в клеточной суспензии при минимизации индуцированного механического стресса. Таким образом, совокупность рыхлых каллусов вводят (10-20% по объему) в жидкую питательную среду, приготовленную с использованием той же композиции, что и агаровая среда для дедифференцировки, но без гелеобразующего агента.
Таким образом, рыхлые каллусы дезинтегрируют в жидкой среде под действием вибрационного стола в течение нескольких дней, и полученную в результате клеточную суспензию очищают от недезинтегрированных частей каллуса с получением, таким образом, гомогенной клеточной суспензии. Эту суспензию культивируют с получением достаточно плотной клеточной популяции. На этой стадии суспензию (субкультивируют или) разводят в новой питательной среде и культивируют таким же образом.
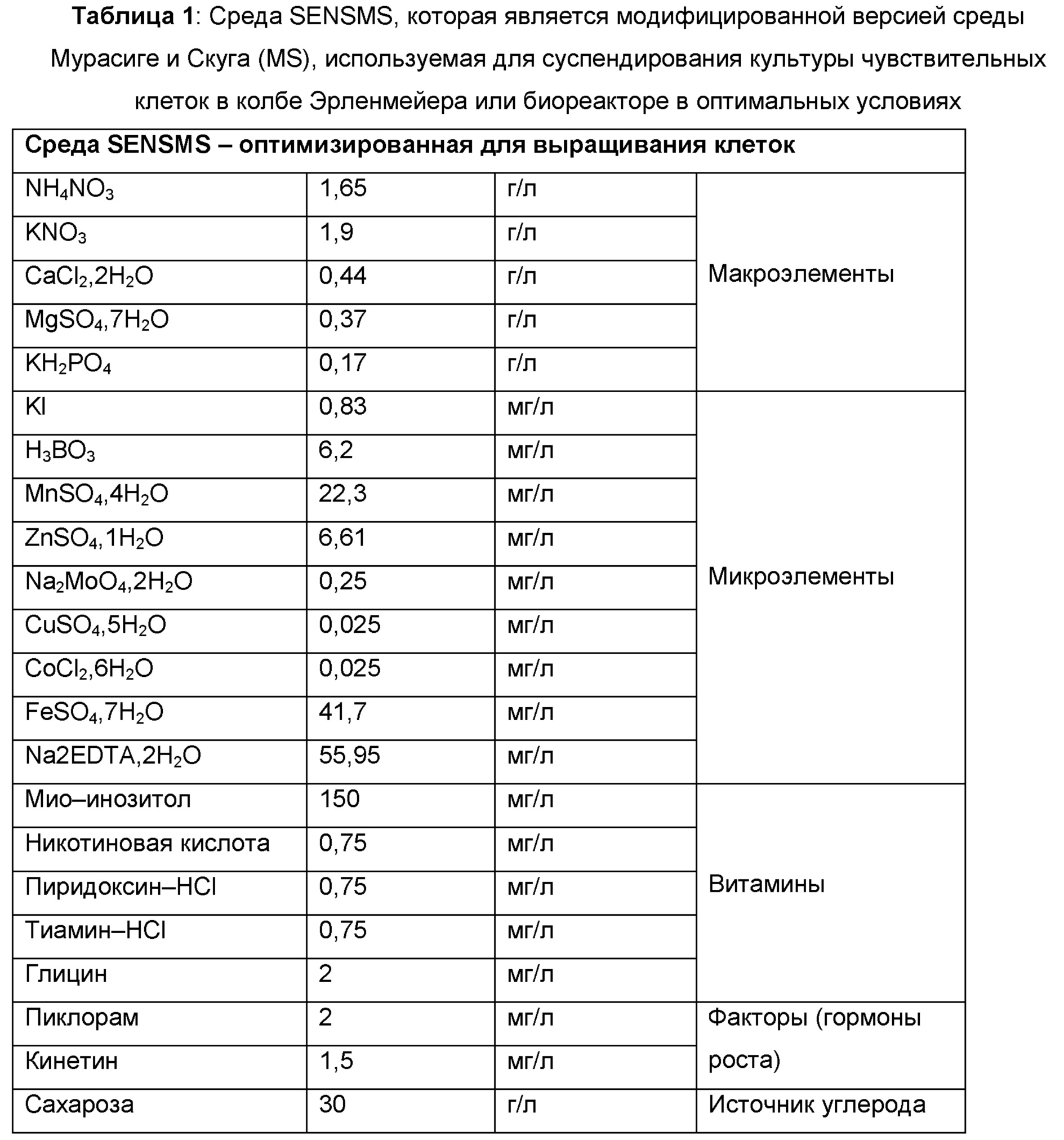
Исходную клеточную суспензию можно получить, поместив от 20 до 40 г рыхлых каллусов в колбу Эрленмейера на 500 мл, содержащую 200 мл среды. Рыхлые каллусы дезинтегрируют в жидкой среде под действием вибрационного стола в течение 2-3 дней при 115 об/мин в темноте при 29°С. Затем клеточную суспензию собирают пипеткой, оставляя недезинтегрированные остаточные кластеры каллуса. Таким образом, клеточная суспензия образует гомогенную суспензию микрокластеров клеток. Эту суспензию культивируют так, чтобы получить «достаточно» плотную клеточную популяцию. Полученную клеточную суспензию культивируют в течение 14 дней, а затем выращивают путем разведения до 1/5 в свежей среде в течение того же количества времени. Композицию культуральной среды (питательные вещества, факторы роста и т. д.) корректируют для максимизации продуктивности биомассы. Результатом является среда выращивания биомассы SENSMS (см. Таблицу 1), оптимизированная для жидкой клеточной суспензии. Эта среда является модифицированной версией среды Мурасиге и Скуга для каллогенеза. РН этой среды доводят до 6 путем добавления КОН с последующим автоклавированием в течение 20 мин при 121°С (р=1 бар) или стерилизующей фильтрацией на 0,2 мкм.
Выращивание культуры и продуцирование биомассы в культуральной среде
После нескольких таких операций субкультивирования клеточная суспензия стабилизируется, когда плотность клеток, полученная в течение этого периода, остается постоянной. В этом случае возможна корректировка состава питательной среды (питательных веществ, факторов роста и т.д.) для максимизации продуктивности биомассы. Эту оптимизированную среду используют в качестве средства получения биомассы для извлечения активных компонентов.
Культуру клеток в «оптимальных» условиях, созданных таким образом, стабилизируют и поддерживают в колбе Эрленмейера (культура для разведения) при 1/5 разведении клеточной суспензии каждые 14 дней. Это эквивалентно инокулированной клеточной культуре с приблизительно 60 г/л свежей биомассы, которая образует клеточную суспензию приблизительно 300 г/л после 14 суток культивирования, либо ее инокулируют в биореактор в зависимости от необходимости.
Свежая биомасса составляет от 100 до 500 г на литр суспензии и более предпочтительно - от 200 до 350 г на литр суспензии.
Необязательная стадия: обогащение внутриклеточного компартмента культуры интересующими метаболитами путем биоконверсии
Иногда важно обеспечить клетки «предшественниками», структура которых достаточно близка структуре конечного продукта, в надежде, что они будут внедрены, модифицированы или трансформированы с использованием ферментативного механизма, присутствующего в клетке.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что культуральная среда стадии с) и/или стадии d) содержит субстрат фениламмоний-лиазы.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что субстрат фениламмоний-лиазы выбирают из группы, состоящей из фенилаланина, в частности L-фенилаланина, коричной кислоты, аспарагиновой кислоты, глутаминовой кислоты и их смесей.
В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что полученный экстракт содержит по меньшей мере одну N-фенилпропеноиламинокислоту.
Этот процесс модификации предшественника клеткой называется биоконверсией. Добавление предшественников в культуральную среду может быть интересным подходом для увеличения продуцирования вторичных метаболитов, представляющих интерес. Эта концепция основана на принципе, что любое соединение, которое является промежуточным звеном реакции в пути биосинтеза интересующего метаболита, может, вероятно, улучшить выход конечного продукта.
Таким образом, исходя из структуры NPA (см. фигуру ниже), определенные молекулы (аминокислоты), по-видимому, являются предшественниками данных интермедиатов реакции. Например, аминокислота L-фенилаланин является полезным предшественником для положительной модуляции активности фермента фениламмоний-лиазы (PAL). Аналогично, коричная кислота может быть источником этого же явления. Можно также предусмотреть несколько комбинаций, особенно с аспарагиновой кислотой или глутаминовой кислотой. Мы провели много экспериментов с использованием этих различных предшественников (отдельно или в комбинации), и, к удивлению, с L-фенилаланином мы получаем полезные NPA, которые никогда не были описаны в клетках Mimosa pudica, такие как:
Р1: 1-O-(4-кумароил)-β-D-глюкоза
C15H18O8

Р2: N-пара-кумароиласпарагиновая кислота или аспарагиновая кислота; (S)-форма, N-(4-гидроксициннамоил)
C13H13NO6

Р3: N-цис-(пара-кумароил)глутаминовая кислота или глутаминовая кислота; (S)-форма, N-(4-гидрокси-Z-циннамоил)
C14H15NO6

Р5: 4-гидроксициннамид
C9H9NO2

Р6: глутаминовая кислота; (S)-форма, N-циннамоил
C14H14NO5

Получение экстракта
После остановки выращивания полученную клеточную суспензию можно отфильтровать или центрифугировать, чтобы отделить ее от культуральной среды и получить как внеклеточную среду (или супернатант культуры), так и собранную биомассу. Биомасса может быть затем обработана по-разному в зависимости от применения. Ее либо сушат сублимационной сушкой, либо ресуспендируют, например, в концентрации 30% в 68,2% глицерине с 0,8% каррагенана и 1% лимонной кислоты. Экстракцию растворителем можно также проводить на клеточной суспензии, сначала выполняя диспергирование клеток с помощью обработки ультразвуком или, например, с помощью французского пресса.
Композиция
Другой объект изобретения относится к косметической или дерматологической композиции, содержащей экстракт in vitro культуры клеток Mimosa pudica, получаемый способом согласно изобретению, и один или более косметически и/или дерматологически приемлемых эксципиентов, предпочтительно предназначенной для местного применения.
Косметически и/или дерматологически приемлемые эксципиенты могут быть любыми эксципиентами среди тех, которые известны специалисту в данной области. Композиция согласно изобретению, в частности, будет представлять собой композицию для местного применения, в частности, в форме крема, лосьона, геля, мази, эмульсии, микроэмульсии, спрея и т.д.
Косметическая или дерматологическая композиция в соответствии с изобретением может, в частности, содержать добавки и вспомогательные агенты, такие как эмульгаторы, загустители, гелеобразующие агенты, средства удержания воды, усиливающие растекание агенты, стабилизаторы, красители, ароматизаторы и консерванты.
Другим объектом изобретения является применение экстракта согласно изобретению для лечения воспалительных заболеваний кожи, в качестве антиоксиданта, включая лечение окислительного стресса из-за загрязнения окружающей среды, и в качестве агента против старения.
«Воспалительное заболевание кожи» означает атопический дерматит, зуд и зудящее состояние вследствие зуда (ингибирование TSLP), экзему и псориаз.
Предпочтительно указанные дерматологические воспалительные заболевания состоят из атопического дерматита, зуда, экземы или псориаза. В соответствии с другим вариантом осуществления изобретение, относящееся к настоящей заявке на патент, относится к композиции, содержащей, по меньшей мере, в качестве активного начала экстракт согласно изобретению.
Следовательно, изобретение предпочтительно относится к косметической или дерматологической композиции. Композиция согласно изобретению предназначена для лечения дерматологических воспалительных заболеваний.
Предпочтительно указанные дерматологические воспалительные заболевания состоят из атопического дерматита, зуда, зудящего состояния вследствие зуда, экземы или псориаза.
Композиция согласно изобретению может быть приготовлена в форме эмульсии вода-в-масле (В/М) или масло-в-воде (М/В), множественной эмульсии, такой как, например, эмульсия вода-в-масле-в-воде (В/М/В) или эмульсия масло-в-воде-в-масле (М/В/М), микроэмульсии или еще в форме гидродисперсии или липодисперсии, геля или аэрозоля. Дерматологически или косметически совместимые эксципиенты могут быть любыми эксципиентами среди тех, которые известны специалисту в данной области в контексте получения композиции для местного применения в форме молочка, крема, бальзама, масла, лосьона, геля, пенящегося геля, мази, спрея и т.д.
В дополнение к дерматологическим и косметическим композициям изобретение также относится к фармацевтическим композициям для применения в качестве лекарственного средства.
Таким образом, изобретение относится к фармацевтической композиции, дополнительно содержащей фармацевтически приемлемый носитель. В настоящем описании фармацевтически приемлемый носитель определяется как соединение или комбинация соединений, содержащихся в фармацевтической композиции, которые не вызывают побочных реакций и которые, например, облегчают введение активного соединения (соединений), увеличивают его срок годности и/или эффективность в организме, увеличивают его растворимость в растворе или улучшают его хранение. Эти фармацевтически приемлемые носители хорошо известны и будут адаптированы специалистом в данной области в зависимости от природы и способа введения.
ПРИМЕР: Культура растительных клеток в биореакторе WAVE (5 л)
Материалы и методы. Реактор WAVE (Sartorius) с полезным объемом 5 л, содержащий 4 л среды MS SENS (состав см. в таблице выше), инокулировали 1 л суспензии культуры клеток М. pudica (плотность клеток от 300 до 400 г/л свежей массы (FW- от англ. "fresh weight"))
Параметры:
- Температура: 27°С
- Объем воздуха: 0,5 л/мин (л в мин)
- Давление: от 5 мПа до 10 мПа
- Угол качания: 7°.
- pO2, поддерживаемое на уровне 75% путем повышения об/мин между D0 (19 об/мин) и D9 (27 об/мин)
Следуя кинетике роста, увеличение биомассы, оцениваемое по свежей массе (FW) или сухой массе (DW), коррелированное с потреблением сахара (снижение кривой), наблюдали до 13-го дня культивирования, D13, когда добавляли среду биоконверсии.
Биоконверсия и сбор
Через 13 дней (D13) периодического культивирования 4 л культуры концентрация клеток составляет 300-350 г/л (FW), что эквивалентно 12-14 г/л (DW). После достижения этой концентрации клеток осуществляют биоконверсию путем введения предшественников стерилизующей фильтрацией: мы выбрали различные аминокислоты (аспарагиновую кислоту, коричную кислоту, глутаминовую кислоту или L-фенилаланин), и в наших условиях культивирования L-фенилаланин дал лучшие результаты с точки зрения выхода биоконверсии NPA. Ниже приведен пример следующих концентраций прекурсоров:

Среда биоконверсии, благоприятствующая гидроксикоричным кислотам, включая их производные, N-фенилпропеноиламинокислотам (NPA)
Разводят соединения в H2O и добавляют смесь в биореактор путем стерилизующей фильтрации. Через 48 часов, то есть между D15 и D16, собирают биомассу прямой фильтрацией, например, с использованием «нейлонового мешка 20 мкм». Биомассу промывают один раз объемом стерильной деминерализованной воды, эквивалентным объему собранной биомассы. Концентрация клеток на момент D13 должна быть эквивалентна (+/-10%) D15. Во всей культуре уменьшение объема суспензии происходит, в основном, из-за взятых образцов.
Объем культуры отбирают в D13, D14, D15 и D16, затем экстрагируют растворителем и различные экстракты растворяют перед анализом ВЭЖХ в сочетании с масс-спектрометрией. На фигуре показано, относительно D13 (день, когда был добавлен предшественник L-фенилаланин), постепенное появление новых пиков в D14, D15 до тех пор, пока не будет достигнута максимальная интенсивность на D16.
Пики Р1, Р2, Р3, Р4, Р5 и Р6 выделяли в D16, анализировали с помощью масс-спектрометрии и ЯМР для определения структуры молекул. Мы не смогли определить структуру пика Р4, поскольку он был в очень небольшом количестве. Впервые и с удивлением мы обнаруживаем, что предшественник L-фенилаланин был лучшей аминокислотой для биоконверсии.
Продукты NPA Р1, Р2, Р3, Р5 и Р6 идентифицировали с помощью масс-спектроскопии и ЯМР.
Список названий NPA:
Р1: 1-O-(4-кумароил)-β-D-глюкоза
С15Н18О8
Р2: N-пара-кумароиласпарагиновая кислота или аспарагиновая кислота; (S)-форма, N-(4-гидроксициннамоил)
C13H13NO6
Р3: N-цис-(пара-кумароил)глутаминовая кислота или
глутаминовая кислота; (S)-форма, N-(4-гидрокси-Z-циннамоил)
C14H15NO6
Р5: 4-гидроксициннамид
C9H9NO2
Р6:
глутаминовая кислота; (S)-форма, N-циннамоил
C14H14NO5
ПРИМЕР 2: АНАЛИЗ МИМОЗИНА В КЛЕТКАХ ЛИСТЬЕВ РАСТЕНИЯ MIMOSA PUDICA
Цель состоит в том, чтобы разработать аналитические условия для выявления и количественного определения мимозина в экстрактах. Биомассу, полученную из суспензионной культуры клеток М. pudica (с биоконверсией), экстрагировали ЕТОН80 или ЕТОН60. Высушенные листья М. pudica высушивали, измельчали и экстрагировали теми же растворителями. В качестве контроля для идентификации и количественного определения использовали L-мимозин от Sigma. Образцы анализировали методом ВЭЖХ/масс-спектрометрии.
Материалы и методы: аналитические условия
Масс-спектрометр ABSciex TripleTOF 4600
Метод (ES+): TOF (100 мc)/MRM (50 мс)
Колонка: Acquity HSS С18, 1,8 мкм, 2,1×100 мм, синтерированная 0,5 мкм.
Элюенты: А (Н2О - 0,1% HCO2H)/В (CH3CN - 0,1% HCO2H)
Скорость потока: 500 мкл/мин
Введение: 10 мкл
Градиент:

Количественные анализы установили, что нижний предел количественного определения (LLOQ), достигнутый в контрольном растворе, составляет 5 нг/мл. Этот LLOQ и способ приготовления наших водноэтанольных образцов подтверждают отсутствие мимозина в наших образцах клеточной культуры на пределе обнаружения (1 нг мимозина на г биомассы):
• EtOH80 и EtOH60 экстракты клеток (20% мас./мас.) <1 нг/г свежих клеток
• EtOH60 экстракт лиофилизированных клеток (5% мас./мас.) <1 нг/г лиофилизированных клеток
• EtOH60 экстракт растений = 2160 нг/г сухого растения.
• EtOH80 экстракт растений = 780 нг/г сухого растения
Анализы выполняли таким же образом на РКК без биоконверсии (т.е. без добавления предшественников NPA) и показали, что содержание мимозина также составляет <1 нг/г свежих или лиофилизированных клеток.
В заключение, в наших культурах растительных клеток М. pudica, к удивлению, мы не обнаружили какого-либо нежелательного элемента, такого как мимозин.
Пример 2 - Противовоспалительная активность: сравнение экстракта растения с экстрактом РКК
В этом примере мы сравниваем противовоспалительную активность двух экстрактов Mimosa pudica (Е11 и Е13). Экстракт Е11 получают экстракцией в этилацетате высушенных и измельченных листьев Mimosa pudica, а экстракт Е13 получают экстракцией тем же растворителем, что и измельченные материалы, полученные из культуры растительных клеток Mimosa pudica без биоконверсии в колбе Эрленмейера. Два экстракта взвешивали после выпаривания растворителя досуха. Их разводили в ДМСО. Чтобы оценить и сравнить противовоспалительную активность двух экстрактов в одной и той же концентрации, у нас есть фармакологический тест in vitro, который состоит в стимуляции мышиных макрофагов, клеток RAW264,7, которые экспрессируют на своей поверхности рецептор TLR4, бактериальными LPS (липополисахаридами) в соответствии с (Kang et al. 2002. J Pharmacol Exp Ther. 302: 138-144). Несколько параметров изучали и сравнивали с контрольным противовоспалительным дексаметазоном:
• продуцирование нитритов по методике Грисса. Уровень нитритов отражает уровень синтеза NO, индуцируемого индуцибельной синтазой оксида нитрита (iNOS).
• секреция цитокинов: интерлейкин-6 методом ELISA
• продуцирование ФНО-альфа (фактора некроза опухоли-альфа) с помощью мультиплексного анализа
КУЛЬТУРА КЛЕТОК
Клетки RAW264.7 являются макрофагами мыши в линии. Эти клетки являются прилипающими и культивируются в 12-луночном планшете при 100000 клеток/см2 (количество скипетров Millipore) в среде DMEM с добавлением 10% фетальной сыворотки теленка (FCS), 2 мМ глютамина и 50 мкг/мл гентамицина.
При конфлюэнтности около 70% клетки обрабатывают экстрактами Mimosa pudica Е11 (растение) или Е13 (РКК) в одинаковых концентрациях (сухая масса) или контрольным противовоспалительным 1 мкМ дексаметазоном (Biovison 1042-1) за 1 ч до активации 0,2 мкг/мл [Е. coli 055: В5] LPS. Клетки инкубируют при 37°С под 5% CO2. Через 24 ч клеточные супернатанты собирают во льду, центрифугируют в течение 5 мин при 3000 об/мин при 4°С, аликвотируют, затем хранят при -80°С. Клеточные тесты повторяли 3 раза, в том числе дважды в двух экземплярах. Средние значения результатов представлены на графиках.
Жизнеспособность клеток контролируют с помощью метаболического теста с МТТ (бромидом 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия) с использованием набора SIGMA CGD1 (набора, основанного на активности фермента, митохондриальной сукцинатдегидрогеназы). Этот тест был сделан заранее, чтобы определить дозы экстрактов, которые будут протестированы в этой модели.
НИТРИТНЫЙ АНАЛИЗ
Уровень синтеза NO оценивают в свежих или замороженных (-80°С) клеточных супернатантах, что не влияет на анализ. Принцип анализа основан на реакции Грисса (диазотирование), которая дает розовое азосоединение с поглощением при 540 нм.
АНАЛИЗ IL6
IL-6 анализируют в клеточных супернатантах, разведенных до 1/200, с помощью колориметрического ELISA, в соответствии с протоколом поставщика (R&D Systems, набор М6000В).
АНАЛИЗ ФНО-АЛЬФА
Одновременный анализ ФНО-альфа. ФНО-альфа в клеточных супернатантах проводили с использованием технологии Luminex хМАР (профилирование нескольких аналитов), которая основана на принципах проточной цитометрии и ELISA в 96-луночном микропланшете. Микрогранулы, используемые в качестве субстрата, включают два флуорохрома в точном соотношении, что дает им идентификационную цветовую маркировку (разные флуоресценции). Оптическая система цитометра (Bio-Plex 200) состоит из двух лазеров: красный лазер (λ=635 нм) возбуждает в каждой микрогрануле определяющую смесь красителей и таким образом идентифицирует цитокин для анализа. Второй лазер - зеленый (λ=532 нм) - возбуждает репортерный флуорохром, прикрепленный к специфическому детекторному антителу, для количественного определения цитокина. Система управляется компьютером, оснащенным программным обеспечением для сбора и анализа данных (Bio-Plex Manager, версия 4,1).
После оттаивания супернатанты тестировали разбавленными до 1/10 и 1/40 в культуральной среде с использованием набора Milliplex (MILLIPORE, номер позиции MCYTOMAG-70K-04). Последний включает специфические гранулы, детекторные антитела и стандарты для анализа цитокинов.
РЕЗУЛЬТАТЫ
Концентрации выражены в виде средних значений. Проценты ингибирования в отношении экстрактов относятся к 0,2% контролю ДМСО. ДМСО (DMSO) используется для предварительного растворения сухого образца перед разбавлением в водном буфере для клеточных тестов.
Описание фигур:
Фиг. 1: Нитритный анализ
Фиг. 2: Анализ IL6
Фиг. 3: Анализ ФНО-альфа
Различные образцы представлены на оси X (слева направо):
• О: отрицательный контроль - культура клеток RAW246,7, активированных 0,2 мкг/мл LPS.
• DEXA: положительный контроль - инкубация клеток с 1 мкМ дексаметазоном (Biovison 1042-1) за 1 ч до активации 0,2 мкг/мл LPS.
• DMSO: инкубация с контролем растворителя, используемым для солюбилизации (Е11 и Е12), за 1 час до активации 0,2 мкг/мл LPS.
• Е11: инкубация с экстрактом, полученным из листьев М. pudica (50 мкг/мл), за 1 час до активации 0,2 мкг/мл LPS.
• Е13: с экстрактом, полученным из растительных клеток (50 мкг/мл), за 1 ч до активации 0,2 мкг/мл LPS.
НИТРИТНЫЙ АНАЛИЗ
Продукция NO является исключительно индуцируемой и значительно ингибируемой дексаметазоном (%i=35). 0,2% ДМСО не влияет на анализ. Растительный экстракт Е11 слабо ингибирует (%i=16%) продуцирование нитритов, в то время как экстракт Е13 ингибирует продуцирование нитритов эквивалентным образом и близок к ингибированию, полученному с контрольным противовоспалительным средством (%i=32%).
IL-6 ELISA
Клетки, активированные (О) с помощью LPS, секретируют IL6. Дексаметазон (DEXA) ингибирует секрецию IL-6 (% i=38%). Экстракты ингибируют секрецию IL-6 для Е11 (% i=24%) и для Е13 (% i=31%)
LUMINEX АНАЛИЗ ФНО-альфа
Клетки RAW264.7 секретируют ФНО-альфа в базальном состоянии (в среднем 0,23 нг/мл). Эта продукция активируется 0,2 мкг/мл LPS до 10 нг/мл ФНО-альфа. Эта активация слабо ингибируется дексаметазоном (%i=16%). Экстракт РКК Е13 снижает выработку ФНО-альфа (%i=40%). И наоборот, растительный экстракт Е11 увеличивает продукцию ФНО-альфа и, по-видимому, усиливает активность LPS (+112%).
В заключение, результаты показывают, что 2 экстракта Е11 и Е13 в одной и той же концентрации сильно ингибируют воспаление, что отражено в этой модели: ингибирование нитритов NO, ингибирование провоспалительного цитокина IL6, подобное контролю, DEXA. Удивительно, что в этих экспериментальных условиях экстракт РКК Е13 лучше, чем DEXA, ингибирует ФНО-альфа, тогда как растительный экстракт Е11 усиливает его.
Пример 3: антиоксидантная активность - тест ORAC
Антиоксидантную активность оценивали с использованием теста способности поглощать кислородные радикалы (ORAC - от англ. oxygen radical absorbance capacity) (

• Экстракты РКК Mimosa pudica со стадией биоконверсии (NPA). Партия WO2. Образцы, взятые в день D13, день биоконверсии, день D14 в 10:00, день D14 в 4 часа дня, D15, 16 и D17.
• Разведение взятых проб экстрактов в воде.
Тест ORAC
Используемые растворы: все растворы приготовлены в фосфатном буфере 75 мМ, рН 7,6. 1,17 мкМ флуоресцеина (используют исходный раствор 117 мМ, хранят 1 неделю при 4°С). 125 мМ ААРН должен быть подготовлен немедленно. 1 мМ Trolox (хранение -20°С)
Приготовление стандартных растворов Trolox:

Реакционный объем: 200 мкл
В черный 96-луночный планшет помещают следующее: 20 мкл антиоксиданта (стандартные растворы Trolox или тестируемый экстракт (измельченная среда культивирования клеток)) + 160 мкл 1,17 мкМ флуоресцеина. Инкубируют покрытый пленкой планшет в течение 15 минут при 37°С. Добавляют 20 мкл 125 мМ ААРН на лунку. Немедленно инкубируют при 37°С в спектрофлуорометре (SpectraMax) и считывают каждую минуту в течение 90 минут при длине волны возбуждения 485 нм и длине волны излучения 520 нм. Каждый тест проводят в трех экземплярах. Рассчитывают площади под кривой (AUC - от англ. area under the curve) для каждого из тестов (стандартные растворы Trolox или образцы). Определяют чистые AUC = значение AUC стандартного раствора или образца - AUC холостой пробы. Строят калибровочную кривую: концентрация Trolox (мкМ) как функция чистой AUC.
Линейное уравнение используется для определения эквивалента Trolox (мкМ) для каждого из анализируемых образцов.
Экв. Trolox в мкМ = а х (чистая AUC) 2+b х (чистая AUC)
(где а и b определяют линейным уравнением).
Значение ORAC соответствует мкмоль Trolox/100 г экстракта
Значение ORAC (ТЕАС) = экв. Trolox в мкМ X 20 X (100000/[протестированного экстракта] X 20)
На фиг. 4 представлена антиоксидантная активность экстракта, содержащего 75 мг сухой массы в мл, разведенного до 1/200; до и после стадии биоконверсии.
Результаты: на оси x экстракт РКК WO2, взятый после X дней культивирования (время) в дни D13, D14 в 10 часов утра, в день D14 в 4 часа дня и каждые 24 часа после D15, D16, D17, и активность последнего образца, одного холостого контроля 40% ЕТОН (без антиоксидантной активности). Видно, что на D14, после 13 дней культивирования и 1 дня после биоконверсии (добавление АА), значение ТЕАС (экв. TROLOX в мкМ) возросло в пять раз и стабилизировалось до D16-D17. В заключение, биоконверсия позволила усилить антиоксидантную активность благодаря наличию NPA.
ПРИМЕР 4: Фармакология - Активность: in vitro модель индуцированного атопического дерматита (АД).
Мультипараметрическая оценка противовоспалительной активности Mimosa pudica на модели in vitro с фенотипом атопического дерматита. Фармакологическая модель была описана Castex-Rizzi et al. (Br J Dermatol. 2014. 170 Suppl 1: 12-8)
4.1. Экстракты и соединения
Экстракты РКК, собранные из измельченной, высушенной стандартизированной культуральной среды Mimosa pudica W01D15 (с биоконверсией), растворяли/разбавляли в растворе в 40% EtOH при исходных концентрациях 75 мг/мл. Соединения растворяли экстемпорально перед тестами на жизнеспособность, а также в соответствующей дозе для измерения фармакологического действия на модели индуцированного атопического дерматита.
4.2 Тип клеток
Нормальные эпидермальные кератиноциты человека (NHEK) от Lonza. Клетки амплифицируют в стандартных условиях культивирования.
4.3 Индукция фенотипа атопического дерматита
Клетки NHEK высевают и культивируют в культуральной среде Кератиноциты-SFM. Затем культуральную среду заменяют средой, содержащей соединения и исследуемые экстракты, или растворителем, используемым в качестве контроля (ЕtOН 40% в концентрациях, эквивалентных тем, которые используются во время обработки соединениями). После «предварительной инкубации» в течение 1 часа добавляют смесь индукторов воспаления (Poly (I:C), IL4, IL13) и клетки культивируют в течение 24 часов.
Параллельно проводят контроль без индуктора и без соединения, что позволяет нам проверить индуцированную модель (NHEK против NHEK + индукторы).
Клетки NHEK также обрабатывают контрольным продуктом, 0,29 мМ дексаметазоном, и используют в качестве контроля эффективности.
РНК извлекают из клеток через 24 часа инкубации со смесью индукторов.
4.5 Анализ дифференциальной экспрессии с помощью ОТ-κПЦР (количественной ПЦР с обратной транскрипцией)
4.5.1. Экстракция тотальных РНК и синтез κДНК
Экстракцию проводили с использованием RNABle (Eurobio) и мини-набора Rneasy от QIAGEN. Все экстрагированные РНК анализируют на спектрофотометре (NanoDrop, ND1000, Thermo Scientific) и анализируют их характеристики на агарозном геле.
4.5.2. Метод количественной ПЦР
• Принцип
ПЦР в реальном времени является точным, чувствительным и быстрым методом, который позволяет дать относительную количественную оценку скорости экспрессии целевого гена по сравнению с универсально экспрессируемым контрольным геном. Этот метод позволяет количественно определить матричную РНК. Эта операция проводится после обратной транскрипции РНК в комплементарную ДНК путем удлинения двух праймеров, расположенных по обе стороны от мишени для амплификации с использованием ДНК-полимеразы. Включение флуорофора (SYBR Green) во время стадии гибридизации экспоненциальной амплификации позволяет количественно определять и отслеживать в реальном времени количество вновь образованного продукта амплификации. Количественные значения получают из числа пороговых циклов (Ct: для порогового значения цикла), при которых увеличение сигнала, связанное с экспоненциальным ростом продукта ПЦР, начинает обнаруживаться с использованием программы анализа Biosystems РЕ в соответствии с руководством производителя. Таким образом, чем больше количество κДНК целевого гена в нулевое время, тем меньше число Ct (номер цикла для достижения порогового значения).
Чтобы стандартизировать количественный анализ ОТ-ПЦР, необходимо количественно определить в том же самом эксперименте по меньшей мере один эндогенный контроль, обозначенный как «референсный ген». Этот «референсный ген» должен иметь конститутивную экспрессию, независимую от обработанного или необработанного состояния клеток. Относительную экспрессию выбранных генов-мишеней рассчитывают методом ΔΔCt с использованием программного обеспечения RQ (Relative Quantification), предоставленного производителем (Applied Biosystems). Значения экспрессии каждого гена, индуцированного конкретным соединением, также нормализуют, так что значение контрольных клеток NHEK (необработанных клеток и клеток, обработанных ДМСО в %, идентичном используемому в качестве носителя для соединения) равно 1. Следовательно, значение RQ, полученное для каждого соединения для данного гена, представляет относительную экспрессию этого гена после обработки по отношению к контрольным клеткам, экспрессия которых равна 1.
• Выбор праймеров
Праймеры выбирали с помощью компьютерных программ, включая Oligo 4 (National Biosciences, Plymouth, MN). Критерии отбора касаются размера амплифицируемого фрагмента (от 80 до 120 нуклеотидов), размера праймеров (от 21 до 25 нуклеотидов), температуры гибридизации праймеров (около 65°С) и положения праймеров; действительно, праймеры конструировали таким образом, что один из 2 праймеров находится между интроном и экзоном, или два праймера находятся в двух разных экзонах, если разделяющий их интрон превышает 2 т.п.н. Выбор довольно специфического положения праймеров позволяет избежать амплификации геномной ДНК в случае загрязнения образца, даже если на кривых диссоциации загрязнения не наблюдалось (ABI, 7900НТ). Все эти меры предосторожности проистекают из того факта, что даже совсем малое загрязнение геномной ДНК может оказать очень значительное влияние на результаты, полученные с помощью такой чувствительной технологии, как количественная ОТ-ПЦР. Другим важным критерием выбора является обеспечение того, чтобы выбранная пара праймеров не образовывала дуплекс, который мог бы неспецифически мешать полученному конкретному продукту ПЦР и, таким образом, искажать результат (свойственный используемой методике SYBR Green). Наконец, праймеры выбирают таким образом, чтобы они не содержали консенсусные области и/или полиморфизмы. Общая специфичность нуклеотидных последовательностей, выбранных в качестве праймеров гена-мишени, проверяется путем получения комбинации (нуклеотид-нуклеотидный бласт) по всему геному человека (Altschul et al., J. Mol. Biol., 215:403-410, 1990).
• Стандартная кривая амплификации
Эффективность праймеров проверяли 5-кратными серийными разведениями (4 балла), приготовленными в двух экземплярах на РНК, выделенной из клеток NHEK. Оставляли только пары праймеров с эффективностью, близкой к 100% (наклон 3,32). Также выполняли амплификацию с контролем без матрицы (NTC), чтобы гарантировать, что не образуются дуплексы, которые могут исказить количественные результаты ПЦР, полученные методом SYBR Green. Кривая диссоциации, полученная на устройстве 7900НТ, используется для подтверждения уникальности полученного продукта амплификации. Регулярно проверяют стандартную кривую амплификации, чтобы предотвратить любое снижение эффективности праймера.
• Амплификация
Амплификации выполняют в системе определения последовательности ABI Prism 7900 (Applied Biosystems) с использованием метода SYBR Green (набор базовых реагентов для ПЦР SYBR Green, Applied Biosystems). Амплификация состоит из стадии денатурации (10 минут при 95°С), затем повторения 40 циклов гибридизации (15 секунд при 95°С) и удлинения (1 минута при 65°С), которые обеспечивают экспоненциальное дублирование каждой цепи.
• Количественное определение генов
Характеристики гена фенотипа АД, которые были определены количественно, представлены в левом столбце Таблицы 2. Значения ответа нормализованы. Слева направо в таблице: столбец АД указывает уровень индукции каждого гена (при отсутствии активного агента). Столбец, обозначенный ЕТОН40, соответствует значениям, полученным с одним растворителем без активного агента, чтобы обнаружить возможное наложение ответов из-за растворителя. Следующие 2 столбца, обозначенные W01, представляют собой тестируемый образец в двух концентрациях, 1,5 мг/мл и 0,75 мг/мл, соответственно, после индукции. В последнем столбце приведены значения, полученные с положительным контролем, 0,28 мМ дексаметазона.
Результаты


Результаты, представленные в таблицах, показывают ингибирующую способность провоспалительных и воспалительных генов (интерлейкины и хемокины), а также индукцию антимикробных пептидов (которые дефицитны при атопическом дерматите). Антимикробными пептидами, которые сильно индуцированы с помощью W01 дозозависимым образом, являются: DEFB103, RNASE7 и особенно псориазин (S100A7). Ингибированными интерлейкинами являются: IFNB1, IL1A и IL1B. IL4R и TLR3 рецепторы подавлены, причем последний хорошо коррелирует с почти полным ингибированием Хемокина TSLP. Эти 2 фактора сверхэкспрессируются у пациентов с АД и, в частности, в случае появления зуда (Miyagaki et al. 2015. J Dermatol Science 78: 89-94). Мы впервые продемонстрировали такое сильное ингибирование анти-TSLP экстрактом РКК Mimosa pudica в этой модели АД in vitro. Хемокины CCL11, CCL13, CCL20, CCL27, CCL5, CX3CL1, IL15 и особенно IL8 были сильно ингибированы экстрактом W01 независимо от дозы. Таким образом, этот эксперимент показывает, что экстракт РКК Mimosa pudica ингибирует большинство провоспалительных и воспалительных факторов так же, если не лучше, как контрольный дексаметазон, особенно фактор TSLP, который вызывает зуд у пациентов с АД.
Реферат
Группа изобретений относится к фармацевтической и косметической промышленности, а именно к экстракту клетокMimosa pudicaс содержанием мимозина менее 5 нг/г сухой массы и его применению. Способ полученияin vitroэкстракта клетокMimosa pudicaс содержанием мимозина менее 5 нг/г сухой массы, включающий следующие стадии: а. обеспечение стерильного растительного материалаMimosa pudica, b. дедифференцировка клеток из указанного растительного материала, с. суспендирование культуры недифференцированных клеток в жидкой среде для поддержания их в недифференцированном состоянии, d. выращивание культуры биомассы недифференцированных клеток в культуральной среде, е. остановка выращивания и получение экстракта клеток с содержанием мимозина менее 5 нг/г сухой массы, при этом культуральная среда стадии с) и/или стадии d) содержит субстрат фениламмоний-лиазы, выбранный из группы, состоящей из фенилаланина, в частности L-фенилаланина, коричной кислоты, аспарагиновой кислоты, глутаминовой кислоты и их смесей. Экстрактin vitroкультуры клетокMimosa pudica, обладающий ингибирующей активностью в отношении тимусного стромального лимфопоэтина. Композиция, обладающая ингибирующей активностью в отношении тимусного стромального лимфопоэтина. Дерматологическая композиция для лечения воспалительного заболевания кожи, выбранного из атопического дерматита, зуда и зудящего состояния вследствие зуда, экземы и псориаза. Применение экстракта для косметического лечения старения кожи и заболеваний кожи, связанных с окислительным стрессом кожи, включая окислительный стресс из-за загрязнения окружающей среды. Косметическая композиция для косметического лечения, выбранного из лечения старения кожи и заболеваний кожи, связанных с окислительным стрессом кожи. Вышеописанный экстракт характеризуется содержанием мимозина менее 5 нг/г сухой массы и эффективен для ингибирования тимусного стромального лимфопоэтина; для лечения воспалительного заболевания кожи, выбранного из атопического дерматита, зуда и зудящего состояния вследствие зуда, экземы и псориаза; для лечения старения кожи и заболеваний кожи, связанных с окислительным стрессом кожи, включая окислительный стресс из-за загрязнения окружающей среды. 6 н. и 20 з.п. ф-лы, 4 ил., 2 табл., 4 пр.
Формула











Комментарии