Композиции иммуногенных/терапевтических гликоконъюгатов и их применения - RU2720295C2
Код документа: RU2720295C2
Чертежи





















































































Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к композициям и способам для иммунотерапии злокачественных опухолей и иммуногенным/терапевтическим гликоконъюгатам, в частности способным вызывать иммунный ответ против злокачественных опухолей.
[0002] ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ Углеводный антиген Globo-H (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc) впервые выделен из клеток рака молочной железы MCF-7 в качестве связанного с церамидом гликолипида и идентифицирован в 1984 Hakomori et al. (Bremer E G, et al. (1984) J. Biol. Chem. 259:14773-14777). Дальнейшие исследования с моноклональными антителами к Globo-H продемонстрировали, что Globo-H присутствовал на множестве других злокачественных опухолей, включая рак предстательной железы, желудка, поджелудочной железы, легкого, яичника и толстого кишечника, и только на минимальном уровне экспрессировался на люминальной поверхности нормальной секреторной ткани, которая не является легкодоступной для иммунной системы. (Ragupathi G, et al. (1997) Angew. Chem. Int. Ed. 36:125-128). Кроме того, установлено, что сыворотка пациента, страдающего раком молочной железы, содержит высокий уровень антител к Globo-H. (Gilewski T et al. (2001) Proc. Natl. Acad. Sci. USA 98:3270-3275; Huang C-Y, et al. (2006) Proc. Natl. Acad. Sci. USA 103:15-20; Wang C-C, et al. (2008) Proc. Natl. Acad. Sci. USA 105(33):11661-11666). Пациенты с положительными по Globo-H опухолями демонстрировали более короткий период выживания по сравнению с пациентами с отрицательными по Globo-H опухолями. (Chang, Y-J, et al. (2007) Proc. Natl. Acad. Sci. USA 104(25):10299-10304). Эти изыскания сделали Globo-H, гексасахаридный эпитоп, привлекательным опухолевым маркером и пригодной мишенью для разработки вакцины против злокачественных опухолей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0003] Несмотря на то, что разработаны вакцины для вызова гуморального ответа к Globo-H, их эффективность против злокачественных опухолей является неудовлетворительной вследствие низкой антигенности Globo-H. Существует необходимость в новых вакцинах, способных к вызову высоких уровней иммунного ответа, направленного на Globo-H.
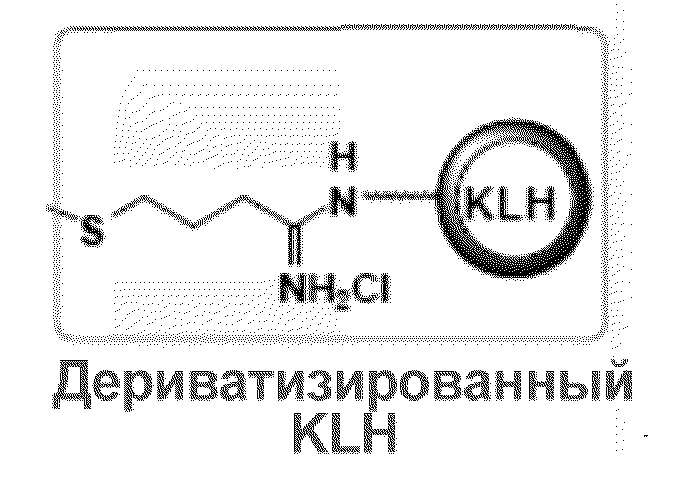
[0004] KLH содержит гликозилированные полипептидные субъединицы, которые могут собираться с формированием декамерных (10-мерных), дидекамерных (20-мерных) и более крупных частиц. Эти мультимерные структуры охарактеризованы способами ультрацентрифугирования, в которых определили коэффициенты седиментации 11-19S для диссоциированных субъединиц и 92-107S для дидекамерных мультимеров. На распределение размеров гемоцианинов моллюсков, включая KLH, может влиять ряд факторов. Эти факторы включают ионную силу, pH, температуру, pO2 и доступность определенных двухвалентных катионов, а именно кальция и магния.
[0005] Авторы настоящего изобретения разработали композицию с неожиданно увеличенной эффективностью, которая преимущественно содержит димеры, тримеры, а также другие мультимеры KLH, связанные с множеством молекул Globo-H.
[0006] Таким образом, настоящее изобретение в основном относится к терапевтическим и/или профилактическим композициям, содержащим Globo-H, а также, иммунотерапевтическим средствам, вакцинам, лекарственным формам, наборам и способам их производства и обработки.
[0007] В одном из вариантов осуществления настоящее изобретение относится к выделенному терапевтическому конъюгат, содержащему молекулу Globo-H, связанную с субъединицей молекулы гемоцианина морского блюдца (KLH). В определенных вариантах осуществления связь представляет собой ковалентную связь.
[0008] В другом варианте осуществления настоящее изобретение относится к выделенному терапевтическому конъюгату, содержащему молекулу Globo-H, ковалентно связанную с субъединицей молекулы гемоцианина морского блюдца (KLH), где KLH представляет собой дериватизированный KLH. Как используют в настоящем документе термин "ковалентно связанный", когда он относится к Globo-H и KLH означает: Globo-H непосредственно ковалентно связана с KLH, или Globo-H ковалентно связана с дериватизированным KLH (как указано в настоящем документе), или Globo-H ковалентно связана с KLH посредством линкерной группы (как указано в настоящем документе), или Globo-H ковалентно связана с KLH посредством линкерной группы и с дериватизированным KLH.
[0009] В определенных иллюстративных вариантах осуществления дериватизированный KLH по изобретению обладает следующей структурой:
[0010] В одном из вариантов осуществления настоящее изобретение относится к выделенному терапевтическому конъюгату, содержащему молекулу Globo-H, ковалентно связанную с субъединицей молекулы гемоцианина морского блюдца (KLH) посредством линкерной молекулы.
[0011] В одном из вариантов осуществления молекулы Globo-H связаны с остатком лизина субъединицы молекулы KLH.
[0012] В одном из вариантов осуществления всего на субъединице молекулы KLH находятся точно или приблизительно 145, 146, 147, 148, 149,150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 суммарных остатков лизина, которые доступны или фактически прямо или опосредовано связаны с молекулой Globo-H.
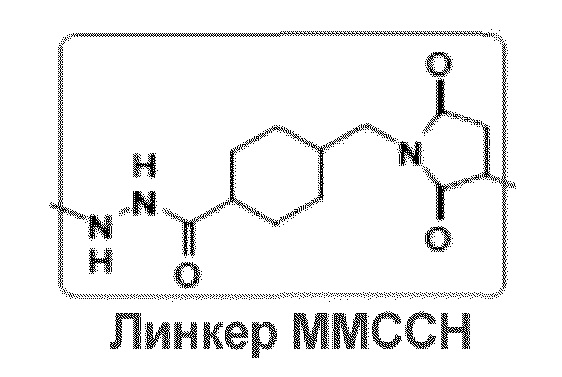
[0013] В другом варианте осуществления настоящее изобретение относится к выделенному терапевтическому конъюгату, содержащему молекулу Globo-H, ковалентно связанную с субъединицей молекулы гемоцианина морского блюдца (KLH) посредством линкерной группы 4-(4-N-малеимидометил)циклогексан-1-карбоксилгидразид (MMCCH). Линкер MMCCH по изобретению обладает следующей структурой:
[0014] В другом иллюстративном варианте осуществления настоящее изобретение относится к выделенному терапевтическому конъюгату следующей общей структуры:
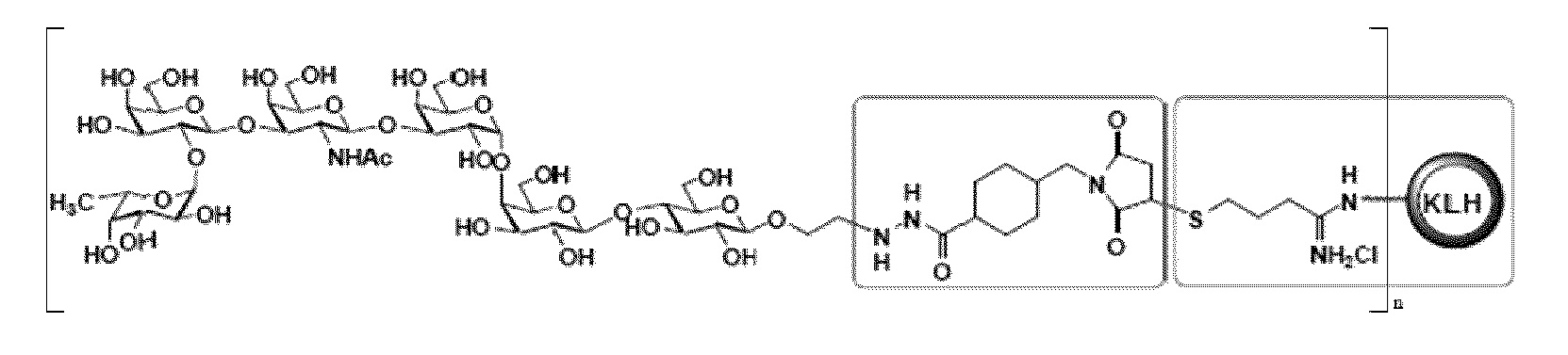
где n представляет собой целое число приблизительно от 1 до приблизительно 160. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 160 молекул Globo-H. Специалисту в данной области понятно, что структуры проиллюстрированы в виде гидрохлорида имина, но они также могут существовать или сосуществовать в форме имина. Таким образом, настоящее изобретение относится к имину, а также его солям, например, включая гидрохлорид имина. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 125 молекул Globo-H. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 100 молекул Globo-H. В определенных вариантах осуществления мономерная молекула KLH может содержать от 1 до приблизительно 75 молекул Globo-H. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 50 молекул Globo-H. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 25 молекул Globo-H. В определенных вариантах осуществления мономерная молекула KLH может содержать приблизительно от 1 до приблизительно 10 молекул Globo-H.
[0015] В определенных вариантах осуществления молекулы Globo-H ковалентно конъюгированы с определенными остатками аминокислот молекулы KLH. В определенных вариантах осуществления остатки аминокислот могут включать или не включать аргинин, лизин, гистидин, аспарагин, пролин, глутамин или их сочетание.
[0016] В другом варианте осуществления молекулы Globo-H связаны с лизиновыми участками конъюгации на мономерной субъединице молекулы KLH.
[0017] В другом варианте осуществления на каждой мономерной субъединице молекулы KLH доступными для связывания или фактически связанными с молекулой Globo-H являются точно или приблизительно 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91,92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109 или 110 лизиновых участков конъюгации. В другом варианте осуществления на каждой субъединице молекулы KLH находятся 62, 66, 67, 68, 70, 72, 76, 86, 87, 88, 90, 92, 93, 100 таких лизиновых участков конъюгации.
[0018] В определенных вариантах осуществления терапевтических композиций, содержащих смесь молекулярных субъединиц (например, KLH1 и KLH2 или их варианты), суммарное количество доступных остатков лизина (для обеих субъединиц), которые подсчитывают вместе по субъединицам различного типа, может составлять или равно приблизительно 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 или 310. В таких вариантах осуществления в различных субъединицах (например, KLH1 и KLH2 или их вариантах) всего находятся точно или приблизительно 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 лизиновых участков конъюгации. В других таких вариантах осуществления находятся 136, 137, 141, 140, 143, 147 или 155 лизиновых участках конъюгации.
[0019] В другом иллюстративном варианте осуществления настоящее изобретение относится к выделенному иммуногенному/терапевтическому конъюгату следующей общей структуры:
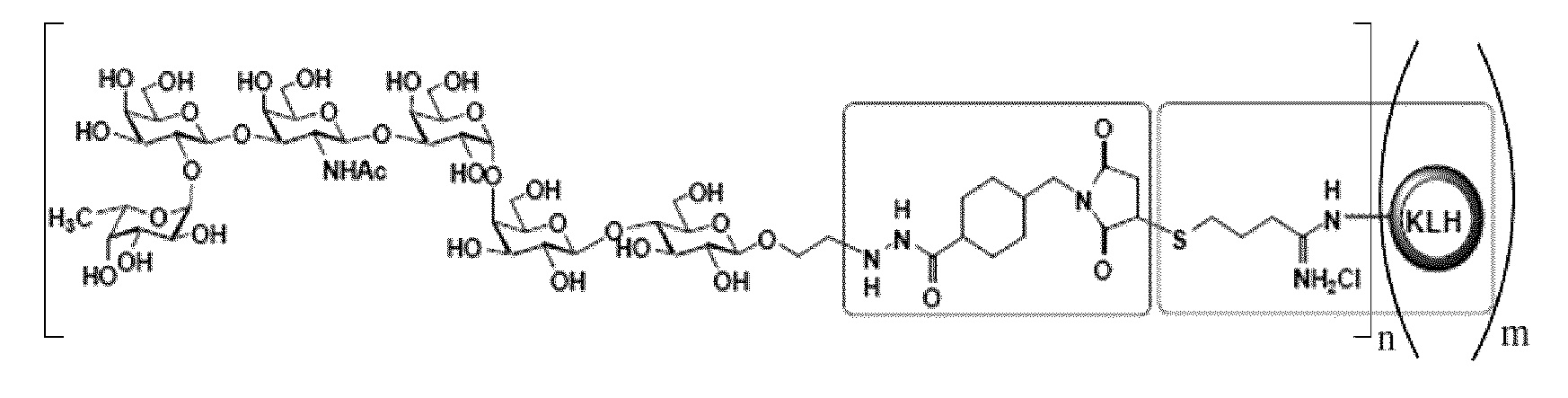
где n независимо представляет собой целое число приблизительно от 1 до приблизительно 3000, и m независимо представляет собой целое число приблизительно от 1 до приблизительно 20. В определенных вариантах осуществления, когда m составляет более 1, молекулы KLH могут агрегировать с формированием мультимерных структур. В определенных вариантах осуществления агрегация представляет собой ковалентную связь. В других определенных вариантах осуществления агрегация не является ковалентной связью (например, агрегация сформирована водородными связями или гидрофобными взаимодействиями). В определенных вариантах осуществления мономерная молекула KLH (например, когда m=1) может содержать приблизительно от 1 до приблизительно 160 молекул Globo-H. В определенных вариантах осуществления димерная молекула KLH (например, когда m=2) может содержать приблизительно от 1 до приблизительно 300 молекул Globo-H. В определенных вариантах осуществления тримерная молекула KLH (например, когда m=3) может содержать приблизительно от 1 до приблизительно 450 молекул Globo-H. В определенных вариантах осуществления тетрамерная молекула KLH (например, когда m=4) может содержать приблизительно от 1 до приблизительно 600 молекул Globo-H. В определенных вариантах осуществления пентамерная молекула KLH (например, когда m=5) может содержать приблизительно от 1 до приблизительно 750 молекул Globo-H. В определенных вариантах осуществления гексамерная молекула KLH (например, когда m=6) может содержать приблизительно от 1 до приблизительно 900 молекул Globo-H. В определенных вариантах осуществления дидекамерная молекула KLH (например, когда m=20) может содержать приблизительно от 1 до приблизительно 3000 молекул Globo-H.
[0020] В другом иллюстративном варианте осуществления настоящее изобретение относится к выделенному иммуногенному/терапевтическому конъюгату следующей общей структуры:

где n независимо представляет собой целое число приблизительно от 1 до приблизительно 150, и m независимо представляет собой целое число приблизительно от 1 до приблизительно 20.
[0021] В других вариантах осуществления настоящее изобретение относится к выделенному терапевтическому конъюгату следующей общей структуры:
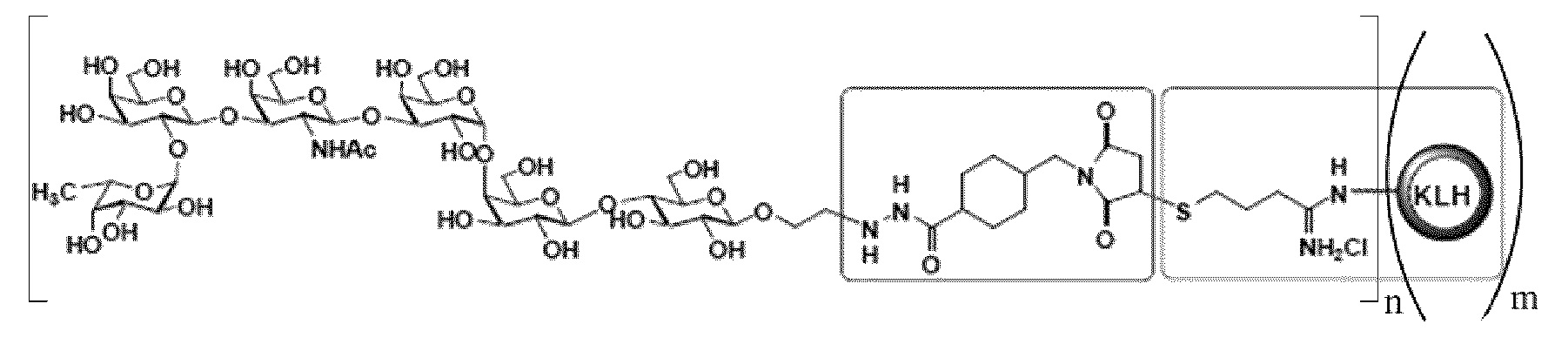
где n независимо представляет собой целое число приблизительно от 1 до приблизительно 160, и где m независимо представляет собой целое число приблизительно от 1 до приблизительно 20. В определенных вариантах осуществления m представляет собой целое число приблизительно от 1 до приблизительно 5. В определенных вариантах осуществления m представляет собой целое число приблизительно от 1 до приблизительно 3. В определенных вариантах осуществления m представляет собой 1. В определенных вариантах осуществления m представляет собой 2. В определенных вариантах осуществления m представляет собой 3. В определенных вариантах осуществления m представляет собой 4. В определенных вариантах осуществления m представляет собой 5. В определенных вариантах осуществления m представляет собой 6. В определенных вариантах осуществления m представляет собой 7. В определенных вариантах осуществления m представляет собой 8. В определенных вариантах осуществления m представляет собой 9. В определенных вариантах осуществления m представляет собой 10. В определенных вариантах осуществления m представляет собой 11. В определенных вариантах осуществления m представляет собой 12. В определенных вариантах осуществления m представляет собой 13. В определенных вариантах осуществления m представляет собой 14. В определенных вариантах осуществления m представляет собой 15. В определенных вариантах осуществления m представляет собой 16. В определенных вариантах осуществления m представляет собой 17. В определенных вариантах осуществления m представляет собой 18. В определенных вариантах осуществления m представляет собой 19. В определенных вариантах осуществления m представляет собой 20. В определенных вариантах осуществления для любых из указанных выше вариантов осуществления, когда m составляет от 1 до 20, каждый из n составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160, соответственно.
[0022] В определенных вариантах осуществления присутствует более одной молекулы Globo-H, связанной с каждой из мономерных молекул KLH. В определенных иллюстративных вариантах осуществления более одной молекулы Globo-H, связанной с каждой из молекул KLH, связаны посредством линкера. В других иллюстративных вариантах осуществления более одной молекулы Globo-H, связанной с каждой из молекул KLH, связаны посредством линкера и связаны с дериватизированной молекулой KLH.
[0023] В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 1. В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 10. В другом варианте осуществления отношение молекул Globo-H к молекуле KLH составляет по меньшей мере 25. В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 50. В дополнительном варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 100. В дополнительном варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 150. В еще одном варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 500. В еще одном дополнительном варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 750. В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 1000. В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 1500. В другом варианте осуществления отношение молекул Globo-H к субъединицам молекулы KLH составляет по меньшей мере 2000.
[0024] В различных вариантах осуществления настоящее изобретение включает от одного мономера KLH до нескольких субъединиц KLH (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20), где с каждой связано несколько молекул Globo-H. В определенных вариантах осуществления отношение молекул Globo-H к молекуле KLH является одинаковым. В других вариантах осуществления отношение молекул Globo-H к молекуле KLH является различным.
[0025] Другой вариант осуществления настоящего изобретения относится к композиции, содержащей по меньшей мере две молекулы KLH. Например, дериватизированную молекулу KLH в форме димера. В другом варианте осуществления по меньшей мере две молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере две молекулы KLH являются различными. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере двух молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере двух молекул KLH является различным.
[0026] Другой вариант осуществления настоящего изобретения относится к терапевтической композиции, содержащей по меньшей мере три молекулы KLH, например, дериватизированную молекулу KLH в форме тримера. В определенных вариантах осуществления по меньшей мере три молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере три молекулы KLH не являются одинаковыми. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере трех молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере трех молекул KLH является различным.
[0027] Другой вариант осуществления настоящего изобретения относится к терапевтической композиции, содержащей по меньшей мере четыре молекулы KLH, например, дериватизированную молекулу KLH в форме тетрамера. В определенных вариантах осуществления по меньшей мере четыре молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере четыре молекулы KLH не являются одинаковыми. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере четырех молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере четырех молекул KLH является различным.
[0028] Другой вариант осуществления настоящего изобретения относится к терапевтической композиции, содержащей по меньшей мере пять молекул KLH, например, дериватизированную молекулу KLH в форме пентамера. В определенных вариантах осуществления по меньшей мере пять молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере пять молекулы KLH не являются одинаковыми. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере пяти молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере пяти молекул KLH является различным.
[0029] Другой вариант осуществления настоящего изобретения относится к терапевтической композиции, содержащей по меньшей мере шесть молекул KLH, например, дериватизированную молекулу KLH в форме гексамера. В определенных вариантах осуществления по меньшей мере шесть молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере шесть молекулы KLH не являются одинаковыми. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере шести молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере шести молекул KLH является различным.
[0030] Другой вариант осуществления настоящего изобретения относится к терапевтической композиции, содержащей по меньшей мере двадцать молекул KLH, например, дериватизированную молекулу KLH в форме дидекамера. В определенных вариантах осуществления по меньшей мере двадцать молекулы KLH являются одинаковыми. В другом варианте осуществления по меньшей мере двадцать молекулы KLH не являются одинаковыми. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере двадцати молекул KLH является одинаковым. В дополнительном варианте осуществления отношение молекулы Globo-H к субъединице молекулы KLH по меньшей мере двадцати молекул KLH является различным.
[0031] В одном из вариантов осуществления молекула Globo-H содержит (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc). В дополнительном варианте осуществления субъединица молекулы KLH представляет собой молекулу KLH-1 или молекулу KLH-2 или их сочетание. Как используют в настоящем документе, термин "KLH" относится к KLH-1, KLH-2 и/или к их сочетанию.
[0032] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 99% идентична соответствующей природной субъединице молекулы KLH.
[0033] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 95% идентична соответствующей природной субъединице молекулы KLH.
[0034] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 90% идентична соответствующей природной субъединице молекулы KLH.
[0035] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 80% идентична соответствующей природной субъединице молекулы KLH.
[0036] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 70% идентична соответствующей природной субъединице молекулы KLH.
[0037] В другом варианте осуществления субъединица молекулы KLH по меньшей мере на 60% идентична соответствующей природной субъединице молекулы KLH.
[0038] В другом варианте осуществления молекула Globo-H ковалентно связана с субъединицей молекулы гемоцианина морского блюдца (KLH) посредством линкера. В еще одном дополнительном варианте осуществления молекула Globo-H ковалентно связана с субъединицей молекулы гемоцианина морского блюдца (KLH) посредством линкера 4-(4-N-малеимидометил)циклогексан-1-карбоксилгидразид (MMCCH). В другом дополнительном варианте осуществления молекула Globo-H ковалентно связана с дериватизированной субъединицей молекулы гемоцианина морского блюдца (KLH) и связана посредством линкера 4-(4-N-малеимидометил)циклогексан-1-карбоксилгидразид (MMCCH).
[0039] В другом варианте осуществления эпитопное отношение выделенного терапевтического конъюгата на основе мономера KLH с молекулярной массой приблизительно от 350 кДа до приблизительно 400 кДа составляет по меньшей мере или приблизительно 150. В другом варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 100. В дополнительном варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 75. В дополнительном варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 50. В еще одном дополнительном варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 25. В другом варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 15. В другом варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 5. В другом варианте осуществления эпитопное отношение выделенного терапевтического конъюгата составляет по меньшей мере или приблизительно 1.
[0040] Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей субъединицы молекулы KLH, где каждая субъединица молекулы KLH содержит одну или более молекул Globo-H, ковалентно связанных с субъединицей молекулы гемоцианина морского блюдца (KLH). В определенных вариантах осуществления фармацевтическая композиция содержит димеры по меньшей мере двух субъединиц молекулы KLH, где каждая из субъединиц молекулы KLH содержит одну или более молекул Globo-H, ковалентно связанных с субъединицей молекулы KLH. В определенных вариантах осуществления фармацевтическая композиция содержит тримеры по меньшей мере трех субъединиц молекулы KLH, где каждая из субъединиц молекулы KLH содержит одну или более молекул Globo-H, ковалентно связанных с субъединицей молекулы KLH. В определенных вариантах осуществления фармацевтическая композиция содержит по меньшей мере четыре субъединицы молекулы KLH, где каждая из субъединиц молекулы KLH содержит одну или более молекул Globo-H, ковалентно связанных с субъединицей молекулы KLH. В определенных вариантах осуществления фармацевтическая композиция содержит смесь из субъединиц молекулы KLH (например, мономеров, димеров, тримеров, тетрамеров, пентамеров, гексамеров и т.д.), где каждая из субъединиц молекулы KLH содержит несколько молекул Globo-H, ковалентно связанных с субъединицей молекулы KLH.
[0041] Другой аспект изобретения относится к фармацевтической композиции, содержащей мономеры, димеры, тримеры, тетрамеры, пентамеры, гексамеры или их сочетания молекул KLH, где каждая KLH содержит одну или более молекул Globo-H, ковалентно связанных с субъединицей молекулы гемоцианина морского блюдца (KLH).
[0042] В одном из вариантов осуществления изобретения эпитопные отношения терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 1 до 3000. В дополнительном варианте осуществления эпитопные отношения терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 75 до 2000. В другом варианте осуществления эпитопные отношения терапевтических конъюгатов в композиции находятся в диапазоне приблизительно от 100 до 1000. В еще одном дополнительном варианте осуществления среднее эпитопное отношение терапевтических конъюгатов в композиции находится в диапазоне приблизительно от 150 до 500.
[0043] В другом варианте осуществления приблизительно от 1% до 99% терапевтических конъюгатов в композиции являются мономерами KLH. В дополнительном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции являются димерами KLH. В другом варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции являются тримерами KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции являются тетрамерами KLH. В дополнительном варианте осуществления приблизительно от 1% до 99% терапевтических конъюгатов в композиции являются пентамерами KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 6 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 7 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 8 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 9 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 10 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 11 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 12 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 13 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 14 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 15 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 16 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 17 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 18 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 19 субъединиц KLH. В еще одном варианте осуществления приблизительно от 0% до 99% терапевтических конъюгатов в композиции содержат 20 субъединиц KLH. В другом варианте осуществления приблизительно от 1% до 99% терапевтических конъюгатов в композиции являются мономерами, димерами, тримерами, тетрамерами или их сочетаниями. В другом варианте осуществления приблизительно 99% терапевтических конъюгатов в композиции являются мономерами, димерами, тримерами, тетрамерами или их сочетаниями.
[0044] В определенных вариантах осуществления определенные иллюстративные варианты композиций и способы их применения могут включать или исключать (например, они изъяты) любое одно или более из других иллюстративных вариантов соединений и/или композиций, описываемых в настоящем документе.
[0045] В другом варианте осуществления фармацевтическая композиция содержит адъювант. Как используют в настоящем документе, термины "иммунологический адъювант" относится к веществу, используемому в сочетании с иммуногеном, которое усиливает или модифицирует иммунный ответ на иммуноген. Конкретно, термины "адъювант" и "иммуноадъювант" используют в настоящем изобретении взаимозаменяемо, и они относятся к соединению или смеси, которые могут не являться иммуногенными при введении хозяину отдельно, но которые усиливают иммунный ответ хозяина на другой антиген при введении совместно с этим антигеном. Опосредуемое адъювантом усиление и/или продление длительности иммунного ответа можно оценивать любым известным в данной области способом, включая в качестве неограничивающих примеров один или более из следующих: (i) увеличение количества антител, продуцируемых в ответ на иммунизацию комбинацией адъювант/антиген по сравнению с количеством антител, продуцируемых в ответ на иммунизацию только антигеном; (ii) увеличение количества T-клеток, распознающих антиген или адъювант; и (iii) увеличение уровня одного или более цитокинов I типа.
[0046] Адъювант можно вводить в виде фармацевтической или вакцинной композиции, содержащей антиген, или в виде отдельного состава, который вводят совместно со второй композицией, содержащей антиген. В любой из этих композиций гликосфинголипиды (GSLs) можно комбинировать с другими адъювантами и/или эксципиентами/носителями. Эти другие адъюванты в качестве неограничивающих примеров включают адъюванты на основе масляных эмульсий и эмульгаторов, такие как полный адъювант Фрейнда, неполный адъювант Фрейнда, MF59 или SAF; минеральные гели, такие как гидроксид алюминия (квасцы), фосфат алюминия или фосфат кальция; получаемые из микробов адъюванты, такие как холерный токсин (CT), токсин коклюша, термолабильный токсин (LT) Escherichia coli, мутантные токсины (например, LTK63 или LTR72), бациллу Кальмета-Герена (BCG), Corynebacterium parvum, CpG-мотивы ДНК, мурамилдипептид или монофосфориллипид A; дисперсные адъюванты, такие как иммуностимулирующие комплексы (ISCOM), липосомы, биоразлагаемые микросферы или сапонины (например, QS-21); цитокины, такие как IFN-γ, IL-2, IL-12 или GM-CSF; синтетические адъюванты, такие как неионные блок-сополимеры, аналоги мурамилпептида (например, N-ацетил-мурамил-L-треонил-D-изоглутамин [thr-MDP], N-ацетил-нормурамил-L-аланил-D-изоглутамин, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-[1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси]-этиламин), полифосфазены или синтетические полинуклеотиды и поверхностно-активные вещества, такие как лизолецитин, полиолы-плюроники, полианионы, пептиды, углеводородные эмульсии или гемоцианины морского блюдца (KLH), молекулы Toll-подобных рецепторов, LPS, липопротеины, липопептиды, флагеллин, двухцепочечная РНК, вирусная ДНК, неметилированные CpG-островки, левамизол, бацилла Кальмета-Герена, изопринозин, задаксин, антагонисты PD-1, антитела к PD-1, антагонисты CTLA, антитела к CTLA, интерлейкин, цитокины, GM-CSF, гликолипид, основная соль алюминия, фосфат алюминия, квасцы, гидроксид алюминия, липосомы, агонисты TLR2, липопептид, наночастицы, монофосфориллипид A, сапонин OBI-821, сапонин, адъювант OBI-834, адъювант C34, наноэмульсии масло-в-воде и подобные бактериям частицы. Предпочтительно эти дополнительные адъюванты также являются фармацевтически приемлемыми для применения у людей.
[0047] В другом варианте осуществления фармацевтическая композиция содержит цитокин, выбранный из группы, состоящей из IL-2, IL-12, IL-18, IL-2, IFN-γ, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β. В дополнительном варианте осуществления фармацевтическая композиция содержит хемокин.
[0048] В дополнительном варианте осуществления иммуногенное/терапевтическое средство вводят в виде фармацевтической композиции.
[0049] В другом варианте осуществления фармацевтическая композиция содержит моноклональные антитела, химиотерапевтические средства, гормональные терапевтические средства, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические средства, антинеопластические средства, антипролиферативные средства, средства против mTOR, средства против Her2, средства против EGFR, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-КоА-редуктазы, азотистые иприты, нитрозокарбамиды, ингибиторы ангиогенеза, бевацизумаб, ингибиторы клеточной пролиферации и пути передачи сигнала выживания, индуцирующие апоптоз средства, средства, блокирующие контрольные точки клеточного цикла, средства, блокирующие рецепторы тирозинкиназы (RTK), блокаторы интегринов, НПВП, агонисты PPAR, ингибиторы наследственной множественной лекарственной устойчивости (MDR), противорвотные средства, средства, пригодные при лечении анемии, средства, пригодные при лечении нейтропении, усиливающие иммунологический ответ лекарственные средства, биофосфонаты, ингибиторы ароматазы, средства, индуцирующие конечную дифференцировку неопластических клеток, ингибиторы γ-секретазы, вакцины против злокачественных опухолей (например, активная иммунотерапия), моноклональные терапевтические средства (например, пассивная иммунотерапия) и любое их сочетание.
[0050] В другом варианте осуществления терапевтические композиции по изобретению могут дополнительно содержать ингибиторы PD-1/PD-L1 (иммунотерапия цитотоксическими T-лимфоцитами (CTL)), средства для иммунотерапии CTLA-4, ингибиторы CDK4/6 (направленная терапия), ингибиторы PI3K (направленная терапия), ингибиторы mTOR (направленная терапия), ингибиторы AKT (направленная терапия), панингибиторы Her (направленная терапия). Также эти ингибиторы можно модифицировать с получением соответствующих моноклональных антител. Такие антитела можно включать в терапевтические композиции по изобретению.
[0051] В другом варианте осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель. В дополнительном варианте осуществления фармацевтическая композиция представляет собой вакцину против злокачественной опухоли. В другом варианте осуществления фармацевтическую композицию формулируют для подкожного введения. В другом варианте осуществления фармацевтическую композицию формулируют для внутримышечного введения. В другом варианте осуществления фармацевтическую композицию формулируют для внутриартериального введения. В другом варианте осуществления фармацевтическую композицию формулируют для внутривенного введения.
[0052] Другой вариант осуществления настоящего изобретения относится к способу лечения нуждающегося в этом пациента, включающему введение пациенту терапевтически эффективного количества терапевтической композиции, содержащей Globo-H и KLH. В одном из вариантов осуществления у пациента диагностировано или предполагается наличие злокачественной опухоли. В другом варианте осуществления злокачественная опухоль представляет собой эпителиальную злокачественную опухоль. В дополнительном варианте осуществления злокачественная опухоль представляет собой рак молочной железы. В другом варианте осуществления терапевтически эффективное количество молекулы Globo-H в фармацевтической/терапевтической композиции может находиться в диапазоне приблизительно от 0,001 мкг/кг до приблизительно 250 мг/кг. В еще одном дополнительном варианте осуществления терапевтически эффективное количество молекулы Globo-H в фармацевтической/терапевтической композиции составляет приблизительно от 10 мкг/кг до приблизительно 50 мкг/кг одного терапевтического конъюгата на дозу. В еще одном дополнительном варианте осуществления терапевтически эффективное количество молекулы Globo-H в фармацевтической/терапевтической композиции составляет приблизительно от 0,10 мкг/кг до приблизительно 0,75 мкг/кг одного терапевтического конъюгата на дозу.
[0053] В другом варианте осуществления терапевтически эффективное количество комплекса Globo-H-KLH в терапевтической композиции может находиться в диапазоне приблизительно от 0,001 мкг/кг до приблизительно 250 мг/кг. В еще одном дополнительном варианте осуществления терапевтически эффективное количество комплекса Globo-H-KLH в терапевтической композиции составляет приблизительно от 10 мкг/кг до приблизительно 50 мкг/кг одного терапевтического конъюгата на дозу. В еще одном дополнительном варианте осуществления терапевтически эффективное количество комплекса Globo-H-KLH в терапевтической композиции составляет приблизительно от 0,60 мкг/кг до приблизительно 4,50 мкг/кг одного терапевтического конъюгата на дозу.
[0054] В другом варианте осуществления с применением способа можно продлевать продолжительность существования без прогрессирования по сравнению с контролем плацебо на период приблизительно или по меньшей мере 1 неделю. В другом варианте осуществления с применением способа можно продлевать продолжительность существования без прогрессирования по сравнению с контролем плацебо на период приблизительно или по меньшей мере 2 недели. В другом варианте осуществления с применением способа можно продлевать продолжительность существования без прогрессирования по сравнению с контролем плацебо на период приблизительно или по меньшей мере 1 месяц. В другом варианте осуществления с применением способа можно продлевать продолжительность существования без прогрессирования по сравнению с контролем плацебо на период приблизительно или по меньшей мере 3 месяца. В другом варианте осуществления с применением способа можно продлевать продолжительность существования без прогрессирования по сравнению с контролем плацебо на период приблизительно или по меньшей мере 6 месяцев. В еще одном варианте осуществления с применением способа можно продлевать или поддерживать общее существование по сравнению с контролем плацебо на период приблизительно или по меньшей мере 12 месяцев.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0055] Более полное понимание изобретения можно получить при обращении к сопровождающим чертежам, рассматриваемым в сочетании с следующим ниже подробным описанием. Варианты осуществления, проиллюстрированные на чертежах, предназначены только для иллюстрации изобретения, и их не следует рассматривать, как ограничивающие изобретение иллюстрируемыми вариантами осуществления.
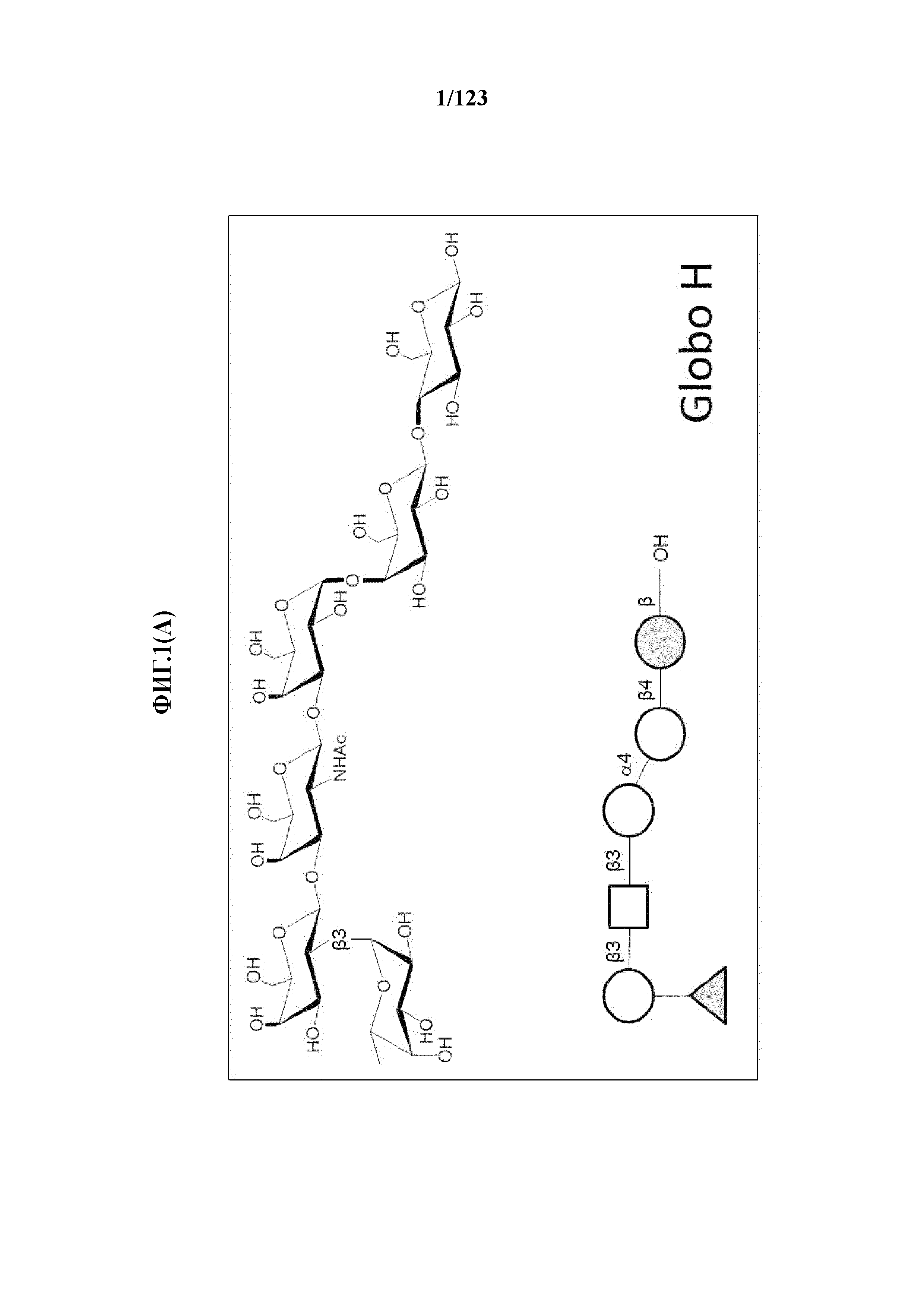
[0056] На фигуре 1A представлена химическая структура Globo-H, а также несколько иллюстративных аналогов Globo-H. Glc обозначает глюкозу, Gal обозначает галактозу, GalNAc обозначает N-ацетилгалактозамин, и Fuc обозначает фукозу. На фигуре 1B представлена иллюстративная субъединица Globo-H-KLH, конъюгированная посредством линкера MMCCH.
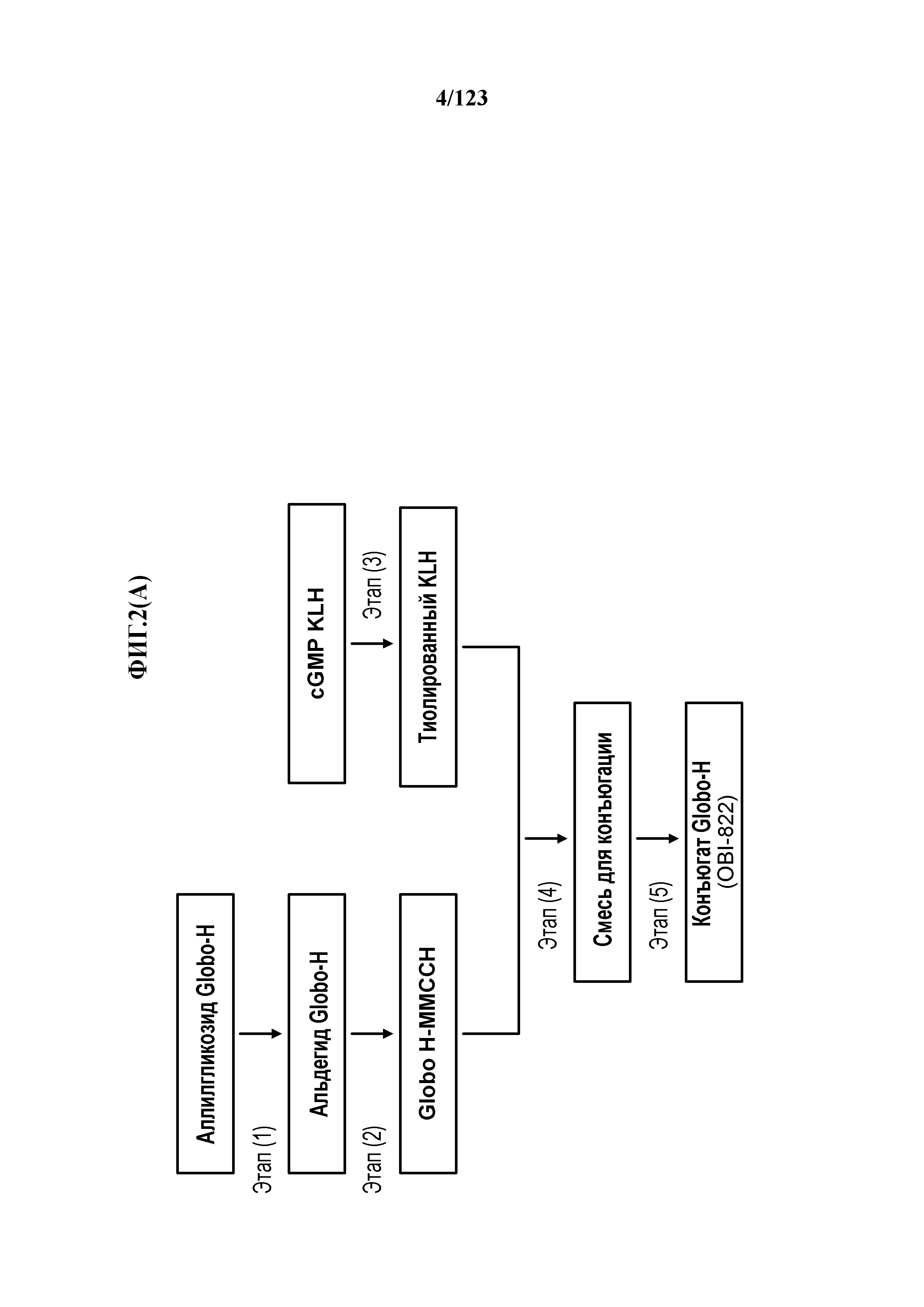
[0057] На фигуре 2A представлен иллюстративный путь синтеза конъюгата Globo-H-субъединицы KLH. На фигуре 2B представлены димеры и тримеры Globo-H-KLH по изобретению по сравнению с конъюгатами Globo-H, описанными в Slovin et al (1999), Proc. Natl. Acad. Sci. USA 96:5710-5 и Gilewski et al (2001), Proc. Natl. Acad. Sci. USA 98: 3270-5.
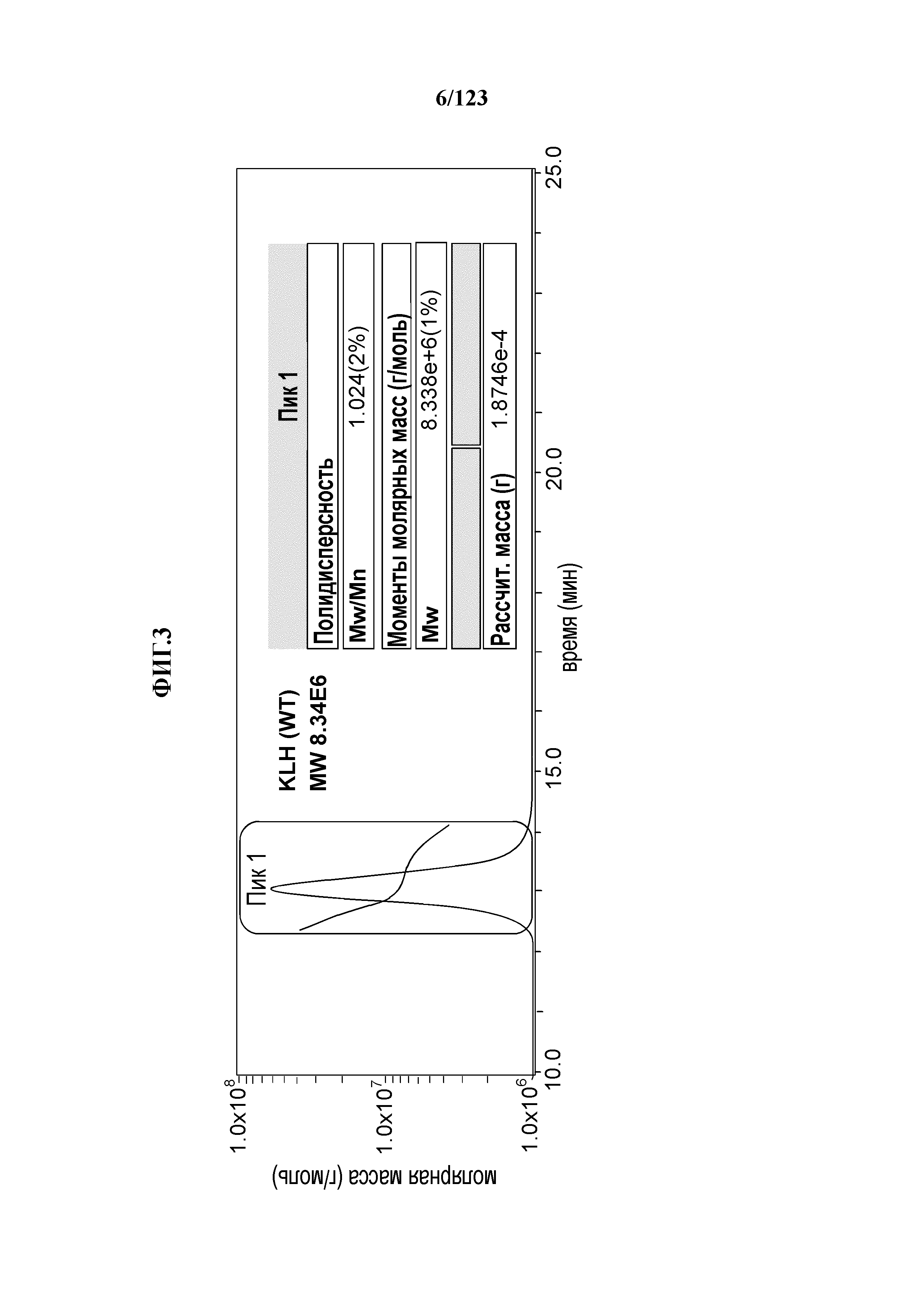
[0058] На фигуре 3 представлен результат спектрометрии углового рассеяния лазерного излучения (MALS) природного KLH (8,3 МДа).
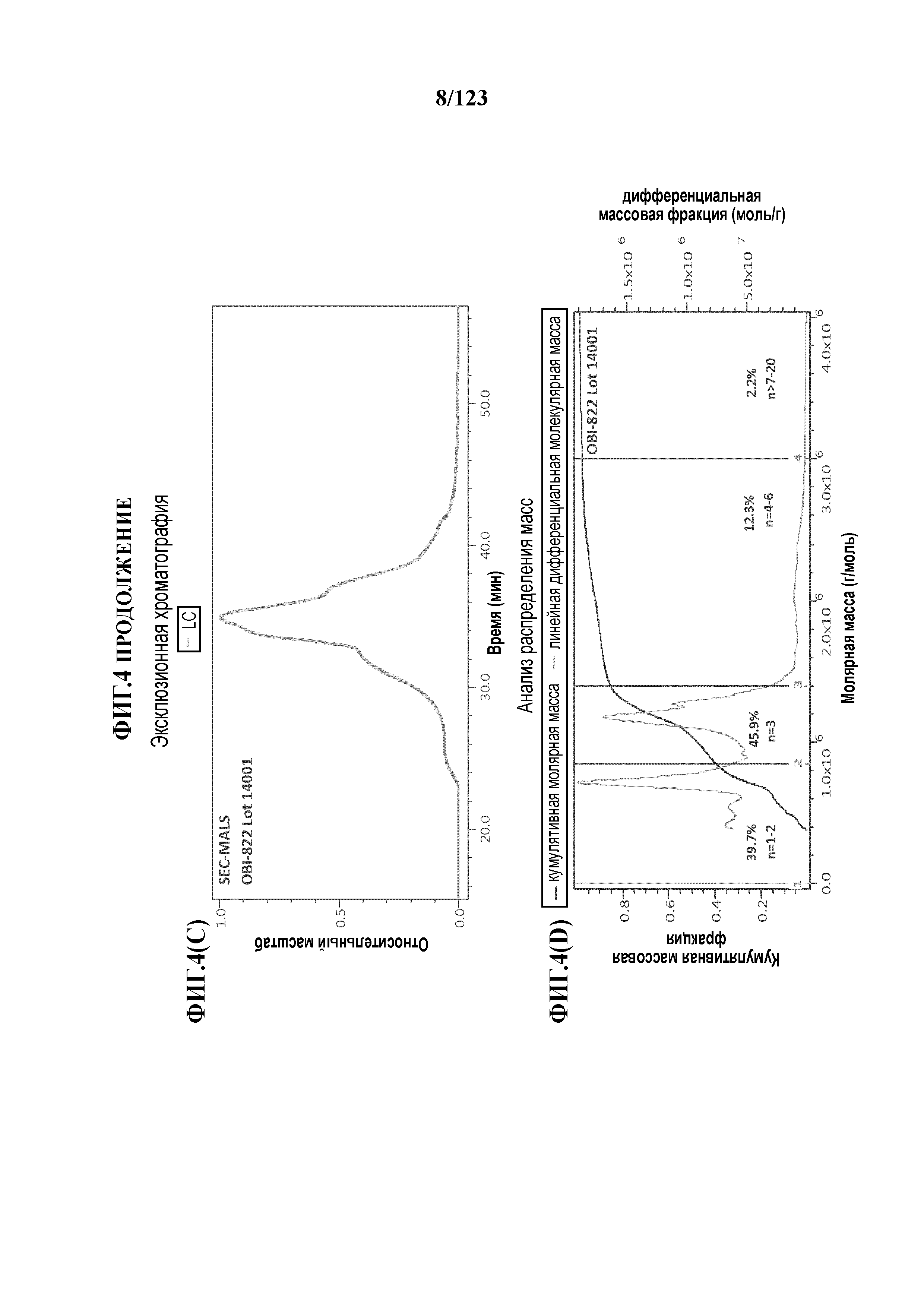
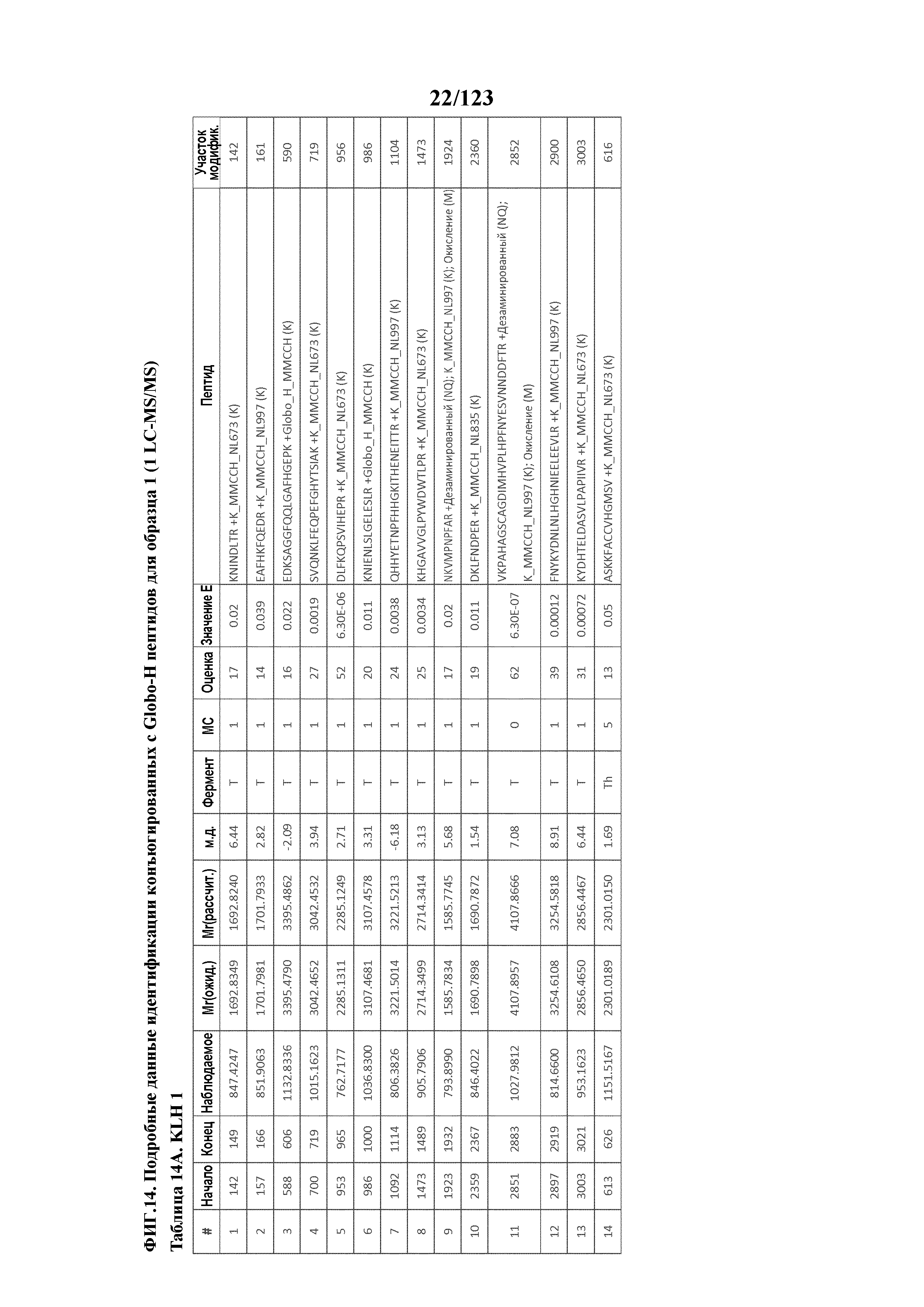
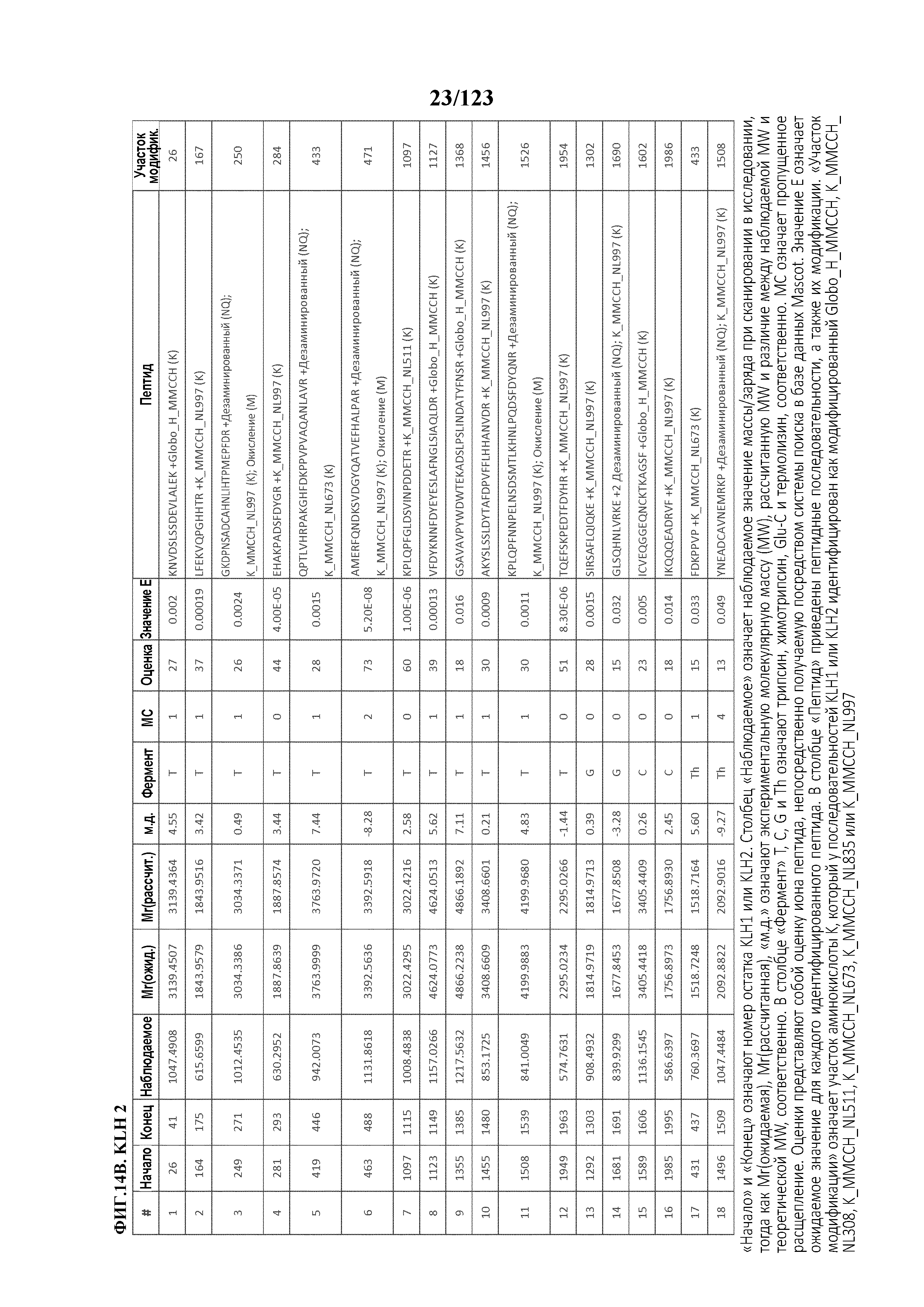
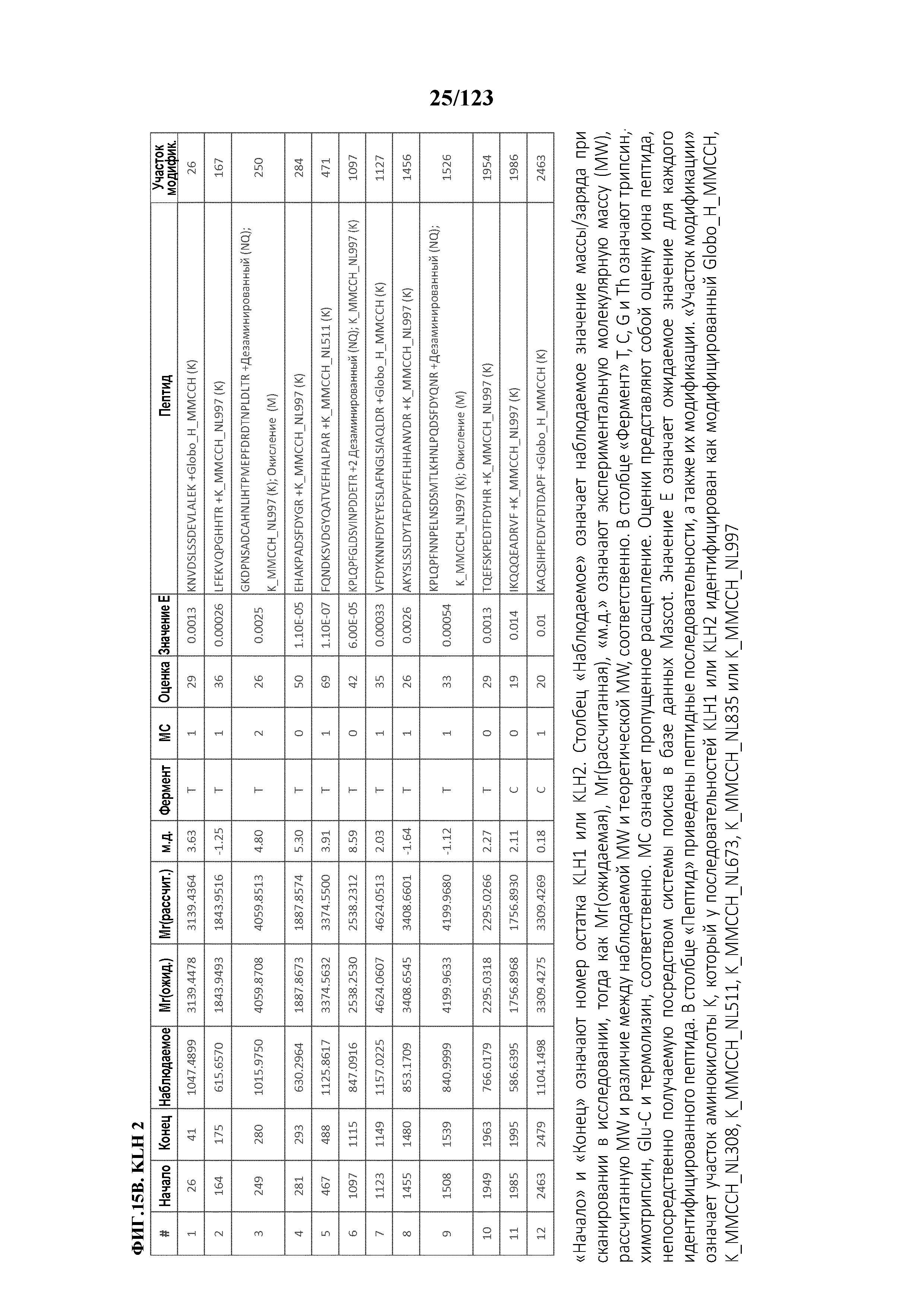
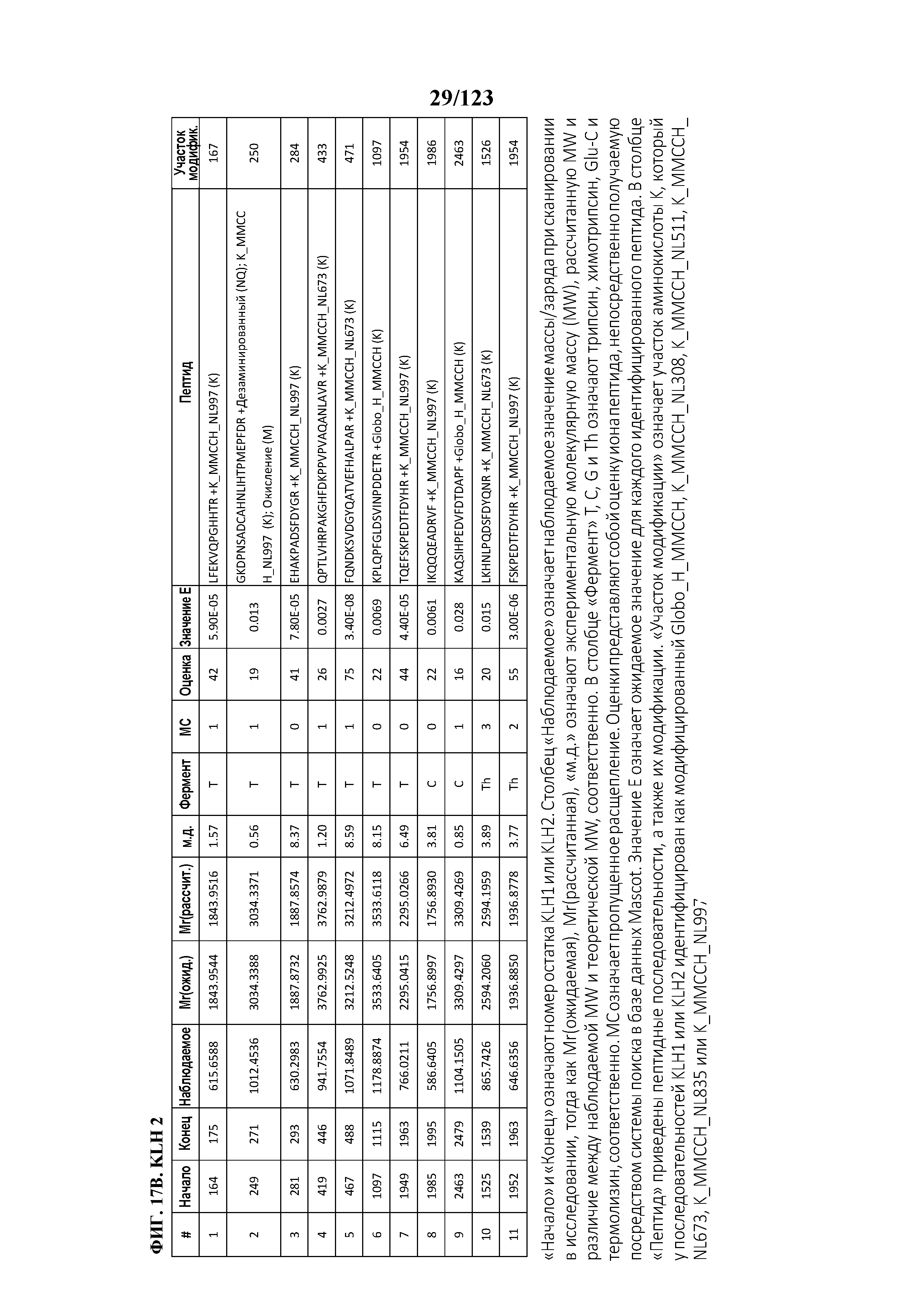
[0059] На фигуре 4A представлен результат эксклюзионной хроматографии KLH с использованием спектрометрии углового рассеяния лазерного излучения (MALS) в качестве детектора. На фигуре 4B представлен анализ распределения масс KLH. На фигуре 4C представлен результат эксклюзионной хроматографии гликоконъюгата Globo-H-KLH (№ партии OBI-822 14001) с использованием спектрометрии углового рассеяния лазерного излучения (MALS) в качестве детектора. На фигуре 4D представлен анализ распределения масс гликоконъюгата Globo-H-KLH.
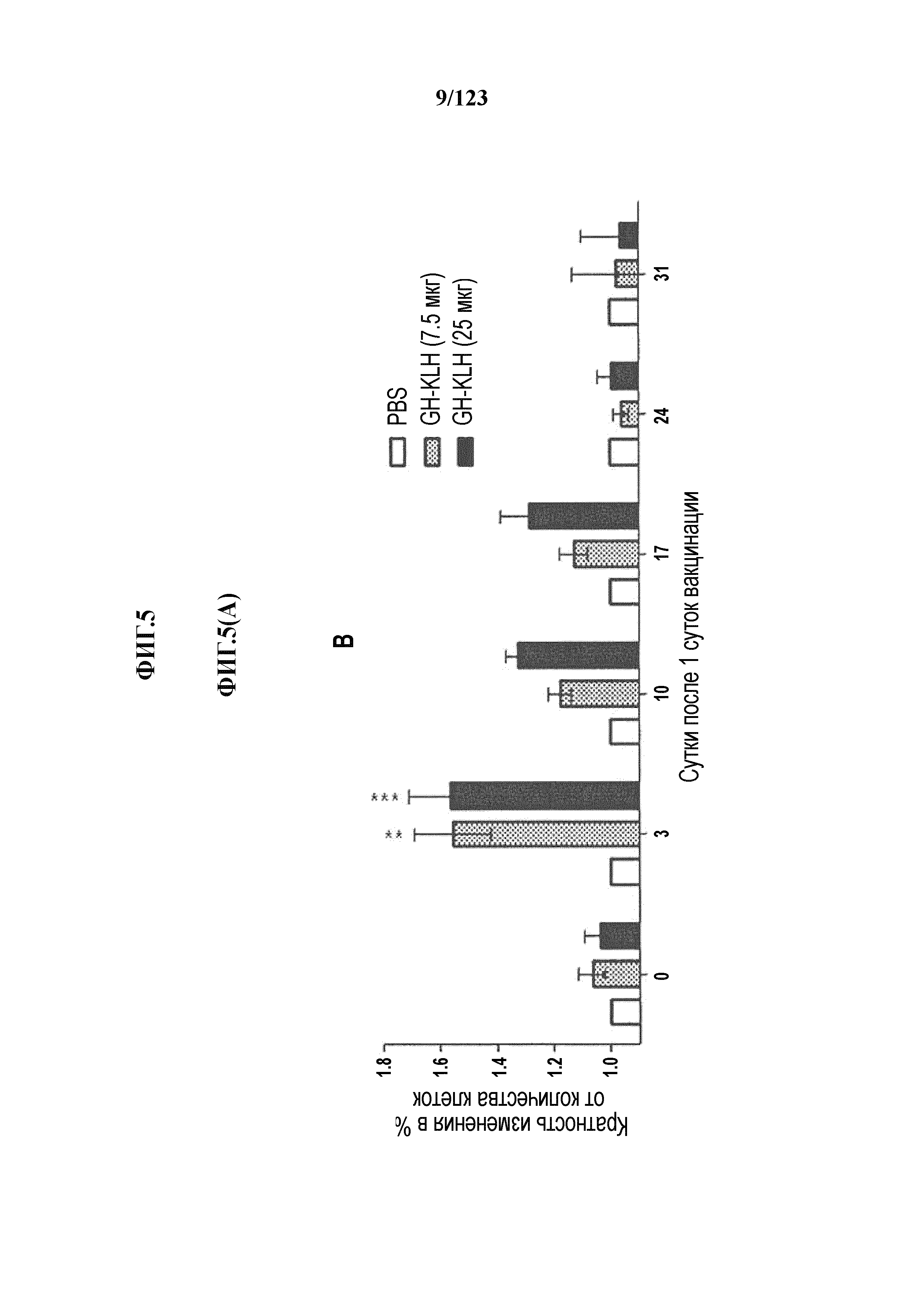
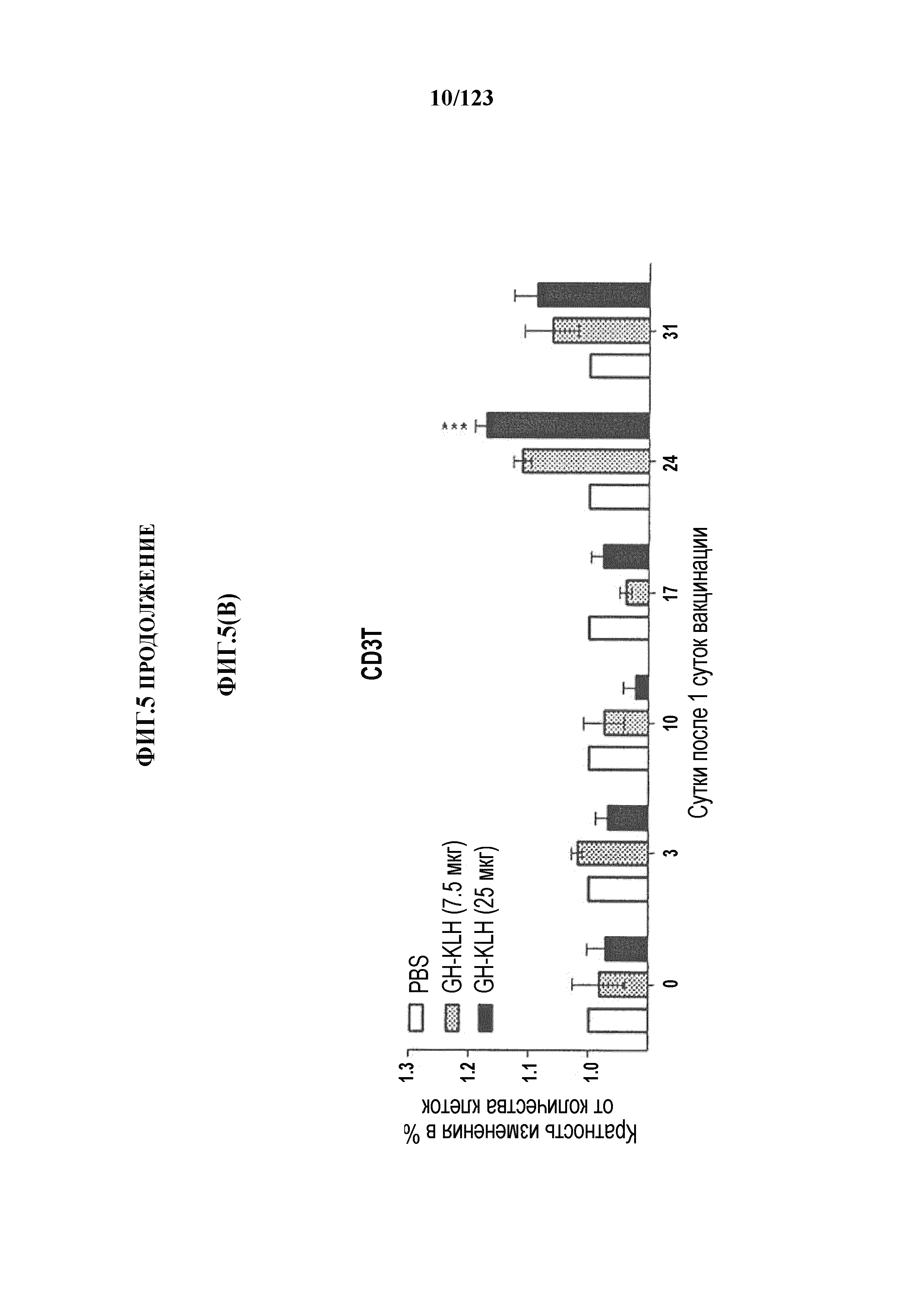
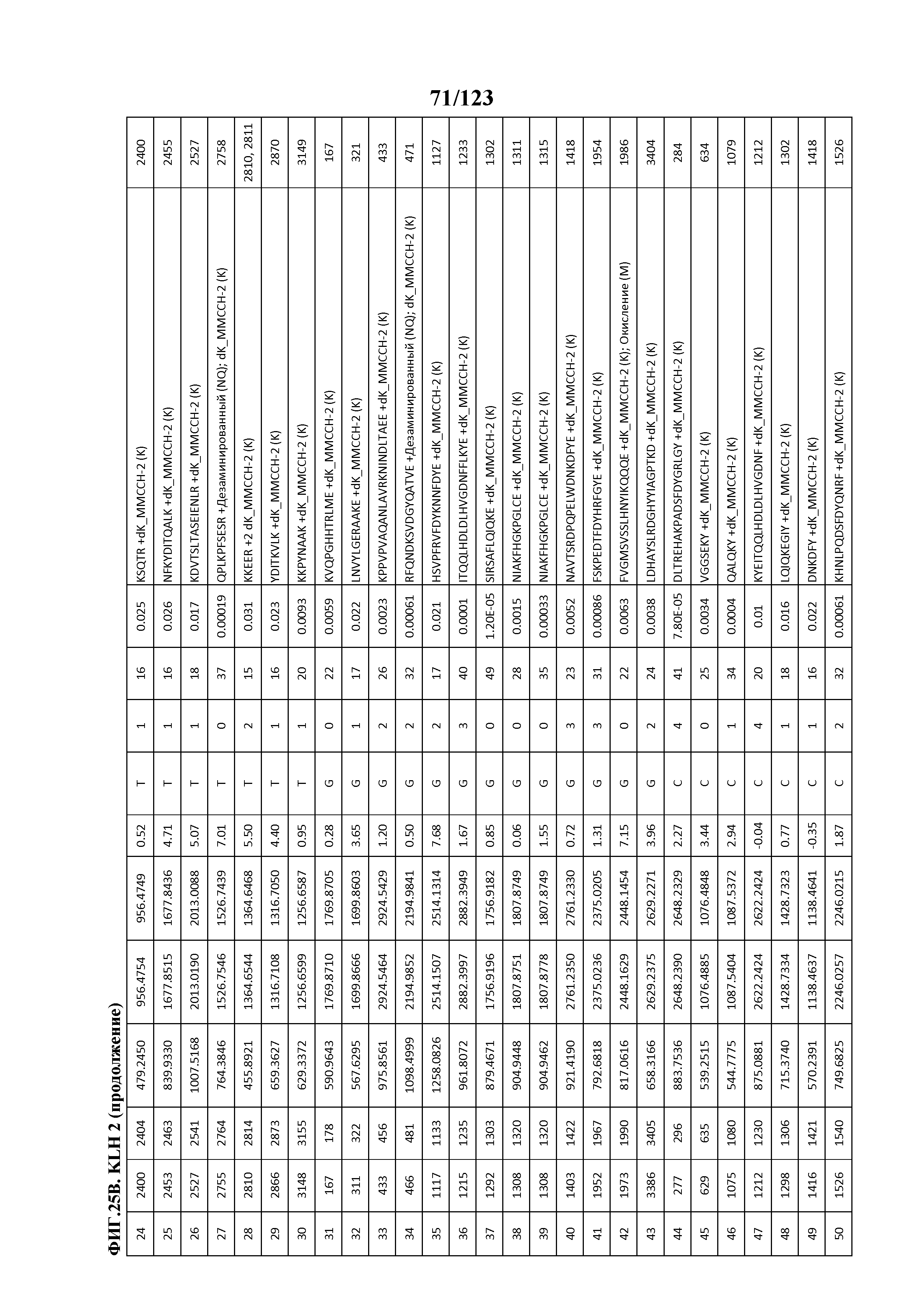
[0060] На фигуре 5A представлен рост популяций B-клеток у крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг), в течение времени. На фигуре 5B представлен рост популяций CD3+-T-клеток у крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг), в течение времени. На фигуре 5C представлен рост популяций CD4+-T-клеток у крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг), в течение времени. На фигуре 5D представлен рост популяций CD8+-T-клеток у крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг), в течение времени. Данные представлены в виде процента количества клеток в указанной группе, нормализованного на процент количества клеток группы с PBS. Множественные сравнения анализировали с использованием двухстороннего ANOVA, с последующими апостериорными поправками Бонферрони. *, p<0,05, **, p<0,01 и ***, p<0,001 по сравнению с PBS.
[0061] На фигуре 6A приведены хронологические изменения реципрокных титров антител IgM в крови крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг). На фигуре 6B представлены хронологические изменения реципрокных титров антитела IgG в крови крыс Lewis, иммунизированных иллюстративным гликоконъюгатом Globo-H-KLH (7,5 мкг и 25 мкг).
[0062] На фигуре 7 представлены титры антител IgM у мышей в ответ на определенные конъюгационные отношения между Globo-H и KLH (0,17:1 и 0,07:1).
[0063] На фигуре 8 проиллюстрирована иммуногенность у мышей C57BL/6, которых иммунизировали PBS, гликоконъюгатом Globo-H-KLH+адъювант сапонин (OBI-822+OBI-821) и гликоконъюгатом Globo-H-KLH+адъювант C34 (OBI-822+OBI-834). Сыворотки собирали на сутки 42 для анализа ELISA с определением продукции антител IgM и IgG к Globo-H. На фигуре 8A представлена продукция IgM. На фигуре 8B представлена продукция IgG. Подкожное (п/к) введение гликоконъюгата Globo-H-KLH составляло 2 мкг, а адъюванта - 20 мкг.
[0064] На фигуре 9 проиллюстрированы шесть групп иммунокомпетентных (возраст 6-8 недель), стерильных (SPF) самок мышей C57BL/6, которым в объеме 0,1 мл инъецировали 5,0×106 клеток карциномы легких Льюиса (LL/2, ATCC CRL-1642), сингенных мышам C57BL/6, которые инъецировали подкожно в брюшную область в направлении бока экспериментальных мышей, на сутки 16. Три тестируемых фактора (только PBS, OBI-822+адъювант OBI-821 и OBI-822+адъювант OBI-834) вводили подкожно по 0,2 мл/мышь (в левый и правый брюшной участки, 0,1 мл/участок) или интраперитонеально в объеме дозирования 10 мл/кг на сутки 0, 5, 11, 19, 29, 34 и 39. После умерщвления на сутки 42 получены по три изображения опухоли с целым телом.
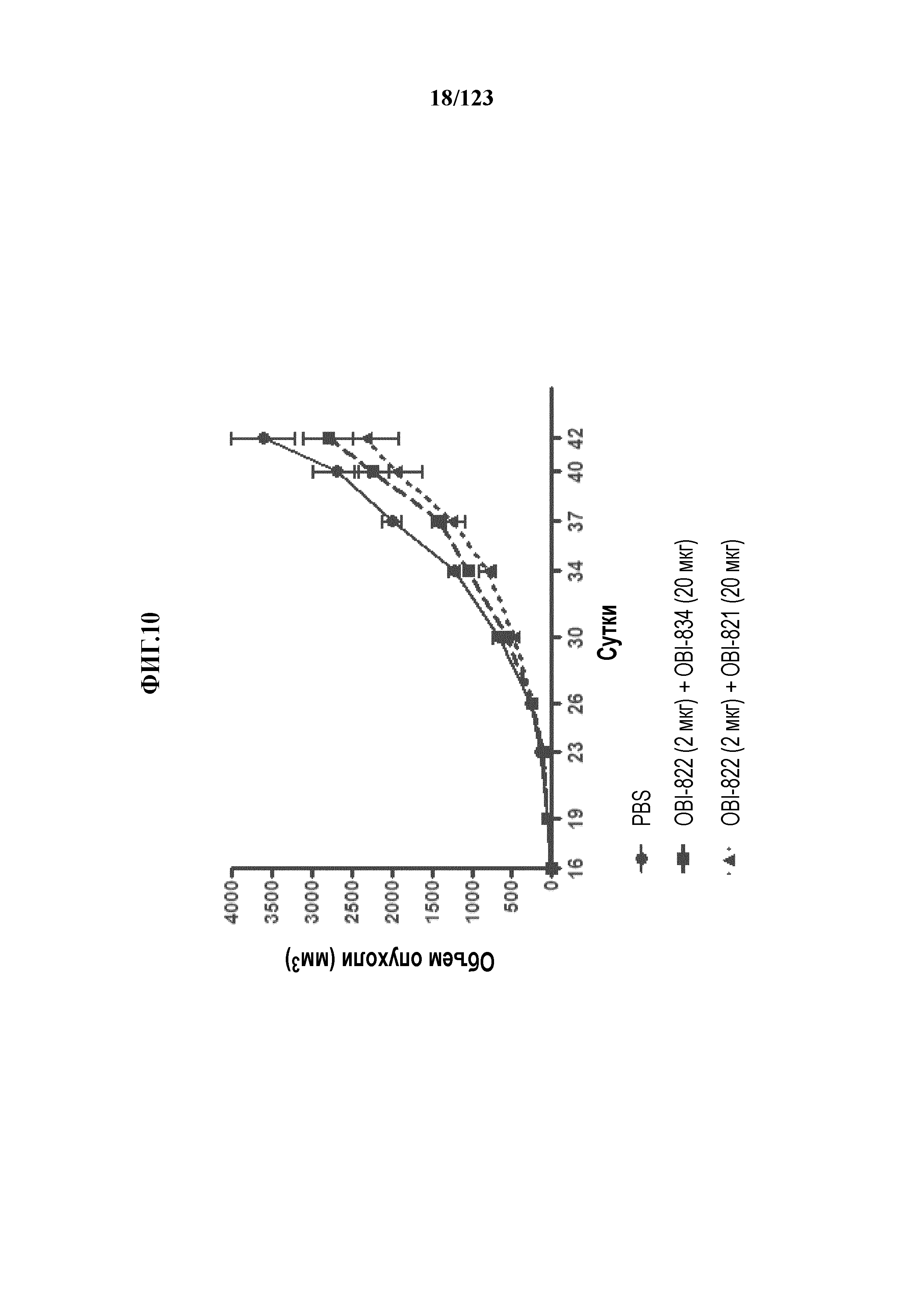
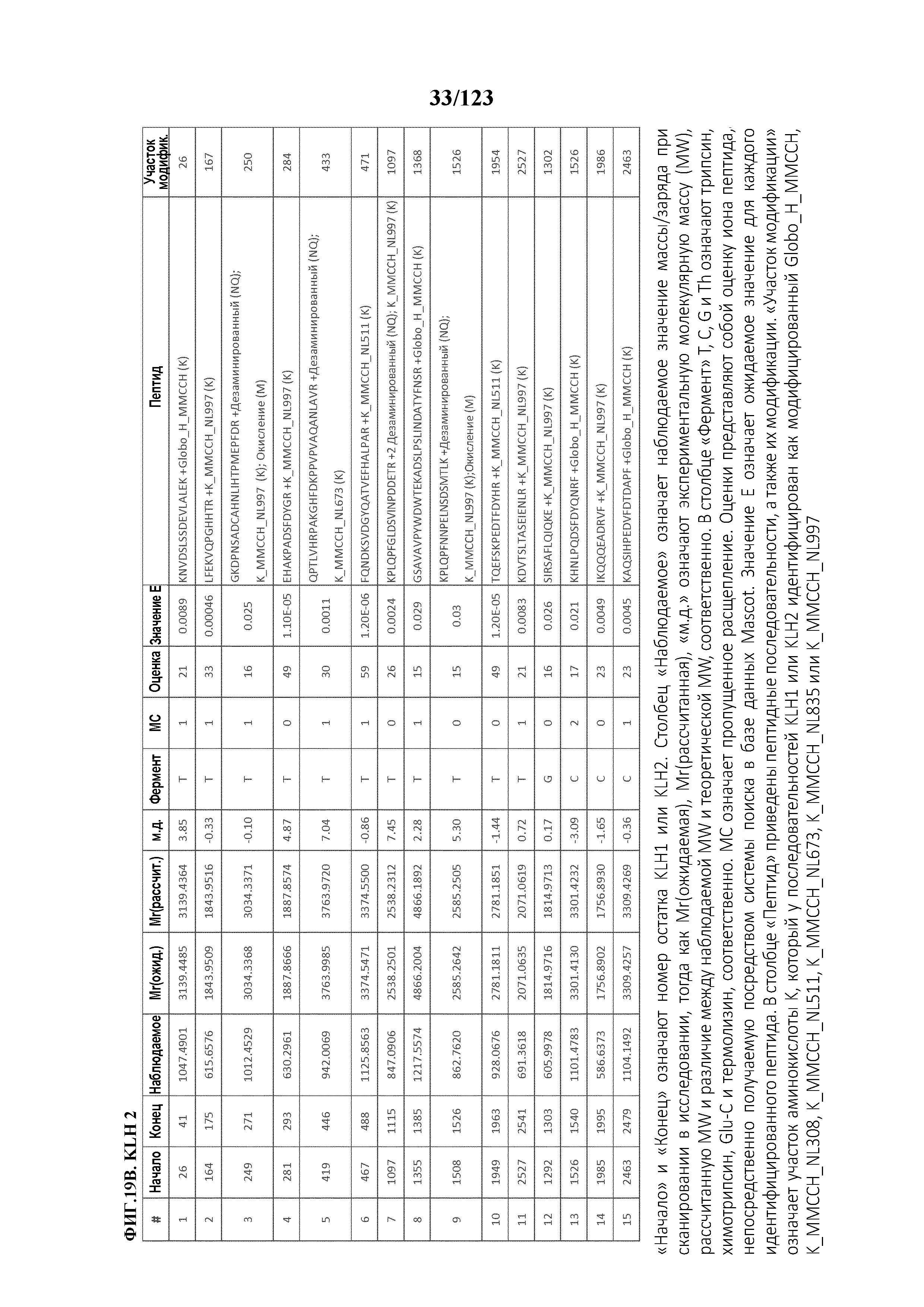
[0065] На фигуре 10 проиллюстрирован рост опухоли LL/2 (линия клеток карциномы легких Льюиса) у иммунизированных гликоконъюгатом Globo-H-KLH мышей C57BL/6, которых подкожно вакцинировали PBS, OBI-822+адъювант OBI-821 и OBI-822+адъювант OBI-834 на сутки 0, 5, 11, 19, 29, 34 и 39. Клетки LL/2 (5,0×106 in 0,1 мл) подкожно инъецировали каждой мыши на сутки 16. Размеры опухолей определяли на сутки 16, 19, 23, 26, 30, 34, 37, 40 и 42.
[0066] На фигуре 11 проиллюстрирована химическая структура производного Globo-H. На фигуре 11A проиллюстрировано производное Globo-H [химическая формула: C(56)H(91)N(5)O(33)S(1), добавление моноизотопной MW: 1393,5317 Да]. На фигуре 11B проиллюстрирован формы с потерей нейтральных частиц производного Globo-H. Химическая формула 1: C(18)H(28)N(4)O(4)S(1), добавление моноизотопной MW: 396,1831 Да; химическая формула 2: C(24)H(38)N(4)O(9)S(1), добавление моноизотопной MW: 558,2360 Да; химическая формула 3: C(30)H(48)N(4)O(14)S(1), добавление моноизотопной MW: 720,2888 Да; химическая формула 4: C(36)H(58)N(4)O(19)S(1), добавление моноизотопной MW: 882,3416 Да; химическая формула 5: C(44)H(71)N(5)O(24)S(1), добавление моноизотопной MW: 1085,4210 Да.
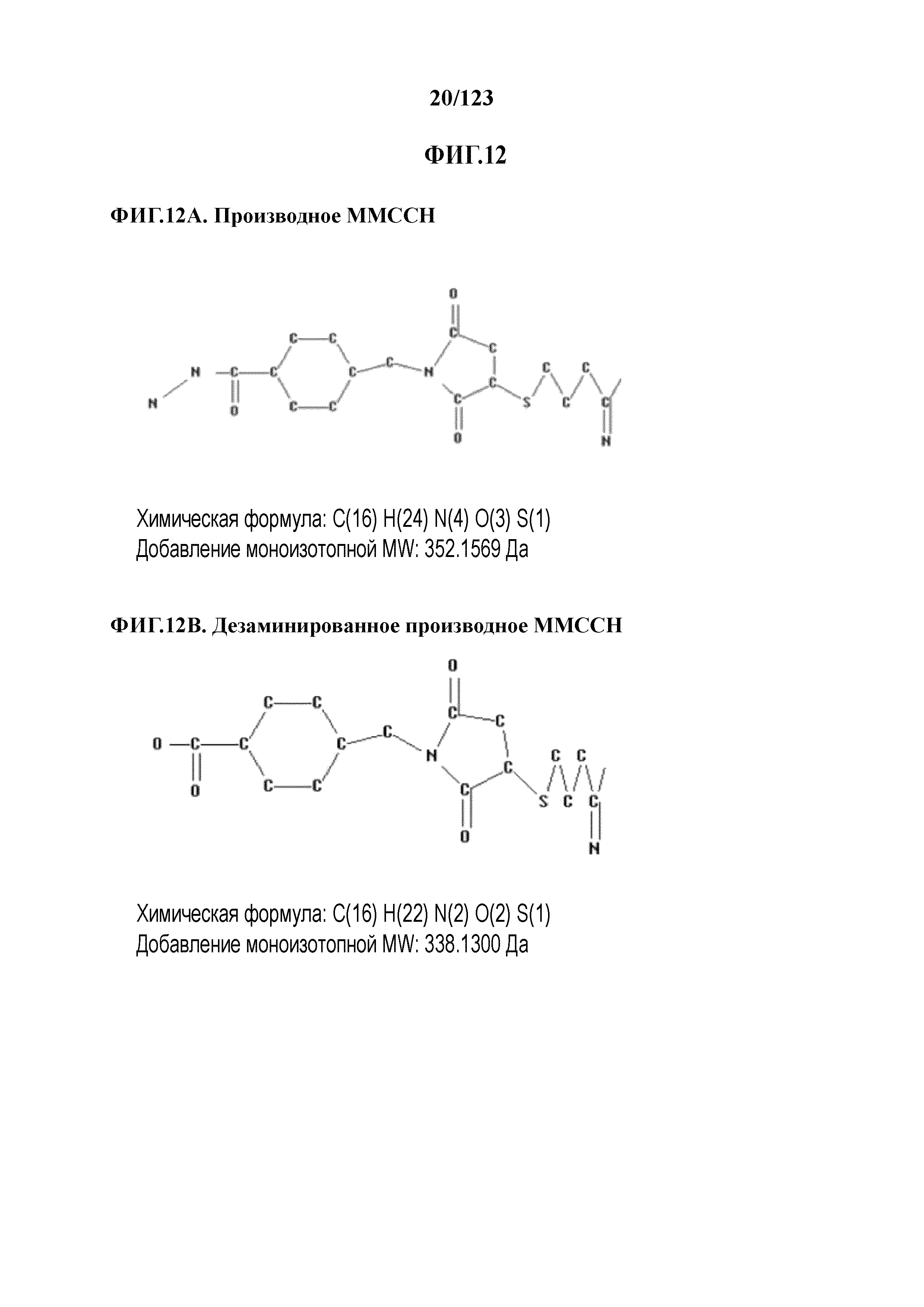
[0067] На фигуре 12 проиллюстрирована химическая структура производного MMCCH. На фигуре 12A проиллюстрирована химическая структура производного MMCCH [химическая формула: C(16)H(24)N(4)O(3)S(1), добавление моноизотопной MW: 352,1569 Да]. На фигуре 12B проиллюстрирован дезаминированное производное MMCCH [химическая формула: C(16)H(22)N(2)O(4)S(1), добавление моноизотопной MW: 338,1300 Да].
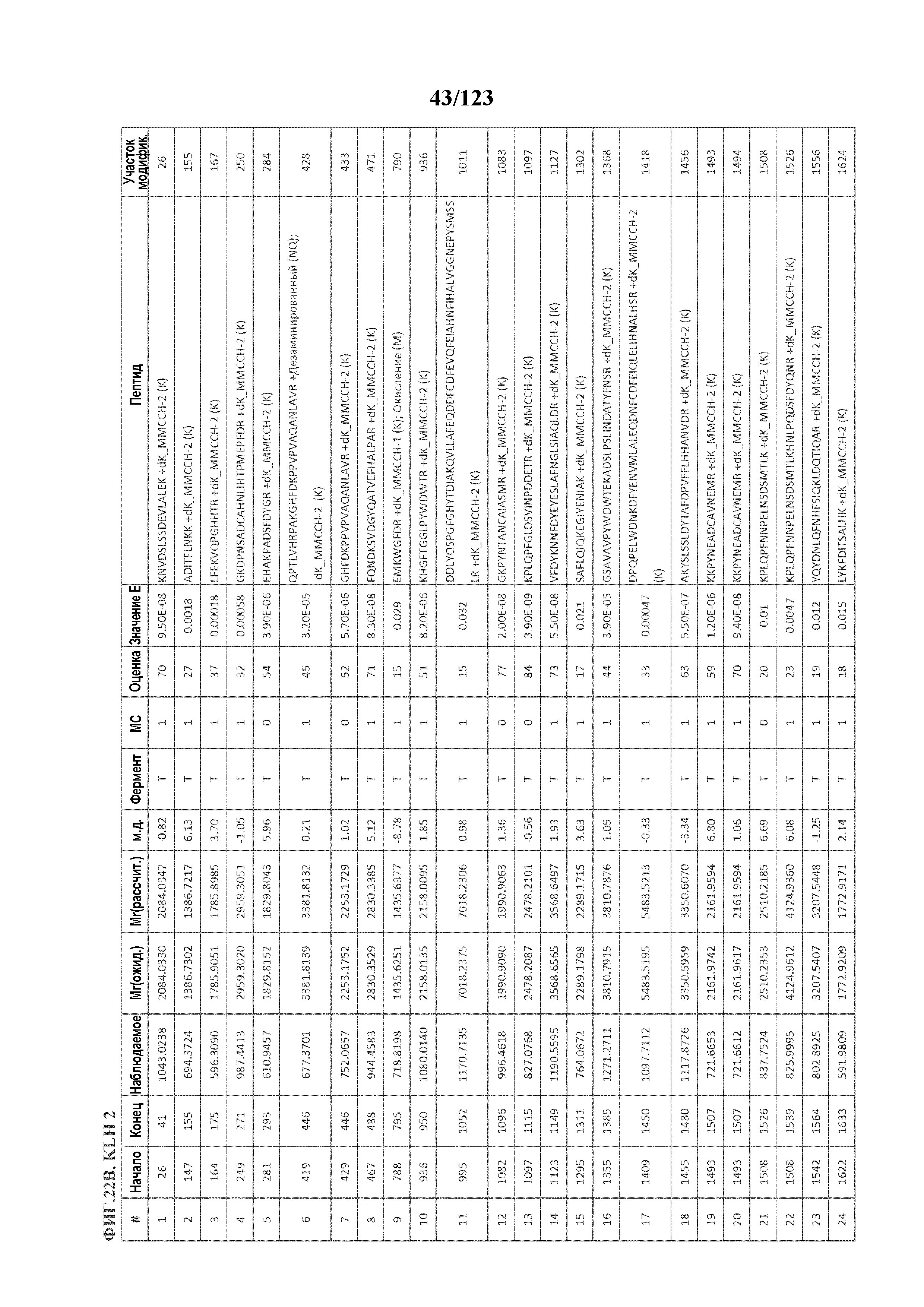
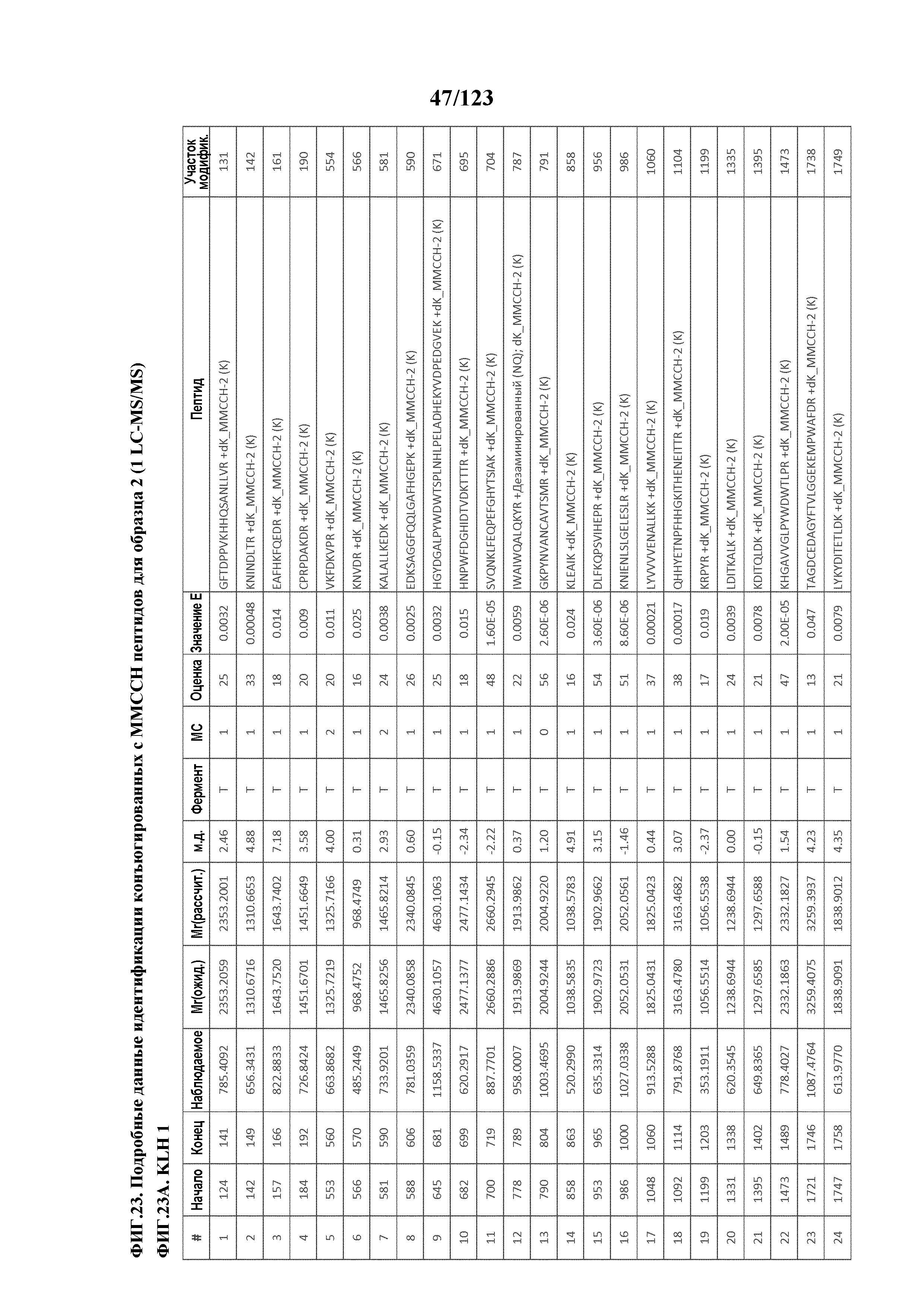
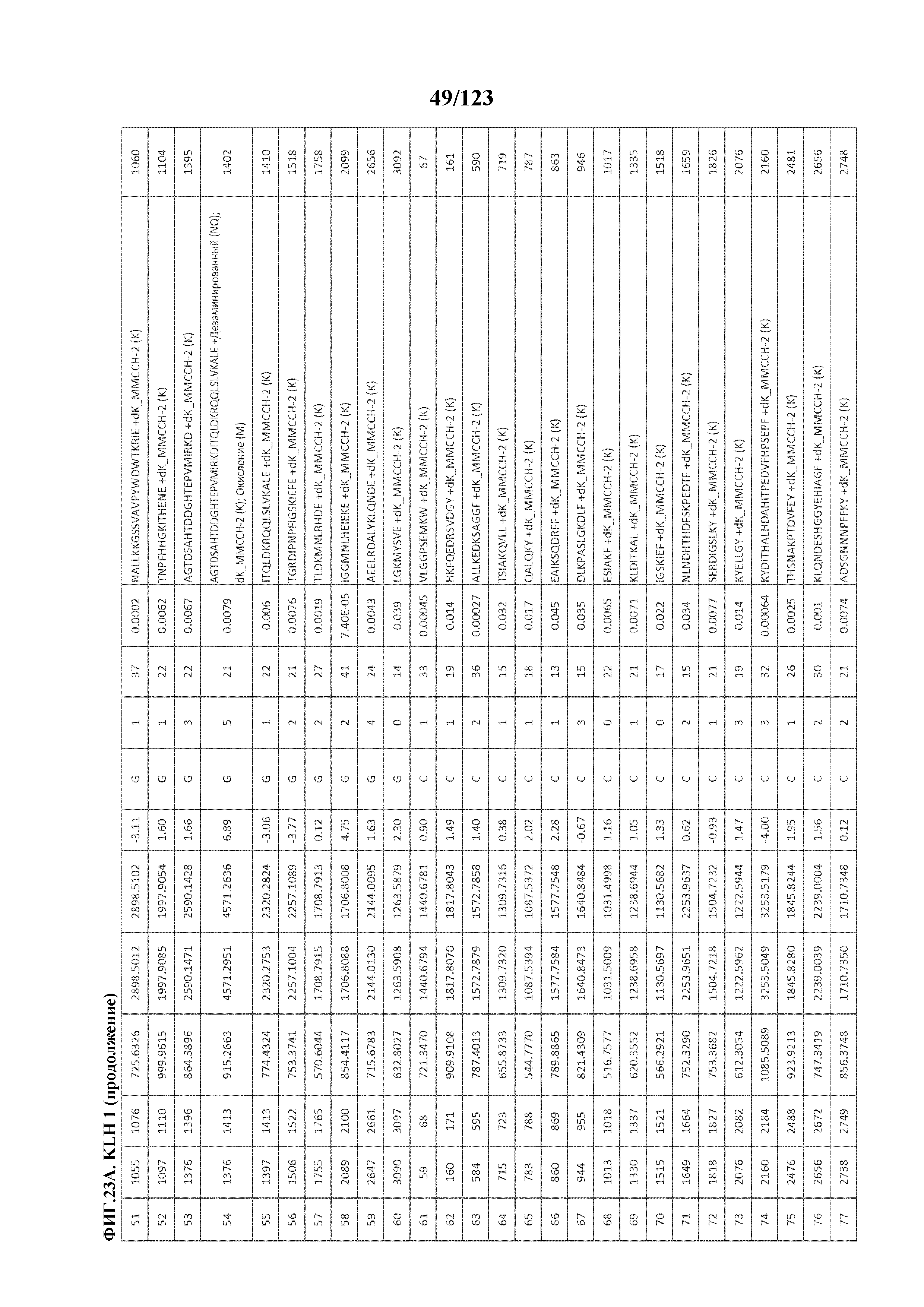
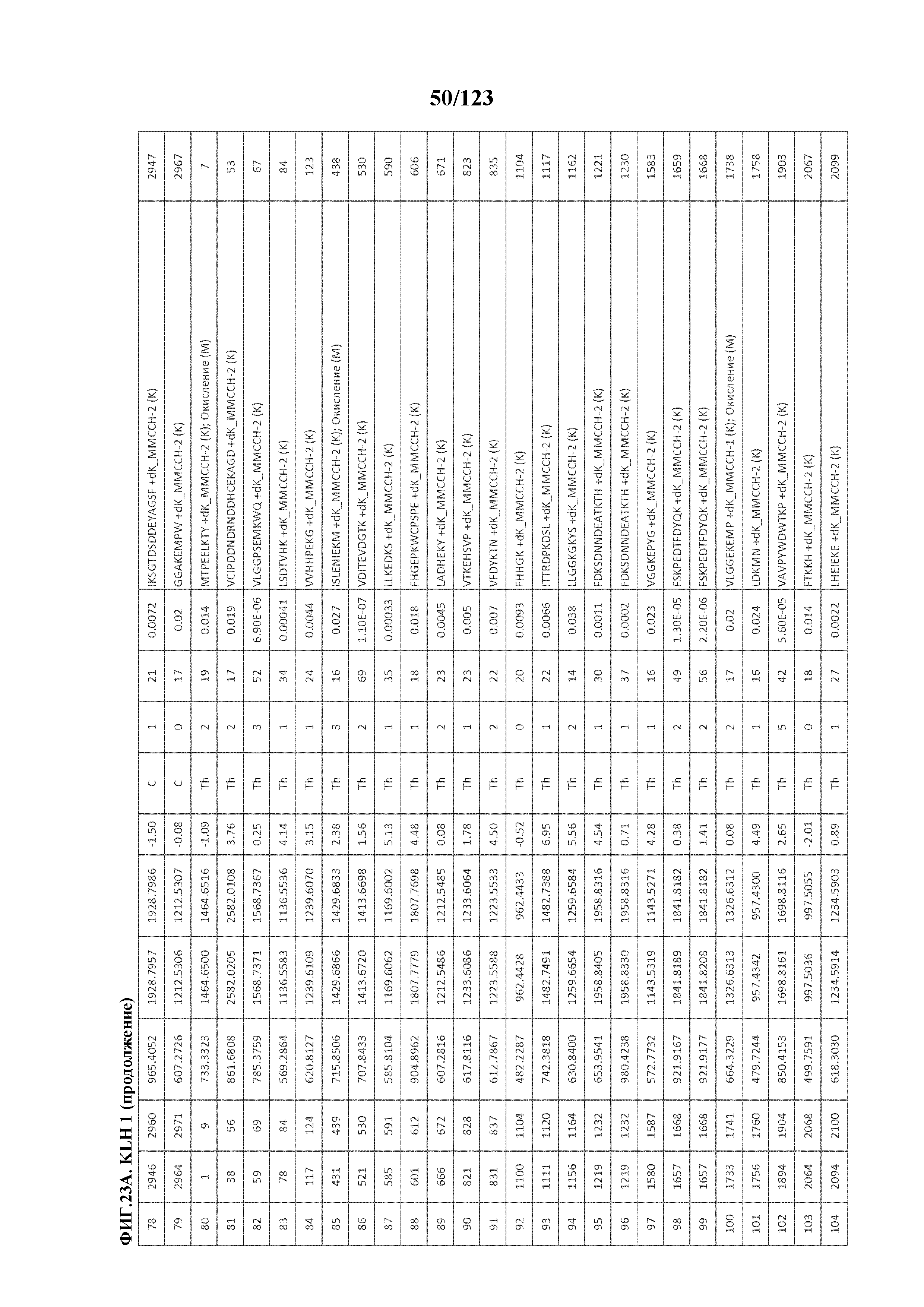
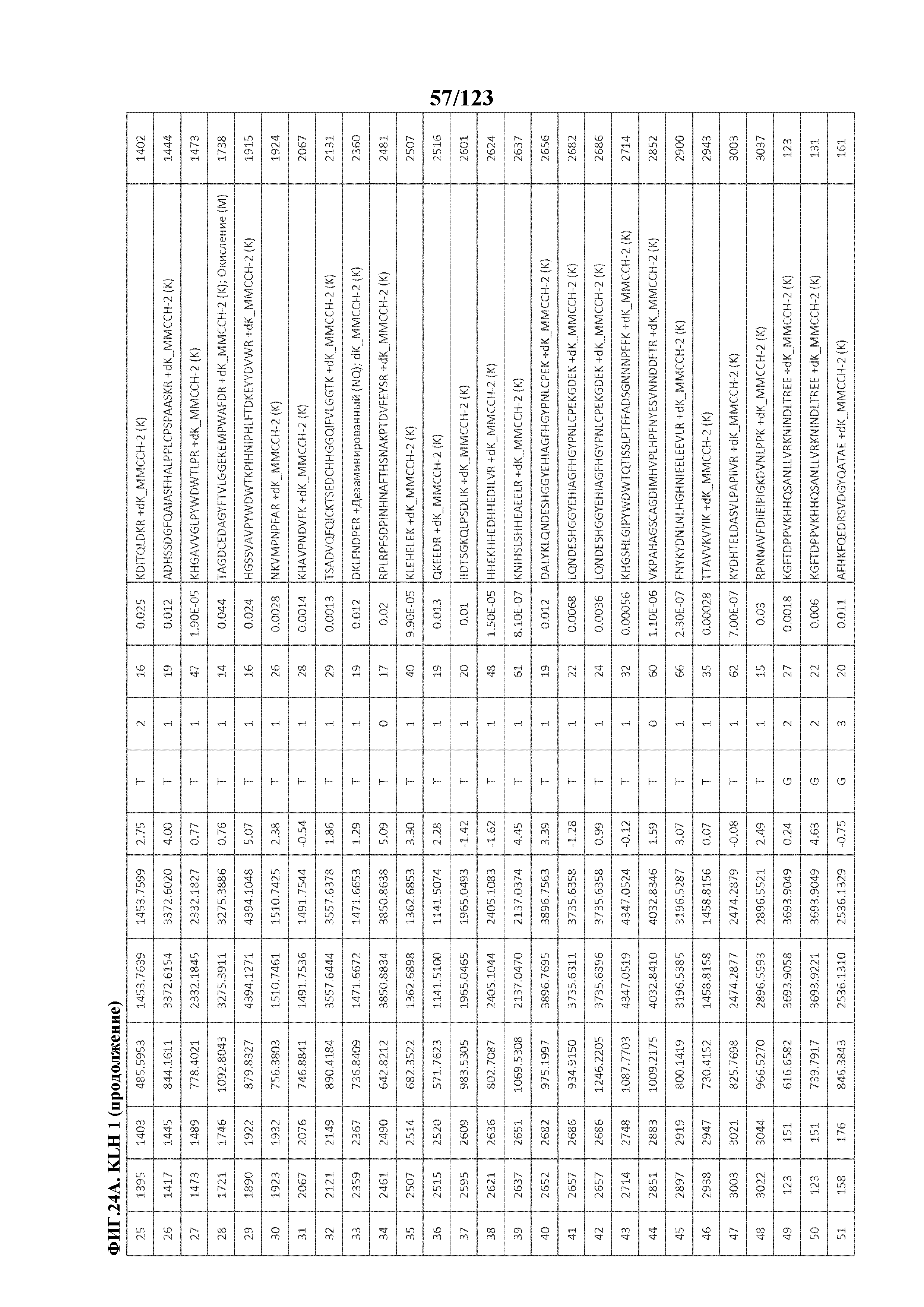
[0068] На фигуре 13 приведена обобщенная информация об идентификации производных пептидов с Globo-H и MMCCH по остаткам лизина
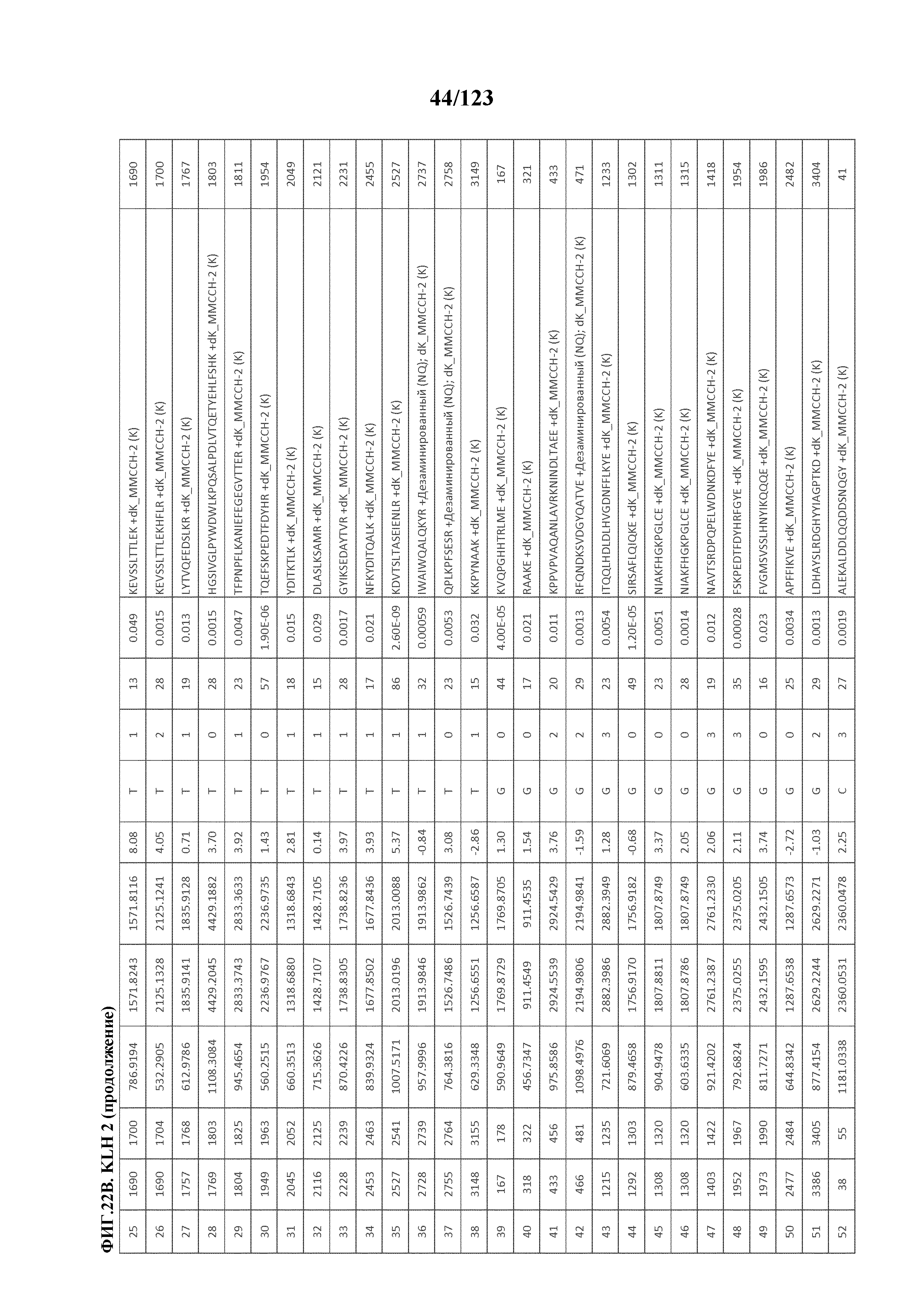
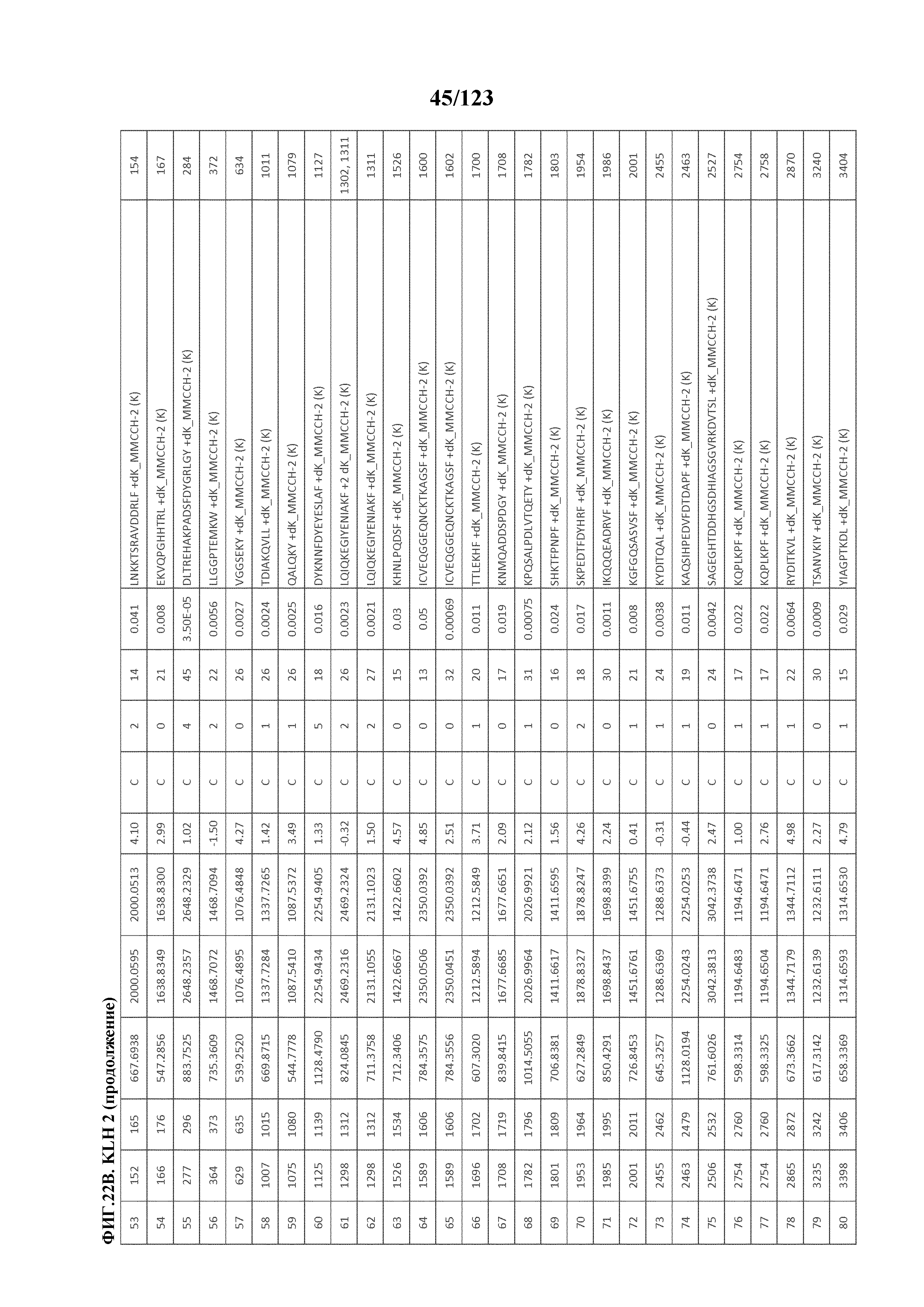
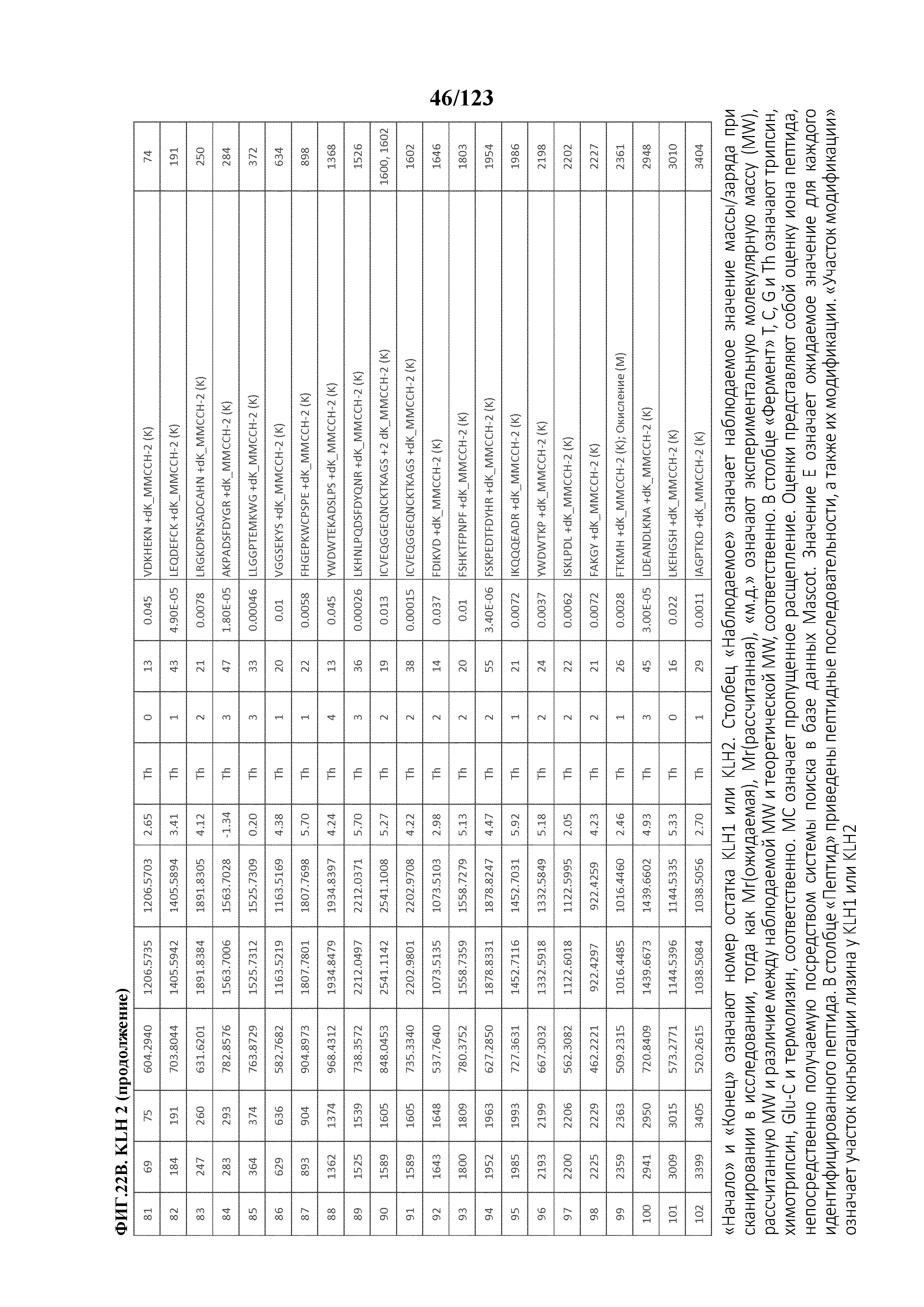
[0069] На фигуре 14 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 1 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
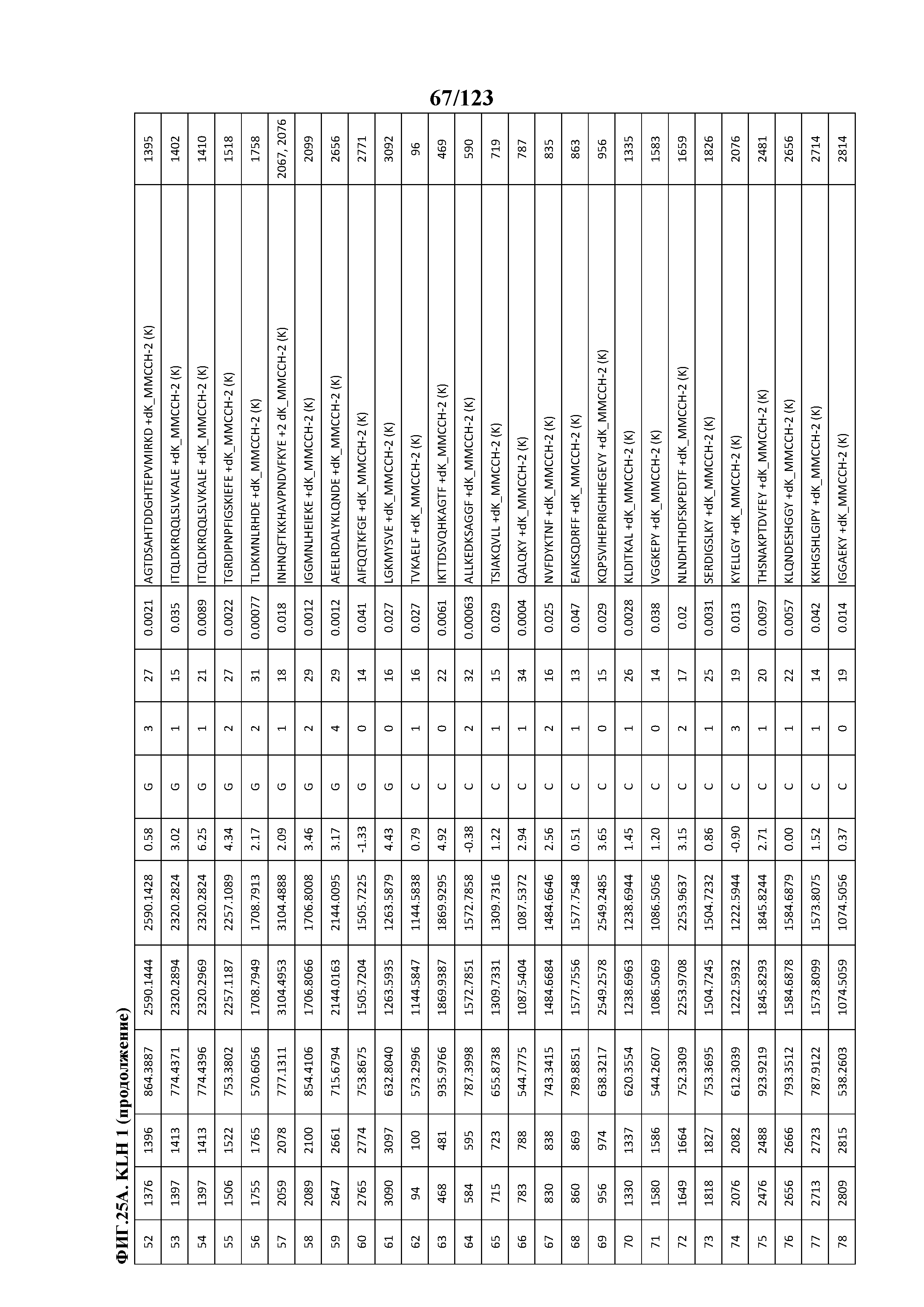
[0070] На фигуре 15 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 2 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0071] На фигуре 16 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 3 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
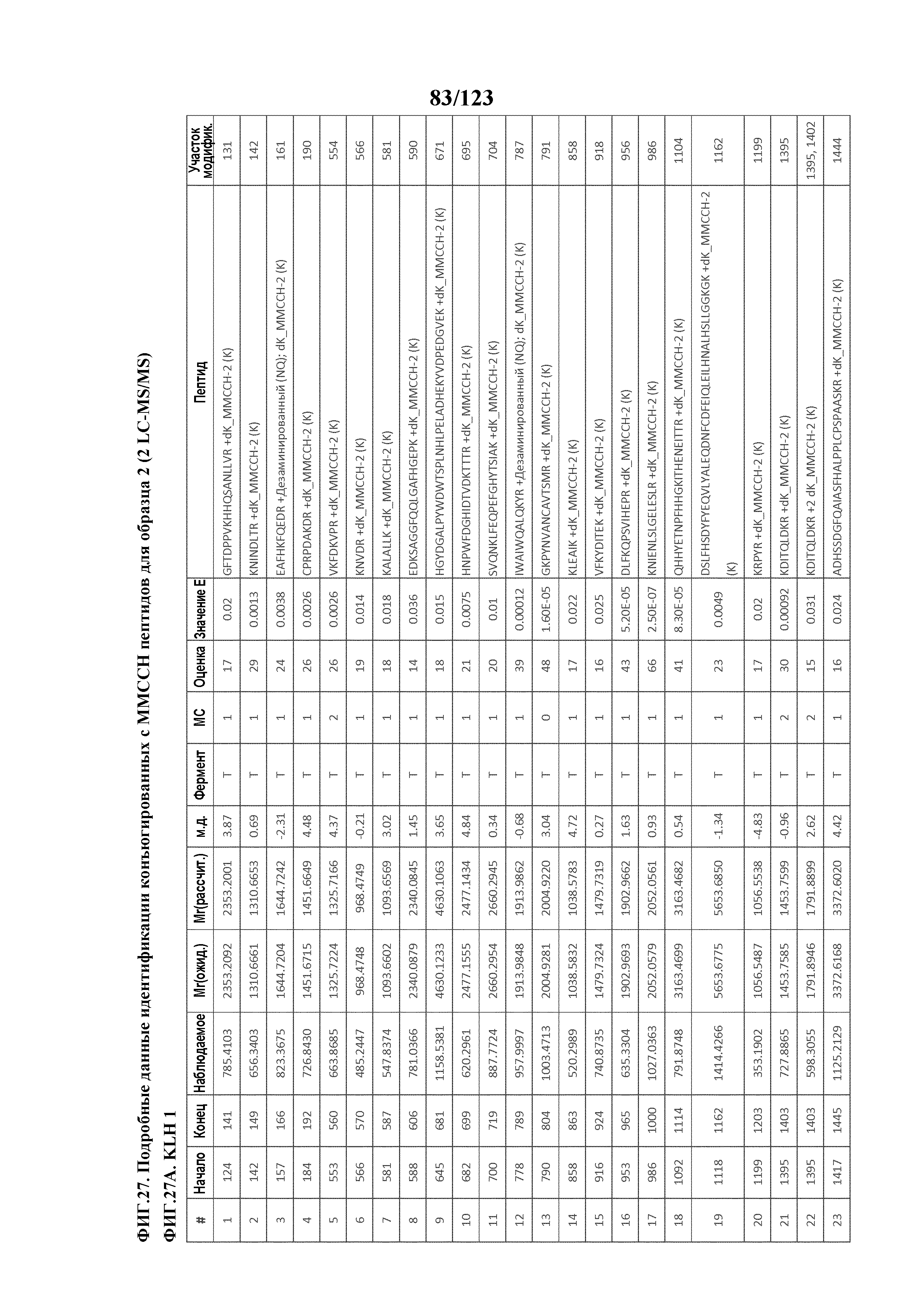
[0072] На фигуре 17 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 4 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
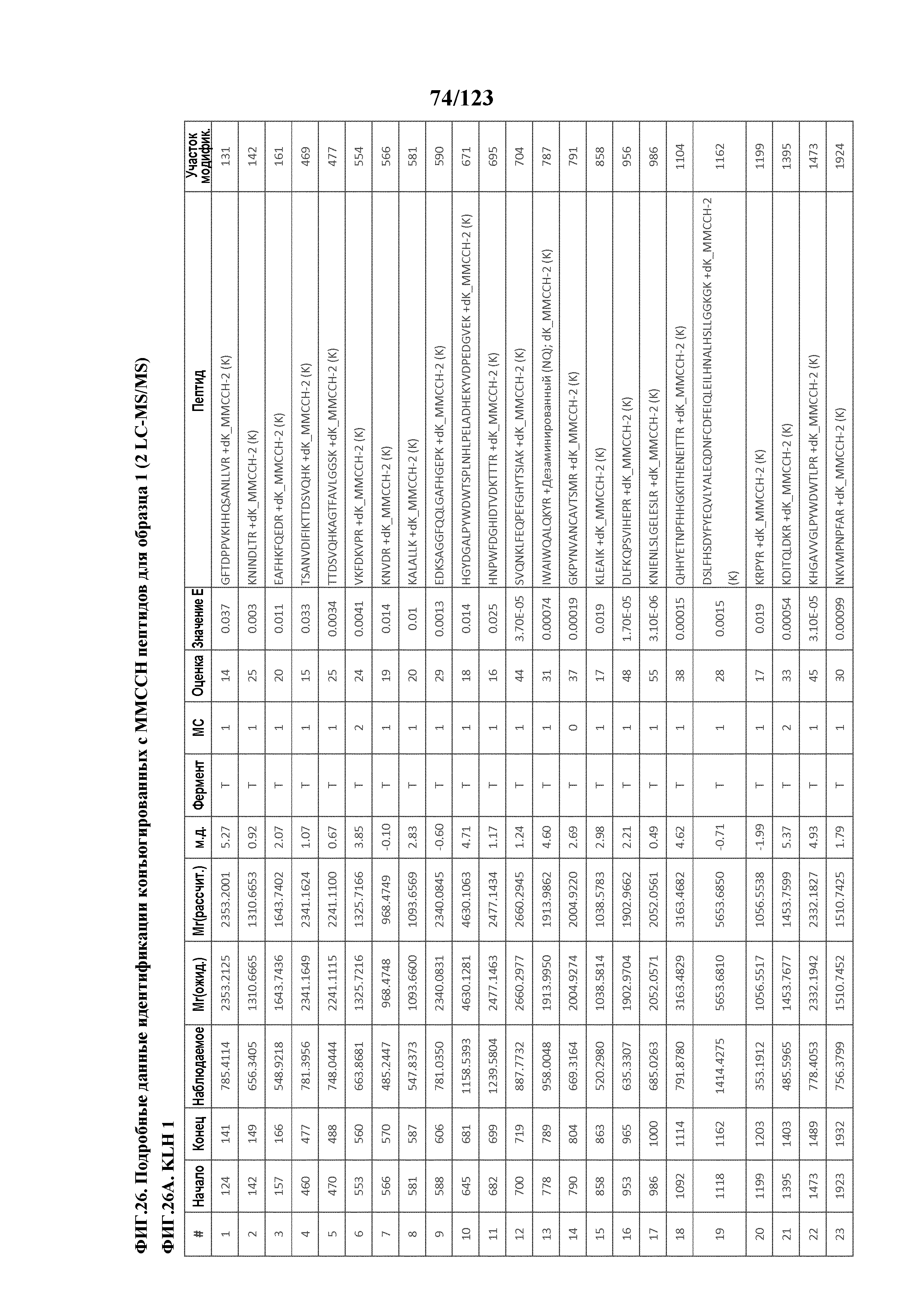
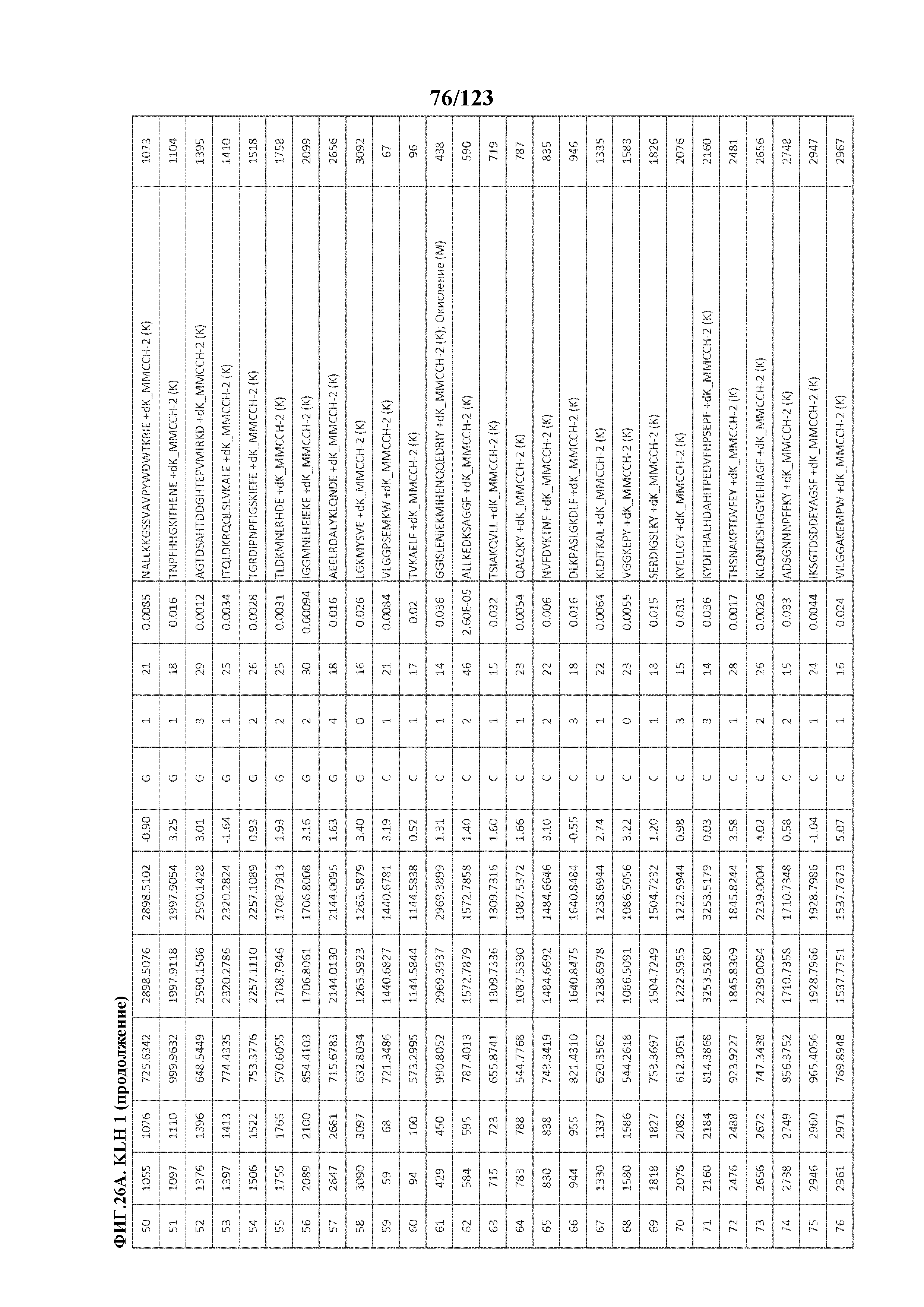
[0073] На фигуре 18 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 1 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
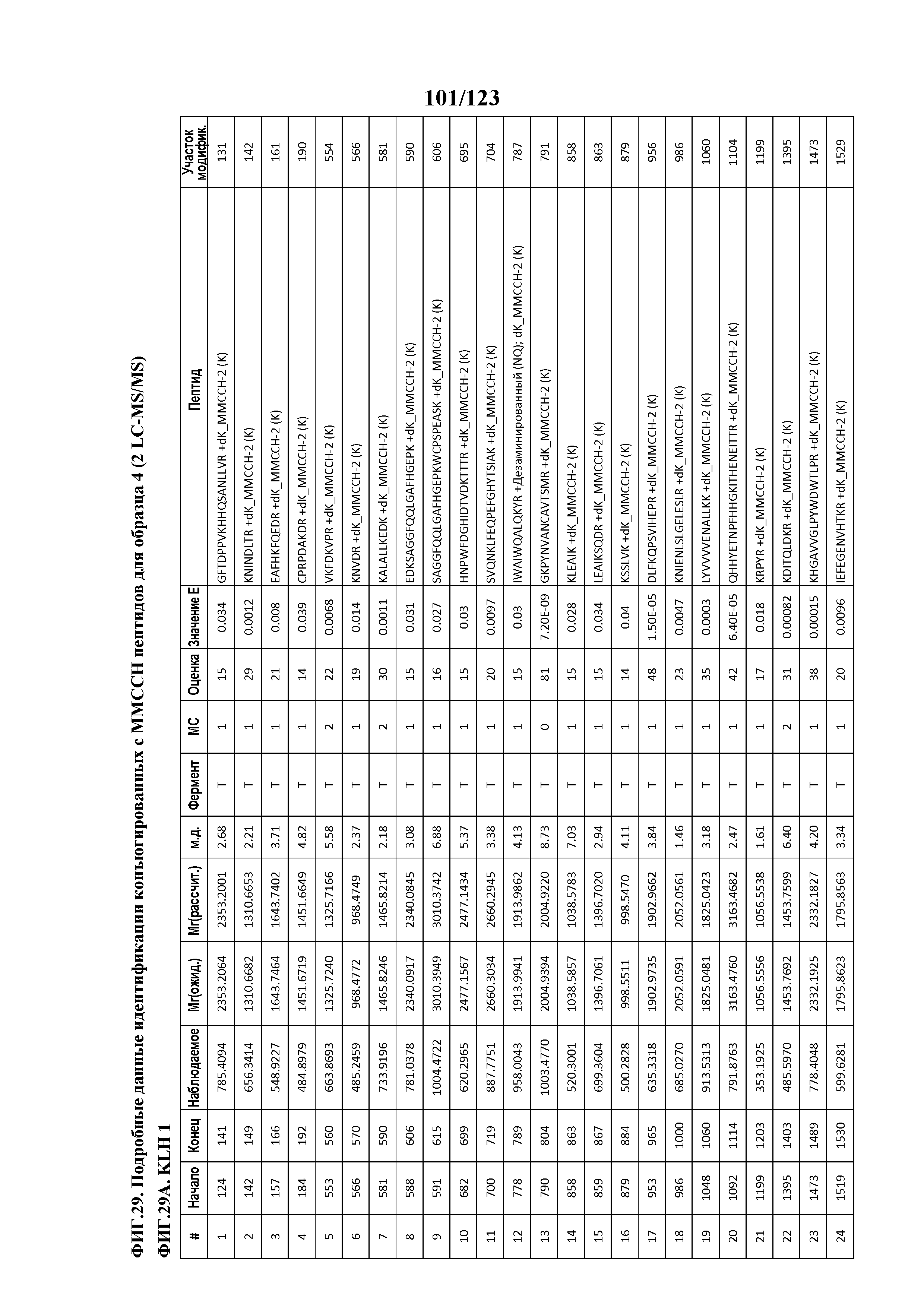
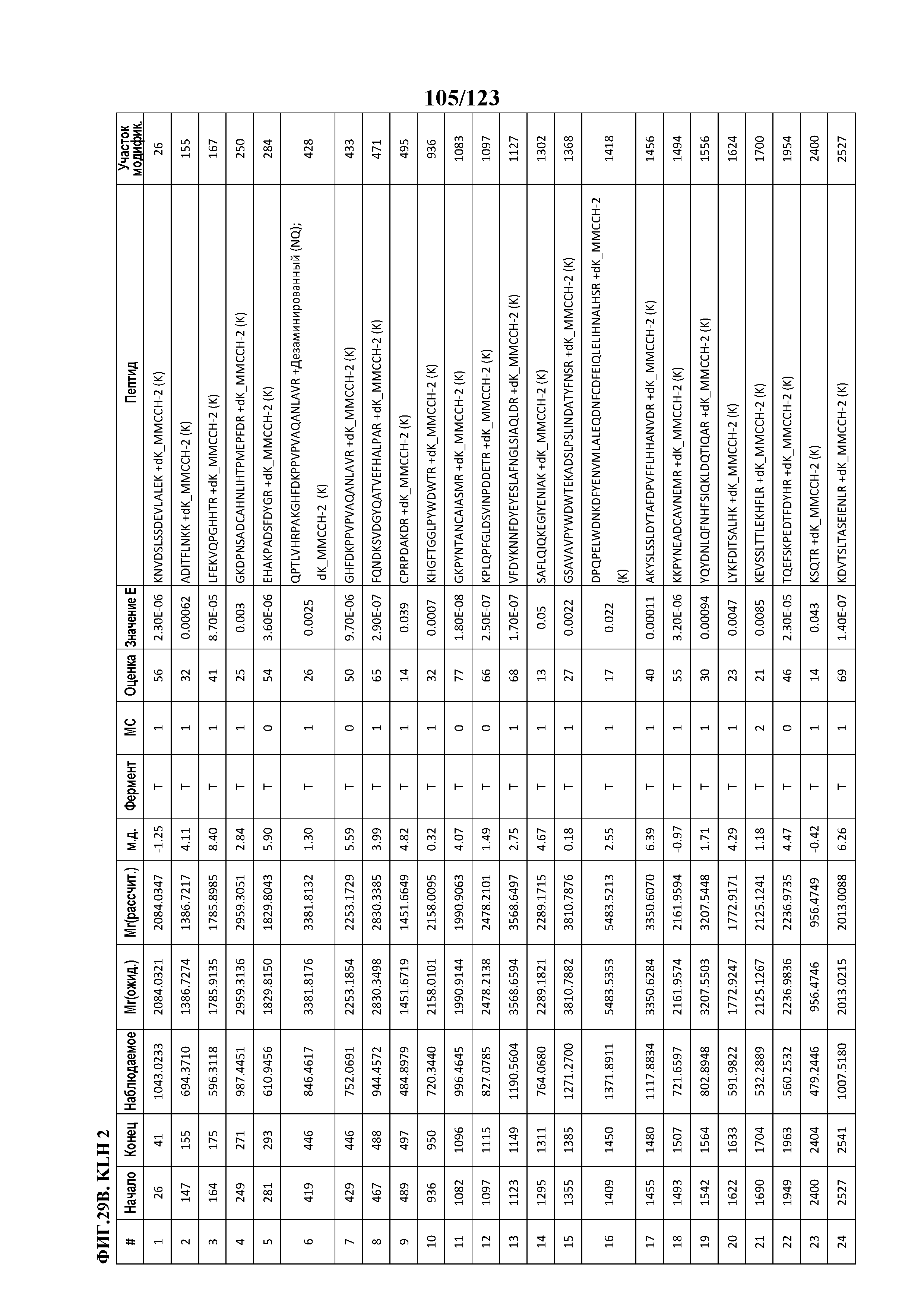
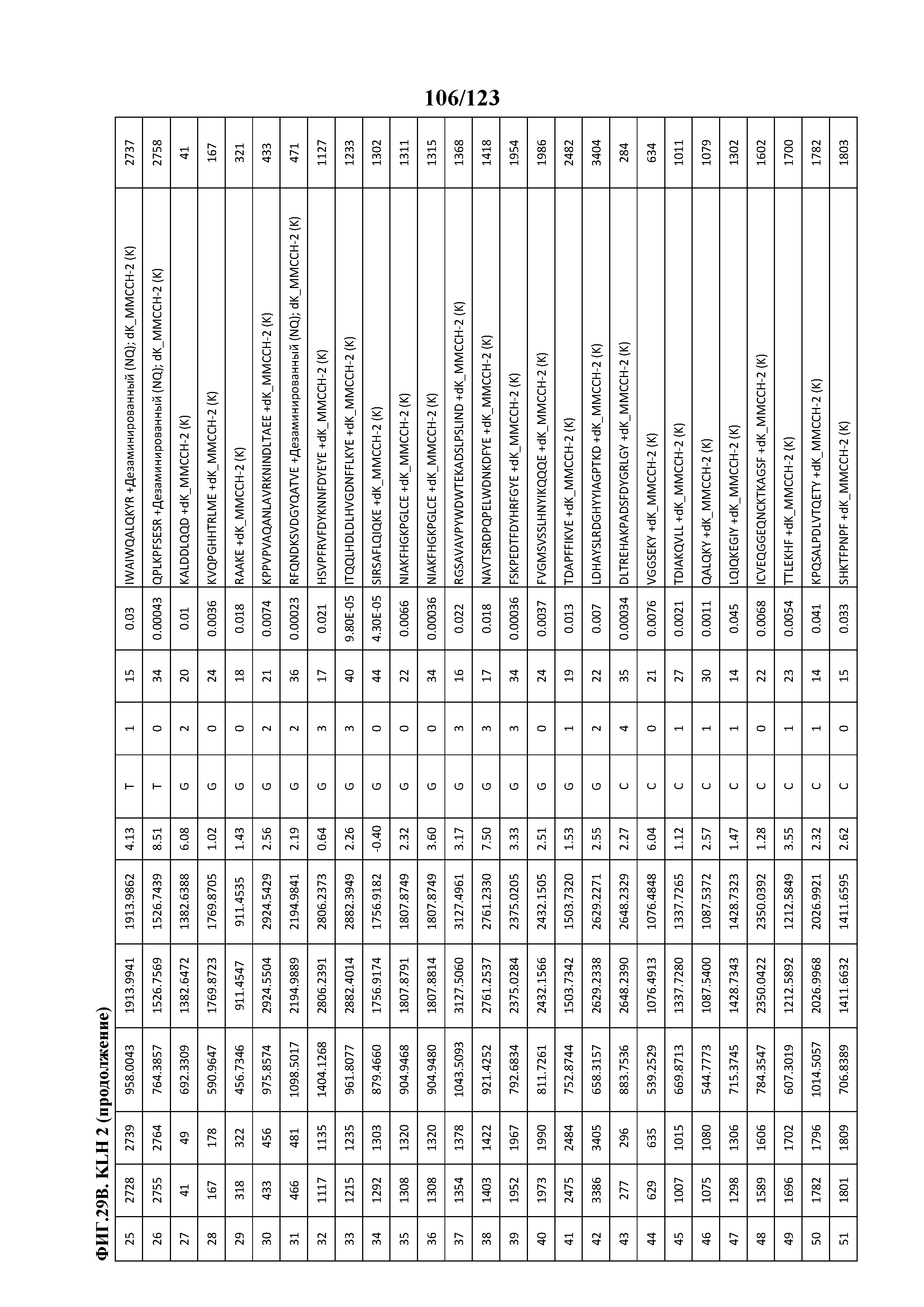
[0074] На фигуре 19 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 2 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
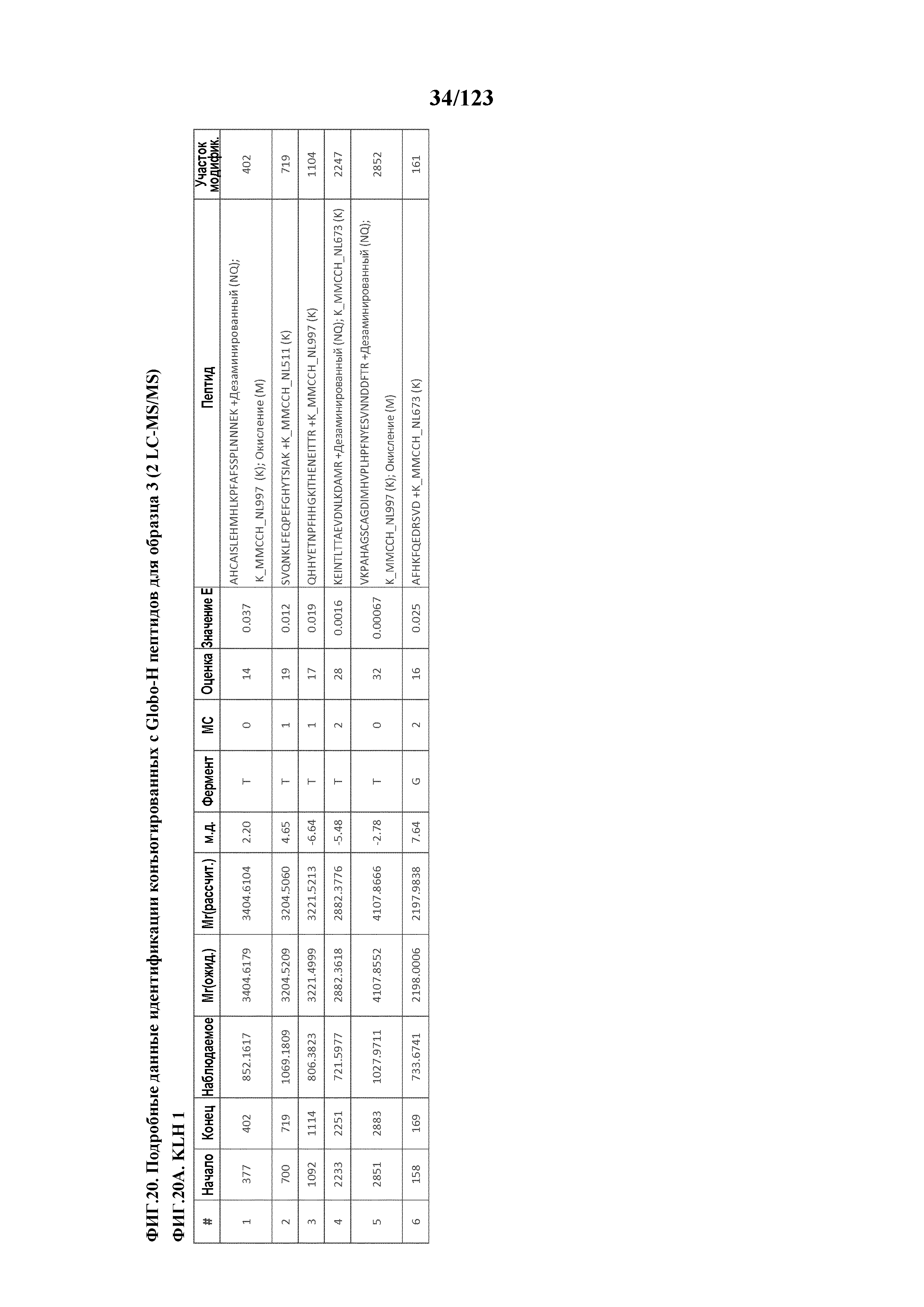
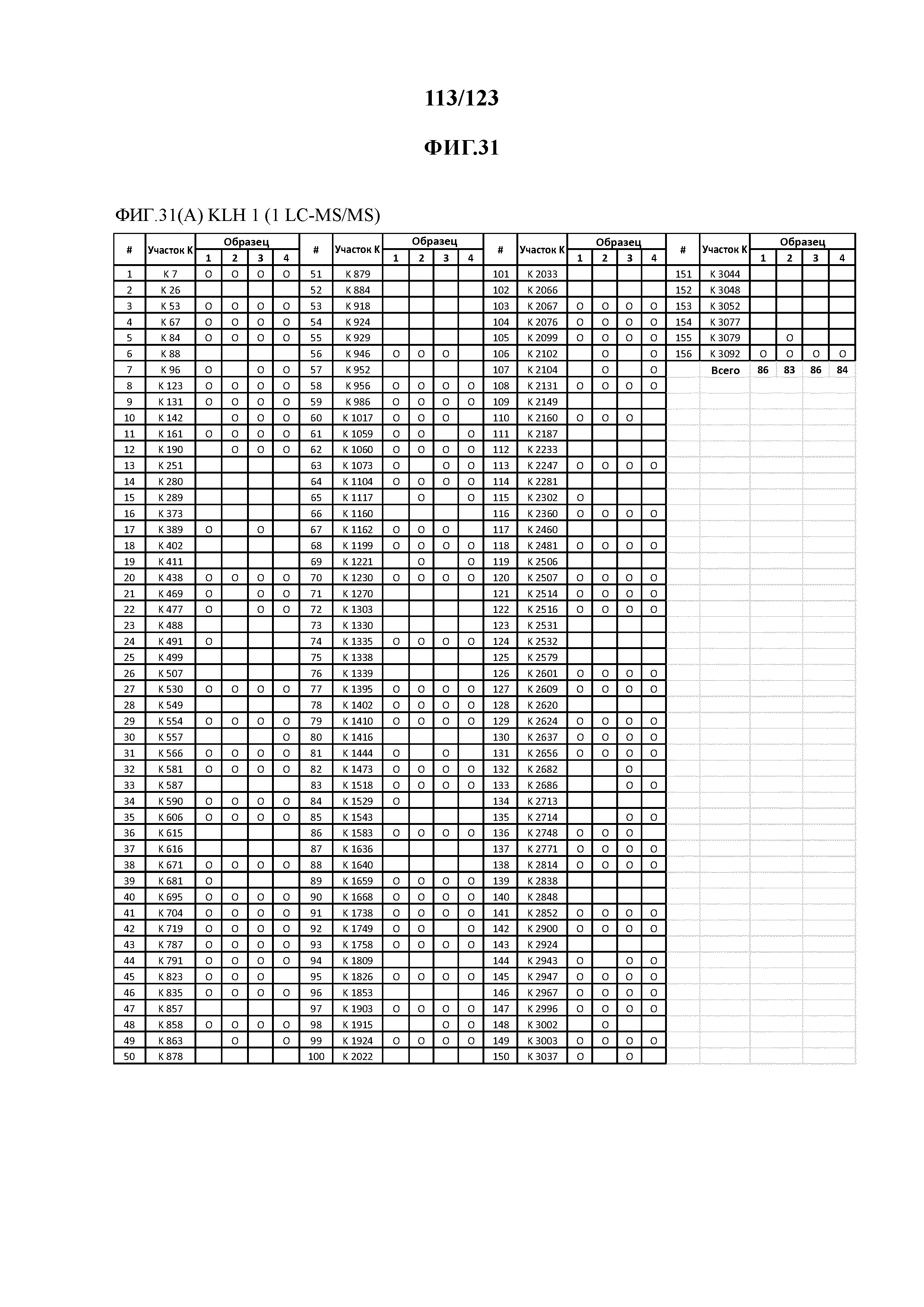
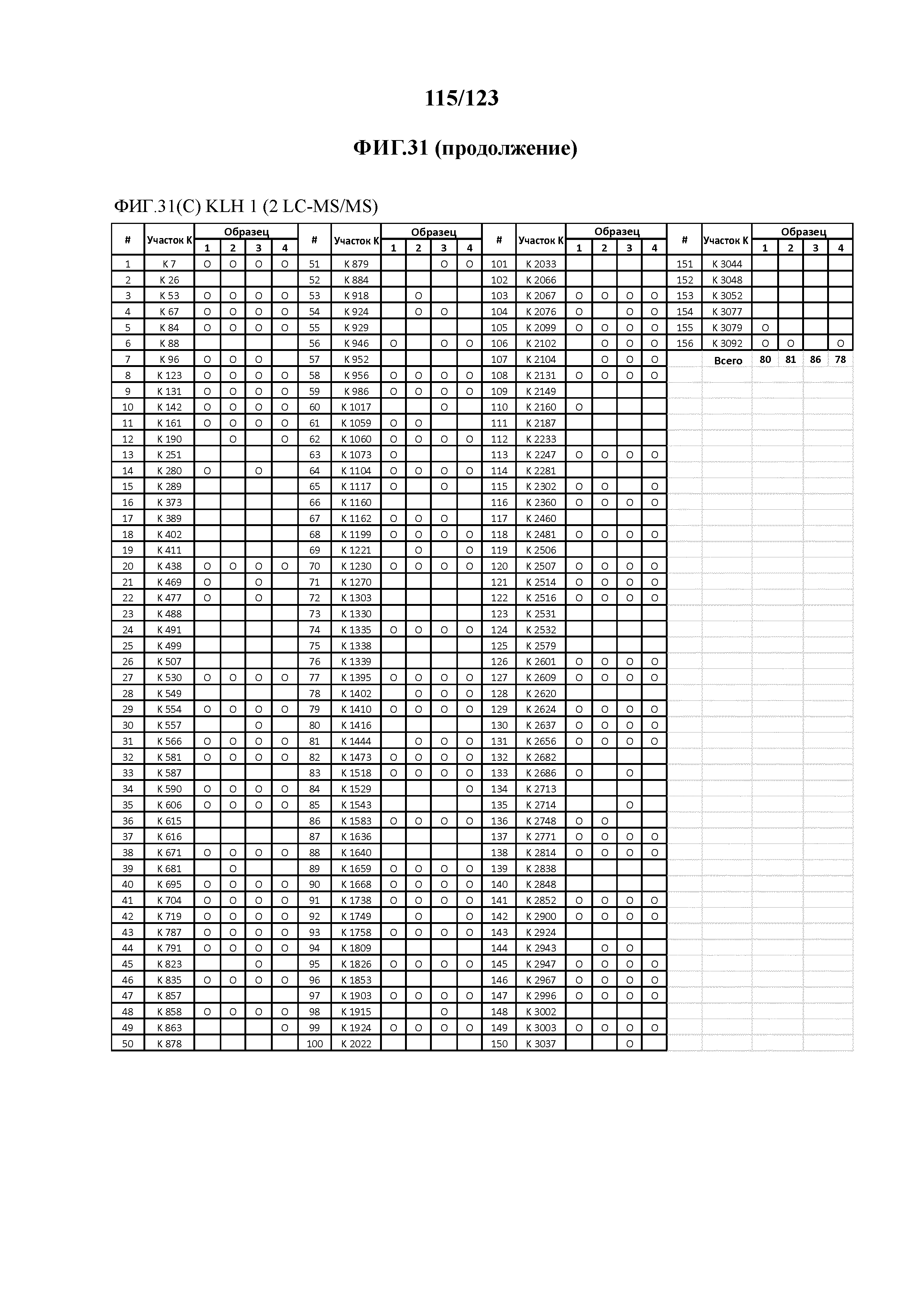
[0075] На фигуре 20 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 3 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0076] На фигуре 21 проиллюстрированы данные идентификации конъюгированных с Globo-H по остаткам лизина пептидов для образца 4 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
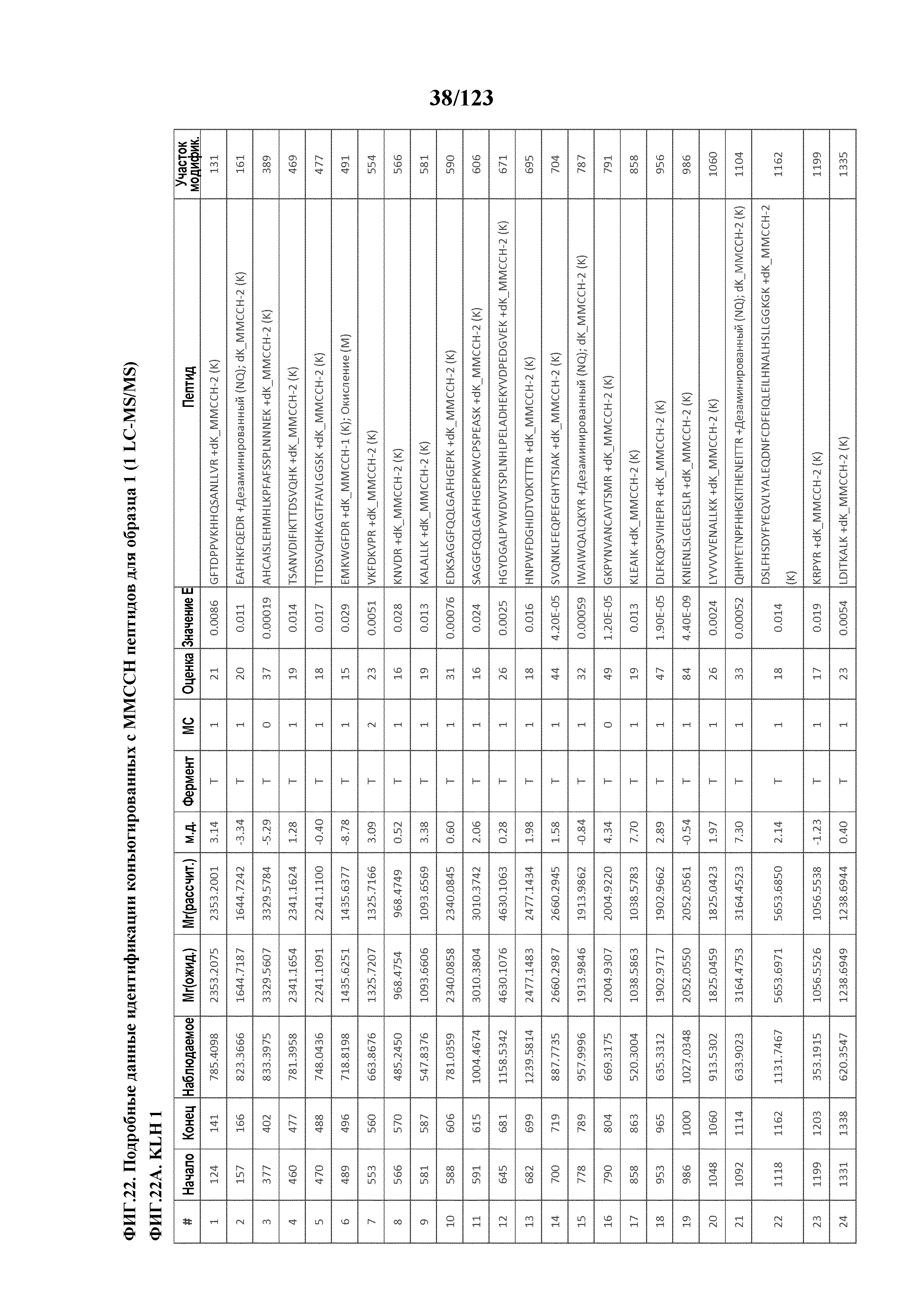
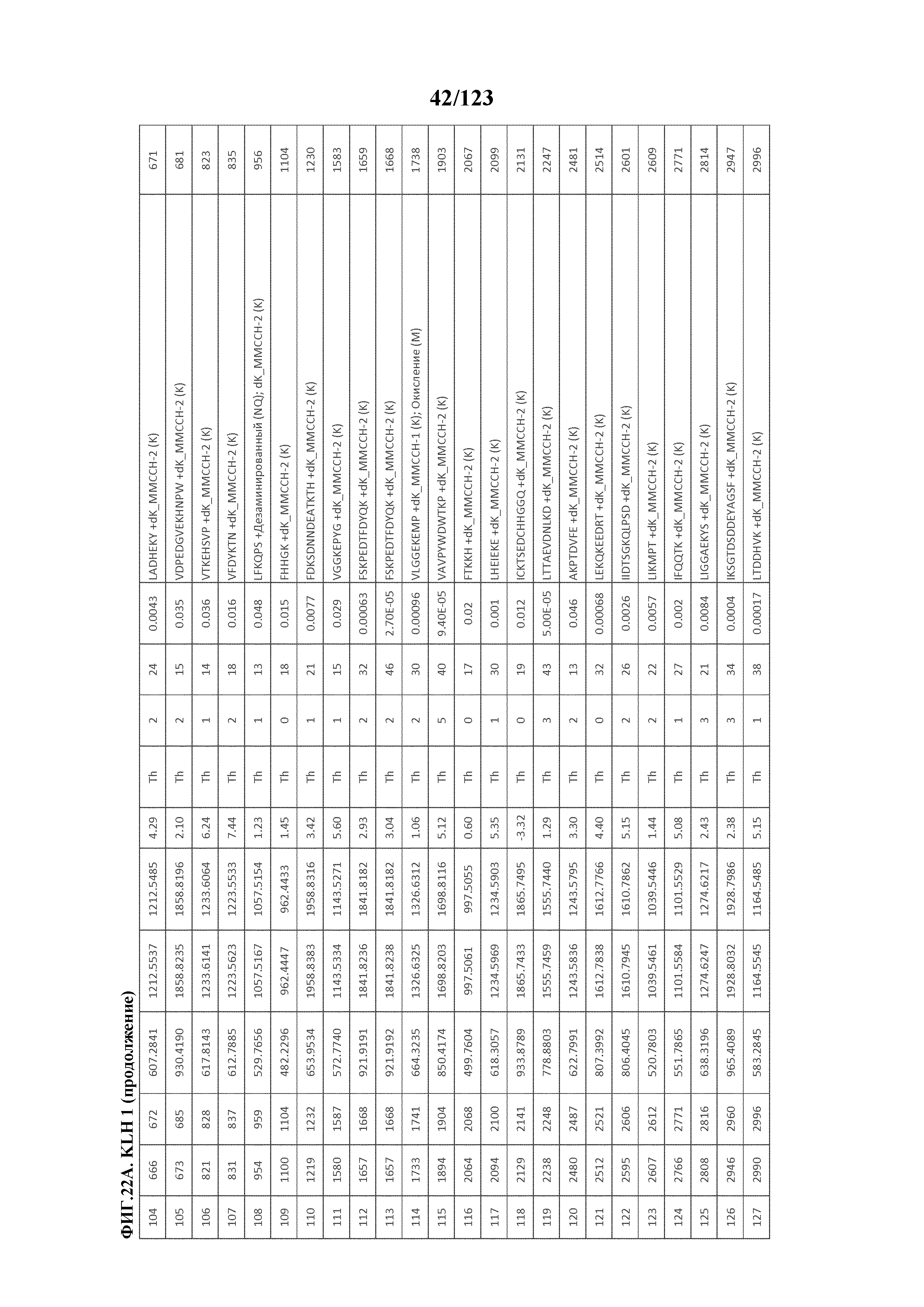
[0077] На фигуре 22 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 1 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0078] На фигуре 23 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 2 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0079] На фигуре 24 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 3 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0080] На фигуре 25 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 4 (1 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0081] На фигуре 26 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 1 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0082] На фигуре 27 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 2 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0083] На фигуре 28 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 3 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0084] На фигуре 29 проиллюстрированы данные идентификации конъюгированных с MMCCH по остаткам лизина пептидов для образца 4 (2 LC-MS/MS) для KLH1 (A) и KLH2 (B).
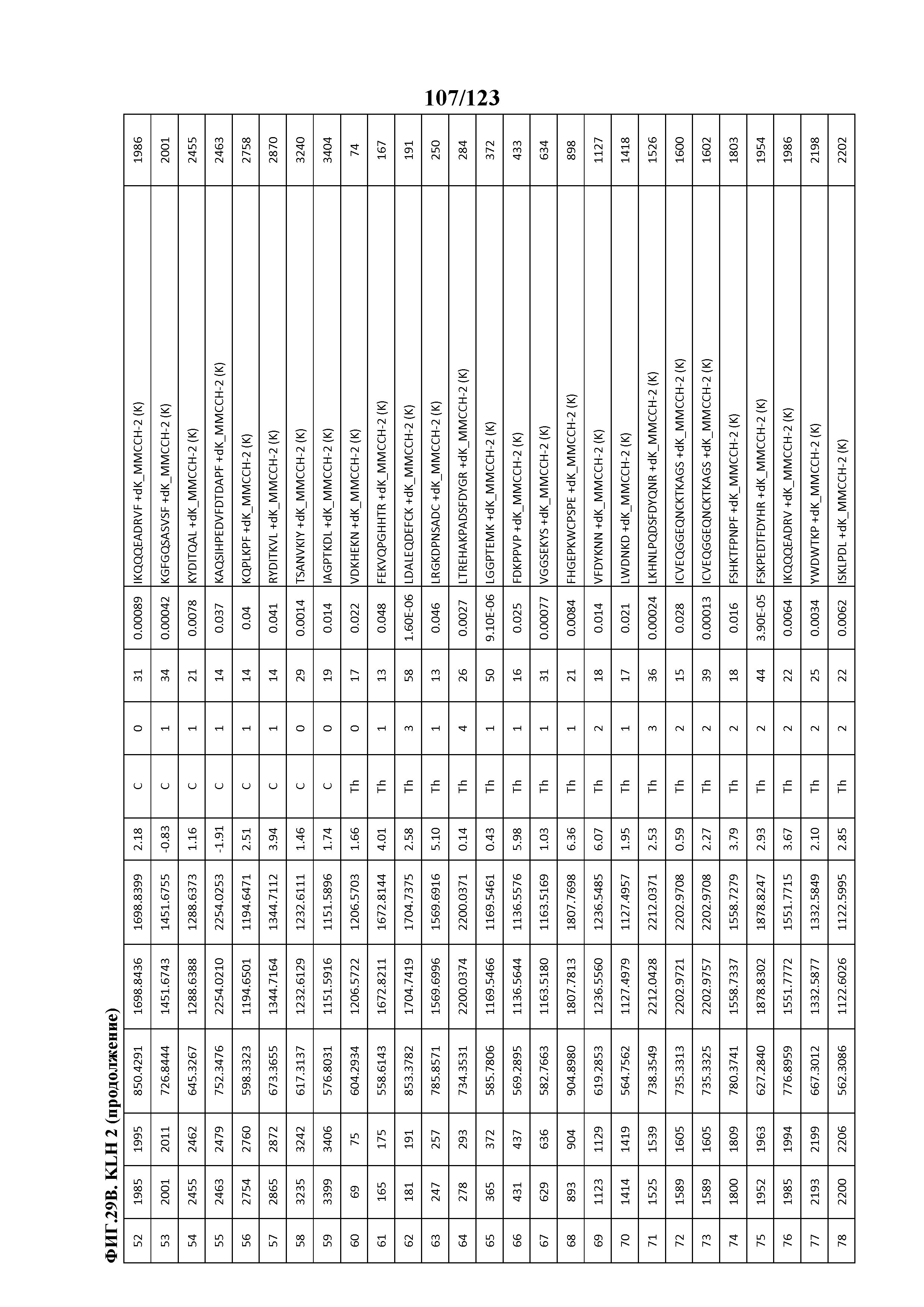
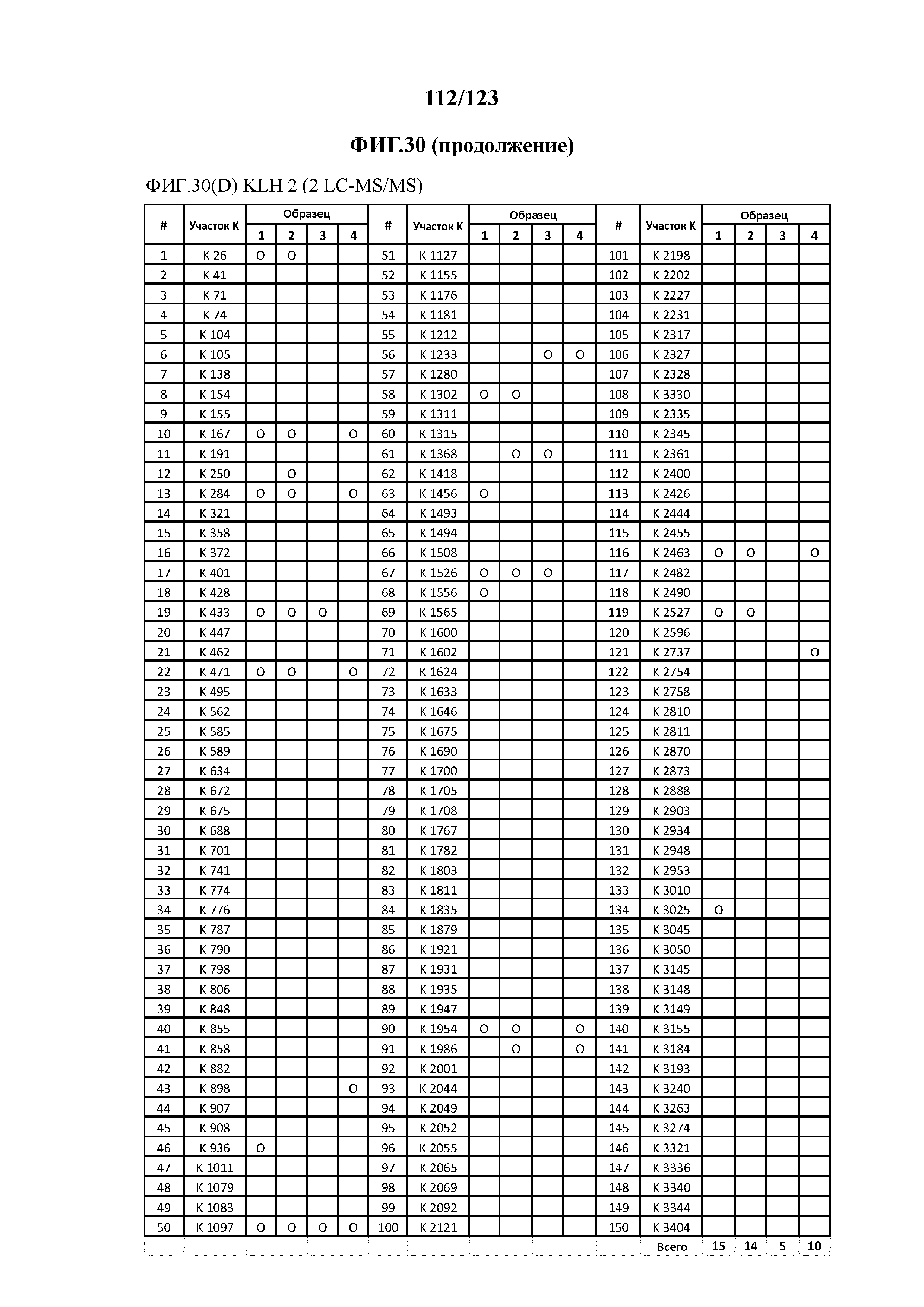
На фигуре 30 приведена обобщенная информация об идентификации конъюгированных с Globo-H участков лизина для (1 LC-MS/MS) для KLH1 (A) и KLH2 (B); (2 LC-MS/MS) для KLH1 (C) и KLH2 (D).
[0085] На фигуре 31 приведена обобщенная информация об идентификации конъюгированных с MMCCH участков лизина для (1 LC-MS/MS) для KLH1 (A) и KLH2 (B) и (2 LC-MS/MS) для KLH1 (C) и KLH2 (D).
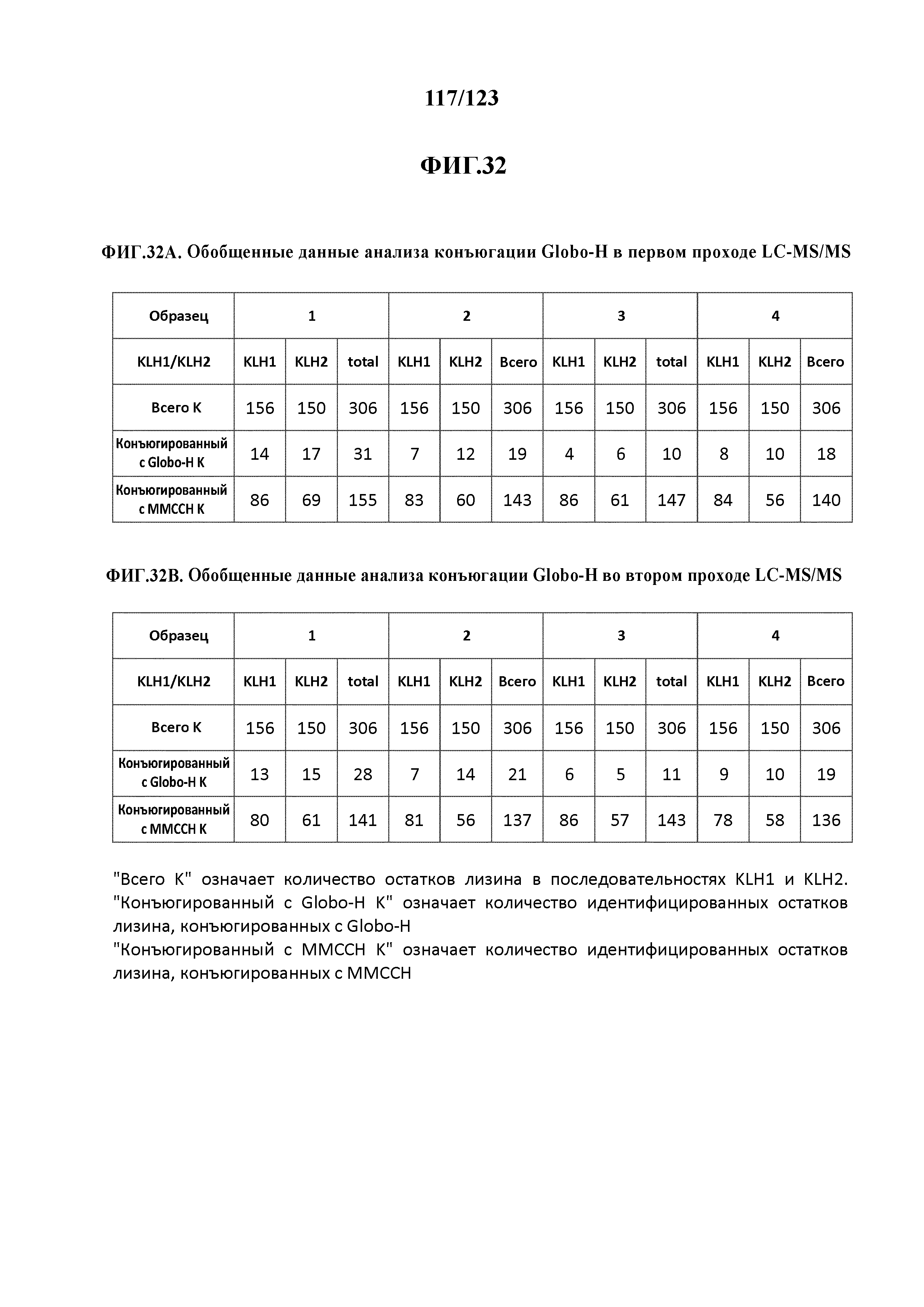
[0086] На фигуре 32 приведена обобщенная информация об анализе конъюгации с Globo-H в первом (A) и втором (B) проходах LC-MS/MS.
[0087] На фигуре 33 приведена обобщенная информация об идентификации иллюстративных производных пептидов с Globo-H и MMCCH по остаткам гистидина (H), аспарагина (N), пролина (P), глутамина (Q) и аргинина (R).
[0088] На фигуре 34 проиллюстрированы данные идентификации конъюгированных с Globo-H и MMCCH пептидов по остаткам HNPQR для образца 1 (LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0089] На фигуре 35 проиллюстрированы данные идентификации конъюгированных с Globo-H и MMCCH пептидов по остаткам HNPQR для образца 2 (LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0090] На фигуре 36 проиллюстрированы данные идентификации конъюгированных с Globo-H и MMCCH пептидов по остаткам HNPQR для образца 3 (LC-MS/MS) для KLH1 (A) и KLH2 (B).
[0091] На фигуре 37 проиллюстрированы данные идентификации конъюгированных с Globo-H и MMCCH пептидов по остаткам HNPQR для образца 4 (LC-MS/MS) для KLH1 (A) и KLH2 (B).
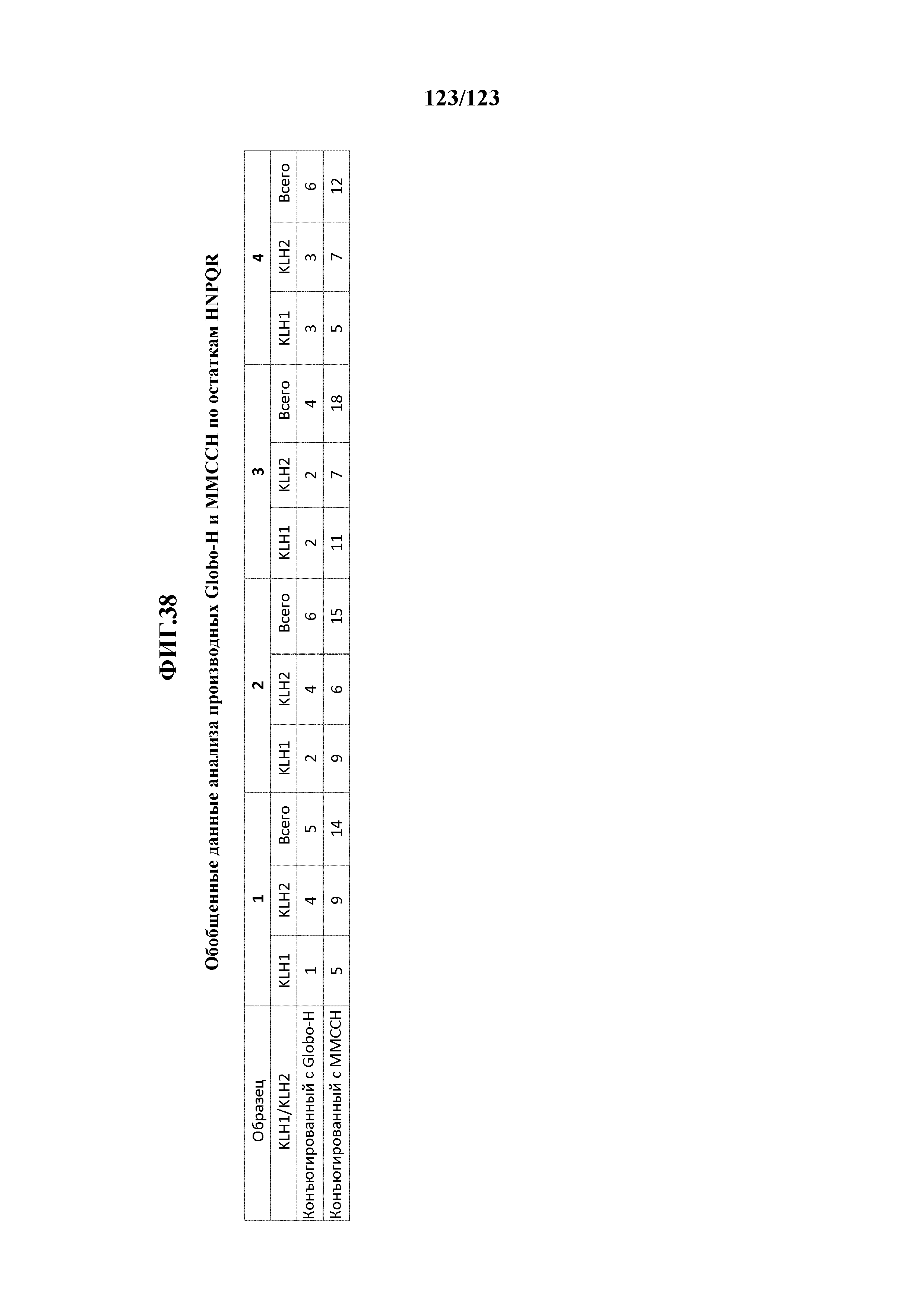
[0092] На фигуре 38 приведена обобщенная информация об анализе иллюстративных производных с Globo-H и MMCCH по остаткам гистидина (H), аспарагина (N), пролина (P), глутамина (Q) и аргинина (R).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0093] Если не указано иначе, в практическом осуществлении настоящего изобретения используют общепринятые способы молекулярной биологии, микробиологии и иммунологии, которые известны специалистам в данной области. Такие способы полностью описаны в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 1989); DNA Cloning, Volumes I and II (D. N. Glover ed., 1985); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); монографии Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Antibodies: A Laboratory Manual, by Harlow and Lanes (Cold Spring Harbor Laboratory Press, 1988) и Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986).
[0094] Использование синтетических конъюгатов с углеводами для вызова образования антител впервые продемонстрировано Goebel и Avery в 1929 году. (Goebel, W. F., and Avery, O. T., J. Exp. Med., 1929, 50, 521; Avery, O. T., and Goebel, W. F., J. Exp. Med., 1929, 50, 533.) Углеводы связывали с белками-носителями посредством бензолдиазониевых гликозидов. Иммунизация кроликов синтетическими антигенами приводила к получению поликлональных антител. Другие исследователи (Allen, P. Z., and Goldstein, I. J., Biochemistry, 1967, 6, 3029; Rude, E., and Delius, M. M., Carbohydr. Res., 1968, 8, 219; Himmelspach, K., et al., Eur. J. Immunol., 1971, 1, 106; Fielder, R. J., et al., J. Immunol., 1970, 105, 265) разработали сходные способы конъюгации углеводов с белками-носителями.
[0095] Гликоконъюгаты можно использовать в активной иммунотерапии, осуществляемой на основе вакцинаций для специфического поражения опухолевых клеток известными поражающими средствами. В норме ответ на углеводные антигены не включает использование T-клеток, которые содействуют отторжению опухоли организмом. Хотя полагают, что вероятность полного отторжения опухоли в результате вакцинации конъюгатом является низкой, такое лечение повышает иммунный надзор и можно снизить вероятность рецидива новых опухолевых колоний. (Dennis, J., Oxford Glycosystems Glyconews Second, 1992; Lloyd, K. O., in Specific Immunotherapy of Cancer with Vaccines, 1993, New York Academy of Sciences, 50-58). Toyokuni и Singhal описали синтетический гликоконъюгат (Toyokuni, T., et al., J. Am. Chem. Soc., 1994, 116, 395), стимулирующий измеряемые титры IgG, результат который является важный, так как ответ IgG, как правило, ассоциирован с привлечением хелперных T-клеток.
[0096] Показано, что синтетическая вакцина Globo-H в комбинации с иммунологическим адъювантом в основном индуцирует антитела IgM и в меньшей степени IgG у пациентов, страдающих раком предстательной железы и метастатическим раком молочной железы. В фазе I клинических испытаний вакцина также продемонстрировала минимальную токсичность с временными местными кожными реакциями в участке вакцинации. (Gilewski T et al. (2001) Proc. Natl. Acad. Sci. USA 98:3270-3275; Ragupathi G, et al. (1997) Angew. Chem. Int. Ed. 36:125-128; Slovin S F et al (1997) Proc. Natl. Acad. Sci. USA 96:5710- 5715). Слабые гриппоподобные симптомы, наблюдаемые у некоторых пациентов, вероятно, ассоциированы с побочным действием QS-21. Опубликовано, что пентавалентная вакцина, содержащая пять ассоциированных с раком предстательной железы и молочной железы углеводных антигенов, Globo-H, GM2, STn, TF и Tn, конъюгированных с модифицированных малеинимидом белком-носителем KLH, продуцирует сыворотку против Globo-H с более высокими титрами IgG, чем IgM, определяемыми в анализах ELISA. (Zhu J. et al. (2009) J. Am. Chem. Soc. 131(26):9298-9303).
[0097] Таким образом, настоящее изобретение относится к иммуногенным/терапевтическим соединениям, композициям и/или композициям фармацевтических составов, направленным на Globo-H/опосредуемых им, а также иммунотерапевтическим средствам, вакцинам, лекарственным формам, наборам на их основе и способам их производства и лечения с их использованием.
[0098] Использование форм единственного числа в сочетании с выражением "содержащий" в формуле изобретения и/или в описании может означать "один", а также это согласуется со значениями "один или более", "по меньшей мере один" и "один или более одного".
[0099] На всем протяжении настоящей заявки термин "приблизительно" используют для указания на то, что значение включает, например, неотъемлемый разброс вследствие погрешности измеряющего устройства, способа, применяемого для определения значения, или разброс, который существует у исследуемых индивидуумов. Как правило, термин предназначен для включения вариабельности приблизительно или менее 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% в зависимости от ситуации.
[0100] Как используют в настоящем документе, термин "алкил" относится к неразветвленному или разветвленному одновалентному углеводороду, содержащему, если не указано иначе, 1-20 атомов углерода, например, C1-C8 или C1-C4, которые могут являться замещенными или незамещенными. Примеры алкила в качестве неограничивающих примеров включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил и трет-бутил.
[0101] Термин "или" в формуле изобретения используют для обозначения "и/или" если явно не указано обозначение исключительно альтернатив или альтернативы не являются взаимоисключающими, хотя в описании поддерживается определение, которое относится к взаимоисключающим альтернативам и "и/или".
[0102] Как используют в этом описании и в формуле изобретения, слова "составляющий" (и любая форма термина содержащий, такая как "составляют" и "составляет"), "обладающий" (и любая форма термина обладающий, такая как "содержат" и "содержит"), "включающий" (и любая форма термина включающий, такая как "включает" и "включают") или "содержащий" (и любая форма термина содержащий, такая как "содержат" и "содержит") являются включительными или не ограничивающими и не исключают дополнительных, необязательных элементов или этапов способов. Предусмотрено, что любой вариант осуществления, описанных в настоящем описании, можно использовать в отношении любых способа или композиции по изобретению и наоборот. Кроме того, композиции по изобретению можно использовать для осуществления способов по изобретению.
[0103] "Лечение" по настоящему документу относится к введению терапевтической композиции индивидууму с целью лечения, облегчения, ослабления, излечения, предотвращения или улучшение состояния нарушения, симптомов нарушения, болезненного состояния, вторичного относительно нарушения или предрасположенности к нарушению.
[0104] "Эффективное количество" представляет собой количество терапевтической композиции, которое может обеспечивать у подвергаемого лечению индивидуума желательный с медицинской точки зрения результат, как описано в настоящем документе. Желательный с медицинской точки зрения результат может являться объективным (например, измеряемым посредством определенного теста или маркера) или субъективным (например, индивидуум предоставляет инморфации или чувствует действие).
[0105] Как используют в настоящем документе, "заболевание, подлежащее лечению терапевтической композицией" означает любые последовательности этапов, патологические состояния, нарушения, недомогания и/или заболевания, которые можно лечить посредством введения терапевтических композиций, описываемых в настоящем документе.
[0106] "Пролиферативное нарушение" представляет собой нарушение, при котором происходит продукция слишком большого количества клеток определенного типа, что приводит к ухудшению здоровья. Пролиферативные нарушение могут являться доброкачественными или злокачественными. Пролиферативные нарушения могут включать, например, злокачественные опухоли.
[0107] Как используют в настоящем документе, "злокачественная опухоль", которую можно лечить терапевтическими композициями, описываемыми в настоящем документе, включает клетки в состоянии аномального роста. Злокачественные клетки можно охарактеризовать потерей нормальных механизмов контроля, и, таким образом, они способны непрерывно размножаться, прорастать в окружающие ткани, мигрировать в отдаленные участки организма и стимулировать рост новых кровеносных сосудов, из которых клетки получают питательные вещества. Как используют в настоящем документе, злокачественная опухоль может являться злокачественной или доброкачественной. Злокачественная опухоль может развиваться из любой ткани организма. По мере роста и размножения клеток они формируют массу ткани, называемую опухолью. Термин опухоль может включать аномальные рост или массу. Опухоли могут являться злокачественными или незлокачественными (доброкачественными). Злокачественные опухоли могут прорастать в соседние ткани или распространяться по всему организму (метастазировать). Однако доброкачественные опухоли, как правило, не прорастают в соседние ткани и не распространяются по всему организму. Злокачественные опухоли можно разделить на опухоли крови и кровеобразующих тканей (лейкозы и лимфомы) и "солидные" опухоли. "Солидные" опухоли могут включать карциномы или саркомы.
[0108] Злокачественные опухоли, которые можно лечить терапевтическими композициями по изобретению, включают злокачественные опухоли, классифицируемые по участку, включая злокачественные опухоли полости рта и глотки (губ, языка, слюнных желез, дна полости рта, десен и других частей полости рта, носоглотки, миндалины, ротоглотки, гортанной части глотки, других частей полости рта/глотки); злокачественные опухоли пищеварительной системы (пищевода; желудка; тонкой кишки; толстой кишки и прямой кишки; ануса, заднепроходного канала и аноректальной области; печени; внутрипеченочного желчного протока; желчного пузыря; других частей желчевыводящих путей; поджелудочной железы; забрюшинного пространства; брюшины, сальника и брыжейки; других частей пищеварительной системы); злокачественные опухоли дыхательной системы (полости носа, среднего уха и носовых пазух; гортани; легких и бронхов; плевры; трахеи, средостения и других частей дыхательной системы); злокачественные опухоли мезотелиомы; костей и суставов и мягких тканей, включая сердце; раки кожи, включая меланомы и другие неэпителиальные злокачественные опухоли кожи; саркому Капоши и рак молочной железы; злокачественные опухоли женской половой системы (шейки матки; тела матки; матка, яичника; влагалища; наружных половых органов и других частей женской половой системы); злокачественные опухоли мужской половой системы (предстательной железы; семенника; полового члена и других частей мужской половой системы); злокачественные опухоли мочевыделительной системы (мочевого пузыря; почек и почечных лоханок; мочеточника и других частей мочевыделительной системы); злокачественные опухоли глаз и глазных орбит; злокачественные опухоли головного мозга и нервной системы (головного мозга и других частей нервной системы); злокачественные опухоли эндокринной системы (щитовидной железы и других частей эндокринной системы, включая тимус); лимфомы (болезнь Ходжкина и неходжкинские лимфомы), множественную миелому и лейкоз (лимфоцитарный лейкоз; миелолейкоз; моноцитарный лейкоз и другие виды лейкоза).
[0109] Другие злокачественные опухоли, классифицируемые по гистологическому типу, которые могут являться подходящими мишенями для терапевтических композиций по настоящему изобретению, в качестве неограничивающих примеров включают неоплазию, злокачественную; карциному, неуточненную; карциному, недифференцированную, неуточненную; гигантоклеточную и веретеноклеточную карциному; мелкоклеточную карциному, неуточненную; папиллярную карциному, неуточненную; плоскоклеточную карциному, неуточненную; лимфоэпителиальную карциному; базально-клеточную карциному, неуточненную; карциному пиломатрикса; переходноклеточную карциному, неуточненную; папиллярную переходноклеточную карциному; аденокарциному, неуточненную; гастриному, злокачественную; холангиокарциному; печеночноклеточную карциному, неуточненную; комбинированную печеночноклеточную карциному и холангиокарциному; трабекулярную аденокарциному; аденокистозную карциному; аденокарциному в аденоматозном полипе; аденокарциному, семейный полипоз кишечника; солидную карциному, неуточненную; карциноидную опухоль, злокачественную; бронхиолоальвеолярную аденокарциному; папиллярную аденокарциному, неуточненную; хромофобную карциному; ацидофильную карциному; оксифильную аденокарциному; базофильную карциному; светлоклеточную аденокарциному, неуточненную; гранулярноклеточную карциному; фолликулярную аденокарциному, неуточненную; папиллярную и фолликулярную аденокарциному; неинкапсулирорванную склерозирующую карциному; карциному коры надпочечника; эндометриоидную карциному; карциному производных кожи; апокринную аденокарциному; аденокарциному сальных желез; церуминальную аденокарциному; мукоэпидермоидную карциному; цистаденокарциному, неуточненную; папиллярную цистаденокарциному, неуточненную; папиллярную серозную цистаденокарциному; слизистую цистаденокарциному, неуточненную; слизистую аденокарциному; перстневидноклеточную карциному; инфильтративно-протоковую карциному; медуллярную карциному, неуточненную; лобулярную карциному; воспалительную карциному; болезнь Педжета, молочной железы; ацинарноклеточную карциному; аденосквамозную карциному; аденокарциному w/ плоскоклеточную метаплазию; тимому, злокачественную; овариальную стромальную опухоль, злокачественную; текому, злокачественную; гранулезноклеткочную опухоль, злокачественную; андробластому, злокачественную; карциному клеток Сертоли; опухоль клеток Лейдига, злокачественную; липидноклеточную опухоль, злокачественную; параганглиому, злокачественную; экстрамаммарную параганглиому, злокачественную; феохромоцитому; гломангиосаркому; злокачественную меланому, неуточненную; беспигментную меланому; поверхностно распространяющуюся меланому; злокачественную меланому в гигантском пигментированном невусе; эпителиоидноклеточную меланому; меланоформный невус, злокачественный; саркому, неуточненную; фибросаркому, неуточненную; фиброзную гистиоцитому, злокачественную; миксосаркому; липосаркому, неуточненную; лейомиосаркому, неуточненную; рабдомиосаркому, неуточненную; эмбриональную рабдомиосаркому; альвеолярную рабдомиосаркома; стромальную саркому, неуточненную; смешанную опухоль, злокачественную, неуточненную; смешанную опухоль мюллерова протока; нефробластому; гепатобластому; карциносаркому, неуточненную; мезенхимому, злокачественную; опухоль Бреннера, злокачественную; листовидную цистосаркому, злокачественную; синовиальную саркому, неуточненную; мезотелиома, злокачественную; дисгерминому; эмбриональную карциному, неуточненную; тератому, злокачественную, неуточненную; струму яичника, злокачественную; хориокарциному; мезонефрому, злокачественную; гемангиосаркому; гемангиоэндотелиому, злокачественную; саркому Капоши; гемангиоперицитому, злокачественную; лимфангиосаркому; остеосаркому, неуточненную; юкстакортикальную остеосаркому; хондросаркому, неуточненную; хондробластому, злокачественную; мезенхимальную хондросаркому; гигантоклеточную опухоль кости; саркому Юинга; одонтогенную опухоль, злокачественную; амелобластическую одонтосаркому; амелобластому, злокачественную; амелобластическую фибросаркому; пинеалому, злокачественную; хордому; глиому, злокачественную; эпендимому, неуточненную; астроцитому, неуточненную; протоплазматическую астроцитому; фибриллярную астроцитому; астробластому; глиобластому, неуточненную; олигодендроглиому, неуточненную; олигодендробластому; примитивную нейроэктодермальную опухоль; саркому мозжечка, неуточненную; ганглионейробластому; нейробластому, неуточненную; ретинобластому, неуточненную; ольфакторную нейрогенную опухоль; менингиому, злокачественную; нейрофибросаркому; шванному, злокачественную; гранулярноклеточную опухоль, злокачественную; злокачественную лимфому, неуточненную; болезнь Ходжкина, неуточненную; парагранулему Ходжкина, неуточненную; злокачественную лимфому, мелкоклеточную лимфоцитарную; злокачественную лимфому, крупноклеточную, диффузную; злокачественную лимфому, фолликулярную, неуточненную; грибовидный микоз; другие специфические неходжкинские лимфомы; злокачественный гистиоцитоз; множественную миелому; саркому тучных клеток; иммунопролиферативная болезнь тонкого кишечника; лейкоз, неуточненный; лимфоидный лейкоз, неуточненный; плазмацитарный лейкоз; эритролейкоз; лимфосаркому; миелолейкоз, неуточненный; базофильный лейкоз; эозинофильный лейкоз; моноцитарный лейкоз, неуточненный; лейкоз тучных клеток; мегакариобластный лейкоз; миелоидную саркому и волосатоклеточный лейкоз.
[0110] Как определено в настоящем документе, "эпителиальные злокачественные опухоли" относится к злокачественным опухолям, которые развиваются из эпителия или родственных тканей кожи, полых органов и других органов. Эпителиальные злокачественные опухоли в качестве неограничивающих примеров включают рак молочной железы, рак легких, рак печени, буккальный рак, рак желудка, рак толстого кишечника, рак носоглотки, рак кожи, рак почки, рак головного мозга, рак предстательной железы, рак яичника, рак шейки матки, рак эндометрия, рак кишечника, рак поджелудочной железы и рак мочевого пузыря.
[0111] Как используют в настоящем документе, "пациент" или "индивидуум" относится к индивидууму, принадлежащему млекопитающим, с диагнозом или подозрением наличия или развития пролиферативного заболевания, такого как злокачественная опухоль. Иллюстративные пациенты могут представлять собой людей, обезьян, собак, свиней, крупный рогатый скот, кошек, лошадей, коз, овец, грызунов и других млекопитающих, у которых могут успешно развиваться пролиферативные заболевания, такие как злокачественные опухоли.
[0112] Как используют в настоящем документе, "в значительной степени очищенная" или "по существу выделенная" относится к молекуле (например, соединению) в состоянии, которое отделено по существу от всех остальных молекул, в норме ассоциированных с ней в природном состоянии. Предпочтительно, в значительной степени очищенная молекула представляет собой преобладающую молекулу в препарате. Конкретно, в значительной степени очищенная молекула может являться более чем на 60%, предпочтительно на 75%, более предпочтительно на 90%, а наиболее предпочтительно - на 95% очищенной от других молекул (за исключением растворителя), находящихся в природной смеси. Термин "в значительной степени очищенная" или "по существу выделенная" не предназначен для включения молекул или веществ, находящихся в их природном состоянии. В определенных вариантах осуществления термин "в значительной степени очищенная" или "по существу выделенная" включает очистку одной молекулы KLH от другой молекулы KLH (например, в значительной степени очищенная или по существу отделенная молекула димера KLH от молекулы тримера KLH). В другом варианте осуществления термин "в значительной степени очищенная" или "по существу выделенная" не включает очистку одной молекулы KLH от другой молекулы KLH (например, димеры KLH и тримеры KLH включены в очищенную в значительной степени или по существу выделенную композицию), но примеси в значительной степени удалены.
[0113] "Введение" относится в настоящем документе к предоставлению терапевтической композиции по изобретению пациенту. В качестве примера, а не ограничения, введение композиции, например, инъекцию, можно проводить посредством внутривенной (в/в) инъекции, подкожной (п/к) инъекции, интрадермальной (и/д) инъекции, интраперитонеальной (и/п) инъекции или внутримышечной (в/м) инъекции. Можно использовать один или более таких маршрутов. Парентеральное введение можно проводить, например, посредством болюсной инъекции или посредством постепенной инфузии с течением времени. Альтернативно, или одновременно, введение можно проводить пероральным маршрутом. Кроме того, введение также можно осуществлять посредством хирургического введения одноразовой дозы или размещения медицинского устройства.
[0114] "Пациент, нуждающийся в этом" в настоящем документе обозначает пациента, с диагнозом или подозрением наличия пролиферативного нарушения. В одном из вариантов осуществления у пациента присутствует злокачественная опухоль или существует вероятность ее развития.
[0115] Как используют в настоящем документе, термин "антиген" определяют как любое вещество, способное вызывать иммунный ответ с помощью или без помощи белка-носителя и/или адъюванта. Предпочтительно антиген композиций по изобретению включает углевод и более предпочтительно - гликановый антиген, а наиболее предпочтительно - молекулу Globo-H.
[0116] Как используют в настоящем документе, термин "иммуногенность" относится к способности иммуногена, антигена или вакцины стимулировать иммунный ответ.
[0117] Как используют в настоящем документе, термин "иммунотерапия" относится к множество стратегий лечения на основе концепции модуляции иммунной системы для достижения профилактической и/или терапевтической цели.
[0118] Как используют в настоящем документе, термин "эпитоп" определяют как части молекулы антигена, которые контактируют с антигенсвязывающим участком антител или T-клеточных рецепторов.
[0119] "Терапевтические композиции" по изобретению включают "иммуногенные конъюгаты и/или терапевтические конъюгаты" и/или "терапевтические антитела". Терапевтические конъюгаты включают по меньшей мере один антиген, связанный с носителем. Предпочтительно, эта связь в терапевтическом конъюгате является ковалентной. В одном из вариантов осуществления терапевтического конъюгата антиген представляет собой гликан, такой как молекула Globo-H, а носитель представляет собой молекулу KLH и/или субъединицу молекулы KLH. По существу, термин терапевтический конъюгат включает одну или более субъединиц молекул KLH, связанных с одной или более молекулами Globo-H. В одном из вариантов осуществления термин терапевтический конъюгат включает одну или более молекул KLH, связанны приблизительно или по меньшей мере с 1, 10, 102 или 103 молекулами Globo-H. В другом варианте осуществления термин терапевтический конъюгат включает одну или более молекул KLH, связанных приблизительно с 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 или более молекулами Globo-H. Другой вариант осуществления включает выделенные димеры, тримеры, тетрамеры, пентамеры или гексамеры таких связанных с Globo-H субъединиц молекул KLH или их сочетания.
[0120] В одном из вариантов осуществления терапевтический конъюгат представляет собой: Fucα(1→2)Galβ(1→3)GalNAcβ(1→3)Galα(1→4)Galβ(1→4)Gluβ(1-O-этилгидразил-1-карбонилциклогексил-4-(метил-N-малеимидо)-3-(тиобутилимидил)-гемоцианин морского блюдца (KLH), также обозначаемый как OBI-822.
[0121] "Терапевтические антитела" определены как антитела (как дополнительно определено ниже), которые специфически связывают терапевтические конъюгаты по изобретению и предпочтительно часть молекулы Globo-H терапевтических конъюгатов.
[0122] Как используют в настоящем документе, термин "вакцина" относится к терапевтической композиции, которая содержит терапевтический конъюгат, который используют для обеспечения иммунитета против заболевания, ассоциированного с антигеном. Вакцины против злокачественных опухолей разрабатывают для стимуляции природной способности организма защищать себя посредством иммунной системы от рисков, обеспечиваемых поврежденными или аномальными клетками, такими как злокачественные клетки. Протективный иммунный ответ представляет собой иммунный ответ, который снижает тяжесть заболевания, включая в качестве неограничивающих примеров, профилактику заболевания, задержку начала заболевания, сниженную тяжесть симптомов, сниженную заболеваемость и отсроченную смертность. Предпочтительно вакцина способна активировать гуморальный иммунный ответ (например, стимуляция продукции антител B-лимфоцитами) и клеточный иммунный ответ (например, иммунный ответ, опосредуемый T-лимфоцитами и/или другими клетками, такими как NK клетки и макрофаги). Для определения иммунного ответа разработаны стандартные анализы, такие как твердофазный иммуноферментный анализ (ELISA), проточная цитометрия, анализ клеточной пролиферации, анализы CTL и анализы ADCC/CDC.
[0123] Как используют в настоящем документе, термин "гликан" относится к полисахариду или олигосахариду. Гликан также используют в настоящем документе для обозначения углеводной части гликоконъюгата, такого как гликопротеин, гликолипид, гликопептид, гликопротеом, пептидогликан, липополисахарид или протеогликан. Как правило, гликаны содержат между моносахаридами исключительно O-гликозидные связи. Например, целлюлоза представляет собой гликан (или более конкретно глюкан), составленный из связанной β-1,4 связями D-глюкозы, а хитин представляет собой гликан, составленный из связанного β-1,4 связями N-ацетил-D-глюкозамина. Гликаны могут представлять собой гомо- или гетерополимеры остатков моносахаридов и могут являться неразветвленными или разветвленными. Гликаны можно выявлять связанными с белками как в гликопротеинах и протеогликанах. Как правило, они находятся на внешних поверхностях клеток. O- и N-связанные гликаны являются очень частыми у эукариот, но также их можно найти, хотя и менее часто, у прокариот. N-связанные гликаны часто связаны с азотом (N) R-группы аспарагина в секвоне. Секвон представляет собой последовательность Asn-X-Ser или Asn-X-Thr, где X представляет собой любую аминокислоту за исключением пролина. Предпочтительным гликаном является молекула Globo-H.
[0124] Globo-H представляет собой гексасахарид, который представляет собой представителя семейства антигенных углеводов, который высоко экспрессированы на различных типах злокачественных опухолей, особенно злокачественных опухолей молочной железы, предстательной железы, поджелудочной железы, желудка, яичника, кишечника и легких. В иллюстративных вариантах осуществления у определенных пациентов на нулевой момент времени не выявляли никаких уровней антител к Globo-H, а после иммунизации терапевтической композицией по изобретению детектировали высокие титры. В других иллюстративных вариантах осуществления у определенных пациентов на нулевой момент времени выявляли определенные уровни антител к Globo-H, и после иммунизации терапевтической композицией по изобретению детектировали высокие титры. В определенных вариантах осуществления антитело к Globo-H экспрессировано на клеточной поверхности злокачественной опухоли в виде гликолипида и возможно в виде гликопротеина. В других вариантах осуществления сыворотка пациента, страдающего раком молочной железы, содержит высокие уровни антител к эпитопу Globo-H. В определенных вариантах осуществления к этому эпитопу в иммуногистохимических исследованиях также направлены моноклональные антитела Mbr1, VK9 и антитела к SSEA-3. Хотя определенные нормальные ткани также реагируют с Mbr1, включая нормальные ткани молочной железы, поджелудочной железы, тонкой кишки и предстательной железы, антиген в этих тканях преимущественно локализован на секреторных границах, куда доступ иммунной системе ограничен.
[0125] "Молекула Globo-H" определена в настоящем документе как гликан (т.е., молекула, содержащая молекулы сахара), который представляет собой Globo-H или его фрагмент или аналог. Globo-H представляет собой гликан, содержащий гексасахаридный эпитоп (Fucα1→2 Galβ1→3 GalNAcβ1→3 Galα1→4 Galβ1→4 Glc) и необязательно, не являющуюся сахаром молекулу. Его фрагмент представляет собой гликан, содержащий фрагмент гексасахаридного эпитопа и, если применимо, не являющуюся сахаром молекулу. Эти олигосахариды можно получать общепринятыми способами. (См. Huang et al., Proc. Natl. Acad. Sci. USA 103:15-20 (2006)). При желании их можно связывать с не являющейся сахаром молекулой. Патентная заявка США с серийным № 12/485546 относится к способу получения антител, специфичных к Globo-H или его фрагменту, посредством введения не являющемуся человеком млекопитающему (например, мыши, кролику, козе, овце или лошади) иммунной композиции, описанной выше, и выделения у млекопитающего антител, которые связываются с Globo-H или его фрагментом.
[0126] Аналоги Globo-H можно получать с использованием микропанели гликанов, и они включают гликаны, описанные в Wang et al., Proc. Natl. Acad. Sci. U S A. 2008 August 19; 105(33): 11661-11666 и представленные на фигуре 1.
[0127] Аналоги Globo-H предпочтительно связываются с антителами VK-9, Mbr1 и антителами к SSEA-3. Предпочтительно, аналоги Globo-H связываются с конкретной константой диссоциации (KD,поверхн.). Для анализа кривых связывания можно использовать изотерму Ленгмюра с получением констант диссоциации на поверхности (KD,поверхн.). В условиях равновесия при инкубации средняя флуоресценция точек репликатов (Fнабл.) можно описать посредством:
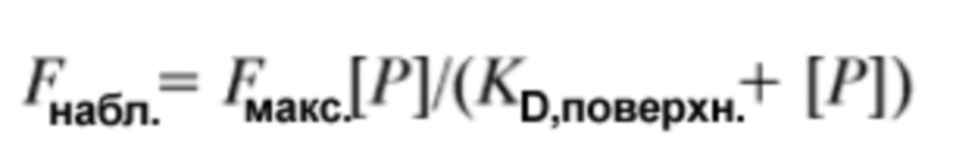
где Fмакс. представляет собой максимальную интенсивность флуоресценции, меру количества активного углевода на поверхность, [P] представляет собой общую концентрацию антитела, и KD,поверхн. представляет собой равновесную константу диссоциации для поверхности углевода и антитела. Как описано в Wang et al. В определенных вариантах осуществления предпочтительная (KD,поверхн.) аналогов Globo-H в отношении антител VK-9, Mbr1 и антител к SSEA-3, описанных в Wang et al., составляет по меньшей мере, приблизительно или точно 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5 или 1,6 нМ.
[0128] "Гемоцианин морского блюдца" (KLH) представляет собой большой, содержащий несколько субъединиц, несущий кислород металлопротеин, выявленный в гемолимфе гигантского морского блюдца, Megathura crenulata. KLH представляет собой гетерогенный гликозилированный белок, состоящий из субъединиц с молекулярной массой приблизительно от 350000 до приблизительно 390000 в агрегатах с молекулярными массами приблизительно от 400 кДа (например, мономер KLH) до приблизительно 8000 кДа (например, дидекамер KLH). Каждый домен субъединицы KLH содержит два атомы меди, которые вместе связывают одну молекулу кислорода. Когда с гемоцианином связан кислород, молекула принимает характерную прозрачную, опалесцирующую синюю окраску. В определенных вариантах осуществления белок KLH является очень иммуногенным, но при этом безопасным для людей. В определенных вариантах осуществления KLH можно выделять из гемолимфы Megathura crenulata посредством ряда этапов, который, как правило, включает осаждение сульфатом аммония и диализ и может включать хроматографическую очистку для получения наибольшей чистоты. В определенных вариантах осуществления очистка KLH также может включать удаление эндотоксина, но этот этап может являться необязательным, так как эндотоксин при инъекции для продукции антител может служить в качестве адъюванта. Предпочтительно, высококачественный препарат KLH с четкой опалесцирующей синей окраской является наилучшим индикатором растворимости KLH. В определенных вариантах осуществления мономерные единицы KLH собираются в более крупный мультимер (декамер или дидекамер) с общей молекулярной массой приблизительно от 4000 кДа до 8000 кДа. "Молекула гемоцианина морского блюдца" или "молекула KLH" определена в настоящем документе как белок KLH1 (SEQ ID NO. 1) или KLH2 (SEQ ID NO. 2) или белок по существу идентичным им или их смеси. По существу идентичный в этом контексте означает, что каждая молекула KLH содержит последовательность аминокислот по меньшей мере, приблизительно или точно на 100, 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81, 80, 79, 78, 77, 76 или 75 процентов идентичную последовательности природного KLH дикого типа. В определенных вариантах осуществления KLH по изобретению обладает увеличенной иммуногенной активностью, в частности, увеличенной противоопухолевой активностью. В определенных вариантах осуществления KLH в композиции по настоящему изобретению содержит интактные неразрушенные субъединицы молекулярной массой приблизительно 400000. В других вариантах осуществления KLH по изобретению содержит мультимеры KLH более высокого порядка.
[0129] В определенных вариантах осуществления мультимеры KLH более высокого порядка обладают молекулярными массами приблизительно 8-10 миллионов с коэффициенты седиментации приблизительно 92-107S. Количество присутствующих мультимеров KLH более высокого порядка основано на анализах седиментационного равновесия и/или скорости седиментации при ультрацентрифугировании. В других вариантах осуществления KLH по изобретению демонстрирует увеличенную иммуногенную активность, в частности увеличенную противоопухолевую активность. Увеличенную иммуногенную активность наблюдают, например, но не ограничиваясь этим, (a) при инъекции KLH (без адъюванта), (b) при KLH, используемом в качестве адъюванта, (c) с KLH, используемым в качестве иммуногенного носителя для гаптенов или слабо иммуногенных антигенов, и (d) с KLH, используемым в качестве противоопухолевого средства. Композиция KLH по изобретению демонстрирует увеличенную противоопухолевую активность для многих опухолей, включая в качестве неограничивающих примеров опухоли мочевого пузыря, молочной железы, яичника и т.д. В определенных вариантах осуществления две молекулы KLH могут формировать димер посредством ковалентной связи между мономерами KLH. Не ограничиваясь теорией, полагают, что ковалентная связь между молекулами KLH формируется посредством дисульфидной связи. В определенных вариантах осуществления две или более молекулы KLH могут формировать димер, тример, тетрамер, пентамер, гексамер и т.д. посредством ковалентной связи между мономерами, димерами, тримерами и т.д. KLH. Не ограничиваясь теорией, полагают, что ковалентная связь между молекулами KLH формируется посредством дисульфидной связи.
[0130] Существует ряд способов связывания молекулы KLH с антигеном, включая прямую конъюгацию и конъюгацию с бифункциональной линкерной группой, такой как 4-(4-N-малеимидометил)циклогексан-1-карбоксилгидразид (MMCCH). Такие способы связывания описаны в патенте США № 6544952. В определенных вариантах осуществления для получения терапевтических конъюгатов по изобретению, например, аллилгликозид Globo-H преобразуют в альдегид посредством озонолиза, и альдегидную группу связывают с NH-группами на кросслинкере MMCCH, получая Globo-H-MMCCH; белок-носитель, KLH, подвергают тиолированию с получением KLH-SH; и затем сульфгидрильные группы на тиолированном KLH связывают с малеинимидной группой на MMCCH, получая конъюгаты Globo-H-KLH.
[0131] В одном из вариантов осуществления аллилгликозид Globo-H получают посредством химического синтеза. Также используют тиолирующий реагент, 2-иминотиолан и KLH степени cGMP и линкер 4-(4-N-малеимидометил)-циклогексан-1-карбоксилгидразид (MMCCH). В определенных вариантах осуществления проводят следующие этапы: (1) преобразование аллилгликозида Globo-H в альдегид Globo-H; (2) связывание альдегида Globo-H с MMCCH с получением Globo-H-MMCCH, отдельно; (3) химическое тиолирование KLH; (4) конъюгация Globo-H-MMCCH с тиолированным KLH и (5) очистка гликоконъюгата Globo-H-KLH (OBI-822). Путь конъюгации Globo-H-субъединица KLH представлен на фигуре 2A.
[0132] В определенных вариантах осуществления при конъюгации молекулы Globo-H с молекулой белка KLH, молекула белка KLH в определенных вариантах осуществления демонстрирует снижение молекулярной массы по сравнение с интактной молекулой предпочтительно вследствие диссоциации субъединиц молекулы Globo-H. В других вариантах осуществления способы конъюгации, описываемые в настоящем документе, приводит к диссоциации субъединиц KLH, не описанной ранее. Не желая быть связанными какой-либо конкретной теорией, полагают, что высокий уровень гликозилирования конъюгатов молекула Globo-H-субъединица молекулы KLH по изобретению приводит к формированию водородных связей между молекулами Globo-H. Поэтому в определенных вариантах осуществления силы Ван-дер-Ваальса и гидрофобные взаимодействия между субъединицами молекулы KLH замещаются водородными связями Globo-H, и это приводит к разделению субъединиц молекулы KLH. После конъюгации, субъединицы молекулы KLH конъюгата молекула Globo-H-молекула KLH предпочтительно агрегируют с формированием новых мономеров, димеров, тримеров, тетрамеров, пентамеров, гексамеров или любого их сочетания. Получаемые в результате иллюстративные терапевтические конъюгаты молекула Globo-H-молекула KLH с неожиданно большим эпитопным отношением обладают необычными и неожиданными превосходными иммуногенными свойствами. В определенных вариантах осуществления молекулы Globo-H конъюгированы с остатками лизина на KLH1 и KLH2. В других вариантах осуществления молекулы Globo-H не конъюгированы с остатками лизина на KLH1 и KLH2. В определенных вариантах осуществления при анализе пептидного картирования выявляют, что конъюгированные с Globo-H участки с остатками лизина являются преобразованными, что позволяет предполагать, что композиция гликоконъюгата Globo-H-KLH является уникальной по своей структуре.
[0133] В одном из вариантов осуществления терапевтические композиции по изобретению содержат одну или более субъединиц молекулы KLH, где по меньшей мере одна такая субъединица конъюгирована по меньшей мере, приблизительно или точно 1, 10, 100 или 1000 раз: с 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108,109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126,127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144,145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 или более молекулами Globo-H.
[0134] Авторы изобретения с использованием масс-спектроскопического анализа выявили, что молекулы Globo-H конъюгированы с остатками лизина KLH. Таким образом, в определенных вариантах осуществления предпочтительно, чтобы молекулы Globo-H были конъюгированы с остатками лизина.
[0135] В одном из вариантов осуществления в субъединице молекулы KLH всего существует точно или приблизительно 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 остатков лизина. В другом варианте осуществления в субъединице молекулы KLH существует точно или приблизительно 150 или 156 остатков лизина. В другом варианте осуществления на каждой субъединице молекулы KLH доступных для связывания или фактически связанных с молекулой Globo-H существует точно или приблизительно 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109 или 110 участков конъюгации лизина. В другом варианте осуществления на каждой субъединице молекулы KLH существует 62, 66, 67, 68, 70, 72, 76, 86, 87, 88, 90, 92, 93, 100 таких участков конъюгации лизина. Участки конъюгации лизина представляют собой остатки лизина в молекуле KLH, которые доступны для связывания или фактически связаны с молекулой Globo-H и/или линкер для молекулы Globo-H, например, таким как линкер MMCCH.
[0136] В определенных терапевтических вариантах осуществления содержащих смесь субъединиц молекулы (например, KLH1 и KLH2 или их вариантов), суммарное количество доступных остатков лизина (для обеих субъединиц), как насчитывается вместе в субъединицах различного типа, может составлять или равно приблизительно 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 или 310. В таких вариантах осуществления вместе в различных субъединицах (например, KLH1 и KLH2 или их вариантах) существует или может существовать точно или приблизительно 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160 участков конъюгации лизина. В других таких вариантах осуществления, существует 136, 137, 141, 140, 143, 147 или 155 участков конъюгации лизина.
[0137] В наиболее предпочтительном варианте осуществления из общего количества 306 остатков лизина в KLH1/KLH2 присутствует 136, 137, 140, 141, 143, 147 или 155 участков конъюгации лизина.
[0138] В определенных вариантах осуществления терапевтические композиции по изобретению содержат смесь конъюгатов субъединица молекулы KLH-молекула Globo-H, где такие конъюгаты остаются мономерами или формируют димеры, тримеры, тетрамеры, пентамеры, гексамеры или любое их сочетание. В другом варианте осуществления терапевтические композиции по изобретению содержат выделенные мономеры, димеры, тримеры или тетрамеры или их комбинации конъюгата субъединица молекулы KLH-молекула Globo-H. В дополнительном варианте осуществления терапевтическая композиции по изобретению содержит только димеры и тримеры конъюгата субъединица молекулы KLH-молекула Globo-H.
[0139] В другом варианте осуществления терапевтические композиции содержат по меньшей мере две субъединицы молекулы KLH, где каждая из двух субъединиц молекулы KLH связана с различными гликанами. Другие ассоциированные с опухолями гликановые антигены, способные к связыванию с субъединицами молекулы KLH в качестве неограничивающих примеров могут включать GM2, GD2, GD3, фукозил, GM1, sTn, сиалил-антиген Льюисаx, антиген Льюисаx, сиалил-антиген Льюисаa, антиген Льюисаa, sTn, TF, полисиаловую кислоту, антиген Льюисаy, муцины, T-антиген и т.п. В определенных вариантах осуществления только по меньшей мере или приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 процентов субъединиц молекулы KLH в терапевтической композиции связаны с молекулами Globo-H, тогда как оставшиеся субъединицы молекулы KLH в терапевтической композиции связаны с другими ассоциированными с опухолями гликановыми антигенами.
[0140] Как используют в настоящем документе, "эпитопное отношение" в отношении терапевтических конъюгатов, описываемых в настоящем документе, относится, например, к отношению антигенных эпитопов к молекулам носителя в терапевтическом конъюгата. Предпочтительно, это относится к отношению молекул Globo-H к молекулам KLH. Наиболее предпочтительно эпитопное отношение терапевтического конъюгата рассчитывают с использованием следующей формулы=(фактическая масса молекул Globo-H/молекулярная масса молекулы Globo-H)/(фактическая масса молекулы KLH/молекулярная масса молекулы KLH) комбинации. Специалист в данной области легко определит эпитопные отношения. Предпочтительно, массы Globo-H определяют, например, посредством высокоэффективной анионообменной хроматографии с импульсным амперометрическим детектированием (HPAEC-PAD).
[0141] Предпочтительно эпитопные отношения терапевтических конъюгатов по изобретению составляют приблизительно, по меньшей мере или точно: 1, 10, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1025, 1050, 1075, 1100, 1125, 1150, 1175, 1200, 1225, 1250, 1275, 1300, 1325, 1350, 1375, 1400, 1425, 1450, 1475, 1500, 1525, 1550, 1575, 1600, 1625, 1650, 1675, 1700, 1725, 1750, 1775, 1800, 1825, 1850, 1875, 1900, 1925, 1950, 1975, 2000, 2025, 2050, 2075, 2100, 2125, 2150, 2175, 2200, 2225, 2250, 2275, 2300, 2325, 2350, 2375, 2400, 2425, 2450, 2475, 2500, 2525, 2550, 2575, 2600, 2625, 2650, 2675, 2700, 2725, 2750, 2775, 2800, 2825, 2850, 2875, 2900, 2925, 2950, 2975 или 3000.
[0142] В одном из вариантов осуществления терапевтические композиции по изобретению содержат смесь терапевтических конъюгатов с определенным диапазоном эпитопных отношений. В одном из вариантов осуществления диапазон, среднее или медиана эпитопных отношений терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 10 до приблизительно 3200, приблизительно от 800 до приблизительно 2500, приблизительно от 1000 до приблизительно 2000, приблизительно от 1250 до приблизительно 1750 или приблизительно от 1400 до приблизительно 1600. В другом варианте осуществления диапазон, среднее или медиана эпитопных отношений терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 10 до приблизительно 150, приблизительно от 40 до приблизительно 125, приблизительно от 50 до приблизительно 100, приблизительно от 62 до приблизительно 87 или приблизительно от 70 до приблизительно 80. В другом варианте осуществления диапазон, среднее или медиана эпитопных отношений терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 20 до приблизительно 300, приблизительно от 80 до приблизительно 250, приблизительно от 100 до приблизительно 200, приблизительно от 125 до приблизительно 175 или приблизительно от 140 до приблизительно 160. В другом варианте осуществления диапазон, среднее или медиана эпитопных отношений терапевтических конъюгатов в терапевтической композиции составляет приблизительно от 30 до приблизительно 450, приблизительно от 120 до приблизительно 375, приблизительно от 150 до приблизительно 300, приблизительно от 185 до приблизительно 260 или приблизительно от 210 до приблизительно 240. В определенных фармацевтических композициях по меньшей мере или приблизительно 30, 40, 50, 60, 70, 80, 90, 95, 98, 99 или 100% терапевтических конъюгатов существуют в виде мономеров или в виде димеров, тримеров, тетрамеров, пентамеров, гексамеров или их сочетаний.
АНТИТЕЛА К ТЕРАПЕВТИЧЕСКИМ КОНЪЮГАТАМ
[0143] В определенных иллюстративных вариантах осуществления изобретение также относится к выделенным терапевтическим антителам, которые специфически связывают терапевтические конъюгаты, описываемые в настоящем документе, с определенной аффинностью, а также их использованию при лечении и/или диагностике пролиферативных заболеваний.
[0144] Как используют в настоящем документе, термины "антитело" и "антитела" (иммуноглобулины) включает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) сформированные по меньшей мере из двух интактных антитела, антителам человека, гуманизированным антителам, камелизированным антителам, химерным антителам, одноцепочечным Fv (scFv), одноцепочечным антителам, однодоменным антителам, доменным антителам, фрагментам Fab, фрагментам F(ab')2, фрагментам антител, которые демонстрируют желаемую биологическую активность, связанным дисульфидами Fv (sdFv) и антиидиотипическим (анти-Id) антителам (включая, например, анти-Id к антителам по изобретению), интраантителам и связывающимся с эпитопами фрагментам любого из указанного выше. В частности, антитела включают молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, т.е., молекулы, содержащие антигенсвязывающие участки молекул иммуноглобулинов, могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
[0145] "Аффинность" антител к эпитопу, например, молекуле Globo-H терапевтического конъюгата, для применения при лечении, описанном в настоящем документе, представляет собой термин, хорошо понимаемый в данной области, и означает меру или силу связывания антител с эпитопом. Аффинность можно измерять и/или выражать рядом способов, известных в данной области, включая в качестве неограничивающих примеров равновесную константу диссоциации (KD или Kd), кажущуюся равновесную константу диссоциации (KD' или Kd') и IC50 (количество, необходимое для осуществления 50% ингибирования в конкурентном анализе). Следует понимать, что для целей настоящего изобретения аффинность представляет собой среднюю аффинность данной популяции антител, которые связываются с эпитопом. Значения KD' приводимые в настоящем документе в единицах мг IgG на мл или мг/мл означают количество мг Ig в мл сыворотки, хотя также можно использовать плазму. Когда аффинность антитело используют в качестве основы для проведения способов лечения, описываемых в настоящем документе, или для выбора для способов лечения, описываемых в настоящем документе, аффинность антител можно измерять до и/или в течение лечения, и полученные значения клинический работник может использовать для оценки того, что представляющий собой человека пациент является подходящим кандидатом для лечения.
[0146] Как используют в настоящем документе, термин "специфическое связывание" относится к взаимодействию между связывающимися парами (например, антителом и антигеном). В различных случаях специфическое связывание может осуществляться при константе аффинности по меньшей мере или приблизительно 10-6 моль/литр, приблизительно 10-7 моль/литр или приблизительно 10-8 моль/литр или менее.
[0147] Иллюстративные антитела к Globo-H можно получать, собирая жидкости организма у иммунизированного индивидуума, исследованных на увеличение количества желаемых антител, такие как сыворотка, и выделяя сыворотку из крови любым общепринятым способом.
[0148] Как правило, антитела индуцируют несколькими инъекциями соответствующего антигена и адъюванта. Пригодным может являться конъюгация соответствующего антигена с белком, который является иммунногенным у иммунизируемых видов, например, с гемоцианином морского блюдца.
[0149] Способы иммунизации животных антигенами известны в данной области. Стандартным способом иммунизации млекопитающих является интраперитонеальная инъекция или подкожная инъекция антигенов. Более конкретно, антигены можно разбавлять и суспендировать в подходящем количестве фосфатно-солевого буфера (PBS), физиологического солевого раствора и т.д. При желании, суспензию антигена можно смешивать с подходящим количеством адъюванта, а затем вводить индивидууму.
[0150] В определенных вариантах осуществления индивидуумов можно стимулировать до достижения плато титра посредством нескольких введений антигена, смешанного с подходящим количеством адъюванта. Также для иммунизации можно использовать подходящий носитель. После иммунизация, как указано выше, сыворотку проверяют способом для определения увеличения количества желаемых антител.
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ
[0151] В одном из вариантов осуществления при введении пациенту терапевтические композиции, содержащие терапевтические конъюгаты по изобретению, способны индуцировать титры антител к Globo-H по меньшей мере или приблизительно в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 50, 100, 250, 500, 1000, 1500, 2000, 2500, 3000, 4000 или 5000 раз выше, чем титры тех же антител к Globo-H до введения (т.е., титры на исходном уровне до обработки) в том же эксперимента. В определенных вариантах осуществления антитела к Globo-H представляют собой антитела IgM. В другом варианте осуществления антитела к Globo-H представляют собой антитела IgG.
[0152] Терапевтические композиции по изобретению способны к индукции у индивидуума гуморального и клеточного ответа. В определенных вариантах осуществления вакцинная композиция по изобретению индуцирует продукцию специфичных к молекуле Globo-H антител IgG и IgM и размножение B-клеток и T-клеток (например, CD3+T-клеток, CD4+T-клеток и/или CD8+T-клеток). Как правило, этот иммунный ответ хронологически происходит после введения. В конкретном примере после введения продукцию B-клеток выявляют приблизительно на сутки 3, 4, 5, 6, 7, 8, 9, 10, 20, 30 или 60 с последующей продукцией антител IgG и IgM приблизительно на сутки 10, 20, 30, 60 или 90 и последующей продукцией T-клеток приблизительно на сутки 24, 30, 40, 50, 60, 90, 120, 150 или 180. Вакцинная композиция по изобретению потенциально обеспечивает длительное иммунологическое защитное действие, которое может предотвращать рост небольших количеств злокачественных клеток, таким образом, являясь идеальной для минимального остаточного заболевания так, чтобы достичь стабилизации заболевания и улучшения выживаемости.
[0153] "Антителозависимая клеточная цитотоксичность" и "ADCC" относятся к опосредуемой клетками реакции, в которой неспецифические цитотоксические клетки (например, клетки естественных киллеров (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишень, а затем вызывают лизис клетки-мишени. В одном из вариантов осуществления такие клетки представляют собой клетки человека. Не ограничиваясь каким-либо конкретным механизмом действия, эти цитотоксические клетки, которые опосредуют ADCC, как правило, экспрессируют рецепторы Fc (FcR). Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, FcγRIII и/или FcγRIV. Экспрессия FcR на гемопоэтических клетках обобщенно описана в Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991). Для оценки активности ADCC молекулы можно проводить анализ ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337. Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и клетки естественных киллеров (NK). Альтернативно или дополнительно, активность ADCC терапевтических конъюгатов по изобретению можно оценивать in vivo, например, в модели на животных, такой как модель, описанная в Clynes et al., Proc. Natl. Acad. Sci. (USA), 95:652-656 (1998).
[0154] В определенных вариантах осуществления введение фармацевтической композиции может обеспечивать иммунный ответ, включая образование антител, которые специфически связываются с Globo-H. В определенных вариантах осуществления разработаны антитела к одному или более из GloboH, экспрессируемых на поверхности злокачественных клеток, и запускающие CDC и/или ADCC с уничтожением этих клеток. В определенных вариантах осуществления антитела преимущественно включают антитела IgG. В определенных вариантах осуществления иммуногенные композиции, предоставляемые по настоящему документу, в основном включают IgG1, IgG2b, IgG2c и IgG3.
[0155] "Обусловленная комплементом цитотоксичность" или "CDC" относится к способности терапевтического конъюгата инициировать активацию комплемента и лизировать мишень в присутствии комплемента. Инициация пути активации комплемента происходит при связывании первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с распознаваемым антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santaro et al., J. Immunol. Methods, 202:163 (1996).
[0156] В другом варианте осуществления при введении пациенту терапевтические композиции, содержащие терапевтические конъюгаты по изобретению, способны индуцировать продукцию у пациента/индивидуума иммунной сыворотки против Globo-H, которая специфически связывается с положительными по Globo-H линиями злокачественных клеток, например, с клетками MCF-7.
КОМБИНАЦИИ
[0157] Терапевтические композиции могут содержать другие лекарственные средства против злокачественных опухолей/антипролиферативные лекарственные средства, а также адъюванты и другие иммуномодулирующие молекулы, такие как цитокины или хемокины. В определенных вариантах осуществления комбинация может представлять собой совместное введение отдельных средств/композиций или совместный состав. Эти средства можно доставлять в наборе совместно в раздельных контейнерах или в одном контейнере. Средства можно комбинировать в момент введения или по меньшей мере или приблизительно за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 минуты, часа или сутки до введения.
[0158] Адъюванты представляют собой фармакологические или иммунологические средства, которые модифицируют действие других средств. Они могут представлять собой неорганические или органические химические вещества, макромолекулы или целые злокачественные клетки или их части, которые усиливают иммунный ответ на данный антиген. Адъюванты включают полный и неполный адъювант Фрейнда, молекулы Toll-подобных рецепторов и их миметики, LPS, липопротеины, липопептиды, флагеллин, двухцепочечную РНК, неметилированные островки CpG, левамизол, бациллу Кальмета-Герена, октреотид, изопринозин и задаксин, различные формы ДНК и РНК, как правило, высвобождаемые бактериями и вирусами, антагонисты PD-1 и антагонисты CTLA. В одном из вариантов осуществления адъювант представляет собой сапониновый адъювант.
[0159] В определенном варианте осуществления сапониновый адъювант представляет собой сапонин OBI-821, который является по существу чистым. В других вариантах осуществления сапонин OBI-821 представляют его биологически активные фрагменты. Адъювант также может включать загрязненные формы сапонинов OBI-821. Очищенные сапонины OBI-821 демонстрируют увеличенное адъювантное действие при введении с вакциной, описываемой в настоящем документе, или смещивании с другим по существу чистым сапонином или несапониновыми адъювантами.
[0160] Сапонины OBI-821 представляют собой природные гликозиды, с высокой чистотой выделяемые из коры дерева Quillaja saponaria Molina посредством высокоэффективной жидкостной хроматографии (ВЭЖХ), жидкостной хроматографии низкого давления с диоксидом кремния и жидкостной хроматографии на основе гидрофильного взаимодействия (HILIC), как описано, например, в патенте США № 5057540 и патенте США № 6524584, содержащие которых полностью включено в качестве ссылки. Анализ жидкостной хроматографии высокого давления продемонстрировал, что OBI-821 представляют собой смесь структурно родственных изомерных соединений. Идентифицированы и описаны в настоящем документе различные очищенные изомерные соединения сапонинов OBI-821.
[0161] В определенных вариантах осуществления сапонин OBI-821 содержит по меньшей мере одно выделенное соединение формулы I, как указано ниже:
где
R1 представляет собой β-D-апиозу или β-D-ксилозу; и
R2 и R3 независимо представляют собой H, алкил,
(ацильную группу жирной кислоты для соединения 1989) или

(ацильную группу жирной кислоты для соединения 1857).
[0162] Также сапонин OBI-821 может содержать выделенное соединение формулы I, где
(i) R1 представляет собой β-D-апиозу, R2 представляет собой ацильную группу жирной кислоты для соединения 1989, изображенную выше, и R3 представляет H (соединение 1989 V1A);
(ii) R1 представляет собой β-D-апиозу, R2 представляет собой H, и R3 представляет собой ацильную группу жирной кислоты для соединения 1989, изображенную выше (соединение 1989 V1B);
(iii) R1 представляет собой β-D-ксилозу, R2 представляет собой ацильную группу жирной кислоты для соединения 1989, изображенную выше, и R3 представляет собой H (соединение 1989 V2A); или
(iv) R1 представляет собой β-D-ксилозу, R2 представляет собой H, и R3 представляет собой ацильную группу жирной кислоты для соединения 1989, изображенную выше (соединение 1989 V2B). Обобщенно, соединение 1989 V1A, соединение 1989 V1B, соединение 1989 V2A и соединение 1989 V2B называют "смесь соединений 1989".
[0163] В таблице 1 приведены функциональные группы соединений 1989 и молярный % каждого соединения 1857 в смеси соединений 1857.
Таблица 1
[0164] Сапонин OBI-821 может содержать выделенное соединение формулы I, где:
(i) R1 представляет собой β-D-апиозу, R2 представляет собой ацильную группу жирной кислоты для соединения 1857, изображенную выше, и R3 представляет собой H (соединение 1857 V1A);
(ii) R1 представляет собой β-D-апиозу, R2 представляет собой H, и R3 представляет собой ацильную группу жирной кислоты для соединения 1857, изображенную выше (соединение 1857 V1B);
(iii) R1 представляет собой β-D-ксилозу, R2 представляет собой ацильную группу жирной кислоты для соединения 1857, изображенную выше, и R3 представляет собой H (соединение 1857 V2A); или
(iv) R1 представляет собой β-D- Ксилоза, R2 представляет собой H, и R3 представляет собой ацильную группу жирной кислоты для соединения 1857, изображенную выше (соединение 1857 V2B). Обобщенно, соединение 1857 V1A, соединение 1857 V1B, соединение 1857 V2A и соединение 1857 V2B называют "смесь соединений 1857".
[0165] В таблице 2 приведены функциональные группы соединений 1857 и молярный % каждого из соединений 1857 в смеси соедининий 1857. ВЭЖХ.
Таблица 2
[0166] Сапонин OBI-821 содержит одно или более из следующих соединений:
(i) соединение 1857 V1A;
(ii) соединение 1857 V1B;
(iii) соединение 1857 V2A;
(iv) соединение 1857 V2B;
(v) соединение 1989 V1A;
(vi) соединение 1989 V1B;
(vii) соединение 1989 V2A; или
(viii) соединение 1989 V2B.
[0167] Процентное содержание смеси соединений 1857 и смеси соединений 1989 в сапонине OBI-821 может находиться в диапазона, как указано ниже:
(i) приблизительно от 1 молярного % до приблизительно 15 молярных % OBI-821 содержит смесь соединений 1857; и
(ii) приблизительно от 85 молярных % до приблизительно 99 молярных % OBI-821 содержит смесь соединений 1989.
[0168] Все молярные % могут варьировать на величину 0,1% (например, приблизительно от 87% до приблизительно 90%, приблизительно от 90,5% до приблизительно 97%, приблизительно от 3,5% до приблизительно 11%, приблизительно от 10% до приблизительно 14%).
[0169] Смесь соединений 1989 может содержать приблизительно 60-70 молярных % соединения 1989 V1A; приблизительно 1-5 молярных % соединения 1989 V1B; приблизительно 30-40 молярных % соединения 1989 V2A и приблизительно 0,1-3 молярных % соединения 1989 V2B. Все молярные % могут варьировать на величину 0,1 (например, 65%, 2,5%, 35,6%).
[0170] Смесь соединений 1857 может содержать приблизительно 60-70 молярных % соединения 1857 V1A; приблизительно 1-5 молярных % соединения 1857 V1B; приблизительно 30-40 молярных % соединения 1857 V2A и приблизительно 0,1-3 молярных % соединения 1857 V2B. Все молярные % могут варьировать на величину 0,1 (например, 65%, 2,5%, 35,6%).
[0171] В другом варианте осуществления по существу чистое OBI-821 очищают из неочищенного экстракта Quillaja saponaria, где указанное OBI-821 характеризуется единственным преобладающим пиком, который составляет 90% или более всей области всех пиков хроматограммы, исключая пик растворителя, при анализе на ВЭЖХ с обращенной фазой на колонке Symmetry C18 с размером частиц 5 мкм, порами 100 Å, 4,6 мм ВД × 25 см длины с программой элюции, включающей подвижную фазу A:B 95%:5% до 75%:25% в течение 11 минут, где подвижная фаза A представляет собой дистиллированную воду с 0,1% трифторуксусной кислотой, а подвижная фаза B представляет собой ацетонитрил с 0,1% трифторуксусной кислотой, при скорости потока 1 мл/мин.
[0172] В одном из вариантов осуществления фармацевтическая композиция содержит соединение формулы (I)
где,
R1 представляет собой β-D-апиозу или β-D-ксилозу; и
R2 и R3 независимо представляют собой H, алкил, или
(ацильную группу жирной кислоты для соединения 1857), и фармацевтически приемлемый носитель.
[0173] Вакцина может содержать углеводный антиген или его иммуногенный фрагмент и сапонин OBI-821. В еще одном варианте осуществления вакцина содержит углеводный антиген или его иммуногенный фрагмент; белок-носитель и сапонин OBI-821. В другом варианте осуществления вакцина содержит углеводный антиген, выбранный из Globo-H, KLH и сапонин OBI-821. Неограничивающие примеры белка-носителя включают KLH.
[0174] Термины "α-галактозилцерамид" и "α-GalCer" относятся к гликолипиду, который стимулирует естественные киллерные T-клетки в направлении продукции цитокинов T хелперов 1 (TH1) и TH2, как описано в патенте США № 8268969, содержание которого полностью включено в качестве ссылки. В определенном варианте осуществления адъювант OBI-834 (известный как C34) характеризуется следующей иллюстративной структурой:
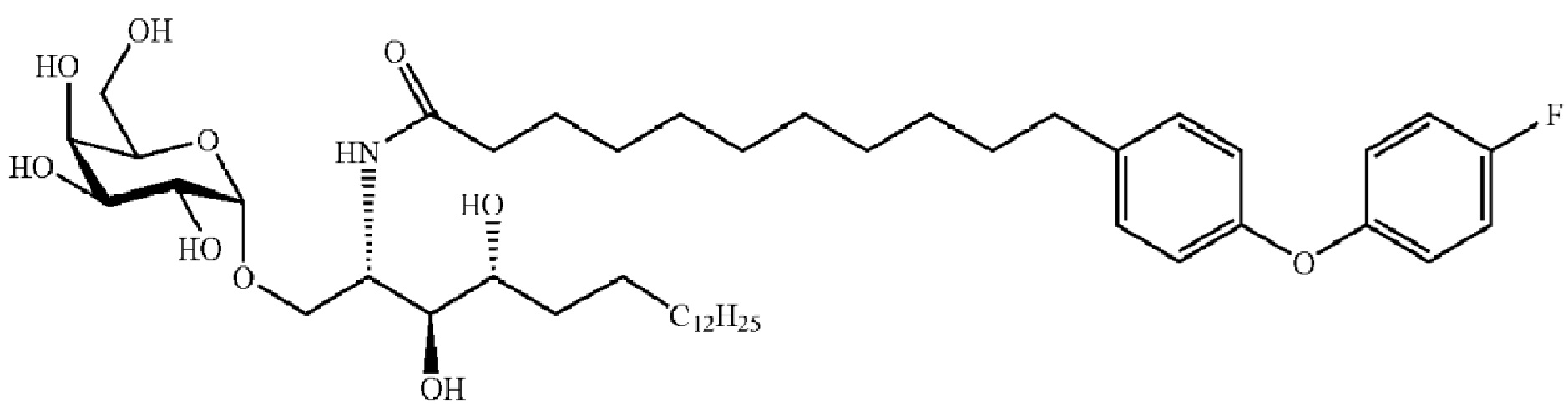
[0175] Как используют в настоящем документе, термин "цитокин" относится к любому из многочисленных низкомолекулярных, секретируемых белков, которые регулируют интенсивность и длительность иммунного ответа, влияя на процессы дифференцировки иммунных клеток, как правило, включающие изменения в экспрессии генов, вследствие чего клетки-предшественники становятся определенным специализированным типом клеток. Цитокины различным образом называют лимфокинами, интерлейкинами и хемокинами на основе их предполагаемой функции, секреции клетками или мишени действия. Например, определенные типичные интерлейкины в качестве неограничивающих примеров включают IL-2, IL-12, IL-18, IL-2, IFN-γ, TNF, IL-4, IL-10, IL-13, IL-21, GM-CSF и TGF-β.
[0176] Как используют в настоящем документе, термин "хемокин" относится к любому из различных низкомолекулярных хемотаксический цитокинов, высвобождаемых в участке инфекции, которые обеспечивают средства для мобилизации и активации лимфоцитов. Хемокины привлекают лейкоциты к участкам инфекции. Хемокины содержат консервативные остатки цистеина, которые позволяют разделять их на четыре группы. Группы с типичными хемокинами представляют собой C-C-хемокины (RANTES, MCP-1, MIP-1α и MIP-1β), C-X-C-хемокины (IL-8), C-хемокины (лимфотактин) и CXXXC хемокины (фракталкин).
[0177] Терапевтические композиции по изобретению могут дополнительно содержать ингибиторы PD-1/PD-L1 (иммунотерапия цитотоксическими T-лимфоцитами (CTL)), средства для иммунотерапии CTLA-4, ингибиторы CDK4/6 (направленная терапия), ингибиторы PI3K (направленная терапия), ингибиторы mTOR (направленная терапия), ингибиторы AKT (направленная терапия), панингибиторы Her (направленная терапия). Также эти ингибиторы можно модифицировать с получением соответствующих моноклональных антител. Такие антитела можно включать в терапевтические композиции по изобретению.
[0178] Терапевтические композиции могут содержать другие средства против злокачественных опухолей/антипролиферативные или химиотерапевтические средства. В определенных вариантах осуществления примеры таких средств можно найти в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Такие средства против злокачественных опухолей в качестве неограничивающих примеров включают следующее: гормональные терапевтические средства (например, селективные модуляторы рецепторов эстрогенов, модуляторы рецепторов андрогенов), препараты моноклональных антител, химиотерапевтические средства, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические средства, антинеопластические средства, антипролиферативные средства, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-КоА-редуктазы, азотистые иприты, нитрозокарбамиды, ингибиторы ангиогенеза (например, бевацизумаб), ингибиторы клеточной пролиферации и пути передачи сигнала выживания, индуцирующие апоптоз средства, средства, блокирующие контрольные точки клеточного цикла, средства, блокирующие рецепторы тирозинкиназы (RTK), мишени млекопитающий ингибиторов рапамицина (mTOR), ингибиторы рецепторов эпидермального фактора роста 2 (HER2) человека, ингибиторы рецепторов эпидермального фактора роста (EGFR), блокаторы интегринвов, НПВП, агонисты PPAR, ингибиторы наследственной множественной лекарственной устойчивости (MDR), противорвотные средства, средства, пригодные при лечении анемии, средства, пригодные при лечении нейтропении, усиливающие иммунологический ответ лекарственные средства, биофосфонаты, ингибиторы ароматазы, средства, индуцирующие конечную дифференцировку неопластических клеток, ингибиторы γ-секретазы, вакцины против злокачественных опухолей и любое их сочетание.
СОСТАВЫ ПО ИЗОБРЕТЕНИЮ
[0179] Как правило, терапевтические композиции (также указываемые в настоящем документе как фармацевтические композиции) содержат фармацевтически приемлемый носитель. Как используют в настоящем документе, формулировка "фармацевтически приемлемый носитель" включает растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие всасывание средства и т.п., совместимые с фармацевтическим введением. В композиции также можно вводить дополнительные активные соединения. Фармацевтическую композицию формулируют так, чтобы она была совместима с назначенным маршрутом введения. Примеры маршрутов введения включают парентеральное, например, внутривенное, интрадермальное, подкожное, внутримышечное, внутриартериальное, пероральное (например, ингаляция), трансдермальном (местное), трансмукозальное и ректальное введения. Растворы или суспензии, используемые для парентерального, интрадермального или подкожного применений могут содержать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, фосфатно-солевой буфер, буферизированный Tris солевой раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль, или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулировки тоничности, такие как хлорид натрия или декстроза. Значение pH можно регулировать кислотами или основаниями, такими как соляная кислота или гидроксид натрия. Парентеральный препарат можно помещать в ампулы, одноразовые шприцы или флаконы для нескольких доз, полученные из стекла или пластика.
[0180] Фармацевтические композиции, подходящие для применения в качестве инъекций, включают стерильные водные растворы (при условии водорастворимости) или дисперсии и стерильные порошки для получаемых перед введением препаратов стерильных инъецируемых растворов или дисперсий. Подходящие для внутривенного введения носители включают физиологический раствор, бактериостатическую воду, кремофор EL® (BASF, Parsippany, N.J.) или фосфатно-солевой буфер (PBS). Во всех случаях композиция должна быть стерильной и должна быть жидкостью в такой степени, чтобы существовала хорошая проходимость через иглу. Она должна оставаться стабильной в условиях производства и хранения и быть предохраненной от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Должную текучесть можно поддерживать, например, используя покрытие, такое как лецитин, поддерживая необходимый размер частиц в случае дисперсии и используя поверхностно-активные вещества. Предотвращение действия микроорганизмов можно добиваться различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимеросалом и т.п. Во многих случаях предпочтительно включать в композиции средства придания изотоничности, например, сахара, полиспирты, такие как манит, сорбит или хлорид натрия. Пролонгированного всасывания инъецируемых композиций можно добиваться включением в композиции средств, задерживающих всасывания, например, моностеарата алюминия и желатина.
[0181] Стерильные инъецируемые растворы можно получать, добавляя требуемое количество активного соединения в подходящий растворитель, содержащий при необходимости один или комбинацию ингредиентов, перечисленных выше, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают, добавляя активное соединение в стерильный носитель, который содержит основную диспергирующую среду и другие требуемые ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов способы получения включают вакуумную сушку и лиофилизацию, которыми получают порошок активного ингредиента с любыми дополнительными желаемыми ингредиентами из ранее простерилизованного фильтрованием их раствора.
[0182] Как правило, пероральные композиции содержат инертный разбавитель или съедобный носитель. С целью перорального терапевтического введения активное соединение можно добавлять в эксципиенты и использовать в форме таблетки, пастилки или капсулы, например, желатиновой капсулы. Пероральные композиции также можно получать с использованием жидкого носителя для применения в качестве ополаскивателя для рта. В качестве части композиции можно включать фармацевтически совместимые связывающие средства или вспомогательные материалы. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединений сходного характера: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, примогель или кукурузный крахмал; смазочное средство, такое как стеарат магния или Sterotes; способствующее скольжению средство, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновая вкусо-ароматическая добавка.
[0183] Кроме того, для перорального введения составы по изобретению могут принимать форму, например, таблеток или капсул, получаемых общепринятыми способами с фармацевтически приемлемыми эксципиентами, такими как связывающие средства (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазочные средства (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или крахмалгликолят натрия); или средства для смачивания (например, лаурилсульфат натрия). На таблетки можно наносить покрытия хорошо известными в данной области способами. Композиции по изобретению также можно добавлять в микросферы или микрокапсулы, например, получаемые из полигликолевой кислоты/молочной кислоты (PGLA) (см., патенты США №№ 5814344; 5100669 и 4849222; публикации PCT №№ WO 95/11010 и WO 93/07861). Жидкие препараты для перорального введение могут принимать форму, например, растворов, сиропов, эмульсий или суспензий, или их можно предоставлять в виде сухого продукта для восстановления перед применением водой или другим подходящим носителем. Такие жидкие препараты можно получать общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Также препараты при необходимости могут содержать буферные соли, вкусо-ароматические добавки, красители и подсластители. Препараты для перорального введения можно соответствующим образом формулировать с обеспечением контролируемого высвобождения активного соединения.
[0184] Для введения посредством ингаляции соединения доставляют в форме распыляемого аэрозоля из контейнера или распределителя под давлением, содержащего подходящий пропеллент, например, газ, такой как диоксид углерода, или ингалятора.
[0185] Системное введение также может являться трансмукозальным или трансдермальным. Для трансмукозального или трансдермального введения в составе используют обеспечивающие проникновение вещества, подходящие для барьера, через который необходимо обеспечить проникновение. Такие обеспечивающие проникновение вещества, как правило, известны в данной области и включают, например, для трансмукозального введения, детергенты, соли желчных кислот и производные фузидовой кислоты. Трансмукозальное введение можно проводить посредством использования назальных спреев или суппозиториев. Для трансдермального введения активные соединения формулируют в мази, бальзамы, гели или кремы, как широко известно в данной области. Соединения также можно получать в форме суппозиториев (например, с общепринятыми основами для суппозиториев, такими как масло какао и другие глицериды) или удерживающая клизма для ректальной доставки.
[0186] В соответствии с реализациями активные соединения получают с носителями, которые защищают соединение от быстрого выведения из организма, такими как состав с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких составов очевидны специалистам в данной области. Материалы также можно получать на коммерческой основе. Также в качестве фармацевтически приемлемых носителей можно использовать суспензии липосом (включая липосомы, направляемые к инфицированным клеткам моноклональными антителами к специфичным для клеток антигенам). Их можно получать способами, известными специалистам в данной области, например, как описано в патенте США № 4522811, включенном в настоящий документ в качестве ссылки.
[0187] Для простоты введения и равномерности дозирования предпочтительно формулировать пероральные или парентеральные композиции в стандартные лекарственные формы. Как используют в настоящем документе, стандартная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для индивидуума, подвергаемого лечению; где каждая единица содержит предопределенное количество активного соединения, рассчитанное так, чтобы оказывать желаемое терапевтическое действие, в ассоциации с требуемым фармацевтическим носителем.
[0188] Иммуногенные составы по изобретению можно доставлять парентерально, т.е., посредством внутривенного (в/в), подкожного (п/к), интраперитонеального (и/п), внутримышечного (в/м), субдермального (с/д) или интрадермального (и/д) введения, посредством прямой инъекции, например, посредством болюсной инъекций, непрерывного вливания или генной пушки (например, для введения индивидууму векторной вакцины, такой как голая ДНК или РНК). Составы для инъекций можно предоставлять в стандартной лекарственной форме, например, в ампулах или в контейнерах для нескольких доз с добавлением консерванта. Композициям можно придавать такие формы, как эксципиенты, суспензии, растворы или эмульсии в масляных или водных носителях, и они могут содержать формулирующие средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может находиться в форме порошка для восстановления перед применением подходящим носителем, например, стерильной не содержащей пирогенов водой.
[0189] По настоящему изобретению также предусмотрены различные стратегии вакцинации через слизистые.
ЛЕКАРСТВЕННЫЕ ФОРМЫ
[0190] Токсичность и терапевтическую эффективность таких терапевтических композиций можно определять стандартными фармацевтическими способами в культурах клеток или у экспериментальных животных, например, определяя LD50 (летальную дозу для 50% популяции) и ED50 (терапевтически эффективную дозу у 50% популяции). Отношение доз при токсическом и терапевтическом действии представляет собой терапевтический индекс и его можно выражать в виде отношения LD50/ED50. Предпочтительными являются терапевтические композиции, демонстрирующие высокие терапевтические индексы. Хотя соединения, демонстрирующие токсические побочные эффекты, можно использовать, необходимо принимать меры для разработки системы доставки, которая направляет такие соединения к участку повреждения для минимизации потенциального повреждения неинфицированных клеток и, таким образом, снижения побочных эффектов.
[0191] Данные, получаемые на основе анализов культур клеток и исследований на животных, можно использовать для формулирования диапазона доз для применения у людей. Дозировки таких соединений предпочтительно находятся в пределах диапазона циркулирующих концентраций, который включает ED50 с минимальной или отсутствующей токсичностью. В пределах этого диапазона дозировка может варьировать в зависимости от применяемой лекарственной формы и используемого маршрута введения. Для любого соединения, используемого в способе по изобретению, терапевтически эффективную дозу исходно можно рассчитать на основе анализов в культуре клеток. Дозу можно формулировать в моделях на животных с достижением диапазона циркулирующей плазматической концентрации, который включает IC50 (т.е., концентрацию тестируемого соединения, при которой достигается половина максимального ингибирования симптомов), как определяют в культуре клеток. Такую информацию можно использовать для более точного определения подходящих доз у людей. Уровни в плазме можно определять, например, посредством высокоэффективной жидкостной хроматографии.
[0192] Описываемые композиции, антиген и адъювант, предоставлены в иммуногенно эффективных количествах. Для каждого конкретного антигена оптимальное иммуногенно эффективное количество необходимо определять экспериментально (принимая во внимание конкретные особенности данного пациента и/или тип лечения). Как правило, это количество находится в диапазоне 0,01 мкг-250 мг антиген на кг массы организма. Для определенного иллюстративного адъюванта по настоящему изобретению иммуногенно эффективное количество может находиться в диапазоне 10-250 мкг адъюванта на кг массы организма.
[0193] В определенных вариантах осуществления терапевтически эффективное количество терапевтической композиции (т.е., эффективная доза) может находиться в диапазоне приблизительно от 0,001 мкг/кг до приблизительно 250 г/кг, от 0,01 мкг/кг до 10 г/кг или от 0,1 мкг/кг до 1 г/кг или приблизительно или по меньшей мере: 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009; 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09;0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 125, 150, 175, 200, 225 или 250 грамм или микрограмм на килограмм масса тела пациента, или в любом диапазоне между любыми из чисел, перечисленных в этом абзаце, или в других диапазонах, которые очевидны и понятны специалистам без излишнего экспериментирования. Специалисту в данной области понятно, что на дозировку и временные параметры, необходимые для эффективного лечения индивидуума могут влиять определенные факторы, включая в качестве неограничивающих примеров тяжесть заболевания или нарушения, предыдущие способы лечения, общее состояние здоровья или возраст индивидуума и другие присутствующие заболевания.
[0194] В других вариантах осуществления терапевтически эффективное количество молекулы Globo-H в терапевтической композиции (например, эффективная доза) может находиться в диапазоне приблизительно от 0,001 мкг/кг до приблизительно 250 г/кг, от 0,01 мкг/кг до 10 г/кг или 0,1 мкг/кг до 1 г/кг или приблизительно или по меньшей мере: 0,001, 0,002, 0,003, 0,004, 0,005, 0,006, 0,007, 0,008, 0,009; 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09;0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 125, 150, 175, 200, 225 или 250 грамм или микрограмм на килограмм массы тела пациента, или в любом диапазоне между любыми из чисел, перечисленных в этом абзаце, или в других диапазонах, которые очевидны и понятны специалистам без излишнего экспериментирования. Специалисту в данной области понятно, что на дозировку и временные параметры, необходимые для эффективного лечения индивидуума могут влиять определенные факторы, включая в качестве неограничивающих примеров тяжесть заболевания или нарушения, предыдущие способы лечения, общее состояние здоровья или возраст индивидуума и другие присутствующие заболевания.
[0195] В определенных вариантах осуществления терапевтические композиции, описываемые в настоящем документе, содержат или ассоциированы, по меньшей мере с одним терапевтическим конъюгатом или терапевтическим антителом, в соответствии с чем каждый из по меньшей мере одного терапевтического конъюгата или терапевтического антитела присутствует в однократной дозе в концентрации приблизительно, по меньшей мере или более чем: 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99, где каждое число умножено на 10-9, 10-8, 10-7, 10-6,10-5, 10-4, 10-3, 10-2, 10-1, моль на дозу. Предпочтительно, терапевтический конъюгат присутствует в однократной дозе в концентрации приблизительно от: 1-100, 2- 60, 3-50, 4-40, 5-30, 6-20, 7-15, 8-10, 2-18, 3-16, 4-14, 5-12, 6-10 или 7-8 мкМ или в любом диапазоне между любыми из чисел, перечисленных в этом абзаце.
[0196] В определенных вариантах осуществления терапевтические композиции, описываемые в настоящем документе, содержат или ассоциированы по меньшей мере с одним терапевтическим конъюгатом или терапевтическим антителом, в соответствии с чем каждый из по меньшей мере одного терапевтического конъюгата или терапевтического антитела присутствует в однократной дозе в концентрации приблизительно, по меньшей мере или более чем: 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99, где каждое число умножено на 10-3, 10-2, 10-1 или10 микрограмм. В определенных вариантах осуществления в дозу присутствует приблизительно или по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 200, 250 или более микрограмм одного терапевтического конъюгата или терапевтического антитела.
[0197] В определенных вариантах осуществления терапевтические композиции, описываемые в настоящем документе, вводят в дозе приблизительно, или по меньшей мере, или более чем: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 раза в сутки, неделю или месяц в течение периода приблизительно, или по меньшей мере, или более чем: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 суток, недель, месяцев или лет.
[0198] Эффективная доза и оценка безопасности
[0199] Способами по настоящему изобретению фармацевтические и вакцинные композиции, описываемые в настоящем документе, вводят пациенту в иммуногенно эффективных дозах, предпочтительно с минимальной токсичностью. Как перечислено в разделе, озаглавленном "Определения", "иммуногенно эффективная доза" или "терапевтически эффективная доза" описываемых составов относится к такому количеству антигена и/или адъюванта, которого достаточно для обеспечения эффективного иммунного ответа у подвергаемого лечению индивидуума и, таким образом, достаточно для обеспечения оздоравливающего действия у указанного индивидуума.
НАБОРЫ
[0200] По другому аспекту специалистом в данной области предусмотрены один или более наборов частей, наборов частей для проведения по меньшей мере оного из способов, описанных в настоящем документе, где набор частей, содержит один или более терапевтических конъюгатов, средств против злокачественных опухолей/антипролиферативных средств, адъювантов, цитокинов и/или хемокинов. Терапевтические композиции, содержащие, отдельно или в комбинации, эффективное количество терапевтических композиций, описаны в настоящем документе, в соответствии по меньшей мере с одним из указанных выше способов. Указанные выше средства могут поступать в отдельном контейнере или в различных контейнерах в наборе.
[0201] При желании композиции можно предоставлять в упаковке или раздаточном устройстве, которые могут содержать один или более стандартных лекарственных форм, содержащих активный ингредиент (т.е., антиген и/или содержащий гликосфинголипиды (GSL) адъювант). Например, упаковка может, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или раздаточное устройство могут сопровождаться инструкциями по введению. Также можно получать композиции по изобретению, сформулированные в совместимом фармацевтическом носителе, помещать в подходящий контейнер и маркировать для лечения указанного патологического состояния.
[0202] Наборы по возможности также содержат идентификаторы биологического события или другие соединения, идентифицируемые специалистом после прочтения настоящего описания. Набор также может содержать по меньшей мере одну композицию, содержащую эффективное количество терапевтических композиций, описываемых в настоящем документе. Терапевтические композиции из наборов для осуществления по меньшей мере одного способа по настоящему документу описаны в соответствии со способом, определяемым специалистом в данной области.
[0203] Описание также включает способы лечения пролиферативных заболеваний с использованием терапевтических композиций, описываемых в настоящем документе. В одном из вариантов осуществления способы включают лечение злокачественной опухоли, например, рака молочной железы. Как правило, способы включают предоставление терапевтических композиций, описываемых в настоящем документе, нуждающемуся в этом пациенту в количестве, эффективном для лечения пролиферативного нарушения.
[0204] В определенных вариантах осуществления терапевтические композиции по изобретению вводят нуждающемуся в этом индивидууму (например, индивидууму со злокачественной опухолью, такой как рак молочной железы) способом, который в среднем увеличивает продолжительность существования без прогрессирования или общую длительность существования по сравнению с контролем плацебо, например, плацебо в виде фосфатно-солевого буфера, на период приблизительно или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 суток, недель, месяцев или лет.
[0205] В определенных вариантах осуществления терапевтические композиции вводит подкожно на неделе 0-2, 6, 14 и 26 в отсутствие неприемлемой токсичности или прогрессирования заболевания.
[0206] В определенных вариантах осуществления терапевтические композиции по изобретению вводят нуждающемуся в этом индивидууму (например, индивидууму со злокачественной опухолью, такой как рак молочной железы) способом, который в среднем уменьшает объем опухоли у пациента относительно контроля плацебо, например, плацебо в виде фосфатно-солевого буфера, на период приблизительно или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 74 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 или более процентов в течение периода 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 суток, недель, месяцев или лет.
[0207] В определенных вариантах осуществления можно точно определять объемы опухолей по меньшей мере в одном измерении (необходимо зарегистрировать наибольший диаметр в плоскости измерения) с минимальным размером 10 мм посредством сканирования КТ (рекомендованная толщина среза при сканировании КТ составляет от 2,5 мм до 5 мм).
СПОСОБЫ СИНТЕЗА КОМПОЗИЦИЙ ПО ИЗОБРЕТЕНИЮ
[0208] Часть гексасахарида Globo-H терапевтических композиций по изобретению химически синтезировали в виде аллилгликозида, а затем подготавливали для конъюгации с KLH.
[0209] В одном из иллюстративных вариантов осуществления химический синтез Globo-H включает следующие основные этапы:

[0210] KLH обрабатывали 2-иминотиоланом в водном буфере. Затем тиолированный KLH отделяли от непрореагировавшего 2-иминотиолана посредством колонки для эксклюзионной хроматографии Sephadex G-15. Тиолированный KLH содержали в атмосфере инертного газа (азота или аргона) и использовали непосредственно для конъюгации с Globo-H-MMCCH.
ПРИМЕРЫ
[0211] Пример 1: Получение гликоконъюгата по изобретению (Globo-H-KLH)
[0212] Аллилгликозид Globo-H (коммерчески доступный) преобразовывали в альдегид посредством озонолиза. Альдегид Globo-H подвергали реакции с линкером MMCCH и NaCNBH3 с получением Globo-H-MMCCH. Смесь очищали посредством колонки с получением Globo-H-MMCCH. Во фракциях подтверждали наличие Globo-H-MMCCH посредством высокоэффективной жидкостной хроматографии (ВЭЖХ), а затем объединяли вместе. KLH растворяли в буфере для тиолирования и в реакционную смесь порционно добавляли 2-иминотиолан. Реакционную смесь инкубировали до завершения реакции, а затем KLH-SH очищали посредством колонки. Globo-H-MMCCH и KLH-SH комбинировали. Реакционную смесь перемешивали до завершения реакции. Затем гликоконъюгат Globo-H-KLH очищали с получением конечного продукта.
[0213] Пример 2: Анализ массового отношения Globo-H и KLH в гликоконъюгате
[0214] Массовое отношение Globo-H и KLH в получаемом гликоконъюгате подтверждали посредством высокоэффективной анионообменной хроматографии с импульсным амперометрическим детектированием (HPAEC-PAD). Результат представлен в таблице 3.
[0215] Таблица 3: Массовое отношение Globo-H и KLH в гликоконъюгате
[0216] Пример 3: Анализ эпитопного отношения Globo-H к KLH в гликоконъюгате
[0217] Молекулярная масса дидекамера KLH (природной агрегированной формы) составляет приблизительно 7,5 МДа-8,6 МДа, как описано в литературе, такой как Micron 30 (1999) 597-623. Природный KLH подтверждали эксклюзионной хроматографией и спектрометрией углового рассеяния лазерного излучения (MALS) с получением молекулярной массы приблизительно 8,6 МДа (см. фигуру 3).
[0218] Распределение масс KLH и гликоконъюгата Globo-H-KLH (OBI-822, № партии 14001) определяли и получали посредством эксклюзионной хроматографии с использованием спектрометр многоуглового рассеяния лазерного излучения (SEC-MALS). Молекулярную массу рассчитывали на основе содержания белка (ε=1,39) (см. фигуру 4). На фигуре 4A можно наблюдать дидекамер (n=20) и мультидекамер (n>20) KLH. На фигуре 4B продемонстрировано, что площадь пика дидекамера составляла 74,3%, а мультидекамера - 25,7%. На фигуре 4C, можно наблюдать от мономера до гексамера (n=1-6) и мультимер (n>7-20) гликоконъюгата Globo-H-KLH (OBI-822). На фигуре 4D представлено, что основным компонентом являлась площадь пика от мономера до гексамера (n=1-6) (>97%), а мультимер (n>7-20) составлял только небольшое количество (2,2%). Итоги анализа распределения масс KLH и олигомера OBI-822 приведены в таблице 4.
[0219] Таблица 4: Итоги анализа распределения масс KLH и олигомера OBI-822
*Начало/Конец MW: Диапазон молекулярных масс (MW) в кДа
**Для KLH, расчетная масса мономера составляет приблизительно 350-400 кДа
***Для OBI-822, расчетная масса мономера составляет приблизительно 400-500 кДа
[0220] Результаты продемонстрировали, что гликоконъюгат по изобретению демонстрировал сниженную молекулярную массу по сравнению с природными агрегированными дидекамерами KLH. Молекулярное отношение рассчитывали как в таблице 5.
[0221] Таблица 5: Расчет молекулярного отношения Globo-H и KLH
* Указанное выше молекулярное отношение рассчитывают на основе приведенной ниже формулы:

** Молекулярная масса KLH зависит от форм димера, тримера, тетрамера, пентамера, гексамера-дидекамера
[0222] Учитывая указанное выше, в определенных вариантах осуществления гликоконъюгатов по изобретению мономерные единицы KLH после конъюгации с Globo-H формируют мономеры, димеры, тримеры, тетрамеры, пентамеры и/или гексамеры.
[0223] Пример 4: Получение вакцинных композиций и иммунизация крыс
[0224] Различные образцы гликоконъюгатов (Globo-H-KLH), как получено в примере 1, хранили при 4°C и смешивали с сапониновым адъювантом в вытяжном шкафу с ламинарным потоком. Полученные вакцинные композиции помещали на лед и транспортировали в виварий для последующей иммунизации.
[0225] Иммунизировали три группы крыс Lewis различными вакцинными композициями, как представлено в таблице 6.
[0226] Таблица 6: Группы иммунизированных крыс
*Globo-H:KLH=0,17:1 (масс./масс.)
[0227] Крыс иммунизировали на сутки 0, 7, 14 и 21. Мононуклеарные клетки периферической крови (PBMC) и плазму собирали на сутки 0, 3, 10, 17, 24 и 31. Селезенки, лимфоузлы и перитонеальные смывы собирали на сутки 31.
[0228] Пример 5: Анализы на индукцию гуморального и клеточного иммунного ответа у крыс
[0229] Пример 5.1: Анализ субпопуляций иммунных эффекторных клеток посредством проточной цитометрии
[0230] У животных выделяли мононуклеарные клетки периферической крови (PBMC), а затем посредством проточной цитометрии идентифицировали различные субпопуляции иммунных эффекторных клеток с использованием специфичных антител к различным клеточным маркерам. PBMC, выделенные у иммунизированных крыс на сутки 0, 3, 10, 17, 24 и 31, окрашивали различными конъюгированными с флуоресцентным соединением (FITC) антителами и помещали на лед на период 30 минут. После инкубации, клетки отмывали отмывочным буфером (1% бычий сывороточный альбумин (Sigma) и 0,1% NaN3 (Sigma) в фосфатно-солевом буфере (UniRegion Biotech) и центрифугировали при 350 g в течение 5 минут. Клетки ресуспендировали в отмывочном буфере для определение флуоресценции посредством FACS Canto (BD Bioscience). Данные анализировали посредством программного обеспечения BD FACSDiva (BD Bioscience). Результаты демонстрируют, что у иммунизированных гликоконъюгатом по настоящему изобретению крыс по сравнению с контрольной группой, которой вводили PBS, B-клетки и T-клетки значимо увеличивались в количестве. Конкретно, популяцию B-клеток впервые выявляли на сутки 3, а последующие клетки CD3T, CD4T и CD8T выявляли на сутки 24. См. фигуры от фигуры 5A до фигуры 5D.
[0231] Пример 5.2: Тестирование специфичных к Globo-H антител посредством ELISA
[0232] Продукцию специфичных к Globo-H антител в плазме иммунизированных крыс определяли посредством анализа ELISA. Результаты продемонстрировали, что титры специфичных к Globo-H IgG начинали подниматься на 10 сутки и достигали пика через 17 суток после иммунизации. Подобные схемы наблюдали для продукции специфичных к Globo-H антител IgM. См. фигуры от фигуры 6A до фигура 6B. Ответа специфичными антителами к Globo-H IgG и IgM у крыс, обработанных только PBS, не наблюдали.
[0233] В итоге у иммунизированных крыс продукцию B-клеток выявляли на сутки 3 с последующей продукцией антител IgM и IgG к Globo-H, которую выявляли на 10 и последующими клетками CD3T, CD4T и CD8T, которые выявляли на сутки 24. Гликоконъюгат (Globo-H-KLH) по изобретению эффективно индуцировал гуморальный и клеточный ответ.
[0234] Пример 6: Иммунизация мышей и тестирование антител посредством ELISA
[0235] Различные образцы гликоконъюгатов (Globo-H-KLH) хранили при 4°C и смешивали с сапониновым адъювантом в вытяжном шкафу с ламинарным потоком. Полученные вакцинные композиции помещали на лед и транспортировали в виварий для последующей иммунизации.
[0236] Мышам Balb/c в возрасте приблизительно восемь недель посредством подкожной инъекции раз в неделю в течение четырех недель (сутки 0, 7, 14 и 21) вводили гликоконъюгат Globo-H-KLH с различными отношениями углевода и белка (Globo-H:KLH). Образцы крови собирали из ретроорбитальной или лицевой вены без антикоагулянта до иммунизации или на сутки 0 и через трое суток после каждой вакцинации (сутки 10, 17 и 24). Затем образцы центрифугировали для разделения сыворотки и эритроцитов. Сыворотку собирали и хранили при -20°C и позже анализировали посредством ELISA. Для статистического анализа использовали t-критерий Манна-Уитни.
[0237] Как представлено на фигуре 7, продемонстрировано, что гликоконъюгат (Globo-H-KLH) в комбинации с сапониновым адъювантом по изобретению в модели на животных по сравнению с контрольной группой, которой вводили PBS, значимо индуцировал ответ специфичными к Globo-H антителами IgM. Конкретно, гликоконъюгат с массовым отношением 0,17: 1 (Globo-H:KLH) индуцировал лучший титр антител, чем гликоконъюгат с массовым отношением 0,07:1 (Globo-H:KLH).
[0238] В итоге гликоконъюгат Globo-H-KLH (OBI-822) в комбинации с надлежащим адъювантом по изобретению в модели на животных продемонстрировал индукцию неожиданно сильного гуморального и клеточного иммунного ответа, в частности, рост B-клеток и T-клеток, включая ответы CTL и IgM и IgG, которые являются важными при иммунотерапии злокачественных опухолей.
[0239] Пример 7: Исследование иммуногенности Globo-H-KLH с различными адъювантами у мышей
[0240] Исследовали способность композиции Globo-H по изобретению при спаривании с различными адъювантами (OBI-821/OBI-834) вызывать иммунный ответ у мышей. Жизнеспособные клетки карциномы легких Льюиса (LL/2, ATCC CRL-1642) (предоставленные Eurofins Panlabs Taiwan Ltd., 5,0 × 106 в 0,1 мл), сингенные мышам C57BL/6, подкожно инъецировали в брюшную область в направление бока экспериментальных мышей на сутки 16. Шесть групп самок мышей C57BL/6 в возрасте 6-8 недель подкожно иммунизировали Globo-H-KLH (OBI-822) и различными адъювантами. Уровни дозирования OBI-822 являлись равными по количеству в каждой группе. Каждая инъекция содержала дозы, равные 2,0 мкг вакцины (OBI-822) и 20 мкг адъювантов (OBI-821/OBI-834), вводимых подкожно в 0,2 мл/мышь (в правую и левую стороны брюшных областей, 0,1 мл/область). Иммунизацию проводили на сутки 0, 5, 11, 19, 29, 34 и 39, а сыворотку собирали на сутки 0 (перед инъекцией) и сутки 42 для сравнительного анализа посредством ELISA. Серологический ответ определяли посредством ELISA с определением титра антител IgM и IgG к Globo-H.
[0241] Как представлено на фигуре 8, у мышей, обработанных фосфатно-солевым буфером (PBS), ответа не наблюдали. В отличие от этого, у мышей, обработанных OBI-822+OBI821 и OBI-822+OBI-834 наблюдали ответ со значительными титрами IgM к Globo-H (фигура 8A). Однако средние титры IgG были ниже, чем IgG (фигура 8B). Это означало, что адъюванты OBI-821 и OBI-834 могли индуцировать иммуногенность Globo-H-KLH (OBI-822). Показано, что вакцинация Globo-H-KLH и адъювантом у самок мышей C57BL/6 вызывала ответ IgG и IgM к Globo-H.
[0242] Как представлено на фигуре 9, у шести групп мышей C57BL/6 проверяли массу тела и размер опухоли на сутки 16, 19, 23, 26, 30, 34, 37, 40 и 42. Изображения, где приведена опухоль с целым телом, получены после умерщвления на сутки 42. Как представлено на фигуре 10, объем опухоли (мм3) расчитывали по формуле для сплющенного эллипсоида: длина (мм) × [ширина (мм)]2 × 0,5. Рост опухоли у обработанных соединением животных рассчитывали как T/C (обработка/контроль) × 100%; для определения значимого ингибирования роста опухоли, демонстрирующего противоопухолевую активность, использовали односторонний ANOVA с последующим критерием Даннетта или непарным критерием Стьюдента. Уровень ингибирования опухоли OBI-822+OBI-821 на сутки 42 составлял приблизительно 35%, а OBI-822+OBI-834 приблизительно составлял 22%. По-видимому, оба адъюванта, OBI-821 и OBI-834, могли ингибировать рост опухоли с Globo-H-KLH (OBI-822).
[0243] Пример 8: Анализ LC-MS/MS участков конъюгации Globo-H (лизина) на KLH
[0244] Участки конъюгации Globo-H в четырех образцах KLH идентифицировали с использованием расщепления несколькими ферментами и LC-MS/MS. Четыре образца конъюгированного с Globo-H KLH сначала расщепляли четырьмя различными ферментами, а затем анализировали посредством LC-MS/MS и поиска в базе данных Mascot. Идентифицировали два типа производных: производное Globo-H (Globo-H+MMCCH) и производное MMCCH (только MMCCH). Производное Globo-H и его формы с потерей нейтральных частиц учитывали для идентификации участков конъюгации Globo-H. Форму MMCCH и ее дезаминированную форму учитывали для идентификации участков конъюгации MMCCH. Учитывали только пептиды с высоким качеством спектров MS/MS и высоким индексом Mascot. При анализе конъюгации Globo-H в двух повторениях анализа LC-MS/MS OBI-822-13001-DP (образец 1) наблюдали 31 и 28 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13002-DP (образец 2) наблюдали 19 и 21 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13003-DP (образец 3) наблюдали 10 и 11 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13004-DS (образец 4) наблюдали 18 и 19 конъюгированных остатков лизина. При анализе конъюгации MMCCH в двух повторениях анализа LC-MS/MS OBI-822-13001-DP (образец 1) наблюдали 155 и 141 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13002-DP (образец 2) наблюдали 143 и 137 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13003-DP (образец 3) наблюдали 147 и 143 конъюгированных остатков лизина; в двух повторениях анализа LC-MS/MS OBI-822-13004-DS (образец 4) наблюдали 140 и 136 конъюгированных остатков лизина.
[0245] Пример 8 Материалы и способы:
[0246] Ниже перечислены сокращения:
K=Лизин; LC-MS/MS=жидкостная хроматография-тандемная масс-спектрометрия; DTT=Дитиолтреитол; IAM=йодацетамид; ACN=ацетонитрил; FA=муравьиная кислота; Glu-C=эндопротеиназа Glu-C; ABC=бикарбонат аммония; RT=комнатная температура; MW=молекулярная масса.
[0247] Четыре образца KLH, образец 1-4, сначала обрабатывали с заменой буфера на 50 мМ буферный раствор бикарбоната аммония посредством фильтров Amicon Ultra Centrifugal Filters с границей пропускания 100 кДа и денатурировали 6 M мочевиной. Затем образцы восстанавливали 10 мМ DTT при 37°C в течение 1 часа, алкилировали с использованием 50 мМ IAM в течение 30 минут в темноте при комнатной температуре и гасили 50 мМ DTT при комнатной температуре в течение 5 минут. Полученные белки разбавляли до концентрации мочевина 1 M и подвергали расщеплению в растворе различными ферментами, как описано в следующем разделе
[0248] Расщепление в растворе различными ферментами проводили в следующих условиях расщепления: (1) расщепление трипсином при 37°C в течение 24 часов (белок:фермент=40:1) (2) расщепление Glu-C при 37°C в течение 24 часов (белок:фермент=25:1); (3) расщепление химотрипсином при комнатной температуре в течение 24 часов (белок:фермент=25:1); (4) расщепление термолизином при 37°C в течение 24 часов (белок:фермент=25:1).
[0249] Реакции расщепления останавливали добавлением муравьиной кислоты и все четыре расщепленных образца подвергали анализу LC-MS/MS. Образцы анализировали на масс-спектрометре Q Exactive (Thermo Scientific), соединенным с системой RSLC Ultimate 3000 (Dionex). Разделение при LC проводили с использованием колонки C 18 (Acclaim PepMap RSLC, 75 мкм x 150 мм, 2 мкм, 100 Å) с градиентом, представленным в таблице 7.
[0250] Таблица 7: Градиент для разделения при LC
*Подвижная фаза A: 5% ацетонитрил/0,1% муравьиная кислота
**Подвижная фаза B: 95% ацетонитрил/0,1% муравьиная кислота
[0251] CID в источнике устанавливали на 45 эВ. Полное MS сканирование проводили в диапазоне массы/заряда 350-2000, и десять ионов с наибольшей интенсивностью после MS сканирования подвергали фрагментации с получением спектров MS/MS. Необработанные данные обрабатывали с получением списка пиков посредством Proteome Discoverer 1.4 для поиска в базе данных Mascot.
[0252] Поиск в базе данных проводили с использованием Mascot версии 2.4.1 и Thermo Proteome Discoverer версии 1.4 по последовательности KLH1 (SEQ ID NO. 1) и последовательности KLH2 (SEQ ID NO. 2). Используемые параметры являлись следующими:
Фермент: трипсин, Glu-C, химотрипсин и термолизин в соответствии со способом расщепления; фиксированная модификация: карбамидометил (C);
Вариабельные модификации для производных MMCCH (только MMCCH): дезаминированные (NQ), окисление (M), dK_MMCCH-1 (K), dK_MMCCH-2 (K);
Вариабельные модификации для производных Globo-H (Globo-H+MMCCH): дезаминированные (NQ), окисление (M), Globo_H_MMCCH (K), dK_MMCCH_NL997 (K), dK_MMCCH_NL835 (K), dK_MMCCH_NL673 (K), dK_MMCCH_NL511 (K), dK_MMCCH_NL308 (K);
Допуск по массе пептида: ± 10 м.д.; допуск по массе фрагмента: ± 0,05 Да; максимум пропущенных расщеплений: 5; тип устройства: ESI-TRAP; граница отсечения ионов: 13.
[0253] "dK_MMCCH-1" в параметрах поиска означает конъюгированный с MMCCH лизин с добавлением MW 352,1569 Да.
[0254] "dK_MMCCH-2" в параметрах поиска означает дезаминированную форму конъюгированного с MMCCH лизина с добавлением MW 338,1300 Да.
[0255] "Globo_H_MMCCH (K)" в параметрах поиска означает конъюгированный с Globo-H лизин с добавлением MW 1393,5317 Да.
[0256] "dK_MMCCH_NL997" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированного с Globo-H лизина с добавлением MW 396,1831 Да.
[0257] "dK_MMCCH_NL835" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированного с Globo-H лизина с добавлением MW 558,2360 Да.
[0258] "dK_MMCCH_NL673" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированного с Globo-H лизина с добавлением MW 720,2888 Да.
[0259] "dK_MMCCH_NL511" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированного с Globo-H лизина с добавлением MW 882,3416 Да.
[0260] "dK_MMCCH_NL308" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированного с Globo-H лизина с добавлением MW 1085,4210 Да.
[0261] "Добавление MW" означает добавление молекулярной массы по сравнению с интактным остатком лизина.
[0262] Результаты примера 8:
[0263] Способы на основе LC-MS/MS являются важным инструментом для идентификации белков и характеристики модификаций аминокислот. Посредством оценки ионов фрагментов, обеспечиваемой спектрами MS/MS, можно получать подробную информацию о пептидных последовательностях и участках модификации. Mascot представляет собой систему поиска, и ее основанный на вероятностях алгоритм оценки хорошо зарекомендован. Оценка Mascot принята в настоящем исследовании как эталон надежности для секвенирования белка и идентификации участков конъюгации Globo-H или MMCCH. Для интенсивного анализа распределения участков конъюгации Globo-H или MMCCH в образцах 1-4, эти образцы расщепляли несколькими ферментами с последующим анализом LC-MS/MS.
[0264] Ожидаемая химическая структура производного Globo-H (Globo-H+MMCCH) представлена на фигуре 11A и в результатах можно наблюдать соответствующее добавление MW 1393,53 Да в содержащих лизин пептидах. Кроме этого, у лабильных полисахаридов существует тенденция к уменьшению вследствие потери нейтральных частиц при ионизации распылением в электрическом поле в анализе LC-MS. Таким образом, у гликоконъюгированных пептидов также можно наблюдать добавление молекулярной массы 396,18 Да, 558,24 Да, 720,29 Да, 882,34 Да и 1085,42 Да, являющееся результатом потери нейтральных частиц, как представлено на фигуре 11B. Все дериватизированные формы рассматривали как идентификацию участков конъюгации Globo-H.
[0265] Кроме того, в этих конъюгированных с Globo-H образцах KLH также наблюдали производное MMCCH (MMCCH отдельно). Ожидаемые химические структуры производного MMCCH и его дезаминированной формы представлены на фигуре 12A и фигуре 12B, а соответствующее добавление MW 352,16 Да и 338,13 Да, соответственно, в содержащих лизин пептидах можно наблюдать в результатах. Обе дериватизированные формы считали идентификацией участков конъюгации MMCCH. Преобразование из производного Globo-H в MMCCH не очевидно, но полагают, что оно происходит при обработке образца.
[0266] В качестве критериев идентификации белка и интерпретации спектров использовали точность определения массы ± 10 м.д. для иона-предшественника и ± 0,05 Да для иона фрагмента. Производное Globo-H, а также его формы с потерей нейтральных частиц выбраны в качестве вариабельной модификации для идентификации участков конъюгации Globo-H, и производное MMCCH, а также его дезаминированная форма выбраны в качестве вариабельной модификации для идентификации участков конъюгации MMCCH. Поиск в базе данных проводили по последовательности KLH1 (SEQ ID NO. 1) и KLH2 (SEQ ID NO. 2). В отчете перечислены только пептиды с высоким качеством спектром MS/MS (оценка ионов ≥ 13, p < 0,05).
[0267] Для демонстрации воспроизводимости результатов анализ LC-MS/MS проводили дважды с последующим отдельным поиском в базе данных Mascot для идентификации участков конъюгации Globo-H и идентификации участков конъюгации MMCCH, как обобщено на фигуре 13A и фигуре 13B.
[0268] В анализе участков конъюгации Globo-H для образца 1 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 31 и 28 остатков лизина; для образца 2 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 19 и 21 остатков лизина; для образца 3 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 10 и 11 остатков лизина; для образца 4 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 18 и 19 остатков лизина. Данные идентификации приведены на фигурах 14-21. В анализе конъюгации MMCCH для образца 1 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 155 и 141 остатков лизина; для образца 2 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 143 и 137 остатков лизина; для образца 3 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 147 и 143 остатков лизина; для образца 4 в 1 LC-MS/MS и 2 LC-MS/MS соответственно выявлено 140 и 136 остатков лизина. Данные идентификации приведены на фигурах 22-29.
[0269] Участки конъюгации Globo-H экспериментов с несколькими ферментами обобщены на фигуре 30 и участки конъюгации MMCCH обобщены на фигуре 31. Общие результаты анализа участков конъюгации для конъюгированных с Globo-H образцов обобщены на фигуре 32.
[0270] Выводы примера 8:
[0271] Масс-спектрометрические сигналы конъюгированных с производными Globo-H пептидов являлись более слабыми, чем масс-спектрометрические сигналы конъюгированных с MMCCH пептидов вследствие нескольких форм с потерей нейтральных частиц и меньшей эффективностью ионизации полисахарида, что делает прямую идентификацию конъюгации Globo-H более трудной. Это объясняет большее количество идентифицированных пептидов в анализе конъюгации MMCCH. Таким образом результаты анализа MMCCH можно использовать для представления конъюгации Globo-H.
[0272] Анализ участков конъюгации позволяет предполагать, что из общего количества 306 остатков лизина в KLH1/KLH2 для образцов 1-4 идентифицировано 155, 143, 147 и 140 участков конъюгации лизина, соответственно. В повторном анализе для образцов 1-4 идентифицировано 141, 137, 143 и 136 участков конъюгации, соответственно.
[0273] Пример 9: Анализ LC-MS/MS участков конъюгации Globo-H (гистидин, аспарагин, пролин, глутамин и аргинин) в KLH
[0274] Исследовали два типа производных по пяти остаткам, H, N, P, Q, R: GMd (Globo-H+линкер MMCCH+производное лизина) и Md (линкер MMCCH+производное лизина).
[0275] Анализ модификаций по HNPQR (GMd и Md) выявил 6 и 13 конъюгированных участков HNPQR в KLH1 и KLH2, соответственно, для OBI-822-13001-DP (образец 1); 11 и 10 конъюгированных участков HNPQR в KLH1 и KLH2, соответственно, для OBI-822-13002-DP (образец 2); 13 и 9 конъюгированных участков HNPQR в KLH1 и KLH2, соответственно, для OBI-822-13003-DP (образец 3); и 8 и 10 конъюгированных участков HNPQR в KLH1 и KLH2, соответственно, для OBI-822-13004-DS (образец 4).
[0276] Пример 9 Материалы и способы:
[0277] Ниже перечислены сокращения:
K=лизин; H=гистидин; N=аспарагин; P=пролин; Q=глутамин; R=аргинин; LC-MS/MS=жидкостная хроматография-тандемная масс-спектрометрия; MW=молекулярная масса.
[0278] Поиск в базе данных проводили с использованием Mascot версии 2.4.1 по последовательности KLH1 (SEQ ID NO. 1) и последовательности KLH2 (SEQ ID NO. 2). Используемые параметры являлись следующими:
Фермент: трипсин, Glu-C, химотрипсин и термолизин в соответствии со способом расщепления;
Фиксированная модификация: Карбамидометил (C);
Вариабельная модификации: окисление(M), дезаминирование (NQ);
1. OBI822_GMd (HKNPQR), GMd_NL997 (HKNPQR);
2. OBI822_Md (HKNPQR), Md_дезаминированный (HKNPQR);
Допуск по массе пептида: ± 10 м.д.; допуск по массе фрагмента: ± 0,05 Да; максимум пропущенных расщеплений: 5; тип устройства: ESI-TRAP; граница отсечения ионов: 13.
[0279] "OBI822_GMd" в параметрах поиска означает конъюгированные с GMd остатки (HKNPQR) с добавлением MW 1393,5317 Да.
[0280] "GMd_NL997" в параметрах поиска означает форму с потерей нейтральных частиц конъюгированных с GMd остатков (HKNPQR) с добавлением MW 396,1831 Да.
[0281] "OBI822_Md" в параметрах поиска означает конъюгированные с Md остатки (HKNPQR) с добавлением MW 352,1569 Да.
[0282] "Md_дезаминированный" в параметрах поиска означает дезаминированную форму конъюгированных с Md остатков (HKNPQR) с добавлением MW 338,1300 Да.
[0283] Результаты примера 9:
[0284] Способы на основе LC-MS/MS являются важным инструментом для идентификации белков и характеристики модификаций аминокислот. Посредством оценки ионов фрагментов, обеспечиваемой спектрами MS/MS, можно получать подробную информацию о пептидных последовательностях и участках модификации. В настоящее время Mascot является наиболее популярным системой поиска с хорошо зарекомендованным алгоритмом поиска на основе вероятностей. Для идентификации различных модификаций по лизину (K) и другим конкретным остаткам (HNPQR) в образцах 1-4 все результаты поиска подвергали последующей ручной проверке для отбора только пептидов с высоким качеством спектров MS/MS.
[0285] При поиске в MASCOT модификаций GMd (Globo-H+линкер MMCCH+производное лизина) и Md (линкер MMCCH+производное лизина) по остаткам HNPQR, идентифицированы ложные пептиды. Если определенный участок модификации располагался близко к остатку лизина, вероятно, что действительным участком модификации являлся лизин. Эти пептиды исключали из списков идентификации. Если поблизости нет остатка лизина, модификацию по HNPQR можно подтвердить. Как представлено на фигуре 38, анализ участков модификации GMd выявил для образцов 1-4, соответственно, 1, 2, 2 и 3 конъюгированных участков HNPQR в KLH1 и, соответственно, для образцов 1-4 4, 4, 2 и 3 конъюгированных участков HNPQR в KLH2. Анализ участков модификации Md выявил для образцов 1-4, соответственно, 5, 9, 11 и 5 конъюгированных участков HNPQR в KLH1 и, соответственно, для образцов 1-4 9, 6, 7 и 7 конъюгированных участков HNPQR в KLH2.
[0286] Выводы примера 9:
[0287] В этих четырех образцах анализ модификаций GMd и Md по конкретным остаткам (HNPQR) позволяет предполагать, что для образцов 1-4, соответственно, существует 6, 11, 13 и 8 конъюгированных участков HNPQR в KLH1 и, соответственно, для образцов 1-4 13, 10, 9 и 10 конъюгированных участков HNPQR в KLH2.
[0288] Если не определено иначе, все технические и научные термины и любые сокращения, используемые в настоящем документе, имеют те же значения, которые обычно понимает специалист в области настоящего изобретения. Хотя в практическом осуществлении настоящего изобретения можно использовать любые композиции, способы, наборы и средства передачи информации, сходные или эквивалентные описываемым в настоящем документе, в настоящем документе описаны предпочтительные композиции, способы, наборы и средства передачи информации.
[0289] Все цитируемые в настоящем документе ссылки включены в настоящий документ в качестве ссылки в полном объеме допустимом законами. Описание их библиографии предназначено исключительно для обобщения заключений, сделанных их авторами. Не сделано никаких допущений, что любая из ссылок (или часть любой из ссылок) является соответствующим предшествующим уровнем техники. Заявители сохраняют за собой право оспорить точность и уместность любой из цитируемых ссылок.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> OBI PHARMA, INC.
<120> КОМПОЗИЦИИ ИММУНОГЕННЫХ/ТЕРАПЕВТИЧЕСКИХ ГЛИКОКОНЪЮГАТОВ И ИХ ПРИМЕНЕНИЯ
<130> G3004-00401
<140> TBD
<141> 2015-09-15
<150> US 62/050,567
<151> 2014-09-14
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 3125
<212> Белок
<213> Megathura crenulata
<400> 1
Met Thr Pro Glu Glu Leu Lys Thr Tyr Leu Asp Glu Arg Ser Ser Arg
1 5 10 15
Ala Arg Ala Phe Ala Ser Phe Arg Leu Lys Gly Phe Gly Gly Ser Ala
20 25 30
Asn Val Phe Val Tyr Val Cys Ile Pro Asp Asp Asn Asp Arg Asn Asp
35 40 45
Asp His Cys Glu Lys Ala Gly Asp Phe Phe Val Leu Gly Gly Pro Ser
50 55 60
Glu Met Lys Trp Gln Phe Tyr Arg Pro Tyr Leu Phe Asp Leu Ser Asp
65 70 75 80
Thr Val His Lys Met Gly Met Lys Leu Asp Gly His Tyr Thr Val Lys
85 90 95
Ala Glu Leu Phe Ser Val Asn Gly Thr Ala Leu Pro Asp Asp Leu Leu
100 105 110
Pro His Pro Val Val Val His His Pro Glu Lys Gly Phe Thr Asp Pro
115 120 125
Pro Val Lys His His Gln Ser Ala Asn Leu Leu Val Arg Lys Asn Ile
130 135 140
Asn Asp Leu Thr Arg Glu Glu Val Leu Asn Leu Arg Glu Ala Phe His
145 150 155 160
Lys Phe Gln Glu Asp Arg Ser Val Asp Gly Tyr Gln Ala Thr Ala Glu
165 170 175
Tyr His Gly Leu Pro Ala Arg Cys Pro Arg Pro Asp Ala Lys Asp Arg
180 185 190
Tyr Ala Cys Cys Val His Gly Met Pro Ile Phe Pro His Trp His Arg
195 200 205
Leu Phe Val Thr Gln Val Glu Asp Ala Leu Val Gly Arg Gly Ala Thr
210 215 220
Ile Gly Ile Pro Tyr Trp Gly Leu Pro Tyr Trp Asp Trp Thr Glu Pro
225 230 235 240
Met Thr His Ile Pro Gly Leu Ala Gly Asn Lys Thr Tyr Val Asp Ser
245 250 255
His Gly Ala Ser His Thr Asn Pro Phe His Ser Ser Val Ile Ala Phe
260 265 270
Glu Glu Asn Ala Pro His Thr Lys Arg Gln Ile Asp Gln Arg Leu Phe
275 280 285
Lys Pro Ala Thr Phe Gly His His Thr Asp Leu Phe Asn Gln Ile Leu
290 295 300
Tyr Ala Phe Glu Gln Glu Asp Tyr Cys Asp Phe Glu Val Gln Phe Glu
305 310 315 320
Ile Thr His Asn Thr Ile His Ala Trp Thr Gly Gly Ser Glu His Phe
325 330 335
Ser Met Ser Ser Leu His Tyr Thr Ala Phe Asp Pro Leu Phe Tyr Phe
340 345 350
His His Ser Asn Val Asp Arg Leu Trp Ala Val Trp Gln Ala Leu Gln
355 360 365
Met Arg Arg His Lys Pro Tyr Arg Ala His Cys Ala Ile Ser Leu Glu
370 375 380
His Met His Leu Lys Pro Phe Ala Phe Ser Ser Pro Leu Asn Asn Asn
385 390 395 400
Glu Lys Thr His Ala Asn Ala Met Pro Asn Lys Ile Tyr Asp Tyr Glu
405 410 415
Asn Val Leu His Tyr Thr Tyr Glu Asp Leu Thr Phe Gly Gly Ile Ser
420 425 430
Leu Glu Asn Ile Glu Lys Met Ile His Glu Asn Gln Gln Glu Asp Arg
435 440 445
Ile Tyr Ala Gly Phe Leu Leu Ala Gly Ile Arg Thr Ser Ala Asn Val
450 455 460
Asp Ile Phe Ile Lys Thr Thr Asp Ser Val Gln His Lys Ala Gly Thr
465 470 475 480
Phe Ala Val Leu Gly Gly Ser Lys Glu Met Lys Trp Gly Phe Asp Arg
485 490 495
Val Phe Lys Phe Asp Ile Thr His Val Leu Lys Asp Leu Asp Leu Thr
500 505 510
Ala Asp Gly Asp Phe Glu Val Thr Val Asp Ile Thr Glu Val Asp Gly
515 520 525
Thr Lys Leu Ala Ser Ser Leu Ile Pro His Ala Ser Val Ile Arg Glu
530 535 540
His Ala Arg Gly Lys Leu Asn Arg Val Lys Phe Asp Lys Val Pro Arg
545 550 555 560
Ser Arg Leu Ile Arg Lys Asn Val Asp Arg Leu Ser Pro Glu Glu Met
565 570 575
Asn Glu Leu Arg Lys Ala Leu Ala Leu Leu Lys Glu Asp Lys Ser Ala
580 585 590
Gly Gly Phe Gln Gln Leu Gly Ala Phe His Gly Glu Pro Lys Trp Cys
595 600 605
Pro Ser Pro Glu Ala Ser Lys Lys Phe Ala Cys Cys Val His Gly Met
610 615 620
Ser Val Phe Pro His Trp His Arg Leu Leu Thr Val Gln Ser Glu Asn
625 630 635 640
Ala Leu Arg Arg His Gly Tyr Asp Gly Ala Leu Pro Tyr Trp Asp Trp
645 650 655
Thr Ser Pro Leu Asn His Leu Pro Glu Leu Ala Asp His Glu Lys Tyr
660 665 670
Val Asp Pro Glu Asp Gly Val Glu Lys His Asn Pro Trp Phe Asp Gly
675 680 685
His Ile Asp Thr Val Asp Lys Thr Thr Thr Arg Ser Val Gln Asn Lys
690 695 700
Leu Phe Glu Gln Pro Glu Phe Gly His Tyr Thr Ser Ile Ala Lys Gln
705 710 715 720
Val Leu Leu Ala Leu Glu Gln Asp Asn Phe Cys Asp Phe Glu Ile Gln
725 730 735
Tyr Glu Ile Ala His Asn Tyr Ile His Ala Leu Val Gly Gly Ala Gln
740 745 750
Pro Tyr Gly Met Ala Ser Leu Arg Tyr Thr Ala Phe Asp Pro Leu Phe
755 760 765
Tyr Leu His His Ser Asn Thr Asp Arg Ile Trp Ala Ile Trp Gln Ala
770 775 780
Leu Gln Lys Tyr Arg Gly Lys Pro Tyr Asn Val Ala Asn Cys Ala Val
785 790 795 800
Thr Ser Met Arg Glu Pro Leu Gln Pro Phe Gly Leu Ser Ala Asn Ile
805 810 815
Asn Thr Asp His Val Thr Lys Glu His Ser Val Pro Phe Asn Val Phe
820 825 830
Asp Tyr Lys Thr Asn Phe Asn Tyr Glu Tyr Asp Thr Leu Glu Phe Asn
835 840 845
Gly Leu Ser Ile Ser Gln Leu Asn Lys Lys Leu Glu Ala Ile Lys Ser
850 855 860
Gln Asp Arg Phe Phe Ala Gly Phe Leu Leu Ser Gly Phe Lys Lys Ser
865 870 875 880
Ser Leu Val Lys Phe Asn Ile Cys Thr Asp Ser Ser Asn Cys His Pro
885 890 895
Ala Gly Glu Phe Tyr Leu Leu Gly Asp Glu Asn Glu Met Pro Trp Ala
900 905 910
Tyr Asp Arg Val Phe Lys Tyr Asp Ile Thr Glu Lys Leu His Asp Leu
915 920 925
Lys Leu His Ala Glu Asp His Phe Tyr Ile Asp Tyr Glu Val Phe Asp
930 935 940
Leu Lys Pro Ala Ser Leu Gly Lys Asp Leu Phe Lys Gln Pro Ser Val
945 950 955 960
Ile His Glu Pro Arg Ile Gly His His Glu Gly Glu Val Tyr Gln Ala
965 970 975
Glu Val Thr Ser Ala Asn Arg Ile Arg Lys Asn Ile Glu Asn Leu Ser
980 985 990
Leu Gly Glu Leu Glu Ser Leu Arg Ala Ala Phe Leu Glu Ile Glu Asn
995 1000 1005
Asp Gly Thr Tyr Glu Ser Ile Ala Lys Phe His Gly Ser Pro Gly
1010 1015 1020
Leu Cys Gln Leu Asn Gly Asn Pro Ile Ser Cys Cys Val His Gly
1025 1030 1035
Met Pro Thr Phe Pro His Trp His Arg Leu Tyr Val Val Val Val
1040 1045 1050
Glu Asn Ala Leu Leu Lys Lys Gly Ser Ser Val Ala Val Pro Tyr
1055 1060 1065
Trp Asp Trp Thr Lys Arg Ile Glu His Leu Pro His Leu Ile Ser
1070 1075 1080
Asp Ala Thr Tyr Tyr Asn Ser Arg Gln His His Tyr Glu Thr Asn
1085 1090 1095
Pro Phe His His Gly Lys Ile Thr His Glu Asn Glu Ile Thr Thr
1100 1105 1110
Arg Asp Pro Lys Asp Ser Leu Phe His Ser Asp Tyr Phe Tyr Glu
1115 1120 1125
Gln Val Leu Tyr Ala Leu Glu Gln Asp Asn Phe Cys Asp Phe Glu
1130 1135 1140
Ile Gln Leu Glu Ile Leu His Asn Ala Leu His Ser Leu Leu Gly
1145 1150 1155
Gly Lys Gly Lys Tyr Ser Met Ser Asn Leu Asp Tyr Ala Ala Phe
1160 1165 1170
Asp Pro Val Phe Phe Leu His His Ala Thr Thr Asp Arg Ile Trp
1175 1180 1185
Ala Ile Trp Gln Asp Leu Gln Arg Phe Arg Lys Arg Pro Tyr Arg
1190 1195 1200
Glu Ala Asn Cys Ala Ile Gln Leu Met His Thr Pro Leu Gln Pro
1205 1210 1215
Phe Asp Lys Ser Asp Asn Asn Asp Glu Ala Thr Lys Thr His Ala
1220 1225 1230
Thr Pro His Asp Gly Phe Glu Tyr Gln Asn Ser Phe Gly Tyr Ala
1235 1240 1245
Tyr Asp Asn Leu Glu Leu Asn His Tyr Ser Ile Pro Gln Leu Asp
1250 1255 1260
His Met Leu Gln Glu Arg Lys Arg His Asp Arg Val Phe Ala Gly
1265 1270 1275
Phe Leu Leu His Asn Ile Gly Thr Ser Ala Asp Gly His Val Phe
1280 1285 1290
Val Cys Leu Pro Thr Gly Glu His Thr Lys Asp Cys Ser His Glu
1295 1300 1305
Ala Gly Met Phe Ser Ile Leu Gly Gly Gln Thr Glu Met Ser Phe
1310 1315 1320
Val Phe Asp Arg Leu Tyr Lys Leu Asp Ile Thr Lys Ala Leu Lys
1325 1330 1335
Lys Asn Gly Val His Leu Gln Gly Asp Phe Asp Leu Glu Ile Glu
1340 1345 1350
Ile Thr Ala Val Asn Gly Ser His Leu Asp Ser His Val Ile His
1355 1360 1365
Ser Pro Thr Ile Leu Phe Glu Ala Gly Thr Asp Ser Ala His Thr
1370 1375 1380
Asp Asp Gly His Thr Glu Pro Val Met Ile Arg Lys Asp Ile Thr
1385 1390 1395
Gln Leu Asp Lys Arg Gln Gln Leu Ser Leu Val Lys Ala Leu Glu
1400 1405 1410
Ser Met Lys Ala Asp His Ser Ser Asp Gly Phe Gln Ala Ile Ala
1415 1420 1425
Ser Phe His Ala Leu Pro Pro Leu Cys Pro Ser Pro Ala Ala Ser
1430 1435 1440
Lys Arg Phe Ala Cys Cys Val His Gly Met Ala Thr Phe Pro Gln
1445 1450 1455
Trp His Arg Leu Tyr Thr Val Gln Phe Gln Asp Ser Leu Arg Lys
1460 1465 1470
His Gly Ala Val Val Gly Leu Pro Tyr Trp Asp Trp Thr Leu Pro
1475 1480 1485
Arg Ser Glu Leu Pro Glu Leu Leu Thr Val Ser Thr Ile His Asp
1490 1495 1500
Pro Glu Thr Gly Arg Asp Ile Pro Asn Pro Phe Ile Gly Ser Lys
1505 1510 1515
Ile Glu Phe Glu Gly Glu Asn Val His Thr Lys Arg Asp Ile Asn
1520 1525 1530
Arg Asp Arg Leu Phe Gln Gly Ser Thr Lys Thr His His Asn Trp
1535 1540 1545
Phe Ile Glu Gln Ala Leu Leu Ala Leu Glu Gln Thr Asn Tyr Cys
1550 1555 1560
Asp Phe Glu Val Gln Phe Glu Ile Met His Asn Gly Val His Thr
1565 1570 1575
Trp Val Gly Gly Lys Glu Pro Tyr Gly Ile Gly His Leu His Tyr
1580 1585 1590
Ala Ser Tyr Asp Pro Leu Phe Tyr Ile His His Ser Gln Thr Asp
1595 1600 1605
Arg Ile Trp Ala Ile Trp Gln Ser Leu Gln Arg Phe Arg Gly Leu
1610 1615 1620
Ser Gly Ser Glu Ala Asn Cys Ala Val Asn Leu Met Lys Thr Pro
1625 1630 1635
Leu Lys Pro Phe Ser Phe Gly Ala Pro Tyr Asn Leu Asn Asp His
1640 1645 1650
Thr His Asp Phe Ser Lys Pro Glu Asp Thr Phe Asp Tyr Gln Lys
1655 1660 1665
Phe Gly Tyr Ile Tyr Asp Thr Leu Glu Phe Ala Gly Trp Ser Ile
1670 1675 1680
Arg Gly Ile Asp His Ile Val Arg Asn Arg Gln Glu His Ser Arg
1685 1690 1695
Val Phe Ala Gly Phe Leu Leu Glu Gly Phe Gly Thr Ser Ala Thr
1700 1705 1710
Val Asp Phe Gln Val Cys Arg Thr Ala Gly Asp Cys Glu Asp Ala
1715 1720 1725
Gly Tyr Phe Thr Val Leu Gly Gly Glu Lys Glu Met Pro Trp Ala
1730 1735 1740
Phe Asp Arg Leu Tyr Lys Tyr Asp Ile Thr Glu Thr Leu Asp Lys
1745 1750 1755
Met Asn Leu Arg His Asp Glu Ile Phe Gln Ile Glu Val Thr Ile
1760 1765 1770
Thr Ser Tyr Asp Gly Thr Val Leu Asp Ser Gly Leu Ile Pro Thr
1775 1780 1785
Pro Ser Ile Ile Tyr Asp Pro Ala His His Asp Ile Ser Ser His
1790 1795 1800
His Leu Ser Leu Asn Lys Val Arg His Asp Leu Ser Thr Leu Ser
1805 1810 1815
Glu Arg Asp Ile Gly Ser Leu Lys Tyr Ala Leu Ser Ser Leu Gln
1820 1825 1830
Ala Asp Thr Ser Ala Asp Gly Phe Ala Ala Ile Ala Ser Phe His
1835 1840 1845
Gly Leu Pro Ala Lys Cys Asn Asp Ser His Asn Asn Glu Val Ala
1850 1855 1860
Cys Cys Ile His Gly Met Pro Thr Phe Pro His Trp His Arg Leu
1865 1870 1875
Tyr Thr Leu Gln Phe Glu Gln Ala Leu Arg Arg His Gly Ser Ser
1880 1885 1890
Val Ala Val Pro Tyr Trp Asp Trp Thr Lys Pro Ile His Asn Ile
1895 1900 1905
Pro His Leu Phe Thr Asp Lys Glu Tyr Tyr Asp Val Trp Arg Asn
1910 1915 1920
Lys Val Met Pro Asn Pro Phe Ala Arg Gly Tyr Val Pro Ser His
1925 1930 1935
Asp Thr Tyr Thr Val Arg Asp Val Gln Glu Gly Leu Phe His Leu
1940 1945 1950
Thr Ser Thr Gly Glu His Ser Ala Leu Leu Asn Gln Ala Leu Leu
1955 1960 1965
Ala Leu Glu Gln His Asp Tyr Cys Asp Phe Ala Val Gln Phe Glu
1970 1975 1980
Val Met His Asn Thr Ile His Tyr Leu Val Gly Gly Pro Gln Val
1985 1990 1995
Tyr Ser Leu Ser Ser Leu His Tyr Ala Ser Tyr Asp Pro Ile Phe
2000 2005 2010
Phe Ile His His Ser Phe Val Asp Lys Val Trp Ala Val Trp Gln
2015 2020 2025
Ala Leu Gln Glu Lys Arg Gly Leu Pro Ser Asp Arg Ala Asp Cys
2030 2035 2040
Ala Val Ser Leu Met Thr Gln Asn Met Arg Pro Phe His Tyr Glu
2045 2050 2055
Ile Asn His Asn Gln Phe Thr Lys Lys His Ala Val Pro Asn Asp
2060 2065 2070
Val Phe Lys Tyr Glu Leu Leu Gly Tyr Arg Tyr Asp Asn Leu Glu
2075 2080 2085
Ile Gly Gly Met Asn Leu His Glu Ile Glu Lys Glu Ile Lys Asp
2090 2095 2100
Lys Gln His His Val Arg Val Phe Ala Gly Phe Leu Leu His Gly
2105 2110 2115
Ile Arg Thr Ser Ala Asp Val Gln Phe Gln Ile Cys Lys Thr Ser
2120 2125 2130
Glu Asp Cys His His Gly Gly Gln Ile Phe Val Leu Gly Gly Thr
2135 2140 2145
Lys Glu Met Ala Trp Ala Tyr Asn Arg Leu Phe Lys Tyr Asp Ile
2150 2155 2160
Thr His Ala Leu His Asp Ala His Ile Thr Pro Glu Asp Val Phe
2165 2170 2175
His Pro Ser Glu Pro Phe Phe Ile Lys Val Ser Val Thr Ala Val
2180 2185 2190
Asn Gly Thr Val Leu Pro Ala Ser Ile Leu His Ala Pro Thr Ile
2195 2200 2205
Ile Tyr Glu Pro Gly Leu Gly Asp His His Glu Asp His His Ser
2210 2215 2220
Ser Ser Met Ala Gly His Gly Val Arg Lys Glu Ile Asn Thr Leu
2225 2230 2235
Thr Thr Ala Glu Val Asp Asn Leu Lys Asp Ala Met Arg Ala Val
2240 2245 2250
Met Ala Asp His Gly Pro Asn Gly Tyr Gln Ala Ile Ala Ala Phe
2255 2260 2265
His Gly Asn Pro Pro Met Cys Pro Met Pro Asp Gly Lys Asn Tyr
2270 2275 2280
Ser Cys Cys Thr His Gly Met Ala Thr Phe Pro His Trp His Arg
2285 2290 2295
Leu Tyr Thr Lys Gln Met Glu Asp Ala Leu Thr Ala His Gly Ala
2300 2305 2310
Arg Val Gly Leu Pro Tyr Trp Asp Gly Thr Thr Ala Phe Thr Ala
2315 2320 2325
Leu Pro Thr Phe Val Thr Asp Glu Glu Asp Asn Pro Phe His His
2330 2335 2340
Gly His Ile Asp Tyr Leu Gly Val Asp Thr Thr Arg Ser Pro Arg
2345 2350 2355
Asp Lys Leu Phe Asn Asp Pro Glu Arg Gly Ser Glu Ser Phe Phe
2360 2365 2370
Tyr Arg Gln Val Leu Leu Ala Leu Glu Gln Thr Asp Phe Cys Gln
2375 2380 2385
Phe Glu Val Gln Phe Glu Ile Thr His Asn Ala Ile His Ser Trp
2390 2395 2400
Thr Gly Gly Leu Thr Pro Tyr Gly Met Ser Thr Leu Glu Tyr Thr
2405 2410 2415
Thr Tyr Asp Pro Leu Phe Trp Leu His His Ala Asn Thr Asp Arg
2420 2425 2430
Ile Trp Ala Ile Trp Gln Ala Leu Gln Glu Tyr Arg Gly Leu Pro
2435 2440 2445
Tyr Asp His Ala Asn Cys Glu Ile Gln Ala Met Lys Arg Pro Leu
2450 2455 2460
Arg Pro Phe Ser Asp Pro Ile Asn His Asn Ala Phe Thr His Ser
2465 2470 2475
Asn Ala Lys Pro Thr Asp Val Phe Glu Tyr Ser Arg Phe Asn Phe
2480 2485 2490
Gln Tyr Asp Asn Leu Arg Phe His Gly Met Thr Ile Lys Lys Leu
2495 2500 2505
Glu His Glu Leu Glu Lys Gln Lys Glu Glu Asp Arg Thr Phe Ala
2510 2515 2520
Ala Phe Leu Leu His Gly Ile Lys Lys Ser Ala Asp Val Ser Phe
2525 2530 2535
Asp Val Cys Asn His Asp Gly Glu Cys His Phe Ala Gly Thr Phe
2540 2545 2550
Ala Ile Leu Gly Gly Glu His Glu Met Pro Trp Ser Phe Asp Arg
2555 2560 2565
Leu Phe Arg Tyr Asp Ile Thr Gln Val Leu Lys Gln Met His Leu
2570 2575 2580
Glu Tyr Asp Ser Asp Phe Thr Phe His Met Arg Ile Ile Asp Thr
2585 2590 2595
Ser Gly Lys Gln Leu Pro Ser Asp Leu Ile Lys Met Pro Thr Val
2600 2605 2610
Glu His Ser Pro Gly Gly Lys His His Glu Lys His His Glu Asp
2615 2620 2625
His His Glu Asp Ile Leu Val Arg Lys Asn Ile His Ser Leu Ser
2630 2635 2640
His His Glu Ala Glu Glu Leu Arg Asp Ala Leu Tyr Lys Leu Gln
2645 2650 2655
Asn Asp Glu Ser His Gly Gly Tyr Glu His Ile Ala Gly Phe His
2660 2665 2670
Gly Tyr Pro Asn Leu Cys Pro Glu Lys Gly Asp Glu Lys Tyr Pro
2675 2680 2685
Cys Cys Val His Gly Met Ser Ile Phe Pro His Trp His Arg Leu
2690 2695 2700
His Thr Ile Gln Phe Glu Arg Ala Leu Lys Lys His Gly Ser His
2705 2710 2715
Leu Gly Ile Pro Tyr Trp Asp Trp Thr Gln Thr Ile Ser Ser Leu
2720 2725 2730
Pro Thr Phe Phe Ala Asp Ser Gly Asn Asn Asn Pro Phe Phe Lys
2735 2740 2745
Tyr His Ile Arg Ser Ile Asn Gln Asp Thr Val Arg Asp Val Asn
2750 2755 2760
Glu Ala Ile Phe Gln Gln Thr Lys Phe Gly Glu Phe Ser Ser Ile
2765 2770 2775
Phe Tyr Leu Ala Leu Gln Ala Leu Glu Glu Asp Asn Tyr Cys Asp
2780 2785 2790
Phe Glu Val Gln Tyr Glu Ile Leu His Asn Glu Val His Ala Leu
2795 2800 2805
Ile Gly Gly Ala Glu Lys Tyr Ser Met Ser Thr Leu Glu Tyr Ser
2810 2815 2820
Ala Phe Asp Pro Tyr Phe Met Ile His His Ala Ser Leu Asp Lys
2825 2830 2835
Ile Trp Ile Ile Trp Gln Glu Leu Gln Lys Arg Arg Val Lys Pro
2840 2845 2850
Ala His Ala Gly Ser Cys Ala Gly Asp Ile Met His Val Pro Leu
2855 2860 2865
His Pro Phe Asn Tyr Glu Ser Val Asn Asn Asp Asp Phe Thr Arg
2870 2875 2880
Glu Asn Ser Leu Pro Asn Ala Val Val Asp Ser His Arg Phe Asn
2885 2890 2895
Tyr Lys Tyr Asp Asn Leu Asn Leu His Gly His Asn Ile Glu Glu
2900 2905 2910
Leu Glu Glu Val Leu Arg Ser Leu Arg Leu Lys Ser Arg Val Phe
2915 2920 2925
Ala Gly Phe Val Leu Ser Gly Ile Arg Thr Thr Ala Val Val Lys
2930 2935 2940
Val Tyr Ile Lys Ser Gly Thr Asp Ser Asp Asp Glu Tyr Ala Gly
2945 2950 2955
Ser Phe Val Ile Leu Gly Gly Ala Lys Glu Met Pro Trp Ala Tyr
2960 2965 2970
Glu Arg Leu Tyr Arg Phe Asp Ile Thr Glu Thr Val His Asn Leu
2975 2980 2985
Asn Leu Thr Asp Asp His Val Lys Phe Arg Phe Asp Leu Lys Lys
2990 2995 3000
Tyr Asp His Thr Glu Leu Asp Ala Ser Val Leu Pro Ala Pro Ile
3005 3010 3015
Ile Val Arg Arg Pro Asn Asn Ala Val Phe Asp Ile Ile Glu Ile
3020 3025 3030
Pro Ile Gly Lys Asp Val Asn Leu Pro Pro Lys Val Val Val Lys
3035 3040 3045
Arg Gly Thr Lys Ile Met Phe Met Ser Val Asp Glu Ala Val Thr
3050 3055 3060
Thr Pro Met Leu Asn Leu Gly Ser Tyr Thr Ala Met Phe Lys Cys
3065 3070 3075
Lys Val Pro Pro Phe Ser Phe His Ala Phe Glu Leu Gly Lys Met
3080 3085 3090
Tyr Ser Val Glu Ser Gly Asp Tyr Phe Met Thr Ala Ser Thr Thr
3095 3100 3105
Glu Leu Cys Asn Asp Asn Asn Leu Arg Ile His Val His Val Asp
3110 3115 3120
Asp Glu
3125
<210> 2
<211> 3421
<212> Белок
<213> Megathura crenulata
<400> 2
Met Trp Thr Ile Leu Ala Leu Leu Thr Ala Thr Leu Leu Phe Glu Gly
1 5 10 15
Ala Phe Ser Val Asp Thr Val Val Arg Lys Asn Val Asp Ser Leu Ser
20 25 30
Ser Asp Glu Val Leu Ala Leu Glu Lys Ala Leu Asp Asp Leu Gln Gln
35 40 45
Asp Asp Ser Asn Gln Gly Tyr Gln Ala Ile Ala Gly Tyr His Gly Val
50 55 60
Pro Thr Met Cys Val Asp Lys His Glu Lys Asn Val Ala Cys Cys Leu
65 70 75 80
His Gly Met Pro Ser Phe Pro Leu Trp His Arg Leu Tyr Val Val Gln
85 90 95
Leu Glu Arg Ala Leu Ile Arg Lys Lys Ala Thr Ile Ser Ile Pro Tyr
100 105 110
Trp Asp Trp Thr Ser Glu Leu Thr His Leu Pro Glu Leu Val Ser His
115 120 125
Pro Leu Phe Val Gly Thr Glu Gly Gly Lys Ala His Asp Asn Ser Trp
130 135 140
Tyr Arg Ala Asp Ile Thr Phe Leu Asn Lys Lys Thr Ser Arg Ala Val
145 150 155 160
Asp Asp Arg Leu Phe Glu Lys Val Gln Pro Gly His His Thr Arg Leu
165 170 175
Met Glu Gly Ile Leu Asp Ala Leu Glu Gln Asp Glu Phe Cys Lys Phe
180 185 190
Glu Ile Gln Phe Glu Leu Ala His Asn Ala Ile His Tyr Leu Val Gly
195 200 205
Gly Arg His Thr Tyr Ser Met Ser His Leu Glu Tyr Thr Ser Tyr Asp
210 215 220
Pro Leu Phe Phe Leu His His Ser Asn Thr Asp Arg Ile Phe Ala Ile
225 230 235 240
Trp Gln Arg Leu Gln Gln Leu Arg Gly Lys Asp Pro Asn Ser Ala Asp
245 250 255
Cys Ala His Asn Leu Ile His Thr Pro Met Glu Pro Phe Asp Arg Asp
260 265 270
Thr Asn Pro Leu Asp Leu Thr Arg Glu His Ala Lys Pro Ala Asp Ser
275 280 285
Phe Asp Tyr Gly Arg Leu Gly Tyr Gln Tyr Asp Asp Leu Ser Leu Asn
290 295 300
Gly Met Ser Pro Glu Glu Leu Asn Val Tyr Leu Gly Glu Arg Ala Ala
305 310 315 320
Lys Glu Arg Thr Phe Ala Ser Phe Ile Leu Ser Gly Phe Gly Gly Ser
325 330 335
Ala Asn Val Val Val Tyr Val Cys Arg Pro Ala His Asp Glu Ile Ser
340 345 350
Asp Asp Gln Cys Ile Lys Ala Gly Asp Phe Phe Leu Leu Gly Gly Pro
355 360 365
Thr Glu Met Lys Trp Gly Phe Tyr Arg Ala Tyr His Phe Asp Val Thr
370 375 380
Asp Ser Val Ala Ser Ile Asp Asp Asp Gly His Gly His Tyr Tyr Val
385 390 395 400
Lys Ser Glu Leu Phe Ser Val Asn Gly Ser Ala Leu Ser Asn Asp Ile
405 410 415
Leu Arg Gln Pro Thr Leu Val His Arg Pro Ala Lys Gly His Phe Asp
420 425 430
Lys Pro Pro Val Pro Val Ala Gln Ala Asn Leu Ala Val Arg Lys Asn
435 440 445
Ile Asn Asp Leu Thr Ala Glu Glu Thr Tyr Ser Leu Arg Lys Ala Met
450 455 460
Glu Arg Phe Gln Asn Asp Lys Ser Val Asp Gly Tyr Gln Ala Thr Val
465 470 475 480
Glu Phe His Ala Leu Pro Ala Arg Cys Pro Arg Pro Asp Ala Lys Asp
485 490 495
Arg Phe Ala Cys Cys Val His Gly Met Ala Thr Phe Pro His Trp His
500 505 510
Arg Leu Phe Val Thr Gln Val Glu Asp Ala Leu Leu Arg Arg Gly Ser
515 520 525
Thr Ile Gly Leu Pro Asn Trp Asp Trp Thr Met Pro Met Asp His Leu
530 535 540
Pro Glu Leu Ala Thr Ser Glu Thr Tyr Leu Asp Pro Val Thr Gly Glu
545 550 555 560
Thr Lys Asn Asn Pro Phe His His Ala Gln Val Ala Phe Glu Asn Gly
565 570 575
Val Thr Ser Arg Asn Pro Asp Ala Lys Leu Phe Met Lys Pro Thr Tyr
580 585 590
Gly Asp His Thr Tyr Leu Phe Asp Ser Met Ile Tyr Ala Phe Glu Gln
595 600 605
Glu Asp Phe Cys Asp Phe Glu Val Gln Tyr Glu Leu Thr His Asn Ala
610 615 620
Ile His Ala Trp Val Gly Gly Ser Glu Lys Tyr Ser Met Ser Ser Leu
625 630 635 640
His Tyr Thr Ala Phe Asp Pro Ile Phe Tyr Leu His His Ser Asn Val
645 650 655
Asp Arg Leu Trp Ala Ile Trp Gln Ala Leu Gln Ile Arg Arg Gly Lys
660 665 670
Ser Tyr Lys Ala His Cys Ala Ser Ser Gln Glu Arg Glu Pro Leu Lys
675 680 685
Pro Phe Ala Phe Ser Ser Pro Leu Asn Asn Asn Glu Lys Thr Tyr His
690 695 700
Asn Ser Val Pro Thr Asn Val Tyr Asp Tyr Val Gly Val Leu His Tyr
705 710 715 720
Arg Tyr Asp Asp Leu Gln Phe Gly Gly Met Thr Met Ser Glu Leu Glu
725 730 735
Glu Tyr Ile His Lys Gln Thr Gln His Asp Arg Thr Phe Ala Gly Phe
740 745 750
Phe Leu Ser Tyr Ile Gly Thr Ser Ala Ser Val Asp Ile Phe Ile Asn
755 760 765
Arg Glu Gly His Asp Lys Tyr Lys Val Gly Ser Phe Val Val Leu Gly
770 775 780
Gly Ser Lys Glu Met Lys Trp Gly Phe Asp Arg Met Tyr Lys Tyr Glu
785 790 795 800
Ile Thr Glu Ala Leu Lys Thr Leu Asn Val Ala Val Asp Asp Gly Phe
805 810 815
Ser Ile Thr Val Glu Ile Thr Asp Val Asp Gly Ser Pro Pro Ser Ala
820 825 830
Asp Leu Ile Pro Pro Pro Ala Ile Ile Phe Glu Arg Ala Asp Ala Lys
835 840 845
Asp Phe Gly His Ser Arg Lys Ile Arg Lys Ala Val Asp Ser Leu Thr
850 855 860
Val Glu Glu Gln Thr Ser Leu Arg Arg Ala Met Ala Asp Leu Gln Asp
865 870 875 880
Asp Lys Thr Ser Gly Gly Phe Gln Gln Ile Ala Ala Phe His Gly Glu
885 890 895
Pro Lys Trp Cys Pro Ser Pro Glu Ala Glu Lys Lys Phe Ala Cys Cys
900 905 910
Val His Gly Met Ala Val Phe Pro His Trp His Arg Leu Leu Thr Val
915 920 925
Gln Gly Glu Asn Ala Leu Arg Lys His Gly Phe Thr Gly Gly Leu Pro
930 935 940
Tyr Trp Asp Trp Thr Arg Ser Met Ser Ala Leu Pro His Phe Val Ala
945 950 955 960
Asp Pro Thr Tyr Asn Asp Ala Ile Ser Ser Gln Glu Glu Asp Asn Pro
965 970 975
Trp His His Gly His Ile Asp Ser Val Gly His Asp Thr Thr Arg Asp
980 985 990
Val Arg Asp Asp Leu Tyr Gln Ser Pro Gly Phe Gly His Tyr Thr Asp
995 1000 1005
Ile Ala Lys Gln Val Leu Leu Ala Phe Glu Gln Asp Asp Phe Cys
1010 1015 1020
Asp Phe Glu Val Gln Phe Glu Ile Ala His Asn Phe Ile His Ala
1025 1030 1035
Leu Val Gly Gly Asn Glu Pro Tyr Ser Met Ser Ser Leu Arg Tyr
1040 1045 1050
Thr Thr Tyr Asp Pro Ile Phe Phe Leu His Arg Ser Asn Thr Asp
1055 1060 1065
Arg Leu Trp Ala Ile Trp Gln Ala Leu Gln Lys Tyr Arg Gly Lys
1070 1075 1080
Pro Tyr Asn Thr Ala Asn Cys Ala Ile Ala Ser Met Arg Lys Pro
1085 1090 1095
Leu Gln Pro Phe Gly Leu Asp Ser Val Ile Asn Pro Asp Asp Glu
1100 1105 1110
Thr Arg Glu His Ser Val Pro Phe Arg Val Phe Asp Tyr Lys Asn
1115 1120 1125
Asn Phe Asp Tyr Glu Tyr Glu Ser Leu Ala Phe Asn Gly Leu Ser
1130 1135 1140
Ile Ala Gln Leu Asp Arg Glu Leu Gln Arg Arg Lys Ser His Asp
1145 1150 1155
Arg Val Phe Ala Gly Phe Leu Leu His Glu Ile Gly Gln Ser Ala
1160 1165 1170
Leu Val Lys Phe Tyr Val Cys Lys His Asn Val Ser Asp Cys Asp
1175 1180 1185
His Tyr Ala Gly Glu Phe Tyr Ile Leu Gly Asp Glu Ala Glu Met
1190 1195 1200
Pro Trp Arg Tyr Asp Arg Val Tyr Lys Tyr Glu Ile Thr Gln Gln
1205 1210 1215
Leu His Asp Leu Asp Leu His Val Gly Asp Asn Phe Phe Leu Lys
1220 1225 1230
Tyr Glu Ala Phe Asp Leu Asn Gly Gly Ser Leu Gly Gly Ser Ile
1235 1240 1245
Phe Ser Gln Pro Ser Val Ile Phe Glu Pro Ala Ala Gly Ser His
1250 1255 1260
Gln Ala Asp Glu Tyr Arg Glu Ala Val Thr Ser Ala Ser His Ile
1265 1270 1275
Arg Lys Asn Ile Arg Asp Leu Ser Glu Gly Glu Ile Glu Ser Ile
1280 1285 1290
Arg Ser Ala Phe Leu Gln Ile Gln Lys Glu Gly Ile Tyr Glu Asn
1295 1300 1305
Ile Ala Lys Phe His Gly Lys Pro Gly Leu Cys Glu His Asp Gly
1310 1315 1320
His Pro Val Ala Cys Cys Val His Gly Met Pro Thr Phe Pro His
1325 1330 1335
Trp His Arg Leu Tyr Val Leu Gln Val Glu Asn Ala Leu Leu Glu
1340 1345 1350
Arg Gly Ser Ala Val Ala Val Pro Tyr Trp Asp Trp Thr Glu Lys
1355 1360 1365
Ala Asp Ser Leu Pro Ser Leu Ile Asn Asp Ala Thr Tyr Phe Asn
1370 1375 1380
Ser Arg Ser Gln Thr Phe Asp Pro Asn Pro Phe Phe Arg Gly His
1385 1390 1395
Ile Ala Phe Glu Asn Ala Val Thr Ser Arg Asp Pro Gln Pro Glu
1400 1405 1410
Leu Trp Asp Asn Lys Asp Phe Tyr Glu Asn Val Met Leu Ala Leu
1415 1420 1425
Glu Gln Asp Asn Phe Cys Asp Phe Glu Ile Gln Leu Glu Leu Ile
1430 1435 1440
His Asn Ala Leu His Ser Arg Leu Gly Gly Arg Ala Lys Tyr Ser
1445 1450 1455
Leu Ser Ser Leu Asp Tyr Thr Ala Phe Asp Pro Val Phe Phe Leu
1460 1465 1470
His His Ala Asn Val Asp Arg Ile Trp Ala Ile Trp Gln Asp Leu
1475 1480 1485
Gln Arg Tyr Arg Lys Lys Pro Tyr Asn Glu Ala Asp Cys Ala Val
1490 1495 1500
Asn Glu Met Arg Lys Pro Leu Gln Pro Phe Asn Asn Pro Glu Leu
1505 1510 1515
Asn Ser Asp Ser Met Thr Leu Lys His Asn Leu Pro Gln Asp Ser
1520 1525 1530
Phe Asp Tyr Gln Asn Arg Phe Arg Tyr Gln Tyr Asp Asn Leu Gln
1535 1540 1545
Phe Asn His Phe Ser Ile Gln Lys Leu Asp Gln Thr Ile Gln Ala
1550 1555 1560
Arg Lys Gln His Asp Arg Val Phe Ala Gly Phe Ile Leu His Asn
1565 1570 1575
Ile Gly Thr Ser Ala Val Val Asp Ile Tyr Ile Cys Val Glu Gln
1580 1585 1590
Gly Gly Glu Gln Asn Cys Lys Thr Lys Ala Gly Ser Phe Thr Ile
1595 1600 1605
Leu Gly Gly Glu Thr Glu Met Pro Phe His Phe Asp Arg Leu Tyr
1610 1615 1620
Lys Phe Asp Ile Thr Ser Ala Leu His Lys Leu Gly Val Pro Leu
1625 1630 1635
Asp Gly His Gly Phe Asp Ile Lys Val Asp Val Arg Ala Val Asn
1640 1645 1650
Gly Ser His Leu Asp Gln His Ile Leu Asn Glu Pro Ser Leu Leu
1655 1660 1665
Phe Val Pro Gly Glu Arg Lys Asn Ile Tyr Tyr Asp Gly Leu Ser
1670 1675 1680
Gln His Asn Leu Val Arg Lys Glu Val Ser Ser Leu Thr Thr Leu
1685 1690 1695
Glu Lys His Phe Leu Arg Lys Ala Leu Lys Asn Met Gln Ala Asp
1700 1705 1710
Asp Ser Pro Asp Gly Tyr Gln Ala Ile Ala Ser Phe His Ala Leu
1715 1720 1725
Pro Pro Leu Cys Pro Ser Pro Ser Ala Ala His Arg His Ala Cys
1730 1735 1740
Cys Leu His Gly Met Ala Thr Phe Pro Gln Trp His Arg Leu Tyr
1745 1750 1755
Thr Val Gln Phe Glu Asp Ser Leu Lys Arg His Gly Ser Ile Val
1760 1765 1770
Gly Leu Pro Tyr Trp Asp Trp Leu Lys Pro Gln Ser Ala Leu Pro
1775 1780 1785
Asp Leu Val Thr Gln Glu Thr Tyr Glu His Leu Phe Ser His Lys
1790 1795 1800
Thr Phe Pro Asn Pro Phe Leu Lys Ala Asn Ile Glu Phe Glu Gly
1805 1810 1815
Glu Gly Val Thr Thr Glu Arg Asp Val Asp Ala Glu His Leu Phe
1820 1825 1830
Ala Lys Gly Asn Leu Val Tyr Asn Asn Trp Phe Cys Asn Gln Ala
1835 1840 1845
Leu Tyr Ala Leu Glu Gln Glu Asn Tyr Cys Asp Phe Glu Ile Gln
1850 1855 1860
Phe Glu Ile Leu His Asn Gly Ile His Ser Trp Val Gly Gly Ser
1865 1870 1875
Lys Thr His Ser Ile Gly His Leu His Tyr Ala Ser Tyr Asp Pro
1880 1885 1890
Leu Phe Tyr Ile His His Ser Gln Thr Asp Arg Ile Trp Ala Ile
1895 1900 1905
Trp Gln Ala Leu Gln Glu His Arg Gly Leu Ser Gly Lys Glu Ala
1910 1915 1920
His Cys Ala Leu Glu Gln Met Lys Asp Pro Leu Lys Pro Phe Ser
1925 1930 1935
Phe Gly Ser Pro Tyr Asn Leu Asn Lys Arg Thr Gln Glu Phe Ser
1940 1945 1950
Lys Pro Glu Asp Thr Phe Asp Tyr His Arg Phe Gly Tyr Glu Tyr
1955 1960 1965
Asp Ser Leu Glu Phe Val Gly Met Ser Val Ser Ser Leu His Asn
1970 1975 1980
Tyr Ile Lys Gln Gln Gln Glu Ala Asp Arg Val Phe Ala Gly Phe
1985 1990 1995
Leu Leu Lys Gly Phe Gly Gln Ser Ala Ser Val Ser Phe Asp Ile
2000 2005 2010
Cys Arg Pro Asp Gln Ser Cys Gln Glu Ala Gly Tyr Phe Ser Val
2015 2020 2025
Leu Gly Gly Ser Ser Glu Met Pro Trp Gln Phe Asp Arg Leu Tyr
2030 2035 2040
Lys Tyr Asp Ile Thr Lys Thr Leu Lys Asp Met Lys Leu Arg Tyr
2045 2050 2055
Asp Asp Thr Phe Thr Ile Lys Val His Ile Lys Asp Ile Ala Gly
2060 2065 2070
Ala Glu Leu Asp Ser Asp Leu Ile Pro Thr Pro Ser Val Leu Leu
2075 2080 2085
Glu Glu Gly Lys His Gly Ile Asn Val Arg His Val Gly Arg Asn
2090 2095 2100
Arg Ile Arg Met Glu Leu Ser Glu Leu Thr Glu Arg Asp Leu Ala
2105 2110 2115
Ser Leu Lys Ser Ala Met Arg Ser Leu Gln Ala Asp Asp Gly Val
2120 2125 2130
Asn Gly Tyr Gln Ala Ile Ala Ser Phe His Gly Leu Pro Ala Ser
2135 2140 2145
Cys His Asp Asp Glu Gly His Glu Ile Ala Cys Cys Ile His Gly
2150 2155 2160
Met Pro Val Phe Pro His Trp His Arg Leu Tyr Thr Leu Gln Met
2165 2170 2175
Asp Met Ala Leu Leu Ser His Gly Ser Ala Val Ala Ile Pro Tyr
2180 2185 2190
Trp Asp Trp Thr Lys Pro Ile Ser Lys Leu Pro Asp Leu Phe Thr
2195 2200 2205
Ser Pro Glu Tyr Tyr Asp Pro Trp Arg Asp Ala Val Val Asn Asn
2210 2215 2220
Pro Phe Ala Lys Gly Tyr Ile Lys Ser Glu Asp Ala Tyr Thr Val
2225 2230 2235
Arg Asp Pro Gln Asp Ile Leu Tyr His Leu Gln Asp Glu Thr Gly
2240 2245 2250
Thr Ser Val Leu Leu Asp Gln Thr Leu Leu Ala Leu Glu Gln Thr
2255 2260 2265
Asp Phe Cys Asp Phe Glu Val Gln Phe Glu Val Val His Asn Ala
2270 2275 2280
Ile His Tyr Leu Val Gly Gly Arg Gln Val Tyr Ala Leu Ser Ser
2285 2290 2295
Gln His Tyr Ala Ser Tyr Asp Pro Ala Phe Phe Ile His His Ser
2300 2305 2310
Phe Val Asp Lys Ile Trp Ala Val Trp Gln Ala Leu Gln Lys Lys
2315 2320 2325
Arg Lys Arg Pro Tyr His Lys Ala Asp Cys Ala Leu Asn Met Met
2330 2335 2340
Thr Lys Pro Met Arg Pro Phe Ala His Asp Phe Asn His Asn Gly
2345 2350 2355
Phe Thr Lys Met His Ala Val Pro Asn Thr Leu Phe Asp Phe Gln
2360 2365 2370
Asp Leu Phe Tyr Thr Tyr Asp Asn Leu Glu Ile Ala Gly Met Asn
2375 2380 2385
Val Asn Gln Leu Glu Ala Glu Ile Asn Arg Arg Lys Ser Gln Thr
2390 2395 2400
Arg Val Phe Ala Gly Phe Leu Leu His Gly Ile Gly Arg Ser Ala
2405 2410 2415
Asp Val Arg Phe Trp Ile Cys Lys Thr Ala Asp Asp Cys His Ala
2420 2425 2430
Ser Gly Met Ile Phe Ile Leu Gly Gly Ser Lys Glu Met His Trp
2435 2440 2445
Ala Tyr Asp Arg Asn Phe Lys Tyr Asp Ile Thr Gln Ala Leu Lys
2450 2455 2460
Ala Gln Ser Ile His Pro Glu Asp Val Phe Asp Thr Asp Ala Pro
2465 2470 2475
Phe Phe Ile Lys Val Glu Val His Gly Val Asn Lys Thr Ala Leu
2480 2485 2490
Pro Ser Ser Ala Ile Pro Ala Pro Thr Ile Ile Tyr Ser Ala Gly
2495 2500 2505
Glu Gly His Thr Asp Asp His Gly Ser Asp His Ile Ala Gly Ser
2510 2515 2520
Gly Val Arg Lys Asp Val Thr Ser Leu Thr Ala Ser Glu Ile Glu
2525 2530 2535
Asn Leu Arg His Ala Leu Gln Ser Val Met Asp Asp Asp Gly Pro
2540 2545 2550
Asn Gly Phe Gln Ala Ile Ala Ala Tyr His Gly Ser Pro Pro Met
2555 2560 2565
Cys His Met His Asp Gly Arg Asp Val Ala Cys Cys Thr His Gly
2570 2575 2580
Met Ala Ser Phe Pro His Trp His Arg Leu Phe Val Lys Gln Met
2585 2590 2595
Glu Asp Ala Leu Ala Ala His Gly Ala His Ile Gly Ile Pro Tyr
2600 2605 2610
Trp Asp Trp Thr Ser Ala Phe Ser His Leu Pro Ala Leu Val Thr
2615 2620 2625
Asp His Glu His Asn Pro Phe His His Gly His Ile Ala His Arg
2630 2635 2640
Asn Val Asp Thr Ser Arg Ser Pro Arg Asp Met Leu Phe Asn Asp
2645 2650 2655
Pro Glu His Gly Ser Glu Ser Phe Phe Tyr Arg Gln Val Leu Leu
2660 2665 2670
Ala Leu Glu Gln Thr Asp Phe Cys Gln Phe Glu Val Gln Phe Glu
2675 2680 2685
Ile Thr His Asn Ala Ile His Ser Trp Thr Gly Gly His Thr Pro
2690 2695 2700
Tyr Gly Met Ser Ser Leu Glu Tyr Thr Ala Tyr Asp Pro Leu Phe
2705 2710 2715
Tyr Leu His His Ser Asn Thr Asp Arg Ile Trp Ala Ile Trp Gln
2720 2725 2730
Ala Leu Gln Lys Tyr Arg Gly Phe Gln Tyr Asn Ala Ala His Cys
2735 2740 2745
Asp Ile Gln Val Leu Lys Gln Pro Leu Lys Pro Phe Ser Glu Ser
2750 2755 2760
Arg Asn Pro Asn Pro Val Thr Arg Ala Asn Ser Arg Ala Val Asp
2765 2770 2775
Ser Phe Asp Tyr Glu Arg Leu Asn Tyr Gln Tyr Asp Thr Leu Thr
2780 2785 2790
Phe His Gly His Ser Ile Ser Glu Leu Asp Ala Met Leu Gln Glu
2795 2800 2805
Arg Lys Lys Glu Glu Arg Thr Phe Ala Ala Phe Leu Leu His Gly
2810 2815 2820
Phe Gly Ala Ser Ala Asp Val Ser Phe Asp Val Cys Thr Pro Asp
2825 2830 2835
Gly His Cys Ala Phe Ala Gly Thr Phe Ala Val Leu Gly Gly Glu
2840 2845 2850
Leu Glu Met Pro Trp Ser Phe Glu Arg Leu Phe Arg Tyr Asp Ile
2855 2860 2865
Thr Lys Val Leu Lys Gln Met Asn Leu His Tyr Asp Ser Glu Phe
2870 2875 2880
His Phe Glu Leu Lys Ile Val Gly Thr Asp Gly Thr Glu Leu Pro
2885 2890 2895
Ser Asp Arg Ile Lys Ser Pro Thr Ile Glu His His Gly Gly Asp
2900 2905 2910
His His Gly Gly Asp Thr Ser Gly His Asp His Ser Glu Arg His
2915 2920 2925
Asp Gly Phe Phe Arg Lys Glu Val Gly Ser Leu Ser Leu Asp Glu
2930 2935 2940
Ala Asn Asp Leu Lys Asn Ala Leu Tyr Lys Leu Gln Asn Asp Gln
2945 2950 2955
Gly Pro Asn Gly Tyr Glu Ser Ile Ala Gly Tyr His Gly Tyr Pro
2960 2965 2970
Phe Leu Cys Pro Glu His Gly Glu Asp Gln Tyr Ala Cys Cys Val
2975 2980 2985
His Gly Met Pro Val Phe Pro His Trp His Arg Leu His Thr Ile
2990 2995 3000
Gln Phe Glu Arg Ala Leu Lys Glu His Gly Ser His Leu Gly Ile
3005 3010 3015
Pro Tyr Trp Asp Trp Thr Lys Ser Met Ile Ala Leu Pro Ala Phe
3020 3025 3030
Phe Ala Asp Ser Ser Asn Ser Asn Pro Phe Tyr Lys Tyr His Ile
3035 3040 3045
Met Lys Ala Gly His Asp Thr Ala Arg Ser Pro Ser Asp Leu Leu
3050 3055 3060
Phe Asn Gln Pro Gln Leu His Gly Tyr Asp Tyr Leu Tyr Tyr Leu
3065 3070 3075
Ala Leu Ser Thr Leu Glu Glu Asp Asn Tyr Cys Asp Phe Glu Val
3080 3085 3090
His Tyr Glu Ile Leu His Asn Ala Val His Leu Trp Leu Gly Gly
3095 3100 3105
Thr Glu Thr Tyr Ser Met Ser Ser Leu Ala Phe Ser Ala Tyr Asp
3110 3115 3120
Pro Val Phe Met Ile Leu His Ser Gly Leu Asp Arg Leu Trp Ile
3125 3130 3135
Ile Trp Gln Glu Leu Gln Lys Leu Arg Lys Lys Pro Tyr Asn Ala
3140 3145 3150
Ala Lys Cys Ala Gly His Met Met Asp Glu Pro Leu His Pro Phe
3155 3160 3165
Asn Tyr Glu Ser Ala Asn His Asp Ser Phe Thr Arg Ala Asn Ala
3170 3175 3180
Lys Pro Ser Thr Val Phe Asp Ser His Lys Phe Asn Tyr His Tyr
3185 3190 3195
Asp Asn Pro Asp Val Arg Gly Asn Ser Ile Gln Glu Ile Ser Ala
3200 3205 3210
Ile Ile His Asp Leu Arg Asn Gln Pro Arg Val Phe Ala Gly Phe
3215 3220 3225
Val Leu Ser Gly Ile Tyr Thr Ser Ala Asn Val Lys Ile Tyr Leu
3230 3235 3240
Val Arg Glu Gly His Asp Asp Glu Asn Val Gly Ser Phe Val Val
3245 3250 3255
Leu Gly Gly Pro Lys Glu Met Pro Trp Ala Tyr Glu Arg Ile Phe
3260 3265 3270
Lys Tyr Asp Ile Thr Glu Val Ala Asn Arg Leu Asn Met His His
3275 3280 3285
Asp Asp Thr Phe Asn Phe Arg Leu Glu Val Gln Ser Tyr Thr Gly
3290 3295 3300
Glu Met Val Thr His His Leu Pro Glu Pro Leu Ile Ile Tyr Arg
3305 3310 3315
Pro Ala Lys Gln Glu Tyr Asp Val Leu Val Ile Pro Leu Gly Ser
3320 3325 3330
Gly His Lys Leu Pro Pro Lys Val Ile Val Lys Arg Gly Thr Arg
3335 3340 3345
Ile Met Phe His Pro Val Asp Asp Thr Val Asn Arg Pro Val Val
3350 3355 3360
Asp Leu Gly Ser His Thr Ala Leu Tyr Asn Cys Val Val Pro Pro
3365 3370 3375
Phe Thr Tyr Asn Gly Tyr Glu Leu Asp His Ala Tyr Ser Leu Arg
3380 3385 3390
Asp Gly His Tyr Tyr Ile Ala Gly Pro Thr Lys Asp Leu Cys Thr
3395 3400 3405
Ser Gly Asn Val Arg Ile His Ile His Ile Glu Asp Glu
3410 3415 3420
<---
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и предназначена для иммунотерапии злокачественных опухолей. Фармацевтическая композиция представляет собой вакцину, индуцирующую образование антител против опухоли. Вакцина содержит иммуногенный гликоконъюгат Globo-H-KLH (OBI-822), в котором молекулы опухолевого антигена Globo-H ковалентно связаны с молекулами структурных субъединиц гемоцианина моллюска KLH по одному или более остаткам аминокислот. Указанная композиция имеет эпитопное отношение молекула Globo-H/молекула структурной субъединицы KLH в диапазоне от 750 до 3000. В одном варианте осуществления изобретения молекула Globo-H связанна с KLH посредством ковалентной связи с 4-(4--малеимидометил)циклогексан-1-карбоксилгидразидом (MMCCH). В другом варианте – указанная композиция может содержать адъювант α-галактозилцерамид (α-GalCer). В одном варианте осуществления способ лечения злокачественной опухоли включает введение пациенту терапевтически эффективного количества указанной фармацевтической композиции. В другом варианте – указанную композицию вводят индивидууму с целью получения моноклональных антител для терапевтического или диагностического применения. Группа изобретений позволяет вызвать высокий уровень иммунного ответа, направленного на Globo-H. 5 н. и 41 з.п. ф-лы, 7 табл., 38 ил., 9 пр.
Формула
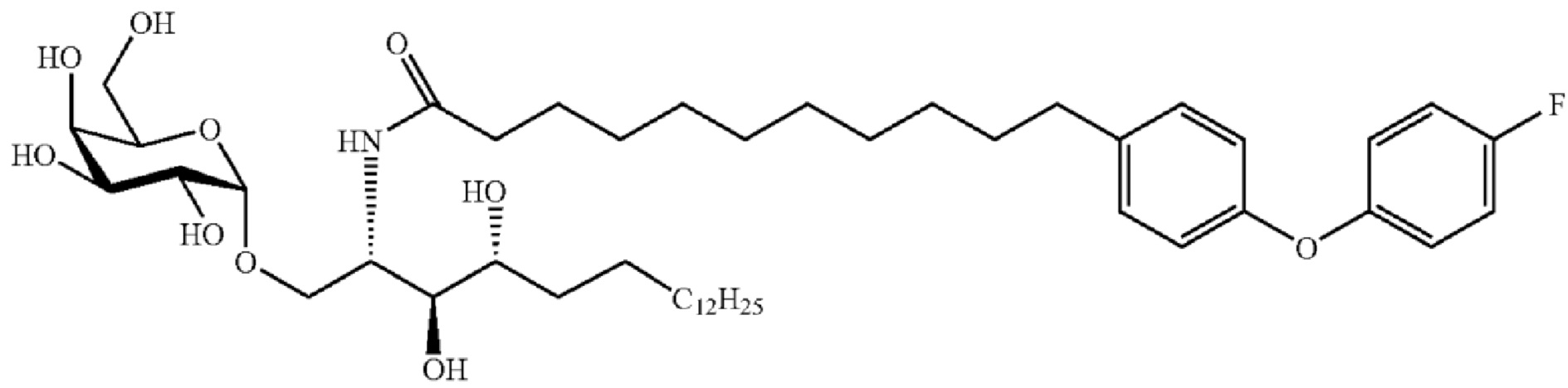
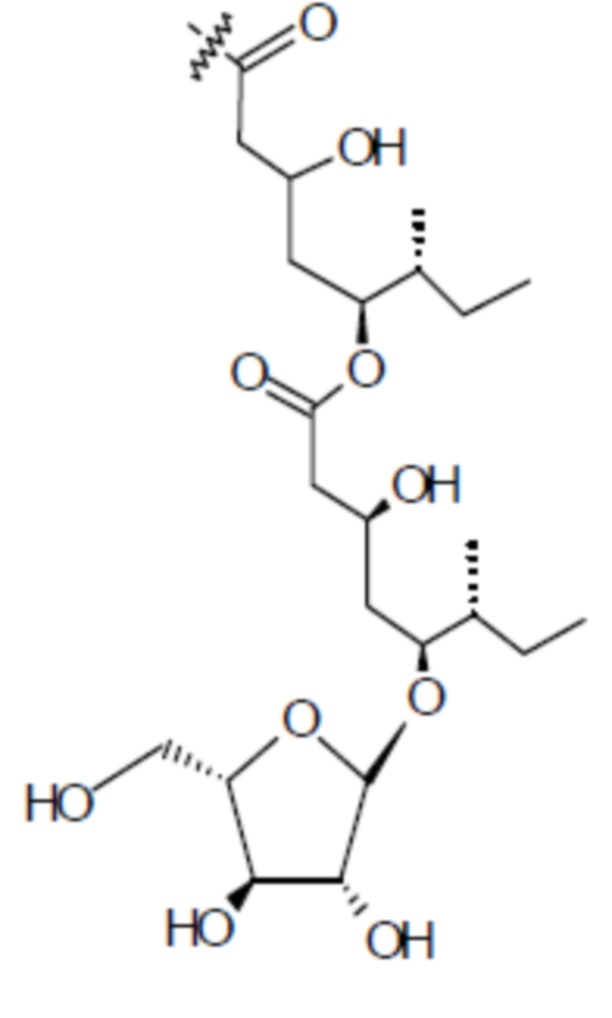
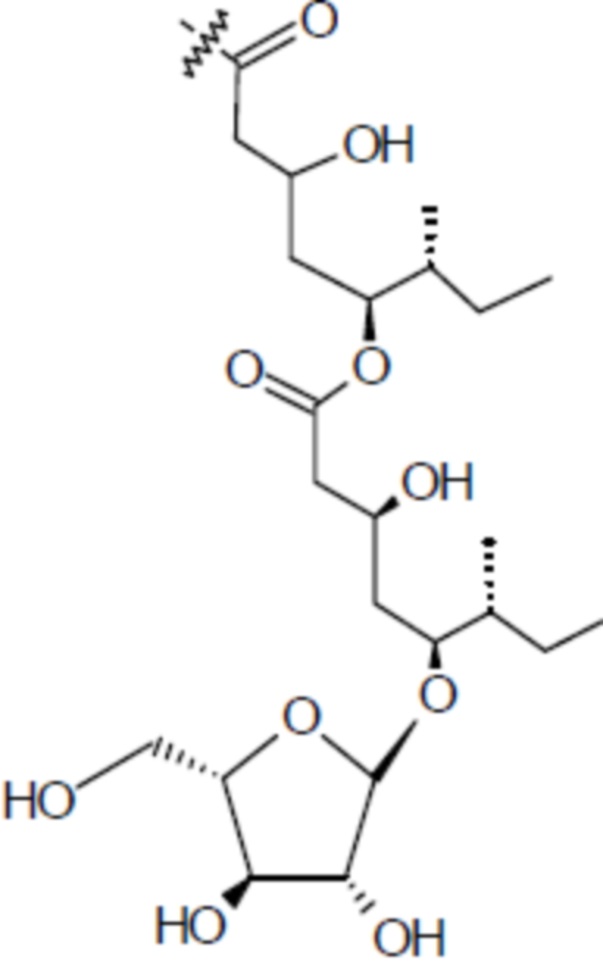
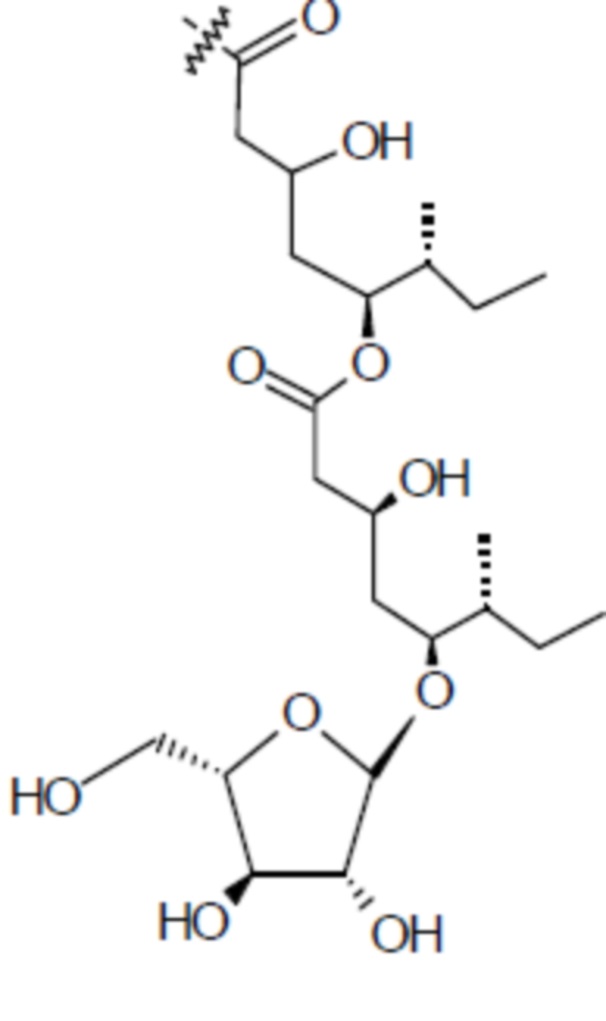


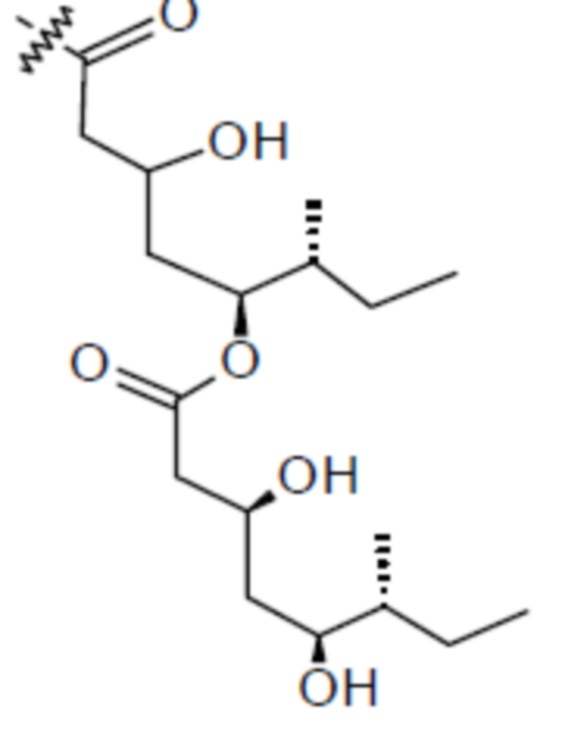

Комментарии