Способ получения полипептидов - RU2699715C2
Код документа: RU2699715C2
Чертежи

















Описание
Настоящее изобретение находится в области экспрессии белков. В данном документе заявлен промотор с по меньшей мере одной точечной мутацией и способ, согласно которому используют этот промотор, чтобы получать полипептид.
Предшествующий уровень техники
Экспрессия белков является фундаментальным процессом в живых клетках. Всю информацию, необходимую для экспрессии белка, определяет единственная нуклеиновая кислота. Эта нуклеиновая кислота не только содержит информацию об аминокислотной последовательности белка, но также обеспечивает необходимую информацию о регуляции (например, рибосомный участок связывания, стартовые и конечные сигналы транскрипции, сигналы сплайсинга, элементы энхансера и т.д.), включая промотор / промоторную последовательность.
Промотор является нуклеиновой кислотой, которая регулирует уровень транскрипции нуклеиновой кислоты, например кодирующей полипептид, с которой он функционально связан, в предшественник матричной рибонуклеиновой кислоты (пре-мРНК). Он представляет собой элемент регулирования транскрипции, который располагается вокруг участка инициации РНК-полимеразы на 5'-конце функционально связанной кодирующей последовательности. Из анализа раннего промотора вируса обезьян 40 (SV40, от лат. "simian virus 40") известно, что участки распознавания/связывания для активаторов транскрипции содержатся в промоторах в сегментах, состоящих из 7-20 пар оснований. Один сегмент является участком инициации синтеза РНК, например хорошо известный ТАТА-бокс. Другие сегменты, расположенные приблизительно на удалении от 30 до 110 пар оснований от 5', т.е. против хода транскрипции, относительно участка инициации синтеза РНК, определяют частоту инициации транскрипции. Промотору требуется по меньшей мере один сегмент, который инициирует синтез РНК на конкретном участке и в определенном направлении, т.е. в направлении от 5' к 3'.
Постепенная потеря продуктивности в долгоживущей культуре является обычной проблемой при разработке клеточных линий на производстве (Barnes, L.M., et al. Biotechnol. Bioeng. 81 (2003) 631-639). Уменьшение экспрессии рекомбинантного белка может быть связано с потерей трансгенных копий и/или подавлением трансгенного промотора (смотрите например Escher, G., et al. J. Lipid Res. 46 (2005) 356-365; Krishnan, M., et al., FASEB J. 20 (2006) 106-108; Yang, Y., et al., J. Biotechnol. 147 (2010) 180-185). Подавление промоторов вызвано эпигенетическими модификациями хроматина, такими как посттрансляционные модификации гистонов, а также прямое метилирование промотора дезоксирибонуклеиновой кислоты (ДНК) на участках CpG (смотрите например Cedar, Н. and Bergman, Y., Nat. Rev. Genet. 10 (2009) 295-304; De Carvalho, D.D. et al., Trends Cell Biol 20 (2010): 609-617; Klose; R.J. and Bird, A.P., Trends Biochem Sci 31 (2006): 89-97). Метилированные промоторы являются обычно неактивными.
Очень сильный промотор и энхансер основных немедленно-ранних генов цитомегаловируса человека (чЦМВ-ОНР) используют для рекомбинантной экспрессии полипептидов в клетках млекопитающих. Было показано, что промотор подвержен подавлению экспрессии метилированием как во временно, так и в стабильно трансфицированных клетках млекопитающих (смотрите например Escher, G., et al. J. Lipid Res. 46 (2005) 356-365; Krishnan, M., et al., FASEB J. 20 (2006) 106-108; Proesch, S. et al., Biol Chem Heppe Seyler 377 (1996): 195-201; Yang, Y., et al., J. Biotechnol. 147 (2010) 180-185).
Прежде в WO 2011/128377 было продемонстрировано, что прямое метилирование промотора чЦМВ-ОНР можно использовать в качестве раннего маркера, чтобы предугадать нестабильность продуцирования рекомбинантных клеточных линий яичников китайского хомячка (СНО, от англ. "Chinese hamster ovary").
Osterlehner, А., с соавтор. сообщает о метилировании промотора и числе копий трансгенов, предсказывает продуцирование нестабильного белка в рекомбинантных клеточных линиях яичников китайского хомячка и описывает, что разные участки CpG метилируются с разной частотой (Biotechnol. Bioeng. 108 (2011) 2670-2681).
Сущность изобретения
Обнаружено, что точечная мутация С (цитозин) в G (гуанин), т.е. одна мутация С в G, в промоторе чЦМВ-ОНР на конкретных участках приводит к сниженному подавлению промотора и таким образом к улучшенной стабильности продуцирования. Кроме того, было обнаружено, что могут быть достигнуты более высокие титры продуцируемого полипептида. Было показано, что мутация С в G в положении -41 и/или в положении -179 относительно участка инициации транскрипции является чрезвычайно эффективной.
Одним аспектом, как сообщается в данном документе, является промотор ЦМВ человека (на основе промотора последовательности SEQ ID NO 1), который имеет в нуклеотидном положении -41 (и/) или -179 относительно участка инициации транскрипции нуклеотид G.
В одном воплощении этого аспекта промотор ЦМВ человека обладает улучшенной стабильностью продуцирования и/или улучшенным титром продукта (по сравнению с промоторами ЦМВ человека без точечных мутаций С в G в положении -41 и/или -179 относительно участка инициации транскрипции).
В одном воплощении этого аспекта промотор ЦМВ человека имеет нуклеотидную последовательность SEQ ID NO 02 или SEQ ID NO 03.
Одним аспектом, как сообщается в данном документе, является промотор, который имеет нуклеотидную последовательность SEQ ID NO 02.
Одним аспектом, как сообщается в данном документе, является нуклеиновая кислота, отличающаяся тем, что включает нуклеиновую кислоту SEQ ID NO 02 и обладает силой промотора по меньшей мере 80% относительно основного немедленно-раннего промотора ЦМВ человека SEQ ID NO 01, когда функционально связана с нуклеиновой кислотой SEQ ID NO 04, кодирующей усиленный зеленый флуоресцентный белок (eGFP, от англ. "enhanced green fluorescent protein").
Одним аспектом, как сообщается в данном документе, является способ получения полипептида, отличающийся тем, что включает следующие стадии, согласно которым:
a) трансфицируют эукариотическую клетку нуклеиновой кислотой, включающей кассету экспрессии, содержащую первую нуклеиновую кислоту SEQ ID NO 02, функционально связанную со второй нуклеиновой кислотой, кодирующей полипептид,
b) отбирают клетку, трансфицированную на стадии а),
c) культивируют клетку, отобранную на стадии b) (в условиях, пригодных для экспрессии полипептида),
d) выделяют полипептид из клетки или культуральной среды,
и таким образом получают полипептид.
В одном воплощении этого аспекта получение является получением в крупных масштабах. В одном воплощении получение проводят в конечном объеме культивирования 500 л или более, в одном воплощении от 500 л до 10000 л.
В одном воплощении этого аспекта указанный полипептид представляет собой иммуноглобулин, или фрагмент иммуноглобулина, или конъюгат иммуноглобулина.
В одном воплощении этого аспекта полипептид представляет собой легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина, или их вариант, или их фрагмент, или их слияние.
В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую селективный маркер. В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина.
В одном воплощении этого аспекта указанная эукариотическая клетка представляет собой клетку млекопитающего.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО, клетку почки новорожденного хомяка (ВНК, от англ. "baby hamster kidney"), клетку почки эмбриона человека (HEK, от англ. "human embryonic kidney"), Sp2/0 клетку или Per.С6® клетку.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО или клетку HEK.
В одном воплощении этого аспекта указанный селективный маркер представляет собой дигидрофолатредуктазу, аминогликозидфосфотрансферазу или гигромицин-фосфотрансферазу.
Одним аспектом, как сообщается в данном документе, является применение промотора SEQ ID NO 02 для получения полипептида.
Одним аспектом, как сообщается в данном документе, является клетка, включающая промотор, как сообщается в данном документе, или нуклеиновую кислоту, как сообщается в данном документе.
Одним аспектом, как сообщается в данном документе, является промотор, который имеет нуклеотидную последовательность SEQ ID NO 03.
Одним аспектом, как сообщается в данном документе, является нуклеиновая кислота, отличающаяся тем, что включает нуклеиновую кислоту SEQ ID NO 03 и обладает силой промотора по меньшей мере 80% относительно основного немедленно-раннего промотора ЦМВ человека SEQ ID NO 01, когда функционально связана с нуклеиновой кислотой SEQ ID NO 04, кодирующей усиленный зеленый флуоресцентный белок (eGFP).
Одним аспектом, как сообщается в данном документе, является способ получения полипептида, отличающийся тем, что включает следующие стадии, согласно которым:
а) трансфицируют эукариотическую клетку нуклеиновой кислотой, включающей кассету экспрессии, содержащую первую нуклеиновую кислоту SEQ ID NO 03, функционально связанную со второй нуклеиновой кислотой, кодирующей полипептид,
b) отбирают клетку, трансфицированную на стадии а),
c) культивируют клетку, отобранную на стадии b) (в условиях, пригодных для экспрессии полипептида),
d) выделяют полипептид из клетки или культуральной среды,
и таким образом получают полипептид.
В одном воплощении этого аспекта получение является получением в крупных масштабах. В одном воплощении получение проводят в конечном объеме культивирования 500 л или более, в одном воплощении от 500 л до 10000 л.
В одном воплощении этого аспекта указанный полипептид представляет собой иммуноглобулин, или фрагмент иммуноглобулина, или конъюгат иммуноглобулина.
В одном воплощении этого аспекта полипептид представляет собой легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина, или их вариант, или их фрагмент, или их слияние.
В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую селективный маркер. В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина.
В одном воплощении этого аспекта указанная эукариотическая клетка представляет собой клетку млекопитающего.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО, клетку ВНК, клетку HEK, Sp2/0 клетку или Per.С6® клетку.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО или клетку HEK.
В одном воплощении этого аспекта указанный селективный маркер представляет собой дигидрофолатредуктазу, аминогликозидфосфотрансферазу или гигромицин-фосфотрансферазу.
Одним аспектом, как сообщается в данном документе, является применение промотора SEQ ID NO 03 для получения полипептида.
Одним аспектом, как сообщается в данном документе, является клетка, включающая промотор, как сообщается в данном документе, или нуклеиновую кислоту, как сообщается в данном документе.
Одним аспектом, как сообщается в данном документе, является промотор ЦМВ человека, который имеет в нуклеотидном положении -41 относительно участка инициации транскрипции нуклеотид G.
В одном воплощении этого аспекта промотор ЦМВ человека представляет собой основной немедленно-ранний промотор ЦМВ человека.
Одним аспектом, как сообщается в данном документе, является промотор ЦМВ человека, который имеет в нуклеотидном положении -179 относительно участка инициации транскрипции нуклеотид G.
В одном воплощении этого аспекта промотор ЦМВ человека представляет собой основной немедленно-ранний промотор ЦМВ человека.
Подробное описание изобретения
При использовании стабильно трансфицированных эукариотических клеточных линий для получения/экспрессии рекомбинантных полипептидов, подобных секретируемым белкам, внутриклеточному репортерному белку или маркеру клеточной поверхности, постепенная потеря продуктивности в долгоживущей культуре является обычной проблемой при разработке клеточных линий на производстве (Barnes, L.M., et al. Biotechnol. Bioeng. 81 (2003) 631-639). При получении клеточных линий/клеточных клонов, т.е. клеточного клона/клеточных линий, которые следует использовать для крупномасштабного рекомбинантного продуцирования полипептида, такого как, например антитело, стабильность получения, т.е. потеря продуктивности выработки в ходе получения, клеточного клона/клеточной линии имеет значение. Таким образом, клеточные линии млекопитающего для продуцирования рекомбинантного белка нуждаются в сохранении продуктивности в течение увеличенного времени культивирования. Как правило, стабильность продуцирования клеточного клона/клеточной линии определяют, культивируя клеточный клон/клеточную линию в течение длительного периода времени. Через равные промежутки времени среду разбавляют свежей средой и удельную продуктивность на клетку определяют, исходя из титра продукта и плотности жизнеспособных клеток. Изменение (обычно снижение) удельной продуктивности указывает на стабильность длительного продуцирования клеточного клона/клеточной линии.
Уменьшение экспрессии рекомбинантного белка может быть связано с потерей трансгенных копий и/или подавлением трансгенного промотора (смотрите например Escher, G., et al. J. Lipid Res. 46 (2005) 356-365; Krishnan, M., et al., FASEB J. 20 (2006) 106-108; Yang, Y., et al., J. Biotechnol. 147 (2010) 180-185). Подавление промоторов вызвано эпигенетическими модификациями хроматина, такими как посттрансляционные модификации гистонов, а также прямое метилирование промотора ДНК на участках CpG (смотрите например Cedar, Н. and Bergman, Y., Nat. Rev. Genet. 10 (2009) 295-304; De Carvalho, D.D. et al., Trends Cell Biol 20 (2010): 609-617; Klose; R.J. and Bird, A.P., Trends Biochem Sci 31 (2006): 89-97). Метилированные промоторы являются обычно неактивными.
Как было ранее показано Osterlehner, А., с соавтор., метилирование промотора и число копий трансгенов предопределяют продуцирование нестабильного белка в рекомбинантных клеточных линиях яичников китайского хомячка, и описано, что разные участки CpG метилируются с разной частотой (Biotechnol. Bioeng. 108 (2011)2670-2681).
В данном документе исследованы разные участки CpG отдельно или в комбинации. Вырабатывали и исследовали на длительную продуктивность разные клеточные линии, содержащие точечные мутации CpG в пределах основного немедленно-раннего промотора/энхансера ЦМВ человека.
Важно, чтобы мутации в промоторах незначительно влияли на его эффективность экспрессии гена, т.е. не должны влиять на силу промотора.
В настоящем изобретении было обнаружено, что на силу промотора не влияют в чЦМВ-ОНР промоторе точечные мутации, выполненные, как сообщается в данном документе. Возможно обнаружить незначительные различия между плазмидами с точечной мутацией во фрагменте основного немедленно-раннего промотора / энхансера ЦМВ человека и немутированной контрольной плазмидой.
Изобретение по меньшей мере частично основывается на открытии, что подавление промоторов можно уменьшить в ходе точечных мутаций из С в G на конкретных участках CpG основного немедленно-раннего промотора / энхансера ЦМВ человека. Таким образом, стабильность длительного продуцирования клеточных линий можно улучшить и рекомбинантные полипептиды могут быть продуцированы в течение длительного периода времени с высокими/более высокими выходами.
Типичные клетки СНО были стабильно трансфицированы плазмидой 16107 (с точечной мутацией С-179 в G) или плазмидой 16109 (с точечной мутацией С-41 в G) и культивированы. Интенсивности eGFP 8-10 независимых стабильно трансфицированных клеточных популяций на плазмиду определяли в течение увеличенного времени культивирования.
Статистически значимое различие в длительной продуктивности трансфицированных клеток детектировали между клетками, которые были трансфицированы либо плазмидой 16109, либо контрольной плазмидой 16111 (р-значения менее 0,05; смотрите таблицу ниже).
Обнаружено, что положительное влияние на стабильность экспрессии репортерного гена может быть достигнуто, когда вводиться точечная мутация С в G в положении -41 относительно участка инициации транскрипции, т.е. участок метилирования исключен.

Таким образом, одним аспектом, как сообщается в данном документе, является промотор, который имеет нуклеотидную последовательность SEQ ID NO 02, т.е. промотор чЦМВ-ОНР с точечной мутацией С-41 в G. В одном воплощении промотор имеет по меньшей мере одну точечную мутацию С в G. В одном воплощении промотор имеет две точечные мутации С в G. В одном воплощении промотор имеет три точечные мутации С в G. В одном предпочтительном воплощении промотор имеет одиночную точечную мутацию из С в G. В одном предпочтительном воплощении промотор имеет одиночную точечную мутацию из С в G в положении -41 относительно участка инициации транскрипции. В одном предпочтительном воплощении промотор имеет одиночную точечную мутацию из С в G в положении -179 относительно участка инициации транскрипции.
Другим аспектом, как сообщается в данном документе, является нуклеиновая кислота, отличающаяся тем, что включает нуклеиновую кислоту SEQ ID NO 02 и обладает силой промотора по меньшей мере 80% относительно основного немедленно-раннего промотора ЦМВ человека SEQ ID NO 01, когда функционально связана с нуклеиновой кислотой SEQ ID NO 04, кодирующей усиленный зеленый флуоресцентный белок (eGFP).
Одним аспектом, как сообщается в данном документе, является способ получения полипептида, отличающийся тем, что включает следующие стадии, согласно которым:
a) трансфицируют эукариотическую клетку нуклеиновой кислотой, включающей кассету экспрессии, содержащую первую нуклеиновую кислоту SEQ ID NO 02 (т.е. чЦМВ-ОНР промотор с точечной мутацией С-41 в G), функционально связанную со второй нуклеиновой кислотой, кодирующей полипептид,
b) отбирают клетку, трансфицированную на стадии а),
c) культивируют клетку, отобранную на стадии b) (в условиях, пригодных для экспрессии полипептида),
d) выделяют полипептид из клетки или культуральной среды,
и таким образом получают полипептид.
В одном воплощении этого аспекта получение является получением в крупных масштабах. В одном воплощении получение проводят в конечном объеме культивирования 500 л или более, в одном воплощении от 500 л до 10000 л.
В одном воплощении этого аспекта указанный полипептид представляет собой иммуноглобулин, или фрагмент иммуноглобулина, или конъюгат иммуноглобулина.
В одном воплощении этого аспекта полипептид представляет собой легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина, или их вариант, или их фрагмент, или их слияние. Подразумевается, что необходимо включать дополнительную кассету экспрессии с нуклеиновой кислотой, кодирующей соответствующую другую цепь иммуноглобулина, если необходимо получить целую молекулу иммуноглобулина. Например, если полипептид представляет собой легкую цепь иммуноглобулина, вводят дополнительную кассету экспрессии с нуклеиновой кислотой, кодирующей тяжелую цепь иммуноглобулина. В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина.
В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую селективный маркер. В одном воплощении этого аспекта указанный селективный маркер представляет собой дигидрофолатредуктазу, аминогликозидфосфотрансферазу или гигромицин-фосфотрансферазу. Другим аспектом, как сообщается в данном документе, является применение промотора SEQ ID NO 02 для получения полипептида.
В одном воплощении этого аспекта указанная эукариотическая клетка представляет собой клетку млекопитающего. В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО, клетку ВНК, клетку HEK, Sp2/0 клетку или Per.С6® клетку. В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО или клетку HEK.
Непосредственно сравнивали дополнительные клеточные линии 16107 и 16111. Тенденция клеточной линии 16107 к большей экспрессии eGFP по сравнению с контрольной клеточной линией 16111 показала положительное влияние точечной мутации С в G в положении С-179 относительно участка инициации транскрипции на стабильность экспрессии гена eGFP.
Положение -41 относительно участка инициации транскрипции соответствует положению 561 SEQ ID NO 01. Положение -179 относительно участка инициации транскрипции соответствует положению 423 SEQ ID NO 01.
Таким образом, одним аспектом, как сообщается в данном документе, является промотор, который имеет нуклеотидную последовательность SEQ ID NO 03, т.е. чЦМВ-ОНР промотор с точечной мутацией С-179 в G.
Другим аспектом, как сообщается в данном документе, является нуклеиновая кислота, отличающаяся тем, что включает нуклеиновую кислоту SEQ ID NO 03 и обладает силой промотора по меньшей мере 80% относительно основного немедленно-раннего промотора ЦМВ человека SEQ ID NO 01, когда функционально связана с нуклеиновой кислотой SEQ ID NO 04, кодирующей усиленный зеленый флуоресцентный белок (eGFP).
Другим аспектом, как сообщается в данном документе, является способ получения полипептида, отличающийся тем, что включает следующие стадии, согласно которым:
a) трансфицируют эукариотическую клетку нуклеиновой кислотой, включающей кассету экспрессии, содержащую первую нуклеиновую кислоту SEQ ID NO 03, функционально связанную со второй нуклеиновой кислотой, кодирующей полипептид,
b) отбирают клетку, трансфицированную на стадии а),
c) культивируют клетку, отобранную на стадии b) (в условиях, пригодных для экспрессии полипептида),
d) выделяют полипептид из клетки или культуральной среды,
и таким образомполучают полипептид.
В одном воплощении этого аспекта получение является получением в крупных масштабах. В одном воплощении получение проводят в конечном объеме культивирования 500 л или более, в одном воплощении от 500 л до 10000 л.
В одном воплощении этого аспекта указанный полипептид представляет собой иммуноглобулин, или фрагмент иммуноглобулина, или конъюгат иммуноглобулина.
В одном воплощении этого аспекта полипептид представляет собой легкую цепь иммуноглобулина или тяжелую цепь иммуноглобулина, или их вариант, или их фрагмент, или их слияние.
В одном воплощении этого аспекта нуклеиновая кислота включает дополнительную кассету экспрессии, кодирующую селективный маркер.
В одном воплощении этого аспекта указанная эукариотическая клетка представляет собой клетку млекопитающего.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО, клетку ВНК, клетку HEK, Sp2/0 клетку или Per.С6® клетку.
В одном воплощении этого аспекта указанная клетка млекопитающего представляет собой клетку СНО или клетку HEK.
В одном воплощении этого аспекта указанный селективный маркер представляет собой дигидрофолатредуктазу, аминогликозидфосфотрансферазу или гигромицин-фосфотрансферазу.
Другим аспектом, как сообщается в данном документе, является применение промотора SEQ ID NO 03 для получения полипептида.
Определения
"Промотор" относится к нуклеиновой кислоте, т.е. полинуклеотидной последовательности, которая регулирует транскрипцию нуклеиновой кислоты, с которой функционально связана. Промотор может включать сигналы связывания РНК-полимеразы и инициации транскрипции. Используемый промотор(ы) может функционировать в таком клеточном типе клетки-хозяина, в котором предполагается экспрессия функционально связанной нуклеиновой кислоты. Большое число промоторов, включая конститутивные, индуцируемые и репрессируемые промоторы из целого ряда разных источников, хорошо известны в данной области техники (и идентифицированы в базах данных, таких как GenBank). Они имеются в продаже в качестве или в составе клонированных полинуклеотидов (например, из хранилищ, таких как Американская коллекция типовых культур (АТСС, от англ. "American Туре Culture Collection", а также из других коммерческих или частных источников). "Промотор" включает нуклеотидную последовательность, которая направляет транскрипцию, например, функционально связанного структурного гена. Обычно промотор располагается в 5'-некодирующей или 5'-нетранслируемой области (5'НТО) гена, проксимально расположенной по отношению к участку инициации транскрипции структурного гена. Элементы последовательности в промоторах, которые задействованы в инициации транскрипции, часто характеризуются согласованными нуклеотидными последовательностями. Такие элементы последовательности включают участки связывания РНК-полимеразы, последовательности TATA, последовательности СААТ, специфичные по дифференциации элементы (DSE, от англ. differentiation specific element; McGehee, R.E., et al., Mol. Endocrinol. 7 (1993) 551), цАМФ-ответный элемент (CRE, от англ. cAMP response element), элементы ответа сыворотки (SRE, от англ. serum response element; Treisman, R., Seminars in Cancer Biol. 1 (1990) 47), глюкокортикоид-отвечающий элемент (GRE, от англ. glucocorticoid response element) и сайты связывания других факторов транскрипции, таких как CRE/ATF (активирующий фактор транскрипции) (O'Reilly, М.А., et al., J. Biol. Chem. 267 (1992) 19938), AP2 (Ye, J., et al., J. Biol. Chem. 269 (1994) 25728), SP1, белок, связывающий цАМФ-ответные элементы (CREB, от англ. "cAMP response element binding protein"; Loeken, M.R., Gene Expr. 3 (1993) 253-264) и октамерные факторы (в общем смотрите Watson et al., eds., Molecular Biology of the Gene, 4th ed., The Benjamin/Cummings Publishing Company, Inc. 1987, и Lemaigre, F.P. and Rousseau, G.G., Biochem. J. 303 (1994) 1-14). Если промотор является индуцируемым промотором, скорость транскрипции повышается в ответ на индуцирующий агент. Напротив, скорость транскрипции не регулируется индуцирующим агентом, если промотор является конститутивным промотором. Также известны репрессируемые промоторы. Например, промотор с-fos специфически активируется при связывании гормона роста с его рецептором на клеточной поверхности. Регулируемая тетрациклином (тет) экспрессия может быть достигнута искусственными гибридными промоторами, которые состоят, например, из промотора ЦМВ с последующими двумя участками Тет-оператора. Тет-репрессор связывается с двумя участками Тет-оператора и блокирует транскрипцию. При добавлении индуктора тетрациклина Тет-репрессор высвобождается из участков Тет-оператора и происходит транскрипция (Gossen, М. and Bujard, Н., Proc. Natl. Acad. Sci. USA 89 (1992) 5547-5551). О других индуцируемых промоторах, включая промотор металлотионеина и промоторы теплового шока, смотрите, например, Sambrook, et al. (выше) и Gossen, М., et al., Curr. Opin. Biotech. 5 (1994) 516-520. Среди эукариотических промоторов, которые определены как сильные промоторы для высокоуровневой экспрессии, присутствуют ранний промотор SV40, главный поздний промотор аденовируса, промотор металлотионеина-1 мыши, длинный концевой повтор вируса саркомы Рауса, фактор элонгации 1 альфа китайского хомячка (CHEF-1, от англ. "Chinese hamster elongation factor 1 alpha", смотрите например US 5,888,809), фактор элонгации 1 (ФЭ-1) альфа человека, убиквитин и основной немедленно-ранний промотор цитомегаловируса человека (ЦМВ-ОНР). "Энхансер" (т.е. цис-действующий элемент ДНК, который воздействует на промотор для увеличения транскрипции) может быть необходим для действия в сочетании с промотором, чтобы повысить уровень экспрессии, получаемый с одним промотором, и может быть включен в качестве регулирующего элемента транскрипции. Часто полинуклеотидный сегмент, содержащий промотор, может также включать последовательности энхансера (например, ЦМВ или SV40).
Термин "CpG-участок" обозначает динуклеотид CG в составе нуклеиновой кислоты, которую могут распознавать метилирующие ферменты клетки, и где цитозин можно превратить в 5-метил-цитозин. В одном воплощении CpG-участок входит в состав нуклеиновой кислоты промотора.
Термин "нуклеиновая кислота", как используется в данном документе, означает полимер, состоящий из отдельных нуклеотидов, т.е. полинуклеотид. Этот термин относится к встречающейся в природе или частично или полностью неприродной нуклеиновой кислоте, которая, например, кодирует полипептид, который можно получать путем рекомбинации. Нуклеиновая кислота может быть образована фрагментами ДНК, которые либо выделены, либо синтезированы химическими способами. Нуклеиновая кислота может быть включена в другую нуклеиновую кислоту, например, в экспрессирующую плазмиду или геном/хромосому клетки-хозяина. Плазмида включает челночные и экспрессирующие векторы. Обычно плазмида также включает прокариотическую единицу размножения, включающую точку начала репликации (например точку начала репликации ColE1) и селективный маркер (например, ген устойчивости к ампициллину или тетрациклину) для репликации и отбора, соответственно, вектора у бактерий.
Термин "сила промотора" и его грамматические эквиваленты, как используются в настоящем изобретении, обозначает эффективность промотора в транскрипции функционально связанной нуклеиновой кислоты. Сила промотора может быть высокой, т.е. может составлять от 75% до более 100%, или средней, т.е. может составлять от 40% до менее 75%, или низкой, т.е. может составлять менее 40%, по сравнению с силой промотора чЦМВ-ОНР промотора дикого типа SEQ ID NO 01. Это значение может быть определено сравнением количества экспрессии гетерологичного полипептида, функционально связанного с промотором, о котором идет речь, с количеством экспрессии гетерологичного полипептида, функционально связанного с промотором SV40 дикого типа в клетках того же типа. Это может быть выполнено, например, путем определения количества экспрессии гетерологичного полипептида в СНО- или HEK-клетках, трансфицированных кассетой экспрессии, включающей рассматриваемый промотор, функционально связанный с нуклеиновой кислотой, кодирующей гетерологичный полипептид, в ходе иммуноферментного анализа (ИФА). Путем сравнения этого количества с количеством экспрессии того же гетерологичного полипептида в той же самой клеточной линии, трансфицированной кассетой экспрессии, включающей промотор SV40 дикого типа, функционально связанного с нуклеиновой кислотой, кодирующей гетерологичный полипептид, определенный тем же способ ИФА, т.е. сравнивая количество гетерологичного полипептида в той же самой клетки с той же самой экспрессирующей плазмидой, где заменен только промотор, можно определить относительную силу промотора.
"Функционально связанный" относится к соприкосновению двух или более компонентов, где компоненты, описанные таким образом, находятся в связи, допускающей их функционирование предполагаемым образом. Например, промотор и/или энхансер функционально связаны с кодирующей последовательностью, если он действует в цис-положении для регулирования или модулирования транскрипции связанной кодирующей последовательности. Как правило, но не обязательно, последовательности ДНК, которые "функционально связаны", соприкасаются и при необходимости соединяют два белка, кодирующие области, такие как секреторная лидерная/сигнальная последовательность и полипептид, соприкасающиеся и находящиеся в рамке считывания. Однако хотя функционально связанный промотор обычно расположен против хода транскрипции от кодирующей последовательности, не обязательно, что он примыкает к ней. Энхансеры не должны соприкасаться. Энхансер функционально связан с кодирующей последовательностью, если энхансер повышает транскрипцию кодирующей последовательности. Функционально связанные энхансеры могут располагаться против хода транскрипции, внутри или по ходу транскрипции кодирующих последовательностей и на значительном удалении от промотора. Участок полиаденилирования функционально связан с кодирующей последовательностью, если он располагается на конце по ходу транскрипции кодирующей последовательности таким образом, что транскрипция происходит через кодирующую последовательность в последовательности полиаденилирования. Связывание выполняется методами рекомбинации, известными в данной области техники, например, при использовании методики полимеразной цепной реакции (ПЦР), и/или в ходе лигирования по подходящим участкам рестрикции. При отсутствии подходящих участков рестрикции используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с традиционной практикой.
В объеме настоящего изобретения трансфицированные клетки могут быть получены по существу любым известным в данной области техники способом трансфекции. Например, нуклеиновая кислота может быть введена в клетки посредством электропорации или микроинъекции. Альтернативно, можно использовать реагенты для липофекции, такие как FuGENE 6 (Roche Diagnostics GmbH, Германия), X-tremeGENE (Roche Diagnostics GmbH, Германия) и липофектамин (Invitrogen Corp., США). В еще альтернативном варианте нуклеиновая кислота может быть введена в клетку с помощью соответствующих систем вирусных векторов, основанных на ретровирусах, лентивирусах, аденовирусах или аденоассоциированных вирусах (Singer, О., Proc. Natl. Acad. Sci. USA 101 (2004) 5313-5314).
Термин "клетка" или "клетка-хозяин" относится к клетке, в которой нуклеиновая кислота, например кодирующая гетерологичный полипептид или составляющая короткую шпилечную РНК (кшРНК), может быть или уже введена/трансфицирована. Клетки-хозяева включают как прокариотические клетки, которые используют для размножения векторов/плазмид, так и эукариотические клетки, которые используют для экспрессии нуклеиновой кислоты. В одном воплощении эукариотические клетки представляют собой клетки млекопитающих. В другом воплощении клетка-хозяин млекопитающего выбрана из клеток млекопитающего, включающих клетки СНО (например, СНО К1 или СНО DG44), клетки ВНК, клетки NS0, клетки SP2/0, клетки HEK 293, клетки HEK 293 EBNA (от англ. "Epstein Barr Nuclear Antigen" - ядерный антиген вируса Эпштейна - Барра), клетки PER.C6 и клетки COS. В дополнительном воплощении клетка млекопитающего выбрана из группы, включающей гибридому, клетки миеломы и клетки грызунов. Миеломные клетки включают клетки миеломы крысы (например, YB2) и клетки миеломы мыши (например, NSO, SP2/0). В одном воплощении полипептиды для фармацевтического применения продуцируются в клетках млекопитающих, таких как клетки СНО, клетки NS0, клетки Sp2/0, клетки COS, клетки HEK, клетки ВНК, клетки PER.C6® или подобные. Для ферментации клетки-хозяина и, следовательно, для экспрессии представляющего интерес полипептида, используют культуральную среду. На сегодняшний день клетки СНО широко применяются для экспрессии фармацевтических полипептидов, либо в малом масштабе в лаборатории, либо в крупном масштабе в производственных процессах. Из-за их широкого распространения и применения хорошо известны отличительные свойства и генетический фон клеток СНО. Следовательно, клетки СНО одобрены регулирующими органами для продуцирования терапевтических белков для назначения людям. В одном воплощении клетка млекопитающего представляет собой клетку СНО.
"Кассета экспрессии" относится к нуклеиновой кислоте, которая содержит элементы, необходимые для экспрессии и секреции по меньшей мере имеющегося структурного гена в клетке-хозяине. Нуклеиновая кислота также характеризуется последовательностью, состоящей из отдельных нуклеотидов, или аминокислотной последовательностью, кодируемой молекулой нуклеиновой кислоты.
"Ген" означает нуклеиновую кислоту, которая представляет собой сегмент, например, на хромосоме или на плазмиде, который может влиять на экспрессию пептида, полипептида или белка. Рядом с кодирующей областью, т.е. структурным геном, ген включает другие функциональные элементы, например, сигнальную последовательность, промотор(ы), интроны и/или терминаторы.
"Структурный ген" означает область гена без сигнальной последовательности, т.е. кодирующую область.
Термин "экспрессия", как используется в данном документе, относится к транскрипции и/или трансляции, происходящей в клетке. Уровень транскрипции целевого продукта в клетке-хозяине может быть определен, исходя из количества соответствующей мРНК, которая находится в клетке. Например, мРНК, транскрибируемая из выбранной нуклеиновой кислоты, может быть оценена количественно в ходе ПЦР или в ходе нозерн-гибридизации (смотрите Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)). Белок, кодируемый выбранной нуклеиновой кислотой, может быть оценен количественно разными способами, например, в ходе ИФА, при анализе биологической активности белка, или при использовании анализов, которые не зависят от такой активности, таких как вестерн-блоттинг или радиоиммунный анализ, при использовании антител, которые распознают и связывают белок (смотрите Sambrook, et al., 1989, выше).
"Полипептид" представляет собой полимер из аминокислотных остатков, соединенных пептидными связями, продуцируемый либо естественным образом, либо синтетическим способом. Полипептиды из менее приблизительно 20 аминокислотных остатков могут называться "пептидами". Полипептиды, включающие две или более аминокислотных цепи или включающие аминокислотную цепь длиной 100 аминокислот или более, могут называться "белками". Полипептид или белок также может включать непептидные компоненты, такие как углеводные группы или ионы металлов. Углеводы и другие непептидные заместители могут быть добавлены к белку клеткой, в которой продуцируется белок, и могут меняться в зависимости от типа клетки. Белки и полипептиды определены в настоящем изобретении с точки зрения их аминокислотной структуры скелета; дополнения, такие как углеводные группы, обычно не указаны, но тем не менее могут присутствовать. В одном воплощении полипептид представляет собой иммуноглобулин или фрагмент иммуноглобулина, или конъюгат иммуноглобулина. В одном воплощении полипептид представляет собой тяжелую цепь иммуноглобулина или легкую цепь иммуноглобулина, или их фрагмент, слияние или конъюгат.
Термин "селективный маркер" означает нуклеиновую кислоту, которая позволяет особым образом за или против произвести отбор клеток, несущих эту нуклеиновую кислоту, в присутствии соответствующего "селективного агента". Полезным положительным селективным маркером является, например, ген устойчивости к антибиотикам. Селективный маркер позволяет отобрать клетку, которая преобразуется при этом, в присутствии соответствующего селективного агента; нетрансформированная клетка не способна расти или выживать в избирательных условиях культивирования, т.е. в присутствии селективного агента. Селективные маркеры могут быть положительными, отрицательными или бифункциональными. Положительные селективные маркеры позволяют отбирать клетки, несущие маркер, тогда как отрицательные селективные маркеры позволяют избирательно уничтожать клетки, несущие маркер. Обычно селективный маркер придает устойчивость к лекарственному средству или компенсирует метаболический или катаболический дефект в клетке. Селективные маркеры, используемые с эукариотическими клетками, включают, например гены аминогликозид-фосфотрансферазы (АФТ), такие как гигромицин-фосфотрансфераза (ГИГ), неомицин- и G418 АФТ, дигидрофолатредуктаза (ДГФР), тимидинкиназа (ТК), глутаминсинтетаза (ГС), аспарагинсинтетаза, триптофансинтетаза (селективный агент индол), гистидинолдегидрогеназа (селективный агент гистидинол D), и гены, обеспечивающие устойчивость к пуромицину, блеомицину, флеомицину, хлорамфениколу, зеоцину и микофеноловой кислоте. Дополнительные селективные маркеры изложены в WO 92/08796 и WO 94/28143.
Термин "в условиях, пригодных для экспрессии указанного полипептида" означает условия, которые используют для культивирования клетки млекопитающего, экспрессирующей гетерологичный полипептид, и которые известны или могут быть легко определены квалифицированным специалистом в данной области техники. Квалифицированному специалисту в данной области техники также известно, что эти условия могут изменяться в зависимости от типа культивируемой клетки млекопитающего и типа экспрессируемого белка. Как правило клетку млекопитающего культивируют при температуре, например между 20°С и 40°С, и в течение периода времени, достаточного для эффективного продуцирования белка, например, в течение 4-28 дней, в объеме от 0,1 литра до 107 литров.
Термин "выделение полипептида", как используется в настоящей заявке, означает осаждение, высаливание, ультрафильтрацию, диафильтрацию, лиофилизацию, уменьшение объема растворителя для получения концентрированного раствора, или хроматографию. Обычно хроматографические способы используют для разделения и очистки полипептидов. Разные способы твердо установлены и широко применяются для выделения и очистки белков, такие как аффинная хроматография с микробными белками (например аффинная хроматография с белком А или белком G), ионообменная хроматография (например катионообменная (карбоксиметильные смолы), анионообменная (аминоэтильные смолы) и смешанного типа обмена), тиофильная адсорбция (например, с бета-меркаптоэтанолом и другими SH лигандами), хроматография гидрофобного взаимодействия или ароматическая адсорбционная хроматография (например, с фенил-сефарозой, аза-аренофильными смолами или м-аминофенилбороновой кислотой), металл-хелатная аффинная хроматография (например, с Ni(II)- и Cu(II)-аффинным веществом), эксклюзионная хроматография и электрофоретические способы (такие как электрофорез в геле, капиллярный электрофорез) (Vijayalakshmi, М.А., Appl. Biochem. Biotech. 75 (1998) 93-102).
Термин "иммуноглобулин" означает молекулу, включающую по меньшей мере два так называемых полипептида легкой цепи (легкая цепь) и два так называемых полипептида тяжелой цепи (тяжелая цепь). Каждый из полипептидов тяжелой и легкой цепи содержит вариабельный домен (вариабельную область) (как правило, аминоконцевую часть полипептидной цепи), включающий области связывания, которые способны взаимодействовать с антигеном. Каждый из полипептидов тяжелой и легкой цепи также включает константную область (как правило, карбоксиконцевую часть). Константная область тяжелой цепи опосредует связывание иммуноглобулина i) с клетками, несущими Fc гамма рецептор (FcγR), такими как фагоциты, или ii) с клетками, несущими неонатальный Fc рецептор (FcRn), также известный как рецептор Brambell. Она также опосредует связывание с некоторыми факторами, включая факторы классической системы комплемента, такие как компонент (C1q).
Термин "иммуноглобулин" используется в данном документе в самом широком смысле и охватывает разные структуры иммуноглобулина, включая, но не ограничиваясь этим, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например биспецифические антитела), и фрагменты иммуноглобулина, при условии, что они проявляют требуемую антигенсвязывающую активность.
В зависимости от аминокислотной последовательности константной области тяжелых цепей иммуноглобулины разделяют на разные классы: класс IgA, класс IgD, класс IgE, класс IgG и класс IgM. Некоторые из этих классов дополнительно подразделяют на подклассы (изотипы), т.е. IgG на IgG1, IgG2, IgG3 и IgG4, или IgA на IgA1 и IgA2. Согласно классу, которому принадлежит иммуноглобулин, константные области тяжелой цепи называют α(IgA), δ(IgD), ε(IgE), γ(IgG) и μ(IgM), соответственно. В одном воплощении иммуноглобулин представляет собой иммуноглобулин класса IgG. В другом воплощении иммуноглобулин имеет константную область человека или константную область человеческого происхождения. В дополнительном воплощении иммуноглобулин принадлежит подклассу IgG4 или подклассу IgG1, IgG2 или IgG3, который модифицирован таким образом, что невозможно обнаружить связывание Fcγ рецептора (например FcγRIIIa) и/или C1q связывание. В одном воплощении иммуноглобулин принадлежит подклассу IgG4 человека или мутированному подклассу IgG1 человека. В одном воплощении иммуноглобулин принадлежит подклассу IgG1 человека с мутациями L234A и L235A. В другом воплощении иммуноглобулин относится к Fcγ рецепторному связыванию подкласса IgG4 или подкласса IgG1 или IgG2 с мутацией L234, L235 и/или D265, и/или содержит мутацию PVA236. В дополнительном воплощении иммуноглобулин имеет мутацию, выбранную из S228P, L234A, L235A, L235E, SPLE (S228P и L235E) и/или PVA236 (PVA236 означает, что аминокислотная последовательность ELLG (приведенная в однобуквенном аминокислотном коде) из аминокислотного положения 233 в 236 IgG1 или EFLG IgG4 заменена PVA). В одном воплощении иммуноглобулин принадлежит подклассу IgG4 и имеет мутацию S228P IgG4, или иммуноглобулин принадлежит подклассу IgG1 и имеет мутацию L234A и L235A.
Вариабельный домен легкой или тяжелой цепи иммуноглобулина в свою очередь включает разные сегменты, т.е. четыре каркасные области (КО) и три гипервариабельные области (CDR, от англ. "complementarity determining region" -определяющая комплементарность область).
"Фрагмент иммуноглобулина" означает полипептид, включающий по меньшей мере один домен из группы доменов, включающих вариабельный домен, домен CH1, шарнирную область, домен CH2, домен CH3, домен CH4 тяжелой цепи иммуноглобулина, или вариабельный домен или домен CL легкой цепи иммуноглобулина. Это понятие также включает производные и их варианты. Дополнительно может присутствовать вариабельный домен, в котором одна или более аминокислот или аминокислотных областей исключены.
"Конъюгат иммуноглобулина" означает полипептид, включающий по меньшей мере один домен тяжелой или легкой цепи иммуноглобулина, конъюгированной посредством пептидной связи с дополнительным полипептидом. Дополнительный полипептид представляет собой пептид, не относящийся к иммуноглобулину, такой как гормон, рецептор роста, антифузогенный пептид или подобные.
Следующие примеры, фигуры и перечень последовательностей приведены, чтобы помочь понять настоящее изобретение, действительный объем которого установлен прилагаемыми пунктами формулы изобретения. Подразумевается, что могут быть выполнены модификации в изложенных процессах, не отклоняясь от сущности изобретения.
Описание перечня последовательностей
SEQ ID NO 01 Нуклеотидная последовательность основного немедленно-раннего промотора/энхансера ЦМВ человека (чЦМВ-ОНР).
SEQ ID NO 02 Нуклеотидная последовательность чЦМВ-ОНР промотора/энхансера с точечной мутацией С в G в положении -41 относительно участка инициации транскрипции.
SEQ ID NO 03 Нуклеотидная последовательность чЦМВ-ОНР промотора/энхансера с точечной мутацией С в G в положении -179 относительно участка инициации транскрипции.
SEQ ID NO 04 Нуклеотидная последовательность усиленного зеленого флуоресцентного белка (eGFP), включающая дестабилизирующую последовательность PEST.
SEQ ID NO 05 Нуклеотидная последовательность секретируемой щелочной фосфатазы плаценты (SEAP, от англ. secreted embryonic alkaline phosphatase), включающая сигнальный пептид.
SEQ ID NO 06 Нуклеотидная последовательность чЦМВ-ОНР промотора/энхансера с точечной мутацией С в G в положении -41 и -179 относительно участка инициации транскрипции.
Описание фигур
Фигура 1 Карта плазмиды р5532, экспрессирующей секретируемую щелочную фосфатазу плаценты (SEAP).
Фигура 2 Карта плазмиды р16111, экспрессирующей усиленный зеленый флуоресцентный белок (eGFP)
Фигура 3 Процедура разбавления супернатанта клеточной культуры.
Фигура 4 Нормированные уровни экспрессии SEAP суспензий временно трансфицированных клеток СНО без обработки (по диагонали заштрихованные столбцы) или с обработкой 5'-аза-2'-дезоксицитидином (ДАЦ) (вертикально заштрихованные столбцы). Указаны плазмиды, которые использовались для трансфекции. Погрешности представляют собой среднеквадратические отклонения восьми (без ДАЦ) или 4 (с ДАЦ) биологических повторов. Также показан фоновый сигнал ложно-трансфицированных клеток СНО-К1 (два биологических повтора).
Фигура 5 Жизнеспособная область нетрансфицированных клеток СНО- К1 на точечной диаграмме прямого рассеяния (ПР) / бокового рассеяния (БР). Та же самая область применялась ко всем пробам в ходе одного и того же анализа сортировки флуоресцентно-активированных клеток (FACS, от англ. "fluorescence-activated cell sorting").
Фигура 6 Гистограмма жизнеспособной области флуоресценции eGFP в ходе культивирования стабильно трансфицированных клеток СНО. Флуоресценцию измеряли при длине волны возбуждения 488 нм с каналом Alexa Fluor 488. Можно различить два пика, представляющие собой две основные субпопуляции экспрессоров, не являющихся eGFP, (левый пик) и высоких eGFP экспрессоров (правый пик).
Фигура 7 Уровни экспрессии eGFP независимых популяций клеток СНО через шесть недель после стабильной трансфекции либо плазмидой 16107, либо 16109, либо 16111. Точки являются средними геометрическими значениями интенсивностеи флуоресценции отдельных популяций СНО.
Фигура 8 Уровни экспрессии eGFP независимых популяций клеток СНО через шесть недель после стабильной трансфекции либо плазмидой 16107, либо 16111. Точки являются средними геометрическими значениями интенсивностей флуоресценции отдельных популяций СНО.
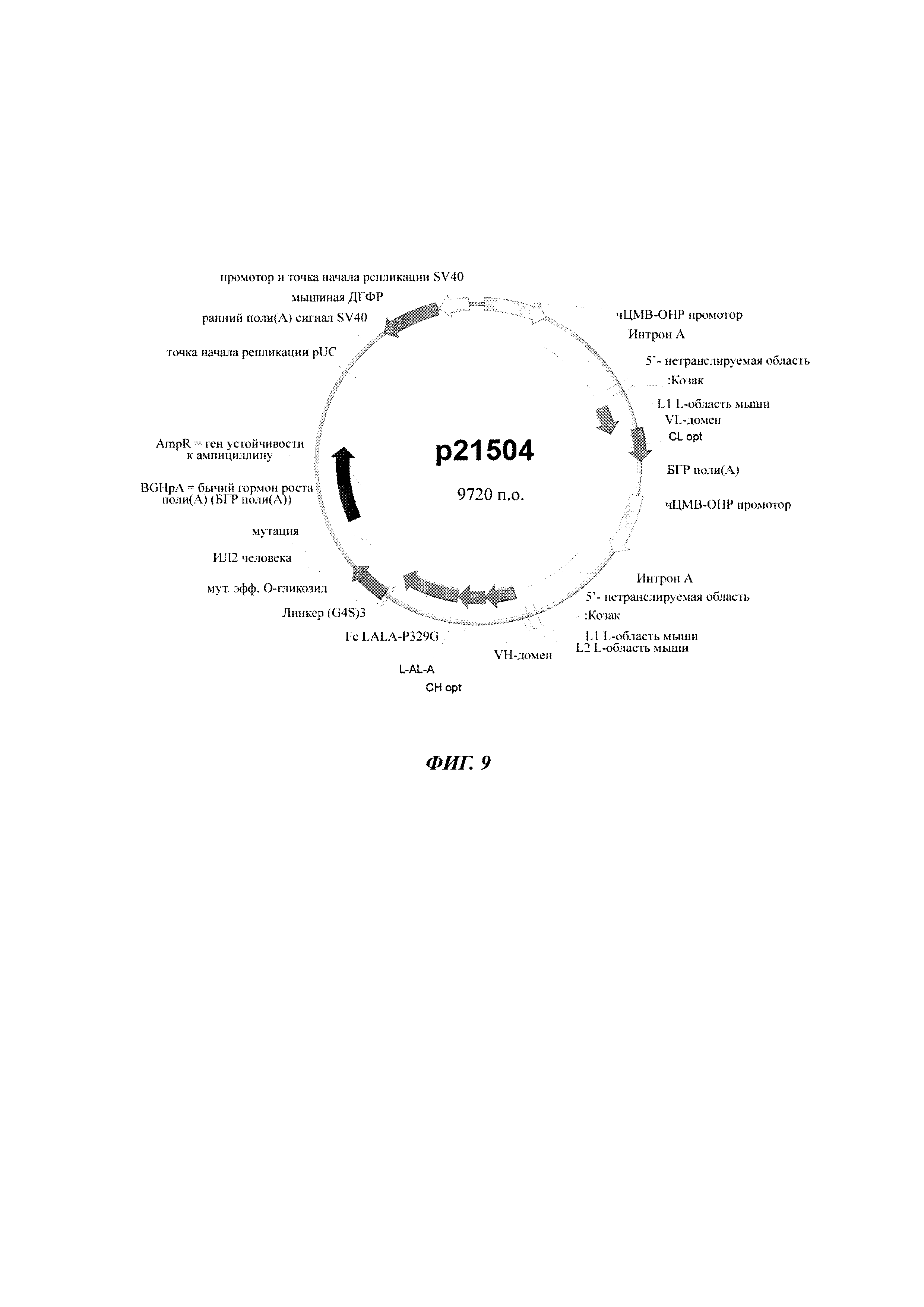
Фигура 9 Карта плазмиды р21504, экспрессирующей антитела класса IgG.
Фигура 10 Титр антител (мкг/мл) популяций стабильно трансфицированных клеток СНО через 68 дней после трансфекции (А) или через 134 дня после трансфекции (В) либо плазмидой 16134 (CGG), либо 16135 (CGC), либо 16136 (CCG), либо 21504 (ССС). Точки являются средними геометрическими значениями титра антител отдельных популяций СНО.
Фигура 11 Удельная продуктивность (qP) популяций стабильно трансфицированных клеток СНО через 68 дней после трансфекции (А) или через 131 день после трансфекции (В) либо плазмидой 16134 (CGG), либо 16135 (CGC), либо 16136 (CCG), либо 21504 (ССС). Точки являются средними геометрическими значениями удельной продуктивности отдельных популяций СНО.
Фигура 12 Сравнение среднего значения с критерием достоверно значимой разности Тьюки (Тьюки HSD тест, от англ. "honestly significant difference") (средние значения ΔqP) мутантных проб с контрольной пробой.
Пример 1
Общие способы
Технологии рекомбинантных ДНК
Использовали стандартные способы, чтобы управлять ДНК, как описано у Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y, (1989). Молекулярные биологические реагенты использовали в соответствии с инструкциями изготовителей.
Определение последовательности ДНК
Секвенирование ДНК осуществляли в SequiServe GmbH (Фатерштеттен, Германия).
Анализ последовательностей ДНК и белка и управление данными последовательностей
Использовали пакет программного обеспечения EMBOSS (European Molecular Biology Open Software Suite) и Invitrogen's Vector NTI версии 9.1 для создания, картирования, анализа, аннотации и иллюстрации последовательностей.
Подготовка проб для анализа антител:
Вычисляли концентрацию клеток и 2 мл на пробу центрифугировали (500 g, 5 минут при 20-30°С). Надосадочную жидкость переносили в новые 96 глубоколуночные планшеты и хранили при -20°С до использования. Замороженную надосадочную жидкость оттаивали в течение ночи при 4°С, 6 × инвертировали и центрифугировали (4000 об/мин, 30 минут при 20-30°С). 310 мкл фильтровали с помощью многоситового планшета Millipore над планшетом с 96 круглыми лунками со штрих-кодом в ходе центрифугирования (1200 об/мин, 3 минуты при 20-30°С).
Пример 2
Выработка рекомбинантных клеточных линий СНО
Суспензии клеток СНО-К1 трансфицировали либо временно, либо стабильно с вектором, несущим репортерный ген, либо секретируемую щелочную фосфатазу (SEAP: фигура 1; SEQ ID NO 05), либо усиленный зеленый флуоресцентный белок (eGFP: фигура 2), либо конструкты антител человека класса IgG (гибридный белок IgG цитокин (интерлейкин-2, ИЛ2), как приведено в WO 2014023752; фигура 9), под контролем фрагмента основного немедленно-раннего промотора / энхансера ЦМВ человека либо дикого типа (SEQ ID NO01), либо включающего точечные мутации С в G. Мутации С в G С-508, С-179 и С-41 CpG динуклеотидов в составе чЦМВ-ОНР фрагмента включали отдельно или в разных сочетаниях, чтобы увеличить длительную стабильность (таблица 1). Мутации С в G устанавливают по их расстоянию до сайта инициации транскрипции (TSS, от англ. transcription start site). Мутации включали с помощью набора для мультисайт-направленного мутагенеза QuikChange (Agilent Technologies, Вальдброн, Германия). Вектор дополнительно включал нуклеотидную последовательность, кодирующую мышиную дигидрофолатредуктазу (ДГФР) (фигуры 1, 2 и 9). Трансфекцию клеток осуществляли с помощью системы для нуклеофекции Amaxa (Lonza Cologne GmbH, Кельн, Германия).


Например, клетки CHO-К1 были трансфицированы кольцевой плазмидной ДНК для временной экспрессии SEAP или линейной плазмидной ДНК для стабильной экспрессии eGFP, или подходящей плазмидой для стабильной экспрессии гибридного белка антитела класса IgG при использовании устройства нуклеофектор в сочетании с набором для нуклеофектора V (Lonza Cologne GmbH, Кельн, Германия) в соответствии с протоколами изготовителя. Временно трансфицированные клеточные суспензии высевали в 96 луночные планшеты и инкубировали в течение 5 дней. Концентрацию SEAP проверяли на устройстве для считывания планшетов Tecan SECTRAFIuor Plus (Tecan Deutschland GmbH, Крайльсхайм, Германия) в ходе изменения цвета химической реакции.
Стабильно трансфицированные клеточные суспензии высевали в 384 или 6-луночные планшеты, содержащие свободную от тимидина среду с 250-1600 нМ метотрексатом (МТК) в качестве селективного агента. После трех - четырех недель eGFP-экспрессирующие популяции клеток или антитело-экспрессирующие популяции клеток проверяли на длительную стабильность в течение от 1 до 3 месяцев. Интенсивность экспрессии eGFP проверяли с помощью проточной цитометрии. Антитело-экспрессирующие одноклеточные клоны высевали в 384 и 96 луночные планшеты. Через три недели антитело-экспрессирующие клеточные линии устанавливали, измеряя титры антител в культуральной среде с помощью ИФА. Лунки для выращивания произвольным образом отбирали и в интересах анализа длительной стабильности клеточные клоны увеличивали в объеме (3 мл на лунку в 6 луночных планшетах), и концентрацию антитела определяли в ходе высокоэффективной жидкостной хроматографии (ВЭЖХ) и ИФА белка А в конце каждого пассажа.
Клетки размножались в одноразовых 125 мл встряхиваемых колбах с отверстием при стандартных условиях влажности (95% относительной влажности, 37°С и от 5% до 8% CO2) при постоянной скорости встряхивания от 120 об/мин до 150 об/мин. Каждые 3-4 дня клетки распределяли в свежей среде. Плотность и жизнеспособность культур определяли, используя устройство для подсчета клеток Cedex HiRes (Roche Innovates AG, Билефельд, Германия). Кроме того, стандартные методики культивирования клеток выполняли, как описано, например в Current Protocols in Cell Biology, Binifacino, J.S. et al. (eds), John Wiley & Sons, Inc., New York (2000).
Пример 3
Длительные культивирование и выработка
На длительную продуктивность исследовали разные популяции клеток СНО, содержащие точечные мутации CpG в составе фрагмента основного немедленно-раннего промотора / энхансера ЦМВ человека (таблица 1), полученного согласно примеру 2.
Клетки тестировали на стабильность продуцирования в течение 2-3 месяцев после трансфекции в присутствии селективного агента МТК. Клетки непрерывно культивировали в 125 мл встряхиваемых колбах с отверстием, содержащих 20-40 мл среды с селективным агентом, и разбавляли два раза в неделю свежей средой. Плотность посева составляла 2-3×105 клеток/мл. Перед пассажем определяли плотность и жизнеспособность жизнеспособных клеток.
Концентрацию антител в надосадочной жидкости (титр антител) определяли в ходе ВЭЖХ и ИФА белка А в конце каждого пассажа. Исходя из этих данных удельную продуктивность клеток (qP) для каждого пассажи вычисляли, используя следующую формулу:

qP [пг/клетка/день]: удельная продуктивность клеток,
P1 [мкг/мл]: титр антител в начале пассажа,
Р2 [мкг/мл]: титр антител в конце пассажа,
D1 [клетки/мл]: плотность жизнеспособных клеток в начале пассажа,
D2 [клетки/мл]: плотность жизнеспособных клеток в конце пассажа,
Δt [день]: продолжительность пассажа.
Значения qP изображали графически в зависимости от возраста культуры в конце соответствующего пассажа в выработках. Линейный тренд вычисляли по всем точкам данных qP и относительное изменение qP (в процентах) за период вычисляли своими силами согласно следующему уравнению:

ΔqP [%]: изменение в процентах qP,
m [пг/клетка/день/выработка]: наклон линейного тренда,
а [№ выработок]: возраст культуры,
qP0: отсекаемый отрезок у-оси линейного тренда.
Что касается нижнего числа точек данных, полученных при анализе стабильности вариантов чЦМВ-ОНР промотора, для каждой пробы среднее значение последних трех значений qP делили на среднее значение первых двух значений qP и выражали в процентах, чтобы получить ΔqP.

Среднее значение qP EOS: среднее значение последних трех значений qP
Среднее значение qP PSB: среднее значение первых двух значений qP
Пример 4
Количественное выражение экспрессии репортерного гена под контролем разных фрагментов основного немедленно-раннего промотора / энхансера ЦМВ человека.
а) Количественное выражение экспрессии SEAP под контролем разных фрагментов основного немедленно-раннего промотора / энхансера ЦМВ человека
Клетки СНО-K1 были трансфицированы кольцевой плазмидной ДНК для временной экспрессии SEAP при использовании устройства нуклеофектор в сочетании с набором для нуклеофектора V (Lonza Cologne GmbH, Кельн, Германия) в 96 луночном планшете Amaxa Shuttle в соответствии с протоколами изготовителя. 12 временно трансфицированных клеточных суспензий на плазмиду высевали в 96 луночные планшеты и инкубировали в течение 5 дней. На 2 день добавляли 5'-аза-2'-дезоксицитидин (ДАЦ) в 4 повторах на плазмиду до конечной концентрации 1 мкМ, чтобы деметилировать ДНК. Концентрацию SEAP проверяли на устройстве для считывания планшетов Tecan SECTRAFIuor Plus (Tecan Deutschland GmbH, Крайльсхайм, Германия).
Относительную концентрацию SEAP определяли по скорости метаболизма пНФФ (пара-нитрофенилфосфата) до пНФ (пара-нитрофенола) согласно следующему протоколу:

150 мкл центрифугированного супернатанта клеточной культуры разбавляли 1:3 в несколько стадий (фигура 3).
По 50 мкл разбавленных растворов добавляли в новый 96 луночный планшет и объединяли с 50 мкл раствора субстрата. Через 5 минут измеряли оптическую плотность при длине волны 405 нм, используя фотометр SECTRAFIuor Plus (Tecan Deutschland GmbH, Крайльсхайм, Германия).
Среднее значение 8 повторов на плазмиду без обработки ДАЦ и среднее значение 4 повторов на плазмиду (таблица 1) с обработкой ДАЦ нормировали по отношению к контрольной плазмиде (р5532) без точечных мутаций (фигура 4).
Не были обнаружены существенные различия между плазмидами с точечной мутацией во фрагменте основного немедленно-раннего промотора / энхансера ЦМВ человека и немутированной контрольной плазмидой 5532. Кроме того, не было обнаружено существенного различия между пробами с и без обработки ДАЦ, что указывает на незначительное подавление промотора, происходящее в течение 5 дней после трансфекции. Следовательно, был сделан вывод, что точечные мутации, которые введены во фрагмент основного немедленно-раннего промотора / энхансера ЦМВ человека, не влияют на силу промотора (точечные мутации не оказывают влияния на прямую эффективность фрагмента немедленно-раннего промотора / энхансера ЦМВ человека).
b) Количественное выражение экспрессии eGFP под контролем разных фрагментов основного немедленно-раннего промотора / энхансера ЦМВ человека с помощью FACS
Стабильно трансфицированные клеточные суспензии, экспрессирующие eGFP, культивировали в течение 1-3 месяцев. Интенсивность экспрессии eGFP измеряли, используя BD FACS Canto II или BD FACS Calibur (BD, Гейдельберг, Германия). Сбор данных осуществляли, используя программное обеспечение BD FACS Diva v6.12 или программное обеспечение Cell Quest Pro (BD, Гейдельберг, Германия). Анализ первичных данных осуществляли с помощью программного обеспечения FlowJo 7.6.5 EN (TreeStar, Ольтен, Швейцария).
Например, суспензии клеток СНО 16105, 16106, 16107, 16108, 16109, 16110 и 16111 исследовали с помощью BD FACS Calibur в многочисленные моменты времени, чтобы детектировать экспрессию eGFP. Все пробы исследовали в 3-4 биологических повторах. Измеряли 10000 объектов на пробу. Область жизнеспособных клеток определяли с нетрансфицированными клетками СНО-K1 и применяли ко всем пробам одного и того же эксперимента FACS (фигура 8).
Флуоресценцию eGFP жизнеспособных клеток измеряли при длине волны возбуждения 488 нм (Alexa Fluor 488 канал) и длине волны излучения приблизительно 516 нм. На фигуре 6 показана гистограмма интенсивностей флуоресценции жизнеспособных объектов области.
Данные флуоресценции анализировали с помощью программного обеспечения FlowJo 7.6.5 EN. Среднее геометрическое значение, среднее значение и медиану экспрессии eGFP в пределах жизнеспособной области вычисляли в FlowJo. Дополнительный статистический анализ выполняли с программным обеспечением JMP версии 10 (SAS, Беблинген, Германия).
Пример 5
Взаимосвязь экспрессии eGFP и точечных мутаций С в G фрагмента основного немедленно-раннего промотора / энхансера ЦМВ человека.
Вырабатывали 8 (плазмиды 16107) или 10 (плазмиды 16109 или 16111) популяций стабильно трансфицированных клеток СНО и культивировали, как описано в примере 2. Интенсивности eGFP измеряли, как описано в примере 4.
Средние геометрические значения интенсивностей eGFP использовали для изучений взаимосвязи и показывали на диаграммах (фигуры 7 и 8). Для определения существенных различий между плазмидами 16107 и 16109 в сравнении с контрольной плазмидой 16111 использовали критерий Даннета.
Р-значения средних геометрических значений интенсивностей eGFP вычисляли для разных моментов времени в ходе длительного культивирования (таблица 3). Предел существенного различия составлял р<0,005.

Например, существенную разницу между плазмидой 16109 и контрольной плазмидой 16111 детектировали между 6 неделей и 8 неделей после трансфекции (дни отбора проб с 03-14 до 03-25) (смотрите таблицу 3). Результаты анализа длительной стабильности в сочетании с результатами анализа SEAP демонстрируют положительное влияние точечной мутации С в G С-41 на стабильность экспрессии репортерного гена без воздействия на силу промотора.
Плазмиды 16107 и 16111 попарно сравнивали при втором вычислении. Средние геометрические значения интенсивностей флуоресценции представляли графически и р-значения вычисляли, используя критерий Даннета (смотрите таблицу 4).

Плазмида 16107 демонстрирует повышенную стабильность продуцирования в сравнении с контрольной плазмидой, т.е. точечная мутация С в G С-179 увеличивает стабильность экспрессии репортерного гена без воздействия на силу промотора.
Пример 6
Количественное выражение продуцирования антител под контролем разных фрагментов основного немедленно-раннего промотора / энхансера ЦМВ человека
a) Количественное выражение продуцирования антител при использовании ВЭЖХ:
Хроматографический способ использовали, чтобы определить количество антитела, находящегося в пробе. Использовали колонку PorosA, которая связывает Fc-область антитела. Антитело связывается с колонкой и затем элюируется в условиях низкого рН. Устанавливали концентрацию белка, определяя оптическую плотность (ОП) при 280 нм, с опорной длиной волны 320 нм, используя молярный коэффициент поглощения, вычисленный исходя из аминокислотной последовательности.
b) Количественное выражение продуцирования антител при использовании ИФА:
Способ ИФА (твердофазный иммуноферментный анализ) основывается на принципе "сэндвича" антител. Захватывающее антитело, специфичное к представляющему интерес анализируемому веществу, например Fc часть IgG, связывается с микротитрационным планшетом (Maxisorp, Inhouse, Roche), что создает твердую фазу. После стадий блокировки и промывки пробы, стандарты (серии растворов эталонного Ab (от англ. "antibody" - антитело)) и контрольные образцы затем инкубировали с твердофазным антителом, которое захватывает анализируемое вещество. После смывания несвязанного анализируемого вещества добавляют конъюгированное детекторное антитело (например конъюгированное с пероксидазой (ПОД)). Это детекторное антитело связывается с другим эпитопом измеряемой молекулы, завершая сэндвич. Из хемилюминесцентного субстрата пероксидазы для иммуноферментного анализа (ИФА) ВМ (англ. ВМ Chemiluminescence ELISA Substrate POD) (Roche, Пенцберг, Германия) получают раствор субстрата второй системы детектирования на основе пероксидазы (ПОД, HRP (от англ. "horseradish peroxidase" - пероксидаза хрена)). Скорость формирования сигнала в иммуноанализе прямо пропорциональна количеству маркерного фермента, связанного с твердой фазой.
Пример 7
Взаимосвязь продуцирования / титра антител и точечных мутаций С в G фрагмента основного немедленно-раннего промотора / энхансера ЦМВ человека.
Концентрацию антитела (гибридного белка IgG-ИЛ2) проверяли, используя методику ИФА, и вычисляли титр антител (мкг/мл), а также удельную продуктивность на клетку и день (qP). Отображали измерения начала и конца фазы культивирования, чтобы наглядно представить различие между мутантными пробами и контрольной пробой и изменение экспрессии в ходе культивирования. Таким образом, начальные и конечные титры фазы культивирования демонстрируют улучшение продуцирования антител во всех мутантных пробах по сравнению с контрольной пробой (фигура 10А и В).
Титры клональных клеточных линий сравнивали с критерием HSD Тьюки (таблица 5). Вычисляли р-значения разности титров между мутированными и немутированными вариантами промотора. Титры сравнивали в течение фазы культивирования. Уровень значимости составлял 0,05 (5%).

Например, мутанты CGC значительно отличались от контрольной пробы в ходе полной фазы культивирования за исключением 127 дня после трансфекции.
Сравнение титров указывало на то, что все мутированные клеточные суспензии обладали более высокой продуктивностью антител на объем, чем контрольные пробы.
Необходимо разъяснить, является ли сила экспрессии или концентрация клеток основным регулирующим элементом различия титров.
С этой целью экспрессии антител на клетку и день (qP) мутантных проб и контрольной пробы сравнивали в течение полной фазы культивирования. Представления значений qP от начала (фигура 11 А) и конца фазы культивирования (фигура 11 В) были сопоставимы со значениями титров с менее четко выраженным различием с контрольной пробой.
Более высокий титр получали для мутанта CGC и CGG в начале культивирования. В конце культивирования мутанты CCG и CGG получали немного более высокие qP, чем контрольная проба. Мутированные клетки CGC имели более высокие значения qP в конце фазы культивирования.
Удельные продуктивности мутированных и немутированных клеточных линий сравнивали с критерием HSD Тьюки (таблица 6). Таким образом, различие между мутантами CGC и немутированной контрольной пробой увеличивается с течением времени. Также для мутации CCG получали увеличение значений qP.

Уровень значимости составлял 0,05 (5%).
Принимая во внимание увеличивающееся различие в зависимости от времени значений qP для одиночных мутированных клеточных линий по сравнению с немутированными клеточными линиями, предполагали более высокую стабильность. Для проверки этой гипотезы вычисляли относительное изменение удельной продуктивности.
Сначала изменение в зависимости от дня и расщепления удельной продуктивности стабилизировали, усредняя первые два (PSB = день 68 и 83) и последние три (EOS = день 124, 127 и 131) значения qP. На второй стадии изменение qP было определено как процентное отношение стабилизированных конечных точек к стабилизированным начальным точкам.

Среднее значение qP EOS: среднее значение последних трех qP
Среднее значение qP PSB: среднее значение первых двух qP
Длительная стабильность моноклональных клеточных линий, включающих CGC и CCG мутанты промоторов, была выше по сравнению с немутированной контрольной пробой (фигура 12). G-41 мутант промотора был стабилен в течение всей фазы культивирования, тогда как G-179 точечная мутация приводит к повышенной экспрессии IgG (среднее значение %ΔqP) с течением времени. Двойная мутация CGG имела более высокие значение экспрессии в начале, которые уменьшались с течением времени.

Моноклональные клеточные линии, включающие варианты чЦМВ-ОНР промотора CGC (16135) и CCG (16136), значительно более стабильны, чем немутированная контрольная проба (21504).
Реферат
Изобретение относится к области биохимии. Описана группа изобретений, включающая промотор цитомегаловируса (ЦМВ) человека, который имеет в нуклеотидном положении -41 и/или -179 относительно участка инициации транскрипции нуклеотид G, способ получения полупептида и применение вышеуказанного промотора для получения полипептида. В одном из вариантов изобретения способ включает в себя стадии: трансфицирование эукариотической клетки нуклеиновой кислотой, включающей кассету экспрессии, содержащую последовательность вышеуказанного промотора, функционально связанную со второй нуклеиновой кислотой, кодирующей полипептид, отбор клетки, культивирование клетки, выделение полипептида из клетки или культуральной среды. Изобретение расширяет арсенал промоторов цитомегаловируса человека. 3 н. и 9 з.п. ф-лы, 12 ил., 6 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Полипептиды, происходящие из триптофанил-трнк-синтетазы, и их применение для регуляции развития кровеносных сосудов

Комментарии