Конъюгированные иммуноглобулины с c-концевым лизином - RU2747581C2
Код документа: RU2747581C2
Чертежи












Описание
Родственные заявки
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке США 62/269138, поданной 18 декабря 2015 года, полное содержание которой прямо включено посредством ссылки.
Область техники, к которой относится изобретение
[0002] В настоящем изобретении обеспечиваются конъюгированные иммуноглобулины с C-концевым лизином, и способы их получения.
Уровень техники
[0003] Применимость моноклональных антител простирается от фундаментальных исследований до терапевтических и диагностических применений. Возможность конъюгировать антитела с функциональными агентами еще больше расширяет их функциональность. Получение конъюгированных антител обычно включает конъюгацию линкера, лекарственного средства или другого функционального агента с реакционноспособными остатками лизина и цистеина в тяжелых (HC) и легких (LC) цепях моноклонального антитела (mAb). См. Deonarain, et al., «Emerging formats for next-generation antibody drug conjugates», Expert Opinion in Drug Discovery (2015), 10(5): 463-481. Конъюгация лизина обычно опосредуется реакциями на основе сукцинимида (NHS) или на основе изотиоцианата. Для конъюгации на основе цистеина требуется частичное восстановление антитела для разрушения некоторых межцепочечных дисульфидных связей, тем самым обеспечивая свободные тиоловые группы боковых цепей. Тиол-реактивные функциональные агенты могут затем реагировать со свободными тиоловыми группами в антителе с образованием конъюгатов антитело-лекарственное средство (ADC). Оба эти метода приводят к модификации многочисленных лизинов или цистеинов, обеспечивая получение гетерогенных смесей ADC с распределением соотношений лекарственное средство к антителу (DAR) и модификациями лекарственного средства в случайных положениях.
[0004] Недавний толчок к применению технологий сайт-специфичной конъюгации в качестве способа получения однородного продукта ADC с определенным DAR дал несколько способов, включая конструирование непарных цистеинов, включение неприродных аминокислот и сайт-специфическую ферментативную модификацию. Несмотря на то, что эти способы дают однородные продукты, каждый из них имеет свои недостатки. Для конъюгации на основе цистеина требуется дополнительная стадия для удаления кэпированного цистеина, глутатиона или даже легкой цепи из непарного цистеина. См., например, Junutula, et al., «Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves Therapeutic Index», Nature Biotechnology, (2008) 26:925-932; Chen, et al., «Charge-based Analysis of Antibodies with Engineered Cysteines», MAbs (2009) 1(6): 563-571; Gomez, et al., «Effect of temperature, pH, dissolved oxygen, and hydrolysate on the formation of triple light chain antibodies in cell culture» Biotechnol Progress (2010), 26: 1438-1445. Кроме того, было показано, что нестабильность в сыворотке крови реакции на основе малеимида, используемая в настоящее время для конъюгатов на основе цистеина, показала наличие проблем, связанных с потерей эффективности или проявлением токсичности вне мишени. Alley, et al., «Contribution of Linker Stability to the Activities of Anticancer Immunoconjugates», Bioconjugate Chemistry (2008) 19(3): 759-765; Shen, et al., «Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates», Nature Biotechnology (2012) 30: 184-189. Кроме того, для включения неприродных аминокислот требуется экспрессия в генетически модифицированной клеточной системе или бесклеточной системе. Hallam, et al., «Unnatural Amino Acids in Novel Antibody Conjugates», Future Med. Chem. (2014) 6(11): 1309-1324. Кроме того, наличие неприродной аминокислоты может индуцировать иммуногенный ответ у пациентов. Однако для сайт-специфических ферментативных модификаций можно потенциально использовать природную аминокислоту дикого типа в последовательности антитела, тем самым минимизируя вероятность проявления иммуногенности. Кроме того, посттрансляционные связи, обычно образованные ферментами, модифицирующими белок, являются очень стабильными.
[0005] Сайт-специфическая ферментативная модификация белков была исследована с использованием семейства белков, называемых трансглутаминазами, которые катализируют образование стабильной изопептидной связи между γ-карбоксиамидной группой (ацил-донор) глутамина и ε-аминогруппы (ацил-акцептор) лизина (см. фиг. 1) (см., например, Yokoyama, et al., «Properties and Applications of Microbial Transglutaminase», Appl. Microbiol. Biotech. (2004) 64: 47-454; Strop, «Versatility of Microbial Transglutaminase», Bioconjugate Chemistry, (2014) 25(5): 855-862; Kieliszek et al., «Microbial Transglutaminase and its Application in the Food Industry», Folia Microbiol (2014) 59:241-250). Недавно несколько групп исследовали применение трансглутаминазы в качестве средства для получения ADC (см., например, Josten et al., «Use of Microbial Transglutaminase for the Enzymatic Biotinylation of Antibodies», J. Immunol Methods, (2000) 240:47-54; Mindt et al., «Modification of Different IgG1 Antibodies via Glutamine and Lysine Using Bacterial and Human Tissue Transglutaminase», Bioconjugate Chemistry (2008) 19(1): 271-278); Jeger, et al., «Site-specific and stoichiometric modification of antibodies by bacterial transglutaminase» Angew. Chem. Int. Ed. Engl. (2010) 49: 9995-9997; Strop et al., «Location Matters: Site of Conjugation Modulates Stability and Pharmacokinetics of Antibody Drug Conjugates», Chem Biol (2013) 20(2):161-167; Dennler et al., «Transglutaminase-Based Chemo-Enzymatic Conjugation Approach Yields Homogeneous Antibody-Drug Conjugates», Bioconjugate Chemistry (2014) 25(3): 569-578; Siegmund, et al., «Locked by Design: A Conformationally Constrained Transglutaminase Tag Enables Efficient Site-Specific Conjugation», Angew. Chem. Int. Ed. Engl. (2015) 54(45):13420-13424). Трансглутаминазы обнаружены в организмах, начиная от бактерий до человека, которые в структурном и функциональном отношении близки, но каждая участвует в конкретных клеточных процессах. Микробная трансглутаминаза (микробная трансглутаминаза), выделенная из бактерии Streptomyces mobaraensis, широко использовалась в пищевой промышленности для сшивания белков, предназначенных для различных применений. Помимо низких затрат на производство, это привлекательный метод конъюгации за счет его способности функционировать в широком диапазоне значений pH, концентрации соли и температуры.
[0006] Несмотря на более чем двухдесятилетний период исследований, субстратная специфичность микробной трансглутаминазы не была четко определена. В общем, глутамины или лизины в петлях с гидрофобными или положительно заряженными смежными остатками имеют тенденцию быть предпочтительными. См. Tagugi et al., Taguchi et al., «Substrate specificity analysis of microbial transglutaminase using proteinaceous protease inhibitors as natural model substrates», J. Biochem. (2000) 128:415-425; Sugimura et al., «Identification of preferred substrate sequences of microbial transglutaminase from Streptomyces mobaraensis using a phage-displayed peptide library», Arch. Biochem. Biophys. (2008) 477:379-383; Tagami et al., «Substrate specificity of microbial transglutaminase as revealed by three-dimensional docking simulation and mutagenesis», Protein Eng. Des. Sel. (2009) 22:747-752. В контексте ацил-донорного глутамина было установлено, что он является более важным, чем ацил-акцепторный лизин. См., например, Ohtsuka et al., «Substrate specificities of microbial transglutaminase for primary amines», J. Agric. Food Chem. (2000) 48: 6230-6233; Ohtsuka et al., «Comparison of substrate specificities of transglutaminases using synthetic peptides as acyl donors», Biosci. Biotechnol. Biochem. (2000) 64: 2608-2613; Gundersen et al., «Microbial transglutaminase displays broad acyl-acceptor substrate specificity», Appl. Microbiol. Biotechnol. (2013) 98:219-230.
[0007] За счет более низкой специфичности для ацил-акцепторного амина исследования микробной трансглутамины до сих пор были сосредоточены только на трансамидировании остатков глутамина антител. См. Josten et al., Mindt et al., Jeger et al., Strop et al., Dennler et al. и Siegmund et al., упомянутые выше. В среднем человеческий IgG содержит 80 лизинов, из которых, как полагается, 80-90% являются гидрофильными (Gautier et al., «Lysine Conjugated Properties in Human IgGs Studied by Integrating High-Resolution Native Mass Spectrometry and Bottom-Up Proteomics», Proteomics (2015) 15(16):2756-2765; данные не показаны), и С-концевой кодон IgG1, IgG2, IgG3 и IgG4 представляет собой лизин (Ellison et al., DNA (1981) 1:11-18; Proc. Nat. Acad. Sci. USA, (1982) 79:1984-1988; Ellison et al., Nucleic Acid Res. (1982) 10:4071-4079). Однако у сывороточного IgG отсутствует лизин (Wang et al., J. Immunol. (1980) 125:1048-1054; Edelman et al., Proc Natl Acad. Sci. USA (1969) 63:78-85; Frangione et al., Biochemistry (1980) 19:4304-4308; Pink et al., Biochem. J. (1970) 117:33-47). То же самое наблюдали для IgD (White et al., Science, 1985) 228: 733-737; Lin et al., Proc. Natl. Acad. Sci. USA, (1981) 78: 504-508; Shinoda et al., Proc. Natl. Acad. Sci. USA (1981) 78: 785-789). Рекомбинантная экспрессия IgG1 в клетках HEK293 и CHO также приводит к белку, не имеющему C-концевого Lys447 (Ellison et al., Harris et al., Eur. J. Biochem. (1990) 194: 611-620; Harris, J. Chromatogr. A (1995) 705: 129-134; Dick et al., Biotechnol. Bioeng. (2008) 100: 1132-1143).
[0008] К настоящему времени специалисты в данной области техники полагают, что использование субстрата на основе донора аминов для трансамидирования лизина может привести к получению неоднородного продукта ADC за счет большого количества реакционноспособных лизинов на поверхности IgG (Josten et al. и Jeger et al.), и, таким образом, использование субстрата на основе донора амина для трансамидирования лизиновых остатков на иммуноглобулинах привело к разочарованию.
[0009] Таким образом, существует потребность в сайт-специфических ферментативных модификациях иммуноглобулинов для получения конъюгатов, которые имеют прогнозируемый уровень конъюгации. Это позволит получить ADC с относительно однородным DAR.
Сущность изобретения
[0010] Настоящее изобретение неожиданно раскрыло, что, несмотря на то, модификация лизинов иммуноглобулина дикого типа с участием микробной трансглутаминазы не наблюдается, когда C-концевой остаток лизина иммуноглобулина защищен от расщепления карбоксипептидазами с использованием C-концевого аминокислотного удлинения, микробная трансглутаминаза была способна использовать нативный С-концевой лизин в качестве ацил-акцептора. Удивительно, но конъюгация С-концевого лизина с использованием микробной трансглутаминазы приводит к сайт-специфичному и предсказуемому включению коньюгированных функциональных агентов.
[0011] В одном аспекте обеспечивается способ получения конъюгированного иммуноглобулина, где способ включает инкубацию иммуноглобулина с микробной трансглутаминазой и функциональным агентом, содержащим ацил-донорный субстрат, где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизина, где ацил-донорный субстрат содержит остаток глутамина, и где функциональным агентом является терапевтический агент или диагностический агент, где микробная трансглутаминаза катализирует конъюгацию С-концевого лизина иммуноглобулина с остатком глутамина ацил-донорного субстрата в функциональном агенте, тем самым обеспечивая получение конъюгированного иммуноглобулина.
[0012] В еще одном аспекте обеспечивается способ получения конъюгированного иммуноглобулина, где способ включает i) инкубацию иммуноглобулина с микробной трансглутаминазой и ацил-донорным субстратом, где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизина, и где ацил-донорный субстрат содержит остаток глутамина и реакционноспособную группу, где микробная трансглутаминаза катализирует конъюгацию С-концевого лизина иммуноглобулина с остатком глутамина ацил-донорного субстрата и ii) конъюгацию функционального агента с реакционноспособной группой ацил-донорного субстрата, где функциональным агентом является терапевтический агент или диагностический агент, тем самым обеспечивая получение конъюгированного иммуноглобулина.
[0013] В одном варианте осуществления реакционноспособная группа ацил-донорного субстрата конъюгирована с функциональным агентом с помощью реакции клик-химии.
[0014] В одном варианте осуществления С-концевой лизин представляет лизин 447 (K447) в тяжелой цепи иммуноглобулина.
[0015] В одном варианте осуществления иммуноглобулин содержит один аминокислотный остаток после С-концевого лизина, и один аминокислотный остаток после С-концевого лизина представляет глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, аспарагин, глутамин или гистидин. В еще одном варианте осуществления иммуноглобулин содержит один аминокислотный остаток после С-концевого лизина, и где один аминокислотный остаток после С-концевого лизина не включает пролин, аспарагиновую кислоту, глутаминовую кислоту, лизин или аргинин.
[0016] В одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует одной из формул (I) или (II):
(Z)m-Gln-(L)n-(Y) (I)
(Y)-(L)n-Gln-(Z)m (II)
[0017] где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Y является функциональным агентом.
[0018] В одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (I), и где Z представляет CBZ группу; где L представляет молекулу полиэтиленгликоля (ПЭГ)(-O((CH2)2)-), этиламин (-NH((CH2)2)-) или пропиламин (-NH((CH2)3)-); и где n равно 0, 1, 2 или 3. В одном варианте осуществления L представляет молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления L содержит одну или более аминокислот и молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (I), где Z представляет CBZ группу, и где L представляет аминокислоту. В одном варианте осуществления L является Gly; m равно 1; и n равно 1. В еще одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (II), где Z представляет CBZ группу; m равно 1; n равно 2, 3 или 4; и, по меньшей мере, один L является Gly; и, по меньшей мере, один L представляет молекулу ПЭГ. В дополнительном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (II), где Z представляет CBZ группу; m равно 1; n равно 4; один L является Gly, и остальные три группы L представляют молекулы ПЭГ.
[0019] В одном варианте осуществления ацил-донорный субстрат соответствует одной из формул (III) или (IV):
(Z)m-Gln-(L)n-(X) (III)
(X)-(L)n-Gln-(Z)m (IV)
где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Х является реакционноспособной группой.
[0020] В одном варианте осуществления L представляет молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления, когда n равно 2-5, то, по меньшей мере, один L содержит одну или более аминокислот, и другой L представляет молекулу полиэтиленгликоля (ПЭГ). В одном варианте осуществления ацил-донорный субстрат соответствует формуле (III), и где Z представляет CBZ группу; где L представляет молекулу полиэтиленгликоля (ПЭГ)(-O((CH2)2)-), этиламин(-NH((CH2)2)-) или пропиламин(-NH((CH2)3)-); и где n равно 0, 1, 2 или 3. В еще одном варианте осуществления ацил-донорный субстрат соответствует формуле (III), где Z представляет CBZ группу, и где L представляет аминокислоту. В одном варианте осуществления L является Gly; n равно 1; и m равно 1. В еще одном варианте осуществления ацил-донорный субстрат соответствует формуле (IV), где Z представляет CBZ группу; m равно 1; n равно 1, 2 или 3; и, по меньшей мере, один L является Gly.
[0021] В еще одном варианте осуществления Х представляет реакционноспособную группу, выбранную из группы, состоящей из:
(1R,8S,9s)бицикло[6.1.0]нон-4-ин-9-илметанола(BCN),

[0022] В одном варианте осуществления терапевтический агент представляет антитело или его антигенсвязывающий фрагмент, химиотерапевтический препарат, лекарственный препарат, радиоактивный агент, цитотоксический агент, антибиотик, небольшую молекулу, нуклеиновую кислоту или полипептид. В еще одном варианте осуществления диагностическим агентом является флуорофор, флуоресцентный краситель, радионуклид или фермент.
[0023] В одном варианте осуществления иммуноглобулин имеет два аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина и второй аминокислотный остаток после С-концевого лизина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина представляет любой аминокислотный остаток, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина, и где второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В еще одном варианте осуществления первый аминокислотный остаток после С-концевого лизина представляет лизин или аргинин. В еще одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0024] В одном варианте осуществления иммуноглобулин имеет три аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина и третий аминокислотный остаток после С-концевого лизина, где третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислоты, глутаминовой кислоты или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0025] В одном варианте осуществления иммуноглобулин имеет четыре аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина, третий аминокислотный остаток после С-концевого лизина и четвертый аминокислотный остаток после С-концевого лизина, где четвертый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0026] В одном варианте осуществления иммуноглобулин имеет пять аминокислотных остатков после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина, третий аминокислотный остаток после С-концевого лизина, четвертый аминокислотный остаток после С-концевого лизина и пятый аминокислотный остаток после С-концевого лизина, где пятый аминокислотный остаток после С-концевого лизина выбран из группы состоящий из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления четвертый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления четвертый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0027] В одном варианте осуществления иммуноглобулин имеет менее 9 аминокислотных остатков после С-концевого лизина, и где последний аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина.
[0028] В одном варианте осуществления иммуноглобулин имеет менее 13 аминокислотных остатков после С-концевого лизина, и где последний аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина.
[0029] В одном варианте осуществления микробная трансглутаминаза происходит из бактерии Streptomyces mobarensis.
[0030] В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgG1. В еще одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgG2, IgG3 или IgG4. В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgA1, IgA2 или IgM, которые не содержат хвостовую область. В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgD или IgE.
[0031] В одном варианте осуществления иммуноглобулин представляет человеческий иммуноглобулин или гуманизированный иммуноглобулин. В одном варианте осуществления иммуноглобулин представляет химерный иммуноглобулин, или не является человеческим иммуноглобулином.
[0032] В одном варианте осуществления иммуноглобулин содержит две тяжелые цепи и две легкие цепи. В одном варианте осуществления отсутствует внутримолекулярное сшивание между двумя тяжелыми цепями иммуноглобулина.
[0033] В одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет от 1:1 до 2:1.
[0034] В еще одном аспекте обеспечивается конъюгированный иммуноглобулин, содержащий иммуноглобулин и функциональный агент, где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизина, функциональный агент содержит ацил-донорный субстрат, где ацил-донорный субстрат содержит остаток глутамина, и функциональный агент является терапевтическим агентом или диагностическим агентом, где С-концевой лизин иммуноглобулина конъюгирован с остатком глутамина ацил-донорного субстрата функционального агента.
[0035] В еще одном аспекте обеспечивается конъюгированный иммуноглобулин, содержащий иммуноглобулин и функциональный агент, где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизина, где С-концевой лизин конъюгирован с остатком глутамина в ацил-донорном субстрате, где ацил-донорный субстрат дополнительно содержит реакционноспособную группу, где реакционноспособная группа конъюгирована с функциональным агентом, где функциональный агент является терапевтическим агентом или диагностическим агентом.
[0036] В одном варианте осуществления С-концевой лизин представляет лизин 447 (K447) в тяжелой цепи иммуноглобулина.
[0037] В одном варианте осуществления иммуноглобулин содержит один аминокислотный остаток после С-концевого лизина, и где один аминокислотный остаток после С-концевого лизина представляет глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, аспарагин, глутамин или гистидин.
[0038] В еще одном варианте осуществления иммуноглобулин содержит один аминокислотный остаток после С-концевого лизина, и где один аминокислотный остаток после С-концевого лизина не является пролином, аспарагиновой кислотой, глутаминовой кислотой, лизином или аргинином.
[0039] В одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует одной из формул (I) или (II):
(Z)m-Gln-(L)n-(Y) (I)
(Y)-(L)n-Gln-(Z)m (II)
[0040] где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Y является функциональным агентом.
[0041] В одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (I), и где Z представляет CBZ группу; где L представляет молекулу полиэтиленгликоля (ПЭГ)(-O((CH2)2)-), этиламин (-NH((CH2)2)-) или пропиламин (-NH((CH2)3)-); и где n равно 1, 2 или 3. В еще одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (I), где Z представляет CBZ группу, и где L представляет аминокислоту. В одном варианте осуществления L является Gly; m равно 1; и n равно 1. В еще одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует формуле (II), где Z представляет CBZ группу; m равно 1; n равно 1, 2 или 3; и, по меньшей мере, один L является Gly. В одном варианте осуществления L представляет молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления L содержит одну или более аминокислот и молекулу полиэтиленгликоля (ПЭГ).
[0042] В одном варианте осуществления ацил-донорный субстрат соответствует одной из формул (III) или (IV):
(Z)m-Gln-(L)n-(X) (III)
(X)-(L)n-Gln-(Z)m (IV)
[0043] где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Х является реакционноспособной группой.
[0044] В одном варианте осуществления ацил-донорный субстрат соответствует формуле (III), и где Z представляет CBZ группу; где L представляет молекулу полиэтиленгликоля (ПЭГ) (-O((CH2)2)-), этиламин (-NH((CH2)2)-) или пропиламин (-NH((CH2)3)-); и где n равно 0, 1, 2 или 3. В еще одном варианте осуществления ацил-донорный субстрат соответствует формуле (III), где Z представляет CBZ группу, и где L представляет аминокислоту. В одном варианте осуществления L является Gly; m равно 1; и n равно 1. В еще одном варианте ацил-донорный субстрат соответствует формуле (IV), где Z представляет CBZ группу; m равно 1; n равно 1, 2 или 3; и, по меньшей мере, один L является Gly. В одном варианте осуществления L представляет молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления, когда n равно 2-5, то тогда, по меньшей мере, один L содержит одну или более аминокислот, и один или более L содержит молекулу полиэтиленгликоля (ПЭГ).
[0045] В одном варианте осуществления Х представляет реакционноспособную группу, выбранную из группы, состоящей из (1R,8S,9s)бицикло[6.1.0]нон-4-ин-9-илметанола (BCN),

[0046] В одном варианте осуществления терапевтический агент представляет антитело или его антигенсвязывающий фрагмент, химиотерапевтический препарат, лекарственный препарат, радиоактивный агент, цитотоксический агент, антибиотик, небольшую молекулу, нуклеиновую кислоту или полипептид. В еще одном варианте осуществления диагностическим агентом является флуорофор, флуоресцентный краситель, радионуклид или фермент.
[0047] В одном варианте осуществления иммуноглобулин имеет два аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина и второй аминокислотный остаток после С-концевого лизина.
[0048] В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина представляет любой аминокислотный остаток, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина, и где второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина представляет лизин или аргинин.
[0049] В одном варианте осуществления иммуноглобулин имеет три аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина и третий аминокислотный остаток после С-концевого лизина, где третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0050] В одном варианте осуществления иммуноглобулин имеет четыре аминокислотных остатка после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина, третий аминокислотный остаток после С-концевого лизина и четвертый аминокислотный остаток после С-концевого лизина, где четвертый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0051] В одном варианте осуществления иммуноглобулин имеет пять аминокислотных остатков после С-концевого лизина, включающих первый аминокислотный остаток после С-концевого лизина, второй аминокислотный остаток после С-концевого лизина, третий аминокислотный остаток после С-концевого лизина, четвертый аминокислотный остаток после С-концевого лизина и пятый аминокислотный остаток после С-концевого лизина, где пятый аминокислотный остаток после С-концевого лизина выбран из группы состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления второй аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления третий аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина. В одном варианте осуществления четвертый аминокислотный остаток после С-концевого лизина не является аспарагиновой кислотой, глутаминовой кислотой или пролином. В одном варианте осуществления четвертый аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, лизина, цистеина, триптофана, аргинина, серина и глицина.
[0052] В одном варианте осуществления иммуноглобулин имеет менее 9 аминокислотных остатков после С-концевого лизина, и где последний аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина.
[0053] В одном варианте осуществления иммуноглобулин имеет менее 13 аминокислотных остатков после С-концевого лизина, и где последний аминокислотный остаток после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина.
[0054] В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgG1. В еще одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgG2, IgG3 или IgG4. В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgA1, IgA2 или IgM, которые не содержат хвостовую область. В одном варианте осуществления иммуноглобулин представляет иммуноглобулин IgD или IgE.
[0055] В одном варианте осуществления иммуноглобулин представляет человеческий иммуноглобулин или гуманизированный иммуноглобулин. В одном варианте осуществления иммуноглобулин представляет химерный иммуноглобулин или не является человеческим иммуноглобулином.
[0056] В одном варианте осуществления иммуноглобулин содержит две тяжелые цепи и две легкие цепи. В одном варианте осуществления отсутствует внутримолекулярное сшивание между двумя тяжелыми цепями иммуноглобулина.
[0057] В одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет от 1:1 до 2:1.
[0058] В одном варианте осуществления функциональный агент представляет антитело или его антигенсвязывающий фрагмент, и где иммуноглобулин и функциональный агент связываются с одним и тем же антигеном или связываются с различными антигенами.
[0059] В еще одном аспекте обеспечивается нуклеиновая кислота, кодирующая конъюгированный иммуноглобулин. В еще одном аспекте обеспечивается плазмида, содержащая нуклеиновую кислоту. В еще одном варианте осуществления обеспечивается выделенная клетка, содержащая плазмиду.
[0060] В еще одном аспекте обеспечивается фармацевтическая композиция, содержащая конъюгированный иммуноглобулин и фармацевтически приемлемый носитель.
[0061] В одном аспекте обеспечивается конъюгированный иммуноглобулин, полученный любым из способов, описанных здесь.
[0062] В одном варианте осуществления способ дополнительно включает стадию очистки иммуноглобулина, конъюгированного с остатком глутамина ацил-донорного субстрата, перед конъюгацией функционального агента с реакционноспособной группой ацил-донорного субстрата. В одном варианте осуществления стадия очистки включает способы на основе критерия размера, такие как хроматография или диафильтрация. В еще одном варианте осуществления стадия очистки включает разделение на основе критерия заряда, такое как анионообменная или катионообменная хроматография. В еще одном варианте осуществления стадия очистки включает стадию на основе аффинности, такую как хроматография на протеине А или протеине G.
Краткое описание фигур
[0063] Раздел «Сущность изобретения», а также последующее подробное описание станут более понятными при чтении в сочетании с прилагаемыми фигурами. Для целей иллюстрации раскрытых способов и конъюгированных иммуноглобулинов на фигурах показаны иллюстративные примеры вариантов осуществления; однако способы и конъюгированные иммуноглобулины не ограничиваются раскрытыми конкретными вариантами осуществления. На фигурах:
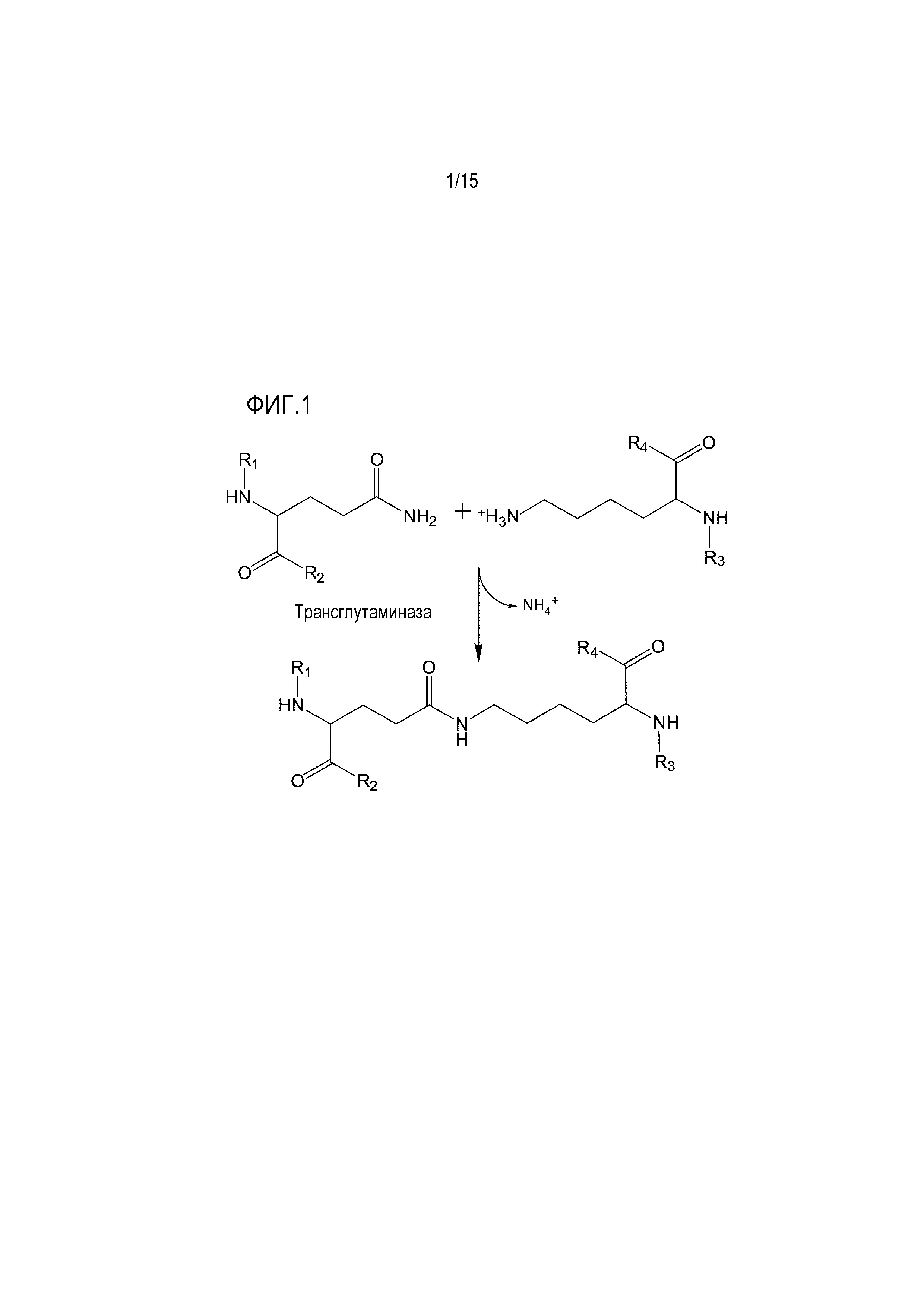
[0064] На фиг. 1 показана трансглутаминазная реакция, где трансглутаминаза катализирует образование изопептидной связи между ацил-донорным глутамином и ацил-акцепторным лизином с высвобождением молекулы аммиака.
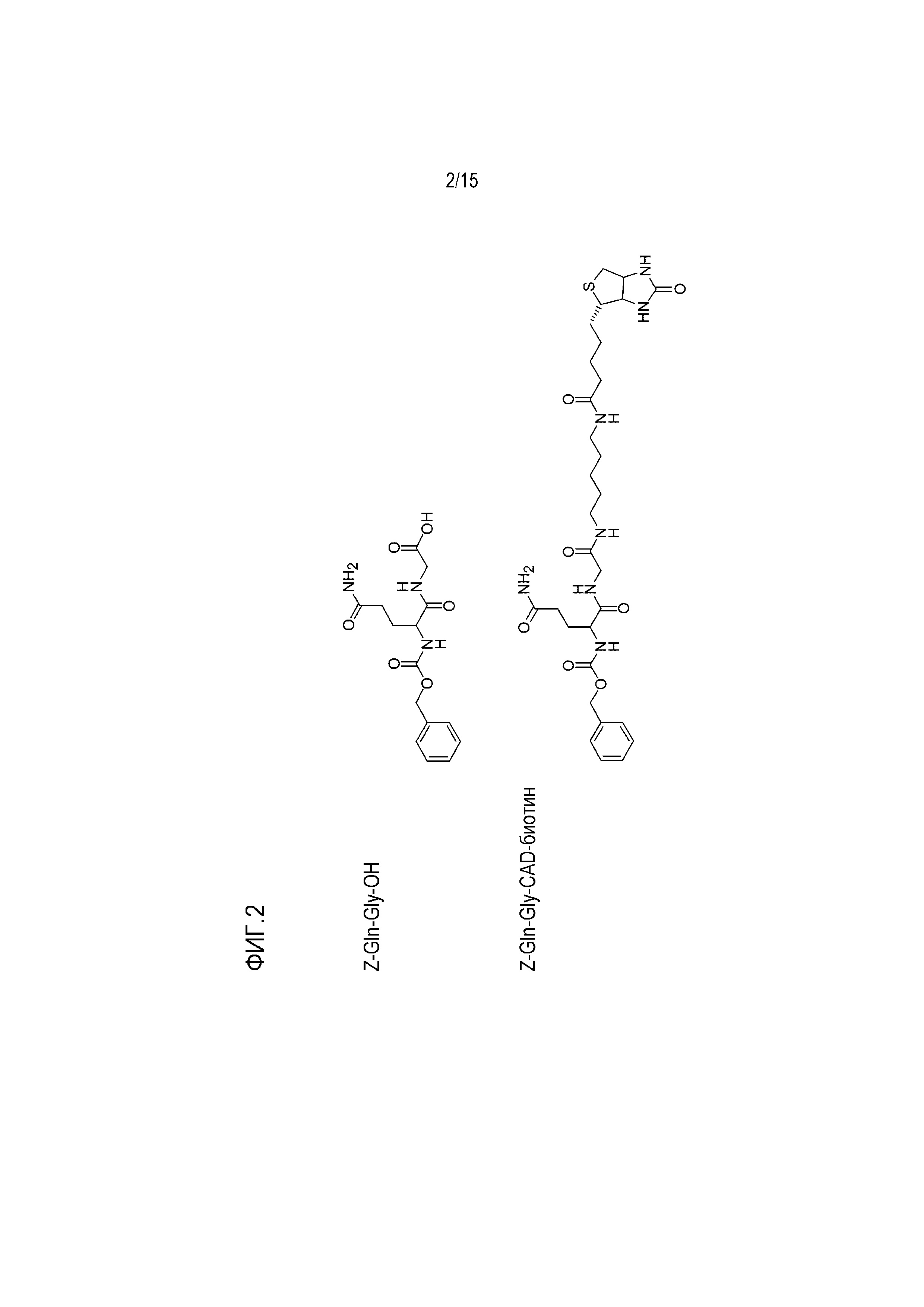
[0065] На фиг. 2 показаны структуры иллюстративных ацил-донорных субстратов Z-Gln-Gly.
[0066] На фиг. 3 показаны возможные пути синтеза некоторых иллюстративных ацил-донорных субстратов Z-Gln-Gly.
[0067] На фиг. 4, включающей фиг. 4А, 4В и 4С, показаны гидрофильные лизины в кристаллических структурах Fab и Fc человеческого IgG1; (A) Fab VH-CH1 и Vκ-Cκ, (B) Fab VH-CH1 и Vλ-Cλ и (C) Fc CH2 и CH3 определяли с использованием моделирования Discovery Studio 4.5 с радиусом зонда 1,4 Å, и они выделены желтым цветом.
[0068] На фиг. 5 показаны последовательности константных областей каппа и лямбда IgG1 человека. Гидрофильные лизины константной области на основе 1FC1 (Fcγ), 4F3F (CH1 и Cκ) и 4HK0 (Cκ) выделены красным цветом; лизины внутри петель подчеркнуты. Константные области нумерованы согласно системе нумерации ЕС.
[0069] На фиг. 6, включающей фиг. 6A, 6B, 6C, 6D, 6E и 6F, показан анализ ESI-MS антител, инкубированных с ацил-донором и микробной трансглутаминазой. Антитела инкубировали с 50-кратным молярным избытком Z-Gln-Gly-CAD-биотина и 1 Е/мл микробной трансглутаминазы в течение ночи при 37°C. После расщепления IdeS и восстановления определяли массы LC, Fd и Fc с использованием ESI-MS.
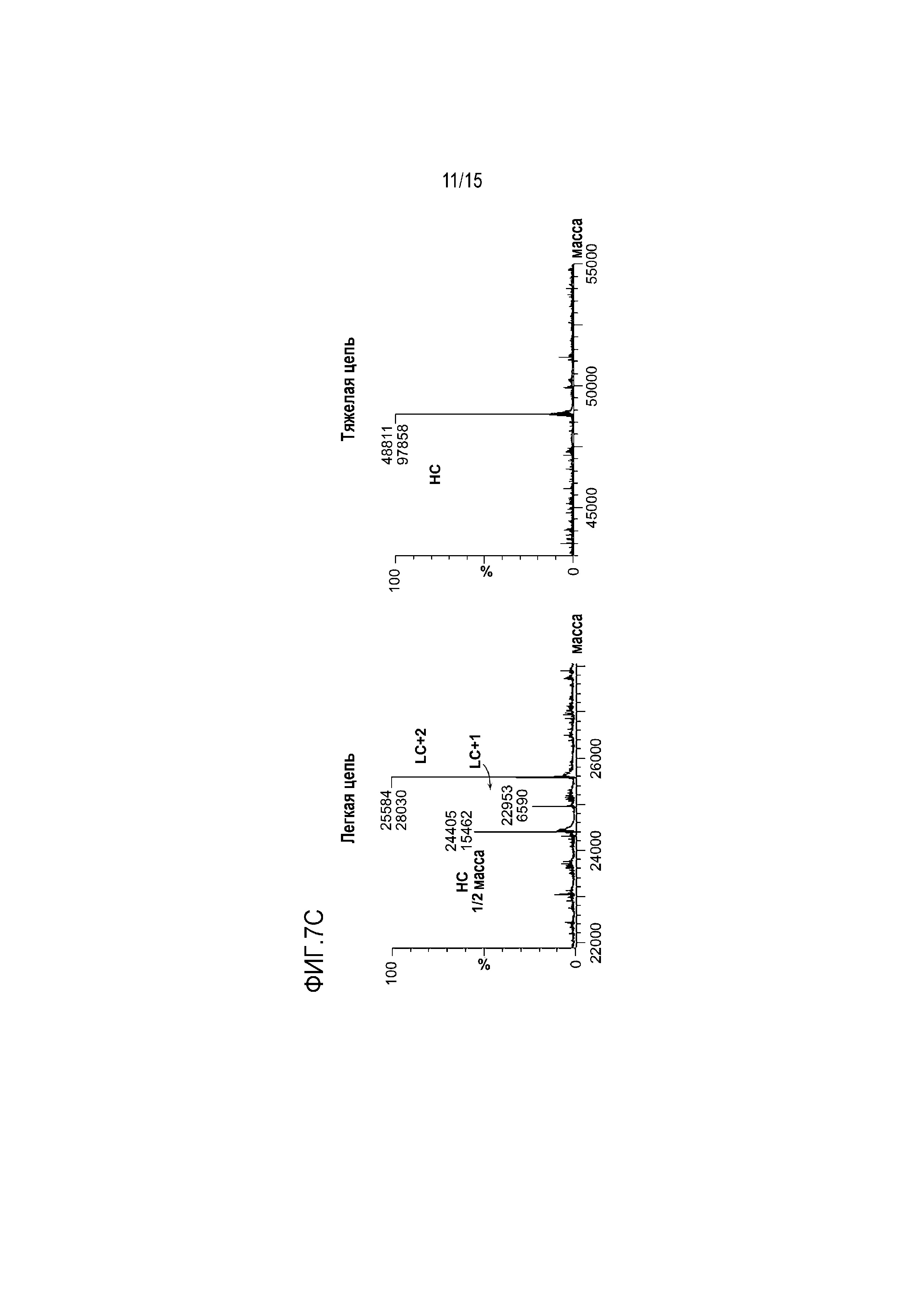
[0070] На фиг. 7 показан анализ ESI-MS реакций микробной трансглутаминазы антитела 01 и K-Tag. mAb инкубировали с Z-Gln-Gly-CAD-биотином и микробной трансглутаминазой в течение ночи при 37°C. После дегликозилирования и восстановления определяли массы HC и LC (A) антитела 01, (B) антитела 01-HC-KTag и (C) антитела 01-LC-KTag с использованием ESI-MS.
[0071] На фиг. 8, включающей фиг. 8A, 8B и 8C, показан анализ ESI-MS C-концевых удлинений антитела 01. (A) антитело 01 MAb, (B) антитело 01-L и (C) антитело 01-LL инкубировали с Z-Gln-Gly-CAD-биотином и микробной трансглутаминазой в течение ночи при 37°C, и массы анализировали с использованием ESI-MS, как показано на фиг. 7.
[0072] На фиг. 9, включающей фиг. 9A-9B, показана одностадийная конъюгация лекарственного препарата с Lys447. (A) Антитело 01-L и (B) антитело 01-L инкубировали с Z-Gln-Gly-ПЭГ2-AuF и микробной трансглутаминазой при 37°C в течение ночи, расщепляли с помощью IdeS и восстанавливали с помощью DTT с получением фрагментов LC, Fd и Fc. Поглощение при 280 нм (AU280) и суммарный ионный ток (TIC) образцов определяли обращенно-фазовой ЖХ-MС, как описано в разделе «Методы».
[0073] На фиг. 10 показан электрофорез SDS-PAGE димерных mAb. Антитело 01-L, трансамидированное с Z-Gln-Gly-N3 или Z-Gln-Gly-ПЭГ3-BCN, смешивали и инкубировали в течение ночи при 22°C. Образцы восстанавливали и анализировали электрофорезом SDS-PAGE с использованием 4-12% полиакриламидного геля Bis-Tris. Масса димера HC-HC составляет примерно 110 кДа.
Подробное описание изобретения
[0074] Раскрытые способы и конъюгированные иммуноглобулины станут более понятными при обращении к следующему подробному описанию, приведенному вместе с прилагаемыми фигурами, которые составляют часть настоящего раскрытия. Следует понимать, что раскрытые способы и конъюгированные иммуноглобулины не ограничиваются конкретными вариантами осуществления, описанными и/или показанными здесь, и что терминология, используемая здесь, предназначена с целью описания конкретных вариантов осуществления только в качестве примера и не предназначена для ограничения заявленных способов или конъюгированных иммуноглобулинов.
[0075] Если специально не указано иное, то любое описание относительно возможного механизма или способа действия, или причины улучшения должно истолковываться только в качестве иллюстративного, и раскрытые способы и конъюгированные иммуноглобулины не должны ограничиваться корректностью или некорректностью любого такого предлагаемого механизма или способа действия или причины улучшения.
[0076] По данному тексту описание относится к конъюгированным иммуноглобулинам и способам их получения. В тех случаях, когда в раскрытии описывается или заявляется признак или вариант осуществления, связанные с конъюгированным иммуноглобулином, то такой признак или вариант осуществления одинаково применимы к способам его получения. Аналогичным образом, когда в раскрытии описывается или заявляется признак или вариант осуществления, связанный со способом получения конъюгированного иммуноглобулина, то такой признак или вариант осуществления в равной степени применимы к конъюгированному иммуноглобулину.
[0077] Ссылка на конкретное числовое значение включает, по меньшей мере, данное конкретное значение, если контекст явно не диктует иное. Когда диапазон выражен в таком виде, то другой вариант осуществления включает от одного конкретного значения и/или до другого конкретного значения. Кроме того, ссылка на значения, указанные в диапазонах, включает каждое значение в этом диапазоне. Все диапазоны являются включающими и комбинируемыми.
[0078] Когда значения выражены в виде приближений, при помощи антецедента «примерно», то следует понимать, что конкретное значение формирует другой вариант осуществления.
[0079] Следует принимать во внимание, что некоторые признаки раскрытых способов и конъюгированных иммуноглобулинов, которые для ясности, описанные здесь в контексте отдельных вариантов осуществления, также могут быть представлены в комбинации в одном варианте осуществления. Напротив, различные признаки раскрытых способов и конъюгированных иммуноглобулинов, которые для краткости, описаны в контексте одного варианта осуществления, также могут быть представлены отдельно или в любой подкомбинации.
[0080] Как используется здесь, единственные формы «a», «an» и «the» включают множественное число.
[0081] Различные термины, относящиеся к аспектам описания, используются в тексте описания и формулы изобретения. Такие термины имеют свое обычное значение, используемое в данной области, если не указано иное. Другие конкретно определенные термины должны истолковываться в соответствии с определениями, представленными здесь.
[0082] Термин «примерно», когда используется для ссылок на числовые диапазоны, отсечения или конкретные значения, используется для обозначения того, что указанные значения могут варьироваться в пределах до 10% от указанного значения. Таким образом, термин «примерно» используется для охвата вариаций ±10% или менее, вариаций ±5% или менее, вариаций ±1% или менее, вариаций ±0,5% или менее или вариаций ± 0,1% или меньше от указанного значения.
[0083] «Кислая аминокислота» относится к аминокислоте, имеющей отрицательный заряд при физиологическом значении рН. Генетически кодированные гидрофобные аминокислоты включают аспартат, глутамат, аспарагин и глутамин.
[0084] Термин «ацил-донорный субстрат» относится к группе с концевой ацильной группой в ней. Предпочтительно «ацил-донорный субстрат» содержит остаток глутамина. Ацил-донорный субстрат может необязательно содержать дополнительную реакционноспособную группу. В первом варианте осуществления ацил-донорный субстрат ковалентно связан с функциональным агентом. Во втором варианте осуществления ацил-донорный субстрат не связан с функциональным агентом. В одном варианте осуществления ацил-донорный субстрат содержит остаток глутамина и реакционноспособную группу. В еще одном варианте осуществления ацил-донорный субстрат содержит один или более линкеров, как здесь описано далее. В любом из вышеуказанных вариантов осуществления необязательно имеется линкер между ацил-донорным субстратом и функциональным агентом или между ацил-донорным субстратом и реакционноспособной группой.
[0085] Как здесь используется, термин «антитело» в широком смысле относится к любой молекуле иммуноглобулина (Ig), состоящей из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, или к ее любому функциональному фрагменту, мутанту, варианту или производному, сохраняющему основные характеристики связывания эпитопа молекулы Ig. Такие форматы мутантов, вариантов или производных антител известны в данной области, и их неограничивающие варианты осуществления обсуждаются здесь. В одном варианте осуществления антитело представляет гуманизированное антитело. В еще одном варианте осуществления антитело представляет человеческое антитело. В еще одном варианте осуществления антитело представляет химерное антитело. В еще одном варианте осуществления антитело представляет антитело, отличное от человеческого антитела.
[0086] В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенной здесь как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенной здесь как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL можно дополнительно подразделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Молекулы иммуноглобулинов могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
[0087] Термин «антигенсвязывающий фрагмент» антитела (или просто «антигенсвязывающий участок») относится к одному или более фрагментам антитела, которые сохраняют способность к специфическому связыванию антигена. Было показано, что антигенсвязывающую функцию антитела могут осуществлять фрагменты полноразмерного антитела. Такие варианты осуществления антител также могут представлять биспецифические форматы, форматы с двойной специфичностью или полиспецифические форматы, которые специфически связываются с двумя или более различными антигенами. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающий фрагмент» антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из областей VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из областей VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb (Ward et al. (1989) Nature, 341:544-546, публикация PCT WO 90/05144), содержащий одну вариабельную область; и (vi) выделенную определяющую комплементарность область (CDR). Кроме того, несмотря на то, что две области фрагмента Fv, VL и VH, кодируются отдельными генами, рекомбинантными способами их можно связать синтетическим линкером, позволяющим получать их в виде одной белковой цепи, в которой области VL и VH спариваются с формированием моновалентной молекулы (известной как одноцепочечное Fv (scFv); см. например, Bird et al. (1988) Science, 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA, 85:5879-5883). Такие одноцепочечные антитела также предназначены для охвата термином «антигенсвязывающий фрагмент» антитела. Также данным термином охватываются другие формы одноцепочечных антител, такие как диатела. Диатела представляют бивалентные биспецифические антитела, в которых области VH и VL экспрессированы в одной полипептидной цепи, но с применением линкера, являющегося слишком коротким, чтобы позволить спаривание двух областей на одной цепи, таким образом вынуждая спариваться области с комплементарными областями другой цепи и формируя два антигенсвязывающих участка (см. например, Holliger et al. (1993) Proc. Natl. Acad. Sci. USA, 90:6444-6448; Poljak et al. (1994) Structure, 2:1121-1123). Такие антигенсвязывающие участки антител известны в данной области (Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York., 790 pp. (ISBN 3-540-41354-5)).
[0088] «Основная аминокислота» относится к аминокислоте, имеющей положительный заряд при физиологическом значении рН. Генетически кодированные гидрофобные аминокислоты включают гистидин, лизин и аргинин.
[0089] Как здесь используется, термин «биологический образец» относится к образцу, полученному от субъекта, включая образец биологической ткани или жидкости, полученный in vivo или in vitro. Такие образцы могут представлять, не ограничиваясь этим, жидкость организма (например, кровь, плазму крови, сыворотку, молоко, спинномозговую жидкость, асцитическую жидкость или мочу), органы, ткани, фракции и клетки, выделенные из организма млекопитающих, включая людей. Биологические образцы также могут включать срезы биологического образца, включая ткани (например, кусочки органа или ткани). Биологические образцы могут также включать экстракты биологического образца, например, антиген из биологической жидкости (например, крови или мочи).
[0090] Термин «С-концевой лизин» относится к С-концу тяжелой цепи иммуноглобулина. Предпочтительно имеется, по меньшей мере, один аминокислотный остаток после С-концевого лизина. В одном варианте осуществления, где после С-концевого лизина (аминокислотное положение +1) имеется только один аминокислотный остаток, то аминокислотный остаток, непосредственно смежный с С-концевым лизином, выбран из группы, состоящей из глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, тирозина, триптофана, серина, треонина, цистеина, аспарагина, глутамина и гистидина. В случае, когда к С-концевому лизину добавляется более одного аминокислотного остатка (аминокислотное положение +1, +2 и т.д.), то аминокислотный остаток, непосредственно смежный с С-концевым лизином (аминокислотное положение +1), может быть выбран из любой аминокислоты, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина. В одном варианте осуществления, когда к С-концевому лизину добавляются два аминокислотных остатка, то аминокислотный остаток, непосредственно смежный с С-концевым лизином (аминокислотное положение +1), представляет любую аминокислоту, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина, и второй аминокислотный остаток (аминокислотное положение +2) после С-концевого лизина выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления, где к С-концевому лизину добавляется два аминокислотных остатка, то первый аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), представляет собой лизин или аргинин.
[0091] В одном варианте осуществления имеется один аминокислотный остаток (аминокислотное положение +1) после С-концевого лизина. В еще одном варианте осуществления имеются два аминокислотных остатка (аминокислотные положения +1 и +2) после С-концевого лизина. В еще одном варианте осуществления имеются три (аминокислотные положения +1, +2 и +3), четыре (аминокислотные положения +1, +2, +3 и +4), пять (аминокислотные положения +1, +2, +3, +4 и +5), шесть (положения аминокислот +1, +2, +3, +4, +5 и +6), семь (аминокислотные положения +1, +2,+3, +4, +5, +6 и +7), восемь (аминокислотные положения +1, +2, +3, +4, +5, +6, +7 и +8), девять (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8 и +9), десять (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9 и +10), одиннадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10 и +11), двенадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11 и +12), тринадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12 и +13), четырнадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13 и +14), пятнадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14 и +15), шестнадцать (аминокислотные положения +1, +2, +3,+4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15 и +16), семнадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16 и +17), восемнадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17 и +18), девятнадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17, +18 и +19) или двадцать (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17, +18, +19 и +20) аминокислотных остатков после С-концевого лизина.
[0092] В одном варианте осуществления аминокислотные остатки после С-концевого лизина не включают GTYFQAYGT. В одном варианте осуществления аминокислотные остатки после С-концевого лизина не включают GECTYFQAYGCTE. В одном варианте осуществления аминокислотные остатки после С-концевого лизина не включают GENTYFQAYGNTE.
[0093] В одном варианте осуществления С-концевой лизин представляет лизин 447 IgG1, IgG2, IgG3 или IgG4. В еще одном варианте осуществления С-концевой лизин представляет С-концевой лизин IgD или IgE. В еще одном варианте осуществления термин «С-концевой лизин» относится к последнему остатку лизина перед хвостовой областью IgA1, IgA2 или IgM. В одном варианте осуществления хвостовая область IgA1, IgA2 или IgM удалена. В одном варианте осуществления хвостовая область IgA1, IgA2 или IgM не удалена. Последовательности хвостовых областей для антител приведены ниже:
[0094] В еще одном варианте осуществления один или более аминокислотных остатков могут быть удалены, например, делецированы из С-конца тяжелой цепи иммуноглобулина, и может быть добавлен С-концевой остаток лизина с последующим, по меньшей мере, одним дополнительным аминокислотным остатком к иммуноглобулину. Например, аминокислотные остатки 446 и 447 иммуноглобулина IgG1, IgG2, IgG3 или IgG4 могут быть делецированы, и может быть добавлен С-концевой лизин, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком, где затем микробная трансглутаминаза может катализировать конъюгацию С-концевого лизина иммуноглобулина с остатком глутамина ацил-донорного субстрата. Другими словами, С-концевой лизин может присутствовать, например, в аминокислотном положении 446 иммуноглобулина, если иммуноглобулин был мутирован для удаления аминокислотных положений 446 и 447 дикого типа. Один или более дополнительных аминокислотных остатков затем могут добавлены к С-концевому лизину, например, в аминокислотных положениях +1, +2, +3, +4 и т.д., как здесь описано. В одном варианте осуществления один, два, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных остатков могут быть удалены, например, делецированы из С-конца тяжелой цепи иммуноглобулина, и С-концевой остаток лизина, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком могут быть добавлены к иммуноглобулину, например, в аминокислотных положениях +1, +2, +3, +4 и т.д., как здесь описано.
[0095] В еще одном варианте осуществления домен СН3 удаляется из С-конца тяжелой цепи иммуноглобулина, и С-концевой остаток лизина, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком может быть добавлен к иммуноглобулину. В еще одном варианте осуществления домен СН2 и домен СН3 удаляются из С-конца тяжелой цепи иммуноглобулина, и С-концевой остаток лизина, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком может быть добавлен к иммуноглобулину. В еще одном варианте осуществления шарнирная область, домен СН2, и домен СН3 удаляются из С-конца тяжелой цепи иммуноглобулина, и С-концевой остаток лизина, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком могут быть добавлены к иммуноглобулину. В еще одном варианте осуществления домен СН1, шарнирная область, домен СН2, и домен СН3 удаляются из С-конца тяжелой цепи иммуноглобулина, и С-концевой остаток лизина, с последующим, по меньшей мере, одним дополнительным аминокислотным остатком могут быть добавлены к иммуноглобулину.
[0096] Термин «клик-химия» относится к определенным реакциям синтеза и/или конъюгации белков, которые являются высокопродуктивными, высокоселективными, надежными и чистыми. См., например, King et al., «Developments in the Field of Bioorthagonal Bond Forming Reactions - Past and Present Trends», Bioconjug. Chem., (2014) 25(5): 825-839; McKay et al., «Click Chemistry in Complex Mixtures: Bioorthagonal Bioconjugation», Chem. Biol., (2014) 21(9): 1075-1101.
[0097] Термин «химеризованное», «химерное», «химерное антитело» и подобные термины относятся к иммуноглобулину, содержащему вариабельную область тяжелой цепи и вариабельную область легкой цепи, т.е. антигенсвязывающий участок, из одного источника или вида и, по меньшей мере, участок константной области тяжелой цепи и константной области легкой цепи, полученной из другого источника или вида. Эти участки могут быть соединены вместе химически обычными способами (например, синтетическими) или получены в виде смежного полипептида с использованием методов генной инженерии (например, ДНК, кодирующая белковые участки химерного антитела, может быть экспрессирована для получения смежной полипептидной цепи). Другие формы «химерных иммуноглобулинов», охватываемые настоящим изобретением, представляют те, в которых класс или подкласс был модифицирован или изменен по сравнению с исходным иммуноглобулином (также называемые «иммуноглобулинами с переключенным классом»). По всему тексту раскрытия химерные иммуноглобулины обозначаются как «xi». Здесь «химерный иммуноглобулин» и подобные термины относятся к последовательности иммуноглобулина, а не к способу, использованному для получения антитела.
[0098] Как здесь используется, «Lys447» или «лизин 447» относится к остатку лизина в аминокислотном положении 447 вариабельной области тяжелой цепи иммуноглобулина (как нумеровано с использованием системы нумерации ЕС), и который представляет, например, C-концевой кодон в IgG1, IgG2, IgG3, IgG4, IgD и IgE.
[0099] Как здесь используется, «функциональный агент» относится к агенту, имеющему терапевтическое, диагностическое или другое функциональное свойство(а). В одном варианте осуществления функциональный агент может представлять терапевтический агент. В еще одном варианте осуществления функциональный агент может быть диагностическим агентом. Функциональные агенты могут представлять крупные молекулы или небольшие молекулы. Высокомолекулярные функциональные агенты включают, не ограничиваясь этим, антитело и его антигенсвязывающие фрагменты. Низкомолекулярные функциональные агенты включают, не ограничиваясь этим, химиотерапевтические препараты, цитотоксические агенты, антибиотики, другие органические соединения, которые могут регулировать биологический процесс (например, лекарственные средства) и полипептиды.
[00100] Термин «гуманизированный», «гуманизированный иммуноглобулин» и подобные термины относятся к иммуноглобулинам, в которых каркасная область или «области, определяющие комплементарность» (CDR), были модифицированы таким образом, чтобы содержать CDR иммуноглобулина различной специфичности по сравнению с таковыми родительского иммуноглобулина. По большей части, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентный иммуноглобулин), в которых остатки гипервариабельной области реципиента заменены остатками гипервариабельной области вида, отличного от человека (донорный иммуноглобулин), такого как мышь, крыса, кролик или примат, не являющийся человеком, имеющий требуемую специфичность, аффинность и активность антител. В некоторых случаях остатки FWR человеческого иммуноглобулина заменены соответствующими остатками, отличными от человеческих. Кроме того, гуманизированные иммуноглобулины могут содержать остатки, которые не обнаружены в реципиентном иммуноглобулине или в донорном иммуноглобулине. Такие модификации сделаны для дополнительного улучшения функции иммуноглобулина. В общем, гуманизированный иммуноглобулин будет включать по существу все, по меньшей мере, из одной и, как правило, две вариабельных области, в которых все или практически все гипервариабельные петли соответствуют иммуноглобулину, отличному от человека, и все или практически все FWR представляют последовательности человеческого иммуноглобулина. Гуманизированный иммуноглобулин может необязательно также содержать, по меньшей мере, участок константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. См., например, Riechmann, L., et al., Nature, 332 (1988) 323-327; и Neuberger, M. S., et al., Nature, 314 (1985) 268-270. По тексту раскрытия «гуманизированные иммуноглобулины» обозначаются «zu». Здесь «гуманизированный иммуноглобулин» и подобные термины относятся к последовательности иммуноглобулина, а не к способу, используемому для получения иммуноглобулина.
[00101] Термин «диагностический агент» относится к соединению, которое может быть пригодным для визуализирующих исследований, таких как исследования КТ, МРТ и рентгеновские in vivo и/или in vitro. Неограничивающие примеры диагностических агентов включают флуорофор, флуоресцентный краситель, радионуклид и фермент.
[00102] Термин «донорный иммуноглобулин» относится к иммуноглобулину, отличному от человеческого, который вносит аминокислотные последовательности его вариабельных областей, CDR или других функциональных фрагментов или их аналогов, в гуманизированный иммуноглобулин и, таким образом, обеспечивает гуманизированный иммуноглобулин антигенной специфичностью и нейтрализующей активностью, характерной для донорного иммуноглобулина.
[00103] Термин «реципиентный иммуноглобулин» относится к иммуноглобулину, гетерологичному донорному иммуноглобулину, который обеспечивает аминокислотные последовательности его каркасных областей тяжелой и/или легкой цепи и/или его константные области тяжелой и/или легкой цепи гуманизированному иммуноглобулину. Реципиентный иммуноглобулин может быть получен от любого млекопитающего. В предпочтительных вариантах осуществления реципиентный иммуноглобулин является неиммуногенным у людей. Предпочтительно реципиентный иммуноглобулин представляет иммуноглобулин человека.
[00104] «Гуманизация» относится к способу получения гуманизированного иммуноглобулина и включает любой способ получения гуманизированных иммуноглобулинов, обладающих вышеуказанными характеристиками, включая, не ограничиваясь этим, in silico гуманизацию, конструирование CDR вида/хозяина в человеческие иммуноглобулины, заменяя остатки каркасной области химерного иммуноглобулина соответствующей человеческой каркасной областью и т.д.
[00105] Как здесь используется, термин «иммуноглобулин» относится к белку, состоящему из одного или более полипептидов, по существу кодированных генами иммуноглобулина, включая легкие цепи каппа и лямбда, а также тяжелые цепи альфа, гамма, дельта, эпсилон и мю. «Легкие цепи» полноразмерного иммуноглобулина (примерно 25 кД или 214 аминокислот) кодируются геном вариабельной области на NH2-конце (примерно 110 аминокислот) и геном константной области каппа или лямбда на COOH-конце. «Тяжелые цепи» полноразмерного иммуноглобулина (примерно 50 кД или 446 аминокислот) аналогично кодируются геном вариабельной области (примерно 116 аминокислот) и одним из других вышеуказанных генов константной области, например гамма (кодирующий примерно 330 аминокислот). «Иммуноглобулины» включают: (a) полипептиды иммуноглобулина, т.е. полипептиды семейства иммуноглобулинов, которые содержат антигенсвязывающий участок, который специфически связывается с определенным антигеном, включая все изотипы иммуноглобулинов (IgG, IgA, IgE, IgM, IgD и IgY), классы (например, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2), подклассы и различные мономерные и полимерные формы каждого изотипа, если не указано иное; и (b) консервативно замещенные варианты таких иммуноглобулиновых полипептидов, которые иммуноспецифически связываются с антигеном. Иммуноглобулины, в общем, описаны, например, в монографии Harlow & Lane, Antibodies: The Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988).
[00106] Одна форма иммуноглобулина, раскрытая здесь, представляет собой основную структурную единицу антитела. Например, антитело может включать тетрамер и состоит из двух идентичных пар цепей иммуноглобулина, где каждая пара имеет одну легкую цепь и одну тяжелую цепь. Как правило, в каждой паре вариабельные области легкой цепи и тяжелой цепи вместе ответственны за связывание с антигеном, и константные области ответственны за эффекторные функции антитела.
[00107] В дополнение к антителам иммуноглобулины могут существовать во множестве других форм, включая, например, антигенсвязывающие фрагменты или части полноразмерного иммуноглобулина, такие как фрагменты Fv, Fab, (Fab')2 и Fv; и альтернативные форматы антител, такие как одноцепочечные иммуноглобулины (scFV и scFab), диатела, триатела, тетратела, линейные антитела и мультиспецифические антитела, если назвать только некоторые из них. См., например, James D. Marks, Antibody Engineering, глава 2, Press Oxford University Press (1995) (Carl K. Borrebaeck, Ed.).
[00108] В одном варианте осуществления иммуноглобулин может содержать Fab-фрагмент. В еще одном варианте осуществления иммуноглобулин может содержать домен СН3. В еще одном варианте осуществления иммуноглобулин может содержать тяжелую цепь.
[00109] Как здесь используется, термин «иммуноспецифически» относится к способности иммуноглобулина специфически связываться с антигеном, против которого был продуцирован иммуноглобулин, и специфически не связываться с другими пептидами или белками. Иммуноглобулин, который иммуноспецифически связывается с антигеном, против которого был продуцирован иммуноглобулин, может не связываться с другими полипептидами или белками или может связываться с другими полипептидами или белками с более низкой аффинностью связывания, чем антиген, против которого был продуцирован иммуноглобулин, что определяется, например, иммуноанализами, BIAcore или другими анализами, известными в данной области. Иммуноглобулин иммуноспецифически связывается с антигеном, против которого продуцирован иммуноглобулин, когда он связывается с антигеном с более высокой аффинностью связывания, чем с любым перекрестно-реактивным антигеном, что определяется с использованием экспериментальных методов, таких как, не ограничиваясь эти, радиоиммуноанализы (RIA) и (ELISA) (см., например, Paul, ed., Fundamental Immunology, 2nded., Raven Press, New York, стр. 332-336 (1989), где приводится обсуждение специфичности антител).
[00110] Как здесь используется, «линкер» относится к спейсеру, который может представлять прямую или разветвленную цепь для соединения иммуноглобулина (через ацил-донорный субстрат) с функциональным агентом или реакционноспособной группой. Такие линкеры могут быть расщепляемыми (например, кислотно-лабильные или расщепляемые протеазами) или нерасщепляемыми. В одном варианте осуществления линкером является молекула полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления линкер содержит одну или более аминокислот и молекулу полиэтиленгликоля (ПЭГ).
[00111] Термин «моноклональное антитело» относится к антителу, которое получено из одного клеточного клона, включая любой клон эукариотических или прокариотических клеток, или фаговый клон, а не к методу, посредством которого оно получено. Моноклональное антитело проявляет одну специфичность и аффинность связывания к определенному эпитопу. Термин «моноклональное антитело» не ограничивается антителами, полученными с помощью гибридомной технологии.
[00112] «Нативный» относится к последовательности иммуноглобулина дикого типа из вида, в котором иммуноглобулин был продуцирован.
[00113] Как здесь используется, термин «процент идентичности» и подобные термины используются для описания отношений между двумя или более нуклеиновыми кислотами, полинуклеотидами, белками или полипептидами, и понимается в контексте и в сочетании с терминами, включающими: (a) референсная последовательность, (b) окно сравнения, (c) идентичность последовательности и (d) процент идентичности последовательности.
(а) «Референсная последовательность» представляет определенную последовательность, используемую в качестве основы для сравнения последовательностей. Референсная последовательность может быть подмножеством большей по величине определенной последовательности; например, сегмент полноразмерной кДНК или последовательности гена, или полная последовательность кДНК или гена. Для полипептидов примерные длины референсной полипептидной последовательности включают, по меньшей мере, примерно 16 аминокислот, по меньшей мере, примерно 20 аминокислот, по меньшей мере, примерно 25 аминокислот, по меньшей мере, примерно 35 аминокислот, по меньшей мере, примерно 50 аминокислот или, по меньшей мере, примерно 100 аминокислот. Для нуклеиновых кислот примерная длина референсной нуклеотидной последовательности включает, по меньшей мере, примерно 50 нуклеотидов, по меньшей мере, примерно 60 нуклеотидов, по меньшей мере, примерно 75 нуклеотидов, по меньшей мере, примерно 100 нуклеотидов или, по меньшей мере, примерно 300 нуклеотидов или любое целое число примерно или между ними.
(b) «Окно сравнения» включает ссылку на смежный и определенный сегмент полинуклеотидной или полипептидной последовательности, где полинуклеотидную или полипептидную последовательность можно сравнить с референсной последовательностью, и где участок полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления, замены или делеции (т.е. гэпы) по сравнению с рефренсной последовательностью (которая не содержит добавлений, замен или делеций) для оптимального выравнивания двух последовательностей. Иллюстративные окна сравнения могут составлять, по меньшей мере, 20 смежных нуклеотидов или аминокислот в длину и необязательно могут составлять 30, 40, 50, 100 или более. Специалисты в данной области техники понимают, что для того, чтобы избежать ошибочно высокого сходства с референсной последовательностью за счет включения гэпов в полинуклеотидной или полипептидной последовательности, обычно вводится штраф за гэп и вычитается из числа совпадений.
(c) Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, алгоритмом локальной гомологии Смита-Уотермана, Adv. Appl. Math. 2:482 (1981), алгоритмом выравнивания гомологии Нидлемана-Вунша, J. Mol. Biol. 48:443 (1970), способом поиска подобия Пирсона-Липмана, Proc. Natl. Acad. Sci. USA 85:2444 (1988), компьютеризованными вариантами осуществления этих алгоритмов, включая, не ограничиваясь этим: CLUSTAL в программе PC/Gene от Intelligenetics, Mountain View, Calif., GAP, BESTFIT, BLAST, FASTA и TFASTA в программном пакете Wisconsin Genetics, Genetics Computer Group (GCG), 7 Science Dr., Madison, Wis., USA; программа CLUSTAL хорошо описана Хиггинсом и Шарпом, Gene, 73: 237-244, 1988; Corpet, et al., Nucleic Acids Research, 16: 881-90, 1988; Huang, et al., Computer Applications in Biosciences, 8: 1-6, 1992; и Pearson, et al., Methods in Molecular Biology, 24: 7-331, 1994. Семейство программ BLAST, которое может использоваться для поиска сходства в базах данных, включает: BLASTN для заданных нуклеотидных последовательностей против нуклеотидных последовательностей в базе данных; BLASTX для заданных нуклеотидных последовательностей против белковых последовательностей в базе данных; BLASTP для заданных белковых последовательностей против белковых последовательностей в базе данных; TBLASTN для заданных белковых последовательностей против нуклеотидных последовательностей в базе данных; и TBLASTX для заданных нуклеотидных последовательностей против нуклеотидных последовательностей в базе данных. См. Current Protocols in Molecular Biology, Chapter 19, Ausubel, et al., Eds., Greene Publishing and Wiley-Interscience, New York, 1995. Новые версии вышеуказанных программ или новые программы, несомненно, станут доступными в будущем, и могут использоваться с настоящим раскрытием.
(d) «Процент идентичности» означает значение, определяемое путем сравнения двух оптимально выравненных последовательностей в окне сравнения, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления, замены или делеции (т.е. гэпы) по сравнению с референсной последовательностью (которая не содержит добавлений, замен или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывается определением количества положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток имеет место в обеих последовательностях, с получением количества совпадающих положений, деля количество совпадающих положений на общее количество положений в окне сравнения и умножая результат на 100, с получением процента идентичности последовательности.
[00114] «Фармацевтически эффективное количество» относится к количеству иммуноглобулина, которое лечит субъекта.
[00115] «Фармацевтически приемлемый носитель» относится к компонентам фармацевтической композиции иммуноглобулина, как здесь описано, для введения субъекту. Например, фармацевтически приемлемый носитель может быть на основе липосом, на основе липидов и/или на основе наночастиц.
[00116] Как здесь используется, термин «реакционноспособная группа» относится к химической функциональной группе, которая может взаимодействовать с другими соединениями, такими как функциональные агенты, с образованием, по меньшей мере, одной ковалентной связи. В одном варианте осуществления реакционноспособные группы являются реакционноспособными в реакциях сочетания клик-химии. Неограничивающие примеры реакционноспособных групп включают (1R,8S,9s)бицикло[6.1.0]нон-4-ин-9-илметанол(BCN),

[00117] Как здесь используется, термин «субъект» относится к организму человека или организму, отличному от организма человека. Таким образом, способы, иммуноглобулины и конъюгированные иммуноглобулины, описанные здесь, применимы как для заболеваний и патологических состояний человека, так и животных. Субъектами могут быть «пациенты», т.е. живые люди или организмы, отличные человека, которые получают медицинскую помощь для лечения заболевания или патологического состояния, или люди или организмы, отличные от человека, без наличия определенного заболевания, которые обследуются на наличие признаков патологии или наличие/отсутствие определенного патологического состояния.
[00118] «Замещение» относится к замене одного аминокислотного остатка на другой. «Замещение» включает, например, миссенс-мутации в одной или более пар оснований ДНК, кодирующих аминокислотный остаток, или конструирование белка с обменом одной аминокислоты на другую аминокислоту.
[00119] Как здесь используется, термин «лечение» и подобные термины относятся к снижению тяжести и/или частоты симптомов заболевания, элиминации симптомов заболевания и/или лежащей в основе причины указанных симптомов, снижению частоты или вероятности проявления симптомов заболевания и/или лежащей в их основе причины, и также ослаблению или устранению последствий повреждения, вызванного, прямо или опосредованно, заболеванием.
[00120] Термин «терапевтический агент» означает крупную или небольшую молекулу, которую можно вводить субъекту, нуждающемуся в этом, для лечения патологического состояния. Терапевтические агенты можно вводить для лечения или предупреждения начала, замедления прогрессирования или ослабления одного или более симптомов патологического состояния у субъектов, страдающих от них. Терапевтические агенты включают, не ограничиваясь этим, антитело или его антигенсвязывающий фрагмент, химиотерапевтический препарат, радиоактивный агент, цитотоксический агент, антибиотик и т.д. В одном варианте терапевтический агент представляет собой небольшую молекулу. В еще одном варианте осуществления терапевтический агент представляет полипептид.
[00121] Как здесь используется, термин «на 90% идентична» включает, по меньшей мере, на 90% идентична, на 91% идентична, на 92% идентична, на 93% идентична, на 94% идентична, на 95% идентична, на 96% идентична, на 97% идентична, на 98% идентична, на 99% идентична или на 100% идентична референсной молекуле (например, биологической последовательности).
[00122] По тексту раскрытия используются следующие сокращенные обозначения: конъюгаты лекарственного средства на основе антитела (ADC); соотношение лекарственный препарат к антителу (DAR); каркасная область (FWR); определяющая комплементарность область (CDR); ауристатин F (AuF); вариабельная область тяжелой цепи (VH); вариабельная область легкой цепи (VL); вариабельная область каппа (Vκ); константная область гамма (Cγ); константная область каппа (Cκ); моноклональное антитело (mAb); лизин в аминокислотном положении 447 тяжелой цепи иммуноглобулина, как нумеровано с использованием системы нумерации ЕС (Lys447).
Получение конъюгированных иммуноглобулинов
[00123] В настоящем изобретении обеспечиваются способы получения конъюгированного иммуноглобулина, где способы включают: инкубацию иммуноглобулина с микробной трансглутаминазой и функциональным агентом, содержащим ацил-донорный субстрат, а) где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизина, b) где ацил-донорный субстрат содержит остаток глутамина и с) где функциональный агент является терапевтическим агентом или диагностическим агентом, где микробная трансглутаминаза катализирует конъюгацию С-концевого лизина иммуноглобулина с остатком глутамина ацил-донорного субстрата в функциональном агенте, тем самым обеспечивая получение конъюгированного иммуноглобулина.
[00124] Также здесь обеспечиваются способы получения конъюгированного иммуноглобулина, где способы включают: i) инкубацию иммуноглобулина с микробной трансглутаминазой и ацил-донорным субстратом, а) где иммуноглобулин содержит, по меньшей мере, один аминокислотный остаток после С-концевого лизин, b) где ацил-донорный субстрат содержит остаток глутамина и реакционноспособную группу, где микробная трансглутаминаза каиализирует конъюгацию С-концевого лизина иммуноглобулина с остатком глутамина ацил-донорного субстрата и ii) конъюгацию функционального агента с реакционноспособной группой ацил-донорного субстрата, где функциональный агент является терапевтическим агентом или диагностическим агентом, тем самым обеспечивая получение конъюгированного иммуноглобулина.
[00125] Конъюгация может быть осуществлена растворением функционального агента, содержащего ацил-донорный субстрат, в растворяющем растворе, и инкубированием растворенного функционального агента с иммуноглобулином и микробной трансглутаминазой в буфере для конъюгации. Конъюгация также может быть выполнена растворением ацил-донорного субстрата в растворяющем растворе и инкубацией ацил-донорного субстрата с иммуноглобулином и микробной трансглутаминазой в буфере для конъюгации.
[00126] Для нерастворимых в воде функциональных агентов и ацил-донорных субстратов подходящие растворяющие растворы включают органические, смешивающиеся с водой растворители, такие как диметилсульфоксид (ДМСО). Для водорастворимых функциональных агентов и ацил-донорных субстратов подходящие растворяющие растворы включают, не ограничиваясь этим, водные или забуференные водные растворы, такие как забуференный фосфатом физиологический раствор, рН 7,2 (1 × PBS) или DPBS.
[00127] Подходящие концентрации функционального агента или ацил-донорного субстрата включают примерно от 10 мкМ до примерно 800 мМ, примерно от 10 мМ до примерно 100 мМ, примерно от 25 мМ до примерно 100 мМ, примерно от 40 мМ до примерно 100 мМ, примерно от 55 мМ до примерно 100 мМ, примерно от 70 мМ до примерно 100 мМ, примерно от 10 мМ до примерно 90 мМ, примерно от 10 мМ до примерно 75 мМ, примерно от 10 мМ до примерно 60 мМ, примерно от 10 мМ до примерно 50 мМ, примерно от 10 мМ до примерно 40 мМ или примерно от 10 мМ до примерно 30 мМ.
[00128] В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 10 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 25 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 50 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 100 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 250 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 500 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 750 мкМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 1 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 10 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 20 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 30 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 40 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 50 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 60 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 70 мМ. В некоторых вариантах осуществления концентрация функционального агента или субстрата донора ацила может составлять примерно 80 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 90 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 100 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 150 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 200 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 250 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 300 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 350 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 400 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 450 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 500 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 550 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 600 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 650 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 700 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 750 мМ. В некоторых вариантах осуществления концентрация функционального агента или ацил-донорного субстрата может составлять примерно 800 мМ.
[00129] Подходящие концентрации иммуноглобулина включают примерно от 0,1 мг/мл до примерно 20 мг/мл, примерно от 0,5 мг/мл до примерно 20 мг/мл, примерно от 1 мг/мл до примерно 20 мг/мл, примерно от 5 мг/мл до примерно 20 мг/мл, примерно от 10 мг/мл до примерно 20 мг/мл, примерно от 0,1 мг/мл до примерно 15 мг/мл, примерно от 0,1 мг/мл до примерно 12 мг/мл, примерно от 0,1 мг/мл до примерно 10 мг/мл, примерно от 0,1 мг/мл до примерно 5 мг/мл или примерно от 0,1 мг/мл до примерно 2 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 0,1 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 0,5 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 1 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 2 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 5 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 10 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 15 мг/мл. В некоторых вариантах осуществления концентрация иммуноглобулина может составлять примерно 20 мг/мл.
[00130] Подходящие соотношения функционального агента или ацил-донорного субстрата:иммуноглобулину составляют примерно от 1:1 до 100:1. В одном варианте осуществления соотношение функционального агента к ацил-донорному субстрату:иммуноглобулину составляет примерно от 25:1 до примерно 75:1. В еще одном варианте осуществления соотношение функционального агента к ацил-донорному субстрату:иммуноглобулину составляет примерно от 40:1 до примерно 60:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата: иммуноглобулину может составлять 1:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 2:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 3:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 4:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 5:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 6:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 7:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 8:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 9:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 10:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 11:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 12:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 13:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 14:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 15:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 16:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 17:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 18:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 19:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 20:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 25:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 30:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 35:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 40:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 45:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 50:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 60:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 70:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 80:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 90:1. В некоторых вариантах осуществления соотношение функционального агента или ацил-донорного субстрата:иммуноглобулину может составлять 100:1.
[00131] Инкубация может быть выполнена в ряде подходящих буферов для конъюгации, включая, например, DPBS, 1×PBS, pH 7,2, фосфат натрия, фосфат калия, борат натрия, трис-буфер и HEPES, если назвать только некоторые из них. Концентрация буфера для конъюгации составляет примерно от 5 мМ до примерно 2 М, примерно от 5 мМ до примерно 1 М, примерно от 5 мМ до примерно 500 мМ, примерно от 5 мМ до примерно 100 мМ, примерно от 10 мМ до примерно 100 мМ, примерно от 20 мМ до примерно 100 мМ, примерно от 30 мМ до примерно 100 мМ, примерно от 45 мМ до примерно 100 мМ, примерно от 60 мМ до примерно 100 мМ, примерно от 75 мМ до примерно 100 мМ, примерно от 10 мМ до примерно 90 мМ, примерно от 10 мМ до примерно 75 мМ, примерно от 10 мМ до примерно 60 мМ, примерно от 10 мМ до примерно 45 мМ или примерно от 10 мМ до примерно 30 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 10 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 20 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 30 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 40 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 50 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 60 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 70 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 80 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 90 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 100 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 250 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 500 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 750 мМ. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 1 М. В некоторых вариантах концентрация буфера для конъюгации может составлять примерно 1,25 М. В некоторых вариантах концентрация буфера для конъюгации может составлять примерно 1,5 М. В некоторых варианты осуществления изобретения концентрация буфера для конъюгации может составлять примерно 1,75 М. В некоторых вариантах осуществления концентрация буфера для конъюгации может составлять примерно 2 М.
[00132] Буфер для конъюгации может дополнительно включать хлорид натрия. Подходящие концентрации хлорида натрия включают примерно от 0 мМ до примерно 2 М, примерно от 0 мМ до примерно 1 М, примерно от 1 М до примерно 2 М, примерно от 500 мМ до примерно 1,5 М, примерно от 25 мМ до примерно 500 мМ, примерно от 50 мМ до примерно 500 мМ, примерно от 75 мМ до примерно 500 мМ, примерно от 100 мМ до примерно 500 мМ, примерно от 150 мМ до примерно 500 мМ, примерно от 200 мМ до примерно 500 мМ, примерно от 250 мМ до примерно 500 мМ, примерно от 300 мМ до примерно 500 мМ, примерно от 350 мМ до примерно 500 мМ, примерно от 400 мМ до примерно 500 мМ, примерно от 0 мМ до примерно 400 мМ, примерно от 0 мМ до примерно 350 мМ, примерно от 0 мМ до примерно 300 мМ, примерно от 0 мМ до примерно 250 мМ, примерно от 0 мМ до примерно 200 мМ, примерно от 0 мМ до примерно 150 мМ, примерно от 0 мМ до примерно 100 мМ, примерно от 0 мМ до примерно 50 мМ или примерно от 0 мМ до примерно 25 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 25 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 50 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 75 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 100 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 150 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 200 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 250 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 300 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 350 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 400 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 500 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 750 мМ. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 1 М. В некоторых вариантах концентрация хлорида натрия может составлять примерно 1,25 М. В некоторых вариантах концентрация хлорида натрия может составлять примерно 1,5 М. В некоторых вариантах осуществления концентрация хлорида натрия может составлять примерно 1,75 М. В некоторых вариантах концентрация хлорида натрия может составлять примерно 2 М.
[00133] рН буфера для конъюгации может составлять примерно от 4 до примерно 9. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно от 5 до примерно 8. В еще одном варианте осуществления рН буфера для конъюгации может составлять примерно от 6 до примерно 7. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 4. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 4,5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 5,5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,0. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,6. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,7. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,8. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 6,9. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,0. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,1. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,2. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,3. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,4. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,6. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,7. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,8. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 7,9. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,0. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,1. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,2. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,3. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,4. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 8,5. В некоторых вариантах осуществления рН буфера для конъюгации может составлять примерно 9.
[00134] Для повышения растворимости функционального агента или ацил-донорного субстрата в буфере для конъюгации конечная концентрация органического смешивающегося с водой растворителя в буфере для конъюгации может составлять примерно от 0% до примерно 20%, примерно от 2% до примерно 20%, примерно от 5% до примерно 20%, примерно от 8% до примерно 20%, примерно от 11% до примерно 20%, примерно от 16% до примерно 20%, примерно от 0% до примерно 18%, от примерно 0% до примерно 15%, примерно от 0% до примерно 12%, примерно от 0% до примерно 10%, примерно от 0% до примерно 8%, примерно от 0% до примерно 6% или примерно от 0% до примерно 2%.
[00135] Буфер для конъюгации может дополнительно содержать пропиленгликоль для повышения растворимости тиол-реактивного соединения в буфере для конъюгации. Подходящие концентрации пропиленгликоля включают примерно от 1 до примерно 50%, примерно от 20% до примерно 50%, примерно от 30% до примерно 50%, примерно от 40% до примерно 50%, примерно от 10% до примерно 40%, примерно от 10% до примерно 30% или примерно от 10% до примерно 20%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 1% или примерно 5%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 10%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 20%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 30%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 40%. В некоторых вариантах осуществления концентрация пропиленгликоля может составлять примерно 50%.
[00136] Буфер для конъюгации может дополнительно содержать неионогенное поверхностно-активное вещество для повышения растворимости конъюгированного иммуноглобулина в буфере для конъюгации. Примеры неионогенных поверхностно-активных веществ включают, не ограничиваясь этим, полисорбат-20 или полисорбат-80. Подходящие концентрации неионогенного поверхностно-активного вещества включают примерно от 0% до примерно 1%, примерно от 0,1% до примерно 1%, примерно от 0,3% до примерно 1%, примерно от 0,5% до примерно 1%, примерно от 0,7% до примерно 1%, примерно от 0% до примерно 0,8%, примерно от 0% до примерно 0,6%, примерно от 0% до примерно 0,4% или примерно от 0% до примерно 0,2%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,1%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,2%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,3%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,4%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,5%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,6%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,7%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,8%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 0,9%. В некоторых вариантах осуществления концентрация неионогенного поверхностно-активного вещества может составлять примерно 1,0%.
[00137] Инкубацию можно проводить в течение примерно от 30 мин до примерно 48 ч, в течение примерно от 1 ч до примерно 48 ч, в течение примерно от 2 ч до примерно 24 ч, в течение примерно от 24 ч до примерно 48 ч, в течение примерно от 30 ч до примерно 48 ч, в течение примерно от 36 ч до примерно 48 ч, в течение примерно от 42 ч до примерно 48 ч, в течение примерно от 2 ч до примерно 42 ч, в течение примерно от 2 ч до примерно 36 ч, в течение примерно от 2 ч до примерно 30 ч, в течение примерно от 2 ч до примерно 24 ч, в течение примерно от 2 ч до примерно 18 ч, в течение примерно от 2 ч до примерно 12 ч, в течение примерно от 30 мин до примерно 1 ч, в течение примерно от 30 мин до примерно 2 ч, или в течение примерно от 2 ч до примерно 6 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение примерно 30 мин. В некоторых вариантах осуществления инкубация может быть выполнена в течение примерно 1 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение примерно 1,5 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 2 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 6 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 12 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 18 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 24 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 30 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 36 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 42 ч. В некоторых вариантах осуществления инкубация может быть выполнена в течение 48 ч.
[0138] Температура инкубации может составлять примерно от 4°С до примерно 50°С, примерно от 18°С до примерно 37°С, примерно от 20°С до примерно 37°С, примерно от 22°С до примерно 37°С, примерно от 24°С до примерно 37°С, примерно от 26°С до примерно 37°С, примерно от 28°С до примерно 37°С, примерно от 30°С до примерно 37°С, примерно от 32°С до примерно 37°С, примерно от 34°С до примерно 37°С, примерно от 18°С до примерно 34°С, примерно от 18°С до примерно 32°С, примерно от 18°С до примерно 30°С, примерно от 18°С до примерно 28°С, примерно от 18°С до примерно 26°С, или примерно от 18°С до примерно 24°С. В некоторых вариантах осуществления инкубация может быть выполнена при 4°C. В некоторых вариантах осуществления инкубация может быть выполнена при 18°C. В некоторых вариантах осуществления инкубация может быть выполнена при 20°C. В некоторых вариантах осуществления инкубация может быть выполнена при 22°С. В некоторых вариантах осуществления инкубация может быть выполнена при 24°C. В некоторых вариантах осуществления инкубация может быть выполнена при 26°C. В некоторых вариантах осуществления инкубация может быть выполнена при 28°С. В некоторых вариантах осуществления инкубация может быть выполнена при 30°C. В некоторых вариантах осуществления инкубация может быть выполнена при 32°C. В некоторых вариантах осуществления инкубация может быть выполнена при 34°C. В некоторых вариантах осуществления инкубация может быть выполнена при 37°C. В некоторых вариантах осуществления инкубация может быть выполнена при 50°C.
[0139] Невключившийся функциональный агент или ацил-донорный субстрат можно отделить от конъюгированного иммуноглобулина с использованием хроматографии для обессоливания с использованием ряда подходящих смол, включая, не ограничиваясь этим, смолу G-25, смолу G-50, Biogel P10 или другие смолы с пределами отсечения в диапазоне 5000-10000 Да. Хроматография может быть выполнена в формате колонки или в формате спин-колонки в зависимости от объема образца. Подходящие буферы для обессоливания включают, например, DPBS, 1×PBS, фосфат натрия, фосфат калия, борат натрия, трис или буферы на основе HEPES, можно заменить на 1× PBS.
[0140] В первом варианте осуществления функциональный агент содержит ацил-донорный субстрат, который содержит остаток глутамина, конъюгированный с С-концевым лизином посредством ацил-донорного субстрата. В этом первом варианте осуществления функциональный агент объединяют с ацил-донорным субстратом до конъюгации с иммуноглобулином взаимодействием реакционноспособной группы в ацил-донорном субстрате с функциональным агентом. Во втором варианте осуществления ацил-донорный субстрат, содержащий остаток глутамина и реакционноспособную группу, сначала конъюгируют с иммуноглобулином, и затем реакционноспособную группу соединяют с функциональным агентом.
[0141] Ацил-донорные субстраты могут содержать линкер «L». Линкеры могут представлять нерасщепляемые линкеры или расщепляемые линкеры. Иллюстративные примеры линкеров включают, например, дисульфидсодержащие линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. В некоторых аспектах линкер может представлять нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают, не ограничиваясь этим, одну или более аминокислот, полиэтиленгликоль (ПЭГ) или алкил. В некоторых вариантах осуществления линкер может содержать ПЭГ. В некоторых аспектах линкер может представлять расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-пара-аминобензил. В некоторых аспектах линкером может быть дисульфидсодержащий линкер. В некоторых аспектах линкер может представлять линкер на основе ацеталей В некоторых аспектах линкер может представлять линкер на основе кеталей. Линкер также может представлять одну или более аминокислот, одних или в комбинации с другим линкером, таким как одна или более молекул ПЭГ.
[0142] Ацил-донорный субстрат, содержащий остаток глутамина, может присутствовать в составе функционального агента или частично быть присоединенным к нему. Подходящие функциональные агенты включают, например, флуорофоры, флуоресцентные красители, полипептиды, иммуноглобулины, антибиотики, нуклеиновые кислоты, радионуклиды, химические линкеры, небольшие молекулы, хелаторы, липиды, нуклеиновые кислоты (такие как ДНК или РНК) и лекарственные препараты. В некоторых аспектах функциональный агент может включать флуорофор. В некоторых аспектах функциональный агент может включать флуоресцентный краситель. В некоторых аспектах функциональный агент может включать полипептид. В некоторых аспектах функциональный агент может включать иммуноглобулин. В некоторых аспектах функциональный агент может включать антибиотик. В некоторых аспектах функциональный агент может включать нуклеиновую кислоту (такую как ДНК или РНК). В некоторых аспектах функциональный агент может включать радионуклид. В некоторых аспектах функциональный агент может включать небольшую молекулу. В некоторых аспектах функциональный агент может включать хелатор (например, DOTA, CHX-A"-DTPA, NOTA, среди прочих). В некоторых аспектах функциональный агент может включать липид. В некоторых аспектах функциональный агент может включать лекарственный препарат. В некоторых аспектах функциональный агент может включать комбинацию любого из вышеуказанных функциональных агентов.
[0143] Ацил-донорный субстрат (т.е. первый ацил-донорный субстрат) может быть связан со вторым ацил-донорным субстратом или линкером, где второй ацил-донорный субстрат или линкер связаны со вторым иммуноглобулином, имеющим вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где вторая вариабельная область тяжелой цепи имеет C-концевой лизин, где С-концевой лизин имеет, по меньшей мере, один аминокислотный остаток после лизина. Например, первый ацил-донорный субстрат и второй ацил-донорный субстрат могут иметь первый и второй химический линкер в качестве первого и второго функциональных агентов соответственно. Первый и второй химические линкеры могут быть связаны друг с другом рядом подходящих способов, включая, например, реакции клик-химии.
[0144] В одном варианте осуществления функциональный агент, содержащий ацил-донорный субстрат, соответствует одной из формул (I) или (II):
(Z)m-Gln-(L)n-(Y) (I)
(Y)-(L)n-Gln-(Z)m (II)
где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Y является функциональным агентом.
[0145] В одном варианте осуществления ацил-донорный субстрат соответствует одной из формул (III) или (IV):
(Z)m-Gln-(L)n-(X) (III)
(X)-(L)n-Gln-(Z)m (IV)
где Z представляет карбоксибензилокси (CBZ) группу или аминокислотный остаток; Gln представляет остаток глутамина; каждый L независимо представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен; или каждый L необязательно и независимо представляет аминокислотный остаток; m равно целому числу от 0 до 5; n равно целому числу от 0 до 5; и Х является реакционноспособной группой.
[0146] В одном варианте осуществления Z представляет CBZ группу. В еще одном варианте осуществления Z представляет аминокислотный остаток.
[0147] В одном варианте осуществления L представляет аминокислотный остаток. В одном варианте осуществления n равно 2-5, и каждый L независимо представляет аминокислотный остаток. В еще одном варианте осуществления L представляет прямой или разветвленный линкер из 1-20 атомов углерода, где один или более атомов углерода могут быть необязательно и независимо заменены атомом азота, кислорода или серы, и где каждый атом углерода и азота может быть необязательно замещен. В еще одном варианте осуществления L представляет молекулу полиэтиленгликоля (ПЭГ). В еще одном варианте осуществления n равно 2-5, и один или более L содержит одну или более аминокислот, и одна или более дополнительных L групп содержат молекулу полиэтиленгликоля (ПЭГ).
[0148] В одном варианте осуществления m равно 0. В еще одном варианте осуществления m равно 1. В еще одном варианте осуществления m равно 2. В еще одном варианте осуществления m равно 3. В еще одном варианте осуществления m равно 4. В еще одном варианте осуществления m равно 5.
[0149] В одном варианте осуществления n равно 0. В еще одном варианте осуществления n равно 1. В еще одном варианте осуществления n равно 2. В еще одном варианте осуществления n равно 3. В еще одном варианте осуществления n равно 4. В еще одном варианте осуществления n равно 5.
[0150] В еще одном варианте осуществления Х представляет (1R,8S,9s)бицикло[6.1.0]нон-4-ин-9-илметанол(BCN). В еще одном варианте осуществления Х представляет

[0151] В одном варианте осуществления для ацил-донорного субстрата формулы (I) Z представляет CBZ группу; L представляет молекулу полиэтиленгликоля (ПЭГ) (-O((CH2)2)-), этиламин (-NH((CH2)2)-) или пропиламин (-NH((CH2)3)-); и n равно 0, 1, 2 или 3.
[0152] В еще одном варианте осуществления ацил-донорный субстрат соответствует формуле (I), где Z представляет CBZ группу; и L представляет аминокислоту. В одном варианте осуществления L является Gly. В одном аспекте этого варианта осуществления m равно 1, и n равно 1.
[0153] В одном варианте осуществления ацил-донорный субстрат соответствует формуле (II), где Z представляет CBZ группу; m равно 1; n равно 1, 2 или 3; и, по меньшей мере, один L является Gly.
[0154] В одном варианте осуществления для ацил-донорного субстрата формулы (III) Z представляет CBZ группу; L представляет молекулу полиэтиленгликоля (ПЭГ) (-O((CH2)2)-), этиламин (-NH((CH2)2)-) или пропиламин (-NH((CH2)3)-); и n равно 0, 1, 2 или 3.
[0155] В еще одном варианте осуществления ацил-донорный субстрат соответствует формуле (III), где Z представляет CBZ группу, и L представляет аминокислоту. В еще одном варианте осуществления L представляет Gly. В одном аспекте этого варианта осуществления m равно 1, и n равно 1.
[0156] В одном варианте осуществления ацил-донорный субстрат соответствует формуле (IV), где Z представляет CBZ группу; m равно 1; n равно 1, 2 или 3; и, по меньшей мере, один L является Gly.
[0157] В одном варианте осуществления иммуноглобулин содержит 1-20 аминокислотных остатков, добавленных после С-концевого лизина (например, Lys447). В одном варианте осуществления, где добавляется 1 аминокислотный остаток после С-концевого лизина, то добавленный аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), выбран из группы, состоящей из глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, тирозина, триптофана, серина, треонина, цистеина, аспарагина, глутамина и гистидина. В одном варианте осуществления, где добавляется 1 аминокислотный остаток после С-концевого лизина, добавленный аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), не является пролином, аспарагиновой кислотой или глутаминовой кислотой. В одном варианте осуществления, где добавляется 1 аминокислотный остаток после С-концевого лизина, добавленный аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), не является лизином или аргинином.
[0158] В одном варианте осуществления иммуноглобулин имеет 2 аминокислотных остатка (аминокислотные положения +1 и +2), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 3 аминокислотных остатка (аминокислотные положения +1, +2 и +3), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 4 аминокислотных остатка (аминокислотные положения +1, +2, +3 и +4), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 5 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4 и +5), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 6 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5 и +6), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 7 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6 и +7), добавленные после С-концевого лизина, например, (Lys447). В одном варианте осуществления иммуноглобулин имеет 8 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7 и +8), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 9 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8 и +9), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 10 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9 и +10), добавленные после C-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 11 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10 и +11) добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 12 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11 и+12), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 13 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, и+13), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 14 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13 и +14), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 15 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14 и +15), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 16 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15 и +16), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 17 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16 и +17), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 18 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17 и +18), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 19 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17, +18 и +19), добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет 20 аминокислотных остатков (аминокислотные положения +1, +2, +3, +4, +5, +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +16, +17, +18, +19 и +20), добавленные после С-концевого лизина (например, Lys447).
[0159] В одном варианте осуществления иммуноглобулин имеет менее 9 аминокислотных остатков, добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин имеет менее 13 аминокислотных остатков, добавленные после С-концевого лизина (например, Lys447). В одном варианте осуществления иммуноглобулин не имеет последовательности: GTYFQAYGT, GECTYFQAYGCTE или GENTYFQAYGNTE, добавленные после C-концевого лизина, например Lys447).
[0160] В одном варианте осуществления, где два или более аминокислотных остатка добавлены или присутствуют после С-концевого лизина, то последний аминокислотный остаток, добавленный или присутствующий после С-концевого лизина (т.е. добавленный аминокислотный остаток, наиболее удаленный от С-концевого лизина), выбран из группы, включающей фенилаланин, лейцин, изолейцин, метионин, валин, серин, пролин, треонин, аланин, тирозин, гистидин, глутамин, аспарагин, аспарагиновую кислоту, глутаминовую кислоту, цистеин, триптофан и глицин. В одном варианте осуществления, где два или более аминокислотных остатка добавлены или присутствуют после С-концевого лизина, то последний аминокислотный остаток, добавленный или присутствующий после С-концевого лизина, не является лизином или аргинином.
[0161] Раскрытые способы можно осуществить на гуманизированном иммуноглобулине. Таким образом, в некоторых вариантах осуществления иммуноглобулин может представлять гуманизированный иммуноглобулин.
[0162] Раскрытые способы можно осуществить на человеческом иммуноглобулине. Таким образом, в некоторых вариантах осуществления иммуноглобулин может представлять человеческий иммуноглобулин. В еще одном варианте осуществления иммуноглобулин может представлять иммуноглобулин, отличный от человеческого иммуноглобулина.
[0163] В одном варианте осуществления раскрытые способы можно осуществить на иммуноглобулине IgG1, IgG2, IgG3 или IgG4. В одном варианте осуществления способ осуществляется на иммуноглобулине IgG1. В одном варианте осуществления способ осуществляется на иммуноглобулине IgG2. В одном варианте осуществления способ осуществляется на иммуноглобулине IgG3. В одном варианте осуществления способ осуществляется на иммуноглобулине IgG4.
[0164] В одном варианте осуществления раскрытые способы можно осуществить на иммуноглобулине IgA1, IgA2 или IgM. В одном варианте осуществления способ осуществляется на иммуноглобулине IgA1. В одном варианте осуществления способ осуществляется на иммуноглобулине IgA2. В одном варианте осуществления способ осуществляется на иммуноглобулине IgM. В одном варианте осуществления иммуноглобулин IgA или IgM имеет хвостовую область. В еще одном варианте осуществления иммуноглобулин в IgA или IgM хвостовая область удалена.
[0165] В одном варианте осуществления способ осуществляется на иммуноглобулине IgD или IgE. В одном варианте осуществления способ осуществляется на иммуноглобулине IgD. В одном варианте осуществления способ осуществляется на иммуноглобулине IgE.
[0166] Для способов, описанных здесь, в одном варианте осуществления микробная трансглутаминаза происходит из Actinomadura sp. T-2, Bacillus circulans BL32, Bacillus subtilis spores, Corynebacterium ammoniagenes, Corynebacterium glutamicum, Enterobacter sp. C2361, Providencia sp. C1112, Streptoverticillium mobaraense (aka Streptomyces mobarensis), Streptomyces platensis M5218, Streptomyces hygroscopicus, Streptomyces lividans, Streptomyces lividans JT46/pAE053, Streptomyces lydicus, Streptomyces platensis, Streptomyces sioyansis, Streptoverticillium griseocarneum, Streptoverticillium ladakanum NRRL-3191, Streptoverticillium sp. s-8112, or Streptococcus suis. В одном варианте осуществления микробная трансглутаминаза происходит из бактерии Streptomyces mobarensis.
[0167] Для способов, описанных здесь, в одном варианте осуществления трансглутаминаза выделена из растения, выбранного из группы, состоящей из Medicago sativa, Beta vulgaris, Helianthus tuberosus, Zea mays, Glycine max, Arabidopsis thaliana, Nicotiana tabacum, Chlamydomonas reinhardtii, Dunaliella salina, Oryza sativa и Rosmarinus officinalis L.
[0168] Для способов, описанных здесь, в одном варианте осуществления трансглутаминаза является трансглутаминазой млекопитающих, и выделена из трансглутаминазы 1-7 и фактора XIII.
[0169] В одном варианте осуществления трансглутаминаза, по меньшей мере, на 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична микробной трансглутаминазе, описанной здесь. В одном варианте осуществления трансглутаминаза, по меньшей мере, на 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична микробной трансглутаминазе из Streptomyces mobarensis. Ферменты трансглутаминазы являются коммерчески доступными от Ajinomoto® или Zedira (номер продукта T001). В еще одном варианте осуществления трансглутаминаза является очищенной. В еще одном варианте осуществления трансглутаминаза рекомбинантно экспрессирована и затем очищена с использованием способов, известных специалисту в данной области техники.
[0170] В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации от примерно 0,1 Е/мл до примерно 250 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации от примерно 1 Е/мл до примерно 25 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно от 1 Е/мл до примерно 25 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 0,1 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 0,5 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 1 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 5 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 10 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 15 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 20 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 25 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 50 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 75 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 100 Е/мл. В одном варианте осуществления фермент трансглутаминаза присутствует в способах, описанных здесь, в концентрации примерно 150 Е/мл, 200 Е/мл или 250 Е/мл.
[0171] Для способов, обеспеченных здесь, в одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет примерно от 1:1 до примерно 2:1. В одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет примерно от 1:1 до примерно 2:1. В одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет примерно 1:1. В одном варианте осуществления соотношение функционального агента к иммуноглобулину составляет примерно 2:1. В одном варианте осуществления соотношение функционального агента и иммуноглобулина известно и последовательно воспроизводится, следуя описанным здесь способам. Как здесь используется, соотношение функционального агента к иммуноглобулину рассчитывается на основе среднего значения соотношения конъюгации функционального агента с иммуноглобулином в пуле антител в композиции.
[0172] В вариантах осуществления, обеспеченных здесь, где, по меньшей мере, два дополнительных аминокислотных остатка присутствуют после С-концевого лизина, и где один, по меньшей мере, из двух дополнительных аминокислотных остатков включает лизин, то отношение функционального агента к иммуноглобулину увеличивается, основываясь на количестве дополнительных аминокислотных остатков, которые представляют лизин. Например, в случае, когда два дополнительных аминокислотных остатка присутствуют после С-концевого лизина, и один из дополнительных аминокислотных остатков также является лизином, то присутствуют два остатка лизина, в результате чего образуется антитело с четырьмя сайтами трансамидирования, и соотношение функционального агента к иммуноглобулину составляет примерно от 2:1 до примерно 4:1. В качестве еще одного примера, в котором пять дополнительных аминокислотных остатков присутствуют после С-концевого лизина, и два дополнительных аминокислотных остатка представляют лизины, то присутствуют три (в целом) остатка лизина, в результате чего получают антитело с шестью сайтами трансамидирования, и соотношение функционального агента к иммуноглобулину составляет примерно от 2:1 до примерно 6:1.
Конъюгированные иммуноглобулины
[00173] Кроме того, здесь обеспечиваются конъюгированные иммуноглобулины, включающие любой из иммуноглобулинов, раскрытых здесь, где лизин в С-концевом положении (например, лизин в положении 447 или «Lys447») имеет, по меньшей мере, один дополнительный аминокислотный остаток после С-концевого лизина, и он конъюгирован с функциональным агентом, содержащим ацил-донорный субстрат, где ацил-донорный субстрат содержит остаток глутамина. Дополнительные варианты осуществления включают конъюгированные иммуноглобулины, содержащие любой из иммуноглобулинов, раскрытых здесь, где лизин в С-концевом положении (например, лизин в положении 447 или «Lys447») имеет, по меньшей мере, один дополнительный аминокислотный остаток после С-концевого лизина, и он конъюгирован с ацил-донорным субстратом, где ацил-донорный субстрат содержит остаток глутамина и реакционноспособную группу, где реакционноспособную группу можно подвергнуть взаимодействию с функциональным агентом после конъюгации ацил-донорного субстрата с иммуноглобулином.
[00174] В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, аспарагин, глутамин или гистидин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает глицин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает аланин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает валин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает лейцин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает изолейцин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает метионин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает фенилаланин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает тирозин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает триптофан. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает серин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает треонин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает цистеин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает аспарагин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает глутамин. В одном варианте осуществления аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), включает гистидин. В одном варианте осуществления, где добавляется 1 аминокислотный остаток после С-концевого лизина, то добавленный аминокислотный остаток, смежный с С-концевым лизином (аминокислотное положение +1), не является пролином, аспарагиновой кислотой, глутаминовой кислотой, лизином или аргинином.
[00175] В еще одном варианте осуществления, если добавляется более чем одна аминокислота к С-концевому лизину, то последняя дополнительная аминокислота (т.е. аминокислота, расположенная на С-конце добавленных аминокислотных остатков) может представлять любую аминокислоту, за исключением лизина или аргинина. Например, когда добавляется два аминокислотных остатка после С-концевого лизина, то последовательность содержит первый аминокислотный остаток после С-концевого лизина (аминокислотное положение +1) и вторую аминокислоту после С-концевого лизина (аминокислотное положение +2), где первый аминокислотный остаток после С-концевого лизина (аминокислотное положение +1) представляет любой аминокислотный остаток, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина, и где второй аминокислотный остаток после С-концевого лизина (аминокислотное положение +2) выбран из группы, состоящей фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В одном варианте осуществления первый аминокислотный остаток после С-концевого лизина представляет лизин или аргинин. В еще одном варианте осуществления второй аминокислотный остаток после С-концевого лизина (аминокислотное положение +2) не является лизином или аргинином.
[00176] В качестве еще одного примера, где пять аминокислотных остатков добавляются после С-концевого лизина (аминокислотные положения +1, +2, +3, +4 и +5), то последовательность включает первый аминокислотный остаток после С-концевого лизина (аминокислотное положение +1), второй аминокислотный остаток после С-концевого лизина (аминокислотное положение +2), третий аминокислотный остаток после С-концевого лизина (аминокислотное положение +3), четвертый аминокислотный остаток после С-концевого лизина (аминокислотное положение +4) и пятый аминокислотный остаток после С-концевого лизина (аминокислотное положение +5). Первым аминокислотным остатком после С-концевого лизина может быть любой аминокислотный остаток, за исключением аспарагиновой кислоты, глутаминовой кислоты или пролина. Второй, третий и четвертый аминокислотные остатки после С-концевого лизина могут представлять любую аминокислоту. Однако пятый аминокислотный остаток после С-концевого лизина (аминокислотное положение +5) выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В еще одном варианте осуществления пятый аминокислотный остаток после С-концевого лизина (аминокислотное положение +5) не является лизином или аргинином. В еще одном варианте осуществления первый, второй, третий или четвертый аминокислотный остаток(и) (аминокислотные положения +1, +2, +3 и/или +4) после С-концевого лизина могут представлять лизин или аргинин.
[00177] В некоторых вариантах осуществления иммуноглобулин может быть гуманизирован. В еще одном варианте осуществления иммуноглобулин является человеческим иммуноглобулином. В еще одном варианте осуществления иммуноглобулин является химерным.
[00178] Ацил-донорный субстрат, содержащий остаток глутамина и реакционноспособную группу, также может содержать линкер «L». Аналогично, функциональные агенты, которые содержат ацил-донорный субстрат, включающий остаток глутамина, могут иметь линкер между функциональным агентом и участком молекулы ацил-донорного субстрата. Линкеры могут представлять нерасщепляемые линкеры или расщепляемые линкеры. Иллюстративные примеры линкеров включают, например, дисульфидсодержащие линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. В некоторых аспектах линкер может представлять нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают, не ограничиваясь этим, полиэтиленгликоль (ПЭГ) или алкил. В некоторых вариантах осуществления линкер может включать ПЭГ. В некоторых аспектах линкер может представлять расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-пара-аминобензил. В некоторых аспектах линкером может представлять дисульфидсодержащий линкер. В некоторых аспектах линкер может представлять линкер на основе ацеталей. В некоторых аспектах линкер может представлять линкер на основе кеталей.
[00179] Конъюгированные иммуноглобулины по изобретению содержат функциональный агент. Подходящие функциональные агенты включают, например, терапевтический агент или диагностический агент. Подходящие функциональные агенты включают, например, флуорофоры, флуоресцентные красители, полипептиды, иммуноглобулины, антибиотики, нуклеиновые кислоты, радионуклиды, химические линкеры, малые молекулы, хелаторы, липиды и лекарственные препараты. В некоторых аспектах функциональный агент может содержать флуорофор. В некоторых аспектах функциональный агент может содержать флуоресцентный краситель. В некоторых аспектах функциональный агент может содержать полипептид. В некоторых аспектах функциональный агент может содержать иммуноглобулин. В некоторых аспектах функциональный агент может содержать антибиотик. В некоторых аспектах функциональный агент может содержать нуклеиновую кислоту (такую как ДНК или РНК). В некоторых аспектах функциональный агент может содержать радионуклид. В некоторых аспектах функциональный агент может содержать небольшую молекулу. В некоторых аспектах функциональный агент может содержать хелатор (например, DOTA, CHX-A"-DTPA, NOTA, среди прочих). В некоторых аспектах функциональный агент может содержать липид. В некоторых аспектах функциональный агент может содержать лекарственный препарат. В некоторых аспектах функциональный агент может содержать комбинацию любого из вышеуказанных функциональных агентов.
[00180] Следовательно, раскрытые конъюгированные иммуноглобулины включают, не ограничиваясь этим, конъюгаты иммуноглобулина-флуорофора с С-концевым лизином, конъюгаты иммуноглобулина-флуоресцентного красителя С-концевым лизином, конъюгаты иммуноглобулина-полипептида с С-концевым лизином, конъюгаты иммуноглобулина-иммуноглобулина с С-концевым лизином, конъюгаты иммуноглобулина-антибиотика с С-концевым лизином, конъюгаты иммуноглобулина-нуклеиновой кислоты с С-концевым лизином, конъюгаты иммуноглобулина-радионуклида с С-концевым лизином, конъюгаты иммуноглобулина-химического линкера с С-концевым лизином, конъюгаты иммуноглобулина-небольшой молекулы с С-концевым лизином, конъюгаты иммуноглобулина-хелатора с С-концевым лизином, конъюгаты иммуноглобулина-липида с С-концевым лизином и конъюгаты иммуноглобулина-лекарственного препарата с С-концевым лизином.
[00181] Любой из иммуноглобулинов, раскрытых здесь, может быть конъюгирован с любым из функциональных агентов, описанных здесь. Например, конъюгированный иммуноглобулин может включать флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственный препарат.
[00182] В некоторых вариантах осуществления иммуноглобулин может быть конъюгирован с низкомолекулярным противоопухолевым агентом, таким как ауристатин. В некоторых аспектах функциональным агентом может быть ауристатин F (AuF). Таким образом, раскрытые конъюгированные иммуноглобулины включают любой из вышеуказанных иммуноглобулинов, конъюгированных с ауристатином F (конъюгат AuF Lys447).
Фармацевтические композиции
[00183] Также здесь обеспечиваются фармацевтические композиции. В некоторых вариантах осуществления фармацевтические композиции могут содержать любой из иммуноглобулинов, раскрытых здесь. В некоторых вариантах осуществления фармацевтические композиции могут содержать любой из конъюгированных иммуноглобулинов, раскрытых здесь. В одном варианте осуществления фармацевтическая композиция содержит конъюгированный иммуноглобулин и фармацевтически приемлемый носитель.
Молекулы нуклеиновой кислоты, кодирующие иммуноглобулины, и клетки-хозяева, содержащие их
[00184] Также здесь обеспечиваются молекулы нуклеиновых кислот, кодирующие любой из иммуноглобулинов, раскрытых здесь. В качестве примера, в одном варианте осуществления молекула нуклеиновой кислоты кодирует иммуноглобулин, содержащий вариабельную область тяжелой цепи и вариабельную область легкой цепи, где вариабельная область легкой цепи имеет лизин в С-концевом положении (например, положение 447 или «Lys447») и одну или более аминокислот после С-концевого лизина, выбранных из глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, тирозина, триптофана, серина, треонина, цистеина, аспарагина, глутамина и гистидина.
[00185] Также обеспечиваются клетки-хозяева, содержащие любую из раскрытых молекул нуклеиновой кислоты. Подходящие клетки-хозяева включают, не ограничиваясь этим, клетки млекопитающих, бактериальные клетки, дрожжевые клетки, клетки насекомых, если назвать только некоторые.
[00186] Следующие примеры приведены для дальнейшего описания некоторых из вариантов осуществления, раскрытых здесь. Примеры предназначены для иллюстрации, а не для ограничения раскрытых вариантов осуществления.
Примеры
Пример 1: материалы и методы
Мутагенез
[0121] Мутации воспроизводили с использованием набора Stratagene QuikChange XL согласно протоколу изготовителя. Наличие требуемых мутаций подтверждали секвенированием ДНК.
Трансфекция и получение стабильной клеточной линии
[0122] Из расчета на каждый миллилитр клеток, подлежащих трансфекции с использованием реагента ExpiFectamine, 333,3 нг HC плазмиды и 333,3 нг LC плазмиды инкубировали в течение 5-10 мин в 50 мкл среды Opti-MEM (ThermoFisher). Аналогично, 2,67 мкл реагента ExpiFectamine инкубировали в 50 мкл среды Opti-MEM. Раствор ExpiFectamine добавляли к смеси ДНК и инкубировали в течение 20-30 мин при комнатной температуре. Смесь ДНК:ExpiFectamine добавляли к клеткам при перемешивании и инкубировали при 37°С, в атмосфере 8% СО2, встряхивая со скоростью 125 об/мин. На следующие сутки к смеси для трансфекции добавляли 5 мкл энхансера 1 и 50 мкл энхансера 2 на мл клеток с последующей инкубацией в течение еще 7-10 суток.
[0123] Стабильные клеточные пулы, экспрессирующие антитело, отбирали добавлением 1 мл трансфектантов к 14 мл среды DMEM в колбе T75 с 5 мг/мл бластицидина и 400 мкг/мл зеоцина (Invivogen) через одни-трое суток после трансфекции. После того, как резистентные к препаратам клетки выросли до слияния, среду заменяли средой для экспрессии FreeStyle 293 на 24-48 ч. Клетки физически снимали, аккуратным постукиванием по колбе (трипсинизация приводила к низкой жизнеспособности, данные не показаны) и затем высевали из расчета 6×105 клеток/мл в 30 мл среды для экспрессии FreeStyle 293 во встряхиваемой колбе емкостью 125 мл. Культуры инкубировали при 37°С, в атмосфере 8% СО2 при встряхивании со скоростью 125 об/мин.
Продукция mAb
[0124] Стабильно трансфицированные пулы клеточных линий высевали из расчета от 0,6 до 1×106 клеток/мл в среде для экспрессии FreeStyle 293. Клетки инкубировали при 37°С, в атмосфере 8% СО2, при встряхивании со скоростью 125 об/мин. Через 2 суток после того, как культура достигла плотности 1×106 клеток/мл, культуры подкармливали добавлением в конечных концентрациях 10 г/л Select Soytone (BD Biosciences), 5 мМ валериановой кислоты (Sigma Aldrich) и 1:100 липидного концентрата CD (ThermoFisher). Когда жизнеспособность клеток составляла менее 50% (7-10 суток), культуры центрифугировали в течение 1 ч при 8000 об/мин в роторе Beckman JLA8.1000. Затем супернатант фильтровали через фильтр из полиэфирсульфона (ПЭС) 0,2 мкм и хранили при 4°С или -20°С до очистки.
Очистка mAb
[0125] mAb очищали, используя один из двух методов. Для супернатантов с mAb объемом менее 10 мл проводили аффинную хроматографию с использованием метода периодической очистки со смолой с протеином А. Супернатанты с MAb объемом, превышающим 25 мл, очищали с использованием предварительно упакованных колонок с протеином А.
Периодическая очистка
[0126] Смолу Prosep-vA с высокой обменной емкостью с протеином А (Millipore) уравновешивали DPBS и 100 мкл добавляли к образцу объемом 3-6 мл. После инкубации при 4°С в течение периода от 1 ч до ночи смолу трижды промывали 1 мл DPBS и центрифугировали при 18000× g в течение 30 с. Образец элюировали со смолы добавлением 400 мкл буфера на основе 0,1 М глицина, рН 2,9 с последующим центрифугированием при 18000× g в течение 30 с. Образец нейтрализовали 40 мкл 1 М Трис-буфера, рН 8,0. Буфер обменивали, используя 0,5 мл Amicon Ultra, фильтры с отсечением 10k (Millipore) концентрированием образца примерно до 100 мкл центрифугированием при 18000× g в течение 3-5 мин. Концентрированный образец разбавляли 400 мкл DPBS с последующим центрифугированием. В общей сложности процедуру повторяли четыре раза.
Очистка на колонке
[0127] Колонку с протеином А (GE Healthcare) уравновешивали 10 колоночными объемами (CV) буфера на основе 20 мМ фосфата натрия, 10 мМ ЭДТА, pH 7,2. Затем наносили образец с последующим вымыванием несвязанного материала 10 CV уравновешивающего буфера. Образец элюировали, используя 5 CV 0,1 M глицина, pH 2,9. Фракции, содержащие mAb, объединяли и диализовали в DPBS с использованием диализного аппарата MWCO 20K Slide-A-Lyzer (ThermoFisher).
Синтез субстрата Z-Gln-Gly
[0128] Z-Gln-Gly-OH получали от Bachem, и Z-Gln-Gly-CAD-биотин получали Zedira (фиг. 2).
[0129] Синтез Z-Gln-Gly-пентафторфенилового эфира (Z-Gln-Gly-PFP) проводили согласно протоколу, описанному Pasternack et al. {Pasternack, 1997 15/id}, в модификации (фиг. 3). Z-Gln-Gly-OH (328,8 мг, 0,975 ммоль) и пентафторфенол (Sigma, 183,3 мг, 0,996 ммоль) растворяли в 10 мл N,N'-диметилформамида (ДМФА). Затем добавляли EDAC-HCl (Sigma, 201 мг, 1,04 ммоль) и реакционную смесь инкубировали при комнатной температуре в атмосфере азота в течение 2 ч. К реакционной смеси добавляли 100 мл охлажденного диэтилового эфира и осаждали в течение ночи при -80°С. Сырой продукт собирали центрифугированием и перекристаллизовывали из 20 мл метанола при 60°С. Конечный продукт промывали охлажденным диэтиловым эфиром и высушивали в струе N2. Конечный выход составил 219,04 мг (44,7%). ESI-MS (прямая инфузия в 50% ацетонитриле в 0,1% муравьиной кислоте) m/z 504,0 ([M+H], 86%), 526,0 ([M+Na], 100%), 542,0 ([M+K], 22%).
Z-Gln-Gly-пропилазид (Z-Gln-Gly-N3)
[0130] Z-Gln-Gly-PFP (21,24 мг, 4,22×10-5 моль) и азидопропиламин (Click Chemical Tools, 42,2 мкл исходного раствора 0,91 М в ДМФА, 3,84×10-5 моль) растворяли в конечном объеме 0,42 мл ДМФА. Реакционную смесь перемешивали в атмосфере азота в течение ночи при комнатной температуре. Продукт очищали с помощью ВЭЖХ с использованием 0,1% муравьиной кислоты в смеси H2O/0,1% муравьиной кислоты в подвижной фазе на основе ацетонитрила. Продукт высушили в вакууме. Конечный выход составил 10,7 мг (60,4%). ESI-MS (градиентная очистка) m/z 420,2 ([M+H], 100%), 442,1 ([M+Na], 32%).
Z-Gln-Gly-ПЭГ3-эндо-бициклононин (Z-Gln-Gly-ПЭГ3-BCN)
[0131] Z-Gln-Gly-PFP (18,4 мг, 3,66×10-5 моль) и эндо-бицикло[6,1,0]нон-4-ин-9-ил-ПЭГ3-амин (Conju-Probe, 175 мкл 0,27 М исходного раствора в ДМФА, 4,75×10-5 моль) растворяли в конечном объеме 0,37 мл ДМФА. Реакционную смесь перемешивали в атмосфере азота в течение ночи при комнатной температуре. Продукт очищали с помощью ВЭЖХ с использованием 0,1% муравьиной кислоты в смеси H2O/0,1% муравьиной кислоты в подвижной фазе на основе ацетонитрила. Продукт высушивали в вакууме. Конечный выход составил 0,6 мг (2%). ESI-MS (градиентная очистка) m/z 688,2 ([M+H], 100%), 710,2 ([M+Na], 69%).
Z-Gln-Gly-ПЭГ2-ауристатин F (Z-Gln-Gly-ПЭГ2-AuF)
[0132] Z-Gln-Gly-PFP (22,2 мг, 4,37×10-5 моль) растворяли в 0,85 мл ДМФА и добавляли 1,2-этилендиамин (2,3×10-5 л, 3,5×10-4 моль) и перемешивали. Реакционную смесь перемешивали в атмосфере азота в течение ночи при комнатной температуре. Продукт очищали с помощью ВЭЖХ с использованием 0,1% муравьиной кислоты в смеси H2O/0,1% муравьиной кислоты в подвижной фазе на основе ацетонитрила. Продукт высушивали в вакууме. Конечный выход Z-Gln-Gly-NH2 составлял 3,8 мг (23%). ESI-MS (градиентная очистка) m/z 380,1 ([M+H], 100%). Z-Gln-Gly-NH2 (3,8 мг, 1,01×10-5 моль) и NHS-ПЭГ2-AuF (10,3 мг, 1,03×10-5 моль) растворяли в 0,2 мл ДМФА. Добавляли триэтиламин (14 мкл, 1×10-4 моль) и реакционную смесь инкубировали в атмосфере азота в течение ночи при комнатной температуре. Половину реакционной смеси очищали с помощью ВЭЖХ с использованием 0,1% муравьиной кислоты в смеси H2O/0,1% муравьиной кислоте в подвижной фазе на основе ацетонитрила. Продукт высушивали в вакууме. Конечный выход CBZ-Gln-Gly-ПЭГ2-AuF составлял 3,8 мг (60%). ESI-MS (градиентная очистка) m/z 634,0 ([M+H]2 +, 100%), 645,1 ([M+Na]2+, 45%). 1267,0 ([М+Н], 16%).
Реакция с микробной трансглутаминазой
[0133] mAb в концентрациях от 100 мкг/мл до 2,5 мг/мл инкубировали с 785 мкМ Z-Gln-Gly-биотина (Zedira), Z-Gln-Gly-N3, Z-Gln-Gly-BCN или Z-Gln-Gly-ПЭГ2-AuF с 1 мкг/мл микробной трансглутаминазы (Zedira) в DPBS в течение, по меньшей мере, 16 ч при 37°C.
Анализ конъюгации mAb ультраэффективной жидкостной хроматографией (UPLC)/ESI-MS
[0134] Очищенные антитела разбавляли до 1 мг/мл в DPBS (если концентрация была ниже 1,0 мг/мл, то образцы оставляли в исходной концентрации). Реакционные смеси, содержащие диметилсульфоксид (ДМСО), обессоливали, используя спин-колонку для обессоливания Zeba. Затем mAb дегликозилировали с использованием пептид-N-гликозидазы F (PNGase F) (NEB) или расщепляли на Fab'2- и Fc-фрагменты с помощью IdeS (Promega). Для дегликозилирования к mAb (50 или 100 мкл) добавляли буфер G7 (5 или 10 мкл) и пептид-N-гликозидазу F (PNGase F) (1 или 2 мкл). Реакционную смесь инкубировали в микроволновом реакторе Discover (CEM) в течение 2 циклов: 1) мощность микроволн 10 Вт, 37°C, 10 мин, и затем выдерживали в течение 3-5 мин; 2) мощность микроволн 2 Вт, 37°С, 10 мин. Часть дегликозилированного образца восстанавливали добавлением дитиотреитола (DTT) до конечной концентрации 20 мМ с последующей инкубацией при 60°С в течение 3 мин. Для получения фрагментов Fab'2- и Fc-фрагментов 50Е/мкл IdeS добавляли к 0,5 мг/мл mAb и инкубировали при 37°C в течение 0,5-1 ч. Образцы после обработки IdeS не восстанавливали, за исключением антитела 01-C, которое восстанавливали, как описано выше.
[0135] Затем образцы анализировали с использованием масс-спектрометра WPLC Water Acquity и Q-Tof Premier. Образцы (по 0,5-2 мкг каждый) наносили на микроколонку для обессоливания MassPrep при 65°С, элюировали из колонки с уравновешиванием в течение 5 мин 95% подвижной фазой А, градиентом в течение 10 мин (5-90% В) и повторным уравновешиванием в течение 10 мин 95% подвижной фазой А со скоростью 0,05 мл/мин. Мобильная фаза А представляла 0,1% муравьиной кислоты в воде. Мобильная фаза В представляла 0,1% муравьиной кислоты в ацетонитриле. Масс-спектрометр Q-Tof работал в режиме положительных ионов, V-режиме с детектированием в диапазоне 500-4000 m/z. Параметры источника были следующими: напряжение на капилляре 2,25 кВ (интактное антитело) и -2,50 кВ (восстановленное антитело); напряжение пробоотборного конуса 65,0 В (интактное антитело) или 50,0 В (восстановленное антитело); температура источника, 100°C; температура десольватации 250°С; газовый поток десольватации 550 л/ч. Развертку пика белка проводили с использованием функции MassLynx MaxEnt 1.
Обращенно-фазовая жидкостная хроматография (ЖХ)-МС
[0136] Антитело 01-L (1 мг/мл) инкубировали в течение ночи с 50-кратным молярным избытком Z-Gln-Gly-ПЭГ2-AuF в присутствии 1 Е/мл фермента TGase при 37°C. mAb расщепляли с образованием Fab'2- и Fc-фрагментов с помощью IdeS и восстанавливали с помощью DTT, как описано выше. Образец анализировали с использованием ВЭЖХ Waters Alliance с детекторами SQD и PDA. Образец (0,5-2 мкг) наносили на колонку Proteomix RP-1000 (4,6×50 мм, Sepax) при 65°C. Разделение LC, Fc- и Fd-фрагментов проводили с уравновешиванием в течение 1,5 мин 75% подвижной фазой A (0,1% ТФК в воде) и градиентом в течение 13,5 [25-65% подвижной фазы B (0,1% ТФК в ацетонитриле)] со скоростью потока 1 мл/мин.
[0137] Масс-спектрометр SQD работал в режиме положительных ионов, V-режиме с детектированием в диапазоне 200-2000 m/z. Параметры источника были следующими: напряжение на капилляре 3,00 кВ; напряжение пробоотборного конуса 40°С; температура источника 120°C; температура десольватации 250°С; газовый поток десольватации, 800 л/ч. Время сканирования 1 сек. Развертку пика белка проводили с использованием функции MassLynx MaxEnt 1. PDA детектора при длине волны 280 нм.
Пример 2: анализ гидрофильных лизиновов в IgG антителах
[0138] Кристаллические структуры IgG1-каппа Fab (антитело 01, 4F3F), IgG1-лямбда Fab (4HK0) и IgG1 Fc (1FC1) исследовали на потенциальные ацил-акцепторные сайты. Поскольку микробная трансглутаминаза имеет тенденцию предпочитать субстрат гидрофильных глутаминов и лизинов внутри петель {Spolaore, 2012 17/id}, то гидрофильные лизины выделяли с использованием Discovery Studio v4.5 с радиусом зонда 1,4 Å (фиг. 4). В антителе 01 VH имеется 7 гидрофильных лизинов с 3, находящимися в петлях. Поскольку количество лизинов может различаться между mAb за счет использования различных семейств вариабельных областей и в результате соматической гипермутации, то анализ гидрофильных лизинов в VH-области пяти других антител также анализировали на основе аналогичных положений остатков в структуре 4F3F. Эти VH-области потенциально содержат 1-5 гидрофильных лизинов с 1 или 2, находящими в петле. В антителе 01 Vκ присутствуют 6 гидрофильных лизинов и 4 находятся в петлях. Области VK из четырех других антител потенциально содержат 3-5 гидрофильных лизинов с 2 в петле. В антителе 05 находится лямбда-цепь, и в гидрофильные лизины определяли с использованием кристаллической структуры 4HK0 на основе сходства последовательностей легкой цепи. В антителе 05 потенциально имеется 2 гидрофильных лизина в домене Vλ, всего с 1 в петле.
[0139] Константные домены CH1 и каппа, Fc и лямбда анализировали с использованием кристаллических структур 4F3F, 1FC1 и 4HK0 соответственно. Константные домены IgG1 имеют 23 гидрофильных лизина в 13 петлях. Константная область каппа имеет 8 лизинов, с 5 в петле. Константная область лямбда имеет 6 гидрофильных лизина с половиной в петлях. В целом, анализированные антитела имеют в диапазоне от 42 до 50 гидрофильных лизинов в петлях mAb.
[0140] Для определения того, может ли микробная трансглутаминаза катализировать трансамидирование нативного остатка лизина в IgG-антителе, антитела инкубировали с 50-кратным молярным избытком Z-Gln-Gly-CAD-биотина и 1 мкг/мл микробной трансглутаминазы при 37°C в течение ночи. Образцы расщепляли с помощью IdeS и восстанавливали с помощью DTT, и массы LC, Fd- и Fc-фрагментов анализировали с использованием масс-спектрометрии. Образцы не подвергались дегликозилированию, и для каждого Fc наблюдали два массовых пика, соответствующих гликоформам G0F (+1445 Да) и G1F (+1608 Да). Антитело 04 также содержит сайт N-связанного гликозилирования в VH, и наблюдали два вида гликанов, G2FS и G2FS2. Все образцы не имели С-концевого лизина (128 Да), о чем свидетельствует разница от -130 до -132 Да между наблюдаемой и теоретической массой для Fc. Хотя, в различных антителах имеется 42-50 потенциальных ацил-акцепторных лизинов, ни HC, ни LC не были модифицированы ацил-донорным субстратом (фиг. 6, таблица 1).
Таблица 1
[0141] Также анализировали два полученных положительных контроля, включающими пептид с двумя известными сайтами ацил-акцептора лизина (GGSTKHKIPGGS; {Takazawa, 2004 23/id}, генетически слитые с C-концом антитела 01 HC или LC (HC-KTag или LC-KTag соответственно). mAb KTag инкубировали с Z-Gln-Gly-CAD-биотином и микробной трансглутаминазой. Образцы дегликозилировали пептид-N-гликозидазой F (PNGase F) и восстанавливали с помощью DTT. Массы тяжелой и легкой цепей анализировали масс-спектрометрией. MAb LC-KTag модифицировали до двух молекул Z-Gln-Gly-CAD-биотина, что согласуется с модификацией двух лизинов в KTag (фиг. 7, таблица 2).
[0142] Массы HC и LC определяли ESI-MS, как приведено на фиг. 7. Теоретическая масса каждого фрагмента определялась аминокислотной последовательностью, вычитаемой из наблюдаемой массы, с определением изменения массы (Δмассы). Δмассы -128 Да обусловлена расщеплением Lys447, и масса +631 Да указывает на добавление одного Z-Gln-Gly-CAD-биотина. Количество молекул Z-Gln-Gly-CAD-биотина, конъюгированных с HC или LC, определяли делением изменения массы на массу Z-Gln-Gly-CAD-биотина. Процент конъюгации определяли делением интенсивности сигнала пика одной HC или LC на сумму интенсивностей всех пиков HC или LC в образце.
[0143] Добавление KTag к HC неожиданно приводило к добавлению в HC не только двух, а трех молекул Z-Gln-Gly-CAD-биотина. Поскольку имеется только два лизина в KTag, то лизин в mAb является третьим ацил-акцепторным сайтом. С учетом близости к KTag, наиболее вероятным акцепторным сайтом mAb был Lys447 тяжелой цепи.
Пример 3: удлинение на одну аминокислоту является достаточным для трансамидирования Lys447
[0144] Lys447 обычно расщепляется с участием карбоксипептидазы В во время рекомбинантной экспрессии IgG в клетках HEK293 и CHO {Harris, 1990 7/id; Harris, 1995 6/id; Dick, 2008 3/id}. Однако добавление KTag к C-концу HC блокирует удаление Lys447, тем самым позволяя микробной трансглутаминазе использовать Lys447 в качестве ацил-акцепторного сайта. Для определения того, может ли микробная трансглутаминаза использовать Lys447 в качестве ацил-акцептора без KTag, расщепление Lys447 блокировали добавлением одного или двух лейцинов на C-конце антитела 01 (антитело 01-HC-L или антитело 01-HC-LL соответственно). Очищенные mAb инкубировали с Z-Gln-Gly-CAD-биотином и микробной трансглутаминазой, и анализировали массу дегликозилированной HC. Действительно, добавление одного или двух лейцинов сохраняло Lys447, и HC модифицировали одним ацил-донорным субстратом, согласующимся с трансамидированием Lys447 (фиг. 8, таблица 3).
[0145] Массы HC и LC определяли ESI-MS. Процентное конъюгирование Z-Gln-Gly-CAD-биотина (Δмассы=631 Да) с mAb определяли, как показано в таблице 2.
[0146] С-концевой лейцин добавляли к двум другим mAb. mAb дикого типа и мутантные инкубировали с микробной трансглутаминазой и Z-Gln-Gly-CAD-биотином в течение ночи при 37°C. Fc-фрагмент каждого образца анализировали с помощью масс-спектрометрии, как описано выше. Как и в случае с антителом 01, добавление С-концевого лейцина приводило к трансамидированию мутанта, но не mAb дикого типа (таблица 4).
[0147] Для определения того, могут ли другие аминокислоты блокировать расщепление Lys447, и насколько они обеспечивают нужную среду для микробной трансглутаминазы для модификации Lys447, остальные аминокислоты добавляли в виде удлинения одним остатком на C-конец. Образцы анализировали на модификацию микробной трансглутаминазой с использованием Z-Gln-Gly-CAD-биотина. Массу Fc-фрагмента анализировали масс-спектрометрией, как описано выше. Неудивительно, что дополнительный C-концевой лизин или аргинин не защищал Lys447 от расщепления, поскольку они являются субстратами для карбоксипептидазы B (таблица 5). Из остальных аминокислот только С-концевой пролин и кислые остатки не обеспечивали 100% конъюгирование с субстратом. В дополнение к среднему сдвигу +628 Да, связанному с конъюгацией с Z-Gln-Gly-CAD-биотином (+631 Да), также наблюдался сдвиг массы +400 Да. Вероятно, это связано с небольшим процентом Z-Gln-Gly-CAD в результате синтеза Z-Gln-Gly-CAD-биотина или деградации последнего.
[0148] За счет расщепления добавленной С-концевой аминокислоты одного лизина или аргинина эффект любой аминокислоты на трансамидирование на Lys447 оценить было невозможным. Следовательно, лейцин добавляли к С-концу вариантов с лизином и аргинином. Кроме того, эффект дополнительного С-концевого лейцина также исследовали с вариантами пролина, аспартата и глутамата. Дополнительный лейцин положительно влиял на трансамидирование всех тестированных С-концевых вариантов (таблица 6). Блокируя расщепление лизина или аргинина, Lys447 подвергался 100% переамидированию. Кроме того, дополнительный лизин в варианте KL также трансамидировали с получением антитела с 4 сайтами трансамидирования. С-концевой лейцин также повышал трансамидирование варианта пролина до 61,3%, и варианты кислотного остатка умеренно трансамидировались (таблица 6).
Пример 4: трансамидирование С-концевого лизина антител различных изотипов
[0149] С-концевой остаток CH3 (или CH4 в случаях IgE и IgM) является лизином для всех изотипов человека (таблица 7). Следовательно, возможно, что этот лизин может использоваться в качестве сайта конъюгации на других изотипах. Получали варианты IgG2, IgG3 и IgG4 антитела 01 с дополнительным С-концевым лейцином или аспартатом, или без них. mAb инкубировали с микробной трансглутаминазой и Z-Gln-Gly-CAD-биотином в течение ночи при 37°C, и массы фрагментов Fc анализировали масс-спектрометрией, как описано выше. Как и в случае IgG1, С-концевые лизины подверглись бы удалению во время экспрессии в клетках НЕК293, если не было дополнительного С-концевого остатка (таблица 8). Никакого трансамидирования не наблюдали с IgG2, IgG3 или IgG4 дикого типа или с C-концевым аспартатом, но C-концевой лейцин облегчал трансамидирование mAb.
Пример 5: ацил-донорные субстраты
[0150] Одна применимость конъюгаций с С-концевым лизином заключается в получении сайт-специфичных ADC. Конъюгирование функциональных агентов с С-концевым лизином может быть достигнуто одним из двух способов. Во-первых, для двухстадийного способа требуется конъюгация с микробной трансглутаминазой C-концевого лизина с ацил-донором, синтезированным с реакционноспособной группой, такой как BCN, DBCO, TCO, азидо (N3), алкин, тетразин или малеимид. Вторая стадия включает конъюгацию функционального агента с реакционноспособной группой с использованием, например, безмедной клик-реакции или тиол-реактивной химии. Таким образом, амино-ПЭГ3-BCN или аминопропил-N3 добавляли к гидроксильной группе Z-Gln-Gly, как подробно описано в разделе «Методы». Антитело 01-HC-L инкубировали с Z-Gln-Gly, Z-Gln-Gly-CAD-биотином, Z-Gln-Gly-N3 или Z-Gln-Gly-ПЭГ3-BCN и микробной трансглутаминазой, как описано выше. Образцы обессоливали, дегликозилировали, восстанавливали и анализировали с помощью ESI-MS для определения добавления субстрата к mAb. Все четыре субстрата эффективно конъюгировались с антителом 01-HC-L (таблица 9).
[0151] Второй способ включает одностадийную конъюгацию, посредством которой синтезируется функциональный агент с донором ацильных групп. Данный способ был тестирован синтезом группы Z-Gln-Gly на ПЭГ2-ауристатине F (Z-Gln-Gly-ПЭГ2-AuF). Z-Gln-Gly-PEG2-AuF инкубировали с антителом 01-L и микробной трансглутаминазой в течение ночи при 37°C. После расщепления с помощью IdeS и восстановления DTT измеряли поглощение при 280 нм с помощью обращенно-фазовой ЖХ-МС. Для антитела 01-L наблюдали три пика (фиг. 9). Массу каждого пика анализировали с помощью ESI-MS, и первый пик был определен как LC, второй пик - Fc, и третий пик - Fd. Четвертый пик наблюдали для антитела 01-L, инкубированного с Z-Gln-Gly-ПЭГ2-AuF и микробной трансглутаминазой. Хотя, данный пик невозможно было полностью отделить от пика Fd, площадь большинства пиков (фиг. 9В, вставка) была определена на уровне 75,4% от общей площади пиков Fc и Fc-Z-Gln-Gly-ПЭГ2-AuF (таблица 10). Таким образом, был достигнут DAR выше 1,58.
Пример 6: Получение димерных молекул антител
[0152] Другой применимостью добавления функциональных групп на С-концевом лизине иммуноглобулина является получение димерных молекул mAb-mAb. Например, BCN-конъюгированное mAb может быть конъюгировано с N3-конъюгированным mAb с использованием безмедной клик-реакции. Следовательно, равные объемы реакционных смесей Z-Gln-Gly-N3 или Z-Gln-Gly-PEG3-BCN-антитела 01-HC-L смешивали и оставляли для инкубации в течение ночи при 22°C. Восстановленную реакционную смесь анализировали на димеризованную HC (~110 кДа) с помощью электрофореза SDS-PAGE с использованием 4-12% полиакриламидного геля Bis-Tris (фиг. 10). Действительно, тяжелые цепи, модифицированные BCN и N3, образовывали димерные молекулы тяжелой цепи.
[0153] Специалистам в данной области техники будет понятно, что в предпочтительные варианты осуществления изобретения могут быть внесены многочисленные изменения и модификации и что такие изменения и модификации могут быть сделаны без отклонения от сущности изобретения. Следовательно, полагается, что прилагаемая формула изобретения охватывает все такие эквивалентные варианты, которые соответствуют истинной сущности и объему изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MORPHOTEK, INC.
<120> Конъюгированные иммуноглобулины с С-концевым лизином
<130> 118557-03820
<140> PCT/US2016/067165
<141> 2016-12-16
<150> 62/269,138
<151> 2015-12-18
<160> 42
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 1
Gly Thr Tyr Phe Gln Ala Tyr Gly Thr
1 5
<210> 2
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 2
Gly Glu Cys Thr Tyr Phe Gln Ala Tyr Gly Cys Thr Glu
1 5 10
<210> 3
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 3
Gly Glu Asn Thr Tyr Phe Gln Ala Tyr Gly Asn Thr Glu
1 5 10
<210> 4
<211> 18
<212> Белок
<213> Homo sapiens
<400> 4
Pro Thr His Val Asn Val Ser Val Val Met Ala Glu Val Asp Gly Thr
1 5 10 15
Cys Tyr
<210> 5
<211> 18
<212> Белок
<213> Homo sapiens
<400> 5
Pro Thr Leu Tyr Asn Val Ser Leu Val Met Ser Asp Thr Ala Gly Thr
1 5 10 15
Cys Tyr
<210> 6
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 6
Gly Gly Ser Thr Lys His Lys Ile Pro Gly Gly Ser
1 5 10
<210> 7
<211> 4
<212> Белок
<213> Homo sapiens
<400> 7
Ser Pro Gly Lys
1
<210> 8
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 8
Ser Pro Gly Lys Leu
1 5
<210> 9
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 9
Ser Pro Gly Lys Leu Leu
1 5
<210> 10
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 10
Ser Pro Gly Lys Gly
1 5
<210> 11
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 11
Ser Pro Gly Lys Ala
1 5
<210> 12
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 12
Ser Pro Gly Lys Val
1 5
<210> 13
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 13
Ser Pro Gly Lys Ile
1 5
<210> 14
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 14
Ser Pro Gly Lys Met
1 5
<210> 15
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 15
Ser Pro Gly Lys Pro
1 5
<210> 16
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 16
Ser Pro Gly Lys Phe
1 5
<210> 17
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 17
Ser Pro Gly Lys Tyr
1 5
<210> 18
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 18
Ser Pro Gly Lys Trp
1 5
<210> 19
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 19
Ser Pro Gly Lys Ser
1 5
<210> 20
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 20
Ser Pro Gly Lys Thr
1 5
<210> 21
<211> 5
<212> Белок
<213> Artificial Sequence
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 21
Ser Pro Gly Lys Cys
1 5
<210> 22
<211> 5
<212> Белок
<213> Artificial Sequence
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 22
Ser Pro Gly Lys Asn
1 5
<210> 23
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 23
Ser Pro Gly Lys Gln
1 5
<210> 24
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 24
Ser Pro Gly Lys Asp
1 5
<210> 25
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 25
Ser Pro Gly Lys Glu
1 5
<210> 26
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 26
Ser Pro Gly Lys His
1 5
<210> 27
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 27
Ser Pro Gly Lys Lys
1 5
<210> 28
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 28
Ser Pro Gly Lys Arg
1 5
<210> 29
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 29
Ser Pro Gly Lys Lys Leu
1 5
<210> 30
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 30
Ser Pro Gly Lys Arg Leu
1 5
<210> 31
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 31
Ser Pro Gly Lys Pro Leu
1 5
<210> 32
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 32
Ser Pro Gly Lys Asp Leu
1 5
<210> 33
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 33
Ser Pro Gly Lys Glu Leu
1 5
<210> 34
<211> 7
<212> Белок
<213> Homo sapiens
<400> 34
Leu Ser Leu Ser Pro Gly Lys
1 5
<210> 35
<211> 7
<212> Белок
<213> Homo sapiens
<400> 35
Leu Ser Leu Ser Leu Gly Lys
1 5
<210> 36
<211> 10
<212> Белок
<213> Homo sapiens
<400> 36
Ile Asp Arg Leu Ala Gly Lys Pro Thr His
1 5 10
<210> 37
<211> 7
<212> Белок
<213> Homo sapiens
<400> 37
Val Ser Val Asn Pro Gly Lys
1 5
<210> 38
<211> 7
<212> Белок
<213> Homo sapiens
<400> 38
Thr Asp His Gly Pro Met Lys
1 5
<210> 39
<211> 10
<212> Белок
<213> Homo sapiens
<400> 39
Val Asp Lys Ser Thr Gly Lys Pro Thr Leu
1 5 10
<210> 40
<211> 330
<212> Белок
<213> Homo sapiens
<400> 40
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 41
<211> 107
<212> Белок
<213> Homo sapiens
<400> 41
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 42
<211> 106
<212> Белок
<213> Homo sapiens
<400> 42
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Lys Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<---
Реферат
Группа изобретений относится к биотехнологии, в частности к способам получения конъюгированных иммуноглобулинов с использованием микробной трансглутаминазы. Осуществляют инкубацию иммуноглобулина с микробной трансглутаминазой и терапевтическим или диагностическим агентом, содержащим ацил-донорный субстрат, включающий остаток глутамина, где трансглутаминаза катализирует конъюгацию K447 иммуноглобулина с остатком глутамина ацил-донорного субстрата. Причем иммуноглобулин содержит по меньшей мере один аминокислотный остаток, но менее чем 13 аминокислотных остатков после лизина 447 (K447) на тяжелой цепи согласно системе нумерации ЕС. Когда иммуноглобулин содержит один аминокислотный остаток после K447, указанный один аминокислотный остаток не является пролином, аспарагиновой кислотой, глутаминовой кислотой, лизином или аргинином. Когда иммуноглобулин содержит более чем один аминокислотный остаток после K447, первый аминокислотный остаток не является аспарагиновой кислотой, глутаминовой кислотой или пролином, и последний аминокислотный остаток выбран из группы, состоящей из фенилаланина, лейцина, изолейцина, метионина, валина, серина, пролина, треонина, аланина, тирозина, гистидина, глутамина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, триптофана и глицина. В другом варианте проводят инкубацию иммуноглобулина с микробной трансглутаминазой и ацил-донорным субстратом, содержащим остаток глутамина и реакционноспособную группу, где микробная трансглутаминаза катализирует конъюгацию K447 иммуноглобулина с остатком глутамина ацил-донорного субстрата. Затем конъюгируют терапевтический или диагностический агент с реакционноспособной группой ацил-донорного субстрата. Конъюгация С-концевого лизина с использованием микробной трансглутаминазы приводит к сайт-специфичному и предсказуемому включению коньюгированных функциональных агентов. 4 н. и 73 з.п. ф-лы, 6 пр., 10 ил.
Формула

Документы, цитированные в отчёте о поиске
Способ конъюгации пептидов, опосредованной трансглутаминазой
Патенты аналоги
Способ конъюгации пептидов, опосредованной трансглутаминазой

Комментарии