Получение вирусоподобных частиц в растениях - RU2655431C2
Код документа: RU2655431C2
Чертежи


















































































Описание
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к получению химерных вирусных белков в растениях. Конкретнее, настоящее изобретение также относится к получению в растениях вирусоподобных частиц, содержащих химерные вирусные белки.
УРОВЕНЬ ТЕХНИКИ
[0002] Вакцинация обеспечивает защиту от заболевания, вызванного похожим агентом, индуцируя у субъекта выработку механизмов защиты до инфекции. Обычно это достигается посредством применения живых ослабленных или цельных инактивированных форм инфекционных агентов в качестве иммуногенов. Чтобы избежать опасностей, связанных с использованием цельного вируса (такого как убитые или ослабленные вирусы) в качестве вакцины, были созданы вакцины на основе рекомбинантных вирусных белков, например субъединиц. Как пептидные, так и субъединичные вакцины подвержены ряду потенциальных ограничений. Субъединичные вакцины могут обладать слабой иммуногенностью, вследствие неправильного сворачивания, плохой презентацией антигена или различиями в углеводном и липидном составе. Основная проблема заключается в трудности обеспечения того, чтобы конформация сконструированных белков имитировала конформацию антигенов в их природном окружении. Для усиления иммунного ответа должны использоваться подходящие адъюванты и, в случае пептидов, белки-носители. Кроме того, данные вакцины вызывают, в первую очередь, гуморальные реакции и, следовательно, могут не приводить к выработке эффективного иммунного ответа. Субъединичные вакцины часто оказываются неэффективными в случае заболеваний, для которых может быть показано, что защиту обеспечивает цельный инактивированный вирус.
[0003] Вирусоподобные частицы (virus-like particles (VLP)) являются потенциальными кандидатами для включения в иммуногенные композиции. VLP очень похожи на зрелые вирионы, но они не содержат вирусный геномный материал. Таким образом, VLP не реплицируются в природе, что делает их безопасными для применения в качестве вакцины. Кроме того, VLP могут быть сконструированы так, чтобы экспрессировались вирусные гликопротеины на поверхности VLP, что является их наиболее нативной физиологической конфигурацией. Кроме того, поскольку VLP напоминают интактные вирионы и являются поливалентными структурами, образованными из частиц, VLP могут быть эффективнее в том, что касается индукции нейтрализующих антител к гликопротеину, чем антигены, представляющие собой растворимые белки оболочки.
[0004] VLP для более чем тридцати различных вирусов были получены в системах, использующих клетки насекомых и млекопитающих в целях их применения в качестве вакцин (Noad, R. and Roy, P., 2003, Trends Microbiol 11: 438-44). Несколько исследований показали, что рекомбинантные белки вируса гриппа самоорганизуются в VLP в клеточной культуре при использовании плазмид экспрессии млекопитающих или бакуловирусных векторов (например, Gomez-Puertas et al., 1999, J. Gen. Virol, 80, 1635-1645; Neumann et al., 2000, J. Virol., 74, 547-551; Latham and Galarza, 2001, J. Virol., 75, 6154-6165).
[0005] Gomez-Puertas et al. (1999, J. Gen. Virol., 80, 1635-1645) показали, что эффективное образование VLP гриппа зависит от уровней экспрессии вирусных белков. Neumann et al. (2000, J. Virol., 74, 547-551) разработали систему на основе плазмиды экспрессии млекопитающих для получения инфекционных частиц, похожих на вирус гриппа, с использованием только клонированной кДНК. Latham and Galarza (2001, J. Virol., 75, 6154-6165) сообщили об образовании VLP гриппа в клетках насекомого, инфицированных рекомбинантным бакуловирусом, при совместной экспрессии генов НА, NA, M1 и М2. Данное исследование продемонстрировало, что белки вириона гриппа самоорганизуются при совместной экспрессии в эукариотических клетках и что матриксный белок M1 необходим для продукции VLP.
[0006] В некоторых системах экспрессии, включая бакуловирус, вирус коровьей оспы, клетки дрозофилы (DS-2), клетки Vero и дрожжевые сферобласты, экспрессия Pr55gag из вируса иммунодефицита человека (human immunodeficiency virus (HIV)) приводит к сборке и высвобождению вирусоподобных частиц (VLP), похожих по морфологии на незрелые вирионы HIV (обзор Demi et al., 2005, Molecular Immunology 42: 259-277).
[0007] Белок оболочки gp160 HIV может быть встроен в VLP, полученные из Gag. Однако встраивается только ограниченное число белков оболочки, несмотря на высокий уровень экспрессии Pr55gag. Wang et al. показали, что замена трансмембранного домена и цитоплазматических "хвостовых" доменов (ТМ/СТ) белка оболочки HIV таковыми другого белка вирусной оболочки, включая гемагглютинин (НА) вируса гриппа, приводит к увеличению встраивания белка оболочки в VLP, полученные из Pr55gag (Journal of Virology, 2007, 81: 10869-10878). Было также показано, что химерный белок оболочки HIV, содержащий ТМ/СТ белка НА, встраивается в VLP, полученные из белка M1 вируса гриппа, при совместной экспрессии в клетках насекомых с использованием системы экспрессии на основе бакуловируса (WO 2008/005777).
[0008] Проникновение вируса гриппа в клетку зависит от НА-зависимого рецептор-опосредованного эндоцитоза. Инфекционный цикл вируса гриппа инициируется присоединением поверхностного белка НА вириона к клеточному рецептору, содержащему сиаловую кислоту (гликопротеины и гликолипиды). Белок нейраминидаза (NA) служит посредником в процессинге рецепторов сиаловой кислоты. В кислых компартментах интернализированных эндосом, содержащих вирион гриппа, белок НА претерпевает конформационные изменения, которые приводят к слиянию вирусной и клеточной мембран, декапсидации вируса и опосредованному белком М2 высвобождению белков M1 из связанных с нуклеокапсидом рибонуклеопротеинов (RNP), которые мигрируют в ядро клетки для синтеза вирусной РНК. Latham and Galarza (2001, J. Virol., 75, 6154-6165) сообщили об образовании VLP гриппа в клетках насекомого, инфицированных рекомбинантным бакуловирусом, при коэкспрессии генов НА, NA, M1 и М2. Помимо этого, Gomez-Puertas et al. (2000, J Virol. 74, 11538-11547) полагают, что, в дополнение к гемагглютинину (НА), матриксный белок (M1) вируса гриппа является существенным для VLP, отпочковывающихся от клеток насекомых. Однако Chen et al. (2007, J. Virol. 81, 7111-7123) считают, что, возможно M1 не требуется для образования VLP.
[0009] Наиболее охарактеризованные механизмы отпочковывания вирусов используют вакуолярный путь сортировки белков (vacuolar protein sorting (VPS)) в качестве пути хозяина (см. Chen and Lamb, Virology 372, 2008). Как было показано, многие оболочечные вирусы взаимодействуют с белками VPS-пути, требующими действия белковых комплексов эндосомного сортировочного комплекса, необходимого для транспорта (endosomal sorting complex required for transport (ESCRT)) (см. таблицу I в публикации Chen and Lamb 2008). "Поздний" домен белка, который взаимодействует с белками VPS-пути, обнаружен в сердцевинных и матриксных белках вирусов, и, следовательно, для VPS-зависимого отпочковывания необходимо присутствие матриксных или сердцевинных белков. Для отпочковывания требуется пальмитоилирование цитоплазматического хвостового домена белка НА вируса гриппа, но данный механизм не до конца понятен, и в нем могут быть задействованы другие домены поверхностных белков. Минимальные условия, обеспечивающие отпочковывание, остаются неизвестными, и не исключено участие эктодомена в данном процессе. Кроме того, VPS-путь в растениях еще мало изучен (см. Schellmann S., and Pimpl P., Current Op Plant Biol 12:670-676, 2009).
[0010] Известно, что отпочковывание вируса гриппа является независимым от VPS-пути. Отпочковывание вируса гриппа включает в себя путь с участием белка Rab11 (Bruce et al., J. Virol 84:5848-5859, 2010). Белки Rab представляют собой находящиеся на поверхности транспортных везикул внутри клеток и связанные с мембраной липидным якорем GTP-азы, которые участвуют в образовании везикул из донорного компартмента, транспорте, стыковке и слиянии с акцепторным компартментом (Vazquez-Martinez and Malagon Frontiers in Endocrinology 2:1-9, 2011). Компоненты пути с участием белка Rab11 были идентифицированы в растениях. Однако, эволюция компонентов путей направленного транспорта в растениях привела к нескольким специфическим особенностям эндомембранной системы растений, включая, например, большую и специализированную вакуоль, быстрое движение стопок Гольджи и уникальную организацию эндосомных компартментов, а также к повышенному числу Rab GTP-аз (Rojo Ε., and Deneke J., Plant Phys 147:1493-1503, 2008). Отпочковывание вирусоподобной частицы гриппа или вируса гриппа зависит от Rab11 (Bruce et. al., J. Virol 84:5848-5859, 2010), но белок или белковый домен, который взаимодействует с Rab11 или Rab11-связанными белками, не идентифицирован. Однако минимальный домен или домены белка НА, которые могли бы обеспечивать процесс отпочковывания и продукции VLP, остаются неизвестными.
[0011] В растениях белок Pr55gag из HIV накапливается на крайне низком уровне, если он не сконструирован для накопления в хлоропластах (Meyers et al., 2008, ВМС Biotechnology 8:53; Scotti et al., 2010, Planta 229: 1109-1122). Накопление в хлоропласте, однако, несовместимо с встраиванием правильно свернутого белка оболочки HIV, поскольку созревание и сворачивание последнего требует посттрансляционных модификаций, специфичных для пути секреции. Rybicki et al. (2010, Plant Biotechnology Journal 8: 620-637) отмечает, что "…кажется, что никому не удалось успешно экспрессировать целый белок gp160 Env HIV или даже большую часть белка в растениях с приемлемым выходом…".
[0012] Вирус бешенства (rabies virus (RV)) относится к семейству Rhabdoviridae. Как и большинство членов данного семейства, RV представляет собой вирус, содержащий однонитевую несегментированную РНК отрицательной полярности, геном которого кодирует пять вирусных белков: РНК-зависимую РНК-полимеразу (L); нуклеопротеин (N); фосфорилированный белок (Р); матриксный белок (М), расположенный на внутренней стороне белковой оболочки вируса; и гликопротеин (G) внешней поверхности. Dietzschold В et al. (1991), Crit. Rev. Immunol. 10: 427-439.
[0013] Получение культуральных вакцин против бешенства сводится к выращиванию инактивированных штаммов вируса в клеточных культурах. Данные вакцины содержат вирус, выращенный в клеточных культурах. Существующие биотехнологические подходы направлены на экспрессирование гена белка оболочки вируса бешенства с целью разработки безопасного рекомбинантного белка, который может быть применен в качестве активной вакцины. Стабильная экспрессия гликопротеина вируса бешенства была показана в клетках яичника китайского хомячка (Burger et al., 1991). Был получен полноразмерный гликозилированный белок с молекулярной массой 67 К, который мигрировал совместно с G-белком, выделенным из инфицированных вирусом клеток.
[0014] В документе WO/1993/001833 раскрыто получение вирусоподобных частиц (VLP) в системе экспрессии на основе бакуловируса, содержащей РНК-геном, включающий в себя 3ʹ-домен и "домен-наполнитель" (filler domain), окруженные оболочкой из белка M вируса бешенства и белка M1 вируса бешенства. VLP также включает в себя липидную оболочку белка G вируса бешенства.
[0015] Вирус ветряной оспы (Varicella Zoster virus (VZV)), также известный как вирус герпеса человека 3-го типа (ВГЧ-3), является членом подсемейства альфагерпесвирусов вирусного семейства герпесвирусов (Herpesviridae). VLP, экспрессирующие гликопротеины или белки оболочки, были ранее получены из разных членов семейства герпесвирусов. Легкие частицы (L-частицы), состоящие из оболочечных белков оболочки, были получены из клеток, инфицированных либо вирусом простого герпеса типа 1 (herpes simplex virus type 1 (HSV-1)), лошадиным вирусом герпеса типа 1 (equine herpesvirus type 1 (EHV-1)) либо вирусом псевдобешенства (McLauchlan and Rixon (1992) J. Gen. Virol. 73: 269-276; патент США №5,384,122). Другой тип VLP, названный pre-viral DNA replication enveloped particles (PREP), удалось получить из клеток, инфицированных HSV-1 в присутствии ингибиторов репликации вирусной ДНК. PREP напоминали структурно L-частицы, но отличались по составу белка (Dargan et al. (1995) J. Virol. 69: 4924-4932; патент США №5,994,116). Гибридные VLP, экспрессирующие фрагменты белка gE из VZV, были получены технологией с использованием белка p1, кодируемого ретротранспозоном Ту дрожжей (Garcia-Valcarcel et al. (1997) Vaccine 15: 709-719; Welsh et al. (1999) J. Med. Virol. 59: 78-83; патент США №6,060,064). В заявке США 2011/0008838 описаны химерные VLP, которые содержат, по меньшей мере, один белок VZV, но не содержат белок Ту дрожжей. Химерные VLP содержат вирусный сердцевинный белок, такой как белок M1 вируса гриппа или белок M ньюкаслской болезни, и, по меньшей мере, один белок вируса ветряной оспы (VZV).
[0016] Распространение эволюционно нового коронавируса (CoV) вызвало глобальную угрозу пандемии тяжелого острого респираторного синдрома (ТОРС, severe acute respiratory syndrome (SARS)) в 2003 году (Kuiken, T. et al., 2003, Lancet 362: 263-270). Как и другие коронавирусы, SARS-CoV морфологически представляет собой покрытые оболочкой частицы с типичными периферийными образованиями, называемыми "короны" или "шипы", окружающими поверхность вирусной сердцевины (Ksiazek, Т.G. et al., 2003, N Engl J Med 348: 1953-1966; Lin, Y. et al., 2004, Antivir Ther 9: 287-289). Сердцевину частицы коронавируса окружает слой липидной оболочки, содержащий, в основном, три мембранных белка, а именно, наиболее обильно представленный белок M (мембранный (membrane)), небольшой белок Ε (оболочечный (envelope)) и белок S (белок шипа (spike)). Гомотримеры белка S совместно образуют вышеупомянутую корону, которая участвует в связывании вируса с рецепторами хозяина, слиянии мембран при проникновении вируса, распространении от клетки к клетке и тканевом тропизме коронавирусов.
[0017] Системы экспрессии на основе бакуловируса были использованы для получения SARS-VLP (Но, Y. et al., 2004, Biochem Biophys Res Commun 318: 833-838; Mortola, Ε. and Roy, P., 2004, FEBS Lett 576: 174-178). Однако, в силу внутренних различий между клетками насекомых и клетками млекопитающих, VLP, собиравшиеся в клетках насекомого (SF9), имели диаметр, равный 110 нм, что намного превышает диаметр аутентичных вирионов SARS-CoV, составляющий 78 нм (Lin, Y. et al., 2004, см. выше, и Но, Y. et al., 2004, см. выше). Более того, иммуногенность SARS-VLP, полученных с помощью клеток насекомых, остается неисследованной. Другие исследователи также пытались использовать системы экспрессии в клетках млекопитающих для получения SARS-VLP (Huang, Y. et al., 2004, J Virol 78: 12557-65). Однако степень высвобождения VLP из клеток не является достаточной, и выход VLP не является удовлетворительным. Например, в документе WO/2005/035556 описывается система для получения SARS-CoV-вирусоподобных частиц (SARS-CoV-VLP), содержащих один или более рекомбинантных векторов, которые экспрессируют Е-белок SARS-CoV, М-белок SARS-CoV и S-белок SARS-CoV в клетках млекопитающих.
[0018] В любой системе образование VLP предъявляет определенные требования к структуре белков - само по себе изменение участков последовательности белка может не оказывать большого влияния на экспрессию полипептида, однако, структурные исследования, показывающие влияние таких изменений на образование VLP, отсутствуют. Взаимодействия различных областей и структур белка эволюционировали вместе с вирусом, так что подобные их изменения могут оказаться невозможны без потери способности к образованию VLP.
[0019] Для совершенствования VLP в качестве вакцин-кандидатов необходимо исследование других систем экспрессии, помимо клеток насекомых и млекопитающих. Следовательно, существует необходимость в оценке способности растительных систем экспрессии продуцировать химерные белковые VLP. В частности, необходимы определение минимального количества вирусных белков, способных собираться в VLP, а также оценка морфологии и иммуногенности таких VLP.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0020] Настоящее изобретение относится к получению химерных вирусных белков в растениях. Конкретнее, настоящее изобретение также относится к получению в растениях вирусоподобных частиц, содержащих химерные вирусные белки.
[0021] Настоящее изобретение относится к способу получения вирусоподобной частицы (VLP) в растении, содержащему
а) введение в растение или в часть растения нуклеиновой кислоты, содержащей регуляторную область, активную в растении и функционально связанную с химерной нуклеотидной последовательностью, кодирующей последовательно эктодомен из вирусного тримерного поверхностного белка или его фрагмент, слитый с трансмембранным доменом вируса гриппа и цитоплазматическим "хвостом" вируса гриппа, причем данный эктодомен взят от тримерного поверхностного белка вируса, не являющегося вирусом гриппа, и является гетерологичным по отношению к трансмембранному домену и цитоплазматическому "хвосту" вируса гриппа, и
б) инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, VLP.
[0022] Способ, описанный выше, может дополнительно содержать стадию (с) сбора растений и очистки VLP. Дополнительно, VLP могут не содержать вирусный матриксный белок или сердцевиннный белок.
[0023] Настоящее изобретение относится к способу, описанному выше, в котором эктодомен из вирусного тримерного поверхностного белка или его фрагмент может быть получен из вирусов семейства Retroviridae, Rhabdoviridae, Herpesviridae, Coronaviridae, Paramyxoviridae, Poxviridae или Filoviridae. Эктодомен из вирусного тримерного поверхностного белка может быть получен, например, из организмов, относящихся к родам Lentivirus, Lyssavirus, Varicellovirus, Coronavirus или Ebolaviras. Эктодомен из вирусного тримерного поверхностного белка может быть получен из, например, но не ограничиваясь ими, HIV, вируса бешенства, VZV, RSV, вируса SARS, вируса Эбола, вируса кори, вируса свинки, вируса ветряной оспы, цитомегаловируса, вируса Эбола/филовируса, вируса герпеса, вируса Эпштейна-Барра или вируса оспы. Вирусный тримерный поверхностный белок в его нативной форме может содержать эктодомен и трансмембранный домен/цитоплазматический хвост, как, например, но не ограничиваясь ими, F-белок (RSV, вирус кори, вирус паротита, вирус ньюкаслской болезни), S-белок (SARS), белок env (HIV), G-белок (вирус бешенства), оболочечный гликопротеин, включая Е, В, С, I, H (VZV, цитомегаловирус, вирус герпеса, вирус Эпштейна-Барра), гликопротеин GP (вирус Эбола, вирус Марбург), гемагглютинин (вирус натуральной оспы, вирус коровьей оспы).
[0024] Настоящее изобретение также включает в себя способ, описанный выше, в котором трансмембранный домен вируса гриппа и цитоплазматический "хвост" вируса гриппа получают из Н5 (A/Indonesia/05/2005) или белка Н3 (A/Brisbane/10/2007). Трансмембранный домен и цитоплазматический "хвост" могут содержать нуклеотидную последовательность, определенную в SEQ ID NO: 41 или в SEQ ID NO: 42.
[0025] Настоящее изобретение также относится к способу, описанному выше, в котором на стадии введения (стадия а) нуклеиновая кислота транзиентно экспрессируется в растении. Альтернативно, на стадии введения (стадия а) нуклеиновая кислота может постоянно экспрессироваться в растении.
[0026] Настоящее изобретение также включает в себя способ, описанный выше, в котором на стадии введения (стадия а) в растение вводят одну или более чем одну дополнительную нуклеиновую кислоту, выбранную из группы нуклеотидных последовательностей, кодирующих один или более чем один белок, относящийся к шаперонам, белковым протонным каналам, ингибиторам протеаз или их комбинации.
[0027] Настоящее изобретение относится к VLP, получаемой способом, описанным выше. Химерный вирусный тримерный поверхностный белок из VLP может содержать специфические для растений N-гликаны или модифицированные N-гликаны. VLP может также содержать один или более чем один липид, полученный из растения.
[0028] Настоящее изобретение относится к композиции, содержащей эффективную дозу VLP, как описано выше, для индукции иммунного ответа, и фармацевтически приемлемый носитель.
[0029] Настоящее изобретение относится к получению химерного вирусного тримерного поверхностного белка из вирусов семейства Retroviridae, Rhabdoviridae, Herpesviridae, Coronaviridae или Filoviridae и к получению вирусоподобных частиц, содержащих данный химерный вирусный тримерный поверхностный белок, в растениях.
[0030] Дополнительно, настоящее изобретение относится к получению в растениях химерного вирусного тримерного поверхностного белка вируса иммунодефицита человека (HIV), вируса бешенства, вируса ветряной оспы (VZV), вируса тяжелого острого респираторного синдрома (SARS) или вируса Эбола. Настоящее изобретение относится к получению в растениях химерных вирусоподобных частиц HIV, бешенства, VZV, SARS и Эбола.
[0031] В соответствии с настоящим изобретением предлагается способ получения в растении химерных VLP HIV, бешенства, VZV, SARS или Эбола, содержащий введение в растение или в часть растения нуклеиновой кислоты, кодирующей химерный вирусный белок HIV, вируса бешенства, VZV, SARS или вируса Эбола, функционально связанной с регуляторной областью, активной в растении, и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP HIV, бешенства, VZV, SARS или Эбола.
[0032] Настоящее изобретение дополнительно относится к VLP, содержащей химерный белок HIV, вируса бешенства, VZV, SARS или вируса Эбола. Такая VLP может быть получена способом, предусмотренным настоящим изобретением. VLP HIV, бешенства, VZV, SARS или Эбола может быть также получена в растении.
[0033] Химерные VLP или VLP, полученные из белков, происходящих из HIV, вируса бешенства, VZV, SARS или вируса Эбола, в соответствии с настоящим изобретением не содержат белок M1. Белок M1, как известно, связывает РНК, которая может рассматриваться как загрязнение препарата VLP. Присутствие РНК является нежелательным при получении разрешения надзорных органов на антигенный (VLP) продукт, поэтому отсутствие РНК в препарате химерных VLP может рассматриваться как преимущество.
[0034] Хотя нативный белок Env HIV плохо накапливается в растениях, химерный белок Env HIV, слитый с трансмембранным (ТМ) и цитоплазматическим хвостовым (СТ) доменами белка НА вируса гриппа, накапливается с высоким содержанием и почкуется с образованием VLP HIV в растениях в отсутствие сердцевинного белка или матриксного белка.
[0035] Данная сущность изобретения не обязательно описывает все признаки настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0036] Данные и другие признаки настоящего изобретения станут более очевидными из приведенного ниже описания, содержащего ссылки на прилагаемые чертежи, где:
[0037] На фигуре 1 представлены несколько нуклеотидных и аминокислотных последовательностей и экспрессионные кассеты для HIV в соответствии с различными вариантами осуществления настоящего изобретения. SEQ ID NO: 1: Консенсусная последовательность нуклеиновой кислоты HIV ConS ΔCFI (Последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домены, подчеркнуты). На фигуре 1А представлена консенсусная последовательность нуклеиновой кислоты (SEQ ID NO: 1) ConS ΔCFI из HIV (последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домен, подчеркнуты). На фигуре 1В представлена нуклеотидная последовательность олигонуклеотида IF-ApaI-SpPDI.c (SEQ ID NO: 2). На фигуре 1С представлена нуклеотидная последовательность олигонуклеотида SpPDI-HIV gp145.r (SEQ ID NO: 3). На фигуре 1D представлена нуклеотидная последовательность олигонуклеотида IF-SpPDI-gp145.c (SEQ ID NO: 4). На фигуре 1E представлена нуклеотидная последовательность олигонуклеотида WtdTm-gp145.r (SEQ ID NO: 5). На фигуре 1F представлена нуклеотидная последовательность (SEQ ID NO: 6) экспрессионной кассеты номер 995, от PacI (выше (по ходу транскрипции) промотора) до AscI (непосредственно после (по ходу транскрипции) терминатора NOS). Удаленный сайт рестрикции SbfI выделен жирным шрифтом. Последовательность PDISP-HIV ConS ΔCFI подчеркнута. На фигуре 1G представлена аминокислотная последовательность PDISP-HIV ConS ΔCFI (SEQ ID NO: 7). На фигуре 1H представлено схематическое изображение конструкции номер 995.
[0038] На фигуре 2 представлены несколько нуклеотидных и аминокислотных последовательностей и экспрессионные кассеты для HIV в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 2А представлена нуклеотидная последовательность олигонуклеотида IF-H3dTm+gp145.r (SEQ ID NO: 8). На фигуре 2В представлена нуклеотидная последовательность олигонуклеотида Gp145+H3dTm.c (SEQ ID NO: 9). На фигуре 2С представлена нуклеотидная последовательность олигонуклеотида H3dTm.r (SEQ ID NO: 10). На фигуре 2D представлена нуклеотидная последовательность (SEQ ID NO: 11) экспрессионной кассеты номер 997, от PacI (выше (по ходу транскрипции) промотора) до AscI (непосредственно после (по ходу транскрипции) терминатора NOS). Удаленный сайт рестрикции SbfI выделен жирным шрифтом. Последовательность PDISP-HIV Con S ΔCFI-A/Brisbane/10/2007 Н3 ТМ+СТ подчеркнута. На фигуре 2Е представлена последовательность аминокислот PDISP-HIV ConS ΔCFI-A/Brisbane/10/2007 Н3 ТМ+СТ (SEQ ID NO: 12). На фигуре 2F представлено схематическое изображение конструкции номер 997.
[0039] На фигуре 3 представлены несколько нуклеотидных и аминокислотных последовательностей и экспрессионные кассеты для HIV в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 3А представлена нуклеотидная последовательность олигонуклеотида IF-H5dTm+gp145.r (SEQ ID NO: 13). На фигуре 3В представлена нуклеотидная последовательность олигонуклеотида Gp145+H5dTm.c (SEQ ID NO: 14). На фигуре 3С представлена нуклеотидная последовательность олигонуклеотида IF-H5dTm.r (SEQ ID NO: 15). На фигуре 3D представлена нуклеотидная последовательность (SEQ ID NO: 16) экспрессионной кассеты номер 999, от PacI (выше (по ходу транскрипции) промотора) до AscI (непосредственно после (по ходу транскрипции) терминатора NOS). Удаленный сайт рестрикции SbfI выделен жирным шрифтом. Последовательность PDISP-HIV ConS ACFI-A/Indonesia/5/2005 Н5 ТМ+СТ подчеркнута. На фигуре 3Е представлена аминокислотная последовательность PDISP-HIV ConS ΔCFI-A/Indonesia/5/2005 Н5 ТМ+СТ (SEQ ID NO: 17). На фигуре 3F представлено схематическое изображение конструкции номер 999.
[0040] На фигуре 4 представлены аминокислотная последовательность и несколько кассет экспрессии для р19 в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 4А представлена нуклеотидная последовательность (SEQ ID NO: 18) экспрессионной кассеты номер 172, от XmaI (выше (по ходу транскрипции) промотора транскрипции гена пластоцианина) до EcoRI (непосредственно после (по ходу транскрипции) терминатора транскрипции гена пластоцианина). Последовательность нуклеиновой кислоты TBSV-P19 подчеркнута. На фигуре 4В представлена аминокислотная последовательность (SEQ ID NO: 19) супрессора "сайленсинга" TBSV-P19. На фигуре 4С представлено схематическое изображение конструкции номер 172.
[0041] На фигуре 5 представлено схематическое изображение химерных генов Env HIV, экспрессированных, как описано в данном документе.
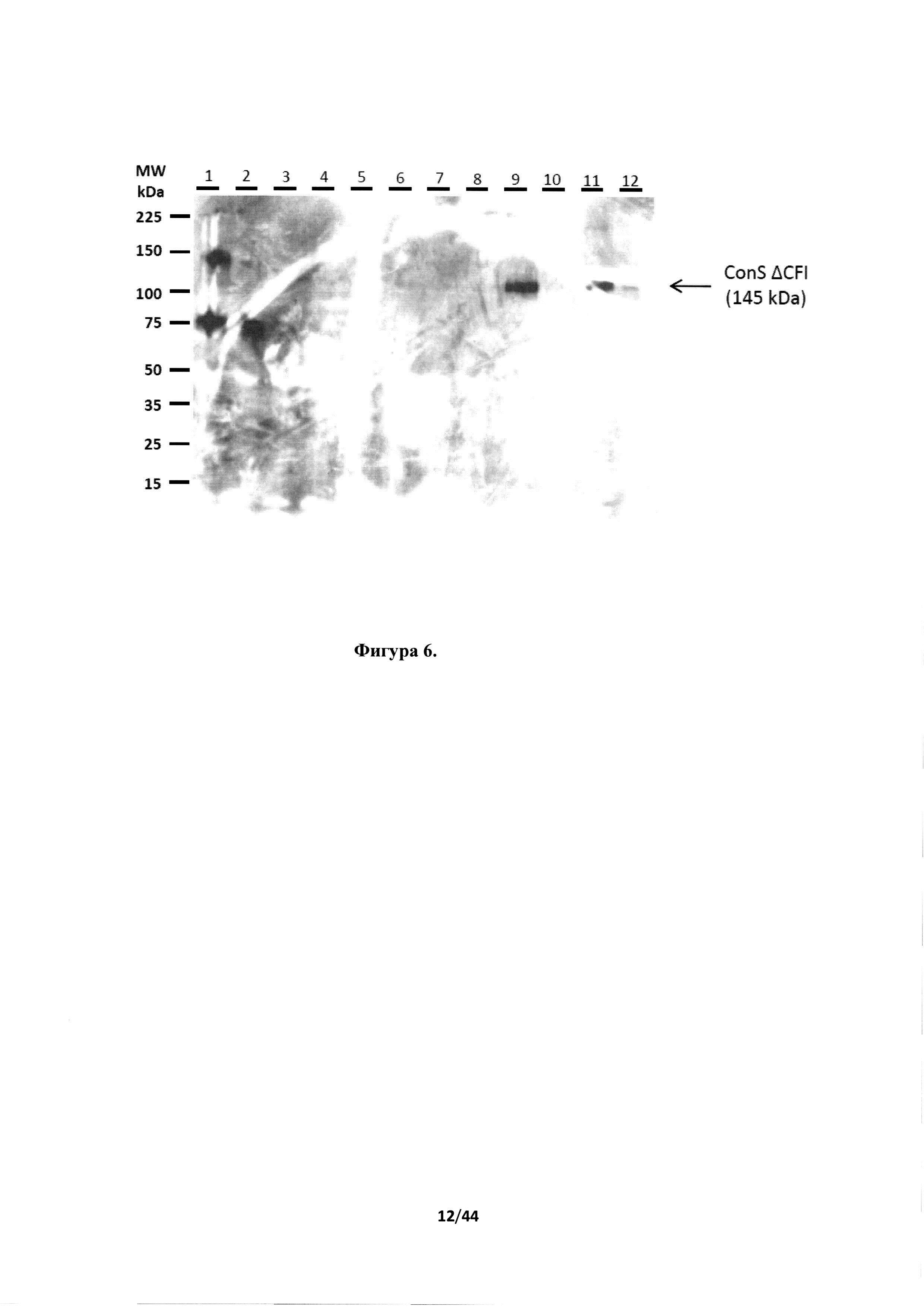
[0042] На фигуре 6 представлен вестерн-блот-анализ экспрессии белка Env HIV в агроинфильтрированных листьях Nicotiana benthamiana. Дорожки 1-4, рекомбинантный gp160 (ab68171) HIV-1, в количестве 100, 50, 10 и 5 нг, соответственно, в 20 мкг белков листьев, экстрагированных из мнимо-инфильтрированных растений (положительный контроль). Дорожка 5, 20 мкг белков, экстрагированных из мнимо-инфильтрированных растений (отрицательный контроль). Дорожки 6-8, белки, экстрагированные из AGL1/995-инфильтрированных листьев (в количестве 20 мкг, 10 мкг и 2 мкг, соответственно, дополненные 20 мкг белков листьев, экстрагированных из мнимо-инфильтрированных растений). Дорожки 9 и 10, белки, экстрагированные из AGL1/997-инфильтрированных листьев (в количестве 20 мкг и 10 мкг, соответственно, дополненные 20 мкг белков листьев, экстрагированных из мнимо-инфильтрированных растений). Дорожки 11 и 12, белки, экстрагированные из AGL1/999-инфильтрированных листьев (в количестве 20 мкг и 10 мкг, соответственно, дополненные 20 мкг белков листьев, экстрагированных из мнимо-инфильтрированных растений).
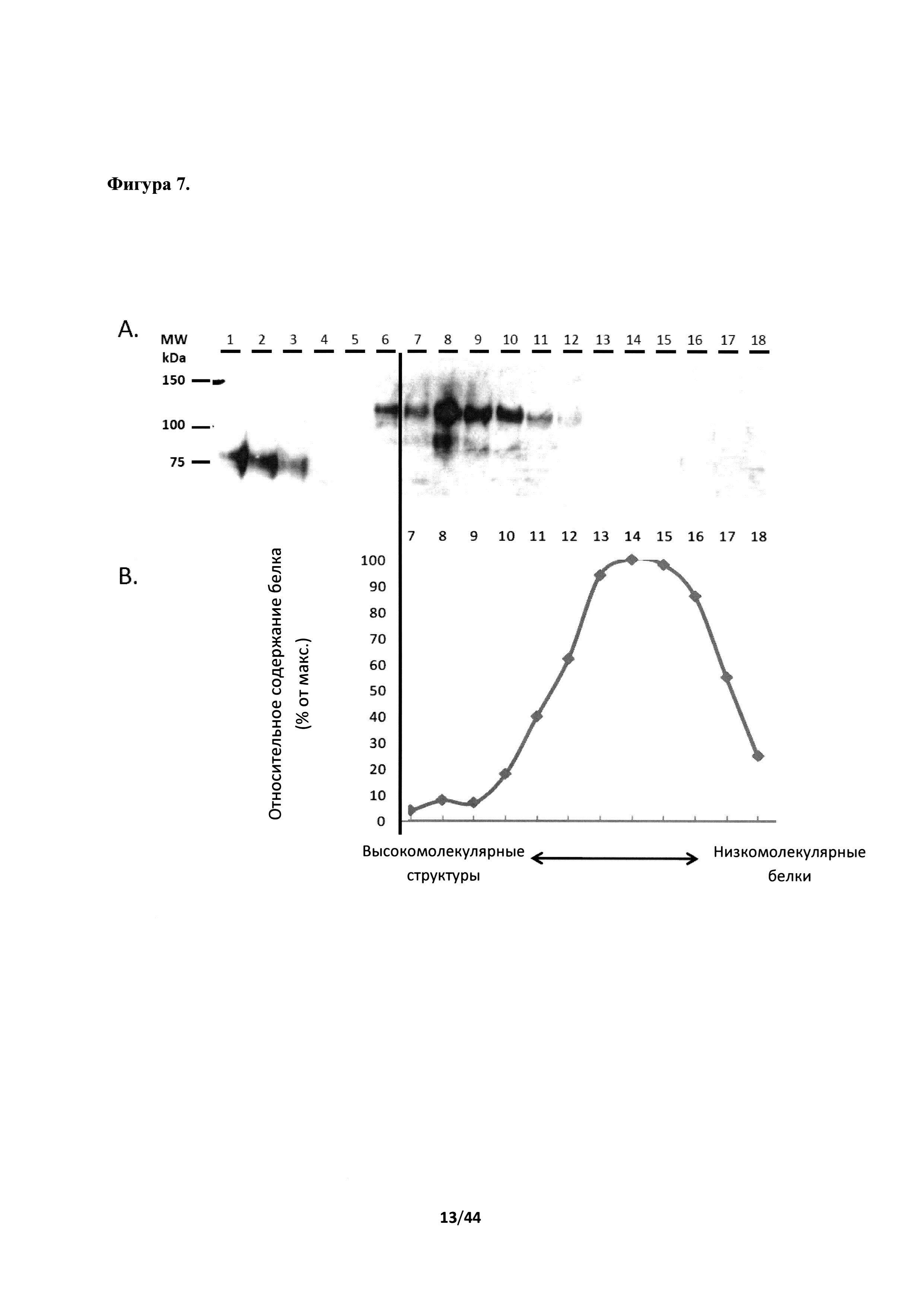
[0043] На фигуре 7 представлена характеристика структур, полученных из HIV ConS ΔCFI эксклюзионной хроматографией. Белковые экстракты из листьев, инфильтрированных AGL1/999, способных производить химерный белок Env/H5, разделяли гель-фильтрацией на калиброванной колонке высокого разрешения S-500. (А) Содержание белка Env HIV в элюированных фракциях выявляли иммунодетекцией с использованием анти-gp120 антител. Дорожки 1-4, рекомбинантный gp160 (ab68171) из HIV-1, в количестве 100, 50, 10 и 5 нг, соответственно, в 20 мкг белков листьев, экстрагированных из мнимо-инфильтрированных растений (положительный контроль). Дорожка 5, 20 мкг белков, экстрагированных из мнимо-инфильтрированных растений (отрицательный контроль). Дорожка 6, 20 мкг белков, экстрагированных из AGL1/999-инфильтрированных листьев. Дорожки 7-18, элюированные фракции от 7-й до 18-й, полученные гель-фильтрационной хроматографией. (В) Относительное содержание белка в элюированных фракциях от 7-й до 18-й, полученных гель-фильтрационной хроматографией.
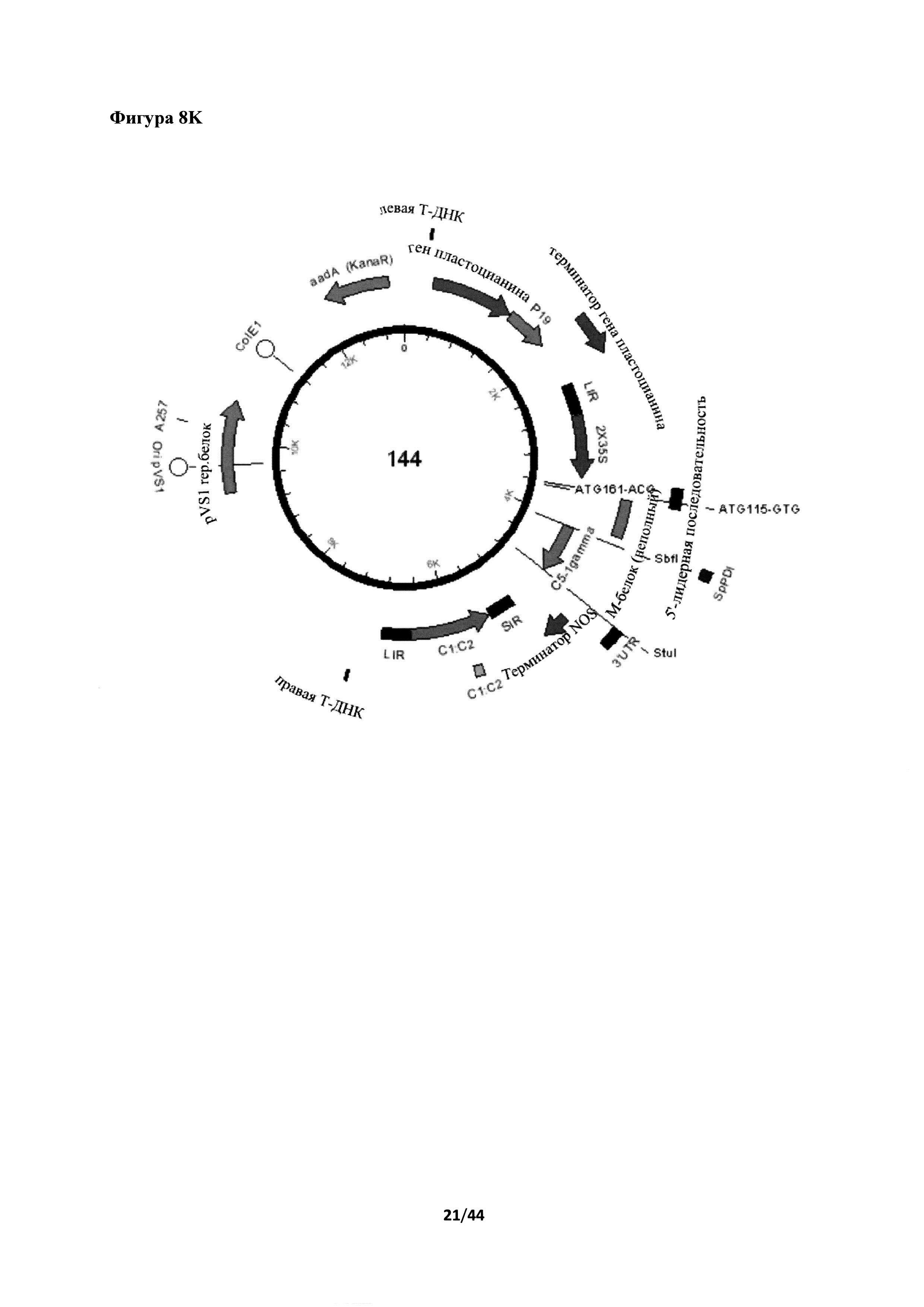
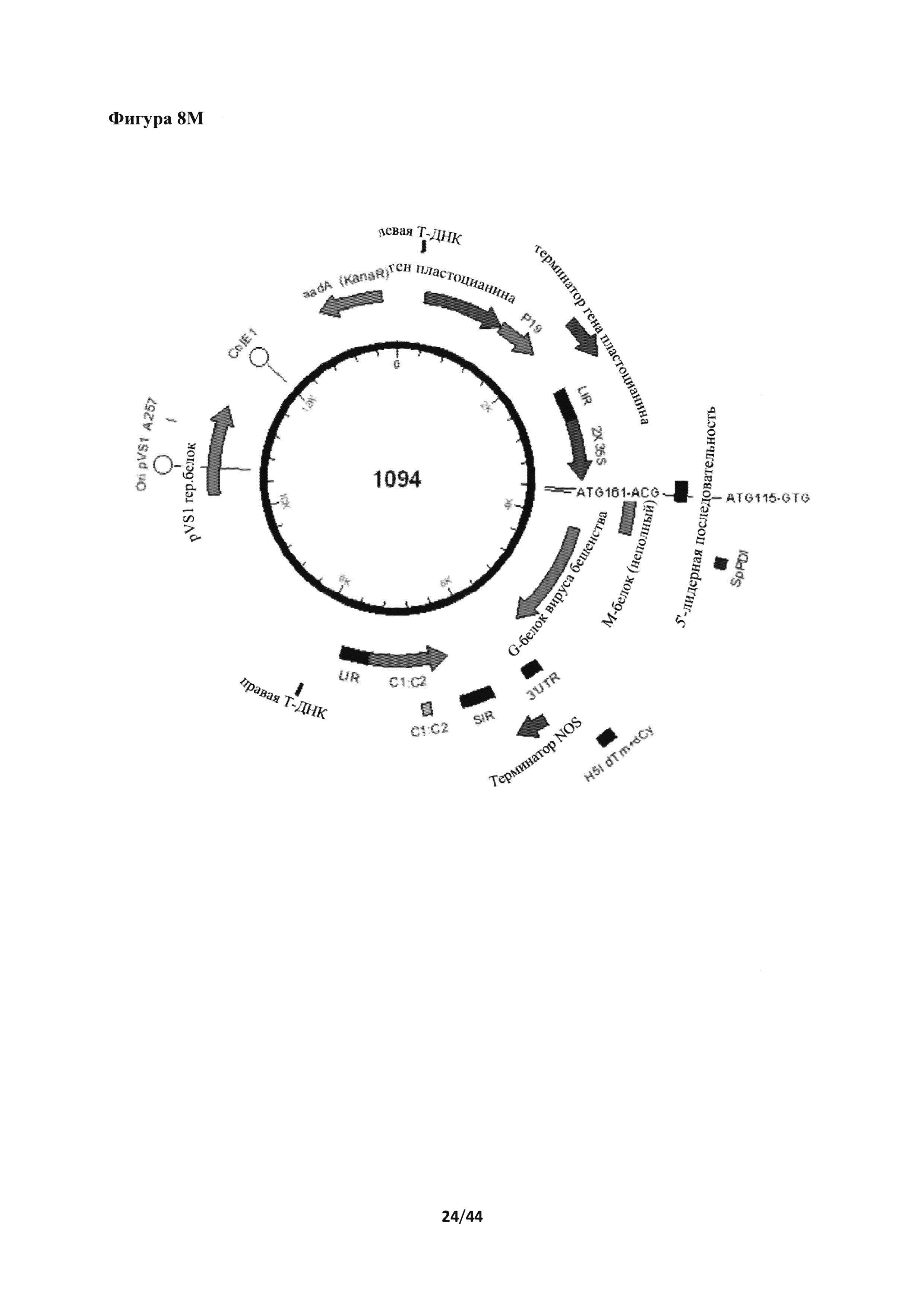
[0044] На фигуре 8 представлены несколько нуклеотидных и аминокислотных последовательностей и экспрессионные кассеты для вируса бешенства в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 8А представлено схематическое изображение конструкции 1074 (С-2X35S-гликопротеин G вируса бешенства (RabG)+трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS в векторе, содержащем ген ингибитора сайленсинга пластоцианин-Р19-пластоцианин). На фигуре 8В представлен праймер IF-RabG-S2+4.c (SEQ ID NO: 32). На фигуре 8С представлен праймер RabG+H5dTm.r (SEQ ID NO: 33). На фигуре 8D представлен синтезированный ген Rab G (соответствующий нуклеотидам 3317-4891 из последовательности с идентификационным номером EF206707 в базе данных Genbank (Genbank accession number EF206707); последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домен, подчеркнуты; SEQ ID NO: 34). На фигуре 8Е представлен праймер IF-H5dTm.c (SEQ ID NO: 35). На фигуре 8F представлена конструкция 141 от левой до правой t-ДНК (подчеркнуто). Система экспрессии 2-X35S-CPMV-HT-PDISP-NOS с кассетой экспрессии ингибитора сайленсинга пластоцианин-Р19-пластоцианин (SEQ ID NO: 36). На фигуре 8G представлено схематическое изображение конструкции 141. Сайты действия рестрикционных ферментов SbfI и StuI, используемые для линеаризации плазмиды, отмечены на изображении. На фигуре 8Н представлена нуклеотидная последовательность для экспрессионной кассеты номер 1074 от промотора 2X35S до терминатора NOS. Последовательность PDISP Rab-G -A/Indonesia/5/2005 Н5 ТМ+СТ подчеркнута (SEQ ID NO: 37). На фигуре 8I представлена аминокислотная последовательность PDISP Rab-G-A/Indonesia/5/2005 Н5 ТМ+СТ (SEQ ID NO: 38). На фигуре 8J представлена нуклеотидная последовательность для конструкции 144 от левой до правой t-ДНК (подчеркнуто). 2-X35S-CPMV-HT-PDISP-NOS в системе экспрессии BeYDV+репликаза с кассетой экспрессии ингибитора сайленсинга пластоцианин-Р19-пластоцианин (SEQ ID NO: 39). На фигуре 8K представлено схематическое изображение конструкции 144. Сайты действия рестрикционных ферментов SbfI и StuI, используемые для линеаризации плазмиды, отмечены на изображении. На фигуре 8L приведена нуклеотидная последовательность экспрессионной кассеты номер 1094 в направлении справа налево BeYDV LIR. Последовательность PDISP Rab-G -A/Indonesia/5/2005 Н5 ТМ+СТ подчеркнута (SEQ ID NO: 40). На фигуре 8М представлено схематическое изображение конструкции номер 1094. На фигуре 8N Вестерн-блот биомасс. Представлены результаты иммуноблот-анализа экспрессии белка G вируса бешенства в растении. Белок G вируса бешенства экспрессировали в слиянии с PDI Sp (конструкция 1071), системой BeYDV + репликаза (rep), ТМ+СТ-доменом из H5A/Indo или их комбинацией. Более конкретно, конструкция 1074 представляет собой результат слияния белка G вируса бешенства с PDI Sp и ТМ+СТ-доменом из H5A/Indo. Конструкция 1094 представляет собой результат слияния белка G вируса бешенства с BeYDV + rep, PDI Sp и ТМ+СТ-доменом из H5A/Indo. Конструкция 1091 представляет собой результат слияния белка G вируса бешенства с PDI Sp и BeYDV + rep. На фигуре 8O представлены результаты иммуноблот-анализа фракций эксклюзионной хроматографии сконцентрированных и осветленных экстрактов белка, экспрессированных из конструкции 1074 и конструкции 1094.
[0045] На фигуре 9А представлены результаты иммуноблот-анализа очищенного белка G вируса бешенства, экспрессированного из конструкции 1074. На фигуре 9В представлено полученное с помощью просвечивающей электронной микроскопии изображение очищенной VLP, полученной в результате экспрессии конструкции 1074 (черная полоска соответветствует 100 нм).
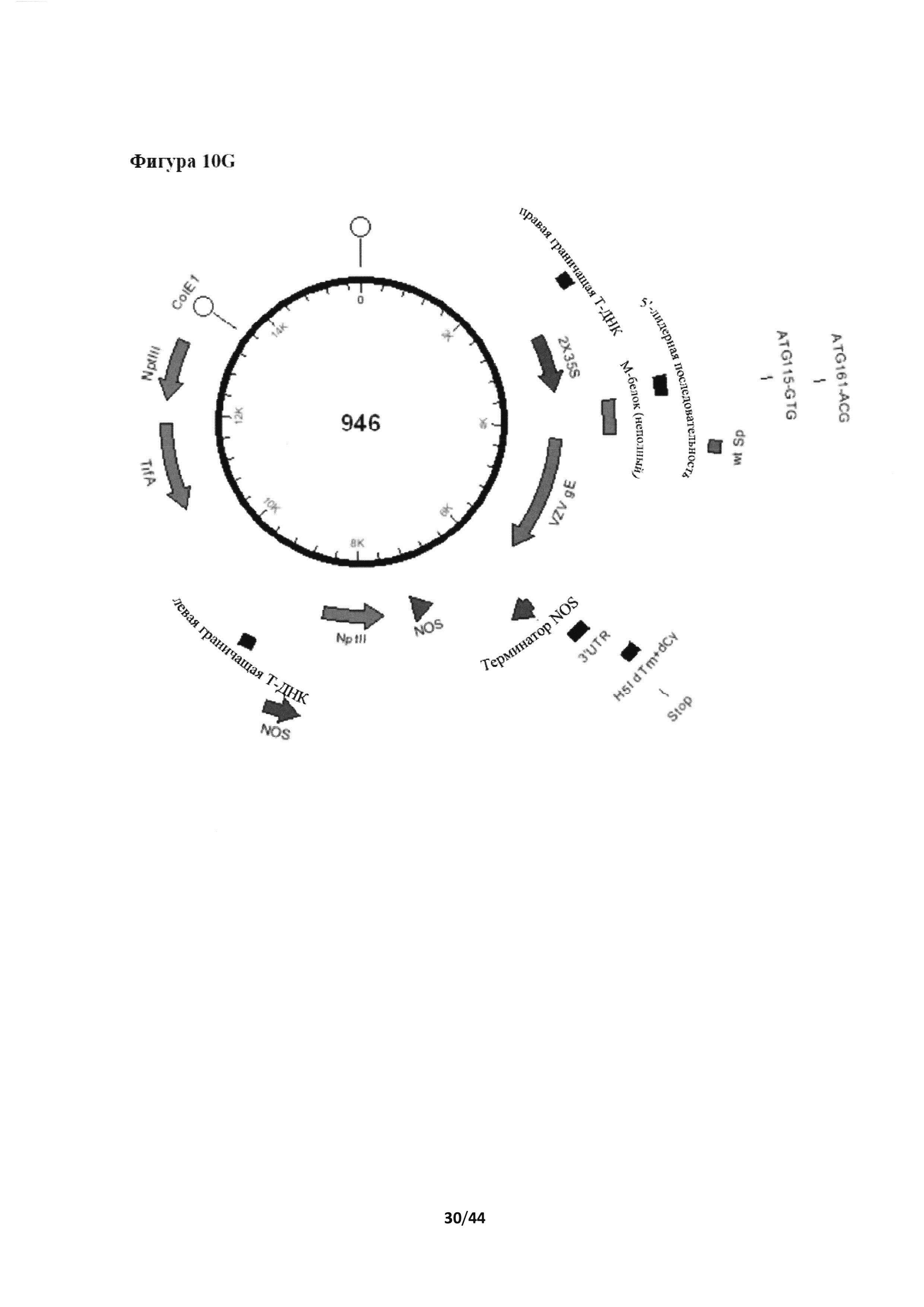
[0046] На фигуре 10 представлены последовательности для приготовления конструкции А-2X35S-гликопротеин Ε вируса ветряной оспы (VZVgE)+TpaHCMeM6paHHbiñ домен и цитоплазматический "хвост" (ТМ+СТ) из Н5 A/Indonesia/5/2005-NOS (конструкция номер 946). На фигуре 10А приведен праймер IF-wtSp-VZVgE.c (SEQ ID NO 20); на фигуре 10В представлен праймер IF-H5dTm+VZVgE.r (SEQ ID NO: 21). На фигуре 10С представлен синтезированный ген gE VZV (SEQ ID NO: 22; соответствующая нуклеотидам 3477-5348 из последовательности с идентификационным номером AY013752.1 в базе данных Genbank) (последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домен, подчеркнуты). На фигуре 10D приведен праймер для VZVgE+H5dTm.c (SEQ ID NO: 23). На фигуре 10E представлена экспрессионная кассета номер 946 (SEQ ID NO: 24) от PacI (выше (по ходу транскрипции) промотора) до AscI (непосредственно после (по ходу транскрипции) терминатора NOS). Последовательность VZV gE-A/Indonesia/5/2005 Н5 ТМ+СТ подчеркнута. На фигуре 10F приведена аминокислотная последовательность VZV gE-A/Indonesia/5/2005 Н5 ТМ+СТ (SEQ ID NO: 25). На фигуре 10G представлено схематическое изображение конструкции номер 946.
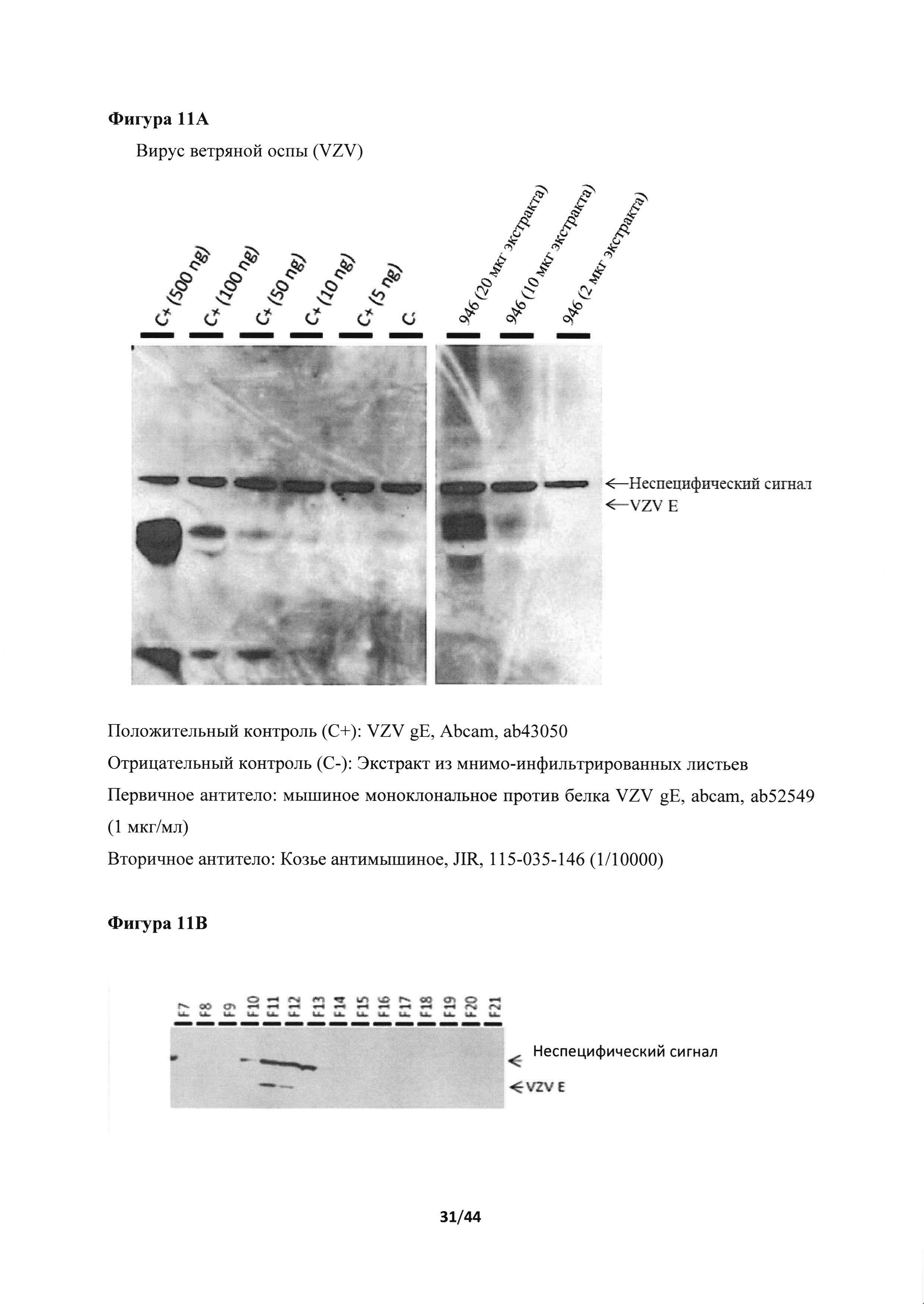
[0047] На фигуре 11А представлены результаты анализа методом иммуноблоттинга экспрессии белка Ε вируса ветряной оспы (VZV). Дорожки 1-5, рекомбинантный белок gE VZV, в количестве 500, 100, 50, 10 и 5 нг, соответственно (положительные контроли). Дорожка 6, экстракт из мнимо-инфильтрированных листьев (отрицательный контроль). Дорожки 7-9, рекомбинантный белок из конструкции 946, в количестве 20, 10 и 2 мкг экстракта, соответственно. Конструкция 946 содержит ген gE VZV с сигнальным пептидом дикого типа и ТМ+СТ-доменом из H5A/Indo. На фигуре 11В представлены результаты анализа методом иммуноблоттинга экспрессии во фракциях, полученных эксклюзионной хроматографией неочищенных экстрактов (конструкция 946).
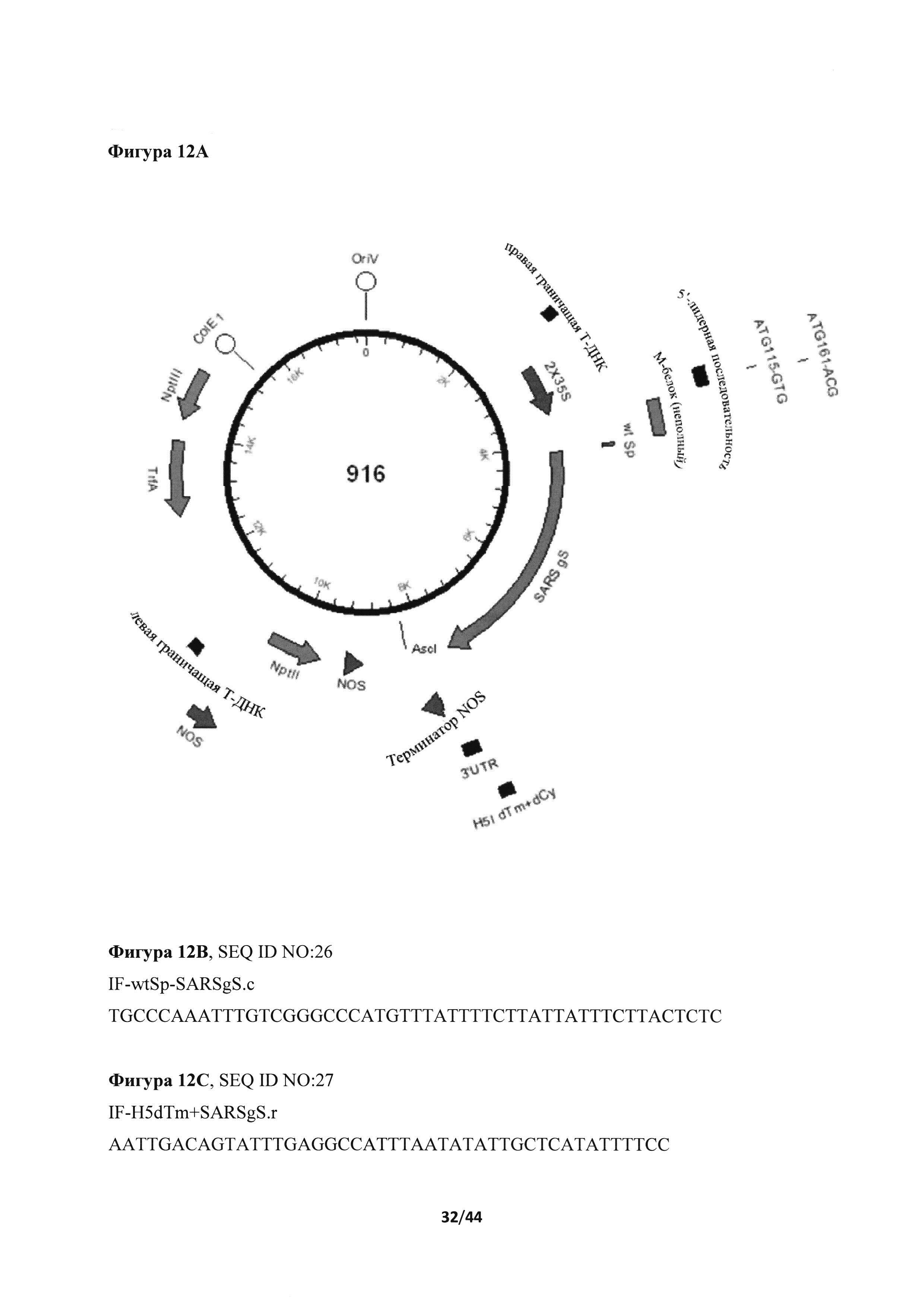
[0048] На фигуре 12 представлено несколько нуклеотидных и аминокислотных последовательностей, а также экспрессионные кассеты для SARS в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 12А представлено схематическое изображение конструкции номер 916 (B-2X35S-гликопротеин S вируса тяжелого острого респираторного синдрома (SARS gS)+трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) из Н5 A/Indonesia/5/2005-NOS). На фигуре 12В приведен праймер IF-wtSp-SARSgS.c (SEQ ID NO: 26). На фигуре 12С приведен праймер IF-H5dTm+SARSgS.r (SEQ ID NO: 27). На фигуре 12D представлен синтезированный ген gS SARS (SEQ ID NO: 28; соответствующая нуклеотидам 21492-25259 из последовательности с идентификационным номером AY278741.1 в базе данных Genbank; последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домен, подчеркнуты). На фигуре 12Е представлен праймер SARSgS+H5dTm.c SEQ ID NO: 29). На фигуре 12F представлена нуклеотидная последовательность экспрессионной кассеты номер 916 (SEQ ID NO: 30) от PacI (выше (по ходу транскрипции) промотора) до AscI (непосредственно после (по ходу транскрипции) терминатора NOS). Последовательность SARS gS-A/Indonesia/5/2005 Н5 ТМ+СТ подчеркнута. На фигуре 12G представлена аминокислотная последовательность SARS gS-A/Indonesia/5/2005 Н5 ТМ+СТ (SEQ ID NO: 31). На фигуре 12Н представлены результаты анализа методом иммуноблоттинга экспрессии белка S вируса тяжелого острого респираторного синдрома (SARS). Конструкция 916 содержит ген gS SARS дикого типа с сигнальным пептидом дикого типа и трансмембранным и цитоплазматическим доменом из H5A/Indo. Дорожка 1, экстракт из мнимо-инфильтрированных растений (отрицательные контроли). Дорожки 2-4, рекомбинантный белок из конструкции 916 (20, 10 и 5 мкг экстракта, соответственно).
[0049] На фигуре 13 представлены несколько нуклеотидных и аминокислотных последовательностей, а также экспрессионные кассеты для вируса Эбола в соответствии с различными вариантами осуществления настоящего изобретения. На фигуре 13А представлена нуклеотидная последовательность праймера IF-Opt_EboGP.s2+4c (SEQ ID NO: 43). На фигуре 13В представлена нуклеотидная последовательность праймера H5iTMCT+Opt_EboGP.r (SEQ ID NO: 44). На фигуре 13С представлена нуклеотидная последовательность оптимизированного синтезированного гена GP (соответствующая нуклеотидам 6039-8069 из последовательности с идентификационным номером AY354458 в базе данных Genbank для последовательности гена дикого типа. Последовательность (SEQ ID NO: 45) была оптимизирована в отношении использования кодонов и содержания GC, удаления критических сайтов сплайсинга, последовательностей Шайн-Дальгарно (Shine-Delgarno), РНК-дестабилизирующей последовательности и сайтов вхождения в прокариотические рибосомы; последовательность, кодирующая нативный сигнальный пептид, выделена жирным шрифтом, последовательности, кодирующие нативные трансмембранный и цитоплазматический домен, подчеркнуты). На фигуре 13D представлена нуклеотидная последовательность праймера opt_EboGP+H5iTMCT.c (SEQ ID NO: 46). На фигуре 13Е представлено схематическое изображение конструкции 1192. Сайты действия рестрикционных ферментов SacII и StuI, используемые для линеаризации плазмиды, отмечены на изображении. На фигуре 13F представлены нуклеотидные последовательности для конструкции 1192 от левой до правой границ t-ДНК (подчеркнуто). 2X35S/CPMV-HT/PDISP/NOS с кассетой экспрессии ингибитора сайленсинга пластоцианин-Р19-пластоцианин (SEQ ID NO: 47). На фигуре 13G представлена нуклеотидная последовательность экспрессионной кассеты номер 1366 от промотора 2X35S до терминатора NOS. Последовательность PDISP-GP из вируса Эбола Zaire 9 (Zaire 95 Ebolavirus)-TM+CT Н5 из вируса A/Indonesia/5/2005 подчеркнута (SEQ ID NO: 48). На фигуре 13Н представлена аминокислотная последовательность PDISP-GP из вируса Эбола Zaire 9-ТМ+СТ Н5 из вируса A/Indonesia/5/2005 (SEQ ID NO. 49). На фигуре 13I представлено схематическое изображение конструкции номер 1366. На фигуре 13J представлены результаты анализа методом иммуноблоттинга экспрессии белка гликопротеина (GP) вируса Эбола. Пятьсот нанограмм вносили в 20 мкг белка, экстрагированного из мнимо-инфильтрированных растений и загружали в качестве положительного контроля (С+). Двадцать микрограммов белков, экстрагированных из мнимо-инфильтрированных растений, загружали в качестве отрицательного контроля (С-). Конструкция 1366 содержит ген GP вируса Эбола с сигнальным пептидом дикого типа и ТМ+СТ-доменом H5A/Indo. Номера в скобках означают количество исходной бактериальной культуры, которое было использовано при приготовлении инокулята для инфильтрации. (200) означает, что 200 мл культуры смешивали с 2,3 л буфера для инфильтрации, и (400) означает, что 400 мл культуры смешивали с 2,1 л буфера для инфильтрации.
Подробное описание
[0050] Следующее описание представляет собой один предпочтительный вариант осуществления изобретения.
[0051] Настоящее изобретение относится к вирусоподобным частицам (VLP). Конкретнее, настоящее изобретение относится к VLP, содержащим химерные вирусные белки и к способам получения химерных VLP в растениях. VLP содержат слитый (химерный) белок, содержащий последовательно эктодомен из вирусного тримерного поверхностного белка (virus trimeric surface protein, viral trimeric surface protein) или его фрагмент, слитый с трансмембранным доменом и цитоплазматическим хвостовым доменом (ТМ/СТ). Эктодомен из вирусного тримерного поверхностного белка является гетерологичным по отношению к ТМ/СТ. ТМ/СТ представляет собой ТМ/СТ гемагглютинина (НА) вируса гриппа.
[0052] Вирусный тримерный поверхностный белок (virus trimeric surface protein) (называемый также viral trimeric surface protein) представляет собой белок, присуствующий на поверхности оболочечного вируса в виде тримера (обычно гомотримера), и содержащий трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ), находящиеся на С-терминальном конце каждого мономера, и эктодомен, находящийся в N-концевой области каждого мономера. Вирусный тримерный поверхностный белок может быть гликопротеином или белком оболочки. Тример представляет собой макромолекулярный комплекс, образованный тремя, обычно нековалентно связанными белками. Без желания быть связанным теорией, следует отметить, что тримеризационный домен белка может иметь важное значение для образования таких тримеров. Поэтому мономеры вирусного тримерного поверхностного белка или его фрагмент могут содержать тримеризационный домен. Вирусный тримерный поверхностный белок или его фрагмент дополнительно содержат эктодомен. Эктодомен тримерного поверхностного белка обращен наружу и не включает в себя трансмембранный домен и цитоплазматический хвостовой домен. Как описано в данном документе, эктодомен вирусного тримерного поверхностного белка не происходит из вируса гриппа. Если фрагмент вирусного тримерного поверхностного белка используется, как описано в данном документе, то является предпочтительным, чтобы вирусный тримерный поверхностный белок сохранял способность образовывать тример.
[0053] Трансмембранный домен и цитоплазматический "хвост" (ТМ/СТ) вирусного тримерного поверхностного белка, ТМ/СТ белка вируса гриппа или ТМ/СТ обоих белков могут быть легко идентифицированы с использованием способов, известных специалистам в данной области техники, например, определением степени гидрофобности аминокислотной последовательности белка, например, с использованием программы предсказания трансмембранных спиралей (например, Expert Protein Analysis System; ExPASy.org, поддерживается Швейцарским институтом биоинформатики; или the Dense Alignment Surface Method, Cserzo M., et al. 1997, Prot. Eng. vol. 10, no. 6, 673-676; Lolkema J.S. 1998, FEMS Microbiol Rev. 22, no 4, 305-322), определением профиля гидрофильности аминокислотной последовательности белка (например, Kyte-Doolittle Hydropathy Profile), определением трехмерной структуры белка и идентификацией структуры, которая является термодинамически стабильной в мембране (например, одиночная альфа-спираль, стабильный комплекс из нескольких трансмембранных альфа-спиралей, трансмембранный бета-бочонок (beta barrel), бета-спираль или любая другая структура, которая является термодинамически стабильной в мембране). После идентификации область ТМ/СТ вирусного тримерного поверхностного белка может быть заменена на трансмембранный домен и цитоплазматический "хвост", полученные из вируса гриппа, как описано ниже.
[0054] Химерная VLP согласно различным вариантам осуществления настоящего изобретения содержит вирусный тримерный поверхностный белок или фрагмент вирусного тримерного поверхностного белка, чей трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ) заменяются ТМ/СТ НА вируса гриппа. Вирусный тримерный поверхностный белок является гетерологичным по отношению к ТМ/СТ. Вирусный тримерный поверхностный белок или его фрагмент могут происходить без ограничений из вирусов семейства Retroviridae, Rhabdoviridae, Herpesviridae, Coronaviridae, Paramyxoviridae, Poxviridae или Filoviridae. Вирусный тримерный поверхностный белок может происходить, например, из организмов, относящихся к родам Lentivirus, Lyssavirus, Varicellovirus, Coronavirus или Ebolavirus. Вирусный тримерный поверхностный белок может происходить из, например, но не ограничиваясь ими, HIV, вируса бешенства, VZV, RSV, вируса SARS, вируса Эбола, вируса кори, вируса свинки, вируса ветряной оспы, цитомегаловируса, вируса Эбола/филовируса, вируса герпеса, вируса Эпштейна-Барра или вируса оспы. Вирусный тримерный поверхностный белок может представлять собой, например, тримерный поверхностный белок, содержащий в нативной форме трансмембранный домен/цитоплазматический "хвост", как, например, но не ограничиваясь ими:
a. F-белок (Paramyxoviridae: RSV, вирус кори, вирус свинки, вирус болезни Ньюкасла);
b. S-белок (Coronaviridae: SARS);
c. белок env (Retroviridae: HIV);
d. G-белок (Rhabdoviridae: бешенство);
e. гликопротеины оболочки, такие как Ε, В, С, I, H (Herpesviridae: VZV, цитомегаловирус, вирус герпеса, вирус Эпштейна-Барра);
f. гликопротеин GP (Filoviridae: вирус Эбола, вирус Марбург);
g. гемагглютинин (Poxviridae: вирус натуральной оспы, вирус коровьей оспы).
Неограничивающие примеры некоторых вирусных тримерных поверхностных белков, которые могут быть использованы в соответствии с настоящим изобретением, описаны более подробно ниже.
HIV
[0055] Настоящее изобретение относится к VLP, содержащим химерный белок вируса иммунодефицита человека (HIV), и к способам получения химерных VLP HIV, причем данный химерный белок HIV содержит слитый белок, например, с белком Env HIV и участком гемагглютинина (НА) вируса гриппа, таким как трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ).
[0056] Настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую химерный белок HIV, функционально связанной с регуляторной областью, активной в растении.
[0057] Дополнительно, настоящее изобретение относится к способу получения химерных VLP HIV в растении. Данный способ включает в себя введение нуклеиновой кислоты, кодирующей химерный белок HIV, функционально связанной с регуляторной областью, активной в растении, в растение или в часть растения и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP HIV.
[0058] Настоящее изобретение дополнительно относится к VLP, содержащей химерный белок HIV. Данная VLP может быть получена способом, предусмотренным настоящим изобретением.
Вирус бешенства
[0059] Настоящее изобретение также относится к VLP, содержащим химерный белок вируса бешенства, и к способам получения химерных VLP вируса бешенства, причем данный химерный белок вируса бешенства содержит слитый белок, например, с белком G вируса бешенства и участком гемагглютинина (НА) вируса гриппа, таким как трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ).
[0060] Настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую химерный белок вируса бешенства, функционально связанной с регуляторной областью, активной в растении.
[0061] Дополнительно, настоящее изобретение относится к способу получения химерных VLP вируса бешенства в растении. Данный способ включает в себя введение нуклеиновой кислоты, кодирующей химерный белок вируса бешенства, функционально связанной с регуляторной областью активный в растении, в растение или в часть растения и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP вируса бешенства.
[0062] Настоящее изобретение также относится к VLP, содержащей химерный белок вируса бешенства. Данная VLP может быть получена способом, предусмотренным настоящим изобретением.
VZV
[0063] Настоящее изобретение также относится к VLP, содержащим химерный белок вируса ветряной оспы (VZV), и к способам получения химерных VLP VZV, причем данный химерный белок VZV содержит слитый белок, например, с гликопротеином Ε VZV и с участком гемагглютинина (НА) вируса гриппа, таким как трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ).
[0064] Настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую химерный белок VZV, функционально связанной с регуляторной областью, активной в растении.
[0065] Дополнительно, настоящее изобретение относится к способу получения химерных VLP VZV в растении. Данный способ включает в себя введение нуклеиновой кислоты, кодирующей химерный белок VZV, функционально связанной с регуляторной областью, активной в растении, в растение или в часть растения, и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP VZV.
[0066] Настоящее изобретение также относится к VLP, содержащей химерный белок VZV. Данная VLP может быть получена способом, предусмотренным настоящим изобретением.
SARS
[0067] Настоящее изобретение также относится к VLP, содержащим химерный белок вируса тяжелого острого респираторного синдрома (SARS), и к способам получения химерных VLP SARS, причем данный химерный белок SARS содержит слитый белок, например, с гликопротеином S SARS и участком гемагглютинина (НА) вируса гриппа, таким как трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ).
[0068] Настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую химерный белок SARS, функционально связанной с регуляторной областью, активной в растении.
[0069] Дополнительно, настоящее изобретение относится к способу получения химерных VLP SARS в растении. Данный способ включает в себя введение нуклеиновой кислоты, кодирующей химерный белок вируса SARS, функционально связанной с регуляторной областью, активной в растении, в растение или в часть растения, и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP SARS.
[0070] Настоящее изобретение также относится к VLP, содержащей химерный белок вируса SARS. Данная VLP может быть получена способом, предусмотренным настоящим изобретением.
Вирус Эбола
[0071] Настоящее изобретение также относится к VLP, содержащим химерный белок вируса Эбола и к способам получения химерных VLP вируса Эбола, причем данный химерный белок вируса Эбола содержит слитый белок, например, с гликопротеином оболочки вируса Эбола и участком гемагглютинина (НА) вируса гриппа, таким как трансмембранный домен и цитоплазматический хвостовой домен (ТМ/СТ).
[0072] Настоящее изобретение относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую химерный белок вируса Эбола, функционально связанной с регуляторной областью, активной в растении.
[0073] Дополнительно, настоящее изобретение относится к способу получения химерных VLP вируса Эбола в растении. Данный способ включает в себя введение нуклеиновой кислоты, кодирующей химерный белок вируса Эбола, функционально связанной с регуляторной областью, активной в растении, в растение или в часть растения, и инкубацию растения или части растения в условиях, обеспечивающих экспрессию нуклеиновой кислоты, с получением, таким образом, химерных VLP вируса Эбола.
[0074] Настоящее изобретение также относится к VLP, содержащей химерный белок вируса Эбола. Данная VLP может быть получена способом, предусмотренным настоящим изобретением.
Химеризация и образование VLP
[0075] Как вирус везикулярного стоматита (рабдовирус, подобный вирусу бешенства), так и вирус простого герпеса (вирус герпеса, подобный вирусу ветряной оспы) почкуются VSP4-зависимым способом (Taylor et al. J. Virol 81:13631-13639, 2007; Crump et al., J. Virol 81:7380-7387, 2007). Поскольку VSP4 взаимодействует с "поздним" доменом матриксного белка, это говорит о том, что матриксный белок требуется для отпочковывания и, как следствие, для продукции VLP. Однако, как описано в данном документе, VLP вируса бешенства и VZV можно получать без матриксного белка при замене ТМ/СТ-домена таковым вируса гриппа НА. Без желания быть связанным теорией, это может говорить о том, что химеризацией можно устранить зависимость от совместной экспрессии матриксного белка в случае образования VLP для вируса бешенства и VZV.
[0076] Эктодомен вирусного тримерного поверхностного белка, как описано выше, слит с трансмембранным доменом и цитоплазматическим хвостовым доменом (ТМ/СТ), так что вирусный тримерный поверхностный белок является гетерологичным по отношению к ТМ/СТ. ТМ/СТ может представлять собой ТМ/СТ из гемагглютинина (НА) вируса гриппа, например, ТМ/СТ Н5 и Н3, например, но не ограничиваясь ими, подтипа A/Indonesia/5/05 (H5N1; "Н5/Indo"; идентификационный номер ABW06108.1 в базе данных Genbank), Н5 A/Vietnam/1194/2004 (A-Vietnam; идентификационный номер ACR48874.1 в базе данных Genbank), Н5 A/Anhui/1/2005 (A-Anhui; идентификационный номер ABD28180.1 в базе данных Genbank), Н3 A/Brisbane/10/2007 ("Н3/Bri"; идентификационный номер ACI26318.1 в базе данных Genbank), Н3 A/Wisconsin/67/2005 (A-WCN; идентификационный номер ABO37599.1 в базе данных Genbank). Границы, определяющие ТМ/СТ нескольких последовательностей Н3 и Н5 описаны в заявке WO 2010/148511 (которая включена в данный документ посредством ссылки). В качестве примеров, которые не следует рассматривать как ограничивающие, аминокислотные последовательности ТМ/СТ могут включать в себя:

и любые нуклеотидные последовательности, кодирующие аминокислотную последовательность SEQ ID NO: 41 или SEQ ID NO: 42.
[0077] Специфическая последовательность нуклеиновой кислоты, упомянутая в настоящем изобретении, может быть "по существу гомологичной" или "по существу похожей" последовательности или последовательности или комплименту последовательности, которые гибридизуются с одной или более чем одной нуклеотидными последовательностями, как определено в данном документе, в жестких условиях гибридизации. Последовательности являются "по существу гомологичными" или "по существу похожими", когда по меньшей мере около 70% или более предпочтительно 75% нуклеотидов совпадают на определенном участке длины нуклеотидной последовательности при условии, что такие гомологичные последовательности обладают одним или более чем одним из свойств последовательности или кодируемого продукта, как описано в данном документе. Например, по существу гомологичный эктодомен из вирусного тримерного поверхностного белка, слитый с трансмембранным доменом и цитоплазматическим хвостовым доменом, полученными из Н3 или Н5, трансмембранный домен и цитоплазматический "хвост", который является по существу гомологичным ТМ/СТ из Н3 или Н5 и слит с эктодоменом из вирусного тримерного поверхностного белка, или как по существу гомологичный ТМ/СТ, так и по существу гомологичный эктодомен из вирусного тримерного поверхностного белка образуют VLP. Правильное сворачивание химерного белка может быть важным для стабильности белка, образования мультимеров, образования VLP и функции. Сворачивание белка может зависеть от одного или многих факторов, включая, но не ограничиваясь ими, последовательность белка, относительное содержание белка, степень внутриклеточного скопления, доступность кофакторов, которые могут связываться или быть временно связанными со свернутым, частично свернутым или развернутым белком.
[0078] Такое сходство последовательностей можно определить с использованием программы сравнения нуклеотидных последовательностей, например, входящих в DNASIS (используя, например, но не ограничиваясь ими, следующие параметры: штраф за пропуск в последовательности 5, номер верхних диагоналей 5, штраф за фиксированный пропуск в последовательности 10, k-кратное 2, плавающий пропуск в последовательности 10, и размер окна 5). Однако другие методы выравнивания последовательностей в целях сравнения являются хорошо известными в данной области, например, алгоритмы Smith & Waterman (1981, Adv. Appl. Math. 2:482), Needleman & Wunsch (J. Mol. Biol. 48:443, 1970), Pearson & Lipman (1988, Proc. Natʹl. Acad. Sci. USA 85:2444), а также выравнивание последовательностей с помощью программ, являющихся компьютерной реализацией данных алгоритмов (GAP, BESTFIT, FASTA и BLAST, доступны через интернет.портал Национальных институтов здоровья США (NIH)) или ручным выравниванием и визуальной инспекцией (см., например, Current Protocols in Molecular Biology, Ausubel et al., eds. 1995 supplement), или с помощью гибридизации методом Нозерн-блот или Саузерн-блот в жестких условиях (см. Maniatis et al., in Molecular Cloning (A Laboratory Manual), Cold Spring Harbor Laboratory, 1982). Предпочтительно последовательности, которые являются по существу гомологичными, проявляют по меньшей мере около 80% и наиболее предпочтительно по меньшей мере около 90% сходства последовательностей на определенном участке длины молекулы.
[0079] В качестве одного такого примера гибридизации в жестких условиях может служить гибридизация в течение ночи (от около 16 до 20 часов) в 4х SSC (1X SSC содержит 0,15 M NaCl, 0,015 M цитрат натрия, pH 7,0) при 65°C с последующей промывкой в 0,1х SSC при 65°С в течение одного часа, или с 2-мя промывками в 0,1х SSC при 65°С в течение 20 или 30 минут каждая. Альтернативно примером гибридизации в жестких условиях может служить гибридизация в течение ночи (от 16 до 20 часов) в 50%-ном формамиде, 4х SSC при 42°C с последующей промывкой в 0,1x SSC при 65°С в течение одного часа, или с 2-мя промывками в 0,1x SSC при 65°С в течение 20 или 30 минут каждая или в течение ночи (от 16 до 20 часов), или гибридизация в Church водном фосфатном буфере (7% SDS, 0,5 M NaPO4-буфере с pH 7,2; 10 мМ ЭДТА) при 65°С, с 2-мя промывками либо при 50°С в 0,1х SSC, 0,1% SDS в течение 20 или 30 минут каждая или с 2-мя промывками при 65°С в 2x SSC, 0,1% SDS в течение 20 или 30 минут каждая для уникальных областей последовательности.
[0080] Нуклеиновая кислота, кодирующая химерный полипептид, химерный белок, слитый белок, химерный вирусный белок или химерный вирусный тримерный поверхностный белок, может быть описана как "химерная нуклеиновая кислота" или "химерная нуклеотидная последовательность". В качестве примеров, которые не следует рассматривать как ограничивающие, вирусоподобная частица, содержащая химерный белок HIV, химерный белок вируса бешенства, химерный белок VZV, химерный белок SARS или химерный белок вируса Эбола может быть описана как "химерная VLP".
[0081] Под "химерным белком" или "химерным полипептидом", также известным как слитый белок, понимают белок или полипептид, который содержит аминокислотные последовательности из двух или более чем двух источников, например, но не ограничиваясь ими, эктодомен или его фрагмент вирусного тримерного поверхностного белка, например, F-белка (например, RSV, вирус кори, паротита, ньюкаслской болезни), S-белка (например, SARS), белка env (HIV), G-белка (вирус бешенства), гликопротеинов оболочки, таких как Е, В, С, I, H (VZV, цитомегаловирус, вирус герпеса, вирус Эпштейна-Барра), гликопротеина GP (например, вирус Эбола, вирус Марбург), гемагглютинина (например, вирус натуральной оспы, вирус коровьей оспы), и, например, ТМ/СТ НА, которые являются слитыми в виде отдельного полипептида. Химерный белок или полипептид может включать в себя сигнальный пептид, который может иметь то же происхождение, что и остаток полипептида или белка, или быть гетерологичным ему.
[0082] Понятие "сигнальный пептид" хорошо известно в данной области и обычно относится к короткой (около 5-30 аминокислот) последовательности аминокислот, находимой обычно на N-конце полипептида, которая может направлять перемещение вновь транслированного полипептида к определенной органелле или помогать в позиционировании специфических доменов полипептидной цепи по отношению к другим. В качестве неограничивающего примера, сигнальный пептид может направлять транслокацию белка в эндоплазматический ретикулум и/или помогать в позиционировании N-терминального проксимального домена относительно мембранно-якорного домена растущего полипептида, чтобы помочь в расщеплении и сворачивании зрелого белка, неограничивающим примером которого может служить зрелый белок НА.
[0083] Сигнальный пептид (SP) может быть нативным для белка или вирусного белка, или сигнальный пептид может быть гетерологичным по отношению к первичной последовательности белка или вирусного белка, который должен экспрессироваться. Белок или вирусный белок может содержать сигнальный пептид из вируса гриппа первого типа, подтипа или штамма с остатком НА из одного или более чем одного вируса гриппа другого типа, подтипа или штамма. Например нативный сигнальный пептид НА из подтипов В H1, Н2, Н3, Н5, Н6, Н7, Н9 или вируса гриппа типа В может быть использован для экспрессии химерного вирусного белка в растительной системе. В некоторых вариантах осуществления изобретения SP может быть из вируса гриппа типа В, H1, Н3 и Н5; или подтипа H1/Bri, H1/NC, H5/Indo, Н3/Bri или B/Flo. В некоторых вариантах осуществления SP может быть из белка Env HIV, G-белка вируса бешенства, гликопротеина Ε VZV, гликопротеина S SARS или гликопротеина оболочки вируса Эбола.
[0084] Сигнальный пептид может быть также ненативным, например, из белка, вирусного белка, вирусного тримерного поверхностного белка или гемагглютинина вируса, не являющегося вирусным тримерным поверхностным белком, или из растительного, животного или бактериального полипептида. Неограничивающим примером сигнального пептида, который может быть использован, является сигнальный пептид протеин-дисульфид изомеразы люцерны (PDI SP; нуклеотиды 32-103 из последовательности с идентификационным номером Z11499).
[0085] Настоящее изобретение, таким образом, относится к химерному вирусному белку, содержащему нативный или ненативный сигнальный пептид, и к нуклеиновым кислотам, кодирующим такие химерные вирусные белки.
[0086] Правильное сворачивание экспрессированного химерного вирусного белка может быть важным для стабильности белка, образования мультимеров, образования VLP, функции химерного вирусного белка и распознавания химерного вирусного белка антителом, помимо других характерных особенностей. Сворачивание и накопление белка могут зависеть от одного или многих факторов, включая, но не ограничиваясь ими, последовательность белка, относительное содержание белка, степень внутриклеточного скопления, величину pH в клеточном компартменте, наличие кофакторов, которые могут связываться или быть временно связанными со свернутым, частично свернутым или развернутым белком, присутствие одного или более белков шаперонов или тому подобное.
[0087] Белки теплового шока (Hsp) или стрессовые белки служат примерами белков-шаперонов, которые могут принимать участие в различных клеточных процессах, включая синтез белка, внутриклеточный транспорт, предотвращение неправильного сворачивания, предотвращение агрегации белка, сборку и разборку белковых комплексов, сворачивание белков и дезагрегацию белков. Примеры таких белков-шаперонов включают в себя, но не ограничиваются ими, Hsp60, Hsp65, Hsp70, Hsp90, Hsp100, Hsp20-30, Hsp10, Hsp100-200, Hsp100, Hsp90, Lon, TF55, FKBP, циклофилины, ClpP, GrpE, убиквитин, калнексин и протеин-дисульфид изомеразы (см., например, Macario, A.J.L., Cold Spring Harbor Laboratory Res. 25:59-70. 1995; Parsell, D.A. & Lindquist, S. Ann. Rev. Genet. 27:437-496 (1993); патент США №5232833). Как описано в данном документе, белки-шапероны Hsp40 и Hsp70, служащие в качестве неограничивающего примера, могут быть использованы для обеспечения сворачивания химерного вирусного белка.
[0088] Примеры Hsp70 включают в себя Hsp72 и Hsc73 из клеток млекопитающих, DnaK из бактерий, в частности, микобактерий, таких как Mycobacterium лепры, Mycobacterium tuberculosis и Mycobacterium bovis (например, бацилла Кальметта-Герена (Bacille-Calmette Guerin): называют в данном документе Hsp71). DnaK из Escherichia coli, дрожжей и других прокариот и BiP и Grp78 из эукариот, таких как A. thaliana (Lin et al. 2001 Cell Stress and Chaperones 6:201-208). Конкретным примером Hsp70 служит Hsp70 A. thaliana (идентификационный номер в базе данных Genbank: AY120747.1). Hsp70 способен специфически связывать АТФ, а также развернутые полипептиды и пептиды, участвуя тем самым в сворачивании и разворачивании белков, а также в сборке и разборке белковых комплексов.
[0089] Примеры Hsp40 включают в себя DnaJ из прокариот, таких как E.coli и микобактерий, и HSJ1, HDJ1 и Hsp40 из эукариот, таких как люцерна (Frugis et al., 1999. Plant Molecular Biology 40:397-408). Конкретным примером Hsp40 служит MsJ1 M. sativa (идентификационный номер в базе данных Genbank: AJ000995.1). Hsp40 играет роль молекулярного шаперона в сворачивании белка, термотолерантности и репликации ДНК, помимо других клеточных активностей.
[0090] Среди HSP, Hsp70 и его кошаперон, Hsp40, участвуют в стабилизации транслируемых и вновь синтезируемых полипептидов до завершения синтеза. Без желания быть связанным теорией, Hsp40 связывается с гидрофобными участками развернутых (только что синтезированных или только что перенесенных через мембрану) полипептидов, что облегчает взаимодействие комплекса Hsp70-АТФ с полипептидом. Гидролиз АТФ приводит к образованию стабильного комплекса между полипептидом, Hsp70 и АДФ и к высвобождению Hsp40. Связывание комплекса Hsp70-ADP с гидрофобными участками полипептида предотвращает их взаимодействие с другими гидрофобными участками, предотвращая неправильное сворачивание и образование агрегатов с другими белками (обзор в Hartl, FU. 1996. Nature 381:571-579).
[0091] Нативные белки-шапероны могут способствовать правильному сворачиванию малых количеств рекомбинантного белка, но как только уровни экспрессии возрастают, недостаток нативных шаперонов может стать ограничивающим фактором. Высокие уровни экспрессии химерного вирусного белка в агроинфильтрированных листьях могут привести к накоплению химерного вирусного белка в цитозоле, так что совместной экспрессией одного или более чем одного белков-шаперонов, таких как Hsp70, Hsp40 или обоих Hsp70 и Hsp40, можно добиться уменьшения количества неправильно свернутых или агрегированных белков, а также увеличения количества белков, проявляющих третичные и четвертичные структурные характеристики, делающие возможным образование вирусоподобных частиц.
[0092] Таким образом, настоящее изобретение также относится к способу получения VLP химерного вирусного белка в растении, в котором первая нуклеиновая кислота, кодирующая химерный вирусный белок, экспрессируется совместно со второй нуклеиновой кислотой, кодирующей шаперон. Первая и вторая нуклеиновые кислоты могут быть введены в растение на одной стадии или могут быть введены в растение последовательно.
[0093] Химерные VLP из белков, полученных из вируса, в соответствии с настоящим изобретением не содержат вирусного матриксного или сердцевинного белка. Вирусный матриксный белок представляет собой белок, который организует и поддерживает структуру вириона. Вирусные матриксные белки взаимодействуют обычно непосредственно с клеточными мембранами и могут быть вовлечены в процесс отпочковывания. Вирусные сердцевинные белки представляют собой белки, которые составляют часть нуклеокапсида и, как правило, являются непосредственно связанными с вирусной нуклеиновой кислотой. Примерами вирусного матриксного или сердцевинного белка служат белки M1 вируса гриппа, M RSV и gag ретровируса. Белок M1, как известно, связывает РНК (Wakefield L., and Brownlee G.G., Nucl Acids res 11:8569-8580, 1989), которая может рассматриваться как загрязнение препарата VLP. Присутствие РНК является нежелательным при получении разрешения надзорных органов на антигенный (VLP) продукт, поэтому отсутствие РНК в препарате химерных VLP может рассматриваться как преимущество.
[0094] Использование понятий "регуляторная область", "регуляторный элемент" или "промотор" в настоящей заявке предназначено для обозначения участка нуклеиновой кислоты, расположенного обычно, но не всегда, выше (по ходу транскрипции) (upstream) по отношению к кодирующей белок области гена, который может содержать либо ДНК, либо РНК, либо как ДНК, так и РНК. Когда регуляторная область является активной и находится в функциональной ассоциации или функционально связана с представляющим интерес геном, это может привести к экспрессии интересующего гена. Регуляторный элемент может быть способен опосредовать органную специфичность или управлять развитием или временной активацией гена. "Регуляторная область" может включать в себя элементы промотора, основные элементы промотора, проявляющие базальную промоторную активность, элементы, которые индуцируются в ответ на внешний стимул, элементы, которые опосредуют активность промотора, такие как отрицательные регуляторные элементы или транскрипционные энхансеры. "Регуляторная область" для целей настоящего изобретения может также включать в себя элементы, которые являются активными после транскрипции, например, регуляторные элементы, которые модулируют экспрессию генов, такие как трансляционные и транскрипционные энхансеры, трансляционные и транскрипционные репрессоры, активирующие выше (по ходу транскрипции) (upstream activating) последовательности и детерминанты нестабильности мРНК. Некоторые из данных последних элементов могут быть расположены проксимально по отношению к кодирующей области.
[0095] В контексте настоящего раскрытия понятие "регуляторный элемент" или "регуляторная область" обычно относится к последовательности ДНК, расположенной, как правило, но не всегда, выше (по ходу транскрипции) (5ʹ) кодирующей последовательности структурного гена, которая контролирует экспрессию кодирующей области, обеспечивая распознавание РНК-полимеразой и/или другими факторами, необходимыми для того, чтобы транскрипция началась в определенном сайте. Однако следует понимать, что другие нуклеотидные последовательности, расположенные в пределах интронов, или 3ʹ-концевой участок последовательности могут также вносить вклад в регулирование экспрессии кодирующей области, представляющей интерес. Примером регуляторного элемента, который обеспечивает распознавание для РНК-полимеразы или других транскрипционных факторов для обеспечения инициации транскрипции в определенном сайте, служит промоторный элемент. Большинство, если не все, эукариотические промоторные элементы содержат ТАТА-бокс, консервативную последовательность нуклеиновой кислоты, содержащую пары аденозиновых и тиминовых нуклеотидных оснований, обычно расположенную приблизительно на 25 пар оснований выше (по ходу транскрипции) сайта начала транскрипции. Промоторный элемент содержит базальный промоторный элемент, ответственный за инициацию транскрипции, а также другие регуляторные элементы (перечисленные выше), которые модифицируют экспрессию генов.
[0096] Существует несколько типов регуляторных областей, включая те, которые регулируются развитием, являются индуцируемыми или конститутивными. Регуляторная область, которая регулируется в процессе развития или контролирует дифференциальную экспрессию гена под его контролем, активируется в некоторых органах или тканях органа в определенные моменты времени в процессе развития такого органа или ткани. Тем не менее некоторые регуляторные области, которые регулируются в процессе развития, предпочтительно могут быть активными в некоторых органах или тканях на определенных стадиях развития, они также могут быть активными, будучи регулируемыми в процессе развития, или на базальном уровне в других органах или тканях в растении. Примеры тканеспецифических регуляторных областей, например, семяспецифическая регуляторная область, включают в себя промотор гена напина и промотор гена круциферина (Rask et al., 1998, J. Plant Physiol. 152: 595-599; Bilodeau et al., 1994, Plant Cell 14: 125-130). Пример специфического для листьев промотора включает в себя промотор гена пластоцианина (см. патент США 7,125,978, который включен в данном документе посредством ссылки).
[0097] Индуцируемая регуляторная область представляет собой область, которая способна к непосредственной или косвенной активации транскрипции одной или более последовательностей ДНК или генов в ответ на индуктор. При отсутствии индуктора последовательности ДНК или гены не транскрибируются. Обычно белковый фактор, который специфически связывается с индуцируемой регуляторной областью, чтобы активировать транскрипцию, может присутствовать в неактивной форме, которая затем непосредственно или опосредованно превращается в активную форму индуктором. Однако белковый фактор может также отсутствовать. Индуктор может представлять собой химический агент, такой как белок, метаболит, регулятор роста, гербицид или фенольное соединение, или физиологический стресс, производимый непосредственно теплом, холодом, солью или токсичными элементами или опосредованно через действие патогена или вызывающего заболевание агента, такого как вирус. Растительная клетка, содержащая индуцируемую регуляторную область, может подвергаться воздействию индуктора посредством внешнего применения индуктора к клетке или растению, например, путем распыления, полива, нагревания или подобными способами. Индуцируемые регуляторные элементы могут происходить из либо растительных или нерастительных генов (например, публикация Gatz, С. and Lenk, LR.P., 1998, Trends Plant Sci. 3, 352-358; которая включена посредством ссылки). Примеры потенциальных индуцируемых промоторов включают, но не ограничиваются ими, промотор, индуцируемый тетрациклином (публикация Gatz, С., 1997, Ann. Rev. Plant Physiol. Plant Mol. Biol. 48,89-108; которая включена посредством ссылки), промотор, индуцируемый стероидами (публикация Aoyama. Т. and Chua, N.H., 1997, Plant 1. 2, 397-404; которая включена посредством ссылки), и промотор, индуцируемый этанолом (Salter, M.G., et al., 1998, Plant Journal 16, 127-132; Caddick, M.X., et al., 1998, Nature Biotech. 16, 177-180, которые включены посредством ссылки), цитокинин-индуцируемые гены IB6 и CKI 1 (публикации Brandstatter, I. and Kieber, 1.1., 1998, Plant Cell 10, 1009-1019; Kakimoto, T., 1996, Science 274, 982-985; которые включены посредством ссылки), и ауксин-индуцируемый элемент, DR5 (публикация Ulmasov, Т., et al., 1997, Plant Cell 9, 1963-1971; которая включена посредством ссылки).
[0098] Конститутивная регуляторная область направляет экспрессию гена в различных частях растения непрерывно в процессе развития растения. Примеры известных конститутивных регуляторных элементов включают в себя промоторы, связанные с транскриптом CaMV 35S (Odell et al., 1985, Nature, 313: 810-812), генами актина 1 (Zhang et al., 1991, Plant Cell, 3: 1155-1165), актина 2 (An et al., 1996, Plant J., 10: 107-121) или tms 2 (патент США 5,428,147, который включен в данный документ посредством ссылки) и триозофосфатизомеразы 1 (Xu et al., 1994, Plant Physiol. 106: 459-467) риса, геном убикитина 1 кукурузы (Cornejo et al., 1993, Plant Mol. Biol. 29: 637-646), генами убиквитина 1 и 6 Arabidopsis (Holtorf et al., 1995, Plant Mol. Biol. 29: 637-646), а также геном фактора инициации трансляции 4А табака (Mandel et al., 1995, Plant Mol. Biol. 29: 995-1004).
[0099] Понятие "конститутивный", используемое в данном документе, не обязательно означает, что ген под контролем конститутивной регуляторной области экспрессируется на одном и том же уровне во всех типах клеток, но что данный ген экспрессируется в клетках различного типа, при том что степень его экспресии может варьировать. Конститутивные регуляторные элементы могут быть соединены с другими последовательностями для дополнительного повышения уровня транскрипции и/или трансляции нуклеотидной последовательности, с которой они функционально связаны. Например, система CPMV-HT получена из нетранслируемых областей вируса мозаики коровьего гороха (Cowpea mosaic virus (CPMV)) и демонстрирует повышенную трансляцию связанной кодирующей последовательности. Понятие "нативный" означает, что последовательность нуклеиновой кислоты или аминокислотная последовательность встречается в природе или представляет собой "дикий тип". Понятие "функционально связанный" означает, что определенные последовательности, например, регуляторный элемент и кодирующая область, представляющие интерес, взаимодействуют непосредственно или опосредованно, чтобы осуществлять предполагаемую функцию, такую как опосредование или модуляция экспрессии гена. Взаимодействие функционально связанных последовательностей может, например, быть опосредовано белками, которые взаимодействуют с функционально связанными последовательностями.
[00100] Химерный белок или полипептид могут экспрессироваться в системе экспрессии, содержащей систему экспрессии, базирующуюся на вирусной ДНК или РНК, например, но не ограничиваясь этим, кассету экспрессии на основе комовируса (comovirus) и амплификационный элемент на основе геминивируса (geminivirus).
[00101] Система экспрессии, как описано в данном документе, может содержать кассету экспрессии на основе состоящего из двух частей вируса или вируса с разделенным на две части геномом. Например, состоящие из двух частей вирусы могут относиться к семейству Comoviridae. Роды семейства Comoviridae включают в себя Comovirus, Nepovirus, Fabavirus, Cheravirus и Sadwavirus. Вирусы рода Comovirus включают в себя вирус мозаики коровьего гороха (Cowpea mosaic virus (CPMV)), вирус мозаики коровьего гороха (Cowpea severe mosaic virus (CPSMV)), вирус мозаики тыквы (Squash mosaic virus (SqMV)), вирус пятнистости красного клевера (Red clover mottle virus (RCMV)), вирус пятнистости бобового стручка (Bean pod mottle virus (BPMV)), вирус кольцевой пятнистости репы (Turnip ringspot virus (TuRSV)), истинный вирус мозаики бобов (Broad bean true mosaic virus (BBtMV)), вирус пятен бобов (Broad bean stain virus (BBSV)), вирус мозаики редьки (Radish mosaic virus (RaMV)). Примеры последовательностей PHK-2 (RNA-2) комовирусов, содержащие энхансерные элементы, которые могут быть применимы для различных объектов настоящего изобретения, включают, но не ограничиваются ими: CPMV RNA-2 (идентификационный номер в базе данных Genbank NC_003550), RCMV RNA-2 (идентификационный номер в базе данных Genbank NC_003738), BPMV RNA-2 (идентификационный номер в базе данных Genbank NC_003495), CPSMV RNA-2 (идентификационный номер в базе данных Genbank NC_003544), SqMV RNA-2 (идентификационный номер в базе данных Genbank NC_003800), TuRSV RNA-2 (идентификационный номер в базе данных Genbank NC_013219.1). BBtMV RNA-2 (идентификационный номер в базе данных Genbank GU810904), BBSV RNA-2 (идентификационный номер в базе данных Genbank FJ028650), RaMV (идентификационный номер в базе данных Genbank NC_003800).
[00102] Сегменты разделенного на две части комовирусного РНК-генома называют РНК-1 и РНК-2. РНК-1 кодирует белки, вовлеченные в репликацию, в то время как РНК-2 кодирует белки, необходимые для переноса из клетки в клетку, и два капсидных белка. Может быть использована кассета на основе любого подходящего комовируса, включая CPMV, CPSMV, SqMV, RCMV или BPMV, например, кассеты экспрессии могут быть основаны на CPMV.
[00103] "Кассета экспрессии" относится к нуклеотидной последовательности, содержащей представляющую интерес нуклеиновую кислоту, находящуюся под контролем соответствующего промотора и функционально (или оперативно) связанную с ним, или другие регуляторные элементы для транскрипции представляющей интерес нуклеиновой кислоты в организме клетки-хозяина.
[00104] Системы экспрессии могут также содержать амплификационные элементы из геминивируса, например, амплификационный элемент из вируса желтой карликовости бобов (bean yellow dwarf virus (BeYDV)). BeYDV относится к роду Mastreviruses, адаптированному к двудольным растениям. Вирусная частица BeYDV имеет геном из одноцепочечной кольцевой ДНК, и может реплицировать очень большое число копий по механизму катящегося кольца. Векторные системы, содержащие ДНК-репликон, полученный из BeYDV, были использованы для быстрой продукции белков с высоким выходом в растениях.
[00105] Для целей настоящего изобретения выражение "амплификационные элементы" обозначает сегмент нуклеиновой кислоты, содержащей, по меньшей мере, один участок из одной или более протяженных межгенных областей (long intergenic region (LIR)) из генома геминивируса. Для целей настоящего изобретения понятие "протяженная межгенная область" относится к области протяженной межгенной области, которая содержит сайт связывания rep, способный опосредовать вырезание и репликацию с участием Rep-белка геминивируса. В некоторых объектах настоящего изобретения сегмент нуклеиновой кислоты, содержащий одну или более LIR, может дополнительно содержать короткую межгенную область (short intergenic region (SIR)) из генома геминивируса. Для целей настоящего изобретения понятие "короткая межгенная область" относится к комплементарной цепи (короткая IR (SIR) из Mastreviruses). Любой подходящий амплификационный элемент, полученный из геминивируса, может быть использован в данном описании. См., например, WO 2000/20557; WO 2010/025285; Zhang X. et al. (2005, Biotechnology and Bioengineering, Vol. 93, 271-279), Huang Z. et al. (2009, Biotechnology and Bioengineering, Vol. 103, 706-714), Huang Z. et al. (2009, Biotechnology and Bioengineering, Vol. 106, 9-17), которые включены в данный документ посредством ссылки).
[00106] Химерный белок или химерный полипептид могут быть получены как транскрипт из химерной нуклеотидной последовательности, химерный белок или химерный полипептид, может расщепляться после синтеза и, в случае необходимости, взаимодействовать с образованием мультимерного белка. Таким образом, химерный белок или химерный полипептид также включает в себя белок или полипептид, содержащий субъединицы, которые связываются между собой посредством дисульфидных мостиков (т.е. мультимерный белок). Например, химерный полипептид, содержащий аминокислотные последовательности из двух или более чем двух источников, может быть процессирован в субъединицы, и субъединицы могут быть связаны дисульфидными мостиками с целью получения химерного белка или химерного полипептида.
[00107] Химерный вирусный белок в соответствии с различными вариантами осуществления настоящего изобретения содержит трансмембранный домен и цитоплазматический хвост (ТМ/СТ) НА вируса гриппа. ТМ/СТ может представлять собой нативный ТМ/СТ НА из любого типа, подтипа вируса гриппа, включая, например, типы или подтипы В, H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15 и Н16. Не ограничивающие примеры типов или подтипов HI, Н3, Н5 или В включают в себя подтип A/NewCaledonia/20/99 (H1N1), подтип H1 A/California/04/09 (H1N1), подтип A/Indonesia/5/05 (H5N1), A/Brisbane/59/2007, B/Florida/4/2006 и Н3 A/Brisbane/10/2007 (см., например международные заявки WO 2009/009876, WO 2009/076778, WO 2010/003225, WO 2010/003235, которые включены в настоящее описание посредством ссылки). Дополнительно, ТМ/СТ может представлять собой любой из тех ТМ/СТ НА, в котором были удалены 1, 2, 3, 4 или 5 аминокислот или к которому была добавлена любая спейсерная или линкерная последовательность, состоящая из 1, 2, 3, 4 или 5 аминокислот.
[00108] Предпочтительно, ТМ/СТ происходит из Н5 или Н3, например, но не ограничиваясь ими, подтипа A/Indonesia/5/05 (H5N1; "H5/Indo"; идентификационный номер ABW06108.1 в базе данных Genbank), Н5 A/Vietnam/1194/2004 (A-Vietnam; идентификационный номер ACR48874.1 в базе данных Genbank), Н5 A/Anhui/1/2005 (A-Anhui; идентификационный номер ABD28180.1 в базе данных Genbank), Н3 A/Brisbane/10/2007 ("Н3/Bri"; идентификационный номер ACI26318.1 в базе данных Genbank), Н3 A/Wisconsin/67/2005 (A-WCN; идентификационный номер ABO37599.1 в базе данных Genbank). ТМ/СТ границ нескольких последовательностей Н3 и Н5 описаны в заявке WO 2010/148511 (которая включена в данный документ посредством ссылки). Не ограничивающие примеры аминокислотных последовательностей для ТМ/СТ включают в себя SEQ ID NO: 41 и SEQ ID NO: 42 и любую нуклеотидную последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 41 или SEQ ID NO: 42.
[00109] Варьирование аминокислот в гемагглютинине вирусов гриппа допускается. Такое варьирование обеспечивает появление новых, постоянно идентифицируемых штаммов. Инфекционность новых штаммов может варьировать. Однако способность к образованию тримеров гемагглютинина, которые впоследствии образуют VLP, сохраняется. Настоящее изобретение, таким образом, относится к химерному вирусному белку, содержащему аминокислотную последовательность гемагглютинина, или к нуклеиновой кислоте, кодирующей химерный вирусный белок, содержащий аминокислотную последовательность гемагглютинина, которая образует вирусоподобные частицы в растении, и включает в себя известные последовательности и последовательности вариантов НА, которые могут образовываться.
[00110] Понятие "вирус-подобная частица" (VLP) или "вирусоподобные частицы" или "VLP" относится к самособирающимся структурам, которые содержат структурные белки, такие как химерный вирусный белок. VLP и химерные VLP являются, как правило, морфологически и антигенно сходными с вирионами, производимыми в процессе инфекции, но не несут генетическую информацию, необходимую для репликации и, следовательно, не являются инфекционными. VLP и химерные VLP могут быть получены в подходящих клетках-хозяевах, включая растительные клетки-хозяева. После извлечения из клетки-хозяина и после выделения и дополнительной очистки в подходящих условиях VLP и химерные VLP может быть очищены в виде интактных структур.
[00111] Химерные VLP по настоящему изобретению могут быть получены в клетке-хозяине, которая характеризуется отсутствием способности сиалировать белки, например, в растительной клетке, клетке насекомых, грибов и других организмов, включая губку, Coelenterata, annelida, arth или opoda, моллюски, nemathelminthea, trochelmintes, plathelminthes, chaetognatha, tentaculate, хламидии, спирохеты, грамположительные бактерии, сине-зеленые водоросли, архебактерии, или тому подобное. См., например, публикации Gupta et al., 1999. Nucleic Acids Research 27:370-372; Toukach et al., 2007. Nucleic Acids Research 35:D280-D286; Nakahara et al., 2008. Nucleic Acids Research 36:D368-D371.
[00112] Данное изобретение относится также к химерным VLP, липидная оболочка которых образуется из плазматической мембраны клетки, в которой экспрессируются химерные VLP. Например, если химерный вирус экспрессируется в системе на основе клеток растений, готовые химерные VLP могут получить липидную оболочку из плазматической мембраны растительной клетки.
[00113] Как правило, понятие "липид" означает жирорастворимую (липофильную), встречающуюся в природе молекулу. Химерная VLP, полученная в растении согласно некоторым объектам настоящего изобретения, может находиться в комплексе с липидами растительного происхождения. Липиды растительного происхождения могут представлять собой двойной липидный слой и могут дополнительно содержать оболочку, окружающую VLP. Липиды растительного происхождения могут образовывать оболочку, окружающую VLP. Липиды растительного происхождения могут содержать липидные компоненты плазматической мембраны растения, в котором продуцируется VLP, включая фосфолипиды, три-, ди- и моноглицериды, а также жирорастворимый стерол или метаболиты, содержащие стеролы. Примеры включают в себя фосфатидилхолин (PC), фосфатидилэтаноламин (РЕ), фосфатидилинозитол, фосфатидилсерин, гликосфинголипиды, фитостеролы или их комбинацию. Липид растительного происхождения может альтернативно называться "растительным липидом". Примеры фитостеролов включают в себя кампестерол, стигмастерол, эргостерол, брассикастерол, дельта-7-стигмастерол, дельта-7-авенастерол, дауностерол, ситостерол, 24-метилхолестерол, холестерол или бета-ситостерол - см., например, публикацию Mongrand et al., 2004. Специалисту в данной области очевидно, что липидный состав плазматической мембраны клетки может изменяться в зависимости от среды или условий роста клетки или организма или вида, из которого получают данную клетку. Как правило, бета-ситостерол является наиболее распространенным фитостеролом.
[00114] Клеточные мембраны обычно содержат двойные слои (бислои) липидов, а также белки с различными функциями. Определенные липиды могут локально скапливаться в липидном бислое, образуя так называемые "липидные рафты". Такие микродомены (липидные рафты) могут быть обогащены сфинголипидами и стеролами. Без желания быть связанным теорией, липидные рафты могут играть значительную роль в эндо- и экзоцитозе, входе или выходе вирусов или других инфекционных агентов, передаче межклеточного сигнала, взаимодействии с другими структурными компонентами клетки или организма, такими как внутриклеточный и внеклеточный матриксы.
[00115] VLP, производимая в растении, может индуцировать химерные белки, содержащие специфические для растений N-гликаны. Таким образом, настоящее изобретение также относится к VLP, содержащей химерные вирусные белки, имеющие специфические для растений N-гликаны.
[00116] Дополнительно, известна модификация N-гликана в растениях (см., например, патент США 60/944,344, который включен в данный документ посредством ссылки), и могут быть получены химерные вирусные белки, содержащие модифицированные N-гликаны. Могут быть получены химерные вирусные белки, содержащие модифицированный паттерн гликозилирования, например, с восстановленными фукозилированными, ксилозилированными или как фукозилированными, так и ксилозилированными N-гликанами, или могут быть получены химерные вирусные белки с модифицированным паттерном гликозилирования, где белок не подвергался фукозилированию, ксилозилированию, или как фукозилированию, так и ксилозилированию, и содержит увеличенное количество галактозных остатков. Дополнительно, модуляция постгрансляционных модификаций, например, добавление концевой галактозы, может привести к снижению уровня фукозилирования и ксилозилирования экспрессированных химерных вирусных белков по сравнению с растением дикого типа, экспрессирующим химерные вирусные белки.
[00117] В качестве примера, который не следует рассматривать как ограничивающий, синтез химерных вирусных белков, имеющих модифицированный паттерн гликозилирования, может быть достигнут совместной экспрессией химерного вирусного белка и нуклеотидной последовательности, кодирующей бета-1.4-галактозилтрансферазу (GalT), например, но не ограничиваясь ими, GalT млекопитающих или GalT человека, однако, может быть также использована GalT из других источников. Каталитический домен GalT также может быть слит с CTS-доменом (т.е. цитоплазматический "хвост" (cytoplasmic tail), трансмембранный домен (cytoplasmic tail), стволовой участок (stem region) N-ацетилглюкозаминил-трансферазы (GNT1) для получения гибридного фермента GNT1-GalT, и гибридный фермент может быть совместно экспрессирован с химерным вирусным белком. Химерный вирусный белок также может быть совместно экспрессирован с нуклеотидной последовательностью, кодирующей N-ацетилглюкозаминил-трансферазу III (GnT-III), например, но не ограничиваясь ими, GnT-III млекопитающих или GnT-III человека, также может быть использована GnT-III из других источников. Дополнительно, также может быть использован гибридный фермент GNT1-GnT-III, содержащий CTS из GNT1, слитый с GnT-III.
[00118] Таким образом, настоящее изобретение также относится к VLP, содержащим химерный вирусный белок, имеющий модифицированные N-гликаны.
[00119] Без желания быть связанным теорией, наличие растительных N-гликанов на поверхности химерного вирусного белка может стимулировать иммунный ответ, способствуя связыванию химерного вирусного белка антигенпрезентирующими клетками. Стимуляция иммунного ответа с использованием растительного N-гликана была предложена Saint-Jore-Dupas et al. (2007). Дополнительно, конформации VLP может быть предпочтительной для презентации антигена и повышать адъювантный эффект VLP при образовании комплекса с липидным слоем растительного происхождения.
[00120] Структура и размер VLP могут быть оценены, например, анализом на гемагглютинацию, электронной микроскопией или эксклюзионной хроматографией.
[00121] Для эксклюзионной хроматографии суммарная фракция растворимых белков может быть экстрагирована из растительной ткани гомогенизацией (Polytron) образца замороженного измельченного растительного материала в экстракционном буфере, с удалением нерастворимого материала центрифугированием. Может также быть полезным осаждение ледяным ацетоном или полиэтиленгликолем (PEG). Определяют количество растворимого белка и экстракт пропускают через колонку с Sephacryl™, например колонку с Sephacryl™ S500. В качестве калибровочного стандарта может быть использован декстран синий 2000. После хроматографии фракции могут быть дополнительно проанализированы иммуноблоттингом для определения белкового комплемента во фракции.
[00122] Выделенная фракция может представлять собой, например, надосадочную жидкость (если проводилось центрифугировние, седиментирование или преципитация) или фильтрат (если проводилась фильтрация) и быть обогащенной белками или белками суперструктур, таких как, например, розетко-подобные структуры или высокоупорядоченные частицы с более высокой молекулярной массой, такие как VLP. Выделенную фракцию можно дополнительно подвергнуть изолированию, очистке, концентрированию (или комбинации этих методов) для получения белков или белков суперструктур, путем, например, дополнительных стадий центрифугирования, стадий преципитации, хроматографических стадий (например, эксклюзионная, ионообменная, аффинная хроматография), тангенциальной проточной фильтрации или их комбинации. Наличие очищенных белов или белков суперструктур, может быть подтверждено, например, нативным электрофорезом или электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ), Вестерн-анализом с использованием соответствующего антитела обнаружения, капиллярного электрофореза, электронной микроскопии или любым другим способом, очевидным специалисту в данной области.
[00123] Профили элюции могут изменяться в зависимости от использованных условий элюирования. На фигурах 7, 8O и 11В приведен пример профиля элюции анализа методом эксклюзионной хроматографии растительного экстракта, содержащего химерные VLP. В данном случае VLP, содержащие химерный вирусный тримерный поверхностный белок HIV, химерный вирусный тримерный поверхностный G-белок вируса бешенства и химерный вирусный тримерный поверхностный белок VZV, элюируют в свободном объеме колонки, розетки и высокомолекулярные структуры элюируют во фракциях около от 13 до 14, и более низкомолекулярные химерные вирусные тримерные поверхностные белки (или их растворимую форму) элюируют во фракциях от около 15 до около 17.
[00124] VLP могут быть очищены или экстрагированы с использованием любого подходящего способа, например, химической или биохимической экстракцией. VLP относительно чувствительны к высушиванию, теплу, pH, сурфактантам и детергентам. Поэтому может оказаться полезным использовать способы, которые обеспечивают максимальные выходы, минимальное загрязнение фракции VLP клеточными белками, сохраняют целостность белков или VLP и, при необходимости, связанной липидной оболочки или мембраны, а также способы разрушения клеточных стенок с целью высвобождения белков или VLP. Например, для получения VLP, как описано в данном документе, могут быть использованы способы, которыми получают протопласты и/или сферопласты (см., например, международную заявку WO 2011/035422, которая включена в настоящее описание посредством ссылки). Сведение к минимуму или устранение применения детергента или сурфактантов, таких, например, как SDS или Triton Х-100, может оказаться полезным для улучшения выхода экстракции VLP. Структура и размер VLP могут быть оценены, например, электронной микроскопией или эксклюзионной хроматографией, как упоминалось выше.
[00125] Одна или более чем одна или более химерных генетических конструкций по настоящему изобретению могут быть экспрессированы в любом подходящем хозяине-растении, которое трансформируется нуклеотидной последовательностью или конструкциями или векторами по настоящему изобретению. Примеры подходящих хозяев включают в себя, но не ограничиваются ими, сельскохозяйственные культуры, включая люцерну, рапс, Brassica spp., кукурузу, Nicotiana spp., люцерну, картофель, женьшень, горох, овес, рис, соевые бобы, пшеницу, ячмень, подсолнечник, хлопчатник и тому подобное.
[00126] Одна или более химерных генетических конструкций по настоящему изобретению могут дополнительно содержать нетранслируемую 3ʹ-область. Нетранслируемая 3ʹ-область относится к тому участку гена, содержащему сегмент ДНК, который содержит сигнал полиаденилирования и любые другие регуляторные сигналы, способные осуществлять процессинг мРНК или экспрессию генов. Сигнал полиаденилирования обычно характеризуется добавлением треков полиадениловой кислоты к 3ʹ-концу предшественника мРНК. Сигналы полиаденилирования обычно распознаются по наличию гомологии с канонической формой 5ʹААТААА-3ʹ, хотя вариации не являются редкостью. Не ограничивающие примеры подходящих 3ʹ-областей представляют собой 3ʹ-транскрибируемые нетранслируемые области, содержащие сигнал полиаденилирования генов Ti-плазмид (tumor inducing - индуцирующих опухоль) Agrobacterium, таких как ген нопалинсинтазы (NOS), генов растений, таких как гены запасных белков сои, ген малой субъединицы рибулозо-1, 5-бисфосфаткарбоксилазы (ssRUBISCO, патент США 4,962,028; который включен в данный документ посредством ссылки), промотор, используемый в регулировании экспрессии гена пластоцианина, описанный в патенте США 7,125,978 (который включен в данный документ посредством ссылки).
[00127] Одна или более химерных генетических конструкций по настоящему изобретению также могут включать в себя дополнительные энхансеры, являющиеся либо энхансерами трансляции либо энхансерами транскрипции, которые могут потребоваться. Энхансеры могут быть расположены в положении 5ʹ- или 3ʹ- по отношению к транскрибируемой последовательности. Энхансерные области хорошо известны специалистам в данной области и могут включать в себя ATG-инициирующий кодон, примыкающие последовательности или тому подобное. Инициирующий кодон, если он присутствует, может находиться в одной фазе с рамкой считывания ("в рамке") кодирующей последовательности для обеспечения правильной трансляции транскрибированной последовательности.
[00128] Конструкции по настоящему изобретению могут быть введены в клетки растений, используя Ti-плазмиды, Ri-плазмиды, векторы вирусов растений, прямую трансформацию ДНК, микроинъекцию, электропорацию и т.д. Для обзора таких способов см., например, публикации Weissbach and Weissbach, Methods for Plant Molecular Biology, Academy Press, New York VIII, pp. 421-463 (1988); Geierson and Corey, Plant Molecular Biology, 2d Ed. (1988); и Miki and Iyer, Fundamentals of Gene Transfer in Plants. In Plant Metabolism, 2d Ed. DT. Dennis, DH Turpin, DD Lefebrve, DB Layzell (eds), Addison Wesly, Langmans Ltd. London, pp. 561-579 (1997). Другие способы включают в себя непосредственное поглощение ДНК, применение липосом, электропорацию, например, с использованием протопластов, микроинъекцию, баллистическую трансфекцию или тонкие волокна карбида кремния (whiskers), а также вакуумную инфильтрацию. См., например, публикации Bilang, et al. (Gene 100: 247-250 (1991), Scheid et al. (Mol. Gen. Genet. 228: 104-112, 1991), Guerche et al. (Plant Science 52: 111-116, 1987), Neuhause et al. (Theor. Appl Genet. 75: 30-36, 1987), Klein et al., Nature 327: 70-73 (1987); Howell et al. (Science 208: 1265, 1980), Horsch et al. (Science 227: 1229-1231, 1985), DeBlock et al., Plant Physiology 91: 694-701, 1989), Methods for Plant Molecular Biology (Weissbach and Weissbach, eds., Academic Press Inc., 1988), Methods in Plant Molecular Biology (Schuler and Zielinski, eds., Academic Press Inc., 1989), Liu and Lomonossoff (J Virol Meth, 105: 343-348, 2002), патенты США 4,945,050; 5,036,006 и 5,100,792, заявки на патент США 08/438666, поданная 10 мая 1995 года и 07/951,715, поданная 25 сентября 1992 (все из которых включены в настоящее описание посредством ссылки).
[00129] Как описано ниже, способы транзиентной экспрессии могут быть использованы для экспрессии конструкций по настоящему изобретению (см. публикацию Liu and Lomonossoff, 2002, Journal of Virological Methods, 105:343-348; которая включена в данный документ посредством ссылки). Альтернативно, может быть использован основанный на применении вакуума способ транзиентной экспрессии, как описано в публикации Kapila et al., 1997, которая включена в настоящее описание посредством ссылки. Данные способы могут включать в себя, например, но не ограничиваясь ими, способ Agro-инокуляции или Agro-инфильтрации, инфильтрации с помощью шприца, однако, другие транзиентные способы могут также использоваться, как указано выше. В случае применения Agro-инокуляции, Agro-инфильтрации или инфильтрации с помощью шприца смесь Agrobacteria, содержащая требуемую нуклеиновую кислоту, поступает в межклеточные пространства ткани, например листьев, наземную часть растения (включая стебель, листья и цветок), другую часть растения (стебель, корень, цветок) или в целое растение. После пересечения эпидермиса Agrobacteria инфицируют клетки и переносят в них копии t-ДНК. Происходит эписомальная транскрипция t-ДНК и трансляция мРНК, что приводит к продукции интересующего белка в инфицированных клетках, однако, прохождение t-ДНК внутрь ядра является транзиентным.
[00130] Чтобы помочь в идентификации трансформированных растительных клеток, можно дополнительно манипулировать конструкциями по настоящему изобретению, чтобы включить в них растительные селектируемые маркеры. Применимые селектируемые маркеры включают в себя ферменты, которые обеспечивают устойчивость к химическим агентам, таким как антибиотик, например, гентамицин, гигромицин, канамицин, или гербицидам, таким как фосфинотрицин, глифосат, хлоросульфурон и тому подобное. Аналогично, могут быть использованы ферменты, обеспечивающие продукцию соединения, идентифицируемого по изменению цвета, такого как GUS (бета-глюкуронидаза) или по люминесценции, такого как люцифераза или GFP.
[00131] Также рассматриваются как часть данного изобретения трансгенные растения, растительные клетки или семена, содержащие химерную генетическую конструкцию по настоящему изобретению. Способы регенерации целых растений из растительных клеток также известны в данной области. Обычно трансформированные растительные клетки культивируют в подходящей среде, которая может содержать селектирующие агенты, такие как антибиотики, при этом селектируемые маркеры используются для облегчения идентификации трансформированных растительных клеток. После образования каллуса можно стимулировать образование побегов, используя соответствующие растительные гормоны в соответствии с известными способами и перенося побеги в среду укоренения для регенерации растений. Растения могут быть использованы для получения воспроизводящихся поколений, либо из семян или с использованием способов вегетативного размножения. Трансгенные растения могут быть также получены без использования тканевых культур
[00132] Настоящее изобретение включает в себя нуклеотидные последовательности:
Таблица 1. Список идентификационных номеров последовательностей.

[00133] Настоящее изобретение дополнительно будет проиллюстрировано следующими примерами.
Примеры
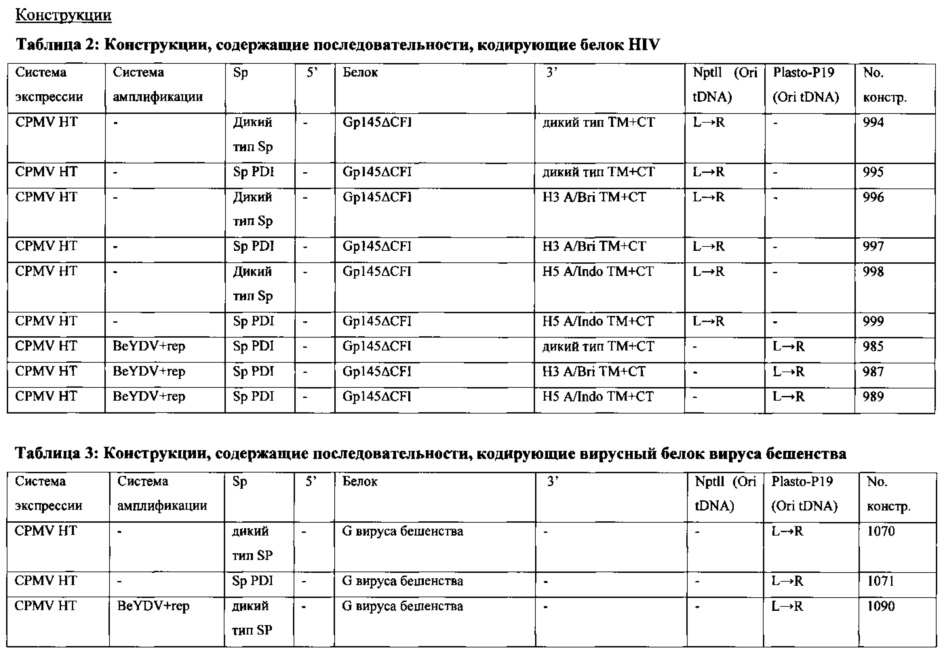

[00134] Пример 1: Сборка экспрессионных кассет с белком HIV
2X35S-CPMV HT-PDISP HIV-ConS ΔCFI-NOS (конструкция номер 995)
[00135] Последовательность, кодирующая сигнальный пептид PDI люцерны, слитый с ΔCFI ConS из HIV с нативными трансмембранным доменом и цитоплазматическим "хвостом", была клонирована в экспрессионной системе 2X35S-CPMV-HT следующим образом. Во-первых, последовательность нуклеиновой кислоты гена ConS ΔCFI из HIV, содержащая нативные сигнальный пептид и трансмембранный и цитоплазматический домены, была синтезирована фирмой GeneArt AG (Regensburg, Germany) в соответствии с последовательностями, раскрытыми в публикации Liao et al., (2006, Virology 353: 268 -282). Последовательность нуклеиновой кислоты ConS ΔCFI из HIV представлена на фигуре 1А (SEQ ID NO: 1). Сигнальный пептид протеин-дисульфид-изомеразы люцерны (PDISP) (нуклеотиды 32-103; идентификационный номер Z11499) соединяли с ConS ΔCFI из HIV основанным на ПЦР способом лигирования, представленным Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий PDISP, амплифицировали с использованием праймеров IF-ApaI-SpPDI.c (фигура 1B, SEQ ID NO: 2) и SpPDI-HIV gp145.r (фигура 1С, SEQ ID NO: 3) с конструкцией номер 540 (см. фигура 52, SEQ ID NO: 61 из международной заявки WO 2010/003225, которая включена в данный документ посредством ссылки, для последовательности конструкции номер 540) в качестве матрицы. Второй фрагмент, содержащий ConS ΔCFI без нативного сигнального пептида, амплифицировали с использованием праймеров IF-SpPDI-gp145.c (фигура 1D, SEQ ID NO: 4) и WtdTm-gp145.r (фигура 1E, SEQ ID NO: 5), используя синтезированный сегмент ConS ΔCFI (фигура. 1A, SEQ ID NO: 1) в качестве матрицы. Во втором раунде ПЦР праймеры IF-ApaI-SpPDI.c (фигура 1B, SEQ ID NO: 2) и WtdTm-gp145.r (фигура 1E, SEQ ID NO: 5) использовали вместе с обоими продуктами ПЦР из первого раунда ПЦР в качестве матрицы. Полученный продукт ПЦР переваривали с помощью рестрикционного фермента ApaI и клонировали в модифицированную конструкцию 972, переваренную рестрикционными ферментами ApaI-StuI. Модифицированную акцепторную плазмиду 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для исходной последовательности конструкции номер 972) обрабатывали, чтобы удалить сайт рестрикции SbfI выше (по ходу транскрипции) промотора 2X35S. Сайт SbfI удаляли перевариванием плазмиды 972 посредством SbfI, обрабатывая полученную плазмиду ДНК-полимеразой Т4, чтобы удалить 3ʹ-выступ и повторно лигируя обработанную плазмиду, получая модифицированную плазмиду 972 без сайта SbfI. Полученной конструкции был присвоен номер 995 (фигура 1F, SEQ ID NO: 6). Аминокислотная последовательность PDISP-HIV ConS ΔCFI представлена на фигуре 1G (SEQ ID NO: 7). Схематическое изображение плазмиды 995 представлено на фигуре 1Н. Данная конструкция не кодирует белок M1.
2X35S-CPMV HT-PDISP HIV-ConS ΔCFI+H3 A/Brisbane/10/2007 (TmD+Cvto хвост)-NOS (конструкция номер 997)
[00136] Последовательность, кодирующую сигнальный пептид PDI люцерны, слитый с ΔCFI ConS из HIV и с трансмембранным и цитоплазматическим доменами из Н3 A/Brisbane/10/2007, клонировали в экспрессионной системе 2X35S-CPMV-HT с помощью способа основанного на ПЦР лигирования, представленного Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий PDISP-HIV ConS ΔCFI без нативных трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров IF-ApaI-SpPDI.c (фигура 1B, SEQ ID NO: 2) и IF-H3dTm+gp145.r (фигура 2А, SEQ ID NO: 8), используя конструкцию номер 995 (фигура 1F, SEQ ID NO: 6) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н3 из A/Brisbane/10/2007, амплифицировали с использованием праймеров Gp145+H3dTm.c (фигура 2В, SEQ ID NO: 9) и H3dTm.r (фигура 2С, SEQ ID NO: 10), используя конструкцию номер 776 (см. фигуру 60, SEQ ID NO: 69 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 776) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-ApaI-SpPDI.c (фигура 1B, SEQ ID NO: 2) и H3dTm.r (фигура 2С, SEQ ID NO: 10) в качестве праймеров. Продукт второй ПЦР затем переваривали с ApaI и клонировали в конструкцию номер 995 (фигура 1F, SEQ ID NO: 6), переваренную рестрикционными ферментами ApaI и StuI. Полученной конструкции был присвоен номер 997 (фигура 2D, SEQ ID NO: 11). Аминокислотная последовательность PDISP-HIV ConS ΔCFI-A/Brisbane/10/2007 Н3 ТМ+СТ представлена на фигуре 2Е (SEQ ID NO: 12). Схематическое изображение плазмиды 997 представлено на фигуре 2F. Данная конструкция не кодирует белок M1.
2X35S-CPMV HT-PDISP-HIV ConS ΔCFI-H5 A/Indonesia/5/2005 (TmD+Cvto хвост)-NOS (конструкция номер 999)
[00137] Последовательность, кодирующую сигнальный пептид PDI люцерны, слитый с ΔCFI ConS из HIV и с трансмембранным и цитоплазматическим доменами из Н5 A/Indonesia/5/2005, клонировали в экспрессионной системе 2X35S-CPMV-HT с помощью способа основанного на ПЦР лигирования, представленного Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий PDISP-HIV ConS ΔCFI без нативных трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров IF-ApaI-SpPDI.c (фигура. 1B, SEQ ID NO: 2), и IF-H5dTm+gp145.r (фигура 3А, SEQ ID NO: 13), используя конструкцию номер 995 (фигура 1F, SEQ ID NO: 6) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 из A/Indonesia/5/2005, амплифицировали с использованием праймеров Gp145+H5dTm.c (фигура 3В, SEQ ID NO: 15) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-ApaI-SpPDI.c (фигура 1B, SEQ ID NO: 2) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Продукт второй ПЦР затем переваривали с ApaI и клонировали в конструкцию номер 995 (фигура 1F, SEQ ID NO: 6), переваренную рестрикционными ферментами ApaI и StuI. Полученной конструкции был присвоен номер 999 (фигура 3D, SEQ ID NO: 16). Аминокислотная последовательность PDISP-HIV ConS ΔCFI-A/Indonesia/5/2005 Н5 ТМ+СТ представлена на фигура 3Е (SEQ ID NO: 17). Схематическое изображение плазмиды 999 представлено на фигуре 3F. Данная конструкция не кодирует белок M1.
Пластоцианин-Р19-пластоцианин (конструкция номер 172)
[00138] Последовательность, кодирующую супрессор сайленсинга Р19 из Tomato Bushy Stunt Virus (TBSV), клонировали между промотором гена пластоцианина люцерны и 3ʹUTR и терминатором следующим образом. Конструкцию номер R472 (см. международную заявку WO 2010/003225 A1, которая включена в настоящее описание посредством ссылки, для сборки, и фигуру 86 из международной заявки WO 2010/003225 A1 для схемы плазмиды R472) переваривали рестрикционными ферментами DraIII (84 пары оснований выше (по ходу транскрипции) начального триплета ATG) и SacI (9 пар оснований ниже (по ходу транскрипции) стоп-кодона) для удаления содержащего 84 пары оснований фрагмента из промотора гена пластоцианина люцерны и последовательности, кодирующей супрессор сайленсинга Р19 TBSV. Полученный фрагмент клонировали в конструкцию 540 (см. международную заявку WO 2010/003225, которая включена в настоящее описание посредством ссылки, для сборки, и фигуру 6 из того же патента для схемы плазмиды 540), предварительно переваренную рестрикционными ферментами DraIII и SacI. Полученной конструкции был присвоен номер 172 (SEQ ID NO: 4А, фигура 18). Аминокислотная последовательность белка Р19 TBSV представлена на фигуре 4В (SEQ ID NO: 19). Схематическое изображение плазмиды 172 представлено на фигуре 4С.
Подготовка растительной биомассы, инокуляция и агроинфильтрация
[00139] Понятия "биомасса" и "растительный материал" для целей настоящего изобретения предназначены для обозначения любого материала, полученного из растения. Биомасса или растительный материал может содержать целое растение, ткани, клетки или любую их фракцию. Дополнительно, биомасса или растительный материал может содержать внутриклеточные растительные компоненты, внеклеточные растительные компоненты, жидкие или твердые экстракты растений или их комбинацию. Дополнительно, биомасса или растительный материал может содержать растения, растительные клетки, ткани, жидкий экстракт или их комбинацию из листьев, стеблей, плодов, корней растений или их комбинации. Часть растения может содержать растительный материал или биомассу.
[00140] Растения Nicotiana benthamiana выращивали из семян в поддонах, заполненных купленным торфяным субстратом. Растениям давали расти в теплице при фотопериоде (день/ночь) 16/8 ч и температурном режиме 25°С днем/20°С ночью. Через три недели после посева отдельные ростки были отделены, пересажены в горшки и оставлены расти в теплице в течение трех дополнительных недель в тех же условиях окружающей среды.
[00141] Agrobacteria, трансфицированные каждой из конструкций, выращивали в среде YEB с добавлением 10 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина при рН 5,6 до достижения ими значения измеренной при 600 нм (OD600) оптической плотности от 0,6 до 1,6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES рН 5,6) и хранили в течение ночи при 4°С. В день инфильтрации партии культуры разводили в 2,5 объемах культуры и давали согреться перед применением. Целые растения N. benthamiana помещали в перевернутом состоянии в бактериальную суспензию в герметичном резервуаре из нержавеющей стали под вакуумом (20-40 торр) в течение 2-х мин. Растения возвращали в теплицу для от 2 от 6 дней инкубационного периода до сбора урожая. Если не указано иное, все инфильтрации проводили как совместную инфильтрацию со штаммом AGL1/172 в соотношении 1:1.
[00142] Штаммы A. tumefaciens, содержащие различные конструкции, как описано в данном документе, называют, используя префикс "AGL1". Например, A. tumefaciens, содержащая конструкцию номер 995 (см. фигуру 1Н), называется "AGL1/995".
Сбор листьев и экстракция суммарного белка
[00143] После инкубации надземную часть растений собирали, замораживали при -80°С и измельчали на куски. Суммарную фракцию растворимых белков экстрагировали гомогенизацией (Polytron) каждого образца замороженного и измельченного растительного материала в 3-х объемах холодного 50 мМ Трис, рН 8,0, 0,15 M NaCl, 0,1% Тритон Х-100 и 1 мМ фенилметансульфонилфторида. После гомогенизации суспензии центрифугировали при 10,000 g в течение 10 мин при 4°С и данные осветленные неочищенные экстракты (супернатант) сохраняли для анализов.
Белковый анализ и иммуноблоттинг
[00144] Общее содержание белка осветленных неочищенных экстрактов определяли по методу Бредфорда (Bradford) (Bio-Rad, Hercules, СА) с использованием бычьего сывороточного альбумина в качестве эталонного стандарта. Белки разделяли посредством SDS-PAGE и переносили электроблоттингом на поливинилендифторидные (ПВДФ, polyvinylene difluoride (PVDF)) мембраны (Roche Diagnostics Corporation, Indianapolis, IN) для иммунодетекции. До иммуноблоттинга мембраны блокировали 5% обезжиренным молоком и 0,1% Твин-20 в Трис-солевом буфере (TBS-T) в течение от 16 до 18 ч при 4°С.
[00145] Иммуноблоттинг проводили инкубацией с козьим поликлональным анти-gp120 первичным антителом (Abcam, ab21179), разведенным в соотношении 1:2500 в концентрации 2 мкг/мл в 2% обезжиренного молока в TBS-Tween 20 0,1%. Детекцию хемилюминесценцией проводили после инкубации с вторичными ослиными антителами против иммуноглобулинов козы, конъюгированными с пероксидазой хрена (JIR 705-035-147), разбавленными в соотношении 1:10000 в 2% обезжиренного молока в TBS-Tbhh-20 0,1%. Иммунореактивные комплексы детектировали хемилюминесценцией с использованием люминола в качестве субстрата (Roche Diagnostics Corporation).
Пример 2: Экспрессия нативных и химерных белков оболочки HIV в растениях
[00146] ConS ΔCFI HIV представляет собой относящийся к М-группе HIV-белок оболочки с консенсусной последовательностью, укороченными вариабельными петлями, делецией сайта расщепления, домена слияния и иммунодоминантной области в gp41. Было показано, что у морских свинок он вызывает образование кросс-нейтрализующих антител сходного или большего диапазона действия и титра, чем оболочечные белки дикого типа (Liao et al., Virology (2006) 353: 268-282).
[00147] На фигуре 5 представлены конструкции, используемые в данном исследовании. В конструкции номер 995 кодирующую область зрелого белка ConS ΔCFI HIV (позже называемого Env), содержащую нативный ТМ/СТ, поместили под контроль экспрессионной системы CPMV-HT. В конструкциях номер 997 и 999 ТМ/СТ-домены Env HIV были заменены таковыми гемагглютинина (НА) вируса гриппа из A/Brisbane/10/2007 (H3N2) и A/Indonesia/05/2005 (H5N1), соответственно. Во всех случаях сигнальный пептид растительного происхождения - из белка протеин-дисульфид-изомеразы люцерны (PDI) - заменил нативный сигнальный пептид белка Env HIV.
[00148] Продукцию HIV-белка Env конструкциями 995, 997 и 999 сравнивали в агроинфильтрированных растениях Nicotiana benthamiana. Белковые экстракты из растений, инфильтрированных AGL1/995, AGL1/997 и AGL1/999, анализировали вестерн-блотом, и полученный результат представлен на фигуре 6, где дорожки 1-4 являются положительными контролями, содержащими различное количество рекомбинантного HIV-1 gp160 (ab68171); дорожка 5, отрицательный контроль; дорожки 6-8, белки, экстрагированные из AGL1/995-инфильтрированных листьев; дорожки 9 и 10, белки, экстрагированные из AGL1/997-инфильтрированных листьев; дорожки 11 и 12, белки, экстрагированные из AGL1/999-инфильтрированных листьев.
[00149] Как представлено на фигуре 6, экспрессия нативного HIV-белка Env не могла быть детектирована в условиях, использованных для обнаружения, подтверждая очень низкий уровень аккумуляции, наблюдавшийся ранее в отношении HIV-белка Env в растениях (Rybicki et al., 2010, Plant Biotechnology Journal 8: 620-637). Химерные формы Env, в которых ТМ/СТ-домены были заменены таковыми белка Н3 вируса гриппа (конструкция номер 997) или Н5 (конструкция номер 999), накапливаются в гораздо больших количествах, чем нативная форма. Как отмечалось выше, конструкции номер 997 и номер 999 не кодируют белок M1.
Пример 3 Сборка химерных Env HIV в вирусоподобные частицы
[00150] Также была исследована способность химерных Env HIV собираться в VLP в растении в отсутствие сердцевинного или матриксного белка. Белковые экстракты из AGL1/997 (Env/Н3) и AGL1/999 (Εnv/Η5) подвергали гельфилырационной хроматографии с последующим анализом элюированных фракций на содержание Env с помощью анти-gp120 антител козы. Из результатов анализа Вестерн-блота, представленного на фигуре 7А, очевидно, что для экстрактов из AGL1/999-инфильтрированных растений содержание химерного Env/H5 в элюированных фракциях достигает максимума во фракциях от 7-й до 10-й, что указывает на его сборку в очень высокомолекулярные структуры с молекулярной массой, составляющей более 2 млн дальтон. Исследование относительного содержания белка во фракциях от 7-й до 18-й ясно показывает, что подавляющее большинство белков хозяина элюировалось во фракциях от 11-й до 18-й (фигура. 7В). Данные результаты показывают, что Εnv/Η5 собирается в высокомолекулярные структуры, масса которых превышает ожидаемую молекулярную массу гомотримера. Аналогичные результаты были получены для Env/Н3 в AGL1/997-инфильтрированных растениях. Вместе взятые, данные результаты демонстрируют, что химерный Env/H5 HIV накапливается в большом количестве в агроинфильтрированных растениях и собирается в вирусоподобные частицы в отсутствие сердцевинного или матриксного белка. Данные результаты также показывают, что слияние ТМ/СТ-доменов НА вируса гриппа с антигенами не из вируса гриппа достаточно для сборки и высвобождения VLP, презентирующих антиген не из вируса гриппа.
[00151] Пример 4: Сборка кассет экспрессии с белком вируса бешенства
C-2X35S-CPMV HT-PDISP-гликопротеин G (RabG) вируса бешенства + трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS (Конструкция номер 1074; фигура 8А, 8Н).
[00152] Последовательность, кодирующую эктодомен гликопротеина G вируса бешенства (RabG), слитый с трансмембранным и цитоплазматическим доменами Н5 A/Indonesia/5/2005, клонировали в экспрессионную систему 2X35S-CPMV-HT-PDISP-NOS в плазмиде, содержащей экспрессионную кассету пластоцианин-Р19-пластоцианин следующим образом, используя базирующийся на ПЦР способ лигирования, представленный Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий эктодомен RabG без нативных сигнального пептида, трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров IF-RabG-S2+4.c (фигура 8В, SEQ ID NO: 32) и RabG+H5dTm.r (фигура 8C, SEQ ID NO: 33), используя синтезированный ген Rab G (соответствующий нуклеотидам от 3317 до 4891 из последовательности с идентификационным номером EF 206707 в базе данных Genbank) (фигура 8D, SEQ ID NO: 34) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 A/Indonesia/5/2005, амплифицировали с использованием праймеров IF-H5dTm.c (фигура 8Е, SEQ ID NO: 35) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-RabG-S2+4.c (фигура 8В, SEQ ID NO: 32) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Полученный фрагмент клонировали в рамке с сигнальным пептидом PDI люцерны в экспрессионной системе 2X35S-CPMV HT-NOS с помощью системы клонирования In-Fusion фирмы Clontech (Mountain View, СА). Конструкцию 141 (фигура 8F, 8G) переваривали рестрикционными ферментами SbfI and StuI и использовали для реакции сборки In-Fusion. Конструкция номер 141 представляет собой акцепторную плазмиду, предназначенную для клонирования "In-Fusion" представляющих интерес генов в экспрессионной кассете на основе HT CPMV. Она также включает в себя генетическую конструкцию для совместной экспрессии белка Р19 TBSV (супрессора сайленсинга) под промотором и терминатором гена пластоцианина люцерны. Вектор представляет собой плазмиду на основе pCAMBIA, и последовательность от левой до правой границ t-ДНК представлена на фигуре 8F (SEQ ID NO: 36). Схематическое изображение вектора 141 приведено на фигуре 8G. Полученной конструкции был присвоен номер 1074 (фигура 8Н, SEQ ID NO: 37). Аминокислотная последовательность PDISP - Rab G - A/Indonesia/5/2005 Н5 ТМ+СТ представлена на фигуре 8I (SEQ ID NO: 38). Схематическое изображение плазмиды 1074 представлено на фигуре 8А. Данная конструкция не кодирует белок M1.
D-2X35S-PDISP-гликопротеин G (RabG) вируса бешенства + трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS в системе амплификации BeYDV+репликаза (Конструкция номер 1094, фигура 8L, 8М)
[00153] Последовательность, кодирующую эктодомен гликопротеина G вируса бешенства (Rab G), слитый с трансмембранным и цитоплазматическим доменами Н5 A/Indonesia/5/2005, клонировали в 2X35S-CPMV-HT-PDISP-NOS в систему экспрессии BeYDV+репликаза в плазмиде, содержащей экспрессионную кассету пластоцианин-Р19-пластоцианин следующим образом, используя базирующийся на ПЦР способ лигирования, представленный Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий эктодомен RabG без нативных сигнального пептида, трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров IF-RabG-S2+4.c (фигура 8В, SEQ ID NO: 32) и RabG+H5dTm.r (фигура 8С, SEQ ID NO: 33), используя синтезированный ген Rab G (соответствующий нуклеотидам от 3317 до 4891 из последовательности с идентификационным номером EF 206707 в базе данных Genbank) (фигура 8D, SEQ ID NO: 34) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 A/Indonesia/5/2005, амплифицировали с использованием праймеров IF-H5dTm.c (фигура 8Е, SEQ ID NO: 35) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-RabG-S2+4.c (фигура 8В, SEQ ID NO: 32) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Полученный фрагмент клонировали в рамке с сигнальным пептидом PDI люцерны в экспрессионной системе 2X35S-CPMV HT-NOS в амплификационную систему BeYDV+репликаза с помощью системы клонирования In-Fusion фирмы Clontech (Mountain View, СА). Конструкцию 144 переваривали рестрикционными ферментами SbfI and StuI и использовали для реакции сборки In-Fusion. Конструкция номер 144 представляет собой акцепторную плазмиду, предназначенную для клонирования "In-Fusion" интересующих генов в базирующейся на HT CPMV кассете экспрессии в амплификационную систему BeYDV+репликаза. Она также включает в себя генетическую конструкцию для совместной экспрессии белка Р19 TBSV (супрессора сайленсинга) под промотором и терминатором гена пластоцианина люцерны. Вектор представляет собой плазмиду на основе pCAMBIA, и последовательность от левой до правой границ t-ДНК представлена на фигуре 8J (SEQ ID NO: 39). Схематическое изображение вектора 144 приведено на фигуре 8K. Полученной конструкции был присвоен номер 1094 (фигура 8L, SEQ ID NO: 40). Аминокислотная последовательность PDISP - Rab G - A/Indonesia/5/2005 H5 TM+CT представлена на фигуре 81 (SEQ ID NO: 38). Схематическое изображение плазмиды 1094 представлено на фигуре 8М. Данная конструкция не кодирует белок M1.
[00154] Пример 5: Экспрессия химерных белков вируса бешенства в растениях
[00155] G-белок экспрессировали слитым с Sp PDI (конструкция 1071). Конструкция 1074 представляет собой результат слияния белка G вируса бешенства с Sp PDI и ТМ+СТ-доменом H5A/Indo. Конструкция 1094 представляет собой результат слияния белка G вируса бешенства с конструкцией BeYDV+репликаза (rep), Sp PDI и ТМ+СТ-доменом H5A/Indo. Конструкция 1091 представляет собой результат слияния белка G вируса бешенства с Sp PDI и конструкцией BeYDV+репликаза (rep).
[00156] Растения Nicotiana benthamiana выращивали из семян в поддонах, заполненных купленным торфяным субстратом. Растениям давали расти в теплице при фотопериоде (день/ночь) 16/8 ч и температурном режиме 25°С днем/20°С ночью. Через три недели после посева отдельные ростки были отделены, пересажены в горшки и оставлены расти в теплице в течение трех дополнительных недель в тех же условиях окружающей среды.
[00157] Agrobacteria, трансфицированные каждой из конструкций (конструкции 1071, 1071, 1074, 1091 и 1094), выращивали в среде YEB с добавлением 10 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина при рН 5,6 до достижения ими значения оптической плотности, измеренной при 600 нм (OD600), от 0,6 до 1,6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES рН 5,6) и хранили в течение ночи при 4°С. В день инфильтрации партии культуры разводили в 2,5 объемах культуры и давали согреться перед применением. Целые растения N. benthamiana помещали в перевернутом состоянии в бактериальную суспензию в герметичном резервуаре из нержавеющей стали под вакуумом (20-40 торр) в течение 2-х мин. Растения возвращали в теплицу для от 2 от 6 дней инкубационного периода до сбора урожая. Если не указано иное, все инфильтрации проводили как совместную инфильтрацию со штаммом AGL1/172 в соотношении 1:1.
[00158] После инкубации надземную часть растений собирали, замораживали при -80°С и измельчали на куски. Суммарную фракцию растворимых белков экстрагировали гомогенизацией (Polytron) каждого образца замороженного и измельченного растительного материала в 3-х объемах холодного 50 мМ Трис, рН 8,0, 0,15 М NaCl, 0,1% Тритон Х-100 и 1 мМ фенилметансульфонилфторида. После гомогенизации
суспензии центрифугировали при 10,000 g в течение 10 мин при 4°С и данные осветленные неочищенные экстракты (супернатант) сохраняли для анализов.
[00159] Общее содержание белка осветленных неочищенных экстрактов определяли по методу Бредфорда (Bradford) (Bio-Rad, Hercules, СА) с использованием бычьего сывороточного альбумина в качестве эталонного стандарта. Белки разделяли посредством SDS-PAGE и переносили электроблоттингом на поливинилендифторидные (ПВДФ, polyvinylene difluoride (PVDF)) мембраны (Roche Diagnostics Corporation, Indianapolis, IN) для иммунодетекции. До иммуноблоттинга мембраны блокировали 5% обезжиренным молоком и 0,1% Твин-20 в Трис-солевом буфере (TBS-T) в течение от 16 до 18 ч при 4°С. [00160] Иммуноблоттинг проводили инкубацией с первичным антителом Santa Cruz SE-57995 в концентрации 0,5 мкг/мл в 2% обезжиренного молока в TBS-Tween 20 0,1%. Детекцию хемилюминесценцией проводили после инкубации с козьим вторичным антимышиным антителом, конъюгированным с пероксидазой хрена (JIR 705-035-147), разбавленным в соотношении 1:10000 в 2% обезжиренного молока в TBS-Твин-20 0,1%. Иммунореактивные комплексы детектировали хемилюминесценцией с использованием люминола в качестве субстрата (Roche Diagnostics Corporation).
[00161] Как показано на фигуре 8N, белок G вируса бешенства экспрессировали слитым с Sp PDI (конструкция 1071), BeYDV + репл. (конструкции 1091 или 1094), ТМ+СТ-доменом H5A/Indo (конструкция 1074) или их комбинацией.
[00162] Пример 6: Сборка химерного белка G вируса бешенства в вирусоподобные частицы
[00163] Также была исследована способность химерного белка G вируса бешенства собираться в VLP в растении в отсутствие сердцевинного или матриксного белка. Белковые экстракты из растений, трансформированных с использованием конструкции 1074 или конструкции 1094, осветляли и подвергали гельфильтрационной хроматографии с последующим анализом элюированных фракций на содержание белка G вируса бешенства с использованием первичных антител Santa Cruz SE-57995. На фигуре 8O показаны результаты анализа методом Вестерн-блот, где дорожки соответствуют экстрактам из инфильтрованных растений, причем содержание химерного белка G вируса бешенства в элюированных фракциях достигает максимума во фракциях от 8 до 14 для белка, получаемого с использованием конструкции 1074, и большая часть белка элюируется во фракциях от 8 до 12 для белковых экстрактов, полученных с использованием конструкции 1094, что указывает на их сборку в высокомолекулярные структуры с очень большой молекулярной массой, составляющей более 2 млн дальтон. Данные результаты показывают, что белок G вируса бешенства собирается в высокомолекулярные структуры, масса которых превышает ожидаемую молекулярную массу гомотримера.
[00164] На фигуре 9А представлены результаты иммуноблот-анализа очищенного белка G вируса бешенства, экспрессированного из конструкции 1074. На фигуре 9В представлено изображение просвечивающей электронной микроскопии VLP очищенного белка G вируса бешенства, полученного из экспрессии конструкции 1074, показывающее морфологию VLP.
[00165]. Таким образом, белок G вируса бешенства накапливался с высоким содержанием в агроинфильтрированных растениях и собирался в вирусоподобные частицы в отсутствие сердцевинного или матриксного белка. Данные результаты также показывают, что слияние ТМ/СТ-доменов вируса гриппа НА с антигеном не из вируса гриппа, таким как белок С вируса бешенства, является достаточным для сборки и высвобождения VLP, презентирующих антиген не из вируса гриппа.
[00166] Пример 7: Сборка кассет экспрессии с SARS
B-2X35S-CPMV НТ-гликопротеин S вируса тяжелого острого респираторного синдрома (SARS gS) + трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS (Конструкция номер 916; фигуры 12А, 12F)
[00167] Последовательность, кодирующую эктодомен гликопротеина S SARS (gS SARS), слитый с трансмембранным и цитоплазматическим доменами Н5 A/Indonesia/5/2005, клонировали в экспрессионную систему 2X35S-CPMV-HT следующим образом, используя базирующийся на ПЦР способ лигирования, представленный Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий эктодомен gS SARS без нативных сигнального пептида, трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров I IF-wtSp-SARSgS.c и IF-H5dTm+SARSgS.r (фигура 12С, SEQ ID NO: 27), используя синтезированный ген gS SARS (соответствующий нуклеотидам от 21492 до 25259 из последовательности с идентификационным номером AY278741.1 в базе данных Genbank; фигура 12D, SEQ ID NO: 28) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 A/Indonesia/5/2005, амплифицировали с использованием праймеров SARSgS+H5dTm.c (фигура 12Е, SEQ ID NO: 29) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-wtSp-SARSgS.c (фигура 12В, SEQ ID NO: 26) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Продукт второй ПЦР затем переваривали ApaI и StuI и клонировали в конструкцию номер 995 (фигура 1F, SEQ ID NO: 6), переваренную рестрикционными ферментами ApaI и StuI. Полученной конструкции был присвоен номер 916 (фигура 12F, SEQ ID NO: 30). Аминокислотная последовательность SARS gS - A/Indonesia/5/2005 Н5 ТМ+СТ представлена на фигуре 12G (SEQ ID NO: 31). Схематическое изображение плазмиды 916 представлено на фигуре 12А. Данная конструкция не кодирует белок M1.
[00168] Пример 8: Эксперименты по экспрессии с химерным SARS в растениях с увеличивающими продукцию факторами и без них
[00169] Белки SARS экспрессировали с помощью конструкции 916, содержащей ген gS SARS с сигнальным пептидом дикого типа и трансмембранным и цитоплазматическим хвостовым доменом из H5A/Indo.
[00170] Растения Nicotiana benthamiana выращивали из семян в поддонах, заполненных купленным торфяным субстратом. Растениям давали расти в теплице при фотопериоде (день/ночь) 16/8 ч и температурном режиме 25°С днем/20°С ночью. Через три недели после посева отдельные ростки были отделены, пересажены в горшки и оставлены расти в теплице в течение трех дополнительных недель в тех же условиях окружающей среды.
[00171] Agrobacteria, трансфицированные каждой из конструкций (конструкция 916), выращивали в среде YEB с добавлением 10 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина при pH 5,6 до достижения ими значения оптической плотности, измеренной при 600 нм (OD600), от 0,6 до 1,6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES pH 5,6) и хранили в течение ночи при 4°С. В день инфильтрации партии культуры разводили в 2,5 объемах культуры и давали согреться перед применением. Целые растения N. benthamiana помещали в перевернутом состоянии в бактериальную суспензию в герметичном резервуаре из нержавеющей стали под вакуумом (20-40 торр) в течение 2-х мин. Растения возвращали в теплицу для от 2 от 6 дней инкубационного периода до сбора урожая. Если не указано иное, все инфильтрации проводили как совместную инфильтрацию со штаммом AGL1/172 в соотношении 1:1.
[00172] После инкубации надземную часть растений собирали, замораживали при -80°С и измельчали на куски. Суммарную фракцию растворимых белков экстрагировали гомогенизацией (Polytron) каждого образца замороженного и измельченного растительного материала в 3-х объемах холодного 50 мМ Трис, pH 8,0, 0,15 M NaCl, 0,1% Тритон Х-100 и 1 мМ фенилметансульфонилфторида. После гомогенизации суспензии центрифугировали при 10,000 g в течение 10 мин при 4°С и данные осветленные неочищенные экстракты (супернатант) сохраняли для анализов.
[00173] Общее содержание белка осветленных неочищенных экстрактов определяли по методу Бредфорда (Bradford) (Bio-Rad, Hercules, СА) с использованием бычьего сывороточного альбумина в качестве эталонного стандарта. Белки разделяли посредством SDS-PAGE и переносили электроблоттингом на поливинилендифторидные (ПВДФ, polyvinylene difluoride (PVDF)) мембраны (Roche Diagnostics Corporation, Indianapolis, IN) для иммунодетекции. До иммуноблоттинга мембраны блокировали 5% обезжиренным молоком и 0,1% Твин-20 в Трис-солевом буфере (TBS-T) в течение от 16 до 18 ч при 4°С. [00174] Иммуноблоттинг проводили инкубацией с первичным антителом Imgenex. IMG-690 в концентрации 2 мкг/мл в 2% обезжиренного молока в TBS-Tween 20 0,1%. Детекцию хемилюминесценцией проводили после инкубации с вторичным мышиным антителом против иммуноглобулина (IgG) кролика, конъюгированным с пероксидазой хрена (JIR, 115-035-144), разбавленными в соотношении 1:10000 в 2% обезжиренного молока в TBS-Твин-20 0,1%. Иммунореактивные комплексы детектировали хемилюминесценцией с использованием люминола в качестве субстрата (Roche Diagnostics Corporation).
[00175] На фигуре 12Н представлены результаты иммуноблот-анализа экспрессии белка S вируса тяжелого острого респираторного синдрома (severe acute respiratory syndrome (SARS)) в табаке. Наблюдается экспрессия конструкции 916 (ген gS SARS с сигнальным пептидом дикого типа и трансмембранным и цитоплазматическим хвостовым доменом из H5A/Indo).
[00176] Пример 9: Сборка кассет экспрессии с белком VZV
[00177] A-2X35S-CPMV НТ-гликопротеин Ε вируса ветряной оспы (VZVgE) + трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS (Конструкция номер 946)
[00178] Последовательность, кодирующую эктодомен гликопротеина Е VZV (gE VZV), слитый с трансмембранным и цитоплазматическим доменами Н5 A/Indonesia/5/2005, клонировали в экспрессионную систему 2X35S-CPMV-HT следующим образом, используя базирующийся на ПЦР способ лигирования, представленный Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). В первом раунде ПЦР фрагмент, содержащий эктодомен gE VZV без нативных сигнального пептида, трансмембранного и цитоплазматического доменов, амплифицировали с использованием праймеров IF-wtSp-VZVgE.c (фигура 10А, SEQ ID NO: 20) и IF-H5dTm+VZVgE.r (фигура 10В, SEQ ID NO: 21), используя синтезированный ген gE VZV (соответствующий нуклеотидам от 3477 до 5348 из последовательности с идентификационным номером AY013752.1 в базе данных Genbank; фигура 10С, SEQ ID NO: 22) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 A/Indonesia/5/2005, амплифицировали с использованием праймеров VZVgE+H5dTm.c (фигура 10D, SEQ ID NO: 23) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-wtSp-VZVgE.c (фигура 10А, SEQ ID NO: 20) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Продукт второй ПЦР затем переваривали ApaI и StuI и клонировали в конструкцию номер 995 (фигура IF, SEQ ID NO: 6), переваренную рестрикционными ферментами ApaI и StuI. Полученной конструкции был присвоен номер 946 (фигура А5, SEQ ID NO: А5). Аминокислотная последовательность VZV gE-A/Indonesia/5/2005 Н5 ТМ+СТ представлена на фигуре 10F (SEQ ID NO: 25). Схематическое изображение плазмиды 946 представлено на фигуре 10G. Данная конструкция не кодирует белок M1.
[00179] Пример 10: Экспрессия химерных белков VZV в растениях
[00180] Экспрессия белка Е вируса ветряной оспы (Varicella Zoster Virus (VZV)) была продемонстрирована с использованием конструкции 946, содержащей ген gE VZV с сигнальным пептидом дикого типа и трансмембранным и цитоплазматическим хвостовым доменом из H5A/Indo.
[00181] Растения Nicotiana benthamiana выращивали из семян в поддонах, заполненных купленным торфяным субстратом. Растениям давали расти в теплице при фотопериоде (день/ночь) 16/8 ч и температурном режиме 25°С днем/20°С ночью. Через три недели
после посева отдельные ростки были отделены, пересажены в горшки и оставлены расти в теплице в течение трех дополнительных недель в тех же условиях окружающей среды.
[00182] Agrobacteria, трансфицированные каждой из конструкций (конструкция 946), выращивали в среде YEB с добавлением 10 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина при pH 5,6 до достижения ими значения оптической плотности, измеренной при 600 нм (OD600), от 0,6 до 1,6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES pH 5,6) и хранили в течение ночи при 4°С. В день инфильтрации партии культуры разводили в 2,5 объемах культуры и давали согреться перед применением. Целые растения N. benthamiana помещали в перевернутом состоянии в бактериальную суспензию в герметичном резервуаре из нержавеющей стали под вакуумом (20-40 торр) в течение 2-х мин. Растения возвращали в теплицу для от 2 от 6 дней инкубационного периода до сбора урожая. Если не указано иное, все инфильтрации проводили как совместную инфильтрацию со штаммом AGL1/172 в соотношении 1:1.
[00183] После инкубации надземную часть растений собирали, замораживали при -80°С и измельчали на куски. Суммарную фракцию растворимых белков экстрагировали гомогенизацией (Polytron) каждого образца замороженного и измельченного растительного материала в 3-х объемах холодного 50 мМ Трис, pH 8,0, 0,15 M NaCl, 0,1% Тритон Х-100 и 1 мМ фенилметансульфонилфторида. После гомогенизации суспензии центрифугировали при 10,000 g в течение 10 мин при 4°С и данные осветленные неочищенные экстракты (супернатант) сохраняли для анализов.
[00184] Общее содержание белка осветленных неочищенных экстрактов определяли по методу Бредфорда (Bradford) (Bio-Rad, Hercules, СА) с использованием бычьего сывороточного альбумина в качестве эталонного стандарта. Белки разделяли посредством SDS-PAGE и переносили электроблоттингом на поливинилендифторидные (ПВДФ, polyvinylene difluoride (PVDF)) мембраны (Roche Diagnostics Corporation, Indianapolis, IN) для иммунодетекции. До иммуноблоттинга мембраны блокировали 5% обезжиренным молоком и 0,1% Твин-20 в Трис-солевом буфере (TBS-T) в течение от 16 до 18 ч при 4°С. [00185] Иммуноблоттинг проводили инкубацией с мышиным моноклональным антителом против белка Ε (продукта гена gE VZV) в концентрации 1 мкг/мл в качестве первичного антитела в 2% обезжиренного молока в TBS-Tween 20 0,1%. Детекцию хемилюминесценцией проводили после инкубации с козьим антимышиным антителом, конъюгированным с пероксидазой хрена (JIR, 115-035-146), в качестве вторичного антитела, разбавленным в соотношении 1:10000 в 2% обезжиренного молока в TBS-Tbhh-20 0,1%. Иммунореактивные комплексы детектировали хемилюминесценцией с использованием люминола в качестве субстрата (Roche Diagnostics Corporation).
[00186] На фигуре 11А представлены результаты иммуноблот-анализа экспрессии белка Ε вируса ветряной оспы (Varicella Zoster Virus (VZV)) в дорожках от 7 до 9 из конструкции 946 (20, 10 и 2 мкг экстракта соответственно). Дорожки 1-5, положительные контроли - рекомбинантный белок gE VZV, в количестве 500, 100, 50, 10 и 5 нг, соответственно; дорожка 6 - отрицательный контроль.
[00187] Также была исследована способность химерного белка E VZV собираться в VLP в растении в отсутствие сердцевинного или матриксного белка. Белковые экстракты из растений, трансформированных с использованием конструкции 946, осветляли и подвергали гельфильтрационной хроматографии с последующим анализом элюированных фракций на содержание белка E VZV с использованием мышиного моноклонального первичного антитела против белка Ε VZV (abcam, ab52549). Из результатов анализа методом вестерн-блот, представленных на фигуре 11В, видно, что в экстрактах из инфильтрованных растений содержание химерного белка E VZV в элюированных фракциях достигает максимума во фракциях от 10 до 13, что указывает на сборку белка E VZV в высокомолекулярные структуры с очень большой молекулярной массой, составляющей более 2 млн дальтон. Данные результаты показывают, что белок E VZV собирается в высокомолекулярные структуры, масса которых превышает ожидаемую молекулярную массу гомотримера.
[00188] Таким образом, белок E VZV накапливался с высоким содержанием в агроинфильтрированных растениях и собирался в вирусоподобные частицы в отсутствие сердцевинного или матриксного белка. Данные результаты также показывают, что слияние ТМ/СТ-доменов НА вируса гриппа с антигеном не из вируса гриппа, таким как белок E VZV, является достаточным для сборки и высвобождения VLP, презентирующих антиген не из вируса гриппа.
[00189] Пример 11. Сборка кассет экспрессии с химерным гликопротеином (GP) вируса Эбола
[00190] A-2X35S-CPMV HT-PDISP-Zaire Ebolavirus GP (EboGP) + трансмембранный домен и цитоплазматический "хвост" (ТМ+СТ) Н5 A/Indonesia/5/2005-NOS (Конструкция номер 1366)
[00191] Последовательность, кодирующую эктодомен гликопротеина (GP) вируса Эбола из штамма Zaire 1995, слитый с трансмембранным и цитоплазматическим доменами Н5 A/Indonesia/5/2005, клонировали в экспрессионную систему 2X35S-CPMV-HT-PDISP-NOS в плазмиде, содержащей экспрессионную кассету пластоцианин-Р19-пластоцианин следующим образом, используя базирующийся на ПЦР способ лигирования, представленный Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). Ген GP вируса Эбола был оптимизирован в отношении использования кодонов и содержания GC из последовательности гена дикого типа (соответствующей нуклеотидам от 6039 до 8069 из последовательности с идентификационным номером AY 354458 в базе данных Genbank). Криптические сайты сплайсинга, последовательности Шайн-Дальгарно (Shine-Delgarno), РНК-дестабилизирующие последовательности и сайты вхождения в прокариотические рибосомы были затем удалены из оптимизированной последовательности, чтобы избежать нежелательных структуры или последовательности. В первом раунде ПЦР фрагмент оптимизированного гена GP, содержащий последовательность, кодирующую эктодомен (без сигнального пептида и трансмембранного и цитоплазматического доменов), амплифицировали с использованием праймеров IF-Opt_EboGP.s2 +4с (фигура 13А, SEQ ID NO: 43) и H5iTMCT+Opt_EboGP.r (фигура 13В, SEQ ID NO: 44) с синтезированным геном GP (фигура 13С, SEQ ID NO: 45) в качестве матрицы. Второй фрагмент, содержащий трансмембранный и цитоплазматический домены Н5 вируса гриппа A/Indonesia/5/2005, амплифицировали с использованием праймеров Opt_EboGP+H5iTMCT.c (фигура 13D, SEQ ID NO: 46) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15), используя конструкцию номер 972 (см. фигуру 94, SEQ ID NO: 134 из международной заявки WO 2010/003225, которая включена в настоящее описание посредством ссылки, для последовательности конструкции номер 972) в качестве матрицы. ПЦР-продукты обеих реакций амплификации затем смешивали и использовали в качестве матрицы для второго раунда амплификации с использованием IF-Opt_EboGP.s2 +4с (фигура 13А, SEQ ID NO: 43) и IF-H5dTm.r (фигура 3С, SEQ ID NO: 15) в качестве праймеров. Полученный продукт ПЦР клонировали в рамке с сигнальным пептидом PDI люцерны в экспрессионной системе 2X35S-CPMV HT-NOS с помощью системы клонирования In-Fusion фирмы Clontech (Mountain View, СА). Конструкцию 1192 (фигура 13Ε) переваривали рестрикционными ферментами SacII and StuI и использовали для реакции сборки In-Fusion. Конструкция номер 1192 представляет собой акцепторную плазмиду, предназначенную для клонирования "In-Fusion" представляющих интерес генов в экспрессионной кассете на основе CPMV HT. Она также включает в себя генетическую конструкцию для совместной экспрессии белка Р19 TBSV (супрессора сайленсинга) под промотором и терминатором гена пластоцианина люцерны. Вектор представляет собой плазмиду на основе pCAMBIA, и последовательность от левой до правой границ t-ДНК представлена на фигуре 13F (SEQ ID NO: 47). Полученной конструкции был присвоен номер 1366 (фигура 13G, SEQ ID NO: 48). Аминокислотная последовательность PDISP-GP из Zaire 95 Ebolavirus-Н5 ТМ+СТ из A/Indonesia/5/2005 представлена на фигуре 13Н (SEQ ID NO: 49). Схематическое изображение плазмиды 1366 представлено на фигуре 131.
[00192] Пример 12. Экспрессия химерного GP вируса Эбола в растениях
[00193] Экспрессия гликопротеина (GP) вируса Эбола (EV) была продемонстрирована с использованием конструкции 1366, содержащей ген GP EV с сигнальным пептидом дикого типа и ТМ+СТ-доменом из Н5 A/Indo.
[00194] Растения Nicotiana benthamiana выращивали из семян в поддонах, заполненных купленным торфяным субстратом. Растениям давали расти в теплице при фотопериоде (день/ночь) 16/8 ч и температурном режиме 25°С днем/20°С ночью. Через три недели после посева отдельные ростки были отделены, пересажены в горшки и оставлены расти в теплице в течение трех дополнительных недель в тех же условиях окружающей среды.
[00195] Agrobacteria, трансфицированные каждой из конструкций (конструкция 946), выращивали в среде YEB с добавлением 10 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина при pH 5,6 до достижения ими значения оптической плотности, измеренной при 600 нм (OD600) от 0,6 до 1,6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES pH 5,6) и хранили в течение ночи при 4°С. В день инфильтрации партии культуры разводили в 2,5 объемах культуры и давали согреться перед применением. Целые растения N. benthamiana помещали в перевернутом состоянии в бактериальную суспензию в герметичном резервуаре из нержавеющей стали под вакуумом (20-40 торр) в течение 2-х мин. Растения возвращали в теплицу для от 2 от 6 дней инкубационного периода до сбора урожая. Если не указано иное, все инфильтрации проводили как совместную инфильтрацию со штаммом AGL1/172 в соотношении 1:1.
[00196] После инкубации надземную часть растений собирали, замораживали при -80°С и измельчали на куски. Суммарную фракцию растворимых белков экстрагировали гомогенизацией (Polytron) каждого образца замороженного и измельченного растительного материала в 3-х объемах холодного 50 мМ Трис, pH 8,0, 0,15 M NaCl, 0,1% Тритон Х-100 и 1 мМ фенилметансульфонилфторида. После гомогенизации суспензии центрифугировали при 10,000 g в течение 10 мин при 4°С и данные осветленные неочищенные экстракты (супернатант) сохраняли для анализов.
[00197] Общее содержание белка осветленных неочищенных экстрактов определяли по методу Бредфорда (Bradford) (Bio-Rad, Hercules, СА) с использованием бычьего сывороточного альбумина в качестве эталонного стандарта. Белки разделяли посредством SDS-PAGE и переносили электроблоттингом на поливинилендифторидные (ПВДФ, polyvinylene difluoride (PVDF)) мембраны (Roche Diagnostics Corporation, Indianapolis, IN) для иммунодетекции. До иммуноблоттинга мембраны блокировали 5% обезжиренным молоком и 0,1% Твин-20 в Трис-солевом буфере (TBS-T) в течение от 16 до 18 ч при 4°С. [00198] Иммуноблоттинг проводили инкубацией с аффинно очищенным кроличьим антителом против гликопротеина (GP) вируса Эбола Zaire (IBT Bioservices, 0301-012) в концентрации 150 нг/мл в качестве первичного антитела в 2% обезжиренного молока в TBS-Tween 20 0,1%. Детекцию хемилюминесценцией проводили после инкубации с козьими антикроличьими вторичными антителами, конъюгированными с пероксидазой хрена (JIR, 11-035-144), разбавленными в соотношении 1:10000 в 2% обезжиренного молока в TBS-Твин-20 0,1%. Иммунореактивные комплексы детектировали хемилюминесценцией с использованием люминола в качестве субстрата (Roche Diagnostics Corporation). Фигура 13J показывает иммуноблот-анализ экспрессии химерного GP вируса Эбола в белковых экстрактах из растений, трансформированных конструкцией номер 1366. Полученный результат показывает, что химерный GP вируса Эбола экспрессируется транзиентно.
[00199] Все цитаты включены в данный документ посредством ссылки.
[00200] Настоящее изобретение было описано в связи с одним или более вариантами осуществления. Тем не менее специалистам в данной области техники очевидно, что ряд вариаций и модификации может быть осуществлен без выхода за пределы объема изобретения, определеного в формуле изобретения.
Реферат
Изобретение относится к биотехнологии. Предложен способ получения вирусоподобных частиц (VLP) в растении, который включает введение нуклеиновой кислоты, содержащей регуляторную область, активную в растении, и функционально связанную с химерной нуклеотидной последовательностью, в растение или часть растения, последующую инкубацию растения или его части в условиях, обеспечивающих экспрессию нуклеиновой кислоты с получением VLP. Также предложены вирусоподобная частица (VLP), полученная указанным способом, композиция и клетка растения, ее содержащие. Химерная нуклеотидная последовательность кодирует последовательно эктодомен из вирусного тримерного поверхностного белка, полученного из вирусов семейства Retroviridae, Rhabdoviridae, Coronaviridae или Filoviridae, слитый с трансмембранным доменом и цитоплазматическим хвостовым доменом (ТМ/CT) гемагглютинина вируса гриппа. Предложенная VLP содержит химерные вирусные поверхностные белки и липиды, полученные из растения. Предложенный способ позволяет получать в растении вирусоподобные частицы, содержащие вирусные поверхностные белки, для применения полученных VLP в качестве вакцины. 8 н. и 10 з.п. ф-лы, 70 ил., 5 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Эффективные вирусоподобные частицы (vlps) гриппа

Комментарии