Слитые белки с fc-фрагментом иммуноглобулина для повышения иммуногенности белковых и пептидных антигенов - RU2248214C2
Код документа: RU2248214C2
Чертежи






























Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в целом к способам и составам для повышения иммуногенности предварительно выбранного белкового или пептидного антигена у млекопитающего. Конкретнее, настоящее изобретение относится к способам и составам, включающим нуклеиновые кислоты, кодирующие аминокислотные последовательности, определяющие слитые белки, содержащие константную область тяжелой цепи иммуноглобулина и предварительно выбранный антиген, причем предварительно выбранный антиген в слитом белке способен вызвать у млекопитающего более сильную иммунную реакцию по сравнению с одним предварительно выбранным антигеном.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Разработка вакцин традиционно была ориентирована на выработку защитных антител, способных нейтрализовать инфекционные агенты. К настоящему времени агенты, используемые в качестве вакцин, обычно включают инактивированные или аттенуированные (ослабленные) микроорганизмы (например, бактерии или вирусы), их продукты (например, токсины) или очищенные антигены. С развитием методологии современной молекулярной биологии и клонирования генов стало возможным получать более чистые и, по-видимому, более специфичные вакцины. Кроме того, знание иммунной системы на молекулярном уровне позволило выделить и исследовать иммунные реакции, стимулированные инфекционными агентами. Два компонента иммунной системы, которые, как считается, являются главными для успешной выработки иммунных реакций, включают: центральную роль регуляторных и цитотоксических Т-клеток и способ, которым антиген предъявляется этим клеткам антиген-предъявляющей клеткой (АПК). Для примера см. Fundamentals of Immunology. Под ред. W.E.Paul. Raven Press, Ltd. New York, 1993.
Обычно белковый или пептидный антиген, полученный АПК извне (экзогенный антиген) расщепляется внутри эндоцитной везикулы, или эндосомы АПК, после чего полученный пептидный фрагмент образует комплекс с белками главного класса II тканевой совместимости (major histocompatibility (MHC) class II). Полученный комплекс перемещается к клеточной поверхности, где он передаутся иммунной клетке, соседствующей с АПК. Пептидный фрагмент попадает в полость, определяемую молекулой MHC, и комплекс может распознаваться Т-клеткой, экспрессирующей Т-клеточный рецептор, способный специфически связываться с комплексом. Взаимодействие между нагруженной пептидом молекулой II класса MHC и хелперной Т-клеткой, которую называют CD4 Т-клеткой, стабилизируется далее взаимодействием между самой молекулой II класса MHC и рецептором CD4+ на поверхности Т-клетки. Таким образом, экзогенный антиген, который преобразован внутри клеток АПК, помещен теперь на поверхность клетки через посредство молекулы II класса MHC. Если комплекс MHC II класса предъявлен CD4+ Т-клеткам, это приводит к появлению секретированных CD4+ хелперной клеткой цитокинов, которые стимулируют В-клетки к продуцированию антител к пептиду (см. выше Paul W.E., ред.).
Вакцинация экзогенным антигеном обычно имеет результатом Т-клеточную реакцию при посредстве CD4 клеток, что, как правило, приводит к продуцированию антител. Цитотоксичные Т-лимфоциты (ЦТЛ) обычно не стимулируются по такому пути. По-видимому, ЦТЛ стимулируются тогда, когда антиген появляется изнутри самих АПК (эндогенный антиген), например при продуцировании вирусных белков в зараженной вирусом клетке или опухолеспецифичных белков в раковой клетке. Действительно, считается, что при многих вирусных заболеваниях образование ЦТЛ является решающим в удалении зараженных вирусом клеток и избавлении от инфекции.
Исследования показывают, что процессы преобразования эндогенного и экзогенного антигенов различны. При синтезе новообразуемых полипептидов часть полипептида расщепляется внутриклеточной структурой, названной протеосомой. Получаемые в этом процессе фрагменты образуют комплекс с молекулами МНС не II класса, а I класса, после чего образовавшиеся комплексы МНС I класса с антигеном переносятся на поверхность клетки. Вновь происходит связывание с рецепторами Т-клеток для специфических пептидных фрагментов, но в этом случае необходимое вспомогательное рецепторное связывание происходит между молекулой МНС I класса и молекулой CD8. Соответственно эндогенный антиген на поверхности АПК предъявляется CD8+ Т-клеткам. Хотя и существуют некоторые нецитотоксичные типы CD8+ Т-клеток, большинство ЦТЛ составляют CD8+ Т-клетки.
Поэтому для создания вакцины, способной индуцировать сильные реакции с участием клеток ЦТЛ, необходимо, чтобы молекула антигена (главным образом белка) либо продуцировалась внутри клетки, либо доставлялась в нужный отсек клетки, чтобы она могла включиться в путь процессинга МНС I класса. Одна из стратегий состоит во включении целевого белка или пептида в вирус с последующим использованием сконструированного вируса в качестве вакцины (Lorenz и др. // Hum. Gene Ther. 1999. Т. 10. С. 623-631). Другая стратегия заключается во введении в клетку кодирующего белок ДНК-вектора с последующим введением клетки животному или пациенту, где белок экспрессируется внутри клетки и затем переносится на поверхность клетки с помощью молекул МНС I класса (Donnelly и др. // Аппи. Rev. Immunol. 1997. Т.15. С.617). Было установлено, что более простая техника инъецирования ДНК-векторов прямо в мышцу или кожу индуцирует реакцию с участием ЦТЛ и/или образование антител к некоторым антигенам (Lai и др. // Crit. Rev. Immunol. 1988. Т. 18. С. 449-484 и патент США №5589466). Исследования показали, что антиген захватывается и процессируется АПК, после чего он предъявляется иммунной системе (Lai и др., см. выше).
Включение экзогенных пептидов или белков в путь МНС I класса было довольно успешным при использовании химических адъювантов, таких как адъювант Фрейнда, и смесей сквалена и детергентов (Hilgers и др. // Vaccine. 1999. Т. 17. С. 219-228), а позднее - при использовании малых гранул, покрытых антигеном, которые подвергаются фагоцитозу макрофагами и индуцируют реакции с участием ЦТЛ по альтернативному пути МНС I класса (De Bruijn и др. // Eur. J. Immunol. 1995. Т. 25. С. 1274-1285). Кроме того, другие способы усиления иммунных реакций на антиген могут включать использование химических адъювантов в комбинации с рекомбинантными иммуностимулирующими цитокинами, например IL-2, IL-12, GM-CSF и другими. Например, в одном из методов применены антитела к гаптену, слитые с IL-2, это позволяет связать этот цитокин с белковым антигеном, который химически прореагировал с гаптеном (Harvill и др. // J.Immunol. 1996. Т. 157. С. 3165).
В другой методике использована “антигенизация” антител, при которой часть вариабельной части иммуноглобулина замещена пептидным антигеном. Пептидный антиген гибридной молекулы предъявляется АПК, как только рекомбинантное антитело связывается с АПК путем взаимодействия с рецепторами для Fc на поверхности АПК (Lanza и др. // Рrос. Nаtl. Acad. USA. 1993. Т. 90. С. 11683-11687). При расширении такого подхода используют инъекцию в селезенку плазмидной ДНК, кодирующей “антигенизированную” тяжелую цепь иммуноглобулина, после чего рождающиеся в селезенке В-клетки секретируют рекомбинантные антитела, как только появляется партнер - легкая цепь иммуноглобулина.
Однако иммуногенность системы доставки антигена является одним из главных препятствий в разработке современных вакцин. Цель вакцинации - вызвать мощную иммунную реакцию. Однако поскольку иммунная система хозяина возникла для борьбы с бактериями и вирусами, при использовании бактерий и вирусов в качестве векторов посланец обычно погибает вместе с посланием. Кроме того, сильная иммунная реакция на некоторые вирусные векторы, например вирус оспы или аденовирус, ограничивает их применимость, и полагают, что подобные же проблемы могут возникать при использовании бактериальных токсинов как белковых векторов. Подобным же образом “белковые векторы” на основе антител, использующие вариабельные части, которые в силу их природы не рассматриваются иммунной системой как “свои”, также потенциально иммуногенны. Предполагается, что частое использование этих молекул-носителей может индуцировать антиидиотипическую реакцию, что препятствует их эффективному использованию. Поэтому задача настоящего изобретения - предложить вакцину, которая дает сильный и продолжительный иммунитет к выбранному предварительно белковому или пептидному антигену.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано частично на открытии того, что можно усилить иммуногенность у млекопитающего предварительно выбранного пептидного или белкового антигена путем слияния предварительно выбранного антигена с константной (неизменяемой) областью тяжелой цепи иммуноглобулина. Получаемый слитый белок (который здесь также называется “слитый белок Fc-антиген” или “слитый антигенный белок”) или последовательность нуклеиновой кислоты, кодирующая слитый белок, могут затем быть введены млекопитающему в виде вакцины, чтобы вызвать иммунную реакцию на предварительно выбранный антиген. Кроме того, было обнаружено, что интенсивность и тип иммунной реакции на предварительно выбранный антиген можно модулировать, вводя вместе со слитым белком Fc-антиген или последовательностью нуклеиновой кислоты, кодирующей слитый белок Fc-антиген, специфические адъюванты.
Поэтому настоящее изобретение предлагает способ повышения иммуногенности у млекопитающего предварительно выбранного антигена. В одном из аспектов способ состоит во введении млекопитающему слитого белка Fc-антиген, содержащего константную область тяжелой цепи иммуноглобулина, соединенную полипептидной связью с предварительно выбранным антигеном, количество которого достаточно для вызывания иммунной реакции. В другом аспекте, способ состоит во введении млекопитающему последовательности нуклеиновой кислоты, например дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), кодирующей слитый белок Fc-антиген, содержащий константную область тяжелой цепи иммуноглобулина, слитую с предварительно выбранным антигеном. Для предварительно выбранного антигена, если он составляет часть слитого белка Fc-антиген (введенного либо как слитый белок, либо как нуклеиновая кислота, которая затем экспрессируется в хозяине с продуцированием слитого белка), характерно то, что он способен стимулировать в млекопитающем иммунную реакцию, превосходящую реакцию после введения сопоставимого количества (например, по весу или по числу молекул) только предварительно выбранного антигена, то есть предварительно выбранного антигена, не слитого с константной областью тяжелой цепи иммуноглобулина.
Кроме того, иммунные реакции на предварительно выбранный антиген в составе слитого белка Fc-антиген можно усилить или модулировать введением слитого белка Fc-антиген вместе с адъювантом. Хотя в практике применения настоящего изобретения можно использовать многие адъюванты, например химические адъюванты, такие как полный адъювант Фрейнда или олигонуклеотид, содержащий неметилированную последовательность CpG, традиционно предпочтительными адъювантами для использования вместе со слитым белком Fc-антиген являются другой слитый с Fc-фрагментом иммуноглобулина белок (называемый здесь “слитый белок Fc-адъювант” или “слитый адъювантный белок”) или нуклеиновая кислота, кодирующая такой слитый с Fc белок. Предпочтительные слитые белки Fc-адъювант содержат константную область тяжелой цепи иммуноглобулина, соединенную полипептидной связью с адъювантным белком, например цитокином. Предпочтительные цитокины, пригодные для использования в конструировании слитых белков Fc-адъювант, включают, например, интерферон-γ (ИФН-γ), интерлейкин-2 (IL-2), интерлейкин-4 (IL-4), интерлейкин-12 (IL-12), IL-18, фактор некроза опухолей (tumor necrosis factor - TNF), гранулоцитный фактор стимуляции образования колоний макрофагами (granulocyte macrophage colony stimulating factor - GMCSF). Другой класс слитых белков Fc-адъювант представляет собой область тяжелой цепи иммуноглобулина, слитую с адъювантной частью, соответствующей внеклеточному домену белка, который обычно является частично или полностью мембраносвязанным. Например, для использования в качестве усиливающего иммунную реакцию адъювантного белка лиганд CD40 сливают с Fc-фрагментом молекулы.
Для модулирования типа стимулированной иммунной реакции на предварительно выбранный антиген можно использовать совместное введение слитых белков Fc-антиген и Fc-адъювант (например, Fc-антиген после Fc-адъюванта или Fc-адъювант после Fc-антигена). В ответ на различные стимулы инициируются два класса иммунных реакций, названные Th1 и Th2, в которых участвуют различные цитокины. Th1 является посредником в иммунных реакциях, по своей природе клеточных, тогда как Th2 является посредником в иммунных реакциях, по своей природе гуморальных. Поэтому реакция Th1 может быть полезной в борьбе с измененными клетками, такими как раковые клетки или зараженные вирусом клетки, тогда как реакция Th2 может быть полезна в воздействии на внеклеточные агенты, такие как паразиты. Часто для стимуляции генерализованной иммунной реакции или для инициирования или модулирования специфических Th1 или Th2 реакций полезно вводить цитокины, слитые с константными областями тяжелой цепи иммуноглобулина.
Например, слитый белок Fc-адъювант, содержащий константную область тяжелой цепи иммуноглобулина, соединенную пептидной связью с GMCSF, является мощным общим стимулятором иммунных реакций, включая как Th1, так и Th2 реакции. Для стимуляции первично клеточной иммунной реакции, или иммунной реакции с участием Th1, может быть одновременно введен слитый белок Fc-адъювант, содержащий IL-12 или ИФН-γ. В качестве альтернативы для стимуляции первично гуморальной иммунной реакции, или иммунной реакции с участием Th2, может быть введен слитый белок Fc-адъювант, содержащий IL-4.
Далее, выбор конкретного цитокина, представленного в слитом белке Fc-адъювант, может определять класс продуцируемых антител к предварительно выбранному антигену в составе слитого белка Fc-антиген. Например, слитый белок Fc-адъювант, содержащий IL-12, может стимулировать хелперные Т-клетки и продуцирование класса антител lgG2a. Наоборот, слитый белок, содержащий IL-4, может стимулировать продуцирование класса антител IgE.
Как обсуждалось выше, в предпочтительном осуществлении способ включает введение слитого белка Fc-антиген или нуклеиновой кислоты, кодирующей слитый белок Fc-антиген, в комбинации со слитым белком Fc-адъювант. Используя два слитых белка, каждый из которых содержит константную область тяжелой цепи иммуноглобулина, можно локализовать совместно (солокализовать) и содержащий предварительно выбранный антиген белок, и содержащий адъювант (например, цитокин) белок в одном и том же или в подобных типах клеток млекопитающего. Например, макрофаги, В-клетки, гранулоциты и дендритные клетки экспрессируют на своей клеточной поверхности рецепторы для Fc. Поэтому совместное введение слитых белков Fc-антиген и Fc-адъювант, способных связываться с рецепторами для Fc, позволяет солокализовать антиген из слитого с антигеном белка и адъювант из слитого с адъювантом белка на одних и тех же типах клеток. Затем адъювант может стимулировать, усиливать или иным образом модулировать иммунную реакцию в окрестностях предварительно выбранного антигена.
В данном предпочтительном осуществлении изобретение использует две различных формы локализации и концентрирования. Во-первых, изобретение использует общую часть молекулы, слитую как с антигеном, так и с адъювантом, которая концентрируется в определенных областях тела. Таким способом повышается эффективная локальная концентрация антигена в соседстве с адъювантом. Во-вторых, изобретение направляет антиген в аппарат иммунной системы, предназначенный для процессинга и предъявления антигена. Первый этап концентрирования может быть осуществлен путем слияния белка-антигена и белка-адъюванта белков с такой частью молекулы, которая приводит к концентрированию в какой-нибудь части тела, доступной для иммунной системы. Второй этап адресования может быть осуществлен слиянием белка-антигена с любой частью молекулы, которая улучшает доставку в систему предъявления антигена или осуществляемый этой системой процессинг.
В соответствии с этим в настоящем изобретении обеспечение этих эффектов концентрирования достигается двумя альтернативными способами. Один способ заключается в конструировании и введении двух различных слитых белков - слитого белка, локализующего антиген, и слитого белка, локализующего адъювант. Второй способ состоит в конструировании и введении слитого белка, содержащего антиген, адъювант и локализующий белок. Фрагмент Fc молекулы является примером локализующего белка.
Важная особенность константной области тяжелой цепи иммуноглобулина состоит в том, что в отличие от предварительно выбранного антигена в слитом белке Fc-антиген она для намеченного реципиента предпочтительно неиммуногенна или только слабо иммуногена. Другими словами, в слитом белке Fc-антиген предварительно выбранному антигену предназначено быть в реципиенте более иммуногенным, чем константная область тяжелой цепи иммуноглобулина. Подобным же образом ожидается, что слитый белок Fc-адъювант будет также неиммуногенным или слабо иммуногенным для намеченного реципиента. Иммуногенность константной области тяжелой цепи иммуноглобулина можно снизить или в некоторых случаях исключить путем использования последовательностей константной области иммуноглобулина, полученных из организмов того же вида, как и намеченный реципиент, или подобных имеющимся в организмах того же вида. Например, для создания слитых белков, которые нужно вводить людям, используют константные области тяжелой цепи иммуноглобулина преимущественно человеческого происхождения. Подобным же образом, если намеченный реципиент - человек, адъювантный белок в слитом белке Fc-адъювант также предпочтительно должен иметь человеческое происхождение. Выбором подходящих аминокислотных последовательностей, определяющих константные области тяжелой цепи иммуноглобулина и адъювантные белки, можно оптимизировать выработку иммунитета непосредственно к предварительно выбранному антигену.
В предпочтительном осуществлении константная область тяжелой цепи иммуноглобулина в слитом белке Fc-антиген содержит шарнирную область иммуноглобулина и факультативно - домен константной области иммуноглобулина, выбранный их группы, состоящей из домена СН2, домена СН3 и домена СН4 или же их комбинации. Однако константная область тяжелой цепи иммуноглобулина предпочтительно лишена по крайней мере домена СН1. Кроме того, слитые белки с Fc-фрагментом иммуноглобулина по настоящему изобретению предпочтительно лишены домена вариабельной области тяжелой цепи иммуноглобулина (VН). Если слитый белок должен быть введен человеку, константная область тяжелой цепи иммуноглобулина предпочтительно содержит шарнирную область и домен СН2 или домен СН3, наиболее же предпочтительно содержит шарнирную область и оба домена – СН2 и СН3. Предполагается, что константные области тяжелой цепи иммуноглобулина, пригодные в практике применения настоящего изобретения, могут быть получены из иммуноглобулинов, принадлежащих к любому из пяти классов иммуноглобулинов, которые в данной области знания обозначаются как IgA (Igα), IgD (lgδ), IgE (Igε), IgG (Igγ) и IgM (lgμ). Однако предпочтительными являются области тяжелой цепи иммуноглобулина из класса IgG.
Предполагается, что в слитый белок Fc-антиген по настоящему изобретению может быть включен любой предварительно выбранный целевой антиген. В предпочтительном осуществлении предварительно выбранный антиген выбран из группы, состоящей из простатит-специфического мембранного антигена, эктодомена рецептора цитокина, вирусного белка и специфичного для рака или опухоли антигена.
В практике применения настоящего изобретения могут быть полезны слитые белки Fc-антиген, имеющие различные конфигурации. Например, N-конец предварительно выбранного антигена может быть соединен полипептидной связью с С-концом константной области тяжелой цепи иммуноглобулина. В качестве альтернативы, С-конец предварительно выбранного антигена может быть соединен пептидной связью с N-концом константной области тяжелой цепи иммуноглобулина. Кроме того, подразумевается, что слитые белки Fc-антиген могут содержать множество из одного или более предварительно выбранных антигенов, один или несколько из которых могут быть присоединены непосредственно или через полипептидный мостик к каждому из других антигенов или к константной области тяжелой цепи иммуноглобулина. Далее, два или несколько слитых белков Fc-антиген могут быть соединены вместе либо нековалентной либо ковалентной связью, например с помощью одной или нескольких дисульфидных связей, образуя димерные или мультимерные композиции. Предполагается, что слитые белки Fc-антиген в димерной конструкции могут быть одними и теми же или отличаться друг от друга. Например, хотя оба слитых белка Fc-антиген могут содержать одинаковую константную область тяжелой цепи иммуноглобулина, предварительно выбранные антигены могут различаться. Предполагается, что подобные же конфигурации могут быть применены также и для слитых белков Fc-адъювант.
Кроме того, в практике применения настоящего изобретения могут быть полезны разнообразные последовательности нуклеиновой кислоты, кодирующие слитые белки с участием Fc. Например, последовательности нуклеиновой кислоты могут кодировать в направлении от 5' к 3' либо константную область тяжелой цепи иммуноглобулина и предварительно выбранный антиген, либо предварительно выбранный антиген и константную область тяжелой цепи иммуноглобулина. Кроме того, последовательности нуклеиновой кислоты могут также факультативно включать “лидерную” или “сигнальную” последовательность, основанную, например, на последовательности легкой цепи иммуноглобулина, непосредственно слитой с последовательностью для шарнирной области константной области тяжелой цепи иммуноглобулина. В предпочтительном варианте осуществления, когда фрагмент Fc основан на последовательностях IgG, соответствующая фрагменту Fc нуклеотидная последовательность кодирует в направлении от 5' к 3' по меньшей мере шарнирную область иммуноглобулина (то есть шарнирную область, содержащую по меньшей мере один цистеиновый аминокислотный остаток, способный образовывать дисульфидную связь со второй последовательностью шарнирной области иммуноглобулина), домен СН2 иммуноглобулина и домен СН3. Кроме того, последовательность нуклеиновой кислоты, кодирующая слитые белки Fc-антиген, может быть также включена в способный к репликации экспрессирующий вектор, который может экспрессировать слитый белок, например, либо в бактерии-хозяине, либо в намеченном реципиенте, либо в обоих.
Ожидается, что инъекция последовательностей нуклеиновой кислоты, кодирующих слитый белок Fc-антиген (или их одних, или в комбинации с последовательностями нуклеиновой кислоты, кодирующими слитый белок Fc-адъювант), может приводить к формированию клеточной иммунной реакции, гуморальной иммунной реакции или их обеих. Сочетание иммунизации нуклеиновой кислотой и иммунизации, основанной на белках (например, введения слитого белка Fc-антиген до, в ходе или после введения нуклеиновой кислоты, кодирующей слитый белок Fc-антиген), может давать синергический эффект, вызывая более сильную иммунологическую реакцию на предварительно выбранный антиген по сравнению с иммунизацией только нуклеиновой кислотой или только белком.
Все вышеизложенное и другие задачи, отличительные особенности и преимущества настоящего изобретения будут очевидны из нижеследующих подробного описания, чертежей и формулы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Все вышеизложенное и другие цели, отличительные особенности и преимущества настоящего изобретения, так же как и само изобретение, будут полнее понятны из последующего описания предпочтительных осуществлении, если их изучать вместе с сопроводительными чертежами, на которых:
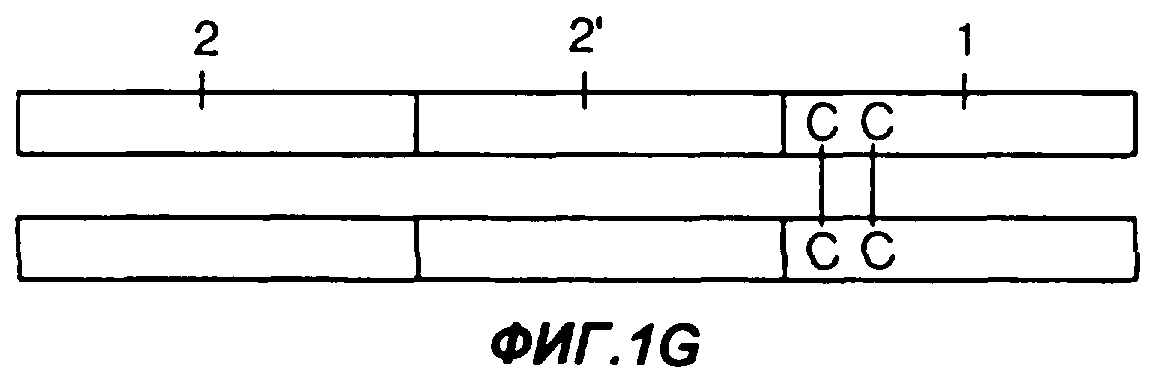
Фигуры 1A-1G являются схематическими иллюстрациями типовых слитых белков с участием Fc, пригодных в практике применения настоящего изобретения. На фиг.1А представлен слитый белок Fc-антиген или Fc-адъювант, у которого константная область тяжелой цепи иммуноглобулина (1) присоединена к N-концу антигена или адъюванта (2). На фиг.1В представлен слитый белок Fc-антиген или Fc-адъювант, у которого константная область тяжелой цепи иммуноглобулина (1) присоединена к С-концу антигена или адъюванта (2). На фиг.1С и 1D представлен димерный белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок Fc-антиген или Fc-адъювант. На фиг.1С по меньшей мере в одной из полипептидных цепей константная область тяжелой цепи иммуноглобулина (1) присоединена к N-концу антигена или адъюванта (2), а на фиг.1D константная область тяжелой цепи иммуноглобулина (1) присоединена к С-концу антигена или адъюванта (2). На фиг.1Е представлен димерный белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок Fc-антиген-антиген, Fc-адъювант-адъювант, Fc-адъювант-антиген или Fc-антиген-адъювант. На фиг.1F представлен димерный слитый белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок антиген -Fс-адъювант или адъювант-Fс-антиген. На фиг.1G представлен димерный слитый белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок антиген-адъювант-Fc или адъювант-антиген-Fc.
На фигурах 2А-2В схематически представлены последовательности ДНК, полезные в практике применения настоящего изобретения. На фиг.2А представлен экспрессирующий вектор для слитого белка с Fc человека. На фиг.2В представлено генное слияние для экспрессии слитого белка с Fc иммуноглобулина IgG2a мыши.
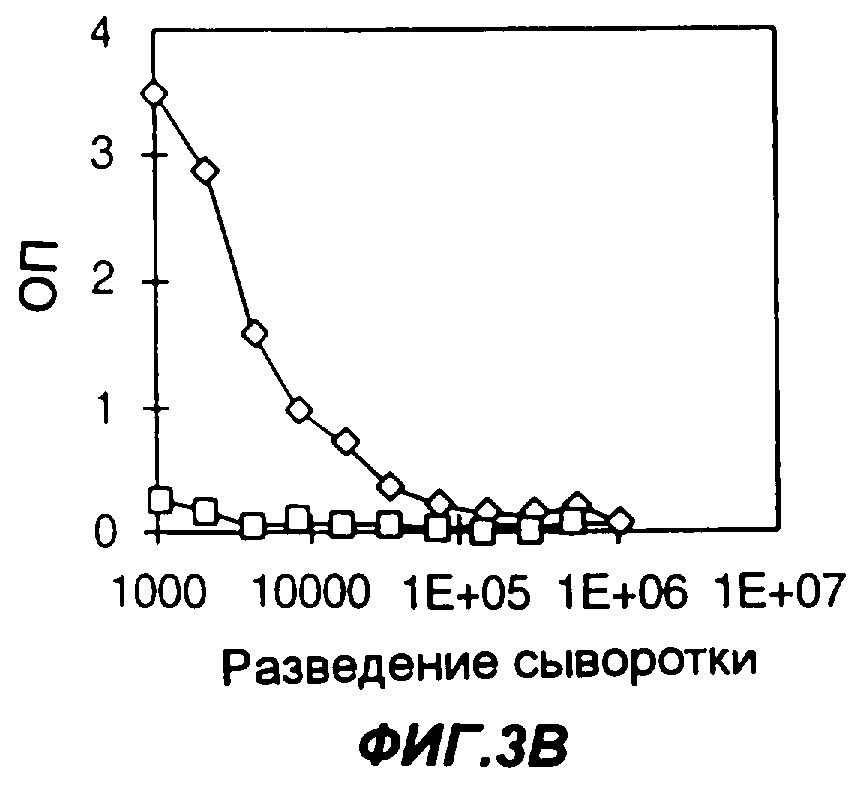
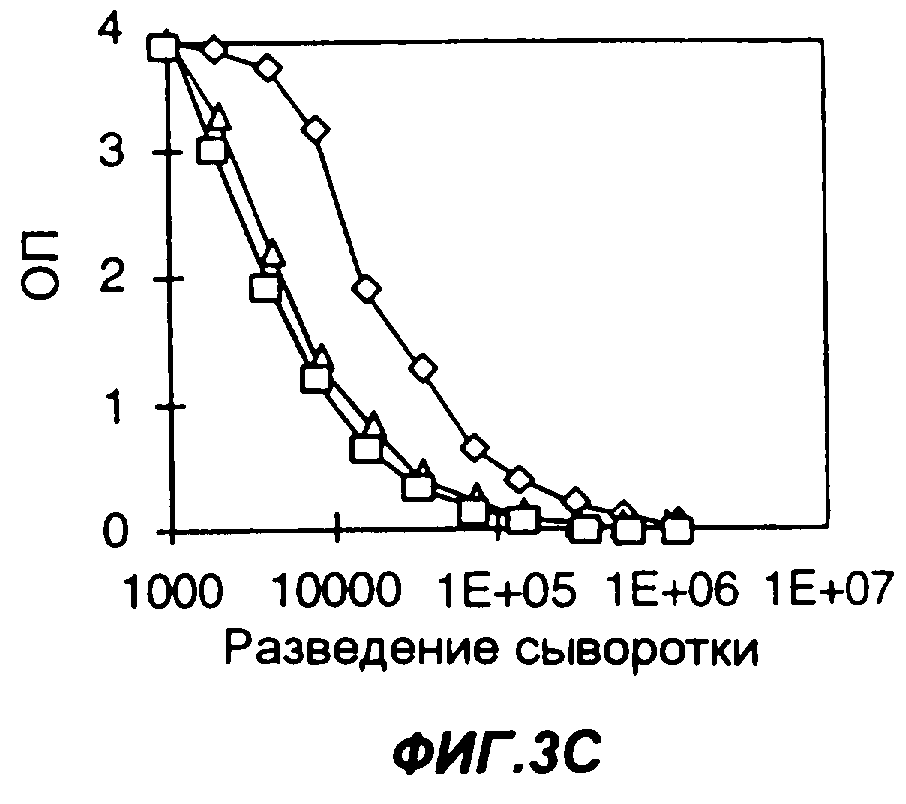
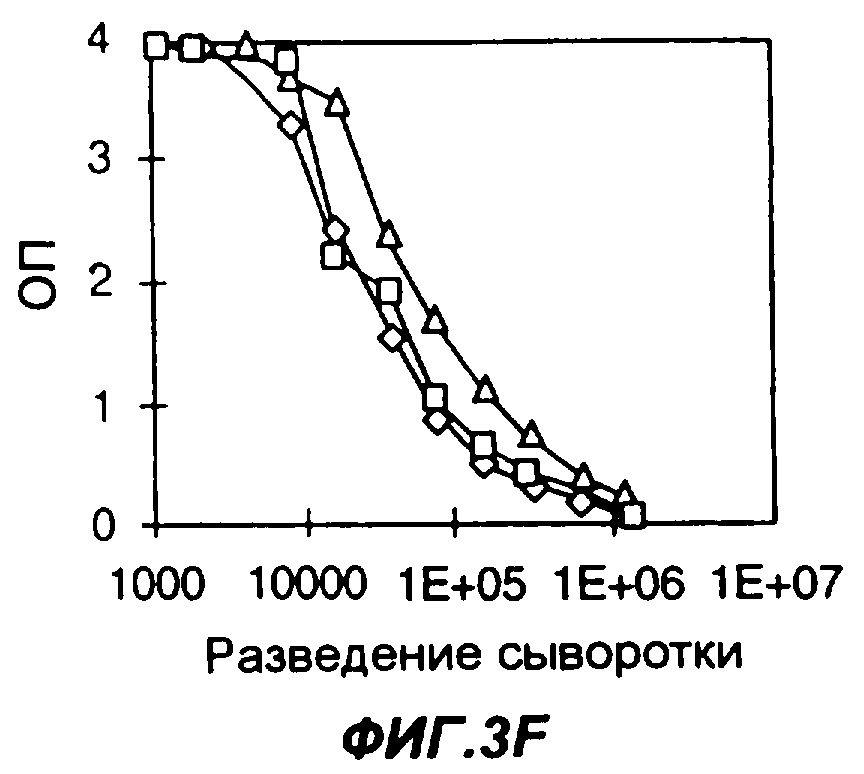
Фигуры 3A-3F представляют собой графики, демонстрирующие влияние химического адъюванта и адъюванта Fc-цитокин на продуцирование антител у мышей, иммунизированных слитым белком Fc-антиген, а именно слитым белком из мышиного Fc с эктодоменом рецептора IL-4 человека (FC-IL-4R). На фиг.3А мыши были иммунизированы FC-IL-4R и Fc-IL-2 в полном адъюванте Фрейнда (CFA). На фиг.3В мыши были иммунизированы FC-IL-4R в фосфатно-буферном солевом растворе (PBS). На фиг.3С мыши были иммунизированы FC-IL-4R в CFA. На фиг.3D мыши были иммунизированы FC-IL-4R и Fc-IL-2 в PBS. На фиг.3Е мыши были иммунизированы FC-IL-4R и Fc-GMCSF в CFA. На фиг.3F мыши были иммунизированы FC-IL-4R и Fc-GMCSF в PBS. На фигурах 3A-3F квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность (ОП) в пробах ELISA.
Фигуры 4A-4D представляют собой графики, показывающие эффект иммунизации мышей раковым антигеном человека PSMA в форме слитого белка Fc-антиген при использовании в качестве адъюванта различных количеств слитого белка Fc-GMCSF. На фиг.4А мышей иммунизировали только 50 мкг слитого белка Fc-PSMA. На фиг.4В мышей иммунизировали 50 мкг Fc-PSMA и 0,05 мкг Fc-GMCSF в качестве адъюванта. На фиг.4С мышей иммунизировали 50 мкг Fc-PSMA и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фиг.4D мышей иммунизировали 50 мкг Fc-PSMA и 5 мкг Fc-GMCSF. На фиг.4A-4D квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей.
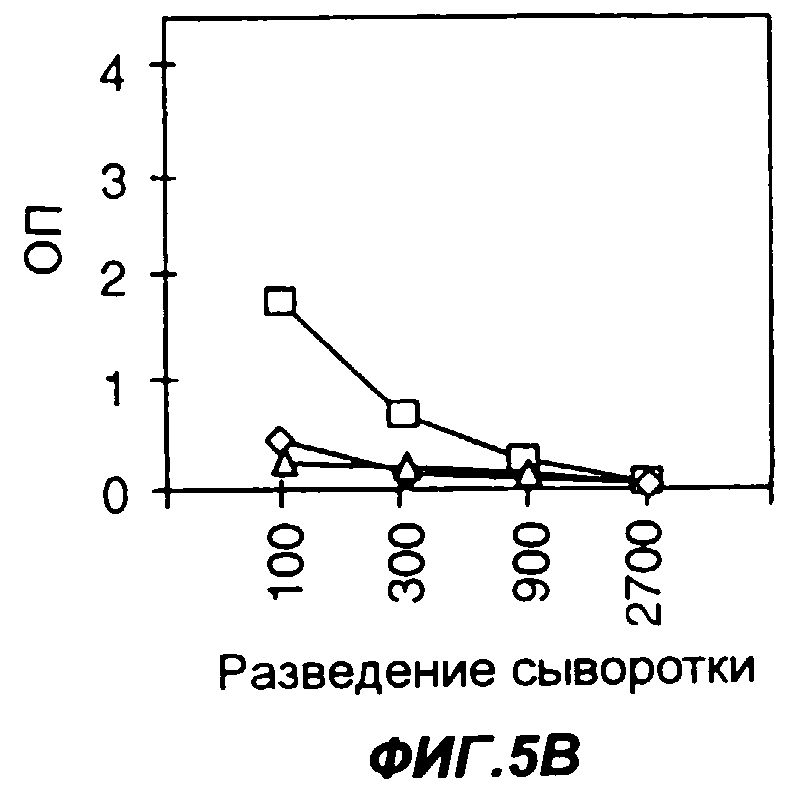
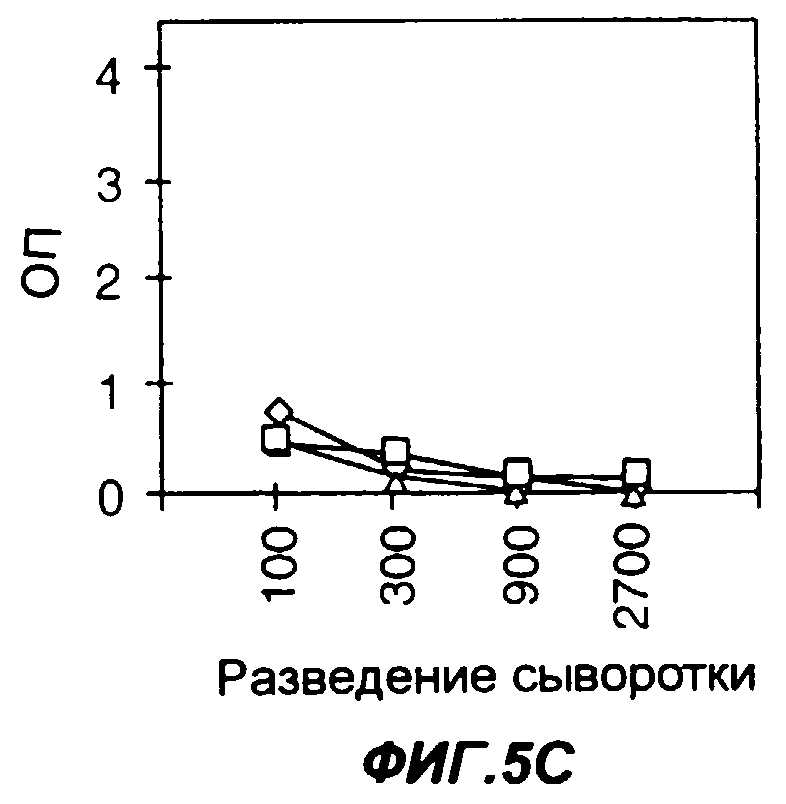
Фигуры 5A-5F представляют собой графики, позволяющие сопоставить продуцирование специфических антител к антигену PSMA, введенному в виде либо нативного белка (5А-5С), либо слитого белка Fc-PSMA с Fc мыши (5D-5F). На фиг.5А мышей иммунизировали 50 мкг PSMA в качестве антигена. На фиг.5В мышей иммунизировали 50 мкг PSMA в качестве антигена и 0,2 мкг GMCSF в качестве адъюванта. На фиг.5С мышей иммунизировали 50 мкг PSMA в качестве антигена и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фиг.5D мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена. На фиг.5Е мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена и 0,2 мкг GMCSF в качестве адъюванта. На фиг.5F мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фигурах 5A-5F квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фиг.6 - это диаграмма сравнения адъювантного действия Fc-GMCSF или Fc-F3L, введенных совместно с Fc-PSMA, на продуцирование антител к PSMA человека. Все животные получали либо только 50 мкг Fc-PSMA, либо 50 мкг Fc-PSMA в комбинации с указанным Fc-цитокином в качестве адъюванта. В каждом опыте использовали трех мышей.
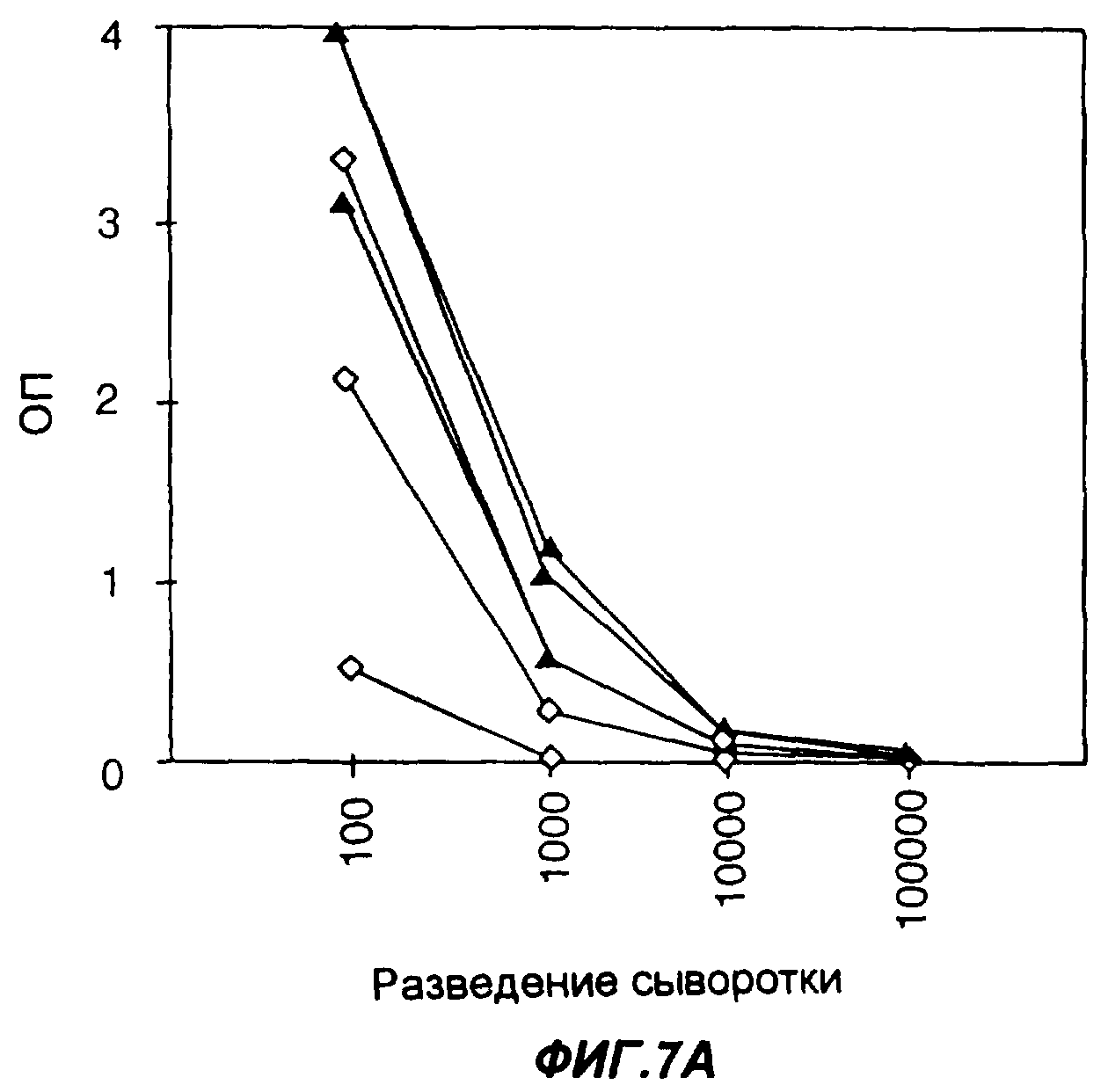
Фигуры 7А-7В представляют собой графики, показывающие иммуногенность слитого белка Fc-EpCAM у индивидуальных мышей при введении его в отдельности или в комбинации с адъювантом Fc-GMCSF. Фиг.7А и 7В показывают титры антител, измеренные соответственно через 7 и 14 дней после активной (“бустерной”) иммунизации. Бустерную иммунизацию проводили через 3 недели после предварительной иммунизации. На обеих фигурах незаполненные ромбы соответствуют подкожной инъекции мышам только 10 мкг Fc-EpCAM, а зачерненные треугольники соответствуют подкожной инъекции мышам 10 мкг Fc-EpCAM и 1 мкг Fc-GMCSF в качестве адъюванта. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фигуры 8А-8В представляют собой графики, показывающие иммуногенность у мышей слитого белка EpCAM-Fc (обратное расположение области Fc и антигена) при введении его в отдельности или в комбинации с адъювантным слитым белком Fc-GMCSF. Фиг.8А и 8В показывают титры антител, измеренные соответственно через 14 дней и 21 день после иммунизации (то есть через 7 дней после бустерной иммунизации). На обеих фигурах незаполненные ромбы представляют средние значения титров антител у трех мышей, иммунизированных 25 мкг слитого белка EpCAM-Fc, а зачерненные треугольники соответствуют иммунизации мышей 25 мкг EpCAM-Fc и 2,5 мкг Fc-GMCSF в качестве адъюванта. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
На фиг.9 показана схема конструирования плазмидного вектора, кодирующего слитый белок EpCAM-Fc-GMCSF. В этом случае антиген ЕрСАМ слит с амино-концом константной области тяжелой цепи иммуноглобулина (Fc-фрагмента), а адъювантный GMCSF слит с карбоксильным концом Fc-фрагмента.
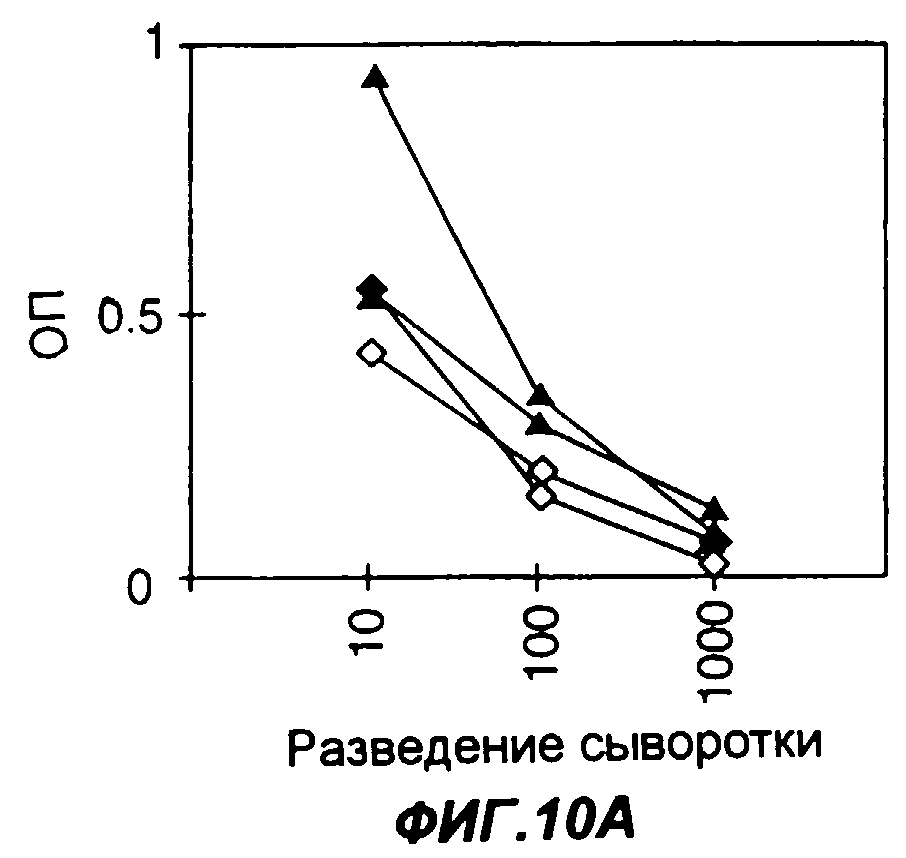
Фигуры 10A-10D представляют собой графики, показывающие титры антител у мышей после инъекции им плазмидных векторов, кодирующих слитый белок Fc-EpCAM при использовании в качестве носителя либо PBS, либо 25% раствора (вес к объему) сахарозы. На фигурах 10A-10D представлены титры антител, регистрируемые соответственно через 13, 27, 55 и 69 дней после первоначальной инъекции. Во всех фигурах незаполненные ромбы соответствуют титрам у отдельных мышей, которым кодирующая Fc-EpCAM плазмида была введена в PBS, а зачерненные треугольники соответствуют титрам у отдельных мышей, которым кодирующая Fc-EpCAM плазмида была введена в сахарозе. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
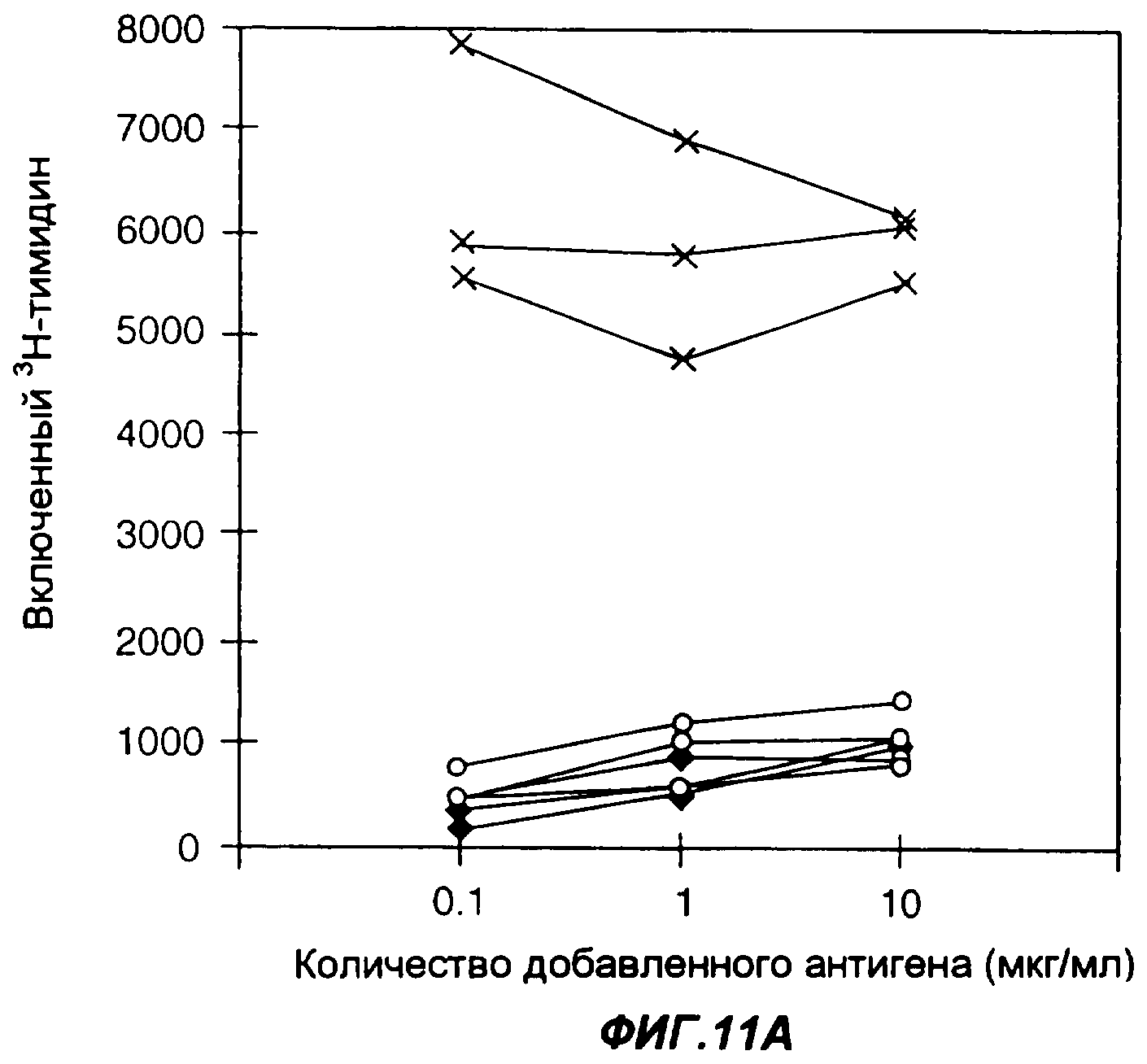
Фигуры 11А-11В представляют собой графики, показывающие стимуляцию включения3Н - тимидина в ответ на стимуляцию антигеном in vitro селезеночных макрофагов (спленоцитов), выделенных из мышей, иммунизированных ДНК-вакцинацией или инъекцией белка. На фиг.11В представлена в увеличенном виде нижняя часть фиг.11А. Во всех фигурах незаполненные ромбы соответствуют спленоцитам, взятым у мышей, иммунизированных 100 мкг плазмидной ДНК, кодирующей слитый белок CMV-Fc-EpCAM (CMV -цитомегаловирус, ЦМВ), незаполненные кружки соответствуют макрофагам, взятым у мышей, иммунизированных 100 мкг плазмидной ДНК кодирующей слитый белок CMV-EpCAM-Fc, а крестики соответствуют макрофагам, взятым у мышей, иммунизированных 10 мкг белка Fc-EpCAM. Селезенки удаляли у мышей на 70-й день после первичной инъекции плазмидной ДНК или белка и двух бустерных иммунизаций с интервалами в 3 недели.
Фигуры 12А-12В представляют собой графики, показывающие результаты испытаний киллерной активности цитотоксических Т-лимфоцитов (ЦТЛ) с использованием спленоцитов из мышей, иммунизированных плазмидной ДНК или белком Fc-EpCAM. На фиг.12А показана активность спленоцитов по отношению к опухолевым клеткам СТ 26 мыши, экспрессирующим белок ЕрСАМ человека. На фиг.12В показана активность спленоцитов по отношению к исходным опухолевым клеткам СТ 26 мыши. На обеих фигурах незаполненные ромбы относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию (промотор CMV)-EpCAM, незаполненные квадраты относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию слияния (промотор CMV)-Fc-EpCAM, незаполненные треугольники относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию слияния (промотор CMV)-EpCAM-Fc, а крестики относятся к спленоцитам из мышей, иммунизированных слитым белком Fc-EpCAM. Для анализа активности ЦТЛ были использованы спленоциты из иммунизированных мышей, культивированные в течение 5 дней с 10 ед/мл IL-2. Меченые клетки-мишени смешивали с указанными эффекторами и инкубировали в течение 4 ч. Процент специфического лизиса рассчитывали по выходу радиоактивности.
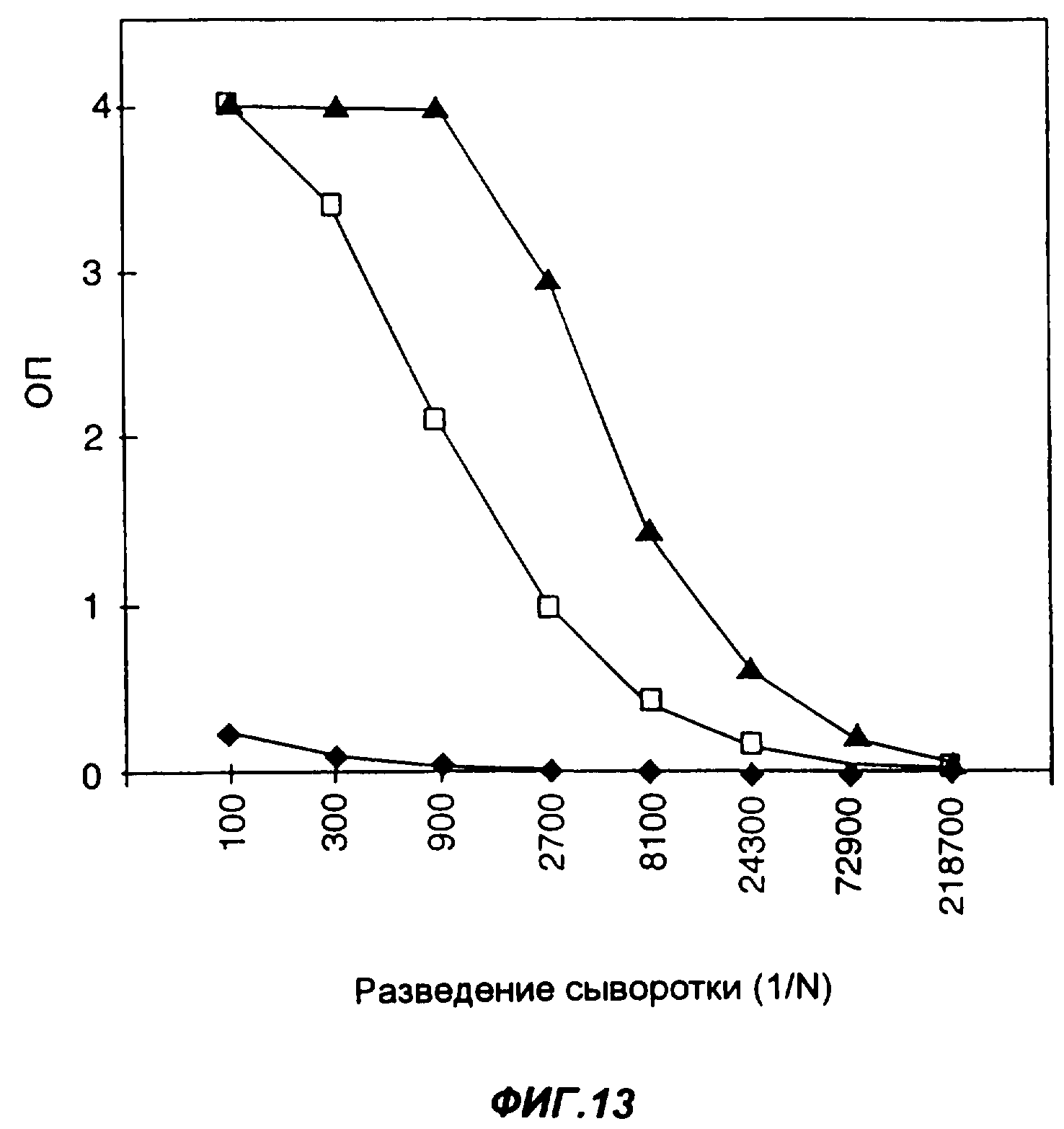
Фиг.13 представляет собой график, показывающий титры антител у мышей, иммунизированных подкожно либо только 50 мкг слитого белка Fc-MCSP в PBS, либо 50 мкг этого слитого белка в комбинации с 5 мкг Fc-GMCSF в качестве адъюванта. Зачерненные ромбы соответствуют титрам антител в нормальной сыворотке, незаполненные квадраты представляют титры антител в сыворотке мышей, иммунизированных только слитым белком Fc-MCSP, a зачерненные треугольники представляют титры антител в сыворотке мышей, иммунизированных слитым белком Fc-MCSP в комбинации с адъювантом Fc-GMCSF. Уровни содержания антител к антигену измеряли методом ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фигуры 14А-14В представляют собой графики, показывающие титры антител у мышей, иммунизированных слитым белком Fc-gp41 pep 626 - либо только им, либо в комбинации с адъювантом Fc-цитокин. На фигурах 14А и 14В представлены титры антител, полученные соответственно через 7 дней и 33 дня после второй бустерной иммунизации. На этих фигурах незаполненные ромбы соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией только 25 мкг антигена Fc-gp41 pep 626, незаполненные квадраты соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией 25 мкг антигена Fc-gp41 рер 626 в комбинации с 2,5 мкг адъюванта Fc-GMCSF, а зачерненные треугольники соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией 25 мкг антигена Fc-gp41 рер 626 в комбинации с 2,5 мкг адъюванта Fc-IL2. Уровни содержания антител к антигену измеряли методом ELISA; по оси Y указана оптическая плотность в пробах ELISA.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение нацелено на эффективную доставку белковых или пептидных антигенов in vivo для индукции у млекопитающего гуморальной (т.е. основанной на антителах) или опосредованной клетками Th2 иммунной реакции, клеточной или опосредованной клетками Тh1 иммунной реакции, а в некоторых случаях - обоих типов иммунных реакций. Теперь установлено, что можно усилить иммуногенность у млекопитающего предварительно выбранного белкового или пептидного антигена слиянием предварительно выбранного антигена с константной областью тяжелой цепи иммуноглобулина, чтобы получить слитый белок Fc-антиген. Полученный слитый белок Fc-антиген или последовательности нуклеиновой кислоты, кодирующие слитые белки Fc-антиген, могут затем быть введены млекопитающему, например человеку, в виде вакцины, чтобы вызвать иммунную реакцию на предварительно выбранный антиген.
Слитый белок Fc-антиген избирательно направляет антиген к антиген-предъявляющим клеткам (АПК). Не вдаваясь в теорию, можно считать, что связывание слитых белков Fc-антиген с АПК происходит при посредстве рецепторов для Fc, экспрессируемых на многих типах иммунных клеток, в том числе, например: на дендритных клетках, макрофагах, В-клетках и гранулоцитах. Слитый белок Fc-антиген, введенный млекопитающему, связывается с рецепторами для Fc, после чего АПК производят эндоцитоз слитого белка Fc-антиген. Полагают, что затем подвергшийся эндоцитозу слитый белок, содержащий предварительно выбранный антиген, разрушается до малых пептидов, которые затем предъявляются на клеточной поверхности. После этого предъявленные пептиды участвуют в гуморальной и/или клеточной иммунной реакции. Конкретный тип стимулированной иммунной реакции можно модулировать путем совместного введения слитого белка Fc-антиген с адъювантом, например с адъювантным слитым белком.
При одном из способов введения реципиенту вводят слитый белок Fc-антиген. В другом способе введения реципиенту вводят последовательность нуклеиновой кислоты, кодирующую слитый белок Fc-антиген. Иммуногенность предварительно выбранного антигена (либо во введенном белке Fc-антиген, либо экспрессированного по введенной нуклеиновой кислоте) выше, чем у одного антигена, то есть антигена, не слитого с помощью полипептидной связи с константной областью тяжелой цепи иммуноглобулина. Кроме того, для максимизации иммуногенности предварительно выбранного антигена при определенных обстоятельствах можно использовать последовательное введение слитого белка и нуклеиновой кислоты, кодирующей тот же самый слитый белок, или, в качестве альтернативы, введение нуклеиновой кислоты, кодирующей слитый белок, с последующим введением того же самого слитого белка. Понятно, что оптимальная иммунная реакция достигается в том случае, когда оба компонента слитых белков Fc-антиген активны. Другими словами, предварительно выбранный антиген в слитом белке Fc-антиген способен вызвать иммунную реакцию, а константная область тяжелой цепи иммуноглобулина способна связываться с рецептором для Fc на поверхности АПК.
Далее, как уже обсуждалось, интенсивность и тип вызванной иммунной реакции на предварительно выбранный антиген можно модулировать введением специфических адъювантов совместно со слитым белком Fc-антиген и/или с нуклеиновой кислотой, кодирующей слитый белок Fc-антиген. Хотя в практике применения изобретения, например в ветеринарной области, могут быть полезны химические адъюванты, например квасцы, или полный или неполный адъюванты Фрейнда, вызываемые ими побочные эффекты, например рубцевание тканей, могут препятствовать их применению у человека. Поэтому предпочтительные адъюванты представляют собой второй слитый с Fc-фрагментом иммуноглобулина белок, в котором константная область тяжелой цепи иммуноглобулина слита с адъювантным белком с получением слитого белка Fc-адъювант. Понятно, что, как и в случае слитых белков Fc-антиген, оптимальная иммунная реакция вызывается в том случае, когда оба компонента в слитом белке Fc-адъювант активны. Иными словами, адъювант в слитом белке Fc-адъювант способен модулировать иммунную реакцию, а константная область тяжелой цепи иммуноглобулина способна связываться с рецептором для Fc на поверхности АПК.
В предпочтительном варианте осуществления настоящего изобретения и антиген, и адъювант вводят в форме слитых с Fc-фрагментом иммуноглобулина белков или нуклеиновых кислот, кодирующих эти слитые белки. Другими словами, антиген вводят как слитый белок Fc-антиген, а адъювант вводят как слитый белок Fc-адъювант. Некоторые предпочтительные варианты осуществления слитых с Fc белков, пригодных в практике применения настоящего изобретения, показаны на фигурах 1A-1G.
На фиг.1А представлен типичный слитый с Fc белок, в котором С-конец константной области тяжелой цепи иммуноглобулина (1) присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу предварительно выбранного антигена или адъюванта (2). Понятно, что термин “полипептидный мостик” в том смысле, как он использован здесь, означает последовательность из одного или нескольких аминокислотных остатков, которая соединяет вместе два белка. Часто полипептидный мостик представляет собой цепочку аминокислот длиной приблизительно 10-15 остатков, содержащую, например, повторяющиеся остатки глицина и/или серина. На фиг.1В представлен типичный слитый с Fc белок, в котором С-конец предварительно выбранного антигена или адъюванта (2) присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу константной области тяжелой цепи иммуноглобулина (1).
На фиг.1С изображена димерная конструкция, содержащая два слитых с Fc белка, соединенных ковалентно с помощью двух дисульфидных связей. Димерная конструкция представляет собой два слитых с Fc белка, в которых С-конец каждой константной области тяжелой цепи иммуноглобулина (1) присоединен к N-концу предварительно выбранного антигена или адъюванта (2). Подобным же образом на фиг.1D изображена димерная конструкция, содержащая два слитых с Fc белка, соединенных ковалентно с помощью двух дисульфидных связей. Димерная конструкция представляет собой два слитых с Fc белка, в которых С-конец каждого предварительно выбранного антигена или адъюванта (2) присоединен к N-концу константной области тяжелой цепи иммуноглобулина (1).
На фиг.1Е изображена димерная конструкция, содержащая два слитых с Fc белка, соединенных с помощью двух дисульфидных связей. Димерная конструкция представляет собой два слитых с Fc белка, в которых С-конец каждой константной области тяжелой цепи иммуноглобулина (1) присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу предварительно выбранного антигена или адъюванта (2), С-конец которого присоединен (либо непосредственно, либо посредством полипептидного мостика) ко второму антигену или адъюванту (2').
На фиг.1F изображена димерная конструкция, содержащая два слитых с Fc белка, также соединенных с помощью двух дисульфидных связей. Димерная конструкция представляет собой два слитых с Fc белка, в которых С-конец антигена или адъюванта (2) присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу константной области тяжелой цепи иммуноглобулина (1), С-конец которой присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу другого антигена или адъюванта (2'). Например, такие слитые белки могут содержать, в направлении от N-конца к С-концу, (предварительно выбранный антиген)-(константную область тяжелой цепи иммуноглобулина)-(адъювант).
На фиг.1G изображена димерная конструкция, содержащая два слитых с Fc белка, также соединенных с помощью двух дисульфидных связей. Димерная конструкция представляет собой два слитых с Fc белка, в которых С-конец антигена или адъюванта (2) присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу отличающегося адъюванта или антигена (2'), чей С-конец присоединен (либо непосредственно, либо посредством полипептидного мостика) к N-концу константной области тяжелой цепи иммуноглобулина (1), Например, такие слитые белки могут содержать, в направлении от N-конца к С-концу (предварительно выбранный антиген)-(адъювант)-(константную область тяжелой цепи иммуноглобулина).
В практике применения настоящего изобретения обычно предпочтительно помещать фрагмент Fc со стороны N-конца адъювантной части. Если адъювантная часть помещена со стороны N-конца фрагмента Fc, тогда слияние адъювант-Fс может связываться с рецептором для адъюванта на иммунной клетке и фрагмент Fc окажется в такой же ориентации, какая принята при связывании антитела с поверхностью клетки. В итоге может иметь место зависящая от антител опосредованная клетками цитотоксичность (ADCC) или связывание комплемента. Однако оказывается, что если фрагмент Fc поместить со стороны N-конца адъювантной части, ADCC и связывание комплемента не наблюдаются.
Конструкции, изображенные на фигурах 1C-1G, представлены как димеры, сшитые парой дисульфидных связей между цистеинами соседствующих шарнирных областей. На рисунках дисульфидные мостики изображены связывающими вместе части константных областей тяжелой цепи иммуноглобулина через шарнирную область, характерную для нативных форм этих молекул. Хотя предпочтительными являются конструкции, содержащие шарнирные области иммуноглобулина, изобретение подразумевает, что при необходимости могут быть выбраны сшивки в других положениях. Кроме того, в некоторых случаях два или несколько мономеров могут быть соединены нековалентно с образованием димеров или мультимеров, полезных в практике применения настоящего изобретения.
В том смысле, как он использован здесь, термин “константная область тяжелой цепи иммуноглобулина” взаимозаменяем с термином “Fc-фрагмент”, и понятно, что он означает карбоксильно-концевую часть константной области тяжелой цепи иммуноглобулина или ее аналог или долю, способные связываться с рецептором для Fc. Как известно, каждая константная область тяжелой цепи иммуноглобулина содержит четыре или пять доменов. Домены обозначены последовательно следующим образом: СН1-шарнир–СН2-СН3(-СН 4). СН4 имеется в IgM, который не имеет шарнирной области. Константная область тяжелой цепи иммуноглобулина, полезная в практике применения настоящего изобретения, предпочтительно содержит шарнирную область иммуноглобулина и предпочтительно содержит также домен СН3. Константная область тяжелой цепи иммуноглобулина наиболее предпочтительно содержит шарнирную область иммуноглобулина, домен СН2 и домен СН3. Понятно, что в том смысле, как он использован здесь, термин “шарнирная область” означает всю шарнирную область иммуноглобулина или по меньшей мере часть шарнирной области иммуноглобулина, достаточную для образования одной или нескольких дисульфидных связей со второй шарнирной областью иммуноглобулина.
Предполагается, что подходящие константные области тяжелой цепи иммуноглобулина могут быть получены из антител, принадлежащих к каждому из классов иммуноглобулинов, которые называются IgA, IgD, IgE, IgG и IgM. Однако предпочтительны константные области тяжелой цепи иммуноглобулина из IgG. Кроме того, подразумевается, что константные области тяжелой цепи иммуноглобулина могут быть получены из любого подкласса IgG, которые в данной области обозначаются как IgG1, IgG2, IgG3 и IgG4.
Домены константной области тяжелой цепи иммуноглобулина имеют перекрестную гомологию в пределах классов иммуноглобулинов. Например, домен СН2 IgG гомологичен домену СН2 IgA и IgG и домену СН3 IgM и IgE. Предпочтительные константные области тяжелой цепи иммуноглобулина включают белковые домены, соответствующие области СН2 и области СН3 IgG или их функциональным частям или производным. Однако константные области тяжелой цепи иммуноглобулина предпочтительно лишены по меньшей мере домена СН1. Кроме того, слитые белки Fc-антиген или Fc-адъювант могут быть лишены вариабельной части иммуноглобулина. В более предпочтительном осуществлении константная область тяжелой цепи иммуноглобулина содержит в направлении от N-конца к С-концу шарнирную область иммуноглобулина, домен СН2 и домен СН3, которые все основаны на последовательностях из молекулы IgG. Выбор подходящих константных областей тяжелой цепи иммуноглобулина подробно обсуждается в патентах США №№5541087 и 5726044. Считается, что квалификации специалистов в данной области достаточно для выбора конкретных последовательностей константной области тяжелой цепи иммуноглобулина среди определенных классов и подклассов иммуноглобулинов для достижения конкретного результата.
При некоторых обстоятельствах может оказаться полезным модифицировать константную область тяжелой цепи иммуноглобулина, например, путем мутации, делеции или других изменений с участием генетической инженерии или других подходов, так что некоторые типы активности - такие, как связывание комплемента или стимуляция зависящей от антител опосредованной клетками цитотоксичности (ADCC), ослабляются или исключаются. Однако считается необходимым, чтобы способность константной области тяжелой цепи иммуноглобулина связываться с рецептором для Fc сохранялась.
В практике применения настоящего изобретения компонент константной области тяжелой цепи иммуноглобулина слитых белков Fc-антиген или Fc-адъювант предпочтительно неиммуногенен или слабо иммуноген в намеченном реципиенте. Область Fc считается неиммуногенной или слабо иммуногенной, если константная область тяжелой цепи иммуноглобулина не может вызвать заметного образования антител к константной области тяжелой цепи иммуноглобулина. Поэтому константная область тяжелой цепи иммуноглобулина должна происходить из иммуноглобулинов, имеющихся в том самом виде, к которому принадлежит намеченный реципиент слитого белка, или основываться на аминокислотных последовательностях, соответствующих этим иммуноглобулинам. Другими словами, если конструкция слияния с Fc-фрагментом иммуноглобулина (слитый белок Fc-антиген и/или Fc-адъювант) предназначена для введения человеку, следует использовать последовательности константной области тяжелой цепи иммуноглобулина человека. Нуклеотидная и аминокислотная последовательности Fc-фрагмента иммуноглобулина IgG человека раскрыты, например, в работе Ellison и др. // Nucteic Acids Res. 1982. Т.10. С.4071-4079. Подобным же образом, если слияние с Fc-фрагментом иммуноглобулина предназначено для введения мышам, следует использовать последовательности мышиного Fc-фрагмента. Нуклеотидная и аминокислотная последовательности Fc-фрагмента иммуноглобулина IgG2a мыши раскрыты, например, в работе Bourgois и др. // Еur. J.Biochem. 1974. Т.43. С.423-435. Такую же логику следует применять, если слитые с Fc белки должны вводиться другим животным, в том числе домашним животным, например кошкам и собакам, а также сельскохозяйственным животным, например коровам и лошадям.
В том смысле, как он использован здесь, термин “предварительно выбранный антиген” понимается как означающий любой белок или его фрагмент, или полипептид, который один или в комбинации с другими реагентами способен индуцировать у млекопитающего иммунную реакцию. Подразумевается, что любой представляющий интерес (целевой) предварительно выбранный антиген может быть включен в слитый белок Fc-антиген по настоящему изобретению. В предпочтительном варианте осуществления предварительно выбранный антиген выбран из группы, состоящей из простатоспецифического мембранного антигена (PSMA); эктодомена рецептора цитокина (например, эктодомена рецептора IL-4 человека); опухолеспецифичного антигена (например, антигена, который подвержен стимулирующей регуляции или как-нибудь иначе присутствует в повышенных количествах в опухолевой клетке по сравнению с нормальной клеткой); и вирусного белка, например белка, кодируемого геномом вируса иммунодефицита человека (ВИЧ).
В том смысле, как он использован здесь, термин “адъювант” понимается как означающий любое вещество, которое способно действовать как иммуномоделятор, например усиливая иммунную реакцию (гуморальную или клеточную) на предварительно выбранный антиген. В том смысле, как он использован здесь, термин “гуморальный” иммунитет понимается как означающий иммунитет, опосредованный антителами, распределенными в биологических жидкостях, например в плазме или лимфе, тогда как термин “клеточный” иммунитет (называемый также в данной области знания “клеточно-опосредованный иммунитет”) понимается как означающий иммунологические реакции, инициируемые Т-лимфоцитами и направляемые эффекторными Т-лимфоцитами и/или макрофагами.
Как обсуждалось выше, при иммунизации млекопитающих-животных могут быть применены различные химические адъюванты, например полный адъювант Фрейнда. Хотя он широко используется для выработки у животных высоких титров антител или выраженной реакции цитотоксических Т-лимфоцитов (ЦТЛ), его побочное действие, например рубцевание тканей, препятствуют его применению у людей. Таким образом, существует необходимость индуцировать сильную иммунную реакцию без сопутствующего воспаления в месте инъекции. Одним из определенных преимуществ использования слитых белков Fc-адъювант является то, что они способны вызвать сильную иммунную реакцию без необходимости использования химических адъювантов, таких как адъювант Фрейнда.
Предпочтительные адъюванты, полезные в практике применения настоящего изобретения, представляют собой слитый белок Fc-адъювант или кодирующую таковой нуклеиновую кислоту. Предпочтительные адъювантные белки для включения слитых с Fc белков включают цитокины. В том смысле, как он использован здесь, термин “цитокин” понимается как означающий любой его белковый или пептидный аналог или функциональный фрагмент, способный модулировать у млекопитающего активность иммунных клеток, например Т-клеток, В-клеток, макрофагов, нейтрофилов, эозинофилов, базофилов, дендритных клеток и их предшественников. Предпочтительные цитокины включают, например, интерферон-γ (ИФН-γ), IL-2, IL-4, IL-12, IL-18, TNF и GMCSF. Лиганд - внеклеточный домен CD40 - также является предпочтительным белком для слияния с Fc, чтобы получить Fc-адъювант. Антиген в слитом белке Fc-антиген, будучи введенным вместе с белком Fc-адъювант, способен вызвать иммунную реакцию, которая сильнее иммунной реакции в том случае, когда слитый белок Fc-антиген введен без слитого белка Fc-адъювант. В некоторых случаях уровень выработки антител, достигаемый после всего лишь двух иммунизации смесью белков Fc-антиген и Fc-адъювант, столь же высок или выше, чем достигаемый с применением адъюванта Фрейнда, но при этом без заметных кожных реакций.
Что касается константных областей тяжелой цепи иммуноглобулина в составе слитых белков Fc-антиген или Fc-адъювант, адъювантный белок предпочтительно неиммуногенен или лишь слабо иммуногенен у намеченного реципиента. Это может быть достигнуто включением в слитые белки Fc-адъювант цитокинов, определяемых аминокислотными последовательностями, соответствующими цитокинам, которые можно выделить из особей того же вида, к которому принадлежит намеченный реципиент. Например, если слитый белок Fc-адъювант нужно вводить человеку, адъювантный белок (например, цитокин) должен быть предпочтительно человеческого происхождения.
Совместное введение слитых белков Fc-антиген и Fc-адъювант, одновременное или поочередное, можно использовать для модулирования типа иммунной реакции, стимулированной по отношению к предварительно выбранному антигену. В ответ на различные типы инфекции стимулируются два класса иммунных реакций, названные Тh1 и Th2, в которых участвуют различные цитокины. Th1 является посредником в иммунных реакциях, по своей природе клеточных, тогда как Th2 является посредником в иммунных реакциях, по своей природе гуморальных. Поэтому реакция Th1 может быть полезна в борьбе с измененными клетками, такими как раковые клетки или зараженные вирусом клетки, тогда как реакция Th2 может быть полезна в воздействии на внеклеточные агенты, такие как паразиты. Часто для стимуляции генерализованной иммунной реакции или для инициирования или модулирования специфических Th1 или Th2 реакций полезно вводить цитокины, слитые с константными областями тяжелой цепи иммуноглобулина.
Кроме того, выбор конкретного цитокина, присутствующего в слитом белке Fc-адъювант, может определять класс продуцируемых антител к предварительно выбранному антигену в составе слитого белка Fc-антиген. Например, слитый белок Fc-IL-12 стимулирует реакцию через хелперные Т-клетки путем стимуляции продуцирования того, что известно как цитокины Th1 (например, ИФН-γ, IL-2 и TNF), что способствует развитию высокого клеточного иммунитета и продуцированию класса антител IgG2a. Наоборот, слитый белок Fc-IL-4 стимулирует продуцирование цитокинов Th2, например IL-5, IL-6, IL-10 и IL-4, способствующих развитию гуморального иммунитета.
Как обсуждалось выше, в предпочтительном варианте осуществления способ включает введение слитого белка Fc-антиген или нуклеиновой кислоты, кодирующей слитый белок Fc-антиген, в комбинации со слитым белком Fc-адъювант. Используя два слитых белка, каждый из которых содержит константную область тяжелой цепи иммуноглобулина, можно совместно локализовать и содержащий предварительно выбранный антиген, и содержащий адъювант (например, цитокин) белки в одном и том же или в подобных типах клеток млекопитающего. Например, макрофаги, В-клетки, гранулоциты и дендритные клетки экспрессируют на своей клеточной поверхности рецепторы для Fc. Поэтому совместное введение слитых белков Fc-антиген и Fc-адъювант, способных связываться с рецепторами для Fc, позволяет совместно локализовать антиген из слитого с антигеном белка и адъювант из слитого с адъювантом белка в одном и том же клеточном отделении клеток АПК. Затем адъювант может усиливать или иным образом модулировать иммунную реакцию вблизи предварительно выбранного антигена.
Комбинации слитых белков Fc-цитокин могут быть также использованы синергическим образом, чтобы вначале стимулировать общую реакцию, а затем повлиять на то, какой тип реакции будет развиваться - клеточная (Тh1) или гуморальная (Th2). Например, Fc-GMCSF является мощным общим стимулятором иммунных реакций. Но чтобы далее модулировать иммунную реакцию по клеточному пути, опосредованному Тh1, можно совместно с Fc-GMCSF вводить, например, адъювантный белок Fc-IL12 или Fc-IFNγ. Чтобы способствовать развитию иммунной реакции более по гуморальному пути, опосредованному Th2, можно совместно с Fc-GMCSF вводить, например, адъювантный белок Fc-IL4, чтобы модулировать реакцию в сторону образования клеток Th2. Можно также применять в виде слияний с Fc другие способствующие развитию Th1 или Th2 цитокины в зависимости от точной природы требуемой физиологической реакции. Подразумевается, что такой общий подход можно также использовать для модулирования существующих патогенных реакций, таких как аутоиммунитет (болезнь, опосредованная Тh 1) и аллергия (болезнь, опосредованная Тh2). Проводя иммунизацию таким образом, чтобы стимулировать новую иммунную реакцию с участием Тh противоположного типа, можно сдвигать реакцию от ответа на вредный антиген к ответу на конкретный антиген.
При некоторых обстоятельствах при иммунизации животного слитым белком Fc-антиген полезно в качестве адъювантов использовать нуклеиновые кислоты. Нуклеиновые кислоты, например олигонуклеотиды, содержащие обогащенную димерами (цитозин)-(фосфодиэфирная связь)-(гуанозин) (CpG) последовательность, могут смещать иммунную реакцию в сторону Тh1 реакции и могут факультативно использоваться вместе с другими адъювантами, таким как цитокины (см., например, Brazolot и др. // Proc. Natt. Acad. Sci. USA 1998. Т. 95. С. 15553-15558; Liu и др. // Blood. 1998. Т. 92. С. 3730-3736; и Klinman и др. // Immunol. 1997. Т. 158. С. 635-3639). Поэтому подразумевается, что для усиления и модулирования должным образом иммунной реакции можно совместно со слиянием Fc-антиген вводить олигонуклеотиды, содержащие CpG. Такие молекулы нуклеиновой кислоты могут быть любой длины, однако предпочтительны олигонуклеотиды длиной более 8 нуклеотидов. Последовательности нуклеиновой кислоты предпочтительно содержат последовательность CpG и более предпочтительно - последовательность пурин-пурин-С- G-пиримидин-пиримидин, причем цитозины в центральном димере CpG не метилированы. Частота наличия динуклеотидов CpG в адъювантной ДНК предпочтительно составляет не менее 5% и более предпочтительно около 10%. Например, в качестве адъюванта можно использовать двунитевую форму олигонуклеотида TCCATGACGTTCCTGACGTT (SEQ ID NO: 22). В зависимости от того, к какому типу иммунной реакции стремятся, может оказаться полезным комбинировать нуклеиновую кислоту с квасцами.
Настоящее изобретение использует для создания слитых с Fc белков, полезных в практике применения изобретения, общепринятые методики для рекомбинантной ДНК. Конструкции слияния с Fc предпочтительно создаются на уровне ДНК, полученные ДНК включают в экспрессирующие векторы и экспрессируют, чтобы получить слитые белки Fc-антиген или Fc-адъювант в соответствии с изобретением. В том смысле, как он использован здесь, термин “вектор” понимается как означающий любую нуклеиновую кислоту, представляющую собой нукпеотидную последовательность, которая способна быть введенной в клетку-хозяина, рекомбинировать с геномом клетки-хозяина и интегрироваться в геном клетки-хозяина или автономно реплицироваться в виде эписомы. Такие векторы включают линейные нуклеиновые кислоты, плазмиды, фагемиды, космиды, РНК-векторы, вирусные векторы и т.п. Неограничивающие примеры вирусного вектора включают ретровирус, аденовирус и адено-ассоциированный вирус. В том смысле, как он использован здесь, термин “экспрессия гена” или “экспрессия” слитого с Fc белка понимается как означающий транскрипцию последовательности ДНК, трансляцию транскрипта - мРНК и секрецию продукта синтеза слитого с Fc белка. Каждый из слитых с Fc белков, содержащих IL2, CD26, Tat, Rev, OSF-2, blG-Н3, рецептор IgE, PSMA или gp120, был экспрессирован с использованием системы экспрессии указанного здесь типа. Такие же или подобные экспрессируемые конструкции раскрыты в патентах США №№5541087 и 5726044.
В качестве альтернативы слиянию белков с помощью техники генетической инженерии для слияния частей молекул белков, может быть использована химическая конъюгация с применением обычных химических сшивающих агентов.
Основные векторы, пригодные в практике применения настоящего изобретения, содержат селектирующий маркер, например ген, кодирующий дигирофолат-редуктазу (ДГФР), запускаемый последовательностями регуляции транскрипции, полученными, например, из вируса SV40, и последовательностями бактериальной плазмиды для селекции и поддержания плазмиды в Е. coli. Экспрессия последовательностей для слитого с Fc белка запускается последовательностями промотора и (факультативно) энхансера, например последовательностями промотора и энхансера цитомегаловируса (ЦМВ, CMV).
Если слитый с Fc белок или нуклеиновая кислота, кодирующая такой слитый белок, должны быть введены людям, тогда кодирующие слитый с Fc белок последовательности предпочтительно начинаются в направлении от 5' к 3' с “лидерной последовательности”, имеющей происхождение, например, от легкой цепи (L) антитела, слитой с сохранением рамки считывания по меньшей мере с частью тяжелой цепи иммуноглобулина или ее мутантной формы, предпочтительно от области Fcγ1 гена иммуноглобулина G1 человека. Область Fcγ1 гена иммуноглобулина G1 предпочтительно содержит по меньшей мере часть шарнирного домена и домен СН3, и более предпочтительно содержит по меньшей мере шарнирный домен, домен СН2 и домен СН3. Если слитый с Fc белок должен быть введен мышам, предпочтительные последовательности нуклеиновой кислоты кодируют в направлении от 5' к 3' шарнирную область, домен СН2 и домен СН3 из мышиных антител IgG2a. Карбоксильный конец константной области тяжелой цепи иммуноглобулина при необходимости модифицируют на уровне нуклеиновой кислоты, чтобы обеспечить сшивание лигазой (лигирование) с сохранением рамки считывания с последовательностями, кодирующими либо предварительно выбранный антиген (в случае слияния Fc-антиген), либо иммуностимулирующий цитокин (в случае слияния Fc-адъювант с цитокином). ДНК, кодирующая кассету секреции, может быть либо в геномной конфигурации, либо в конфигурации комплементарной ДНК (кДНК).
Часть ДНК, кодирующая сигнальную последовательность, предпочтительно кодирует пептидный сегмент, который руководит секрецией слитого с Fc белка и после этого отщепляется от оставшегося слитого с Fc белка. Сигнальная последовательность по настоящему изобретению представляет собой полинуклеотид, кодирующий аминокислотную последовательность, которая инициирует транспорт белка сквозь мембрану эндоплазматического ретикулума. Сигнальные последовательности, пригодные в настоящем изобретении, включают сигнальные последовательности легкой цепи антител - например, антител 14.18 (Gillies и др. // J. Of Immunol. Meth. 1989. Т.125. С.191), сигнальные последовательности тяжелой цепи антител, например сигнальные последовательности тяжелой цепи антител МОРС141 (Sakano и др. // Nature. 1980. Т.286. С.5774) и любые другие сигнальные последовательности, известные в данной области (см., например, Watson // Nucleic Acids Research. 1984. Т.12. С.5145).
Сигнальные последовательности хорошо изучены в данной области знания. Известно, что они обычно содержат от 16 до 30 аминокислотных остатков и могут содержать большее или меньшее число аминокислотных остатков. Типичная сигнальная последовательность состоит из трех участков: основного N-концевого участка, центрального гидрофобного участка и более полярного С-концевого участка. Центральный гидрофобный участок содержит от 4 до 12 гидрофобных остатков, которые сквозным образом закрепляют сигнальный пептид в липидном бислое мембраны при транспортировке синтезированного полипептида. После инициирования транспорта сигнальный пептид обычно расщепляется в просвете эндоплазматического ретикулума клеточными ферментами, известными как сигнальные пептидазы. Потенциальные места расщепления сигнального пептида, как правило, подчиняются “правилу (-3, -1)”. Это означает, что типичный сигнальный пептид содержит небольшие нейтральные аминокислотные остатки в положениях -1 и -3 и не содержит в этой области остатков пролина. Сигнальная пептидаза расщепляет такой сигнальный пептид между аминокислотами -1 и +1. Таким образом, сигнальная последовательность может быть отщеплена в процессе секреции от амино-конца слитого белка. Это приводит к секреции слитого белка с Fc, состоящего из Fc-фрагмента иммуноглобулина и целевого белка. Детальное обсуждение последовательностей сигнального пептида дано von Heijne // Nucleic Acids Res. 1986. Т.14. С.4683.
Как очевидно специалистам в данной области, пригодность конкретной сигнальной последовательности для использования в секреторной кассете может потребовать некоторой обычной экспериментальной проверки. Такая экспериментальная проверка включает определение способности сигнальной последовательности управлять секрецией слитого с Fc белка и также определение оптимальной конфигурации кодирования - геномной ДНК или “ДНК - той последовательности, которую можно использовать для достижения эффективной секреции слитых с Fc белков. Дополнительно к этому специалист в данной области способен создать синтетический сигнальный пептид, следуя правилам, установленным von Heijne (см. ссылку выше), и проверить эффективность такой синтетической сигнальной последовательности в обычных экспериментах. Сигнальная последовательность может также иметь название “сигнальный пептид”, “лидерная последовательность” или “лидерные пептиды”.
Предполагается, что для иммунизации реципиента предварительно выбранным антигеном может быть использовано несколько различных способов введения слитых с Fc белков или последовательностей нуклеиновой кислоты, кодирующих слитый белок. Для формирования реакции с участием ЦТЛ можно использовать два различных применения настоящего изобретения. Одно из них основано на инъекции ДНК, кодирующей слитый белок Fc-антиген, а второе основано на введении слитого белка Fc-антиген, способного ввести белок в путь МНС I класса.
Чтобы вызвать иммунную реакцию у млекопитающих, обычно используют инъекцию белковых антигенов. Однако настоящее изобретение обеспечивает также способы доставки антигена в АПК с помощью инъекции ДНК. Обычно используемая техника - это внутримышечная инъекция экспрессирующих ДНК векторов, кодирующих антигенный белок. Имеющиеся сведения позволяют предположить, что клетки мышц экспрессируют белковый антиген, но эти клетки не предъявляют антиген иммунной системе. Напротив, есть уверенность в том, что специализированные АПК, например макрофаги и дендритные клетки, мигрируют к месту инъекции, захватывают антиген и предъявляют его по механизму, пока еще не исследованному. Использование экспрессирующих слитый белок Fc-антиген векторов делает этот процесс более эффективным, поскольку секретируемый слитый белок связывается с АПК более эффективно, чем нативный антигенный белок.
Одно из последствий подхода с применением инъекции ДНК состоит в том, что он часто приводит к появлению как гуморальной, так и клеточной реакции. Обычно для экзогенно введенных белков труднее попасть в путь предъявления на молекулах МНС I класса. Тем не менее, введение слитых с Fc белков по настоящему изобретению усиливает продуцирование цитотоксических клеток. По-видимому, это происходит за счет предъявления предварительно выбранного экзогенного антигена по пути МНС I класса. Сочетания иммунизации ДНК и иммунизации белком может также давать синергический эффект, вначале давая первоначальный толчок иммунной системе, а затем ударно повышая уровень реакции в форме как продуцирования антител, так и появления цитотоксических клеток. Совместное введение со слитым белком Fc-антиген слитого белка Fc-адъювант, например Fc-IL-2, Fc-GMCSF, Fc-IL-12 и Fc-лиганд FIt3 обеспечивает совместное попадание слитых белков в один и тот же клеточный отдел АПК, стимулируя таким образом более мощную иммунную реакцию на предварительно выбранный антиген.
Композиции по настоящему изобретению (например, слитые белки Fc-антиген и/или Fc-адъювант, или последовательности нуклеиновой кислоты, кодирующие такие слитые белки) могут быть введены животному любым подходящим способом: прямо (например, локально, как инъекцией, имплантацией или местным нанесением на участок ткани) или системно (например, парентерально или орально).
Если композиция должна быть введена парентерально (внутривенно, подкожно, офтальмологически, внутрибрюшинно, внутримышечно, трансбуккально, ректапьно, вагинально, интраорбитально, транодермально, интрацеребрально, внутричерепным способом, интраспинально, интравентрикулярно, внутриоболочечным способом, интрацистернально, внутрисуставно, интраназально или аэрозольным способом), то композиция предпочтительно содержит как часть суспензию или раствор в воде или физиологически совместимой жидкости. Так, носитель или наполнитель являются физиологически приемлемыми, если их добавление при введении пациенту необходимой композиции не влияет неблагоприятным образом на электролитный и объемный баланс физиологических жидкостей пациента. Поэтому жидкая среда для лечебного агента может представлять собой нормальный физиологический раствор (например, 9,85% водный раствор NaCl, 0,15 М, рН 7-7,4).
Предпочтительные дозировки слитого белка Fc-антиген на одно введение находятся в пределах от 50 нг/м2 до 1 г/м2, более предпочтительно от 5 мкг/м2 до 200 мг/м2 и наиболее предпочтительно от 0,1 до 50 мг/м2. Предпочтительные дозировки слитого белка Fc-адъювант на одно введение находятся в пределах от 1 нг/м2 до 0,1 г/м2, более предпочтительно от 0,5 мкг/м2 до 20 мг/м2 и наиболее предпочтительно от 10 мкг/м2 до 5 мг/м2. Предпочтительные дозировки нуклеиновых кислот, кодирующих слитые белки Fc-антиген или Fc-адъювант, составляют на одно введение от 1 мкг/м2 до 100 мг/м2, более предпочтительно от 20 мкг/м2 до 10 мг/м2 и наиболее предпочтительно от 400 мкг/м2 до 4 мг/м2.
Ожидается, что максимальной иммунизации можно достичь, производя несколько отдельных иммунизации, например, от одной до трех инокуляций с интервалом от 3 недель до 6 месяцев. Кроме того, как обсуждалось выше, можно достичь максимальных иммунных реакций, чередуя введение слитых с Fc белков и нуклеиновых кислот, кодирующих такие слитые с Fc белки. Ожидается, что слитый белок Fc-антиген или нуклеиновую кислоту, кодирующую слитый белок, можно вводить до введения, одновременно с введением или после введения млекопитающему слитого белка Fc-адъювант или нуклеиновой кислоты, кодирующей слитый белок Fc-адъювант. Предполагается, однако, что оптимальные способы введения, дозировки и режимы бустерной иммунизации могут быть определены обычным экспериментальным исследованием в соответствии с уровнем квалификации в данной области.
Далее изобретение иллюстрируется нижеследующими не ограничивающими примерами.
Пример 1.
Конструирование векторов, экспрессирующих слитые белки Fc-антиген и Fc-адъювант
Чтобы правильно определить иммуногенность слитых с Fc белков на мышиной модели, были сконструированы экспрессирующие векторы с использованием последовательностей нуклеиновой кислоты, кодирующих области Fc мышиного IgG2a. Это снижает риск индукции Fc-фрагментом каждого из слитых белков иммунной реакции у млекопитающего. Кроме того, в качестве партнеров слияния в конструкциях слияния Fc-адъювант были использованы мышиные цитокины, поскольку их биологическая активность имеет высокую видовую специфичность. Таким образом, ранее описанные векторы (Lo и др. // Protein Engineering. 1998. Т.11. С.495-500) были модифицированы (см. фиг.2) путем замены последовательности Fc человеческого IgG1 на последовательности кДНК, кодирующие Fc-фрагмент мышиного lgG2a (патент США №5726044).
Последовательность для Fc мышиного lgG2a клонировали из библиотеки клеток селезенки мыши с помощью амплификации в полимеразной цепной реакции (ПЦР). Праймеры для ПЦР содержали адапторную последовательность для присоединения лидерной последовательности на 5'-конце и уникальный сайт рестрикции Smal/Xmal на 3'-конце для лигирования с последовательностями, кодирующими либо антигены, либо адъювантные цитокины. Последовательности для антигена и адъюванта (цитокина) готовили с сайтом Smal на 5'-конце и с соблюдением рамки считывания между Fc и антигенным или адъювантным белками, а уникальный сайт Xhol располагали сразу после стоп-сигнала трансляции.
Полученная конструкция ДНК кодировала лидерную последовательность легкой цепи, слитую непосредственно с шарнирной областью тяжелой цепи мышиного IgG2a, и продолжалась экзонами СН2 и СН3 мышиного IgG2a и партнером слияния (последовательностями антигена или адъювантного цитокина). Транскрипцию запускали промотором/энхансером CMV (цитомегаловируса), который, как было показано, был полезен для экспрессии в культурах большинства типов клеток, а также для экспрессии в клетках мышц и других типах клеток после инъекции ДНК in vivo. В каждый вектор включали селектируемый маркерный ген дигидрофолат-редуктазы (DHFR), чтобы облегчить селекцию стабильно трансфицированных клонов, так как эти последовательности, необходимые для поддержания плазмидной ДНК в Е. coli.
Нижеследующие типовые конструкции Fc-антиген были созданы введением нужным образом адаптированных последовательностей между уникальными сайтами Smal и ХhоI в вектор, обозначенный pdCs-muFc, где "mu" указывает на то, что Fc имеет мышиное происхождение.
Эктодомен (внеклеточную часть) рецептора IL4 человека (IL-4R) клонировали из одноядерных клеток периферической крови человека (РВМС) с помощью ПЦР -амплификации.
Использовали праймеры 5' GTCCCGGGTATGAAGGTCTTGCAGGAGC (SEQ ID NO: 1) и 5' CCCCTCGAGCTAGTGCTGCTCGAAGGGCTCCCTG (SEQ ID NO: 2), содержавшие сайты рестрикции соответственно Smal и Xhol для внедрения в вектор pdCs-muFc. Условия реакции для этого и последующих клонирований были следующими. Для амплификации целевого гена (генов) использовали препараты полимераз KlenTaq и Polymerase Mix (фирма Clontech, Palo Alto, CA, США) и специфические праймеры. Реакционные смеси содержали в 100 мл: 10 мМ трис-HCI, рН 8,3, 50 мМ KCI, 1,5 мМ MgCl2, 0,01% желатин (вес к объему), 0,2 мМ каждого из дезоксинуклеозид-трифосфатов и 1,25 единицы KlenTaq. Проводили 30 циклов ПЦР, каждый цикл включал тепловую денатурацию при 94°С в течение 1 мин, отжиг при 42°С в течение 45 сек и удлинение праймера при 72°С в течение 1 мин. Затем амплифицированный продукт субклонировали в вектор SK vector (Stratagene, San Diego, CA, США) и нуклеотидную последовательность его ДНК проверяли стандартной техникой секвенирования.
Эктодомен простато-специфичного мембранного антигена (PSMA) клонировали из линии клеток LnCAP карциномы простаты (АТСС CRL1740) с помощью ПЦР с праймерами 5' AAGCTTAAATCCTCCAATGAAGC (SEQ ID NO: 3) и 5' CTCGAGTTAGGCTACTTCACTCAAAG (SEQ ID NO: 4) соответственно для смысловой и антисмысловой нитей. Проверяли нуклеотидную последовательность ДНК, и ПЦР-фрагмент вставляли в вектор pdCs-muFc, чтобы получить слитую конструкцию pdCs-muFc-PSMA.
Эктодомен ЕрСАМ человека (известный также как антиген KS) и поверхностный белок клеток эндотелия, регулируемый со стимуляцией в большинстве клеток карциномы, клонировали из клеток LnCAP с помощью ПЦР с праймерами 5' CCCCGGGTAAACAGGAAGAATGTGTCTGTG (SEQ ID NO: 5) и 5' CTCGAGTCATTTTAGACCCTGCATTGAG (SEQ ID NO: 6) соответственно для смысловой и антисмысловой нитей. С помощью стандартной методики секвенирования проверяли нуклеотидную последовательность ДНК и ПЦР-фрагмент вставляли в вектор pdCs-muFc, чтобы получить слитую конструкцию pdCs-muFc-EpCAM. Другой вектор конструировали, используя эктодомен ЕрСАМ в качестве партнера слияния на N-конце, и в этом случае ПЦР-продукт включал природную лидерную последовательность кДНК ЕрСАМ и последовательность зрелого эктодомена до границы пронизывающего мембрану домена. Конец 3' этого ПЦР-продукта содержал вставленный сайт рестрикции AflII для лигирования к 5'-сайту AflII мышиного фрагмента Fc. Используемые праймеры для ПЦР включали 5' TCTAGAGCAGCATGGCGCCCCCGC (SEQ ID NO: 7) и 5' CCTTAAGCACCCTGCATTGAGAATTCAG (SEQ ID NO: 8). В этом случае мышиный фрагмент Fc не содержал 3'-сайта вставления для внедрения слитого белка, но зато на конце последовательности, кодирующей Fc, содержал сигнал терминации трансляции.
Как пример последовательности короткого полипептидного антигена в качестве слитого с Fc белка была экспрессирована относительно сохраняющаяся часть проксимальной по отношению к мембране области gp41 ВИЧ, простирающаяся от сайта HindIII до остатка лизина, соседнего с пронизывающим мембрану участком. Хотя была использована последовательность белка из штамма IIIB ВИЧ, кодирующая последовательность была оптимизирована для оптимальной экспрессии в эукариотической клетке использованием кодонных вариантов с высоким содержанием GC. Последовательность ДНК, кодирующая аминокислотные остатки с 626 по 669, имеющая следующий состав: С CCG GGA ТСС CTG АТС САС ТСС CTG АТС GAG GAA TCC CAG AAC CAG САА GAG AAG AAC GAG CAG GAG CTG CTG GAG CTC GAC AAG TGG GCC TCC CTG TGG AAC TGG TTC AAC ATC ACC AAT TGG CTG TGG TAC ATC AAG TGA CTCGAG (SEQ ID NO: 9), была синтезирована химическим способом и вшита в вектор pdCs-muFc. Аминокислотная последовательность слитого полипептида была следующей: SLIHSLIEESQNQQEKNEQELLELDKWASLWNWFNITNWLWYIK (SEQ ID NO: 10).
Последовательности, кодирующие другие белки ВИЧ, были использованы для конструирования слитых белков Fc-антиген, как описано ранее (патенты США №№5541087 и 5726044), с использованием Fc мышиного IgG2a вместо исходного Fc человеческого lgG1. Эти конструкции представляют дальнейшие варианты осуществления настоящего изобретения.
Таким же путем, как и для слитых белков Fc-антиген, был сконструирован набор слитых белков Рс-адъювант(цитокин), содержащих Fc мышиного IgG2a и несколько мышиных цитокинов. Конкретные цитокины и праймеры для клонирования обсуждаются ниже.
Мышиный IL-2 клонировали из одноядерных клеток периферической крови мыши (РМВС) с помощью ПЦР с использованием следующих ПЦР-праймеров:
5' GGCCCGGGTAAAGCACCCACTTCAAGCTCC (SEQ ID NO: 11) (смысловой) и 5' CCCTCGAGTTATTGAGGGCTTGTTG (SEQ ID NO: 12) (антисмысловой).
Мышиный GMCSF клонировали из мышиных РВМС с помощью ПЦР с использованием следующих ПЦР-праймеров:
5' CCCGGGAAAAGCACCCGCCCGCTCACCC (SEQ ID NO: 13) (смысловой) и 5' CTCGAGTCATTTTTGGCTTGGTTTTTTGC (SEQ ID NO: 14) (антисмысловой).
Лиганд FIt3 мыши клонировали из тимуса мыши с помощью ПЦР с использованием следующих ПЦР-праймеров:
5' CAAGCTTACACCTGACTGTTACTTCAGC (SEQ ID NO: 15) (смысловой) и 5' CTCGAGTCAAGGCTCTGGGAGCTCCGTGGC (SEQ ID NO: 16) (антисмысловой).
Мышиный IL-12p35 клонировали из мышиных РВМС с помощью ПЦР с использованием следующих ПЦР-праймеров:
5' CCCCGGGTAGGGTCATTCCAGTCTCTGG (SEQ ID NO: 17) (смысловой) и 5' CTCGAGTCAGGCGGAGCTCAGATAGC (SEQ ID NO: 18) (антисмысловой).
Мышиный IL12 р40 клонировали из мышиных РВМС с помощью ПЦР с использованием следующих ПЦР-праймеров:
5' TCTAGACCATGTGTCCTCAGAAGCTAAC (SEQ ID NO: 19) (смысловой) и 5' CTCGAGCTAGGATCGGACCCTGCAG (SEQ ID NO: 20) (антисмысловой).
Все продукты ПЦР, кроме мышиного IL-12 р40, клонировали в виде фрагментов от сайта Smal до сайта Xhol, анализировали по стандартной методике секвенирования ДНК и вшивали в вектор pdCs-muFc, содержащий в качестве последовательности для Fc последовательность для Fc мышиного IgG2. Продукт ПЦР для мышиного IL-12 р40 экспрессировали отдельно (не как слитый с Fc белок) в векторе, содержащем такой же энхансер CMV, слитую непосредственно с последовательностью для зрелой субъединицы р40 мышиного IL-12 лидерную последовательность легкой цепи и ген устойчивости к неомицину вместо селектирующего маркерного гена DHFR в векторе pdCs-muFc. Полученный вектор назвали pNC-mp40, где N означает селектирующий ген устойчивости к неомицину.
Все плазмидные конструкции индуцировали синтез и секрецию конкретных слитых белков путем преходящей экспрессии в клетках 293 почки человека. Вкратце, плазмиды вводили в монослойные культуры клеток 293 почки человека с помощью соосаждения с фосфатом кальция (Sambrook и др. // Molecular Cloning - A Laboratory Manual. Cold Spring Harbor. N.Y., 1989). Клетки оставляли на ночь (16 ч), промывали PBS и добавляли к ним свежую питательную среду DMEM с добавкой 10% сыворотки плода коровы - fetal bovine serum (FBS), Еще через 2-3 дня культуральную жидкость анализировали на наличие секретированных слитых белков с помощью специфического для Fc твердофазного иммуноанализа ELISA (Gillies и др. // J.Immunol. Methods. 1989. Т.125. С.191) с использованием антител, специфичных для области мышиного белка IgG-Fc. В случае мышиного Fc-IL12 ДНК плазмид, экспрессирующих и Fc-p35, и Fc-p40, кратковременно экспрессировалась в одной и той же культуре клеток, так что гетеродимерный слитый с цитокином белок собирался перед секрецией из клеток (Gillies и др. // J.Immunol. 1998. Т.160. С.6195).
Далее, стабильно трансфицированные клетки, экспрессирующие различные слитые с Fc белки, создавали введением линеаризованной ДНК в клетки NS/0 миеломы мыши стандартным методом электропорации. Вкратце, клетки суспендировали в кювете прибора Gene Pulser (BioRad) при плотности 107клеток/мл, 0,5 мл суспензии смешивали с 10 мкг ДНК и смесь охлаждали во льду в течение 10 мин. Электропорацию проводили в приборе Gene Pulser (BioRad) с параметрами 0,25 В и 500 мкФ. Клеткам давали восстановиться в течение 10 мин во льду, после чего их ресуспендировали в питательной среде и переносили в планшеты с 96 ячейками. Каждые 2-3 дня начиная со 2-го дня после электропорации к клеткам добавляли свежую питательную среду для селекции, содержащую 0,1 мкМ метотрексат. Выросшие на планшетах устойчивые к лекарству колонии проверяли на экспрессию с помощью специфичной для Fc методики ELISA.
Для экспрессии слитого белка muFc-IL12 трансфицированную линию клеток NS/0, уже экспрессирующие субъединицу р40 мышиного IL-12, трансфицировали, как описано выше, вектором, экспрессирующим слитый белок (Fc мыши)-(субъединица р35). Линию, экспрессирующую р40, получали электропорацией клеток NS/0 в присутствии вектора pNC-mp40, описанного выше, и селекцией в среде, содержащей аналог G418 неомицина (Life Sciences Technologies). После второй трансфекции проводили скрининг клонов выживших клеток с помощью специфичного для Fc ELISA и специфичного для мышиного IL-12 ELISA (Genzyme, Cambridge, MA, USA).
Структурную целостность полученных слитых белков проверяли электрофорезом в полиакриламидном геле в присутствии SDS (SDS-PAGE). Вначале слитые белки связывали с малым объемом (10-20 мкл на 1 мл среды) сорбента (белок А)-сефароза (Repligen, Needham, MA, США). Связанный материал промывали PBS с 0,01% твина-20, потом элюировали буфером с SDS для электрофореза и затем кипятили в течение 2 мин в присутствии 5% 2-меркаптоэтанола. После этого восстановленные белки подвергали электрофорезу в заранее приготовленных гелях SDS-PAGE и окрашивали Кумасси голубым. Масштабированную очистку продуктов из стабильных клонов клеток осуществляли на колонках с сорбентом (белок А)-сефароза (Repligen, Needham, MA, США) в соответствии с инструкциями поставщика.
Пример 2.
Иммуногенность слитого белка Fс-антиген и влияние химических или Fc-цитокин адъювантов на продуцирование антител
Приготовленную в Примере 1 конструкцию слияния Fc мыши (muFc) с альфа-субъединицей IL-4R человека (hulL-4Rα), muFc-hulL-4Rα использовали в качестве антигена для проверки на животной модели возможного адресующего в АПК действия этих белков. Эктодомен альфа-субъединицы IL-4R представляет собой молекулу с достаточно высокой консервативностью в пределах различных видов, имеющую между человеческим и мышиным вариантами идентичность последовательностей более 50%.
Группам мышей вводили подкожно по 50 мкг слитого белка Fc-антиген (Fc-IL-4R) либо в PBS, либо в виде эмульсии в полном адъюванте Фрейнда (CFA). Некоторым группам вводили также (в смеси с Fc-IL-4R) дозы по 5 мкг слитого белка Fc-адъювант -Fc-IL2 или Fc-GMCSF. Спустя две недели мышам вводили ту же смесь, но уже в брюшную полость. Составы с CFA образовывали мицеллы, которые служили источником медленно высвобождаемого антигена, обеспечивая постоянную стимуляцию иммунной системы. Белки микобактерий в CFA индуцировали также сильную воспалительную реакцию, стимулируя выброс цитокинов, что дополнительно усиливало иммунную реакцию. Однако CFA обладает сильным побочным действием, в том числе вызывает повреждения кожи, что делает недопустимым его применение у людей. Однако смеси со слитыми белками Fc-адъювант PBS не вызывали ни у одного из животных никаких видимых кожных реакций и никаких других явных признаков токсичности.
Через две недели после бустерной иммунизации (т.е. через 28 дней после первой инъекции) у животных брали кровь и получали сыворотку, давая цельной крови свертываться в центрифужных пробирках, удаляя клетки и сгустки скоростным центрифугированием при 12000 об/мин в течение 5 мин и отбирая надосадочную жидкость. Полученные сыворотки разбавляли буфером для анализа (PBS с 0,01% твина-20) и определяли в них антитела, реагирующие с человеческим IL-4R. Проводили специфический к антигену иммуноферментный анализ ELISA, используя планшеты с 96 ячейками, покрытыми слитым белком с Fc человека (huFc-hulL-4R). В каждую ячейку вводили по 100 мкп раствора этого белка с концентрацией 5 мкг/мл в PBS и инкубировали ночь при 4°С. Затем покрытые антигеном планшеты промывали и перед использованием блокировали блокирующим буфером (1% BSA и 0,01% твин-20 в PBS). Разбавленные испытуемые сыворотки инкубировали в ячейках в течение 2 ч при комнатной температуре, затем ячейки промывали 8 раз буфером для анализа. Добавляли вторичные антитела, специфичные к антителам к Fc мыши, конъюгированные с пероксидазой хрена (разбавление 1:2000, Jackson ImmunoResearch), и планшеты инкубировали еще в течение 1 часа. После еще 8 промывок буфером для анализа добавляли раствор орто-фенилендиамин-дигидрохлорида (ОФД), содержавший 50 мМ Na2HPO4, pH 5 и 0,03% добавленной непосредственно перед использованием Н2O2. Приблизительно через 30 мин реакцию останавливали добавлением 100 мкл 4Н H2SO4. Затем планшеты сканировали при 490 нм в считывающем устройстве с автоматическим вычитанием фоновых отчетов при 650 нм. Результаты выражали зависимостью оптической плотности (ОП) от разведения антисыворотки. Относительные титры антител были определены как количество сыворотки, которое нужно разбавить, чтобы оптическая плотность оказалась ниже некоей произвольно выбранной величины, например 1 ед. ОП.
Результаты процедур иммунизации представлены на фиг.3. Инъекция одного слитого белка muFc-IL-4R в PBS индуцировала образование антител только у одной мыши (фиг.3В). Однако добавление CFA приводило к увеличению числа дающих антитела мышей, но титры были приблизительно такими же, как и у мышей, которым был введен только слитый белок FC-IL4R в PBS (фиг.3С). Совместное с Fc-IL4R введение адъюванта muFc-IL2 в PBS индуцировало образование антител у всех мышей, однако количество вырабатываемых антител в каждом случае было разным (фиг.3D). Комбинация CFA и адъюванта muFc-IL2 (фиг.3А) давала индукцию более высоких титров антител, чем давал каждый из агентов поодиночке (фиг.3С и 3D). Совместное введение адъюванта muFc-GMCSF в PBS индуцировало во всех группах наиболее сильную иммунную реакцию (фиг.3Е), в том числе в группе, которая была иммунизирована комбинацией обоих адъювантов - Fc-GMCSF и CFA (фиг.3F). Иными словами, адъювант muFc-GMCSF в PBS, введенный совместно с антигеном muFc-IL4R, избавлял от необходимости использовать CFA. Предполагается, что такой способ более подходит для использования у людей.
Пример 3
Зависимость продуцирования антител к раковому антигену PSMA в составе слитого белка Fc-PSMA от дозы адъюванта Fc-GMCSF
В настоящее время PSMA является привлекательным целевым антигеном, связанным с опухолями человека, так как он мало распространен в нормальных тканях. Сейчас намечены клинические исследования PSMA как кандидата для противоопухолевой вакцины. В этом примере была оценена антигенность PSMA как антигена в составе слитого белка Fc-PSMA.
Слитый белок muFc-PSMA получали, как обсуждалось в Примере 1. Группам мышей вводили подкожно 50 мкг muFc-PSMA в PBS, вместе с различными концентрациями слитого белка Fc-адъювант, а именно Fc-GMCSF, а затем через 14 дней проводили бустерную иммунизацию внутрибрюшинной инъекцией. Титры антител измеряли методом El-ISA со связыванием с антигеном Fc-PSMA, как было описано в примере 2 для слитого белка Fc-IL4R. Результаты представлены на фиг.4 в виде зависимости титра антител (разбавления, при котором ОП снижается до 1) от времени с момента первой инъекции.
В отсутствие Fc-GMCSF титры антител у мышей к PSMA были в пределах от 1000 до приблизительно 20000 (фиг.4А). Однако совместное с антигеном введение даже 0,05 мкг Fc-GMCSF давало титры в диапазоне от 30000 до 140000 (фиг.4В). Десятикратное увеличение количества Fc-GMCSF ещу повышало титры антител к этому раковому антигену (фигуры 4С и 4D). Наивысшая вводимая доза (5 мкг слитого белка Fc-GMCSF на мышь) соответствовала всего лишь около 2 мкг GMCSF на инъекцию. Эта доза не оказывала никакого заметного действия на кожу мышей и не давала никаких признаков на уровне организма, что животные были иммунизированы (см. фиг.4D). Кроме того, в отличие от CFA, не было никакого видимого увеличения селезенки.
Пример 4
Влияние доставки PSMA при посредстве Fc на продуцирование антител в ответ на иммунизацию
Было испытано специфическое действие компонента Fc слитых белков Fc-антиген и Fc-адъювант путем сопоставления индуцированных иммунных реакций у мышей, которым были введены слитые белки, неслитые антигенный или адъювантный белки или смеси указанных выше вариантов. Для этой цели была использована система PSMA человека.
Неслитый PSMA получали протеолитическим расщеплением человеческого слитого белка Fc-PSMA (Lo и др. // Protein Engineering. 1998. Т.Ц.С. 495-500) плазмином в соответствии с инструкциями поставщика. Высвобожденный Fc и нерасщепленный Fc-PSMA удаляли адсорбцией на сорбенте (белок А)-сефароза (Repligen, Needham, MA, США).
Группам мышей (n=3) вводили одиночную подкожную дозу 50 мкг PSMA - либо одного (фиг.5А), либо в комбинации с 0,2 мкг свободного GMCSF (фиг.5В) или с 0,5 мкг Fc-GMCSF (фиг.5С) (0,5 мкг Fc-GMCSF содержит около 0,2 мкг GMCSF). В другой группе мышей каждой мыши вводили одну подкожную дозу 50 мкг слитого белка Fc-PSMA либо одного (фиг.5D), либо вместе с 0,2 мкг свободного GMCSF (фиг.5Е) или с 0, 5 мкг Fc-GMCSF (фиг.5F). Все инъекционные составы были в PBS без химического адъюванта. На 14-й день после иммунизации измеряли количество антител, реагирующих с muFc-PSMA.
Значение компонента Fc слитого белка Fc-антиген в слитом белке Fc-PSMA для иммуногенности PSMA было разительным, когда животных иммунизировали составами в PBS без химических адъювантов. Важно, что к PSMA, введенному в PBS, не было первичной иммунной реакции (фиг.5А). Добавление в иммунизацию GMCSF или Fc-GMCSF давало очень слабый эффект (фигуры 5В и 5С) за исключением очень слабой реакции у одного из животных (фиг.5В). Наоборот, у всех животных, которым был введен только Fc-PSMA, обнаруживалась сильная первичная иммунная реакция (фиг.5D). Добавление к Fc-PSMA свободного GMCSF несколько подстегивало эффект (фиг.5Е), однако совместное введение и антигена, и цитокина в виде слитых с Fc белков давало наивысший уровень иммунной реакции (фиг.5F).
Эти результаты показывают, что комбинация слитых белков Fc-антиген и Fc-адъювант особенно полезна для формирования иммунной реакции и демонстрирует очевидную пользу совместной локализации антигена и стимулирующего цитокина in vivo, предположительно в АПК.
Пример 5
Сравнение адъювантного действия слитых белков Fc-GMCSF или Fc-Flt3L
Было установлено, что лиганд для Flt3, который специалисты в этой области называют также FIt3-лиганд (Flt3L), играет определяющую роль в возникновении и созревании дендритных клеток (Soligo и др. // Br. J.Haematol. 1998. Т.101. С.352-363). Считают, что дендритные клетки вместе с клетками тканевых макрофагов являются наиболее важными АПК. Исследования на мышах показали, что ежедневные инъекции в течение 10 дней повышают число и антиген-предъявляющую активность дендритных клеток, извлекаемых из лимфатической ткани и селезенки, и что эти клетки чрезвычайно активны в предъявлении антигена как CD4+, так и CD8+ Т-клеткам. Есть основания считать, что клетки Лангерганса кожи представляют один из типов дендритных клеток, способных предъявлять антиген после захвата и миграции к локальным лимфатическим узлам. Поскольку есть уверенность, что большинство дендритных клеток не экспрессируют множество рецепторов для Fc, обычно обнаруживаемых на макрофагах (например, FcγRI), невозможно было предсказать, что действие совместной локализации слитых с Fc белков будет включать такое происхождение АПК.
Чтобы проверить, может ли Fit-31-действовать как адъювант, группам мышей вместо Fc-GMCSF (активный стимулятор макрофагов и гранулоцитов) вводили muFc-PSMA и muFc-FLt3L. В этом случае ожидалось, что любой адъювантный эффект будет следствием активации дендритных клеток и захвата ими, что в конечном счете приведет к выработке антител к PSMA. Результаты суммированы на фиг.6.
Это исследование показывает, что muFc-Flt3L является высокоактивным адъювантом, стимулирующим выработку антител к PSMA так же хорошо или даже лучше, чем Fc-GMCSF в такой же дозе. Результаты подтверждают наблюдение, что комбинация слитых белков Fc-антиген и Fc-адъювант может быть особенно эффективна в индукции иммунной реакции. Результаты показывают также, что Fc-антиген и Fc-цитокин могут адресованно направляться и на дендритные АПК, и на макрофагальные АПК, что позволяет предположить, что на этих клетках имеется по крайней один вид рецептора для Fc.
Пример 6
Иммунные реакции на слитые белки Fc-EpCAM и EpCAM-Fc
Ещу один потенциально важный раковый антиген человека, ЕрСАМ (называемый также антиген KSA и антиген 17-1А), был получен в форме слитого белка с областью Fc мышиного IgG2a с использованием плазмид и методов, описанных в примере 1, и введен либо только один, либо в комбинации с Fc-GMCSF в качестве адъюванта. Инъекция мышам производилась подкожно с бустерным введением 3 недели спустя 10 мкг Fc-EpCAM и 1 мкг Fc-GMCSF в PBS. Контрольные мыши не получали Fc-GMCSF. Титры антител к ЕрСАМ измеряли через 7 дней (фиг.7А) и 14 дней (фиг.7В) после бустерной иммунизации. Результаты показывают, что Fc-EpCAM, введенный один, является активным иммуногеном (незаполненные ромбы), и что Fc-GMCSF может дополнительно усиливать реакцию на этот антиген (зачерненные треугольники).
В дополнение к этому антиген ЕрСАМ экспрессировали в противоположной ориентации по отношению к фрагменту Fc в виде слитого белка EpCAM-muFc (см. Пример 1, фиг.1В). Эту молекулу использовали для иммунизации мышей Balb/c при подкожном введении. Использовали более высокие дозы (25 мкг на дозу) слитого белка EpCAM-Fc и количество адъюванта также повышали (2,5 мкг Fc-GMCSF). Титры антител к ЕрСАМ измеряли через 14 дней (фиг.8А) и 21 день (фиг.8В) после иммунизации. Один слитый белок EpCAM-Fc был весьма иммуногенен в отсутствие Fc-GMCSF (фигуры 8А и 8В, незаполненные ромбы). Добавление слитого белка Fc-цитокин повышало титр антител приблизительно в 3 раза (фигуры 8А и 8В, зачерненные треугольники).
Чтобы проверить, может ли иммунная реакция на ЕрСАМ защитить млекопитающих от экспрессирующих этот антиген опухолевых клеток, неиммунизированным мышам или мышам, иммунизированным слитым белком EpCAM-Fc (в некоторых случаях с добавлением Fc-цитокинов) в хвостовую вену вводили 105 клеток СТ 26 рака толстой кишки мыши, трансфицированных человеческим ЕрСАМ (Gillies и др. // J.Immunol. 1998. Т.160. С.6195). Через 21 день животных забивали и оценивали развитие легочных метастазов (1) путем определения стадии покрытия поверхности легких и (2) взвешивая легкие и сопоставляя их с легкими нормальных животных, для определения прибавки веса за счет массы опухоли. Суммированные в Таблице 1 результаты показывают, что у всех иммунизированных мышей наблюдалось по сравнению с контрольными мышами достоверное уменьшение метастазирования опухоли, в том числе у животных, иммунизированных только слитым белком EpCAM-Fc. Подобные же результаты были получены при использовании в качестве антигена слитого белка Fc-EpCAM.
Регистрация метастазов основывалась на покрытии поверхности легких с использованием следующих градаций: 1 - покрытие 1-25%; 2 - покрытие 26-50%; 3 - покрытие 51-75%; 4 - покрытие 76-100%.
Пример 7
Комбинация слияния антиген-Fc и адъювантного цитокина в одном слитом белке
Описанный в примере 6 белок EpCAM-Fc является примером N-концевого антигена, прикрепленного к области Fc иммуноглобулина как к карбоксильному белковому домену. Этот белок, так же как и другие, может быть введен совместно со слитыми белками типа Fc-адъювант, например, с Fc-цитокинами, для подстегивания иммунной реакции на антиген. В качестве альтернативы, сочетание антигена, константной области тяжелой цепи иммуноглобулина и адъювантного белка (например, цитокина) может быть осуществлено в виде одного слитого белка, например в виде слитого белка EpCAM-Fc-GMCSF.
Экспрессирующая плазмида для этого белка была сконструирована с использованием последовательностей для Fc мышиного IgG2a и GM-CSF, так что конструкцию можно было проверить на мышиной модели. Из исходного экспрессирующего EpCAM-Fc вектора (Пример 1) был получен малый фрагмент между Xbal и Smal, содержащий кодирующие последовательности для слияния лидер-EpCAM-Fc, и лигирован в большой фрагмент между сайтами Smal и Xbal вектора, экспрессирующего Fc-GMCSF (фиг.9).
Полученный вектор pdCs-EpCAM-Fc-GMCSF вводили для временной экспрессии в клетки 293 с помощью метода соосаждения с фосфатом кальция, а для стабильной экспрессии - в клетки NS/0 с помощью электропорации. Стабильные трансфектанты отбирали при культивировании клеток в среде, содержащей метотрексат (0,1 мкМ). Экспрессирующие клоны идентифицировали методом Fc-ELISA (см. Пример 1) высокоактивные продуценты размножали как культуру. Очистку белка EpCAM-Fc-GMCSF из культуральной среды осуществляли связыванием с сорбентом (белок А)-сефароза (Repligen, Needham, МА, США) с последующим элюированием, структурную полноценность проверяли методом SDS-PAGE с последующим восстановлением 2-меркаптоэтанолом. Результаты показали, что белок имел молекулярный вес около 90 кДа, как и ожидалось для слияния в одной цепи ЕрСАМ, Fc и GMCSF.
Чтобы сопоставить относительную иммуногенность комбинированного слитого белка, мышам вводили подкожно эквивалентные дозы EpCAM-Fc-GMCSF и индивидуальных слитых белков в комбинации: EpCAM-Fc и Fc-GMCSF. Такую же инъекцию повторяли спустя 14 дней, а через 7 дней после бустерной иммунизации определяли в пробах сыворотки активность специфических антител к человеческому ЕрСАМ. Такой же подход может быть использован для других белковых или пептидных антигенов, так же как и для других стимулирующих цитокинов, таких как IL-2, IL-12 и FIt3L.
Пример 8
Иммунизация слитым белком Fc-антиген путем инъекции ДНК
Такие же плазмидные векторы, которые были использованы для трансфекции и продуцирования muFc-EpCAM и EpCAM-Fc в клетках млекопитающих (см. Пример 1), были введены как “голая” плазмидная ДНК инъекцией в мышцу задней ноги группам мышей Balb/c. ДНК вводили в концентрации 0,5 мг/мл, общее ее количество 100 мкг вводили или в PBS, или в растворе сахарозы 25% (вес к объему). Инъекции повторяли каждые 3 недели - всего 3 инъекции. Уровни выработки антител измеряли в различные моменты времени и количественно определяли с помощью ELISA. Для связывания использовали планшеты с 96 ячейками, покрытыми huFc-EpCAM, для детектирования использовали конъюгированные с пероксидазой хрена поликлональные антитела, специфичные для мышиного Fc (Jackson ImmunoResearch). Представленные на фиг.10 данные показывают титры антител через 14 дней (фиг.10А), 27 дней (фиг.10В), 55 дней (фиг.10С) и 69 дней (фиг.10D) после инъекции.
Представленные на фиг.10 результаты показывают, что в течение первого месяца при использовании обоих составов индуцировались низкие титры специфических к ЕрСАМ антител (фигуры 10А и 10В). Намного более высокие титры были получены к 55 дню (фиг.10С) и ещу более высокие к 69 дню (фиг.10D). Подобные же результаты были получены при инъекции ДНК в виде вектора, экспрессирующего EpCAM-Fc, хотя титры были ниже. Эти данные показывают, что антиген, экспрессированный как слитая молекула, содержащая белковый антиген и область Fc иммуноглобулина, может индуцировать иммунную реакцию, если он введен инъекцией “голой” ДНК, и что постоянное экспонирование с антигеном приводит у большинства животных к затянутой иммунной реакции.
Клеточные иммунные реакции определяли путем культивирования стимулированных in vitro различными концентрациями белка Fc-EpCAM спленоцитов из вакцинированных ДНК или иммунизированных белком мышей (через 70 дней после инъекции). Представленные на фиг.11 данные (верхняя рамка, фиг.11А) показывают пролиферативную реакцию на антиген (измеренную по включению3H-тимидина) у животных, иммунизированных либо белком Fc-EpCAM (крестики) или вакцинацией ДНК с экспрессирующими векторами (промотор CMV)-EpCAM-Fc (незаполненные кружки) или (промотор CMV)-Fc-EpCAM (зачерненные ромбы). Иммунизированные белком животные давали намного более выраженную реакцию на антиген даже при очень низких дозах. Реакции у вакцинированных ДНК животных (представленные также в другом масштабе в нижней рамке, фиг.11В) зависели от дозы, но были ниже по величине, чем у мышей, которым был введен белок. Эти реакции были характерны для ограниченных классом II главной тканевой совместимости CD4+ Т-клеточных реакций.
Чтобы проверить цитотоксическую активность (обычно указывающую на ограниченные классом I главной тканевой совместимости Т-клеточные реакции), культуры спленоцитов из иммунизированных ДНК или белком мышей культивировали в течение 5 дней в присутствии приблизительно 10 ед/мл IL-2. Эффекторными клетками были культивируемые спленоциты, а клетками-мишенями служили либо меченые клетки СТ26 карциномы прямой кишки, экспрессирующие человеческий ЕрСАМ (сингенные для мышей Balb/c), либо меченые исходные клетки (нетрансфицированные клетки СТ26). Эффекторные клетки и клетки-мишени смешивали в различных соотношениях и определяли степень лизиса. Степень лизиса, принятую за 100%, получали инкубацией меченых клеток-мишеней в присутствии детергента и измерением высвобожденной метки.
Результаты представлены на фиг.12, где фиг.12А показывает активность спленоцитов по отношению к клеткам СТ26, экспрессирующим человеческий ЕрСАМ, а фиг.12В показывает активность спленоцитов по отношению к исходным клеткам СТ26. На обеих фигурах незаполненные ромбы соответствуют спленоцитам, выделенным из мышей, иммунизированных ДНК, содержащей конструкцию с ЕрСАМ, незаполненные квадраты соответствуют спленоцитам, выделенным из мышей, иммунизированных ДНК. содержащей конструкцию со слиянием Fc-EpCAM, незаполненные треугольники соответствуют спленоцитам, выделенным из мышей, иммунизированных ДНК, содержащей конструкцию со слиянием EpCAM-Fc, а крестики соответствуют спленоцитам, выделенным из мышей, иммунизированных слитыми белками Fc-EpCAM.
Фиг.12 показывает, что хотя вакцинация ДНК вызывает слабую цитотоксическую реакцию по отношению к обоим типам клеток-мишеней, у иммунизированных белком мышей обнаруживалась значительно более высокая цитотоксичность. В тестовой системе убивались и исходные клетки опухоли СТ26, и клетки опухоли СТ26, экспрессирующие ЕрСАМ. Наблюдаемая цитотоксичность по отношению к исходным клеткам СТ26 может быть следствием того, что эти клетки могут экспрессировать большие количества мышиного гомолога ЕрСАМ, который на аминокислотном уровне имеет идентичность около 81% с человеческим белком. Однако иммунизация белком Fc-EpCAM не вызывает заметной цитотоксической активности по отношению к клеткам опухоли СТ26, экспрессирующим человеческий ЕрСАМ, и это объясняет высокую противоопухолевую активность, описанную в примере 6.
Пример 9
Иммунизация слитым с Fc белком, содержащим суб-область белкового опухолевого антигена
Хотя некоторые полномерные белки не могут быть применимы в качестве антигенов для иммунотерапии, суб-области белков меньшего размера могут быть намного более эффективными. Например, белки могут содержать домены, которые модифицированы на пост-трансляционном уровне, чтобы сделать их менее иммуногенными, и это снижает иммунореактивность по отношению к реальному полипептидному компоненту. Крупные белки могут индуцировать образование антител, которые реагируют только с неполипептидными частями антигена и не участвуют в создании зависящей от антител клеточной цитотоксичности (ADCC) - потенциально важного компонента в антиопухолевых иммунных реакциях. Хорошим примером такой ситуации может служить специфический для меланомы человека антиген – хондроитинсульфат-протеогликан (MCSP), который экспрессируется фактически во всех меланомах, а также в некоторых типах рака мозга. Этот белок высоко гликозилирован и далее модифицирован прикреплением нескольких глюкозаминогликановых цепей. Антитела, известные как 9.2.27 (Bumol и др. // Proc. Natl. Acad. Sci. USA. 1982. Т.79. С.1245-1249), связываются с этим белком с высоким сродством, но не осуществляют никакой эффекторной функции - ни ADCC, ни опосредованной комплементом цитотоксичности (CDC). Даже частично “очеловеченные” (химерные) формы этих антител не могут осуществлять такие типы активности.
Чтобы вызвать более сфокусированные реакции на более оптимизированные области-мишени этой большой молекулы, в этой белковой последовательности были идентифицированы предполагаемые места прикрепления гликана (Pluske и др. // Proc. Natl. Acad. Sci. USA. 1996. Т.93. С.9710-9715). Была выбрана суб-область, не очень удаленная от пронизывающей мембрану клеточной поверхности последовательности и находящаяся на некотором расстоянии от мест прикрепления гликана.
Последовательность для пептида:
QGATLRLDPTVLDAGELANRTGSVPRFRLLEGRHGRVVRVPRARTEPGGSQL VEQFTQQDLEDGRLGLEVGRPEGRAPGPAGD (SEQ ID NO: 21) была переведена в последовательность ДНК, эту последовательность ДНК синтезировали химически и вшивали лигазой в экспрессирующий вектор pdCs-Fc-X с использованием тех же сайтов рестрикции, как и в более ранних примерах. На 3'-конце был добавлен сайт терминации трансляции сразу после последовательности, кодирующей последнюю аминокислоту, после чего следовал уникальный сайт Xhol. Полученную экспрессирующую плазмиду вводили электропорацией в клетки миеломы NS/0 и экспрессирующие требуемый белок стабильные трансфектанты получали, как описано в примере 1.
Очистку белка Fc-MCSP из культуральных жидкостей проводили с помощью хроматографии на (белок А)-сефарозе (Repligen, Needham, MA, USA). Титры антител измеряли у мышей Balb/c, иммунизированных подкожным введением 50 мкг слитого белка Fc-MCSP в PBS - либо одного, либо в комбинации с 5 мкг Fc-GMCSF в качестве адъюванта. Результаты представлены на фиг.13. Зачерненные ромбы соответствуют титрам антител в нормальной сыворотке, незаполненные квадраты соответствуют титрам антител в сыворотке мышей, иммунизированных Fc-MCSP, а зачерненные треугольники соответствуют титрам антител в сыворотке мышей, иммунизированных Fc-MCSP с Fc-GMCSF в качестве адъюванта.
На 14-й день после иммунизации были зарегистрированы специфические антитела к этой суб-области MCSP, количество которых существенно увеличивалось после бустерной иммунизации. Результаты показывают, что мыши, иммунизированные и Fc-GMCSF, и Fc-MCSP, давали более высокие титры антител к MCSP (зачерненные треугольники), чем мыши, иммунизированные только MCSP (незаполненные квадраты).
Пример 10
Иммунизация слитым с Fc белком, содержащим вирусный антиген
Разработка эффективной вакцины против вируса иммунодефицита человека (ВИЧ) - вируса, вызывающего СПИД, является одной из наиболее важных задач в исследованиях, связанных с вакцинами. Недавно в нескольких работах было показано, что некоторые особенности вирусной оболочки искажают иммунную реакцию в сторону реакции на несущественные эпитопы, маскируя, таким образом, важные и способные участвовать в нейтрализации участки вирусной частицы. Эти особенности включают наличие высоко иммунодоминантных антигенных участков, служащих ловушками, и обширное гликозилирование, которое физически маскирует важные эпитопы и снижает их иммуногенность (Wyatt и др. // Nature. 1998. Т.393. С.705-711).
Один из возможных способов обойти механизм “ловушки” - это экспрессировать небольшие участки гена вирусной оболочки, чтобы исключить иммунодоминантные реакции, не являющиеся защитными, и индуцировать образование нейтрализующих антител. Для вакцин из малых субъединиц проблема заключается в пониженной иммуногенности синтетического пептида или малого белка. Одним из способов преодолеть это было связывание белков или пептидов с иммуногенными белками-носителями, такими как гемоцианин типа “липучки для замочной скважины” - keyhole limpet hemocyanin (KLH). При этом индуцируется сильная иммунная реакция не только на белок или пептид, но и на KLH. Другой способ - объединить в слитом с Fc белке, как описано в Примере 1, суб-область, например, эктодомена gp41 (якорного домена гликопротеина вирусной оболочки gp160). В отличие от других носителей область иммуноглобулина воспринимается как “своя”, что сводит к минимуму всякий эффект иммунодоминантности.
Слитая конструкция Fc-gp41pep626 содержит полипептид из 44 аминокислот, соединенный с карбоксильным концом области Fc мышиного иммуноглобулина. Последовательность штамма IIIB ВИЧ в этой области содержит сигнал для гликозилирования N-конца, поэтому слитый белок Fc-gp41pep626, продуцированный либо клетками 293 при временной экспрессии, либо в клетках миеломы NS/0 при их стабильной трансфекции, при анализе методом SDS-PAGE обнаруживает большие различия в подвижности, что указывает на гетерогенность в степени гликозилирования.
Несмотря на то, что этот вирусный антиген достаточно мал (длиной 44 аминокислотных остатка) и гетерогенен по степени гликозилирования, он оказался способным вызвать иммунную реакцию у мышей Balb/c (см. фиг.14). В этом случае группам из 5 мышей вводили внутрикожно в первый день и затем еще 2 раза с интервалом в 2 недели по 25 мкг слитого белка Fc-gp41pep626 - либо без добавок (незаполненные ромбы), либо в комбинации с 2,5 мкг слитых белков Fc-адъювант - Fc-GMCSF (незаполненные квадраты) или Fc-IL2 (зачерненные треугольники). На фигурах 14А и 14В представлены титры антител соответственно через 7 дней и 33 дня после второй бустерной иммунизации.
Иммунная реакция была более сильной при совместном введении с Fc-цитокинами, и высокий титр антител достигался позднее. Предполагается, что можно вызвать более сильную иммунную реакцию, используя такие модификации этой последовательности, которые не содержат сигнала гликозилирования (действительно, многие штаммы не кодируют этот сайт), или ферментативно удаляя in vitro углеводные боковые цепи.
Пример 11
Адъювантная активность слитого с Fc белка, содержащего внеклеточный домен молекулы клеточной поверхности
Для конструирования слитых белков Fc-адъювант иногда полезно слить с Fc внеклеточный домен белка, который может быть связан с мембраной. Например, лиганд CD40 (CD40L) слит на N-конце С-концевой части с Fc. Факультативно используется также пептидный мостик (линкер).
Удобство CD40L заключается в том, что его рецептор CD40 экспрессируется на поверхности В-клеток и участвует в стимуляции В-клеток Т-клетками. Подобно фактору некроза опухолей (TNF) CD40L представляет собой тример, который вызывает димеризацию или тримеризацию своего рецептора на поверхности клетки. В результате внутриклеточные домены рецепторов входят в контакт и происходит передача сигнала. Также подобно TNF CD40L может быть связан с мембраной, но может также быть отщеплен от поверхности клетки и действовать как цитокин.
Слитый белок Fc-CD40L вводится животным совместно со слитым белком Fc-антиген. В контрольных опытах белок Fc-CD40L и белок Fc-антиген вводят разным группам животных. Ожидается, что у животных, которым вводятся оба слитых белка, вырабатываются более высокие титры антител, чем у животных, которым каждый слитый белок вводится по отдельности.
В качестве альтернативы, используют один слитый с Fc белок, содержащий в виде частей и антиген, и CD40L, с факультативными линкерами (L) между Fc, CD40L и антигеном. Порядок частей в слитом белке в направлении от N-конца до С-конца может быть следующим: Fc-(L)-антиген-(L)-CD40L, FC-(L)-CD40L-(L)-антиген, антиген-(L)-CD40L-(L)-Fc, CD40L-(L)-антиген-(L)-Fc, антиген-(L)-Fc-(L)-CD40L или CD40L-(L)-Fc-(L)-антиген. Слитый белок, содержащий Fc, антиген и CD40L, вводят животным и измеряют титр антител. Предполагается, что титры антител вследствие введения слитого белка, содержащего и CD40L, и антиген, выше, чем титры антител, полученные инъекцией слитых белков, содержащих только Fc и антиген или Fc и CD40L.
В указанных выше введениях слитых белков инъекция животным производится внутривенно, подкожно или другими подходящими путями. Интервалы между первичным и бустерным введением антигенов и/или адъювантов и измерением титров антител указаны в предыдущих примерах. В качестве альтернативы используются стандартные дозировки и схемы анализов.
Эквиваленты
Изобретение может быть осуществлено в других конкретных формах, не выходя за границы его идеи и существенных характеристик. Поэтому предыдущие варианты осуществления должны рассматриваться во всех отношениях как иллюстрирующие, но не ограничивающие описанное здесь изобретение. Таким образом, объем изобретения обозначен не столько предшествующим описанием, сколько прилагаемой формулой, и поэтому подразумевается, что здесь содержатся все изменения, укладывающиеся в смысл и область эквивалентности формулы.
Включение ссылкой
Изложение всех патентных документов и научных публикаций, упомянутых здесь выше, специально включено сюда ссылкой на них.
Реферат
Изобретение относится к области фармакологии. Сущность изобретения состоит в том, что иммуногенность повышается путем слияния предварительно выбранного антигена с константной областью тяжелой цепи иммуноглобулина для получения слитого белка Fc-антиген. Слитые белки Fc-антиген связываются рецепторами для Fc на поверхности предъявляющих антиген клеток, тем самым адресно направляя антиген к предъявляющим антиген клеткам. Кроме того, в изобретении раскрыто семейство адъювантов. Например, описан слитый белок Fc-адъювант для использования в комбинации со слитыми белками Fc-антиген, чтобы усилить или модулировать специфическую иммунную реакцию на предварительно выбранный антиген. Технический результат - расширение арсенала средств стимуляции иммунитета. 2 с. и 25 з.п.ф-лы, 14 ил., 1 табл.
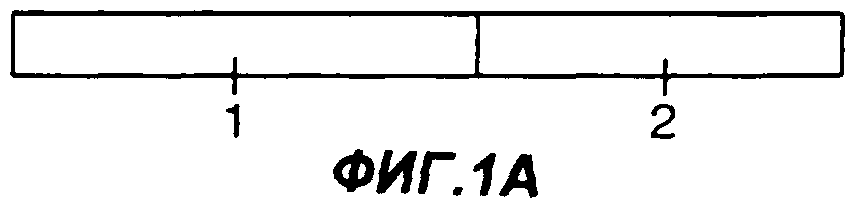

Комментарии