Иммобилизованный белковый материал и его применение и использование в качестве гетерогенных катализаторов - RU2684619C2
Код документа: RU2684619C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к иммобилизованному белковому материалу, содержащему белок, который иммобилизован на стеклянном материале или органическом полимере через связывание аффинного маркера. Стеклянный материал может представлять собой пористый стеклянный материал, такой как (гибридное) стекло с контролируемой пористостью. Данное изобретение также относится к использованию иммобилизованного ферментативного материала в качестве гетерогенного биокатализатора химического синтеза. Данное изобретение также относится к способу иммобилизации аффинно маркированных белков на стеклянном материале или органическом полимере и к способу очистки и выделения аффинно маркированных белков путем иммобилизации таких белков на стеклянном материале или органическом полимере.
УРОВЕНЬ ТЕХНИКИ
Белки представляют собой крупные биологические молекулы, образованные одной или несколькими линейными цепями аминокислотных остатков. Ферменты представляют собой специфическую группу белков, которые служат биологическими катализаторами метаболизма всех живых клеток. В качестве таковых ферменты способны преобразовывать органические молекулы в различные молекулы. Вследствие специфической трехмерной структуры каждого конкретного фермента, только очень немногие органические молекулы способны взаимодействовать с активным сайтом фермента таким образом, чтобы преобразование могло иметь место. Ферменты, следовательно, являются обычно высокоселективными катализаторами, а использование ферментов в качестве катализаторов в синтетической органической химии является по этой причине очень многообещающим. Однако, поскольку ферменты представляют собой биологические молекулы, развившиеся в условиях клетки, они часто непригодны для других условий окружающей среды. Когда они используются в органических растворителях, ферменты склонны к агрегации и часто утрате пространственной структуры (т.е., денатурации). Поэтому является привлекательной идеей иммобилизовать ферменты на твердой основе и использовать их как катализаторы в таком иммобилизованном состоянии, поскольку это может улучшить стабильность фермента, позволить создать условия реакции, которые фермент обычно не переносит, и также облегчить отделение от реакционной смеси и выход материала.
Иммобилизация ферментов на твердой подложке выполнялась с использованием различных технологий и различных твердых подложек (Tischer and Wedekind, ʺImmobilized Enzymes: Methods and Applicationsʺ, Topics in Current Chemistry, 1999, vol. 200, pp. 95-126; Brena and Batista-Viera, ʺImmobilization of Enzymes: A Literature Surveyʺ, Methods in Biotechnology: Immobilization of Enzymes and Cells, 2006, second edition, pp. 15-30).
Адсорбция ферментов на твердых поверхностях может приводить к нежелательным взаимодействиям между ферментом и твердой подложкой. Было показано, что адсорбция белка на наночастицах окиси кремния может приводить к изменениям вторичной структуры белка, что приводит к инактивации фермента (Lundqvist et al., Langmuir 2004, vol. 20, pp. 10639-10647). Следовательно, поэтому важно, чтобы твердая подложка не влияла на структуру и активность иммобилизованных ферментов.
Аффинная хроматография с иммобилизованным ионом металла (IMAC) представляет собой технологию очистки белков, которая основывается на аффинности белков к ионам металлов, таким как Fe2+, Cu2+, Zn2+, Ni2+и Co2+. Ионы металлов иммобилизованы на агарозном геле и могут селективно адсорбировать белки, содержащие гистидин и цистеин (Porath et al., Nature 1975, vol. 258, pp. 598-599). Усовершенствованная версия этой технологии использует рекомбинантные белки, содержащие слитый полигистидиновый пептид. Поскольку полигистидиновый пептид имеет намного более высокую аффинность к иммобилизованным ионам металлов, чем одиночный остаток гистидина, уровень очистки, который может быть достигнут, намного выше (Hochuli et al., Nat. Biotechnol. 1988, vol. 6, pp. 1321-1325; Ljungquist et al., Eur. J. Biochem. 1989, vol. 186, pp. 563-569). Хотя эта технология может быть успешно применена в хроматографических процедурах для очистки и выделения белков, ферменты, иммобилизованные на геле, менее пригодны в качестве гетерогенных катализаторов в органическом синтезе. Технология IMAC также ограничена, в первую очередь, водными условиями.
В попытках изготовить гетерогенные катализаторы принципы связывания аффинного маркера, основанные на IMAC, были применены для иммобилизации помеченных полигистидином ферментов на модифицированной окиси кремния (Cassimjee et al., Biotechnol. Bioeng. 2008, vol. 99, pp. 712-716; Cassimjee et al., Biotechnol. J. 2011, vol. 6, pp. 463-469). Это оправдало себя для липазы В из Candida antarctica (CalB), но было обнаружено, что другие, менее стабильные ферменты инактивируются в присутствии окиси кремния, особенно в присутствии органических растворителей. Из литературы известно, что наночастицы окиси кремния имеют дестабилизирующий эффект на белки (Lundqvist et al., Langmuir 2004, vol. 20, pp. 10639-10647).
Стекло с контролируемой пористостью (CPG) представляет собой еще один материал, который был использован для иммобилизации ферментов. CPG обычно обрабатывается 3-аминопропилтриэтоксисиланом, а ферментам затем позволяют связаться с аминопропил-CPG через остатки лизина, присутствующие на поверхности ферментов с помощью глютаральдегида в качестве вещества, образующего поперечные связи. Эти результаты при неспецифическом связывании фермента с CPG часто [связаны] с сопутствующей потерей ферментативной активности. Еще один недостаток этого способа состоит в том, что фермент, который надо иммобилизовать, должен быть очищен от других ферментов перед стадией иммобилизации, чтобы устранить иммобилизацию смеси различных ферментов на CPG.
Была описана иммобилизация ферментов на CPG с помощью органотитанатов (Патент США 4,632,904) или с помощью слоев полисахаридов и 1,1'-дикарбонилдиимидазола (Rogalski et al., J. Mol. Catal. B: Enzym. 1999, vol. 6, pp. 29-39).
Engström et al. (Angew. Chem. Int. Ed. 2013, vol. 52, pp. 14006-14010) описали гибридный катализатор, в котором липаза В из Candida antarctica и наносоединения палладия совместно иммобилизованы в компартментах мезопористой двуокиси кремния.
Использование ферментов в качестве катализаторов в химической промышленности, т.е. в биокатализе, является ключом к достижению более высокой рациональности, меньшей токсичности отходов и более высокой рентабельности. Однако высокая стоимость ферментов и часто наблюдающаяся потеря активности после иммобилизации фермента на твердой подложке являются препятствиями для такого развития. Стандартизованная и в целом работоспособная процедура иммобилизации фермента, которая позволила бы повторное использование фермента, была бы в высшей степени желательной. Несмотря на прогресс, достигнутый за последние годы, до сих пор отсутствует общий и простой способ изготовления гетерогенных катализаторов путем иммобилизации ферментов. Существует, следовательно, постоянная потребность в улучшенных способах иммобилизации ферментов на твердой подложке, и в стабильных гетерогенных биокатализаторах, которые могут быть применены в органическом синтезе и в водных условиях реакций, и в условиях органических реакций.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
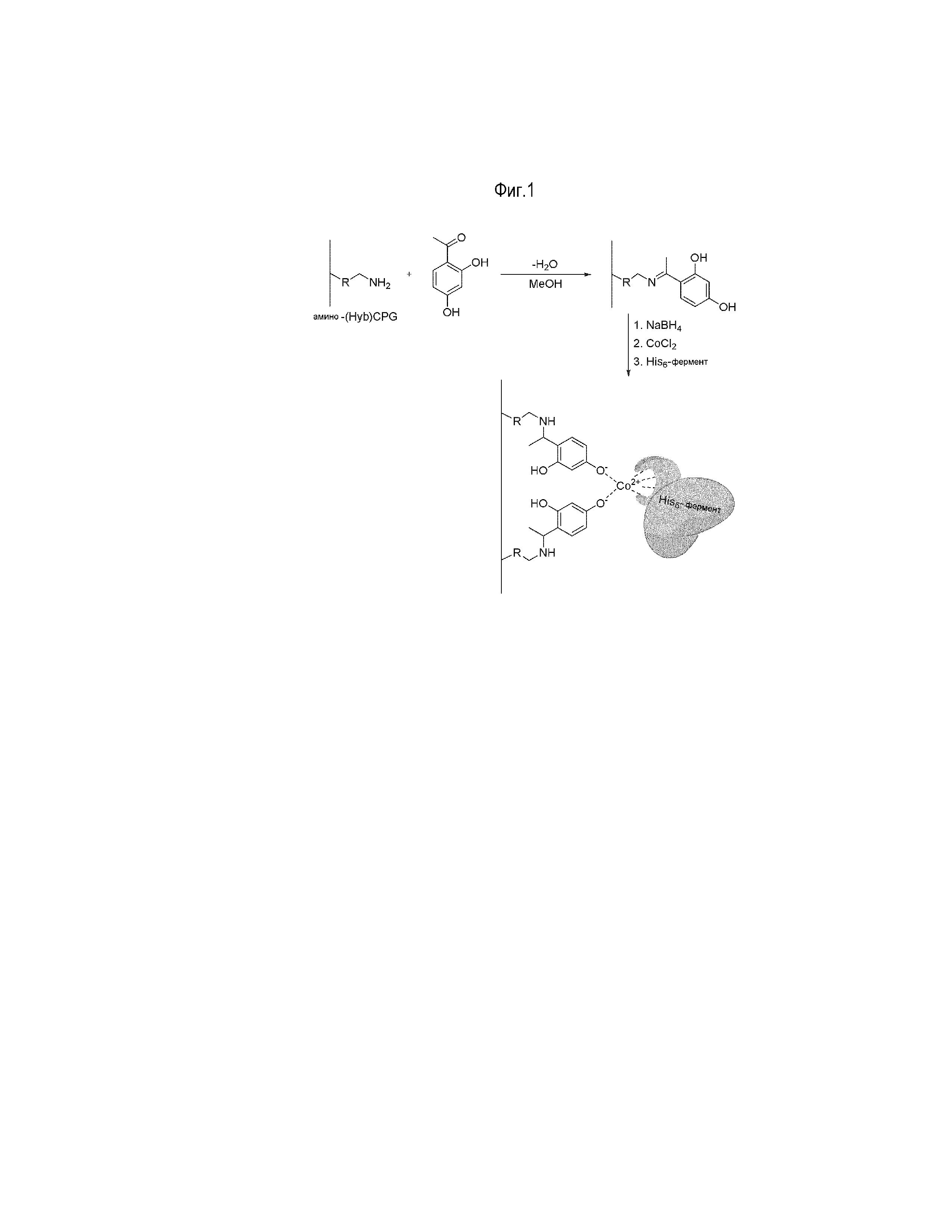
Фиг. 1 показывает изготовление CPG-материала с иммобилизованным ферментом из амино-(Hyb)CPG, с использованием полигистидин-меченого фермента и Co2+ в качестве хелатируемого металла. Группа R представляет собой подходящий линкер и варьирует у [разных] продуктов CPG. Схематически изображено хелатоообразование иона кобальта с остатком 2,4-дигидроксифенила и ферментом, меченным полигистидином.
Фиг. 2 показывает изготовление CPG-материала, содержащего иммобилизованный фермент и металлические наночастицы, из амино-(Hyb)CPG, с использованием полигистидин-меченного фермента, Co2+ в качестве хелатируемого металла и палладия в качестве металлических наночастиц. Группа R представляет собой подходящий линкер и варьирует у [разных] продуктов CPG. Схематически изображены и связывание наночастиц палладия с CPG-материалом, и хелатоообразование иона кобальта с остатком 2,4-дигидроксифенила и ферментом, меченым полигистидином.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Удивительно, но было обнаружено, что путем иммобилизации белков на пористом стеклянном материале или пористом органическом полимере связыванием с аффинным маркером, получающийся иммобилизованный белковый материал обладает улучшенными свойствами в отношении стабильности иммобилизованных белков, в которых биологическая функция белков сохраняется. Было обнаружено, что препараты иммобилизованных ферментов обладают высокой каталитической активностью, что делает их пригодными в качестве биокатализаторов.
По данному изобретению белок, содержащий аффинный маркер, иммобилизован путем связывания со специфической группой на аффинном матриксе, присоединенном к пористому стеклянному материалу или пористому органическому полимеру. Вследствие высокой аффинности связывания аффинного маркера со специфической группой на матриксе, связывание белка с матриксом является сильным, и высокоспецифичным. Данное изобретение, таким образом, предоставляет общие способы очистки и иммобилизации белков, таких как ферменты.
Первый объект данного изобретения относится к иммобилизованному белковому материалу, содержащему носитель и, по меньшей мере, один белок, иммобилизованный на носителе, причем носитель содержит материал носителя, к которому присоединен аффинный матрикс, упомянутый материал носителя выбран из группы, состоящей из:
(a) стекла с контролируемой пористостью (CPG);
(b) гибридного стекла с контролируемой пористостью (Hybrid CPG); и
(c) пористого органического полимера;
причем, по меньшей мере, один белок содержит аффинный маркер и иммобилизован на носителе специфическим аффинным связыванием с аффинным матриксом.
Иммобилизация белков на носителе через аффинный маркер дает преимущество специфического связывания белков на предопределенном месте. В то же время, однако, способ иммобилизации в целом применим ко многим различным белкам. Аффинным маркером, который используется в данном изобретении, может быть какой-либо маркер, который способен специфически связываться с матриксом, к которому он обладает аффинностью. Аффинное связывание может быть результатом, например, ванн-дер-вальсова взаимодействия, образования водородных связей, ионных связей или гидрофобного взаимодействия. В любом случае, аффинное связывание должно быть достаточно сильным, чтобы позволить аффинному маркеру и матриксу оставаться тесно связанными друг с другом, по меньшей мере, пока определенные специфические условия не будут применены, чтобы диссоциировать аффинный маркер от матрикса.
Другой объект данного изобретения относится к носителю для иммобилизации белков, содержащему материал носителя, к которому присоединен аффинный матрикс, упомянутый материал носителя выбран из группы, состоящей из:
(a) стекла контролируемой пористости (CPG);
(b) гибридного стекла контролируемой пористости (Hybrid CPG); и
(c) пористого органического полимер;
причем белки иммобилизованы на носителе специфическим аффинным связыванием с аффинным матриксом.
Белок, который должен быть иммобилизован на носителе, может представлять собой какой-либо белок, содержащий аффинный маркер, такой как (рекомбинантный) белок или фермент, содержащий аффинный маркер. Предпочтительно, белок представляет собой фермент, содержащий аффинный маркер. Следует понимать, что маркер должен иметь специфическую аффинность к аффинному матриксу, присоединенному к носителю.
В данной области техники известно множество аффинных маркеров и соответствующих матриксов. Примеры аффинных маркеров, которые могут быть применимы в данном изобретении, и соответствующих групп на матриксе перечислены в таблице ниже:
В предпочтительном варианте реализации аффинный маркер на белке представляет собой полигистидиновый маркер и аффинный матрикс, присоединенный к носителю и содержащий хелатируемый ион металла. Хелатируемый ион металла предпочтительно представляет собой ион металла, выбранный из группы, состоящей из Fe2+, Fe3+, Co2+, Ni2+, Cu2+ и Zn2+, а более предпочтительно - выбранный из группы, состоящей из Fe3+, Ni2+ и Co2+. В предпочтительном варианте реализации хелатируемый ион металла представляет собой Co2+. В другом предпочтительном варианте реализации хелатируемый ион металла представляет собой Fe3+.
Выбор хелатируемого иона металла может зависеть от предполагаемого использования. Например, если носитель предназначен для очистки и выделения аффинно меченого белка, связывание фермент с носителем должно быть обратимым. В таких случаях предпочтительно, чтобы хелатируемый ион металла представлял собой Ni2+ или Co2+, а наиболее предпочтительно - Co2+. Эти ионы металлов связываются достаточно сильно при иммобилизации с полигистидин-меченым ферментом, но способны отделиться от иммобилизованного фермента, когда применяются специфические условия, такие как обработка буферным раствором, содержащим имидазол или этилендиаминтетраацетат (EDTA).
Для использования иммобилизованных ферментов в гетерогенном биокатализе желательно сильное связывание фермента с носителем. В таких случаях предпочтительно, чтобы хелатируемый ион металла представлял собой Co2+ или Fe3+, наиболее предпочтительно - Fe3+, поскольку это дает особенно сильное связывание полигистидиновой метки с носителем. Как продемонстрировано в примерах, вымывание либо фермента, либо иона металла из иммобилизованного белкового материала, содержащего Fe3+ в качестве хелатируемого иона металла, почти не принимается в расчет. Отсутствие вымывания позволяет использовать иммобилизованный белковый материал (биокатализатор) в каталитических количествах. Использование каталитических количеств особенно важно в реакциях непрерывного действия.
Еще одно преимущество Fe3+ в качестве хелатируемого иона металла состоит в том, что этот металл нетоксичен. Образующийся иммобилизованный белковый материал может, следовательно, быть безопасно применен, например, в пищевой промышленности.
Матрикс аффинно-меченого белка присоединен к поверхности носителя через соответствующий линкер. Поверхность стекла контролируемой пористости (CPG) содержит свободные группы силанола (Si-OH), которые могут быть присоединены к молекуле линкера через ковалентную связь. Обычно поверхность реагирует с бифункциональной алкилсилановой молекулой линкера (длина цепи и структура которого могут варьировать), в результате чего атом кремния ковалентно связывается с силаноловыми группами стеклянной поверхности, причем терминальная группа силана представляет собой функциональную группу, такую как альдегид, амин, эпоксигруппа, галоид или производное карбоновой кислоты. Соответствующая функциональная группа, которая должна использоваться, зависит от природы матрикса, который должен быть присоединен к поверхности CPG. Способы присоединения матрикса к поверхности CPG через соответствующий линкер известны специалистам в данной области техники.
CPG представляет собой прочный и инертный стеклянный материал, который может быть произведен в виде частиц с макро- или мезопорами контролируемого размера. Распределение размеров пор CPG может варьироваться для размеров пор около 10 до 300 нм в диаметре. Это предоставляет удобное микроокружение без затруднений вследствие стерической изоляции. Соединенная между собой структура пор приводит к низкому сопротивлению потоку и облегчает массовый перенос участников реакции и продуктов через материал. Жесткая структура CPG предоставляет прочную несжимаемую среду, пригодную для конструкций высокопродуктивных реакторов и линейного увеличения при высоких скоростях потока. Материал демонстрирует ограниченное набухание в растворителях и является стабильным химически и в отношении размеров в большинстве органических сред и в водной среде при рН ниже 10.
Общепринятое CPG демонстрирует способность к загрузке лигандом, которая обратно пропорционально относится к размеру его пор. Таким образом, подложка CPG с порами крупного размера не может быть загружена таким большим количеством белка, как подложка CPG с порами меньшего размера. Частично это происходит вследствие обратного соотношения между размером пор и площадью поверхности, а частично вследствие того, что доступные на поверхности группы силанола, служащие функционализирующими фрагментами, имеют определенную плотность на единицу площади поверхности, приблизительно 4,5 мкмоль/м2. Общепринятое CPG демонстрирует неравномерное распределение силанола, когда сайты силанола, имеющие стерические затруднения, не могут служить в качестве точек функционального присоединения.
Гибридное стекло с контролируемой пористостью (Hybrid CPG или HybCPG) представляет собой вариант CPG, в котором внутренняя и внешняя поверхности CPG покрыты приблизительно 10 нм пленкой поперечно-сшитого органического полимера, как описано в WO 2009/005631. Полимерное покрытие на Hybrid CPG может содержать функциональные группы, такие как альдегиды, аминогруппы, эпоксигруппы, галоиды, карбоновые кислоты и эфиры или их смеси, к которым может быть присоединен матрикс. Способы присоединения матрикса к соответствующей функциональной группе известны специалистам в данной области техники.
Hybrid CPG предлагает определенные преимущества по сравнению с общепринятым CPG. Как результат полимерного покрытия зависимость между загрузкой и размером пор может быть минимизирована, а пространственное распределение функционализованных сайтов может более точно и одинаково контролироваться. Hybrid CPG в качестве носителя материала для иммобилизации белка может предложить дополнительные преимущества, поскольку дизайн полимерного покрытия может быть адаптирован, чтобы предоставить характеристики поверхности, которые желательны или требуются для данного применения. Например, гомогенный полимер, такой как полистирол, дает более гидрофобную поверхность носителя, тогда как гомогенный полимер, такой как полиакрилонитрил, дает более гидрофильную поверхность носителя. Путем использования смесей двух или более различных полимеров может быть получено сополимерное покрытие, в котором характеристики поверхности носителя специфически адаптированы для данного применения. Тонкий слой покрытия позволяет определенную степень микроскопического набухания в органических растворителях, но без объемного расширения подложки из Hybrid CPG или увеличения реактивного давления. Покрытие также позволяет использование Hybrid CPG в водных средах при рН выше 10.
В дальнейшем описании и прилагающейся формуле изобретения какие-либо ссылки на CPG должны интерпретироваться как включающие в себя и (общепринятое) CPG, и Hybrid CPG, если иное не указано специально.
Материал носителя, отличающийся от CPG и HybCPG, может быть желателен по таким соображениям, как более высокая рентабельность или специфические требования к процессу. Такие материалы включают в себя пористые органические полимерные (пластмассовые) материалы. Эти полимеры функционализованы такими функциональными группами, как альдегиды, аминогруппы, эпоксигруппы, галоиды, карбоновые кислоты или эфиры, или их смеси, к которым может присоединяться матрикс. Способы присоединения матрикса к соответствующей функциональной группе известны специалистам в данной области техники. Функционализованные пластмассы могут быть получены в виде пористых частиц с ограниченным набуханием. Подходящие органические полимеры могут основываться на таких мономерах, как стирол, этилен, пропилен, акриловая кислота, метакриловая кислота, метилакрилат и метилметакрилат. Примеры таких органических полимеров включают в себя функционализованный полиэтилен, сверхвысокомолекулярный полиэтилен (UHMWPE), полиэтилен высокой плотности (HDPE), полипропилен (PP), политетрафторэтилен (PTFE), и поливинилиден фторид (PVDF), полистирол, полиметакрилат и поли(метилметакрилат). В предпочтительном варианте реализации пористый органический полимер представляет собой функционализованный полистирол или функционализованный полиметакрилат.
Присоединение аффинно меченых белков к HybCPG, описанное в данном документе, демонстрирует возможность использования пористых органических полимерных носителей, поскольку пористая поверхность HybCPG представляет собой сам по себе органический полимер. HybCPG главным образом поддерживает несжимаемую и не набухающую природу CPG, при том, что поверхностные свойства могут быть использованы от органических полимеров. Когда жесткость CPG не требуется, возможно, что органический полимер сам по себе представляет собой лучший вариант. Способ применения присоединения аффинного маркера к таким материалам далее продемонстрирован в данном документе.
Белковый материал, иммобилизованный на CPG, может быть легко продуцирован всего в несколько стадий, начиная либо с амино-CPG, либо с амино-HybCPG, как представлено на Фиг. 1. Например, материалы CPG могут быть обработаны 2,4-дигидроксиацетофеноном, таким образом связывая фенильную группу с CPG через имин. Если желательно, реакционная способность имина может быть затем восстановлена до соответствующего амина с помощью соответствующего восстановителя, такого как, например, борогидрид натрия, цианоборогидрид натрия или литийалюминийгидрид. Хелатируемый ион металла, такой как Co2+ или Fe3+, может быть затем введен в суспензию материала в водном растворе CoCl2 или FeCl3, соответственно. После высушивания полученный материал может быть непосредственно использован как связывающий матрикс для одного или более белков, меченых полигистидином.
Иммобилизованный белковый материал, в котором материал носителя представляет собой органический полимер, может быть получен сходным образом с тем, который описан выше для CPG и HybCPG.
Высокая аффинность полигистидиновой метки к ионам металлов, таким как Co2+ или Fe3+, позволяет проводить иммобилизацию белков, меченных полигистидином, из растворов сырья, содержащих белки, без необходимости экстенсивной очистки раствора перед стадией иммобилизации. Органический материал, который не содержит полигистидиновой метки, свяжется с хелатируемыми ионами металла лишь слабо или совсем не свяжется, и его будет легко удалить из финального материала с иммобилизованными белками путем отмывки, например, водой или буферными водными растворами. Таким образом, если меченый полигистидином белок приготавливался путем внутриклеточной сверхэкспрессии, иммобилизация белка могла быть выполнена непосредственно из клеточного лизата. В качестве альтернативы, если меченый полигистидином белок секретировался организмом-хозяином, иммобилизация белка могла быть выполнена непосредственно из супернатанта клеточной культуры.
Таким образом, еще один объект данного изобретения относится к способу иммобилизации аффинно меченого белка, содержащему стадии:
i) иммобилизации аффинно меченого белка на носителе, содержащем материал носителя, к которому присоединен аффинный матрикс, упомянутый материал носителя выбран из группы, состоящей из:
(a) стекла с контролируемой пористостью (CPG);
(b) гибридного стекла с контролируемой пористостью (Hybrid CPG); и
(c) пористых органических полимеров; и
ii) дополнительной отмывки иммобилизованного белкового материала водой или соответствующим буфером.
Еще один объект данного изобретения предоставляет способ изготовления иммобилизованного белкового материала, упомянутый способ содержит:
i) предоставление материала носителя, содержащего аминогруппы, упомянутый материал носителя выбран из группы, состоящей из:
(a) стекла с контролируемой пористостью (CPG);
(b) гибридного стекла с контролируемой пористостью (Hybrid CPG); и
(c) пористого органического полимера;
ii) реагирования материала носителя с 2,4-дигидроксиацетофеноном, таким образом соединяя дигидроксифенильную группу с материалом носителя;
iii) образования хелатного комплекса между дигидроксифенильной группой и ионом металла, способным к связыванию меченого полигистидином белка; и
iv) связывания меченого полигистидином фермента с материалом носителя, содержащим упомянутый ион металла.
Если требуется, способ изготовления иммобилизованного белкового материала, описанный выше, также содержит связывание наночастиц металла переходного ряда с материалом носителя.
В одном из вариантов реализации носитель представляет собой стекло с контролируемой пористостью (CPG). В другом варианте реализации носитель представляет собой гибридное стекло с контролируемой пористостью (Hybrid CPG). В еще одном варианте реализации носитель представляет собой пористый органический полимер.
В предпочтительном варианте реализации способ содержит иммобилизацию аффинно меченых белков на CPG или Hybrid CPG. В другом предпочтительном варианте реализации аффинно меченый белок представляет собой меченный полигистидином фермент, а аффинный матрикс содержит хелатируемый ион металла. В более предпочтительном варианте реализации способ содержит иммобилизацию меченых полигистидином ферментов на CPG или Hybrid CPG, в которых используемый хелатируемый ион металла представляет собой Co2+ или Fe3+.
Другой объект данного изобретения предоставляет иммобилизованный белковый материал, который может быть получен способом, описанным выше.
Диссоциация связанного белка может быть достигнута с помощью стандартных способов IMAC. Связанный белок может быть, например, отделен от носителя путем снижения рН или добавления конкурентной молекулы, имеющей равную или большую аффинность к хелатированным ионам металла, чем полигистидиновая группа, таким как применение буферного раствора, содержащего имидазол или этилендиаминтетраацетат (EDTA). После диссоциации очищенных белков с носителя, полигистидиновая метка может быть удалена из белков, если необходимо, с помощью технологий, известных в данной области техники, например, путем расщепления аффинного маркера соответствующим ферментом, таким как специфическая протеаза, с получением таким образом чистого и лишенного метки белка.
Таким образом, еще один объект данного изобретения относится к способу очистки и выделения аффинно меченого белка, содержащему стадии:
i) иммобилизации аффинно меченого белка на носителе, содержащем материал носителя, к которому присоединен аффинный матрикс, упомянутый материал носителя выбран из группы, состоящей из:
(a) стекла с контролируемой пористостью (CPG);
(b) гибридного стекла с контролируемой пористостью (Hybrid CPG); и
(c) пористых органических полимеров;
ii) если требуется, отмывки иммобилизованного белкового материала водой или соответствующим буфером; и
iii) диссоциации очищенного белка с аффинного матрикса.
Стадия иммобилизации может быть выполнена в соответствующем буфере. Если необходимо, иммобилизованный белковый материал может быть затем отмыт водой или соответствующим буфером, чтобы удалить какие-либо несвязанные белки и прочие нежелательные соединения из иммобилизованного белкового материала. Диссоциация очищенного белка от аффинного матрикса может быть достигнуто путем применения условий, которые соответствуют конкретному аффинному маркеру. Соответствующие условия диссоциации различных аффинных маркеров известны в данной области техники.
Способ, если необходимо, может содержать дополнительную стадию iv) удаления аффинного маркера из очищенного белка.
В предпочтительном варианте реализации способ содержит очистку и выделение аффинно-меченных белков на CPG или Hybrid CPG. В другом предпочтительном варианте реализации аффинно меченый белок представляет собой меченный полигистидином фермент, а аффинный матрикс содержит хелатируемый ион металла. В более предпочтительном варианте реализации способ содержит очистку и выделение меченых полигистидином ферментов на CPG или Hybrid CPG, в котором используемым хелатируемым ионом металла является Co2+.
Если белки иммобилизованы на носителе, как описано выше, являются ферментами, они содержат активный сайт, который способен катализировать химическую реакцию. В качестве такового иммобилизованный ферментный материал потенциально пригоден в качестве биокатализатора в органическом синтезе. Поэтому еще один объект данного изобретения относится к использованию иммобилизованного ферментного материала, как раскрыто в данном документе, в качестве биокатализатора, например, при трансформациях в органическом синтезе. Данное изобретение также предоставляет способ катализа реакции, катализируемой ферментом, содержащий предоставление иммобилизованного белкового материала по данному изобретению, и приведение упомянутого иммобилизованного белкового материала в контакт, по меньшей мере, с одним субстратом, на котором фермент, который иммобилизован на носителе, способен действовать.
Иммобилизация ферментов на носителе через связывание аффинного маркера, как раскрыто в данном документе, улучшает стабильность используемых ферментов. Было обнаружено, что иммобилизованные ферменты устойчивы и в водных условиях, так же, как в ряде различных органических растворителей. Это делает возможным использованием иммобилизованных ферментных материалов в реакционных условиях, при которых свободные неиммобилизованные ферменты были бы нестабильны. Возможно, что иммобилизованный ферментный материал также может быть использован в более широком диапазоне рН, чем могли бы перенести свободные неиммобилизованные ферменты.
Когда фермент связывается из сырого (неочищенного) препарата, получающийся иммобилизованный белковый материал содержит обогащенный фермент. Поскольку нативная активность фермента по способу сохраняется, иммобилизованный препарат демонстрирует более высокую каталитическую активность на массу белка, чем исходный неиммобилизованный белковый материал.
Другое преимущество данного изобретения состоит в том, что иммобилизованный ферментный материал может быть легко использован повторно. Поскольку иммобилизованный ферментный материал представляет собой гетерогенный катализатор, материал может быть легко собран из реакционной смеси путем фильтрации. Материал может быть затем повторно использован в следующей реакции, если необходимо - после очистки материала. Особенно в случае дорогостоящих и (или) трудно культивируемых ферментов, возможность повторного использования иммобилизованного ферментного материала представляет собой важный аспект.
Фермент, который иммобилизован на носителе, может представлять собой какой-либо фермент, который пригоден в качестве биокатализатора в трансформациях органического синтеза, включая в себя, но, не ограничиваясь этим, ферменты, действующие как оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы. Таким образом, иммобилизованные ферментные материалы могут быть использованы в качестве гетерогенных биокатализаторов в каких-либо органических реакциях, в которых иммобилизованный фермент способен специфически катализировать реакцию. Примеры таких биокаталитических реакций включают в себя, но не ограничиваются ими, реакции ферментативного окисления и восстановления, реакции ферментативного гидролиза и реакции ферментативной изомеризации. Особенно полезными биокаталитическими реакциями являются энантиоселективные реакции. Специфические примеры биокаталитических реакций включают в себя селективное ацилирование спиртов или аминов липазой, трансаминирование ω-трансаминазой, моноокисление с участием CYP P450 или монооксигеназы Байер-Виллигер, окисления спиртов или восстановления кетонов/альдегидов алкогольдегидрогеназой и окисления аминов моноаминоксидазой.
В одном из вариантов реализации два или более различных ферментов могут быть иммобилизованы на носителе, причем каждый из разных ферментов способен катализировать различные реакции. Возможно затем использовать материал, содержащий два или более различных иммобилизованных ферментов в качестве гетерогенного биокатализатора в многостадийной или каскадной реакции. Такой каскадной реакцией может быть, например, реакция, в которой выполняется две или более ферментативно катализируемых реакций на субстрате в две или более стадий (т.е., реакции, в которых субстрат для первого фермента преобразуется в субстрат для второго фермента и так далее), таких как реакция трансаминирования ω-трансаминазой, за которой следует реакция ацилирования липазой. В качестве альтернативы, такая каскадная реакция может представлять собой реакцию, в которой субстрат трансформируется первым ферментом и в которой кофактор первого фермента регенерируется вторым ферментом, такую как селективное/специфичное восстановление кетона/альдегида алкогольдегидрогеназой с сопутствующей регенерацией потребленного НАДН формиатдегидрогеназой.
Когда два или более различных ферментов иммобилизованы на носителе, целесообразно, если разные ферменты содержат одинаковый аффинный маркер, такой как полигистидиновая метка. Если аффинность связывания хелатируемого иона металла одинакова для каждого из ферментов, различные ферменты будут связываться с носителем одинаково сильно. Теоретически, следовательно, при использовании равных количеств n различных ферментов, имеющих один и тот же аффинный маркер, количество каждого из различных ферментов на носителе составит 1/n (не учитывая каких-либо диффузионных эффектов).
Для каскадных реакций, использующих иммобилизованный белковый материал с двумя или более различными иммобилизованными ферментами, и в которых различные ферменты демонстрируют различие в каталитической активности, может быть полезным иммобилизовать большие количества фермента (ферментов), имеющих более низкую каталитическую активность, по сравнению с количеством фермента, имеющего более высокую каталитическую активность. Это ускорит стадию, лимитирующую скорость, и увеличит общую скорость каскада реакций.
В качестве альтернативы каскадные реакции могут быть выполнены путем смешивания одного или более различных иммобилизованных ферментных материалов в желаемых соотношениях.
Еще один объект данного изобретения предоставляет способ катализа ферментативно катализируемой многостадийной каскадной реакции. В этом аспекте способ содержит предоставление иммобилизованного белкового материала, содержащего два или более иммобилизованных фермента по данному изобретению, и приведение упомянутого иммобилизованного белкового материала в контакт, по меньшей мере, с одним субстратом, на котором ферменты, иммобилизованные на носителе, способны действовать.
В еще одном варианте реализации иммобилизованный ферментный материал дополнительно содержит металлические наночастицы, такие как наночастицы металлов переходного ряда, такие как, но, не ограничиваясь ими, кобальт, никель или палладий. Материал, содержащий металлические наночастицы, может быть приготовлен, например, погружением амино-CPG или амино-HybCPG в раствор соответствующего количества соли металла, такой как CoCl2, NiCl2, Li2PdCl4, PdCl2 или Pd(TFA)2, в ацетонитриле или воде, или их смеси. Ионы металла затем восстанавливаются до металлических наночастиц путем добавления избытка соответствующего восстанавливающего агента, такого как гидрид натрия, борогидрид натрия, цианоборогидрид натрия, литийалюминий гидрид и подобное. После добавления 2,4-дигидроксиацетофенона первоначально сформировавшийся имин немедленно восстанавливается до соответствующего амина. После удаления восстанавливающего агента путем отмывки ион металла, такой как Co2+, Fe3+ или Ni2+, хелатируется на матриксе суспензией материала в водном растворе CoCl2, FeCl3 или NiCl2, соответственно. После высушивания полученный материал может быть использован непосредственно в качестве матрикса для одного или более меченного полигистидином фермента; см. Фиг. 2.
Не желая быть связанными теорией, полагают, что металлические наночастицы связываются с материалом CPG через аминогруппы на материале CPG. Также допустимо, что металлические наночастицы, образованные восстановлением ионов металла, достаточно велики, чтобы быть захваченными в поры материала CPG.
Иммобилизованный белковый материал, содержащий и иммобилизованный фермент, и металлические наночастицы, может быть применен в качестве гетерогенного биокатализатора в комбинированных ферментативных и катализируемых металлами переходного ряда реакциях. Примеры таких реакций включают в себя, но не ограничиваются ими, реакции динамического кинетического разделения. Специфический пример таких реакций представляет собой динамическое кинетическое разделение аминов рацемизацией амина палладиевыми (Pd) наночастицами, после которой следовало ацилирование липазой, как и показано в прилагаемых примерах.
Таким образом, еще один объект данного изобретения предоставляет способ катализа комбинированной ферментативно катализируемой и катализируемой металлом переходного ряда реакции. В этом аспекте способ содержит предоставление иммобилизованного белкового материала, который дополнительно содержит наночастицы металла переходного ряда по данному изобретению, и приведение упомянутого иммобилизованного белкового материала в контакт, по меньшей мере, с одним субстратом, на котором фермент и металл переходного ряда, иммобилизованные на носителе, способны действовать.
Примеры иммобилизованного белкового материала раскрыты в данном документе и использование такого материала описано в экспериментальном разделе.
Определения
Термин «аффинный маркер» обозначает определенную группу, такую как органическая или органометаллическая молекула, фрагмент белка или другое, которые присоединены к рекомбинантному белку и которые способны связываться со специфической группой, иммобилизованной на матриксе. Примерами аффинных маркеров являются полигистидиновая метка, глютатион S-трансферазная метка (GST), метка хитин-связывающего белка (CBP), метка белка, связывающего мальтозу (MBP), метка FLAG, авидиновая метка или стрептавидиновая метка. Аффинные маркеры могут быть также обозначены как метки слияния.
Так, как это используется в данном документе, термин «аффинно меченый белок» обозначает рекомбинантный белок, в котором аффинный маркер, как определено выше, добавлен к белку-мишени. Аффинно меченые белки могут быть изготовлены с помощью технологии рекомбинантной ДНК с использованием способов, известных в данной области техники, таких как лигирование фрагментов ДНК или технологии полимеразной цепной реакции (PCR). Аффинно меченые белки могут также обозначаться как «белки с меткой слияния» или «белки слияния».
Термин «полигистидиновая метка» обозначает цепь, по меньшей мере, из двух остатков гистидина, которая присоединена к C- или N-концу белка. Полигистидиновая метка представляет собой предпочтительно цепь, по меньшей мере, из шести гистидиновых остатков. Другие названия, обычно используемые для полигистидиновой метки это - метка полиHis, гистидиновая метка, гексагистидиновая метка, метка 6xHis и метка His6, так же как His-tag™.
Термин «меченый полигистидином фермент» обозначает рекомбинантный фермент, в котором фермент-мишень соединен с полигистидиновой меткой, как определено выше.
Так, как это используется в данном документе, термин «амино-CPG» обозначает материал CPG, который функционализован аминогруппой через соответствующий линкер. Термин «амино-HybCPG», так как он используется в данном документе, обозначает материал Hybrid CPG, в котором полимерное покрытие содержит аминогруппы.
Данное изобретение далее проиллюстрировано с помощью нижеследующих примеров, которые не ограничивают данное изобретение в каком-либо отношении. Все процитированные документы и ссылки включены в данный документ по ссылке.
Сокращения
Экспериментальные способы
Материалы CPG были получены на фирме Prime Synthesis, Inc., (Aston, PA, США). В примерах были использованы нижеследующие стеклянные материалы с контролируемой пористостью:
LCAA CPG представляет собой CPG, дериватизированное длинноцепочечными алкиламинами (CPG-0502-N12).
Copoly-HybCPG-amine (далее также обозначаемое как «HybCPG copo») представляет собой гибридное CPG, покрытое сополимером, образованным из 1:1 акрилонитрила:винилбензил хлорида и поперечносшитые in situ.
VBC HybCPG-amine (далее также обозначаемое как «HybCPG VBC») представляет собой гибридное CPG, покрытое полимером, образованным винилбензил хлорид мономерами и поперечносшитыми in situ.
(Со-)полимеры покрытия поперечно сшиты бифункциональным амином, как описано в WO 2009/005631. Аминогруппы затем вводились на хлорополимерное покрытие путем реакции с фталимидом натрия, после чего следует дефталоилирование с гидразином.
Нижеследующие пористые органические полимеры были использованы в примерах:
ʺMid-Swell Polystyreneʺ (приобретенный на фирме 3-Prime LLC, США; каталожный номер 04-02-03-32), аминофункционализованная полистироловая подложка. Размер пор ~1000 Å (очень широкое распределение), размер частиц 100 мкм, загрузка амина 222 мкмоль/г.
ʺLow-Swell Methacrylate Copolymerʺ (приобретенный на фирме SPRIN Technologies S.p.A., Италия; каталожный номер 1A02BN), аминофункционализированная метакрилатная подложка. Диаметр пор неизвестен, размер частиц 100-300 мкм, загрузка амина 270 мкмоль/г.
Культивирование сверхэкспрессированной ω-трансаминазы из Chromobacterium violaceum было выполнено, как описано в Cassimjee et al. (ACS Catal. 2011, vol. 1, pp. 1051-1055). Культивирование сверхэкспрессированной липазы А из Candida Antarctica было выполнено, как описано у Sandström et al. (Protein Eng Des Sel. 2009, vol 22, pp. 413-420). Культивирование сверхэкспрессированной липазы В и CalB Trp104Ala, нестабильного варианта липазы В из Candida Antarctica, было выполнено, как описано у Engström et al. (Org. Biomol. Chem. 2011, vol. 9, pp. 81-82). Культивирование сверхэкспрессированной 2,5-дикетокамфан монооксигеназы из Pseudomonas putida было выполнено, как описано у Kadow et al. (AMB Express 2011, 1:13). Культивирование сверхэкспрессированной флавинредуктазы из E. coli было выполнено, как описано у Kadow et al. (Appl. Microbiol. Biotechnol. 2013, опубликовано онлайн 5 ноября 2013). Культивирование сверхэкспрессированной аланиндегидрогеназы из B. subtilis было выполнено, как описано у Mutti et al. (Eur. J. Org. Chem. 2012, issue 5, pp. 1003-1007). Когда она отсутствовала, метку His6-tag добавляли к генам с помощью PCR. Меченные полигистидином CalA и CalB были иммобилизованы на Accurel в соответствии с процедурами, описанными у Engström et al. (Org. Biomol. Chem. 2011, vol. 9, pp. 81-82).
ПРИМЕРЫ
Пример 1
Изготовление хелатирующих носителей CPG для иммобилизации и очистки ферментов, меченных полигистидином
Амино-CPG (5 г) желательного типа обрабатывали 2,4-дигидроксиацетофеноном (1,5 эквив. функциональных аминогрупп на CPG) в метаноле (200 мл) при непрерывном перемешивании в течение 60 мин. Образовавшийся имин восстанавливали последующим добавлением борогидрида натрия (4 эквив.) при непрерывном перемешивании в течение 60 мин. Твердый материал фильтровали, споласкивали насыщенным водным раствором карбоната натрия, водой и затем этанолом, а затем высушивали при 80°С в течение 2 ч. Частицы затем погружали в насыщенный водный раствор CoCl2 (100 мл). После фильтрования и споласкивания водой и этанолом частицы высушивали при 80°C в течение 2 ч. Свойства различных носителей CPG показаны в Табл. 1.
Носители, содержащие Fe3+ в качестве хелатируемого иона металла, были изготовлены сходным образом с процедурой, описанной выше, но с использованием водного раствора FeCl3 вместо CoCl2.
Пример 2
Изготовление хелатирующих пористых полистиролового и полиметакрилатного носителей для иммобилизации и очистки меченых полигистидином ферментов
Отмытые (вода/этанол 1:1, 400 мл) и высушенные (вакуум 16 ч после фильтрования) аминофункционализованные пористые частицы из органического полимера (2 г) желаемого типа (см. ниже) были обработаны 2,4-дигидроксиацетофеноном (1,5 эквив. функционализованным аминогруппам на пластмассе) в метаноле (50 мл) при постоянном перемешивании в течение 60 мин. Образовавшийся имин восстанавливали последующим добавлением борогидрида натрия (4 эквив.) при постоянном перемешивании в течение 60 мин. Твердый материал фильтровали, споласкивали насыщенным водным раствором карбоната натрия, водой и этанолом, а затем высушивали под вакуумом при 25°С в течение 16 ч.
Частицы затем погружали в насыщенный водный раствор CoCl2 (100 мл). После фильтрования и споласкивания водой и этанолом частицы высушивали при 25°С в течение 16 ч. Свойства различных хелатирующих пористых пластмассовых носителей показаны в Табл. 2.
Пример 3
Иммобилизация меченых полигистидином ферментов на хелатирующих носителях
Супернатанты клеточной культуры, содержащие CalA или CalB, использовали без забуферивания. Клеточные лизаты ω-TA готовили ресуспендированием клеток в буфере HEPES (50 мМ, 500 мМ NaCl, pH 8,3). После добавления детергентов (BugBuster™ 10X, фирма Novagen) остатки клеток удаляли центрифугированием. Хелатирующий носитель CPG погружали в лизаты или супернатанты, после чего перемешивали на круговой качалке (150 об/мин). Образцы растворов, проанализированные по Брэдфорд в ходе иммобилизации, подтверждают завершение связывания и насыщения хелатирующего носителя CPG, когда концентрация белка начинает снижаться. Анализы активности также проводились на растворах после удаления носителя CPG фильтрованием. Иммобилизованные препараты затем споласкивались буфером (MOPS (50 мМ, pH 7,4) для CalA и CalB; HEPES (см. выше) -для ω-TA) и высушивались под вакуумом в течение 16 ч.
Экстракция иммобилизованного фермента из носителя на CPG была выполнена путем погружения частиц в буфер элюции (50 мМ фосфата натрия, 500 мМ имидазола, pH 7,5) и инкубации на круговой качалке в течение 20 мин. Присутствие и чистота экстрагированных ферментов были визуализированы с помощью SDS-PAGE; были видимы только полосы, соответствующие ферментам, помеченным His6.
Количественная оценка активного сайта ω-TA в растворителе была выполнена, как описано ранее (Cassimjee et al., ACS Catal. 2011, vol. 1, pp. 1051-1055). Количественная оценка активного сайта иммобилизованной ω-TA в растворителе была выполнена путем добавления ω-TA-CPG к 1-фениэтиламину (1 мМ, 1 мл, MTBE aw=0,6, 1 мМ пентадекана). Реакционную смесь перемешивали на круговой качалке (150 об/мин, 24 ч, 22°С). Водная активность растворителя устанавливалась парами гидратов солей (Na2HPO4,×2H2O/7H2O), но не контролировалась после добавления ω-TA-CPG или в ходе реакции. Степень превращения измеряли с помощью GC (образцы 200 мкл в EtOAc, 3 капли уксусного ангидрида и триэтиламина, 8 ч инкубации при 22°С) при пентадекане в качестве внутреннего стандарта.
Количественная оценка активного сайта иммобилизованной ω-TA в буфере была выполнена путем добавления ω-TA-CPG к 1-фенилэтиламину (1 мМ, 1 мл, 50 мМ HEPES, pH 7,0). Реакционную смесь перемешивали на круговой качалке (150 об/мин, 24 ч, 22°С). Образцы (400 мкл) были обработаны водным раствором NaOH (1%), экстрагировались DCM и анализировались с помощью GC после добавления пентадекана (1 мМ, EtOAc). Во всех случаях степень превращения сравнивали с контрольными реакциями с хелатирующим CPG (без связанного фермента).
Выход иммобилизации, т.е. количество активного фермента, удаленного из лизата против количества активного фермента, оставшегося на CPG после отмывки, составлял более чем 99%, основываясь на количественной оценке активного сайта. Результаты показаны в Табл. 3.
Иммобилизация меченых полигистидином ферментов (CalA и CalB) на хелатирующем пористом полистироловом и полиметакрилатном носителях была выполнена, как описано выше для носителей CPG.
Пример 4
Использование ω-TA-CPG в качестве катализаторов
ω-TA-CPG, приготовленные в Примере 3, были применены в качестве катализаторов в энантиоспецифическом трансаминировании фенокси-2-пропанона:

20 мг ω-TA-CPG были добавлены к 3 мл раствора MTBE (aw=0.6) с 100 мМ рацемического 1-фенилэтиламина и 50 мМ 2-феноксипропанона, и реакционную смесь инкубировали на круговой качалке (150 об/мин) при 50°C. Пентадекан (50 мМ) был использован в качестве внутреннего стандарта. Степень превращения и энантиомерную чистоту 1-фенилэтиламина отслеживали с помощью хиральной газовой хроматографии после взятия образцов (50 мкл) в зарегистрированные моменты времени; образцы были дериватизированы уксусным ангидридом и триэтиламином, как описано выше. Образование 1-феноксипропан-2-амина измеряли без дериватизации. Результаты показаны в Табл. 4.
Пример 5
Использование иммобилизованных CalA и CalB в качестве катализаторов
CalA-CPGs, CalB-CPGs, CalB-полистирол и CalB-полиметакрилат, приготовленные по Примеру 3, были применены в качестве катализаторов в энантиоселективном ацилировании 1-фенилэтанола (кинетическое разделение):

Реакции кинетического разделения, катализируемый липазой были выполнены путем добавления иммобилизованного фермента (20 мг) к 3 мл раствора толуола (aw=0,1) с 10 мМ 1-фенилэтанола и 100 мМ винилбутирата, и смесь инкубировали на круговой качалке (200 об/мин) при 22°С (для CalA и CalB) или 50°С (для CalB Trp104Ala). Пентадекан (5 мМ) был использован как внутренний стандарт. Степень превращения и энантиомерная чистота 1-фенилэтанола и 1-фенилэтилбутирата были измерены с помощью хиральной GC путем взятия образцов (50 мкл) в регистрируемые моменты времени.
Следующие реакции были включены для сравнения:
- CalB иммобилизованный на Accurel®, пористый полипропиленовый порошок.
- CalB иммобилизованный на амино-HybCPG copo в немодифицированной форме (т.е., не обработанный по Примеру 1).
Иммобилизация CalB (и CalB Trp104Ala) на активированном этанолом Accurel® (Accurel MP1001, размер частиц <1000 мкм, фирма Membrana GmbH, Вупперталь, Германия) проводилась путем добавления пористого материала к концентрированному супернатанту в соотношении 50:1 к количеству фермента (содержание белка измеряли по способу Брэдфорд), после чего следовала инкубация в течение, по меньшей мере, восьми часов. Результаты показаны в Табл. 5.
Пример 6
Изготовление каскадного CPG с тремя различными ферментами (ʺBV-cascade-CPGʺ)
Клеточные лизаты 2,5-DKCMO, FRE и AlaDH были изготовлены путем ресуспендирования клеток в натрий-фосфатном буфере (50 мМ, 500 мМ NaCl, pH 7,5) и добавления BugBuster™ 10X. После центрифугирования и устранения клеточных остатков, хелатирующий Co2+ CPG-носитель был погружен в смесь равных объемов трех клеточных лизатов, после чего следовало перемешивание на круговой качалке (150 об/мин). Анализ образцов растворов по Брэдфорд в ходе иммобилизации подтвердил завершение связывания и насыщение носителя CPG, когда концентрация белка стала снижаться. Анализы активности были выполнены на растворах после удаления CPG путем фильтрования. Иммобилизованные препараты были затем сполоснуты натрий-фосфатным буфером (см. выше), а затем высушены под вакуумом в течение 16 ч.
Пример 7
Ферментативная каскадная реакция с использованием BV-cascade-CPG в качестве катализаторов
Каскадные CPG, приготовленные по Примеру 6, были применены в качестве катализаторов в окислении Байера-Виллигера (+)-камфоры:

65 мг BV-cascade-CPG были добавлены к реакционной смеси фосфатного буфера (100 мМ, pH 7,5) с 2,0 мМ (+)-камфоры, 5,0 мМ L-аланина, 0,3 мМ FMN и 0,5 мМ NADH с общим объемом жидкости 5,0 мл. Затем растворяли кислород (барботирование в течение 30 с), после чего герметизировали сосуд; смесь инкубировали на круговой качалке (150 об/мин) при 22°С. Образцы (500 мкл) экстрагировались в EtOAc с этилбензоатом в качестве внутреннего стандарта и анализировались GC. Степень превращения измеряли через 3 часа. Кислород добавляли через 24 часа и позволяли реакции продолжаться в течение дополнительных 3 часов, после чего степень превращения измеряли снова (27 ч).
Также была поведена сравнительная реакция со свободным (неиммобилизованным) 2,5-DKCMO, FRE и AlaDH (из клеточных лизатов). Пропорции и количества ферментов не измерялись. Результаты показаны в Табл. 6.
Многофазные реакции выполняли путем добавления 1,0 г BV-cascade-CPG к реакционной смеси фосфатного буфера (100 мМ, pH 7,5) с 160 мМ L-аланина, 0,3 мМ FMN и 0,5 мМ NADH при общем объеме жидкости 5,0 мл. 5 мл циклогексана с (+)-камфорой (100 мМ) затем добавляли в качестве второй жидкой фазой. Герметизированный сосуд перемешивали на круговой качалке (100 об/мин) при 22°С при постоянном добавлении кислорода в водную фазу. Образцы (50 мкл) из органической фазы were брали в зарегистрированные моменты времени и анализировали с помощью GC после добавления этилбензоата (2,0 мМ в EtOAc) в качестве внутреннего стандарта. Степень превращения через 72 ч была измерена после экстракции всех компонентов с помощью EtOAc (20 мл).
Были также выполнены сравнительные реакции со свободными (неиммобилизованными) 2,5-DKCMO, FRE и AlaDH (из клеточных лизатов). Пропорции и количества ферментов не были измерены. Результаты показаны в Табл. 7.
Пример 8
Изготовление каскадного CPG с CalB и Pd-наночастиц («Pd-CalB-CPG»)
Амино-CPG (5 г) погружали в раствор Pd(TFA)2 (0,5 эквив. функциональных аминогрупп CPG) в воде (200 мл) и смесь непрерывно перемешивали в течение 10 мин. Затем добавляли NaBH4 (7 эквив.), и смесь перемешивали в течение дополнительных 30 мин. Затем добавляли 2,4-дигидроксиацетофенон (0,5 эквив.), после чего смесь перемешивали в течение 30 мин. Твердый материал отфильтровывали и тщательно споласкивали водой, а затем погружали в насыщенный водный раствор CoCl2 (100 мл). После фильтрования и отмывки водой твердый материал погружали в раствор меченного полигистидином CalB (очищенного или из супернатанта) и перемешивали в течение 30 мин. Иммобилизованный препарат затем фильтровали, споласкивали буфером (20 мМ MOPS, pH 7,4), а затем высушивали под вакуумом в течение 16 ч.
Пример 9
Каскадная реакция с использованием Pd-CalB-CPGs
Материал, изготовленный по Примеру 8, применяли в качестве катализатора в энантиоселективном ацилировании 1-фенилэтиламина (динамическое кинетическое разделение):
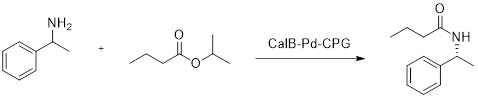
100 мг Pd-CalB-CPG погрузили в раствор 1,0 мл толуола, содержащий 20 мМ рацемического 1-фенилэтиламина и 100 мМ изопропилбутирата. Добавляли 1 мг NaBH4, и реакционный сосуд герметизировали. Систему инкубировали при 65°С при постоянном перемешивании на круговой качалке (100-800 об/мин) в течение 24-48 ч. Степень превращения и энантиомерную чистоту субстрата и продукта (например, (R)-N-(1-фенилэтил)бутирамид) измеряли хиральной GC взятием образцов в определенные моменты времени.
Продукт получали путем разделения фаз, встряхивания органической фазы с 1 N HCl (три раза), чтобы удалить остаточный донор ацила и амина, а затем снова экстракция отмывочных фаз с помощью EtOAc. Комбинированные органические фазы выпаривали под вакуумом с получением продукта, который далее очищали с помощью флэш-хроматографии.
Пример 10
A. Определение вымывания ионов металла
Чтобы определить количество ионов металла, которое вымывается с носителя при заданных условиях, носители, основанные на CPG и HybCPG и содержащие либо Co2+, либо Fe3+, подвергались продолжительной инкубации в водном буфере.
250 мг каждого из LCAA CPG, HybCPG VBC и HybCPG copo, со связанными [с ними] либо Co2+, либо Fe3+, подвергались инкубации в 3 мл водного буфера (HEPES 20 мМ, pH 7,0) в течение 72 ч на вращающемся столике при комнатной температуре.
Количество Co2+ измеряли путем смешивания одной части инкубируемого раствора с одной частью раствора NH4SCN (1,0 M), одной частью раствора HCl (6,0 M) и двумя частями ацетона. Эта процедура дает синее окрашивание, пропорциональное концентрации Co2+, которое количественно оценивали спектрофотометрией на [длине волны] 620 нм. Также тестировали контрольный образец, содержащий только буфер.
Количество Fe3+ измеряли путем смешивания одной части инкубируемого раствора с одной частью раствора NH4SCN (1,0 M) и одной частью раствора HCl (6,0 M). Эта процедура давала красное окрашивание, пропорциональное концентрации Fe3+, которое количественно оценивали с помощью спектрофотометрии на [длине волны] 480 нм. Также тестировали контрольный образец, содержащий только буфер.
После удаления одной половины растворов (1,5 мл) из инкубируемого материала носителей добавляли 1,5 мл 6,0 M раствора HCl, и материалы инкубировали на качалке в течение 1 ч; эта процедура эффективно десорбирует все связанные ионы металла. Одну часть этого инкубируемого раствора затем смешивали с одной частью раствора HCl (3 M) и одной частью раствора NH4SCN (1,0 M). В те образцы, в которых количественно оценивали Co2+, добавляли две части ацетона. Регистрировали поглощение на [длине волны] 620 нм для количественной оценки Co2+ и на [длине волны] 480 нм для количественной оценки Fe3+. Основываясь на измерениях поглощения, значения, соответствующие общему количеству ионов металла рассчитывали для тестируемых объемов в двух разных инкубациях (первая - при pH 7,0, а затем в 3,0 M HCl), и делалась поправка на удаленный объем (1,5 мл после первой инкубации). Фракция вымытых ионов металла при pH 7,0 могла быть таким образом оценена количественно. Результаты представлены в Табл. 8 ниже.
Можно видеть, что связывание Fe3+ к материалу носителя CPG и HybCPG менее склонно к вымыванию, чем Co2+.
B. Определение вымывания фермента
Чтобы определить количество фермента, которое было диссоциировано с носителя при данных условиях, иммобилизованные препараты ω-TA на CPG или HybCPG были подвергнуты длительной инкубации в водном буфере.
12-16 мг каждого из ω-TA-LCAA CPG, ω-TA-HybCPG VBC и ω-TA-HybCPG copo, причем ферменты связаны с либо Co2+, либо Fe3+, инкубировались в 4 мл водного буфера (HEPES 100 мМ, pH 7,0) в течение 1 мин на круговой качалке. После этого времени никаких ферментов нельзя было детектировать в растворе. Это было измерено с помощью теста активности, в котором 1 мл раствора был использован после осаждения иммобилизованного материала. Препараты с оставшимися 3 мл инкубировались в течение 24 ч на круговой качалке, после чего некоторые препараты демонстрировали измеримые количества фермента в растворе.
Анализ активности был выполнен путем взятия 1 мл раствора, добавления 1 мл аналитической смеси (1-фенилэтиламин (10 мМ), пируват натрия (5 мМ) и PLP (1 мкМ), растворенные в том же буфере), и измерения изменения поглощения [на длине волны] 245 нм во времени в течение 5 мин. Также тестировали контрольную реакцию с чистым буфером. На этой длине волны образование ацетофенона - продукта реакции трансаминирования, может быть отслежено как увеличение поглощения при коэффициенте экстинкции 12 мМ-1см-1 (Schätzle et al., Anal. Chem. 2009, vol. 81, pp. 8244-8248). Поскольку кинетические константы известны (Cassimjee et al., Org. Biomol. Chem. 2012, vol. 10, pp. 5466-5470), количество вымытого фермента может быть рассчитано. Перед экспериментом по вымыванию количество связанного фермента в иммобилизованных препаратах было измерено по количественной оценке активности сайта. Количество вымытого через 24 ч для каждого материала показано в Табл. 9.
Значения показывают, что при протестированных условиях, Fe3+ в качестве хелатируемого иона металла дает меньшее вымывание фермента. HybCPG copo в качестве носителя не приводил к обнаружимому вымыванию фермента при выбранных условиях либо с Co2+, либо с Fe3+ в качестве хелатируемого иона металла. LCAA CPG, которое имело стеклянную поверхность, давало наивысшее количество вымытого фермента. Это может быть результатом неспецифического связывания фермента со стеклянной поверхностью.
Пример 11
Очистка меченой полигистидином ω-TA с помощью HybCPG copo (Co2+)
Клеточный лизат (5,0 мл) из осажденной индуцированной IPTG 24 часовой культуры ω-TA в 100 мл среды Лурия-Бертани с добавлением 50 мкг/мл канамицина был приготовлен с использованием BugBuster™. Был добавлен избыток кофермента (PLP), и раствор инкубировали при 37°С в течение 1 ч. Избыток PLP (не связанного ферментом) был затем устранен заменой буфера с помощью колонки PD10 (два прохода) на HEPES-буфер (50 мМ, 500 мМ NaCl, pH 8,2 (Буфер 1)), что дало 7,0 мл раствора, содержащего голофермент, являющийся целью, нативные белки и другие загрязнения.
Колонку заполняли 204 мг HybCPG copo (Co2+), содержащего 26 мкмоль/г Co2+. Материал был предварительно смочен добавлением 7,0 мл Буфера 1, и элюат удаляли.
Активный голофермент измеряли спектрофотометрически при [длине волны] 395 нм, ε=8,1 мМ-1см-1 (Cassimjee et al., ACS Catal. 2011, vol. 1, pp. 1051-1055). После измерения поглощения лизат добавляли на колонку, и собирали элюат. Разность поглощения лизата на этой длине волны перед и после прохождения через колонку до величины измеряли до величины 0,62 (все измерения проводили при длине пути в 1,0 см). Это соответствует 29 мг фермента, связанного теперь с носителем HybCPG copo (Co2+) в колонке.
Затем колонку отмывали 7,0 мл Буфера 1. В собранном элюате поглощение измеряли до достижения 0,11 при Буфере 1 для сравнения. Это соответствует 5 мг фермента, который был отмыт с колонки, предположительно вследствие неспецифического связывания или несвязанности фермента, оставляя 24 мг связанного фермента в колонке.
Диссоциация связанного фермента в колонке выполнялась внесением 5,0 мл Tris-буфера (50 мМ, 500 мМ имидазола, pH 7,5 (Буфер 2)). Элюат собирали, и снова добавляли избыток кофермента. Как описано выше, избыток PLP был удален заменой буфера с использованием колонки PD10 на Буфер 1, что дало общий объем в 7,0 мл раствора с растворенным голоферментом. Поглощение измеряли до 0,465. Это соответствует 22 мг очищенного фермента, или выходу 92%. Раствор выглядел значительно очищенным от загрязняющих белков клетки-хозяина, что также было подтверждено с помощью SDS-PAGE.
Реферат
Группа изобретений относится к медицине и касается иммобилизованного белкового материала, содержащего носитель и по меньшей мере один белок, иммобилизованный на носителе. Причем носитель содержит материал носителя, к которому присоединен аффинный матрикс, где указанный материал носителя выбран из группы, состоящей из стекла с контролируемой пористостью (CPG) и гибридного стекла с контролируемой пористостью (Hybrid CPG), и где по меньшей мере один белок содержит аффинный маркер и иммобилизован на носителе специфическим аффинным связыванием с аффинным матриксом, где аффинный маркер представляет собой полигистидиновую метку и где аффинный матрикс содержит хелатируемый ион металла. Группа изобретений также касается применения указанного носителя для иммобилизации белков; применения иммобилизованного белкового материала в качестве гетерогенного катализатора; способа катализа ферментативно катализируемой многостадийной или каскадной реакции, содержащей приведение иммобилизованного белкового материала в контакт по меньшей мере с одним субстратом. Группа изобретений обеспечивает улучшенную стабильность иммобилизованных белков. 10 н. и 14 з.п. ф-лы, 11 пр., 2 ил., 9 табл.

Комментарии