Получение гетеромультимерных белков с использованием клеток млекопитающих - RU2727012C2
Код документа: RU2727012C2
Чертежи










Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка испрашивает приоритет по предварительной заявке США номер 61/989,509, поданной 6 мая 2014, которая включена в настоящий документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способам получения гетеромультимерных белков.
УРОВЕНЬ ТЕХНИКИ
Моноклональные антитела класса IgG содержат два идентичных антигенсвязывающих плеча и константный домен (Fc). Антитела, плечи которых имеют разную специфичность связывания, обычно не встречаются в природе и поэтому должны быть созданы химическим способом (например, путем химического перекрестного сшивания и т.п.), методом рекомбинантных ДНК и/или методом слияния клеток.
Биспецифические антитела одновременно могут связывать два разных антигена. Это открывает возможности для разработки терапевтических стратегий, которые было невозможно осуществить, используя обычные моноклональные антитела. Сильный интерес к этим молекулам выражается в разработке большой панели всевозможных форматов биспецифических антител. Смотрите Berg J, Lotscher Е, Steimer KS, et al., "Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain," Proc Natl Acad Sci USA (1991) 88(11): 4723-4727 и Fischer N and Leger O., "Biospecific Antibodies: Molecules That Enable Novel Therapeutic Strategies," Pathobiology (2007) 74:3-14.
Другой класс мультиспецифических молекул представляют собой рекомбинантные белки слияния. Рекомбинантные белки слияния, включающие внеклеточный домен иммунорегуляторных белков и константный (Fc) домен иммуноглобулина (Ig), представляют собой развивающийся класс терапевтических средств для лечения человека. В иммуноадгезинах сочетается связывающая область из последовательности белка, имеющая желаемую специфичность, и эффекторный домен антитела. Иммуноадгезины обладают двумя важными свойствами, которые важны с точки зрения их использования в качестве терапевтических агентов: целевая специфичность и фармакокинетическая стабильность (период полужизни in vivo, сравнимый с периодом полужизни in vivo для антител). Иммуноадгезины могут использоваться в качестве антагониста для ингибирования или блокирования нежелательных взаимодействий или в качестве агониста для имитирования или усиления физиологического ответа. Смотрите Chamow SM, Zhang DZ, Tan XY, et al., "A humanized, bispecific immunoadhesin-antibody that retargets CD3+ effectors to kill HIV-1-infected cells, " J Hematother 1995; 4(5): 439-446.
Другие мультиспецифические молекулы обсуждались ранее в других источниках. Неограничивающие примеры включают Fisher et al., Pathobiology (2007) 74:3-14 (обзор различных биспецифических форматов); патент США номер 6,660,843, опубликованный 9 декабря 2003, авторы Feige et al., (пептитела); опубликованная заявка на патент США номер 2002-004587, опубликованная 10 января 2002 (мультиспецифические антитела); патент США номер 7612181, опубликованный 3 ноября 2009, авторы Wu et al. (формат антител с двойным вариабельным доменом); патент США номер 6,534,628, Nord К et al., Prot Eng (1995) 8:601-608, Nord К et al., Nat Biotech (1997) 15:772-777 и

Получение достаточно чистого для клинического применения материала остается сложной задачей для мультиспецифических молекул, описанных выше. Как указано выше, существует множество способов получения молекул со смешанными связывающими плечами, т.е. связывающими плечами, которые не идентичны друг другу. Каждый из этих способов имеет свои недостатки.
Химическое перекрестное сшивание является трудоемким методом, поскольку соответствующие продукты все равно должны быть очищены от гомодимеров и других нежелательных побочных продуктов. Кроме того, стадии химической модификации могут изменять целостность белков, что приводит к снижению стабильности белков. Таким образом, этот способ часто является неэффективным и может привести к потере активности антител.
С помощью метода слияния клеток (например, межвидовых гибридом) удается экспрессировать две тяжелых и две легких цепи, которые объединяются случайным образом, в результате чего образуются 10 комбинаций антител. Желаемые гетеромультимерные антитела представляют собой только небольшую фракцию антител, полученных таким образом. Процедура очистки желаемых гетеромультимерных белков значительно уменьшает выход и увеличивает производственные затраты.
Методы рекомбинантных ДНК использовали для создания различных гетеромультимерных форматов антител, которые не содержат домен Fc, например, одноцепочечных Fv, диател и т.п. Основным недостатком молекул антител этого типа является отсутствие домена Fc и, следовательно, способности антитела инициировать эффекторную функцию (например, активация комплемента, связывание с Fc-рецептором и т.п.). Таким образом, существует необходимость в биспецифическом антителе, включающем функциональный домен.
Методы рекомбинантных ДНК также использовали для создания биспецифических антител типа ‘выступ-во-впадину’. Смотрите заявку на патент США номер 20030078385 (Arathoon et at. - Genentech). Одно из ограничений этой стратегии заключается в том, что легкие цепи двух исходных антител должны быть идентичны, чтобы предотвратить неправильное сочетание цепей и образование нежелательных и/или неактивных молекул, экспрессируемых в той же клетке.
Таким образом, по-прежнему существует необходимость в альтернативных способах получения гетеромультимерных белков. Изобретение, описанное в настоящем документе, предусматривает такие способы. Эти и другие аспекты и преимущества изобретения будут понятны из описания изобретения, приведенного в настоящем документе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение предусматривает эффективные и новые способы получения мультиспецифических иммуноглобулиновых комплексов (например, мультиспецифических антител) и других мультимерных белков (совместно называются в настоящем документе гетеромультимерными белками) в клетках млекопитающих, превосходящие способы, известные в данной области техники. Смотрите WO 2013/055958 и WO 2011/133886.
Таким образом, в первом аспекте, предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, способной экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь;
(b) культивирование второй клетки-хозяина, способной экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь; и,
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки-хозяина, где комбинированная культуральная среда содержит гетеромультимерный белок, и где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, комбинированная культуральная среда была получена без разрушения клеточной мембраны первой и второй клеток-хозяев. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
Также предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, способной экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, способной экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки хозяина без разрушения клеточной мембраны первой и второй клеток-хозяев, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(d) инкубирование комбинированной культуральной среды в восстанавливающих условиях, достаточных для образования гетеромультимерного белка, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первый полипептид, содержащий шарнирный участок, и второй полипептид, содержащий шарнирный участок, включают первую и вторую тяжелые цепи. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, описанным в настоящем документе, первый полипептид, содержащий шарнирный участок, и первая легкая цепь включает первую половину антитела. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, описанным в настоящем документе, второй полипептид, содержащий шарнирный участок, и вторая легкая цепь включает вторую половину антитела.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, получение комбинированной культуральной среды включает:
(1) сбор первой культуральной среды от первой культуры клетки-хозяина;
(2) сбор второй культуральной среды от второй культуры клетки-хозяина; и (3) объединение первой культуральной среды и второй культуральной среды для получения комбинированной культуральной среды.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, получение комбинированной культуральной среды включает сбор культуральной среды от комбинированной культуры клеток, включающей первую клетку-хозяин и вторую клетку-хозяин. В некоторых вариантах воплощения, комбинированная культуральная среда была получена без разрушения клеточной мембраны первой и второй клеток-хозяев.
Первые и вторые клетки-хозяева в способах по настоящему изобретению можно культивировать в любых условиях, которые обеспечивают экспрессию и выделение целевых полипептидов. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первая клетка-хозяин и вторая клетка-хозяин культивируются отдельно друг от друга до объединения в комбинированную клеточную культуру.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, способы дополнительно включают стадию культивирования комбинированной клеточной культуры при температуре от примерно 25°С до примерно 40°C. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду инкубируют на протяжении от примерно 24 часов до примерно 7 дней после получения комбинированной культуральной среды. Внекоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду инкубируют при температуре от примерно 4°C до примерно 8°C. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду перемешивают.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, способы дополнительно включают выделение гетеромультимерного белка из комбинированной культуральной среды. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, гетеромультимерный белок выделяют с использованием колонки с белком А. В некоторых вариантах воплощения, гетеромультимерный белок дополнительно очищают с использованием способов, известных в данной области техники.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, способы дополнительно включают добавление восстанавливающего агента к первой культуральной среде и/или ко второй культуральной среде до или после сбора первой и второй культуральной среды. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, способы дополнительно включают добавление восстанавливающего агента к культуральной среде от комбинированной культуры клеток до сбора культуральной среды от комбинированной культуры клеток. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент добавляют примерно за 4-12 часов, примерно за 5-20 часов, примерно за 10-20 часов, примерно за 10-15 часов или примерно за 15-18 часов до стадии сбора. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент добавляют примерно за 15 часов до стадии сбора.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, способы дополнительно включают добавление восстанавливающего агента к комбинированной среде для культивирования клеток. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду, содержащую восстанавливающий агент, дополнительно инкубируют на протяжении от примерно 4 часов до примерно 7 дней. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду, содержащую восстанавливающий агент, дополнительно инкубируют на протяжении примерно 15 часов. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент добавляют к комбинированной культуральной среде до выделения гетеромультимерного белка из комбинированной культуральной среды. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду, содержащую восстанавливающий агент, инкубируют на протяжении, по меньшей мере, примерно 24 часов перед выделением гетеромультимерного белка. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду, содержащую восстанавливающий агент, инкубируют на протяжении, по меньшей мере, примерно 48 часов перед выделением гетеромультимерного белка. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, гетеромультимерный белок выделяют с использованием колонки с белком А.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент выбран из группы, состоящей из глутатиона, 2-меркаптоэтанола, 2-меркаптоэтиламина, трис(2-карбоксиэтил)фосфина (ТСЕР), цистеина, цистеина, дитиотрейтола, цистеина дитиотрейтола, дитиобутиламина или их комбинации. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент представляет собой глутатион, и глутатион добавляют в концентрации от примерно 5 мМ до не более чем примерно 20 мМ. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент представляет собой глутатион, и глутатион добавляют в концентрации от примерно 2 мМ до примерно 10 мМ. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент представляет собой глутатион, и глутатион добавляют в концентрации от примерно 5 мМ до не более чем примерно 20 мМ. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент представляет собой глутатион, и глутатион добавляют в концентрации примерно 15 мМ.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первая клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, вторая клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первая клетка-хозяин представляет собой клетку СНО. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, вторая клетка-хозяин представляет собой клетку СНО.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, соотношение первой клетки-хозяина и второй клетки-хозяина оптимизируют таким образом, что молярное соотношение первого полипептида, содержащего шарнирный участок, и второго полипептида, содержащего шарнирный участок, составляет от примерно 1:10 до примерно 10:1 после объединения культуры первых клеток-хозяев и культуры вторых клеток-хозяев и получения комбинированной культуры клеток. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, молярное соотношение первого полипептида, содержащего шарнирный участок, экспрессируемого первой клеткой-хозяином, и второго полипептида, содержащего шарнирный участок, экспрессируемого второй клеткой-хозяином составляет 1:1 после объединения культуры первых клеток- хозяев и культуры вторых клеток-хозяев и получения комбинированной культуры клеток.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, полипептиды, содержащие шарнирный участок, включают участок Fc или его вариант. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первый и/или второй полипептид, содержащий шарнирный участок, включают тяжелую цепь антитела.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первый домен гетеродимеризации включает модификацию выступ на поверхности взаимодействия, и второй домен гетеродимеризации включает модификацию впадина на поверхности взаимодействия. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, модификация выступ включает замену исходного аминокислотного остатка из первого домена гетеродимеризации на аминокислотный остаток с боковой цепью большего размера, чем у исходного аминокислотного остатка. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, замещающий аминокислотный остаток выбран из группы, состоящей из триптофана, фенилаланина, тирозина и аргинина. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, модификация впадина включает замену исходного аминокислотного остатка из второго домена гетеродимеризации на аминокислотный остаток с боковой цепью меньшего размера, чем у исходного аминокислотного остатка. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, замещающий аминокислотный остаток выбран из группы, состоящей из серина, треонина, валина и аланина. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, модификация выступ включает замену T366W (нумерация EU). В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, модификация впадина включает две или больше аминокислотных замен, выбранных из группы, состоящей из T366S, L368A и Y407V (нумерация EU).
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, указанная межцепьевая дисульфидная связь находится между шарнирными участками. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, гетеромультимерный белок представляет собой антитело. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, гетеромультимерный белок представляет собой биспецифическое антитело. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, указанное антитело представляет собой гуманизированное или человеческое антитело. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, антитело представляет собой полноразмерное антитело. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, антитело представляет собой фрагмент антитела, включающий, по меньшей мере, часть человеческого домена CH2 и/или CH3. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, антитело выбрано из группы, состоящей из IgG, IgA и IgD. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, антитело представляет собой IgG. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, антитело представляет собой IgG1, IgG2 или IgG4. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первая легкая цепь и вторая легкая цепь включают разные последовательности вариабельных доменов.
В другом аспекте предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование комбинированной культуры первой клетки-хозяина и второй клетки-хозяина, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего;
(b) добавление восстанавливающего агента к комбинированной культуральной среде; и
(c) сбор комбинированной культуральной среды из комбинированной культуры без разрушения клеточной мембраны, где комбинированная культуральная среда содержит гетеромультимерные белки.
В некоторых вариантах воплощения, первая клетка-хозяин секретирует первый гомодимер, включающий два первых полипептида, содержащих шарнирные участки, и две первых легких цепи, где вторая клетка-хозяин секретирует второй гомодимер, включающий два вторых полипептида, содержащих шарнирные участки, и две вторые легкие цепи, где комбинированная культура включает первый гомодимер и второй гомодимер. В некоторых вариантах воплощения, добавление восстанавливающего агента к комбинированной культуре обеспечивает образование гетеромультимерного белка.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, восстанавливающий агент добавляют после культивирования комбинированной культуры на протяжении не более чем примерно 18 дней. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральню среду собирают через 4-24 часа после добавления восстанавливающего агента. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, стадия сбора комбинированной культуральной среды включает удаление первой клетки-хозяина и второй клетки-хозяина из комбинированной культуральной среды. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, комбинированную культуральную среду инкубируют на протяжении от 4 часов до 7 дней.
В некоторых вариантах воплощения, способы дополнительно включают стадию оптимизации соотношения первой клетки-хозяина и второй клетки-хозяина в комбинированной культуре клеток. В некоторых вариантах воплощения, соотношение клеток оптимизируют таким образом, что молярное соотношение первого полипептида, содержащего шарнирный участок (со связанной с ним легкой цепью), экспрессируемого первой клеткой-хозяином, и второго полипептида, содержащего шарнирный участок (со связанной с ним легкой цепью), экспрессируемого второй клеткой-хозяином, в комбинированной культуре достигает желаемого молярного соотношения. В некоторых вариантах воплощения, клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, стабильная клеточная линия стабильно трансфицирована молекулой нуклеиновой кислоты (молекулами нуклеиновых кислот), которая может экспрессировать полипептид, содержащий шарнирный участок, и легкую цепь.
Следует понимать, что способы по настоящему изобретению могут включать другие стадии, которые, как правило, представляют собой обычные стадии, предназначенные для начала и/или завершения процесса, охватываемого способами по настоящему документу, описанными в настоящем документе. Например, в одном из вариантов воплощения, стадии (а) способа по настоящему изобретению предшествует стадия, в которой нуклеиновую кислоту, кодирующую первый полипептид, содержащий шарнирный участок, вводят в первую клетку-хозяин, и нуклеиновую кислоту, кодирующую второй полипептид, содержащий шарнирный участок, вводят во вторую клетку-хозяин. В одном из вариантов воплощения, способы по настоящему изобретению дополнительно включают стадию очистки гетеромультимерных белков, обладающих специфичностью связывания, по меньшей мере, с двумя разными мишенями.
В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, первый полипептид, содержащий шарнирный участок, и первая легкая цепь (или связанная с ним легкая цепь) включают первый связывающий домен для первой мишени. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, второй полипептид, содержащий шарнирный участок, и вторая легкая цепь (или связанная с ним легкая цепь) включают второй связывающий домен для второй мишени. Первая и вторая мишени могут быть разными эпитопами, расположенными на одной молекуле или расположенными на разных молекулах.
В другом аспекте предусмотрен гетеромультимерный белок, полученный любыми способами, указанными выше. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, гетеромультимерный белок представляет собой биспецифическое антитело. Также предусмотрены композиции, включающие гетеромультимерный белок, полученный любыми способами, указанными выше (такой как биспецифическое антитело), и фармацевтически приемлемый носитель.
Гетеромультимерные белки по настоящему изобретению, как правило, способны связываться, преимущественно специфично, с антигенами. Такие антигены включают, например, опухолевые антигены, факторы, регулирующие выживание клеток, факторы, регулирующие пролиферацию клеток, молекулы, ассоциированные с развитием или дифференцировкой тканей (например, про которые известно, что они функционально участвуют в развитии или дифференцировке тканей, или которые, как предполагается, функционально участвуют в развитии или дифференцировке тканей), молекулы клеточной поверхности, лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в васкулогенезе, и молекулы, ассоциированные с ангиогенезом (например, про которые известно, что они функционально участвуют в ангиогенезе, или которые, как предполагается, функционально участвуют в ангиогенезе). Антиген, с которым способен связываться гетеромультимерный белок по настоящему изобретению, может принадлежать к одной из подгрупп упомянутых выше категорий, при этом другая подгруппа (другие подгруппы) указанной категории включает другие молекулы/антигены, имеющие другие характеристики (отличающиеся от характеристик целевого антигена). Целевой антиген также может принадлежать к двум или более категориям. В одном из вариантов воплощения, изобретение предусматривает гетеромультимерный белок, который связывается, преимущественно специфично, с опухолевым антигеном, который не является молекулой клеточной поверхности. В одном из вариантов воплощения, опухолевый антиген является молекулой клеточной поверхности, такой как полипептидный рецептор. В другом примере, в некоторых вариантах воплощения, гетеромультимерный белок по настоящему изобретению связывается, преимущественно специфично, с опухолевым антигеном, который не является фактором кластера дифференцировки. В другом примере, гетеромультимерный белок по настоящему изобретению способен связываться, преимущественно специфично, с фактором кластера дифференцировки, который в некоторых вариантах воплощения, не представляет собой, например, CD3 или CD4. В некоторых вариантах воплощения, гетеромультимерный белок по настоящему изобретению представляет собой анти-VEGF антитело. В некоторых вариантах воплощения, гетеромультимерный белок по настоящему изобретению представляет собой биспецифическое антитело, выбранное из группы, состоящей из антител против IL-1 альфа/IL-1 бета, IL-12/IL-18; IL-13/IL-9; IL-13/IL-4; IL-13/IL-5; IL-5/IL-4; IL-13/IL-I бета; IL-13/IL-25; IL-13/TARC; IL-13/MDC; IL-13/MEF; IL-13/TGF-β; IL-13/агониста LHR; IL-12/TWEAK, IL-13/CL25; IL-13/SPRR2a; IL-13/SPRR2b; IL-13/ADAM8, IL-13/PED2, IL17A/IL17F, CD3/CD19, CD138/CD20; CD138/CD40; CD19/CD20; CD20/CD3; CD38/CD138; CD38/CD20; CD38/CD40; CD40/CD20; CD-8/IL-6; CD20/BR3, TNF альфа/TGF-бета, TNF альфа/IL-1 бета; TNF альфа/IL-2, TNF альфа/IL-3, TNF альфа/IL-4, TNF альфа/IL-5, TNF альфа/IL6, TNF альфа/IL8, TNF альфа/IL9, TNF альфа/IL-10, TNF альфа/IL-11, TNF альфа/IL-12, TNF альфа/IL-13, TNF альфа/IL-4, TNF альфа/IL-15, TNF альфа/IL-16, TNF альфа/IL-17, TNF альфа/IL-18, TNF альфа/IL-19, TNF альфа/IL-20, TNF альфа/IL-23, TNF альфа/IFN альфа, TNF альфа/CD4, TNF альфа/VEGF, TNF альфа/MIF, TNF альфа/ICAM-1, TNF альфа/PGE4, TNF альфа/PEG2, TNF альфа/RANK лиганда, TNF альфа/Те38; TNF альфа/BAFF; TNF альфа/CD22; TNF альфа/CTLA-4; TNF альфа/GP130; TNFα/IL-12p40; VEGF/HER2, VEGF-A/HER2, VEGF-A/PDGF, HER1/HER2, VEGF-A/VEGF-C, VEGF-C/VEGF-D, HER2/DR5,VEGF/IL-8, VEGF/MET, VEGFR/MET рецептора, VEGFR/EGFR, HER2/CD64, HER2/CD3, HER2/CD16, HER2/HER3; EGFR/HER2, EGFR/HER3, EGFR/HER4, IL-13/CD40L, IL4/CD40L, TNFR1/IL-1R, TNFR1/IL-6R, TNFR1/IL- 18R, EpCAM/CD3, MAPG/CD28, EGFR/CD64, CSPGs/RGM A; CTLA-4/BTN02; IGF1/IGF2; IGF1/2/Erb2B; MAG/RGM A; NgR/RGM A; NogoA/RGM A; OMGp/RGM A; PDL-I/CTLA-4; и RGM A/RGM B, IL1β/IL18, NRP1/VEGFA, VEGFA/NRP2, cMET/EGFR, ALK1/BMP9, VEGFA/α5β1, HER1/HER3-BU и CMV. В некоторых вариантах воплощения, гетеромультимерный белок по настоящему изобретению связывается, по меньшей мере, с двумя целевыми молекулами, выбранными из группы, состоящей из: α5β1, ALK1, ВМР9, IL-1 альфа, IL-1 бета, TARC, MDC, MEF, TGF-β, агониста LHR, TWEAK, CL25, SPRR2a, SPRR2b, ADAM8, PED2, CD3, CD4, CD16, CD19, CD20, CD22, CD28, CD40, CD38, CD64, CD138, CD-8, BR3, TNF альфа, TGF-бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL- 10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-17A, IL-17F, IL-18, IL-19, IL-20, IL-23, IL-25, IFN альфа, MIF, ICAM-1, PGE4, PEG2, RANK лиганда, Te38, BAFF, CTLA-4, GP130, IL-12p40, VEGF, VEGF-A, PDGF, HER1, HER2, HER3, HER3-BU, HER4, VEGF-C, VEGF-D, DR5, cMET, MET, рецептора MET, VEGFR, EGFR, CD40L, TNFR1, IL-1R, IL-6R, IL-18R, EpCAM, MAPG, CSPGs, BTNO2, IGF1, IGF2, IGF1/2, Erb2B, MAG, NgR, NogoA, NRP1, NRP2, OMGp, PDL-I, RGM А и RGM B. В некоторых вариантах воплощения, гетеромультимерный белок по настоящему изобретению связывается с CD3 и, по меньшей мере, с одной дополнительной целевой молекулой, выбранной из BLR1, BR3, CD19, CD20, CD22, CD72, CD79A, CD79B, CD180 (RP105), CR2, FcRH1, FcRH2, FcRH5, FCER2, FCRL4, HLA-DOB и NAG14.
Гетеромультимерные белки могут быть модифицированы с целью усиления и/или добавления дополнительных желаемых характеристик. Такие характеристики включают биологические функции, желаемый период полужизни/клиренс in vivo, биодоступность, биораспределение или другие фармакокинетические характеристики. Такие модификации хорошо известны в данной области техники и могут быть определены опытным путем, и могут включать модификации фрагментами на основе пептидов или не на основе пептидов. Например, антитела могут быть гликозилированными или агликозилированными, как правило, по меньшей мере отчасти в зависимости от природы клетки-хозяина. Преимущественно, антитела по настоящему изобретению являются агликозилированными. Агликозилированное антитело, полученное способом по настоящему изобретению, может впоследствии быть гликозилировано, например, с использованием способов гликозилирования in vitro, хорошо известных в данной области техники. Как описано выше и в настоящем документе в общем, гетеромультимерные белки по настоящему изобретению могут быть получены в прокариотической клетке, такой как, например, Е. coli. Гетеромультимерные белки, продуцируемые Е. coli, как правило, являются агликозилированными, и у них утрачены функции, которые в норме связаны с профилями гликозилирования, характерными для клетки-хозяина млекопитающих (например, CHO), продуцирующей гетеромультимерные белки.
Изобретение также предусматривает иммуноконъюгаты, включающие гетеромультимерный белок по настоящему изобретению, конъюгированный с гетерологичным фрагментом. Любой гетерологичный фрагмент будет подходящим, при условии, что конъюгация с антителом значительно не снижает желаемую функцию и/или характеристику антитела. Например, в некоторых вариантах воплощения, иммуноконъюгат включает гетерологичный фрагмент, который представляет собой цитотоксический агент. В некоторых вариантах воплощения, указанный цитотоксический агент выбран из группы, состоящей из радиоактивного изотопа, химиотерапевтического агента и токсина. В некоторых вариантах воплощения, указанный токсин выбран из группы, состоящей из калихеамицина, майтансина и трихотецина. В некоторых вариантах воплощения, иммуноконъюгат включает гетерологичный фрагмент, который представляет собой обнаруживаемый маркер. В некоторых вариантах воплощения, указанный обнаруживаемый маркер выбран из группы, состоящей из радиоактивного изотопа, представителя пары лиганд-рецептор, представителя пары фермент-субстрат и представителя пары с резонансным переносом энергии флуоресценции.
В другом аспекте предусмотрены клетки-хозяева, включающие полинуклеотид или рекомбинантный вектор, кодирующий первый полипептид, содержащий шарнирный участок, гетеромультимерного белка, описанного выше, где клетка-хозяин не экспрессирует второй полипептид гетеромультимерного белка, содержащий шарнирный участок. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, полипептид, содержащий шарнирный участок, составляет пару с легкой цепью антитела. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, клетка-хозяин представляет собой клетку млекопитающего. В некоторых вариантах воплощения, в соответствии с (или применительно к) любым из вариантов воплощения, указанным выше, клетка-хозяин представляет собой клетку CHO.
Другие цели, отличительные признаки и преимущества настоящего изобретения станут очевидными из приведенного ниже подробного описания. Следует понимать, тем не менее, что подробное описание и конкретные примеры, демонстрирующие предпочтительные варианты воплощения изобретения, даются только в качестве иллюстрации, и различные изменения и модификации в пределах объема и сущности настоящего изобретения станут очевидными для специалиста в этой области техники из этого подробного описания.
Все цитируемые в настоящем документе ссылки включены в настоящий документ во всей своей полноте посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1А иллюстрирует полностью окисленное полуантитело. Не показаны “выступ” или “впадина” или другие домены гетеродимеризации. Полуантитело, изображенное на этой фигуре, имеет изотип IgG1. Специалистам в данной области техники будет понятно, что другие изотипы иммуноглобулинов также могут быть представлены в виде полуантител с соответствующими связями между и внутри цепей. В интактном Ab шарнирные цистеины образуют межцепьевые дисульфидные связи.
Фигура 1В иллюстрирует полноразмерное биспецифическое антитело. Не показаны дисульфидные связи между тяжелыми цепями в шарнирном участке.
На Фигуре 2 приведены схемы двух анализов, которые могут быть использованы для определения % полуантитела и % ковалентного биспецифического антитела.
На Фигуре 3 приведен % биспецифических антител, образуемых при добавлении восстановителя в комбинированную культуру клеток, включающую первую клетку-хозяина млекопитающих, экспрессирующую анти-мишень А (выступ), и вторую клетку-хозяина млекопитающих, экспрессирующую анти-мишень В (впадина), за 4 часа, за 15 часов или за 24 часа до сбора комбинированной культуральной среды.
На Фигуре 4 приведены результаты 4-20% Трис-Глицин SDS PAGE анализа выделенных пулов полуантител с модификацией выступ и с модификацией впадина.
На Фигуре 5А приведена хроматограмма разделения образцов по гидрофобности для анти-мишень G, в которой один широкий пик соответствует гомодимеру и полуантителу, которые были элюированы совместно. На Фигуре 5В приведена хроматограмма разделения образцов по гидрофобности для анти-мишень Н.
На Фигуре 6 показаны результаты масс-спектрометрии для биспецифического антитела против мишени G/против мишени Н.
На Фигуре 7А показаны результаты времяпролетной масс-спектрометрии с электрораспылительной ионизацией (ESI-TOF MS), осуществленной для необработанной и обработанной GSH комбинированной культуральной среды, в которую секретировались полуантитела против мишени A и против мишени В. На Фигуре 7В в увеличенном виде показан диапазон m/z для пика биспецифического антитела. На Фигуре 7С в увеличенном виде показан диапазон m/z для пика полуантитела.
СОКРАЩЕНИЯ
ADCC = Антителозависимая клеточноопосредованная цитотоксичность
API = Противопатогенные иммуноадгезины
BPI = Бактерицидный белок, увеличивающий проницаемость клеточной мембраны
C1q = Фактор комплемента 1q
CD = Кластер дифференцировки
CDC = Комплементзависимая цитотоксичность
СН1 или CH1 = Первый константный домен тяжелой цепи
СН2 или CH2 = Второй константный домен тяжелой цепи
CH3 или CH3 = Третий константный домен тяжелой цепи
CH4 или CH4 = Четвертый константный домен тяжелой цепи
CL или CL = Константный домен легкой цепи
CTLA = Молекула, ассоциированная с цитотоксическим Т-лимфоцитом
Fc = Кристаллизующийся фрагмент
FcγR = Гамма рецептор для Fc части IgG
HIV = Вирус иммунодефицита человека
ICAM = Молекула межклеточной адгезии
BsAb = Биспецифическое антитело
BsDb = Биспецифическое диатело
dsFv = Стабилизированный дисульфидной связью Fv
Fc = Константный фрагмент антитела
Fd = VH+CH1 антитела
FcR=Fc рецептор
Fv = Вариабельный фрагмент антитела
IgG = Иммуноглобулин G
mAb = Моноклональное антитело
PBL = Лимфоцит периферической крови
scDb = Одноцепочечное диатело
scFv = Одноцепочечный Fv
(scFv)2=scFv-scFv тандем
Tandab=Тандемное диатело
VH или VH = Вариабельный домен тяжелой цепи антитела
VL или VL = Вариабельный домен легкой цепи антитела
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение далее будет описано подробно посредством ссылки только с использованием следующих определений и примеров. Все патенты и опубликованные заявки, в том числе все последовательности, раскрытые в таких патентах и опубликованных заявках, упомянутые в настоящем описании, специально включены в настоящий документ посредством ссылки.
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в области, к которой относится это изобретение. Singleton, et al., Dictionary of Microbiology and Molecular Biology, 2D ED., John Wiley and Sons, New York (1994) и Hale & Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991), являются для специалиста в данной области техники общим руководством для многих терминов, используемых в настоящем изобретении. Несмотря на то, что при осуществлении на практике или при тестировании настоящего изобретения могут быть использованы любые способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, описанные способы и материалы являются предпочтительными. Числовые диапазоны включают числа, задающие диапазон. Если не указано иное, последовательности нуклеиновых кислот записываются слева направо в направлении от 5' к 3' концу; аминокислотные последовательности записываются слева направо в направлении от амино-конца к карбоксильному концу, соответственно. Специалисты-практики, в частности, могут обратиться к Sambrook et al., 1989 и Ausubel FM et al., 1993, чтобы найти определения и термины из данной области техники. Следует понимать, что данное изобретение не ограничивается конкретной описанной методикой, протоколами и реагентами, поскольку они могут варьировать.
Числовые диапазоны включают числа, задающие диапазон.
Если не указано иное, последовательности нуклеиновых кислот записываются слева направо в направлении от 5' к 3' концу; аминокислотные последовательности записываются слева направо в направлении от амино- конца к карбоксильному концу, соответственно.
Заголовки, приведенные в настоящем документе, не являются ограничениями различных аспектов или вариантов воплощения изобретения, которые могут быть определены со ссылкой на описание в целом. Соответственно, термины, определенные непосредственно ниже, могут быть более полно определены посредством ссылки на описание в целом.
I. Определения
"Гетеромультимер", "гетеромультимерный комплекс" или "гетеромультимерный белок" относятся к молекуле, включающей первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью. Гетеромультимер может включать "гетеродимер", образованный первым полипептидом, содержащим шарнирный участок, первой легкой цепью, вторым полипептидом, содержащим шарнирный участок, и второй легкой цепью. Альтернативно, гетеромультимер может образовывать, например, биспецифическое антитело. Полипептиды гетеромультимера могут взаимодействовать друг с другом посредством непептидной, ковалентной связи (например, дисульфидной связи) и/или нековалентного взаимодействия (например, водородные связи, ионные связи, ван-дер-ваальсовы силы и/или гидрофобные взаимодействия).
Используемый в настоящем документе “домен гетеромультимеризации” относится к изменениям или добавлениям, которые вносят в биологическую молекулу, чтобы способствовать образованию гетеромультимера и препятствовать образованию гомомультимера. Любой домен гетеродимеризации, который намного предпочтительнее образует гетеродимеры, чем гомодимеры, охватывается объемом настоящего изобретения. Иллюстративные примеры включают, например, заявку на патент США номер 20030078385 (Arathoon et al. - Genentech; описывает выступы-во-впадины); WO 2007147901 (

Фраза "полипептид, содержащий шарнирный участок", используемый в настоящем документе, относится к полипептиду, который включает участок, соответствующий шарнирному участку иммуноглобулина, как он определен в данной области техники, например, участок между доменами CH1 и CH2 тяжелой цепи. "Шарнирный участок", "шарнирная последовательность" и вариации этих терминов, используемые в настоящем документе, включают значение, известное в данной области техники, которое пояснено, например, в Janeway’s Immunobiology (Garland Science, Taylor & Francis Group, LLC, NY) (7th ed., 2008); Bloom et al., Protein Science (1997), 6:407-415; Humphreys et al., J. Immunol. Methods (1997), 209:193-202. Смотрите также, например, Burton, Molec. Immunol. 22:161-206 (1985) и Papadea, C. and I. J. Check (1989) "Human immunoglobulin G and immunoglobulin G subclasses: biochemical, genetic, and clinical aspects." Crit Rev Clin Lab Sci 27(1): 27-58. Специалисту в данной области техники будет понятно, что число аминокислот, а также число остатков цистеина, доступных для образования межцепьевой дисульфидной связи, варьирует между классами и изотипами иммуноглобулинов. Все такие шарнирные участки могут присутствовать в полипептидах, содержащих шарнирный участок, и охвачены объемом настоящего изобретения. В некоторых вариантах воплощения, первый полипептид, содержащий шарнирный участок, включает первую тяжелую цепь антитела. В некоторых вариантах воплощения, первая тяжелая цепь связана с первой легкой цепью и образует первое полуантитело. В настоящем документе термин "антитело" используется в самом широком смысле и относится к любой молекуле иммуноглобулина (Ig), включающей две тяжелые цепи и две легкие цепи, и к любому ее фрагменту, мутанту, варианту или производному, при условии, что они обладают желаемой биологической активностью (например, активностью связывания с эпитопом). Примеры антител включают моноклональные антитела, поликлональные антитела, мультиспецифические атитела (например, биспецифические антитела) и фрагменты антител, описанные в настоящем документе. Антитело может быть человеческим, гуманизированным и/или с созревшей аффинностью.
Для определенности, в настоящем документе антитело относится к структуре иммуноглобулина G (IgG). Тем не менее, специалисту в данной области техники будет понятно, что в способе по настоящему изобретению, описанному в настоящем документе, может быть использовано антитело, принадлежащее к любому классу иммуноглобулинов. Для ясности, молекула IgG содержит пару идентичных тяжелых цепей (НС) и пару идентичных легких цепей (LC). Каждая LC имеет один вариабельный домен (VL) и один константный домен (CL), тогда как каждая НС имеет один вариабельный (VH) и три константных домена (CH1, CH2 и CH3). Домены CH1 и CH2 соединены шарнирным участком. Эта структура хорошо известна в данной области техники. Ссылка дана на Фигуру 1В.
Используемый в настоящем документе термин "полуантитело" относится к одной тяжелой цепи иммуноглобулина, связанной с одной легкой цепью иммуноглобулина. Пример полуантитела приведен на Фигуре 1А. Специалисту в данной области будет очевидно, что полуантитело также может иметь антигенсвязывающий домен, состоящий из единственного вариабельного домена.
Термин "макситело (maxibody)" относится к белку слияния, включающему scFv, слитый с полипептидом Fc. Ссылка дана на Фигуру 8а в WO 2009089004. Ссылка дана на Фигуру 2 в WO 2009089004 для биспецифического макситела.
Термин "домен CH2" участка Fc человеческого IgG обычно относится к остаткам от примерно 231 до примерно 340 в IgG в соответствии с системой нумерации EU. Домен CH2 уникален, поскольку не находится в тесной парной связи с другим доменом. Наоборот, между двумя доменами CH2 в интактной нативной молекуле IgG расположены две N-связанные разветвленные углеводные цепи. Предполагается, что углевод может заменять взаимодействие между доменами и может способствовать стабилизации домена CH2. Burton, Molec. Immunol. 22:161-206 (1985).
Термин "домен CH3" включает остатки, расположенные по направлению к С-концу от домена CH2 в участке Fc (т.е. примерно от аминокислотного остатка 341 до примерно аминокислотного остатка 447 в IgG в соответствии с системой нумерации EU).
Термин "участок Fc", используемый в настоящем документе, как правило, относится к димерному комплексу, включающему С-концевую полипептидную последовательность тяжелой цепи иммуноглобулина, где С-концевая полипептидная последовательность представляет собой последовательность, полученную в результате расщепления папаином интактного антитела. Участок Fc может включать нативную последовательность Fc или вариант последовательности Fc. Несмотря на то, что границы последовательности Fc тяжелой цепи иммуноглобулина могут варьировать, обычно принимают, что последовательность Fc тяжелой цепи человеческого IgG располагается от аминокислотного остатка в положении примерно Cys226 или в положении примерно Рго230 до карбоксильного конца последовательности Fc. Если в настоящем документе не указано иное, нумерация аминокислотных остатков в участке Fc или в константной области приведена в соответствии с системой нумерации EU, также называемой EU индекс, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Последовательность Fc иммуноглобулина, как правило, включает два константных домена, домен CH2 и домен CH3, и необязательно включает домен CH4. "полипептид Fc" в настоящем документе означает один из полипептидов, который составляет участок Fc, например, мономерный Fc. Полипептид Fc может быть получен из любого подходящего иммуноглобулина, такого как иммуноглобулин подкласса IgG1, IgG2, IgG3 или IgG4, IgA, IgE, IgD или IgM. Участок Fc включает карбокси-концевые части обеих Н цепей, соединенные вместе дисульфидными связями. Эффекторные функции антител определяются последовательностями в Fc области; этот участок также является частью, которая распознается Fc рецепторами (FcR), обнаруженными на некоторых типах клеток. В некоторых вариантах воплощения, полипептид Fc включает полноразмерную шарнирную последовательность дикого типа или ее часть (как правило, на своем N-конце). В некоторых вариантах воплощения, полипептид Fc не включает функциональную или шарнирную последовательность дикого типа.
"Функциональный участок Fc" обладает "эффекторной функцией" нативной последовательности участка Fc. Примеры "эффекторных функций" включают связывание C1q; CDC; связывание с Fc рецептором; ADCC; фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора; BCR) и т.п. В случае таких эффекторных функций, как правило, необходимо, чтобы участок Fc был комбинирован со связывающим доменом (например, вариабельный домен антитела), и их можно было бы оценить с использованием различных анализов, раскрытых, например, в определениях в настоящем документе.
"Нативная последовательность участка Fc" включает аминокислотную последовательность, идентичную аминокислотной последовательности участка Fc, встречающегося в природе. Нативные последовательности человеческих участков Fc включают нативную последовательность участка Fc человеческого IgG1 (аллотипов не-A и А); нативную последовательность участка Fc человеческого IgG2; нативную последовательность участка Fc человеческого IgG3; и нативную последовательность участка Fc человеческого IgG4, а также их варианты, встречающиеся в природе.
"Вариант участка Fc" включает аминокислотную последовательность, которая отличается от аминокислотной последовательности нативной последовательности участка Fc, по меньшей мере, одной аминокислотной модификацией, предпочтительно, одной или несколькими аминокислотными заменами. Предпочтительно, вариант участка Fc содержит, по меньшей мере, одну аминокислотную замену по сравнению с нативной последовательностью участка Fc или по сравнению с участком Fc исходного полипептида, например, от примерно одной до примерно десяти аминокислотных замен, и, предпочтительно, от примерно одной до примерно пяти аминокислотных замен по сравнению с нативной последовательностью участка Fc или участка Fc исходного полипептида. Вариант участка Fc в настоящем документе предпочтительно будет иметь, по меньшей мере, примерно 80% гомологии с нативной последовательностью участка Fc и/или с участка Fc исходного полипептида, и более предпочтительно, по меньшей мере, примерно 90% гомологии с ними, более предпочтительно, по меньшей мере, примерно 95%, по меньшей мере, примерно 96%, по меньшей мере, примерно 97%, по меньшей мере, примерно 98% или по меньшей мере, примерно 99% гомологии с ними.
Термин "компонент Fc", используемый в настоящем документе, относится к шарнирному участку, домену CH2 или домену CH3 участка Fc.
В некоторых вариантах воплощения, полипептид, содержащий шарнирный участок, включает участок Fc IgG, предпочтительно, полученный из участка Fc человеческого IgG дикого типа. Fc человеческого IgG "дикого типа" обозначает последовательность аминокислот, которая встречается в природе в человеческой популяции. Конечно, так как последовательность Fc может несколько отличаться у разных индивидуумов, в последовательность дикого типа может быть внесено одно или более изменений, и при этом такая последовательность также будет охватываться объемом настоящего изобретения. Например, участок Fc может содержать дополнительные изменения, которые не относятся к настоящему изобретению, например, мутации в сайте гликозилирования или включение неприродной аминокислоты.
Термин "вариабельный участок" или вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с мишенью. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, имеют схожие структуры, где каждый домен включает четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (Смотрите, например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Со., страница 91 (2007)). Единственного домена VH или VL может быть достаточно для обеспечения антигенсвязывающей специфичности. Более того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, которое связывается с антигеном, для осуществления скрининга библиотеки комплементарных доменов VL или VH, соответственно. Смотрите, например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Термин "Fab", используемый в настоящем документе, относится к антигенсвязывающему фрагменту антитела. Как было отмечено выше, папаин может использоваться для расщепления интактного антитела. В результате расщепления антител папаином образуются два идентичных антигенсвязывающих фрагмента, т.е. "Fab" фрагменты, и остаточный "Fc" фрагмент (т.е. участок Fc, см. выше). Fab фрагмент состоит из целой L цепи, а также из вариабельного участка домена Н цепи (VH) и первого константного домена одной из тяжелых цепей (CH1).
Фразы "антигенсвязывающее плечо", "плечо, связывающее целевую молекулу", "плечо, связывающее мишень" и вариации этих фраз, используемые в настоящем документе, относятся к компоненту гетеромультимерного белка по настоящему изобретению, который обладает способностью специфично связываться с целевой мишенью. Как правило и предпочтительно, антигенсвязывающее плечо представляет собой комплекс иммуноглобулиновых полипептидных последовательностей, например, последовательностей CDR и/или вариабельных доменов легкой и тяжелой цепи иммуноглобулина.
"Мишень" или "целевая молекула" относятся к фрагменту, распознаваемому связывающим плечом гетеромультимерного белка. Например, если гетеромультимерный белок представляет собой антитело, тогда мишенью могут быть эпитопы на одной молекуле или на разных молекулах, или патоген, или опухолевая клетка, в зависимости от контекста. Аналогично, если гетеромультимерный белок представляет собой белок слияния рецептор-Fc, тогда мишенью будет распознаваемый партнер по связыванию для рецептора. Специалисту в данной области техники будет понятно, что мишень определяется специфичностью связывания с ней связывающего плеча, и что разные связывающие плечи могут распознавать разные мишени. Мишень предпочтительно связывается с гетеромультимерным белком по этому изобретению с аффинностью связывания с Kd выше 1 мкМ (в соответствии с анализом Скэтчарда). Примеры целевых молекул включают растворимые белки сыворотки и/или их рецепторы, такие как цитокины и/или рецепторы цитокинов, адгезины, факторы роста и/или их рецепторы, гормоны, вирусные частицы (например, белок F RSV, CMV, StaphA, вирус гриппа, вирус гепатита C), микроорганизмы (например, белки бактериальных клеток, клеток грибов), адгезины, белки CD и их рецепторы, но не ограничиваются ими.
Одним из примеров "интактного" или "полноразмерного" антитела является антитело, которое включает антигенсвязывающее плечо, а также CL и, по меньшей мере, константные домены тяжелой цепи, CH1, CH2 и CH3.
Константные домены могут представлять собой константные домены, имеющие нативную последовательность (например, человеческая нативная последовательность константных доменов) или варианты этой аминокислотной последовательности.
Термин "связывание", используемый в настоящем документе, относится к стадиям, необходимым для соединения первого и второго полипептидов, содержащих шарнирные участки, друг с другом, например, для образования ковалентной связи. Такие стадии включают восстановление, совмещение и/или окисление остатков цистеина в первом и втором полипептидах, содержащих шарнирные участки, с образованием межцепьевой дисульфидной связи. Связывание может достигаться с помощью химического перекрестного сшивания или с использованием окислительно-восстановительной системы. Смотрите, например, Humphreys et al., J. Immunol. Methods (1998) 217:1-10 и Zhu et al., Cancer Lett., (1994) 86: 127-134.
Термин "мультиспецифическое антитело" используется в самом широком смысле и специально охватывает антитело, которое имеет полиэпитопную специфичность. Такие мультиспецифические атитела включают антитело, включающее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где VHVL обладает полиэпитопной специфичностью, антитела, имеющие два или более доменов VL и VH, где каждый VHVL связывается с другим эпитопом, антитела, имеющие два или более единственных вариабельных доменов, где каждый единственный вариабельный домен связывается с другим эпитопом, полноразмерные антитела, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диатела, биспецифические диатела и триатела, фрагменты антител, которые были ковалентно или нековалентно соединены, но не ограничиваются ими. Термин "полиэпитопная специфичность" относится к способности специфично связываться с двумя или более разными эпитопами на одной или разных мишенях. Термин "моноспецифический" относится к способности связываться только с одним эпитопом. В соответствии с одним из вариантов воплощения мультиспецифическое антитело представляет собой антитело IgG, которое связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкМ до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пМ. На Фигуре 1B в качестве примера приведено биспецифическое антитело.
"Фрагменты антитела" включают часть интактного антитела, предпочтительно антигенсвязывающий или вариабельный участок интактного антитела. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела (Db); тандемные диатела (taDb), линейные антитела (например, патент США номер 5,641,870; Zapata et al., Protein Eng. 8(10):1057-1062 (1995)); неполные антитела, антитела с единственным вариабельным доменом, миниантитела, молекулы одноцепочечных антител; и мультиспецифические атитела, образованные из фрагментов антител (например, в том числе, Db-Fc, taDb-Fc, taDb-CH3 и (scFV)4-Fc, но не ограничиваясь этим).
Выражение "однодоменные антитела" (sdAbs) или "антитела с единственным вариабельным доменом (SVD)", как правило, относится к антителам, в которых единственный вариабельный домен (VH или VL) может обеспечивать связывание с антигеном. Другими словами, единственный вариабельный домен не должен взаимодействовать с другим вариабельным доменом, чтобы распознавать целевой антиген. Однодоменные антитела состоят из единственного мономерного вариабельного домена (VH или VL) в каждом антигенсвязывающем плече. Примеры однодоменных антител включают однодоменные антитела, полученные из верблюдовых (ламы и верблюды) и хрящевых рыб (например, акулы-няньки), и однодоменные антитела, полученные рекомбинантными способами из человеческих и мышиных антител (Ward et al., Nature (1989) 341:544-546; Dooley and Flajnik, Dev Comp Immunol (2006) 30:43-56; Muyldermans et al., Trend Biochem Sci (2001) 26:230-235; Holt et al., Trends Biotechnol (2003):21:484-490; WO 2005/035572; WO 03/035694; Davies and Riechmann, Febs Lett (1994) 339:285-290; WO 00/29004; WO 02/051870). Антитело с единственным вариабельным доменом может присутствовать в антигенсвязывающем плече (например, гомо- или гетеро-мультимер) с другими вариабельными областями или вариабельными доменами, в этом случае оно не является однодоменным антителом.
Выражение "линейные антитела", как правило, относится к антителам, описанным в Zapata et al., Protein Eng. 8(10): 1057-1062 (1995). Кратко, эти антитела включают пару тандемных Fd сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легких цепей образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифическими или моноспецифическими.
Упоминающаяся в настощем документе технология "выступ-во-впадину" или технология "KnH", относится к технологии, направляющей объединение двух полипептидов друг с другом in vitro или in vivo за счет введения выпуклости (выступа) в один полипептид и полости (впадины) в другой полипептид на поверхности их взаимодействия. Например, KnH вводят в связывающие поверхности Fc:Fc, поверхности CL:CH1 или VH/VL поверхности антител (например, US 2007/0178552, WO 96/027011, WO 98/050431 и Zhu et al. (1997) Protein Science 6:781-788). В особенности этот подход используют для облегчения объединения двух разных тяжелых цепей друг с другом в процессе получения мультиспецифических антител. Например, мультиспецифические антитела, имеющие КnН в их участках Fc, могут дополнительно включать одинаковые вариабельные домены, соединенные с участком Fc, или могут дополнительно включать разные вариабельные домены тяжелых цепей, которые объединяются с одинаковыми или разными вариабельными доменами легких цепей. Технология KnH также может использоваться для объединения двух разных внеклеточных доменов рецепторов друг с другом или с любыми другими полипептидными последовательностями, которые включают последовательности распознавания мишени (например, включая аффитела, пептитела и другие белки слияния с Fc).
"Fv" состоит из димера одного домена вариабельного участка тяжелой цепи и одного домена вариабельного участка легкой цепи, находящихся в плотной нековалентной ассоциации друг с другом. В результате фолдинга этих двух доменов образуются шесть гипервариабельных петель (3 петли из H цепи и 3 цепи из L цепи), аминокислотные остатки которых участвуют в связывании антигена и определяют антигенсвязывающую специфичность антитела. Тем не менее, каждый единственный вариабельный домен (или половина Fv, включающая только три CDR, специфичных к антигену) способен распознавать и связывать антиген, хотя часто с более низкой аффинностью, чем полный сайт связывания.
"Одноцепочечный Fv", также сокращенно "sFv" или "scFv", представляет собой фрагменты антител, которые включают VH и VL домены антител, соединенные в одну полипептидную цепь. Предпочтительно, полипептид sFv дополнительно включает полипептидный линкер между доменами VH и VL, который позволяет sFv формировать нужную структуру для связывания антигена. Обзор sFv смотрите в Pluckthun, The Pharmacology of Monoclonal antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Malmborg et al., J. Immunol. Methods 183:7-13, 1995.
Термин "диатела" относится к небольшим фрагментам антител, сконструированным из sFv фрагментов (смотрите предыдущий параграф) и коротких линкеров (примерно 5-10 остатков) между доменами VH и VL, так что происходит межцепьевое, но не внутрицепьевое объединение V доменов, и образуется бивалентный фрагмент, т.е. фрагмент, имеющий два антигенсвязывающих сайта. Биспецифические диатела представляют собой гетеродимеры из двух "перекрестных" sFv фрагментов, в которых домены VH и VL двух антител находятся в разных полипептидных цепях. Диатела описаны более подробно, например, в ЕР 404,097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993).
Термины "неполное антитело" или "неполные антитела" относятся к антителу, которое включает (1) вариабельный домен, соединенный пептидной связью с полипептидом, включающим домен CH2, домен CH3 или домен CH2-CH3 и (2) второй домен CH2, CH3 или CH2-CH3, где с полипептидом, включающим второй домен CH2, CH3 или CH2-CH3, не соединен пептидной связью вариабельный домен. В одном из вариантов воплощения, неполное антитело включает 3 полипептида (1) первый полипептид, включающий вариабельный домен (например, VH), CH1, CH2 и CH3, (2) второй полипептид, включающий вариабельный домен (например, VL) и домен CL и (3) третий полипептид, включающий домены CH2 и CH3. В другом варианте воплощения, неполное антитело содержит часть шарнирного участка, содержащую два остатка цистеина, которые формируют дисульфидные связи, соединяющие константные тяжелые цепи. В одном из вариантов воплощения, вариабельные домены неполного антитела формируют антигенсвязывающий участок. В другом варианте воплощения, вариабельные домены неполного антитела представляют собой отдельные вариабельные домены, где каждый отдельный вариабельный домен представляет собой антигенсвязывающий участок. В одном варианте воплощения, неполное антитело представляет собой антитело с единственным вариабельным доменом.
Антитела по настоящему изобретению могут представлять собой "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу, тогда как оставшаяся часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных из других видов или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желаемой биологической активностью (патент США номер 4,816,567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Химерные антитела, представляющие интерес в настоящем документе, включают приматизированные антитела, включающие антигенсвязывающие последовательности вариабельных доменов, полученные из приматов, не относящихся к человеку (например, мартышковые, обезьяны, и т.п.), и последовательности человеческих константных участков.
"Гуманизированные" формы не человеческих (например, крысиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из не человеческого антитела. В большинстве случаев, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), где остатки из гипервариабельного участка реципиентного антитела замещены на остатки из гипервариабельного участка антитела из вида, не относящегося к человеку (донорное антитело), такого как мышь, крыса, кролик или примат, не относящийся к человеку, при этом антитело обладает желаемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасного участка (FR) человеческого иммуноглобулина замещены на соответствующие не человеческие остатки. Более того, гуманизированные антитела могут включать остатки, которые отсутствуют в реципиентном антителе или в донорном антителе. Эти модификации сделаны для дополнительного улучшения характеристик антитела. В общем, гуманизированное антитело будет содержать по существу все из, по меньшей мере, одного, и, как правило, двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям нечеловеческого иммуноглобулина, и все или практически все FR имеют последовательность человеческого иммуноглобулина. Гуманизированное антитело необязательно также будет включать, по меньшей мере, часть константного участка иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Для получения более подробной информации смотрите Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
"Пептитело" (peptibody) или "пептитела" относятся к слиянию случайным образом созданных пептидов с Fc доменом. Смотрите патент США номер 6,660,843, опубликованный 9 декабря 2003, авторы Feige et al. (включен посредством ссылки во всей своей полноте). Они включают один или более пептидов, соединенных с N-концом, С-концом, боковыми цепями аминокислот, или с более чем одним из этих сайтов. С помощью технологии пептител можно создавать терапевтические агенты, которые включают пептиды, нацеленные на один или более лигандов или рецепторов, пептиды с хомингом в опухоль, пептиды, осуществляющие транспорт через мембрану, и тому подобные пептиды. Технология пептител успешно применялась для создания ряда таких молекул, включая линейные пептиды и пептиды с ограниченной конформационной свободой из-за наличия дисульфидных связей, "тандемные пептидные мультимеры" (т.е. более одного пептида на одной цепи Fc домена). Смотрите, например, патент США номер 6,660,843; заявку на патент США номер 2003/0195156, опубликованную 16 октября 2003 (соответствующую WO 02/092620, опубликованной 21 ноября 2002); заявку на патент США номер 2003/0176352, опубликованную 18 сентября 2003 (соответствующую WO 03/031589, опубликованной 17 апреля 2003); патент США номер 6,835,809 (соответствующий WO 00/24770, опубликованной 4 мая 2000); заявку на патент США номер 2003/0229023, опубликованную 11 декабря 2003; WO 03/057134, опубликованную 17 июля 2003; заявку на патент США номер 2003/0236193, опубликованную 25 дкабря 2003 (соответствующую PCT/US04/010989, поданной 8 апреля 2004); патент США номер 6,919,426, поданный 18 сентября 2003 (соответствующий WO 04/026329, опубликованной 1 апреля 2004), где каждый документ включен в настоящий документ посредством ссылки во всей своей полноте.
"Аффитело" (affibody) относится к использованию белка, связанного пептидной связью с участком Fc, где белок используется в качестве каркаса для обеспечения поверхности для связывания с целевой молекулой. Белок часто представляет собой белок, встречающийся в природе, такой как стафилококковый белок А или IgG-связывающий В домен, или Z белок, полученный из него (смотрите Nilsson et al (1987), Prot Eng 1, 107-133 и патент США номер 5,143,844), или его фрагмент ил производное. Например, аффитело может быть создано из вариантов Z белков, имеющих измененную аффинность связывания в отношении целевой молекулы (целевых молекул), где сегмент Z белка был подвергнут случайному мутагенезу для создания библиотеки вариантов, способных связываться с целевой молекулой. Примеры аффител включают аффитела, описанные в патенте США номер 6,534,628, Nord K et al, Prot Eng 8:601-608 (1995) и Nord K et al, Nat Biotech 15:772-777 (1997). Biotechnol Appl Biochem. 2008 Jun; 50 (Pt 2):97-112.
Используемый в настоящем документе термин "иммуноадгезин" обозначает молекулы, которые сочетают специфичность связывания гетерологичного белка ("адгезина") с эффекторными функциями константных доменов иммуноглобулинов. Структурно иммуноадгезины включают слияние аминокислотной последовательности, обладающей желаемой специфичностью связывания, где аминокислотная последовательность отличается от сайта распознавания и связывания антигена в антителе (т.е. является "гетерологичной" в сравнении с константным доменом антитела), с последовательностью константного домена иммуноглобулина (например, последовательностью CH2 и/или CH3 IgG). Примеры последовательностей адгезинов включают непрерывные аминокислотные последовательности, которые включают часть рецептора или лиганда, которая связывается с целевым белком. Последовательности адгезинов также могут представлять собой последовательности, которые связываются с целевым белком, но не являются при этом последовательностями рецептора или лиганда (например, последовательности адгезинов в пептителах). Такие полипептидные последовательности могут быть выбраны или идентифицированы различными способами, в том числе с помощью технологии фагового дисплея и высокопроизводительных методов сортинга. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любых иммуноглобулинов, таких как подклассы IgG1, IgG2, IgG3 или IgG4, IgA (в том числе IgA1 и IgA2), IgE, IgD или IgM.
Термин "комплекс" используемый в настоящем документе, относится к ассоциации двух или более молекул, которые взаимодействуют друг с другом посредством связей и/или сил (например, ван-дер-ваальсовы, гидрофобные, гидрофильные связи), не являющихся пептидными связями. В одном из вариантов воплощения, комплекс является гетеромультимерным. Следует понимать, что термины "белковый комплекс" или "полипептидный комплекс", используемые в настоящем документе, включают комплексы, которые имеют небелковый компонент, конъюгированный с белком в белковом комплексе (например, включая химические молекулы, такие как токсин или обнаруживаемый агент, но не ограничиваясь этим).
Гетеромультимерный белок по этому изобретению, "который связывается с целевым антигеном" представляет собой гетеромультимерный белок, который связывается с мишенью с аффинностью, достаточной для того, чтобы гетеромультимерный белок использовался в качестве диагностического и/или терапевтического агента для направленного действия на белок, или клетку, или ткань, экспрессирующие мишень, и значительно не связывается перекрестно с другими белками. В таких вариантах воплощения, степень связывания гетеромультимерного белка с "не целевым" белком будет составлять меньше чем примерно 10% от связывания антитела с его конкретным целевым белком, где степень связывания определяют методом сортировки клеток с активированной флуоресценцией (FACS) или с помощью радиоиммунопреципитации (RIA) или ELISA. В отношении связывания гетеромультимерного белка с целевой молекулой термины "специфическое связывание" или "специфично связывается с" или "специфичный к" конкретному целевому полипептиду или эпитопу на конкретном целевом полипептиде означают связывание, которое измеримо отличается от неспецифического взаимодействия (например, неспецифическое взаимодействие может представлять собой связывание с бычьим сывороточным альбумином или казеином). Специфическое связывание может быть измерено, например, путем определения связывания молекулы в сравнении с контрольной молекулой. Например, специфическое связывание может быть определено путем конкурентного анализа с контрольной молекулой, которая схожа с мишенью, например, с избытком немеченой мишени. В этом случае на специфичное связывание указывает конкурентное ингибирование связывания меченой мишени с зондом под действием избытка немеченой мишени. Термины "специфическое связывание" или "специфично связывается с" или "специфичный к" конкретному полипептиду или эпитопу на конкретном целевом полипептиде, используемые в настоящем документе, могут относиться, например, к молекуле, имеющей Kd для связывания с мишенью, равную, по меньшей мере, примерно 200 нМ, альтернативно, по меньшей мере, примерно 150 нМ, альтернативно, по меньшей мере, примерно 100 нМ, альтернативно, по меньшей мере, примерно 60 нМ, альтернативно, по меньшей мере, примерно 50 нМ, альтернативно, по меньшей мере, примерно 40 нМ, альтернативно, по меньшей мере, примерно 30 нМ, альтернативно, по меньшей мере, примерно 20 нМ, альтернативно, по меньшей мере, примерно 10 нМ, альтернативно, по меньшей мере, примерно 8 нМ, альтернативно, по меньшей мере, примерно 6 нМ, альтернативно, по меньшей мере, примерно 4 нМ, альтернативно, по меньшей мере, примерно 2 нМ, альтернативно, по меньшей мере, примерно 1 нМ или больше. В одном из вариантов воплощения, термин "специфическое связывание" относится к связыванию, при котором гетеромультимерный белок связывается с конкретным полипептидом или эпитопом на конкретном полипептиде и по существу не связывается с любым другим полипептидом или эпитопом на полипептиде.
"Аффинность связывания" обычно относится к силе всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иное, используемый в настоящем документе термин "аффинность связывания" относится к собственной аффинности связывания, которая соответствует взаимодействию 1:1 между членами связывающей пары (например, антитело и антиген). Аффинность молекулы X в отношении ее партнера Y, как правило, можно представить в виде константы диссоциации (Kd). Например, Kd может составлять примерно 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или Kd, указывающую на более сильное связывание. Аффинность можно измерить обычными способами, известными в данной области техники, в том числе способами, описанными в настоящем документе. Низкоаффинные антитела, как правило, слабо связываются с антигеном и легко диссоциируют, тогда как высокоаффинные антитела, как правило, быстрее связываются с антигеном и остаются связанными дольше. Различные способы измерения аффинности связывания известны в данной области техники, любые из них могут быть использованы для целей настоящего изобретения.
В одном из вариантов воплощения, значения "Kd" или "Kd" в соответствии с этим изобретением измеряют, используя поверхностный плазмонный резонанс на приборе BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с использованием чипов СМ5 с иммобилизованной мишенью (например, антигеном) до ~10 единиц ответа (RU). Кратко, карбоксиметилированные декстрановые биосенсорные чипы (СМ5, BIAcore Inc.) активируют N-этил-N’-(3-диметиламинопропил)-карбодиимид гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости потока 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена для блокирования непрореагировавших групп инъецируют 1М этаноламина. Для измерений кинетики инъецируют двухкратные серийные разведения Fab (например, от 0,78 нМ до 500 нМ) в PBS с 0,05% Tween 20 (PBST) при 25°С при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя модель простого связывания Ленгмюра со стехиометрией 1:1 (программное обеспечение BIAcore Evaluation Software версия 3.2) с одновременной аппроксимацией сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают в виде отношения koff/kon. Смотрите, например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации по данным метода поверхностного плазмонного резонанса, описанного выше, превышает 106 М-1с-1, то скорость ассоциации можно определить, используя метод гашения флуоресценции, при котором измеряют увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25°С образца 20 нМ антитела против антигена (Fab форма) в PBS, pH 7,2, в присутствии увеличивающихся концентраций антигена, где измерения проводят с помощью спектрометра, например, спектрофотометра с возможностью остановки потока (Aviv Instruments) или спектрофотометра SLM-Aminco серии 8000 (ThermoSpectronic) и кюветы с перемешиванием.
"Биологически активный" и "биологическая активность" и "биологические характеристики" в отношении гетеромультимерного белка по настоящему изобретению, такого как антитело, его фрагмент или производное, означают наличие способности связываться с биологической молекулой, за исключением случаев, когда указано иное.
Термин "выделенные", когда он используется для описания различных гетеромультимерных полипептидов, означает гетеромультимер, который был отделен и/или извлечен из клетки или культуры клеток, в которых он экспрессировался. Загрязняющие компоненты природного окружения представляют собой материалы, которые будут мешать диагностическим или терапевтическим применениям гетеромультимеров, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные компоненты. В некоторых вариантах воплощения, гетеромультимер будет очищен (1) до 95% и более по массе белка, как это определено по методу Лоури, и, наиболее предпочтительно, до 99% и более по массе, (2) до степени, достаточной для секвенирования, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенного состояния, определяемого с помощью SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием Кумасси или, предпочтительнее, окрашивания серебром. Тем не менее, как правило, выделенный полипептид будет получен, по меньшей мере, за одну стадию очистки.
Гетеромультимеры по настоящему изобретению, как правило, очищены до по существу гомогенного состояния. Фразы "по существу гомогенные", "по существу гомогенная форма" и "по существу гомогенное состояние" используются для указания на то, что в продукте по существу отсутствуют побочные продукты, возникающие из-за нежелательных комбинаций полипептидов (например, гомомультимеры).
При описании чистоты по существу гомогенное состояние означает, что количество побочных продуктов не превышает 10%, 9%, 8%, 7%, 6%, 4%, 3%, 2% или 1% по массе или меньше 1% по массе. В одном из вариантов воплощения содержание побочного продукта меньше 5%.
"Биологическая молекула" относится к нуклеиновой кислоте, белку, углеводу, липиду и их комбинациям. В одном из вариантов воплощения биологическая молекула существует в природе.
Термины "связанный" или "соединяет", используемые в настоящем документе, означают либо непосредственную пептидную связь между первой и второй аминокислотными последовательностями, либо связь, которая включает третью аминокислотную последовательность, которая посредством пептидной связи связана с первой и второй аминокислотными последовательностями. Например, линкер связан пептидной связью с C-концом одной аминокислотной последовательности и N-концом другой аминокислотной последовательности.
"Линкер", используемый в настоящем документе, означает аминокислотную последовательность из двух или более аминокислот в длину. Линкер может состоять из нейтральных полярных или неполярных аминокислот. Линкер может иметь, например, от 2 до 100 аминокислот в длину, например, от 2 до 50 аминокислот в длину, например, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот в длину. Линкер может быть "расщепляемым", например, саморасщепляемым, ферментативно или химически расщепляемым. Сайты расщепления в аминокислотных последовательностях, а также ферменты и химические соединения, которые осуществляют расщепление по таким сайтам, хорошо известны в данной области техники, а также описаны в настоящем документе.
"Мостик", используемый в настоящем документе, означает аминокислотный линкер, который соединяет две других аминокислотных последовательности. Мостик, как описано в настоящем документе, может соединять N-конец вариабельного домена тяжелой цепи иммуноглобулина с C-концом константного домена легкой цепи иммуноглобулина. В конкретных вариантах воплощения мостик имеет примерно от 15 до 50 аминокислот в длину, например, от 20 до 26 аминокислот в длину (например, 20, 21, 22, 23, 24, 25 или 26 аминокислот в длину). Мостик может быть "расщепляемым", например, саморасщепляемым или ферментативно или химически расщепляемым с использованием стандартных и известных в данной области техники способов и реагентов.
Ферментативное расщепление "линкера" или "мостика" может включать использование эндопептидазы, такой как, например, Lys-C, Asp-N, Arg-C, V8, Glu-C, химотрипсин, трипсин, пепсин, папаин, тромбин, Genenase, фактор Ха, TEV (цистеиновая протеаза вируса гравировки табака), энтерокиназа, HRV С3 (протеаза человеческого риновируса С3), кининогеназа, а также субтилизин-подобных конвертаз пробелков (например, фурин (РС1), РС2 или РС3) или N-аргинин двухосновных конвертаз. Химическое расщепление может включать использование, например, гидроксиламина, N-хлорсукцинимида, N-бромсукцинимида или бромциана.
"Сайт расщепления эндопептидазой Lys-C", используемый в настоящем документе, представляет собой остаток лизина в аминокислотной последовательности, с C-концевой стороны от которого происходит расщепление эндопептидазой Lys-C. Эндопептидаза Lys-C расщепляет с C-концевой стороны от остатка лизина.
"Хаотропный агент" означает растворимое в воде вещество, которое разрушает пространственную структуру белка (например, антитела), нарушая стабилизацию за счет внутримолекулярных взаимодействий (например, водородных связей, ван-дер-ваальсовых сил или гидрофобных эффектов). Примеры хаотропных агентов включают мочевину, гуанидин-HCl, перхлорат лития, гистидин и аргинин, но не ограничиваются ими.
"Мягкий детергент" означает растворимое в воде вещество, которое разрушает пространственную структуру белка (например, антитела), нарушая стабилизацию за счет внутримолекулярных взаимодействий (например, водородных связей, ван-дер-ваальсовых сил или гидрофобных эффектов), но которое не разрушает структуру белка необратимо, лишь приводя к потере белком биологической активности (т.е. не денатурирует белок). Примеры мягких детергентов включают Tween (например, Tween-20), Triton (например, Triton Х-100), NP-40 (нонил феноксилполиэтоксилэтанол), Nonidet Р-40 (октил феноксилполиэтоксилэтанол) и додецилсульфат натрия (SDS), но не ограничиваются ими.
"Эффекторные функции" антитела относятся к тем биологическим активностям, которые связаны с участком Fc (нативной последовательностью участка Fc или вариантом аминокислотной последовательности участка Fc) антитела, и варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антител включают связывание с C1q и комплементзависимую цитотоксичность; связывание с Fc рецептором; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточный рецептор) и активацию B-клеток.
"Антителозависимая клеточноопосредованная цитотоксичность" или "ADCC" относится к форме цитотоксичности, при которой секретируемые Ig связываются с Fc рецепторами (FcR), присутствующими на некоторых цитотоксических клетах (например, ествественных киллерах (NK), нейтрофилах и макрофагах), что приводит к тому, что эти цитотоксические эффекторные клетки специфично связываются с целевой клеткой, несущей антиген, и далее убивают эту целевую клетку цитотоксическими агентами. Антитела "активируют" цитотоксические клетки и абсолютно необходимы для такого уничтожения. Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Информация об экспрессии FcR на гематопоэтических клетках суммирована в Таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки ADCC активности интересующей молекулы может быть осуществлен анализ ADCC in vitro, например, описанный в патенте США номер 5,500,362 или 5,821,337. Используемые для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (РВМС) и естественные киллеры (NK). Альтернативно или дополнительно, ADCC активность интересующей молекулы можно оценить in vivo, например, в модели на животных, например, раскрытой в Clynes et at., Proc. Natl. Acad. Sci. USA 95:652-656 (1998).
"Fc рецептор" или "FcR" описывает рецептор, который связывается с участком Fc антитела. Предпочтительным FcR является человеческий FcR. Более того, предпочтительным FcR является такой Fc рецептор, который связывается с антителом IgG (гамма рецептор), включая рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. FcγRII рецепторы включают FcγRIlA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют схожие аминокислотные последовательности, различающиеся, главным образом, их цитоплазматическими доменами. Активирующий рецептор FcγRMA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в составе своего цитоплазматического домена. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в составе своего цитоплазматического домена (смотрите обзор М.

"Человеческие эффекторные клетки" представляют собой лейкоциты, которые экспрессируют один или более FcR и осуществляют эффекторные функции. Предпочтительно, клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют эффекторную функцию ADCC. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононукпеарные клетки периферической крови (РВМС), естественные киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы; предпочтительными являются РВМС и NK клетки. Эффекторная клетка может быть выделена из природного источника, например, из крови.
"Комплементзависимая цитотоксичность" или "CDC" относится к лизису целевой клетки в присутствии комплемента. Классический путь активации комплемента инициирует связывание первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с их распознанным антигеном. Чтобы оценить активацию комплемента, можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Термин "терапевтически эффективное количество" относится к количеству антитела, фрагмента антитела или его производного, эффективному для лечения заболевания или расстройства у субъекта. В случае опухоли (например, раковой опухоли) терапевтически эффективное количество антитела или фрагмента антитела (например, мультиспецифического антитела или фрагмента антитела) может снижать число раковых клеток; снижать размер первичной опухоли; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковыми клетками периферических органов; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или облегчать, до некоторой степени, один или более симптомов, связанных с расстройством. В зависимости от степени, до которой антитело или фрагмент антитела могут предотвращать рост и/или убивать существующие раковые клетки, они могут быть цитостатическими и/или цитотоксическими. Для противораковой терапии эффективность in vivo может, например, быть измерена путем оценки продолжительности выживания, времени до прогрессирования заболевания (ТТР), частоты ответа (RR), продолжительности ответа и/или качества жизни.
Термин "снижать или ингибировать" означает способность вызывать общее уменьшение, предпочтительно, на 20% или больше, предпочтительнее, на 50% или больше и, предпочтительнее, на 75%, 85%, 90%, 95% или больше. Термин "снижать или ингибировать" может относиться к симптомам расстройства, подлежащего лечению, наличию или размеру метастаз, размеру первичной опухоли или размеру или числу кровеносных сосудов в случае ангиогенных расстройств.
Термины "рак" и "раковый" относятся к физиологическому состоянию у млекопитающих или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом/пролиферацией клеток. Это определение включает доброкачественные и злокачественные виды рака. Примеры рака включают карциному, лимфому, бластому, саркому и лейкемию, но не ограничиваются ими. Более конкретные примеры таких видов рака включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудка, в том числе рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почек (например, почечно-клеточная карцинома), рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, меланому и различные типы рака головы и шеи. "Ранняя стадия рака" означает рак, который не является инвазивным или метастатическим или который классифицируется как рак 0, I или II стадии. Термин "предраковый" относится к состоянию или росту, которые, как правило, предшествуют раку или развиваются в рак. "Не метастатический" означает рак, который является доброкачественным или который остается в первичном очаге и не проникает в лимфатическую или кровеносную системы или в ткани, отличные от первичного очага. Как правило, неметастатический рак представляет собой любой рак, который классифицируют как рак 0, I или II стадии, и иногда как рак III стадии.
"Аллергическое или воспалительное расстройство" в настоящем документе представляет собой заболевание или расстройство, возникающее в результате гиперактивации иммунной системы у индивидуума. Примеры аллергических или воспалительных расстройств включают астму, псориаз, ревматоидный артрит, атопический дерматит, рассеянный склероз, системную красную волчанку, экзему, трансплантацию органов, возрастную макулодистрофию, болезнь Крона, язвенный колит, эозинофильный эзофагит и аутоиммунные заболевания, связанные с воспалением, но не ограничиваются ими.
"Аутоиммуное заболевание" в настоящем документе представляет собой заболевание или расстройство, возникающее и направленное против собственных тканей индивидуума, или их косегрегацию или проявление, или состояние, возникшее вследствие такого заболевания или расстройства. Примеры аутоиммунных заболеваний или расстройств включают артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, прогрессирующий артрит, псориатический артрит, артрит позвоночника и ювенильный ревматоидный артрит, остеоартрит, прогрессирующий хронический артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилоартрит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковидный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, дерматит, в том числе контактный дерматит, хронический контактный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит и атопический дерматит, Х-связанный гипер-IgM синдром, крапивницу, такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, в том числе хроническая аутоиммунная крапивница, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродермию (в том числе системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (MS), такой как спинально-оптический MS, первично-прогрессирующий MS (PPMS) и ремиттирующий-рецидивирующий MS (РРС), прогрессирующий системный склероз, атеросклероз, артериосклероз, диссеминированный склероз и атаксический склероз, воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммунные опосредованные желудочно-кишечные заболевания, колиты, такие как неспецифический язвенный колит, язвенный колит, микроскопический колит, коллагенозный колит, полипозные колиты, некротизирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), гангренозную пиодермию, узловатую эритему, первичный склерозирующий холангит, эписклерит, респираторный дистресс-синдром, в том числе синдром респираторный дистресс-синдром у взрослого или острый респираторный дистресс-синдром (ARDS), менингит, воспаление всей или части сосудистой оболочки, ирит, хориоидит, аутоиммунное гематологическое заболевание, ревматоидный спондилит, внезапную потерю слуха, IgE-опосредованные заболевания, такие как анафилаксия и аллергический атопический ринит, энцефалит, такой как энцефалит Расмуссена и лимбический и/или стволовой энцефалит, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозным увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромом и без него, такой как хронический или острый гломерулонефрит, такой как первичный GN, иммуно-опосредованный GN, мембранозный GN (мембранозная нефропатия), идиопатический мембранозный GN или идиопатическая мембранозная нефропатия, мембранный или мембранозный пролиферативный GN (MPGN), в том числе I типа и II типа, и быстро прогрессирующий GN, аллергические состояния, алергические реакции, экзему, в том числе аллергическую или атопическую экзему, астму, такую как бронхиальная астма, бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию Т клетками и хронические воспалительные ответы, хроническое легочное воспалительное заболевание, аутоиммунный миокардит, дефицит адгезии лейкоцитов, системную красную волчанку (SLE) или системную эритематозную волчанку, такую как кожная SLE, подострая кожная волчанка, синдром неонатальной волчанки (NLE), диссеминированную красную волчанку, волчанку (в том числе нефрит, церебрит, педиатрическая волчанка, непочечная волчанка, внепочечная волчанка, дисковидная волчанка, алопеция), ювенильный сахарный диабет (I типа), в том числе педиатрический инсулинозависимый сахарный диабет (IDDM), диабет зрелого возраста (диабет II типа), аутоиммунный диабет, идиопатический несахарный диабет, иммунный ответ, связанный с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, в том числе лимфогранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулиты, в том числе васкулит (включая васкулит больших сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит Такаясу), васкулит средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), микроскопический полиартерит, васкулит ЦНС, некротизирующий, кожный или аллергический васкулит, системный некротизирующий васкулит и ANCA-ассоциированный васкулит, например, синдром или васкулит Черджа-Стросса (CSS)), височный артериит, апластическую анемию, аутоиммунную апластическую анемию, анемию с положительным тестом Кумбса, анемию Даймонда-Блэкфана, гемолитическую анемию или иммунную гемолитическую анемию, в том числе аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, болезнь Аддисона, врожденную красноклеточную анемию или аплазию (PRCA), дефицит фактора VIII, гемофилию А, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, связанные с диапедезом лейкоцитов, воспалительные расстройства ЦНС, синдром полиорганной недостаточности, например, на фоне септицемии, травмы или кровоизлияния, заболевания, опосредованные комплексом антиген-антитело, болезнь Гудпасчера, синдром антифосфолипидного антитела, аллергический неврит, синдром Бехчета или болезнь Бехчета, болезнь Кастлемена, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, например, буллезный пемфигоид и пемфигоид кожи, пемфигус (в том числе вульгарный пемфигус, листовидный пемфигус, пемфигус слизистых оболочек и себорейный пемфигус), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, нефрит с иммунными комплексами, антитело- опосредованный нефрит, оптиконевромиелит, полинейропатию, хроническую нейропатию, например, IgM полинейропатию или IgM-опосредованную нейропатию, тромбоцитопению (например, развивающуюся у пациентов с инфарктом миокарда), в том числе тромботическую тромбоцитопеническую пурпуру (ТТР) и аутоиммунную или иммуно-опосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), в том числе хроническая или острая ITP, аутоиммунное заболевание яичек и яичников, в том числе аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, в том числе тироидит, например, аутоиммунный тироидит, болезнь Хашимото, хронический тироидит (тироидит Хашимото), или подострый тироидит, аутоиммунные заболевания щитовидной железы, идиопатический гипотиреоз, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, в том числе неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром скованного человека, энцефаломиелит, например, аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (ЕАЕ), миастению гравис, такую как тимома-ассоциированная миастения, мозжечковую дегенерацию, нейромиотонию, опсоклонус-миоклонус синдром (OMS) и сенсорную нейропатию, мультифокальную моторную нейропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (не в результате трансплантации), NSIP, синдром Гийена-Барре, болезнь Берже (IgA нефропатия), идиопатическую IgA нефропатию, линейный IgA дерматоз, первичный билиарный цирроз печени, цирроз легкого, аутоиммунный энтеропатический синдром, глютеновую болезнь, целиакию, целиакию-спру (глютеновую энтеропатию), рефрактерный спру, идиопатический спру, криоглобулинемию, амиотрофический боковой склероз (ALS; болезнь Лу Герига), ишемическую болезнь сердца, аутоиммунные заболевания ушей, такие как аутоиммунные заболевания внутреннего уха (AIED), аутоиммунная потеря слуха, синдром опсоклонус-миоклонус (OMS), полихондрит, например, рефрактерный или рецидивирующий полихондрит, легочный альвеолярный протеиноз, амилоидоз, склерит, нераковый лимфоцитоз, первичный лимфоцитоз, который включает моноклональный В-клеточный лимфоцитоз (например, оброкачественная моноклональная гаммапатия и моноклональная гаммапатия неясного генеза, MGUS), периферическую нейропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич и каналопатии ЦНС, аутизм, воспалительные миопатии, фокально-сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное гепатологическое расстройство, фибромиалгию, множественную недостаточность эндокринных желез, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическую нефропатию, синдром Дресслера, очаговую алопецию, синдром CREST (кальциноз, феномен Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, смешанное заболевание соединительной ткани, болезнь Шагаса, ревматическую атаку, привычный выкидыш, аллергический альвеолит у сельскохозяйственных рабочих, полиморфную эритему, посткардиотомный синдром, синдром Кушинга, легочную аллергию птицеводов, аллергический гранулематоз и ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальное заболевание легких, трансфузионную реакцию, проказу, малярию, лейшманиоз, трипаносомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самтера, синдром Каплана, лихорадку денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный фиброз легких, интерстициальный фиброз легких, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, стойкую возвышающуюся эритему, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хронический циклит, гетерохромный циклит, иридоциклит или циклит Фукса, пурпуру Шенлейна-Геноха, инфекцию вируса иммунодефицита человека (ВИЧ), ECHO-вирусную инфекцию, кардиомиопатию, болезнь Альцгеймера, парвовирусную инфекцию, инфекцию вируса краснухи, поствакцинальные синдромы, врожденную краснуху, инфекцию вируса Эпштейна-Барр, свинку, синдром Эванса, аутоиммунную гонадную дисфункцию, хорею Сиденгама, постстрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотку спинного мозга, хориоидит, гигантоклеточную полимиалгию, эндокринную офтальмопатию, хронический пневмонит гиперчувствительности, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефротический синдром, нефропатию минимальных изменений, доброкачественное семейное и ишемически-реперфузионное повреждение, аутоиммунное повреждение сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические расстройства, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактический эндофтальмит, аллергический энтерит, узловатую лепрозную эритему, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматоидную лихорадку, болезнь Хаммена-Рича, сенсоневральную тугоухость, пароксизмальную гемоглобинурию, гипогонадизм, регионарный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатическую офтальмию, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозную пиодермию, тиреоидит Кервена, приобретенную атрофию селезенки, бесплодие вследствие образования антител против сперматозоидов, незлокачественную тимому, витилиго, SCID и заболевания, ассоциированные с вирусом Эпштейна-Барр, синдром приобретенного иммунодефицита (СПИД), паразитарные болезни, такие как лейшманиоз, синдром токсического шока, пищевое отравление, состояния, включающие инфильтрацию Т-клеток, дефицит адгезии лейкоцитов, иммунные реакции, связанные с острой гиперчувствительностью и гиперчувствительностью замедленного типа, опосредованной цитокинами и Т-лимфоцитами, заболевания, включающие диапедез лейкоцитов, синдром полиорганной недостаточности, заболевания, опосредованные комплексом антиген-антитело, болезнь, вызванную образованием антител к гломерулярной базальной мембране, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, симпатическую офтальмию, ревматические заболевания, смешанное заболевание соединительной ткани, нефротический синдром, приобретенный инсулит, полиэндокринную недостаточность, периферическую невропатию, аутоиммунный полигландулярный синдром I типа, взрослый (приобретенный) идиопатический гипопаратиреоз (AOIH), тотальную алопецию, дилатационную кардиомиопатию, приобретенный буллезный эпидермолиз (ЕВА), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, решетчатый, лобный, верхнечелюстной или клиновидный синусит, расстройство, связанное с эозинофилами, например, эозинофилия, эозинофильный инфильтрат легкого, синдром эозинофилии-миалгии, синдром Леффлера, хроническую эозинофильную пневмонию, тропическую легочную эозинофилию, бронхопульмональный аспергиллез, аспергиллому или гранулемы, содержащие эозинофилы, анафилаксию, серонегативный спондилоартрит, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, хронический кандидоз кожи и слизистых, склеры, эписклеры, синдром Брутона, транзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдрича, атаксию-телеангиэктазию, аутоиммунные расстройства, связанные с коллагеновой болезнью, ревматизм, неврологические заболевания, ишемическое реперфузионное расстройство, снижение реакции артериального давления, сосудистую дисфункцию, ангиэктазию, повреждение ткани, сердечно-сосудистую ишемию, гипералгезию, ишемию головного мозга и болезнь, сопровождающуюся васкуляризацией, аллергические расстройства гиперчувствительности, гломерулонефрит, реперфузионные повреждения, реперфузионное повреждение миокарда или других тканей, дерматозы с острыми воспалительными компонентами, острый гнойный менингит или другие воспалительные расстройства центральной нервной системы, воспалительные расстройства глаза, синдромы, связанные с переливанием гранулоцитов, индуцированная цитокинами токсичность, острое тяжелое воспаление, хроническое неустранимое воспаление, пиелит, цирроз легкого, диабетическую ретинопатию, диабетическое поражение крупных артерий, внутриартериальную гиперплазию, язвенную болезнь желудка и двенадцатиперстной кишки, вальвулит и эндометриоз, но не ограничиваясь этим.
Термин "цитотоксический агент", используемый в настоящем документе, относится к веществу, которое ингибирует или препятствует функционированию клетки и/или вызывает разрушение клетки. Термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Ra223, P32 и радиоактивные изотопы Lu), химиотерапевтические агенты, например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, в том числе их фрагменты и/или варианты, и различные противоопухолевые, противораковые и химиотерапевтические агенты, раскрытые в настоящем документе. Другие цитотоксические агенты описаны в настоящем документе. Противоопухолевый агент вызывает разрушение опухолевых клеток.
"Химиотерапевтический агент" представляет собой химическое соединение, используемое для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкил сульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапакон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополетин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (в том числе их синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамин оксид гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, в особенности калихеамицин гамма 1 (смотрите, например, Agnew, Chem Intl. Ed. Engl. 33: 183-186 (1994)); динемицин, в том числе динемицин А; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые ендииновые антибиотики-хромофоры), аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин (в том числе морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идаруцибин, марцелломицин, митомицины, такие как митомицин С, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фолиновая кислота; ацеглатон; алдофосфамида гликозид; аминолевулиновая кислота; енилурацил; амсакрин; бестрабуцил; бизантрен эдатрексат; дефофамин; демеколцин; диазиквон; эфлорнитин; эллиптиниум ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; мейтансиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецины (в особенности токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, NJ), ABRAXANE™ без кремофора, альбуминовые нанокомпозиции паклитаксела (American Pharmaceutical Partners, Schaumberg, IL) и доцетаксел TAXOTERE® (

Также это определение охватывает противогормональные агенты, которые регулируют, снижают, блокируют или ингибируют эффекты гормонов, которые могут способствовать росту рака, применяемые обычно в форме системного лечения. Они могут сами представлять собой гормоны. Примеры включают анти-эстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), в том числе, например, тамоксифен (в том числе тамоксифен NOLVADEX®), EVISTA® ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; анти-прогестероны; понижающие регуляторы эстрогеновых рецепторов (ERD); агенты, которые вызывают супрессию или прекращение работы яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как лейпролида ацетат LUPRON® и ELIGARD®, гозерелина ацетат, бусерелина ацетат и трипторелин; другие анти-андрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продукцию эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат MEGASE®, экземестан AROMASIN®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, такое определение химиотерапевтических агентов включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов сигнальных путей, вовлеченных в аберрантную пролиферацию клеток, такие как, например, РКС-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® gnRH; лапатиниба дитозилат (двойной низкомолекулярный ингибитор тирозинкиназы ErbB-2 и EGFR, также называемый GW572016); и фармацевтически приемлемые соли, кислоты или производные любых приведенных выше соединений.
Термин "агент, ингибирующий рост", используемый в настоящем документе, относится к соединению или композиции, которые ингибируют рост клеток либо in vitro, либо in vivo. Таким образом, агент, ингибирующий рост, может представлять собой агент, который значительно уменьшает процент клеток в S фазе. Примеры агентов, ингибирующих рост, включают агенты, которые блокируют прохождение по клеточному циклу (в точке, отличной от S фазы), такие как агенты, которые вызывают остановку в G1-фазе и остановку в М-фазе. Классические блокаторы М-фазы включают алкалоиды барвинка (например, винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, которые вызывают остановку в G1-фазе, также вызывают остановку в S-фазе, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, озаглавленная "Cell cycle regulation, oncogenes, and antineoplastic drugs", авторы Murakami et al. (WB Saunders: Philadelphia, 1995), в особенности см. с. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, полученные из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел способствуют сбору микротрубочек из димеров тубулина и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
Термин "противораковая терапия", используемый в настоящем документе, относится к лечению, которое уменьшает или ингибирует рак у субъекта. Примеры противораковой терапии включают цитотоксическую радиотерапию, а также введение субъекту терапевтически эффективного количества цитотоксического агента, химиотерапевтического агента, агента, ингибирующего рост, противораковой вакцины, ингибитора ангиогенеза, пролекарства, цитокина, антагониста цитокина, кортикостероида, иммуносупрессора, противорвотного средства, антитела или фрагмента антитела или анальгетика.
Термин "пролекарство", использованный в этой заявке, относится к форме предшественника или производного фармацевтически активного вещества, которое менее цитотоксично для опухолевых клеток, чем исходное лекарственное средство, и может быть ферментативным путем активировано или превращено в более активную исходную форму. Смотрите, например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства включают фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, бета-лактам-содержащие пролекарства, необязательно замещенные феноксиацетамид-содержащие пролекарства или необязательно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное свободное цитотоксическое лекарственное средство, но не ограничиваясь этим. Примеры цитотоксических лекарственных средств, которые могут быть превращены в форму пролекарства для использования в этом изобретении, включают химиотерапевтические агенты, описанные выше, но не ограничиваются ими.
Термин "цитокин" является общим термином для белков, высвобождаемых одной популяцией клеток, которые действуют на другие клетки, выступая в роли межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Цитокины включают гормон роста, такой как человеческий гормон роста (HGH), N-метионил человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); эпидермальный фактор роста (EGF); печеночный фактор роста; фактор роста фибробластов (FGF); пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-альфа; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста -I и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (М- CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1 альфа, IL-1 бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-18, фактор некроза опухолей, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, в том числе LIF и kit лиганд (KL). Используемый в настоящем документе термин цитокин включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты природных цитокинов.
"Антагонист цитокина" означает молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность, по меньшей мере, одного цитокина. Например, антагонисты цитокинов могут ингибировать активность цитокина путем ингибирования экспрессии и/или секреции цитокина или путем связывания с цитокином или рецептором цитокина. Антагонисты цитокинов включают антитела, синтетические или природные пептиды, иммуноадгезины и низкомолекулярные антагонисты, которые связываются с цитокином или рецептором цитокина. Антагонист цитокина необязательно конъюгирован или слит с цитотоксическим агентом. Примерами антагонистов TNF являются этанерцепт (ENBREL®), инфликсимаб (REMICADE®) и адалимумаб (HUMIRA™).
Термин "иммуносупрессор", используемый в настоящем документе, относится к веществам, которые супрессируют или маскируют иммунную систему субъекта, подвергающегося лечению. Они включают вещества, которые супрессируют продукцию цитокинов, снижают или супрессируют экспрессию собственных антигенов или маскируют антигены МНС. Примеры иммуносупрессоров включают 2-амино-6-арил-5-замещенные пиримидины (смотрите патент США номер 4,665,077); микофенолят мофетил, например, CELLCEPT®; азатиоприн (IMURAN®, AZASAN®/6-меркаптопурин; бромокриптин; даназол; дапсон; глутаральдегид (маскирует антигены МНС, как описано в патенте США номер 4,120,649); антиидиотипические антитела к антигенам МНС и фрагментам МНС; циклоспорин А; стероиды, такие как кортикостероиды и глюкокортикостероиды, например, преднизон, преднизолон, такие как PEDIAPRED® (преднизолона фосфата натрия) или ORAPRED® (пероральный раствор преднизолона фосфата натрия), метилпреднизолон и дексаметазон; метотрексат (пероральный или подкожный) (RHEUMATREX®, TREXALL™); гидроксихлорохин/хлорохин; сульфасалазин; лефлуномид; антагонисты цитокинов или рецепторов цитокинов, в том числе антитела против интерферона-γ, -β или -α, антитела против фактора некроза опухолей-α (инфликсимаб или адалимумаб), иммуноадгезин против TNFα (ENBREL®, этанерцепт), антитела против фактора некроза опухолей-β, антитела против интерлейкина-2 и антитела против рецептора IL-2; анти-LFA-1 антитела, в том числе анти-CD11a и анти-СР18 антитела; анти-L3T4 антитела; гетерологичный антилимфоцитарный глобулин; поликлональные или пан-Т антитела или моноклональные анти-СР3 или анти-CD4/CD4a антитела; растворимый пептид, содержащий LFA-3 связывающий домен (WO 90/08187); стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК из хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (Cohen et al., патент США номер 5,114,721); фрагменты Т-клеточного рецептора (Offner et al., Science 251: 430-432 (1991); WO 90/11294; Janeway, Nature 341:482 (1989); и WO 91/01133); антитела к Т-клеточному рецептору (ЕР 340,109), такие как Т10В9; циклофосфамид (CYTOXAN®); дапсон; пеницилламин (CUPRIMINE®); плазмаферез; или внутривенный иммуноглобулин (IVIG). Они могут быть использованы по отдельности или в комбинации друг с другом, в частности, могут быть использованы комбинации стероида и другого иммуносупрессора или такие комбинации с последующей поддерживающей дозой нестероидного агента, чтобы снизить потребность в стероидах.
"Анальгетик" относится к лекарственному средству, действие которого направлено на подавление или снятие боли у субъекта. Примеры анальгетиков включат нестероидные противовоспалительные препараты (НПВП), в том числе ибупрофен (MOTRIN®), напроксен (NAPROSYN®), ацетилсалициловая кислота, индометацин, сулиндак и толметин, в том числе их соли и их производные, а также различные другие лекарственные средства, используемые для уменьшения острой боли, которая может возникнуть, в том числе антиконвульсанты (габапентин, фенитоин, карбамазепин) или трициклические антидепрессанты. Конкретные примеры включают ацетаминофен, аспирин, амитриптилин (ELAVIL®), карбамазепин (TEGRETOL®), фенитоин (DILANTIN®), габапентин (NEURONTIN®), (E)-N-ванилил-8-метил-6-нонамид (CAPSAICIN®) или блокатор нервов.
"Кортикостероид" относится к любому из нескольких синтетических или природных веществ с общей химической структурой стероидов, обладающие такими же или усиленными эффектами, как и природные кортикостероиды. Примеры синтетических кортикостероидов включают преднизон, преднизолон (в том числе метилпреднизолон), дексаметазон, триамцинолон и бетаметазон.
Термин "противораковая вакцина", используемый в настоящем документе, представляет собой композицию, которая стимулирует у субъекта иммунный ответ против рака. Противораковые вакцины, как правило, состоят из источника ассоциированного с раком материала или клеток (антиген), который может быть аутологичным (собственным) или аллогенным (чужим) для субъекта, наряду с другими компонентами (например, адъюванты), которые дополнительно стимулируют иммунный ответ против антигена.
Противораковые вакцины могут привести к стимуляции иммунной системы субъекта для выработки антител к одному или нескольким конкретным антигенам и/или для выработки киллерных Т-клеток, атакующих раковые клетки, которые несут эти антигены.
Термин "цитотоксическая радиотерапия", используемый в настоящем документе, относится к лучевой терапии, которая ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Лучевая терапия может включать, например, внешнее облучение или терапию с применением радиоактивно меченного агента, такого как антитело. Термин включает использование радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Ra223, P32 и радиоактивных изотопов Lu).
"Субъект" представляет собой позвоночное животное, такое как млекопитающее, например, человека. Млекопитающее включает сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки и лошади), приматов, мышей и крыс, но не ограничиваясь этим.
За исключением случаев, когда контекстом указано иное, термины "первый" полипептид, содержащий шарнирный участок, и "второй" полипептид, содержащий шарнирный участок, и их варианты являются лишь общими идентификаторами, и не должны рассматриваться как идентифицирующие определенный или конкретный полипептид или компонент антител по настоящему изобретению.
Коммерчески доступные реагенты, упомянутые в Примерах, если это имело место, использовали в соответствии с инструкциями производителя, если не указано иное. Клетки, которые упоминаются в нижеследующих Примерах и в описании, если это имеет место, доступны под учетными номерами АТСС в Американской коллекции типовых культур, Манассас, Виргиния. Если не указано иное, в настоящем изобретении используются стандартные методики метода рекомбинантных ДНК, например, описанные в настоящем документе выше и в следующих изданиях: Sambrook et al., см. выше; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates and Wiley Interscience, NY, 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc., NY, 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press, Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press, Oxford, 1984); Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991.
Следует понимать, что в этом описании и в формуле изобретения слово "включать" или его вариации, такие как "включает" или "включающий" подразумевает включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Понятно, что аспекты и варианты воплощения изобретения, описанные в настоящем документе, включают аспекты и варианты воплощения, "состоящие из" и/или "состоящие по существу из" аспектов и вариантов воплощения.
Указание в настоящем документе на "примерно" значение или параметр включает (и описывает) вариации, направленные на это значение или параметр как таковой. Например, описание с указанием на "примерно X" включает описание "X".
Используемые в настоящем документе и в прилагаемой формуле изобретения формы единственного числа включают указания множественного числа, если в контексте явно не указано иное. Понятно, что аспекты и вариации изобретения, описанные в настоящем документе, включают аспекты и вариации, "состоящие из" и/или "состоящие по существу из" аспектов и вариаций.
II. Способы получения гетеромультимерных белков в клетках-хозяевая млекопитающих
Получение гетеромультимерных белков, например,
мультиспецифических атител с использованием существующих в настоящее время технологий имеет свои недостатки, заключающиеся в получении смеси продуктов, низком выходе и в снижении/отсутствии эффекторных функций. Таким образом, желательно получать гетеромультимерные белки эффективно и с высокими выходами.
Получение молекул антител различными способами, как правило, хорошо известно. В патенте США номер 6331415 (Cabilly et al.), например, описан способ рекомбинантного получения иммуноглобулинов, в котором тяжелые и легкие цепи экспрессируют одновременно из одного вектора или из двух разных векторов в одной клетке. В Wibbenmeyer et al., (1999, Biochim Biophys Acta 1430(2): 191-202) и Lee and Kwak (2003, J. Biotechnology 101:189-198) описано получение моноклональных антител из продуцируемых по отдельности тяжелых и легких цепей с использованием плазмид, экспрессируемых в разных культурах Е. coli. Различные другие методы, имеющие отношение к получению антител, описаны, например, в Harlow, et al., ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988) и WO 2006028936. Тем не менее, каждый из методов имеет свои недостатки, такие как низкий выход, использование химических реактивов.
Способы, предусмотренные в настоящем документе, основаны на неожиданном открытии, что первый полипептид, содержащий шарнирный участок, и первая легкая цепь, экспрессируемые и секретируемые первой клеткой-хозяином млекопитающих, и второй полипептид, содержащий шарнирный участок, и вторая легкая цепь, экспрессируемые и секретируемые второй клеткой-хозяином млекопитающих, собираются с образованием гетеромультимерного белка в комбинированной культуральной среде. Как более подробно обсуждается ниже, комбинированная культуральная среда может быть получена путем культивирования первой клетки-хозяина млекопитающих в культуре первых клеток-хозяев, культивирования второй клетки-хозяина млекопитающих в культуре вторых клеток-хозяев, сбора первой и второй культуральной среды без разрушения клеточной мембраны первой и второй клеток-хозяев и объединения собранных первой и второй культуральных сред для получения комбинированной культуральной среды, которая включает гетеромультимерный белок. Альтернативно, комбинированная культуральная среда может быть получена путем культивирования первой и второй клеток-хозяев млекопитающих в комбинированной культуре клеток и сбора комбинированной культуральной среды, которая включает гетеромультимерный белок, от комбинированной культуры клеток. В некоторых вариантах воплощения, стадия сбора включает удаление первой и/или второй клеток-хозяев без разрушения клеточной мембраны.
Способы, предусмотренные в настоящем документе, являются неожиданными, поскольку принято было считать, что системы контроля качества белков эукариотических клеток (таких как клетки млекопитающих) не позволят эффективно продуцировать неполные антитела. Смотрите, например, Spiess et al. (2013) Nature, 31(8): 753-758.
Заявители также неожиданно обнаружили, что гетеромультимерный белок может образовываться с высоким выходом в восстанавливающих условиях в комбинированной культуральной среде, включающей первый гомодимер, включающий два первых полипептида, содержащих шарнирные участки, и две первые легкие цепи, который был секретирован первой клеткой-хозяином, и второй гомодимер, включающий два вторых полипептида, содержащих шарнирные участки, и две вторые легкие цепи, который был секретирован второй клеткой-хозяином.
Таким образом, в некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, способной экспрессировать и секретировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь,
(b) культивирование второй клетки-хозяина, способной экспрессировать и секретировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь; и,
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки хозяина без разрушения клеточной мембраны первой и второй клеток-хозяев, где комбинированная культуральная среда включает гетеромультимерный белок, и где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего.
В некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, способной экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, способной экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки-хозяина, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(d) инкубирование комбинированной культуральной среды в восстанавливающих условиях, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего.
В некоторых вариантах воплощения, комбинированную культуральную среду получают без разрушения клеточной мембраны первой и второй клеток- хозяев. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента. В некоторых вариантах воплощения, восстанавливающие условия являются достаточными для формирования гетеромультимерного белка.
В некоторых вариантах воплощения, первый полипептид, содержащий шарнирный участок, и первая легкая цепь составляют первое полуантитело. В некоторых вариантах воплощения, второй полипептид, содержащий шарнирный участок, и вторая легкая цепь составляют второе полуантитело.
В некоторых вариантах воплощения, примерно 99%, примерно 95%, примерно 90%, примерно 85%, примерно 80%, примерно 75%, примерно 70%, примерно 65%, примерно 60%, примерно 55%, примерно 50%, примерно 45%, примерно 40%, примерно 35%, примерно 30%, примерно 25%, примерно 20%, примерно 15%, примерно 10%, примерно 5% или менее примерно 5% (например, примерно 4%, примерно 3%, примерно 2% или примерно 1%) первого полипептида, содержащего шарнирный участок, и первой легкой цепи (например, первого полуантитела), присутствующих в комбинированной культуральной среде, находятся в форме первого гомодимера до инкубации в восстанавливающих условиях или до добавления восстанавливающего агента, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, от примерно 10% до примерно 75%, от примерно 20% до примерно 65% или от примерно 30% до примерно 55% первого полипептида, содержащего шарнирный участок, и первой легкой цепи (например, первого полуантитела), присутствующих в комбинированной культуральной среде, находятся в форме первого гомодимера до инкубации в восстанавливающих условиях или до добавления восстанавливающего агента.
В некоторых вариантах воплощения, примерно 99%, примерно 95%, примерно 90%, примерно 85%, примерно 80%, примерно 75%, примерно 70%, примерно 65%, примерно 60%, примерно 55%, примерно 50%, примерно 45%, примерно 40%, примерно 35%, примерно 30%, примерно 25%, примерно 20%, примерно 15%, примерно 10%, примерно 5% или менее примерно 5% (например, примерно 4%, примерно 3%, примерно 2% или примерно 1%) второго полипептида, содержащего шарнирный участок, и второй легкой цепи (например, второго полуантитела), присутствующих в комбинированной культуральной среде, находятся в форме второго гомодимера до инкубации в восстанавливающих условиях или до добавления восстанавливающего агента, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, от примерно 10% до примерно 75%, от примерно 20% до примерно 65% или от примерно 30% до примерно 55% второго полипептида, содержащего шарнирный участок, и второй легкой цепи (например, второго полуантитела), присутствующих в комбинированной культуральной среде, находятся в форме второго гомодимера до инкубации в восстанавливающих условиях или до добавления восстанавливающего агента.
В некоторых вариантах воплощения, комбинированная культуральная среда включает менее примерно 75%, менее примерно 70%, менее примерно 65%, менее примерно 60%, менее примерно 55%, менее примерно 50%, менее примерно 45%, менее примерно 40%, менее примерно 35%, менее примерно 30%, менее примерно 20%, менее примерно 19%, менее примерно 18%, менее примерно 17%, менее примерно 16%, менее примерно 15%, менее примерно 14%, менее примерно 13%, менее примерно 12%, менее примерно 11%, менее примерно 10%, менее примерно 9%, менее примерно 8%, менее примерно 7%, менее примерно 6% менее примерно 5%, менее примерно 4%, менее примерно 3%, менее примерно 2% или менее примерно 1% первого гомодимера после инкубации в восстанавливающих условиях или после добавления восстанавливающего агента, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, комбинированная культуральная среда включает менее чем от примерно 2% до примерно 20%, менее чем от примерно 5% до примерно 15% или от примерно 10% до примерно 15% первого гомодимера после инкубации в восстанавливающих условиях или после добавления восстанавливающего агента.
В некоторых вариантах воплощения, комбинированная культуральная среда включает менее примерно 75%, менее примерно 70%, менее примерно 65%, менее примерно 60%, менее примерно 55%, менее примерно 50%, менее примерно 45%, менее примерно 40%, менее примерно 35%, менее примерно 30%, менее примерно 20%, менее примерно 19%, менее примерно 18%, менее примерно 17%, менее примерно 16%, менее примерно 15%, менее примерно 14%, менее примерно 13%, менее примерно 12%, менее примерно 11%, менее примерно 10%, менее примерно 9%, менее примерно 8%, менее примерно 7%, менее примерно 6% менее примерно 5%, менее примерно 4%, менее примерно 3%, менее примерно 2% или менее примерно 1% второго гомодимера после инкубации в восстанавливающих условиях или после добавления восстанавливающего агента, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, комбинированная культуральная среда включает менее чем от примерно 2% до примерно 20%, менее чем от примерно 5% до примерно 15% или менее чем от примерно 10% до примерно 15% второго гомодимера после инкубации в восстанавливающих условиях или после добавления восстанавливающего агента.
В некоторых вариантах воплощения, предусмотрен способ получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь; и,
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки-хозяина, где комбинированная культуральная среда содержит гетеромультимерный белок, и где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, первая и вторая нуклеиновые кислоты представляют собой одну молекулу нуклеиновой кислоты; но в некоторых других вариантах воплощения первая и вторая нуклеиновые кислоты представляют собой разные молекулы нуклеиновых кислот. В некоторых вариантах воплощения, третья и четвертая нуклеиновые кислоты представляют собой одну молекулу нуклеиновой кислоты; но в некоторых других вариантах воплощения третья и четвертая нуклеиновые кислоты представляют собой разные молекулы нуклеиновых кислот.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки хозяина без разрушения клеточной мембраны первой и второй клеток-хозяев, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(d) инкубирование комбинированной культуральной среды в восстанавливающих условиях, достаточных для формирования гетеромультимерного белка, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, первая и вторая нуклеиновые кислоты представляют собой одну молекулу нуклеиновой кислоты; но в некоторых других вариантах воплощения первая и вторая нуклеиновые кислоты представляют собой разные молекулы нуклеиновых кислот. В некоторых вариантах воплощения, третья и четвертая нуклеиновые кислоты представляют собой одну молекулу нуклеиновой кислоты; но в некоторых других вариантах воплощения третья и четвертая нуклеиновые кислоты представляют собой разные молекулы нуклеиновых кислот. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, предусмотрен способ получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь; и,
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки-хозяина, где комбинированная культуральная среда содержит гетеромультимерный белок, и где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки хозяина без разрушения клеточной мембраны первой и второй клеток-хозяев, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(d) инкубирование комбинированной культуральной среды в восстанавливающих условиях, достаточных для образования гетеромультимерного белка, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, в культуре первых клеток-хозяев;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, в культуре вторых клеток-хозяев;
(c) сбор первой культуральной среды от первой клетки-хозяина млекопитающих;
(d) сбор второй культуральной среды от второй клетки-хозяина млекопитающих;
(e) комбинирование первой культуральной среды и второй культуральной среды для получения комбинированной культуральной среды, где комбинированная культуральная среда включает гетеромультимерный белок. В некоторых вариантах воплощения, сбор первой культуральной среды включает удаление первой клетки-хозяина из культуры первых клеток-хозяев. В некоторых вариантах воплощения, сбор второй культуральной среды включает удаление второй клетки-хозяина из культуры вторых клеток-хозяев. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(а) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, в культуре первых клеток-хозяев, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, в культуре вторых клеток-хозяев, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) сбор первой культуральной среды от первой клетки-хозяина млекопитающих, где первая культуральная среда включает первый гомодимер;
(d) сбор второй культуральной среды от второй клетки-хозяина млекопитающих, где вторая культуральная среда включает второй гомодимер;
(e) комбинирование первой культуральной среды и второй культуральной среды для получения комбинированной культуральной среды, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(f) инкубирование комбинированной культуральной среды в восстанавливающих условиях, достаточных для образования гетеромультимерного белка, и;
(g) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, сбор первой культуральной среды включает удаление первой клетки-хозяина из культуры первых клеток-хозяев. В некоторых вариантах воплощения, сбор второй культуральной среды включает удаление второй клетки-хозяина из культуры вторых клеток-хозяев. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первое и второе полуантитела соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, в культуре первых клеток-хозяев;
(b) культивирование второй клетки-хозяина млекопитающих, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, в культуре вторых клеток-хозяев;
(c) сбор первой культуральной среды от первой клетки-хозяина млекопитающих;
(d) сбор второй культуральной среды от второй клетки-хозяина млекопитающих;
(e) комбинирование первой культуральной среды и второй культуральной среды для получения комбинированной культуральной среды, где комбинированная культуральная среда включает гетеромультимерный белок. В некоторых вариантах воплощения, сбор первой культуральной среды включает удаление первой клетки-хозяина из культуры первых клеток-хозяев. В некоторых вариантах воплощения, сбор второй культуральной среды включает удаление второй клетки-хозяина из культуры вторых клеток-хозяев.
В некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, в культуре первых клеток-хозяев, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, в культуре вторых клеток-хозяев, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) сбор первой культуральной среды от первой клетки-хозяина млекопитающих, где первая культуральная среда включает первый гомодимер;
(d) сбор второй культуральной среды от второй клетки-хозяина млекопитающих, где вторая культуральная среда включает второй гомодимер;
(e) комбинирование первой культуральной среды и второй культуральной среды для получения комбинированной культуральной среды, где комбинированная культуральная среда включает первый гомодимер и второй гомодимер;
(f) инкубирование комбинированной культуральной среды в восстанавливающих условиях, достаточных для образования гетеромультимерного белка, и;
(g) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, сбор первой культуральной среды включает удаление первой клетки-хозяина из культуры первых клеток-хозяев. В некоторых вариантах воплощения, сбор второй культуральной среды включает удаление второй клетки-хозяина из культуры вторых клеток-хозяев. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь;
(b) культивирование второй клетки-хозяина млекопитающих, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь; и
(c) сбор культуральной среды от комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, для получения комбинированной культуральной среды для первой клетки-хозяина млекопитающих и второй клетки-хозяина млекопитающих, где комбинированная культуральная среда включает гетеромультимерный белок.
В некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина млекопитающих, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, где вторая клетка-хозяин млекопитающих способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) сбор культуральной среды от комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, для получения комбинированной культуральной среды для первой клетки-хозяина млекопитающих и второй клетки-хозяина млекопитающих, где культуральная среда от комбинированной культуры клеток включает первый гомодимер и второй гомодимер;
(d) инкубирование культуральной среды в восстанавливающих условиях, достаточных для формирования гетеромультимерного белка, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, изобретение предусматривает способы получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь;
(b) культивирование второй клетки-хозяина млекопитающих, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь; и
(c) сбор культуральной среды от комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, для получения комбинированной культуральной среды для первой клетки-хозяина млекопитающих и второй клетки-хозяина млекопитающих, где комбинированная культуральная среда включает гетеромультимерный белок.
В некоторых вариантах воплощения, предусмотрены способы получения гетеромультимерного белка, включающего i) первое полуантитело, включающее первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и ii) второе полуантитело, включающее второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью, где способ включает следующие стадии:
(a) культивирование первой клетки-хозяина млекопитающих, включающей первую нуклеиновую кислоту, которая кодирует первый полипептид, содержащий шарнирный участок, и вторую нуклеиновую кислоту, которая кодирует первую легкую цепь, где первая клетка-хозяин способна экспрессировать первый полипептид, содержащий шарнирный участок, и первую легкую цепь, и где первый гомодимер, включающий два первых полипептида, содержащих шарнирный участок, и две первые легкие цепи, является секретируемым;
(b) культивирование второй клетки-хозяина млекопитающих, включающей третью нуклеиновую кислоту, которая кодирует второй полипептид, содержащий шарнирный участок, и четвертую нуклеиновую кислоту, которая кодирует вторую легкую цепь, где вторая клетка-хозяин способна экспрессировать второй полипептид, содержащий шарнирный участок, и вторую легкую цепь, и где второй гомодимер, включающий два вторых полипептида, содержащих шарнирный участок, и две вторые легкие цепи, является секретируемым;
(c) сбор культуральной среды от комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, для получения комбинированной культуральной среды для первой клетки-хозяина млекопитающих и второй клетки-хозяина млекопитающих, где культуральная среда от комбинированной культуры клеток включает первый гомодимер и второй гомодимер;
(d) инкубирование культуральной среды в восстанавливающих условиях, достаточных для формирования гетеромультимерного белка, и;
(e) получение гетеромультимерного белка, где первая клетка-хозяин и вторая клетка-хозяин представляют собой клетку млекопитающего. В некоторых вариантах воплощения, способ дополнительно включает добавление восстанавливающего агента к комбинированной культуральной среде.
В некоторых вариантах воплощения, культивирование комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, осуществляют при температуре примерно между 25°C и 40°C. В некоторых вариантах воплощения, культивирование комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, осуществляют при температуре примерно между 30°C и 37°C. В некоторых вариантах воплощения, культивирование комбинированной культуры клеток, включающей первую клетку-хозяина и вторую клетку-хозяина, осуществляют при pH примерно между 7,2 и 8,7.
В некоторых вариантах воплощения, комбинированную культуральную среду инкубируют при температуре примерно между 4°C и 40°C. В некоторых вариантах воплощения, комбинированную культуральную среду инкубируют при температуре примерно между 30°C и 37°C. В некоторых вариантах воплощения, комбинированную культуральную среду инкубируют при температуре примерно между 4°C и 8°C.
В некоторых вариантах воплощения, комбинированную культуральную среду перемешивают. В некоторых вариантах воплощения, комбинированную культуральную среду перемешивают на протяжении примерно 6 часов, примерно 12 часов, примерно 18 часов, примерно 24 часов, примерно 1 дня, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней, примерно 7 дней, примерно 8 дней или более 8 дней после получения комбинированной культуральной среды. В некоторых вариантах воплощения, комбинированную культуру периодически перемешивают.
В некоторых вариантах воплощения, способы дополнительно включают выделение гетеромультимерного белка (такого как биспецифическое антитело) из комбинированной культуральной среды. В некоторых вариантах воплощения, гетеромультимерный белок (такой как биспецифическое антитело) выделяют с использованием колонки с белком A.
В некоторых вариантах воплощения, способы включают добавление восстанавливающего агента в процессе получения гетеромультимерного белка (такого как биспецифическое антитело.) В некоторых вариантах воплощения предусмотренных в настоящем документе способов, используемый восстанавливающий агент представляет собой глутатион, 2-меркаптоэтанол, 2- меркаптоэтиламин, трис(2-карбоксиэтил)фосфин (ТСЕР), цистеин, цистеин, дитиотреитол, цистеин дитиотреитол, дитиобутиламин или их комбинации. В некоторых вариантах воплощения, восстанавливающий агент представляет собой восстановленный глутатион. В некоторых вариантах воплощения, восстанавливающий агент не является 2-меркаптоэтанолом. В некоторых вариантах воплощения, восстанавливающий агент не является дитиотреитолом.
В некоторых вариантах воплощения, где первые и вторые клетки-хозяева млекопитающих культивируют по отдельности, т.е. растят в виде отдельных культур клеток, восстанавливающий агент добавляют к культуральной среде от первой клетки-хозяина и к культуральной среде от второй клетки-хозяина до сбора первой и второй культуральной среды и их объединения для получения комбинированной культуральной среды. В некоторых вариантах воплощения, где первые и вторые клетки-хозяева млекопитающих растят в одной и той же культуре клеток, восстанавливающий агент добавляют к культуральной среде комбинированной культуры клеток до сбора комбинированной культуры клеток и получения комбинированной культуральной среды.
В некоторых вариантах воплощения, восстанавливающий агент добавляют примерно за 4 часа, примерно за 5 часов, примерно за 6 часов, примерно за 7 часов, примерно за 8 часов, примерно за 9 часов, примерно за 10 часов, примерно за 11 часов, примерно за 12 часов, примерно за 13 часов, примерно за 14 часов, примерно за 15 часов, примерно за 16 часов, примерно за 17 часов, примерно за 18 часов, примерно за 19 часов, примерно за 20 часов, примерно за 21 час, примерно за 22 часа, примерно за 23 часа, примерно за 24 часа, примерно за 25 часов, примерно за 26 часов, примерно за 27 часов, примерно за 28 часов, примерно за 29 часов или примерно за 30 часов до стадии сбора, включая любой диапазон между этими значениями.
В некоторых вариантах воплощения, восстанавливающий агент добавляют к комбинированной культуральной среде. В некоторых вариантах воплощения, комбинированную культуральную среду, содержащую восстанавливающий агент, инкубируют на протяжении примерно 4 часов, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 11 часов, примерно 12 часов, примерно 15 часов, примерно 18 часов, примерно 21 часов, примерно 24 часов, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней или примерно 7 дней, включая любой диапазон между этими значениями.
В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуре клеток до достижения финальной концентрации примерно 5 мМ, примерно 6 мМ, примерно 7 мМ, примерно 8 мМ, примерно 9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ, примерно 20 мМ, примерно 21 мМ, примерно 22 мМ, примерно 23 мМ, примерно 24 мМ, примерно 25 мМ, примерно 26 мМ, примерно 27 мМ, примерно 28 мМ, примерно 29 мМ или примерно 30 мМ, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуре клеток до достижения финальной концентрации меньше 20 мМ. В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуре клеток до достижения финальной концентрации не более 20 мМ.
В некоторых вариантах воплощения, восстанавливающий агент добавляют к комбинированной культуральной среде до выделения гетеромультимерного белка (такого как биспецифическое антитело) из комбинированной культуральной среды. В некоторых вариантах воплощения, комбинированную культуральную среду, содержащую восстанавливающий агент, инкубируют на протяжении примерно 4 часов, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 11 часов, примерно 12 часов, примерно 15 часов, примерно 18 часов, примерно 21 часов, примерно 24 часов, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней или примерно 7 дней до выделения гетеромультимерного белка (такого как биспецифическое антитело) из комбинированной культуральной среды, содержащей восстанавливающий агент, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, гетеромультимерный белок выделяют с использованием колонки с белком А.
В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуральной среде до достижения финальной концентрации примерно 5 мМ, примерно 6 мМ, примерно 7 мМ, примерно 8 мМ, примерно 9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ, примерно 20 мМ, примерно 21 мМ, примерно 22 мМ, примерно 23 мМ, примерно 24 мМ, примерно 25 мМ, примерно 26 мМ, примерно 27 мМ, примерно 28 мМ, примерно 29 мМ или примерно 30 мМ. В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуральной среде для достижения финальной концентрации меньше 20 мМ. В некоторых вариантах воплощения, восстанавливающий агент (такой как глутатион) добавляют к комбинированной культуральной среде для достижения финальной концентрации не более 20 мМ.
В некоторых вариантах воплощения способов, первая клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, вторая клетка-хозяин представляет собой стабильную клеточную линию. В некоторых вариантах воплощения, первая клетка-хозяин представляет собой клетку CHO. В некоторых вариантах воплощения, вторая клетка-хозяин представляет собой клетку CHO. В некоторых вариантах воплощения, где первую клетку-хозяин и вторую клетку-хозяин растят в одной и той же культуре клеток, соотношение первой клетки-хозяина и второй клетки-хозяина в начальный момент в комбинированной культуре клеток составляет примерно 1:10, примерно 1:9, примерно 1:8, примерно 1:7, примерно 1:6, примерно 1:5, примерно 1:4, примерно 1:3, примерно 1:2, примерно 1:1, примерно 2:1, примерно 3:1, примерно 4:1, примерно 5:1, примерно 6:1, примерно 7:1, примерно 8:1, примерно 9:1 или примерно 10:1.
Используемый в настоящем документе термин "молярное соотношение" относится к соотношению первого полипептида, содержащего шарнирный участок, связанного с первой легкой цепью (например, первое полуантитело), который был экспрессирован и/или секретирован, и второго полипептида, содержащего шарнирный участок, связанного со второй легкой цепью (например, второе полуантитело), который был экспрессирован и/или секретирован. В некоторых вариантах воплощения, молярное соотношение первого полипептида, содержащего шарнирный участок, свзанного с первой легкой цепью, и второго полипептида, содержащего шарнирный участок, связанного со второй легкой цепью, составляет примерно 1:5, примерно 1:4, примерно 1:3, примерно 1:2, примерно 1:1, примерно 2:1, примерно 3:1, примерно 4:1 или примерно 5:1, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, молярное соотношение первого полипептида, содержащего шарнирный участок, связанного с первой легкой цепью, и второго полипептида, содержащего шарнирный участок, связанного со второй легкой цепью, составляет примерно 1:1. В некоторых вариантах воплощения, молярное соотношение первого полуантитела и второго полуантитела составляет примерно 1:5, примерно 1:4, примерно 1:3, примерно 1:2, примерно 1:1, примерно 2:1, примерно 3:1, примерно 4:1 или примерно 5:1, включая любой диапазон между этими значениями. В некоторых вариантах воплощения, молярное соотношение первого полуантитела и второго полуантитела составляет примерно 1:1.
III. Гетеромультимерные белки
Также в настоящем изобретении предусмотрены гетеромул ьтимерные белки, получаемые любым способом, описанным в настоящем документе. В некоторых вариантах воплощения, гетеромультимерный белок включает участок Fc антитела или его вариант (например, вариант с измененной функцией ADCC). В некоторых вариантах воплощения, гетеромультимерный белок включает значительную часть участка Fc антитела или его варианта (например, варианта с измененной функцией ADCC). В некоторых вариантах воплощения, гетеромультимерный белок включает тяжелую цепь, включающую только часть доменов CH1, CH2 и/или CH3. В некоторых вариантах воплощения, гетеромультимерный белок представляет собой фрагмент антитела, включающий только часть доменов CH1, CH2 и/или CH3. В некоторых вариантах воплощения, гетеромультимерный белок представляет собой антитело. В некоторых вариантах воплощения, гетеромультимерный белок представляет собой биспецифическое антитело. В некоторых вариантах воплощения, гетеромультимерный белок представляет собой гуманизированное антитело. В некоторых вариантах воплощения, гетеромультимерный белок представляет собой человеческое антитело. В некоторых вариантах воплощения, антитело представляет собой IgG (например, IgG1, IgG2 или IgG4), IgA или IgD. В некоторых вариантах воплощения, первая легкая цепь и вторая легкая цепь гетеромультимерного белка включают разные последовательности вариабельных доменов. В некоторых вариантах воплощения, первый и второй полипептиды, содержащие шарнирные участки, гетеромультимерного белка, полученные способами, описанными в настоящем документе, включают участок Fc или его вариант. В некоторых вариантах воплощения, первый и второй полипептиды, содержащие шарнирные участки, гетеромультимерного белка включают тяжелую цепь антитела.
Домены гетеромультимеризации
Гетеромультимерные белки включают домен гетеромультимеризации. Для создания по существу гомогенной популяции гетеродимерных молекул домен гетеродимеризации должен предпочтительнее образовывать гетеродимеры, а не гомодимеры. Несмотря на то, что в гетеромультимерных белках, приведенных в качестве примера в настоящем документе, реализована технология выступы-во-впадину для облегчения гетеромультимеризации, специалистам в данной области техники будут очевидны другие домены гетеромультимеризации, которые могут быть использованы в настоящем изобретении.
Выступы-во-впадины
Использование выступов-во-впадину в качестве способа получения мультиспецифических атител хорошо известно в данной области техники. Смотрите патент США номер 5,731,168, выданный 24 марта 1998, принадлежащий Genentech, опубликованную заявку РСТ номер WO2009089004, опубликованную 16 июля 2009 и принадлежащую Amgen, и опубликованную заявку на патент США номер 20090182127, опубликованную 16 июля 2009 и принадлежащую Novo Nordisk А/S. Смотрите также Marvin and Zhu, Acta Pharmacologica Sincia (2005) 26(6):649-658 и Kontermann (2005) Acta Pharacol. Sin., 26:1-9. Краткое обсуждение приведено ниже.
"Выпуклость" относится, по меньшей мере, к одной боковой цепи аминокислотного остатка, которая выступает над поверхностью
взаимодействия первого полипептида и, следовательно, располагается в компенсирующей полости в прилегающей поверхности взаимодействия (т.е. поверхности взаимодействия второго полипептида), чтобы стабилизировать гетеромультимер, и тем самым, например, способствовать предпочтительному формированию гетеромультимера, а не гомомультимера. Выпуклость может существовать в исходной поверхности взаимодействия или может быть введена синтетическим путем (например, путем изменения нуклеиновой кислоты, кодирующей поверхность взаимодействия). Обычно, нуклеиновую кислоту, кодирующую поверхность взаимодействия первого полипептида, изменяют таким образом, чтобы она кодировала выпуклость. Чтобы достичь этого, нуклеиновую кислоту, кодирущую, по меньшей мере, один "исходный" аминокислотный остаток в поверхности взаимодействия первого полипептида, замещают на нуклеиновую кислоту, кодирующую, по меньшей мере, один "импортируемый" аминокислотный остаток с более крупной по объему боковой цепью по сравнению с исходным аминокислотным остатком. Следует принять во внимание, что может быть более одного исходного и соответствующего импортируемого остатка. Верхний предел числа исходных остатков, которые могут быть заменены, представляет собой общее число остатков в поверхности взаимодействия первого полипептида. Объемы боковых цепей различных аминокислотных остатков приведены в Таблице 1 ниже:

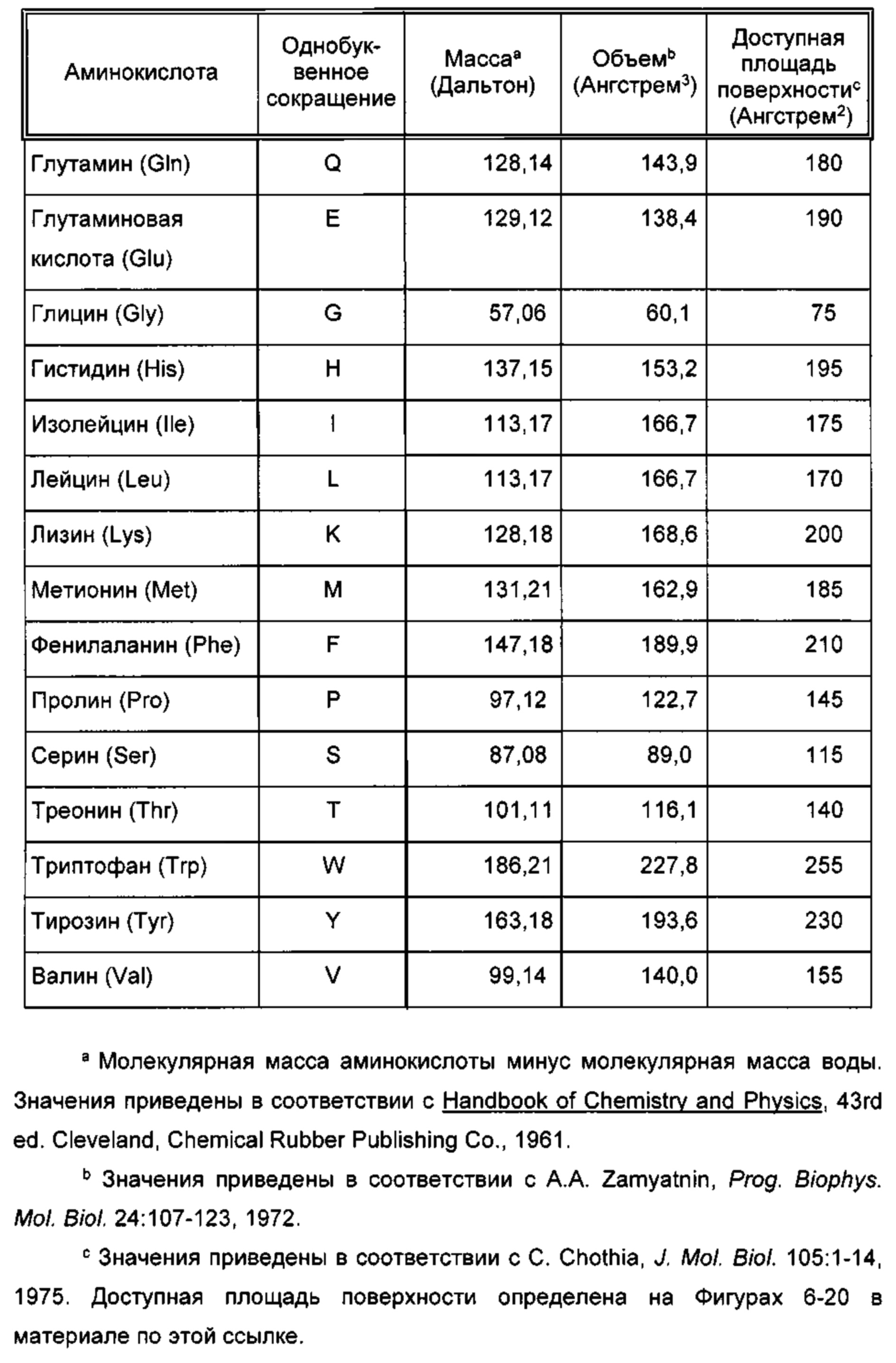
Предпочтительными импортируемыми остатками для формирования выпуклости, как правило, являются встречающиеся в природе аминокислотные остатки, предпочтительно выбранные из аргинина (R), фенилаланина (F), тирозина (Y) и триптофана (W). Наиболее предпочтительным является триптофан и тирозин. В одном из вариантов воплощения, исходный остаток для формирования выпуклости представляет собой остаток с небольшим объемом боковой цепи, такой как аланин, аспарагин, аспарагиновая кислота, глицин, серин, треонин или валин.
"Полость" относится, по меньшей мере, к одной боковой цепи аминокислотного остатка, которая углублена на поверхности взаимодействия второго полипептида и, следовательно, вмещает соответствующую выпуклость на прилегающей поверхности взаимодействия первого полипептида. Полость может существовать в исходной поверхности взаимодействия или может быть введена синтетическим путем (например, за счет изменения нуклеиновой кислоты, кодирующей поверхность взаимодействия). Обычно, нуклеиновую кислоту, кодирующую поверхность взаимодействия второго полипептида, изменяют таким образом, чтобы она кодировала полость. Чтобы достичь этого, нуклеиновую кислоту, кодирущую, по меньшей мере, один "исходный" аминокислотный остаток в поверхности взаимодействия второго полипептида, замещают на нуклеиновую кислоту, кодирующую, по меньшей мере, один "импортируемый" аминокислотный остаток с более маленькой по объему боковой цепью по сравнению с исходным аминокислотным остатком. Следует принять во внимание, что может быть более одного исходного и соответствующего импортируемого остатка. Верхний предел числа исходных остатков, которые могут быть заменены, представляет собой общее число остатков в поверхности взаимодействия второго полипептида. Объемы боковых цепей различных аминокислотных остатков приведены в Таблице 1 выше. Предпочтительными импортируемыми остатками для формирования полости обычно являются встречающиеся в природе аминокислотные остатки, предпочтительно выбранные из аланина (А), серина (S), треонина (Т) и валина (V). Наиболее предпочтительным является серин, аланин или треонин. В одном из вариантов воплощения исходный остаток для формирования полости имеет боковую цепь большого размера, например, тирозин, аргинин, фенилаланин или триптофан.
"Исходным" аминокислотным остатком является аминокислотный остаток, который замещается на "импортируемый" остаток, с боковой цепью меньшего или большего размера, чем у исходного остатка. Импортируемый аминокислотный остаток может представлять собой аминокислотный остаток, встречающийся в природе или не встречающийся в природе, но предпочтительно представляет собой аминокислотный остаток, встречающийся в природе. Аминокислотные остатки, "встречающиеся в природе", представляют собой те остатки, которые кодируются генетическим кодом и приведены в Таблице 1 выше. Аминокислотный остаток, "не встречающийся в природе", означает остаток, который не кодируется генетическим кодом, но который способен ковалентно связываться с соседним аминокислотным остатком (аминокислотными остатками) в полипептидной цепи. Примерами не встречающихся в природе аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как аминокислотные остатки, например, описанные в Ellman et al., Meth. Enzym. 202:301-336 (1991). Для получения таких не встречающихся в природе аминокислотных остатков могут быть использованы методики из Noren et al. Science 244: 182 (1989) и Ellman et al., см. выше. Кратко, методики включают химическую активацию супрессорной тРНК не встречающимся в природе аминокислотным остатком и последующую транскрипцию и трансляцию РНК in vitro. Способ по настоящему изобретению включает замену, по меньшей мере, одного исходного аминокислотного остатка, но может быть замещено более одного исходного остатка. В норме, не более чем все остатки в поверхности взаимодействия первого или второго полипептида будут включать замещенные исходные аминокислотные остатки. Как правило, исходные остатки для замены являются "погруженными". "Погруженный" означает, что остаток по существу является недоступным для растворителя. Как правило, импортируемый остаток не является цистеином, чтобы предотвратить возможное окисление или ошибочное формирование дисульфидных связей.
Выпуклости "располагаются" в полости, что означает, что пространственное расположение выпуклости и полости на поверхности взаимодействия первого полипептида и второго полипептида, соответственно, и размеры выпуклости и полости таковы, что выпуклость может располагаться в послости, значительно не мешая нормальной ассоциации первого и второго полипептидов на поверхности взаимодействия. Поскольку выпуклости, такие как Tyr, Phe и Trp, как правило, не выступают перпендикулярно относительно оси поверхности взаимодействия и имеют предпочтительные конформации, выравнивание выпуклости с соответствующей полостью опирается на моделирование пары выпукпость/полость на основе пространственной структуры, полученной, например, с помощью рентгеновской кристаллографии или ядерного магнитного резонанса (ЯМР). Это может быть достигнуто с использованием широко распространенных в данной области техники методов. "Исходная или матричная нуклеиновая кислота" означает нуклеиновую кислоту, кодирующую целевой полипептид, который может быть "изменен" (т.е. изменен методами генной инженерии или мутирован) таким образом, чтобы кодировать выпуклость или полость. Исходная или первоначальная нуклеиновая кислота может представлять собой встречающуюся в природе нуклеиновую кислоту или может включать нуклеиновую кислоту, которая была предварительно изменена (например, фрагмент гуманизированного антитела). "Изменение" нуклеиновой кислоты означает, что исходная нуклеиновая кислота была мутирована путем введения, удаления или замены, по меньшей мере, одного кодона, кодирующего целевой аминокислотный остаток. Обычно, кодон, кодирующий исходный остаток, замещен на кодон, кодирующий импортируемый остаток. Такие методы генетической модификации ДНК рассмотрены в Mutagenesis: a Practical Approach. M.J. McPherson, Ed., (IRL Press, Oxford, UK. (1991) и включают, например, сайт-направленный мутагенез, кассетный мутагенез и мутагенез полимеразной цепной реакцией. В результате изменения исходной/матричной нуклеиновой кислоты исходный/матричный полипептид, кодируемый исходной/матричной нуклеиновой кислотой, соответствующим образом изменяется.
Выпуклость или полость могут быть "введены" в поверхность взаимодействия первого или второго полипептида синтетическим способом, например, рекомбинантными способами, с помощью пептидного синтеза in vitro, с помощью методов для введения не встречающихся в природе аминокислотных остатков, которые были описаны ранее, путем ферментативного или химического связывания пептидов или с помощью некоторой комбинации этих методов. Соответственно, выпуклость или полость, которые "вводят", являются "не встречающимися в природе" или "не природными", что означает, что они не существуют в природе или в исходном полипептиде (например, в гуманизированном моноклональном антителе).
Как правило, импортируемый аминокислотный остаток для формирования выпуклости имеет относительно небольшое число "ротамеров" (например, примерно 3-6). "Ротамер" представляет собой энергетически выгодную конформацию боковой цепи аминокислотного остатка. Ряд ротомеров различных аминокислотных остатков рассмотрен в Ponders and Richards, J. Mol. Biol. 193: 775-791 (1987).
В некоторых вариантах воплощения способов, предусмотренных в настоящем документ, первый домен гетеродимеризации гетеромультимерного белка включает модификацию выступ на поверхности взаимодействия, и второй домен гетеродимеризации включает модификацию впадину. В некоторых вариантах воплощения, модификация выступ включает замену исходного аминокислотного остатка в первом домене гетеродимеризации на аминокислотный остаток с боковой цепью большего размера, чем у исходного аминокислотного остатка. В некоторых вариантах воплощения, замещающий аминокислотный остаток с боковой цепью большего размера представляет собой триптофан, фенилаланин, тирозин или аргинин. В некоторых вариантах воплощения, модификация выступ включает замену T366W (нумерация EU). В некоторых вариантах воплощения, модификация впадина включает замену исходного аминокислотного остатка из второго домена гетеродимеризации на аминокислотный остаток с боковой цепью меньшего размера, чем у исходного аминокислотного остатка. В некоторых вариантах воплощения, замещающий аминокислотный остаток с боковой цепью меньшего размера представляет собой серин, треонин, валин или аланин. В некоторых вариантах воплощения, модификация впадина включает две или больше аминокислотных замен, включающих T366S, L368A и/или Y407V (нумерация EU).
IV. Векторы, клетки-хозяева и рекомбинантные способы
Для рекомбинантного получения гетеромультимерного белка (например, антитела) по настоящему изобретению кодирующую его нуклеиновую кислоту выделяют и вставляют в реплицируемый вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделить и секвенировать с использованием стандартных методик (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител). Многие векторы являются доступными. Выбор вектора частично зависит от используемой клетки-хозяина. Как правило, клетки-хозяева представляют собой клетки-хозяева млекопитающих. Следует принять во внимание, что для этой цели могут быть использованы константные участки любого изотипа, в том числе константные участки IgG, IgM, IgA, IgD и IgE, и что такие константные участки могут быть получены из человека или из любого вида животных.
a. Создание гетеромультимерных белков с использованием клеток-хозяев млекопитающих
Компоненты вектора, как правило, включают один или несколько из следующих компонентов: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансер, промотор и последовательность терминации транскрипции, но не ограничиваясь этим.
i. Сигнальная последовательность
Вектор для использования в клетке-хозяине млекопитающих также может содержать сигнальную последовательность или другую полипептидную последовательность, имеющую специфичный сайт расщепления на N-конце зрелого белка или целевого полипептида. Предпочтительной является гетерологичная сигнальная последовательность, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) в клетке-хозяине. Для экспрессии в клетках млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнальная последовательность gD вируса простого герпеса. ДНК для такого участка белка-предшественника лигируют в рамке считывания с ДНК, кодирующей желаемый гетеромультимерный белок (гетеромультимерные белки) (например, антитела).
ii. Точка начала репликации
Как правило, точка начала репликации не нужна для экспрессирующих векторов млекопитающих. Например, как правило, может использоваться точка начала репликации SV40, но только потому, что она содержит ранний промотор.
iii. Ген для селекции
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый селектируемым маркером. Типичные гены для селекции кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) в подходящих случаях, восполняют ауксотрофные дефициты или (c) обеспечивают важными веществами, недоступными из комплексной среды.
В одном из примеров схемы отбора для остановки роста клетки-хозяина используют лекарстенное средство. Те клетки, которые были успешно трансформированы гетерологичным геном, продуцирующим белок, приобретают устойчивость к лекарственному средству и, следовательно, проходят отбор. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другими примерами подходящих селектируемых маркеров для клеток млекопитающих являются селектируемые маркеры, которые позволяют идентифицировать клетки, способные поглощать нуклеиновую кислоту антитела, такие как ген DHFR, ген тимидинкиназы, ген металлотионеина-I и -II, преимущественно гены металлотионеинов приматов, ген аденозиндеаминазы, ген орнитиндекарбоксилазы и т.п.
Например, клетки, трансформированные геном DHFR для селекции, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. В случае использования DHFR дикого типа подходящей клеткой-хозяином является линия клеток яичника китайского хомячка (CHO) с дефицитом активности DHFR (например, АТСС CRL-9096).
Альтернативно, клетки-хозяева (в частности клетки-хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид 3'-фосфотрансфераза (АРН), могут быть отобраны путем выращивания на среде, содержащей селектируемый агент для селектируемого маркера, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. Смотрите, например, патент США номер 4,965,199.
iv. Промотор
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом хозяина и функционально связан с нуклеиновой кислотой нужного полипептида, содержащего шарнирный участок (нуклеиновыми кислотами нужных полипептидов, содержащих шарнирные участки). Последовательности промоторов для клеток млекопитающих известны. Практически все гены млекопитающих имеют АТ-богатый участок, расположенный приблизительно на 25-30 оснований выше сайта инициации транскрипции. Другая последовательность, обнаруженная на 70-80 оснований выше начала инициации транскрипции многих генов, представляет собой участок CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства генов млекопитающих находится последовательность ААТААА, которая может быть сигналом для присоединения поли-А хвоста к 3'-концу кодирующей последовательности. Все эти последовательности соответствующим образом вставлены в экспрессирующие векторы млекопитающих.
Транскрипция нужного полипептида, содержащего шарнирный участок (нужных полипептидов, содержащих шарнирные участки), и транскрипция легкой цепи (легких цепей) из векторов в клетках-млекопитающих контролируется, например, промоторами, полненными из геномов вирусов, такими как промотор вируса полиомы, промотор вируса оспы кур, промотор аденовируса (такого как аденовирус 2), промотор вируса папилломы крупного рогатого скота, промотор вируса саркомы птиц, промотор цитомегаловируса, промотор ретровируса, промотор вируса гепатита В и промотор вируса обезьян 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулинов, или из промоторов теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит точку начала репликации вируса SV40. Немедленно-ранний промотор цитомегаловируса человека обычно получают в виде рестрикционного фрагмента HindIII Е. Система для экспрессии ДНК в клетках-хозяевах млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора раскрыта в патенте США номер 4,419,446. Модификация этой системы описана в патенте США номер 4,601,978. В Reyes et al., Nature 297:598-601 (1982) смотрите также описание экспрессии кДНК человеческого β-интерферона в клетках мышей под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно, в качестве промотора может использоваться длинный концевой повтор вируса саркомы Рауса.
v. Энхансер
Транскрипция ДНК, кодирующей нужный полипептид, содержащий шарнирный участок (нужные полипептиды, содержащие шарнирные участки), и легкую цепь (легкие цепи), клетками-хозяевами млекопитающих может быть усилена за счет вставки последовательности энхансера в вектор. Для генов млекопитающих (например, для генов глобина, эластазы, альбумина, α-фетопротеина и инсулина) известно много последовательностей энхансеров. Также можно использовать энхансер из вирусов, поражающих клетки млекопитающих. Примеры включают энхансер SV40 из поздней области точки начала репликации (bp 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы из поздней области точки начала репликации и энхансеры аденовирусов. Описание элементов, усиливающих активацию эукариотических промоторов, смотрите также в Yaniv, Nature 297:17-18 (1982). Энхансер может быть сплайсирован в вектор в положении 5' или 3' относительно последовательности, кодирующей полипептид антитела, при условии, что достигается усиление, но, как правило, энхансер располагается с 5' стороны от промотора.
vi. Терминатор транскрипции
Экспрессирующие векторы, используемые в клетках-хозяевах млекопитающих, также, как правило, будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5' и, иногда, из 3'-нетранслируемых областей ДНК или кДНК млекопитающих или вирусной ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из примеров используемого терминатора транскрипции является участок полиаденилирования бычьего гормона роста. Смотрите WO 94/11026 и экспрессирующий вектор, раскрытый в этом документе.
vii. Отбор и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования и экспрессии ДНК в векторах в настоящем документе включают клетки млекопитающих, описанные в настоящем документе, в том числе клетки-хозяева позвоночных. Выращивание клеток позвоночных в культуре (культура тканей) стало обычной процедурой. Примерами используемых линий клеток-хозяев млекопитающих являются линия CV1 почек обезьяны, трансформированная SV40 (COS-7, АТСС CRL 1651); линия клеток почки эмбриона человека (293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (ВHК, АТСС CCL 10); клетки яичника китайского хомячка/-DHFR (СНО, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 АТСС CCL 70); клетки почки африканской зеленой мартышки (VERO-76, АТСС CRL-1587); человеческие клетки карциномы шейки матки (HELA, АТСС CCL 2); клетки почки собаки (MDCK, АТСС CCL 34); клетки печени крысы линии Buffalo (BRL 3А, АТСС CRL 1442); человеческие клетки легких (W138, АТСС CCL 75); человеческие клетки печени (Hep G2, НВ 8065); клетки опухоли молочной железы мышей (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и человеческая линия клеток гепатомы (Нер G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для получения нужного полипептида, содержащего шарнирный участок (нужных полипептидов, содержащих шарнирные участки), и легкой цепи (легких цепей), и культивируют в обычной питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. В некоторых вариантах воплощения, клетка-хозяин представляет собой стабильно трансфицированную клетку-хозяин. В некоторых вариантах воплощения, клетка-хозяин представляет собой стабильную клеточную линию.
viii. Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения нужного полипептида, содержащего шарнирный участок (нужных полипептидов, содержащих шарнирные участки), и легкой цепи (легких цепей) по этому изобретению, можно культивировать в различных средах. Для культивирования клеток- хозяев подходят коммерчески доступные среды, такие как среда Ham F10 (Sigma), минимальная питательная среда ((MEM), Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma). Кроме того, в качестве среды для культивирования клеток-хозяев могут быть использованы любые среды, описанные в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США номер 4,767,704; 4,657,866; 4,927,762; 4,560,655 или 5,122,469; WO 90/03430; WO 87/00195; или патенте США номер Re30,985. Любая из этих сред при необходимости может быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как натрия хлорид, соли кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), следовыми элементами (определяемыми как неорганические соединения, обычно присутствующие в финальных концентрация в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые должны быть известны специалистам в данной области. Могут быть использованы такие же условия культивирования, такие как температура, pH и т.п., которые использовали ранее для клетки-хозяина, выбранной для экспрессии, и они будут очевидны специалисту в данной области техники.
ix. Очистка гетеромультимерных белков
При использовании рекомбинантных методов полипептиды, содержащие шарнирные участки, связанные с полипептидами легких цепей, могут быть получены внутриклеточно или могут секретироваться непосредственно в среду. Если полипептид, содержащий шарнирный участок, и полипептид легкой цепи продуцируются внутриклеточно, на первой стадии удаляют дебрис в виде частиц, который включает либо клетки-хозяева, либо лизированные фрагменты, например, с помощью центрифугирования или ультрафильтрации. В том случае, когда полипептид, содержащий шарнирный участок, связанный с полипептидом легкой цепи, секретируется в среду, супернатанты от таких экспрессирующих систем, как правило, вначале концентрируют с использованием коммерчески доступных фильтров для концентрирования белков, например, ультрафильтрационных фильтров Amicon или Millipore Pellicon. Ингибитор протеаз, такой как PMSF, может быть добавлен на любой упомянутой выше стадии с целью ингибирования протеолиза, а также могут быть добавлены антибиотики для предотвращения роста случайных загрязняющих микроорганизмов.
Композиция гетеромультимера, полученная из клеток, может быть очищена с использованием, например, хроматографии с гидроксиапатитом, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография является предпочтительным методом очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого иммуноглобулинового домена Fc в антителе. Белок А может использоваться для очистки антител, основанных на человеческих тяжелых цепях γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется использовать для всех мышиных изотипов и для человеческого γ3 (Guss et al., EMBO J. 5:15671575 (1986)). Матрицей, к которой прикрепляется аффинный лиганд, чаще всего является агароза, но также могут использоваться другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, позволяют достичь более высоких скоростей потока и более короткого времени обработки по сравнению с матрицами из агарозы. В тех случаях, когда антитело включает домен CH3, для очистки используют смолу Bakerbond АВХ™ (J.Т. Baker, Phillipsburg, NJ). Другие методы очистки белков, такие как фракционирование на ионообменной колонке, высаживание этанолом, обращено-фазовая HPLC, хроматография на оксиде кремния, хроматография на гепарин SEPHAROSE™, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и высаживание сульфатом аммония, также являются доступными и зависят от антитела, подлежащего очистке.
После любой стадии предварительной очистки (стадий предварительной очистки) смесь, включающую целевое антитело и загрязнители, подвергают хроматографии гидрофобных взаимодействий при низком pH, используя элюирующий буфер в диапазоне pH примерно 2,5-4,5, предпочтительно, при низких концентрациях солей (например, от примерно 0 до примерно 0,25М соли). Получение гетеромультимерных белков может альтернативно или дополнительно (для любого из указанных выше конкретных способов) включать диализ раствора, содержащего смесь полипептидов.
V. Формирование/сборка гетеромультимерного белка
Формирование полного гетеромультимерного белка включает повторную сборку первого полипептида, содержащего шарнирный участок, первой легкой цепи, второго полипептида, содержащего шарнирный участок, и второй легкой цепи, за счет формирования дисульфидной связи, которая в настоящем изобретении называется рефолдингом. Рефолдинг включает ассоциацию первого полипептида, содержащего шарнирный участок, со вторым полипептидом, содержащим шарнирный участок, и формирование межцепьевых дисульфидных связей, например, с образованием биспецифического антитела. Таким образом, в некоторых вариантах воплощения способов, предусмотренных в настоящем документе, межцепьевая дисульфидная связь гетеромультимерного белка образуется между шарнирными участками первого и второго полипептида, содержащих шарнирные участки. Рефолдинг в настоящем изобретении происходит in vitro.
После того, как полипептиды, содержащие шарнирные участки, и связанные с ними легкие цепи секретируются клеткой, домены гетеромультимеризации способствуют ассоциации гетеромультимерных белков. Происходит формирование межцепьевой дисульфидной связи между ассоциированными полипептидами, содержащими шарнирные участки. Полученный гетеромультимерный белок, связанный дисульфидной связью, далее очищают.Необязательно, он может быть введен в композицию для научно-исследовательских, диагностических, терапевтических или других целей.
VI. Целевые молекулы (молекулы-мишени)
Примеры молекул, на которые может быть направлено действие гетеромультимерного белка по этому изобретению, включают растворимые белки сыворотки и их рецепторы и другие мембраносвязанные белки (например, адгезины), но не ограничиваются ими.
В другом варианте воплощения гетеромультимерный белок по настоящему изобретению способен связывать один, два или более цитокинов, родственных цитокинам белков и цитокиновых рецепторов, выбранных из группы, состоящей из ВМР1, ВМР2, ВМРЗВ (GDF10), ВМР4, ВМР6, ВМР8, CSFI (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), ЕРО, FGF1 (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNBI, IFNG, IFNWI, FELI, FELI (EPSELON), FELI (ZETA), IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-b), LTB, TNF (TNF-a), TNFSF4 (лиганд для OX40), TNFSF5 (лиганд для CD40), TNFSF6 (FasL), TNFSF7 (лиганд для CD27), TNFSF8 (лиганд для CD30), TNFSF9 (лиганд для 4-1 ВВ), TNFSFIO (TRAIL), TNFSF1I (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, HGF (VEGFD), VEGF, VEGFB, VEGFC, IL1R1, IL1R2, IL1RL1, IL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21R, IL22R, IL1HY1, IL1RAP, IL1RAPL1, IL1RAPL2, IL1RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIF1, HGF, LEP (лептин), PTN и THPO.
В другом варианте воплощения целевая молекула представляет собой хемокин, хемокиновый рецептор или родственный хемокинам белок, выбранный из группы, состоящей из CCL1 (I-309), CCL2 (МСР-1 / MCAF), CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (МСР-3), CCL8 (МСР-2), CCL11 (эотаксин), CCL13 (МСР-4), CCL15 (MIP-1d), CCL16 (НСС-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MDP-3b), CCL20 (MIP-3a), CCL21 (SLC / exodus-2), CCL22 (MDC / STC-I), CCL23 (MPIF-1), CCL24 (MPIF-2 / эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (СТАСК / ILC), CCL28, CXCL1 (GRO1), CXCL2 (GRO2), CXCL3 (GRO3), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP 10), CXCL11 (l-TAC), CXCL12 (SDFI), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYD1), SCYE1, XCL1 (лимфотактин), XCL2 (SCM-1b), BLR1 (MDR15), CCBP2 (D6 / JAB61), CCR1 (CKR1 / HM145), CCR2 (mcp-IRB / RA), CCR3 (CKR3 / CMKBR3), CCR4, CCR5 (CMKBR5 / ChemR13), CCR6 (CMKBR6 / CKR-L3 / STRL22 / DRY6), CCR7 (CKR7 / EBII), CCR8 (CMKBR8 / TERI / CKR-L1), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), XCR1 (GPR5 / CCXCR1), CMKLR1, CMKOR1 (RDC1), CX3CR1 (V28), CXCR4, GPR2 (CCR10), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR /STRL33 / Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCP10, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCC10 (С10), EPO, FY (DARC), GDF5, HDFIA, DL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREM1, TREM2 и VHL.
В другом варианте воплощения гетеромультимерные белки по настоящему изобретению способны связываться с одной или несколькими мишенями, выбранными из группы, состоящей из ABCF1; ACVR1; ACVR1B; ACVR2; ACVR2B; ACVRL1; AD0RA2A; аггрекана; AGR2; AICDA; AIF1; AIG1; АКАР1; АКАР2; АМН; AMHR2; ANGPT1; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; АРС; АРОС1; AR; AZGP1 (цинк-а-гликопротеин); В7.1; В7.2; BAD; BAFF (BLys); BAG1; BAN; BCL2; BCL6; BDNF; BLNK; BLRI (MDR15); BMP1; BMP2; BMP3B (GDF10); BMP4; BMP6; BMP8; BMPR1A; BMPR1B; BMPR2; BPAG1 (плектин); BRCA1; C19 or f10 (IL27w); С3; C4A; C5; C5R1; CANT1; CASP1; CASP4; CAV1; CCBP2 (D6 / JAB61); CCL1 (1-309); CCL11 (эотаксин); CCL13 (MCP-4); CCL15 (MIP-1d); CCL16 (HCC-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3b); CCL2 (MCP-1); MCAF; CCL20 (MIP-3a); CCL21 (MTP-2); SLC; exodus-2; CCL22 (MDC / STC-I); CCL23 (MPIF-1); CCL24 (MPIF-2 / эотаксин-2); CCL25 (TECK); CCL26 (эотаксин-3); CCL27 (CTACK / ILC); CCL28; CCL3 (MTP-1a); CCL4 (MDP-1b); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); CCNA1; CCNA2; CCND1; CCNE1; CCNE2; CCR1 (CKR1 / HM145); CCR2 (mcp-1RB / RA); CCR3 (CKR3 / CMKBR3); CCR4; CCR5 (CMKBR5 / ChemR13); CCR6 (CMKBR6 / CKR-L3 / STRL22 / DRY6); CCR7 (CKR7 / EBII); CCR8 (CMKBR8 / TERI / CKR-LI); CCR9 (GPR-9-6); CCRL1 (VSHK1); CCRL2 (L-CCR); CD164; CD19; CDIC; CD20; CD200; CD22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD52; CD69; CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CDH1 (Е-кадгерин); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; CDKN1A (p21Waf1/Cip1); CDKN1B (p27Kip1); CDKN1C; CDKN2A (P161NK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CER1; CHGA; CHGB; хитиназы; CHST10; CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3; CLDN7 (клаудин-7); CLN3; CLU (кластерин); CMKLR1; CMKOR1 (RDC1); CNR1; COL18A1; COL1AI; COL4A3; COL6A1; CR2; CRP; CSF1 (M-CSF); CSF2 (GM-CSF); CSF3 (GCSF);CTLA4; CTNNB1 (b-катенин); CTSB (катепсин В); CX3CL1 (SCYDI); CX3CR1 (V28); CXCL1 (GRO1); CXCL10 (IP-10); CXCL11 (I-TAC / IP-9); CXCL12 (SDFI); CXCL13; CXCL14; CXCL16; CXCL2 (GRO2); CXCL3 (GRO3); CXCL5 (ENA-78 / LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR /STRL33 / Bonzo); CYB5; CYC1; CYSLTR1; DAB2IP; DES; DKFZp451 J0118; DNCLI; DPP4; E2F1; ECGF1; EDG1; EFNA1; EFNA3; EFNB2; EGF; EGFR; ELAC2; ENG; ENO1; ENO2; ENO3; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESR1; ESR2; F3 (TF); FADD; FasL; FASN; FCER1A; FCER2; FCGR3A; FGF; FGF1 (aFGF); FGF10; FGF11; FGF12; FGF12B; FGF13; FGF14; FGF16; FGF17; FGF18; FGF19; FGF2 (bFGF); FGF20; FGF21; FGF22; FGF23; FGF3 (int-2); FGF4 (HST); FGF5; FGF6 (HST-2); FGF7 (KGF); FGF8; FGF9; FGFR3; FIGF (VEGFD); FELI (EPSILON); FILI (ZETA); FLJ12584; FLJ25530; FLRT1 (фибронектин); FLT1; FOS; FOSL1 (FRA-1); FY (DARC); GABRP (GABAa); GAGEB1; GAGEC1; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; GM-CSF; GNAS1; GNRH1; GPR2 (CCR10); GPR31; GPR44; GPR81 (FKSG80); GRCC10 (C10); GRP; GSN (гельзолин); GSTP1; HAVCR2; HDAC4; HDAC5; HDAC7A; HDAC9; HGF; HIF1A; HDP1; гистамина и гистаминовых рецепторов; HLA-A; HLA-DRA; HM74; HMOX1; HUMCYT2A; ICEBERG; ICOSL; ID2; IFN-a; IFNA1; IFNA2; IFNA4; IFNA5; IFNA6; IFNA7; IFNB1; IFNгамма; DFNWI; IGBPI; IGFI; IGFIR; IGF2; IGFBP2; IGFBP3; IGFBP6; IL-I; IL10; IL10RA; IL10RB; IL11; IL11RA; IL-12; IL12A; IL12B; IL12RB1; IL12RB2; IL13; IL13RA1; IL13RA2; IL14; IL15; IL15RA; IL16; IL17; IL17B; IL17C; IL17R; IL18; IL18BP; IL18R1; IL18RAP; IL19; IL1A; IL1B; ILIF10; IL1F5; IL1F6; IL1F7; IL1F8; IL1F9; IL1HY1; IL1R1; IL1R2; IL1RAP; IL1RAPL1; IL1RAPL2; IL1RL1; IL1RL2, IL1RN; IL2; IL20; IL20RA; IL21R; IL22; IL22R; IL22RA2; IL23; IL24; IL25; IL26; IL27; IL28A; IL28B; IL29; IL2RA; IL2RB; IL2RG; IL3; IL30; IL3RA; IL4; IL4R; IL5; IL5RA; IL6; IL6R; IL6ST (гликопротеин 130); EL7; EL7R; EL8; IL8RA; DL8RB; IL8RB; DL9; DL9R; DLK; INHA; INHBA; INSL3; INSL4; IRAKI; ERAK2; ITGA1; ITGA2; ITGA3; ITGA6 (а6 интегрин); ITGAV; ITGB3; ITGB4 (b4 интегрин); JAG1; JAK1; JAK3; JUN; K6HF; KAII; KDR; KITLG; KLF5 (GC Box BP); KLF6; KLK10; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (кератин 19); KRT2A; KHTHB6 (специфичный для волос кератин H типа); LAMAS; LEP (лептин); Lingo-p75; Lingo-Troy; LPS; LTA (TNF-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; MAP2K7 (c-Jun); MDK; MIB1; мидкина; MEF; MIP-2; MKI67; (Ki-67); MMP2; MMP9; MS4A1; MSMB; MT3 (металлотионеин-III); MTSSI; MUC1 (муцин); MYC; MYD88; NCK2; нейрокан (neurocan); NFKB1; NFKB2; NGFB (NGF); NGFR; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; NME1 (NM23A); N0X5; NPPB; NR0B1; NR0B2; NR1D1; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRPI; NRP2; NT5E; NTN4; ODZ1; OPRD1; P2RX7; PAP; PART1; PATE; PAWR; PCA3; PCNA; PDGFA; PDGFB; PECAM1; PF4 (CXCL4); PGF; PGR; фосфакан (phosphacan); PIAS2; PIK3CG; PLAU (uPA); PLG; PLXDC1; PPBP (CXCL7); PPID; PRI; PRKCQ; PRKD1; PRL; PROC; PROK2; PSAP; PSCA; PTAFR; PTEN; PTGS2 (COX-2); PTN; RAC2 (p21Rac2); RARB; RGS1; RGS13; RGS3; RNF110 (ZNF144); ROBO2; S100A2; SCGB1D2 (липофилин В); SCGB2A1 (маммаглобин 2); SCGB2A2 (маммаглобин 1); SCYE1 (эндотелиальный активирующий моноциты цитокин); SDF2; SERPINA1; SERPINA3; SERP1NB5 (маслин); SERPINE1 (PAI-I); SERPDMF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPP1; SPRR1B (Spr1); ST6GAL1; STAB1; STAT6; STEAP; STEAP2; TB4R2; ТВХ21; ТСР10; TDGF1; ТЕК; TGFA; TGFB1; TGFB111; TGFB2; TGFB3; TGFB1; TGFBR1; TGFBR2; TGFBR3; THIL; THBS1 (тромбоспондин-1); THBS2; THBS4; ТНРО; TIE (Tie-1); ТМР3; тканевого фактора; TLR10; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; TNF; TNF-a; TNFAEP2 (В94); TNFA1P3; TNFRSFIIA; TNFRSF1A; TNFRSF1B; TNFRSF21; TNFRSF5; TNFRSF6 (Fas); TNFRSF7; TNFRSF8; TNFRSF9; TNFSF10 (TRAIL); TNFSF11 (TRANCE); TNFSF12 (AP03L); TNFSF13 (April); TNFSF13B; TNFSF14 (HVEM-L); TNFSF15 (VEGI); TNFSF18; TNFSF4 (лиганд для OX40); TNFSF5 (лиганд для CD40); TNFSF6 (FasL); TNFSF7 (лиганд для CD27); TNFSF8 (лиганд для CD30); TNFSF9 (лиганд для 4-1 ВВ); TOLLIP; Toll-подобных рецепторов; ТОР2А (топоизомераза Еа); ТР53; ТРМ1; ТРМ2; TRADD; TRAF1; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREM1; TREM2; TRPC6; TSLP; TWEAK; VEGF; VEGFB; VEGFC; версикан; VHL С5; VLA-4; XCL1 (лимфотактин); XCL2 (SCM-1b); XCR1 (GPR5 / CCXCR1); YY1 и ZFPM2.
Предпочтительные молекулы-мишени для антител, охваченные настоящим изобретением, включают CD белки, такие как CD3, CD4, CD8, CD16, CD19, CD20, CD34; CD64, CD200; представители семейства ErbB рецепторов, такие как рецептор EGF, рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Мас1, р150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7 интегрин и альфаv/бета3 интегрин, в том числе либо его альфа, либо его бета субъединицы (например, анти-CD11a, анти-CD18 или анти-CD11b антитела); факторы роста, такие как VEGF-A, VEGF-C; тканевой фактор (TF); альфа интерферон (альфа IFN); TNF альфа, интерлейкин, такой как IL-1бета, IL-3, IL-4, IL-5, IL-8, IL-9, IL-13, IL17A/F, IL-18, IL-13Rальфа1, IL13Rальфа2, IL-4R, IL-5R, IL-9R, IgE; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (ОВ); рецептор mpl; CTLA-4; RANKL, RANK, белок F RSV, белок C и т.п.
В одном из вариантов воплощения, гетеромультимерные белки по этому изобретению связываются с белком, родственным рецептору липопротеина низкой плотности (LRP)-1 или LRP-8, или рецептором трансферрина и, по меньшей мере, с одной мишенью, выбранной из группы, состоящей из 1) бета-секретазы (ВАСЕ1 или ВАСЕ2), 2) альфа-секретазы, 3) гамма-секретазы, 4) tau-секретазы, 5) белка-предшественника амилоида (АРР), 6) рецептора смерти 6 (DR6), 7) пептида амилоида бета, 8) альфа-синуклеина, 9) паркина, 10) гентингтина, 11) р75 NTR и 12) каспазы-6.
В одном из вариантов воплощения гетеромультимерные белки по этому изобретению связываются, по меньшей мере, с двумя целевыми молекулами, выбранными из группы, состоящей из IL-1 альфа и IL-1 бета, IL-12 и IL-18; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-5 и IL-4; IL-13 и IL-1 бета; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MEF; IL-13 и TGF-β; IL-13 и агониста LHR; IL-12 и TWEAK, IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD38 и CD138; CD38 и CD20; CD38 и CD40; CD40 и CD20; CD-8 и IL-6; CD20 и BR3, TNF альфа и TGF-бета, TNF альфа и IL-1 бета; TNF альфа и IL-2, TNF альфа и IL-3, TNF альфа и IL-4, TNF альфа и IL-5, TNF альфа и IL6, TNF альфа и IL8, TNF альфа и IL-9, TNF альфа и IL-10, TNF альфа и IL-11, TNF альфа и IL-12, TNF альфа и IL-13, TNF альфа и IL-14, TNF альфа и IL-15, TNF альфа и IL-16, TNF альфа и IL-17, TNF альфа и IL-18, TNF альфа и IL-19, TNF альфа и IL-20, TNF альфа и IL-23, TNF альфа и IFN альфа, TNF альфа и CD4, TNF альфа и VEGF, TNF альфа и MIF, TNF альфа и ICAM-1, TNF альфа и PGE4, TNF альфа и PEG2, TNF альфа и RANK лиганда, TNF альфа и Те38; TNF альфа и BAFF; TNF альфа и CD22; TNF альфа и CTLA-4; TNF альфа и GP130; TNFα и IL-12p40; VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, VEGFR и МЕТ рецептора, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3; EGFR(HERI) и HER2, EGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R и TNFR1 и IL-18R, ЕрСАМ и CD3, MAPG и CD28, EGFR и CD64, CSPGs и RGM A; CTLA-4 и BTNO2; IGF1 и IGF2; IGF1/2 и Erb2B; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-1 и CTLA-4; и RGM А и RGM В.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для создания антител. Для трансмембранных молекул, таких как рецепторы, в качестве иммуногена могут быть использованы их фрагменты (например, внеклеточный домен рецептора). Альтернативно, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природного источника (например, линия раковых клеток) или могут представлять собой клетки, трансформированные рекомбинантным методом, чтобы они могли экспрессировать трансмембранную молекулу. Другие антигены и их формы, используемые для получения антител, будут очевидны специалистам в данной области техники.
VII. Анализы активности
Физические/химические свойства и биологические функции гетеромультимерных белков по настоящему изобретению могут быть охарактеризованы с помощью различных анализов, известных в данной области техники.
Очищенные гетеромультимерные белки также могут быть охарактеризованы с помощью серии анализов, включая N-концевое секвенирование, аминокислотный анализ, неденатурирующую эксклюзионную высокоэффективную жидкостную хроматографию (HPLC), масс-спектрометрию, ионообменную хроматографию и расщепление папаином, но не ограничиваясь этим.
В некоторых вариантах воплощения изобретения, анализируют биологическую активность иммуноглобулинов, продуцируемых по настоящему документу. В некоторых вариантах воплощения, тестируют активность связывания иммуноглобулинов по настоящему изобретению с их антигенами. Анализы связывания антигенов, которые известны в данной области техники и могут быть использованы в настоящем документе, включают, без ограничения, любые прямые или конкурентные анализы связывания с использованием таких методов как вестерн блоттинг, радиоиммунологические анализы, ELISA (твердофазный иммуноферментный анализ), "сэндвич" иммунологические анализы, анализы иммунопреципитации, флуоресцентные иммунологические анализы и иммунологические анализы с белком А. Пример анализа связывания антигена предусмотрен ниже в разделе Примеры.
В одном из вариантов воплощения, настоящее изобретение предусматривает измененное антитело, которое обладает некоторыми, но не всеми эффекторными функциями, что делает его желаемым кандидатом для многих применений, для которых важен период полужизни антитела in vivo, тогда как некоторые эффекторные функции (такие как комплемент и ADCC) являются ненужными или вредными. В некоторых вариантах воплощения, для подтверждения того, что сохраняются только желаемые свойства, измеряют активности Fc продуцируемого гетеромультимерного белка. Для подтверждения снижения/исчезновения активностей CDC и/или ADCC могут быть проведены анализы цитотоксичности in vitro и/или in vivo. Например, для подтверждения того, что гетеромультимерный белок не связывается с FcγR (и, следовательно, у него, вероятно, отсутствует активность ADCC), но при этом у него сохраняется способность связываться с FcRn, могут быть проведены анализы связывания с рецептором Fc (FcR). Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в Таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Пример анализа in vitro для оценки активности ADCC целевой молекулы описан в патенте США номер 5,500,362 или 5,821,337. Используемые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и естественные киллеры (NK). Альтернативно или дополнительно, активность ADCC целевой молекулы можно оценить in vivo, например, в модели на животных, такой как модель, раскрытая в Clynes et al. PNAS (USA) 95:652-656 (1998). Для подтверждения того, что антитело не может связываться с C1q и, как следствие, не обладает активностью CDC, могут быть осуществлены анализы связывания с C1q. Для оценки активации комплемента может быть проведен анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Анализы связывания с FcRn и определение клиринса/периода полужизни in vivo также можно осуществить, используя известные в данной области техники способы.
VIII. Конъюгированные белки
Изобретение также предусматривает конъюгированные белки, такие как конъюгированные антитела или иммуноконъюгаты (например, "конъюгаты антитело-лекарственное средство" или "ADC"), включающие любой из гетеромультимерных белков, описанных в настоящем документе (например, антитело, полученное в соответствии со способами, описанными в настоящем документе), где одна из константных областей легкой цепи или тяжелой цепи конъюгирована с химической молекулой, такой как краситель или цитотоксический агент, такой как химиотерапевтический агент, лекарственное средство, агент, ингибирующий рост, токскин (например, ферментативно активный токсин бактериального, грибного, растительного или животного просихождения или их фрагмент) или радиоактивный изотоп (т.е. радиоактивный конъюгат). В частности, как описано в настоящем документе, использование доменов гетеромультимеризации позволяет получить конструкцию антител, содержащую две разных тяжелых цепи (НС1 и HC2), а также две разные легкие цепи (LC1 и LC2). Иммуноконъюгат, полученный с использованием способов, описанных в настоящем документе, может содержать цитотоксический агент, конъюгированный с константным участком только одной из тяжелых цепей (НС1 или НС2) или только одной из легких цепей (LC1 или LC2). Также, поскольку иммуноконъюгат может содержать цитотоксический агент, присоединенный только к одной тяжелой или легкой цепи, количество цитотоксического агента, вводимого субъекту, снижается относительно введения антитела, содержащего цитотоксический агент, присоединенный к обеим тяжелым или легким цепям. Снижение количества цитотоксического агента, вводимого субъекту, ограничивает нежелательные побочные эффекты, связанные с цитотоксическим агентом.
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток для лечения рака (Syrigos and Epenetos, Anticancer Research 19:605-614 (1999); Niculescu-Duvaz and Springer, Adv. Drg. Del. Rev. 26:151-172 (1997); патент США номер 4,975,278), позволяет направленно доставлять лекарственный фрагмент к опухолям, в результате чего он накапливается внутриклеточно в опухолях, тогда как системное введение этих не конъюгированных лекарственных агентов может приводить к неприемлемым уровням токсичности в отношении нормальных клеток, а также в отношении опухолевых клеток, которые подлежат элиминированию (Baldwin et al., Lancet (Mar. 15, 1986):603-605 (1986); Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," Monoclonal antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (eds.), pp. 475-506). Таким образом достигается максимальная эффективность при минимальной токсичности. В этих стратегиях использовали как поликлональные антитела, так и моноклональные антитела (Rowland et al., Cancer Immunol. Immunother. 21:183-187 (1986)). Лекарственные средства, используемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) см. выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al., Jour, of the Nat. Cancer Inst. 92(19):1573-1581 (2000); Mandler et al., Bioorganic & Med. Chem. Letters 10:1025-1028 (2000); Mandler et al., Bioconjugate Chem. 13:786-791 (2002)), майтансиноиды (ЕР 1391213; Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996)) и калихеамицин (Lode et al., Cancer Res. 58:2928 (1998); Hinman et al., Cancer Res. 53:3336-3342 (1993)). Цитотоксические и цитостатические эффекты токсинов могут быть опосредованы такими механизмами как, например, связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства, как правило, становятся неактивными или менее активными при конъюгации с большими антителами или лигандами рецепторных белков.
Химиотерапевтические агенты, используемые для создания иммуноконъюгатов, описаны в настоящем документе (например, выше). Ферментативно активные токсины и их фрагменты, которые могут использоваться, включают А цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А цепь экзотоксина (из Pseudomonas aeruginosa), А цепь рицина, А цепь абрина, А цепь модекцина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины. Смотрите, например, WO 93/21232, опубликованную 28 октября 1993. Для получения радиоконъюгированных антител доступны различные радионуклиды. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического агента получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол. Например, иммунотоксин с рицином может быть получен, как описано в Vitetta et at., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклеотида с антителом. Смотрите, например, WO 94/11026.
Конъюгаты антитела с одним или несколькими низкомолекулярными токсинами, такими как калихеамицин, майтансиноиды, доластатины, ауростатины, трихотецины и СС1065, а также с производными этих токсинов, обладающими активностью токсина, также рассматриваются в настоящем документе. Более подробную информацию о таких низкомолекулярных токсинах см. WO 2008/021290.
i. Майтансин и майтансиноиды
В некоторых вариантах воплощения, иммуноконъюгат включает антитело (полноразмерное антитело или фрагменты антитела) по настоящему изобретению, конъюгированное с одной или несколькими молекулами майтансиноида.
Майтансиноиды являются ингибиторами митоза, действие которых заключается в ингибировании полимеризации тубулина. Майтансин был впервые выделен из восточноафриканского кустарника Maytenus serrata (патент США номер 3,896,111). В дальнейшем было обнаружено, что некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и С-3 эфиры майтансинола (патент США номер 4,151,042). Синтетический майтансинол и его производные и аналоги раскрыты, например, в патентах США номер 4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,450,254; 4,362,663; и 4,371,533.
Привлекательность использования лекарственных фрагментов майтансиноидов в конъюгатах антитело-лекарственное средство заключается в следующем: (i) они относительно доступны для получения путем ферментации или химической модификации, дериватизации продуктов ферментации, (ii) могут быть дериватизированы функциональными группами, подходящими для конъюгации с антителами посредством не дисульфидных линкеров, (iii) стабильны в плазме и (iv) эффективны в отношении различных линий опухолевых клеток.
Иммуноконъюгаты, содержащие майтансиноиды, способы их получения и их терапевтическое применение рыскрыты, например, в патентах США номер 5,208,020, 5,416,064 и Европейском патенте ЕР 0425235 В1, раскрытия которых специально включены в настоящий документ посредством ссылки. В Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтансиноид, обозначенный DM1, связанный с моноклональным антителом С242, направленные против человеческого колоректального рака. Было обнаружено, что конъюгат высоко токсичен в отношении культивируемых клеток рака толстой кишки и демонстрирует противоопухолевую активность в анализе роста опухоли in vivo. В Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтансиноид конъюгирован посредством дисульфидного линкера с мышиным антителом А7, связывающимся с антигеном на человеческой линии клеток рака толстой кишки, или с другим мышиным моноклональным антителом ТА.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата ТА.1-майтансиноид тестировали in vitro на человеческой линии клеток рака молочной железы SK-BR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Степень цитотоксичности конъюгата с лекарственным средством была аналогична цитотоксичности свободного лекарственного средства майтансиноида, при этом могла быть увеличена за счет увеличения числа молекул майтансиноида на молекулу антитела. Конъюгат А7-майтансиноид показал низкую системную цитотоксичность в мышах.
Конъюгаты антитело-майтансиноид получают путем химического связывания антитела с молекулой майтансиноида без существенного снижения биологической активности либо антитела, либо молекулы майтансиноида. Смотрите, например, патент США номер 5,208,020 (раскрытие патента специально включено в настоящий документ посредством ссылки). В среднем 3-4 молекулы майтансиноида, конъюгированные с молекулой антитела, демонстрируют эффективность в увеличении цитотоксичности для клеток-мишеней без отрицательного влияния на функцию или растворимость антитела, хотя можно было ожидать, что даже одна молекула токсина на антитело приведет к увеличению цитотоксичности по сравнению с использованием голого антитела. Майтансиноиды хорошо известны в данной области техники и могут быть синтезированы известными методами или выделены из природных источников. Подходящие майтансиноиды раскрыты, например, в патенте США номер 5,208,020 и в других патентах и не патентных публикациях, упомянутых выше. Предпочтительными майтансиноидами являются майтансинол и аналоги майтансинола, модифицированные в ароматическом кольце или в других положениях молекулы майтансинола, например, различные эфиры майтансинола.
В данной области техники известно много связывающих групп для получения конъюгатов антитело-майтансиноид, включая, например, связывающие группы, которые раскрыты в патенте США номер 5,208,020 или европейском патенте 0425235 В1, Chari et al., Cancer Research 52:127-131 (1992) и опубликованной заявке на патент США номер 2005/0169933, раскрытия которых специально включены в настоящий документ посредстом ссылки. Конъюгаты антитело-майтансиноид, содержащие линкерный компонент SMCC, могут быть получены, как раскрыто в опубликованной заявке на патент США номер 2005/0169933. Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, неустойчивые к пептидазам группы или неустойчивые к эстеразам группы, раскрытые в вышеуказанных патентах, предпочтительными являются дисульфидные и тиоэфирные группы. Дополнительные связующие группы описаны и проиллюстрированы примерами в настоящем документе.
Конъюгаты антитела и майтансиноида могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Конкретные предпочтительные связывающие агенты включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP), чтобы обеспечить формирование дисульфидной связи.
Линкер может быть присоединен к молекуле майтансиноида в различных положениях в зависимости от типа связи. Например, эфирная связь может быть образована реакцией с гидроксильной группой с использованием обычных методов связывания. Реакция может проходить по положению С-3, имеющему гидроксильную группу, по положению С-14, модифицированному гидроксиметилом, по положению С-15, модифицированному гидроксильной группой, и по положению С-20, имеющую гидроксильную группу. В предпочтительном варианте воплощения, связь образуется в положении С-3 майтансинола или аналога майтансинола.
ii. Ауристатины и доластатины
В некоторых вариантах воплощения, иммуноконъюгат включает антитело по настоящему изобретению, конъюгированное с доластатинами или пептидными аналогами и производными долостатина, ауристатинами (патенты США номер 5,635,483 и 5,780,588). Было показано, что доластатины и ауристатины влияют на динамику микротрубочек, гидролиз ГТФ и деление ядра и клетки (Woyke et al., Antimicrob. Agents and Chemother. 45(12):3580-3584 (2001)) и обладают противораковой (патент США номер 5,663,149) и противогрибковой активностью (Pettit et al., Antimicrob. Agents Chemother. 42:2961-2965 (1998)). Фрагмент лекарственного средства доластатина или ауристатина может быть присоединен к антителу через N-(амино) конец или С-(карбоксильный) конец пептидного лекарственного фрагмента (WO 02/088172).
Примеры вариантов воплощения с ауристатином включают связанные с N-концом лекарственные фрагменты монометилауристатина DE и DF, раскрытые в опубликованной заявке США номер 2005/0238649 "Monomethylvaline Compounds Capable of Conjugation to Ligands", раскрытие которой специально включено в настоящий документ посредством ссылки во всей своей полноте.
Как правило, лекарственные фрагменты на основе пептидов могут быть получены путем формирования пептидной связи между двумя или несколькими аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии с жидкофазным способом синтеза (смотрите Е. Schroder and K.

iii. Калихеамицин
В других вариантах воплощения, иммуноконъюгат включает антитело по настоящему изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики семейства калихеамицинов могут вносить двухцепочечные разрывы в ДНК при субпикомолярных концентрациях. Для получения конъюгатов семейства калихеамицинов смотрите патенты США номер 5,712,374, 5,714,586, 5,739,116, 5,767,285, 5,770,701, 5,770,710, 5,773,001 и 5,877,296 (все принадлежат American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы в настоящем документе, включают, без ограничения,


iv. Другие цитотоксические агенты
Другие противоопухолевые агенты, которые могут быть конъюгированы с антителами по настоящему изобретению или антителами, полученными в соответствии со способами, описанными в настоящем документе, включают BCNU, стрептозоцин, винкристин и 5-фторурацил, семейство агентов, известных под общим названием комплекс LL-E33288, описанный в патентах США номер 5,053,394 и 5,770,710, а также эсперамицины (патент США номер 5,877,296).
Ферментативно активные токсины и их фрагменты, которые могут быть использованы согласно настоящему изобретению, включают А цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А цепь экзотоксина (из Pseudomonas aeruginosa), А цепь рицина, А цепь абрина, А цепь модекцина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, РАРМ и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaha officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины (смотрите, например, WO 93/21232, опубликованную 28 октября 1993).
Настоящее изобретение дополнительно включает иммуноконъюгат, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеаза или ДНК эндонуклеаза, такая как дезоксирибонуклеаза; ДНКаза).
Для селективного уничтожения опухоли антитело может включать высокорадиоактивный атом. Для создания радиоконъюгированных антител доступны различные радиоактивные изотопы. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат используется для обнаружения, он может включать радиоактивный атом для сцинтиграфических исследований, например tc99m или I123, или спиновую метку для визуализации с помощью ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная визуализация, MRI), такую как иод-123, иод-131, иод-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными способами. Например, пептид может быть получен биосинтезом или может быть синтезирован с использованием химического аминокислотного синтеза с использованием подходящих аминокислотных предшественников, включающих, например, фтор-19 вместо водорода. Метки, такие как tc99m или I123, Re186, Re188 и In111, могут быть присоединены через остаток цистеина в пептиде. Иттрий-90 может быть присоединен через остаток лизина. Для введения иода-123 может быть использован способ lodogen (Fraker et al., Biochem. Biophys. Res. Commun. 80:49-57 (1978)). В "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) более подробно описаны другие способы.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1 -изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклеотида с антителом. Смотрите, например, WO 94/11026. Линкер может быть "расщепляемым линкером", облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, могут быть использованы кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США номер 5,208,020).
Соединения по настоящему изобретению специально включают, но не ограничиваются, ADC, полученными с использованием следующих перекрестносшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A). Смотрите страницы 467-498, 2003-2004 Applications Handbook and Catalog.
v. Получение конъюгированных антител
В конъюгированных антителах по настоящему изобретению антитело конъюгировано с одним или несколькими фрагментами (например, фрагментами лекарственного средства), например, в количестве от примерно 1 до примерно 20 фрагментов на антитело, необязательно посредством линкера. Конъюгированные антитела могут быть получены несколькими способами с использованием реакций, условий и реагентов из области органической химии, известных специалистам в области техники, включая: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом с образованием ковалентной связи и последующую реакцию с целевым фрагментом; и (2) реакцию нуклеофильной группы фрагмента с бивалентным линкерным реагентом с образованием ковалентной связи и последующую реакцию с целевой нуклеофильной группой антитела. Дополнительные способы получения конъюгированных антител описаны в настоящем документе.
Линкерный реагент может состоять из одного или нескольких компонентов линкера. Примеры компонентов линкера включают 6-малеимидокапроил ("МС"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("РАВ"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилат ("SMCC') и N-сукцинимидил(4-иодацетил)аминобензоат ("SIAB"). Дополнительные компоненты линкера известны в данной области техники и некоторые из них описаны в настоящем документе. Смотрите также "Monomethylvaline Compounds Capable of Conjugation to Ligands," опубликованную заявку на патент США номер 2005/0238649, содержание которой включено в настоящий документ посредством ссылки во всей своей полноте.
В некоторых вариантах воплощения, линкер может включать аминокислотные остатки. Примеры аминокислотных компонентов линкера включают дипептид, трипептид, тетрапептид или пентапептид. Примеры дипептидов включают валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Примеры трипептидов включают глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, входящие в состав аминокислотного компонента линкера, включат аминокислотные остатки, которые встречаются в природе, а также минорные аминокислотные остатки и не встречающейся в природе аналоги аминокислот, такие как цитруллин. Аминокислотные компоненты линкера могут быть разработаны и оптимизированы в отношении их селективности к ферментативному расщеплению конкретными ферментами, например, опухолеассоциированной протеазой, катепсином B, C и D или протеазой плазмином.
Нуклеофильные группы антител включают, но не ограничиваются (i) N-концевыми аминогруппами, (ii) аминогруппами боковых цепей, например, лизина, (iii) тиольными группами боковых цепей, например, цистеина, и (iv) гидроксильными или аминогруппами сахаров, в случае, если антитело гликозилировано. Амино-, тиольные и гидроксильные группы являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах, включая (i) активные эфиры, такие как NHS эфиры, HOBt эфиры, галогенформиаты и галогенангидриды; (ii) галоидный алкил и галоидный бензил, например, галогенацетамиды; (iii) альдегидные, кетонные, карбоксильные и малеимидные группы. Некоторые антитела содержат восстанавливаемые межцепьевые дисульфидные связи, т.е. цистеиновые мостики. Антитела могут быть активированы для конъюгирования с линкерными реагентами обработкой восстанавливающим агентом, таким как DTT (дитиотреитол). Каждый цистеиновый мостик, таким образом, теоретически, будет образовывать два реакционноспособных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела реакцией лизинов с 2-иминотиоланом (реагент Траута), в результате которой аминогруппа превращается в тиольную группу. Реакционноспособные тиольные группы могут быть введены в антитело (или его фрагмент) введением одного, двух, трех, четырех или более остатков цистеина (например, получение мутантных антител, содержащих один или несколько неприродных аминокислотных остатков цистеина).
Конъюгированные антитела по настоящему изобретению также могут быть получены путем модификации антитела для введения электрофильных фрагментов, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или фрагменте лекарственного средства или другом фрагменте. Сахара гликозилированных антител могут быть окислены, например, с помощью периодатных окисляющих реагентов, с образованием альдегидных или кетонных групп, которые могут реагировать с аминогруппой линкерных реагентов или лекарственных или других фрагментов. Полученные имино группы оснований Шиффа могут образовывать стабильные связи или могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминогрупп. В одном из вариантов воплощения, в результате реакции углеводной части гликозилированного антитела с галактозооксидазой, либо с метапериодатом натрия в белке могут образовываться карбонильные (альдегидные и кетонные) группы, которые могут реагировать с соответствующими группами на лекарственном или другом фрагменте (Hermanson, Bioconjugate Techniques). В другом варианте воплощения, белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, в результате чего образуется альдегид вместо первой аминокислоты (Geoghegan and Stroh, Bioconjugate Chem. 3:138-146 (1992); патент США номер 5,362,852). Такой альдегид может реагировать с фрагментом лекарственного средства или нуклеофилом линкера.
Таким же образом, нуклеофильные группы на фрагменте (таком как фрагмент лекарственного средства) включают амино, тиольные, гидроксильные группы, гидразиды, оксимы, гидразины, тиосемикарбазоны, гидразинкарбоксилатные группы и арилгидразиды, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах, включая (i) активные эфиры, такие как NHS эфиры, HOBt эфиры, галогенформиаты и галогенангидриды; (ii) галоидный алкил и галоидный бензил, например, галогенацетамиды; и (iii) альдегидные, кетонные, карбоксильные и малеимидные группы, но не ограничиваясь этим.
Альтернативно, белок слияния, включающий антитело и цитотоксический агент, может быть получен, например, рекомбинантным методом или с помощью пептидного синтеза. Молекула ДНК может включать соответствующие участки, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные участком, кодирующим линкерный пептид, который не нарушает желаемые свойства конъюгата. В еще одном варианте воплощения, антитело может быть конъюгировано с "рецептором" (таким как стрептавидин) для использования для предварительного направленного воздействия на опухоль, где конъюгат антитело-рецептор вводят индивидууму с последующим выведением несвязавшегося конъюгата из циркуляции с использованием агента для выведения и введением "лиганда" (например, авидина), который конъюгирован с цитотоксическим агентом (например, радионуклеотидом).
IX. Применения
Настоящие способы, предусмотренные в настоящем документе, находят промышленное применение в получении гетеромультимерных белков. Способы по настоящему изобретению уменьшают объем работы, затрачиваемой на две отдельные ферментации и выделение, поскольку существуют технические трудности, связанными с двумя отдельными ферментациями. Более того, исключение стадии совмещения белковых молекул и окисления-восстановления из процедур предшествующих способов может увеличить выходы и уменьшить технологическую сложность и затраты.
Гетеромультимерные белки, описанные в настоящем документе, находят применение, например, в терапевтических способах in vitro, ex vivo и in vivo. Изобретение предусматривает различные способы, основанные на применении одной или нескольких из этих молекул. В некоторых патологических условиях необходимо и/или желательно использовать гетеромультимерные белки, например, мультиспецифические антитела. Изобретение предусматривает эти гетеромультимерные белки, которые могут использоваться для различных целей, например, терапевтических, профилактических и диагностических целей. Например, изобретение предусматривает способы лечения заболевания, где указанные способы включают введение субъекту, нуждающемуся в лечении, гетеромультимерного белка по настоящему изобретению, посредством чего заболевание подвергается лечению. Любые гетеромультимерные белки по настоящему изобретению, описанные в настоящем документе, могут использоваться в терапевтических (или профилактических или диагностических) способах по настоящему документу.
Например, в случае, когда гетеромультимерный белок является мультивалентным, ценным преимуществом является улучшение его авидности в отношении своего антигена. В дополнение к наличию собственной высокой аффинности связывающей части (т.е. Fab) в отношении антигена нормальные антитела IgG также характеризуются эффектом авидности, который увеличивает их ассоциацию с антигенами в результате бивалентного связывания с мишенями.
Гетеромультимерный белок, направленный против двух отдельных эпитопов на одной и той же молекуле антигена, не только обеспечивает преимущество, заключающееся в увеличении авидности связывания (благодаря бивалентному связыванию), но также приобретает новые свойства, которые не связаны ни с одним исходным антителом. Таким образом, гетеромультимерные белки по настоящему изобретению находят применение, например, в блокаде лиганд-рецепторных взаимодействий.
Гетеромультимерные белки, описанные в настоящем документе, также находят применение в одновременной блокаде сигнальных путей двух мишеней одной молекулой.
X. Терапевтическое применения
Гетеромультимерные белки, такие как антитела и фрагменты антител, описанные в настоящем документе (например, антитело и/или его фрагмент, полученные в соответствии со способами, описанными в настоящем документе) могут использоваться для терапевтических применений. Например, такие гетеромультимерные белки могут использоваться для лечения опухолей, в том числе предраковых, неметастатических, метастатических и раковых опухолей (например, ранняя стадия рака), для лечения аллергических или воспалительных расстройств, или для лечения аутоиммунного заболевания, или для лечения субъекта с риском развития рака (например, рака молочной железы, колоректального рака, рака легких, почечно-клеточной карциномы, глиомы или рака яичников), аллергического или воспалительного расстройства или аутоиммунного заболевания.
Термин рак включает группу пролиферативных расстройств, включая предраковые опухоли, доброкачественные опухоли и злокачественные опухоли, но не ограничиваясь этим. Доброкачественные опухоли остаются локализованными в месте происхождения и не способны инфильтрировать, проникать или метастазировать в отдаленные участки. Злокачественные опухоли проникают в другие ткани вокруг них и повреждают их. Они также могут получить возможность оторваться от места возникновения и распространиться в другие части тела (метастазирование), обычно через кровь или через лимфатическую систему, где расположены лимфатические узлы. Первичные опухоли классифицируют по типу ткани, из которой они возникли; метастатические опухоли классифицируют по типу ткани, из которых происходят раковые клетки. Со временем, клетки злокачественной опухоли становятся все более аномальными и сильнее отличаются от нормальных клеток. Это изменение внешнего вида раковых клеток называется степенью злокачественности опухоли, и раковые клетки описывают как хорошо дифференцированные, умеренно дифференцированные, слабо дифференцированные или недифференцированные. Хорошо дифференцированные клетки имеют вполне нормальний внешний вид и напоминают нормальные клетки, из которых они произошли. Недифференцированные клетки представляют собой клетки, которые стали настолько аномальными, что определить происхождение этих клеток больше не представляется возможным.
Опухоль может представлять собой солидную опухоль, или не солидную опухоль, или опухоль мягких тканей. Примеры опухолей мягких тканей включают лейкемию (например, хронический миелоидный лейкоз, острый миелоидный лейкоз, острый лимфобластный лейкоз взрослых, острый миелоидный лейкоз, острый лимфобластный лейкоз зрелых В-клеток, хронический лимфоцитарный лейкоз, полилимфоцитарный лейкоз или лейкоз ворсистых клеток) или лимфому (например, неходжкинская лимфома, кожная Т-клеточная лимфома или болезнь Ходжкина). Солидная опухоль включает любой рак тканей тела, отличных от крови, костного мозга или лимфатической системы. Солидные опухоли далее могут быть разделены на опухоли, которые происходят из эпителиальных клеток и опухол, которые происходят из неэпителиальных клеток. Примеры эпителиальных солидных опухолей включают опухоли желудочнокишечного тракта, толстой кишки, молочной железы, предстательной железы, легких, почек, печени, поджелудочной железы, яичников, головы и шеи, ротовой полости, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника, ануса, желчного пузыря, губы, носоглотки, кожи, матки, мужского полового органа, мочеполовых органов, мочевого пузыря и кожи. Солидные опухоли неэпителиального происхождения включают саркомы, опухоли мозга и опухоли костей.
Эпителиальный рак, как правило, развивается из доброкачественной опухоли в преинвазивную стадию (например, карцинома in situ) и в злокачественный рак, проникший через базальную мембрану и поразивший субэпителиальную строму.
Комплексы мультиспецифических белков также могут быть использованы для этих терапевтических применений, и антитела, которые связываются с HER2, могут, в частности, быть использованы для лечения рака молочной железы, колоректального рака, рака легких, почечно-клеточной карциномы, глиомы или рака яичников.
Другие субъекты, являющиеся кандидатами для получения композиций по этому изобретению, имеют следующие состояния или имеют риск развития следующих состояний: ненормальной пролиферации фиброваскулярной ткани, розовых угрей, синдрома приобретенного иммунодефицита, окклюзии артерии, атопического кератита, бактериальной язвы, болезни Бехчета, опухолей, передающихся через кровь, обструктивной болезни сонной артерии, неоваскуляризации хориоидеи, хронического воспаления, хронического отслоения сетчатки, хронического увеита, хронического витрита, осложнений от ношения контактных линз, отторжения трансплантата роговицы, неоваскуляризации роговицы, неоваскуляризации трансплантата роговицы, болезни Крона, болезни Илза, эпидемического кератоконъюнктивита, грибковых язв, инфекций вируса простого герпеса, инфекций опоясывающего герпеса, синдромов повышенной вязкости крови, саркомы Капоши, лейкоза, липидной дегенерации, болезни Лайма, маргинального кератолиза, язвы Мурена, микобактериальных инфекций кроме проказы, миопии, глазной неоваскулярной болезни, ямок в диске зрительного нерва, синдрома Ослера-Вебера (Ослера-Вебера-Рандю), остеоартрита, болезни Педжета, воспаления pars plana (парспланит), пемфигоида, фликтенулеза, полиартрита, осложнений после процедур с использованием лазерного облучения, протозойных инфекций, эластической псевдоксантомы, птеригиума глаза и сухого кератита, радиальной кератотомии, неоваскуляризации сетчатки, ретинопатии недоношенных, ретролентальной фиброплазии, саркоида, склерита, серповидно-клеточной анемии, синдрома Шегрена, солидных опухолей, болезни Штаргардта, болезни Стивенса-Джонсона, верхнего лимбического кератита, сифилиса, системной красной волчанки, краевой дегенерации Террьена, токсоплазмоза, опухолей саркомы Юинга, опухолей нейробластомы, опухолей остеосаркомы, опухолей ретинобластомы, опухолей рабдомиосаркомы, язвенного колита, окклюзии вен, дефицита витамина A, саркоидоза Вегенера, нежелательного ангиогенеза, связанного с диабетом, паразитарных заболеваний, аномального заживления ран, гипертрофии после хирургического вмешательства, повреждения или травмы (например, острое повреждение легких/ARDS), ингибирования роста волос, ингибирования овуляции и формирования желтого тела, ингибирования имплантации и торможения развития эмбриона в матке.
Примеры аллергических или воспалительных расстройств или аутоиммунных заболеваний или расстройств, которые могут подвергаться лечению с использованием антитела, полученного в соответствии со способами, описанными в настоящем документе, включают артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, прогрессирующий артрит, псориатический артрит, артрит позвоночника и ювенильный ревматоидный артрит, остеоартрит, хронический прогрессирующий артрит, деформирующий артрит, хронический первичный полиартрит, реактивный артрит и анкилозирующий спондилоартрит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковидный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, дерматит, в том числе контактный дерматит, хронический контактный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит и атопический дерматит, X-связанный гипер-IgM синдром, крапивницу, такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, в том числе хроническая аутоиммунная крапивница, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродермию (в том числе системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (MS), такой как спинально-оптический MS, первично-прогрессирующий MS (PPMS) и ремиттирующий-рецидивирующий MS (РРС), прогрессирующий системный склероз, атеросклероз, артериосклероз, диссеминированный склероз и атаксический склероз, воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммунные желудочно-кишечные заболевания, колиты, такие как неспецифический язвенный колит, язвенный колит, микроскопический колит, коллагенозный колит, полипозные колиты, некротизирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), гангренозную пиодермию, узловатую эритему, первичный склерозирующий холангит, эписклерит), респираторный дистресс-синдром, в том числе синдром респираторный дистресс-синдром у взрослого или острый респираторный дистресс-синдром (ARDS), менингит, воспаление всей сосудистой оболочки или ее части, ирит, хориоидит, аутоиммунное гематологическое заболевание, ревматоидный спондилит, внезапную потерю слуха, IgE-опосредованные заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и лимбический и/или стволовой энцефалит, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозным увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромо и без него, такой как хронический или острый гломерулонефрит, такой как первичный GN, иммуно-опосредованный GN, мембранозный GN (мембранозная нефропатия), идиопатический мембранозный GN или идиопатическую мембранозную нефропатию, мембранный или мембранозный пролиферативный GN (MPGN), в том числе I типа и II типа, и быстро прогрессирующий GN, аллергические состояния, алергические реакции, экзему, в том числе аллергическую или атопическую экзему, астму, такую как бронхиальная астма, бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию Т клетками и хронические воспалительные ответы, хроническое легочное воспалительное заболевание, аутоиммунный миокардит, дефицит адгезии лейкоцитов, системную красную волчанку (SLE) или системную эритематозную волчанку, такую как кожная SLE, подострая кожная волчанка, синдром неонатальной волчанки (NLE), диссеминированную красную волчанку, волчанку (в том числе нефрит, церебрит, педиатрическая волчанка, непочечная волчанка, внепочечная волчанка, дисковидная волчанка, алопеция), ювенильный сахарный диабет (I типа), в том числе педиатрический инсулинозависимый сахарный диабет (IDDM), диабет зрелого возраста (диабет II типа), аутоиммунный диабет, идиопатический несахарный диабет, иммунный ответ, связанный с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, в том числе лимфогранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулиты, в том числе васкулит (включая васкулит больших сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит Такаясу), васкулит средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), микроскопический полиартерит, васкулит ЦНС, некротизирующий, кожный или аллергический васкулит, системный некротизирующий васкулит и ANCA-ассоциированный васкулит, например, синдром или васкулит Черджа-Стросса (CSS)), височный артериит, апластическую анемию, аутоиммунную апластическую анемию, анемию с положительным тестом Кумбса, анемию Даймонда-Блэкфана, гемолитическую анемию или иммунную гемолитическую анемию, в том числе аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, болезнь Аддисона, врожденную красноклеточную анемию или аплазию (PRCA), дефицит фактора VIII, гемофилию А, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, связанные с диапедезом лейкоцитов, воспалительные расстройства ЦНС, синдром полиорганной недостаточности на фоне септицемии, травмы или кровоизлияния, заболевания, опосредованные комплексом антиген-антитело, болезнь Гудпасчера, синдром антифосфолипидного антитела, аллергический неврит, синдром Бехчета или болезнь Бехчета, болезнь Кастлемена, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, например, буллезный пемфигоид и пемфигоид кожи, пемфигус (в том числе вульгарный пемфигус, листовидный пемфигус, пемфигус слизистых оболочек и себорейный пемфигус), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, нефрит с иммунными комплексами, антитело-опосредованный нефрит, оптиконевромиелит, полинейропатию, хроническую нейропатию, например, IgM полинейропатию или IgM-опосредованную нейропатию, тромбоцитопению (например, развивающуюся у пациентов с Инфарктом миокарда), в том числе тромботическую тромбоцитопеническую пурпуру (ТТР) и аутоиммунную или иммуно-опосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), в том числе хроническая или острая ITP, аутоиммунное заболевание яичек и яичников, в том числе аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, в том числе тироидит, например, аутоиммунный тироидит, болезнь Хашимото, хронический тироидит (тироидит Хашимото), или подострый тироидит, аутоиммунные заболевания щитовидной железы, идиопатический гипотиреоз, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, в том числе неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром скованного человека, энцефаломиелит, например, аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (EAE), миастению гравис, такую как тимома-ассоциированная миастения, мозжечковую дегенерацию, нейромиотонию, опсоклонус-миоклонус синдром (OMS) и сенсорную нейропатию, мультифокальную моторную нейропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (не в результате трансплантации), NSIP, синдром Гийена-Барре, болезнь Берже (IgA нейропатия), идиопатическую IgA нейропатию, линейный IgA дерматоз, первичный билиарный цирроз печени, цирроз легкого, аутоиммунный энтеропатический синдром, глютеновую болезнь, целиакию, целиакию-спру (глютеновую энтеропатию), рефрактерный спру, идиопатический спру, криоглобулинемию, амиотрофический боковой склероз (ALS; болезнь Лу Герига), ишемическую болезнь сердца, аутоиммунные заболевания ушей, такие как аутоиммунные заболевания внутреннего уха (AIED), аутоиммунная потеря слуха, опсоклонус-миоклонус синдром (OMS), полихондрит, например, рефрактерный или рецидивирующий полихондрит, легочный альвеолярный протеиноз, амилоидоз, склерит, нераковый лимфоцитоз, первичный лимфоцитоз, который включает моноклональный В-клеточный лимфоцитоз (например, оброкачественная моноклональная гаммапатия и моноклональная гаммапатия неясного генеза, MGUS), периферическую нейропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич, и каналопатии ЦНС, аутизм, воспалительные миопатии, фокально-сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное гепатологическое расстройство, фибромиалгию, множественную недостаточность эндокринных желез, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическую нефропатию, синдром Дресслера, очаговую алопецию, синдром CREST (кальциноз, феномен Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, смешанное заболевание соединительной ткани, болезнь Шагаса, ревматическую атаку, привычный выкидыш, аллергический альвеолит у сельскохозяйственных рабочих, полиморфную эритему, посткардиотомный синдром, синдром Кушинга, легочную аллергию птицеводов, аллергический гранулематоз и ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальное заболевание легких, трансфузионную реакцию, проказу, малярию, лейшманиоз, трипаносомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самтера, синдром Каплана, лихорадку денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный фиброз легких, интерстициальный фиброз легких, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, стойкую возвышающуюся эритему, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хронический циклит, гетерохромный циклит, иридоциклит или циклит Фукса, пурпуру Шенлейна-Геноха, инфекцию вируса иммунодефицита человека (ВИЧ), ECHO-вирусную инфекцию, кардиомиопатию, болезни Альцгеймера, парвовирусную инфекцию, инфекцию вируса краснухи, поствакцинальные синдромы, врожденную краснуху, инфекцию вируса Эпштейна-Барр, свинку, синдром Эванса, аутоиммунную гонадную дисфункцию, хорею Сиденгама, постстрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотку спинного мозга, хориоидит, гигантоклеточную полимиалгию, эндокринную офтальмопатию, хронический пневмонит гиперчувствительности, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефротический синдром, нефропатию минимальных изменений, доброкачественное семейное и ишемически-реперфузионное повреждение, аутоиммунное повреждение сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические расстройства, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактический эндофтальмит, аллергический энтерит, узловатую лепрозную эритему, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматоидную лихорадку, болезнь Хаммена-Рича, сенсоневральную тугоухость, пароксизмальную гемоглобинурию, гипогонадизм, регионарный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатическую офтальмию, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозную пиодермию, тироидит Кервена, приобретенную атрофию селезенки, бесплодие вследствие образования антител против сперматозоидов, незлокачественную тимому, витилиго, SCID и заболевания, ассоциированные с вирусом Эпштейна-Барр, синдром приобретенного иммунодефицита (СПИД), паразитарные болезни, такие как лейшманиоз, синдром токсического шока, пищевое отравление, состояния, включающие инфильтрацию Т-клеток, дефицит адгезии лейкоцитов, иммунные реакции, связанные с острой гиперчувствительностью и гиперчувствительностью замедленного типа, опосредованной цитокинами и Т-лимфоцитами, заболевания, включающие диапедез лейкоцитов, синдром полиорганной недостаточности, заболевания, опосредованные комплексом антиген-антитело, болезнь, вызванную образованием антител к гломерулярной базальной мембране, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, симпатическую офтальмию, ревматические заболевания, смешанное заболевание соединительной ткани, нефротический синдром, приобретенный инсулит, полиэндокринную недостаточность, периферическую невропатию, аутоиммунный полигландулярный синдром I типа, взрослый (приобретенный) идиопатический гипопаратиреоз (AOIH), тотальную алопецию, дилатационную кардиомиопатию, приобретенный буллезный эпидермолиз (ЕВА), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, решетчатый, лобный, верхнечелюстной или клиновидный синусит, расстройство, связанное с эозинофилами, например, эозинофилия, эозинофильный инфильтрат легкого, синдром эозинофилии-миалгии, синдром Леффлера, хроническую эозинофильную пневмонию, тропическую легочную эозинофилию, бронхопульмональный аспергиллез, аспергиллому или гранулемы, содержащие эозинофилы, анафилаксию, серонегативный спондилоартрит, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, хронический кандидоз кожи и слизистых, склеры, эписклеры, синдром Брутона, транзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдрича, атаксию-телеангиэктазию, аутоиммунные расстройства, связанные с коллагеновой болезнью, ревматизм, неврологические заболевания, ишемическое реперфузионное расстройство, снижение реакции артериального давления, сосудистую дисфункцию, ангиэктазию, повреждение ткани, сердечно-сосудистую ишемию, гипералгезию, ишемию головного мозга и болезнь, сопровождающуюся васкуляризацией, аллергические расстройства гиперчувствительности, гломерулонефрит, реперфузионные повреждения, реперфузионное повреждение миокарда или других тканей, дерматозы с острыми воспалительными компонентами, острый гнойный менингит или другие воспалительные расстройства центральной нервной системы, воспалительные расстройства глаза, синдромы, связанные с переливанием гранулоцитов, индуцированная цитокинами токсичность, острое тяжелое воспаление, хроническое неустранимое воспаление, пиелит, цирроз легкого, диабетическую ретинопатию, диабетическое поражение крупных артерий, внутриартериальную гиперплазию, язвенную болезнь желудка и двенадцатиперстной кишки, вальвулит и эндометриоз, но не ограничиваясь этим.
В дополнение к терапевтическому применению антитела по настоящему изобретению могут быть использованы для других целей, в том числе в способах диагностики, таких как способы диагностики заболеваний и состояний, описанных в настоящем документе.
XI. Дозировки, лекарственные формы и продолжительность
Белки по этому изобретению будут составлены в виде композиций, дозированы и введены в соответствии с надлежащей медицинской практикой. Факторы, подлежащие рассмотрению в этом контексте, включают конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного субъекта, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. "Терапевтически эффективное количество" белков для введения будет определено в соответствии с этими соображениями, и оно представляет собой минимальное количество, необходимое для предотвращения, облегчения или лечения конкретного расстройства (например, рака, аллергического или воспалительного расстройства или аутоиммунного расстройства). Белки необязательно могут быть составлены в виде композиций с одним или более агентами, используемыми в настоящее время для предотвращения или лечения расстройства. Эффективное количество таких других агентов зависит от количества белков, присутствующих в лекарственной форме, типа расстройства или вида лечения и других факторов, обсуждавшихся выше. Такие агенты, как правило, используют в тех же самых дозировках и вводят теми же способами, которые были описаны ранее, или в дозах, составляющих примерно от 1 до 99% от используемых ранее дозировок. Как правило, облегчение или лечение рака включает ослабление одного или нескольких симптомов или медицинских проблем, связанных с раком. Терапевтически эффективное количество лекарственного средства позволяет достичь одного из следующих показателей или их комбинации: снижения (по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или более) количества раковых клеток; уменьшения или ингибирования размера опухоли или опухолевой массы; ингибирования (т.е. уменьшения до некоторой степени и/или остановки) инфильтрации раковых клеток в периферические органы; снижения гормональной секреции в случае аденомы; уменьшения плотности сосудов; снижения метастазирования опухоли; уменьшения или ингибирования роста опухоли; и/или облегчения в некоторой степени одного или более симптомов, связанных с раком. В некоторых вариантах воплощения, белки используют для предотвращения возникновения или повторного возникновения рака или аутоиммунного расстройства у субъекта.
В одном из вариантов воплощения, настоящее изобретение может использоваться для увеличения продолжительности выживания человеческого субъекта, который предрасположен к раку или аутоиммунному расстройству, или у которого диагностирован рак или аутоиммунное расстройство. Продолжительность выживания определяется как время от момента первого введения лекарственного средства до смерти. Продолжительность выживания также может быть измерена с помощью стратифицированного отношения рисков (HR) в группе лечения по сравнению с контрольной группой, которое отражает риск смерти для субъекта во время лечения.
В еще одном варианте воплощения, лечение по настоящему изобретению значительно увеличивает частоту ответа в группе человеческих субъектов, которые предрасположены к раку, или у которых диагностирован рак, и которых лечат с использованием различных противораковых способов лечения. Частота ответа определяется как процент субъектов, подвергнутых лечению, которые ответили на лечение. В одном из аспектов комбинированное лечение по настоящему изобретению с использованием белков по настоящему изобретению и хирургического вмешательства, лучевой терапии или одного или более химиотерапевтических агентов значительно увеличивает частоту ответа у группы субъектов, получающих лечение, по сравнению с группой субъектов, которых лечат только хирургическим вмешательством, лучевой терапией или химиотерапией, при этом увеличение характеризуется p-значением по критерию хи-квадрат не более 0,005. Дополнительные измерения терапевтической эффективности при лечении рака описаны в опубликованной заявке на патент США номер 20050186208.
В некоторых вариантах воплощения, предусмотрена композиция, включающая гетеромультимерный белок, полученный в соответствии с любым способом, описанным в настоящем документе, и фармацевтически приемлемый носитель. Терапевтические лекарственные формы получают, используя стандартные способы, известные в данной области техники, смешивая активный ингредиент, имеющий нужную степень чистоты, с необязательными физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences (20th edition), ed. A. Gennaro, 2000, Lippincott, Williams & Wilkins, Philadelphia, PA). Приемлемые носители включают солевые растворы или буферы, такие как фосфатный, цитратный буфер и буферы на основе других органических кислот; антиоксиданты, в том числе аскорбиновую кислоту; низкомолекулярные (примерно менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или декстрины; хелатирующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные сурфактанты, такие как TWEEN™, PLURONICS™ или PEG.
Необязательно, но предпочтительно, лекарственная форма содержит фармацевтически приемлемые соли, предпочтительно натрия хлорид и предпочтительно примерно в физиологических концентрациях. Необязательно лекарственные формы по настоящему изобретению могут содержать фармацевтически приемлемый консервант. В некоторых вариантах воплощения, концентрации консерванта находятся в диапазоне от 0,1 до 2,0%, обычно объем/объем. Подходящие консерванты включают консерванты, известные в фармакологии. Предпочтительными консервантами являются бензиловый спирт, фенол, м-крезол, метилпарабен и пропилпарабен. Необязательно, лекарственные формы по настоящему изобретению могут включать фармацевтически приемлемый сурфактант в концентрации от 0,005 до 0,02%.
Лекарственная форма в настоящем документе может также содержать более одного активного соединения, если это необходимо для конкретного показания, подвергаемого лечению, где активные соединения, предпочтительно, имеют взаимодополняющие активности, не оказывающие отрицательного влияния друг на друга. Такие молекулы могут присутствовать в комбинации в количествах, которые эффективны для конкретного назначения.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или путем межфазной полимеризации, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, см. выше.
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие гетеромультимерный белок, где матрицы находятся в виде формованных изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США номер 3,773,919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не разлагаемые сополимеры этилен-винилацетата, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляную кислоту. Тогда как полимеры, такие как этилен-винилацетат и сополимер молочной кислоты и гликолевой кислоты, способны высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Когда инкапсулированный гетеромультимерный белок (гетеромультимерные белки) остается в организме в течение длительного времени, он может денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к потере биологической активности и возможным изменениям иммуногенности. В зависимости от задействованного механизма могут быть разработаны рациональные стратегии для стабилизации. Например, если установлено, что механизм агрегации включает образование межмолекулярной S-S связи посредством тиол-дисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги, использования соответствующих добавок и разработки матричных композиций из конкретных полимеров.
Белки, описанные в настоящем документе (например, гетеромультимерный белок, такой как мультиспецифическое антитело, созданное в соответствии со способами, описанными в настоящем документе), вводят человеческому субъекту в соответствии с известными способами, такими как внутривенное введение в виде болюсной или непрерывной инфузии в течение периода времени, внутримышечное, внутрибрюшинное, интрацереброспинальное, подкожное, интраартикулярное, внутрисуставное, интратекальное, пероральное, местное введение или путем ингаляции. Местное введение может быть особенно желательным, если с антагонизмом в отношении молекулы-мишени, распознаваемой белками, связаны тяжелые побочные эффекты или токсичность. Для терапевтических применений также может быть использована стратегия ex vivo. Стратегии ex vivo включают трансфекцию или трансдукцию клеток, полученных из субъекта, полинуклеотидом, кодирующим белок по этому изобретению. Трансфицированные или трансдуцированные клетки затем возвращают субъекту. Клетки могут быть любых типов, включая, без ограничений, гематопоэтические клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, Т-клетки или B-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки.
В одном из примеров белковый комплекс (например, гетеромультимерный белок, такой как мультиспецифическое антитело, созданное в соответствии со способами, описанными в настоящем документе) вводят локально, например, путем прямых инъекций, если это возможно в случае конкретного расстройства или расположения опухоли, и инъекции могут периодически повторяться. Белковый комплекс также можно доставлять субъекту системно или непосредственно в опухолевые клетки, например, в опухоль или ложе опухоли после хирургического иссечения опухоли, чтобы предотвратить или уменьшить местный рецидив или метастазы.
XII. Изделия
Другой вариант воплощения изобретения представляет собой изделие, содержащее один или более гетеромультимерных белков, описанных в настоящем документе, и материалы, используемые для лечения или диагностики расстройства (например, аутоиммунного заболевания или рака). Изделие включает контейнер и этикетку или вкладыш в упаковку, помещенные в контейнер или связанные с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.п. Контейнеры могут быть сделаны из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон, имеющий пробку, поддающуюся прокалыванию иглой для подкожной инъекции). По меньшей мере, один активный агент в композиции представляет собой гетеромультимерный белок (например, антитело или фрагмент антитела) по изобретению. На этикетке или вкладыше в упаковку указано, что композиция используется для лечения конкретного состояния. Этикетка или вкладыш в упаковку дополнительно могут включать инструкции для введения композиции гетеромультимерного белка субъекту. Также предусмотрены изделия и наборы, содержащие комбинации терапевтических средств, описаные в настоящем документе.
Вкладыши в упаковку относятся к инструкциям, обычно включенным в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов. В некоторых вариантах воплощения, вкладыш в упаковку указывает, что композиция может использоваться для лечения рака молочной железы, колоректального рака, рака легкого, почечно-клеточной карциномы, глиомы или рака яичников.
Дополнительно, изделие может также включать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Изделие дополнительно может включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Также предусмотрены наборы, которые используют для различных целей, например, для очистки или иммунопреципитации антигена из клеток. Набор для выделения и очистки антигена может содержать гетеромультимерный белок, присоединенный к частицам (например, гранулам сефарозы). Могут быть предусмотрены наборы, которые содержат гетеромультимерный белок (гетеромультимерные белки) для обнаружения и количественного анализа антигена in vitro, например, в ELISA или в вестерн блоттинге. Как и изделие, набор включает контейнер и этикетку или вкладыш в упаковку, закрепленные на контейнере или иным образом связанные с контейнером. Контейнер содержит композицию, содержащую, по меньшей мере, один гетеромультимерный белок (например, мультиспецифическое антитело или фрагмент антитела) по изобретению. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители и буферы или контрольные антитела. На этикетке или вкладыше в упаковку может содержаться описание композиции, а также инструкции по применению in vitro или в диагностических целях.
Изложенное выше письменное описание считается достаточным, чтобы дать возможность специалисту в данной области техники использовать изобретение. Следующие Примеры представлены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения каким-либо образом. Действительно, различные модификации изобретения в дополнение к приведенным и описанным в настоящем документе, станут очевидными для специалистов в данной области из приведенного выше описания и охватываются объемом прилагаемой формулы изобретения.
В экспериментальном описании, приведенном ниже, применяются следующие сокращения: экв. (эквиваленты); М (молярный); мкМ (микромолярный); н. (нормальный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); кг (килограммы); мкг (микрограммы); л (литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); °C (градусы по шкале Цельсия); ч (часы); мин (минуты); с (секунды); мс (миллисекунды); ADCC (антителозависимая клеточноопосредованная цитотоксичность)); BsAb (биспецифическое антитело); CL (константный домен легкой цепи); CH (константный домен тяжелой цепи); CMC (комплементопосредованная цитотоксичность); Fab (антигенсвязывающий фрагмент); Fc (кристаллизирующий фрагмент); Fv (вариабельный фрагмент (VL+VH)); EGFR (рецептор эпидермального фактора роста); НС (тяжелая цепь); IGFR (рецептор инсулиноподобного фактора роста); LC (легкая цепь); scFv (одноцепочечный вариабельный фрагмент (VL и VH, соединенные аминокислотным линкером); VEGF (фактор роста эндотелия сосудов); VEGFR2 (рецептор 2 фактора роста эндотелия сосудов); VH (вариабельный тяжелый домен); VL (вариабельный легкий домен).
ПРИМЕРЫ
Настоящее изобретение более подробно описано в следующих примерах, которые ни в коей мере не предназначены для ограничения объема заявленного изобретения. Прилагаемые Фигуры следует рассматривать как неотъемлемую часть раскрытия и описания изобретения. Все цитируемые в настоящем документе ссылки специально включены в настоящий документ посредством ссылки для всего описания настоящего документа. Следующие примеры включены только с иллюстративной целью и не предназначены для ограничения объема заявленного изобретения.
Пример 1. Молярное соотношение мономерных компонентов биспецифического антитела в комбинированной культуре клеток можно контролировать, оптимизируя соотношение клетка: клетка
Следующие примеры демонстрируют молярное соотношение полуантител с модификацией выступ и с модификацией впадина в случае, когда две линии клеток млекопитающих (клетки CHO), каждая из которых экспрессирует либо полуантитело с модификацией выступ, либо полуантитело с модификацией впадина, растят в одной и той же культуре клеток.
Процесс получения исследовали с целью определения титра (т.е, общего количества антитела, продуцируемого клетками, в том числе гетеродимера, гомодимера и мономерного полуантитела) для каждой линии клеток. Индивидуальные линии клеток пересевали каждые 3 или 4 дня в среде для системы посевных ферментеров до получения данных о титрах антител, продуцируемых индивидуальными линиями клеток.
Две линии клеток далее растили в отдельных культурах клеток и индуцировали в них экспрессию полуантител с модификацией выступ и полуантител с модификацией впадина. Индивидуальные культуры клеточных линий, продуцирующих полуантитела с модификацией выступ и полуантитела с модификацией впадина, пересевали во встряхиваемую колбу объемом 40 мл каждые 3 или 4 дня в среде для системы посевных ферментеров. В день, когда культуры должны были быть объединены, количество клеток измеряли с помощью Vicell (Beckman Coulter).
Отдельные культуры далее объединяли при определенных соотношениях клеток-хозяев, продуцирующих полуантитело с модификацией выступ, к клеткам-хозяевам, продуцирующим полуантитело с модификацией впадина. Соотношение клеток-хозяев, продуцирующих полуантитело с модификацией выступ, к клеткам-хозяевам, продуцирующим полуантитело с модификацией впадина, рассчитывали на основе известных титров антител, продуцируемых индивидуальными линиями клеток. Для каждого мелкомасштабного производства требовалось примерно 40×106 клеток. С помощью счетчика Vicell (клеток/мл) было возможно определить объем каждой клеточной линии, который необходимо было добавить к комбинированной культуре клеток для достижения желаемого соотношения клеток-хозяев, продуцирующих полуантитело с модификацией выступ, к клеткам-хозяевам, продуцирующим полуантитело с модификацией впадина. Соответствующие объемы каждой из линий клеток, продуцирующей антитела с модификацией выступ или с модификацией впадина, объединяли в новой встряхиваемой колбе с конечным объемом 40 мл в продукционной среде.
За 15 часов до сбора получали концентрированный раствор глутатиона (GSH), растворяя GSH в 1М аргинине (рН=9,0) в 400 мМ янтарной кислоте до конечной концентрации концентрированного раствора GSH 250 мМ. Концентрированный раствор GSH добавляли к продукционной культуре, чтобы конечная концентрация GSH составила 15 мМ. Далее собирали комбинированную культуральную среду и определяли % полуантител с модификацией выступ и % полуантител с модификацией впадина для каждой комбинированной культуры клеток с помощью обращенной фазы в восстанавливающих условиях. Процент ковалентного биспецифического антитела, образовавшегося в случае каждого тестируемого соотношения, определяли, как описано на Фигуре 2.
Эти эксперименты проводили со следующими парами полуантитело с модификацией выступ/полуантитело с модификацией впадина:
анти-Мишень A (выступ) / анти-Мишень B (впадина)
анти-Мишень C (выступ) / анти-Мишень D (впадина)
анти-Мишень D (выступ) / анти-Мишень C (впадина)
анти-Мишень E (выступ) / анти-Мишень F (впадина)
Результаты этих экспериментов представлены в Таблице 2 ниже:


Как показано в Таблице 2, выходы % ковалентного биспецифического антитела улучшались, когда молярное соотношение полуантитело с модификацией выступ: полуантитело с модификацией впадина составляло примерно 1:1 или значение, близкое к этому. Оптимальное молярное соотношение для образования биспецифического антитела, вероятнее всего, должно будет определяться для каждого конкретного биспецифического антитела. Соотношение клеток-хозяев, продуцирующих полуантитело с модификацией выступ, к клеткам-хозяевам, продуцирующим полуантитело с модификацией впадина, которое дает молярное соотношение полуантител с модификацией выступ и полуантител с модификацией впадина, равное 1:1, изменяется в зависимости от линии клеток и определяется экспериментальным путем.
Пример 2. Варьирование времени добавления восстановителя и концентрации восстановителя, добавляемого в процессе получения биспецифического антитела в комбинированной культуре клеток
В следующих примерах рассмотрено добавление восстановителя на разных стадиях в процессе получения биспецифического антитела, включающего анти-мишень А (выступ) и анти-мишень В (впадина). Две линии клеток млекопитающих, экспрессирующих анти-мишень А (выступ) или анти-мишень В (впадина), сначала растили в отдельных культурах клеток и индуцировали в них экспрессию полуантитела с модификацией выступ или полуантитела с модификацией впадина, эти отдельные культуры клеток далее объединяли в множество отдельных продукционных культур клеток, чтобы достичь молярного соотношения анти-Мишень А (выступ): анти-Мишень В (впадина), равного 1:1, как описано выше. Концентрированный раствор GSH добавляли к продукционным культурам за 24 часа, 15 часов или 4 часа до сбора до финальной концентрации 2 мМ, 4 мМ или 10 мМ или оставляли культуры клеток необработанными. Далее собирали комбинированную культуральную среду от каждой из продукционных культур и определяли % полуантител с модификацией выступ и % полуантител с модификацией впадина для каждой комбинированной культуры клеток с помощью обращенной фазы в восстанавливающих условиях. Процент ковалентного биспецифического антитела, образовавшегося в случае каждого тестируемого соотношения, определяли, как описано на Фигуре 2.
Как показано на Фигуре 3, выход ковалентного биспецифического антитела в продукционных культурах клеток с финальной концентрацией GSH 10 мМ был лучше по сравнению с выходом биспецифического антитела в продукционных культурах клеток с финальной концентрацией 2 мМ или 4 мМ или в необработанной контрольной группе. Как было показано, стадия производства, на которой происходит добавление GSH, не влияет на выход ковалентного биспецифического антитела.
В дальнейших экспериментах линии клеток, экспрессирующие анти-Мишень А (выступ) или анти-Мишень В (впадина) сначала растили в отдельных культурах клеток и индуцировали в них экспрессию полуантитела с модификацией выступ или полуантитела с модификацией впадина, эти отдельные культуры клеток далее объединяли в множество отдельных продукционных культур клеток, чтобы достичь молярного соотношения анти-Мишень А (выступ): анти-Мишень В (впадина), равного 0,82:1 или 1:1, как описано выше. Концентрированный раствор GSH добавляли к продукционным культурам за 15 часов или 4 часа до сбора до финальной концентрации 5 мМ или 10 мМ или оставляли культуры клеток необработанными ("0 мМ").
Жизнеспособность клеток каждой комбинированной культуры клеток определяли на стадии сбора и далее с помощью ионообменного анализа определяли % биспецифического антитела, образовавшегося при каждом тестируемом условии, как показано на Фигуре 2. Результаты экспериментов показаны в Таблице 3 ниже.
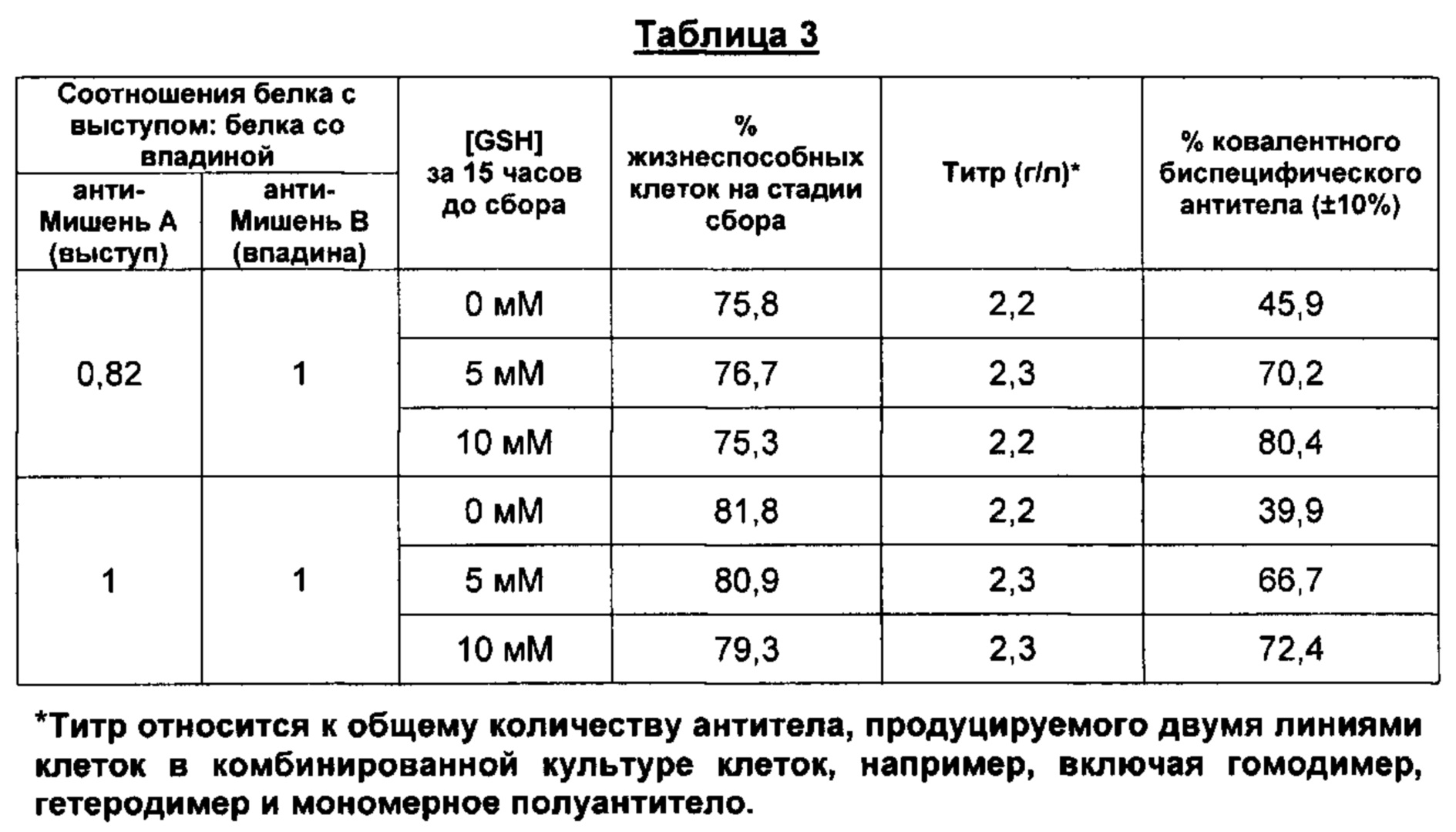
Как показано на Фигуре 3, выход ковалентного биспецифического антитела в продукционных культурах клеток с финальной концентрацией GSH 10 мМ превышал выход биспецифического антитела в продукционных культурах клеток с финальной концентрацией 5 мМ и в необработанных продукционных культурах. Было показано, что добавление GSH к комбинированной культуре клеток до финальной концнетрации 10 мМ не влияет на жизнеспособность клеток или общую продукцию антител. Нежелательное образование смешанных дисульфидов или неправильное комбинирование белков не наблюдалось при 10 мМ GSH (данные не показаны).
Аналогичные эксперименты были проведены с двумя другими линиями клеток млекопитающих, экспрессирующих либо анти-Мишень D (выступ), либо анти-Мишень С (впадина). Две линии клеток сначала растили в отдельных культурах клеток и индуцировали в них экспрессию анти-Мишень D (выступ), либо анти-Мишень С (впадина), эти отдельные культуры клеток далее объединяли в множество отдельных продукционных культур клеток, чтобы достичь молярного соотношения анти-Мишень D (выступ): анти-Мишень С (впадина), равного 0,82: 1, как описано выше. Концентрированный раствор GSH добавляли к продукционным культурам за 15 часов до сбора до финальной концентрации 10 мМ, 15 мМ или 20 мМ или оставляли культуры клеток необработанными ("0 мМ"). Жизнеспособность клеток каждой комбинированной культуры клеток определяли на стадии сбора и далее определяли % биспецифического антитела, образовавшегося при каждом тестируемом условии, как показано на Фигуре 2. Результаты этих экспериментов показаны в Таблице 4 ниже.

Как показано на Фигуре 4, выход ковалентного биспецифического антитела в продукционных культурах клеток с финальной концентрацией GSH 20 мМ превышал выход биспецифического антитела в продукционных культурах клеток с финальной концентрацией 10 мМ или 15 мМ и в необработанных продукционных культурах. Было показано, что добавление GSH к комбинированной культуре клеток до финальной концнетрации 20 мМ не влияет на титр. Тем не менее, при добавлении GSH к продукционным культурам до финальной концентрации 20 мМ наблюдались ковалентные модификации полуантитела GSH (данные не показаны).
Пример 3. Выход биспецифического антитела, образовавшегося в комбинированной культуральной среде, по сравнению со сборкой in vitro Были проведены дополнительные эксперименты с использованием анти-Мишень Е (выступ) и анти-Мишень F (впадина), чтобы сравнить выход биспецифического антитела, полученного в комбинированной культуре клеток-хозяев млекопитающих (например, клетки СНО), экспрессирующих анти-Мишень Е, и клеток-хозяев млекопитающих (например, клетки СНО), экспрессирующих анти-Мишень F, с выходом биспецифического антитела, полученного путем комбинирования очищенного анти-Мишень Е (выступ) и очищенного анти-Мишень F (впадина) in vitro с использованием колонки с белком А. Кратко, две линии клеток млекопитающих, экспрессирующих анти-мишень Е (выступ) или анти-мишень F (впадина), сначала растили в отдельных культурах клеток и индуцировали в них экспрессию полуантитела с модификацией выступ или полуантитела с модификацией впадина. Эти отдельные культуры далее комбинировали и растили в течение дополнительного периода времени. Комбинированную культуральную среду собирали и % образовавшегося биспецифического антитела далее определяли с помощью катионообменного анализа, как показано на Фигуре 2. Параллельно биспецифическое антитело получали комбинацией очищенного анти-Мишень Е (выступ) и анти-Мишень F (впадина) in vitro (смотрите, например, WO 2013/055958). Сравнивали конечный выход биспецифического антитела, образовавшегося в обоих условиях (данные не показаны).
Пример 4. Продукция биспецифического антитела
Проводили дополнительные эксперименты с использованием анти-Мишень G (выступ) и анти-Мишень Н (впадина), чтобы протестировать, можно ли получить биспецифическое антитело анти-Мишень G/анти-Мишень Н из препарата очищенного полуантитела анти-Мишень G, содержащего гомодимер анти-Мишень G/ анти-Мишень G, и из препарата очищенного полуантитела анти-Мишень Н, содержащего гомодимер анти-Мишень Н/ анти-Мишень Н. Отдельные культуры клеток-хозяев млекопитающих (например, клетки СНО), временно экспрессирующих полуантитело анти-Мишень G (выступ), и клеток-хозяев млекопитающих (например, клетки СНО), временно экспрессирующих полуантитело анти-Мишень Н (впадина), растили и собирали, как описано выше.
Каждое полуантитело собирали на 5 мл колонке с белком A MabSURE SELECT. Колонку далее промывали 10 объемами колонки (CV) следующих буферов: уравновешивающий буфер, содержащий 50 мМ ТРИС, pH 8,0, 150 мМ NaCl, 0,05% Triton Х-100, 0,05% Triton Х-114; промывочный буфер, содержащий 25 мМ цитрат натрия, pH 6,0. Каждое плечо элюировали в 0,15 М ацетате натрия, pH 2,7. Идентификацию каждого полуантитела проводили с помощью МС.
В случае биспецифического антитела каждое полуантитело независимо титровали до pH 5,0, используя 1:10 1М ТРИС аргинин с pH 9,0, и далее объединяли вместе в соотношении 1:1. Смесь далее титровали до pH 8,5, используя 1:10 1М ТРИС аргинин с pH 9,0, и оставляли при комнатной температуре на 3 дня, после чего добавляли избыток свежеприготовленного 0,5 М восстановленного L-глутатиона (Sigma Aldrich) в молярном соотношении 1:200. Реакцию образования биспецифического антитела контролировали с помощью МС.
Выделенные пулы полуантител с модификацией выступ и антител с модификацией впадина разделяли при помощи 4-20% Трис-глицин SDS PAGE, выявляя наличие полос, соответствующих молекулярному весу полуантитела и гомодимера в каждом выделенном пуле. Смотрите Фигуру 4. Кроме того, после выделения на MabSURE SELECT 0,5 мг каждого полуантитела наносили на колонку для разделения по гидрофобности (2,1×100 мм). Подвижный буфер представлял собой 25 мМ калия фосфат, 1М аммония сульфат, pH 6,5, и элюирующий буфер представлял собой 25 мМ калия фосфат, pH 6,5, с 25% изопропанола. Хроматограммы отражали гетерогенность, которую также наблюдали на геле, и дополнительно выявили различия во времени удержания основого пика. Смотрите Фигуры 5А и 5В, на которых приведены хроматограммы для анти-Мишень G (выступ) и анти-Мишень H (впадина), соответственно. Количества гомодимера и полуантитела в выделенных пулах могут варьировать в зависимости от конкретных антител.
После обработки глутатионом биспецифическое антитело наносили на колонку для разделения по гидрофобности. На хроматограмме был выявлен единственный основной пик (>90%), время удержания которого попадает в диапазон между временем удержания каждого полуантитела. Смотрите Фигуру 6. С помощью МС подтвердили, что основной пик соответствует биспецифическому антителу. Эти результаты свидетельствуют о том, что в выделенных пулах полуантител присутствует ковалентный гомодимер, и гомодимер может быть разрушен, если использовать условия сборки, указанные выше, и доступен для образования биспецифического антитела.
Условия сборки биспецифического антитела далее исследовали, сравнивая сборку анти-мишень А (выступ) и анти-мишень В (впадина) в комбинированной культуральной среде в отсутствии GSH и в присутствии 10 мМ GSH.
Клетки CHO трансфицировали с использованием Lipofectamine 2000 в соответствии с рекомендациями производителя (Invitrogen, Carlsbad, СА). Трансфицированные клетки отбирали при различных концентрациях MSX (метионина сульфоксимин, 25 и 50 мкМ). Для оценки продукции антител собранными колониями собирали супернатант от колоний и анализировали его с помощью ELISA. Для получения стабильного пула на основе титров по данным ELISA объединяли и далее растили лучшие 48 клонов. Индивидуальные клоны также растили для оценки продукции антител с целью определения лучших клонов.
Далее использовали 40 л культуры клеток и клетки высевали при 1,2×106 клеток/мл в 2,8 л культуральной среды. Культуру клеток регулярно разделяли и перемешивали при 90 об/мин и поддерживали при pH 7,0±0,03 и 30% растворенного кислорода (dO2). 15 мМ GSH добавляли на 11 день и на 12 день собирали клетки.
Необработанную и обработанную GSH бесклеточную культуральную среду обрабатывали с помощью MabSURE SELECT и выделенные пулы анализировали, используя ESI-TOF. Смотрите Фигуру 7А. На Фигуре 7В показано увеличенное изображение диапазона m/z для пика биспецифического антитела (правый пик, как показано на 7А). На Фигуре 7С показано увеличенное изображение диапазона m/z для пика полуантитела (левый пик, как показано на 7А).
Фигуры 7А-С демонстрируют, что пики гомодимера и полуантитела заметно снижаются в результате добавления 10 мМ GSH в культуру клеток, что свидетельствует о том, что образование биспецифического антитела зависит как от содержания полуантитела, так и от содержания гомодимера, присутствующих в совместной культуре. Степень, в которой каждый гомодимер участвует в образовании биспецифического антитела, зависит от конкретного полуантитела.
Специалистам в данной области техники должно быть понятно, что в пределах объема и сущности настоящего изобретения возможны некоторые варианты воплощения. Изобретение описано более подробно со ссылкой на не ограничивающие примеры. Примеры дополнительно иллюстрируют изобретение, но, конечно, их не следует рассматривать как каким-либо образом ограничивающие его объем.
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ получения гетеромультимерного белка, включающего первый полипептид, содержащий шарнирный участок, имеющий первый домен гетеродимеризации, где первый полипептид, содержащий шарнирный участок, связан с первой легкой цепью, и второй полипептид, содержащий шарнирный участок, имеющий второй домен гетеродимеризации, где второй полипептид, содержащий шарнирный участок, связан со второй легкой цепью, где второй домен гетеродимеризации взаимодействует с первым доменом гетеродимеризации на поверхности взаимодействия, и где первый и второй полипептиды, содержащие шарнирный участок, соединены, по меньшей мере, одной межцепьевой дисульфидной связью (варианты). В одном из вариантов реализации способ включает стадии культивирования клеток-хозяев, способных экспрессировать первый и второй полипептиды, и получение комбинированной культуральной среды для первой клетки-хозяина и второй клетки-хозяина без разрушения клеточной мембраны клеток-хозяев, где комбинированная культуральная среда включает гетеромультимерный белок. Изобретение расширяет арсенал методов получения гетеромультимерных белков. 3 н. и 51 з.п. ф-лы, 10 ил., 4 пр., 4 табл.
Формула
Документы, цитированные в отчёте о поиске
Получение гетеромультимерных белков

Комментарии