Способ получения средства, обладающего седативной, противосудорожной и нейромодуляторной антиалкогольной активностью - RU2613312C2
Код документа: RU2613312C2
Чертежи


Описание
Область техники, к которой относится изобретение
Изобретение относится к области фармации и заключается в способе получения лекарственного средства из растительного сырья, обладающего седативной, противосудорожной активностью и снижающего нейротоксическое действие алкоголя.
Уровень техники
Актуальной проблемой современной фармацевтической науки является поиск новых эффективных средств для лечения заболеваний нервной системы, обладающих способностью устранять тревогу, страх, беспокойство, напряжение, повышенную раздражительность, бессонницу и другие проявления невротических, неврозоподобных, психопатических состояний, вегетативных дисфункций, а также различных судорожных состояний, которые являются тяжелыми и широко распространенными заболеваниями. Судорожные состояния могут возникать при разных заболеваниях и интоксикациях. К ним относятся энцефалиты, менингиты, травмы черепа и мозга, опухоли, нарушения мозгового кровообращения, нарушения функции желез внутренней секреции и связанные с ними нарушения обмена веществ.
Практически все современные препараты вызывают побочные действия и осложнения, кроме того, при длительном применении возможно возникновение лекарственной зависимости [7].
Интерес вызывают препараты растительного происхождения, содержащие комплекс биологически активных веществ, имеющие большую терапевтическую широту в сравнении с существующими, обладающие уникальным сочетанием свойств. Спектр фармакологической активности новых средств для лечения заболеваний нервной системы должен включать такие виды действия, как противосудорожное, седативное, нейромодуляторное. Поиск ведется с целью снизить побочные эффекты и токсичность, а также расширить область применения лекарственных средств.
Лекарственные средства растительного происхождения обладают рядом преимуществ по сравнению с синтетическими - малой токсичностью, мягкостью действия, поэтому актуальным является изучение растений, обладающих указанными выше видами биологической активности.
Среди дикорастущих растений, влияющих на нервную систему, выделяют виды рода Melampyrum L. Марьянник лесной широко распространен на территории России и имеет достаточную сырьевую базу [1]. Надземная часть растения издавна применяется в народной медицине. Из нее готовят водные извлечения (настои, отвары), которые в малых дозах назначают в качестве эффективных средств при заболеваниях сердца [6], однако они содержат низкое количество биологически активных веществ (Табл. 1). В настоящее время проводится ряд научных исследований о возможности использования марьянника и препаратов из него в научной медицине [4, 5].

Фитохимический анализ надземной части с корнями марьянника лесного позволил установить наличие в ней таких биологически активных веществ, как флавоноиды (цинарозид, гиперозид, гликозиды кверцетина), иридоиды (аукубин), фенолкарбоновые кислоты (хлорогеновая кислота), алкалоиды, аминокислоты [2], которые принимают участие в комплексном фармакологическом действии.
Из способов получения комплексных природных продуктов, оказывающих седативное действие, известен способ получения экстракта валерианы (патент РФ №2098115). Способ получения включает экстракцию надземной части растения (65-75) % этанолом, отстаивание в холодильной камере, разделение фаз декантацией и фильтрацией, упаривание и сушку.
Этот способ целесообразно использовать в качестве прототипа вследствие наличия общих этапов получения и схожести фармакологического действия конечного продукта.
Прототип имеет ряд недостатков:
- трудоемкость и длительность способа получения;
- использование в качестве экстрагента (65-75) % этанола;
- высокие концентрации этанола извлекают из растительного сырья большое количество липофильных веществ (хлорофиллы, каротиноиды, смолы).
Вследствие этого требуется стадия разделения образовавшихся гидрофильной и липофильной фаз - отстаивание в течение 5 ч при температуре 10°C и очистка полученного извлечения путем декантации и последующей фильтрации.
В свою очередь это приводит к потере части биологически активных компонентов и снижению качества биологических свойств целевого продукта.
Также недостатком является отсутствие у препарата нейромодуляторной антиалкогольной активности.
Раскрытие изобретения
Цель изобретения - получение препарата, содержащего комплекс природных соединений, обладающий седативной и противосудорожной активностью, а также расширение арсенала средств, используемых для лечения заболеваний нервной системы. Способ обладает простотой, доступностью и возможностями экстрагента извлекать определенный комплекс биологически активных веществ (БАВ), отсутствием стадий с использованием токсичных веществ, а также достаточной сырьевой базой.
Влияние экстрагента
Существенное влияние на концентрацию действующих веществ и фармакологическую активность конечного продукта оказывает экстрагент, а также соотношение сырья и экстрагента. При подборе оптимального экстрагента было исследовано количественное содержание основных групп действующих веществ в водном извлечении из травы м. лесного, в настое, спиртовом экстракте. Максимальная сумма экстрактивных веществ наблюдалась в сухом спиртовом экстракте. Подбор оптимального соотношения проводили путем определения содержания основных групп биологически активных веществ при следующих соотношениях сырья и экстрагента в сухом спиртовом экстракте 1:1 и 1:2. Максимальная концентрация соединений наблюдались при соотношении 1:2.
Источник препарата - трава (надземная часть с корнями) марьянника лесного (Herba melampyri), заготовленная в фазу цветения.
Сущность изобретения
Траву марьянника измельчают до размера частиц (1-3) мм, экстрагируют методом реперколяции с равной загрузкой сырья с законченным циклом в батарее из четырех перколяторов в соотношении сырье:экстрагент - 1:2. В качестве экстрагента используют 50% этанол. Время настаивания 6 ч. Объединенные извлечения отстаивают, фильтруют, декантируют и упаривают в ротационном вакуумном испарителе при температуре 50°C до получения сухого остатка.
Пример: 500 г воздушно-сухой надземной части с корнями марьянника лесного измельчают до размера частиц диаметром 2 мм, загружают в четыре перколятора в равном количестве. В первый день растительное сырье в перколяторе №1 заливают экстрагентом - 50% этанолом до «зеркала» и настаивают в течение 6 ч. По истечении 6 ч заливают перколятор №2 извлечением, полученным в перколяторе №1, а в первый перколятор заливают свежий экстрагент до «зеркала». Через 6 ч загружают перколятор №3 вытяжкой из перколятора №2, а перколятор №2 - вытяжкой из перколятора №1. Через 6 ч заполняют перколятор №4 извлечением из перколятора №3, перколятор №3 - извлечением из перколятора №2, а перколятор №2 - вытяжкой из перколятора №1. Через 6 ч из перколятора №4 получают первый слив готового продукта, извлечение из перколятора №3 заливают в перколятор №4, из перколятора №2 - в перколятор №3, а из перколятора №1 - в перколятор №2; сырье из перколятора №1 отжимают, сам перколятор отключают от батареи. Через следующие 6 часов из перколятора №4 получают вторую часть готового продукта. Вытяжку из перколятора №3 заливают в перколятор №4, а из перколятора №2 - в перколятор №3, перколятор №2 отключают от батареи, сырье в нем отжимают. Через 6 часов сливают третью порцию экстракта из четвертого перколятора, жидкость из третьего перколятора переливают в перколятор №4, а перколятор №3 отключают от батареи, сырье из третьего перколятора отжимают. Через 6 часов получают последнюю порцию экстракта, сырье из четвертого перколятора отжимают. Четыре порции готового продукта объединяют. Объем полученного экстракта превышает массу сырья в два раза. Далее объединенные извлечения упаривают в вакууме при температуре реакционной массы (50±2)°C и давлении 0,01 кгс/см2 (9,81 гПа) до получения сухого остатка. Выход экстракта составляет 12% от массы сырья.
Сухой экстракт представляет собой гигроскопическую массу темно-коричневого цвета с характерным специфическим запахом, горьким вкусом, растворим в воде. Содержание флавоноидов (11.74±0,14) %, влаги (6.67±0.012) %. Срок годности экстракта 3 года.
Параметры стандартизации конечного продукта
Содержание влаги определяли по методике ГФ XI [3].
Подлинность препарата подтверждается качественными реакциями, хроматографическими пробами и УФ-спектральными характеристиками.
1. Реакции подлинности на содержание биологически активных веществ марьянника лесного:
а) Флавоноиды
К 1 мл 10% водного раствора экстракта добавляют 10 мг кристаллического магния и 5 капель кислоты хлористоводородной концентрированной, нагревают на кипящей водяной бане 3 мин, появляется красно-коричневое окрашивание (проба Синода);
б) Иридоиды
К 1 мл 10% водного раствора экстракта добавляют 0.5 мл реактива Тримм-Хилла (2 мл конц. HCl, 10 мл 0.2% водного раствора CuSO4, ледяной уксусной кислоты до 100 мл), 2.5 мл 50% уксусной кислоты, нагревают на кипящей водяной бане в течение 10 мин, появляется синее окрашивание;
в) Фенолкарбоновые кислоты
К 1 мл 10% водного раствора экстракта добавляют 5 капель квасцов железоаммониевых, нагревают на кипящей водяной бане в течение 5 мин, появляется осадок черного цвета;
г) Алкалоиды
К 1 капле 10% водного раствора экстракта добавляют 2 капли кислоты хлористоводородной и 2 капли Реактив Бушарда (раствор 1,27 г йода и 2 г калия йодида в 100 мл воды), появляется бурый, труднорастворимый в воде осадок;
д) Кумарины
К 1 мл 10% водного раствора экстракта прибавляют 5-10 капель 10% спиртового раствора NaOH и нагревают на водяной бане несколько минут. При наличии кумаринов раствор желтеет. К содержимому пробирки добавляют (5-10) мл дистиллированной воды и перемешивают. После прибавления 5-10 капель 10% хлористоводородной кислоты наблюдается помутнение или, реже, выпадение осадка (лактонная проба).
Результаты качественных реакций, проведенных с экстрактом марьянника лесного, приведены в таблице 2.

2. Хроматографическая характеристика флавоноидов
На лист хроматографической бумаги марки «Ленинградская - С» размером (30×40) см наносят 0,1 мл экстракта и хроматографируют в стеклянной камере восходящим методом в системе растворителей изопропанол - муравьиная кислота - вода (2:5:6) в течение в течение 4 часов. Хроматограмму вынимают из камеры, высушивают, поворачивают на 90° таким образом, чтобы флавоноиды, распределившиеся в первом направлении, были внизу, помещают в систему растворителей бутанол - кислота уксусная - вода (4:1:2), где выдерживают в течение 8 ч (второе направление). По истечение времени хроматограмму вынимают из камеры, высушивают и просматривают в УФ-свете до и после обработки парами аммиака, а также обрабатывают хромогенным реактивом - 1% спиртовым раствором алюминия хлорида. Результаты хроматографического анализа представлены в таблице 3.

На основании люминисцентно-хроматографических свойств и реакций с хромогенными реактивами установлено, что в экстракте марьянника лесного содержится 5 веществ флавоноидной природы. Значение коэффициентов распределения (Rf) этих веществ служит показателем подлинности препарата.
3. УФ-спектральная характеристика
УФ-спектры экстракта в разведении 1:50 представлены в таблице 4. Как следует из полученных данных, в УФ-спектре экстракта марьянника лесного четко выражен один максимум поглощения при 335 нм. При добавлении хромогенного реактива (AlCl3) кроме указанного (335 нм), отмечается появление двух максимумов - в коротковолновой (275 нм) и длинноволновой (396 нм) области спектра, интенсивность поглощения в максимуме при 335 нм незначительно снижается при добавлении хлористого алюминия. Изменения в УФ-спектре подтверждают наличие флавоноидов в препарате и участие их в реакциях комплексообразования.

В дифференциальном спектре также отмечено наличие максимума поглощения в длинноволновой области спектра (396 нм), свободной от поглощения простых фенольных соединений (простых фенолов, гидроксикоричных кислот, кумаринов и др.). Данный максимум может использоваться как для подтверждения подлинности, так и для разработки метода количественного определения флавоноидов в экстракте.
4. Количественное определение флавоноидов
В мерную колбу вместимостью 25 мл помещают 0,5 г препарата (точная навеска), доводят до метки водой очищенной (раствор А). 1 мл раствора А помещают в мерную колбу на 100 мл, добавляют 3 мл 2% раствора алюминия хлорида, доводят объем раствора до метки водой очищенной и перемешивают (раствор Б). Выдерживают 30 минут и измеряют оптическую плотность раствора Б на спектрофотометре СФ-2000 в кювете с толщиной слоя 10 мм при длине волны 396 нм. В качестве раствора сравнения используют следующий раствор: 1 мл раствора А помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой очищенной до метки. Массовую долю суммы флавоноидов в экстракте марьянника в пересчете на цинарозид и абсолютно сухое сырье X, %, вычисляют по формуле:

где D - оптическая плотность исследуемого раствора;
- удельный показатель поглощения комплекса цинарозида с хлоридом алюминия при λ396=387;
a - точная навеска экстракта, г;
W - влажность экстракта, %.
Содержание флавоноидов в экстракте составляет 11,74%.
5. Количественное определение иридоидов
В мерную колбу на 25 мл помещают 0,1 г (точная навеска) экстракта, доводят водой очищенной до метки, перемешивают (раствор А). К 1 мл раствор А добавляют 2,5 мл 50% уксусной кислоты, 0,5 мл реактива Тримм-Хилла, нагревают 15 мин (раствор Б). Измеряют оптическую плотность на КФК-2М при длине волны 590 нм (желтый светофильтр).
Раствор сравнения: К 1 мл воды очищенной добавляют 2,5 мл 50% уксусной кислоты, 0,5 мл реактива Тримм-Хилла, нагревают 15 мин. Охлаждают.
Содержание суммы иридоидов в экстракте м. лесного в пересчете на аукубин и абсолютно сухое сырье X, %, вычисляют по формуле:

где С - содержание суммы иридоидов в пересчете на аукубин, найденное по графику (Фиг. 1), мкг/мл;
25 - объем раствора А, мл;
а - точная навеска экстракта, г;
W - потеря в массе при высушивании экстракта, %.
На калибровочном графике (Фиг. 1) показана зависимость оптической плотности раствора от концентрации аукубина. Концентрация аукубина по графику дана в мкг/мл, перевод в граммы учтен в формуле.
Фармакологические испытания
Острую токсичность экстракта определяли в соответствии с базовым документом «Методические рекомендации по изучению общетоксического действия ЛС» [8], при пероральном введении на нелинейных белых мышах массой (17-25) г. Экстракт М. sylvaticum вводили в дозе 5000 мг/кг. Летальность в экспериментальной группе животных отсутствовала. ЛД50 выявить не удалось. Дальнейшее увеличение дозы экстракта нецелесообразно в связи с отсутствием токсичности в дозе 5000 мг/кг и со сложностью введения большего количества экстракта.
Испытание на седативную активность
Эксперименты выполнены на 40 нелинейных мышах обоего пола массой (20-25) г. Животные содержались на стандартном пищевом рационе вивария в соответствии с «Правилами проведения работ с использованием экспериментальных животных» и требованиями Фармкомитета РФ к проведению доклинических испытаний. Опыты на животных выполнены в соответствии с Европейской конвенцией по защите и использованию позвоночных животных для экспериментальных и других целей EST №123 (1986 г.), ст. 37 и ст. 40 Федерального закона «О лекарственных средствах» (1998 г.), «Правилами лабораторной практики в Российской Федерации» (2003 г.). Животные содержались в контролируемых условиях окружающей среды при температуре воздуха (18-26)°C, влажности не более 50%, объеме воздухообмена (вытяжка:приток) как 8:10. В комнате поддерживался 12-часовой цикл освещения. Животные находились в стандартных пластиковых клетках, в качестве подстила использовалась резаная автоклавированная бумага. Регулярно проводилась рутинная проверка подстила на микробиологические загрязнения. Животные адаптировались в лаборатории в течение 10 суток до начала введения исследуемых веществ.
За пять дней до начала эксперимента регистрировали исходные характеристики поведения мышей, после чего животные были разделены на 4 группы. Животные распределялись по группам рандомизированно. В качестве критерия принималась масса тела таким образом, чтобы ее индивидуальное значение не отклонялось от среднего значения в пределах одного пола более чем на 10%. Измерение поведенческих показателей в каждой из четырех групп животных проводили до начала эксперимента (контроль) и далее через 10, 20 и 30 суток после введения препаратов.
Седативную активность оценивали в тесте «Открытое поле». Исследование проводили в специальной камере диаметром 34 см и высотой 17 см, дно которой разбитой на окружности и сектора площадью 9 см2. На Фиг. 2 приведена схема установки.
Экстракт вводили перорально в виде водного раствора в дозе 200 мг/кг. В качестве контроля животным вводили воду очищенную стерильную в дозе 1 мл/кг. В качестве препарата сравнения была использована настойка корневищ с корнями валерианы лекарственной (ФС 42-3865-99) в дозе 0.5 мл/кг. Перед введением настойку упаривали до 1/3 объема для удаления спирта и доводили водой до первоначального объема. Выбранный препарат сравнения и описанный выше способ его подготовки позволяет избежать в эксперименте образования нерастворимого в воде осадка, что обеспечивает максимальную биологическую доступность комплекса БАВ. Тестирование подопытных животных проводили до начала эксперимента, затем через каждые десять дней в течение месяца.
Оценивали влияние экстракта на горизонтальную активность (число выходов животного в центр площадки и переходов по секторам), вертикальную активность (по числу вставаний мышей на задние лапки с упором на стенку поля и на весу), груминг (короткий и длительный). Статистическую обработку данных фармакологического эксперимента проводили по t-критерию Стьюдента, эффект считали достоверным при Р≤0.05.
Уже при однократном применении экстракта марьянника лесного через 30 минут после перорального введения было отмечено изменение двигательной активности, сопоставимое с действием валерианы (Табл. 5.). При длительном применении экстракта марьянника происходит достоверное снижение вертикальной активности (Фиг. 3, Табл. 5). Уменьшение числа «вертикальных стоек» свидетельствует о наличии у экстракта марьянника седативного действия. Достоверно снижается и горизонтальная активность по периферии, а также число выходов животных в центр площадки, что говорит об угнетении ориентировочно-исследовательского поведения. Уже после десятидневного приема экстракта увеличивается короткий и длительный груминг, что является показателем комфортного поведения для данной группы животных (Фиг. 3, Табл. 5).

Испытание на активность в нейронной культуре гиппокампа
Исследование влияния экстракта на спонтанную активность нейронов проводили в диссоциированной культуре гиппокампа, достигшей 3-недельного возраста in vitro. При изготовлении, инкубации и содержании культуры следовали протоколу, подробно описанному в [9]. В возрасте 3 недель, на стекле формируется достаточно плотная функциональная сеть нейронов, образующих возбудительные и тормозные синапсы, которые формируют весь комплекс рецепторов и нейромериаторов. Функциональные и морфологические параметры работы синапсов гиппокампа в культуре близки к таковым в составе интактного мозга животного [13].
Для исследования применяли метод динамической визуализации внутриклеточного кальция, позволяющий оценить спонтанную активность в нейронных сетях исследуемой культуры и выявить любые вариации и отклонения в ее паттерне. Исследование проводили на основе метода лазерной конфокальной микроскопии, подробно описанного в [9].
Вначале производилась запись фоновой спонтанной активности, проверялась ее частота и устойчивость. После установления этих параметров нейронная культура омывалась раствором, содержащим различные концентрации спиртового экстракта марьянника из концентрированного маточного раствора. Использовались разведения спиртового экстракта марьянника на 1 мл омывающего раствора, приведенные в таблице 6.

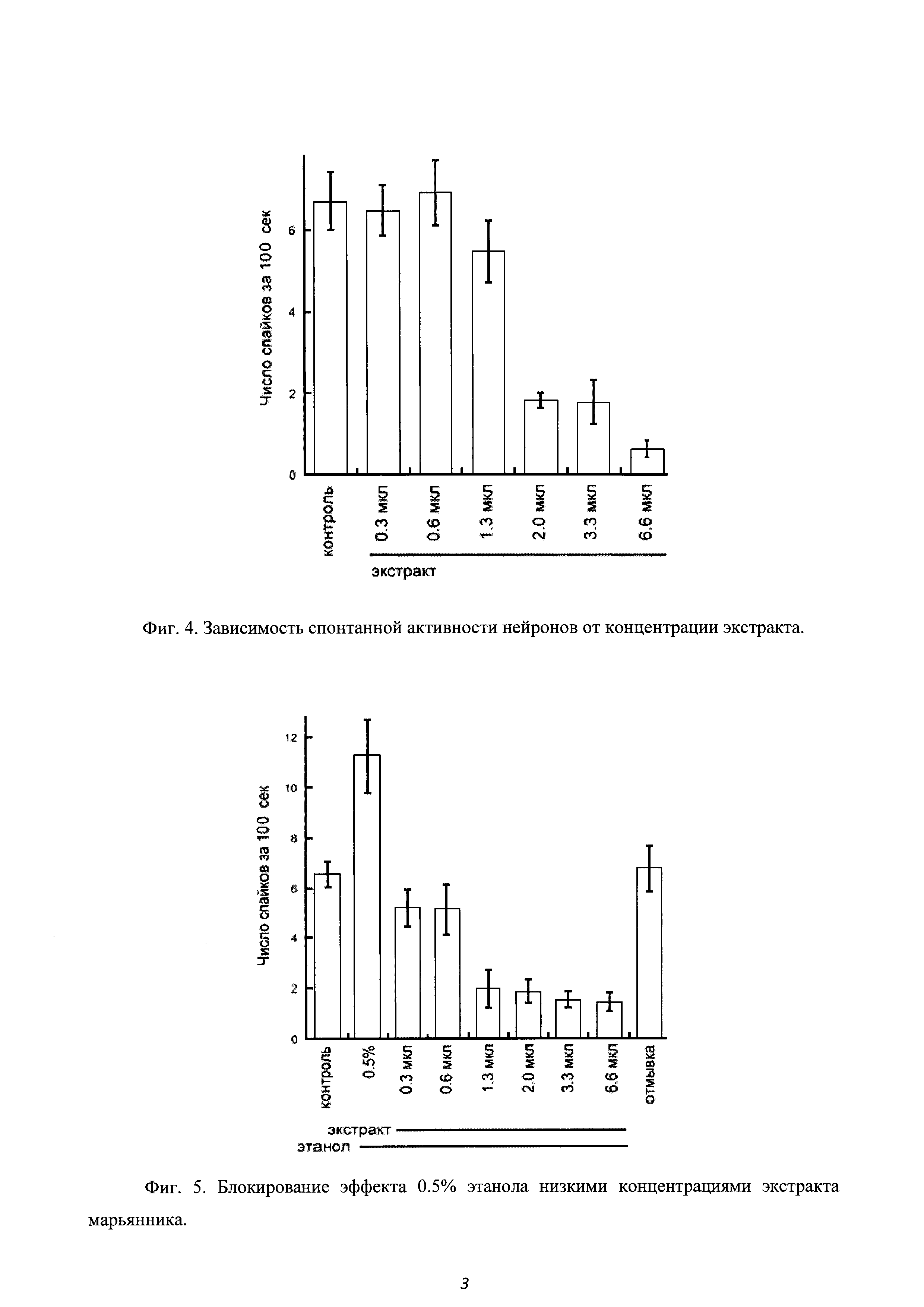
В 6 экспериментах, на 35 клетках было установлено, что при добавлении 0.3, 0.6 и 1.3 мкл водного раствора экстракта не наблюдалось статистически значимого отличия спайковой активности за 100 с от уровня контроля.
При 2, 3.3 и особенно 6.6 мкл экстракта обнаруживалось очень существенное, более чем троекратное, снижение числа спайков за 100 сек (Р<0.0001) (Фиг. 4). Данные эксперимента указывают на значительное снижение спайковой активность нейронов гиппокампа уже при 0.07 мг/мл сухого экстракта.
Испытание на противосудорожную активность
Определение противосудорожной активности проводили на нелинейных белых мышах обоего пола, массой (17-25) г [7]. Судороги вызывали внутрибрюшинным введением коразола в дозе 120 мг/кг в виде 1% водного раствора. От данной дозы у всех животных возникают тонико-клонические судороги с латентным временем (0.80±0.02) мин и смерть 100% животных в фазу тонической экстензии. Экстракт вводили перорально в виде водного раствора за 30 мин до инъекции коразола. О противосудорожном действии судили по предупреждению тонической фазы судорог. Статистическую обработку данных фармакологического эксперимента проводили по критерию Стьюдента, эффект считали достоверным при Р≤0.05 [3]. Результаты приведены в таблице 7.
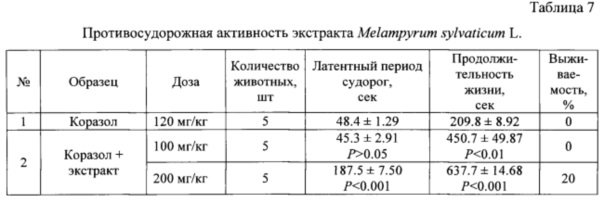
Данные таблицы показывают, что экстракт в дозе 100 мг/кг не влияет на латентный период судорог, но достоверно увеличивает продолжительность жизни. В дозе 200 мг/кг существенно увеличивается латентный период и продолжительность жизни, а выживаемость животных составляет 20%.
Испытание на нейромодуляторную антиалкогольную активность
В результате исследования действия алкоголя на нейрональную культуру [9] было установлено, что физиологические дозы алкоголя повышают спонтанную активность клеток гиппокампа, тем самым нарушая его нормальную работу. Данные нарушения влияют на когнитивные функции мозга, зависящие от гиппокампа, такие как: оперативная память, ориентация в пространстве, пространственное обучение и другие [10, 11]. В силу этого исследования на крестообразном лабиринте, при прохождении которого особую роль играет именно нормальное функционирование гиппокампа [12], являются адекватным тестом для изучения антиалкогольного эффекта спиртового экстракта марьянника.
Определение антиалкогольной активности проводили на нелинейных белых мышах обоего пола, массой (17-25) г, в тесте крестообразного лабиринта.
Изучение влияния физиологических доз алкоголя in vivo (соответствующие концентрации в крови в пределах 0.01%-0.50%) проводили при внутрибрюшинном введении 20% этилового спирта [7]. Контрольной группе животных вводили внутрибрюшинно 0,9% раствор натрия хлорида.
У алкоголизированных животных в тесте крестообразного лабиринта было отмечено сокращение латентного периода, общего времени в лабиринте и времени полного обхода в сравнении с контролем, что подтверждает установленное в опытах в культуре повышение активности [9]. Кроме того, наблюдалась четко выраженная стереотипичность поведения и асимметрия локомоции в сравнении с контрольной группой животных (Табл. 8).

Влияние указанных доз алкоголя изучали на фоне действия экстракта м. лесного. Экстракт вводили перорально в виде водного раствора за 30 мин до инъекции этилового спирта. У животных наблюдалось увеличение общего времени в лабиринте в сравнении с алкоголизированными животными, времени, затраченного животными на совершение полного обхода, а также снижение стереотипичности поведения и асимметрии локомоции, что свидетельствует о предотвращении возникновения спонтанной активности нервных клеток, вызываемой действием алкоголя.
Испытание на антиалкогольную активность в нейронной культуре
Физиологические концентрации алкоголя (0.1-0.5) % вызывают существенное повышение уровня спонтанной активности в культуре нейронов гиппокампа [9]. Функционально эти изменения коррелируют с такими нарушениями in vivo как координация движений, гиперреактивность, эйфория, пониженная сосредоточенность и общее уменьшение тормозных функций мозга [14, 15]. В экспериментах исследована активность экстракта марьянника на фоне воздействия 0,5%, т.е. физиологической концентрации алкоголя.
На фоне воздействия алкоголя повышался уровень регистрируемой спонтанной активности культивируемых нейронов гиппокампа, о чем судили на основе динамической флуоресцентной визуализации внутриклеточного кальция. На фоне повышенной активности нейронных сетей, методом перфузии подавались различные концентрации экстракта марьянника (см. Табл. 8). Уже при концентрациях 0.3 и 0.6 мкл (что соответствует 0.01-0.02 мг сухого экстракта) наблюдалось существенное снижение активности нейронов, показанное на гистограмме Фиг. 5 (Р<0.01). Дальнейшее повышение концентрации приводило к еще большему подавлению спонтанной активности в нейронных сетях. Следует отметить, что при отмывке исходный уровень спонтанной активности полностью восстанавливался (4 эксперимента, 36 клеток).
Регистрируемый эффект указывает на наличие выраженного антиалкогольного влияния низких концентраций марьянника на спонтанную активность культивируемых нейронов гиппокампа мыши, еще до наступления тормозного (седативного) эффекта. Дальнейшее повышение концентрации марьянника приводит к существенному снижению спонтанной активности (Фиг. 5, правые столбики), как это было показано на Фиг. 4.
Экспериментально доказано, что экстракт травы марьянника обладает выраженной седативной, противосудорожной и нейромодуляторной антиалкогольной активностью.
Предлагаемый способ позволяет получить препарат с высоким содержанием действующих веществ, низкой токсичностью и выраженной биологической активностью, а также контролировать стадии технологического процесса и стандартизовать готовый продукт, удобный для хранения и транспортировки. Перечисленные преимущества подтверждают перспективность внедрения данного изобретения в фармацевтическую промышленность, что позволяет расширить ассортимент лекарственных средств растительного происхождения для лечения заболеваний нервной системы.
Литература
1. Галишевская Е.Е., «Ресурсоведческая характеристика двух видов растений рода Марьянник (Melampyrum L.)», Галишевская Е.Е., Скрябина Е.Н., Левинова В.Ф. Materialy VII Międzynarodowej naukowi-praktycznej konferencji «Perspektywiczne opracowania są nauką i technikami - 2011» Volume 42. Nauk biologicznych.: Przemyśl. Nauka i studia. - Str. 14-18
2. Галишевская E.E. «Фенольные соединения растений рода марьянник» Галишевская Е.Е., Петриченко В.М., Скрябина Е.Н. // Фармация: Науч. - практ. журн. - 2011. - №2. - С. 25-29
3. Государственная Фармакопея СССР: Вып. 1. Общие методы анализа / МЗ СССР. XI - изд., доп. - М.: Медицина. - 1987. - 336 с.
4. Отинова Е.В. «Влияние водных и спиртовых экстрактов различных видов Марьянника на свертываемость крови». Отинова Е.В., Петриченко В.М., Сыропятов Б.Я. и др. // Украинский научно-медицинский молодежный журнал. - 2011. - №1. - С. 29-31.
5. Петриченко, В.М., «Биологические и химические свойства растений семейства Норичниковые». Петриченко В.М., Сухинина Т.В., Сыропятов Б.Я., Галишевская, Е.Е. Шестакова Т.С., Мищенкова, К.А. Региональный конкурс РФФИ-Урал. Результаты научных исследований, полученные за 2007 год. Сборник статей. Часть II. Пермь. Екатеринбург.2008. - С. 120-123.
6. Растительные ресурсы СССР. Цветковые растения, их хим. Состав, исп-е, сем-во Caprifoliaceae-Plantaginaceae. - М.: Наука, 1990. - 328 с.
7. Руководство по доклиническому исследованию лекарственных средств», М., 2012
8. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К, 2012. - 944 с.
9. Е. Korkotian, Т. Bombela, Т. Odegova, P. Zubov, М. Segal "Ethanol Affects Network Activity in Cultured Rat Hippocampus: Mediation by Potassium Channels" // PLOS one - 2013 - DOI: 10.1371/journal.pone.0075988.
10. J.A. King, I. Trinkler, T. Hartley, F. Vargha-Khadem, N. Burgess "The Hippocampal Role in Spatial Memory and the Familiarity-Recollection Distinction: A Case Study" // Neuropsychology - 2004 - Vol. 18, No. 3 - pp. 405-417
11. L.E. Jarrard "On the Role of the Hippocampus in Learning and Memory in the Rat" // Behavioral and neural biology - 1993 - No. 60 - pp. 9-26.
12. D.М. Bannerman, R. Sprengel, D.J. Sanderson, S.B. McHugh, J.N.P. Rawlins, H. Monyer, P.H. Seeburg "Hippocampal synaptic plasticity, spatial memory and anxiety" // Nature Reviews Neuroscience - 2014 - No. 15, pp. 181-192.
13. С. Boyer, T. Schikorski, C.F. Stevens "Comparison of Hippocampal Dendritic Spines in Culture and in Brain" // The Journal of Neuroscience, - 1998 - No. 18(14) - pp. 5294-5300.
14. B. Smith, B. Molina, W. Pelham "The Clinically Meaningful Link Between Alcohol Use and Attention Deficit Hyperactivity Disorder" // Alcohol research and Health - 2002 - No. 26(2)-pp. 122-129.
15. C.F. Valenzuela "Alcohol and Neurotransmitter Interactions" // Alcohol health and research World - 1997 - No. 21(2)-pp. 144-148.
Реферат
Изобретение относится к способу получения средства, обладающего седативной, противосудорожной и нейромодуляторной антиалкогольной активностью. Указанный способ включает экстрагирование растительного сырья - травы марьянника лесного 50% этанолом, методом реперколяции с равной загрузкой сырья, с законченным циклом в батарее из четырех перколяторов в соотношении сырье:экстрагент - 1:2, при настаивании на каждой ступени экстракции в течение шести часов, далее объединенные извлечения отстаивают, фильтруют, декантируют, упаривают до сухого остатка в ротационном вакуумном испарителе. Изобретение обеспечивает получение средства с выраженной седативной, противосудорожной и нейромодуляторной антиалкагольной активностью. 5 ил., 8 табл., 1 пр.

Комментарии