Специфические антитела к альфа-енолазе и способ применения при иммунных заболеваниях - RU2707812C1
Код документа: RU2707812C1
Чертежи






























Описание
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США номер 61/919,391, поданной 20 декабря 2013 года, содержание которой полностью включено в настоящую заявку посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам лечения рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки и соответствующих иммунных расстройств, включая хроническую обструктивную болезнь легких (ХОБЛ), астму, аллергию, псориаз, сахарный диабет 1 типа и остеопороз, с помощью специфических антител к альфа-енолазе.
Рассеянный склероз (РС) является хроническим воспалительным заболеванием центральной нервной системы. При рассеянном склерозе разрушается миелиновая оболочка нервных волокон, т.е. происходит демиелинизация нервных волокон посредством аутоантител. Симптомы рассеянного склероза являются относительно неспецифическими, например, рецидив и ремиссия усталости, онемение, нарушения походки и координации, нарушение функции кишечника/мочевого пузыря, когнитивная дисфункция и боли. На сегодняшний день плохо изучены причины и патофизиология РС, и он может быть вызван генетической предрасположенностью, дефицитом витамина D и местом проживания. Уровень растространения РС варьируется в зависимости от географического региона. В Западной Европе и Северной Америке отмечается наиболее высокий масштаб эпидемии - на 100000 человек приходится 100 пациентов с симптомами РС в США и 118/100000 - в Англии. Уровень растространения в Японии и Тайване составляет 8,57/10000 и 1,9/100000, соответственно (Amino, MJ. et al. (2009) New York: McGraw Hill Medical., с. 848-911; Tsai, C-P. et al. (2004), Chinese Med. Assoc., 67: 500-505). Генетическая предрасположенность также играет роль в патогенезе РС. Если член семьи имеет заболевание РС, риск развития РС у его родственников пропорционален генетическому сходству между ними и заболевшим лицом. Есть подтверждения о том, что из числа факторов окружающей среды факторами, связанными с РС, являются витамин D и вирусная инфекция Эпштейн-Барр. В последнее время имеются предположения о том, что вирусы герпеса типа V и VI имеют отношение к РС в Тайвани. Раннее при изучении патологии РС считалось, что миелин-специфические CD4+T-лимфоциты перемещаются из крови в головной мозг, связываются с антигенными пептидами, представленными антигенпрезентирующими клетками (включая микроглиальные в головном мозге), клонально распространяются, атакуют и повреждают олигодендроциты, разрушая миелин. Последняя гипотеза позволяет предположить, что миелин CD+4 T-клетки участвуют только на ранней стадии РС. Циркулирующие моноциты, индуцированные MCP-1 в ЦНС, отвечают за прогрессирование заболевания на средней и поздней стадии. Мыши с дефицитом хемокинового рецептора CCR2, в котором лигандом является MCP-1, устойчивы к экспериментальному аутоиммунному энцефаломиелиту (ЭАЭ). Когда нокаутным мышам CCRC2 переливают различное количество моноцитов от ЭАЭ-индуцированных мышей CCRC2+, клинический показатель реципиентных мышей пропорционален количеству перелитых моноцитов от донорных мышей с ЭАЭ. Эти результаты позволяют предположить, что моноциты играют очень важную роль в течении заболевания ЭАЭ.
До недавнего времени не было найдено ни одной удовлетворительной терапии рассеянного склероза. Существует 8 лекарственных средств, одобренных Управлением по контролю за продуктами и лекарствами США, для лечения пациентов с РС. Ребиф, авонекс, бетаферон и экставия являются различными видами β-интерферонов, являющихся иммуномодуляторами. Копаксон является аналогом миелина, выполняющим функцию рецептора-приманки для антигена Th1 CD4+. Гиления является модулятором сфингозин-1-фосфатного рецептора (S1P-1) со структурой, близкородственной сфингозину. Гиления выступает в качестве функционального антагониста при лимфоцитарном S1P, и иммуномодулирующий эффект гилении вероятно вызван ингибированием выхода антиген-специфических T-клеток из дренирующих лимфоузлов. Тисарби представляет собой моноклональное антитело к рецептору интегрину внеклеточного матрикса (α4β1), что играет важную роль для перемещения лейкоцитов. Лахинимод является NFκB-опосредованным ингибитором пути передачи воспаления; эффективные клетки включают T-клетки, B-клетки и дендритные клетки. Текфидера (диметилфумарат BG12) является ингибитором транскрипционного пути Nrf2, и он предотвращает секретирование цитокинов иммунными клетками и экспрессирования CD 62E в эпителиальных клетках. Митоксантрон представляет собой аналог антрацендиона, который является токсичным по отношению к активированным иммунным клеткам. Несмотря на то, что некоторые из них очень эффективны, эти лекарственные средства приводят только к снижению частоты возникновения и интенсивности острых фаз заболевания. Они всегда имеют некоторые побочные эффекты, например, инфекции в ответ на β-интерферон-ассоциированные лекарственные средства, и прогрессирующая многоочаговая лейкоэнцефалопатия - в ответ на Тисарби.
Ревматоидный артрит (РА) является хроническим воспалительным заболеванием, поражающим суставы пациентов. Симптомы РА включают боли, опухание, тугоподвижность и деформации в суставах. Пациенты всегда чувствуют повышение температуры и усталость. Этиология РА до конца не изучена. Заболевание начинается с аутоантител к соединительной ткани пациентов с последующей инфильтрацией лейкоцитов, включая моноциты, макрофаги и нейтрофилы. Затем лимфоциты прорываются и заполняют кости и мягкие ткани суставов. Традиционные терапевтические лекарственные средства РА обозначают как противоревматические лекарства, включая, например, метотрексат и лефуномид. Иногда используют стероиды. В последнее время могут быть представлены более эффективные биологические препараты, такие как РемикейдTM и ХумираTM, которые являются антителами к TNF-альфа, или Энбрел, который является рецептором-приманкой TNF-альфа, или АнакинраTM,который является антагонистом на уровне рецептора к IL-1. Несмотря на то, что эти лекарственные средства являются эффективными, могут наблюдаться побочные эффекты, например, инфекции и лихорадка. Тем не менее, во многих случаях не представляется возможным удовлетворительное лечение заболевания с исключением нанесения вреда суставам, который может даже привести к иммобилизации.
При обоих заболеваниях (РС и РА), данные в литературе подкрепляют мнение о том, что моноциты и макрофаги в крови при воспалении участвуют в прогрессировании обоих иммунных заболеваний.
Альфа-енолаза (енолаза-1 или ENO1) является многофункциональным белком, впервые обнаруженном как ключевой фермент в гликолизном пути. В нормальных условиях ENO1 экспрессируется в цитозоле. Однако по последним данным в литературе поддерживается точка зрения о том, что ENO1 может экспрессироваться на клеточной поверхности в качестве рецептора плазминогена во многих злокачественных клетках и активированных гематопоэтических клетках, таких как нейтрофилы, лимфоциты и моноциты. Известно, что повышение экспрессии рецепторных белков плазминогена индуцирует каскад ответных реакций UPAS (сигнал активации плазминогена урокиназы) и приводит к разрушение внеклеточного матрикса. Как следствие, это приводит к увеличению метастазов злокачественных клеток и инфильтрации иммунных клеток. Стимулы воспаления, например, ЛПС, повышают экспрессию ENO1 на клеточной поверхности в моноцитах крови человека и моноцитарных клетках U937 посредством посттрансляционной модификации и транслокации на клеточную поверхность.
Считается, что транслокация ENO1 регулируется путем передачи сигнала митоген-активируемой протеинкиназы. Это подразумевает то, что повышение экспресии ENO1 на клеточной поверхности может играть важную роль при воспалительных заболеваниях. Аутоантитела к ENO1 обнаружены при различных аутоиммунных и воспалительных заболеваниях, включая красную волчанку, системный склероз, болезнь Бехчета, язвенный колит и болезнь Крона. Исследования Saulot et al. (Arthritis Aheum., 46:1196-1201(2002)) и Wkui et al. (Clin. Exp. Immunol., 118:445-450 (1999)) позволяют предположить, что 25-66% пациентов с РА имеют повышенный уровень антител к ENO1 в сыворотке. В исследовании Бея (J. Immunology, 189:365-372 (2013)) указано, что когда МНПК пациентов с РА получают антитело к ENO1 для стимуляции активности рецептора плазминогена ENO1, моноциты и макрофаги из МНПК продуцируют большее количество провоспалительных медиаторов, таких как TNFα, IL1-α/β, IFN-γ и PGE2 посредством пути p38 MAPK и NF-κB. Это исседование позволяет предположить, что ENO1 посредством своей активности рецептора плазминогена играет ключевую роль в развитии заболевания у пациентов с РА посредством повышения инвазивной активности моноцитов и макрофагов.
Обобщая вышеизложенное, моноциты с повышенным уровнем экспрессии ENO1 на клеточной поверхности в качестве рецепторов плазминогена для повышения инвазивной активности играют важную роль в прогрессировании заболеваний РС, РА и соответствующих иммунных расстройств. Таким образом, таргетирование ENO1 на клеточной поверхности моноцитов представляет большую потенциальную возможность для лечения воспалительных заболеваний, таких как РС, РА, болезнь Крона, язвенный колит и системная красная волчанка, или соответствующих иммунных расстройств, таких как хроническая обструктивная болезнь легких (ХОБЛ), астма, аллергия, псориаз, сахарный диабет 1 типа, атеросклероз и остеопороз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения относятся к новым способам лечения воспалительного заболевания или иммунного расстройства, такого как рассеянный склероз, ревматоидный артрит, болезнь Крона, язвенный колит, системная красная волчанка, или соответствующего иммунного расстройства, такого как хроническая обструктивная болезнь легких (ХОБЛ), астма, аллергия, псориаз, сахарный диабет 1 типа, атеросклероз и остеопороз.
В соответствии с любым вариантом осуществления изобретения способ лечения воспалительного заболевания или иммунного расстройства может включать введение нуждающемуся в этом индивидууму антагониста к ENO1, где антагонист связывает ENO1 и ингибирует активность рецептора плазминогена ENO1. В соответствии с любым вариантом осуществления изобретения антагонистом может быть антитело к ENO1 или его фрагмент scFv, Fab или F(ab)2. Кроме того, в соответствии с любым вариантом осуществления изобретения способ может дополнительно включать введение индивидууму иммуномодулятора. Примером иммуномодулятора является диментилфумарат.
В соответствии с любым вариантом осуществления изобретения способ лечения воспалительного заболевания или иммунного расстройства может быть осуществлен с помощью лекарственного средства, содержащего антитело, которое может специфически связываться с рецептором плазминогена ENO1 для лечения рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или соответсвующих иммунных расстройств у индивидуума, и применения указанного антитела для получения лекарственного средства для лечения рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или соответсвующих иммунных расстройств у индивидуума, соответственно.
В соответствии с любым вариантом осуществления изобретения антитело или его фрагмент scFv, Fab или F(ab)2 может связываться с эпитопом на ENO1 человека и ингибировать активность рецептора плазминогена ENO1, где эпитоп может быть расположен в области, состоящей из последовательности296FDQDDWGAWQKFTASAGIQVVG DDLTVTNPKRIAKAVNEKS336 (SEQ ID NO:39) ENO1 человека. В соответствии с любыми вариантами осуществления изобретения антитело или его фрагмент scFv, Fab или F(ab)2 может связываться с эпитопом на ENO1 человека и ингибировать активность рецептора плазминогена ENO1, где эпитоп может быть расположен в области, состоящей из последовательности296FDQDDWGAWQKFTA309 (SEQ ID NO:40) или326KRIAKAVNEKS336(SEQ ID NO:41) ENO1 человека.
Как указано выше, в исследовании Бея (J. Immunology, 189:365-372 (2013)) указывается на то, что когда МНПК пациентов с РА обрабатывают с помощью антитела к ENO1, происходит стимуляция активности рецептора плазминогена ENO1, и моноциты и макрофаги из МНПК продуцируют большее количество провоспалительных медиаторов, таких как TNFα, IL1-α/β, IFN-γ и PGE2 посредством пути p38 MAPK и NF-κB. В отличие от этого наблюдения, авторы настоящего изобретения неожиданным образом обнаружили, что введение антител, направленных против ENO1, может влиять на клиническое улучшение ревматоидного артрита. Таким образом, выявлено, что посредством введения антител, направленных против активности ENO1 вместо активации с помощью эпитопа антитела, отличного от того, который выбран Bae et al., может быть достигнуто клиническое улучшение воспалительного заболевания или иммунного расстройства (такого как ревматоидный артрит). Аналогично, выявлена возможность влияния на клиническое улучшение при рассеянном склерозе. Эти наблюдения позволяют предположить, что не каждое антитело к ENO1 оказывает терапевтический эффект на иммунные заболевания, и это влияние зависит от эпитопа.
Кроме того, удивительным образом было обнаружено, что лечение не только возможно в начале заболевания у экспериментальной модели на животном, но также когда явно выраженные клинические симптомы заболевания уже присутствуют. Это создает возможность для относительно позднего терапевтического вмешательства, наряду с другими, так как это необходимо в клинической практике для людей.
Рецептор плазминогена ENO1 человека известен специалисту в данной области (см., GenBank: AAH50642,1 на веб-сайте Национального института здравоохранения). Этот рецептор представляет собой рецептор плазминогена и существует в двух различных вариантах сплайсинга у людей - ENO1 и Myc-связывающий белок. ENO1 также известен как ENO1 человека, альфа-енолаза или ген ENO-1.
Соответствующие ортологи ENO1 из различных видов также известны, и специалист в данной области может легко их определить, например, посредством поисков последовательности, начиная с ENO1 человека. В соответствии с вариантами осуществления изобретения термин «ENO1» относится к белкам ENO1 как человека, так и животного (например, домашнего животного и домашнего скота).
По настоящему изобретению термин «антитело» в широком смысле обозначает и, наряду с другими, включает поликлонально, моноклонально и рекомбинантно полученные антитела, включая биспецифические антитела, а также их фрагменты, такие как фрагменты Fv, Fab, и F(ab)2, где Fv может быть одноцепочечным. Предпочтительно, антитело является одним из изотипов IgG. Предпочтительно, антителом является таким, которое не отвергает или только в незначительной степени отвергает иммунная система индивидуума. Это может быть достигнуто, например, посредством конверсии областей антитела (например, Fc-областей), которые не требуются для распознавания антигена (например, белок ENO1, который является рецептором плазминогена) в последовательности, полученные из последовательностей антител видов индивидуума. Например, так называемые гуманизированные антитела известны специалисту в данной области и особенно подходят для применения у людей. Предполагается, что антитела, модифицированные иным образом, например, биспецифические антитела (см., например, Kontermann, R.E. (editor) (2011), Bispecific antibodies, Springer Heidelberg Dordrecht London New York), диатела, а также так называемые связывающие средства или аптамеры, которые могут быть получены, например, посредством пептидного остова или остова нуклеиновой кислоты, например, aRNA, также охвачены термином «антитело» в контексте настоящего изобретения. Предпочтительно, антитела в контексте настоящего изобретения имеют молекулярную массу менее чем 600 кДа, более предпочтительно менее чем 300 кДа, еще более предпочтительно менее чем 200 кДа и наиболее предпочтительно приблизительно 150 кДа. Антитело в рамках изобретения также может включать химерное антитело, антитело человека, антитело с созревшей аффинностью, которое является антителом, подвергнутым мутации для оптимизации связывания (аффинности). Антитело может также быть конъюгировано с лекарственным средством для образования конъюгата антитело-лекарственное средство (ADC). Способы образования конъюгатов антитело-лекарственное средство хорошо известны в данной области, например, они включают окисление углеводов на антителе с периодатом натрия для образования альдегидов, которые затем вступают в реакцию с аминной функциональной группой на лекарственном средстве или линкере, присоединенном к лекарственному средству.
Способы получения подходящих поликлональных, моноклональных и рекомбинантных антител, включая получение связывающих средств и аптамеров, известны специалисту в данной области (см., например, Jorg Knablein (editor), Modern Biopharmaceuticals, т. 2, с. 635); также см. примеры, описанные ниже. Например, иммунизацию можно проводить посредством введения белка ENO1. Идентицикация подходящих антител также возможна посредством скрининга гибридомного супернатанта с соответствующими молекулами (антигенами). После идентификации антитела можно получать способами, известными специалисту в данной области.
По вариантам осуществления настоящего изобретения антителом к ENO1 может быть EN10 mAb или 7E5 mAb, или его фрагмент scFv, Fab или F(ab)2. Антитело к ENO1 - EN10 mAb и 7E5 mAb - может связываться с рецептором плазминогена ENO1. Предпочтительно, антитело связывается с константой диссоциации Kd, составляющей 10-7 M или менее, более предпочтительно 10-8 M или менее, даже более предпочтительно 10-9 M или менее, наиболее предпочтительно 10-10 M или менее. Предпочтительно, связывание является специфическим. Специфическое связывание в контексте настоящего изобретения означает, что в физиологических условиях (то есть, например, в физиологическом растворе, в клеточной культуре или in vivo, предпочтительно в крови или ткани соответствующего индивидуума), антитело связывается с ENO1, с по меньшей мере 10-кратно улучшенной аффинностью, предпочтительно 20-кратно улучшенной аффинностью, более предпочтительно 50-кратно улучшенной аффинностью, наиболее предпочтительно 100-кратно улучшенной аффинностью с ENO1, по сравнению с другими белками, в частности, по сравнению с подобными белками (например, по сравнению с Annexin 2, Histone 2B, CK8 или другими рецепторами плазминогена). Однако связывания с другими белками можно допустить при условии, что оно не нарушает терапевтических эффектов антитело. При этом, перекрестная реактивность с ортоголическими рецепторами плазминогена ENO1 от других видов возможна и даже может быть предпочтительной с целью создания возможности для применения антитела у различных видов. Такая перекрестная реактивность не является редкостью, и специалисту в данной области известно, как определять перекрестную реактивность. Дополнительные сведения по этому вопросу можно также найти в примерах.
Предпочтительно, антитело для использования согласно вариантам осуществления изобретения может ингибировать активность рецептора плазминогена ENO1. Можно легко определить, ингибирует ли антитело активность рецептора плазминогена ENO1. Например, такое антитело моет снижать активность протеиназы плазмина, что является результатом ЛПС-индуцированной экспресии рецептора плазминогена ENO1 на клетках, вступающих в реакцию посредством ENO1, таких как клетки U937. Пример анализа описан ниже в примерах.
Кроме того, ингибирование активности рецептора плазминогена ENO1 можно определять с помощью того факта, что ингибирование инвазивной активности, индуцированной ЛПС и MCP-1, возникает в клетках, например, U937. Иллюстративный анализ описан ниже в примерах.
Примеры антител, которые являются подходящими или которые напоминают исходные положения для модифицированных антител, включают моноклональное антитело EN10 mAb и 7E5 mAb. Получение антител EN10 mAb и 7E5 mAb, а также их характеристики описаны в примерах ниже.
Лекарственное средство в соответствии с вариантами осуществления изобретения может содержать антитело EN10 mAb и 7E5 mAb. Кроме того, лекарственное средство может содержать любой вид адъюванта, который специалист в данной области сочтет приемлемым. Такими адъювантами, например, могут быть вещества-носители, такие как крахмал, лактоза, жиры, стеариновая кислота, спирт, физиологические растворы или другие добавки. В частности, предпочтительными являются адъюванты, стабилизирующие антитела и сохраняющие их активность. Лекарственное средство в соответствии с вариантами осуществления изобретения может также содержать антитела, имеющие другие терапевтические молекулы, конъюгированные с антителами (т.е., конъюгаты антитело-лекарственное средство, ADC), способы получения ADC хорошо известны в данной области.
Введение лекарственного средства можно проводить с помощью любого известного способа, который может доставить антитело EN10 mAb и 7E5, содержащееся в лекарственном средстве, к клеткам-мишеням, например, моноцитам, in vitro или in vivo. Например, лекарственное средство можно вводить посредством инъекции, например, внутривенно (в/в), подкожно (п/к) или интраперитонеально (и/п) в форме растворов, суспензий или инфузий. Однако также возможны другие способы введения, такие как в микроинкапсулированной форме или в форме имплантатов. Предпочтительно, введение лекарственного средства проводят так, чтобы антитело могло вступать в циркуляцию или в соответствующую целевую область. Также возможно непосрественное введение в целевую область, например, для рассеянного склероза - непосредственно в центральную нервную систему (например, цереброспинальную жидкость), для ревматоидного артрита - непосредственно в пораженные суставы, для воспалительного заболевания кишечника - непосредственно в кишечник, для системной красной волчанки - непосредственно в почки, или для других воспалительных заболеваний - непосредственно в соответствущие органы.
Рассеянный склероз (РС) и ревматоидный артрит (RA) известны специалисту в данной области и описаны во введении. Термин «лечение» также известен специалисту в данной области. В контексте настоящего изобретения, лечение относится к любому виду вмешательства, приводящему к клиническому улучшению течения заболевания или расстройства, такого как рассеянный склероз, ревматоидный артрит, болезнь Крона, язвенный колит или системная красная волчанка, или иммунных расстройств у индивидуума. Клиническое улучшение, например, при рассеянном склерозе, можно определять посредством измерения ослабления неврологической симптоматики, например, паралича. При ревматоидном артрите клиническое улучшение можно определять, например, посредством ослабления симптомов, таких как опухание, воспаление или боль. Предпочтительно, улучшение проявляется в ослаблении клинических симптомов, которые, например, соответствуют улучшению по шкале оценки ЭАЭ, например, на по меньшей мере 0,25 единицы, предпочтительно 0,5 единицы, более предпочтительно по меньшей мере 0,75 единицы, более предпочтительно по меньшей мере 1,0 единицу или наиболее предпочтительно по меньшей мере 1,3 единицу. Предпочтительно, улучшение проявляется в ослаблении клинических симптомов, которые, например, соответствуют улучшению по шкале оценки артрита, например, на по меньшей мере 0,25 единицы, предпочтительно по меньшей мере 0,5 единицы, более предпочтительно по меньшей мере 1,0 единицу, более предпочтительно по меньшей мере 2,0 единицы или наиболее предпочтительно по меньшей мере 3,0 единицы.
Для оценки клинического улучшения у человека, также известны многие параметры, например, клинический показатель для рассеянного склероза (Avnir, Y. et al., (2011) PLoS ONE.6:1-13). Кроме того, лечение может, в частности, относиться к стойкому к терапии рассеянному склерозу и/или ревматоидному артриту, т.е. форме соответствующего заболевания, при котором клиническое улучшение не могло быть достигнуто с помощью изветсных до этого веществ. У значительного количества индивидуумов течение заболевания таково, что клиническое улучшение более невозможно посредством известных веществ. Кроме того, лечение может относиться к индивидууму с соответствующим заболеванием, при котором нежелательные побочные эффекты возникают до неприемлемой степени посредством существующих до этого способов лечения. Лечение может также относиться к соответствующему заболеванию в запущенной стадии.
В соответствии с вариантами осуществления настоящего изобретения индивидуумом может быть позвоночное, предпочтительно млекопитающее. Млекопитающим может быть, например, грызун (например, мышь, крыса или кролик), свинья, собака, кошка или примат. Предпочтительно, млекопитающим является примат (например, макак или обыкновенная игрунка или человек). Особенно предпочтительн, индивидуумом является человек.
Как правило, для введения лекарственного средства определяют эффективную дозу. Термин «эффективная доза» и определение эффективной дозы известны специалисту в данной области. Кроме того, специалист в данной области может обратиться к информации, представленной в настоящем документе, для определения эффективной дозы. Под эффективной дозой понимается та, которая приводит к клиническому улучшению при лечимом заболевании. В частности, в контексте настоящего изобретения под дозой лекарственного средства, оказывающей воздействие на ослабление симптомой рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или иммунного расстройства у индивидуума, понимается эффективная доза. Эффективной дозой является, например, выбранная доза, при которой ингибируется по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, наиболее предпочтительно по меньшей мере 50% инвазивной активности ENO1-экспрессирущих моноцитов в периферической крови.
Предпочтительно, эффективную дозу лекарственного средства выбирают таким образом, чтобы она совпадала с самой малой дозой, обеспечивающей удовлетворительное лечение рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или иммунного расстройства. A в особенности подходящую эффективную дозу можно определять посредством непрерывного повышения дозы в серии испытаний до достижения необходимого соотношения эффекта к нежелательным побочным эффектам. В контексте настоящего изобретения, это может быть случай, например, когда при лечимом заболевании более не наблюдается клиническое улучшение при дальнейшем увеличении дозы (соответственно, даже усугубляется) и/ или когда становятся непримелемыми нежелательные побочные эффекты относительно терапевтического эффекта.
Кроме того, настоящее изобретение относится к лекарственному средству, содержащему антитело, способное ингибировать инвазивную активность моноцитов при рассеянном склерозе, ревматоидном артрите, болезни Крона, язвенном колите, системной красной волчанке или иммунном расстройстве у индивидуума, и применению указанного антитела для получения лекарственного средства для лечения рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или иммунного расстройства у индивидуума.
Все предпочтительные варианты осуществления изобретения и варианты по изобретению и определения, приведенные в настоящем описании, очевидным образом также относятся ко всем вышеуказанным лекарственным средствам и способам применения соответствующим образом.
В контексте настоящего изобретения выявлено, что введение антитела, способного ингибировать рецептор плазминогена ENO1, может оказывать влияние на инвазивную активность ENO1-экспрессирующих моноцитов.
Авторы настоящего изобретения предполагают, что лечение рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки или иммунного расстройства предпочтительно происходит посредством нарушения активности рецептора плазминогена ENO1-экспрессирующих моноцитов при воспалении.
В контексте настоящего изобретения под ингибированием активности рецептора плазминогена ENO1-экспрессирующих моноцитов при воспалении понимается достижение нарушения инвазивной активности соответствующих моноцитов.
На механизм ингибирования активности рецептора плазминогена может влиять структура антитела. Предпочтительно, на ингибирование влияет механизм нарушения активности UPAS (сигнала активации плазминогена урокиназы). Ингибирование на основе UPAS может быть опосредовано, например, посредством белка ENO1. Антитело ENO1 создает возможность для сдерживания перемещения моноцитов в очаг воспаления.
Ингибирование инвазивной активности с помощью антитела по изобретению может быть достигнуто у различных видов. Например, популяции моноцитов мыши и человека схожи. У мышей проявляется разделение моноцитов крови на моноциты при присутствии воспаления (CD11b+ CCR2+ GR1+ CD62L+ CX3CRllow) и при отсутствии воспаления (CD11b+ CCR2-GRl- CD62L- CX3CRlhigh) (Geissmann F. et al. (2003), Immunity, 19: 71-82). У людей эти две популяции моноцитов давно известны, и их преимущественно определяют с помощью уровней экспрессии поверхностных маркеров CD14 и CD16 (Ziegler-Heitbrock H.W. et al. (2000), J. Leukoc. Biol., 67: 603-6).
Варианты осуществления настоящего изобретения относятся к способам ингибирования инвазии моноцитов, включающим: взаимодействие моноцитов с антителом, которое может специфически связываться с рецептором плазминогена ENO1. Предпочтительно, взаимодействие проводят in vivo или in vitro. Под термином «in vitro» понимают его наиболее широкую форму в этом контексте. Он относится к любому случаю, имеющему место вне живого организма, такому как способы в клеточной культуре, тканевой культуре или органной культуре. Подразумевается, что термин «in vitro» в частности также включает способ, относящийся к лечению крови вне организма индивидуума.
Настоящее изобретение дополнительно относится к способам лечения рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита или системной красной волчанки или иммунного расстройства у индивидуума. Способ включает стадию введения антитела, способного специфически связываться с рецептором плазминогена ENO1.
Настоящее изобретение дополнительно относится к способам ингибирования инвазивной активности специфических моноцитов у индивидуума. Способ включает стадию введения антитела, способного специфически связываться с рецептором плазминогена ENO1.
Все предпочтительные варианты осуществения и варианты по изобретению и определения, уже представленные выше, очевидным образом относятся к вышеуказанным способам соответствующим образом.
Краткое описание фигур
На ФИГ. 1 показаны результаты ELISA связывания анти-ENO1 mAb мыши, выделенного из асцита гибридомы. Очистку сульфатом аммония, колоночную очистку с белком A и очистку методом ДСН-ПААГ-электрофореза проводили, как описано в примере 1. Эти данные показывают Kd антитела EN10 mAb к ENO1 человека.
На фигурах 2A, 2B и 2C показаны результаты экспресии ENO1 на поверхности клетки CD11b+, когда МНПК здорового человека обрабатывают с помощью ЛПС. Индуцирование экспресии ENO1 с помощью ЛПС в МНПК здорового человека проводили, как описано в примере 2. На ФИГ. 1A показано, что ЛПС индуцировал экспресиию ENO1 на клеточной поверхности, о чем свидетельствует увеличение и смещения вправо популяции флуоресцентных клеток на FACS-скане. Данные на ФИГ. 2B и ФИГ. 2C показывают повышение экспресии ENO1 в клетках CD11bhigh (фиг. 2B) и Mac3high (фиг. 2C) МНПК при воспалении.
На ФИГ. 3 показаны результаты воздействия на ЛПС-индуцированную U937 фибринoлитическую активность посредством EN10 mAb (антитела к ENO1), выделенного из асцитов гибридом. Индуцирование экспресии ENO1 с помощью ЛПС на моноцитарной линии клеток U937 человека и анализ плазминной активности проводили, как описано в примере 3. Эти данные показывают, что EN10 mAb может ингибировать функцию рецептора плазминогена ENO1 на моноцитах.
На ФИГ. 4 показаны результаты инвазивной активности моноцитарной линии клеток U937 человека, обработанной различной концентрацией EN10 mAb, когда экспрессия ENO1 на клеточной поверхности индуцирована ЛПС. Подробный порядок проведения процедуры соблюдали, как описано в примере 4. Эти данные показывают, что EN10 mAb дозозависимо ингибирует инвазивную активность клеток U937.
На ФИГ. 5 показано, что EN10 mAb распознает клеточный поверхностный ENO1 на моноцитах U937 человека, обработанных ЛПС. Подробный порядок проведения процедуры соблюдали, как описано в примере 5.
На ФИГ. 6A показана активность связывания EN10 mAb делеционных мутантов ENO1. Связывающий эпитоп EN10 mAb расположен между аминокислотными остатками под номерами 297 и 434 белка ENO1 человека ввиду того, что делеция этого фрагмента по существу разрушает связывание антитела. Крупнопорционную делецию ENO1 для определения связывающей области EN10 mAb проводили, как описано в примере 6.
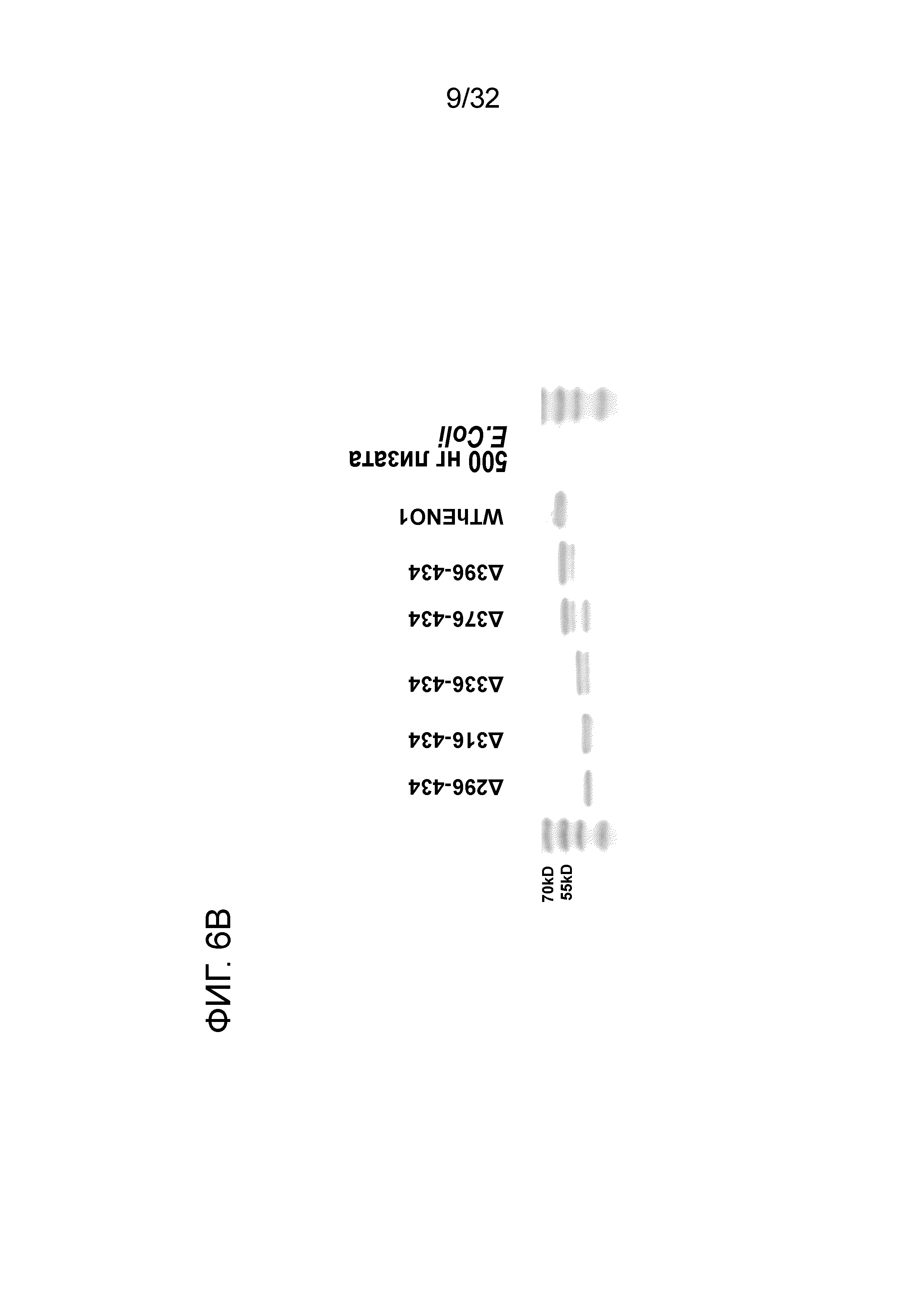
На ФИГ. 6B показан 12% ДСН-ПААГ-электрофорез 6 C-концевого делеционного мутантного белка ENO1, очищенного от E.coli. Подробный порядок очистки делеционных мутантов ENO1 описан в примере 6.
На ФИГ. 6C показана активность связывания EN10 mAb 6 C-концевых делеционных мутантов ENO1. Связывающий эпитоп EN10 mAb расположен между аминокислотными остатками под номерами 296 и 336 белка ENO1 человека. Крупнопорционную делецию ENO1 для определения связывающей области EN10 mAb проводили, как описано в примере 6.
На ФИГ. 7A изображена кристаллическая структура и поверхность, отображающая аминокислотные остатки под номерами с 296 по 336 ENO1 человека. Предсказание структуры было описано в примере 7.
На ФИГ. 7B показан 12% ДСН-ПААГ-электрофорез 11 мутантных белков аланинного сканирования ENO1, очищенных в E.coli. Подробный порядок очистки мутантных белков ENO1 описан в примере 7.
На ФИГ. 7C показан ELISA связывания ENO1 и значения Kd 11 мутантов аланинного сканирования по отношению к EN10 mAb. Результат позволяет предположить, что последовательности пептида 1, FDQDDWGAWQKFTA (SEQ ID NO: 40), и пептида 2, KRIAKAVNEKS (SEQ ID NO:41) ENO1, расположенных между аминокислотными остатками под номерами 296 и 336 ENO1 человека, участвуют в связывании EN10 mAb. Аланиновое сканирование проводили, как описано в примере 7.
На ФИГ. 7D показаны последовательности пептида 1 (FDQDDWGAWQKFTA (SEQ ID NO: 40)) и пептида 2 (KRIAKAVNEKS (SEQ ID NO:41)) ENO1 между аминокислотными остатками под номерами 296 и 336 ENO1 человека (SEQ ID NO:39), участвующие в ENO1 человека и связывании EN10 mAb.
На фигурах 8A и 8B показаны результаты ингибирования лейкоцитарной инфильтрации у модели мыши с неинфекционным воспалением посредством введения EN10 mAb в мышей. Подробный порядок проведения процедуры соблюдали, как описано в примере 8. На ФИГ. 8A показано воздействие EN10 mAb на общее количество клеток брюшной полости, и на ФИГ. 8B показано отсутствуе воздействия на количество нейтрофилов после введения EN10 mAb.
На ФИГ. 9 показано, что введение EN10 mAb улучшает течение экспериментального аутоиммунного энцефаломиелита (ЭАЭ) на профилактической животной модели рассеянного склероза. Подробный порядок проведения процедуры соблюдали, как описано в примере 9.
На ФИГ. 10A показано, что введение EN10 mAb ослабляет многие симптомы рассеянного склероза при ЭАЭ на терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 10.
На ФИГ. 10B показано, что введение EN10 mAb снижает гистопатологический показатель ЦНС при ЭАЭ на терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 10.
На ФИГ. 10C показано, что введение EN10 mAb улучшает показатель демиелинизации ЦНС при ЭАЭ на терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 10.
На ФИГ. 10D показано, что введение EN10 mAb уменьшает воспаление в ЦНС при ЭАЭ на терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 10.
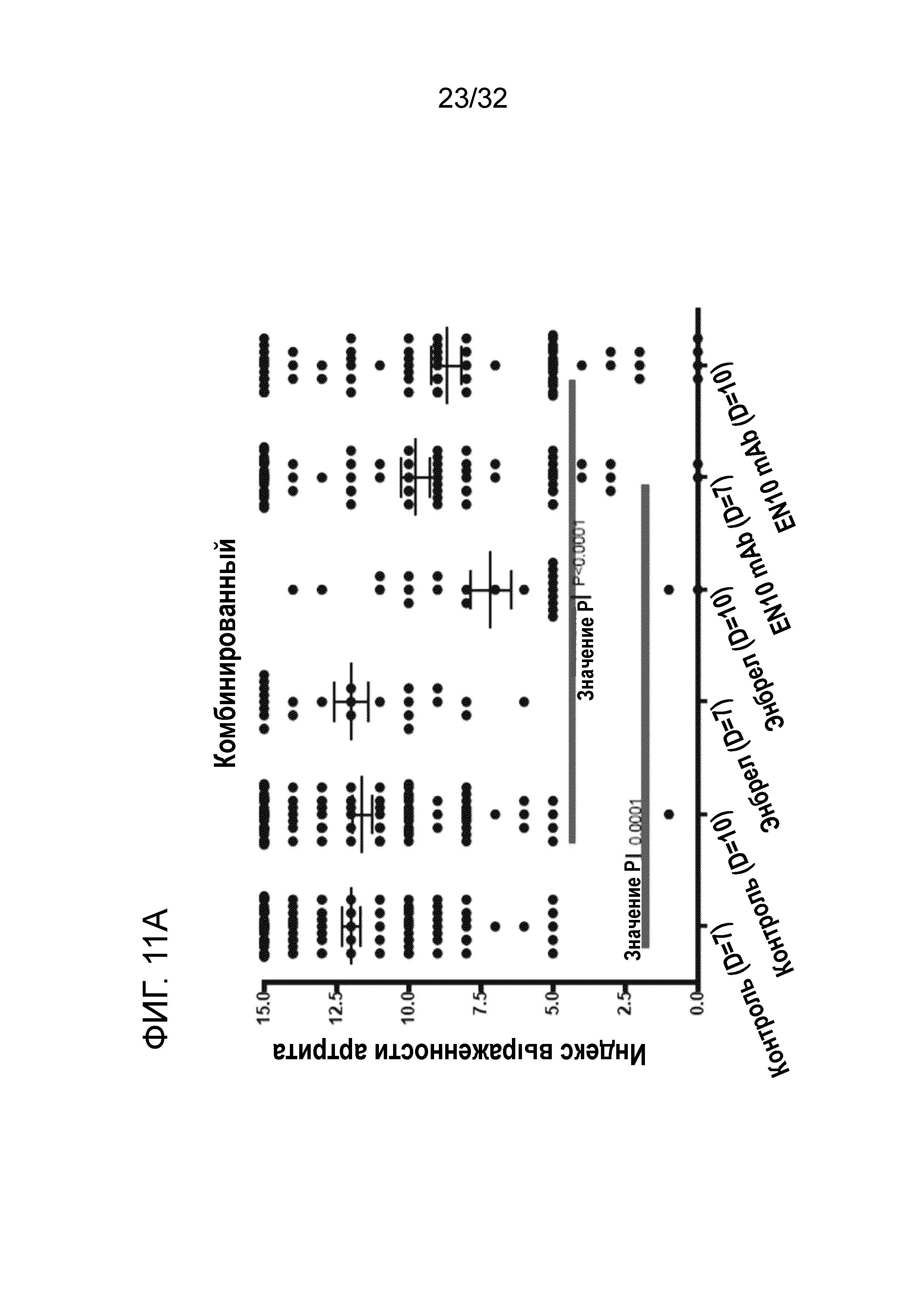
На ФИГ. 11A показано, что введение EN10 mAb ослаблят симптомы артрита на модели грызуна с артритом, индуцированным антителом к коллагену. Подробный порядок проведения процедуры соблюдали, как описано в примере 11.
На ФИГ. 11B показано, что лечение EN10 mAb подавляет синовиальный IL1-b на модели грызуна с артритом, индуцированным антителом к коллагену. Подробный порядок проведения процедуры соблюдали, как описано в примере 11.
На ФИГ. 11C показано, что лечение EN10 mAb подавляет синовиальный MMP9 на модели грызуна с артритом, индуцированным антителом к коллагену. Подробный порядок проведения процедуры соблюдали, как описано в примере 11.
На ФИГ. 12A и 12B. показано образование гибридом крысиного антитела к ENO1 мыши и проверку каждого клона моноклонального антитела анализом связывания ELISA и конкурентным анализом ELISA. Считывание OD из анализов ELISA показано рядом с каждым клоном. Процедура образования гибридомы и получение каждого антитела, и проверка антитела на связывание с помощью ELISA и конкурентного ELISA были описаны в примере 12. Эти данные показывают, что 5 из 75 гибридом антитела могут распознавать ортологичный эпитоп
N10 mAB в белке ENO1 мыши.
На ФИГ.13. показаны результаты ELISA связывания ENO1 5 крысиных антител к ENO1 мыши, выделенных из супернатантов отдельной гибридомы. Очистку сульфатом аммония и колоночную очистку с белком A проводили, как описано в примере 1. Эти данные показывают Kd крысиного 7E5 к ENO1 мыши.
На ФИГ.14A. показано, что введение крысиного антитела 7E5 к ENO1 мыши ослабляет симптомы рассеянного склероза при ЭАЭ EAE у терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 14.
На ФИГ. 14B показано, что введение крысиного антитела 7E5 к ENO1 мыши снижает гистопатологический показатель ЦНС при ЭАЭ у терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 14.
На ФИГ. 14C показано, что введение крысиного антитела 7E5 к ENO1 мыши улучшает показатель демиелинизации ЦНС при ЭАЭ у терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 14.
На ФИГ. 14D показано, что введение крысиного антитела 7E5 к ENO1 мыши ослабляет воспаление в ЦНС при ЭАЭ терапевтической животной модели. Подробный порядок проведения процедуры соблюдали, как описано в примере 14.
Подробное описание изобретения
Варианты осуществления изобретения относятся к способам лечения различных заболеваний или расстройств, связанных с ENO1. Заболевания или расстройства, связанные с ENO1, могут включать воспалительные заболевания или иммунные расстройства. Примеры воспалительных заболеваний включают рассеянный склероз, ревматоидный артрит, болезнь Крона, язвенный колит и системную красную волчанку. Примеры иммунных расстройств включают хроническую обструктивную болезнь легких (ХОБЛ), астму, аллергию, псориаз, сахарный диабет 1 типа, атеросклероз и остеопороз. В способах используют антагонист, способный связываться с ENO1 для ингибирования его функции рецептора плазминогена. Посредством такого ингибирования ингибируют активацию плазминогена, таким образом происходит предотвращение или снижение реакций в прямом направлении, участвующих в активности плазмина. Антагонистами к ENO1 могут быть антитела, которыми могут быть поликлональные антитела, моноклональные антитела или другие модифицированные антитела, которые могут связывать ENO1 и ингибировать функцию ENO1 в активации плазминогена.
Далее следует иллюстрация вариантов осуществления изобретения на конкретных примерах, представленных ниже. Специалисту в данной области понятно, что эти примеры являются иллюстративными и не претендуют на ограничивающий характер ввиду того, что варианты и модификации возможны в пределах объема изобретения.
ПРИМЕРЫ
Пример 1
Для оценки аффинности связывания ENO1 антитела EN10 mAb к ENO1 человека гибридомы выращивали в RPMI-растворе, содержащем 10% эмбриональную телячью сыворотку (ЭТС). Спустя одну неделю культивирования 1 × 106 клетки собирали, промывали с помощью ФБР, ресуспендировали в 200 мкл среды RPMI и вводили мышам с тяжелым комбинированным иммунодефицитом (SCID) посредством интраперитонеальной инъекции. Через три недели асциты мышей собирали и разбавляли до 15 мл. Антитело дополнительно очищали с помощью 40% сульфата аммония и колонки с белком А (набор для очистки антитела Montage antibody purification kit от Millipore) в соответствии с процедурами, известными в данной области. Очищенное антитело концентрировали с помощью устройства центрифужного фильтра Amicon Ultra-15, соблюдая инструкции производителя (Millpore). Чистоту антитела анализировали с помощью 12% ДСН-ПААГ-электрофореза.
Четыреста (400) нг белка ENO1 человека наносили на 96-луночный планшет ELISA, и планшет дополнительно промывали с помощью ФБР. К планшету добавляли серийные разведения от 1 × 10-12до1 × 10-8M антитела EN10 mAb, и планшет инкубировали при 37°C в течение 1 часа. Добавляли антимышинный IgG козы, конъюгированный с гипоксантин-фосфорибозилтрансферазой (HPRT). Через 1 час добавляли 3,3′,5,5′-тетраметилбензидин (ТМБ) и считывали при OD405. Каждое исследование повторяли три раза. Данные представляли как среднее ± стандартное отклонение. Считывания OD и концентрации антител использовали для составляения диаграмма многократного рассеяния с использованием Sigmaplot. Значения Kd теоретически рассчитывали посредством логистической модели с четырьмя параметрами.
Результаты этого эксперимента показаны на ФИГ. 1. Продуктивность антитела EN10 mAb составляла от 20,4 мг до 4,6 мг на мышей. Значение Kd антитела EN10 mAb составило 2,03±0,12 × 10-10 M (N=3). Данный результат позволяет предположить, что антитело EN10 mAb может распознавать белок ENO1 человека и имеет предпочтительную аффинность со значением Kd приблизительно 2,03±0,12 × 10-10 M (N=3).
Пример 2
Известно, что уровень экспресии белка ENO1 повышается в моноцитах при воспалении у мыши in vivo и in vitro (Wygrecka, M. et al. (2009) Blood. 113:5588-5598). Для оценки уровня экспрессии ENO1 в МНПК при воспалении, собирали свежие образцы крови от здоровых добровольцев, соблюдая нормы институционального наблюдательного совета организации при центре разработок в области биотехнологии, Тайвань. Кровь обрабатывали для очистки МНПК с использованием градиентного центрифугирования Фиколл-Гипак. Плотность Фиколл-Гипак (Pharmacia, Франция) корретикровали до приблизительно 1,077 г/мл. Собранные клетки выращивали в RPMI-растворе, содержащем 10% эмбриональной телячьей сыворотки до плотности клеток приблизительно 1×106 клетки/мл. Жизнеспособность клеток проверяли с помощью окрашивания трипановым синим для подтверждения того, что общий % лимфоцитов составляли более 90%. МНПК дополнительно обрабатывали с помощью 10 микрограмм/мл липополисахарида (ЛПС) в течение 6 часов. Клетки промывали с помощью ФБР два раза и подвергали анализу проточной цитометрии. Интактные клетки окрашивали с или без EN10 mAb (разведение 1:300) и с крысиным античеловеческим антителом CD11b или Mac3. Окрашенные клетки визуализировали с FITC-конъюгированным козьим антимышиным IgG для EN10 mAb и PE-конъюгированным антикрысиным IgG для антитела CD11b или Mac3 (Becton Dickinson). Затем образцы анализировали посредством проточного цитометра FACScan (Becton Dickinson). Экспрессию ENO1 и CD11b+ измеряли с помощью получаемой в результате интенсивности флуоресценции.
Результаты этих экспериментов показаны на ФИГ. 2A. Обработка здоровых МНПК с помощью ЛПС и EN10 mAb сдвигает гистограмму вправо по сравнению с инкубированием клеток без ЛПС и с EN10 mAb. Данное наблюдение указывает на то, что здоровые МНПК экспрессируют ENO1 на клеточной поверхности, когда клетки находятся в состоянии воспаления (например, стимулированы посрдством ЛПС). Кроме того, можно определить клеточные популяции с высокой экспрессией ENO1. Как показано на ФИГ. 2B и ФИГ. 2C, популяции клеток Mac3+ и CD11b+ также увеличиваются в ЛПС-обработанных МНПК человека по сравнению с необработанными клетками. Между клеточной популяциией с высокой экспрессией ENO1 устанавливается связь с клетками CD11bhigh и Mac3high (фиг. 2B и ФИГ. 2C). Эти результаты указывают на повышение экспрессии белка ENO1 на клеточной поверхности активированных моноцитов и макрофагов.
Примеры 3
Исследование Wygrecka указывает на то, что активность рецептора плазминогена ENO1 играет важную роль для перемещения моноцитов в области воспаления (Wygrecka, M. et al., (2009), Blood., 113:5588-5598). Для оценки способности EN10 mAb ингибировать активность рецептора плазминогена ENO1 моноцитов человека, моноцитную линию клеток U937 человека выращивали в RPMI-растворе, содержащем 10% ЭТС. Клетки обрабатывали с помощью 10 микрограмм/мл ЛПС в течение 6 часов для индууцирования экспресии белка ENO1 на клеточной поверхности. Затем 1,5 × 106 клеток/мл в ФБР предварительно инкубировали посредством 1 микрограмма/мл Lys-плазминогена человека и 10 микрограммов/мл EN10 mAb в течение одного часа, соответственно. Образцы дважды промывали с помощью ФБР и добавляли 3 нМ тканеспецифического плазминогенного активатора и 0,5 мМ хромогенного субстрата S-2251. Через один час инкубации при 370C, считывали при OD405. Каждое исследование повторяли три раза и анализировали антагонистическую активность. Данные представляли как среднее ± стандартное отклонение. Для сравнения каждой грруппы использовали T-критерий. Значения P <0,05 считали статистически значимыми.
Результаты данного эксперимента показаны на ФИГ. 3. EN10 mAb обладало высокой антагонистической активностью рецептора плазминогена ENO1 и может достигать 100% ингибирования ЛПС-индуцированной специфической ENO1 активности. Таким образом, EN10 mAb обладало бы большим потенциалом для ингибирования перемещения моноцитов в органы-мишени.
Примеры 4
Результат примера 3 позволяет предположить, что EN10 mAb может ингибировать активность рецептора плазминогена ENO1 и приводит к активации плазминогена и активность перемещения в ЛПС-стимулированных моноцитах человека. Данный результат также подкрепляется другими данными в литературе, указывая на то, что моноциты мышей без плазминогена теряют способность к перемещению и инфильтрационную активность у мышей с неинфекционным воспалением(Ploplis, V.A. et al., (1998) Blood, 91:2005-2009).
Для оценки того, приводит ли нарушение активности рецептора плазминогена ENO1 к снижению инвазивной активности активированных моноцитов, выращивали клеточную линию моноцитов U937 человека в RPMI-растворе, содержащем 10% ЭТС. Клетки обрабатывали посредством 10 микрограммов/мл ЛПС в течение 6 часов для индуцирования экспресии белка ENO1 на клеточной поверхности. После смешивания с 5-50 микрограммами/мл EN10 mAb 2 × 104 клетки высеивали в верхней камере двухкамерной системы анализа, содержащей 15 микромолей Lys-плазминогена и инкубировали в течение 24 часов с помощью среды, содержащей 10% ФБР и 10 нМ MCP-1 в нижней камере. Антимышиный IgG использовали в качестве группы отрицательного контроля. Две камеры разделяли с помощью микропористого фильтра (с 8-микрометровым размером пор), покрытого матригелем. После инкубационного периода подсчитывали клетки в нижней камере посредством гемоцитометра под микроскопом. Каждое исследование повторяли три раза. Данные представлены как среднее ± стандартное отклонение. Для сравнения каждой группы использовали T-критерий. Значения P <0,05 считали статистически значимыми.
Результаты показаны на ФИГ. 4. Когда ЛПС-обработанные клетки U937 обрабатывали с помощью 5-50 микрограммов/мл EN10 mAb, инвазивная активность U937 составляла от 90,2±2% до 49,1±1% (N=3) контрольного IgG. Эти результаты указывают на то, что EN10 mAb может снижать инвазивную способность активированных моноцитов U937 посредством нарушения дозозависимо активности рецептора плазминогена ENO1. Посредством таргетирования белка ENO1 на поверхности моноцитов в очаге воспаления ингибирование клеток, проникающих пораженные участки, с использованием EN10 mAb практически осуществимо.
Примеры 5
Для того, что узнать уровень экспрессии ENO1 на клеточной поверхности после стимуляции воспаления, выращивали U937 моноциты человека в RPMI-растворе, содержащем 10% ЭТС. Клетки обрабатывали с помощью 10 микрограммов/мл ЛПС в течение 6 часов для индуцирования экспрессии белка ENO1 на клеточной поверхности. Для анализа методом проточной цитометрии интактные цельные клетки окрашивали с или без EN10 mAb (разведение 1:300), визуализировали с FITC-конъюгированной антисывороткой козы (Jackson Lab) и анализировали с помощью проточного цитометра FACScan (Becton Dickinson). Экспрессию ENO1 измеряли с помощью получаемой в результате интенсивности флуоресценции.
Результаты этих экспериментов показаны на ФИГ. 5. Инкубация U937 с помощью ЛПС и EN10 mAb сдвигает гистограмму вправо по сравнению с инкубированием клеток без ЛПС, но с EN10 mAb. Данный результат указывает на то, что клетки U937 экспрессируют ENO1 на клеточной поверхности, когда они стимулированы ЛПС. Эти данные подкрепляют точку зрения о том, что EN10 mAb распознает ЛПС-индуцированный ENO1 на поверхности моноцитов.
Пример 6 Картирование эпитопов
Картирование эпитопов антитела
Для определения эпитопа EN10 mAb на белке ENO1 человека создавали два прямых праймера с нуклеотидными последовательностями, 5ʹ-GGATCCGCAGCAAACTTCAGGGAAGCCATG-3ʹ (SEQ ID NO:1) и 5ʹ-GGATCCTCGAAGATCCCTTTGACCAGGATG-3ʹ (SEQ ID NO:2), и обратный праймер 5ʹ-TCAGGCTGAAAATCTCTCATCCGC-3 (SEQ ID NO:3). Экспрессионный плазмид E.coli pTRC-HIS ENO1, содержащий ген кДНК ENO1 человека использовали в качестве шаблона для амплификации делеционных мутантов ENO1. Праймеры с SEQ NO:1 и SEQ NO:2 использовали в качестве прямых праймеров, с SEQ ID NO:3 -в качестве обратного праймера, для амплификации делеционных мутантов Δ1-189 (Фиг. 6A) и Δ1-297 (фиг. 6A), соответственно. Другой набор праймеров с последовательностями 5ʹ-GGATCCTATCTATTCTCAAGATCCATGCC-3ʹ (SEQ ID NO:4) и 5ʹ-CTCGAGGTCATGGTGTCTCATCGTTCGCTCGAG-3ʹ (SEQ ID NO:5) использовали для амплификации делеционного мутанта Δ297-434 (на фиг. 6A). Для амплификации каждого мутанта получали реакционный раствор, состоящий из 1 микролитра разведенной 1:1000 шаблонной ДНК приблизительно 0,1нг, 5 микролитров 10× реакционного буфера, 1 микролитра 10 мМ смеси дНТФ, 1 микролитра 2,5 е.а. ДНК-полимеразы Taq, 1 микролитра прямого праймера и 1 микролитра обратного праймера, доводя до конечного объема, составляющего 50 микролитров, с помощью бидистиллированной воды и подвергали ПЦР. Использовали цикл при 94 градусах Цельсия в течение 10 минут, затем цикл при 94 градусах Цельсия в течение одной минуты, при 52 градусах Цельсия в течение одной минуты и при 72 градусах Цельсия в течение 1 минуты повторяли 35 раз, и реакцию инкубировали при 72 градусах Цельсия в течение 10 дополнительных минут. Этот реакционный раствор подвергали 2% электрофорезу в агарозном геле для анализа продуктов реакции. Продукты реакции с точными молекулярными массами лигировали в вектор pCR 2,1-TOPO (производства Invitrogen) для субклонирования в соответствии с прилагаемой инструкцией. Затем прямой M13 5'-GTAAACAACGACGGCGAG--3'(SEQ ID NO: 6) и обратный M13 5'-CAGGAAACAGCTATGAC--3' (SEQ ID NO: 7) праймеры использовали для определения нуклеотидной последовательности. Каждый мутантный клон с точной последовательностью расщепляли с помощью рестрикционных ферментов BamHI и XhoI, и продукты расщепления подвергали 2% электрофорезу в агарозном геле. Фрагмент с вставкой каждого мутанта вырезали из агарозного геля и очищали с помощью набора Gene Clean Kit в соответствии с прилагаемой инструкцией производителя (BIO101). Фрагмент ДНК BamHI и XhoI каждого мутанта лигировали в сайтах BamHI и XhoI экспрессионого вектора E.coli pTRC His A (Invitrogen). Получаемую в результате плазмиду трансформировали в E.coli BL21 Rosseta. Мутантный белок ENO1 экспрессировали в E.coli посредством индукции IPTG и очищали с помощью Ni-агарозы в соотвесттвии с прилагаемой инструкцией производителя (Qiagen) после подвержения действию ультразвука бактериального осадка. Чистоту каждого мутанта анализировали с помощью 12% ДСН-ПААГ-электрофореза. Для определения активности связывания каждого мутантного белка 400 нг каждого мутантного белка ENO1 человека наносили на 96-луночный планшет ELISA, и планшет промывали с помощью ФБР. К планшету добавляли 10 микрограммов EN10 mAb и планшет инкубировали при 37°C в течение 1 часа. После промывки связующего комплекса два раза с помощью ФБР добавляли антимышиный IgG козы, конъюгированный с гипоксантингуанин-фосфорибозилтрансферазой, через 1 час инкубации добавляли ТМБ. Аффинность связывания определяли считыванием OD 405. Каждое исследование повторяли три раза. Данные представлены как среднее ± стандартное отклонение. Для сравнения активности между группами использовали T-критерий. Значения P <0,05 считали статистически значимыми.
Результаты показаны на ФИГ. 6A. Мутанты ENO1 Δ1-189 и Δ1-297 считывали при OD405 приблизительно 1,43 ± 0,18 и 1,56 ± 0,08 (N=3) (на ФИГ. 6A), что соответствует приблизительно 42% и 39% ENO1 дикого типа (2,87 ± 0,08) (N=3). Однако когда аминокислотные остатки с 297 по 434 удаляли, активность связывания этих мутированных ENO1 с EN10 mAb утрачивалась на фоне БСА. Данные результаты позволяют предположить, что аминокислотные остатки с 297 по 434 необходимы для связывания белка ENO1 с EN10 mAb, и снижение активности связывания мутантов Δ1-182 и Δ1-297 может быть вызвано нестабильностью или изменением структуры мутантных белков.
Для дальнейшего изучения эпитопа EN10 mAb в белке ENO1 создавали 5 обратных праймеров с последовательностями 5ʹ-CTCGAGAGGGATCTTCGATAGACACCACTGGG-3ʹ (SEQ ID NO:8), 5ʹ-CTCGAGCTACCTGGATTCCTGCACTGGCTG-3ʹ (SEQ ID NO:9), 5ʹ-CTCGAGACTTCTCGTTCACGGCCTTGGCGATC-3ʹ (SEQ ID NO:10), 5ʹ- CTCGAGACTTCTCGTTCACGGCCTTGGCGATCC-3ʹ (SEQ ID NO:11), 5ʹ-CTCGAGCAGTCTCCCCCGAACGATGAGACACC-3ʹ (SEQ ID NO:12) и 5ʹ- CTCGAG CACCAGTCTTGATCTGCCCAGTGCAC-3ʹ (SEQ ID NO:13). Экспрессионный плазмид E.coli pTRC-HIS ENO1, содержащий ген кДНК ENO1 человека использовали в качестве шаблона для амплификации делеционных мутантов ENO1. SEQ ID NO:4 использовали в качестве прямого праймера для амплификации делеционных мутантов 296-434, 316-434, 336-434, 376-434 и 396-434 с прймерами SEQ ID NO:8, SEQ ID:9, SEQ ID:10, SEQ ID:11, SEQ ID:12 и SEQ ID:13, соответственно. Для амплификации каждого мутанта получали реакционный раствор, состоящий из 1 микролитра раствора 1:1000 шаблона ДНК приблизительно 0,1 нг, 5 микролитров 10× реакционного буфера, 1 микролитра 10 мМ смеси дНТФ, 1 микролитра 2,5 е.а. ДНК-полимеразы Taq, 1 микролитра прямого праймера и 1 микролитра обратного праймера, доводя до конечного объема, составляющего 50 микролитров, с помощью бидистиллированной воды и подвергали ПЦР. Использовали цикл при 94 градусах Цельсия в течение 10 минут. Затем цикл при 94 градусах Цельсия в течение одной минуты, при 52 градусах Цельсия в течение одной минуты и при 72 градусах Цельсия в течение 1 минуты повторяли 35 раз, и реакцию инкубировали при 72 градусах Цельсия в течение 10 дополнительных минут. Этот реакционный раствор подвергали 2% электрофорезу в агарозном геле для анализа продуктов реакции. Продукты реакции с точными молекулярными массами лигировали в вектор pCR 2,1-TOPO вектор (производства Invitrogen) для субклонирования в соответствии с прилагаемой инструкцией. Прямой M13 (5'-GTAAACAACGACGGCGAG--3' (SEQ ID NO:6), а затем обратный M13 (5'-CAGGAAACAGCTATGAC--3' (SEQ ID NO:7) праймеры использовали для определения нуклеотидной последовательности. Каждый мутантный клон с точной последовательностью расщепляли с помощью рестрикционных ферментов BamHI и XhoI и продукт расщепления подвергали 2% электрофорезу в агарозном геле и очищали с помощью набора Gene Clean Kit в соответствии с прилагаемой инструкцией производителя (BIO101). Фрагмент ДНК BamHI и XhoI каждого мутанта лигировали в сайтах BamHI и XhoI экспрессионого вектора E.coli pTRC His A (Invitrogen). Получаемую в результате плазмиду трансформировали в E.coli BL21 Rosseta. Мутантный белок ENO1 экспрессировали в E.coli посредством индукции IPTG и очищали с помощью Ni-агарозы в соответствии с прилагаемой инструкцией производителя (Qiagen) после подвержения действию ультразвука бактериального осадка. Чистоту каждого мутанта анализировали посредством 12% ДСН-ПААГ-электрофореза. Для определения активности связывания каждого мутантного белка 400 нг белка ENO1 человека или мутантного белка наносили на 96-луночный планшет ELISA, и планшет промывали с помощью ФБР. 10 микрограммов EN10 mAb добавляли и инкубировали при 37°C в течение 1 часа. После промывки связующего комплекса с помощью ФБР два раза добавляли антимышиный IgG козы, конъюгированный с гипоксантингуанин-фосфорибозилтрансферазой. Через 1 час инкубации добавляли ТМБ. Аффинность связывания определяли считыванием OD 405. Каждое исследование повторяли три раза. Данные представлены как среднее ± стандартное отклонение. Для сравнения активности между группами использовали T-критерий. Значения P <0,05 считаются статистически значимыми.
12% ДСН-ПААГ-электрофорез каждого мутантного белка и белка дикого типа показан на ФИГ. 6B. Молекулярная масса каждого мутанта увеличивается от мутанта 296-343 до дикого типа. Данный результат позволяет предположить, что авторы могут получать цельный белок из каждого мутанта, несмотря на то, что может наблюдаться некоторая деградация в мутантах 336-434 и 376-434. Как показано на ФИГ. 6C, отсутствует значимое отличие между аффинностью связывания EN10 mAb ENO1 дикого типа и таковой делеционных мутантов 336-434, 376-434 и 369-343. Однако когда аминокислотные остатки с 296 по 316 и с 317 по 336 удалены, активность связывания EN10 mAb этих двух мутантов ENO1 утрачивалась по сравнению с на фоне клеточного лизата E.coli. Эти результаты позволяют предположить, что аминокислотные остатки в области с приблизительно 296 по приблизительно 336 (296FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS336, SEQ ID NO:39) играют важную роль в связывании белка ENO1 с EN10 mAb.
Пример 7 Аланиновое сканирование
Для дальнейшего изучения, какие остатки с 296 по 336 ENO1 человека имеют значение для связывания EN10 mAb, кристаллическую структуру ENO1 загружали из базы данных белков (pdb-entry: 2PSN). После проведения анализа структуры аминокислотные остатки D300, W301, G302, Q305, K306, A309, K326, K330, N333, E334 и K335 теоретически будут представлены на поверхности белка и являются кандидатами для мутации для анализа того, что они действительно играют роль в связывании EN10 mAb. 10 из этих 11 остатков были выбраны для мутации на аланин, за исключением A309, который был мутирован на глицин с использованием набора сайт-специфического мутагенеза QuickChange II в соответствии с приложенной инструкцией производителя (Agilent Technology). Следующие мутагенные олигонуклеотиды для аланинового сканирования (таблица 1) получали с помощью Genomics BioScience и Technology Co., Ltd.
ТАБЛИЦА 1: олигопоследовательности
5ʹ-GATCCCTTTGACCAGGATGCCTGGGGAGCTTGGCAG-3ʹ (SEQ ID NO:14)
5ʹ-CTGCCAAGCTCCCCAGGCATCCTGGTCAAAGGGATC-3ʹ (SEQ ID NO: 15)
5ʹ-CCCTTTGACCAGGATGACGCGGGAGCTTGGCAGAAG-3ʹ (SEQ ID NO: 16)
5ʹ-CTTCTGCCAAGCTCCCGCGTCATCCTGGTCAAAGGG-3ʹ(SEQ ID NO:17)
5ʹ-CTTTGACCAGGATGACTGGGCAGCTTGGCAGAAGTTC-3ʹ(SEQ ID NO: 18)
5ʹ-GAACTTCTGCCAAGCTGCCCAGTCATCCTGGTCAAAG-3ʹ (SEQ ID NO:19)
5ʹ-GACTGGGGAGCTTGGGCGAAGTTCACAGCCAGTGCA-3ʹ(SEQ ID NO:20)
5ʹ-TGCACTGGCTGTGAACTTCGCCCAAGCTCCCCAGTC-3ʹ(SEQ ID NO:21)
5ʹ-GGGGAGCTTGGCAGGCGTTCACAGCCAGTGCAGG-3ʹ(SEQ ID NO:22)
5ʹ-CCTGCACTGGCTGTGAACGCCTGCCAAGCTCCCC-3ʹ(SEQ ID NO:23)
5ʹ-GGCAGAAGTTCACAGGCAGTGCAGGAATCCAGGTAG-3ʹ(SEQ ID NO:24)
5ʹ-CTACCTGGATTCCTGCACTGCCTGTGAACTTCTGCC-3ʹ(SEQ ID NO:25)
C5ʹ-TCACAGTGACCAACCCAGCGAGGATCGCCAAGGCC-3ʹ(SEQ ID NO:26)
5ʹ-GCCTTGGCGATCCTCGCTGGGTTGGTCACTGTGAG-3ʹ(SEQ ID NO:27)
5ʹ-CAACCCAAAGAGGATCGCCGCGGCCGTGAACGAGAAG-3ʹ(SEQ ID O:28)
5ʹ-CTTCTCGTTCACGGCCGCGGCGATCCTCTTTGGGTTG-3ʹ (SEQ ID NO:29)
5ʹ-GAGGATCGCCAAGGCCGTGGCCGAGAAGTCCTGCAAC-3ʹ(SEQ ID NO:30)
5ʹ-GTTGCAGGACTTCTCGGCCACGGCCTTGGCGATCCTC-3ʹ(SEQ ID NO:31)
5ʹ-GATCGCCAAGGCCGTGAACGCGAAGTCCTGCAACTG-3ʹ C(SEQ ID NO:32)
5ʹ-GCAGTTGCAGGACTTCGCGTTCACGGCCTTGGCGATC-3ʹ(SEQ ID NO:33)
5ʹ-GCCAAGGCCGTGAACGAGGCGTCCTGCAACTGCCTC-3ʹ(SEQ ID NO:34)
5ʹ-GAGGCAGTTGCAGGACGCCTCGTTCACGGCCTTGGC-3ʹ(SEQ ID NO:35)
5ʹ-CAAGGCCGTGAACGCGGCGTCCTGCAACTGCCTCCTG-3ʹ(SEQ ID NO:36)
5ʹ-CAGGAGGCAGTTGCAGGACGCCGCGTTCACGGCCTTG-3ʹ(SEQ ID NO:37)
Для амплификации каждого мутанта получали реакционный раствор, состоящий из 3 микролитров шаблона ДНК приблизительно 30 нг, 5 микролитров 10× реакционного буфера, 1 микролитра 10 мМ смеси дНТФ, 1 микролитра 2,5 е.а. полимеразы Pfu, 12,5 микролитров 125 нг прямого праймера и 12,5 микролитров 125 нг обратного праймера, доводя до конечного объема, составляющего 50 микролитров, с помощью бидистиллированной воды и подвергали ПЦР. Использовали цикл при 95 градусах Цельсия в течение 10 минут. Затем цикл при 95 градусах Цельсия в течение 30 секунд, 55 градусах Цельсия в течение 30 секунд и 68 градусах Цельсия в течение 6 минут повторяли 16 раз. После проведения реакции ПЦР 1 микролитр DpnI добавляли в каждую ПЦР-пробирку, инкубировали при 37°C в течение 1 часа, а затем DpnI нагревали для инактивации при 80°C в течение 20 минут. Продукты реакции трансформировали до 50 микролитров компетентных клеток XL1-Blue в соответствии с прилагаемой инструкцией (от производителя Invitrogen). Праймер ENO1 R400-420 (5'-GCAAGGGGCACCAGTCTTGATCTG--3' (SEQ ID NO:38)) использовали для определения нуклеотидной последовательности. Каждый мутантный клон плазмиды с точной последовательностью трансформировали в E.coli BL21 Rosseta. Мутантный белок ENO1 экспрессировали в E.coli посредством индукции IPTG и очищали с помощью Ni-агарозы в соответствии с прилагаемой инструкцией производителя (Qiagen) после подвержения действию ультразвука бактериального осадка. Чистоту каждого мутантного белка анализировали с помощью 12% ДСН-ПААГ-электрофореза.
Для определения активности связывания каждого мутантного белка 400нг/100 микролитров белка ENO1 человека или мутировавшего белка ENO1 наносили на 96-луночный планшет ELISA в течение ночи при 4°C, и планшет промывали с помощью ФБР. Планшет блокировали с помощью 1% БСА (масс./об.) в ФБР при комнатной температуре в течение 1 часа, затем снова промывали с помощью 1x ФБР. Первичное антитело (EN10 mAb) 2-кратно серийно разводили до 15 различных концентраций и добавляли к планшету при 37°C в течение 1 часа. После завершения реакции планшет промывали 3 раза с помощью 1× ФБР. Антимышиное козье антитело к HRP в разведении 1/8000 добавляли и инкубировали при 37°C в течение 1 часа, затем планшет промывали 3 раза с помощью 1× ФБР. Затем добавляли субстрат TMB и реакцию оставляли при комнатной температуре в течение 30 минут. Реакцию останавливали с помощью добавления 1N HCl и считывали при OD450 для определения активности. Кажое исследование повторяли три раза. Данные представлены как среднее ± стандартное отклонение. Считывания OD и концентрации антитела использовали для составления диаграммы многократного рассеяния с использованием SigmaplotTM. Значения Kd теоретически рассчитывали с помощью логистической модели с четырьмя параметрами.
Согласно результатам исследования крупнопорционной делеции ENO1, показанным в примере 6, пептидная последовательность296FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS336(SEQ ID NO:39) из остатков под номерами с 296 по 336 необходима для прочного связывания белка ENO1 с EN10 mAb. «Прочное связывание» в рамках изобретения относится к связыванию между специфическим связывающим средством (например, антителом, scFv или фрагментом Fab) и лигандом/мишенью (например, пептидом, белком или клеткой) с константой диссоциации (Kd), составляющей 10 нМ или менее, предпочтительно 1,0 нМ или менее.
С помощью вышеуказанных делеционных экспериментов определяют остатки с 296 по 336 на ENO1 в качестве области для связывания антитела. Для дальнейшей характеризации фактических участков связывания (например, эпитопов) кристаллическую структуру ENO1 загружали из базы данных белков (pdb-entry: 2PSN) для анализа положений остатков из этой области. На поверхности белка представлено одиннадцать аминокислотных остатков, включая D300, W301, G302, Q305, K306, A309, K326, K330, N333, E334 и K335 (фиг. 6A, предполагаемый эпитоп). С использованием сайт-специфического мутагенеза эти 11 аминокислот были мутированы, и полученные в результате мутантные белки экспрессировали в E.coli и очищали, соответственно (фиг. 7B). Каждый очищенный мутантный белок ENO1 анализировали для определения любых изменений Kd (в сравнении со связыванием ENO1) с использованием ELISA.
Результаты указывают на то, что существует три функциональных класса аминокислотных остатков в этих мутантах. Аминокислотные остатки W301 и K330 играют важную роль для связывания белка ENO1 с EN10 mAb. Если эти два аминокислотных остатка были мутированы на аланин, соответственно, активность связывания этих двух мутантов ENO1 с EN10 mAb в значительной степени исчезает. Второй класс аминокислотных остатков включает A309, E334, K335 и D300. Если E334, K335 и D300 были мутированы на аланин или A309 был мутирован на глицин, соответственно, активность связывания этих мутантов ENO1 с EN10 mAb нарушается. Остальные аминокислотные остатки, включая G302, Q305, K306, N333 и K326, принадлежат к группе аминокислотных остатков, не оказывающих значительного влияния на связывание белка ENO1 с EN10 mAb (фиг.7C и таблица II). Эти результаты позволяют предположить, что W301, K330 A309, E334, K335 и D300 играют важную роль для связывания белок-белок между ENO1 и EN10 mAb. Эти аминокислотные остатки принадлежат к последовательностям пептида 1,296FDQDDWGAWQKFTA309 (фиг. 7D, SEQ ID NO:40) и пептида 2,326KRIAKAVNEKS336 (фиг. 7D, SEQ ID NO:41) ENO1, которые могут быть связывающими эпитопами EN10 mAb в аминокислотных остатках под номерами с 296 по 335 (ФИГ. 7D; SEQ ID NO:39) ENO1 человека.
Таблица II: значения Kd мутантов
Пример 8
Результаты примеров 3 и 4 позволяют предположить, что EN10 mAb может нарушать активность рецептора плазминогена ENO1. Это снижение активности рецептора плазминогена ENO1 в свою очередь ингибирует активацию плазминогена, приводя к ослаблению инвазивной способности активированных моноцитов U937. Этот результат также подкрепляется сведениями в литературе, указывающими на то, что моноциты мышей без плазминогена теряют способность к перемешению и инфильтрационную активность у моделей мышей с неинфекционным воспалением (Ploplis, V.A. et al., (1998), Blood, 91:2005-2009).
Для доказательства эффективности EN10 mAb на ингибирование лейкоцитарной инфильтрации in vivo, для исследования использовали модель мыши с неинфекционным воспалением (NII). Двенадцать мышей разделяли на 4 группы, по три мыши в каждой группе. На первые сутки каждая группа получала ФБР, 6 мг/кг массы тела (mpk) Энбрела, 10 мг/кг IgG мыши и 10 мг/кг EN10 mAb (внутрибрюшинно), соответственно. Через два часа каждой мыши инъецировали 200 микрограммов казеина (внутрибрюшинно). Мышей оставляли при 25°C в течение 12 часов. Затем мыши получали такую же дозу такого же лекарственного средства, затем через два часа - 200 микрограммов казеина, соответственно. Спустя три часа мышь вскрывали брюшную полость и собирали жидкость. Подсчитывали общее количество клеток в брюшинной полости в каждой группе. Для определения распределения популяций клеток моноцитов и нейтрофилов, клетки жидкости брюшной полости каждой группы окрашивали с помощью крысиного антитела 1A8 для нейтрофилов и крысиного антитела к BR1 для моноцитов, визуализировали с FITC-конъюгированным козьим антикрысиным IgG (Jackson Lab) и анализировали с помощью проточного цитометра FACScan (Becton Dickinson). Данные представлены как среднее значение ± стандартная ошибка среднего. Для сравнения каждой группы использовали T-критерий. Значения P <0,05 считали статистически значимыми.
Результаты этого исследования показаны на ФИГ. 8A и ФИГ. 8B. Среднее общее количество клеток мышей, получивших 6 мг/кг Энбрела, носителя и 10 мг/кг контрольного IgG составляет 1,5±0,1 × 107 (N=3), 1,8 × 107и4±0,5 × 107(N=3) в брюшной полости, соответственно. Однако когда тем же мышам, получившим казеином, дают 10 мг/кг EN10 mAb, среднее количество клеток в брюшной полости составляет 5±1,2 × 106 (N=3), что значительно ниже, чем у групп, получивших Энбрел, носитель и контрольный IgG. Не обнаружено существенного отличия между группой, получившей 10 мг/кг EN10 mAb, и группой, ранее не подвергнутой экспериментам(3,9±1,2 × 106(N=3))(фиг. 8A).
Когда анализировали клеточные популяции в брюшной полости, количество нейтрофилов составляло приблизительно от 73% до 85% общего количества клеток в брюшной полости, и в данном исследовании не было обнаружено существенного отличия между группами (за исключением группы, не получившей предварительного лечения) (фиг. 8B). Данный результат указывает на то, что EN10 mAb может нарушать активность рецептора плазминогена ENO1, что в свою очередь как у мышей без плазминогена снижает активацию плазминогена в ткани и предотвращает инфильтрацию клеток (например, нейтрофилов) в пораженные участки при воспалении. Таким образом, таргетирование рецептора плазминогена ENO1 с помощью антитела ENO1 представляет возможности для применения в терапии иммунных заболеваний.
Пример 9
Недавние сведения в литературе указывают на то, что моноцитарная играет важную роль в прогрессировании заболевания рассеянного склероза у модели на животных с ЭАЭ. На основании данных в примере 8 была выдвинута гипотеза о том, что нарушение активности рецептора плазминогена ENO1 посредством антитела к ENO1 ослабляет симптомы рассеянного склероза при ЭАЭ у модели на животных. Двенадцати самкам мышей линии CB57/BL/6 в возрасте от семи до 10 недель вводили подкожно 100 микрограммов MOG p35-55 в полном адъюванте Фрейнда, а затем внутрибрюшинно инъецировали 100 нг токсина коклюша. Мышей произвольно разделяли на две группы по 6 мышей в каждой группе. На вторые сутки каждой группе мышей подкожно вводили 200 микролитров 10 мг/кг EN10 mAb и IgG мыши, соответственно. На третьи сутки внутрибрюшинно вводили другую дозу, составляющую 100 нг токсина коклюша. За животными наблюдали ежедневно, и клинические симптомы оценивали следующим образом: 0, отсутствие признаков; 1, снижение тонуса хвоста; 2, слабо выраженный монопарез или парез; 3, острый парапарез; 4, параплегия и или тетрапарез; 5 агония или смерть. Все исследования проводили в соответствии с нормами, предписанными комитетом по уходу за животными и их использованию при центре разработок в области биотехнологии, Тайвань.
Результаты показаны на ФИГ. 9. У каждой группы мышей начали проявляться симптомы ЭАЭ на 7 сутки, и не было значимого отличия в клинических показателях между двумя группами с 7 по сутки. В группе лечения с помощью EN10 mAb мыши достигают фазы плато заболевания на 13 сутки со средним максимальным клиническим показателем, составляющим приблизительно 2,7±032 (N=6). Затем мыши входили в фазу ремиссии ЭАЭ до 28 суток, в это время исследование прекращали. В противоположность этому, мыши, получившие IgG мыши, достигают фазы плато заболевания на 16 сутки со средним максимальным клиническим показателем, составляющим приблизительно 3,3± 0,21 (N=6). Затем эти мыши начинали входить в фазу ремиссии. В конце исследования обе группы имеют одинаковый средний клинический показатель.
Данное исследование указывает на то, что максимальный клинический показатель мыши, получившей лечение с антителом ENO1, ниже и составляет в среднем приблизительно 0,6 по сравнению с мышами, получившими лечение с IgG. Эти данные позволяеют предположить, что ингибирование активности рецептора плазминогена ENO1 с помощью антитела обеспечивает клинический положительный эффект у профилактической модели мыши с ЭАЭ.
Пример 10
В примере 9 результат указывает на то, что введение антитела ENO1 обеспечивает клинический положительный эффект у профилактической модели мыши с ЭАЭ. Для изучения терапевтического эффекта EN10 mAb на РС в следующем исследовании использовали терапевтическую модель мыши с ЭАЭ. 28 самкам мышей линии CB57/BL/6 в возрасте от семи до 10 недель вводили подкожно 100 микрограммов MOG p35-55 в полном адъюванте Фрейнда, а затем внутрибрюшинно инъецировали 100 нг токсина коклюша. На третьи сутки вводили еще одну дозу 100 нг токсина коклюша. За животными наблюдали ежедневно и клинические симптомы оценивали следующим образом: 0, отсутствие признаков; 1, снижение тонуса хвоста; 2, слабо выраженный монопарез или парез; 3, острый парапарез; 4, параплегия и или тетрапарез; 5 агония или смерть. До приблизительно 10 суток, когда средний клинический показатель мышей составлял приблизительно 0,5, мышей произвольно разделяли на 4 группы по 7 мышей в каждой группе. На 11, 13 и 15 сутки мышам из группы 1 внутрибрюшинно инъецировали 5 мг/кг EN10 mAb. Мышам группы 2 ежедневно давали 15 мг/кг диметилфумарата (ДМФ) дважды в сутки после 11 суток. Мыши группы 3 получали то же, что и мыши группы 2, за исключением того, что этим мышам инъецировали 5мг/кг EN10 mAb внутрибрюшинно на 11, 13 и 15 сутки. Группа 4 была контрольной группой, которой инъецировали носитель; этим мышам ежедневно внутрибрюшинно инъецировали ФБР.
В конце исследования отбирали трех мышей из каждой группы с близким к среднему средним максимальным клиническим показателем, и все их тела перфузировали раствором Буэна. Мозг и спинной мозг этих мышей фиксировали в 10% формалине, рассекали и окрашивали с помощью быстрого голубого Luxol, а также гематоксилина и эозина (H&E). Гистопатологический показатель в очагах демиелинизации при миненгиальном и паренхимальныом воспалении оценивал патолог на основании метода оценки Шакельфорда (Toxicologic Pathology, т. 30, № 1, с. 93-96, 2002) следующим образом: 1, минимальный; 2, слабовыраженный; 3, средний; 4, средний/тяжелый; 5, тяжелый/высокий. Данные представлены как среднее ± стандартная ошибка среднего. Для сравнения каждой группы использовали T-критерий. Значения P <0,05 считали статистически значимыми. Все исследования проводили в соответствии с нормами, предписанными комитетом по уходу за животными и их использованию при центре разработок в области биотехнологии, Тайвань.
Результаты показаны на фигурах 10A, 10B, 1°C и 10D. У каждой группы мышей начала проявляться симптомы ЭАЭ на 10 сутки, и в это время средний клинический показатель составлял приблизительно 0,5. После того, как мышам начали давать испытываемые лекарственные средства на 11 сутки, у мышей, которым вводили 5мг/кг EN10 mAb, 15 мг/кг ДМФ два раза в сутки и комбинацию EN10 mAb с ДМФ, соответственно, начало проявляться замедление возникновения симптомов ЭАЭ. Мыши в каждой группе достигают фазы плато заболевания приблизительно на 27 сутки. В это время средний максимальный клинический показатель групп с носителем, 5мг/кг EN10 mAb, 15 мг/кг ДМФ дважды в сутки, и комбинацией EN10 mAb с ДМФ составляет 4,1± 0,34 (N=7), 2,9±0,16 (N=7), 2,7±0,47 (N=7), и 2,4±0,39 (N=7), соответственно (фиг. 10A). Исследование завершали на 32 сутки, и 3 мыши в группе с носителем погибли по причине прогрессирования заболевания в период исследования. Отсутствует статистическая разница в средних максимальных клинических показателях в каждой группе, даже несмотря на то, что у мышей, получивших 5мг/кг EN10 mAb, 15 мг/кг ДМФ дважды в сутки и комбинацию EN10 mAb с ДМФ появился положительный эффект лечения, о чем свидетельствует снижение среднего максимального клинического показателя, приблизительно 1,2, 1,4 и 1,7, соответственно, по сравнению с группой с носителем.
Эти результаты указывают на то, что ингибирование активности рецептора плазминогена ENO1 посредством антитела показало клинический положительный эффект у терапевтической модели мыши с ЭАЭ, и три дозы 5 мг/кг EN10 mAb обеспечивают схожую эффективность как 15мг/кг ДМФ два раза в сутки. Некоторое синергическое действие наблюдали в группе с комбинацией EN10 mAb с ДМФ (фигуры 10A-10D).
Для изучения положительного эффекта у мышей с заболеванием ЭАЭ, получивших EN10 mAb и ДМФ, также анализировали заболеваемость по гистопатологическим показателям срезов ЦНС этих мышей.Данные для анализа включают общую клиническую гистопатологию, показатель демиелинизации и степень воспаления ЦНС, и исследуемые ткани включают головной мозг, мозжечок, спинной мозг, шейный позвонок, грудной позвонок, поясничный позвонок и крестецРезультаты показаны на фигурах 10B, 1°C и 10D.
Средний общий гистопатологический показатель заболеваемости в группах мышей с носителем, 5мг/кг EN10 mAb, 15 мг/кг ДМФ два раза в сутки и комбинациией EN10 mAb с ДМФ составляет 40,7± 7,1 (N=3), 15±4,4 (N=3), 28±5,2 (N=3) и 13±11,7(N=3), соответственно. Мыши в группе лечения с EN10 mAb и группе с лечением комбинацией EN10 mAb с ДМФ показали статистическую разницу в среднем общем гистопатологическом показателе заболеваемости на мышей по сравнению с группой с носителем, со значениями P, составляющими 0,025 и 0,004, соответственно (фиг.10B). Данный результат указывает на то, что мыши, получившие лечение с EN10 mAb или с комбинацией EN10 mAb с ДМФ имеют общий положительный эффект на патологию и очаги поражения в ЦНС при заболевании ЭАЭ. Результаты сравнения показателя демиелинизации ЦНС показаны на ФИГ. 10C. Средний общий показатель демиелинизации на мыши в ЦНС групп с носителем, 5мг/кг EN10 mAb, 15 мг/кг ДМФ два раза в сутки и с комбинацией EN10 mAb с ДМФ составляет 13± 1,8 (N=3), 4,3±0,7 (N=3), 7±1,0 (N=3) и 3±2,3(N=3), соответственно. Все группы лечения лекарственными средствами показывают статистическую разницу в среднем общей показателе частоты встречаемости демиелинизации на мыши в ЦНС по сравнению с группой с носителем, со значениями P, составляющими 0,01 для группы с EN10 mAb, 0,04 для группы с ДМФ и 0,04 для группы с комбинированным лечением, соответственно. Данный результат указывает на то, что мыши, получившие лечение с EN10 mAb, или ДМФ, или с комбинацией EN10 mAb с ДМФ имеют защиту с помощью лекарственных средств, испытанных в данном исследовании от повреждения, наносимого демиелинизацией ЦНС в ходе течения заболевания ЭАЭ ЦНС демиелинизация damages in the EAE заболевание course. Это исследование также поддерживается данными в литературе о том, что ДМФ обладает эффектом защиты нейронов у пациентов с РС (Moharregh-Khiabani, D. et al., (2009), Current Neuropharmacology, 7:60-64; Oh, C.J. (2012) et al., PLoS ONE, 7:1-10). Три дозы по 5мг/кг EN10 mAb в ходе течения заболевания имеют большую эффективность, чем доза по 30мг/кг ДМФ ежедневно.
Еще одним исследованным параметром является коэффициент часттоты возникновения лейкоцитарной инфильтрации в ЦНС. Результаты показаны на ФИГ. 10D. Средний общий показатель воспаления на мыши в ЦНС в группах с носителем, 5мг/кг EN10 mAb, 15 мг/кг ДМФ два раза в сутки и с комбинацией EN10 mAb с ДМФ составляет 10,3±1,18 (N=3), 6,3±0,9 (N=3), 9±1,0 (N=3) и 2,7±1,3(N=3), соответственно. Мыши в группе лечения с EN10 mAb и грурпе лечения с комбинацией EN10 mAb с ДМФ показывают статистическую разницу в среднем общем показателе воспаления на мыши в ЦНС по сравнению с группой с носителем, со значениями Р, составляющими 0,05 и 0,01, соответственно (фиг. 10D). Однако кажется, что ДМФ не оказывает статистического эффекта на предотвращение проникновения клеток в пораженные участки ЦНС при восплении. Данный результат позволяет предположить, что EN10 mAb или EN10 Mb в комбинации с ДМФ способен предотвратить инфильтрацию лейкоцитами ЦНС, таким образом снижая частоту возникновения патологии в ЦНС, что особенно важно - облегчать симптомы при РС от демиелинизации нейрона ЦНС.
Пример 11
Результат Бея (Bae, S. et al. (2013) J. Immunology. 189:365-372) показывает, что активация активности рецептора плазминогена ENO1 на поверхности моноцитов увеличивает количество провоспалительных цитокинов, например, TNFα и ILβ в МНПК пациента с ревматоидным артритом (РА) и приводит к обострению заболеваний. При сравнении эпитопа антитела, использованного в исследовании Бея, с EN10 mAb, авторы обнаружили, что EN10 mAb связывается с эпитопом, отличным от эпитопа в исследовании Бея. Эпитоп античеловеческого ENO1, использованный в исследовании Бея, расположен в N-концевой и центральной части белка ENO1. Однако эпитоп EN10 mAb находится на аминокислотных остатки с 296 по 336. Два антитела показывают различные агонистические несоответствия рецептора плазминогена. Антитело, использованное в исследовании Бея, демонстрирует агонистическую активность, которая активирует активность рецептора плазминогена ENO1. Однако EN10 mAb показывает антагонистическую активность, когда антитело вводили в стимулированные моноциты человека. Это исследование подкрепляет наши результаты по РС, приведенные в примерах 8, 9 и 10 и исследования Пресслора у модели с воспалением легкого в том, что подавление активности рецептора плазминогена ENO1 на моноцитах предовтращает инфильтрацию активированных моноцитов в участки воспаления. Оба результата позволяют предположить, что терапевтический эффект антител ENO1 при иммунных заболеваниях является эпитоп-зависимым, и некоторые из антител ENO1, такие как то, которое было использовано в исследовании Бея, могут приводить к обострению заболеваний. Для подтверждения эффективности EN10 mAb при РА, проводили исследование с использованием модели грызуна с артритом, индуцированным антителом к коллагену. Самцам мышей линии Balb/c в возрасте шести недель внутривенно инъецировали 1,5 мг/мыши моноклонального антитела к коллаген типа II мыши. Спустя четверо суток мышам внутрибрюшинно вводили 50 микрограммов/мыши ЛПС (E. coli 0111B4). Мышей разделали на 3 группы по три мыши в каждой группе. Каждая группа получала 5мг/кг IgG мыши, 5мг/кг EN10 mAb и 6мг/кг Энбрела, соответственно, на 1, 3, 5 и 7 сутки. За животными наблюдали ежедневно и клинические симптомы оценивали следующим образом: масса тела (ежедневно), плотность подушечки стопы (1, 3, 7 и 10 сутки), индекс выраженности артрита (3, 7 и 10 сутки), патология (10 сутки) и цитокины (ELISA). Данные представлены как среднее ± стандартная ошибка среднего. Для сравнения трех и более групп использовали ANOVA, а затем критерий множественного сравнения Ньюмана-Кейлса. Значения P <0,05 считали статистически значимыми. Все исследования проводили в соответствии с нормами, предписанными комитетом по уходу за животными и их использованию при центре разработок в области боитехнологии, Тайвань. Для анализа цитокинов, вскрывали колени, и синовиальн жидкость промывали ФБР и собирали. Концентрацию цитокинов анализировали с помощью набора Cytokine ELISA kit.
Результат показан на ФИГ. 11A. На 7 сутки средний индекс выраженности артрита в группах с 10 мг/кг EN10 mAb, 6мг/кг Энбрела и с носителем составляет 10±0,54 (N=3), 12±0,8 (N=3) и 12±0,3 (N=3), соответственно. Средний индекс выраженности артрита у мышей, получивших лечение с EN10 mAb, является статистически отличным от группы с носителем со значением P, составляющим 0,0001. На 10 сутки средний индекс выраженности артрита в группах с 10 мг/кг EN10 mAb, 6мг/кг Энбрела и с носителем составляет 8,9±0,53(N=3), 7,2±0,8 (N=3) и 11,7±0,3 (N=3), соответственно. Средний индекс выраженности артрита у мышей, получивших лечение с EN10 mAb и 6мг/кг Энбрела, является статистически отличным от группы с носителем со значением P менее чем 0,0001 (фиг. 11A). Результаты этого исследования указывают на то, что нарушение активности рецептора плазминогена ENO1 с EN10 mAb ослабляло симптомы РА у модели грызуна с артритом, индуцированным антителом к коллагену(CAIA). При анализе цитокинов IL1b и MMP9 в синовиальной жидкости у мышей с CAIA средняя концентрация MMP9 в группах, получивших лечение с EN10 mAb, Энбрелом и с носителем составляет 62,5±5, 34±9,4 и 92,5±11,25 нг/мл (N=3). Средняя концентрация цитокина IL1b в группах, получивших лечение с EN10 mAb, Энбрелом и с носителем составляет 91±15,8, 68,9±31 и 115,6±20 пг/мл (N=3), соответственно. В группах, получивших лечение с EN10 mAb и Энбрелом, происходит снижение количества обоих цитокинов. Исходя из результатов, показанных на ФИГ. 11A, 11B и 11C, можно сделать вывод, что в обоих случаях три дозы по 10 мг/кг EN10 mAb и Enbel оказывают терапевтический эффект ослабления симптомов РА.
Пример 12
Результат из примеров 9, 10 и 11 позволяет предположить, что нарушение активности ENO1 посредством антагонистического антитела к ENO1 ослабляет симптомы РС и ревматоидного артрита у моделей мыши с ЭАЭ и CAIA.
Авторы предполагают, что схожий эпитоп ENO1 мыши является эффективным при схожих аутоиммуных заболеваниях мыши. Приобретали 10 мг белка ENO1 мыши для создания крысиного антимышиного антитела к ENO1 от Genescript Inc. (Piscataway, NJ, США). Для скрининга гибридом, секретирующих крысиное антимышиное антитело ENO1 четыреста нанограммов белка ENO1 мыши наносили на 96-луночный планшет ELISA и затем планшет промывали с помощью ФБР. К планшету добавляли серийные разведения из каждого супернатанта гибридомы, и планшет инкубировали при 37°C в течение 1 часа. Добавляли антикрысиный IgG козы, конъюгированный с гипоксантин- фосфорибозилтрансферазой (HPRT). Через 1 час добавляли 3,3ʹ,5,5ʹ-тетраметилбензидин (TMB) и считывали при OD405. Затем использовали 75 положительных клонов из 30000 гибридом со значительной аффиннностью связывания ENO1 мыши для проведения анализа конкуренции EN10 mAb (фиг.12A). Планшет ELISA, покрытый белком ENO1 мыши, использовали для связывания отдельных супернатантов (приблизительно 100 микролитров) положительных клонов гибридом. После того, как планшет трижды промыли с помощью ФБР, к планшету добавляли 100 нанограмм EN10 mAb, и планшет инкубировали при 370c в течение одного часа. Добавляли антикрысиный IgG козы, конъюгированный с гипоксантин-фосфорибозилтрансферазой (HPRT). Через 1 час добавляли 3,3ʹ,5,5ʹ-тетраметилбензидин (TMB) и считывали при OD405. Результат показан на ФИГ.12B. Только 5 из 75 супернатантов гибридом обладают активностью связывания ENO1 мыши по сравнению с EN10 mAb. Данный результат позволяет предположить, что эти 5 крысиных антимышиных антител к ENO1 могут иметь эпитоп в ENO1 мыши, схожий с эпитопом EN10 mAb в ENO1 человека.
Пример 13
Для оценки аффинности связывания 5 антимышиных антител к ENO1 гибридомы выращивали в 25 мл бессывороточной среды (Gibco Inc). Спустя одну неделю культивирования собирали отдельный супернатант. Антитело дополнительно очищали с помощью 40% сульфата аммония и колонки с белком A (набор для очистки антитела Montage antibody purification kit от Millipore). Очищенное антитело концентрировали с помощью устройства центрифужного фильтра Amicon, соблюдая инструкцию производителя (Millpore Inc).
Четыреста нанограммов белка ENO1 мыши наносили на 96-луночный планшет ELISA, и планшет дополнительно промывали с помощью ФБР. К планшету добавляли серийные разведения от 1 × 10-12до1 × 10-8 M индивидуального антитела и планшет инкубировали при 37°C в течение 1 часа. Добавляли антикрысиный IgG козы, конъюгированный с гипоксантин-фосфорибозилтрансферазой (HPRT). Через 1 час добавляли 3,3ʹ,5,5ʹ-тетраметилбензидин (TMB) и считывали при OD405. Каждое исследование повторяли три раза. Данные представлены как среднее ± стандартное отклонение. Считывания OD концентрации антител использовали для получения диаграммы многократного рассеяния с использованием Sigmaplot. Значения Kd теоретически рассчитывали посредством логистической модели с четырьмя параметрами.
Результаты этого эксперимента показаны на ФИГ. 13. Значение Kd индивидуальных антител варьируются от 3,90 ± 0,66 × 10-10M (N=3) до 3,39 ± 1,89 X10-8 M(N=3). Ввиду низкой продуктивности клона 12D9, для дальнейшего исследования был выбран 7E5.
Пример 14
В примерах 9 и 10 результат указывает на то, что введение антитела ENO1 обеспечивает клинический положительный эффект у профилактической и терапевтической модели мыши с ЭАЭ. Для изучения того, оказывает ли 7E5 подобный терапевтический эффект EN10 mAb на РС, терапевтическую модель мыши с ЭАЭ использовали в следующем исследовании. 18 самкам мышей линии CB57/BL/6 в возрасте от семи до 10 недель вводили подкожно 100 микрограммов MOG p35-55 в полном адъюванте Фрейнда, а затем внутрибрюшинно инъецировали 100 нг токсина коклюша. На третьи сутки вводили еще одну дозу 100 нг токсина коклюша. За животными наблюдали ежедневно, и клинические симптомы оценивали следующим образом: 0, отсутствие признаков; 1, снижение тонуса хвоста; 2, слабо выраженный монопарез или парез; 3, острый парапарез; 4, параплегия и или тетрапарез; 5 агония или смерть. До приблизительно 10 суток, когда средний клинический показатель мышей составлял приблизительно 0,5, мышей произвольно разделяли на 3 группы по 6 мышей в каждой группе. На 11, 13 и 15 сутки мышам группы 1 подкожно инъецировали 5мг/кг 7E5 mAb. Мышам группы 2 подкожно инъецировали 20000 единиц бетаферона. Группа 3 была контрольной группой, которой подкожно вводили носитель ФБР.
По окончании исследования отбирали трех мышей с близкими к средним максимальным клиническим показателям из каждой группы, и все их тела перфузировали раствором Буэна. Мозг и спинной мозг этих мышей фиксировали в 10% формалине, рассекали и окрашивали с помощью быстрого голубого Luxol, а также гематоксилина и эозина (H&E). Гистопатологический показатель в очагах демиелинизации при миненгиальном и паренхимальныом воспалении оценивал патолог на основании метода оценки Шакельфорда (Toxicologic Pathology, т. 30, № 1, с. 93-96, 2002) следующим образом: 1, минимальный; 2, слабовыраженный; 3, средний; 4, средний/тяжелый; 5, тяжелый/высокий. Данные представлены как среднее ± стандартная ошибка среднего. Для сравнения каждой группы использовали T-критерий. Значения P <0,05 считали статистически значимыми. Все исследования проводили в соответствии с нормами, предписанными комитетом по уходу за животными и их использованию при центре разработок в области биотехнологии, Тайвань.
Результаты показаны на фигурах 14A, 14B, 14C и 14D. В каждой группе мышей начали проявляться симптомы ЭАЭ на 10 сутки, и в то время средний клинический показатель составил приблизительно 0,5. После того, как мыши начали получать испытываемые лекарственные средства на 11 сутки, у мышей, которым вводили 5мг/кг 7E5 mAb и 20000 единиц бетаферона, соответственно, начало проявляться замедление возникновения симптомов ЭАЭ. Мыши в каждой группе достигают фазы плато заболевания приблизительно на 27 сутки. В это время средние максимальный клинический показатель групп с носителем, 5мг/кг 7E5 mAb и 20000 единицами бетаферона составляют 2,6± 0,9 (N=6), 1,6± 0,5 (N=6), и 2,1±0,4 (N=6), соответственно (фиг. 14A). Отсутствует статистическая разница в средних максимальных клинических показателях в каждой группе, даже несмотря на то, что у мышей, получивших 7E5 mAb и 20000 единиц бетаферона, появился положительный эффект лечения, о чем свидетельствует снижение среднего максимального клинического показателя, приблизительно 1,0 и 0,5, соответственно, по сравнению с группой с носителем. Эти результаты указывают на то, что антитело 7E5 обеспечивает схожее ингибирование активности рецептора плазминогена ENO1, как и EN10 mAb, которое показало положительный клинический эффект у терапевтической модели мыши с ЭАЭ, даже несмотря на то, что они связываются с различными видами ENO1 со схажим эпитопом.
Для изучения положительного эффекта у мышей с заболеванием ЭАЭ, получивших 7E5 mAb и бетаферон, также анализировали заболеваемость по гистопатологическим показателям срезов ЦНС этих мышей. Данные для анализа включают общую клиническую гистопатологию, показатель демиелинизации и степень воспаления ЦНС, и исследуемые ткани включают головной мозг, мозжечок, спинной мозг, шейный позвонок, грудной позвонок, поясничный позвонок и крестец. Результаты показаны на фигурах 14B, 14C и 14D.
Средний общий гистопатологический показатель заболеваемости у мышей в группах с носителем, 5мг/кг 7E5 mAb и 20000 единицами бетаферона составляет 40,7 ± 6,8 (N=3), 14,7±9. (N=3) и 41,8±3,4 (N=3), соответственно. Мыши в группе лечения с 7E5 mAb показаи статистическую разницу в среднем общей гистопатологическом показателе заболеваемости на мыши по сравнению с группой с носителем, со значением P, составляющим 0,025 (фиг. 14B). Данный результат указывает на то, что мыши, получившие лечение с 7E5 mAb, имеют общий положительный эффект на патологию и очаги воспаления в ЦНС при заболевании ЭАЭ. Результаты сравнения показателя демиелинизации ЦНС показаны на ФИГ. 14C. Средний общий показатель демиелинизации в ЦНС на мыши в группах с носителем, 5мг/кг 7E5 mAb и 20000 единицами бетаферона составляет 12,2± 0,8 (N=3), 5,1±1,4 (N=3) и 9,1±1,1(N=3), соответственно. Группа с 7E5 mAb показывает статистическую разницу в среднем общем показателе встречаемости демиелинизации на мыши в ЦНС по сравнению с группой с носителем, со значением P, составляющим 0,01. Данный результат указывает на то, что мыши, получившие лечение 7E5 mAb, имеют защиту с помощью лекарственных средств, испытанных в данном исследовании, от повреждения, наносимого демиелинизацией ЦНС в ходе течения заболевания ЭАЭ.
Показатель отслеживания лейкоцитарной инфильтрации в ЦНС является другим исследуемым параметром. Результаты показаны на ФИГ. 14D. Средний общий показатель воспаления в ЦНС у мышей в группах с носителем, 5мг/кг 7E5 mAb и 20000 единицами бетаферона составляет 10.±1,9 (N=3), 4,6±2,7 (N=3) и 9,2±2,6 (N=3), соответственно. Мыши в группе лечения с 7E5 mAb показывают статистическую разницу в среднем общем показателе воспаления в ЦНС по сравнению с группой с носителем, со значением P, составляющим 0,05 (фиг. 14D). Однако кажется, что бетаферон не оказывает статистического эффекта в предотвращении проникновения клеток в пораженные участки ЦНС при воспалении. Это результат позволяет предположить, что так же, как EN10 mAb, 7E5 mAb способен препятствовать инфильтрации лейкоцитами в ЦНС, таким образом снижая частоту возникновения патологии в ЦНС, что особенно важно - облегчать симптомы при РС от демиелинизации нейрона ЦНС. Наши результаты позволяют предположить, что пептидная область ENO1 человека из аминокислот под номерами с 296 по 336 (SEQ ID NO:39), включая пептидные последовательности FDQDDWGAWQKFTA (SEQ ID NO:40) и KRIAKAVNEKS (SEQ ID NO:41), играет важную роль для ингибирования антителом активности рецептора плазминогена и в качестве терапевтического средства для лечения иммунных заболеваний, опосредованных иммунными моноцитами, даже у мышей механизм действия является эффективным.
Результаты, приведенные в примерах 9, 10 11 и 14, указывают на то, что ингибирование активности рецептора плазминогена ENO1 с помощью антител к ENO1, независимо от вида, может снижать активацию плазминогена, ингибировать каскад UPAS и уменьшать ослабление активности внеклеточного матрикса. В результате ингибируется инфильтрация моноцитов воспаления для повреждения пораженных клеток, и это ингибирование ослабляет симптомы воспаления при NII, РС при ЭАЭ, и РА у моделей с артритом, индуцированным антителами к коллагену. Таким образом, таргетирование рецептора плазминогена ENO1 на поверхности активированных клеток (таких как моноциты) можно использовать для лечения воспалительных заболеваний, и антитело к ENO1 к пептидной области ENO1 человека из аминокислот под номерами с 296 по 336 (SEQ ID NO:39), включая пептидные последовательности FDQDDWGAWQKFTA (SEQ ID NO:40) и KRIAKAVNEKS (SEQ ID NO:41), пригодно в качестве терапевтического лекарственного средства для пациентов с иммунным заболеванием.
Несмотря на то, что изобретение описано в отношении ограниченного количества вариантов осуществления, специалистам в данной области, имеющим преимущество настоящего описания, будет понятно, что могут быть разработаны другие варианты осуществления в пределах объема изобретения, как описано в настоящем документе. Таким образом, объем изобретения должен быть ограничен только прилагаемой формулой изобретения.
Реферат
Изобретение относится к биотехнологии. Описан способ лечения воспалительного заболевания, включающий введение нуждающемуся в этом индивидууму антитела к ENO1, где антитело специфически связывается с эпитопом на ENO1 и ингибирует активность ENO1 в качестве рецептора плазминогена, где эпитоп расположен в области, состоящей из последовательности 296FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS336 (SEQ ID NO:39) ENO1 человека, где воспалительное заболевание выбрано из группы, состоящей из рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки, хронической обструктивной болезни легких (ХОБЛ), астмы, аллергии, псориаза, атеросклероза и их сочетания. Кроме того, описан способ лечения иммунного расстройства, включающий введение нуждающемуся в этом индивидууму антитела к ENO1, где антитело связывается с эпитопом на ENO1 и ингибирует активность ENO1 в качестве рецептора плазминогена, где эпитоп расположен в области, состоящей из последовательности 296FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS336 (SEQ ID NO:39) ENO1 человека, где иммунное расстройство выбирают из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), сахарного диабета 1 типа, остеопороза, атеросклероза и их сочетания. Представлена фармацевтическая композиция для лечения воспалительного заболевания, содержащая эффективное количество антитела или его фрагмента scFv, Fab или F(ab)2, которое специфически связывается с эпитопом на ENO1 и ингибирует активность ENO1 в качестве рецептора плазминогена, где эпитоп расположен в области, состоящей из последовательности 296FDQDDWGAWQKFTASAGIQVVG DDLTVTNPKRIAKAVNEKS336 (SEQ ID NO:39) ENO1 человека, где воспалительное заболевание выбрано из группы, состоящей из рассеянного склероза, ревматоидного артрита, болезни Крона, язвенного колита, системной красной волчанки, хронической обструктивной болезни легких (ХОБЛ), астмы, аллергии, псориаза, атеросклероза и их сочетания. Кроме того, представлена фармацевтическая композиция для лечения иммунного расстройства, содержащая эффективное количество антитела или его фрагмента scFv, Fab или F(ab)2, которое специфически связывается с эпитопом на ENO1 и ингибирует активность ENO1 в качестве рецептора плазминогена, где эпитоп расположен в области, состоящей из последовательности 296FDQDDWGAWQKFTASAGIQVVG DDLTVTNPKRIAKAVNEKS336 (SEQ ID NO:39) ENO1 человека, где иммунное расстройство выбирают из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), сахарного диабета 1 типа, остеопороза, атеросклероза и их сочетания. Изобретение расширяет арсенал средств для лечения воспалительных и иммунных расстройств. 4 н. и 7 з.п. ф-лы, 14 ил., 2 табл., 2 пр.

Комментарии