Антитело, связывающееся с карбоангидразой, и его применение - RU2727682C1
Код документа: RU2727682C1
Чертежи
































Описание
Область изобретения
Настоящее изобретение относится к антителу, которое распознает и связывает карбоангидразу, молекуле нуклеиновой кислоты, кодирующей это антитело или его антигенсвязывающий фрагмент, вектору, несущему эту молекулу нуклеиновой кислоты, клетке-хозяину, включающей в себя молекулу нуклеиновой кислоты или вектор, и применению антитела или его антигенсвязывающего фрагмента в облегчении, профилактике, лечении или диагностике связанных с карбоангидразой заболеваний, например солидных опухолей.
Предшествующий уровень техники
Карбоангидраза (СА) образует семейство ферментов, которые катализируют быстрое взаимное превращение диоксида углерода и воды в бикарбонат и протон или их обратное превращение для поддержания гомеостаза рН в организме. Активный центр большинства карбоангидраз содержит ион цинка, поэтому их относят к металлоферментам.
В состав семейства карбонагидраз входит несколько представителей. Они составляют по меньшей мере пять отдельных семейств СА (α, β, γ, δ и ε). α-СА обнаружены у млекопитающих. α-СА делят на четыре широкие подгруппы, которые, в свою очередь, состоят из нескольких изоформ: цитозольных СА (CA-I, СА-II, СА-III, CA-VII и СА-XIII), митохондриальных СА (CA-VA и CA-VB), секретируемых СА (CA-VI) и мембраносвязанных СА (CA-IV, CA-IX, СА-XII, CA-XIV и CA-XV).
Изоферменты СА II, IX и XII ассоциированы с неопластическими процессами и являются потенциальными гистологическими и прогностическими биомаркерами некоторых опухолей [Nordfors et al. (2010), ВМС cancer; 10:148]. Представителем семейства генов α-СА с наиболее обширной экспрессией, присутствующим практически во всех тканях и органах человека, является СА-II. Трансмембранный фермент CA-IX впервые стал известен как новый опухолеассоциированный антиген, экспрессирующийся в некоторых типах карцином человека, а также в нормальной ткани желудочно-кишечного тракта. CA-IX функционально связан с клеточной адгезией, дифференцировкой, пролиферацией и онкогенными процессами, и его ферментативная активность сопоставима с СА II. Другой трансмембранный изофермент СА, СА-XII, был впервые обнаружен в нормальной ткани почек и почечно-клеточной карциноме. Дополнительные исследования показали, что он экспрессируется в некоторых других опухолях (Ulmasov et al. (2000)), но также и в некоторых нормальных органах, таких как ободочная кишка и матка. Кроме того, высокая экспрессия СА-II, CA-IX и СА-XII в опухолях, особенно в гипоксических условиях, позволяет предположить, что эти ферменты могут принимать функциональное участие в процессе инвазии, которому способствует повышение кислотности внеклеточного пространства.
Описание изобретения
Техническая задача
В соответствии с одним воплощением в настоящем изобретении предложено антитело, связывающееся с карбоангидразой, и его антигенсвязывающий фрагмент.
В другом воплощении настоящего изобретения предложена молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент, вектор, несущий эту молекулу нуклеиновой кислоты, и клетка-хозяин, включающая эту молекулу нуклеиновой кислоты.
В следующем воплощении настоящего изобретения предложен способ или набор для выявления или диагностики связанного с карбоангидразой заболевания, содержащий антитело, молекулу нуклеиновой кислоты, вектор и/или клетку-хозяина.
Еще в одном воплощении настоящего изобретения предложена композиция для профилактики, лечения или облегчения связанного с карбоангидразой заболевания, содержащая антитело, молекулу нуклеиновой кислоты, вектор и/или клетку-хозяина, или применение антитела, молекулы нуклеиновой кислоты, вектора и/или клетки-хозяина в профилактике, лечении или облегчении связанного с карбоангидразой заболевания.
Еще в одном воплощении настоящего изобретения предложен способ профилактики, лечения или облегчения связанного с карбоангидразой заболевания, включающий введение субъекту со связанным с карбоангидразой заболеванием композиции, содержащей антитело, молекулу нуклеиновой кислоты, вектор и/или клетку-хозяина.
Еще в одном воплощении настоящего изобретения предложена композиция или способ для уменьшения размера солидных опухолей или клеток солидных опухолей или для индуцирования или стимуляции регрессии опухоли.
Техническое решение
Настоящее изобретение относится к антителу, которое распознает и связывает карбоангидразу, молекуле нуклеиновой кислоты, кодирующей это антитело или его антигенсвязывающий фрагмент, вектору, несущему эту молекулу нуклеиновой кислоты, клетке-хозяину, включающей эту молекулу нуклеиновой кислоты или вектор, и применению антитела или его антигенсвязывающего фрагмента в облегчении, профилактике, терапии или диагностике СА-XII-положительных солидных опухолей.
В настоящем изобретении полезно антитело, которое специфично распознает карбоангидразу и связывается с ней. Конкретно антитело по настоящему изобретению связывается с СА-XII. Антигенной детерминантой, то есть эпитопом, с которым связывается антитело по настоящему изобретению, является некаталитическая область, расположенная на N-конце СА-XII. Предпочтительно СА-XII представляет собой фермент человеческого происхождения. В частности, СА-XII человеческого происхождения имеет аминокислотную последовательность SEQ ID NO: 5.
Термин «каталитический домен» хорошо известен в данной области техники и в контексте настоящего изобретения относится к участку СА-XII, в котором протекает катализ карбоновой кислоты до бикарбоната и протонов. Напротив, термин «некаталитический домен» относится к участку, отличающемуся от каталитического домена, в котором протекает катализ карбоновой кислоты до бикарбоната и протонов. В настоящем изобретении некаталитический домен СА-XII представляет собой N-концевой некаталитический домен и может означать пептид, состоящий из 93-х аминокислотных остатков от N-концевого положения 1 до положения 93 в аминокислотной последовательности SEQ ID NO: 5 для СА-XII человеческого происхождения или его фрагмента.
Область антигена, с которой связывается антитело по настоящему изобретению, может представлять собой некаталитическую область или ее фрагмент. Таким образом, эта область антигена может представлять собой пептид, состоящий из аминокислот с 1-й по 93-ю N-конца аминокислотной последовательности SEQ ID NO: 5 или ее фрагмент, либо из аминокислот с 25-й по 93-ю или с 25-й по 57-ю аминокислотной последовательности СА-XII человеческого происхождения изотипа I (SEQ ID NO: 5) или ее фрагмент.
В качестве конкретного воплощения изобретения антигенсвязывающая область или эпитоп, который должно распознавать антитело по настоящему изобретению, представляет собой пептид, имеющий от 7 до 93 последовательных аминокислот, от 7 до 69 последовательных аминокислот, от 7 до 33 последовательных аминокислот, от 14 до 93 последовательных аминокислот, от 14 до 69 последовательных аминокислот, от 14 до 33 последовательных аминокислот, от 19 до 93 последовательных аминокислот, от 19 до 69 последовательных аминокислот или от 19 до 33 последовательных аминокислот, который включает аминокислотную последовательность SEQ ID NO: 1, 2, 3 или 4.
Более конкретно антигенсвязывающая область, или эпитоп, который должно распознавать антитело по настоящему изобретению, представляет собой пептид, имеющий от 7 до 93 последовательных аминокислот или 7 от 69 последовательных аминокислот, который по существу включает аминокислотную последовательность SEQ ID NO: 1, предпочтительно от 14 до 93 последовательных аминокислот или от 14 до 69 последовательных аминокислот, и по существу включает аминокислотную последовательность SEQ ID NO: 2, более предпочтительно от 7 до 14 последовательных аминокислот и по существу включает аминокислотную последовательность SEQ ID NO: 1 в аминокислотной последовательности SEQ ID NO: 2, или наиболее предпочтительно пептид, состоящий из SEQ ID NO: 1 или SEQ ID NO: 2.
В аминокислотной последовательности СА-XII человеческого происхождения SEQ ID NO: 5 аминокислотная последовательность SEQ ID NO: 1 может представлять собой пептид, состоящий из 32-38 последовательных аминокислот, а аминокислотная последовательность SEQ ID NO: 2 может представлять собой от 25 до 38 последовательных аминокислот.
Альтернативно антигенсвязывающая область, или эпитоп, который должно распознавать антитело по настоящему изобретению, представляет собой пептид, имеющий от 14 до 93 последовательных аминокислот или 14 от 69 последовательных аминокислот, который по существу включает аминокислотную последовательность SEQ ID NO: 3 в аминокислотной последовательности SEQ ID NO: 5, предпочтительно от 19 до 93 последовательных аминокислот или от 19 до 69 последовательных аминокислот, и по существу включает аминокислотную последовательность SEQ ID NO: 4 в аминокислотной последовательности SEQ ID NO: 5, более предпочтительно от 14 до 19 последовательных аминокислот и по существу включает аминокислотную последовательность SEQ ID NO: 3 в аминокислотной последовательности SEQ ID NO: 4, или наиболее предпочтительно пептид, состоящий из SEQ ID NO: 3 или SEQ ID NO: 4.
В аминокислотной последовательности СА-XII человеческого происхождения SEQ ID NO: 5 аминокислотная последовательность SEQ ID NO: 3 может представлять собой пептид, состоящий из 39-52 последовательных аминокислот, а аминокислотная последовательность SEQ ID NO: 4 может представлять собой от 39 до 57 последовательных аминокислот.
Аминокислотная последовательность SEQ ID NO: 5, которая представляет собой аминокислотную последовательность СА-XII человеческого происхождения, и эпитопы SEQ ID NO: 1-4 представлены в сводном виде в Таблице 1.


Антитело по настоящему изобретению представляет собой антитело, которое специфично распознает некаталитическую область карбоангидразы и связывается с ней, и включает мышиное антитело, химерное антитело или гуманизированное антитело. Некаталитическая область карбоангидразы представляет собой пептид или его фрагмент, состоящий из N-концевых аминокислот 1-93 в аминокислотной последовательности СА-XII человеческого происхождения изотипа I (SEQ ID NO: 5), пептид или его фрагмент, состоящий из N-концевых аминокислот 25-93, или пептид или его фрагмент, состоящий из N-концевых аминокислот 25-57.
Пример антитела может связываться с пептидом, состоящим из N-концевых аминокислот 1-93 в аминокислотной последовательности СА-XII человеческого происхождения изотипа I (SEQ ID NO: 5), или с пептидом, по существу включающим SEQ ID NO: 1 или предпочтительно SEQ ID NO: 2 в аминокислотной последовательности SEQ ID NO: 5.
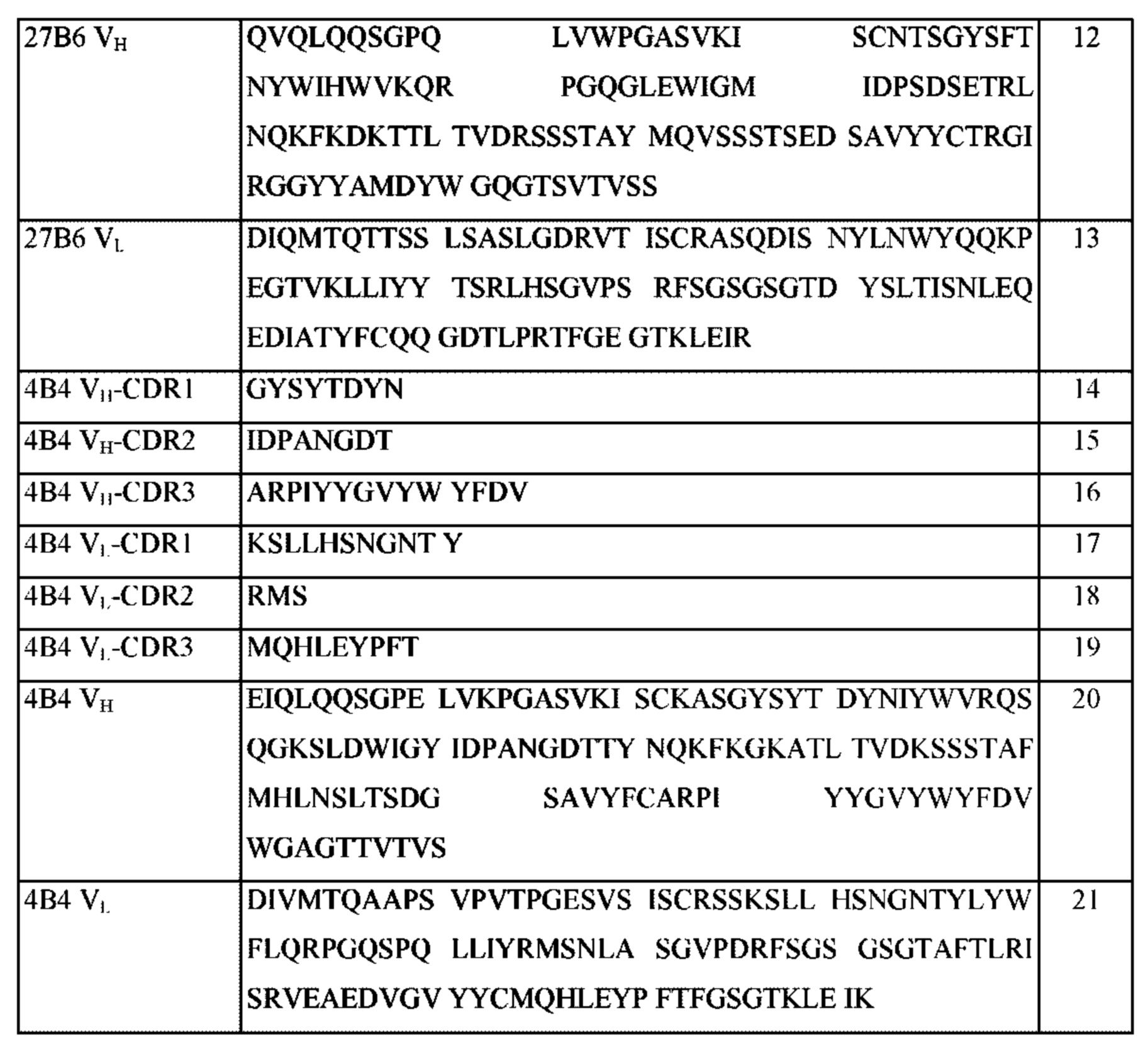
В одном воплощении настоящего изобретения предложено антитело, которое связывается с пептидом, содержащим аминокислотную последовательность SEQ ID NO: 1, где антитело представляет собой CDR(определяющая комплементарность область)1-CDR3 вариабельной области тяжелой цепи и CDR1-CDR3 вариабельной области легкой цепи антитела, продуцируемого клетками гибридомы под номером по каталогу KCLRF-BP-00280. Линия клеток гибридомы была депонирована Научно-исследовательским фондом клеточных линий Кореи Фонда онкологических исследований Сеульского национального университета, расположенным в 28, Yongon-Dong, Chongno-gu, г. Сеул, Корея 14 февраля 2012 г., и ей был присвоен номер по каталогу KCLRF-BP-00280 20 февраля 2012 г. Антитело, продуцируемое гибридомой, депонированной под номером по каталогу KCLRF-BP-00280, обозначено 27В6 и включает вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 12, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13.
Конкретно в соответствии с одним воплощением настоящего изобретения антитело может содержать по меньшей мере одно, выбранное из группы, состоящей из CDR области VH, включающих аминокислотные последовательности SEQ ID NO: 6-8, и CDR области VL, включающих аминокислотные последовательности SEQ ID NO: 9-11. В конкретном воплощении изобретения антитело по настоящему изобретению может содержать аминокислотные последовательности SEQ ID NO: 6 (CDR1), SEQ ID NO: 7 (CDR2) и SEQ ID NO: 8 (CDR3) в качестве CDR для области VH и/или аминокислотные последовательности SEQ ID NO: 9 (CDR1), SEQ ID NO: 10 (CDR2) и SEQ ID NO: 11 (CDR3) в качестве CDR для области VL. Антитело по другому воплощению настоящего изобретения может содержать область VH, включающую аминокислотную последовательность SEQ ID NO: 12 и область VL, включающую аминокислотную последовательность SEQ ID NO: 13.
Пример антитела связывается с пептидом, состоящим из N-концевых аминокислот 1-93 в аминокислотной последовательности СА-XII человеческого происхождения изотипа I (SEQ ID NO: 5, или пептидом, по существу включающим аминокислотную последовательность SEQ ID NO: 3 или предпочтительно SEQ ID NO: 4 в аминокислотной последовательности SEQ ID NO: 5.
В соответствии с одним воплощением настоящего изобретения антитело связывается с пептидом, включающим аминокислотную последовательность SEQ ID NO: 3, и примеры этого антитела могут содержать CDR1-CDR3 вариабельной области тяжелой цепи и CDR1-CDR3 вариабельной области легкой цепи антитела, продуцируемого клетками гибридомы, депонированной под номером по каталогу KCLRF-BP-00279. Линия клеток гибридомы была депонирована Научно-исследовательским фондом клеточных линий Кореи научно-исследовательского института онкологических исследований Сеульского национального университета, расположенным в 28, Yongon-Dong, Chongno-gu, г. Сеул, Корея 14 февраля 2012 г., и ей был присвоен номер по каталогу KCLRF-BP-00279 20 февраля 2012 г. Антитело, продуцируемое гибридомой, депонированной под номером по каталогу KCLRF-BP-00279, обозначено как 4В4 и включает вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20, и вариабельную область легкой цепи, содержащей аминокислотную последовательность SEQ ID NO: 21.
Конкретно антитело в соответствии с одним воплощением настоящего изобретения может включать по меньшей мере одно, выбранное из группы, состоящей из CDR, включающих аминокислотные последовательности SEQ ID NO: 14-16, и CDR, включающих аминокислотные последовательности SEQ ID NO: 17-19, или предпочтительно включает аминокислотные последовательности SEQ ID NO: 14 (CDR1), SEQ ID NO: 15 (CDR2) и SEQ ID NO: 16 (CDR3) в качестве аминокислотных последовательностей, определяющих CDR области VH, и/или аминокислотные последовательности SEQ ID NO: 17 (CDR1), SEQ ID NO: 18 (CDR2) и SEQ ID NO: 19 (CDR3) в качестве аминокислотных последовательностей, определяющих CDR области VL. Антитело по другому воплощению настоящего изобретения может содержать область VH, включающую аминокислотную последовательность SEQ ID NO: 20, и область VL, включающую аминокислотную последовательность SEQ ID NO: 21.
Последовательности CDR и последовательности вариабельной области в соответствии с примером мышиного антитела или химерного антитела, представлены в сводном виде в Таблице ниже.

В соответствии с одним воплощением настоящего изобретения антитело, связывающееся с эпитопом, включающим аминокислотную последовательность SEQ ID NO: 1, и антитело, связывающееся с эпитопом, включающим аминокислотную последовательность SEQ ID NO: 3, могут одновременно связываться с одним и тем же антигеном. Следовательно, эти два антитела могут быть полезны в анализе антигена СА-XII методом сэндвич-варианта ELISA (твердофазный иммуноферментный анализ). В частности, в анализе методом сэндвич-ELISA антитело, связывающееся с эпитопом, включающим аминокислотную последовательность SEQ ID NO: 1, такое как антитело 27В6, можно использовать в качестве захватывающего антитела, при этом связывание антитела с эпитопом, включающим аминокислотную последовательность SEQ ID NO: 3, такого как антитело 4В4, можно использовать в качестве детектирующего антитела.
В соответствии с настоящим изобретением гуманизированное антитело (далее обозначенное в настоящем документе как DNP004), которое связывается с антигеном СА-XII, получают путем использования в качестве матрицы генов вариабельной области легкой цепи и генов вариабельной области тяжелой цепи мышиного моноклонального антитела 4В4 (номер по каталогу KCLRF-BP-00279), специфично связывающегося с СА-XII. Например, гуманизированное антитело может включать по меньшей мере одну CDR, выбранную из группы, состоящей из CDR области VH, содержащих аминокислотные последовательности SEQ ID NO: 14, 15 и 28, и CDR области VL, содержащих аминокислотные последовательности SEQ ID NO: 29, 30 и 31.
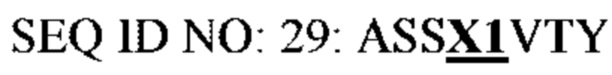

CDR1 области VL в антителе представлена общей формулой SEQ ID NO: 29 и может включать аминокислотную последовательность SEQ ID NO: 32 или 33 в качестве конкретного примера. CDR2 области VL представлена общей формулой SEQ ID NO: 30 и может включать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 33-42, в качестве конкретного примера.
Последовательности CDR и последовательности вариабельной области в соответствии с примером гуманизированного антитела (DNP004) представлены в сводном виде в Таблице ниже. В SEQ ID NO: 32-42 в Таблице 3 полужирным шрифтом выделена модифицированная аминокислота.


Каркасные последовательности, включенные в пример гуманизированного антитела (DNP004) в соответствии с настоящим изобретением, представлены в сводном виде в Таблице 4 ниже, где антитело включает по меньшей мере одно, выбранное из группы, состоящей из каркасных областей 1-4 вариабельной области тяжелой цепи и каркасных областей 1-4 вариабельной области легкой цепи. Аминокислотные последовательности каркасных областей 1-4 вариабельной области тяжелой цепи могут содержать SEQ ID NO: 43-46 соответственно, а аминокислотные последовательности каркасных областей 1-4 вариабельной области легкой цепи включают SEQ ID NO: 47, 48, 51 и 52 соответственно. Каркасная область 2 вариабельной области легкой цепи представлена общей формулой SEQ ID NO: 48 и может включать аминокислотную последовательность SEQ ID NO: 49 или 50 в качестве конкретного примера.

Каркасные последовательности в соответствии с примером гуманизированного антитела (DNP004) представлены в сводном виде в Таблице ниже.


В качестве примера гуманизированное антитело (DNP004) в соответствии с настоящим изобретением может содержать вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 53, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54-63.
Как показано на ФИГ. 31, гуманизированное антитело (DNP004) в соответствии с настоящим изобретением было выбрано из группы антител-кандидатов, обладающих более высокой аффинностью связывания с антигеном по сравнению с химерным антителом 4В4 (пример 16), которая свидетельствует о более высокой аффинности связывания гуманизированного антитела (DNP004) с различными линиями клеток (пример 18). Гуманизированное антитело характеризуется значительно сниженным иммуногенным потенциалом, свойственным мышиному антителу или химерному антителу, и превосходит химерное антитело 4В4.
Антитело или его антигенсвязывающий фрагмент по настоящему изобретению проявляет активность, вызывающую регрессию опухоли, и обладает прямым ингибирующим действием на опухолевые клеточные линии. При использовании в настоящем документе термина «регрессия опухоли» подразумевают, что он охватывает индуцирование или стимуляцию уменьшения размера опухоли и/или ингибирование, нарушение или уменьшение роста опухолевых клеток. Уменьшение размера опухоли означает, что при введении антитела или его фрагмента в соответствии с настоящим изобретением размер опухоли уменьшается, например, до 97% или менее, 95% или менее, 90% или менее, 85% или менее, 80% или менее или 75% или менее от размера опухоли до введения.
Антитело в соответствии с настоящим изобретением проявляет как антителозависимую клеточно-опосредованную цитотоксичность (ADCC), так и комплементзависимую цитотоксичность (CDC).
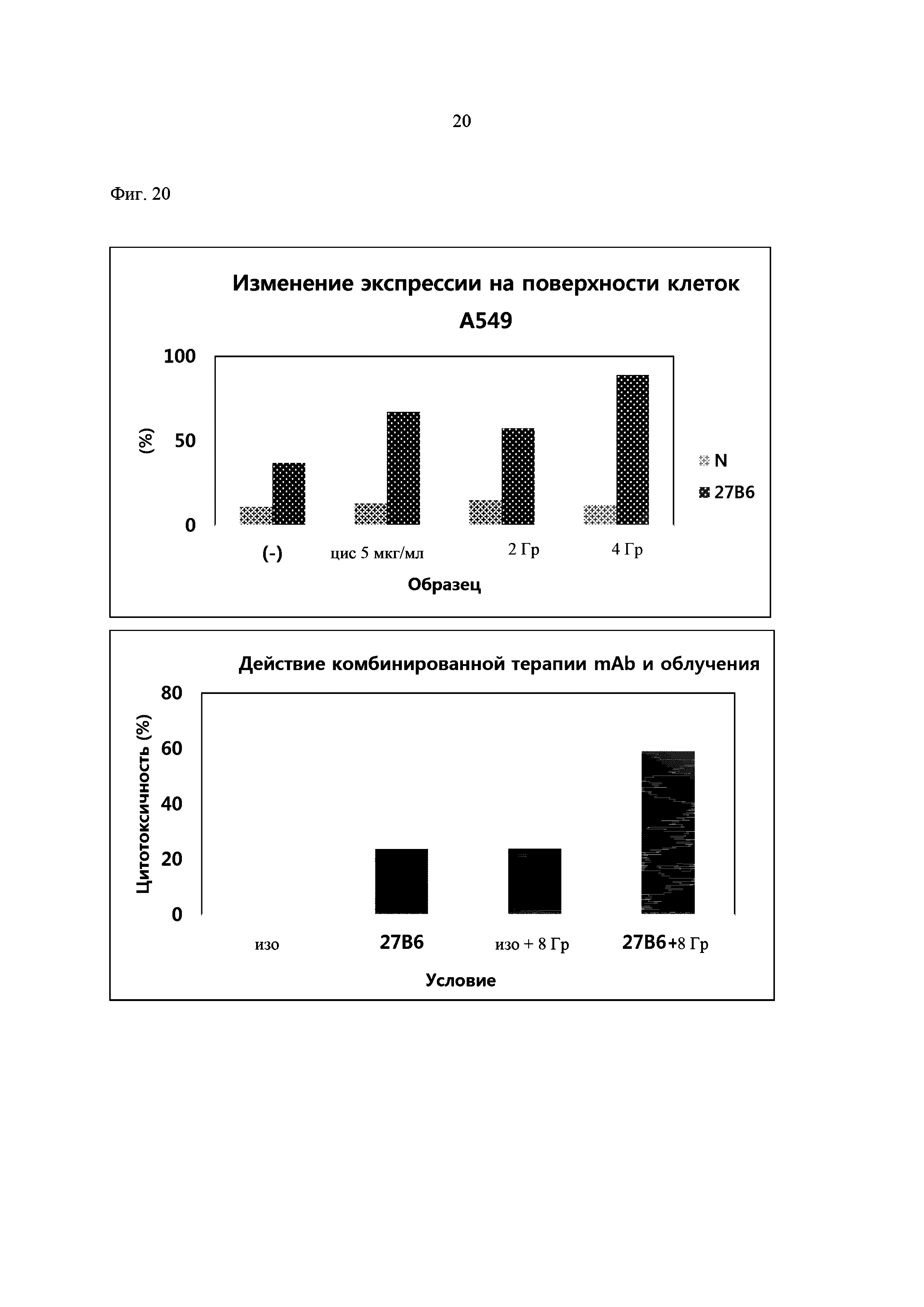
В соответствии с настоящим изобретением антитело может быть полностью или частично дефукозилированным в отношении связанных остатков сахара. Дефукозилированное антитело в соответствии с настоящим изобретением сохраняет активность в отношении ингибирования роста солидных опухолей и стимуляции регрессии опухоли. Например, при дефукозилировании антитело 27В6 и антитело 4В4 проявляют повышенный супрессивный эффект в отношении рака молочной железы, чем в фукозилированном состоянии (Фиг. 14 и 17).
Антитело или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением может не существовать в организме или может представлять собой не встречающееся в природе вещество, например рекомбинантное или синтетическое вещество. Рекомбинантные или синтетические антитела или их антигенсвязывающие фрагменты могут быть получены с использованием методов, хорошо известных в данной области техники.
В дополнение к этому в настоящем изобретении предложено вещество, распознающее определяющую антиген область СА-XII. Это вещество может быть выбрано из группы, состоящей из антитела, фрагмента антитела и лиганда. Антитело может быть поликлональным или моноклональным и может быть получено от человека или животных. Например, антитело может быть моноклональным. Моноклональные антитела могут быть получены известным в данной области техники способом, например методом фагового дисплея. Мышиное антитело и химерное антитело входят в объем определения антитела в соответствии с настоящим изобретением.
Термин «CDR (область, определяющая комплементарность)» относится к аминокислотной последовательности гипервариабельной области тяжелой цепи и легкой цепи иммуноглобулина. Каждая тяжелая цепь и легкая цепь может включать три CDR (CDRH1, CDRH2, CDRH3 и CDRL1, CDRL2, CDRL3). CDR антитела могут обеспечивать необходимый контактный остаток для связывания с антигеном или эпитопом.
Во всем тексте описания термины «специфичное связывание» или «специфичное распознавание» имеют одинаковое значение, которое в целом известно обычному специалисту в данной области техники, показывающее, что антиген и антитело специфично взаимодействуют друг с другом и вызывают иммунологический ответ.
Термин «антигенсвязывающий фрагмент» означает фрагмент полной структуры иммуноглобулина, который представляет собой частичный полипептид, включающий домен, с которым может связываться антиген. Например, он может представлять собой scFv, (scFv)2, scFv-Fc, Fab, Fab' или F(ab')2, но не ограничен ими.
Антитело к СА-XII может представлять собой моноклональное антитело. Моноклональные антитела могут быть получены способами, хорошо известными в данной области техники. Например, они могут быть получены с использованием метода фагового дисплея. Альтернативно антитело к СА-XII может быть получено традиционным способом с использованием моноклонального антитела мышиного происхождения.
С другой стороны, отдельные моноклональные антитела можно подвергать скринингу на основании их способности к связыванию СА-XII с использованием типичного формата ELISA (твердофазного иммуноферментного анализа). Для количественного определения молекулярного взаимодействия конъюгатов для тестирования ингибиторной активности используют функциональные анализы, такие как конкурентный ELISA (ELISA в условиях конкуренции) или анализы на основе клеток. Затем для представителей моноклональных антител, отобранных на основании сильной ингибирующей активности, проводят количественное определение аффинности (величины Kd (константы диссоциации)) каждого антитела.
Наконец, отобранные антитела можно использовать в качестве гуманизированных антител, а также антител, замещенных антителами иммуноглобулинов человека за исключением антигенсвязывающего участка. Способы получения гуманизированных антител хорошо известны в данной области техники (Almagro, J.C. and Fransson, J., \Humanization of antibodies\, Frontiers in Bioscience, 13 (2008), 1619-1633).
В другом воплощении изобретения предложена гибридома, продуцирующая указанное антитело к СА-XII. В одном воплощении изобретения гибридома может иметь номер по каталогу KCLRF-BP-00279 или KCLRF-BP-00280.
В следующем воплощении изобретения предложено антитело к СА-XII, продуцируемое указанной гибридомой, или его антигенсвязывающий фрагмент.
Другие воплощения изобретения включают области, определяющие комплементарность, тяжелой цепи (CDR-H1, CDR-H2, CDR-H3 или их комбинацию) антитела к СА-XII, продуцируемого гибридомой, области, определяющие комплементарность, легкой цепи (CDR-L2, CDR-L3 или их комбинацию) или их комбинацию; альтернативно антитело к СА-XII или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, вариабельную область легкой цепи или их комбинацию антитела к СА-XII, продуцируемого указанной гибридомой. В этот момент область, определяющая комплементарность, может быть определена любым традиционным способом, например определения по базе данных иммуногенетики (IMGT; ImMunoGeneTics Database) (http://www.imgt.org/IMGT_vquest/share/textes/) или определения по Кабат (Cabat) (http://www.imgt.org/IMGT_vquest/share/textes/). bioinf.org.uk/abs/), но не ограниченным ими.
Антитело к СА-XII или его фрагмент можно сшивать с различными маркирующими агентами, токсинами или противоопухолевыми лекарственными средствами. Специалистам в данной области техники будет очевидно, что антитело по изобретению можно сшивать с маркирующим агентом, токсином или противоопухолевым лекарственным средством способом, хорошо известным в данной области техники. Такое сшивание можно проводить химическим путем в месте присоединения после экспрессии антитела или антигена. Альтернативно продукт сшивания может быть сконструирован в антителе или антигене по изобретению на уровне ДНК. Впоследствии ДНК экспрессируют в подходящей системе-хозяине, как описано в настоящем документе ниже, и экспрессированные белки собирают и при необходимости подвергают ренатурации. Сшивание может быть достигнуто посредством линкера, известного в данной области техники. В частности, в данной технологии можно использовать различные линкеры, которые высвобождают токсин или противоопухолевое лекарственное средство в кислых или щелочных условиях или под действием специфичных протеаз. В некоторых воплощениях изобретения может быть желательным присоединение маркирующего агента, токсина или противоопухолевого лекарственного средства к спейсерным группам различной длины, чтобы уменьшить потенциальное стерическое затруднение.
Маркирующий агент может быть выбран из группы, состоящей из радиоизотопа, гаптена, флуоресцентного вещества, хромогена и красителя. В частности, маркирующий агент может быть выбран из FLAG, GFP (зеленый флуоресцентный белок), YFP (желтый флуоресцентный белок), RFP (красный флуоресцентный белок), красителя dTomato, вишнево-красного красителя, Су3, Су5, Су5.5., Су7, DNP (динитрофенол), АМСА (ацетат аминометилкумарина), биотина, дигоксигенина, Tamra (карбокситетраметилродамин), техасского красного, родамина, флуоресцентных красителей Alexa, FITC (флуоресцеинтиокарбамоилэтилендиамин) и TRITC (тетраметилродаминизотиоцианат). Альтернативно маркирующий агент может представлять собой радиоизотоп, такой как, например,3Н,14С,15N,35S,90Y,99Тс,111In,125I или131I. Дополнительные примеры подходящего маркирующего агента включают ферментативные группы (например, пероксидазу хрена, галактозидазу хрена, люциферазу, щелочную фосфатазу), хемилюминесцентные группы, биотинильные группы или заранее определенные полипептидные эпитопы, распознаваемые вторичным белком-репортером.
В настоящем изобретении можно использовать любой токсин в зависимости от того, насколько он токсичен для клеток или организмов. Например, в качестве токсина можно использовать радиоактивный изотоп, малую молекулу, пептид или белок. Антитело или его фрагмент можно сшивать с токсином с образованием слитого белка. В качестве белкового токсина можно использовать рицин, сапорин, гелонин, момордин, дифтерийный токсин или токсин псевдомонад. Что касается радиоактивного изотопа, его примеры включают131I,188Rh и90Y, но не ограничены ими.
При использовании в настоящем документе термином «противоопухолевый агент» обозначают лекарственное средство, способное остановить или замедлить патологический рост тканей. Таким образом, противоопухолевые агенты особенно полезны в лечении злокачественного новообразования. Противоопухолевый агент может представлять собой ингибитор ангиогенеза, интеркалирующий ДНК агент или поперечно сшивающий ДНК агент, ингибитор синтеза ДНК, регулятор транскрипции ДНК-РНК, ингибитор фермента, регулятор гена, ингибитор микротрубочек или другие противоопухолевые агенты.
Настоящее изобретение дополнительно относится к молекуле нуклеиновой кислоты, кодирующей антитело по настоящему изобретению. Молекула нуклеиновой кислоты по настоящему изобретению, кодирующая антитело по настоящему изобретению, может представлять собой, например, ДНК, кДНК (комплементарная ДНК), РНК, полученную синтетическим путем ДНК или РНК или полученную рекомбинантным методом химерную молекулу нуклеиновой кислоты, содержащую любую из этих молекул нуклеиновой кислоты, либо отдельно, либо в комбинации. Молекула нуклеиновой кислоты может также представлять собой геномную ДНК, соответствующую полноразмерному гену или его существенному участку, либо его фрагменту или производному. Нуклеотидная последовательность молекулы нуклеиновой кислоты может представлять собой модифицированную нуклеотидную последовательность, в которой в одном или более нуклеотидных остатков произошла замена, делеция или добавление, вызывающие замену или мутацию по меньшей мере одного аминокислотного остатка в аминокислотной последовательности антитела. В конкретном воплощении настоящего изобретения молекула нуклеиновой кислоты представляет собой молекулу кДНК.
Одно воплощение настоящего изобретения также относится к вектору, содержащему молекулу нуклеиновой кислоты в экспрессируемой форме. Вектор по настоящему изобретению может представлять собой, например, фаг, плазмиду, вирусный вектор или ретровирусный вектор. Ретровирусные векторы могут быть способными реплицироваться или с нарушенной репликацией. В последнем случае размножение вируса будет, как правило, происходить в комплементирующих клетках/хозяевах.
Упомянутая выше молекула нуклеиновой кислоты может быть включена в вектор в качестве вставки таким образом, чтобы произошло ее слияние с другим полинуклеотидом в процессе трансляции. Как правило, вектор может содержать одну или более точек начала репликации (ori) и наследственные системы для клонирования или экспрессии, один или более маркеров для отбора в клетке-хозяине, например устойчивости к антибиотикам, и одну или более экспрессионных кассет. Примеры подходящей точки начала репликации (ori) включают точки начала репликации Col E1, вируса SV40 и фага М13.
В настоящем изобретении молекула нуклеиновой кислоты может быть сконструирована для введения в хозяина, либо непосредственно, либо посредством липосомы, фагового вектора или вирусного вектора (например, аденовирусного вектора, ретровирусного вектора и т.д.). Дополнительно бакуловирусные системы или системы на основе вируса осповакцины или вируса леса Семлики можно использовать как эукариотические экспрессионные системы для молекул нуклеиновой кислоты по настоящему изобретению.
Другое воплощение настоящего изобретения относится к клетке-хозяину, отличающейся от человеческой, включающей в себя вектор по настоящему изобретению. Клетка-хозяин может быть прокариотической или эукариотической. Полинуклеотид или вектор по настоящему изобретению, присутствующий в клетке-хозяине, может быть либо интегрирован в геном клетки-хозяина, либо поддерживаться экстрахромосомно.
В дополнение к этому настоящее изобретение относится к трансгенному животному, отличающемуся от человека, которое можно использовать для получения антитела по настоящему изобретению, содержащему одну или более молекул нуклеиновой кислоты по настоящему изобретению. Антитела можно продуцировать и выделять из тканей или жидкостей организма, таких как молоко, кровь или моча, от коз, коров, лошадей, свиней, крыс, мышей, кроликов, хомяков или других млекопитающих.
Кроме того, в настоящем изобретении предложен способ получения вещества, селективно распознающего определяющую антиген область СА-XII, и линия клеток, продуцирующая антитело, селективно распознающее определяющую антиген область СА-XII. Антитело к определяющей антиген области СА-XII или его фрагмент могут быть получены типичным способом, используя в качестве антигена белок СА-XII, определяющую антиген область СА-XII, участок СА-XII, содержащий определяющую антиген область СА-XII, или клетку, экспрессирующую определяющую антиген область СА-XII. Например, способ получения антитела к СА-XII можно осуществлять посредством способа получения линии клеток, продуцирующей антитело к СА-XII, включающего: (а) инъецирование животному белка СА-XII, определяющей антиген области СА-XII, участка СА-XII, содержащего определяющую антиген область СА-XII, или клетки, экспрессирующей определяющую антиген область СА-XII, и его иммунизацию; (б) получение спленоцитов, продуцирующих антитело, специфчное к СА-XII, и (в) слияние спленоцитов с клетками миеломы с получением клеток гибридомы и отбор клетки гибридомы, продуцирующей антитело к СА-XII. Антитело можно выделять путем культивирования линии клеток in vitro или путем введения линии клеток in vivo. Например, линию клеток можно вводить мышам путем интраперитонеальной инъекции с последующим выделением и очисткой антитела из асцитов. Выделение и очистку моноклональных антител можно осуществлять, подвергая супернатант культуры и асцитов ионообменной хроматографии (DEAE (на диэтиламиноэтилцеллюлозе) или DE52 (на DEAE-целлюлозе-52)) или аффинной хроматографии с использованием колонки с антителом против иммуноглобулина или с белком А.
Определяющую антиген область, с которой связывается антитело по настоящему изобретению, характеризуется специфичной экспрессией в солидных опухолях. Следовательно, антитело к СА-XII можно не только эффективно использовать для выявления опухолевых клеток, но в том случае, когда оно несет токсическое вещество, оно также может оказывать цитотоксическое действие только на опухолевые клетки.
В следующем воплощении настоящего изобретения предложено применение СА-XII, в частности определяющей антиген области, локализованной в некаталитическом домене СА-XII, при обнаружении солидных опухолей. Также предложена композиция для выявления раковых стволовых клеток солидных опухолей, содержащая вещество, взаимодействующее с определяющей антиген областью. Взаимодействующее вещество может представлять собой любое вещество, способное взаимодействовать с СА-XII, в частности определяющей антиген областью CD-XII, локализованной в его некаталитическом домене. В частности, взаимодействующее вещество может быть выбрано из группы, состоящей из низкомолекулярного химического вещества, антитела, антигенсвязывающего фрагмента антитела, аптамера или их комбинации.
В другом воплощении настоящее изобретение относится к диагностической композиции, содержащей антитело по настоящему изобретению, молекулу нуклеиновой кислоты по настоящему изобретению, вектор по настоящему изобретению или клетку-хозяин по настоящему изобретению. Используемый в настоящем документе термин «диагностическая композиция» относится к композиции, содержащей по меньшей мере одно из антитела, молекулы нуклеиновой кислоты, вектора и/или клетки-хозяина по настоящему изобретению.
Диагностическая композиция по настоящему изобретению полезна при выявлении нежелательной экспрессии или сверхэкспрессии СА, в частности СА-XII, в различных клетках, тканях или другом подходящем образце путем приведения в контакт образца с антителом по настоящему изобретению и определения присутствия СА, в частности СА-XII, в этом образце. Соответственно, диагностическая композиция по изобретению может быть доступна для оценки начала или статуса заболевания, как определено в настоящем документе ниже. В частности, антитело по настоящему изобретению или его фрагмент или производное может быть нацелено на злокачественные клетки, например раковые клетки, способные экспрессировать СА, в частности СА-XII. Клетки, связавшие антитело по настоящему изобретению, могут подвергаться атаке со стороны таких функций иммунной системы, как система комплемента или клеточно-опосредованная цитотоксичность, и, следовательно, количество клеток, демонстрирующих нежелательную экспрессию или сверхэкспрессию СА, в частности СА-XII, уменьшается, или происходит их полная эрадикация.
В другом воплощении изобретения антитело по настоящему изобретению или его фрагмент или производное сшиты с маркирующим агентом. Такие антитела особенно подходят для диагностического применения.
Диагностическую композицию по изобретению можно вводить в качестве активного агента отдельно или в комбинации с другими агентами.
Еще одно воплощение настоящего изобретения относится к способу выявления опухолевой клетки, включающему: (а) взаимодействие антитела к СА-XII с образцом, включающим опухолевую клетку, и (б) определение образца как представляющего собой опухоль, если образец положителен в отношении антитела. Образец может включать, без ограничений, лимфоидную жидкость, костный мозг, кровь и кровяные тельца. Опухолевая клетка может предпочтительно представлять собой клетку рака молочной железы, клетку рака легкого, рака ободочной кишки, клетку рака желудка, клетку рака предстательной железы или клетку рака печени.
При использовании для скрининга опухолевых клеток антитело к СА-XII может быть конъюгировано с меткой, способной к выявлению реакционной способности антигена с антителом. Метка, полезная для этой цели, может включать радиоизотоп, флуоресцентное вещество, люминесцентное вещество, хромоген и краситель.
Антитело к СА-XII по настоящему изобретению может быть также предложено в наборе для диагностики солидных опухолей.
Диагностический набор в дополнение к антителу к СА-XII может содержать средства выявления реакции антигена с антителом. Эти средства выявления могут представлять собой агент, полезный для выполнения методики, выбранной из группы, состоящей из проточной цитометрии, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA), радиоиммунологического анализа (RIA), иммуноферментного анализа (EIA), иммунофлуоресцентного анализа (FIA) и иммунолюминесцентного анализа (LIA). В этом контексте метка может представлять собой фермент, такой как HRP (пероксидаза хрена), флуоресцентную метку, такую как FITC (флуоресцеинтиокарбамоилэтилендиамин), люминесцентную метку, такую как люминол, изолюминол и люцигенин, или радиоизотоп, такой как125I,3Н,14С и131I, но не ограничена ими. Конъюгацию с меткой можно определять, используя средства для измерения ферментативной реакции с субстратом, флуоресценции, люминесценции или радиоактивного излучения. Например, антитело к СА-XII может быть подготовлено к применению в наборе для ELISA или в наборе стрипов.
Антитела 27В6 и 4В4 в соответствии с некоторыми воплощениями настоящего изобретения могут одновременно связываться с одним и тем же антигеном, поскольку их эпитопы не перекрываются. Соответственно, эти два антитела могут быть полезны в анализе сэндвич-ELISA на предмет антигена СА-XII. В частности, в сэндвич-ELISA антитело 27В6 можно использовать в качестве захватывающего антитела, а антитело 4В4 может функционировать в качестве детектирующего антитела.
В соответствии с одним его воплощением настоящее изобретение относится к фармацевтической композиции, содержащей антитело, молекулу нуклеиновой кислоты, вектор или клетку-хозяина по настоящему изобретению. Антитело, молекулу нуклеиновой кислоты, вектор или клетку-хозяина по настоящему изобретению применяют для лечения или регрессии солидной злокачественной опухоли. Лечение или регрессия солидных опухолей могут быть достигнуты посредством введения нуждающемуся в этом субъекту молекулы нуклеиновой кислоты, вектора или клетки-хозяина по настоящему изобретению в эффективной дозе.
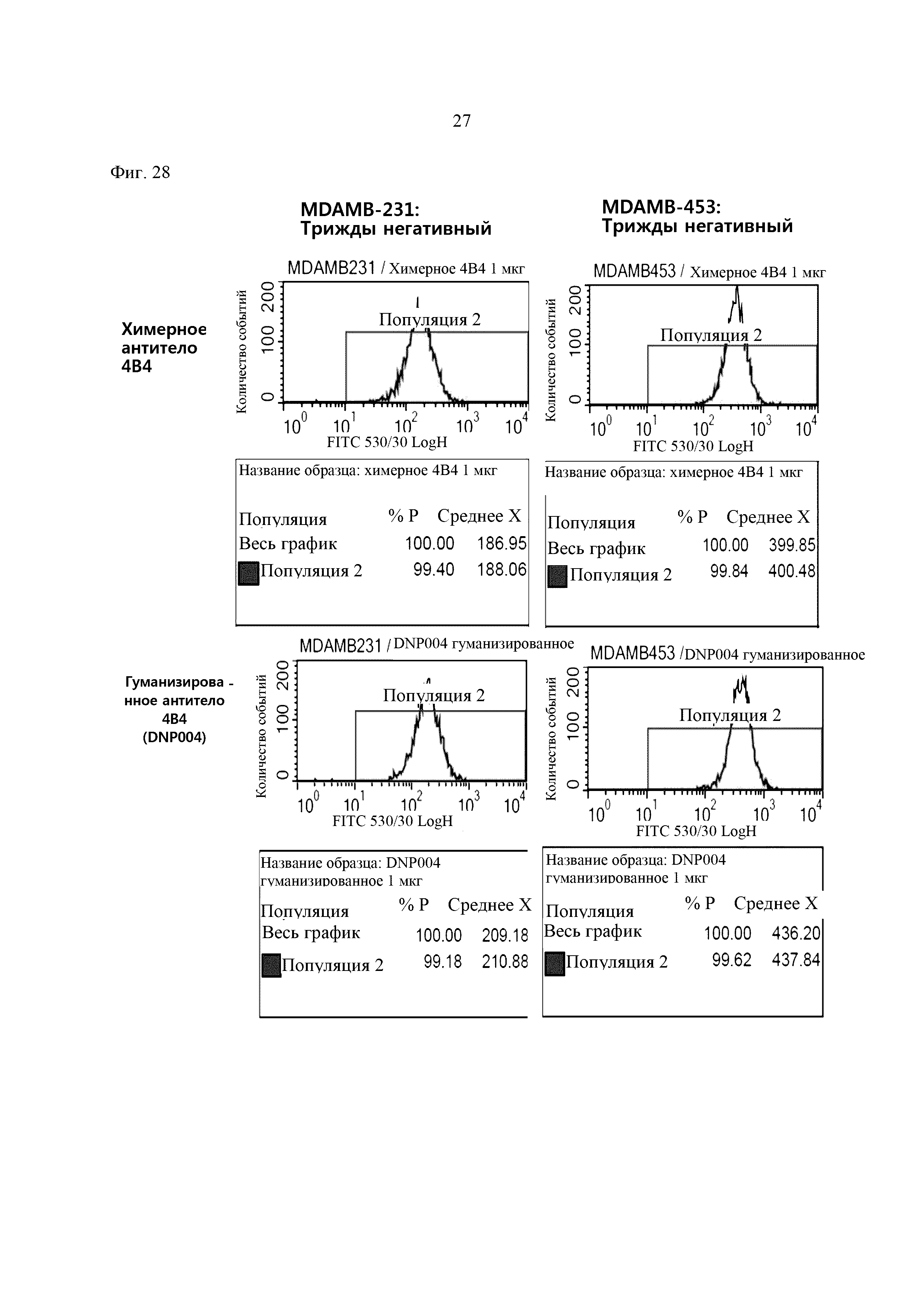
При использовании в настоящем документе термином «солидная опухоль» определяют патологическое тканевое образование, которое обычно не содержит кисты или жидкие области. Солидная опухоль может быть доброкачественной (нераковой) или злокачественной (часто называемой в данной области техники раковой). Примеры солидных опухолей, при которых применимо антитело в соответствии с изобретением, включают саркому, глиому, злокачественное новообразование, мезотелиому, лимфому, рак почки, рак легкого, рак молочной железы, рак шейки матки, рак яичника, рак ободочной кишки, рак печени, рак предстательной железы, рак поджелудочной железы и рак головы и шеи, и предпочтительно рак молочной железы, рак легкого, колоректальный рак, рак желудка, рак предстательной железы или рак печени. Рак молочной железы может представлять собой трижды негативный рак молочной железы (TNBC), который может быть определен как негативный при использовании трех диагностических маркеров HER2, рецептора эстрогена (ER) и рецептора прогестерона (PR), поэтому его очень трудно обнаружить. Рак легкого может представлять собой мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого или плоскоклеточную карциному легкого.
Терапевтический эффект в отношении солидных опухолей в соответствии с настоящим изобретением включает эффекты подавления миграции, инвазии и метастазирования раковых клеток (в частности, раковых стволовых клеток) или тканей, включающих раковые клетки, и, следовательно, ослабления злокачественности раковой опухоли, а также ингибирования ее роста (количественного уменьшения) и апоптоза.
При использовании в настоящем документе термин «субъект» или «пациент» относится к млекопитающему, включая примата, такого как человек, обезьяна и т.д., и грызуна, такого как мышь, крыса и т.д., которое поражено или потенциально может быть поражено солидной опухолью или симптомом и, следовательно, нуждается в облегчении, профилактике и/или лечении солидной опухоли.
Введение антитела или его фрагмента в соответствии с настоящим изобретением можно выполнять любым приемлемым способом. Например, терапевтический агент, включающий антитело к СА-XII в качестве активного ингредиента, вводят субъекту, например человеку или животному, имеющему опухолевые клетки, перорально или парентерально, и предпочтительно парентерально. Этот терапевтический агент может включать фармацевтически приемлемый эксципиент, и доза терапевтического агента может изменяться в зависимости от состояния пациента и находиться в диапазоне от, например, 3 мг до 6000 мг в сутки. Терапевтический агент может находиться в таких формах, как жидкие формы, порошки, эмульсии, суспензии или формы для инъекций, но без ограничения ими.
Дополнительно в настоящем изобретении предложен способ лечения острого или хронического миелогенного или лимфоцитарного лейкоза с применением по меньшей мере одного, выбранного из антитела к определяющей антиген области СА-XII, фрагмента антитела (F(ab')2, Fab, Fv и т.д.) и лиганда к определяющей антиген области СА-XII.
Антитело или его фрагмент могут быть моноклональными или поликлональными и могут быть получены от человека или животных. Антитело к СА-XII или его фрагмент может дополнительно содержать описанный выше токсин. Токсин можно подвергать слиянию, сшиванию, конъюгации или связыванию с антителом, используя хорошо известную методику.
Фармацевтическую композицию по настоящему изобретению можно вводить в виде одного активного агента или в комбинации с любыми другими агентами, предпочтительными для лечения представляющего интерес заболевания. В дополнение к этому антитело по настоящему изобретению можно применять в сочетании с другими видами противораковой терапии, такими как химиотерапия, радиотерапия, цитотерапия и т.д. В химиотерапии или цитотерапии можно применять различные хорошо известные противораковые агенты.
В другом воплощении настоящего изобретения предложен способ скрининга терапевтического агента или ингибитора солидных опухолей, включающий приведение в контакт соединения-кандидата с СА-XII, в частности с определяющей антиген областью, локализованной в некаталитическом домене СА-XII, и отнесения соединения-кандидата к категории потенциальных терапевтических агентов для солидных опухолей, если определено, что соединение-кандидат связывается с определяющей антиген областью. В еще одном воплощении настоящего изобретения предложена фармацевтическая композиция для лечения солидных опухолей, содержащая прошедший скрининг терапевтический агент для солидных опухолей в качестве активного ингредиента.
Соединение-кандидат может представлять собой по меньшей мере одно, выбранное из группы, состоящей из различных синтетических или встречающихся в природе соединений, полипептидов, олигопептидов, пептидов или белковых конструкций (например, антител, антигенсвязывающих фрагментов, пептител, нанотел и т.д.), полинуклеотидов, олигонуклеотидов, антисмысловых РНК, кшРНК (короткой шпилечной РНК), миРНК (малой интерферирующей РНК), аптамеров и экстрактов из натуральных продуктов.
Связывание между соединением-кандидатом и определяющей антиген областью можно определить путем выявления образования комплекса, которое можно выполнять с использованием различных методик, известных в данной области техники. Например, для подтверждения связывания соединения-кандидата с определяющей антиген областью можно определять характерные ферментативные реакции, флуоресценцию, люминесценцию и/или радиоактивное излучение. Подробно методики, доступные для выявления комплекса, включают, без ограничений, иммунохроматографию, иммуногистохимию, твердофазные иммуноферментные анализы (ELISA), радиоиммунологические анализы (RIA), иммуноферментные анализы (EIA), иммунофлуоресцентные анализы (FIA), иммунолюминесцентные анализы (LIA) и Вестерн-блоттинг.
Преимущественные эффекты изобретения
Предложено антитело, распознающее и связывающее карбоангидразу, молекула нуклеиновой кислоты, кодирующая это антитело или антигенсвязывающий фрагмент антитела, вектор, несущий эту молекулу нуклеиновой кислоты, клетка-хозяин, включающая вектор или молекулу нуклеиновой кислоты, и применение антитела или его антигенсвязывающего фрагмента в облегчении, профилактике или диагностике связанных с карбоангидразой заболеваний, например солидных опухолей.
Краткое описание графических материалов
На Фиг. 1 показаны титры мышиного моноклонального антитела 27В6, специфичного к солидной опухоли, в периферической крови, определенные количественно в соответствии с примером 1.
На Фиг. 2 показана антигенная специфичность и аффинность химерного антитела 27В6, определенная количественно в соответствии с примером 2.
На Фиг. 3 проиллюстрирована методика скрининга титров моноклонального антитела 4В4 в периферической крови, определенных количественно в соответствии с примером 3.
На Фиг. 4 показана антигенная специфичность и аффинность химерного антитела 4В4, определенная количественно в соответствии с примером 4.
На Фиг. 5а, 5b и 5с показаны паттерны экспрессии мышиного химерного антитела 4В4 на антигене карбоангидразы 12 в различных клетках рака молочной железы, определенные количественно в соответствии с примером 5.
На Фиг. 6 показаны электрофореграммы антигенов, выделенных и очищенных из линии клеток аденокарциномы легкого А549 с помощью колонок с пришитым химерным антителом 4В4 и химерным антителом 27В6.
На Фиг. 7 показана идентификация карбоангидразы 12 в качестве антигена для моноклонального антитела 4В4 и 27В6 на основании анализа методом ELISA.
На Фиг. 8 показана идентификация карбоангидразы 12 в качестве антигена для моноклонального антитела 4В4 и 27В6 на основании анализа методом Вестерн-блоттинга в Примере 6.
На Фиг. 9 показан процесс и результат эпитопного кртирования моноклональных антител 27В6 и 4В4.
На Фиг. 10 показаны комплементзависимые цитотоксические эффекты химерного антитела 27В6 на основании анализа в соответствии с примером 8.
На Фиг. 11 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты химерного антитела 27В6 на основании анализа в соответствии с примером 9-1.
На Фиг. 12 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты химерного антитела 27В6 в отношении трижды негативного рака молочной железы на основании анализа в соответствии с примером 9-2.
На Фиг. 13 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты дефукозилированного химерного антитела 27В6 в различных солидных опухолях на основании анализа в соответствии с примером 10-1.
На Фиг. 14 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты дефукозилированных химерных антител 4В4 и 27В6 в линии клеток рака молочной железы на основании люциферазного анализа, описанного в Примере 10-2.
На Фиг. 15 показаны уровни экспрессии антигена СА12 в линиях клеток трижды негативного рака молочной железы и связывание химерных антител 27В6 и 4В4 с клеточной поверхностью линий клеток на основании анализа в соответствии с примером 11.
На Фиг. 16 показаны ингибирующие активности химерных антител 27В6 и 4В4 против роста опухоли в животных моделях трижды негативного рака молочной железы.
На Фиг. 17 показана ингибирующая активность антитела 4В4 против трижды негативного рака молочной железы на основании анализа в соответствии с примером 11.
На Фиг. 18 и 19 показано, что связывание одного антитела 4В4 с опухолевыми клетками не влияет на рост опухолевых клеток в соответствии с примером 12.
На Фиг. 20 показан эффект комбинации антитела 27В6 и радиотерапии на основании анализа в соответствии с примером 13.
На Фиг. 21 показаны результаты тестирования аффинности связывания отобранного клона (scFv, выявленного методом фагового дисплея) с СА-XII методом ELISA.
На Фиг. 22 показана последовательность вариабельной области легкой цепи (VL) и последовательности CDR1 и CDR2 10-ти клонов (номера клонов 1, 2, 8, 11, 15, 19, 22, 25, 26 и 30), отобранных в соответствии с примером 14, и последовательности матрицы CDR1 и CDR2.
На Фиг. 23 и Фиг. 24 представлены графики, показывающие результаты тестирования аффинности полноразмерного IgG 10-ти клонов (номера клонов 1, 2, 8, 11, 15, 19, 22, 25, 26 и 30), отобранных в соответствии с примером 14.
На Фиг. 25 показано связывание гуманизированного антитела DNP004 в соответствии с примером 15 в линии клеток положительного по СА-XII и трижды негативного рака молочной железы MDAMB-231.
На Фиг. 26 представлена фотография, на которой показан результат анализа физических свойств групп антител-кандидатов с помощью SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) в соответствии с примером 16.
На Фиг. 27 показана оценка силы связывания групп антител-кандидатов с положительной по СА-XII линией клеток в соответствии с примером 16.
На Фиг. 28 и Фиг. 29 показаны результаты определения профилей связывания гуманизированного антитела DNP004 против антигена карбоангидразы XII в различных клетках рака молочной железы в соответствии с примером 17.
На Фиг. 30 показаны результаты определения антителозависимого цитотоксического эффекта гуманизированного антитела DNP004 в линии клеток рака молочной железы в соответствии с примером 18.
На Фиг. 31 показаны результаты определения антителозависимого цитотоксического эффекта гуманизированного антитела DNP004 в линии клеток рака легкого в соответствии с примером 18.
На Фиг. 32 показаны результаты определения антителозависимых цитотоксических эффектов гуманизированного антитела DNP004 в линии клеток рака печени в соответствии с примером 18.
На Фиг. 33 показаны результаты определения антителозависимых цитотоксических эффектов гуманизированного антитела DNP004 в линии клеток рака желудка в соответствии с примером 18.
На Фиг. 34-35 показаны результаты определения противоопухолевого действия гуманизированного антитела DNP004 в модели трижды негативного рака молочной железы у мыши в соответствии с примером 19.
На Фиг. 36 показаны результаты определения противоопухолевого действия гуманизированного антитела DNP004 в животной модели линии клеток рака почки в соответствии с примером 19.
Способ осуществления изобретения
Лучшее понимание настоящего изобретения может быть достигнуто с помощью приведенных ниже примеров, которые представлены для иллюстрации, но не должны быть истолкованы как ограничивающие настоящее изобретение.
Пример 1. Получение моноклонального антитела к СА-XII (27В6)
В описанных ниже экспериментах была выполнена разработка новых антител, специфичных к СА 12. Наблюдали, что разработанные антитела специфичны к солидным опухолям, таким как аденокарцинома легких, рак молочной железы, колоректальный рак и рак предстательной железы, поскольку они реагировали с антигенами, специфично экспрессирующимися в этих опухолях. Они были обозначены 27В6 и 4В4 соответственно.
1-1: Дизайн целевого сайта для конструирования моноклонального антитела 27В6
Было сконструировано антитело, специфичное к клеткам солидной опухоли. Для этого мышей иммунизировали непосредственно клетками солидной опухоли, и моноклональные антитела были созданы методом слияния клеток. Затем анализировали и идентифицировали антиген, с которым связывалось моноклональное антитело, специфичное к клеткам солидной опухоли.
1-2: Иммунизация мышей
Клетки А549, представляющие собой клетки альвеолярного базального эпителия аденокарциномы человека, иммунизировали и проводили отбор антитела, проявляющего положительную реакцию с линией клеток А549, но не реагирующего с линией клеток L132, в процессе отбора гибридом методом проточной цитометрии. Процентное содержание клеток, проявляющих положительную реакцию с моноклональным антителом, рассчитывали как количество клеток, связывающихся с антителом DNP004, на 5000 клеток исследуемого субъекта, представленное в %; - (отрицательный результат) относится к случаю, где количество положительных клеток составляет менее 10%, а + (положительный результат) относится к случаю, где количество положительных клеток находится в диапазоне от 10 до 30%. ++ означает, что количество положительных клеток находится в диапазоне от 30 до 70%, и +++ означает, что количество положительных клеток составляет от 70 до 100%.
Для этого каждой самке мышей линии Balb/c возраста 6 недель вводили путем и/п (в интраперитонеальную полость) инъекции линию клеток А549 (АТСС CCL-185) в дозе 1×107 клеток три раза через регулярные интервалы в течение трех недель, после чего получали сыворотки из венозной крови. Разведение сыворотки добавляли к клеткам А549. После выдерживания в течение 30 мин при 4°С для взаимодействия разведение смешивали с 3 мл PBS (забуференный фосфатом физиологический раствор) и центрифугировали в течение 3 мин при 1500 об/мин. Несвязанные антитела отмывали. Для выявления связанных антител использовали вторичное антитело, представляющее собой 200-кратное разведение козьего антимышиного Ig-FITC (DINONA INC, Корея). После взаимодействия в течение 15 мин при 4°С реакционную смесь промывали 3 мл PBS таким же способом. Титр антитела к клеткам А549 в сыворотках крови измеряли методом проточной цитометрии. Наблюдали, что сыворотки, иммунизированные клетками А549, в высокой степени положительны в отношении (результаты не показаны). В кратком описании, за трое суток до эксперимента по слиянию клеток добавляли 50 мкг агонистического моноклонального антитела (mAb) к CD40 для усиления иммунной реакции, и клетки А549 (АТСС CCL-185) инъецировали в дозе 1×107 клеток для индуцирования амплификации антитела к поверхностному антигену А549.
1-3: Получение клеток гибридомы
У иммунизированных мышей вырезали селезенку, получали суспензию отдельных спленоцитов и дважды промывали их питательной средой RPMI (GIBCO). Жизнеспособные клетки считали, используя смесь 1:1 (об./об.) 0,4%-ного раствора трипанового синего (Sigma), который окрашивает только мертвые клетки. В качестве партнера слияния использовали линию клеток миеломы мыши Х63 (АТСС CRL-1580), клетки промывали и считали таким же путем, как спленоциты.
Клетки миеломы смешивали со спленоцитами в соотношении 1:5 и центрифугировали. К полученному таким образом осадку медленно добавляли в течение 1 мин 1 мл 50%-го раствора PEG (полиэтиленгликоля) 1500, подогретого до 37°С. После инкубации в течение около 1 мин смесь клеток медленно разбавляли питательной средой RPMI и центрифугировали. Полученный в результате осадок клеток ресуспендировали в среде RPMI (20% FBS (фетальная бычья сыворотка)), содержащей 1-кратный раствор HAT (гипоскантин-аминоптерин-тимидин), высевали в объеме 150 мкл/лунка в 96-луночные планшеты и выращивали в СО2 инкубаторе при 37°С. Через заданные промежутки времени после слияния проводили подпитку культуры HAT. Когда в лунках наблюдали колонию, в каждую лунку добавляли 150 мкл среды НТ с последующей инкубацией в течение 48 часов в инкубаторе при 37°С, 5% СО2. Затем перед проточной цитометрией проводили трехцветное иммунофлуоресцентное окрашивание. Кратко, проводили иммунологическое окрашивание линии клеток аденокарциномы легкого А549 и линии клеток нормального легкого L132 двумя различными красителями и смешивали в соотношении 1:1. Эту смесь клеток инкубировали со 100 мкл супернатанта культуры клеток гибридомы при 4°С в течение 30 мин и центрифугировали совместно с 3 мл PBS при 1500 об/мин в течение 3 мин для удаления несвязанных антител. Связанные антитела выявляли путем инкубации с 200-кратным разведением вторичного антитела, представляющего собой козий антимышиный Ig-APC (DINONA INC, Корея), при 4°С в течение 15 мин с последующим промыванием 3 мл PBS таким же способом. Затем клетки гибридомы измеряли методом проточной цитометрии.
Было проведено исследование, чтобы определить, связывается ли антитело с клетками периферической крови. С этой целью РВМС (мононуклеарные клетки периферической крови из Корейской службы переливания крови Красного Креста) инкубировали со 100 мкл супернатанта гибридомы при 4°С в течение 30 мин и центрифугировали совместно с 3 мл PBS при 1500 об/мин в течение 3 мин для отмывки несвязанных антител. Для выявления связанных антител использовали вторичное антитело, представляющее собой 200-кратное разведение козьего антимышиного Ig-FITC (DINONA INC, Корея). После взаимодействия в течение 15 мин при 4°С реакционную смесь промывали 3 мл PBS таким же способом. Титр антитела измеряли методом проточной цитометрии, и результаты представлены на Фиг. 1. На Фиг. 1 показаны титры мышиного моноклонального антитела 27В6, специфичного к клеткам аденокарциномы легкого, в периферической крови, измеренные методом проточной цитометрии.
Таким образом, было отобрано антитело, проявляющее положительную реакцию с линией клеток рака легкого А549 и отрицательную реакцию с линией клеток нормального легкого L132 и всеми гранулоцитами, лимфоцитами и моноцитами периферической крови, и обозначено как 27В6. Наконец, следуя методике ограничивающего разведения, клетки гибридомы 27В6 разводили и отбирали для выращивания отдельных колоний.
Линия клеток гибридомы 27В6 была депонирована 14 февраля 2012 г. банком линий клеток Кореи, расположенным по адресу 28, Yongon-Dong, Chongno-gu, г. Сеул, Корея, и ей присвоен номер по каталогу KCLRF-BP-00280 20 февраля 2012 г.
1-4: Определение изотипа моноклонального антитела 27В6
Моноклональное антитело 27В6, полученное в Примере 1-3, анализировали на предмет изотипа, используя набор для изотипирования иммуноглобулинов мыши методом ELISA (BD Biosciences, США). Кратко, изотипирование проводили с антисыворотками, специфичными к изотипу (IgG1, IgG2a, IgG2b, IgG3, IgM, IgA, каппа, лямбда), при этом в качестве вторичного антитела использовали меченый пероксидазой козий антимышиный IgG. Проявление цвета индуцировали орто-фенилендиамином (OPD) и пероксидом водорода в качестве субстрата. Регистрировали оптическую плотность при 450 нм.
В результате моноклональное антитело 27В6 было идентифицировано как мышиный IgG1/легкая цепь каппа (результаты не представлены).
1-5: Последовательности CDR антитела 27В6
Процедура клонирования антитела проиллюстрирована на Фиг. 1. Конкретно ген антитела 27В6 клонировали с помощью набора праймеров к Ig мыши (Millipore, № по каталогу: 69831). Проводили PCR (полимеразная цепная реакция) с использованием набора праймеров к Ig с РНК, выделенной из гибридомы 27В6, встраивали в вектор PGem-T (Promega, № по каталогу: A3600) и секвенировали для подтверждения последовательности ДНК. Ген мышиного антитела был идентифицирован с помощью сайта IMGT (www.imgt.org). Последовательности тяжелой и легкой цепи, включая последовательности CDR Ab (антитела) 27В6, представлены SEQ ID NO: 12 и 13 соответственно. CDR1-CDR3 вариабельной области тяжелой цепи показаны в SEQ ID NO: 6-8, соответственно, a CDR1-CDR3 вариабельной области легкой цепи показаны в SEQ ID NO: 9-11 соответственно (см. Таблицу 2).
Пример 2. Получение химерного антитела 27В6
При введении моноклонального антитела мышиного происхождения в организм человека иммунная система человека распознает это моноклональное антитело как чужеродный антиген и, таким образом, продуцирует человеческое антимышиное антитело (НАМА) для элиминации мышиного антитела из крови. Кроме того, домен Fc мышиного антитела не может эффективно выполнять свои биологические функции в организме человека. Поэтому происходит не только снижение терапевтического эффекта, но также могут быть вызваны такие побочные эффекты, как тяжелые аллергические реакции и дисфункция почек. Чтобы снизить иммуногенность антитела 27В6 при введении в организм человека, было сконструировано химерное антитело, в котором мышиное антитело за исключением вариабельной области было заменено Fc человеческого антитела. Наблюдали, что это химерное антитело подобно по антигенной специфичности и аффинности исходному мышиному антителу 27В6.
Для конструирования химерного антитела линию клеток DHFR DG44, имеющую происхождение от клеток яичника китайского хомячка (СНО), трансфицировали ДНК 27B6-HuIgFc, полученной описанным выше способом, после чего проводили процедуру селективного культивирования в селективной среде для основания стабильной линии клеток, продуцирующей рекомбинантное антитело 27В6. Подробное описание приведено ниже.
Сначала за три часа до трансфекции линию клеток DG44 (Invitrogen, № по каталогу А1100001) высевали при плотности 1×106 клеток/мл в 6-луночные планшеты и инкубировали с 1 мл среды GIBCO® CD DG44 (Invitrogen, США) при 37°С в атмосфере 5% СО2 в течение 3 часов. Затем ДНК 27B6-HuIgFc трансфицировали компетентные клетки DG 44, используя набор реагентов для трансфекции Effectene (QIAGEN, г. Хильден, Германия).
Через трое суток после трансфекции отбирали супернатант и добавляли к клеткам А549, которые впоследствии инкубировали при 4°С в течение 30 мин. Несвязанные антитела удаляли посредством совместного центрифугирования с 3 мл PBS при 1500 об/мин в течение 3 мин. Связанные антитела выявляли путем инкубации с 150-кратным разведением вторичного антитела, представляющего собой козий антимышиный Ig-APC (DINONA INC, Корея), при 4°С в течение 15 мин с последующим промыванием 3 мл PBS таким же способом. Затем титр антитела к клеткам А549 определяли количественно методом проточной цитометрии. Впоследствии была основана стабильная линия клеток. Для этого питательную среду заменяли питательной средой Power для клеток СНО (LONZA, Швейцария) с добавлением 30 нМ метотрексата (МТХ) (Sigma, США) и 200 мкг/мл G418 (Invitrogen, США), после чего начинали селекцию клонов. Концентрации МТХ и G418 в селективной среде увеличивали при повторении раундов селекции клонов. Каждый раунд составлял три недели. Окончательный раунд селекции клонов проводили в среде Power СНО с добавлением 1000 нМ МТХ и 400 мкг/мл G418. Затем методом ограничивающего разведения была основана конечная линия клеток из отдельной колонии.
На основании количественного определения методом проточной цитометрии было обнаружено, что полученное таким образом химерное антитело 27В6 обладает такой же антигенной специфичностью и аффинностью, что и исходное мышиное антитело 27В6. На Фиг. 2 показана антигенная специфичность и аффинность химерного антитела 27В6.
Пример 3. Получение моноклонального антитела к СА-XII (4В4)
3-1: «Спаренное» (pairing) антитело 27В6
Для разработки другого антитела, распознающего тот же антиген, но связывающегося с другим эпитопом, было получено «спаренное» антитело 27В6.
В первую очередь для изучения возможности разработки «спаренного» антитела 27В6 был поставлен сэндвич-ELISA с использованием химерного антитела 27В6 и мышиной сыворотки. Таким же способом, как описано в Примере 1-2, каждой самке мышей линии balb/c в возрасте 6 недель вводили путем и/п (в интраперитонеальную полость) инъекции линию клеток А549 (1×107 клеток) через регулярные интервалы в течение трех недель, после чего получали сыворотки из венозной крови.
Конкретно, очищенное химерное антитело 27В6 в концентрации 100 нг/мл добавляли в микропланшет в виде покрытия и инкубировали при 37°С в течение 1 часа. В лунки микропланшета, покрытые антителом 27В6, добавляли 200 мкл/лунка блокирующего буфера (Sigma) и блокировали при 37°С в течение 1 часа. Клетки А549 в количестве 1×107 клеток/мл подвергали лизису, используя буфер для лизиса, представляющий собой 1% NP40. Полученный лизат клеток А549 добавляли в микропланшет в количестве 50 мкл/лунка, подвергали взаимодействию при 37°С в течение 1 часа, а затем промывали PBS три раза. В микропланшет добавляли 100 мкл/лунка 1000-кратного разведения сыворотки крови мышей, иммунизированных А549, и инкубировали при 37°С в течение 1 часа, а затем промывали PBS три раза. Наконец, добавляли 100 мкл/лунка 2000-кратного разведения вторичного козьего антимышиного антитела IgG-HRP (Jackson) и инкубировали при 37°С в течение 30 минут, после чего промывали PBS 3 раза. Добавляли ТМВ (3,3',5,5'-тетраметилбензидин) в количестве 50 мкл/лунка с последующим взаимодействием при комнатной температуре в течение 10 минут, чтобы индуцировать проявление цвета, и добавляли такое же количество 2 н. H2SO4 (Sigma). Затем измеряли оптическую плотность при длине волны 450 нм.
Как и ожидалось, при использовании химерного антитела 27В6 и мышиной сыворотки в сэндвич-ELISA наблюдали положительную реакцию (данные не представлены).
3-2: Получение моноклонального антитела
Клетки гибридомы из спленоцитов иммунизированных мышей получали так же, как в Примере 1-3.
В результате было отобрано антитело, проявляющее положительную реакцию с линией клеток рака легкого А549 и отрицательную реакцию с линией клеток нормального легкого L132 и всеми гранулоцитами, лимфоцитами и моноцитами периферической крови, и обозначено как 4В4. Наконец, следуя методике ограничивающего разведения, клетки гибридомы 4В4 разводили и отбирали для выращивания отдельных колоний (Фиг. 3). На Фиг. 3 показаны титры моноклонального антитела 4В4 в периферической крови, измеренные методом проточной цитометрии. Линия клеток гибридомы 4В4 была депонирована 14 февраля 2012 г. банком линий клеток Кореи, расположенным по адресу 28, Yongon-Dong, Chongno-gu, г. Сеул, Корея, и ей присвоен номер по каталогу KCLRF-BP-00279 20 февраля 2012 г.
3-3: Анализ антитела 4В4
Анализ аминокислотных последовательностей антитела проводили по существу таким же способом, как в Примере 1-5. Последовательности тяжелой цепи и последовательности легкой цепи, включая последовательности CDR Ab 4В4, полученного в Примере 3-2, представлены SEQ ID NO: 20 и 21 соответственно, а CDR1-CDR3 тяжелой цепи показаны в SEQ ID NO: 14 и 16 соответственно, и CDR1-CDR3 легкой цепи показаны в SEQ ID NO: 17-19 (см. Таблицу 2).
Пример 4. Получение химерного антитела 4В4
Чтобы снизить иммуногенность антитела 4В4 при введении в организм человека, в соответствии с примером 2 было сконструировано химерное антитело, в котором мышиное антитело за исключением вариабельной области было заменено Fc человеческого антитела. Наблюдали, что это химерное антитело подобно по антигенной специфичности и аффинности исходному мышиному антителу 4В4.
Способ получения химерного антитела 4В4 осуществляли таким же способом, как в Примере 2. В результате на основании количественного определения методом проточной цитометрии (Фиг. 5) было обнаружено, что полученное антитело обладает такой же антигенной специфичностью и аффинностью, что и исходное мышиное антитело 4В4. На Фиг. 5 показана антигенная специфичность и аффинность химерного антитела 4В4.
Пример 5. Анализ экспрессии антитела в различных линиях клеток
5-1: Экспрессия антитела в различных линиях клеток
Методом проточной цитометрии проводили анализ связывания химерного антитела 27В6, полученного в Примере 2, и химерного антитела 4В4, полученного в Примере 4, с различными линиями клеток, полученными из KCLB (банк линий клеток Кореи) и SNU (Сеульский национальный университет).
Конкретно из KCLB (банк линий клеток Кореи) и SNU (Сеульский национальный университет) были получены различные линии клеток. L-132, SW-900, DU145, LNCap, MCF-7, Huh7 и Hs-578T культивировали при 37°С в атмосфере 5% СО2 в среде, представляющей собой модифицированную Дульбекко MEM (GIBCO, Invitrogen), с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen), а А549, NCI-H460, NCI-H417, DLD-1, НСТ116, НТ-29, SW-480, SW-620, LS174T, РС-3, SNU1, SNU638, SNU719, MKN1, MKN28, MKN45, MKN74, NCI-N87, SK-BR3, MDA-MB231 и MDA-MB453 культивировали в среде RPMI 1640 (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием FBS. Кроме того, инкубацию Calu-3, Нер3В, SK-HEP-1, С3А, Hep G2, PLC/PRF/5 и ВТ-20 проводили при 37°С в атмосфере 5% CO2 в среде Игла MEM (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen), инкубацию KATO III - в среде IMDM (GIBCO, Invitrogen) с добавлением 20% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen) и инкубацию SW480 и MDA-MB468 - в среде L-15 Лейбовица с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen).
Культивируемые линии раковых клеток инкубировали с моноклональным антителом 27В6 или 4В4 по настоящему изобретению при 4°С в течение 30 мин, промывали PBS и обрабатывали конъюгированным с FITC козьим антимышиным IgG (DINONA INC, Korea) при 4°С в течение 15 мин. Линии клеток снова промывали PBS, перед анализом посредством FACScaliber (Becton Dickinson, США). Сводные результаты приведены ниже в Таблице 5. Титры антител 27В6 и 4В4 также определяли количественно в различных линиях опухолевых клеток.
В приведенной ниже Таблице 5 представлен паттерн экспрессии антигена карбоангидразы 12 в различных линиях клеток солидных раковых опухолей. В Таблице 16 приведено процентное содержание клеток с положительным результатом определения моноклональных антител 27В6 и 4В4 из 5000 исследованных клеток, которое тестировали в анализе FACS, где знак - обозначает 10% или менее из числа положительных клеток, + обозначает диапазон от 10 до 30% от числа положительных клеток, ++ относится к 30-70% от числа положительных клеток, и +++ относится к 70-100% от числа положительных клеток. Если количество положительных клеток составляет менее 10%, их считают отрицательными, а при количестве положительных клеток 10% или более их считают положительными.

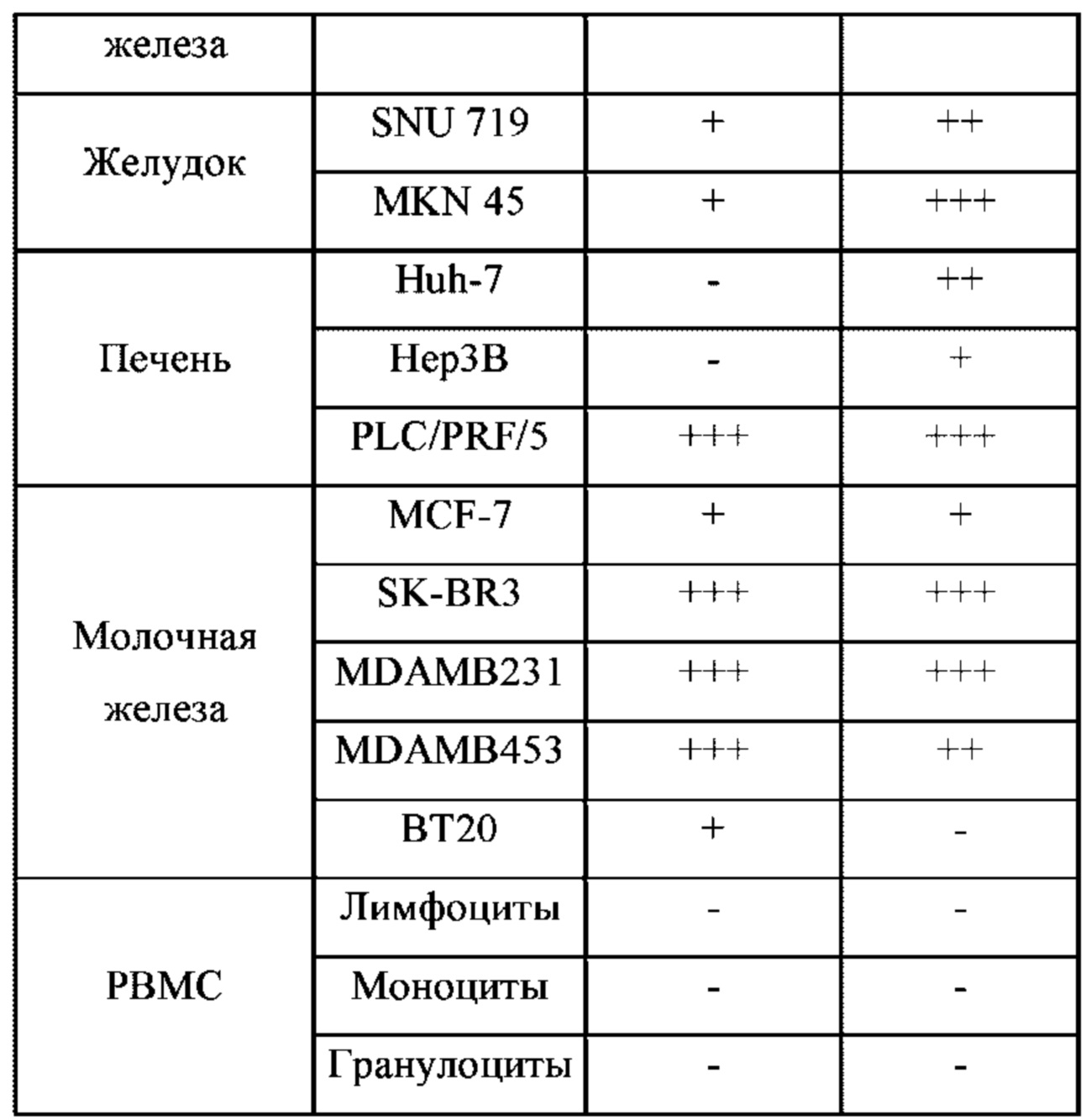
Профилирование связывания химерного антитела 4В4 с клетками, проведенное методом проточной цитометрии:
-: менее 10% количества положительных клеток
+: 10-30%
++: 30-70%
+++: более 70%.
Как показано в Таблице 5, моноклональные антитела 27В6 и 4В4 по настоящему изобретению демонстрировали положительную реакцию, хотя степень аффинности связывания различалась в различных типах линий клеток рака легкого, колоректального рака, рака желудка, рака печени и рака молочной железы. Напротив, все из лимфоцитов, мононуклеарных клеток и гранулоцитов периферической крови демонстрировали отрицательные результаты. Это свидетельствует о том, что антитела 27В6 и 4В4 по настоящему изобретению можно применять в качестве терапевтических агентов против солидных опухолей, экспрессирующих антиген СА-XII.
5-2: Профиль экспрессии в клетках рака молочной железы
Были выявлены положительные реакции 27В6 и 4В4 с клетками ER-, PR- и HER2-положительного рака молочной железы. Соответственно, оба антитела можно применять в качестве терапевтических агентов для различных подтипов рака молочной железы, в том числа трижды негативного рака молочной железы.
Связывание моноклонального антитела 27В6 и 4В4 с тремя линиями клеток рака молочной железы с различными фенотипами изучали методом проточной цитометрии. Культивирование клеток проводили при 37°С в атмосфере 5% CO2; для клеток MCF-7 (клетки ER-положительного рака молочной железы) использовали модифицированную Дульбекко MEM (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen), а для клеток MDA-MB231 (линии клеток, выделенные из злокачественной опухоли молочной железы) и клеток SK-BR-3 (линия клеток рака молочной железы человека с гиперэкспрессией продукта гена Her2 (Neu/ErbB-2)) использовали среду RPMI 1640 (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием FBS.
Культуры линий раковых клеток инкубировали при 4°С в течение 30 мин с моноклональным антителом 27В6 или 4В4 по настоящему изобретению, промывали PBS и обрабатывали при 4°С в течение 15 мин конъюгированным с FITC козьим антимышиным IgG (DINONA INC, Корея). Перед анализом посредством FACScaliber (Becton Dickinson, США) линии клеток еще раз промывали PBS. Сводные результаты приведены в Таблице 6.

Таким образом, антитела 27В6 и 4В4 в соответствии с настоящим изобретением можно применять не только для трижды негативного рака молочной железы, но также для различных типов рака молочной железы, поскольку показана их положительная реакция с ER- и PR-, а также HER2-положительными клетками рака молочной железы.
5-3: IHC (иммуногистохимия)
Анализ распределения антигенов, с которыми связываются моноклональные антитела 27В6 и 4D4, в нормальных тканях организма человека проводили методом иммуногистохимии (IHC). Нормальные ткани тимуса и небной миндалины человека были получены из клиники Национального университета Чунгбук, и срезы замороженных тканей были изготовлены в отделении патологии клиники Национального университета Чунгбук.
Иммуногистохимическое окрашивание срезов замороженных тканей моноклональными антителами 27В6 и 4В4 по настоящему изобретению проводили, как описано ниже. Срезы замороженных тканей тимуса и небной миндалины, которые хранили при температуре -20°С или ниже, сушили при комнатной температуре в течение 30-60 мин и погружали в 1-кратный PBS на 60 мин. Затем ткани обрабатывали в течение 10 мин 3% Н2О2 при комнатной температуре для подавления активности эндогенной пероксидазы, промывали проточной водой и блокировали при комнатной температуре в течение 30 мин содержащей иммуноглобулин козьей сывороткой, чтобы исключить неспецифическое окрашивание мышиными антителами. Затем ткани инкубировали при комнатной температуре в течение 60 мин с первым антителом (27В6, 4В4). Каждое антитело использовали в концентрации 10 мкг/мл. Затем ткани промывали три раза 1-кратным PBS в течение 5 мин, инкубировали при комнатной температуре в течение 30 мин с конъюгированным с HRP козьим антимышиным антителом (Dako, Дания), а затем промывали три раза 1-кратным PBST (0,05% Твин 20, 1-кратный PBS) в течение 5 мин. Окрашивание проявляли диаминобензидином (DAB) с последующим промыванием в течение 5 мин проточной водой. Проводили контрастирующее окрашивание тканей гематоксилином, а затем промывали в течение 7 мин проточной водой. После окрашивания предметные стекла обезвоживали и заклеивали. Результаты окрашивания анализировали под микроскопом, как описано ниже.

Как показано в Таблице 7, распределение антигенов, распознаваемых моноклональным антителом 27В6 и 4В4 по настоящему изобретению, отсутствует в нормальных тканях тимуса и небной миндалины. В частности, ни в зрелых, ни в незрелых Т- или В-лимфоцитах эти антигены не экспрессируются. Слабое окрашивание антителом 27В6 было выявлено в базальном слое небной миндалины, что, по-видимому, является результатом неспецифического связывания.
Пример 6. Анализ антигена для моноклонального антитела
6-1: Выделение и очистка моноклональных антител 4В4 и 27В6
Культивировали линию клеток аденокарциномы легкого А549, используемую для получения моноклонального антитела 4В4 и 27В6. Затем 1×108 клеток суспендировали в 50 мл буфера для лизиса (1% Нонидет Р-40; NP-40 в 50 мМ Трис-HCl, рН 7,4, 50 мМ EDTA (этилендиаминтетрауксусная кислота) и 1 мМ фенилметилсульфонилфторида; PMSF) и проводили лизис в течение 15 мин. После центрифугирования обломки клеток удаляли, и клеточный лизат был получен в виде супернатанта. Клеточные лизаты использовали для разделения антигенов, распознаваемых антителами 4В4 и 27В6.
Пять мг каждого из очищенных моноклональных антител 4В4 и 27В6 подвергали диализу против связывающего буфера (раствор 0,2 М бикарбоната натрия, 0,5 М хлорида натрия, рН 8,3) с получением растворов двух различных антител. Колонку Fast Flow (GE Healthcare) объемом 5 мл, заполненную 2 мл смолы сефарозы, активированной NHS (N-гидроксисукцинимид), промывали 20 мл раствора 1 мМ HCl, а затем 20 мл связывающего буфера (20 мМ бикарбоната натрия, 0,5 мМ хлорида натрия, рН 8,3), чтобы дать возможность подготовленным антителам связаться с колонкой. Выходное отверстие колонки блокировали, наносили растворы каждого из двух различных антител и блокировали входное отверстие колонки. Инкубацию проводили при комнатной температуре в течение 4 ч. Затем через колонку пропускали 20 мл отмывочного буфера (20 мМ ацетата натрия, 0,5 М хлорида натрия, рН 5,4), чтобы удалить избыток антител, не связавшихся со смолой. Колонку снова промывали 50 мл блокирующего буфера (0,1 М этаноламина, 0,5 М хлорида натрия, рН 8,3) для удаления оставшихся реакционных групп. Две колонки промывали 20 мл маточного буферного раствора (20 мМ Трис-HCl, 150 мМ NaCl, 0,02% азид натрия, рН 8,0) и замораживали до использования.
Подготовленные колонки помещали в прибор для FPLC (экспресс-хроматографии белков) ActaFPLC, чтобы связанные со смолой антитела могли распознать антигены и, таким образом, можно было разделить эти антигены. На колонку, соединенную с прибором для FPLC, наносили лизаты линии клеток аденокарциномы легкого А549, которые использовали в качестве источника антигена, распознаваемого моноклональными антителами 4В4 и 27В6. Разделение антигенов проводили в процессе, состоящем из четырех стадий: уравновешивание; нанесение образца, отмывка и вторая отмывка; элюирование. Буфер для уравновешивания и для отмывки имеет следующий состав: 0,5% Твин-80, 20 мМ фосфата натрия, 150 мМ хлорида натрия, рН 7,4. Этот буфер использовали в количестве 10 мл для уравновешивания и в количестве 20 мл для отмывки. Буфер для элюирования содержал 0,3 М глицина, 0,1 М сахарозы, 0,1 М маннита, 1,0 М мочевины и 0,5% Твин-80, его рН составлял 3,0, и этот буфер использовали для отмывки в количестве 20 мл. Для второй отмывки использовали смесь, в которой буфер для элюирования смешивали с отмывочным буфером в соотношении 25%. К 20 мл элюированного раствора, полученного в процессе разделения антигена, добавляли 5 мл ТСА (трихлоруксусная кислота) и хранили в холодильнике в течение 30 мин. После центрифугирования осадок дополнительно дважды промывали ацетоном. Наконец, полученный осадок суспендировали в 1-кратном буфере для нанесения образца на SDS-PAGE и окрашивали Кумасси синим. Как описано выше, антигены, которые были выделены и очищены на колонках, изготовленных с антителами 4В4 и 27В6, показаны на Фиг. 6. На Фиг. 6 показаны электрофореграммы антигенов, выделенных и очищенных из линии клеток аденокарциномы легкого А549 с помощью колонок, изготовленных с моноклональными антителами 4В4 и 27В6.
6-2: Идентификация антигена для моноклональных антител 4В4 и 27В6
Антигены, выделенные и очищенные из смолы, полученной в результате сшивания с моноклональным антителом 4В4 и 27В6, визуализировали, как показано на Фиг. 7. Анализ двух основных указанных стрелками полос белка размером около 58 кДа был проведен в Seoul Pharma Laboratories. Для идентификации были получены пептиды путем расщепления в геле и проведен их анализ методом LC-MS/MS (жидкостная хроматография с тандемной масс-спектрометрией) с последующей обработкой спектров MS/MS с помощью программ PLGS (Waters) и MASCOT (Matrix Science). Была проведена серия анализов, как описано ниже.
Фрагменты геля, содержащие белки, подвергали дегидратации, используя 100% CAN (ацетонитрил) и полностью высушивали в Speed-vac. Белки, содержащиеся во фрагментах высушенного геля, расщепляли в течение 15 мин трипсином. Пептиды, образовавшиеся после расщепления трипсином, экстрагировали 60% раствором CAN, содержащим 0,1% TFA (трифторуксусная кислота). Объединенные экстракты высушивали в Speed-vac. Образцы растворяли в 20 мкл 5% CAN, 0,2% TFA (трифторуксусная кислота), после чего проводили анализ LC-MS/MS. В ходе анализа LC-MS/MS пептиды элюировали из колонки LC nanoACQUITY UPLC ВЕН С18 (1,7 мкм,

Конечные результаты идентификации, полученные в описанной выше серии анализов, как показано в следующей ниже Таблице, представлены в Таблице 8 ниже.
Как и ожидалось, по результатам анализа карбоангидраза 12 была идентифицирована как общий антиген, очищенный на обоих моноклональных антителах 4В4 и 27В6, и было обнаружено, что она находится на клеточной поверхности. Другие белки не могут быть антигенами для моноклональных антител 4В4 и 27В6, поскольку они представляют собой внутриклеточные белки. Таким образом, они, по-видимому, оказались примесями, включенными вследствие недостаточного разделения и очистки.
С помощью антитела 27В6 было разделено четыре пептида:



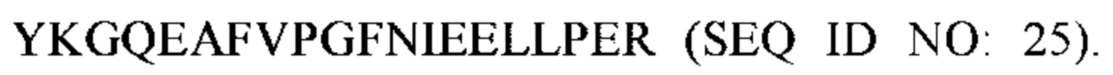


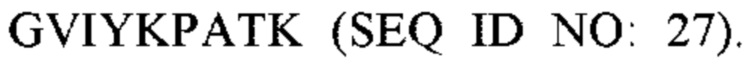


6-3: Анализ антигена для моноклональных антител 4В4 и 27В6 (ELISA)
Для оценки результатов идентификации антигена, полученных методом LC-MS/MS, изучали реакционность моноклональных антител 4В4 и 27В6 с рекомбинантным белком карбоангидразой 12 (R&D Systems) методами ELISA и Вестерн-блоттинга.
Рекомбинантный белок СА12 наносили при плотности 100 нг/лунка в лунки планшета Maxisrop ELISA и инкубировали при 37°С в течение 1 ч. Для блокирования в каждую из лунок, покрытых антигеном, добавляли 200 мкл 1-кратного блокирующего буфера (Sigma) с последующей инкубацией при 37°С в течение 1 ч. В лунки планшетов наносили антитела 4В4, 27В6 и моноклональное антитело к СА12 (R&D Systems) со 100 мкл PBS. После инкубации в течение 1 ч при 37°С планшеты промывали PBS для удаления несвязанных антител. После этого в лунки добавляли разведение козьего антимышиного IgG-HRP (Jackson), оставляли для взаимодействия на 30 мин и промывали PBS. Проявление окрашивания осуществляли в течение 10 мин добавлением в каждую лунку 50 мкл ТМВ и останавливали реакцию 50 мкл серной кислоты. Регистрировали оптическую плотность при 450 нм. Хотя реакционность моноклонального антитела 27В6 с рекомбинантной карбоангидразой 12 была низкой, сигналы реакции 4В4, 27В6 и моноклонального антитела к СА12 (R&D Systems) с рекомбинантным антигеном показаны на Фиг. 7. На Фиг. 7 показана идентификация карбоангидразы 12 в качестве антигена для моноклонального антитела 4В4 и 27В6 на основании количественного определения методом ELISA.
6-4: Количественное определение антигена для моноклональных антител 4В4 и 27В6 (Вестерн-блоттинг)
Распознавание карбоангидразы 12 в качестве антигена моноклональными антителами 4В4 и 27В6, доказанное в предыдущем эксперименте, было подтверждено Вестерн-блоттингом. Рекомбинантную карбоангидразу 12 кипятили в течение 3 мин, наносили на 8% разделяющий полиакриламидный гель с додецилсульфатом натрия и проводили электрофорез. Разделенные белки переносили на нитроцеллюлозную мембрану, которую после этого блокировали 5% раствором обезжиренного молока (Sigma) и обрабатывали 4В4, 27В6 или моноклональным антителом к СА12 (R&D Systems) (27В6: дорожки 1 и 2, 4В4: дорожки 3 и 4, моноклональное антитело к СА12: дорожки 5 и 6). После трех раундов отмывки в отмывочном буфере (0,1% Твин-20 в PBS) антитело сшивали с конъюгированным с пероксидазой козьим антимышиным IgG (Sigma, г. Сент-Луис, США). Затем нитроцеллюлозную мембрану промывали отмывочным буфером, полосы визуализировали с использованием системы выявления хемилюминесценции (ECL, Amersham, Швеция). Результаты показаны на Фиг. 8. На Фиг. 8 показана идентификация карбоангидразы 12 в качестве антигена для моноклонального антитела 4В4 и 27В6 на основании анализа методом Вестерн-блоттинга. Рекомбинантная СА12 была выявлена в области 40 кДа всеми антителами - 4В4, 27В6 и моноклональным антителом СА12 (R&D Systems).
6-5: Анализ антигена для моноклональных антител 4В4 и 27В6 (сэндвич-ELISA)
В анализах методами ELISA и WB (Вестерн-блоттинг) было показано, что моноклональные антитела 4В4 и 27В6 распознают карбоангидразу 12 в качестве антигена, но сигнал обнаружения моноклональным антителом 27В6 был относительно низким. Для компенсации этого относительно низкого сигнала был проведен сэндвич-ELISA. Химерное моноклональное антитело 4В4 или 27В6 наносили в концентрации 100 нг/лунка в лунки планшета Maxisrop ELISA и инкубировали при 37°С в течение 1 ч. Для блокирования в каждую из лунок, покрытых антигеном, добавляли 200 мкл 1-кратного блокирующего буфера (Sigma) с последующей инкубацией при 37°С в течение 1 ч. В лунки добавляли двукратные серийные разведения рекомбинантной карбоангидразы 12, начиная с концентрации 100 нг/мл, инкубировали при 37°С в течение 1 ч и промывали PBS для удаления несвязанных антигенов. Затем в лунки, покрытые химерным антителом 4В4 и химерным антителом 27В6, наносили моноклональное антитело 4В4 и моноклональное антитело 27В6, соответственно, в концентрации 100 нг/лунка. После инкубации в течение 1 ч при 37°С лунки промывали PBS для удаления несвязанных антител. Далее связанные антитела инкубировали с разведением козьего антимышиного IgG-HRP (Jackson) в течение 30 мин и промывали PBS. Проявление окрашивания осуществляли в течение 10 мин добавлением в каждую лунку 50 мкл ТМВ и останавливали реакцию 50 мкл серной кислоты. Определение оптической плотности выполняли при 450 нм. При использовании химерных антител 27В6 и 4В4 в качестве захватывающего антитела и детектирующего антитела, соответственно, были зарегистрированы высокие сигналы реакции, как показано в Таблице 10. Таким образом, было доказано, что оба моноклональных антитела 4В4 и 27В6 распознают карбоангидразу 12 в качестве антигена.
В Таблице 10 показано конкурентное распознавание карбоангидразы 12 моноклональными антителами 27В6 и 4В4, определенное количественно в анализе методом сэндвич-ELISA с использованием моноклональных антител 27В6 и 4В4 в качестве захватывающих/детектирующих антител.

Пример 7. Эпитопное картирование
Для анализа эпитопов, как показано на Фиг. 13, был сконструирован рекомбинантный антиген с эпитопом или без эпитопа и проведен анализ иммунных реакций с моноклональными мышиными антителами 27В6 и 4В4 в Примере 1 и 3.
7-1: Конструирование и экспрессия мутантного рекомбинантного гена СА12
Для получения мутантных рекомбинантных генов СА12 рекомбинантный вектор pSec-Tag-CA12-full-hFc расщепляли поседством BamHI и HindIII. Рекомбинантный ген, в котором полноразмерная последовательность оснований антигена СА12 была соединена с hFc, встраивали в вектор pSec-Tag, что позволяло экспрессировать рекомбинантный гибридный белок, содержащий полноразмерный СА12 и hFc. Как видно на Фиг. 13, были получены делеционные мутантные конструкции с hFc различной длины в диапазоне от N-конца до аминокислоты 300.
Соответствующие векторы pSec-Tag, несущие конструкцию CA12-full-hFc и пять различных делеционных мутантных конструкций с hFc, вводили в клетки СНО с помощью реагента ViaFect (Promega).
Кратко, за одни сутки до трансфекции клетки СНО высевали и инкубировали. После замены среды на свежую на клетки СНО наносили комплекс вектора и реагента ViaFect и инкубировали в течение 48 часов. Через двое суток после трансфекции супернатант культуры собирали и проводили анализ экспрессии гена путем выявления человеческой Fc области (hFc) с помощью сэндвич-ELISA.
7-2: Анализ эпитопа моноклонального антитела
Чтобы определить эпитоп СА12, распознаваемый антителом по настоящему изобретению, в каждую лунку добавляли 50 нг антитела к Ig человека (Jackson Laboratory) и инкубировали при 37°С в течение 1 ч. Зафиксированное в лунке антитело, используемое в качестве иммобилизованного антитела, блокировали путем инкубации с 200 мкл на лунку 1-кратного блокирующего буфера (Sigma) при 37°С в течение 1 ч. В лунки планшетов добавляли каждую из соответствующих культур, содержащих СА12 full-hFc, и пять различных делеционных мутантных конструкций с hFc в концентрации 100 мкл/лунка. После инкубации в течение 1 ч при 37°С лунки промывали PBS для удаления несвязанных антител. После этого в лунки добавляли разведение антимышиного Fc-специфичного Ig, меченного HRP (Jackson Laboratory), оставляли для взаимодействия на 30 мин и промывали PBS. Проявление окрашивания осуществляли в течение 10 мин добавлением в каждую лунку 50 мкл ТМВ и останавливали реакцию 50 мкл серной кислоты. Оптическую плотность регистрировали при 450 нм. Наличие белков, содержащих мутантный СА12 и hFc, в супернатантах культуры определяли с использованием набора реагентов Capture & Detect Sandwich ELISA, при этом антитело к Ig человека служило в качестве контроля. Результаты представлены на Фиг. 9.
Как видно на Фиг. 9, эпитопы были локализованы в участке от аминокислоты 25 до аминокислоты 57, который представляет собой некаталитический домен. Следовательно, антитела по настоящему изобретению не связываются с каталитическим доменом СА-XII, поэтому они не ингибируют каталитическую активность СА-XII.
В подробном описании, на основании анализа делеционным методом было обнаружено, что эпитоп, специфичный для антитела 27В6, имеет аминокислотную последовательность


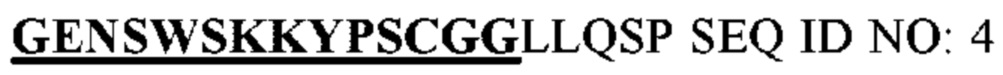

Пример 8. Терапевтический эффект химерного антитела в отношении солидной опухоли (CDC)
8-1: Действие CDC на линию клеток аденокарциномы легкого
Линию клеток аденокарциномы легкого А549 высевали при плотности 5×103 клеток/лунка в 96-луночные планшеты и культивировали в течение 20-24 часов в СО2 инкубаторе при 37°С. После удаления культуральной среды из каждой лунки среду RPMI, не содержащую фетальную бычью сыворотку, смешивали с 10% сывороткой человека и добавляли в смесь химерное антитело 27В6 в конечной концентрации 10 мкг/мл. Этот раствор вносили в лунки планшета в концентрации 100 мкл/лунка.
Аналогичным образом также обрабатывали химерное антитело 4В4. После 3 часов инкубации в СО2 инкубаторе при 37°С в каждую лунку добавляли реагент Ez-СуТох (DOGEN, KOREA) в количестве 10 мкл. После инкубации в течение 3,5 часов в СО2 инкубаторе при 37°С оптическую плотность при 450 нм измеряли на ридере для планшетов. Результаты представлены на Фиг. 10. На Фиг. 10 показаны комплементзависимые цитотоксические эффекты антитела 27В6.
Как видно на Фиг. 10, химерные антитела 27В6 и 4В4, полученные в примерах 2 и 4, проявляют комплементзависимую цитотоксичность.
8-2: Эффект CDC при трижды негативном раке молочной железы
В соответствии со способом, аналогичным описанному в Примере 8-1, была проведена оценка терапевтического эффекта за исключением того, что в качестве целевой линии клеток вместо линии клеток А549 использовали линию клеток трижды негативного рака молочной железы MDAMB-231, и измеряли оптическую плотность при 450 нм, как показано в Таблице 11. В Таблице 11 показаны результаты, подтверждающие, что химерное антитело 4В4 в соответствии с Примером 8 проявляет комплементзависимую цитотоксичность при трижды негативном раке молочной железы.

Как показано в Таблице 11, моноклональное антитело 27В6 по настоящему изобретению проявляло комплементзависимую цитотоксичность против опухолей, представляющих собой аденокарциному легкого.
Пример 9. Терапевтическое действие химерного антитела на солидную опухоль (ADCC)
9-1: Анализ антителозависимой клеточно-опосредованной цитотоксичности (анализ ADCC-LDH)
Для получения эффекторных клеток к образцу крови человека добавляли фиколл (кровь : фиколл = 1:2) с последующим центрифугированием при 2000 об/мин в течение 20 мин с получением РВМС. РВМС хранили при 37°С в среде RPMI с добавлением 5% FBS. Анализ антителозависимой клеточной цитотоксичности проводили в сочетании с анализом LDH (лактатдегидрогеназа) или люциферазным анализом.
В качестве мишеней использовали различные линии клеток солидных опухолей - НТ29 (колоректальный рак), А549 (аденокарцинома легкого), NCI-H460 (аденокарцинома легкого) и MCF7 (рак молочной железы), каждую из которых высевали при плотности 1×104 клеток/лунка в 96-луночные планшеты и культивировали в течение 18-20 часов в CO2 инкубаторе при 37°С. После удаления культуральной среды из каждой лунки в культуральную среду с добавлением 5% FBS добавляли химерное антитело 27В6 в концентрации 0 мкг/мл, 0,1 мкг/мл или 3 мкг/мл, а затем вносили в лунки планшета в концентрации 100 мкл/лунка, после чего инкубировали в течение 30 мин в CO2 инкубаторе при 37°С. Затем эффекторные клетки, полученные, как описано выше, высевали при плотности 5×105 клеток/лунка (в 50 раз больше по сравнению с клетками-мишенями) и культивировали в течение 24 часов в СО2 инкубаторе при 37°С. В качестве положительного контроля перед инкубацией добавляли буфер для лизиса при 37°С на 24 часа. После 24 часов инкубации культуру клеток центрифугировали при 2500 об/мин в течение 5 мин. В полученном таким образом супернатанте количественно определяли активность лактатдегидрогеназы (LDH) для расчета лизиса клеток (набор для анализа Promega). Как показано на Фиг. 11, моноклональное антитело 27В6 по настоящему изобретению проявляло антителозависимую клеточно-опосредованную цитотоксичность против различных солидных опухолей (Фиг. 11). На Фиг. 10 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты антитела 27В6.
9-2: Анализ антителозависимой клеточно-опосредованной цитотоксичности при трижды негативном раке молочной железы (анализ ADCC-LDH)
Эффекторные клетки были получены таким же способом, как в Примере 9-1, и проведено их тестирование для определения антителозависимой клеточно-опосредованной цитотоксичности.
Дополнительно было обнаружено, что антитело 27В6 проявляет высокую антителозависимую клеточно-опосредованную цитотоксичность в линиях клеток трижды негативного рака молочной железы (MDAMB-231, MDAMB-468, MDAMB-453, ВТ-20), для которого еще не разработаны терапевтические агенты (Фиг. 12). На Фиг. 12 показаны антителозависимые клеточно-опосредованные цитотоксические эффекты антитела 27В6 на линии клеток трижды негативного рака молочной железы.
Пример 10. Терапевтическое действие дефукозилированного антитела в отношении солидной опухоли (ADCC)
10-1: Анализ ADCC дефукозилированного химерного антитела 27В6 - рак ободочной кишки, легкого, молочной железы
Для индуцирования дефукозилирования белков антител линии клеток антитела 27В6 примера 2 и линии клеток химерного антитела 4В4 примера 4 инкубировали со 100 нг/мл кифунензина, который индуцирует дефукозилирование антитела, и дефукозилированные антитела разделяли и сравнивали с соответствующими фукозилированными антителами. Анализ ADCC обработанного кифунензином химерного антитела 27В6 с усиленной ADCC показал эффект ADCC дефукозилированного антитела при раке ободочной кишки, раке легкого и раке молочной железы.
Как видно на Фиг. 13, антителозависимая клеточно-опосредованная цитотоксичность антител, дефукозилированных кифунензином, против различных линий клеток солидных опухолей была повышена. На Фиг. 13 показана антителозависимая клеточно-опосредованная цитотоксичность дефукозилированного химерного антитела 27В6.
10-2: Анализ ADCC дефукозилированного химерного антитела 27В6 - трижды негативный рак молочной железы
С использованием люциферазного анализа ADCC был проведен анализ антителозависимой клеточно-опосредованной цитотоксичности против линии клеток трижды негативного рака молочной железы MDAMB231 и линии клеток рака молочной железы, положительного по рецептору HER2, SK-BR3. Антитела после дефукозилирования обработкой кифунензином проявляли повышенную антителозависимую клеточно-опосредованную цитотоксичность в отношении линий клеток MDAMB231 и SK-BR-3 по сравнению с соответствующими фукозилированными антителами (Фиг. 14).
На Фиг. 14 показана антителозависимая клеточно-опосредованная цитотоксичность дефукозилированных химерных антител 4В4 и 27В6, определенная посредством люциферазного анализа.
Конкретно в качестве клеток-мишеней использовали линии клеток рака молочной железы MDAMB231 и SK-BR3, которые высевали при плотности 1,25×104 клеток/лунка в 96-луночные планшеты и культивировали в течение 20-24 часов в СО2 инкубаторе при 37°С. После удаления культуральной среды из каждой лунки, в которые были высеяны клетки, в лунки добавляли 25 мкл среды RPMI, содержащей 4% FBS с низкой концентрацией IgG. Проводили 3-кратное серийное разведение антител 27В6 и 4В4 от 10 мкг/мл до 1,2 нг/мл в среде RPMI, содержащей 4% FBS с низкой концентрацией IgG. Каждое серийное разведение антитела добавляли в количестве 25 мкл/лунка, планшеты закрывали крышками и оставляли в чистом лабораторном боксе. Клетки-репортеры ADCC (ADCC Reporter Bioassay, Promega) собирали из культуры клеток и суспендировали в концентрации 3×106 клеток/мл в среде RPMI, содержащей 4% FBS с низкой концентрацией IgG. В каждую лунку добавляли 25 мкл суспензии клеток-репортеров ADCC с последующей инкубацией в течение 24 часов в СО2 инкубаторе при 37°С. Перед извлечением планшетов замороженный субстрат люциферазы размораживали на водяной бане. Планшеты извлекали из чистого лабораторного бокса и оставляли при комнатной температуре на 15 мин. В лунки планшетов добавляли субстрат люциферазы в концентрации 75 мкл/лунка и оставляли для взаимодействия на 30 мин в темноте, после чего измеряли люминесценцию с помощью люминометра. Результат тестирования антителозависимой цитотоксичности дефукозилированных химерных антител 27В6 и 4В4 с использованием люциферазного анализа представлен на Фиг. 14.
Как видно на Фиг. 14, антитела 27В6 и 4В4 после дефукозилирования обработкой кифунензином проявляли повышенную антителозависимую клеточно-опосредованную цитотоксичность в отношении линий клеток MDAMB231 и SK-BR-3 по сравнению с соответствующими фукозилированными антителами.
Пример 11. Терапевтический эффект антител 27В6 и 4В4 в моделях на мышах
11-1: Основание линии клеток
Животные модели рака молочной железы человека были созданы с использованием линий клеток трижды негативного рака молочной железы MDA-MB-231 и MDA-MB-453. Сначала MDA-MB-231 или MDA-MB-453 вводили путем подкожной инъекции в дозе 1,5×108 клеток (в RPMI: смеси Матригель) в правый бок мышей. После инъекции мышей случайным образом распределяли в экспериментальную и контрольную группы.
На Фиг. 15 дополнительно показано связывание химерного антитела 27В6, описанного в Примере 2, и химерного антитела 4В4, описанного в Примере 4, с поверхностью клеток MDA-MB231, используемых в эксперименте с животными, а на Фиг. 16 показаны результаты эксперимента с животными с использованием антител, демонстрирующие, что эти антитела подавляют рост и размер опухоли, индуцированной MDA-МВ231.
В качестве тестируемых материалов в клетки рака молочной железы вносили фукозилированное химерное антитело 27В6, дефукозилированное химерное антитело 27В6, фукозилированное химерное антитело 4В4 и дефукозилированное химерное антитело 4В4. Спустя трое суток каждой мыши вводили клетки путем интраперитонеальной инъекции в дозе 12 мг/кг. Инъекцию проводили два раза в неделю в течение трех недель. Непосредственно перед инъекцией измеряли размер опухоли. Ингибирующую активность антител к СА12 против рака молочной железы выражали в виде объема опухоли, рассчитанного по следующей формуле: (а×b2)/2 (а представляет собой короткий диаметр, a b представляет собой длинный диаметр). Уравнение для расчета объема аналогично формуле расчета объема Примера 20-1.
[Уравнение]
Уравнение расчета объема (объем = (а×b2)/2, где а представляет собой короткий диаметр, a b представляет собой длинный диаметр).
11-2: Ингибирующая активность антител к СА12 против трижды негативного рака молочной железы
Был проведен анализ ингибирующей активности против трижды негативного рака молочной железы химерного антитела 4В4 к СА12, нацеленного на эпитоп СА12, специфично экспрессирующийся в клетках трижды негативного рака молочной железы.
Под действием антитела 4В4 опухоли молочной железы уменьшались в объеме, и активность дефукозилированного антитела превосходила активность соответствующего фукозилированного антитела против роста опухоли. Ингибирующая активность фукозилированного антитела 4В4 против роста опухолей молочной железы была обнаружена в обеих линиях клеток MDA-MB-231 и MDA-МВ-453.
В частности, в модели MDA-MB-453 наблюдали полную ремиссию, так как опухоль переставала расти после суток 21 (Фиг. 17). На Фиг. 17 показана ингибирующая активность антитела 4В4 против трижды негативного рака молочной железы.
Пример 12. Эффект антитела на выживаемость клеток
Был подтвержден эффект химерного антитела 4В4 примера 4 на жизнеспособность клеток. Эффекты антител на рост и выживаемость клеток исследовали при нанесении антител на СА12-положительные раковые клетки. Для этого за одни сутки до нанесения антитела клетки высевали в 96-луночные планшеты с плоским дном лунки при плотности 3×104 клеток/лунка (10% RPMI). Через 24 часа среду RPMI удаляли, и в каждую лунку добавляли по 100 мкл свежей 5% среды RPMI, содержащей антитело.
Через 24 часа добавляли набор CytoTox 96® для нерадиоактивного анализа цитотоксичности (Promega, номер по каталогу G1780) в концентрации 50 мкл/лунка и инкубировали в течение 30 мин при комнатной температуре. Жизнеспособность клеток определяли с помощью спектрофотометра. Жизнеспособность клеток MDA-МВ231 определяли через двадцать четыре часа после нанесения антитела.
Результаты измерений показаны на Фиг. 18. Введение антител не приводило ни к стимуляции, ни к нарушению жизнеспособности клеток. Антитела не ингибировали ферментативную активность клеток СА12 и не влияли на рост опухолевых клеток. Таким образом, было обнаружено, что антитела в соответствии с настоящим изобретением осуществляют противоопухолевую активность посредством ADCC и CDC за счет иммунной системы.
Жизнеспособность клеток определяли через 24 часа, 48 часов и 72 часа после введения антитела к А549. Значимых изменений жизнеспособности клеток по сравнению с клетками, в которые не вводили антитела, не наблюдалось. На Фиг. 19 и 20 показано, что связывание одного антитела 4В4 с опухолевыми клетками не влияет на рост опухолевых клеток.
Антитело 4В4 в качестве антитела к СА12 не оказывало влияния на рост клеток только при связывании антитела с клетками. По-видимому, это объясняется тем фактом, что антитело 4В4 не влияет на ферментативную активность СА12, поскольку оно связывается с N-концевой неферментативной областью антигена СА12.
Пример 13. Оценка терапевтического эффекта комбинированной терапии антителом и радиотерапии
Было проведено исследование, чтобы определить, приведет ли комбинация антитела по настоящему изобретению и радиотерапии к повышенному противораковому эффекту.
Кратко, химерное антитело 27В6 по Примеру 2 применяли в комбинации с 5 мкг/мл цисплатина, облучением в дозе 2 Гр или 4 Гр и проводили анализ экспрессии СА12 в клетках А549 методом проточной цитометрии. В результате было обнаружено, что и цисплатин, и облучение повышают экспрессию СА12 на поверхности клеток, при этом максимальный уровень экспрессии индуцировало облучение в дозе 4 Гр. Это свидетельствует о том, что комбинация антитела к СА12 по настоящему изобретению с радиотерапией способна влиять на рост опухолевых клеток (верхняя диаграмма на Фиг. 20).
Для исследования эффекта комбинированной терапии на рост опухолевых клеток, как показано на нижней диаграмме Фиг. 20, определяли жизнеспособность линии раковых клеток А549 с помощью анализа МТТ, после чего ее подвергали воздействию комбинации антитела 27В6 и радиотерапии. На нижнем графике на Фиг. 20 показаны эффекты комбинации антитела 27В6 и радиотерапии на жизнеспособность клеток. Как видно на Фиг. 20, комбинация 27В6 и радиотерапии индуцировала гибель клеток в более высокой степени по сравнению с одним антителом или комбинацией контрольного антитела того же изотипа и радиотерапии.
Пример 14. Гуманизация химерного антитела к СА-XII
14-1: Конструирование гуманизированных вариабельных доменов (отбор формы DNP004 scFv)
Химерное антитело 4В4 в полноразмерной форме IgG, полученное в Примере 4, было преобразовано в форму scFv для скрининга антител с помощью технологии фагового дисплея, принадлежащей D.H. Lab. Для этого кодоны вариабельной области химерного антитела 4В4 были изменены на кодоны E. coli, и сконструирован ген scFv путем соединения VL и VH методом PCR. Для получения различных конструкций комбинировали порядок последовательностей VL и VH и длину линкера и лигировали их с фагмидным вектором. Лигированный плазмидный вектор подвергали анализу связывания с антигеном СА-XII и отобрали DNP004 scFv в форме VH-длинный линкер-VL, которую использовали в качестве матрицы для мутагенеза.
14-2: Конструирование и скрининг подбиблиотеки
Для полной или частичной вариабельной области было получено 11 подбиблиотек случайных мутаций или специфичных к положению мутаций методом «ноу-хау», принадлежащим D.H. Lab. Были получены следующие типы подбиблиотек:
(1) Подбиблиотека случайных мутаций: 1 вид VL, 1 вид VH, 2 вида VH и VL и
(2) Подбиблиотека специфичных к положению мутаций: три вида LCDR, три вида HCDR и 1 вид VH и VL.
Проводили биопэннинг СА-XII в этих одиннадцати (11) подбиблиотеках. В результате первого скрининга было отобрано 552 клона с высоким сигналом в области VL. Был проведен второй скрининг, и отобрано 78 клонов, сигнал которых превышал сигнал материнского клона. После подтверждения нуклеотидной последовательности было отобрано в общей сложности 32 клона с различными полинуклеотидными последовательностями.
Аффинность связывания этих отобранных 32 клонов с СА-XII повторно подтверждали методом ELISA и отобрали 10 клонов (ID (идентификационные номера) клонов 1, 2, 4, 5, 8, 15, 24, 25, 26, 28) с сигналом ELISA, в 1,5 раза превышающим сигнал химерного антитела 4В4. В результате анализа последовательностей их CDR было подтверждено наличие мутаций в областях LCDR1 и LCDR2 (Фиг. 22).
Поэтому участки LCDR1 и LCDR2 считали «горячими точками» мутаций и отобрали 10 клонов (ID клона: 1, 2, 4, 5, 8, 15, 24, 25, 26, 28) и 4 дополнительных клона с мутациями в участке LCDR2 (ID клона: 11, 22, 19, 30), которые затем были преобразованы в полноразмерный IgG (LK Sun, Р Curtis, Chimeric antibody with human constant regions and mouse variable regions directed against carcinoma-associated antigen 17-1A, Proc Natl Acad Sci USA. 1987 Jan; 84 (1): 214-8) (Фиг. 21 и 22). Однако клоны ID 4, 5, 24 и 28 были исключены из этих 14 клонов в качестве материала для дальнейшего анализа в связи с низкой экспрессией. Сводные данные о сайтах мутаций из десяти отобранных клонов представлены в Таблице 12.


14-3: Трансфекция культуры гуманизированной библиотекой и количественное определение IgG
Клетки СНО (яичника китайского хомячка) высевали в 96-луночные планшеты и трансфицировали ДНК, выделенной из гуманизированных клонов минипрепаративным методом. Подробно методика эксперимента описана ниже.
Сначала за 12 часов до трансфекции линию клеток СНО высевали в 6-луночный планшет в концентрации 1×105 клеток/мл и добавляли 3 мл среды DMEM, содержащей 5% фетальную бычью сыворотку и культивировали при 37°С в 5% СО2 в течение 12 часов. Подготовленные клетки СНО трансформировали десятью видами ДНК полноразмерного IgG, используя набор реагентов ViaFect (Promega, США). Супернатанты культуры клеток собирали через 48 часов после трансфекции и подтверждали реакционность каждого гуманизированного клона и контрольного антитела IgG посредством ELISA.
В каждую лунку планшета Maxisrop ELISA добавляли 100 нг рекомбинантного белка СА-XII и подвергали взаимодействию при 37°С в течение одного часа для иммобилизации антигена в виде покрытия. Затем в каждую лунку добавляли 200 мкл 1-кратного блокирующего раствора (Sigma) и проводили реакцию блокирования при 37°С в течение одного часа. В подготовленный планшет добавляли моноклональное антитело 4В4, 27В6, антитело к СА-XII (R&D Systems) и PBS по 100 мкл, инкубировали при 37°С в течение 1 часа и промывали PBS для удаления несвязанных антител. Затем к реакционной смеси добавляли козье антитело к человеческому IgG-HRP (Jackson), инкубировали в течение 30 минут, промывали PBS, подвергали взаимодействию с раствором ТМВ в количестве 50 мкл на лунку в течение 10 минут, и реакцию гасили добавлением 50 мкл серной кислоты. Поглощение продукта реакции определяли при 450 нм.
14-4: Тестирование аффинности гуманизированного антитела-кандидата к антигену посредством ELISA
Параллельное тестирование связывания гуманизированных клонов с антигеном СА-XII проводили с использованием протоколов и антигенов, предоставленных D.H. Lab. Рассчитывали активность (аффинность) каждого клона и сравнивали с активностью положительного контроля (химерный клон 4В4) на том же планшете. Аффинность связывания 10 вариантов с антигеном (ID клона 1, 2, 4, 5, 8, 15, 24, 25, 26, 28) не превышала значительно аффинность материнского клона (химерного 4В4). Ожидаемая аффинность материнского клона, определяемая посредством ELISA, составляла около KD 10-10 М, то есть была достаточно высокой. Поэтому силу связывания 10 антител-кандидатов считают не сниженной даже в том случае, если аффинность связывания клонов-кандидатов с антигеном не достигает аффинности материнского клона (Фиг. 23 и 24).
Пример 15. Последовательность CDR/последовательность антитела гуманизированного антитела
15-1: Отбор последовательности гена гуманизированного антитела DNP004
Для получения гена гуманизированного антитела DNP004 в качестве матрицы использовали ген вариабельной области легкой цепи и ген вариабельной области легкой цепи мышиного моноклонального антитела 4В4 (гибридома депонирована под номером по каталогу: KCLRF-BP-00279), специфично связывающегося с СА-XII. Для полной или частичной вариабельной области было получено 10 подбиблиотек случайных мутаций или специфичных к положению мутаций методом «ноу-хау» in silico, принадлежащим D.H. Lab.
552 клона подвергали скринингу методом фагового дисплея с использованием сконструированной библиотеки, и 78 клонов показали сигнал, превышающий сигнал при скрининге материнского клона. 32 различных клона подвергали скринингу путем анализа нуклеотидной последовательности. В результате анализа аффинности связывания 32 клонов с СА-XII было отобрано 10 клонов, сигнал которых в ELISA более чем в 1,5 раза превышал сигнал материнского клона, и участки мутаций были определены большей частью в областях LCDR1 и LCDR2. Таким образом, LCDR1 и 2 были выбраны как «горячие точки», и 4 вида (ID клона: 11, 22, 19, 30) с мутацией в области LCDR2 было отобрано для проведения преобразования в полноразмерный IgG1. Из 14 полученных IgG клоны ID 4, 5, 24 и 28 были исключены в связи с низкой экспрессией, и оставшиеся 10 клонов подвергали экспрессии и очистке, и наконец проводили ELISA для отбора конечных 10 видов.
Наконец, было отобрано антитело-кандидат №8, которое было в наибольшей степени подобно мышиному моноклональному антителу 4В4. Гены для каждого антитела-кандидата были идентифицированы путем секвенирования. Последовательности вариабельной области тяжелой цепи и последовательности вариабельной области легкой цепи анализируемого антитела DNP004 представлены ниже (Таблицы 13 и 14). Как показано ниже в Таблице 13, последовательности CDR вариабельной области тяжелой цепи могут быть одинаковыми или частично различаться, но последовательности CDR вариабельной области легкой цепи могут различаться. Аминокислоты, выделенные полужирным шрифтом в SEQ ID NO: 15, 16, 28 и 32-42 ниже, модифицированы.



В Таблице 15 ниже представлены последовательности вариабельной области тяжелой цепи и последовательности вариабельной области легкой цепи; все вариабельные области тяжелой цепи идентичны (SEQ ID NO: 53), но вариабельные области легкой цепи (SEQ ID NO: 54-63) различаются. Подчеркнутая часть последовательности соответствует последовательности CDR.


15-2: Получение гуманизированного антитела
Гуманизированное антитело было получено на основании аминокислотной последовательности полученного гуманизированного антитела к СА-XII DNP004.
Для экспрессии гуманизированных антител к СА-XII были получены плазмида для экспрессии тяжелой цепи и плазмида для экспрессии легкой цепи, соответственно. В качестве плазмиды для экспрессии тяжелой цепи использовали вектор PcDNA3.4 (Invitrogen), а в качестве плазмиды для экспрессии легкой цепи использовали вектор pOptiVEC (Invitrogen).
Для экспрессии кодирующей кДНК вариабельной области и кодирующей кДНК константной области каждого антитела в виде непрерывной аминокислотной последовательности без вставки дополнительной аминокислоты были синтезированы кодирующая последовательность клонированной вариабельной области и известной константной области IgG1 человека (тяжелая цепь) и константной области каппа (легкая цепь) (Bioneer). Для конструирования плазмиды для экспрессии полноразмерного антитела синтезированные гены тяжелой цепи и гены легкой цепи расщепляли ферментами рестрикции Xho I и Sal I, и фрагмент гена тяжелой цепи лигировали с вектором pcDNA3.4, а фрагмент гена легкой цепи лигировали с вектором pOptiVec (плазмида для экспрессии тяжелой цепи pcDNA3.4-4B4 и плазмида для экспрессии легкой цепи pOptiVEC-4B4).
Для проведения трансформации клетки DG44 (Invitrogen), имеющие происхождение от клеток СНО, трансфицировали полученными плазмидами для экспрессии тяжелой цепи pcDNA3.4-4B4 и для экспрессии легкой цепи pOptiVEC-4B4.
За трое суток до трансфекции клетки DG44 в суспензии адаптировали к питательной среде MEM, содержащей 5% FBS для их преобразования в прикрепленные клетки и повышения эффективности трансфекции. Трансфекцию проводили на 6-луночном планшете, используя реагент для трансфекции ViaFect (Promega, № по каталогу: Е4981). За сутки до трансфекции клетки DG44, адаптированные к прикрепленному состоянию, готовили к трансфекции путем субкультивирования с получением концентрации 1×105 клеток/лунка. Количество ДНК, используемое для трансфекции, было определено путем использования 3 мкг плазмиды для экспрессии легкой цепи pOptiVEC-4B4 и 1 мкг pcDNA3.4-4B4 плазмиды для экспрессии тяжелой цепи в соотношении смешивания 3:1. Трансфекцию выполняли в течение 48 часов. Для анализа популяции трансфицированных клеток использовали метод проточной цитометрии.
На Фиг. 25 показано связывание гуманизированного антитела DNP004 в линии клеток положительного по СА-XII и трижды негативного рака молочной железы MDAMB-231.
Пример 16. Оценка физических свойств группы антител-кандидатов
Для сопоставления экспрессии и физических свойств гуманизированных вариантов антитела была проведена их оценка и сравнение методами анализа SDS-PAGE, эксклюзионной хроматографии, температуры плавления, ANS-реакционность.
16-1: Анализ уровня экспрессии группы антител-кандидатов
Для подтверждения уровня экспрессии и наличия осаждения при очистке с белком А проводили транзиторную трансфекцию путем введения комбинированного вектора из 8 мутантов в клетки HEK293F.
300 мл каждой культуры наносили на колонку с белком A (GE Healthcare, № по каталогу 11-0034-93) и очищали, используя буфер для элюирования (цитратный буфер 20 мМ, рН 3,0). Полученное антитело подвергали диализу с забуференным фосфатом физиологическим раствором и определяли количественно до и после диализа для подтверждения потерь. Уровни экспрессии очень сильно различались в диапазоне 1,0-10,0 мкг/мл, и самые высокие уровни экспрессии наблюдали для вариантов под номерами 25 и 26 (Таблица 16).
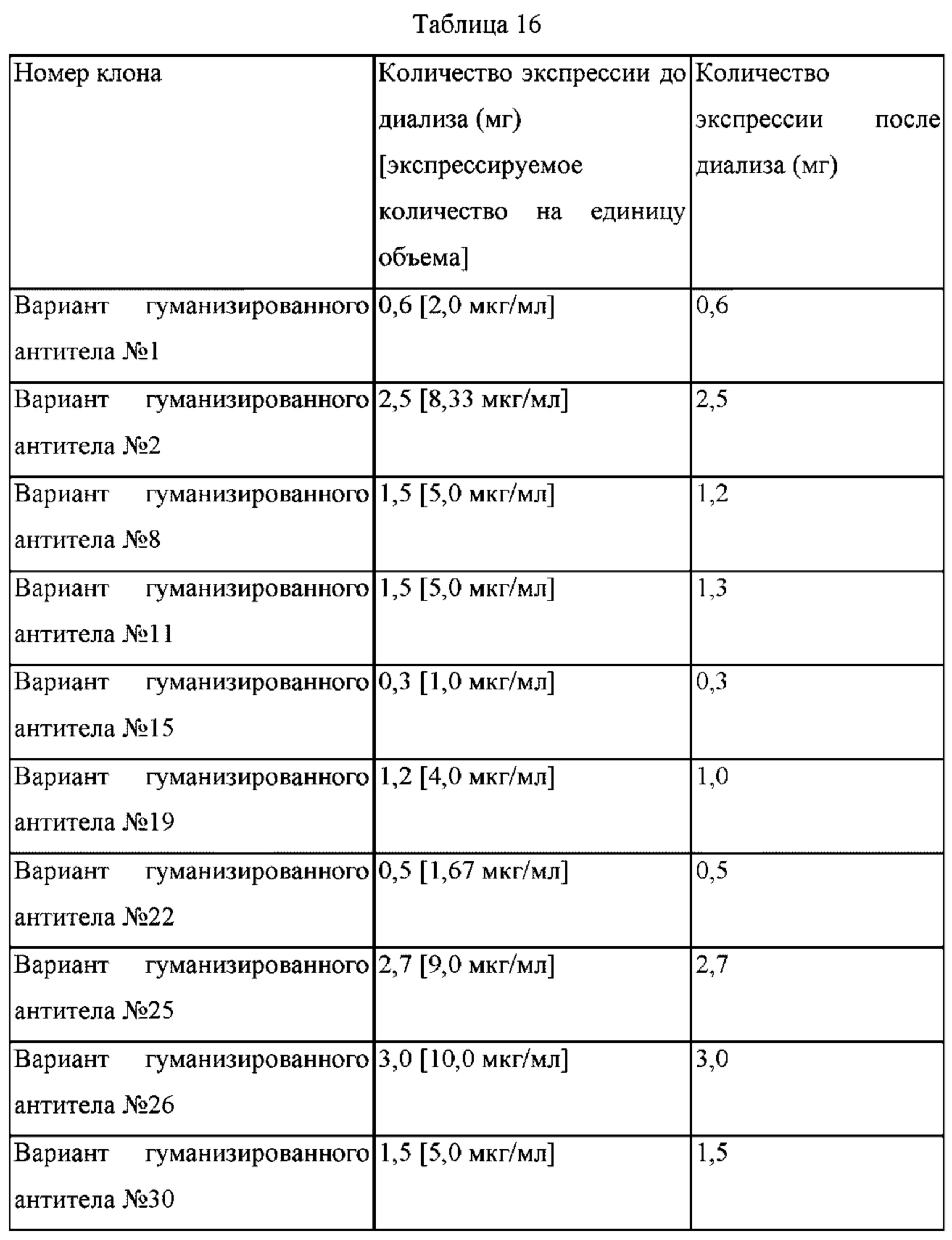
16-2: SDS-PAGE-анализ антител-кандидатов
Анализ SDS-PAGE проводили, чтобы определить полноту связывания тяжелой/легкой цепи гуманизированных вариантов антитела, единства тяжелой цепи и легкой цепи.
При анализе в невосстанавливающих условиях 5 мкг антитела восстанавливали, 10 мкг антитела смешивали с 2-кратным буфером Лэммли (Bioread, № по каталогу 161-0737), кипятили при 100°С в течение 5 минут и наносили на гель ini-PROTEAN TGX Bio-Rad, № по каталогу 456-1083). Электрофорез проводили при 150 В в течение 1 часа и окрашивали красителем Simply Blue Safestain (Invitrogen, № по каталогу LC6060) в течение 2 часов и обессоливали дистиллированной водой. Из восьми гуманизированных вариантов антитела в варианте клона №15 окрашивание легкой цепи было нечетким, но ни в одном из остальных 7 вариантов отклонений не было обнаружено (Фиг. 26).
На Фиг. 26 представлена фотография, на которой показан результат анализа физических свойств группы антител-кандидатов с использованием SDS-PAGE. Из 15 гуманизированных вариантов антитела в варианте клона №15 окрашивание легкой цепи было нечетким, но ни в одном из остальных 7 вариантов отклонений не было обнаружено (Фиг. 26).
16-3: Анализ антител-кандидатов методом SE-HPLC (эксклюзионной высокоэффективной жидкостной хроматографии)
Анализ методом эксклюзионной хроматографии проводили для оценки чистоты.
Каждое антитело разводили забуференным фосфатом физиологическим раствором до получения 1,0 мг/мл и наносили 20 мкл на колонку TSKgel G3000SWXL (TOSOH), уравновешенную буфером для уравновешивания (0,1 М фосфата натрия, 0,1 М хлорида натрия, рН 7,0). Буфер для уравновешивания пропускали со скоростью потока 0,5 мл/мин в течение 40 минут, и элюируемый белок выявляли при длине волны 280 нм. Для расчета площади каждого пика выявленные пики интегрировали с помощью автоматического анализа, и доля площади основного пика указана в процентах.
Доля площади основного пика большинства вариантов соответствовала 95% или более чистоты, но для вариантов №11 и №26 она составляла 94,3% и 94,1% соответственно, то есть несколько ниже (Таблица 17).
16-4: Анализ температуры плавления (Tm) группы антител-кандидатов
Для сравнительной оценки устойчивости измеряли температуру плавления гуманизированных вариантов антитела.
Краситель для определения термического сдвига белка и буфер (Invitrogen, № по каталогу 4462263) добавляли к 0,44 мкг варианта антитела в соответствии с инструкцией производителя с получением 20 мкл смешанного раствора, который вводили в прибор для PCR в реальном времени, оборудованный программным обеспечением Protein Thermal Shift™ версия 1.0. Значения флуоресценции, определяемые за счет связывания красителя для определения термического сдвига белков и антителом, определяли при непрерывном повышении температуры с 25°С до 95°С со скоростью 0,05°С/с. После завершения этого теста применяли подбор кривой Больцмана с помощью программного обеспечения ViiA (ТМ) 7 и рассчитывали температуру плавления (Tm) для каждого антитела. Самым устойчивым антителом был мутант 8, Tm которого составляла 71,41°С. Для подтверждения корреляции между Tm и чистотой каждый мутант оставляли без перемешивания при высокой температуре 62°С на 3 часа, а затем подвергали анализу методом эксклюзионной хроматографии, чтобы рассчитать долю площади основного пика.
Самое высокое соотношение пиков после выдерживания при высокой температуре 62°С было показано для мутанта 8, который был самым устойчивым вариантом при таком же анализе Tm (Таблица 18).

16-5: Оценка силы связывания с СА-XII-положительной линией клеток
Линию клеток рака молочной железы MDAMB231, экспрессирующую антиген СА-XII, культивировали в среде RPMI 1640 (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием FBS, десорбировали трипсином-EDTA (Invitrogen), промывали забуференным фосфатом физиологическим раствором и наливали в пробирку в количестве 2×106 клеток/пробирка.
В каждую пробирку добавляли гуманизированные варианты антитела до концентрации 1,0 мкг/мл и подвергали взаимодействию в течение 30 мин при охлаждении. Добавляли меченное FITC второе козье антитело к IgG мыши (HL) -FITC (DINONA INC, Корея), и клетки подвергали взаимодействию в течение 20 минут в холодильнике. Клетки центрифугировали еще раз с забуференным фосфатом физиологическим раствором, суспендировали их в забуференном фосфатом физиологическом растворе, содержащем 1% формальдегид, и анализировали флуоресценцию в проточном цитометре (Stratedigm, S1000EXi).
Сила связывания мутантов на основании средней интенсивности флуоресценции (MFI) химерного антитела 4В4, связанного с линией клеток MDAMB231, показана на Фиг. 28 в процентах. Для всех вариантов показано, что относительная сила связывания составляет 90% или более, а для вариантов 8, 11, 15 и 26 показана относительная сила связывания 99%, то есть незначительно отличается от химерного антитела (Фиг. 27).
Пример 17. Анализ экспрессии гуманизированного антитела в различных линиях клеток
17-1: Экспрессия антитела в различных линиях клеток
Связывание гуманизированного антитела (DNP004) в различных линиях раковых клеток, полученных из банка линий клеток Кореи (KCLB) и Сеульского национального университета (SNU), было подтверждено методом проточной цитометрии. LNCap, MCF-7, Huh7 и Hs-578T культивировали в питательной среде MEM Дульбекко (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen), а А549, NCI-H460, DLD-1, НТ-29, LS174T, РС-3, SNU638, SNU719, MKN45, NCI-H87, SK-BR3, MDA-МВ231, MDA-MB453 культивировали в питательной среде RPMI 1640 (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием FBS в инкубаторе при 37°С и 5% СО2. В дополнение к этому Нер3В.1-7 и PLC/PRF/5 культивировали в питательной среде MEM Игла (GIBCO, Invitrogen) с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS; GIBCO, Invitrogen), и KATO III культивировали в питательной среде IMDM (GIBCO, Invitrogen) с добавлением 20% инактивированной нагреванием фетальной бычьей сыворотки (GIBCO, Invitrogen) в инкубаторе при 37°С и 5% CO2.
После инкубации с DNP004 при 4°С в течение 30 минут раковые клетки промывали PBS и добавляли к культивируемым раковым клеткам конъюгированное с FITC козье антитело к IgG человека (DINONA INC, Корея). После отмывки PBS клетки анализировали с помощью прибора FACS caliber (Becton Dickinson, США), и результаты представлены ниже (Таблица 19). В приведенной ниже Таблице 19 представлены паттерны экспрессии антигена карбоангидразы 12 в различных линиях солидных раковых клеток. В Таблице 19 процент DNP004-положительных клеток определяли с помощью анализа FACS. Количество клеток, которые связываются с антителом DNP004 из 5000 исследованных клеток рассчитывали в %, - относится к менее 10% от числа положительных клеток, + относится к 10-30% от числа положительных клеток, ++ относится к 30-70% от числа положительных клеток, и +++ относится к 70-100% от числа положительных клеток.


Как показано в Таблице 19, даже несмотря на то, что клетки, имеющие одинаковое происхождение, получены из различных тканевых источников, используемых при конструировании линий клеток, степень положительной реакции может варьировать в зависимости от типа клеток. Однако для гуманизированного антитела DNP004 по настоящему изобретению показана положительная реакция с различными типами линий клеток - аденокарциномы легкого, рака ободочной кишки, рака желудка, рака печени и рака молочной железы, - даже несмотря на несколько различающуюся степень положительной реакции, но показана отрицательная реакция для клеток рака предстательной железы. С другой стороны, для лимфоцитов, мононуклеарных клеток и гранулоцитов периферической крови выявлен отрицательный результат. Эти результаты свидетельствуют о том, что гуманизированное антитело DNP004 по настоящему изобретению можно применять в качестве терапевтического агента для показаний при солидных опухолях, проявляющих положительную реакцию.
17-2: Паттерны экспрессии в различных типах клеток рака молочной железы
Для антитела DNP004 получена положительная реакция как в обоих ER- и PR-положительных, так и в HER2-положительных клетках рака молочной железы. Таким образом, антитело по настоящему изобретению можно применять для лечения трижды негативного рака молочной железы, а также различных типов рака молочной железы. Связывание гуманизированных антител DNP004 в линиях клеток рака молочной железы трех различных фенотипов было подтверждено проточной цитометрией и проведено сравнение со степенью связывания с химерным антителом 4В4.
В частности, линии клеток MDAMB-231 и MDAMB453, MCF-7 и SK-BR-3 культивировали таким же образом, как описано в Примере 5-2. К каждой из культивируемых линий раковых клеток добавляли гуманизированное антитело DNP004. Клетки инкубировали при 4°С в течение 30 минут, промывали PBS и инкубировали при 4°С в течение 15 минут с конъюгированным с FITC козьим антителом к IgG человека (DINONA INC, Корея). Клетки снова промывали PBS и проводили анализ с помощью прибора FACS caliber (Becton Dickinson, США), и результаты показаны на Фиг. 28 и 29.
На Фиг. 28 и 29 показаны результаты тестирования связывания гуманизированных антител DNP004 к антигену карбоангидразы 12 в различных типах клеток рака молочной железы. Таким образом, гуманизированное антитело DNP004 в соответствии с настоящим изобретением можно применять не только для трижды негативного рака молочной железы, но также для различных типов рака молочной железы, поскольку показана их положительная реакция с ER- и PR-, а также HER2-положительными клетками рака молочной железы.
Пример 18. Терапевтический эффект (ADCC) гуманизированных антител против различных солидных опухолей
Оценку антителозависимой цитотоксичности (ADCC) проводили в различных солидных опухолях путем люциферазного анализа. Линии клеток MDAMB-231 и MDAMB-453, MCF7, SK-BR3, линию клеток рака легкого А549, линии клеток рака печени Huh7 и НЕР3В и линии клеток рака желудка KATO III, SNU719 и MKN-45 высевали в концентрации 1,25×104 клеток/лунка и инкубировали при 37°С в СО2-инкубаторе в течение 20-24 часов. После удаления культуральной среды из каждой лунки с высеянными клетками добавляли 25 мкл среды RPMI, содержащей 4% FBS с низкой концентрацией IgG. Гуманизированное антитело DNP004 примера 15 разводили в 3 раза средой RPMI, содержащей 4% FBS с низкой концентрацией IgG, от максимальной концентрации 10 мкг/мл до 1,2 нг/мл. Каждый приготовленный образец антитела добавляли в соответствующие лунки в соответствующих концентрациях, крышку планшета закрывали, и планшет выдерживали в чистом лабораторном боксе. Клетки-репортеры ADCC (набор реагентов ADCC Reporter Bi 5, Promega) собирали из культуры и суспендировали в среде RPMI, содержащей 4% FBS с низкой концентрацией IgG, в концентрации 3×106 клеток/мл. В каждую лунку добавляли 25 мкл суспензии клеток-репортеров ADCC и культивировали при 37°С в СО2-инкубаторе в течение 24 часов.
Готовили предварительно замороженный субстрат люциферазы, размораживая его на горячей водяной бане. Планшет оставляли на 15 минут при комнатной температуре. После добавления в каждую лунку 75 мкл субстрата люциферазы реакцию проводили в течение 30 минут в темном помещении и измеряли интенсивность люминесценции с помощью люминометра.
На Фиг. 30 показан результат определения антителозависимого цитотоксического действия гуманизированного антитела DNP004 в линии клеток рака молочной железы, на Фиг. 31 показан результат определения антителозависимого цитотоксического эффекта гуманизированного антитела DNP004 в линии клеток рака легкого А549, на Фиг. 32 показан антителозависимый цитотоксический эффект гуманизированного антитела DNP004 в линиях клеток Huh7 и НЕР3В и на Фиг. 33 показаны результаты определения антителозависимого цитотоксического действия гуманизированного антитела DNP004 в линиях клеток рака желудка КАТО III, SNU719 и MKN-45.
Таким образом, было доказано, что гуманизированное антитело DNP004 по настоящему изобретению характеризуется апоптическим механизмом действия на клетки посредством антителозависимого цитотоксического эффекта на различные типы клеток солидных опухолей, экспрессирующих антиген DNP004 (СА-XII, карбоангидраза XII).
Пример 19. Оценка терапевтического эффекта гуманизированного антитела с использованием мышиной экспериментальной модели
19-1: Модель рака молочной железы у животных/группа, получавшая антитело в одной концентрации
Модели рака молочной железы человека у животных были установлены с использованием линии клеток MDA-MB-453 трижды негативного рака молочной железы. Сначала 1,5×107 клеток MDA-MB-453 инокулировали подкожно в правый бок мыши, наблюдали образование и рост опухолей и рассчитывали размер опухоли по следующему уравнению.
(Объем = (а×b)/2, а представляет собой короткий диаметр, a b представляет собой длинный диаметр)
После достижения размера опухоли 100±20 мм3 мышей случайным образом распределяли в контрольную группу (5 мышей) и экспериментальную группу (5 мышей) и вводили гуманизированное антитело DNP004 мышам в хвостовую вену в дозе 10 мг/кг. Затем опухоли измеряли два раза в неделю с интервалом 3-4 суток в течение всего периода эксперимента, строили кривые роста от начала введения антитела до окончания эксперимента, и результаты определения средней величины представлены на Фиг. 34а. Таким образом, в группе, которой вводили гуманизированное антитело, было показано ингибирующее действие на рост большинства опухолей (Фиг. 34).
19-2: Модель рака молочной железы у животных/группа, получавшая антитело в нескольких концентрациях
Используя ту же модель рака молочной железы у животных, как в Примере 19-1, проводили эксперименты по введению гуманизированного антитела DNP004 в различных концентрациях.
В частности, мышей делили на четыре группы (4 мг/кг, 8 мг/кг, 16 мг/кг и 32 мг/кг), в каждую из которых распределяли по 5 мышей. В группе, получавшей антитело в дозе 16 мг/кг, показано частичное подавление роста опухоли, но не выявлено какой-либо зависимости эффекта подавления роста опухоли от дозы, но результат полной ремиссии, при котором рост опухоли был полностью подавлен, был склонен к возрастанию по мере увеличения концентрации (Фиг. 35, таблица 20).


19-3: Модель рака почки у животных/группа, получавшая антитело в одной концентрации
Для подтверждения мышиных животных моделей и противоопухолевых эффектов использовали клетки линии 786-O, представляющей собой линию клеток рака почки с высокой экспрессией антигена-мишени (СА-XII) гуманизированного антитела (DNP004) (Фиг. 36).
Конкретно, бестимусным мышам подкожно инъецировали линию клеток 786-O в количестве 1,5×107 клеток. Однако в данных экспериментальных условиях образование опухоли происходило очень медленно в отличие от линии клеток рака молочной железы, и образование опухоли было подтверждено приблизительно через 70 дней. Гуманизированное антитело DNP004 вводили мышам в хвостовую вену в дозе 32 мг/кг в экспериментальных группах, в которых было подтверждено образование опухоли. Опухоли измеряли два раза в неделю через интервалы 3-4 суток в течение всего эксперимента. Строили кривые роста опухоли от начала введения антитела до окончания эксперимента, и общую кривую роста опухоли для 8 мышей в группе, получавшей гуманизированное антитело DNP004, сравнивали с кривой для 3 мышей контрольной группы, как показано на Фиг. 36.
Таким образом, противораковый эффект гуманизированного антитела DNP004 был подтвержден не только для рака молочной железы, но и для рака почки.
Реферат
Изобретение относится к области биохимии, в частности к антителу к CA-XII (карбоангидраза 12) или его антигенсвязывающему фрагменту, специфично связывающемуся с CA-XII, а также к фармацевтической композиции для профилактики, облегчения или лечения солидного злокачественного новообразования, экспрессирующего CA-XII, его содержащей. Также раскрыта молекула нуклеиновой кислоты, кодирующая вышеуказанное антитело или его антигенсвязывающий фрагмент, а также вектор экспрессии и клетка-хозяин, ее содержащие. Изобретение также относится к способу выявления солидного злокачественного новообразования, экспрессирующего CA-XII, предусматривающему использование вышеуказанного антитела или его антигенсвязывающего фрагмента, специфично связывающегося с CA-XII. Изобретение позволяет эффективно осуществлять профилактику, облегчение или лечение солидного злокачественного новообразования, экспрессирующего CA-XII. 6 н. и 30 з.п. ф-лы, 36 ил., 20 табл., 19 пр.
Формула
Документы, цитированные в отчёте о поиске
Избирательное выявление костных метастазов при светлоклеточной почечно-клеточной карциноме

Комментарии