Способы и композиции для лечения фиброзных заболеваний легких - RU2561672C2
Код документа: RU2561672C2
Чертежи


















Описание
Перекрестная ссылка на родственные заявки
Данная заявка притязает на преимущество временной заявки на патент США No. 61/235,846, поданной 21 августа 2009, содержание которого включено посредством ссылки во всей полноте для всех целей.
Утверждение, касающееся федеральной поддержки
Не применимо.
Область техники
Изобретение лежит в области фиброзных заболеваний легких, например, идиопатического фиброза легких (IPF).
Введение
Фиброзные заболевания легких характеризуются воспалением и патологическим образованием соединительной ткани в легких и включают такие патологии, как интерсцитиальная пневмония, синдром острого респираторного дистресса (ARDS) и идиопатический фиброз легких(1РР). Это хронические прогрессирующие заболевания, для которых в настоящее время нет эффективной терапии.
IPF характеризуется воспалением и возможным фиброзом легочной ткани; несмотря на то, что эти два проявления могут быть также разделены. Причина IPF неизвестна; она может возникать либо в результате аутоиммунного заболевания, либо в результате инфекции. Проявления IPF включают одышку (т.е. укорочение дыхания), которая становится основным симптомом при прогрессировании заболевания, и сухой кашель. Смерть может наступить от гипоксемии, право-сердечной недостаточности, сердечного приступа, легочной эмболии, инсульта или легочной инфекции, причем все эти проявления могут быть вызваны этим заболеванием.
С точки зрения патологии ранние стадии IPF характеризуются воспалением альвеол, сопровождающимся альвеолярным фиброзом. Это включает активацию фибробластов, экспансию фибробластов и миофибробластов и аномальное отложение внеклеточного матрикса в легочной паренхиме.
Миофибробласты, связанные с IPF, могут возникать из активированных фибробластов, могут происходить из клеток-предшественников из костного мозга или могут возникать при «эпителиально мезенхимальном переходе (ЕМТ)» эпителиальных клеток легочных альвеол. Фиброзное рубцевание альвеол снижает способность к транспорту кислорода, что приводит к гипоксемии. Гипоксемия, в свою очередь, может вызвать легочную гипертензию, которая со временем ослабляет правый желудочек.
Лечение IPF, главным образом, фармацевтическое, и большая часть больных IPF требует лечения в течение всей жизни. Чаще всего для лечения IPF применяют кортикостероиды (например, преднизон), пеницилламин и различные противоопухолевые средства (например, циклофосфамид, азатипорин, хлорамбуцил, винкристин и колхицин). Другие виды лечения включают введение кислорода и, в экстремальных случаях, трансплантацию легких.
Важно, что все виды лечения IPF, кроме трансплантации легких, не могут вызвать реверсию фиброзного поражения, а только предотвращают дальнейшее развитие фиброза. Поэтому существует потребность в неинвазивных видах лечения IPF, которые не только предотвращали бы прогрессирование заболевания, но и вызывали реверсию имеющегося фиброзного поражения.
Сущность изобретения
В настоящей заявке описаны способы и композиции для предотвращения и лечения фиброзных заболеваний легких. Кроме того, описаны способы и композиции для реверсии и/или уменьшения симптомов фиброзного заболевания легких
Описанные композиции включают ингибиторы лизилоксидазоподобного белка 2 (LOXL2), такие как, например, малые молекулы, нуклеиновые кислоты и белки (например, антитела; например, анти LOXL2 антитело). Поставляются также фармацевтические композиции, включая ингибитор LOXL2 (например, анти-LOXL2 антитело), иногда в сочетании с фармацевтически приемлемым наполнителем.
Типичные фиброзные заболевания легких включают идиопатический фиброз легких (IPF), интерсцитиальную пневмонию и синдром острого респираторного дистресса (ARDS).
Симптомы фиброзных заболеваний легких могут включать, но не ограничиваются ими: сниженный вес тела, повышенный вес легких, фиброз легких, патологическую структуру легких (например, ячеистые легкие), повышенный показатель Ашкрофта, повышенные значения концентрации коллагена в легких, повышенное количество клеток CD45/коллаген, пролиферацию пневмоцитов и расширение и повышенное содержание лейкоцитов в бронхоальвеолярной промывной жидкости (BAL). Симптомы могут также включать, например, повышенные уровни в легких одной или нескольких из следующих молекул: LOXL2, α-актина (α-SMA) из гладких мышц, трансформирующего фактора роста β-1 (TGFβ-1), стромального фактора 1 (SDF-1) (например, SDF-1α), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
Заявленные способы лечения включают введение больному с фиброзным заболеванием легких ингибитора лизилоксидазоподобного белка 2 (LOXL2). Типичные ингибиторы включают, но не ограничиваются антителами к LOXL2. Типичные антитела - это описанные в данной заявке антитела АВ0023 и АВ0024.
Кроме того, представлены способы диагностики фиброзных заболеваний легких у больного путем измерения уровня LOXL2 в образце легочной ткани субъекта, у которого повышенные значения LOXL2 свидетельствуют о становлении или развитии фиброзного заболевания легких. Уровень LOXL2 можно измерять любым общепринятым способом; например, приводя образец в контакт с анти - LOXL2 антителом, регистрируя образование в образце комплекса между антителом и LOXL2 и измеряя количество образованного комплекса. Дополнительные способы измерения включают измерение уровня мРНК LOXL2. Способы измерения уровня мРНК хорошо известны специалистам.
Кроме того, признаками становления или прогрессирования фиброзного заболевания легких являются увеличение в легочной ткани концентрации, например, α-актина гладких мышц (α-SMA), трансформирующего фактора роста β-1 (TGFβ-1), стромального фактора 1 (SDF-1) (например, SDF-1α или SDF-1β), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
В дополнительных воплощениях, предлагаются прогностические способы. Так изобретение включает способы мониторинга реакции субъекта на терапию, направленную на лечение фиброзного заболевания легких у субъекта, с помощью измерения уровня LOXL2 в образце легочной ткани субъекта, у которого сниженный уровень LOXL2 указывают на улучшение при фиброзном заболевании легких. Уровень LOXL2 можно измерять любым известным способом, например, приводя образец в контакт с анти-LOXL2 антителом, регистрируя образование в образце комплекса между антителом и LOXL2 и измеряя количество образованного комплекса. Дополнительные способы измерения включают измерение уровня мРНК LOXL2. Способы измерения уровня мРНК хорошо известны специалистам.
Кроме того, показателем улучшения при фиброзном заболевании легких является снижение в легочной ткани уровня, например, α-актина из гладких мышц (α-SMA), трансформирующего фактора роста β-1 (TGFβ-1), стромального фактора 1 (SDF-1) (например, SDF-1α или SDF-1β), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
Соответственно, настоящее описание включает следующие воплощения, но не ограничивается ими:
1. Способ предотвращения фиброзного заболевания легких у субъекта, где способ включает введение субъекту ингибитора активности лизилоксидазоподобного белка 2 (LOXL2).
2. Способ по п.1, в котором фиброзное заболевание легких выбирают из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброзного заболевания легких (IPF).
3. Способ по п.1, в котором ингибитором является антитело к LOXL2.
4. Способ по п.3, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные BSEQID NO:2.
5. Способ по п.3, в котором антитело является гуманизированным антителом.
6. Способ по п.5, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
7. Способ лечения фиброзного заболевания легких у субъекта, где способ включает введение больному ингибитора активности лизилоксидазоподобного белка 2 (LOXL2).
8. Способ по пункту 7, в котором фиброзное заболевание легких выбрано из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
9. Способ по п.7, в котором ингибитором является антитело к LOXL2.
10. Способ по п.9, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
11. Способ по п.9, в котором антитело является гуманизированным антителом.
12. Способ по п.11, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
13. Способ реверсии симптомов фиброзного заболевания легких у субъекта, где способ включает введение субъекту ингибитора активности лизилоксидазоподобного белка 2 (LOXL2).
14. Способ по п.13, в котором фиброзное заболевание легких выбрано из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
15. Способ по п.13, в котором ингибитором является антитело к LOXL2.
16. Способ по п.15, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
17. Способ по п.15, в котором антитело является гуманизированным антителом.
18. Способ по п.17, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
19. Способ по п.13, в котором симптом выбран из группы, включающей сниженный вес тела, повышенный вес легких, фиброз, структуру легких, повышенный показатель Ашкрофта, повышенную концентрацию коллагена в легких и увеличенное число клеток CD45+/коллаген+.
20. Способ по п.13, в котором симптомом является повышенное содержание одной или большего числа молекул, выбранных из группы, содержащей LOXL2, α-актин из гладких мышц (α-SMA), трансформирующий фактор роста β-1 (TGFβ-1), стромальный фактор-1α (SDF-1α), эндотелин-1 (ЕТ-1) и фосфорилированный SMAD2.
21. Способ по п.13, в котором симптомом является повышенное количество лейкоцитов в бронхоальвеолярной смывной жидкости (BAL).
22. Фармацевтическая композиция для предотвращения или лечения фиброзного заболевания легких или для реверсии симптомов фиброзного заболевания легких у субъекта, которая содержит ингибитор активности лизилоксидазоподобного белка 2 (LOXL2), и фармацевтически приемлемый наполнитель.
23. Композиция по п.22, в котором фиброзное заболевание легких выбрано из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
24. Композиция по п.22, в котором ингибитором является антитело к LOXL2.
25. Композиция по п.24, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
26. Композиция по п.24, где антитело является гуманизированным антителом.
27. Композиция по п.26, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
28. Композиция по п.22, в котором симптом выбран из группы, состоящей из сниженного веса тела, повышенного веса легких, фиброза, структуры легких, повышенного показателя Ашкрофта, повышенной концентрации коллагена в легких и повышенного количества клеток CD45/коллаген.
29. Композиция по п.22, в котором симптомом является повышенный уровень одной или большего числа молекул, выбранных из группы, состоящей из LOXL2, α-актина из гладких мышц (α-SMA), трансформирующего фактора роста β-1 (TGFβ-1), стромального фактора 1 (SDF-1), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
30. Композиция по п.22, в котором симптомом является повышенное содержание лейкоцитов в бронхоальвеолярной промывной жидкости (BAL).
31. Способ диагностирования фиброзного заболевания легких у субъекта, где способ включает:
(a) получение образца легочной ткани субъекта; и
(b) определение уровня LOXL2 в образце;
в котором повышенный уровень LOXL2 в образце субъекта, по сравнению с контрольным образцом, указывают на существование фиброзного заболевания легких.
32. Способ по п.31, в котором фиброзное заболевание легких выбирают из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
33. Способ по п.31, в котором уровень LOXL2 в образце определяют с помощью приведения образца в контакт с антителом к LOXL2, чтобы мог образоваться комплекс между антителом и LOXL2 в образце, и измерения количества образовавшегося комплекса.
34. Способ по п.33, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
35. Способ по п.33, в котором антитело является гуманизированным антителом.
36. Способ по п.35, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
37. Способ мониторинга реакции субъекта на терапию, направленную на лечение фиброзного заболевания легких, причем способ включает:
(a) получение образца ткани у субъекта; и
(b) определение уровня LOXL2 в образце;
в котором сниженный уровень LOXL2 в этом образце по сравнению с контрольным образцом, указывает на улучшение течения фиброзного заболевания легких.
38. Способ по п.37, где фиброзное заболевание легких выбирают из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких(1РР).
39. Способ по п.37, в котором уровень LOXL2 в образце определяют с помощью приведения образца в контакт с антителом к LOXL2, чтобы мог образоваться комплекс между антителом и LOXL2 в образце, и измерения количества образовавшегося комплекса.
40. Способ по п.39, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
41. Способ по п.39, в котором антитело является гуманизированным антителом.
42. Способ по п.41, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
43. Способ по п.37, в котором лечение включает введение субъекту ингибитора LOXL2.
44. Способ по п.43, в котором ингибитором является антитело.
45. Способ по п.44, в котором ингибитор содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
46. Способ по п.44, в котором антитело является гуманизированным антителом.
47. Способ по п.46, в котором ингибитор содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
48. Ингибитор активности лизилоксидазоподобного белка 2 (LOXL2) для применения в предотвращении фиброзного заболевания легких.
49. Ингибитор по п.48, в котором фиброзное заболевание легких выбрано из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
50. Ингибитор по п.48, в котором ингибитором является антитело к LOXL2.
51. Ингибитор по п.50, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
52. Ингибитор по п.50, в котором антитело является гуманизированным антителом.
53. Ингибитор по п.52, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
54. Ингибитор активности лизилоксидазоподобного белка 2 (LOXL2) для применения при лечении фиброзного заболевания легких.
55. Ингибитор по п.54, в котором фиброзное заболевание легких выбирают из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
56. Ингибитор по п.54, в котором ингибитором является антитело к LOXL2.
57. Ингибитор по п.56, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
58. Ингибитор по п.56, в котором антитело является гуманизированным антителом.
59. Ингибитор по п.58, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
60. Ингибитор активности лизилоксидазоподобного белка 2 (LOXL2) для применения при реверсии симптомов фиброзного заболевания легких у субъекта.
61. Ингибитор по п.60, в котором фиброзное заболевание легких выбирают из группы, состоящей из интерсцитиальной пневмонии, синдрома острого респираторного дистресса (ARDS) и идиопатического фиброза легких (IPF).
62. Ингибитор по п.60, в котором ингибитором является антитело к LOXL2.
63. Ингибитор по п.62, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:1 и последовательности легкой цепи, представленные в SEQ ID NO:2.
64. Ингибитор по п.62, в котором антитело является гуманизированным антителом.
65. Ингибитор по п.64, в котором антитело содержит последовательности тяжелой цепи, представленные в SEQ ID NO:3 и последовательности легкой цепи, представленные в SEQ ID NO:4.
66. Ингибитор по п.60, в котором симптом выбран из группы, состоящей из сниженного веса тела, повышенного веса легких, фиброза, структуры легких, повышенного показателя Ашкрофта, повышенных концентраций коллагена в легких, повышенного количества клеток CD45/коллаген.
67. Ингибитор по п.60, в котором симптомом является повышенный уровень одной или большего числа молекул, выбранных из группы, состоящей из LOXL2, α-актина из гладких мышц (α-SMA), трансформирующего фактора роста β-1 (TGFβ-1), стромального фактора 1 (SDF-1), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
68. Ингибитор по п.60, в котором симптомом является увеличение числа лейкоцитов в бронхоальвеолярной промывной жидкости (BAL).
Краткое описание фигур
Фигура 1 демонстрирует средний вес тела в ходе профилактического исследования. Ромбами обозначены контрольные животные, получавшие физиологический раствор (группа 1); звездочками обозначены животные, получавшие блеомицин в нулевой день (группа 2); кружками обозначены животные, которым предварительно вводили анти-LOXL2 антитела и получавшие блеомицин в нулевой день, затем дважды в неделю получавшие антитела анти-LOXL2 (группа 3).
Фигура 2 демонстрирует среднее число лейкоцитов в BAL жидкости из (слева направо) животных, получавших физиологический раствор (группа 1), животных, получавших блеомицин, (Группа 2) и животных, получавших блеомицин, которым до и после были введены анти-LOXL2 (группа 3).
Фигура 3 демонстрирует срезы легких, проанализированные иммуногистохимически на присутствие α-актина из гладких мышц (α-SMA, левые панели) и LOXL2 (правые панели). Верхние панели демонстрируют срезы легких животных, получавших блеомицин и растворитель, который использовали для разведения антител, (группа 2); нижние панели демонстрируют срезы легких животных, получавших блеомицин, которым до и после были введены антитела анти-LOXL2 (AB0023).
Фигура 4 демонстрирует среднюю площадь сигнала LOXL2 в срезах легких животных в группе 1 («Физ р-р»), группе 2 («Блео: носитель») и группе 3 («Блео: АВ0023»).
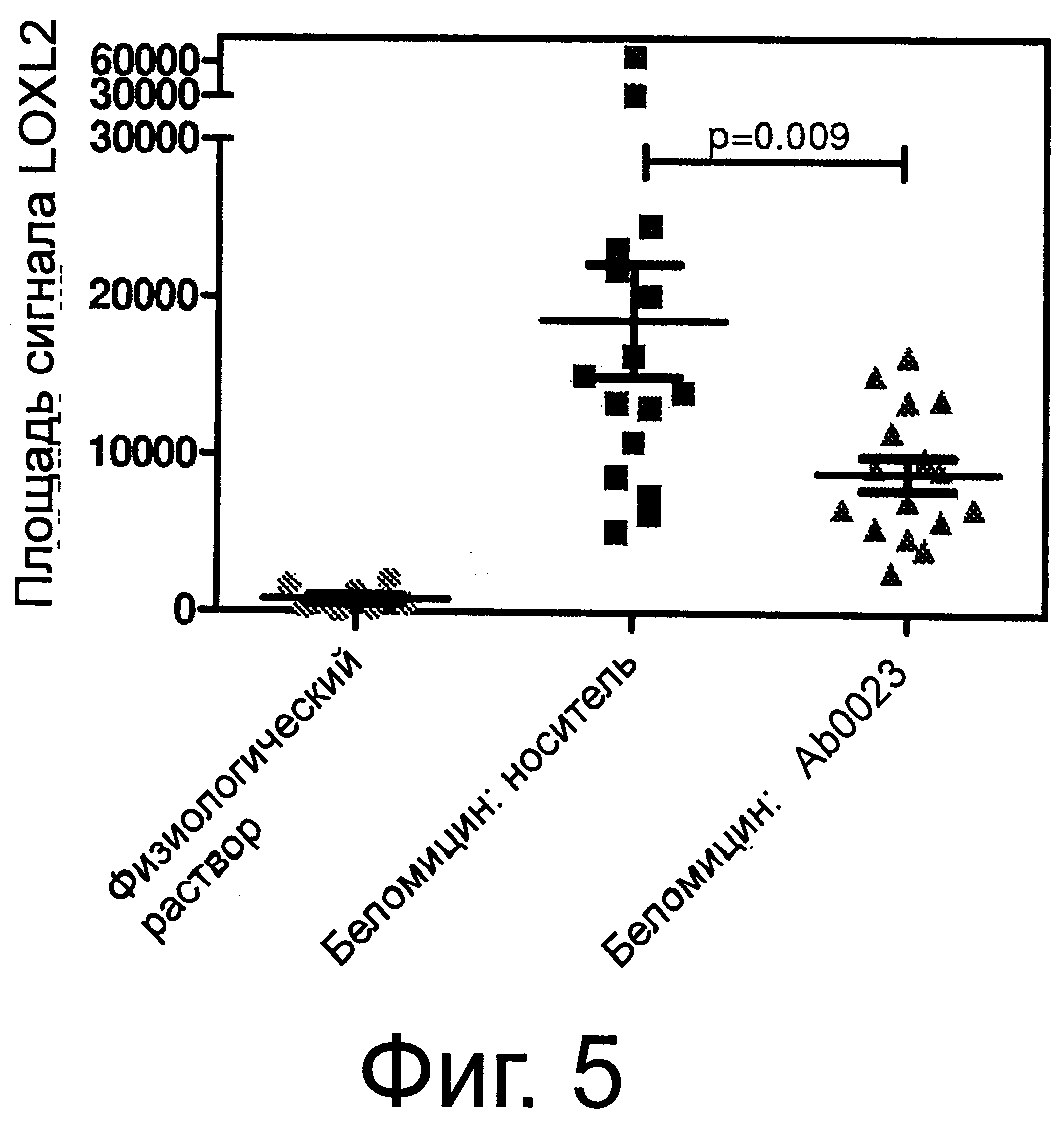
Фигура 5 демонстрирует среднюю площадь сигнала α-SMA в срезах легких животных в группе 1 («Физ р-р»), группе 2 («Блео: носитель») и группе 3 («Блео: АВ0023»).
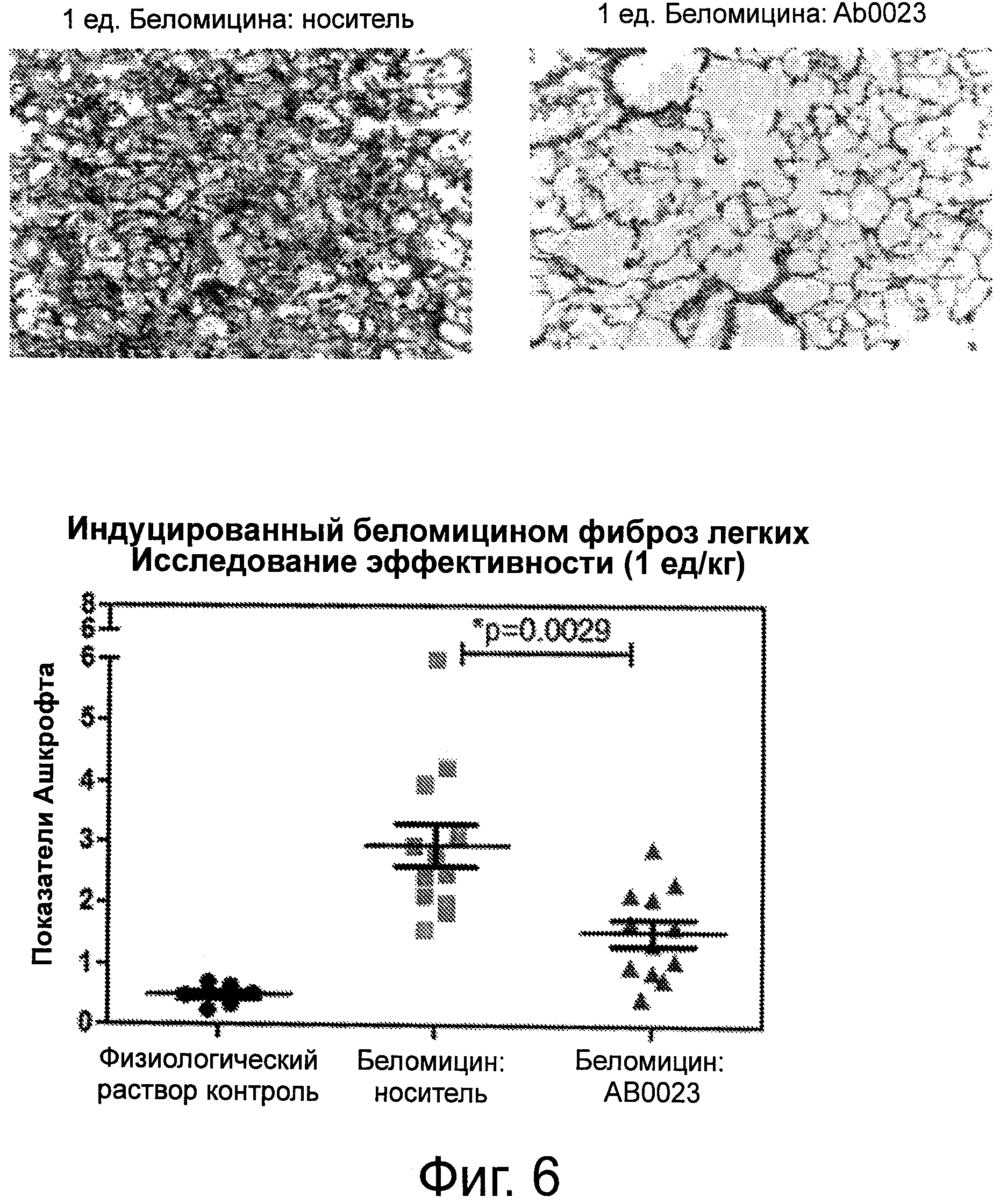
Фигура 6 демонстрирует Н&Е-окрашенные срезы легких животных, получавших блеомицин (группа 2, слева вверху) и блеомицин + анти-LOXL2 антитела (группа 3, справа вверху). Увеличение равно 20х. Показатели Ашкрофта для легких контрольных животных («Физ р-р контроль»), животных, получавших блеомицин («Блеомицин: носитель) и для животных, получавших блеомицин + анти-LOXL2 антитела («Блеомицин: АВ0023»), показаны на нижней панели.
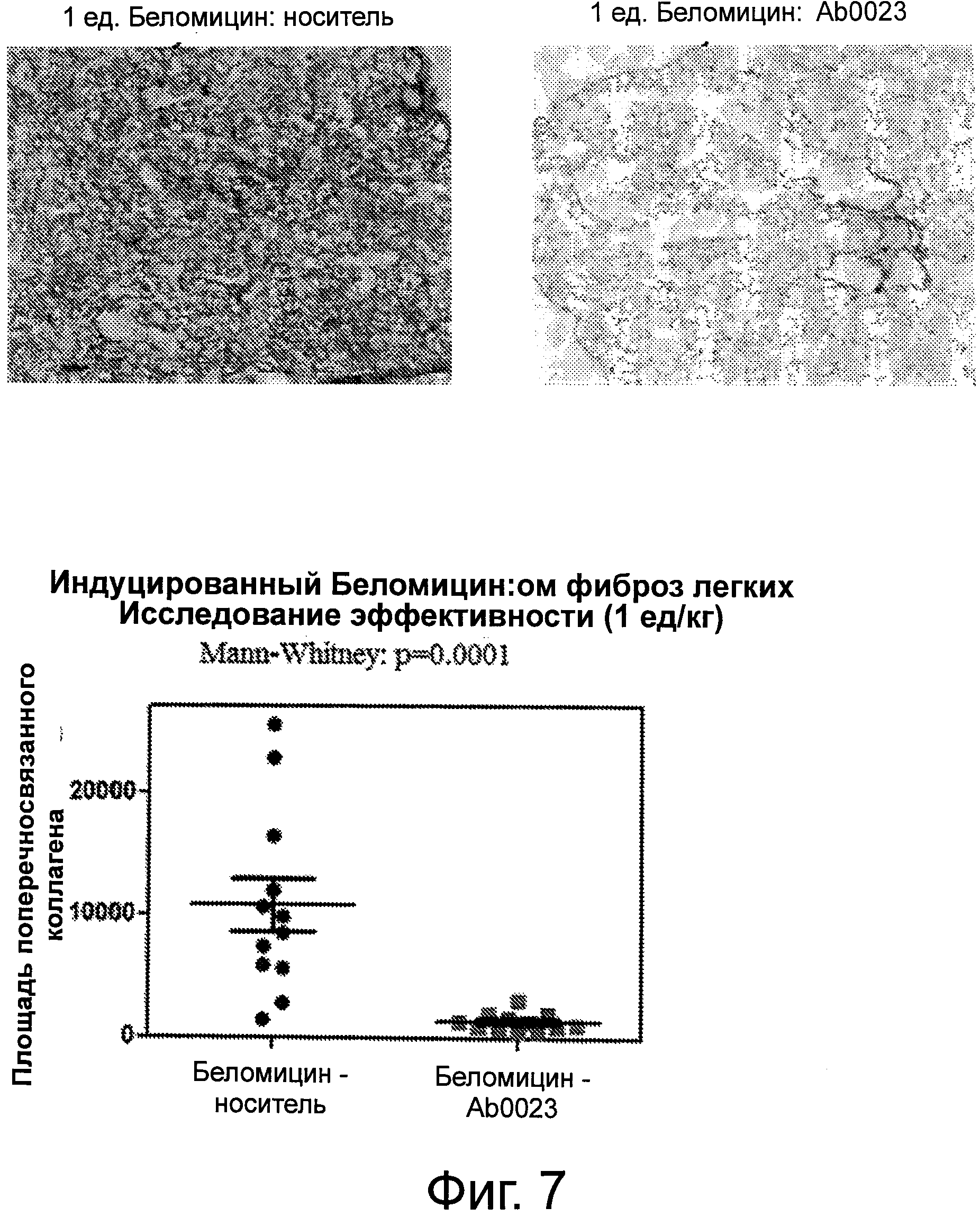
Фигура 7 демонстрирует окрашенные Сириусом красным срезы легких, наблюдавшиеся в проходящем свете, от животных, получавших блеомицин, (группа 2, слева вверху) и блеомицин + анти-LOXL2 антитела (группа 3, справа вверху). Увеличение равно 20х. Количественная оценка уровня поперечно-сшитого коллагена (определяемого путем регистрации окрашивания Сириусом красным в поляризованном свете) для легких животных, получавших блеомицин, («Блеомицин: носитель») и животных, получавших блеомицин + анти-LOXL2 антитела («Блеомицин: АВ0023»), показаны на нижней панели.
Фигура 8 демонстрирует срезы, исследовавшиеся на присутствие стромального фактора-1α (SDF-1α) иммуногистохимическим методом, в срезах легких животных, получавших блеомицин, (группа 2, слева вверху) и + анти-LOXL2 антитела (группа 3, справа вверху). Увеличение равно 20х. Количественная оценка сигнала SDF-1α в срезах легких контрольных животных («физ р-р»), получавших блеомицин, («Блео: носитель») и животных, получавших блеомицин + анти-LOXL2 антитела («Блео: АВ0023»), показаны на нижней панели.
Фигура 9 демонстрирует срезы, исследовавшиеся на присутствие TGFβ-1 иммуногистохимическим методом в срезах легких животных, получавших блеомицин, (группа 2, слева вверху) и блеомицин + анти-LOXL2 антитела (группа 3, справа вверху). Увеличение равно 20х. Количественная оценка сигнала TGFβ-1 в срезах легких контрольных животных («физ р-р»), получавших блеомицин, («Блео: носитель») и животных, получавших блеомицин + анти-LOXL2 антитела («Блео: АВ0023»), показаны на нижней панели.
Фигура 10 демонстрирует относительный уровень p-SMAD2 в легких мышей, получавших блеомицин, которые в то же время получали либо анти-LOXL2 антитела, либо контрольные антитела (АС-1, слева), определяемые с помощью ELISA.
Фигура 11 демонстрирует срезы легких, исследовавшиеся на присутствие TGFβ-1 иммуногистохимическим методом в срезах легких животных, получавших блеомицин, (группа 2, слева вверху) и блеомицин + анти-LOXL2 антитела (группа 3, справа вверху). Увеличение равно 20х. Количественная оценка сигнала TGFβ-1 в срезах легких контрольных животных («физ р-р»), получавших блеомицин, («Блео: носитель») и животных, получавших блеомицин + анти-LOXL2 антитела («Блео: АВ0023»), показаны на нижней панели.
Фигура 12 демонстрирует репрезентативные изображения срезов легких, окрашенных для обнаружения коллагена типа I (зеленый) и CD45 (красный). Увеличение равно 20х на верхней панели и 63х на нижней панели. Две левых панели демонстрируют срезы легких животных, получавших блеомицин («1ед Блеомицин:Носитель») две правые панели демонстрируют срезы легких животных, получавших блеомицин и анти- LOXL2 антитела («1ед Блеомицин: АВ0023»). Колокализация СВ45-положительных клеток и коллагена (указаны стрелками) свидетельствует о возможном присутствии фиброцитов, то есть предшественников фибробластов, которые вносят вклад в фиброз легких.
Введение антител снижало появление клеток - предшественников фиброцитов в ткани легких.
Фигура 13 демонстрирует измерения среднего увеличения веса тела животных, получавших блеомицин, которые получали также последующие инъекции либо антител анти-LOXL2 АВ0023 (верхний график), либо контрольных антител, которые не распознают LOXL2 (АС-1, нижний график).
Фигура 14 демонстрирует измерения увеличения веса легких животных, получавших блеомицин, и контрольных животных. На фигуре показаны значения веса легких у контрольных животных, которые не получали блеомицин («Физ р-р»), которые получали блеомицин, вскоре после введения блеомицина («Harvest Rx»), у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции анти-LOXL2 антител («Блео: АВ0023»).
Фигура 15 демонстрирует окрашенные гематоксилином и эозином (Н&Е) срезы мышиных легких. Верхняя панель демонстрирует репрезентативный срез образца Harvest Rx, сделанный через 24-48 часа после начала введения антитела на 7 день после введения блеомицина, свидетельствуя об утолщении легочной ткани и распространении повреждения легкого. Средняя панель демонстрирует репрезентативный срез легкого животного, получавшего блеомицин и получившего инъекции контрольных АС-1 антител, где наблюдается прогрессирование повреждения легкого. Нижняя панель демонстрирует репрезентативный срез легкого животного, получавшего блеомицин и получившего инъекции анти-LOXL2 АВ0023 антител, свидетельствуя о реверсии поражения легкого, вызванного блеомицином и о нормализации структуры легкого.
Фигура 16 демонстрирует показатели Ашкрофта у контрольных животных, которые не получали блеомицин («Физ р-р»), у животных вскоре после введения блеомицина («Harvest Rx»), у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции контрольных антител («Блео-AC1») и у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции анти-LOXL2 антител («Блео-АВ0023»).
Фигура 17 демонстрирует концентрации α-SMA у контрольных животных, которым не вводили блеомицин («Физ р-р»), у животных вскоре после введения блеомицина («Harvest Rx»), у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции контрольных антител («Блео-ACl») и у животных через 22 дня после введения блеомицина животным, получавших дважды в неделю инъекции анти-LOXL2 антител («Блео-АВ0023»). Уровни α-SMA оценивали иммуногистохимически и определяли количественно с помощью программного обеспечения MetaMorph Imaging (Molecular Devices, Downingtown, PA).
Фигура 18 демонстрирует уровень LOXL2 у контрольных животных, которым не вводили блеомицин («Физ р-р»), у животных вскоре после введения блеомицина («Harvest Rx»), у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции контрольных антител («Блео-ACl») и у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции анти-LOXL2 антител («Блео-АВ0023»). Уровни LOXL2 оценивали иммуногистохимически и определяли количественно с помощью программного обеспечения MetaMorph Imaging (Molecular Devices, Downingtown, PA).
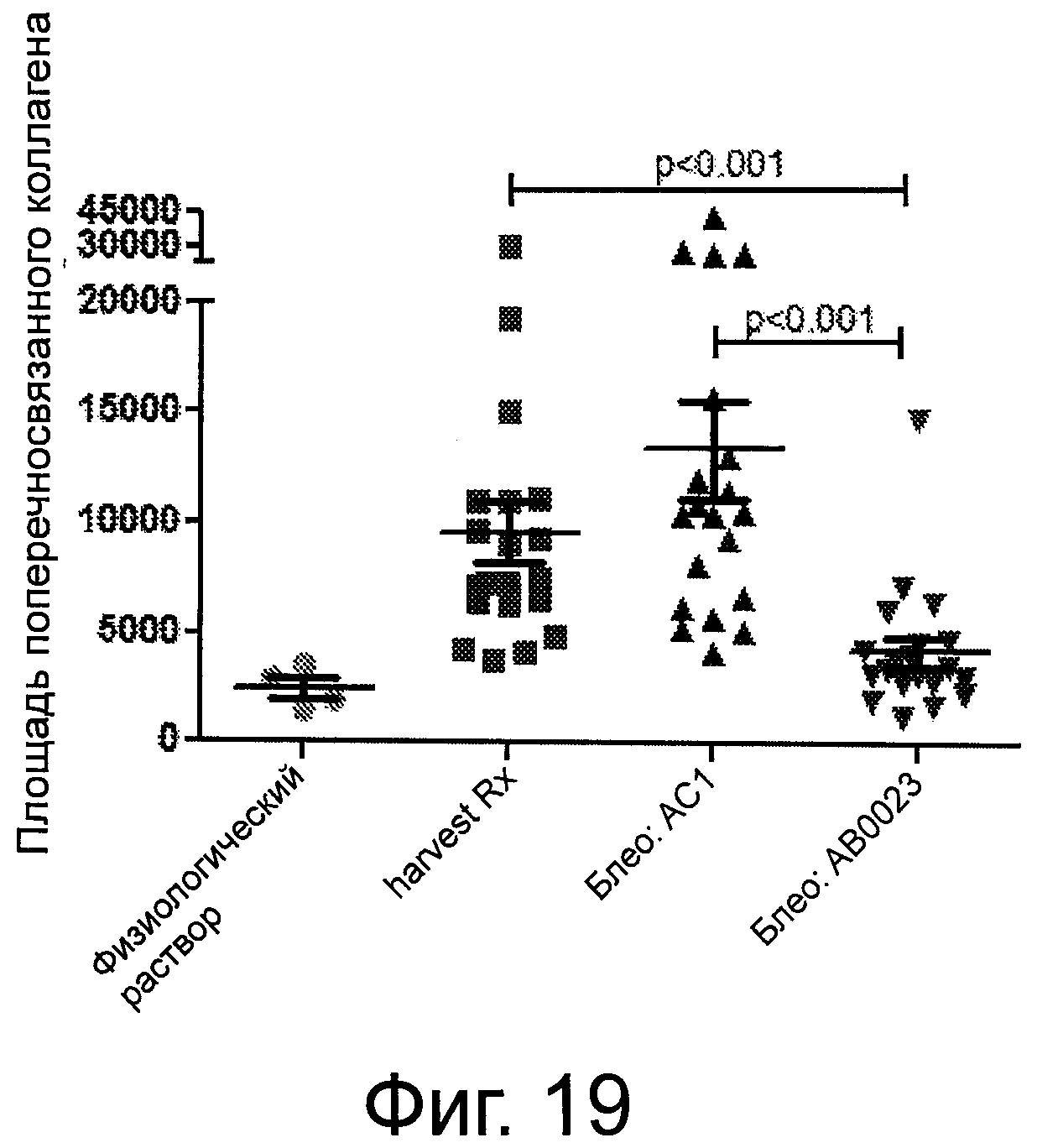
Фигура 19 демонстрирует уровни поперечно связанного коллагена, определенного путем регистрации окрашивания Сириусом красным в поляризованном свете, у контрольных животных, которые не получали блеомицина («Физ р-р»), у животных вскоре после введения блеомицина («Harvest Rx»), у животных через 22 дня после введения блеомицина, получавших дважды в неделю инъекции контрольных антител («Блео-AC1») и у животных через 22 дня после введения блеомицина получавших дважды в неделю инъекции анти-LOXL2 антител («В1ео-АВ0023»).
Детальное описание
При практическом осуществлении настоящего изобретения, если нет указаний на обратное, применяют стандартные методы и общепринятые методики в области клеточной биологии, токсикологии, молекулярной биологии, биохимии, культивирования клеток, иммунологии, онкологии, рекомбинантной ДНК и в смежных специальностях, относящихся к данной области. Такие методики описаны в литературе и поэтому доступны специалистам. См. в качестве примера, Alberts, В. et al., "Molecular Biology of the Cell," 5й edition, Garland Science, New York, NY, 2008; Voet, D. et al. "Fundamentals of Biochemistry: Life at the Molecular Level," 3rd edition, John Wiley & Sons, Hoboken, NJ, 2008;
Sambrook, J. et al., "Molecular Cloning: A Laboratory Manual," 3rd edition, Cold Spring Harbor Laboratory Press, 2001; Ausubel, F. et al., "Current Protocols in Molecular Biology," John Wiley & Sons, New York, 1987 and periodic updates; Freshney, R.I., "Culture of Animal Cells: A Manual of Basic Technique," 4th edition, John Wiley & Sons, Somerset, NJ, 2000; and the series "Methods in Enzymology," Academic Press, San Diego, CA.
Фиброзные заболевания легких
Фиброзные заболевания легких характеризуются воспалением и фиброзом легочной паренхимы. Этиология этих заболеваний неизвестна, и прогноз обычно неблагоприятный. В настоящее время фиброзные заболевания классифицируют, выделяя следующие группы по частоте встречаемости: идиопатический фиброз легких (IPF), неспецифическая интерсцитиальная пневмония (NSIP), респираторное интерсцитиальное заболевание легких, связанное с бронхитом, десквамативная интерсцитиальная пневмония, криптогенная организующая пневмония, острая интерсцитиальная пневмония и лимфотическая интерсцитиальная пневмония (LIP). Синдром острого респираторного дистресса (ARDS) тоже относят к фиброзным заболеваниям легких.
Кроме того, фиброзные заболевания легких включают фиброз легких, связанный со склеродермой, и фиброзное заболевание, вызванное саркоидозом.
Проявления фиброзных заболеваний легких включают сниженный вес тела, увеличенный вес легких, присутствие активированных фибробластов или фиброцитов, присутствие клеток-предшественников фиброцитов (например, клеток, которые экспрессируют и CD45, и коллаген), аномальную структуру легких (включая утолщение альвеол, пролиферацию и экспансию пневмоцитов и ячеистое строение легких), повышенный показатель Ашкофта (отражающий общую структуру и строение легких, повышенные уровни коллагена и увеличение числа лейкоцитов в бронхоальвеолярной промывной жидкости.
Молекулярные проявления фиброза легких включают увеличение уровня одного или большего числа следующих белков: LOXL2, α-актина из гладких мышц (α-SMA), трансформирующего фактора роста β-1 (TG Fβ-1), стромального фактора-1α (SDF-1α), стромального фактора-1α (SDF-1β), эндотелина-1 (ЕТ-1) и фосфорилированного SMAD2.
Участие LOXL2 в фиброзных заболеваниях легких
Исследование биопсии легких больных с фиброзными заболеваниями свидетельствует о повсеместной экспрессии LOXL2 на всех гистологически определяемых стадиях IPF. Особенно сильно выражен LOXL2 при заболевании в сосудистой системе и в областях ремоделирования матрикса и активного фиброгенеза.
Экспрессия LOXL2 отмечена также в реактивных пневмоцитах Типа II фиброзной ткани легких.
Кроме того, участки повышенной экспрессии LOXL2 коррелируют с участками, где экспрессируется альфа-актин из гладких мышц (α-SMA). SMA - это маркер активированных фибробластов, которые являются признаком фиброзной ткани легких.
Таким образом, первичными источниками LOXL2 в фиброзной ткани легких являются активированные фибробласты («фиброциты») и связанные с заболеванием («реактивные») пневмоциты.
В связи с избыточной экспрессией LOXL2 в фиброзных легких и колокализацией избыточной экспрессии LOXL2 с участками активации фиброгенеза и фибробластов, авторы изобретения установили, что ингибирование LOXL2 является эффективным методом предотвращения и/или лечения фиброзных заболеваний легких. Более того, авторы изобретения установили, что ингибирование LOXL2 вызывает реверсию симптомов легочного фиброза, включая упомянутые выше. Таким образом, в противоположность другим способам, которые блокируют, улучшают или предотвращают прогрессирование легочного фиброза, описанные в данной заявке способы и композиции, действительно, вызывают излечение фиброзной легочной ткани и поэтому могут применяться для реверсии течения фиброзного заболевания легких.
Ферменты типа лизилоксидазы
Использованный в настоящей заявке термин «фермент типа лизилоксидазы» относится к члену семейства белков, который, помимо прочего, катализирует окислительное дезаминирование ε-аминогрупп лизиновых и гидроксилизиновых остатков, приводя к превращению пептидил лизина в пептидил-α-амидоадипин-β-семиальдегид (аллизин) и высвобождению стохиометрических количеств аммония и перекиси водорода:

Пептидил лизин пептидил аллизин
Эта реакция обычно происходит внеклеточно на лизиновых остатках коллагена и эластина.
Альдегидные остатки аллизина являются реактивными и могут спонтанно конденсироваться с другими аллизиновыми и лизиновыми остатками, приводя к поперечному связыванию молекул коллагена с образованием коллагеновых фибрилл.
Ферменты типа лизилоксидазы выделяли из цыплят, крыс, мышей, быков и человека.
Все ферменты типа лизилоксидазы содержат общий каталитический домен, имеющий длину около 205 аминокислот, локализованный в карбокси-концевой части белка и содержащий активный центр фермента. В активном центре находится связывающий медь сайт, который включает консервативную последовательность аминокислот, содержащую четыре гистидиновых остатка, находящиеся в координационной связи с атомом Cu(II)
Активный центр содержит также лизилтирозил хиноновый (LTQ) кофактор, образованный внутримолекулярной ковалентной связью между лизиновым и тирозиновым остатками (соответствующими lys314 и tyr349 в лизилоксидазе крысы и lys320 и tyr355 в лизилоксидазе человека).
Последовательность, окружающая тирозиновый остаток, которая образует LTQ кофактор, также консервативна среди ферментов типа лизилоксидазы.
Каталитический домен также содержит десять консервативных цистеиновых остатка, которые участвуют в образовании пяти дисульфидных связей. Каталитический домен включает также фибронектин - связывающий домен. Наконец, в каталитическом домене присутствует аминокислотная последовательность, подобная последовательности в домене рецептора к фактору роста и к цитокину, содержащая четыре цистеиновых остатка. Несмотря на присутствие этих консервативных областей, разные ферменты типа лизилоксидазы можно отличать друг от друга как внутри, так и вне их каталитических доменов, благодаря областям дивергентных нуклеотидов и аминокислотных последовательностей.
Первый член этого семейства ферментов, который был выделен и охарактеризован, это лизилоксидаза (ЕС 1.4.3.13), известная также как протеин-лизин 6-оксидаза, протеин-L-лизин: оксиген 6-оксидоредуктаза (дезаминирующая) или LOX.
См., например, Harris et al., Biochim. Biophys. Acta 341:332-344 (1974); Rayton et al., J. Biol. Chem. 254:621-626 (1979); Stassen, Biophys. Acta 438:49-60 (1976).
Затем были открыты другие ферменты типа лизилоксидаз. Эти белки были названы "LOX-подобными," или "LOXL." Все они содержат общий каталитический домен, описанный выше, и имеют одинаковую ферментативную активность. В настоящее время известно пять различных ферментов типа лизилоксидаз как у людей, так и у мышей: LOX и четыре родственных LOX или LOX-подобных белков LOXL1 (также обозначаемые «лизилоксидазоподобные», «LOXL» или «LOL»), LOXL2 (также обозначаемый «LOR-1»), LOXL3 (также обозначаемый «LOR-2») и LOXL4. Каждый из генов, кодирующих пять различных ферментов типа лизилоксидаз находятся на разных хромосомах. См, например, Molnar et al., Biochim Biophys Acta. 1647:220-24 (2003); Csiszar, Prog. Nucl. Acid Res. 70:1-32 (2001); WO 01/83702, опубликованном в ноябре 8, 2001, и патент США No. 6,300,092, все из которых включены в заявку путем ссылки. LOX-подобный белок, названный LOXC, имеющий некоторое сходство с LOXL4, но с другим паттерном экспрессии, был выделен из мышиной клеточной линии ЕС.Ito et al. (2001) J. Biol. Chem. 276:24023-24029. Два фермента типа лизилоксидаз DmLOXL-1 и DmLOXL-2 были выделены из Drosophila.
Хотя все ферменты типа лизилоксидаз содержат общий каталитический домен, все они отличаются друг от друга, особенно в амино-концевых областях. Четыре LOXL белка имеют удлинение на амино-конце, по сравнению с LOX. Таким образом, хотя у человека preproLOX (то есть первичный продукт трансляции перед отщеплением сигнальной последовательности, см ниже) содержит 417 аминокислотных остатков; LOXL1 содержит 574, LOXL2 содержит 638, LOXL3 содержит 753 и LOXL4 содержит 756.
В своих амино-концевых областях LOXL2, LOXL3 и LOXL4 содержат четыре повторяющихся обогащенных цистеином домена скавенджер рецептора (SRCR). Этих доменов нет в LOX или LOXL1. SRCR домены найдены в секретируемых, трансмембранных или внеклеточных белках матрикса и, как известно, они опосредуют связывание лигандов в некоторых секретируемых и рецепторных белках. Hoheneste et al. (1999) Nat. Struct. Biol. 6:228-232; Sasaki et al. (1998) EMBO J. 17:1606-1613. Кроме SRCR доменов, LOXL3 содержит в амино-концевой области сигнал ядерной локализации. Богатый пролином домен является уникальным для LOXL1. Molnar et al. (2003) Biochim. Biophys. Acta 1647:220-224. Различные ферменты типа лизилоксидаз также отличаются по паттерну гликозилирования.
Ферменты типа лизилоксидаз различаются также по распределению в тканях. У человека мРНК LOX высоко экспрессирована в сердце, плаценте, семенниках, легких, почках и матке, но в малой степени в мозгу и печени. мРНК LOXL1 человека экспрессирована в плаценте, почках, мышцах, сердце, легких и поджелудочной железе и, как и LOX, экспрессирована в значительно меньшей степени в мозгу и печени. Kim et al. (1995) J. Biol. Chem. 270:7176-7182. Высокие уровни экспрессии мРНК LOXL2 отмечены в матке, плаценте и других органах, но, как и в случае LOX и LOXL1, низкие значения экспрессии отмечены в мозгу и печени. Jourdan Le-Saux et al. (1999) J. Biol. Chem. 274:12939:12944. мРНК LOXL3 высоко экспрессирована в семенниках, селезенке и простате, умеренно экспрессирована в плаценте и не экспрессирована в печени, в то время как в печени наблюдаются высокие уровни мРНК LOXL4. Huang et al. (2001) Matrix Biol. 20:153-157; Maki and Kivirikko (2001) Biochem. J. 355:381-387; Jourdan Le-Saux et al. (2001) Genomics 74:211-218; Asuncion et al. (2001) Matrix Biol. 20:487-491.
Экспрессия и/или участие различных ферментов типа лизилоксидаз при заболеваниях тоже различны. См, например, Kagen (1994) Pathol. Res. Pract. 190:910-919; Murawaki et al. (1991) Hepatology 14:1167-1173; Siegel et al. (1978) Proc. Natl. Acad. Sci. USA 75:2945-2949; Jourdan Le-Saux et al. (1994) Biochem. Biophys. Res. Comm. 199:587-592; and Kirn et al. (1999) J. Cell Biochem. 72:181-188. Ферменты типа лизилоксидаз связаны с некоторыми формами рака, включая рак головы и шеи, рак мочевого пузыря, рак прямой кишки, рак пищевода и рак молочной железы. См, например, Wu et al. (2007) Cancer Res. 67:4123-4129; Gorough et al. (2007) J. Pathol. 212:74-82; Csiszar (2001) Prog. Nucl. Acid Res. 70:1-32 и Kirschmann et al. (2002) Cancer Res. 62:4478-4483.
Таким образом, несмотря на то, что ферменты типа лизилоксидаз обнаруживают некоторое перекрывание в структуре и функции, каждый из них также имеет свою структуру и свои функции. Например, по отношению к структуре некоторые антитела против каталитического домена белка LOX человека не связываются с человеческим LOXL2.
Что касается функции, установлено, что прицельное уничтожение LOX оказывается летальным при родах у мыши, в то время как дефицит LOXL1 не приводит к серьезным изменениям фенотипа. Homstra et al. (2003) J. Biol. Chem. 278:14387-14393; Bronson etal. (2005) Neurosci. Lett. 390:118-122.
Хотя наиболее документированной активностью ферментов типа лизилоксидаз является окисление специфических остатков лизина во внеклеточных коллагене и эластине, имеются данные, что ферменты типа лизилоксидаз участвуют также в некоторых внутриклеточных процессах. Например, имеются сообщения, что некоторые ферменты типа лизилоксидаз регулируют экспрессию генов. Li et al. (1997) Proc. Natl. Acad. Sci. USA 94:12817-12822; Giampuzzi et al. (2000) J. Biol. Chem. 275:36341-36349. Кроме того, сообщали, что LOX окисляет лизиновые остатки в ги стоне HI. Дополнительные внеклеточные формы активности LOX включают индукцию хемотаксиса моноцитов, фибробластов и гладкомышечных клеток. Lazarus et al. (1995) Matrix Biol. 14:727-731; Nelson etal. (1988) Proc. Soc. Exp.Biol. Med. 188:346-352. Экспрессию самого LOX индуцирует несколько факторов роста и стероидов, таких как TGF-p, TNF-a и интерферон. Csiszar (2001) Prog, Nucl. Acid Res. 70:1-32. Проведенные в последнее время исследования приписывали LOX другие роли в различных биологических функциях, такие как регуляция развития, супрессию опухолей, клеточная подвижность и старение клеток.
Примеры лизилоксидазных белков (LOX) из различных источников включают ферменты, имеющие аминокислотную последовательность, по существу идентичную полипептиду, экспрессированному или транслированному с одной из следующих последовательностей: номер доступа в EMBL/GenBank: M94054; ААА59525.1 - мРНК; S45875; ААВ23549.1 - мРНК; S78694; ААВ21243.1-мРНК; AF039291; AAD02130.1 - мРНК; ВС074820; ААН74820.1 - мРНК; ВС074872; ААН74872.1 - мРНК; М84150; ААА59541.1 - геномная ДНК Один вариант LOX - это препротеин лизилоксидазы человека (hLOX).
Типичные примеры последовательностей, кодирующих ферменты типа лизилоксидаз, таковы: LOXL1 кодируется мРНК, депонированной в GenBank/EMBL ВС015090; ААН15090.1; LOXL2 кодируется мРНК, депонированной в GenBank/EMBL U89942; LOXL3 кодируется мРНК, депонированной в GenBank/EMBL AF282619; ААК51671.1; и LOXL4 кодируется мРНК, депонированной в GenBank/EMBL AF3 38441; ААК71934.1.
Первичный продукт трансляции белка LOX известный как препропептид, содержит сигнальную последовательность, состоящую из аминокислот 1-21. Эта сигнальная последовательность высвобождается внутриклеточно в результате расщепления между Cys21 и Ala22 как в мышином, так и в человеческом LOX с образованием 46-48 кДа пропептидной формы LOX, так же упоминаемой в данной заявке, как и полноразмерная форма.
Пропептид при прохождении через аппарат Гольджи приобретает N-гликолизированную форму, в результате чего образуется белок 50 кДа, который затем секретируется во внеклеточную среду. На этой стадии белок каталитически не активен. Дальнейшее расщепление между Glyl68 и Aspl69 в мышиной LOX и между Glyl74 и Asp 17 5 в человеческом LOX образует зрелый каталитически активный фермент весом 30-32 кДа, высвобождающий 18 кДа пропептид. Это финальное расщепление катализируется металлоэндопротеазой проколлаген С-протеиназой, известной также как костный морфогенетический белок-1 (BMP-1). Интересно, что этот фермент функционирует, взаимодействуя с субстратом LOX, коллагеном. Впоследствии N-гликозил-единицы удаляются.
Потенциальные сайты отщепления сигнальной последовательности были предсказаны в амино-концевой области LOXL1, LOXL2, LOXL3 и LOXL4. Предсказанные сайты отщепления сигнальной последовательности находятся между Gly25 и Gln26 для LOXL1, между Ala25 и Gln26, для LOXL2, между Gly25 и Ser26 для LOXL3 и между Arg23 и Рго24 для LOXL4.
Сайт расщепления ВМР-1 в белке LOXL1 идентифицировали между Ser354 и Asp355. Borel et al. (2001) J. Biol. Chem. 276:48944-48949. Потенциальные сайты расщепления BMP-1 в других ферментах типа лизилоксидаз были предсказаны на основе консенсусной последовательности расщепления BMP-1 в проколлагенах и про- LOX и находились в последовательности Ala/Gly-Asp, часто сопровождаемой кислотными или заряженными остатками. Предсказанный сайт расщепления BMP-1 в LOXL3 локализован между Gly447 и Asp448; причем процессинг в этом сайте может привести к образованию зрелого пептида такого же размера, как зрелый LOX. Потенциальный сайт расщепления BMP-1 был также идентифицирован в LOXL4, между остатками А1а569 и Asp570. Kim et al. (2003) J. Biol. Chem. 278:52071-52074. LOXL2 может быть также протеолитически расщеплен аналогично другим членам семейства LOXL и секретирован. Akiri et al. (2003) Cancer Res. 63:1657-1666.
Как ожидалось, на основании существования общего каталитического домена в ферментах типа лизилоксидаз, последовательность С-концевой области профермента весом 30 кДа, в которой локализован активный сайт высоко консервативна (приблизительно 95%). Более умеренная степень консервативности (приблизительно 60-70%) 60-70%) наблюдается в пропептидном домене.
Для целей настоящего описания термин «фермент типа лизилоксидазы» включает все пять лизин-окисляющих ферментов, обсуждавшихся выше (LOX, LOXL1, LOXL2, LOXL3 and LOXL4), и также включает функциональные фрагменты и/или производные LOX, LOXL1, LOXL2, LOXL3 и LOXL4, которые по существу сохраняют ферментативную активность, например способность катализировать дезаминирование лизиловых остатков. Типично функциональный фрагмент или производное сохраняет, по меньшей мере, 50% своей лизин-оксидазной активности. В некоторых воплощениях, функциональный фрагмент или производное сохраняет, по меньшей мере, 60%„ по меньшей мере, 70%„ по меньшей мере, 80%„ по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 99% или 100% своей лизин-оксидазной активности.
Подразумевается, что функциональный фрагмент фермента типа лизилоксидазы может включать консервативные аминокислотные замены (по отношению к нативной полипептидной последовательности), которые по существу не изменяют каталитическую активность. Термин «консервативные аминокислотные замены» относится к группированию аминокислот на основе определенных общих структур и/или свойств. По отношению к общим структурам, аминокислоты могут быть разделены на аминокислоты с неполярными боковыми цепями (глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин и триптофан), аминокислоты с незаряженными полярными боковыми цепями (серин, треонин, аспарагин, глутамин, тирозин и цистеин) и с заряженными полярными боковыми цепями (лизин, аргинин, аспарагиновая кислота, глутаминовая кислота и гистидин).
Группа аминокислот, содержащая ароматические боковые цепи, включает фенилаланин, триптофан и тирозин. Гетероциклические боковые цепи присутствуют в пролине, триптофане и гистидине. В группе аминокислот, содержащих неполярные боковые цепи, можно отличить аминокислоты с короткой углеводной боковой цепью (глицин, аланин, валин, лейцин, изолейцин) от аминокислот с более длинной не углеводной боковой цепью (метионин, пролин, фенилаланин, триптофан). В группе аминокислот с заряженными полярными боковыми цепями кислые аминокислоты (аспарагиновая кислота, глутаминовая кислота) можно отличить от аминокислот с основными боковыми цепями (лизин, аргинин и гистидин).
Функциональный метод для определения общих свойств индивидуальных аминокислот заключается в анализе нормализованной частоты замен аминокислот между соответствующими белками гомологичных организмов. (Schuiz, G.E. and R.H.Schirmer, Principles of Protein Structure, Springer-Verlag, 1979). Согласно данным такого анализа могут быть определены группы аминокислот, в пределах которых аминокислоты предпочтительно замещают друг друга в гомологичных белках, и поэтому они оказывают сходное действие на полную структуру белка (Schuiz, G.E. and R.H.Schirmer, Principles of Protein Structure, Springer-Verlag, 1979). Согласно данным такого типа анализа можно идентифицировать следующие группы аминокислот, которые могут быть консервативным образом замещены друг другом:
(i) аминокислоты, содержащие заряженную группу, состоящую из Glu, Asp, Lys, Arg и His,
(ii) аминокислоты, содержащие положительно заряженную группу, состоящую из Lys, Arg и His,
(hi) аминокислоты, содержащие отрицательно заряженную группу, состоящую из Glu и Asp,
(iv) аминокислоты, содержащие ароматическую группу, состоящую из Phe, Туг и Тгр,
(v) аминокислоты, содержащие азотсодержащую кольцевую группу, состоящую из His and Trp,
(vi) аминокислоты, содержащие большую алифатическую неполярную группу, состоящую из Val, Leu and He,
(vii) аминокислоты, содержащие слабополярную группу, состоящую из Met и Cys, (viii) аминокислоты, содержащие группу с малыми остатками, состоящую из Ser, Thr, Asp, Asn, Gly, Ala, Glu, Gin and Pro,
(ix) аминокислоты, содержащие алифатическую группу, состоящую из Val, Leu, He, Met and Cys, и
(x) аминокислоты, содержащие гидроксильную группу, состоящую из Ser and Thr.
Таким образом, как проиллюстрировано выше, консервативные замены аминокислот известны специалистам в данной области и могут быть выполнены, как правило, без изменения биологической активности результирующей молекулы. Специалисты в данной области, как правило, знают, что замещение одной аминокислоты в малозначимых областях полипептида не изменяет существенно биологическую активность. См. например, Watson, etal., "Molecular Biology of the Gene," 4th Edition, 1987, The Benjamin/Cummings Pub. Co., Menio Park, CA, p.224.
Для дополнительной информации, касающейся ферментов типа лизилоксидазы, см, например, Rucker et al. (1998) Am. J. Clin. Nutr. 67:996S-1002S and Kagan et al. (2003) J. Cell. Biochem 88:660-672. См также публикации совместных заявок на патент США Nos. 2009/0053224 (Feb. 26, 2009) и 2009/0104201 (April 23, 2009); описания которых включены в настоящую заявку путем ссылки.
Модуляторы активности ферментов типа лизилоксидазы
Модуляторы активности ферментов типа лизилоксидазы включают как активаторы (агонисты), так и ингибиторы (антагонисты) и могут быть выбраны с помощью ряда скрининговых исследований. В одном воплощении, модуляторы могут быть идентифицированы путем выяснения, связывается ли тестируемое соединение с ферментом типа лизилоксидазы; причем если связывание имеет место, это соединение является потенциальным модулятором. По желанию можно использовать дополнительный тест этого кандидата в модуляторы. В альтернативном варианте рассматриваемое соединение приводят в контакт с ферментом типа лизилоксидазы, и исследуют биологическую активность исследуемого фермента типа лизилоксидазы; соединение, которое изменяет биологическую активность фермента типа лизилоксидазы, является модулятором фермента типа лизилоксидазы. Как правило соединение, которое снижает биологическую активность фермента типа лизилоксидазы, является ингибитором фермента. Другие методы идентификации модуляторов активности ферментов типа лизилоксидазы включают инкубацию соединения-кандидата в клеточной культуре, содержащей один или большее число ферментов типа лизилоксидазы, и изучение одного или большего числа видов биологической активности или характеристик клеток.
Соединения, которые изменяют биологическую активность или характеристики клеток в культуре, являются потенциальными модуляторами активности фермента типа лизилоксидазы. Виды биологической активности, которые могут быть исследованы, включают, например, окисление лизина, образование перекиси, образование аммония, уровень активности фермента, типа лизилоксидазы, уровень мРНК, кодирующей фермент типа лизилоксидазы, и/или одну или большее число функций, специфических для фермента типа лизилоксидазы.
В дополнительных вариантах упомянутых выше исследований в отсутствие контактов с соединением-кандидатом один или более видов биологической активности или клеточных характеристик коррелируют с уровнем или активностью одного или большего числа ферментов типа лизилоксидазы. Например, биологическая активность может представлять собой клеточную функцию, такую как миграция, хемотаксис, эпителиально-мезенхимный переход или мезенхимно-эпителиальный переход, и отмечается изменение по сравнению с одним или большим числом контрольных или референтных образцов. Например, отрицательные контрольные образцы могут включать культуру со сниженным содержанием фермента типа лизилоксидазы, к которому добавлено соединение-кандидат; или культуру с тем же количеством фермента типа лизилоксидазы, что и в тест-культуре, но без добавления соединения-кандидата. В некоторых вариантах отдельные культуры, содержащие разные уровни фермента типа лизилоксидазы приводят в контакт с соединением-кандидатом. Если наблюдается изменение биологической активности, и если это изменение больше в культуре, имеющей более высокое содержание фермента типа лизилоксидазы, соединение идентифицируют как модулятор активности фермента типа лизилоксидазы.
Определение того, является соединение активатором или ингибитором фермента типа лизилоксидазы, может быть получено из фенотипа, индуцированного соединением или может потребоваться дальнейшее исследование, таких как тестирование действия соединения на ферментативную активность одного или большего числа ферментов типа лизилоксидазы.
Специалистам известны способы получения фермента типа лизилоксидазы, либо биохимическим, либо рекомбинантным способом, так же, как способы исследования культуры клеток и ферментативных исследований для идентификации модуляторов активности фермента типа лизилоксидазы, как описано выше.
Ферментативная активность фермента типа лизилоксидазы может быть исследована рядом различных методов. Например, лизил оксидазная ферментативная активность может быть исследована путем определения и/или количественной оценки образования перекиси водорода, иона аммония и/или альдегида, путем определения окисления лизина и/или поперечного сшивания коллагена, или путем измерения инвазивной способности клеток, клеточной адгезии, клеточного роста или метастатического роста. См, например. Trackman et al. (1981) Anal. Biochem. 113:336-342; Kagan et al. (1982) Meth. Enzymol. 82A:637-649; Palamakumbura et al. (2002) Anal. Biochem. 300:245-251; Albini et al. (1987) Cancer Res. 47:3239-3245; Kamath et al. (2001) Cancer Res. 61:5933-5940; U.S. Patent No. 4,997,854 и опубликованные заявки на патент США No. 2004/0248871.
Соединения для тестирования включают низкомолекулярные органические соединения (например, органические молекулы с молекулярной массой между приблизительно 50 и приблизительно 2500 Да), нуклеиновые кислоты или белки, но не ограничиваются ими. Соединение или множество соединений могут быть синтезированы химически или образованы микробиологически и/или могут включать, например, такие образцы, как клеточные экстракты из растений, животных или микроорганизмов. Таким образом, соединения(е) могут быть известны специалистам, но до сих пор неизвестно, способны ли они модулировать активность фермента типа лизилоксидазы. Реакционная смесь для исследования на предмет модулятора фермента типа лизилоксидазы может быть бесклеточным экстрактом или может содержать клеточную или тканевую культуру. Множество соединений может, например, быть добавлено к реакционной смеси, добавлено к культуральной среде, введено в клетку или введено трансгенному животному. Клетка или ткань, используемые в исследовании, может быть, например, бактериальной клеткой, клеткой грибов, клеткой насекомых, клеткой позвоночных, клеткой млекопитающих, клеткой приматов, клеткой человека или может быть получена из трансгенных животных, не являющихся человеком.
Специалистам известно несколько способов получения и скрининга больших библиотек для идентификации соединений, обладающих специфическим сродством к мишени, такой как фермент типа лизилоксидазы. Эти способы включают метод фагового дисплея, в котором рандомизированные пептиды представляют на фагах и отбирают с помощью аффинной хроматографии с использованием иммобилизованного рецептора. См., например, WO 91/17271, WO 92/01047, и патент США No. 5,223,409. В другом подходе комбинаторные библиотеки полимеров, иммобилизуют на твердой подложке (так называемый «чип») полученной с помощью фотолитографии. См, например, патент США No. 5,143,854, WO 90/15070 и WO 92/10092. Иммобилизованные полимеры контактируют с меченым рецептором (например, ферментом типа лизилоксидазы), и подложку сканируют для определения локализации метки, идентифицируя таким образом, полимеры, связанные с рецептором.
Синтез и скрининг пептидных библиотек на сплошной целлюлозной мембранной подложке, которая может быть использована для идентификации лигандов связывающих представляющие интерес полипептиды (например, фермента типа лизилоксидазы) описаны, например, в Kramer (1998) Methods Mol. Biol. 87:25-39. Лиганды, идентифицированные при таких исследованиях, являются кандидатами в модуляторы представляющего интерес белка и могут быть отобраны для дальнейшего тестирования. Этот способ может использоваться, например, для определения сайтов связывания и мотивов распознавания в представляющем интерес белке. См. например, Rudiger (1997) EMBOJ. 16:1501-1507 и Weiergraber (1996) FEBSLett. 379:122-126.
WO 98/25146 описывает дополнительные способы для скрининга библиотек комплексных соединений, для описка соединений обладающих желаемыми свойствами, например, свойством способствовать или противодействовать связыванию полипептида или его клеточного рецептора. Комплексы в таких библиотеках содержат исследуемое соединение, маркер, идентифицирующий по меньшей мере один этап синтеза соединения, и связующий участок, который может быть модифицирован репортерной группой. Модификацию этого связующего участка используют, как признак того, что комплекс содержит соединение, обладающее желаемыми свойствами. Маркер можно расшифровать чтобы установить по меньшей мере один этап синтеза такого соединения. Другие способы идентификации соединений, взаимодействующих с ферментом типа лизилоксидазы, - это, например, in vitro скрининг с использованием технологии фагового дисплея, исследование связывания на фильтре, и измерение взаимодействия в реальном времени с использованием, например, аппаратуры BIAcore (Pharmacia).
Все эти способы могут быть использованы в сочетании с настоящим описанием для идентификации активаторов/агонистов и ингибиторов/антагонистов ферментов типа лизилоксидазы или сходных полипептидов.
Другой подход к синтезу модуляторов ферментов типа лизилоксидазы использует миметические аналоги пептидов. Миметические аналоги пептидов можно генерировать, например, путем замещения стереоизомеров, то есть D-аминокислот на естественно распространенные аминокислоты; см. например, Tsukida (1997) J. Med. Chem. 40:3534-3541. К тому же про-миметические компоненты могут быть включены в пептид, чтобы восстановить конформационные свойства, которые могут быть потеряны при удалении части исходного полипептида. См, например, Nachman (1995) Regul. Pept. 57:359-370.
Другой способ конструирования пептидомиметиков - это включать ахиральный о-аминокислотный остаток в пептид, получая замещение амидных связей полиметиленовыми элементами алифатической цепи. Banerjee (1996) Biopolymers 39:769-777. Были описаны суперактивные пептидомиметические аналоги небольших пептидных гормонов небольшого размера. Zhang (1996) Biochem. Biophys. Res. Commun. 224:327-331.
Пептидомиметики модулятора фермента типа лизилоксидазы также могут быть идентифицированы путем синтеза комбинаторных библиотек пептидомиметиков путем последовательного амидного алкилирования, после чего тестируют образовавшиеся соединения, например, по их способности к связыванию и по иммунологическим свойствам. Были описаны способы создания и использования комбинаторных библиотек пептидомиметиков. См., например, Ostresh, (1996) Methods in Enzymology 267:220-234 and Domer (1996) Bioorg. Med. Chem. 4:709-715. К тому же для дизайна пептидомиметических ингибиторов активности одного или большего числа ферментов типа лизилоксидазы можно использовать трехмерную и/или кристаллографическую структуру. Rose (1996) Biochemistry 35:12933-12944; Rutenber (1996) Bioorg. Med. Chem. 4:1545-1558.
Основанные на структуре дизайн и синтез низкомолекулярных синтетических молекул, которые имитируют активность нативных биологических полипептидов, описаны далее в, например, Dowd (1998) Nature Biotechnol. 16:190-195; Kieber-Emmons (1997) Current Opinion Biotechnol. 8:435-441; Moore (1997) Proc. West Pharmacol. Soc. 40:115-119; Mathews (1997) Proc. West Pharmacol. Soc. 40:121-125; и Mukhija (1998) European J. Biochem. 254:433-438.
Кроме того, специалистам хорошо известно, что можно разработать, синтезировать и оценить миметики из низкомолекулярных органических соединений, которые, например, могут действовать в качестве субстрата или лиганда фермента типа лизилоксидазы. Например, было описано, что D-глюкозные миметики гапалозина проявляют такую же эффективность, как гапалозин, ингибируя белок, ассоциированный с множественной лекарственной устойчивостью. Dinh(1998)J. Med. Chem. 41:981-987.
Структура ферментов типа лизилоксидазы может быть исследована для проведения отбора модуляторов, таких как, например, малые молекулы, пептиды, миметики пептидов и антитела. Структурные характеристики фермента типа лизилоксидазы могут способствовать идентификации естественных или синтетических молекул, которые связываются, или функционируют как лиганд, субстрат, связующий партнер или рецептор фермента типа лизилоксидазы. См, например, Engleman (1997) J. Clin. Invest. 99:2284-2292. Например, имитация структуры и компьютерный дизайн структурных мотивов ферментов типа лизилоксидазы могут быть выполнены с помощью соответствующих компьютерных программ. Olszewski (1996) Proteins 25:286-299; Hoffman (1995) Comput. Appl. Biosci. 11:675-679. Компьютерное моделирование структуры белка может быть использовано для конформационного и энергетического анализа детализированной пептидной и белковой структуры. Monge (1995) J. Mol. Biol. 247:995-1012; Renouf(1995) Adv. Exp.Med. Biol. 376:37-45. Соответствующие программы могут быть использованы для идентификации на ферментах типа лизилоксидазы сайтов, взаимодействующих с лигандами и связывающими партнерами с помощью компьютерных поисков комплементарных пептидных последовательностей. Fassina (1994) Immunomethods 5:114-120. Дополнительные системы дизайна белка и пептидов описаны, например, в работах Berry (1994) Biochem. Soc. Trans. 22:1033-1036; Wodak (1987), Ann. N.Y. Acad. Sci. 501:1-13; и Pabo (1986) Biochemistry 25:5987-5991. Результаты, полученные из описанного выше структурного анализа, могут применяться, например, для приготовления органических молекул, пептидов и их миметиков, которые функционируют в качестве модуляторов активности одного или большего числа ферментов типа лизилоксидазы.
Ингибитор фермента типа лизилоксидазы может быть конкурентным ингибитором, неконкурентным ингибитором, смешенным ингибитором или бесконкурентным ингибитором. Конкурентные ингибиторы часто обнаруживают структурное сходство с субстратом, обычно связываются с активным центром и более эффективны при меньших концентрациях субстрата. Кажущееся Км увеличивается в присутствии конкурентного ингибитора. Неконкурентные ингибиторы обычно связываются с фермент-субстратным комплексом или с сайтом, который становится доступным после связывания субстрата с активным центром и могут разрушать активный центр. В присутствии неконкурентного ингибитора кажущееся Км и Fmax снижаются, и концентрация субстрата оказывает небольшой эффект на ингибирование или не оказывает никакого эффекта. Смешенные ингибиторы могут связываться как со свободным ферментом, так и с фермент-субстратным комплексом, и поэтому влияют на связывание субстрата и на каталитическую активность. Бесконкурентное ингибирование - специальный случай смешенного ингибирования, в котором ингибитор связывается с ферментом и с фермент-субстратным комплексом с одинаковым сродством, и ингибирование не зависит от концентрации субстрата. Неконкурентные ингибиторы обычно связываются с ферментом в области, находящейся вне активного центра. Для дополнительных деталей по ингибированию ферментов см., например, Voet et al. (2008) supra. Для таких ферментов, как ферменты типа лизилоксидазы, чьи естественные субстраты (например, коллаген, эластин) в норме присутствуют in vivo в значительном избытке (по сравнению с концентрацией любого ингибитора, которая может быть достигнута in vivo,), преимущество имеют неконкурентные ингибиторы, поскольку ингибирование не зависит от концентрации субстрата.
Антитела
В некоторых воплощениях, модулятор фермента типа лизилоксидазы является антителом. В дополнительных воплощениях антитело является ингибитором активности фермента типа лизилоксидазы.
Использованный в настоящей заявке термин «антитело» означает выделенный или рекомбинантный агент, связывающий полипептид и содержащий пептидные последовательности (например, последовательности вариабельного участка), которые специфически связываются с антигенным эпитопом. Этот термин используют в его самом широком смысле, и он специфически включает моноклональные антитела (в том числе полномерные моноклональные антитела), поликлональные антитела, человеческие антитела, гуманизированные антитела, химерные антитела, нанотела, диатела, мультиспецифичные антитела (например, биспецифичные антитела), и фрагменты антител, включающие, но не ограничивающиеся ими Fv, scFv, Fab, Fab' F(ab')2 и Fab2 до тех пор, пока они проявляют желаемую биологическую активность. Термин «человеческое антитело» относится к антителам, содержащим последовательности человеческого происхождения, исключая возможные не человеческие CDR области и не предполагает, чтобы присутствовала полная структура молекулы иммуноглобулина, но требует, чтобы антитело оказывало минимальный иммуногенный эффект на человека (то есть оно не должно индуцировать образование антител к себе самому).
Фрагмент антитела содержит часть полномерного антитела, например, антиген связывающую или вариабельную область полномерного антитела. Примеры фрагментов антител включают Fab, Fab', F(ab')2, и Fv фрагменты; диатела; линейные антитела (Zapata et al. (1995) Protein Eng. 8(10):1057-1062); одноцепочечные молекулы антител; и мультиспецифичные антитела, образованные из фрагментов антител. Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab" фрагментами, каждый из которых содержит один антигенсвязывающий сайт, и остающийся фрагмент "Fc", причем это обозначение отражает способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который содержит два антигенсвязывающих сайта и способен поперечно связывать антиген.
"Fv" - минимальный фрагмент антитела, содержащий полный антиген-распознающий и связывающий сайт.Эта область состоит из димерного вариабельного домена, - одной тяжелой и одной легкой цепи, находящихся в жесткой нековалентной связи. В такой конфигурации три CDR каждого вариабельного домена взаимодействуют, образуя антигенсвязывающий сайт на поверхности VH-VL димера. Вместе взятые, шесть CDR обеспечивают антигенсвязывающую специфичность к антителу. Однако даже один вариабельный домен (или выделенная VH или VL область, содержащая только три из шести CDR, специфичных по отношению к антигену), способен распознать и связать антиген, хотя обычно с меньшим сродством, чем полный фрагмент Fv.
Фрагмент "Fab" содержит также, вдобавок к вариабельным областям тяжелой и легкой цепи, константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab исходно наблюдали после расщепления антитела папаином. Фрагменты Fab' отличаются от фрагментов Fab тем, что фрагменты F(ab') содержат несколько дополнительных остатков на карбоксильном конце CH1, включая один или большее число цистеинов из шарнирной области антитела. Фрагменты F(ab')2 содержат два фрагмента Fab, объединенных вблизи шарнирной области дисульфидными связями, и обычно наблюдаются после расщепления антитела пепсином.
Fab'-SH - обозначение, применяемое здесь для фрагментов Fab', в которых цистеиновые остатки константных доменов имеют свободную тиоловую группу. Известны также другие химические связи фрагментов антител.
«Легкие цепи» антител (иммуноглобулинов) из различных видов позвоночных можно отнести к одному из двух типов четко различающихся на основании аминокислотных последовательностей их константных доменов, называемых каппа и лямбда. В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, иммуноглобулины можно относить к пяти большим классам: IgA, IgD, IgE, IgG, и IgM, и некоторые из них можно еще подразделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1, и IgA2.
Фрагменты антитела «одноцепочечные Fv» или «sFv» или «scFv» содержат vh и vl домены антитела, где эти домены присутствуют в виде одной полипептидной цепи. В некоторых воплощениях, полипептид Fv содержит, кроме того, полипептидный линкер между доменами VH и VL, которые позволяют sFv образовывать желаемую структуру для связывания антигена. Для обзора sFv, см. Pluckthun, в The Pharmacology of Monoclonal Antibodies, vol. 113 (Rosenburg and Moore eds.) Springer-Verlag, New York, pp.269-315 (1994).
Термин «диатела» относится к небольшим фрагментам антитела с двумя антигенсвязывающими сайтами, содержащими вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (VH-VL). Используя линкер, слишком короткий, чтобы позволить связывание двух доменов на одной и той же цепи, домены принуждали соединяться с комплементарными доменами другой цепи, создавая два антигенсвязывающих сайта. Диатела дополнительно описаны, например, в in EP 404,097; WO 93/11161 and Hollinger et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448.
«Изолированное» антитело было идентифицировано и выделено и/или восстановлено из компонента естественной среды. Компоненты естественной среды могут включать ферменты, гормоны и другие белковые или небелковые растворы. В некоторых воплощениях, выделенное антитело очищают (1) более, чем до 95% по массе антитела, как определяли методом Lowry, например, более, чем до 99% по массе, (2) до степени,. достаточной, чтобы получить по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности, например, используя вращающийся чашечный секвенатор, или (3), до гомогенности гель-электрофорезом (например, SDS-PAGE) при восстанавливающих или не восстанавливающих условиях с детекцией Coomassie blue или серебряным красителем. Термин «выделенное антитело» включает антитело в рекомбинантных клетках in situ, поскольку не будет, по меньшей мере, одной компоненты естественного окружения антитела. В определенных воплощениях, выделенное антитело готовят, по меньшей мере, в один этап очистки.
В некоторых воплощениях, антитело является гуманизированным антителом или антителом человека. Гуманизированные антитела включают человеческие иммуноглобулины (реципиентное антитело), в которых остатки гипервариабельной области (CDR) реципиента заменены остатками из CDR видов, не относящихся к человеку (донорское антитело), таких как мышь, крыса или кролик, имеющих желаемые специфичность, сродство и активность. Таким образом, гуманизированные формы нечеловеческих (например, мышиных) антител - это химерные иммуноглобулины, которые содержат минимальную последовательность, полученную из иммуноглобулинов нечеловеческого происхождения. Последовательности нечеловеческого происхождения локализованы, в первую очередь, в вариабельных областях, особенно в гипервариабельных областях (CDR). В некоторых воплощениях, каркасные Fv остатки человеческого иммуноглобулина замещены соответствующими остатками нечеловеческого происхождения. Гуманизированные антитела могут также содержать остатки, не найденные ни в реципиентном, ни в перенесенных CDR или каркасных последовательностях. В определенных воплощениях, гуманизированное антитело содержит почти все из по меньшей мере, одного или обычно двух вариабельных доменов, в которых все или почти все из гипервариабельных областей (CDR) соответствуют иммуноглобулину не человеческого происхождения, и все или почти все каркасные области это области консенсусной последовательности человеческого иммуноглобулина. Для целей настоящего описания гуманизированные антитела могут также включать фрагменты иммуноглобулина, такие как Fv, Fab, Fab', F(ab')2 или другие связывающие антиген последовательности антител.
Гуманизированное антитело может также содержать, по меньшей мере, часть иммуноглобулиновой константной области (Fc), обычно человеческого иммуноглобулина. См., например, Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-329; и Presta (1992) Curr. Op.Struct. Biol. 2:593-596.
Специалистам известны способы гуманизации антител нечеловеческого происхождения. Обычно гуманизированное антитело имеет один или большее число аминокислотных остатков, введенных из источника, который не является человеком. Эти аминокислотные остатки нечеловеческого происхождения часто называют «импортными» или «донорскими» остатками, которые обычно получают из «импортного» или «донорского» вариабельного домена. Например, гуманизация может быть выполнена существенно по способу Winter и сотр., путем замещения нескольких или одного CDR последовательностей грызунов на соответствующие последовательности человеческого антитела.. См., например, Jones et al., supra; Riechmann et al., supra and Verhoeyen et al. (1988) Science 239:1534-1536. Соответственно такие «гуманизированные» антитела включают химерные антитела (патент США No. 4,816,567), которые существенно меньше, чем интактный человеческий вариабельный домен, замещенный соответствующей последовательностью из других видов. В определенных воплощениях, гуманизированные антитела - это человеческие антитела, в которых некоторые CDR остатки и по выбору некоторые остатки каркасной области замещены остатками из аналогичных сайтов антител, полученных из грызунов (например, мышиные моноклональные антитела).
Человеческие антитела тоже могут быть образованы, например, с использованием библиотек фаговых дисплеев. Hoogenboom et al. (1991) J. Mol. Biol, 227:381; Marks et al. (1991) J. Mol. Biol. 222:581. Другие способы для приготовления человеческих моноклональных антител описаны в работах Cole et al. (1985) "Monoclonal Antibodies and Cancer Therapy," Alan R. Liss, p.77 и Boemer et al. (1991) J. Immunol. 147:86-95.
Человеческие антитела могут быть приготовлены путем введения локусов человеческого иммуноглобулина трансгенным животным (например, мышам), у которых гены эндогенных иммуноглобулинов были частично или полностью инактивированы.
Что касается иммунологической оценки, наблюдается образование антител, которые во всех отношениях весьма похожи на человеческие, включая генную перестройку, объединение и репертуар антител. Такой подход описан, например, в патентах США Nos. 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,661,016, и в следующих научных публикациях: Marks et al. (1992) Bio/Technology 10:779-783 (1992); Lonberg et al. (1994) Nature 368: 856-859; Morrison (1994) Nature 368:812-813; Fishwald et al. (1996) Nature Biotechnology 14:845-851; Neuberger (1996) Nature Biotechnology 14:826; и Lonberg et al. (1995) Intern. Rev. Immunol. 13:65-93.
У антитела может быть увеличена аффинность (affinity maturation) с использованием известных способов отбора и/или мутагенеза, как описано выше. В некоторых воплощениях сродство аффинно-зрелых антител в пять раз или более, в десять раз или более, в двадцать раз или более или в тридцать раз или более выше, чем сродство исходных антител (обычно мышиных, кроличьих. цыплячьих, гуманизированных или человеческих), из которых зрелые антитела были приготовлены.
Антитело может быть также биспецифичным антителом. Биспецифичные антитела являются моноклональными и могут быть человеческими или гуманизированными антителами, обладающими способностью специфического связывания, по меньшей мере, двух разных антигенов. В данном случае две разных специфичности связывания могут быть направлены на два разных фермента типа лизилоксидазы или на два разных эпитопа одного фермента типа лизилоксидазы.
Описанное здесь антитело может также быть иммуноконъюгатом. Такие иммуноконъюгаты содержат антитело (например, к ферменту типа лизилоксидазы), конъюгированное со второй молекулой, такой как репортер. Иммуноконъюгат может также содержать антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или их фрагмент), или с радиоактивным изотопом (то есть радиоконъюгат).
Антитело, которое «специфически связывается с» или «специфическое к» конкретному полипептиду или эпитопу на конкретном полипептиде, это то антитело, которое связывается с конкретным полипептидом или эпитопом и по существу не связывается с любым другим полипептидом или эпитопом полипептида. В некоторых воплощениях антитело настоящего описания специфически связывается со своей мишенью с константой диссоциации (КД равной или меньшей, чем 100 нМ, обычно меньше, чем 10 нМ, обычно меньше, чем 1 нМ, обычно меньшей, чем 0.5 нМ, обычно меньшей, чем 0,1 нм, обычно меньшей, чем 0,01 нм или обычно меньшей, чем 0,005 нм; в форме моноклонального антитела, scFv, Fab, или других формах антител, измеренной при температуре около 4°С, 25°С, 37°С или 42°С.
В определенных воплощениях антитело по настоящему изобретению связывается с одним или большим числом сайтов процессинга (например, сайтов протеолитического расщепления) в ферменте типа лизилоксидазы, эффективно блокируя, таким образом, процессирование профермента или препрофермента в каталитически активный фермент, уменьшая таким образом активность фермента типа лизилоксидазы.
В определенных воплощениях, в соответствии с настоящим изобретением антитело. связывается с человеческим LOXL2 со сродством, например, по меньшей мере, в 10 раз, по меньшей мере, в 100 раз, или даже по меньшей мере, в 1000 раз большим, чем его сродство к связыванию с другими ферментами типа лизилоксидазы, например., LOX, LOXL1, LOXL3 и LOXL4.
В определенных воплощениях, в соответствии с настоящим изобретением, антитело является неконкурентным ингибитором каталитической активности фермента типа лизилоксидазы. В определенных воплощениях, в соответствии с настоящим изобретением, антитело связывает снаружи каталитический домен фермента типа лизилоксидазы. В определенных воплощениях, в соответствии с настоящим изобретением, антитело связывается с SRCR4 доменом LOXL2. В определенных воплощениях, в соответствии с настоящим изобретением, анти-LOXL2 антитело, которое связывается с SRCR4 доменом LOXL2 и действует как неконкурентный ингибитор, это антитело АВ0023, описанное в совместных заявках на патент США No. US 2009/0053224 и US 2009/0104201. В определенных воплощениях, в соответствии с настоящим изобретением, анти-LOXL2 антитело, которое связывается с SRCR4 доменом LOXL2 и действует как неконкурентный ингибитор, это антитело АВ0024 (человеческая версия антитела АВ0023), описанное в совместных заявках на патент США US 2009/0053224 и US 2009/0104201.
В некоторых случаях антитело в соответствии с настоящим изобретением, не только связывается с ферментом типа лизилоксидазы, но также уменьшает или ингибирует поглощение или интернализацию фермента типа лизилоксидазы, например, " через интегрин бета 1 или другие клеточные рецепторы или белки. Такое антитело может, например, связываться с белками внеклеточного матрикса, клеточными рецепторами и/или интегринами.
Типичные антитела, которые распознают ферменты типа лизилоксидазы и дополнительные данные, касающиеся антител к ферментам типа лизилоксидазы,. представлены в совместных заявках на патент США No. US 2009/0053224 и US 2009/0104201, причем эти данные включены путем ссылок с целью описания антител к ферментам типа лизилоксидазы, их производства и использования.
Полинуклеотиды для модулирования экспрессии ферментов типа лизилоксидазы
Антисмысловые
Модуляция (например, ингибирование) фермента типа лизилоксидазы может осуществляться путем подавления экспрессии фермента лизилоксидазы как на уровне транскрипции, так и на уровне трансляции. Один такой способ модуляции включает применение антисмысловых олиго- или полинуклеотидов, способных к специфическому для последовательностей связыванию с мРНК-транскриптом, кодирующим фермент типа лизилоксидазы.
Связывание антисмыслового олигонуклеотида (или антисмыслового аналога олигонуклеотида) с молекулой-мишенью мРНК может привести к ферментативному расщеплению гибрида внутриклеточной РНКазой Н. В определенных случаях образование антисмыслового РНК - мРНК гибрида может мешать правильному сплайсингу. В обоих. случаях число интактных функциональных мРНК - мишеней, пригодных для трансляции, снижено или они отсутствуют.В других случаях связывание антисмыслового олигонуклеотида или аналога олигонуклеотида с мРНК-мишенью может предотвратить (например, из-за стерических препятствий) связывание с рибосомой и соответственно трансляцию мРНК.
Антисмысловые олигонуклеотиды могут содержать любой тип нуклеотидных субъединиц, например, это могут быть аналоги ДНК, РНК, такие как пептидые нуклеиновые кислоты (ПНК), или их смеси. РНК олигонуклеотиды образуют более стабильный дуплекс с молекулой-мишенью мРНК, но непрогибридизовавшиеся олигонуклеотиды менее стабильны в клетке, чем другие типы олигонуклеотидов и аналогов олигонуклеотидов. Это может быть преодолено путем экспрессии олигонуклеотидов РНК внутри клетки с помощью созданных для этой цели векторов. Этот подход можно применять, например, при попытке прицельно воздействовать на мРНК, кодирующую изобильный и долго живущий белок.
Можно принять во внимание дополнительные соображения при разработке антисмысловых олигонуклеотидов, включающие: (i) достаточную специфичность в связывании с последовательностью-мишенью; (ii) растворимость; (iii) устойчивость к действию внутриклеточных и внеклеточных нуклеаз; (iv) способность проникать через клеточную мембрану; и (v) при использовании для лечения организма низкую токсичность.
Существуют алгоритмы для идентификации олигонуклеотидных • последовательностей с высоко предсказуемым сродством связывания с их мишенью мРНК, основанном на термодинамическом цикле, который определяет энергию структурных перестроек как в мишени мРНК, так и в олигонуклеотидах. Например, Walton et al. (1999) Biotechnol. Bioeng. 65:1-9 применял такой способ для создания антисмысловых олигонуклеотидов, направленных на копии кроличьего бета-глобина (RBG) и мышиного фактора некроза опухоли-альфа (TNF-α). Та же исследовательская группа сообщила также, что антисмысловая активность рационально отобранных олигонуклеотидов против трех модельных мишеней мРНК (человеческая лактатдегидрогеназа А и В крысиный гликопротеин 130) в культуре клеток оказалась эффективной почти во всех случаях. Эти случаи включают тесты против трех разных мишеней в двух типах клеток с использованием олигонуклеотидов, выполненные с помощью как фосфодиэфирной, так и фосфоротиоатной связи.
Кроме того, имеются некоторые подходы к созданию и предсказанию эффективности специфических олигонуклеотидов, используемых в системе in vitro См., например, Matveeva et al. (1998) Nature Biotechnology 16:1374-1375.
Антисмысловой олигонуклеотид по настоящему изобретению включает полинуклеотид или аналог полинуклеотида из по меньшей мере, 10 нуклеотидов, например, между 10 и 15, между 15 и 20, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19, по меньшей мере, 20, по меньшей мере, 22, по меньшей мере, 25, по меньшей мере, 30, или даже по меньшей мере, 40 нуклеотидов. Такой полинуклеотид или аналог полинуклеотидов способен отжигаться или гибридизироваться (то есть образовывать двухнитевую структуру на основе комплементарности оснований) in vivo, в физиологических условиях с мРНК, кодирующей фермент типа лизилоксидазы, например, LOX или LOXL2.
Антисмысловые олигонуклеотиды по настоящему изобретению, могут быть экспрссированы с конструкции нуклеиновой кислоты, введенной в клетку или ткань. В некоторых случаях, экспрессия антисмысловых последовательностей контролируется индуцируемым промотером, таким что экспрессия антисмысловых олигонуклеотидов может быть включена и выключена в клетке или ткани. Альтернативно, антисмысловые олигонуклеотиды могут быть синтезированы химически и введены непосредственно в клетку или ткань, например, как часть фармацевтической композиции.
Антисмысловая техника привела к генерации высокоточных алгоритмов антисмыслового дизайна и широкому разнообразию систем доставки олигонуклеотидов, позволяя обычным специалистам конструировать и осуществлять антисмысловые подходы, подходящие для снижения экспрессии известных последовательностей. Для дополнительной информации, касающейся антисмысловой техники, см., например, Lichtenstein et al., "Antisense Technology: A Practical Approach," Oxford University Press, 1998.
Малые РНК и РНКи
Другой способ ингибирования активности фермента типа лизилоксидазы - это РНК интерференция (РНКи), подход, который использует двухнитевые малые интерферирующие молекулы РНК (миРНК), гомологичные мРНК-мишени и приводит к их деградации. Carthew (2001) Curr. Opin. Cell. Biol. 13:244-248.
РНК интерференция это обычно двухэтапный процесс.На первом этапе, называемом этапом инициации, введенная двухцепочечная РНК (дцРНК) расщепляется на 21-23 нуклеотидные малые интерферирующие РНК (миРНК), вероятно, под действием фермента Dicer члена семейства РНКаз III, состоящего из специфических к двухцепочечным субстратам рибонуклеаз, которые расщепляют двухцепочечные РНК АТФ-зависимым образом. Введенная РНК может быть доставлена, например, непосредственно или через трансген или вирус.Успешные процессы расщепления вызывают распад РНК на 19-21 по дуплексы (миРНК), каждая с 2 выступающими олигонуклеотидами на 3' конце. Hutvagner et al. (2002) Curr. Opin. Genet. Dev. 12:225-232; Bernstein (2001) Nature 409:363-366.
На втором эффекторном этапе миРНК дуплексы связываются с нуклеазным комплексом с образованием РНК-индуцированного комплекса сайленсинга (RISC). Для активации RISC требуется АТФ-зависимое раскручивание дуплекса миРНК. Активный RISC (содержащий одну миРНК и РНКазу) затем нацеливается на гомологичный транскрипт путем взаимодействия пар оснований и, как правило, расщепляет мРНК на фрагменты приблизительно по 12 нуклеотидов, начиная с 3' конца миРНК. Hutvagner et al., supra; Hammond et al. (2001) Nat. Rev. Gen. 2:110-119; Sharp (2001) Genes. Dev. 15:485-490.
РНКи и связанные с ней способы описаны также в работах Tuschi (2001) Chem. Biochem. 2:239-245; Cullen (2002) Nat. Immunol. 3:597-599; и Branti (2002) Biochem. Biophys.Acta. 1575:15-25.
Примером стратегии для синтеза молекул РНКи, подходящих для применения в настоящем изобретении в качестве ингибиторов активности фермента типа лизилоксидазы может служить сканирование соответствующей последовательности мРНК вниз от начального кодона до АА динуклеотидной последовательности. Каждый АА, плюс нижерасположенные (т.е. примыкающие к 3') 19 нуклеотидов указаны как потенциальная мишень миРНК. Мишени в кодирующих областях предпочтительней, поскольку белки, которые связаны с нетранслируемыми областями (UTRs) мРНК и/или комплексами, инициирующими трансляцию, могут мешать связыванию эндонуклеазного комплекса с миРНК. Tuschi (2001) supra. Тем не менее, важно, что миРНК, направленные на нетранслируемые области, тоже могут быть эффективными, поскольку было показано что миРНК, направленная на 5' UTR гена GADPH, опосредовала 90% снижение количества мРНК GAPDH в клетке и полную ликвидацию белка (www.ambion.com/techlib/tn/91/912.html).
Если получен набор потенциальных сайтов-мишеней, как описано выше, последовательности потенциальных мишеней сравнивали с соответствующими базами данных геномов (например, человека, мыши, крысы и т.д.), используя программное обеспечение для выравнивания последовательности (такое как программное обеспечение BLAST, доступное с сайта NCBI, www.ncbi.nlm.nih.gov/BLAST/). Потенциальные мишени, проявляющие значительную гомологию по отношению к другим кодирующим последовательностям, не рассматриваются.
Подходящие последовательности мишеней выбирают как матрицу для синтеза миРНК. Выбранные последовательности могут включать последовательности с низким значением содержания G/C, поскольку было показано, что они более эффективно опосредуют сайленсинг генов по сравнению с имеющими содержание G/C выше 55%. Некоторые сайты-мишени могут быть выбраны на протяжении гена-мишени. Для лучшей оценки выбранных миРНК, дополнительно используют отрицательный контроль. Отрицательный контроль миРНК может включать последовательность с тем же нуклеотидным составом, что и у тестируемой миРНК, но не имеющую значительной гомологии с геномом. Таким образом, может быть использована, например, искаженная нуклеотидная последовательность миРНК, если она не проявляет значительной гомологии с каким-либо другим геном.
Молекулы миРНК по настоящему изобретению могут быть транскрибированы из экспрессионных векторов, которые могут облегчить стабильную экспрессию копий миРНК, введенных в клетку хозяина. Эти векторы создают для экспрессии малых шпилечных РНК (мшРНК), которые превращаются in vivo в молекулы миРНК, способные выполнять ген-специфичный сайленсинг.См., например, Brwnmelkamp et al. (2002) Science 296:550-553; Paddison et al (2002) Genes Dev. 16:948-958; Paul et al. (2002) Nature Biotech. 20:505-508; Yuetal. (2002) Proc. Natl. Acad. Sci. USA 99:6047-6052.
Малые шпилечные РНК (мшРНК) являются одноцепочечными полинуклеотидами, образующими двухцепочечную структуру шпилька-петля. Двухцепочечная область образуется из первой последовательности, которая может гибридизоваться с последовательностью мишени, такой как полинуклеотид, кодирующий фермент типа лизилоксидазы (например, мРНК LOX или LOXL2), и второй последовательности, комплементарной к первой последовательности. Первая и вторая последовательности образуют двухцепочечную область, в то время как неспаренные нуклеотиды линкера, лежащего между первой и второй последовательностями, образуют петельную структуру в шпильке. Двухцепочечная область (стебель) мшРНК может содержать сайт, распознающий рестрикционную эндонуклеазу.
Молекула мшРНК в некоторых случаях может иметь выступающие по концам нуклеотиды, такие как выступы из 2 оснований, например, выступ 3' UU. Хотя могут быть вариации, длина стебля обычно составляет от приблизительно 15 до 49, от приблизительно 15 до 35, от приблизительно 19 до 35, от приблизительно 21 до 31 пар оснований (по), или приблизительно от 21 до 29 по, и размер петли может составлять от приблизительно 4 до 30 по, например, от около 4 до 23 по.
Для экспрессии MinPHKs внутри клетки можно использовать плазмидные векторы, содержащие промотор (например, промотор РНК Полимеразы III HI-РНК или U6 РНК промотор), сайт клонирования для инсерции последовательностей, кодирующих мшРНК, и сигнал терминации транскрипции (например, участок, содержащий 4-5 аденин-тимидиновых пар). Промоторы полимеразы III обычно содержат хорошо определенные участки инициации транскрипции и терминации, и транскрипты с них не содержат поли(А) хвостов. Терминирующий сигнал для этих промоторов определяется политимидиновым участком, и транскрипт обычно расщепляется после второго закодированного уридина. Расщепление в этой позиции генерирует выступ 3' UU в экспрессированной мшРНК, который аналогичен 3' выступам синтетических миРНК. Дополнительные способы экспрессии мшРНК в клетках млекопитающих описаны в работах, цитированных выше.
Пример подходящего вектора для экспрессии мшРНК, это pSUPER™ (Oligoengine, Inc., Seattle, WA), который содержит промотор гена полимеразы III HI-РНК с хорошо определенным участком начала транскрипции и сигналом терминации, содержащим пять последовательных аденин-тимидиновых пар. Brummelkamp et al., supra. Продукт транскрипции расщепляется в сайте, следующем за вторым уридином (из пяти кодируемых последовательностью терминации), приводя к образованию транскрипта с концевыми участками похожими на концы синтетических миРНК, которые также содержат нуклеотидные выступы. Последовательности, транскрибируемые в мшРНК, клонированы в такой вектор, который будет создавать транскрипт, содержащий первую последовательность, комплементарную части мРНК-мишени (например, мРНК, кодирующую фермент типа лизилоксидазы), отделенную коротким спейсером от второй последовательности, содержащей обратно-комплементарную к первой последовательности цепь. Результирующий транскрипт сворачивается с образованием структуры шпилька-петля, которая опосредует РНК-интерференцию (РНКи).
Другой подходящий вектор экспрессии миРНК кодирует смысловую и антисмысловую миРНК под контролем отдельных промоторов полимеразы III. Miyagishi et al. (2002) Nature Biotech. 20:497-500. миРНК, генерированная этим вектором, также включает терминирующий сигнал из пяти тимидинов (Т5).
миРНК, мшРНК и/или векторы, их кодирующие, могут быть введены в клетку с помощью ряда способов, например, липофекции. Были также разработаны способы, опосредованные вектором. Например, молекулы миРНК могут быть введены в клетки с помощью ретровирусов. Доставка миРНК с помощью ретровирусов может обеспечивать преимущества в определенных ситуациях, поскольку доставка с помощью ретровирусов может быть эффективной, однородной и позволяет немедленно отобрать стабильные «нокдаун» клетки. Devroe et al. (2002) ВМС Biotechnol. 2:15.
Недавние научные публикации подтвердили эффективность таких коротких двухцепочечных молекул РНК при ингибировании экспрессии мРНК-мишеней и таким образом, ясно показали терапевтический потенциал таких молекул. Например, РНКи использовали для ингибирования в клетках, инфицированных вирусом гепатита С. (McCaffrey et al. (2002) Nature 418:38-39), инфицированных HIV-1 клетках (Jacque et al. (2002) Nature 418:435-438), клетках цервикального рака (Jiang et al. (2002) Oncogene 21:6041-6048) и лейкемических клетках (Wilda et al. (2002) Oncogene 21:5716-5724).
Способы модулирования экспрессии ферментов типа лизилоксидазы
Другой способ модулирования активности фермента типа лизилоксидазы - это модулирование экспрессии кодирующего его гена, что ведет к меньшему уровню активности, если экспрессия гена подавлена и большему уровню, если экспрессия генов активирована. Модулирование экспрессии гена в клетке может быть достигнуто рядом способов.
Например, олигонуклеотиды, которые связывают геномную ДНК (например., регуляторные участки гена типа лизилоксидазы) путем замещения цепи или путем образования тройной спирали могут блокировать транскрипцию, предотвращая экспрессию фермента типа лизилоксидазы. Имея это в виду, было описано использование так называемого «переключателя» химического связывания, в котором олигонуклеотид распознает полипуриновый тяж на одной цепи ее мишени и гомопуриновый участок на другой цепи. Образование тройной спирали может также быть получено с использованием олигонуклеотидов, содержащих искусственные основания, расширяя условия связывания по отношению к ионной силе и рН.
Модуляция транскрипции гена, кодирующего фермент типа лизилоксидазы, может также быть достигнута, например, путем введения в клетку слитого белка, содержащего функциональный домен и ДНК-связывающий домен, или нуклеиновой кислоты, кодирующей такой слитый белок. Функциональный домен может быть, например, доменом активации транскрипции или доменом подавления транскрипции. Типичные домены активации транскрипции включают VP16, VP64 и субъединица р65 ядерного фактора каппа В, типичные домены подавления транскрипции включают KRAB, КОХ and v-erbA.
В определенных воплощениях, ДНК-связывающая часть домена такого слитого белка - это специфичный для последовательности ДНК - связывающий домен, который связывается в гене или около гена, кодирующего фермент типа лизилоксидазы, или в регуляторном участке такого гена. ДНК - связывающий домен может либо естественным образом связываться с участком на гене или вблизи гена, либо может быть сконструирован таким образом, чтобы так связываться. Например, ДНК-связывающий домен может быть получен из природного белка, который регулирует экспрессию гена, кодирующего фермент типа лизилоксидазы. Напротив, ДНК - связывающий домен может быть сконструирован так, чтобы связываться с выбранным участком гена или вблизи гена, кодирующего фермент типа лизилоксидазы или с регуляторным участком такого гена.
В этом отношении ДНК - связывающий домен, содержащий «цинковые пальцы», полезен, поскольку можно создавать белки со структурным мотивом «цинковый палец», чтобы связываться с любым выбранным участком ДНК. Связывающий домен типа «цинковые пальцы», содержит одну или большее число структурных мотивов «цинковый палец». Miller et al. (1985) EMBO J 4:1609-1614; Rhodes (1993) Scientific American, February: 56-65; U.S. Patent No. 6453242. Обычно один «цинковый палец», содержит около 30 аминокислот в длину и содержит четыре аминокислотных остатка, связанных координационными связями с цинком. Структурные исследования показали, что канонический (С2Н2) мотив «цинковый палец», содержит два бета листа (удерживаемых в форме бета изгиба, которые обычно содержат два цистеиновых остатка, находящихся в координационной связи с цинком), расположенные напротив альфа-спирали (обычно содержащей два гистидиновых остатка, находящихся в координационной связи с цинком).
Цинковые пальцы включают как канонические C2H2 цинковые пальцы (то есть такие, в которых ион цинка координирован двумя цистеиновыми и двумя гистидиновыми остатками) и не канонические цинковые пальцы, такие как, например, С3Н цинковые пальцы (такие, в которых ион цинка находится в координационной связи с тремя цистеиновыми остатками и одним гистидиновым остатком) и C4 цинковые пальцы (такие, в которых ион цинка находится в координационной связи с четырьмя цистеиновыми остатками). Не канонические цинковые пальцы могут также включать такие, в которых в один из этих координирующих цинк остатков замещен аминокислотой, отличающейся от цистеина или гистидина. См., например, WO 02/057293 (июль 25, 2002) и US 2003/0108880 (июнь 12, 2003).
Можно создать связывающие домены, типа цинковые пальцы, обладающие новой специфичностью связывания по сравнению с естественными белками со структурными мотивами цинковый палец; позволяя таким образом конструировать домены с цинковыми пальцами для связи с желаемым участком. См., например, Beerii et al. (2002) Nature Biotechnol. 20:135-141; Pabo et al. (2001) Ann. Rev. Biochem. 70:313-340; Isalan et al. (2001) Nature Biotechnol. 19:656-660; Segal et al. (2001) Curr. Opin. Biotechnol. 12:632-637; Choo et. al. (2000) Curr. Opin. Struct. Biol. 10:411-416. Методы конструирования включают, но не ограничиваются им рациональный дизайн и различные типы эмпирических способов селекции.
Рациональный дизайн включает, например, использование базы данных, содержащей триплетные (или квадриплетные) последовательности нуклеотидов и индивидуальные аминокислотные последовательности цинковых пальцев, в которых каждая триплетная или квадриплетная последовательность связана с одной или большим числом аминокислотных последовательностей цинковых пальцев, которые связывают определенные триплетные или квадриплетные последовательности. См., например патенты США No. 6, 140,081; 6,453,242; 6,534,261; 6,610,512; 6,746,838; 6,866,997; 7,030,215; 7,067,617; Опубликованные заявки на патент США No. 2002/0165356; 2004/0197892; 2007/0154989; 2007/0213269; опубликованные международные заявки No. WO 98/53059 и WO 2003/016496.
Примеры методов отбора, включая фаговый дисплей, ловушку взаимодействия, гибридный отбор и двухгибридные системы, раскрыты в патентах США No 5789538; 5925523; 6007988; 6013453; 6140466; 6200759; 6242568; 6410248; 6733970; 6790941; 7029847 и 7297491; а также в опубликованных заявках на патент США No. 2007/0009948 и 2007/0009962; WO 98/37186; WO 01/60970 и GB 2,338,237.
Увеличение специфичности связывания для связывающих доменов типа цинковые пальцы, описаны, например, в патенте США No 6794136 (сент. 21, 2004). Дополнительные аспекты формирования цинковых пальцев по отношению к межпальцевым последовательностям линкера представлены в патенте США No. 6 479 626 и опубликованной заявке на патент США No. 2003/0119023. См. также Moore et al. (2001a) Proc. Natl. Acad. Sci. USA 98:1432-1436; Moore et al. (2001b) Proc. Natl. Acad. Sci. USA 98:1437-1441 и WO 01/53480.
Дальнейшие детали использования слитых белков, содержащих сконструированные ДНК-связывающие домены типа цинковых пальцев, представлены, например, в патентах США 6534261; 6607882; 6824978; 6933113; 6979539; 7013219; 7070934; 7163824 и 7220719.
Дополнительные способы для модулирования экспрессии фермента типа лизилоксидазы включают целенаправленный мутагенез гена или регуляторного участка, который контролирует экспрессию гена. Типичные способы для целенаправленного мутагенеза с использованием слитых белков, содержащих нуклеазный домен и сконструированный ДНК-связывающий домен, представлены, например, в опубликованных заявках на патент США No.2005/0064474; 2007/0134796; и 2007/0218528.
Лекарственные формы, наборы и способы введения
Были также представлены терапевтические композиции, содержащие соединения, идентифицированные как модуляторы активности фермента типа лизилоксидазы (например, ингибиторы или активаторы фермента типа лизилоксидазы). Такие композиции обычно содержат модулятор и фармацевтически приемлемый носитель. Дополнительные активные соединения также могут быть включены в композицию. Например, ингибиторы LOXL2 в комбинации со стероидами, антибиотиками или противоопухолевыми препаратами применяют для лечения фиброзных заболеваний легких. Соответственно терапевтические композиции, как представлено в настоящей заявке, могут содержать как модулятор активности фермента типа лизилоксидазы, так и стероидный и противоопухолевый агенты и/или антибиотики
Использованные здесь термины «терапевтически эффективное количество» или «эффективное количество» относятся к количеству терапевтического агента, которое при введении в клетку, ткань или организм (например, млекопитающего, такого как человек,. или животное, такое как примат, грызун, корова, лошадь свинья, овца и т.д.) отдельно или в комбинации с другим терапевтическим агентом эффективно предотвращает или улучшает болезненное состояние или прогрессирование заболевания или вызывает реверсию заболевания. Кроме того, терапевтически эффективная доза относится к количеству соединения, достаточному для действия, заключающегося в полном или частичном улучшении проявлений, например, в лечении, исцелении, предотвращении или улучшении соответствующих медицинских показателей или повышении скорости лечения, исцеления, предотвращения или улучшения таких показателей. Терапевтически эффективное количество, например, ингибитора активности фермента типа лизилоксидазы зависит от типа заболевания или нарушения, тяжести заболевания или нарушения и от размера организма, страдающего от болезни или заболевания.
Терапевтические композиции, предложенные в настоящей заявке, используются, в частности, для снижения фиброзных повреждений и реверсии фиброзных заболеваний легких. Соответственно «терапевтически эффективное количество» модулятора (например, ингибитора) активности фермента типа лизилоксидазы (например, LOXL2) может быть количеством, которое приводит к реверсии фиброзного заболевания легких. Например, когда ингибитор LOXL2 представляет собой антитело, и антитело вводят in vivo, нормальная дозировка может изменяться от приблизительно 10 нг/кг до 100 мг/кг веса тела млекопитающего или более в день, например, около 1 мкг/кг/день до 50 мг/кг/день, по выбору около 100 мкг/кг/день до 20 мг /кг/день, 500 мкг/кг/день до 10 мг/кг/день, или 1 мг/кг/день до 10 мг/кг/день, или около 15 мг/кг/день в зависимости от, например, веса тела, способа введения, тяжести заболевания и т.д. Прием дозировок может также быть не ежедневным, а по схеме один, два или три раза в неделю в количестве от 10 нг/кг до 100 мг/кг веса тела млекопитающего или на дозу, например, около 1 мкг/кг/дозу до 50 мг/кг/дозу, по выбору от около 100 мкг/кг/дозу до 20 мг/кг/дозу, 500 мкг/кг/дозу до 10 мг/кг/дозу, или 1 мг/кг/дозу до 10 мг/кг/дозу, или около 15 мг/кг/дозу. В одном примере доза составляет около 15/мг/кг и вводится два раза в неделю. Периоды лечения могут длиться от, например, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель или больше.
Когда модулятор активности фермента типа лизилоксидазы применяется в комбинации со стероидом, антибиотиком или противоопухолевым агентом, можно рассматривать терапевтически эффективную дозу лекарственной формы, которая представляет собой комбинированные количества модулятора и другого агента, которые приводят к уменьшению фиброзного поражения легких, независимо от того, вводят их в лекарственной форме последовательно или одновременно. Терапевтически эффективной могут быть более одной комбинации концентраций.
В свете настоящего изобретения специалистам известны различные фармацевтические композиции и техники их приготовления и использования. Для подробного перечня подходящих фармакологических композиций и техник их введения можно обратиться к детальным руководствам в настоящей заявке, а также к тексту, такому как Remington's Pharmaceutical Sciences, 17th ed. 1985; Brunton et al., "Goodman and Oilman's The Pharmacological Basis of Therapeutics," McGraw-Hill, 2005; University of the Sciences in Philadelphia (eds.), "Remington: The Science and Practice of Pharmacy," Lippincott Williams & Wilkins, 2005; and University of the Sciences in Philadelphia (eds.), "Remington: The Principles of Pharmacy Practice," Lippincott Williams & Wilkins, 2008.
Кроме того, описанные терапевтические композиции включают фармацевтически приемлемые материалы, композиции или носители, такие как жидкий или твердый наполнитель, разбавитель, формообразователь, растворитель или инкапсулированный материал, например, носитель. Эти носители принимают участие в переносе модулятора от одного органа или участка тела к другому органу или участку тела. Каждый носитель должен быть «приемлемым», то есть быть совместимым с другими ингредиентами композиции и не быть вредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают сахара, такие как лактоза, глюкоза и сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметил целлюлозу, этил целлюлозу и ацетат целлюлозы; порошок трагантовой камеди, солод, желатин, тальк; наполнители, такие как масло какао и воска для суппозитория; масла, такие как арахисовое масло, масло из семян хлопка, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропилен гликоль; многоатомные спирты, такие как глицерин, сорбит, манит и пропиленгликоль; эфиры, такие как этил олеат и этил лаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; физиологический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; и другие нетоксические совместимые вещества, применяемые в фармацевтических композициях. Увлажняющие агенты, эмульсификаторы и смазывающие агенты, такие как натрий лаурил сульфат и стеарат магния, а также красящие агенты, высвобождающие агенты, покрывающие агенты, подслащивающие, и ароматизирующие агенты, предохранители и антиоксиданты тоже могут присутствовать в композиции.
Еще один аспект настоящего изобретения относится к наборам для введения модулятора активности фермента типа лизилоксидазы, например, ингибитора LOXL2. Другой аспект настоящего изобретения относится к наборам для комбинированного введения модулятора активности фермента типа лизилоксидазы и стероида, антибиотика или противоопухолевого агента. В одном воплощении набор содержит ингибитор активности фермента типа лизилоксидазы (например, ингибитор LOXL2), антибиотика или противоопухолевого агента в фармацевтическом носителе, содержащем по выбору по меньшей мере, один стероид, антибиотик или противоопухолевый агент, объединенных соответственно в один или большее число отдельных фармацевтических препаратов.
Лекарственная форма и способы доставки могут быть адаптированы в соответствии с местом и степенью фиброзного поражения. Типичные лекарственные формы включают, (но не ограничиваются ими) лекарственные формы, пригодные для парентерального введения, например, внутрилегочного, внутривенного внутриартериального внутриглазного или подкожного введения, в том числе лекарственные формы, инкапсулированные в мицеллы, липосомы или капсулы, высвобождающие (активные агенты, включенные в биосовместимое покрытие, приспособленное для медленного высвобождения)); расщепляемые лекарственные формы; лекарственные формы для местного применения, такие как глазные капли, кремы, мази и гели; и другие лекарственные формы, такие как ингаляторы, аэрозоли и спреи. Дозировка веществ по изобретению будет изменяться соответственно степени и серьезности необходимости лечения, активности вводимой композиции, общему состоянию здоровья пациента и другим обстоятельствам, хорошо известным специалистам в данной области.
В дополнительных воплощениях описанные в данной заявке композиции доставляются локально, например, внутрилегочно. Таким образом, лекарственная форма, содержащая ингибитор LOXL2, может быть введена с помощью ингаляции, и распыленные лекарственные формы могут быть введены орально или назально. Локализованная доставка позволяет осуществлять доставку композиции систематически, уменьшая таким образом, нагрузку композиции на организм по сравнению с системной доставкой. Такая локальная доставка может быть достигнута, например, путем применения различных имплантированных медицинских приспособлений, таких как стенты и катетеры, или путем ингаляций, инъекций или хирургически. Способы покрытия, имплантирования, размещения и другие способы присоединения желаемых агентов к медицинским приспособлениям, таким как стенты и катетеры, установлены специалистами и рассмотрены в данной заявке.
Анти-LOXL2 Антитела
Моноклональное антитело, направленное против LOXL2, было описано в совместной заявке на патент США публикационный No. US 2009/0053224 (фев. 26, 2009). Это антитело обозначено АВ0023. Представляют интерес антитела, имеющие тяжелую цепь, содержащую области CDR (CDR1, CDR2, и CDR3) АВ0023 и имеющие легкую цепь, содержащую области CDR (CDR1, CDR2, и CDR3) АВ0023. Последовательности CDR и каркасных участков вариабельной области его тяжелой цепи представлены ниже (подчеркнуты последовательности CDR1, CDR2, и CDR3):
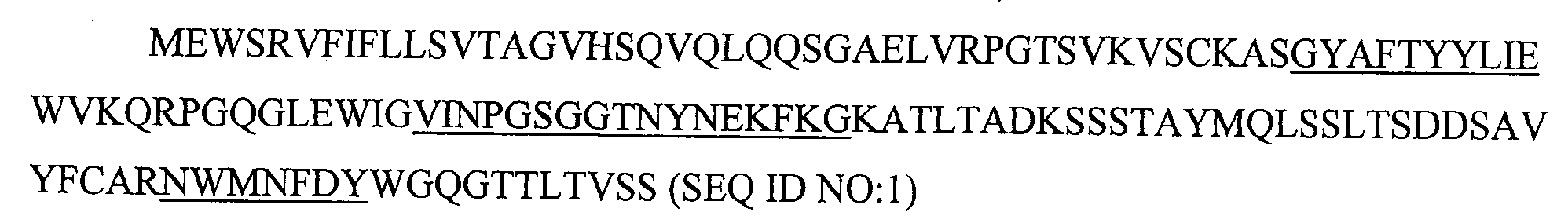
Кроме того, представлены дополнительные аминокислотные последовательности вариабельной области тяжелой цепи, имеющие 75% или больше, 80% или больше, 90% или больше, 95% или больше, или 99% или большую гомологию к SEQ ID N0:4.
Последовательность CDR и каркасных участков вариабельной области легкой цепи антитела АВ0023 - это (последовательности CDR1, CDR2, и CDR3 подчеркнуты):
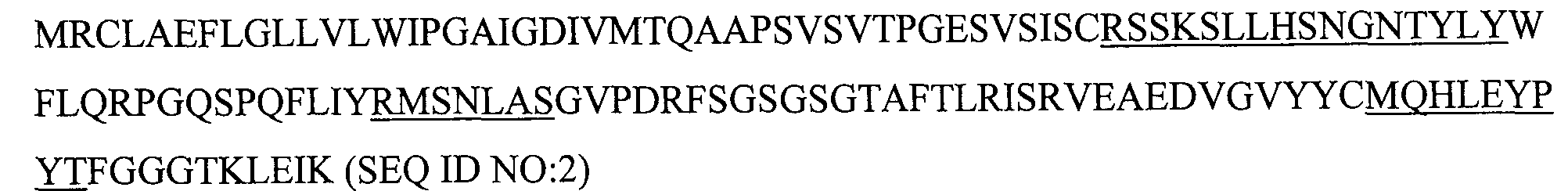
Кроме того, представлена дополнительная аминокислотная последовательность вариабельной области легкой цепи, имеющей 75% или больше, 80% или больше, 90% или больше, 95% или больше, или 99% или большую гомологию к SEQ ID NO:2.
Гуманизированные версии вышеупомянутого моноклонального антитела анти-LOXL2 было описано в совместно заявленной заявке на патент США публикационный No. US 2009/0053224 (фев. 26, 2009). Типичное гуманизированное антитело обозначено АВ0024. Представляют интерес антитела, имеющие тяжелую цепь, содержащую последовательности CDR (CDR1, CDR2, и CDR3) АВ0024 и имеющие легкую цепь, содержащую последовательности CDR (CDR1, CDR2, и CDR3) АВ0024.
Последовательности CDR и каркасных участков вариабельной области тяжелой цепи это: (последовательности CDR1, CDR2, и CDR3 подчеркнуты):
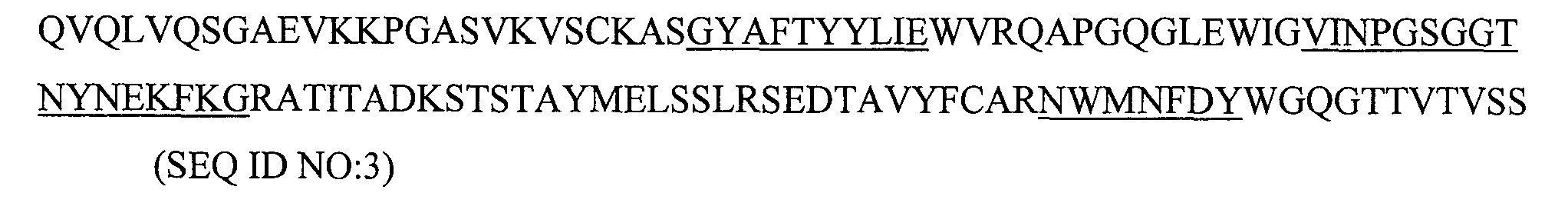
Кроме того, представлены дополнительные аминокислотные последовательности вариабельной области тяжелой цепи, имеющие 75% или больше, 80% или больше, 90% или больше, 95% или больше, или 99% или большую гомологию к SEQ ID NO:3.
Последовательности CDR и каркасных участков вариабельной области легкой цепи антитела АВ0024 - это (последовательности CDR1, CDR2, и CDR3 подчеркнуты):

Кроме того, представлены дополнительные аминокислотные последовательности вариабельной области легкой цепи, имеющие 75% или больше, 80% или больше, 90% или больше, 95% или больше, или 99% или большую гомологию к SEQ ID NO:4.
Дополнительные последовательности анти-LOXL2 антитела, включающие дополнительные гуманизированные варианты вариабельных участков, аминокислотные последовательности области каркаса и аминокислотные последовательности гипервариабельных областей были описаны в совместно заявленной заявке на патент США публикационный No. US 2009/0053224 (Фев. 26, 2009), которая включена отсылкой в настоящую заявку, представляя аминокислотные последовательности различных анти-LOXL2 антител.
LOXL2 как диагностический маркер для фиброзных заболеваний легких
Увеличение активности LOXL2 в фиброзной легочной ткани, раскрытое в данной заявке, и одновременное снижение активности LOXL2, которое наблюдается при нормализации структуры легких после лечения ингибиторами LOXL2, также раскрытое в заявке, свидетельствуют о том, что активность LOXL2 в легочной ткани может быть использована в качестве диагностического маркера фиброзных заболеваний легких. Соответственно, увеличение активности LOXL2 в легочной ткани указывает на начало или прогрессирование фиброзного заболевания легких.
Способы измерения активности LOXL2 известны специалистам и включают оценку ферментативной активности белка LOXL2 и оценку мРНК LOXL2. См., например, заявку на патент США US 2006/0127402 (июнь 15, 2006), 2009/0053224 (фев. 26, 2009) и 2009/0104201 (апрель 23, 2009), and Rodriguez et al. (2010) J. Biol. Chem. 285:20964-20974, описания которых включены в данную заявку путем ссылки во всей их полноте для раскрытия различных методов детекции, количественной оценки и ингибирования LOXL2.
LOXL2 как прогностический маркер фиброзных заболеваний легких
Фиброзные заболевания легких могут включать периоды относительной стабильности, перемежаемые периодами острой фазы, проявляющейся в заболеваемости и/или смертности. Соответственно, нужны хорошие прогностические маркеры.
Изобретатели определили, что лечением ингибиторами LOXL2 вызывает реверсию избыточной экспрессии LOXL2, характерной для фиброзных заболеваний легких. Поэтому активность LOXL2 в легочной ткани можно использовать в качестве прогностического маркера для оценки эффективности лечения фиброзных заболеваний легких, причем снижение активности LOXL2 указывает на уменьшение симптомов и улучшение прогноза заболевания. Лечение может включать лечение стероидами, антибиотиками или противоопухолевыми препаратами и/или лечение ингибиторами LOXL2.
Примеры
Пример 1. Модельная система
Индуцированный блеомицином фиброз легких у мышей - известная стандартная модельная система для IPF и других фиброзных заболеваний легких. См., например, Harrison and Lazo (1987) J. Pharmacol. Exp.Ther. 243:1185-1194; Walters and Kleeberger (2008) Current Protocols Pharmacol. 40:5.46.1-5.46.17. Эту систему использовали для изучения действия ингибитора LOXL2 в форме анти-LOXL2 антитела на течение и последствия фиброза легких.
Вкратце, легочный фиброз индуцировали у самцов мышей C57B/L6 ротоглоточным введением блеомицина. Для введения блеомицина животных анестезировали и подвешивали на спине под углом приблизительно 60° с помощью резиновой полоски, пропущенной под верхними резцами.
Язык удерживали одной рукой с помощью пинцета с мягкими насадками, открывая воздушные пути. Раствор блеомицина вводили в заднюю часть ротовой полости с помощью пипетки, и язык и рот оставляли открытыми, пока жидкость не была более видна во рту.
Мышам вводили также анти-LOXL2 антитело (АВ0023) либо до (исследование предотвращения: пример 2) либо после (исследование лечения: пример 3) введения блеомицина. Антитело АВ0023 раскрыто в настоящей заявке в разделе, озаглавленном «Анти-LOXL2 Антитела», и было описано в совместной заявке US 2009/0053224 (фев. 26, 2009), раскрытие которой включено отсылкой в настоящую заявку для описания анти-LOXL2 антител, их приготовления и их свойств.
Пример 2. Исследование предотвращения
В этом исследовании 21 самцов мыши C57BL/ в возрасте 7-8 недель, делили на три группы: группа 1 содержала 5 животных, а группы 2 и 3 содержали по 8 животных каждая. Группа 1 была контрольной группой, в которой животные получали физиологический раствор в нулевой день и затем по два раза в неделю. Животные в группе 2 получали 1 ед/кг блеомицина в нулевой день. За четыре дня и за один день до введения блеомицина животные в группе 2 получали также инъекции растворителя (используемого для разведения антител) (PBS), и инъекции растворителя два раза в неделю после введения блеомицина. Животные в группе 3 получали 1 ед/кг блеомицина в нулевой день. За четыре дня и за один день до введения блеомицина животные в группе 3 получали 15 мг/кг aHTH-LOXL2 антитела (АВ0023) и инъекции 15 мг/кг антитела дважды в неделю после введения блеомицина. Дизайн исследования показан в таблице 1.
Блеомицин сульфат (МР Biomedicals, Catalogue #19030, Lot 2373K) растворяли в 0,9% физиологического раствора и вводили ротоглоточно под анестезией до достижения конечной концентрации 1 единица на килограмм веса тела. См. Walters & Kleeberger, supra. АВ0023 вводили внутрибрюшинной инъекцией 3 мг/мл исходного раствора в PBS до конечной концентрации 15 мг/мл. Носитель (PBS) вводили путем внутрибрюшинной инъекции.
На 14 день исследование оканчивалось, и всех животных забивали для анализа. Собирали кровь пункцией сердца и использовали ее для приготовления сыворотки. Иссекали легкие и взвешивали их. Легкие из половины животных каждой группы использовали для сбора бронхоальвеолярной промывной жидкости путем перфузии сбалансированным солевым раствором Хэнкса. Промывную жидкость центрифугировали, и супернатант удаляли и замораживали. Осажденные клетки ресуспендировали в 2 мл буфера Pharmalyse (BD Biosciences, San Jose, CA), чтобы лизировать эритроциты. Лизис прекращали добавлением PBS+2% бычьего сывороточного альбумина, и клетки центрифугировали. В осадке определяли количество не прокрашивавшихся трипановым синим лейкоцитов с помощью гемоцитометра.
После промывания эти легкие фиксировали в 10% нейтральном забуференном формалине. Легкие оставшихся животных подвергали быстрому замораживанию в жидком азоте и хранили при -80°С для гистологии и определения белка.
Иммуногистохимия (IHC) и Иммунофлуоресиенция (IF)
Все растворы и реагенты были получены из Biocare Medical (Concord, CA), если не указано иначе, и все процедуры проводили при комнатной температуре. Срезы (5 мкм) легочной ткани получали либо после фиксации формалином, либо после замораживания и окрашивали либо гематоксилином и эозином, либо Сириусом Красным.
Для IHC или IF на фиксированных формалином срезах ткани, проводили извлечение антигена в камере для демаскировки антигенов (decloaking chamber) при 90°С в течение 45 мин. Первичные антитела к коллагену I, α-актину из гладких мышц, трансформирующему фактору роста β-1 (TGP β-1), эндотелину-1 (ЕТ-1), CD45 и стромальному фактору-1α (SDF-1α/CXCL12) получали из AbCam (Cambridge, MA) и применяли в концентрации 1-10 мкг/мл.
Свежезамороженные ткани фиксировали 4% параформальдегидом и проводили гистохимическое исследование IHC с помощью первичных анти-LOXL2 поликлональных антител (Arresto Biosciences, Inc., Palo Alto, CA).
Перед контактом с первичным антителом срезы обрабатывали блокатором пероксидаз Peroxidazed-1 (Biocare Medical, Concord, CA), чтобы блокировать активность эндогенных пероксидаз, и блокирующим реагентом Background Sniper (Biocare Medical, Concord, CA).
Процедуру IHC осуществляли следующим образом. Первичное антитело добавляли к срезу и инкубировали 30 мин. После отмывания добавляли вторичное антитело, конъюгированное с пероксидазой хрена (HRP), (МАСН 2, Biocare Medical, Concord, CA) и инкубировали в течение 30 мин. После отмывания вторичного антитела срез инкубировали с диаминобензидиновым (DAB) хромогеном в течение 1 мин, и затем докрашивали гематоксилином.
Для IF к срезам фиксированной формалином ткани добавляли раствор первичного антитела (анти-СВ45 крысы или анти-коллагена I) и инкубировали в течение одного часа. После отмывания добавляли смесь Alexa Fluor 488 (зеленый) анти-кроличьих и Alexa Fluor 546 (красный) анти-крысиных вторичных козьих антител (оба из Invitrogen, Carlsbad, CA) и инкубировали в течение одного часа. Срезы докрашивали DAPI, закрепляли и наблюдали с помощью флуоресцентного микроскопа. Для визуализации Alexa Fluor 488 (зеленого, указывающего на коллаген,) использовали длину волны возбуждения 495 нм и длину волны эмиссии 519 нм. Для визуализации Alexa Fluor 546 (красного, указывающего на CD45) использовали длину волны возбуждения 556 нм и длину волны эмиссии 573 нм.
Для каждой из трех исследуемых групп для каждого антигена тестировали 3-4 поля для разных легких. Площадь сигнала на поле рассчитывали с помощью программного обеспечения для компьютерной графики MetaMorph (Molecular Devices, Downingtown, PA).
ELISA ИССЛЕДОВАНИЕ pSMAD 2
Легочную ткань гомогенизировали в Лизирующем Клетки Буфере (CELL Signaling Technology, Inc., Danvers, MA), содержащем 1 мМ PMSF, и гомогенат использовали в ELISA исследовании фосфорилированного SMAD2 (p-SMAD2).
Результаты
Животные, получавшие блеомицин, обнаруживали ограниченный прирост веса или небольшую степень потери веса в течение всего исследования (например, группа 2). Однако животные получавшие блеомицин и обработанные также АВ0023 (например, группа 3) демонстрировали стабильный прирост веса (фигура 1). Как ожидалось обработанные физиологическим раствором контрольные животные (группа 1) также обнаруживали стабильный прирост веса в течение всего исследования.
Полные количества лейкоцитов в BAL жидкости были выше у животных, получавших блеомицин (группа 2), по сравнению с контрольной группой, получавшей физиологический раствор (группа 1) см. фигуру 2. В дополнительных экспериментах наблюдали корреляцию между более высокими концентрациями блеомицина и повышенным количеством полного числа лейкоцитов в BAL жидкости. Обработка Ab0023 проявлялась в снижении числа лейкоцитов в BAL обработанных блеомицином животных до значений, аналогичных наблюдаемым в контроле под действием физиологического раствора (фигура 2). Аналогичные результаты были получены во втором исследовании (р=0.032).
Обработка мышей 1 ед/кг блеомицина (группа 2) индуцирует фиброзную реакцию у грызунов, что следует из повышенных значений концентрации поперечно связанного коллагена и пролиферации α-SMA-положительных клеток («активированных фибробластов» или «фиброцитов»). Структура легких также нарушалась, что следует из утолщения альвеол и пролиферации пневмоцитов (в первую очередь, пневмоцитов Типа II).
Анализ легких при изучения животных показывает, что экспрессия LOXL2 индуцировалась в эпителиальной ткани легких (пневмоциты Типа I и Типа II) и в инфильтрующихся фибробластах вследствие обработки блеомицином (фигура 3, верхняя правая панель; фигура 4). Клетки положительные по α-актину из гладких мышц, используемые для идентификации активированных фибробластов или миофибробластов, также преобладали в легких мышей, обработанных блеомицином (фигура 3, верхняя левая панель; фигура 5). Животные, обработанные биомицином, и обработанные также Ab0023, проявляли значительно меньшие количества как LOXL2, так и α-SMA-положительных клеток (фигура 3, нижние панели, фигура 4, фигура 5).
Повреждение легких оценивали морфологически с помощью руководства по использованию показателей Ашкрофта. См. Ashcroft et al. (1988) J. din. Pathol. 41:467-470. Анализ выполняли три разных лица, не информированных о характере исследуемой группы. Легкие животных в контрольной группе, получавшей физиологический раствор, имели баллы Ашкрофта <1. Средний балл Ашкрофта у получавших блеомицин животных равнялся 3, и этот балл значительно снижался при обработке АВ0023 (р=0.0029, фигура б). При этом структура легких тоже восстанавливалась при обработке анти-LOXL2 антителами.
Независимую количественную оценку фиброза осуществляли с помощью окрашивания Сириусом красным для регистрации поперечно-сшитого коллагена. Легкие животных, обработанных блеомицином, содержали большое количество поперечно-сшитого коллагена (фигура 7, вверху слева); хотя введение анти-LOXL2 антител животным, обработанным блеомицином, сильно снижало количество поперечно-сшитого коллагена (свидетельствующего о фиброзе легких), который возникал в результате экспозиции с блеомицином (фигура 7, вверху справа). Количественная оценка площади сигнала, видимого в поляризованном свете, указывает на то, что снижение статистически достоверно, (р=0.0001, фигура 7, внизу).
TGFβ-1 и SDF-1α были идентифицированы в качестве стимуляторов заболевания как при фиброзе легких у человека, так и в индуцированной блеомицином модели фиброза. Фактор-1 из стромы (SDF-1) это хемокин, вырабатываемый, в первую очередь, нейтрофилами и макрофагами, рецептор CXCR4 которых обнаружен на небольшой популяции стволовых клеток костного мозга. SDF-1 существует в двух формах, производимых альтернативными путями сплайсинга: SDF-1α и SDF-1β. В случае патологии IPF, считается, что SDF-1α опосредует рекрутинг этих CXCR4+ стволовых клеток в легкие, где они дифференцируются до фиброцитов и вырабатывают коллаген, участвующий в фиброзном поражении. См., например, Xu, et al. (2007) Am. J. Resp.Cell. Mol. Biol. 37:291-299. Относительно роли TGF-β1 в IPF, см Noble (2008) Eur. Respir. Rev. 17:123-129.
Благодаря роли этих белков в патологии IPF, эффекты анти -LOXL2 АВ0023 на их экспрессию в фиброзных легких оценивали с помощью иммуногистохимии.
Активности SDF-1α в значительной степени увеличивались по сравнению с контрольными значениями в легких животных, обработанных блеомицином (фигура 8, сверху, слева), с экспрессией пневмоцитами типа II, потенциальными фиброцитами и, возможно, другими типами клеток. Лечение АВ0023 значительно снижало экспрессию SDF-1α, индуцированную вследствие экспозиции с блеомицином (фигура 8, вверху справа). Количественная оценка площади сигнала указывает на то, что снижение статистически достоверно, (р<0.0001, фигура 8, внизу).
Обработка блеомицином приводила к экспрессии TGFβ-1 различными типами клеток в легких, включая макрофаги, пневмоциты типа II, миофибробласты и, возможно, фиброциты (фигура 9, вверху слева). Концентрации TGFp-1 значительно снижались (фигура 9, вверху справа) в легких животных, получавших лечение АВ0023 (р<0.0001, фигура 9, внизу).
В отдельном исследовании определяли концентрации фосфорилированного SMAD2 (p-SMAD2), маркера активации TGFβ-1 сигнального пути. У мышей, обработанных блеомицином для индуцирования фиброза легких, основанное на ткани исследование ELISA свидетельствует о снижении фосфорилирования SMAD2 у мышей, обработанных анти-LOXL2 антителом, по сравнению с мышами, обработанными контрольным антителом (фигура 10).
Экспрессия эндотелина -1(ЕТ-1) индуцирована TGFβ-1, и эндотелии-1 участвует совместно с TGFp-1 в патогенезе фиброза легких. Анализ с помощью иммуногистохимии показывает, что у животных, обработанных блеомицином, характер экспрессии ЕТ-1 очень похож на характер экспрессии TGFp-1 (фигура 11, вверху слева), а при лечении АВ0023 наблюдалось также значительное снижение ЕТ-1 (фигура 11, вверху справа). Количественная оценка площади сигнала указывает на то, что снижение статистически достоверно (р=0.005, фигура 11 внизу).
Один из источников коллаген-продуцирующих клеток в фиброзных легких возникает из СВ45-положительной гематопоэтической стволовой клетки. Эти клетки-предшественники («фиброциты») могут быть обнаружены в тканевых срезах с помощью колокализации реакции на коллаген и CD45. Когда срезы легких животных из групп 2 и 3 исследовали иммунофлуоресцентным методом на присутствие коллагена типа I и CD45, было показано, что легкие животных, обработанных блеомицином, (группа 2) содержали много фиброцитов (фигура 12, левые панели). В группе 3 животных, получавших как блеомицин, так и анти-LOXL2 антитело, было обнаружено меньше фиброцитов (фигура 12, правые панели).
Выводы
Лечение анти-LOXL2 антителом улучшало общее состояние здоровья (судя по увеличивающемуся весу тела), нормализовало количество лейкоцитов в BAL жидкости, уменьшало фиброз, уменьшало утолщение альвеол, улучшало структуру легких, снижало число фиброцитов, уменьшало количество CD45+/КоллагенI+предшественников фиброцитов и улучшало показатель Ашкрофта у мышей с индуцированным блеомицином фиброзом легких. Кроме того концентрации следующих белков (являющихся маркерами фиброзной ткани) снижались при лечении анти-LOXL2: LOXL2, трансформирующий фактор роста β-1 (TGFβ-1), эндотелин-1, p-SMAD2 и стромальный фактор-1α (SDF-1α/CXCL12). Эти результаты демонстрируют эффективность ингибиторов LOXL2, в частности, анти-LOXL2 антител для уменьшения тяжести и реверсии симптомов фиброза легких.
Пример 3. Исследование лечения
В данном исследовании мышам вводили блеомицин и индуцировали развитие фиброза легких, а затем лечили их либо анти-LOXL2 антителом (АВ0023), либо контрольным антителом (АС-1).
Дизайн исследования
Мышей C57BL/6 в возрасте 7-8 недель разделяли на три группы. Группа 1 (контрольные) содержала пять животных, а группы 2 и 3 содержали по 8 животных каждая. В 0 день животные в группах 2 и 3 получали блеомицин, как описано в примере 2, но доза составляла 2.5 ед/кг.Контрольным животным в группе 1 вводили равный объем физиологического раствора теми же методами. Животные в группе 1 не получали никаких других воздействий, и их забивали на 14-й день. На 7-й день животные в группе 2 получали 15 мг/кг антитела АС-1 (контроль), а животные в группе 3 получали 15 мг/кг анти-LOXL2 антитела АВ0023. Введение антитела осуществляли путем внутрибрюшинной инъекции (IP). Введение антител животным из групп 2 и 3 продолжали дважды в неделю, используя те же антитела, те же концентрации и те же способы введения. На 22-й день животных из групп 2 и 3 забивали для анализа. Дизайн исследования суммирован в таблице 2.
Анализ
Всех животных взвешивали перед введением блеомицина и затем по два раза в неделю до конца исследования.
В момент сбора кровь собирали путем опускания из сердца после забоя, и готовили сыворотку. Легкие некоторых животных иссекали и взвешивали. Легкие оставшихся животных быстро замораживали в жидком азоте и хранили при -80°С для гистопатологического анализа или фиксировали в 10% нейтральном забуференном формалине.
Растворы, применяемые для иммуногистохимического анализа (IHC) получали из Biocare Medical (Concord, CA). Все процедуры выполняли при комнатной температуре. Изготавливали срезы и окрашивали их Сириусом красным, анти-LOXL2 поликлональным антителом (Arresto Biosciences, Palo Alto, CA), и анти-aSMA антителами (1:250; Abeam, Cambridge, MA). Извлечение антигена выполняли на 5 мкм срезах фиксированной формалином ткани, эндогенную пероксидазу блокировали с помощью Peroxidazed-1 (Biocare Medical), и блокировали Background Sniper (Biocare Medical). Срезы окрашивали первичными антителами в течение 30 минут, инкубировали с вторичным антителом (антикроличьим, конъюгированным с МАСН 2 HRP, Biocare Medical, Concord, CA) в течение 30 минут; инкубировали с DAB в течение 1 мин и повторно окрашивали гематоксилином. Для каждой обработки окрашивали четыре поля из пяти произвольно выбранных легких. Площадь сигнала от срезов легких рассчитывали с помощью программного обеспечения для компьютерной графики MetaMorph (Molecular Devices, Downingtown, PA), которое измеряло площадь окрашивания DAB на срезе.
Результаты
Вес тела: На 22 день животные, леченые АВ0023, (экспозиция после введения блеомицина, группа 3) прибавили в весе в среднем 1.34 граммов через 7 дней после начала лечения антителом, в то время как животные, получавшие АС-1 (группа 2), прибавили в среднем только 0.64 граммов за тот же временной интервал (фигура 13). Как ожидалось, контрольные животные, получавшие физиологический раствор (группа 1), также демонстрировали постоянную прибавку в весе в течение всего исследования.
Поскольку сниженный вес тела является проявлением IPF и других фиброзных заболеваний легких, эти результаты показывают, что лечение ингибитором LOXL2 снижает симптомы фиброзных заболеваний в легких, таких как IPF.
Вес легких: Семь получавших блеомицин животных, выбранных из групп 2 и 3, были забиты в течение 24-48 часов на 7-й день после введения антител. Этих животных обозначили образец "Harvest Rx". Легкие этих животных имели средний вес 239.5 мг.Для сравнения контрольных животных (группа 1, обработанная физиологическим раствором), забитых на 22 день, имели средний вес 186.4 мг.В конце периода обработки (то есть на 22-й день), средний вес легких животных, обработанных блеомицином, которые получали инъекции контрольного антитела АС-1 (группа 2), увеличился со значения у Harvest Rx, равного 239.5 мг до среднего значения 322.7 мг, в то время как средний вес легких животных обработанных блеомицином, которые получали инъекции контрольного антитела (группа 2), АВ0023 анти-LOXL2 антитела (группа 3) увеличился лишь незначительно по сравнению с величиной Harvest Rx до 248.2 мг. Эти данные показаны на фигуре 14. Таким образом, ингибитор LOXL2 предотвращал увеличение веса легких, вызванное обработкой блеомицином.
Поскольку увеличение веса легких является проявлением IPF и других фиброзных заболеваний легких, эти результаты показывают, что лечение ингибитором LOXL2 снижает симптомы фиброзных заболеваний легких, таких как IPF.
Структура легких: Иммуногистохимический анализ показал, что в легких животных, получавших блеомицин, была индуцирована фиброзная реакция грызунов (фигура 15). Повреждение легких, включающее утолщение альвеол, присутствие фиброзных центров и ячеистых легких. Лечение aнти-LOXL2 антителом уменьшало и вызывала реверсию этого повреждения, восстанавливая близкую к нормальной структуре легких у животных, получавших блеомицин (например, фигура 15, нижняя панель).
Показатель Ашкрофта: Повреждение легких оценивали также с помощью руководства по использованию показателей Ашкрофта (Ashcroft et al., supra) (См. фигуру 16). Оценку выполняли лица, не информированные о характере исследуемой группы. Легкие животных в получавшей физиологический раствор контрольной группе (группа 1) имела показатель Ашкрофта <1. В начале лечения (Harvest Rx), легкие обработанных блеомицином животных имели средний показатель Ашкрофта 4.23. На 22 день легкие блеомицин-обработанных животных, которые получали инъекции АС-1 (группа 2) демонстрировали признаки тяжелого заболевания с множественными случаями очаговой ячеистости легких (Фигура 15, средняя панель), и имеют показатель Ашкрофта 5.33. Легкие животных, обработанных блеомицином, которые получали инъекции АВ0023 (группа 3) имели средний показатель Ашкрофта 3.13 (фигура 16). Таким образом, лечение АВ0023 не только существенно ингибирует прогрессирование фиброза по сравнению с обработкой АС-1 (р<0.027, фигура 16), но оно также вызывают реверсию характерных повреждений в легких, выделенных из животных в начале лечения. Гистологические признаки легких у животных, леченых АВ0023 на 22 день (фигура 15, нижняя панель) были подобны таковым у животных, получавших физиологический раствор, кроме небольшого увеличения числа пневмоцитов типа II; показатели Ашкрофта отражают это наблюдение.
Иммуногистохимия Легкие контрольных и леченых антителами животных проверяли на иммунореактивность альфа-актина из гладких мышц (α-SMA) (признак активированных фибробластов); и на иммунореактивность LOXL2. Эти анализы выполненные на легких, выделенных на 22-й день, демонстрируют статистически достоверное уменьшение концентрации α-SMA levels (фигура 17), и активности LOXL2 (фигура 18), в легких от животных, леченых АВ0023, (группа 3), по сравнению с легкими животных, получавших АС-1 (группа 2). К тому же образцы Harvest Rx от получавших блеомицин животных демонстрировали значительную активацию фибробластов (о чем свидетельствует увеличение α-SMA-положительных клеток по сравнению с нормальными легкими), которое реверсировало на 22-й день в образцах от животных, леченых АВ0023 (фигура 17).
IHC анализы показали также, что экспрессия LOXL2 соответствует площадям фибробластных участков в легких, исследованных в начале лечения (образец Harvest Rx), и в легких животных, получавших АС-1. К тому же, образцы Harvest Rx от получавших блеомицин животных демонстрировали значительные отложения коллагена (о чем свидетельствует увеличение сигнала LOXL2 по сравнению с контрольными образцами от животных, получавших физиологический раствор), которые реверсировали на 22-й день в образцах от животных, леченых АВ0023 (Figure 18).
Эти данные показывают, что LOXL2 играет важную роль в индуцировании и поддерживании фиброза легких, и что ингибиторы LOXL2 (такие как, например, анти-LOXL2 антитела) не только уменьшают, но также и вызывают реверсию повреждения в легких, благодаря в том числе ингибированию активации фибробластов и отложений коллагена.
Морфология эпителия: Анализы окрашенных Н&Е срезов при большом увеличении демонстрируют, что введение АВ0023 животным, получавшим блеомицин, уменьшает фиброз в стенках альвеол и вызывают реверсию экспансии пневмоцитов, которое сопровождает индуцированный блеомицином фиброз.
Содержание коллагена: Легкие контрольных леченых антителом животных окрашивали Сириусом красным, и окрашенные срезы анализировали в поляризованном свете. В этих условиях степень окрашивания отражает концентрацию фибриллярного поперечно-сшитого коллагена. Результаты этих анализов демонстрировали увеличение концентрации фибриллярного поперечно-сшитого коллагена у животных, получавших блеомицин, вскоре после начала лечения антителом (образец Harvest Rx), и статистически достоверное снижение концентрации поперечно-сшитого коллагена (то есть реверсию фиброза) в срезах легких животных, получавших блеомицин, которые получали также инъекции АВ0023, по сравнению с животными, получавшими блеомицин и инъекции АС-1 (фигура 19).
Окрашивание Трихромом Мэссона (другой коллаген-специфичный реагент) подтверждало снижение отложения коллагена в леченых АВ0023 фиброзных легких по сравнению с фиброзными легкими животных, получавших АС-1, давая дополнительное подтверждение реверсии фиброзного повреждения при лечении АВ0023.
Выводы
Лечение ингибитором LOXL2 (то есть анти-LOXL2 антителом АВ0023) в индуцированной блеомицином модели установившегося фиброза легких приводило к значительному уменьшению фиброза и снижению числа активированных фибробластов, и нормализации структуры легких веса легких и веса тела. Кроме того уменьшение активированных фибробластов и уменьшение активности самой LOXL2, сопровождающие лечение АВ0023, способствовали реверсии симптомов фиброза, восстановлению и защите легочного эпителия.
Реферат
Предложенная группа изобретений относится к области медицины. Предложены способы предотвращения, лечения или реверсии симптомов фиброзного заболевания легких у субъекта, включающие введение субъекту изолированного антитела против лизилоксидазоподобного белка 2 (LOXL2), которое специфически связывается с белком LOXL2 и/или ингибирует активность белка LOXL2, тем самым предотвращая, излечивая или вызывая реверсию симптомов фиброзного заболевания легких, где симптомом является увеличение числа лейкоцитов в легких у субъекта. Предложена фармацевтическая композиция, содержащая изолированное анти-LOXL2 антитело и фармацевтически приемлемый наполнитель. Предложенная группа изобретений обеспечивает эффективные средства и методы для предотвращения, лечения или реверсии симптомов фиброзного заболевания легких у субъекта. 3 н. и 6 з.п. ф-лы, 19 ил., 2 табл., 3 пр.
Формула
где симптомом является увеличение числа лейкоцитов в легких у субъекта.
где симптомом является увеличение числа лейкоцитов в легких у субъекта.
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 1, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 2; или
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 3, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 4.
где симптомом является увеличение числа лейкоцитов в легких у субъекта.

Комментарии