Иммуноконъюгаты направленного действия - RU2583876C2
Код документа: RU2583876C2
Чертежи


























































































































































































































































































































Описание
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к антигенспецифическим иммуноконъюгатам, предназначенным для избирательного переноса обладающих эффекторной функцией фрагментов (эффекторных фрагментов), которые оказывают влияние на клеточную активность. Кроме того, настоящее изобретение относится к молекулам нуклеиновых кислот, кодирующим указанные иммуноконъюгаты, и векторам и клеткам-хозяевам, которые содержат указанные молекулы нуклеиновых кислот. Изобретение относится также к способам получения иммуноконъюгатов, предлагаемых в изобретении, и способам применения указанных конъюгатов для лечения заболевания.
Известный уровень техники
В различных клинических ситуациях часто требуется деструкция индивидуальной клетки или конкретного типа клеток. Например, основной задачей при терапии рака является специфическое разрушение опухолевых клеток с сохранением при этом в интактном и неповрежденном состоянии здоровых клеток и тканей. С выживаемостью и/или гибелью клеток связано множество путей трансдукции сигналов в клетке. Таким образом, для оказания влияния на поддержание клетки или ее деструкцию можно применять непосредственное введение связанного с указанным путем фактора, который участвует в обеспечении выживаемости или гибели клеток.
Цитокины представляют собой молекулы, обеспечивающие передачу клеточных сигналов, которые принимают участие в регуляции иммунной системы. При применении в терапии рака цитокины могут действовать в качестве иммуномодуляторов, которые обладают противоопухолевой активностью и которые могут повышать иммуногенность некоторых типов опухолей. Однако быстрый клиренс из крови и отсутствие специфичности для опухоли обусловливают необходимость системного введения высоких доз цитокинов для достижения достаточной для активации иммунного ответа или противоопухолевого действия концентрации цитокина в области локализации опухоли. Такие высокие уровни обладающих системным действием цитокинов могут приводить к проявлению серьезной токсичности и нежелательных реакций.
Одним из путей введения in vivo фактора пути трансдукции сигнала, такого как цитокин, в конкретную область (например, опухоль или микроокружение опухоли) является конъюгация фактора с иммуноглобулином, специфическим для указанной области. Осуществляемые ранее стратегии, целью которых было введение факторов путей трансдукции сигналов, таких как цитокины, в конкретную область in vivo, предусматривали применение тяжелых цепей иммуноглобулинов, конъюгированных с различными цитокинами, такими как лимфотоксин, фактор некроза опухоли-α (TNF-α), интерлейкин-2 (IL-2) и колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF). Тяжелые цепи иммуноглобулинов либо конъюгировали с цитокином химически, либо конъюгат иммуноглобулин-цитокин экспрессировали в виде слитого белка (см. Nakamwa К. и Kubo A., Cancer Supplement 80, 1997, cc.2650-2655; Jun L-и др., Chin. Med. J. 113, 2000, cc.151-153 (2000) и Becker J.C. и др., Proc. Natl. Acad. Sci. USA 93, 1996, cc.7826-7831). Исследователи обнаружили, что они не только обладали способностью обеспечивать направленный перенос цитокинов к специфическим областями in vivo, но и обладали преимуществом, связанным с тем, что моноклональные антитела имели более продолжительное время полужизни в сыворотке, чем большая часть других белков. Из-за системной токсичности, ассоциированной с высокими дозами определенных неконъюгированных цитокинов, а именно IL-2, возможность применения слитого белка иммуноглобулин-цитокин в более низких дозах, обеспечивающих максимальное повышение иммуностимулирующее действие при поддержании системных побочных действий на минимальном уровне, позволила исследователям высказать предположение о том, что иммуноконъюгаты иммуноглобулин-цитокин являются оптимальными терапевтическими средствами. Однако одним из основных ограничений клинического применения иммуноглобулинов в качестве обеспечивающих введение агентов является их неудовлетворительное поглощение и плохое распределение в опухолях, что обусловлено, прежде всего, крупным размером молекулы иммуноглобулина (см. Xiang J. и др., Immunol. Cell Biol. 72, 1994, cc.275-285). Кроме того, высказано предположение о том, что иммуноконъюгаты иммуноглобулин-цитокин могут активировать комплемент и взаимодействовать с Fc-рецепторами. Это присущее иммуноглобулину свойство рассматривалось как нежелательное, поскольку мишенью терапевтических иммуноконъюгатов могут быть клетки, экспрессирующие Fc-рецепторы, а не целевые несущие антиген клетки.
Один из подходов, позволяющих преодолевать эти проблемы, состоит в применении сконструированных фрагментов иммуноглобулина. В многочисленных исследованиях подробно описаны характеристики иммуноконъюгатов, представляющих собой фрагмент иммуноглобулина-цитокин (см. Savage Р. и др., Br.J.Cancer 67, 1993, cc.304-310; Harvill E.T. и Morrison S.L., Immunotechnol. 1, 1995, cc.95-105 и Yang J. и др., Mol. Immunol. 32, 1995, cc.873-881). В целом, известны две общепринятые конструкции слитых белков, представляющих собой фрагмент иммуноглобулина-цитокин, такие как F(аb')2-цитокин, экспрессия которого происходит в клетках млекопитающих, и scFv-цитокин экспрессия которого происходи в клетках Escherichia coli (см., Xiang J., Hum. Antibodies 9, 1999, cc.23-36). У большинства типов таких иммуноконъюгатов сохраняются, как способность связываться с опухолью, так и функциональная активность цитокина. Опубликованные в последние годы исследования продемонстрировали, что эти слитые белки обладают способностью обеспечивать in vivo направленный перенос цитокинов к опухолям, которые экспрессируют ассоциированный с опухолью антиген, и ингибировать как первичные, так и метастатические опухоли при оценке на созданной на иммунокомпетентных животных модели.
Примерами иммунокоъюгатов, включающих фрагмент иммуноглобулина-цитокин, являются иммуноконъюгат scFv-IL-2, описанный в публикации РСТ WO 2001/062298 А2; иммуноконъюгат, включающий фрагмент тяжелой цепи иммуноглобулина-GM-CSF, который описан в US 565050; иммуноконъюгат, описанный в РСТ-публикации WO 2006/119897 А2, в котором первая субъединица (scFv) конъюгата scFv-IL-12 соединена только дисульфидным(ими) мостиком(ами) с второй субъединицей (IL-12), и иммуноконъюгат, описанный в РСТ-публикации WO 99/29732 А2, в котором первая субъединица (фрагмент тяжелой цепи Ig) конъюгата фрагмент тяжелой цепи Ig-IL-12 соединена только дисульфидным(ими) мостиком(ами) с второй субъединицей (IL-12). Хотя эти иммуноконъюгаты второго поколения обладают некоторыми улучшенными свойствами по сравнению с иммуноконъюгатами первого поколения, которые содержат иммуноглобулин-цитокин, требуется разработка более специфических и даже более безопасных терапевтических агентов, обладающих более высокой эффективностью в отношении опухолевых клеток и пониженным количеством случаев возникновения и серьезностью побочных действий, свойственных этим продуктам (например, токсичность, деструкция неопухолевых клеток и т.д.). Кроме того, требуется идентифицировать пути дальнейшей стабилизации иммуноконъюгатов с сохранением приемлемых уровней терапевтической активности.
В настоящем изобретении предложены иммуноконъюгаты, обладающие повышенной эффективностью, высокой специфичностью действия, пониженной токсичностью и улучшенной стабильностью в крови по сравнению с известными иммуноконъюгатами.
Краткое изложение сущности изобретения
Одним из объектов настоящего изобретения являются иммуноконъюгаты, обладающие повышенной эффективностью, высокой специфичностью действия, пониженной токсичностью и улучшенной стабильностью по сравнению с известными иммуноконъюгатами. Иммуноконъюгаты, предлагаемые в настоящем изобретении, можно применять для избирательного введения эффекторных фрагментов в область-мишень. Согласно другому варианту осуществления изобретения иммуноконъюгат обеспечивает введение цитокина в область-мишень, при этом цитокин может обладать локализованным биологическим действием, таким как локальный воспалительный ответ, стимуляция роста и активации Т-клеток и/или активация В- и/или NK-клеток.
Одним из объектов настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый эффекторный фрагмент и по меньшей мере первый и второй антигенсвязывающие фрагменты, независимо друг от друга выбранные из группы, включающей Fv и Fab, при этом первый эффекторный фрагмент связан с помощью амино- или карбоксиконцевой пептидной связи с первым антигенсвязывающим фрагментом, а второй антигенсвязывающий фрагмент связан с помощью амино- или карбоксиконцевой пептидной связи либо с I) первым эффекторным фрагментом, либо с II) первым антигенсвязывающим фрагментом.
Следующим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент, сцепленный на его аминоконцевой аминокислоте с одной или несколькими scFv-молекулами, и в котором первый одноцепочечный эффекторный фрагмент сцеплен на его карбоксиконцевых аминокислотах с одной или несколькими scFv-молекулами.
Другим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент и первый и второй антигенсвязывающие фрагменты, в котором первый и второй антигенсвязывающие фрагменты содержат scFv-молекулу, сцепленную на ее карбоксиконцевой кислоте с константной областью, которая содержит константную область иммуноглобулина, независимо выбранную из группы, включающей: СН1 IgG, Скаппа IgG и СН4 IgE, и первый антигенсвязывающий фрагмент сцеплен на карбоксиконцевой аминокислоте его константной области с аминоконцевой аминокислотой одного из эффекторных фрагментов, и первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Следующим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент и первый и второй антигенсвязывающие фрагменты, в котором и первый и второй антигенсвязывающие фрагменты содержат scFv-молекулу, сцепленную на ее карбоксиконцевой аминокислоте с СН3-доменом IgG1, и в котором первый антигенсвязывающий фрагмент сцеплен на его карбоксиконцевой аминокислоте с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Другим объектом настоящего изобретения является иммуноконъюгат, который содержит первый и второй одноцепочечные эффекторные фрагменты и первый и второй антигенсвязывающие фрагменты, в котором каждый из антигенсвязывающих фрагментов содержит Fab-молекулу, сцепленную на карбоксиконцевой аминокислоте ее тяжелой или легкой цепи с СН3-доменом IgG1, и в котором каждый из СН3-доменов IgG1 сцеплен на его карбоксиконцевой аминокислоте с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 95. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 104. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 105. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 106. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 107. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 96. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 96 и полипептидную последовательность, выбранную из группы, включающей SEQ ID NO: 95 и 104-107. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептид, последовательность которого идентична по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности, выбранной из группы, включающей SEQ ID NO: 95, 96 и 104-107.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 108. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 108. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 117. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 117. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 118. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 118. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 119. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 119. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 120. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 120. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 109. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 109.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит вариабельную область тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 13, либо последовательности SEQ ID NO: 15. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 9, либо последовательности SEQ ID NO: 11. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 13, либо последовательности SEQ ID NO: 15, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 9, либо последовательности SEQ ID NO: 11.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 14, либо последовательности SEQ ID NO: 16. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 14, либо SEQ ID NO: 16. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 10, либо последовательности SEQ ID NO: 12. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 10, либо SEQ ID NO: 12.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 99. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 100, либо последовательности SEQ ID NO: 215. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 101, либо последовательности SEQ ID NO: 235. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 100, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 101. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 215, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 235.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 112. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 112. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 113, либо SEQ ID NO: 216. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 113, либо SEQ ID NO: 216. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO; 114, либо SEQ ID NO: 236. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 114, либо SEQ ID NO: 236.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID N0:195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 177,SEQ ID NO: 181, SEQ ID NO:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO:195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 177. SEQ ID NO: 181, SEQ ID NO:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243. Согласно другому варианту осуществления изобретения конъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO: 249. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO: 249.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей; SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171 и SEQ ID NO: 175. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO: 173. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171 и SEQ ID NO: 175, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO:173.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162, SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162, SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 211, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 219, SEQ ID NO: 221, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 229, SEQ ID NO: 231, SEQ ID NO: 233 и SEQ ID NO: 237. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 211, SEQ ID NO: 219 и SEQ ID NO: 221, полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 231. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 229. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 213, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 233. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 217, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 237.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222, SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222, SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 257, либо последовательности SEQ ID NO: 261. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 259, либо последовательности SEQ ID NO: 271. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 257, либо последовательности SEQ ID NO: 261, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 259, либо последовательности SEQ ID NO: 271.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 258, либо последовательности SEQ ID NO: 262. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью SEQ ID NO: 258 или SEQ ID NO: 262. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 260, либо последовательности SEQ ID NO: 272. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью SEQ ID NO: 260 или SEQ ID NO: 272.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 251, либо последовательности SEQ ID NO: 255. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 253, либо последовательности SEQ ID NO: 265. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 251, либо последовательности SEQ ID NO: 255, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 253, либо последовательности SEQ ID NO: 265.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%. 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 252, либо последовательности SEQ ID NO: 256. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 252 или SEQ ID NO: 256. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 254, либо последовательности SEQ ID NO: 266. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 254 или SEQ ID NO: 266.
Согласно другому варианту осуществления изобретения иммуноконъюгат содержит по меньшей мере один эффекторный фрагмент, где эффекторный фрагмент представляет собой цитокин. В конкретном варианте осуществления изобретения эффекторный фрагмент представляет собой цитокин, выбранный из группы, включающей: интерлейкин-2 (IL-2), колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), интерферон-α (INF-α), интерлейкин-12 (IL-12), интерлейкин-8 (IL-8), воспалительный белок макрофагов-1α (МIР-1α), воспалительный белок макрофагов-1β (MIP-1β) и трансформирующий фактор роста-β (TGF-β). Согласно другому варианту осуществления изобретения по меньшей мере один антигенсвязывающий фрагмент является специфическим по меньшей мере в отношении одной из следующих антигенных детерминант: внеклеточный домен В фибронектина (EDB), А1-домен тенасцина (TNC-A1), А2-домен тенасцина (TNC-A2), белок активации фибробластов (FAP) и меланомный хондроитин-сульфатный протеогликан (MCSP).
Согласно другому варианту осуществления изобретения связывание иммуноконъюгата, предлагаемого в изобретении, с рецептором эффекторного фрагмента характеризуется значением константы диссоциации (КD), превышающим по меньшей мере примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или 10 раз константу диссоциации контрольного эффекторного фрагмента. Согласно другому варианту осуществления изобретения в конце периода введения иммуноконъюгат ингибирует увеличение объема опухоли in vivo по меньшей мере примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или более. Согласно другому варианту осуществления изобретения иммуноконъюгат удлиняют продолжительность жизни млекопитающих, имеющих злокачественные опухоли, по меньшей мере примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% при его введении млекопитающему, который нуждается в этом, по сравнению с контрольным эффекторным фрагментом или эффекторным фрагментом, входящим в иммуноконъюгат, который содержит молекулу «димерного» антитела.
Следующим объектом настоящего изобретения являются выделенные полинуклеотиды, кодирующие иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты. Следующим объектом настоящего изобретения является экспрессионный вектор, содержащий экспрессионную кассету, которая содержит полинуклеотидные последовательности, предлагаемые в изобретении.
Следующим объектом настоящего изобретения являются клетки-хозяева, который экспрессируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты.
Другим объектом настоящего изобретения являются способы получения иммуноконъюгатов, предлагаемых в изобретении, или их фрагментов, заключающиеся в том, что культивируют клетки-хозяева, трансформированные экспрессионными векторами, которые кодируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты, в условиях, пригодных для их экспрессии.
Другим объектом настоящего изобретения являются способы усиления пролиферации и дифференцировки активированных Т-лимфоцитов, заключающиеся в том, что приводят в контакт активированный Т-лимфоцит с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы усиления пролиферации и дифференцировки активированных В-лимфоцитов, заключающиеся в том, что приводят в контакт активированный В-лимфоцит с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы усиления пролиферации и дифференцировки естественных клеток-киллеров (NK), заключающиеся в том, что приводят в контакт NK-клетку с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы усиления пролиферации и дифференцировки гранулоцита, моноцита или дендритной клетки, заключающиеся в том, что приводят в контакт гранулоцит, моноцит или дендритную клетку с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы усиления дифференцировки цитотоксических Т-лимфоцитов (CTL), заключающиеся в том, что приводят в контакт Т-лимфоцит с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы ингибирования репликации вирусов, заключающиеся в том, что приводят в контакт инфицированную вирусом клетку с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы повышающей регуляции экспрессии главного комплекса гистосовместимости I (ГКС I), заключающиеся в том, что приводят в контакт клетку-мишень с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы индукции клеточной гибели, заключающиеся в том, что приводят в контакт клетку-мишень с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении.
Другим объектом настоящего изобретения являются способы индукции хемотаксиса клетки-мишени, заключающиеся в том, что приводят в контакт клетку-мишень с взятыми в эффективном количестве иммуноконъюгатами, предлагаемыми в изобретении,
Другим объектом настоящего изобретения является способ лечения заболевания у индивидуума, заключающийся в том, что вводят индивидууму в терапевтически эффективном количестве композицию, которая содержит иммуноконъюгат, предлагаемый в изобретении, и фармацевтический носитель.
Краткое описание чертежей
На чертежах показано:
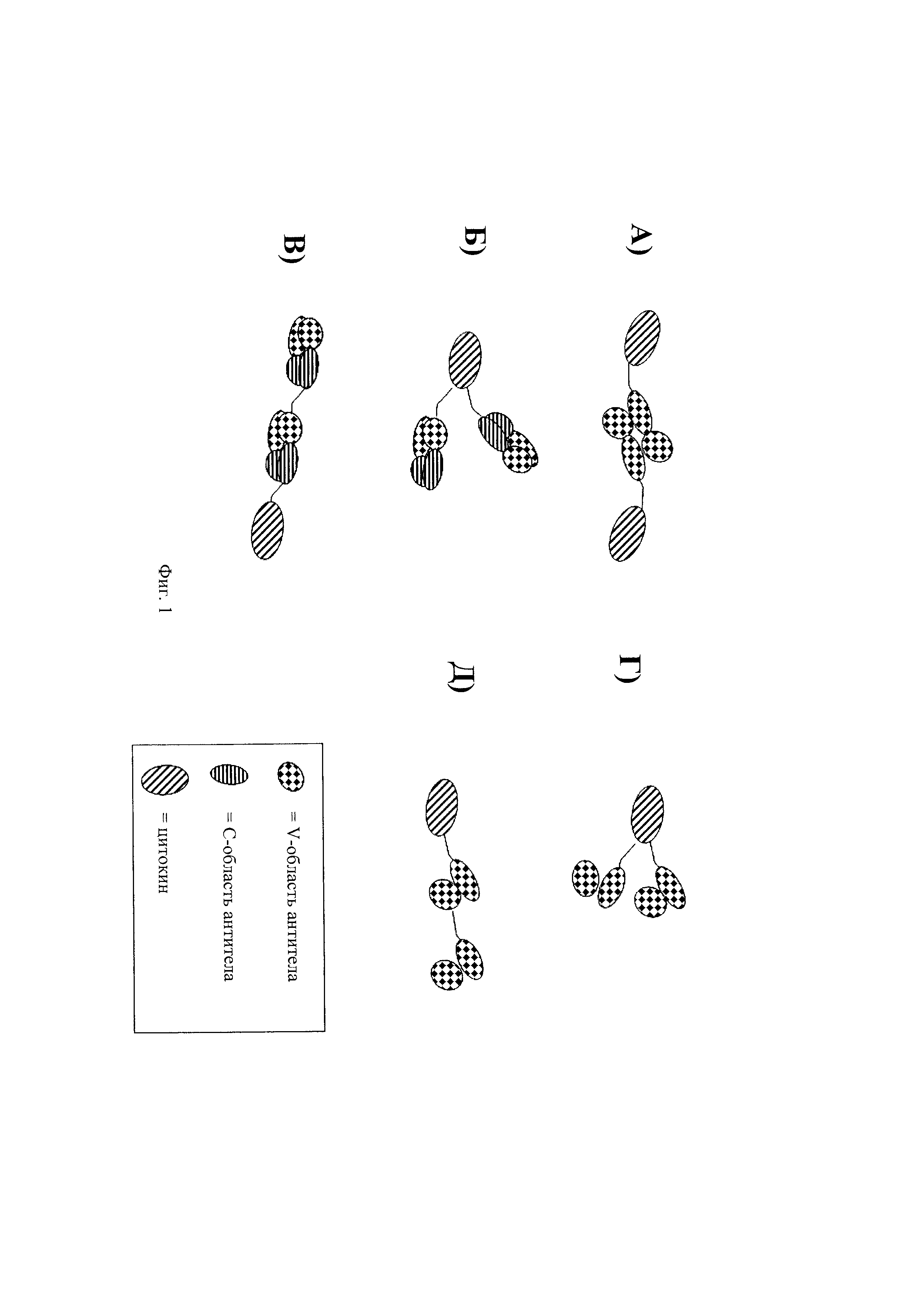
на фиг.1 - схематическое изображение различных форматов полученных путем слияния иммуноконъюгатов. Все конструкции, представленные на фиг.1, содержат два scFv-фрагмента антитела (в антигенсвязывающем фрагменте) и одну или две молекулы цитокина (в качестве эффекторных фрагментов), которая(ые) связана(ы) с ними. На панелях А-Д представлены различные варианты соединений и стехиометрических соотношений антигенсвязывающих фрагментов и эффекторных фрагментов. На панели А) представлено слияние «димерное антитело»-IL-2. В «димерном антителе» объединены с помощью нековалентной связи две идентичные полипептидные цепи. На панели Б) представлен иммуноконъюгат, содержащий тяжелую цепь Fab-молекулы, слитую на ее карбоксиконце с цитокином, который в свою очередь слит на его карбоксиконце со второй тяжелой цепью Fab. Легкую цепь совместно экспрессируют с конструкцией: полипептид тяжелой цепи Fab-цитокин-полипептид тяжелой цепи Fab с получением иммуноконъюгата. В альтернативном варианте можно сливать с цитокином две легкие цепи, и тяжелые цепи совместно экспрессировать. На панели В) представлена конструкция, в которой две тяжелые цепи Fab слиты непосредственно друг с другом. Цитокин связан посредством аминоконцевой пептидной связи с тяжелой цепью второго антигенсвязывающего фрагмента. Два молекулярных формата, которые представлены на панелях Б) и В), можно изменять таким образом, чтобы заменять Fab-цепь на scFv-фрагмент, что продемонстрировано на панелях Г) и Д);
на фиг.2 - схематическое изображение дополнительных иммуноконъюгатов, которые содержат два антигенсвязывающих фрагмента и по меньшей мере один или несколько эффекторных фрагментов. На панели А) представлена Fab-молекула, которая слита посредством ее карбоксиконца с СН3-доменом IgG. Для достижения ковалентной гомодимеризации антигенсвязывающего фрагмента можно интродуцировать искусственный дисульфидный мостик на карбоксиконец СН3-домена IgG (иммуноконъюгат справа на панели А)). СН3-домен IgG, представленный на панели А), можно заменять на СН4-домен IgE. Fab-фрагменты, представленные на панели А), можно заменять на scFv-фрагменты, представленные на панели Б). Для создания иммуноконъюгата, представленного на панели В), шарнирную область встречающего в естественных условиях IgG сливали на С-конце с Fab-молекулами. Поскольку карбоксиконцевая область шарнирной области может накладывать некоторые геометрические ограничения при сборке константных областей, которые слиты на С-конце с шарнирной областью IgG, можно интродуцировать искусственный линкер между карбоксиконцевой областью шарнирной области и аминоконцом СН3-домена IgG. Шарнирную область можно интродуцировать также между scFv-фрагментом и константной областью иммуноглобулина, что представлено на панели Г). На панелях А)-Г) СН3-домен IgG1 или СН4-домен IgE применяют для гомодимеризации конструкций. На панели Д) представлен иммуноконъюгат, в котором димеризацию обеспечивают с помощью гетеродимеризационного взаимодействия CH1/Скаппа. Иммуноконъюгат, представленный на панели Г), может содержать один или два цитокина в одном иммуноконъюгате;
на фиг.3 - результаты эксперимента по оценке эффективности двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических в отношении стромы опухоли. Тератокарциному линии F9 инъецировали подкожно мышам линии 129SvEv и размер опухолей определяли с помощью кронциркуля. Эффективность молекулы, содержащей «димерное антитело»-IL-2, сравнивали в двух различных концентрациях с иммуноконъюгатом Fаb-интерлейкин-2-Fab (Fab-IL2-Fab), где концентрации соответствовали одинаковому количеству молекул иммуноконъюгатов. На фиг.3 иммуноконъюгат Fab-IL2-Fab обозначали как «Fab-L19», применяемый в качестве контроля неконъюгированный интерлейкин-2 обозначали как «Unconj rIL-2», молекулу «димерное антитело»-IL-2 обозначали как «димерное антитело». Антитело L19 к внеклеточному домену В фибронектина (EDB) применяли для создания антигенсвязывающих фрагментов в иммуноконъюгатах, содержащих как димерное антитело, так и Fab-L19. Количество иммуноконъюгатата, которое инъецировали одной мыши (в мкг), представлено в описании чертежа;
на фиг.4 - результаты по оценке выживаемости при применении двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических в отношении стромы опухоли. Человеческую клеточную линию опухоли желудка LS174T инъецировали в селезенку мышей с тяжелым комбинированным иммунодефицитом (SCID) с врожденным отсутствием естественных клеток-киллеров. На фиг.4 иммуноконъюгат Fab-IL2-Fab обозначали как «Fab-L19», применяемый в качестве контроля неконъюгированный интерлейкин-2 обозначали как «Unconj rIL-2», молекулу «димерное антитело»-IL-2 обозначали как «димерное антитело». Антитело к EDB L19 применяли для создания антигенсвязывающих фрагментов в иммуноконъюгатах, содержащих как димерное антитело, так и Fab-L19. Количество иммуноконъюгатата, которое инъецировали одной мыши (в мкг), представлено в описании чертежа, и оно соответствует одинаковому количеству молекул иммуноконъюгатов;
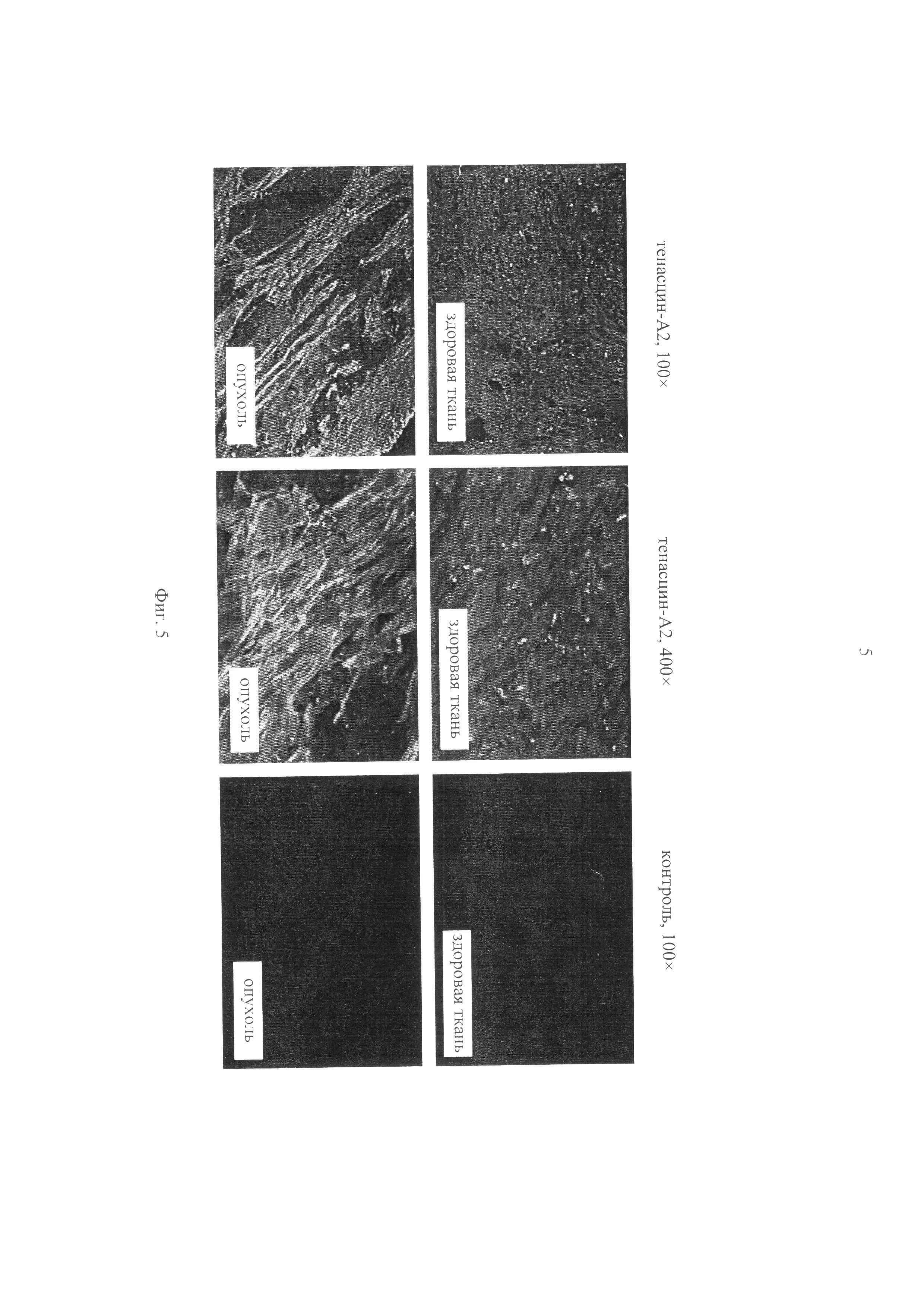
на фиг.5 - полученные с помощью иммуногистохимии изображения ткани человеческой матки при 100-кратном и 400-кратном увеличении. Вариабельная область клона 2B10, созданная с помощью метода, описанного в примере 3, связывается с А2-доменом человеческого тенасцина (TNC-A2). Вариабельную область Fab-фрагмента 2B10 сливали с FLAG-фрагментом (SHD2B10-FLAG). Образцы ткани человеческой здоровой и имеющей злокачественные опухоли матки подготавливали для иммуногистохимического окрашивания. Затем образцы инкубировали с SHD2B10-FLAG-Fab-фрагментом. После этого образцы отмывали и инкубировали с флуоресцентным антителом, специфическим для эпитопа FLAG. В имеющих злокачественные опухоли образцах ткани обнаружены повышенные уровни экспрессии TNC-A2 по сравнению со здоровыми образцами ткани:
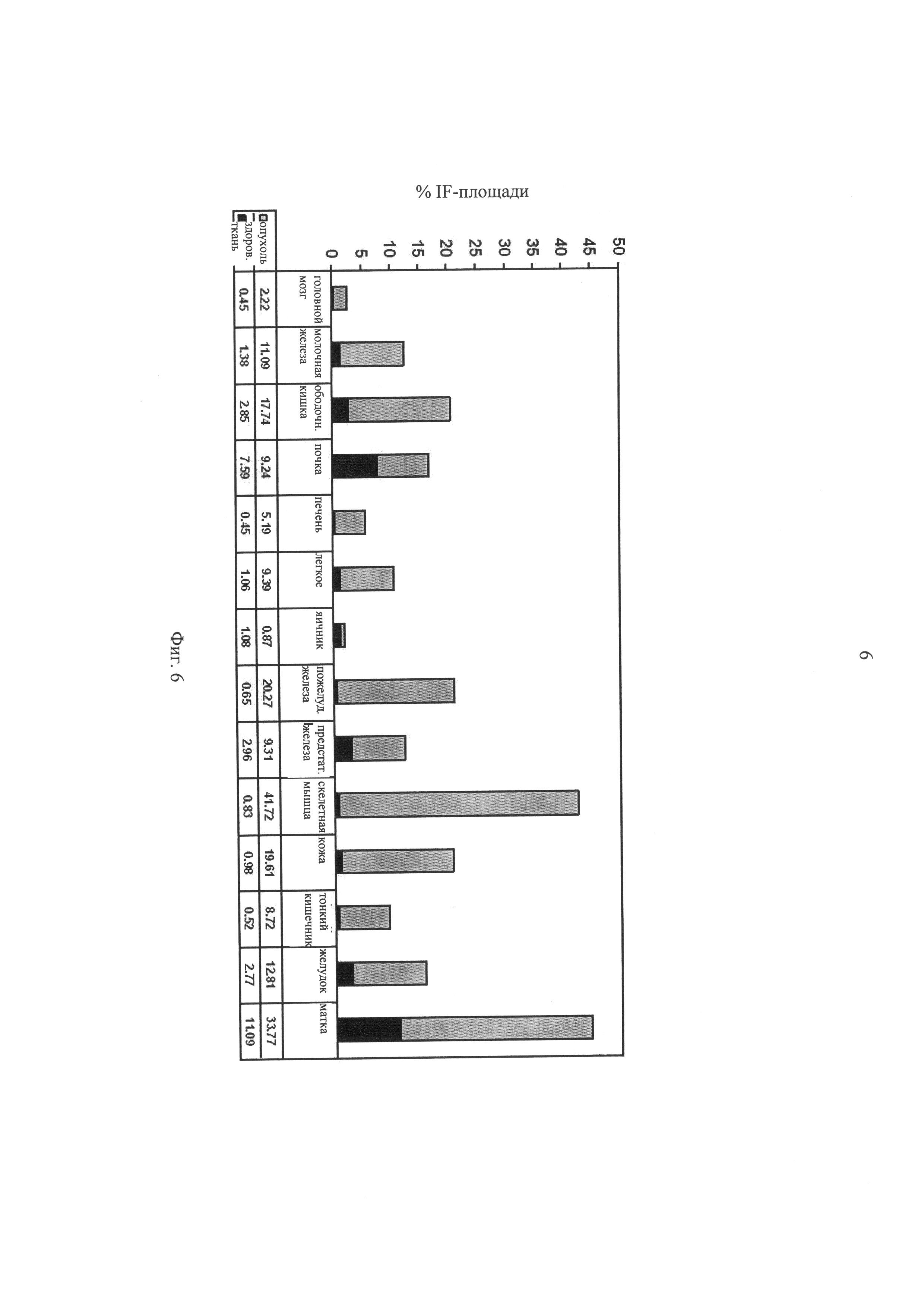
на фиг.6 - уровни экспрессии TNC-A2 в различных образцах человеческих тканей, выраженные в виде % площади иммунофлуоресцентной поверхности (% IF-площади). Различные образцы человеческой ткани, полученные из организма здоровых добровольцев и страдающих раком пациентов, инкубировали с SHD2B10-FLAG-Fab-фрагментом, представленным на фиг.5;
на фиг.7 - уровни экспрессии белка активации фибробластов (FAP) в различных образцах человеческих тканей, выраженные в виде % площади иммунофлуоресцентной поверхности. Различные образцы человеческой ткани, полученные из организма здоровых добровольцев и страдающих раком пациентов, инкубировали с поступающим в продажу антителом к FAP (фирма Abcam). Верхняя часть каждого столбика на графике соответствует экспрессии FAP в опухоли, а нижняя часть каждого столбика соответствует уровню экспрессии FAP в здоровой ткани;
на фиг.8 - данные BIACORE-анализа, касающиеся аффинности к EDB известного антитела IgG-типа, т.е. L19;
на фиг.9 - данные BIACORE-анализа, касающиеся аффинности специфического для EDB иммуноконъюгата Fab-IL-2-Fab. Fab-фрагменты, входящие в иммунокоъюгат, выводили из антитела L19;
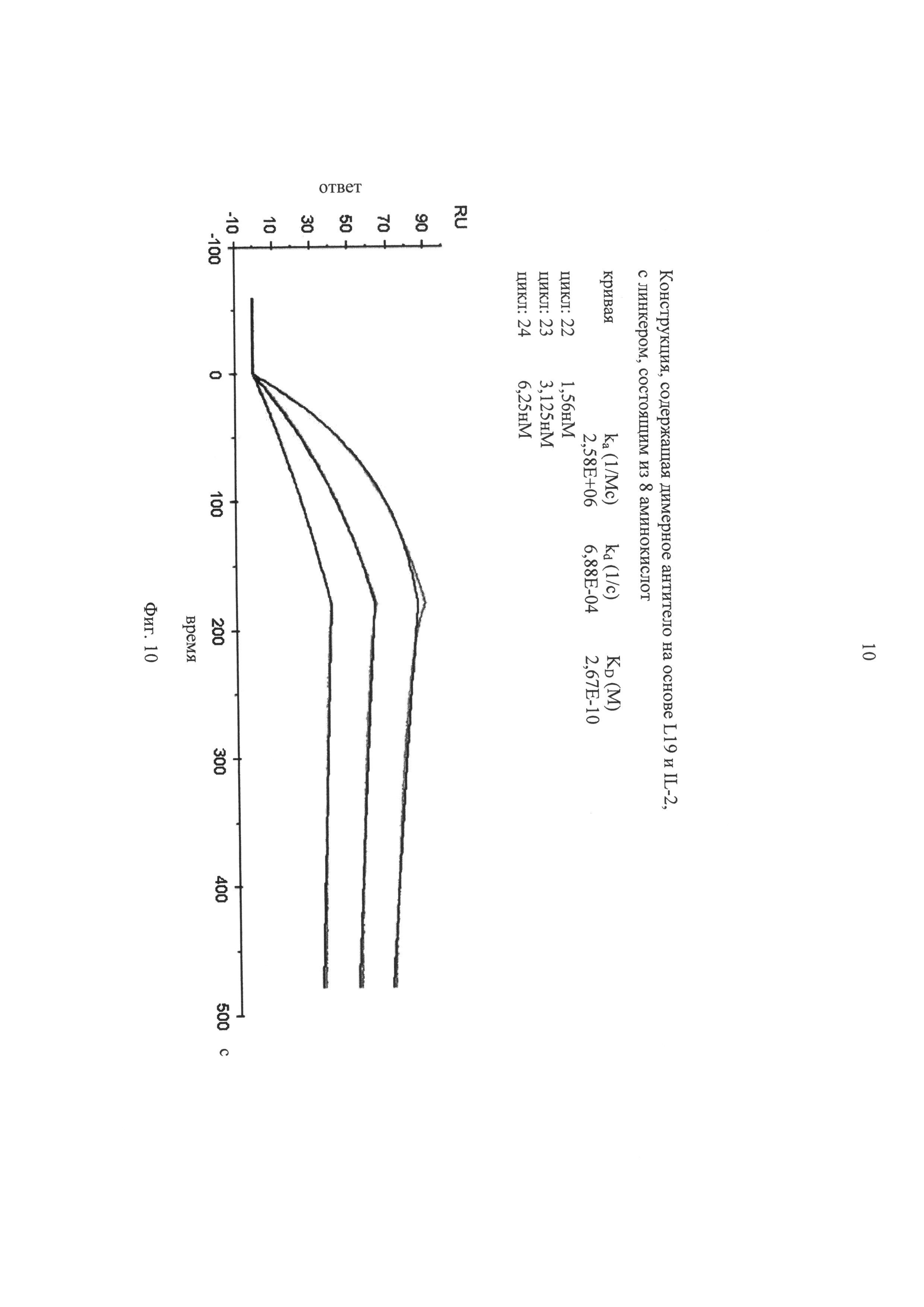
на фиг.10 - данные BIACORE-анализа, касающиеся аффинности специфического для EDB слитого белка «димерное антитело»-IL2. scFv-фрагмент «димерного антитела» выводили из антитела L19. Слитый белок «димерное антитело»-IL2 включает состоящий из 8 аминокислот линкер, локализованный между scFv-фрагментом и молекулой IL-2;
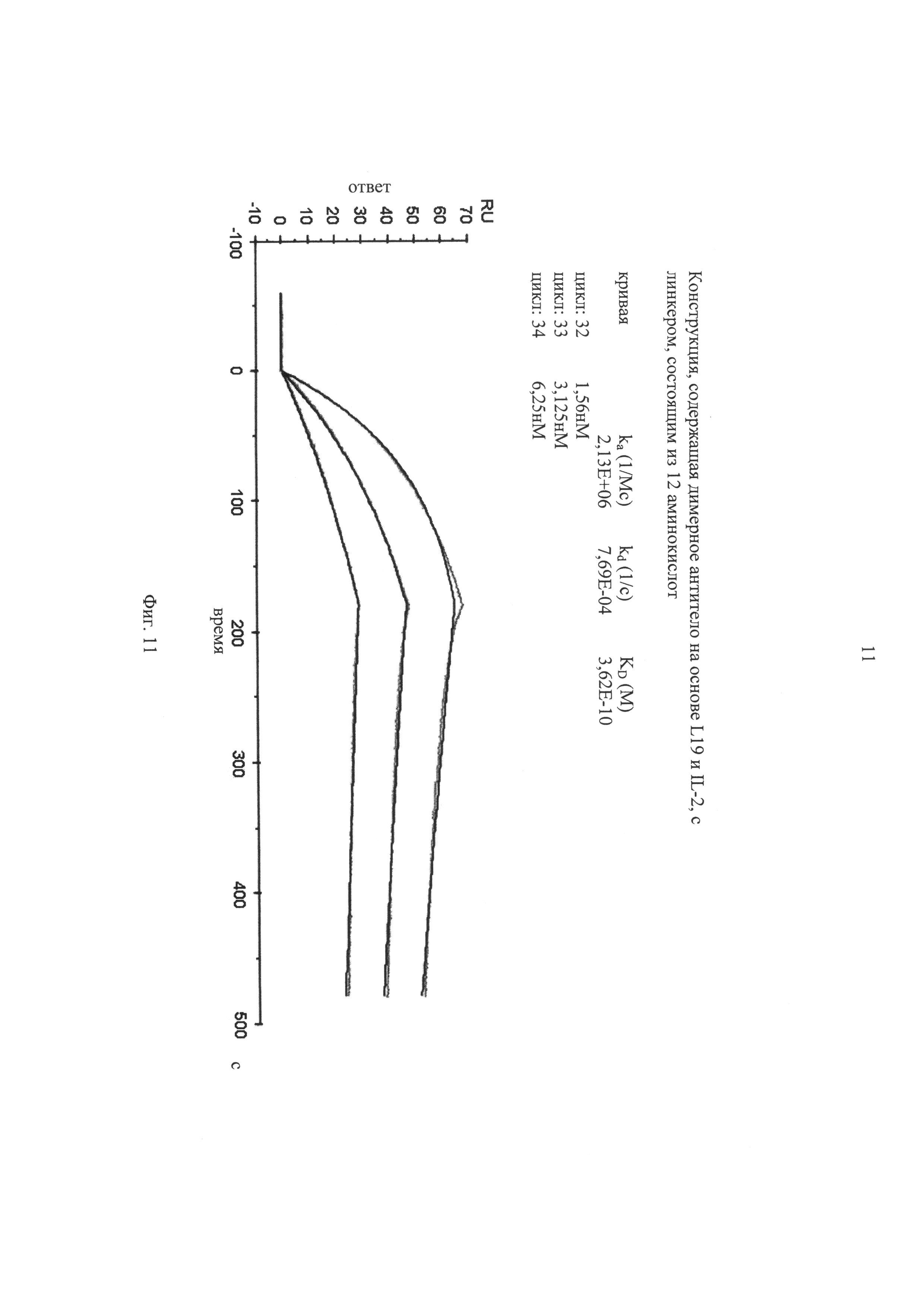
на фиг.11 - данные BIACORE-анализа, касающиеся аффинности специфического для EDB слитого белка «димерное антитело»-IL2. scFv-фрагмент «димерного антитела» вывод или из антитела L19. Слитый белок «димерное антитело»-IL2 включает состоящий из 12 аминокислот линкер, локализованный между scFv-фрагментом и молекулой IL-2;
на фиг.12 - данные BIACORE-анализа, касающиеся аффинности известного антитела IgG-типа F16 к иммобилизованному домену А1 тенасцина (TNC-A1). На фиг.12 представлены также данные BIACORE-анализа, касающиеся аффинности Fab-фрагмента антитела F16 к TNC-A1. На чертеже показаны значения констант диссоциации (КD), рассчитанные для F16 в виде IgG и в виде Fab-молекул;
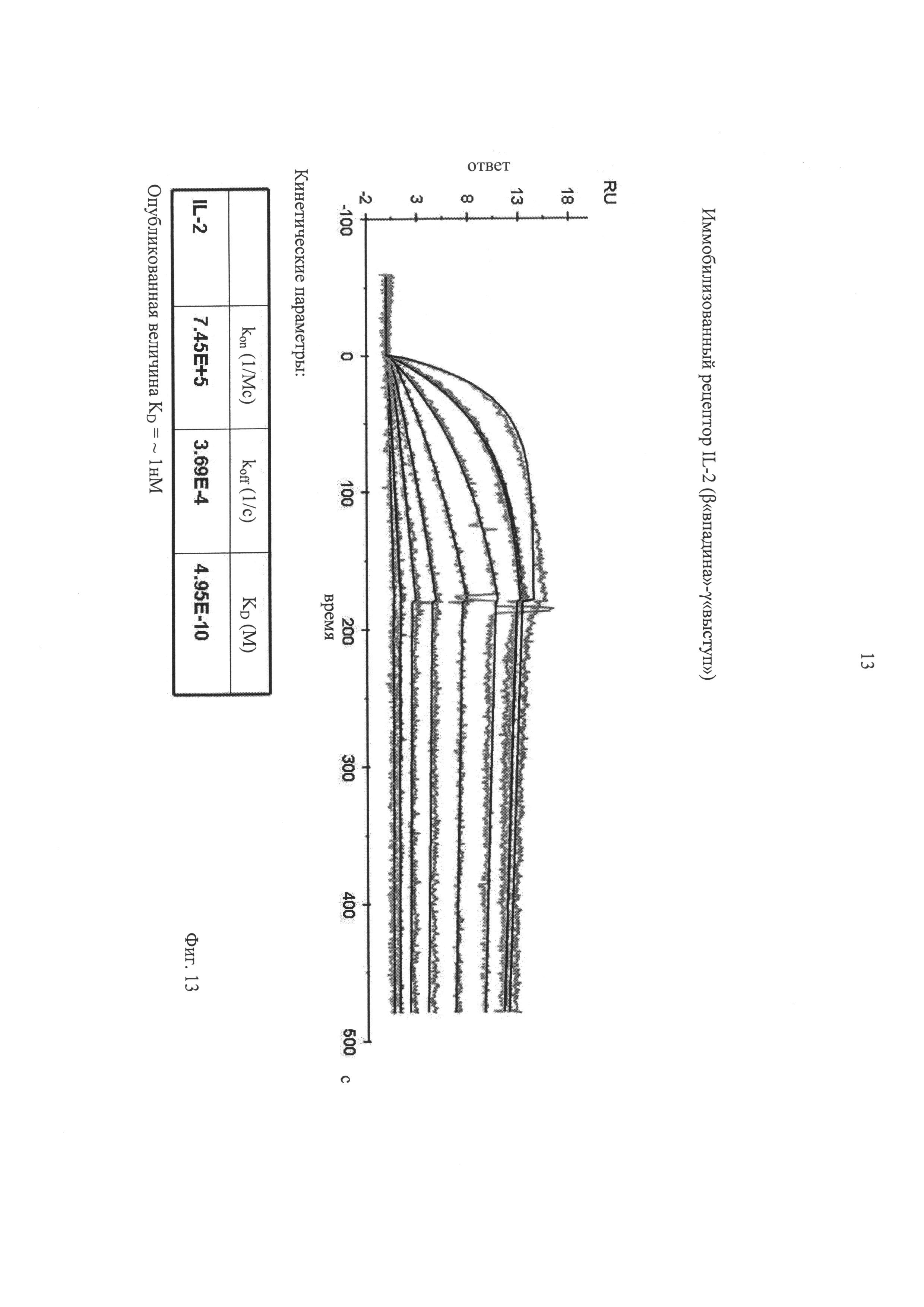
на фиг.13 - данные BIACORE-анализа, касающиеся аффинности IL-2 к иммобилизованному рецептору IL-2. Для гетеродимеризации β- и γ-цепей IL-2R осуществляли слияние соответствующих цепей с вариантами, полученными с помощью технологии «knob-into-holes» (взаимодействие по типу выступ-впадина) Fc-области человеческого IgG1, которая описана у Merchant A.M. и др., Nat. Biotech. 16, 1998, cc.677-681. На чертеже показаны значения Ко, рассчитанные на основе данных, полученных с помощью BIACORE-анализа;
на фиг.14 - данные BIACORE-анализа, касающиеся аффинности слитого белка «димерное антитело»-IL-2 к TNC-A1 и рецептору IL-2. Молекулу scFv димерного антитела выводили из антитела F16. На чертеже показаны значения KD, рассчитанные на основе данных, полученных с помощью BIACORE-анализа;
на фиг.15 - данные BIACORE-анализа, касающиеся аффинности иммуноконъюгата Fab-IL-2-Fab к TNC-A1 и рецептору IL-2. Fab-молекулы иммуноконъюгата выводили из антитела F16. На чертеже показаны значения Ко, рассчитанные на основе данных, полученных с помощью BIACORE-анализа;
на фиг.16 - данные BIACORE-анализа, касающиеся аффинности иммуноконъюгата scFv-IL-2-scFv к TNC-A1 и рецептору IL-2. Молекулы scFv иммуноконъюгата выводили из антитела F16. На чертеже показаны значения KD, рассчитанные на основе данных, полученных с помощью BIACORE-анализа;
на фиг.17 - таблица, в которой обобщены значения КD, полученные в опытах, проведенных с помощью BIACORE-анализа, которые представлены на фиг.12-16;
на фиг.18 - результаты сравнительного эксперимента по оценке эффективности молекулы «димерное антитело»-IL-2, мишенью которой является EDB-домен фибронектина, и иммуноконъюгата Fаb-интерлейкин-2-Fab (обозначен как «Fab-SH2B10», который содержит вариабельные области тяжелой и легкой цепи, представленные в SEQ ID NO: 3 и 7 соответственно), мишенью которого является домен А2 тенасцина С.На фиг.18 применяемый в качестве контроля неконъюгированный интерлейкин-2 обозначали как «Unconj rIL-2», молекулу «димерное антитело»-IL-2 обозначали как «димерное антитело» L19. Антитело к EDB L19 применяли для создания антигенсвязывающего фрагмента в содержащем димерное антитело иммуноконъюгате. Клеточную линию тератокарциномы F9 инъецировали подкожно иммунокомпетентным мышам линии 129. Количество иммуноконъюгатата (в мкг), которое инъецировали одной мыши, представлено в описании чертежа. Обработку начинали в день 6 и осуществляли в общей сложности 5 инъекций до дня 11 эксперимента;
на фиг.19 - данные об индукции пролиферации NK-92-клеток антителом к FAP или антителом к тенасцину С, иммуноконъюгатами Fab-IL2-Fab (созданных с использованием последовательностей VH и VL конструкций 3F2, 3D9, 4В3 (антитела к FAP), 2F11 и 2В10 (антитела к тенасцину С)) в сравнении с неконъюгированным человеческим IL-2. Клеточную пролиферацию оценивали с помощью системы CellTiter Glo после двух дней инкубации;
на фиг.20 - результаты, полученные с помощью ELISA-анализа, касающиеся оценки индукции производства IFN-γ различными содержащими интерлейкин-12 иммуноконъюгатами в сравнении либо с неконъюгированными цитокинами, либо с иммуноконъюгатами, которые содержат р35- и р40-домены IL-12 в различных молекулах. На панели А) представлены результаты, полученные с использованием сенсибилизированных фибронктином планшетов. На панели Б) представлены результаты, полученные в растворе;
на фиг.21 - результаты анализов кинетических характеристик, полученные с помощью поверхностного плазменного резонанса (SPR), для Fab-фрагментов антитела с созревшей аффинностью к FAP. Наборы обработанных кинетических данных даны для клона 19G1, связывающегося с человеческим (hu) FAP (А) и мышиным (mu) FAP (Б), для клона 20G8, связывающегося с hu FAP (В), mu FAP (Г), и для клона 4 В9, связывающегося с hu FAP (Д) и mu FAP (E). Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.22 - результаты анализов кинетических характеристик, полученные с помощью SPR, для Fab-фрагментов антитела с созревшей аффинностью к FAP. Наборы обработанных кинетических данных даны для клона 5В8, связывающегося с hu FAP (А) и mu FAP (Б), для клона 5F1, связывающегося с hu FAP (В), mu FAP (Г), и для клона 14В3, связывающегося с hu FAP (Д) и mu FAP (Е). Гладкими линиями обозначены данные, полученное c помощьюглобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.23 - результаты анализов кинетических характеристик, полученные с помощью SPR, для Fab-фрагментов антитела с созревшей аффинностью к FAP. Наборы обработанных кинетических данных даны для клона 16F1, связывающегося с hu FAP (А) и mu FAP (Б), для клона 16F8, связывающегося с hu FAP (В), mu FAP (Г), и для клона О3С9, связывающегося с hu FAP (Д) и mu FAP (Е). Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием интерактивной модели 1:1;
на фиг.24 - результаты анализов кинетических характеристик, полученные с помощью SPR, для Fab-фрагментов антитела с созревшей аффинностью к FAP. Наборы обработанных кинетических данных даны для клона O2D7, связывающегося с hu FAP (А) и mu FAP (Б), клона 28Н1, связывающегося с hu FAP (В), mu FAP (Г), суnо FAP (Д), и для клона 22А3, связывающегося с hu FAP (Е), mu FAP (Ж) и обезьяны циномолгус (яванский макак-крабоед) (суnо) FAP (3). Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.25 - результаты анализов кинетических характеристик, полученные с помощью SPR, для Fab-фрагментов антитела с созревшей аффинностью к FAP. Наборы обработанных кинетических данных даны для клона 29В11, связывающегося с hu FAP (А), mu FAP (Б), супо FAP (В), и для клона 23С10, связывающегося с hu FAP (Г), mu FAP (Д) и суnо FAP (Е). Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
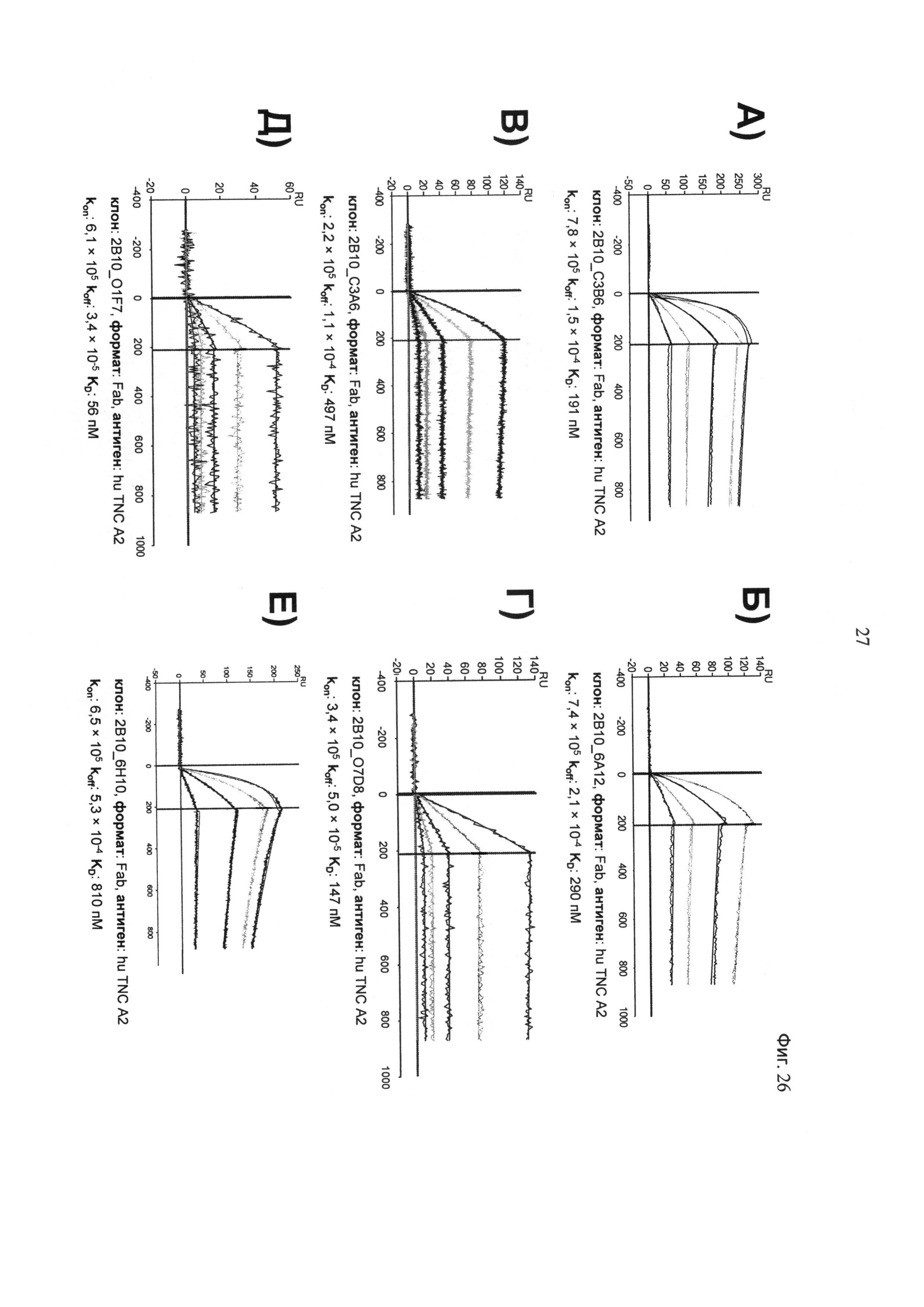
на фиг.26 - результаты анализов кинетических характеристик, полученные с помощью SPR, для Fab-фрагментов антитела с созревшей аффинностью к TNC-А2, которое связывается с человеческим (hu) TNC-A2. Наборы обработанных кинетических данных даны для клона 2В10_С3В6 (А), клона 2В10_6А12 (Б), клона 2В10_С3А6 (В), клона 2B10_O7D8 (Г), клона 2B10_O1F7 (Д) и клона 2В10_6Н10 (Е). Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием интерактивной модели 1:1;
на фиг.27 - обзор трех стадий очистки конструкции Fab-IL2-Fab на основе 3F2;
на фиг.28 - результаты очистки Fab-IL2-Fab на основе 3F2 (А и Б) и результаты очистки Fab-IL2-Fab на основе 4G8 (В и Г). (А, В) Применяли 4-12% бис-Трис и 3-8% Трис-ацетатный ДСН-ПААГ для фракций, полученных в процессе процедуры очистки, и конечного продукта. (Б, Г) Применяли аналитическую гель-фильтрацию после трех используемых стадий очистки;
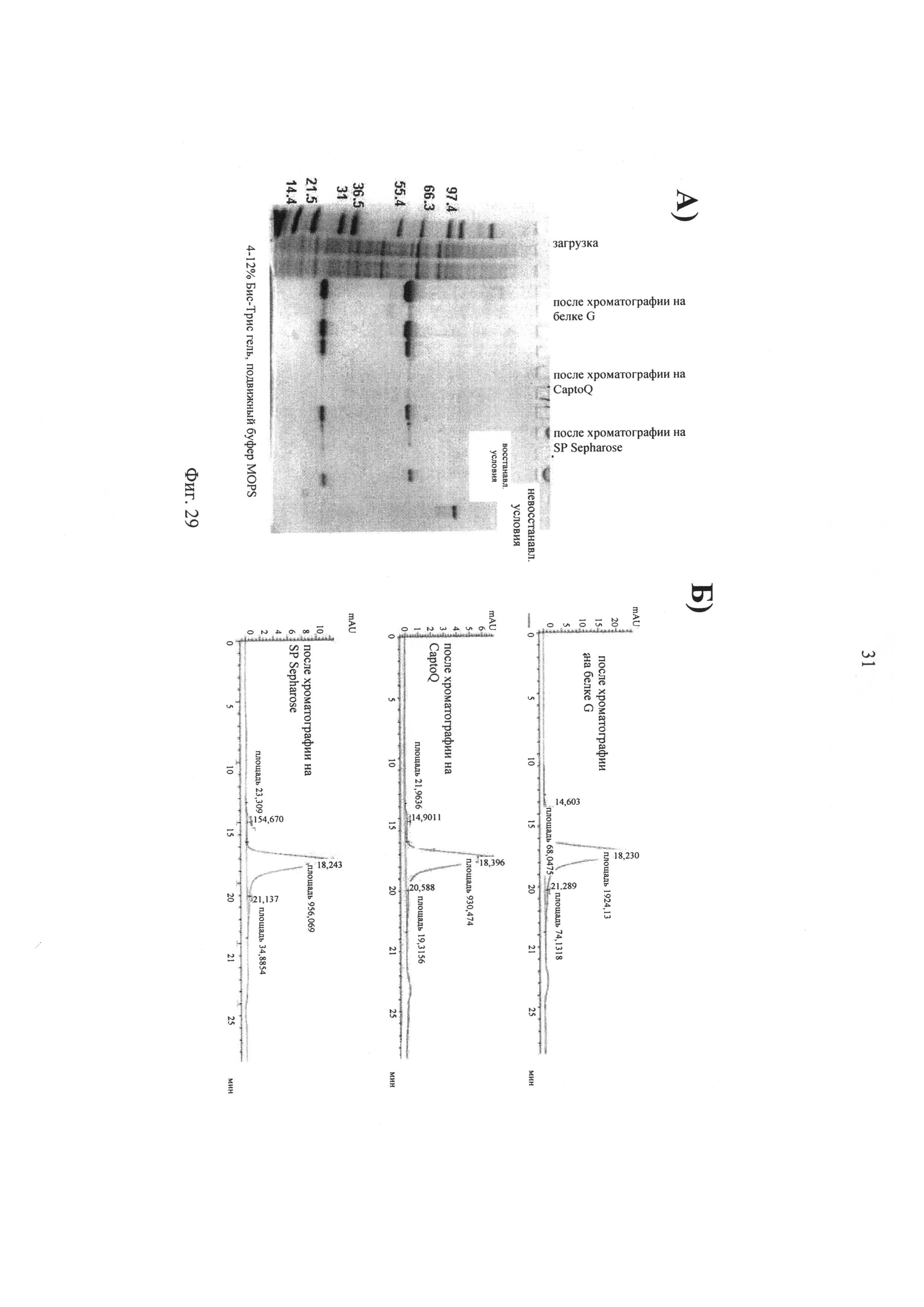
на фиг.29 - результаты очистки иммуноконъюгата Fab-IL2-Fab на основе 2В10. (А) Применяли 4-12% бис-Трис ДСН-ПААГ для фракций, полученных в процессе процедуры очистки, и конечного продукта. (Б) Применяли аналитическую гель-фильтрацию после трех используемых стадий очистки;
на фиг.30 - результаты оценки стабильности иммуноконъюгата Fab-IL2-Fab на основе антитело к EDB фибронектина L19. Fab-IL2-Fab на основе L19 приготавливали в 20 мМ гистидине·HCl, 140 мМ NaCl, pH 6,0 в концентрации 6,3 мг/мл и хранили в течение 4 недель при комнатной температуре и при 4°С. Образцы анализировали каждую неделю, определяя (А) концентрацию с помощью УФ-спектроскопии (после центрифугирования для пеллетирования продукта, который потенциально может осаждаться) и (Б) содержание агрегатов с помощью аналитической гель-фильтрации;
на фиг.31 - результаты анализов кинетических характеристик, полученные с помощью SPR, для иммуноконъюгатов Fab-IL2-Fab на основе 3F2, мишенью которых является FAP, с использованием FAP человека, мыши и обезьяны циномолгус (суnо) и человеческого IL-2-рецептора-β/Y (IL2R bg), для определения которых применяли поверхностный плазменный резонанс. Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
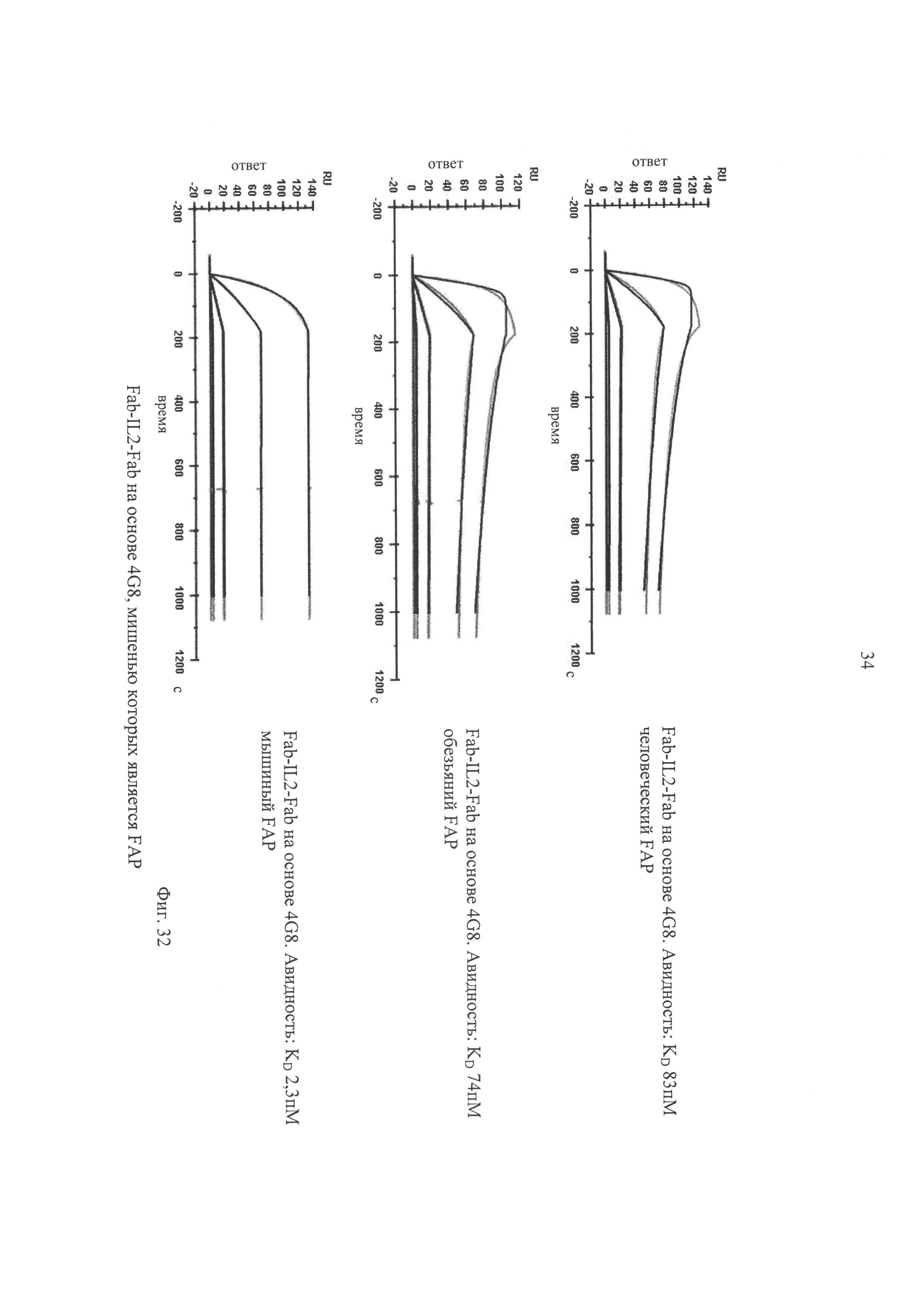
на фиг.32 - результаты анализов кинетических характеристик, полученные с помощью SPR, для иммуноконъюгатов Fab-IL2-Fab на основе 4G8, мишенью которых является FAP, с использованием FAP человека, мыши и обезьяны циномолгус (суnо), для определения которых применяли поверхностный плазменный резонанс. Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.33 - результаты анализов кинетических характеристик, полученные с помощью SPR, для конструкций Fab-IL2-Fab на основе 4G8, мишенью которых является FAP, с использованием человеческих и мышиных β/γ- и α-цепей IL-2-рецептора, для определения которых применяли поверхностный плазменный резонанс. Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели реакции с двумя (стационарными) состояниями;
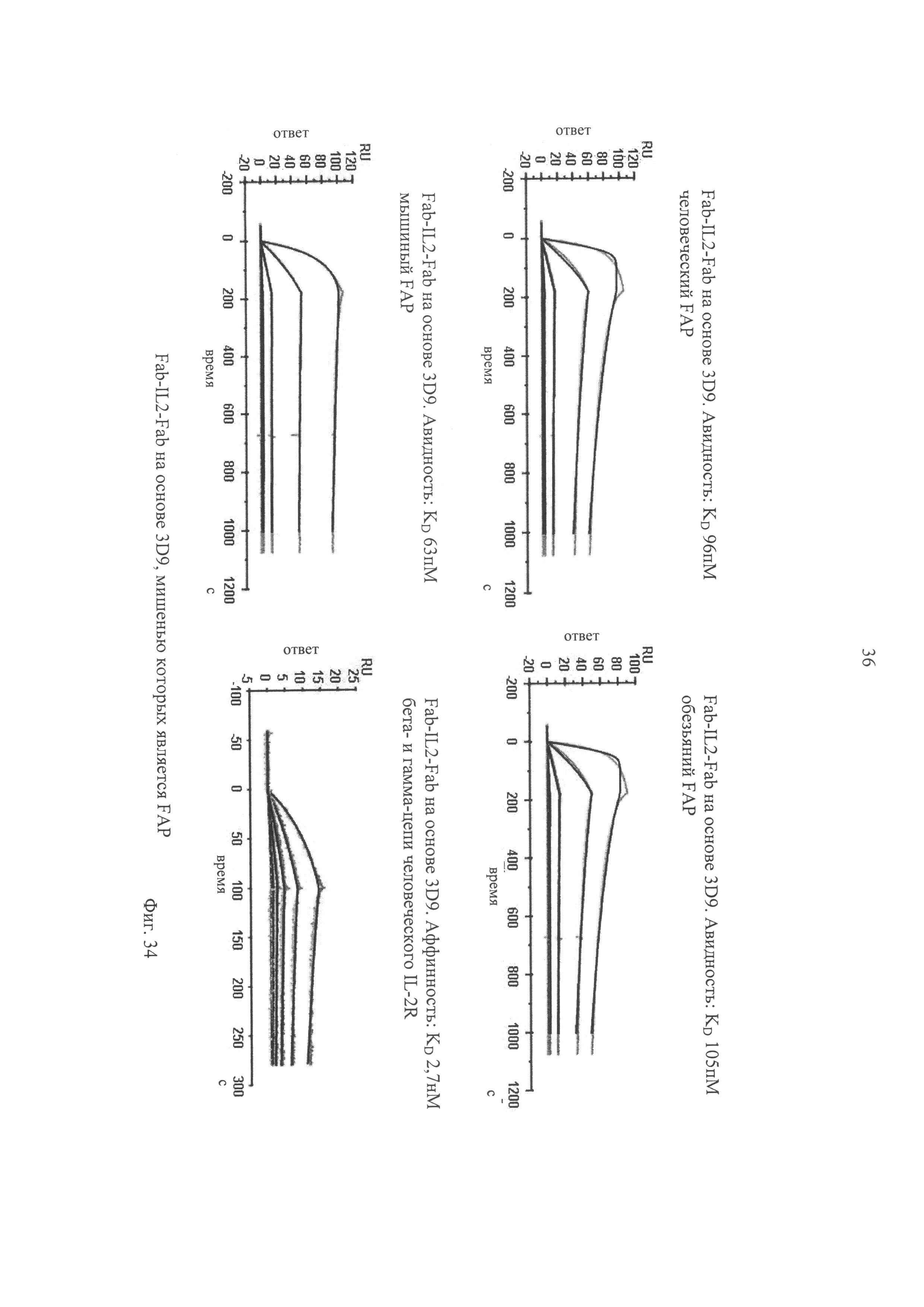
на фиг.34 - результаты анализов кинетических характеристик, полученные с помощью SPR, для конструкций Fab-IL2-Fab на основе 3D9, мишенью которых является FAP, с использованием FAP человека, мыши и обезьяны циномолгус (суnо) и человеческого IL-2-рецептора-β/γ (IL2R bg), для определения которых применяли поверхностный плазменный резонанс. Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.35 - результаты анализов кинетических характеристик, полученные с помощью SPR, для конструкций Fab-IL2-Fab на основе 2B10, мишенью которых является TNC-A2, с использованием слитых белков химерного TNC-A2 человека, мыши и обезьяны циномолгус (суnо) и человеческого IL-2-рецептора-β/γ (IL2R bg), для определения которых применяли поверхностный плазменный резонанс. Гладкими линиями обозначены данные, полученные с помощью глобальной аппроксимации с использованием модели взаимодействия 1:1;
на фиг.36 - результаты оценки эффективности иммуноконъюгатов Fab-IL2-Fab, предназначенных для направленного переноса IL-2, которые распознают TNC-A2 (2В10) или FAP (3F2 и 4G8), касательно индукции пролиферации NK92-клеток, представленные в сравнении с IL-2 (пролейкин) и димерным антителом L19, распознающим EDB фибронектина. На оси х представлены данные, стандартизованные относительно количества молекул IL-2, поскольку димерное антитело имеет два эффекторных фрагмента IL-2, а конструкции Fab-IL2-Fab содержат только один эффекторный фрагмент IL-2. Пролиферацию клеток оценивали с использованием системы CellTiter Glo после двух дней инкубации;
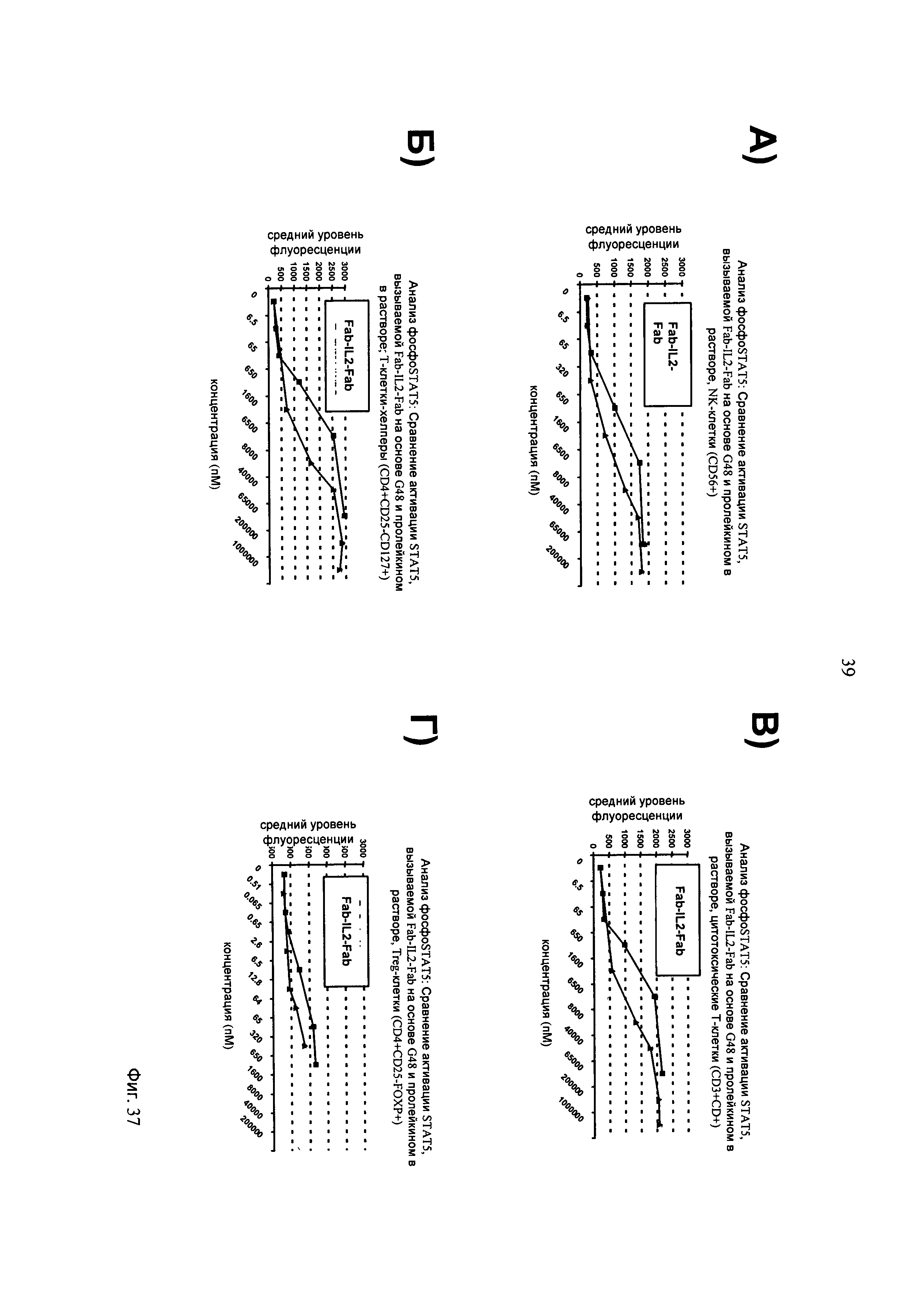
на фиг.37 - данные об индукции фосфорилирования STAT5 в результате опосредуемой IL-2 передачи сигналов IL-2-рецептора после инкубации с содержащим IL-2 иммуноконъюгатом Fab-IL2-Fab на основе 4G8, мишенью которого является FAP, который распознает FAP на различных популяциях эффекторных клеток, включая (A) CD56+ NK-клетки, (Б) CD4+CD25-CD127+- Т-клетки-хелперы, (В) цитотоксические CD3+, CD8+- Т-клетки и (Г) регуляторные CD4+CD25+FOXP3+- Т-клетки (Treg) из человеческих РВМС, которые присутствуют в растворе;
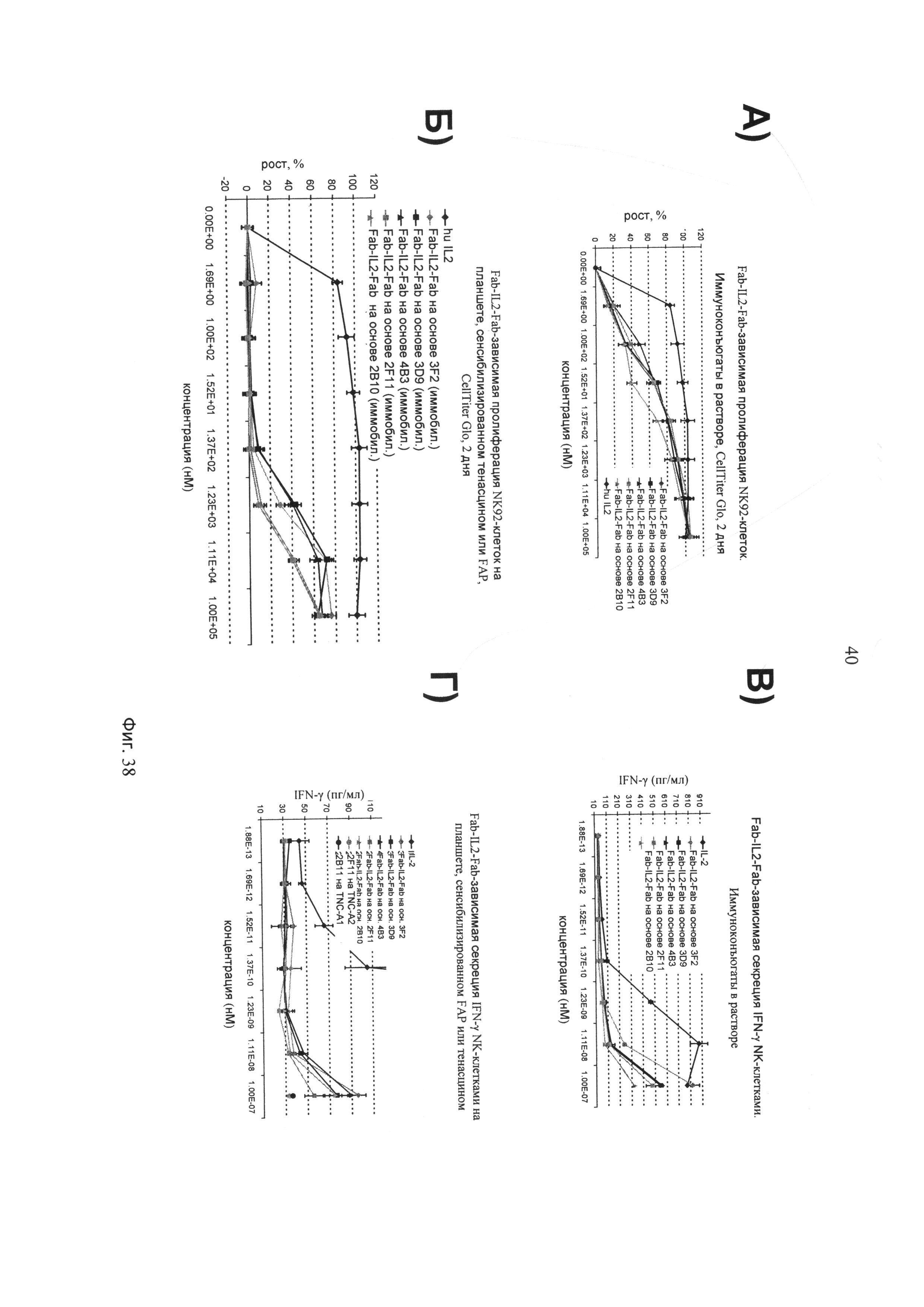
на фиг.38 - данные об эффективности осуществляющих направленный перенос IL-2 иммуноконъюгатов Fab-IL2-Fab, распознающих TNC-A1 (2F11), TNC-A2 (2В10) или FAP (3F2, 4В3 и 3D9), касательно индукции высвобождения IFN-γ и пролиферации NK-92-клеток в сравнении с IL-2, когда иммуноконъюгаты либо присутствуют в растворе, либо иммобилизованы посредством сенсибилизации FAP или TNC-A2 на титрационных микропланшетах;
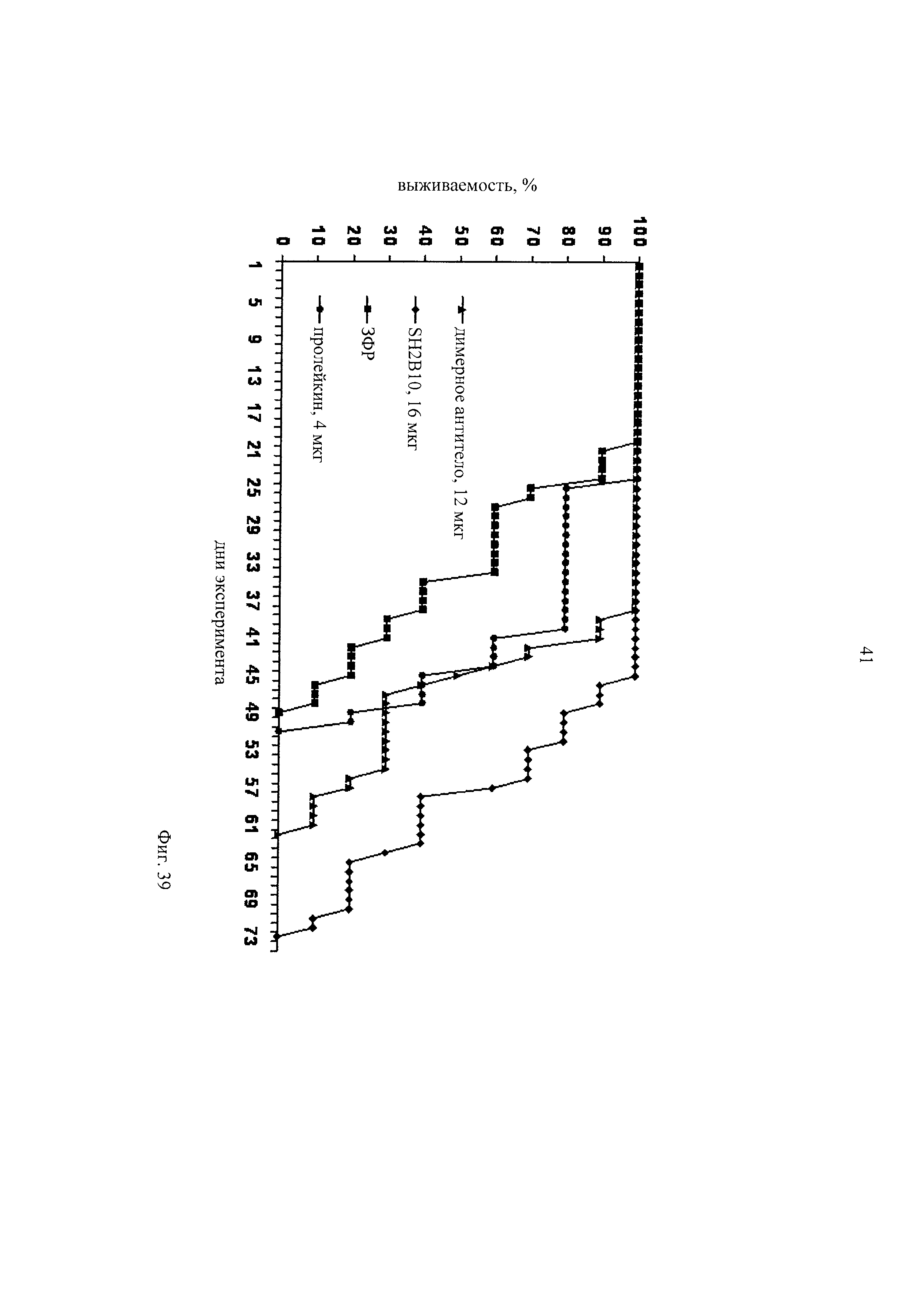
на фиг.39 - результаты эксперимента по оценке выживаемости при применении двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических в отношении стромы опухоли. Человеческую клеточную линию опухолевых клеток ободочной кишки LS174T инъецировали в селезенку SCID-мышей. Иммуноконъюгат Fab-IL2-Fab на основе 2B10, мишенью которого является TNC-A2, обозначали как «SH2B10», применяемый в качестве контроля неконъюгированный IL-2 обозначали как «пролейкин», молекулу иммунокоъюгата «димерное антитело»-IL-2, мишенью которого является EDB фибронектина, обозначали как «димерное антитело». Количество иммуноконъюгатата (в мкг), которое инъецировали одной мыши, представлено в описании чертежа, и оно соответствует одинаковому количеству молекул иммуноконъюгатов;
на фиг.40 - результаты эксперимента по оценке выживаемости при применении двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических в отношении стромы опухоли. Человеческую клеточную почечную линию ACHN инъецировали внутрь почки SCID-мышам. Иммуноконъюгаты Fab-IL2-Fab на основе 3F2 или 4G8, мишенью которых является FAP, обозначали как «FAP-3F2» и «FAP-4G8», применяемый в качестве контроля неконъюгированный IL-2 обозначали как «пролейкин», молекулу иммунокоъюгата «димерное антитело»-IL-2, мишенью которого является EDB фибронектина, обозначали как «димерное антитело». Количество иммуноконъюгатата (в мкг), которое инъецировали одной мыши, представлено в описании чертежа, и оно соответствует одинаковому количеству молекул иммуноконъюгатов;
на фиг.41 - результаты эксперимента по оценке выживаемости при применении двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических в отношении стромы опухоли. Человеческую клеточную линию NSCLC (немелкоклеточный рак легкого) А549 инъецировали i.v. SCID-мышам. Иммуноконъюгат Fab-IL2-Fab на основе 2B10, мишенью которого является TNC-A2, обозначали как «2B10», молекулу иммунокоъюгата «димерное антитело»-IL-2, мишенью которого является EDB фибронектина, обозначали как «димерное антитело». Количество иммуноконъюгатата (в мкг), которое инъецировали одной мыши, представлено в описании чертежа, и оно соответствует одинаковому количеству молекул иммуноконъюгатов;
на фиг.42 (А) - схема процесса очистки иммуноконъюгата Fab-GM-CSF-Fab, в котором в качестве Fab использовали антитело L19 (связывающееся с эктодоменом-В фибронектина), и (Б) - результаты, полученные с помощью ДСН-ПААГ (в восстанавливающих, невосстанавливающих условиях), очищенного иммуноконъюгата Fab-GM-CSF-Fab;
на фиг.43 - результаты оценки GM-CSF-зависимой пролиферации TF-1-клеток, позволяющие сравнивать воздействие GM-CSF и очищенного иммуноконъюгата Fab-GM-CSF-Fab, в котором в качестве Fab использовали антитело L19 (связывающееся с эктодоменом-В фибронектина);
на фиг.44 (А) - схема процесса очистки иммуноконъюгата Fab-IL12-Fab, содержащего в качестве Fab 4G8 (связывающийся в FAP агент), и (Б) результаты, полученные с помощью ДСН-ПААГ (в восстанавливающих, невосстанавливающих условиях), очищенного иммуноконъюгата Fab-IL12-Fab;
на фиг.45- результаты анализа по оценке индуцированного IL-12 высвобождения IFN-γ, позволяющие сравнивать воздействие IL-12 и очищенного иммуноконъюгата Fab-IL12-Fab, содержащего в качестве Fab 4G8 (связывающийся с FAP агент), с использованием РВМС, которые выделяли из свежей человеческой крови здорового донора;
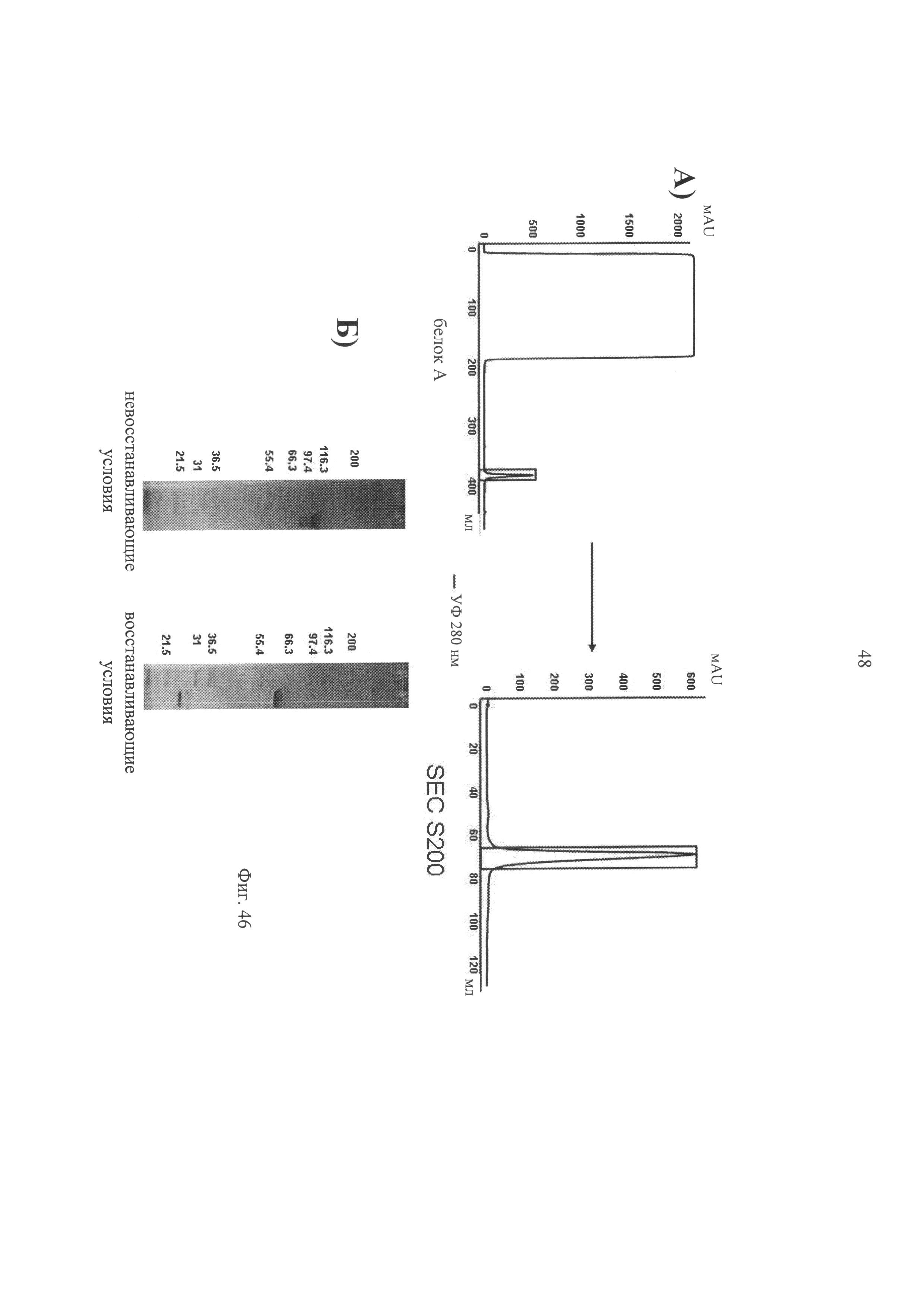
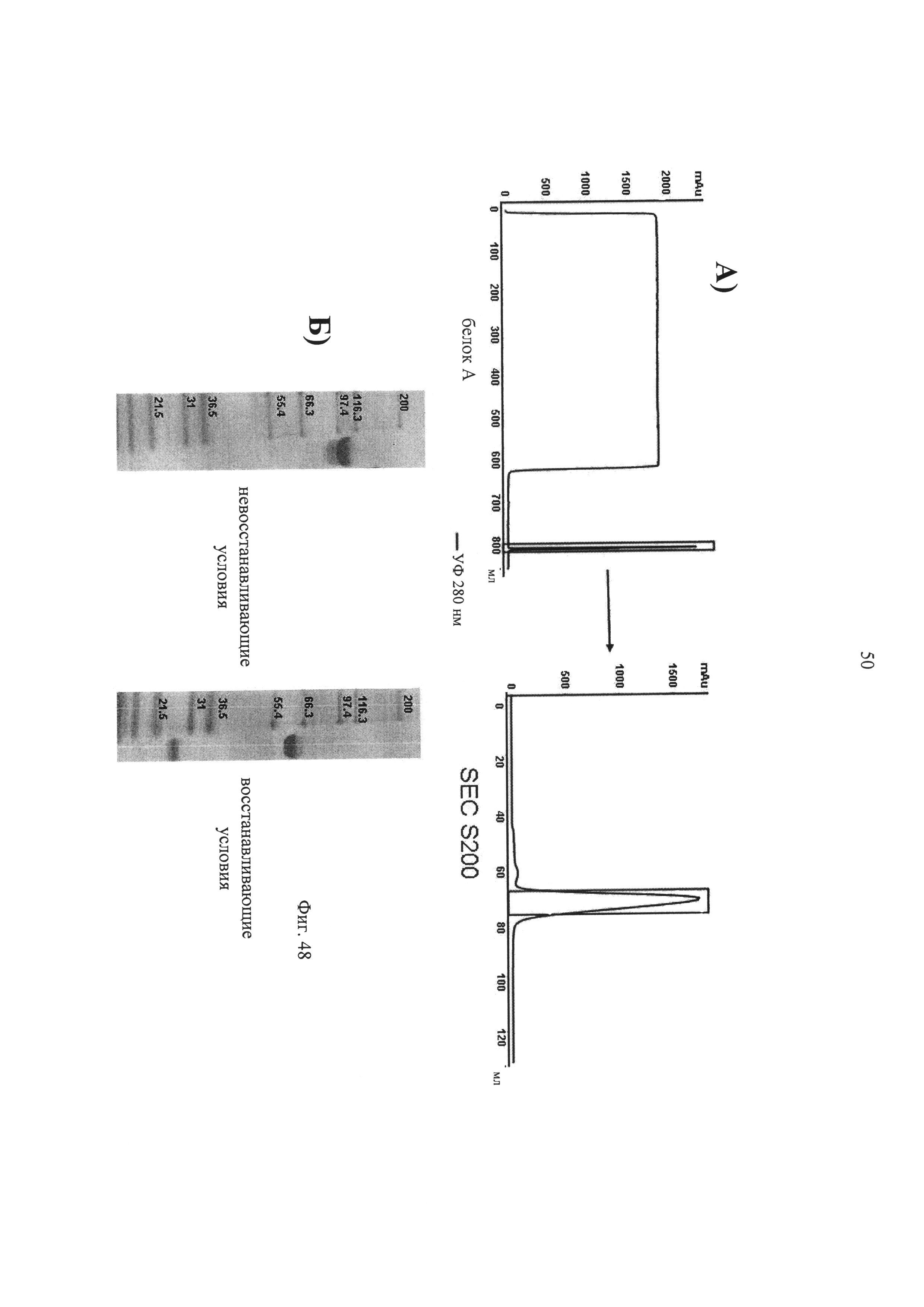
на фиг.46 (А) схема процесса очистки иммуноконъюгата Fab-IFNα2-Fab, в котором в качестве Fab использовали антитело L19 (связывающееся с эктодоменом-В фибронектина), и (Б) результаты, полученные с помощью ДСН-ПААГ (в восстанавливающих, невосстанавливающих условиях), очищенного иммуноконъюгата Fab-IFNα2-Fab;
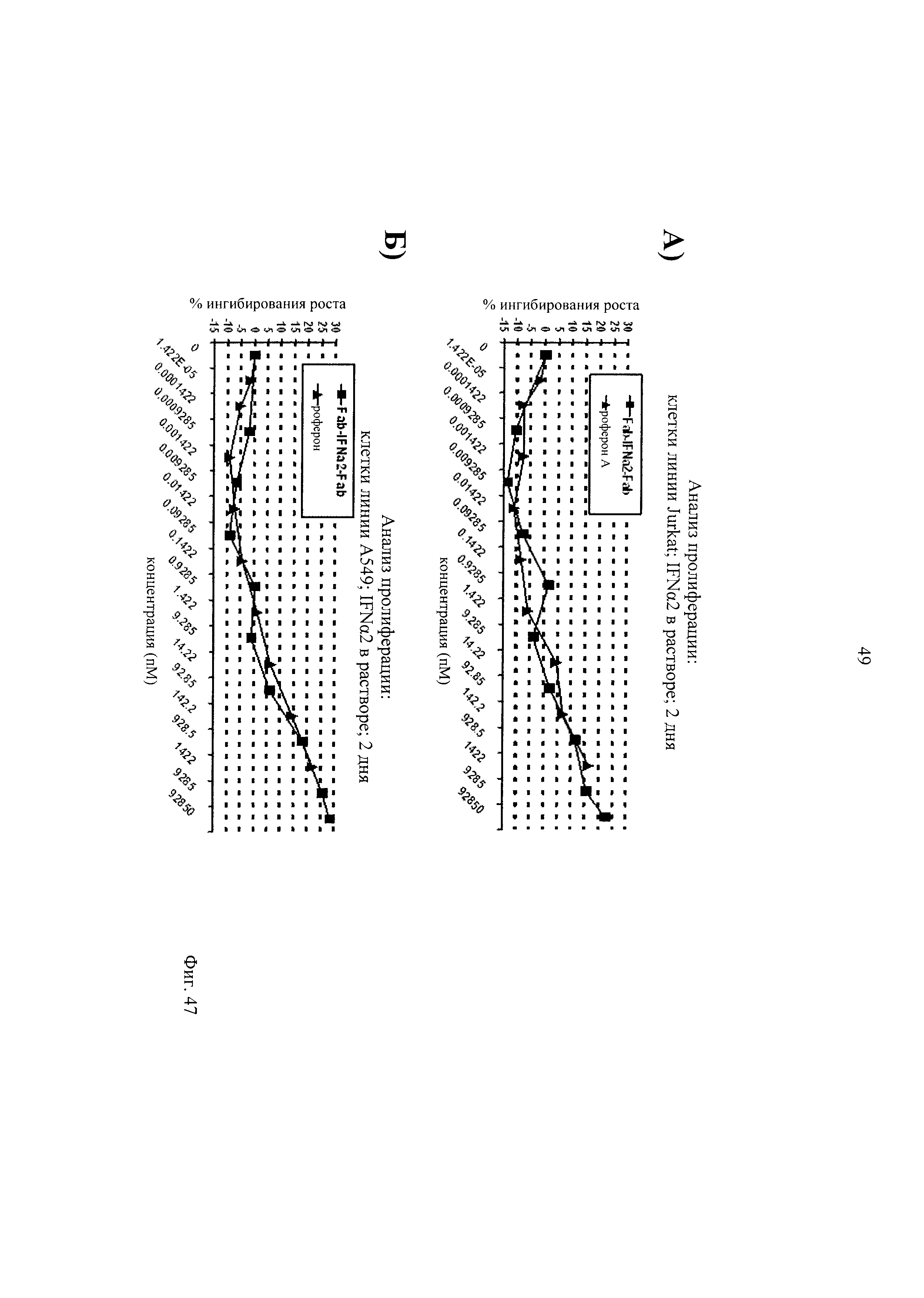
на фиг.47- результаты анализа по оценке индуцированного IFN-α ингибирования пролиферации (А) Т-клеток линии Jurkat и (Б) опухолевых клеток линии А549, позволяющие сравнивать воздействие IFN-α (роферон А, фирма Roche) и очищенного иммуноконъюгата Fab-IFNα2-Fab, в котором в качестве Fab использовали антитело L19 (связывающееся с эктодоменом-В фибронектина):
на фиг.48(А) - профили элюции, полученные в процессе очистки имеющего MHLG-основу Fab-IL2-Fab, мишенью которого является MCSP, и (Б) - результаты, полученные при аналитической характеризации этой конструкции Fab-IL2-Fab с помощью ДСН-ПААГ (NuPAGE Novex Бис-Трис минигель, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия);
на фиг.49(А) - профили элюции, полученные в процессе очистки имеющего MHLG1-основу Fab-IL2-Fab, мишенью которого является MCSP, и (Б) - результаты, полученные при аналитической характеризации этой конструкции Fab-IL2-Fab с помощью ДСН-ПААГ (NuPAGE Novex Бис-Трис минигель, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия);
на фиг.50 - результаты анализа по оценке индуцированного IL-2 высвобождения IFN-γ, позволяющие сравнивать воздействие очищенного иммуноконъюгата Fab-IL2-Fab, содержащего в качестве Fab 4G8 (связывающийся с FAP агент), и очищенного иммуноконъюгата Fab-IL2-Fab, содержащего в качестве Fab MHLG KV9 (связывающийся с MCSP агент), с использованием NK-92-клеток с пониженным уровнем IL-2;
на фиг.51 - результаты анализа по оценке индуцированного IL-2 высвобождения IFN-γ, позволяющие сравнивать воздействие очищенного иммуноконъюгата Fab-IL2-Fab, содержащего в качестве Fab 4G8 (связывающийся с FAP агент), и очищенного иммуноконъюгата Fab-IL12-Fab, содержащего в качестве Fab MHLG1 KV9 (связывающийся с MCSP агент), с использованием NK-92-клеток с пониженным уровнем IL-2;
на фиг.52 - результаты оценки связывания иммуноконъюгата MHLG1 KV9 Fab-IL2-Fab, мишенью которого является MCSP, с клетками линии Соlo38, полученные с помощью проточной цитометрии. В качестве отрицательных контролей применяли только вторичное антитело или только клетки:
на фиг.53(А) - схема процесса очистки иммуноконъюгата Fab-IL2-Fab на основе 2B10, содержащего в качестве Fab 2B10 (связывающийся с TNC-A2 агент), и (Б) - результаты, полученные с помощью ДСН-ПААГ (восстанавливающие, невосстанавливающие условия) очищенного иммуноконъюгата Fab-IL2-Fab на основе 2В10.
Подробное описание изобретения
Определения
Все технические и научные понятия, применяемые в настоящем описании, как правило, если не указано иное, имеют значения, хорошо известное обычному специалисту в данной области. Как правила, применяемая в контексте настоящего описания номенклатура и лабораторные процедуры, применяемые для культивирования клеток, в молекулярной генетике, химии нуклеиновых кислот и гибридизации, которые представлены ниже, соответствуют хорошо известным и общепринятым в данной области. Стандартные методики и процедуры, как правило, осуществляют согласно методам, общепринятым в данной области и описанным, в целом, в следующих ссылках (см. общие методы у Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2-ое изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989, публикация включена в настоящее описание в качестве ссылки), которые указаны в настоящем документе.
В контексте настоящего описания понятие «иммуноконъюгат» относится к молекуле полипептида, которая включает по меньшей мере один эффекторный фрагмент и по меньшей мере один антигенсвязывающий фрагмент. В одном из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один одноцепочечный эффекторный фрагмент и по меньшей мере два антигенсвязывающих фрагмента. Антигенсвязывающая молекула может быть сцеплена с эффекторным фрагментом посредством различных взаимодействий, и находиться в различных конфигурациях, представленных в настоящем описании.
В контексте настоящего описания понятие «эффекторный фрагмент»
относится к полипептиду, например, белку или гликопротеину, который оказывает влияние на клеточную активность, например, через трансдукцию сигналов или посредством других клеточных путей. Таким образом, эффекторный фрагмент, предлагаемый в изобретении, может быть ассоциирован с опосредуемой рецептором передачей сигналов, что приводит к передаче сигнала от наружной части клеточной мембраны, модулируя ответ в клетке, которая несет один или несколько рецепторов эффекторного фрагмента. В одном из вариантов осуществления изобретения эффекторный фрагмент может вызывать цитотоксический ответ в клетках, несущих один или несколько рецепторов эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может вызывать пролиферативный ответ в клетках, несущих один или несколько рецепторов эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может вызывать дифференцировку клеток, несущих один или несколько рецепторов эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может изменять экспрессию (т.е. может обладать способностью осуществлять повышающую регуляцию или понижающую регуляция) эндогенного клеточного белка в клетках, несущих рецепторы эффекторного фрагмента. Примерами эффекторных фрагментов являются (но, не ограничиваясь только ими) цитокины, факторы роста, гормоны, ферменты, субстраты и кофакторы. Эффекторный фрагмент может быть ассоциирован с антигенсвязывающим фрагментом в различных конфигурациях с образованием иммуноконъюгата.
В контексте настоящего описания понятие «цитокин» относится к молекуле, которая опосредует и/или регулирует биологическую или клеточную функцию или процесс (например, иммунитет, воспаление и гематопоэз). Понятие «цитокин» в контексте настоящего описания относится к «лимфокинам», «хемокинам», «монокинам» и «интерлейкинам». Примерами пригодных для применения цитокинов являются (но, не ограничиваясь только ими) GM-CSF, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IFN-α, IFN-β, IFN-γ, MIP-1α, MIP-1β, TGF-β, TNF-α и TNF-β.
В контексте настоящего описания понятие «одноцепочечный» относится к молекуле, содержащей аминокислотные мономеры, связанные линейно посредством пептидных связей. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. Примерами одноцепочечных эффекторных фрагментов являются (но, не ограничиваясь только ими) цитокины, факторы роста, гормоны, ферменты, субстраты и кофакторы. Когда эффекторный фрагмент представляет собой цитокин, и представляющий собой интерес цитокин в норме в естественных условиях существует в виде мультимера, то каждая субъединица мультимерного цитокина последовательно кодируется одной цепью эффекторного фрагмента. Таким образом, примерами пригодных для применения одноцепоченых эффекторных фрагментов являются (но, не ограничиваясь только ими) GM-CSF, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IFN-α, IFN-β, IFN-γ, MIP-1α, MIP-1β, TGF-β, TNF-α и TNF-β.
В контексте настоящего описания понятие «применяемый в качестве контроля эффекторный фрагмент» относится к неконъюгированному эффекторному фрагменту. Например, при осуществлении сравнения содержащего IL-2 иммуноконъюгата, предлагаемого в настоящем изобретении, и применяемого в качестве контроля эффекторного фрагмента, применяемый в качестве контроля эффекторный фрагмент представляет собой свободный неконъюгированный IL-2. Аналогично этому, например, при осуществлении сравнения содержащего IL-12 иммуноконъюгата, предлагаемого в настоящем изобретении, и применяемого в качестве контроля эффекторного фрагмента, применяемый в качестве контроля эффекторный фрагмент представляет собой свободный неконъюгированный IL-2 (например, существующий в виде гетеродимерного белка, когда субъединицы р35 и р40 соединены только дисульфидной(ыми) связью(ями)).
В контексте настоящего описания понятие «рецептор эффекторного фрагмента» относится к полипептидой молекуле, которая обладает способностью специфически связываться с эффекторным фрагментом. Например, когда эффекторный фрагмент представляет собой IL-2, рецептор эффекторного фрагмента, который связывается с IL-2 (например, с иммуноконъюгатом, который содержит IL-2), представляет собой рецептор IL-2. Аналогично этому, например, когда IL-12 представляет собой эффекторный фрагмент иммуноконъюгата, то рецептором эффекторного фрагмента является рецептор IL-12. Когда рецепторный фрагмент специфически связывается более чем с одним рецептором, все рецепторы, которые специфически связываются с эффекторным фрагментом, представляют собой «рецепторы эффекторного фрагмента» для указанного эффекторного фрагмента.
В контексте настоящего описания понятие «антигенсвязывающий фрагмент» относится к молекуле полипептида, которая специфически связывается с антигенной детерминантой. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент обладает способностью направлять субстанцию, к которой он присоединен (например, эффекторный фрагмент или второй антигенсвязывающий фрагмент), к области-мишени, например, к специфическому типу опухолевой клетки или строме опухоли, несущей антигенную детерминанту. Антигенсвязывающие фрагменты включают антитела и их фрагменты, что будет дополнительно описано далее. Понятие «специфически связывается» означает, что связывание является избирательным в отношении антигена и его можно отличать от нежелательных или неспецифических взаимодействий. В одном из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, несущих константные области, что будет дополнительно описано ниже и что является известным в данной области. Пригодные для применения константные области тяжелых цепей включают любой из пяти изотипов: α, δ, ε, γ или µ. Пригодные для применения константные области легких цепей включают любой из двух изотипов: κ и λ.
В контексте настоящего описания понятие «антигенная детерминанта» является синонимом понятий «антиген» и «эпитоп» и относится к сайту (например, участку, состоящему из смежных аминокислот, или конформационной конфигурации, состоящей из различных областей несмежных аминокислот) на полипептидной макромолекуле, с которой связывается антигенсвязывающий фрагмент с образованием комплекса антигенсвязывающий фрагмент-антиген.
В контексте настоящего описания понятие «применяемый в качестве контроля антигенсвязывающий фрагмент» относится к антигенсвязывающему фрагменту, если он является свободным от других антигенсвязывающих фрагментов и эффекторных фрагментов. Например, при осуществлении сравнения иммуноконъюгата Fab-IL2-Fab, предлагаемого в изобретении, и применяемого в качестве контроля антигенсвязывающего фрагмента, применяемый в качестве контроля антигенсвязывающий фрагмент представляет собой свободный Fab, в случае, когда иммуноконъюгат представляет собой Fab-IL2-Fab, и свободная молекула Fab может также связываться с этой же антигенной детерминантой.
В контексте настоящего описания понятия «первый» и «второй» касательно антигенсвязывающих фрагментов, эффекторных фрагментов и т.д. применяют с целью удобства для того, чтобы можно было осуществлять разделение, когда присутствует более одного типа каждого из фрагментов. Применение этих понятий не подразумевает их конкретный порядок или ориентацию в иммуноконъюгате, если специально не указано иное.
В случае, когда в данной области применяют и/или являются приемлемыми два или более определений понятия, то в контексте настоящего описания подразумевается, что применяемое определение включает все такие значения, если специально не указано иное. Конкретным примером является применение понятия «гипервариабельный участок» («CDR») для описания не соприкасающихся антигенсвязывающих центров, присутствующих в полипептидах вариабельной области как тяжелой, так и легкой цепи. Этот конкретный участок описан у Kabat и др., «Sequences Proteins oflmmunological Interest», изд-во U.S.Dept. of Health and Human Services, (1983) и у Chothia и др., J.Mol.Biol. 196, 1987, cc.901-917, указанные публикации включены в настоящее описание в качестве ссылки, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в таблице 1. Точные номера остатков, которые образуют конкретный CDR, должны варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области легко могут определить, какие остатки входят в конкретный CDR, на основе данных об аминокислотной последовательности вариабельной области антитела.
Кэбот с соавторами предложили также систему нумерации последовательностей вариабельных областей, которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему «нумерации по Кэботу» к любой последовательности вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие «нумерация по Кэботу» относится к системе нумерации, описанной у Kabat и др., «Sequence of Proteins of lmmunological Interest», изд-во U.S.Dept. of Health and Human Services, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в антигенсвязывающем фрагменте даны в соответствии с системой нумерации по Кэботу. Нумерация в полипептидных последовательностях, представленных в перечне последовательностей (т.е. SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 96, 97 и др.) не соответствует системе нумерации по Кэботу. Однако обычный специалист в данной легко может превратить нумерацию последовательностей в перечне последовательностей в систему нумерации по Кэботу.
Иммуноконъюгаты
Иммуноконъюгаты представляют собой полипептидные молекулы, которые содержат по меньшей мере один эффекторный фрагмент и по меньшей мере один антигенсвязывающий фрагмент. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. В одном из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере два антигенсвязывающих фрагмента. Антигенсвязывающие фрагменты и эффекторные фрагменты иммуноконъюгата включают фрагменты, описанные выше подробно в контексте настоящего описания и на прилагаемых чертежах. Антигенсвязывающий фрагмент иммуноконъюгата может быть направлен к различным молекулам-мишеням (например, антигенной детерминанте на белковой молекуле, экспрессируемой на опухолевой клетке или в строме опухоли), В настоящем описании представлены не ограничивающие объем изобретения примеры антигенсвязывающих фрагментов. В одном из вариантов осуществления изобретения мишенью по меньшей мере одного антигенсвязывающего фрагмента является антигенная детерминанта одного или нескольких полипептидов, представленных ниже в таблице 5. Иммуноконъюгаты, предлагаемые в изобретении, как правило, обладают одним или несколькими из следующих свойств: высокая специфичность действия, пониженная токсичность и/или улучшенная стабильность, прежде всего по сравнению с известными иммуноконъюгатами различной конфигурации, мишенью которых являются такие же антигенные детерминанты, и имеющими такие же эффекторные фрагменты.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере первый эффекторный фрагмент и по меньшей мере первый и второй антигенсвязывающие фрагменты. В предпочтительном варианте осуществления изобретения первый эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. В предпочтительном варианте осуществления изобретения первый и второй антигенсвязывающие фрагменты независимо друг от друга выбирают из группы, включающей Fv и Fab. В конкретном варианте осуществления изобретения первый эффекторный фрагмент связан амино- или карбоксиконцевой пептидной связью с первым антигенсвязывающим фрагментом, а второй антигенсвязывающий фрагмент связан амино- или карбоксиконцевой пептидной связью либо I) с первым эффекторным фрагментом, либо II) с первым антигенсвязывающим фрагментом. В другом варианте осуществления изобретения иммуноконъюгат состоит практически из первого одноцепочечного эффекторного фрагмента и первого и второго антигенсвязывающих фрагментов.
Согласно одному из вариантов осуществления изобретения первый эффекторный фрагмент соединен карбоксиконцевой пептидной связью с первым антигенсвязывающим фрагментом и также соединен аминоконцевой пептидной связью со вторым антигенсвязывающим фрагментом. Согласно другому варианту осуществления изобретения первый антигенсвязывающий фрагмент соединен карбоксиконцевой пептидной связью с первым эффекторным фрагментом, предпочтительно одноцепочечным эффекторным фрагментом, и дополнительно соединен аминоконцевой пептидной связью со вторым антигенсвязывающим фрагментом. Согласно другому варианту осуществления изобретения первый антигенсвязывающий фрагмент соединен аминоконцевой пептидной связью с первым эффекторным фрагментом, предпочтительно одноцепочечным эффекторным фрагментом, и дополнительно соединен карбоксиконцевой пептидной связью со вторым антигенсвязывающим фрагментом.
Согласно одному из вариантов осуществления изобретения первый эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, соединен карбоксиконцевой пептидной связью с первой вариабельной областью тяжелой цепи и дополнительно соединен аминоконцевой пептидной связью со второй вариабельной областью тяжелой цепи. Согласно другому варианту осуществления изобретения первый эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, соединен карбоксиконцевой пептидной связью с первой вариабельной областью легкой цепи и дополнительно соединен аминоконцевой пептидной связью со второй вариабельной областью легкой цепи. Согласно другому варианту осуществления изобретения первая вариабельная область тяжелой или легкой цепи сцеплена с помощью карбоксиконцевой пептидной связи с первым эффекторным фрагментом, предпочтительно одноцепочечным эффекторным фрагментом, и дополнительно сцеплена с помощью аминоконцевой пептидной связи с второй вариабельной областью тяжелой или легкой цепи. Согласно другому варианту осуществления изобретения первая вариабельная область тяжелой или легкой цепи сцеплена с помощью аминоконцевой пептидной связи с первым эффекторным фрагментом, предпочтительно одноцепочечным эффекторным фрагментом, и дополнительно сцеплена с помощью карбоксиконцевой пептидной связи с второй вариабельной областью тяжелой или легкой цепи.
Согласно одному из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, соединен карбоксиконцевой пептидной связью с тяжелой или легкой цепью первого Fab и дополнительно соединен аминоконцевой пептидной связью с тяжелой или легкой цепью второго Fab. Согласно другому варианту осуществления изобретения тяжелая или легкая цепь первого Fab соединена карбоксиконцевой пептидной связью с первым одноцепочечным эффекторным фрагментом и дополнительно соединена аминоконцевой пептидной связью с тяжелой или легкой цепью второго Fab. В других вариантах осуществления изобретения тяжелая или легкая цепь первого Fab соединена аминоконцевой пептидной связью с первым одноцепочечным эффекторным фрагментом и дополнительно соединен карбоксиконцевой пептидной связью с тяжелой или легкой цепью второго Fab.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере первый эффекторный фрагмент, соединенный аминоконцевой пептидной связью с одной или несколькими молекулами scFv, и в нем первый эффекторный фрагмент дополнительно соединен карбоксиконцевой пептидной связью с одной или несколькими молекулами scFv. В предпочтительном варианте осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
Согласно другому варианту осуществления изобретения иммуноконъюгат содержит по меньшей мере первый эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, и первый и второй антигенсвязывающие фрагменты, где каждый из антигенсвязывающих фрагментов включает молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с константной областью, которая включает константную область иммуноглобулина, и где первый антигенсвязывающий фрагмент сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой первого эффекторного фрагмента, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньшей мере одного дисульфидного мостика. В предпочтительном варианте осуществления изобретения константную область независимо друг от друга выбирают из группы, включающей домены СН1 IgG, СН2 IgG, CH3 IgG, Скаппа IgG» Слямбда IgG и CH4 IgE. Согласно одному из вариантов осуществления изобретения иммуноглобулиновый домен первого антигенсвязывающего фрагмента ковалентно связан с иммуноглобулиновым доменом второго антигенсвязывающего фрагмента через дисульфидный мостик. Согласно одному из вариантов осуществления изобретения по меньшей мере один дисульфидный мостик локализован на карбоксиконцах иммуноглобулиновых доменов первого и второго антигенсвязывающих фрагментов. Согласно другому варианту осуществления изобретения по меньшей мере один дисульфидный мостик локализован на аминоконцах иммуноглобулиновых доменов первого и второго антигенсвязывающих фрагментов. Согласно другому варианту осуществления изобретения по меньшей мере два дисульфидных мостика локализованы на аминоконцах иммуноглобулиновых доменов первого и второго антигенсвязывающего фрагмента.
В конкретном варианте осуществления изобретения иммуноконъюгат содержит первый и второй антигенсвязывающие фрагменты, каждый из которых содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с константной областью, которая содержит СН1-домен IgG, где первый антигенсвязывающий фрагмент сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой первого эффекторного фрагмента, предпочтительно одноцепочечного эффекторного фрагмента, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньшей мере одного дисульфидного мостика. Второй антигенсвязывающий фрагмент иммуноконъюгата может быть дополнительно сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой второго эффекторного фрагмента. В одном из вариантов осуществления изобретения второй эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
В конкретном варианте осуществления изобретения иммуноконъюгат содержит первый и второй антигенсвязывающие фрагменты, каждый из которых содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с константной областью, которая включает Скаппа-домен IgG, где первый антигенсвязывающий фрагмент сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой первого эффекторного фрагмента, предпочтительно одноцепочечного эффекторного фрагмента, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньшей мере одного дисульфидного мостика. Второй антигенсвязывающий фрагмент иммуноконъюгата может быть дополнительно сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой второго эффекторного фрагмента. В одном из вариантов осуществления изобретения второй эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит первый и второй антигенсвязывающие фрагменты, каждый из которых содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с константной областью, которая включает СН4-домен IgE, где первый антигенсвязывающий фрагмент сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой первого эффекторного фрагмента, предпочтительно одноцепочечного эффекторного фрагмента, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньше мере одного дисульфидного мостика. Второй антигенсвязывающий фрагмент иммуноконъюгата может быть дополнительно сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой второго эффекторного фрагмента. В одном из вариантов осуществления изобретения второй эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит первый и второй антигенсвязывающие фрагменты, каждый из который содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с СН3-доменом IgE, где первый антигенсвязывающий фрагмент сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой первого эффекторного фрагмента, предпочтительно одноцепочечного эффекторного фрагмента, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньшей мере одного дисульфидного мостика. Второй антигенсвязывающий фрагмент иммуноконъюгата может быть дополнительно сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой второго эффекторного фрагмента. В одном из вариантов осуществления изобретения второй эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
Согласно другому варианту осуществления изобретения иммуноконъюгат содержит первый и второй эффекторный фрагменты и первый и второй антигенсвязывающие фрагменты, где каждый из антигенсвязывающих фрагментов содержит молекулу Fab, сцепленную с помощью карбоксиконцевой аминокислоты его тяжелой или легкой цепи с СН3-доменом IgG1, и где каждый из СН3-доменов IgG1 сцеплен с помощью соответствующей карбоксиконцевой аминокислоты с аминоконцевой аминокислотой одного из эффекторных фрагментов, и где первый и второй антигенсвязывающие фрагменты ковалентно связаны посредством по меньшей мере одного дисульфидного мостика. В предпочтительном варианте осуществления изобретения первый и/или второй эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. В следующем варианте осуществления изобретения СН3-домены IgG1 антигенсвязывающих фрагментов могут быть сцеплены посредством дисульфидного мостика. В другом варианте осуществления изобретения по меньшей мере один дисульфидный мостик локализован на карбоксиконце СН3-доменов IgG1 в первом и втором антигенсвязывающих фрагментах. В другом варианте осуществления изобретения по меньшей мере один дисульфидный мостик локализован на аминоконце СН3-доменов IgG1 в первом и втором антигенсвязывающих фрагментах В другом варианте осуществления изобретения по меньшей мере два дисульфидных мостика локализованы на аминоконце СН3-доменов IgG1 в первом и втором антигенсвязывающих фрагментах.
В другом варианте осуществления изобретения иммуноконъюгат содержит один или два сайта протеолитического расщепления, которые локализованы между эффекторными фрагментами и антигенсвязывающими фрагментами.
Компоненты иммуноконъюгата (например, антигенсвязывающие фрагменты и/или эффекторные фрагменты) могут быть сцеплены непосредственно или через различные линкеры (например, пептидные линкеры, содержащие одну или несколько аминокислот, как правило, примерно 2-10 аминокислот), которые представлены в настоящем описании или являются известными в данной области.
В конкретном варианте осуществления изобретения иммуноконъюгат может обладать повышенной стабильностью в растворе, прежде всего по сравнению с известными препаратами иммуноконъюгатов. В одном из вариантов осуществления изобретения связывание иммуноконъюгата с антигенной детерминантой характеризуется значением константы диссоциации (КD), которое по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 20 или 25 раз ниже, чем значение, характерное для применяемого в качестве контроля антигенсвязывающего фрагмента. В более конкретном варианте осуществления изобретения связывание иммуноконъюгата с антигенной детерминантой характеризуется значением КD, которое примерно в 10 раз ниже, чем значение для применяемого в качестве контроля антигенсвязывающего фрагмента. В одном из вариантов осуществления изобретения связывание иммуноконъюгата с антигенной детерминантой характеризуется значением KD, более низким чем примерно 10 нМ, более низким чем примерно 1 нМ или более низким чем примерно 0,1 нМ.
Согласно другому варианту осуществления изобретения иммуноконъюгат обладает улучшенным профилем безопасности по сравнению с известными препаратами иммуноконъюгатов. Иммуноконъюгат предпочтительно обусловливает меньшее количество или менее серьезные побочные действия, такие как токсичность, деструкция неопухолевых клеток и т.д. Снижение побочных действий может быть связано с пониженной аффинностью связывания иммуноконъюгатов, предлагаемых в изобретении, с рецепторами эффекторных фрагментов. В одном из вариантов осуществления изобретения связывание иммунокоъюгата с рецептором эффекторного фрагмента характеризуется значением KD, которое по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 раз выше, чем значение для применяемого в качестве контроля эффекторного фрагмента. В более конкретном варианте осуществления изобретения связывание иммуноконъюгата с рецептором эффекторного фрагмента характеризуется значением KD, превышающим примерно в 2 раза значение для применяемого в качестве контроля эффекторного фрагмента. В другом варианте осуществления изобретения связывание иммуноконъюгата с рецептором эффекторного фрагмента характеризуется значением KD, превышающим примерно в 10 раз значение для применяемого в качестве контроля эффекторного фрагмента. В другом варианте осуществления изобретения связывание иммуноконъюгата с рецептором эффекторного фрагмента характеризуется значением КD, которое по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз выше, чем значение для соответствующего эффекторного фрагмента в содержащей «димерное антитело» молекуле иммуноконъюгата. В другом варианте осуществления изобретения связывание иммуноконъюгата с рецептором эффекторного фрагмента характеризуется значением KD, которое примерно в 10 раз выше, чем значение, характерное для соответствующего эффекторного фрагмента в содержащей «димерное антитело» молекуле иммуноконъюгата.
Согласно другому варианту осуществления изобретения иммуноконъюгат обладает повышенной эффективностью, прежде всего по сравнению с известными препаратами иммуноконъюгатов. В одном из вариантов осуществления изобретения иммуноконъюгат обладает способностью в большей степени ингибировать объем опухолей in vivo и/или обладает большей способностью удлинять продолжительность жизни млекопитающего, имеющего злокачественные опухоли. В одном из вариантов осуществления изобретения иммуноконъюгат ингибирует увеличение объема опухолей in vivo по меньшей мере примерно на 10%, 15%, 20%, 25%, 30%. 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% в конце периода обработки, составляющего примерно по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 дней. В одном из вариантов осуществления изобретения иммуноконъюгат ингибирует увеличение объема опухолей in vivo по меньшей мере на 50%, 55%, 60%, 65%, 70% или 75% в конце 13-дневного периода обработки. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% при его введении млекопитающему, которое нуждается в этом, по сравнению с применяемым в качестве контроля эффекторным фрагментом. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 30%, 32% или 35% при его введении млекопитающему, которое нуждается в этом, по сравнению с применяемым в качестве контроля эффекторным фрагментом. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 30% при его введении млекопитающему, которое нуждается в этом, по сравнению с применяемым в качестве контроля эффекторным фрагментом. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% при его введении млекопитающему, которое нуждается в этом, по сравнению с эффекторным фрагментом в содержащей «димерное антитело» молекуле иммуноконъюгата. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 30%, 32% или 35% при его введении млекопитающему, которое нуждается в этом, по сравнению с эффекторным фрагментом в содержащей «димерное антитело» молекуле иммуноконъюгата. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 30% при его введении млекопитающему, которое нуждается в этом, по сравнению с эффекторным фрагментом в содержащей «димерное антитело» молекуле иммуноконъюгата. В другом варианте осуществления изобретения иммуноконъюгат пролонгирует продолжительность жизни млекопитающего, имеющего злокачественные опухоли, по меньшей мере на 5%, 10% или 15% по сравнению с применяемым в качестве контроля эффекторным фрагментом или эффекторным фрагментом в содержащей «димерное антитело» молекуле иммуноконъюгата.
Антигенсвязывающие фрагменты
Антигенсвязывающий фрагмент иммуноконъюгата, предлагаемого в изобретении, как правило, представляет собой полипептидную молекулу, которая связывается со специфической антигенной детерминантой и обладает способностью направлять субстанцию, к которой она присоединен (например, эффекторный фрагмент или второй антигенсвязывающий фрагмент), к области-мишени, например, к специфическому типу опухолевой клетки или строме опухоли, несущей антигенную детерминанту. Иммуноконъюгат может связываться с антигенными детерминантами, присутствующими, например, на поверхности опухолевых клеток, на поверхности инфицированных вирусом клеток, на поверхности других пораженных болезнью клеток, свободных клеток, находящихся в сыворотке крови, и/или во внеклеточном матриксе (ЕСМ).
Примерами опухолевых антигенов являются (но, не ограничиваясь только ими) MAGE, MART-1/Мелан-А, gp100, дипептидилпептидаза IV (DPPIV), белок, связывающий анедозиндеаминазу (ADAbp), циклофилин b, антиген, ассоциированный с колоректальным раком (CRC)-C017-1A/GA733, карциномоэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и CAP-2, etv6, aml1, простатический антиген (PSA) и его иммуногенные эпитопы PSA-1, PSA-2 и PSA-3, простатический мембранный антиген (PSMA), Т-клеточный рецептор /цепь СD3-зета, опухолевые антигены из MAGE-семейства (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-АН, MAGE-A12, MAGE-Хр2 (MAGE-B2), MAGE-Хр3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), опухолевые антигены из GAGE-семейства (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, р53, MUC-семейство, HER2/neu, p21ras, RCAS1, α-фетопротеин, Е-кадгерин, α-катенин, β-катенин и γ-катенин, p120ctn, gp100 пMel 117, PRAME, NY-ESO-1, cdc27, белок аденоматозного полипоза толстой кишки (АРС), фодрин, коннексин 37, Ig-идиотип, р15, gp75, ганглиозиды GM2 и GD2, вирусные агенты, такие как белки вируса человеческой папилломы, Smad-семейство опухолевых антигенов, Imp-1, PI A, кодируемый EBV ядерный антиген (EBNA)-1, гликогенфосфорилаза, присутствующая в головном мозге, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7 и с-еrbВ-2.
Примерами вирусных антигенов являются (но, не ограничиваясь только ими) гемагглютинин вируса гриппа, LMP-1 вируса Эпштейна-Барра, гликопротеин Е2 вируса гепатита С, gpl60 ВИЧ и gpl20 ВИЧ.
Примерами ЕСМ-антигенов являются синдекан, гепараназа, интегрины, остеопонтин, «link», кадхерины, ламинин, EGF-подобный домен ламинина, лектин, фибронектин, «notch», тенасцин и матриксин.
Иммуноконъюгаты, предлагаемые в изобретении, могут связываться, например, со следующими специфическими антигенами клеточной поверхности (но, не ограничиваясь только ими): FAP, Her2, EGFR, CD2 (поверхностный Т-клеточный антиген), CD3 (гетеромультимер, ассоциированный с TCR), CD22 (В-клеточный рецептор), CD23 (низкоаффинный IgE-рецептор), CD25 (IL-2-рецептор, α-цепь), CD30 (рецептор цитокинов), CD33 (поверхностный антиген миелоидной клетки), CD40 (рецептор фактора некроза опухолей), IL-6R (IL6-рецептор), CD20, MCSP и PDGFβR (рецептор фактора роста тромбоцитов-β).
Согласно одному из вариантов осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит два или большее количество антигенсвязывающих фрагментов, где каждый из этих антигенсвязывающих фрагментов специфически связывается с одной и то же антигенной детерминантой. Согласно другому варианту осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит два или большее количество антигенсвязывающих фрагментов, где каждый из этих антигенсвязывающих фрагментов специфически связывается с разными антигенными детерминантами.
Антигенсвязывающий фрагмент может представлять собой антитело любого типа или его фрагмент, сохраняющий способность к специфическому связыванию с антигенной детерминантой. К фрагментам антитела относятся (но, не ограничиваясь только ими) VH-фрагменты, VL-фрагменты, Fab-фрагменты, F(аb')2-фрагменты, scFv-фрагменты, Fv-фрагменты, миниантитела, димерные, тримерные и четырехмерные антитела (см., например, Hudson и Souriau, Nature Med. 9, 2003, cc.129-134).
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических для экстра-домена В фибродектина (EDB). Согласно другому варианту осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, которые могут конкурировать с моноклональным антителом L19 за связывание с эпитопом EDB (см., например, РСТ публикацию WO 2007/128563 А1 (которая полностью включена в настоящее описание в качестве ссылки). Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, выведенного из моноклонального антитела L19, соединена карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, выведенного из моноклонального антитела L19. Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, выведенного из моноклонального антитела L19, соединена карбоксиконцевой пептидной связью с молекулой IL-12, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, выведенного из моноклонального антитела L19. Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, выведенного из моноклонального антитела L19, соединена карбоксиконцевой пептидной связью с молекулой IFNα, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, выведенного из моноклонального антитела L19. Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, выведенного из моноклонального антитела L19, соединена карбоксиконцевой пептидной связью с молекулой GM-CSF, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, выведенного из моноклонального антитела L19. Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой первый scFv, выведенный из моноклонального антитела L19, соединен карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью со вторым scFv, выведенным из моноклонального антитела L19. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 95 или ее вариант, который сохраняет функциональность. В другом варианте осуществления изобретения иммуноконъюгат содержит легкую цепь Fab, выведенного из моноклонального антитела L19. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 96 или ее варианту, который сохраняет функциональность. В еще одном варианте осуществления изобретения иммуноконъюгат содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 95 и SEQ ID NO: 96 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 104 или ее варианту, который сохраняет функциональность. В следующем варианте осуществления изобретения иммуноконъюгат содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 104 и SEQ ID NO: 96 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 105 или ее варианту, который сохраняет функциональность. В следующем варианте осуществления изобретения иммуноконъюгат содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 105 и SEQ ID NO: 96 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 106 или ее варианту, который сохраняет функциональность. В следующем варианте осуществления изобретения иммуноконъюгат содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 106 и SEQ ID NO: 96 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 107 или ее варианту, который сохраняет функциональность. В следующем варианте осуществления изобретения иммуноконъюгат содержит полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 107 и SEQ ID NO: 96 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения полипептиды ковалентно связаны, например, с помощью дисульфидного мостика.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических в отношении A1-домена тенасцина (TNC-A1). В другом варианте осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, которые могут конкурировать с моноклональным антителом F16 за связывание с эпитопом TNC-A1 (см. например, РСТ публикацию WO 2007/128563 А1, которая полностью включена в настоящее описание в качестве ссылки). Согласно еще одному варианту осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических в отношении А1- и/или А4-домена тенасцина (TNC-A1 или TNC-A4, или TNC-A1/A4). В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении А 1-домена тенасцина соединена карбоксиконцевой пептидной связью с молекулой IL-2, молекулой IL-12, молекулой IFNα или молекулой GM-CSF, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении А1-домена тенасцина. В следующем варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении А1-домена тенасцина соединен карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении А 1-домена тенасцина. В следующем варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой первый scFv, специфический в отношении А1-домена тенасцина, соединен карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с вторым scFv, специфическим в отношении А1-домена тенасцина. В конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 13, либо SEQ ID NO: 15, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 9, либо SEQ ID NO: 11, или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 13, либо SEQ ID NO: 15, либо их вариантам, которые сохраняют функциональность, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 9, либо SEQ ID NO: 11, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 14, либо SEQ ID NO: 16. В следующем варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью SEQ ID NO: 14 или SEQ ID NO: 16. В другом конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 10, либо SEQ ID NO: 12. В следующем варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью SEQ ID NO: 10 или SEQ ID NO: 12. В конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 99 или ее вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 100, либо SEQ ID NO: 215, или их вариантам, которые сохраняют функциональность. В следующем конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 101, либо SEQ ID NO: 235, или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 100 и SEQ ID NO: 101 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 215 и SEQ ID NO: 235 или их вариантам, которые сохраняют функциональность. В конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 112. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 112. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 113, либо SEQ ID NO: 216. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 113 или SEQ ID NO: 216. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 114, либо SEQ ID NO: 236. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 114 или SEQ ID NO: 236.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических в отношении А2-домена тенасцина (TNC-A2). В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении А2-домена тенасцина соединена карбоксиконцевой пептидной связью с молекулой IL-2, молекулой IL-12, молекулой IFNα или молекулой GM-CSF, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении А2-домена тенасцина. В следующем варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении А2-домена тенасцина, соединена карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении А1-домена тенасцина. В конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, которая включает SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO: 195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5; SEQ ID NO: 177, SEQ ID NO: 181, SEQ ID NO:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205, или их вариантам, которые сохраняют функциональность.
В более конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO: 195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207, или их вариантам, которые сохраняют функциональность, и последовательности вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5; SEQ ID NO: 177, SEQ ID NO: 181, SEQ ID N0:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. В другом конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206. В конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243, или их, вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO: 249, или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243, или их вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO:249, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 239 и либо SEQ ID NO: 247, либо SEQ ID NO: 249, или их вариантам, которые сохраняют функциональность. В следующем конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 241 и либо SEQ ID NO: 245, либо SEQ ID NO: 247, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 243 и SEQ ID NO: 245 или их вариантам, которые сохраняют функциональность. В конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250. В следующем конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических в отношении белка активации фибробластов (FAP). В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении FAP, соединена карбоксиконцевой пептидной связью с молекулой IL-2, молекулой IL-12, молекулой IFNα или молекулой GM-CSF, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении FAP. В следующем варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении FAP, соединена карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении FAP. В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении FAP, соединена карбоксиконцевой пептидной связью с молекулой IL-12, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении FAP. В конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171 и SEQ ID NO: 175, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO: 173, или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171, и SEQ ID NO: 175, или их вариантам, которые сохраняют функциональность, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19. SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO: 173, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. В другом конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162. SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162, SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 211, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 219, SEQ ID NO: 221, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227, или их вариантам, которые сохраняют функциональность. В следующем конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 229, SEQ ID NO: 231, SEQ ID NO: 233 и SEQ ID NO: 237, или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 211, SEQ ID NO: 219 и SEQ ID NO: 221, или их вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 231 или ее вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227, или их вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 229 или ее вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 213 и SEQ ID NO: 233 или их вариантам, которые сохраняют функциональность. В следующем конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 217 и SEQ ID NO: 237 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 221 и SEQ ID NO: 231 или их вариантам, которые сохраняют функциональность. Еще в одном конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 223 и SEQ ID NO: 229 или их вариантам, которые сохраняют функциональность. В следующем конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 225 и SEQ ID NO: 229 или их вариантам, которые сохраняют функциональность. Еще в одном конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит две полипептидные последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны SEQ ID NO: 227 и SEQ ID NO: 229 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222, SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. Еще в одном конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID N0: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222. SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. В следующем конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит по меньшей мере один, как правило, два или большее количество антигенсвязывающих фрагментов, специфических в отношении меланомного хондроитин-сульфатного протеогликана (MCSP). В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении MCSP, соединена карбоксиконцевой пептидной связью с молекулой IL-2, молекулой IL-12, молекулой IFNα или молекулой GM-CSF, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении MCSP. В другом варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, в которой тяжелая цепь первого Fab, специфического в отношении MCSP, соединена карбоксиконцевой пептидной связью с молекулой IL-2, которая в свою очередь соединена карбоксиконцевой пептидной связью с тяжелой цепью второго Fab, специфического в отношении MCSP. В конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 257, либо SEQ ID NO: 261 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 259, либо SEQ ID NO: 271 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения, антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 257, либо SEQ ID NO: 261 или их вариантам, которые сохраняют функциональность, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 259, либо SEQ ID NO: 271 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения, антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 257, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 259. В другом конкретном варианте осуществления изобретения, антигенсвязывающие фрагменты иммуноконъюгата содержат последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 261, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 259. В другом конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности либо SEQ ID NO: 258, либо SEQ ID NO: 262. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области тяжелой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью либо SEQ ID NO: 258, либо SEQ ID NO: 262. В другом конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности либо SEQ ID NO: 260, либо SEQ ID NO: 272. В следующем конкретном варианте осуществления изобретения последовательность вариабельной области легкой цепи антигенсвязывающих фрагментов иммуноконъюгата кодируется полинуклеотидной последовательностью либо SEQ ID NO: 260, либо SEQ ID NO: 272. В конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 251, либо SEQ ID NO: 255 или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 253, либо SEQ ID NO: 265 или их вариантам, которые сохраняют функциональность. В более конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в нестоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 251, либо SEQ ID NO: 255 или их вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 253, либо SEQ ID NO: 265, или их вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 251 или ее вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 253 или ее вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 255 или ее вариантам, которые сохраняют функциональность, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 253 или ее вариантам, которые сохраняют функциональность. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности либо SEQ ID NO: 252, либо SEQ ID NO: 256. Еще в одном конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 252, либо SEQ ID NO: 256. В другом конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности либо SEQ ID NO: 254, либо SEQ ID NO: 266. Еще в одном конкретном варианте осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 254, либо SEQ ID NO: 266.
Согласно одному из вариантов осуществления изобретения антигенсвязывающие фрагменты содержат по меньшей мере вариабельную область, обладающую способностью связываться с антигенной детерминантой. Вариабельные области, которые можно применять согласно настоящему изобретению, можно выводить из антител из организма мышей, приматов или человека (но, не ограничиваясь только ими). Человеческие вариабельные области можно выводить из человеческих моноклональных антител, созданных с помощью метода на основе гибридом. Клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, которые можно применять для получения человеческих моноклональных антител, описаны, например, у Kozbor и др., J Immunol. 133, 1984, cc.3001-3005 и Brodeur и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc.51-63. Человеческие вариабельные области можно получать также с использованием трансгенных животных (например, мышей), которые могут после иммунизации продуцировать популяцию человеческих антител в отсутствии эндогенного производства иммуноглобулинов. Например, описано, что гомозиготная делеция гена области стыка тяжелой цепи антитела (JH) в химерной линии и в мутанте зародышевой линии мышей приводит к полному ингибированию эндогенного производства антител. Перенос массива генов иммуноглобулинов человеческой зародышей линии в таких несущих мутант зародышевой линии мышей может приводить к производству человеческих антител после контрольного заражения антигеном (см., например, Jakobovits и др., Nature 362, 1993, cc.255-258).
В альтернативном варианте можно применять метод фагового дисплея для получения человеческих антител и человеческих вариабельных областей in vitro из популяций генов вариабельной (V) области иммуноглобулина, например, из организма иммунизированных доноров (McCafferty и др., Nature 348, 1990, cc.552-554). В одном из примеров применения этой методики гены V-области антитела клонировали в рамке считывания гена либо главного, либо минорного оболочечного белка нитчатого бактериофага, такого как М13 или fd, и экспонировали в виде функциональных фрагментов антитела на поверхности фаговой частицы.
Поскольку частица нитчатого фага содержит одноцепочечную ДНК-копию фагового генома, селекции в отношении функциональных свойств антитела/фрагментов антитела приводят также к селекции гена, кодирующего антитело/фрагменты антитела, обладающие такими свойствами. Так, фаг имитирует некоторые свойства В-клеток. Для осуществления фагового дисплея можно применять различные форматы. Обзор форматов фагового дисплея см. у Hoogenboom и др., Nucleic Acids Res. 19, 1991, cc.4133-4137. Для фагового дисплея можно использовать несколько источников сегментов V-генов. Clackson с соавторами выделяли массив разнообразных антител к оксазолону из небольшой произвольной комбинаторной библиотеки V-генов, созданной из селезенок иммунизированных мышей (см. Clackson et al., Nature 352, 1991, cc.624-628). Можно создавать популяцию человеческих V-генов из иммунизированных доноров и антитела к массивам разнообразных антигенов (включая аутоантигены) можно выделять, в целом, согласно методам, описанным у Marks и др., J.Mol.Bio. 222, 1991, cc.581-597. При естественном иммунном ответе гены антител накапливают высокий уровень мутаций (соматическое гипермутирование). Некоторые из интродуцированных изменений могут обусловливать более высокую аффинность, и В-клетки, экспонирующие обладающий высокой аффинностью поверхностный иммуноглобулин, предпочтительно реплицируются и дифференцируются в процессе последующего контрольного заражения антигеном. Этот встречающийся в естественных условиях процесс можно имитировать, применяя методику, известную как «перестановка цепи» (см. Marks и др., Biotech. 10, 1992, cc.779-783). Согласно этому методу аффинность «первичных» человеческих антител или вариабельных областей, полученных с помощью фагового дисплея, можно улучшать путем последовательной замены генов V-области тяжелой и легкой цепи на популяцию встречающихся в естественных условиях вариантов (популяции) генов V-областей, полученных из иммунизированных доноров. Эта методика позволяет получать антитела и вариабельные области, для которых характерны величины аффинности, находящиеся в наномолярном диапазоне. Стратегия создания очень больших популяций антител на фагах описана у Waterhouse и др., Nucl. Acids Res. 21, 1993, cc.2265-2266, а выделение обладающих высокой аффинностью человеческих антител непосредственно из одной большой фаговой библиотеки описано у Griffith и др., J.Cell.Bio. 120, 1993, cc.885-896. Перестановку генов можно применять также для получения человеческих антител и вариабельных областей из антител грызунов, при этом человеческое антитело или человеческая вариабельная область имеет характеристики аффинности и специфичности, сходные с характеристиками исходного антитела или вариабельной области антитела грызунов. Согласно этому методу, который обозначают также как «эпитопный импринтинг», ген V-области тяжелой или легкой цепи антител грызунов, полученных с помощью методов фагового дисплея, заменяют на популяцию генов человеческой V-области, создавая химерные антитела грызунов-человека. Селекция с использованием антигена позволяет выделять человеческие вариабельные области, обладающие способностью восстанавливать функциональный антигенсвязывающий центр, т.е. эпитоп «определяет» выбор партнера (т.е. запечатлевает, обусловливает импринтинг). Когда процесс повторяют с целью замены оставшейся V-области грызунов, получают человеческое антитело (см. РСТ публикацию WO 93/06213). В отличие от традиционной гуманизации антител грызунов метод эпитопного импринтинга обеспечивает получение полностью человеческих антител или вариабельных областей, в которых отсутствуют остатки каркасных участков или CDR грызунов.
Вариабельные области, которые можно использовать, включают также последовательности мышиных вариабельных областей, которые были либо приматизированы, либо гуманизированы, или последовательности вариабельных областей приматов, которые были гуманизированы. В контексте настоящего описания понятие «гуманизированная» относится к последовательности вариабельной области антигенсвязывающего фрагмента, полученного из антитела организма кроме человека, например, мышиного антитела, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для людей. Для этой цели можно применять различные методы, которые включают (а) трансплантацию только нечеловеческих CDR в человеческие каркасные и константные области с сохранением имеющих решающее значение остатков каркасного участка (например остатков, важных для сохранения хорошей аффинности связывания антигена или функций антитела) или без их сохранения, или (б) трансплантацию нечеловеческих вариабельных областей, но с их «маскировкой» участком, напоминающим человеческий, путем замены находящихся на поверхности остатков. Такие методы описаны у Jones и др., Morrison и др., Ргос.Natl. Acad. Sci., 81, 1984, cc.6851-6855; Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92; Verhoeyen и др., Science, 239, 1988, cc.1534-1536; Padlan, Molec. Immun., 28, 1991, cc.489-498; Padlan, Molec. Immun., 31(3), 1994, cc.169-217, все указанные публикации полностью включены в настоящее описание в качестве ссылки. В каждой из вариабельных областей тяжелой и легкой цепи антитела, как правило, присутствуют 3 гипервариабельных участка или CDR (CDR1, CDR2 и CDR3), которые фланкированы четырьмя каркасными подобластями (участками) (т.е., FR1, FR2, FR3 и FR4) в каждой из вариабельных областей тяжелой и легкой цепи антитела: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Обсуждение антител, имеющих гуманизированные вариабельные области, представлено среди прочего в US 6632927 и в опубликованной заявке на патент США №.2003/0175269, оба документа полностью включены в настоящее описание в качестве ссылки.
Аналогично этому, в контексте настоящего описания понятие «приматизированная» относится к вариабельной области антигенсвязывающего фрагмента, полученного из антитела организма кроме примата, например, мышиного антитела, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для приматов.
Выбор человеческих вариабельных областей как тяжелой, так и легкой цепи, применяемых для создания гуманизированных антигенсвязывающих фрагментов, очень важен для снижения антигенности. Согласно так называемому методу «наилучшего подбора» последовательность антигенсвязывающих фрагментов вариабельной области антитела грызунов подвергают скринингу с использованием полной библиотеки известных последовательностей человеческих вариабельных областей. Затем человеческую последовательность, наиболее сходную с последовательностью антител грызунов, отбирают в качестве человеческого каркасного участка (FR) для создания гуманизированного антигенсвязывающего фрагмента (Sims и др., J.ImmunoL, 151, 1993, с.2296; Chothia и др., J.Mol.Biol., 196, 1987, с.901). Другой метод выбора последовательности человеческого каркасного участка заключается в сравнении последовательности каждой индивидуальной подобласти полного каркасного участка антител грызунов (т.е., FR1, FR2, FR3 и FR4) или определенной комбинации индивидуальных подобластей (например FR1 и FR2) и библиотеки известных последовательностей человеческих вариабельных областей, которые соответствуют указанной каркасной подобласти (например с использованием нумерации по Кэботу), и выборе человеческой последовательности для каждой подобласти или комбинации, которая является наиболее сходной с последовательностью грызунов (заявка на патент США №2003/0040606А1). Еще один метод основан на применении конкретного каркасного участка, выведенного из консенсусной последовательности конкретной подгруппы легких и тяжелых цепей всех человеческих антител. Один и тот же каркасный участок можно применять для нескольких различных гуманизированных антигенсвязывающих фрагментов (Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с.4285; Presta и др., J.ImmunoL, 151, 1993, с.2623).
Как правило, антигенсвязывающие фрагменты иммуноконъюгата, предлагаемого в изобретении, сохраняют высокую аффинность к конкретным антигенным детерминантам и другие предпочтительные биологические свойства. Так, гуманизированные вариабельные области получают путем анализа родительских последовательностей и различных концептуальных (схематических) гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов доступны и хорошо известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных в качестве перспективных («кандидатов») последовательностей вариабельных областей иммуноглобулинов. Изучение этих изображений позволяет проанализировать вероятную роль остатков в проявлении функции последовательности вариабельной области иммуноглобулина-«кандидата», т.е. анализ остатков, которые влияют на способность вариабельной области иммуноглобулина-«кандидата» связываться с его антигеном. Таким методом можно отбирать остатки FR-участка и объединять остатки, полученные из реципиента, и «импортные» последовательности так, чтобы получать требуемые характеристики антигенсвязывающего фрагмента, такие как повышенная аффинность к антигену(ам)-мишени(ям), В целом, остатки гиперварибельных участков непосредственно и в наибольшей степени оказывают воздействие на связывание антигена.
Согласно другому варианту осуществления изобретения антигенсвязывающие молекулы, предлагаемые в настоящем изобретении, конструируют так, чтобы они обладали повышенной аффинностью связывания, например, с использованием методов, описанных в опубликованной заявке на патент США №2004/0132066, полное содержание которой включено в настоящее описание в качестве ссылки. Способность-иммуноконъюгата, предлагаемого в изобретении, связываться либо с рецептором эффекторного фрагмента, либо с конкретной антигенной детерминантой можно оценивать количественно либо с помощью твердофазного иммуноферментного анализа (ELISA), либо с помощью других методик, известных специалисту в данной области, например, с помощью поверхностного плазменного резонанса (анализ, осуществляемый с помощью системы BIACORE Т100) (Liljeblad и др., Glyco. J. 17, 2000, cc.323-329), и традиционных анализов связывания (Heeley R.Р., Endocr. Res. 28, 2002, cc.217-229).
Эффекторные фрагменты
Эффекторные фрагменты, предназначенные для применения согласно изобретению, как правило, представляют собой полипептиды, которые оказывают воздействие на клеточную активность, например, посредством путей трасндукции сигналов. Таким образом, эффекторный фрагмент иммуноконъюгата, предлагаемого в изобретении, может быть ассоциирован с опосредуемой рецептором передачей сигналов, что приводит к передаче сигнала от наружной части клеточной мембраны, модулируя ответ в клетке. Например, эффекторный фрагмент иммуноконъюгата может представлять собой цитокин. В конкретном варианте осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент, как он определен выше. В одном из вариантов осуществления изобретения один или несколько эффекторных фрагментов, как правило, одноцепочечных эффекторных фрагментов иммуноконъюгатов, предлагаемых в изобретении, представляют собой цитокины, выбранные из группы, включающей: IL-2, GM-CSF, IFN-α и IL-12. В другом варианте осуществления изобретения один или несколько одноцепочечных эффекторных фрагментов иммуноконъюгатов представляют собой цитокины, выбранные из группы, включающей: IL-8, MIP-1α, MIP-1β и TGF-β.
В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой IL-2. В конкретном варианте осуществления изобретения представляющий собой IL-2 эффекторный фрагмент может вызывать один или несколько клеточных ответов, выбранных из группы, включающей:
пролиферацию активированного Т-лимфоцита, дифференцировку активированного Т -лимфоцита, активность цитототоксической Т-клетки (CTL), пролиферацию активированной В-клетки, дифференцировку активированной В-клетки, пролиферацию естественной клетки-киллера (NK), дифференцировку NK-клетки и противоопухолевую цитотоксичность лимфокинактивированных NK (LAK-клеток). В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой GM-CSF. В конкретном варианте осуществления изобретения, представляющий собой GM-CSF эффекторный фрагмент может вызывать пролиферацию и/или дифференцировку грнанулоцита, моноцита или дендритной клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой IFN-α. В конкретном варианте осуществления изобретения представляющий собой IFN-α эффекторный фрагмент может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: ингибирование репликации вирусов в инфицированной вирусом клетке и повышающую регуляцию экспрессии главного комплекса гистосовместимости I (ГКС I). В другом конкретном варианте осуществления изобретения представляющий собой IFN-α эффекторный фрагмент может ингибировать пролиферацию опухолевой клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой IL-12. В конкретном варианте осуществления изобретения представляющий собой IL-12 эффекторный фрагмент может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: пролиферацию NK-клетки, дифференцировку NK-клетки, пролиферацию Т-клетки и дифференцировку Т-клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой IL-8. В конкретном варианте осуществления изобретения эффекторный фрагмент, представляющий собой IL-8, может вызывать хемотаксис нейтрофилов. В одном из вариант осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой MIP-1α. В конкретном варианте осуществления изобретения представляющий собой MIP-1α эффекторный фрагмент может вызывать хемотаксис моноцитов и Т-лимфоцитов. В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой MIP-1β. В конкретном варианте осуществления изобретения эффекторный фрагмент, представляющий собой MIP-1β, может вызывать хемотаксис моноцитов и Т-лимфоцитов. В одном из вариантов осуществления изобретения эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, иммуноконъюгата представляет собой TGF-β. В конкретном варианте осуществления изобретения эффекторный фрагмент, представляющий собой TGF-β, может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: хемотаксис моноцитов, хемотаксис макрофагов, повышающую регуляцию экспрессии IL-1 в активированных макрофагах и повышающую регуляцию экспрессии IgA в активированных В-клетках.
Полипептиды и полинуклеотиды иммуноконъюгатов
Иммуноконъюгаты, предлагаемые в изобретении, содержат полипептиды и их фрагменты. В контексте настоящего описания подразумевается, что понятие «полипептид» относится как к индивидуальному «полипептиду», так и к множеству «полипептидов» и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (которые обозначают также как пептидные связи). Понятие «полипептид» относится к любой цепи или цепям, состоящей(им) из двух или большего количества аминокислот, и не подразумевает, что продукт имеет конкретную длину. Так, пептиды, дипептиды, трипептиды, олигопептиды, «белок», «аминокислотная цепь» или любое иное общепринятое понятие, относящееся к цепи или цепям, состоящей(им) из двух или большего количества аминокислот, все подпадают под определение «полипептид», и понятие «полипептид» можно применять вместо или взаимозаменяемо с любым из указанных понятий. Подразумевается также, что понятие «полипептид» относится в продуктам, которые несут пост-экспрессионные модификации полипептида, включая (но, не ограничиваясь только ими) гликозилирование, ацетилирование, фосфорилирования, амидирование, дериватизацию с использованием известных защитных/блокирующих групп, протеолитическое расщепление или модификацию с помощью не встречающихся в естественных условиях аминокислот.Полипептид можно получать из встречающегося в естественных условиях биологического источника или можно получать с помощью метода рекомбинантной ДНК, и его не обязательно транслировать с созданной нуклеотидной последовательности. Его можно создавать любым путем, включая химический синтез.
Полипептид, предлагаемый в изобретении, может состоять примерно из 3 или более, 5 или более, 10 или более, 20 или более, 25 или более, 50 или более, 75 или более, 100 или более, 200 или более, 500 или более, 1000 или более или 2000 или более аминокислот. Полипептиды могут иметь определенную трехмерную структуру, хотя наличие такой структуры не является обязательным. Полипептиды с определенной трехмерной структурой обозначают как полипептиды, имеющие укладку, а Полипептиды, которые не обладают определенной трехмерной структурой, но которые легче могут адаптироваться к большому количеству различных конформаций, обозначают как полипептиды, не имеющие укладку.
Под «выделенным» полипептидом или его вариантом, или производным подразумевают полипептид, который не находится в его естественном окружении. Не требуется какого-то конкретного уровня очистки. Например, выделенный полипептид можно удалять из его нативного или естественного окружения. Полученные путем рекомбинации полипептиды и белки, экспрессируемые в клетках-хозяевах, рассматриваются как выделенные для целей настоящего изобретения, если они представляют собой нативные или рекомбинантные полипептиды, которые отделены, фракционированы или частично или полностью очищены с помощью любого приемлемого метода.
Кроме того, к полипептидам согласно настоящему изобретению относятся производные, аналоги или варианты вышеуказанных полипептидов и любая их комбинация. Понятия «вариант», «производное» и «аналог», когда они относятся к полипептидам, предлагаемым в настоящем изобретении, включают любые полипептиды, которые сохраняют по меньшей мере частично биологические, антигенные или иммуногенные свойства соответствующего нативного полипептида. Варианты полипептидов, предлагаемых в настоящем изобретении, включают полипептиды с измененными в результате аминокислотных замен, делеций или инсерций аминокислотными последовательностями. Варианты могут встречаться или не встречаться в естественных условиях. Не встречающиеся в естественных условиях варианты можно получать с помощью известных в данной области методов мутагенеза. Варианты полипептидов могут содержать консервативные или неконсервативные аминокислотные замены, делеций или добавления. Производными полипептидов, предлагаемых в настоящем изобретении, являются полипептиды, которые изменены таким образом, чтобы обладать дополнительными особенностями, которые не присущи нативному полипептиду. Их примерами являются слитые белки. Варианты полипептидов в контексте настоящего описания можно обозначать также как «полипептидные аналоги». В контексте настоящего описания «производное» полипептида относится к рассматриваемому полипептиду, в котором один или несколько остатков дериватизированы химически в результате взаимодействия, в котором участвуют функциональные группы боковой цепи. Под понятие «производные» подпадают также пептиды, которые содержат одно или несколько производных двадцати встречающихся в естественных условиях аминокислот. Например, пролин может быть заменен на 4-гидроксипролин; лизин заменен на 5-гидроксилизин; гистидин может быть заменен на 3-метилгистидин; серии может быть заменен на гомосерин; и лизин может быть заменен на орнитин.
Альтернативно этому рекомбинантные варианты, кодирующие такие же или сходные полипептиды, можно синтезировать или отбирать на основе «избыточности» генетического кода. Различные замены кодонов, такие как «молчащие» замены, которые приводят к получению различных сайтов рестрикции, можно интродуцировать с целью оптимизации клонирования в плазмидном или вирусном векторе или экспрессии в конкретной прокариотической или эукариотической системе. Мутации в полинуклеотидной последовательности могут проявляться в полипептиде или доменах других пептидов, добавленных к полипептиду для модификации свойств любого фрагмента полипептида с целью изменения характеристик, таких как аффинность связывания лиганда, внутрицепочечная аффинность или скорость расщепления/обновления.
Предпочтительно аминокислотные «замены» являются результатом замены одной аминокислоты другой аминокислотой, которая имеет сходные структурные и/или химические свойства, т.е. консервативные аминокислотные замены. «Консервативные» аминокислотные замены можно создавать на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы используемых для этой цели остатков. Например, к неполярным (гидрофобным) аминокислотам относятся аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; к полярным нейтральным аминокислотам относятся глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; к положительно заряженным (основным) аминокислотам относятся аргинин, лизин и гистидин; и к отрицательно заряженным (кислотным) аминокислотам относятся аспарагиновая кислота и глутаминовая кислота. «Инсерции» или «делеции» предпочтительно затрагивают примерно 1-20 аминокислот, более предпочтительно 1-10 аминокислот. Приемлемую вариацию можно определять экспериментально, систематически создавая инсерции, делеции или замены аминокислот в полипептидной молекуле с помощью методов рекомбинантной ДНК и анализируя активность полученных рекомбинантных вариантов.
Под полипептидом, аминокислотная последовательность которого, например, по меньше мере на 95% «идентична» «запрашиваемой» аминокислотной последовательности (референс-последовательности), предлагаемой в настоящем изобретении, подразумевается, что аминокислотная последовательность анализируемого полипептида идентична референс-последовательности за исключением того, анализируемая полипептидная последовательность может включать вплоть до пяти аминокислотных замен на каждые 100 аминокислот в аминокислотной референс-последовательности. Другими словами для получения полипептида, имеющего аминокислотную последовательность, идентичную по меньшей мере на 95% аминокислотной референс-последовательности, можно встраивать, изымать путем делеции или заменять другими аминокислотами вплоть до 5% аминокислотных остатков анализируемой последовательности. Эти изменения референс-последовательности могут иметь место в амино- или карбоксиконцевых положениях аминокислотной референс-последовательности или в иных сайтах между этими концевыми положениями, которые встроены либо индивидуально между остатками в референс-последовательности или в одну или несколько смежных групп в референс-последовательности.
С практической точки зрения определять является ли любой конкретный полипептид по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичным референс-полипептиду, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения референс-последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательностей, можно использовать компьютерную программу FASTDB, основанную на алгоритме, описанном у Brutlag и др., Сотр. Арр. Biosci. 6, 1990, cc.237-245. При сравнительном анализе последовательностей как референс-последовательность, так и анализируемая последовательность обе представляют собой либо нуклеотидные последовательности, либо аминокислотные последовательности. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами для расчета процента идентичности, используемыми в программе FASTDB для сравнительного анализа аминокислотных последовательностей, являются: матрица = РАМ 0, k-запись в базе данных = 2, штраф за несовпадение = 1, штраф за присоединение = 20, длина рандомизированной группы = 0, балл за «срезание» = 1, размер окна = длина последовательности, штраф за брешь = 5, штраф за размер бреши = 0,05, размер окна = 500 или он равен длине анализируемой аминокислотной последовательности в зависимости от того, что короче.
Если анализируемая последовательность короче референс-последовательности вследствие наличия делеций на N- или С-конце, но не вследствие внутренних делеций, то результаты следует скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на N- и С-конце анализируемой последовательности при расчете глобального процента идентичности. Для анализируемых последовательностей, укороченных на N- и С-концах по отношению к референс-последовательности, процент идентичности корректируют путем вычисления количества остатков референс-последовательности, расположенных за N- и С-концами анализируемой последовательности, которые не совпали/не выровнены относительно соответствующего остатка анализируемой последовательности, в виде процента от общего количества оснований референс-последовательности. Совпадает ли/выровнен ли остаток, определяется результатами сравнительного анализа последовательностей с помощью программы FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью указанной выше программы FASTDB, с использованием указанных заданных параметров, в результате чего получают окончательную оценку процента идентичности. Эту конечную скорректированную оценку процента идентичности используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности при расчете учитывают только остатки, расположенные за N- и С-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программы FASTDB, которые не совпадали/не выровнены относительно референс-последовательности. Таким образом, учитывают только остатки референс-последовательности, находящиеся в положениях, которые расположены вне наиболее удаленных N- и С-концевых остатков анализируемой последовательности.
Например, для определения процента идентичности анализируемую аминокислотную последовательность, содержащую 90 остатков, сравнивают с референс-последовательностью, содержащей 100 остатков. Ha N-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения при сравнительном анализе для 10 первых остатков на N-конце. 10 несовпавших остатков представляют собой 10% последовательности (количество несовпавших остатков на N- и С-концах/общее количество остатков в референс-последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 остатков идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность, содержащую 90 остатков, сравнивают с референс-последовательностью, содержащей 100 остатков. В данном случае делеции представляют собой внутренние делеции, так что на N- или С-конце анализируемой последовательности не имеется остатков, которые не совпадают при сравнительном анализе с референс-последовательностью. В этом случае процент идентичности, рассчитанный с помощью программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что при сравнительном анализе, осуществляемом с помощью программы FASTDB, вручную осуществляют коррекцию только для несовпавших/невыровненных остатков, которые расположены вне N- и С-концов анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций.
Полипептиды, предлагаемые в изобретении, включают полипептиды, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны последовательностям, представленным ниже в таблицах 3 и 4, включая их функциональные фрагменты или варианты. Под объем изобретения подпадают также полипептиды, которые содержат последовательности, представленные в таблицах 3 или 4, с консервативными аминокислотными заменами.
Полипептиды, предлагаемые в изобретении, могут кодироваться индивидуальным полинуклеотидом. В другом варианте они могут кодироваться несколькими (например, двумя или большим количеством) полинуклеотидов, в результате чего происходит коэкспрессия полипептидов. Полипептиды, которые коэкспрессируются с нескольких полинуклеотидов, могут быть связаны посредством, например, дисульфидных мостиков или другими путями, с образованием функционального иммуноконъюгата. Например, участок тяжелой цепи антигенсвязывающего фрагмента может кодироваться полинуклеотидом, отличным от того, который кодирует часть иммуноконъюгата, которая содержит участок легкой цепи антигенсвязывающего фрагмента и эффекторный фрагмент. При коэкспрессии полипептиды тяжелой цепи могут быть связаны с полипептидами легкой цепи с образованием антигенсвязывающего фрагмента. В другом альтернативном примере участок легкой цепи антигенсвязывающего фрагмента может кодироваться полинуклеотидом, отличным от кодирующего часть иммуноконъюгата, которая включает участок тяжелой цепи антигенсвязывающего фрагмента и эффекторный фрагмент.
Иммуноконъюгаты, предлагаемые в настоящем изобретении, и их фрагменты, как правило, кодируются полинуклеотидами. Подразумевается, что понятие «полинуклеотид» относится к индивидуальной нуклеиновой кислоте, а также к множеству нуклеиновых кислот и относится к выделенной молекуле нуклеиновой кислоты или конструкции, например, матричной РНК (мРНК), РНК вирусного происхождения или плазмидной ДНК (пДНК). Полинуклеотид может содержать обычную фосфодиэфирную связь или не традиционную связь (например, амидную связь, такую, которая присутствует в пептидных нуклеиновых кислотах (ПНК)). Понятие «нуклеиновая кислота» относится к любому одному или нескольким сегментам нуклеиновой кислоты, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде. Под «выделенной» нуклеиновой кислотой или полинуклеотидом подразумевается молекула нуклеиновой кислоты, т.е. ДНК или РНК, которая отделена от ее нативного окружения. Например, рекомбинантный полинуклеотид, кодирующий входящий в вектор терапевтический полипептид, рассматривается как выделенный для целей настоящего изобретения. Другими примерами выделенного полинуклеотида являются рекомбинантные полинуклеотиды, присутствующие в гетерологичных клетках-хозяевах, или очищенные (частично или полностью) полинуклеотиды, находящиеся в растворе. Выделенные молекулы РНК включают полученные in vivo или in vitro РНК-транскрипты, предлагаемые в настоящем изобретении, а также формы с позитивной и негативной цепью и двухцепочечные формы пестивирусных векторов, которые представлены в настоящем описании.
Выделенные полинуклеотиды или нуклеиновые кислоты, предлагаемые в настоящем изобретении, включают также указанные молекулы, полученные с помощью синтеза. Кроме того, полинуклеотид или нуклеиновая кислота может включать регуляторный элемент, такой как промотор, сайт связывания рибосом или терминатор транскрипции.
В контексте настоящего описания «кодирующая область» представляет собой часть нуклеиновой кислоты, которая состоит из кодонов, транслируемых в аминокислоты. Хотя «стоп-кодон» (TAG, TGA или ТАА) не транслируется в аминокислоту, он может рассматриваться, если присутствует, как часть кодирующей области, в то время как любые фланкирующие последовательности, например, промоторы, сайты связывания рибосом, терминаторы транскрипции, интроны, 5' -и 3'-нетранслируемые области и т.п., не являются частью кодирующей области. Две или большее количество кодирующих областей, предлагаемых в настоящем изобретении, могут присутствовать в одной полинуклеотидной конструкции, например, в одном векторе, или в различных полинуклеотидных конструкциях, например, в отдельных (различных) векторах. Кроме того, любой вектор может содержать одну кодирующую область или может содержать две или большее количество кодирующих областей, например, вектор, предлагаемый в настоящем изобретении, может кодировать один или несколько полипротеинов, которые при пост- или котрансляции отделяются друг от друга в конечных белках посредством протеолитического расщепления. Кроме того, вектор, полинуклеотид или нуклеиновая кислота, предлагаемый/предлагаемая в изобретении, может кодировать гетерологичные кодирующие области, либо слитые, либо не слитые с первой или второй нуклеиновой кислотой, которая кодирует иммуноконъюгат, предлагаемый в изобретении, или его вариант или производное. Гетерологичные кодирующие области включают (но, не ограничиваясь только ими) специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен.
В конкретных вариантах осуществления изобретения полинуклеотид или нуклеиновая кислота представляет собой ДНК. В случае ДНК полинуклеотид, содержащий нуклеиновую кислоту, которая кодирует полипептид, в норме может включать промотор и/или другие контролирующие транскрипцию или трансляцию элементы, функционально связанные с одной или несколькими кодирующими областями. Под понятием «функционально связана» подразумевается, что кодирующая область генного продукта, например полипептида, связана с одной или несколькими регуляторными последовательностями таким образом, что экспрессия генного продукта находится под воздействием или контролем регуляторной(ых) последовательности(ей). Два ДНК-фрагмента (такие как кодирующая область полипептида и связанный с ней промотор) являются «функционально связанными», если индукция функции промотора приводит к транскрипции мРНК, кодирующей требуемый генный продукт, и если природа связи между двумя ДНК-фрагментами не оказывает воздействие на способность регулирующих экспрессию последовательностей обеспечивать экспрессию генного продукта или оказывать воздействие на способность ДНК-матрицы транскрибироваться. Таким образом, промоторная область может рассматриваться в качестве функционально связанной с кодирующей полипептид нуклеиновой кислотой, если промотор обладает способностью влиять на транскрипцию нуклеиновой кислоты. Промотор может представлять собой специфический для клетки промотор, который обеспечивает в основном транскрипцию ДНК только в предварительно отобранных клетках. Другие, отличные от промотора, контролирующие транскрипцию элементы, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, можно функционально связывать с полинуклеотидом для обеспечения специфической для клетки транскрипции. Приемлемые промоторы и другие контролирующие транскрипцию области указаны в настоящем описании.
Специалистам в данной области известны различные контролирующие транскрипцию области. Они включают (но, не ограничиваясь только ими) контролирующие транскрипцию области, которые функционируют в клетках позвоночных, такие как (но, не ограничиваясь только ими) промоторные и энхансерные сегменты из цитомегаловирусов (например, немедленно-ранний промотор, в сочетании с интроном-А), из обезьяньего вируса 40 (например, ранний промотор) и ретровирусов (таких, например, как вирус саркомы Рауса). Другие контролирующие транскрипцию области включают области, полученные из генов позвоночных, таких как гены актина, белка теплового шока, бычьего гормона роста и кроличьего β-глобина, а также другие последовательности, обладающие способностью контролировать генную экспрессию в эукариотических клетках. К дополнительным приемлемым контролирующим транскрипцию областям относятся тканеспецифические промоторы и энхансеры, а также индуцируемые лимфокинами промоторы (например, промоторы, индуцируемые интерферонами или интерлейкинами).
Обычному специалисту в данной области известны также различные контролирующие трансляцию элементы. К ним относятся (но, не ограничиваясь только ими) сайты связывания рибосом, кодоны инициации и терминации трансляции и элементы, имеющие происхождение из вирусных систем (в частности, внутренний сайт связывания (посадки) рибосом или IRES, который обозначают также как CITE-последовательность).
В других вариантах осуществления изобретения полинуклеотид, предлагаемый в настоящем изобретении, представляет собой РНК, например, в форме матричной РНК (мРНК). РНК, предлагаемая в настоящем изобретении, может быть одноцепочечной или двухцепочечной.
Предлагаемые в настоящем изобретении кодирующие области полинуклеотида и нуклеиновой кислоты могут быть ассоциированы с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, которые обеспечивают секрецию полипептида, кодируемого полинуклеотидом, предлагаемым в настоящем изобретении. Согласно гипотезе о роли сигналов белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, которая отщепляется от зрелого белка, когда инициируется экспорт растущей белковой цепи через эндоплазматический ретикулум. Обычным специалистам в данной области известно, что полипептиды, секретируемые клетками позвоночных, как правило, несут сигнальный пептид, слитый с N-концом полипептида, который отщепляется от полного или «полноразмерного (процессированного)» полипептид с образованием секретируемой или «зрелой» формы полипептида. В конкретных вариантах осуществления изобретения применяют нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина или его функциональное производное, последовательность которого сохраняет способность обеспечивать секрецию полипептида, функционального связанного с ним. В альтернативном варианте можно применять гетерологичный сигнальный пептид млекопитающих или его функциональное производное. Например, лидерную последовательность дикого типа можно заменять на лидерную последовательность человеческого тканевого активатора плазминогена (ТРА) или мышиной β-глюкуронидазы.
Понятие «кассета экспрессии) относится к полинуклеотиду, полученному с помощью рекомбинации или синтеза, который содержит серии специфических нуклеотидных элементов, которые обеспечивают транскрипцию конкретной нуклеиновой кислоты в клетке-мишени. Рекомбинантную кассету экспрессии можно встраивать в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Как правило, рекомбинантная кассета экспрессии, представляющая собой часть экспрессионного вектора, включает среди прочих последовательностей подлежащую транскрипции нуклеотидную последовательность и промотор. В одном из вариантов осуществления изобретения кассета экспрессии, предлагаемая в изобретении, содержит полинуклеотидные последовательности, которые кодируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты.
Понятие «экспрессионный вектор» является синонимом понятия «экспрессионная конструкция» и относится к молекуле ДНК, которую применяют для интродукции и обеспечения экспрессии конкретного гена, с которой он функционально связан с клетке-мишени. Экспрессионный вектор, предлагаемый в настоящем изобретении, содержит кассету экспрессии. Экспрессионные векторы позволяют осуществлять транскрипцию больших количеств стабильной мРНК. Когда экспрессионный вектор находится внутри клетки-мишени, то молекула рибонуклеиновой кислоты или белок, который кодируется геном, продуцируется в результате клеточного механизма транскрипции и/или трансляции. В одном из вариантов осуществления изобретения экспрессионный вектор, предлагаемый в изобретении, содержит кассету экспрессии, которая включает полинуклеотидные последовательности, которые кодируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты.
Понятие «искусственный» относится к синтетической или выведенной из клетки, не являющейся хозяином, композиции, например, синтезированному химическим путем олигонуклеотиду.
Понятие нуклеиновая кислота или полинуклеотид, имеющая/имеющий нуклеотидную последовательность, по меньшей мере, например, на 95% «идентичную» нуклеотидной референс-последовательности, предлагаемой в настоящем изобретении, означает, что нуклеотидная последовательность полинуклеотида идентична референс-последовательности за исключением того, что полинуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов нуклеотидной референс-последовательности. Другими словами для получения полинуклеотида, имеющего нуклеотидную последовательность, идентичную по меньшей мере на 95% нуклеотидной референс-последовательности, можно изымать путем делеции или заменять другими нуклеотидами вплоть до 5% нуклеотидов референс-последовательности или вплоть до 5% от общего количества нуклеотидов в референс-последовательности можно встраивать в референс-последовательность.
С практической точки зрения определять является ли любая конкретная молекула нуклеиновой кислоты или полипептид по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной/идентичным нуклеотидной последовательности или полипептидной последовательности, предлагаемой в настоящем изобретении, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения референс-последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательности, можно использовать компьютерную программу FASTDB, основанную на алгоритме, описанном у Brutlag и др., Сотр. Арр. Biosci. 6, 1990, cc.237-245. При сравнительном анализе последовательностей как референс-последовтаельность, так и анализируемая последовательность обе представляют собой последовательности ДНК. Последовательности РНК можно сравнивать путем замены остатков U на Т. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами для расчета процента идентичности, используемыми в программе FASTDB сравнительного анализа последовательностей ДНК являются: матрица = унитарная, k-запись в базе данных = 4, штраф за несовпадение = 1, штраф за присоединение = 30, длина рандомизированной группы = 0, балл за «срезание» = 1, штраф за брешь = 5, штраф за размер бреши 0,05, размер окна = 500 или он равен длине анализируемой нуклеотидной последовательности, в зависимости от того, что короче.
Если анализируемая последовательность короче референс-последовательности вследствие наличия делеций на 5'- или 3'-конце, но не вследствие внутренних делеций, то результаты можно скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на 5'- и 3'-конце анализируемой последовательности при расчете процента идентичности. Для анализируемых последовательностей, укороченных на 5'- или 3'-концах по отношению к референс-последовательности, процент идентичности корректируют путем вычисления количества оснований референс-последовательности, расположенных за 5'- и 3'-концами анализируемой последовательности, которые не совпали/не выровнены, в виде процента от общего количества оснований в референс-последовательности. Совпадают ли/выровнены ли нуклеотиды, определяется результатами сравнительного анализа последовательностей с помощью программы FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью указанной выше программы FASTDB, с использованием указанных заданных параметров, в результате чего получают окончательную оценку процента идентичности. Эту скорректированную оценку используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности при расчете учитывают только основания, расположенные за 5'- и 3'-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программы FASTDB, которые не совпадали/не выровнены относительно референс-последовательности.
Например, для определения процента идентичности анализируемую последовательность длиной 90 оснований сравнивают с референс-последовательностью длиной 100 оснований. На 5'-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения/анализировать 10 первых оснований на 5'-конце. 10 неспаренных оснований представляют собой 10% последовательности (количество несовпавших оснований на 5'- и 3'-концах/общее количество оснований в референс-последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 оснований идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность длиной 90 оснований сравнивают с референс-последовательностью длиной 100 оснований. В данном случае делеции представляют собой внутренние делеции, так что на 5'- или 3'-конце анализируемой последовательности не имеется оснований, которые не совпадали/не проанализированы в сравнении с референс-последовательностью. В этом случае процент идентичности, рассчитанный с помощью программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что вручную осуществляют коррекцию только для оснований, которые не совпали/не выровнены на 5'- и 3'-концах анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций.
Полинуклеотиды, предлагаемые в изобретении, включают полинуклеотиды, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны последовательностям, представленным ниже в таблицах 6 и 8, включая их функциональные фрагменты или варианты. Полинуклеотиды можно экспрессировать в виде индивидуального полинуклеотида, который кодирует полный иммуноконъюгат, или в виде нескольких (например, двух или большего количества) полинуклеотидов, в результате чего происходит коэкспрессия полипептидов. Полипептиды, кодируемые совместно экспрессируемыми полинуклеотидами, могут быть связаны посредством, например, дисульфидных мостиков или другими путями, с образованием функционального иммуноконъюгата. Например, участок тяжелой цепи антигенсвязывающего фрагмента может кодироваться полинуклеотидом, отличным от того, который кодирует часть иммуноконъюгата, которая содержит участок легкой цепи антигенсвязывающего фрагмента и эффекторный фрагмент. При коэкспрессии полипептиды тяжелой цепи могут быть связаны с полипептидами легкой цепи с образованием антигенсвязывающего фрагмента. В другом альтернативном примере участок легкой цепи антигенсвязывающего фрагмента может кодироваться полинуклеотидом, отличным от кодирующего часть иммуноконъюгата, которая включает участок тяжелой цепи антигенсвязывающего фрагмента и эффекторный фрагмент.
В конкретном варианте осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, содержащий по меньшей мере один эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, и по меньшей мере один, предпочтительно два или большее количество антигенсвязывающих фрагментов, причем, первый эффекторный фрагмент соединен амино- или карбоксиконцевой пептидной связью с первым антигенсвязывающим фрагментом, второй антигенсвязывающий фрагмент соединен амино- или карбоксиконцевой пептидной связью либо с первым эффекторным фрагментом, либо с первым антигенсвязывающим фрагментом. В предпочтительном варианте осуществления изобретения антигенсвязывающие фрагменты независимо друг от друга выбирают из группы, включающей Fv и Fab. В другом конкретном варианте осуществления изобретения полинуклеотид кодирует тяжелые цепи двух антигенсвязывающих фрагментов и один из эффекторных фрагментов. В другом конкретном варианте осуществления изобретения полинуклеотид кодирует легкие цепи двух антигенсвязывающих фрагментов и один из эффекторных фрагментов. В другом конкретном варианте осуществления изобретения полинуклеотид кодирует одну легкую цепь одного из антигенсвязывающих фрагментов, одну тяжелую цепь второго антигенсвязывающего фрагмента и один из эффекторных фрагментов.
В другом конкретном варианте осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, причем, полинуклеотид кодирует тяжелые цепи двух молекул Fab и эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент. В другом конкретном варианте осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, причем, полинуклеотид кодирует легкие цепи двух молекул Fab и эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент. В другом конкретном варианте осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, причем, полинуклеотид кодирует тяжелую цепь одной из молекул Fab, легкую цепь второй молекулы Fab и эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует иммуноконъюгат, который содержит по меньшей мере один эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, сцепленный с помощью его амино- и карбоксиконцевых аминокислот с одной или несколькими молекулами scFv.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, который содержит по меньшей мере один эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, и по меньшей мере первый и второй антигенсвязывающие фрагменты, причем, каждый из антигенсвязывающих фрагментов содержит молекулу scFv, сцепленную с помощью его карбоксиконцевой аминокислоты с константной областью, содержащей константную область иммуноглобулина, независимо друг от друга выбранную из группы, включающей СН1 IgG1, Скаппа IgG и СН4 IgE, и в котором один из антигенсвязывающих фрагментов сцеплен с помощью карбоксиконцевой аминокислоты константной области с аминоконцевой аминокислотой одного из эффекторных фрагментов и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через дисульфидный мостик. В другом варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, кодирует один из антигенсвязывающих фрагментов и эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, который содержит первый и второй эффекторные фрагменты и два антигенсвязывающих фрагмента, причем, каждый из антигенсвязывающих фрагментов содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с константной областью, которая содержит константную область иммуноглобулина, и в котором один из антигенсвязывающих фрагментов сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой одного из эффекторных фрагментов и в котором второй антигенсвязывающий фрагмент сцеплен с помощью карбоксиконцевой аминокислоты его константной области с аминоконцевой аминокислотой второго эффекторного фрагмента, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через дисульфидный мостик. В предпочтительном варианте осуществления изобретения первый и/или второй эффекторный фрагменты представляют собой одноцепочечные эффекторный фрагменты. В предпочтительном варианте осуществления изобретения константную область независимо друг от друга выбирают из группы, включающей СН1 IgG1, Cкаппа IgG и СН4 IgE. В другом варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, кодирует один из антигенсвязывающих фрагментов и один из эффекторных фрагментов.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, который содержит по меньшей мере один эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент, и по меньшей мере первый и второй антигенсвязывающие фрагменты, причем, каждый из антигенсвязывающих фрагментов содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с СН3-доменом IgG, и в котором один из антигенсвязывающих фрагментов сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через дисульфидный мостик. В другом варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, кодирует один из антигенсвязывающих фрагментов и эффекторный фрагмент, предпочтительно одноцепочечный эффекторный фрагмент.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, который содержит два эффекторных фрагмента и два антигенсвязывающих фрагмента, причем, каждый из антигенсвязывающих фрагментов содержит молекулу scFv, сцепленную с помощью ее карбоксиконцевой аминокислоты с СН3-доменом IgG, и в котором один из антигенсвязывающих фрагментов сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором второй антигенсвязывающий фрагмент сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой второго эффекторного фрагмента, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через дисульфидный мостик. В предпочтительном варианте осуществления изобретения первый и/или второй эффекторный фрагменты представляют собой одноцепочечные эффекторные фрагменты. В другом варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, кодирует один из антигенсвязывающих фрагментов и один из эффекторных фрагментов, предпочтительно одноцепочечный эффекторный фрагмент.
В одном из вариантов осуществления изобретения выделенный полинуклеотид, предлагаемый в изобретении, кодирует фрагмент иммуноконъюгата, который содержит два эффекторных фрагмента и два антигенсвязывающих фрагмента, причем, каждый из антигенсвязывающих фрагментов содержит молекулу Fab, сцепленную с помощью карбоксиконцевой аминокислоты ее тяжелой или легкой цепи с СН3-доменом IgG1, и в котором каждый из СН3-доменов IgG1 сцеплен с помощью его карбоксиконцевой аминокислоты с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через дисульфидный мостик. В предпочтительном варианте осуществления изобретения первый и/или второй эффекторные фрагменты представляют собой одноцепочечные эффекторные фрагменты. В следующем варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, содержит последовательность, которая кодирует вариабельную область тяжелой цепи одного из антигенсвязывающих фрагментов и один из указанных эффекторных фрагментов, предпочтительно одноцепочечный фрагмент. Еще в одном варианте осуществления изобретения полинуклеотид, предлагаемый в изобретении, содержит последовательность, которая кодирует вариабельную область легкой цепи одного из антигенсвязывающих фрагментов и один из эффекторных фрагментов, предпочтительно одноцепочечный эффекторный фрагмент.
Другим вариантом осуществления настоящего изобретения является выделенный полинуклеотид, который кодирует иммуноконъюгат или его фрагмент, где полинуклеотид содержит последовательность, кодирующую последовательность вариабельной области, которая представлена ниже в таблице 3. Другим вариантом осуществления настоящего изобретения является выделенный полинуклеотид, который кодирует иммуноконъюгат или его фрагмент, где полинуклеотид содержит последовательность, кодирующую полипептидную последовательность, представленную в таблице 4. Следующим вариантом осуществления изобретения является также выделенная нуклеиновая кислота, кодирующая иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична нуклеотидной последовательность, представленной ниже в таблицах 6 и 8. Следующим вариантом осуществления изобретения является выделенная нуклеиновая кислота, кодирующая иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит нуклеотидную последовательность, представленную в таблицах 6 и 8. Следующим вариантом осуществления изобретения является выделенная нуклеиновая кислота, кодирующая иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит последовательность, кодирующую последовательность вариабельной области, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, представленной в таблице 3. Другим вариантом осуществления изобретения является выделенная нуклеиновая кислота, кодирующая иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит последовательность, кодирующую полипептидную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, представленной в таблице 4. Изобретение относится к выделенной нуклеиновой кислоте, кодирующей иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит последовательность, которая кодирует последовательности вариабельных областей, представленные в таблице 3, с консервативными аминокислотными заменами. Изобретение относится также к выделенной нуклеиновой кислоте, кодирующей иммуноконъюгат или его фрагмент, где нуклеиновая кислота содержит последовательность, которая кодирует последовательности вариабельных областей, представленные в таблице 4, с консервативными аминокислотными заменами.
Клетки-хозяева
В контексте настоящего описания понятие «клетка-хозяин» относится к любому типу клеточной системы, которую можно сконструировать для производства иммуноконъюгатов, предлагаемых в изобретении, или их фрагментов. Согласно одному из вариантов осуществления изобретения клетку-хозяина конструируют так, чтобы с ее помощью получать фрагмент иммуноконъюгата. Клетки-хозяева представляют собой клетки, которые можно культивировать, например (но, не ограничиваясь только ими), культивируемые клетки млекопитающих, такие как СНО-клетки, ВНК-клетки, NS0-клетки, SP2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, РЕК.С6-клетки или клетки гибридомы, клетки дрожжей, клетки насекомых, бактериальные и растительные клетки, а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В одном из вариантов осуществления изобретения клетка-хозяин, предлагаемая в изобретении, содержит экспрессионный вектор, несущий полинуклеотидные последовательности, которые кодируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты. Клетки-хозяева, предлагаемые в изобретении, могут представлять собой эукариотические или прокариотические клетки. Очистка полипептидов иммуноконъюгата и его фрагментов Иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты можно очищать с помощью известных в данной области методов, таких как высокоэффективная жидкостная хроматография, ионообменная хроматография, гель-электрофорез, аффинная хроматография, гель-фильтрация и т.п. Фактические условия, применяемые для очистки конкретного белка, должны зависеть, в частности, от таких факторов, как чистый заряд, гидрофобность, гидрофильность и т.д., и они известны специалистам в данной области.
Для очистки с помощью аффинной хроматографии можно применять матрицу на основе белка А или белка G. В альтернативном варианте для очистки с помощью аффинной хроматографии можно применять любое антитело, которое специфически связывается с одноцепочечным эффекторным фрагментом иммуноконъюгата. Для получения антител различных животных-хозяев, таких как (но, не ограничиваясь только ими) кролики, мыши, крысы и т.д., можно иммунизировать путем введения иммуноконъюгата, предлагаемого в изобретении, или его фрагмента. Иммуноконъюгат можно присоединять к приемлемому носителю, такому как бычий сывороточный альбумин (БСА), с помощью функциональной группы боковой цепи или линкеров, связанных с функциональной группой боковой цепи. Для повышения иммунологического ответа в зависимости от видов-хозяев можно применять различные адъюванты, включая (но, не ограничиваясь только ими) адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин из лимфы улитки, динитрофенол, а также пригодные для введения человеку адъюванты, такие как БЦЖ (бацилла Кальметта-Герена) и Cornyebacterium parvum. Таким образом, одним из вариантов осуществления изобретения является способ получения иммуноконъюгатов, предлагаемых в изобретении, заключающийся в том, что культивируют клетку-хозяина, которая содержит экспрессионный вектор, несущий полинуклеотидные последовательности, которые кодируют иммуноконъюгаты, предлагаемые в изобретении, или их фрагменты в условиях, пригодных для их экспрессии.
Методы применения иммуноконъюгатов
Иммуноконъюгаты, предлагаемые в изобретении, можно применять для направленного переноса специфических антигенных детерминант и стимуляции различных клеточных ответов в клетках-мишенях и в постоянно обновляющихся иммунокомпетентных клетках. Иммуноконъюгат, предлагаемый в изобретении, можно применять также в качестве диагностического реагента. Связывание иммуноконъюгата с антигенной детерминантой легко можно выявлять с помощью вторичного антитела, специфического в отношении эффекторного фрагмента. В одном из вариантов осуществления изобретения вторичное антитело и иммуноконъюгат облегчают обнаружение связывания иммуноконъюгата с антигенной детерминантой, локализованной на поверхности клетки или ткани.
В некоторых вариантах осуществления изобретения иммуноконъюгаты, предлагаемые в изобретении, вводят в клетку в эффективном количестве. В других вариантах осуществления изобретения иммуноконъюгаты, предлагаемые в изобретении, вводят в терапевтически эффективном количестве индивидууму для лечения болезни. Понятие «эффективное количество» в контексте настоящего описания относится к количеству иммуноконъюгата, предлагаемого в изобретении, которое необходимо для достижения физиологического изменения в клетке или ткани, в которые его вводят. Понятие «терапевтически эффективное количество» в контексте настоящего описания относится к количеству иммуноконъюгата, предлагаемого в изобретении, которое элиминирует, снижает, замедляет, минимизирует или предупреждает вредные воздействия болезни.
Иммуноконъюгаты, предлагаемые в изобретении, можно вводить индивидууму per se или в форме фармацевтической композиции. В одном из вариантов осуществления изобретения болезнь представляет собой пролиферативное нарушение, такое как рак. Примерами пролиферативных нарушений, таких как различные вида рака, являются (но, не ограничиваясь только ими) рак мочевого пузыря, рак головного мозга, рак головы и шеи, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, рак матки, рак шейки матки, рак эндометрия, рак пищевода, рак ободочной кишки, колоректальный рак, ректальный рак, рак желудка, рак предстательной железы, рак крови, рак кожи, плоскоклеточная карцинома, рак кости и рак почки. Другими нарушениями, связанными с клеточной пролиферацией, которые можно лечить в помощью иммуноконъюгата, предлагаемого в настоящем изобретении, являются (но, не ограничиваясь только ими) неоплазмы, локализованные в:
брюшной области, кости, молочной железе, пищеварительной системе, печени, поджелудочной железе, брюшине, эндокринных железах (надпочечник, паращитовидная железа, гипофиз, яички, яичник, тимус, щитовидная железа), глазу, голове и шеи, нервной системе (центральной и периферической), лимфатической системе, области таза, коже, мягкой ткани, селезенке, грудной области и мочеполовой системе. К ним относятся также предраковые состояния или повреждения и метастазы рака. Аналогично этому с помощью иммуноконъюгатов, предлагаемых в настоящем изобретении можно лечить и другие связанные с пролиферацией клеток нарушения. Примерами указанных связанных с пролиферацией клеток нарушениями являются (но, не ограничиваясь только ими): гипергаммаглобулинемия, лимфопролиферативные нарушения, парапротеинемия, пурпура, саркоидоз, синдром Сезари, макроглобулинемия Вальденстрема, болезнь Гоше, гистоцитоз и любое другое связанное с пролиферацией клеток заболевание помимо неоплазм, локализованных в перечисленных выше системах органов. В другом варианте осуществления изобретения болезнь связана с аутоиммунитетом, отторжением трансплантата, пост-травматическими иммунными ответами и инфекционными болезнями (например, ВИЧ). Более конкретно иммуноконъюгаты можно применять для элиминации клеток, участвующих в опосредуемых иммунными клетками нарушениях, включая лимфому; клеток, с которым связан аутоиммунитет, отторжение трансплантата, реакция трансплантат-против-хозяина, ишемия и «удар». Специалисту в данной области очевидно, что во многих случаях иммуноконъюгаты не могут обеспечивать исцеление, но могут оказывать лишь частичное благоприятное воздействие. В некоторых вариантах осуществления изобретения физиологическое изменение, оказывающее некоторое благоприятное воздействие, также считается терапевтически ценным. Таким образом, в некоторых вариантах осуществления изобретения количество иммуноконъюгата, обеспечивающее физиологическое изменение, рассматривается как «эффективное количество» или «терапевтически эффективное количество».
Субъект, пациент или индивидуум, нуждающийся в лечении, как правило, представляет собой млекопитающее, более конкретно человека.
Композиции, препаративные формы, дозы и пути введения
Фармацевтические композиции, предлагаемые в настоящем изобретении, содержат в эффективном количестве один или несколько иммуноконъюгатов, растворенных или диспергированных в фармацевтически приемлемом носителе. Фраза «фармацевтически или фармакологически приемлемый» относится к молекулам и композициям, которые не обладают вредным, аллергическим действием или не вызывают другой нежелательной реакции при введении при необходимости животному, например, человеку. Препараты, представляющие собой фармацевтическую композицию, которая содержит по меньшей мере один иммуноконъюгат и необязательно дополнительное действующее вещество, должны быть очевидны специалистам в данной области в свете настоящего описания, и они представлены в качестве примеров в справочнике Remington's Pharmaceutical Sciences, 18-oe изд., изд-во Mack Printing Company, 1990, включенном в настоящее описание в качестве ссылки. Кроме того, следует понимать, что препараты, предназначенные для введения животному (например, человеку), должны с позиций стерильности, пирогенности, общей безопасности и чистоты удовлетворять стандартам, разработанным отделением биологических стандартов FDA или соответствующими компетентными органами в других странах.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» включает любые и все материалы и их комбинации, такие как растворители, буферы, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), придающие изотоничность агенты, замедляющие абсорбцию агенты, соли, лекарственные средства, стабилизаторы лекарственных средств, гели, связующие агенты, эксципиенты, разрыхлители, замасливатели, подслащивающие вещества, корригенты, красители, которые известны обычному специалисту в данной области (см., например, справочник Remington's Pharmaceutical Sciences, 18-oe изд., изд-во Mack Printing Company, 1990, включенный в настоящее описание в качестве ссылки). За исключением случая, когда они не совместимы с действующим веществом, любые агенты можно применять в терапевтических или фармацевтических композициях.
Иммуноконъюгаты могут содержать различные типы носителей в зависимости от того, вводят ли его в твердой, жидкой или аэрозольной форме, и от того должны ли они быть стерильными при использовании такого пути введения, как инъекция. Иммуноконъюгаты, предлагаемые в настоящем изобретении можно вводить путем внутривенной, внутрикожной, внутриартериальной, внутрибрюшинной, осуществляемой внутрь повреждения, внутричерепной, внутрисуставной, осуществляемой внутрь предстательной железы, внутриселезеночной, внутрипочечной, внутриплевральной, внутритрахеальной, внутриносовой, осуществляемой в стекловидное тело, внутривагинальной, внутриректальной, местной, осуществляемой внутрь опухоли, внутримышечной, подкожной, подконъюнктивальной, внутрипузырной, мукозальной, внутриперикардиальной, внутрипупочной, внутриглазной обработки, орально, местно, локально, путем ингаляции (например, аэрозольной ингаляции), инъекции, инфузии, длительной инфузии, локальной перфузии с промывкой клеток-мишеней непосредственно, с применением катетера, с помощью лаважа, в составе кремов, в липидных композициях (например, липосомах) или с помощью другого метода или любой комбинации вышеуказанных путей введения, известных обычному специалисту в данной области (см., например, справочник Remington's Pharmaceutical Sciences, 18-oe изд., изд-во Mack Printing Company, 1990, включенный в настоящее описание в качестве ссылки). Парентеральное введение в частности внутривенную инъекцию, наиболее широко применяют для введения полипептидных молекул, таких как Иммуноконъюгаты, предлагаемые в изобретении.
Фактическая доза композиции, предлагаемой в настоящем изобретении, которую вводят индивидууму, может определяться физикальными и физиологическими факторами, такими как вес тела, серьезность состояния, тип заболевания, подлежащего лечению, предшествующие или осуществляемые одновременно терапевтические вмешательства, идиопатия пациента и путь введения. Практикующий специалист, ответственный за осуществление введения, в любом случае должен определять концентрацию действующих(его) веществ(а) в композиции и дозу(ы), приемлемую(ые) для конкретного индивидуума.
В некоторых вариантах осуществления изобретения фармацевтические композиции могут содержать иммуноконъюгат, предлагаемый в изобретении, в количестве, составляющем по меньшей мере примерно 0,1%. В других вариантах осуществления изобретения содержание иммуноконъюгатов может составлять от примерно 2 до примерно 75 мас.% или, например, от примерно 25 до примерно 60 мас.%, включая любые значения в этом диапазоне. В других примерах (но, не ограничиваясь только ими) доза, применяемая для осуществления одного введения, может составлять также от примерно 1 мкг/кг веса тела, примерно 5 мкг/кг веса тела, примерно 10 мкг/кг веса тела, примерно 50 мкг/кг веса тела, примерно 100 мкг/кг веса тела, примерно 200 мкг/кг веса тела, примерно 350 мкг/кг веса тела, примерно 500 мкг/кг веса тела, примерно 1 мг/кг веса тела, примерно 5 мг/кг веса тела, примерно 10 мг/кг веса тела, примерно 50 мг/кг веса тела, примерно 100 мг/кг веса тела, примерно 200 мг/кг веса тела, примерно 350 мг/кг веса тела, примерно 500 мг/кг веса тела до примерно 1000 мг/кг веса тела или более, включая любые значения в этом диапазоне. Примерами подпадающих под указанный диапазон доз, которые можно вводить, являются (но, не ограничиваясь только ими) дозы, составляющие от примерно 5 до примерно 100 мг/кг веса тела, от примерно 5 мкг/кг веса тела до примерно 500 мг/кг веса тела и т.д. с учетом указанных выше значений.
В каждом случае композиция может содержать различные антиоксиданты, предназначенные для замедления окисления одного или нескольких компонентов. Кроме того, для предупреждения действия микроорганизмов можно вносить консерванты, такие как различные антибактериальные и противогрибковые агенты, включая (но, не ограничиваясь только ими) парабены (например, метилпарабены, пропилпарпабены), хлорбутанол, фенол, сорбиновую кислоту, тримерозал или их комбинации.
Иммуноконъюгаты можно включать в композицию в виде свободного основания, в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, например, образованные с помощью свободных аминогрупп в случае белковой композиции, или образованные с неорганическими кислотами, такими, например, как соляная или фосфорная кислота, или с органическими кислотами, такими как уксусная, щавелевая, винная или миндальная кислота. Соли, образованные с помощью свободных карбоксильных групп, можно получать также с использованием неорганических оснований, таких, например, как гидроксиды натрия, калия, аммония, кальция или железа; или таких органических оснований, как изопропиламин, триметиламин, гистидин или прокаин.
В тех вариантах осуществления изобретения, в которых композиция находится в жидкой форме, носитель может представлять собой растворитель или дисперсионную среду, включая (но, не ограничиваясь только ими) воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.д.), липиды (например, триглицериды, растительные масла, липосомы) и их комбинации. Требуемую текучесть можно поддерживать, например, путем использования покрытий, таких как лецитин; путем поддержания требуемого размера частиц, создавая дисперсию в носителях, таких, например, как жидкий полиол или липиды; путем применения поверхностно-активных веществ, таких, например, как гидроксипропилцеллюлоза; или с помощью комбинации указанных методов. Во многих случаях может оказаться целесообразным включать придающие изотоничность агенты, такие, например, как сахара, хлорид натрия или их комбинации, и/или забуферивающие агенты, предназначенные для поддержания физиологически приемлемых значений рН.
В других вариантах осуществления изобретения можно применять глазные капли, назальные растворы или спреи, аэрозоли или лекарственные формы для ингаляции, предлагаемые в настоящем изобретении. Указанные композиции, как правило, создают так, чтобы они были совместимы с целевым типом ткани. Например (но, не ограничиваясь только ими) назальные растворы, как правило, представляют собой водные растворы, созданные таким образом, чтобы их можно было вводить в носовые ходы в виде капель или спреев. Назальные растворы приготавливают так, чтобы они по многим параметрам напоминали назальные секреты, с тем, чтобы сохранять нормальную деятельность ресничек. Таким образом, в некоторых вариантах осуществления изобретения водные назальные растворы, как правило, являются изотоническими или слегка забуференными для поддержания значения рН от примерно 5,5 до примерно 6,5. Кроме того, в препаративную форму при необходимости можно включать антимикробные консерванты, аналогичные тем, которые используют в офтальмологических препаратах, лекарственные средства или соответствующие стабилизаторы для лекарственных средств. Например, различные поступающие в продажу назальные препараты являются известными и включают лекарственные средства, такие как антибиотики и антигистамины.
В некоторых вариантах осуществления изобретения иммуноконъюгат приготавливают с целью введения таким путем как оральный прием внутрь. В этих вариантах осуществления изобретения твердая композиция может представлять собой, например, растворы, суспензии, эмульсии, таблетки, пилюли, капсулы (например, твердые или мягкие желатиновые капсулы), препаративные формы с замедленным высвобождением, трансбуккальные композиции, пастилки, эликсиры, суспензии, сиропы, облатки или их комбинации. Оральные композиции можно принимать непосредственно с пищей во время еды. Предпочтительными носителями для орального введения являются инертные разбавители, съедобные носители или их комбинации. Согласно другим объектам изобретения оральную композицию можно приготавливать в виде сиропа или эликсира. Сироп или эликсир может содержать, например, по меньшей мере одно действующее вещество, подслащивающее вещество, консервант, корригент, краситель или их комбинации.
В определенных вариантах осуществления изобретения композиция для орального введения может содержать одно или несколько связующих веществ, эксципиентов, разрыхлителей, замасливателей, корригентов и их комбинации. В определенных вариантах осуществления изобретения композиция может содержать один или несколько из следующих компонентов: связующее вещество, такое, например, как трагакантовая камедь, аравийская камедь, кукурузный крахмал, желатин или их комбинации; эксципиент, такой, например, как дикальций фосфат, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния или их комбинации; разрыхлитель, такой, например, как кукурузный крахмал, картофельный крахмал, альгиновая кислота или их комбинации; замасливатель, такой, например, как стеарат магния; подслащивающее вещество, такое, например, как сахароза, лактоза, сахарин или их комбинации; корргиент, такой, например, как мята перечная, масло грушанки, вишневая отдушка, апельсиновая отдушка и т.д.; или комбинации указанных выше веществ. Когда стандартная доза представляет собой капсулу, то она помимо материалов указанных выше типов может содержать носители, такие как жидкий носитель. Различные другие материалы могут присутствовать в виде покрытий или их можно включать для иной модификации физической формы стандартной дозы. Например, на таблетки, пилюли и капсулы можно наносить покрытие из шеллака, сахара или их обоих.
Дополнительные препаративные формы, пригодные для других путей введения, представляют собой суппозитории. Суппозитории представляют собой твердые лекарственные формы различной массы и формы, как правило, медицинского назначения, предназначенные для введения в прямую кишку, влагалище или мочеиспускательный канал. После введения суппозитории становятся более мягкими, плавятся или растворяются в жидкостях полости. Как правило, суппозитории могут включать традиционные носители, например, полиалкиленгликоли, триглицериды или их комбинации. В некоторых вариантах осуществления изобретения суппозитории могут состоять из смесей, содержащих, например, действующее вещество в количестве от примерно 0,5% до примерно 10% и предпочтительно от примерно 1% до примерно 2%.
Стерильные инъецируемые растворы приготавливают путем включения иммуноконъюгатов, предлагаемых в изобретении, в требуемом количестве в соответствующий растворитель, содержащий при необходимости различные другие ингредиенты, перечисленные выше, с последующей стерилизацией фильтрацией. Как правило, дисперсии получают путем включения различных стерилизованных действующих веществ в стерильный наполнитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для приготовления стерильных инъецируемых растворов, суспензий или эмульсий предпочтительными методами приготовления являются вакуумная сушка или сушка вымораживанием, в результате которых получают порошок действующего вещества плюс любого дополнительного требуемого ингредиента из предварительно стерилизованной фильтрацией содержащей их жидкой среды. Жидкую среду можно при необходимости соответствующим образом забуферивать и жидкому разбавителю сначала перед инъекцией придавать изотоничность с помощью достаточного количества физиологического раствора или глюкозы. Под объем изобретения подпадает также приготовление высококонцентрированных композиций для непосредственной инъекции, для приготовления которых в качестве растворителя используют ДМСО, что приводит к очень быстрому проникновению, позволяя вносить высокие концентрации действующих веществ в небольшую область.
Композиция должна обладать стабильностью в условиях производства и хранения и должна быть защищена от загрязнения микроорганизмами, такими как бактерии и грибы. Считается, что загрязнение эндотоксинами должно поддерживаться на минимальном безопасном уровне, составляющем, например, менее 0,5 нг/мг белка.
В конкретных вариантах осуществления изобретения для пролонгирования абсорбции инъецируемой композиции можно применять в композициях агенты, замедляющие абсорбцию, такие, например, как моностеарат алюминия, желатин или их комбинации.
Фармацевтические композиции, которые содержат иммуноконъюгаты, предлагаемые в изобретении, можно приготавливать с помощью общепринятых процессов смешения, растворения, грануляции, изготовления драже, растирания в порошок, эмульгирования, капсулирования, улавливания или лиофилизации. Фармацевтические композиции можно включать в препаративные формы с помощью общепринятого метода с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые облегчают обработку белков с получением препаратов, которые можно применять в фармацевтике. Выбор соответствующей препаративной формы зависит от выбранного пути введения.
Для местного применения иммуноконъюгаты, предлагаемые в изобретении, можно приготавливать в виде растворов, гелей, мазей, кремов, суспензий и т.д., хорошо известных в данной области.
Препаративные формы для системного введения представляют собой формы, предназначенные для введения с помощью инъекции, например, подкожной, внутривенной, внутримышечной, внутриоболочечной или внутрибрюшинной инъекции, а также формы, предназначенные для трансдермального, трансмукозального введения, введения путем ингаляции, орально или в легкие.
Для инъекции иммуноконъюгаты, предлагаемые в изобретении, можно приготавливать в виде водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический соляной буфер. Раствор может содержать применяемые для получения препаративной формы агенты, такие как суспендирующие агенты, стабилизаторы и/или диспергирующие вещества.
В другом варианте иммуноконъюгаты могут находиться в форме порошка, в который перед применением добавляют приемлемый наполнитель, например, стерильную свободную от пирогенов воду.
Для трансмукозального применения в препаративной форме применяют способствующие проникновению вещества, пригодные для проникновения через соответствующий барьер. Такие способствующие проникновению вещества хорошо известны в данной области.
Для орального применения иммуноконъюгаты можно включать в препаративные формы путем объединения иммуноконъюгатов с фармацевтически приемлемыми носителями, известными в данной области. Такие носители пригодны для получения на основе иммуноконъюгатов, предлагаемых в изобретении, таких препаративных форм как таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, густые суспензии, суспензии и т.п., предназначенных для орального приема пациентом, подлежащим лечению. Приемлемыми эксципиентами для оральных твердых препаративных форм, таких, например, как порошки, капсулы и таблетки, являются наполнители, такие как сахара, например, лактоза, сахароза, маннит и сорбит; препараты целлюлозы, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон (ПВП); гранулирующие агенты; и связующие вещества. При необходимости можно добавлять разрыхлители, такие как сшитый поливинилпирролидон, агар или альгиновую кислоту или ее соль, такую как альгинат натрия.
При необходимости на твердые лекарственные формы можно наносить сахарное покрытие или энтеросолюбильное покрытие с помощью стандартных методов.
Для оральных жидких препаратов, таких, например, как суспензии, эликсиры и растворы, приемлемыми носителями, эксципиентами или разбавителями являются вода, гликоли, масла, спирты и т.д. Дополнительно можно добавлять корригенты, консерванты, красители и т.п.
Предназначенные для трансбуккального применения иммуноконъюгаты могут иметь форму таблеток, лепешек и т.д., которые приготавливают общепринятым образом.
Для введения с помощью ингаляции иммуноконъюгаты, предназначенные для применения согласно изобретению, как правило, применяют в форме аэрозольного спрея из находящихся под давлением упаковок или распылителя с использованием приемлемого пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого приемлемого газа. В случае находящего под давлением аэрозоля стандартную дозу можно определять, снабжая упаковку клапаном, предназначенным для введения отмеренного количества. Можно приготавливать желатиновые капсулы или картриджи, предназначенные для применения в ингаляторе или инсуффляторе, которые содержат порошкообразную смесь иммуноконъюгата и приемлемую порошкообразную основу, такую как лактоза или крахмал.
Иммуноконъюгаты можно приготавливать также в виде ректальных или вагинальных композиций, таких как суппозитории или микроклизмы с удержанием, которые содержат общепринятую основу для суппозиториев, такую как масло какао или другие глицериды.
Помимо описанных выше препаративных форм иммуноконъюгаты можно включать также в препараты, имеющие депо-форму. Указанные препаративные формы длительного действия можно вводить путем имплантации (например, подкожной или внутримышечной) или путем внутримышечной инъекции. Так, например, иммуноконъюгаты можно включать в препаративные формы в сочетании с приемлемыми полимерными или гидрофобными субстанциями (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или малорастворимыми производными, например, малорастворимой солью.
В другом варианте можно применять другие фармацевтические системы введения. Липосомы и эмульсии являются хорошо известными примерами обеспечивающих введение носителей, которые можно применять для введения иммуноконъюгатов, предлагаемых в изобретении. Можно применять также определенные органические растворители, такие как диметилсульфоксид, хотя это, как правило, приводит к увеличению токсичности. Кроме того, иммуноконъюгаты можно вводить с помощью системы с пролонгированным высвобождением, такой как полупроницаемые матрицы из твердых полимеров, содержащих терапевтическое средство. Созданы различные материалы, обеспечивающие пролонгированное высвобождение и они хорошо известны специалистам в данной области. Капсулы с пролонгированным высвобождением могут в зависимости от их химической природы обеспечивать высвобождение иммуноконъюгатов в течение промежутка времени, составляющего от нескольких недель вплоть до 100 дней. В зависимости от химической природы и биологической стабильности иммуноконъюгатов можно применять дополнительные стратегии стабилизации иммуноконъюгатов.
Поскольку иммуноконъюгаты, предлагаемые в изобретении, могут нести заряженные боковые цепи или концы, их можно включать в любые описанные выше препаративные формы в виде свободных кислот или оснований, или в виде фармацевтически приемлемых солей. Фармацевтически приемлемые соли представляют собой соли, которые практически сохраняют биологическую активность свободных оснований и которые получают путем взаимодействия с неорганическими кислотами. Фармацевтические соли имеют тенденцию обладать лучшей растворимостью в водных и других протонных растворителях по сравнению с соответствующими формами в виде свободных оснований.
Иммуноконъюгаты, предлагаемые в изобретении, как правило, следует применять в количестве, эффективном для достижения поставленной цели. При применении для лечения или предупреждения болезненного состояния иммуноконъюгаты, предлагаемые в изобретении, или содержащие их фармацевтические композиции вводят или применяют в терапевтически эффективном количестве. Терапевтически эффективное количество представляет собой количество, эффективное в отношении облечения или предупреждения симптомов или удлинения продолжительности жизни пациента, подлежащего лечению. Определение терапевтически эффективного количества находится в компетенции специалистов в данной области, прежде всего после ознакомления с представленным описанием.
В случае системного введения терапевтически эффективную дозу можно определять предварительно в опытах in vitro. Например, дозу можно определять с использованием созданных на животных моделей, так, чтобы она позволяла достигать диапазона концентраций в кровотоке, который включает значения IC50, установленные с использованием клеточной культуры. Указанную информацию можно применять для более точного определения пригодных для применения на человеке доз.
Начальную дозу можно определять, исходя из полученных in vivo данных, например, на животных моделях, используя методы, хорошо известные в данной области. Обычный специалист в данной области легко может оптимизировать введение человеку на основе полученных в опытах на животных данных.
Уровень и интервал доз можно регулировать индивидуально для достижения уровней иммуноконъюгата в плазме, которые являются достаточными для поддержания терапевтического действия. Обычные дозы, применяемые для введения пациенту путем инъекции, составляют примерно от 0,1 до 50 мг/кг/день, как правило, примерно от 0,5 до 1 мг/кг/день. Терапевтически эффективные уровни в сыворотке можно получать путем введения нескольких доз каждый день.
В случае локального введения или избирательного поглощения эффективная локальная концентрация иммуноконъюгатов может не быть связана с концентрацией в плазме. Специалист в данной области может оптимизировать терапевтически эффективные локальные дозы без чрезмерных экспериментальных процедур.
Количество, в котором вводят иммуноконъюгат, должно, естественно зависеть от индивидуума, подлежащего лечению, веса индивидуума, серьезности поражения, пути введения и рекомендации лечащего врача.
Терапию можно дробно повторять, если обнаружены симптомы или даже, если они не обнаружены. Терапия может включать индивидуальное применение иммуноконъюгата или его применение в сочетании с другими лекарственными средствами. В случае аутоиммунных нарушений лекарственные средства, которые можно применять в сочетании с иммуноконъюгатами, предлагаемыми в изобретении, представляют собой (но, не ограничиваясь только ими) стероидные и нестероидные противовоспалительные средства.
Токсичность
Терапевтически эффективная доза иммуноконъюгатов, представленных в настоящем описании, как правило, обеспечивает терапевтическую пользу, не обладая при этом существенной токсичностью. Токсичность иммуноконъюгатов можно определять стандартными фармацевтическими процедурами с использованием культур клеток или экспериментальных животных, например. путем определения значения LD50 (доза, летальная для 50% популяции) или LD100 (доза, летальная для 100% популяции). Соотношение доз, обладающих токсичностью и терапевтической эффективностью, называется терапевтическим индексом. В одном из вариантов осуществления изобретения для иммуноконъюгата характерен высокий терапевтический индекс.Данные, полученные при осуществлении указанных анализов на клеточных культурах и в опытах на животных, можно применять для определения диапазона доз, которые являются нетоксичными, например, при применении на человеке. Дозы иммуноконъюгатов, представленных в настоящем описании, предпочтительно находятся в пределах таких концентраций в кровотоке, которые включают эффективную дозу, обладающую низкой токсичностью или не обладающую токсичностью. Дозы могут варьироваться в этом диапазоне в зависимости от применяемой лекарственной формы и используемого пути введения. Соответствующую препаративную форму, путь введения и дозы может индивидуально подбирать лечащий врач в зависимости от состояния пациента (см., например, у Fingl и др., The Pharmacological Basis of Therapeutics, ч.1, 1975, с.1), публикация полностью включена в настоящее описание в качестве ссылки).
Другие агенты и варианты лечения
Согласно настоящему изобретению в сочетании с иммуноконъюгатами, предлагаемыми в настоящем изобретении, можно применять другие агенты с целью повышения терапевтической эффективности лечения. Эти дополнительные агенты представляют собой иммуномодуляторы, агенты, которые обусловливают повышающую регуляцию рецепторов клеточной поверхности и щелевых контактов, цитостатические и оказывающие воздействие на дифференцировку агенты, ингибиторы клеточной адгезии или агенты, повышающие чувствительность гиперпролиферативных клеток к индукторам апоптоза. К иммуномодуляторам относятся фактор некроза опухолей;
интерферон альфа, бета и гамма; IL-2 и другие цитокины; F42K и другие аналоги цитокинов; или MIP-1, MIP-1β, MCP-1, RANTES и другие хемокины. Подразумевается также, что повышающая регуляция рецепторов клеточной поверхности или их лигандов, таких как лиганд Fas/Fas, DR4 или DR5/TRAIL, может потенциировать способность к индукции апоптоза, предлагаемую в настоящем изобретении, в результате аутокринного или паракринного действия на гиперпролиферативные клетки. Усиление межклеточных путей передачи сигналов в результате увеличения количества щелевых контактов должно повышать антигиперпролиферативные воздействия на расположенную вблизи популяцию гиперпролиферативных клеток. В другом варианте осуществления изобретения цитостатические или оказывающие воздействие на дифференцировку агенты можно применять в сочетании с иммуноконъюгатами, предлагаемыми в настоящем изобретении, для повышения антигиперпролиферативной эффективности лечения. Подразумевается, что ингибиторы клеточной адгезии повышают эффективность настоящего изобретения. Примерами ингибиторов клеточной адгезии являются ингибиторы фокальных адгезионных киназ (FAK) и ловастатин. Подразумевается также, что для повышения эффективности лечения можно применять в сочетании с иммуноконъюгатами, предлагаемыми в настоящем изобретении, и другие агенты, повышающие чувствительность гиперпролиферативной клетки к апоптозу, такие как антитело С225.
Гормональную терапию можно применять также в сочетании с иммуноконъюгатами, предлагаемыми в настоящем изобретении, или в комбинации с любой другой противораковой терапией, описанной выше. Гормоны можно применять для лечения определенных видов рака, таких как рак молочной железы, предстательной железы, яичника или шейки матки, для снижения уровня или блокады воздействий определенных гормонов, таких как тестостерон или эстроген. Такое лечение применяют часто в сочетании по меньшей мере с одной другой противораковой терапией в качестве варианта лечения или для снижения риска метастазов.
Иммуноконъюгаты, предлагаемые в изобретении, можно применять также в сочетании с химиотерапией, лучевой терапией или другими иммунотерапиями. Противораковые агенты для такой комбинированной терапии можно выбирать, например, из группы, включающей агенты, которые разрушают микротрубки (например, алкалоиды барвинка, такие как винбластин или винкристин, таксаны, такие как доцетаксел или паклитаксел, эпотилоны, такие как иксабепилон), антиметаболиты (например, антифолаты, такие как метотрексат или аминоптерин, антипурины, такие как флударабин, 6-меркаптопурин или 6-тиогуанин, антипиримидины, такие как 5-фторурацил, капецитабин или гемцитабин, гидроксимочевина), ингибиторы топоизомеразы (например, камптотецин, иринотекан, топотекан, или подофиллотоксины, такие как этопозид), ДНК-интеркаляторы (например, доксорубицин, даунорубицин, актиномицин, блеомицин), алкилирующие агенты (например, циклофосфамид, хлорамбуцил, нитрозомочевины, такие как кармустин или нимистин, стрептозоцин, бусульфан, цисплатин, оксалиплатин, триэтиленмеламин, дакарбазин), средства, применяемые в гормональных терапиях (например, глюкокортикоиды, ингибиторы ароматазы, такие как тамоксифен, антиандрогены, такие как флутамид, аналоги гонадотропин-рилизинг-гормона (GnRH), такие как леупролид), антибиотики, ингибиторы киназ (например, эрлотиниб, гефитиниб, иматиниб), антагонисты рецепторов (например, антитела к рецепторам клеточной поверхности, для которых известна способность усиливать онкогенез и рост опухолей), ингибиторы ферментов (например, ингибиторы циклинзависимой киназы (CDK)), истощающие аминокислоты ферменты (например, аспарагиназа), леуковорин, ретиноиды, активаторы апоптоза опухолевых клеток и антиангиогенные средства.
Примеры
Пример 1
Harvill Е.Т. и Morrison S.L. (Immunotech. 1(2), 1995, cc.95-105), впервые осуществившие опосредуемое антителом введение цитокинов, использовали конструкции с двумя антигенсвязывающими фрагментами к опухолевому антигену и двумя фрагментами цитокинов для индукции активации лимфоцитов (молекулу IL-2 сливали с каждым из С-концов тяжелой цепи IgG3). Аффинность цитокина к рецептору, как правило, была высокой. Молекула, несущая два фрагмента цитокина, могла обладать даже более высокий аффинностью к рецепторам цитокинов в результате явления авидности (или многовалентности). Поэтому указанная молекула легче могла активировать лимфоциты в кровотоке даже до того, как имел место целенаправленный перенос в опухоль. Пациент мог не нуждаться в таком действии. В отличие от этого молекула иммуноконъюгата, несущая только один цитокиновый фрагмент и два или большее количество обеспечивающих направленный перенос доменов, должна с меньшей вероятностью активировать лимфоциты в кровотоке и могла переносить полную молекулу иммуноконъюгата в опухоль, где активация лимфоцитов происходила с меньшей скоростью. Таким образом, молекулы, представленные на фиг.1 и 2, конструировали с интерлейкином-2 (IL-2) в качестве модельного цитокина. Все созданные молекулы были двухвалентными касательно опухолевого антигена и либо двух-, либо одновалентные касательно цитокина IL-2, что проиллюстрировано на чертежах. Аффинность к антигену сравнивали для двух форматов иммуноконъюгатов, используя антитело L19 в качестве примера. Для сравнения это антитело клонировали в формате человеческого IgG1, формате димерного антитела (фиг.1А) и виде слияния Fab-IL2-Fab (фиг.1Б). В формате димерного антитела использовали одну переменную, а именно длину линкерного пептида между VH и VL, который состоял либо из 8, либо из 12 аминокислот.Очищенный антиген, представляющий собой экстра-домен фибронектина (EDB), иммобилизовали на BIACORE-чипе и слитую конструкцию антитела применяли в качестве растворимого анализируемого продукта при определении аффинности. На фиг.8-11 представлены результаты этого эксперимента. IgG рассматривали в качестве идеального варианта случая двухвалентного связывания. При этом определено значение константы аффинности, составляющее 260 пМ. Для слитой конструкции Fab-IL2-Fab установлено значение константы аффинности, составляющее 310 пМ, что практически идентично значению, установленному для IgG. Для двух вариантов димерного антитела (см. фиг.10 и 11) установлены значения констант аффинности, составляющие 270 пМ и 360 пМ соответственно. Таким образом, все указанные конструкции характеризовались близкими уровнями аффинности к антигену. Аффинность к антигену и рецептору IL-2 определяли с использованием аналогичных конструкций, в которых в качестве основы применяли последовательность антитела F16 (Brack S.S. и др., Clin. Canc. Res. 12(10), 2006, cc.3200-3208). На фиг.12 представлены BIACORE-сенсограммы антитела F16 в виде IgG и соответствующего ему одновалентного Fab-фрагмента, полученные для случая, когда TNC-A1-домен был иммобилизован на BIACORE-чипе. В указанных конкретных экспериментальных условиях для молекулы IgG установлено значение константы аффинности, составляющие 2,6 нМ, а для молекул Fab значение константы аффинности, составляющие 50 нМ. Таким образом, аффинность, присущая двухвалентной конструкции, возросла в 20 раз. Для иммуноконъюгатов на основе димерного антитела, Fab-IL2-Fab и scFv-IL2-scFv, значения констант аффинности к антигену составляли 5, 4,8 и 12 нМ соответственно. Таким образом, для всех указанных конструкций аффинность к антигену в существенно большей степени соответствовали двухвалентному характеру молекулы IgG, чем поведению одновалентного Fab-фрагмента.
Различия оказались более выраженными при оценке аффинности к рецептору IL-2. Для изучения аффинности связывания с рецептором IL-2 создавали «инструмент», позволяющий экспрессировать гетеродимерный рецептор IL-2; β-цепь рецептора IL-2 сливали с Fc-молекулой, сконструированной для гетеродимеризации (Fс(«выступ»)), используя технологию «knobs-into-holes» (Merchant A.M. и др., Nat.Biotech. 16, 1998, cc.677-681). Затем гамма-цепь рецептора IL-2 сливали с вариантом Fс(«впадина»), который гетеродимеризовали с помощью Fс («выступ»). Этот слитый белок, несущий гетеродимерный Fc, затем применяли в качестве субстрата при анализе взаимодействия IL-2/рецептор IL-2. На фиг.13 показана BIACORE-сенсограмма для поступающего в продажу IL-2 (пролейкин), в качестве анализируемого продукта при использовании иммобилизованного рецептора IL-2. Измеренное значение аффинности составляло ~0,5нМ, что согласуется с опубликованными ранее данными. Данные об аффинности различных конструкций к рецептору IL-2 обобщены на фиг.17. Важным полученным результатом являлись данные о различии между димерным антителом (F16, два IL2), которое являлось двухвалентным касательно цитокина, и молекулой Fab-IL2-Fab, которая несла только один IL-2-фрагмент. Аффинность связывания IL-2-рецептора димерным антителом (0,8 нМ) оказалась близкой к значению для неконъюгированного IL-2 (пролейкин) (0,5 нМ), несмотря на то, что димерное антитело являлось двухвалентным, а IL-2 являлся одновалентным. Для слитой конструкции Fab-IL2-Fab аффинность связывания с рецептором IL-2 снижалась почти в 10 раз по сравнению с димерным антителом, что отражалось в пониженной способности индуцировать пролиферацию МК92-клеток, как продемонстрировано на фиг.19.
Пример 2
Конструирование характерных для определенного класса Fab-библиотек
Характерные для определенного класса антител библиотеки в Fab-формате конструировали на основе генов человеческой зародышевой линии, используя следующие варианты спаривания V-области: Vk3_20 легкой каппа-цепи с VH3_23 тяжелой цепи для библиотеки DP47-3 и Vkl_17 легкой каппа-цепи с VH1_69 тяжелой цепи для библиотеки DP88-3 (см. таблицу 2). Обе библиотеки рандомизировали касательно CDR3 легкой цепи (L3) и CDR3 тяжелой цепи (Н3) и осуществляли сборку, используя по 3 фрагмента на библиотеку с помощью ПЦР на основе сплайсинга с использованием перекрывающихся удлиняющих сегментов (SOE). Фрагмент 1 содержал 5'-конец гена антитела, включая рандомизированный L3, фрагмент 2 представлял собой центральный константный фрагмент, простирающийся от L3 до H3, а фрагмент 3 содержал рандомизированный Н3 и 3'-область гена антитела.
Для создания входящих в библиотеку фрагментов для DР47-3-библиотеки применяли следующие комбинации праймеров: фрагмент 1 (LMB3 - LibLlb_new), фрагмент 2 (MS63-MS64), фрагмент 3 (Lib2H - fdseqlong) (см. таблицу 9). Для создания входящих в библиотеку фрагментов для DP88-3-библиотеки применяли следующие комбинации праймеров: фрагмент 1 (LMB3 -RJH_LIB3), фрагмент 2 (RJH31-RJH32) и фрагмент 3 (LIB88_2 - fdseqlong) (см. таблицу 10).
Протокол ПЦР для получения входящих в библиотеки фрагментов включал: начальную денатурацию в течение 5 мин при 94°С; 25 циклов по 1 мин при 94°С, 1 мин при 58°С и 1 мин при 72°С; и конечное удлинение в течение 10 мин при 72°С. Для ПЦР-сборки в качестве матрицы использовали эквимолярные соотношения трех фрагментов. Протокол ПЦР-сборки включал: начальную денатурацию в течение 3 мин при 94°С; и 5 циклов по 30 с при 94°С, 1 мин при 58°С и 2 мин при 72°С. На этой стадии добавляли праймеры, комплементарные последовательности, расположенной вне фрагментов 1-3, и осуществляли дополнительные 20 циклов перед конечным удлинением в течение 10 мин при 72°С.
После сборки с получением достаточных количеств полноразмерных рандомизированных Fab-конструкций Fab-конструкции расщепляли с помощью NcoI/NotI в случае DР47-3-библиотеки и с помощью NcoI/NheI в случае DP88-3-библиотеки наряду с обработанными аналогичным образом акцепторным фагмидым вектором. В случае DР47-3-библиотеки 22,8 мкг Fab-библиотеки лигировали с 16,2 мкг фагмидного вектора. В случае DР88-3-библиотеки 30,6 мкг Fab-библиотеки лигировали с 30,6 мкг фагмидного вектора.
Очищенные полученные в результате лигирования смеси использовали для осуществления 68 трансформаций с использованием DР47-3-библиотеки и 64 трансформаций с использованием DР88-3-библиотеки соответственно с получением конечных размеров библиотек 4,2×1010 DP47-3 и 3,3×109 DP88-3.
Фагмидные частицы, презентующие Fab-библиотеки, высвобождали («спасали») и очищали с помощью ПЭГ/NaCl для применения для селекции.
Пример 3
Селекция клона 2 В 10 антитела к TNC-A2
Селекции осуществляли с использованием клеток Е.coli, экспрессирующих человеческий TNC-A2, который субклонировали с avi-меткой и 6×his-меткой на 5'-конце (см. SEQ ID NO: 57 в таблице 5). Антиген биотинилировали in vivo при экспрессии. Селекции осуществляли в растворе согласно следующему протоколу: (I) связывание -1012 фагмидных частиц библиотеки DP88-3 и 100 нМ биотинилированного человеческого TNC-A2 в течение 0,5 ч в общем объеме 1 мл; (II) «захват» биотинилированного человеческого TNC-A2 и присоединенного фага путем добавления 5,4×107 покрытых стрептавидином магнитных гранул в течение 10 мин; (III) отмывка гранул с использованием 5×1 мл ЗФР/Твин 20 и 5×1 мл ЗФР; (IV) элюция фаговых частиц путем добавления 1 мл 100 мМ ТЭА (триэтаноламин) в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/НСl рН 7,4; и (V) повторное заражение находящихся на log-фазе клеток Е.coli линии TG1, заражение фагом-хелпером VCSM13 и последующее осаждение с помощью ПЭГ/NaCl фагмидных частиц, применяемых в последующих циклах селекции.
Селекции осуществляли с применением трех циклов, используя постоянную концентрацию антигена, составлявшую примерно 100 нМ. А цикле 2 для «захвата» комплексов антиген: фаг использовали сенсибилизированные нейтравидином планшеты вместо стрептавидиновых гранул. Специфические связывающие агенты идентифицировали с помощью ELISA, используя: 100 мкл 100 нМ биотинилированного человеческого TNC-A2 для сенсибилизации каждой лунки сенсибилизированных нейтравидином планшетов.
Добавляли содержащие Fab супернатанты бактерий и связывающиеся Fab-фрагменты определяли посредством их Flag-меток, используя в качестве вторичного антитела антитело к Flag/HRP. После идентификации клон 2В10 экспрессировали в бактериях в 0,5 л культуры, очищали на основе аффинности и затем характеризовали с помощью SPR-анализа, используя устройство BIACORE Т100 (см. SEQ ID NO: 3 и 7 в таблице 3).
Пример 4
Селекция клона 2F11 антитела к TNC-A1/A4
Селекции осуществляли с использованием клеток Е.соli, экспрессирующих человеческий TNC-A1, который субклонировали с avi-меткой и 6×his-меткой на 5'-конце (см. SEQ ID NO: 59 в таблице 5). Антиген биотинилировали in vivo при экспрессии. Селекции осуществляли в растворе согласно следующему протоколу: (I) связывание ~1012 фагмидных частиц библиотеки DP47-3 и 100 нМ биотинилированного человеческого TNC-A1 в течение 0,5 ч в общем объеме 1 мл; (II) «захват» биотинилированного человеческого TNC-A1 и присоединенного фага путем добавления 5,4×107 покрытых стрептавидином магнитных гранул в течение 10 мин; (III) отмывка гранул с использованием 5×1 мл ЗФР/Твин 20 и 5×1 мл ЗФР; (IV) элюция фаговых частиц путем добавления 1 мл 100 мМ ТЭА (триэтаноламин) в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/НСl рН 7,4; и (V) повторное заражение находящихся на log-фазе клеток Е. coli линии TG1, заражение фагом-хелпером VCSM13 и последующее осаждение с помощью ПЭГ/NaCl фагмидных частиц, применяемых в последующих циклах селекции.
Селекции осуществляли с применением трех циклов, используя постоянную концентрацию антигена, составлявшую примерно 100 нМ. А цикле 2 для «захвата» комплексов антиген: фаг использовали сенсибилизированные нейтравидином планшеты вместо стрептавидиновых гранул.
Во все реакции связывания вносили дополнительно 100 нМ СН3-домен константной области небиотинилированного человеческого IgG, содержащий на карбоксиконце avi-метку и 6×his-метку для конкуренции с «ненужными» клонами, распознающими метки антигена.
На первой стадии скрининга специфические связывающие агенты идентифицировали с помощью ELISA, используя: 100 мкл 100 нМ биотинилированного человеческого TNC-A1 для сенсибилизации каждой лунки сенсибилизированных нейтравидином планшетов. Добавляли содержащие Fab супернатанты бактерий и Fab-фрагменты, специфически связывающиеся с человеческим TNC-A1, определяли посредством их Flag-меток, используя в качестве вторичного антитела антитело к Flag/HRP.
На второй стадии скрининга повторяли вышеописанный ELISA, используя также мышиный TNC-A1, человеческий TNC-A4 и mu TNC-A4 в качестве антигенов для оценки перекрестной реактивности. Все антигены содержали одинаковые avi-метку и 6×his-метку на С-конце и были биотинилированы in vivo (см. SEQ ID NO: 50 и 61 в таблице 5).
После идентификации клон 2F11 экспрессировали в бактериях в 0,5 л культуры, очищали на основе аффинности и затем характеризовали с помощью SPR-анализа, используя устройство BIACORE T100 (см. SEQ ID NO: 9 и 13 в таблице 3).
Пример 5
Селекция клонов антитела к FAP (первичные селекции)
Селекции осуществляли в отношении эктодомена человеческого или мышиного белка активации фибробластов (FAP), которые клонировали против хода транскрипции относительно полилизиновой и 6×his-метки (см. SEQ ID NO: 53 и 55 в таблице 5). Перед осуществлением селекции антигенами сенсибилизировали пробирки для иммуноанализов (иммунопробирки) в концентрации либо 10, либо 5 мкг/мл в зависимости от цикла селекции. Селекции осуществляли согласно следующему протоколу: (I) связывание ~ 1012фагмидных частиц библиотеки DP47-3 с иммобилизованным человеческим или мышиным FAP в течение 2 ч; (II) отмывка иммунопробирок 5×5 мл ЗФР/Твин 20 и 5×5 мл ЗФР; (III) элюция фаговых частиц путем добавления 1 мл 100 мМ ТЭА (триэтаноламин) в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/HCl, рН 7,4; и (IV) повторное заражение находящихся на log-фазе клеток Е. coli линии TG1, заражение фагом-хелпером VCSM13 и последующее осаждение с помощью ПЭГ/NaCl фагмидных частиц, применяемых в последующих циклах селекции.
Селекции осуществляли с применением трех или четырех циклов, используя понижающиеся концентрации при применении в качестве антигена человеческого FAP и в некоторых случаях используя мышиный FAP в концентрации 5 мкг/мл в конечном цикле селекции. Специфические связывающие агенты определяли по наличию сигналов, в 5 раз превышающих фоновый сигнал, и идентифицировали с помощью ELISA. Планшеты NUNC maxisorp сенсибилизировали 10 мкг/мл человеческого или мышиного FAP с последующим добавлением содержащих Fab супернатантов бактерий и определяли специфическое связывание Fab-фрагментов посредством их Flag-меток, используя в качестве вторичного антитела антитело к Flag/HRP.
Позитивные по данным ELISA клоны экспрессировали в бактериях в виде 1-миллилитровых культур в 96-луночном формате и супернатанты подвергали скринингу в отношении кинетических характеристик с использованием устройства BIACORE Т 100.
Пример 6
Конструирование библиотеки для созревания аффинности антител к FAP
Конструировали три библиотеки для созревания аффинности на основе предварительно отобранных антител, полученных при первичных селекциях антител к FAP. Более конкретно их создавали на основе (I) клона 2D9 антитела к FAP (библиотека a.m.FAP2D9) (см. SEQ ID NO: 67 и 69 в таблице 3), (II) клона 4 В8 антитела к FAP (библиотека a.m.FAP4B8) (см. SEQ ID NO: 71 и 73 в таблице 3) и (III) обладающих перекрестной реактивностью клонов 7А1, 13 В2, 13С2, 13Е8, 14С10 и 17А11 (библиотека a.m.FAPpool) (см. SEQ ID NO: 75 и 77 в таблице 3, соответствующие последовательностям вариабельных областей клона 7А1; SEQ ID NO: 79 и 81 в таблице 3, соответствующие последовательностям вариабельных областей клона 13С2; SEQ ID NO: 83 и 85, соответствующие последовательностям вариабельных областей клона 13Е8; SEQ ID NO: 87 и 89, соответствующие последовательностям вариабельных областей клона 14С10; и SEQ ID NO: 91 и 93, соответствующие последовательностям вариабельных областей клона 17А11).
Каждая из указанных библиотек состояла из двух подбиблиотек, в которых были рандомизированы либо CDR1 и CDR2 легкой цепи (L1/L2), либо CDR1 и CDR2 тяжелой цепи (Н1/Н2) соответственно. Указанные подбиблиотеки объединяли при трансформации. Каждую из указанных подбиблиотек конструировали с помощью четырех последующих стадий амплификации и сборки.
Для L1/L2-библиотеки протокол амплификации и сборки включал: (I) амплификацию фрагмента 1 (LMB3 - DPK22_CDR1_rand_ba_opt) и фрагмента 2 (DPK22_CDRl_fo - DPK22_Ck_BsiWI_ba); (II) сборку фрагментов 1 и 2 с помощью внешних праймеров LMB3 и DPK22_Ck_BsiWI_ba для создания матрицы для фрагмента 3; (III) амплификацию фрагмента 3 (LMB3 - DPK22_CDR2_rand_ba) и фрагмента 4 (DPK22_CDR2_fo - DPK22_Ck_BsiWI_ba); и (IV) конечную сборку фрагментов 3 и 4 с помощью тех же внешних праймеров, которые указаны выше (см. в таблице 11 последовательности праймеров).
Для Н1/Н2-библиотеки протокол амплификации и сборки включал: (I) амплификацию фрагмента 1 (RJH53 - DP47_CDRl_rand_ba_opt) и фрагмента 2 (DP47_CDRl_fo - MS52); (II) сборку фрагментов 1 и 2 с помощью внешних праймеров RJH53 и MS52 для создания матрицы для фрагмента 3; (III) амплификацию фрагмента 3 (RJH53 - DP47_CDR2_rand_ba) и фрагмента 4 (DP47_CDR2_fo - MS52); и (IV) конечную сборку фрагментов 3 и 4 с помощью тех же внешних праймеров, которые указаны выше (см. в таблице 12 последовательности праймеров).
Продукты, полученные после конечной сборки, расщепляли с помощью Ncol/BsiWI в случае L1/L2-подбиблиотеки a.m.FAP2D9 и a.m.FAP4B8, с помощью MunI и NheI в случае Н1/Н2-подбиблиотеки a.m.FAP2D9 и a.m.FAP4B8, а также с помощью NcoI/BamHI в случае L1/L2-библиотеки a.m.FAPpool и с помощью BspEI/PstI в случае Н1/Н2-библиотеки a.m.FAPpool соответственно, наряду с обработанными аналогичным образом акцепторными векторами, основой который являлись препараты плазмид, содержащих клоны 2D9, 4 В8 или эквимолярную смесь клонов 7А1, 13В2, 13С2, 13Е8, 14С10 и 17А11 соответственно. В каждом случае лигировали взятые в указанных ниже количествах расщепленные рандомизированные (частично) V-области и расщепленный(ые) акцепторный(ые) вектор(ы) для соответствующих библиотек (мкг V-области/мкг вектора): a.m.FAP2D9 L1/L2-подбиблиотека (5,7/21,5), a.m.FAP2D9 Н1/Н2-подбиблиотека (4,1/15,5), a.m.FAP4B8 L1/L2-подбиблиотека (6,5/24,5), a.m.FAP4B8 Н1/Н2-подбиблиотека (5,7/21,5), a.m.FAPpool L1/L2-подбиблиотека (4,4/20), a.m.FAPpool Н1/Н2-подбиблиотека (3,4/15,5).
Очищенные полученные в результате лигирования смеси L1/L2- и Н1/Н2-подбиблиотек объединяли и применяли для 60 трансформаций с использованием каждой из трех библиотек для созревания аффинности, получая следующие конечные размеры библиотек: 6,2×109 в случае a.m.FAP2D9, 9,9×109 в случае a.m.FAP4B8 и 2,2×109 в случае a.m.FAPpool.
Фагмидные частицы, презентующие Fab-библиотеки, высвобождали («спасали») и очищали с помощью ПЭГ/NaCl для применения для вторичных селекции.
Пример 7
Селекция клонов антител к FAP с созревшей аффинностью
Селекции осуществляли в отношении эктодомена человеческого или мышиного белка активации фибробластов (FAP), который клонировали в 5'-направлении относительно полилизиновой и 6×his-метки (см. SEQ ID NO: 53 и 55 в таблице 5). Перед осуществлением селекции антигенами сенсибилизировали иммунопробирки в концентрации либо 10, либо 5, либо 0,2 мкг/мл в зависимости от конкретной библиотеки и цикла селекции. Селекции осуществляли согласно следующему протоколу: (I) связывание -1012 фагмидных частиц библиотеки a.m.FAP2D9, a.m.FAP4B8 или a.m.FAPpool DP47-3 с иммобилизованным человеческим или мышиным FAP в течение 2 ч; (II) отмывка иммунопробирок 10-20×5 мл ЗФР/Твин 20 и 10-20×5 мл ЗФР (в зависимости от библиотеки и цикла селекции); (III) элюция фаговых частиц путем добавления 1 мл 100 мМ ТЭА (триэтаноламин) в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/HCl, рН 7,4; и (IV) повторное заражение находящихся на log-фазе клеток Е.coli линии TG1, заражение фагом-хелпером VCSM13 и последующее осаждение с помощью ПЭГ/NaCl фагмидных частиц, применяемых в последующих циклах селекции.
Селекции осуществляли, применяя 2 цикла, и условия регулировали индивидуально для каждой из трех библиотек. В частности, применяли следующие параметры селекции: a.m.FAP2D9 (5 мкг /мл человеческого FAP и 20 отмывок в целом при осуществлении цикла 1, 1 мкг/мл человеческого FAP и 30 отмывок в целом при осуществлении цикла 2), a.m.FAP4B8 (1 мкг/мл мышиного FAP и 30 отмывок в целом при осуществлении цикла 1, 0,2 мкг/мл человеческого FAP и 40 отмывок в целом при осуществлении цикла 2) и a.m.FAPpool (5 мкг/мл человеческого FAP и 30 отмывок в целом при осуществлении цикла 1, 5 мкг/мл мышиного FAP и 30 отмывок в целом при осуществлении цикла 2). Специфические связывающие агенты определяли по наличию сигналов, в 5 раз превышающих фоновый сигнал, и идентифицировали с помощью ELISA. Планшеты типа NUNC Maxisorp сенсибилизировали 1 мкг/мл или 0,2 мкг/мл человеческого или мышиного FAP с последующим добавлением содержащих Fab супернатантов бактерий и определяли специфическое связывание Fab-фрагментов посредством их Flag-меток, используя в качестве вторичного антитела антитело к Flag/HRP.
Позитивные по данным ELISA клоны экспрессировали в бактериях в виде 1-миллилитровых культур в 96-луночном формате и супернатанты подвергали скринингу в отношении кинетических характеристик с помощью устройства BIACORET100.
Пример 8
Опыты по оценке эффективности различных форматов иммуноконъюгатов. предназначенных для направленного переноса IL-2
Эксперимент по оценке эффективности осуществляли с использованием двух различных молекулярных форматов содержащих интерлейкин-2 иммуноконъюгатов, специфических для стромы опухоли. Тератокарциному линии F9 инъецировали подкожно мышам линии 129SvEv и размер опухоли оценивали количественно с помощью кронциркуля. Эффективность молекулы, содержащей «димерное антитело»-IL-2, сравнивали в двух различных концентрациях с иммуноконъюгатом Fаb-интерлейкин-2-Fаb (Fab-IL2-Fab), где концентрации соответствовали одинаковому количеству молекул иммуноконъюгатов. Результаты представлены на фиг.3. При применении иммуноконъюгата Fab-IL2-Fab обнаружено существенное ингибирование роста опухолей, и оно превышало эффективность форматов в виде димерного антитела при оценке двух различных концентраций и превышало эффективность контролей.
Оценивали также выживаемость мышей, обработанных двумя различными содержащими интерлейкин-2 молекулярными форматами иммуноконъюгатов, специфических для стромы опухоли. Человеческую клеточную линию опухоли желудка LS174T инъецировали в селезенку SCID-мышей с врожденным отсутствием естественных клеток-киллеров. Сравнивали молекулу «димерное-антитело»-IL-2 в двух различных концентрациях с иммуноконъюгатом Fab-IL-2-Fab, где концентрации соответствовали одинаковому количеству молекул иммуноконъюгатов. Результаты представлены на фиг.4. Установлено, что формат Fab-IL-2-Ат обеспечивал более высокий процент выживаемости по сравнению с форматом в виде димерного антитела и контролями.
Пример 9
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др.. Molecular cloning: A laboratory manual; изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии применяли согласно инструкциям производителей.
Общую информацию, касающуюся нуклеотидных последовательностей легких и тяжелых цепей человеческих иммуноглобулинов, см.: Kabat E.A. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во NIH, публикация No 91-3242, 1991.
Секвенирование ДНК
Последовательности ДНК определяли посредством секвенирования двух цепей.
Синтез генов
Требуемые сегменты генов создавали на фирме Geneart AG (Регенсбург, Германия) из синтетических олигонуклеотидов и ПЦР-продуктов посредством автоматического синтеза генов. Сегменты генов, фланкированные единичными сайтами, распознаваемыми рестриктазами, клонировали в плазмидах pGA18 (ampR). Плазмидную ДНК очищали из трансформированных бактерий и определяли концентрацию с помощью УФ-спектроскопии. Последовательность ДНК субклонированных фрагментов генов подтверждали ДНК-секвенированием. Создавали сегменты генов с требуемыми сайтами рестрикции, позволяющими субклонироовать их в соответствующих экспрессионных векторах. Все конструкции обозначали, начиная с 5'-концевой ДНК-последовательности, кодирующей лидерный пептид, который придает белкам способность секретироваться в эукариотических клетках. В таблице 13 и 14 представлены примеры лидерных пептидов и кодирующих их полинуклеотидных последовательностей соответственно.
Получение иммуноконъюгатов
Полученные ДНК-последовательности субклонировали в экспрессионных векторах млекопитающих (один для легкой цепи и один для тяжелой цепи/слитый белок) под контролем промотора MPSV и против хода транскрипции относительно синтетического сайта поли(А), каждый вектор содержал последовательность OriP из EBV.
Иммуноконъюгаты, указанные ниже в примерах, получали путем котрансфекции находящихся на экспоненциальной фазе роста клеток линии HEK293-EBNA экспрессионными векторами млекопитающих, используя опосредуемую фосфатом кальция трансфекцию. В другом варианте НЕК293-клетки, выращенные в виде суспензионной культуры, трансфектировали полиэтиленимином (ПЭИ) в сочетании с экспрессионными векторами или применяли пулы стабильно трансфектированных СНО-клеток. В то время как конструкции на основе клонов 3F2 и 4G8, мишенью которых является FAP, такие как Fab-IL2-Fab, можно очищать аффинной хроматографией, используя в качестве матрикса белок А, конструкции на основе клона 2 В 10, мишенью которых является TNC-A2, такие как Fab-IL2-Fab, требуется очищать с помощью аффинной хроматографии, используя в качестве матрикса белок G.
В целом, метод состоял в следующем: конструкции на основе клона 2 В 10, мишенью которых является TNC-A2, такие как Fab-IL2-Fab, очищали из супернатантов с помощью одной стадии аффинной хроматографии (белок G) с последующей гель-фильтрацией (Superdex 200, фирма GE Healthcare). Колонку с белком G уравновешивали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5, вносили супернатант и колонку промывали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5. Fab-IL2-Fab элюировали 8,8 мМ муравьиной кислотой, рН 3. Элюированные фракции объединяли и окончательно очищали гель-фильтрацией в конечном буфере следующего состава: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7. На фиг.53 в качестве примера представлены результаты очистки и аналитического исследования.
Конструкции, мишенью которых является FAP, такие как Fab-IL2-Fab на основе клона 3F2 или Fab-IL2-Fab на основе клона 4G8, очищали аналогичным методом, который включал одну стадию аффинной хроматографии (белок А) с последующей гель-фильтрацией (Superdex 200, фирма GE Healthcare). Колонку с белком А уравновешивали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5, вносили супернатант и колонку промывали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, 500 мМ хлоридом натрия, рН 7,5, после чего промывали 13,3 мМ фосфатом натрия, 20 мМ цитратом натрия, 500 мМ хлоридом натрия, рН 5,45. Необязательно осуществляли третью отмывку 10 мМ MES, 50 мМ хлоридом натрия, рН 5. Fab-IL2-Fab элюировали 20 мМ цитратом натрия, 100 мМ хлоридом натрия, 100 мМ глицином, рН 3. Элюированные фракции объединяли и окончательно очищали гель-фильтрацией в конечном буфере следующего состава: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7.
Пример 10
Конструирование дополнительных библиотек для созревания аффинности антител к FAP (на основе клонов 3F2, 3D9, 4G8, 4В3 и 2С6)
Создавали 4 дополнительные библиотеки для созревания аффинности на основе предварительно отобранных обладающих перекрестной реактивностью антител из первой группы антител к FAP с созревшей аффинностью, а именно клонов 3F2, 3D9, 4G8, 4В3 и 2С6 (см. SEQ ID NO: 17 и 21 из таблицы 3, которые соответствуют последовательностям вариабельной области клона 3F2; SEQ ID NO: 23 и 25 из таблицы 3, которые соответствуют последовательностям вариабельной области клона 3D9; SEQ ID NO: 33 и 35 из таблицы 3, которые соответствуют последовательностям вариабельной области клона 4В3; SEQ ID NO: 41 и 43 из таблицы 3, которые соответствуют последовательностям вариабельной области клона 2С6). Более конкретно основой четырех библиотек являлись 1) клоны антител к FAP 3F2, 4G8 и 4В3 (VH-библиотека с рандомизированными CDR 1 и 2 вариабельной области тяжелой цепи, т.е. Н1/Н2-библиотека), 2) клоны антител к FAP 3D9 и 2С6 (VL-библиотека с рандомизированными CDR 1 и 2 вариабельной области легкой цепи, т.е. L1/L2-библиотека), 3) клон антитела к FAP 3F2 (L3-библиотека со слабой рандомизацией CDR3 легкой цепи, т.е. L3-библиотека) и 4) клон антитела к FAP 3F2 (Н3-библиотека со слабой рандомизацией CDR3 тяжелой цепи, т.е. Н3-библиотека). Первые две библиотеки конструировали точно в соответствии с методом, изложенным для первой группы антител к FAP с созревшей аффинностью, т.е. для L1/L2- и Н1/Н2-библиотек соответственно. В отличие от этого для L3- и Н3-библиотек с созревшей аффинностью на основе клона 3F2 применяли два новых праймера для интродукции слабой рандомизации в L3 (AM_3F2_DPK22_L3_ba: CACTTTGGTCCCCTGGCCGAACGTCGGGGGAAGCATAATACCCTGCTGACAGTAATACACTGC, где из подчеркнутых оснований 60% представляют собой исходные основания, а 40% оснований рандомизированы с использованием смеси N (смесь четырех нуклеотидов А, С, G и Т)) и H3 (AM_3F2_DP47_H3_fo: GGCCGTATATTACTGTGCGАAАGGGTGGTTТGGTGGТТТТAАСTACTGGGGCCAAGGAAC где из подчеркнутых оснований 60% представляют собой исходные основания, а 40% оснований представляют собой смесь N, из выделенных курсивом оснований 60% представляют собой исходные основания, а 40% оснований представляют собой G, а также из подчеркнутых оснований, выделенных курсивом, 60% оснований представляют собой указанные основания, а 40% оснований представляют собой смесь К (смесь двух нуклеотидов G и Т)) родительского клона. Библиотеки имели следующие размеры: Н1/Н2-библиотека (1,13×1010), L1/L2-библиотека (5,6×109), L3-библиотека (2,3×1010) и Н3-библиотека (2,64×1010).
Пример 11
Селекция клонов антител к FAP с созревшей аффинностью
Селекции осуществляли в отношении эктодомена человеческого или мышиного белка активации фибробластов (FAP), который клонировали против хода транскрипции относительно бхлизиновой и 6×his-метки (см. SEQ ID NO: 53 и 55 в таблице 5). Перед осуществлением селекции антигенами сенсибилизировали иммунопробирки в концентрации либо 1, либо 0,2, либо 0,02 мкг/мл в зависимости от библиотеки и цикла селекции. Селекции и основанный на применении ELISA скрининг осуществляли согласно методу, описанному для первой группы антител к FAP с созревшей аффинностью. Вторичный скрининг осуществляли с использованием биосенсора ProteOn XPR36 (фирма Biorad) и константы скорости реакции и аффинность определяли, анализируя препараты Fab с созревшей аффинностью с использованием этого же «инструмента». Идентифицировали следующее клоны с созревшей аффинностью: 19G1 (см. SEQ ID NO: 121 и 123 в таблице 3), 20G8 (см. SEQ ID NO: 125 и 127 в таблице 3), 4В9 (см. SEQ ID NO: 129 и 131 в таблице 3), 5В8 (см. SEQ ID NO: 133 и 135 в таблице 3), 5F1 (см. SEQ ID NO: 137 и 139 в таблице 3), 14В3 (см. SEQ ID NO: 141 и 143 в таблице 3), 16F1 (см. SEQ ID NO: 145 и 147 в таблице 3), 16F8 (см. SEQ ID NO: 149 и 151 в таблице 3), О3С9 (см. SEQ ID NO: 153 и 155 в таблице 3), 22А3 (см. SEQ ID NO: 165 и 167 в таблице 3) и 29В11 (см. SEQ ID NO: 169 и 171 в таблице 3) (все эти клоны отбирали из Н1/Н2-библиотеки и получали из родительского клона 3F2), O2D7 (см. SEQ ID NO: 157 и 159 в таблице 3) (отобран из L3-библиотеки, основой которой является родительский клон 3F2) и 28Н1 (см. SEQ ID NO: 161 и 163 из таблицы 3) и 23С10 (см. SEQ ID NO: 173 и 175 из таблицы 3) (эти два клона отбирали из Н1/Н2-библиотеки и получали из родительского клона 4G8).
На фиг.21-25 представлены сенсограммы, полученные методом поверхностного плазменного резонанса, для отобранных Fab-фрагментов с созревшей аффинностью к FAP, а в таблице 15 представлены соответствующие значения аффинности. Отобранные Fab характеризовались аффинностью в широком диапазоне от пикомолярных до наномолярных значений и обладали перекрестной реактивностью к человеческому (hu) и мышиному (mu) FAP, а также FAP обезьяны циномолгус (суnо), что установлено для отобранных клонов. Fab-фрагменты с созревшей аффинностью к FAP превращали в формат Fab-IL2-Fab. Наличие специфичности связывания подтверждали по отсутствию связывания с белком DPPIV, близким гомологом FAP, при его экспрессии на НЕК293- или СНО-клетках.
Пример 12
Конструирование библиотеки для созревания аффинности антител к TNC-А2 (на основе клона 2В10)
Библиотеку для созревания аффинности конструировали на основе антитела к TNC-A2, предварительно отобранного на основе первичных селекции. Более конкретно, основой для создания библиотеки был родительский клон 2В10, и она состояла из двух подбиблиотек: 1) VL-подбиблиотека с рандомизированными CDR1 и CDR2 легкой цепи (L1/L2) и 2) VH-подбиблиотека с рандомизированными CDR1 и CDR2 тяжелой цепи (Н1/Н2). Эти подбиблиотеки объединяли посредством трансформации. Каждую из указанных подбиблиотек конструировали с использованием четырех последовательных стадий амплификации и сборки. Для L1/L2-библиотек: 1) амплификация фрагмента 1 (LMB3 - AM_VklA30_L1_ba) и фрагмента 2 (RJH50 (VklA30_L1/L2_fo) - RJH51 (VklA30_BsiWI_ba)), 2) сборка фрагментов 1 и 2 с использование внешних праймеров LMB3 and RJH51 (VklA30_BsiWI_ba) для создания матрицы для 3) амплификации фрагмента 3 (LMB3 - AM_VklA30_L2_ba) и фрагмента 4 (RJH52 (VklA30_L2/L3) - RJH51 (VklA30_BsiWI_ba)) и 4) конечная сборка фрагментов 3 и 4 с использованием тех же описанных выше внешних праймеров. Для Н1/Н2-библиотек: 1) амплификация фрагмента 1 (RJH53 - AM_DP88_Hl_ba_opt) и фрагмента 2 (RJH54(DP88_H1/H2_fo) - MS52), 2) сборка фрагментов 1 и 2 с использованием внешних праймеров RJH53 и MS52 для создания матрицы для 3) амплификации фрагмента 3 (RJH53 - AM_DP88_H2_ba) и фрагмента 4 (RJH55 (DP88_H2H3_fo)-MS52)4) конечная сборка фрагментов 3 и 4 с использованием тех же описанных выше внешних праймеров. Конечные продукты сборки расщепляли NcoI/BsiWI в случае VL-подбиблиотек и MunI и NheI в случае VH-подбиблиотек и клонировали в расщепленных аналогичным образом акцепторных векторах. Размеры полученных библиотек составляли 1,16×1010 независимых клонов.
Пример 13
Селекция клонов антител к TNC-A2 с созревшей аффинностью Селекции осуществляли с использованием клеток Е.соli, экспрессирующих человеческий TNC-A2, который клонировали против хода транскрипции относительно avi-метки и 6×his-метки (см. SEQ ID NO: 57 в таблице 5). Антиген биотинилировали in vivo при экспрессии. Селекции осуществляли в растворе согласно методу, описанному для первичных селекции с использованием TNC-A2, применяя человеческий TNC-A2 в понижающихся концентрациях от 100 до 2 нМ. После идентификации клонов с созревшей аффинностью с помощью ELISA осуществляли вторичный скрининг с использованием биосенсора ProteOn XPR36 (фирма Biorad) и константы скорости реакции и аффинность определяли, анализируя препараты Fab с созревшей аффинностью с использованием этого же инструмента. Идентифицировали следующее клоны с созревшей аффинностью: 2B10_O1F7 (см. SEQ ID NO: 201 и 203 из таблицы 3), 2В10_6Н10 (см. SEQ ID NO: 205 и 207 из таблицы 3), 2В10_С3А6 (см. SEQ ID NO: 185 и 187 из таблицы 3), 2B10_D1A2 (см. SEQ ID NO: 189 и 191 из таблицы 3) и 2B10_O7D8 (см. SEQ ID NO: 197 и 199 из таблицы 3) (все эти клоны получали из VL-подбиблиотеки), а также 2В10_С3В6 (см. SEQ ID NO: 177 и 179 из таблицы 3) и 2В10_6А12 (см. SEQ ID NO: 181 и 183 из таблицы 3) (эти два клона получали из VH-подбиблиотеки). Кроме того, для клона 2B10_D1A2 создавали мутант V32D (см. SEQ ID NO: 193 и 195 из таблицы 3) (нумерация согласно Кэботу).
На фиг.26 представлены сенсограммы, полученные методом поверхностного плазменного резонанса, для отобранных Fab-фрагментов с созревшей аффинностью к TNC-A2, а в таблице 18 представлены соответствующие значения аффинности. Отобранные Fab характеризовались аффинностью в широком диапазоне пикомолярных значений.
Пример 14
Очистка конструкций Fab-IL2-Fab, основой которых являются клоны 2В10, 3F2 и 4G8
Другой метод очистки (дополнительно к методу, описанному в примере 9) разработали для конструкций Fab-IL2-Fab, основой которых являются клоны 2В10, 3F2 и 4G8. В то время как конструкции Fab-IL2-Fab, основой которых являются 3F2 и 4G8, можно очищать аффинной хроматографией, используя в качестве матрикса белок А (например, MabSelect Sure), конструкции Fab-IL2-Fab, основой которых является 2 В10, следует очищать аффинной хроматографией, используя в качестве матрикса белок G. Процедура очистка включала следующие четыре стадии:
1. аффинная хроматография с использованием MabSelect Sure или белка G,
2. поддержание низкого значения рН для инактивации ретровирусов,
3. анионообменная хроматография (АЕХ) - хроматография с использованием CaptoQ для удаления ДНК,
4. катионообменная хроматография (SEX) - хроматография с использованием SP Sepharose FF для удаления агрегатов.
В альтернативном варианте для удаления агрегатов в небольших количествах можно применять гель-фильтрацию на колонке с использованием Superdex 200 (фирма GE Healthcare).
В качестве примера представлена последовательность процедуры очистки Fab-IL2-Fab, основой которого является 3F2. На первой стадии значение рН супернатанта кратковременно трансфектированных ПЭИ НЕК-293-клеток в среде FreeStyle (фирма Invitrogen) доводили до 7 и вносили в колонку с белком А MabSelect (фирма GE Healthcare), промывали 100 мМ NaPO4, 250 мМ NaCl, рН 7 и элюировали 8,8 мМ формиатом натрия, рН 3. В отобранных фракциях осуществляли замену буфера для отмывки и вносили в колонку с CaptoQ (фирма GE Healthcare), отмывали 10 мМ NaPO4, 40 мМ NaCl, рН 6,5 и элюировали 2М NaCl. Значение рН потока доводили до 5 и вносили в колонку с SP Sepharose FF (фирма GE Healthcare), промывали 25 мМ ацетатом натрия, 25 мМ NaCl, рН 5 и элюировали 25 мМ ацетатом натрия, 300 мМ NaCl, рН 5. Осуществляли замену буфера на конечный буфер для продукта. На фиг.27 представлен обзор процедуры очистки.
Очищенный Fab-IL2-Fab, основой которого является 3F2, после очистки представлял собой чистый продукт (фиг.28А) и не содержал агрегатов (фиг.28Б). Описанную процедуру очистки применяли для Fab-IL2-Fab, основой которого является 4G8. Поведение Fab-IL2-Fab на основе 4G8 оказалось таким же, как и поведение Fab-IL2-Fab на основе 3F2. Очищенный продукт после очистки был чистым и не содержал агрегатов (фиг.28, В-Г).
Осуществляли очистку для формата Fab-IL2-Fab, в котором в качестве Fab-фрагмента служит 2 В 10 (ТNC-А2-связывающий агент), в виде. На первой стадии значение рН супернатанта из кратковременно трансфектированных ПЭИ НЕК293-клеток в среде FreeStyle (фирма Invitrogen) доводили до 7 и вносили в колонку с белком G (фирма GE Healthcare), промывали 100 мМ NaPO4, 250 мМ NaCl рН 7 и элюировали 8,8 мМ формиатом Na, рН 3. В отобранных фракциях осуществляли замену буфера для отмывки и вносили в колонку CaptoQ (фирма GE Healthcare), отмывали 10 мМ NaPO4, 40 мМ NaCl,pH 6,5 и элюировали 2М NaCl. Значение рН потока доводили до 5 и вносили в колонку SP Sepharose FF column (фирма GE Healthcare), промывали 25 мМ ацетатом натрия, 25 мМ NaCl, рН 5 и элюировали 25 мМ ацетатом натрия, 300 мМ NaCl, pH 5. Во фракциях осуществляли замену буфера на конечный буфер для продукта.
На фиг.29 представлены результаты (А) аналитической характеризации продукта с помощью ДСН-ПААГ (NuPAGE Novex Bis-Tris Mini Gel, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия) и (Б) аналитической гель-фильтрации продукта после каждой из трех стадий очистки. В конечном продукте обнаружено 2,3% агрегатов.
Пример 15
Оценка стабильности
Осуществляли оценку стабильности иммуноконъюгата формата Fab-IL2-Fab, содержащего связывающееся с экдоменом-В фибронектина антитело L19 в качестве Fab-фрагмента. Для опытов по оценке стабильности конструкцию Fab-IL2-Fab очищали с помощью аффинной хроматографии на белке А со стадией элюции при рН 3 с последующей гель-фильтрацией на колонке Superdex 200 (фирма GE Healthcare) согласно описанному выше методу. Оценивали три различных буфера и буфер, содержащий 20 мМ гистидин-HCl, 140 мМ NaCl, рН 6,0, был выбран в качестве приемлемого буфера. Затем Fab-IL2-Fab на основе L19 приготавливали в 20 мМ гистидине-HCl, 140 мМ NaCl, рН 6,0 в концентрации 6,3 мг/мл и хранили в течение 4 недель при комнатной температуре и 4°С. На фиг.30 представлены приведенные в качестве примера данные о стабильности: пробы анализировали каждую неделю в отношении концентрации с помощью УФ-спектроскопии (фиг.30А) (после центрифугирования для пеллетирования продукта, который потенциально может осаждаться) и в отношении содержания агрегатов с помощью аналитической гель-фильтрации на колонке Superdex 200 (фиг.30Б). Результаты продемонстрировали отсутствие агрегации и расщепления при хранении конструкции при 4°С или при комнатной температуре в течение 28 дней, а также после цикла замораживания/оттаивания при использовании концентрации 6 мг/мл. Эти данные свидетельствуют о том, что формат Fab-IL2-Fab обладает высокой стабильностью и поведением, сопоставимым с антителами в виде IgG.
Пример 16
Определение аффинности связывания Fab-IL2-Fab, мишенью которых является FAP, с помощью поверхностного плазмонного резонанса (фирма Biacore)
Аффинности связывания трех конструкций Fab-IL2-Fab, мишенью которых является FAP, т.е. Fab-IL2-Fab на основе 3F2, Fab-IL2-Fab на основе 4G8 и Fab-IL2-Fab на основе 3D9, определяли с помощью поверхностного плазменного резонанса.
Для определения связывания с FAP FAP «захватывали» с помощью иммобилизованного антитела к His (Penta His, фирма Qiagen №34660) и конструкции применяли в качестве анализируемых продуктов. При осуществлении анализа температура составляла 25°С, и конструкции Fab-IL2-Fab разводили в соотношении 1:5, начиная с концентрации 10 нМ и до достижения концентрации 3,2 пМ. При осуществлении измерений использовали следующие параметры: продолжительность ассоциации 180 с, диссоциации 900 с, скорость потока 90 мкл/мин. Чип регенерировали с помощью 10 мМ глицина, рН 2 в течение 60 с.Для аппроксимации кривых использовали модель 1:1 для получения значений KD (локальное значение Rmax, RI=0).
Для определения аффинности к цепям рецептора IL-2 (IL-2R), β- и γ-цепи (b/g; «кnоb-into-hоlе»-конструкция) или α-цепь (a) IL-2R иммобилизовывали на чипе и конструкции Fab-IL2-Fab применяли в качестве анализируемых продуктов. Температура анализа составляла 25°С. Конструкции Fab-IL2-Fab на основе 3F2 и 3D9 разводили в соотношении 1:2, начиная с концентрации 25 нМ и до 0,78 нМ, и при осуществлении измерений использовали следующие параметры: продолжительность ассоциации 100 с, диссоциации 180 с, скорость потока 90 мкл/мин. Чип регенерировали с помощью 10 мМ глицина, рН 1,5 в течение 20 с.Конструкции Fab-IL2-Fab на основе 4G8 разводили, начиная с концентрации 100 нМ и до 3,125 нМ, и при осуществлении измерений использовали следующие параметры: продолжительность ассоциации 180 с, диссоциации 180 с, скорость потока 40 мкл/мин. Чип регенерировали с помощью 3М MgCl2 в течение 30 с.
В таблице 19 обобщены данные об аффинностях связывания иммуноконъюгатов 3F2 Fab-IL2-Fab, 4G8 Fab-IL2-Fab и 3D9 Fab-IL2-Fab. Полученные значения аффинности в пикомолярных концентрациях соответствовали пределу обнаружения Biacor-анализа. На фиг.31-34 представлены соответствующие Biacore-сенсограммы и данные об аффинности.
Пример 17
Определение аффинности связывания Fab-IL2-Fab. мишенью которых является TNC-A2, с помощью поверхностного плазмонного резонанса (фирма Biacore)
Для определения связывания с TNC-A2 биотинилированные антигены (TNC fn5-А1-А2-А3-домены, слитые вместе, экспрессировали в E.coli. В то время как fn5- и А3-домена всегда получали из организма человека, А1- и А2-домены получали из организма человека, мышей или обезьян циномолгус), иммобилизовывали на покрытом стрептавидином чипе и конструкции иммуноконъюгатов применяли в качестве анализируемых продуктов. При проведении анализа температура составляла 25°С. Fab-IL2-Fab разводили в соотношении 1:2, начиная с концентрации 25 нМ и до достижения концентрации 0,39 нМ, и при осуществлении измерений использовали следующие параметры: продолжительность ассоциации 180 с, диссоциации 180 с, скорость потока 50 мкл/мин. Чип регенерировали с помощью 10 мМ глицина, рН 1,5 в течение 60 с. Для аппроксимации кривых использовали модель 1:1 для получения значений KD В качестве отрицательного контроля применяли домены 1-8 TNC, полученные в НЕК-клетках (TNC 1-8 НЕК).
Для определения аффинности к цепям рецептора IL-2 (IL-2R) β- и γ-цепи (b/g; «knоb-intо-hоlе»-конструкция)) IL-2R иммобилизовывали на чипе и иммуноконъюгаты Fab-IL2-Fab применяли в качестве анализируемых продуктов. При проведении анализа температура составляла 25°С. Иммуноконъюгаты Fab-IL2-Fab разводили в соотношении 1:2, начиная с концентрации 25 нМ и до достижения концентрации 0,78 нМ, и при осуществлении измерений использовали следующие параметры: продолжительность ассоциации 100 с, диссоциации 180 с, скорость потока 90 мкл/мин. Чип регенерировали с помощью 10 мМ глицина, рН 1,5 в течение 20 с. Конструкции Fab-IL2-Fab разводили, начиная с концентрации 100 нМ и до 3,125 нМ, и при осуществлении измерений использовали следующие параметры: продолжительность ассоциации 180 с, диссоциации 180 с, скорость потока 40 мкл/мин. Чип регенерировали с помощью 3М MgCl2 в течение 30 с.
В таблице 20 обобщены данные об аффинностях связывания иммуноконъюгата 2В10 Fab-IL2-Fab, на фиг.35 представлены соответствующие Biacore-сенсограммы и данные об аффинности.
Пример 18
Анализ биологической активности иммуноконъюгатов Fab-IL2-Fab. обеспечивающих направленный перенос IL-2
Биологическую активность иммуноконъюгатов Fab-IL2-Fab, обеспечивающих направленный перенос IL-2, исследовали с помощью нескольких клеточных анализов в сравнении IL-2 (пролейкин).
Индукция пролиферации NК92-клеток
Исследовали способность молекул Fab-IL2-Fab, обеспечивающих направленный перенос IL-2, которые распознают TNC-A2 (2В10) или FAP (3F2 и 4G8), индуцировать пролиферацию NК92-клеток в сравнении с IL-2 (пролейкин) и содержащим IL-2 димерным антителом L19, распознающим фибронектин-EDB.
Человеческим тенасцином, FAP или фибронектином в концентрации 2 мкг/мл сенсибилизировали в течение ночи при 4°С лунки 96-луночного плоскодонного планшета для ELISA. После блокады планшета осуществляли титрование планшета конструкциями Fab-IL2-Fab или димерным антителом и инкубировали в течение 90 мин при комнатной температуре (КТ) для обеспечения связывания. После интенсивной отмывки для удаления несвязанных конструкций добавляли NK92-клетки с пониженным уровнем IL-2 (10000 клеток/лунку). В качестве положительного контроля в некоторые лунки добавляли раствор пролейкина. Клетки инкубировали в течение 2 дней при 37°С во влажной камере (с 5% СО2), после чего осуществляли лизис клеток для определения пролиферации на основе измерения АТФ с помощью набора CellTiter Glo (фирма Promega).
Результаты, представленные на фиг.36, демонстрируют, что все конструкции Fab-IL2-Fab обладали способностью активировать передачу сигналов IL-2R на NК92-клетках и стимулировать их пролиферацию. Из-за пониженной аффинности связывания с гетеродимером IL-2R β/γ, что необходимо для передачи сигналов, способность индуцировать клеточной рост снижалась примерно в 10 раз или более по сравнению с IL-2 (пролейкин). Однако общая эффективность при применении в более высоких дозах сохранялась и была сопоставима с эффективностью IL-2 (пролейкин).
Индукция фосфорилирования STAT5
В другом эксперименте оценивали индукцию фосфорилирования STAT5, являющуюся следствием опосредуемой IL-2 передачи сигналов IL-2R после инкубации с обеспечивающей направленный перенос IL-2 молекулой Fab-IL2-Fab, которая распознает FAP (на основе клона 4G8), с использованием различных популяций эффекторных клеток, таких как: A) CD56-NK-клетки, Б) CD4+CD25-CD127+-Т-клетки-хелперы, В) цитотоксические CD3+, CD8+-Т-клетки и Г) регуляторные CD4+CD25+FOXP3+-Т-клетки (Treg) из человеческих РВМС, в растворе.
РВМС, выделенные из крови здоровых доноров, обрабатывали в течение 20 мин пролейкином или Fab-IL2-Fab в различных концентрациях перед их фиксацией/повышением проницаемости и окрашивали их антителом к фосфоSТАТ5 (фирма Becton Dickinson) согласно инструкциям поставщика. После внутриклеточного окрашивания фосфорилированного STAT5, а также FOXP3 окрашивали поверхностные маркеры (CD3, CD4, CD8, CD56 и CD127) для определения различных субпопуляций с помощью проточной цитометрии (FACS Canto II).
Результаты, представленные на фиг.37, подтверждают результаты, представленные на фиг.36, и демонстрируют, что конструкция 4G8 Fab-IL2-Fab обладала способностью активировать передачу сигналов IL-2R на различных IL-2R-позитивных эффекторных клетках и индуцировать передачу сигналов IL-2R в прямом направлении и фосфорилирование STAT5. Из-за пониженной аффинности связывания с гетеродимером IL-2R β/γ, что необходимо для передачи сигналов, способность индуцировать фосфорилирование STAT5 снижалась примерно в 10 раз или более по сравнению с IL-2 (пролейкин). Однако общая эффективность при применении в более высоких дозах сохранялась и была сопоставима с эффективностью IL-2 (пролейкин).
Высвобождение IFN-γ и индукция пролиферации в растворе и при иммобилизации
Задачей, положенной в основу другого эксперимента, была имитация ситуации, которая имеет место в опухоли, когда обеспечивающий направленный перенос IL-2 иммуноконъюгат связывается и иммобилизуется на опухолевых клетках или в строме опухоли и может активировать эффекторные клетки. Для этой цели при создании изобретения осуществляли анализ высвобождения IFN-γ с использованием NК92-клеток, а также анализ пролиферации при использовании иммуноконъюгатов в растворе или осуществляли сенсибилизацию титрационных микропланшетов антигеном TNC или FAP, в результате чего обеспечивающие направленный перенос IL-2 иммуноконъюгаты иммобилизовывались посредством связывания с TNC или FAP.
Человеческим тенасцином или FAP в концентрации 2 мкг/мл сенсибилизировали в течение ночи при 4°С лунки 96-луночного плоскодонного планшета для ELISA. После блокады планшета осуществляли титрование планшета конструкциями Fab-IL2-Fab и инкубировали в течение 90 мин при КТ для обеспечения связывания. После интенсивной отмывки для удаления несвязанных конструкций добавляли NК92-клетки с пониженным уровнем IL-2 (10000 клеток/лунку). В качестве положительного контроля в некоторые лунки добавляли раствор пролейкина. Для определения пролиферации клетки инкубировали в течение 2 дней при 37°С во влажной камере (с 5% CO2), после чего осуществляли лизис клеток для определения пролиферации на основе измерения АТФ с помощью набора CellTiter Glo (фирма Promega). Высвобождение IFN-γ оценивали с использованием другого подхода после инкубации в течение 24 ч с Fab-IL-2-Fab в супернатанте клеток с использованием набора для ELISA, предназначенного для оценки IFN-γ (фирма Becton Dickinson).
Результаты подтвердили, что все конструкции Fab-IL2-Fab, мишенью которых является FAP, TNC-A1 или TNC-A2, обладали способностью активировать передачу сигналов IL-2R на NK92-клетках и индуцировать пролиферацию (фиг.38А) клеток, а также секрецию IFN-γ (фиг.38B), когда они находятся в растворе. Из-за пониженной аффинности связывания с гетеродимером IL-2R β/γ, что необходимо для передачи сигналов, способность индуцировать высвобождение IFN-γ снижалась примерно в 10 раз или более по сравнению с IL-2 (пролейкин). Однако общая эффективность при применении в более высоких дозах сохранялась и была сопоставима с эффективностью IL-2 (пролейкин). Если титрационные микропланшеты сенсибилизировали FAP или TNC и конструкциями, иммобилизованными на планшете, то все конструкции Fab-IL2-Fab, мишенью которых является FAP, TNC-A1 или TNC-A2, все еще сохраняли способностью активировать передачу/сигналов IL-2R на NK92-клетках и индуцировать рост клеток (фиг.38Б) и высвобождение IFN-γ (фиг.38Г). По сравнению с анализами, которые осуществляли в растворе, эффективность вариантов, в которых не использовали сенсибилизацию IL-2 (пролейкин) и применяли иммобилизованные конструкции Fab-IL2-Fab, оказалась на порядок выше, однако общая эффективность при применении в более высоких дозах сохранялась и была сопоставима с эффективностью IL-2 (пролейкин).
Эти данные убедительно подтверждают концепцию о необходимости создания обеспечивающих направленный перенос иммуноконъюгатов, которые обладают низким системным действием, но накапливаются в пораженной заболеванием области, в которой они опосредуют их функцию.
В следующем примере описаны результаты опытов, позволяющих решить вопрос о том, транслируются ли свойства, обнаруженные in vitro, в повышенную эффективность in vivo на моделях ксенотрансплантатов.
Пример 19
Оценка эффективности in vivo иммуноконъюгатов Fab-IL2-Fab, мишенью которых являются FAP и TNC-A2, на ксенотрансплантатах линий человеческих опухолевых клеток
Оценивали противоопухолевую эффективность иммуноконъюгатов Fab-IL2-Fab, мишенью которых являются FAP и TNC-A2, в отношении нескольких моделей ксенотрансплантатов.
Модель LS174Т-ксенотрансплантата
Иммуноконъюгат 2В10 Fab-IL2-Fab, мишенью которого является TNC-A2, оценивали с использованием человеческих колоректальных клеток линии LS174T, которые инъецировали внутрь селезенки SCID-мышей.
Исходные клетки LS174T (клетки человеческой карциномы ободочной кишки) получали из ЕСАСС (Европейская коллекция клеточных культур) и после размножения депонировали во внутреннем клеточном банке фирмы Glycart. Клетки LS174T культивировали в среде Игла MEM, содержащей 10% FCS (фирма РАА Laboratories, Австрия), 1% глутамакса, 1% заменимых аминокислот MEM (фирма Sigma). Клетки культивировали при 37°С в насыщенной водяным паром атмосфере с 5% СО2. Пассаж 15, жизнеспособность которого составляла 92,8%, полученный in vitro, применяли для внутриселезеночной инъекции. Осуществляли небольшой разрез на левой брюшной области анестезированных мышей SCID/c врожденным отсутствием естественных клеток-киллеров. Пятьдесят микролитров (3×106 LS174Т-клеток в среде AimV) клеточной суспензии инъецировали через брюшную стенку непосредственно под капсулу селезенки. Раны на коже закрывали скобками.
Самок SCID-мышей, возраст которых в начале эксперимента составлял 8-9 недель (полученных от фирмы Taconics, Дания), содержали в условиях без специфических патогенов с суточным циклом 12 ч света /12 ч темноты согласно утвержденным руководствам (GV-Solas; Felasa; TierschG). Протокол эксперимента был изучен и одобрен местными органами власти (Р 2008016). После доставки животных выдерживали в течение 1 недели, давая им акклиматизироваться в новых условиях, и для обследования. Регулярно проводили постоянный мониторинг состояния здоровья.
Мышам инъецировали внутрь селезенки в день 0 по 3×106 LS174Т-клеток, произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. дважды в неделю в течение 3 недель конструкцию 2В10 Fab-IL2-Fab, мишенью которой является TNC-A2 (Fab-IL2-Fab-SH2B10), конструкцию димерное антитело L19-IL-2, мишенью которой является фибронектин-EDB, или пролейкин.
Всем мышам для i.v.-инъекций использовали по 200 мкл соответствующих растворов. Мышам, из группы, обработанной наполнителем, инъецировали ЗФР, а мышам из групп, обработанных тестируемыми соединениями, инъецировали конструкцию Fab-IL2-Fab, димерное антитело или пролейкин. Для получения требуемого количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
Данные, представленные на фиг.39, демонстрируют, что иммуноконъюгат Fab-IL2-Fab, мишенью которого является TNC-A2, опосредует более высокую эффективность с точки зрения повышенной медианной выживаемости по сравнению с «голым» IL-2 (пролейкин) и содержащей IL-2 молекулой димерного антитела, мишенью которой является фибронектин-EDB.
Модель ACHN-ксенотрансплантата
Иммуноконъюгаты, мишенью которых является FAP, такие как Fab-IL2-Fab на основе 3F2 или 4G8, оценивали с использованием клеток человеческой почечной клеточной линии ACHN, которые инъецировали внутрь почки SCID-мышей.
Исходные клетки линии ACHN (клетки человеческой аденокарциномы почки) получали из АТСС (Американская коллекция типовых культур) и после размножения депонировали во внутреннем клеточном банке фирмы Glycart. Клетки ACHN культивировали в среде DMEM, содержащей 10% FCS. Клетки культивировали при 37°С в насыщенной водяным паром атмосфере с 5% CO2. Пассаж 9, жизнеспособность которого составляла 97,7%, полученный in vitro, применяли для внутрипочечной инъекции. Осуществляли небольшой разрез (2 см) на правом боку и перитонеальной стенке анестезированных SCID-мышей. Пятьдесят микролитров (1×106 ACHN-клеток в среде AimV) клеточной суспензии инъецировали подкапсульно в почку. Раны на коже и перитонеальной стенке закрывали скобками.
Самок SCID-мышей, возраст которых в начале эксперимента составлял 8-9 недель (полученных от фирмы Charles River, Сульцфельд, Германия), содержали в условиях без специфических патогенов с суточным циклом 12 ч света/12 ч темноты согласно утвержденным руководствам (GV-Solas; Felasa; TierschG). Протокол эксперимента был изучен и одобрен местными органами власти (Р 2008016). После доставки животных выдерживали в течение 1 недели, давая им акклиматизироваться в новых условиях, и для обследования. Регулярно проводили постоянный мониторинг состояния здоровья.
Мышам инъецировали внутрипочечно в день 0 по 1×106 ACHN-клеток, произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. дважды в неделю в течение 3 недель пролейкин, конструкцию димерное антитело L19-IL-2 или иммуноконъюгаты Fab-IL2-Fab на основе 4G8 или 3F2, мишенью которых является FAP.
Всем мышам для i.v.-инъекций использовали по 200 мкл соответствующего растворов. Мышам, из группы, обработанной наполнителем, инъецировали ЗФР, а мышам из групп, обработанных тестируемыми соединениями, инъецировали пролейкин, димерное антитело L19-IL-2 или иммуноконъюгаты Fab-IL2-Fab на основе 4G8 или 3F2, мишенью которых является FAP. Для получения требуемого количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
Данные, представленные на фиг.40, демонстрируют, что иммуноконъюгаты Fab-IL2-Fab на основе 3F2 и 4G8, мишенью которых является FAP, опосредуют высокую эффективность с точки зрения повышенной медианной выживаемости по сравнению с «голым» IL-2 (пролейкин) и содержащей IL-2 молекулой димерного антитела, мишенью которой является фибронектин-EDB. Конструкция Fab-IL2-Fab на основе 4G8, для которой характерна более высокая аффинность к мышиному FAP, обладала более высокой эффективностью, чем конструкция Fab-IL2-Fab на основе 3F2.
Модель А549-ксенотрансплантата
Иммуноконъюгат, мишенью которого является TNC-A2, такой как 2 В 10 Fab-IL2-Fab, оценивали с использованием клеток человеческой клеточной линии NSCLC A549, которые инъецировали i.v. трансгеным по человеческому FcγRIII SCID-мышам.
Исходные клетки немелкоклеточной карциномы легкого линии A549 получали из АТСС (CCL-185) и после размножения депонировали во внутреннем клеточном банке фирмы Glycart. Линию опухолевых клеток согласно общепринятым методам культивировали в среде DMEM, содержащей 10% FCS (фирма Gibco) при 37°С в насыщенной водяным паром атмосфере с 5% СО2. Пассаж 2, жизнеспособность которого составляла 98%, применяли для трансплантации. По 2×106 клеток инъецировали каждому животному i.v. в хвостовую вену в 200 мкл среды для культуры клеток Aim V (фирма Gibco).
Самок мышей линии SCID-FcγRIII (GLYCART-RCC), возраст которых в начале эксперимента составлял 8-9 недель (выращенные на фирме RCC, Швейцария), содержали в условиях без специфических патогенов с суточным циклом 12 ч света /12 ч темноты согласно утвержденным руководствам (GV-Solas; Felasa; TierschG). Протокол эксперимента был изучен и одобрен местными органами власти (Р 2008016). После доставки животных выдерживали в течение 1 недели, давая им акклиматизироваться в новых условиях, и для обследования. Регулярно проводили постоянный мониторинг состояния здоровья.
Мышам инъецировали i.v. в день опыта 0 по 5×106 А549-клеток, произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. дважды в неделю в течение 3 недель 2В10 Fab-IL2-Fab или димерное антитело L19-IL-2.
Всем мышам для i.v.-инъекций использовали по 200 мкл соответствующих растворов. Мышам, из группы, обработанной наполнителем, инъецировали ЗФР, а мышам из групп, обработанных тестируемыми соединениями, инъецировали конструкцию 2В10 Fab-IL2-Fab или димерное антитело L19-IL-2. Для получения требуемого количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
Данные, представленные на фиг.41, демонстрируют, что иммуноконъюгат Fab-IL2-Fab на основе 2В10, мишенью которого является TNC-A2, опосредует высокую эффективность с точки зрения повышенной медианной выживаемости по сравнению с содержащей IL-2 молекулой димерного антитела, мишенью которой является фибронектин-EDB.
Пример 20
Очистка иммуноконъюгата Fab-GM-CSF-Fab, обеспечивающего направленный перенос GM-CSF
Первоначальную очистку иммуноконъюгата Fab-GM-CSF-Fab, в котором в качестве Fab-фрагмента служило антитело L19 (агент, связывающий эктодомен-В фибронектина), осуществляли из супернатантов кратковременно трансфектированных клеток НЕК 293 EBNA. В целом, метод состоял в следующем: Fab-GM-CSF-Fab очищали на белке А с последующей гель-фильтрацией. Колонку с белком А уравновешивали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5. Вносили супернатант и колонку промывали сначала 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5, а затем 20 мМ фосфатом натрия, 20 мМ цитратом натрия, 100 мМ хлоридом натрия, рН 7.5. Доставленный в результате направленного переноса GM-CSF элюировали с помощью 20 мМ цитрата натрия, 100 мМ хлорида натрия, 100 мМ глицина, рН 3 и затем нейтрализовали. Для продукта применяли следующий конечный буфер: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7.
На фиг.42 представлены профили элюции при очистке и результаты аналитической характеризации продукта, полученные с помощью ДСН-ПААГ (NuPAGE Novex Bis-Tris Mini Gel, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия). Выход составлял 4,8 мг/л.
Пример 21
Анализ биологической активности иммуноконъюгата Fab-GM-CSF-Fab, обеспечивающего направленный перенос GM-CSF
Затем очищенный иммуноконъюгат Fab-GM-CSF-Fab, в котором в качестве Fab-фрагмента служило антитело L19 (агент, связывающий эктодомен-В фибронектина), анализировали в отношении GM-CSF-зависимой пролиферации. В целом, метод состоял в следующем: TF-1-клетки, рост которых зависит от GM-CSF, высевали после выращивания в течение ночи на минимальной среде из расчета 10000 клеток/лунку в 96-луночный плоскодонный планшет. Человеческий рекомбинантный GM-CSF (фирма Miltenyi, №130-093-862) или иммуноконъюгат Fab-GM-CSF-Fab применяли для титрования клеток в растворе. После пролиферации в течение 2 дней при 37°С во влажной камере с 5% СО2клетки лизировали и оценивали количественно содержание АТФ с помощью набора для анализа CellTiter Glo фирмы Promega. При расчете рост необработанных GM-CSF клеток принимали за 0%. Результаты, представленные на фиг.43, демонстрируют, что иммуноконъюгат Fab-GM-CSF-Fab индуцировал значительную пролиферацию TF-1-клеток.
Пример 22
Очистка иммуноконъюгата Fab-IL12-Fab, обеспечивающего направленный перенос IL-12
Первоначальную очистку иммуноконъюгата Fab-IL12-Fab, в котором в качестве Fab-фрагмента служило антитело 4G8 (агент, связывающий с FAP), осуществляли из супернатантов кратковременно трансфектированных клеток НЕК 293 EBNA. В целом, метод состоял в следующем: Fab-IL12-Fab очищали на белке А с последующей гель-фильтрацией. Колонку с белком А уравновешивали в 20 мМ фосфат натрия, 20 мМ цитрате натрия, рН 7,5. Вносили супернатант и колонку промывали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, 500 мМ хлоридом натрия, рН 7,5. Для второй промывки использовали 13,3 мМ фосфат натрия, 20 мМ цитрат натрия, 500 мМ хлорид натрия, рН 5,45. После третьей промывки с помощью 10 мМ MES, 50 мМ хлорида натрия рН 5, доставленный в результате направленного переноса IL-12 элюировали с помощью 20 мМ цитрата натрия, 100 мМ хлорида натрия, 100 мМ глицина, рН 3 и затей нейтрализовали. Для продукта применяли следующий конечный буфер: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7.
На фиг.44 представлены профили элюции при очистке и результаты аналитической характериации продукта, полученные с помощью ДСН-ПААГ (NuPAGE Novex Bis-Tris Mini Gel, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия). Выход составлял 43 мг/л.
Пример 23
Анализ биологической активности иммуноконъюгата Fab-IL12-Fab, обеспечивающего направленный перенос IL-12
Затем очищенный иммуноконъюгат Fab-IL12-Fab, в котором в качестве Fab-фрагмента служило антитело 4G8 (агент, связывающий с FAP), анализировали в отношении индуцируемого IL-12 высвобождения IFN-γ, осуществляя сравнение воздействия IL-12 и очищенного иммуноконъюгата 4G8 Fab-IL12-Fab, используя человеческие РВМС, выделенные из свежей крови здорового донора.
В целом, метод состоял в следующем: человеческие РВМС выделяли из свежей крови здорового донора и высевали в 96-луночный планшет с U-образным дном (1,5×105 клеток/лунку) в среду AIM V. В каждую лунку добавляли постоянную концентрацию 10 нг/мл hu IL-2 (фирма Peprotech). Конструкцию Fab-IL12-Fab развод или средой и титровали с использованием РВМС.Супернатанты собирали примерно через 20 ч для определения концентраций IFN-γ с помощью набора hu IFN-γ ELISA II фирмы Becton Dickinson (№550612).
Результаты, представленные на фиг.45, демонстрируют, что А) при применении в выбранной концентрации человеческий (hu) IL-2 индивидуально, а также IL-12 индивидуально, не обладали способностью заметно индуцировать высвобождение IFN-γ человеческими РВМС, в то время как комбинация обоих цитокинов приводила к существенному повышению высвобождения IFN-γ РВМС.Б) конструкция Fab-IL-12-Fab индуцировала высвобождение IFN-γ человеческими РВМС в зависимости от концентрации в присутствии 10 нг/мл человеческого IL-2.
Пример 24
Очистка иммуноконъюгата Fab-IFNα2-Fab, обеспечивающего направленный перенос IFNα
Первоначальную очистку иммуноконъюгата Fab-IFNα2-Fab, в котором в качестве Fab-фрагмента служило антитело L19 (агент, связывающий эктодомен-В фибронектина), осуществляли из супернатантов кратковременно трансфектированных клеток НЕК 293 EBNA. В целом, метод состоял в следующем: Fab-FNα2-Fab очищали на белке А с последующей гель-фильтрацией. Колонку с белком А уравновешивали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5. Вносили супернатант и колонку промывали сначала 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5, а затем 20 мМ фосфатом натрия, 20 мМ цитратом натрия, 100 мМ хлоридом натрия, рН 7,5. Fab-IFNα2-Fab элюировали, используя 20 мМ цитрат натрия, 100 мМ хлорид натрия, 100 мМ глицин, рН 3 и затем нейтрализовали. Для продукта применяли следующий конечный буфер: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7.
На фиг.46 представлены профили элюции при очистке и результаты аналитической характеризации продукта, полученные с помощью ДСН-ПААГ (NuPAGE Novex Bis-Tris Mini Gel, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия). Выход составлял 8,4 мг/л.
Пример 25
Оценка биологической активности иммуноконъюгата Fab-IFNα2-Fab, обеспечивающего направленный перенос IFNα
Затем очищенный иммуноконъюгат Fab-IFNα2-Fab, в котором в качестве Fab-фрагмента служило антитело L19 (агент, связывающий эктодомен-В фибронектина), анализировали в отношении индуцируемого IFN-α ингибирования пролиферации Т-клеток линии Jurkat и опухолевых клеток линии А549 в сравнении с эффективностью IFN-α (роферон А, фирма Roche) и очищенного иммуноконъюгата Fab-IFNα2-Fab на основе L19. В целом, метод состоял в следующем: клетки А549 и Т-клетки Jurkat, которые обладают чувствительностью к индуцируемому IFN-α ингибированию пролиферации, высевали из расчета 5000 клеток/лунку (А549) или 10000 клеток/лунку (Jurkat) в 96-луночные плоскодонные планшеты. Разведения роферона А (фирма Roche) или Fab-IFNα2-Fab в соответствующей среде для культуры клеток применяли для титрования клеток в растворе. После пролиферации в течение 2 дней при 37°С во влажной камере с 5% СО2 клетки лизировали и оценивали количественно содержание АТФ с помощью набора для анализа CellTiter Glo фирмы Promega. При расчете рост необработанных IFN-α клеток принимали за 0%. Результаты, представленные на фиг.47, демонстрируют, что конструкции Fab-IFN-α-Fab ингибировали пролиферацию А) Т-клеток линии Jurkat и Б) А549-клеток в зависимости от концентрации, аналогично действию IFN-α (роферон А).
Пример 26
Получение иммуноконъюгатов Fab-IL2-Fab, мишенью которых является MCSP
Гуманизированное антитело к MCSP MHLG создавали согласно методу, описанному в WO 2006/100582 (см., в частности пример 1 в указанной заявке), полное содержание которой включено в настоящее описание в качестве ссылки, и превращали в формат Fab-IL2-Fab (см. SEQ ID NO: 255, 256, 261, 262).
Гуманизированное антитело к MCSP MHLG1 создавали следующим образом: мышиную аминокислотную последовательность антитела к MCSP 225.28 (см. ниже последовательности легкой цепи и тяжелой цепи) сравнивали с коллекцией V-генов антител человеческой зародышевой линии и сортировали на основе идентичности и гомологии последовательностей.
Легкая цепь 225.28; GenBank, регистрационный №САА65007 (SEQ ID 267): DIELTQSPKFMSTSVGDRVSVTCKASQNVDTNVAWYQQKPGQSPEPLLFSASYRYTGVPDRFTGSGSGTDFTLTISNVQSEDLAEYFCQQYNSYPLTFGGGTKLEIK.
Тяжелая цепь 225.28; регистрационный № в GenBank отсутствует (SEQ ID 268): QVKLQQSGGGLVQPGGSMKLSCVVSGFTFSNYWMNWVRQSPEKGLEWIAEIRLKSNNFGRYYAESVKGRFTISRDDSKSSAYLQMINLRAEDTGIYYCTSYGNYVGHYFDHWGQGTTVTVSS.
Потенциальную акцепторную последовательность отбирали на основе высокой степени общей гомологии и присутствия «правильных» канонических остатков, уже присутствующих в акцепторной последовательности. Последовательность человеческой зародышей линии IGHV3-15 (IMGT, регистрационный №Х92216) была выбрана в качестве акцепторной для тяжелой цепи, а последовательность IGKV1-9 (IMGT, регистрационный №Z00013) была выбрана для легкой цепи. Гуманизированные конструкции обозначали как М-KV1 (см. SEQ ID NO: 263, 264, 269, 270), -7 (SEQ ID NO: 265, 266, 271, 272) и -9 (SEQ ID NO: 253, 254, 259, 260) для легкой цепи и MHLG1 (см. SEQ ID NO: 251, 252, 257, 258) для тяжелой цепи.
При конструировании экспрессионных плазмид гены указанных сконструированных последовательностей антитела создавали с помощью общепринятых методов на основе ПЦР и сливали с человеческим IgG1 и константными областями каппа-цепей.
Антитела экспрессировали либо в виде IgG, либо в виде слитых белков Fab-IL2-Fab в системах культур клеток млекопитающих типа НЕК или СНО и очищали с помощью белка А и гель-фильтрации. Сравнение данных о связывании вариантов легкой цепи M-KV1 и M-KV7 позволило установить, что остаток пролина в положении 46 согласно нумерации по Кэботу имеет решающее значение для функционального связывания с антигеном. Два различных подхода применяли для точного установления присутствия указанной аминокислоты: А) так называемую обратную мутацию интродуцировали с человеческий каркасный участок IGKV1-9. И Б) для того, чтобы избежать присутствия обратных мутаций, полный каркасный участок 2 (положения 35-49 по Кэботу) заменяли на соответствующий участок человеческого антитела, GenBank, №ААА 17574, Это антитело содержало в естественных условиях остаток пролина в положении 46.
Fab-IL2-Fab на основе MHLG или MHLG1 KV9, мишенью которых является MCSP, очищали с помощью описанного выше метода (пример 9), который включал одну стадию аффинной хроматографии (белок А) с последующей гель-фильтрацией (Superdex 200, фирма GE Healthcare). Колонку с белком А уравновешивали 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5, вносили супернатант и колонку промывали 20 мМ фосфатом натрия, 20 мМ цитратом натрия,, 500 мМ хлоридом натрия, рН 7,5, после чего промывали 13,3 мМ фосфатом натрия, 20 мМ цитратом натрия, 500 мМ хлоридом натрия, рН 5,45. Необязательно включали третью промывку с помощью 10 мМ MES, 50 мМ хлорида натрия, рН 5 Fab-IL2-Fab элюировали с помощью 20 мМ цитрата натрия, 100 мМ хлорида натрия, 100 мМ глицина, рН 3. Элюированные фракции объединяли и окончательно очищали с помощью гель-фильтрации в конечном буфере для продукта, имеющем следующий состав: 25 мМ фосфат калия, 125 мМ хлорид натрия, 100 мМ глицин, рН 6,7.
На фиг.48 (для MHLG Fab-IL2-Fab) и на фиг.49 (для MHLG1 Fab-IL2-Fab) представлены (А) профили элюции при очистке и (Б) результаты аналитической характеризации Fab-IL2-Fab на основе MHLG или MHLG1, мишенью которых является MCSP, полученные с помощью ДСН-ПААГ (NuPAGE Novex Bis-Tris Mini Gel, фирма Invitrogen, MOPS в качестве подвижного буфера, восстанавливающие и невосстанавливающие условия).
Пример 27
Анализ биологической активности иммуноконъюгатов Fab-IL2-Fab. мишенью которых является MCSP
Затем очищенные иммуноконъюгаты Fab-IL2-Fab, в которых в качестве Fab использовали MHLG KV9 или MHLG1 KV9 (агенты, связывающие MCSP), анализировали в отношении индуцируемого IL-2 высвобождения IFN-γ, осуществляя сравнение действия очищенного Fab-IL2-Fab на основе 4G8 (агент, связывающий FAP) и Fab-IL2-Fab на основе MHLG или MHLG1 с использованием NК92-клеток.
Имеющие пониженный уровень IL-2 NК92-клетки (предварительно инкубированные в течение 2 ч без IL-2) высевали в 96-луночные планшеты с U-образным дном (10 клеток/лунку) в среду для NK-клеток (МЕМа + 10% FCS+10% лошадиной сыворотки + 0,1 мМ 2-меркаптоэтанол + 0,2 мМ инозит + 0,02 мМ фолиевая кислота). Иммуноконъюгаты Fab-IL2-Fab, мишенью которых является MCSP, разводили в среде для NK-клеток и титровали с использованием NK92-клеток для осуществления непосредственного сравнения с иммуноконъюгатами Fab-IL2-Fab на основе 4G8, мишенью которых является FAP. Супернатанты собирали через 22-24 ч для определения концентраций IFN-γ, используя набор ELISA II для человеческого IFN-γ, фирма Becton Dickinson (№550612).
Результаты, представленные на фиг.50 (для Fab-IL2-Fab на основе MHLG KV9) и фиг.51 (для Fab-IL2-Fab на основе MHLG1 KV9), демонстрируют, что все иммуноконъюгаты Fab-IL2-Fab, мишенью которых являются MCSP или FAP, индуцировали сопоставимую секрецию IFN-γ в NK92-клетках в зависимости от концентрации и вне зависимости от применяемого антигенсвязывающего фрагмента.
Пример 28
Клеточный анализ связывания с иммуноконъюгатом MHLG1 KV9 Fab-IL2-Fab, мишенью которого является MCSP
Очищенный иммуноконъюгат Fab-IL2-Fab на основе MHLG1 KV9, мишенью которого является MCSP, оценивали с помощью проточной цитометрии в отношении связывания с экспрессирующими человеческий MCSP клетками меланомы линии Соlо38. В целом, метод состоял в следующем: клетки собирали, подсчитывали их количество и определяли жизнеспособность. Количество клеток (жизнеспособных) доводили до 1,112×106 клеток/мл в ЗФР/0,1% БСА и вносили аликвоты по 180 мкл/лунку (200000 клеток/лунку) в круглодонный 96-луночный планшет. В содержащие клетки лунки добавляли по 20 мкл иммуноцитокина MHLG1 KV9 Fab-IL2-Fab (в различных разведениях) и инкубировали в течение 30 мин при 4°С. Затем клетки собирали центрифугированием (4 мин, 400×g), отмывали, используя 150 мкл/лунку ЗФР/0,1% БСА, ресуспендировали и инкубировали в течение 30 мин при 4°С, используя по 12 мкл/лунку вторичного антитела (конъюгированный с ФИТЦ AffiniPure F(аb')2-фрагмент козьего антитела к человеческому F(аb')2 (фирма Jackson Immuno Research Lab №109-096-097), растворенного в 1,5 мл смеси 1:1 воды и глицерина (маточный раствор), используя разведение 1:20 в ЗФР/0,1% БСА. Затем клетки отмывали, используя по 150 мкл/лунку ЗФР/0,1% БСА, с последующей стадией отмывки в ЗФР, собирали центрифугированием (4 мин, 400×g) и ресуспендировали, используя по 200 мкл/лунку ЗФР/0,1% БСА, содержащий йодид пропидия (PI). Измерения осуществляли с помощью устройства FACSCantoII (с использованием программного обеспечения FACS Diva). Результаты, представленные на 52, демонстрируют, что иммуноконъюгат MHLG1 KV9 Fab-IL2-Fab, мишенью которого является MCSP, в зависимости от дозы отличался высокой способностью к связыванию с клетками линии Соlо38.
Необходимо иметь ввиду, что для интерпретации формулы изобретения следует использовать раздел «Подробное описание изобретения», а не разделы «Краткое изложение сущности изобретения» и «Реферат». В разделах «Краткое изложение сущности изобретения» и «Реферат» могут быть описаны один или несколько, но не все примеры вариантов осуществления изобретения, предложенные автором(ами), и следовательно, их не следует рассматривать, как ограничивающие каким-либо образом настоящее изобретение.
Настоящее изобретение было описано выше с помощью функциональных конструктивных элементов для иллюстрации осуществления их конкретных функций и взаимосвязей. Для удобства описания были условно определены границы указанных функциональных конструктивных элементов. Можно определять и другие границы, если при этом будут соответствующим образом осуществляться конкретные функции и взаимосвязи.
Представленное выше описание конкретных вариантов осуществления изобретения должно раскрыть общую сущность изобретения настолько полно, чтобы другие специалисты на основе своих знаний в данной области были способны без излишних экспериментов легко модифицировать и/или адаптировать такие конкретные варианты осуществления изобретения для различных применений, не отклоняясь от общей концепции настоящего изобретения. Таким образом, на основе представленных в настоящем описании идеи и руководства следует считать, что такие адаптации и модификации с точки зрения объема и сущности соответствуют эквивалентам описанных вариантов осуществления изобретения. Следует иметь ввиду, что фразеология или терминология употребляется для целей описания, но не для ограничения, таким образом, специалист в данной области должен интерпретировать употребляемую в настоящем описании терминологию или фразеологию в свете идей изобретения и рассматриваемого руководства.
Широта и объем настоящего изобретения не ограничиваются никаким из представленных выше в качестве примеров вариантов осуществления изобретения, они определяются только представленными ниже пунктами формулы изобретения и их эквивалентами.
Реферат
Изобретение относится к области биотехнологии и иммунологии. Описаны иммуноконъюгат для доставки эффекторного фрагмента, который влияет на клеточную активность. Иммуноконъюгат содержит один одноцепочечный эффекторный фрагмент и два антигенсвязывающих фрагментов, представляющих собой молекулу Fab. Также описаны молекулы нуклеиновых кислот, кодирующие иммуноконъюгаты, векторы и клетки-хозяева, которые содержат молекулы нуклеиновых кислот, способы получения иммуноконъюгатов, предлагаемых в изобретении, и способы применения указанных иммуноконъюгатов для лечения болезни. 4 н. и 129 з.п. ф-лы, 53 ил., 23 табл., 28 пр.
Формула
(а) одноцепочечный эффекторный фрагмент; и
(б) первый и второй антигенсвязывающие фрагменты, где первый и второй антигенсвязывающие фрагменты представляют собой молекулу Fab,
причем первая молекула Fab сцеплена с помощью карбоксиконца ее тяжелой или легкой цепи с аминоконцевой аминокислотой эффекторного фрагмента, а эффекторный фрагмент сцеплен с помощью его карбоксиконцевой аминокислоты с концевой аминокислотой тяжелой или легкой цепи второй молекулы Fab.
(i) последовательность вариабельной области тяжелой цепи SEQ ID NO: 7 и последовательность вариабельной области легкой цепи SEQ ID NO: 5,
(ii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 179 и последовательность вариабельной области легкой цепи SEQ ID NO: 177,
(iii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 183 и последовательность вариабельной области легкой цепи SEQ ID NO: 181,
(iv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 187 и последовательность вариабельной области легкой цепи SEQ ID NO: 185,
(v) последовательность вариабельной области тяжелой цепи SEQ ID NO: 191 и последовательность вариабельной области легкой цепи SEQ ID NO: 189,
(vi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 195 и последовательность вариабельной области легкой цепи SEQ ID NO: 193,
(vii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 199 и последовательность вариабельной области легкой цепи SEQ ID NO: 197,
(viii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 203 и последовательность вариабельной области легкой цепи SEQ ID NO: 201 или
(ix) последовательность вариабельной области тяжелой цепи SEQ ID NO: 207 и последовательность вариабельной области легкой цепи SEQ ID NO: 205.
(i) последовательность вариабельной области тяжелой цепи SEQ ID NO: 131 и последовательность вариабельной области легкой цепи SEQ ID NO: 129,
(ii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 163 и последовательность вариабельной области легкой цепи SEQ ID NO: 161,
(iii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 31 и последовательность вариабельной области легкой цепи SEQ ID NO: 29,
(iv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 21 и последовательность вариабельной области легкой цепи SEQ ID NO: 19,
(v) последовательность вариабельной области тяжелой цепи SEQ ID NO: 25 и последовательность вариабельной области легкой цепи SEQ ID NO: 23,
(vi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 35 и последовательность вариабельной области легкой цепи SEQ ID NO: 33,
(vii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 39 и последовательность вариабельной области легкой цепи SEQ ID NO: 37,
(viii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 43 и последовательность вариабельной области легкой цепи SEQ ID NO: 41,
(ix) последовательность вариабельной области тяжелой цепи SEQ ID NO: 47 и последовательность вариабельной области легкой цепи SEQ ID NO: 45,
(x) последовательность вариабельной области тяжелой цепи SEQ ID NO: 51 и последовательность вариабельной области легкой цепи SEQ ID NO: 49,
(хi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 69 и последовательность вариабельной области легкой цепи SEQ ID NO: 67,
(xii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 73 и последовательность вариабельной области легкой цепи SEQ ID NO: 71,
(xiii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 77 и последовательность вариабельной области легкой цепи SEQ ID NO: 75,
(xiv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 81 и последовательность вариабельной области легкой цепи SEQ ID NO: 79,
(xv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 85 и последовательность вариабельной области легкой цепи SEQ ID NO: 83,
(xvi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 89 и последовательность вариабельной области легкой цепи SEQ ID NO: 87,
(xvii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 93 и последовательность вариабельной области легкой цепи SEQ ID NO: 91,
(xviii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 123 и последовательность вариабельной области легкой цепи SEQ ID NO: 121,
(xix) последовательность вариабельной области тяжелой цепи SEQ ID NO: 127 и последовательность вариабельной области легкой цепи SEQ ID NO: 125,
(xx) последовательность вариабельной области тяжелой цепи SEQ ID NO: 135 и последовательность вариабельной области легкой цепи SEQ ID NO: 133,
(xxi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 139 и последовательность вариабельной области легкой цепи SEQ ID NO: 137,
(xxii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 143 и последовательность вариабельной области легкой цепи SEQ ID NO: 141,
(ххiii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 147 и последовательность вариабельной области легкой цепи SEQ ID NO: 145,
(xxiv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 151 и последовательность вариабельной области легкой цепи SEQ ID NO: 149,
(xxv) последовательность вариабельной области тяжелой цепи SEQ ID NO: 155 и последовательность вариабельной области легкой цепи SEQ ID NO: 153,
(xxvi) последовательность вариабельной области тяжелой цепи SEQ ID NO: 159 и последовательность вариабельной области легкой цепи SEQ ID NO: 157,
(xxvii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 167 и последовательность вариабельной области легкой цепи SEQ ID NO: 165,
(xxviii) последовательность вариабельной области тяжелой цепи SEQ ID NO: 171 и последовательность вариабельной области легкой цепи SEQ ID NO: 169 или
(xxix) последовательность вариабельной области тяжелой цепи SEQ ID NO: 175 и последовательность вариабельной области легкой цепи SEQ ID NO: 173.

Комментарии