Молекулярные массивы антигенов - RU2324704C2
Код документа: RU2324704C2
Чертежи














Описание
Область изобретения
Данное изобретение относится к областям медицины, иммунологии, вирусологии и молекулярной биологии.
Уровень техники
Вакцинация обеспечила один из наиболее эффективных путей борьбы с инфекционными заболеваниями и привела к наиболее значительной пользе для общественного здравоохранения в последнем столетии. Стратегии ранней вакцинации использовали живые, аттенуированные или инактивированные патогены в качестве иммуногена. Соображения безопасности в обществе и в соответствующих учреждениях благоприятствовали поиску более точно охарактеризованных и более безопасных вакцин.
Этот поиск стимулировал новое направление исследований, где выделяли или рекомбинантно экспрессировали и инъецировали индивидуальные антигены в качестве иммуногенов. Примеры их включают в себя разработку и применение субъединичных вакцин. Однако такие вакцины часто требуют добавления адъюванта для индуцирования достаточной иммунной реакции против такого антигена, так как выделенный белок обычно является недостаточно иммуногенным для индуцирования защитной иммунной реакции. Хотя известны несколько сильных адъювантов, таких как полный адъювант Фрейнда, они являются обычно токсичными и не могут быть использованы в случае людей. Таким образом, предпринимались большие усилия в поиске новых адъювантов.
Недавно поиск в отношении принципов дискриминации иммунной системой между аутоантигенами и чужеродными антигенами обнаружил, что степень организации и частота встречаемости антигенов на поверхностях вирусов являются очень сильным сигналом для того, чтобы антиген узнавался как чужеродный (Bachmann & Zinkernagel, Immunol. Today 17:553-558 (1996)). Это свойство вирусных структур было использовано в конструировании новых вакцин на основе вирусоподобных частиц (VLP), которые объединяли иммуногенность вирусных структур и улучшенный профиль безопасности нереплицируемых вакцин. В этих вакцинах антиген либо слит, либо химически соединен с вирусоподобными частицами, причем химическое соединение является ковалентным или нековалентным. Таким образом, иммуногенное свойство этой вирусной структуры переносится на антиген посредством связывания этого антигена с вирусоподобными частицами.
Разнообразные VLP были использованы для присоединения антигенов. Например, в WO 00/32227 описано использование антигена кора (ядра) вируса гепатита В в получении определенных типов вакцин.
Новый класс высокоэкспрессируемых и высокоиммуногенных VLP был описан в WO 03/056905, который включен здесь в качестве ссылки в его полном виде. Эти VLP состоят из белка оболочки РНК-бактериофагов. Эти белки оболочки экспрессируются рекомбинантно в бактериях, и эти VLP не содержат РНК-генома фага и, следовательно, не могут реплицироваться.
Недавно был идентифицирован новый РНК-бактериофаг, АР205 (Klovins, J. et al., J. Gen. Virol. 83: 1523-33 (2002). РНК-фаг АР205 (Taxonomy ID: 154784) является одноцепочечным, имеющим положительную цепь РНК-вирусом (без стадии ДНК), который принадлежит к семейству Leviviridae, роду Levivirus, подгруппе неклассифицируемый Levivirus. Другими членами этой подгруппы являются РНК-фаги ВО1, fr1, TW19 и РР7. Две описанные подгруппы Levivirus включают в себя следующие РНК-фаги: fr, JP501, f2, M12, MS2 и R17 (подгруппа I) и BZ13, JP34, TH1, GA и KU1 (подгруппа II). Геном АР205 имеет длину 4267 нуклеотидов (нт). Полноразмерная геномная последовательность: номера доступа AF334111, NC_002700. Природным хозяином фага АР205 являются Acinetobacter spp. (Klovins, J. et al., J. Gen. Virol. 83: 1523-33 (2002)). Геном фага АР205 содержит три большие открытые рамки считывания (ORF), которые кодируют белки созревания, белки оболочки и белки репликазы. Кроме того, на 5'-конце присутствуют две дополнительные малые ORF перед геном созревания. Функция белков, кодируемых этими ORF, является неизвестной. Постулировалось, что одна из этих ORF может кодировать белок лизиса (Klovins, J. et al., J. Gen. Virol. 83: 1523-33 (2002)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что белок оболочки АР205 может быть рекомбинантно экспрессирован в бактериях с использованием векторов данного изобретения. Авторы разработали также способы очистки вирусоподобных частиц АР205. Кроме того, белки оболочки АР205, получаемые данным способом, самопроизвольно образовывали капсиды, как показано электронной микроскопией (ЭМ) и иммунодиффузией, и, следовательно, только белок оболочки вместе с РНК был достаточным для сборки капсида в E. coli. Это исключает любую роль белков, кодируемых этими двумя ORF неизвестной функции. Неожиданным признаком данного изобретения является то, что не существует гомологии последовательности между последовательностью белка оболочки АР205 и белками оболочки других РНК-фагов, из которых эта структура была выяснена, хотя структурные свойства капсида, образуемого белком оболочки АР205, и капсидов, образуемых белком оболочки этих РНК-фагов, являются почти неразличимыми при наблюдении с использованием электронной микроскопии. Авторы обнаружили, что VLP АР205 являются высокоиммуногенными и могут быть связаны с органическими молекулами для получения вакцинных конструкций, презентирующих эти органические молекулы, ориентированные повторяющимся образом. Высокие титры индуцировались против презентируемых таким образом органических молекул, что свидетельствует о том, что связанные органические молекулы являются доступными для взаимодействия с молекулами антител и являются иммуногенными.
Данное изобретение относится к рекомбинантно экспрессируемым вирусоподобным частицам (VLP), спонтанно собираемым по меньшей мере из одного белка оболочки бактериофага АР205, рекомбинантно экспрессируемого в E. coli. В связанном аспекте данное изобретение относится к компетентным в отношении сборки мутантным формам VLP АР205, включающим в себя белок оболочки АР205 с заменой пролина в положении аминокислоты 5 треонином (SEQ ID NO:3). Эти VLP, VLP АР205, полученные из природных источников (SEQ ID NO:1), или вирусные частицы АР205, могут быть связаны по меньшей мере с одной органической молекулой с образованием упорядоченных повторяющихся массивов органических молекул. Органические молекулы данного изобретения включают в себя антигены и антигенные детерминанты, аллергены, аутоантигены, гаптены, раковые антигены и антигены инфекционных заболеваний, а также малые органические молекулы, такие как приводящие к злоупотреблению средства, такие как никотин и его производные. Иммунизация животных с использованием VLP-конъюгатов антиген-АР205 или композиций, содержащих такие конъюгаты, обеспечиваемых данным изобретением, индуцируют сильную иммунную реакцию против презентируемого антигена. Таким образом, VLP данного изобретения применимы для присоединения и презентирования молекул, в частности антигенов. Таким образом, конъюгаты, композиции и способы данного изобретения применимы для стимуляции иммунной реакции против разнообразных презентируемых антигенов и, следовательно, для применения в животных.
В первом аспекте данное изобретение относится к вирусоподобной частице, содержащей по меньшей мере один белок, выбранный из группы, состоящей из (а) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:1; (b) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:3, и (с) мутеина указанного белка (а) или (b), альтернативно или предпочтительно по существу состоящий из этого белка или альтернативно или предпочтительно состоящий из этого белка. Предпочтительно указанный белок является рекомбинантным. Таким образом, данное изобретение относится к капсиду, образованному по меньшей мере одним белком, выбранным из группы, состоящей из (а) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:1; (b) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:3, и (с) мутеина указанного белка (а) или (b). В предпочтительном варианте указанный мутеин имеет аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, где по меньшей мере один аминокислотный остаток, предпочтительно три аминокислотных остатка, более предпочтительно два аминокислотных остатка и даже еще более предпочтительно один аминокислотный остаток, SEQ ID NO:1 или SEQ ID NO:3, является добавленным, делетированным или замененным, где предпочтительно указанная по меньшей мере одна замена является консервативной заменой. В следующем предпочтительном варианте указанный мутеин имеет аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, где по меньшей мере один остаток цистеина, предпочтительно два остатка цистеина SEQ ID NO:1 или SEQ ID NO:3, делетированы или заменены, где предпочтительно указанная по меньшей мере одна замена, предпочтительно две замены, являются консервативными заменами. Еще в одном предпочтительном варианте указанный мутеин имеет аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, где по меньшей мере один остаток лизина, предпочтительно три остатка лизина, более предпочтительно два остатка лизина и даже более предпочтительно один лизин SEQ ID NO:1 или SEQ ID NO:3, добавлены, делетированы или заменены, где предпочтительно указанная по меньшей мере одна замена является консервативной заменой.
Во втором аспекте данное изобретение относится к мутеину, имеющему аминокислотную последовательность, представленную в SEQ ID NO:3. Альтернативно, данное изобретение относится к мутеину рекомбинантного белка SEQ ID NO:1 или SEQ ID NO:3, где по меньшей мере один аминокислотный остаток, предпочтительно три аминокислотных остатка, более предпочтительно два аминокислотных остатка и даже еще более предпочтительно один аминокислотный остаток SEQ ID NO:1 или SEQ ID NO:3, добавлены, делетированы или заменены, где предпочтительно указанная по меньшей мере одна замена является консервативной заменой.
Еще в одном аспекте данное изобретение относится к мутеину рекомбинантного белка SEQ ID NO:1 или SEQ ID NO:3, где по меньшей мере один остаток цистеина, предпочтительно два остатка цистеина SEQ ID NO:1 или SEQ ID NO:3, делетированы или заменены, где предпочтительно указанная по меньшей мере одна замена, предпочтительно две замены, являются консервативными заменами. Альтернативно, данное изобретение относится к мутеину рекомбинантного белка SEQ ID NO:1 или SEQ ID NO:3, где по меньшей мере один остаток лизина, предпочтительно три остатка лизина, более предпочтительно два остатка лизина и даже более предпочтительно один лизин SEQ ID NO:1 или SEQ ID NO:3, добавлены, делетированы или заменены, где предпочтительно указанная по меньшей мере одна замена является консервативной заменой.
В другом аспекте данное изобретение относится к вектору для получения вирусоподобной частицы АР205, последовательность которой является по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и даже еще более предпочтительно на 99%, идентичной последовательности SEQ ID NO:2 или SEQ ID NO:4. Альтернативно, данное изобретение относится к вектору для получения рекомбинантного белка, содержащего полипептид, слитый с белком, где указанный белок выбран из группы, состоящей из (а) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:1; (b) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:3, и (с) мутеина указанного полипептида (а) или (b).
В следующем аспекте данное изобретение относится к способу получения вирусоподобной частицы АР205, предусматривающий стадии (а) обеспечения нуклеиновой кислоты, содержащей нуклеотидную последовательность, являющуюся по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и даже еще более предпочтительно на 100%, идентичной последовательности SEQ ID NO:2 или SEQ ID NO:4, или обеспечения вектора, содержащего нуклеотидную последовательность, являющуюся по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и даже еще более предпочтительно на 99% идентичной последовательности SEQ ID NO:2 или SEQ ID NO:4; (b) введения указанной нуклеиновой кислоты или указанного вектора в клетку-хозяина; (с) экспрессии указанной нуклеиновой кислоты или последовательности указанного вектора в указанной клетке-хозяине для получения белка или мутеина, способного образовывать вирусоподобную частицу АР205. Предпочтительно указанной клеткой-хозяином является E. coli.
Еще в одном аспекте данное изобретение относится к способу получения вирусоподобной частицы АР205, предусматривающий стадии (а) обеспечения нуклеиновой кислоты или вектора, кодирующих по меньшей мере один белок, выбранный из группы, состоящей из (i) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:1; (ii) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO:3, и (iii) мутеина указанного белка (i) или (ii); (b) введения указанной нуклеиновой кислоты или указанного вектора в клетку-хозяина; (с) экспрессии указанной нуклеиновой кислоты или последовательности указанного вектора в указанной клетке-хозяине для получения указанного белка или указанного мутеина, способного образовывать вирусоподобную частицу АР205. Предпочтительно указанной клеткой-хозяином является E. coli. Предпочтительные варианты этих белков и мутеинов, указанных в (i) и (ii) уже были указаны выше.
В первом варианте данное изобретение относится к композиции, содержащей одну или несколько рекомбинантных VLP РНК-бактериофага АР205 или его мутантов. В следующем варианте данное изобретение относится к композициям, содержащим одну или несколько VLP АР205 и одну или несколько органических молекул, где эта молекула является прикрепленной, соединенной, сопряженной или слитой, т.е. связанной, с VLP АР205. В другом варианте этой органической молекулой является антиген.
В некоторых других вариантах эта органическая молекула выбрана из группы, состоящей из (а) органической молекулы, подходящей для индукции иммунной реакции против раковых клеток; (b) органической молекулы, подходящей для индукции иммунной реакции против инфекционных заболеваний; (с) органической молекулы, подходящей для индукции иммунной реакции против аллергенов; (d) органической молекулы, подходящей для индукции улучшенной реакции против аутоантигенов; (е) органической молекулы, подходящей для индукции иммунной реакции в сельскохозяйственных животных или домашних животных; (f) органической молекулы, подходящей для индукции реакции против наркотика, гормона или токсического соединения, и (g) фрагментов (например, эпитопа или антигенного домена любой из молекул, показанных в (а)-(f)).
В другом варианте этими органическими молекулами являются один или несколько антигенов. В одном подобном варианте этими антигенами являются рекомбинантные полипептиды. В другом варианте эти антигены экстрагируют из природного источника, такого как пыльца, пчелы, патогены или опухоли. Еще в одном варианте этот антиген выбран из группы, состоящей из (а) полипептида, подходящего для индукции иммунной реакции против раковых клеток; (b) полипептида, подходящего для индукции иммунной реакции против инфекционных заболеваний; (с) полипептида, подходящего для индукции иммунной реакции против аллергенов; (d) полипептида, подходящего для индукции иммунной реакции против аутоантигенов; (е) полипептида, подходящего для индукции иммунной реакции в сельскохозяйственных животных или домашних животных.
В конкретном варианте этот антиген содержит эпитоп цитотоксических Т-клеток или хелперных Т-клеток. В родственном варианте этот антиген содержит В-клеточный эпитоп.
В родственном аспекте данное изобретение относится к способам присоединения, т.е. связывания органических молекул с VLP АР205. В некоторых вариантах эти органические молекулы связаны ориентированным образом с VLP АР205.
В другом варианте данного изобретения эти конъюгаты или композиции используют в способах иммунизации животного введением их в животное подкожно, внутримышечно, интраназально, внутрикожно, внутривенно, чрескожно, через слизистую оболочку, перорально или непосредственно в лимфатический узел. В другом варианте эту композицию наносят локально, вблизи опухоли или локального вирусного резервуара, против которого вакцинация является желательной.
Данное изобретение относится также к вакцине, содержащей иммунологически эффективное количество композиции данного изобретения вместе с фармацевтически приемлемым разбавителем, носителем или наполнителем. В следующем варианте, эта вакцина дополнительно содержит по меньшей мере один адъювант, такой как квасцы или неполный адъювант Фрейнда. Данное изобретение относится также к способам иммунизации и/или лечения животного, предусматривающим введение этому животному иммунологически эффективного количества конъюгатов, композиций или вакцин данного изобретения.
Конъюгаты или композиции VLP АР205 могут быть использованы, например, для вакцинации против опухолей, вирусных заболеваний, аутомолекул или непептидных малых молекул. Вакцинация может выполняться для профилактических или терапевтических целей или для обеих этих целей. Конъюгаты или композиции VLP АР205 могут быть использованы для вакцинации против аллергий для индукции иммунодевиации и/или реакций в виде образования антител против аллергена, подходящих для лечения или профилактики аллергий.
Кроме того, данное изобретение относится к способам лечения или профилактики заболеваний, физических нарушений или состояний в индивидууме или популяции индивидуумов введением композиций, содержащих VLP АР205, связанную с органической молекулой, или, альтернативно, по существу состоящих из VLP АР205, связанных с органической молекулой. В родственном аспекте иммунные молекулы и антитела, соответственно, такие как антитела, генерированные против таких композиций, могут быть использованы для лечения, профилактики или диагностики заболевания, состояния или нарушения.
В другом аспекте данного изобретения композиции, содержащие VLP АР205, связанные с органической молекулой, обеспечены в форме набора. В другом аспекте данного изобретения композиции, содержащие иммунную молекулу и антитело, соответственно, выделенные с использованием VLP АР205, связанной с органической молекулой, обеспечены также в форме набора. Такие наборы применимы для разнообразных целей, в том числе, но не только, для детектирования иммунных молекул и антител, соответственно, реагирующих с органическими молекулами, презентируемыми на этих VLP, для обнаружения органических молекул, для скрининга иммунных молекул и антител, соответственно, и/или для диагностики состояний, характеризующихся присутствием или отсутствием этих иммунных молекул и антител, соответственно. В некоторых родственных вариантах наборы данного изобретения могут содержать один или несколько дополнительных компонентов, таких как буферы, носители, наполнители, адъюванты, детектирующие реагенты и т.д.
В другом аспекте данное изобретение относится также к векторам и клеткам-хозяевам для экспрессии белка оболочки РНК-бактериофага АР205, образующего вирусоподобные частицы. Клетки-хозяева включают в себя прокариоты, в том числе E. coli, и эукариоты, в том числе дрожжи, животные, клеточные линии и т.д.
В другом аспекте данное изобретение относится к способам экспрессии белка оболочки РНК-бактериофага АР205 и его вирусоподобным частицам. В другом аспекте данное изобретение относится к способам очистки и выделения вирусоподобных частиц бактериофага АР205.
Другие варианты данного изобретения будут очевидными специалисту с обычной квалификацией в данной области в свете того, что известно в данной области, в свете следующих чертежей и описания данного изобретения и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
Фиг.1А-Е изображают электронные микрофотографии, сравнивающие частицы фага АР205 с вирусоподобными частицами АР205, спонтанно собранными из рекомбинантного белка, экспрессируемого в E. coli и очищенного. Фиг.1А показывает картину электронной микрофотографии частиц фага АР205, тогда как картина электронной микрофотографии самособранных частиц рекомбинантного VLP АР205 показана на фиг.1В.
Фиг.2 показывает анализ электрофореза в ДСН-ПААГ реакции сочетания VLP АР205 и VLP Qβ с пептидом Derp1.2. Пробы подвергали электрофорезу при восстанавливающих условиях на 16% Трис-глициновом геле. Дорожка 1 является белковым маркером с соответствующими молекулярными массами, указанными на левой границе геля; дорожка 2, дериватизованный капсидный белок Qβ; дорожка 3, супернатант реакции сочетания капсидного белка Qβ с пептидом Derp1.2; дорожка 4, осадок реакции сочетания капсидного белка Qβ с пептидом Derp1.2; дорожка 5, дериватизованная VLP АР205; дорожка 6, супернатант реакции сочетания VLP АР205 с пептидом Derp1.2; дорожка 7, осадок реакции сочетания VLP АР205 с пептидом Derp1.2. Продукты сочетания, соответствующие сочетанию 1, 2, 3, 4 и, соответственно, 5 пептидов на мономер, указаны стрелками на этой фигуре. Более высокое количество эпитопов может быть связано с VLP АР205, чем с капсидным белком Qβ.
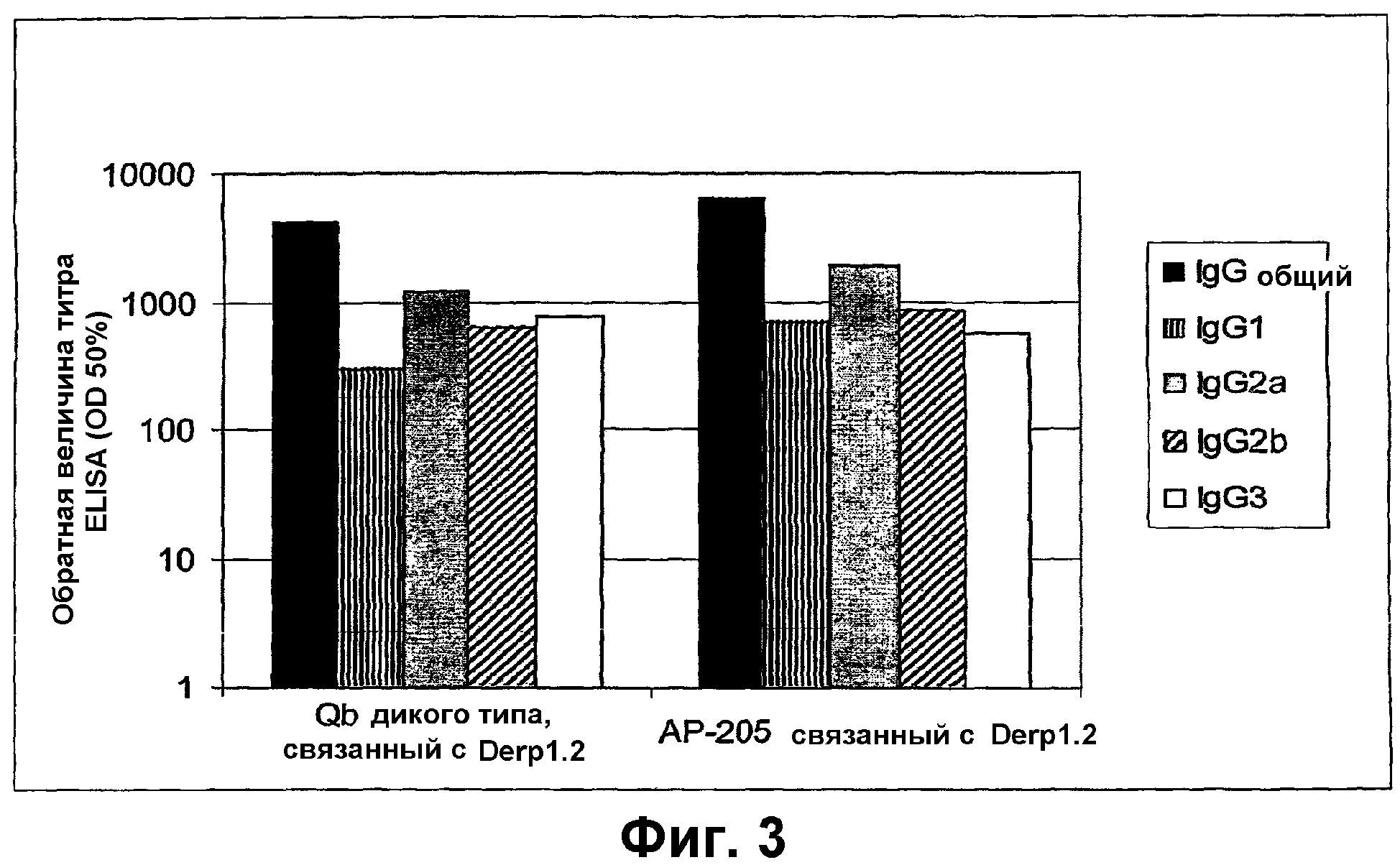
Фиг.3 показывает анализ ELISA IgG-антител, специфических для "Derp1.2", в сыворотках мышей, иммунизированных против пептида Derp1.2, связанного с VLP АР205 или капсидным белком Qβ соответственно. Определяли общие титры IgG, а также титры подтипов IgG. Антитела, специфические для Derp1.2, не могли быть детектированы ни в одной из неимунных сывороток, анализированных на каждый из подтипов IgG. Эта фигура показывает, что как для АР205, так и для Qβ индуцируются подтипы, типичные для иммунной реакции Th1, так как титр IgG2а является гораздо более высоким, чем титр IgG1. Сильную специфическую антипептидную иммунную реакцию получали с пептидом, связанным с обеими VLP. Антитела, специфические для носителя, также измеряли при помощи ELISA, и они были сравнимыми для обоих носителей.
Фиг.4А-4С показывают частичные последовательности различных использованных эукариотических векторов экспрессии. Показаны только модифицированные последовательности. Фиг.4А: рСер-Ха-Fc*: эта последовательность показана от сайта BamHI и далее, и различные признаки показаны над транслированной последовательностью (SEQ ID NO:103 и SEQ ID NO:104). Стрелка указывает сайт расщепления фактор Ха-протеазы. Фиг.4В: рСер-ЕК-Fc*: эта последовательность показана от сайта BamHI и далее, и различные признаки показаны над транслированной последовательностью (SEQ ID NO:105 и SEQ ID NO:106). Стрелка указывает сайт расщепления энтерокиназы. Последовательность справа от сайта HindIII является идентичной последовательности, показанной на фиг.4А. Фиг.4С: рСер-SP-EK-Fc*: эта последовательность показана от начала сигнального пептида, и различные признаки показаны над транслированной последовательностью (SEQ ID NO:107 и SEQ ID NO:108). Последовательность сигнального пептида, которая отщепляется сигнальной пептидазой, показана жирным шрифтом. Стрелки указывают сайт расщепления энтерокиназы. Последовательность справа от сайта HindIII идентична последовательности, показанной на фиг.4А.
Фиг.5А-В изображают конструкции rMIF и электрофорез в ДСН-ПААГ, показывающий экспрессию и очистку конструкций rMIF, для связывания с VLP АР205. Фиг.5А показывает схематическое описание MIF-конструкций с добавленным аминокислотным линкером, содержащим остаток цистеина. Фиг.5В показывает анализ электрофореза в ДСН-ПААГ очищенных конструкций MIF, проведенного при восстанавливающих условиях и окрашенного Кумасси бриллиантовым синим. На эти гели нанесены очищенные крысиные конструкции rMIF-С1 (SEQ ID NO:114), rMIF-С2 (SEQ ID NO:115) и rMIF-С3 (SEQ ID NO:117), описанные на фиг.5А.
Фиг.6 показывает результат реакции сочетания rMIF-С1 с VLP АР205. Дорожка 1: молекулярный маркер. Дорожка 2: VLP АР205. Дорожка 3: дериватизованная VLP АР205. Дорожка 4: диализованная дериватизованная VLP АР205. Дорожка 5: диализованная дериватизованная VLP АР205. Дорожка 6: Реакция сочетания rMIF-С1 с VLP АР205. Продукт сочетания указан на этой фигуре стрелкой. Молекулярные массы маркерных белков указаны на левой границе геля.
Фиг.7 показывает анализ ELISA IgG-реакции, специфической для rMIF-С1, в сыворотках мышей, иммунизированных rMIF-С1, связанным с VLP АР205.
Фиг.8 показывает анализ ELISA IgG-антител, специфических для пептида Angio I, в сыворотках трех мышей (1-3), иммунизированных в день 0 и в день 14 против пептида Angio I, связанного с VLP АР205. Общие титры IgG определяли в сыворотках в день 21.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Следующие определения суммируют концепции, обычно понимаемые специалистами с обычной квалификацией в данной области, и приводятся для лучшего понимания следующего далее описания, но не должны пониматься как ограничение данного изобретения.
Аминокислотный линкер: "аминокислотный линкер", также называемый "линкер" в этом описании, в данном контексте либо ассоциирует (соединяет) антиген или антигенную детерминанту со вторым сайтом присоединения, либо, более предпочтительно, уже включает в себя или содержит второй сайт присоединения, обычно - но не обязательно - в виде одного аминокислотного остатка, предпочтительно в виде остатка цистеина. Однако термин "аминокислотный линкер" в данном контексте не подразумевает, что такой аминокислотный линкер состоит исключительно из аминокислотных остатков, даже если аминокислотный линкер, состоящий из аминокислотных остатков, является предпочтительным вариантом данного изобретения. Аминокислотные остатки аминокислотного линкера состоят предпочтительно из природно встречающихся аминокислот или неприродных аминокислот, известных в данной области, все из которых являются L- или D-аминокислотами или их смесями. Однако аминокислотный линкер, содержащий молекулу с сульфгидрильной группой или остатком цистеина, также включен в данное изобретение. Такая молекула содержит предпочтительно С1-С6-алкильную, циклоалкильную (С5, С6), арильную или гетероарильную часть. Однако, кроме аминокислотного линкера, в рамки данного изобретения будет также включен линкер, содержащий предпочтительно С1-С6-алкильную, циклоалкильную (С5, С6), арильную или гетероарильную часть и лишенный какой-либо аминокислоты (аминокислот). Ассоциация (связь) между антигеном или антигенной детерминантой или необязательно вторым сайтом присоединения и аминокислотным линкером осуществляется предпочтительно посредством по меньшей мере одной ковалентной связи, более предпочтительно посредством по меньшей мере одной пептидной связи.
Животное: в данном контексте термин "животное" включает в себя, например, людей, овец, лосей, оленей, чернохвостых оленей, норок, млекопитающих, обезьян, лошадей, крупный рогатый скот, свиней, коз, собак, кошек, крыс, мышей, птиц, кур, пресмыкающихся, рыбу, насекомых и паукообразных.
Антитело: в данном контексте термин "антитело" обозначает молекулы, которые способны связывать эпитоп или антигенную детерминанту. Этот термин включает в себя целые антитела и их антигенсвязывающие фрагменты, в том числе одноцепочечные антитела. Такие антитела включают в себя антигенсвязывающие фрагменты антител человека и включают в себя без ограничения Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидной связью Fv (sdFv) и фрагменты, содержащие либо VL-, либо VH-домен. Эти антитела могут происходить из любого животного, в том числе из птиц и млекопитающих. Предпочтительно антитела являются антителами млекопитающих, например человека, мыши, кролика, козы, морской свинки, верблюда, лошади и т.п., или других подходящих животных, например кур. В данном контексте "человеческие" антитела включают в себя антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включают в себя антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных в отношении одного или нескольких иммуноглобулинов человека и не экспрессирующих эндогенные иммуноглобулины, такие как описанные, например, в Патенте США № 5939598, описание которого включено здесь в качестве ссылки в его полном виде.
Антиген: в данном контексте термин "антиген" относится к молекуле, способной связываться антителом или Т-клеточным рецептором (TCR), при презентации молекулами МНС. Термин "антиген" в данном контексте включает в себя также Т-клеточные эпитопы. Т-клеточный эпитоп узнается Т-клеточным рецептором в контексте МНС класса I, присутствующего на всех клетках тела, за исключением эритроцитов, или класса II, присутствующего на иммунных клетках, в частности антигенпрезентирующих клетках. Это событие узнавания приводит к активации Т-клеток и последующих эффекторных механизмов, таких как пролиферация Т-клеток, секреция цитокинов, секреция перфоринов и т.д. Антиген дополнительно может узнаваться иммунной системой и/или способен индуцировать гуморальную иммунную реакцию и/или клеточную иммунную реакцию, приводящую к активации В- и/или Т-лимфоцитов. Однако это может требовать того, чтобы, по меньшей мере в некоторых случаях, этот антиген содержал ТН-клеточный эпитоп или был связан с ТН-клеточным эпитопом и предоставлялся в адъюванте. Антиген может иметь один или несколько эпитопов (В- и Т-эпитопов). Предполагается, что описанная выше специфическая реакция указывает на то, что данный антиген будет предпочтительно реагировать, обычно высокоселективным образом, с его соответствующим антителом или TCR, но не со множеством других антител или TCR, которые могут индуцироваться другими антигенами. Антигены в данном контексте могут быть также смесями нескольких отдельных антигенов. Антигены в данном контексте включают в себя без ограничения аллергены, аутоантигены, гаптены, раковые антигены и антигены инфекционных заболеваний, а также малые органические молекулы, такие как средства, вызывающие злоупотребление (такие как никотин), и их фрагменты и производные. Кроме того, антигены, используемые для данного изобретения, могут быть пептидами, белками, доменами, углеводами, алкалоидами, липидами или малыми молекулами, такими как, например, стероидные гормоны и их фрагменты и производные.
Антигенная детерминанта: в данном контексте термин "антигенная детерминанта" обозначает часть антигена, которая специфически узнается либо В-, либо Т-лимфоцитами. В-лимфоциты отвечают на чужеродные антигенные детерминанты через образование антител, тогда как Т-лимфоциты являются медиатором клеточного иммунитета. Таким образом, антигенные детерминанты или эпитопы являются теми частями антигена, которые узнаются антителами или, в контексте МНС, Т-клеточными рецепторами. Антигенная детерминанта содержит один или несколько эпитопов. Аллергены также служат в качестве антигенов в позвоночных животных.
Аллергены: в данном контексте термин "аллерген" обозначает антигены, ассоциированные с аллергиями. Аллергическая реакция характеризуется высвобождением воспалительных факторов, в частности гистамина, приводящих к патологическому воспалению в индивидууме. Аллергии обычно ассоциированы с IgE-антителами, направленными против аллергенов. Термин "аллерген" в данном контексте включает в себя также "экстракты аллергена" и "аллергенные эпитопы". Примеры аллергенов включают в себя без ограничения пыльцу (например, злака, амброзии, березы и можжевельника мексиканского); домашнюю пыль и домашних клещей; эпидермальные аллергены млекопитающих и перхоть животных; плесень и грибы; тела и яд насекомых; перья; пищевые продукты и лекарственные средства (например, пенициллин).
Вирусоподобная частица АР205 или VLP АР205: в данном контексте термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, соответственно, содержащие или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один белок и белок оболочки, соответственно, бактериофага АР205, или его фрагмент или мутеин, где указанный по меньшей мере один белок оболочки, или его фрагмент или мутеин, обычно и предпочтительно способен собираться с образованием вирусоподобной частицы. В альтернативных и предпочтительных вариантах осуществления изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают в данном контексте композиции и вирусоподобные частицы, соответственно, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один белок и белок оболочки, соответственно, бактериофага АР205, или его мутеин, где указанный по меньшей мере один белок оболочки бактериофага АР205 или его мутеин способен собираться с образованием вирусоподобной частицы. В очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, соответственно, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один белок оболочки бактериофага АР205, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1, причем обычно и предпочтительно указанный по меньшей мере один белок оболочки способен собираться в вирусоподобную частицу и капсид, соответственно. В следующем альтернативном очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один мутеин белка оболочки бактериофага АР205, имеющий аминокислотную последовательность, представленную в SEQ ID NO:3, причем указанный по меньшей мере один мутеин указанного белка оболочки способен собираться в вирусоподобную частицу. В следующем альтернативном очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один мутеин белка оболочки бактериофага АР205, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1 или SEQ ID NO:3, причем указанный по меньшей мере один мутеин указанного белка способен собираться в вирусоподобную частицу. В следующем альтернативном очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один мутеин, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, причем по меньшей мере один аминокислотный остаток, предпочтительно три аминокислотных остатка, более предпочтительно два аминокислотных остатка и даже еще более предпочтительно один аминокислотный остаток, является добавленным, делетированным или замененным, причем предпочтительно указанная по меньшей мере одна замена является консервативной заменой. Еще в одном альтернативном очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один мутеин, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, где по меньшей мере один остаток цистеина, предпочтительно три остатка цистеина, более предпочтительно два остатка цистеина и даже более предпочтительно один остаток цистеина, является делетированым или замененным, причем предпочтительно указанная по меньшей мере одна замена является консервативной заменой. Еще в одном альтернативном очень предпочтительном варианте данного изобретения термины "вирусоподобная частица АР205" или "VLP АР205" обозначают композиции и вирусоподобные частицы, содержащие, или альтернативно по существу состоящие из них, или альтернативно и предпочтительно состоящие из них, по меньшей мере один мутеин, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1 или представленную в SEQ ID NO:3, где по меньшей мере один остаток лизина, предпочтительно три остатка лизина, более предпочтительно два остатка лизина и даже более предпочтительно один остаток лизина, является добавленным, делетированым или замененным, причем предпочтительно указанная по меньшей мере одна замена является консервативной заменой. Дополнительные предпочтительные варианты VLP АР205 станут очевидными по мере дальнейшего описания. Субъединицы АР205, составляющие VLP АР205, могут быть связаны с другими субъединицами в этой частице дисульфидными мостиками, или, альтернативно, большинство субъединиц VLP АР205 связаны с другими субъединицами VLP АР205 в этой частице дифульфидными мостиками. В некоторых вариантах небольшая часть или ни одна из субъединиц VLP АР205 не связаны дисульфидными мостиками с другими субъединицами VLP АР205 в этой частице.
Ассоциация (связывание): в данном контексте термин "ассоциация", когда он применяется к первому и второму сайтам присоединения, обозначает связывание первого и второго сайтов присоединения, которое предпочтительно осуществляется посредством по меньшей мере одной непептидной связи. Природа этой ассоциации может быть ковалентной, ионной, гидрофобной, полярной или любой их комбинацией, предпочтительно природа этой ассоциации является ковалентной.
Сайт присоединения, первый: в данном контексте фраза "первый сайт присоединения" обозначает элемент неприродного или природного происхождения, с которым может ассоциироваться второй сайт присоединения, локализованный на антигене или антигенной детерминанте. Первый сайт присоединения может быть белком, полипептидом, аминокислотой, пептидом, сахаром, полинуклеотидом, природным или синтетическим полимером, вторичным метаболитом или соединением (биотином, флуоресцеином, ретинолом, дигоксигенином, ионами металлов, фенилметилсульфонилфторидом) или их комбинацией или их химически реакционноспособной группой. Первый сайт присоединения локализован, обычно и предпочтительно, на поверхности частицы кора (ядра), такой как, например, вирусоподобная частица. Множественные первые сайты присоединения присутствуют на поверхности коровой и вирусоподобной частицы, соответственно, обычно в многократно повторяющейся конфигурации.
Сайт присоединения, второй: в данном контексте фраза "второй сайт присоединения" относится к элементу, ассоциированному с антигеном или антигенной детерминантой, с которой может ассоциироваться (связываться) первый сайт присоединения, локализованный на поверхности частицы кора или вирусоподобной частицы, соответственно. Второй сайт присоединения антигена или антигенной детерминанты может быть белком, полипептидом, пептидом, сахаром, полинуклеотидом, природным или синтетическим полимером, вторичным метаболитом или соединением (биотином, флуоресцеином, ретинолом, дигоксигенином, ионами металлов, фенилметилсульфонилфторидом) или их комбинацией или их химически реакционноспособной группой. По меньшей мере один второй сайт присоединения присутствует на антигене или на антигенной детерминанте. Термин "антиген или антигенная детерминанта по меньшей мере с одним вторым сайтом присоединения" относится, следовательно, к антигену или антигенной конструкции, содержащей по меньшей мере один антиген или одну антигенную детерминанту и второй сайт присоединения. Однако, в частности, для второго сайта присоединения, который является сайтом присоединения неприродного происхождения, т.е. не встречающимся природно в этом антигене или в этой антигенной детерминанте, эти антиген или антигенные конструкции содержат "аминокислотный линкер".
Связанный: в данном контексте термин "связанный" относится к связыванию или присоединению, которое может быть ковалентным, например, химическим связыванием или нековалентным связыванием, например, ионными взаимодействиями, гидрофобными взаимодействиями, водородными связываниями и т.д. Ковалентные связи могут быть, например, сложноэфирными, простыми эфирными, фосфоэфирными, амидными, пептидными, имидными связями, связями углерод-сера, связями углерод-фосфор и т.п. Термин "связанный" является более широким и включает в себя такие термины, как "сопряженный", "слитый" и "присоединенный".
Белок (белки) оболочки: в данном контексте термин "белок (белки) оболочки" относится к белку (белкам) бактериофага или РНК-фага, способным включаться в сборку капсида бактериофага или РНК-фага. Белок оболочки называют также СР. В данном изобретении этот термин обычно относится к белку (белкам) оболочки РНК-фага АР205.
Частица кора: в данном контексте термин "частица кора" относится к жесткой структуре с присущей ей повторяющейся организацией. Частица кора в данном контексте может быть продуктом синтетического процесса или продуктом биологического процесса.
Заболевание, нарушение, состояние: в данном контексте термины "заболевание" или "нарушение" относится к любому неблагоприятному состоянию индивидуума, в том числе опухолям, раку, аллергиям, привыканию к чрезмерному употреблению средств или наркотиков, аутоиммунной реакции, отравлению или ухудшению оптимальной умственной или телесной функции. Термин "состояния" в данном контексте включает в себя заболевания и нарушения, но относится также к физиологическим состояниям. Например, фертильность является физиологическим состоянием, а не заболеванием или нарушением. Таким образом, композиции данного изобретения, пригодные для предупреждения беременности посредством уменьшения фертильности, могут быть описаны в качестве способа воздействия на состояние (фертильность), а не в качестве способа лечения нарушения или заболевания. Другие состояния являются понятными для специалистов с обычной квалификацией в данной области.
Эпитоп: в данном контексте термин "эпитоп" относится к основному элементу или наименьшей единице узнавания индивидуальным антителом или Т-клеточным рецептором и, следовательно, к конкретному домену, району или молекулярной структуре, с которыми связывается это антитело или Т-клеточный рецептор. Антиген может состоять из многочисленных эпитопов, тогда как гаптен обычно обладает небольшим количеством эпитопов.
Иммунная реакция: в данном контексте термин "иммунная реакция" относится к любому действию иммунной системы индивидуума, которое направлено против молекулы или соединения, такого как антиген. В млекопитающих эта иммунная реакция включает в себя как активности клеток, так и продуцирование растворимых молекул, таких как цитокины и антитела. Таким образом, этот термин включает в себя гуморальную иммунную реакцию и/или клеточную иммунную реакцию, приводящую к активации или пролиферации В- и/или Т-лимфоцитов. Однако в некоторых случаях иммунные реакции могут быть реакциями низкой интенсивности и становятся детектируемыми только при использовании по меньшей мере одного вещества в соответствии с данным изобретением. Термин "иммуногенный" относится к агенту, используемому для стимуляции иммунной системы живого организма таким образом, что одна или несколько функций иммунной системы увеличиваются и направляются в направлении иммуногенного агента. Термин "иммуногенный полипептид" обозначает полипептид, который индуцирует клеточную и/или гуморальную иммунную реакцию, независимо от того, вводится ли он один или в связи с носителем в присутствии или в отсутствие адъюванта.
Иммунодевиация: в данном контексте термин иммунодевиация относится к стимуляции иммунной реакции, которая имеет отличающуюся природу относительно предсуществующей иммунной реакции. Например, индивидуум, обладающий ТН2-иммунной реакцией против аллергена, так что продуцируются IgE-антитела при подвергании действию данного антигена, может быть индуцирован, вариантами данного изобретения, к продуцированию ТН1-иммунной реакции против этого аллергена. Такая ТН1-реакция будет противодействовать аллергии, индуцируемой ТН2-реакцией, и таким образом ослаблять аллергическое состояние.
Иммунотерапевтическая: в данном контексте термин "иммунотерапевтическая" относится к композиции для лечения заболеваний, нарушений и состояний. Более конкретно, этот термин используют для обозначения способа лечения, в котором благоприятная иммунная реакция генерируется вакцинацией.
Иммунологически эффективное количество: в данном контексте термин "иммунологически эффективное количество" относится к количеству композиции, достаточному для индукции иммунной реакции в индивидууме при введении в этого индивидуума. Количество композиции, необходимое для того, чтобы быть иммунологически эффективным, варьируется в соответствии со многими факторами, в том числе в соответствии с конкретной композицией, присутствием других компонентов в этой композиции (например, адъювантов), антигена, способа иммунизации, конкретного индивидуума, предыдущего иммунного или физиологического состояния и т.д.
Индивидуум: в данном контексте термин "индивидуум" относится к многоклеточным организмам и включает в себя как растения, так и животных. Предпочтительными многоклеточными организмами являются животные, более предпочтительно, позвоночные, даже более предпочтительно млекопитающие и наиболее предпочтительно люди.
Низкий или недетектируемый: в данном контексте фраза "низкий или недетектируемый", применительно к уровню экспрессии генов, обозначает уровень экспрессии, который является либо значительно более низким, чем уровень, наблюдаемый при максимальной индукции этого гена (например, по меньшей мере в 5 раз более низкий), или не является легко детектируемым способами, используемыми здесь в примерах.
Мимотоп: в данном контексте термин "мимотоп" относится к веществу, которое индуцирует иммунную реакцию к антигену или к антигенной детерминанте. Обычно термин мимотоп будет использоваться со ссылкой на конкретный антиген. Например, пептид, который индуцирует продуцирование антител к фосфолипазе А2 (PLA2), является мимотопом антигенной детерминаты, с которой связываются антитела. Мимотоп может иметь или может не иметь существенного структурного сходства или не иметь общих структурных свойств с антигеном или с антигенной детерминантой, к которым он индуцирует иммунную реакцию. Способы получения и идентификации мимотопов, которые индуцируют иммунные реакции на конкретные антигены или антигенные детерминанты, известны в данной области и описаны здесь в другом месте.
Мутеин: в данном контексте термин "мутеин" относится к белку или полипептиду, отличающемуся одной или несколькими аминокислотами от конкретного ссылочного (например, природного, дикого типа и т.д.) полипептида, причем такое различие обусловлено добавлением, заменой или делецией по меньшей мере одной аминокислоты или их комбинации. Предпочтительные варианты содержат мутации, происходящие из замены по меньшей мере одной аминокислоты, предпочтительно происходящие из консервативной замены по меньшей мере одной аминокислоты. Консервативные замены включают в себя изостерические замены, замены, где сохраняется заряженная, полярная, ароматическая, алифатическая или гидрофобная природа данной аминокислоты. Например, замена остатка цистеина остатком серина является консервативной заменой. В предпочтительном варианте данного изобретения термин "мутеин" относится к белку или полипептиду, отличающемуся тремя, предпочтительно двумя и наиболее предпочтительно одной аминокислотой от конкретного ссылочного (например, природного, дикого типа и т.д.) полипептида, причем такое различие обусловлено добавлением, заменой или делецией по меньшей мере одной аминокислоты или их комбинации. В следующих предпочтительных вариантах данного изобретения термин "мутеин" относится к белку или полипептиду, отличающемуся тремя, предпочтительно двумя и наиболее предпочтительно одной аминокислотой от конкретного ссылочного (например, природного, дикого типа и т.д.) полипептида, причем такое различие происходит вследствие замены трех, предпочтительно двух и наиболее предпочтительно одной аминокислоты, предпочтительно происходит вследствие консервативной замены трех, предпочтительно двух и наиболее предпочтительно одной аминокислоты.
Природное происхождение: в данном контексте термин "природное происхождение" обозначает, что все целое или его части не являются синтетическими и существуют или продуцируются в природе. Предпочтительно в данном контексте термин "природное происхождение" обозначает, что целое не является синтетическим и существует или продуцируется в природе.
Неприродный: в данном контексте этот термин обозначает "полученный не из природы", более конкретно этот термин обозначает "полученный руками человека".
Неприродное происхождение: в данном контексте термин "неприродное происхождение" обычно означает синтетическое происхождение или происхождение не из природы; более конкретно, этот термин обозначает происхождение вследствие приложения рук человека.
Упорядоченный и повторяющийся массив антигенов или антигенных детерминант: в данном контексте термин "упорядоченный и повторяющийся массив антигенов или антигенных детерминант" обычно обозначает повторяющееся распределение антигенов или антигенных детерминант, характеризующееся обычно и предпочтительно однородным пространственным размещением антигенов или антигенных детерминант относительно частицы кора и вирусоподобной частицы соответственно. В одном варианте данного изобретения это повторяющееся распределение может иметь геометрический характер распределения. Типичными и предпочтительными примерами подходящим образом упорядоченного и повторяющегося массива антигенов или антигенных детерминант являются массивы, которые обладают строго повторяющимися паракристаллическими порядками антигенов или антигенных детерминант, предпочтительно с интервалами 1-30 нанометров, предпочтительно 5-15 нанометров.
Органическая молекула: в данном контексте термины "органическая молекула" или "органические молекулы" данного изобретения включают в себя предпочтительно антигены и антигенные детерминанты, аллергены, аутоантигены, гаптены, раковые антигены и антигены инфекционных заболеваний, а также малые органические молекулы, такие как средства, вызывающие злоупотребление (подобные никотину), и их фрагменты и производные.
Полипептид: в данном контексте термин "полипептид" обозначает полимер, составленный из аминокислотных остатков, обычно природных аминокислотных остатков, связанных вместе посредством пептидных связей. Полипептид может быть необязательно ограниченным по размеру и включает в себя как белки, так и пептиды. Пептид является полипептидом с размером обычно приблизительно 5 - приблизительно 50 аминокислот или любое количество аминокислот в пределах этого общего диапазона. Однако пептид может быть также и большей длины, например до 120-150 аминокислот.
Белок: в данном контексте термин белок обозначает полипептид с размером обычно приблизительно 5 или более, 10 или более, 20 или более, 25 или более, 50 или более, 75 или более, 100 или более, 200 или более, 500 или более, 1000 или более, 2000 или более аминокислот. Белки обычно имеют определенную трехмерную структуру, хотя не обязательно должны иметь такую структуру, и часто их называют имеющими укладку, в противоположность пептидам и полипептидам, которые часто не обладают определенной трехмерной структурой, а скорее могут принимать большое количество различных конформаций и называются не имеющими укладки. Однако пептиды могут также иметь определенную трехмерную структуру.
Очищенная: в данном контексте при применении термина "очищенная" к молекуле, этот термин обозначает, что концентрация очищаемой молекулы увеличилась относительно молекул, связанных с ней в ее природном окружении, или в окружении, в котором она была получена, найдена или синтезирована. Природно связанные молекулы включают в себя белки, нуклеиновые кислоты, липиды и сахара, но обычно не включают в себя воду, буферы и реагенты, добавляемые для поддержания целостности или облегчения очистки очищаемой молекулы. Например, даже если мРНК разбавляют водным растворителем во время олиго-dT-колоночной хроматографии, мРНК молекулы очищаются посредством этой хроматографии, если природно связанные нуклеиновые кислоты и другие биологические молекулы не связываются с этой колонкой и отделяются от рассматриваемых молекул мРНК. В соответствии с этим определением вещество может быть на 5% или более, 10% или более, 20% или более, 30% или более, 40% или более, 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 95% или более, 98% или более, 99% или более или на 100% чистым при оценке относительно их примесей.
Рецептор: в данном контексте термин "рецептор" относится к белкам или гликопротеинам или их фрагментам, способным взаимодействовать с другой молекулой, называемой лигандом. Этот лиганд может принадлежать к любому классу биохимических или химических соединений. Рецептор не должен быть обязательно мембраносвязанным белком. Растворимые белки, подобные, например, мальтозасвязывающему белку или ретинолсвязывающему белку, также являются рецепторами.
Остаток: в данном контексте термин "остаток" обозначает конкретную аминокислоту в полипептидном каркасе или боковой цепи.
Рекомбинантная клетка-хозяин: в данном контексте термин "рекомбинантная клетка-хозяин" обозначает клетку-хозяина, в которую были введены молекулы нуклеиновой кислоты данного изобретения. Клетки-хозяева включают в себя клетки эукариот, например, млекопитающего, насекомого, растения, птиц, дрожжей, и прокариот, например, E. coli, Bacillus subtilis и т.д.
РНК-фаг: в данном контексте термин "РНК-фаг" обозначает РНК-вирусы, инфицирующие бактерии, более конкретно одноцепочечные позитивно-смысловые РНК-вирусы, инфицирующие бактерии.
Аутоантиген: в данном контексте термин "аутоантиген" относится к молекулам или соединениям, способным кодироваться ДНК хозяина. Они включают в себя пептиды, белки, углеводы, нуклеиновые кислоты, липиды и другие биологические молекулы. Более часто и предпочтительно термин "аутоантиген" относится к полипептидам или белкам, кодируемым ДНК хозяина. Продукты, генерируемые белками или РНК, кодируемыми ДНК хозяина, также определяются как "свои" (ауто) продукты. Белки, модифицированные посттрансляционными модификациями и протеолитическим процессингом или альтернативным сплайсингом продукта собственного гена, также определяются как "свои". Продукты, генерируемые белками или РНК, кодируемыми ДНК хозяина, определяются как "свои". Кроме того, белки, которые происходят вследствие комбинации двух или нескольких аутомолекул или которые представляют фракцию аутомолекул, и белки, которые имеют высокую гомологию с аутомолекулами, определенными выше (>95%, предпочтительно >97%, более предпочтительно >99%), могут также рассматриваться как "свои".
Вектор: в данном контексте термин "вектор" обозначает агент (например, плазмиду или вирус), используемый для переноса генетического материала в клетку-хозяина. Вектор может состоять либо из ДНК, либо из РНК.
Вирусоподобная частица (VLP): в данном контексте термин "вирусоподобная частица" обозначает структуру, сходную с вирусной частицей. Кроме того, вирусоподобная частица в соответствии с данным изобретением является нерепликативной и неинфекционной, так как она не имеет всего или части вирусного генома, в частности репликативных и инфекционных компонентов вирусного генома. Вирусоподобная частица в соответствии с данным изобретением может содержать нуклеиновую кислоту, отличающуюся от ее генома. Типичным и предпочтительным вариантом вирусоподобной частицы в соответствии с данным изобретением является вирусный капсид, такой как вирусный капсид соответствующего вируса, бактериофага или РНК-фага. Термины "вирусный капсид" или "капсид", используемые здесь взаимозаменяемо, обозначает макромолекулярный ансамбль, составленный из субъединиц вирусного белка. Обычно и предпочтительно субъединицы вирусного белка собираются в вирусный капсид и капсид, соответственно имеющий структуру с присущей ему повторяющейся организацией, где указанная структура обычно является сферической или трубчатой. Например, капсиды РНК-фагов имеют сферическую форму икосаэдральной (двадцатигранной) симметрии. Термин "капсидоподобная структура" в данном контексте обозначает макромолекулярную упорядоченную структуру, составленную из субъединиц вирусных белков, напоминающую морфологию капсида в описанном выше смысле, но отклоняющуюся от типичной симметричной упорядоченной структуры при сохранении достаточной степени упорядоченности и повторяемости.
Вирусоподобная частица бактериофага: в данном контексте термин "вирусоподобная частица бактериофага" обозначает вирусоподобную частицу, сходную со структурой бактериофага, являющуюся нерепликативной и неинфекционной и лишенной по меньшей мере гена или генов, кодирующих аппарат репликации бактериофага, и обычно лишенную также гена или генов, кодирующих белок или белки, ответственные за присоединение вируса к хозяину или вхождение в хозяина. Однако это определение должно также включать в себя вирусоподобные частицы бактериофагов, в которых вышеуказанный ген или вышеуказанные гены все еще присутствуют, но являются неактивными и, следовательно, также приводящими к нерепликативным и неинфекционным вирусоподобным частицам бактериофага.
Вирусная частица: термин "вирусная частица", используемый здесь, обозначает морфологическую форму вируса. В некоторых типах вирусов она содержит геном, окруженный белковым капсидом; другие имеют дополнительные структуры (например, оболочки, хвосты и т.д.).
Один или некоторый: при применении терминов "один, некоторый" в данном описании они означают "по меньшей мере один" или "один или более", если нет других указаний.
В данном контексте при упоминании любой числовой величины термин "приблизительно" ("около") обозначает величину ±10% указанной величины (например, "приблизительно 50°С включает в себя диапазон температур от 45 до 55°С, включительно; подобно этому, "приблизительно 100 мМ" включает в себя диапазон концентраций от 90 до 110 мМ включительно).
Обзор
Авторы обнаружили, что рекомбинантные белки оболочки АР205 могут быть экспрессированы в бактериях с использованием векторов данного изобретения и получены в очищенной форме. Рекомбинантные белки оболочки АР205 при этом спонтанно самособираются в бактериях в подобные вирусу АР205 частицы. Данное изобретение относится к клеткам-хозяевам и векторам, подходящим для экспрессии VLP АР205, а также компетентным в отношении сборки вариантных форм белка оболочки АР205. Эти экспрессированные VLP, VLP АР205, происходящие из природных источников, или частицы вируса АР205 могут быть связаны с органическими молекулами для получения упорядоченных повторяющихся массивов органических молекул. Органические молекулы данного изобретения включают в себя антигены, аллергены, аутоантигены, гаптены, раковые антигены и антигены инфекционных заболеваний. В одном варианте этими органическими молекулами являются полипептиды или белки.
Образование конъюгатов данного изобретения, т.е. связывание органических молекул с VLP, достигается прикреплением, присоединением, слиянием или иным связыванием, в том числе ковалентными и нековалентными связями. В одном варианте VLP содержит первый сайт присоединения, органическая молекула содержит второй сайт присоединения. Ассоциация между органической молекулой и VLP происходит посредством связывания первого и второго сайтов присоединения непосредственно или посредством третьей молекулы, обычно и предпочтительно через сшивающий линкер. Сайты присоединения могут встречаться природно или могут быть введены. В предпочтительном варианте это связывание содержит по меньшей мере одну ковалентную связь и предпочтительно содержит непептидную связь.
Иммунизация животных конъюгатами VLP АР205 или композициями, содержащими такие конъюгаты, обеспеченными данным изобретением, индуцирует сильную иммунную реакцию против презентируемой органической молекулы. Таким образом, эти конъюгаты и композиции данного изобретения применимы для стимуляции иммунной реакции против различных презентируемых антигенов и, следовательно, для использования в животных. Данное изобретение относится также к вакцине, содержащей иммунологически эффективное количество композиции одного или нескольких конъюгатов данного изобретения вместе с фармацевтически приемлемыми разбавителем, носителем или наполнителем. VLP АР205 могут быть использованы, например, для вакцинации против гаптенов, аллергенов, опухолей, вирусных заболеваний или аутомолекул или непептидных малых молекул. Эта вакцинация может выполняться для профилактических или терапевтических целей или для обеих целей. В родственном аспекте иммунные молекулы и антитела, соответственно, такие как антитела, генерируемые против таких композиций, могут быть использованы для лечения, профилактики или диагностики заболевания, состояния или нарушения. Такие антитела и композиции данного изобретения применимы также в виде наборов.
Клонирование белка оболочки бактериофага АР205
Геном АР205 состоит из гена белка созревания, гена белка оболочки, гена репликазы и двух открытых рамок считывания, не присутствующих в родственных фагах, причем ген лизиса и открытая рамка считывания играют роль в трансляции гена созревания (Klovins, J. et al., J. Gen. Virol. 83: 1523-33 (2002)). В одном аспекте данного изобретения кДНК белка оболочки выделяли обратной транскрипцией РНК бактериофага АР205 с последующей ПЦР с использованием способов, известных в данной области. кДНК белка оболочки, включающую в себя сайт связывания рибосом слева от гена белка оболочки, клонировали в вектор pQb10 (Kozlovska, T.M. et al., Gene 137:133-37 (1993)). В другом подходе кДНК белка оболочки АР205 может быть клонирована в вектор pQb185 вместо гена белка оболочки Qβ и, следовательно, справа от сайта связывания рибосом, присутствующего в этом векторе. Оба подхода приводят к экспрессии этого белка и образованию капсидов. Таким образом, в данном изобретении белок оболочки может быть экспрессирован из векторов, содержащих сайт связывания рибосом, который не является сайтом связывания рибосом АР205, таких как вектор pQb185.
Векторы pQb10 и pQb185 являются векторами, произведенными из вектора pGEM, и экспрессия этих клонированных генов в этих векторах регулируется промотором trp (Kozlovska, T.M. et al., Gene 137:133-37 (1993)). рАР283-58 (SEQ ID NO:2) содержит предположительный сайт связывания рибосом АР205 в следующей последовательности, которая находится справа от сайта XbaI и сразу же слева от стартового кодона ATG белка оболочки АР205: tctagaATTTTCTGCGCACCCATCCCGGGTGGCGCCCAAAGTGAGGAAAATCACatg (SEQ ID NO:5). Вектор pQb185 содержит последовательность Шайна-Дальгарно справа от сайта XbaI и слева от стартового кодона (tctagaTTAACCCAACGCGTAGGAGTCAGGCCatg (SEQ ID NO:6), последовательность Шайна-Дальгарно подчеркнута), которая также присутствует в векторе рАР281-32 (SEQ ID NO:4). Другие векторы, известные в данной области, включают в себя, например, рКК 223.3, семейство векторов рЕТ, рBR322 (Sutcliffe, J.G. Cold Spring Harb. Symp. Quant, Biol. 43 Pt 1: 77-90 (1979)), pUC 18, pUC19, которые все модифицированы для содержания подходящего промотора и сайтов связывания рибосом, если они не присутствуют или не пригодны для экспрессии белка оболочки и последующего образования вирусоподобных частиц, как это будет понятно специалистам с квалификацией в данной области. Другие векторы, произведенные из вышеуказанных векторов и других векторов, подходящих для экспрессии белков в E. coli и других хозяевах, известных специалисту с квалификацией в данной области, и вообще любые векторы, пригодные для экспрессии в E. coli или других хозяевах, являются пригодными для применения на практике данного изобретения, при условии, что они делают возможной экспрессию белка оболочки и последующее образование вирусоподобных частиц. В одном аспекте данного изобретения векторы для экспресси гена белка оболочки АР205 трансфицируют в E. coli. Подходящие штаммы E. coli включают в себя без ограничения E. coli К802, JM 109, RR1. Другие штаммы E. coli известны специалисту с обычной квалификацией в данной области, и подходящие комбинации векторов и штаммов могут быть найдены тестированием экспрессии белка оболочки при помощи электрофореза в ДСН-ПААГ и образования капсида и сборки посредством сначала (необязательно) очистки капсидов гель-фильтрацией и затем тестирования их в тесте иммунодиффузии (тесте Ouchterlony) или с использованием электронной микроскопии (Kozlovska, T.M. et al., Gene 137:133-37 (1993)).
Белки оболочки АР205, экспрессируемые из векторов рАР283-58 и рАР281-32, могут быть лишены начальной аминокислоты метионина вследствие процессинга в цитоплазме E. coli. Полипептиды с отщепленным метионином и, таким образом, в частности, полипептид с отщепленным метионином SEQ ID NO:1 и SEQ ID NO:3, а также нерасщепленные формы полипептидов АР205, приводящие к VLP АР205 в соответствии с данным изобретением, или их смеси, также приводящие к VLP АР205 в соответствии с данным изобретением, являются вариантами данного изобретения и находятся в рамках данного изобретения.
Вирусоподобные частицы АР205
В одном варианте данное изобретение относится к белкам оболочки АР205, которые образуют капсиды. Такие белки экспрессируются рекомбинантно или их получают из природных источников. Фрагменты рекомбинантного белка оболочки АР205, способные собираться в VLP, являются следующими вариантами данного изобретения. Эти фрагменты могут быть получены делецией либо внутри, либо на концах белка оболочки. Инсерции в последовательности белка оболочки или слияния с последовательностью белка оболочки, совместимые со сборкой в VLP, являются следующими вариантами данного изобретения. Результат введения инсерций, делеций и слияний с последовательностью белка оболочки и их совместимость со сборкой в VLP могут быть определены при помощи электронной микроскопии.
Данное изобретение относится к способам очистки рекомбинантного белка оболочки АР205. Частицы, образованные белком оболочки АР205, могут быть выделены в чистой форме комбинированием стадий фракционирования со стадиями осаждения и очистки с использованием гель-фильтрации. Другие способы выделения вирусоподобных частиц также известны в данной области и могут быть использованы для выделения вирусоподобных частиц (VLP) бактериофага АР205. Например, использование ультрацентрифугирования для выделения VLP дрожжевого ретротранспозона Ty описано в Патенте США № 4918166, который включен здесь в качестве ссылки в его полном виде. Кроме гель-фильтрации, могут быть также использованы другие хроматографические стадии, такие как ионообменная хроматография, хроматография гидрофобного взаимодействия или аффинная хроматография.
Экспрессия рекомбинантного белка оболочки АР205 приводит к сборке в вирусоподобные частицы, которые при анализе с использованием электронной микроскопии имеют такой же вид и размер, что и частицы фага. То, что VLP могут быть очищены, является открытием данного изобретения. Таким образом, данное изобретение относится к новым VLP, которые могут быть получены в высоких количествах в чистом виде.
VLP АР205, самособранные в E. coli, имеют вид и размер, идентичные фаговым частицам АР205. Как показано для других VLP (VLP полиомы VP1 и VLP папилломы L1, Chackerian B. et al., PNAS 96: 2373-2378 (1999)), манипуляции экспериментальных условий или слияние эпитопов с VLP могут приводить к VLP с отличающимся состоянием сборки. Например, могут быть получены частицы с более низким треугольным числом, чем в случае формы дикого типа или большой частицы. Таким образом, VLP АР205 меньшего размера, чем частицы фага АР205, или смеси VLP АР205 того же размера или меньшего размера, чем частицы фага АР205, также являются вариантами данного изобретения.
При анализе в невосстанавливающем электрофорезе в ПААГ субъединицы VLP АР205 мигрируют при более высокой средней молекулярной массе, чем при анализе в восстанавливающем электрофорезе в ПААГ, что свидетельствует о том, что эти субъединицы связаны дисульфидными мостиками, как описано в примере 17 WO 03/024481.
В следующем аспекте данное изобретение относится к векторам, содержащим открытую рамку считывания, пригодную для получения вирусоподобной частицы АР205, причем указанный вектор содержит, кроме того, дополнительную нуклеиновую кислоту, так что полученный вектор способен продуцировать рекомбинантную вирусоподобную частицу АР205, содержащую аминокислоты, кодируемые указанной дополнительной нуклеиновой кислотой.
В другом аспекте данное изобретение относится к вектору, содержащему открытую рамку считывания, пригодную для получения вирусоподобной частицы АР205, причем указанный вектор содержит дополнительно сайт рестриктазы, пригодный для введения дополнительной нуклеиновой кислоты, так что полученный вектор способен продуцировать рекомбинантную вирусоподобную частицу, содержащую аминокислоты, кодируемые указанной дополнительной нуклеиновой кислотой.
Органические молекулы, гаптены и антигены
Органические молекулы, используемые в способах, конъюгатах и композициях данного изобретения, включают в себя любой антиген, гаптен, органическую молекулу или ее фрагмент. Молекулы данного изобретения включают в себя гаптены, органические молекулы и фрагменты антигенов, которые сами (т.е. не связанные с вирусом или вирусоподобной частицей АР205) не способны индуцировать иммунную реакцию в животном. Органические молекулы включают в себя, например: (а) органическую молекулу, пригодную для индукции иммунной реакции против раковых клеток; (b) органическую молекулу, пригодную для индукции иммунной реакции против инфекционных заболеваний; (с) органическую молекулу, пригодную для индукции иммунной реакции против аллергенов; (d) органическую молекулу, пригодную для индукции иммунной реакции против аутоантигенов; (е) антигены или гаптены, пригодные для индукции иммунной реакции против наркотиков, гормонов или токсинов, в частности, вызывающих привыкание средств, и (f) фрагменты (например, домен) любых из органических молекул, антигенов или гаптенов, описанных в (а)-(е).
Инфекционные заболевания
В одном характерном варианте данного изобретения органическая молекула, антиген или антигенная детерминанта являются такими, которые могут быть применимы для профилактики инфекционного заболевания. Такое лечение будет применимо для лечения большого разнообразия инфекционных заболеваний, поражающих большой диапазон хозяев, например человека, корову, овцу, свинью, собаку, кошку, другие виды млекопитающих, а также виды, не являющиеся млекопитающими. Такие вакцины могут использоваться профилактически, для профилактики инфекции в индивидууме или популяции, или терапевтически, для смягчения текущей инфекции. Инфекционные заболевания, для которых вакцина является известной или желательной, хорошо известны специалистам в данной области, примеры их включают в себя инфекции вирусной этиологии, такие как ВИЧ, грипп, герпес, вирусный гепатит, болезнь Эпштейна-Барр, полиомиелит, вирусный энцефалит, корь, оспу (дифтерит) птиц и т.д., инфекции бактериальной этиологии, такие как пневмония, туберкулез, сифилис, болезнь Лайма, холера, сальмонеллез, менингит, сепсис и т.д., или инфекции паразитарной этиологии, такие как малярия, трипаносомоз, лейшманиоз, трихомоноз, амебиоз и т.д. Антигены или антигенные детерминанты, используемые в конъюгатах, композициях и способах данного изобретения, известны специалистам с обычной квалификацией в соответствующих областях. Примеры антигенов или антигенных детерминант включают в себя следующие: антигены gp140 и gp160 ВИЧ; антигены гриппа гемагглютинин, белок М2 и нейраминидазу, поверхностный антиген гепатита В и циркумспорозоитный белок малярии.
В одном таком варианте данного изобретения антиген или антигенную детерминанту выбирают из группы, состоящей из (а) рекомбинантного белка ВИЧ, (b) рекомбинантного белка вируса гриппа (например, белка М2 вируса гриппа или его фрагмента), (с) рекомбинантного белка вируса гепатита С, (d) рекомбинантного белка Toxoplasma, (е) рекомбинантного белка Plasmodium falciparum, (f) рекомбинантного белка Plasmodium vivax, (g) рекомбинантого белка Plasmodium ovale, (h) рекомбинантного белка Plasmodium malariae, (i) рекомбинантного белка Chlamidia и (j) фрагмента любого из белков, представленных в (а)-(i).
В другом варианте данное изобретение относится к вакцинным композициям, содержащим по меньшей мере один антиген или одну антигенную детерминанту, кодируемую нуклеиновой кислотой вируса гриппа, и к применению таких вакцинных композиций для индукции иммунных реакций. В таком конкретном варианте антигеном или антигенной детерминантой является белок М2 (например, белок М2, имеющий аминокислоты, показанные в GenBank Accession No. P06821, PIR Accession No. MFIV62 или их фрагмент (например, аминокислоты приблизительно 2 - приблизительно 24). Части белка М2, а также других белков, против которых требуется иммунологическая реакция, пригодные для применения с данным изобретением, содержат пептиды, имеющие длину из любого количества аминокислот, но обычно имеющие длину по меньшей мере 6 аминокислот (например, пептиды, имеющие длину 6, 7, 8, 9, 10, 12, 15, 18, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 97 аминокислот).
Гормоны, токсины и наркотики, в частности средства, вызывающие пристрастие
В дополнительном аспекте данное изобретение относится к композициям, пригодным для стимуляции иммунных реакций против гаптенов. Эти гаптены включают в себя без ограничения гормоны, наркотики и токсические соединения. Иммунные реакции против многих наркотиков, гормонов и токсичных соединений используют для защиты индивидуума, находящегося при риске подвергания действию таких соединений, в качестве терапии в индивидууме, подвергаемом действию таких соединений, или для профилактики или лечения пристрастия к таким соединениям.
Репрезентативные токсичные соединения включают в себя, без ограничения, природные продукты токсичных растений, животных и микроорганизмов. Такие продукты включают в себя афлатоксин, токсин Ciguautera и тетродотоксин. Другие репрезентативные токсичные соединения, продуцируемые искусственным путем или в результате метаболизма, включают в себя антибиотики (например, ванкомицин), противораковые соединения (например, винбластин) и агенты химического оружия (например, зарин (нервный газ, ингибитор ацетилхолинэстеразы), иприт, VX)). Один аспект данного изобретения включает в себя получение антител против токсичных метаболитов обычно используемых фармацевтических агентов, так чтобы индивидуум мог продолжать получать полезные действия фармацевтического агента без побочных действий, ассоциированных с токсичными метаболитами. Таким образом, в предпочтительном варианте этот токсин является метаболитом фармацевтического агента. В следующем предпочтительном варианте этот токсин является агентом химического оружия.
Органические молекулы, антигены или антигенные детерминанты, подходящие для использования в конъюгатах, композициях и способах лечения пристрастия в отношении наркотиков, в частности рекреационного пристрастия к наркотикам, будут известны специалистам с обычной квалификацией в релевантных областях. Репрезентативные примеры органических молекул, антигенов или антигенных детерминант включают в себя, например, опиоиды и производные морфина, такие как кодеин, фентанил, героин, морфин и опий; стимуляторы, такие как амфетамин, кокаин, MDMA (метилендиоксиметамфетамин), метамфетамин, метилфенидат и никотин; галлюциногены, такие как LSD (ЛСД), мескалин и псилоцибин; каннабиноиды, такие как гашиш и марихуана, другие вызывающие пристрастие наркотики или соединения; производные, побочные продукты, варианты и комплексы таких соединений.
Аллергии и рак
В родственных вариантах данное изобретение относится к композициям, пригодным для применения в качестве иммунотерапевтических веществ, которые могут быть использованы для лечения или профилактики аллергий и рака.
Антигены или антигенные детерминанты, пригодные для применения в конъюгатах, композициях и способах лечения или профилактики аллергий, будут известны специалистам с обычной квалификацией в релевантной области. Репрезентативные примеры таких антигенов или антигенных детерминант включают в себя следующее: фосфолипазу А2 пчелиного яда, Bet v I (аллерген пыльцы березы), 5 Dol m V (аллерген яда осы пятнистой), меллитин и Der p I (аллерген клещика домашней пыли), глютен, глиадин, аллергены моллюсков, аллергены тараканов, аллергены арахиса и других орехов, аллергены амброзии и другой пыльцы, аллерген Grevillea, а также фрагменты каждого из них, которые могут быть использованы для индукции иммунологических реакций. В конкретном варианте данного изобретения этот аллерген выбран из группы, состоящей из (а) рекомбинантного белка аллергии, вызываемой укусом пчелы, (b) рекомбинантных белков аллергии, вызываемой орехами, (с) рекомбинантных белков пищевых аллергий, (d) рекомбинантных белков астмы, (е) рекомбинантных белков Chlamidia и (f) фрагмента любого из аллергенов (а)-(е).
Как отмечалось выше, подходящим антигеном или подходящей антигенной детерминантой для применения в конъюгатах, композициях или способах данного изобретения является Der p I. Der p I является протеазой 25 кДа, найденной в фекальных частицах клещика домашней пыли, и представляет собой главный аллерген клещика домашней пыли. Поэтому 80% аллергических к этому клещику пациентов имеют IgE-антитела против Der p I. В частности, известно, что пептиды Der p I р52-72 и р117-133 (SEQ ID NO:64), среди прочих, содержат эпитопы, которые узнаются антителами, специфическими для нативного Der p I. IgE-антитела, индуцированные в поликлональной реакции к целому антигену, связываются с высокой аффинностью с пептидным районом 59-94 (L. Pierson-Mullany et al. (2000) Molecular Immunology). Другие районы также связывают IgE с высокой аффинностью. Пептид р117-133 содержит цистеин на его N-конце, представляющий второй сайт присоединения в соответствии с данным изобретением. Трехмерное моделирование позволяет отнести пептиды р52-72 и р117-133 к поверхности целого белка (Jeannin, P. et al., Molecular Immunology 30:1511-1518 (1993)). Однако и другие фрагменты белка Der p I могут содержать В-клеточные эпитопы, подходящие для данного изобретения.
В предпочтительном варианте композиции данного изобретения антигеном или антигенной детерминантой является пептид Der p I, причем указанный пептид Der p I с указанным вторым сайтом присоединения имеет аминокислотную последовательность, выбранную из группы, состоящей из а) CGNQSLDLAEQELVDCASQHGCH (SEQ ID NO:97); b) CQIYPPNANKIREALAQTHSA (SEQ ID NO:64).
В дополнительных вариантах данное изобретение относится к вакцинным композициям, пригодным для применения в способах профилактики и/или аттенуирования аллергических реакций, таких как аллергические реакции, которые ведут к анафилаксии. Как описано здесь в другом месте, аллергические реакции могут характеризоваться ТН2-реакциями против антигена, что приводит к присутствию IgE-антител. Стимуляция ТН1-иммунных реакций и продуцирование IgG-антител может облегчать аллергическое заболевание. Таким образом, вакцинные композиции данного изобретения включают в себя композиции, которые приводят к продуцированию антител, которые предотвращают и/или аттенуируют аллергические реакции. Таким образом, в некоторых вариантах вакцинные композиции данного изобретения включают в себя композиции, которые индуцируют иммунологическую реакцию против аллергена. Примеры таких аллергенов включают в себя фосфолипазы, такие как белки фосфолипазы А2 (PLA2) Apis mellifera (GenBank Accession No. 443189, GenBank Accession No. 229378), Apis dorsata (GenBank Accession No. В59055), Apis cerana (GenBank Accession No. А59055), Bombus pennsylvanicus (GenBank Accession No. В56338) и Heloderma suspectum (GenBank Accession No. Р80003; GenBank Accession No. S14764; GenBank Accession No. 226711).
С использованием аминокислотной последовательности PLA2 Apis mellifera (GenBank Accession No. 443189, GenBank Accession No. 229378) для иллюстрации, пептиды с длиной по меньшей мере приблизительно 60 аминокислот, которые представляют любую часть целой последовательности PLA2, могут быть также использованы в композициях для профилактики и/или аттенуирования аллергических реакций. Примеры таких пептидов включают в себя пептиды, которые содержат аминокислоты 1-60, аминокислоты 1-70, аминокислоты 10-70, аминокислоты 20-80, аминокислоты 30-90, аминокислоты 40-100, аминокислоты 47-99, аминокислоты 50-110, аминокислоты 60-120, аминокислоты 70-130 или аминокислоты 90-134, а также соответствующие части других белков PLA2 (например, белков PLA2, описанных выше). Следующие примеры таких пептидов включают в себя пептиды, которые содержат аминокислоты 1-10, аминокислоты 5-15, аминокислоты 10-20, аминокислоты 20-30, аминокислоты 30-40, аминокислоты 40-50, аминокислоты 50-60, аминокислоты 60-70, аминокислоты 70-80, аминокислоты 80-90, аминокислоты 90-100, аминокислоты 100-110, аминокислоты 110-120 или аминокислоты 120-130, а также соответствующие части других белков PLA2 (например, белков PLA2, описанных выше).
Части PLA2, а также части других белков, против которых требуется иммунологическая реакция, пригодные для применения с данным изобретением, могут содержать, или альтернативно состоят из них, пептиды, которые обычно имеют длину по меньшей мере 6 аминокислот (например, пептиды, имеющие длину 6, 7, 8, 9, 10, 12, 15, 18, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 аминокислот).
Пептиды PLA2 (например, полноразмерные белки PLA2, обсуждаемые выше, а также их подчасти) могут быть также связаны с любой последовательностью (например, капсидным белком АР205 или его фрагментом), которая делает возможной образование упорядоченных и повторяющихся массивов антигенов.
Выбор антигенов или антигенных детерминант для композиций и способов лечения рака будет известным специалистам с обычной квалификацией в релевантных областях. В конкретном варианте данного изобретения антиген или антигенная детерминанта выбраны из группы, состоящей из (а) рекомбинантного белка рака молочной железы; (b) рекомбинантного белка клеток рака почки; (с) рекомбинантного белка клеток рака предстательной железы; (d) рекомбинантного белка клеток рака кожи; (е) рекомбинантного белка клеток рака головного мозга; (f) рекомбинантного белка клеток лейкоза; (g) рекомбинантного profiling и (h) фрагмента любого из белков, представленных в (а)-(g).
Репрезентативные примеры таких типов антигенов или антигенных детерминант включают в себя следующее: Her2 (рак молочной железы), GD2 (нейробластому), EGF-R (злокачественную глиобластому), CEA (медуллярно-тиреоидный рак) и CD52 (лейкоз), белок gp100 меланомы человека, белок melan-A/MART-1 меланомы человека, тирозиназу, белок Na17-A nt, белок MAGE-3, белок р53 и белок HPV16E7, а также фрагменты каждого из них, которые могут быть использованы для индукции иммунологических реакций. Другими антигенными детерминантами, применимыми для композиций и способов для лечения рака, являются молекулы и антигенные детерминанты, участвующие в ангиогенезе. Ангиогенез, образование новых кровеносных сосудов, играет неотъемлемую роль в физиологических и патофизиологических процессах, таких как заживление ран и рост солидных опухолей соответственно (Folkman, J. (1995) Nat. Medicine 1, 27-31; Folkman, J., and Klagsburn, M. (1987) Science 235, 442-446; Martiny-Baron, G., and Marmé, D. (1995) Curr. Opin. Biotechnol. 6, 675-680; Risau, W. (1997) Nature 386, 671-674). Быстро растущие опухоли инициируют образование кровеносных сосудов и зависят от образования кровеносных сосудов для обеспечения необходимого кровоснабжения. Таким образом, считается, что антиангиогенные агенты являются эффективными в качестве противораковых терапевтических веществ.
Среди нескольких предположительных ангиогенных факторов, которые были идентифицированы, васкулярный эндотелиальный фактор роста (VEGF) является сильным специфическим в отношении эндотелиальных клеток митогеном и первичным стимулятором васкуляризации многих солидных опухолей. Таким образом, блокада действия VEGF является мишенью для вмешательства в индуцируемый опухолью ангиогенез, в виде средства блокирования скорее эндотелия, чем опухоли, в качестве стратегии для борьбы с раками (Millauer, B. et al. (1994) Nature 367, 576-579; Kim, J. et al. (1993) Nature 362, 841-844).
Были описаны анти-VEGFR-II-антитело (IMC-1C11) и анти-VEGF-антитело (Lu, D. et al. (2000) J. Biol. Chem. 275, 14321-14330; Presta, L.G. et al. (1997) Cancer Res. 47, 4593-4599). Первое нейтрализующее моноклональное анти-VEGFR-2-антитело узнает эпитоп, который был идентифицирован как предположительный сайт связывания VEGF/VEGFR-II (Piossek, C. et al. (1999) J. Biol. Chem. 274, 5612-5619).
Таким образом, в одном варианте данного изобретения антиген или антигенная детерминанта, используемые в конъюгатах, композициях или способах данного изобретения, является пептидом, полученным из сайта контакта VEGFR-II. Это обеспечивает композицию и вакцинную композицию в соответствии с данным изобретением, которая может иметь антиангиогенные свойства, полезные для лечения рака. Было продемонстрировано ингибирование роста опухоли в мышах с использованием сывороток, специфических в отношении VEGFR-II (Wei, YQ et al. (2000) Nature Medicine 6, 1160-1165). Таким образом, следующие антигенные детерминанты, пригодные для композиций данного изобретения и антиангиогенных вакцинных композиций в соответствии с данным изобретением, включают в себя или произведенный из VEGFR-II человека пептид с аминокислотной последовательностью CTARTELNVGI DFNWEYPSSKHQHKK (SEQ ID NO:99), и/или произведенный из мышиного VEGFR-II пептид с аминокислотной последовательностью CTARTELNVGLDFTWHSPPSKSHHKK (SEQ ID NO:113), и/или соответствующие внеклеточные глобулярные домены 1-3 VEGFR-II.
Аутоантигены
В конкретных вариантах данное изобретение относится к вакцинным композициям, пригодным для использования в способах профилактики и/или аттенуирования заболеваний или состояний, которые обусловлены или обострены продуктами "своих" генов (например, факторами некроза опухолей). Обычно трудно, если не невозможно, индуцировать реакции в виде антител к "своим" молекулам общепринятой вакцинацией. Данное изобретение относится к одному пути для улучшения эффективности вакцинации увеличением степени повторяемости антигена, используемого для иммунизации через связывание этого антигена с VLP АР205.
В отличие от выделенных белков вирусы индуцируют немедленные и эффективные иммунные реакции в отсутствие каких-либо адъювантов как с помощью, так и без помощи Т-клеток (Bachmann & Zinkernagel, Ann. Rev. Immunol: 15:235-270 (1997)). Хотя вирусы часто состоят из нескольких белков, они способны запускать гораздо более сильные иммунные реакции, чем их выделенные компоненты. Для В-клеточных реакций известно, что одним из решающих факторов для иммуногенности вирусов является повторяемость и упорядоченность поверхностных эпитопов. Многие вирусы обнаруживают квазикристаллическую поверхность, которая обнаруживает правильный массив эпитопов, которые эффективно сшивают эпитоп-специфические иммуноглобулины на В-клетках (Bachmann & Zinkernagel, Immunol. Today 17: 553-558 (1996)). Это сшивание поверхности иммуноглобулинов на В-клетках является сильным сигналом активации, который непосредственно индуцирует прогрессирование клеточного цикла и продуцирование IgM-антител. Далее, такие приведенные в действие В-клетки способны активировать Т-хелперные клетки, которые, в свою очередь, индуцируют переключение продуцирования антител с IgM на IgG в В-клетках и генерирование долгоживущей памяти В-клеток - задачу любой вакцинации (Bachmann & Zinkernagel, Ann. Rev. Immunol: 15:235-270 (1997)). Вирусная структура равным образом связана с генерированием антител в аутоиммунном заболевании и в качестве части природной реакции на патогены (см. Fehr, T. et al., J. Exp. Med. 185:1785-1792 (1995)). Таким образом, антитела, презентируемые высокоорганизованной вирусной поверхностью, способны индуцировать сильные анти-антитело-реакции.
Иммунная система обычно не способна продуцировать антитела против собственных структур. Для растворимых антигенов, присутствующих в низких концентрациях, это обусловлено толерантностью на уровне Th-клеток. При таких условиях связывание аутоантигена с носителем, который может доставлять Т-помощь, может разрушать эту толерантность. Для растворимых белков, присутствующих в высоких концентрациях, или мембраносвязанных белков в низких концентрациях В- и ТН-клетки могут быть толерантными. Однако толерантность В-клеток может быть обратимой (анергия, т.е. иммунологическая толерантность) и может быть разрушена введением антигена, высокоорганизованным образом связанного с чужеродным носителем (Bachmann & Zinkernagel, Ann. Rev. Immunol: 15:235-270 (1997)).
Таким образом, вакцинные композиции данного изобретения включают в себя конъюгаты, композиции и способы, которые приводят к продуцированию антител, которые предотвращают и/или аттенуируют заболевания или состояния, вызываемые или обостряемые продуктами "своих" генов. Примеры таких заболеваний или состояний включают в себя реакцию трансплантат против хозяина, IgE-опосредованные аллергические реакции, анафилаксию, респираторный дистресс-синдром взрослых, болезнь Крона, аллергическую астму, острый лимфобластный лейкоз (ALL), диабет, неходжкинскую лимфому (NHL), болезнь Грейвса (токсический зоб), системную красную волчанку (SLE), воспалительные аутоиммунные заболевания, тяжелую псевдопаралитическую миастению, иммунопролиферативное заболевание лимфаденопатию (IPL), ангиоиммунопролиферативную лимфаденопатию (AIL), иммунобластную лимфаденопатию (IBL), ревматоидный артрит, диабет, рассеянный склероз, болезнь Альцгеймера, остеопороз и аутоиммунные состояния, ассоциированные с некоторыми инфекциями, в том числе ревматическую лихорадку, скарлатину, болезнь Лайма и инфекционный полиартрит.
Выбор антигенов или антигенных детерминант для конъюгатов, композиций и способов лечения других заболеваний и состояний, связанных с аутоантигенами, будет известным специалистам с обычной квалификацией в релевантной области. Репрезентативными примерами таких антигенов или антигенных детерминант являются, например, лимфотоксины (например, лимфотоксин α (LTα), лимфотоксин β (LTβ)) и рецепторы лимфотоксинов, рецепторный активатор лиганда ядерного фактора kB (RANKL), васкулярный эндотелиальный фактор роста (VEGF), рецептор васкулярного эндотелиального фактора роста (VEGF-R), интерлейкин-5, интерлейкин-17, интерлейкин-13, CCL21, CXCL12, SDF-1, MCP-1, эндоглин, резистин, GHRH, LHRH, TRH, MIF, эотаксин, брадикинин, BLC, фактор α некроза опухолей и бета-пептид амилоида (Аβ1-42), а также фрагменты каждого из них, которые могут быть использованы для индукции иммунологических реакций.
В одном варианте антигенной детерминантой является бета-пептид амилоида (Аβ1-42) (DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA (SEQ ID NO:7) или его фрагмент. Аβ -пептид играет центральную роль в нейропатологии болезни Альцгеймера. Район-специфическое, внеклеточное накопление Аβ-пептида сопровождается образованием микроглий, изменениями цитоскелета, дистрофическим невритом и потерей синапса. Считается, что эти патологические изменения связаны с ухудшением познавательной способности, которая определяет это заболевание.
В мышиной модели болезни Альцгеймера трансгенные животные, сконструированные для продуцирования Аβ1-42 (PDAPP-мыши), развивают бляшки и повреждения нейронов в их головном мозгу. Недавнее исследование показало, что иммунизация молодых PDAPP-мышей с использованием Аβ1-42 приводила к ингибированию бляшкообразования и ассоциированного дистрофического неврита (Schenk, D. et al., Nature 400:173-77 (1999)).
Кроме того, иммунизация более старых PDAPP-мышей, которые уже развили AD-подобные невропатологии, уменьшала степень и прогрессирование этих невропатологий. В другом исследовании вводимые периферически антитела, индуцированные против Аβ1-42, были способны индуцировать клиренс предсуществующего амилоида (Bard, F. et al., Nature Medicine 6:916-19 (2000)). Данное изобретение использовало либо поликлональные антитела, индуцированные против Аβ1-42, либо моноклональные антитела, индуцированные против синтетических фрагментов, произведенных из различных районов Аβ. Таким образом, индукция антител против Аβ с использованием конъюгатов, композиций и способов данного изобретения может рассматриваться как потенциальный терапевтический способ лечения болезни Альцгеймера.
Хорошо установлено, что введение только очищенных белков обычно является недостаточным для индукции сильной иммунной реакции; выделенный антиген обычно должен предоставляться со вспомогательными веществами, называемыми адъювантами. В этих адъювантах введенный антиген защищен против быстрой деградации, и адъювант обеспечивает пролонгированное высвобождение низкого уровня антигена. В данном изобретении пептид Аβ или его фрагменты делают иммуногенными посредством связывания с VLP АР205, и они не требуют обязательного использования адъюванта.
Как указывалось, одним из ключевых событий в болезни Альцгеймера (AD) является отложение амилоида в виде нерастворимых волокнистых масс (амилоидогенез), приводящее к внеклеточным невритным бляшкам и отложениям вокруг стенок мозговых кровеносных сосудов (в отношении обзора см. Selkoe, D.J. (1999) Nature, 399, A23-31). Главным компонентом этих невритных бляшек и окрашиваемой Конго красным ангиопатии является амилоид β (Аβ), хотя эти отложения содержат также другие белки, такие как гликозаминогликаны и аполипопротеины. Аβ протеолитически отщепляется от гораздо большего гликопротеина, известного как амилоидные белки-предшественники (АРР), который содержит изоформы из 695-770 аминокислот с единственным гидрофобным трансмембранным доменом. Аβ образует группу пептидов длиной до 43 аминокислот, обнаруживающую значительную амино- и карбокситерминальную гетерогенность (усечение), а также модификации (Roher, A.E. et al. (1988) J. Cell. Biol. 107, 2703-2716. Roher, A.E. et al. (1993) J. Neurochem. 61, 1916-1926). Известными изоформами являются 1-40 и 1-42. Он имеет высокую склонность к образованию β-складок, агрегирующихся в фибриллы, что в конечном счете приводит к амилоиду. Недавние исследования продемонстрировали, что индуцированное вакцинацией уменьшение отложения амилоида приводило к когнитивным улучшениям (Schenk, D. et al. (1999) Nature, 400, 173-177). Таким образом, фрагменты Аβ, пригодные для генерирования вакцин данного изобретения, включают в себя без ограничения: Аβ 1-15, Аβ 1-27 и Аβ 33-42. С аминокислотной последовательностью Аβ или фрагментов Аβ сливают аминокислотный линкер, чтобы сделать возможным связывание с VLP АР205, как описано здесь в другом месте. Аминокислотные линкеры, подходящие для слияния с N-концом Аβ или фрагментов Аβ, включают в себя без ограничения последовательность CGG и CGHGNKS. Линкеры, подходящие для слияния с С-концом Аβ или фрагментов Аβ, включают в себя без ограничения последовательность GGC. В одном варианте, когда линкер слит с С-концом Аβ или фрагментов Аβ, С-концевой цистеин является амидированным. Аβ-фрагмент 1-15 слит с аминокислотным линкером и имеет последовательность: DAEFRHDSGYEVHHQGGC-NH2(SEQ ID NO:8), где С-концевой цистеин является амидированным, что показано С-концевой группой NH2. Фрагмент Аβ 1-27 слит с аминокислотным линкером и имеет последовательность: DAEFRHDSGYEVHHQKLVFFAEDVGSNGGC-NH2 (SEQ ID NO:9). Фрагмент Аβ 33-42 слит с аминокислотным линкером и имеет последовательность: CGHGNKSGLMVGGVVIA(SEQ ID NO:10).
В одном варианте данного изобретения антиген или антигенная детерминанта содержит пептид ангиотензина или его фрагмент, или предпочтительно состоит из пептида ангиотензина или его фрагмента. Термин "пептид ангиотензина" включает в себя, в данном контексте, любой пептид, содержащий последовательность, или любой ее фрагмент, ангиотензиногена, ангиотензина I или ангиотензина II. Ангиотензин ассоциирован с гипертензией (Gardiner et al., Br. J. Pharm. 129: 1178 (2000)). Таким образом, конъюгаты, композиция и способы данного изобретения, подходящие для уменьшения уровней ангиотензина, пригодны для лечения гипертензии. В одном варианте этот конъюгат или композиция содержит по меньшей мере один пептид ангиотензина. Аминокислотные последовательности пептидов в некоторых вариантах являются следующими: ангиотензиноген: DRVYIHPFHLVIHN (SEQ ID NO:11); ангиотензин I: DRVYIHPFHL (SEQ ID NO:12); ангиотензин II: DRVYIHPF (SEQ ID NO:13). Обычно одна или несколько дополнительных аминокислот добавлены на С- и/или N-конце последовательностей пептидов ангиотензина. Эти дополнительные аминокислоты являются, в частности, ценными для ориентированной и упорядоченной ассоциации вирусоподобной частицы АР205. Последовательность пептидов ангиотензина соответствует человеческой последовательности, которая идентична мышиной последовательности. Таким образом, иммунизация человека или мыши вакцинами или композициями, соответственно содержащими такие пептиды ангиотензина в качестве антигена или антигенной детерминанты, в соответствии с данным изобретением является вакцинацией против аутоантигена. В некоторых вариантах пептид ангиотензина с указанным вторым сайтом присоединения имеет аминокислотную последовательность, выбранную из группы, состоящей из а) аминокислотной последовательности CGGDRVYIHPF (SEQ ID NO:14); b) аминокислотной последовательности CGGDRVYIHPFHL (SEQ ID NO:15); с) аминокислотной последовательности DRVYIHPFHLGGC (SEQ ID NO:16) и d) аминокислотной последовательности CDRVYIHPFH (SEQ ID NO:98).
В другом варианте данного изобретения антигенной детерминантой является RANKL (рецепторный активатор лиганда NFkB). RANKL известен также как TRANCE (индуцированный TNF-связанной активацией цитокин), ODF (фактор дифференцировки остеокластов) или OPGL (лиганд остеопрогетерина). Аминокислотная последовательность внеклеточной части RANKL человека показана в депозите RANKL_human базы данных EMBL: TrEMBL:O14788. Последовательности для внеклеточной части мышиного RANKL и изоформы показаны в депозитах RANKL_mouse: TrEMBL:O35235 и в сплайсинговых формах RANKL_mouse: TrEMBL:Q9JJK8 и TrEMBL:Q9JJK9 соответственно.
Было показано, что RANKL является важным фактором остеокластогенеза. Ингибирование взаимодействия RANKL с его рецептором RANK может приводить к супрессии остеокластогенеза и, следовательно, обеспечивать средство остановки избыточной ресорбции костей, наблюдаемой в остеопорозе и других состояниях. Взаимодействие RANKL/RANK ингибировалось либо слитым белком RANK-Fc, либо растворимым рецептором-ловушкой RANKL, называемым остеопротегерином (OPG).
В костях RANKL экспрессируется на стромальных клетках или остеобластах, тогда как RANK экспрессируется на предшественнике остеокласта. Взаимодействие RANK и RANKL является решающим для развития предшественников остеокластов для созревания остеокластов. Это взаимодействие может быть блокировано OPG. OPG-зависимые мыши развивают остеопороз, который может быть элиминирован инъекцией рекомбинантного OPG, что предполагает, что OPG способен обращать остеопороз. Таким образом, ингибирование взаимодействия RANK-RANKL обеспечением подходящих конъюгатов, композиций и способов данного изобретения (например, конъюгатов RANKL-VLP АР205) является эффективным в обращении или профилактике остеопороза.
Кроме того, кальцификацию артерий наблюдали при нокауте гена OPG, которая могла быть обращена инъекцией OPG (Min et al., J. Exp. Med. 4: 463 (2000)). В модели индуцированного адъювантом артрита инъекция OPG была способна предотвращать разрежение кости и деструкцию хряща, но не воспаление (опухание лапок). Было сделано предположение, что активированные Т-клетки приводят к RANKL-опосредуемому увеличению остеокластогенеза и разрежению кости. OPG ингибирует индуцируемый раком остеокластогенез в кости мыши и предотвращает рост опухоли предстательной железы. OPG уменьшает боль при запущенном раке кости в мышах.
RANKL является трансмембранным белком из 245 аминокислот, принадлежащим к TNF-суперсемейству. Часть внеклеточного района (178 аминокислот) может отщепляться ТАСЕ-подобной протеазой (Lum et al., J. Biol. Chem. 274:13613 (1999)). Кроме того, были описаны сплайсинговые варианты, лишенные трансмембранного домена (Ikeda et al., Endocrinology 142: 1419 (2001)). Отщепляемая внеклеточная часть содержит домен, высокогомологичный относительно растворимого TNF-α, и образует гомотримеры, наблюдаемые для TNF-α. С-конец, по-видимому, участвует в тримерном сайте контакта. В этом районе последовательности присутствует один цистеин.
Авторы сконструировали модель для этой трехмерной структуры соответствующего района RANKL и обнаружили, что природно встречающийся цистеин может быть недоступным в этой уложенной структуре для взаимодействия с первым сайтом присоединения на носителе в соответствии с данным изобретением. N-конец является одним сайтом, подходящим для присоединения второго сайта присоединения, содержащего аминокислотный линкер с дополнительным остатком цистеина. Конструкция RANKL человека с N-концевым аминокислотным линкером, содержащим остаток цистеина, слитый с внеклеточной частью RANKL, является одним из вариантов данного изобретения. Однако аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта присоединения и слитый на С-конце последовательности RANKL или внеклеточной части RANKL, приводит к следующим вариантам данного изобретения.
Конструкции RANKL человека получают в соответствии с приведенными здесь описаниями, и специалист с обычной квалификацией в данной области сможет сравнить последовательности мышиного и человеческого RANKL в сопоставлении аминокислотных последовательностей для идентификации части последовательности RANKL человека, которая должна клонироваться в векторах. Фрагменты, содержащие аминокислоты 138-317 и соответствующий С-концевой район внеклеточного домена RANKL человека, являются одним из вариантов данного изобретения, и их модифицируют для связывания с VLP АР205, как это требуется, в соответствии с описаниями данного изобретения. Данное изобретение включает в себя также другие подходящие векторы, используемые для экспрессии в подходящем хозяине, описанные ниже. Дополнительные конструкции RANKL человека, которые также включены в объем данного изобретения, включают в себя конструкции, содержащие часть внеклеточного района (178 аминокислот) или его фрагменты, которые могут отщепляться ТАСЕ-подобной протеазой (Lum et al., J. Biol. Chem. 274:13613 (1999)), или которые содержат последовательность, соответствующую альтернативным сплайсинговым вариантам, лишенным трансмембранного домена, а также ее консервативные фрагменты. С-концевые фрагменты RANKL человека, содержащие аминокислоты 165-317, также являются вариантами данного изобретения. Фрагменты RANKL, которые охватывают весь внеклеточный район (аминокислоты 71-317) и могут быть модифицированы для связывания с VLP АР205 в соответствии с описанием данного изобретения, также находятся в рамках данного изобретения.
RANKL экспрессировали в различных системах (например, E. coli, клетках насекомых, клетках млекопитающих), и было показано, что он является активным. Таким образом, несколько систем экспрессии могут быть использованы для получения подходящих антигенов RANKL данной композиции. В случае, когда экспрессия данного белка направляется в периплазму E. coli, сигнальный пептид RANKL или конструкций RANKL, состоящих из внеклеточной части этого белка, оба, возможно, модифицированные таким образом, что они содержат второй сайт присоединения, заменяют бактериальным сигнальным пептидом. Для экспрессии этого белка в цитоплазме E. coli конструкции RANKL лишены сигнального пептида.
В одном варианте данного изобретения антигенной детерминантой является MIF или его фрагмент. MIF является цитокином, который функционирует как ингибитор миграции макрофагов. Он известен также как белок 6 (DER6) замедленно ранней реакции, фактор ингибирования гликозилирования или фенилпируваттаутомераза.
Было показано, что MIF участвует в большом диапазоне состояний. MIF (мРНК и белок) положительно регулируется в реакции гиперчувствительности (аллергии) замедленного типа (DTH), индуцируемой туберкулином, а анти-MIF-антитело ингибирует эту реакцию DTH. MIF положительно регулируется также в отторжении аллотрансплантата почки. В модели глазного аутоиммунного заболевания, экспериментального аутоиммунного увеоретинита (EAU) лечение с использованием анти-MIF вызывало задержку развития EAU. В пациентах имеется увеличение MIF в сыворотке, которое также имеет место в пациентах с болезнью Бехчета и пациентах, страдающих от иридоциклита. Иммунизация против MIF может обеспечить способ лечения против ревматоидного артрита. Таким образом, конъюгаты, композиции и способы данного изобретения, пригодные для иммунизации против MIF или для уменьшения сывороточного MIF, применимы в лечении или профилактике заболеваний, нарушений и состояний, ассоциированных со сверхпродуцированием MIF.
Высокая концентрация MIF в сыворотке была обнаружена в пациентах с атопическим дерматитом. В кожных повреждениях MIF экспрессировался диффузно в сравнении с обнаружением в слое базальных клеток в контролях. Концентрация MIF уменьшалась лечением стероидами, что согласуется с ролью MIF в воспалении. Было также обнаружено, что MIF способствует развитию гломерулонефрита. Животные, получающие анти-MIF-антитело, обнаруживают значимо уменьшенный гломерулонефрит. MIF происходит из гипофиза, секретируется, например, после стимуляции LPS и усиливает эндотоксемию. Таким образом, mAb против MIF ингибирует эндотоксемию и септический шок, тогда как рекомбинантный MIF заметно увеличивает летальность перитонита. MIF является также индуцируемым глюкокортикоидами модулятором продуцирования цитокинов и стимулирует воспаление.
MIF продуцируется также Т-клетками (ТН2), поддерживает пролиферацию Т-клеток, и лечение анти-MIF-антителами уменьшает пролиферацию Т-клеток и уровни IgG. Увеличенная концентрация MIF имеется также в спинномозговой жидкости при рассеянном склерозе и в пациентах с нейрозаболеванием Бехчета. Высокие уровни MIF были обнаружены в сыворотках пациентов с продолжительным псориазом. Высокие уровни MIF были обнаружены в сыворотках пациентов с язвенным колитом, но не в пациентах с болезнью Крона.
Высокие уровни MIF были обнаружены в сыворотках пациентов с бронхиальной астмой. MIF положительно регулируется в синовиальной жидкости пациентов с ревматоидным артритом. Лечение анти-MIF-антителами эффективно уменьшало ревматоидный артрит в мышиных и крысиных моделях (Mikulowska et al., J. Immunol. 158:5514-7 (1997); Leech et al., Arthritis Rheum. 41:910-7 (1998), Leech et al., Arthritis Rheum. 43:827-33 (2000), Santos et al., Clin. Exp. Immunol. 123:309-14 (2001)). Таким образом, лечение, направленное на ингибирование активности MIF, с использованием композиции, содержащей MIF в качестве антигенной детерминанты, является полезным для вышеуказанных состояний.
MIF из мыши, крысы и человека состоит из 114 аминокислот и содержит три консервативных цистеина, как показано в SEQ ID NO:120 MIF крысы, SEQ ID NO:121 MIF мыши и SEQ ID NO:119 MIF человека (SwissProt). Три субъединицы образуют гомотример, который не стабилизирован дисульфидными связями. Рентгеновская (кристаллическая) структура была исследована, и она обнаруживает три свободных цистеина (Sun et al., PNAS 93: 5191-96 (1996)), хотя некоторые литературные данные утверждают присутствие дисульфидной связи. Тем не менее ни один из цистеинов не выставлен достаточно для оптимального взаимодействия с возможным первым сайтом присоединения, присутствующем на носителе. Таким образом, С-конец этого белка является открытым в этой тримерной структуре, аминокислотный линкер, содержащий остаток цистеина, в одном аспекте добавляют к С-концу этого белка для генерирования второго сайта присоединения в этом варианте данного изобретения. Имеется только одна аминокислотная замена между мышиным и крысиным MIF, а также очень высокая гомология последовательности (приблизительно 90% идентичность последовательности) между MIF человека, MIF крысы и MIF мыши. Данное изобретение относится к конъюгатам, композициям и способам, содержащим конструкции MIF человека и мыши, связанные с VLP АР205.
Аминокислотный линкер, содержащий цистеин, который добавляют на N-конце последовательности MIF, приводит к дополнительным вариантам данного изобретения. MIF экспрессировали в E. coli, очищали, и было показано, что он был полностью функциональным (Bernhagen et al., Biochemistry 33: 14144-14155 (1994)). Таким образом, MIF может экспрессироваться в E. coli для получения полезных вариантов данного изобретения.
Таутомеразная активность MIF ингибируется, если стартовый метионин не отщеплен от этой конструкции. Конструкции MIF, экспрессируемые в E. coli, обнаруживают таутомеразную активность. Мутанты MIF, в которых стартовый метионин отщеплен и в которых остаток пролина справа от стартового метионина в этой последовательности, мутирован в аланин, также не обнаруживают таутомеразной активности и представляют следующие варианты данного изобретения, и предполагается, что они включены в рамки данного изобретения. В одном конкретном варианте АР205 конъюгируют с мутантами MIF, лишенными таутомеразной активности.
В одном варианте данного изобретения антигеном или антигенной детерминантой является интерлейкин-17 (IL-17). IL-17 человека является имеющим дисульфидные связи, гомодимерным белком 32 кДа с вариабельным гликозилированием (Yao, Z. et al., J. Immunol. 155:5483-5486 (1995); Fossiez, F. et al., J. Exp. Med. 183: 2593-2603 (1996)). Этот белок содержит 155 аминокислот и включает в себя N-концевую последовательность сигнала секреции из 19-23 остатков. Аминокислотная последовательность IL-17 сходна с белком Herpesvirus (HSV13) и не является сходной с другими цитокинами или известными белками. Аминокислотная последовательность IL-17 человека показана в последовательности GenBank Accession No. ААС50341. Последовательность мышиного белка показана в последовательности GenBank Accession No. ААА37490. При оценке из большого числа тканей и клеточных линий мРНК-транскрипт, кодирующий IL-17, был обнаружен только в активированных Т-клетках и стимулированных форбол-12-миристат-13-ацетатом/иономицином мононуклеарных клетках периферической крови (Yao, Z. et al., J. Immunol. 155:5483-5486 (1995); Fossiez, F. et al., J. Exp. Med. 183: 2593-2603 (1996)). Как человеческая, так и мышиная последовательности содержат 6 остатков цистеина.
Рецептор для IL-17 широко экспрессируется во многих тканях и типах клеток (Yao, Z. et al., Cytokine 9: 794-800 (1997)). Хотя аминокислотная последовательность рецептора IL-17 человека (866 аминокислот) прогнозирует белок с единственным трансмембранным доменом и длинным внутриклеточным доменом из 525 аминокислот, эта рецепторная последовательность является уникальной и не похожей на последовательность любого из рецепторов из семейства рецепторов цитокинов/факторов роста. Это, вместе с отсутствием сходства самого IL-17 с другими известными белками, указывает на то, что IL-17 и его рецептор могут быть частью нового семейства белков передачи сигналов и рецепторов. Клинические исследования указывают на то, что IL-17 может участвовать во многих воспалительных заболеваниях. IL-17 секретируется синовиальными Т-клетками из пациентов с ревматоидным артритом и стимулирует продуцирование воспалительных медиаторов (Chabaud, M. et al., J. Immunol. 161:409-414 (1998); Chabaud, M. et al., Arthritis Rheum. 42:963-970 (1999)). Высокие уровни IL-17 сообщались в пациентах с ревматоидным артритом (Ziolkowska M. et al., J. Immunol. 164:2832-8 (2000)).
Было показано, что интерлейкин-17 действует на деградацию протеогликана в коленных суставах мышей (Dudler J. et al., Ann Rheum Dis. 59: 529-32 (2000)) и способствует деструкции матрикса синовия (Chabaud M. et al., Cytokine, 12:1092-9 (2000)). Существуют релевантные модели артрита в животных для испытания действия иммунизации против IL-17 (Chabaud M. et al., Cytokine, 12:1092-9 (2000)). Повышенные уровни мРНК IL-17 были обнаружены в мононуклеарных клетках из пациентов с рассеянным склерозом (Matusevicius, D. et al., Mult. Scler. 5: 101-104 (1999)). Повышенные сывороточные уровни IL-17 наблюдают в пациентах, страдающих от системной красной волчанки (Wong C.K. et al., Lupus 9: 589-93 (2000)). Кроме того, уровни мРНК IL-17 увеличиваются в Т-клетках, выделенных из поврежденной псориатической кожи (Teunissen, M.B. et al., J. Invest. Dermatol. 111: 645-649 (1998)).
Было также продемонстрировано участие IL-17 в отторжении трансплантата почек (Fossiez F. et al., Int. Rev. Immunol. 16:541-51 (1998)). Доказательство роли IL-17 в отторжении аллотрансплантатов органов было представлено также Antonysamy et al. (J. Immunol. 162:577-84 (1999)), которые показали, что IL-17 стимулирует функциональную дифференцировку предшественников дендритных клеток. Их открытия предполагают роль IL-17 в пролиферации аллогенных Т-клеток, которая может быть частично опосредована индуцирующим созревание действием на дендритные клетки (DC). Кроме того, та же группа исследователей сообщает (Tang J.L. et al., Transplantation 72:348-59 (2001)) о роли IL-17 в иммунопатогенезе острого васкулярного отторжения, где антагонизм интерлейкина-17 ингибирует острое, но не хроническое васкулярное отторжение. IL-17 имеет, по-видимому, потенциал в качестве новой мишени для терапевтического вмешательства в отторжение аллотрансплантатов.
Моноклональное антитело против IL-17 mAb5 (Schering-Plough Research Institute) способно полностью ингибировать продуцирование IL-6 из супернатантов синовия ревматоидного артрита (RA) после индукции 50 нг/мл IL-17. Постороннее mAb МХ1 не оказывало действия в этом анализе. mAb5 является мышиным IgG1, полученным после иммунизации человеческим rIL-17 (r = рекомбинантный). Концентрация 1 мкг/мл mAb5 была способна полностью ингибировать продуцирование IL-6 в той же самой системе анализа (Chabaud, M. et al., J. Immunol. 161: 409-414 (1998)). Таким образом, иммунизация против IL-17 обеспечивает способ лечения для различных описанных выше состояний.
Таким образом, в одном варианте данного изобретения композиция содержит линкер, содержащий второй сайт присоединения, слитый с С-концом рекомбинантного IL-17. В следующих вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы этого белка, С-терминально (слева) относительно сигнального пептида. Для эукариотических систем экспрессии сигнальный пептид гена IL-17, как это имеет место для других аутоантигенов, указанных здесь, может быть заменен другим сигнальным пептидом, например, происходящим из специфического эукариотического экспрессирующего вектора. Для экспрессии в бактериях этот сигнальный пептид заменяют бактериальным сигнальным пептидом для экспрессии в растворе в периплазме. Для экспрессии в цитоплазме эта конструкция лишена сигнального пептида. Конструкции человеческого IL-17, лишенные сигнального пептида, будут, в некоторых вариантах, содержать остатки 24-155, 22-155, 21-155 или 20-155. Конструкции мышиного IL-17, лишенные сигнального пептида, будут, в некоторых вариантах, содержать остатки 26-158, 25-158, 24-158 или 27-155. IL-17 человека может экспрессироваться в клетках CV1/EBNA; было показано, что рекомбинант hIL-17 секретируется как в гликозилированной, так и в негликозилированной формах (Yao, Z. et al., J. Immunol. 155:5483-5486 (1995)). IL-17 может также экспрессироваться в виде слитого белка hIL-17/Fc с последующим отщеплением белка IL-17 от этого слитого белка. IL-17 может также экспрессироваться в дрожжах Pichia pastoris (Murphy K.P. et al., Protein Expr Purif. 12: 208-14 (1998)). IL-17 человека может также экспрессироваться в E. coli. Когда экспрессия IL-17 в E. coli направлена в периплазму, сигнальный пептид IL-17 заменяют бактериальным сигнальным пептидом. В одном варианте конструкции IL-17 лишены сигнального пептида для экспрессии этого белка в цитоплазме E. coli.
В другом варианте данного изобретения антигенной детерминантой является интерлейкин-13 (IL-13). IL-13 является цитокином, который секретируется активированными Т-лимфоцитами и первично воздействует на моноциты, макрофаги и В-клетки. Первые 20 аминокислот белка-предшественника соответствуют сигнальному пептиду и отсутствуют в процессированном белке. Была описана также мышиная последовательность (Brown K.D. et al., J. Immunol. 142:679-687 (1989)). В зависимости от экспрессионного хозяина конструкция IL-13 будет содержать последовательность белка-предшественника, например, для экспрессии и секреции в эукариотических хозяевах, или состоять из зрелого белка, например, для цитоплазматической экспрессии в E. coli. Для экспрессии в периплазме E. coli сигнальный пептид IL-13 заменяют бактериальным сигнальным пептидом.
IL-13 является происходящим из Т-хелперных клеток 2 цитокином (подобно IL-4, IL-5), который, как было показано недавно, участвует в аллергических реакциях дыхательных путей (астме). Была обнаружена повышающая регуляция IL-13 и рецептора IL-13 во многих типах опухолей (например, лимфоме Ходжкина). Интерлейкин-13 секретируется клетками лимфомы Ходжкина и клетками Рида-Штернберга (при лимфогранулематозе) (Kapp U. et al., J. Exp Med. 189:1939-46 (1999)). Таким образом, иммунизация против IL-13 обеспечивает способ лечения, среди прочего, состояний, описанных выше, таких как астма и лимфома Ходжкина.
В одном варианте эта композиция содержит аминокислотный линкер, содержащий остаток цистеина и слитый с N- или С-концом последовательности зрелого IL-13, для введения второго сайта присоединения в этом белке. В других вариантах аминокислотный линкер, содержащий цистеин, добавлен к N-концу зрелой формы IL-13, так как он является свободно доступным в соответствии с ЯМР-структурой IL-13 (Eisenmesser, E.Z. et al., J. Mol. Biol. 310: 231 (2001)). В других вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы этого белка, С-терминально (справа) от сигнального пептида. В других вариантах аминокислотный линкер, содержащий остаток цистеина, добавлен к С-концу этого белка.
IL-13 может экспрессироваться в E. coli (Eisenmesser E.Z. et al., Protein Expr. Purif. 20:186-95 (2000)) или в клетках NS-0 (линии эукариотических клеток) (Cannon-Carlson S. et al., Protein Expr. Purif. 12:239-48)).
В одном варианте данного изобретения антигенной детерминантой является интерлейкин-5 (IL-5). IL-5 является специфическим в отношении линии дифференцировки цитокином для эозинофилопоэза и играет важную роль в заболеваниях, ассоциированных с увеличенным количеством эозинофилов, таких как астма.
Биологическая функция IL-5 была показана в нескольких исследованиях (Coffman R.L. et al., Science 245: 308-10 (1989); Kopf et al., Immunity 4:15-24 (1996)), которые показывают полезное действие ингибирования функции IL-5 в заболеваниях, опосредованных эозинофилами. Таким образом, ингибирование действия IL-5 обеспечивает способ лечения астмы и других заболеваний, ассоциированных с эозинофилами.
IL-5 образует димер, ковалентно связанный дисульфидным мостиком. Сообщалась одноцепочечная (sc) конструкция, в которой два мономера IL-5 связаны пептидным линкером.
В одном варианте данного изобретения пептидный линкер, содержащий цистеин, добавляют на N-конце последовательности процессированной формы IL-5. Добавление линкера, содержащего цистеин, рассматривается также на N-конце последовательности процессированной формы scIL-5. В других вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы этого белка, С-терминально (справа) от сигнального пептида.
В других вариантах линкер, содержащий цистеин, слит с С-концом последовательности IL-5 или с С-концом последовательности scIL-5.
Был описан ряд систем экспрессии для IL-5, и они могут быть использованы в получении композиций данного изобретения. Бактериальная система экспрессии с использованием E. coli была описана Proudfoot et al. (Biochem. 270:357-61 (1990)). В случае, когда IL-5 экспрессируется в цитоплазме E. coli, конструкция IL-5 лишена сигнального пептида. Клетки насекомых могут быть также использованы для получения конструкций IL-5 для приготовления композиций данного изобретения (Pierrot C. et al., Biochem. Biophys. Res. Commun. 253:756-60 (1998)). Подобным образом, бакуловирусные системы экспрессии (клетки sf9; Ingley E. et al., Eur. J. Biochem. 196:623-9 (1991) и Brown P.M. et al., Protein Expr. Purif. 6: 63-71 (1995)) могут быть также использованы. Наконец, были сообщены системы экспрессии млекопитающих, и они могут быть использованы в получении этих композиций данного изобретения (Kodama S. et al., J. Biochem. (Tokyo) 110:693-701 (1991)).
Бакуловирусные системы экспрессии (Mitchell et al., Biochem. Soc. Trans. 21:3328 (1993); Kunimoto DY et al., Cytokine 3:224-30 (1991)) и система экспрессии млекопитающих, использующая клетки СНО (Kodama S. et al., Glycobiology 2:419-27 (1992)), также были описаны для мышиного IL-5.
Экспрессия мышиных конструкций IL-5, где последовательность IL-5 слита на ее N-конце с аминокислотными линкерами, содержащими остаток цистеина, пригодна для связывания IL-5 с VLP АР205. Человеческие конструкции могут быть получены в соответствии с приведенными здесь описаниями, и они дают белки C-IL-5-Е человека, С-IL-5-F человека и С-IL-5-S человека, пригодные для связывания с VLP АР205, и приводят к другим вариантам данного изобретения.
В одном варианте данного изобретения антигенной детерминантой является CCL-21. CCL-21 является хемокином СС-подсемейства, который также известен как малый индуцируемый цитокин А21, как экзодус-2, как SLD (вторичный лимфоцитарный цитокин), как ТСА4 (происходящий из тимуса (вилочковой железы) хемотаксический агент 4) или как 6С-кин.
CCL21 ингибирует гемопоэз и стимулирует хемотаксис для тимоцитов, активированных Т-клеток и дендритных клеток, но не для В-клеток, макрофагов или нейтрофилов. Он обнаруживает преимущественную активность в отношении "необученных" Т-клеток. Он является также сильным хемоаттрактантом мезангиальных клеток. CCL21 связывается с рецепторами хемокинов CCR7 и CXCR3 (в зависимости от вида). Он может запускать интегрин-зависимую остановку перекатывания лимфоцитов при физиологической срезающей силе и экспрессируется в высокой степени высокоэндотелиальными венулами.
Мышиный CCL21 ингибировал рост опухоли и ангиогенез в модели мышей SCID рака легкого человека (Arenberg et al., Cancer Immunol. Immunother. 49:587-92 (2001)) и опухолевой модели рака ободочной кишки в мышах (Vicari et al., J. Immunol. 165: 1992-2000 (2001)). Ангиостатическая активность мышиного CCL21 была детектирована также в анализе с роговичным микрокарманом крыс (Soto et al., Proc. Natl. Acad. Sci. USA 95: 8205-10 (1998)).
Было показано, что рецепторы хемокинов CCR7 и CXCR4 повышающим образом регулируются в клетках рака молочной железы и что CCL21 и CXCL12, соответствующие лиганды, высоко экспрессируются в органах, представляющих первое место назначения метастазирования рака молочной железы (Muller et al. (Nature 410: 50-6 (2001)). In vitro CCL21-опосредованный хемотаксис мог бы блокироваться нейтрализацией анти-CCL21-антител, как и CXCR4-опосредованный хемотаксис мог бы блокироваться соответствующими антителами. Таким образом, иммунизация против CCL21 обеспечивает способ лечения против метастазов в случае раков, более конкретно в случае рака молочной железы.
Секретируемый CCL21 состоит из 110 или 111 аминокислот в мышах и человеке соответственно. Соответствующие последовательности показаны в Swissprot: SY21_human и в Swissprot: SY21_mouse. В противоположность другим СС-цитокинам CCL21 содержит еще два цистеина в удлиненном районе на С-конце. Предполагается, что все цистеины участвуют в дисульфидных связях.
Далее описаны конструкции и системы экспрессии для получения композиций данного изобретения, содержащих антигенную детерминанту CCL21. В ЯМР-структуре гомологичного белка эотаксина как N-, так и С-конец экспонированы растворителю. В некоторых вариантах на С-конце этого белка добавлен аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта присоединения. Слитый со щелочной фосфатазой белок (слитый на С-конце CCL21) экспрессировали, и было показано, что он является функциональным, что свидетельствует о том, что слияния на С-конце CCL21 являются совместимыми со связыванием с рецептором. В конкретных вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы этого белка, С-терминально (справа) от сигнального пептида.
Несколько систем экспрессии были описаны для получения CCL21 (например, Hedrick et al., J. Immunol. 159: 1589-93 (1997)). Например, он может экспрессироваться в бакуловирусной системе (Nagira et al., J. Biol. Chem. 272: 19518-24 (1997)).
В родственном варианте антигенной детерминантой является происходящий из стромы фактор-1 (SDF-1), называемый теперь CXCL12. CXCL12 является хемокином, продуцируемым стромальными клетками костного мозга, и был первоначально идентифицирован как стимуляторный фактор для пре-В-клеток.
Как упоминалось выше, было показано, что рецепторы хемокинов CCR7 и CXCR4 положительно регулируются в клетках рака молочной железы и что CCL21 и SDF-1, соответствующие лиганды, высоко экспрессируются в органах, представляющих первое место назначения метастазирования рака молочной железы (Muller et al. (Nature 410: 50-6 (2001)). In vitro SDF-1/CXCR4-опосредованный хемотаксис мог бы ингибироваться нейтрализацией анти-SDF-1-антителами и анти-CXCR4-антителами.
В модели метастазирования рака молочной железы в мышах SCID с использованием клеточной линии рака молочной железы MDA-MB-231 наблюдали значимое уменьшение метастазирования в легких, когда мышей обрабатывали анти-CXCR4-антителами. В дренирующих лимфатических узлах наблюдали уменьшение метастазирования к паховым и вспомогательным лимфатическим узлам (38% вместо 100% метастазирования в контролях). Таким образом, иммунизация против CXCL12 обеспечивает способ лечения против метастазирования раков, более конкретно раков молочной железы.
Было показано, что пара SDF-1/CXCR4-хемокин-рецептор увеличивает эффективность стремления более примитивных гемопоэтических клеток-предшественников к костному мозгу как их родному микроокружению (хоминга). Кроме того, предполагается, что CXVR4 и SDF-1 влияют на распределение клеток хронического лимфоцитарного лейкоза. Эти клетки неизменно инфильтрируют костный мозг пациентов, и было показано, что их миграция в костный мозг была CXCR4-зависимой. Клетки хронического лимфоцитарного лейкоза подвергаются апоптозу, если их не сокультивируют со стромальными клетками. Блокирующие SDF-1 антитела могли бы ингибировать это защитное действие стромальных клеток (Burger et al., Blood 96: 2655-63 (2000)). Таким образом, иммунизация против CXCL12 обеспечивает способ лечения против хронического лимфоцитарного лейкоза.
Было показано, что CХCR4 является корецептором для вхождения ВИЧ в Т-клетки. SDF-1 ингибирует инфекцию CD4+ клеток Х4 (CXCR4-зависимыми) штаммами ВИЧ (Oberlin et al., Nature 382:833-5 (1996); Bleul et al., Nature 382:829-33 (1996), Rusconi et al., Antivir. Ther. 5:199-204 (2000)). Было показано, что синтетические пептидные аналоги SDF-1 эффективно ингибируют вхождение и инфицирование ВИЧ-1 посредством CXCR4-рецептора (WO 059928А1). Таким образом, иммунизация против CXCL12 обеспечивает способ блокирования вхождения ВИЧ в Т-клетки и, следовательно, способ лечения СПИДа.
Сообщалось также, что взаимодействия SDF-1-CXCR4 играют центральную роль в накоплении CD4+ Т-клеток в синовии ревматоидного артрита (Nanki et al., 2000). Таким образом иммунизация против SDF-1 обеспечивает способ лечения ревматоидного артрита.
Известно, что человеческий и мышиный SDF-1 возникают в двух формах, SDF-1α и SDF-1β, посредством дифференциального сплайсинга из одного гена. Они отличаются в четырех С-концевых аминокислотах, которые присутствуют в SDF-1β (74 аминокислоты) и отсутствуют в SDF-1α (70 аминокислот). Последовательность SDF-1 человека показана в Swissprot: SDF-1_human, а последовательность мышиного SDF-1 показана в Swissprot: SDF-1_mouse. SDF-1 содержит четыре консервативных цистеина, которые образуют две внутримолекулярные дисульфидные связи. Кристаллическая структура SDF показывает нековалентно связанный димер (Dealwis et al., PNAS 95: 6941-46 (1998)). Структура SDF-1 также показывает длинное N-концевое удлинение.
Для идентификации (части) рецепторсвязывающего сайта на SDF-1 использовали аланинсканирующий мутагенез (Ohnishi et al., J. Interferon Cytokine Res. 20:691-700 (2000) и Elisseeva et al. (J. Biol. Chem. 275:26799-805 (2000)), а Heveker et al. (Curr. Biol. 8:369-76 (1998)) описали происходящие из SDF-1 пептиды, ингибирующие связывание рецептора (и вхождение ВИЧ).
Далее описаны конструкции и экспрессионные системы, подходящие для генерирования композиций данного изобретения, связанных с SDF-1. N- и С-конец SDF-1 экспонированы растворителю. Таким образом, в конкретных вариантах аминокислотный линкер, содержащий цистеин в качестве второго сайта присоединения, слит с С-концом этой белковой поверхности, тогда как в других конкретных вариантах аминокислотный линкер, содержащий цистеин в качестве второго сайта присоединения, слит с N-концом белковой последовательности. Аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы белка, С-терминально (справа) от сигнального белка. Гены, кодирующие эти специфические конструкции, могут быть клонированы в подходящем экспрессирующем векторе.
Была описана экспрессия SDF-1 в системе вируса сендай в фибробластах куриного эмбриона (Moriya et al., FEBS Lett. 425:105-11 (1998)), а также экспрессия в E. coli (Holmes et al., Prot. Expr. Purif. 21: 367-77 (2001)) и химический синтез SDF-1 (Dealwis et al., PNAS 95: 6941-46 (2001)).
В другом варианте данного изобретения антигенной детерминантой является хемоаттрактант В-лимфоцитов (BLC, CXCL13). BLC экспрессируется в селезенке, пейеровых бляшках и лимфатических узлах (Gunn et al., 1998). Его экспрессия является наиболее сильной в зародышевых центрах, где В-клетки подвергаются соматической мутации и созреванию аффинности. BLC принадлежит к семейству хемокинов СХС, и его ближайшим гомологом является GROα (Gunn et al., Nature 391:799-803 (1998)). BLC человека имеет 64% гомологию с мышиным BLC. Его рецептором является CXCR5. BLC имеет также гомологию относительно IL-8. BLC рекрутирует В-клетки в фолликулы во вторичных лимфоидных органах, таких как селезенка и пейеровы бляшки. BLC требуется также для рекрутинга В-клеток в компартмент лимфатических узлов, богатых фолликулярными дендритными клетками (FDC) (Ansel et al., Nature 406:309-314 (2000)). BLC индуцирует также увеличенную экспрессию лимфотоксина α1β2 (LTα1β2) на рекрутированных В-клетках. Это обеспечивает положительную петлю обратной связи, так как LTα 1β2 стимулирует экспрессию BLC (Ansel et al., Nature 406:309-314 (2000)). Было также показано, что BLC способен индуцировать регенерацию (неогенез) лимфоидов (Luther et al., Immunity 12:471-481 (2000)). По-видимому, FDC также экспрессирует BLC. Таким образом, иммунизация против BLC может обеспечить способ лечения аутоиммунных заболеваний, в которых участвует лимфоидная регенерация, таких как ревматоидный синовит и ревматоидный артрит или диабет типа I. Была описана конструкция BLC, несущая С-концевую His-метку, и она является функциональной (Ansel, K.M. et al., J. Exp. Med. 190: 1123-1134 (1999)).
В одном варианте данного изобретения эта композиция содержит линкер, содержащий остаток цистеина в качестве второго сайта присоединения, слитого на С-конце последовательности BLC.
В IL-8, который гомологичен BLC, как N-конец, так и С-конец являются свободными. Слияние аминокислотного линкера, содержащего остаток цистеина в качестве второго сайта присоединения, с N-концом BLC приводит к одному варианту данного изобретения.
В других вариантах данного изобретения эта композиция содержит аминокислотный линкер, содержащий цистеин и слитый с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен при N-конце последовательности зрелой формы этого белка, С-терминально (справа) от сигнального пептида. Гены, кодирующие эти специфические конструкции, могут быть клонированы в подходящем экспрессирующем векторе и, соответственно, экспрессированы. Последовательность BLC человека показана в последовательности Accession: NP_006410. Аминокислоты 1-22 этой последовательности являются сигнальным пептидом. Мышиная последовательность показана в Accession: NP_061354. Аминокислоты 1-21 являются сигнальным пептидом. Композиции данного изобретения с BLC в качестве антигенной детерминанты, в некоторых вариантах, используют зрелую форму белка для генерирования композиций данного изобретения.
В другом конкретном варианте антигенной детерминантой является эотаксин. Эотаксин является хемотаксином, специфическим для рецептора 3 хемокина, присутствующего на эозинофилах, базофилах и Th2-клетках. Однако эотаксин, по-видимому, является высокоспецифическим для эозинофилов (Zimmerman et al., J. Immunol. 165:5839-46 (2000)). Миграция эозинофилов уменьшается на 70% в мыши с нокаутом эотаксина-1, которая, однако, все еще может развивать эозинофилию (Rothenberg et al., J. Exp. Med. 185: 785-90 (1997)). IL-5 является, по-видимому, ответственным за миграцию эозинофилов из костного мозга в кровь, а эотаксин - за локальную миграцию в ткани (Humbles et al., J. Exp. Med. 186: 601-12 (1997)).
Геном человека содержит 3 гена эотаксина, эотаксин 1-3. Они имеют 30% гомологию один относительно другого. Два гена известны до настоящего времени в мыши: эотаксин 1 и эотаксин 2 (Zimmerman et al., J. Immunol. 165:5839-46 (2000)). Они имеют 38% гомологию один относительно другого. Мышиный эотаксин-2 имеет 59% гомологию с эотаксином-2 человека. В мыши эотаксин-1, по-видимому, экспрессируется повсеместно в желудочно-кишечном тракте, тогда как эотаксин-2, по-видимому, преимущественно экспрессируется в тощей кишке (Zimmerman et al., J. Immunol. 165:5839-46 (2000)). Эотаксин-1 присутствует в бронхоальвеолярной жидкости (Teixeira et al., J. Clin. Invest. 100: 1657-66 (1997)). Эотаксин имеет молекулярную массу 8,3 кДа. Он находится в равновесии между мономерами и димерами на протяжении широкого диапазона состояний, причем приближенно определенная Kd равна 1,3 мМ при 37°С (Crump et al., J. Biol. Chem. 273: 22471-9 (1998)). Однако форма мономера является преобладающей. Структура эотаксина была выяснена ЯМР-спектроскопией. Сайт связывания с ее рецептором находится при N-конце, а район, предшествующий первому цистеину, является критическим (Crump et al., J. Biol. Chem. 273: 22471-9 (1998)). Пептиды рецепторов хемокинов, связанные с эотаксином, подтвердили это открытие. Эотаксин имеет четыре остатка цистеина, образующие два дисульфидных мостика. Таким образом, в одном варианте, композиция данного изобретения содержит аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта присоединения и, в одном варианте, слит с С-концом последовательности эотаксина. В следующих вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы белка, С-терминально (справа) от сигнального пептида. Гены, кодирующие эти специфические конструкции, могут быть клонированы в подходящем экспрессирующем векторе.
Эотаксин может быть синтезирован химически (Clark-Lewis et al., Biochemistry 30:3128-3135 (1991)). Экспрессия в E. coli была также описана для эотаксина-1, в цитоплазме (Crump et al., J. Biol. Chem. 273: 22471-9 (1998)). Экспрессия в E. coli в виде телец включения с последующим рефолдингом (Mayer et al., Biochemistry 39: 8382-95 (2000)), а экспрессия в клетках насекомых (Forssmann et al., J. Exp. Med. 185: 2171-6 (1997)) была описана для эотаксина-2 и может быть, кроме того, использована успешно в специфических вариантах данного изобретения.
Еще в одном конкретном варианте данного изобретения антигенной детерминантой является макрофагальный колониестимулирующий фактор (M-CSF или CSF-1). M-CSF или CSF-1 является регулятором пролиферации, дифференцировки и выживания макрофагов и их предшественников в костном мозгу. Рецептором для M-CSF является тирозинкиназный рецептор клеточной поверхности, кодируемый протоонкогеном cFMS. Повышенная экспрессия М-CSF и его рецептора была ассоциирована с плохим прогнозом в нескольких эпителиальных раках, таких как рак молочной железы, рак матки и рак яичника. Прогрессирование опухоли исследовали в штамме мышей, происходящем из скрещивания трансгенной мыши, восприимчивой к раку молочной железы (PyMT), с мышью, содержащей условно-летальную нуль-мутацию в гене csf-1. Эти мыши проявляют аттенуированную инвазивную карциному последней стадии и легочное метастазирование в сравнении с PyMT-мышью (Lin et al., J. Exp. Med. 193:727-739 (2001)). Причиной является, по-видимому, отсутствие рекрутинга макрофагов в неопластические ткани. Подкожный рост рака легкого Lewis также является ухудшенным в csf-1-нуль-мышах. Постулируется, что механизм усиления роста опухоли макрофагами работает через ангиогенные факторы, факторы роста и протеазы, продуцируемые макрофагами.
Доступными являются структурные данные относительно растворимой формы M-CSF (кристаллическая структура: Pandit et al., Science 258: 1358-62 (1992)), и они показывают, что и N-, и С-конец этого белка являются доступными. Однако N-конец находится близко к сайту взаимодействия с рецептором. Кроме того, M-CSF присутствует как в растворимой форме, так и в связанной с клеточной поверхностью форме, где трансмембранный район находится при его С-конце. Таким образом, определенные варианты данного изобретения содержат аминокислотный линкер, содержащий цистеин и, в одном варианте, добавленный на С-конце M-CSF, или его фрагменты, на С-конце растворимой формы M-CSF. В других вариантах аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка или растворимой формы этого белка, или встроен на N-конце последовательности зрелой формы белка или растворимой формы этого белка, С-терминально (справа) от сигнального пептида. M-CSF является димером, где два мономера связаны через межцепочечный дисульфидный мостик.
Экспрессионная система в E. coli была описана для N-концевого фрагмента из 149 аминокислот (функционального) M-CSF (Koths et al., Mol. Reprod. Dev. 46:31-37 (1997)). Этот фрагмент M-CSF, модифицированный, как описано выше, представляет одну антигенную детерминанту в соответствии с вариантами данного изобретения. Последовательность человека показана в Accession: NP_000748. Другие антигенные детерминанты данного изобретения содержат N-концевой фрагмент, содержащий остатки 33-181 или 33-185 указанной выше последовательности, соответствующий растворимой форме этого рецептора.
Мышиная последовательность показана в Accession: NP_031804. Зрелая последовательность начинается при аминокислоте 33. Таким образом, антигенная детерминанта в соответствии с данным изобретением содержит аминокислоты 33-181 или 33-185.
В одном варианте антигенной детерминантой является резистин (Res). Исследования пассивной иммунизации выполняли с кроличьими поликлональными антителами, генерированными против слитого белка мыши резистина (mRes), слитого с GST, экспрессируемого в бактериях. Эта пассивная иммунизация приводит к улучшенному поглощению глюкозы в модели животного ожирения/диабета типа II (Steppan et al., Nature 409: 307-12 (2001)).
Резистин (Res) является пептидным гормоном из 114 аминокислот с молекулярной массой приблизительно 12 кДа. Он содержит 11 цистеинов, из которых, как было показано, наиболее N-концевой является ответственным за димеризацию этого белка, а остальные 10, как считают, участвуют во внутримолекулярных дисульфидных связях (Banerjee and Lazar, J. Biol. Chem. 276: 25970-3 (2001)). Мутация первого цистеина в аланин устраняет димеризацию mRes.
mRes с меткой FLAG на его С-конце остается активным в модели животного (Steppan et al., Nature 409: 307-12 (2001)). Подобным образом, как было показано, меченая на С-конце (гемагглютининовой меткой) версия резистина является активной в анализе на культуре ткани (Kim et al., J. Biol. Chem. 276: 11252-6 (2001)). Таким образом, в одном варианте данные композиции содержат аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта присоединения и слитый на С-конце последовательности резистина. В другом варианте аминокислотный линкер, содержащий цистеин, слит с N-концом последовательности, соответствующей последовательности процессированного белка, или встроен на N-конце последовательности зрелой формы этого белка, С-терминально (справа) от сигнального пептида.
В одном варианте данного изобретения mRes или huRes могут также экспрессироваться в виде слитых с Fc молекул с сайтом расщепления протеазы, встроенным между резистином и Fc-частью этой конструкции, например, С-терминально относительно одного или нескольких остатков цистеина шарнирной области Fc-части этого слитого белка в эукариотической системе экспрессии, или так, как описано здесь. Расщепление этого слитого белка высвобождает резистин, содержащий дополнительно либо аминокислотный линкер, содержащий остаток цистеина, либо часть шарнирной области или всю шарнирную область Fc-части слитого белка, которая содержит остаток цистеина на ее С-конце, который пригоден для связывания с VLP АР205. Последовательность резистина человека показана в последовательности Accession AF323081. Мышиная последовательность показана в последовательности Accession AF323080. Предпочтительным вариантом данного изобретения является белок резистина человека, слитый на его С-конце с аминокислотным линкером, содержащим остаток цистеина. Конструкция резистина человека может быть получена в соответствии с приведенными здесь описаниями и сравнением последовательностей мышиного и человеческого резистина в сопоставлении белковых последовательностей для идентификации части последовательности человеческого резистина для клонирования в описанные здесь векторы или в другие подходящие экспрессирующие векторы. Примерами конструкций человеческого резистина, подходящих для генерирования композиций данного изобретения, являются человеческий резистин-С-Ха, человеческий резистин-С-ЕК и человеческий резистин-С.
Конструкции резистина человека, полученные таким образом, являются одним из вариантов данного изобретения. Таким образом, вакцинация против резистина с использованием вышеуказанных композиций данного изобретения может обеспечивать способ лечения диабета типа II и ожирения.
В другом варианте антигенной детерминантой является лимфотоксин-β. Иммунизация против лимфотоксина-β может быть применима в опосредованном прионами заболевании. Прионы являются клеточными белками, существующими в большинстве видов млекопитающих. Прионовые белки существуют в двух формах: нормально уложенной форме, которая обычно присутствует в здоровых индивидуумах (PrPc), и неправильно уложенной форме, которая вызывает заболевание (PrpSc). Существующая в настоящее время гипотеза прионов постулирует, что неправильно уложенная форма приона PrpSc может катализировать рефолдинг здорового приона PrPc в вызывающий заболевание PrpSc (A. Aguzzi, Haematologica 85, 3-10 (2000)). В некоторых редких случаях этот переход может также происходить спонтанно, вызывая классическую CJD (болезнь Крейтцфельда-Якоба) у людей. Некоторые мутации в PrPc связаны с увеличением этого спонтанного перехода и вызывают различные формы семейной болезни CJD. Однако PrpSc может быть также инфекционным и может передаваться переливанием крови или через пищевую цепь. Последняя форма опосредованного прионами заболевания известна как Куру-Куру и обычно встречается у каннибалов. Однако, поскольку виды, которые поедают их собственных индивидуумов, не являются широко представленными, эта форма перорально передаваемого заболевания была слишком редкой для документации для других видов.
Огромный масштаб употребления в пищу коровьего мяса с продуктами из говядины по всей Европе изменил эту ситуацию, и количество коров, инфицированных трансмиссивной формой вызывающего коровью губчатую энцефалопатию (BSE) PrpSc, разительно увеличилось в последние годы, что привело к поражению сотен тысяч коров. Это неожиданное появление огромных количеств заболевших BSE коров вызвало большое опасение у людей, что сходное заболевание может быть также индуцировано у людей. Действительно, в 1996 году был сообщен первый случай вариантной формы CJD, который мог быть приписан употреблению инфицированного PrpSc мяса. К настоящему времени это опасение дополнительно увеличилось, так как количество инфицированных людей постоянно увеличивалось во время последующих лет в отсутствие каких-либо способов лечения. Кроме того, поскольку овцы поддаются опосредованной прионами болезни, называемой скрепи, и поскольку другие виды млекопитающих могут быть инфицированы PrpSc, возможным является то, что BSE-подобные заболевания могут также встречаться и в других видах.
Считается, что репликация агента скрепи (опосредованной прионами болезни) в основном происходит в лимфоидных тканях, и было показано, что она зависит от экспрессирующих белок прион фолликулярных дендритных клеток (FDC) (Brown et al., Nature Med. 11: 1308-1312 (1999)). Механизм передачи прионов был исследован подробно. В настоящее время ясно, что прионы сначала размножаются в лимфоидных органах инфицированной мыши и затем транспортируются в центральную нервную систему. Было показано, что мыши, лишенные функциональных фолликулярных дендритных клеток, обнаруживают нарушенную репликацию прионов в селезенке и (небольшую) задержку нейроинвазии (Montrasio et al., Science 288: 1257-1259 (2000)). Это достигалось инъецированием мышей слитым белком (растворимый рецептор лимфотоксина-β-Fc (LTβR-Fc)). Эта конструкция растворимого рецептора ингибирует развитие FDC вмешательством в решающее взаимодействие лимфотоксина-β на Т-, В- или NK-клетках с рецептором лимфотоксина-β на клетках-предшественниках FDC. FDC являются слабо изученным типом клеток, но в настоящее время ясно, что эти клетки зависят от продуцирования лимфотоксина и/или TNF В-клетками для их развития (F. Mackay, J.L. Browning, Nature 395, 26-27 (1998)). Действительно, мыши, лишенные лимфотоксина, не обнаруживают FDC (M.S. Matsumoto et al., Science 264, 703-707 (1996)). Кроме FDC, антитела могут также играть роль в прогрессировании заболевания (S. Brandner, M.A. Klein, A. Aguzzi, Transfus Clin Biol 6, 17-23 (1999)).
Таким образом, вакцинация против лимфотоксина-β (также называемого TNFγ), LTα- или LTβ-рецептора, тем самым элиминация FDC из лимфоидных органов, может обеспечивать вакцину для лечения или профилактики болезни Крейтцфельда-Якоба (вариантной формы) или других опосредованных прионами болезней, таких как коровья губчатая энцефалопатия (BSE), и, следовательно, предотвращать репликацию и нейроинвазию прионов.
Иммунизация против лимфотоксина-β может также обеспечить способ лечения диабета. Трансгенная экспрессия слитого белка (растворимый LTβR-Fc) в не имеющих ожирения диабетических мышах NOD ингибировала развитие диабета, но не инсулита (Ettinger et al., J. Exp. Med. 193: 1333-40 К (2001)). Wu et al., (J. Exp. Med. 193: 1327-32 (2001)) также использовали мышей NOD для исследования участия лимфотоксина-β, но вместо трансгенных животных они действительно инъецировали слитый белок LTβR-Fc. Они наблюдали сильное ингибирование развития диабета и ингибирование инсулита. Наиболее интересно то, что они смогли даже обратить предсуществующий инсулит с использованием для лечения этого слитого белка. Таким образом, в поджелудочной железе удалось обратить образование лимфоидных фолликулярных структур. Таким образом, вакцинация против лимфотоксина-β может обеспечить способ лечения диабета типа I.
В одном варианте композиция данного изобретения содержит аминокислотный линкер, содержащий цистеин и добавленный к N-концу последовательности, соответствующей процессированной форме лимфотоксина-β, или встроенный между N-концом последовательности, соответствующей зрелой форме этого белка, и сигнальным пептидом, С-терминально (справа) относительно сигнального пептида. В родственных вариантах данного изобретения внеклеточная часть лимфотоксина-β экспрессируется в виде слитого белка либо с глутатион-S-трансферазой, слитой N-терминально относительно лимфотоксина-β, либо с меткой из 6 гистидинов, за которой следует myc-метка, слитая опять N-терминально относительно внеклеточной части лимфотоксина-β. Аминокислотный спейсер, содержащий сайт расщепления протеазы, а также линкерную последовательность, содержащую цистеин в качестве сайта присоединения, С-терминально относительно сайта расщепления протеазы, сливают с N-концом последовательности внеклеточной части лимфотоксина-β. В одном варианте внеклеточная часть лимфотоксина-β состоит из фрагментов, соответствующих аминокислотам 49-306 или 126-306 лимфотоксина-β. Эти специфические композиции данного изобретения могут быть клонированы и экспрессированы в эукариотическом векторе рСЕР-Pu. В некоторых вариантах композиции данного изобретения содержат аминокислотный линкер, содержащий остаток цистеина, подходящий в качестве второго сайта присоединения и слитый с С-концом лимфотоксина-β или фрагментов лимфотоксина-β. В особенно предпочтительном варианте аминокислотную последовательность LACGG, содержащую аминокислотный линкер ACGG, который сам содержит остаток цистеина для связывания с VLP АР205, сливают с N-концом внеклеточной части лимфотоксина-β или фрагмента внеклеточной части лимфотоксина-β с получением белков С-LTβ49-306 человека и С-LTβ126-306 человека после расщепления энтерокиназой соответствующих слитых белков, экспрессируемых в векторе рСЕР-SP-GST-EK или векторе pCP-SP-his-myc-EK.
В одном варианте антигеном или антигенной детерминантой является прионовый белок, его фрагменты и, в частности, пептиды прионового белка. В варианте данного изобретения антигенной детерминантой является прионовый белок или его фрагменты. Иммунизация против прионового белка может обеспечивать способ лечения или профилактики болезни Крейтцфельда-Якоба (вариантной формы) или других опосредованных прионами болезней. Мышиные пептиды, соответствующие фрагментам мышиного прионового белка и последовательности CSAMSRPMIHFGNDWEDRYYRENMYR (SEQ ID NO:17) ("cprplong") и CGNDWEDRYYRENMYR ("cprpshort") (SEQ ID NO:18), содержат добавленный N-концевой остаток цистеина для химического связывания с VLP АР205 и приводят к одному из вариантов данного изобретения. В одном варианте прионовый белок является частью прионового белка человека. Руководство в отношении того, как модифицировать прионовый белок человека для ассоциации с VLP АР205, дается на протяжении этой заявки. Описаны конструкции мышиного прионового белка и могут быть получены конструкции прионового белка человека. Дополнительные конструкции содержат полноразмерную последовательность прионового белка человека и другие фрагменты прионового белка человека, которые являются следующими композициями данного изобретения. Иммунизация против прионового белка может обеспечивать способ лечения или профилактики болезни Крейтцфельда-Якоба (вариантной формы) или других опосредованных прионами болезней. Иммунизация с использованием композиций данного изобретения, содержащих прионовый белок, может обеспечить способ лечения опосредованных прионами заболеваний в других животных. Пептиды прионового белка человека, соответствующие фрагментам мышиного прионового белка, описанным выше, и аминокислотной последовательности CSAMSRPIIHFGSDYEDRYYRENMHR ("cprplong человека") (SEQ ID NO:19) и CGSDYEDRYYRENMHR ("cprpshort человека") (SEQ ID NO:20), приводят к вариантам данного изобретения. Эти пептиды содержат N-концевой остаток цистеина, добавленный для связывания с VLP АР205. Соответствующие пептиды коровы и овцы представляют собой CSAMSRPLIHFGNDYEDRYYRENMHR ("cprplong коровы") (SEQ ID NO:21) и CGNDYEDRYYRENMHR ("cprpshort коровы") (SEQ ID NO:22), CSAMSRPLIHFGNDYEDRYYRENMYR ("cprplong овцы") (SEQ ID NO:23) и CGNDYEDRYYRENMYR ("cprpshort овцы") (SEQ ID NO:24), все приводящие к вариантам данного изобретения.
В одном варианте данного изобретения антигенной детерминантой является фактор α некроза опухолей (TNF-α), его фрагменты или пептиды TNF-α. В частности, пептиды или фрагменты TNF-α могут быть использованы для индукции аутоантигенспецифической иммунной реакции, направленной против целого белка, иммунизацией человека или животного вакцинами и композициями, соответственно, содержащими такие пептиды или фрагменты, в соответствии с данным изобретением. Следующие мышиные пептиды являются мышиными гомологами пептидов человека, которые, как было показано, связываются антителами, нейтрализующими активность TNF-α (Yone et al., J. Biol. Chem. 270: 19509-19515), и они были, в другом варианте данного изобретения, модифицированы остатками цистеина для связывания с VLP АР205.
Пептид MuTNFα; последовательность CGG была добавлена на N-конце эпитопа, состоящего из аминокислотных остатков 22-32 зрелого мышиного TNF-α, с образованием последовательности: CGGVEEQLEWLSQR (SEQ ID NO:25).
Пептид 3'TNF II; последовательность GGC была слита на С-конце эпитопа, состоящего из аминокислотных остатков 4-22 зрелого мышиного TNF-α, и глутамин 21 был мутирован в глицин. Последовательность полученного пептида является следующей: SSQNSSDKPVAHVVANHGVGGC (SEQ ID NO:26).
Пептид 5'TNF II; остаток цистеина был слит с N-концом эпитопа, состоящего из аминокислотных остатков 4-22 зрелого мышиного TNF-α, и глутамин 21 был мутирован в глицин. Последовательность полученного пептида является следующей: CSSQNSSDKPVAHVVANHGV (SEQ ID NO:27).
Соответствующая последовательность эпитопа 4-22 человека является следующей: SSRTPSDKPVAHVVANPQAEGQ (SEQ ID NO:28). Как и в случае мышиной последовательности, цистеин, в одном варианте, слит на N-конце этого эпитопа, или последовательность GGC слита на С-конце этого эпитопа для ковалентного связывания с VLP АР205 в соответствии с данным изобретением. Однако в рамках данного изобретения находится и то, что другие цистеинсодержащие последовательности слиты на N- или С-концах этих эпитопов. Обычно один или два остатка глицина встроены, в одном варианте, между добавленным остатком цистеина и этой последовательностью эпитопа. Однако другие аминокислоты могут быть также встроены вместо остатков глицина, и эти аминокислотные остатки включают в себя небольшие аминокислоты, такие как серин.
В следующем предпочтительном варианте композиции данного изобретения антигеном или антигенной детерминантой является фактор α некроза опухолей (TNF-α), его фрагменты или мутеины или пептиды TNF-α или их фрагменты или мутеины, где указанный антиген или антигенная детерминанта с указанным вторым сайтом присоединения имеет аминокислотную последовательность, выбранную из группы, состоящей из а) аминокислотной последовательности CSSRTPSDKPVAHVVANPQAEGQ (SEQ ID NO:100); b) аминокислотной последовательности SSRTPSDKPVAHVVANPQAEGQGGC (SEQ ID NO:101) и с) аминокислотной последовательности CGGQLQWLNRRANA (SEQ ID NO:102).
Последовательность человека, соответствующая аминокислотным остаткам 22-32, является QLQWLNRRANA (SEQ ID NO:29). В одном родственном варианте последовательность CGG слита на N-конце эпитопа для ковалентного связывания с VLP АР205 в соответствии с данным изобретением. Были описаны другие эпитопы TNF-α для применения в данном изобретении, они описаны, например, Yone et al. (J. Biol. Chem. 270: 19509-19515). Далее, данное изобретение включает в себя композиции, которые содержат мимотопы антигенов или антигенных детерминант, описанных здесь.
Одна конкретная композиция данного изобретения содержит антитело или фрагмент антитела, представленный на вирусоподобной частице, для индукции иммунной реакции против этого антитела. В одном варианте антитела или фрагменты антител, которые продуцируются клетками лимфомы, выбирают для присоединения к вирусоподобной частице для иммунизации для индукции защитной иммунной реакции против лимфомы.
В других дополнительных вариантах антитело или фрагмент антитела, имитирующие антиген, присоединяют к VLP АР205. Это имитирующее антитело или имитирующий фрагмент антитела генерируют иммунизацией и последующим выделением имитирующего антитела или фрагмента антитела или любым известным в данной области способом, таким как, например, гибридомная технология (Gherardi, E. et al., J. Immunol. Methods 126: 61-68 (1990)), фаговый дисплей (Harrison et al., Methods Enzymol. 267: 83-109 (1996)), рибосомный дисплей (Hanes, J. et al., Nat. Biotechnol. 18: 1287-1292 (2000), дрожжевой двухгибридный скрининг (Visintin, M. et al., Proc. Natl. Acad. Sci. USA 96: 11723-11728 (1999)), дисплей поверхности дрожжей (Boder, ET. & Wittrup, KD. Methods. Enzym. 328: 430-444 (2000)), дисплей бактериальной поверхности (Daugherty, PS. et al., Protein Eng. 12:613-621 (1999)). Имитирующее антитело может быть также выделено из библиотеки антител или библиотеки "необученных" антител с использованием известных в данной области способов.
В следующем варианте используют антитело, узнающее антигенсвязывающий сайт другого антитела, т.е. антиидиотипическое антитело, далее называемое иммунизирующим антителом. Антитело, узнаваемое антиидиотипическим антителом, будет далее называться нейтрализующим антителом. Таким образом, посредством иммунизации против антиидиотипического антитела получают in situ молекулы со специфичностью нейтрализующего антитела; авторы будут называть в дальнейшем эти генерируемые антитела индуцированными антителами. В другом варианте иммунизирующее антитело выбирают таким образом, что оно взаимодействует с молекулой-лигандом молекулы-мишени, против которой проводят иммунизацию. Молекулой-лигандом может быть любая молекула, взаимодействующая с молекулой-мишенью, но, в одном варианте, она будет предпочтительно взаимодействовать с сайтом молекулы-мишени, против которой должны быть генерированы антитела для ингибирования ее функции. Молекула-лиганд может быть природным лигандом молекулы-мишени или может быть любым полученным генной инженерией, сконструированным или выделенным лигандом, имеющим подходящие связывающие свойства.
Иммунизирующие антитела могут происходить из человека, например могут быть выделены из библиотеки "необученных" или иммунных антител человека, или могут быть выделены из библиотеки, генерированной из другого животного источника, например из мыши.
Связывание антитела или фрагмента антитела с VLP АР205 достигается либо ограниченным восстановлением открытых дисульфидных мостиков (например, межцепочечного дисульфидного мостика между СН1 и Сκ или Сλ в Fab-фрагменте), либо, в другом варианте, слиянием линкера, содержащего остаток цистеина на С-конце антитела или фрагмента антитела. В следующем варианте линкер, содержащий остаток цистеина, слит с N-концом антитела или фрагмента антитела для присоединения к VLP или белку пилуса (фимбрии).
Ряд вакцинных композиций, которые используют мимотопы, известны в данной области, как и способы генерирования и идентификации мимотопов конкретных эпитопов. Например, статья Arnon et al., Immunology 101:555-562 (2000), полное описание которой включено здесь в качестве ссылки, описывает вакцины на основе пептида-мимотопа против Schistosoma mansoni. Мимотопы, используемые в этих вакцинах, получали скринингом твердофазной библиотеки 8-мерных случайных пептидов для идентификации мимотопов эпитопа, узнаваемого защитным моноклональным антителом против Schistosoma mansoni. Подобным образом, работа Olszewska et al., Virology 272:98-105 (2000), полное описание которой включено здесь в качестве ссылки, описывает f-мышей. Кроме того, работа Zuercher et al., Eur. J. Immunol. 30:128-135 (2000), полное описание которой включено здесь в качестве ссылки, описывает композиции и способы для пероральной анти-IgE-иммунизации с использованием эпитоппредставляющего фага. В частности, эпитоппредставляющие бактериофаги М13 используют в качестве носителей для пероральной анти-IgE-вакцины. Испытанные вакцинные композиции содержат мимотопы и эпитопы моноклонального анти-IgE-антитела BSW17.
Варианты данного изобретения включают в себя вакцинные композиции, которые содержат мимотопы, которые индуцируют иммунологические реакции против конкретных антигенов, а также конъюгаты индивидуальный мимотоп/VLP АР205, из которых готовят эти вакцинные композиции, и использование этих вакцинных композиций для индукции иммунологических реакций против специфических антигенов или антигенных детерминант. Мимотопы могут быть также полипептидами, такими как антиидиотипические антитела. Таким образом, в следующем варианте данного изобретения антигеном или антигенной детерминантой является антиидиотипическое антитело или фрагмент антиидиотипического антитела.
Далее, данное изобретение включает в себя композиции, которые содержат мимотопы антигенов или антигенных детерминант, описанные здесь.
Мимотопы конкретных антигенов могут быть получены и идентифицированы любым рядом способов, включающих в себя скрининг библиотек фагового диплея (представления) случайных пептидов (см., например, WO 97/31948, полное описание которого включено здесь в качестве ссылки). Скрининг таких библиотек часто выполняют для идентификации пептидов, которые связываются с одним или несколькими антителами, имеющими специфичность в отношении конкретного антигена.
Мимотопы, подходящие для использования в вакцинных композициях данного изобретения, могут быть линейными или кольцевыми пептидами. Мимотопы, которые являются линейными или кольцевыми пептидами, могут быть связаны с неприродными молекулярными каркасами или частицами кора ("сердцевины") и VLP, соответственно, посредством связи, которая не является пептидной связью.
Как предполагалось выше, были идентифицированы ряд IgE-мимотопов и эпитопов человека, которые индуцируют иммунологические реакции против IgE-молекул человека (см., например, WO 97/31948). Таким образом, в некоторых вариантах вакцинные композиции данного изобретения включают в себя композиции, которые индуцируют иммунологическую реакцию против молекул иммуноглобулинов (например, IgE-молекул).
Пептиды, которые могут быть использованы для индукции таких иммунологических реакций, включают в себя белки, субъединицы белков, домены молекул IgE и мимотопы, которые способны индуцировать продуцирование антител, имеющих специфичность в отношении молекул IgE. Обычно части молекул IgE, используемых для приготовления вакцинных композиций, будут происходить из молекул IgE видов, в которые эта композиция должна вводиться. Например, вакцинная композиция, предназначенная для введения в людей, часто будет содержать одну или несколько частей молекулы IgE человека и/или один или несколько мимотопов, которые способны индуцировать иммунологические реакции против молекул IgE человека.
В конкретных вариантах вакцинные композиции данного изобретения, предназначенные для введения людям, будут содержать по меньшей мере одну часть константной области тяжелой цепи IgE, представленную в ACCESSION No. AAB59424. В более конкретных вариантах пептиды IgE, используемые для приготовления вакцинных композиций данного изобретения, содержат, или альтернативно состоят из них, пептиды, имеющие следующие аминокислотные последовательности: CGGVNLTWSRASG (SEQ ID NO:30).
В дополнительных конкретных вариантах, вакцинные композиции данного изобретения будут содержать по меньшей мере один мимотоп, способный вызывать иммунную реакцию, которая приводит к продуцированию антител, имеющих специфичность в отношении конкретного антигена. Примеры мимотопов IgE, подходящих для использования в приготовлении вакцинных композиций данного изобретения, включают в себя пептиды, имеющие следующие аминокислотные последовательности:
Получение вакцин и иммуногенов
VLP бактериофага АР205 применимы в генерировании вакцинных конструкций и придании присоединенным к ним антигенам высокой иммуногенности. Данное изобретение относится к способам присоединения антигенов к VLP АР205. В одном варианте антиген присоединяют к VLP посредством химического сшивания с использованием гетеробифункционального сшивающего агента. В данной области известны несколько гетеробифункциональных сшивающих линкеров. В некоторых вариантах этот гетеробифункциональный сшивающий линкер содержит функциональную группу, которая может реагировать с аминогруппой боковой цепи остатков лизина VLP, и функциональную группу, которая может реагировать с остатком цистеина, природно присутствующим, сделанным доступным для реакции посредством восстановления или сконструированным на антигене и необязательно сделанным доступным для реакции посредством восстановления. Первой стадией этой процедуры, называемой дериватизацией, является реакция VLP со сшивающим агентом. Продукт этой реакции является активированной VLP, также называемой активированным носителем. Во второй стадии непрореагировавший сшивающий линкер удаляют при помощи обычных способов, таких как гель-фильтрация или диализ. В третьей стадии антиген реагирует с активированными VLP, и эту стадию называют стадией сопряжения. Непрореагировавший антиген может необязательно удаляться в четвертой стадии. Несколько гетеро-бифункциональных сшивающих линкеров известны в данной области. Они включают в себя сшивающие линкеры SMPH (Pierce), Sulfo-MBS, Sulfo-EMCS, Sulfo-GMBS, Sulfo-SIAB, Sulfo-SMPB, Sulfo-SMCC, SVSB, SIA и другие сшивающие линкеры, например, из Pierce Chemical Company (Rockford, IL, USA), и имеющие одну функциональную группу, реактивную в отношении аминогрупп, и одну функциональную группу, реактивную в отношении остатков цистеина. Все вышеуказанные сшивающие линкеры приводят к образованию простой тиоэфирной связи. Другой класс сшивающих линкеров, подходящих для применения на практике данного изобретения, характеризуется введением дисульфидной связи между антигеном и VLP после связывания. Сшивающие линкеры, принадлежащие к этому классу, включают в себя, например, SPDP и Sulfo-LC-SPDP (Pierce). На степень дериватизации VLP сшивающим линкером могут влиять варьирующие экспериментальные условия, такие как концентрация каждого из партнеров реакции, избыток одного реагента над другим, рН, температура и ионная сила, как хорошо известно из теории реакций в области органической химии. Степень связывания, т.е. количество антигенов на субъединицы VLP АР205, может корректироваться варьированием описанных выше экспериментальных условий таким образом, чтобы эти условия согласовались с требованиями вакцины. Растворимость антигена может производить ограничение количества антигена, которое может быть связано на каждой субъединице, и в тех случаях, в которых полученная вакцина является нерастворимой, предпочтительным является уменьшение количества антигена на субъединицу.
Одним из способов присоединения антигенов к VLP АР205 является связывание остатков лизина на поверхности VLP АР205 с остатком цистеина на антигене. В некоторых вариантах требуется конструирование аминокислотного линкера, содержащего остаток цистеина, для связывания антигена с VLP АР205. Альтернативно, цистеин может быть введен либо инсерцией, либо мутацией в антигене.
В предпочтительном варианте данного изобретения композиция содержит аминокислотный линкер. Предпочтительно указанный аминокислотный линкер связан по меньшей мере с одним антигеном, одной аминокислотной детерминантой и органической молекулой, соответственно, посредством по меньшей мере одной ковалентной связи. Выбор аминокислотного линкера будет зависеть от природы антигена, от его биохимических свойств, таких как pI, распределение заряда или гликозилирование. Обычно предпочтительными вариантами являются гибкие аминокислотные линкеры. Примерами аминокислотных линкеров являются шарнирная область иммуноглобулинов, глицин-сериновые линкеры (GGGGS)n (SEQ ID NO:49) и глициновые линкеры (G)n, все дополнительно содержащие остаток цистеина в качестве второго сайта присоединения и необязательно дополнительные остатки глицина. Далее приведены примеры таких аминокислотных линкеров:
N-концевой гамма 1: CGDKTHTSPP (SEQ ID NO:50)
С-концевой гамма 1: DKTHTSPPCG (SEQ ID NO:51)
N-концевой гамма 3: CGPKPSTPPGSSGGAP (SEQ ID NO:52)
С-концевой гамма 3: PKPSTPPGSSGGAPGGCG (SEQ ID NO:53)
N-концевой глициновый линкер: GCGGGG (SEQ ID NO:54)
С-концевой глициновый линкер: GGGGCG (SEQ ID NO:55)
С-концевой глицин-лизиновый линкер: GGKKGC (SEQ ID NO:56)
N-концевой глицин-лизиновый линкер: CGKKGG (SEQ ID NO:57)
Показано, что для пептидов применимы линкеры GGCG (SEQ ID NO:58), GGC или GGC-NH2 (NH2 обозначает амидирование) на С-конце пептида или CGG на N-конце. В некоторых вариантах остатки глицина будут встроены между объемными аминокислотами и цистеином, используемым в качестве второго сайта присоединения.
Предпочтительные варианты аминокислотного линкера выбраны из группы, состоящей из (а) CGG; (b) N-концевого гамма 1-линкера; (с) N-концевого гамма 3-линкера; (d) шарнирных областей Ig; (е) N-концевых глициновых линкеров; (f) (G)kC(G)n c n=0-12 и k=0-5 (SEQ ID NO:93); (g) N-концевых глицин-сериновых линкеров; (h) (G)kC(G)m(S)l(GGGGS)n с с n=0-3, k=0-5, m=0-10, l=0-2 (SEQ ID NO:94); (i) GGC; (k) GGC-NH2; (l) C-концевого гамма-1 линкера; (m) С-концевого гамма 3-линкера; (n) С-концевых глициновых линкеров; (о) (G)nC(G)k с n=0-12 и k=0-5 (SEQ ID NO:95); (р) С-концевых глицин-сериновых линкеров; (q) (G)m(S)l(GGGGS)n(G)oC(G)k с n=0-3, k=0-5, m=0-10, l=0-2 и o=0-8 (SEQ ID NO:96).
В некоторых вариантах антиген или антигенная детерминанта содержит единственный второй сайт присоединения или единственный реакционноспособный сайт присоединения, способный к ассоциации с первыми сайтами присоединения на VLP АР205 или субъединицах VLP соответственно. Это гарантирует определенное и однородное связывание и ассоциацию, соответственно, по меньшей мере одного, но обычно более чем одного, предпочтительно более чем 10, 20, 40, 80, 120 антигенов с VLP АР205. Таким образом, обеспечение единственного второго сайта присоединения или единственного реакционноспособного сайта на антигене гарантирует единственный и однородный тип связывания и ассоциации, соответственно, приводя к очень высоко упорядоченному и повторяющемуся массиву. Например, если связывание и ассоциация, соответственно, выполняется посредством взаимодействия лизина (в качестве первого сайта присоединения) и цистеина (в качестве второго сайта присоединения), это гарантирует, в соответствии с этим предпочтительным вариантом данного изобретения, что только один остаток цистеина на антиген, независимо от того, присутствует ли этот остаток цистеина природно или неприродно, способен связываться и ассоциироваться, соответственно, с VLP АР205 и первым сайтом присоединения VLP АР205, соответственно.
Остаток цистеина, присутствующий на антигене, должен находиться в его восстановленном состоянии для реакции с гетеро-бифункциональным сшивающим линкером на активированной VLP, т.е. должен быть доступен свободный цистеин или остаток цистеина со свободной сульфгидрильной группой. В том случае, когда остаток цистеина, для функционирования в качестве второго сайта присоединения, находится в окисленной форме, например, если он образует дисульфидный мостик, требуется восстановление этого дисульфидного мостика, например, при помощи DTT, TCEP или β-меркаптоэтанола.
Присоединение антигена к VLP АР205 с использованием гетеро-бифункционального сшивающего агента в соответствии с описанным выше способом делает возможным связывание антигена с VLP АР205 ориентированным образом. Другие способы связывания антигена с VLP АР205 включают в себя способы, в которых антиген сшивают с VLP АР205 с использованием карбодиимида EDC и NHS. Антиген или антигенная детерминанта могут быть также сначала тиолированы посредством реакции, например, с SATA, SATP или иминотиоланом. Затем антиген и антигенная детерминанта, после удаления защитных групп, если это необходимо, могут быть связаны с VLP АР205 следующим образом. После отделения избытка агента тиолирования антигену или антигенной детерминанте дают реагировать с VLP АР205, предварительно активированными гетеро-бифункциональным сшивающим линкером, содержащим цистеиновую реактивную часть молекулы, и, следовательно, выставляющими по меньшей мере одну или несколько функциональных групп, реактивных в отношении остатков цистеина, с которыми тиолированный антиген или тиолированная антигенная детерминанта могут реагировать, как описано выше. Необязательно низкие количества восстанавливающего агента включают в эту реакционную смесь. В других способах антиген присоединяют к VLP АР205 с использованием гомо-бифункционального сшивающего линкера, такого как глутаровый альдегид, DSG, BM[PEO]4, BS3 (Pierce Chemical Company, Rockford, IL, USA), или другие известные гомо-бифункциональные линкеры с функциональными группами, реактивными в отношении аминогрупп или карбоксильных групп VLP АР205.
В следующем варианте антиген или антигенную детерминанту связывают с VLP АР205 посредством модификации углеводных частей молекулы на гликозилированном антигене или на гликозилированной антигенной детерминанте и последующей реакции с VLP АР205. В одном варианте гликозилированный антиген или гликозилированная антигенная детерминанта реагирует с периодатом натрия в условиях мягкого окисления углеводной части с образованием активированного антигена или активированной антигенной детерминанты с одной или несколькими альдегидными функциональными группами. Активированные таким образом антиген или антигенную детерминанту отделяют от избытка периодата натрия и дают им дополнительно взаимодействовать с VLP АР205, где остатки лизина VLP АР205 или по меньшей мере одной из субъединиц VLP АР205 взаимодействуют с предварительно образованной альдегидной функциональной группой на антигене или антигенной детерминанте, например, как описано Hermanson, G.T. in Bioconjugate Techniques, Academic Press Inc., San Diego, CA, USA. Самополимеризация активированного антигена или антигенной детерминанты может регулироваться коррекцией рН, как описано в вышеуказанной публикации. Образованное основание Шиффа предпочтительно дополнительно восстанавливают цианоборогидридом натрия, который затем удаляют гель-фильтрацией или диализом. Альтернативно, карбоксильные группы VLP АР205 или по меньшей мере одной из субъединиц VLP АР205 могут взаимодействовать с EDC и дигидразидом, таким как дигидразид адипиновой кислоты, с образованием гидразидной части, доступной для реакции с одной или несколькими альдегидными функциональными группами, присутствующими на активированном антигене или антигенной детерминанте. Образованный таким образом гидразон может быть дополнительно восстановлен цианоборогидридом натрия. Альтернативно, активированные антиген или антигенная детерминанта с одной или несколькими альдегидными функциональными группами взаимодействуют с цистеамином, что приводит к введению цистеиновой группы в антиген или антигенную детерминанту. Дополнительные способы сшивания и сшивающие линкеры, подходящие для связывания антигена или антигенной детерминанты с VLP АР205, а также руководство к выполнению реакций связывания и применению химических сшивающих линкеров и процедур химического сшивания могут быть найдены в Hermanson, G.T. in Bioconjugate Techniques, Academic Press Inc., San Diego, CA, USA.
Другие способы связывания VLP с антигеном включают в себя способы, в которых VLP биотинилируют, а антиген экспрессируют в виде слитого со стрептавидином белка, или способы, в которых как антиген, так и VLP биотинилируют. В этом случае антиген может быть сначала связан со стрептавидином или авидином коррекцией отношения антигена к стрептавидину таким образом, что свободные сайты связывания являются все еще доступными для связывания VLP, которые добавляют на следующей стадии. Альтернативно, все компоненты могут быть смешаны в реакции "в одном сосуде". Другие пары лиганд-рецептор, где доступна растворимая форма рецептора и лиганда и они способны сшиваться с VLP или антигеном, могут быть использованы в качестве связывающих агентов для связывания антигена с VLP. В предпочтительном варианте данного изобретения указанные первый и/или второй сайты присоединения выбраны из группы, состоящей из (а) антигена и антитела или фрагмента антитела; (b) биотина и авидина; стрептавидина и биотина; (с) рецептора и его лиганда; (d) лигандсвязывающего белка и его лиганда; (е) взаимодействия полипептидов лейциновой молнии; (f) аминогруппы и химической группы, реагирующей с ней; (g) карбоксильной группы и химической группы, реагирующей с ней; (h) сульфгидрильной группы и химической группы, реагирующей с ней, и (i) их комбинации.
Иммунные реакции
Природа и тип иммунной реакции не является ограничивающим фактором данного описания. Желаемый результат терапевтической или профилактической иммунной реакции может варьироваться в соответствии с конкретным заболеванием, в соответствии с принципами, хорошо известными в данной области. Например, иммунная реакция против иммунного агента может полностью предотвращать колонизацию и репликацию инфекционного агента, вызывая "стерильный иммунитет" и отсутствие каких-либо симптомов заболевания. Однако вакцина против инфекционного агента может считаться эффективной, если она уменьшает количество, тяжесть или продолжительность симптомов или уменьшает трансмиссию инфекционного агента. Подобным образом, иммунные реакции против рака, аллергенов или аутоантигенов могут полностью излечивать заболевание, могут ослаблять симптомы или могут быть одним аспектом в общем терапевтическом вмешательстве против заболевания. Например, стимуляция иммунной реакции против рака может быть связана с хирургическим, химиотерапевтическим, радиологическим, гормональным и другими иммунологическими подходами для осуществления лечения.
Кроме того, может быть желательной стимуляция различных типов иммунной реакции в зависимости от конкретного заболевания и в соответствии с принципами, известными в данной области. Например, хорошо известно, что некоторые иммунные реакции являются более подходящими для конкретного антигена, чем другие иммунные реакции. Некоторые иммунные реакции, действительно, являются неподходящими и могут вызывать патологию, например патологическое воспаление в ответ на инфекцию, аллергии и аутоиммунное заболевание, описанные здесь далее. В то время как определенные специфические иммунные реакции являются нежелательными, данное изобретение стимулирует иммунные реакции в направлении терапевтических и профилактических задач. Следующий конкретный вариант данного изобретения включает в себя индуцирование иммунной реакции, способной противодействовать эффектам патологической иммунной реакции.
На характер иммунной реакции может влиять природа антигена, способ введения в тело, доза, схема введения доз, повторяющаяся природа антигена, генетический фон хозяина и факторы передачи сигналов иммунной системы. Такая информация хорошо известна в данной области. Иммунная реакция, сама по себе, может быть приспособлена по желанию с использованием как известной в данной области теории, так и рутинного экспериментирования.
Хотя авторы данного изобретения и не желают ограничивать себя какой-либо теорией, данное изобретение представляет конкретные новые и неожиданные преимущества в качестве компонента фармацевтической композиции для индуцирования иммунной реакции и, в частности, в виде вакцины.
Во-первых, другие носители, известные в данной области, включающие в себя БСА, гемоцианин фиссуреллы, столбнячный токсоид, бактериальные белки наружной мембраны, холерный токсин, экзотоксин А Pseudomonas aeruginosa и бактериальные пили (фимбрии), могут быть непригодными для использования в индивидууме, в частности человеке. Вышеуказанные носители могут индуцировать аллергические реакции или стимулировать патологические иммунные реакции (например, холерный токсин, KLH, БСА). Вышеуказанные носители могут требовать присутствия адъювантов, таких как неполный адъювант Фрейнда, считающихся в настоящее время неприемлемыми для использования у людей. Ряд носителей могут быть компонентами существующих вакцин (например, столбнячный токсоид, холерный токсин, экзотоксин А) или представлять антигены, которые обычно встречаются (например, бактериальные пили, экзотоксин А, белки наружной мембраны). Индивидуум сам по себе может иметь высокий уровень предсуществующего иммунитета к этим носителям, так что иммунизация конъюгата антиген-носитель будет индуцировать относительно более высокую иммунную реакцию в отношении носителя, чем в отношении нового антигена. По этим причинам отдельно или в целом применение АР205 в качестве белка-носителя может представлять полезное усовершенствование в сравнении с существующими белками-носителями. Композиция АР205-DerР1 способна стимулировать иммунную реакцию против DerP1 без использования полного адъюванта Фрейнда и без появления патологических иммунных реакций.
При использовании АР205 в качестве белка-носителя возможно то, что антигены конъюгата АР205-антиген, конъюгированные с АР205, могут поглощаться антигенпрезентирующими клетками и посредством этого стимулировать помощь Т-клеток для индукции иммунной реакции. Далее, гаптены, которые обычно не являются иммуногенными, могут быть связаны с АР205 и посредством этого индуцировать иммунную реакцию против таких гаптенов.
Следующим выгодным признаком данного изобретения является то, что антиген может быть представлен на поверхности VLP в виде правильных повторяющихся массивов, которые способны индуцировать эффективные иммунные реакции как при помощи Т-клеток, так и без помощи Т-клеток. Этот признак данного изобретения является особенно выгодным.
Таким образом, данное изобретение относится к способам улучшения эффективности вакцинации, в частности, против аутоантигенов, увеличением повторяемости антигена, который должен использоваться для иммунизации, посредством связывания этого антигена с VLP АР205.
Композиции, вакцины и их введение и способы лечения
Данное изобретение относится к вакцинным композициям, которые могут быть использованы для профилактики и/или аттенуирования заболеваний или состояний. Кроме того, данное изобретение относится к способам вакцинации для профилактики и/или аттенуирования заболеваний или состояний в индивидуумах.
В одном варианте данное изобретение относится к вакцинам для профилактики инфекционных заболеваний в широком диапазоне видов, в частности видов млекопитающих, таких как человек, обезьяна, корова, собака, кошка, лошадь, свинья и т.д. Вакцины могут быть сконструированы для лечения инфекций вирусной этиологии, таких как ВИЧ, грипп, герпес, вирусный гепатит, болезнь Эпштейна-Барра, полиомиелит, вирусный энцефалит, корь, оспа (дифтерит) птиц и т.д.; инфекций бактериальной этиологии, таких как пневмония, туберкулез, сифилис и т.д., или инфекций паразитарной этиологии, таких как малярия, трипаносомоз, лейшманиоз, трихомоноз, амебиоз и т.д.
В другом варианте данное изобретение относится к вакцинам для профилактики и лечения рака в широком диапазоне видов, в частности видов млекопитающих, таких как человек, обезьяна, корова, собака, кошка, лошадь, свинья и т.д. Вакцины могут быть сконструированы для лечения всех типов рака: лимфом, карцином, сарком, меланом и т.д.
В другом варианте данного изобретения конъюгаты, композиции и способы данного изобретения могут быть использованы в конструировании вакцин для лечения аллергий. Антитела изотипа IgE являются важными компонентами в аллергических реакциях. Мастоциты связывают IgE-антитела на их поверхности и высвобождают гистамины и другие медиаторы аллергической реакции после связывания специфического антигена с молекулами IgE, связанными на поверхности мастоцитов. Таким образом, ингибирование продуцирования антител IgE является перспективной мишенью для защиты против аллергий. Это было бы возможным в результате получения желаемой реакции Т-хелперных клеток. Реакции Т-хелперных клеток могут быть разделены на реакции Т-хелперных клеток типа 1 (ТН1) и типа 2 (ТН2) (Romagnani, Immunol. Today 18:263-266 (1997)). ТН1-клетки секретируют интерферон-гамма и другие цитокины. В отличие от этого критическим цитокином, продуцируемым ТН2-клетками, является IL-4, который запускает продуцирование IgE В-клетками. Во многих экспериментальных системах развитие реакций ТН1 и ТН2 является взаимоисключающим, так как ТН1-клетки подавляют индукцию ТН2-клеток и vice versa. Таким образом, антигены, которые запускают сильную ТН1-реакцию, одновременно подавляют развитие ТН2-реакций и, следовательно, продуцирование IgE-антител. Открытием данного изобретения является то, что VLP АР205 индуцируют иммунную реакцию ТН1-типа. Таким образом, с использованием способов данного изобретения VLP АР205 могут быть декорированы различными аллергенами и использованы для иммунизации. Вследствие связывания аллергена с VLP АР205 будет индуцироваться ТН1-реакция, будут продуцироваться "протективные" (защитные) антитела IgG и продуцирование антител IgE, которые вызывают аллергические реакции, будет предотвращаться. Поскольку аллерген предоставляется VLP, которые узнаются другим набором хелперных Т-клеток, чем сам аллерген, возникает вероятность того, что аллерген-специфические IgG-антитела будут индуцироваться даже в аллергических индивидуумах, несущих предсуществующие ТН2-клетки, специфические в отношении этого аллергена. Присутствие высоких концентраций антител IgG может предотвращать связывание аллергенов со связанным с мастоцитами IgE, ингибируя посредством этого высвобождение гистамина. Таким образом, присутствие IgG-антител может защищать от IgE-опосредованных аллергических реакций. Типичные вещества, вызывающие аллергию, включают в себя без ограничения пыльцу (например, злака, амброзии, березы и можжевельника мексиканского), домашнюю пыль, клещей, эпидермальные аллергены млекопитающих и перхоть животных, плесень и грибы, тела насекомых и яд насекомых, волосы, слюну, сыворотку, перья; пищевые продукты или лекарственные средства (например, пенициллин). См. Shough, H. et al., Remington's Pharmaceutical Sciences, 19th edition, (Chap. 82), Mack Publishing Company, Mack Publishing Group, Easton, Pennsylvania (1995), все содержание которого включено здесь в качестве ссылки.
В конкретных вариантах данное изобретение относится к способам профилактики и/или аттенуирования заболеваний или состояний, которые вызываются или обостряются продуктами "своих" генов (например, факторами некроза опухолей), т.е. "аутоантигенами", в данном контексте. В родственных вариантах данное изобретение относится к способам индуцирования иммунологических реакций в индивидуумах, которые приводят к продуцированию антител, предотвращающих и/или аттенуирующих заболевания или состояния, которые вызываются или обостряются продуктами "своих" генов. Примеры таких заболеваний или состояний включают в себя реакцию трансплантат против хозяина, IgE-опосредованные аллергические реакции, анафилаксию, респираторный дистресс-синдром взрослых, болезнь Крона, аллергическую астму, острый лимфобластный лейкоз (ALL), неходжкинскую лимфому (NHL), болезнь Грейвса (токсический зоб), воспалительные аутоиммунные заболевания, тяжелую псевдопаралитическую миастению, системную красную волчанку (SLE), иммунопролиферативное заболевание лимфаденопатию (IPL), ангиоиммунопролиферативную лимфаденопатию (AIL), иммунобластную лимфаденопатию (IBL), ревматоидный артрит, диабет, рассеянный склероз, остеопороз и болезнь Альцгеймера.
Как будет понятно специалисту в данной области, при введении композиций данного изобретения индивидууму они могут быть композициями, которые содержат соли, буферы, адъюванты или другие вещества, которые являются желательными для улучшения эффективности композиции. Примеры материалов, подходящих для применения в приготовлении фармацевтических композиций, обеспечены в многочисленных литературных источниках, в том числе в Remington's Pharmaceutical Sciences (Osol, A, ed. Mack Publishing Co. (1990)).
Композиции данного изобретения называют "фармакологически приемлемыми", если их введение может переноситься индивидуумом-реципиентом. Кроме того, композиции данного изобретения будут вводиться в "терапевтически эффективном количестве" (т.е. в количестве, которое дает желаемый физиологический эффект).
Композиции данного изобретения могут вводиться различными способами, известными в данной области, но обычно должны вводиться инъекцией, инфузией, ингаляцией, пероральным введением или другими подходящими физическими способами. Эти композиции, альтернативно, вводят внутримышечно, внутривенно, через слизистую оболочку, чрескожно или подкожно. Компоненты композиций для введения включают в себя стерильные водные (например, в физиологическом солевом растворе) или неводные растворы и суспензии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические эфиры, такие как этилолеат. Носители или окклюзионные повязки могут использоваться для увеличения кожной проникаемости и усиления абсорбции антигена.
Другие варианты данного изобретения включают в себя способы приготовления композиций данного изобретения и способы консервативного лечения с использованием этих композиций. Должно быть понятно, что как предыдущее общее описание, так и последующее подробное описание приведены только в качестве примеров и объяснений и предназначены для обеспечения дополнительного объяснения заявленного изобретения.
Кроме вакцинных технологий, другие варианты данного изобретения относятся к способам консервативного лечения раков и аллергий и к способам лечения заболеваний или состояний, которые вызываются или обостряются продуктами "своих" генов.
Все патенты и публикации, на которые здесь ссылаются авторы, специально включены в качестве ссылки в их полном объеме.
Наборы
В других вариантах композиции данного изобретения могут быть собраны в наборы для применения в детектировании в анализах или в промышленных условиях, в диагностике или в обнаружении заболеваний, состояний или нарушений. Такие наборы в соответствии с данным изобретением могут содержать по меньшей мере один контейнер, содержащий один или несколько описанных выше конъюгатов или композиций, в том числе конъюгатов АР205 и иммунных молекул и антител, соответственно направленных против таких конъюгатов. Наборы данного изобретения могут необязательно содержать дополнительно по меньшей мере один дополнительный контейнер, который может содержать, например, один или несколько антигенов, один или несколько гаптенов, один или несколько частиц, один или несколько конъюгатов/одну или несколько композиций данного изобретения, один или несколько фармацевтически приемлемых носителей или наполнителей, один или несколько буферов, один или несколько белков, одну или несколько молекул нуклеиновых кислот и т.п.
Специалисту с обычной квалификацией в релевантных областях будет понятно, что другие подходящие модификации и адаптации в отношении описанных здесь способов и применений являются очевидными и могут быть произведены без отклонения от объема данного изобретения или любого его варианта. Теперь, после подробного описания данного изобретения, оно будет более понятным при ссылке на следующие примеры, которые включены здесь только для целей иллюстрации и не предназначены для того, чтобы быть ограничением данного изобретения.
ПРИМЕР 1
Клонирование гена белка оболочки АР205
кДНК белка оболочки (СР) АР205 собирали из двух кДНК-фрагментов, полученных из РНК фага АР205 с использованием способа ПЦР с обратной транскрипцией и клонирования в коммерчески доступной плазмиде pCR 4-TOPO для секвенирования. Способы обратной транскрипции хорошо известны специалистам с обычной квалификацией в релевантной области. Первый фрагмент, содержащийся в плазмиде р205-246, содержал 269 нуклеотидов слева от последовательности СР и 74 нуклеотида, кодирующих первые 24 N-концевых аминокислоты СР. Второй фрагмент, содержащийся в плазмиде р205-262, содержал 364 нуклеотида, кодирующих аминокислоты 12-131 СР, и дополнительные 162 нуклеотида справа от последовательности СР.
Плазмиду 283.-58 конструировали двухстадийной ПЦР для слияния обоих фрагментов СР из плазмид р205-246 и р205-262 в одной полноразмерной последовательности СР. Использовали левый праймер р1.44, содержащий сайт NcoI для клонирования в плазмиду pQb185, или р1.45, содержащий сайт XbaI для клонирования в плазмиду pQb10, и правый праймер р1.46, содержащий сайт рестрикции HindIII (последовательность узнавания рестрикционного фермента подчеркнута):
р1.44 5'-AACC ATG GCA AAT AAG CCA ATG CAA CCG-3' (SEQ ID NO:59)
р1.45 5'-AATCTAGAATTTTCTGCGCACCCATCCCGG-3' (SEQ ID NO:60)
р1.46 5'-AAAAGC TTA AGC AGT AGT ATC AGA CGA TAC G-3' (SEQ ID NO:61)
Два дополнительных праймера, р1.47, отожженный на 5'-стороне фрагмента, содержащегося в р205-262, и р1.48, отожженный на 3'-стороне фрагмента, содержащегося в плазмиде р205-246, использовали для амплификации этих фрагментов в первой ПЦР. Праймеры р1.47 и р1.48 являются комплементарными один другому.
р1.47: 5'-GAGTGATCCAACTCGTTTATCAACTACATTT-TCAGCAAGTCTG-3' (SEQ ID NO:62)
р1.48: 5'-CAGACTTGCTGAAAATGTAGTTGATAAACGA-GTTGGATCACTC-3' (SEQ ID NO:63)
В первых двух ПЦР-реакциях генерировали два фрагмента. Первый фрагмент генерировали с праймерами р1.45 и р1.48 и матрицей р205-246. Второй фрагмент генерировали с праймерами р1.47 и р1.46 и матрицей р205-262. Оба фрагмента использовали в качестве матриц для второй ПЦР-реакции, сплайсингового перекрывающегося удлинения, с комбинацией праймеров р1.45 и р1.46 или р1.44 и р1.46. Продукт ПЦР-реакций двух вторых стадий расщепляли XbaI или NcoI соответственно и HindIII и клонировали с теми же сайтами рестрикции в pQb10 или pQb185 соответственно двух произведенных из pGEM экспрессирующих векторах под контролем промотора триптофанового оперона E. coli.
Получали две плазмиды, рАР283-58 (SEQ ID NO:2), содержащую ген, кодирующий СР АР205 дикого типа (SEQ ID NO:1), в pQB10, и рАР281-32 (SEQ ID NO:4), содержащую нуклеотидную последовательность SEQ ID NO:125, кодирующую мутеин с мутацией Pro5 → Thr, имеющую аминокислотную последовательность SEQ ID NO:3, в pQb185. Эти последовательности белка оболочки подтверждали секвенированием ДНК. рАР283-58 содержит 49 нуклеотидов слева от кодона ATG СР, справа от сайта XbaI, и содержит предположительный сайт связывания рибосом мРНК белка оболочки.
ПРИМЕР 2
Экспрессия и очистка рекомбинантной VLP АР205
А. Экспрессия рекомбинантной VLP АР205.
E. coli JM109 трансформировали плазмидой рАР283-58. 5 мл жидкой среды LB (Луриа-Бертани) с 20 мкг/мл ампициллина инокулировали единственной колонией и инкубировали при 37°С в течение 16-24 часов без встряхивания.
Приготовленный инокулят разбавляли 1:100 в 100-300 мл LB-среды, содержащей 20 мкг/мл ампициллина, и инкубировали при 37°С в течение ночи без встряхивания. Полученный второй инокулят разбавляли 1:50 в 2TY-среде, содержащей 0,2% глюкозу и фосфат для забуферивания, и инкубировали при 37°С в течение ночи на шейкере. Клетки собирали центрифугированием и замораживали при -80С.
В. Очистка рекомбинантной VLP АР205.
Растворы и буферы
1. Лизисный буфер:
50 мМ Трис-HCl, рН 8,0, с 5 мМ ЭДТА, 0,1% тритон Х-100 и ФМСФ при 5 мкг/мл.
2. SAS:
насыщенный сульфат аммония в воде.
3. Буфер NET:
20 мМ Трис-HCl, рН 7,8, с 5 мМ ЭДТА и 150 мМ NaCl.
4. ПЭГ:
40% (м/о) полиэтиленгликоль 6000 в NET.
Лизис
Замороженные клетки ресуспендировали в лизисном буфере при 2 мл/г клеток. Эту смесь обрабатывали ультразвуком с 22 кГ пять раз в течение 15 секунд с интервалами 1 мин для охлаждения этого раствора на льду. Затем лизат центрифугировали в течение 20 минут при 12000 об/мин с использованием ротора F34-6-38 (Эппендорфа). Все стадии центрифугирования, описанные ниже, выполняли с использованием одного и того же ротора, если нет других указаний. Супернатант хранили при 4°С, тогда как остатки клеток (дебрис) промывали дважды лизисным буфером. После центрифугирования супернатанты лизата и промывные фракции объединяли.
Далее для очистки VLP АР205 может использоваться осаждение сульфатом аммония. В первой стадии выбирают концентрацию сульфата аммония, при которой VLP АР205 не осаждается. Полученный осадок выбрасывают. В следующей стадии выбирают концентрацию сульфата аммония, при которой VLP количественно осаждается, и VLP АР205 выделяют из этого остатка на этой стадии осаждения центрифугированием (14000 об/мин, в течение 20 минут). Полученный осадок солюбилизируют в NET-буфере.
Хроматография
Капсидный белок из объединенных супернатантов наносили на колонку Сефарозы 4В (2,8 х 70 см) и элюировали NET-буфером при 4 мл/час/фракция. Фракции 28-40 собирали и осаждали сульфатом аммония при 60% насыщении. Эти фракции анализировали электрофорезом в ДСН-ПААГ и Вестерн-блоттингом с использованием антисыворотки, специфической для белка оболочки VLP АР205, перед осаждением. Осадок, выделенный центрифугированием, повторно солюбилизировали в NET-буфере и наносили на колонку Сефарозы 2В (2,3 х 65 см) и элюировали при 3 мл/час/фракция. Фракции анализировали электрофорезом в ДСН-ПААГ и фракции 44-50 собирали, объединяли и осаждали сульфатом аммония при 60% насыщении. Осадок, выделенный центрифугированием, повторно солюбилизировали в NET-буфере и наносили на колонку Сефарозы 6В (2,5 х 47 см) и элюировали при 3 мл/час/фракция. Фракции анализировали электрофорезом в ДСН-ПААГ. Фракции 23-27 собирали, концентрацию соли доводили до 0,5 М и осаждали ПЭГ 6000, добавленным из 40% исходного раствора в воде и до конечной концентрации 13,3%. Осадок, выделенный центрифугированием, повторно солюбилизировали в NET-буфере и наносили на колонку Сефарозы 2В, как описано выше, элюировали таким же образом. Фракции анализировали электрофорезом в ДСН-ПААГ. Фракции 43-53 собирали и осаждали сульфатом аммония при 60% насыщении. Осадок, выделенный центрифугированием, повторно солюбилизировали в воде и полученный раствор интенсивно диализовали против воды. Можно было выделить приблизительно 10 мг очищенного белка на 1 г клеток. Очистка VLP АР205 могла быть показана при анализе электрофорезом и Вестерн-блоттингом. Фракции рекомбинантных VLP АР205 первой стадии хроматографии на Сефарозе 4В, а также последней стадии хроматографии на Сефарозе 2В могли быть показаны на геле электрофореза в ДСН-ПААГ, проводимого при восстанавливающих условиях, а также Вестерн-блоттингом с антисывороткой, специфической для белка оболочки VLP АР205.
Исследование этих вирусоподобных частиц при помощи электронной микроскопии показало, что они были идентичны фаговым частицам (фиг.1А и 1В).
Фиг.1А показывает ЭМ-картину частиц фага АР205, тогда как на фиг.1В показана ЭМ-картина самособранных частиц рекомбинантных VLP АР205.
Для простоты термин "подобная вирусу АР205 частица" и термин "VLP АР205", используемые в разделе примеров, обозначают вирусоподобную частицу, экспрессированную и очищенную, как описано в примере 2, и состоящую из белков оболочки, имеющих аминокислотную последовательность, представленную в SEQ ID NO:1.
ПРИМЕР 3
Связывание пептидных антигенов Derp1.2 и FLAG с VLP АР205 и иммунизация мышей пептидом Derp1.2, связанным с VLP АР205
А. Связывание пептида Derp1.2 и пептида FLAG с рекомбинантной VLP.
Пептид Derp1.2 (последовательность: CQIYPPNANKIREALAQTHSA "Der p 1 р117"; аминокислоты 117-137 (SEQ ID NO:64)) и FLAG (последовательность: CGGDYKDDDDK (SEQ ID NO:65)) синтезировали химически в соответствии с известными в данной области способами. VLP АР205, экспрессированные и очищенные, как описано в примере 2, повторно солюбилизировали в буфере 20 мМ HEPES, 150 мМ NaCl, рН 7,4 (HBS-буфере). Затем повторно солюбилизированные VLP АР205 взаимодействовали при концентрации 2 мг/мл (определенной по способу Бредфорда) с 2,85 мМ SMPH (Pierce) в течение 30 минут при комнатной температуре (КТ). Затем реакционную смесь диализовали против HBS-буфера и давали взаимодействовать с 0,714 мМ Derp1.2 или FLAG, разведенным в реакционной смеси из 50 мМ исходного раствора в ДМСО. Реакции сочетания давали протекать в течение 2 часов при 15°С и реакционную смесь диализовали 2 х 2 час против 1000-кратного объема HBS и быстро замораживали в жидком азоте в виде аликвот для хранения при -80°С до последующего использования.
Аликвоту оттаивали и связывание антигена с субъединицей АР205 оценивали электрофорезом в ДСН-ПААГ и концентрацию белка измеряли по способу Бредфорда. Результат реакции сочетания Derp1.2 с VLP АР205 показан на фиг.2. Мономерная субъединица VLP АР205 имеет молекулярную массу 14 кДа. После дериватизации VLP АР205 сшивающим линкером при электрофорезе в ДСН-ПААГ обнаруживаются димеры, тримеры, тетрамеры, пентамеры и гексамеры, в дополнение к мономерной форме этой субъединицы.
Фиг.2 показывает анализ электрофорезом в ДСН-ПААГ реакции сочетания VLP АР205 и VLP Qβ с пептидом Derp1.2. Пробы подвергали электрофорезу при восстанавливающих условиях на 16% Трис-глициновом геле. Дорожка 1 является белковым маркером с соответствующими молекулярными массами, указанными на левой границе геля; дорожка 2, дериватизованный капсидный белок Qβ; дорожка 3, супернатант реакции сочетания капсидного белка Qβ с пептидом Derp1.2; дорожка 4, осадок реакции сочетания капсидного белка Qβ с пептидом Derp1.2; дорожка 5, дериватизованная VLP АР205; дорожка 6, супернатант реакции сочетания VLP АР205 с пептидом Derp1.2; дорожка 7, осадок реакции сочетания VLP АР205 с пептидом Derp1.2. Продукты связывания, соответствующие связыванию 1, 2, 3, 4 и соответственно 5 пептидов на мономер, показаны стрелками на этой фигуре. Более высокое количество эпитопов могло быть связано с VLP АР205, чем с капсидным белком Qβ.
В. Анализ иммунной реакции иммунизации мышей пептидом Derp1.2, связанным с рекомбинантной VLP, и определение подтипа IgG.
VLP АР205, связанные с пептидом Derp1.2, или VLP Qβ, связанные с пептидом Derp1.2, инъецировали s.c. в мышей (по 3 мыши в каждом случае) в день 0 и день 14. Пептид Derp1.2 связывали с капсидным белком Qβ с использованием тех же условий, которые описаны в А для связывания с VLP АР205. Каждую мышь иммунизировали 10 мкг вакцины, разбавленной в ЗФР до 200 мкл. У мышей брали кровь ретроорбитально в день 20 и титр антител, специфических в отношении пептида Derp1.2, измеряли в ELISA против пептида Derp1.2. Пептид Der p I "Der p I р52" связывали с бычьей РНКазой А с использованием химического сшивающего линкера сульфо-SPDP. Планшеты ELISA покрывали связанными с РНКазой препаратами при концентрации 10 мкг/мл. Планшеты блокировали и затем инкубировали серийно разведенными мышинами сыворотками. Связанные антитела детектировали меченными ферментом антителами против мышиного IgG, специфическими в отношении соответствующих подтипов. В качестве контроля испытывали также неиммунные сыворотки тех же самых мышей (данные не показаны). Эти результаты показаны на фиг.3.
Фиг.3 показывает анализ ELISA IgG-антител, специфических для "Derp1.2", в сыворотках мышей, иммунизированных против пептида Derp1.2, связанного с VLP АР205 или капсидным белком Qβ соответственно. Определяли общие титры IgG, а также титры подтипов IgG. Эта фигура показывает, что как для АР205, так и для Qβ индуцируются подтипы, типичные для иммунной реакции Th1, так как титр IgG2а был гораздо более высоким, чем титр IgG1. Сильную специфическую иммунную реакцию против пептида получали с пептидом, связанным с обеими VLP. Антитела, специфические для носителя, также измеряли при помощи ELISA, и их сравнивали с обоими носителями.
ПРИМЕР 4
Модулярная система эукариотической экспрессии для связывания антигенов с VLP
Эту систему генерировали для добавления различных последовательностей аминокислотных линкеров, содержащих остаток цистеина, к антигенам для химического связывания с VLP.
А. Конструирование происходящей из EBNA (ядерного антигена вируса Эпштейна-Барр) экспрессионной системы, кодирующей цистеинсодержащий аминокислотный линкер и отщепляемую Fc-метку.
рСер-Pu (Wuttke et al. J. Biol. Chem. 276: 36839-48 (2001)) расщепляли KpnI и BamHI и новый сайт клонирования вводили отожженными олигонуклеотидами РН37 и РН381 с получением рСер-MCS.
Модулярную систему, содержащую свободный цистеин, фланкированный несколькими глицинами, сайт расщепления протеазы и константную область IgG1 человека, генерировали следующим образом. pSec2/Hygro B (Invitrogen Cat. No. V910-20) расщепляли Bsp120I и HindIII и лигировали с отожженными олигонуклеотидами SU7 и SU8 с получением конструкции pSec-B-MCS. Затем pSec-B-MCS расщепляли NheI и HindIII и лигировали с отожженными олигонуклеотидами РН29 и РН30 с получением конструкции pSec 29/30. Конструкцию pSec-FL-EK-Fc* генерировали лигированием трех фрагментов с использованием следующих фрагментов: первый pSec 29/30, расщепленный EcoRI и HindIII, отожженные олигонуклеотиды РН31 и РН32 и BglI/EcoRI-фрагмент плазмиды (pSP-Fc*-C1), содержащий модифицированную версию константной области IgG1 человека (в отношении подробностей для последовательности hu IgG1, см. последовательность конечной конструкции pCep-Xa-Fc* (фиг.4А-4С). Полученная конструкция была названа pSec-FL-EK-Fc*. Из этой плазмиды линкерный район и Fc-часть IgG1 человека вырезали расщеплением при помощи NheI, PmeI и клонировали в pCep-MCS, расщепленную NheI и PmeI, с получением конструкции pCep-FL-EK-Fc*. Таким образом, создавали модулярный вектор, в котором линкерная последовательность и сайт расщепления протеазы, которые помещены между сайтами NheI и HindIII, могут легко обмениваться с отожженными олигонуклеотидами. Для генерирования векторов расщепляемых слитых белков pCep-FL-EK-Fc* расщепляли NheI и HindIII и сайт расщепления Фактора Ха, фланкированный на N-конце аминокислотами GGGGCG (SEQ ID NO:55), вводили с отожженными олигонуклеотидами РН35 и РН36 и сайт энтерокиназы, фланкированный на N-конце GGGGCG (SEQ ID NO:55), вводили с отожженными олигонуклеотидами РН39 и РН40 с получением конструкций pCep-Xa-Fc* (фиг.4А, нуклеотидная последовательность, представленная в SEQ ID NO:103, аминокислотная последовательность, представленная в SEQ ID NO:104) и pCep-EK-Fc* (фиг.4В, нуклеотидная последовательность, представленная в SEQ ID NO:105, аминокислотная последовательность, представленная в SEQ ID NO:106) соответственно. Конструкцию pCep-SP-EK-Fc* (фиг.4С, нуклеотидная последовательность, представленная в SEQ ID NO:107, аминокислотная последовательность, представленная в SEQ ID NO:108), которая, кроме того, содержит эукариотический сигнальный пептид, генерировали лигированием трех фрагментов pCep-EK-Fc*, расщепленной KpnI/BamHI, отожженных олиго РН41 и рН42 и отожженных олиго РН43 и РН44.
В. Крупномасштабное получение слитых (химерных) белков.
Для крупномасштабного получения различных слитых белков клетки 293-EBNA (Invitrogen) трансфицировали различными экспрессионными плазмидами рСер с реагентом Липофектамином 2000 (Invitrogen Corporation; Carlsbad, CA) в соответствии с рекомендациями изготовителя. Спустя 24-36 часов после трансфекции эти клетки разбивали на отдельные клетки при отношении 1:3 с отбором при помощи пуромицина (1 мкг/мл) в DMEM, дополненной 10% ФТС. Затем устойчивые клетки размножали в селективной среде. Для сбора слитых белков популяцию устойчивых клеток пассировали на покрытые поли-L-лизином чашки. После достижения клетками конфлюентности их промывали 2 раза ЗФР и в чашки добавляли бессывороточную среду (DMEM). Супернатант культуры ткани собирали каждые 2-4 дня и заменяли свежей средой DMEM во время периода до одного месяца. Собранные супернатанты хранили при 4°С.
С. Очистка слитых белков.
Рекомбинантные Fc-слитые белки очищали аффинной хроматографией с использованием протеин А-сефарозы CL-4B (Amersham Pharmacia Biotech AG). Вкратце, хроматографические колонки упаковывали 1-3 мл протеин А-смолы и супернатанты культуры ткани, содержащие эти рекомбинантные белки, наносили на колонку с использованием перистальтического насоса при скорости тока 0,5-1,5 мл/мин. Затем эту колонку промывали 20-50 мл ЗФР. В зависимости от слитого белка расщепление протеазой выполняли на колонке или этот белок элюировали, как описано ниже. Рекомбинантные слитые белки элюировали цитратным/фосфатным буфером (рН 3,8), дополненным 150 мМ NaCl, и фракции, содержащие белок, объединяли и концентрировали с использованием центрифужных фильтров без давления (Millipore Corporation; Bedford, MA).
D. Протеазное расщепление рекомбинантных слитых белков (с использованием фактора Ха, энтерокиназы).
Элюированные рекомбинантные слитые белки, содержащие сайт расщепления энтерокиназы (ЕК), расщепляли с использованием системы EKmax (Invitrogen) в соответствии с рекомендациями изготовителя. Отщепленную Fc-часть слитого белка удаляли инкубированием с протеином А. Затем энтерокиназу удаляли при помощи системы удаления энтерокиназы EK-away (Invitrogen Corporation; Carlsbad, CA) в соответствии с рекомендациями изготовителя. Аналогично, слитые белки, содержащие сайт отщепления фактора Ха (Ха), расщепляли с использованием набора рестриктаз для отщепления и удаления фактора Ха (Roche) в соответствии с рекомендациями производителя. Отщепленную Fc-часть удаляли инкубированием с протеином А, а протеазу удаляли смолой со стрептавидином, обеспечиваемой с данным набором.
Различные слитые белки концентрировали с использованием центрифужных фильтров Ultrafree (Millipore Corporation; Bedford, MA), определяли количественно УФ-спектрометрией и использовали для последующих реакций связывания.
Фиг.4А-4С показывают частичные последовательности различных используемых эукариотических экспрессирующих векторов. Показаны только модифицированные последовательности.
Фиг.4А: pCep-Xa-Fc*: эта последовательность показана от сайта BamHI и далее, и различные признаки показаны над транслируемой последовательностью (SEQ ID NO:103 и SEQ ID NO:104). Стрелка указывает сайт расщепления фактор Ха-протеазы.
Фиг.4В: pCep-EK-Fc*: эта последовательность показана от сайта BamHI и далее, и различные признаки показаны над транслируемой последовательностью (SEQ ID NO:105 и SEQ ID NO:106). Стрелка указывает сайт расщепления энтерокиназы. Последовательность справа от сайта HindIII является идентичной последовательности, показанной на фиг.4А.
Фиг.4С: pCep-SP-EK-Fc*: эта последовательность показана от начала сигнального пептида, и различные признаки показаны над транслируемой последовательностью (SEQ ID NO:107 и SEQ ID NO:108). Последовательность сигнального пептида, которая отщепляется сигнальной пептидазой, показана жирным шрифтом. Стрелка указывает сайт расщепления энтерокиназы. Последовательность справа от сайта HindIII является идентичной последовательности, показанной на фиг.4А.
ПРИМЕР 5
Эукариотическая экспрессия и связывание мышиного резистина с VLP АР205
А. Клонирование мышиного резистина.
Тотальную РНК выделяли из 60 мг мышиной жировой ткани с использованием набора Qiagen RNeasy в соответствии с рекомендациями изготовителя. РНК элюировали 40 мкл Н2О. Затем эту тотальную РНК использовали для обратной транскрипции с олиго-dT-праймером с использованием ОТ-ПЦР-системы ThermoScript™ (Invitrogen, Corparation, Carlsbad) в соответствии с рекомендациями изготовителя. Пробу инкубировали при 50°С в течение 1 часа, нагревали до 85°С в течение 5 минут и обрабатывали в течение 20 минут при 37°С РНКазой Н.
2 мкл ОТ-реакции использовали для ПЦР-амплификации мышиного резистина. ПЦР проводили с применением Platinum TAQ (Invitrogen, Carlsbad CA) в соответствии с рекомендациями изготовителя с использованием праймеров РН19 и РН20. Праймер РН19 соответствует положениям 58-77, а праймер РН20 положениям 454-435 последовательности мышиного резистина. ПЦР-смесь сначала денатурировали при 94°С в течение 2 минут, а затем выполняли 35 циклов следующим образом: 30 секунд 94°С, 30 секунд 56°С и 1 минута 72°С, после чего эти пробы оставляли на 10 минут при 72°С. Фрагмент ПЦР очищали и субклонировали ТА-клонированием в вектор pGEMeasy (Invitrogen Corparation, Carlsbad CA) с получением pGEMT-mRes. Для добавления подходящих сайтов рестрикции выполняли вторую ПЦР на pGEMT-mRes с праймерами РН21 и РН22 с использованием той же самой программы циклов, что и описанная выше. Прямой праймер РН21 содержит сайт BamHI и нуклеотиды 81-102 последовательности мышиного резистина. Обратный праймер РН22 содержит сайт XbaI и нуклеотиды 426-406 последовательности мышиного резистина. Указанные положения соответствуют последовательности резистина Gene Accession No. AF323080. Продукт ПЦР очищали и расщепляли BamHI и XbaI и субклонировали в pcmv-Fc*-C1, расщепленный BamHI и XbaI, с получением конструкции pcmv-mRes-Fc*.
Открытую рамку считывания резистина вырезали из pcmv-Res-Fc* BamHI/XbaI-расщеплением и клонировали в pCep-Xa-Fc* и pCep-EK-Fc* (см. пример 4, раздел В), расщепленные BamHI и NheI, с получением конструкций pCep-mRes-Xa-Fc* и pCep-mRes-EK-Fc* соответственно.
В. Получение, очистка и отщепление резистина
Затем конструкции pCep-mRes-Xa-Fc* и pCep-mRes-EK-Fc* использовали для трансфекции клеток 293-EBNA для получения рекомбинантных белков, как описано в примере 4, разделе В. Супернатанты культуры ткани очищали, как описано в примере 4, разделе С. Затем очищенные белки расщепляли, как описано в примере 4, разделе D. Полученные рекомбинантные белки были названы "резистин-С-Ха" или "Res-С-Ха" и "резистин-С-ЕК" или "Res-С-ЕК" в соответствии с использованным вектором. Эти очищенные белки анализировали электрофорезом в ДСН-ПААГ. Полосы, соответствующие очищенному резистину-С-Ха и очищенному резистину-С-ЕК, были ясно видимыми на геле.
SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111 и SEQ ID NO:112 показывают последовательности предшественники рекомбинантных белков мышиного резистина, используемые для экспрессии. Процессированный рекомбинантный мышиный резистин, использованный для связывания, т.е. Res-C-Xa и Res-C-EK, показаны на фиг.2А и 2В WO 02/056905. Сигнальная последовательность резистина, которая отщепляется после секреции белка сигнальной пептидазой, показана курсивом. Аминокислотные последовательности, которые образуются вследствие расщепления сигнальной пептидазой и специфической протеазой (фактором Ха или энтерокиназой) показаны жирным шрифтом.
С. Связывание резистина-С-Ха и резистина-С-ЕК с VLP АР205.
Раствор 0,2 мл 2 мг/мл VLP АР205 в 20 мМ HEPES, 150 мМ NaCl, рН 7,4, взаимодействует в течение 30 минут с 5,6 мкл раствора 100 мМ SMPH (Pierce) в ДМСО при 25°С на качалке. Затем реакционный раствор диализуют дважды в течение 2 часов против 1 л 20 мМ HEPES, 150 мМ NaCl, рН 7,4, при 4°С. Затем 8 мкл диализованной реакционной смеси капсидного белка АР205 взаимодействуют с 32 мкл раствора резистин-С-Ха (приводя к конечной концентрации резистина 0,39 мг/мл) и 13 мкл реакционной смеси капсидного белка АР205 взаимодействуют с 27 мкл раствора резистин-С-ЕК (приводя к конечной концентрации резистина 0,67 мг/мл) в течение четырех часов при 25°С на качалке. Продукты связывания анализируют электрофорезом в ДСН-ПААГ и Вестерн-блоттингом при восстанавливающих условиях.
ПРИМЕР 6
Экспрессия, очистка и связывание конструкций мышиного лимфотоксина-β с VLP АР205
А. Введение цис-содержащих линкеров, экспрессия и очистка мышиного лимфотоксина-β.
Внеклеточную часть мышиного лимфотоксина-β (LT-β) рекомбинантно экспрессировали с аминокислотным линкером CGG на его N-конце. Линкер содержал один цистеин для связывания с VLP. Длинную (аминокислоты 49-306) и короткую версию (аминокислоты 126-306) этого белка сливали на их N-конце либо с глютатион-S-трансферазой (GST), либо с гистидин-myc-меткой для очистки. Для отщепления этой метки встраивали сайт расщепления энтерокиназы (ЕК).
Конструирование С-LT-β49-306 и С-LT-β126-306
Мышиный С-LT-β49-306 амплифицировали при помощи ПЦР с олигонуклеотидами 5'LT-β и 3'LT-β из библиотеки кДНК мышиной селезенки в pFB-LIB. Для ПЦР-реакции 0,5 мкг каждого праймера и 200 нг ДНК-матрицы использовали в 50 мкл реакционной смеси (1 единица PFX Platinum polymerase, 0,3 мМ dNTP и 2 мМ MgSO4). Температурные циклы были следующими: 94°С в течение 2 минут с последующими 25 циклами 94°С (15 секунд), 68°С (30 секунд), 68°С (1 минута) и затем 68°С в течение 10 минут. Продукт ПЦР фосфорилировали киназой Т4 и лигировали в плазмиду pEntry1A (Life Technologies), которая была разрезана EcoRV и дефосфорилирована. Полученная плазмида была названа pEntry1A-LT-β49-306.
Вторую ПЦР-реакцию выполняли с олиго 5'LT-βlong-NheI и 3'-LT-βstop-NotI, соответственно, 5'LT-βshort-NheI и 3'LT-β stop-NotI с использованием pEntry1A-LT-β49-306 в качестве матрицы. Олигонуклеотиды 5'LT-βlong-NheI и 5'LT-βshort-NheI имели внутренний сайт NheI и содержали кодоны для Cys-Gly-Gly-линкера, а 3'LT-βstop-NotI имел внутренний сайт NotI и содержал стоп-кодон. Для второй ПЦР-реакции использовали 0,5 мкг каждого праймера и 150 нг ДНК-матрицы в 50 мкл реакционной смеси (1 единица PFX Platinum polymerase, 0,3 мМ dNTP и 2 мМ MgSO4). Температурные циклы были следующими: 94°С в течение 2 минут с последующими 25 циклами 94°С (15 секунд), 50°С (30 секунд), 68°С (1 минута), с последующими 20 циклами 94°С (15 секунд), 64°С (30 секунд) 68°С (1 минута) и затем 68°С в течение 10 минут.
Продукты ПЦР расщепляли NheI и NotI и встраивали либо в рСер-SP-GST-EK, либо в рСер-SP-his-myc-EK (Wuttke et al. J. Biol. Chem. 276:36839-48 (2001)). Полученные плазмиды были названы pCEP-SP-GST-EK-C-LT-β49-306, pCEP-SP-GST-EK-C-LT-β126-306, pCEP-SP-his-myc-EK-C-LT-β49-306 и pCEP-SP-his-myc-EK-C-LT-β126-306 соответственно. GST обозначает глутатион-S-трансферазу, ЕК обозначает энтерокиназу, his обозначает гексагистидиновую метку и myc обозначает эпитоп анти-с-myc. С указывает CGG-линкер, содержащий дополнительный цистеин.
Все остальные стадии выполняли стандартными процедурами молекулярной биологии.
Последовательность олигонуклеотидов
5'LT-β:
5'-CTT GGT GCC GCA GGA TCA G-3' (SEQ ID NO:66)
3'LT-β:
5'-CAG ATG GCT GTC ACC CCA C-3' (SEQ ID NO:67)
5'LT-βlong-NheI:
5'-GCC CGC TAG CCT GCG GTG GTC AGG ATC AGG GAC GTC G-3' (SEQ ID NO:68)
5'LT-βshort-NheI:
5'-GCC CGC TAG CCT GCG GTG GTT CTC CAG CTG CGG ATT C-3' (SEQ ID NO:69)
3'LT-βstop-NotI
5'-CAA TGA CTG CGG CCG CTT ACC CCA CCA TCA CCG-3' (SEQ ID NO:70)
В. Экспрессия и получение GST-EK-C-LT-β49-306, GST-EK-C-LT-β126-306, his-myc-EK-C-LT-β49-306 и his-myc-EK-C-LT-β126-306.
Плазмиды pCEP-SP-GST-EK-C-LT-β49-306, pCEP-SP-GST-EK-C-LT-β126-306, pCEP-SP-his-myc-EK-C-LT-β49-306 и pCEP-SP-his-myc-EK-C-LT-β126-306 трансфицировали в клетки 293-EBNA (Invitrogen) для получения белков, как описано в примере 4. Полученные белки были названы GST-EK-C-LT-β49-306, GST-EK-C-LT-β126-306, his-myc-EK-C-LT-β49-306 и his-myc-EK-C-LT-β126-306. Белковые последовательности LT-β-слитых белков транслировали из кДНК-последовательностей:
GST-EK-C-LT-β49-306
GST-EK-C-LT-β126-306
his-myc-EK-C-LT-β49-306
his-myc-EK-C-LT-β126-306
Эти слитые белки анализировали электрофорезом на 12% ДСН-ПААГ в восстанавливающих условиях. Гели блоттировали на нитроцеллюлозные мембраны. Мембраны блокировали, инкубировали с моноклональным мышиным анти-myc-антителом или с анти-GST-антителом. Затем блоты инкубировали с конъюгированным пероксидазой хрена козьим антителом против мышиного IgG или конъюгированным пероксидазой хрена кроличьим антителом против козьего IgG. Могла быть показана экспрессия LT-β-слитых белков. LT-β-слитые белки анализировали на 12% ДСН-ПААГ в восстанавливающих условиях. Гели блоттировали на нитроцеллюлозные мембраны. Мембраны блокировали, инкубировали с моноклональным мышиным анти-myc-антителом (разведение 1:2000) или с анти-GST-антителом (разведение 1:2000). Затем блоты инкубировали с конъюгированным пероксидазой хрена козьим антителом против мышиного IgG (разведения 1:4000) или с конъюгированным пероксидазой хрена кроличьим антителом против козьего IgG (разведения 1:4000). GST-EK-C-LT-β49-306 и GST-EK-C-LT-β126-306 могли быть детектированы анти-GST-антителом при молекулярной массе 62 кДа и 48 кДа соответственно, his-myc-EK-C-LT-β49-306 и his-myc-EK-C-LT-β126-306 могли быть детектированы анти-myc-антителом при 40-56 кДа и 33-39 кДа соответственно.
С. Очистка GST-EK-C-LT-β49-306,GST-EK-C-LT-β126-306, his-myc-EK-C-LT-β49-306 и his-myc-EK-C-LT-β126-306.
GST-EK-C-LT-β49-306 и GST-EK-C-LT-β126-306 очищают на глутатион-сефарозной колонке, а his-myc-EK-C-LT-β49-306 и his-myc-EK-C-LT-β126-306 очищают на Ni-NTA-сефарозной колонке с использованием стандартных протоколов очистки. Эти очищенные белки расщепляют энтерокиназой и анализируют электрофорезом на 16% ДСН-ПААГ при восстанавливающих условиях.
D. Связывание C-LT-β49-306 и C-LT-β126-306 с VLP АР205.
Раствор 120 мкМ VLP АР205 в 20 мМ HEPES, 150 мМ NaCl, рН 7,2, взаимодействует в течение 30 минут с 25-кратным молярным избытком SMPH (Pierce), разведенным из исходного раствора в ДМСО, при 25°С на качалке. Затем реакционный раствор диализуют два раза в течение 2 часов против 1 л 20 мМ HEPES, 150 мМ NaCl, рН 7,2, при 4°С. Затем диализованная реакционная смесь VLP АР205 взаимодействует с раствором С-LT-β49-306 и С-LT-β126-306 (конечные концентрации: 60 мкМ VLP АР205, 60 мкМ С-LT-β49-306 и С-LT-β126-306) в течение четырех часов при 25°С на качалке. Продукты связывания анализируют электрофорезом в ДСН-ПААГ и Вестерн-блоттингом при восстанавливающих условиях.
ПРИМЕР 7
Клонирование, очистка и связывание VLP АР205 с MIF
А. Введение цис-содержащих линкеров, экспрессия, очистка крысиного ингибирующего миграцию макрофагов фактора MIF.
Крысиный ингибирующий миграцию макрофагов фактор (rMIF) рекомбинантно экспрессировали с тремя различными аминокислотными линкерами С1, С2 и С3, слитыми на его С-конце. Каждый из линкеров содержал один цистеин для связывания с VLP.
Конструирование rMIF-С1, rMIF-С2 и rMIF-С3
Сайт множественного клонирования (MCS) pET22b(+) (Novagen, Inc.) заменяли на GTTTAACTTTAAGAAGGAGATATACATATGGATCCGGCTAGCGCTCGAGGGTTTAAACGGCGGCCGCATGCACC (SEQ ID NO:71) заменой первоначальной последовательности от сайта NdeI до сайта XhoI отожженными праймером MCS-1F и праймером MCS-1R (отожжеными в 15 мМ Трис-HCl-буфере, рН 8). Полученная плазмида была названа pMod00, и она имеет сайты рестрикции NdeI, BamHI, NheI, XhoI, PmeI и NotI в ее MCS. Отожженную пару олигоBamhis6-EK-Nhe-F и Bamhis6-EK-Nhe-R и отожженную пару олиго1F-С-глициновый линкер и олиго1R-С-глициновый линкер лигировали вместе в расщепленную BamHI-NotI плазмиду pMod00 с получением pModEC1, которая имела N-концевую гексагистидиновую метку, сайт расщепления энтерокиназы и С-концевой аминокислотный глициновый линкер, содержащий один остаток цистеина. Отожженную пару олиго Bamhis6-EK-Nhe-F и Bamhis6-EK-Nhe-R вместе с отожженной парой олиго1F-С-гамма1-линкер и олиго1R-С-гамма1-линкер лигировали в расщепленную BamHI-NotI плазмиду pMod00 с получением pModEC2, которая имела N-концевую гексагистидиновую метку, сайт расщепления энтерокиназы и С-концевой γ1-линкер, содержащий один остаток цистеина. Отожженную пару олиго Bamhis6-EK-Nhe-F и Bamhis6-EK-Nhe-R, отожженную пару олиго1FА-С-гамма3-линкер и олиго1RА-С-гамма3-линкер и отожженную пару олиго1FВ-С-гамма3-линкер и олиго1RВ-С-гамма3-линкер лигировали вместе в расщепленную BamHI-NotI плазмиду pMod00 с получением pModEC3, которая имела N-концевую гексагистидиновую метку, сайт расщепления энтерокиназы и С-концевой γ3-линкер, содержащий один остаток цистеина, происходящий из шарнирной области мышиного иммуноглобулина γ3.
Плазмиду pBS-rMIF, которая содержит кДНК rMIF, амплифицировали при помощи ПЦР с олиго rMIF-F и rMIF-Xho-R. rMIF-F имел внутренний сайт NdeI, а rMIF-Xho-R имел внутренний сайт XhoI. Продукт ПЦР расщепляли NdeI и XhoI и лигировали в плазмиды pModEC1, pModEC2 и pModEC3, расщепленные теми же рестриктазами. Полученные плазмиды были названы pMod-rMIF-С1, pMod-rMIF-С2 и pMod-rMIF-С3 соответственно.
Для ПЦР-реакции 15 пмоль каждого из олиго и 1 нг ДНК-матрицы использовали в 50 мкл реакционной смеси (2 единицы PFX Platinum polymerase, 0,3 мМ dNTP и 2 мМ MgSO4). Температурные циклы были следующими: 94°С в течение 2 минут с последующими 30 циклами 94°С (30 секунд), 60°С (30 секунд), 68°С (30 секунд) и затем 68°С в течение 2 минут.
Все остальные стадии выполняли с использованием стандартных протоколов молекулярной биологии.
Последовательность олигонуклеотидов
праймер MCS-1F:
5'-TAT GGA TCC GGC TAG CGC TCG AGG GTT TAA ACG GCG GCC GCA T-3' (SEQ ID NO:72)
праймер MCS-1R:
5'-TCG AAT GCG GCC GCC GTT TAA ACC CTC GAG CGC TAG CCG GAT CCA-3' (SEQ ID NO:73)
Bamhis6-EK-Nhe-F:
5'-GAT CCA CAC CAC CAC CAC CAC CAC GGT TCT GGT GAC GAC GAT GAC AAA GCG CTA GCC C-3' (SEQ ID NO:74)
Bamhis6-EK-Nhe-R:
5'-TCG AGG GCT AGC GCT TTG TCA TCG TCG TCA CCA GAA CCG TGG TGG TGG TGG TGG TGT G-3' (SEQ ID NO:75)
олиго1F-C-глициновый линкер:
5'-TCG AGG GTG GTG GTG GTG GTT GCG GTT AAT AAG TTT AAA CGC-3' (SEQ ID NO:76)
олиго1R-C-глициновый линкер:
5'-GGC CGC GTT TAA ACT TAT TAA CCG CAA CCA CCA CCA CCA CCC-3' (SEQ ID NO:77)
олиго1F-C-гамма1-линкер:
5'-TCG AGG ATA AAA CCC ACA CCT CTC CGC CGT GTG GTT AAT AAG TTT AAA CGC-3' (SEQ ID NO:78)
олиго1R-C-гамма1-линкер:
5'-GGC CGC GTT TAA ACT TAT TAA CCA CAC GGC GGA GAG GTG TGG GTT TTA TCC-3' (SEQ ID NO:79)
олиго1FА-C-гамма3-линкер:
5'-TCG AGC CGA AAC CGT CTA CCC CGC CGG GTT CTT CTG-3' (SEQ ID NO:80)
олиго1RA-C-гамма3-линкер:
5'-CAC CAC CAG AAG AAC CCG GCG GGG TAG ACG GTT TCG GC-3' (SEQ ID NO:81)
олиго2FВ-C-гамма3-линкер:
5'-GTG GTG CTC CGG GTG GTT GCG GTT AAT AAG TTT AAA CGC-3' (SEQ ID NO:82)
олиго2RB-C-гамма3-линкер:
5'-GGC CGC GTT TAA ACT TAT TAA CCG CAA CCA CCC GGA G-3' (SEQ ID NO:83)
rMIF-F:
5'-GGA ATT CCA TAT GCC TAT GTT CAT CGT GAA CAC-3' (SEQ ID NO:84)
rMIF-XhoI-R:
5'-CCC GCT CGA GAG CGA AGG TGG AAC CGT TC-3' (SEQ ID NO:85)
Экспрессия и очистка rMIF-C
Компетентные клетки E. coli BL21 (DE3) трансформировали плазмидами pMod-rMIF-С1, pMod-rMIF-С2 и pMod-rMIF-С3. Отдельные колонии из чашек с агаром, содержащим ампициллин (Amp), размножали в жидкой культуре (SB с 150 мМ MOPS ("биологический буфер, морфолинопропансульфоновая кислота), рН 7,0, 200 мкг/мл Amp, 0,5% глюкозой)) и инкубировали при 30°С со встряхиванием при 220 об/мин в течение ночи. Затем 1 л SB (150 мМ MOPS, рН 7,0, 200 мкг/мл Amp) инокулировали 1:50 (об./об.) ночной культурой и выращивали до OD600=2,5 при 30°С. Экспрессию индуцировали 2 мМ IPTG. Клетки собирали после ночного культивирования и центрифугировали при 6000 об/мин. Клеточный осадок суспендировали в лизисном буфере (10 мМ Na2HPO4, 30 мМ NaCl, 10 мМ ЭДТА и 0,25% Твин-20) с 0,8 мг/мл лизоцима, обрабатывали ультразвуком и обрабатывали бензоназой. Затем 2 мл этого лизата пропускали через 20 мл колонки Q XL и 20 мл колонки SP XL. Белки rMIF-С1, rMIF-С2 и rMIF-С3 были в проходящем через колонку растворе.
Белковые последовательности rMIF-С транслировались из кДНК-последовательностей.
rMIF-С1 (SEQ ID NO:114; С1 представляет GGGGCG (SEQ ID NO:55))
rMIF-С2 (SEQ ID NO:115; С2 представляет PKPSTPPGSSGGAPGGCG (SEQ ID NO:116))
rMIF-С3 (SEQ ID NO:117; С3 представляет DKTHTSPPCG (SEQ ID NO:118))
Фиг.5А показывает схематическое описание конструкций MIF с добавленным аминокислотным линкером, содержащим остаток цистеина. MIF может быть белком из любого млекопитающего, в том числе без ограничения человеческим MIF (SEQ ID NO:119), крысиным MIF (SEQ ID NO:120) или мышиным MIF (SEQ ID NO:121). Последовательности MIF человека, содержащие С-концевой аминокислотный линкер С1, С2 или С3, показаны в SEQ ID NO:122-124). Фиг.5В показывает анализ с использованием электрофореза в ДСН-ПААГ очищенных конструкций MIF, проводимый в невосстанавливающих условиях с окрашиванием Кумасси бриллиантовым синим. На гель нанесены очищенные крысиные конструкции rMIF-С1 (SEQ ID NO:114); rMIF-С2 (SEQ ID NO:115) и rMIF-С3 (SEQ ID NO:117), описанные на фиг.5А.
ПРИМЕР 8
Клонирование, экспрессия, очистка и связывание RANKL
А. Введение аминокислотных линкеров, содержащих остаток цистеина, экспрессия и очистка мышиного RANKL.
Фрагмент рецепторного активатора лиганда ядерного фактора каппа b (RANKL), который был также назван фактором дифференцировки остеокластов, лигандом остеопротегерина и индуцированным связанной с фактором некроза опухолей активацией цитокином, рекомбинантно экспрессировали с N-концевым линкером, содержащим один цистеин для связывания с VLP.
Конструирование экспрессионных плазмид
С-концевой кодирующий район гена RANKL амплифицировали при помощи ПЦР с олигонуклеотидами RANKL-UP и RANKL-DOWN. RANKL-UP имел внутренний сайт ApaI, а RANKL-DOWN имел внутренний сайт XhoI. ПЦР-продукт расщепляли ApaI и XhoI и лигировали в плазмиду pGEX-6p1 (Amersham Pharmacia). Полученная плазмида бала названа pGEX-RANKL. Все стадии выполняли посредством стандартных протоколов молекулярной биологии и последовательность подтверждали. Плазмида pGEX-RANKL кодирует слитый белок глутатион-S-трансфераза-сайт расщепления протеазы Prescission-цистеинсодержащий аминокислотный линкер-RANKL (GST-PS-C-RANKL). Цистеинсодержащий аминокислотный линкер имел последовательность GCGGG. Эта конструкция содержит также гексагистидиновую метку между цистеинсодержащим аминокислотным линкером и последовательностью RANKL.
Олигонуклеотиды
RANKL-UP:
5'-CTGCCAGGGGCCCGGGTGCGGCGGTGGCCATCATCACCACCATCACCAGCGCTTCTCAGGAG-3' (SEQ ID NO:86)
RANKL-DOWN:
5'-CCGCTCGAGTTAGTCTATGTCCTGAACTTTGAAAG-3' (SEQ ID NO:87)
Белковая последовательность GST-PS-C-RANKL и кДНК-последовательность GST-PS-C-RANKL
Экспрессия и очистка С-RANKL
Компетентные клетки E. coli BL21 (DE3) трансформировали плазмидой pGEX-RANKL. Отдельные колонии из чашек с агаром, содержащим канамицин и хлорамфеникол, размножали в жидкой культуре (LB-среда, 30 мкг/мл канамицина, 50 мкг/мл хлорамфеникола) и инкубировали при 30°С при качании при 220 об/мин в течение ночи. Затем 1 л LB (с 30 мкг/мл канамицина) инокулировали 1:100 (об./об.) ночной культурой и выращивали до OD600=1 при 24°С. Экспрессию индуцировали 0,4 мМ IPTG. Клетки собирали после 16 часов и центрифугировали при 5000 об/мин. Клеточный осадок суспендировали в лизисном буфере (50 мМ Трис-HCl, рН=8; 25% сахароза; 1 мМ ЭДТА, 1% NaN3; 10 мМ ДТТ; 5 мМ MgCl2; 1 мг/мл лизоцима; 0,4 мкг/мл ДНКазы) в течение 30 минут. Затем добавляли 2,5 объемов буфера А (50 мМ Трис-HCl, рН=8,0; 1% Тритон Х-100; 100 мМ NaCl; 0,1% NaN3; 10 мМ ДТТ; 1 мМ ФМСФ) и инкубировали при 37°С в течение 15 минут. Клетки обрабатывали ультразвуком и осаждали при 9000 об/мин в течение 15 минут. Супернатант сразу же использовали для GST-аффинной хроматографии.
Колонку GST-Trap FF 5 мл (Amersham Pharmacia) уравновешивали в ЗФР, рН 7,3 (140 мМ NaCl, 2,7 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ К2HPO4). Супернатант наносили на 5 мл колонки GST-Trap FF и затем колонку промывали 5 колоночными объемами ЗФР. Белок GST-PS-C-RANKL элюировался 50 мМ Трис-HCl, рН=8,0, содержащим 10 мМ GSH.
Очищенный белок GST-PS-C-RANKL расщепляли с использованием протеазы PreScission (Amersham Pharmacia). Расщепление выполняли при 37°С в течение 1 часа с использованием молярного отношения 500/1 GST-PS-C-RANKL к PreScission.
Кроме того, реакция расщепления протеазой является реакцией со сменой буфера при помощи обессоливающей колонки HiPrep 26/10 (Amersham Pharmacia), фракции объединяли и немедленно использовали для другой стадии GST-аффинной хроматографии с применением описанных ранее условий. Очищенный С-RANKL анализировали электрофорезом в ДСН-ПААГ. Гель окрашивали Кумасси бриллиантовым синим. Расщепленный С-RANKL присутствует в проходящем растворе (несвязанной фракции), тогда как нерасщепленный GST-PS-C-RANKL, расщепленный GST-PS и протеаза PreScission остаются связанными с колонкой. Белок С-RANKL ожидаемого размера 22 кДа получали с высокой чистотой.
Пробы, нанесенные на гель, были следующими.
Дорожка 1: низкомолекулярный маркер. Дорожки 2 и 3: супернатант клеточных лизатов клеток BL21/DE3, трансформированных пустым вектором pGEX6p1 и pGEX-RANKL, соответственно, после шестнадцати часов индукции 0,4 мМ IPTG. Дорожка 4: очищенный белок GST-PS-C-RANKL после колонки GST-Trap FF. Дорожка 5: фракция, не связанная с колонкой GST-Trap FF. Дорожка 6: очищенный белок GST-PS-C-RANKL после расщепления протеазой PreScission. Дорожка 7: не связанная фракция колонки GST-Trap FF, нанесенная с расщеплением GST-RANKL, которая содержит очищенный С-RANKL. Дорожка 8: связанная фракция колонки GST-Trap FF, нанесенная с расщеплением GST-PS-C-RANKL и элюированная GSH.
В. Связывание С-RANKL с VLP АР205.
Раствор 120 мкМ VLP АР205 в 20 мМ HEPES, 150 мМ NaCl, рН 7,2, взаимодействует в течение 30 минут с 25-кратным молярным избытком SMPH (Pierce), разбавленным из исходного раствора в ДМСО, при 25°С на качалке. Затем реакционный раствор диализуют дважды в течение 2 часов против 1 л 20 мМ HEPES, 150 мМ NaCl, рН 7,2, при 4° С. Затем реакционная смесь диализованных VLP АР205 взаимодействует с раствором С-RANKL (конечные концентрации: 60 мкМ VLP АР205, 60 мкМ С-RANKL) в течение четырех часов при 25°С на качалке. Продукты связывания анализируют электрофорезом в ДСН-ПААГ и Вестерн-блоттингом при восстанавливающих условиях.
ПРИМЕР 9
Клонирование, экспрессия и очистка IL-5 с N-концевым аминокислотным линкером, содержащим остаток цистеина. Связывание с VLP и индукция иммунной реакции в мышах
А. Клонирование мышиного His-C-IL5 и экспрессия в виде телец включения в E. coli.
IL-5 амплифицировали из клона АТСС (pmIL5-4G; номер АТСС: 37562) при помощи ПЦР с использованием двух следующих праймеров: Spelinker3-F1 (SEQ ID NO:90) и Il5StopХho-R (SEQ ID NO:91). Продукт этой ПЦР использовали в качестве матрицы для второй ПЦР с праймерами Spelinker3-F2 (SEQ ID NO:92) и Il5StopXho-R. Инсерт расщепляли SpeI и NotI. Этот инсерт лигировали в производное вектора рЕТ (вектор pMODEC3-8), предварительно расщепленное NheI и NotI, и трансформировали в клетки E. coli TG1. Конструкция, генерированная клонированием IL-5 в pMODEC3-8, содержит от ее N-конца гексагистидиновую метку (для облегчения очистки), сайт расщепления энтерокиназы, произведенный из гамма 3 аминокислотный линкер (фланкированный на N-конце аминокислотами ALV и на С-конце AS), содержащий остаток цистеина, и ДНК, кодирующую зрелую форму белка IL-5. Правильность процедуры клонирования подтверждали секвенированием ДНК. Белок, высвобождаемый расщеплением энтерокиназой, был назван "мышиным С-IL-5-Е".
Конструкция, содержащая IL-5, описанная выше, была названа pMODС6-IL5.2 (также называемая pMODС6-IL5), и ее трансформировали в штамм E. coli BL21-DE3. Рекомбинантный белок, экспрессируемый в E. coli, был назван His-С-IL5.
Клональные клетки BL21-DE3, несущие pMODС6-IL5, выращивали в течение ночи в 5 мл LB-среды, содержащей 1 мг/л ампициллина. Аликвоту 2,0 мл этой культуры разбавляли в 100 мл "превосходного бульона" (ТВ), содержащего 1 мг/л ампициллина. Культуру выращивали до оптической плотности, OD600нм, 0,7-1,0 и экспрессию индуцировали в течение 4 часов добавлением 0,1 мл 1,0 М исходного раствора изопропил-β-D-тиогалактопиранозида (IPTG). Пробы брали каждые 2 часа. Рекомбинантный His-С-IL5 экспрессировался в нерастворимой форме и был локализован во фракции телец включения индуцированных клеток. Экспрессию His-С-IL5 подтверждали следующим образом. Пробу 10 мл брали спустя 4 часа после индукции и центрифугировали в течение 10 минут при 4000 g. Осадок суспендировали в 0,5 мл лизисного буфера, состоящего из 50 мМ Трис-HCl, 2 мМ ЭДТА, 0,1% Тритона Х-100 (рН 8,0). К этой суспензии добавляли 20 мкл лизоцима (40 мг/мл) и спустя 30 минут при 4°С обрабатывали ультразвуком в течение 2 минут. Добавляли аликвоту 1,0 мл бензоназы и аликвоту 100 мкл 50 мМ MgCl2 и инкубировали в течение 30 минут при комнатной температуре. После центрифугирования в течение 15 минут при 13000 g супернатант выбрасывали и осадок нагревали в течение 5 минут при 98°С в 100 мкл ДСН-буфера для нанесения. Затем аликвоты 10 мкл анализировали электрофорезом в ДСН-ПААГ при восстанавливающих условиях. Анализ электрофорезом в ДСН-ПААГ показал полосу белка 17 кДа, соответствующую молекулярной массе IL-5. В качестве контроля клетки BL21-DE2, содержащие pMODC6-IL5, выращивали в отсутствие IPTG и экстракты получали из нерастворимой фракции клеток, как описано выше.
В. Очистка и рефолдинг мышиного His-С-IL5.
Более крупномасштабную экспрессию IL-5 из клона pMODC6-IL5 в клетках BL21-DE3 выполняли для получения достаточных количеств чистого IL-5 для приготовления вакцины. Ночные культуры выращивали и разбавляли в объемах либо 100 мл, либо 1 л ТВ-среды, содержащей 1,0 мг/л ампициллина. Таким образом получали в целом 3 литра культуры и выращивали при 37°С, пока OD600нм не достигала 0,7, после чего добавляли IPTG с получением конечной концентрации 1,0 мМ. После 4 часов инкубирования клетки собирали центрифугированием в течение 30 минут при 10000 g. После сбора осадок ресуспендировали в ЗФР (5,0 мл/г сырого веса) и центрифугировали в течение 15 минут при 10000 g. Промытый осадок хранили при -20°С до последующего использования.
Этот бактериальный осадок суспендировали в ЗФР (2,0 мл/г сырого веса клеток) с использованием гомогенизатора Даунса. К этой суспензии добавляли лизоцим (0,8 мг/мл) и инкубировали в течение 30 минут при комнатной температуре. Эту суспензию обрабатывали ультразвуком в течение 1 минуты, 3 раза на льду, затем добавляли бензоназу и MgCl2 (конечная концентрация 10 мМ) и инкубировали в течение 30 минут при комнатной температуре. Добавляли Тритон Х-100 до конечной концентрации 1% (масса/объем), эту смесь осторожно перемешивали при комнатной температуре в течение 30 минут. Раствор центрифугировали в течение 20 минут при 20000 g (в пробирках SS34) и супернатант выбрасывали. Осадок, несущий тельца включения, суспендировали (5,0 мл/г сырого веса) в промывном буфере (ЗФР, содержащем 2 М мочевину и 1% (масса/объем) Тритон Х-100) с использованием гомогенизатора Даунса и перемешивали в течение 5 минут. Раствор центрифугировали в течение 20 минут при 20000 g и супернатант выбрасывали. Осадок промывали и центрифугировали, как описано выше, еще 2 раза. Конечную промывку телец включения выполняли промывным буфером в отсутствие Тритона Х-100.
His-С-IL-5, присутствующий в тельцах включения этого осадка, солюбилизировали (5,0 мл/г сырого веса клеток) в денатурирующем буфере (100 мМ NaH2PO4, 10 мМ Трис-HCl, 6,0 М гидрохлорид гуанидина, рН 8,0) и осторожно перемешивали в течение 1 часа при 25°С. Эту суспензию центрифугировали в течение 20 минут при 20000 g и супернатант смешивали со смолой Ni-NTA (QIAgen, уравновешенной буфером для солюбилизации). После 3 часов осторожного перемешивания при 4°С суспензию выливали в стеклянную колонку (С10/10) и смолу промывали раствором 100 мл 100 мМ NaH2PO4, 10 мМ Трис, 6,0 М гидрохлорида гуанидина (рН 6,3). Дополнительную стадию промывания выполняли с использованием 15 мл раствора 100 мМ NaH2PO4, 10 мМ Трис, 6,0 М гидрохлорида гуанидина (рН 5,9). Мышиный His-С-IL5 элюировали из смолы нанесением 20 мл раствора 100 мМ NaH2PO4, 10 мМ Трис, 6, 0 М гидрохлорида гуанидина (рН 4,5). Очистку анализировали электрофорезом в ДСН-ПААГ.
Фракции из стадии элюции, содержащие His-С-IL-5, объединяли и диализовали против буфера, содержащего 8,0 М мочевину, 100 мМ NaH2PO4, 10 мМ Трис-HCl (рН 8,0) при 4°С с использованием мембраны с пределом отсечения 10 кДа. После диализа концентрацию белка определяли спектрофотометрически с использованием следующей формулы: белок (мг/мл) = (1,55×А280нм) - (0,76×А260нм). Концентрацию белка разбавляли диализным буфером до 0,2 мг/мл. Затем этот раствор диализовали с использованием мембраны 3,5 кДа в течение 24 часов при 4°С против буфера рефолдинга 1, содержащего 2,0 М мочевину, 50 мМ NaH2PO4, 5 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 0,5 М аргинин, 10% (об./об.) глицерин (рН 8,5), и в течение дополнительных 24 часов против другого буфера рефолдинга 2, содержащего 50 мМ NaH2PO4, 5 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 0,5 М аргинин, 10% (об./об.) глицерин (рН 8,5). В конце концов этот белок диализовали в течение 24 часов при 4°С против ЗФР, рН 8,0, затем центрифугировали при 10000 g в течение 30 минут. Содержание белка супернатанта определяли по способу Бредфорда.
Для дальнейшей очистки His-С-IL5 выполняли ионообмен с использованием смолы Hitrap Q (Amersham Pharmacia, Uppsala Sweeden). His-С-IL5 концентрировали до 1 мг/мл при помощи центрифужных фильтров (Ultrafree-15 Millipore, предел отсечения 10 кДа) и диализовали в течение 14 часов против 50 мМ фосфатного буфера, рН 8,4. Этот раствор наносили на колонку Hitrap Q и промывали 50 мМ фосфатным буфером, рН 8,4. His-С-IL5 элюировали из этой колонки с использованием NaCl-градиента от 0 до 1 М. His-С-IL5 элюировался из этой колонки при 100 мМ NaCl. Анализ очистки выполняли электрофорезом в ДСН-ПААГ и концентрацию белка измеряли способом Бредфорда. Четвертичную структуру белка оценивали электрофорезом в ДСН-ПААГ, выполняемым при невосстанавливающих условиях, который выявил, что His-С-IL5 присутствует в этом препарате в виде димера.
С. Получение вакцины: связывание His-С-IL5 с VLP АР205.
Различные условия могут быть испытаны для оптимизации эффективности реакции связывания. Они включают в себя добавление восстановителя (ТСЕР) к His-С-IL5 и варьирование молярных отношений мономера субъединицы VLP и His-С-IL5 в реакции связывания. Вакцину АР205-His-С-IL5 получают следующим образом. Очищенный His-С-IL5 (40 мкМ) восстанавливают в течение 1 часа эквимолярным количеством ТСЕР в ЗФР, рН 8,0. Восстановленный IL-5 (20 мкМ) инкубируют в течение 4 часов при 22°С с 10 мкМ Qβ, дериватизованным SMPH, в общем объеме 700 мкл. Реакционную смесь диализуют в течение 12 часов против ЗФР, рН 8,0, с использованием диализной мембраны с пределом отсечения 300 кДа. Реакцию связывания анализируют электрофорезом в ДСН-ПААГ и Вестерн-блоттингом с анти-His- и анти-АР205-антителами (поликлональной кроличьей антисывороткой). Концентрацию белка измеряют по Бредфорду. Эффективность связывания [т.е. моль Qβ-IL-5/моль мономера Qβ (всего)] измеряют денситометрическим анализом соответствующих полос на окрашенном Кумасси синим геле электрофореза в ДСН-ПААГ.
D. Анализ активности IL-5.
Способность линии клеток В-клеточной лимфомы BCL1 пролиферировать в ответ на мышиный IL-5 использовали для проверки биоактивности повторно уложенного рекомбинантного His-С-IL-5 (Harriman G.R. (1991) Current Protocols in Immunology 6.5.1-6.5.5 John Wiley and Sons Inc.). Может быть также оценена пролиферативная активность His-С-IL5, ковалентно связанного с VLP АР205. В качестве контроля использовали рекомбинантный мышиный IL-5 ((R&D systems, Minneapolis USA). Различные формы рекомбинантного IL-5 инкубировали в плоскодонных 96-луночных планшетах с 2·104 BCL1-клеток на лунку в течение 24 часов при 37°С, 5% СО2. В каждую лунку добавляли 1 мкКи3Н-тимидина (Hartmann Analytic, Switzerland) и планшеты инкубировали еще в течение 6 часов при 37°С, 5% СО2. Эти клетки собирали, промывали и включение тимидина определяли счетом β-излучения с использованием жидкостного сцинтилляционного счетчика. Этот анализ показал, что His-С-IL5 является активным.
Е. Протокол иммунизации.
Для генерирования аутореактивных антител к мышиному IL-5 четырех мышей Balb/c инъецируют подкожно в день 0 и в день 14 25 мкг вакцины АР205-His-C-IL5 в 200 мкл ЗФР. В качестве контроля пять мышей иммунизируют в день 0 и в день 14 простой смесью 6,4 мкг VLP АР205 и 16 мкг IL-5, т.е. не связанных ковалентно (АР205 + His-C-IL5) в ЗФР. У мышей берут кровь перед иммунизацией и в день 21 протокола иммунизации. Сыворотки анализируют при помощи ELISA.
F. Анализ сывороток.
ELISA. Планшеты ELISA Maxisorp (Nunc) покрывают 50 мкл очищенного His-C-IL-5 (3 мкг/мл) в течение 14 часов при 4°С. Эти планшеты промывают 3 раза ЗФР и блокируют 2% БСА в ЗФР в течение 2 часов при 37°С и затем промывают дважды ЗФР. Пятикратные разведения сывороток добавляют в 2% БСА, 0,1% ФТС в ЗФР и инкубируют при комнатной температуре в течение 1 часа. Затем планшеты промывают 3 раза ЗФР и инкубируют с антителами против мышиного IgG, конъюгированными с HRP (разведение 1:1000) при комнатной температуре в течение 1 часа. Эти планшеты опять промывают 3 раза ЗФР и добавляют 100 мкл на лунку проявляющего раствора (0,066 М Na2HPO4, 0,035 М лимонная кислота, 0,032% Н2О2, 0,4% дигидрохлорид 1,2-фенилендиамина). После 5 минут реакции при комнатной температуре ELISA останавливают 50 мкл на лунку 5% H2 SO4. Оптическую плотность измеряют при 450 нм на спектрофотометре Spectramax (Molecular Devices).
ПРИМЕР 10
Клонирование, экспрессия и связывание мышиного прионового белка
А. Введение аминокислотного линкера, содержащего остаток цистеина, экспрессия и очистка процессированной (укороченной) формы мышиного прионового белка.
Укороченную форму (аминокислоты 121-230) мышиного прионового белка (названного mPrPt) рекомбинантно экспрессировали с аминокислотным линкером GGGGCG (SEQ ID NO:55), слитым на ее С-конце, для связывания с VLP АР205. Этот белок сливали с N-концом человеческого Fc-фрагмента для очистки. Сайт расщепления энтерокиназы (ЕК) вводили после сайта расщепления ЕК для отщепления Fc-части слитого белка после очистки.
Конструирование mPrPt-EK-Fc*
Мышиный PrPt амплифицировали при помощи ПЦР с праймером 5'PrP-BamHI и 3'PrP-NheI с использованием плазмиды pBRCMVPrP-Fc в качестве матрицы. pBRCMVPrP-Fc содержала последовательность дикого типа мышиного прионового белка. 5'PrP-BamHI содержал внутренний сайт BamHI и содержал ATG, а 3'PrP-NheI имел внутренний сайт NheI.
Для ПЦР-реакции 0,5 мкг каждого праймера и 200 нг ДНК-матрицы использовали в 50 мкл реакционной смеси (1 единица PFX Platinum polymerase, 0,3 мМ dNTP и 2 мМ MgSO4). Температурные циклы были следующими: 94°С в течение 2 минут с последующими 5 циклами 94°С (15 секунд), 50°С (30 секунд), 68°С (45 секунд) и с последующими 20 циклами 94°С (15 секунд), 64°С (30 секунд), 68°С (45 секунд) и затем 68°С в течение 10 минут.
Продукт ПЦР расщепляли BamHI и NheI и встраивали в pCEP-SP-EK-Fc*, содержащую линкерную последовательность GGGGCG (SEQ ID NO:55) на 5'-конце последовательности расщепления ЕК. Полученная плазмида была названа pCEP-SP-mPrPt-EK-Fc*.
Все остальные стадии выполняли с использованием стандартных протоколов молекулярной биологии.
Олиго
Праймер 5'PrP-BamHI
5'-CGG GAT CCC ACC ATG GTG GGG GGC CTT GG-3' (SEQ ID NO:88)
Праймер 3'PrP-NheI
5'- CTA GCT AGC CTG GAT CTT CTC CCG-3' (SEQ ID NO:89)
Экспрессия и очистка mPrPt-EK-Fc*
Плазмиду pCEP-SP-mPrPt-EK-Fc* трансфицировали в клетки 293-EBNA (Invitrogen) и очищали на протеин А-сефарозной колонке, как описано в примере 4. mPrPt после отщепления имеет последовательность, идентифицированную в SEQ ID NO:324, с линкером GGGGCG на ее С-конце. Очищенный слитый белок mPrPt -EK-Fc* расщепляли энтерокиназой и анализировали электрофорезом в 16% ДСН-ПААГ-геле при восстанавливающих условиях до и после расщепления энтерокиназой. Этот гель окрашивали Кумасси бриллиантовым синим. Слитый белок mPrPt-EK-Fc* мог быть детектирован в виде полосы 50 кДа. Отщепленный белок mPrPt, содержащий аминокислотный линкер GGGGCG (SEQ ID NO:55), слитый на его С-конце, мог быть детектирован в виде широкой полосы между 18 и 25 кДа. Идентичность mPrPt подтверждали Вестерн-блоттингом (данные не показаны). Таким образом, mPrPt, с С-концевым аминокислотным линкером, содержащим остаток цистеина, мог быть экспрессирован и очищен для использования для связывания с VLP АР205.
Пробы, нанесенные на гель, были следующими.
Дорожка 1: маркер молекулярной массы. Дорожка 2: mPrPt-EK-Fc* перед отщеплением. Дорожка 3: mPrPt после отщепления.
В. Связывание mPrPt с VLP АР205.
Раствор 120 мкМ VLP АР205 в 20 мМ HEPES, 150 мМ NaCl, рН 7,2, взаимодействует в течение 30 минут с 25-кратным молярным избытком SMPH (Pierce), разбавленным из исходного раствора в ДМСО, при 25°С на качалке. Затем реакционный раствор диализуют дважды в течение 2 часов против 1 л 20 мМ HEPES, 150 мМ NaCl, рН 7,2, при 4°С. Затем реакционная смесь диализованных VLP АР205 взаимодействует с раствором mPrPt (конечные концентрации: 60 мкМ VLP АР205, 60 мкМ mPrPt) в течение четырех часов при 25°С на качалке. Продукты связывания анализируют электрофорезом в ДСН-ПААГ и Вестерн-блоттингом при восстанавливающих условиях.
ПРИМЕР 11
Связывание rMIF с VLP АР205
0,18 мМ rMIF-С1 (SEQ ID NO:114), экспрессированный и очищенный, как описано в примере 7, в 20 мМ HEPES, 150 мМ NaCl, рН 7,2, инкубировали с одним молярным эквивалентом ТСЕР в течение 1 часа при комнатной температуре перед использованием в реакции связывания. 1 мл раствора VLP АР205, 2,5 мг/мл, взаимодействовал с 2,3-кратным молярным избытком SMPH в течение 1 часа при комнатной температуре. Эти дериватизованные VLP АР205 диализовали два раза в течение 2 часов против 2 л 20 мМ HEPES, 150 мМ NaCl, рН 7,2. Затем 820 мкл диализованных дериватизованных VLP АР205 (0,18 мМ) взаимодействовали с 820 мкл 0,18 мМ раствора rMIF-С1, предварительно обработанного ТСЕР, как описано выше, в течение 3 часов при комнатной температуре. В конце этой реакции связывания не наблюдали осадка, эти пробы анализировали электрофорезом в ДСН-ПААГ при восстанавливающих условиях и гель окрашивали Кумасси бриллиантовым синим. Результат этой реакции связывания показано на фиг.6. Субъединица VLP АР205 имеет молекулярную массу 14 кДа, в то время как rMIF-С1 имеет молекулярную массу 13 кДа. Продукт связывания мигрирует, как ожидалось, со средней молекулярной массой 27 кДа, как показано на фиг.6.
На фиг.6 показан результат реакции связывания rMIF-С1 с VLP АР205. Дорожка 1: молекулярный маркер. Дорожка 2: VLP АР205. Дорожка 3: дериватизованная VLP АР205. Дорожка 4: диализованная, дериватизованная VLP АР205. Дорожка 5: диализованная, дериватизованная VLP АР205. Дорожка 6: реакция связывания rMIF-С1 с VLP АР205. Продукт связывания указан стрелкой на этой фигуре. Молекулярные массы маркерных белков указаны на левой границе геля.
ПРИМЕР 12
Иммунизация мышей и крыс rMIF, связанным с VLP АР205
А. Иммунизация мышей VLP АР205, связанной с rMIF-С1.
VLP АР205, связанную с rMIF-С1 (из примера 11), инъецировали подкожно в самок мышей Balb/c (3 мышей) в день 0 и день 14. Каждую мышь иммунизировали 10 мкг вакцины, разведенной в ЗФР до 200 мкл. У мышей брали кровь ретроорбитально в день 21 и титр антител, специфических в отношении rMIF-С1, измеряли в ELISA, специфическом для rMIF-С1, следующим образом.
Планшеты ELISA покрывали rMIF-С1 в концентрации 5 мкг/мл. Планшеты блокировали и затем инкубировали с серийно разведенными мышиными сыворотками. Связанные антитела детектировали с меченым ферментом антителом против мышиного IgG. В качестве контроля испытывали также неиммунные сыворотки тех же самых мышей.
Иммунизация с использованием rMIF-С1, связанного с VLP АР205, приводила к сильной специфической иммунной реакции против rMIF-С1 (фиг.7), вследствие чего средний титр трех мышей против rMIF-С1, определенный в виде разведения сыворотки, дающего полумаксимальную OD, был 1:31000. Таким образом, rMIF-С1 был должным образом представлен VLP АР205 и был доступен иммунной системе для индуцирования сильной иммунной реакции.
На фиг.7 показан анализ с использованием ELISA IgG-реакции, специфической для rMIF-С1, в сыворотках мышей, иммунизированных rMIF-С1, связанным с VLP АР205. Анализ сывороток в день 21 трех мышей (М1, М2 и М3) выполняли в двух повторностях. Трехкратные разведения сывороток наносили в лунку. "Неиммунная" означает неиммунную сыворотку (т.е. перед иммунизацией) одной мыши, впоследствии иммунизированной rMIF-С1, связанным с VLP АР205.
В. Иммунизация крыс VLP АР205, связанным с rMIF-С1.
VLP АР205, связанную с rMIF-С1 (из примера 12), инъецировали подкожно (s.c.) в крыс (3 крысы в каждом случае) в день 0 и день 28 в отсутствие адъюванта. Каждую крысу иммунизировали 50 мкг вакцины, разведенной в ЗФР до 200 мкл. У крыс брали кровь в день 42 и титр антител, специфических в отношении rMIF-С1, измеряли в ELISA, специфическом для rMIF-С1, как описано выше, но с использованием меченного ферментом вторичного антитела против крысиного IgG.
ПРИМЕР 13
Связывание пептида Angio I с VLP АР205 и иммунизация мышей
А. Связывание пептида Angio I с VLP АР205.
Пептид Angio I, имеющий последовательность ангиотензина II (DRVYIHPF) (SEQ ID NO:13), слитый на его N-конце с линкерной последовательностью CGG, содержащей остаток цистеина для связывания с активированным VLP, синтезировали химически. VLP АР205, экспрессированную и очищенную, как описано в примере 2, повторно солюбилизировали в буфере 20 мМ HEPES, 150 мМ NaCl, рН 7,4 (HBS-буфере). Затем повторно солюбилизированная VLP АР205 взаимодействовала в концентрации 2 мг/мл (как определено в способе Бредфорда) с 1,43 мМ SMPH (Pierce) в течение 30 минут при комнатной температуре (КТ). Затем реакционную смесь диализовали дважды против HBS-буфера в течение 2 часов при 4°С, и она взаимодействовала с 1,144 мМ пептидом Angio I (последовательность: CGGDRVYIHPF (SEQ ID NO:12), свободный амин и свободная кислота)), разведенным в реакционной смеси из 50 мМ исходного раствора в ДМСО. Реакции связывания давали протекать в течение 2 часов при 15°С, и эту реакционную смесь диализовали 2 раза в течение 2 часов против 1000-кратного объема HBS и быстро замораживали в жидком азоте в виде аликвот для хранения при -80°С до последующего использования.
Аликвоту оттаивали и связывание антигена с субъединицей АР205 оценивали электрофорезом в ДСН-ПААГ, концентрацию белка измеряли в способе Бредфорда. Эффективность связывания этого пептида с VLP АР205, определенная по сумме интенсивностей полос, соответствующих 1, 2 или 3 пептидам, связанным на субъединицу мономера, деленной на сумму интенсивностей связанных и несвязанных мономерных субъединиц, была равна 88%. Оптическую плотность эпитопа измеряли подобно измерению эффективности связывания, с той модификацией, что интенсивность связывания связанных полос умножали на число связанного пептида на субъединицу в соответствующей полосе, в нумераторе. Плотность эпитопа была 1,6 пептидов Angio I на субъединицу VLP АР205.
В. Иммунизация мышей VLP АР205, связанной с пептидом Angio I.
VLP АР205, связанные с пептидом Angio I, полученные, как описано в части А, инъецировали подкожно (s.c.) в трех мышей в день 0 и день 14 в отсутствие адъюванта. Каждую мышь иммунизировали 25 мкг вакцины, разведенной в ЗФР до 200 мкл. У мышей брали кровь ретроорбитально в день 21 и титр антител, специфических в отношении пептида Angio I, измеряли при помощи ELISA. Пептид Angio I связывали с бычьей РНКазой А с использованием химического сшивающего линкера сульфо-SPDP. Планшеты ELISA покрывали связанной с Angio I РНКазой в концентрации 10 мкг/мл. Планшеты блокировали и затем инкубировали с серийно разведенными мышиными сыворотками. Связанные антитела детектировали с меченными ферментом антителами против мышиного IgG. В качестве контроля испытывали также неиммунные сыворотки тех же самых мышей. Результаты показаны на фиг.8.
Фиг.8 показывает анализ ELISA IgG-антител, специфических для пептида Angio I, в сыворотках трех мышей (1-3), иммунизированных в день 0 и день 14 против пептида Angio I, связанного с VLP АР205. Общие IgG-титры определяли в сыворотках в день 21. В анализируемой неиммунной сыворотке не смогли детектировать антитела, специфические для пептида Angio I. Получали очень высокий специфический титр против Angio I 1:69000 в среднем (выраженный в виде разведения, дающего полумаксимальную OD при 450 нм), что свидетельствовало о том, что аутотолерантность против Angio I ("своего" пептида в этих мышах) была разрушена. Эти результаты демонстрируют, что после связывания антигенов с VLP АР205 были получены вакцины с очень высокой презентацией пептидов. Эти результаты показывают также, что после связывания аутоантигенов с VLP АР205 и последующей иммунизации полученной вакциной в отсутствие адъюванта получены очень высокие титры против этих аутоантигенов.
Теперь, после полного описания данного изобретения с некоторыми подробностями в качестве иллюстрации и примера для целей ясности понимания, специалисту с обычной квалификацией в данной области будет очевидно, что то же самое может быть выполнено посредством модификации или изменения данного изобретения в широком и эквивалентном диапазоне условий, композиций и других параметров без отклонения от объема данного изобретения или его любого конкретного варианта и что предполагается, что такие модификации или изменения находятся в пределах объема прилагаемой формулы изобретения.
Все публикации, патенты и заявки на патенты, упоминаемые в этом описании, указывают на уровень квалификации специалистов, имеющих квалификацию в области, к которой относится данного изобретения, и включены здесь в качестве ссылки в той же самой степени, как если бы каждая отдельная публикация, патент или заявка на патент были конкретно и отдельно указаны как включенные в качестве ссылки.








































Реферат
Данное изобретение относится к композиции, содержащей вирусоподобную частицу АР205 (VLP) и антиген. Данное изобретение относится также к способу получения антигена или антигенной детерминанты, связанной с VLP AP205. VLP AP205, связанные с антигеном, применяются в получении композиций для индукции иммунных реакций. Композиции применяются для профилактики или лечения заболеваний, нарушений или состояний, в том числе инфекционных заболеваний, аллергий, рака, злоупотребления лекарственным средством, отравления, и для эффективной индукции аутоспецифических иммунных реакций, в частности реакций в виде образования антител. 6 н. и 37 з.п. ф-лы, 15 ил., 1 табл.

Комментарии