Конъюгированные через cys80 иммуноглобулины - RU2756101C2
Код документа: RU2756101C2
Чертежи











Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США № 62/182,020, поданной 19 июня 2015 года, содержание которой полностью включено в настоящую заявку посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и полностью включен в настоящую заявку посредством ссылки. Копия ASCII, созданная 16 июня 2016 года, названа 104018.000953_SL.txt и имеет размер 379,441 байт.
область техники
[0003] Согласно настоящему изобретению предложены конъюгированные через Cys80 иммуноглобулины и способы их получения.
уровень техники
[0004] Спектр применения моноклональных антител включает как фундаментальные исследования, так и использование в терапевтических и диагностических целях. Возможность конъюгирования антител с функциональными агентами еще больше расширяет их функциональность. Получение конъюгированных антител обычно включает конъюгирование линкера, лекарственного средства или другого функционального агента с реакционноспособными остатками лизина или цистеина на тяжелой (HC) и легкой (LC) цепях моноклонального антитела (mAb). Конъюгирование лизина, как правило, опосредовано химическими реакциями на основе сукцинимида (NHS) или изотиоцианата. Учитывая количество экспонированных на поверхности антитела лизинов, подходы, связанные с конъюгированием на основе амина, приводят к модификации множества лизинов, несмотря на то, что не все остатки лизина модифицируются в одинаковой степени. Таким образом, конечный продукт представляет собой гетерогенную смесь mAb с различным соотношением лекарственное средство-антитело (DAR).
[0005] Большинство цистеинов молекулы антитела образуют меж- или внутрицепочечные дисульфидные связи. Конъюгирование с цистеинами, таким образом, требует по меньшей мере частичного восстановления антитела. Подобно конъюгированию через лизин, конъюгирование через цистеин приводит к получению гетерогенной смеси конъюгированных антител, различающихся по нагрузке лекарственного средства и сайтам конъюгации. Каждый вид конъюгированного антитела может иметь различные свойства, которые в свою очередь могут приводить к широкой вариабельности фармакокинетических свойств in vivo. Кроме того, такая гетерогенность может затруднять получение конъюгированного антитела.
краткое описание изобретения
[0006] В настоящей заявке описаны способы получения конъюгированного иммуноглобулина, включающие: декэпирование цистеина в положении аминокислоты 80 («Cys80») в вариабельной области легкой цепи иммуноглобулина, полученного от кролика, где указанный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи; и конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0007] Также предложены способы получения антиген-связывающей молекулы, включающие инкубирование первого конъюгированного иммуноглобулина со вторым конъюгированным иммуноглобулином для получения указанной антиген-связывающей молекулы, где: первый конъюгированный иммуноглобулин содержит первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым способным реагировать с тиолом соединением, содержащим первую способную реагировать с тиолом группу; и второй конъюгированный иммуноглобулин содержит вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым способным реагировать с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
[0008] Согласно настоящему изобретению предложены иммуноглобулины, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys, а также молекулы нуклеиновой кислоты, кодирующие указанные иммуноглобулины, и клетки-хозяева, содержащие указанные молекулы нуклеиновой кислоты.
[0009] Также предложены конъюгированные иммуноглобулины, содержащие описанные иммуноглобулины, в которых цистеин в положении 80 конъюгирован с реагирующим с тиолом соединением, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0010] В настоящей заявке также описаны способы лечения рака у субъекта, включающие введение указанному субъекту фармацевтически эффективного количества иммуноглобулина против иммуноглобулина, где указанный иммуноглобулин против мезотелина содержит любой из описанных иммуноглобулинов против мезотелина и реагирующее с тиолом соединение, содержащее способную реагировать с тиолом группу, линкер и функциональный агент.
[0011] Согласно настоящему изобретению предложены антиген-связывающие молекулы, содержащие: первый конъюгированный иммуноглобулин, содержащий первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым реагирующим с тиолом соединением, содержащим первую способную реагировать с тиолом группу, и второй конъюгированный иммуноглобулин, содержащий вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым реагирующим с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
[0012] В настоящей заявке также описаны вариабельные области легких цепей для применения в конъюгированном иммуноглобулине, где указанные вариабельные области легких цепей содержат цистеин в положении аминокислоты 80 («Cys80») и аминокислотный остаток в положении 83, отличный от Phe, Lys или Cys, где Cys80 является неспаренным.
краткое описание графических материалов
[0013] Рассмотрение краткого описания изобретения, а также следующего далее подробного описания изобретения совместно с прилагаемыми чертежами обеспечивает лучшее понимание изобретения. Для иллюстрации описанных способов, конъюгированных иммуноглобулинов, антиген-связывающих молекул, иммуноглобулинов и вариабельных областей легких цепей, типичные варианты реализации изобретения проиллюстрированы в чертежах; однако способы, конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей не ограничиваются конкретными описанными вариантами реализации.
Чертежи:
[0014] На Фигуре 1 представлено выравнивание последовательностей легких цепей кролика и человека. (A) Выравнивание последовательностей генов Vκ зародышевых линий кролика (IGKV1S2, X02336) и человека (IGKV1-5, Z00001). Жирный шрифт указывает на Cys80 (в соответствии с нумерацией по Kabat или Chothia) в последовательности кролика. (B) Выравнивание последовательностей Cκ зародышевых линий кролика (IGKC1, K01360) и человека (IGKC, J00241). Жирный шрифт указывает на Cys171 (EU-нумерация) в последовательности кролика.
[0015] На Фигуре 2 представлена структурная модель (A) mAb кролика, показывающая дисульфидную связь Cys80-Cys171, (B) структурная модель mAb человека и (C) структурная модель гибридного mAb, происходящего от кролика/человека, показывающая неспаренный Cys80.
[0016] На Фигуре 3 показано выравнивание семейств генов Vκ зародышевой линии кролика. Остаток в положении 80 указан стрелкой.
[0017] На Фигуре 4 показан пример масс-спектрометрического анализа легкой цепи xi155D5 при (A) восстановлении с применением жестких условий (20 мМ ДТТ, 60°C, 5 минут) и (B) восстановлении с применением мягких условий (100 мкМ ДТТ, 22°C, 30 минут).
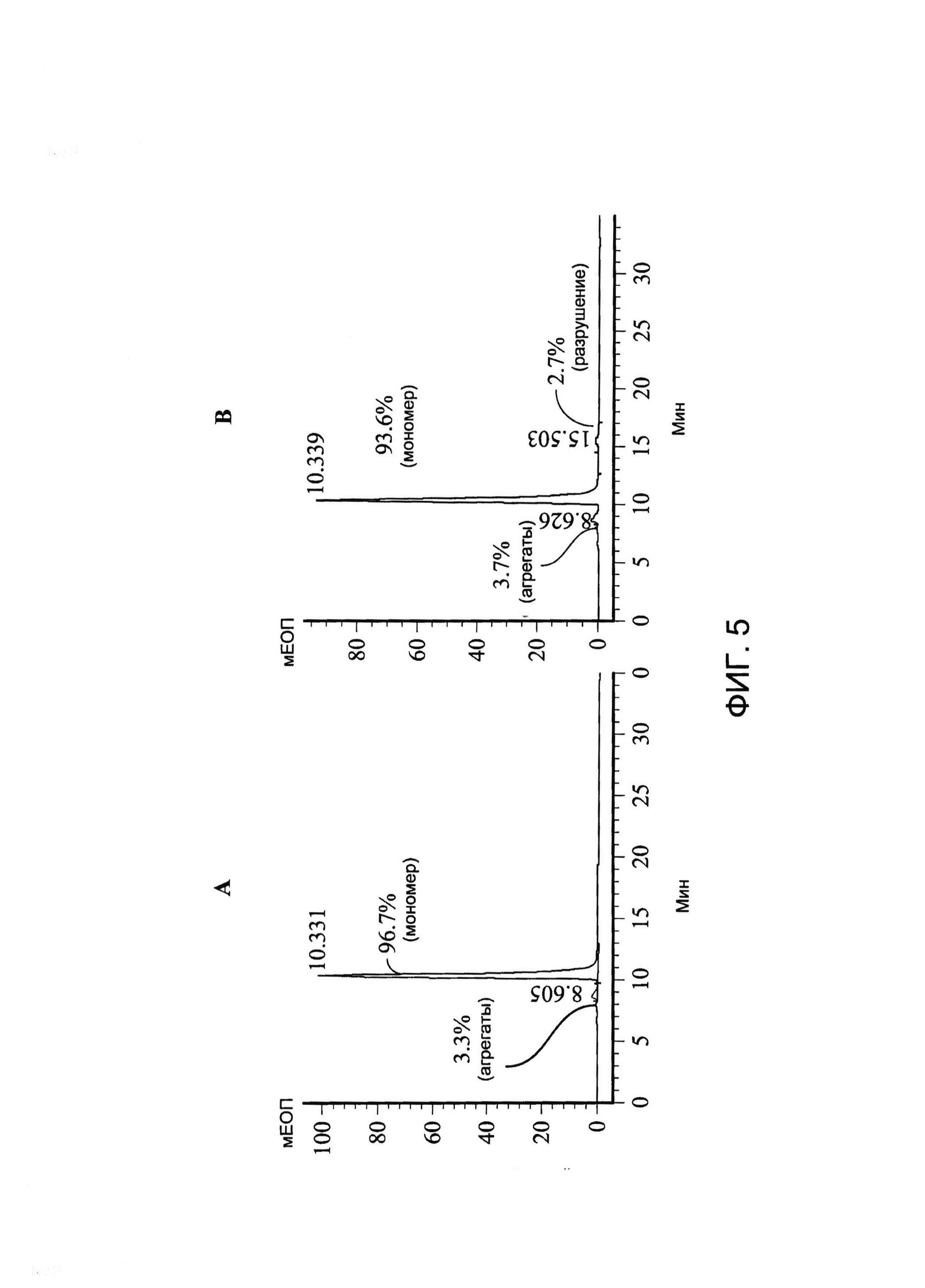
[0018] На Фигуре 5 показан пример анализа стабильности xi155D5 с помощью эксклюзионной ВЭЖХ. (A) Стабильность xi155D5 при хранении при -80°C. (B) Стабильность xi155D5 при хранении при 37°C в течение 1 недели. Наблюдали только очень незначительное повышение образования агрегатов или деградации продуктов. Y ось - мЕОП; x ось - время удерживания (минуты).
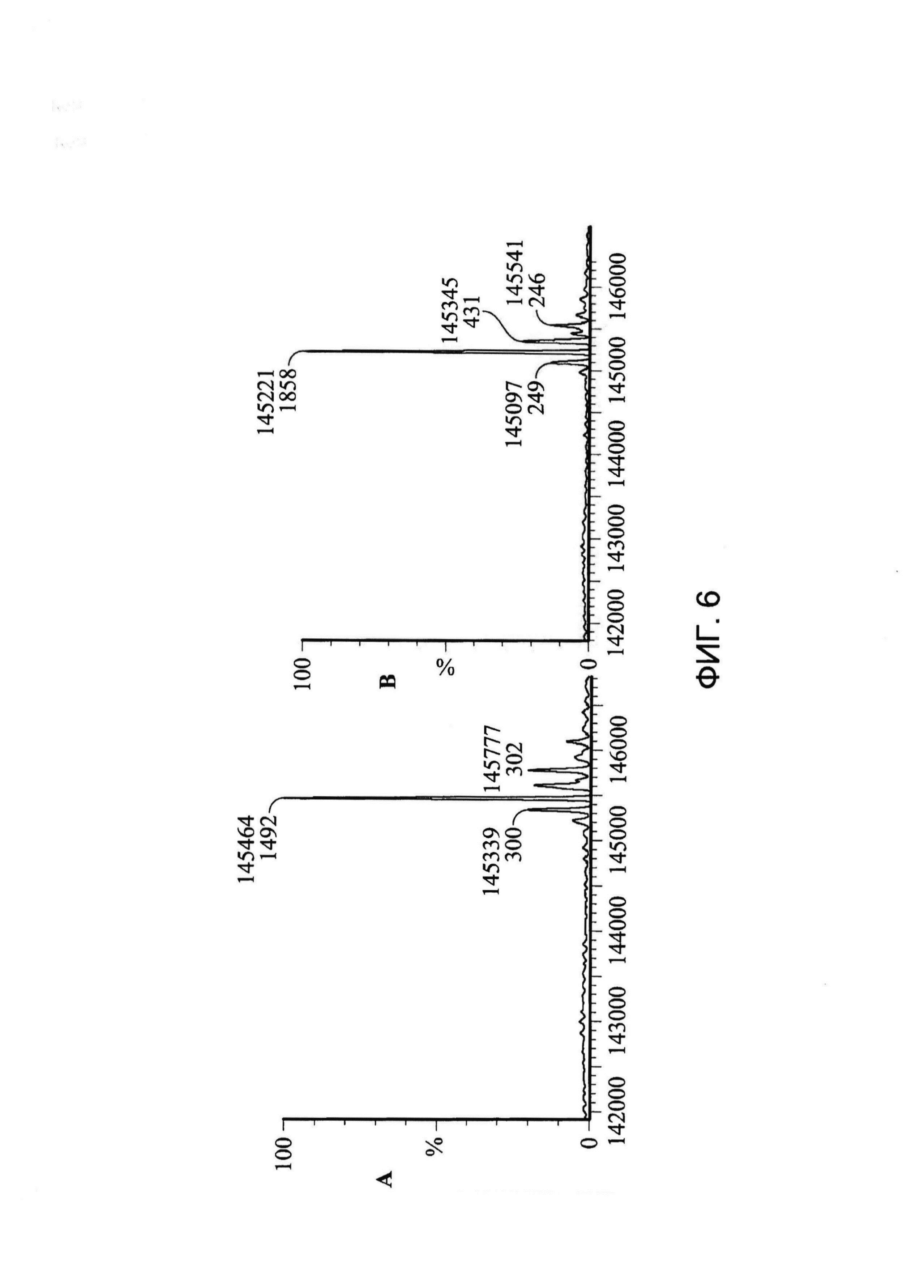
[0019] На Фигуре 6 показан пример эксперимента по декэпированию, указывающий на то, что цистеин, кэпирующий Cys80, можно удалять с помощью мягких восстанавливающих условий (использование буфера, содержащего 5 мМ цистеин, в течение 16 часов с последующей промывкой Трис-содержащим буфером без цистеина в течение 60 часов; все инкубации осуществляли при 4°C). Масса xi155D5 до (A) и после (B) декэпирования составляла 145,464 и 145,221 Да соответственно. Различие (243 Да) приблизительно соответствует массе двух свободных цистеинов.
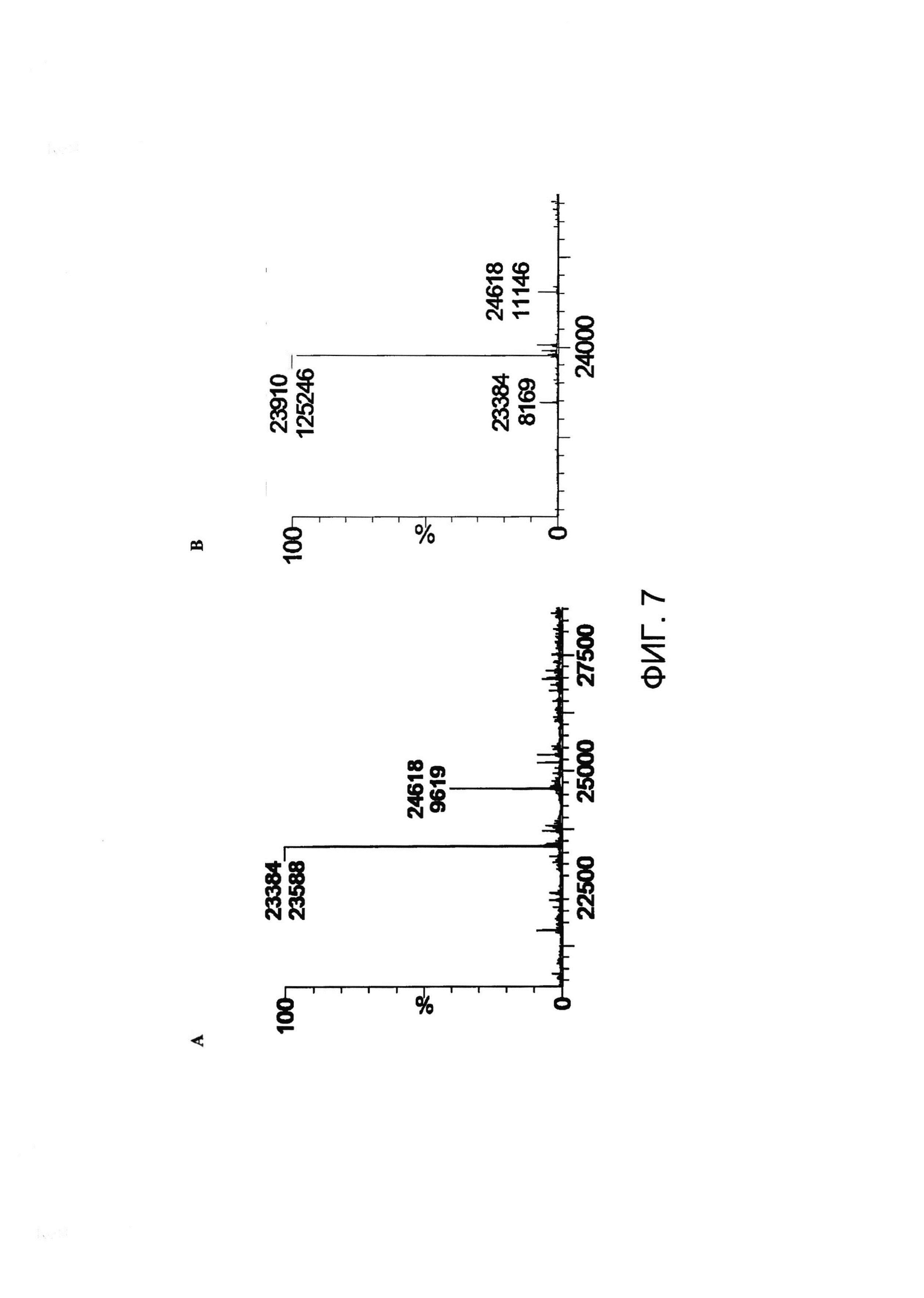
[0020] На Фигуре 7 приведен пример эксперимента по конъюгированию, показывающий, что некэпированный Cys80 можно конъюгировать с малеимид-ПЭГ2- биотином. (A) Легкая цепь восстановленного xi155D5 (предсказанная масса 23,399 Да) имела массу 23,384 Да; (B) после инкубации с малеимид-ПЭГ2-биотином наблюдалось увеличение массы 94% продукта на 526 Да (23,910 Да). Звездочками обозначены пики, не соответствующие легкой цепи.
[0021] НаФигуре 8 показаны последовательности Vκ и VH 155D5 кролика после выравнивания с наиболее гомологичными вариабельными доменами зародышевой линии человека. Границы каркасной области (FWR) и определяющей комплементарность области (CDR) по нумерации Kabat указаны над последовательностью. CDR по нумерации Chothia подчеркнуты. C-концевая половина CDR2 по Kabat не считается CDR по нумерации Chothia и выделена курсивом.
[0022] НаФигуре 9 показан пример стандартного способа очистки zu155D5-1 с помощью белка A. Было обнаружено, что zu155D5-1 является кэпированным (A), о чем свидетельствует изменение массы после декэпирования (B) на 233 Да, что приблизительно соответствует массе двух кэпирующих цистеинов.
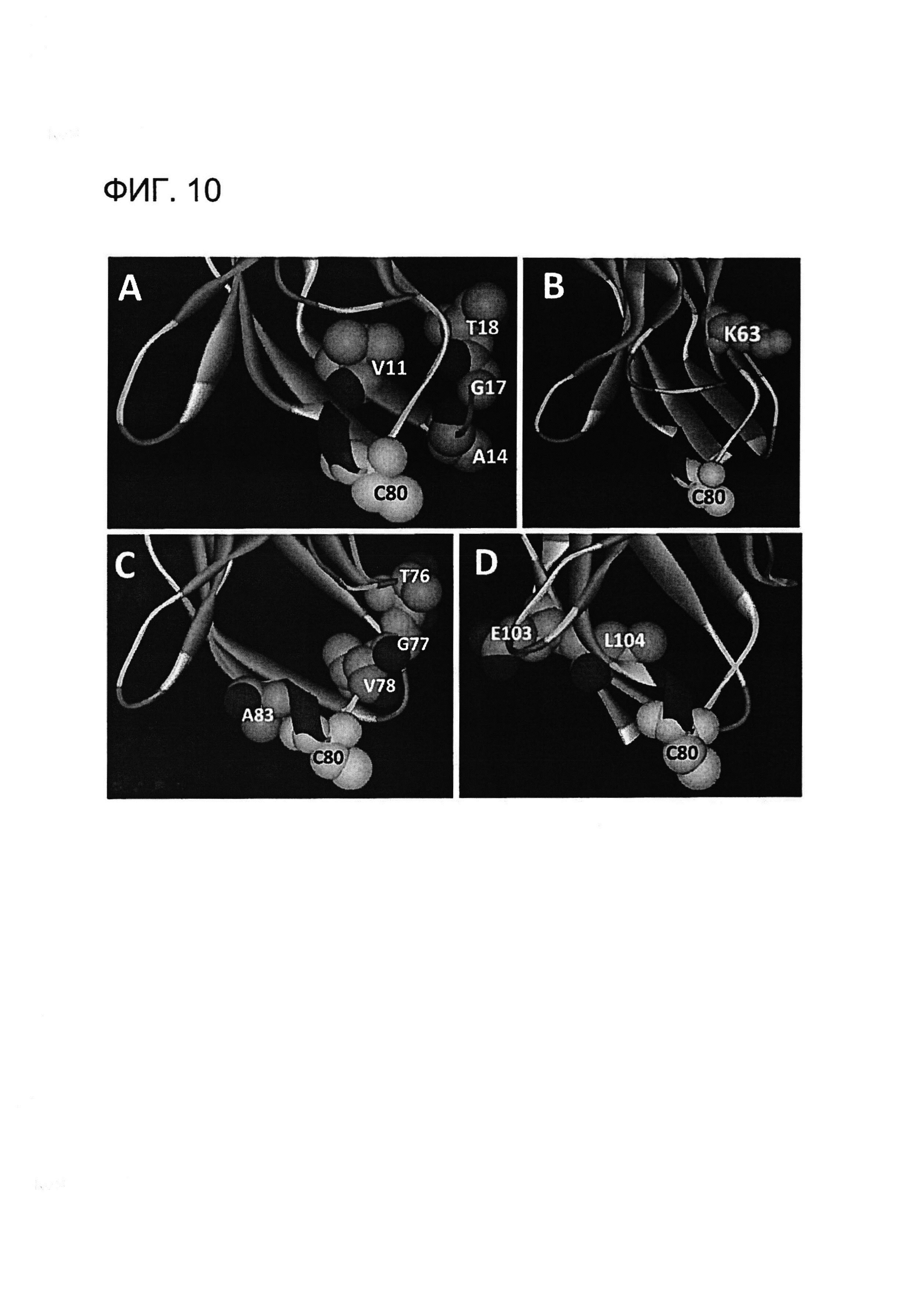
[0023] НаФигуре 10 показан пример структурных моделей гибридного xi155D5. Моделирование для определения удаленности Cys80 выполняли, как на Фигуре 2. Выделяли остатки, различающиеся между xi155D5 и zu155D5-1, и измеряли расстояние до Cys80 каждого из указанных остатков. (A) Остатки Val11, Ala14, Gly17, Thr18; (B) Lys63; (C) Thr76, Gly77, Val78, Ala83 и (D) Glu103 и Leu104 находятся в пределах 11 Å от Cys80, за исключением Lys63 (18 Å). Указанные остатки заменяли обратно на аминокислоты кролика в присутствии Cys80.
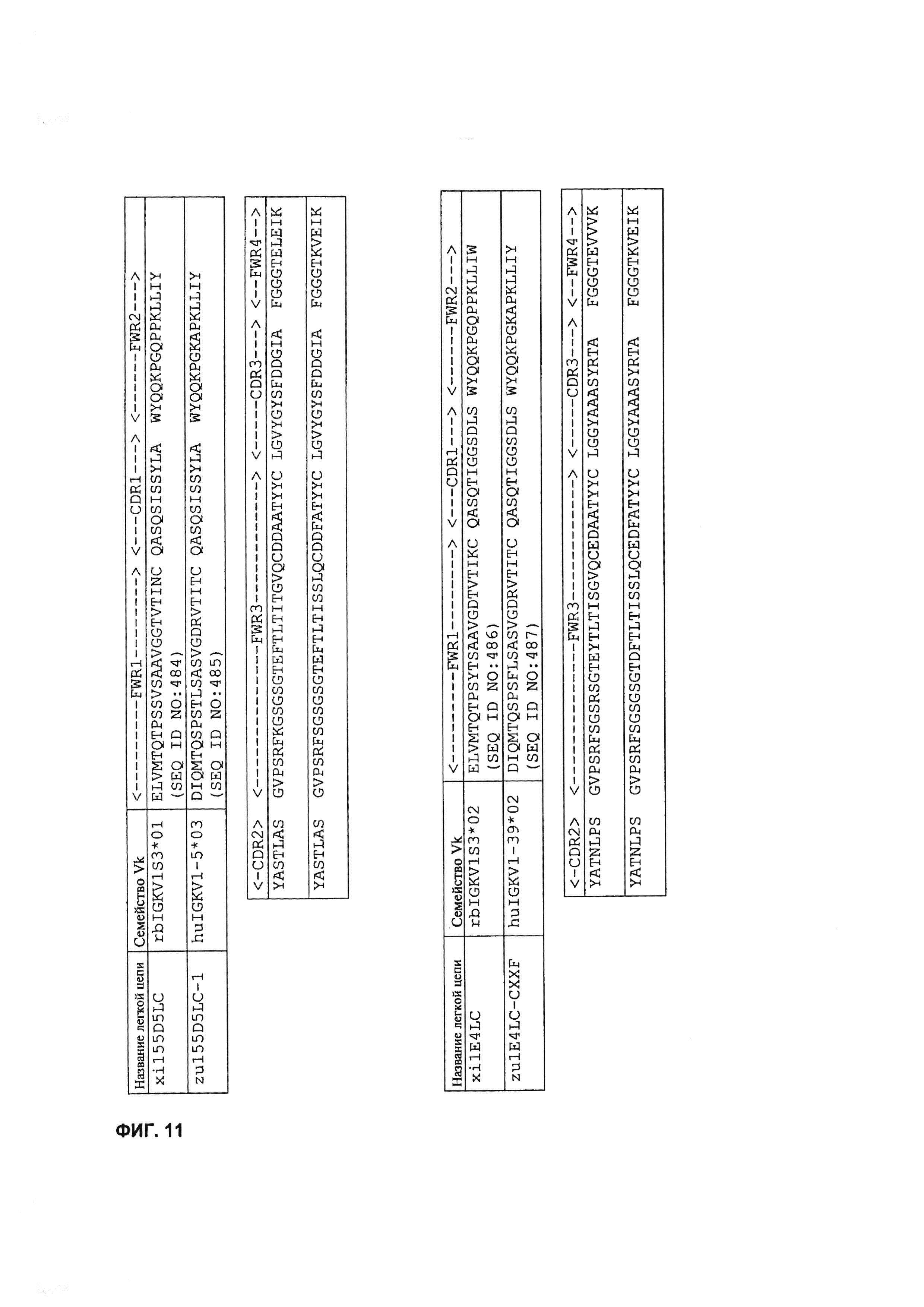
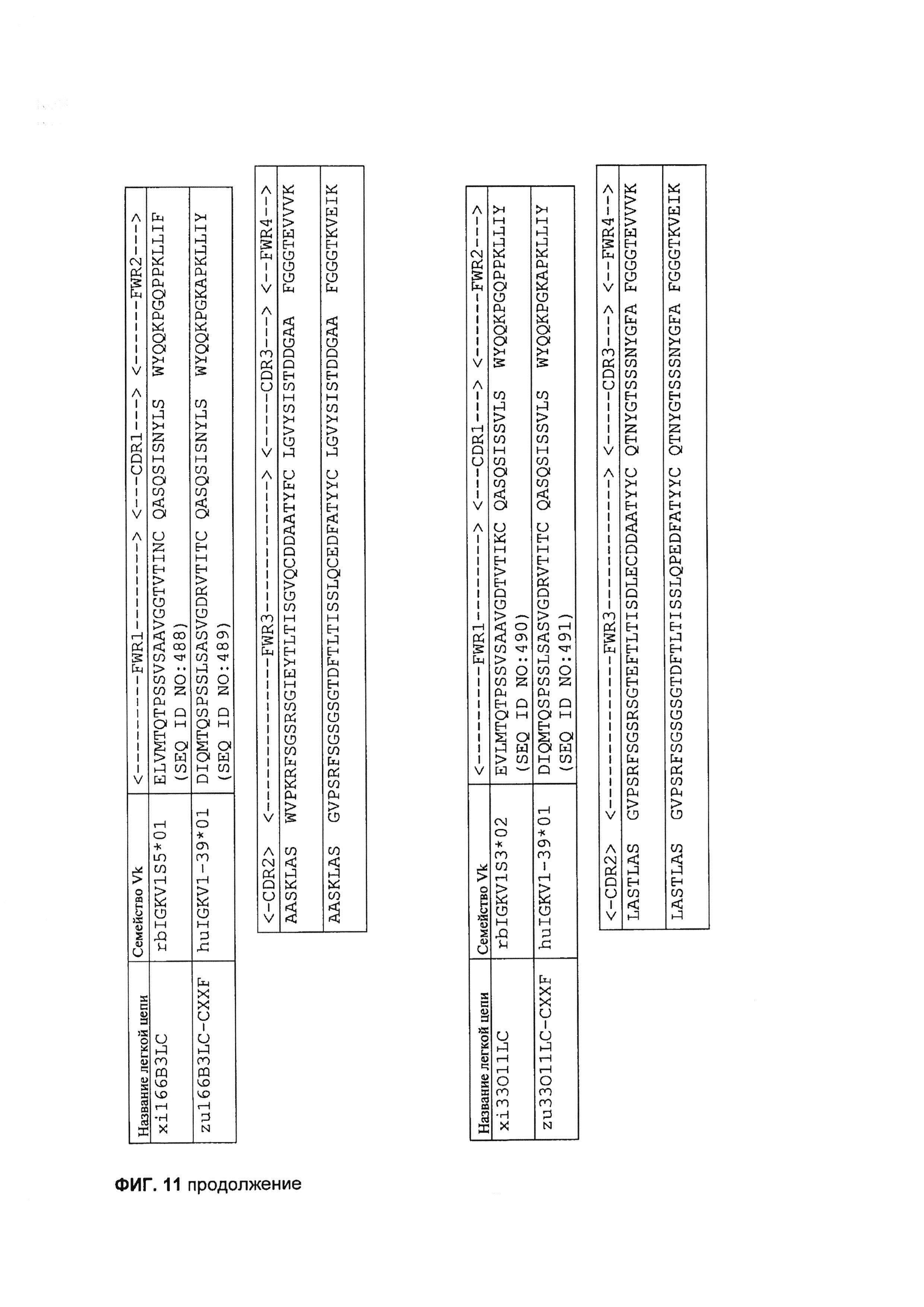
[0024] НаФигуре 11 показан пример последовательностей легкой цепи гуманизированных mAb 155D5, 1E4, 166B3 и 33O11.
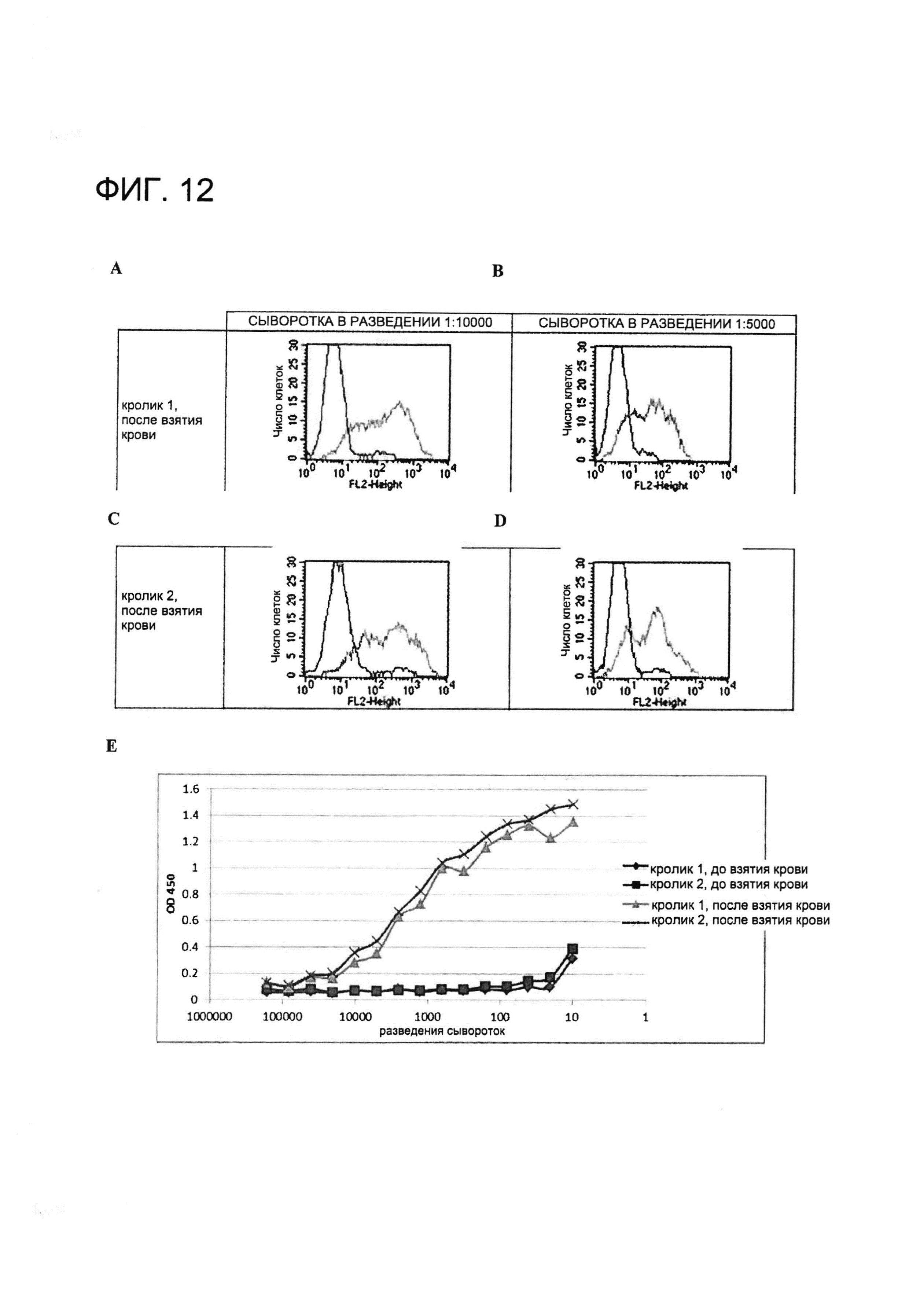
[0025] НаФигуре 12 показан (A-D) скрининг с помощью проточной цитометрии сывороток от иммунизированных животных и (E) скрининг с помощью ИФА сывороток от иммунизированных животных. (A-D) Клетки инкубировали с сыворотками от взятой после иммунизации крови в указанных разведениях (A: после взятия крови, сыворотка кролика 1, разведенная в отношении 1:1000; B: после взятия крови, сыворотка кролика 1, разведенная в отношении 1:5000; C: после взятия крови, сыворотка кролика 2, разведенная в отношении 1:1000; и D: после взятия крови, сыворотка кролика 2, разведенная в отношении 1:5000). Показан сигнал от клеток, временно экспрессирующих MSLN человека (+MSLN), и сигнал от MSLN-отрицательных клеток (-MSLN). (E) Планшеты для ИФА покрывали MSLN человека в концентрации 1 мкг/мл при 4°C в течение ночи и блокировали с применением 1% БСА в PBS с 0,01% Tween (PBST) в течение 2 часов при комнатной температуре. После блокирования буфер удаляли, в лунки добавляли образцы крови, полученной до и после иммунизации в серийных разведениях. Планшет инкубировали в течение 2 часов при комнатной температуре и затем промывали три раза PBST. HRP-конъюгированные антитела козы против антител кролика добавляли в блокирующем буфере и инкубировали в течение 1 часа. Планшет промывали три раза и добавляли TMB-субстрат. Реакцию останавливали и абсорбцию измеряли при 450 нм.
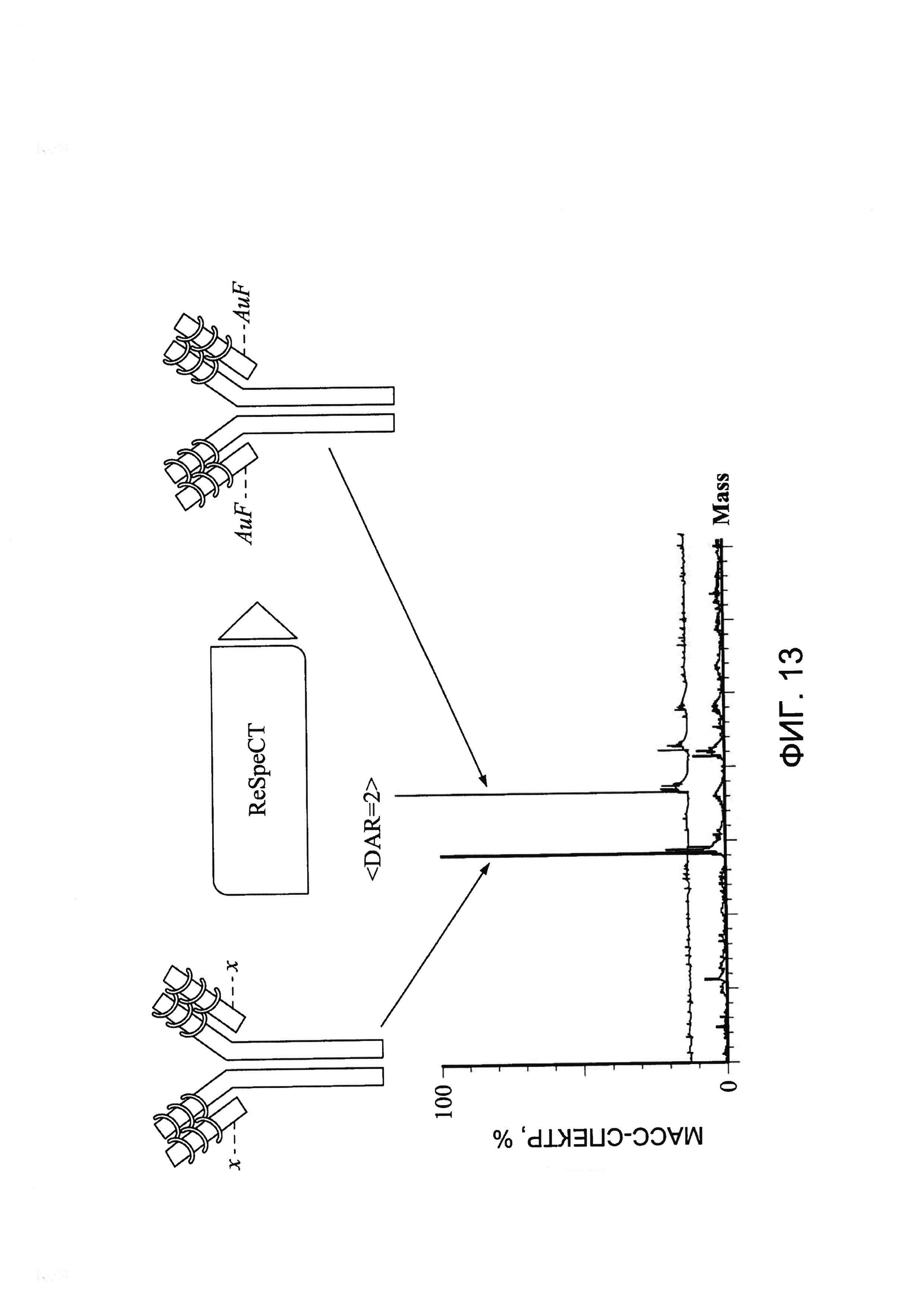
[0026] На Фигуре 13 показан пример пика белка масс-спектрометрического анализа с деконволюцией до и после конъюгации малеимид-ПЭГ2-ауристатина F (AuF) с Cys80.
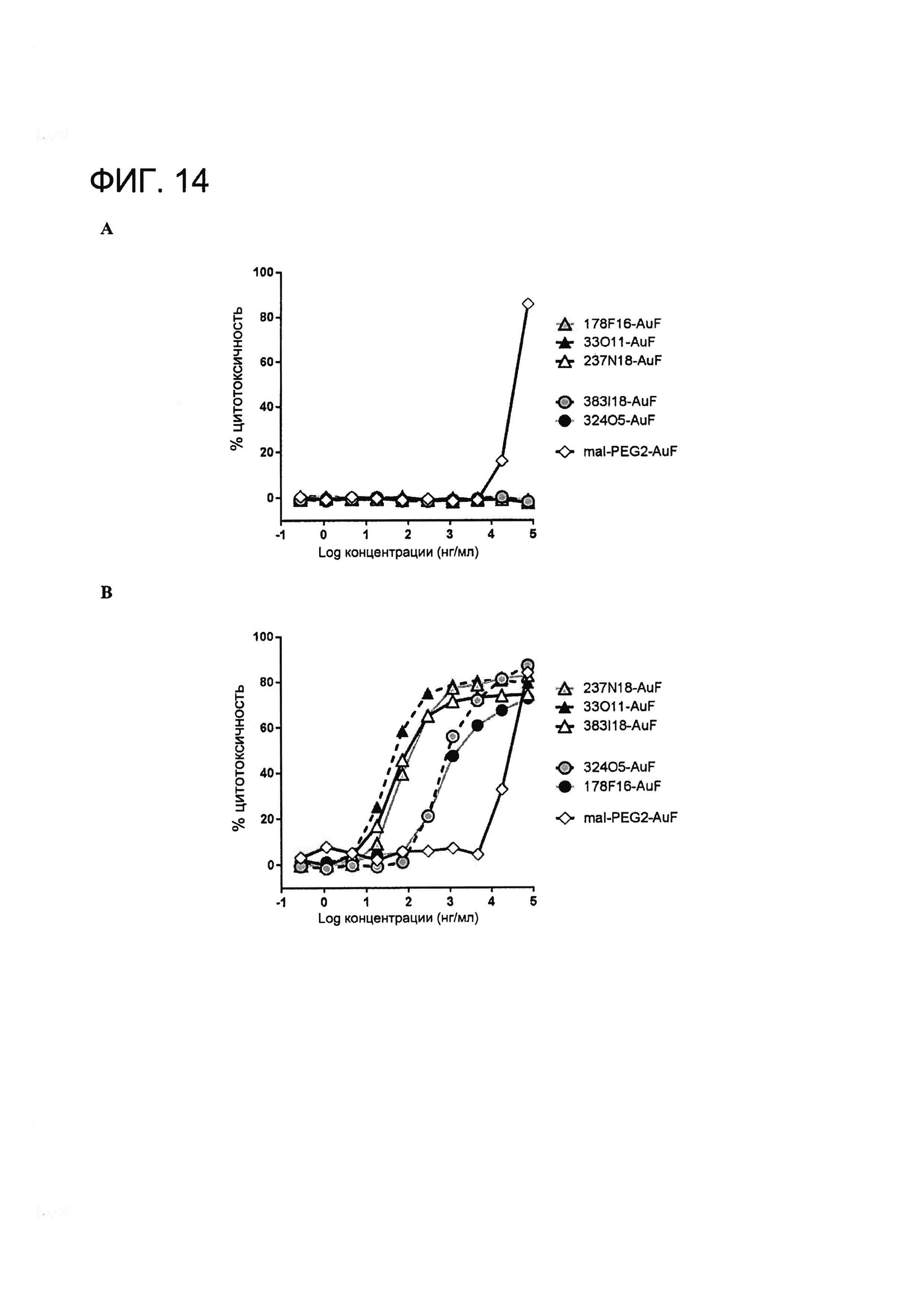
[0027] НаФигуре 14 показана (A) цитотоксичность mAb MSLN-AuF, конъюгированного через Cys80, в отношении MSLN-отрицательных клеток A431 и (B) mAb MSLN-AuF, конъюгированного через Cys80, в отношении MSLN-положительных клеток A431-MSLN.
[0028] На Фигуре 15 показаны средние объемы опухолей в различных группах, проходящих лечение.
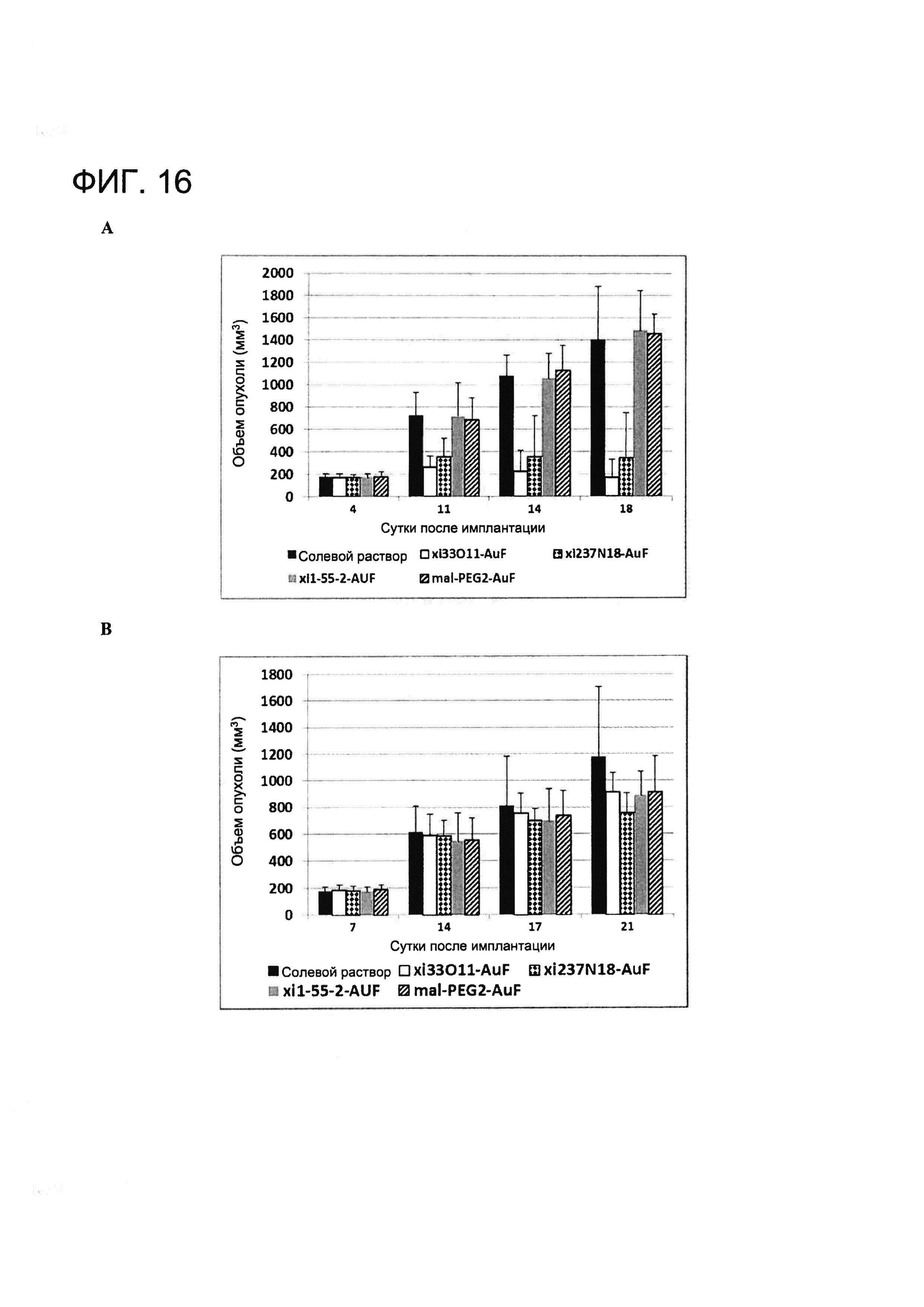
[0029] На Фигуре 16 показаны (A) средние объемы опухолей A431-MSLN (левый бок) в различных лечебных группах и (B) средние объемы опухолей A431 в различных группах, проходящих лечение (правый бок).
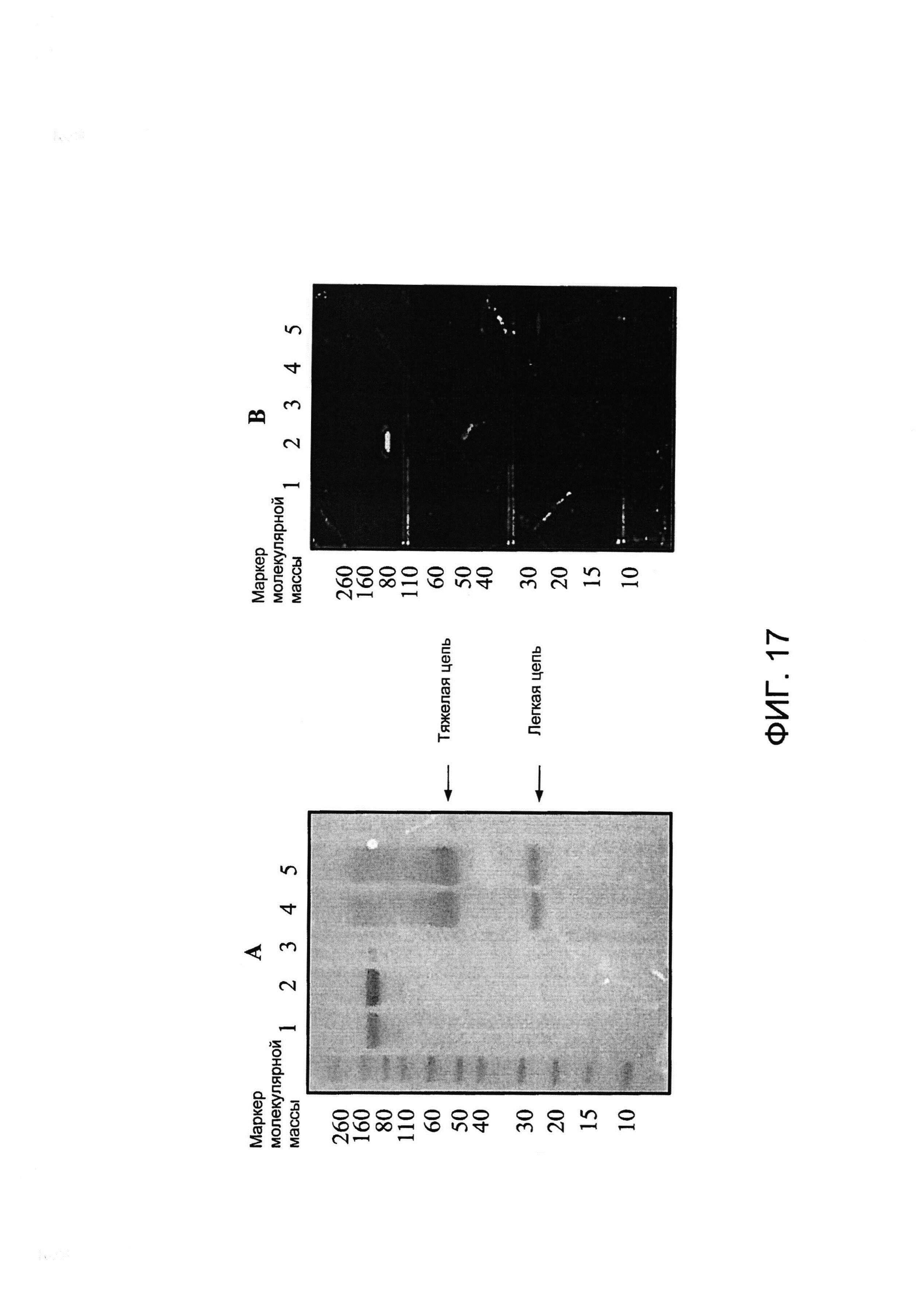
[0030] На Фигуре 17 представлены результаты анализа с помощью электрофореза в ПААГ в присутствии ДСН примера конъюгированного антитела xi155D5-800CW. (A) mwm - маркер молекулярной массы; дорожка 1 - xi155D5, неконъюгированное, невосстановленное; дорожка 2 - xi155D5, xi155D5-800CW, невосстановленное; дорожка 3 - пробел; дорожка 4 - xi155D5, неконъюгированное, восстановленное; дорожка 5 - xi155D5, xi155D5-800CW, восстановленное. Все дорожки содержали 5 мкг белка, окрашивание Кумасси. (B) Тот же гель, что и в A, визуализированный на системе IVIS. Результаты указывают на то, что IRDye 800CW конъюгировал только с легкой цепью xi155D5. Анализ xi155D5-800CW с помощью ИФА указывает на то, что полное связывание с CA9 сохранялось (данные не представлены).
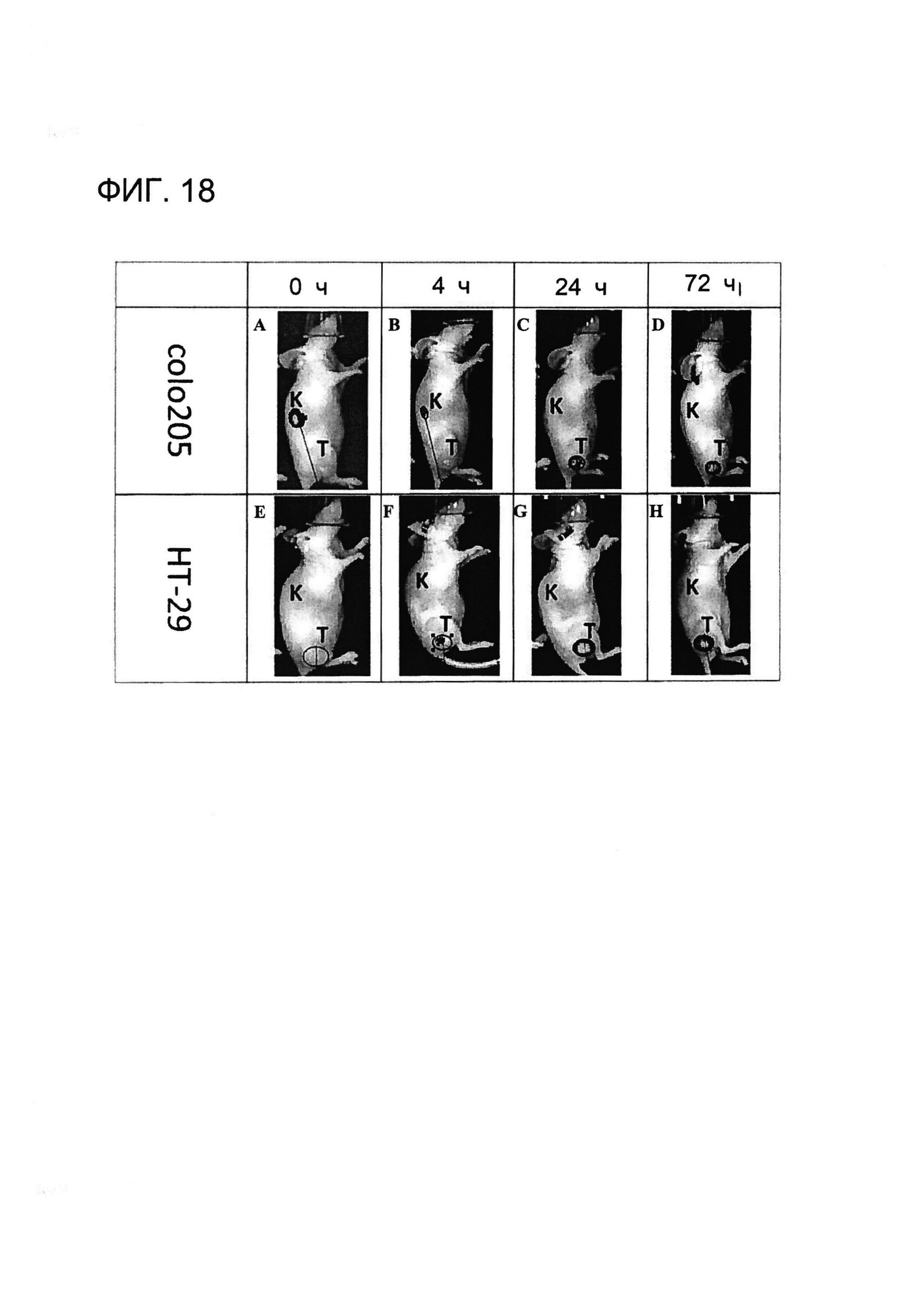
[0031] На Фигуре 18 показана опухоль-специфичная локализация примера конъюгированного с DyeIR 800CW антитела (xi155D5-800CW). Клетки человека colo205 (A-D) и HT-29 (E-H) трансплантировали мышам «nude», которым позже инъецировали xi155D5-800CW. За флуоресцентным сигналом (оранжево-красным) наблюдали в различные точки времени, включая 0 ч (A и E), 4 ч (B и F), 24 ч (C и G) и 72 ч (D и H) (показано время только от 0 до 72 часов и правый бок). Показано приблизительное расположение почки (K) и опухоли (T).
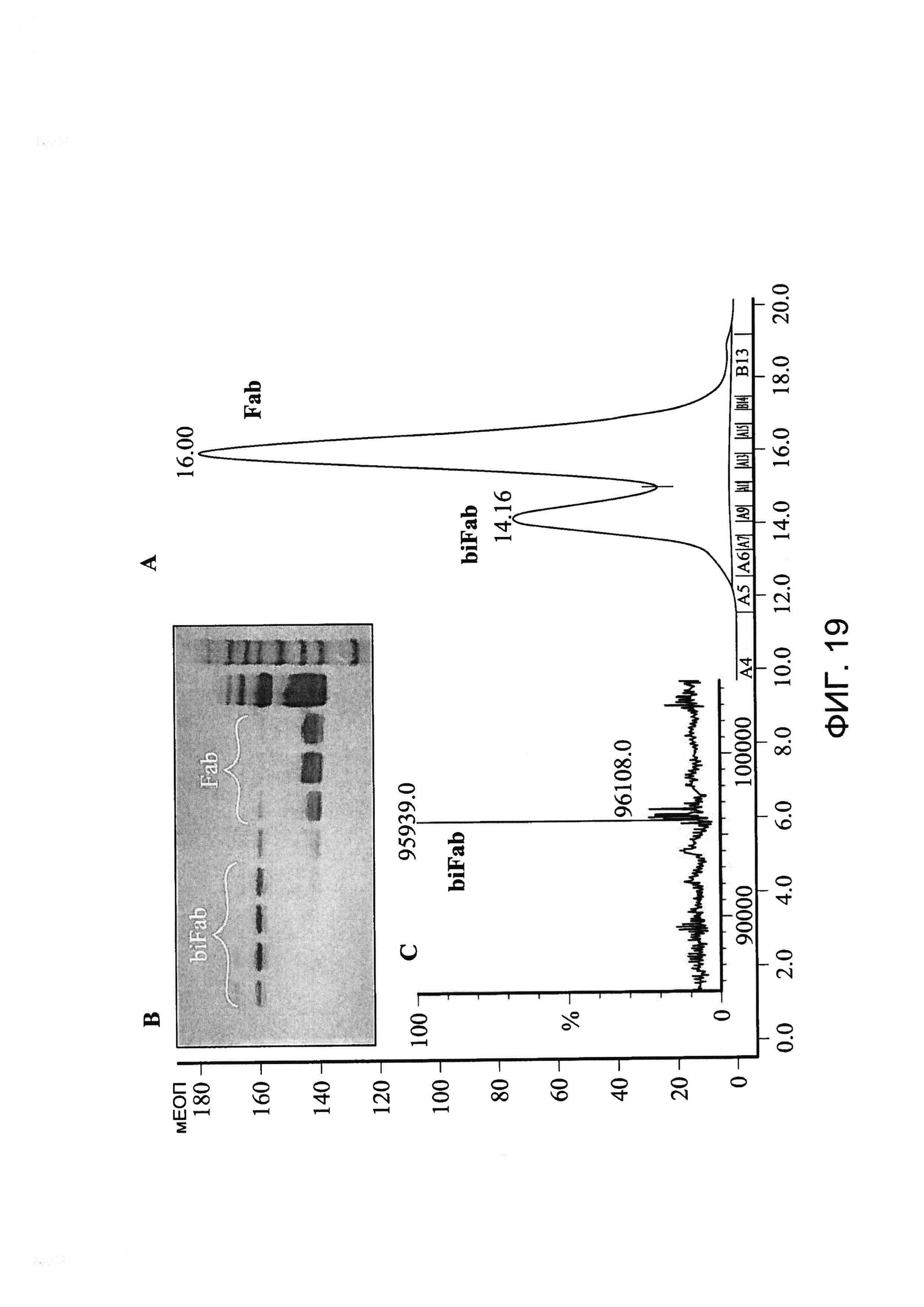
[0032] На Фигуре 19 показан пример очистки бивалентной/биспецифичной антиген-связывающей молекулы xi155D5/xi1-55-2. График хроматографии с гель-фильтрацией, показывающий пик, соответствующий бивалентной/биспецифичной антиген-связывающей молекуле xi155D5/xi1-55-2 (называемой «biFab») (A). Молекулярный вес фракции анализировали с помощью электрофореза в ПААГ в присутствии ДСН (B). Фракции, содержащие бивалентную/биспецифическую антиген-связывающую молекулу xi155D5/xi1-55-2 (biFab) объединяли и массу определяли с помощью масс-спектрометрии (C).
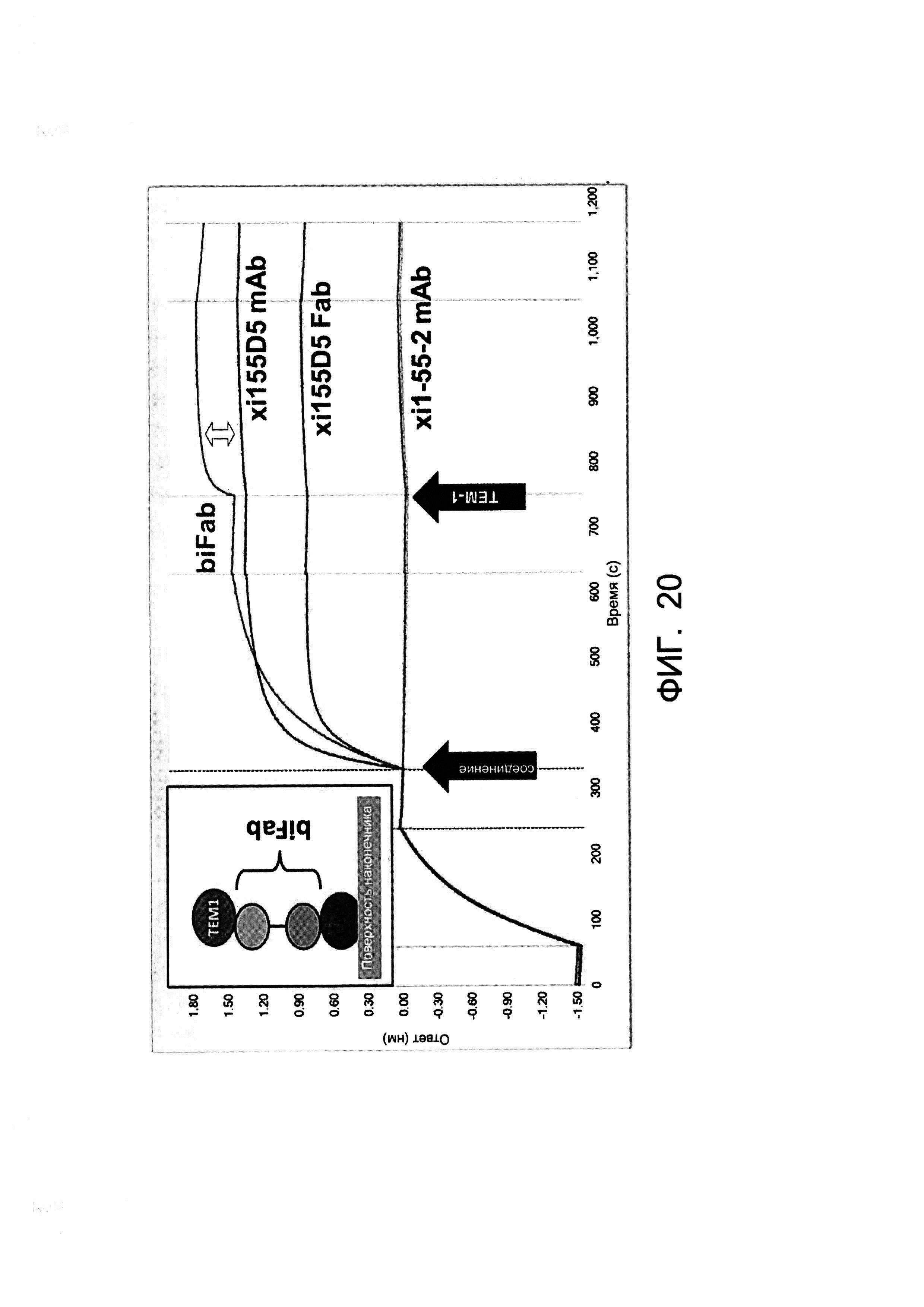
[0033] На Фигуре 20 показана биспецифичность примера бивалентной/биспецифичной антиген-связывающей молекулы xi155D5/xi1-55-2 (biFab). Осуществляли захват биотинилированного CA9 человека на покрытые стрептавидином биосенсорные наконечники Octet. Соединение добавляли в момент времени, указанный первой стрелкой («соединение»), затем указанному соединению позволяли связываться. После этого добавляли растворимый TEM-1 человека (вторая стрелка; «TEM-1») и измеряли его связывание с захваченными комплексами CA9/соединение. Сдвиг ответа (двойная стрелка), указывающий на захват растворимого TEM-1, наблюдали только в случае бивалентной/биспецифичной антиген-связывающей молекулы xi155D5/xi1-55-2 (biFab).
[0034] На Фигуре 21 показан анализ с помощью электрофореза в ПААГ в присутствии ДСН mAb xi33O11-Aβ(1-16), конъюгированных через CYS80, и mAb xi1-55-2-Aβ(1-16), конъюгированных через CYS80. Показанные продукты представляют собой продукты до (B) и после (A) конъюгации mAb-DBCO с пептидом Aβ(1-16). MW - маркер молекулярной массы. LC - легкая цепь.
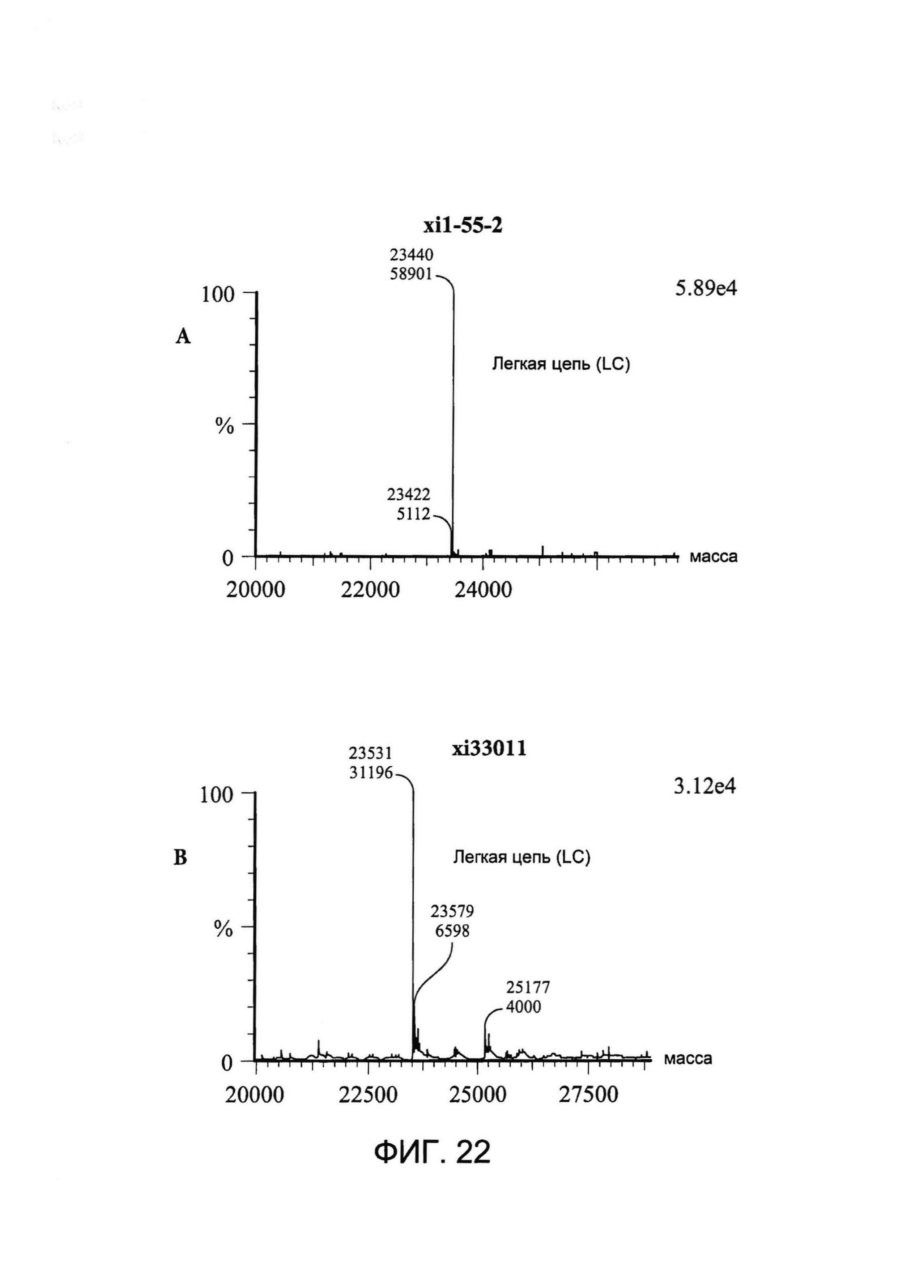
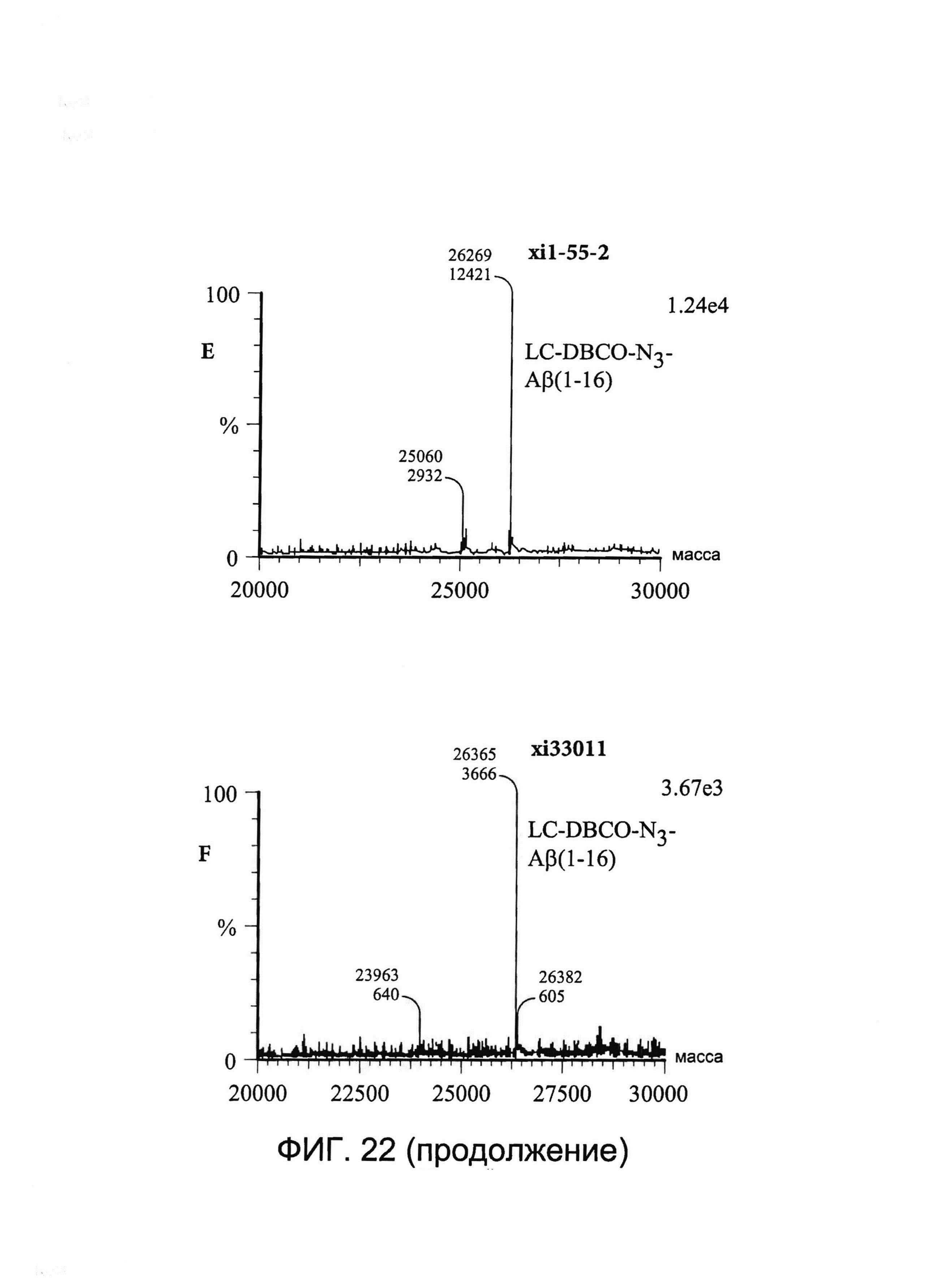
[0035] На Фигуре 22 показаны примеры масс-спектрометрического анализа исходных легких цепей (LC) xi1-55-2 и xi33O11 (A и B соответственно), CYS80-конъюгированных LC xi1-55-2-DBCO и xi33O11-DBCO (C и D соответственно) и CYS80- конъюгированных LC xi1-55-2-Aβ(1-16) и xi33O11-Aβ(1-16) (E и F соответственно).
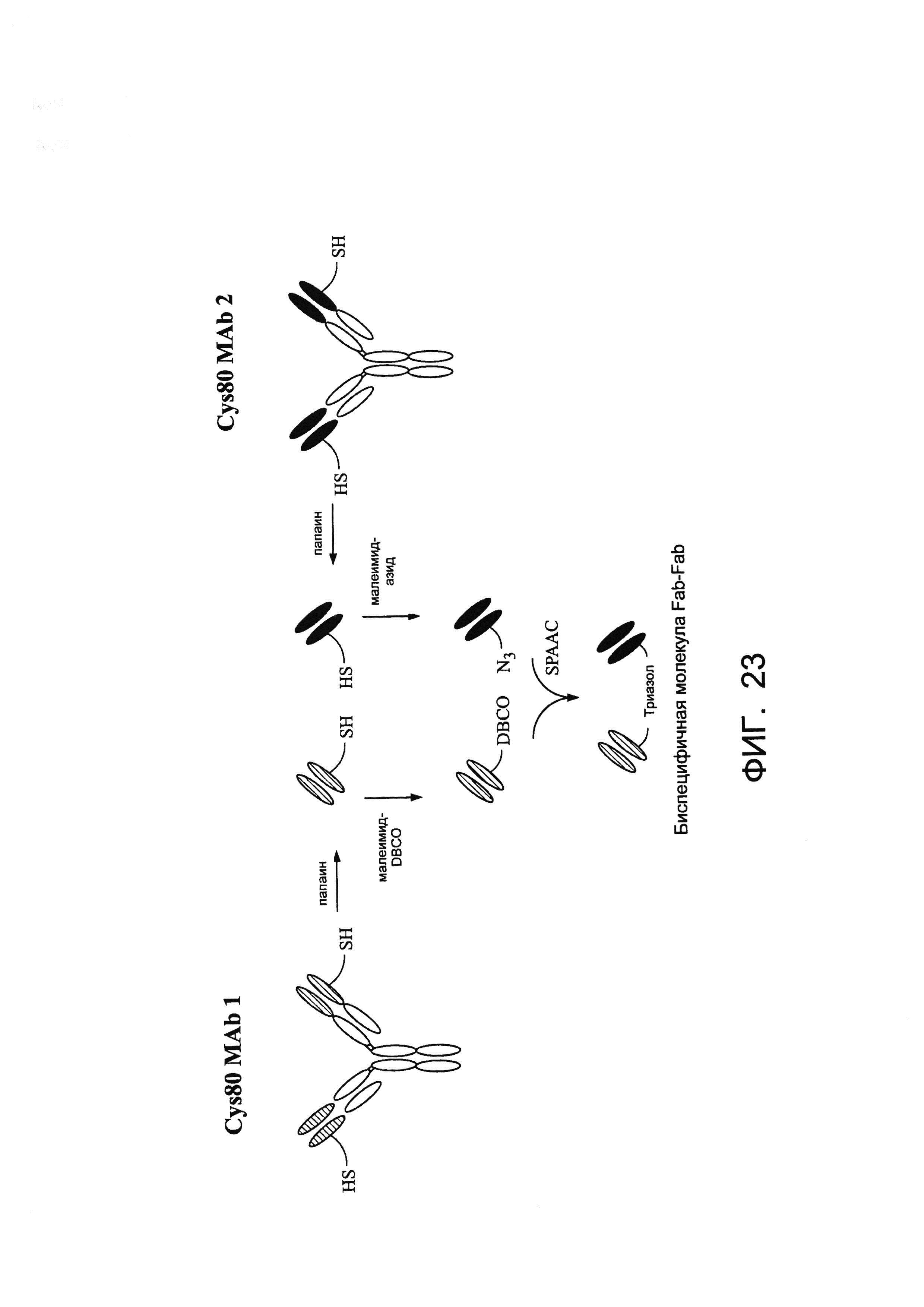
[0036] На Фигуре 23 показан пример схемы получения антиген-связывающих молекул. Иммуноглобулины, происходящие от кролика, можно расщеплять с помощью папаина для получения Fab-фрагмента. Первый Fab можно инкубировать с малеимидо-DBCO и второй Fab можно инкубировать малеимидо-азидом. Первый и второй Fab можно объединять с получением биспецифичной связывающей молекулы Fab-Fab. SPAAC = облегченное напряжением конъюгирование алкин-азид.
подробное описание иллюстративных вариантов реализации изобретения
[0037] Совместное рассмотрение следующего далее подробного описания с сопутствующими графическими материалами, образующими часть настоящего изобретения, позволяет лучше понять описанные способы, конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей. Следует понимать, что описанные способы, конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей не ограничиваются конкретными вариантами реализации, описанными и/или показанными в настоящей заявке, и что терминология, используемая в настоящей заявке, приведена исключительно для описания конкретных вариантов реализации в качестве примера и не ограничивает заявленные способы, конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей.
[0038] Если иное специально не указано, предполагается, что любое описание, имеющее отношение к возможному механизму или способу действия или причине улучшения, приведено исключительно в качестве иллюстрации, и описанные способы, конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей не ограничиваются точностью или неточностью описания любого такого предполагаемого механизма или способа действия или причины улучшения.
[0039] На протяжении настоящей заявки описаны конъюгированные иммуноглобулины, антиген-связывающие молекулы, иммуноглобулины и вариабельные области легких цепей и способы их получения. Когда в описании описан или заявлен признак или вариант реализации изобретения, связанный с конъюгированным иммуноглобулином, антиген-связывающей молекулой, иммуноглобулином или вариабельной областью легкой цепи, такой признак или вариант реализации изобретения в равной степени применим к способам их получения. Подобным образом, когда в описание описан или заявлен признак или вариант реализации изобретения, связанный со способом создания конъюгированного иммуноглобулина, антиген-связывающей молекулы, иммуноглобулина или вариабельной области легкой цепи, такой признак или вариант реализации изобретения в равной степени применим к конъюгированному иммуноглобулину, антиген-связывающей молекуле, иммуноглобулину или вариабельной области легкой цепи.
[0040] Ссылка на конкретное числовое значение включает по меньшей мере указанное конкретное значение, если иное явно не следует из контекста. Когда приведен диапазон значений, другой вариант реализации изобретения включает значения от одного конкретного значения и/или до другого конкретного значения. Кроме того, ссылка на значения, указанные в диапазонах, включает все и каждое значение в пределах указанного диапазона. Все диапазоны являются инклюзивными и комбинируемыми.
[0041] Когда значения представлены в виде приблизительных значений, которым предшествует уточнение «приблизительно», следует понимать, что конкретное значение представляет собой другой вариант реализации изобретения.
[0042] Следует иметь в виду, что конкретные признаки описанных способов, конъюгированных иммуноглобулинов, антиген-связывающих молекул, иммуноглобулинов и вариабельных областей легких цепей, которые для ясности описаны в настоящей заявке в контексте отдельных вариантов реализации, также могут быть предложены в комбинации в одном варианте реализации изобретения. Напротив, различные признаки описанных способов, конъюгированных иммуноглобулинов, антиген-связывающих молекул, иммуноглобулинов и вариабельных областей легких цепей, которые для краткости описаны в контексте одного варианта реализации изобретения, также могут быть представлены раздельно или в любой частичной комбинации.
[0043] Употребление в настоящей заявке предметов в единственном числе включает множественное число указанных предметов.
[0044] Предполагается, что термин «содержащий» включает примеры, включенные в термины «состоящий по существу из» и «состоящий из»; подобным образом, предполагается, что термин «состоящий по существу из» включает примеры, включенные в термин «состоящий из».
[0045] Различные термины, имеющие отношение к аспектам описания, используются на протяжении заявки и формулы изобретения. Такие термины следует рассматривать в их обычном значении, принятом в данной области техники, если иное специально не указано. Понимание других терминов, имеющих специфические определения, должно быть совместимым с определениями, предложенными в настоящей заявке.
[0046] Термин «приблизительно» при использовании со ссылкой на числовые диапазоны, пределы или конкретные значения указывает на то, что перечисленные значения могут варьировать в пределах 10% от указанного значения. Таким образом, термин «приблизительно» при его употреблении включает отклонения ± 10% или менее, отклонения ± 5% или менее, отклонения ± 1% или менее, отклонения ± 0,5% или менее или отклонения ± 0,1% или менее от конкретно указанного значения.
[0047] При использовании в настоящей заявке термин «биологический образец» относится к образцу, полученному от субъекта, включая образец биологической ткани или жидкости, полученный in vivo или in vitro. Такие образцы могут представлять собой, но не ограничиваются указанными, биологическую жидкость (например, кровь, плазму крови, сыворотку крови, молоко, спинно-мозговую жидкость, асциты или мочу), органы, ткани, фракции и клетки, выделенные из организма млекопитающих, включая людей. Биологические образцы также могут включать срезы образца, полученного от субъекта, включая ткани (например, срезы частей органа или ткани). Биологические образцы также могут включать экстракты из образца, полученного от субъекта, например, антиген из биологической жидкости (например, крови или мочи).
[0048] Термин «кэпирующий цистеин» относится к свободному цистеину из раствора, который образует дисульфидную связь с Cys80 вариабельной области легкой цепи.
[0049] Термин «гибридизованный», «гибридный», «гибридное антитело» и подобные термины относятся к иммуноглобулину, содержащему вариабельную область тяжелой цепи и вариабельную область легкой цепи, т.е. антиген-связывающий участок, из одного источника или вида и по меньшей мере часть константной области тяжелой цепи и константной области легкой цепи, происходящей из другого источника или вида. Эти части можно соединять вместе химическим путем с помощью стандартных методов (например, синтетических) или получать в виде непрерывного полипептида с помощью методов генетической инженерии (например, можно осуществлять экспрессию ДНК, кодирующей части белка гибридного антитела, с получением непрерывной полипептидной цепи). Примеры гибридных иммуноглобулинов включают иммуноглобулины, содержащие вариабельную область, происходящую от кролика, и константную область, происходящую от человека. Такие гибридные иммуноглобулины, происходящие от кролика/человека, представляют собой продукт экспрессии генов иммуноглобулина, содержащий сегменты ДНК, кодирующие вариабельные области иммуноглобулина, происходящие от кролика, и сегменты ДНК, кодирующие константные области, происходящие от человека. Другие формы «гибридных иммуноглобулинов», включенные в настоящее изобретение, представляют собой формы, в которых класс или подкласс иммуноглобулина модифицирован или изменен по сравнению с классом исходного иммуноглобулина (также называемые «иммуноглобулины с переключением классов»). На протяжении настоящей заявки гибридные иммуноглобулины в соответствии с настоящим изобретением обозначены «xi.», термин «гибридный иммуноглобулин» и подобные термины относятся к последовательности иммуноглобулина, а не к процессу, используемому для создания антитела.
[0050] При использовании в настоящей заявке «Cys80» относится к цистеиновому остатку в положении аминокислоты 80 вариабельной области легкой цепи в контексте вариабельной области легкой цепи с отсутствием лидирующей последовательности. Например, вариабельные области легких цепей, описанные в таблице 25, содержат лидирующую последовательность из 19 аминокислот (кодируемых 57 нуклеотидами). «Cys80» встречается в положении аминокислоты 99, когда присутствует лидирующая последовательность, и в положении аминокислоты 80, когда лидирующая последовательность отсутствует. Нумерация Cys80 основана на номенклатуре Kabat/Chothia.
[0051] Термин «декэпирование» относится к удалению кэпирующего цистеина с использованием способов, предложенных в настоящей заявке, в условиях, которые минимизируют разрушение нативных дисульфидных связей внутри и между цепями иммуноглобулина.
[0052] Термин «иммуноглобулин, происходящий из» относится к иммуноглобулинам или их частям, содержащим по меньшей мере CDR-области иммуноглобулина, происходящие от кролика. «Иммуноглобулин, полученный из», включает гибриды, происходящие от кролика/человека, или гуманизированные иммуноглобулины, происходящие от кролика. Степень вариабельности, допустимой при получении иммуноглобулина из кролика, может быть определена, например, Советом Соединенных Штатов по принятым наименованиям (USAN) Американской медицинской ассоциации (AMA).
[0053] При использовании в настоящей заявке «функциональный агент» относится к агенту, обладающему терапевтическим, диагностическим или другим функциональным свойством (свойствами). Различные функциональные агенты, которые включены в объем настоящего изобретения, описаны в другом месте в настоящей заявке.
[0054] Термин «гуманизированный», «гуманизированный иммуноглобулин» и подобные термины относятся к иммуноглобулинам, происходящим от кролика, в которых аминокислотные последовательности в пределах вариабельных областей заменены на последовательности, имеющие гомологию с вариабельной областью, происходящей от человека. Примеры гуманизированных иммуноглобулинов могут содержать вариабельный домен кролика, в котором остатки в пределах каркасной области (FWR) и/или CDR-областей заменены на последовательности, гомологичные иммуноглобулину человека. В некоторых примерах остатки FWR-области иммуноглобулина, происходящего от кролика, не заменены на соответствующие остатки, происходящие от человека. В качестве альтернативы, «гуманизированный», «гуманизированный иммуноглобулин» и подобные термины могут относиться к иммуноглобулинам человеческой природы, в которых остатки в пределах области FWR и/или CDR-областей заменены на последовательности, гомологичные иммуноглобулину, происходящему от кролика. Например, гуманизированные иммуноглобулины могут представлять собой иммуноглобулины человека, в которых остатки из гипервариабельной области иммуноглобулина человека заменены на остатки из гипервариабельной области иммуноглобулина, происходящего от кролика, имеющей желаемую специфичность, аффинность и активность. Кроме того, гуманизированные иммуноглобулины могут содержать остатки, которые не встречаются в иммуноглобулине-реципиенте или иммуноглобулине-доноре. Указанные модификации осуществляют для дополнительного улучшения характеристик иммуноглобулина. В целом, гуманизированный иммуноглобулин содержит по существу все из по меньшей мере одного и, как правило, двух, вариабельных доменов, в которых все или по существу все из гипервариабельных участков соответствуют участкам иммуноглобулина не происходящего от человека и все или по существу все из FWR-областей представляют собой последовательности FWR иммуноглобулина человека. Гуманизированный иммуноглобулин может необязательно также содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, константной области иммуноглобулина человека. См., например, Riechmann, L., et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Согласно настоящему изобретению, на протяжении данной заявки «гуманизированные иммуноглобулины» обозначаются как «zu.», «гуманизированный иммуноглобулин» и подобные термины относятся к последовательности иммуноглобулина, а не к процессу, используемому для получения иммуноглобулина.
[0055] Термин «иммуноглобулин-донор» относится к иммуноглобулину, не происходящему от человека, который предоставляет аминокислотные последовательности вариабельных областей, CDR, или других функциональных фрагментов или их аналогов для гуманизированного иммуноглобулина и, таким образом, придает гуманизированному иммуноглобулину антигенную специфичность и нейтрализует активность, характерную для иммуноглобулина-донора.
[0056] Термин «иммуноглобулин-реципиент» относится к иммуноглобулину, гетерологичному по отношению к иммуноглобулину-донору, который предоставляет аминокислотные последовательности каркасных областей тяжелой и/или легкой цепи и/или константных областей тяжелой и/или легкой цепи для гуманизированного иммуноглобулина. Иммуноглобулин-реципиент может происходить из любого млекопитающего. Согласно предпочтительному варианту реализации, иммуноглобулин-реципиент не является иммуногенным у людей. Предпочтительно, иммуноглобулин-реципиент представляет собой иммуноглобулин человека.
[0057] «Гуманизация» относится к процессу создания гуманизированного иммуноглобулина и включает любой процесс для создания гуманизированных иммуноглобулинов, обладающих указанными выше характеристиками, включая, но не ограничиваясь указанными, гуманизация in silico, встраивание CDR вида/хозяина в иммуноглобулины человека, замену остатков каркасной области гибридного иммуноглобулина для ее совпадения с соответствующей каркасной областью человека и т.д.
[0058] «Гидрофобная аминокислота» относится к аминокислоте, обладающей превышающей ноль гидрофобность в соответствии с нормированной одобренной шкалой гидрофобности по Eisenberg, 1984, J. Mol. Biol. 179:125-142. Кодируемые генами гидрофобные аминокислоты включают Pro (P), Ile (I), Phe (F), Val (V), Leu (L), Trp (W), Met (M), Ala (A), Gly (G), и Tyr (Y).
[0059] «Иммуноглобулин» при использовании в настоящей заявке относится к белку, содержащему один или более полипептидов, по существу кодирующихся генами иммуноглобулина, включая легкие каппа- и лямбда-цепи и тяжелые альфа-, гамма-, дельта-, эпсилон- и мю-цепи. Полноразмерные «легкие цепи» иммуноглобулина (приблизительно 25 кД или 214 аминокислот) кодируются геном вариабельной области на NH2-конце (приблизительно 110 аминокислот) и геном константной области каппа- или лямбда-цепи на COOH-конце. Полноразмерные «тяжелые цепи» иммуноглобулина (приблизительно 50 кД или 446 аминокислот) подобным образом кодируются геном вариабельной области (приблизительно 116 аминокислот) и одним из других перечисленных выше генов константной области, например, гамма-цепи (кодирует приблизительно 330 аминокислот). «Иммуноглобулины» включают: (a) полипептиды иммуноглобулина, т.е. полипептиды семейства иммуноглобулинов, которые содержат антиген-связывающий сайт, который специфично связывается со специфическим антигеном (например, MSLN, CA9, TEM1 и т.д.), включая все изотипы иммуноглобулинов (IgG, IgA, IgE, IgM, IgD и IgY), классы (например IgG1, IgG2, IgG3, IgG4, IgA1, IgA2), подклассы и различные мономерные и полимерные формы каждого изотипа, если иное специально не указано; и (b) варианты таких полипептидов иммуноглобулинов с консервативными заменами, которые иммуноспецифично связываются с антигеном (например, MSLN, CA9, TEM1 и т.д.). Иммуноглобулины в целом описаны, например, в источнике Harlow & Lane, Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988).
[0060] Одна из форм иммуноглобулина, описанных в настоящей заявке, представляет собой основную структурную единицу антитела. Например, антитело может включать тетрамер и состоять из двух идентичных пар цепей иммуноглобулина, где каждая пара содержит одну легкую цепь и одну тяжелую цепь. В целом, в каждой паре вариабельные области легкой цепи и тяжелой цепи вместе отвечают за связывание с антигеном, и константные области отвечают за эффекторные функции антитела.
[0061] Помимо антител, иммуноглобулины могут существовать в различных других формах, включая, например: антиген-связывающие фрагменты или части иммуноглобулина, такие как Fv, Fab, (Fab')2и Fv фрагменты; и альтернативные формы антител, такие как одноцепочечные иммуноглобулины (scFV и scFab), диатела, триатела, тетратела, линейные антитела и мультиспецифичные антитела, например. См., например, James D. Marks, Antibody Engineering, Chapter 2, Oxford University Press (1995) (Carl K. Borrebaeck, Ed.)
[0062] При использовании в настоящей заявке, термин «иммуноспецифичный» относится к способности иммуноглобулина специфично связываться с антигеном, против которого указанный иммуноглобулин был создан, и не специфично связываться с другими пептидами или белками. Иммуноглобулин, который иммуноспецифично связывается с антигеном, против которого указанный иммуноглобулин был создан, может не связываться с другими полипептидами или белками или может связываться с другими полипептидами или белками с более низкой аффинностью связывания по сравнению с антигеном, против которого указанный иммуноглобулин был создан, по результатам, например, иммунологического анализа, анализа BIAcore или других анализов, известных в данной области техники. Иммуноглобулин иммуноспецифично связывается с антигеном, против которого он был получен, когда указанный иммуноглобулин связывается с указанным антигеном с более высокой аффинностью связывания по сравнению с любым кросс-реактивным антигеном, по результатам экспериментальных методов, включая, но не ограничиваясь указанными, радиоиммунологические анализы (РИА) и иммуноферментные анализы (ИФА) (обсуждение, касающееся специфичности антител, см., например, в источнике Paul, ed., Fundamental Immunology, 2nd ed., Raven Press, New York, pages 332-336 (1989).
[0063] Термин «линкер» при использовании в настоящей заявке относится к спейсеру, который может представлять собой прямую или разветвленную цепь для связывания иммуноглобулина (через способную реагировать с тиолом группу неспаренного Cys80) с функциональным агентом. Такие линкеры могут быть расщепляемыми (например, кислотонеустойчивыми или поддающимися расщеплению протеазами) или нерасщепляемыми.
[0064] Термин «моноклональное антитело» относится к антителу, которое происходит из единственного клеточного клона, включая любой клон эукариотической или прокариотической клетки или фага, и не относится к способу, с помощью которого производится указанное антитело. Моноклональное антитело обладает моноспецифичностью связывания и аффинностью в отношении конкретного эпитопа. Термин «моноклональное антитело» не ограничивается антителом, полученным с помощью гибридомной технологии.
[0065] Термин «нативный» относится к последовательности иммуноглобулина дикого типа из видов, в которых указанный иммуноглобулин был получен. Например, согласно вариантам реализации изобретения, при которых Cys80 присутствует в вариабельной области легкой цепи вида, из которого он получен, считается, что Cys80 присутствует в нативной вариабельной области легкой цепи.
[0066] При использовании в настоящей заявке термин «процентная идентичность» и подобные ему термины используются для описания отношений по последовательностям между двумя или более нуклеиновыми кислотами, полинуклеотидами, белками или полипептидами и понимаются в контексте и вместе с такими терминами, как: (a) эталонная последовательность, (b) окно сравнения, (c) идентичность по последовательности и (d) процентная идентичность по последовательности.
(a) «Эталонная последовательность» представляет собой определенную последовательность, используемую в качестве основы для сравнения последовательностей. Эталонная последовательность может представлять собой часть или целую конкретную последовательность; например, сегмент полноразмерной последовательности кДНК или гена или полную последовательность кДНК или гена. Для полипептидов примеры длины эталонной полипептидной последовательности включают по меньшей мере приблизительно 16 аминокислот, по меньшей мере приблизительно 20 аминокислот, по меньшей мере приблизительно 25 аминокислот, по меньшей мере приблизительно 35 аминокислот, по меньшей мере приблизительно 50 аминокислот или по меньшей мере приблизительно 100 аминокислот. Для нуклеиновых кислот примеры длины эталонной последовательности нуклеиновой кислоты включают по меньшей мере приблизительно 50 нуклеотидов, по меньшей мере приблизительно 60 нуклеотидов, по меньшей мере приблизительно 75 нуклеотидов, по меньшей мере приблизительно 100 нуклеотидов или по меньшей мере приблизительно 300 нуклеотидов или любое целое число около или между указанными значениями.
(b) «Окно сравнения» включает ссылку на непрерывный и точно определенный участок последовательности полинуклеотида или полипептида, где указанную последовательность полинуклеотида или полипептида можно сравнивать с эталонной последовательностью и где часть указанной полинуклеотидной или полипептидной последовательности в окне сравнения может содержать вставки, замены или делеции (т.е., пропуски) по сравнению с эталонной последовательностью (которая не содержит указанные вставки, замены или делеции) для оптимального выравнивания двух последовательностей. Примеры окон сравнения могут представлять собой по меньшей мере 20 непрерывно расположенных нуклеотидов или аминокислот в длину и необязательно могут содержать 30, 40, 50, 100 или более нуклеотидов или аминокислот. Специалисту в данной области техники ясно, что во избежание недостоверного завышения подобия с эталонной последовательностью из-за включения пробелов, как правило, в последовательность полинуклеотида или полипептида вводят «штраф» за внесение пробела, который вычитают из количества совпадений.
(c) Способы выравнивания последовательностей для их сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для их сравнения можно проводить с помощью алгоритма поиска локальной гомологии Смита-Уотермана (Smith and Waterman, Adv. Appl. Math., 2: 482, 1981); алгоритма выравнивания областей гомологии Нидлмана-Вунша (Needleman and Wunsch, J. Mol. Biol., 48: 443, 1970); с помощью метода поиска сходства по Пирсону-Липману (Pearson and Lipman, Proc. Natl. Acad. Sci. USA, 8: 2444, 1988); с помощью автоматизированного выполнения указанных алгоритмов, включая, но не ограничиваясь указанными: CLUSTAL в программе PC/Gene от компании Intelligenetics, Маунтин-Вью, Калифорния, GAP, BESTFIT, BLAST, FASTA и TFASTA в пакете программ Wisconsin Genetics, Genetics Computer Группа (GCG), 7 Science Dr., Мэдисон, Висконсин, США. Программа CLUSTAL хорошо описана Хиггинсом и Шарпом (Higgins и Sharp, Gene, 73: 237-244, 1988) и в источниках Corpet, et al., Nucleic Acid Research, 16:881-90, 1988; Huang, et al., Computer Applications in the Biosciences, 8:1-6, 1992; и Pearson, et al., Methods in Molecular Biology, 24:7-331, 1994. Семейство программ BLAST, которые можно использовать для поиска подобий в базах данных включает: программу BLASTN для запрашиваемой нуклеотидной последовательностей против базы данных нуклеотидных последовательностей; BLASTX для запроса нуклеотидных последовательностей против базы данных белковых последовательностей; BLASTP для запроса белковых последовательностей против базы данных белковых последовательностей; TBLASTN для запроса белковых последовательностей против базы данных нуклеотидных последовательностей и TBLASTX для запроса нуклеотидных последовательностей против базы данных нуклеотидных последовательностей (см., Current Protocols in Molecular Biology, Chapter 19, Ausubel, et al., Eds., Greene Publishing and Wiley-Interscience, New York, 1995). В будущем несомненно появятся новые версии указанных выше программ или новые программы, которые можно будет использовать совместно с настоящим изобретением.
(d) «Процентная идентичность» означает значение, определенное путем сравнения двух оптимально выровненных по окну сравнения последовательностей, где часть последовательности полинуклеотида или полипептида в окне сравнения может содержать вставки, замены или делеции (т.е., пробелы) по сравнению с эталонной последовательностью (которая не содержит указанных вставок, замен или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества положений, в которых одно и то же нуклеиновое основание или аминокислотный остаток встречается в обеих последовательностях, с определением количества совпадающих положений, деления указанного количества совпадающих положений на общее число положений в окне сравнения и умножения результата на 100 с получением процентной идентичности по последовательности.
[0067] «Фармацевтически эффективное количество» относится к количеству иммуноглобулина, которое обеспечивает лечение субъекта.
[0068] «Полярная аминокислота» относится к гидрофильной аминокислоте, содержащей боковую цепь, которая является незаряженной при физиологическом значении pH, но содержит по меньшей мере одну связь, в которой пара электронов, принадлежащих одновременно двум атомам, располагается ближе к одному из атомов. Кодируемые генами полярные аминокислоты включают Asn (N), Gln (Q) Ser (S) и Thr (T).
[0069] Термин «субъект» при использовании в настоящей заявке относится к человеку или отличному от человека организму. Таким образом, способы, иммуноглобулины и конъюгированные иммуноглобулины, описанные в настоящей заявке, применимы для лечения заболеваний и состояний как человека, так и животных. Субъекты могут представлять собой «пациентов», т.е. живого человека или отличный от человека организм, которому проводят медицинское лечение заболевания или состояния, или человека или отличный от человека организм, не страдающий определенным заболеванием, которому проводят исследование для выявления признаков патологии или наличия/отсутствия конкретного состояния.
[0070] Термин «замена» относится к замещению (замене) одного аминокислотного остатка на другой. «Замена» включает, например, миссенс-мутации в одной или более пар оснований ДНК, кодирующей аминокислотный остаток, или конструирование белка с заменой одной аминокислоты на другую.
[0071] При использовании в настоящей заявке термин «лечение» и подобные ему термины относятся к снижению тяжести и/или частоты симптомов заболевания, устранению симптомов заболевания и/или причины, обуславливающей указанные симптомы, снижению частоты или вероятности появления симптомов заболеваний и/или причины, обусловливающей указанные симптомы, и улучшению или восстановлению повреждения, прямо или косвенно вызванного заболеванием. Примеры заболеваний включают рак, но не ограничиваются указанным.
[0072] «Реагирующая с тиолом группа» относится к реагенту или группе, которая может образовывать ковалентную связь с тиоловой группой цистеина.
[0073] «Неспаренный Cys80» относится к Cys80, присутствующему в иммуноглобулине и содержащему тиоловую функциональную группу, которая не вовлечена во внутримолекулярную или межмолекулярную дисульфидную связь. Например, тиоловая функциональная группа «неспаренного Cys80» не вовлечена в дисульфидную связь с Cys171.
[0074] При использовании в настоящей заявке термин «идентичный на 90%» включает идентичность эталонному элементу (например, биологической последовательности) по меньшей мере на 90%, на 91%, на 92%, на 93%, на 94%, на 95%, на 96%, на 97%, на 98%, на 99% или на 100%.
[0075] Следующие далее сокращения используются на протяжении всей заявки: конъюгаты антитела и лекарственного средства (ADC); лекарственное средство-антитело (DAR); каркасная область (FWR); определяющая комплементарность область (CDR); карбоангидраза IX (CA9); мезотелин (MSLN); ауристатин F (AuF); вариабельная область тяжелой цепи (VH); вариабельная область легкой цепи (VL); вариабельная область каппа-цепи (Vκ); происхождение от кролика (Rb; rabb); константная область гамма-цепи (Cγ); константная область каппа-цепи (Cκ); моноклональное антитело (mAb); цистеин в положении аминокислоты 80 (Cys80).
Получение конъюгированных иммуноглобулинов
[0076] В настоящей заявке описаны способы получения конъюгированных иммуноглобулинов, включающие:
декэпирование цистеина в положении аминокислоты 80 («Cys80») в вариабельной области легкой цепи иммуноглобулина, происходящего от кролика, где указанный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи; и
конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0077] Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Вариабельные области легких цепей описанных иммуноглобулинов происходят от кролика. Согласно некоторым вариантам реализации изобретения, Cys80 может присутствовать в нативной вариабельной области легкой цепи иммуноглобулина, происходящего от кролика. Примеры кроликов, из которых может происходить вариабельная область легкой цепи, содержащая Cys80, включают кролика вида Oryctolagus cuniculus, но не ограничиваются указанным. В некоторых аспектах, вариабельная область легкой цепи может, например, происходить из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область легкой цепи может происходить из кролика b9.
[0078] Примеры способов декэпирования Cys80 в вариабельной области легкой цепи иммуноглобулина включают инкубирование иммуноглобулина с восстанавливающим буфером с последующим инкубированием указанного иммуноглобулина с окисляющим буфером. Восстанавливающие буферы содержат один или более восстанавливающих агентов. Подходящие восстанавливающие агенты включают, например, цистеин (включая L-цистеин и D-цистеин), 2-меркаптоэтиламин, трис(2-карбоксиэтил)фосфин, 2-меркаптоэтансульфоновую кислоту, 2-меркаптопропионовую кислоту или их комбинации. Согласно предпочтительным вариантам реализации, восстанавливающий буфер может содержать мягкий восстановитель, такой как цистеин. Концентрация восстанавливающего агента может варьировать от приблизительно 0,2 мМ до приблизительно 100 мМ, от приблизительно 1 мМ до приблизительно 100 мМ, от приблизительно 2 мМ до приблизительно 100 мМ, от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 100 мМ, от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 50 мМ до приблизительно 100 мМ, от приблизительно 0,2 мМ до приблизительно 90 мМ, от приблизительно 0,2 мМ до приблизительно 80 мМ, от приблизительно 0,2 мМ до приблизительно 70 мМ, от приблизительно 0,2 мМ до приблизительно 50 мМ, от приблизительно 0,2 мМ до приблизительно 30 мМ, от приблизительно 0,2 мМ до приблизительно 25 мМ, от приблизительно 0,2 мМ до приблизительно 10 мМ или от приблизительно 0,2 мМ до приблизительно 5 мМ. Концентрация восстанавливающего агента может составлять приблизительно 0,2 мМ. Концентрация восстанавливающего агента может составлять приблизительно 1 мМ. Концентрация восстанавливающего агента может составлять приблизительно 2 мМ. Концентрация восстанавливающего агента может составлять приблизительно 5 мМ. Концентрация восстанавливающего агента может составлять приблизительно 10 мМ. Концентрация восстанавливающего агента может составлять приблизительно 15 мМ. Концентрация восстанавливающего агента может составлять приблизительно 20 мМ. Концентрация восстанавливающего агента может составлять приблизительно 25 мМ. Концентрация восстанавливающего агента может составлять приблизительно 30 мМ. Концентрация восстанавливающего агента может составлять приблизительно 40 мМ. Концентрация восстанавливающего агента может составлять приблизительно 50 мМ. Концентрация восстанавливающего агента может составлять приблизительно 60 мМ. Концентрация восстанавливающего агента может составлять приблизительно 70 мМ. Концентрация восстанавливающего агента может составлять приблизительно 80 мМ. Концентрация восстанавливающего агента может составлять приблизительно 90 мМ. Концентрация восстанавливающего агента может составлять приблизительно 100 мМ.
[0079] Согласно некоторым вариантам реализации изобретения, восстанавливающий агент, например, может содержать от приблизительно 2 мМ до приблизительно 10 мМ цистеина. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 2 мМ до приблизительно 10 мМ D-цистеина. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 2 мМ до приблизительно 10 мМ L-цистеина. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 10 мМ до приблизительно 100 мМ 2-меркаптоэтиламина. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 0,2 мМ до приблизительно 5 мМ трис(2-карбоксиэтил)фосфина. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 2 мМ до приблизительно 20 мМ 2-меркаптоэтансульфоновой кислоты. Согласно некоторым вариантам реализации изобретения, восстанавливающий агент может содержать от приблизительно 2 мМ до приблизительно 20 мМ 2-меркаптопропионовой кислоты.
[0080] Восстанавливающий буфер может дополнительно содержать буферные агенты, такие как фосфат натрия, фосфат калия, MOPS, HEPES, борат натрия, борат калия или любую их комбинацию. Подходящие концентрации буферного агента включают, но не ограничиваются указанными, от приблизительно 10 мМ до приблизительно 100 мМ, от приблизительно 15 мМ до приблизительно 100 мМ, от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 35 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ, от приблизительно 80 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 90 мМ, от приблизительно 10 мМ до приблизительно 80 мМ, от приблизительно 10 мМ до приблизительно 60 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 10 мМ до приблизительно 30 мМ или от приблизительно 10 мМ до приблизительно 20 мМ.
[0081] Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать, например, от приблизительно 10 мМ до приблизительно 100 мМ фосфата натрия. Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать от приблизительно 10 мМ до приблизительно 100 мМ фосфата калия. Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать от приблизительно 10 мМ до приблизительно 100 мМ MOPS. Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать от приблизительно 10 мМ до приблизительно 100 мМ HEPES. Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать от приблизительно 10 мМ до приблизительно 100 мМ бората натрия. Согласно некоторым вариантам реализации изобретения, восстанавливающий буфер может содержать от приблизительно 10 мМ до приблизительно 100 мМ бората калия.
[0082] Восстанавливающий буфер может дополнительно содержать хелатирующий агент, включая, но не ограничиваясь указанными, ЭДТА (этилендиаминтетрауксусную кислоту), DTPA (диэтилентриаминпентауксусную кислоту) или их комбинацию. Подходящие концентрации хелатирующих агентов включают от приблизительно 10 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 80 мМ, от приблизительно 10 мМ до приблизительно 60 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 10 мМ до приблизительно 30 мМ, от приблизительно 10 мМ до приблизительно 20 мМ, от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 50 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ или от приблизительно 80 мМ до приблизительно 100 мМ.
[0083] Подходящие диапазоны значения pH восстанавливающего буфера включают от приблизительно 6,8 до приблизительно 8,0. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 6,8. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 6,9. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,0. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,1. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,2. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,3. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,4. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,5. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,6. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,7. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,8. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 7,9. Согласно некоторым вариантам реализации изобретения, значение pH восстанавливающего буфера может составлять приблизительно 8,0.
[0084] Иммуноглобулин можно инкубировать с восстанавливающим буфером в течение от приблизительно 12 часов до приблизительно 96 часов, от приблизительно 18 часов до приблизительно 96 часов, от приблизительно 24 часов до приблизительно 96 часов, от приблизительно 30 часов до приблизительно 96 часов, от приблизительно 36 часов до приблизительно 96 часов, от приблизительно 42 часов до приблизительно 96 часов, от приблизительно 48 часов до приблизительно 96 часов, от приблизительно 54 часов до приблизительно 96 часов, от приблизительно 60 часов до приблизительно 96 часов, от приблизительно 12 часов до приблизительно 90 часов, от приблизительно 12 часов до приблизительно 84 часов, от приблизительно 12 часов до приблизительно 78 часов, от приблизительно 12 часов до приблизительно 72 часов, от приблизительно 12 часов до приблизительно 66 часов, от приблизительно 12 часов до приблизительно 60 часов, от приблизительно 12 часов до приблизительно 54 часов, от приблизительно 12 часов до приблизительно 48 часов, от приблизительно 12 часов до приблизительно 42 часов, от приблизительно 12 часов до приблизительно 36 часов или от приблизительно 12 часов до приблизительно 30 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 12 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 18 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 24 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 30 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 36 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 42 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 48 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 54 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 60 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 66 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 72 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 78 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 84 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 90 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение приблизительно 96 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с восстанавливающим буфером в течение более чем 96 часов.
[0085] Подходящие окисляющие буферы включают, но не ограничиваются указанными, буферы на основе Трис-буфера, глутамина, аргинина или другие буферы на основе аминокислоты или первичного амина. Концентрация окисляющего буфера может варьировать от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ, от приблизительно 80 мМ до приблизительно 100 мМ, от приблизительно 20 мМ до приблизительно 80 мМ, от приблизительно 20 мМ до приблизительно 60 мМ или от приблизительно 20 мМ до приблизительно 40 мМ. Концентрация окисляющего буфера может составлять приблизительно 20 мМ. Концентрация окисляющего буфера может составлять приблизительно 25 мМ. Концентрация окисляющего буфера может составлять приблизительно 30 мМ. Концентрация окисляющего буфера может составлять приблизительно 40 мМ. Концентрация окисляющего буфера может составлять приблизительно 50 мМ. Концентрация окисляющего буфера может составлять приблизительно 60 мМ. Концентрация окисляющего буфера может составлять приблизительно 70 мМ. Концентрация окисляющего буфера может составлять приблизительно 80 мМ. Концентрация окисляющего буфера может составлять приблизительно 90 мМ. Концентрация восстанавливающего агента может составлять приблизительно 100 мМ.
[0086] Иммуноглобулин можно инкубировать с окисляющим буфером в течение от приблизительно 24 часов до приблизительно 96 часов, от приблизительно 30 часов до приблизительно 96 часов, от приблизительно 36 часов до приблизительно 96 часов, от приблизительно 42 часов до приблизительно 96 часов, от приблизительно 48 часов до приблизительно 96 часов, от приблизительно 54 часов до приблизительно 96 часов, от приблизительно 60 часов до приблизительно 96 часов, от приблизительно 24 часов до приблизительно 90 часов, от приблизительно 24 часов до приблизительно 84 часов, от приблизительно 24 часов до приблизительно 78 часов, от приблизительно 24 часов до приблизительно 72 часов, от приблизительно 24 часов до приблизительно 66 часов, от приблизительно 24 часов до приблизительно 60 часов, от приблизительно 24 часов до приблизительно 54 часов, от приблизительно 24 часов до приблизительно 48 часов, от приблизительно 24 часов до приблизительно 42 часов или от приблизительно 24 часов до приблизительно 36 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 24 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 30 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 36 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 42 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 48 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 54 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 60 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 66 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 72 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 78 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 84 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 90 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение приблизительно 96 часов. Согласно некоторым вариантам реализации изобретения, иммуноглобулин можно инкубировать с окисляющим буфером в течение более чем 96 часов.
[0087] Подходящие диапазоны pH окисляющего буфера включают от приблизительно 7,5 до приблизительно 9,0. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 7,5. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 7,6. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 7,7. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 7,8. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 7,9. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,0. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,1. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,2. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,3. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,4. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,5. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,6. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,7. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,8. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 8,9. Согласно некоторым вариантам реализации изобретения, значение pH окисляющего буфера может составлять приблизительно 9,0.
[0088] Способ может дополнительно включать осуществление иммобилизации иммуноглобулина на подложке (матрице) перед осуществлением инкубирования с восстанавливающим агентом и элюирование указанного иммуноглобулина из подложки после инкубирования с окисляющим буфером. Подходящие подложки включают любую поверхность, с которой иммуноглобулин может связываться и из которой его можно элюировать, включая, но не ограничиваясь указанными, белок A, белок G, белок L, антитело против Fab-фрагмента, антитело против Fc-фрагмента, аффинные подложки на основе антител против mAb и сильные катионообменные смолы. Согласно некоторым вариантам реализации изобретения, подложка может представлять собой белок A. Согласно некоторым вариантам реализации изобретения, подложка может представлять собой белок G. Согласно некоторым вариантам реализации изобретения, подложка может представлять собой белок L. Согласно некоторым вариантам реализации изобретения, подложка может содержать антитело против Fab-фрагмента. Согласно некоторым вариантам реализации изобретения, подложка может содержать антитело против Fc-фрагмента. Согласно некоторым вариантам реализации изобретения, подложка может содержать антитела против mAb. Согласно некоторым вариантам реализации изобретения, подложка может содержать сильную катионообменную смолу.
[0089] Описанные способы декэпирования иммуноглобулина могут включать: уравновешивание подложки; иммобилизацию иммуноглобулина на подложке; инкубирование иммобилизированного иммуноглобулина на подложке с восстанавливающим буфером для удаления кэпирующей группы; инкубирование иммобилизированного иммуноглобулина на подложке с окисляющим буфером; элюирование иммуноглобулина из подложки и нейтрализация иммуноглобулина.
[0090] Специалистам в данной области техники очевидно, что буфер, концентрация, pH и время элюирования иммуноглобулина из подложки зависит, по меньшей мере отчасти, от подложки. Например, согласно вариантам реализации, при которых подложка представляет собой белок A, иммуноглобулин можно элюировать из белка A с применением глицина (например, 0,1 M глицина при pH 2,9). Согласно некоторым вариантам реализации изобретения, элюирование можно осуществлять при низком значении pH буфера.
[0091] Нейтрализация иммуноглобулина может включать инкубирование указанного иммуноглобулина в буфере на основе Трис-буфера, фосфата натрия или фосфата калия (называемом в настоящей заявке также «нейтрализующий буфер»). Концентрация нейтрализующего буфера может составлять от приблизительно 0,5 M до приблизительно 2 M, и значение pH указанного буфера может составлять от приблизительно 8,0 до приблизительно 9,5.
[0092] Конъюгирование можно осуществлять путем растворения реагирующего с тиолом соединения в смеси для растворения и инкубирования растворенного реагирующего с тиолом соединения с иммуноглобулином в буфере для конъюгации.
[0093] Для нерастворимых в воде реагирующих с тиолом соединений, которые могут включать соединения на основе малеимида, но не ограничиваются ими, подходящие растворы для растворения включают органические смешивающиеся с водой растворители, такие как диметилсульфоксид (ДМСО). Для водорастворимых реагирующих с тиолом соединений подходящие растворы для растворения включают, но не ограничиваются указанными, водные или водные буферные растворы, такие как фосфатно-солевой буфер, pH 7,2 (1 x PBS).
[0094] Подходящие концентрации реагирующих с тиолом соединений включают от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 100 мМ, от приблизительно 25 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 55 мМ до приблизительно 100 мМ, от приблизительно 70 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 90 мМ, от приблизительно 10 мМ до приблизительно 75 мМ, от приблизительно 10 мМ до приблизительно 60 мМ, от приблизительно 10 мМ до приблизительно 50 мМ, от приблизительно 10 мМ до приблизительно 40 мМ или от приблизительно 10 мМ до приблизительно 30 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 10 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 20 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 30 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 40 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 50 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 60 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 70 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 80 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 90 мМ. Согласно некоторым вариантам реализации изобретения, концентрация реагирующего с тиолом соединения может составлять приблизительно 100 мМ.
[0095] Подходящие концентрации иммуноглобулина включают от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 1 мг/мл до приблизительно 20 мг/мл, от приблизительно 5 мг/мл до приблизительно 20 мг/мл, от приблизительно 10 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл или от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 0,1 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 0,5 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 1 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 2 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 5 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 10 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 15 мг/мл. Согласно некоторым вариантам реализации изобретения, концентрация иммуноглобулина может составлять приблизительно 20 мг/мл.
[0096] Подходящие отношения реагирующего с тиолом соединения к иммуноглобулину включают от приблизительно 3:1 до 20:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 3:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 4:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 5:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 6:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 7:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 8:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 9:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 10:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 11:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 12:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 13:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 14:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 15:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 16:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 17:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 18:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 19:1. Согласно некоторым вариантам реализации изобретения, отношение реагирующее с тиолом соединение:иммуноглобулин может составлять 20:1.
[0097] Инкубирование можно осуществлять в ряде подходящих буферов для конъюгации, включая, например, 1xPBS, pH 7,2, фосфат натрия, фосфат калия, борат натрия и HEPES. Концентрация буфера для конъюгации включает от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 100 мМ, от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 45 мМ до приблизительно 100 мМ, от приблизительно 60 мМ до приблизительно 100 мМ, от приблизительно 75 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 90 мМ, от приблизительно 10 мМ до приблизительно 75 мМ, от приблизительно 10 мМ до приблизительно 60 мМ, от приблизительно 10 мМ до приблизительно 45 мМ или от приблизительно 10 мМ до приблизительно 30 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 10 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 20 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 30 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 40 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 50 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 60 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 70 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 80 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 90 мМ. Согласно некоторым вариантам реализации изобретения, концентрация буфера для конъюгации может составлять приблизительно 100 мМ.
[0098] Буфер для конъюгации дополнительно может содержать хлорид натрия. Подходящие концентрации хлорида натрия включают от приблизительно 0 мМ до приблизительно 500 мМ, от приблизительно 25 мМ до приблизительно 500 мМ, от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 75 мМ до приблизительно 500 мМ, от приблизительно 100 мМ до приблизительно 500 мМ, от приблизительно 150 мМ до приблизительно 500 мМ, от приблизительно 200 мМ до приблизительно 500 мМ, от приблизительно 250 мМ до приблизительно 500 мМ, от приблизительно 300 мМ до приблизительно 500 мМ, от приблизительно 350 мМ до приблизительно 500 мМ, от приблизительно 400 мМ до приблизительно 500 мМ, от приблизительно 0 мМ до приблизительно 400 мМ, от приблизительно 0 мМ до приблизительно 350 мМ, от приблизительно 0 мМ до приблизительно 300 мМ, от приблизительно 0 мМ до приблизительно 250 мМ, от приблизительно 0 мМ до приблизительно 200 мМ, от приблизительно 0 мМ до приблизительно 150 мМ, от приблизительно 0 мМ до приблизительно 100 мМ, от приблизительно 0 мМ до приблизительно 50 мМ или от приблизительно 0 мМ до приблизительно 25 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 25 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 50 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 75 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 100 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 150 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 200 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 250 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 300 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 350 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 400 мМ. Согласно некоторым вариантам реализации изобретения, концентрация хлорида натрия может составлять приблизительно 500 мМ.
[0099] Значение pH буфера для конъюгации может составлять от приблизительно 6,5 до приблизительно 8,5. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 6,5. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 6,6. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 6,7. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 6,8. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 6,9. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,0. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,1. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,2. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,3. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,4. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,5. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,6. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,7. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,8. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 7,9. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,0. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,1. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,2. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,3. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,4. Согласно некоторым вариантам реализации изобретения, значение pH буфера для конъюгации может составлять приблизительно 8,5.
[0100] Для облегчения растворения реагирующего с тиолом соединения в буфере для конъюгации конечная концентрация органического смешиваемого с водой растворителя в буфере для конъюгации может составлять от приблизительно 0% до приблизительно 20%, от приблизительно 2% до приблизительно 20%, от приблизительно 5% до приблизительно 20%, от приблизительно 8% до приблизительно 20%, от приблизительно 11% до приблизительно 20%, от приблизительно 16% до приблизительно 20%, от приблизительно 0% до приблизительно 18%, от приблизительно 0% до приблизительно 15%, от приблизительно 0% до приблизительно 12%, от приблизительно 0% до приблизительно 10%, от приблизительно 0% до приблизительно 8%, от приблизительно 0% до приблизительно 6% или от приблизительно 0% до приблизительно 2%.
[0101] Буфер для конъюгации может дополнительно содержать пропиленгликоль для облегчения растворения реагирующего с тиолом соединения в буфере для конъюгации. Подходящие концентрации пропиленгликоля включают от приблизительно 10% до приблизительно 50%, от приблизительно 20% до приблизительно 50%, от приблизительно 30% до приблизительно 50%, от приблизительно 40% до приблизительно 50%, от приблизительно 10% до приблизительно 40%, от приблизительно 10% до приблизительно 30% или от приблизительно 10% до приблизительно 20%. Согласно некоторым вариантам реализации изобретения, концентрация пропиленгликоля может составлять приблизительно 10%. Согласно некоторым вариантам реализации изобретения, концентрация пропиленгликоля может составлять приблизительно 20%. Согласно некоторым вариантам реализации изобретения, концентрация пропиленгликоля может составлять приблизительно 30%. Согласно некоторым вариантам реализации изобретения, концентрация пропиленгликоля может составлять приблизительно 40%. Согласно некоторым вариантам реализации изобретения, концентрация пропиленгликоля может составлять приблизительно 50%.
[0102] Буфер для конъюгации может дополнительно содержать неионный детергент для облегчения растворения конъюгированного иммуноглобулина в буфере для конъюгации. Примеры неионных детергентов включают полисорбат-20 или полисорбат-80, но не ограничиваются указанными. Подходящие концентрации неионного детергента включают от приблизительно 0% до приблизительно 1%, от приблизительно 0,1% до приблизительно 1%, от приблизительно 0,3% до приблизительно 1%, от приблизительно 0,5% до приблизительно 1%, от приблизительно 0,7% до приблизительно 1%, от приблизительно 0% до приблизительно 0,8%, от приблизительно 0% до приблизительно 0,6%, от приблизительно 0% до приблизительно 0,4% или от приблизительно 0% до приблизительно 0,2%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,1%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,2%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,3%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,4%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,5%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,6%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,7%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,8%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 0,9%. Согласно некоторым вариантам реализации изобретения, концентрация неионного детергента может составлять приблизительно 1,0%.
[0103] Инкубирование можно осуществлять в течение от приблизительно 2 часов до приблизительно 48 часов, в течение от приблизительно 6 часов до приблизительно 48 часов, в течение от приблизительно 12 часов до приблизительно 48 часов, в течение от приблизительно 24 часов до приблизительно 48 часов, в течение от приблизительно 30 часов до приблизительно 48 часов, в течение от приблизительно 36 часов до приблизительно 48 часов, в течение от приблизительно 42 часов до приблизительно 48 часов, в течение от приблизительно 2 часов до приблизительно 42 часов, в течение от приблизительно 2 часов до приблизительно 36 часов, в течение от приблизительно 2 часов до приблизительно 30 часов, в течение от приблизительно 2 часов до приблизительно 24 часов, в течение от приблизительно 2 часов до приблизительно 18 часов, в течение от приблизительно 2 часов до приблизительно 12 часов или в течение от приблизительно 2 часов до приблизительно 6 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 2 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 6 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 12 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 18 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 24 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 30 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 36 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 42 часов. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять в течение 48 часов.
[0104] Температура инкубирования может составлять от приблизительно 18ºC до приблизительно 37ºC, от приблизительно 20ºC до приблизительно 37ºC, от приблизительно 22ºC до приблизительно 37ºC, от приблизительно 24ºC до приблизительно 37ºC, от приблизительно 26ºC до приблизительно 37ºC, от приблизительно 28ºC до приблизительно 37ºC, от приблизительно 30ºC до приблизительно 37ºC, от приблизительно 32ºC до приблизительно 37ºC, от приблизительно 34ºC до приблизительно 37ºC, от приблизительно 18ºC до приблизительно 34ºC, от приблизительно 18ºC до приблизительно 32ºC, от приблизительно 18ºC до приблизительно 30ºC, от приблизительно 18ºC до приблизительно 28ºC, от приблизительно 18ºC до приблизительно 26ºC или от приблизительно 18ºC до приблизительно 24ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 18ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 20ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 22ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 24ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 26ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 28ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 30ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 32ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 34ºC. Согласно некоторым вариантам реализации изобретения, инкубирование можно осуществлять при 37ºC.
[0105] Не связанные реагирующие с тиолом соединения можно отделять от конъюгированного иммуноглобулина с помощью хроматографии с обессоливанием с применением ряда подходящих смол, включая, но не ограничиваясь указанными, смолу G-25, смолу G-50, Biogel P10 или другие смолы с эксклюзионным пределом в диапазонах 5,000-10,000 Да. Хроматографию можно осуществлять на колонке или спин-колонке в зависимости от объема. Подходящие буферы для обессоливания включают, например, 1xPBS, фосфат натрия, фосфат калия, борат натрия, или же буферы на основе HEPES могут заменять 1x PBS.
[0106] Согласно типичным вариантам реализации изобретения, конъюгирование можно осуществлять путем растворения реагирующего с тиолом соединения на основе малеимида в 100% диметилсульфоксиде (ДМСО) при конечной концентрации реагирующего с тиолом соединения 10 мМ. Растворенное реагирующее с тиолом соединение затем можно инкубировать с иммуноглобулином при концентрации иммуноглобулина 5 мг/мл в 1xPBS, pH 7,2, при молярном отношении реагирующее с тиолом соединение:иммуноглобулин 5:1 при тщательном перемешивании. Инкубирование можно осуществлять в течение 24 часов при 22ºC. Невключенное в иммуноглобулин реагирующее с тиолом соединение можно отделять от конъюгированного иммуноглобулина с помощью хроматографии с обессоливанием с применением смолы G-25 с использованием 1x PBS в качестве электродного буфера.
[0107] Предпочтительно, реагирующее с тиолом соединение конъюгировано с Cys80 через способную реагировать с тиолом группу. Способные реагировать с тиолом группы включают галогенацетилы, малеимиды, азиридины, акрилoилы, арилирующие агенты, винилсульфоны, пиридилдисульфиды, TNB-тиолы и дисульфид-восстанавливающие агенты. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать малеимид. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать галогенацетил. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать азиридин. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать акрилоил. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать арилирующий агент. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать винилсульфон. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать пиридилдисульфид. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать TNB-тиол. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать дисульфид-восстанавливающий агент.
[0108] Способные реагировать с тиолом группы могут происходить из ряда подходящих реагентов, включая йодацетамиды, малеимиды, бензиловые галиды и бромметилкетоны, которые могут вступать в реакцию через S-алкилирование тиолов с образованием стабильных тиоэфирных продуктов.
[0109] Способная реагировать с тиолом группа может быть присоединена к линкеру. Линкеры могут представлять собой нерасщепляемые линкеры или расщепляемые линкеры. Примеры линкеров включают, например, содержащие дисульфид линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. Согласно некоторым аспектам, линкер может представлять собой нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают, но не ограничиваются указанными, полиэтиленгликоль (ПЭГ) или алкил. Согласно некоторым вариантам реализации изобретения, линкер может содержать ПЭГ. Согласно некоторым аспектам, линкер может представлять собой расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-пара-аминобензил. Согласно некоторым аспектам, линкер может представлять собой содержащий дисульфид линкер. Согласно некоторым аспектам, линкер может представлять собой линкер на основе ацеталя. Согласно некоторым аспектам, линкер может представлять собой линкер на основе кеталя. Примеры линкеров, ковалентно присоединенных к способной реагировать с тиолом группе, описаны, например, в публикации заявки на патент США № 20140050746.
[0110] Реагирующее с тиолом соединение может дополнительно содержать функциональный агент. Подходящие функциональные агенты включают, например, флуорофоры, флуоресцентные красители, полипептиды, иммуноглобулины, антибиотики, нуклеиновые кислоты, радионуклиды, химические линкеры, малые молекулы, хелаторы, липиды и лекарственные средства. Согласно некоторым аспектам, функциональный агент может содержать флуорофор. Согласно некоторым аспектам, функциональный агент может содержать флуоресцентный краситель. Согласно некоторым аспектам, функциональный агент может содержать полипептид. Согласно некоторым аспектам, функциональный агент может содержать иммуноглобулин. Согласно некоторым аспектам, функциональный агент может содержать антибиотик. Согласно некоторым аспектам, функциональный агент может содержать нуклеиновую кислоту (такую как ДНК или РНК). Согласно некоторым аспектам, функциональный агент может содержать радионуклид. Согласно некоторым аспектам, функциональный агент может содержать химический линкер (например, дибензилциклооктин (DBCO) или азид). Согласно некоторым аспектам, функциональный агент может содержать малую молекулу. Согласно некоторым аспектам, функциональный агент может содержать хелатор (например, DOTA, CHX-A”-DTPA, NOTA и др.). Согласно некоторым аспектам, функциональный агент может содержать липид. Согласно некоторым аспектам, функциональный агент может содержать лекарственное средство. Согласно некоторым аспектам, функциональный агент может содержать комбинацию любых из перечисленных выше функциональных агентов.
[0111] Реагирующее с тиолом соединение (т.е. первое реагирующее с тиолом соединение) может быть связано со вторым реагирующим с тиолом соединением, где указанное второе реагирующее с тиолом соединение связано со вторым иммуноглобулином, содержащим вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении аминокислоты 80 («Cys802»), и где второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу, связанную с Cys802. Например, первое реагирующее с тиолом соединение и второе реагирующее с тиолом соединение могут содержать первый и второй химический линкер в качестве первого и второго функционального агента соответственно. Первый и второй химические линкеры можно соединять друг с другом с помощью ряда подходящих способов, включая, например, реакции клик-химии.
[0112] Согласно предпочтительному варианту реализации, Cys80 может быть неспаренным. Подходящие способы получения неспаренного Cys80 включают, например, гибридизацию вариабельной области легкой цепи, содержащей Cys80, с константным доменом, содержащим аминокислотный остаток в положении 171, отличный от цистеина.
[0113] Описанные способы можно осуществлять на гибридизованном иммуноглобулине. Таким образом, согласно некоторым вариантам реализации изобретения, иммуноглобулин может представлять собой гибридизованный иммуноглобулин. Согласно вариантам реализации изобретения, при которых иммуноглобулин является гибридизованным, способы получения конъюгированного иммуноглобулина могут включать: декэпирование Cys80 в вариабельной области легкой цепи гибридного иммуноглобулина, где указанный гибридизованный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи; и конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0114] В качестве альтернативы, описанные способы могут дополнительно включать гибридизацию иммуноглобулина до этапа декэпирования. Например, способы получения конъюгированного иммуноглобулина могут включать: гибридизацию иммуноглобулина, содержащего вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит Cys80; декэпирование указанного Cys80 и конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0115] Описанные способы можно осуществлять на гуманизированном иммуноглобулине. Таким образом, согласно некоторым вариантам реализации изобретения, иммуноглобулин может представлять собой гуманизированный иммуноглобулин. Согласно вариантам реализации изобретения, при которых иммуноглобулин является гуманизированным, способы получения конъюгированного иммуноглобулина могут включать: декэпирование Cys80 в вариабельной области легкой цепи гуманизированного иммуноглобулина, где указанный гуманизированный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи; и конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0116] В качестве альтернативы, описанные способы могут дополнительно включать гуманизацию иммуноглобулина до этапа декэпирования. Например, способы получения конъюгированного иммуноглобулина могут включать: гуманизацию иммуноглобулина, содержащего вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит Cys80; декэпирование Cys80 и конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0117] Способы могут дополнительно включать замену аминокислотного остатка в положении 83 на аминокислотный остаток, отличный от Phe, Lys или Cys. Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на аланин («Ala83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на валин («Val83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на изолейцин («Ile83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на треонин («Thr83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на аргинин («Arg83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на аспарагин («Asn83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на аспарагиновую кислоту («Asp83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на глутаминовую кислоту («Glu83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на глутамин («Gln83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на глицин («Gly83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на гистидин («His83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на лейцин («Leu83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на метионин («Met83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на пролин («Pro83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на серин («Ser83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на триптофан («Trp83»). Согласно некоторым аспектам, способы могут включать замену фенилаланина в положении 83 вариабельной области легкой цепи на тирозин («Tyr83»). Согласно некоторым вариантам реализации изобретения, способы могут включать замену аминокислотного остатка в положении 83 на полярную или гидрофобную аминокислоту, включая, но не ограничиваясь указанными, аланин, валин, изолейцин или треонин.
[0118] Аминокислотный остаток в положении 83, отличный от Phe, Lys или Cys, в комбинации с описанными способами декэпирования может вызывать снижение степени агрегации и повышать эффективность Cys80-конъюгации иммуноглобулина. Подходящая степень агрегации иммуноглобулина, достигаемая с помощью описанных способов, включает, например, менее чем приблизительно 5%, менее чем приблизительно 7%, менее чем приблизительно 10%, менее чем приблизительно 12%, менее чем приблизительно 15%, менее чем приблизительно 17%, менее чем приблизительно 20%, менее чем приблизительно 22% или менее чем приблизительно 25%. Подходящая эффективность конъюгации, достигаемая с помощью описанных способов, включает, например, больше чем приблизительно 70%, больше чем приблизительно 73%, больше чем приблизительно 76%, больше чем приблизительно 79%, больше чем приблизительно 82%, больше чем приблизительно 85%, больше чем приблизительно 88%, больше чем приблизительно 91%, больше чем приблизительно 94%, больше чем приблизительно 97% или больше чем приблизительно 99%.
Способы получения антиген-связывающих молекул
[0119] Согласно настоящему изобретению также предложены способы получения антиген-связывающей молекулы, включающие инкубирование первого конъюгированного иммуноглобулина со вторым конъюгированным иммуноглобулином для получения указанной антиген-связывающей молекулы, где:
первый конъюгированный иммуноглобулин содержит первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым реагирующим с тиолом соединением, содержащим первую способную реагировать с тиолом группу; и
второй конъюгированный иммуноглобулин содержит вторую вариабельную области тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым реагирующим с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
[0120] Антиген-связывающие молекулы включают мультивалентные и/или мультиспецифичные антиген-связывающие молекулы. Например, антиген-связывающие молекулы включают бивалентные, тривалентные и тетравалентные антиген-связывающие молекулы, которые являются моноспецифичными или биспецифичными. Согласно некоторым аспектам, антиген-связывающая молекула может являться бивалентной и моноспецифичной. Согласно некоторым аспектам, антиген-связывающая молекула может являться бивалентной и биспецифичной. Согласно некоторым аспектам, антиген-связывающая молекула может являться тривалентной и моноспецифичной. Согласно некоторым аспектам, антиген-связывающая молекула может являться тривалентной и биспецифичной. Согласно некоторым аспектам, антиген-связывающая молекула может являться тетравалентной и моноспецифичной. Согласно некоторым аспектам, антиген-связывающая молекула может являться тетравалентной и биспецифичной. Согласно некоторым аспектам, валентность может превышать тетравалентность. Согласно некоторым аспектам, специфичность может превышать биспецифичность.
[0121] Cys801, Cys802 или Cys801 и Cys802 могут быть неспаренными. Подходящие способы получения неспаренного Cys80 включают, например, гибридизацию вариабельной области легкой цепи, содержащей Cys80, с константным доменом, содержащим в положении 171 аминокислотный остаток, отличный от цистеина.
[0122] Согласно некоторым аспектам, способы могут дополнительно включать декэпирование Cys801. Согласно некоторым аспектам, способы могут дополнительно включать декэпирование Cys802. Согласно другим аспектам, способы могут дополнительно включать декэпирование Cys801 и Cys802.
[0123] Декэпирование может включать инкубирование первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина с восстанавливающим буфером с последующим инкубированием указанного первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина с окисляющим буфером. Согласно некоторым аспектам способов получения антиген-связывающих молекул, декэпирование может дополнительно включать осуществлении иммобилизации первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина на подложке до этапа инкубирования с восстанавливающим буфером и элюирование указанного первого иммуноглобулин, второго иммуноглобулина или первого и второго иммуноглобулина из подложки после инкубирования с окисляющим буфером.
[0124] Подходящие условия декэпирования и конъюгации, включая восстанавливающие буферы, окисляющие буферы, концентрации, значения pH, временные интервалы и подложки, описаны в разделе под названием «Получение конъюгированных иммуноглобулинов» и в равной степени применимы согласно настоящему изобретению.
[0125] Согласно некоторым аспектам, способы могут дополнительно включать конъюгирование первого реагирующего с тиолом соединения с Cys801, где указанное первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу. Согласно некоторым аспектам, способы могут дополнительно включать конъюгирование второго реагирующего с тиолом соединения с Cys802, где указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу. Согласно другим аспектам, способы могут дополнительно включать конъюгирование первого реагирующего с тиолом соединения с Cys801 и второго реагирующего с тиолом соединения с Cys802, где указанное первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу, и указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу.
[0126] Способы могут дополнительно включать декэпирование и конъюгирование. Например, способы могут дополнительно включать (до этапа инкубирования)
декэпирование Cys801, Cys802 или Cys801 и Cys802; и
конъюгирование первого реагирующего с тиолом соединения с Cys801, второго реагирующего с тиолом соединения с Cys802 или конъюгирование первого реагирующего с тиолом соединения с Cys801 и второго реагирующего с тиолом соединения с Cys802, где указанное первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу, и указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу.
[0127] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулины могут быть гибридизованными. В других случаях способы могут дополнительно включать гибридизацию первого иммуноглобулина, гибридизацию второго иммуноглобулина или гибридизацию первого и второго иммуноглобулина. Способы, например, могут дополнительно включать до этапа инкубирования:
гибридизацию первого иммуноглобулина, содержащего Cys801, для создания первого гибридного иммуноглобулина;
гибридизацию второго иммуноглобулина, содержащего Cys802, для создания второго гибридного иммуноглобулина;
декэпирование Cys801, Cys802 или Cys801 и Cys802 и
конъюгирование первого реагирующего с тиолом соединения с Cys801, второго реагирующего с тиолом соединения с Cys802 или первого реагирующего с тиолом соединения с Cys801 и второго реагирующего с тиолом соединения с Cys802, где указанное первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу, и указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу,
но не ограничиваются указанными этапами.
[0128] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулины могут быть гуманизированными. В другом случае способы могут дополнительно включать гуманизацию первого иммуноглобулина, гуманизацию второго иммуноглобулина или гуманизацию первого и второго иммуноглобулина. Например, способы могут дополнительно включать до этапа инкубирования:
гуманизацию первого иммуноглобулина, содержащего Cys801 для создания первого гуманизированного иммуноглобулина;
гуманизацию второго иммуноглобулина, содержащего Cys802 для создания второго гуманизированного иммуноглобулина;
декэпирование Cys801, Cys802 или Cys801 и Cys802; и
конъюгирование первого реагирующего с тиолом соединения с Cys801, второго реагирующего с тиолом соединения с Cys802 или конъюгирование первого реагирующего с тиолом соединения с Cys801 и второго реагирующего с тиолом соединения с Cys802, где указанное первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу, и указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу,
но не ограничиваются указанными этапами.
[0129] Предпочтительно, первое и второе реагирующее с тиолом соединение конъюгировано с Cys801 и Cys802 соответственно через первую способную реагировать с тиолом группу и вторую способную реагировать с тиолом группу. Подходящие способные реагировать с тиолом группы включают галогенацетилы, малеимиды, азиридины, акрилоилы, арилирующие агенты, винилсульфоны, пиридилдисульфиды, TNB-тиолы и дисульфид-восстанавливающие агенты. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать малеимид. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать галогенацетил. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать азиридин. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать акрилоил. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать арилирующий агент. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать винилсульфон. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать пиридилдисульфид. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать TNB-тиол. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать дисульфид-восстанавливающий агент.
[0130] Первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут быть присоединены к линкеру. Согласно некоторым аспектам, первая способная реагировать с тиолом группа может быть присоединена к линкеру («первый линкер»). Согласно некоторым аспектам, вторая способная реагировать с тиолом группа может быть присоединена к линкеру («второй линкер»). Согласно другим аспектам первая способная реагировать с тиолом группа может быть присоединена к первому линкеру, и вторая способная реагировать с тиолом группа может быть присоединена ко второму линкеру. Подходящие первый и второй линкеры могут представлять собой нерасщепляемые линкеры или расщепляемые линкеры. Примеры первого и второго линкеров включают, например, содержащие дисульфид линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой нерасщепляемые линкеры. Подходящие нерасщепляемые линкеры включают полиэтиленгликоль (PEG) или алкил, но не ограничиваются указанными. Согласно некоторым вариантам реализации изобретения, первый линкер, второй линкер или первый и второй линкер могут содержать PEG. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-парааминобензил. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой содержащий дисульфид линкер. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой линкер на основе ацеталя. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой линкер на основе кеталя. Примеры линкеров, ковалентно присоединенных к способной реагировать с тиолом группе, описаны, например, в публикации заявки на патент США № 20140050746.
[0131] Первое реагирующее с тиолом соединение, второе реагирующее с тиолом соединение или первое и второе реагирующее с тиолом соединение могут дополнительно содержать функциональный агент. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может дополнительно содержать функциональный агент («первый функциональный агент»). Согласно некоторым аспектам, второе реагирующее с тиолом соединение может дополнительно содержать функциональный агент («второй функциональный агент»). Согласно другим аспектам, первое реагирующее с тиолом соединение может дополнительно содержать первый функциональный агент, и второе реагирующее с тиолом соединение может дополнительно содержать второй функциональный агент.
[0132] Подходящие функциональные агенты включают, например, химические линкеры. Предпочтительно, химический линкер первого реагирующего с тиолом соединения («первый химический линкер») и химический линкер второго реагирующего с тиолом соединения («второй химический линкер») могут быть соединены. Например, один из первого и второго химического линкера может представлять собой дибензилциклооктин (DBCO), и другой из первого или второго химического линкера может представлять собой азид, но не ограничивается указанными соединениями. Согласно некоторым вариантам реализации изобретения, первый химический линкер, например, может представлять собой DBCO, и второй химический линкер может представлять собой азид. В противоположном случае первый химический линкер может представлять собой азид, и второй химический линкер может представлять собой DBCO. DBCO и азид можно соединять, что приводит к конъюгированию первого иммуноглобулина и второго иммуноглобулина. Например, первый иммуноглобулин и второй иммуноглобулин можно конъюгировать друг с другом с помощью реакций клик-химии.
[0133] Согласно типичным вариантам реализации изобретения, способные реагировать с тиолом соединения могут включать малеимид-ПЭГ4-азид и малеимид-ПЭГ4-дибензоциклооктин. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может, например, представлять собой малеимид-ПЭГ4-азид, и второе реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-дибензоциклооктин. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-дибензоциклооктин, и второе реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-азид.
[0134] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин могут представлять собой Fab-фрагменты. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может представлять собой Fab («первый Fab»). Согласно некоторым вариантам реализации изобретения, второй иммуноглобулин может представлять собой Fab («второй Fab»). Согласно другим вариантам реализации, первый иммуноглобулин может представлять собой первый Fab, и второй иммуноглобулин может представлять собой второй Fab.
[0135] Согласно некоторым вариантам реализации изобретения, способы включают создание первого Fab, второго Fab или первого и второго Fab до этапа инкубирования. Подходящие способы создания Fab-фрагментов известны в данной области техники и включают, например, расщепление полноразмерного иммуноглобулина или части иммуноглобулина с получением Fab-фрагмента или экспрессию рекомбинантного иммуноглобулина в виде Fab-фрагмента. Например, способы создания антиген-связывающих молекул могут дополнительно включать (до этапа инкубирования)
расщепление первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина папаином для получения первого Fab, второго Fab или первого и второго Fab, где первый иммуноглобулин содержит первую тяжелую цепь и первую легкую цепь, и указанная первая легкая цепь содержит цистеин в положении 80 («Cys801»), и где второй иммуноглобулин содержит вторую тяжелую цепь и вторую легкую цепь, и указанная вторая легкая цепь содержит цистеин в положении 80 («Cys802»), или
экспрессию рекомбинантного первого Fab, содержащего первую тяжелую цепь и первую легкую цепь, содержащую цистеин в положении 80 (Cys801), экспрессию рекомбинантного второго Fab, содержащего вторую тяжелую цепь и вторую легкую цепь, содержащую цистеин в положении 80 (Cys802), или экспрессию рекомбинантного первого Fab, содержащего первую тяжелую цепь и первую легкую цепь, содержащую цистеин в положении 80 (Cys801), и экспрессию рекомбинантного второго Fab, содержащего вторую тяжелую цепь и вторую легкую цепь, содержащую цистеин в положении 80 (Cys802);
и конъюгирование первого Fab через Cys801 с первым реагирующим с тиолом соединением для получения первого конъюгированного Fab, конъюгирование второго Fab через Cys802 со вторым реагирующим с тиолом соединением для получения второго конъюгированного Fab или конъюгирование первого Fab через Cys801 с первым реагирующим с тиолом соединением для получения первого конъюгированного Fab и конъюгирование второго Fab через Cys802 со вторым реагирующим с тиолом соединением для получения второго конъюгированного Fab.
[0136] Способы создания антиген-связывающих молекул могут дополнительно включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys. Способы создания антиген-связывающих молекул могут дополнительно включать замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys. Способы создания антиген-связывающих молекул могут дополнительно включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys, и замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys.
[0137] Согласно некоторым аспектам, способы могут включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи, замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи или замену аминокислотного остатка в положении 83 первой и второй вариабельной области легкой цепи на аланина(«Ala83»), валин («Val83»), изолейцин («Ile83»), треонин («Thr83»), аргинин («Arg83»), аспарагин («Asn83»), аспарагиновую кислоту («Asp83»), глутаминовую кислоту («Glu83»), глутамин («Gln83»), глицин («Gly83»), гистидин («His83»), лейцин («Leu83»), метионин («Met83»), пролин («Pro83»), серин («Ser83»), триптофан («Trp83») или тирозин («Tyr83»).
[0138] Аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может являться такой же, как аминокислотный остаток в положении 83 второй вариабельной области легкой цепи. В противоположном случае аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может отличаться от полярной или гидрофобной аминокислотного остатка в положении 83 второй вариабельной области легкой цепи. Аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, первой вариабельной области легкой цепи и/или аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, второй вариабельной области легкой цепи может представлять собой полярную или гидрофобную аминокислоту, включая, но не ограничиваясь указанными, аланин, валин, изолейцин или треонин. Согласно некоторым аспектам, способы могут включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи, замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи или замену аминокислотного остатка в положении 83 первой и второй вариабельной области легкой цепи на валин («Val83»). Согласно некоторым аспектам, способы могут включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи, замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи или замену аминокислотного остатка в положении 83 первой и второй вариабельной области легкой цепи на изолейцин («Ile83»). Согласно некоторым аспектам, способы могут включать замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи, замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи или замену аминокислотного остатка в положении 83 первой и второй вариабельной области легкой цепи на треонин («Thr83»). Полярная или гидрофобная аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может являться такой же или отличаться от полярной или гидрофобной аминокислотного остатка в положении 83 второй вариабельной области легкой цепи.
[0139] Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Согласно некоторым вариантам реализации изобретения, Cys801, Cys802 или Cys801 и Cys802 могут присутствовать в нативной вариабельной области легкой цепи. Первая вариабельная область легкой цепи и вторая вариабельная область легкой цепи происходят от кролика. Примеры кроликов, из которых может происходить первая вариабельная область легкой цепи, вторая вариабельная область легкой цепи или первая и вторая вариабельная область легкой цепи, включают кролика вида Oryctolagus cuniculus, но не ограничиваются указанным. Согласно некоторым аспектам, например, вариабельная область (области) легкой цепи может происходить из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область (области) легкой цепи может происходить из кролика b9.
Иммуноглобулиновые компоненты конъюгированных иммуноглобулинов
[0140] В настоящей заявке описаны иммуноглобулины, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys.
[0141] Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Вариабельная область легкой цепи происходит от кролика. Согласно некоторым вариантам реализации изобретения, Cys80 может присутствовать в нативной вариабельной области легкой цепи иммуноглобулина, происходящего от кролика. Примеры кроликов, из которых может происходить вариабельная область легкой цепи, содержащая Cys80, включают кролика вида Oryctolagus cuniculus, но не ограничиваются указанным. Согласно некоторым аспектам, вариабельная область легкой цепи может, например, происходить из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область легкой цепи может происходить из кролика b9.
[0142] Аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, включает аланин («Ala83»), валин («Val83»), изолейцин («Ile83»), треонин («Thr83»), аргинин («Arg83»), аспарагин («Asn83»), аспарагиновую кислоту («Asp83»), глутаминовую кислоту («Glu83»), глутамин («Gln83»), глицин («Gly83»), гистидин («His83»), лейцин («Leu83»), метионин («Met83»), пролин («Pro83»), серин («Ser83»), триптофан («Trp83») или тирозин («Tyr83»).
[0143] Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, может представлять собой полярную или гидрофобную аминокислоту, включая, но не ограничиваясь указанными, аланин, валин, изолейцин или треонин. Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой аланин («Ala83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой валин («Val83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой изолейцин («Ile83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой треонин («Thr83»).
[0144] Cys80 может быть неспаренным. Например, вариабельная область легкой цепи, содержащая Cys80, может быть гибридизована с константным доменом, содержащим аминокислотный остаток в положении 171, отличный от цистеина.
[0145] Предпочтительно, Cys80 декэпирован.
[0146] Согласно некоторым вариантам реализации изобретения, иммуноглобулины могут быть гибридизованными. Согласно другим вариантам реализации, иммуноглобулины могут быть гуманизированными.
[0147] Согласно некоторым вариантам реализации изобретения, описанный иммуноглобулин иммуноспецифично связывается с CA9 человека. Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с CA9 человека, содержит:
a. вариабельную область тяжелой цепи, имеющуюаминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136).
[0148] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с CA9 человека, содержит:
a. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, указанную как аминокислоты 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi166B3LC (SEQ ID NO:132); или
f. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136).
[0149] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с CA9 человека, содержит:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi155D5HC, представленные как SEQ ID NO:146, 148 и 150 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi155D5LC, представленные как SEQ ID NO:224, 226 и 228 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu155D5HC, представленные как SEQ ID NO:152, 154 и 156 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu155D5LC-3, представленные как SEQ ID NO:242, 244 и 246 соответственно, zu155D5LC-4, представленные как SEQ ID NO:248, 250 и 252 соответственно, zu155D5LC-5, представленные как SEQ ID NO:254, 256 и 258 соответственно, zu155D5LC-6, представленные как SEQ ID NO:260, 262 и 264 соответственно, zu155D5LC-7, представленные как SEQ ID NO:266, 268 и 270 соответственно, zu155D5LC-huVK2-40, представленные как SEQ ID NO 278, 280 и 282 соответственно, zu155D5LC-huVK4-1, представленные как SEQ ID NO 290, 292 и 294 соответственно, zu155D5LC-huVK6-21, представленные как SEQ ID NO 296, 298 и 300 соответственно, zu155D5LC-huVK6D-41, представленные как SEQ ID NO 302, 304 и 306 соответственно или zu155D5LC-huVK7-3-Glu81, представленные как SEQ ID NO 308, 310 и 312 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1E4HC, обозначенную как SEQ ID NO 164, 166 и 168 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1E4LC, обозначенную как SEQ ID NO 320, 322 и 324 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu1E4HC, представленные как SEQ ID NO:170, 172 и 174 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu1E4LC-CXXA, представленные как SEQ ID NO:332, 334 и 336 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi166B3HC, представленные как SEQ ID NO:212, 214 и 216 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi166B3LC, представленные как SEQ ID NO:386, 388 и 390 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu166B3HC, представленные как SEQ ID NO:218, 220 и 222 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu166B3LC-CXXA, представленные как SEQ ID NO:398, 400 и 402 соответственно.
[0150] Согласно некоторым вариантам реализации изобретения, описанные иммуноглобулины иммуноспецифично связываются с белком TEM1 человека. Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с TEM1 человека, содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108).
[0151] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с TEM1 человека, содержит вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-129 последовательности xi1-55-2LC (SEQ ID NO:108).
[0152] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с TEM1 человека, содержит участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1-55-2HC, представленные как SEQ ID NO:158, 160 и 162 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1-55-2LC, представленные как SEQ ID NO:314, 316 и 318 соответственно.
[0153] Согласно некоторым вариантам реализации изобретения, описанные иммуноглобулины иммуноспецифично связываются с мезотелином человека. Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с мезотелином человека, содержит:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0154] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с мезотелином человека, содержит:
a. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0155] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с мезотелином человека, содержит:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
Конъюгированные иммуноглобулины
[0156] В настоящей заявке также описаны конъюгированные иммуноглобулины, содержащие любой из иммуноглобулинов, описанных в настоящей заявке, где цистеин в положении 80 («Cys80») конъюгирован с реагирующим с тиолом соединением, и указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
[0157] Согласно некоторым вариантам реализации изобретения, конъюгированные иммуноглобулины включают иммуноглобулин, содержащий вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит Cys80 и аминокислоту в положении 83, отличную от Phe, Lys или Cys, где указанный Cys80 конъюгирован с реагирующим с тиолом соединением, и указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу. Согласно некоторым вариантам реализации изобретения, вариабельная область легкой цепи может содержать Cys80 и полярную или гидрофобную аминокислоту в положении 83, отличную от Phe, Lys или Cys.
[0158] Иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Вариабельная область легкой цепи происходит от кролика. Согласно некоторым вариантам реализации изобретения, Cys80 может присутствовать в нативной вариабельной области легкой цепи иммуноглобулина, происходящего от кролика. Примеры кроликов, из которых может происходить вариабельная область легкой цепи, содержащая Cys80, включают кролика вида Oryctolagus cuniculus, но не ограничиваются указанным. Согласно некоторым аспектам, вариабельная область легкой цепи может, например, происходить из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область легкой цепи может происходить из кролика b9.
[0159] Вариабельная область легкой цепи может содержать Cys80 и аминокислоту в положении 83, отличную от Phe, Lys или Cys. Аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, включает аланин («Ala83»), валин («Val83»), изолейцин («Ile83»), треонин («Thr83»), аргинин («Arg83»), аспарагин («Asn83»), аспарагиновую кислоту («Asp83»), глутаминовую кислоту («Glu83»), глутамин («Gln83»), глицин («Gly83»), гистидин («His83»), лейцин («Leu83»), метионин («Met83»), пролин («Pro83»), серин («Ser83»), триптофан («Trp83») или тирозин («Tyr83»). Согласно некоторым вариантам реализации изобретения, вариабельная область легкой цепи может содержать Cys80 и полярную или гидрофобную аминокислоту в положении 83, отличную от Phe, Lys или Cys. Подходящие полярные или гидрофобные аминокислоты включают, но не ограничиваются указанными, аланин, валин, изолейцин или треонин. Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой аланин («Ala83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой валин («Val83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой изолейцин («Ile83»). Согласно некоторым аспектам, полярная или гидрофобная аминокислотный остаток в положении 83, отличная от Phe, представляет собой треонин («Thr83»).
[0160] Cys80 может быть неспаренным. Например, вариабельная область легкой цепи, содержащая Cys80, может быть гибридизована с константным доменом, содержащим аминокислотный остаток в положении 171, отличный от цистеина.
[0161] Предпочтительно, Cys80 декэпирован.
[0162] Согласно некоторым вариантам реализации изобретения, иммуноглобулин может быть гибридизованным. Согласно другим вариантам реализации, иммуноглобулин может быть гуманизированным.
[0163] Предпочтительно, реагирующее с тиолом соединение конъюгировано с Cys80 через способную реагировать с тиолом группу. Способные реагировать с тиолом группы включают галогенацетилы, малеимиды, азиридины, акрилоилы, арилирующие агенты, винилсульфоны, пиридилдисульфиды, TNB-тиолы и дисульфид-восстанавливающие агенты. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать малеимид. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать галогенацетил. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать азиридин. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать акрилоил. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать арилирующий агент. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать винилсульфон. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать пиридилдисульфид. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать TNB-тиол. Согласно некоторым вариантам реализации изобретения, способная реагировать с тиолом группа может содержать дисульфид-восстанавливающий агент.
[0164] Способная реагировать с тиолом группа может быть присоединена к линкеру. Линкеры могут представлять собой нерасщепляемые линкеры или расщепляемые линкеры. Примеры линкеров включают, например, содержащие дисульфид линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. Согласно некоторым аспектам, линкер может представлять собой нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают, но не ограничиваются указанными, полиэтиленгликоль (PEG) или алкил. Согласно некоторым вариантам реализации изобретения, линкер может содержать PEG. Согласно некоторым аспектам, линкер может представлять собой расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-парааминобензил. Согласно некоторым аспектам, линкер может представлять собой содержащий дисульфид линкер. Согласно некоторым аспектам, линкер может представлять собой линкер на основе ацеталя. Согласно некоторым аспектам, линкер может представлять собой линкер на основе кеталя. Примеры линкеров, ковалентно присоединенных к способной реагировать с тиолом группе, описаны, например, в публикации патента США № 20140050746.
[0165] Реагирующее с тиолом соединение может дополнительно содержать функциональный агент. Подходящие функциональные агенты включают, например, флуорофоры, флуоресцентные красители, полипептиды, иммуноглобулины, антибиотики, нуклеиновые кислоты, радионуклиды, химические линкеры, малые молекулы, хелаторы, липиды и лекарственные средства. Согласно некоторым аспектам, функциональный агент может содержать флуорофор. Согласно некоторым аспектам, функциональный агент может содержать флуоресцентный краситель. Согласно некоторым аспектам, функциональный агент может содержать полипептид. Согласно некоторым аспектам, функциональный агент может содержать иммуноглобулин. Согласно некоторым аспектам, функциональный агент может содержать антибиотик. Согласно некоторым аспектам, функциональный агент может содержать нуклеиновую кислоту (такую как ДНК или РНК). Согласно некоторым аспектам, функциональный агент может содержать радионуклид. Согласно некоторым аспектам, функциональный агент может содержать химический линкер (например, дибензилциклооктин, DBCO, или азид). Согласно некоторым аспектам, функциональный агент может содержать малую молекулу. Согласно некоторым аспектам, функциональный агент может содержать хелатор (например, DOTA, CHX-A”-DTPA, NOTA и др.). Согласно некоторым аспектам, функциональный агент может содержать липид. Согласно некоторым аспектам, функциональный агент может содержать лекарственное средство. Согласно некоторым аспектам, функциональный агент может содержать комбинацию любых из перечисленных выше функциональных агентов.
[0166] Таким образом, описанные конъюгированные иммуноглобулины включают: конъюгаты иммуноглобулин-флуорофор, образованные через Cys80, конъюгаты иммуноглобулин-флуоресцентный краситель, образованные через Cys80, конъюгаты иммуноглобулин-полипептид, образованные через Cys80, конъюгаты иммуноглобулин-иммуноглобулин, образованные через Cys80, конъюгаты иммуноглобулин-антибиотик, образованные через Cys80, конъюгаты иммуноглобулин-нуклеиновая кислота, образованные через Cys80, конъюгаты иммуноглобулин-радионуклид, образованные через Cys80, конъюгаты иммуноглобулин-химический линкер, образованные через Cys80, конъюгаты иммуноглобулин-малая молекула, образованные через Cys80, конъюгаты иммуноглобулин-хелатор, образованные через Cys80, конъюгаты иммуноглобулин-липид, образованные через Cys80, и конъюгаты иммуноглобулин-лекарственное средство, образованные через Cys80.
[0167] Любой из иммуноглобулинов, описанных в настоящей заявке, может быть конъюгирован с любым из функциональных агентов, описанных в настоящей заявке. Например, конъюгированный иммуноглобулин может содержать иммуноглобулин, который иммуноспецифично связывается с CA9 человека, и флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственное средство. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-флуорофор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-флуоресцентный краситель, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-полипептид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-иммуноглобулин, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-антибиотик, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-нуклеиновая кислота, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-радионуклид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-химический линкер, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-малая молекула, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-хелатор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-липид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат CA9-лекарственное средство, образованный через Cys80.
[0168] Подходящие иммуноглобулины, которые иммуноспецифично связываются с CA9 человека, которые можно конъюгировать через Cys80 с любым из перечисленных выше функциональных агентов, содержат:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132);
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136);
g. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi155D5LC (SEQ ID NO:78);
h. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
i. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi1E4LC (SEQ ID NO:110);
j. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
k. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi166B3LC (SEQ ID NO:132);
l. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136);
m. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi155D5HC, представленные как SEQ ID NO:146, 148 и 150 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi155D5LC, представленные как SEQ ID NO:224, 226 и 228 соответственно;
n. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu155D5HC, представленные как SEQ ID NO:152, 154 и 156 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu155D5LC-3, представленные как SEQ ID NO:242, 244 и 246 соответственно, zu155D5LC-4, представленные как SEQ ID NO:248, 250 и 252 соответственно, zu155D5LC-5, представленные как SEQ ID NO:254, 256 и 258 соответственно, zu155D5LC-6, представленные как SEQ ID NO:260, 262 и 264 соответственно, zu155D5LC-7, представленные как SEQ ID NO:266, 268 и 270 соответственно, zu155D5LC-huVK2-40, представленные как SEQ ID NO 278, 280 и 282 соответственно, zu155D5LC-huVK4-1, представленные как SEQ ID NO 290, 292 и 294 соответственно, zu155D5LC-huVK6-21, представленные как SEQ ID NO 296, 298 и 300 соответственно, zu155D5LC-huVK6D-41, представленные как SEQ ID NO 302, 304 и 306 соответственно или zu155D5LC-huVK7-3-Glu81, представленные как SEQ ID NO 308, 310 и 312 соответственно;
o. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1E4HC, представленные как SEQ ID NO:164, 166 и 168 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1E4LC, представленные как SEQ ID NO:320, 322 и 324 соответственно;
p. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu1E4HC, представленные как SEQ ID NO:170, 172 и 174 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu1E4LC-CXXA, представленные как SEQ ID NO:332, 334 и 336 соответственно;
q. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi166B3HC, представленные как SEQ ID NO:212, 214 и 216 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi166B3LC, представленные как SEQ ID NO:386, 388 и 390 соответственно; или
r. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu166B3HC, представленные как SEQ ID NO:218, 220 и 222 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu166B3LC-CXXA, представленные как SEQ ID NO:398, 400 и 402 соответственно.
[0169] Конъюгированный иммуноглобулин может содержать иммуноглобулин, который иммуноспецифично связывается с белком TEM1 человека, и флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственное средство. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-флуорофор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-флуоресцентный краситель, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-полипептид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-иммуноглобулин, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-антибиотик, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-нуклеиновая кислота, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-радионуклид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-химический линкер, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-малая молекула, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-хелатор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-липид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат TEM1-лекарственное средство, образованный через Cys80.
[0170] Подходящие иммуноглобулины, которые иммуноспецифично связываются с белком TEM1 человека и которые можно конъюгировать через Cys80 с любым из перечисленных выше функциональных агентов, содержат:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-129 последовательности xi1-55-2LC (SEQ ID NO:108); или
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1-55-2HC, представленные как SEQ ID NO:158, 160 и 162 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1-55-2LC, представленные как SEQ ID NO:314, 316 и 318 соответственно.
[0171] Конъюгированный иммуноглобулин может содержать иммуноглобулин, который иммуноспецифично связывается с мезотелином (MSLN) человека, и флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственное средство. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-флуорофор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-флуоресцентный краситель, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-полипептид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-иммуноглобулин, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-антибиотик, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-нуклеиновая кислота, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-радионуклид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-химический линкер, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-малая молекула, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-хелатор, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-липид, образованный через Cys80. Согласно некоторым вариантам реализации изобретения, конъюгированный иммуноглобулин представляет собой конъюгат MSLN-лекарственное средство, образованный через Cys80.
[0172] Подходящие иммуноглобулины, которые иммуноспецифично связываются с MSLN человека и которые можно конъюгировать через Cys80 с любым из перечисленных выше функциональных агентов, содержат:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128);
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130);
g. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности xi33O11LC (SEQ ID NO:116);
h. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
i. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi324O5LC (SEQ ID NO:124);
j. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi178F16LC (SEQ ID NO:126);
k. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi237N18LC (SEQ ID NO:128);
l. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi383I18LC (SEQ ID NO:130);
m. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
n. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
o. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
p. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
q. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
r. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
[0173] Согласно некоторым вариантам реализации изобретения, иммуноглобулин, который иммуноспецифично связывается с MSLN человека, можно конъюгировать с низкомолекулярным противоопухолевым агентом, таким как ауристатин. Согласно некоторым аспектам, функциональный агент может представлять собой ауристатин F (AuF). Таким образом, описанные конъюгированные иммуноглобулины включают любой их описанных выше иммуноглобулинов, который иммуноспецифично связывается с MSLN человека, где указанный иммуноглобулин конъюгирован с ауристатином F (конъюгат MSLN-AuF, образованный через Cys80).
[0174] Согласно вариантам реализации изобретения, при которых иммуноглобулин содержит вариабельные области двух легких цепей, отношение иммуноглобулин:функциональный агент в конъюгированном иммуноглобулине может составлять 2:1, при этом каждая легкая цепь содержит функциональный агент, конъюгированный через Cys80.
Антиген-связывающие молекулы
[0175] Согласно настоящему изобретению, также предложены антиген-связывающие молекулы, содержащие:
первый конъюгированный иммуноглобулин, содержащий первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым реагирующим с тиолом соединением, содержащим первую способную реагировать с тиолом группу, и
второй конъюгированный иммуноглобулин, содержащий вторую вариабельную область тяжелой цепи и вторую вариабельную области легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым реагирующим с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
[0176] Первый конъюгированный иммуноглобулин и второй конъюгированный иммуноглобулин могут представлять собой любой из конъюгированных иммуноглобулинов, описанных в настоящей заявке.
[0177] Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Первая вариабельная область легкой цепи и вторая вариабельная область легкой цепи происходят от кролика. Согласно некоторым вариантам реализации изобретения, Cys801, Cys802 или Cys801 и Cys802 могут присутствовать в нативной вариабельной области легкой цепи иммуноглобулина, происходящего от кролика. Примеры кроликов, из которых может происходить первая вариабельная область легкой цепи, вторая вариабельная область легкой цепи или первая и вторая вариабельная область легкой цепи, включают вид Oryctolagus cuniculus, но не ограничиваются им. Согласно некоторым аспектам, вариабельная область (области) легкой цепи может происходить, например, из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область (области) легкой цепи может происходить из кролика b9.
[0178] Cys801, Cys802 или Cys801 и Cys802 могут быть неспаренными. Подходящие способы получения неспаренного Cys801 и/или Cys802 включают, например, гибридизацию вариабельной области легкой цепи (первой вариабельной области легкой цепи, второй вариабельной области легкой цепи или первой и второй вариабельной области легкой цепи), содержащей Cys80, с константным доменом, содержащим в положении 171 аминокислотный остаток, отличный от цистеина.
[0179] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин могут быть гибридизованными. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может быть гибридизованным. Согласно некоторым вариантам реализации изобретения, второй иммуноглобулин может быть гибридизован. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин и второй иммуноглобулин могут быть гибридизованы.
[0180] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин могут быть гуманизированными. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может быть гуманизированным. Согласно некоторым вариантам реализации изобретения, второй иммуноглобулин может быть гуманизированным. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин и второй иммуноглобулин могут быть гуманизированными.
[0181] Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может быть гибридизованным, а второй иммуноглобулин может быть гуманизированным. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может быть гуманизированным, а второй иммуноглобулин может быть гибридизованным.
[0182] Аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может представлять собой аминокислоту, отличную от Phe, Lys или Cys, если аминокислотный остаток в положении 83 представляет собой Phe. Аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой аминокислоту, отличную от Phe, Lys или Cys, если аминокислотный остаток в положении 83 представляет собой Phe. Аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может представлять собой аминокислоту, отличную от Phe, Lys или Cys, если аминокислотный остаток в положении 83 представляет собой Phe, и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой аминокислоту, отличную от Phe, Lys или Cys, если аминокислотный остаток в положении 83 представляет собой Phe. Аминокислотный остаток в положении 83 первой вариабельной области легкой цепи и/или второй вариабельной области легкой цепи может представлять собой аланин («Ala83»), валин («Val83»), изолейцин («Ile83»), треонин («Thr83»), аргинин («Arg83»), аспарагин («Asn83»), аспарагиновую кислоту («Asp83»), глутаминовую кислоту («Glu83»), глутамин («Gln83»), глицин («Gly83»), гистидин («His83»), лейцин («Leu83»), метионин («Met83»), пролин («Pro83»), серин («Ser83»), триптофан («Trp83») или тирозин («Tyr83»). Аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может являться такой же, как аминокислотный остаток в положении 83 второй вариабельной области легкой цепи. В противоположном случае аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может отличаться от аминокислотного остатка в положении 83 второй вариабельной области легкой цепи.
[0183] Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может представлять собой полярный или гидрофобный остаток, отличный от Phe, если аминокислотный остаток в положении 83 представляет собой Phe. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой полярный или гидрофобный остаток, отличный от Phe, если аминокислотный остаток в положении 83 представляет собой Phe. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи может представлять собой полярный или гидрофобный остаток, отличный от Phe, если аминокислотный остаток в положении 83 представляет собой Phe, и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой полярный или гидрофобный остаток, отличный от Phe, если аминокислотный остаток в положении 83 представляет собой Phe. Подходящие полярные или гидрофобные аминокислоты включают, но не ограничиваются указанными, аланин, валин, изолейцин или треонин. Согласно некоторым аспектам, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи, аминокислотный остаток в положении 83 второй вариабельной области легкой цепи или аминокислотный остаток в положении 83 первой вариабельной области легкой цепи и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой аланин («Ala83»). Согласно некоторым аспектам, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи, аминокислотный остаток в положении 83 второй вариабельной области легкой цепи или аминокислотный остаток в положении 83 первой вариабельной области легкой цепи и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой валин («Val83»). Согласно некоторым аспектам, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи, аминокислотный остаток в положении 83 второй вариабельной области легкой цепи или аминокислотный остаток в положении 83 первой вариабельной области легкой цепи и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой изолейцин («Ile83»). Согласно некоторым аспектам, аминокислотный остаток в положении 83 первой вариабельной области легкой цепи, аминокислотный остаток в положении 83 второй вариабельной области легкой цепи или аминокислотный остаток в положении 83 первой вариабельной области легкой цепи и аминокислотный остаток в положении 83 второй вариабельной области легкой цепи может представлять собой Треонин («Thr83»). Полярная или гидрофобная аминокислотный остаток в положении 83 в первой вариабельной области легкой цепи может являться такой же или отличаться от полярной или гидрофобной аминокислотного остатка в положении 83 во второй вариабельной области легкой цепи.
[0184] Первый иммуноглобулин и второй иммуноглобулин могут связываться с одними и теми же антигенами. Согласно некоторым аспектам, первый иммуноглобулин и второй иммуноглобулин могут связываться с одним и тем же эпитопом одного и того же антигена. Согласно другим аспектам, первый иммуноглобулин и второй иммуноглобулин могут связываться с различными эпитопами одного антигена. Согласно некоторым вариантам реализации изобретения, например, первый иммуноглобулин и второй иммуноглобулин могут представлять собой иммуноглобулин, который иммуноспецифично связывается с CA9 человека, где первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин конъюгированы с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин и второй иммуноглобулин могут представлять собой иммуноглобулины, которые иммуноспецифично связываются с TEM1 человека, где указанный первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин конъюгированы с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин и второй иммуноглобулин могут представлять собой иммуноглобулины, которые иммуноспецифично связываются с MSLN человека, где указанный первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин конъюгированы с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства.
[0185] Первый иммуноглобулин и второй иммуноглобулин могут связываться с различными антигенами. Согласно некоторым вариантам реализации изобретения, первый конъюгированный иммуноглобулин может представлять собой, например, иммуноглобулин, который иммуноспецифично связывается с CA9 человека, где первый иммуноглобулин, который связывается с CA9 человека, конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства, тогда как второй иммуноглобулин может представлять собой иммуноглобулин, который иммуноспецифично связывается с TEM1 человека или MSLN человека. Согласно таким вариантам реализации, второй иммуноглобулин может быть конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства. Согласно некоторым вариантам реализации изобретения, первый конъюгированный иммуноглобулин может представлять собой иммуноглобулин, который иммуноспецифично связывается с TEM1 человека, где указанный иммуноглобулин конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства, тогда как второй иммуноглобулин может представлять собой иммуноглобулин, который иммуноспецифично связывается с CA9 человека или MSLN человека. Согласно таким вариантам реализации, второй иммуноглобулин может быть конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклеотида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства. Согласно некоторым вариантам реализации изобретения, первый конъюгированный иммуноглобулин может представлять собой иммуноглобулин, который иммуноспецифично связывается с MSLN человека, где указанный иммуноглобулин конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства, тогда как второй иммуноглобулин может представлять собой иммуноглобулин, который иммуноспецифично связывается с CA9 человека или TEM1 человека. Согласно таким вариантам реализации, второй иммуноглобулин может быть конъюгирован с любым из флуорофора, флуоресцентного красителя, полипептида, иммуноглобулина, антибиотика, нуклеиновой кислоты, радионуклида, химического линкера, малой молекулы, хелатора, липида или лекарственного средства.
[0186] Подходящие способные реагировать с тиолом группы включают галогенацетилы, малеимиды, азиридины, акрилоилы, арилирующие агенты, винилсульфоны, пиридилдисульфиды, TNB-тиолы и дисульфид-восстанавливающие агенты. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать малеимид. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать галогенацетил. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать азиридин. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать акрилоил. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать арилирующий агент. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать винилсульфон. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать пиридилдисульфид. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать TNB-тиол. Согласно некоторым вариантам реализации изобретения, первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут содержать дисульфид-восстанавливающий агент.
[0187] Первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа могут быть присоединены к линкеру. Согласно некоторым аспектам, первая способная реагировать с тиолом группа может быть присоединена к линкеру («первый линкер»). Согласно некоторым аспектам, вторая способная реагировать с тиолом группа может быть присоединена к линкеру («второй линкер»). Согласно другим аспектам, первая способная реагировать с тиолом группа может быть присоединена к первому линкеру, и вторая способная реагировать с тиолом группа может быть присоединена ко второму линкеру. Подходящий первый и второй линкеры могут представлять собой нерасщепляемые линкеры или расщепляемые линкеры. Примеры первого и второго линкеров включают, например, дисульфид-содержащие линкеры, линкеры на основе ацеталей и линкеры на основе кеталей. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают, но не ограничиваются указанными, полиэтиленгликоль (ПЭГ) или алкил. Согласно некоторым вариантам реализации изобретения, первый линкер, второй линкер или первый и второй линкер могут содержать PEG. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой расщепляемый линкер. Подходящие расщепляемые линкеры включают, например, валин-цитруллин-парааминобензил. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой дисульфид-содержащий линкер. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой линкер на основе ацеталя. Согласно некоторым аспектам, первый линкер, второй линкер или первый и второй линкер могут представлять собой линкер на основе кеталя. Примеры линкеров, ковалентно присоединенных к способной реагировать с тиолом группе, предложены, например, в публикации заявки на патент США № 20140050746.
[0188] Первое реагирующее с тиолом соединение, второе реагирующее с тиолом соединение или первое и второе реагирующее с тиолом соединение могут дополнительно содержать функциональный агент. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может дополнительно содержать функциональный агент («первый функциональный агент»). Согласно некоторым аспектам, второе реагирующее с тиолом соединение может дополнительно содержать функциональный агент («второй функциональный агент»). Согласно другим аспектам, первое реагирующее с тиолом соединение может дополнительно содержать первый функциональный агент, и второе реагирующее с тиолом соединение может дополнительно содержать второй функциональный агент.
[0189] Подходящие функциональные агенты включают, например, химические линкеры. Предпочтительно, химический линкер первого реагирующего с тиолом соединения («первый химический линкер») и химический линкер второго реагирующего с тиолом соединения («второй химический линкер») могут быть соединены. Например, один из первого и второго химического линкера может представлять собой дибензилциклооктин (DBCO), и другой из первого и второго химического линкера может представлять собой азид, но не ограничиваются указанными соединениями. Согласно некоторым вариантам реализации изобретения, первый химический линкер может, например, представлять собой DBCO, и второй химический линкер может представлять собой азид. В противоположном случае первый химический линкер может представлять собой азид, и второй химический линкер может представлять собой DBCO. DBCO и азид можно соединять, приводя, таким образом, к конъюгированию первого иммуноглобулина и второго иммуноглобулина. Например, первый иммуноглобулин и второй иммуноглобулин можно конъюгировать друг с другом с помощью реакций клик-химии.
[0190] Согласно типичным вариантам реализации изобретения, реагирующие с тиолом соединения могут включать малеимид-ПЭГ4-азид и малеимид-ПЭГ4-дибензоциклооктин. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может представлять собой, например, малеимид-ПЭГ4-азид, и второе реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-дибензоциклооктин. Согласно некоторым аспектам, первое реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-дибензоциклооктин, и второе реагирующее с тиолом соединение может представлять собой малеимид-ПЭГ4-азид. Таким образом, первое реагирующее с тиолом соединение может отличаться от второго реагирующего с тиолом соединения.
[0191] Первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин могут представлять собой Fab-фрагменты. Согласно некоторым вариантам реализации изобретения, первый иммуноглобулин может представлять собой Fab («первый Fab»). Согласно некоторым вариантам реализации изобретения, второй иммуноглобулин может представлять собой Fab («второй Fab»). Согласно другим вариантам реализации, первый иммуноглобулин может представлять собой первый Fab, и второй иммуноглобулин может представлять собой второй Fab.
Способы лечения рака у субъекта
[0192] В настоящей заявке также описаны способы лечения рака у субъекта, включающие введение указанному субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина против мезотелина, где указанный конъюгированный иммуноглобулин против мезотелина содержит:
любой из конъюгированных иммуноглобулинов против мезотелина, описанных в настоящей заявке, и
реагирующее с тиолом соединение, содержащее способную реагировать с тиолом группу, линкер и функциональный агент.
[0193] Следует понимать, что любые из характеристик, признаков и вариантов реализации, имеющих отношение к описанным конъюгированным иммуноглобулинам, в равной степени применимы к конъюгированным иммуноглобулинам, используемым в описанных способах лечения рака. Соответственно, описанные способы могут включать введение субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина против мезотелина, где указанный конъюгированный иммуноглобулин против мезотелина содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys, где Cys80 конъюгирован с реагирующим с тиолом соединением, и указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу, линкер и функциональный агент. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, представляет собой полярную или гидрофобную аминокислоту.
[0194] Предпочтительно, рак представляет собой мезотелин-экспрессирующий рак. Согласно некоторым вариантам реализации изобретения, конъюгированные антитела для применения в описанных способах могут содержать:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0195] Антитела (a)-(f) можно конъюгировать с рядом подходящих реагирующих с тиолом соединений, включая, но не ограничиваясь указанными, способные реагировать с тиолом соединения, содержащие в качестве функционального агента противоопухолевый агент, такие как ауристатин. Таким образом, согласно некоторым вариантам реализации изобретения, способы могут включать введение субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина, где указанный конъюгированный иммуноглобулин содержит один или более иммуноглобулинов (a)-(f), каждый из которых конъюгирован с реагирующим с тиолом соединением, содержащим ауристатин F, где указанное реагирующее с тиолом соединение конъюгировано с вариабельной областью легкой цепи иммуноглобулина через Cys80.
[0196] Согласно некоторым вариантам реализации изобретения, конъюгированные антитела для применения в описанных способах могут содержать:
a. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0197] Антитела (a)-(f) можно конъюгировать с рядом подходящих реагирующих с тиолом соединений, включая, но не ограничиваясь указанными, способные реагировать с тиолом соединения, содержащие в качестве функционального агента противоопухолевый агент, такой как ауристатин. Таким образом, согласно некоторым вариантам реализации изобретения, способы могут включать введение субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина, где указанный конъюгированный иммуноглобулин содержит один или более из иммуноглобулинов (a)-(f), каждый из которых конъюгирован с реагирующим с тиолом соединением, содержащим ауристатин F, где указанное реагирующее с тиолом соединение конъюгировано с вариабельной областью легкой цепи иммуноглобулина через Cys80.
[0198] Согласно некоторым вариантам реализации изобретения, конъюгированные антитела для применения в описанных способах могут содержать:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
[0199] Антитела (a)-(f) можно конъюгировать с рядом подходящих реагирующих с тиолом соединений, включая, но не ограничиваясь указанными, способные реагировать с тиолом соединения, содержащие противоопухолевый агент в качестве функционального агента, такой как ауристатин. Таким образом, согласно некоторым вариантам реализации изобретения, способы могут включать введение субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина, где указанный конъюгированный иммуноглобулин содержит один или более из иммуноглобулинов (a)-(f), каждый из которых конъюгирован с реагирующим с тиолом соединением, содержащим ауристатин F, где указанное реагирующее с тиолом соединение конъюгировано с вариабельной областью легкой цепи иммуноглобулина через Cys80.
Способы выявления рака
[0200] В настоящей заявке также описаны способы выявления рака у субъекта. Согласно некоторым вариантам реализации изобретения, способы можно осуществлять на субъекте. Например, способы могут включать введение указанному субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина, где указанный конъюгированный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys, где указанный Cys80 конъюгирован с реагирующим с тиолом соединением, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу, линкер и функциональный агент. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, является полярной или гидрофобной.
[0201] В качестве альтернативы, способы можно осуществлять на биологическом образце, полученном от субъекта. Например, способы могут включать приведение биологического образца в контакт с конъюгированным иммуноглобулином, где указанный конъюгированный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys, где Cys80 конъюгирован с реагирующим с тиолом соединением, и указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу, линкер и функциональный агент. Аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, является полярной или гидрофобной. Согласно некоторым вариантам реализации изобретения, способы можно осуществлять ex vivo. Согласно некоторым вариантам реализации изобретения, способы можно осуществлять in vivo.
[0202] Функциональный агент представляет собой флуорофор или флуоресцентный краситель.
[0203] Любой из иммуноглобулинов, описанных в настоящей заявке, может быть конъюгирован с флуорофором или флуоресцентным красителем и использоваться в описанных способах выявления рака. Согласно некоторым вариантам реализации изобретения, рак представляет собой CA9-экспрессирующий рак, и конъюгированный иммуноглобулин представляет собой конъюгат CA9-флуорофор, образованный через Cys80, или конъюгат CA9-флуоресцентный краситель, образованный через Cys80, содержащий:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132);
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136);
g. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi155D5LC (SEQ ID NO:78);
h. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
i. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, указанную как аминокислоты 20-130 последовательности xi1E4LC (SEQ ID NO:110);
j. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
k. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi166B3LC (SEQ ID NO:132);
l. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136);
m. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi155D5HC, представленные как SEQ ID NO:146, 148 и 150 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi155D5LC, представленные как SEQ ID NO:224, 226 и 228 соответственно;
n. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu155D5HC, представленные как SEQ ID NO:152, 154 и 156 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu155D5LC-3, представленные как SEQ ID NO:242, 244 и 246 соответственно, zu155D5LC-4, представленные как SEQ ID NO:248, 250 и 252 соответственно, zu155D5LC-5, представленные как SEQ ID NO:254, 256 и 258 соответственно, zu155D5LC-6, представленные как SEQ ID NO:260, 262 и 264 соответственно, zu155D5LC-7, представленные как SEQ ID NO:266, 268 и 270 соответственно, zu155D5LC-huVK2-40, представленные как SEQ ID NO 278, 280 и 282 соответственно, zu155D5LC-huVK4-1, представленные как SEQ ID NO 290, 292 и 294 соответственно, zu155D5LC-huVK6-21, представленные как SEQ ID NO 296, 298 и 300 соответственно, zu155D5LC-huVK6D-41, представленные как SEQ ID NO 302, 304 и 306 соответственно или zu155D5LC-huVK7-3-Glu81, представленные как SEQ ID NO 308, 310 и 312 соответственно;
o. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1E4HC, представленные как SEQ ID NO:164, 166 и 168 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1E4LC, представленные как SEQ ID NO:320, 322 и 324 соответственно;
p. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu1E4HC, представленные как SEQ ID NO:170, 172 и 174 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu1E4LC-CXXA, представленные как SEQ ID NO:332, 334 и 336 соответственно;
q. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi166B3HC, представленные как SEQ ID NO:212, 214 и 216 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi166B3LC, представленные как SEQ ID NO:386, 388 и 390 соответственно; или
r. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu166B3HC, представленные как SEQ ID NO:218, 220 и 222 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu166B3LC-CXXA, представленные как SEQ ID NO:398, 400 и 402 соответственно.
[0204] Согласно некоторым вариантам реализации изобретения, рак представляет собой TEM1-экспрессирующий рак, и конъюгированный иммуноглобулин представляет собой конъюгат TEM1-флуорофор, образованный через Cys80, или конъюгат TEM1-флуоресцентный краситель, образованный через Cys80, содержащий:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-129 последовательности xi1-55-2LC (SEQ ID NO:108); или
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1-55-2HC, представленные как SEQ ID NO:158, 160 и 162 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1-55-2LC, представленные как SEQ ID NO:314, 316 и 318 соответственно.
[0205] Согласно некоторым вариантам реализации изобретения, рак представляет собой MSLN-экспрессирующий рак, и конъюгированный иммуноглобулин представляет собой конъюгат MSLN-флуорофор, образованный через Cys80, или конъюгат MSLN-флуоресцентный краситель, образованный через Cys80, содержащий:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128);
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130);
g. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности xi33O11LC (SEQ ID NO:116);
h. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
i. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi324O5LC (SEQ ID NO:124);
j. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi178F16LC (SEQ ID NO:126);
k. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi237N18LC (SEQ ID NO:128);
l. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi383I18LC (SEQ ID NO:130);
m. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
n. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
o. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
p. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
q. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
r. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
[0206] Примеры флуорофоров для конъюгации с иммуноглобулином включают, например, IRDye-800CW.
[0207] Способы могут включать введение конъюгированного иммуноглобулина субъекту или приведение биологического образца в контакт с конъюгированным иммуноглобулином и выявление связывания указанного конъюгированного иммуноглобулина с антигеном (CA9, TEM1 или MSLN), присутствующим в организме субъекта или в биологическом образце соответственно. Подходящие способы выявления включают, например, получение флуоресцентных изображений. Выявление связывания конъюгированного иммуноглобулина с антигеном (например, на основе испускания флуоресцентного сигнала) является показателем рака.
Фармацевтические композиции
[0208] Кроме того, согласно настоящему изобретению, предложены фармацевтические композиции. Согласно некоторым вариантам реализации изобретения, фармацевтические композиции могут содержать любой из иммуноглобулинов, описанных в настоящей заявке. Согласно некоторым вариантам реализации изобретения, фармацевтические композиции могут содержать любой из конъюгированных иммуноглобулинов, описанных в настоящей заявке.
[0209] Введение конъюгированного иммуноглобулина в соответствии со способами лечения или диагностики, описанными в настоящей заявке, может осуществляться с помощью любых методов, известных в данной области техники.
Вариабельные области легких цепей для применения в конъюгированных иммуноглобулинах
[0210] Согласно настоящему изобретению, предложены вариабельные области легких цепей для применения в конъюгированном иммуноглобулине, где указанные вариабельные области легких цепей содержат цистеин в положении аминокислоты 80 («Cys80») и аминокислотный остатков положении 83, отличный от Phe, Lys или Cys, где Cys80 является неспаренным. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, является полярной или гидрофобной.
[0211] Согласно предпочтительному варианту реализации, легкая цепь содержит мотив Cys80-Xaa1-Xaa2-Xaa3, где Xaa3 представляет собой аминокислоту, отличную от Phe, Lys или Cys.
[0212] Подходящие вариабельные области легких цепей включают, например, вариабельную область легкой каппа-цепи. Вариабельная область легкой цепи происходит от кролика. Согласно некоторым вариантам реализации изобретения, Cys80 может присутствовать в нативной вариабельной области легкой цепи иммуноглобулина, происходящего от кролика. Примеры кроликов, из которых может происходить вариабельная область легкой цепи, содержащая Cys80, включают вид Oryctolagus cuniculus, но не ограничиваются им. Согласно некоторым аспектам, вариабельная область легкой цепи может происходить, например, из новозеландского белого кролика (NZW). Согласно другим аспектам, вариабельная область легкой цепи может происходить из кролика b9.
[0213] Cys80 может являться некэпированным, может быть вовлечен во внуримолекулярный или межмолекулярный дисульфидный мостик или может содержать кэпирующий цистеин.
[0214] Согласно некоторым вариантам реализации изобретения, вариабельная область легкой цепи может быть гибридизованной. Согласно другим вариантам реализации, вариабельная область легкой цепи может быть гуманизированной.
[0215] Вариабельная область легкой цепи может содержать, состоять из или по существу состоять из:
a. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132);
f. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136);
g. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108);
h. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
i. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
j. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
k. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
l. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
m. вариабельной области легкой цепи, имеющей аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130).
Молекулы нуклеиновой кислоты, кодирующие иммуноглобулины, и клетки-хозяева, содержащие указанные молекулы
[0216] Согласно настоящему изобретению также предложены молекулы нуклеиновых кислот, кодирующие любой их описанных выше иммуноглобулинов. Согласно некоторым вариантам реализации изобретения, молекулы нуклеиновой кислоты кодируют иммуноглобулин, содержащий вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys. Согласно некоторым вариантам реализации изобретения, аминокислотный остаток в положении 83, отличная от Phe, Lys или Cys, является полярной или гидрофобной.
[0217] Описанные молекулы нуклеиновых кислот могут кодировать иммуноглобулин, который может иммуноспецифично связываться с CA9 человека. Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи,
имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136).
[0218] Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности xi166B3LC (SEQ ID NO:132); или
f. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136).
[0219] Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi155D5HC, представленные как SEQ ID NO:146, 148 и 150 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi155D5LC, представленные как SEQ ID NO:224, 226 и 228 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu155D5HC, представленные как SEQ ID NO:152, 154 и 156 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu155D5LC-3, представленные как SEQ ID NO:242, 244 и 246 соответственно, zu155D5LC-4, представленные как SEQ ID NO:248, 250 и 252 соответственно, zu155D5LC-5, представленные как SEQ ID NO:254, 256 и 258 соответственно, zu155D5LC-6, представленные как SEQ ID NO:260, 262 и 264 соответственно, zu155D5LC-7, представленные как SEQ ID NO:266, 268 и 270 соответственно, zu155D5LC-huVK2-40, представленные как SEQ ID NO 278, 280 и 282 соответственно, zu155D5LC-huVK4-1, представленные как SEQ ID NO 290, 292 и 294 соответственно, zu155D5LC-huVK6-21, представленные как SEQ ID NO 296, 298 и 300 соответственно, zu155D5LC-huVK6D-41, представленные как SEQ ID NO 302, 304 и 306 соответственно или zu155D5LC-huVK7-3-Glu81, представленные как SEQ ID NO 308, 310 и 312 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1E4HC, представленные как SEQ ID NO:164, 166 и 168 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1E4LC, представленные как SEQ ID NO:320, 322 и 324 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu1E4HC, представленные как SEQ ID NO:170, 172 и 174 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu1E4LC-CXXA, представленные как SEQ ID NO:332, 334 и 336 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi166B3HC, представленные как SEQ ID NO:212, 214 и 216 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi166B3LC, представленные как SEQ ID NO:386, 388 и 390 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu166B3HC, представленные как SEQ ID NO:218, 220 и 222 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu166B3LC-CXXA, представленные как SEQ ID NO:398, 400 и 402 соответственно.
[0220] Описанные молекулы нуклеиновой кислоты могут кодировать иммуноглобулин, который может иммуноспецифично связываться с TEM1 человека. Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108). Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-129 последовательности xi1-55-2LC (SEQ ID NO:108). Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1-55-2HC, представленные как SEQ ID NO:158, 160 и 162 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1-55-2LC, представленные как SEQ ID NO:314, 316 и 318 соответственно.
[0221] Описанные молекулы нуклеиновой кислоты могут кодировать иммуноглобулин, который может иммуноспецифично связываться с MSLN человека. Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи,
имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0222] Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, обозначенную как аминокислоты 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, обозначенную как аминокислоты 20-127 последовательности xi383I18LC (SEQ ID NO:130).
[0223] Согласно некоторым вариантам реализации изобретения, молекула нуклеиновой кислоты кодирует:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
[0224] Также описаны клетки-хозяева, содержащие любые из описанных молекул нуклеиновой кислоты. Подходящие клетки-хозяева включают, например, клетки млекопитающих, клетки бактерий, дрожжевые клетки, клетки насекомых, но не ограничиваются указанными.
[0225] Следующие далее примеры предложены для дополнительного описания некоторых вариантов реализации изобретения, описанных в настоящей заявке. Примеры приведены для иллюстрации описанных вариантов реализации и не ограничивают настоящее изобретение.
ПРИМЕРЫ
Пример 1 - Примеры способов
Получение mAb кролика, специфичных в отношении TEM1 человека (эндосиалина/CD248)
[0226] Иммунизация кроликов: Для создания mAb кролика, специфичных в отношении TEM1 человека (hTEM1), готовили растворимый гибридный белок внеклеточный домен эндосиалина человека-Fc мыши («эндосиалин человека/внеклеточный домен TEM1, гибридизованный с Fc IgG2b мыши»). Внеклеточный домен hTEM1 клонировали внутри рамки считывания EcoRI/HpaI с pEF6-EK-IgG2b, который содержал сайт расщепления энтерокиназой, с последующим использованием гамма-фрагмента Fc IgG2b мыши. Клетки CHO-K1 трансфицировали указанной конструкцией и селектировали с помощью 5 мкг/мл бластицидина. Секретированной TEM1-Fc подвергали электрофорезу на 4-12% ПААГ геле и окрашивали Кумасси с последующим вырезанием полос. Кусочки гелей эмульгировали в полном/неполном адъюванте и вводили новозеландским белым кроликам каждые 3 - 4 недели в виде четырех инъекций. Селезенку кролика, для которого с помощью ИФА были показаны наилучшие титры против hTEM1, отбирали для создания гибридом.
[0227] Создание гибридом: Слияние осуществляли, как следует далее: клетки селезенки (1,5-3 × 108) иммунизированных кроликов и клетки-партнеры слияния 240E 1-1-2 сливали в отношении 2:1 в присутствии 50% ПЭГ 4000 (EM Science, Черри-Хилл, Нью Джерси) при 37°C в бессывороточной среде. Клетки селезенки помещали в 48-луночные титрационные микропланшеты в количестве приблизительно 2x×105 клеток на лунку в среде, содержащей 15% ЭБС. Через 72 часа добавляли гипоксантин-аминоптерин-тимидин (HAT). Среду сменяли каждые 5-6 дней. Супернатанты подвергали скринингу с помощью ИФА для оценки наличия антител, специфичных в отношении TEM-1, с применением покрытых TEM1-Fc планшетов и подвергали скринингу против Fc мыши с помощью счетчика. Супернатанты из гибридом подвергали скринингу с помощью ИФА для оценки реакционной способности по отношению к hTEM1 и клон 1-55-2 был выбран для рекомбинантного клонирования.
[0228] Амплификация вариабельной области легкой и тяжелой цепей анти-hTEM11-55-2: РНК выделяли из гибридомы кролика 1-55-2 с использованием набора RNeasy mini kit (Qiagen, Валенсия, Калифорния). 2 мкг РНК использовали для проведения ОТ-ПЦР с использованием системы SuperScript III One-Step RT-PCR с ДНК-полимеразой Platinum Taq High Fidelity (Invitrogen). Фрагменты генов вариабельной области тяжелой цепи и полноразмерной легкой цепи кролика амплифицировали с применением пар праймеров N02937/N02898 и N02937/N02347 соответственно (Таблица 1). Параметры циклов амплификации с помощью ОТ-ПЦР были следующими: 55°C - 30 мин; 94°C - 2 мин; 30 циклов при следующих условиях: 94°C - 15 с, 55°C - 30 с, 68°C - 1 мин; 68°C -2 мин.
[0229] Указанные ПЦР-продукты затем использовали во втором цикле ПЦР для амплификации фрагментов, подходящих для создания гибридных IgG происходящих от кролика/человека с применением пар праймеров N02416/N02761 и N02417/N02764 (Таблица 1). Параметры циклов для второго цикла ПЦР были следующими: 94°C - 2 мин; 30 циклов при следующих параметрах: 94°C - 30 с, 55°C - 30 с, 68°C - 1 мин; 68°C - 2 мин,
Таблица 1. Праймеры, используемые для ОТ-ПЦР и клонирования последовательности 1-55-2 против hTEM1
[0230] Продукты ПЦР затем разделяли с помощью электрофореза в агарозном геле. Продукты ПЦР, имеющие правильную молекулярную массу, соответствующую продуктам VL и VH, очищали с помощью набора для экстракции из геля QIAquick® (Qiagen, Валенсия, Калифорния) и клонировали, как описано ниже.
Создание mAb кролика, специфичных в отношении CA9 человека
[0231] Иммунизация кроликов: Для создания антител кролика, специфичных в отношении CA9 человека, создавали рекомбинантный внеклеточный домен CA9 человека («внеклеточный домен CA9 человека» или «CA9-ECD»). Двух кроликов b9 иммунизировали CA9-ECD. Вкратце, кроликам подкожно вводили антигены каждый 21 день. Каждый кролик получал 400 мкг CA9-ECD и полный адъювант Фрейнда (FCA) в составе первой бустер-инъекции и 200 мкг CA9-ECD и неполный адъювант Фрейнда (FIA) в составе следующих бустер-инъекций. Получали исследуемые образцы крови и образцы крови до начала исследования для оценки титра антител.
[0232] Образцы крови, полученные до и после иммунизации, исследовали для оценки связывания с CA9 с помощью иммуноферментного анализа (ИФА), как описано в настоящей заявке. Готовили серийные разведения образцов крови и добавляли в покрытые белком CA9-ECD микропланшеты. Когда после введения четырех инъекций титр достигал 1:15,000, кроликам проводили конечную иммунизацию путем внутривенной инъекций 400 мкг CA9-ECD без адъюванта. Селезенки кроликов собирали через одну неделю после конечной иммунизации. До 100 мл образцов крови собирали в емкость с антикоагулянтом в результате кровопускания и выделяли лимфоциты из селезенок и лимфатических узлов каждого кролика.
[0233] Создание гибридом: Спленоциты кролика быстро размораживали, откручивали при 1200 об./мин при комнатной температуре в течение 5 мин и ресуспендировали в среде IMDM с добавлением 10% ЭБС с содержание 100 мкг/мл ДНКазы. Клетки стимулировали митогеном лаконоса в концентрации 2,5 мкг/мл при 37ºC в течение по меньшей мере 1 часа. После стимуляции клетки центрифугировали при скорости 1200 об./мин при комнатной температуре в течение 5 мин и ресуспендировали в свежей среде. Определяли количество клеток и жизнеспособность.
[0234] Клетки-партнеры слияния CBF7 размораживали и культивировали при 37ºC в присутствии 5% CO2 в течение одной недели до осуществления слияния. Подходящее количество спленоцитов кролика и клеток-партнеров слияния CBF7 смешивали в желаемом соотношении (1:1,55 ~ 1:4) в пробирках на 50 мл. Смесь клеток центрифугировали при скорости 1000 об./мин при комнатной температуре в течение 5 мин и промывали два раза ледяной средой для слияния CytoPulse (20 мл, CPFM Formula C: CytoPulse Sciences #LCM-C) при 4ºC. Клетки ресуспендировали в среде CPFM до достижения плотности 106 клеток/мл.
[0235] Для проведения слияния клеток использовали прибор CytoPulse CEEF-50 (CytoPulse Sciences). Клетки в подходящем объеме переносили в камеру для слияния и слияние осуществляли путем активации соединения с высоким напряжением. После слияния клетки инкубировали в камере при комнатной температуре в течение 5 мин, осторожно ресуспендировали в послереакционной среде (RPMI1640 с добавлением 10% ЭБС, содержащей глутамат, пируват, заменимые аминокислоты, β-меркаптоэтанол, пенициллин, стрептомицин и не содержащей феноловый красный) и затем переносили во флакон. Камеру промывали тем же объемом послереакционной среды для получения дополнительной порции клеток. Клетки инкубировали при комнатной температуре в течение 25 мин и затем в течение ночи при 37ºC, 5% CO2.
[0236] Через день после слияния клетки разводили в предварительно нагретой среде для посева (IMDM с добавлением 10% ЭБС, содержащей 1X гипоксантин-аминоптерин-тимидин) с достижением желаемой плотности (35,000 клеток/мл) и наносили в 96-луночные микропланшеты в концентрации 200 мкл/лунку. Планшеты инкубировали при 37ºC, 5% CO2, свежую среду добавляли каждую неделю в течение 3-4 недель.
[0237] Скрининг mAb против CA9: B-клетки из спленоцитов кролика сливали с клетками-партнерами слияния CBF7 с получением гибридом, как описано в настоящей заявке. Через четыре недели после нанесения клеток собирали супернатанты от отдельных гибридомных культур и подвергали скринингу с использованием CA9-специфичного ИФА. 384-луночные прозрачные аналитические планшеты (Greiner Bio-on High Binding, cat #655081) покрывали CA9-ECD в концентрации 1 мкг/мл на ночь при 4°C и блокировали с помощью 1X аналитического буфера (PBS с добавлением 1% БСА, содержащим 0,05% Tween-20). Затем в блокированные планшеты добавляли супернатанты в концентрации 25 мкл/лунку и контроли и инкубировали в течение ночи при 4°C. Аналитические планшеты промывали три раза и в планшеты добавляли вторые антитела в концентрации 25 мкл/лунку (HRP-конъюгированные козьи антимышиные IgG, Jackson # 115-035-146), разведенные в аналитическом буфере 1:10,000. После инкубации при комнатной температуре в течение одного часа аналитические планшеты промывали три раза и в планшеты добавляли TMB-субстрат в концентрации 25 мкл/лунку (KPL #52-000-04). После инкубирования при комнатной температуре в течение 5 минут добавляли 1X останавливающий раствор в концентрации 25 мкл/лунку (1:10 H2SO4, VWR #EM-SX1244-75). Измеряли абсорбцию для образца при 450 нм с использованием считывателя для планшетов Paradigm (Beckman). Положительные ответы от первого скрининга подтверждали с помощью второго CA9-специфичного ИФА.
Клонирование и мутагенез
[0238] Амплификация областей VH и Vκ CA9 и hTEM1 mAb: Клетки гибридомы, секретирующие интересующие mAb кролика, лизировали для экстрагирования РНК. РНК затем использовали для амплификации ДНК вариабельной области каппа-цепи (Vκ) и вариабельной области тяжелой цепи (VH) с использованием полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР). От 100 до 10,000 культивируемых клеток гибридомы промывали ледяным PBS и лизировали путем добавления 100 мкл лизирующего/связывающего раствора (Ambion, 8540G5) и пипетирования. Лизированные клетки быстро замораживали на сухом льду. РНК выделяли с помощью набора RNAqueous (Ambion) в соответствии с протоколом изготовителя. Приблизительно 5 нг РНК подвергали первому циклу ОТ-ПЦР с использованием праймеров, перечисленных в Таблице 2 для каждой реакции.
Таблица 2. Праймеры, используемые в первом цикле ОТ-ПЦР
[0239] Параметры циклов амплификации ОТ-ПЦР были следующими: 55°C - 30 минут; 95°C - 2 минуты; 30 циклов при следующих условиях: 94°C - 1 мин, 54°C - 50 секунд, 68°C -1,5 мин; 68°C - 10 мин.
[0240] Продукты первого цикла ОТ-ПЦР подвергали второму циклу амплификации с помощью ПЦР в отдельных реакциях для тяжелой и легкой цепи с использованием праймеров, перечисленных в Таблице 3.
Таблица 3. Праймеры, используемые для второго цикла ПЦР-амплификации
[0241] Параметры циклов для второго цикла ПЦР-амплификации были следующими: 5 мин - 95°C ; 40 циклов при следующих условиях: 1 мин - 94°C, 50 с - 54°C, 1,5 мин - 68°C; 10 мин - 68°C; охлаждение при 4ºC.
[0242] Продукты ПЦР затем разделяли с помощью электрофореза на агарозном геле. ПЦР-продукты, содержащие молекулярные массы, соответствующие продуктам VL и VH, очищали с помощью набора для экстракции из геля QIAquick® (Qiagen, Валенсия, Калифорния) и фрагменты субклонировали в экспрессионной плазмиде, содержащей константную область гамма (Cγ) или каппа (Cκ) человека, с применением набора для клонирования InFusion HD (Clontech). Все клоны секвенировали для подтверждения наличия и правильности инсерций.
[0243] Синтез гена: Гуманизированные VH- домены и Vκ-домены zu155D5LC-1, -huVK1-39, -huVK2-40, -huVK3-11, -huVK4-1, -huVK5-2, -huVK6-21, -huVK6D-41, -huVK7-3, zu1E4LC-1 и zu166B3LC-1 были кодон-оптимизированы для экспрессии в клетках человека и синтезированы с помощью DNA2,0. Вариабельные домены были синтезированы с последовательностью Козака и ведущей последовательностью Ig и включали 15 пар оснований на 5' и 3' концах, гомологичные сайтам клонирования в пределах вектора субклонирования. После вырезания из вектора DNA2,0 фрагменты субклонировали в экспрессионной плазмиде, содержащей область Cγ или Cκ человека, с использованием набора для клонирования InFusion HD. Все клоны секвенировали для подтверждения наличия и правильности инсерций.
[0244] QuikChange: Мутагенез кодон-оптимизированных доменов Vκ осуществляли с применением Stratagene's QuikChange XL в соответствии с протоколом изготовителя. Все клоны секвенировали для подтверждения наличия мутации.
Клеточная культура
[0245] Трансфекция и получение стабильной клеточной линии: За день до трансфекции клетки 293F высевали в плотности 6,0×105 клеток/мл в среде 293FreeStyle (Thermo Fisher Scientific) во встряхиваемой колбе и инкубировали при 37°C, 8% CO2, при встряхивании при 125 об./мин. В день трансфекции клетки высевали в плотности 1×106 клеток/мл, как описано выше. Клетки трансфицировали с применением полиэтиленимина (PEI, 25 кДа, линейный; Polysciences) или ExpiFectamine (Thermo Fisher Scientific). Для трансфекции с использованием PEI 166,7 нг плазмиды HC, 166,7 нг плазмиды LC, 2,2 мкг PEI и 50 мкл OptiPro (Thermo Fisher Scientific) на мл трансфицированных клеток инкубировали в течение 15 мин при 22°C. Смесь ДНК:PEI добавляли к клеткам при взбалтывании и инкубировали при 37°C, 8% CO2, при встряхивании при 125 об./мин. Через 48-72 ч клетки снабжали дрожжевым экстрактом в конечной концентрации 10 г/л (BD Biosciences), 5 мМ валериановой кислоты (Sigma Aldrich) и 1:100 липидным концентратом CD (Thermo Fisher Scientific).
[0246] Для каждого мл клеток, подлежащих трансфекции с помощью ExpiFectamine, 333,3 нг HC-плазмиды и 333,3 нг LC-плазмиды инкубировали в течение 10 мин в 50 мкл Opti-MEM (Thermo Fisher Scientific). Подобным образом, 2,67 мкл ExpiFectamine инкубировали в 50 мкл Opti-MEM. Раствор ExpiFectamine добавляли к смеси ДНК и инкубировали в течение 30 мин при 22°C. Смесь ДНК:ExpiFectamine добавляли к клеткам при взбалтывании и инкубировали при 37°C, 8% CO2, при встряхивании при 125 об./мин. На следующий день в реакцию трансфекции добавляли 3 мкл энхансера 1 и 30 мкл энхансера 2 на мл клеток и продолжали инкубировать в течение дополнительных 7 или 10 дней в зависимости от плотности клеток.
[0247] Стабильные пулы, экспрессирующие антитела, выбирали путем добавления через один-три дня после трансфекции 3 мл трансфектантов к 12 мл DMEM в колбе T75, содержащим 5 мкг/мл бластицидина и 400 мкг/мл зеоцина (Thermo Fisher Scientific). После того, как устойчивые к лекарственным средствам клетки дорастали до конфлюентного состояния, среду заменяли на экспрессионную среду FreeStyle 293. Через 24 или 48 ч клетки снимали механическим способом путем простукивания колбы (обработка трипсином приводила к низкой выживаемости; данные не представлены) и затем высевали в 30 мл экспрессионной среды FreeStyle 293 во встряхиваемую колбу объемом 125 мл в плотности 6×105 клеток/мл. Культуры инкубировали при 37°C в присутствии 8% CO2 при встряхивании со скоростью 125 об./мин.
[0248] Получение mAb: Антитела получали из стабильных пулов с помощью одного из двух способов:
1. Пулы клеток стабильно трансфицированной клеточной линии высевали в концентрации 0,6 - 1×106 клеток/мл в среде 293FreeStyle. Через два дня после того, как культура достигала плотности 1×106 клеток/мл, культуру снабжали питательной средой, как описано в настоящей заявке, или
2. Пулы клеток стабильно трансфицированной клеточной линии центрифугировали при скорости 1000 об./мин в центрифуге Beckman Allegra 6 в течение 5 мин. Супернатант удаляли и клетки ресуспендировали в 1 л среды expi293 (Gibco) в концентрации 0,5-0,8×106 клеток/мл во встряхиваемой колбе на 2,8 л. Клетки инкубировали при 37 °C, 8% CO2 при встряхивании при скорости 125 об./мин.
[0249] Согласно обоим способам, культуры инкубировали при 37°C в присутсвии 8% CO2 при встряхивании со скоростью 125 об./мин в течение 7-10 дней в зависимости от того, когда выживаемость клеток снижалась до приблизительно 50%, после чего культуры центрифугировали в течение 1 часа при скорости 8000 об./мин в роторной центрифуге Beckman JLA8,1000. Супернатант затем фильтровали через фильтр PES, 0,2 мкм, и хранили при 4°C или -20°C до очистки.
Очистка mAb
[0250] Очистка антитела с помощью аффинной хроматографии с использованием белка A: С использованием хроматографической системы ÄKTA Explorer (GE Healthcare) колонку, содержащую белок A (GE Healthcare), уравновешивали 10 колоночными объемами (КО) смеси 20 мМ фосфата натрия и 10 мМ ЭДТА, pH 7,2. Затем вводили образец с последующей отмывкой несвязавшегося материала с помощью 10 КО уравновешивающего буфера. Образец элюировали с помощью 5 КО 0,1 M глицина, pH 2,9. Фракции, содержавшие mAb, объединяли и диализировали в фосфатно-солевом буфере Дульбекко (DPBS) с применением емкости для диализа Slide-A-Lyzer с мембраной для исключения по молекулярной массе (MWCO, 20K, Thermo Fisher Scientific).
[0251] Декэпирование цистеина: С использованием хроматографической системы ÄKTA Explorer (GE Healthcare) колонку, содержащую белок A (GE Healthcare), уравновешивали 10 колоночными объемами (КО) смеси 20 мМ фосфата натрия и 10 мМ ЭДТА, pH 7,2 (уравновешивающий буфер). Затем вводили образец с последующей отмывкой несвязавшегося материала с помощью 10 КО уравновешивающего буфера. Колонку промывали 16 КО смеси 20 мМ фосфата натрия, 10 мМ ЭДТА и 5 мМ цистеина, pH 7,2, при скорости 0,5 мл/мин в течение 16 ч при 4°C для удаления кэпирующей группы. Затем колонку промывали 60 КО 20 мМ Трис, pH 7,5, при скорости 0,5 мл/мин в течение 60 ч при 4°C. Образец элюировали с помощью 5 КО 0,1 M глицина, pH 2,9, и сразу нейтрализовали с помощью 5% объема 2M Трис, pH 9,0. Фракции, содержавшие mAb, объединяли и диализировали в DPBS с применением емкости для диализа Slide-A-Lyzer с мембраной для исключения по молекулярной массе (MWCO, 20K, Thermo Fisher Scientific).
Анализ с помощью ЖХ-МС/МС для картирования цистеинилирования и дисульфидной связи
[0252] Буфер для mAb замещали на 50 мМ аммоний-бикарбонатный буфер, pH 7,8, с применением спин-колонки для обессоливания Zeba (Thermo-Fisher). Концентрацию доводили до 1 мг/мл и добавляли поверхностно-активное вещество RapiGest (Waters) до достижения концентрации 0,1%. Затем mAb расщепляли с помощью Glu-C (25:1 по массе, New England BioLabs) при 37 °C в течение 4 ч с последующим расщеплением с помощью Asp-N (25:1 по массе, New England BioLabs) при 37°C в течение 18 часов. После расщепления добавляли 5% трифторуксусную кислоту (TFA) до концентрации 0,5% и инкубировали при 37°C в течение 90 мин. Образец центрифугировали при скорости 13,000 об./мин в течение 30 мин для удаления осадков и анализировали с помощью ЖХ-МС/МС с применением метода MSE во второй фазе ионизации. Метод MSE использует постепенно нарастающее напряжение вместо фиксированного напряжения во второй фазе ионизации для получения более полного ионного профиля. Образцы анализировали с помощью СВЭЖХ на системе Acquity (Waters) и масс-спектрометра Q-Tof Premier. Образцы наносили на колонку BEH 300 C18 (Waters, 2,1 × 100 мм, размер пор 1,7 мкм), элюировали из колонки следующим образом: уравновешивание в 97%-ной подвижной фазе A - 3 мин (0,1%-ая муравьиная кислота в H2O); линейный градиент - 55 мин (3-45%-ная подвижная фаза B - 0,1%-ная муравьиная кислота в ацетонитриле); линейный градиент - 5 мин (45%-90%-ная подвижная фаза B); изократическая фаза - 5 мин (90%-ная подвижная фаза B); линейный градиент - 5 мин (90%-3%-ная подвижная фаза B); повторное уравновешивание в 97%-ой подвижной фазе A - 5 мин, при скорости 0,05 мл/мин. Масс-спектрометр Q-Tof запускали в V-режиме регистрации положительных ионов с выявлением в диапазоне 200-2000 m/z. Исходные параметры были следующими: капиллярное напряжение - 3,0 кВ, напряжение пробоотборного конуса - 40 В; исходная температура - 120°C; температура десольвации - 250°C; газовый поток десольвации - 600 л/ч. Внутренний эталонный стандарт с известной массой (Lockspray) представлял собой пептид Glu-Fib. Способ MSE осуществляли следующим образом: время экспозиции - 3-70 мин; диапазон масс - 200-2000 m/z; время сканирования - 1,5 секунды; регистрация, низкая энергия - 6 В, возрастание энергии - от 10 до 30 В.
[0253] Агрегацию антител анализировали с помощью метода эксклюзионной высокоэффективной жидкостной хроматографии (эксклюзионной-ВЭЖХ) с использованием прибора Agilent 1100. mAb разводили до концентрации 1 мг/мл в DPBS. Антитела (20 мкл) наносили на предколонку TSKgel SuperSW (4,6 мм × 3,5 см, размер пор 4 мкм, Tosoh Bioscience) с последующим использованием колонки TSKgel SuperSW3000 (4,6 мм x 30 см, размер пор 4 мкм), элюировали из колонки с помощью 0,1 M PBS, содержавшего 0,15 M NaCl и 0,05% NaN3, pH 7,4, при скорости потока 0,3 мл/мин в течение 20 мин. Все данные анализировали с помощью программы Agilent ChemStation. Процентную агрегацию агрегирование рассчитывали как [PAагрегатов/PAобщая]*100, где PA = интегральная площадь пика.
Анализ конъюгации малеимид-биотин:mAb с помощью СВЭЖХ/ИЭР-МС
[0254] Очищенные антитела разводили до концентрации 1 мг/мл в DPBS (исходную концентрацию образцов сохраняли, если она была ниже 1,0 мг/мл). Малеимид-ПЭГ2-биотин ((mal)-PEG2-Biotin, Thermo Fisher Scientific) растворяли в DPBS с получением 20 мМ исходного раствора с последующим разведением до концентрации 1 мМ в DPBS. Mal-PEG2-Biotin добавляли к 1 мл декэпированных mAb в отношении для конъюгации 5:1 и инкубировали при 22°C при слабом вращении в течение 2 ч. Реакционную смесь обессоливали с применением спин-колонки для обессоливания Zeba. Затем mAb дегликозилировали с использованием гликозидазы PNGase F (New England BioLabs). К mAb (90 мкл) добавляли буфер G7 (10 мкл) и гликозидазу PNGase F (2 мкл). Проводили два цикла инкубации реакционной смеси в микроволновой печи Discover (CEM): 1) микроволновая мощность 10 Вт, 37°C, 10 мин, с последующим 5-минутным перерывом и 2) микроволновая мощность 2 Вт, 37°C, 10 мин. Часть образца восстанавливали путем добавления дитиотреитола (ДТТ) до достижения конечной концентрации 20 мМ с последующим инкубированием при 60°C в течение 3 мин.
[0255] Образцы затем анализировали с помощью системы для СВЭЖХ (Waters Acquity) и масс-спектрометра Q-Tof Premier. Образцы (по 0,5-2 мкг каждого) наносили на микроколонку для обессоливания MassPrep при 65°C, элюировали из колонки путем уравновешивания в течение 5 мин в 95%-ной подвижной фазе A, использования градиента (5-90% B) в течение 10 мин и повторного уравновешивания в течение 10 мин в 95%-ной подвижной фазе A при скорости 0,05 мл/мин. Подвижная фаза A представляла собой 0,1%-ную муравьиную кислоту в воде. Подвижная фаза B представляла собой 0,1%-ную муравьиную кислоту в ацетонитриле. Масс-спектрометр Q-Tof запускали в V-режиме регистрации положительных ионов с выявлением в диапазоне масс 500-4000 m/z. Исходные параметры были следующими: капиллярное напряжение - 2,25 кВ (интактное антитело) - 2,50 кВ (восстановленное антитело); напряжение пробоотборного конуса - 65,0 В (интактное антитело) или 50,0 В (восстановленное антитело); исходная температура - 100°C; температура десольвации - 250°C; газовый поток десольвации - 550 л/ч. Деконволюцию белковых пиков проводили с использованием функции MaxEnt 1 программы MassLynx. Эффективность конъюгации рассчитывали как [Iбиотинилированного/(Iбиотинилированного+Iнемодифицированного)]*100 реконструированных масс-спектров, где I = интенсивность массового пика.
Анализ аффинности mAb:антиген BIAcore
[0256] Концентрацию антител подводили таким образом, чтобы при их связывании с антитгеном генерировался сигнал 30-40 УЕ. Гуманизированные mAb, очищенные с помощью стандартной аффинной хроматографии с использованием белка A или с помощью способа декэпирования, пропускали через биосенсор на основе антител против IgG человека на чипе BIAcore T100 (GE Healthcare) в течение 1 мин при скорости потока 10 мкл/мин. Поверхность сенсора промывали путем инъекции буфера HBS-P в течение 1 мин при скорости потока 50 мкл/мин. Для регистрации ассоциации антигена с захваченным mAb антиген в серийно повышающихся концентрациях вводили в течение 60 секунд при скорости потока 50 мкл/мин. За диссоциацией антигена следили в течение 30 мин при той же скорости потока. Поверхность сенсора восстанавливали путем инъекции 3 M MgCl2 в течение 1 мин и затем 30 секунд при скорости потока 30 мкл/мин. Сенсограммы анализировали с помощью программы Biacore T100 Evaluation с применением модели связывания Ленгмюра 1:1.
Получение бивалентного/биспецифичного Fab
[0257] Произошедшие из mAb Fab-фрагменты получали отдельно с использованием иммобилизированного папаина и последующим отделением чистых Fab-фрагментов от Fc/нерасщепленных mAb с помощью хроматографии с использованием белка A. Малеимид-PEG4-азид синтезировали путем объединения NHS-малеимида и азидо-PEG4-амина в ДМСО в течение 1 часа в молярном отношении 1:1. Непрореагировавший NHS гасили путем добавления буфера Трис-HCl для предотвращения гомодимеризации. Fab-фрагменты конъюгировали либо с малеимид-ПЭГ4-азидом, либо с малеимид-ПЭГ4-дибензоциклооктином (DBCO) в молярном отношении малеимид:Fab 5:1 и подвергали реагированию в течение 4 ч при 22°C. Модифицированные Fab-фрагменты обессоливали по два раза в DPBS для удаления всех непрореагировавших продуктов и Fab-фрагменты объединяли в молярном отношении 1:1 при конечной концентрации 2 мг/мл и давали возможность образования димеров в течение ночи при 22°C. Реакционную смесь анализировали с помощью электрофореза в ПААГ в присутствии ДСН и эффективность димеризации оценивали при 20%. Препарат димера очищали от непрореагировавшего мономера с помощью гель-фильтрационной хроматографии на колонке, заполненной S-200.
Анализ бивалентности/биспецифичности Octet
[0258] Биотинилированный CA9 человека захватывали на покрытые стрептавидином биосенсорные наконечники (Pall) в течение 4 мин. После инкубирования в PBS в течение 2 мин наконечники инкубировали с бивалентными/биспецифичными Fab, отдельно mAb или отдельно Fab в течение 5 мин. После инкубирования в PBS в течение 2 мин наконечники инкубировали с эндосиалином человека/TEM-1 в течение 5 мин. Наконец, наконечники инкубировали в PBS в течение дополнительных 2 мин. Присоединение и отсоединение белка к наконечникам измеряли на протяжении всего эксперимента.
Пример 2 -Конъюгирование через Cys80
Цель
[0259] Методы сайт-специфического конъюгации являются желательными для создания гомогенного продукта с определенным отношением лекарственное средство-антитело (DAR). Vκ-домен mAb кролика, такой как домены, полученные из кролика вида Oryctolagus cuniculus, может содержать цистеин в положении 80 (называемый «Cys80») (Фигура 1A), и область Cκ может содержать цистеин в положении 171 («Cys171») (Фигура 1B). Моделирование in-silico предсказало, что Cys80 и Cys171 должны образовывать дисульфидную связь, поскольку согласно результатам моделирования два атома S отстоят друг от друга приблизительно на 1,6 Å (Фигура 2A). mAb человека содержат остатки пролина, серина или аланина в положении 80 (Фигура 1A) и серин в положении 171 (Фигура 1B). Таким образом, между вариабельной и константной областью нет дисульфидного мостика (Фигура 2B).
[0260] Кристаллическую структуру, наиболее близкую к последовательностям Vκ и Cκ кролика или человека, идентифицировали с помощью базы данных BLAST pdb и использовали в качестве матрицы для моделирования структуры mAb 155D5. Модели создавали с помощью инструмента Discovery Studio's «Build Homology Models» (Accelrys). Была выбрана самая низкоэнергетическая модель, энергию пересчитывали с помощью силового поля CHARMm и дополнительно минимизировали с помощью двух циклов минимизации энергии с использованием инструмента «Minimize». CDR-участки затем оптимизировали с использованием инструмента «Model Antibody Loops». Выбирали самую низкоэнергетическую модель, энергию пересчитывали с помощью силового поля CHARMm и дополнительно минимизировали, как описано выше. Близость Cys80 и Cys171 (Фигура 2A) предсказывает, что указанные цистеины могут образовывать дисульфидную связь. Инструмент «Build Mutants» использовали для моделирования этой дисульфидной связи.
[0261] Поскольку дисульфидные связи критичны для поддержания целостности вторичной и третичной структуры, которая в свою очередь необходима для биологической активности антитела, было важно проверить, действительно ли предсказанная связь Cys80-Cys171 существует. В связи с этом были проведены ad hoc эксперименты, которые однозначно показали, что mAb кролика содержат такую связь (Таблица 4).
Таблица 4. Демонстрация существования дисульфидной связи Cys80-Cys171
С помощью ЖХ-МС/МС проводили анализ Glu-C/Asp-N-лизата mAb кролика 155D5 (из новозеландского кролика). Были обнаружены только массы, соответствующие связанным дисульфидной связью cys80-cys171, что указывает на то, что cys80 образует дисульфидную связь с cys171 в IgG кролика. Сходный анализ проводили с использованием mAb 1-55-2 (от кролика b9).
[0262] Гибридизованное mAb вид/человек получали путем слияние между: i) вариабельной областью, полученной от вида, в котором было создано указанное mAb; и ii) константной области человека. Этот процесс называется гибридизацией. Гуманизированное mAb главным образом получено из вариабельных и константных областей человека, за исключением тех остатков, которые необходимы для связывания с антигеном и которые происходят из хозяина того же вида, из которого было получено mAb. Этот процесс называется гуманизацией. Для создания гибридизованных mAb человека или гуманизированных mAb, где mAb были получены в организме хозяина, принадлежащего видам Oryctolagus cuniculus, целые константные домены, а также большинство из вариабельных областей (если гуманизированы) генетическим путем заменяют на вариабельные и константные последовательности человека. После гибридизации или гуманизации Cys80 в области Vκ больше не образовывал дисульфидную связь с остатком в положении 171 в области Cκ (Фигура 2C), и являлся, таким образом, неспаренным.
[0263] Семейства последовательностей Vκ зародышевых линий новозеландского кролика содержат цистеин в положении 80, как показано на Фигуре 3 (области CDR удаляли и каркасные области (FWR) 1, 2 и 3 выравнивали).
Исследование и характеристика неспаренного цистеина в положении 80
[0264] Константные области 155D5 и 1E4 кролика(анти-CA9), 1-55-2 (анти-hTEM1), а также 33O11 (анти-MSLN), все из которых содержат Cys80 и были получены, как описано в Примере 1, заменяли на константные области IgG1κ человека для создания гибридного mAb, происходящего от кролика/человека, как описано в другом месте в настоящей заявке. В частности, область VH 155D5 кролика сливали с областью Cγ человека для создания xi155D5HC, и область Vκ 155D5 кролика сливали с областью Cκ человека для создания xi155D5LC. Гибридизованное mAb 155D5, происходящее от кролика/человека, с неспаренным Cys80 называется в настоящей заявке xi155D5.
[0265] Область VH 1-55-2 кролика сливали с областью Cγ человека для создания xi1-55-2H, и область Vκ 1-55-2 кролика сливали с областью Cκ человека для создания xi1-55-2LC. Гибридизованное 1-55-2 mAb, происходящее от кролика/человека, с неспаренным Cys80 называется в настоящей заявке xi1-55-2.
[0266] Область VH 1E4 кролика сливали с областью Cγ человека для создания xi1E4HC и область Vκ 1E4 кролика сливали с областью Cκ человека для создания xi1E4LC. Гибридизованное 1E4 mAb, происходящее от кролика/человека, с неспаренным Cys80 называется в настоящей заявке xi1E4.
[0267] Область VH 33O11 кролика сливали с областью Cγ человека для создания xi33O11HC и область Vκ 33O11 кролика сливали с областью Cκ человека для создания xi33O11LC. Гибридизованное 33O11 mAb (xi33O11), происходящее от кролика/человека, с неспаренным Cys80 называется в настоящей заявке xi33O11.
[0268] Поскольку Cys171 был заменен на Ser171 во время гибридизации, гибридизованные антитела (xi155D5, xi1-55-2, xi1E4 и xi33O11) содержали неспаренный цистеин в положении 80 в Vκ (называемый «Cys80»). При восстановлении с применением жестких условий (20 мМ ДТТ при 60°C в течение 5 мин) молекулярный вес (масса) очищенной с помощью белка A легкой цепи mAb xi155D5 составлял 23,382 Да (Фигура 4A). Однако при подвержении мягким восстанавливающим условиям (100 мкМ ДТТ, RT, 30 мин) масса увеличивалась на 120 Да (Фигура 4B). Указанное увеличение массы указывало на то, что Cys80 должен был образовывать дисульфидную связь со свободным цистеином, называемым «кэпирующим» цистеином. Эта молекулярная структура, которая является результатом реакции, называемой «цистеинилированием», называется «кэпированным» Cys80. Для подтверждения этой гипотезы mAb xi155D5 расщепляли с помощью Asp-N и Glu-C и анализировали массы пептидов. Масс-спектрометрический анализ пептидных фрагментов, соответствующих остаткам 71 - Cys80 (FTLTITGVQC) (SEQ ID NO:24), указывает на повышение молекулярной массы на 119 Да (Таблица 5), подтверждая, таким образом, кэпирование Cys80.
Таблица 5. Масс-спектрометрический анализ фрагментов 71-Cys80 пептида xi155D5
[0269] Поскольку отсутствие дисульфидной связи Cys80-Cys171 могло бы привести к нестабильности антитела, разрушению связи с антигеном или нестабильности и разрушению связи с антигеном, проводили исследования стабильности антитела и его связывания с антигеном. Стабильность последовательности xi155D5 исследовали с помощью эксклюзионной ВЭЖХ. Этот анализ показывает, может ли отсутствие дисульфидной связи Cys80-Cys171 приводить к агрегации (из-за возможности образования межмолекулярной связи Cys80-Cys80) или разрушению (из-за повышенной чувствительности к протеазам). Очищенное антитело в концентрации 1 мг/мл в 1X PBS хранили при -80°C или 37°C в течение 1 недели. Десять мкл последовательности xi155D5 вводили в колонку SuperSW3000 (TOSOH Biosciences, 4,6 мм X 30 см, размер частиц 4 мкм), снабженную встроенной предколонкой TSKgel (4,6 мм X 3,5 см) при скорости потока 0,3 мл/мин с использованием смеси 0,1 M фосфата натрия, 0,15 М NaCl, 0,05% NaN3 в качестве подвижной фазы. Не наблюдали существенного изменения в агрегации между двумя вариантами условий хранения (Фигура 5A и 5B). Степень агрегации находилась в диапазоне 3-4% и, таким образом, в пределах нормального диапазона типичных IgG1 человека (данные не представлены). Не наблюдали или наблюдали незначительную деградацию продуктов при любых условиях хранения (Фигура 5). Указанные результаты предполагают, что xi155D5 с отсутствием дисульфидной связи Cys80-Cys171 представляет собой стабильный белок при исследуемых условиях хранения.
[0270] Для определения того, приводит ли гибридизация и, таким образом, потеря дисульфидной связи Cys80-Cys171 к структурным изменениям, ведущим к потере способности связывания с антигеном, аффинность связывания mAb 155D5, xi155D5, 1-55-2 и xi1-55-2 оценивали с помощью поверхностного плазмонного резонанса. Осуществляли захват биотинилированного лиганда (биотин-hTEM1 для 1-55-2, биотин-CA9 для 155D5) на покрытый для захвата биотина чип CAP BIAcore (GE Healthcare, Пискатуэй, Нью-Джерси) с применением HBS-EP в качестве электродного буфера. Конечная степень захвата антигена составляла 130 УЕ и 280 УЕ для биотин-TEM1 и биотин-CA9 соответственно. Антитела в серийных разведениях (120 мкл, 0-50 нМ) пропускали по чипу, покрытому лигандом. Диссоциацию наблюдали в течение 25 мин. Поверхность чипа восстанавливали с помощью 6 M GuHCl, 250 мМ NaOH. Дважды строили сенсограммы и кинетические параметры определяли с применением программы BIAEvaluations (версия 4,1). Не наблюдали или наблюдали незначительную потерю аффинности связывания в результате гибридизации двух различных mAb (Таблица 6), что указывает на то, что отсутствие дисульфидной связи Cys80-Cys171 не приводит к разрушению связывающей области.
Таблица 6. Константы скорости гибридизованных и mAb кролика
Оценка применимости Cys80 для конъюгации функциональных агентов
[0271] После того, как было установлено, что отсутствие дисульфидной связи Cys80-Cys171 не приводит к структурным изменениям, исследовали возможность замены кэпирующего цистеина на реагирующее с тиолом соединение. Способная реагировать с тиолом группа может быть присоединена к линкеру, который в свою очередь может быть присоединен к молекуле диагностический или терапевтической значимости, называемой в настоящей заявке «функциональным агентом». Функциональные агенты могут включать флуорофоры, флуоресцентные красители, полипептиды, иммуноглобулины, антибиотики, нуклеиновые кислоты, радионуклиды, химические линкеры, малые молекулы (такие как химиотерапевтические агенты), хелаторы, липиды и лекарственные средства.
[0272] Для замены кэпирующего цистеина на функциональный агент сначала удаляют указанный кэпирующий цистеин. Подвержение очищенных mAb восстанавливающим условиям может приводить к разрушению дисульфидной связи между Cys80 и кэпирующим цистеином, которое называется в настоящей заявке «декэпированием». Однако субоптимальные восстанавливающие условия, например, жесткие восстанавливающие условия, также могут приводить к разрушению меж- и внутрцепочечных дисульфидных связей, нарушая, таким образом структуру и активность mAb. В связи с этим разрабатывали способ декэпирования, не приводящий к изменению структуры и активности mAb, при этом позволяющий удаление кэпирующего цистеина, включающий удаление указанного кэпирующего цистеина с применением слабого восстановителя и последующим повторным окислением с помощью Трис-содержащего буфера. Изначально оценивали ряд восстанавливающих агентов, включая восстановленный глутатион, цистеин, TCEP и ДТТ. Глутатион не приводил к эффективному удалению кэпирующего цистеина (данные не представлены). Как ДТТ, так и TCEP приводили к эффективному удалению кэпирующего цистеина, но более высокие концентрации указанных агентов также приводили к практически полному разрыву межцепочечных дисульфидных связей и, вероятно, также некоторых внутрицепочечных дисульфидных связей (данные не представлены). Слабый восстановитель цистеин приводил к эффективному удалению кэпирующего цистеина, при этом наблюдалось только ограниченное разрушение межцепочечных дисульфидный связей. Оценивали повторное окисление при использовании фосфатного буфера, Трис-буфера и сильного окислителя CuSO4. При использовании фосфатного буфера не наблюдалось повторного окисления разрушенных межцепочечных дисульфидных связей, тогда как CuSO4 приводил к эффективному и быстрому повторному образованию дисульфидных связей, однако дополнительную оценку указанного соединения не проводили из-за присущей ему токсичности по сравнению с Трисом. Оптимизированные условия адаптировали для колонки для возможности последовательной очистки и декэпирования из исходного материала. Согласно указанному способу антитело связывали со смолой на основе белка A и инкубировали при слабом потоке (0,5 мл/мин) буфера, содержащего 5 мМ цистеин, в течение 16 ч для восстановления (разрыва) дисульфидной связи Cys80-цистеин с последующей отмывкой Трис-содержащим буфером без цистеина в течение 60 ч для удаления цистеинов, высвободившихся в результате указанной обработки, и повторно окисляли любые восстановленные межцепочечные дисульфидные связи. Затем mAb вымывали в глициновом буфере с низким значением pH. В соответствии с примером эксперимента, в котором способ декэпирования применяли для последовательности xi155D5, была определена масса невосстановленного очищенного mAb и было обнаружено, что указанное mAb было декэпировано на ~99%, на что указывало снижение массы, эквивалентное двум свободным цистеинам (Фигура 6A и 6B). Анализ со свободным тиолом подтвердил наличие двух тиоловых групп на mAb, что также демонстрирует эффективное повторное окисление (данные не представлены).
Декапированный Cys80 можно конъюгировать с малеимидом
[0273] Цистеин представляет собой α-аминокислоту с неполярной боковой цепью (тиол; -SH). Восстановленная тиоловая боковая цепь в неспаренном цистеине может служить в качестве нуклеофила, который может реагировать с электрофильной молекулой, такой как малеимид - химическое соединение формулы H2C2(CO)2NH. Электрофильная двойная связь малеимида легко реагирует с нуклеофильной тиоловой группой, встречающейся на цистеине, с образованием стабильной тиоэфирной связи углерод-сера. Неполярность тиоловой боковой цепи в зависимости от окружающих остатков может придавать свойство гидрофобности цистеину, способное предотвращать воздействие растворителя, необходимое для химический модификации. Кроме того, расположение цистеина в рамках вторичной структуры пептида, в котором он находится, может также предотвращать доступ к молекуле, способной реагировать с тиолом. Для определения того, может ли Cys80 реагировать с молекулой, способной реагировать с тиолом, после декэпирования, проводили экспериментaльное исследование. Последовательность xi155D5 после декэпирования инкубировали с Малеимид-ПЭГ2-биотином, как описано в другом месте в настоящей заявке. Масс-спектрометрический анализ показал, что mAb на 94% было конъюгировано с Малеимид-ПЭГ2-биотином, на что указывает повышение молекулярной массы на 526 Да (Фигура 7), соответствующее массе функционального агента. Поскольку было обнаружено, что каждая легкая цепь является конъюгированной (один массовый пик, Фигура 7), отношение Малеимид-ПЭГ2-биотин:xi155D5 равномерно составляло 2:1. Одну молекулу Малеимид-ПЭГ2-биотина конъюгировали с Cys80 в каждой из двух легких цепей в гибридизованном mAb (Cys801 и Cys802).
[0274] Описанные результаты демонстрируют, что Cys80 и Cys171 образуют дисульфидную связь, которая связывает области Vκ и Cκ mAb кролика. При гибридизации mAb кролика Cys171 был заменен на Ser171, присутствующий в области Cκ человека. Эта замена приводила к удалению дисульфидной связи Cys80-Cys171. Оценка влияния потери этой дисульфидной связи на структурную стабильность и активность полученного гибридного mAb по сравнению с исходным mAb кролика показала, что гибридизованное mAb являлось стабильным и активным. Было обнаружено, что и Cys801, и Cys802, которые оставались неспаренными в гибридизованном mAb, были кэпированы свободным цистеином (кэпирующий цистеин). Впоследствии был разработан способ для удаления кэпирующего цистеина (декэпирования), позволяющий сохранять структурную стабильность и активность полученного гибрида mAb. Кроме того, было показано, что использование функционального агента и mAb в отношении 2:1 позволяло достигнуть высокого выхода mAb, конъюгированного с Малеимид-ПЭГ2-биотином.
Гуманизация mAb кролика
[0275] Гибридизованные mAb могут являться иммуногенными при введении человеку. В связи с этим желательно гуманизировать mAb кролика путем замены последовательностей, происходящих от кролика, на последовательности, происходящие от человека, в областях Vκ и VH. Аминокислотную последовательность mAb 155D5 анализировали с использованием поиска BLAST против базы данных для вариабельного домена человека (адрес http://www.ncbi.nlm.nih.gov/igblast/) для идентификации последовательности человека, имеющей наивысшую гомологию с последовательностью кролика. Последовательности IGHV3-64*04 и IGKV1-5*03 были определены как лучшие последовательности для гуманизации, поскольку их приводит к наименьшему количеству замен остатков последовательности кролика (Фигура 8).
[0276] Последовательности 155D5, соответствующие антиген-связывающим доменам, идентифицированным как CDRH1 (по номенклатуре Kabat и Chothia), CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 (по номенклатуре Chothia), были встроены в каркасные области (FWR) последовательности IGHV3-64*04 или IGKV1-5*03 человека для создания гуманизированного 155D5 mAb, названного zu155D5-1 (Таблица 7 и Таблица 8).
[0277] Во время гуманизации 155D5LC (zu155D5LC) сохраняли Cys80, который был неспаренным, поскольку последовательность каппа-цепи человека содержит Ser171 в отличие от Cys171. zu155D5-1 получали и очищали с применением стандартного метода очистки на белке A. Было обнаружено, что указанная последовательность является кэпированной, о чем свидетельствует изменение массы после декэпирования на 233 Да, что приблизительно соответствует двум кэпирующим цистеинам (Фигура 9). Как наблюдалось и в случае xi155D5, последовательность zu155D5-1 также можно было декэпировать с эффективностью, близкой к 100% (Таблица 9). Однако декэпирование приводило к высокой степени агрегации (70%) по сравнению со значением для xi155D5 (всего 14%). При подвержении zu155D5-1 реакции с Малеимид-ПЭГ2-биотином наблюдали конъюгирование на 0%, тогда как в случае xi155D5 наблюдали конъюгирование на 93% (Таблица 9). Указанные результаты были неожиданными, поскольку они указывали на то, что: 1) содержание цистеина в положении 80 необходимо, но не достаточно для обеспечения возможности сайт-специфического конъюгации функционального агента; и 2) в некоторых условиях попытки конъюгации с Cys80 могли приводить к высокой степени агрегации, не совместимой с технологичностью изготовления лекарственного средства. Однако поскольку описанные исследования, характеризующие xi155D5, показали, что по меньшей мере в некоторых условиях конъюгирование функционального агента с Cys80 могло быть очень эффективным, далее исследовали, как остатки, окружающие Cys80, могут влиять на эффективность конъюгации. В результате были созданы структурные модели гибридного xi155D5 (Фигура 10), которые указывали на то, что остатки Val11, Ala14, Gly17, Thr18, Lys63, Thr76, Gly77, Val78, Ala83, Glu103 и Leu104 были в непосредственной близости (в пределах 18 Å) от Cys80 и, таким образом, могли потенциально влиять на эффективность его конъюгации.
[0278] На основе вышеуказанных остатков были созданы два варианта FWR1 (FWR1a-b), один вариант FWR2, три варианта FWR3 (FWR3a-c) и два варианта FWR4 (FWR4a-b) (Таблица 7).
Таблица 7. Варианты каркасов, полученные из семейства последовательностей Vκ человека IGKV1-5
Остатки, выделенные жирным шрифтом, указывают на различия между вариантами каркасов. n/a - не применимо.
[0279] Был получен ряд вариантов гуманизированной последовательности 155D5, которые содержали комбинации указанных каркасов и мотив Cys80-Xaa1-Xaa2-Phe83 (также называемый C-X-X-F или CXXF) или Cys80-Xaa1-Xaa2-Ala83 (также называемый C-X-X-A или CXXA), где «Xaa» или «X» обозначает аминокислоты в положении 81 и 82 (Таблица 8).
Таблица 8. Варианты гуманизированной последовательности 155D5, полученные из семейства последовательностей Vκ человека IGKV1-5
[0280] Независимо от используемого варианта FWR, для гуманизированных mAb, содержащих мотив C-X-X-F, наблюдалась высокая степень агрегации (после декэпирования) и слабое конъюгирование (Таблица 9). Напротив, для 4 из 5 вариантов mAb, содержащих мотив C-X-X-A, независимо от используемого варианта FWR, была показана высокая процентная эффективность конъюгации (≥80%) и низкая степень агрегации (после декэпирования), составляющая <18% (Таблица 9). zu155D5-4 является исключением, для которого наблюдалась низкая процентную эффективность конъюгации и высокая степень агрегации после декэпирования. Следует отметить, что антитело zu155D5-4 имело склонность к агрегации независимо от декэпирования, что может объяснять наблюдаемые результаты. Указанные данные предполагают, что Phe83 участвует в появлении высокой степени агрегации после декэпирования и не подходит для конъюгации через Cys80.
Таблица 9. Степень агрегации и эффективность конъюгации последовательности xi155D5 по сравнению с различными вариантами последовательности zu155D5
Жирным шрифтом обозначен мотив C-X-X-F и значения, не удовлетворяющие требованиям по конъюгированию.
[0281] Желательным является достижение степени агрегации 25% или менее в начальный момент последующей оптимизации способа, где дополнительная оптимизация параметров ферментации, условий очистки и получения лекарственного средства может приводить к достижению более предпочтительного уровня агрегации, составляющего 5% или менее. Также желательным является достижение эффективности конъюгации 70% или выше для минимизации потери продукта, стоимости товара и максимального повышения гомогенности продукта. Здесь и далее настоящее исследование было нацелено на удовлетворение и превышение указанных требований путем экстраполяции правил на способы гуманизации mAb кролика.
[0282] 155D5-1 создавали с помощью следующей стандартной методики, которая включает использование последовательностей зародышевых линий человека, обладающих наибольшей гомологией с исходной последовательностью. В связи с этом методом для гуманизации 155D5 использовали подсемейство Vκ человека IGKV1-5, имеющее процентную идентичность 70,5% (данные не представлены) и содержащее Phe83. Альтернативные подсемейства Vκ, которые имеют сходную процентную идентичность (данные не представлены), также содержали Phe83 (Фигура 8). Поскольку оказалось, что этот остаток отрицательно влиял на эффективность Cys80-конъюгации и вызывал высокую степень агрегацию, проводили оценку наличия или отсутствия Phe83 в других семействах Vκ человека, несмотря на то, что наиболее высокая идентичность, обнаруженная для указанных семейств Vκ, была ниже (68,4%), и таким образом, указанные семейства в большинстве случаев не стали бы использовать для гуманизации 155D5. Поскольку все из семейств Vκ человека, за исключением IGKV4, IGKV5 и IGKV7, включают множество подсемейств, выравнивали последовательности всех подсемейств в пределах семейств (данные не представлены). После удаления лишних последовательностей, для каждого из семейств IGKV-4, -5, -6, -6D и -7 оставалась только одна последовательность, которую можно было использовать для гуманизации. Для семейств IGKV-1, -2 и -3 подсемейство с наиболее близкой к консенсусной последовательности гомологией была выбрана в качестве каркасной последовательности для гуманизации 155D5. Предварительный анализ указывает на то, что некоторые из указанных семейств Vκ содержали Phe83, тогда как другие не содержали Phe83 (см. также Таблицу 10).
[0283] Для изучения влияния наличия или отсутствия Phe83 для указанных семейств Vκ CDR-участки 155D5 генетическим путем встраивали в каркасные области человека IGKV1-39*01, IGKV2-40*01, IGKV3-11*01, IGKV4-1*01, IGKV5-2*01, IGKV6-21*01, IGKV6D-41*01 и IGKV7-3*01. IGKV5-2*01-Asn20, который содержит N-связанный сайт гликозилирования в положении остатка 20, и его Thr20-вариант не были включены в настоящий анализ, поскольку первый из указанных вариантов нельзя было анализировать с помощью масс-спектрометрии в связи с гетерогенностью, а последний вариант плохо экспрессировался. IGKV7-3*01-Asn81 не был включен в анализ из-за невозможности его анализа с помощью масс-спектрометрии. Однако вариант IGKV7-3*01-Glu81 был включен в анализ. В результате анализа были получены следующие результаты (Таблица 10):
1. Для гуманизированного mAb с последовательностью huIGKV1-39, содержащего Phe83, было показано повышение агрегации от 0 до 26% после декэпирования; эффективность конъюгировании была на границе приемлемого значения (68%) в отличие от степени агрегации, составляющей >25%;
2. Гуманизированное mAb с последовательностью huIGKV2-40 содержало Val83 зародышевой линии человека; для указанного mAb была показана агрегация <25% после декэпирования (11%) и эффективность конъюгации >70% (92%). Указанные параметры были приемлемыми, указывая на то, что Val83 подходит для спаривания с Cys80 с обеспечением возможности Cys80-конъюгации;
3. Гуманизированное mAb с последовательностью huIGKV3-11 содержало Phe83; тогда как агрегация была ниже 25%, эффективность конъюгации составляла 55%, и, таким образом, не удовлетворяла требованию по эффективности >70%;
4. Гуманизированное mAb с последовательностью huIGKV4-1 содержало Val83 зародышевой линии человека; для указанного mAb была показана агрегация <25% после декэпирования (6%) и эффективность конъюгации >70% (82%). Указанные параметры были приемлемыми, указывая на то, что Val83 человека подходит для спаривания с Cys80 с обеспечением возможности Cys80-конъюгации, как видно на примере последовательности huIGKV2-40;
5. Гуманизированные mAb с последовательностями huIGKV6-21 или huIGKV6D-41 содержали Ala83 зародышевой линии человека; для указанных mAb была показана агрегация <25% после декэпирования и эффективность конъюгации >70%. Указанные параметры были приемлемыми, указывая на то, что Ala83 зародышевой линии человека подходит для спаривания с Cys80 с обеспечением возможности Cys80-конъюгации, как видно на примере последовательности xi155D5; и
6. Гуманизированное mAb с последовательностью huIGKV7-3-Glu81 содержит Thr83 зародышевой линии человека; для указанного mAb была показана агрегация <25% после декэпирования (6%) и эффективность конъюгации, близкая к 100%. Указанные параметры были приемлемые, что предполагает, что Thr83 зародышевой линии человека подходит для спаривания с Cys80 с обеспечением возможности Cys80-конъюгации.
Таблица 10. Степень агрегации и эффективность конъюгации различных вариантов последовательности zu155D5, созданных с использованием различных подсемейств Vκ человека
Жирным шрифтом обозначен мотив C-X-X-F и значения, не удовлетворяющие требованиям по конъюгированию.
[0284] Указанные результаты подтверждают открытие того факта, что фенилаланин в положении 83 отрицательно влияет на эффективность конъюгации Cys80, и указывают на то, что помимо аланина валин и треонин также могут заменять Phe83 для обеспечения возможности Cys80-конъюгации.
[0285] Для подтверждения того, что в случае других mAb Phe83 также оказывает влияние, приводя к высокой степени агрегации после декэпирования, и не подходит для Cys80-конъюгации, получали варианты гуманизированных mAb 1E4 (анти-CA9), 166B3 (анти-CA9) и 33O11 (анти-MSLN), содержащие мотив C-X-X-F или C-X-X-A.
[0286] Варианты моноклональных антител, имеющие мотив C-X-X-F, удовлетворяли требованиям по конъюгированию, но не удовлетворяли требованиям по агрегации, тогда как для всех вариантов гуманизированных mAb, содержащих C-X-X-A, была показана менее чем 25%-ная агрегация и эффективность конъюгации больше чем 70% (Таблицы 11 и 12). Указанные исследования показывают, что C-X-X-(non) F или K является мотивом, который позволяет удовлетворять требованиям по конъюгированию.
Таблица 11. Степень агрегации и эффективность конъюгации различных вариантов гуманизированных mAb, содержащих C-X-X-F, по сравнению с мотивами C-X-X-A и C-X-X-I
Жирным шрифтом обозначен мотив C-X-X-F и значения, не удовлетворяющие требованиям по конъюгированию.
Таблица 12. Степень агрегации и эффективность конъюгации различных вариантов последовательности zu1E4 mAb, содержащих C-X-X-F по сравнению с мотивами C-X-X-(non)F или K
Жирным шрифтом обозначены мотивы C-X-X-F и C-X-X-K и значения, не удовлетворяющие требованиям по агрегации или конъюгированию.
[0287] Помимо Ala83, Val83 и Thr83, которые могут быть обнаружены в последовательностях Vκ, принадлежащих подсемействам huIGKV1-7 зародышевой линии, в семействе huIGKV1 зародышей линии также, хоть и редко, может быть обнаружен Ile83. Поскольку уже было обнаружено, что Ala83, Val83 и Thr83 подходят для Cys80-конъюгации (Таблица 9 и Таблица 11), оставалось определить, будет ли Ile83 являться благоприятными или неблагоприятным остатком с точки зрения Cys80-конъюгации. Таким образом, был получен гуманизированный вариант mAb 33O11, содержащий мотив Cys80-Xaa1-Xaa2-Ile83 (также называемый C-X-X-I или CXXI), для которого была показана менее чем 25%-ная агрегация и эффективность конъюгации более 70% (Таблица 11), что сопоставимо с предыдущими исследуемыми мотивами C-X-X-(non)F. Этот результат подтверждает открытие того факта, что помимо Ala83, Val83 и Thr83, Ile83 также может заменять Phe83 с обеспечением возможности Cys80-конъюгации при удовлетворении требованиям по конъюгированию.
[0288] Описанные исследования указывают на то, что тогда как гибридизованные mAb кролика подходят для сайт-специфичного конъюгации через Cys80 только после применения описанного способа декэпирования, как обсуждается выше, гуманизированные mAb кролика, содержащие мотив C-X-X-F или C-X-X-K, плохо подходят для таких модификации из-за высокой степени агрегации и/или низкой эффективности конъюгации после декэпирования. Было сделано предположение, что остатки, окружающие Cys80, могут играть роль в этом явлении. Поскольку область Vκ содержит более 100 остатков, для понимания взаимодействия между Cys80 и ключевыми окружающими его остатками было необходимо использование структурного моделирования в сочетании с экспериментaльным исследованием. Было обнаружено, что из остатков, расположенных в непосредственной близости от Cys80, Phe83 оказывал отрицательное влияние на эффективность Cys80-конъюгации. Также было обнаружено, что все из mAb кролика содержали Phe83 после гуманизации с применением классического подхода (Фигура 11), несмотря на тот факт, что последовательности Vκ человека могут дополнительно содержать другие аминокислотного остатка в положении 83, включая аланин, треонин, валин и изолейцин. Использование указанных семейства последовательностей Vκ для гуманизации подтвердило, что Phe83 и Lys83 являются достаточными для придания нежелательных свойств гуманизированному mAb, таких как высокая степень агрегации и/или низкая эффективность конъюгации, тогда как остальные аминокислотные остатки (за исключением Cys, который не исследовали в связи с желанием получить единственный Cys для конъюгации) подходили для Cys80- конъюгации.
[0289] Указанные результаты предполагают, что мотивы C-X-X-F и C-X-X-K следует избегать при конъюгировании через Cys80. С использованием мотива C-X-X-(not)F или K, например, мотива C-X-X-A, C-X-X-T, C-X-X-V и C-X-X-I, путем замены Phe83 создавали гибридизованные, а также гуманизированные mAb, которые удовлетворяли желаемым требованиям по конъюгированию.
Аффинность последовательности xi155D5 и гуманизированных вариантов
[0290] Последовательность xi155D5 и гуманизированные варианты очищали с помощью стандартной хроматографии с использованием белка A или метода декэпирования и их аффинность анализировали с помощью системы BIAcore (Таблица 13). Наблюдали менее чем 2-кратное различие в KD между гибридной и гуманизированной 155D5 и небольшое различие между образцами, очищенным с помощью двух различных способов.
Таблица 13. Анализ связывания антигена BIAcore для гуманизированных и гибридных mAb 155D5
Пример 3 - Создание конъюгированных с ауристатином моноклональных антител против мезотелина
[0291] Мезотелин (MSLN) представляет собой белок клеточной поверхности, экспрессируемый в раковых клетках, включая определенные опухоли яичников, легких, поджелудочной железы и мезотелиому. Для улучшения активности агентов, направленных на MSLN, были разработаны de novo моноклональные антитела кролика (mAb) против MSLN, которые затем получали и конъюгировали с ауристатином F (AuF) через Cys80 для получения панели конъюгированных mAb MSLN-AuF.
Создание и характеристика mAb кролика против MSLN
[0292] Новозеландских кроликов (Oryctolagus cuniculus) иммунизировали по технологии компании Aldevron (Германия) с применением плазмидной ДНК, кодирующей белок MSLN человека («MSLN»). На 52 день получали сыворотку крови животных и затем исследовали на связывание с MSLN с помощью проточной цитометрии с применением клеток млекопитающих, временно экспрессирующих MSLN человека. На Фигуре 12-D показано, что сыворотка от обоих животных содержала MSLN-связывающие антитела. Позднее ИФА-анализ подтвердил полученный результат (Фигура 12E). Затем животных умерщвляли и получали и криоконсервировали МКПК из крови, а также лимфоциты из селезенки и лимфатических узлов.
[0293] Ранее замороженные лимфоциты из лимфатических узлов восстанавливали и обрабатывали ДНКазой I и митогеном лаконоса в течение одного часа при 37°C/5% CO2. Клетки подсчитывали и высевали в концентрации 5 клеток/40 мкл/лунку в полной питательной среде IMDM, содержащей 10% эмбриональной бычьей сыворотки (ЭБС) и цитокины (IL-2 и IL-21 в концентрации 10,5 нг/мл) в 384-луночные планшеты, на которые предварительно в качестве фидерных клеток высевали клетки CHO-K1, экспрессирующие CD154. Через неделю клеткам снова добавляли ту же питательную среды, как описано выше, в объеме 20 мкл/лунку. Через две недели после посева получали супернатанты культуры B-клеток для их скрининга для идентификации клонов со специфичной реакционной активностью в отношении MSLN человека. Планшеты с клетками замораживали и хранили при -80°C для последующего выделения РНК и амплификации генов. Супернатанты культуры B-клеток сначала подвергали скринингу для выявления продукции IgG с помощью FRET-анализа с IgG кролика. IgG-продуцирующие клоны (5,775) выбирали и подвергали скринингу с помощью ИФА для определения связывания с MSLN человека (1-ый скрининг). Некоторые клонов, обладающих реакционной способностью по отношению к MSLN, повторно исследовали (2-ой скрининг) для оценки реакционной способности по отношению к MSLN, но не контрольного антигена (CD73 человека). Были выбраны пять mAb, которые показаны в Таблице 14.
Таблица 14. Клоны со специфичной реакционной способностью по отношению к MSLN человека
[0294] Планшеты, содержавшие выбранные mAb, размораживали и B-клетки лизировали для выделения РНК с применением набора РНКqueous (Ambion). РНК использовали для осуществления ОТ-ПЦР для амплификации вариабельных областей антитела. Полученные последовательности ДНК секвенировали и создавали праймеры для совместимости с системой клонирования InFusion HD®, как описано в инструкции производителя (Clontech, Маунтин-Вью, Калифорния). Вариабельную область фрагментов ПЦР клонировали в экспрессионной плазмиде, содержащей константную область гамма- или каппа-цепи человека. Указанные плазмиды трансфицировали с использованием экспрессионной системы FreeStyle 293 (Thermo Fisher Scientific) с получением mAb, как описано в другом месте в настоящей заявке.
Получение и характеристика mAb MSLN-AuF, конъюгированных через CYS80
[0295] Гибридизованные mAb получали, как описано в Примере 2, где xi33O11 является одним из пяти mAb против MSLN, а другие четыре mAb были гибридизованы после получения с помощью такого же способа. Поэтому указанные mAb против MSLN содержат неспаренный Cys80, в частности, мотив C-X-X-A. В настоящей заявке они называются xi324O5, xi178F16, xi237N18, xi33O11 и xi383I18.
[0296] После получения выбранные пять гибридизованных mAb конъюгировали с ауристатином F (AuF) в соответствии со следующими далее способами получения mAb MSLN-AuF, конъюгированных через CYS80.
[0297] Очистка антитела путем «декэпирования»: Декэпирование mAb, происходящего от кролика/человека, является этапом, необходимым для конъюгации с Cys80. С использованием системы ÄKTA Explorer (GE Healthcare) колонку с белком A (GE Healthcare) уравновешивали с помощью 10 колоночных объемов (КО) смеси, содержащей 20 мМ фосфат натрия, 10 мМ ЭДТА, pH 7,2. Затем вводили образец с последующей отмывкой несвязавшегося материала 10 КО уравновешивающего буфера. Колонку промывали 16 КО смеси, содержащей 20 мМ фосфат натрия, 10 мМ ЭДТА, 5 мМ цистеин, pH 7,2, при скорости 0,5 мл/мин в течение 16 ч. Затем колонку промывали 60 КО 20 мМ Триса, pH 7,5, при скорости 0,5 мл/мин в течение 60 ч. Образец элюировали с помощью 5 КО 0,1 M глицина, pH 2,9. Фракции, содержавшие mAb, объединяли и диализировали в DPBS с применением емкости для диализа Slide-A-Lyzer с мембраной для исключения по молекулярной массе (MWCO, 20K, Thermo Fisher Scientific). Восстановление белка определяли с помощью BCA-анализа.
[0298] Конъюгирование ауристатина F: Очищенные и декэпированные гибридизованные MSLN-mAb, содержащие мотив C-X-X-A, инкубировали с малеимид-PEG2-ауристатин F (mal-PEG2-AuF, структура показана ниже), разводили из 10 мМ исходного раствора в ДМСО (Concortis Biosystems, Сан-Диего, Калифорния) в молярном отношении AuF:MAb 5:1 с конечной концентрацией антител 5 мг/мл в 1x PBS. Конъюгирование осуществляли в течение 2 ч при 22°C. Непрореагировавший mal-PEG2-AuF удаляли путем очистки с обессоливанием на системе для ВЭЖХ AKTA, снабженной колонкой для обессоливания 26/10 (GE Healthcare) с использованием 1x PBS в качестве электродного буфера. Фракции, содержащие антитела, объединяли и концентрацию белка определяли с помощью BCA-анализа.
Малеимид-PEG2-ауристатин F:
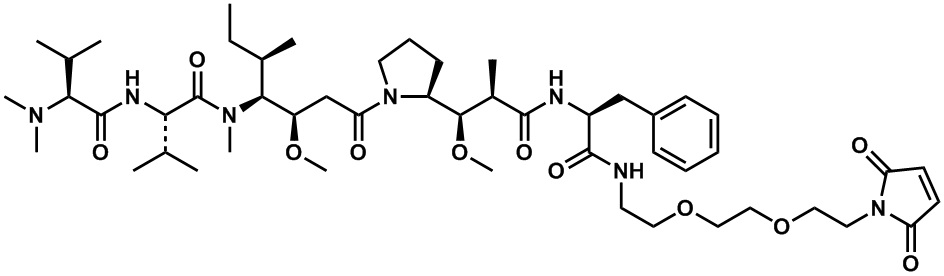
[0299] Анализ с помощью СВЭЖХ/МС-ИЭР: Образцы восстанавливали путем добавления ДТТ до достижения конечной концентрации 20 мМ с последующим инкубированием при 60°C в течение 3 мин. Затем образцы затем анализировали с применением системы для СВЭЖХ (Waters Acquity) и масс-спектрометра Q-Tof Premier. Образцы (каждый по 0,5-2 мкг) вводили в микроколонку для обессоливания MassPrep при 65°C, элюировали из колонки путем уравновешивания в течение 5 мин в 95%-ной подвижной фазы A, использования градиента (5-90% B) в течение 10 мин и повторного уравновешивания в 95%-ной подвижной фазе A в течение 10 мин при скорости 0,05 мл/мин. Подвижная фаза A представляла собой 0,1% муравьиную кислоту в воде. Подвижная фаза B представляла собой 0,1% муравьиную кислоту в ацетонитриле. Масс-спектрометр Q-Tof прогоняли в V-режиме регистрации положительных ионов с выявлением масс в диапазоне 500-4000 m/z. Исходные параметры были такими, как следует далее: капиллярное напряжение - 2,25 кВ (интактное антитело)-2,50 кВ (восстановленное антитело); напряжение пробоотборного конуса - 65,0 В (интактное антитело) или 50,0 В (восстановленное антитело); исходная температура - 100°C; температура десольвации - 250°C; газовый поток десольвации - 550 л/ч. Деконволюцию белкового пика проводили с использованием функции MaxEnt 1 программы MassLynx. Пример анализа показан на Фигуре 13. Как правило, соотношение антитело-функциональный агент для ≥90% конъюгированных mAb составляло 2, что указывает на то, что каждое гибридизованное mAb против MSLN содержало молекулу AuF, конъюгированную с каждым из Cys801 и Cys802.
Цитотоксичность in vitro
[0300] A431-MSLN представляют собой клетки, полученные из клеток A431 (ATCC® CRL-1555™), которые стабильно экспрессируют MSLN человека. Клетки A431-MSLN субкультивировали и высевали в 96-луночные планшеты в концентрации 10,000 клеток/лунку/100 мкл в среде RPMI, содержащей 10% ЭБС, и инкубировали при 37°C, 5% CO2 в течение 16 часов. Получали серийные разведения 1:4 mAb MSLN-AuF, конъюгированных через CYS80, в планшетах для разведения с глубокими лунками на 2 мл. Разведенные соединения (100 мкл) добавляли в клеточные планшеты с достижением конечной концентрацией, варьирующей от 0,28 до 75 мкг/мл. Mal-PEG2-AuF использовали в концентрации, эквимолярной конъюгированному mAb. Например, 10 мкг/мл mAb MSLN-AuF, конъюгированного через CYS80 (DAR=2), соответствует 0,14 мкг/мл mal-PEG2-AuF. Планшеты инкубировали при 37°C, 5% CO2 в течение дополнительных 48 часов. Среду выливали, планшеты промывали один раз 200 мкл DPBS, окрашивали 50 мкл 0,2% раствора кристаллического фиолетового при 22°C в течение 15 минут и затем интенсивно промывали водопроводной водой. Планшеты сушили на воздухе, кристаллический фиолетовый растворяли в 200 мкл 1% раствора ДСН. Колориметрическое измерение оптической плотности проводили при 570 нм. Программу Excel использовали для преобразования значений оптической плотности в количество клеток, а программу GraphPad Prism 6 использовали для построения графика процентной цитотоксичности.
[0301] При обработке MSLN-отрицательных клеток A431 mAb MSLN-AuF, конъюгированными через CYS80, не наблюдали существенной цитотоксичности, тогда как mal-PEG2-AuF являлся цитотоксичным только при самой высокой исследуемой концентрации (Фигура 14A). При обработке MSLN-положительных клеток A431-MSLN mAb MSLN-AuF, конъюгированными через CYS80, наблюдали значительную цитотоксичность. На основании кривых зависимости ответа от дозы (Фигура 14B) mAb MSLN-AuF, конъюгированные через CYS80, можно было разделить на 2 группы: средняя цитотоксичность - xi324O5-AuF и xi178F16-AuF; и высокая цитотоксичность - xi237N18-AuF, xi33O11-AuF и xi383I18-AuF.
Оценка in vivo - исходный выбор mAb MSLN-AuF, конъюгированных через CYS80
[0302] Исследовали эффективность in vivo mAb MSLN-AuF, конъюгированных через CYS80, в отношении опухоли, экспрессирующей MSLN, с целью выбора нескольких соединений с высокий эффективностью и низкой токсичностью.
[0303] Клетки A431-MSLN размножали в клеточной культуре, суспендировали в бессывороточной ростовой среде, смешивали с Matrigel™ в отношении 1:1 и имплантировали бестимусным мышам NCr nu/nu подкожно (ПК) в концентрации 5 миллионов клеток/0,2 мл/мышь. Объем опухоли определяли путем измерения с помощью штангенциркуля (мм) и с использованием формулы для определения объема эллиптической сферы: длина x ширина2/2 = объем (мм3). Когда объем опухолей варьировал от 100 до 250 мм3,мышей распределяли случайным образом на лечебные группы. Массу тела животных и размер опухоли регистрировали два раза в неделю. Обобщенная общая схема настоящего исследования представлена в Таблице 15. В целом вводили 2 дозы mAb MSLN-AuF, конъюгированных через CYS80, внутривенно (ВВ) один раз в 7 дней (Q7D), начиная с дня распределения по группам (1 день).
Таблица 15. Схема исследования
[0304] На Фигуре 15 показан средний объем опухолей в различных лечебных группах до 18 дня после имплантации, когда 3 из 8 животных в группе, получавшей лечение солевым раствором, пришлось усыпить в связи с большой массой опухоли и/или изъязвлением опухоли. 4 сутки после имплантации соответствует дню, когда мышей распределяли случайным образом на различные лечебные группы, при этом средний объем опухолей варьировал от 157 до 160 мм3 по всем группам. В этот день вводили первую дозу mAb MSLN-AuF, конъюгированных через CYS80, с последующим введением второй дозы на 11 день.
[0305] При использовании mAb MSLN-AuF, конъюгированных через CYS80, наблюдался противоопухолевый ответ, о чем свидетельствует тот факт, что объем опухолей на 18 день составлял 20% или менее по сравнению с группой, получавшей лечение солевым раствором (Таблица 16). Напротив, при использовании mal-PEG2-AuF не наблюдалось противоопухолевого ответа.
Таблица 16. Процентный объем опухоли по сравнению с группой, получавшей солевой раствор
[0306] Токсичность также оценивали путем наблюдения за любой потерей массы тела животных на 18 сутки по сравнению с 4 сутками (на основе средней массы тела участвующих в исследовании животных в каждой группе), а также по результатам выявления умерших или умирающих животных (Таблица 17). В группе, получавшей лечение xi324O5-AuF, наблюдалось уменьшение массы тела на 11% у выживших животных и также наблюдалось два умерших/умирающих животных. В группах, получавших лечение xi178F16-AuF, xi237N18-AuF и xi383I18-AuF, не наблюдали значительного уменьшения массы тела, однако наблюдали одно или два умерших/умирающих животных. Во всех других лечебных группах не наблюдалось ни потери массы тела, ни умерших/умирающих животных.
Таблица 17. Оценка общей токсичности
[0307] На основании противоопухолевых ответов, а также минимальной токсичности антитела mAb xi33O11-AuF и xi237N18-AuF были выбраны для дополнительной оценки.
Оценка специфичности противоопухолевой активности, опосредованной mAb MSLN-AuF, конъюгированными через CYS80, в отношении мишени
[0308] В данном исследовании использовался такой же способ, как описано выше (оценка in vivo - исходный выбор mAb MSLN-AuF, конъюгированных через CYS80). Помимо клеток A431-MSLN, которые имплантировали в левый бок каждой мыши на 4 сутки, на 1 сутки тем же мышам имплантировали в противоположный (правый) бок MSLN-отрицательные клетки A431. Клетки A431-MSLN образовывали опухоль быстрее по сравнению с MSLN-отрицательными клетками, в связи с этим их имплантировали через 3 дня таким образом, чтобы обеспечить введение первой дозы исследуемого лекарственного средства, когда опухоли с обеих сторон имели сходный объем. Общая схема настоящего исследования приведена в Таблице 18.
Таблица 18. Схема исследования
[0309] MSLN-положительные опухоли: На Фигуре 16A показаны средние объемы опухолей в различных лечебных группах до 18 суток после имплантации, когда 4 из 8 животных в группе, получающей лечение солевым раствором, пришлось усыпить из-за большой массы опухоли и/или изъязвления опухоли. 4 сутки после имплантации соответствует дню, когда мышей распределяли случайным образом в различные лечебные группы, при этом средний объем опухоли A431-MSLN варьировал от 169 до 178 мм3 по всем группам. В этот день вводили первую дозу mAb MSLN-AuF, конъюгированных через CYS80, следующее введение второй дозы осуществляли на 11 день.
[0310] xi33O11-AuF опосредовал противоопухолевые ответы, которые приводили к снижению объема опухоли на 18 сутки до 12% по сравнению с группой, получавшей лечение солевым раствором (Таблица 19). xi237N18-AuF опосредовал противоопухолевые ответы, которые приводили к снижению объема опухоли до 24% по сравнению группой, получавшей лечение солевым раствором (Таблица 19). С помощью непарного двустороннего t-критерия Стьюдента были получены p-значения, составляющие 0,00039 и 0,00197 соответственно, предполагающие, что отличие указанных противоопухолевых ответов по сравнению с группой, получавшей лечение солевым раствором, были статистически достоверными. Напротив, для mal-PEG2-AuF или xi1-55-2-AuF, направленного на эндосиалин/TEM1, не наблюдалось существенных противоопухолевых ответов.
Таблица 19. Процентный объем опухоли A431-MSLN по сравнению с группой, получавшей солевой раствор
[0311] MSLN-отрицательные опухоли: На Фигуре 16B показаны средние объемы опухолей в различных лечебных группах до 21 суток после имплантации. 21 сутки соответствуют 18 суткам после имплантации A431-MSLN, как описано выше, тогда как 7 сутки после имплантации соответствуют дню, когда мышей распределяли случайным образом на различные лечебные группы, при этом средний объем опухоли A431 варьировал от 174 до 184 мм3 по всем группам. xi33O11-AuF опосредовал противоопухолевые ответы, которые приводили к снижению объема опухоли на 21 сутки до 78% по сравнению с группой, получавшей лечение солевым раствором (Таблица 20). mAb xi237N18-AuF, конъюгированное через CYS80, опосредовало противоопухолевые ответы, которые приводили к снижению объема опухоли на 21 сутки до 64% по сравнению с группой, получавшей лечение солевым раствором (Таблица 20). С помощью непарного двустороннего t-критерия Стьюдента были получены p-значения 0,317 и 0,091 соответственно, предполагающие, что отличия указанных противоопухолевых ответов по сравнению с группой, получавшей лечение солевым раствором, не были статистически достоверны. Указанные ответы были сходны с ответами, наблюдаемыми при использовании mal-PEG2-AuF или xi1-55-2-AuF.
Таблица 20. Процентный объем опухоли A431 (MSLN-отрицательной) по сравнению с группой, получавшей солевой раствор
[0312] Токсичность также оценивали по результатам наблюдения какого-либо уменьшения массы тела на 21 сутки после имплантации клеток A431 по сравнению с 7 сутками, а также по результатам наблюдения умерших или умирающих животных (Таблица 21). Уменьшения массы тела ≥10% в каких-либо лечебных группах не наблюдалось. В обеих группах, получавших лечение xi33O11-AuF и xi237N18-AuF, было по два умерших животных.
Таблица 21. Оценка общей токсичности
Заключение
[0313] Получали mAb MSLN-AuF, конъюгированное через CYS80, и подвергали скринингу для оценки цитотоксичности in vitro и противоопухолевой активности in vivo. Анализ цитотоксичности in vitro показал, что указанные соединения были направлены на MSLN-положительные опухолевые клетки и убивали их в отличие от MSLN-отрицательных опухолевых клеток.
[0314] Все исследуемые mAb MSLN-AuF, конъюгированные через CYS80, обладали противоопухолевой активностью, при этом некоторые из них оказались потенциально более токсичными, чем другие. Природу указанной токсичности дополнительно не описывали. Было показано, что оба исследуемых in vivo mAb MSLN-AuF, конъюгированных через CYS80, были могли действовать в отношении MSLN-положительных опухолей и подавлять их рост, тогда как существенного эффекта в отношении MSLN-отрицательных опухолей с противоположного бока не наблюдалось. Тогда как профиль токсичности последовательности xi237N18 был сходным в обоих исследованиях, лечение xi33O11-AuF не приводило к токсичности в первом исследовании, однако было связано с двумя смертельными случаями во втором исследовании. Природу указанной токсичности дополнительно не исследовали, однако поскольку у мышей, получавших лечение xi33O11-AuF, сохранялась крупная MSLN-отрицательная опухоль на другом боку, и эти животные, таким образом, были более слабыми по сравнению с животными в первом исследовании, указанные мыши могли быть более чувствительными к эффекту масштабного лизиса опухолевых клеток MSLN-положительной опухоли.
Пример 4 - Создание конъюгатов антитело-флуоресцентный краситель
[0315] Антитела mAb xi155D5, содержащее мотив C-X-X-A, конъюгировали с красителем 800CW (LI-COR Biotechnology, Линкольн, Небраска) для создания mAb xi155D5-800CW, конъюгированного через CYS80, содержащего две молекулы красителя, конъюгированные с Cys801 и Cys802.
[0316] Конъюгирование 800CW с Cys80 осуществляли с использованием малеимид-(CH2)2-800CW (LiCor), где (CH2)2 представляет собой алкильный линкер. Вкратце, малеимид-(CH2)2-800CW растворяли в 100% ДМСО в конечной концентрации 10 мМ. Малеимид-(CH2)2-800CW добавляли к xi155D5 (5 мг/мл в 1x PBS) в молярном отношении краситель:MAb 5:1 и инкубировали в течение 4 ч при комнатной температуре. Не встроившийся краситель удаляли путем обессоливания на колонке PD-10 (Millipore). xi155D5-800CW дополнительно очищали с помощью эксклюзионной хроматографии на колонке, содержащей Superdex 75. Материал исключенного объема колонки объединяли, аликвотировали и замораживали при -80 до его использования. Анализ с помощью электрофореза в ПААГ в присутствии ДСН и анализ изображений восстановленного xi155D5-800CW показал, что краситель был конъюгирован только с легкой цепью в отличие от тяжелой цепи (Фигура 17).
[0317] Самкам голых мышей NCR подкожно вводили опухолевые клетки человека colo205 или HT-29 в правые задник конечности. За ростом опухоли наблюдали с помощью штангенциркуля. Когда объем опухоли составлял 200-300 мм3, в хвостовую вену вводили xi155D5-800CW в концентрации 0,1 мг/200мкл/мышь. Для наблюдения за распределением xi155D5-800CW с помощью прижизненной визуализации флуоресценции животных помещали в камеру для анестезии с помощью изофурана/O2 приблизительно на 3-4 минуты до момента потери сознания. Визуализацию проводили с использованием следующих настроек на приборе IVIS® Lumina II-Kinetic (PerkinElmer, Уолтем, Массачусетс): возбуждение флуоресценции при 745 и испускание флуоресценции при 840. Получали изображения задней, правой, передней и левой части в различные точки времени, как указано на Фигуре 18. После получения каждого последующего изображения животным позволяли прийти в сознание в камере для восстановления с подачей 100% кислорода с последующей подачей нормального воздуха.
[0318] При использовании моделей colo205 или HT-29 наблюдали, что xi155D5-800CW был эффективно направлен против опухоли человека, на что указывает опухоль-специфичная локализация его флуоресцентного сигнала (Фигура 18).
[0319] Указанные результаты показали, что mAb, содержащее мотив C-X-X-(not)F, K или C, можно конъюгировать с красителем, и что полученное конъюгированное mAb можно использовать для идентификации и наблюдения за состоянием опухоли.
Пример 5 - Создание бивалентных/биспецифичных антиген-связывающих молекул
[0320] Когда mAb, содержащее мотив C-X-X-(not)F, K или C, расщепляют папаином или проводят его рекомбинантную экспрессию в виде Fab-фрагмента, указанное антитело содержит один неспаренный Cys80, так как Fab содержит только одну область Vκ. С помощью химических реакций независимого конъюгации Fab-фрагменты, содержащие Cys80, можно использовать для создания конъюгированных химическим путем бивалентных/биспецифичных антиген-связывающих молекул, таких как бивалентная/биспецифичная молекула Fab-Fab, которые можно применять для нацеливания на мишени, соответствующие двум независимым заболеванием, включая два лиганда (цитокины, хемокины), два мембранных рецептора или, например, комбинации лиганд/рецептор.
[0321] В качестве примера, Fab-фрагменты получали из xi155D5 и xi1-55-2 с помощью неполного расщепления папаином и последующей хроматографии с использованием белка A для удаления Fc-фрагментов и нерасщепленных mAb. С помощью масс-спектрометрии было показано, что Fab-фрагменты были полностью декэпированы (данные не представлены). Затем Fab-фрагменты xi155D5 и xi1-55-2 конъюгировали раздельно с применением малеимид-ПЭГ4-дибензилциклооктина (DBCO) и малеимид-ПЭГ4-азида соответственно. Неконъюгированное соединение удаляли с помощью хроматографии с обессоливанием и полную занятость сайтов Cys80 подтверждали с помощью масс-спектрометрии (данные не представлены). Затем фрагменты xi155D5-малеимидо-PEG4-DBCO и xi1-55-2-малеимид-ПЭГ4-азид конъюгировали друг с другом с помощью реакций клик-химии, облегченных напряжением, без применения соединений меди путем инкубирования в PBS при 22°C в течение 16 часов. Конъюгированные продукты фракционировали с помощью гель-фильтрующей хроматографии (Фигура 19A) и различные виды конъюгатов идентифицировали с помощью электрофореза в ПААГ в присутствии ДСН на основе их ожидаемой молекулярной массы (Фигура 19B). Фракции, содержащие бивалентную/биспецифичную антиген-связывающую молекулу xi155D5/xi1-55-2, объединяли и подлинность бивалентной/биспецифичной антиген-связывающей молекулы xi155D5/xi1-55-2 подтверждали с помощью масс-спектрометрии на основе ее ожидаемой массы (95,939 Да, Фигура 19C).
[0322] Биспецифичность последовательности xi155D5/xi1-55-2 бивалентной/биспецифичной антиген-связывающей молекулы подтверждали путем анализа с помощью биослойной интерферометрии (BLI) с применением обратного сэндвич-анализа. Указанный анализ показал связывание с иммобилизированным CA9 человека (связывание с помощью Fab-фрагмента xi155D5) с последующим связыванием с растворимым TEM-1 (связывание с помощью Fab-фрагмента xi1-55-2) (Фигура 20). Как ожидалось, mAb xi155D5, Fab xi155D5 и бивалентная/биспецифичная антиген-связывающая молекула xi155D5/xi1-55-2 связывались с иммобилизированным CA9. Только иммобилизированная на CA9 бивалентная/биспецифичная антиген-связывающая молекула xi155D5/xi1-55-2 была способная связываться также с эндосиалином/TEM-1 человека, на что указывает дополнительное наблюдаемое смещение кривой ответа (Фигура 20, двойная стрелка). Анализ с использованием поверхностного плазмонного резонанса показал, что аффинность последовательности xi155D5/xi1-55-2 в отношении CA9 или TEM-1 была такой же или незначительно снижалась соответственно (Таблица 22).
[0323] Описанные результаты демонстрируют, что: 1) mAb, содержащее мотив C-X-X-(not)F, можно конъюгировать с полипептидами, такими как фрагмент антитела или Fab-фрагмент; и 2) при независимой конъюгации двух mAb или Fab-фрагментов с различной специфичностью, содержащих мотив C-X-X-(not)F, может быть получено бивалентное/биспецифичное соединение.
Таблица 22. Аффинность бивалентной/биспецифичной антиген-связывающей молекулы xi155D5/xi1-55-2 в отношении CA9 и TEM-1
Пример 6 - Создание конъюгатов антитело-пептид
[0324] mAb xi33O11 и xi1-55-2, содержащие мотив C-X-X-A, конъюгировали с азид-модифицированным пептидом Aβ(1-16) (SEQ ID NO:40) (Таблица 23).
Таблица 23.Последовательность пептида Aβ(1-16)
[0325] Конъюгирование пептида Aβ(1-16) с Cys80 осуществляли с применением двухэтапной процедуры конъюгации, при которой Cys80 сначала конъюгировали с малеимид-дибензилциклооктином (mal-DBCO). Азид-модифицированный пептид Aβ(1-16) затем конъюгировали с DBCO-модифицированными mAb с применением облегченных напряжением реакции клик-химии без применения соединений меди. Вкратце, mAb (20 мг) инкубировали с mal-DBCO (Click Chemistry Tools, cat A108) в молярном отношении мал-DBCO:MAb 5:1 в течение 16 часов при 22°C в 1x DPBS. Не включившийся в конъюгат mal-DBCO отделяли от конъюгированных mAb с помощью хроматографии с обессоливанием с применением колонки HiPrep 26/10 с использованием 1x DPBS в качестве электродного буфера. Для обоих mAb подтверждали 100%-ную эффективность конъюгации (без признаков наличия неконъюгированной легкой цепи) с помощью ЖХ-МС (Фигура 21 и Таблица 24). Каждое mAb (50 мкл каждого mAb, 95 мкг и 70 мкг последовательности xi1-55-2 и xi33O11 соответственно) инкубировали с пептидом Aβ(1-16) в молярном отношении пептид:MAb 20:1 в 1X DPBS в течение 16 часов при 22°C. Конъюгаты анализировали с помощью электрофореза в ПААГ в присутствии ДСН. Образцы подвергали электрофоретическому анализу при восстанавливающих условиях с использованием 20 мМ ДТТ в качестве восстанавливающего агента и при нагреве до 75°C в течение 10 мин до разделения.
[0326] Анализ с помощью электрофореза в ПААГ в присутствии ДСН показал снижение подвижности конъюгированной с пептидом легкой цепи, которое сопровождалось отсутствием выявляемой неконъюгированный легкой цепи, что указывает на эффективное конъюгирование (Фигура 21). Не наблюдали изменений в подвижности тяжелой цепи. Конъюгаты затем обессоливали с применением спин-колонок для обессоливания (0,5 мл, Zeba 40k MWCO, Thermo-Fisher) для удаления неконъюгированного пептида и анализировали с помощью ЖХ-МС. Масс-спектрометрический анализ показал (Фигура 22A-F), что эффективность конъюгации пептида с последовательностями легких цепей xi1-55-2 и xi33O11 составляла 85%-100% (Таблица 24).
[0327] Описанные результаты показали, что mAb, содержащее мотив C-X-X-(not)F, K или C, можно эффективно конъюгировать с пептидами.
Таблица 24. Обобщенные результаты конъюгации
Таблица 25. Моноклональные антитела и соответствующие легкие цепи (LC) и тяжелые цепи (HC)
Таблица 26. Последовательности
Таблица 27. CDR-последовательности
[0328] Специалистам в данной области техники будет очевидно, что возможно множество изменений и модификаций предпочтительных вариантов реализации изобретения и что такие изменения и модификации можно осуществлять в пределах сущности настоящего изобретения. Таким образом, предполагается, что прилагаемая формула изобретения включает все такие эквивалентные варианты в пределах реального объема и сущности настоящего изобретения.
ВАРИАНТЫ РЕАЛИЗАЦИИ
Cледующий далее перечень вариантов реализации приведен в качестве дополнения и не изменяет или не замещает предыдущее описание.
Вариант реализации 1. Способ получения конъюгированного иммуноглобулина, включающий:
декэпирование цистеина в положении аминокислоты 80 («Cys80») в вариабельной области легкой цепи иммуноглобулина, происходящего от кролика, где указанный иммуноглобулин содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи; и
конъюгирование реагирующего с тиолом соединения с Cys80, где указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
Вариант реализации 2. Способ согласно варианту реализации изобретения 1, отличающийся тем, что указанная вариабельная область легкой цепи представляет собой вариабельную область легкой каппа-цепи.
Вариант реализации 3. Способ согласно варианту реализации изобретения 1 или 2, отличающийся тем, что указанная вариабельная область легкой цепи происходит из кролика вида Oryctolagus cuniculus.
Вариант реализации 4. Способ согласно варианту реализации 1 или 2, отличающийся тем, что указанная вариабельная область легкой цепи представляет собой вариабельную область легкой каппа-цепи семейства IGKV-1 человека.
Вариант реализации 5. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что декэпирование включает инкубирование иммуноглобулина с восстанавливающим буфером с последующим инкубированием указанного иммуноглобулина с окисляющим буфером.
Вариант реализации 6. Способ согласно варианту реализации 5, дополнительно включающий осуществление иммобилизации иммуноглобулина на подложке перед этапом инкубирования с восстанавливающим буфером и элюирование указанного иммуноглобулина из подложки после инкубирования с окисляющим буфером.
Вариант реализации 7. Способ согласно варианту реализации 6, отличающийся тем, что подложка содержит белок A.
Вариант реализации 8. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что способная реагировать с тиолом группа представляет собой малеимид или галогенацетил.
Вариант реализации 9. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что способная реагировать с тиолом группа присоединена к линкеру.
Вариант реализации 10. Способ согласно варианту реализации 9, отличающийся тем, что линкер представляет собой нерасщепляемый линкер или расщепляемый линкер.
Вариант реализации 11. Способ согласно варианту реализации 10, отличающийся тем, что линкер представляет собой содержащий дисульфид линкер, линкер на основе ацеталя или линкер на основе кеталя.
Вариант реализации 12. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что реагирующее с тиолом соединение присоединено к функциональному агенту.
Вариант реализации 13. Способ согласно варианту реализации 12, отличающийся тем, что функциональный агент содержит флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственное средство.
Вариант реализации 14. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что реагирующее с тиолом соединение связано со вторым способным реагировать с тиолом соединением, где указанное второе реагирующее с тиолом соединение связано со вторым иммуноглобулином, содержащим вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении аминокислоты 80 («Cys802») и где указанное второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу, связанную с Cys802.
Вариант реализации 15. Способ согласно варианту реализации 14, отличающийся тем, что реагирующее с тиолом соединение связывается со вторым способным реагировать с тиолом соединением с помощью реакций клик-химии.
Вариант реализации 16. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что Cys80 является неспаренным.
Вариант реализации 17. Способ согласно любому из предыдущих вариантов реализации, отличающийся тем, что иммуноглобулин представляет собой гибридизованный иммуноглобулин.
Вариант реализации 18. Способ согласно любому из вариантов реализации 1-16, дополнительно включающий гибридизацию иммуноглобулина до этапа декэпирования.
Вариант реализации 19. Способ согласно любому из вариантов реализации 1-16, отличающийся тем, что иммуноглобулин представляет собой гуманизированный иммуноглобулин.
Вариант реализации 20. Способ согласно любому из вариантов реализации 1-16, дополнительно включающий гуманизацию иммуноглобулина.
Вариант реализации 21. Способ согласно любому из предыдущих вариантов реализации, дополнительно включающий замену аминокислотного остатка в положении 83 на аминокислотный остаток, отличный от Phe, Lys или Cys.
Вариант реализации 22. Способ согласно варианту реализации 21, отличающийся тем, что аминокислотный остаток, отличный от Phe, Lys или Cys, представляет собой полярный или гидрофобный остаток.
Вариант реализации 23. Способ создания антиген-связывающей молекулы, включающий инкубирование первого конъюгированного иммуноглобулина со вторым конъюгированным иммуноглобулином для получения указанной антиген-связывающей молекулы, где:
первый конъюгированный иммуноглобулин содержит первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым способным реагировать с тиолом соединением, содержащим первую способную реагировать с тиолом группу; и
второй конъюгированный иммуноглобулин содержит вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым способным реагировать с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
Вариант реализации 24. Способ согласно варианту реализации 23, отличающийся тем, что Cys801, Cys802 или Cys801и Cys802 являются неспаренными.
Вариант реализации 25. Способ согласно варианту реализации 23 или 24, до этапа инкубирования дополнительно включающий
декэпирование Cys801, Cys802 или Cys801 и Cys802 и
конъюгирование первого реагирующего с тиолом соединения с Cys801, второго реагирующего с тиолом соединения с Cys802 или первого реагирующего с тиолом соединения с Cys801 и второго реагирующего с тиолом соединения с Cys802, где первое реагирующее с тиолом соединение содержит первую способную реагировать с тиолом группу и второе реагирующее с тиолом соединение содержит вторую способную реагировать с тиолом группу.
Вариант реализации 26. Способ согласно любому из вариантов реализации 23-25, отличающийся тем, что декэпирование включает инкубирование первого иммуноглобулина, второго иммуноглобулина или первого иммуноглобулина и второго иммуноглобулина с восстанавливающим буфером с последующим инкубированием первого иммуноглобулина, второго иммуноглобулина или первого иммуноглобулина и второго иммуноглобулина с окисляющим буфером.
Вариант реализации 27. Способ согласно варианту реализации 26, дополнительно включающий иммобилизацию первого иммуноглобулина, второго иммуноглобулина или первого иммуноглобулина и второго иммуноглобулина на подложке до этапа инкубирования с восстанавливающим буфером и элюирование указанного первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина из подложки после инкубирования с окисляющим буфером.
Вариант реализации 28. Способ согласно варианту реализации 27, отличающийся тем, что подложка содержит белок A.
Вариант реализации 29. Способ согласно любому из вариантов реализации 23-28, отличающийся тем, что первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин являются гибридизованными.
Вариант реализации 30. Способ согласно любому из вариантов реализации 23-28, дополнительно включающий гибридизацию первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина до этапа декэпирования.
Вариант реализации 31. Способ согласно любому из вариантов реализации 23-28, отличающийся тем, что первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин являются гуманизированными.
Вариант реализации 32. Способ согласно любому из вариантов реализации 23-28, дополнительно включающий гуманизацию первого иммуноглобулина, второго иммуноглобулина или первого и второго иммуноглобулина.
Вариант реализации 33. Способ согласно любому из вариантов реализации 23-32, отличающийся тем, что первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа представляют собой малеимид или галогенацетил.
Вариант реализации 34. Способ согласно любому из вариантов реализации 23-33, отличающийся тем, что первое реагирующее с тиолом соединение присоединено к первому линкеру, второе реагирующее с тиолом соединение присоединено ко второму линкеру или первое реагирующее с тиолом соединение присоединено к первому линкеру и второе реагирующее с тиолом соединение присоединено ко второму линкеру.
Вариант реализации 35. Способ согласно варианту реализации 34, отличающийся тем, что первый линкер, второй линкер или первый и второй линкер представляют собой нерасщепляемый линкер или расщепляемый линкер.
Вариант реализации 36. Способ согласно варианту реализации 35, отличающийся тем, что первый линкер, второй линкер или первый и второй линкер представляют собой содержащий дисульфид линкер, линкер на основе ацеталя или линкер на основе кеталя.
Вариант реализации 37. Способ согласно любому из вариантов реализации 23-36, отличающийся тем, что первое реагирующее с тиолом соединение дополнительно содержит первый функциональный агент, второе реагирующее с тиолом соединение дополнительно содержит второй функциональный агент или первое реагирующее с тиолом соединение дополнительно содержит первый функциональный агент и второе реагирующее с тиолом соединение дополнительно содержит второй функциональный агент.
Вариант реализации 38. Способ согласно варианту реализации 37, отличающийся тем, что первый функциональный агент, второй функциональный агент или первый и второй функциональный агент представляют собой химический линкер.
Вариант реализации 39. Способ согласно варианту реализации 38, отличающийся тем, что первое реагирующее с тиолом соединение представляет собой малеимид-ПЭГ4-азид или малеимид-ПЭГ4-дибензоциклооктин.
Вариант реализации 40. Способ согласно варианту реализации 38 или 39, отличающийся тем, что второе реагирующее с тиолом соединение представляет собой малеимид-ПЭГ4-дибензоциклооктин или малеимид-ПЭГ4-азид.
Вариант реализации 41. Способ согласно любому из вариантов реализации 23-40, отличающийся тем, что первый иммуноглобулин и второй иммуноглобулин конъюгированы друг с другом с помощью реакций клик-химии.
Вариант реализации 42. Способ согласно любому из вариантов реализации 23-41, отличающийся тем, что первый иммуноглобулин представляет собой первый Fab-фрагмент, второй иммуноглобулин представляет собой второй Fab-фрагмент или первый иммуноглобулин представляет собой первый Fab-фрагмент и второй иммуноглобулин представляет собой второй Fab-фрагмент.
Вариант реализации 43. Способ согласно любому из вариантов реализации 23-42, дополнительно включающий замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys, замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys, или замену аминокислотного остатка в положении 83 первой вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys, и замену аминокислотного остатка в положении 83 второй вариабельной области легкой цепи на аминокислотный остаток, отличный от Phe, Lys или Cys.
Вариант реализации 44. Способ согласно варианту реализации 43, отличающийся тем, что аминокислотный остаток, отличный от Phe, Lys или Cys, представляет собой полярный или гидрофобный остаток.
Вариант реализации 45. Способ согласно любому из вариантов реализации 23-44, отличающийся тем, что первая вариабельная область легкой цепи, вторая вариабельная область легкой цепи или первая и вторая вариабельная область легкой цепи происходят из кролика вида Oryctolagus cuniculus.
Вариант реализации 46. Антиген-связывающая молекула, полученная в соответствии со способом согласно любому из вариантов реализации 23-45.
Вариант реализации 47. Иммуноглобулин, содержащий вариабельную область тяжелой цепи и вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит цистеин в положении 80 («Cys80») и аминокислоту в положении 83, отличную от Phe, Lys или Cys.
Вариант реализации 48. Иммуноглобулин согласно варианту реализации 47, отличающийся тем, что указанная вариабельная область легкой цепи представляет собой вариабельную область легкой каппа-цепи.
Вариант реализации 49. Иммуноглобулин согласно варианту реализации 47 или 48, отличающийся тем, что указанная вариабельная область легкой цепи происходит из кролика вида Oryctolagus cuniculus.
Вариант реализации 50. Иммуноглобулин согласно любому из вариантов реализации 47-49, отличающийся тем, что аминокислота, отличная от Phe, Lys или Cys, представляет собой полярную или гидрофобную аминокислоту.
Вариант реализации 51. Иммуноглобулин согласно любому из вариантов реализации 47-50, отличающийся тем, что Cys80 является неспаренным.
Вариант реализации 52. Иммуноглобулин согласно любому из вариантов реализации 47-51, отличающийся тем, что Cys80 декэпирован.
Вариант реализации 53. Иммуноглобулин согласно любому из вариантов реализации 47-52, отличающийся тем, что указанный иммуноглобулин является гибридизованным.
Вариант реализации 54. Иммуноглобулин согласно любому из вариантов реализации 47-53, отличающийся тем, что указанный иммуноглобулин является гуманизированным.
Вариант реализации 55. Иммуноглобулин согласно любому из вариантов реализации 47-54, отличающийся тем, что указанный иммуноглобулин иммуноспецифично связывается с белком CA9 человека.
Вариант реализации 56. Иммуноглобулин согласно варианту реализации 55, содержащий:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-141 последовательности xi155D5HC (SEQ ID NO:52), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi155D5LC (SEQ ID NO:78);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-144 последовательности zu155D5HC (SEQ ID NO:54), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu155D5LC-3 (SEQ ID NO:84), zu155D5LC-4 (SEQ ID NO:86), zu155D5LC-5 (SEQ ID NO:88), zu155D5LC-6 (SEQ ID NO:90), zu155D5LC-7 (SEQ ID NO:92), zu155D5LC-huVK2-40 (SEQ ID NO:96), zu155D5LC-huVK4-1 (SEQ ID NO:100), zu155D5LC-huVK6-21 (SEQ ID NO:102), zu155D5LC-huVK6D-41 (SEQ ID NO:104) или zu155D5LC-huVK7-3-Glu81 (SEQ ID NO:106);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-138 последовательности xi1E4HC (SEQ ID NO:58), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi1E4LC (SEQ ID NO:110);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-140 последовательности zu1E4HC (SEQ ID NO:60), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu1E4LC-CXXA (SEQ ID NO:114);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi166B3HC (SEQ ID NO:74), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности xi166B3LC (SEQ ID NO:132); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu166B3HC (SEQ ID NO:76), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-130 последовательности zu166B3LC-CXXA (SEQ ID NO:136).
Вариант реализации 57. Иммуноглобулин согласно варианту реализации 56, содержащий:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi155D5HC, представленные как SEQ ID NO:146, 148 и 150 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi155D5LC, представленные как SEQ ID NO:224, 226 и 228 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu155D5HC, представленные как SEQ ID NO:152, 154 и 156 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu155D5LC-3, представленные как SEQ ID NO:242, 244 и 246 соответственно, легкой цепи последовательности zu155D5LC-4, представленные как SEQ ID NO:248, 250 и 252 соответственно, легкой цепи последовательности zu155D5LC-5, представленные как SEQ ID NO:254, 256 и 258 соответственно, легкой цепи последовательности zu155D5LC-6, представленные как SEQ ID NO:260, 262 и 264 соответственно, легкой цепи последовательности zu155D5LC-7, представленные как SEQ ID NO:266, 268 и 270 соответственно, легкой цепи последовательности zu155D5LC-huVK2-40, представленные как SEQ ID NO 278, 280 и 282 соответственно, легкой цепи последовательности zu155D5LC-huVK4-1, представленные как SEQ ID NO 290, 292 и 294 соответственно, легкой цепи последовательности zu155D5LC-huVK6-21, представленные как SEQ ID NO 296, 298 и 300 соответственно, легкой цепи последовательности zu155D5LC-huVK6D-41, представленные как SEQ ID NO 302, 304 и 306 соответственно, или легкой цепи последовательности zu155D5LC-huVK7-3-Glu81, представленные как SEQ ID NO 308, 310 и 312 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1E4HC, представленные как SEQ ID NO:164, 166 и 168 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1E4LC, представленные как SEQ ID NO:320, 322 и 324 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu1E4HC, представленные как SEQ ID NO:170, 172 и 174 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu1E4LC-CXXA, представленные как SEQ ID NO:332, 334 и 336 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi166B3HC, представленные как SEQ ID NO:212, 214 и 216 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi166B3LC, представленные как SEQ ID NO:386, 388 и 390 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu166B3HC, представленные как SEQ ID NO:218, 220 и 222 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu166B3LC-CXXA, представленные как SEQ ID NO:398, 400 и 402 соответственно.
Вариант реализации 58. Иммуноглобулин согласно любому из вариантов реализации 46-54, отличающийся тем, что указанный иммуноглобулин иммуноспецифично связывается с беком TEM1 человека.
Вариант реализации 59. Иммуноглобулин согласно варианту реализации 58, содержащий:
вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-139 последовательности xi1-55-2HC (SEQ ID NO:56), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-129 последовательности xi1-55-2LC (SEQ ID NO:108).
Вариант реализации 60. Иммуноглобулин согласно варианту реализации 59, содержащий:
участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi1-55-2HC, представленные как SEQ ID NO:158, 160 и 162 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi1-55-2LC, представленные как SEQ ID NO:314, 316 и 318 соответственно.
Вариант реализации 61. Иммуноглобулин согласно любому из вариантов реализации 46-54, отличающийся тем, что указанный иммуноглобулин иммуноспецифичным образом связывается с мезотелином человека.
Вариант реализации 62. Иммуноглобулин согласно варианту реализации 61, содержащий:
a. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-142 последовательности xi33O11HC (SEQ ID NO:62), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности xi33O11LC (SEQ ID NO:116);
b. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-145 последовательности zu33O11HC (SEQ ID NO:64), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-131 последовательности zu33O11LC-CXXA (SEQ ID NO:120) или zu33O11LC-CXXI (SEQ ID NO:122);
c. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi324O5HC (SEQ ID NO:66), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi324O5LC (SEQ ID NO:124);
d. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi178F16HC (SEQ ID NO:68), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi178F16LC (SEQ ID NO:126);
e. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-132 последовательности xi237N18HC (SEQ ID NO:70), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi237N18LC (SEQ ID NO:128); или
f. вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-137 последовательности xi383I18HC (SEQ ID NO:72), и вариабельную область легкой цепи, имеющую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 20-127 последовательности xi383I18LC (SEQ ID NO:130).
Вариант реализации 63. Иммуноглобулин согласно варианту реализации 62, содержащий:
a. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi33O11HC, представленные как SEQ ID NO: 176, 178 и 180 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi33O11LC, представленные как SEQ ID NO:338, 340 и 342 соответственно;
b. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности zu33O11HC, представленные как SEQ ID NO:182, 184 и 186 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности zu33O11LC-CXXA, представленные как SEQ ID NO:350, 352 и 354 соответственно или zu33O11LC-CXXI, представленные как SEQ ID NO:356, 358 и 360 соответственно;
c. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi324O5HC, представленные как SEQ ID NO:188, 190 и 192 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi324O5LC, представленные как SEQ ID NO:362, 364 и 366 соответственно;
d. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi178F16HC, представленные как SEQ ID NO:194, 196 и 198 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi178F16LC, представленные как SEQ ID NO:368, 370 и 372 соответственно;
e. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi237N18HC, представленные как SEQ ID NO:200, 202 и 204 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi237N18LC, представленные как SEQ ID NO:374, 376 и 378 соответственно; или
f. участки CDR1, CDR2 и CDR3 тяжелой цепи последовательности xi383I18HC, представленные как SEQ ID NO:206, 208 и 210 соответственно, и участки CDR1, CDR2 и CDR3 легкой цепи последовательности xi383I18LC, представленные как SEQ ID NO:380, 382 и 384 соответственно.
Вариант реализации 64. Конъюгированный иммуноглобулин, содержащий:
иммуноглобулин согласно любому из вариантов реализации 46-63, где цистеин в положении 80 конъюгирован с способным реагировать с тиолом соединением и указанное реагирующее с тиолом соединение содержит способную реагировать с тиолом группу.
Вариант реализации 65. Конъюгированный иммуноглобулин согласно варианту реализации 64, отличающийся тем, что способная реагировать с тиолом группа представляет собой малеимид или галогенацетил.
Вариант реализации 66. Конъюгированный иммуноглобулин согласно варианту реализации 64 или 65, отличающийся тем, что способная реагировать с тиолом группа присоединена к линкеру.
Вариант реализации 67. Конъюгированный иммуноглобулин согласно варианту реализации 66, отличающийся тем, что линкер представляет собой нерасщепляемый линкер или расщепляемый линкер.
Вариант реализации 68. Конъюгированный иммуноглобулин согласно варианту реализации 67, отличающийся тем, что линкер представляет собой содержащий дисульфид линкер, линкер на основе ацеталя или линкер на основе кеталя.
Вариант реализации 69. Конъюгированный иммуноглобулин согласно любому из вариантов реализации 64-68, отличающийся тем, что реагирующее с тиолом соединение дополнительно содержит функциональный агент.
Вариант реализации 70. Конъюгированный иммуноглобулин согласно варианту реализации 69, отличающийся тем, что функциональный агент содержит флуорофор, флуоресцентный краситель, полипептид, иммуноглобулин, антибиотик, нуклеиновую кислоту, радионуклид, химический линкер, малую молекулу, хелатор, липид или лекарственное средство.
Вариант реализации 71. Конъюгированный иммуноглобулин согласно варианту реализации 70, отличающийся тем, что функциональный агент представляет собой ауристатин F.
Вариант реализации 72. Конъюгированный иммуноглобулин согласно любому из вариантов реализации 69-71, отличающийся тем, что соотношение иммуноглобулин:функциональный агент в указанном конъюгированном иммуноглобулине составляет 2:1.
Вариант реализации 73. Способ лечения рака у субъекта, включающий введение указанному субъекту фармацевтически эффективного количества конъюгированного иммуноглобулина против мезотелина, где указанный конъюгированный иммуноглобулин против мезотелина содержит:
иммуноглобулин согласно любому из вариантов реализации 61-63 и
реагирующее с тиолом соединение, содержащее способную реагировать с тиолом группу, линкер и функциональный агент.
Вариант реализации 74. Способ согласно варианту реализации 73, отличающийся тем, что функциональный агент представляет собой ауристатин F.
Вариант реализации 75. Способ согласно варианту реализации 73 или 74, отличающийся тем, что рак представляет собой мезотелин-экспрессирующий рак.
Вариант реализации 76. Антиген-связывающая молекула, содержащая:
первый конъюгированный иммуноглобулин, содержащий первую вариабельную область тяжелой цепи и первую вариабельную область легкой цепи, где указанная первая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys801») и указанный Cys801 конъюгирован с первым способным реагировать с тиолом соединением, содержащим первую способную реагировать с тиолом группу, и
второй конъюгированные иммуноглобулин, содержащий вторую вариабельную область тяжелой цепи и вторую вариабельную область легкой цепи, где указанная вторая вариабельная область легкой цепи содержит цистеин в положении 80 («Cys802») и указанный Cys802 конъюгирован со вторым способным реагировать с тиолом соединением, содержащим вторую способную реагировать с тиолом группу.
Вариант реализации 77. Антиген-связывающая молекула согласно варианту реализации 76, отличающаяся тем, что первая вариабельная область легкой цепи, вторая вариабельная область легкой цепи или первая и вторая вариабельная область легкой цепи происходят из кролика вида Oryctolagus cuniculus.
Вариант реализации 78. Антиген-связывающая молекула согласно варианту реализации 76 или 77, отличающаяся тем, что Cys801, Cys802 или Cys801 и Cys802 являются неспаренными.
Вариант реализации 79. Антиген-связывающая молекула согласно любому из вариантов реализации 76-78, отличающаяся тем, что первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин являются гибридизованными.
Вариант реализации 80. Антиген-связывающая молекула согласно любому из вариантов реализации 76-78, отличающаяся тем, что первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин являются гуманизированными.
Вариант реализации 81. Антиген-связывающая молекула согласно любому из вариантов реализации 76-80, отличающаяся тем, что аминокислотный остаток в положении 83 первого иммуноглобулина, аминокислотный остаток в положении 83 второго иммуноглобулина или аминокислотный остаток в положении 83 первого иммуноглобулина и аминокислотный остаток в положении 83 второго иммуноглобулина представляют собой аминокислотные остатки, отличные от Phe, Lys или Cys.
Вариант реализации 82. Антиген-связывающая молекула согласно варианту реализации 81, отличающаяся тем, что аминокислотный остаток, отличный от Phe, Lys или Cys, представляет собой полярный или гидрофобный остаток.
Вариант реализации 83. Антиген-связывающая молекула согласно любому из вариантов реализации 76-82, отличающаяся тем, что первый иммуноглобулин и второй иммуноглобулин связываются с различными антигенами.
Вариант реализации 84. Антиген-связывающая молекула согласно любому из вариантов реализации 76-83, отличающаяся тем, что первая способная реагировать с тиолом группа, вторая способная реагировать с тиолом группа или первая и вторая способная реагировать с тиолом группа представляют собой малеимид или галогенацетил.
Вариант реализации 85. Антиген-связывающая молекула согласно любому из вариантов реализации 76-84, отличающаяся тем, что первое реагирующее с тиолом соединение дополнительно содержит первый линкер, второе реагирующее с тиолом соединение дополнительно содержит второй линкер, или первое реагирующее с тиолом соединение дополнительно содержит первый линкер и второе реагирующее с тиолом соединение дополнительно содержит второй линкер.
Вариант реализации 86. Антиген-связывающая молекула согласно варианту реализации 85, отличающаяся тем, что первый линкер, второй линкер или первый и второй линкер представляют собой расщепляемые линкеры или нерасщепляемые линкеры.
Вариант реализации 87. Антиген-связывающая молекула согласно варианту реализации 86, отличающаяся тем, что первый линкер, второй линкер или первый и второй линкер представляют собой содержащий дисульфид линкер, линкер на основе ацеталя или линкер на основе кеталя.
Вариант реализации 88. Антиген-связывающая молекула согласно любому из вариантов реализации 76-87, отличающаяся тем, что первое реагирующее с тиолом соединение дополнительно содержит первый функциональный агент, второе реагирующее с тиолом соединение дополнительно содержит второй функциональный агент или первое реагирующее с тиолом соединение дополнительно содержит первый функциональный агент и второе реагирующее с тиолом соединение дополнительно содержит второй функциональный агент.
Вариант реализации 89. Антиген-связывающая молекула согласно варианту реализации 88, отличающаяся тем, что первый функциональный агент, второй функциональный агент или первый и второй функциональный агент представляют собой химический линкер.
Вариант реализации 90. Антиген-связывающая молекула согласно любому из вариантов реализации 76-89, отличающаяся тем, что первое реагирующее с тиолом соединение, второе реагирующее с тиолом соединение или первое и второе реагирующее с тиолом соединение представляют собой малеимид-ПЭГ4-азид или малеимид-ПЭГ4-дибензоциклооктин.
Вариант реализации 91. Антиген-связывающая молекула согласно любому из вариантов реализации 76-90, отличающаяся тем, что первое реагирующее с тиолом соединение отличается от второго реагирующего с тиолом соединения.
Вариант реализации 92. Антиген-связывающая молекула согласно любому из вариантов реализации 76-91, отличающаяся тем, что первый иммуноглобулин, второй иммуноглобулин или первый и второй иммуноглобулин представляют собой Fab-фрагменты.
Вариант реализации 93. Вариабельная область легкой цепи для применения в конъюгированном иммуноглобулине, где указанная вариабельная область легкой цепи содержит цистеин в положении аминокислоты 80 («Cys80») и аминокислотный остаток, отличный от Phe, Lys или Cys, в положении аминокислоты 83, где указанный Cys80 является неспаренным.
Вариант реализации 94. Вариабельная область легкой цепи согласно варианту реализации 93, где указанная вариабельная область легкой цепи содержит мотив Cys80-Xaa1-Xaa2-Xaa3, где Xaa3 представляет собой любую аминокислоту, отличную от Phe, Lys или Cys.
Вариант реализации 95. Вариабельная область легкой цепи согласно варианту реализации 93 или 94, где указанная вариабельная область легкой цепи происходит из кролика вида Oryctolagus cuniculus.
Вариант реализации 96. Вариабельная область легкой цепи согласно любому из вариантов реализации 93-95, где указанная вариабельная область легкой цепи является гибридизованной.
Вариант реализации 97. Вариабельная область легкой цепи согласно любому из вариантов реализации 93-95, где указанная вариабельная область легкой цепи является гуманизированной.
Вариант реализации 98. Молекула нуклеиновой кислоты, кодирующая иммуноглобулин согласно любому из вариантов реализации 47-63.
Вариант реализации 99. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты согласно варианту реализации 98.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MORPHOTEK, INC.
<120> КОНЪЮГИРОВАННЫЕ ЧЕРЕЗ CYS80 ИММУНОГЛОБУЛИНЫ
<130> 104018.000953
<140>
<141>
<150> 62/182,020
<151> 2015-06-19
<160> 491
<170> PatentIn version 3.5
<210> 1
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный праймер"
<400> 1
gatcaagctt gccgccacca tgggctggtc ctgcatcatc ctgtttctgg tggcggccgc 60
caccggcgtg cactcc 76
<210> 2
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 2
gtgcctttgg ctggcctgar gagayggtga ccagggtgcc 40
<210> 3
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 3
gatcaagctt gccgccacca tgggctggtc ctgcatcatc ctgtttctgg tggcggccgc 60
caccggcgtg cactcc 76
<210> 4
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 4
gatcggcgcg cctcacttgc cggggctccg g 31
<210> 5
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 5
gccaccggcg tgcactccca gtcggtgrag gagtccrggg g 41
<210> 6
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 6
gggcccttgg tggatgctga rgagayggtg accagggtgc c 41
<210> 7
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 7
gccaccggcg tgcactccga gctcgtgatg acccagactc ca 42
<210> 8
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 8
agccacagtt cgtttgacsa ccacctcggt ccc 33
<210> 9
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 9
cagtcgctgc tcgagtccgg gggt 24
<210> 10
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 10
ctctggcaca ggagctc 17
<210> 11
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 11
ggagacgagc gggtacagag t 21
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 12
cgtgggcttg ctgcatgtcg 20
<210> 13
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 13
gtgatgaccc agactcca 18
<210> 14
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 14
acagtcaccc ctattgaagc tctgg 25
<210> 15
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 15
gcagtcaccc ctgttgaagc tctg 24
<210> 16
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 16
gccaccggcg tgcactccca gtcggtgrag gagtccrggg g 41
<210> 17
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 17
gggcccttgg tggatgctga rgagayggtg accagggtgc c 41
<210> 18
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 18
gccaccggcg tgcactccga gctcgtgatg acccagactc ca 42
<210> 19
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 19
agccacagtt cgtttgatct ccagctcggt ccc 33
<210> 20
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 20
agccacagtt cgtttgattt ccacattggt gcc 33
<210> 21
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
праймер"
<400> 21
agccacagtt cgtttgacsa ccacctcggt ccc 33
<210> 22
<211> 14
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 22
Asp Cys Thr Tyr Asn Leu Ser Ser Thr Leu Ser Leu Thr Lys
1 5 10
<210> 23
<211> 11
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 23
Phe Thr Leu Thr Ile Thr Gly Val Gln Cys Asp
1 5 10
<210> 24
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 24
Phe Thr Leu Thr Ile Thr Gly Val Gln Cys
1 5 10
<210> 25
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 25
Thr Leu Thr Ile Thr Gly Val Gln Cys
1 5
<210> 26
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 26
Leu Thr Ile Thr Gly Val Gln Cys
1 5
<210> 27
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 27
Thr Ile Thr Gly Val Gln Cys
1 5
<210> 28
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 28
Ile Thr Gly Val Gln Cys
1 5
<210> 29
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 29
Thr Gly Val Gln Cys
1 5
<210> 30
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 30
Gly Val Gln Cys
1
<210> 31
<211> 2
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 31
Gln Cys
1
<210> 32
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 33
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 33
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 34
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 34
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Cys Asp Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 35
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 35
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 36
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Thr Cys
20
<210> 37
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 37
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr
1 5 10 15
Leu Thr Ile Thr Gly Val Gln Cys Asp Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 38
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 38
Phe Gly Gly Gly Thr Glu Leu Glu Ile Lys
1 5 10
<210> 39
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 39
Gly Val Pro Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Glu Phe Thr
1 5 10 15
Leu Thr Ile Thr Gly Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 40
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 40
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
<210> 41
<211> 2274
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 41
atgctgctgc gcctgttgct ggcctgggcg gccgcagggc ccacactggg ccaggacccc 60
tgggctgctg agccccgtgc cgcctgcggc cccagcagct gctacgctct cttcccacgg 120
cgccgcacct tcctggaggc ctggcgggcc tgccgcgagc tggggggcga cctggccact 180
cctcggaccc ccgaggaggc ccagcgtgtg gacagcctgg tgggtgcggg cccagccagc 240
cggctgctgt ggatcgggct gcagcggcag gcccggcaat gccagctgca gcgcccactg 300
cgcggcttca cgtggaccac aggggaccag gacacggctt tcaccaactg ggcccagcca 360
gcctctggag gcccctgccc ggcccagcgc tgtgtggccc tggaggcaag tggcgagcac 420
cgctggctgg agggctcgtg cacgctggct gtcgacggct acctgtgcca gtttggcttc 480
gagggcgcct gcccggcgct gcaagatgag gcgggccagg ccggcccagc cgtgtatacc 540
acgcccttcc acctggtctc cacagagttt gagtggctgc ccttcggctc tgtggccgct 600
gtgcagtgcc aggctggcag gggagcctct ctgctctgcg tgaagcagcc tgagggaggt 660
gtgggctggt cacgggctgg gcccctgtgc ctggggactg gctgcagccc tgacaacggg 720
ggctgcgaac acgaatgtgt ggaggaggtg gatggtcacg tgtcctgccg ctgcactgag 780
ggcttccggc tggcagcaga cgggcgcagt tgcgaggacc cctgtgccca ggctccgtgc 840
gagcagcagt gtgagcccgg tgggccacaa ggctacagct gccactgtcg cctgggtttc 900
cggccagcgg aggatgatcc gcaccgctgt gtggacacag atgagtgcca gattgccggt 960
gtgtgccagc agatgtgtgt caactacgtt ggtggcttcg agtgttattg tagcgaggga 1020
catgagctgg aggctgatgg catcagctgc agccctgcag gggccatggg tgcccaggct 1080
tcccaggacc tcggagatga gttgctggat gacggggagg atgaggaaga tgaagacgag 1140
gcctggaagg ccttcaacgg tggctggacg gagatgcctg ggatcctgtg gatggagcct 1200
acgcagccgc ctgactttgc cctggcctat agaccgagct tcccagagga cagagagcca 1260
cagataccct acccggagcc cacctggcca cccccgctca gtgcccccag ggtcccctac 1320
cactcctcag tgctctccgt cacccggcct gtggtggtct ctgccacgca tcccacactg 1380
ccttctgccc accagcctcc tgtgatccct gccacacacc cagctttgtc ccgtgaccac 1440
cagatccccg tgatcgcagc caactatcca gatctgcctt ctgcctacca acccggtatt 1500
ctctctgtct ctcattcagc acagcctcct gcccaccagc cccctatgat ctcaaccaaa 1560
tatccggagc tcttccctgc ccaccagtcc cccatgtttc cagacacccg ggtcgctggc 1620
acccagacca ccactcattt gcctggaatc ccacctaacc atgcccctct ggtcaccacc 1680
ctcggtgccc agctaccccc tcaagcccca gatgcccttg tcctcagaac ccaggccacc 1740
cagcttccca ttatcccaac tgcccagccc tctctgacca ccacctccag gtcccctgtg 1800
tctcctgccc atcaaatctc tgtgcctgct gccacccagc ccgcagccct ccccaccctc 1860
ctgccctctc agagccccac taaccagacc tcacccatca gccctacaca tccccattcc 1920
aaagcccccc aaatcccaag ggaagatggc cccagtccca agttggccct gtggctgccc 1980
tcaccagctc ccacagcagc cccaacagcc ctgggggagg ctggtcttgc cgagcacagc 2040
cagagggatg accggtggct gctggtggca ctcctggtgc caacgtgtgt ctttttggtg 2100
gtcctgcttg cactgggcat cgtgtactgc acccgctgtg gcccccatgc acccaacaag 2160
cgcatcactg actgctatcg ctgggtcatc catgctggga gcaagagccc aacagaaccc 2220
atgcccccca ggggcagcct cacaggggtg cagacctgca gaaccagcgt gtga 2274
<210> 42
<211> 757
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 42
Met Leu Leu Arg Leu Leu Leu Ala Trp Ala Ala Ala Gly Pro Thr Leu
1 5 10 15
Gly Gln Asp Pro Trp Ala Ala Glu Pro Arg Ala Ala Cys Gly Pro Ser
20 25 30
Ser Cys Tyr Ala Leu Phe Pro Arg Arg Arg Thr Phe Leu Glu Ala Trp
35 40 45
Arg Ala Cys Arg Glu Leu Gly Gly Asp Leu Ala Thr Pro Arg Thr Pro
50 55 60
Glu Glu Ala Gln Arg Val Asp Ser Leu Val Gly Ala Gly Pro Ala Ser
65 70 75 80
Arg Leu Leu Trp Ile Gly Leu Gln Arg Gln Ala Arg Gln Cys Gln Leu
85 90 95
Gln Arg Pro Leu Arg Gly Phe Thr Trp Thr Thr Gly Asp Gln Asp Thr
100 105 110
Ala Phe Thr Asn Trp Ala Gln Pro Ala Ser Gly Gly Pro Cys Pro Ala
115 120 125
Gln Arg Cys Val Ala Leu Glu Ala Ser Gly Glu His Arg Trp Leu Glu
130 135 140
Gly Ser Cys Thr Leu Ala Val Asp Gly Tyr Leu Cys Gln Phe Gly Phe
145 150 155 160
Glu Gly Ala Cys Pro Ala Leu Gln Asp Glu Ala Gly Gln Ala Gly Pro
165 170 175
Ala Val Tyr Thr Thr Pro Phe His Leu Val Ser Thr Glu Phe Glu Trp
180 185 190
Leu Pro Phe Gly Ser Val Ala Ala Val Gln Cys Gln Ala Gly Arg Gly
195 200 205
Ala Ser Leu Leu Cys Val Lys Gln Pro Glu Gly Gly Val Gly Trp Ser
210 215 220
Arg Ala Gly Pro Leu Cys Leu Gly Thr Gly Cys Ser Pro Asp Asn Gly
225 230 235 240
Gly Cys Glu His Glu Cys Val Glu Glu Val Asp Gly His Val Ser Cys
245 250 255
Arg Cys Thr Glu Gly Phe Arg Leu Ala Ala Asp Gly Arg Ser Cys Glu
260 265 270
Asp Pro Cys Ala Gln Ala Pro Cys Glu Gln Gln Cys Glu Pro Gly Gly
275 280 285
Pro Gln Gly Tyr Ser Cys His Cys Arg Leu Gly Phe Arg Pro Ala Glu
290 295 300
Asp Asp Pro His Arg Cys Val Asp Thr Asp Glu Cys Gln Ile Ala Gly
305 310 315 320
Val Cys Gln Gln Met Cys Val Asn Tyr Val Gly Gly Phe Glu Cys Tyr
325 330 335
Cys Ser Glu Gly His Glu Leu Glu Ala Asp Gly Ile Ser Cys Ser Pro
340 345 350
Ala Gly Ala Met Gly Ala Gln Ala Ser Gln Asp Leu Gly Asp Glu Leu
355 360 365
Leu Asp Asp Gly Glu Asp Glu Glu Asp Glu Asp Glu Ala Trp Lys Ala
370 375 380
Phe Asn Gly Gly Trp Thr Glu Met Pro Gly Ile Leu Trp Met Glu Pro
385 390 395 400
Thr Gln Pro Pro Asp Phe Ala Leu Ala Tyr Arg Pro Ser Phe Pro Glu
405 410 415
Asp Arg Glu Pro Gln Ile Pro Tyr Pro Glu Pro Thr Trp Pro Pro Pro
420 425 430
Leu Ser Ala Pro Arg Val Pro Tyr His Ser Ser Val Leu Ser Val Thr
435 440 445
Arg Pro Val Val Val Ser Ala Thr His Pro Thr Leu Pro Ser Ala His
450 455 460
Gln Pro Pro Val Ile Pro Ala Thr His Pro Ala Leu Ser Arg Asp His
465 470 475 480
Gln Ile Pro Val Ile Ala Ala Asn Tyr Pro Asp Leu Pro Ser Ala Tyr
485 490 495
Gln Pro Gly Ile Leu Ser Val Ser His Ser Ala Gln Pro Pro Ala His
500 505 510
Gln Pro Pro Met Ile Ser Thr Lys Tyr Pro Glu Leu Phe Pro Ala His
515 520 525
Gln Ser Pro Met Phe Pro Asp Thr Arg Val Ala Gly Thr Gln Thr Thr
530 535 540
Thr His Leu Pro Gly Ile Pro Pro Asn His Ala Pro Leu Val Thr Thr
545 550 555 560
Leu Gly Ala Gln Leu Pro Pro Gln Ala Pro Asp Ala Leu Val Leu Arg
565 570 575
Thr Gln Ala Thr Gln Leu Pro Ile Ile Pro Thr Ala Gln Pro Ser Leu
580 585 590
Thr Thr Thr Ser Arg Ser Pro Val Ser Pro Ala His Gln Ile Ser Val
595 600 605
Pro Ala Ala Thr Gln Pro Ala Ala Leu Pro Thr Leu Leu Pro Ser Gln
610 615 620
Ser Pro Thr Asn Gln Thr Ser Pro Ile Ser Pro Thr His Pro His Ser
625 630 635 640
Lys Ala Pro Gln Ile Pro Arg Glu Asp Gly Pro Ser Pro Lys Leu Ala
645 650 655
Leu Trp Leu Pro Ser Pro Ala Pro Thr Ala Ala Pro Thr Ala Leu Gly
660 665 670
Glu Ala Gly Leu Ala Glu His Ser Gln Arg Asp Asp Arg Trp Leu Leu
675 680 685
Val Ala Leu Leu Val Pro Thr Cys Val Phe Leu Val Val Leu Leu Ala
690 695 700
Leu Gly Ile Val Tyr Cys Thr Arg Cys Gly Pro His Ala Pro Asn Lys
705 710 715 720
Arg Ile Thr Asp Cys Tyr Arg Trp Val Ile His Ala Gly Ser Lys Ser
725 730 735
Pro Thr Glu Pro Met Pro Pro Arg Gly Ser Leu Thr Gly Val Gln Thr
740 745 750
Cys Arg Thr Ser Val
755
<210> 43
<211> 2796
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 43
atgctgctgc gcctgttgct ggcctgggcg gccgcagggc ccacactggg ccaggacccc 60
tgggctgctg agccccgtgc cgcctgcggc cccagcagct gctacgctct cttcccacgg 120
cgccgcacct tcctggaggc ctggcgggcc tgccgcgagc tggggggcga cctggccact 180
cctcggaccc ccgaggaggc ccagcgtgtg gacagcctgg tgggtgcggg cccagccagc 240
cggctgctgt ggatcgggct gcagcggcag gcccggcaat gccagctgca gcgcccactg 300
cgcggcttca cgtggaccac aggggaccag gacacggctt tcaccaactg ggcccagcca 360
gcctctggag gcccctgccc ggcccagcgc tgtgtggccc tggaggcaag tggcgagcac 420
cgctggctgg agggctcgtg cacgctggct gtcgacggct acctgtgcca gtttggcttc 480
gagggcgcct gcccggcgct gcaagatgag gcgggccagg ccggcccagc cgtgtatacc 540
acgcccttcc acctggtctc cacagagttt gagtggctgc ccttcggctc tgtggccgct 600
gtgcagtgcc aggctggcag gggagcctct ctgctctgcg tgaagcagcc tgagggaggt 660
gtgggctggt cacgggctgg gcccctgtgc ctggggactg gctgcagccc tgacaacggg 720
ggctgcgaac acgaatgtgt ggaggaggtg gatggtcacg tgtcctgccg ctgcactgag 780
ggcttccggc tggcagcaga cgggcgcagt tgcgaggacc cctgtgccca ggctccgtgc 840
gagcagcagt gtgagcccgg tgggccacaa ggctacagct gccactgtcg cctgggtttc 900
cggccagcgg aggatgatcc gcaccgctgt gtggacacag atgagtgcca gattgccggt 960
gtgtgccagc agatgtgtgt caactacgtt ggtggcttcg agtgttattg tagcgaggga 1020
catgagctgg aggctgatgg catcagctgc agccctgcag gggccatggg tgcccaggct 1080
tcccaggacc tcggagatga gttgctggat gacggggagg atgaggaaga tgaagacgag 1140
gcctggaagg ccttcaacgg tggctggacg gagatgcctg ggatcctgtg gatggagcct 1200
acgcagccgc ctgactttgc cctggcctat agaccgagct tcccagagga cagagagcca 1260
cagataccct acccggagcc cacctggcca cccccgctca gtgcccccag ggtcccctac 1320
cactcctcag tgctctccgt cacccggcct gtggtggtct ctgccacgca tcccacactg 1380
ccttctgccc accagcctcc tgtgatccct gccacacacc cagctttgtc ccgtgaccac 1440
cagatccccg tgatcgcagc caactatcca gatctgcctt ctgcctacca acccggtatt 1500
ctctctgtct ctcattcagc acagcctcct gcccaccagc cccctatgat ctcaaccaaa 1560
tatccggagc tcttccctgc ccaccagtcc cccatgtttc cagacacccg ggtcgctggc 1620
acccagacca ccactcattt gcctggaatc ccacctaacc atgcccctct ggtcaccacc 1680
ctcggtgccc agctaccccc tcaagcccca gatgcccttg tcctcagaac ccaggccacc 1740
cagcttccca ttatcccaac tgcccagccc tctctgacca ccacctccag gtcccctgtg 1800
tctcctgccc atcaaatctc tgtgcctgct gccacccagc ccgcagccct ccccaccctc 1860
ctgccctctc agagccccac taaccagacc tcacccatca gccctacaca tccccattcc 1920
aaagcccccc aaatcccaag ggaagatggc cccagtccca agttggccct gtggctgccc 1980
tcaccagctc ccacagcagc cccaacagcc ctgggggagg ctggtcttgc cgagcacagc 2040
cagagggatg accgggttaa cgacgacgac gacaaagagc ccagcggacc aatttcaaca 2100
atcaacccct ctcctccatc caaggagtct cacaaaagcc cagctcctaa cctcgagggt 2160
ggaccatccg tcttcatctt ccctccaaat atcaaggatg tactcatgat ctccctgaca 2220
cccaaggtca cgtgtgtggt ggtggatgtg agcgaggatg acccagacgt ccagatcagc 2280
tggtttgtga acaacgtgga agtacacaca gcycagacac aaacccatag agaggattac 2340
aacagtacta tccgggtggt cagcaccctc cccatccagc accaggactg gatgagtggc 2400
aaggagttca aatgcaaggt caacaacaaa gacctcccat cacccatcga gagaaccatc 2460
tcaaaaatta aagggctagt cagagctcca caagtataca tcttgccgcc accagcagag 2520
cagttgtcca ggaaagatgt cagtctcact tgcctggtcg tgggcttcaa ccctggagac 2580
atcagtgtgg agtggaccag caatgggcat acagaggaga actacaagga caccgcacca 2640
gtcctggact ctgacggttc ttacttcata tatagcaagc tcaatatgaa aacaagcaag 2700
tgggagaaaa cagattcctt ctcatgcaac gtgagacacg agggtctgaa aaattactac 2760
ctgaagaaga ccatctcccg gtctccgggt aaatga 2796
<210> 44
<211> 931
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 44
Met Leu Leu Arg Leu Leu Leu Ala Trp Ala Ala Ala Gly Pro Thr Leu
1 5 10 15
Gly Gln Asp Pro Trp Ala Ala Glu Pro Arg Ala Ala Cys Gly Pro Ser
20 25 30
Ser Cys Tyr Ala Leu Phe Pro Arg Arg Arg Thr Phe Leu Glu Ala Trp
35 40 45
Arg Ala Cys Arg Glu Leu Gly Gly Asp Leu Ala Thr Pro Arg Thr Pro
50 55 60
Glu Glu Ala Gln Arg Val Asp Ser Leu Val Gly Ala Gly Pro Ala Ser
65 70 75 80
Arg Leu Leu Trp Ile Gly Leu Gln Arg Gln Ala Arg Gln Cys Gln Leu
85 90 95
Gln Arg Pro Leu Arg Gly Phe Thr Trp Thr Thr Gly Asp Gln Asp Thr
100 105 110
Ala Phe Thr Asn Trp Ala Gln Pro Ala Ser Gly Gly Pro Cys Pro Ala
115 120 125
Gln Arg Cys Val Ala Leu Glu Ala Ser Gly Glu His Arg Trp Leu Glu
130 135 140
Gly Ser Cys Thr Leu Ala Val Asp Gly Tyr Leu Cys Gln Phe Gly Phe
145 150 155 160
Glu Gly Ala Cys Pro Ala Leu Gln Asp Glu Ala Gly Gln Ala Gly Pro
165 170 175
Ala Val Tyr Thr Thr Pro Phe His Leu Val Ser Thr Glu Phe Glu Trp
180 185 190
Leu Pro Phe Gly Ser Val Ala Ala Val Gln Cys Gln Ala Gly Arg Gly
195 200 205
Ala Ser Leu Leu Cys Val Lys Gln Pro Glu Gly Gly Val Gly Trp Ser
210 215 220
Arg Ala Gly Pro Leu Cys Leu Gly Thr Gly Cys Ser Pro Asp Asn Gly
225 230 235 240
Gly Cys Glu His Glu Cys Val Glu Glu Val Asp Gly His Val Ser Cys
245 250 255
Arg Cys Thr Glu Gly Phe Arg Leu Ala Ala Asp Gly Arg Ser Cys Glu
260 265 270
Asp Pro Cys Ala Gln Ala Pro Cys Glu Gln Gln Cys Glu Pro Gly Gly
275 280 285
Pro Gln Gly Tyr Ser Cys His Cys Arg Leu Gly Phe Arg Pro Ala Glu
290 295 300
Asp Asp Pro His Arg Cys Val Asp Thr Asp Glu Cys Gln Ile Ala Gly
305 310 315 320
Val Cys Gln Gln Met Cys Val Asn Tyr Val Gly Gly Phe Glu Cys Tyr
325 330 335
Cys Ser Glu Gly His Glu Leu Glu Ala Asp Gly Ile Ser Cys Ser Pro
340 345 350
Ala Gly Ala Met Gly Ala Gln Ala Ser Gln Asp Leu Gly Asp Glu Leu
355 360 365
Leu Asp Asp Gly Glu Asp Glu Glu Asp Glu Asp Glu Ala Trp Lys Ala
370 375 380
Phe Asn Gly Gly Trp Thr Glu Met Pro Gly Ile Leu Trp Met Glu Pro
385 390 395 400
Thr Gln Pro Pro Asp Phe Ala Leu Ala Tyr Arg Pro Ser Phe Pro Glu
405 410 415
Asp Arg Glu Pro Gln Ile Pro Tyr Pro Glu Pro Thr Trp Pro Pro Pro
420 425 430
Leu Ser Ala Pro Arg Val Pro Tyr His Ser Ser Val Leu Ser Val Thr
435 440 445
Arg Pro Val Val Val Ser Ala Thr His Pro Thr Leu Pro Ser Ala His
450 455 460
Gln Pro Pro Val Ile Pro Ala Thr His Pro Ala Leu Ser Arg Asp His
465 470 475 480
Gln Ile Pro Val Ile Ala Ala Asn Tyr Pro Asp Leu Pro Ser Ala Tyr
485 490 495
Gln Pro Gly Ile Leu Ser Val Ser His Ser Ala Gln Pro Pro Ala His
500 505 510
Gln Pro Pro Met Ile Ser Thr Lys Tyr Pro Glu Leu Phe Pro Ala His
515 520 525
Gln Ser Pro Met Phe Pro Asp Thr Arg Val Ala Gly Thr Gln Thr Thr
530 535 540
Thr His Leu Pro Gly Ile Pro Pro Asn His Ala Pro Leu Val Thr Thr
545 550 555 560
Leu Gly Ala Gln Leu Pro Pro Gln Ala Pro Asp Ala Leu Val Leu Arg
565 570 575
Thr Gln Ala Thr Gln Leu Pro Ile Ile Pro Thr Ala Gln Pro Ser Leu
580 585 590
Thr Thr Thr Ser Arg Ser Pro Val Ser Pro Ala His Gln Ile Ser Val
595 600 605
Pro Ala Ala Thr Gln Pro Ala Ala Leu Pro Thr Leu Leu Pro Ser Gln
610 615 620
Ser Pro Thr Asn Gln Thr Ser Pro Ile Ser Pro Thr His Pro His Ser
625 630 635 640
Lys Ala Pro Gln Ile Pro Arg Glu Asp Gly Pro Ser Pro Lys Leu Ala
645 650 655
Leu Trp Leu Pro Ser Pro Ala Pro Thr Ala Ala Pro Thr Ala Leu Gly
660 665 670
Glu Ala Gly Leu Ala Glu His Ser Gln Arg Asp Asp Arg Val Asn Asp
675 680 685
Asp Asp Asp Lys Glu Pro Ser Gly Pro Ile Ser Thr Ile Asn Pro Ser
690 695 700
Pro Pro Ser Lys Glu Ser His Lys Ser Pro Ala Pro Asn Leu Glu Gly
705 710 715 720
Gly Pro Ser Val Phe Ile Phe Pro Pro Asn Ile Lys Asp Val Leu Met
725 730 735
Ile Ser Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Val Ser Glu
740 745 750
Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val
755 760 765
His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Ile
770 775 780
Arg Val Val Ser Thr Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly
785 790 795 800
Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ser Pro Ile
805 810 815
Glu Arg Thr Ile Ser Lys Ile Lys Gly Leu Val Arg Ala Pro Gln Val
820 825 830
Tyr Ile Leu Pro Pro Pro Ala Glu Gln Leu Ser Arg Lys Asp Val Ser
835 840 845
Leu Thr Cys Leu Val Val Gly Phe Asn Pro Gly Asp Ile Ser Val Glu
850 855 860
Trp Thr Ser Asn Gly His Thr Glu Glu Asn Tyr Lys Asp Thr Ala Pro
865 870 875 880
Val Leu Asp Ser Asp Gly Ser Tyr Phe Ile Tyr Ser Lys Leu Asn Met
885 890 895
Lys Thr Ser Lys Trp Glu Lys Thr Asp Ser Phe Ser Cys Asn Val Arg
900 905 910
His Glu Gly Leu Lys Asn Tyr Tyr Leu Lys Lys Thr Ile Ser Arg Ser
915 920 925
Pro Gly Lys
930
<210> 45
<211> 1380
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 45
atggcaccac tgtgcccaag cccatggctg ccactgctga tcccagcacc agcaccagga 60
ctgaccgtgc agctgctgct gagcctgctg ctgctggtgc ccgtgcaccc ccagcggctg 120
ccccggatgc aggaggacag ccccctgggc ggcggcagca gcggcgagga cgaccccctg 180
ggcgaggagg acctgcccag cgaggaggac agcccccggg aggaggaccc ccccggagaa 240
gaggacctgc ccggcgagga ggacctgcca ggagaggagg acctgccaga ggtgaagcca 300
aagagcgagg aggagggaag cctgaagctg gaggacctgc caaccgtgga ggcaccaggc 360
gacccacagg agccccagaa caacgcccac cgggacaagg agggcgacga ccagagccac 420
tggagatacg gaggcgaccc accatggcca cgggtgagcc cagcatgcgc aggacggttc 480
cagagccccg tggacatccg gccccagctg gccgccttct gccccgccct gcggcccctg 540
gagctgctgg gcttccagct gccccccctg cccgagctgc ggctgcggaa caacggccac 600
agcgtgcagc tgaccctgcc ccccggcctg gagatggccc tgggccccgg ccgggagtac 660
cgggccctgc agctgcacct gcactggggc gccgccggcc ggcccggcag cgagcacacc 720
gtggagggac acaggttccc agcagagatc cacgtggtgc acctgagcac cgcattcgca 780
agggtggacg aggcactggg aaggccagga ggactggcag tgctggcagc cttcctggag 840
gagggaccag aggagaacag cgcatacgag cagctgctga gccggctgga ggagatcgca 900
gaggagggaa gcgagaccca ggtgccaggc ctggacatca gcgcactgct gccaagcgac 960
ttcagccggt acttccagta cgagggcagc ctgaccaccc ccccctgcgc ccagggcgtg 1020
atctggaccg tgttcaacca gaccgtgatg ctgagcgcaa agcagctgca caccctgagc 1080
gacaccctgt ggggaccagg cgacagccgg ctgcagctga acttcagggc aacccagccc 1140
ctgaacggaa gagtgatcga ggcaagcttc ccagcaggag tggacagcag cccaagggca 1200
gcagagccag tgcagctgaa cagctgcctg gcagcaggcg acatcctggc actggtgttc 1260
ggactgctgt tcgcagtgac cagcgtggcc ttcctggtgc agatgcggcg gcagcaccgg 1320
cggggcacca agggcggcgt gagctaccgg cccgccgagg tggccgagac cggcgcctga 1380
<210> 46
<211> 459
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 46
Met Ala Pro Leu Cys Pro Ser Pro Trp Leu Pro Leu Leu Ile Pro Ala
1 5 10 15
Pro Ala Pro Gly Leu Thr Val Gln Leu Leu Leu Ser Leu Leu Leu Leu
20 25 30
Val Pro Val His Pro Gln Arg Leu Pro Arg Met Gln Glu Asp Ser Pro
35 40 45
Leu Gly Gly Gly Ser Ser Gly Glu Asp Asp Pro Leu Gly Glu Glu Asp
50 55 60
Leu Pro Ser Glu Glu Asp Ser Pro Arg Glu Glu Asp Pro Pro Gly Glu
65 70 75 80
Glu Asp Leu Pro Gly Glu Glu Asp Leu Pro Gly Glu Glu Asp Leu Pro
85 90 95
Glu Val Lys Pro Lys Ser Glu Glu Glu Gly Ser Leu Lys Leu Glu Asp
100 105 110
Leu Pro Thr Val Glu Ala Pro Gly Asp Pro Gln Glu Pro Gln Asn Asn
115 120 125
Ala His Arg Asp Lys Glu Gly Asp Asp Gln Ser His Trp Arg Tyr Gly
130 135 140
Gly Asp Pro Pro Trp Pro Arg Val Ser Pro Ala Cys Ala Gly Arg Phe
145 150 155 160
Gln Ser Pro Val Asp Ile Arg Pro Gln Leu Ala Ala Phe Cys Pro Ala
165 170 175
Leu Arg Pro Leu Glu Leu Leu Gly Phe Gln Leu Pro Pro Leu Pro Glu
180 185 190
Leu Arg Leu Arg Asn Asn Gly His Ser Val Gln Leu Thr Leu Pro Pro
195 200 205
Gly Leu Glu Met Ala Leu Gly Pro Gly Arg Glu Tyr Arg Ala Leu Gln
210 215 220
Leu His Leu His Trp Gly Ala Ala Gly Arg Pro Gly Ser Glu His Thr
225 230 235 240
Val Glu Gly His Arg Phe Pro Ala Glu Ile His Val Val His Leu Ser
245 250 255
Thr Ala Phe Ala Arg Val Asp Glu Ala Leu Gly Arg Pro Gly Gly Leu
260 265 270
Ala Val Leu Ala Ala Phe Leu Glu Glu Gly Pro Glu Glu Asn Ser Ala
275 280 285
Tyr Glu Gln Leu Leu Ser Arg Leu Glu Glu Ile Ala Glu Glu Gly Ser
290 295 300
Glu Thr Gln Val Pro Gly Leu Asp Ile Ser Ala Leu Leu Pro Ser Asp
305 310 315 320
Phe Ser Arg Tyr Phe Gln Tyr Glu Gly Ser Leu Thr Thr Pro Pro Cys
325 330 335
Ala Gln Gly Val Ile Trp Thr Val Phe Asn Gln Thr Val Met Leu Ser
340 345 350
Ala Lys Gln Leu His Thr Leu Ser Asp Thr Leu Trp Gly Pro Gly Asp
355 360 365
Ser Arg Leu Gln Leu Asn Phe Arg Ala Thr Gln Pro Leu Asn Gly Arg
370 375 380
Val Ile Glu Ala Ser Phe Pro Ala Gly Val Asp Ser Ser Pro Arg Ala
385 390 395 400
Ala Glu Pro Val Gln Leu Asn Ser Cys Leu Ala Ala Gly Asp Ile Leu
405 410 415
Ala Leu Val Phe Gly Leu Leu Phe Ala Val Thr Ser Val Ala Phe Leu
420 425 430
Val Gln Met Arg Arg Gln His Arg Arg Gly Thr Lys Gly Gly Val Ser
435 440 445
Tyr Arg Pro Ala Glu Val Ala Glu Thr Gly Ala
450 455
<210> 47
<211> 1203
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 47
atgggctgga gctgcatcat cctgttcctg gtggcaaccg caaccggagt gcacagccag 60
aggctgccac ggatgcagga ggacagcccc ctgggcggcg gcagcagcgg cgaggacgac 120
cccctgggcg aggaggacct gcccagcgag gaggacagcc caagggagga ggacccacca 180
ggagaggagg acctgcctgg cgaggaggac ctgcctgggg aggaggacct gccagaggtg 240
aagccaaaga gcgaagagga gggaagcctg aagctggagg acctgccaac cgtggaggca 300
ccaggcgacc cacaggagcc ccagaacaac gcccaccggg acaaggaggg cgacgaccag 360
agccactgga gatacggagg cgacccacca tggccacggg tgagcccagc atgcgcagga 420
cggttccaga gccccgtgga catccggccc cagctggccg ccttctgccc cgccctgcgg 480
cccctggagc tgctgggctt ccagctgccc cccctgcccg agctgcggct gcggaacaac 540
ggccacagcg tgcagctgac cctgcccccc ggcctggaga tggccctggg ccccggccgg 600
gagtaccggg ccctgcagct gcacctgcac tggggcgccg ccggccggcc cggcagcgag 660
cacaccgtgg agggacacag gttcccagca gagatccacg tggtgcacct gagcaccgca 720
ttcgcaaggg tggacgaggc actgggaagg ccaggaggac tggcagtgct ggcagccttc 780
ctggaggagg gaccagagga gaacagcgca tacgagcagc tgctgagccg gctggaggag 840
atcgcagagg agggaagcga gacccaggtg ccaggcctgg acatcagcgc actgctgcca 900
agcgacttca gccggtactt ccagtacgag ggcagcctga ccaccccccc ctgcgcccag 960
ggcgtgatct ggaccgtgtt caaccagacc gtgatgctga gcgcaaagca gctgcacacc 1020
ctgagcgaca ccctgtgggg accaggcgac agccggctgc agctgaactt cagggcaacc 1080
cagcccctga acggaagagt gatcgaggca agcttcccag caggagtgga cagcagccca 1140
agggcagcag agccagtgca gctgaacagc tgcctggccg gccaccacca ccaccaccac 1200
tga 1203
<210> 48
<211> 400
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 48
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Arg Leu Pro Arg Met Gln Glu Asp Ser Pro Leu Gly
20 25 30
Gly Gly Ser Ser Gly Glu Asp Asp Pro Leu Gly Glu Glu Asp Leu Pro
35 40 45
Ser Glu Glu Asp Ser Pro Arg Glu Glu Asp Pro Pro Gly Glu Glu Asp
50 55 60
Leu Pro Gly Glu Glu Asp Leu Pro Gly Glu Glu Asp Leu Pro Glu Val
65 70 75 80
Lys Pro Lys Ser Glu Glu Glu Gly Ser Leu Lys Leu Glu Asp Leu Pro
85 90 95
Thr Val Glu Ala Pro Gly Asp Pro Gln Glu Pro Gln Asn Asn Ala His
100 105 110
Arg Asp Lys Glu Gly Asp Asp Gln Ser His Trp Arg Tyr Gly Gly Asp
115 120 125
Pro Pro Trp Pro Arg Val Ser Pro Ala Cys Ala Gly Arg Phe Gln Ser
130 135 140
Pro Val Asp Ile Arg Pro Gln Leu Ala Ala Phe Cys Pro Ala Leu Arg
145 150 155 160
Pro Leu Glu Leu Leu Gly Phe Gln Leu Pro Pro Leu Pro Glu Leu Arg
165 170 175
Leu Arg Asn Asn Gly His Ser Val Gln Leu Thr Leu Pro Pro Gly Leu
180 185 190
Glu Met Ala Leu Gly Pro Gly Arg Glu Tyr Arg Ala Leu Gln Leu His
195 200 205
Leu His Trp Gly Ala Ala Gly Arg Pro Gly Ser Glu His Thr Val Glu
210 215 220
Gly His Arg Phe Pro Ala Glu Ile His Val Val His Leu Ser Thr Ala
225 230 235 240
Phe Ala Arg Val Asp Glu Ala Leu Gly Arg Pro Gly Gly Leu Ala Val
245 250 255
Leu Ala Ala Phe Leu Glu Glu Gly Pro Glu Glu Asn Ser Ala Tyr Glu
260 265 270
Gln Leu Leu Ser Arg Leu Glu Glu Ile Ala Glu Glu Gly Ser Glu Thr
275 280 285
Gln Val Pro Gly Leu Asp Ile Ser Ala Leu Leu Pro Ser Asp Phe Ser
290 295 300
Arg Tyr Phe Gln Tyr Glu Gly Ser Leu Thr Thr Pro Pro Cys Ala Gln
305 310 315 320
Gly Val Ile Trp Thr Val Phe Asn Gln Thr Val Met Leu Ser Ala Lys
325 330 335
Gln Leu His Thr Leu Ser Asp Thr Leu Trp Gly Pro Gly Asp Ser Arg
340 345 350
Leu Gln Leu Asn Phe Arg Ala Thr Gln Pro Leu Asn Gly Arg Val Ile
355 360 365
Glu Ala Ser Phe Pro Ala Gly Val Asp Ser Ser Pro Arg Ala Ala Glu
370 375 380
Pro Val Gln Leu Asn Ser Cys Leu Ala Gly His His His His His His
385 390 395 400
<210> 49
<211> 1041
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 49
atgggatgga gctgtatcat cctcttcttg gtagcaacag ctacaggtgt acacagcgaa 60
gtggagaaga cagcctgtcc ttcaggcaag aaggcccgcg agatagacga gagcctcatc 120
ttctacaaga agtgggagct ggaagcctgc gtggatgcgg ccctgctggc cacccagatg 180
gaccgcgtga acgccatccc cttcacctac gagcagctgg acgtcctaaa gcataaactg 240
gatgagctct acccacaagg ttaccccgag tctgtgatcc agcacctggg ctacctcttc 300
ctcaagatga gccctgagga cattcgcaag tggaatgtga cgtccctgga gaccctgaag 360
gctttgcttg aagtcaacaa agggcacgaa atgagtcctc aggtggccac cctgatcgac 420
cgctttgtga agggaagggg ccagctagac aaagacaccc tagacaccct gaccgccttc 480
taccctgggt acctgtgctc cctcagcccc gaggagctga gctccgtgcc ccccagcagc 540
atctgggcgg tcaggcccca ggacctggac acgtgtgacc caaggcagct ggacgtcctc 600
tatcccaagg cccgccttgc tttccagaac atgaacgggt ccgaatactt cgtgaagatc 660
cagtccttcc tgggtggggc ccccacggag gatttgaagg cgctcagtca gcagaatgtg 720
agcatggact tggccacgtt catgaagctg cggacggatg cggtgctgcc gttgactgtg 780
gctgaggtgc agaaacttct gggaccccac gtggagggcc tgaaggcgga ggagcggcac 840
cgcccggtgc gggactggat cctacggcag cggcaggacg acctggacac gctggggctg 900
gggctacagg gcggcatccc caacggctac ctggtcctag acctcagcat gcaagaggcc 960
ctctcgggga cgccctgcct cctaggacct ggacctgttc tcaccgtcct ggcactgctc 1020
ctagcctcca ccctggcctg a 1041
<210> 50
<211> 346
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 50
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Glu Lys Thr Ala Cys Pro Ser Gly Lys Lys Ala
20 25 30
Arg Glu Ile Asp Glu Ser Leu Ile Phe Tyr Lys Lys Trp Glu Leu Glu
35 40 45
Ala Cys Val Asp Ala Ala Leu Leu Ala Thr Gln Met Asp Arg Val Asn
50 55 60
Ala Ile Pro Phe Thr Tyr Glu Gln Leu Asp Val Leu Lys His Lys Leu
65 70 75 80
Asp Glu Leu Tyr Pro Gln Gly Tyr Pro Glu Ser Val Ile Gln His Leu
85 90 95
Gly Tyr Leu Phe Leu Lys Met Ser Pro Glu Asp Ile Arg Lys Trp Asn
100 105 110
Val Thr Ser Leu Glu Thr Leu Lys Ala Leu Leu Glu Val Asn Lys Gly
115 120 125
His Glu Met Ser Pro Gln Val Ala Thr Leu Ile Asp Arg Phe Val Lys
130 135 140
Gly Arg Gly Gln Leu Asp Lys Asp Thr Leu Asp Thr Leu Thr Ala Phe
145 150 155 160
Tyr Pro Gly Tyr Leu Cys Ser Leu Ser Pro Glu Glu Leu Ser Ser Val
165 170 175
Pro Pro Ser Ser Ile Trp Ala Val Arg Pro Gln Asp Leu Asp Thr Cys
180 185 190
Asp Pro Arg Gln Leu Asp Val Leu Tyr Pro Lys Ala Arg Leu Ala Phe
195 200 205
Gln Asn Met Asn Gly Ser Glu Tyr Phe Val Lys Ile Gln Ser Phe Leu
210 215 220
Gly Gly Ala Pro Thr Glu Asp Leu Lys Ala Leu Ser Gln Gln Asn Val
225 230 235 240
Ser Met Asp Leu Ala Thr Phe Met Lys Leu Arg Thr Asp Ala Val Leu
245 250 255
Pro Leu Thr Val Ala Glu Val Gln Lys Leu Leu Gly Pro His Val Glu
260 265 270
Gly Leu Lys Ala Glu Glu Arg His Arg Pro Val Arg Asp Trp Ile Leu
275 280 285
Arg Gln Arg Gln Asp Asp Leu Asp Thr Leu Gly Leu Gly Leu Gln Gly
290 295 300
Gly Ile Pro Asn Gly Tyr Leu Val Leu Asp Leu Ser Met Gln Glu Ala
305 310 315 320
Leu Ser Gly Thr Pro Cys Leu Leu Gly Pro Gly Pro Val Leu Thr Val
325 330 335
Leu Ala Leu Leu Leu Ala Ser Thr Leu Ala
340 345
<210> 51
<211> 1416
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 51
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagccag 60
tcggtgaagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagtctctg gattctccct caatagctat gcgatgatct gggtccgcca ggctccaggg 180
gaggggctgg aatacatcgg attcattact actggtggta ccacatacta cgcgagctgg 240
gcaaaaggcc gattcaccat ctccagaacc tcgaccacgg tggatctgaa gctcacccgt 300
ccgacaaccg aggacacggc cacctatttc tgtgccagag atcgggttaa aagctacgat 360
gactatggtg atttagatgc tttcgagccc tggggcccag gcaccctggt caccatctcc 420
tcagcatcca ccaagggccc atcggtcttc cccctggcac cctcctccaa gagcacctct 480
gggggcacag cggccctggg ctgcctggtc aaggactact tccccgaacc ggtgacggtg 540
tcgtggaact caggcgccct gaccagcggc gtgcacacct tcccggctgt cctacagtcc 600
tcaggactct actccctcag cagcgtggtg accgtgccct ccagcagctt gggcacccag 660
acctacatct gcaacgtgaa tcacaagccc agcaacacca aggtggacaa gaaagttgag 720
cccaaatctt gtgacaaaac tcacacatgc ccaccgtgcc cagcacctga actcctgggg 780
ggaccgtcag tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc 840
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt caagttcaac 900
tggtacgtgg acggcgtgga ggtgcataat gccaagacaa agccgcggga ggagcagtac 960
aacagcacgt accgtgtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc 1020
aaggagtaca agtgcaaggt ctccaacaaa gccctcccag cccccatcga gaaaaccatc 1080
tccaaagcca aagggcagcc ccgagaacca caggtgtaca ccctgccccc atcccgggat 1140
gagctgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta tcccagcgac 1200
atcgccgtgg agtgggagag caatgggcag ccggagaaca actacaagac cacgcctccc 1260
gtgctggact ccgacggctc cttcttctta tattcaaagc tcaccgtgga caagagcagg 1320
tggcagcagg ggaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac 1380
acgcagaaga gcctctccct gtctcccggg aaatga 1416
<210> 52
<211> 471
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 52
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Lys Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Asn
35 40 45
Ser Tyr Ala Met Ile Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu
50 55 60
Tyr Ile Gly Phe Ile Thr Thr Gly Gly Thr Thr Tyr Tyr Ala Ser Trp
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Leu Thr Arg Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala
100 105 110
Arg Asp Arg Val Lys Ser Tyr Asp Asp Tyr Gly Asp Leu Asp Ala Phe
115 120 125
Glu Pro Trp Gly Pro Gly Thr Leu Val Thr Ile Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
245 250 255
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
260 265 270
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
275 280 285
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
290 295 300
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
305 310 315 320
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
325 330 335
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
340 345 350
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
355 360 365
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
370 375 380
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
385 390 395 400
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
405 410 415
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
420 425 430
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
435 440 445
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
450 455 460
Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 53
<211> 1425
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 53
atgggttgga gttgcatcat tctgttcctg gtggccacag ctactggcgt gcactcacag 60
gtgcagctgg tggagtccgg aggaggactg gtgcagccag gtggctctct gcgactgtct 120
tgtagtgctt caggcttttc cctgaacagc tacgctatga tctgggtcag gcaggcacct 180
ggcaagggcc tggaatatat cggattcatt accacaggag ggactaccta ctatgccgac 240
tccgtgaagg ggagattcac tatctctcgc gataacagta agaataccct gtacctgcag 300
atgaatagcc tgagagcaga ggacacagcc gtgtactatt gcgccaggga tcgggtgaaa 360
tcttacgacg attatggaga cctggatgct ttcgaaccat ggggacaggg gaccctggtg 420
acagtgtcca gcgcatccac caagggccca tcggtcttcc ccctggcacc ctcctccaag 480
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 540
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 600
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 660
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtggacaag 720
aaagttgagc ccaaatcttg tgacaaaact cacacatgcc caccgtgccc agcacctgaa 780
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 840
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 900
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 960
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1020
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1080
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1140
tcccgggatg agctgaccaa gaaccaggtc agcctgacct gcctggtcaa aggcttctat 1200
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1260
acgcctcccg tgctggactc cgacggctcc ttcttcttat attcaaagct caccgtggac 1320
aagagcaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1380
aaccactaca cgcagaagag cctctccctg tctcccggga aatga 1425
<210> 54
<211> 474
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 54
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Ser Leu
35 40 45
Asn Ser Tyr Ala Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Tyr Ile Gly Phe Ile Thr Thr Gly Gly Thr Thr Tyr Tyr Ala Asp
65 70 75 80
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
85 90 95
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Arg Val Lys Ser Tyr Asp Asp Tyr Gly Asp Leu
115 120 125
Asp Ala Phe Glu Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
145 150 155 160
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
165 170 175
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
180 185 190
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
195 200 205
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
210 215 220
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
225 230 235 240
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
370 375 380
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 55
<211> 1410
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 55
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcggtggagg agtccggggg agacctggtc aagcctgagg gatccctgac actcacctgc 120
acagcctctg gattctcctt cagtagcagc tactggggat gctgggtccg ccaggctcca 180
gggaaggggc ctgagtggat cgcatgcatt tatggtggta gtagtggtac cacttattac 240
ccgaactggg cgaaaggccg attctccatc tccaaaacct cgtcgaccac ggtgactctg 300
caaatggcca gtctgacagc cgcggacacg gccacctatt tctgtgcgag agtgactaat 360
ggtggtgatt gggattttaa attgtggggc ccaggcaccc tggtcaccat ctcctcagca 420
tccaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc 480
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg 540
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga 600
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac 660
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagaaagt tgagcccaaa 720
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg 780
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 840
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 900
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 960
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1020
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa 1080
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggatgagctg 1140
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1200
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1260
gactccgacg gctccttctt cttatattca aagctcaccg tggacaagag caggtggcag 1320
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1380
aagagcctct ccctgtctcc cgggaaatga 1410
<210> 56
<211> 469
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 56
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Glu Glu Ser Gly Gly Asp Leu Val Lys Pro
20 25 30
Glu Gly Ser Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Phe Ser
35 40 45
Ser Ser Tyr Trp Gly Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Pro
50 55 60
Glu Trp Ile Ala Cys Ile Tyr Gly Gly Ser Ser Gly Thr Thr Tyr Tyr
65 70 75 80
Pro Asn Trp Ala Lys Gly Arg Phe Ser Ile Ser Lys Thr Ser Ser Thr
85 90 95
Thr Val Thr Leu Gln Met Ala Ser Leu Thr Ala Ala Asp Thr Ala Thr
100 105 110
Tyr Phe Cys Ala Arg Val Thr Asn Gly Gly Asp Trp Asp Phe Lys Leu
115 120 125
Trp Gly Pro Gly Thr Leu Val Thr Ile Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
210 215 220
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
225 230 235 240
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
245 250 255
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
260 265 270
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
275 280 285
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
290 295 300
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
305 310 315 320
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
325 330 335
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
340 345 350
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
355 360 365
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly Lys
465
<210> 57
<211> 1407
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 57
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagccag 60
tcggtggagg agtccagggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagtctctg gaatcgacct cagtaattat gcaatgacct gggtccgcca ggctccaggg 180
aaggggctgg aatggatcgg aatcattagt agtaatgata agacatggta cgcgagctgg 240
gtgaaaggcc ggttcaccat ctcaaaaacc tcgtcgacca cggtggatct gaaaatgacc 300
agtctgacaa ccgaggacac ggccacctat ttctgtgcca gagctgctat gcctggtggt 360
ttaaagaatg ctttcgatcc ctggggccca ggcaccctgg tcaccgtctc ttcagcatcc 420
accaagggcc catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca 480
gcggccctgg gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac 540
tcaggcgccc tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc 600
tactccctca gcagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc 660
tgcaacgtga atcacaagcc cagcaacacc aaggtggaca agaaagttga gcccaaatct 720
tgtgacaaaa ctcacacatg cccaccgtgc ccagcacctg aactcctggg gggaccgtca 780
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 840
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 900
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 960
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 1020
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 1080
aaagggcagc cccgagaacc acaggtgtac accctgcccc catcccggga tgagctgacc 1140
aagaaccagg tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg 1200
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 1260
tccgacggct ccttcttctt atattcaaag ctcaccgtgg acaagagcag gtggcagcag 1320
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 1380
agcctctccc tgtctcccgg gaaatga 1407
<210> 58
<211> 468
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 58
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Glu Glu Ser Arg Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser
35 40 45
Asn Tyr Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Ser Ser Asn Asp Lys Thr Trp Tyr Ala Ser Trp
65 70 75 80
Val Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp
85 90 95
Leu Lys Met Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys
100 105 110
Ala Arg Ala Ala Met Pro Gly Gly Leu Lys Asn Ala Phe Asp Pro Trp
115 120 125
Gly Pro Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
245 250 255
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
260 265 270
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
275 280 285
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
290 295 300
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
305 310 315 320
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
325 330 335
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
340 345 350
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
355 360 365
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
370 375 380
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
385 390 395 400
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
405 410 415
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
420 425 430
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
435 440 445
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
450 455 460
Ser Pro Gly Lys
465
<210> 59
<211> 1413
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 59
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgag 60
gtccagctgc tggaatcagg gggaggactg gtgcagcccg gagggtcact gcgactgtct 120
tgtgccgctt caggcattga tctgtctaac tacgctatga cttgggtgag gcaggcaccc 180
ggcaagggac tggagtgggt cggaatcatt agctccaatg acaagacctg gtacgccgat 240
tcagtgaaag gccggttcac catctctaga gacaacagta agaatacact gtatctgcag 300
atgaacagcc tgcgggcaga agatacagcc gtctactatt gcgctaaagc cgctatgcct 360
ggcggactga agaacgcatt tgatccttgg ggacagggaa ctctggtcac cgtctcatct 420
gcatccacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 480
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 540
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 600
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 660
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 720
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 780
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 840
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 900
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 960
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 1020
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 1080
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 1140
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 1200
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1260
ctggactccg acggctcctt cttcttatat tcaaagctca ccgtggacaa gagcaggtgg 1320
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 1380
cagaagagcc tctccctgtc tcccgggaaa tga 1413
<210> 60
<211> 470
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 60
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Leu
35 40 45
Ser Asn Tyr Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Gly Ile Ile Ser Ser Asn Asp Lys Thr Trp Tyr Ala Asp
65 70 75 80
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
85 90 95
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Lys Ala Ala Met Pro Gly Gly Leu Lys Asn Ala Phe Asp
115 120 125
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
130 135 140
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
145 150 155 160
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
165 170 175
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
180 185 190
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
195 200 205
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
210 215 220
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
225 230 235 240
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
370 375 380
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
385 390 395 400
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
405 410 415
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
420 425 430
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
435 440 445
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
450 455 460
Ser Leu Ser Pro Gly Lys
465 470
<210> 61
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 61
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcggtggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
accgtctctg gaatctccct cagtagcgat gcaataagct gggtccgcca ggctccaggg 180
aaggggctcg aatacatcgg aatcattaat ggtggtggta acacatacta cgcgagctgg 240
gcgaaaggcc gattcaccat ctccaaaacc tcgaccacgg tggatctgaa aatcaccagt 300
ccgacaaccg aggacacggc cacctatttc tgtgccagag gcattcaaca tggtggtggt 360
aatagtgatt attattatta cggcatggac ctctggggcc caggcaccct ggtcactgtc 420
tcttcagcat ccaccaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaactcctg 780
gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg 840
acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc 900
aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag 960
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 1020
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcccccat cgagaaaacc 1080
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatcccgg 1140
gatgagctga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc 1200
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1260
cccgtgctgg actccgacgg ctccttcttc ttatattcaa agctcaccgt ggacaagagc 1320
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 1380
tacacgcaga agagcctctc cctgtctccc gggaaatga 1419
<210> 62
<211> 472
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 62
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Ser Leu Ser
35 40 45
Ser Asp Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Tyr Ile Gly Ile Ile Asn Gly Gly Gly Asn Thr Tyr Tyr Ala Ser Trp
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Ile Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala
100 105 110
Arg Gly Ile Gln His Gly Gly Gly Asn Ser Asp Tyr Tyr Tyr Tyr Gly
115 120 125
Met Asp Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
245 250 255
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
260 265 270
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
275 280 285
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
290 295 300
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
305 310 315 320
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
325 330 335
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
340 345 350
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
355 360 365
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
370 375 380
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
385 390 395 400
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
405 410 415
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
420 425 430
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
435 440 445
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
450 455 460
Ser Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 63
<211> 1428
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 63
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgaa 60
gtccaactgg tggaaagcgg gggaggactg gtgcagccgg gcggatccct ccggctgtca 120
tgtgctgcat cgggaatttc cctctcctcc gacgcgatta gctgggtcag acaggccccc 180
ggaaaggggc tggagtacat cggtatcatc aacggcggcg gaaacaccta ctacgcctcc 240
tgggccaagg gccgcttcac catctcgcgg cataattcca agaacactct gtacttgcaa 300
atgaactccc tgagggccga ggacaccgcc gtgtactact gcgcgcgcgg catccagcac 360
ggtggtggaa acagcgacta ctactactat gggatggatc tgtggggcca gggaactctt 420
gtgaccgtgt cgtcagcatc caccaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtggac 720
aagaaagttg agcccaaatc ttgtgacaaa actcacacat gcccaccgtg cccagcacct 780
gaactcctgg ggggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt acaacagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgccc 1140
ccatcccggg atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttct tatattcaaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctcccg ggaaatga 1428
<210> 64
<211> 475
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 64
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Ser Leu
35 40 45
Ser Ser Asp Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Tyr Ile Gly Ile Ile Asn Gly Gly Gly Asn Thr Tyr Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg His Asn Ser Lys Asn Thr
85 90 95
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Ile Gln His Gly Gly Gly Asn Ser Asp Tyr Tyr
115 120 125
Tyr Tyr Gly Met Asp Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475
<210> 65
<211> 1404
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 65
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcgctggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagcctctg gattctccct cagtaactat gcaatgacct gggtccgcca ggctccaggg 180
aaggggctag aatacatcgg aatcattagt actggcggta tcacatacta tatggactcg 240
gcaaaaggcc gattcaccat ctccagaacc tcgaccacgg tggatctgaa aatgaccagt 300
ctgacaaccg aggacacggc cacctatttc tgtggcagaa atgctggtgg tagttatatt 360
ttctattatt ttgacttgtg gggccaaggc accctggtca ctgtctcttc agcatccacc 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt 720
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 1140
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcttata ttcaaagctc accgtggaca agagcaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ctcccgggaa atga 1404
<210> 66
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 66
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser
35 40 45
Asn Tyr Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Tyr Ile Gly Ile Ile Ser Thr Gly Gly Ile Thr Tyr Tyr Met Asp Ser
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Met Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Gly
100 105 110
Arg Asn Ala Gly Gly Ser Tyr Ile Phe Tyr Tyr Phe Asp Leu Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 67
<211> 1404
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 67
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcgttggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagcctctg gattctccct cagtaactat gcaatgacct gggtccgcca ggctccaggg 180
aaggggctag aatacatcgg aatcattagt actggcggta tcacatacta tatggactcg 240
gcaaaaggcc gattcaccat ctccagaacc tcgaccacgg tggatctgaa aatgaccagt 300
ctgacaaccg aggacacggc cacctatttc tgtggcagaa atgctggtgg tagttatatt 360
ttctattatt tcgacttgtg gggccaaggg accctcgtca ctgtctcttc agcatccacc 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt 720
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 1140
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcttata ttcaaagctc accgtggaca agagcaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ctcccgggaa atga 1404
<210> 68
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 68
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser
35 40 45
Asn Tyr Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Tyr Ile Gly Ile Ile Ser Thr Gly Gly Ile Thr Tyr Tyr Met Asp Ser
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Met Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Gly
100 105 110
Arg Asn Ala Gly Gly Ser Tyr Ile Phe Tyr Tyr Phe Asp Leu Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 69
<211> 1389
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 69
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcgctggagg agtccggggg tcgcctggtc gcgcctggga cacccctgac actcacctgc 120
acagtctctg gattctccct cagtagttac cacatgagct gggtccgcca ggctccaggg 180
gaggggctgg aatggatcgg aggcattact gctatgagtc gcacatacta cgcgagctgg 240
gcgaaaggcc gattcaccat ctccaaaacc tcgaccacgg tccatctgaa aatcaccagt 300
ccgacaaccg aggacacggc cacctatttc tgtgccaggg aacctggttt tgttagtaac 360
atctggggcc caggcaccct ggtcaccgtc tccttagcat ccaccaaggg cccatcggtc 420
ttccccctgg caccctcctc caagagcacc tctgggggca cagcggccct gggctgcctg 480
gtcaaggact acttccccga accggtgacg gtgtcgtgga actcaggcgc cctgaccagc 540
ggcgtgcaca ccttcccggc tgtcctacag tcctcaggac tctactccct cagcagcgtg 600
gtgaccgtgc cctccagcag cttgggcacc cagacctaca tctgcaacgt gaatcacaag 660
cccagcaaca ccaaggtgga caagaaagtt gagcccaaat cttgtgacaa aactcacaca 720
tgcccaccgt gcccagcacc tgaactcctg gggggaccgt cagtcttcct cttcccccca 780
aaacccaagg acaccctcat gatctcccgg acccctgagg tcacatgcgt ggtggtggac 840
gtgagccacg aagaccctga ggtcaagttc aactggtacg tggacggcgt ggaggtgcat 900
aatgccaaga caaagccgcg ggaggagcag tacaacagca cgtaccgtgt ggtcagcgtc 960
ctcaccgtcc tgcaccagga ctggctgaat ggcaaggagt acaagtgcaa ggtctccaac 1020
aaagccctcc cagcccccat cgagaaaacc atctccaaag ccaaagggca gccccgagaa 1080
ccacaggtgt acaccctgcc cccatcccgg gatgagctga ccaagaacca ggtcagcctg 1140
acctgcctgg tcaaaggctt ctatcccagc gacatcgccg tggagtggga gagcaatggg 1200
cagccggaga acaactacaa gaccacgcct cccgtgctgg actccgacgg ctccttcttc 1260
ttatattcaa agctcaccgt ggacaagagc aggtggcagc aggggaacgt cttctcatgc 1320
tccgtgatgc atgaggctct gcacaaccac tacacgcaga agagcctctc cctgtctccc 1380
gggaaatga 1389
<210> 70
<211> 462
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 70
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Ala Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr His Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu
50 55 60
Trp Ile Gly Gly Ile Thr Ala Met Ser Arg Thr Tyr Tyr Ala Ser Trp
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val His Leu
85 90 95
Lys Ile Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala
100 105 110
Arg Glu Pro Gly Phe Val Ser Asn Ile Trp Gly Pro Gly Thr Leu Val
115 120 125
Thr Val Ser Leu Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
225 230 235 240
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
245 250 255
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
260 265 270
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
275 280 285
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
290 295 300
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
305 310 315 320
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
325 330 335
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
340 345 350
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
355 360 365
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
370 375 380
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
385 390 395 400
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
405 410 415
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
420 425 430
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
435 440 445
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 71
<211> 1404
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 71
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactcccag 60
tcggtggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagtctctg gattctccct cagtagctat gcaatgggct gggtccgcca ggctccaggg 180
gaggggctgg aatggatcgg aaccattagt actggtggta ttacatacta cgcgagctgg 240
gcgaaaggcc gattcaccat ctccaaaacc tcgaccacgg tggatctgaa aatcaccagt 300
ccgacaaccg aggacacggc cacctatttc tgtgccagag tgggtagtag tggttatctt 360
ttctacttct ttaacttgtg gggccaaggc accctcgtca ctgtctcctc agcatccacc 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt 720
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 1140
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcttata ttcaaagctc accgtggaca agagcaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ctcccgggaa atga 1404
<210> 72
<211> 467
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 72
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Ala Met Gly Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu
50 55 60
Trp Ile Gly Thr Ile Ser Thr Gly Gly Ile Thr Tyr Tyr Ala Ser Trp
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Ile Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala
100 105 110
Arg Val Gly Ser Ser Gly Tyr Leu Phe Tyr Phe Phe Asn Leu Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 73
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 73
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagccag 60
tcggtgaagg agtccagggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagtctctg gattctccct cagtaggtat acattgatct gggtccgcca ggctccaggg 180
aaggggctgg aatggatcgg aatcatagat agtagtagta gtgcatacta cgcgaggtgg 240
gcgaaaggcc gattcaccat ctccaaaacc tcgaccacgg tggatctgaa aatcaccagt 300
ccgacaaccg aggacacggc cacctatttc tgtgccagag acagagtcct aagctacgat 360
gactatggtg atttgcccga tggtttcgat ccctggggcc caggcaccct ggtcaccgtc 420
tcctcagcat ccaccaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaactcctg 780
gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg 840
acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc 900
aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag 960
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 1020
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcccccat cgagaaaacc 1080
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatcccgg 1140
gatgagctga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc 1200
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1260
cccgtgctgg actccgacgg ctccttcttc ttatattcaa agctcaccgt ggacaagagc 1320
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 1380
tacacgcaga agagcctctc cctgtctccc gggaaatga 1419
<210> 74
<211> 472
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 74
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Lys Glu Ser Arg Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser
35 40 45
Arg Tyr Thr Leu Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Asp Ser Ser Ser Ser Ala Tyr Tyr Ala Arg Trp
65 70 75 80
Ala Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu
85 90 95
Lys Ile Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala
100 105 110
Arg Asp Arg Val Leu Ser Tyr Asp Asp Tyr Gly Asp Leu Pro Asp Gly
115 120 125
Phe Asp Pro Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
245 250 255
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
260 265 270
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
275 280 285
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
290 295 300
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
305 310 315 320
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
325 330 335
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
340 345 350
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
355 360 365
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
370 375 380
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
385 390 395 400
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
405 410 415
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
420 425 430
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
435 440 445
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
450 455 460
Ser Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 75
<211> 1428
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 75
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgaa 60
gtgcagctgg tcgaatctgg aggaggactg gtgcagcctg gagggagcct gagactgagt 120
tgcgcagcaa gcgggtttag cctgtcccga tacaccctga tctgggtgag acaggccccc 180
ggcaagggac tggagtgggt ctctatcatt gacagctcct ctagtgccta ctatgctgat 240
agtgtgaagg gcaggttcac catttcacgc gacaacgcta aaaatagcct gtatctgcag 300
atgaactccc tgcgggcaga agacacagcc gtgtactatt gcgcacggga tagagtcctg 360
agctacgacg attatgggga cctgcctgac ggctttgatc cttggggaca gggaactctg 420
gtgacagtga gcagcgcatc caccaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtggac 720
aagaaagttg agcccaaatc ttgtgacaaa actcacacat gcccaccgtg cccagcacct 780
gaactcctgg ggggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt acaacagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgccc 1140
ccatcccggg atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttct tatattcaaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctcccg ggaaatga 1428
<210> 76
<211> 475
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 76
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu
35 40 45
Ser Arg Tyr Thr Leu Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Ile Ile Asp Ser Ser Ser Ser Ala Tyr Tyr Ala Asp
65 70 75 80
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser
85 90 95
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Arg Val Leu Ser Tyr Asp Asp Tyr Gly Asp Leu
115 120 125
Pro Asp Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475
<210> 77
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 77
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgag 60
ctcgtgatga cccagactcc atcctccgtg tctgcagctg tgggaggcac agtcaccatc 120
aattgccagg ccagtcagag cattagtagc tacttagcct ggtatcagca gaaaccaggg 180
cagcctccca agctcctgat ctattatgca tccactctgg cgtctggggt cccatcgcgg 240
ttcaaaggca gtggctctgg gacagagttc actctcacca tcaccggcgt gcagtgtgac 300
gatgctgcca cttactactg tctaggtgtt tatggttata gttttgatga tggtattgct 360
ttcggcggag ggaccgagct ggagatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 78
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 78
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Leu Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Lys Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Glu Leu Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 79
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 79
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta tttctagtct gcagtgcgac 300
gatttcgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 80
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 80
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 81
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 81
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta ttactggtgt gcagtgcgac 300
gatttcgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 82
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 82
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 83
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 83
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta tttctagtct gcagtgcgac 300
gatgccgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 84
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 84
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 85
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 85
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta ttactggtgt gcagtgcgac 300
gatgccgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 86
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 86
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 87
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 87
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttcaaaggtt ccggcagcgg aactgagttt acactgacta ttactggtgt gcagtgcgac 300
gatgccgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 88
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 88
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Lys Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 89
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 89
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccgtg tccgctgcag tgggaggtac agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta ttactggtgt gcagtgcgac 300
gatgccgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacaaaagt ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 90
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 90
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Val Ser Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 91
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 91
atggggtggt cttgcatcat tctgttcctg gtggcaaccg ccacaggtgt gcactccgac 60
atccagatga ctcagagtcc atcaaccctg tccgctagcg tgggagatag agtgactatc 120
acctgtcagg cctctcagag tatttccagc tacctggctt ggtatcagca gaagccaggc 180
aaagcaccca agctgctgat ctactatgct agtacactgg catcaggagt gccttcccgc 240
ttctcaggtt ccggcagcgg aactgagttt acactgacta ttactggtgt gcagtgcgac 300
gatgccgcta cctactattg cctgggggtg tacggttatt ctttcgacga tggcatcgca 360
tttggcggag ggacagagct ggagattaag aggactgtgg ccgctcccag tgtgttcatt 420
tttcccccta gcgacgaaca gctgaaaagc gggacagcct ctgtggtgtg tctgctgaac 480
aatttttacc ctcgggaggc caaagtgcag tggaaggtgg ataacgctct gcagtctggc 540
aatagtcagg agtcagtgac cgaacaggac tccaaagata gcacatattc tctgtcatcc 600
accctgacac tgtccaaggc agactacgag aagcacaaag tgtatgcctg cgaagtgact 660
catcagggcc tgagctctcc cgtgaccaag agctttaaca ggggagaatg ttga 714
<210> 92
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 92
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Glu Leu Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 93
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 93
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
attcagatga ctcagtcccc ctcctccctt tcggcctccg tcggcgaccg cgtgaccatt 120
acctgtcaag ccagccagtc catctcctcc tacttggcct ggtaccaaca gaagccagga 180
aaagctccta agctgctcat ctactacgcc tccactctgg cgtctggtgt cccgtcacgg 240
ttcagcgggt ccggatcagg aactgacttc accctgacga tcagcagcct ccagtgcgag 300
gattttgcga cctactactg cctgggggtg tatggttact cgttcgacga tggaatcgca 360
ttcggctcgg gcaccaaggt ggaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 94
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 94
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 95
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 95
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
attgtgatga cccagactcc tctctccctg cccgtgactc ctggagaacc cgcctcgatc 120
tcatgtcaag cgtcgcagag catctcctca tacttggctt ggtacctcca aaagccgggc 180
cagagcccac agcttctgat ctattacgcc tccaccctgg cctcgggcgt gccggatcgg 240
ttttccggtt ctggaagcgg aaccgacttc accctgaaaa tctcccgcgt ggagtgcgag 300
gacgtgggcg tgtactactg cctgggagtc tacgggtact ccttcgatga cggcattgca 360
ttcgggtccg gtaccaaggt cgaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 96
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 96
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val
20 25 30
Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Asp Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg
85 90 95
Val Glu Cys Glu Asp Val Gly Val Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 97
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 97
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgaa 60
attgtgctca ctcaatcccc tgccaccctt tccttgtccc ccggcgaaag agccactctg 120
tcatgtcaag ccagccagtc gatctcctct tacctggctt ggtaccagca gaagccagga 180
caggcaccgc gcctgctgat ctactacgcg tcgaccctcg cctcgggaat cccggcccgg 240
ttcagcggat caggctccgg taccgacttc actctgacca ttagctccct ggagtgcgag 300
gacttcgcgg tgtattactg cctgggggtg tacggctact ccttcgatga cggaatcgcc 360
tttgggagcg gtaccaaggt cgagatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 98
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 98
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu
20 25 30
Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Ile Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Glu Cys Glu Asp Phe Ala Val Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 99
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 99
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
atcgtgatga cccaaagccc tgactccctt gccgtgtcac tcggagaacg cgccaccatc 120
aactgtcaag cgtcgcagtc catctcctca tacctggcct ggtatcagca gaaaccgggg 180
cagccgccaa agctgctgat ctactacgct tccactctgg cctccggcgt gcccgatcgg 240
ttctccggat cgggctccgg caccgacttt actctgacca ttagcagcct ccagtgcgag 300
gacgtggcgg tgtactactg cttgggtgtc tacggatact ccttcgacga cgggatcgca 360
ttcggttcgg gaaccaaggt cgagattaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 100
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 100
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val
20 25 30
Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Asp Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Val Ala Val Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 101
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 101
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgaa 60
atcgtcttga cccaaagccc tgacttccaa tccgtgaccc ccaaggaaaa ggtcaccatc 120
acgtgtcagg cctcccagtc aatttcctcg taccttgcgt ggtaccagca gaagccagac 180
cagtccccga agctcctgat taagtacgca tccaccctgg ctagcggagt gccgagccgg 240
ttctcgggat ccggctctgg aactgacttc actctgacca tcaactcgct cgagtgcgaa 300
gatgccgcca cttactattg cctgggggtg tacgggtact catttgacga tggcatcgcc 360
ttcggctccg gtaccaaagt ggagatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 102
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 102
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val
20 25 30
Thr Pro Lys Glu Lys Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys
50 55 60
Leu Leu Ile Lys Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser
85 90 95
Leu Glu Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 103
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 103
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
gtcgtgatga ctcaaagccc cgcattcctt tccgtgactc ctggagaaaa ggtcaccatc 120
acctgtcaag ccagccagtc catttcgtcc tacttggcct ggtatcagca gaagccagac 180
caggccccga agctgctgat taagtacgcc tccaccctgg ccagcggagt gccgtcacgg 240
ttctccgggt ccggctcagg aaccgacttc acgttcacca tctcgtccct cgagtgcgaa 300
gatgctgcga cttactactg cctgggcgtg tacggttact cgtttgatga cggcatcgcg 360
ttcgggtctg gaaccaaagt ggagatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 104
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 104
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val
20 25 30
Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys
50 55 60
Leu Leu Ile Lys Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser
85 90 95
Leu Glu Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 105
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 105
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
atcgtcctca ctcaatcccc cgcttcactc gccgtgtccc ctggtcaacg cgccaccatt 120
acgtgtcagg cgtcccagtc catttcgagc taccttgcat ggtaccagca gaagcctgga 180
cagcccccga aactgctgat ctattacgcc tccaccttgg cctcgggagt gccagcgcgg 240
tttagcggtt cgggctccgg cactgacttc actctgacca tcaacccggt ggagtgcgaa 300
gataccgcca actactactg cctgggggtg tacggatact cattcgacga cgggatcgcc 360
ttcggaagcg gcaccaaggt cgaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 106
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 106
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val
20 25 30
Ser Pro Gly Gln Arg Ala Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Pro
85 90 95
Val Glu Cys Glu Asp Thr Ala Asn Tyr Tyr Cys Leu Gly Val Tyr Gly
100 105 110
Tyr Ser Phe Asp Asp Gly Ile Ala Phe Gly Ser Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 107
<211> 711
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 107
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgag 60
ctcgtgatga cccagactcc agcctctgtg gaggtagctg tgggaggcac agtcaccatc 120
aagtgccagg ccagtcagag cattaatacc tacttagcct ggtatcagca gaaaccaggg 180
cagcctccca agctcctgat ctacagggca tccactctgg catctggggt cccatcgcgg 240
ttcaaaggca gtggatctgg gacagagttc actctcacca ttagcgacct ggagtgtgcc 300
gatgctgcca cttactactg tcaacagagt gttcgtgtta ttgatgttga taatactttc 360
ggcggaggga ccgaggtggt ggtcaaacga actgtggctg caccatctgt cttcatcttc 420
ccgccatctg atgagcagtt gaaatctgga actgcctctg ttgtgtgcct gctgaataac 480
ttctatccca gagaggccaa agtacagtgg aaggtggata acgccctcca atcgggtaac 540
tcccaggaga gtgtcacaga gcaggacagc aaggacagca cctacagcct cagcagcacc 600
ctgacgctga gcaaagcaga ctacgagaaa cacaaagtct acgcctgcga agtcacccat 660
cagggcctga gctcgcccgt cacaaagagc ttcaacaggg gagagtgttg a 711
<210> 108
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 108
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Leu Val Met Thr Gln Thr Pro Ala Ser Val Glu Val
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile
35 40 45
Asn Thr Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Lys Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Val Arg
100 105 110
Val Ile Asp Val Asp Asn Thr Phe Gly Gly Gly Thr Glu Val Val Val
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 109
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 109
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgag 60
ctcgtgatga cccagactcc atcctacacg tctgcagctg tgggagacac agtcaccatc 120
aagtgccagg ccagtcagac cattggtggt agcgacttat cctggtatca gcagaaacca 180
gggcagcctc ccaaactcct gatctggtat gcaaccaatc tgccatctgg ggtcccatcg 240
cggttcagtg gcagtagatc tgggacagag tacactctca ccatcagcgg cgtgcagtgt 300
gaggatgctg ccacctacta ctgtctaggt ggttatgctg ctgcttctta cagaactgct 360
ttcggcggag ggaccgaggt ggtcgtcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 110
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 110
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Leu Val Met Thr Gln Thr Pro Ser Tyr Thr Ser Ala
20 25 30
Ala Val Gly Asp Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Thr Ile
35 40 45
Gly Gly Ser Asp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
50 55 60
Lys Leu Leu Ile Trp Tyr Ala Thr Asn Leu Pro Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Arg Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser
85 90 95
Gly Val Gln Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr
100 105 110
Ala Ala Ala Ser Tyr Arg Thr Ala Phe Gly Gly Gly Thr Glu Val Val
115 120 125
Val Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 111
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 111
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
attcagatga cccagagccc ttccttcctg tcagccagcg tcggggatag agtcacaatc 120
acttgccagg ccagccagac cattggcggg agcgacctgt cctggtacca gcagaagccc 180
ggaaaagccc ctaagctgct gatctactat gctacaaacc tgccatctgg cgtgcccagc 240
cggttctctg gaagtggctc agggactgac tttaccctga caattagctc cctgcagtgc 300
gaggatttcg ccacctacta ttgtctgggg ggctatgccg ccgcaagcta ccgcaccgcc 360
ttcggaggag gaactaaagt ggaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 112
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 112
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Thr Ile
35 40 45
Gly Gly Ser Asp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Tyr Ala Thr Asn Leu Pro Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Cys Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr
100 105 110
Ala Ala Ala Ser Tyr Arg Thr Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 113
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 113
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
attcagatga ctcagagccc ttccttcctg tccgcttccg tcggggatcg ggtcacaatc 120
acttgccagg cctcacagac tattggcggg agcgacctgt cctggtacca gcagaagccc 180
ggaaaagcac ctaagctgct gatctactat gccacaaacc tgccatctgg cgtgcccagc 240
cggttctctg gaagtggctc agggactgac tttaccctga caattagctc cctgcagtgc 300
gaggatgccg ctacctacta ttgtctgggg ggctacgccg ccgcttcata caggaccgcc 360
ttcggaggag gaactaaagt ggaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 114
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 114
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Thr Ile
35 40 45
Gly Gly Ser Asp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Tyr Ala Thr Asn Leu Pro Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr
100 105 110
Ala Ala Ala Ser Tyr Arg Thr Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 115
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 115
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgaa 60
gtgttgatga cccagactcc atcctccgtg tctgcagctg tgggagacac agtcaccatc 120
aagtgccagg ccagtcagag cattagtagt gtcttgtcct ggtatcagca gaaaccaggg 180
cagcctccca agctcctgat ctatctggca tccactctgg catctggggt cccatcgcgg 240
ttcagcggca gtagatctgg gacagagttc actctcacca tcagcgacct ggagtgtgac 300
gatgctgcca cttactactg tcaaaccaat tatggtacta gtagtagtaa ttatggtttt 360
gctttcggcg gagggaccga ggtggtcgtc aaacgaactg tggctgcacc atctgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttga 717
<210> 116
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 116
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Leu Met Thr Gln Thr Pro Ser Ser Val Ser Ala
20 25 30
Ala Val Gly Asp Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Val Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Arg Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly
100 105 110
Thr Ser Ser Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Glu Val
115 120 125
Val Val Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 117
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 117
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
attcagatga cccagtcccc aagctcgctg tccgcctccg tgggcgaccg cgtgaccatc 120
acgtgccagg cgtcccagtc aattagcagc gtgctctcct ggtaccaaca gaagccgggg 180
aaagcaccca agctgctgat ctacttggcc tccactctgg cctcgggagt gccttcacgg 240
ttctccggat cgggatctgg tactgatttc accctcacca tctcgagcct tcagtgcgag 300
gacttcgcta cttactattg tcaaaccaac tacggaacct ccagctccaa ctacggcttt 360
gccttcggtg gcgggaccaa ggtcgaaatc aaacgaactg tggctgcacc atctgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttga 717
<210> 118
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 118
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Val Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly
100 105 110
Thr Ser Ser Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Lys Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 119
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 119
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
attcagatga cccagtcccc aagctcgctg tccgcctccg tgggcgaccg cgtgaccatc 120
acgtgccagg cgtcccagtc aattagcagc gtgctctcct ggtaccaaca gaagccgggg 180
aaagcaccca agctgctgat ctacttggcc tccactctgg cctcgggagt gccttcacgg 240
ttctccggat cgggatctgg tactgatttc accctcacca tctcgagcct tcagtgcgag 300
gacgccgcta cttactattg tcaaaccaac tacggaacct ccagctccaa ctacggcttt 360
gccttcggtg gcgggaccaa ggtcgaaatc aaacgaactg tggctgcacc atctgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttga 717
<210> 120
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 120
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Val Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly
100 105 110
Thr Ser Ser Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Lys Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 121
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 121
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgac 60
attcagatga cccagtcccc aagctcgctg tccgcctccg tgggcgaccg cgtgaccatc 120
acgtgccagg cgtcccagtc aattagcagc gtgctctcct ggtaccaaca gaagccgggg 180
aaagcaccca agctgctgat ctacttggcc tccactctgg cctcgggagt gccttcacgg 240
ttctccggat cgggatctgg tactgatttc accctcacca tctcgagcct tcagtgcgag 300
gacatcgcta cttactattg tcaaaccaac tacggaacct ccagctccaa ctacggcttt 360
gccttcggtg gcgggaccaa ggtcgaaatc aaacgaactg tggctgcacc atctgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttga 717
<210> 122
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 122
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Ser Val Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly
100 105 110
Thr Ser Ser Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Lys Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 123
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 123
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgca 60
ttcgaattga cccagactcc atcctccgtg gaggcagctg tgggaggcac agtcaccatc 120
aagtgccagg ccagtcagag catttacagt tatttagcct ggtatcagca gaaaccaggg 180
cagcctccca agctcctgat ctattctgca tccactctgg catctggggt ctcatcgcgg 240
ttcagaggca gtggatctgg gacagaatac actctcacca tcagcgacct ggagtgtgcc 300
gatgctgcca cttactactg tcaaacctat tatgatattg ttactagtac tttcggcgga 360
gggaccgagg tggtcgtcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 420
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 480
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 540
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 600
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 660
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttga 705
<210> 124
<211> 234
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 124
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Ala Phe Glu Leu Thr Gln Thr Pro Ser Ser Val Glu Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile
35 40 45
Tyr Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg
65 70 75 80
Phe Arg Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Thr Tyr Tyr Asp
100 105 110
Ile Val Thr Ser Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 125
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 125
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgca 60
ttcgaattga cccagactcc atcctccgtg gaggcagctg tgggaggcac agtcaccatc 120
aagtgccagg ccagtcagag catttacagt tatttagcct ggtatcagca gaaaccaggg 180
cagcctccca agctcctgat ctattctgca tccactctgg catctggggt ctcatcgcgg 240
ttcagaggca gtggatctgg gacagaatac attctcacca tcagcgacct ggagtgtgcc 300
gatgctgcca cttactactg tcaaacctat tatgatattg ttactagtac tttcggcgga 360
gggaccgagg tggtggtcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 420
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 480
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 540
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 600
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 660
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttga 705
<210> 126
<211> 234
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 126
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Ala Phe Glu Leu Thr Gln Thr Pro Ser Ser Val Glu Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile
35 40 45
Tyr Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg
65 70 75 80
Phe Arg Gly Ser Gly Ser Gly Thr Glu Tyr Ile Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Thr Tyr Tyr Asp
100 105 110
Ile Val Thr Ser Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 127
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 127
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgcc 60
gtcgtgctga cccagactgc atcccccgtg tctggagttg tgggaggcac agtcaccatc 120
aagtgccagg ccagtcagaa catttacagc aatttagcct ggtatcagca gaaaccaggg 180
cagcgtccca agctcctgat gtatgatgca tccactctgg catctggggt cccatcgcgg 240
ttcaaaggca gtggatctgg gacacagttc actctcacca tcagcgacct ggagtgtgcc 300
gatgctgcca cttactactg tcaaagtatt agtagtgttg acaataatgt tttcggcgga 360
gggaccgagg tggtggtcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 420
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 480
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 540
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 600
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 660
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttga 705
<210> 128
<211> 234
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 128
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Ala Val Val Leu Thr Gln Thr Ala Ser Pro Val Ser Gly
20 25 30
Val Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Asn Ile
35 40 45
Tyr Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys
50 55 60
Leu Leu Met Tyr Asp Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Ser Ile Ser Ser
100 105 110
Val Asp Asn Asn Val Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 129
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 129
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactccgta 60
ttcgaattga cccagactcc atcccccgtg tctgcagctg tgggaggcac agtcaccatc 120
aggtgccagg ccagtcagaa cattaagagc tacttagcct ggtatcagca gaaaccaggg 180
cagcctccca aactcctgat ctatgaagca tccattctgg catctggggt ctcatcgcgg 240
ttcaaaggca gtggatctgg gacagagttc actctcacca tcagcgacct ggagtgtgcc 300
gatgctgcca cttactactg tcaaagctat tatgctgcta gtagtaatgc tttcggcgga 360
gggaccgagg tggtggtcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 420
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 480
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 540
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 600
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 660
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttga 705
<210> 130
<211> 234
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 130
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Val Phe Glu Leu Thr Gln Thr Pro Ser Pro Val Ser Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Arg Cys Gln Ala Ser Gln Asn Ile
35 40 45
Lys Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Tyr Glu Ala Ser Ile Leu Ala Ser Gly Val Ser Ser Arg
65 70 75 80
Phe Lys Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp
85 90 95
Leu Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Ser Tyr Tyr Ala
100 105 110
Ala Ser Ser Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 131
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 131
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgag 60
ctcgtgatga cccagactcc atcctccgtg tctgcagctg tgggaggcac agtcaccatc 120
aattgccagg ccagtcagag cattagtaac tacttatcct ggtatcagca gaaaccagga 180
cagcctccca agctcctgat ctttgctgca tccaaactgg catcttgggt cccaaagcgg 240
ttcagtggca gcagatctgg gatagaatac actctcacca ttagcggcgt gcagtgtgac 300
gatgctgcca cttacttctg tctaggagtt tatagtatta gtactgatga tggagctgct 360
ttcggcggag ggaccgaggt ggtcgtcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 132
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 132
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Leu Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala
20 25 30
Ala Val Gly Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Asn Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys
50 55 60
Leu Leu Ile Phe Ala Ala Ser Lys Leu Ala Ser Trp Val Pro Lys Arg
65 70 75 80
Phe Ser Gly Ser Arg Ser Gly Ile Glu Tyr Thr Leu Thr Ile Ser Gly
85 90 95
Val Gln Cys Asp Asp Ala Ala Thr Tyr Phe Cys Leu Gly Val Tyr Ser
100 105 110
Ile Ser Thr Asp Asp Gly Ala Ala Phe Gly Gly Gly Thr Glu Val Val
115 120 125
Val Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 133
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 133
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
attcagatga cccagtctcc ttcctccctg tccgcttccg tcggcgatag agtcacaatc 120
acttgccagg cttcccagag catcagcaac tacctgtcct ggtatcagca gaagcccggc 180
aaagcaccta agctgctgat ctacgccgct tctaaactgg caagcggagt gccaagccgg 240
ttctctggaa gtgggtcagg aactgacttt accctgacaa ttagctccct gcagtgcgag 300
gatttcgcta cctactattg tctgggcgtc tattcaatct caactgacga cggagccgca 360
ttcggagggg gcaccaaagt ggaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 134
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 134
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Asn Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Ala Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Ser
100 105 110
Ile Ser Thr Asp Asp Gly Ala Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 135
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 135
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcacagcgat 60
attcagatga cccagagccc ttcctccctg tccgctagtg tcggggatag agtgaccatt 120
acttgccagg ccagccagag cattagcaac tacctgtcct ggtatcagca gaagcccggc 180
aaagctccta agctgctgat ctacgccgct tctaaactgg caagcggagt gccaagccgg 240
ttctctggaa gtgggtcagg aactgacttt accctgacaa ttagctccct gcagtgcgag 300
gatgcagcca cctactattg tctgggcgtc tactcaatct caaccgacga cggagctgct 360
tttggagggg gcactaaggt ggaaatcaaa cgaactgtgg ctgcaccatc tgtcttcatc 420
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 480
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 540
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 600
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 660
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg ttga 714
<210> 136
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 136
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile
35 40 45
Ser Asn Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Ala Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Ser
100 105 110
Ile Ser Thr Asp Asp Gly Ala Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 137
<211> 993
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 137
gcatccacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 720
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcttatat tcaaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tcccgggaaa tga 993
<210> 138
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 138
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 139
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 139
cgaactgtgg ctgcaccatc tgtcttcatc ttcccgccat ctgatgagca gttgaaatct 60
ggaactgcct ctgttgtgtg cctgctgaat aacttctatc ccagagaggc caaagtacag 120
tggaaggtgg ataacgccct ccaatcgggt aactcccagg agagtgtcac agagcaggac 180
agcaaggaca gcacctacag cctcagcagc accctgacgc tgagcaaagc agactacgag 240
aaacacaaag tctacgcctg cgaagtcacc catcagggcc tgagctcgcc cgtcacaaag 300
agcttcaaca ggggagagtg ttga 324
<210> 140
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 140
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 141
<211> 972
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 141
gggcaaccta aggctccatc agtcttccca ctggccccct gctgcgggga cacacccagc 60
tccacggtga ccctgggctg cctggtcaaa ggctacctcc cggagccagt gaccgtgacc 120
tggaactcgg gcaccctcac caatggggta cgcaccttcc cgtccgtccg gcagtcctca 180
ggcctctact cgctgagcag cgtggtgagc gtgacctcaa gcagccagcc cgtcacctgc 240
aacgtggccc acccagccac caacaccaaa gtggacaaga ccgttgcacc ctcgacatgc 300
agcaagccca cgtgcccacc ccctgaactc ctggggggac cgtctgtctt catcttcccc 360
ccaaaaccca aggacaccct catgatctca cgcacccccg aggtcacatg cgtggtggtg 420
gacgtgagcc aggatgaccc cgaggtgcag ttcacatggt acataaacaa cgagcaggtg 480
cgcaccgccc ggccgccgct acgggagcag cagttcaaca gcacgatccg cgtggtcagc 540
accctcccca tcacgcacca ggactggctg aggggcaagg agttcaagtg caaagtccac 600
aacaaggcac tcccggcccc catcgagaaa accatctcca aagccagagg gcagcccctg 660
gagccgaagg tctacaccat gggccctccc cgggaggagc tgagcagcag gtcggtcagc 720
ctgacctgca tgatcaacgg cttctaccct tccgacatct cggtggagtg ggagaagaac 780
gggaaggcag aggacaacta caagaccacg ccggccgtgc tggacagcga cggctcctac 840
ttcctctaca acaagctctc agtgcccacg agtgagtggc agcggggcga cgtcttcacc 900
tgctccgtga tgcacgaggc cttgcacaac cactacacgc agaagtccat ctcccgctct 960
ccgggtaaat ga 972
<210> 142
<211> 323
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 142
Gly Gln Pro Lys Ala Pro Ser Val Phe Pro Leu Ala Pro Cys Cys Gly
1 5 10 15
Asp Thr Pro Ser Ser Thr Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Leu Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Thr Leu Thr Asn
35 40 45
Gly Val Arg Thr Phe Pro Ser Val Arg Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Ser Val Thr Ser Ser Ser Gln Pro Val Thr Cys
65 70 75 80
Asn Val Ala His Pro Ala Thr Asn Thr Lys Val Asp Lys Thr Val Ala
85 90 95
Pro Ser Thr Cys Ser Lys Pro Thr Cys Pro Pro Pro Glu Leu Leu Gly
100 105 110
Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
115 120 125
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
130 135 140
Asp Asp Pro Glu Val Gln Phe Thr Trp Tyr Ile Asn Asn Glu Gln Val
145 150 155 160
Arg Thr Ala Arg Pro Pro Leu Arg Glu Gln Gln Phe Asn Ser Thr Ile
165 170 175
Arg Val Val Ser Thr Leu Pro Ile Thr His Gln Asp Trp Leu Arg Gly
180 185 190
Lys Glu Phe Lys Cys Lys Val His Asn Lys Ala Leu Pro Ala Pro Ile
195 200 205
Glu Lys Thr Ile Ser Lys Ala Arg Gly Gln Pro Leu Glu Pro Lys Val
210 215 220
Tyr Thr Met Gly Pro Pro Arg Glu Glu Leu Ser Ser Arg Ser Val Ser
225 230 235 240
Leu Thr Cys Met Ile Asn Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu
245 250 255
Trp Glu Lys Asn Gly Lys Ala Glu Asp Asn Tyr Lys Thr Thr Pro Ala
260 265 270
Val Leu Asp Ser Asp Gly Ser Tyr Phe Leu Tyr Asn Lys Leu Ser Val
275 280 285
Pro Thr Ser Glu Trp Gln Arg Gly Asp Val Phe Thr Cys Ser Val Met
290 295 300
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Ile Ser Arg Ser
305 310 315 320
Pro Gly Lys
<210> 143
<211> 315
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полинуклеотид"
<400> 143
ggtgatccag ttgcacctac tgtcctcatc ttcccaccat ctgctgatct tgtggcaact 60
ggaacagtca ccatcgtgtg tgtggcgaat aaatactttc ccgatgtcac cgtcacctgg 120
gaggtggatg gcaccaccca aacaactggc atcgagaaca gtaaaacacc gcagaattct 180
gcagattgta cctacaacct cagcagcact ctgacactga ccagcacaca gtacaacagc 240
cacaaagagt acacctgcaa ggtgacccag ggcacgacct cagtcgtcca gagcttcaat 300
aggggtgact gttag 315
<210> 144
<211> 104
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 144
Gly Asp Pro Val Ala Pro Thr Val Leu Ile Phe Pro Pro Ser Ala Asp
1 5 10 15
Leu Val Ala Thr Gly Thr Val Thr Ile Val Cys Val Ala Asn Lys Tyr
20 25 30
Phe Pro Asp Val Thr Val Thr Trp Glu Val Asp Gly Thr Thr Gln Thr
35 40 45
Thr Gly Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser Ala Asp Cys Thr
50 55 60
Tyr Asn Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr Gln Tyr Asn Ser
65 70 75 80
His Lys Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr Thr Ser Val Val
85 90 95
Gln Ser Phe Asn Arg Gly Asp Cys
100
<210> 145
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 145
ggattctccc tcaatagcta tgcg 24
<210> 146
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 146
Gly Phe Ser Leu Asn Ser Tyr Ala
1 5
<210> 147
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 147
attactactg gtggtaccac a 21
<210> 148
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 148
Ile Thr Thr Gly Gly Thr Thr
1 5
<210> 149
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 149
gatcgggtta aaagctacga tgactatggt gatttagatg ctttcgagcc c 51
<210> 150
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 150
Asp Arg Val Lys Ser Tyr Asp Asp Tyr Gly Asp Leu Asp Ala Phe Glu
1 5 10 15
Pro Trp Gly Pro
20
<210> 151
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 151
ggcttttccc tgaacagcta cgct 24
<210> 152
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 152
Gly Phe Ser Leu Asn Ser Tyr Ala
1 5
<210> 153
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 153
attaccacag gagggactac c 21
<210> 154
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 154
Ile Thr Thr Gly Gly Thr Thr
1 5
<210> 155
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 155
gatcgggtga aatcttacga cgattatgga gacctggatg ctttcgaacc a 51
<210> 156
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 156
Asp Arg Val Lys Ser Tyr Asp Asp Tyr Gly Asp Leu Asp Ala Phe Glu
1 5 10 15
Pro Trp Gly Pro
20
<210> 157
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 157
ggattctcct tcagtagcag ctac 24
<210> 158
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 158
Gly Phe Ser Phe Ser Ser Ser Tyr
1 5
<210> 159
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 159
atttatggtg gtagtagtgg taccact 27
<210> 160
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 160
Ile Tyr Gly Gly Ser Ser Gly Thr Thr
1 5
<210> 161
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 161
gtgactaatg gtggtgattg ggattttaaa ttg 33
<210> 162
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 162
Val Thr Asn Gly Gly Asp Trp Asp Phe Lys Leu
1 5 10
<210> 163
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 163
ggaatcgacc tcagtaatta tgca 24
<210> 164
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 164
Gly Ile Asp Leu Ser Asn Tyr Ala
1 5
<210> 165
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 165
attagtagta atgataagac a 21
<210> 166
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 166
Ile Ser Ser Asn Asp Lys Thr
1 5
<210> 167
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 167
gctgctatgc ctggtggttt aaagaatgct ttcgatccc 39
<210> 168
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 168
Ala Ala Met Pro Gly Gly Leu Lys Asn Ala Phe Asp Pro
1 5 10
<210> 169
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 169
ggcattgatc tgtctaacta cgct 24
<210> 170
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 170
Gly Ile Asp Leu Ser Asn Tyr Ala
1 5
<210> 171
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 171
attagctcca atgacaagac c 21
<210> 172
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 172
Ile Ser Ser Asn Asp Lys Thr
1 5
<210> 173
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 173
gccgctatgc ctggcggact gaagaacgca tttgatcct 39
<210> 174
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 174
Ala Ala Met Pro Gly Gly Leu Lys Asn Ala Phe Asp Pro
1 5 10
<210> 175
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 175
ggaatctccc tcagtagcga tgca 24
<210> 176
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 176
Gly Ile Ser Leu Ser Ser Asp Ala
1 5
<210> 177
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 177
attaatggtg gtggtaacac a 21
<210> 178
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 178
Ile Asn Gly Gly Gly Asn Thr
1 5
<210> 179
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 179
ggcattcaac atggtggtgg taatagtgat tattattatt acggcatgga cctc 54
<210> 180
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 180
Gly Ile Gln His Gly Gly Gly Asn Ser Asp Tyr Tyr Tyr Tyr Gly Met
1 5 10 15
Asp Leu
<210> 181
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 181
ggaatttccc tctcctccga cgcg 24
<210> 182
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 182
Gly Ile Ser Leu Ser Ser Asp Ala
1 5
<210> 183
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 183
atcaacggcg gcggaaacac c 21
<210> 184
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 184
Ile Asn Gly Gly Gly Asn Thr
1 5
<210> 185
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 185
ggcatccagc acggtggtgg aaacagcgac tactactact atgggatgga tctg 54
<210> 186
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 186
Gly Ile Gln His Gly Gly Gly Asn Ser Asp Tyr Tyr Tyr Tyr Gly Met
1 5 10 15
Asp Leu
<210> 187
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 187
ggattctccc tcagtaacta tgca 24
<210> 188
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 188
Gly Phe Ser Leu Ser Asn Tyr Ala
1 5
<210> 189
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 189
attagtactg gcggtatcac a 21
<210> 190
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 190
Ile Ser Thr Gly Gly Ile Thr
1 5
<210> 191
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 191
aatgctggtg gtagttatat tttctattat tttgacttg 39
<210> 192
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 192
Asn Ala Gly Gly Ser Tyr Ile Phe Tyr Tyr Phe Asp Leu
1 5 10
<210> 193
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 193
ggattctccc tcagtaacta tgca 24
<210> 194
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 194
Gly Phe Ser Leu Ser Asn Tyr Ala
1 5
<210> 195
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 195
attagtactg gcggtatcac a 21
<210> 196
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 196
Ile Ser Thr Gly Gly Ile Thr
1 5
<210> 197
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 197
aatgctggtg gtagttatat tttctattat ttcgacttg 39
<210> 198
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 198
Asn Ala Gly Gly Ser Tyr Ile Phe Tyr Tyr Phe Asp Leu
1 5 10
<210> 199
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 199
ggattctccc tcagtagtta ccac 24
<210> 200
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 200
Gly Phe Ser Leu Ser Ser Tyr His
1 5
<210> 201
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 201
attactgcta tgagtcgcac a 21
<210> 202
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 202
Ile Thr Ala Met Ser Arg Thr
1 5
<210> 203
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 203
gaacctggtt ttgttagtaa catc 24
<210> 204
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 204
Glu Pro Gly Phe Val Ser Asn Ile
1 5
<210> 205
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 205
ggattctccc tcagtagcta tgca 24
<210> 206
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 206
Gly Phe Ser Leu Ser Ser Tyr Ala
1 5
<210> 207
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 207
attagtactg gtggtattac a 21
<210> 208
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 208
Ile Ser Thr Gly Gly Ile Thr
1 5
<210> 209
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 209
gtgggtagta gtggttatct tttctacttc tttaacttg 39
<210> 210
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 210
Val Gly Ser Ser Gly Tyr Leu Phe Tyr Phe Phe Asn Leu
1 5 10
<210> 211
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 211
ggattctccc tcagtaggta taca 24
<210> 212
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 212
Gly Phe Ser Leu Ser Arg Tyr Thr
1 5
<210> 213
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 213
atagatagta gtagtagtgc a 21
<210> 214
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 214
Ile Asp Ser Ser Ser Ser Ala
1 5
<210> 215
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 215
gacagagtcc taagctacga tgactatggt gatttgcccg atggtttcga tccc 54
<210> 216
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 216
Asp Arg Val Leu Ser Tyr Asp Asp Tyr Gly Asp Leu Pro Asp Gly Phe
1 5 10 15
Asp Pro
<210> 217
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 217
gggtttagcc tgtcccgata cacc 24
<210> 218
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 218
Gly Phe Ser Leu Ser Arg Tyr Thr
1 5
<210> 219
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 219
attgacagct cctctagtgc c 21
<210> 220
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 220
Ile Asp Ser Ser Ser Ser Ala
1 5
<210> 221
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 221
gatagagtcc tgagctacga cgattatggg gacctgcctg acggctttga tcct 54
<210> 222
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 222
Asp Arg Val Leu Ser Tyr Asp Asp Tyr Gly Asp Leu Pro Asp Gly Phe
1 5 10 15
Asp Pro
<210> 223
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 223
cagagcatta gtagctac 18
<210> 224
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 224
Gln Ser Ile Ser Ser Tyr
1 5
<210> 225
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 225
tatgcatcc 9
<210> 226
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 226
Tyr Ala Ser
1
<210> 227
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 227
ctaggtgttt atggttatag ttttgatgat ggtattgct 39
<210> 228
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 228
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 229
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 229
cagagtattt ccagctac 18
<210> 230
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 230
Gln Ser Ile Ser Ser Tyr
1 5
<210> 231
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 231
tatgctagt 9
<210> 232
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 232
Tyr Ala Ser
1
<210> 233
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 233
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 234
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 234
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 235
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 235
cagagtattt ccagctac 18
<210> 236
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 236
Gln Ser Ile Ser Ser Tyr
1 5
<210> 237
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 237
tatgctagt 9
<210> 238
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 238
Tyr Ala Ser
1
<210> 239
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 239
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 240
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 240
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 241
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 241
cagagtattt ccagctac 18
<210> 242
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 242
Gln Ser Ile Ser Ser Tyr
1 5
<210> 243
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 243
tatgctagt 9
<210> 244
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 244
Tyr Ala Ser
1
<210> 245
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 245
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 246
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 246
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 247
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 247
cagagtattt ccagctac 18
<210> 248
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 248
Gln Ser Ile Ser Ser Tyr
1 5
<210> 249
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 249
tatgctagt 9
<210> 250
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 250
Tyr Ala Ser
1
<210> 251
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 251
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 252
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 252
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 253
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 253
cagagtattt ccagctac 18
<210> 254
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 254
Gln Ser Ile Ser Ser Tyr
1 5
<210> 255
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 255
tatgctagt 9
<210> 256
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 256
Tyr Ala Ser
1
<210> 257
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 257
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 258
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 258
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 259
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 259
cagagtattt ccagctac 18
<210> 260
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 260
Gln Ser Ile Ser Ser Tyr
1 5
<210> 261
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 261
tatgctagt 9
<210> 262
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 262
Tyr Ala Ser
1
<210> 263
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 263
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 264
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 264
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 265
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 265
cagagtattt ccagctac 18
<210> 266
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 266
Gln Ser Ile Ser Ser Tyr
1 5
<210> 267
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 267
tatgctagt 9
<210> 268
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 268
Tyr Ala Ser
1
<210> 269
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 269
ctgggggtgt acggttattc tttcgacgat ggcatcgca 39
<210> 270
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 270
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 271
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 271
cagtccatct cctcctac 18
<210> 272
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 272
Gln Ser Ile Ser Ser Tyr
1 5
<210> 273
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 273
tacgcctcc 9
<210> 274
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 274
Tyr Ala Ser
1
<210> 275
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 275
ctgggggtgt atggttactc gttcgacgat ggaatcgca 39
<210> 276
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 276
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 277
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 277
cagagcatct cctcatac 18
<210> 278
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 278
Gln Ser Ile Ser Ser Tyr
1 5
<210> 279
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 279
tacgcctcc 9
<210> 280
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 280
Tyr Ala Ser
1
<210> 281
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 281
ctgggagtct acgggtactc cttcgatgac ggcattgca 39
<210> 282
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 282
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 283
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 283
cagtcgatct cctcttac 18
<210> 284
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 284
Gln Ser Ile Ser Ser Tyr
1 5
<210> 285
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 285
tacgcgtcg 9
<210> 286
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 286
Tyr Ala Ser
1
<210> 287
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 287
ctgggggtgt acggctactc cttcgatgac ggaatcgcc 39
<210> 288
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 288
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 289
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 289
cagtccatct cctcatac 18
<210> 290
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 290
Gln Ser Ile Ser Ser Tyr
1 5
<210> 291
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 291
tacgcttcc 9
<210> 292
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 292
Tyr Ala Ser
1
<210> 293
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 293
ttgggtgtct acggatactc cttcgacgac gggatcgca 39
<210> 294
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 294
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 295
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 295
cagtcaattt cctcgtac 18
<210> 296
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 296
Gln Ser Ile Ser Ser Tyr
1 5
<210> 297
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 297
tacgcatcc 9
<210> 298
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 298
Tyr Ala Ser
1
<210> 299
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 299
ctgggggtgt acgggtactc atttgacgat ggcatcgcc 39
<210> 300
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 300
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 301
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 301
cagtccattt cgtcctac 18
<210> 302
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 302
Gln Ser Ile Ser Ser Tyr
1 5
<210> 303
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 303
tacgcctcc 9
<210> 304
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 304
Tyr Ala Ser
1
<210> 305
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 305
ctgggcgtgt acggttactc gtttgatgac ggcatcgcg 39
<210> 306
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 306
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 307
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 307
cagtccattt cgagctac 18
<210> 308
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 308
Gln Ser Ile Ser Ser Tyr
1 5
<210> 309
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 309
tacgcctcc 9
<210> 310
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 310
Tyr Ala Ser
1
<210> 311
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 311
ctgggggtgt acggatactc attcgacgac gggatcgcc 39
<210> 312
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 312
Leu Gly Val Tyr Gly Tyr Ser Phe Asp Asp Gly Ile Ala
1 5 10
<210> 313
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 313
cagagcatta atacctac 18
<210> 314
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 314
Gln Ser Ile Asn Thr Tyr
1 5
<210> 315
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 315
agggcatcc 9
<210> 316
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 316
Arg Ala Ser
1
<210> 317
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 317
caacagagtg ttcgtgttat tgatgttgat aatact 36
<210> 318
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 318
Gln Gln Ser Val Arg Val Ile Asp Val Asp Asn Thr
1 5 10
<210> 319
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 319
cagaccattg gtggtagcga c 21
<210> 320
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 320
Gln Thr Ile Gly Gly Ser Asp
1 5
<210> 321
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 321
tatgcaacc 9
<210> 322
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 322
Tyr Ala Thr
1
<210> 323
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 323
ctaggtggtt atgctgctgc ttcttacaga actgct 36
<210> 324
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 324
Leu Gly Gly Tyr Ala Ala Ala Ser Tyr Arg Thr Ala
1 5 10
<210> 325
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 325
cagaccattg gcgggagcga c 21
<210> 326
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 326
Gln Thr Ile Gly Gly Ser Asp
1 5
<210> 327
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 327
tatgctaca 9
<210> 328
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 328
Tyr Ala Thr
1
<210> 329
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 329
ctggggggct atgccgccgc aagctaccgc accgcc 36
<210> 330
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 330
Leu Gly Gly Tyr Ala Ala Ala Ser Tyr Arg Thr Ala
1 5 10
<210> 331
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 331
cagaccattg gcgggagcga c 21
<210> 332
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 332
Gln Thr Ile Gly Gly Ser Asp
1 5
<210> 333
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 333
tatgctaca 9
<210> 334
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 334
Tyr Ala Thr
1
<210> 335
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 335
ctggggggct atgccgccgc aagctaccgc accgcc 36
<210> 336
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 336
Leu Gly Gly Tyr Ala Ala Ala Ser Tyr Arg Thr Ala
1 5 10
<210> 337
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 337
cagagcatta gtagtgtc 18
<210> 338
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 338
Gln Ser Ile Ser Ser Val
1 5
<210> 339
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 339
ctggcatcc 9
<210> 340
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 340
Leu Ala Ser
1
<210> 341
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 341
caaaccaatt atggtactag tagtagtaat tatggttttg ct 42
<210> 342
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 342
Gln Thr Asn Tyr Gly Thr Ser Ser Ser Asn Tyr Gly Phe Ala
1 5 10
<210> 343
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 343
cagtcaatta gcagcgtg 18
<210> 344
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 344
Gln Ser Ile Ser Ser Val
1 5
<210> 345
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 345
ttggcctcc 9
<210> 346
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 346
Leu Ala Ser
1
<210> 347
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 347
caaaccaact acggaacctc cagctccaac tacggctttg cc 42
<210> 348
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 348
Gln Thr Asn Tyr Gly Thr Ser Ser Ser Asn Tyr Gly Phe Ala
1 5 10
<210> 349
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 349
cagtcaatta gcagcgtg 18
<210> 350
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 350
Gln Ser Ile Ser Ser Val
1 5
<210> 351
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 351
ttggcctcc 9
<210> 352
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 352
Leu Ala Ser
1
<210> 353
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 353
caaaccaact acggaacctc cagctccaac tacggctttg cc 42
<210> 354
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 354
Gln Thr Asn Tyr Gly Thr Ser Ser Ser Asn Tyr Gly Phe Ala
1 5 10
<210> 355
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 355
cagtcaatta gcagcgtg 18
<210> 356
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 356
Gln Ser Ile Ser Ser Val
1 5
<210> 357
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 357
ttggcctcc 9
<210> 358
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 358
Leu Ala Ser
1
<210> 359
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 359
caaaccaact acggaacctc cagctccaac tacggctttg cc 42
<210> 360
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 360
Gln Thr Asn Tyr Gly Thr Ser Ser Ser Asn Tyr Gly Phe Ala
1 5 10
<210> 361
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 361
cagagcattt acagttat 18
<210> 362
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 362
Gln Ser Ile Tyr Ser Tyr
1 5
<210> 363
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 363
tctgcatcc 9
<210> 364
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 364
Ser Ala Ser
1
<210> 365
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 365
caaacctatt atgatattgt tactagtact 30
<210> 366
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 366
Gln Thr Tyr Tyr Asp Ile Val Thr Ser Thr
1 5 10
<210> 367
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 367
cagagcattt acagttat 18
<210> 368
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 368
Gln Ser Ile Tyr Ser Tyr
1 5
<210> 369
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 369
tctgcatcc 9
<210> 370
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 370
Ser Ala Ser
1
<210> 371
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 371
caaacctatt atgatattgt tactagtact 30
<210> 372
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 372
Gln Thr Tyr Tyr Asp Ile Val Thr Ser Thr
1 5 10
<210> 373
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 373
cagaacattt acagcaat 18
<210> 374
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 374
Gln Asn Ile Tyr Ser Asn
1 5
<210> 375
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 375
gatgcatcc 9
<210> 376
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 376
Asp Ala Ser
1
<210> 377
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 377
caaagtatta gtagtgttga caataatgtt 30
<210> 378
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 378
Gln Ser Ile Ser Ser Val Asp Asn Asn Val
1 5 10
<210> 379
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 379
cagaacatta agagctac 18
<210> 380
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 380
Gln Asn Ile Lys Ser Tyr
1 5
<210> 381
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 381
gaagcatcc 9
<210> 382
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 382
Glu Ala Ser
1
<210> 383
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 383
caaagctatt atgctgctag tagtaatgct 30
<210> 384
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 384
Gln Ser Tyr Tyr Ala Ala Ser Ser Asn Ala
1 5 10
<210> 385
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 385
cagagcatta gtaactac 18
<210> 386
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 386
Gln Ser Ile Ser Asn Tyr
1 5
<210> 387
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 387
gctgcatcc 9
<210> 388
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 388
Ala Ala Ser
1
<210> 389
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 389
ctaggagttt atagtattag tactgatgat ggagctgct 39
<210> 390
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 390
Leu Gly Val Tyr Ser Ile Ser Thr Asp Asp Gly Ala Ala
1 5 10
<210> 391
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 391
cagagcatca gcaactac 18
<210> 392
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 392
Gln Ser Ile Ser Asn Tyr
1 5
<210> 393
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 393
gccgcttct 9
<210> 394
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 394
Ala Ala Ser
1
<210> 395
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 395
ctgggcgtct attcaatctc aactgacgac ggagccgca 39
<210> 396
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 396
Leu Gly Val Tyr Ser Ile Ser Thr Asp Asp Gly Ala Ala
1 5 10
<210> 397
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 397
cagagcatca gcaactac 18
<210> 398
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 398
Gln Ser Ile Ser Asn Tyr
1 5
<210> 399
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 399
gccgcttct 9
<210> 400
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 400
Ala Ala Ser
1
<210> 401
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
олигонуклеотид"
<400> 401
ctgggcgtct attcaatctc aactgacgac ggagccgca 39
<210> 402
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 402
Leu Gly Val Tyr Ser Ile Ser Thr Asp Asp Gly Ala Ala
1 5 10
<210> 403
<211> 100
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 403
Ala Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Val Tyr Asp Asn
20 25 30
Asn Trp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
35 40 45
Leu Ile Tyr Asp Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Ser Tyr Tyr Ser
85 90 95
Ser Gly Trp Tyr
100
<210> 404
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 404
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ser
85 90 95
<210> 405
<211> 103
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 405
Asp Pro Val Ala Pro Thr Val Leu Ile Phe Pro Pro Ala Ala Asp Gln
1 5 10 15
Val Ala Thr Gly Thr Val Thr Ile Val Cys Val Ala Asn Lys Tyr Phe
20 25 30
Pro Asp Val Thr Val Thr Trp Glu Val Asp Gly Thr Thr Gln Thr Thr
35 40 45
Gly Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser Ala Asp Cys Thr Tyr
50 55 60
Asn Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr Gln Tyr Asn Ser His
65 70 75 80
Lys Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr Thr Ser Val Val Gln
85 90 95
Ser Phe Asn Arg Gly Asp Cys
100
<210> 406
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 406
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 407
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 407
Ala Leu Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 408
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 408
Ala Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 409
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 409
Ala Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 410
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 410
Ala Gln Val Leu Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Leu Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 411
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 411
Ala Gln Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ile Cys Trp Tyr Gln Gln Lys Leu Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 412
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 412
Ala Ile Asp Met Thr Gln Thr Pro Ala Ser Val Glu Ala Ala Val Gly
1 5 10 15
Gly Thr Ile Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 413
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 413
Asp Pro Val Met Thr Gln Thr Pro Ser Ser Thr Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Lys Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 414
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 414
Asp Gly Val Met Thr Gln Thr Pro Ala Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Asn Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 415
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 415
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 416
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 416
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 417
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 417
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 418
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 418
Asp Val Val Met Thr Gln Thr Pro Ser Ser Lys Ser Ala Ala Val Gly
1 5 10 15
Asp Thr Val Thr Ile Lys Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 419
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 419
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 420
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 420
Asp Pro Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 421
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
пептид"
<400> 421
Ala Leu Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln
20 25
<210> 422
<211> 43
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 422
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg
1 5 10 15
Phe Lys Gly Ser Gly Phe Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly
20 25 30
Ala Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys
35 40
<210> 423
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 423
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 424
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 424
Ala Gln Gly Pro Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 425
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 425
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 426
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 426
Ala Leu Val Met Thr Gln Thr Pro Ala Ser Val Glu Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 427
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 427
Ala Ala Val Met Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 428
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 428
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 429
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 429
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 430
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 430
Tyr Val Met Met Thr Gln Thr Pro Ser Ser Val Ser Glu Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Tyr Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Arg Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Met Lys Ala Glu Asp
50 55 60
Val Ala Thr Tyr Tyr Cys
65 70
<210> 431
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 431
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 432
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 432
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 433
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 433
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 434
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 434
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 435
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 435
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 436
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 436
Tyr Val Met Met Thr Gln Thr Pro Ser Ser Val Ser Glu Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Tyr Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 437
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 437
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 438
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 438
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 439
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 439
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 440
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 440
Asp Ile Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 441
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 441
Ala Val Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Arg
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 442
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 442
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 443
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 443
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 444
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 444
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Arg Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Met Lys Ala Glu Asp
50 55 60
Val Ala Thr Tyr Tyr Cys
65 70
<210> 445
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 445
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Arg
35 40 45
Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 446
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 446
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 447
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 447
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 448
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 448
Asp Pro Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 449
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 449
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 450
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 450
Asp Pro Met Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Pro Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 451
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 451
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Pro Gly Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 452
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 452
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 453
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 453
Asp Pro Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 454
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 454
Ala Ile Lys Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 455
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 455
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 456
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 456
Asp Pro Val Leu Thr Gln Thr Pro Ser Ser Ala Cys Glu Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Asp Leu Glu Cys Ala Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 457
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 457
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 458
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 458
Tyr Val Met Met Thr Gln Thr Pro Ser Ser Val Ser Glu Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Tyr Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 459
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 459
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 460
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 460
Tyr Val Met Met Thr Gln Thr Pro Ser Ser Val Ser Glu Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 461
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 461
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 462
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 462
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 463
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 463
Asp Pro Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 464
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 464
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Trp Val Ser Ser Ser Gly
35 40 45
Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Gly Val Gln Pro Gly Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 465
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 465
Asp Val Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 466
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 466
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 467
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 467
Asp Pro Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 468
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 468
Ala Leu Val Met Thr Gln Thr Pro Ser Ser Thr Ser Glu Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 469
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 469
Asp Val Val Met Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 470
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 470
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 471
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 471
Asp Pro Val Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 472
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 472
Tyr Val Met Met Thr Gln Thr Pro Ser Ser Val Ser Glu Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Tyr Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Arg Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 473
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 473
Asp Pro Met Leu Thr Gln Thr Ala Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Ser Thr Val Thr Ile Ser Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Arg Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 474
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 474
Asp Val Val Met Thr Gln Thr Pro Ser Ser Lys Ser Ala Ala Val Gly
1 5 10 15
Asp Thr Val Thr Ile Lys Cys Trp Tyr Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Pro Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 475
<211> 70
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 475
Ala Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Trp Phe Gln Gln Lys Pro Gly Gln Pro
20 25 30
Pro Lys Leu Leu Ile Tyr Gly Val Ser Ser Arg Phe Lys Gly Ser Gly
35 40 45
Ser Gly Thr Gln Phe Thr Leu Thr Ile Asn Gly Val Gln Cys Asp Asp
50 55 60
Ala Ala Thr Tyr Tyr Cys
65 70
<210> 476
<211> 94
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 476
Gln Ser Val Lys Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Ser Tyr Ala
20 25 30
Met Ile Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Tyr Ile Gly
35 40 45
Phe Ile Thr Thr Gly Gly Thr Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu Lys Leu Thr
65 70 75 80
Arg Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg
85 90
<210> 477
<211> 98
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 477
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 478
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 478
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu Ser
1 5 10 15
Cys Thr Ala Ser Gly Phe Thr Phe Gly Asp Tyr Ala Met Ser Trp Val
20 25 30
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Phe Ile Arg Ser
35 40 45
Lys Ala Tyr Gly Gly Thr Thr Glu Tyr Ala Ala Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile Ala Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg
85 90 95
<210> 479
<211> 93
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 479
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
1 5 10 15
Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala Met His Trp Val
20 25 30
Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val Ser Ala Ile Ser Ser
35 40 45
Asn Gly Gly Ser Thr Tyr Tyr Ala Asn Ser Val Lys Gly Arg Phe Thr
50 55 60
Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Gly Ser
65 70 75 80
Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys Ala Arg
85 90
<210> 480
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 480
Glu Leu Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly Val Gln Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly Tyr Ser
85 90 95
<210> 481
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 481
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ser
85 90 95
<210> 482
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 482
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ser
85 90 95
<210> 483
<211> 91
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 483
Met Thr Gln Ser Pro Ser Ser Phe Ser Ala Ser Thr Gly Asp Arg Val
1 5 10 15
Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Tyr Leu Ala Trp
20 25 30
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
35 40 45
Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
50 55 60
Gly Thr Asp Phe Thr Leu Thr Ile Ser Cys Leu Gln Ser Glu Asp Phe
65 70 75 80
Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Tyr
85 90
<210> 484
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 484
Glu Leu Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly Val Gln Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly Tyr Ser Phe
85 90 95
Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Glu Leu Glu Ile Lys
100 105 110
<210> 485
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 485
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Cys
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Gly Tyr Ser Phe
85 90 95
Asp Asp Gly Ile Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 486
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 486
Glu Leu Val Met Thr Gln Thr Pro Ser Tyr Thr Ser Ala Ala Val Gly
1 5 10 15
Asp Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Thr Ile Gly Gly Ser
20 25 30
Asp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Trp Tyr Ala Thr Asn Leu Pro Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Arg Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln
65 70 75 80
Cys Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Ala Ala Ala
85 90 95
Ser Tyr Arg Thr Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 487
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 487
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Thr Ile Gly Gly Ser
20 25 30
Asp Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Ala Thr Asn Leu Pro Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Cys Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Ala Ala Ala
85 90 95
Ser Tyr Arg Thr Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 488
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 488
Glu Leu Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Phe Ala Ala Ser Lys Leu Ala Ser Trp Val Pro Lys Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ile Glu Tyr Thr Leu Thr Ile Ser Gly Val Gln Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Phe Cys Leu Gly Val Tyr Ser Ile Ser Thr
85 90 95
Asp Asp Gly Ala Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 489
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 489
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Cys
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gly Val Tyr Ser Ile Ser Thr
85 90 95
Asp Asp Gly Ala Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 490
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 490
Glu Val Leu Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Asp Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Ser Ser Val
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly Thr Ser Ser
85 90 95
Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 491
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /ссылка="Описание искусственной последовательности: синтезированный
полипептид"
<400> 491
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Ser Ser Val
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Thr Asn Tyr Gly Thr Ser Ser
85 90 95
Ser Asn Tyr Gly Phe Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<---
Реферат
Настоящее изобретение относится к области биотехнологии, в частности к новым конъюгатам иммуноглобулинов с различными агентами. Изобретение раскрывает способ получения конъюгированных иммуноглобулинов через химию аминокислотных остатков цистеина в особых положениях вариабельной области легкой цепи иммуноглобулина («Cys80»). Изобретение также относится к конъюгатам гибридных или гуманизированных иммуноглобулинов кролика, иммуноспецифично связывающихся с CA9, TEM1 или мезотелином человека, а также раскрывает возможность использования таких конъюгатов в терапии раковых заболеваний. 11 н. и 21 з.п. ф-лы, 23 ил., 27 табл., 6 пр.

Комментарии