Выделенное антитело против специфического мембранного антигена простаты (psma) и способ ингибирования роста клеток, экспрессирующих psma - RU2421466C2
Код документа: RU2421466C2
Чертежи


















































Описание
Область, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности к дефукозилированным антителам к PSMA человека с усиленной способностью направлять клеточную цитотоксичность по отношению к экспрессирующим PSMA клеткам. Изобретение также направлено на клетки-хозяева, экспрессирующие анти-PSMA антитела без фукозильных остатков. Предлагаются также способы применения антител изобретения для ингибирования роста клеток, экспрессирующих PSMA, и ингибирования роста опухолевых клеток с экспрессией PSMA при различных раковых заболеваниях.
Уровень техники
Заболеваемость раком простаты у мужчин занимает лидирующую позицию и является одной из основных причин их смертности. Традиционные методы лечения включают в себя хирургические операции, гормоно- и химиотерапию, а также лучевую терапию. Однако эти методы малоэффективны в случае развития метастаз. Поэтому очень важна идентификация генов и/или их продуктов, представляющих собой диагностические и прогностические маркеры заболевания, а также являющихся мишенями при терапии. Простатоспецифический антиген (PSA) является одним из таких маркеров и используется при клинической диагностике и определении стадии развития опухоли при раке простаты. Однако PSA не дает возможности дифференцировать доброкачественную гиперплазию простаты (ВРН) от простатита и рака простаты в диапазоне 4-10 нг/мл, что требует проведения дополнительных цитологических и/или гистологических исследований для установления точного диагноза (Barren, R.J. et al. (1998) Prostate 36:181-188).
Простатоспецифический мембранный антиген (PSMA) - это трансмембранный гликопротеин II типа массой примерно 110 kD, состоящий из 750 аминокислотных остатков и имеющий примерно 54% гомологии с рецептором трансферрина. PSMA имеет три структурных домена: внутриклеточный - 19 аминокислотных остатков, трансмембранный - 24 аминокислотных остатка и наружный - 707 аминокислотных остатков. PSMA обладает нейрокарбоксипептидазной и фолатгидролазной активностью и, как сообщается, участвует в нейроэндокринной регуляции роста и дифференциации клеток простаты (Heston, W.D. (1996) Urologe-Ausgabe A. 35:400-407). PSM' - это локализованный в цитоплазме белок, полученный в результате альтернативного сплайсинга PSMA.
PSMA преимущественно экспрессируется эпителиальными клетками простаты. Уровень его экспрессии возрастает при раке простаты, особенно в слабодифференцированных, метастатических и резистентных к гормональной терапии карциномах (Gregorakis, А.К. et al. (1998) Seminars in Urologic Oncology 16:2-12; Silver, D.A. (1997) Clinical Cancer Research 3:81-85). В тканях вне простаты, например в тонком кишечнике, слюнной железе, слизистой оболочке двенадцатиперстной кишки, проксимальных почечных канальцах и тканях мозга, наблюдается низкий уровень экспрессии PSMA (Silver, D.A. (1997) Clinical Cancer Research 3:81-85). PSMA также экспрессируется эндотелиальными клетками капилляров в околоопухолевой области и внутри опухоли определенной степени злокачественности, в том числе в клетках почечной карциномы и карциномы толстой кишки, но не экспрессируется в кровеносных сосудах нормальных тканей. Сообщалось, что PSMA участвует в ангиогенезе опухолей (Silver, D.A. (1997) Clinical Cancer Research 3:81-85).
Описаны антитела против внеклеточного (наружного) домена PSMA (См., например, Liu, H. et al. (1997) Cancer Res. 57:3629-3634; Murphy, G.P. et al. (1998) J. Urol. 160:2396-2401; Wang, S. et al. (2001) Int. J. Cancer 92:871-876; Kato, K. et al. (2003) Int. J. Urol. 10:439-444; US Patent No. 6,150,508 and US Patent No. 6,107,090). Недавно получены антитела против человеческого и гуманизированного PSMA (См., например, Bander, N.H. et al. (2003) Semin. Oncol. 30:667-676; PCT Publication WO 02/098897; PCT Publication WO 01/09192; PCT Publication WO 03/064606; PCT Publication WO 03/034903; and US Application No. 2004/0033229). Эти антитела используются для окрашивания клеток рака простаты. (См., например, Yao, D. et al. (2002) Semin. Urol. Oncol. 20:211-218; Bander, N.H. et al. (2003) J. Urol. 170:1717-1721). Антитела против PSMA используются также при терапевтическом лечении рака простаты, обычно в виде конъюгата с хемотерапевтическими агентами или радиоактивными изотопами. (См., например, Nanus, D.M. et al. (2003) J. Urol. 170:S84-89; Milowsky, M.I. et al. (2004) J. Clin. Oncol. 22:2522-2531; Henry, M.D. et al. (2004) Cancer Res. 64:7995-8001).
В настоящее время ощущается потребность в улучшенных антителах против PSMA, которые могут быть использованы при терапии и эффективны при лечении и/или предотвращении заболевания, включая экспрессию PSMA. Особенно это касается антител, обладающих цитотоксическим эффектом без конъюгации с хемотерапевтическими агентами или радиоактивными изотопами.
Раскрытие изобретения
Настоящее изобретение направлено на изолированные дефукозилированные антитела (то есть на антитела без остатков фукозы), которые связываются с человеческим PSMA и демонстрируют улучшенную опосредованную (направляемую) антителами клеточную цитотоксичность (ADCC) по отношению к клеткам, экспрессирующим PSMA, по сравнению с недефукозилированной формой антител (то есть с антителами, содержащими остатки фукозы). Изобретение направлено также на методы лечения разнообразных заболеваний, при которых наблюдается экспрессия PSMA, с использованием антител и композиций настоящего изобретения.
Дефукозилированные антитела настоящего изобретения связываются с PSMA и ингибируют рост клеток, экспрессирующих PSMA, усиливая опосредуемую антителами клеточную цитотоксичность (ADCC) в присутствии человеческих клеток-эффекторов (например, моноцитов или моноядерных клеток), по сравнению с фукозилированной формой антител. Таким образам, антитела настоящего изобретения обеспечивают лучшую эффективность при лечении заболеваний, характеризующихся экспрессией PSMA.
В соответствии с одним из аспектов изобретение направлено на изолированные антитела против простатоспецифического мембранного антигена, не имеющие фукозильных остатков. Предпочтительно, чтобы антитела усиливали зависящую от антител клеточную цитотоксичность по отношению к клеткам, экспрессирующим РSМА на поверхности, по сравнению с формой антигена, содержащего остатки фукозы. В соответствии с предпочтительным аспектом изобретения, антитела без фукозильных остатков имеют значения EC50 ADCC активности против клеток рака простаты LNCaP 0,05 мкг/мл или меньше, или 0,04 мкг/мл или меньше, или 0,03 мкг/мл или меньше, или 0,02 мкг/мл или около 0,018 мкг/мл или меньше. В соответствии с другим предпочтительным аспектом изобретения антитела без фукозильных остатков характеризуются значениями ЕС50 ADCC активности против клеток рака простаты LNCaP, которые, по крайней мере, в 3 раза ниже (или, по крайней мере, в 4 раза ниже, или в 5 раз ниже, или в 6 раз ниже), чем те же значения для антител, имеющих фукозильные остатки.
Предпочтительно, если дефукозилированные антитела настоящего изобретения представляют собой моноклональные антитела. В соответствии с одним из аспектов изобретение направлено на гуманизированные или химерные моноклональные антитела. Предпочтительно, если гуманизированные или химерные антитела получают из антител мыши против PSMA, выбранных из следующей группы: 3F5.4G6, 3D7.1.1, 4Е10-1.14, 3Е11, 4D8, 3Е6, 3С9, 2С7, 1G3, 3С4, 3С6, 4D4, 1G9, 5С8В9, 3G6, 4С8В9, Е99, J415, J533 и J591. В соответствии с другим аспектом изобретение направлено на человеческие моноклональные антитела.
В соответствии с предпочтительным аспектом изобретения человеческое моноклональное антитело содержит вариабельный участок тяжелой цепи человека и вариабельный участок легкой цепи человека, где:
(а) вариабельный участок тяжелой цепи человека содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 1-9; и
(b) вариабельный участок легкой цепи человека содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 10-18.
В соответствии с различными аспектами изобретения следующие комбинации тяжелых и легких цепей являются предпочтительными:
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 1, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 10;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 2, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 11;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 3, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 12;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 4, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 13;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 5, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 14;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 6, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 15;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 7, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 16;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 8, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 17;
вариабельный участок тяжелой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 9, и вариабельный участок легкой цепи человека, содержащий аминокислотную последовательность SEQ ID NO: 18.
В соответствии с другим аспектом изобретения моноклональное антитело содержит:
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 19-27;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 28-36;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 37-45;
(d) вариабельный участок легкой цепи человека CDR1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 46-54;
(e) вариабельный участок легкой цепи человека CDR2, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 55-63; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 64-72.
В различных аспектах настоящего изобретения следующие комбинации тяжелой цепи и легкой цепи CDR1, CDR2 и CDR3 являются предпочтительными:
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 19;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 28;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 37;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 46;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 55; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 64;
или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 20;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 29;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 38;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 47;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 56; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 65;
или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 21;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 30;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 39;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 48;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 57; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 66;
или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 22;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 31;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 40;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 49;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 58; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 67; или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 23;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 32;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 41;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 50;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 59; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 68; или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 24;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 33;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 42;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 51;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 60; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 69; или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 25;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 34;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 43;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 52;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 61; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 70; или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 26;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 35;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 44;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 53;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 62; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 71; или
(a) вариабельный участок тяжелой цепи человека CDR1, содержащий SEQ ID NO: 27;
(b) вариабельный участок тяжелой цепи человека CDR2, содержащий SEQ ID NO: 36;
(c) вариабельный участок тяжелой цепи человека CDR3, содержащий SEQ ID NO: 45;
(d) вариабельный участок легкой цепи человека CDR1, содержащий SEQ ID NO: 54;
(e) вариабельный участок легкой цепи человека CDR2, содержащий SEQ ID NO: 63; и
(f) вариабельный участок легкой цепи человека CDR3, содержащий SEQ ID NO: 72.
В соответствии с еще одним аспектом изобретение направлено на дефукозилированные человеческие анти-PSMA антитела, содержащие вариабельный участок тяжелой цепи, который представляет собой продукт или производное гена человека VH 5-51 или VH 3-30.3. Изобретение также направлено на дефукозилированные анти-PSMA антитела человека, содержащие вариабельный участок легкой цепи, который представляет собой продукт или производное гена человека Vk L6, 04/014 или L18. Кроме того, изобретение направлено на дефукозилированные человеческие антитела против PSMA, содержащие вариабельный участок тяжелой цепи, который представляет собой продукт или производное гена человека VH 5-51 или VH 3-30.3, и вариабельный участок легкой цепи, который представляет собой продукт или производное гена человека Vk L6, 04/014 или L18.
В соответствии с еще одним аспектом изобретение направлено на химерных цыплят, содержащих гены тяжелых и легких цепей иммуноглобулинов, кодирующие анти-PSMA антитела, такие как анти-PSMA антитела, экспрессированные в зародышах химерных цыплят, где эти антитела не содержат фукозильных остатков. Предпочтительно, гены тяжелых и легких цепей иммуноглобулинов являются генами тяжелых и легких цепей иммуноглобулинов человека.
В соответствии с еще одним аспектом изобретение направлено на клетку-хозяин, содержащую гены тяжелых и легких цепей иммуноглобулина, кодирующие анти-PSMA антитела, где указанная клетка не содержит фукозилтрансферазу, так что экспрессируемые указанной клеткой анти-PSMA антитела не содержат остатков фукозы. Предпочтительно, чтобы гены тяжелых и легких цепей иммуноглобулина представляли собой гены тяжелых и легких цепей иммуноглобулина человека. Предпочтительно, если фукозилтрансфераза - это FUT8. Предпочтительно, чтобы клетка-хозяин относилась к линии СНО.
В соответствии с еще одним аспектом изобретение направлено на метод ингибирования роста клеток PSMA+. Метод включает приведение клеток в контакт с дефукозилированными антителами против PSMA в условиях, достаточных для индукции зависящей от антител клеточной цитотоксичности (ADCC) указанных клеток. Клетки могут быть, например, опухолевыми клетками. Предпочтительно, чтобы анти-PSMA антитела представляли собой антитела человека.
Изобретение направлено также на метод ингибирования роста опухолевых клеток у субъекта, где эти опухолевые клетки или эндотелиальные клетки сосудов, расположенных поблизости от опухоли, экспрессируют PSMA. Указанный метод включает назначение субъекту дефукозилированных анти-РSМА антител в количестве, эффективном для ингибирования роста опухолевых клеток у субъекта. Предпочтительно, чтобы анти-PSMA антитела представляли собой антитела человека. В соответствии с предпочтительными аспектами опухолевые клетки представляют собой опухолевые клетки карциномы простаты.
Другие аспекты и преимущества настоящего изобретения станут очевидны из следующего далее подробного описания и примеров, которые не ограничивают область изобретения. Содержание всех ссылок, записей генетического банка (Genbank), патентов и опубликованных патентных заявок, процитированных в настоящей заявке, явным образом включены в нее по ссылке.
Краткое описание чертежей
На Фиг.1 показано приведение аминокислотной последовательности вариабельного участка тяжелой цепи 4А3, 7F12, 8С12, 8А11 и 16F9 (SEQ ID NOs: 1-5, соответственно) в соответствие (выравнивание) с аминокислотной последовательностью зародышевой линии человека VH 5-51 (SEQ ID NO: 73).
На Фиг.2 показано приведение аминокислотной последовательности вариабельного участка легкой цепи 4А3, 7F12 и 8С12 (SEQ ID NOs: 10-12, соответственно) в соответствие с аминокислотной последовательности зародышевой линии человека Vk L6 (SEQ ID NO: 74).
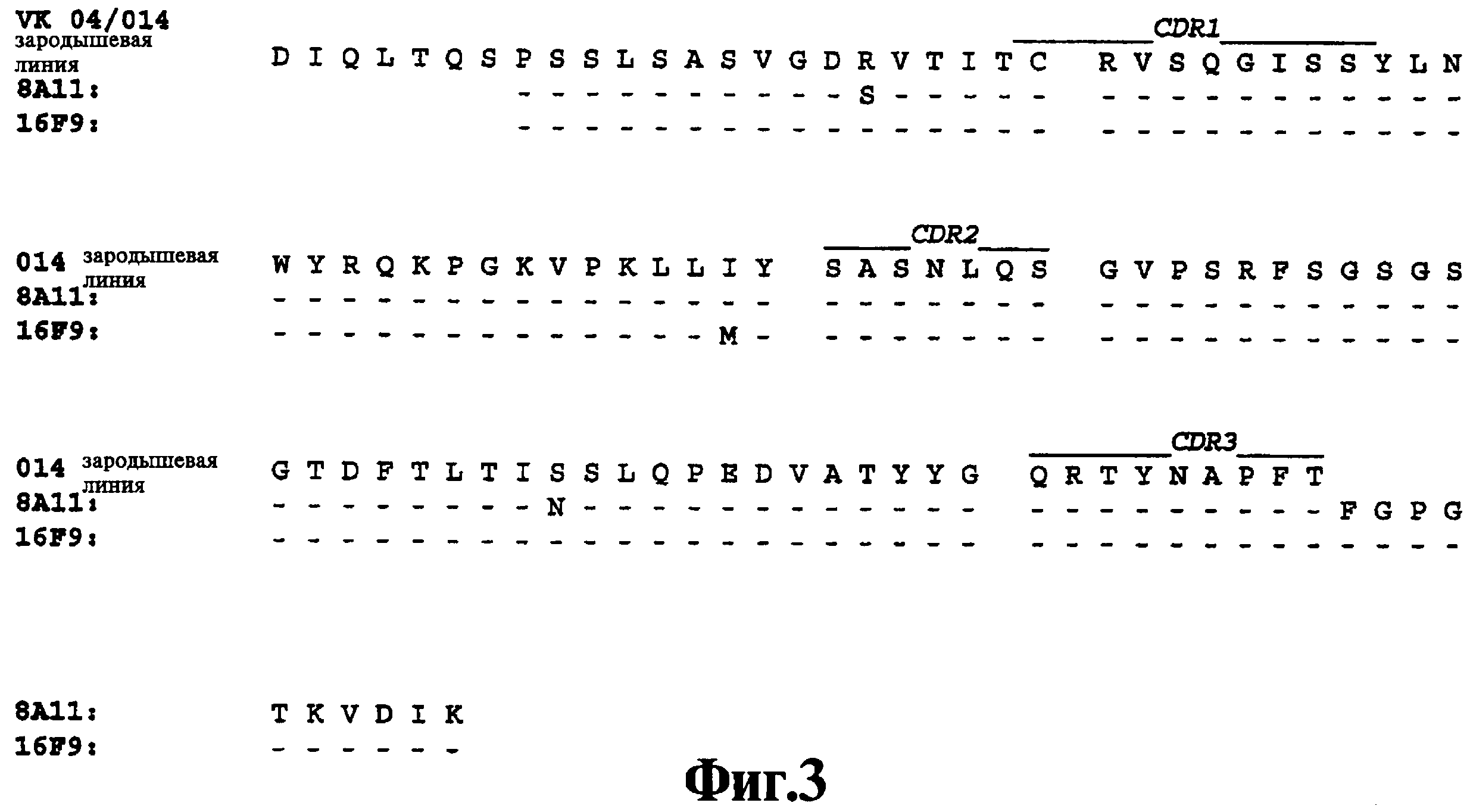
На Фиг.3 показано приведение аминокислотной последовательности вариабельного участка легкой цепи 8А11 и 16F9 (SEQ ID NOs: 13 и 14, соответственно) в соответствие с аминокислотной последовательностью зародышевой линии человека Vk 04/014 (SEQ ID NO: 75).
На Фиг.4 показана нуклеотидная последовательность (SEQ ID NO: 78) и аминокислотная последовательность (SEQ ID NO: 9) вариабельного участка тяжелой цепи 1С3 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 27), CDR2 (SEQ ID NO: 36) и CDR3 (SEQ ID NO: 45) и указаны отклонения от зародышевых линий V, D и J.
На Фиг.5 показана нуклеотидная последовательность (SEQ ID NO: 82) и аминокислотная последовательность (SEQ ID NO: 18) вариабельного участка легкой цепи 1С3 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 54), CDR2 (SEQ ID NO: 63) и CDR3 (SEQ ID NO: 72) и указаны отклонения от зародышевых линий V и J.
На Фиг.6 показана нуклеотидная последовательность (SEQ ID NO: 79) и аминокислотная последовательность (SEQ ID NO: 6) вариабельного участка тяжелой цепи 2А10 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 24), CDR2 (SEQ ID NO: 33) и CDR3 (SEQ ID NO: 42) и указаны отклонения от зародышевых линий V и J.
На Фиг.7 показана нуклеотидная последовательность (SEQ ID NO: 83) и аминокислотная последовательность (SEQ ID NO: 15) вариабельного участка легкой цепи 2А10 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 51), CDR2 (SEQ ID NO: 60) и CDR3 (SEQ ID NO: 69) и указаны отклонения от зародышевых линий V и J.
На Фиг.8 показана нуклеотидная последовательность (SEQ ID NO: 80) и аминокислотная последовательность (SEQ ID NO: 7) вариабельного участка тяжелой цепи 2С6 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 25), CDR2 (SEQ ID NO: 34) и CDR3 (SEQ ID NO: 43) и указаны отклонения от зародышевых линий V, D и J.
На Фиг.9 показана нуклеотидная последовательность (SEQ ID NO: 84) и аминокислотная последовательность (SEQ ID NO: 16) вариабельного участка легкой цепи 2С6 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 52), CDR2 (SEQ ID NO: 61) и CDR3 (SEQ ID NO: 70) и указаны отклонения от зародышевых линий V и J.
На Фиг.10 показана нуклеотидная последовательность (SEQ ID NO: 81) и аминокислотная последовательность (SEQ ID NO: 8) вариабельного участка тяжелой цепи 2F5 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 26), CDR2 (SEQ ID NO: 35) и CDR3 (SEQ ID NO: 44) и указаны отклонения от зародышевых линий V, D и J.
На Фиг.11 показана нуклеотидная последовательность (SEQ ID NO: 85) и аминокислотная последовательность (SEQ ID NO: 17) вариабельного участка легкой цепи 2F5 моноклональных антител человека. Отмечены области CDR1 (SEQ ID NO: 53), CDR2 (SEQ ID NO: 62) и CDR3 (SEQ ID NO: 71) и указаны зародышевые отклонения V и J.
На Фиг.12 показано приведение аминокислотной последовательности вариабельного участка тяжелой цепи 2А10, 2С6 и 2F5 (SEQ ID NOs: 6-8, соответственно) в соответствие с аминокислотной последовательностью зародышевой линии человека VH 5-51 (SEQ ID NO: 73).
На Фиг.13 показано приведение аминокислотной последовательности вариабельного участка тяжелой цепи 1С3 (SEQ ID NO: 9) в соответствие с аминокислотной последовательностью зародышевой линии человека VH 3-30.3 (SEQ ID NO: 76) и аминокислотной последовательностью зародышевой лини JH6b (SEQ ID NO: 86).
На Фиг.14 показано приведение аминокислотной последовательности вариабельного участка легкой цепи 2С6 (SEQ ID NO: 16) в соответствие с аминокислотной последовательностью зародышевой линии человека Vk L6 (SEQ ID NO: 74) и аминокислотной последовательностью зародышевой линии JK3 (SEQ ID NO: 87).
На Фиг.15 показано приведение аминокислотной последовательности вариабельного участка легкой цепи 1С3, 2А10 и 2F5 (SEQ ID NOs: 18, 15 и 17, соответственно) в соответствие с аминокислотной последовательностью зародышевой линии человека Vk L18 (SEQ ID NO: 77) и аминокислотной последовательностью зародышевой линии JK4 (SEQ ID NO: 88).
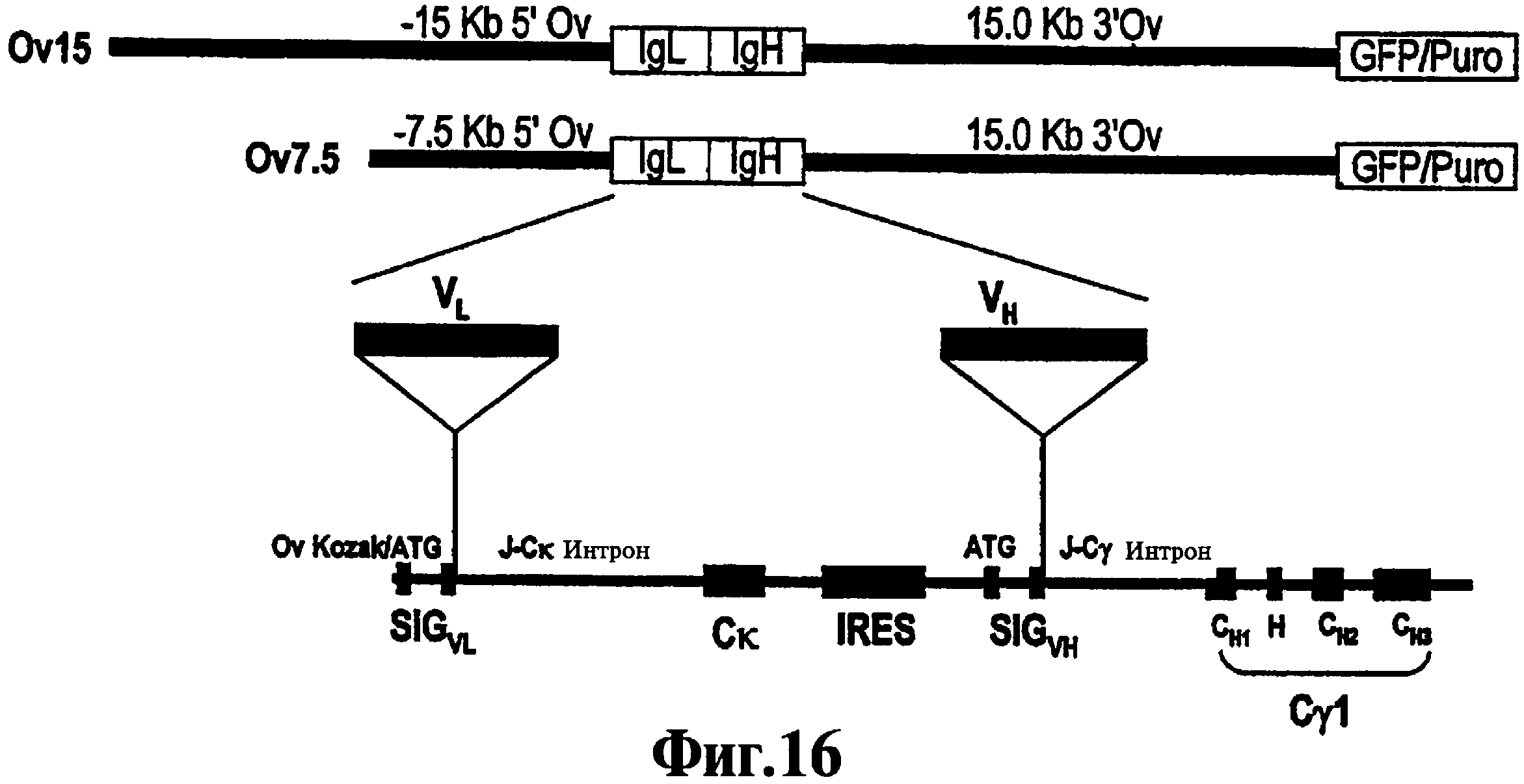
На Фиг.16 показана диаграмма векторов экспрессии Ov7.5 и Ov15. Указаны положения регуляторных последовательностей 5' и 3' векторов Ov. В 3'-конец вектора включена кассета, содержащая EGFP и пиромицин (Puro), которая управляется промотором (Сх), функционирующим в клетках всех типов и облегчающим выделение стабильно трансфектированных линий клеток cES и идентификацию вклада клеток cES в химеры. Подробно МАb-кассета проиллюстрирована в нижней части диаграммы. Тонкая черная линия соответствует последовательностям интронов и нетранслируемым последовательностям, производным от цепей L и Н человека (хотя последовательности интронов не представлены в конструкте Ov15Mab7F12). SiGVL: последовательность сигнального пептида L-цепи; VL: последовательность гена V L-цепи; Ск: последовательность постоянного участка Каппа L-цепи; IRES: внутренняя рибосомальная последовательность ввода; SiGVH: последовательность сигнального пептида Н-цепи; VH: последовательность гена V Н-цепи; СН1, Н, СН2 и СН3: кодирующие последовательности доменов СН1, Hinge(шарнира), СН2 и СН3 гамма 1 Н-цепи.
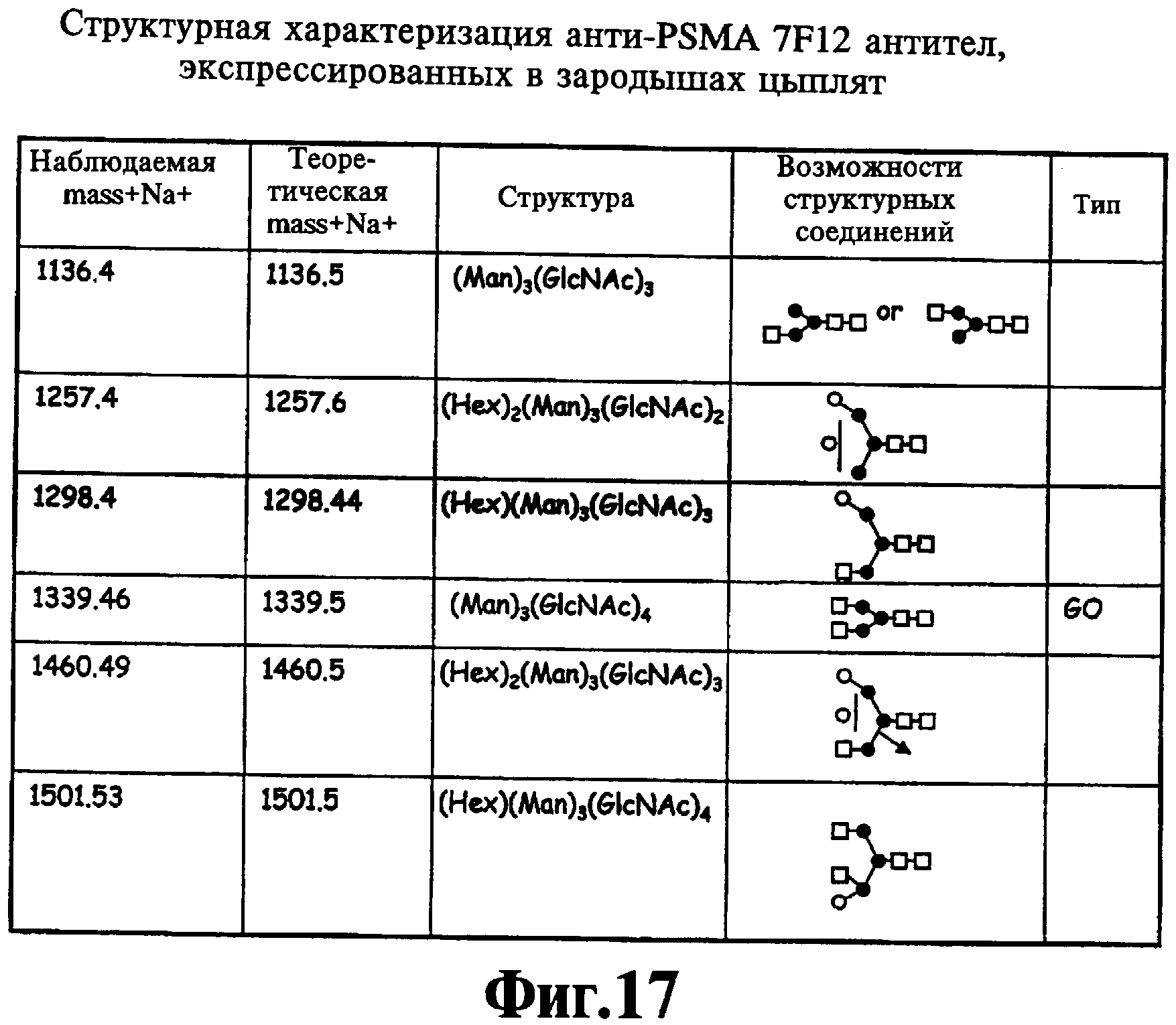
На Фиг.17 и 18 собраны структуры олигосахаридных цепей анти-PSMA антител 7F12, экспрессированные в зародышах цыпленка. Определение проводилось на масс-спектрометре MALDI TOF. Темными кружками отмечена манноза, светлыми кружками - гексозы (манноза или галактоза), темными квадратами - N-ацетилглюкозамин. Вертикальная линия указывает, что последняя гексоза может быть связана с или маннозой, или с N-ацетилглюкозаминовыми остатками вдоль линии.
Фиг.19, 20 представляют собой графики, показывающие результаты измерения ADCC с использованием экспрессируемого клетками СНО антитела 7F12 и экспрессированного организмом цыплят 7F12, по сравнению с изотипическим контролем. Результаты выражены в процентах лизиса.
На Фиг.19 представлены результаты, полученные с использованием IL-2 стимулированных эффекторных клеток.
На Фиг.20 представлены результаты, полученные с использованием свежевыделенных эффекторных клеток периферической крови человека.
На Фиг.21 представлена столбиковая диаграмма, показывающая результаты экспериментов, где ADCC активность экспрессируемых клетками СНО антител 7F12 и экспрессированных организмом цыплят 7F12 была блокирована антителами против CD16, по сравнению с изотипным контролем.
На Фиг.22 и 23 представлен график, показывающий результаты ADCC-анализов фукозилированной и дефукозилированной форм 2А10 mAb ("дефукозилированная") и 2А10 mAb ("родительская") и изотипного контроля.
На Фиг.22 и 23 представлены два независимых эксперимента с использованием клеток-мишеней LNCaP-C42b и стимулированных IL-2 эффекторных клеток.
На Фиг.24 представлены результаты, полученные с использованием клеток LNCaP-C42b и свежевыделенных эффекторных клеток периферической крови человека.
Фиг.25 представляет собой столбиковую диаграмму с результатами анализов ADCC активности для дефукозилированной и фукозилированной форм антител 2А10 mAb ("дефукозилированная") и 2А10 mAb ("родительская") по сравнению с изотипическим контролем и контролем в отсутствие антител, причем в этих анализах ADCC активность была блокирована анти-CD16 антителами.
Осуществление изобретения
Настоящее изобретение направлено на усовершенствованные композиции антител и основанные на их использовании улучшенные методы терапии для лечения и диагностики спектра заболеваний, ассоциированных с экспрессией PSMA и/или клетками, экспрессирующими PSMA. Антитела настоящего изобретения не содержат фукозильных остатков на своих углеводных цепях. Более того, антитела демонстрируют улучшенную направляемую антителами клеточную цитотоксичность (ADCC), связанную с уничтожением клеток PSMA+.
В соответствии с конкретными аспектами антитела настоящего изобретения представляют собой гуманизированные или полностью человеческие антитела и особенно полезны для терапевтического лечения заболеваний людей, связанных с РSМА-экспрессирующими клетками. Методы применения анти-PSMA антител без фукозильных остатков для терапевтического лечения (то есть для лечения и/или профилактики заболеваний, связанных с экспрессией PSMA) также охватываются настоящим изобретением.
Чтобы лучше понять настоящее изобретение, необходимо определить некоторые термины. Это сделано далее. В ходе подробного описания будут введены также дополнительные определения.
Термины "простатоспецифический мембранный антиген" и "PSMA" используются здесь взаимозаменяемо и включают любые варианты, изоформы и межвидовые гомологи человеческого PSMA, естественно экспрессирующиеся клетками и связывающиеся с описанными здесь антителами 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3. Выданный Генбанком номер полной аминокислотной последовательности человеческого белка PSMA - это NP_004467. Полная последовательность кДНК, кодирующая человеческий белок PSMA, получила номер Генбанка NM_004476.
В настоящем изобретении термины "антитела без остатков фукозы" и "дефукозилированные антитела" используются взаимозаменяемо и означают антитела, углеводные фрагменты которых не содержат фукозильных остатков или у которых фукозильные остатки были удалены. Антитела без фукозильных остатков можно получить, например, экспрессией антитела в клетке или системе экспрессии, которая не прикрепляет фукозильные остатки к углеводной цепи антитела или минимизирует прикрепление, или путем химической модификации антитела, удаляющей фукозильные остатки с углеводной цепи (например, обработкой антитела фукозидазой). Термины "без остатков фукозы" и "дефукозилированные" не ограничены механизмами получения антител с измененной структурой углеводов.
В настоящем изобретении термины "антитела, экспрессирующие остатки фукозы" и "фукозилированные антитела" используются взаимозаменяемо и означают антитела, углеводные фрагменты которых содержат фукозу.
Термин "иммунный ответ" означает действие, например, лимфоцитов, антиген представляющих клеток, фагоцитирующих клеток, гранулоцитов и растворимых макромолекул, образующихся в упомянутых выше клетках или в печени (включая антитела, цитокины и комплемент), которое приводит к селективному повреждению, разрушению или выведению из человеческого организма внешних патогенов, клеток или тканей, инфицированных патогенами, раковых клеток или, в случае аутоиммунного заболевания или патологического воспаления, нормальных человеческих клеток или тканей.
В настоящем изобретении термин "эффекторные клетки" означает иммунные клетки, вовлеченные в эффекторную фазу иммунного ответа, а не в когнитивную фазу или фазу активации иммунного ответа. Примеры иммунных клеток включают клетки миелоидного или лимфоидного происхождения, например лимфоциты (например, В- и Т-клетки, в том числе цитолитические Т-клетки (CTL)), клетки-киллеры, клетки-природные киллеры, макрофаги, моноциты, эозинофилы, нейтрофилы, полиморфоядерные клетки, гранулоциты, тучные клетки и базофилы. Некоторые эффекторные клетки экспрессируют специфические рецепторы Fc и выполняют специфические иммунные функции. В соответствии с предпочтительными аспектами эффекторная клетка способна индуцировать зависящую от антител опосредованную клетками цитотоксичность (ADCC), например, такой способностью обладают нейтрофилы. Например, экспрессирующие FcR моноциты и макрофаги принимают участие в специфическом уничтожении клеток-мишеней и представлении антигенов другим компонентам иммунной системы или в связывании с клетками, которые представляют антигены. В соответствии с другими аспектами эффекторная клетка может фагоцитировать антиген-мишень или клетку-мишень. Экспрессия конкретного FcR эффекторной клеткой может регулироваться гуморальными факторами, такими как цитокины. Например, показано, что экспрессия FcαRI усиливается под действием G-CSF или GM-CSF. Такая усиленная экспрессия усиливает эффекторную функцию клеток-носителей FcαRI по отношению к мишеням. Эффекторная клетка может фагоцитировать или лизировать антиген-мишень или клетку-мишень.
"Клетка-мишень" или "целевая клетка" означает любую клетку или патоген, чье уничтожение было бы благоприятно для субъекта (например, человека или животного), и на которое может быть направлена композиция (например, антитела) настоящего изобретения. Например, клеткой-мишенью может быть клетка, экспрессирующая или сверхэкспрессирующая PSMA.
Термин "зависящая от антитела клеточная цитотоксичность" или "ADCC" означает опосредуемую клетками цитотоксическую реакцию, когда клетка-мишень PSMA+ со связанным анти-PSMA антителом распознается эффекторной клеткой с Fc рецепторами и затем лизируется без обязательного участия комплемента.
В контексте настоящего изобретения термин "усиливает ADCC" (например, применительно к клеткам) означает любое заметное усиление лизиса клеток при их взаимодействии с анти-PSMA антителами без фукозильных остатков, по сравнению с уничтожением этих клеток при взаимодействии с фукозилированными анти-РSМА антителами в присутствии эффекторных клеток (например, при отношении клетки-мишени:эффекторные клетки = 1:50), например усиление лизиса клеток по меньшей мере, приблизительно, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 250%, 300% или 325%.
Термин "антитело" в контексте настоящего изобретения включает целые антитела и их любые антиген-связывающие фрагменты (антиген-связывающие участки) или отдельные цепи. "Антитело" означает гликопротеин, содержащий по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные между собой дисульфидными мостиками, или его антиген-связывающий участок. Каждая тяжелая цепь содержит вариабельный участок тяжелой цепи (обозначается VH) и постоянный участок тяжелой цепи. Постоянный участок тяжелой цепи состоит из трех доменов, СH1, СH2 и СH3. Каждая легкая цепь состоит из вариабельного участка легкой цепи (обозначается VL) и постоянного участка легкой цепи. Постоянный участок легкой цепи состоит только из одного домена, CL. Участки VH и VL можно также разделить на участки гипервариабельности, называемые областями, определяющими комплементарность (CDR) и перемежающимися с более консервативными участками, так называемыми каркасными участками (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных в следующем порядке, начиная от аминоконца и до карбоксильного конца: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные участки тяжелых и легких цепей содержат домен связывания, взаимодействующий с антигеном. Три постоянных участка антитела могут опосредовать связывание иммуноглобулина с хозяйскими тканями или факторами, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (CIq) классической системы комплемента.
Термин "антиген-связывающий участок антитела" (или просто "участок антитела") здесь означает один или несколько фрагментов антитела, обладающих способностью специфически связываться с антигеном (например, с PSMA). Показано, что антиген-связывающая функция антитела может осуществляться фрагментами антитела полной длины. Примеры связывающих фрагментов антитела, подходящих под определение "антиген-связывающих участков", включают: (i) фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, СL и СH1; (ii) фрагмент F(ab')2, двухвалентный фрагмент, содержащий два домена Fab, связанных дисульфидными мостиками в области петли, (iii) фрагмент Fd, содержащий домены VH и СH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного "плеча" антитела; (v) фрагмент dAb (Ward et al., (1989) Nature 341:544-546), содержащий домен VH; и (vi) изолированный (CDR). Более того, хотя два домена фрагмента Fv, VL и VH, кодируются двумя различными генами, их можно объединить с использованием рекомбинантных методов и синтетического линкера, в результате чего они будут образовываться как одна белковая цепочка, в которой пара участков VL и VH формирует одновалентные молекулы (называемые одноцепочечными Fv (scFv); см., например., Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также попадают под определение "антиген-связывающего участка антитела". Фрагменты этих антител получают традиционными методами, известными специалистам в соответствующей области; их проверка на применимость осуществляется так же, как и в случае интактных антител.
Термин "рекомбинантное человеческое антитело" здесь означает все человеческие антитела, которые готовят, экспрессируют, создают или выделяют рекомбинантными методами, в том числе (а) выделенные из животных (например, из мышей) антитела, трансгенные или трансхромосомальные с включением генов иммуноглобулина человека или приготовленные с помощью гибридом (далее этот метод описан подробно), (b) антитела, выделенные из клеток-носителей, которые были трансформированы так, чтобы экспрессировать антитела человека, например, из трансфектом, (с) антитела, взятые из рекомбинантной комбинаторной библиотеки антител человека, и (d) антитела, приготовленные, экспрессированные, созданные или выделенные другими способами, предполагающими сплайсинг последовательностей гена иммуноглобулина человека на другие последовательности ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные участки, в которых области каркаса и CDR являются производными от иммуноглобулина зародышевых линий человека. В соответствии с некоторыми аспектами, однако, рекомбинантные человеческие антитела могут быть подвержены мутагенезу in vitro (или, в случае использования последовательностей животных, трансгенных по отношению к Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности участков VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и производны от человеческих зародышевых последовательностей VH и VL и родственны им, могут и не встречаться в зародышевых человеческих антителах в природе.
Термин "моноклональное антитело" или "композиция моноклональных антител" здесь означает препарат молекул антитела одного молекулярного состава. Композиция моноклональных антител демонстрирует простую (одиночную) специфичность связывания и сродство к конкретному эпитопу.
Термин "антитело человека" здесь означает антитела с переменными участками, у которых как участки каркаса, так и CDR, производны от последовательностей зародышевых линий иммуноглобулина человека. Более того, если антитело содержит постоянный участок, то этот участок также будет производным от последовательностей зародышевых линий иммуноглобулина человека. Антитела человека (человеческие антитела) настоящего изобретения могут содержать аминокислотные остатки, не кодируемые последовательностями зародышевых линий иммуноглобулина человека (например, они могут быть результатом мутаций вследствие случайного или сайт-специфического мутагенеза in vitro или соматических мутаций in vivo).
Термин "человеческое моноклональное антитело" означает антитела, демонстрирующие простую специфичность связывания, каркасные и CDR вариабельные участки которых происходят от последовательностей зародышевых линий иммуноглобулина человека. В соответствии с одним аспектом изобретения человеческие моноклональные антитела получают из гибридомы, которая содержит В-клетки трансгенного животного, например трансгенной мыши, геном которых содержит трансген тяжелой цепи и легкой цепи человека, включенные в иммортализованную клетку.
Термин "человеческое моноклональное антитело" здесь означает также все антитела человека, которые готовят, экспрессируют, создают или выделяют рекомбинантными методами, в том числе (а) выделенные из животных (например, из мышей) антитела, трансгенные или трансхромосомальные с включением генов иммуноглобулина человека или приготовленные с помощью гибридом (далее этот метод описан подробно), (b) антитела, выделенные из клеток-носителей, которые были трансформированы так, чтобы экспрессировать антитела человека, например, из трансфектом, (с) антитела, взятые из рекомбинантной комбинаторной библиотеки антител человека, и (d) антитела, приготовленные, экспрессированные, созданные или выделенные другими способами, предполагающими сплайсинг последовательностей гена иммуноглобулина человека на другие последовательности ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные участки, в которых области каркаса и CDR являются производными от иммуноглобулина зародышевых линий человека. В соответствии с некоторыми аспектами, однако, рекомбинантные человеческие антитела могут быть подвержены мутагенезу in vitro (или, в случае использования последовательностей животных, трансгенных по отношению к Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности участков VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и производны от человеческих зародышевых последовательностей VH и VL и родственны им, могут и не встречаться в зародышевых человеческих антителах в природе.
Термин "выделенное (изолированное) антитело" здесь означает антитела, в значительной степени свободные от примесей других антител с другой антигенной специфичностью (например, выделенные антитела, специфически связывающиеся с PSMA, в значительной степени не содержат примесей антител, связывающихся с другими антигенами). Выделенные антитела, специфически связывающиеся с эпитопами, изоформами или вариантами человеческого PSMA, могут, однако, обладать кросс-реактивностью по отношению к другим родственным антигенам, например, из других видов (например, видовые гомологи PSMA). Более того, выделенное антитело может быть в значительной степени свободно от примесей других клеточных компонентов и/или химических веществ. В соответствии с одним аспектом настоящего изобретения комбинацию "выделенных" моноклональных антител с различной специфичностью объединяют в хорошо описанную композицию.
Термин "гуманизированное антитело" здесь означает антитела, у которых последовательности CDR, выделенные у зародышевых линий других млекопитающих, например мыши, были трансплантированы в каркасные последовательности человека. В каркасные участки этих последовательностей человека могут быть внесены дополнительные модификации.
Термин "химерное антитело" здесь означает антитела, вариабельные участки последовательностей которых получены у одних видов, а постоянные участки - у других видов. Например, у такого антитела вариабельные участки могут быть производными от антитела мыши, а постоянные участки - от антитела человека.
Термин "эпитоп" означает протеиновый детерминант, способный к специфическому связыванию к или с антителом. Обычно эпитопы состоят из химически активных групп молекул на своей поверхности, такие как аминокислоты или боковые цепи сахаров, и, обычно, характеризуются специфической трехмерной структурой и специфическими зарядами. Конформационные эпитопы отличаются от неконформационных тем, что связывание с первыми прекращается в присутствии денатурирующих агентов, а со вторыми - нет.
В настоящей заявке термин "специфическое связывание" означает связывание антитела с предопределенным антигеном. Как правило, при связывании константа диссоциации (KD) комплекса антиген-антитело составляет 10-7 М или меньше, причем KD при связывании антитела с предопределенным антигеном по меньшей мере в два раза меньше KD связывания с неспецифическим антигеном (например, с BSA, казеином), то есть не с предопределенным или близкородственным ему антигеном. Фразы "антитело, распознающее антиген" и "антитело, специфическое для антигена" используются взаимозаменяемо с термином "антитело, которое специфически связывается с антигеном".
Термин "изотип" означает здесь класс антитела (например, IgM или IgGI), кодирующийся генами постоянного участка тяжелой цепи.
Термин "вектор" означает здесь молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов вектора является "плазмида", представляющая собой петлю двухцепочечной ДНК, в которую могут быть встроены дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, дополнительные сегменты ДНК могут быть встроены в вирусный геном. Некоторые векторы способны автономно реплицироваться в клетке-хозяине, в которую они были введены (например, бактериальные векторы с бактериальной природой репликации или эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина при попадании в нее и, таким образом, реплицируются вместе с геномом носителя. Более того, существуют векторы, способные управлять экспрессией генов, с которыми оперативно связаны. Такие векторы называются здесь "векторы рекомбинантной экспрессии" (или просто "векторы экспрессии"). В общем случае, векторы экспрессии, применимые в технологиях рекомбинантной ДНК, часто существуют в виде плазмид. В настоящем описании термины "плазмида" и "вектор" могут использоваться взаимозаменяемо, поскольку плазмида является самой распространенной формой вектора. Однако настоящее изобретение охватывает также и другие формы векторов экспрессии, такие как вирусные векторы (например, ретровирусы с дефектом репликации, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции.
Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") в настоящем изобретении означает клетку, в которую был введен вектор рекомбинантной экспрессии. Необходимо понимать, что эти термины относятся не только к конкретной клетке, но и к ее потомству. Поскольку в последующих поколениях могут возникать различные модификации, определяемые либо мутациями, либо влиянием окружающей среды, такое потомство может и не быть идентичным родительской клетке, но все-таки оно входит в область действия термина "клетка-хозяин" в настоящей заявке. Рекомбинантные клетки-носители включают, например, клетки СНО, трансфектомы и лимфатические клетки.
Термин "субъект" здесь означает человека или другое животное. Термин "другое животное" включает всех позвоночных, например млекопитающих и немлекопитающих, таких как приматы (не люди), овцы, собаки, кошки, лошади, коровы, куры, амфибии, рептилии и т.д.
Термин "трансгенное животное" означает здесь животное (не человека), геном которого содержит один или больше трансген или трансхромосому тяжелых и/или легких цепей человека (интегрированных или неинтегрированных в природную геномную ДНК животного) и которое способно экспрессировать полностью человеческие антитела. Например, трансгенная мышь может содержать трансген легкой цепи человека и либо трансген, либо трансхромосому тяжелой цепи человека, так что такая мышь будет вырабатывать анти-PSMA антитела человека при иммунизации антигеном PSMA и/или экспрессирующими PSMA клетками. Трансген тяжелой цепи человека можно интегрировать в хромосомную ДНК мыши, что имеет место в случае трансгенной мыши, например мыши HuMAb, а можно ввести его экстрахромосомно, что имеет место для трансхромосомной мыши (например, КМ), как описано в патенте WO 02/43478. Такие трансгенные и трансхромосомные мыши способны вырабатывать различные изотипы моноклональных антител человека к PSMA (например, IgG, IgA и/или IgE), если осуществлять рекомбинацию V-D-J и переключать изотипы.
В следующих подразделах более подробно описаны различные аспекты настоящего изобретения.
Анти-PSMA антитела без остатков фукозы, обладающие усиленной активностью ADCC
Настоящее изобретение направлено на дефукозилированные анти-PSMA антитела с усиленной управляемой антителами клеточной цитотоксичностью (ADCC) по отношению к клеткам, экспрессирующим PSMA, по сравнению с фукозилированной формой антител. В соответствии с предпочтительным аспектом дефукозилированные антитела настоящего изобретения индуцируют повышенную ADCC к клеткам карциномы простаты LnCaP in vitro (АТСС CRL-1740) по сравнению с фукозилированной формой антител, например, в условиях, когда концентрация антител составляет 0,1 мкг/мл, а отношение количества клеток-мишеней к эффекторным клеткам составляет 1:100. Предпочтительно, если эффекторными клетками являются IL-2 стимулированные клетки периферической крови человека (например, 1×106моноядерных клеток периферической крови человека инкубируют с человеческим IL-2 (10 U/мл) в течение ночи при 37°С). Дефукозилированная форма антител предпочтительно сравнивается с фукозилированной формой, которая получена экспрессией в клетках млекопитающих, таких как клетки СНО.
В соответствии с предпочтительными аспектами изобретения ADCC активность дефукозилированной формы антител характеризуется значением эффективной коцентрации EC50, равным 0,05 мкг/мл или меньше, более предпочтительно 0,04 мкг/мл или меньше, еще более предпочтительно 0,03 мкг/мл или меньше, еще более предпочтительно 0,02 мкг/мл или меньше и еще более предпочтительно, если ЕС50, приблизительно составляет 0,018 мкг/мл. В соответствии с другими предпочтительными аспектами изобретения ADCC активность дефукозилированной формы антител характеризуется значением ЕС50, равным 0,01 мкг/мл или меньше, более предпочтительно 0,009 мкг/мл или меньше, еще более предпочтительно 0,008 мкг/мл или меньше, еще более предпочтительно 0,007 мкг/мл или меньше, еще более предпочтительно 0,005 мкг/мл или меньше и еще более предпочтительно, если ЕС50 приблизительно составляет 0,002 мкг/мл. Предпочтительно определять значения ЕС50 ADCC активности анализом, который описан в Примере 4 с использованием IL-2-стимулированных эффекторных клеток, или анализом, описанным в Примере 4 с использованием человеческих эффекторных клеток свежевзятой периферической крови.
В соответствии с другими предпочтительными аспектами изобретения значения ЕС50 ADCC активности дефукозилированной формы антител, по меньшей мере, в три раза меньше, чем для фукозилированной формы (например, формы антител, экспрессирующихся клеткам СНО), более предпочтительно, если, по меньшей мере, в 4 раза меньше, чем для фукозилированной формы, еще более предпочтительно, если, по меньшей мере, в 5 раз меньше, чем для фукозилированной формы, еще более предпочтительно, если, по меньшей мере, в 6 раз меньше, чем для фукозилированной формы, еще более предпочтительно, если, по меньшей мере, в 7 раз меньше, чем для фукозилированной формы, еще более предпочтительно, если, по меньшей мере, в 8 раз меньше, чем для фукозилированной формы, еще более предпочтительно, если, по меньшей мере, в 9 раз меньше, чем для фукозилированной формы, и еще более предпочтительно, если, по меньшей мере, в 10 раз меньше, чем для фукозилированной формы антитела. Предпочтительно также определять значения ЕС50 ADCC активности анализом, который описан в Примере 4 с использованием IL-2-стимулированных эффекторных клеток, или анализом, описанным в Примере 4 с использованием человеческих эффекторных клеток свежевзятой периферической крови. Как правило, отношение ЕС50 (фукозилированные):ЕС50 (дефукозилированные) больше для эффекторных клеток свежевзятой периферической крови, хотя в этом случае максимальный процент лизиса будет меньше.
Усиленную активность ADCC дефукозилированных антител настоящего изобретения можно количественно измерить, например, как увеличение процента лизиса клеток по сравнению с фукозилированной формой антитела, причем активность ADCC для фукозилированной и дефукозилированной форм измеряется в одних и тех же условиях (например, одинаковые концентрации антител и одинаковые отношения концентрации клеток-мишеней к эффекторным клеткам). В дополнение к этому или альтернативно, усиленную активность ADCC дефукозилированных антител настоящего изобретения можно количественно измерить через снижение значения EC50 дефукозилированной формы по сравнению с фукозилированной. Это снижение можно выразить как отношение ЕС50 фукозилированной формы к ЕС50 дефукозилированной формы.
Примеры клеточных линий PSMA+, которые могут использоваться в эссеях ADCC настоящего изобретения и по отношению к которым дефукозилированные антитела настоящего изобретения демонстрируют усиленную активность ADCC, по сравнению с фукозилированной формой антител, включают клетки LnCaP, 22Rv1 и/или PCa2b. Усиленный дефукозилированными анти-PSMA антителами ADCC эффект может приводить к ADCC-активности клеток PSMA+ при такой концентрации антител, когда ADCC вообще не наблюдается при использовании фукозилированной формы.
Дефукозилирование анти-PSMA антител
Анти-PSMA антитела (например, мышиные, химерные, гуманизированные и человеческие) известны в науке, и они могут применяться в настоящем изобретении. Анти-PSMA антитела настоящего изобретения модифицированы так, что у них отсутствуют фукозильные остатки. Антитела без фукозильных остатков можно получить различными способами. Например, с помощью технологий рекомбинантной ДНК их можно экспрессировать в клетке с измененным механизмом гликозилирования, при котором будет ингибироваться введение остатков фукозы в углеводную цепочку. Кроме того (или в дополнение к этому), антитела можно дефукозилировать, химически удалив фукозильные остатки.
Более того, в соответствии с предпочтительным аспектом антитела можно экспрессировать в химерной системе экспрессии цыплят, так что антитела будут образовываться в зародышах химерных цыплят. Работа с химерными зародышами цыплят, экспрессирующими анти-PSMA антитела, подробно описана в Примере 1, а в Примере 3 показано, что такие экспрессированные в зародышах цыплят анти-PSMA антитела не содержат остатков фукозы. Химерные цыплята, зародыши которых подходят для экспрессии протеинов, описаны в заявке РСТ WO 2004/015123. Таким образом, в соответствии с другим аспектом изобретение направлено на химерных цыплят, содержащих гены тяжелых и легких цепей иммуноглобулина, кодирующие экспрессирующиеся в зародышах химерных цыплят анти-PSMA антитела, причем эти антитела не содержат остатков фукозы. Предпочтительно, чтобы гены тяжелых и легких цепей иммуноглобулина представляли собой гены тяжелых и легких цепей иммуноглобулина человека.
В соответствии с одним аспектом изобретения антитела экспрессируют в клетках, в которых отсутствует фермент фукозилтрансфераза, так что такая клеточная линия вырабатывает протеины без остатков фукозы в углеводных цепях (см. Примеры 5 и 6). Например, ген фукозилтрансферазы FUT8 (альфа(1,6)фукозилтрансфераза) отсутствует в клеточных линиях Ms704, Ms705 и Ms709, так что в углеводных цепочках антител, экспрессирующихся в клетках Ms704, Ms705 и Ms709, отсутствуют остатки фукозы. Линии Ms704, Ms705 и Ms709 FUT8-/- были созданы целевым разрушением гена FUT8 в клетках CHO/DG44 с использованием двух векторов замещения (см. U.S. Patent Publication No. 20040110704 by Yamane et al. и Yamane-Ohnuki et al. (2004) Biotechnol Bioeng 87:614-22). В качестве еще одного примера, в работе ЕР 1,176,195 Hanai et al. описывают клеточную линию с функционально поврежденным геном FUT8, кодирующим фукозилтрансферазу, так что антитела, экспрессируемые в таких линиях, демонстрируют гипофукозилирование, уменьшая количество или вовсе устраняя фермент, родственный альфа 1,6 связи. Hanai с соавторами описывают клеточные линии, от природы характеризующиеся низкой активностью фермента, присоединяющего фукозу к N-ацетилглюкозамину, который связывается с участоком Fc антитела, или не обладающие такой активностью. Например, это может быть линия крысиной миеломы YB2/0 (АТСС CRL 1662). Поданная Presta заявка РСТ Publication WO 03/035835 содержит описание вариантной линии клеток СНО, клеток Lec13 с уменьшенной способностью прикреплять фукозу к Asn(297)-связанным углеводам, что также приводит к гипофукозилированию антител, экспрессирующихся в этих клетках-носителях (см. также Shields, R.L et al. (2002) J. Biol. Chem. 277:26733-26740). В публикации РСТ WO 99/54342 Umana et al. описывает клеточные линии, сконструированные так, чтобы экспрессировать гликопротеин-модифицированные гликозилтрансферазы (например, бета(1,4)-N-ацетилглюкозаминилтрансферазу III (GnTIII)), так что экспрессирующиеся в этих сконструированных клеточных линиях антитела демонстрировали повышенное содержание раздвоенных структур GlcNac, что приводило к повышению активности ADCC антител (см. также Umana et al. (1999) Nat. Biotech. 17:176-180).
В соответствии с другим аспектом анти-PSMA антитела экспрессируются, а фукозильные остатки отщепляются от нее с помощью фермента фукозидазы. Например, удалить фукозильные остатки от антител можно с помощью фукозидазы альфа-L-фукозидазы (Tarentino, A.L. et al. (1975) Biochem. 14:5516-23).
Кроме того, в соответствии с другими аспектами можно приготовить и другие формы гликозилированных антител. Например, можно сделать агликозилированные антитела (то есть антитела без гликозилирования). Подобные углеводные модификации могут сопровождаться, например, изменением одного или нескольких сайтов гликозилирования последовательности антитела. Например, в результате одной или нескольких аминокислотных замен можно удалить один или несколько каркасных сайтов гликозилирования вариабельного участка и, таким образом, этот сайт гликозилироваться не будет. Подобное агликозилирование может повышать сродство антитела к антигену. Подробно этот подход описан в патентах U.S. Patent Nos. 5,714,350 и 6,350,861 Co et al.
Определение отсутствия остатков фукозы у анти-PSMA антител
Антитела настоящего изобретения не содержат фукозильных остатков, например, в фрагменте Fc углеводной цепи. Антитела можно проверить на отсутствие фукозильных остатков стандартными методами, известными в соответствующей области, например капиллярным электрофорезом APTS с индукцией флуоресценции лазерным излучением. Кратко, N-связанные олигосахариды очищенных анти-PSMA антител выделяют, добавляя пептид N-гликаназу (Прозим) с последующей инкубацией в течение одной ночи. Углеводы ресуспендируют и дериватизируют 8-аминопирен-1,3,6-трисульфонатом (APTS) в мягких условиях восстановительного аминирования, при которых минимизируется дезалилирование и отщепление фукозильных остатков. Аддукты реакции анализируют капиллярным электрофорезом с детекцией индуцированной лазером флуоресценции на детекторе производства Beckman Coulter. Отсутствие фукозы можно определить по сдвигу в электрофорезе по сравнению с тем же антителом, содержащим фукозу. Отсутствие фукозы в анти-PSMA антителах можно определить также методом моносахаридного анализа с использованием HPLC. Другие методы анализа содержания углеводов и структуры антител включают MS-профилирование экспрессируемых углеводов (гликомика), прямой MALDI TOF анализ высвобождающихся интактных гликанов (позволяющий определить массу гликанов различных классов), низкие спектры CID MSMS (чтобы получить информацию о структурной композиции гликанов), высокие спектры CID MSMS и спектры MSn (дающие информацию о соединимости гликанов между собой), а также последовательное поглощение экзогликозидазой (дающее информацию о структурной совместимости гликанов). Методология определения содержания углеводов в антителах подробно рассматривается в Примере 3.
Измерение зависящего от антител уничтожения клеток PSMA+
Дефукозилированные анти-PSMA антитела можно проверить на способность опосредовать фагоцитоз и убивать клетки, экспрессирующие PSMA. В соответствии с одним аспектом изобретения дефукозилированные анти-PSMA антитела усиливают уничтожение клеток, экспрессирующих PSMA, по сравнению с такими же антителами, содержащими фукозу в той же концентрации. В соответствии с другим аспектом дефукозилированные анти-PSMA антитела индуцируют гибель экспрессирующих PSMA клеток, причем такие же антитела, содержащие фукозу, в той же концентрации не индуцируют эту гибель.
ADCC активность моноклональных антител можно проверить в анализах in vitro. Например, можно воспользоваться анализом ADCC, основанным на высвобождении хрома. Кратко, моноядерные клетки периферической крови (РВМС) или другие эффекторные клетки здоровых доноров очищают центрифугированием в градиенте плотности Ficoll Hypaque с последующим лизисом содержащихся там следовых количеств эритроцитов. Промытые РВМС суспендируют в RPMI с 10% инактивированной нагреванием фетальной телячьей сывороткой и смешивают с клетками, меченными51Cr и экспрессирующими PSMA. Это делают с различным отношением концентрации эффекторных клеток к клеткам опухолей (эффекторные клетки:опухолевые клетки). После этого в различных концентрациях добавляют анти-PSMA антитела. В качестве отрицательного контроля можно использовать изотипно соответствующие антитела. Анализы выполняют при 37°С в течение 4-18 часов. Цитолиз образцов измеряют, определяя высвобождение51Cr в культуральный супернатант. Можно также тестировать одновременный эффект различных анти-РSМА моноклональных антител, определяя, не усиливается ли цитолиз в присутствии нескольких форм антител.
Альтернативным анализом, позволяющим определить способность анти-РSМА антител опосредовать фагоцитоз и гибель экспрессирующих РSМА клеток, является флуорометрический анализ с разрешением во времени. Кратко, экспрессирующие PSMA клетки загружают в ацетоксиметильный эфир усиливающего флуоресценцию лиганда (BATDA), проникающего сквозь клеточные мембраны. Внутри клетки эфирные связи гидролизуются, и соединение уже не может проходить сквозь мембраны. После этого в различных концентрациях добавляют анти-PSMA антитела. По завершении цитолиза в систему вводят раствор европия (Perkin Elmer), и все свободные лиганды связываются с европием, формируя высокофлуоресцирующий стабильный комплекс (EuTDA), который можно определять на микропланшетном ридере (Perkin Elmer). Интенсивность измеренного сигнала коррелирует с количеством лизировавшихся клеток.
Предпочтительный метод анализа ADCC для изучения ADCC активности анти-PSMA антител настоящего изобретения подробно рассматривается в Примере 4.
Анти-PSMA антитела можно тестировать на модели in vivo (например, на мышах), определяя их эффективность в опосредовании фагоцитоза и уничтожении экспрессирующих PSMA клеток, то есть опухолевых клеток. Эти антитела можно выбирать, например, руководствуясь следующими не ограничивающимися критериями:
1. Связывание с живыми клетками, экспрессирующими PSMA.
2. Высокое сродство при связывании PSMA.
3. Связывание с уникальным эпитопом на PSMA (чтобы устранить возможную конкуренцию моноклональных антител с комплементарной активностью при совместном использовании).
4. Интернализация клеток, экспрессирующих PSMA.
5. Опосредование in vitro ингибирования роста, фагоцитоза и/или уничтожения клеток, экспрессирующих PSMA, в присутствии эффекторных клеток человека.
Предпочтительные моноклональные антитела настоящего изобретения соответствуют одному или нескольким перечисленным критериям. В конкретном аспекте настоящего изобретения моноклональные антитела используют совместно, например, в составе фармацевтической композиции, содержащей два или более анти-PSMA моноклональных антитела или их фрагментов. Например, чтобы добиться желаемого терапевтического или диагностического эффекта, в одном составе можно объединить анти-PSMA моноклональные антитела с различной, но комплементарной активностью. Иллюстрацией такого подхода является композиция, содержащая анти-PSMA моноклональные антитела, опосредующие высокоэффективное уничтожение клеток-мишеней в присутствии эффекторных клеток, а также еще один тип анти-PSMA моноклональных антител, ингибирующих рост клеток, экспрессирующих PSMA.
Измерение связывания с PSMA
Связывание антител настоящего изобретения с PSMA можно тестировать, например, стандартными методами анализа, известными в соответствующей области, такими как ELISA, FACS и/или Biacore. Кратко, в типичном анализе ELISA планшеты для микротитрования покрывают очищенным PSMA в концентрации 0.25 мкг/мл в PBS и затем блокируют раствором 5% бычьего сывороточного альбумина в PBS. В каждую ячейку вводят разбавленные до нужной концентрации антитела и инкубируют на 1-2 часа при температуре 37°С. Планшеты промывают после этого системой PBS/Tween и инкубируют с вторичным реагентом (например, Fc-специфическим поликлональным реагентом в случае антител человека или козы к человеческому IgG), конъюгированным к щелочной фосфатазе. Промывку осуществляют в течение часа при 37°С. По завершении промывки планшеты инкубируют с субстратом pNPP (1 мг/мл) и анализируют при OD 405-650.
Чтобы продемонстрировать связывание моноклональных антител с экспрессирующими PSMA живыми клетками, можно использовать цитометрию в потоке. В соответствии с типичным протоколом такого метода (не ограничивающим область изобретения), экспрессирующие PSMA клеточные линии (выращенные в стандартных условиях) смешивают с различными концентрациями моноклональных антител в PBS, содержащем 0,1% BSA и 20% мышиной сыворотки, и затем один час инкубируют при 37°С. После последующей промывки клетки реагируют с меченными флуоресцеином вторичными антителами (например, античеловеческим IgG антителом) в тех же условиях, что и для первичных антител. Образцы можно анализировать на приборе FACScan, использующем свет и свойства бокового рассеяния, позволяющие регистрировать отдельные клетки. В дополнение или помимо цитометрии в потоке можно использовать также флуоресцентную микроскопию. Клетки окрашивают так, как было описано, и затем изучают методом флуоресцентной микроскопии. Данный метод позволяет увидеть отдельные клетки, но его чувствительность может быть понижена в зависимости от плотности антигена.
Взаимодействие анти-PSMA антител с антигеном PSMA можно исследовать также методом Вестерн-блоттинга. Например, можно приготовить экстракты клеток, экспрессирующих PSMA, и поставить с ними электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS). По окончании электрофореза выделенные антигены переносят на мембрану из микроцеллюлозы, блокируют 20% мышиной сывороткой и анализируют с помощью тестируемых моноклональных антител. Для детекции связывания антител можно использовать антиспецифические специфические вторичные антитела, соединенные со щелочной фосфатазой и поставляемые с субстратными таблетками BCIP/NBT (Sigma Chem. Co., St. Louis, МО). Известны и другие технологии, позволяющие оценить способность антител связываться с PSMA, к их числу относятся RIA и анализ Biacore. Подробно подходящие методы определения связывания PSMA описаны в Примере 4.
Химерные или гуманизированные анти-PSMA антитела
В соответствии с определенными аспектами дефукозилированные анти-PSMA антитела настоящего изобретения представляют собой химерные или гуманизированные антитела. Такие антитела получают из доступных мышиных анти-PSMA антител с помощью известных процедур превращения мышиного антитела в химерное или гуманизированное антитело. Неограничивающие примеры таких мышиных анти-PSMA антител включают 3F5.4G6, 3D7.1.1, 4Е10-1.14, 3Е11, 4D8, 3Е6, 3С9, 2С7, 1G3, 3С4, 3С6, 4D4, 1G9, 5С8В9, 3G6, 4С8В9, Е99, J415, J533 и J591 моноклональные антитела. Гибридомы, секретирующие 3F5.4G6, 3D7.1.1, 4Е10-1.14, 3Е11, 4D8, 3Е6, 3С9, 2С7, 1G3, 3С4, 3С6, 4D4, 1G9, 5С8В9, 3G6 или 4С8В9 были выгружены для всеобщего доступа и описаны в патенте US No. 6,150,508. Гибридомы, секретирующие Е99, J415, J533 или J591 были выгружены для всеобщего доступа и описаны в патенте US No. 6,107,090. Более того, гуманизированные анти-PSMA антитела, включая гуманизированную версию J591, подробно описаны в публикации РСТ WO 02/098897. Кроме того, другие античеловеческие PSMA антитела также были описаны, например, это антитела mAb 107-1A4 (Wang, S. et al. (2001) Int. J. Cancer 92:871-876) и mAb 2C9 (Kato, K. et al. (2003) Int. J. Urol. 10:439-444).
Моноклональные анти-PSMA антитела человека
Предпочтительные антитела настоящего изобретения включают анти-PSMA моноклональные антитела человека. В качестве примеров таких антител можно указать 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 антитела, они были выделены и структурно охарактеризованы, как первоначально было описано в публикациях РСТ WO 01/09192 и WO 03/064606, а также в американской временной заявке (U.S. Provisional Application) No. 60/654,125, озаглавленной "Моноклональные антитела человека к простатоспецифическому мембранному антигену (PSMA)", поданной 18 февраля 2005 года; содержание всех этих работ явным образом включено сюда по ссылке. Аминокислотные последовательности VH антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены как SEQ ID NOs: 1-9, соответственно. Аминокислотные последовательности VL антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены как SEQ ID NOs: 10-18, соответственно. Другие человеческие анти-PSMA антитела, которые могут быть использованы в настоящем изобретении, включают антитела, которые рассматриваются в публикации РСТ WO 03/034903 и заявке США No. 2004/0033229.
Поскольку каждая из этих молекул может связываться с PSMA, последовательности VH и VL можно смешивать и спаривать друг с другом, создавая другие анти-PSMA связывающие молекулы настоящего изобретения. Для проверки способности таких "перемешанных" антител связывать PSMA можно воспользоваться анализами для определения связывания, хорошо известными в данной области, такими как анализы FACS и ELISA. Предпочтительно, когда цепи VH и VL смешаны и приведены в соответствие друг с другом и последовательность VH конкретной пары VH/VL замещена на структурно похожую последовательность VH. Аналогично, предпочтительно, если последовательность VL конкретной пары VH/VL замещена на структурно похожую последовательность VL. Например, очень хорошо поддаются перемешиванию последовательности VH антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6 и 2F5, так как в этих антителах используются VH последовательности, которые получены от одной и той же зародышевой последовательности (VH 5-51) и поэтому демонстрируют структурное сходство. Аналогично этому очень хорошо поддаются перемешиванию последовательности VL антител 4А3, 7F12, 8С12 и 2С6, так как в этих антителах используются VL последовательности, которые получены от одной и той же зародышевой последовательности (VL L6), и поэтому они демонстрируют структурное сходство. Аналогично этому также очень хорошо поддаются перемешиванию последовательности VL антител 8А11 и 16F9, так как в этих антителах используются VL последовательности, которые получены от одной и той же зародышевой последовательности (VL 04/014), и поэтому они демонстрируют структурное сходство. Аналогично этому также очень хорошо поддаются перемешиванию последовательности VL антител 1С3, 2А10 и 2F5, так как в этих антителах используются VL последовательности, которые получены от одной и той же зародышевой последовательности (VL L18), и поэтому они демонстрируют структурное сходство.
В соответствии с конкретными аспектами изобретение направлено на дефукозилированные моноклональные антитела или их антиген-связывающие участки, содержащие:
(a) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы SEQ ID NOs: 1-9; и
(b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность, выбранную из группы SEQ ID NOs: 410-18, где антитела специфически связывают PSMA человека.
Предпочтительные комбинации тяжелых и легких цепей включают:
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 1; и
(b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 10; или
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 2; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 11; или
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 3; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 12;
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 4; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 13;
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 5; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 14;
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 6; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 15; или
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 7; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 16;
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 8; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 17;
(а) вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 9; и (b) вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 18.
В соответствии с другим аспектом изобретение направлено на дефукозилированные антитела, содержащие тяжелую и легкую цепи CDR1, CDR2 и CDR3 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3, или их комбинацию. Аминокислотные последовательности VH цепей CDR1 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 19-27, соответственно. Аминокислотные последовательности VH цепей CDR2 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 28-36, соответственно. Аминокислотные последовательности VH цепей CDR3 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 37-45, соответственно. Аминокислотные последовательности VK цепей CDR1 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 46-54, соответственно. Аминокислотные последовательности VК цепей CDR2 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 55-63, соответственно. Аминокислотные последовательности VК цепей CDR3 антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3 представлены номерами SEQ ID NOs: 64-72, соответственно. Регионы CDR выделены в соответствии с системой Kabat (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health и Human Services, NIH Publication No. 91-3242).
Поскольку каждое из этих антител может связываться с PSMA, и антиген-связывающая специфичность обеспечивается, в основном, участками CDR1, 2 и 3, цепи VH последовательностей CDR1, 2 и 3 и цепи VК последовательностей CDR1, 2 и 3 можно смешивать и соотносить (то есть можно смешивать и соотносить CDR различных антител, хотя каждое антитело должно содержать VH CDR1, 2 и 3 и Vk CDR1, 2 и 3) с получением других анти-PSMA связывающих молекул настоящего изобретения. Для проверки способности таких "перемешанных" антител связывать PSMA можно воспользоваться анализами для определения связывания, хорошо известными в данной области, такими как анализ FACS и анализ ELISA. Предпочтительно, в случае смешивания последовательностей VH CDR, последовательности CDR1, CDR2 и/или CDR3 конкретной последовательности VH замещают на структурно похожие последовательности CDR. Аналогично этому, в случае смешивания последовательностей VК CDR, последовательности CDR1, CDR2 и/или CDR3 конкретной последовательности VК замещают на структурно похожие последовательности CDR. Специалисту в данной области понятно, что для создания новых последовательностей VH и VL одну или несколько последовательностей CDR участков VH и/или VL можно заменить на структурно похожие последовательности CDR, описанные здесь для моноклональных антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3.
В соответствии с другим аспектом настоящее изобретение направлено на дефукозилированные моноклональные антитела или их антиген-связывающие фрагменты, содержащие:
(а) вариабельный участок тяжелой цепи CDR1, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 19-27;
(b) вариабельный участок тяжелой цепи CDR2, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 28-36;
(c) вариабельный участок тяжелой цепи CDR3, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 37-45;
(d) вариабельный участок легкой цепи CDR1, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 46-54;
(e) вариабельный участок легкой цепи CDR2, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 55-63; и
(f) вариабельный участок легкой цепи CDR3, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 64-72;
Где антитело специфически связывается с PSMA.
В соответствии с предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 19;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 28;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 37;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 46;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 55; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 64.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 20;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 29;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 38;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 47;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 56; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 65.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 21;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 30;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 39;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 48;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 57; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 66.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 22;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 31;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 40;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 49;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 58; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 67.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 23;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 32;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 41;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 50;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 59; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 68.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 24;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 33;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 42;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 51;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 60; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 69.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 25;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 34;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 43;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 52;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 61; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 70.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 26;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 35;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 44;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 53;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 62; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 71.
В соответствии с еще одним предпочтительным аспектом антитела содержат:
(a) вариабельный участок тяжелой цепи CDR1 человека, содержащий SEQ ID NO: 27;
(b) вариабельный участок тяжелой цепи CDR2 человека, содержащий SEQ ID NO: 36;
(c) вариабельный участок тяжелой цепи CDR3 человека, содержащий SEQ ID NO: 45;
(d) вариабельный участок легкой цепи CDR1 человека, содержащий SEQ ID NO: 54;
(e) вариабельный участок легкой цепи CDR2 человека, содержащий SEQ ID NO: 63; и
(f) вариабельный участок легкой цепи CDR3 человека, содержащий SEQ ID NO: 72.
Антитела с особыми последовательностями зародышевых линий
В соответствии с некоторыми аспектами дефукозилированные антитела настоящего изобретения содержат вариабельный участок тяжелой цепи из гена тяжелой цепи иммуноглобулина конкретной зародышевой линии и/или вариабельный участок легкой цепи из гена легкой цепи иммуноглобулина конкретной зародышевой линии.
Например, в соответствии с предпочтительным аспектом, изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок тяжелой цепи, который представляет собой продукт или производное гена VH 5-51 человека, причем антитело специфически связывается с PSMA человека. В соответствии с другим предпочтительным аспектом изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок тяжелой цепи, который представляет собой продукт или производное гена VH 3-30.3 человека, причем антитело специфически связывается с PSMA. В соответствии с еще одним предпочтительным аспектом изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок легкой цепи, который представляет собой продукт или производное гена VK L6 человека, причем антитело специфически связывается с PSMA человека. В соответствии с еще одним предпочтительным аспектом изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок легкой цепи, который представляет собой продукт или производное гена VK 04/014 человека, причем антитело специфически связывается с PSMA человека. В соответствии с еще одним предпочтительным аспектом изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок легкой цепи, который представляет собой продукт или производное гена VK L18 человека, причем антитело специфически связывается с PSMA человека.
В соответствии с еще одним предпочтительным аспектом настоящее изобретение направлено на дефукозилированные моноклональные антитела или их антиген-связывающие фрагменты, причем антитела:
(a) содержат вариабельный участок тяжелой цепи, представляющий собой продукт или производное генов VH 5-51 или 3-30.3 человека (которые кодируют аминокислотные последовательности SEQ ID NOs: 73 и 76, соответственно);
(b) содержат вариабельный участок легкой цепи, представляющий собой продукт или производное генов Vk L6, 04/014 или L18 человека (которые кодируют аминокислотные последовательности SEQ ID NOs: 74, 75 и 77, соответственно); и
(c) специфически связываются с PSMA человека.
Предпочтительная комбинация зародышевых VH и Vk представляет собой VH 5-51 и Vk L6. Примером антител, VH и Vk которых представляют собой VH 5-51 и Vk L6, соответственно, являются антитела 4А3, 7F12, 8С12 и 2С6. Еще одной предпочтительной комбинацией VH и Vk является VH 5-51 и Vk 04/014. Примером антител с VH и Vk, соответствующими VH 5-51 и Vk 04/014, соответственно, является 8А11 и 16F9. Еще одной предпочтительной комбинацией VH и Vk является VH 5-51 и Vk L18. Примером антител с VH и Vk, соответствующими VH 5-51 и Vk L18, соответственно, являются 2А10 и 2F5. Еще одной предпочтительной комбинацией VH и Vk является VH 3-30.3 и Vk L18. Примером антитела с VH и Vk, соответствующими VH 3-30.3 и Vk L18, соответственно, является антитело 1С3.
В настоящей заявке антитело человека содержит вариабельные участки тяжелой и легкой цепей, которые представляют собой продукт или производное конкретной зародышевой последовательности, если вариабельные участки антитела получаются из системы, в которой используются зародышевые гены иммуноглобулина человека. Такие системы включают трансгенную мышь с генами иммуноглобулина человека, иммунизированную интересующим антигеном, или скрининг библиотеки генов иммуноглобулина человека, отображенной на фаге с интересующим антигеном. Человеческое антитело, представляющее собой "продукт" или "производное" зародышевой последовательности иммуноглобулина человека, можно идентифицировать, сравнивая аминокислотные последовательности антитела человека с аминокислотными последовательностями зародышевых иммуноглобулинов человека (например, с помощью базы данных Vbase) и выбирая такие зародышевые последовательности иммуноглобулинов человека, которые ближе всего к последовательности антитела человека (то есть у них наибольший процент идентичности). Антитело человека, представляющее собой "продукт" или "производное" конкретной зародышевой последовательности иммуноглобулина человека, может содержать аминокислотные отличия от этой зародышевой последовательности, вызванные, например, происходящими в природе соматическими мутациями или полученными сайт-специфическим мутагенезом. Однако, как правило, аминокислотная последовательность антитела человека по меньшей мере на 90% идентична последовательности, кодируемой зародышевым геном иммуноглобулина человека, и содержит аминокислотные остатки, идентифицирующее ее именно как антитело человека, по сравнению с аминокислотными последовательностями зародышевых иммуноглобулинов других видов (например, мышиными). Иногда аминокислотная последовательность антитела человека может быть, по меньшей мере, на 95% или даже, по меньше мере, на 96%, 97%, 98% или 99% идентична последовательности, кодируемой зародышевым геном иммуноглобулина человека. Как правило, человеческое антитело, производное от конкретной зародышевой последовательности человека, демонстрирует не больше 10 аминокислотных отличий от аминокислотной последовательности, кодируемой человеческим зародышевым геном иммуноглобулина. В некоторых случаях антитело человека может демонстрировать не больше 5 или даже не больше 4, 3, 2 или 1 аминокислотного отличия от аминокислотной последовательности, кодируемой геном иммуноглобулина человека.
Гомологичные антитела
В соответствии с еще одним аспектом дефукозилированные антитела настоящего изобретения содержат вариабельные участки тяжелых и легких цепей, аминокислотные последовательности которых гомологичны аминокислотным последовательностям предпочтительных описанных здесь антител, причем эти антитела сохраняют желательные функциональные свойства анти-PSMA антител настоящего изобретения.
Например, изобретение направлено на дефукозилированные моноклональные антитела или на их антиген-связывающие фрагменты, содержащие вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, где:
(а) вариабельный участок тяжелой цепи содержит аминокислотную последовательность, по меньшей мере, на 80% гомологичную аминокислотной последовательности, выбранной из группы, содержащей SEQ ID NO: 1-9;
(b) вариабельный участок легкой цепи содержит аминокислотную последовательность, по меньшей мере, на 80% гомологичную аминокислотной последовательности, выбранной из группы, содержащей SEQ ID NO: 10-18; и
(c) антитела специфически связывают с PSMA человека.
В соответствии с другими аспектами аминокислотные последовательности VH и/или VL могут быть на 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологичны последовательностям, описанным выше. Антитела, VH и VL участки которых характеризуются высокой (то есть 80% или больше) гомологией с VH и VL участками описанных выше последовательностей, можно получить мутагенезом (то есть сайт-направленным или опосредованным ПЦР мутагенезом) одной или нескольких молекул нуклеиновых кислот, кодирующих SEQ ID NOs: 1-18, с последующей проверкой наличия у кодируемых такой измененной последовательностью антител требуемой функции (то есть связывания с PSMA) с помощью описанных выше анализов связывания. Молекулы нуклеиновых кислот, кодирующие последовательности SEQ ID NOs: 6-9 и 15-18, представлены как SEQ ID NOs: 78-85. Молекулы нуклеиновых кислот, кодирующие последовательности SEQ ID NOs: 1-5 и 10-14, описаны в публикации РСТ WO 03/064606, а также на Фиг.17А и 17B.
В настоящей заявке процент гомологии между двумя аминокислотными последовательностями эквивалентен проценту идентичности между ними. Процент идентичности между двумя последовательностями представляет собой функцию от количества идентичных позиций последовательностей (то есть % гомологии = (число идентичных позиций)/(общее число позиций)×100). При этом необходимо учитывать количество и длину пробелов, которые требуется ввести для оптимального выравнивания (соотнесения) двух последовательностей. Сравнение последовательностей и определение процента идентичности между ними можно осуществить с помощью математического алгоритма, как описано в приводимых ниже неограничивающих примерах.
Процент идентичности между двумя нуклеотидными последовательностями можно определить с помощью программы GAP программного пакета GCG (доступного на сайте http://www.gcg.com), используя матрицу NWSgapdna.CMP и значения параметра "вес пробела" (gap weight) 40, 50, 60, 70 или 80, и значения параметра "длина пробела" (length weight) 1, 2, 3, 4, 5 или 6. Процент идентичности между двумя нуклеотидными или аминокислотными последовательностями можно определить также с помощью алгоритма, разработанного Е.Meyers и W.Miller (Comput. Appl. Biosci., 4:11-17 (1988)) и включенного в программу ALIGN (версия 2.0), используя таблицу весовых остатков РАМ120, значение параметра "штраф за длину пробела" (gap length penalty) 12, и значение "штраф за пробел" (gap penalty) 4. Кроме того, процент идентичности между двумя аминокислотными последовательностями можно определить по алгоритму Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970)), входящего в состав программы GAP программного пакета GCG (доступного на сайте http://www.gcg.com), используя либо матрицу Blossum 62, либо матрицу РАМ250, значения параметра "вес пробела" 16, 14, 12, 10, 8, 6 или 4 и значения параметра "длина пробела" 1, 2, 3, 4, 5 или 6.
Процент идентичности между двумя аминокислотными последовательностями можно определить по алгоритму Е.Meyers и W.Miller (Comput. Appl. Biosci., 4:11-17 (1988)) и включенного в программу ALIGN (версия 2.0), используя таблицу весовых остатков РАМ120, значение параметра "штраф за длину пробела", равное 12, и значение параметра "штраф за пробел" 4. Кроме того, процент идентичности между двумя аминокислотными последовательностями можно определить по алгоритму Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970)), входящего в состав программы GAP программного пакета GCG (доступного на сайте http://www.gcg.com), используя либо матрицу Blossum 62, либо матрицу РАМ250, значения параметра "вес пробела" 16, 14, 12, 10, 8, 6 или 4 и значение параметра "длина пробела" 1, 2, 3, 4, 5 или 6.
В дополнение или альтернативно белковые последовательности настоящего изобретения можно использовать также как последовательности запроса для выполнения поиска в публичных базах данных, чтобы, например, обнаружить там родственные последовательности. Такой поиск можно выполнить с помощью программы XBLAST (версия 2.0) автора Altschul et al. (1990) J. Mol. Biol. 215:403-10. Для поиска протеинов BLAST программой XBLAST необходимо задать значения score = 50, wordlength = 3. Так можно получить аминокислотные последовательности, гомологичные молекулам антител настоящего изобретения. Чтобы выполнить выравнивание с учетом пробелов для сравнения, можно воспользоваться программой Gapped BLAST, как описано в работе Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При работе с модулями BLAST и Gapped BLAST можно воспользоваться значениями параметров соответствующих программ (например, параметров программ XBLAST и NBLAST). Более подробная информация содержится на сайте http://www.ncbi.nlm.nih.gov.
Антитела с консервативными модификациями
В соответствии с некоторыми аспектами дефукозилированные антитела настоящего изобретения содержат вариабельный участок тяжелой цепи, содержащий последовательности CDR1, CDR2 и CDR3, и вариабельный участок легкой цепи, содержащий последовательности CDR1, CDR2 и CDR3, где одна или более этих CDR последовательностей содержат указанные аминокислотные остатки, основанные на описанных здесь предпочтительных антителах (например, на 4A3, 7F12, 8C12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3) или их консервативные модификации, и где антитела сохраняют требуемые функциональные свойства анти-PSMA антител изобретения. Соответственно, изобретение направлено на дефукозилированные моноклональные антитела или их антиген-связывающие фрагменты, содержащие вариабельный участок тяжелой цепи, содержащий последовательности CDR1, CDR2 и CDR3, и вариабельный участок легкой цепи, содержащий последовательности CDR1, CDR2 и CDR3, где:
(a) последовательность вариабельного участка CDR3 тяжелой цепи содержит аминокислотные последовательности SEQ ID NO: 37-45 и их консервативные модификации;
(b) последовательность вариабельного участка CDR3 легкой цепи содержит аминокислотные последовательности SEQ ID NO: 64-72 и их консервативные модификации; а также
(c) антитела специфически связываются с человеческим PSMA.
В соответствии с предпочтительным аспектом последовательность вариабельного участка тяжелой цепи CDR2 содержит аминокислотную последовательность SEQ ID NO: 28-36 и ее консервативные модификации; а последовательность вариабельного участка легкой цепи CDR2 содержит аминокислотную последовательность SEQ ID NO: 55-63 и ее консервативные модификации. В соответствии с другим предпочтительным аспектом последовательность вариабельного участка тяжелой цепи CDR1 содержит аминокислотную последовательность SEQ ID NO: 19-27 и ее консервативные модификации; а последовательность вариабельного участка легкой цепи CDR1 содержит аминокислотную последовательность SEQ ID NO: 46-54 и ее консервативные модификации.
В настоящей заявке термин "консервативная модификация последовательности" означает аминокислотные модификации, которые всего лишь незначительно влияют на (изменяют) характеристики связывания содержащего аминокислотную последовательность антитела. Такие аминокислотные модификации включают аминокислотные замены, включения или делеции. Модификации антител настоящего изобретения можно осуществлять стандартными известными методами, такими как сайт-направленный мутагенез или ПЦР-опосредованный мутагенез. При консервативных аминокислотных заменах аминокислотные остатки заменяют на другие аминокислотные остатки с такими же боковыми цепями. Семейства аминокислотных остатков с одинаковыми боковыми цепями описаны в соответствующей литературе. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), с кислыми боковыми цепями (например, аспарагиновая или глутаминовая кислоты), с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), с бета-ветвящимися боковыми цепями (например, треонин, валин, изолейцин) и с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Так, один или больше аминокислотных остатков CDR участков антител настоящего изобретения можно заменить на другие аминокислотные остатки из того же семейства боковых цепей, после чего измененные антитела проверяют на сохранение у них функции (то есть функций, описанных в пунктах (i)-(iv) выше) с помощью описанных здесь функциональных эссеев.
Альтернативно, в соответствии с другим аспектом изобретения, мутации можно вводить случайным образом по всей кодирующей последовательности анти-PSMA антитела или в ее части, как это происходит при насыщающем мутагенезе, и полученные в результате модифицированные анти-PSMA антитела также затем скринируют на связывание.
Антитела, связывающиеся с тем же эпитопом, что и анти-PSMA антитела настоящего изобретения
В соответствии с другим своим аспектом настоящее изобретение направлено на дефукозилированные антитела, связывающиеся с тем же эпитопом, что и различные описанные здесь анти-PSMA антитела настоящего изобретения; это могут быть другие антитела человека, связывающиеся с тем же эпитопом, что и описанные здесь антитела 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3. Такие дополнительные антитела можно идентифицировать по их способности к перекрестной конкуренции (например, к статистически значимому конкурентному ингибированию связывания) с другими антителами настоящего изобретения, такими как 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3, что определяется стандартными методами определения связывания с PSMA. Способность исследуемого антитела ингибировать связывание, например, 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3 с PSMA человека показывает, что оно может конкурировать с этими антителами за связывание с PSMA; в соответствии с неограничивающей настоящее изобретение теорией такое антитело может связываться с тем же или родственным эпитопом (например, структурно или пространственно похожим) PSMA человека, что и антитело, с которым оно конкурирует. В соответствии с предпочтительным аспектом дефукозилированные антитела, связывающиеся с таким же эпитопом PSMA человека, что и антитела 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3, представляют собой моноклональные антитела человека. Методы получения и выделения таких моноклональных антител описаны в публикациях РСТ WO 01/09192 и WO 03/064606.
Сконструированные и модифицированные антитела
Дефукозилированные антитела настоящего изобретения могут также быть приготовлены из антител с одной или более описанными здесь последовательностями VH и/или VL как исходный материал, из которого конструируют модифицированное антитело, причем свойства последнего могут отличаться от свойств исходного антитела. Антитело может быть сконструировано путем модификации одного или нескольких аминокислотных остатков одного или нескольких вариабельных участков (то есть VH и/или VL), например, внутри одного или нескольких участков CDR или одного или нескольких каркасных участков. Дополнительно или альтернативно антитело может быть сконструировано путем модификации остатков постоянных участков, например, чтобы изменить эффекторные функции антитела.
Один возможный тип конструирования вариабельного участка называется пересадка CDR (CDR grafting). Антитела взаимодействуют с антигенами мишени, предпочтительно, с помощью аминокислотных остатков, расположенных в шести тяжелых и легких цепях участков, определяющих комплементарность (CDR). По этой причине входящие в CDR аминокислотные последовательности различных антител более разнообразны по сравнению с участками за пределами CDR. Так как CDR последовательности отвечают за большую часть взаимодействий антиген-антитело, для экспрессии рекомбинантного антитела, имитирующего свойства конкретного природного антитела, можно сконструировать вектора экспрессии, включающие CDR последовательности конкретного природного антитела, которые перенесли (пересадили) в каркасные последовательности другого антитела с другими свойствами (см., например, Riechmann, L. et al. (1998) Nature 332:323-327; Jones, P. et al. (1986) Nature 321:522-525; Queen, C. et al. (1989) Proc. Natl. Acad. See. U.S.A. 86:10029-10033; U.S. Patent No. 5,225,539 to Winter и U.S. Patent Nos. 5,530,101; 5,585,089; 5,693,762 и 6,180,370 to Queen et al.).
Соответственно, еще один аспект настоящего изобретения направлен на дефукозилированные моноклональные антитела или их антиген-связывающие фрагменты, включающие вариабельные участки тяжелой цепи, содержащие последовательности CDR1, CDR2 и CDR3, аминокислотные последовательности которых выбраны из группы SEQ ID NOs: 19-27, SEQ ID NOs: 28-36 и SEQ ID NOs: 37-45, соответственно, и вариабельные участки легкой цепи, содержащие аминокислотные последовательности, выбранные из группы SEQ ID NOs: 46-54, SEQ ID NOs: 55-63 и SEQ ID NOs: 64-72, соответственно. Такие антитела содержат VH и VL CDR последовательности моноклональных антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 или 1С3, но могут также содержать каркасные последовательности и других антител.
Такую каркасную последовательность можно получить из публичных баз данных ДНК или из литературных источников, содержащих зародышевые последовательности генов антител. Например, зародышевые последовательности ДНК генов вариабельных участков тяжелых и легких цепей человека можно найти в базе данных зародышевых последовательностей человека "VBase" (доступной на сайте www.mrc-cpe.cam.ac.uk/vbase) или в работах Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health и Human Services, NIH Publication No. 91-3242; Tomlinson, I. M., et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops" J. Mol. Biol. 227:776-798; и Сох, J. P. L et al. (1994) "A Directory of Human Germ-line VH Segments Reveals a Strong Bias in their Usage" Eur. J. Immunol. 24:827-836. Содержание всех этих работ явным образом включено сюда по ссылке.
Предпочтительные каркасные последовательности для использования с антителами настоящего изобретения структурно похожи на каркасные последовательности избранных антител настоящего изобретения, например, похожи на последовательности настоящего изобретения VH 5-51 или 3-30.3 (SEQ ID NO: 73 и 76, соответственно) и/или на каркасные последовательности Vk L6, 04/014 или L18 (SEQ ID NO: 74, 75 или 77, соответственно). Это последовательности предпочтительных моноклональных антител изобретения. Последовательности VH CDR1, 2 и 3 и последовательности VК CDR1, 2 и 3 можно перенести в каркасные участки, последовательности которых идентичны тем, что представлены в зародышевых генах иммуноглобулина, от которых происходит данная каркасная последовательность, или же CDR последовательности можно перенести в каркасные участки, содержащие одну или несколько мутаций, по сравнению с зародышевыми последовательностями. Например, показано, что иногда бывает полезно внести мутации в остатки в каркасных участках, чтобы сохранить или усилить антиген-связывающую способность антитела (см., например, U.S. Patent Nos. 5,530,101; 5,585,089; 5,693,762 и 6,180,370 авторов Queen et al.).
Еще один тип модификации вариабельного участка связан с внесением мутаций в аминокислотные остатки участков VH и/или VК CDR1, CDR2 и/или CDR3 с тем, чтобы улучшить связывающие свойства (то есть сродство) интересующих антител. Для осуществления мутаций можно использовать сайт-направленный или ПЦР-опосредованный мутагенез, а эффект мутаций на связывание антител или другие интересующие функциональные свойства можно проверить различными методами анализа in vitro или in vivo, описанными здесь и приведенными в разделе примеров. Предпочтительно осуществлять консервативные модификации (как описано выше). Мутации могут представлять собой замены, вставки и делеции аминокислот, но предпочтительными мутациями являются замены. Более того, как правило, в участке CDR изменяют не более чем один, два, три, четыре или пять остатков.
Таким образом, в соответствии с другим аспектом настоящее изобретение направлено на дефукозилированные анти-PSMA моноклональные антитела или их антиген-связывающие фрагменты, вариабельный участок тяжелой цепи который содержит: (a) VH CDR1 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 19-27, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 19-27; (b) VH CDR2 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28-36, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28-36; (с) VH CDR3 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 37-45, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 37-45; (d) VК CDR1 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46-54, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 46-54; (е) VК CDR2 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 55-63, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 55-63; и (f) VК CDR3 участок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 64-72, или аминокислотную последовательность с одной, двумя, тремя, четырьмя или пятью аминокислотными заменами, делециями или вставками, по сравнению с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 64-72.
К числу сконструированных антител настоящего изобретения относятся и такие, модификации у которых были сделаны в аминокислотных остатках каркаса внутри последовательностей VH и/или VК, например, чтобы улучшить свойства антител. Как правило, такие модификации каркаса делают, чтобы снизить иммуногенность антитела. Например, одним подходом является "обратная мутация" одного или нескольких остатков каркаса для приведения в соответствие с зародышевой последовательностью. Конкретно, подвергавшееся соматической мутации антитело может содержать аминокислотные остатки каркаса, отличающиеся от зародышевой последовательности, из которой оно было получено. Такие остатки идентифицируют, сравнивая каркасную последовательность антитела с зародышевой последовательностью, из которой оно было получено. Например, в случае 8С12 и 8A11 аминокислотный остаток # 13 (внутри FR1) последовательности VH представляет собой треонин, в то время как остаток соответствующей зародышевой последовательности VH 5-51 - лизин. Чтобы вернуть последовательность каркаса в "зародышевую" конфигурацию, можно обратно мутировать соматическую мутацию к зародышевому виду, например, с помощью сайт-направленного или ПЦР-опосредованного мутагенеза (например, остаток 13 последовательности FR1 участка VH антител 8С12 и 8А11 можно "обратно мутировать" из треонина в лизин). Такие "обратно мутированные" антитела также входят в область действия настоящего изобретения.
Еще один тип каркасной модификации включает мутирование одного или нескольких остатков каркасного участка или даже одного или нескольких участков CDR, чтобы удалить эпитопы Т-клеток и, тем самым, снизить потенциальную иммуногенность антитела. Этот подход называется "деиммунизация" и подробно был описан в патенте Carr et al. U.S. Patent Publication No. 20030153043.
В дополнение или альтернативно модификациям в каркасных участках или участках CDR, при конструировании антител настоящего изобретения модификации можно включать в участок Fc. Как правило, это делается, чтобы изменить одно или несколько свойств антитела, такие как период полужизни в сыворотке, фиксация комплемента, связывание Fc рецептора и/или антиген-зависимая клеточная цитотоксичность. Кроме того, антитела настоящего изобретения можно модифицировать химически (например, к ним можно прикрепить одну или несколько химических групп). Это делается, чтобы изменить состояние их гликозилирования или также для изменения одного или нескольких их функциональных свойств. Каждое указанное антитело подробно описано далее. Нумерация остатков участка Fc соответствует EU индексу Кабата (Kabat).
В соответствии с одним аспектом изобретения шарнирный участок СН1 модифицируют так, чтобы изменить там количество остатков цистеина (например, увеличить его или уменьшить). Этот подход подробно описан в работе Bodmer et al. U.S. Patent No. 5,677,425. Число остатков цистеина в шарнирной области СН1 изменяют, например, чтобы облегчить сборку легких и тяжелых цепей или чтобы увеличить или уменьшить стабильность антитела.
В соответствии с другим аспектом область Fc антитела мутируют так, чтобы уменьшить время биологического полураспада (полужизни) антитела. Конкретно, одну или несколько аминокислотных мутаций вводят в участок интерфейса домена СН2-СН3 фрагмента шарнирной области Fc, так чтобы антитело хуже связывалось с протеином А стафилококка (SpA) по сравнению со связыванием нативного домена Fc-шарнирной области. Этот подход подробно описан в работе Ward et al. U.S. No. 6,165,745.
В соответствии с другим аспектом изобретения антитело модифицируют, чтобы увеличить время его биологической жизни. Возможны различные подходы. Например, можно ввести одну или несколько мутаций T252L, T254S, T256F, как описано в патенте U.S. No. 6,277,375 автором Ward. Альтернативно, чтобы увеличить время биологической жизни, можно внести изменения в участки антитела СН1 или СL, включив в него эпитоп, связывающий стабилизирующий рецептор и взятый из двух петель домена СН2 Fc-участка IgG, как описано в патентах U.S. Nos. 5,869,046 и 6,121,022, чье авторство принадлежит Presta et al.
В соответствии с другими аспектами участок Fc изменяют, замещая один или несколько аминокислотных остатков на другие аминокислотные остатки, чтобы изменить эффекторную функцию (функции) антитела. Например, один или несколько аминокислотных остатков, выбранных из числа остатков 234, 235, 236, 237, 297, 318, 320 и 322, можно заменить на другие остатки, так чтобы антитело изменило сродство к эффекторному лиганду, но сохранило антиген-связывающую способность родительского антитела. Эффекторный лиганд, сродство к которому следует изменить, может, например, соответствовать Fc-рецептору или компоненту С1 комплемента. Этот подход подробно описан в патентах U.S. Nos. 5,624,821 и 5,648,260, оба написаны Winter et al.
В соответствии с другим примером один или несколько аминокислотных остатков, выбранных из числа 329, 331 и 322, можно заменить на другие остатки, так чтобы изменить у нового антитела связывание C1q и/или уменьшить или полностью устранить комплемент-зависимую цитотоксичность (CDC). Этот подход подробно описан в патенте U.S. Nos. 6,194,551 автора Idusogie et al.
В соответствии с еще одним примером можно изменить один или несколько аминокислотных остатков в положениях 231 и 239, чтобы изменить способность антитела фиксировать комплемент. Этот подход более подробно описан Bodmer et al. в публикации РСТ WO 94/2935.
В соответствии с еще одним примером область Fc модифицируют, чтобы повысить способность антитела опосредовать зависящую от него клеточную цитотоксичность (ADCC) и/или чтобы повысить сродство антитела к рецептору Fcγ, модифицируя один или несколько аминокислотных остатков в положениях 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Этот подход подробно описан Presta в публикации РСТ WO 00/42072. Более того, были картированы сайты связывания IgG1 человека с FcγR1, FcγRII, FcγRIII и FcRn, и были описаны варианты с улучшенным связыванием (см. Shields, R.L. et al. (2001) J. Biol. Chem. 276:6591-6604). Показано, что специфические мутации в положениях 256, 290, 298, 333, 334 и 339 улучшают связывание с FcγRIII. Кроме того, связывание с FcγRIII улучшает следующая комбинация мутантов: T256A/S298A, S298A/E333A, S298A/K224A и S298A/E333A/K334A.
Еще одна модификация антител настоящего изобретения связана с явлением пегилирования. Антитело можно пегилировать, например, чтобы увеличить продолжительность ее биологической (например, в сыворотке) полужизни. Чтобы пегилировать антитело, проводят его (или его фрагмента) реакцию с полиэтиленгликолем (PEG), например, с его реактивным эфирным или альдегидным производным, в таких условиях, когда одна или несколько PEG групп связываются с антителом или его фрагментом. Предпочтительно, если пегиляция выполняется с помощью реакции ацилирования или алкилирования с реактивной молекулой PEG (или аналогичного реактивного водорастворимого полимера). В настоящей заявке термин "полиэтиленгликоль" охватывает все формы PEG, используемые для дериватизации других протеинов, такие как моно (С1-С10алкокси- или арилокси-полиэтиленгликоль или полиэтилен гликоль-малеимид. В соответствии с некоторыми аспектами изобретения антитело необходимо пегилировать в агликозилированное антитело. Методы пегилирования протеинов известны в соответствующей области и могут быть применены к антителам настоящего изобретения. См., например, патенты (Nishimura et al.) ЕР 0154316 и ЕР 0401384 (Ishikawa et al.).
Методы конструирования антител
Как было описано выше, дефукозилированные анти-PSMA антитела настоящего изобретения, последовательности VH и VK которых описаны в этом изобретении, можно использовать для создания новых анти-PSMA антител. Для этого модифицируют последовательности VH и/или VK или связанные с ними постоянные участки. Так, в соответствии с другим аспектом настоящего изобретения, структурные характеристики анти-РSМА антител изобретения, например, 4А3, 7F12, 8С12, 8А11, 16F9, 2A10, 2C6, 2F5 или 1С3, позволяют создать структурно родственные дефукозилированные анти-PSMA антитела, сохраняющие по меньшей мере одно функциональное свойство антител изобретения, такое как связывание с PSMA человека. Например, один или несколько CDR участков антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2C6, 2F5 или 1С3 или их мутаций можно рекомбинантно объединить с известными каркасными участками и/или другими CDR для создания новых рекомбинантно сконструированных анти-PSMA антител настоящего изобретения, как описано выше. Другой тип модификации включает описанные в предыдущем разделе. Исходным материалом для конструирования является одна или несколько описанных здесь последовательностей VH и/или VK или один или несколько участков CDR. Для создания сконструированного антитела не обязательно фактически делать (то есть экспрессировать в виде протеина) антитела с одной или несколькими описанными здесь VH и/или VK последовательностями или одним или несколькими участками CDR.
Достаточно только воспользоваться содержащейся в последовательностях информацией и создать на ее основе последовательности "второго поколения", а затем приготовить эти последовательности и экспрессировать их как протеин.
Таким образом, в соответствии с другим своим аспектом изобретение направлено на метод получения анти-PSMA антител, включающий:
(a) получение: (i) последовательности вариабельного участка тяжелой цепи антитела, содержащей последовательность CDR1, выбранную из группы SEQ ID NOs: 19-27, последовательность CDR2, выбранную из группы SEQ ID NOs: 28-36, и/или последовательность CDR3, выбранную из группы SEQ ID NOs: 37-45; и/или (ii) последовательности вариабельного участка легкой цепи антитела, содержащей последовательность CDR1, выбранную из группы SEQ ID NOs: 46-54, последовательность CDR2, выбранную из группы SEQ ID NOs: 55-63, и/или последовательность CDR3, выбранную из группы SEQ ID NOs: 64-72;
(b) изменение по меньшей мере одного аминокислотного остатка последовательности вариабельного участка тяжелой цепи антитела и/или последовательности вариабельного участка легкой цепи антитела для создания по меньшей мере одной измененной последовательности антитела; и
(c) экспрессия измененной последовательности антитела в виде протеина.
Получить и экспрессировать измененные последовательности антитела позволяют стандартные методы, известные в молекулярной биологии. Приготовленное таким способом измененное антитело можно дефукозилировать описанными здесь методами, получив дефукозилированное измененное анти-PSMA антитело.
Функциональные свойства измененных антител проверяют стандартными методами анализа, известными в соответствующей области и/или описанными здесь, такими как те, что излагаются в разделе Примеров (например, цитометрия в потоке, анализы связывания, анализы ADCC).
В соответствии с определенными аспектами методов конструирования антител настоящего изобретения, мутации можно вводить случайным образом или селективно во всей кодирующей последовательности анти-PSMA антитела или в ее части, а полученные модифицированные анти-PSMA антитела можно скринировать на способность к связыванию и/или другие описанные здесь функциональные свойства. Методы создания мутаций описаны в литературе. Например, в публикации РСТ WO 02/092780 автор Short описывает методы создания и скринирования мутаций антител с помощью насыщающего мутагенеза, монтажа синтетических сшивок или их комбинации. Кроме того, в публикации РСТ WO 03/074679 ее авторы Lazar et al. описывают использование методов компьютерного скрининга для оптимизации физико-химических свойств антител.
Молекулы нуклеиновых кислот, кодирующие антитела настоящего изобретения
Еще один аспект настоящего изобретения направлен на молекулы нуклеиновых кислот, кодирующие антитела настоящего изобретения. Термин "молекула нуклеиновой кислоты" здесь означает молекулу РНК или ДНК. Молекулы нуклеиновых кислот могут быть двухцепочечными или одноцепочечными, но предпочтительно, чтобы это была двухцепочечная ДНК. Нуклеиновые кислоты могут содержаться в целых клетках, в клеточных лизатах, в частично очищенном или практически чистом виде. Нуклеиновая кислота называется "выделенной" или "практически чистой", если очищена от других клеточных компонентов или других загрязнителей, например, от других нуклеиновых кислот или протеинов, стандартными методами, включая обработку щелочью/SDS, расслоение с помощью CsCl, хроматографию на колонке, электрофорез в агарозном геле и другие методы, хорошо известные в данной области. См. F. Ausubel, et al., ed. (1987) Current Protocols in Molecular Biology, Greene Publishing и Wiley Interscience, New York. Нуклеиновая кислота настоящего изобретения может представлять собой, например, ДНК или РНК и может содержать или не содержать интронные последовательности. В соответствии с предпочтительным аспектом нуклеиновая кислота представляет собой молекулу кДНК.
Нуклеиновые кислоты настоящего изобретения можно получить стандартными методами молекулярной биологии. Если антитела экспрессируются в гибридомах (например, в гибридомах, полученных у трансгенной мыши с генами иммуноглобулина человека, подробно описанной ниже), то получаемые в гибридомах кДНК, кодирующие легкие и тяжелые цепи антитела, можно выделить стандартными методами ПЦР-амплификации или кДНК-клонирования. Если антитела получают из библиотеки генов иммуноглобулина (например, методами дисплея в фагах), кодирующие антитела нуклеиновые кислоты можно выделить из библиотеки.
Предпочтительные молекулы нуклеиновых кислот настоящего изобретения кодируют последовательности VH и VL моноклональных антител 4А3, 7F12, 8С12, 8А11, 16F9, 2А10, 2С6, 2F5 и 1С3. Последовательности ДНК, кодирующие VH и VL аминокислотные последовательности 4А3, 7F12, 8С12, 8А11, 16F9, опубликованы в публикации РСТ No. WO 03/064606 (см. Фиг.17А и 17B), содержание которой явным образом включено сюда по ссылке. Последовательность ДНК, кодирующая VH последовательность 1С3, показана как SEQ ID NO: 78. Последовательность ДНК, кодирующая VL последовательность 1С3, показана как SEQ ID NO: 82. Последовательность ДНК, кодирующая VH последовательность 2А10, показана как SEQ ID NO: 79. Последовательность ДНК, кодирующая VL последовательность 2А10, показана как SEQ ID NO: 83. Последовательность ДНК, кодирующая VH последовательность 2С6, показана как SEQ ID NO: 80. Последовательность ДНК, кодирующая VL последовательность 2С6, показана как SEQ ID NO: 84. Последовательность ДНК, кодирующая VH последовательность 2F5, показана как SEQ ID NO: 81. Последовательность ДНК, кодирующая VL последовательность 2F5, показана как SEQ ID NO: 85.
После получения фрагментов ДНК, кодирующих VH и VL, с этими фрагментами можно работать стандартными рекомбинантными методами работы с ДНК. Например, можно конвертировать гены вариабельного участка в гены цепи антитела полной длины, в гены фрагмента Fab или в ген scFv. В соответствии с этими методами VH или VL-кодирующий фрагмент ДНК оперативно связывают с другим фрагментом ДНК, кодирующим другой протеин, например постоянный участок антитела или гибкий линкер. Термин "оперативно связывают" в контексте настоящего изобретения означает, что два фрагмента ДНК объединяют так, чтобы кодируемые ими аминокислотные последовательности оставались внутри рамки.
Выделенную ДНК, кодирующую VH участок, можно конвертировать в ген тяжелой цепи полной длины, оперативно связав VH-кодирующую последовательность ДНК с другой молекулой ДНК, кодирующей постоянные участки тяжелой цепи (СН1, СН2 и СН3). Последовательности генов постоянных участков тяжелых цепей человека известны в литературе (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health и Human Services, NIH Publication No. 91-3242), и содержащие эти участки фрагменты ДНК можно получить методом стандартной ПЦР-амплификации. Постоянный участок тяжелой цепи может представлять собой постоянный участок IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно, если это постоянный участок IgG1 или IgG4. В случае гена тяжелой цепи фрагмента Fab VH-кодирующую ДНК можно оперативно связать с другой молекулой ДНК, кодирующей только постоянный участок тяжелой цепи СН1.
Выделенную молекулу ДНК, кодирующую VL участок, можно конвертировать в ген полной длины легкой цепи (или в ген Fab легкой цепи), оперативно связав VL-кодирующую последовательность ДНК с другой молекулой ДНК, кодирующей постоянный участок легкой цепи, СL. Последовательности генов постоянных участков легких цепей человека известны в литературе (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health и Human Services, NIH Publication No. 91-3242), и содержащие эти участки фрагменты ДНК можно получить методом стандартной ПЦР-амплификации. Постоянный участок легкой цепи может представлять собой постоянный участок каппа или лямбда, но наиболее предпочтительно, если это постоянный участок каппа.
Для создания гена scFv VH- и VL-кодирующие фрагменты ДНК оперативно связывают с другим фрагментом, кодирующим гибкий линкер, например, аминокислотную последовательность (Gly4-Ser)3, (SEQ ID NO: 89), так что VH и VL последовательности будут экспрессироваться в виде сплошного одноцепочечного протеина, VH и VL участки которого будут соединены гибким линкером (см., например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., (1990) Nature 348:552-554).
Композиции нуклеиновых кислот настоящего изобретения часто бывают представлены в виде нативных последовательностей (за исключением модифицированных сайтов ограничения и тому подобное). Однако геномные композиции, композиции, полученные из кДНК, и их смеси можно мутировать в соответствии со стандартными методами получения генных последовательностей. В случае кодирующих последовательностей эти мутации могут желательным образом влиять на последовательности аминокислот. В особенности, в область действия настоящего изобретения входят последовательности ДНК, в значительной степени гомологичные или производные от нативных V, D, J, константы, переключателей и других подобных последовательностей (слово "производные" означает, что последовательность идентична другой последовательности или представляет собой ее модификацию).
Продукция моноклональных антител изобретения
Моноклональные антитела настоящего изобретения (mAbs) можно получить разнообразными методами, включая традиционные методы работы с моноклональными антителами, например, стандартный метод гибридизации соматических клеток, описанный в работе Kohler and Milstein (1975) Nature 256: 495. Хотя предпочтительными являются процедуры гибридизации соматических клеток, в принципе, можно использовать и другие методы получения моноклональных антител, например вирусную или онкогенную трансформацию В-лимфоцитов.
Предпочтительной животной системой для получения гибридом является мышиная система. Получение гибридом в мышах представляет собой хорошо отработанную процедуру. В молекулярной биологии хорошо известны протоколы иммунизации и методы выделения иммунизированных спленоцитов для гибридизации. Описаны также партнеры гибридизации (например, клетки мышиной миеломы) и процедуры гибридизации.
В соответствии с различными аспектами антитела могут быть, например, антителами мыши, гуманизированными антителами или химерными антителами.
Химерные или гуманизированные антитела настоящего изобретения можно получить на основании последовательности мышиного моноклонального антитела, приготовленного как описано выше. ДНК, кодирующие иммуноглобулины тяжелых и легких цепей, можно получить из интересующей гибридомы мыши и включить в них не мышиные (например, человеческие) последовательности иммуноглобулинов с помощью стандартных методов молекулярной биологии. Например, для создания химерного антитела вариабельные участки мыши можно связать с постоянными участками человека с помощью хорошо известных методов (см., например, U.S. Patent No. 4,816,567 автора Cabilly et al.). Для создания гуманизированного антитела можно мышиные участки CDR включить в каркас человека с помощью хорошо известных методов (см., например, U.S. Patent No. 5,225,539 авторов Winter и U.S. Patent Nos. 5,530,101; 5,585,089; 5,693,762 и 6,180,370 авторов Queen et al.). В литературе известно множество анти-PSMA антител мыши, с их помощью можно создавать химерные или гуманизированные анти-PSMA антитела, например, 3F5.4G6, 3D7.1.1, 4Е10-1.14, 3Е11, 4D8, 3Е6, 3С9, 2С7, 1G3, 3С4, 3С6, 4D4, 1G9, 5С8В9, 3G6, 4С8В9, Е99, J415, J533 и J591. В соответствии с предпочтительными аспектами антитела настоящего изобретения представляют собой моноклональные антитела человека. Такие антитела, направленные против PSMA, можно генерировать с помощью трансгенных или трансхромосомальных мышей, несущих, скорее, части иммунной системы человека, а не системы мыши. Указанные трансгенные или трансхромосомальные мыши включают мышей, называемых здесь HuMAb и KМ, соответственно, их вместе называют в данной работе "мышами Ig человека".
Мышь HuMAb mouse® (Medarex, Inc.) содержит минилокус гена иммуноглобулина человека, который кодирует неперегруппированные последовательности тяжелых (µ и γ) и легких κ цепей иммуноглобулина человека; совместно с направленными мутациями он инактивирует эндогенный локус цепей µ и к (см. Lonberg, et al. (1994) Nature 368(6474): 856-859). Соответственно, мышь демонстрирует сниженную экспрессию IgM или к мыши, и, в ответ на иммунизацию, введенные трансгены тяжелых и легких цепей человека подвергаются переключению класса и соматической мутации с генерацией моноклонального IgGк человека высокого сродства (Lonberg, N. (1994) Handbook of Experimental Pharmacology 113:49-101; Lonberg, N. и Huszar, D. (1995) Intern. Rev. Immunol. 13: 65-93, и Harding, F. and Lonberg, N. (1995) Ann. N.Y. Acad. Sci. 764:536-546). Получение и использование мыши HuMab, а также содержащиеся в ней геномные модификации подробнее описаны в работах Taylor, L. et al. (1992) Nucleic Acids Research 20:6287-6295; Chen, J. et al. (1993) International Immunology 5: 647-656; Tuaillon et al. (1993) Proc. Natl. Acad. Sci. USA 90:3720-3724; Choi et al. (1993) Nature Genetics 4:117-123; Chen, J. et al. (1993) EMBO J. 12:821-830; Tuaillon et al. (1994) J. Immunol. 152:2912-2920; Taylor, L. et al. (1994) International Immunology 6: 579-591; и Fishwild, D. et al. (1996) Nature Biotechnology 14: 845-851, содержание всех указанных работ специально включено сюда по ссылке во всей полноте. См. также U.S. Patent Nos. 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,789,650; 5,877,397; 5,661,016; 5,814,318; 5,874,299; и 5,770,429 (авторы всех Lonberg и Kay); U.S. Patent No. 5,545,807 (Surani et al.); публикации РСТ Nos. WO 92/03918, WO 93/12227, WO 94/25585, WO 97/13852, WO 98/24884 и WO 99/45962 (Lonberg и Kay); и публикации РСТ No. WO 01/14424 (Korman et al.).
В соответствии с еще одним аспектом антитела настоящего изобретения можно получить от мыши-носителя последовательностей иммуноглобулина человека на трансгенах и трансхромосомах, например, мышь может быть носителем трансгена тяжелой цепи человека и трансхромосомы легкой цепи человека. Такая мышь называется "мышь KМ", она подробно описана в публикации РСТ WO 02/43478 (Ishida et al.).
В литературе известны и альтернативные трансгенные системы животных, экспрессирующие гены иммуноглобулина человека и позволяющие вырастить анти-PSMA антитела настоящего изобретения. Например, одной альтернативной трансгенной системой является система Xenomouse (Abgenix, Inc.); кроме того, такая мышь описана, например, в патентах U.S. Nos. 5,939,598; 6,075,181; 6,114,598; 6,150,584 и 6,162,963 (Kucherlapati et al.).
Более того, в литературе известны и альтернативные трансхромосомальные системы животных, экспрессирующие гены иммуноглобулина человека и позволяющие вырастить анти-PSMA антитела настоящего изобретения. Например, для этой цели можно использовать мышь-хозяин трансхромосомы тяжелой цепи человека и трансхромосомы легкой цепи человека, называемую также "мышь ТС", такая мышь описана в работе Tomizuka et al., (2000) Proc. Natl. Acad. Sci. USA 97:722-727. Описаны также коровы, являющиеся носителями трансхромосом тяжелой и легкой цепей человека (Kuroiwa et al. (2002) Nature Biotechnology 20:889-894), с их помощью также можно вырастить анти-PSMA антитела настоящего изобретения.
Человеческие моноклональные антитела настоящего изобретения можно приготовить также с помощью методов фагового дисплея, применяемых для скрининга библиотек генов иммуноглобулина человека. Применение таких методов фагового дисплея для выделения антител человека хорошо известно в молекулярной биологии. См., например, U.S. Patent Nos. 5,223,409; 5,403,484; и 5,571,698 (Ladner et al.); U.S. Patent Nos. 5,427,908 и 5,580,717 (Dower et al.); U.S. Patent Nos. 5,969,108 и 6,172,197 (McCafferty et al.); и U.S. Patent Nos. 5,885,793; 6,521,404; 6,544,731; 6,555,313; 6,582,915 и 6,593,081 (Griffiths et al.).
Человеческие моноклональные антитела настоящего изобретения можно приготовить также с использованием мыши SCID, которой были привиты иммунные клетки человека, так что после иммунизации такой мыши можно генерировать ответ в виде антител человека. Подобная мышь описана, например, в патентах U.S. Nos. 5,476,996 и 5,698,767 (Wilson et al.).
Иммунизация мыши Ig человека
Если человеческие антитела настоящего изобретения выращивают в мыши с Ig человека, то такую мышь можно иммунизировать экспрессирующей PSMA клеточной линией (такой как клетки LnCaP, ATCC CRL-1740), очищенным или обогащенным препаратом антигена PSMA (такой как клеточные мембраны LnCaP) и/или рекомбинантным PSMA, или слитым рекомбинантным PSMA, как, в целом, описано в работах Lonberg, N. et al. (1994) Nature 368(6474): 856-859; Fishwild, D. et al. (1996) Nature Biotechnology 14: 845-851; и публикации РСТ WO 98/24884 и WO 01/14424. Предпочтительно, чтобы возраст мыши на момент первой инфузии составлял 6-16 недель. Например, для внутрибрюшинной иммунизации мыши Ig человека можно использовать мембранный препарат клеток LnCaP.
Подробная процедура генерации полностью человеческих моноклональных антител к PSMA описана в публикациях РСТ WO 01/09192 и WO 03/064606. Обобщая имеющийся опыт работы с различными антигенами, можно сказать, что для реакции трансгенной мыши ее надо первоначально иммунизировать внутрибрюшинно (ip) антигеном в полном адъюванте Фрейнда, после чего каждую неделю (в течение вплоть до 6 недель) повторять иммунизации ip в неполном адъюванте Фрейнда. Однако эффективными могут быть также и другие адъюванты, а не только Фрейнда. Кроме того, чрезвычайно иммуногенными оказались цельные клетки в отсутствие адъюванта. Для отслеживания иммунного ответа в ходе иммунизации образцы плазмы крови забирают с помощью ретроорбитальных кровопусканий. Плазму скринируют методом ELISA (как описано ниже), и мышь с достаточными титрами анти-PSMA иммуноглобулина человека может быть использована для дальнейшей работы. С этой целью мыши внутривенно вводят антиген в течение трех дней, после чего ее забивают и выделяют селезенку. Предполагается, что для каждой иммунизации необходимо выполнить две-три фузии. Обычно, каждым антигеном иммунизируют от 6 до 24 мышей. Как правило, при этом используют штаммы как НСо7, так и НСо12. Кроме того, оба трансгена НСо7 и НСо12 можно вырастить совместно в одной мыши с двумя различными трансгенами тяжелых цепей человека (НСо7/НСо12).
Генерация гибридом, продуцирующих человеческие моноклональные антитела настоящего изобретения
Для генерации гибридом, продуцирующих человеческие моноклональные антитела настоящего изобретения, спленоциты и/или клетки лимфоузлов иммунизированной мыши можно выделить и слить с соответствующей иммортализованной клеточной линией, такой как клеточная линия миеломы мыши. Полученные гибридомы скринируют на генерацию антиген-специфических антител. Например, суспензии, содержащие только лимфоциты селезенки иммунизированной мыши, можно сплавить с одной шестой этого количества Р3Х63-Ag8.653 несекретирующих клеток миеломы мыши (АТСС, CRL 1580) с 50% PEG. Клетки переносят в плоскодонные планшеты для микротитрования в количестве приблизительно 2×105, а затем две недели инкубируют в селективной среде, содержащей 20% фетальную сыворотку Clone Serum, 18% среды "653" conditioned media, 5% оригена (IGEN), 4 mM L-глутамина, 1 mM пирувата натрия, 5mM HEPES, 0.055 mМ 2-меркаптоэтанола, 50 единиц/мл пенициллина, 50 мг/мл стрептомицина, 50 мг/мл гентамицина и 1Х HAT (Sigma; HAT добавляют через 24 часа после фузии). Приблизительно спустя две недели клетки можно культурировать в среде, в которой HAT заменен на НТ. Индивидуальные ячейки можно скринировать методом ELISA на наличие человеческих моноклональных антител IgM и IgG. Состояние среды анализируют приблизительно через 10-14 дней после начала экстенсивного роста гибридомы. Секретирующие антитела гибридомы можно перенести в другие планшеты, скринировать еще раз, и если ответ на человеческий IgG будет, по-прежнему, положительным, то моноклональные антитела можно субклонировать, по крайней мере, дважды при ограниченном разбавлении. Стабильные субклоны можно затем культурировать in vitro, чтобы генерировать небольшие количества антител в культуральной среде ткани для характеризации.
Для очистки моноклональных антител человека выбранные гибридомы можно вырастить в двухлитровой колбе с мешалкой, предназначенной для очистки моноклональных антител. Супернатанты фильтруют и концентрируют, после чего применяют метод аффинной хроматографии с протеином А-сефарозой (Pharmacia, Piscataway, N.J.). Чистоту элюированного IgG проверяют гель-электрофорезом и высокопроизводительной жидкостной хроматографией. Буферный раствор можно заменить на PBS, а концентрацию определить с помощью прибора OD280 с коэффициентом экстинкции 1.43. Моноклональные антитела разаликвочивают и хранят при температуре -80°С.
Генерация трансфертом, продуцирующих человеческие моноклональные антитела настоящего изобретения
Антитела настоящего изобретения можно также продуцировать в трансфектомах клетки-носителя с помощью, например, сочетания хорошо известных рекомбинантных методов работы с ДНК и методов трансфекции генов (например, Morrison, S. (1985) Science 229:1202).
Например, чтобы экспрессировать антитела или их фрагменты, ДНК, кодирующие частично или полностью тяжелые и легкие цепи, можно получить стандартными методами молекулярной биологии (например, ПЦР-амплификация или кДНК-клонирование с использованием гибридомы, которая экспрессирует интересующие антитела), после чего их встраивают в векторы экспрессии, так что гены оперативно связываются с последовательностями, контролирующими транскрипцию и трансляцию. В этом контексте термин "оперативно связываются" означает, что ген антитела встраивается в вектор, так что контролирующие транскрипцию и трансляцию последовательности выполняют предназначенные для них функции регуляции транскрипции и трансляции гена антитела. Вектор экспрессии и контролирующие экспрессию последовательности должны быть совместимы с используемой для экспрессии клеткой-носителем. Гены легкой и тяжелой цепей антитела можно включить в разные векторы, или, что более распространено, оба гена можно встроить в один и тот же вектор экспрессии. Для встраивания генов антитела в вектор экспрессии используют стандартные методы (например, лигирование комплементарных сайтов рестрикции фрагмента гена антитела и вектора или, если сайтов рестрикции нет, то лигацию по типу тупых концов. Описанные здесь вариабельные участки тяжелой и легкой цепей антитела можно использовать для создания генов полной длины любого изотипа антитела. Для этого их включают в вектор экспрессии, уже кодирующий константные области тяжелой и легкой цепей желаемого изотипа, так что сегмент VH оперативно связывается с сегментом СH вектора, сегмент VК оперативно связывается с сегментом СL вектора. В дополнение или помимо этого, вектор рекомбинантной экспрессии может кодировать сигнальный пептид, облегчающий секрецию цепи антитела из клетки-носителя. Ген цепи антитела можно клонировать в вектор, так чтобы сигнальный пептид связывался внутри каркаса с аминоконцом гена цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (то есть сигнальный пептид протеина, не являющегося иммуноглобулином).
Помимо генов цепей антитела, векторы регуляторной экспрессии настоящего изобретения содержат регуляторные последовательности, которые контролируют экспрессию генов цепей антитела в клетке-хозяине. Термин "регуляторные последовательности" означает промоторы, усилители и другие контролирующие экспрессию элементы (например, сигналы полиаденилирования), которые контролируют экспрессию и трансляцию генов цепей антитела. Указанные регуляторные последовательности включают, например, Goeddel (Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, CA (1990)). Компетентные в молекулярной биологии специалисты понимают, что конструирование вектора экспрессии, включая выбор регуляторной последовательности, может зависеть от таких факторов, как трансформируемая клетка-хозяин, требуемый уровень экспрессии протеина и т.д. Предпочтительные регуляторные последовательности для экспрессии в клетках млекопитающих включают вирусные элементы, определяющие высокий уровень экспрессии протеинов в клетках млекопитающих, например, это могут быть промоторы и/или усилители, производные от цитомегаловируса (CMV), вируса SV40, аденовируса (например, большой поздний промотор аденовируса AdMLP) и полиомы. Можно также использовать и невирусные регуляторные последовательности, такие как промоторы убиквитин и бета-глобин. Более того, возможны регуляторные элементы, состоящие из последовательностей из различных источников, такие как промоторная система SRα, содержащая последовательности раннего промотора SV40 и длинного терминального повтора вируса типа I Т-клеток лейкемии человека (Takebe, Y. et al. (1988) Mol. Cell. Biol. 8:466-472).
Помимо генов цепей и регуляторных последовательностей антитела, векторы рекомбинантной экспрессии настоящего изобретения могут содержать дополнительные последовательности, например, регулирующие репликацию вектора в клетках-хозяевах (например, области начала репликации) и селективные маркерные гены. Селективные маркерные гены облегчают выбор клетки, в которую был введен вектор (см., например, U.S. Pat. Nos. 4,399,216, 4,634,665 и 5,179,017, Axel et al.). Например, обычно, селективные маркерные гены передают в те клетки-хозяева, в которые был введен вектор, резистентность к лекарствам, таким как G418, гигромицин или метатрексат. Предпочтительные селективные маркерные гены включают ген дигидрофолат редуктазы (DHFR) (для использования в клетках с DHFR с селекцией/амплификацией метатрексатом) и ген neo (для селекции G418).
В случае экспрессии легких и тяжелых цепей кодирующие эти цепи векторы экспрессии переносят в клетку-хозяин стандартными способами. Различные формы термина "трансфекция" охватывают огромное количество методов, обычно применяемых для введения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева. Например, это может быть электропорация, кальций-фосфат преципитация, DEAE-декстран трансфекция и т.д. Хотя теоретически возможно экспрессировать антитела настоящего изобретения либо в прокариотических, либо в эукариотических клетках, наиболее предпочитаема экспрессия в эукариотических клетках, и особенно, в клетках млекопитающих, поскольку именно эукариотические клетки, в особенности клетки млекопитающих, с большей вероятностью, по сравнению с прокариотическими клетками, способны собрать и секретировать правильно "свернутое" иммунологически активное антитело. Сообщалось, что прокариотическая экспрессия генов антител неэффективна для достижения больших выходов активных антител (Boss, M. А. и Wood, С.R. (1985) Immunology Today 6:12-13).
Предпочтительные клетки-хозяева для экспрессии рекомбинантных антител настоящего изобретения включают клетки, изменяющие фукозилирование экспрессируемого антитела. Например, в клетке-хозяине может отсутствовать фермент фукозилтрансфераза, так что такая клетка будет продуцировать протеины, в состав углеводов которых не входит фукоза, или клетка-хозяин может экспрессировать гликопротеин-модифицирующие гликозилтрансферазы, так что экспрессируемые в такой клетке антитела будут содержать увеличенное количество разветвляющихся структур GlcNac, не допускающих фукозилирования. Другие используемые для экспрессии рекомбинантных антител клетки млекопитающих включают клетки СНО (включая dhfr-CHO, описанные в работе Urlaub и Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, используемые совместно с DHFR-маркером, например, как описано в работе R.J.Kaufman и Р.A.Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NSO, клетки COS и клетки SP2. В частности, в случае клеток миеломы NS0, другой предпочтительной системой экспрессии является система экспрессии гена GS, рассмотренная в патентах WO 87/04462, WO 89/01036 и ЕР 338,841. Когда кодирующие гены антител рекомбинантные векторы экспрессии вводят в клетку-хозяин млекопитающего, антитела вырабатываются клеткой-хозяином в течение периода времени, достаточного, чтобы обеспечить экспрессию антитела в клетке-хозяине или, более предпочтительно, секрецию антитела в культуральную среду, в которой эти клетки находятся. Для выделения антител из культуральной среды используют стандартные методы очистки протеинов.
Иммуноконъюгаты
В соответствии с другим аспектом изобретение направлено на дефукозилированные анти-PSMA антитела или их фрагменты, конъюгированные с терапевтической группой, включающей цитотоксин, лекарство (например, иммуносуппрессант) или радиотоксин. Такие конъюгаты называются здесь "иммуноконъюгатами". Иммуноконъюгаты, содержащие один или более цитотоксин, называются иммунотоксинами. Цитотоксин или цитотоксический агент представляет собой любой агент, разрушающий (например, убивающий) клетки. Примеры цитотоксинов включают таксол, цитокалазин В, грамицидин D, этидиум бромид, эмитин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидрокси антрацин дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин и их аналоги и гомологи. Терапевтические агенты, включают, кроме того, например, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабарин, 5-фторурацил декарбазин), алкилирующие агенты (например, мехлорэтамин, тиоэпа хлорамбуцил, малфалан, кармустин (BSNU) и ломустин (CCNU), циклотосфамид, бисульфан, дибромоманитол, стрептозотоцин, митомицин С и цис-дихлордиаминплатина(II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС)), а также антимитотические агенты (например, винкристин и винбластин).
Другие предпочтительные примеры терапевтических цитотоксинов, которые можно конъюгировать с антителами настоящего изобретения, включают дуокармицины, калихеамицины, майтанзины и ауристатины, а также их производные. Пример конъюгата антитела с калихеамицином в настоящее время доступен коммерчески (Mylotarg(tm); Wyeth-Ayerst).
Цитотоксины можно конъюгировать с антителами настоящего изобретения с использованием линкера, технологически доступного в этой отрасли. Примеры типов линкеров, используемых для конъюгации цитотоксина с антителом, включают, но не ограничиваются, гидразоны, тиоэфиры, сложные эфиры, дисульфиды и пептид-содержащие линкеры. Можно выбрать такой линкер, чтобы он, например, расщеплялся при низком рН в содержимом лизосом или расщеплялся протеазами, такими как протеазы, предпочтительно экспрессирующиеся в опухолевых тканях, например, катепсинами (например, катепсинами В, С и D).
Более подробное описание типов цитотоксинов, линкеров и методов конъюгации терапевтических агентов с антителами содержится в работах Saito, G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail, P.A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne, G. (2003) Cancer Cell 3:207-212; Allen, T.M. (2002) Nat. Rev. Cancer 2:750-763; Pastan, I. и Kreitman, R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter, P.D. and Springer, C.J. (2001) Adv. Drug Deliv. Rev. 53:247-264.
Антитела настоящего изобретения можно конъюгировать также с радиоактивными изотопами, получая цитотоксические адиофармацевтические препараты, называемые также радиоиммуноконъюгатами. Примеры радиоактивных изотопов, которые можно конъюгировать с антителами для терапевтического или диагностического применения, включают, но не ограничиваются, иод131, индий111, иттрий90 и лютеций177. Известны методы приготовления радиоиммуноконъюгатов. Примеры коммерчески доступных радиоиммуноконъюгатов включают Zevalin(tm) (IDEC Pharmaceuticals) и Bexxar(tm) (Corixa Pharmaceuticals), радиоиммуноконъюгаты с антителами настоящего изобретения можно получить похожими методами.
Конъюгаты антител настоящего изобретения могут использоваться, чтобы модифицировать данный биологический ответ, и лекарственную группу не следует ограничивать только классическими терапевтическими агентами. Например, лекарственная группа может представлять собой протеин или полипептид, обладающий желательной биологической активностью. Такие протеины могут включать, например, ферментативно активный токсин или его активный фрагмент, такой как абрин, рицин А, экзотоксин синегнойной палочки или токсин дифтерии; такой протеин, как фактор некроза опухолей или гамма-интерферон; или модификаторы биологического ответа, такие как, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), фактор стимуляции колонии макрофагов гранулоцитов ("GM-CSF"), фактор стимуляции колонии гранулоцитов ("G-CSF"), или другие факторы роста.
Методы конъюгирования подобных терапевтических групп с антителами хорошо известны в соответствующей области. См., например, работы Arnon et al., "Monoclonal Антитела For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Антитела и Cancer Therapy, Reisfeld et al. (eds.), pp.243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Антитела For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp.623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Aнтиbody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Антитела '84: Biological и Clinical Applications, Pinchera et al. (eds.), pp.475-506 (1985); "Analysis, Results, и Future Prospective Of The Therapeutic Use Of Radiolabeled Антиbody In Cancer Therapy", in Monoclonal Антитела For Cancer Detection и Therapy, Baldwin et al. (eds.), pp.303-16 (Academic Press 1985), и Thorpe et al., "The Preparation и Cytotoxic Properties Of Антиbody-Toxin Conjugates", Immunol. Rev., 62:119-58 (1982).
Фармацевтические композиции
В соответствии с еще одним аспектом настоящее изобретение направлено на композиции, например на фармацевтические композиции, содержащие одно моноклональное антитело настоящего изобретения (или его антиген-связывающий фрагмент) или их комбинацию совместно с фармацевтически приемлемым носителем. Такие композиции могут включать одно или несколько (например, два или больше различных) антител или иммуноконъюгатов изобретения. Например, фармацевтическая композиция настоящего изобретения может содержать комбинацию антител (или иммуноконъюгатов), связывающихся с различными эпитопами антигена-мишени или обладающих комплементарной активностью.
Фармацевтические композиции настоящего изобретения можно также назначать в ходе совместной терапии, то есть совместно с другими агентами. Например, совместная терапия может включать назначение дефукозилированного анти-PSMA антитела настоящего изобретения совместно, по меньшей мере, с одним антинеопластическим, противовоспалительным или подавляющим иммунитет агентом. Подобные терапевтические агенты включают, помимо прочего, стероидные и нестероидные противовоспалительные лекарства (NSAIDS), например аспирин и другие салицилаты, такие как ибупрофен (Motrin, Advil), напроксен (Naprosyn), сулиндак (Clinoril), дихлофенак (Voltaren), пироксикам (Feldene), кетопрофен (Orudis), дифлунизал (Dolobid), набуметон (Relafen), этодолак (Lodine), оксапрозин (Daypro), индометацин (Indocin), и аспирин в высоких дозах. Другие примеры терапевтических агентов, которые могут использоваться в совместной терапии, подробно описаны далее в разделе, посвященном применению антител настоящего изобретения.
В контексте настоящего изобретения термин "фармацевтически приемлемый хозяин" включает любой и все растворители, среды диспергирования, покрытия, противогрибковые и антибактериальные агенты, изотонические агенты, средства задержки абсорбции, а также подобные препараты, которые должны быть физиологически совместимы. Предпочтительно, чтобы хозяин был приемлем для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, инъекция или инфузия). В зависимости от маршрута введения активное соединение, то есть антитело или иммуноконъюгат, может быть защищено покрытием из вещества, защищающего соединение от действия кислот и других природных условий, которые способны его инактивировать.
Фармацевтические соединения настоящего изобретения могут содержать одну или больше фармацевтически приемлемых солей. "Фармацевтически приемлемой" называют соль, которая сохраняет требуемую биологическую активность родительского соединения и не вызывает нежелательных биологических эффектов (см., например, Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19). Примеры таких солей включают соли присоединения кислот и оснований. Соли присоединения кислот получают из нетоксических неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромоводородная, иодоводородная, фосфористая и подобные им, а также из нетоксических органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и подобные им. Соли присоединения оснований включают полученные из щелочных и щелочно-земельных металлов, таких как натрий, калий, магний, кальций и подобные им, а также из нетоксических органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлоропрокаин, холин, диэтаноламин, этилендиамин, прокаин и подобные им.
Фармацевтические композиции настоящего изобретения могут содержать также фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат и метабисульфат натрия, сульфит натрия и подобные им; (2) маслорастворимые антиоксиданты, такие как аскорбил пальмиат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и подобные им; (3) хелаторы металлов, такие как лимонная кислота, этилендиамин тетрауксусная кислота (ЭДТА), сорбитол, винная кислота, фосфористая кислота и подобные им.
Примеры растворимых водных и неводных носителей, которые могут использоваться в фармацевтических композициях настоящего изобретения, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и подобные им) и их подходящие смеси, растительные масла, такие как оливковое масло, а также пригодные для инъекций органические сложные эфиры, такие как этил олеат. Для обеспечения требуемой текучести можно воспользоваться такими покрытиями, как лецитин, в случае использования дисперсий обеспечить требуемый размер частиц, а также использовать поверхностно-активные вещества.
Указанные композиции могут также содержать такие адъюванты, как консерванты, увлажнители, эмульсификаторы и диспергирующие агенты. Чтобы не допустить развития микроорганизмов, проводят стерилизацию, а также включают различные антибактериальные и противогрибковые агенты, например парабен, хлоробутанол, фенолсорбиновая кислота и подобные им. Иногда бывает желательно включить также изотонические агенты, такие как сахара, хлорид натрия и подобные им. Кроме того, можно обеспечить продолжительную абсорбцию пригодных для инъекций фармацевтических форм, включив в композиции агенты, замедляющие абсорбцию, например моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии, а также стерильные порошки для немедленного приготовления стерильных водных растворов или дисперсий. Использование таких средств и агентов в фармацевтически приемлемых субстанциях хорошо известно в фармацевтике. Их применение в фармацевтических композициях настоящего изобретения входит в область действия изобретения, за исключением случаев, когда растворимые хозяин или агент несовместим с активным соединением. В композицию можно включить также дополнительные активные соединения.
Как правило, терапевтические композиции должны быть стерильны и стабильны в условиях их производства и хранения. Композиции можно составить в виде раствора, микроэмульсии, липосомы и других упорядоченных структур, подходящих для высоких концентраций лекарства. Носителем может быть растворитель или среда диспергирования, содержащая, например, воду, этанол, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и подобные им), а также их подходящие смеси. Для обеспечения требуемой текучести можно воспользоваться такими покрытиями, как лецитин, в случае использования дисперсий обеспечить требуемый размер частиц, а также использовать поверхностно-активные вещества. Часто бывает желательно включить в композицию также изотонические агенты, например сахара, полиспирты, такие как манит, сорбит, или хлорид натрия. Кроме того, можно обеспечить продолжительную абсорбцию пригодных для инъекций композиций, включив в них агенты, замедляющие абсорбцию, например соли моностеаратов и желатин.
Для приготовления стерильных растворов для инъекций требуемое количество активного соединения можно включить в соответствующий растворитель с одним или несколькими перечисленными выше ингредиентами. Если требуется, затем проводят стерилизацию микрофильтрацией. В общем случае, для приготовления дисперсий активное соединение включают в стерильный хозяин, содержащий базовую среду для диспергирования и другие необходимые ингредиенты, перечисленные выше. Для получения стерильных порошков, используемых при приготовлении стерильных водных растворов для инъекций, предпочтительными методами является вакуумная сушка и вымораживание (лиофилизация); в результате получают порошок, состоящий из активного ингредиента, а также дополнительных ингредиентов, содержащихся в использованном для сушки заранее профильтрованном стерильном растворе.
Количество активного ингредиента, который можно смешать с веществом носителя для получения формы единичной дозировки, зависит от субъекта, которого требуется лечить, и конкретного режима приема препарата. В общем случае, количество активного ингредиента, который можно смешать с веществом носителя для получения формы единичной дозировки, должно обеспечивать терапевтический эффект. В целом, это количество колеблется приблизительно от 0.01 до 99% активного ингредиента, предпочтительно приблизительно от 0.1 до 70%, более предпочтительно, от 1 до 30% активного ингредиента, смешанного с фармацевтически приемлемым носителем.
Режим дозирования подбирается так, чтобы обеспечить оптимальный требуемый эффект (например, терапевтический ответ). Например, можно назначить однократную дозу, можно разделить ее на несколько доз в течение определенного временного промежутка, либо дозу можно увеличивать или уменьшать, в зависимости от терапевтической ситуации. Полезно составить парентеральную композицию, соответствующую форме единичной дозировки, это облегчит введение и сделает дозировку универсальной. Форма единичной дозировки в контексте настоящего изобретения означает физически дискретную единицу, подходящую для унитарной дозировки субъектам лечения; каждая такая единица содержит заранее определенное количество активного соединения, рассчитанное так, чтобы произвести желаемый терапевтический эффект, совместно с требуемым фармацевтическим носителем. Спецификация формы единичной дозировки изобретения определяется и непосредственно зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, который необходимо получить; и (b) ограничений, связанных с индивидуальной чувствительностью субъектов.
Дозировка при введении антитела колеблется приблизительно от 0.0001 до 100 мг/кг, чаще от 0.01 до 5 мг/кг веса тела пациента. Например, доза может составлять 0.3 мг/кг веса тела, 1 мг/кг веса тела, 3 мг/кг веса тела, 5 мг/кг веса тела или 10 мг/кг веса тела, или находятся в диапазоне 1-10 мг/кг. Примеры режима лечения включают назначение один раз в неделю, один раз в две недели, раз в три недели, раз в четыре недели, раз в месяц, раз в три месяца или раз каждые три-шесть месяцев. Предпочтительные режимы дозировки дефукозилированных анти-PSMA антител изобретения включают внутривенное введение 1 мг/кг веса тела или 3 мг/кг веса тела, причем режим введения антител может быть следующим: (i) шесть введений каждые четыре недели, а затем каждые три месяца; (ii) каждые три недели; (iii) однократное введение 3 мг/кг веса тела, а затем по 1 мг/кг каждые три недели.
В соответствии с некоторыми методами настоящего изобретения два или более моноклональных антитела с различными характеристиками связывания вводят одновременно, в этом случае дозировка каждого антитела находится в указанных границах. Обычно антитела вводят по различным причинам. Интервалы между отдельными введениями могут составлять, например, неделю, месяц, три месяца или год. Интервалы могут также быть нерегулярными и определяться содержанием в крови пациента антитела к антигену-мишени. Иногда дозировку подбирают так, чтобы добиться содержания антитела в плазме крови, приблизительно 1-1000 мкг/мл или, в соответствии с некоторыми методами, приблизительно 25-300 мкг/мл.
Альтернативно, антитела можно вводить в составе препарата, обеспечивающего замедленный режим высвобождения, в этом случае требуется назначать его менее часто. Дозировки и частота зависят от продолжительности полужизни антитела в организме пациента. В общем случае, дольше всего живут антитела человека, затем следуют гуманизированные антитела, химерные антитела и нечеловеческие антитела. Дозировка и частота введения может зависеть от того, является ли лечение профилактическим или терапевтическим. В профилактических целях назначают относительно низкую дозу при относительно нечастых интервалах в течение длительного времени. Некоторые пациенты продолжают принимать препарат всю свою жизнь. В терапевтических целях относительно высокие дозы назначают достаточно часто. Это делают до тех пор, пока развитие болезни не замедляется или не останавливается, предпочтительно до тех пор, пока пациент не продемонстрирует частичное или полное прекращение симптомов болезни. После этого пациента можно перевести на профилактический режим.
Фактические дозировки активных ингредиентов фармацевтических композиций настоящего изобретения могут колебаться так, чтобы найти такое количество активного ингредиента, которое эффективно позволяет добиться требуемого терапевтического ответа у конкретного пациента, для конкретного состава и режима введения, и при этом будучи нетоксичным для пациента. Выбранная дозировка зависит от большого количества фармакокинетических факторов, включая активность конкретных используемых композиций настоящего изобретения, использования его в виде эфира, соли или амида, маршрута и времени введения, скорости экскреции (выведения) используемого соединения, продолжительности лечения, других лекарств, соединений и/или веществ, используемых совместно с конкретной композицией, возраста, пола, веса, состояния, общего состояния здоровья и истории болезни пациента, а также других факторов, хорошо известных в медицинской практике.
Терапевтически эффективная дозировка анти-PSMA антител настоящего изобретения, предпочтительно, приводит к снижению интенсивности симптомов болезни, увеличению частоты и продолжительности периодов без симптомов, или предотвращению нарушений или инвалидности, вызванных влиянием болезни. Например, в случае лечения злокачественных опухолей "терапевтически эффективная дозировка", предпочтительно, ингибирует рост клеток или опухоли, по меньшей мере, на 20%, более предпочтительно, по меньшей мере на 40%, еще более предпочтительно, по меньшей мере на 60%, и еще более предпочтительно, по меньшей мере на 80%, по сравнению с субъектами, не получавшими такое лечение. Способность соединения ингибировать рост опухолей можно оценить на животной модельной системе, способной предсказать эффективность лечения опухолей человека. Альтернативно, для оценки этого свойства композиции можно определить способность соединения ингибировать развитие опухолевых клеток, опытные практикующие врачи знают такие анализы in vitro. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли или иначе ослабить симптомы у субъекта. Компетентный специалист может определить такое количество, основываясь на таких факторах, как размер субъекта, тяжесть симптомов, а также конкретная композиция или выбранный способ введения.
Композицию настоящего изобретения можно вводить одним или несколькими способами, используя один или несколько известных методов. Как понимает опытный врач, способ и/или режим введения зависит от требуемых результатов. Предпочтительные способы введения для антител настоящего изобретения включают внутривенное, внутримышечное, интрадермальное, внутрибрюшинное, подкожное, спинальное или другие парентеральные способы введения, например инъекции или инфузии. Термин "парентеральное введение" означает в контексте настоящего изобретения режимы введения, которые отличаются от энтерального или топического, обычно осуществляются методом инъекции и включают, но не ограничиваются, внутривенное, внутримышечное, внутриартериальное, интратекальное, антракапсулярное, внутриорбитальное, в сердечную мышцу, интрадермальное, внутрибрюшинное, транстрахеальное, подкожное, интраартикулярное, субкапсулярное, субарахноидальное, субкутикулярное, интраспинальное, эпидуральное и интрастернальное введение методом инъекции или инфузии.
Альтернативно, дефукозилированные антитела настоящего изобретения можно вводить по непарентеральному маршруту, такому как топический, эпидермальный или мукозальный маршруты введения, например интраназальный, оральный, вагинальный, ректальный, сублингвальный или топический маршруты.
В состав активных соединений можно включить носители, защищающие его от быстрого высвобождения. В результате будут получены составы с контролируемым высвобождением, включая импланты, трансдермальные пластыри и микроинкапсулированные системы доставки. В них могут использоваться биодеградируемые, биосовместимые полимеры, такие как винилацетат этилена, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие методы приготовления таких составов запатентованы или широко известны специалистам. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
При введении терапевтических композиций можно использовать медицинские приспособления, известные в соответствующей области. Например, в соответствии с предпочтительным аспектом изобретения, терапевтическую композицию настоящего изобретения можно ввести с помощью безыголочного гиподермического устройства для инъекций, такого как описано в патентах U.S. Nos. 5,399,163; 5,383,851; 5,312,335; 5,064,413; 4,941,880; 4,790,824 или 4,596,556. Примеры хорошо известных имплантов и модулей, полезных в практике настоящего изобретения, включают: U.S. Patent No. 4,487,603, описывающий имплантируемую помпу для микроинфузии для введения препарата с контролируемой скоростью; U.S. Patent No. 4,486,194, описывающий терапевтическое приспособление для введения лекарств через кожу; U.S. Patent No. 4,447,233, описывающий помпу для инфузии медикаментов, которая обеспечивает точную скорость инфузии; U.S. Patent No. 4,447,224, описывающий имплантируемый аппарат для инфузии с переменной скоростью, который обеспечивает непрерывную доставку лекарства; U.S. Patent No. 4,439,196, описывающий осмотическую систему доставки лекарства, содержащую несколько отсеков; а также U.S. Patent No. 4,475,196, в котором также раскрыта осмотическая система доставки лекарства. Эти патенты включены в данную заявку по ссылке. Компетентным специалистам известно много других имплантов, систем доставки и модулей.
В соответствии с определенными аспектами дефукозилированные антитела настоящего изобретения можно включить в состав, обеспечивающий правильное распределение лекарства in vivo. Например, большое количество высокогидрофильных лекарств не проходит через гематоэнцефалический барьер (ГЭБ). Чтобы терапевтические соединения настоящего изобретения проходили через ГЭБ (если это требуется), их надо включить в состав, например, липосом. Методы изготовления липосом описаны, например, в работах U.S. Patents 4,522,811; 5,374,548; и 5,399,331. Липосомы могут содержать одну или несколько групп, селективно транспортируемых в специфические клетки или органы, что улучшает доставку лекарства (см., например, V.V. Ranade (1989) J. Clin. Pharmacol. 29:685). Примеры таких целевых групп включают фолат и биотин (см., например, U.S. Patent 5,416,016 to Low et al.); маннозиды (Umezawa et al., (1988) Biochem. Biophys. Res. Commun. 153:1038); антитела (P.G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Антиmicrob. Agents Chemother. 39:180); рецептор поверхностно-активного протеина A (Briscoe et al. (1995) Am. J. Physiol. 1233:134); p120 (Schreier et al. (1994) J. Biol. Chem. 269:9090); см. также К.Keinanen; M.L.Laukkanen (1994) FEBS Lett. 346:123; J.J.Killion; I.J.Fidler (1994) Immunomethods 4:273.
Применения и методы настоящего изобретения
Дефукозилированные антитела, их композиции и методы настоящего изобретения находят многочисленные диагностические и терапевтические применения in vivo и in vitro, включая диагностику и лечение расстройств, в которых участвует экспрессия PSMA. Например, эти молекулы можно вводить клеткам в культуре, например, in vitro или ex vivo или людям, например, in vivo для лечения, профилактики или диагностики разнообразных заболеваний. Термин "субъект" здесь означает людей или других животных. К числу животных относятся все позвоночные, например млекопитающие и не млекопитающие, такие как приматы, овцы, собаки, кошки, коровы, лошади, свиньи, цыплята, птицы, амфибии и рептилии. Предпочтительные субъекты - это люди, страдающие заболеваниями, которые характеризуются экспрессией PSMA. Если антитела к PSMA вводят совместно с другим агентом, то их можно вводить в любом порядке или одновременно.
Подходящие маршруты введения композиций антител (например, антител или иммуноконъюгатов) настоящего изобретения in vivo и in vitro хорошо известны в соответствующей области и могут быть подобраны специалистом. Например, композиции антител можно вводить методом инъекции (например, внутривенно или подкожно). Дозировка зависит от возраста и веса субъекта и от концентрации и/или состава композиции антител.
В соответствии с одним аспектом антитела настоящего изобретения можно первоначально тестировать на связывание, ассоциированное с терапевтическим или диагностическим применением in vitro. Например, композиции настоящего изобретения можно тестировать методом ELISA и потоковыми цитометрическими эссеями. Более того, можно проверить также способность этих молекул участвовать в запуске по меньшей мере одной опосредованной эффекторами активности эффекторных клеток, включая ингибирование роста и/или уничтожение клеток, экспрессирующих PSMA. Протоколы анализа опосредованной эффекторными клетками ADCC описаны в следующем далее разделе Примеров.
А. Методы детекции
В соответствии с одним аспектом антитела настоящего изобретения можно использовать для детекции уровней PSMA или клеток с PSMA на поверхности своей мембраны, эти уровни можно затем связать с симптомами определенных заболеваний.
В соответствии с конкретным аспектом изобретение направлено на методы детекции наличия PSMA в образце или измерения количества PSMA на поверхности клетки, включающие воздействие на образец или на контрольный образец дефукозилированного антитела или его антиген-связывающего фрагмента, которые специфически связываются с PSMA, в условиях, позволяющих образоваться комплексу между PSMA и антителом или его фрагментом. После этого регистрируют образование комплекса, причем различие в образовании комплекса между образцом и контрольным образцом позволяет сделать вывод о наличии в образце антигена PSMA. Например, с композициями настоящего изобретения можно использовать стандартные хорошо известные методы регистрации, такие как ELISA и потоковые цитометрические анализы.
Таким образом, в соответствии с одним своим аспектом изобретение направлено на методы определения наличия PSMA (например, антигена PSMA человека) в образце или измерения количества PSMA, включающие воздействие на образец или на контрольный образец дефукозилированного антитела или его антиген-связывающего фрагмента, которые специфически связываются с PSMA, в условиях, позволяющих образоваться комплексу между PSMA и антителом или его фрагментом. После этого регистрируют образование комплекса, причем различие в образовании комплекса между образцом и контрольным образцом позволяет сделать вывод о наличии в образце антигена PSMA.
Композиции настоящего изобретения можно также применять к клеткам-мишеням, экспрессирующим PSMA, например, для мечения таких клеток. Для этого к молекуле необходимо прикрепить агент связывания, который может быть обнаружен. Таким образом, настоящее изобретение направлено на методы локализации экспрессирующих PSMA клеток ex vivo или in vitro. В качестве детектируемой метки можно использовать, например, радиоизотоп, флуоресцирующее соединение, фермент или его кофактор.
В. Ингибирование роста клеток PSMA+
Антитела можно использовать для ингибирования роста клеток, экспрессирующих PSMA, что, в свою очередь, можно связать с профилактикой или ослаблением симптомов некоторых заболеваний, связанных с экспрессией PSMA. Различия в экспрессии PSMA при заболевании, по сравнению со здоровыми субъектами, можно определить, воздействуя на тестовый образец, взятый у субъекта, страдающего от заболевания, и на контрольный образец анти-PSMA антителами в условиях, позволяющих образоваться комплексу между антителом и PSMA. Любые комплексы, образующиеся между антителом и PSMA, регистрируют и сравнивают полученные данные для образца и контроля.
Например, антитела позволяют осуществить in vivo или in vitro одно или несколько следующих действий: ингибировать рост и/или уничтожить экспрессирующие PSMA клетки; опосредовать фагоцитоз или ADCC экспрессирующих PSMA клеток в присутствии эффекторных клеток человека; ингибировать удаление растворенного PSMA. Как описано в настоящей заявке, дефукозилированные антитела настоящего изобретения демонстрируют усиленную активность ADCC по сравнению с их фукозилированной формой.
Таким образом, в соответствии с еще одним своим аспектом настоящее изобретение направлено на метод ингибирования роста клеток PSMA+, включающий воздействие на указанные клетки дефукозилированных анти-PSMA антител в условиях, достаточных для индукции зависящей от антител клеточной цитотоксичности (ADCC) указанных клеток. Клетки могут, например, представлять собой опухолевые клетки. В соответствии с предпочтительным аспектом анти-PSMA антитела представляют собой антитела человека.
В соответствии с еще одним аспектом антитела настоящего изобретения или их связывающие фрагменты могут использоваться для модуляции уровней PSMA клеток-мишеней, например, путем захвата или элиминации рецепторов на клеточной поверхности. Для этой цели также можно использовать смеси анти-Fc рецепторных антител.
Мишень-специфические эффекторные клетки, например эффекторные клетки, связанные с композициями настоящего изобретения, могут также использоваться в качестве терапевтических агентов. Подходящие в качестве мишеней эффекторные клетки могут представлять собой лейкоциты человека, такие как макрофаги, нейтрофилы или моноциты. Другие клетки включают эозинофилы, природные клетки-киллеры и другие клетки, содержащие IgG- или IgA-рецепторы. Если необходимо, эффекторные клетки можно получить у субъекта, подлежащего лечению. Мишень-специфические эффекторные клетки можно вводить в виде суспензии клеток в физиологически приемлемом растворе. Количество вводимых клеток может быть порядка 108-109, но оно сильно зависит от терапевтической цели. В общем случае количества должно быть достаточно, чтобы определить локализацию клетки-мишени, например, экспрессирующей PSMA опухолевой клетки и повлиять на уничтожение клеток, например на фагоцитоз. Также могут варьироваться маршруты введения.
Терапия мишень-специфическими эффекторными клетками может проводиться совместно с другими методами с целью удаления клеток мишени. Например, противоопухолевая терапия с использованием композиций настоящего изобретения и/или нацеленных на эти композиции эффекторных клеток может проводиться совместно с химиотерапией. В дополнение к этому, методами комбинационной иммунотерапии две различные популяции цитотоксических эффекторов можно нацелить на удаление опухолевых клеток.
С. Использование иммуноконъюгатов и комбинационной терапии
В соответствии с одним из аспектов иммуноконъюгаты настоящего изобретения можно использовать для того, чтобы направить определенные соединения (например, терапевтические агенты, метки, цитотоксины, радиотоксины, иммуносуппрессанты и т.д.) на клетки с PSMA клеточными рецепторами на поверхности, связав такие соединения с антителами. Таким образом, изобретение также направлено на методы локализации ex vivo или in vitro клеток, экспрессирующих PSMA (например, с помощью регистрируемой метки, такой как радиоизотоп, флуоресцирующее соединение, фермент или его кофактор). Альтернативно иммуноконъюгаты можно использовать для того, чтобы убивать клетки с клеточными PSMA рецепторами на поверхности, направляя цитотоксины и радиотоксины на PSMA, например на PSMA-экспрессирующие опухолевые клетки, чтобы эти клетки убивать.
В соответствии с другими аспектами пациента можно дополнительно лечить агентом, который модулирует, например усиливает или ингибирует, экспрессию или активность Fcγ или Fcγ рецепторов, например, воздействуя на пациента цитокинами. Цитокины, предпочтительные для введения при лечении, включают колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор гранулоцитов макрофагов (GM-CSF), γ-интерферон (IFN-γ) и фактор некроза опухолей (TNF).
В соответствии с другим аспектом пациентам, которых лечат композициями антител настоящего изобретения, можно дополнительно вводить (до, одновременно или после введения антител изобретения) другие терапевтические агенты, такие как цитотоксические или радиотоксические агенты, которые усиливают терапевтический эффект антител человека. Антитела можно связать с агентом (например, с иммунокомлексом), или их можно вводить отдельно от агента. В последнем случае (раздельная администрация) их можно вводить до, после или параллельно с агентом, или их можно назначать совместно с другими видами лечения, такими как противораковая терапия, например лучевая терапия. Подобные терапевтические агенты включают, помимо прочего, антинеопластические агенты, такие как доксорубицин (адриамицин), цисплатин блеомицин сульфат, кармустин, хлорамбуцил, а также циклофосфамид гидроксимочевина; сами по себе эти вещества эффективны при таких концентрациях, когда они становятся токсичными или субтоксичными для пациентов. Цисплатин назначают внутривенно в дозе 100 мг/мл раз в четыре недели, а адриамицин назначают внутривенно в дозе 60-75 мг/мл каждые 21 день. Совместное введение анти-PSMA антител или их антиген-связывающих фрагментов настоящего изобретения и химиотерапевтического агента позволяет получить два противораковых агента, действующих по различным механизмам и вызывающих цитотоксический эффект у человеческих опухолевых клеток. Такая совместная администрация позволяет решить проблемы, связанные с развитием резистентности к действию лекарств или изменением антигенных свойств опухолевых клеток, которые могут сделать их невосприимчивыми к действию антител.
D. Лечение рака
Установлено, что PSMA экспрессируется в опухолевых клетках, таких как опухолевые клетки карциномы простаты; показано также, что это вещество экспрессируется также в эндотелиальных клетках кровеносных сосудов, расположенных неподалекую от раковых клеток, таких как уротелиальные раковые клетки, раковые клетки толстого кишечника, ректальные раковые клетки, раковые клетки легких, молочной железы и метастатические раковые клетки аденокарциномы, расположенные в печени (см. Патент US No. 6,136,311). Соответственно, антитела настоящего изобретения могут использоваться для лечения рака путем ингибирования роста экспрессирующих PSMA раковых клеток и путем ингибирования роста эндотелиальных клеток кровеносных сосудов, расположенных поблизости от опухолевых клеток. Таким образом, в соответствии с другим аспектом настоящее изобретение направлено на метод ингибирования роста опухоли у субъекта, если клетки опухоли или эндотелия расположенных поблизости от нее кровеносных сосудов представляют собой клетки PSMA+. При реализации этого метода дефукозилированные анти-PSMA антитела настоящего изобретения вводят субъекту, так чтобы они заингибировали рост опухоли. В случае людей предпочтительно, чтобы антитело представляло собой гуманизированное антитело или антитело человека. В соответствии с предпочтительным аспектом опухолевые клетки представляют собой клетки опухоли простаты. В соответствии с другими аспектами опухолевые клетки относятся к следующим видам рака: рак толстой кишки, почек, прямой кишки, уротелия, молочной железы, мочевого пузыря, печени, поджелудочной железы, а также меланома.
Методы лечения настоящего изобретения включают назначение субъекту композиции антител настоящего изобретения в количестве, эффективном для лечения или профилактики заболевания. Композицию антител можно вводить самостоятельно или совместно с другим терапевтическим агентом, таким как цитотоксический или радиотоксический агент (в этом случае агент может быть конъюгирован или просто вводиться совместно с антителом), который действует вместе с или синергично с композицией антител, осуществляя лечение или профилактику заболеваний, связанных с экспрессией PSMA.
Наборы
В область действия настоящего изобретения попадают также наборы, включающие антитела настоящего изобретения и инструкции по их применению. Наборы могут содержать также один или больше дополнительных реагентов, таких как иммуностимулирующий реагент, цитотоксический агент или радиотоксический агент, или одно или больше дополнительных антител настоящего изобретения (например, антител с комплементарной активностью, связывающихся с эпитопом антигена PSMA, отличающимся от того, на который действует первое антитело). Наборы, как правило, содержат наклейку, на которой написано, для чего предназначено их содержание. Термин "наклейка" включает любой письменный материал, поставляемый совместно с набором или на наборе или сопровождающий набор каким-либо иным способом.
Далее настоящее изобретение иллюстрируется следующими примерами, которые не ограничивают его область. Содержание всех рисунков, всех ссылок, патентов и опубликованных патентных заявок, процитированных в настоящей заявке, явным образом включено в нее по ссылке.
Пример 1: Экспрессия анти-PSMA моноклональных антител в зародышах химерных цыплят
В этом примере описана экспрессия человеческих моноклональных анти-PSMA антител, 7F12, в зародышах химерных цыплят. Общая методология экспрессии протеинов, включая антитела, в зародышах химерных цыплят описана в публикации РСТ WO 2004/015123, содержание которой явным образом включено сюда по ссылке. Дополнительная информация по экспрессии антител в зародышах химерных цыплят описана в американской патентной заявке U.S. Application Serial No. 11/062,325, озаглавленной "Tissue Specific Expression of Антиbodies in Chickens" (тканеспецифическая экспрессия антител в цыплятах) и поданной 18 февраля 2005 года, содержание которой явным образом включено сюда по ссылке.
В следующем примере сконструирован трансген, содержащий эндогенные регуляторные последовательности яичного белка, которые включают промотор совместно с генами легких и тяжелых цепей экзогенного иммуноглобулина. Этот трансген используется для тканеспецифической экспрессии антител в тубулярных клетках желез яйцевода.
Экспрессировавшиеся в такой системе молекулы антител накапливаются в яичном белке трансгенных цыплят. В настоящем аспекте антитела с любыми перегруппированными генами иммуноглобулина экспрессируются специфически в ткани, содержащей клетки тубулярных желез области magnum яйцевода, и могут быть выделены из яичного белка. Перегруппированные гены иммуноглобулина, кодирующие моноклональные антитела, предпочтительно экспрессируются в яйцеводе. Экспрессия в других тканях практически отсутствует, хотя и может превышать обнаруживемые уровни.
Предпочтительные трансгенные конструкты среди конструктов моноклональных антител, полученных из овальбумина, показаны на Фиг.16. Эти конструкты обозначены Ov7.5 и Ov15 и содержат приблизительно 7,5 kb и 15 kb области, соответствующие кодирующей области МАb, фланкированной овальбуминовым промотором на 5'-конце, и 15 kb кодирующей области с промоторной последовательностью на 3'-конце. Кодирующие участки состоят из вариабельных участков легких и тяжелых цепей, J-C интронных последовательностей, постоянного каппа-участка легкой цепи, последовательности IRES и изотипного постоянного участка тяжелой цепи гамма 1. 3'-конец конструкта содержит ген GFP и селективный маркер, в данном случае это ген резистентности к пуриномицину, управляемый промотером СХ. Длины последовательностей 3'- и 5'-концов кодирующих участков моноклональных антител из овальбуминового промотора приведены только для примера; аналогичные конструкты могут содержать последовательности длиной 25-100 kb или больше со стороны 5'-конца, длины последовательностей по 3'-концу также могут различаться. Специалисты в области молекулярной биологии понимают, что маркер GFP присутствует только для регистрации в физиологических условиях, и его можно удалить, не нарушая полезности трансгена. Маркер сопротивляемости пуриномицину можно заменить на любой другой маркер, который позволяет выделить стволовые эмбриональные клетки, успешно трансформированные трансгеном. Хорошо известно несколько типов аналогичных заметных маркеров, их можно использовать взаимозаменяемо с геном сопротивляемости пуриномицину настоящего аспекта.
Трансген, использовавшийся для экспрессии человеческого анти-PSMA mAb 7F12, называется Ov15mAb7F12 и содержит 15 kb область 5' регуляторной последовательности овальбуминового промотора. Кроме того, сигнальный пептид был непосредственно соединен с VL, чтобы не допустить его удаления при обработке мРНК. Использовались свежеполученные клеточные линии самок cES (приготовленные, как описано в публикации РСТ WO 2004/015123), так что химеры высокого качества смогли снести яйца. Вектор Ov15MAb7F12 трансфицировали в женскую клеточную линию cES, и стабильные клоны скринировали методом ПЦР. Один из клонов (OVH) затем проанализировали еще методом Саузерн блоттинг. Этот метод показал, что только одна копия трансгена Ov15MAb7F12 была интегрирована в геном cES и что трансген содержал по меньшей мере 10 kb 5' Ov промоторной последовательности.
Химерные цыплята для трансгенного анализа были получены из клона OVH. Для ранней индукции эстрогена использовали десять химерных цыплят. В ходе анализа собрали полученные из cES донорные области (GFP-положительные) из различных тканей, включая большую область яйцевода, мышцы, мозг, печень и кишечник. Для мониторинга экспрессии трансгена использовали метод RT-PCR с праймерами, специфическими для L и Н цепей. Транскрипты L и Н цепей обнаружили в образцах большой области яйцевода, но не мышц, мозга или печени, у трех из четырех индуцированных цыплят-самок (OV15-34, OV15-76 и OV15-83). Однако низкие уровни экспрессии наблюдались также в подвздошной, слепой и толстой кишках. Иммуногистохимия срезов эстроген-индуцированных областей magnum подтвердила экспрессию моноклональных антител в GFP-положительных клетках тубулярных желез, но не в GFP-положительных эпителиальных клетках. Вместе приведенные данные показывают, что вектор Ov15MAb7F12 привел к экспрессии трансгена в клетках тубулярных желез яйцевода. Низкоуровневая эктопическая экспрессия в кишечнике показывает, что 15 Kb область 5' регуляторной последовательности Ov может быть недостаточно, чтобы быть уверенным в позиционно независимой, тканеспецифической экспрессии трансгена.
Чтобы определить наличие полностью человеческих МАb в зародышах, из OVH cES клеток генерировали 69 химер с Ov15MAb7F12. Тридцать химерных кур доросли до половой зрелости и отложили яйца. По данным анализа ELISA в белке всех яиц содержался МАb. Концентрация и количество МАb в яйцах варьировало в зависимости от конкретной курицы, вероятно, из-за различной степени химеризма в области magnum. Яйца восьми химерных кур содержали более 1 мг МАb на яйцо, максимальное содержание среди 30 химер составило 3,4 мг МАb на яйцо. Четыре химерные курицы снесли яйца со средним уровнем МАb от 1,2 до 1,6 мг на яйцо. В яйцах шести кур среднее содержание МАb колебалось от 0,5 до 1,0 мг на яйцо.
МАb в яичном белке затем анализировали методом вестерн блоттинга с использованием античеловеческого IgG (H+L) кролика, распознававшего как Н, так и L цепи. В качестве отрицательного контроля использовали белок нехимерных кур Белый Леггорн дикого типа. В качестве стандарта использовали очищенный человеческий IgG1, к (Sigma). Цепи L и Н полной длины обнаружили в яичном белке пяти химерных кур (OV15-17, OV15-29, Ov15-71, OV16-34 и OV16-42). Были обнаружены также полностью собранные H2L2, но присутствовали также небольшие количества интермедиатов сборки.
Чтобы определить колебания в концентрации МАb в откладываемых яйцах, у пяти различных химерных кур (OV16-34, OV16-42, OV17-29, OV17-52 и OV17-83) яйца анализировали в течение 3-4 месяцев. У трех куриц количество МАb достигло пика в течение первых нескольких недель, затем упало приблизительно в два раза, и оставалось стабильным на протяжении следующих нескольких месяцев. У двух куриц уровни экспрессии оставались стабильными на протяжении всего времени исследования. Если не все тубулярные железы секретируют и откладывают овальбумин по мере прохождения яиц через область magnum яйцевода, то количество откладываемого в яичном белке МАb в этой области может колебаться из-за химерной природы тубулярных желез этих кур.
Образцы крови 26 химерных кур и кур Barred Plymouth Rock (BPR) (негативный контроль) анализировали методом ELISA на наличие человеческого IgG. У 18 кур отмечался регистрируемый уровень МАb в крови, наибольшая концентрация составляла 39 нг/мл для курицы OV17-83. Коэффициент корреляции (r) между уровнем МАb в крови и концентрацией МАb в яичном белке составлял 0,67. Однако такое сравнение усложняется тем, что степень химеризма в различных тканях может различаться очень сильно. Например, в яйцах кур OV17-122 наблюдалось очень небольшое содержание МАb (в среднем, 0,02 мг мг/яйцо), но в крови этой куры содержание МАb второе по величине (36 нг/мл). Мы полагаем, что наличие МАb в крови может быть не результатом "утечки" из яйцевода, а отражением эктопической экспрессии (например, в кишечнике, где эктопическая экспрессия была обнаружена в эстроген-индуцированных химерах методом RT-PCR).
Пример 2: Очистка и характеризация антитела
МАb 7F12 выделили из яичного белка следующим образом. Сначала яичный белок перемешивали на миксере с небольшой скоростью 30 минут при комнатной температуре, после чего овомуцин осадили известным в литературе методом. Один объем суспензии гомогенизированного яичного белка добавили к трем объемам воды, очищенной методом обратного осмоса, и перемешивали еще 30 минут. Разбавленную суспензию довели до рН 6,0 с помощью 0,5 М фосфорной кислоты, после чего 20 минут центрифугировали при 12000g. Этим методом удалили приблизительно 3% яичного белка, содержащего большую часть овомуцина. Супернатант довели до рН 7,4 с помощью 0,5 М двухосновного фосфата натрия и 150 мМ хлорида натрия, содержащего кристаллическую соль. Человеческий IgG очистили на колонке Protein A-Sepharose FF (Amersham Biosciences) при линейной скорости потока 120 см/ч. Адсорбировавшийся человеческий IgG промыли загрузочным буфером (PBS, рН 7,4) в количестве, соответствующем пяти объемам колонки, после чего элюировали 3 мМ фосфорной кислотой. Элюированную фракцию человеческого IgG довели до рН 7,4 раствором 60 мМ фосфата натрия (рН 7,5), содержащего 230 mM NaCl. Финальная концентрация фосфата натрия составляла 40 мМ, а NaCl - 150 мМ. Образец затем профильтровали через 0,2 мкм шприцевого фильтра (Pall).
Большая часть выделенного материала представляла собой полностью собранную молекулу МАb с чистотой больше 90% (определено методами ELISA и А280). Полученный из цыплят MAb7F12 сравнили с MAb7F12, полученным в традиционной культуре клеток СНО с помощью нескольких видов анализа:
1. Анализ антитела SEC-HPLC
Приблизительно 10 мкг образца IgG проанализировали на аппарате HPLC Waters 2795 с использованием колонки 4,6×300 мм BioSep SEC S3000 column (Phenomenex). Хроматографию провели в следующей среде: 0,1 мМ фосфата натрия, 0,12 М NaCl и 0,1 М сульфата натрия, рН 7,2, скорость 0,4 мл/мин, время 20 минут. За процессом разделения следили по поглощению при длине волны 280 нм. Чтобы определить приблизительный молекулярный вес, использовали стандарт молекулярного веса (Bio-Rad). Анализ SEC-HPLC показал, что оба образца более чем на 90% состояли из мономера IgG.
2. Анализ последовательности протеина методом нано LC ESI MS/MS
Оба препарата МАb (экспрессированный в куриных яйцах и в культуре клеток СНО) восстановили и алкилировали, диализировали одну ночь и в течение 4 часов расщепляли трипсином при 37°С в 25 мМ бикарбоната аммония (рН 8). Масс-спектрометрию обоих препаратов выполнили тандемным методом в системе Nano HPLC (Dionex, Sunnyvale, CA), подключенной к масс-спектрометру QSTAR (MDS Sciex, Concord, Ontario, Canada), работающему в режиме положительных ионов, тандемные спектры были получены с помощью коллизионно индуцированной диссоциации (CID). Аликвоту каждого образца объемом 1 мкл ввели в систему и разделили на 75 мкм колонке Pepmap C18 при скорости потока 250 нл/мин. Мобильная фаза представляла собой раствор А (95% воды, 5% ацетонитрила, 0,5% муравьиной кислоты) и раствор В (20% воды, 80% ацетонитрила, 0,5% муравьиной кислоты). Инструмент работал в режиме информационно зависящих запросов, продолжительность операционных циклов составляла 7 с; при этом весь спектр записывался за 2 секунды, а затем в течение оставшихся 5 секунд выбирался наиболее интенсивный ион и проводилась запись спектра CID. Спектры анализировались на приборе Mascot (Matrix Science, London, UK). Проведенный описанными методами анализ обоих препаратов МАb не обнаружил различий в последовательностях различных систем экспрессии.
3. Анализ LC-MS
Образцы IgG (50 мкг) в 4М гуанидин НСl восстановили в 25 мМ DTT, инкубируя образцы 90 минут при температуре 60°С. Затем 15 минут образцы алкилировали в 45 мМ иодуксусной кислоте при комнатной температуре в темноте; реакцию остановили добавлением 22 мМ DTT. Непосредственно перед LC-MS анализом образцы диализировали против 1 л 25 мМ бикарбоната аммония, и 50 мкл каждого образца впрыснули в колонку Poros R1/10 2,1×100 мм (Applied Biosystems) аппарата Waters 2795 HPLC с масс-спектрометром MicromassZQ и анализировали в режиме положительных ионов. Использовалась следующая мобильная фаза: (А) 0,1% муравьиной кислоты и 0,01% трифторуксусной кислоты (TFA); и (В) 100% CH3CN и 0,1% муравьиной кислоты и 0,01% TFA. Элюирование (0.25 мл/мин) проводили в линейном градиенте 10-60% раствора (В) в (А), развитие градиента занимало 100 минут.
Анализ L-цепи показал, что оба препарата МАb обладают идентичной массой (+/- 3 Da).
4. Анализ cIEF
Образцы IgG (по 50 мкг каждый, концентрация 1,0 мг/мл) диализировали в воде, чтобы удалить соли, после чего поставили анализ СЕ. Изоэлектрическую фокусировку методом капиллярного электрофореза выполнили в системе Р/АСЕ MDQ СЕ (Beckman) с нормальной полярностью, использовав нейтральные капилляры еСАР (Beckman) внутренним диаметром 50 мкм и эффективной длиной 30 см. Образец вводился в течение 60 секунд инъекцией под давлением 20 psi. Разделение выполняли в течение 45 мин при напряжении 15 кВ. Температура капилляра составляла 20°С. Анолит представлял собой 20 мМ фосфорную кислоту, а католит - 40 мМ гидроксид натрия. Промывочный раствор представлял собой 10 мМ фосфорную кислоту, в качестве катодного мобилизатора использовали раствор, поставляемый производителем (Beckman). За процессом разделения следили по А280. Анализ cIEF показал, что оба препарата характеризуются одинаковыми изоэлектрическими точками, хотя полученный в СНО MAb7F12 обладает более высокой гетерогенностью заряда.
5. Определение термической стабильности методом дифференциальной сканирующей калориметрии
Термическую стабильность 7F12 из цыплят и из системы экспрессии в СНО определили методом дифференциальной сканирующей калориметрии (DSC) и сравнили с соответствующими значениями для форм антител, дегликозилированных по домену Fc. Калориметрические измерения температур плавления (Тm) выполнили на дифференциальной сканирующей микрокалориметрической платформе VP-Capillary DSC с автосэмплером (MicroCal LLC, Northampton, MA, USA). Объем ячейки с образцом составлял 0.144 мл. Данные о денатурации гликозилированной и негликозилированной форм антител были получены при нагревании образцов в концентрации 2.3 мкМ от 30 до 95°С со скоростью 1°С/мин. Образцы белка находились в фосфатном буферном растворе (PBS) при рН 7,4. Тот же буфер использовался в ячейке сравнения для получения необходимого для сравнения значения молярной теплоемкости. Полученные термограммы скорректировали на базовую линию, а нормализованные данные проанализировали с помощью программного обеспечения Origin v7.0.
Профили денатурации антител из СНО и цыплят были весьма различны, хотя для Fc-дегликозилированных антител они практически идентичны. Данные DSC показали, что различия в термической стабильности МАb из СНО и цыплят обусловлены, в основном, различными паттернами гликозилирования в соответствующих доменах СН2. Из нескольких переходных точек плавления первая является критичной, поскольку она определяет общую стабильность антител при низкой температуре. Тm1 антител из цыплят составляет 63,8°С, Тm1 антител, экспрессированных в СНО, составляет 62,7°С. Поскольку Тm1 антител из цыплят выше, чем из СНО, возможно, что антитела из цыплят будут более термостабильны при комнатной температуре.
Пример 3: Анализ олигосахаридов анти-PSMA антител, экспрессированных в цыплятах
В настоящем примере различными методами были проанализированы паттерны гликозилирования антитела 7F12, экспрессированного в куриных яйцах.
1. Характеризация олигосахаридов методом CE-LIF
Олигосахариды выделили из образцов IgG (100 мкг), добавив 12.5 mU PNGaseF (Prozyme) при 40°С и инкубировав систему одну ночь. В использовавшихся условиях высвобождались N-связанные гликаны из Fc-участка гена HuMAbF1, экспрессировавшегося в клетках СНО и цыплятах. После осаждения этанолом для удаления протеина МАb супернатант с гликанами высушили методом центрифугирования в вакууме и ресуспендировали в 19 мМ APTS (Beckman) в 15% уксусной кислоте и 1 М растворе цианоборогидрида натрия в THF (Sigma). Реакция мечения гликанов протекала одну ночь при температуре 40°С, после чего образцы разбавили водой в 25 раз. APTS-меченые гликаны подвергли капиллярному электрофорезу с индуцированной лазером флуоресценцией в системе Р/АСЕ MDQ СЕ (Beckman) с обращенной полярностью, использовав для этого покрытые N-CHO капилляры (Beckman) внутренним диаметром 50 мкм и эффективной длиной 50 см. Образцы впрыснули под давлением (8 sec), и разделение осуществляли при температуре 20°C с использованием карбогидратного сепарирующего гель буфера (Beckman) 20 минут при напряжении 25 кВ. За процессом разделения следили с помощью системы регистрации индуцированной лазером флуоресценции (Beckman), использовали 3 мВт аргоновый лазер, длина волны возбуждения составляла 488 нм, а длина волны эмиссии - 520 нм. Обнаружено, что профиль олигосахаридов 7F12 цыплят сильно отличался от такого профиля 7F12 из клеток СНО.
2. Характеризация олигосахаридов методом MALDI Q-TOF MS
Очищенные антитела (по 100 мкг каждого в концентрации 1.0 мг/мл) обработали 4 мкл PNGaseF, расщепляющей N-связанные углеводы эндогликозидазы (Prozyme). Образцы одну ночь инкубировали при 37°C с последующим диализом в течение еще одной ночи против 50 мМ бикарбоната аммония (рН 8). Протеин удалили осаждением в этаноле. Выделившиеся углеводы обессолили на микроуглеродной колонке производства Glygen Corp. (Columbia, MD), в целом, следуя предложенному изготовителем протоколу, но объем элюирования уменьшили до 5 мкл. Аликвоту каждого образца гликана (1 мкл) смешали в отношении 1:1 (v:v) с матричным раствором (альфа-циано-4-гидроксициннамовая кислота или 2,5-дигидроксибензойная кислота (Applied Biosystems)), нанесли на целевую плату MALDI и позволили высохнуть досуха. Анализ интактных гликоконъюгатов выполнили методом тандемного анализа MALDI-Q-TOF. Все масс-спектры были записаны на масс-спектрометре QSTAR пульсар, оборудованном источником 2 o-MALDI (MDS Sciex, Concord, Ontario, Canada), позволяющим получить массу (состав) классов углеводов. По завершении профилирования гликанов обоих МАb были изучены возможные гликозидные связи в каждом гликане. Масс-спектры CID записали на анализаторе 4700 Proteomics с оптикой TOF/TOf (Applied Biosystems, Forster City, CA). В экспериментах высокого разрешения CID MSMS энергию столкновений установили равной 1 кВ. Внутри ячейки для столкновений ионы выбранных для эксперимента олигосахаридов сталкивались с атомами аргона под давлением 2×10-6 Torr.
Результаты анализа углеводных композиций и возможных гликозидных связей одиннадцати основных гликанов в 7F12 из цыплят представлены на Фиг.17-18. Обнаружено, что структуры олигосахаридов содержат N-гликаны высокоманнозного, комплексного и гибридного типов. Ни одна структура не содержала фукозильных остатков.
3. Анализ моносахаридов методом HPLC с НРАЕ-DAD
Образцы IgG (200 мкг) подвергли кислотному гидролизу с использованием либо 2 N TFA (для оценки содержания нейтральных Сахаров), либо 6 N HCl (для оценка аминосахаров). Эксперимент проводили 4 часа при температуре 100°С. Образцы высушили вакуумным центрифугированием при температуре окружающей среды и реконституировали в 200 мкл воды, после чего провели анализ на приборе HPAE-PAD (Dionex). Моносахариды разделили на колонке CarboPac PA10 4×250 мм с предколонками Amino Trap и Borate Trap (Dionex). Процедуру проводили в соответствии с рекомендациями Dionex Technical Note 53. Идентичность и относительное содержание пиков моносахаридов определяли с помощью стандартов моносахаридов (Dionex).
Результаты анализа моносахаридов 7F12 из цыплят и СНО приведены далее в Таблице 1.
Результаты анализа моносахаридов показывают различие в составе углеводов; остатки N-ацетил глюкозамина, маннозы и очень небольшое содержание остатков галактозы обнаружено в 7F12 из цыплят. У этих моносахаридов не обнаружено остатков фукозы, что отличает их от препаратов антител из СНО, которые фукозильные остатки содержат.
Экзогликозидазный анализ гликанов методами СЕ и масс-спектрометрии, проведенный с целью идентификации терминальных остатков сахаров, подтверждает отсутствие терминальных остатков слюнной кислоты и фукозы в MAb7F12 из тубулярных клеток желез цыплят.
Резюмируя, можно сказать, что наибольшим наблюдаемым различием в профиле N-связанных олигосахаридов является наличие в антителах, полученных из цыплят, N-гликанов высокоманнозного типа, а также отсутствие остатков фукозы и очень низкое содержание остатков галактозы.
Пример 4. Функциональный анализ анти-PSMA антител, экспрессируемых в организме цыплят
В этом примере изучены функциональные свойства анти-PSMA антител из экспрессированных в зародышах цыплят 7F12, включая сродство связывания, интернализацию, период полужизни в сыворотке и зависящую от антител клеточную цитотоксичность (ADCC)
1. Сродство к PSMA
В качестве антигена при анализе сродства связывания методом цитометрии в потоке использовали PSMA клеток LNCaP (ATCC CRL-1740). Клетки вырастили в среде RPMI 1640 с 10% FBS, 10 мМ HEPES, 2 мМ L-глуамина и 1 мМ пирувата натрия. Антиген-связывающие свойства 7F12 из клеток тубулярных желез цыплят сравнили с 7F12 из клеток СНО. 200000 клеток на лунку инкубировали в двух повторах в течение 30 минут с 50 мкл аликвотами антител в различных концентрациях. Клетки дважды промыли, после чего добавили античеловеческие IgG РЕ меченые антитела козы (Jackson ImmunoResearch) в разведении 1:200, 50 мкл на ячейку в течение 30 минут при 4°С. Клетки дважды промыли PBS с 1% BSA и проанализировали методом FACS. Значения ЕС50 МАb связывания с PSMA для клеток LNCaP определили из кривых связывания с использованием программного обеспечения GraphPad Prism 3.0 (GraphPad Software).
Оба препарата антител демонстрировали практически идентичные кривые связывания с PSMA, экспрессировавшимися в клетках LNCaP и похожими значениями EC50. Данные показывают, что, хотя антитела из цыплят и СНО гликозилированы по-разному, они одинаково распознают и связывают антигены.
2. Интернализация антител
Связывание 7F12 mAb с PSMA ведет к интернализации антител. В соответствии с возможным применением MAb можно конъюгировать с цитотоксинами, чтобы находить и разрушать экспрессирующие PSMA опухолевые клетки. Интернализацию связывания антител с PSMA для клеток LNCaP определили, инкубируя клетки с MAb и Hum-Zap (Advanced Targeting Systems). Hum-Zap представляет собой козьи антитела козы к IgG человека, конъюгированные с протеином, инактивирующим рибосомы, сапорином. Клетки погибают, когда комплекс 7F12 MAb/Hum-Zap связывается с PSMA клеточной поверхности, и интернализуются, если антитела или Hum-Zap по отдельности не токсичны для клеток LNCaP. Клетки LNCaP (10000 / лунку) инкубировали в трех повторах в течение 48 часов при 37°С в 150 мкл культуральной среды, содержащей 300 нг Hum-Zap и 300 нг 7F12 MAb или контрольного MAb. Пролиферацию и выживание клеток определяли люминесцентным анализом живучести клеток CellTiter-Glo (Promega). Анализы интернализации выполняли так же, инкубируя разведения антител в клеточной культуральной среде, содержащей 10000 прикрепившихся клеток LNCaP на лунку, в течение двух часов при 4°С. Растворы антител осторожно удалили и заменили на 150 мкл среды, содержащей 200 нг HumZap. Выживаемость клеток определили после 48-часовой инкубации при 37°С. Значения ЕС50 интернализации антител определили графически с помощью программного обеспечения Prism 3.0 (GraphPad Software).
Препараты антител, экспрессированных в цыплятах и в клетках СНО, одинаково эффективно осуществляли интернализацию. В обоих случаях значения EC50 составили 0.49 нМ.
3. Период полужизни in vivo
Период полужизни для 7F12 МАb цыплят и СНО в мышах BALB/c определяли методом внутривенной инъекции радиоактивно меченных антител. Десять мкг протеина МАb слегка иодировали (менее одного атома иода на антитело)125I методом Iodobead (Pierce). Шестинедельных самок мышей BALB/c (Taconic Farms, Germantown, NY) кормили, добавляя 0.1 мг/мл иодида калия в питьевую воду в течение недели до начала эксперимента. Затем мышам (по четыре мыши на протеин) внутривенно в хвостовую вену вводили приблизительно 600,000 cpm меченого МАb и измеряли радиоактивность всего организма через определенные интервалы времени с помощью гамма-счетчика для целого организма (детектор Wm. В. Johnson Nal crystal detector со счетчиком Ludlum). Период полужизни вычислили, проведя экспоненциальный регрессионный анализ остающейся радиоактивности.
7F12 МАb из клеток тубулярных желез цыплят удалялись с периодом полужизни (t1/2) 102.4±0.9 часов, в то же время, 7F12 MAb из клеток СНО разрушались более медленно, их период полужизни составил 207.5±18.3 часа.
4. Активность ADCC
Клетки LNCaP-C42B протестировали в модифицированном ADCC-анализе51Cr. Моноядерные клетки человеческой периферической крови выделили из гепаринизированной цельной крови стандартным методом разделения Ficoll-paque. Клетки ресуспендировали (в концентрации 1×106 клеток/мл) в среде RPMI1640, содержащей 10% FBS и 10 ед/мл IL-2 человека, а затем одну ночь инкубировали при температуре 37°С. На следующий день клетки собрали, однократно промыли культуральной средой и ресуспендировали в концентрации 2×107 клеток/мл. Два миллиона клеток-мишеней LNCaP-C42b инкубировали с 200 µCi51Cr в 1 мл общего объема в течение часа при 37°С. Затем клетки мишени промыли один раз, ресуспендировали в 1 мл среды и еще 30 минут инкубировали при 37°С. После заключительной инкубации клетки мишени промыли еще один раз и разбавили, получив 1×105 клеток/мл. Для заключительной стадии анализа ADCC 100 мкл меченых клеток LNCaP проинкубировали с 50 мкл эффекторных клеток и 50 мкл антител. В экспериментах использовали финальное отношение мишень:эффектор, равное 1:100. Во всех экспериментах выполняли человеческий изотипный контроль IgG1 и сравнивали результаты с полученными в СНО анти-PSMA 7F12 антитела. Также выполняли следующие контроли: а) клетки-мишени и эффекторные клетки без антител; b) клетки-мишени без эффекторных клеток; с) клетки-мишени и эффекторные клетки в присутствии 3% Triton X-100. Через 4 часа инкубации при 37°С супернатанты собрали и перенесли в счетчик гамма-излучения (Cobra II производства Packard Instruments) с окном регистрации 240-400 кэВ. На графике изобразили счет за минуту как функцию концентрации антител и проанализировали данные методом нелинейной регрессии с сигмоидальным доза-ответом (вариабельный наклон) с помощью программного обеспечения Prism (San Diego, CA).
Процент лизиса определили по следующему уравнению:
% лизиса = (СРМ образца - СРМ без антител)/(СРМ TritonX - СРМ без антител)×100
Мы выяснили, что очень важно, чтобы во всех экспериментах определяли и % лизиса, и EC50. Например, при сравнении двух типов антител можно обнаружить различия либо в значениях EC50, либо в проценте лизиса, либо в обоих этих показателях.
Результаты двух различных экспериментов ADCC представлены на Фиг.19 (IL-2-стимулированные эффекторные клетки) и 20 (эффекторные клетки из свежей человеческой периферийной крови). Как видно на Фиг.19, СНО-производные МАb индуцируют доза-зависимый лизис клеток, выходящий на плато при 38% лизисе с ЕС50 0.11 мкг/мл в случае IL-2-стимулированных эффекторных клеток. МАb из зародышей цыплят были более сильными и более эффективными. Максимальный процент лизиса для таких МАb составил 60% в случае двух препаратов антитела, приготовленных независимо друг от друга. ЕС50 для этих МАb составляет 0.018 мкг/мл, что также говорит об увеличенной активности, по сравнению с СНО-производными МАb. Действительно, EC50 антител, экспрессированных в организме цыплят, оказался приблизительно в шесть раз меньше, чем для антител, экспрессированных в СНО. Наконец, как и ожидалось, антитела из изотипного контроля не индуцируют лизиса клеток. ADCC с использованием нестимулированных эффекторных клеток (свежие РВМС) показал более значимые различия в значениях ЕС50, но меньшую общую способность уничтожать клетки (Фиг.20).
Ключевым рецептором, опосредующим ADCC, является CD16 (FcγRIII). Специфичность ответа ADCC была показана блокадой взаимодействия эффекторных клеток и клеток-мишеней моноклональными антителами, направленными против CD16. Блокаду ADCC анти-CD16 антителами осуществили в соответствии с анализом ADCC, описанным выше, но со следующими модификациями. Клетки инкубировали либо с 1 мкг/мл (насыщающая доза), либо с 0.01 мкг/мл (субоптимальная доза) 7F12 анти-PSMA антител (экспрессированных в цыплятах или СНО) в отсутствие или в присутствии 5 мкг/мл анти-CD16 антитела 3G8 или изотипного контроля. Результаты показаны на Фиг.21. Один мкг/мл анти-PSMA антител, в отсутствие анти-CD16 антител индуцировал приблизительно 15% и 38% лизис при использовании антител из СНО и цыплят, соответственно. В присутствии анти-CD16 антител этот процент лизиса снизился приблизительно до 4%, антитела из изотипного контроля эффекта не оказали.
Пример 5. Получение и характеризация дефукозилированных анти-PSMA антител в FUT8-отрицательных клетках-носителях
В этом примере полностью человеческие моноклональные анти-PSMA антитела экспрессируются в линии клеток, в которых отсутствует фермент фукозилтрансфераза, так что углеводные цепи протеинов, продуцируемых клеточной линией, не содержат фукозы. Дефукозилированные антитела были протестированы в сравнении с фукозилированными анти-PSMA антителами (экспрессирующимися в другой клеточной линии, содержащей фермент фукозилтрансферазу) с целью определить структурные и характеристические различия между антителами. При анализе использовались разнообразные методы химического анализа, включая капиллярный электрофорез, сравнение аминокислотных последовательностей, определение массовых различий методом масс-спектроскопии и разницы в зарядах методом капиллярной изоэлектрической фокусировки.
Использовались анти-PSMA полностью человеческие моноклональные антитела 2А10. Аминокислотные и нуклеотидные последовательности тяжелой цепи 2А10 показаны на Фиг.6, а аминокислотные и нуклеотидные последовательности легкой цепи 2А10 показаны на Фиг.7. Вариабельные последовательности тяжелых и легких цепей 2А10 были субклонированы в вектор экспрессии. Вариабельный каппа-участок кДНК 2А10, включая его сигнальную последовательность и оптимальную последовательность Козака, был субклонирован в одной рамке совместно с постоянным каппа-участком человека. Вариабельный участок кДНК тяжелой цепи 2А10, включая его сигнальную последовательность и оптимальную последовательность Козака, был субклонирован в одной рамке совместно с постоянным тяжелым участком человека δ1. Экспрессию тяжелых и легких цепей осуществляли с помощью промотора SR альфа. Этот вектор экспрессии более подробно описан в заявке PCT/US2004/028954, содержание которой явным образом включено сюда по ссылке.
Вектор экспрессии перенесли в FUT8-/- клеточную линию Ms704 с помощью электропорации ДНК. Линию Ms704 FUT8-/- создали направленным разрушением гена FUT8 в клетках CHO/DG44 с помощью двух замещающих векторов, что более подробно описано в американской патентной публикации U.S. 20040110704 авторами Yamane et al., а также в работе Yamane-Ohnuki et al. (2004) Biotechnol Bioeng 87:614-22. Клетки Ms704 адаптировали для роста в культуре суспензии в среде роста EX-CELLTM 325 PF CHO Medium (JRH #14335), в которой дополнительно растворили 100 мкМ гипоксантина и 16 мкМ тимидина (Invitrogen #11067-030), а также 6 мМ L-глутамина (Invitrogen #25030-081). Используемый для электропорации вектор ДНК осадили этанолом и ресуспендировали в воде. Для каждой из восьми электропораций использовали по 1.5 мкг ДНК. Клетки Ms704 приготовили для трансфекции, промыв клетки в буферном растворе с сахарозой (sucrose-buffered solution (SBS)) и ресуспендировав их в растворе SBS в концентрации 1×107клеток/мл. 400 мкл суспензии клеток смешали с конструктом ДНК и электропорировали со следующими настройками прибора: напряжение 250 В, емкость 275 мкФ и сопротивление 25 Ом (ВТХ Molecular Delivery Systems #630 electro cell manipulator). Клетки извлекли из кювет для электропорации, после чего к ним добавили 20 мл среды роста. После этого их поместили в 96-луночные планшеты по 200 мкл клеток на лунку, приблизительно 4×104клеток на лунку. Через два дня после электропорации из каждой лунки извлекли по 150 мкл среды и заменили ее на 150 мкл среды селекции и среды роста, содержащей 400 мкг/мл G418 (Invitrogen #10131-035). Каждые три-семь дней по 150 мкл среды селекции на лунку заменяли свежей средой.
Клетки-носители CHO DG44 (FUT8+/+) электропорировали конструктом, идентичным 2А10, с помощью такой же процедуры, так получили трансфектанты СНО DG44, экспрессирующие рекомбинантные антитела 2А10, которые содержали фукозилированные углеводы.
Наиболее продуктивные клоны Ms704 и СНО DG44 развернули, и рекомбинантные антитела 2А10 выделили из супернатантов клеточной культуры аффинной хроматографией с протеином А.
Сравнительный анализ N-связанных олигосахаридов, полученных из образцов анти-PSMA моноклональных антител, которые были выделены из клеточных линий Ms704 и СНО DG44, выполнили методом капиллярного электрофореза с детекцией флуоресценции, индуцированной лазером (cLIF) (Chen и Evangelista (1998) Electrophoresis 15:1892). N-связанные олигосахариды очищенных антител выделили, добавив пептид N-гликаназу (Prozyme) и инкубировав систему одну ночь. Протеин осадили этанолом, а супернатант, содержащий углеводы, перенесли в новую пробирку и высушили с помощью приспособления Speedvac. Углеводы ресуспендировали и дериватизировали с помощью 8-аминопирен-1,3,6-трисульфоната (APTS) в условиях мягкого восстановительного аминирования, при котором влияние дезаллилирования и отщепления остатков фукозы сведено к минимуму. Аддукты реакции анализировали методом капиллярного электрофореза с детекцией флуоресценции, индуцированной лазером (Beckman Coulter) (Ma и Nashabeh (1999) Anal. Chem. 71:5185). Между антителами, полученными из клеточной линии Ms704 и из клеточной линии СНО DG44, обнаружили различия в профиле олигосахаридов; эти различия хорошо согласовывались с отсутствием остатков фукозы у анти-PSMA антител, выделенных из линии Ms704. Анализ моносахаридов с помощью анион-обменной хроматографии Dionex-HPLC с пульсирующей амперометрической детекцией подтвердил, что в Ms704-экспрессированных антителах экспрессия остатков фукозы отсутствует. Результаты приведены в Таблице 2.
Если не считать различия в олигосахаридах, продемонстрированного методом капиллярного электрофореза и анализом моносахаридов, образцы протеинов анти-PSMA антител, полученных из клеток Ms704 и СНО DG44, были практически идентичны. Анализ N-терминальных последовательностей протеинов также показал, что эти последовательности идентичны. Масс-спектроскопия легких цепей анти-PSMA антител, производных от Ms704 и СНО DG44, показала массы 23,552 и 23,548, соответственно, что укладывается в инструментальную ошибку. Оба антитела протестировали с помощью стандартного капиллярного изоэлектрического фокусирующего набора (Beckman Coulter), результаты анализа показывают, что оба образца антитела характеризуются идентичными изоэлектрическими точками. Проведенные анализы позволяют заключить, что белковые компоненты образцов антител из клеток Ms704 и СНО DG44 практически идентичны, за исключением дефукозилирования углеводного компонента антител из Ms704. Анализ углеводов показал, что у дефукозилированной формы антитела имеется большее количество терминальных остатков галактозы, чем у фукозилированной формы.
Пример 6. Анализ ADCC активности дефукозилированных анти-PSMA антител, экспрессированных в FUT8-отрицательных клетках-носителях
Цитотоксическую активность антител 2А10 из Ms704 по отношению к клеткам LNCaP-C42B (закупленным в компании ViroMed Laboratories, Minnetonka, MN) определяли в модифицированном51Cr ADCC анализе. Моноядерные клетки человеческой периферической крови выделили из гепаринизированной цельной крови стандартным методом разделения Ficoll-paque. Клетки ресуспендировали (в концентрации 1×106 клеток/мл) в среде RPM 11640, содержащей 10% FBSn 10 ед/мл IL-2 человека, а затем одну ночь инкубировали при температуре 37°С. На следующий день клетки собрали, однократно промыли культуральной средой и ресуспендировали в концентрации 2×107 клеток/мл. Два миллиона клеток-мишеней LNCaP-C42b инкубировали с 200 µCi 51Cr в 1 мл общего объема в течение часа при 37°С. Затем клетки-мишени промыли один раз, ресуспендировали в 1 мл среды и еще 30 минут инкубировали при 37°С. После заключительной инкубации клетки-мишени промыли еще один раз и разбавили, получив 1×105 клеток/мл. Для заключительной стадии анализа ADCC 100 мкл меченых клеток LNCaP проинкубировали с 50 мкл эффекторных клеток и 50 мкл антител. В экспериментах использовали финальное отношение мишень:эффектор, равное 1:100. Во всех экспериментах выполняли человеческий изотипный контроль IgG1 и сравнивали результаты с полученными из СНО ОС44-производными (фукозилированными) анти-PSMA 2А10 антителами. Также выполняли следующие контроли: а) клетки-мишени и эффекторные клетки без антител; b) клетки-мишени без эффекторных клеток; с) клетки-мишени и эффекторные клетки в присутствии 3% Triton X-100. Через 4 часа инкубации при 37°С супернатанты собрали и перенесли в счетчик гамма-излучения (Cobra II производства Packard Instruments) с окном регистрации 240-400 кэВ. На графике изобразили счет за минуту как функцию концентрации антител и проанализировали данные методом нелинейной регрессии с сигмоидальным доза-ответом (вариабельный наклон) с помощью программного обеспечения Prism (San Diego, CA).
Процент лизиса определили по следующему уравнению:
% лизиса=(СРМ образца - СРМ без антител)/(СРМ TritonX - СРМ без антител)×100
Результаты трех различных экспериментов ADCC представлены на Фиг.22-23 (IL-2-стимулированные эффекторные клетки) и 16С (эффекторные клетки из свежей человеческой периферийной крови). Была определена кривая клеточной цитотоксичности для клеток линии LnCaP с различными концентрациями fuc-2A10 и defuc-2A10, а также значения ЕС50 и % лизиса в этой системе. Результаты трех различных экспериментов, соответствующих Фиг.22, 23 и 24, приведены далее в Таблице 3.
Таблица 3: Цитотоксическая активность дефукозилированных анти-PSMA mAb 2А10
Повышенная эффективность антител 2А10 mAb, производных от клеток Ms704 (то есть дефукозилированных), по сравнению с 2А10b mAb из СНО DG44 (то есть фукозилированных) становится очевидной из более низких значений EC50 и более высокого процента лизиса для дефукозилированной формы антител. Например, значения ЕС50 для дефукозилированной формы приблизительно в 3-18 раз меньше, чем для фукозилированной формы. Активность ADCC для нестимулированных эффекторных клеток (свежие РВМС), по сравнению с IL-2 стимулированными эффекторными клетками, показала еще большие различия в значениях ЕС50, но менее выраженное общее уничтожение клеток (Фиг.24).
Ключевым рецептором, опосредующим ADCC, является CD16 (FcγRIII). Специфичность ответа ADCC была показана блокадой взаимодействия эффекторных клеток и клеток-мишеней моноклональными антителами, направленными против CD16. Блокаду ADCC анти-CD16 антителами осуществили в соответствии с анализом ADCC, описанным выше, но со следующими модификациями. Клетки инкубировали либо с 1 мкг/мл (насыщающая доза), либо с 0.01 мкг/мл (субоптимальная доза) 2А10 анти-PSMA антител (Ms704 или СНО DG44-экспрессированных) в отсутствие или в присутствии 5 мкг/мл анти-CD16 антитела 3G8 или изотипного контроля. Результаты показаны на Фиг. 17. Один мкг/мл анти-PSMA антител, в отсутствие анти-CD16 антител, индуцировал приблизительно 12% и 37% лизис при использовании фукозилированных и дефукозилированных антител, соответственно. В присутствии анти-CD16 антител этот процент лизиса снизился до менее чем 5%, антитела из изотипного контроля эффекта не оказали.
Эквиваленты
Компетентные в соответствующей области специалисты смогут распознать или установить, проведя рутинные эксперименты, множество эквивалентов описанных здесь конкретных аспектов изобретения. Эти эквиваленты входят в объем притязаний.
Реферат
Изобретение касается анти-PSMA антител, которые содержат вариабельные участки тяжелой и легкой цепей, при этом антитело не содержит фукозильных остатков. Аминокислотные последовательности указанных цепей приведены в формуле. Антитела по изобретению являются моноклональным антителом, гуманизированным или химерным антителом, антителом человека. Описан также способ ингибирования роста клеток PSMA+, таких как опухолевые клетки путем контактирования указанных клеток с анти-PSMA антителами. Антитела демонстрируют повышенную, зависящую от антител клеточную цитотоксичность (ADCC) в отношении рака простаты по сравнению с фукозилированной формой антител. 2 н. и 30 з.п. ф-лы, 3 табл., 25 ил.

Комментарии