Моноклональное антиидиотипическое антитело ab2, способ его получения, использования против болезней, сопровождающихся экспрессией lewis y6 антигена, и для очистки варианта br55-2 антитела, лечебно-профилактический состав - RU2208642C2
Код документа: RU2208642C2
Чертежи






































Описание
Моноклональное антиидиотипическое антитело Ab2, способ его получения, использования против болезней, сопровождающихся экспрессией Lewis Y6 антигена, и для очистки
варианта BR55-2 антитела, лечебно-профилактический состав
Один из способов воздействия на иммунную систему базируется на идиотипических взаимодействиях. Уникальные антигенные детерминанты
внутри и вокруг антигенсвязывающего сайта молекулы иммуноглобулина (Ig), придающие специфичность антителам, называют идиотопами. Совокупность всех идиотопов, представленных в вариабельной области
данного антигена, называют его идиотипом (id). Молекулярная структура идиотипа локализована как в областях, ответственных за комплементарность, так и в каркасных областях вариабельного домена и, как
правило, но не всегда, образуется как тяжелыми, так и легкими цепями, связанными специфическим образом.
Идиотипы являются серологически определенными объектами, так как инъекция антитела (обозначаемого часто Аb1) сингенному, аллогенному или ксеногенному реципиенту индуцирует синтез антиидиотипических антител (обозначаемых обычно Аb2). Основываясь на предположении о существовании взаимодействий идиотип - антиидиотип, было постулировано [1] положение о физиологической рецепторной регуляции иммунной системы. Эта сетевая теория рассматривает иммунную систему как совокупность иммуноглобулиновых молекул и рецепторов на Т-лимфоцитах, каждый из которых способен узнавать антигенную детерминанту (эпитоп) с помощью своего сайта связывания (паратопа), и может быть узнан другими антителами или рецепторами клеточной поверхности этой системы через идиотопы, которые он имеет. Многочисленные исследования убедительно показали, что идиотипические и антиидиотипические рецепторы присутствуют на поверхности как В-, так и Т-лимфоцитов, а также и на секретируемых антителах.
В том случае, когда связывание между Аb1 и Аb2 ингибируется антигеном, к которому получен Аb1, идиотип считают относящимся к сайту связывания, так как он включает в себя сайты на вариабельном домене антитела, который участвует в антигенном узнавании. Идиотипы, конформационно имитирующие антигенный эпитоп, называют "внутренним образом" этого эпитопа. Поскольку как Аb2, так и антиген связываются с соответствующим Аb1, то они могут давать схожую трехмерную конформацию, предствляющую собой "внутренний образ" данного антигена. Антиидиотипические антитела, являющиеся "внутренним образом", в принципе могут рассматриваться как замена антигена, к которому они были получены посредством идиотипической сети. Поэтому эти заменительные антигены могут использоваться в схемах активной иммунизации. Например, они обладают рядом преимуществ в случае, когда исходный антиген не достаточно иммуногенен для того, чтобы индуцировать значительный иммунный ответ. Поэтому соответствующие антиидиотипические антитела, являющиеся "внутренним образом" и имитирующие неиммуногенный углеводный антиген, могут быть особенно перспективными при реализации некоторых вариантов вакцинации. Ниже эти проблемы освещены более подробно.
В результате внедрения гибридомной технологии были созданы моноклональные антитела (MAT), главным образом, мышиного происхождения, ко многим разновидностям рака человека. Практически большинство маркеров, определяемых ксеногенными MAT, не являются строго опухолеспецифичными, однако они являются антигенами дифференциации, производимыми опухолевыми и некоторыми нормальными и/или эмбриональными тканями. Поэтому правильнее именовать их антигенами, ассоциированными с опухолью (ААО). Способны ли человеческие опухолевые маркеры, обнаруживаемые ксеногенными MAT, вызывать антиопухолевый ответ у раковых больных, и действительно ли такие антигены связаны с ответом на автологичные опухоли, зависит от природы соответствующего ААО, и механизм этого явления до сих пор не расшифрован окончательно. ААО, которые являются либо естественно иммуногенными у сингенного хозяина, либо способны приобретать иммуногенную природу, в принципе могут использоваться для индукции антиопухолевого иммунитета с целью достижения терапевтического и, возможно, профилактического эффекта.
Антигены, ассоциированные с опухолью, часто являются частью "себя" и вызывают очень слабый иммунный ответ у раковых больных. Напротив, антиидиотипические антитела, являющиеся "внутренним образом" и дающие трехмерные структуры, обладающие сходством со структурными эпитопами соответствующего ААО, узнаются как чужеродные молекулы в организме, пораженном опухолью. Поэтому иммунный ответ, вызываемый терапевтической или даже профилактической иммунизацией соответствующим анти-id MAT, может приводить к возникновению антиопухолевого иммунитета.
Терапевтическая иммунизация против рака анти-id MAT может быть особенно эффективной на ранних стадиях заболевания: во время оперирования первичной опухоли, когда часто скрытым образом отдельные опухолевые клетки уже были рассеяны в различных органах пациента. Эти микрометастазные клетки, как известно, являются причиной последующего роста метастазов часто спустя годы после диагностирования и оперативного удаления всей клинически выявленной опухолевой ткани. До настоящего времени практически в большинстве случаев метастазный рак эпителиального происхождения неизлечим. Поэтому медицина остро нуждается в разработке способов воздействия на "минимальный остаточный рак", например, путем разрушения скрытых микрометастазных клеток, обеспечивая предупреждение роста микрометастазов. На этой стадии заболевания (вспомогательная регуляция) общепринятые химиотерапевтические методы весьма малоэффективны. Однако при индукции специфического антиопухолевого иммунитета на стадии минимального остаточного заболевания посредством иммунизации соответствующими анти-id MAT, являющимися "внутренним образом", микрометастазные клетки могут быть селективно элиминированы иммунной системой, что приведет к увеличению длительности жизни без рецидивов заболевания.
Моноклональные антитела со специфичностью BR55-2 [2,3,4] определяют Lewis Y6 антиген, углеводную детерминанту, селективно экспрессируемую на поверхности большинства твердых опухолей человека. Исходя из их свойств, антитела BR55-2 могут использоваться для пассивной иммунотерапии, главным образом, эпителиального рака.
Ассоциированная с опухолью Lewis Y олигосахаридная детерминанта, которая также экспрессируется на определенных стадиях эмбрионального развития, практически не вызывает возникновения иммунитета к самой себе. Однако моноклональные антиидиотипические антитела (Аb2) против BR55-2 (Аb1), обладающие свойствами "внутреннего образа", благодаря их сходству со структурными эпитопами Lewis Y антигена, могут быть использованы для индукции защитного противоопухолевого иммунитета, особенно на ранних стадиях развития заболевания.
В дополнение к его экспрессии при раке эпителиального происхождения Lewis Y углеводный антиген участвует также в патогенезе инфекции вирусом иммунодефицита человека (ВИЧ). Синдром приобретенного иммунодефицита (СПИД) проявляется как отдельное заболевание, этиология которого связана с инфицированием лимфотрофическим ретровирусом (ВИЧ). Заболевание характеризуется расстройством, связанным с ослабленным клеточным иммунитетом и абсолютной лимфопенией, и особенно ослаблением хелперных Т-лимфоцитов (CD4). СПИДу может предшествовать предварительный синдром, проявляющийся обычно в виде комплекса характерных клинических симптомов и Т-клеточной лимфопении. Предварительный синдром называют СПИД-связанным комплексом (ССК).
ВИЧ относится к группе вирусов, интенсивно исследовавшихся в течение последних двух десятилетий. Когда ретровирус поражает человеческую или животную клетку, РНК превращается в ДНК и проникает внутрь клетки-хозяина, которая начинает синтезировать вирусные гены, как свои собственные. ВИЧ может сохраняться в латентной форме в таких клетках в течение ряда лет, в безопасности от атак иммунной системы пациента и автоматически копируется каждый раз при делении клетки-хозяина. И только в случае запуска быстрой репликации вируса посредством активации инфицированных клеток продуцируемые вирусы убивают эти клетки и проникают в ток крови.
В силу ряда специфических особенностей ВИЧ трудно добиться излечения путем элиминирования как вируса, так и провирусной генетической информации, уже транскрибированной в человеческом геноме инфицированных пациентов. Поэтому большинство терапевтических подходов сосредотачивалось на применении препаратов, замедляющих развитие болезни посредством вмешательства в процессы, существенные для репликации вируса.
Основной задачей является предотвращение ВИЧ-инфицирования и терапевтическое лечение уже инфицированных пациентов путем введения им безопасных и эффективных вакцин. Некоторые варианты вакцин уже проходят испытания на предклинических и ранних клинических стадиях. Они основываются главным образом на вирусных структурах в качестве антигена, и в частности, на основном гликопротеине оболочки gp 120.
Протекающий естественным образом иммунный ответ на вирус состоит из выработки антител ко всем вирусным белкам, а также из активации клеточного иммунитета. Однако эта реакция хозяина на ВИЧ-инфекцию не проявляется на столько, чтобы окончательно остановить развитие болезни после бессимптомной стадии, которая часто длится годами. Следовательно, варианты вакцин, базирующиеся на антигенах, вызывающих естественно протекающий, но не защитный иммунный ответ, вызывают сомнения в их эффективности. Главной проблемой является обширная гетерогенность ВИЧ, за счет которой вирус избегает атак типоспецифичных нейтрализующих анти-gр 120 антител.
Эффективная защита от ВИЧ посредством вакцинации требует две защитные стратегии: одна - против свободного вируса, циркулирующего в токе крови, другая - против уже инфицированных клеток. Известно, что ВИЧ-инфицированные клетки in vitro и in vivo экспрессируют на своей поверхности измененную гликозилирующую структуру, а именно Lewis Y углеводную детерминанту. Так как этот антиген наблюдается только на определенных стадиях эмбрионального развития и связан также с целым рядом злокачественных образований, то экспрессия на ВИЧ-инфицированных клетках может отражать их измененный статус дифференциации, индуцированный ретровирусной трансформацией. Таким образом, этот поверхностный фенотип напоминает уникальную реакцию клетки-хозяина на трансфекцию человеческого генома ВИЧ.
Гликопротеин оболочки ВИЧ нарабатывается аппаратом гликозилирования инфицированной клетки. Поэтому изменения в характере гликозилирования инфицированной клетки, производящей ВИЧ, обнаруживаются также на высвобожденных вирусных частицах. Кроме того, гликопротеин оболочки ВИЧ, производимый в таких клетках, также состоит из Lewis Y углеводных детерминант. Таким образом, Lewis Y олигосахарид представляет собой специфический ответ хозяина, экспрессируемый как на ВИЧ-инфицированных клетках, так и свободными ВИЧ-частицами.
Исходя из вышеизложенных соображений можно заключить, что Lewis Y структура удовлетворяет основным требованиям, определяющим возможность его использования в схемах вакцинации как против свободного вируса, так и против ВИЧ-инфицированных клеток. Кроме того, являясь реакцией хозяина на ВИЧ в целом, Lewis Y антиген не зависит от штамма ВИЧ и на него не влияет генетическая вариабельность этого вируса. К сожалению, из-за особенностей углеводной структуры и его "своих" свойств как антигена эмбриональной дифференциации, Lewis Y почти не вызывает иммунитета к самому себе. У человека не было обнаружено естественного иммунного ответа против этого антигена. Однако моноклональные антиидиотипические антитела (Аb2) против BR55-2 (Аb1) со свойствами "внутреннего образа", обладающие сходством со структурными эпитопами Lewis Y антигена, могут использоваться для индукции профилактического и терапевтического иммунитета как против свободного ВИЧ, так и против ВИЧ-инфицированных клеток независимо от штамма вируса.
В дополнение к их профилактическому и терапевтическому использованию в качестве уникальных вакцин, моноклональные антитела, обладающие свойством "внутреннего образа", являются высокоспецифичными реагентами для идиотипа антитела, на которое они были получены. Они практически исключительно узнают область связывания Аb1. Узнаваемая конфигурация не зависит от других детерминант Ab1. Другими словами, соответствующие анти-id MAT селективно определяют любую молекулу, состоящую из уникального идиотипа Аb1 в его правильной трехмерной конфигурации. Поэтому эти анти-id MAT связываются со сравнимым сродством с F(ab')2-, Fab и Fv- фрагментами Аb1 также, как и с их измененными вариантами (измененные варианты состоят из различных константных областей, например, муриновых иммуноглобулинов IgG2a, IgG2b, IgG1, но имеют идентичный идиотип). Кроме того, эта высоко специфичная узнаваемая конфигурация анти-id MAT, являющихся "внутренним образом", включает в себя также варианты родительского муринового MAT, полученные с помощью техники рекомбинантной ДНК.
Для того чтобы решить возможные проблемы, связанные с повторным использованием муриновых антител для пассивной иммунотерапии человека, могут быть получены мышь/человек химерные MAT путем комбинирования вариабельных доменов родительского муринового MAT по выбору с человеческими константными областями. Для обнаружения таких химерных мышь/человек MAT в сыворотке человека необходимы высокоспецифичные реагенты, поскольку эти химерные MAT несут константные области, идентичные областям человеческих иммуноглобулинов естественного происхождения. Анти-id MAT, являющиеся "внутренним образом", полученные к родительскому муриновому Аb1, узнают и химерные антитела, являющиеся его производными. Таким образом, подобные антиидиотипические MAT являются удобными реагентами для специфического и чувствительного количественного определения, например, сывороточных концентраций мышь/человек химерных MAT в присутствии огромного избытка нормальных человеческих иммуноглобулинов.
Для дальнейшего улучшения свойств MAT в сторону терапевтически перспективных свойств для использования в пассивной иммунотерапии с помощью техники рекомбинантной ДНК могут быть сконструированы "полностью очеловеченные" антитела, в которых только минимально необходимые части родительского мышиного антитела, определяющие комплементарность области (ОКО), комбинируют с каркасными областями человеческой вариабельной области и человеческими константными областями. Для отбора и конструирования таких "полностью очеловеченных" MAT используют гомологию последовательностей и молекулярное моделирование, позволяющие отбирать такие комбинации элементов мышиных и человеческих последовательностей, которые в дальнейшем понижали бы иммуногенность при сохранении связывающих свойств. Определенные анти-id MAT, являющиеся "внутренним образом" и полученные к идиотипу родительского муринового Аb1, могут связываться с ОКО-привитыми очеловеченными вариантами, если они удовлетворяют следующим требованиям.
а) Трехмерная структура связывающего локуса очеловеченного варианта очень близка к структуре связывающего локуса родительского мышиного антитела.
б) Конкретное анти-id антитело строго узнает эту трехмерную структуру связывающих локусов ("антитело, действительно являющееся внутренним образом").
Таким образом, антиидиотипические MAT, обладающие вышеперечисленными свойствами, являются наиболее перспективными реагентами для специфического и чуствительного количественного определения, например, сывороточных концентраций полностью очеловеченных (ОКО-привитых) MAT в присутствии огромного избытка нормальных человеческих иммуноглобулинов.
Данное изобретение охватывает образование, выработку и характеристику муриновых моноклональных антиидиотипических, являющихся "внутренним образом" антител (Аb2) к моноклональным антителам BR55-2 (Аb1). Другим аспектом данного изобретения является применение этих антиидиотипических MAT для активной терапевтической и профилактической иммунизации против рака эпителиальной этиологии и рака мелких легочных клеток, а также против заболеваний, вызываемых ВИЧ-инфекцией. Кроме того, аспектом изобретения является использование этих антиидиотипических MAT для высокоселективного количественного определения антител либо их фрагментов и производных с BR55-2 специфичностью, включая химеризированные и полностью очеловеченные варианты [5], а также широко используемый способ селективной иммуноаффинной очистки молекул с BR55-2 специфичностью.
Образование и характеристика муриновых
моноклональных антиидиотипических антител против идиотипа антител BR55-2
В качестве варианта, позволяющего свести к
минимуму нежелательные антиизотипические иммунные ответы, для иммунизации
был выбран F(ab')2-фрагмент BR55-2, муриновый иммуноглобулин IgG3. Для успешного образования муриновых анти-id MAT
против идиотипа муринового MAT BR55-2 важно максимально увеличить
иммуногенность, что позволит усилить соответствующий иммунный ответ у сингенного хозяина. Для этого F(ab')2-фрагмент,
лишенный Fc-части (очистка и выделение описаны [6]), связывали с
гемоцианином лимфы улитки (ГЛУ), выступающим в качестве иммунного носителя, с помощью гетеробифункционального линкера N-сукцинимидил
3-(2-пиридилдитио)пропионата (=СПДП) согласно описанным методам
[7].
Ва1b/с мышей иммунизировали этим ВR55-2/муриновым IgG3-F(ab')2-ГЛУ-конъюгатом с помощью полного адъюванта Freund по стандартной методике для генерации муриновых МАТ. В ходе последующих повторных иммунизаций муриновые клетки селезенки объединяли с муриновой клеточной линией миеломы SP2/0 (подробное описание эксперимента приведено в примере 1).
Для соответствующей селекции культивируемых клеток гибридомы проводили серию анализов их супернатантов. Эта селекция базировалась на следующих критериях.
а) Интенсивность секреции гибридом путем определения концентрации муринового IgG в супернатантах (подробное описание эксперимента приведено в примере 2). Клетки, продуцировавшие большие количества муринового IgG, были субклонированы в отдельные клеточные культуры.
б) Связывание отобранных супернатантов с F(ab')2 -фрагментом ВR55-2/муринового IgG3 (подробное описание эксперимента приведено в примере 3).
в) Ингибирование отобранными супернатантами связывания ВR55-2/муринового IgG2a с Lewis Y антигенположительными SKBR5 клетками рака грудной железы человека (подробное описание эксперимента приведено в примере 4).
Последний тест позволяет выявить свойства "внутреннего образа" Аb2. Для связывания использовали муриновый IgG2a, измененный вариант BR55-2, позволяющий свести к минимуму выявление узнаваемых Аb2 остаточных константных областей F(ab')2-фрагмента ВR55-2/муринового IgG3, используемого для иммунизации. Этот тест проводили количественно, основываясь на концентрации IgG, определенной в тесте а) (пример 2). Кроме того, в этом эксперименте по ингибированию добавляли избыток неспецифического мышиного IgG, что позволяет избежать любого выявления антител Аb2, неспецифичных для идиотипа BR55-2. Отбирали гибридомы, продуцирующие IgG с ингибирующей способностью, превышающей 95% (ингибирование связывания ВR55-2/муринового IgG2a с SKBR5 клеточной линией).
Используя вышеописанный способ тестирования, окончательно отобрали и описали шесть различных гибридом (Е4, С11, В3, В9, G6, G9). Все эти шесть гибридом продуцируют муриновый IgG1, что было установлено с помощью подтипа ELISA с использованием конъюгата кроличий антимышиный-IgG1/пероксидаза (например, в виде реагентов Zymed).
Все шесть гибридом культивировали в качалочных колбах (37oС, 5% CO2 в среде G, смена среды каждые 3-4 дня), а супернатанты собирали для соответствующей очистки.
Каждый супернатант, содержащий соответствующий анти-id BR55-2 MAT, очищали с помощью иммуноаффинной хроматографии. В целом, аффинная хроматография основана на взаимодействии между иммобилизованным лигандом и интересующим нас веществом. В случае антиидиотипических антител BR55-2, высокоспецифичным лигандом для аффинной колонки является MAT ВR55-2/муриновый IgG2a, который избирательно связывает антиидиотипические MAT (подробное описание эксперимента приведено в примере 5).
Степень очистки выделенных анти-id BR55-2 MAT (E4, С11; В3, В9, G6, G9) оценивали с помощью аналитической жидкостной хроматографии быстрого разделения, ионообменной хроматографии, гель-хроматографии, ДДС-ПААГ и иэоэлектрического фокусирования. Чистота всех шести анти-id BR55-2 MAT превышала 95% (подробное описание эксперимента приведено в примере 6, ДДС-ПААГ и изоэлектрическое фокусирование представлены на фиг.1 и 2).
Очищенные анти-id MAT характеризовали количественно путем определения их способности к ингибированию связывания ВR55-2/муринового IgG3 с Lewis Y антигенположительной SKBR5 клеточной линией. Все анти-id MAT ингибируют связывание Аb1 его антигеном, основываясь на 1:1 стехиометрии (подробное описание эксперимента приведено в примере 7, показательные результаты представлены на фиг.3).
Окончательная проверка свойств "внутреннего образа" анти-id BR55-2 MAT, описанных ранее, и их использование в качестве заменителя опухолевого антигена базируется на их способности образовывать Аb3 в ответ на антиген, ассоциированный с опухолью, у различных видов.
Согласно сетевой теории N.Jerne, антитела (Аb3), индуцируемые при иммунизации анти-id MAT (Аb2), являющимися "внутренним образом", обладают специфичностью связывания, сходной со специфичностью Аb1. Поэтому иммунный ответ, возбуждаемый путем иммунизации анти-id BR55-2 MAT, должен быть специфичным для Lewis Y антиген положительных опухолевых клеток. Вследствие этого защитный противоопухолевый иммунитет может быть индуцирован у человека путем иммунизации анти-id BR55-2 МАТ.
Для изучения свойств Аb3 ответа кроликов и макак-резусов иммунизировали анти-id BR55-2# E4 и гидроксидом алюминия в качестве носителя и адъюванта. Этот мягкий адъювант широко применяют при изготовлении различных вакцин, предназначенных для человека. В качестве отрицательного контроля иммунизировали животных тем же количеством неспецифического мышиного IgG1. После четырех иммунизаций в течение 5 недель на 9-ой неделе собирали иммунные сыворотки (подробное описание эксперимента приведено в примере 8). Определяли связывание сывороточного иммуноглобулина с Lewis Y антигенположительной SKBR5 клеточной линией рака грудной железы и Lewis Y антиген отрицательной WM9 клеточной линией меланомы (подробное описание эксперимента приведено в примерах 9 и 10).
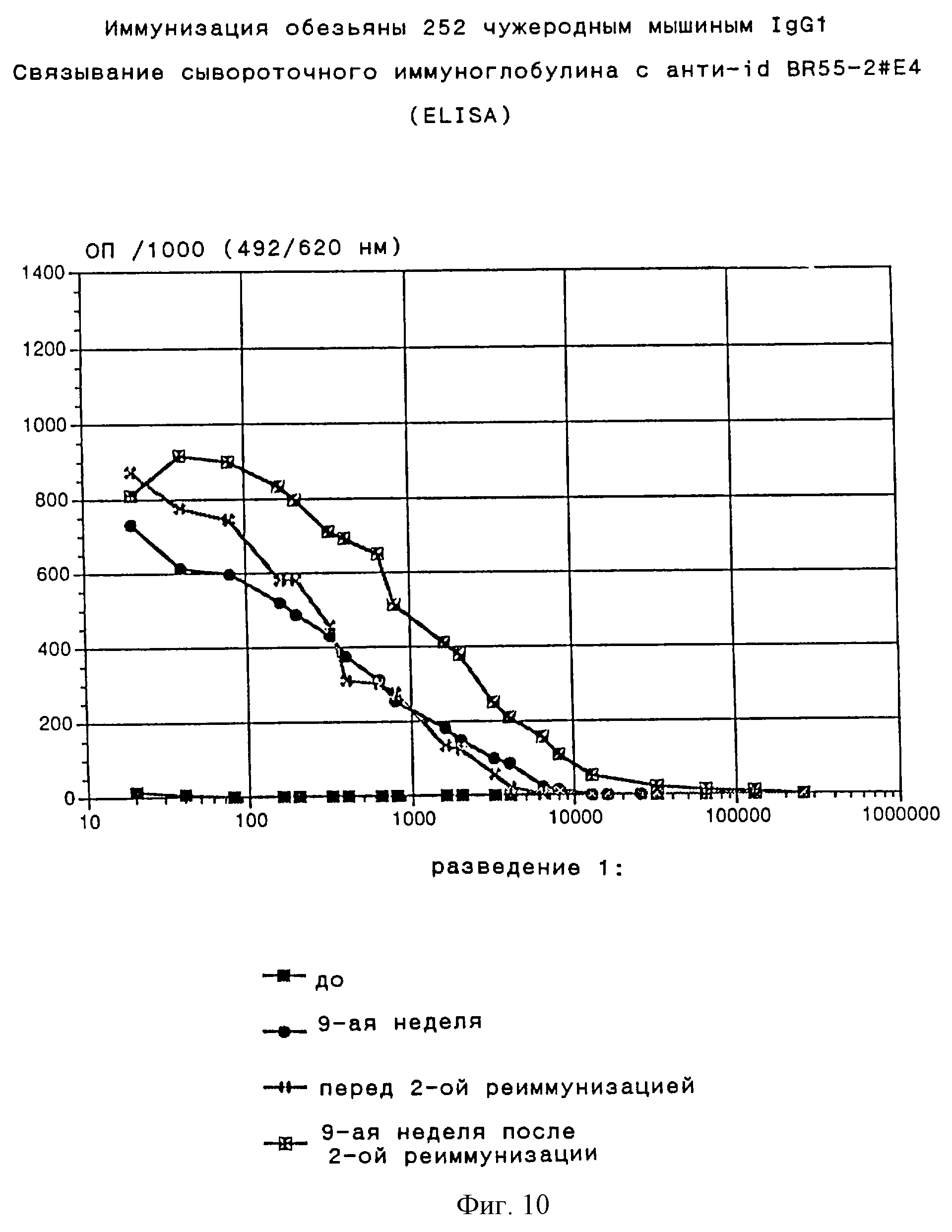
Анти-id BR55-2# E4 вызывает гуморальный иммунный ответ с высоким титром как у кроликов, так и у макак-резусов. Иммуноглобулин сыворотки животных, иммунизированных анти-id BR55-2#E4, селективно связывается с Lewis Y антиген положительной SKBR5 клеточной линией, но не связывается с Lewis Y антигенотрицательной WM9 клеточной линией. Напротив, при иммунизации неспецифическим мышиным IgG1 практически не обнаруживается сывороточный иммуноглобулин, связывающий опухолевые клетки. Эти результаты обобщены в табл. 1. На фиг.4 и 5 показаны характерные кривые связывания иммуноглобулина, полученные с пре- и иммунными сыворотками кроликов и макак-резусов при проведении клеточного ELISA (SKBR5 клетки). Связывание сывороточного иммуноглобулина животных, иммунизированных анти-id BR55-2#E4, с SKBR5 клетками может быть обнаружено даже при разведении сыворотки 1:10000.
Два года спустя после первичного курса иммунизации соответствующие макаки-резусы получили первую однократную реиммунизирующую инъекцию анти-id BR55-2# E4 либо неспецифического мышиного IgG1. Таким же образом была проведена вторая однократная реиммунизация спустя три года после первоначальной (= 1 год после первой реиммунизации, описание эксперимента приведено в примере 8). Сыворотки собирали до и после этих повторных иммунизаций.
Общий гуморальный иммунный ответ макак-резусов, вакцинированных анти-id BR55-2# E4, определяли с помощью ELISA, основанного на анти-id BR55-2#E4, сенсибилизированных на микротитрационных планшетах (описание эксперимента приведено в примере 13). В сыворотках всех макак-резусов обнаруживают иммунный ответ с высоким титром как после первичного цикла иммунизации, так и после первой и второй реиммунизаций. Иммуноглобулин, связывающийся с анти-id BR55-2# E4, обнаруживают даже в разведениях сыворотки 1:50000. Несколько меньший, но достаточно значительный титр обнаруживают в сыворотках и перед реиммунизирующими инъекциями. Эти результаты показаны на фиг.6-8.
Гуморальный иммунный ответ макак-резусов, вакцинированных неспецифическим мышиным IgQ1, также определяли с помощью вышеуказанного теста ELISA (описание эксперимента приведено в примере 13). Как и ожидалось, титры сывороточного иммуноглобулина, связывающегося с анти-id BR55-2#E4, несколько ниже, чем титры, обнаруженные в сыворотках обезьян, вакцинированных анти-id BR55-2#E4. В то время как иммунный ответ макак-резусов, иммунизированных неспецифическим мышиным IgG1, перекрестие взаимодействует с константными областями анти-id BR55-2# E4, фракция иммунного ответа к гипервариабельным участкам анти-id очевидно отсутствует. Эти результаты представлены на фиг. 9-10.
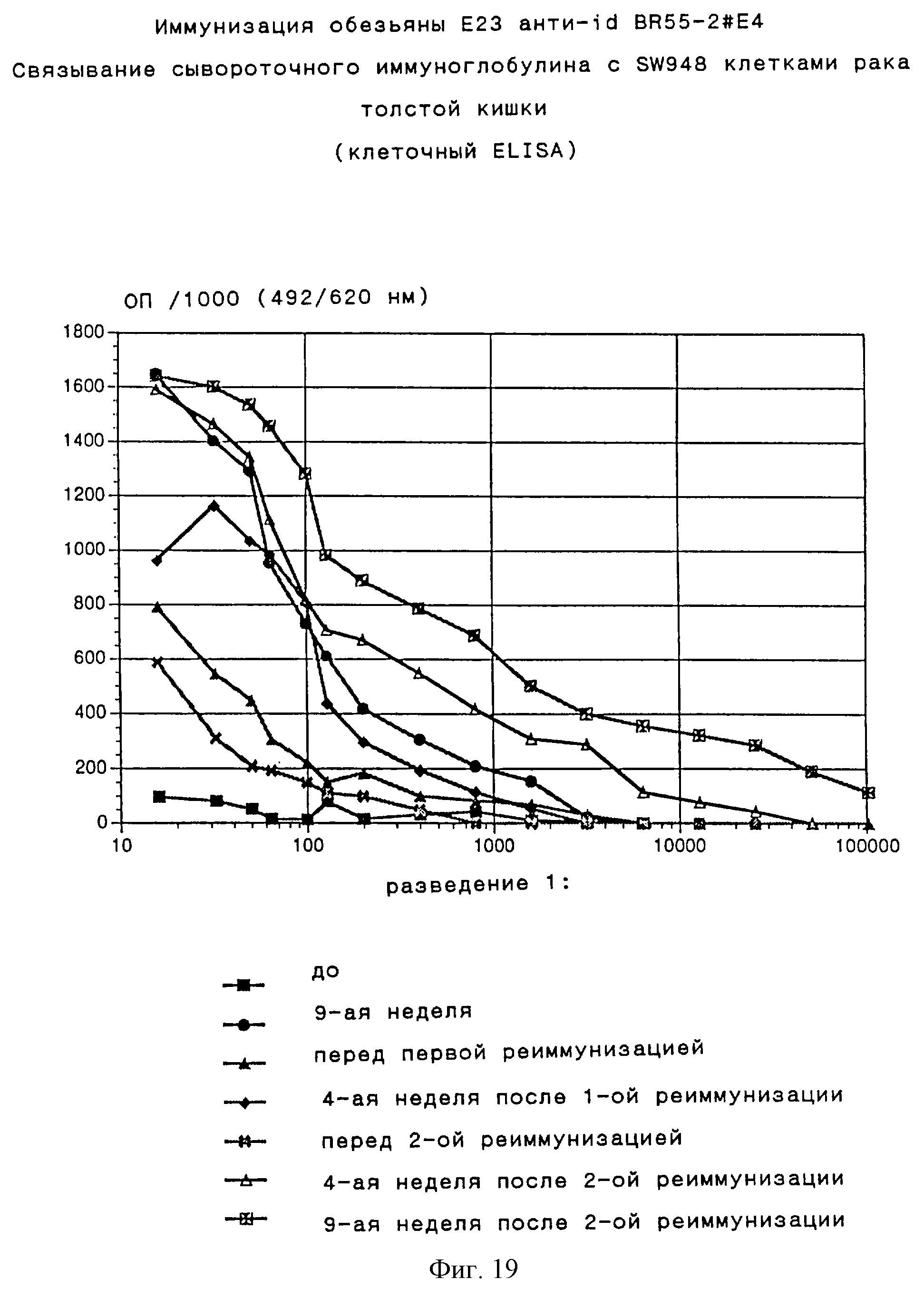
Для доказательства опухолевой специфичности иммунного ответа после первичного курса иммунизаций и как до, так и после повторных иммунизаций определяли связывание сывороточного иммуноглобулина обезьян с некоторыми Lewis Y антигенположительными раковыми клеточными линиями (рак грудной железы, желудка, толстой кишки и мелких легочных клеток), а также с Lewis Y отрицательной меланомной клеточной линией (подробное описание эксперимента приведено в примере 10). У макак-резусов, обработанных анти-id BR55-2#E4, спустя два года после первичной иммунизации и до первой повторной иммунизации может обнаруживаться сывороточный иммуноглобулин, который связывается с Lewis Y антиген положительной опухолевой линией. После первой реиммунизации у животных, иммунизированных анти-id BR55-2#E4, обнаруживают сильно возросшие титры сывороточного иммуноглобулина, специфически связывающегося с Lewis Y антигенположительной опухолевой линией, но практически не удается обнаружить связывания с антигенотрицательной клеточной линией. Не наблюдается какого-либо специфического связывания ни в какой момент времени в сыворотке макак-резусов, иммунизированных неспецифическим мышиным IgG1. Сходные результаты получают и для сывороток, полученных до и после второй реиммунизации. Эти результаты титрования сывороток, полученные в разные моменты времени при проведении клеточного ELISA с использованием некоторых опухолевых клеточных линий, представлены на фиг.11-20.
Сходный характер иммунореактивности иммуноглобулина различных сывороток обезьян как до и после первого курса иммунизации, так и до и после первой реиммунизации может быть продемонстрирован в экспериментах по связыванию с мембранным препаратом Lewis Y антигенположительных SKBR5 клеток (подробное описание эксперимента приведено в примере 11). Полученные результаты обобщены в табл. 2.
Для дальнейшего детального анализа гуморального иммунного ответа, индуцируемого у макак-резусов посредством иммунизации анти-id BR55-2#E4, различные сыворотки вакцинированных обезьян очищали иммуноаффинным методом на колонке, заполненной анти-id BR55-2#E4, пришитым к Сефарозе ( подробное описание эксперимента приведено в примере 12). С помощью этого селективного одноступенчатого процесса полный гуморальный иммунный ответ против анти-id BR55-2#E4 отделяют ото всех других посторонних сывороточных белков. В первом эксперименте иммуноглобулин макак-резусов, иммунизированных анти-id BR55-2# E4, выделяли иммуноаффинным методом из сыворотки, полученной на 9-ой неделе после первичного курса иммунизации. Во втором эксперименте иммуноглобулин макак-резусов, иммунизированных анти-id BR55-2#E4, выделяли иммуноаффинным методом из пула сывороток, полученных на 4-ой и 9-ой неделях после второй реиммунизации. На основании их сорбции на анти-id ВR55-2#Е4-колонке полученные Ig-фракции специфически связываются с различными эпитопами анти-id BR55-2# E4 молекулы антигена. Эти Ig-фракции содержат антитела против константных областей анти-id BR55-2# E4 (антиизотипический иммунный ответ), а также антитела против вариабельных участков, включая связывающую область анти-id BR55-2# E4 (антиидиотипический иммунный ответ). Исходя из сетевой идиотипической теории, упоминавшейся во введении, последняя фракция (АВ3) особенно важна, так как она ингибирует связывающие свойства, сопоставимые со свойствами антител со специфичностью BR55-2 (АВ1).
Определяли связывание очищенной иммуноаффинным методом Ig-фракции из пула сывороток, полученных на 4-ой и 9-ой неделях после второй реиммунизации, и прошедшей фракции (фракция, не задержанная на колонке) с анти-id BR55-2# E4 (подробное описание эксперимента приведено в примере 13). В то время как очищенная иммунноаффинным методом Ig-фракция сильно связывается с анти-id BR55-2# E4, не удается обнаружить никакого связывания у прошедшей фракции. Эти результаты доказывают селективность и эффективность данного метода иммуноаффинной очистки (результаты представлены на фиг.21).
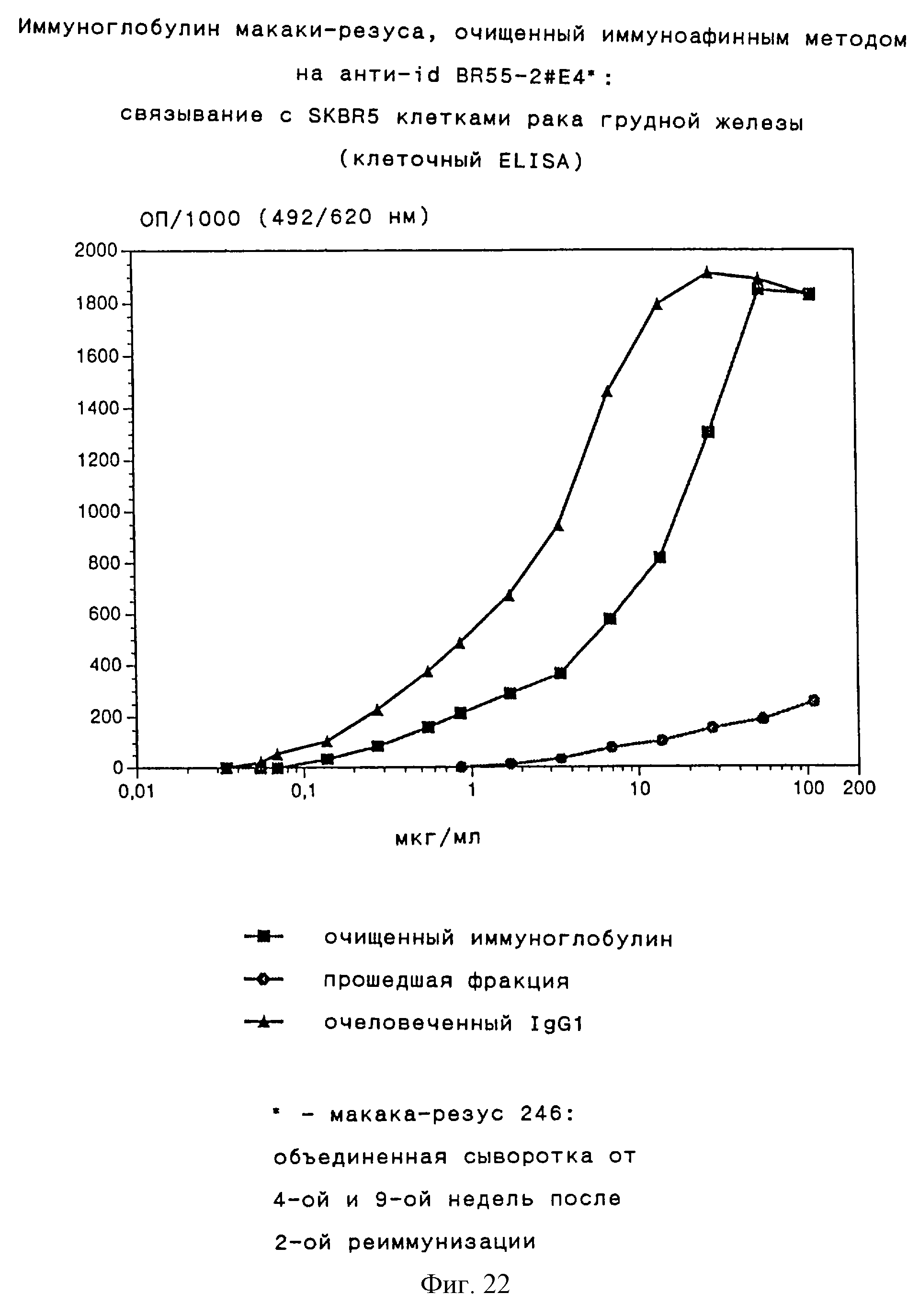
Затем проводили сравнение связывающих свойств очищенной иммуноаффинным методом Ig-фракции из пула сывороток, полученных на 4-ой и 9-ой неделях после второй реиммунизации, прошедшей фракции и очеловеченного варианта родительского муринового MAT (АВ1) на примере SKBR5 клеток рака грудной железы. Этот очеловеченный АВ1 вариант (ВR55-2-очеловеченный IgG1) был выбран для облегчения сравнения, так как он может быть обнаружен тем же реагентом, который используется для обнаружения иммуноглобулинов макак-резусов (конъюгат козий-античеловеческий-Ig/пероксидаза, который аналогичным образом связывается также с близкородственным иммуноглобулином макак-резусов). Практически вся связывающая опухолевые клетки реактивность аккумулируется в очищенной иммуноаффинным методом Ig-фракции. Эти результаты доказывают наличие перекрестной реактивности иммуноглобулина макак-резусов, индуцированного иммунизацией анти-id BR55-2# E4, с Lewis Y антигенположительной опухолевой клеточной линией. Кроме того, по отношению весов сила связывания Ig-фракции, очищенной иммуноаффинным методом, только в 5 раз ниже, чем сила связывания ВR55-2/очеловеченного IgG1 (AB1). Принимая во внимание, что только определенная часть очищенной иммуноаффинным методом Ig-фракции относится к связывающей области анти-id BR55-2#E4 и, согласно сетевой теории, только эта часть обладает связывающими свойствами, сравнимыми с AB1, данный результат является выдающимся. Исходя из данных о выходе иммуноаффинной очистки сывороток макак-резусов, титр очищенной иммуноаффинным методом Ig-фракции составляет приблизительно 200 мкг/мл сыворотки, что соответствует примерно 40 мкг/мл иммуноглобулина со свойствами связывания с опухолевыми клетками, аналогичными свойствам ВR55-2/очеловеченного IgG1 (результаты представлены на фиг.22, подробное описание эксперимента приведено в примерах 10 и 12).
Сравнение свойств связывания очищенного иммуноаффинным методом обезьяньего иммуноглобулина (АВ3) со свойствами ВR55-2/очеловеченного IgG1 на примере Lewis Y положительной клеточной линии SKBR5 рака грудной железы и Lewis Y отрицательной меланомной клеточной линии WM9 представлено на фиг. 23 (подробное описание эксперимента приведено в примере 10). В то время как АВ3 фракция и ВR55-2/очеловеченный IgG1 сильно связываются с Lewis Y положительной клеточной линией, как описано выше, оба эти антитела не связываются специфически с Lewis Y отрицательной клеточной линией. Эти результаты доказывают сходство характера связывания АВ3-фракции и очеловеченного варианта AB1.
Сходный характер иммунореактивности АВ-фракции наблюдают также при проведении ELISA с использованием мембранных фракций Lewis Y положительной SKBR5 клеточной линии и Lewis Y отрицательной клеточной линии WM9. Существенное связывание АВ3-фракции выявляют только с Lewis Y положительными клеточными мембранами (полученные результаты представлены на фиг.24, подробное описание эксперимента приведено в примере 11).
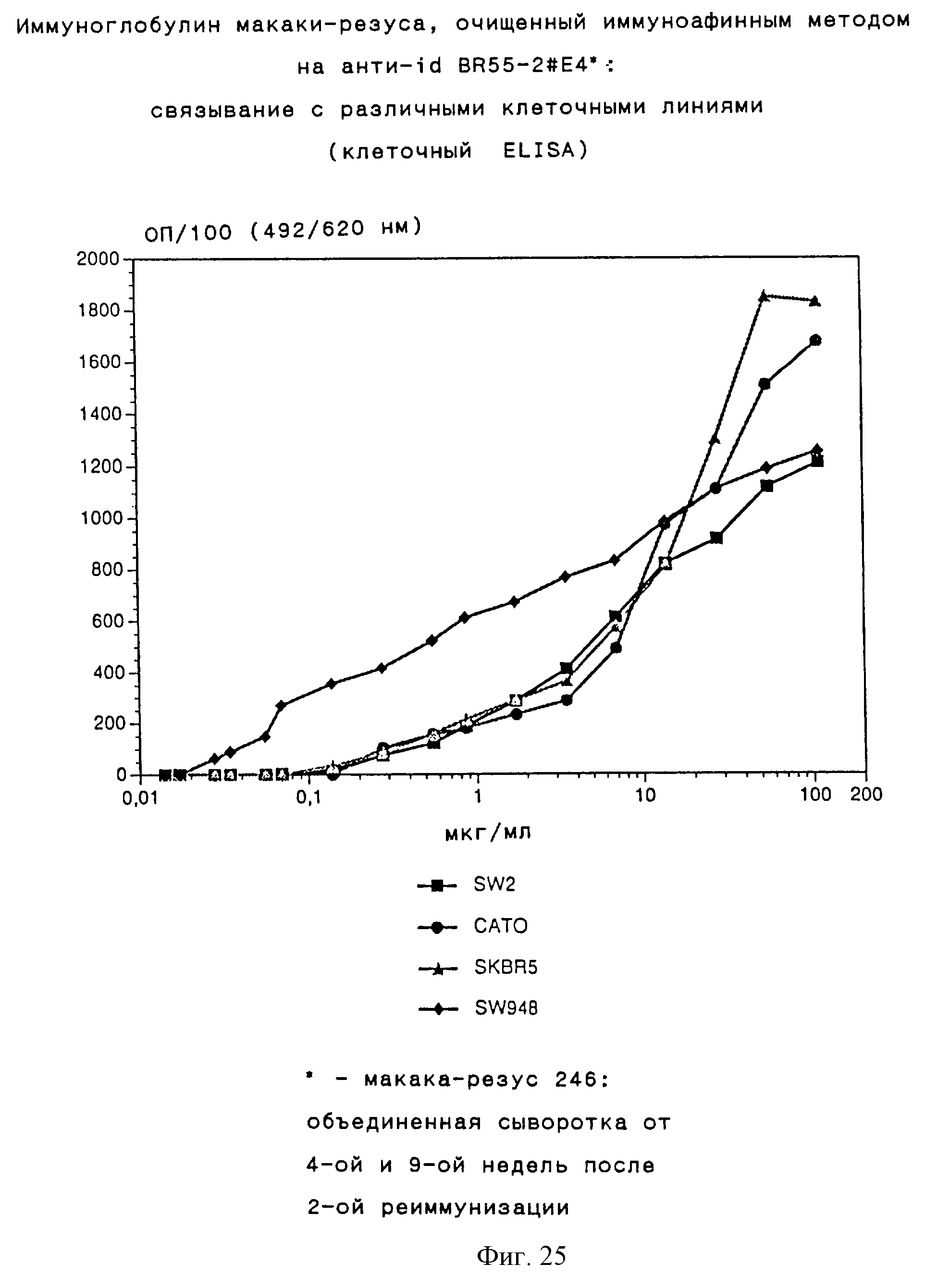
Связывающие свойства очищенного иммуноаффинным методом обезьяньего иммуноглобулина (АВ3) были затем подтверждены на примере нескольких Lewis Y положительных клеточных линий опухолей человека (рак мелких клеток легких, рак желудка, толстой кишки, грудной железы). Очищенный иммуноаффинным методом иммуноглобулин сильно связывается со всеми тестируемыми клеточными линиями (полученные результаты представлены на фиг.25, подробное описание эксперимента приведено в примере 10).
После связывания с опухолевыми клетками ВR55-2/муриновый IgG3, антитело АВ1, опосредует разрушение опухолевых клеток путем активации эффекторных механизмов человека. Для тестирования способности к деструкции опухолевых клеток иммуноглобулина макаки-резуса, индуцированного иммунизацией анти-id BR55-2# E4, использовали очищенный иммуноаффинным методом обезьяний иммуноглобулин (АВ3). Для этого эксперимента АВ3-фракцию выделяли иммуноаффинным методом из сыворотки макаки-резуса, полученной спустя 9 недель после курса первичной иммунизации анти-id BR55-2# E4. Эту АВ3-фракцию сравнивали с ВR55-2/муриновым IgG3(AB1) в эксперименте на антителообусловленную клеточную цитотоксичность (АЗКЦ) с использованием человеческих мононуклеаров периферической крови (МПК) в качестве клеток-эффекторов (полученные результаты представлены на фиг.26, подробное описание эксперимента приведено в примере 14). Очищенная иммуноаффинным методом АВ3-фракция в более высоких концентрациях опосредует разрушение опухолевых клеток путем активации эффекторных клеток человека, аналогично муриновому АВ1. Этот результат демонстрирует индукцию селективной цитотоксичности по отношению к опухолевым клеткам путем вакцинации анти-id BR55-2#E4. Требуется более высокая концентрация АВ3, так как только определенная часть очищенной иммуноаффинным методом Ig-фракции относится к связывающей области анти-id BR55-2#E4, и только эта часть, как предполагается, будет связываться с опухолевыми клетками и опосредовать А3КЦ.
Как уже отмечалось в введении, известно, что Lewis Y углеводный антиген экспрессируется также на человеческих лейкоцитах, инфицированных ВИЧ. Для того чтобы исследовать свойство связывания сывороточного иммуноглобулина макак-резусов, иммунизированных анти-id BR55-2#E4 или неспецифическим мышиным IgG1, с ВИЧ-инфицированными клетками, обезьяньи сыворотки, полученные до и 9 недель спустя после исходного курса иммунизации, тестировали с помощью разработанного коммерческого набора для тестирования, который первоначально был создан для обнаружения ВИЧ-серопозитивной реакции в сыворотках человека. Этот тест основан на способности человеческого сывороточного иммуноглобулина связываться с ВИЧ-инфицированной Т-клеточной линией человека PALL, что выявляется по непрямой иммунофлуоресценции с использованием античеловеческого IgG-флюоресцеинизотиоцианата. Из-за сильного сходства человеческого иммуноглобулина и иммуноглобулина макак-резусов исходный реагент набора для тестирования может быть использован и для иммуноглобулина макак-резусов. Связывание с неинфицированными PALL-клетками служит контролем (подробное описание деталей эксперимента приведено в примере 15).
У нормальной сыворотки макак-резусов фоновая флуоресценция как для ВИЧ-инфицированных, так и для неинфицированных PALL клеток несколько выше фоновой флуоресценции, обнаруживаемой у нормальной сыворотки человека. Однако только сывороточный иммуноглобулин макак-резусов, иммунизированных анти-id BR55-2# E4, связывается в значительной степени с ВИЧ-инфицированными PALL клетками, в то время как связывания с неинфицированными PALL-клетками не наблюдается. Реактивность сывороточного иммуноглобулина макак-резусов, иммунизированных неспецифическим мышиным IgG1, с ВИЧ-инфицированными PALL клетками проявляется значительно слабее и близка к фоновой иммунофлуоресценции, наблюдаемой у нормальных обезьяньих сывороток (результаты обобщены в табл. 3).
Иммуноглобулин макаки-резуса, иммунизированной анти-id BR55-2#E4, выделяли иммуноаффинным методом из пула сывороток, полученных на 4-ой и 9-ой неделях после второй реиммунизации, с помощью анти-id BR55-2#E4 колонки (смотри выше). Связывающие свойства этого очищенного иммуноаффинным методом иммуноглобулина (АВ3) сравнивали со свойствами ВR55-2/муринового IgG3 (AB1) с помощью уже упоминавшегося коммерческого набора для тестирования, предназначенного для выявления ВИЧ-серопозитивной реакции в сыворотках человека (подробное описание эксперимента приведено в примере 15). Очищенная иммуноаффинным методом Ig-фракция (АВ3) селективно связывается с ВИЧ-инфицированными PALL клетками, а у неинфицированных PALL клеток никакого связывания не обнаруживают. Аналогичный характер связывания обнаруживают и для ВR55-2/муринового IgG3 (AB1). Полученные результаты обобщены в табл. 4.
В дополнение к их использованию в качестве уникальных вакцин для профилактики и лечения различных видов рака и болезней, вызываемых ВИЧ, антиидиотипические MAT, являющиеся "внутренним образом", полученные против области связывания BR55-2, описанные в данном изобретении, являются мощным средством для количественного определения моноклональных антител, их производных или фрагментов со специфичностью связывания BR55-2. Например, они могут быть использованы для селективного определения концентрации всех муриновых субтипов BR55-2 в человеческих сыворотках. Из-за узнавания трехмерной конфигурации области связывания BR55-2 эти анти-id MAT связываются только с иммунореактивным BR55-2 структурами. Это свойство обуславливает превосходство этой системы определения над системами, основанными на использовании обычных реагентов против константной области. ELISA-система для количественного определения иммунореактивного ВR55-2/муринового IgG3 или ВR55-2/муринового IgG2a описана в примере 16, а типичная стандартная кривая этих MAT в человеческой сыворотке представлена на фиг.27.
Аналогичная ELISA-система, основанная на использовании анти-id MAT, описанных в этом изобретении, может быть применена для высокоселективного количественного определения иммунореактивных химер BR55-2 мышь/человек в человеческой сыворотке. Такие химеры состоят из вариабельных областей BR55-2 и человеческих константных областей (например, человеческий IgG1 или человеческий IgG3). Из-за огромного избытка нормального человеческого иммуноглобулина в человеческой сыворотке (>10 мг/мл), такие химеры мышь/человек не обнаруживаются в человеческой сыворотке с помощью обычных античеловеческий-Fc реагентов, которые связываются с любым человеческим иммуноглобулином, присутствующим в сыворотке. Селективная ELISA-система описана в примерах 17 и 18, типичные стандартные кривые для человеческой сыворотки представлены на фиг.28 и 29.
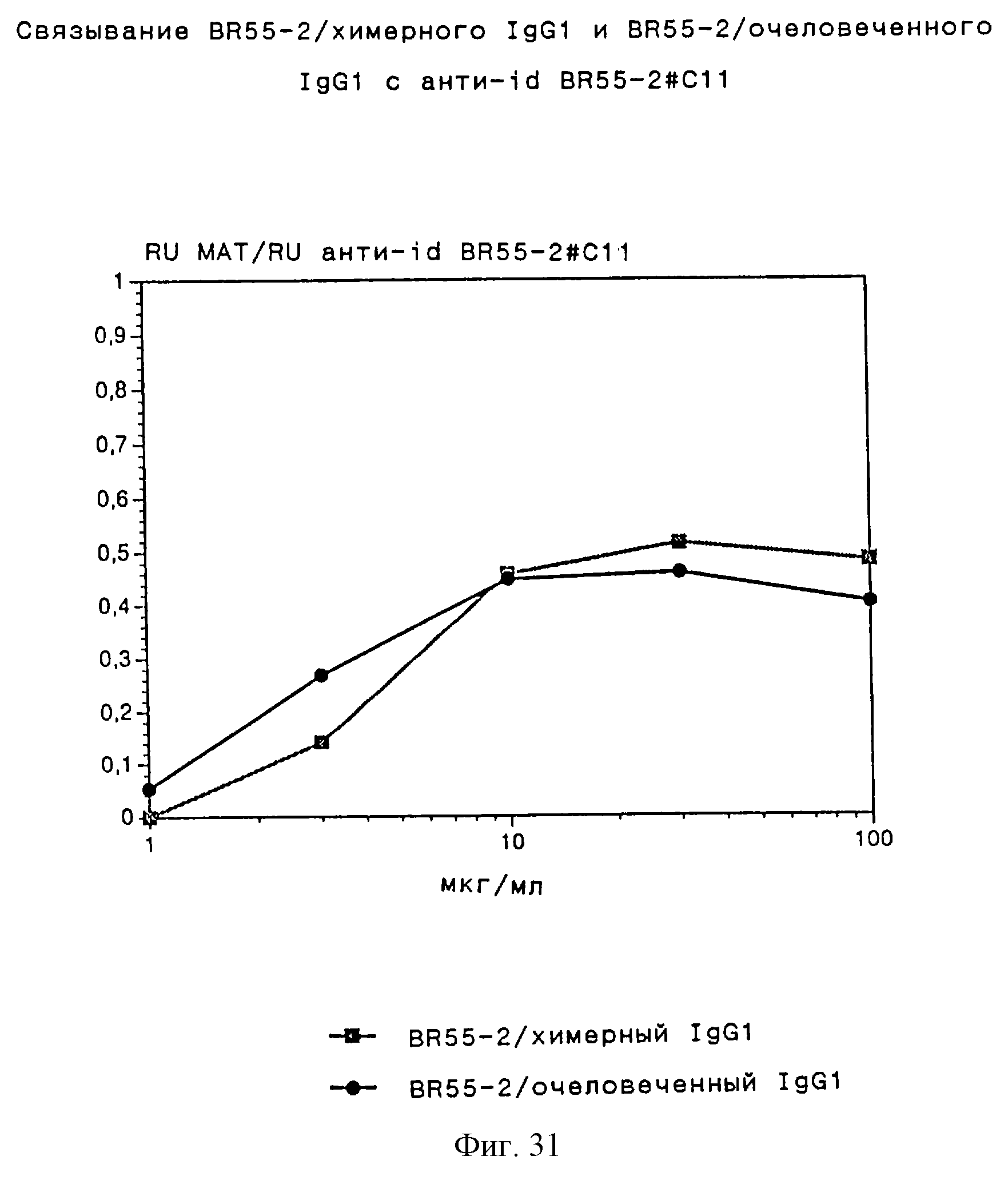
Полностью очеловеченные варианты BR55-2 были сконструированы путем трансплантации определяющих комплементарность областей (ОКО) муринового родительского MAT в человеческие константные области и каркасные области. С помощью компьютерного моделирования выбирают определенные точечные мутации в человеческих каркасных областях, приводящие к получению очеловеченных вариантов без существенной потери связывающего сродства к Lewis Y положительным опухолевым клеткам по сравнению родительскими муриновыми МАТ. Таким образом, в таких очеловеченных вариантах только небольшая часть исходной муриновой аминокислотной последовательности, определяющей характеристики связывания, остается неизменной. Интересно, что все анти-id BR55-2 MAT, описываемые в данном изобретении, также сильно связываются с идиотипом таких очеловеченных вариантов IgG1 родительского мышиного IgG3 MAT. Характер связывния анти-id MAT по отношению к очеловеченным вариантам АВ1 сравним с характером связывания по отношению к химерным MAT мышь/человек, упоминавшимся ранее. Это подтверждается результатами анализа биоспецифического взаимодействия с помощью BIAcoreTM системы производства Pharmacia. В большинстве случаев при более высоких концентрациях наблюдают почти 1:1 стехиометрию между анти-id BR55-2 и ВR55-2/химерным человеческим IgG1 или ВR55-2/очеловеченным IgG1. Подробное описание эксперимента приведено в примере 19, кривые титрования представлены на фиг. 30-35. Эти результаты делают очевидной селективность связывания анти-id MAT с интактной трехмерной структурой гипервариабельного участка всех вариантов BR55-2 и доказывают их свойства "внутреннего образа".
На основании этого уникального и селективного способа узнавания анти-id BR55-2 MAT могут быть использованы также для высокоселективного количественного определения иммунореактивных очеловеченных антител со специфичностью BR55-2 в человеческой сыворотке несмотря на огромный избыток человеческого иммуноглобулина, присутствующего в сыворотке. Такая же ELISA-система может быть использована для количественного определения очеловеченных антител со специфичностью BR55-2 в обезьяньей сыворотке. Это важно, например, для изучения токсичности и фармакокинетики у обезьян, требуемого в ходе доклинических испытаний очеловеченного BR55-2 MAT для пассивной иммунотерапии. ELISA-система описана в примере 20, типичная стандартная кривая для человеческой сыворотки представлена на фиг.36.
Узнавание связывающей области всех вариантов BR55-2 анти-id BR55-2 MAT подтверждается также конкуренцией связывания ВR55-2/муринового IgG3 с анти-id BR55-2#E4, демонстрируемой ВR55-2/химерным человеческим IgG1 и ВR55-2/химерным человеческим IgG3. Обе химеры конкурентно ингибируют связывание определенной концентрации родительского муринового MAT с анти-id BR55-2#E4 способом, зависящим от дозировки. Этот конкретный ELISA-тест описан в примере 21, а результаты представлены на фиг.37.
Связывание ВR55-2/муринового IgG3 с антигенположительными клеточными линиями является необходимым условием для комплемент опосредованной деструкции. Так, например, ингибирование опухолевой цитотоксичности анти-id BR55-2 MAT отражает их способность блокировать связывание АВ1 с его антигеном на клеточной поверхности. Активная нейтрализация анти-id BR55-2#E4 комплемент зависимой цитотоксичности по отношению к SKBR5 клеткам рака грудной железы человека, опосредованная ВR55-2/муриновым IgG3, представлена на фиг.38, подробное описание эксперимента приведено в примере 22.
Благодаря своему высокоспецифическому узнаванию всех структур интактным локусом связывания BR55-2, анти-id BR55-2 MAT могут использоваться для одноступенчатого способа иммуносорбционной очистки всех вариантов BR55-2. Анти-id BR55-2#E4 пришивали к СH-Сефарозе 4В. Этот иммуноаффинный материал может быть, например, использован для направленной очистки ВR55-2/химерного человеческого IgG1, культивируемого in vitro. Химерное MAT получают с выходом 75% и степенью очистки >95%. Из-за существенно большей селективности этот метод иммуноаффинной очистки превосходит аффинную очистку с использованием Протеина А. Детальное описание эксперимента приведено в примере 23, результаты ДДС-ПААГ представлены на фиг.39. Присутствия примесей не установлено. Этот же способ очистки может быть с успехом использован с аналогичными результатами для высокоэффективной одноступенчатой очистки супернатантов клеточной культуры очеловеченного варианта BR55-2, полученного путем трансплантации ОКО.
В заключение следует указать, что иммунизация кроликов и макак-резусов муриновым моноклональным антиидиотипическим антителом IgG1 к идиотипу антител со специфичностью BR55-2 (анти-id BR55-2#E4) приводит к возникновению высокотитрованного иммунного ответа, который специфически связывается с Lewis Y положительными опухолевыми клетками. Как показано в экспериментах на макаках-резусах, при повторных реиммунизациях антиопухолевая иммунность сохраняется в течение ряда лет. Иммуноглобулин, вызванный этими иммунизациями, в присутствии человеческих эффекторных клеток проявляет опухолевую цитотоксичность в АЗКЦ. Специфичность анти-id иммунизации доказывается иммунизацией контрольной группы макак-резусов неспецифическим мышиным IgG1. Несмотря на значительный иммунный ответ на неспецифический мышиный IgG1, не было обнаружено какого-либо связывания с каким-либо типом опухолевых клеток.
Согласно полученным результатам исследование анти-id BR55-2 MAT, выступающих в качестве заменителя Lewis Y ассоциированного с опухолью антигена для терапевтической и профилактической активной иммунизации с целью индукции антиопухолевой устойчивости у человека, выдвигается на первый план.
Кроме того, иммунизация макак-резусов анти-id BR55-2 MAT вызывает возникновение высокотитрованного иммунного ответа, который селективно связывается с ВИЧ-инфицированными положительными клетками. Как известно, такие клетки экспрессируют Lewis Y. Напротив, иммунизация макак-резусов неспецифическим мышиным IgG1 не вызывает никакого специфического связывания с ВИЧ-положительными или отрицательными клетками.
Согласно полученным результатам, применение анти-id BR55-2 MAT в качестве заменителя Lewis Y углеводного антигена при терапевтической и профилактической вакцинации человека с целью индукции защитного иммунитета против ВИЧ и заболеваний, вызываемых ВИЧ-инфицированием, выдвигается на первый план.
Помимо использования анти-id BR55-2 MAT в качестве профилактических и терапевтических вакцин, анти-id MAT со свойствами "внутреннего образа" могут применяться как перспективные реагенты для высокоселективного и специфичного определения молекул со специфичностью BR55-2, включая химеризованные и очеловеченные варианты в сыворотках или других биологических жидкостях. В силу их способности ковалентно связываться с соответствующим матриксом такие анти-id MAT могут использоваться для высокоселективной одноступенчатой иммуноаффинной очистки любых молекул со специфичностью BR55-2 с высоким выходом продукта.
Приводимые ниже примеры иллюстрируют данное изобретение. Аббревиатуры имеют
следующие
значения:
АЗКЦ антителозависимая клеточная цитотоксичность
БСА бычий сывороточный альбумин
КЗЦ комплементзависимая цитотоксичность
МДСИ модифицированная
Дульбенко
среда Игла
ЭДК N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорид
ELISA твердофазный иммуноферментный анализ
ФТС фетальная телячья сыворотка
Н-ЗФР
hepes-забуференный физиологический раствор
MAT моноклональное антитело
N-ГС N-гидроксисукцинимид
МПК мононуклеары периферической крови
ЗФР забуференный фосфатом
физиологический раствор
KAM-IgG1 кроличий антимышиный IgG1 иммуноглобулин
RPMI Roswell Park Memorial Institute
ДДС додецил сульфат натрия
ГЛУ гемоцианин лимфы
улитки
СПДП N-сукцинимидил-3-(2-пиридилдитио-пропионат)
ПААГ электрофорез в полиакриламидном геле
ИЭФ изоэлектрическое фокусирование
ПЭГ полиэтиленгликоль
ФИТЦ флуоресцинизотиоцианат
ИФА иммуноферментный анализ
В примерах упоминаются следующие материалы:
Микротитрационные планшеты: иммунопланшеты II (Nunc)
Клеточные
линии:
SKBR5: клеточная линия рака грудной железы человека
САТО: клеточная линия рака желудка человека
SW 948: клеточная линия рака толстой кишки человека
SW2:
клеточная линия рака мелких легочных клеток человека
WM9: клеточная линия человеческой меланомы
PALL: линия Т-клеток человека
SP2: клеточная линия мышиной миеломы
Среда A: RPMI 1640+2г/л NаНСО3
100 ед/мл пенициллина G
100 мкг/мл стрептомицин сульфата
4 мМ глутамина
10% ФТС (инактивированная нагреванием, не
содержащая гамма-глобулина)
Среда В: RPMI 1640+2г/л NаНСО3
100 ед/мл пенициллина G
100 мкг/мл стрептомицин сульфата
4 мМ глутамина
5% ФТС
(инактивированная нагреванием)
Среда С: МДСИ
10% NCTC-135 (синтетическая среда Gibco)
1% MEM без основных аминокислот (Gibco)
0,5% пирувата натрия
0,5%
оксалоуксусной кислоты (Sigma)
20% ФТС (инактивированная нагреванием)
4 мМ глутамина
100 ед/мл пенициллина G
100 мкг/мл стрептомицин сульфата
Среда D:
Среда С+1,36 мг/л гипоксантина
0,39 мг/л тимидина
Среда Е: Среда D+0,4 мг/л аминоптерина
Среда F: Среда С+мышиные тимоциты (тимоциты одной Balb/с мыши, ресуспендированные в
25 мл Среды С)
Среда G: МДСИ
10% ФТС, инактивированная нагреванием
4 мМ глутамина
100 ед/мл пенициллина G
100 мкг/мл стрептомицин сульфата
Среда
Н: 10 мМ N-(2-гидроксиэтил)пиперазин-N'-2-этан-сульфоновой кислоты
3,4 мМ этилендинитро тетрауксусной кислоты
0,15 М NaCl
0,005% Р20 (Pharmacia Biosensor AB, Uppsala,
Sweden)
ПЭГ: полиэтиленгликоль (МВ=3400)
1 г растворяют в 1 мл МДСИ
ЗФР неполный: 138,0 мМ NaCl
1,5 мМ КОН
2,7 мМ КСl
6,5 мМ Na2
HPO4
pH 7,2
Буфер для сенсибилизации поверхностей: 15 мМ Na2CO3
35 мМ NаНСО3
3 мМ NaN3
pH 9,6
Буфер
для окрашивания: 24,3 мМ лимонной кислоты
51,4 mm Na2HPO4
pH 5,0
Буфер для прмывки: 2% NaCl
0,2% Тритон Х-100
в неполном
ЗФР
Субстратный раствор: 40 мг о-фенилендиаминдигидрохлорида
100 мл буфера для окрашивания
20 мкл H2O2 30%
Буфер для связывания: 0,1 М
Трис/HCl
0,
2 М NaCl
pH 7,5
Буфер для элюции: 0,15 М глицин/HCl
0,2 М NaCl
рН 2,8
Буфер для пришивания: 0,1 М NaHCO3
0,5 М
NaCl
рН 8,0
Пример 1. Генерация анти-id BR55-2 МАТ.
1.1 Иммунизация мышей
Каждую из Balb/c мышей иммунизируют 100 мкг F(ab')2-фрагментом
ВР55-2/муринового IgG3, пришитого
к ГЛУ с помощью СПДП [7], путем внутрибрюшинных инъекций по следующей схеме:
сутки 0-ые: 100 мкг конъюгата (1 мг/мл в неполном ЗФР) + 100 мкл Freund's
полного адъюванта
сутки 7-ые и
28-ые: 100 мкг конъюгата (1 мг/мл в неполном ЗФР) + 100 мкл Freund's неполного адъюванта
На 8-ые, 9-ые, 10-ые и 11-ые сутки после первичной
внутривенной иммунизации делают четыре
реиммунизирующие инъекции (каждая содержит 100 мкг конъюгата в 100 мкл неполного ЗФР). На 12-ые сутки асептически извлекают селезенки, суспенди-руют их в
неполном ЗФР и трижды промывают в неполном
ЗФР.
1.2 Гибридизация
Полученные клетки селезенки добавляют к суспензии SP2/0 клеток в соотношении 1:1 и центрифугируют при 900 g в
течение 5 минут. К осадку клеток по каплям
в течение минуты добавляют раствор ПЭГ (37oС) и разводят 1 мл неполного ЗФР (37oС) в течение следующей минуты. При осторожном
перемешивании добавляют 10 мл среды С и доводят
объем суспензии до 50 мл неполным ЗФР. Суспензию центрифугируют при 800 g в течение 5 минут, осадок ресуспендируют в среде D, а клетки переносят в
лунки микротитрационного планшета (Nunc 96) в
концентрации 2,5 х 105 клеток/лунку. После инкубации в течение ночи при 37oС, 5% CO2, добавляют 100 мкл/лунку среды Е.
Спустя 72 часа и затем каждые четыре дня среду
заменяют средой D,
Пример 2. Количественное определение мышиного IgG в супернатантах гибридом.
Аликвоты по 100 мкл кроличьего антимышиного IgG (например, реагент Nordic, 1: 1000 в буфере для сенсибилизации) вносят в лунки микротитрационных планшетов, инкубируют при 37oС в течение 60 минут. Планшеты 6 раз промывают буфером для промывки, добавляют 200 мкл неполного ЗФР/5% ФТС и инкубируют в течение 30 минут при 37oС. Планшеты промывают, как описано ранее. Добавляют аликвоты по 100 мкл супернатантов гибридомы, полученных после двухнедельного культивирования, и инкубируют планшеты в течение 60 минут при 37oС. Несвязанное антитело отмывают, как описано выше, и добавляют аликвоты по 100 мкл антитела, конъюгированного с пероксидазой (конъюгат кроличий антимышиный IgG/пероксидаза типа Dianova, 1:1000 в ЗФР/2% ФТС). После инкубации в течение 30 минут при 37oС планшеты промывают четыре раза буфером для промывки и дважды буфером для окрашивания. Добавляют аликвоты по 100 мкл субстратного раствора и через 5 минут останавливают развитие окраски путем добавления аликвот по 50 мкл 4N H2SO4. Фотометрическую экстинцию измеряют при 492 нм (эталонное измерение 620 нм).
Пример 3. Специфическое связывание супернатанта IgG-гибридомы с BR55-2 F(ab')-фрагментом (ELISA).
Гибридомы, продуцирующие достаточно высокий уровень мышиного IgG (например, десятикратное увеличение оптической плотности по сравнению со средой-эталоном), субклонируют в виде отдельной культуры клеток в среде F и культивируют в среде С в течение 2 еще недель. Супернатанты тестируют, как описано в примере 2, используя аликвоты по 100 мкл F(ab')-фрагмента BR55-2 (10 мкл/мл, разведение буфером для сенсибилизации).
Пример 4. Ингибирование связывания ВR55-2/муринового IgG2a с SKBR5 клетками рака грудной железы человека супернатантом-IgG гибридомы (клеточный ELISA).
Все супернатанты гибридомы, проявившие положительную реакцию в вышеописанном тесте, анализируются далее следующим образом.
Микротитрационные планшеты обрабатывают предварительно гидробромидом поли-L-лизина (20-30 кДальтон, 20 мкг/мл в неполном ЗФР, 100 мкл/лунку, 30 минут, комнатная температура), дважды промывают неполным ЗФР (200 мкл/лунку) и инкубируют в течение ночи при 4oС с 50 мкл/лунку суспензии SKBR5 клеток в среде В (4 х 106 клеток/мл). После удаления супернатанта клетки фиксируют глутаровым альдегидом (0,1%-й в физиологическом растворе) в количестве 50 мкл/лунку в течение 5 минут при комнатной температуре, супернатанты удаляют, клетки ресуспендируют в 200 мкл/лунку смеси неполного ЗФР/1% БСА/0,1% NaN и выдерживают в течение 1 часа при комнатной температуре. Супернатанты удаляют и планшеты дважды промывают 200 мкл/лунку ЗФР, содержащего 0,05% Твин-20.
Супернатанты гибридомы, обработанные 1 мкг/мл мышиного IgG, преинкубируют с 10-кратным избытком неспецифического мышиного IgG в течение 30 минут при 37oС. Затем эти образцы преинкубируют с 0,5 мкг/мл ВR55-2/муринового IgG2a в течение 30 минут при 37oС. 100 мкл этой смеси добавляют к клеткам и планшеты инкубируют в течение 1 часа при 37oС.
Методика приготовления смеси: несвязанное антитело промывают дважды 100 мкл/лунку охлажденного на льду ЗФР, содержащего 0,05% Твин-20. Добавляют аликвоты по 100 мкл антитела, конъюгированного с пероксидазой (конъюгат кроличий антимышиный IgС2а/пероксидаза типа реагентов Zymed, 1:1000 в неполном ЗФР/2% ФТС). После инкубирования в течение 45 минут при 37oС лунки трижды промывают раствором ЗФР/Твин-20, описанным ранее, а затем в каждую лунку добавляют по 100 мкл субстратного раствора. Спустя 5 минут развитие окраски останавливают добавлением 50 мкл/лунку 4N H2SO4. Связывание антитела с клетками определяют путем измерения экстинции при 492 нм (эталонное измерение 620 нм).
Пример 5. Иммуноаффинная очистка анти-id BR55-2 МАТ.
5.1 Приготовление ВR55-2/муриновый IgG2a Сефарозы.
10 г высушенной замораживанием активированной СН-Сефарозы 4В суспендируют в 1мМ НСl, переносят на шлаковый стеклянный фильтр и промывают 2 л 1мМ НСl в течение 15 минут. Лиганд (120 мг ВR55-2/муринового IgG2a), растворенный в 50 мкл рабочего буфера, смешивают с отмытым гелем в закупоренном сосуде и качают из стороны в сторону в течение часа при комнатной температуре. Гель промывают буфером для пришивания и инкубируют в течение часа с 50 мл 1М этаноламина для связывания всех оставшихся активных групп. Затем аффинный сорбент промывают тремя циклами градиента рН. Каждый цикл состоит из отмывки при рН 4 (0,1М ацетат, 0,5М NaCl) с последующей отмывкой при рН 8 (0,1М Трис, 0,5М NaCl).
5.2 Выделение анти-id BR55-2 MAT.
Хроматографию проводят при +4oC. Колонку (ВIO REX MP колонка с диаметром 1,5 см) заполняют Сефарозой MAT ВR55-2/муриновый IgG2a (объем 35 мл). Гель промывают буфером для связывания и буфером для элюции. После уравновешивания буфером для связывания в колонку вводят кондиционную среду, содержащую анти-id BR55-2, со скоростью протока 15 мл/мин. После элюции прошедшей фракции связанный анти-id BR55-2 десорбируют буфером для элюции и сразу же после десорбции нейтрализуют 1М Трис/HCl буфером рН 7,5.
5.3 Концентрирование анти-id BR55-2 MAT.
Концентрирование элюированного раствора антитела (0,12 мг/мл) проводят в ячейке для ультрафильтрации с перемешиванием производства Ami con с использованием РМ 10 Diaflo мембраны. Выход избыточного раствора для IgG превышает 98%, конечная концентрация IgG составляет 3,7 мг/мл.
Пример 6. Характеристика очищенных анти-id BR55-2 МАТ.
6.1 Ионообменная хроматография на Mono-Q.
Колонка: Mono-Q HR5/5 (Pharmacia)
Буфер А: 20 мМ триэтаноламин, рН 7,7
Буфер В: 20 мМ
триэтаноламин, 1М NaCl, рН 7,7
Скорость
протока: 1 мл/мин
Определение: УФ 280 нм
Градиент: линейный 2%/мин
Результаты: >95% чистоты установлено для всех
анти-id BR55-2 MAT
6.2 Гель-хроматография
высокого разрешения
Колонка: Zorbax GF 250, 9,4 х 250 мм
Буфер: фосфат натрия 0,1М, 0,2 М NaCl, pH 7,0
Скорость протока:
1 мл/мин
Определение: УФ 280 нм
Результаты: >95% чистоты установлено для всех анти-id BR55-2 MAT
6.3 ДДС-ПААГ
Эксперименты проводят как в восстанавливающих,
так и в невосстанавливающих условиях согласно
методу Laemmli с использованием 10%-ных акриламидных гелей. Наличия примесей выявлено не было (результаты представлены на фиг.1).
6.4
Изоэлектрическое фокусирование
Анализ
проводят с использованием Phast-системы (Pharmacia), с градиентом pH 3-9 (Phast гель IEF 3-9) и окрашиванием серебром (результаты представлены на
фиг.2).
Пример 7. Свяэывниие ВR55-2/муринового IgG3 с SKBR5 клеточной линией (клеточный ELISA) - ингибирование очищенными анти-id МАТ.
Проводят предварительную обработку микротитрационных планшетов, как описано в примере 4. Соответствующее анти-id BR55-2 MAT разводят неполным ЗФР, содержащим 2% ФСТ (от 10 до 0,5 мкг/мл). В каждое из этих разведении добавляют 1 мкг/мл ВR55-2/муринового IgG3. 100 мкл этой смеси добавляют к клеткам и планшеты инкубируют в течение 1 часа при 37oС. Смесь обрабатывают, как описано в примере 4. Степень связывания ВR55-2/муринового IgG3 с клетками определяют путем измерения экстинции при 492 нм (эталонное измерение 620 нм).
Пример 8. Иммунизация кроликов и макак-резусов анти-id BR55-2#Е4.
8.1 Иммунизация кроликов анти-id
BR55-2#E4
Трех самок кроликов-шиншилл иммунизируют путем подкожного введения 300 мкг анти-id BR55-2#E4, адсорбированного на
гидроксиде алюминия (1 мг антитела и 3,3 мг Аl(ОН)3/мл
неполного ЗФР) на 1-ые, 8-ые, 15-ые и 36-ые сутки. Трех кроликов иммунизируют таким же количеством неспецифического мышиного-IgG1 в
качестве отрицательного контроля при тех же условиях. Сыворотки
собирали перед иммунизацией и на 9-ой неделе после первой иммунизации.
8.2 Иммунизация макак-резусов анти-id
BR55-2#E4
Трех макак-резусов иммунизируют путем подкожного
введения 0,1 мг анти-id ВR55-2# Е4/кг, адсорбированного на гидроксиде алюминия (1 мг и плюс 3,3 мг Аl(ОН)3/мл неполного
ЗФР) на 1-ые, 8-ые, 15-ые и 36-ые сутки. Двух макак-резусов
иммунизируют таким же количеством неспецифического мышиного IgG1 в качестве отрицательного контроля при тех же условиях. Сыворотки собирают
перед иммунизацией и на 4-ой и 9-ой неделях после первой
иммунизации.
Два года спустя после первичного курса иммунизации эти же обезьяны получают первую подкожную повторную инъекцию анти-id BR55-2#E4 или неспецифического мышиного IgG1 соответственно (то же количество и состав, что и прежде). Сыворотки собирают до, а также на 1-ой и 4-ой неделях после первой реиммунизации.
Три года спустя после первичного курса иммунизации (=один год после первой повторной инъекции) те же самые обезьяны получают вторую повторную подкожную инъекцию анти-id BR55-2#E4 либо неспецифического мышиного IgG1, соответственно (в том же количестве и составе, что и ранее). Сыворотки собирают до, а также на 1-ой, 4-ой и 9-ой неделях после этой второй реиммунизации.
Пример 9. Связывание кроличьего сывороточного иммуноглобулина с SKBR5 либо WM9 клеточной линией (клеточный ELISA).
Проводят предварительную обработку микротитрационных планшетов, как описано в примере 4. Аликвоты по 100 мкл кроличьих сывороток в соответствующих разведениях добавляют к клеткам и инкубируют планшеты в течение 1 часа при 37oС. Связывание антитела с клетками определяют путем измерения экстинции при 492 нм (эталонное измерение 620 нм).
Пример 10. Связывание сывороточного иммуноглобулина макаки-резуса либо очищенного иммуноаффинным методом иммуноглобулина (АВ3) с SKBR5, САТО, SW948, SW2 и WM9 клеточными линиями опухолей человека (клеточный ELISA).
Проводят предварительную обработку микротитрационных планшетов, как описано в примере 4. Аликвоты по 100 мкл сывороток макаки-резуса либо очищенного иммуноаффинным методом иммуноглобулин макаки-резуса (смотри также пример 12) и BR55-5 очеловеченного IgG1 в качестве контроля в соответвующих разведениях добавляют к клеткам и инкубируют планшеты в течение 1 часа при 37oС. Смесь обрабатывают, как описано в примере 4. Связывние антитела с клетками определяют путем измерения экстинции при 492 нм (эталонное измерение 620 нм).
Пример 11. Связывание сывороточного иммуноглобулина макаки-резуса или очищенного иммуноаффинным методом иммуноглобулина (АВ3) с SKBR5- либо WМ9-мембранным образцом опухолевых клеток (ELISA).
Мембраны Lewis Y антиген положительной SKBR5 клеточной линии рака человеческой грудной железы и Lewis Y агтиген отрицательной WM9 меланомной клеточной линии получали согласно описанию [8]. Аликвоты по 100 мкл соответствующих мембранных образцов (10 мкг/мл, разведение в буфере для сенсибилизации) добавляют в лунки микротитрационных планшетов и инкубируют в течение ночи при 4oС. Планшеты промывают 4 раза буфером для промывки, добавляют 200 мкл неполного ЗФР/5% ФСТ и инкубируют в течение 30 минут при 37oС. Планшеты промывают, как и ранее. Аликвоты по 100 мкл сывороток макак-резусов либо очищенного иммуноаффинным методом иммуноглобулина макак-резусов (смотри пример 2) в соответствующих раэведениях в неполном ЗФР/2% ФСТ добавляют в лунки и инкубируют планшеты в течение 60 минут при 37oС. Несвязанное антитело отмывают, как описано ранее, и добавляют аликвоты по 100 мкл антитела, конъюгированного с пероксидазой (конъюгат козий античеловеческий Ig/пероксидаза, например, в виде реагентов Chemicon & Co., 1:1000 в ЗФР/2% ФСТ). После инкубации в течение 30 минут при 37oС планшеты дважды промывают буфером для отмывки и дважды окрашивающим буфером.
Добавляют аликвоты по 100 мкл субстратного раствора, развитие окраски останавливают через 5 минут добавлением аликвот по 50 мкл 4N H2SO4. Оптическую плотность (ОП) измеряют при 492 нм (эталонное измерение 620 нм).
Пример 12. Иммуноаффинная очистка сывороточного иммуноглобулина макак-резусов, иммунизированных анти-id BR55-2#E4 (АВ3), с помощью анти-id BR55-2# E4 Сефарозы.
12.1 Получение анти-id ВR55-2#Е4-Сефарозы
9 г высушенной замораживанием активированной СН-Сефарозы 4В суспендируют в 1мМ НCl, переносят на шлаковый стеклянный
фильтр и промывают 2 л 1мМ НСl в течение 15 минут. Лиганд (95 мг анти-id
BR55-2#E4), растворенный в 50 мл буфера для сшивки, смешивают с промытым гелем в закупоренном сосуде и качают туда и обратно в
течение часа при комнатной температуре. Гель промывают буфером для сшивки
и инкубируют в течение часа с 50 мл 1мМ этаноламина для нейтрализации всех оставшихся активных групп. Затем аффинный сорбент
промывают тремя циклами градиента рН. Каждый цикл состоит из промывки при
рН 4 (0,1 М ацетат, 0,5 М NaCl ) и последующей промывки при рН 8 (0,1 М Трис, 0,5 М NaCl).
12.2 Выделение сывороточного иммуноглобулина макак-резусов (АВ3), иммунизированных анти-id BR55-2#E4.
Хроматографию проводят при 4oС. Колонку (Pharmacia колонка HR5/2, основные размеры 5 х 25 мм) заполняют анти-id ВR55-2#Е4-Сефарозой (объем 0,5 мл). Гель промывают буфером для связывания и буфером для элюции. Стартовым веществом является 2 мл сыворотки макаки-резуса, иммунизированной ати-id BR55-2# E4, полученной 9 недель спустя после начала иммунизации. Для других серий экспериментов используют 2 мл пула сывороток макаки-резуса, иммунизированной анти-id BR55-2# E4, полученных спустя 4 и 9 недель после второй реиммунизации. Соответствующие сыворотки разводят 1:2 буфером для связывания и вводят в колонку. После элюции прошедшей фракции связанный иммуноглобулин макаки-резуса десорбируют буфером для элюции и сразу же после десорбции нейтрализуют 1М Трис/HCl буфером рН 7,5.
Пример 13. Связывание сывороточного иммуноглобулина или очищенного иммуноаффинным методом иммуноглобулина макак-резусов, иммунизированных анти-id Вг55-2#Е4, либо неспецифическим мышиным IgG1, с анти-id BR55-2#E4 (ELISA).
Аликвоты по 100 мкл анти-id BR55-2#E4 (10 мкг/мл, разведение в рабочем буфере) вносят в лунки микротитрационных планшетов и инкубируют при 37oС в течение 60 минут. Планшеты промывают 6 раз буфером для промывки, добавляют 200 мкл неполного ЗФР/5% ФСТ и инкубируют в течение 30 минут при 37oС. Планшеты промывают, как описано выше. Сыворотки обезьян либо очищенный иммуноаффинным методом обезьяний иммуноглобулин разводят в неполном ЗФР/2% ФТС. Аликвоты по 100 мкл этих образцов вносят в лунки микротитрационных планшетов и инкубируют в течение 60 минут при 37oС. Несвязанное антитело отмывают, как описано выше, и добавляют аликвоты по 100 мкл антитела, конъюгированного с пероксидазой (конъюгат козий античеловеческий Ig/пероксидаза, например, в виде реагентов Chemicon & Co., 1:1000 в ЗФР/2% ФТС). После инкубации в течение 30 минут при 37oС планшеты промывают 4 раза буфером для промывки и дважды окрашивающим буфером. Добавляют аликвоты по 100 мкл субстратного раствора и останавливают развитие окраски через пять минут добавлением аликвот по 50 мкл 4N Н SO. Оптическую плотность (ОП) измеряют при 492 нм (эталонное измерение 620 нм).
Пример 14. Антителозависимая клеточная цитотоксичность (АЗКЦ) с использованием человеческих МПК по отношению к SKBR5 клеткам, опосредованная очищенным иммуноаффинным методом обезьяньим иммуноглобулином (АВ3) либо ВR55-2/муриновым IgG3.
В день проведения анализа SKBR5 клетки переносят в свежую среду А и культивируют при 37oС /5% СО2 в колбе для клеточных культур.
51Сr течение клеток-мишеней.
Клетки собирают из культуральной колбы и инкубируют в концентрации 5 х 106 клеток в 800 мкл среды А при 37o С/5% СO2 в течение часа со 100 мкл Na51CrO4. Затем клетки промывают средой А для удаления избытка51Сr, ресуспендируют в свежей среде А и доводят их концентрацию до 2,5•105 клеток/мл.
Выделение МПК.
50 мл гепаринизированной свежей человеческой крови разбавляют 60 мл полного ЗФР, содержащего 0,1% глюкозы. Аликвоты по 15 мл этого раствора наслаивают на поверхность Ficol1-Paque раствора и центрифугируют пробирки при 400 g в течение 30-60 минут. Плазменные супернатанты удаляют, слои МПК собирают и доводят объем до 50 мл полным ЗФР + 0,1% глюкозы. После центрифугирования при 80 g (10 минут) осадок ресуспендируют в 25-30 мл полного ЗФР+0,1% глюкозы, затем повторно центрифугируют (80 g, 10 минут), осадок собирают, суспендируют в среде А, клетки подсчитывают и суспензию разводят средой А до концентрации примерно 2-9 х106 клеток/мл. Аликвоты по 100 мкл с помощью пипетки вносят в каждую из лунок микротитрационного планшета и инкубируют эффекторные клетки в течение ночи при 37oС/5% СO2.
АЗКЦ:
100 мкл51Сr-меченых
клеток-мишеней добавляют к предварительно
инкубировавшимся эффекторным клеткам в нужном соотношении эффекторных клеток и клеток-мишеней. Добавляют 50 мкл очищенного иммуноаффинным методом обезьяннего
иммуноглобулина (АВ3) либо
ВR55-2/муринового IgG3, разведенных до желаемых концентраций неполным ЗФР, и планшет инкубируют в течение ночи (около 18 часов) при 37oС/5% СO2. Затем
супернатанты собирают с
помощью Skatron-Harvesting Press и подсчитывают в гамма-счетчике. Это дает значение экспериментального высвобождения. Общее51Cr высвобождение определяют, как и
ранее, путем замены МПК 100
мкл 2% ДДС, 50мМ Na2CO3 и 10мМ ЭДТА, а также путем замены раствора антитела 50 мкл неполного ЗФР. Значение спонтанного высвобождения51Cr
получают путем замены МПК на
100 мкл среды А и раствора антигена на 50 мкл неполного ЗФР.
После проведения подсчетов результаты обрабатывают следующим образом:

Пример 15. Связывание сывороток макак-резусов, очищенного иммуноаффинным методом иммуноглобулина макак-резусов или ВR55-2/муринового IgG3 с ВИЧ-инфицированными/неинфицированными PALL-клетками (непрямая иммунофлуоресценция, IFA-Ant-i-HIV1-Kit Waldheim).
В коммерческих вариантах набора для иммунофлуоресцентного анализа (Waldheim & Со, предназначен для определения ВИЧ серо-позитивности) ВИЧ-инфицированные и неинфицированные PALL-клетки (человеческая Т-клеточная линия) фиксируются на предметных стеклах. Методика эксперимента базируется главным образом на рекомендациях изготовителя. После инкубации с 1% БСА в течение 30 минут при 37oС предметные стекла инкубируют с сыворотками макак-резусов (концентрированными и разведенными неполным ЗФР в соотношении 1:10) либо очищенным иммуноаффинным методом иммуноглобулином макак-резусов (АВ3), разведенным нормальной человеческой сывороткой, либо ВR55-2/муриновым IgG3, в течение 1 часа при 37oС. ВИЧ-положительная человеческая сыворотка (являющаяся частью набора для тестирования) служит положительным контролем, нормальная человеческая сыворотка - отрицательным контролем. Несвязанные детерминанты тестируемых образцов вымывают трижды неполным ЗФР и добавляют разведение 1:20 античеловеческогo-IgG-ФИТЦ реагента (входит в набор для тестирования) в неполном ЗФР, содержащем 2% ФТС либо антимуринового-IgG-ФИТЦ (для выявления муринового MAT). После инкубации в течение 30 минут при 37oС, трехкратной промывки неполным ЗФР и заливки предметные стекла изучают под флуоресцентным микроскопом, определяя величины флуоресценции и регистрируя их (0=отсутствие флуоресценции, 5=максимальная флуоресценция).
Пример 16. ELISA для определения иммунореактивного ВR55-2/муринового IgG3 либо ВR55-2/муринового IgG2a в человеческой сыворотке с помощью анти-id BR55-2#E4.
Аликвоты по 100 мкл анти-id BR55-2#E4 (10 мкг/мл, разведение буфером для сенсибилизации) вносят в лунки микротитрационных планшетов и инкубируют при 37o С в течение 60 минут.
Планшеты промывают 6 раз буфером для промывки, добавляют 200 мкл неполного ЗФР/5% ФТС и инкубируют в течение 30 минут при 37oС. Планшеты промывают, как описано выше. Человеческие сыворотки, содержащие ВR55-2/муриновый IgG3 либо ВR55-2/муриновый IgG2a, тестируют в соответствующих разведениях в неполном ЗФР/2% ФСТ. Аликвоты по 100 мкл этих образцов вносят в лунки микротитрационных планшетов и инкубируют в течение 60 минут при 37oС. В качестве стандарта предварительно разводят ВR55-2/муриновый IgG3 или ВR55-2/муриновый IgG2a в нормальной человеческой сыворотке в концентрации 10 мкг/мл. Соответствующие разведения в неполном ЗФР/2% ФСТ обрабатывают, как и ранее. Несвязанное антитело отмывают, как описано выше, и добавляют аликвоты по 100 мкл антитела, конъюгированного с пероксидазой (конъюгат кроличий-антимышиный IgG3/пероксидаза или кроличий-антимышиный IgG2а/пероксидаза, например, в виде реагентов Zymed, 1:1000 в ЗФР/2% ФСТ). После инкубации в течение 30 минут при 37oС планшеты промывают 4 раза буфером для промывки и дважды - окрашивающим буфером.
Добавляют аликвоты по 100 мкл субстратного раствора и через 5 минут останавливают развитие окраски добавлением аликвот по 50 мкл 4N H2SO4. Оптическую плотность (ОП) измеряют при 492 нм (эталонное измерение 620 нм).
Значения ОП образцов сыворотки откладываются на стандартной кривой и выражаются в мкг/мл.
Пример 17. ELISA для определения иммунореактивного BR55-2/xимерного человеческого IgG1 в человеческой сыворотке с помощью анти-id BR55-2#E4.
Человеческие сыворотки, содержащие ВR55-2/химерный человеческий IgG1, тестируют, как описано в примере 16, с помощью конъюгированного с пероксидазой антитела (конъюгат козий-античеловеческий IgG/пероксидаза, например, в виде реагентов Chemicon & Co., 1:1000 в ЗФР/2% ФТС).
Пример 18. ELISA для определения иммунореактивности ВR55-2/химерного человеческого IgG3 в человеческой сыворотке с помощью анти-id BR55-2#E4.
Человеческие сыворотки, содержащие ВR55-2/химерный человеческий IgG3, тестируют, как описано в примере 17.
Пример 19. Единовременный анализ биоспецифического взаимодействия ВR55-2/химерного человеческого IgG1 и ВR55-2/очеловеченного IgG1 с анти-id BR55-2 МАТ.
Эксперименты проводили на системе BIA coreTM производства Pharmacia Biosensor AB, Uppsala, Sweden. Связывание ВR55-2/химерного человеческого IgG1 или ВR55-2/очеловеченного IgG1 с различными муриновыми IgG1 анти-id BR55-2 MAT, пришитыми к иммобилизованному KAM-IgG1 (например, в виде реагентов производства Pharmacia Biosensor AB, Uppsala, Sweden) определяют путем проведения единовременного анализа биоспецифического взаимодействия.
Скорость протока системы устанавливают на значении 5 мкл/мин. Сенсорный датчик активируют смесью 0,201 мг NHS и 1,313 мг ЭДК, растворенных в 35 мкл дистилированной воды. KAM-IgG1, растворенный в 35 мкл 10 мМ натрий-ацетатного буфера рН 5,0 в концентрации 30 мкг/мл, взаимодействует с активированной поверхностью сенсора. Оставшиеся свободными активированные сайты блокируют путем добавления 35 мкл 1 М гидрохлорида этано-ламина/NaOH, рН 8, 5.
Анализ проводят в 3
этапа:
1) Соответствующие анти-id BR55-2 MAT (Е4, С11, В3, В9, G6, G9) разводят средой Н до конечной концентрации 10-17 мкг/мл. Для каждого анализа
антиидиотипическое антитело связывают с
KAM-IgG1 путем пропускания 35 мкл этого раствора над поверхностью сенсора. "Единицы отклика", пропорциональные массе связавшегося MAT, регистрируют и
фиксируют.
2) Затем вводят 20 мкл разведении мышь/человек химерного IgG1 и очеловеченного IgG1 в среде Н в концентрациях от 1 до 100 мкг/мл и осуществляют связывание с пришитым анти-id. "Единицы отклика", пропорциональные массе связавшегося MAT, регистрируют и фиксируют.
3) Поверхность сенсора затем регенерируют для проведения следующих анализов путем последовательнного впрыскивания 5 мкл 1 М муравьиной кислоты и 5 мкл 8 М мочевины.
Скорость связывания определяют путем вычисления соотношения максимума "Единиц отклика", полученных для второго антитела (ВR55-2/химерный человеческий IgG1 либо ВR55-2/очеловеченный IgG1), и максимума "единиц отклика", полученных для первого антитела (соответствующее антиидиотипическое MAT).
Пример 20. ELISA для определения иммунореактивного ВR55-2/очеловеченного IgG1 в человеческой сыворотке с помощью анти-id BR55-2#E4.
Человеческие сыворотки, содержащие ВR55-2(очеловеченный IgG1), тестируют, как описано в примере 17.
Пример 21. Конкуренция связывания ВR55-2/муринового IgG3 с анти-id BR55-2# E4 со стороны ВR55-2/химерного человеческого IgG1 или ВR55-2/химерного человеческого IgG3.
Аликвоты по 100 мкл анти-id BR55-2#E4 (10 мкг/мл, разведение в буфере для сенсибилизации) вносят в лунки микротитрационных планшетов и инкубируют при 37oС в течение 60 минут.
Планшеты промывают 6 раз буфером для промывки, добавляют 200 мкл неполного ЗФР/5% ФТС и инкубируют в течение 30 минут при 37oС. Планшеты промывают, как описано ранее. Химерный человеческий IgG1 или химерный человеческий IgG3 разводят в неполном ЗФР/2% ФТС (0,5 мкг/мл - 3 нг/мл). К каждому разведению добавляют 0,05 мкг/мл ВR55-2/муринового IgG3. Аликвоты по 100 мкл этой смеси вносят в лунки микротитрационных планшетов и инкубируют в течение 60 минут при 37oС. Несвязанное антитело отмывают, как описано ранее, и добавляют аликвоты по 100 мкл конъюгированного с пероксидазой антитела (конъюгат козий-античеловеческий IgG/пероксидаза, например, в виде реагентов производства Chemicon Co, 1:1000 в ЗФР/2% ФТС).
После инкубации в течение 30 минут при 37oС планшеты промывают 4 раза буфером для промывки и дважды - окрашивающим буфером.
Добавляют аликвоты по 100 мкл субстратного раствора и через 5 минут останавливают развитие окраски добавлением аликвот по 50 мкл 4 N H2SO4. Оптическую плотность (ОП) измеряют при 492 нм (эталонное измерение 620 нм).
Пример 22. Комплементзависимая цитотоксичность (КЗЦ) по отношению к SKBR5 клеточной линии, опосредованная ВR55-2/муриновым IgG3 - Ингибирование анти-id BR55-2#E4.
В день, предшествующий анализу, SKBR5 клетки переносят в свежую среду А и культивируют при 37oС/5% CO2 в колбе для клеточных культур.
51Cr мечение клеток-мишеней:
Клетки собирают из культуральной колбы и инкубируют в концентрации 5 х 106 клеток в 800 мкл среды А при 37oС/5% CO2 в течение 1 часа со 100 мкл Na251CrO4. Затем клетки промывают средой А для удаления избытка51Сr, ресуспендируют в
свежей среде А и доводят их концентрацию до 2,5•105 клеток/мл.
КЗЦ:
Аликвоты по 100 мкл этой клеточной суспензии пипеткой вносят в лунки микротитрационного
планшета. Добавляют аликвоты по 50 мкл анти-id BR55-2#E4, разведенного до
необходимых концентраций в неполном ЗФР. Затем вносят в лунки аликвоты по 100 мкл человеческой сыворотки, содержащей 2 мкг/мл
BR55-2/IgG3, и клетки инкубируют в течение ночи при 37oС/5%
CO2. Супернатанты собирают с помощью Skatron-Harvesting Press и подсчитывают в гамма-счетчике. Это дает значение
экспериментального высвобождения.
Для определения общего51Cr высвобождения клетки обрабатывают, как и ранее, заменяя человеческую сыворотку раствором, состоящим из 2% ДДС, 50 мМ Nа2СО3, 10 мМ ЭДТА, а раствор анти-id BR55-2#E4 - 50 мкл неполного ЗФР. Значение спонтанного51Cr высвобождения получают путем замены человеческой сыворотки средой А, а раствора анти-id BR55-2#E4 - 50 мкл неполного ЗФР.
После подсчета результат получают по следующей формуле:

Пример 23. Иммуноаффинная очистка ВR55-2/химерного человеческого IgG1 с помощью анти-id ВR55-2#Е4-Сефарозы.
23.1
Приготовление анти-id ВR55-2#Е4-Сефарозы
9 г высушенной замораживанием активированной
СН-Сефарозы 4В суспендируют в 1 мМ НСl, переносят на стеклянный шлаковый фильтр и промывают 2 л 1 мМ НСl
в течение 15 минут. Лиганд (95 мг анти-id BR55-2#E4), растворенный в 50 мл буфера для
пришивания, смешивают с отмытым гелем в закупоренном сосуде и перемешивают путем качания в разные стороны в
течение 1 часа при комнатной температуре. Гель промывают буфером для пришивания и инкубируют
в течение 1 часа с 50 мл 1 М этаноламина для связывания всех оставшихся активных групп. Затем аффинный
сорбент промывают тремя циклами градиента рН. Каждый цикл состоит из промывки с рН 4 (0,1 М
ацетат, 0,5 М NaCl) и последующей промывки с рН 8 (0,1 М Трис, 0,5 М NaCl).
23.2 Выделение
ВR55-2/химерного человеческого IgG1
Хроматографию проводят при 4oС.
Колонку (BIO REX MP колонка с диаметром 1,5 см) заполняют анти-id ВR55-2#Е4-Сефарозой (объем 35 мл). Гель
промывают буфером для связывания и буфером для элюции. Стартовым веществом является 1 л
ВR55-2/химерного человеческого IgG1 кондиционной среды. После концентрирования 5: 1 с помощью Amicon DC2
концентрирующей системы, снабженной картриджем из полых волокон Р10, концентрат вводят в
колонку. После элюирования прошедшей фракции связанный ВR55-2/химерный человеческий IgG1 десорбируют буфером
для элюции и сразу же после окончания десорбции нейтрализуют 1 М Трис/HCl буфером рН 7,
5.
23.3 Концентрирование ВR55-2/химерного человеческого IgG1
Концентрирование
элюированного раствора антитела проводят в Amicon ячейке для ультрафильтрации с перемешивающим
устройством, снабженной РМ10 Diaflo мембраной. Степень концентрирования для IgG превышает 98%, конечная
концентрация IgG составляет 3,36 мг/мл.
23.4 Характеристика очищенного ВR55-2/химерного человеческого IgG1.
23.4.1 Ионообменная хроматография на Mono-Q
Колонка: Mono-Q HR5/5 (Pharmacia)
Буфер А: 20 MM TEA, pH 7,7
Буфер В: 20 мМ
TEA, 1 мМ NaCl, pH 7,7
Скорость протока: 1 мл/мин
Обнаружение: УФ 280 нм
Градиент: линейный 2%/мин
Результат: >98% чистоты
23.4.2 Гель-хроматография
высокого разрешения
Колонка: Zorbax GF 250, 9,4 х 250 мм
Буфер: Фосфат натрия 0,
1 М, 0,2 М NaCl,
pH 7,0
Скорость протока: 1 мл/мин
Обнаружение: УФ 280
нм
Результат: >95% чистоты
23.4.3 ДДС-ПААГ
Эксперименты проводят в
восстанавливающих условиях по методу Laemmli с использованием 10%-ных акриламидных гелей
(результаты представлены на фиг. 10).
Исходный материал
Муриновые моноклональные
антитела BR55-2, пригодные для получения гибридом BR55.2 (BR55-2/IgG3) и, соответственно,
BR55.2S2a (BR55-2/IgG2a).
Эти гибридомы были первоначально депонированы 17 февраля 1987 года и, соответственно, 10 марта 1987 года в American Type Culture Collection, Rockville, MD 20852, USA, при содействии Budapest Treaty, под депозитными номерами АТСС НВ 9324 и, соответственно, АТСС НВ 9347.
ЛИТЕРАТУРА
1. Niels Jerne, Ann. Immunol.125С,373, 1974.
2. Wistar EP 285 059.
3. M.Blaszcyk-Thurin et al., J. Biol. Chem.
262(1987)372-379/
4. Z.Steplewski et al., Hibridoma 9(1990)201-210.
5. WO 92/03165.
6. ЕРА 528.767.
7. J.Carlsson et al., Biochem. J. 173, 723, (1978).
8. Thorn D. et al., Biochem J.168,187-194, (1977).
Реферат
Изобретение относится к области иммунологии и может быть использовано в медицине. Изобретение касается моноклонального мышиного антиидиотипического антитела BR55-2 Ab2, которое является заменителем антигена Lewis Y6. Антитело получают с помощью гибридомной технологии с использованием конъюгата фрагмента F(ab')2 JgG63 BR55-2 мыши в качестве антигена. Полученное антиидиотипическое антитело используют для профилактической или терапевтической иммунизации против болезней, сопровождающихся экспрессией Lewis Y6 - антигена, а также в лечебно-профилактическом фармацевтическом составе. Полученное антиидиотипическое антитело используют также для количественного определения моноклонального антитела со специфичностью связывания BR55-2 и для одноступенчатой иммуноаффинной очистки варианта BR55-2 антитела. Использование изобретения обеспечивает профилактику ВИЧ-инфекций, рака эпителиального происхождения и рака мелких клеток легких, а также их лечение. 6 с. и 4 з.п. ф-лы, 39 ил., 4 табл.

Комментарии