Гуманизированные антитела к liv-1 и их применение для лечения рака - RU2608646C2
Код документа: RU2608646C2
Чертежи






































































































Описание
Настоящая заявка является непредварительной и испрашивает приоритет по 61/420,291, поданной 6 декабря 2010, и 61/446,990, поданной 25 февраля 2011, каждая включена посредством отсылки во всей их полноте для всех целей.
УРОВЕНЬ ТЕХНИКИ
LIV-1 является членом подсемейства LZT (Транспортеры Цинка LIV-1-ZIP) белков-транспортеров цинка. Taylor et al., Biochim. Biophys. Acta 1611: 16-30 (2003). Компьютерный анализ белка LIV-1 показывает возможный мотив металлопротеазы, соответствующий консенсусной последовательности для каталитического цинк-связывающего сайта мотива металлопротеазы цинка. мРНК LIV-1 первично экспрессируется в молочной железе, предстательной железе, питуитарной железе и ткани головного мозга.
Белок LIV-1 также связан с определенными раковыми состояниями, напр., раком молочной железы и раком предстательной железы. Обнаружение LIV-1 связано с раком молочной железы, положительным по отношению к рецептору эстрогена, McClelland et al., Br. J. Cancer 77: 1653-1656 (1998), и метастатическим распространением этих видов рака в регионарные лимфатические узлы. Manninget al., Eur. J. Cancer 30A: 675-678 (1994).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Изобретение обеспечивает гуманизированное антитело, содержащее зрелый вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 53, при условии, что положение Н27 занято L, положение Н29 занято I, H30 - Е и Н94 - V, и зрелый вариабельный участок легкой цепи, по меньшей мере на 90% идентичный SEQ ID NO: 60, при условии, что положение L36 занято Y и положение L46 - Р. Необязательно, гуманизированное антитело содержит три CDR из SEQ ID NO: 53 и три CDR из SEQ ID NO: 60. Те CDR показаны на Фигуре 16. Необязательно, положение Н76 занято N. Необязательно, гуманизированное содержит зрелый вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, по меньшей мере на 95% идентичную SEQ ID NO: 53, и зрелый вариабельный участок легкой цепи, по меньшей мере на 95% идентичный SEQ ID NO: 60. Необязательно, зрелый вариабельный участок тяжелой цепи слит с константным участком тяжелой цепи, и зрелый константный участок легкой цепи слит с константным участком легкой цепи. Необязательно, константный участок тяжелой цепи представляет собой мутантную форму природного константного участка человека, который имеет пониженное связывание с рецептором Fcgamma по сравнению с природным константным участком человека. Необязательно, константный участок тяжелой цепи представляет собой изотип IgG1. Необязательно, константный участок тяжелой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 44, и константный участок легкой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 42. Необязательно, константный участок тяжелой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 46 (S239C), и константный участок легкой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 42. В некоторых таких гуманизированных антителах любые различия в CDR зрелого вариабельного участка тяжелой цепи и зрелого вариабельного участка легкой цепи из SEQ ID NO 52 и 60 соответственно находятся в положениях Н60-Н65. В некоторых таких гуманизированных антителах зрелый вариабельный участок тяжелой цепи имеет аминокислотную последовательность, определенную SEQ ID NO: 52 или 53, и зрелый вариабельный участок легкой цепи имеет аминокислотную последовательность, определенную SEQ ID NO: 59 или 60. В некоторых таких гуманизированных антителах зрелый вариабельный участок тяжелой цепи имеет аминокислотную последовательность, определенную SEQ ID NO: 53, и зрелый вариабельный участок легкой цепи имеет аминокислотную последовательность, определенную SEQ ID NO: 60. Некоторые такие гуманизированные антитела конъюгированы с цитотоксическим или цитостатическим агентом. Некоторые такие гуманизированные антитела имеют константы ассоциации для LIV-1 человека или яванского макака от 0,5 до 2×109 М-1.
Изобретение также обеспечивает гуманизированное антитело, содержащее зрелый вариабельный участок тяжелой цепи, содержащий три Kabat CDR из SEQ ID NO: 52, где положение Н27 занято L, положение Н29 занято I, Н30 - Е, Н76 - N и Н94 - V, и зрелый вариабельный участок легкой цепи, содержащий три Kabat CDR из SEQ ID NO: 60, при условии, что положение L36 занято Y, и положение L46 - Р.
Изобретение также обеспечивает нуклеиновую кислоту, кодирующую зрелый вариабельный участок тяжелой цепи и/или зрелый вариабельный участок легкой цепи любого из определенных выше гуманизированных антител.
Изобретение дополнительно обеспечивает способ лечения пациента, имеющего рак или подверженного риску рака, включающий введение пациенту эффективного режима любого из определенных выше гуманизированных антител. Рак может быть, например, раком молочной железы, раком шейки матки, меланомой или раком предстательной железы.
Изобретение дополнительно обеспечивает фармацевтическую композицию, содержащую гуманизированное антитело, как определено выше.
Изобретение дополнительно обеспечивает способы лечения субъекта, страдающего меланомой, которая экспрессирует белок LIV-1, путем введения субъекту LIV-1-специфичного антитела или конъюгата антитела LIV-1 и лекарственного средства в количестве, достаточном для ингибирования роста раковых клеток меланомы.
Изобретение дополнительно обеспечивает способы лечения субъекта, страдающего раком шейки матки, который экспрессирует белок LIV-1, путем введения субъекту LIV-1-специфичного антитела или конъюгата антитела LIV-1 и лекарственного средства в количестве, достаточном для ингибирования роста раковых клеток шейки матки.
Изобретение также обеспечивает гуманизированное антитело, содержащее зрелый вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, по меньшей мере на 90% идентичную НВ (SEQ ID NO: 10), и зрелый вариабельный участок легкой цепи, по меньшей мере на 90% идентичный LB (SEQ ID NO: 5). Необязательно, антитело содержит зрелый вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, по меньшей мере на 95% идентичную НВ, и зрелый вариабельный участок, по меньшей мере на 95% идентичный LB. Необязательно, в любом таком антителе положения Н29, Н30 и Н76 заняты I, E и N, и L36 занято Y. Необязательно, любое различие в каркасах вариабельных участков зрелого вариабельного участка тяжелой цепи и SEQ ID NO: 10 выбрано из группы, состоящей из Н27, занятого F, H28, занятого N, H48, занятого I, Н66, занятого К, Н67, занятого А, Н71, занятого А, Н76, занятого N, H93, занятого N, H94, занятого V, L37, занятого L, L39, занятого К, L45, занятого К, и L46, занятого L. Необязательно, три CDR зрелого вариабельного участка тяжелой цепи представляют собой SEQ ID NO. 10, и три CDR зрелого вариабельного участка легкой цепи представляют собой SEQ ID NO: 15. CDR показаны на Фиг. 1. Необязательно, зрелый вариабельный участок тяжелой цепи слит с константным участком тяжелой цепи, и зрелый константный участок легкой цепи слит с константным участком легкой цепи. Необязательно, константный участок тяжелой цепи представляет собой мутантную форму природного константного участка человека, который имеет пониженное связывание с рецептором Fcgamma по сравнению с природным константным участком человека. Необязательно, константный участок тяжелой цепи представляет собой изотип IgG1. Необязательно, константный участок тяжелой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 6, и константный участок легкой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 4. Необязательно, константный участок тяжелой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 8 (S239C), и константный участок легкой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 4. Необязательно, любые различия в CDR зрелого вариабельного участка тяжелой цепи и зрелого вариабельного участка легкой из SEQ ID NO 10 и 15 соответственно находятся в положениях Н60-Н65. Необязательно, зрелый вариабельный участок тяжелой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 10, и зрелый вариабельный участок легкой цепи имеет аминокислотную последовательность, содержащую SEQ ID NO: 15. Необязательно, антитело конъюгировано с цитотоксическим или цитостатическим агентом. Предпочтительны гуманизированные антитела, имеющие большую аффинность к LIV-1, чем антитело BR2-14a. В другом варианте осуществления изобретения гуманизированное антитело имеет константу ассоциации для LIV-1 человека или яванского макака, от 0,5 до 2×109 М-1.
Изобретение дополнительно обеспечивает гуманизированное антитело, содержащее зрелый вариабельный участок тяжелой цепи, содержащий 3 CDR из SEQ ID NO: 10, и где положения Н29, Н30 и Н76 заняты I, E и N соответственно, и зрелый вариабельный участок легкой цепи, содержащий три CDR из SEQ ID NO: 15, и где положение L36 занято Y.
Изобретение дополнительно обеспечивает нуклеиновую кислоту, кодирующую зрелый вариабельный участок тяжелой цепи и/или зрелый вариабельный участок легкой цепи любого из гуманизированных антител, определенных выше.
Изобретение дополнительно обеспечивает способ лечения пациента, имеющего рак или подверженного риску рака, включающий введение пациенту эффективного режима любого из гуманизированного антитела, как определено выше. Необязательно, рак представляет собой рак молочной железы, рак шейки матки, меланому или рак предстательной железы.
Изобретение дополнительно обеспечивает фармацевтическую композицию, содержащую гуманизированное антитело, как определено выше.
Изобретение дополнительно обеспечивает способ лечения пациента, имеющего или подверженного риску тройному негативному раку молочной железы, включающий введение пациенту эффективного режима антитела, которое специфично связывается с LIV-1. Необязательно, в таких способах антитело конъюгировано с цитотоксическим или цитостатическим агентом.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фигуре 1 показано выравнивание аминокислотных последовательностей родительского мышиного mAb (называемого BR2-14a) с гуманизированными LIV-1 вариабельных участками тяжелой (две верхние панели) и легкой цепи (две нижние панели).
На Фигуре 2 показаны связывающие кривые для гуманизированных LIV-1 mAb и родительского мышиного антитела (называемого BR2-14a).
На Фигуре 3 показаны результаты исследований конкурентного связывания гуманизированных LIV-1 mAb и родительского мышиного антитела (называемого BR2-14a). Цифры в скобках после каждого варианта обозначают количество обратных мутаций.
На Фигуре 4 показаны результаты исследований насыщенного связывания на клетках MCF7. BR2-14a-AF относится к AF-меченному родительскому мышиному антителу. hLIV-14 относится к AF-меченому антителу HBLB, гуманизированному антителу, которое специфично связывается с LIV-1.
На Фигуре 5 показаны результаты исследований конкурентного связывания на клетках СНО, экспрессирующих рекомбинантный белок LIV-1. BR2-14a относится к родительскому мышиному антителу. hLIV-14 HBLB WT относится к антителу HBLB. hLIV-14 HBLB S239C относится к антителу HBLB, имеющему замещения серина на цистеин в каждом положении в тяжелой цепи.
На Фигуре 6 показан анализ экспрессии белка LIV-1 по IHC на образцах пациентов с пост-гормональным лечением рака молочной железы.
На Фигуре 7 показан анализ экспрессии белка LIV-1 по IHC на образцах пациента с гормонорезистентным метастазирующим раком предстательной железы.
На Фигуре 8 показан анализ экспрессии белка LIV-1 по IHC на образцах пациента с тройным негативным раком молочной железы.
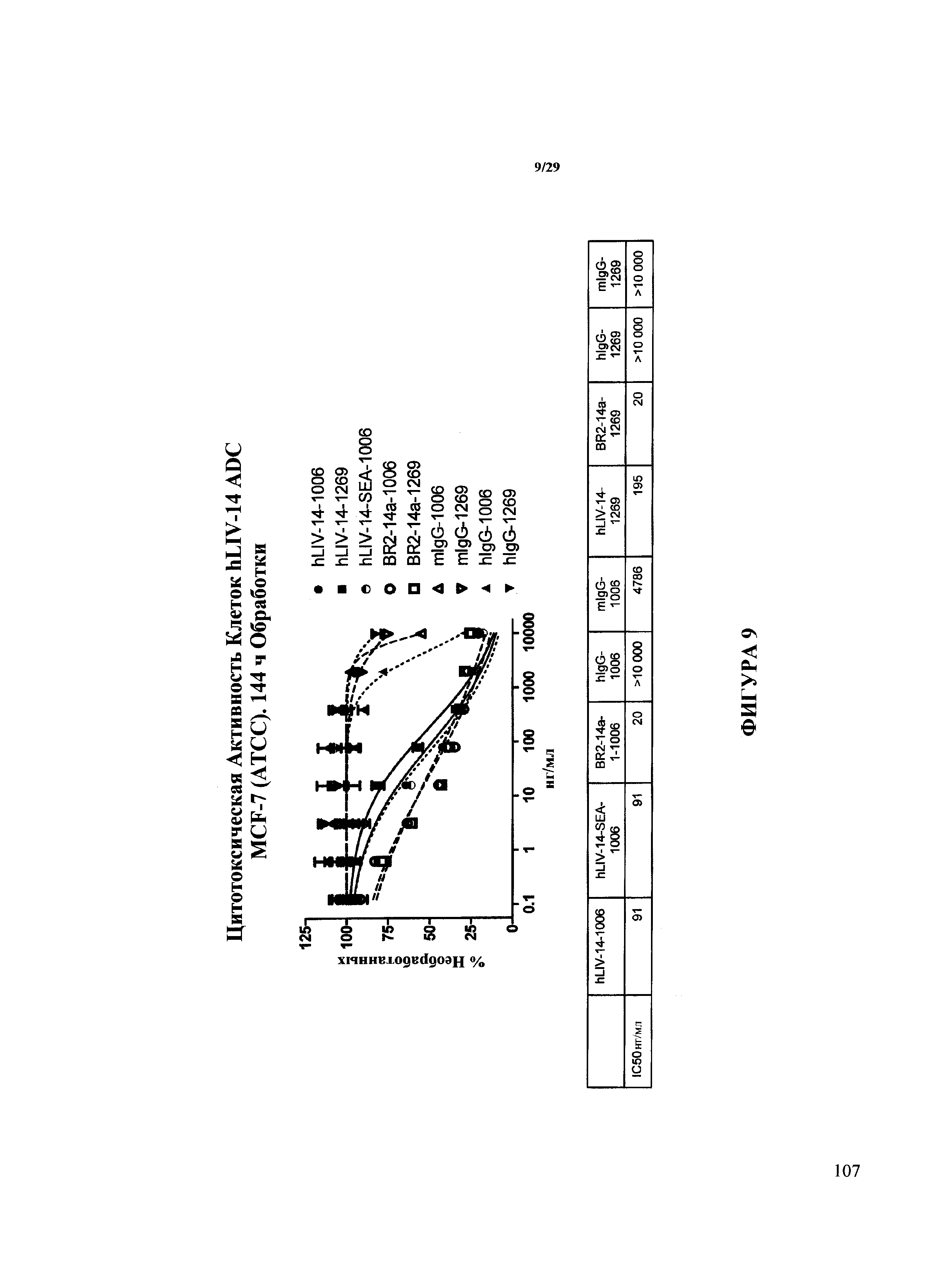
На Фигуре 9 показаны результаты анализов на цитотоксичность на конъюгатах антитела hLIV-14 и лекарственного средства, т.е. mAb HBLB, конъюгированного с vcMMAE (1006) или mcMMAF (1269), а также конъюгатах контрольных мышиного (mIgG) и человеческого (hIgG) антител. hLIV-14-SEA-1006 относится к нефукозилированной форме mAb HBLB, конъюгированного с vcMMAE (1006).
На Фигуре 10 показаны результаты in vitro анализа ADCC на клетках MCF7 с использованием клеток NK человека (донор 1; V/V). hLIV-14 WT относится к HBLB mAb. hLIV-14 SEA относится к нефукозилированной форме HBLB mAb. hLIV-14 mcMMAF относится к конъюгату антитело-лекарственное средство mAb HBLB, конъюгированного с mcMMAF. hLIV vcMMAE-14 относится к конъюгату антитело-лекарственное средство mAb HBLB, конъюгированного с vcMMAE. hLIV-14 SEA vcMMAE относится к нефукозилированной форме конъюгата антитело-лекарственное средство HBLB mAb-vcMMAE.
На Фигуре 11 показаны результаты in vitro анализа ADCC на клетках MCF7 с использованием клеток NK человека (донор 2). hLIV-14 WT относится к HBLB mAb. hLIV-14 SEA относится к нефукозилированной форме HBLB mAb. cLIV-14 SEA относится к нефукозилированной форме химерного родительского мышиного антитела. hLIV-14 mcF (4) относится к конъюгату антитело-лекарственное средство HBLB mAb в среднем с 4 молекулами mcMMAF линкера лекарственного средства на антитело. hLIV-14 vcE (4) относится к конъюгату антитело-лекарственное средство HBLB mAb в среднем с 4 молекулами vcMMAE линкера лекарственного средства на антитело. hLIV-14 vcE (4) SEA относится к нефукозилированной форме конъюгата антитело-лекарственное средство HBLB mAb-vcMMAE, имеющего в среднем четыре молекулы vcMMAE линкера лекарственного средства на антитело. hIgG относится к контрольному IgG человека. H00-mcF (4) относится к контрольному конъюгату антитело-лекарственное средство несвязывающего антитела в среднем с 4 молекулами mcMMAA линкера лекарственного средства на антитело. H00-vcE (4) относится к контрольному конъюгату антитело-лекарственное средство несвязывающего антитела в среднем с 4 молекулами vcMMAE линкера лекарственного средства на антитело.
На Фигуре 12 показаны результаты изучения ксенотранспланта рака молочной железы линии MCF7 у бестимусных мышей. cLIV-14-mcMMAF (4) относится к конъюгату антитело-лекарственное средство химерной формы родительского мышиного антитела, имеющего в среднем 4 молекулы mcMMAF линкера лекарственного средства на антитело. cLIV-14-vcMMAE (4) относится к конъюгату антитело-лекарственное средство химерной формы родительского мышиного антитела, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. H00-mcMMAF (4) относится к конъюгату антитело-лекарственное средство несвязывающего контрольного антитела, имеющему в среднем 4 молекулы mcMMAF линкера лекарственного средства на антитело. Н00-vcMMAE (4) относится к контрольному конъюгату антитело-лекарственное средство несвязывающего антитела в среднем с 4 молекулами vcMMAE линкера лекарственного средства на антитело. Доза и время введения указаны на фигуре.
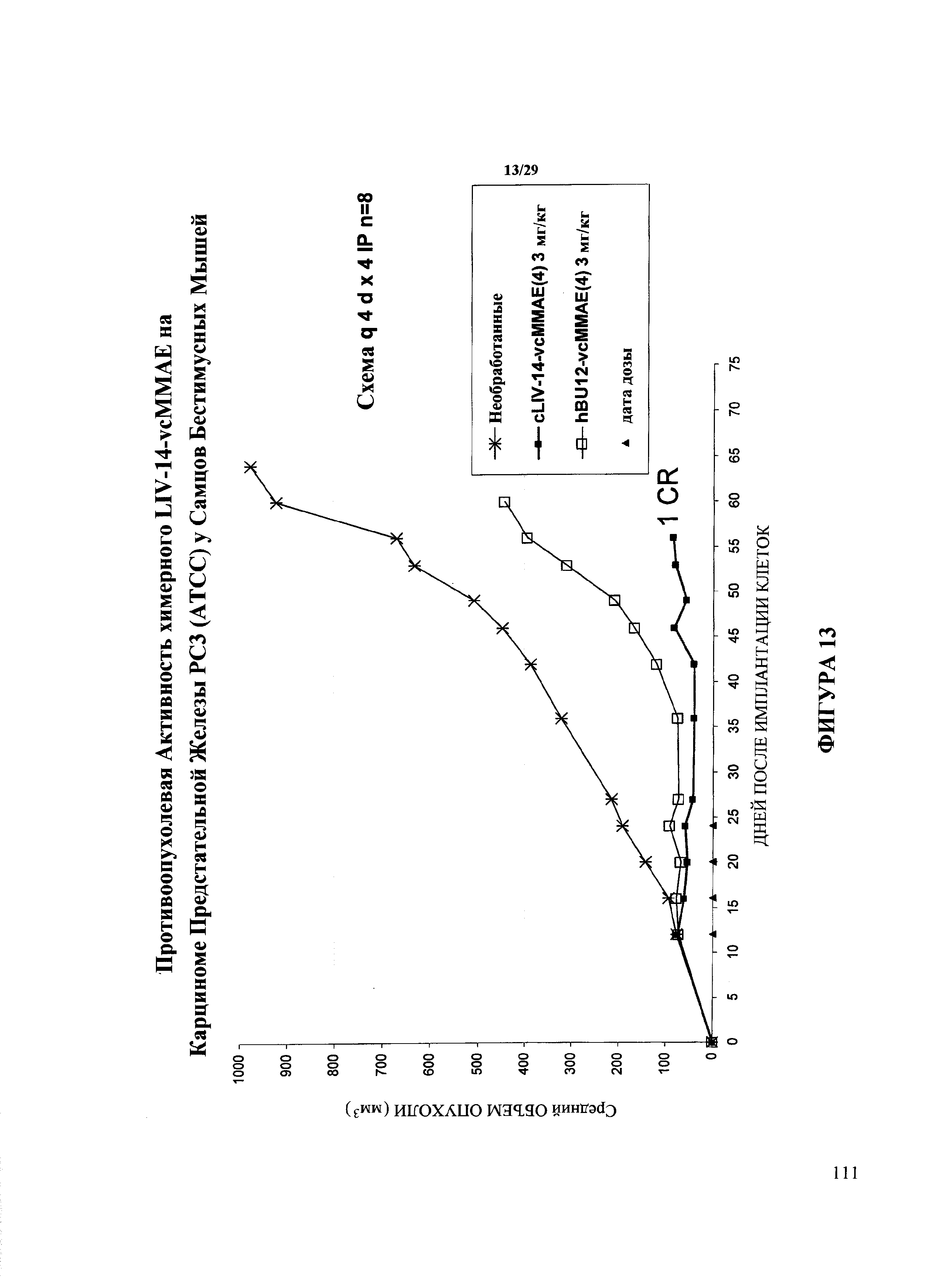
На Фигуре 13 показаны результаты исследования ксенотрансплантата рака предстательной железы линии РС3 у самцов бестимусных мышей. cLIV-14-vcMMAE (4) относится к конъюгату антитело-лекарственное средство химерной формы родительского мышиного антитела, имеющего в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. hBU12-vcMMAE (4) относится к конъюгату антитело-лекарственное средство антитела анти-CD19, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. Доза и время введения указаны на фигуре.
На Фигуре 14 показаны результаты исследования ксенотрансплантата рака молочной железы линии MCF7 у бестимусных мышей. hLIV-14-vcMMAE (4) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. hLIV-14d-vcMMAE (2) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело, причем каждый конъюгирован в положении S239C каждой тяжелой цепи. H00-vcMMAE (4) относится к конъюгату антитело-лекарственное средство несвязывающего контрольного антитела, имеющему в среднем 4 молекулы mcMMAF линкера лекарственного средства на антитело. Доза и время введения указаны на фигуре.
На Фигуре 15 показаны результаты исследования ксенотрансплантата рака предстательной железы линии РС3 у самцов бестимусных мышей. hLIV-14-vcMMAE (4) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. hLIV-14-mcMMAF (4) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 4 молекулы mcMMAF линкера лекарственного средства на антитело. hLIV-14d-vcMMAE (2) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 2 молекулы vcMMAE линкера лекарственного средства на антитело, причем каждый конъюгирован в положении S239C каждой тяжелой цепи. hLIV-14d-mcMMAF (2) относится к конъюгату антитело-лекарственное средство антитела HBLB, имеющему в среднем 2 молекулы mcMMAF линкера лекарственного средства на антитело, причем каждый конъюгирован в положении S239C каждой тяжелой цепи. H00-vcMMAE (4) относится к конъюгату антитело-лекарственное средство несвязывающего контрольного антитела, имеющему в среднем 4 молекулы vcMMAE линкера лекарственного средства на антитело. H00-mcMMAF (4) относится к конъюгату антитело-лекарственное средство несвязывающего контрольного антитела, имеющему в среднем 4 молекулы mcMMAF линкера лекарственного средства на антитело. Доза и время введения указаны на фигуре.
На Фигурах 16А и 16В показаны выравнивания гуманизированной тяжелой цепи (Фигура 16А) и легкой цепи (Фигура 16В) зрелых вариабельных участков с теми же участками мышиного BR2-22a.
На Фигуре 17 показаны анализы конкурентного связывания различных перестановок гуманизированных тяжелых цепей HA-HF и гуманизированных легких цепей LA-LF, полученных из мышиного моноклонального анти LIV-1 антитела BR2-22a. Общее количество мышиных обратных мутаций в каждой легкой или тяжелой цепи показано в скобках. Только HELF показал достаточное удерживание связывания.
На Фигуре 18 показана систематическая вариация цепей НЕ и LF для тестирования вклада отдельных обратных мутаций в связывание антигена. Сайты потенциальной соматической гипермутации указаны в скобках. Мышиные остатки подчеркнуты. Остальные остатки являются остатками зародышевой линии человека.
На Фигуре 19 показано конкурентное связывание вариантов LF в верхней части фигуры. Тестируемые обратные мутации показаны в нижней части фигуры. Мышиные остатки подчеркнуты. Остальные остатки являются остатками зародышевой линии человека.
На Фигуре 20 показано конкурентное связывание вариантов НЕ в верхней части фигуры. Тестируемые обратные мутации показаны в нижней части фигуры. Мышиные остатки подчеркнуты. Остальные остатки являются остатками зародышевой линии человека.
На Фигуре 21 показано конкурентное связывание различных перестановок НЕ, HF, HG, и LF, и LG.
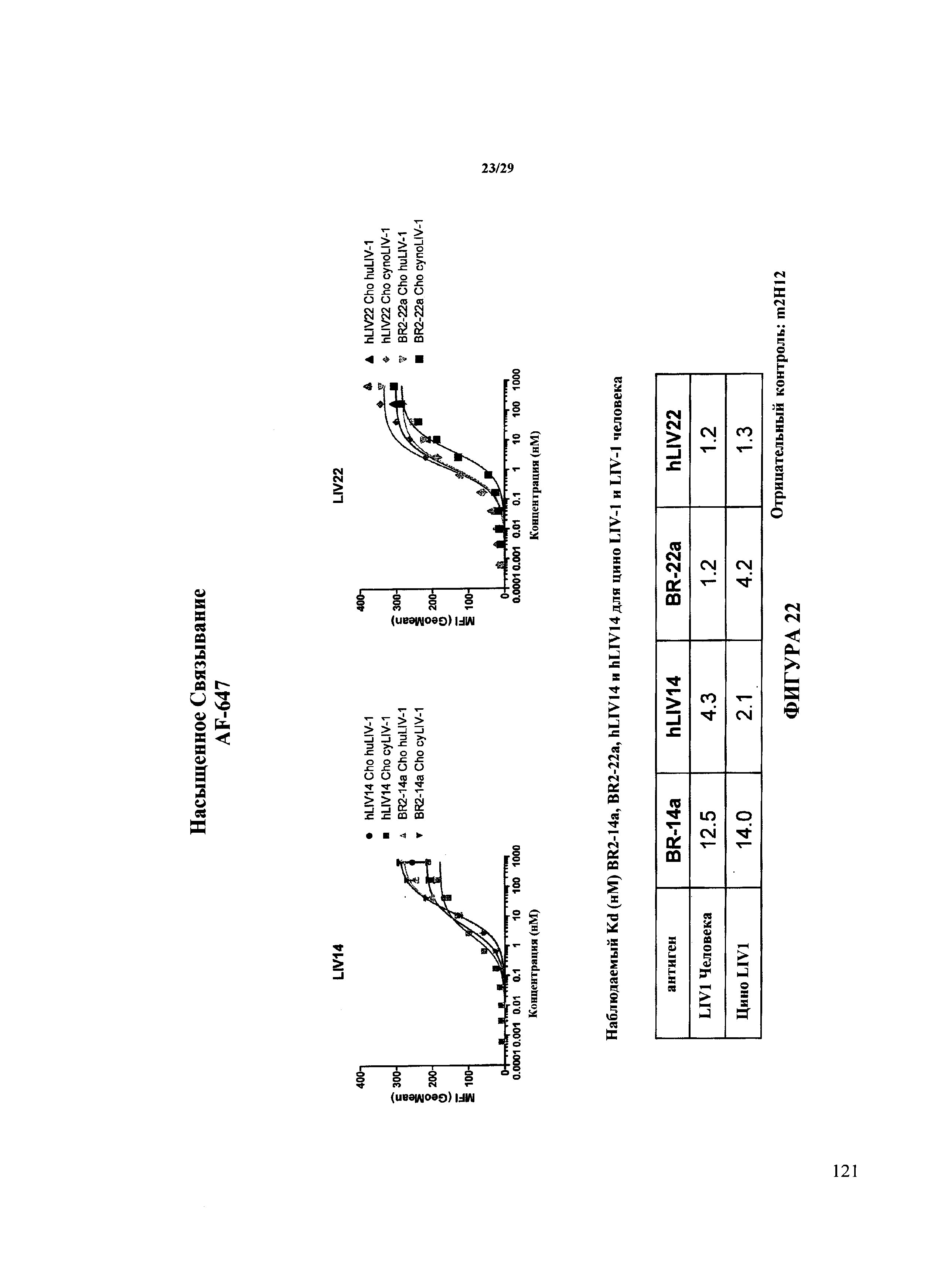
На Фигуре 22 показано насыщенное связывание гуманизированного антитела LIV14 и гуманизированного антитела LIV22 на LIV-1 человека и макака, экспрессированного из клетках СНО.
На Фигуре 23 показана цитотоксическая активность гуманизированного LIV22-vcMMAE на клетках MCF-7 после 144 ч обработки. Н00-1006 представляет собой контрольное конъюгированное с лекарственным средством антитело.
На Фигуре 24 показана цитотоксическая активность hLIV22-mcMMAF на клетках MCF-7 после 144 ч обработки. Н00-1269 представляет собой контрольное конъюгированное с лекарственным средством антитело.
На Фигуре 25 показана активность антитела hLIV22 на РС3 (DSMZ) модели карциномы предстательной железы у бестимусных самок мышей. Дни введения дозы обозначены треугольниками на оси X.
На Фигуре 26 показана активность антитела hLIV22 на MCF7 (NCI) опухолях карциномы молочной железы у бестимусных мышей.
На Фигуре 27 сравнивается активность hLIV22 и hLIV14 в той же модели, что и на Фигуре 26.
На Фигуре 28 показан анализ экспрессии белка LIV-1 посредством IHC на образцах пациента с меланомой.
ОПРЕДЕЛЕНИЯ
Моноклональные антитела, как правило, обеспечиваются в изолированной форме. Это означает, что антитело, как правило, по меньшей мере на 50% масс./масс. очищено от интерферирующих белков и других загрязняющих веществ, что обусловлено его производством или очисткой, но не исключается возможность того, что моноклональное антитело объединяют с избытком фармацевтически приемлемого носителя(ей) или другой среды, способствующей облегчению его применения. Иногда моноклональные антитела по меньшей мере на 60%, 70%, 80%, 90%, 95 или 99% масс./масс. очищены от интерферирующих белков и загрязняющих веществ из производства или очистки.
Специфичное связывание моноклонального антитела с его антигеном-мишенью означает аффинность по меньшей мере 106, 107, 108, 109 или 1010 М-1. Специфичное связывание в большей степени обнаруживают с большей вероятностью и отличают от неспецифичного связывания, возникающего по меньшей мере в одной неродственной мишени. Специфичное связывание может быть результатом образования связей между конкретными функциональными группами или конкретными пространственными состояниями (напр., типа ключа и замка), тогда как неспецифичное связывание обычно является результатом Ван-дер-Ваальсовых сил. Специфичное связывание, однако, не обязательно означает, что моноклональное антитело связывает одну и только одну мишень.
Основной структурной единицей антитела является тетрамер субъединиц. Каждый тетрамер включает две идентичные пары полипептидных цепей, причем каждая пара имеет одну «легкую» (около 25 кДа) и одну «тяжелую» цепь (около 50-70 кДа). Амино-концевая часть каждой цепи включает вариабельный участок примерно от около 100 до 110 или более аминокислот, главным образом отвечающий за распознавание антигена. Этот вариабельный участок первоначально экспрессируется связанным с расщепляемым сигнальным пептидом. Вариабельный участок без сигнального пептида иногда называют зрелым вариабельным участком. Таким образом, например, зрелый вариабельный участок легкой цепи означает вариабельный участок без сигнального пептида легкой цепи. Карбокси-концевая часть каждой цепи определяет константный участок, главным образом отвечающий за эффекторную функцию.
Легкие цепи классифицируются как либо каппа, либо лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, и определяют изотип антитела как IgG, IgM, IgA, IgD и IgE соответственно. В легких и тяжелых цепях, вариабельные и константные участки соединены участком «J» из около 12 или более аминокислот, при этом тяжелая цепь также включает участок «D» из около 10 или более аминокислот. (Смотри в общем, Fundamental Immunology (Paul, W., ed., 2nd ed. Raven Press, N.Y., 1989, Ch. 7, включенную посредством ссылки по всей своей полноте для всех целей).
Зрелые вариабельные участки каждой пары легкой/тяжелой цепи образуют антителосвязывающий сайт. Таким образом, интактное антитело имеет два связывающих сайта. За исключением бифункциональных или биспецифичных антител два связывающих сайта являются одинаковыми. Все цепи имеют одинаковую общую структуру из относительно консервативных каркасных участков (FR), соединенных тремя гипервариабельными участками, также называемыми определяющими комплементарность участками или CDR. CDR из двух цепей каждой пары выровнены по каркасным участкам, позволяя связывание со специфичным эпитопом. От N-конца до С-конца как легкая, так и тяжелая цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Распределение аминокислот к каждому домену осуществляется в соответствии с определениями Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD, 1987 and 1991), or Chothia & Lesk, J. Mol. Biol. 196: 901-917 (1987); Chothia et al., Nature 342: 878-883 (1989). Kabat также обеспечивает широкое применение системы нумерации (нумерация Kabat), в которой соответствующим остаткам между различными тяжелыми цепями или между различными легкими цепями присваивается одинаковый номер.
Термин "антитело" включает интактные антитела и их связывающие фрагменты. Как правило, фрагменты антитела конкурируют с интактным антителом, из которого они были получены, за специфичное связывание мишеней, включая отдельные тяжелые цепи, легкие цепи Fab, Fab', F(ab')2, F(ab)c, диатела, Dabs, нанотела и Fv. Фрагменты могут быть получены с помощью методик рекомбинантной ДНК или путем ферментативного или химического разделения интактных иммуноглобулинов. Термин «антитело» также включает диатело (гомодимерный фрагмент Fv) или минитело (VL-VH-СН3), биспецифичное антитело или подобное. Биспецифичное или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различных пары тяжелой/легкой цепей и два различных связывающих сайта (см., напр., Songsivilai and Lachmann, Clin. Exp. Immunol., 79: 315-321 (1990); Kostelny et al., J. Immunol., 148: 1547-53 (1992)). Термин «антитело» включает антитело само по себе (голое антитело) или антитело, конъюгированное с цитотоксическим или цитостатическим лекарственным средством.
Термин «эпитоп» относится к сайту на антигене, с которым связывается антитело. Эпитоп может быть сформирован из заменимых аминокислот или незаменимых аминокислот, соединенных третичной укладкой одного или более белков. Эпитопы, сформированные из заменимых аминокислот, как правило, сохраняются под воздействием денатурирующих растворителей, тогда как эпитопы, сформированные путем третичной укладки, как правило, разрушаются при обработке денатурирующими растворителями. Эпитоп, как правило, включает по меньшей мере 3 и более обычно по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов включают, например, рентгеноструктурную кристаллографию и 2-мерный ядерный магнитный резонанс. См., напр., Epitope Mapping Protocols, in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996).
Антитела, которые распознают одинаковые или перекрывающиеся эпитопы, могут быть идентифицированы в простом иммунологическом анализе, показывающем способность одного антитела конкурировать в связывании другого антитела с антигеном-мишенью. Эпитоп антитела может быть также определен с помощью рентгеноструктурной кристаллографии антитела, связанного с его антигеном для идентификации контактных остатков. Альтернативно, два антитела имеют одинаковый эпитоп, если все аминокислотные мутации в антигене, который снижает или исключает связывание антитела, снижают или исключают связывание другого. Два антитела имеют перекрывающиеся эпитопы, если некоторые аминокислотные мутации, которые снижают или исключают связывание одного антитела, снижают или исключают связывание другого.
Конкуренция между антителами определяется анализом, в котором антитело при испытании ингибирует специфичное связывание стандартного антитела с обычным антигеном (см., напр., Junghans et al., Cancer Res. 50: 1495, 1990). Тестируемое антитело конкурирует со стандартным антителом, если избыток тестируемого антитела (например, по меньшей мере, 2×, 5×, 10×, 20× или 100×) ингибирует связывание стандартного антитела по меньшей мере на 50%, но предпочтительно на 75%, 90% или 99%, как измерено в анализе конкурентного связывания. Антитела, идентифицированные в конкурентном анализе (конкурирующие антитела), включают антитела, связывающие тот же эпитоп, что и стандартное антитело, и антитела, связывающие смежный эпитоп, достаточно близкий к эпитопу, связанному со стандартным антителом для возникновения стерического затруднения.
Термин "пациент" включает человека и других субъектов млекопитающих, которые получают либо профилактическое, либо терапевтическое лечение.
Для целей классификации аминокислотных заместителей, как консервативных, так и неконсервативных, аминокислоты сгруппированы следующим образом: Группа I (гидрофобные боковые цепи): met, ala, val, leu, ile; Группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; Группа III (кислотные боковые цепи): asp, glu; Группа IV (основные боковые цепи): asn, gln, his, lys, arg; Группа V (остатки, влияющие на ориентацию цепи): gly, pro; и Группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные заместители включают заместители между аминокислотами в одном классе. Неконсервативные заместители составляют замену члена одного их этих классов членом другого.
Процент идентичностей последовательности определяется последовательностью антитела, максимально выровненной по системе нумерации Kabat. После выравнивания если участок антитела субъекта (напр., целый зрелый вариабельный участок тяжелой или легкой цепи) сравнивают с таким же участком стандартного антитела, процент идентичности последовательности между участками антитела субъекта и стандартного антитела равно числу положений, занятых одинаковыми аминокислотами, как в участке антитела субъекта, так и в участке стандартного антитела, деленному на общее число выровненных положений двух участков, не считая гэпов, умноженному на 100 для пересчета в проценты.
Композиции и способы, «содержащие» один или более из перечисленных элементов, могут включать другие элементы, специально не перечисленные. Например, композиция, которая содержит антитело, может содержать антитело отдельно или в комбинации с другими ингредиентами.
Обозначение диапазона значений включает все целые числа в пределах или границах диапазона.
Эффекторной функцией антитела называется функция, содействующая Fc-домену(ам) Ig. Такие функции могут быть, например, антитело-зависимой клеточной цитотоксичностью, антитело-зависимым клеточным фагоцитозом или коплемент-зависимой цитотоксичностью. Такая функция может быть осуществлена путем, например, связывания Fc-эффекторного домена(ов) с Fc-рецептором на иммунной клетке с фагоцитарной или литической активностью или путем связывания Fc-эффекторного домена(ов) с компонентами системы комплементов. Как правило, эффект(ы), опосредованный Fc-связывающами клетками или компонентами комплемента, приводят к ингибированию и/или истощению LIV-1-нацеленной клетки. Fc-участки антител могут вовлекать Fc-рецептор (FcR)-экспрессирующие клетки и соединять их с покрытыми антителом клетками-мишенями. Клетки, экспрессирующие поверхностный FcR для IgG, включая FcγRIII (CD16), FcγRII (CD32) и FcγRIII (CD64), могут выступать в качестве эффекторных клеток для уничтожения покрытых IgG клеток. Такие эффекторные клетки включают моноциты, макрофаги, природные киллерные (NK) клетки, нейтрофилы и эозинофилы. Привлечение FcγR путем IgG активирует антителозависимую клеточную цитотоксичность (ADCC) или антитело-зависимый клеточный фагоцитоз (ADCP). ADCC опосредована клетками-эффекторами CD16+ через секрецию мембранных порообразующих белков и протеаз, в то время как фагоцитоз опосредован клетками-эффекторами CD32+ и CD64+ (см. Fundamental Immunology, 4th ed., Paul ed., Lippincott-Raven, N.Y., 1997, Chapters 3, 17 and 30; Uchida et al., 2004, J. Exp. Med. 199: 1659-69; Akewanlop et al., 2001, Cancer Res. 61: 4061-65; Watanabe et al., 1999, Breast Cancer Res. Treat. 53: 199-207). В дополнение к ADCC и ADCP, Fc-участки клеточно-связанных антител также могут активировать классический путь комплемента, чтобы вызвать комплемент-зависимую цитотоксичность (CDC). C1q системы комплемента связывается с Fc-участками антител, когда они находятся в комплексе с антигенами. Связывание C1q с клеточно-связанными антителами может инициировать каскад событий, связанных с протеолитической активацией С4 и С2 для генерирования конвертазы С3. Расщепление С3 до C3b за счет конвертазы С3 обеспечивает активацию компонентов терминального комплемента, включая C5b, С6, С7, С8 и С9. В совокупности эти белки образуют мембраноатакующий комплекс пор на покрытых антителом клетках. Эти поры разрушают целостность клеточной мембраны, убивая клетки-мишени (см. Immunobiology, 6th ed., Janeway et al., Garland Science, N.Y., 2005, Chapter 2).
Термин «антителозависимая клеточная цитотоксичность» или ADCC представляет собой механизм для индуцирования гибели клеток, который зависит от взаимодействия покрытых антителом клеток-мишеней с иммунными клетками, обладающими литической активностью (также называются эффекторными клетками). Такие эффекторные клетки включают природные киллерные клетки, моноциты/макрофаги и нейтрофилы. Эффекторные клетки прикрепляются к Fc-эффекторному домену(ам) Ig, связанного с клетками-мишенями посредством их антигенобъединяющих сайтов. Гибель покрытой антигеном клетки-мишени происходит в результате эффекторной клеточной активности.
Термин «антитело-зависимый клеточный фагоцитоз» или ADCP относится к процессу, посредством которого покрытые антителом клетки поглощаются либо полностью либо в части фагоцитарными иммунными клетками (напр., макрофагами, нейтрофилами и дендритными клетками), которые связываются с Fc-эффекторным доменом(ами) Ig.
Термин «комплементзависимая цитотоксичность» или CDC относится к механизму для индуцирования гибели клеток, в котором Fc-эффекторный домен(ы) мишень-связанного антитела активирует серии ферментативных реакций, приводящих к образованию отверстий в мембране клетки-мишени. Как правило, комплексы антиген-антитело, такие как на покрытых антителами клетках-мишенях связывают и активируют компонент комплемента C1q, который в свою очередь активирует каскад комплемента, приводящий к гибели клетки-мишени. Активация комплемента может также привести к осаждению компонентов комплемента на поверхности клетки-мишени, что облегчает ADCC путем связывания рецепторов комплемента (напр., CR3) на лейкоцитах.
«Цитотоксический эффект» относится к истощению, исключению и/или гибели клетки-мишени. «Цитотоксический агент» относится к агенту, который имеет цитотоксический эффект на клетку. Цитотоксические агенты могут быть конъюгированы с антителом или введены в комбинации с антителом.
«Цитостатический эффект» относится к ингибированию пролиферации клеток. «Цитостатический агент» относится к агенту, которой имеет цитостатический эффект на клетку, тем самым ингибируя рост и/или расширение специфичной субпопуляции клеток. Цитостатические агенты могут быть конъюгированы с антителом или введены в комбинации с антителом.
Термин «фармацевтически приемлемый» означает одобренный, или утверждаемый регулирующим агентством Федерального правительства или правительства штата, или перечисленный в Фармакопее США или другой общепризнанной фармакопее для применения на животных и более конкретно на людях. Термин «фармацевтически совместимый ингредиент» относится к фармацевтически приемлемому разбавителю, адъюванту, эксципиенту или носителю, с которым антитело анти-LIV-1.
Фраза «фармацевтически приемлемая соль» относится к фармацевтически приемлемым органическим или неорганическим солям антитела анти-LIV-1 или его конъюгата или агенту, введенному с антителом анти-LIV-1. Примерные соли включают сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать внедрение другой молекулы, такой как ацетат-ион, сукцинат-ион или другой противоион. Противоион может быть любым органическим или неорганическим фрагментом, который стабилизирует заряд исходного соединения. Кроме того, его фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. Примеры, когда многозарядные атомы являются частью фармацевтически приемлемая соль, могут иметь несколько противоионов. Тем самым, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или более противоион.
Если иное не следует из контекста, термин «примерно» охватывает значения в пределах стандартного отклонения от указанного значения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
I. Общая информация
Изобретение обеспечивает моноклональные антитела, которые специфично связываются с LIV-1. Антитела пригодны для лечения и диагностики различных видов рака, а также обнаружения LIV-1.
II. Молекулы-мишени
Если не указано иное, LIV-1 означает LIV-1 человека. Типичной последовательности человека присваивается инвентарный номер Swiss Prot Q13433. Q13433 включен в настоящий документ как SEQ ID NO: 83. Известны три вариантные изоформы и один полиморфизм. Второй вариант белка LIV-1 человека, инвентарный номер ААА96258.2, включен в настоящий документ как SEQ ID NO: 84. Четыре внеклеточных домена связаны остатками 29-325, 377-423, 679-686 и 746-755 из Q13433 соответственно.
Если иное не следует из контекста, указание LIV-1 означает по меньшей мере внеклеточный домен белка и обычно полный белок, иной чем расщепляемый сигнальный пептид (аминокислоты 1-28 из Q13433).
III. Антитела по изобретению
А. Специфичность связывания и функциональные свойства
Изобретение обеспечивает гуманизированные антитела, полученные из двух антител мыши, BR2-14a и BR2-22a. Если специально не указано иное, настоящие раскрытия относятся к обоими антителами. Два антитела мыши проявляют 94% и 91% идентичность в последовательности друг с другом в зрелых вариабельных участках тяжелой и легкой цепи. Два антитела связываются с одинаковыми или перекрывающимися эпитопами на LIV-1 человека. Однако антитело BR2-22a имеет в около 10 раз более высокую аффинность к LIV-1 человека и в около 3 раз более высокую аффинность к LIV-1 яванского макака, чем BR2-14a, как показано на Фиг. 22.
Аффинность гуманизированных форм антитела BR2-14a мыши (т.е. Ка) предпочтительно находится в пределах фактора из пяти или фактора из двух факторов антитела BR2-14a мыши для LIV-1 человека. Гуманизированные антитела BR2-14a специфично связываются с LIV-1 человека в нативной форме и/или рекомбинантно экспрессированы из клеток СНО, так же как и антитело мыши, из которых они были получены. Предпочтительные гуманизированные антитела BR2-14a имеют такую же аффинность или больше чем (т.е., больше, чем запас на ошибку в измерении) аффинность BR2-14a для LIV-1 человека (напр., в 1.1-5 раз, от 1,1 до 3 раз, от 1,5 до 3 раз, от 1,7 до 2,3 раз или 1,7-2,1 раз больше аффинности или в около двух раз больше аффинности BR2-14a). Предпочтительные гуманизированные антитела BR2-14a связываются с тем же эпитопом и/или конкурируют с BR2-14a за связывание с LIV-1 человека. Предпочтительные гуманизированные антитела BR2-14a также связываются с cyno-гомологом LIV-1, таким образом разрешая доклиническое тестирование на нечеловекообразных приматах.
Аффинность гуманизированных форм антитела BR2-22a мыши (т.е. Ка) для LIV-1 человека, нативно экспрессированных или экспрессированных из клеток СНО, предпочтительно находится в пределах фактора из пяти или фактора из двух факторов антитела BR2-22. Некоторые гуманизированные антитела BR2-22a имеют константу ассоциации, которые по существу такая же как для BR2-22a (т.е. в пределах экспериментальной ошибки). Некоторые гуманизированные антитела BR2-22a имеют константу ассоциации в диапазоне от 0,5 до 1 или 0,5-1,5 от константы ассоциации антитела BR2-22a. Предпочтительные гуманизированные антитела BR2-22a имеют константу ассоциации больше чем 5×108 М-1 или в диапазоне от 0,5 до 2×109 М-1 или около 0,8×109 М-1 (+/- ошибка в измерении) для LIV-1 человека, экспрессированного из клеток СНО. Здесь, как и в других местах в этой заявке аффинности могут быть измерены в соответствии со способами по Примерам. Предпочтительные гуманизированные антитела BR2-22a связываются с тем же эпитопом и/или конкурируют с BR2-22a за связывание с LIV-1 человека. Гуманизированные антитела BR2-22a связываются с cyno-гомологом LIV-1, а также LIV-1 человека. Предпочтительные гуманизированные антитела BR2-22a связываются с по существу теми же константами ассоциации для LIV-1 человека и яванского макака, оба из которых экспрессированы из клеток СНО (в пределах экспериментальной ошибки), таким образом разрешая и повышая точность прогноза доклинического тестирования на нечеловекообразных приматах.
Предпочтительные антитела (как гуманизированные BR2-14a, так и гуманизированные BR2-22a) ингибируют рак (напр., рост клеток, метастазы и/или летальность для организмов), как показано на раковых клетках, распространяющихся в культуре, на моделях животных или в клиническом исследовании. Модели животных могут быть получены путем имплантации экспрессирующих LIV-1 опухолевых линий клеток человека в подходящие иммунодефицитные виды грызунов, напр., бестимусные мыши или мыши SCID. Эти опухолевые линии клеток могут быть помещены в иммунодефицитные грызуны-хозяева либо в виде твердых опухолей путем подкожных инъекций или как рассеянные опухоли путем внутривенных инъекций. После помещения внутрь хозяина эти модели опухолей могут быть применены для оценки терапевтических эффективностей антител анти-LIV-1 или их конъюгированных форм, как описано в Примерах.
В. Гуманизированные антитела
Гуманизированное антитело является генно-инженерным антителом, в котором CDR из антитела «донора», не являющемся человеком, прививаются в «акцепторные» последовательности антитела человека (см., напр., Queen, US 5,530,101 и 5,585,089; Winter, US 5,225,539; Carter, US 6,407,213; Adair, US 5,859,205; и Foote, US 6,881,557). Акцепторные последовательности антитела могут быть, например, зрелой последовательностью антитела человека, композитом таких последовательностей, консенсусной последовательностью последовательностей антитела человека или последовательностью участка зародышевой линии. Предпочтительной акцепторной последовательностью для тяжелой цепи является экзон VH1-2 зародышевой линии VH (также называемым в литературе HV1-2) (Shin et al., 1991, EMBO J. 10: 3641-3645) и для шарнирного участка (JH) экзон JH-6 (Mattila et al., 1995, Eur. J. Immunol. 25: 2578-2582). Для легкой цепи предпочтительной акцепторной последовательностью является экзон VK2-30 (также называемый в литературе KV2-30) и для шарнирного участка экзон Jκ-4 (Hieter et al., 1982, J. Biol. Chem. 257: 1516-1522). Таким образом, гуманизированное антитело представляет собой антитело, имеющее некоторые или все CDR, полностью или по существу из антитела донора и каркасных последовательностей вариабельного участка, и константные участки, если присутствуют, полностью или по существу из последовательностей антитела человека. Аналогично гуманизированная тяжелая цепь имеет по меньшей мере один, два и обычно все три CDR полностью или по существу из тяжелой цепи антитела донора, и каркасная последовательность вариабельного участка тяжелой цепи и константный участок тяжелой цепи, если присутствуют, по существу из каркасной последовательности вариабельного участка тяжелой цепи и последовательности константного участка человека. Аналогично гуманизированная легкая цепь имеет по меньшей мере один, два и обычно все три CDR полностью или по существу из антитела донора легкой цепи, и каркасная последовательность вариабельного участка легкой цепи и константный участок легкой цепи, если присутствуют, по существу из каркасной вариабельного участка легкой цепи и последовательности константного участка человека. Кроме нанотел и dAb гуманизированное антитело содержит гуманизированную тяжелую цепь и гуманизированную легкую цепь. CDR в гуманизированном антителе по существу происходит из соответствующего CDR в не являющимся человеческом антителе, когда по меньшей мере 60%, 85%, 90%, 95% или 100% соответствующих остатков (как определено по Kabat) идентичны между соответствующими CDR. Каркасные последовательности вариабельного участка цепи антитела или константный участок цепи антитела по существу происходят из каркасной последовательности вариабельного участка или константного участка человека соответственно, когда по меньшей мере 85%, 90%, 95% или 100% соответствующих остатков, определенных по Kabat идентичны.
Хотя гуманизированные антитела часто включают все шесть CDR (предпочтительно, как определено по Kabat) из антитела мыши, они также могут быть изготовлены с меньшим количеством чем все CDR, (напр., по меньшей мере, 3, 4 или 5) CDR из антитела мыши (напр., Pascalis et al., J. Immunol. 169: 3076, 2002; Vajdos et al., Journal of Molecular Biology, 320: 415-428, 2002; Iwahashi et al., Mol. Immunol. 36: 1079-1091, 1999; Tamura et al, Journal of Immunology, 164: 1432-1441, 2000).
Определенные аминокислоты из каркасных остатков вариабельного участка человека могут быть выбраны для замещения, основанного на их возможном влиянии на конформацию CDR и/или связывание с антигеном. Исследование таких возможных влияний проводятся путем моделирования, исследования характеристик аминокислот в определенных положениях или эмпирического наблюдения эффектов замещения или мутагенеза конкретных аминокислот.
Например, когда аминокислота отличается от мышиного каркасного остатка вариабельного участка и выбранного каркасного остатка вариабельного участка человека, каркасная аминокислота человека может быть замещена эквивалентной каркасной аминокислотой из антитела мыши, когда обоснованно ожидается, что аминокислота:
(1) нековалентно связывает антиген напрямую,
(2) примыкает к участку CDR,
(3) иным образом взаимодействует с участком CDR (напр., в пределах около 6 Å участка CDR); или
(4) опосредует взаимодействие между тяжелой и легкой цепями.
Изобретение обеспечивает гуманизированные формы антитела BR2-14a мыши, включающие пять примерных гуманизированных зрелых вариабельных участков тяжелой цепи (НА-НЕ) и шесть примерных гуманизированных зрелых вариабельных участков легкой цепи (LA-LF). Перестановками этих цепей, имеющих наиболее сильное связывание (самое низкое значение ЕС50), являются HBLB, HBLF, HCLB, HCLF, HDLB, HDLF, HELE и HELF. Из этих перестановок предпочтительным является HBLB (также известное как hLIV14), поскольку оно имеет наиболее сильное связывание, примерно в 2 раза сильнее, чем донорское антитело мыши, и имеет минимальное количество обратных мутаций (четыре).
Изобретение обеспечивает варианты гуманизированного антитела HBLB, в котором гуманизированный зрелый вариабельный участок тяжелой цепи показывает по меньшей мере 90%, 95% или 99% идентичность с SEQ ID NO: 10, и гуманизированный зрелый вариабельный участок легкой цепи показывает по меньшей мере 90%, 95% или 99% идентичность в последовательности с SEQ ID NO: 15. Предпочтительно в таких антителах сохраняются некоторые или все обратные мутации в HBLB. Другими словами, по меньшей мере 1, 2 или предпочтительно все 3 из положений Н29, Н30 и Н76 тяжелой цепи заняты I и Е и Н соответственно. Подобно этому, положение L36 предпочтительно занято Y. Участки CDR таких гуманизированных антител являются по существу идентичными участкам CDR HBLB, которые являются такими же, как у донорского антитела мыши. Участки CDR могут быть определены любым традиционным определением (напр., Chothia), но предпочтительно определяются по Kabat. В одном варианте осуществления изобретения гуманизированное антитело содержит тяжелую цепь, содержащую три CDR из SEQ ID NO: 10, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка SEQ ID NO: 10. В одном варианте осуществления изобретения гуманизированное антитело содержит легкую цепь, содержащую три CDR из SEQ ID NO: 15, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка SEQ ID NO: 15. В дополнительном варианте осуществления изобретения гуманизированное антитело содержит тяжелую цепь, содержащую три CDR из SEQ ID NO: 10, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка из SEQ ID NO: 10, и легкую цепь, содержащую 3 CDR из SEQ ID NO: 15, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка из SEQ ID NO: 15.
Поскольку гуманизированные антитела показывают любые изменения от типичного гуманизированного антитела HBLB, одной возможностью для такого дополнительного изменения являются дополнительные обратные мутации в каркасах вариабельного участка. Также могут быть сделаны любые или все положения с обратными мутациями в других примерных гуманизированных зрелых вариабельных участках тяжелой или легкой цепи (напр., 1, 2, 3, 4, 5, 6, 7, 8 или все 9 из Н27 заняты F, H28 заняты N, H48 заняты I, H66 заняты К, Н67 заняты А, Н71 заняты А, Н76 заняты N, H93 заняты N и Н94 заняты V в тяжелой цепи и 1, 2, 3, 4 или все 5 из L37 заняты L, L39 заняты К, L45 заняты К, L46 заняты L в легкой цепи. Однако, такие дополнительные обратные мутации не являются предпочтительными, потому что они в целом не улучшают аффинность, и внедрение большего количества остатков мыши может дать повышенный риск иммуногенности.
Изобретение обеспечивает гуманизированные формы антитела BR2-22a мыши, включающие три примерные гуманизированные зрелые вариабельные участкки тяжелой цепи (НЕ, HF и HG) и две примерные гуманизированные легкие цепи (LF и LG), которые могут быть объединены в различные перестановки с адекватным связыванием (см. Фигуру 21). Из этих перестановок предпочтительным является HGLG (также известный как hLIV22), поскольку он имеет наилучшее сочетание связывающих свойств (по существу такие же как антитело BR2-22a мыши в пределах экспериментальной ошибки) и наименьшее количество обратных мутаций (семь).
Изобретение обеспечивает варианты гуманизированного антитела HGLG, в котором гуманизированный зрелый вариабельный участок тяжелой цепи показывает по меньшей мере 90%, 95%, 98% или 99% идентичность с SEQ ID NO: 53, и гуманизированный зрелый вариабельный участок легкой цепи показывает по меньшей мере 90%, 95%, 98% или 99% идентичность в последовательности с SEQ ID NO: 60. Предпочтительно в таких антителах сохраняются некоторые или все обратные мутации в HGLG. Другими словами, по меньшей мере, 1, 2, 3, 4 или предпочтительно все 5 положений тяжелой цепи Н27, Н29, Н30, Н76 и Н94 заняты L, I, E, N и V (здесь, как и везде в этой заявке, используется нумерация Kabat для описания положений в зрелых вариабельных участках тяжелой и легкой цепи). Из этих обратных мутаций Н94 вносит наибольший вклад в сохранение связывающей аффинности, и Н76 - наименьший. Подобно этому положения L36 и L46 предпочтительно заняты Y и Р соответственно. Участки CDR таких гуманизированных антител являются по существу идентичными участкам CDR HGLG, которые являются такими же, как у донорнского антитела мыши. Участки CDR могут быть определены любым традиционным определением (напр., Chothia), но предпочтительно определяются по Kabat. В одном варианте осуществления изобретения гуманизированное антитело содержит тяжелую цепь, содержащую три CDR из SEQ ID NO: 53, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка SEQ ID NO: 53. В другом варианте осуществления изобретения гуманизированное антитело содержит легкую цепь, содержащую три CDR из SEQ ID NO: 60, и каркасы вариабельного участка с по меньшей мере 95% идентичностью с каркасами вариабельного участка SEQ ID NO: 60. В дополнительном варианте осуществления изобретения гуманизированное антитело содержит тяжелую цепь, содержащую 3 CDR из SEQ ID NO: 53, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка SEQ ID NO: 53, и легкую цепь, содержащую 3 CDR из SEQ ID NO: 60, и каркасы вариабельного участка с по меньшей мере 95% идентичностью каркасам вариабельного участка SEQ ID NO: 60.
Поскольку гуманизированные антитела BR2-22a показывают любые изменения от примерного гуманизированного антитела HGLG, одной возможностью для такого дополнительного изменения являются дополнительные обратные мутации в каркасах вариабельного участка. Также могут быть сделаны любые или все положения с обратными мутациями в других примерных гуманизированных зрелых вариабельных участках тяжелой или легкой цепи (напр., 1, 2, 3, 4, 5 или все 6 из Н28 заняты N, H28 заняты N, H48 заняты I, Н66 заняты К, Н67 заняты А, Н71 заняты А, Н93 заняты Т и в тяжелой цепи и 1 или 2 из L37 заняты L37 заняты L и L45 заняты К. Однако, такие дополнительные обратные мутации не являются предпочтительными, потому что они в целом не улучшают аффинность, и внедрение большего количества остатков мыши может дать повышенный риск иммуногенности.
Другим возможным изменением является замещение определенных остатков в CDR антитела мыши соответствующими остатками из последовательностей CDR человека, как правило, из CDR акцепторных последовательностей человека, использованных в разработке типичных гуманизированных антител. В некоторых антителах только часть CDR, а именно субопопуляция остатков CDR, требуемая для связывания, названная SDR, необходима для сохранения связывания в гуманизированном антителе. Остатки CDR, не контактирующие с антигеном и не находящиеся в SDR, могут быть идентифицированы на основании предшествующих испытаний (например, остатки Н60-Н65 в CDR H2 часто не требуются), из участков Kabat CDR, лежащих вне гипервариабельных петель (Chothia, J. Mol. Biol. 196: 901, 1987), по молекулярному моделированию и/или эмпирически, или как описано в Gonzales и соавт., Mol. Biol. 196: 901, 1987) с помощью молекулярного моделирования и/или эмпирически, или как описано в Gonzales et al., Mol. Immunol. 41: 863 (2004). В таких гуманизированных антителах в положениях, в которых один или более остатков CDR донора отсутствует или в которых CDR донора полностью пропущен, аминокислота, занимающая положение, может быть аминокислотой, занимающей соответствующее положение (по нумерации Kabat) в акцепторной последовательности антитела. Число таких акцепторных замещений на включение донорских аминокислот в CDR отражает баланс конкурирующих аспектов. Такие замещения потенциально предпочтительны в снижении числа аминокислот мыши в гуманизированном антителе и, следовательно, снижении потенциальной иммуногенности. Однако, замещения также вызывают изменения в аффинности, а значительные снижения в аффинности предпочтительно избегаются. В дополнительном варианте один или более остатков в CDR гуманизированного антитела BR2-22a (которое иначе будет такими же, как CDR антитела BR2-22a мыши) могут быть заменены соответствующими остатками из CDR антитела BR2-14a мыши (или наоборот). Положения для замещения в пределах CDR и аминокислот, которые замещаются, могут быть выбраны эмпирически.
Хотя могут быть сделаны другие непредпочтительные замещения аминокислот, например, в каркасных остатках, не контактирующих с CDR или даже некоторых потенциальных контактирующих с CDR остатках аминокислот в пределах CDR. Часто замены, сделанные в вариантных гуманизированных последовательностях, являются консервативными в отношении замещенных аминокислот HBLB (в случае гуманизированного BR2-14a) или аминокислот HGLG (в случае гуманизированного BR2-22). Предпочтительно, замещения, относящиеся к HBLB или HGLG (консервативные или нет) не оказывают существенного влияния на связывающую аффинность или потенциал гуманизированного mAb, говоря другими словами, его способность связываться с LIV-1 человека и ингибировать рост раковых клеток.
Варианты, как правило, отличаются от последовательностей зрелого вариабельного участка тяжелой и легкой цепи HBLB (hLIV14) или HGLG (hLIV22) на небольшое число (напр., как правило, не более чем 1, 2, 3, 5 или 10 в зрелом вариабельном участке либо легкой, либо тяжелой цепи) замещений, удалений или вставок.
С. Выбор Константного Участка
Вариабельные участки тяжелой и легкой цепи гуманизированных антител могут быть связаны по меньшей мере с частью константного участка человека. Выбор константного участка зависит, отчасти, требуются ли антителозависимая клеточно-опосредованная цитотоксичность, антитело-зависимый клеточный фагоцитоз и/или комплементзависимая цитотоксичность. Например, изотопы IgG1 и IgG3 человека обладают сильной комплементзависимой цитотоксичностью, изотип IgG2 человека - слабой комплементзависимой цитотоксичностью, и IgG4 человека не обладает комплементзависимой цитотоксичностью. IgG1 и IgG3 человека также вызывают более сильные клеточно-опосредованные эффекторные функции, чем IgG2 и IgG4 человека. Константные участки легкой цепи могут быть лямбда или каппа. Антитела могут быть экспрессированы как тетрамеры, содержащие две легкие и две тяжелые цепи, как отдельные тяжелые цепи, легкие цепи, как Fab, Fab', F(ab')2 и Fv или как одноцепочечные антитела, в которых вариабельные домены тяжелой и легкой цепей связаны посредством спейсера.
Константные участки человека показывают аллотипическое изменение или изоаллотипическое изменение между различными индивидуумами, говоря другими словами, константные участки могут отличаться у различных индивидуумов в одном или более полиморфных положениях. Изоаллотипы отличаются от аллотипов тем, что сыворотка, распознающая изоаллотип, связывается с неполиморфным участком одного или более других изотипов.
Одна или несколько аминокислот в аминном или карбоксильном конце легкой и/или тяжелой цепи, таком как С-концевой лизин тяжелой цепи, может отсутствовать или быть в виде производного в части или во всех молекулах. Замещения могут быть сделаны в константных участках для снижения или увеличения эффекторной функции, такой как комплемент-опосредованная цитотоксичность или ADCC (см., напр., Winter et al., Патент США No. 5,624,821; Tso et al., Патент США No. 5,834,597; и Lazar et al., Proc. Natl. Acad. Sci. USA 103: 4005, 2006) или для увеличения периода полужизни у людей (см., напр., Hinton et al., J. Biol. Chem. 279: 6213, 2004).
Типичные замещения, включающие аминокислотные замещения нативной аминокислоты на цистеиновый остаток, представлены в аминокислотных положениях 234, 235, 237, 239, 267, 298, 299, 326, 330 или 332, предпочтительно мутация S239C в изотипе IgG1 человека (US 20100158909). Наличие дополнительного цистеинового остатка позволяет образование межцепочечной дисульфидной связи. Такое образование межцепочечной дисульфидной связи может вызывать пространственное затруднение, тем самым снижая аффинность связывающего взаимодействия участка Fc - FcγR. Цистеиновый остаток(ки), введенный в или рядом с участком Fc константного участка IgG, может также служить в качестве сайтов для конъюгирования с терапевтическими агентами (т.е., связывания цитотоксических лекарственных средств с использованием тиол-специфичных реагентов, таких как малеимидные производные лекарственных средств). Наличие терапевтического агента вызывает пространственное затруднение, тем самым дополнительно снижая сродство связывающего взаимодействия участка Fc - FcγR. Другие замещения в любых из положений 234, 235, 236 и/или 237 снижают аффинность к рецепторам Fcγ, особенно рецептору FcγRI (см., напр., US 6,624,821, US 5,624,821.)
Период полужизни антитела in vivo может также оказывать влияние на его эффекторные функции. Период полужизни антитела может быть увеличен или снижен для того, чтобы модифицировать его терапевтические активности. FcRn представляет собой рецептор, который структурно похож на антиген главного комплекса гистосовместимости Класса I, который нековалентно связывается с β2-микроглобулином. FcRn регулирует катаболизм IgG и их трансцитоз через ткани (Ghetie and Ward, 2000, Annu. Rev. Immunol. 18: 739-766; Ghetie and Ward, 2002, Immunol. Res. 25: 97-113). Взаимодействие IgG-FcRn происходит при рН 6,0 (рН внутриклеточных везикул), но не при рН 7,4 (рН крови); это взаимодействие позволяет IgG возвращаться назад в кровоток (Ghetie and Ward, 2000, Ann. Rev. Immunol. 18: 739-766; Ghetie and Ward, 2002, Immunol. Res. 25: 97-113). Участок на IgG1 человека, вовлеченный в FcRn-связывание, был картирован (Shields et al., 2001, J. Biol. Chem. 276: 6591-604). Замещения аланина в положениях Pro238, Thr256, Thr307, Gln311, Asp312, Glu380, Glu382 или Asn434 IgG1 человека повышает FcRn-связывание (Shields et al., 2001, J. Biol. Chem. 276: 6591-604). Молекулы IgG1, в которых скапливаются эти замещения, имеют более продолжительные периоды полувыведения сыворотки. Следовательно, эти модифицированные молекулы IgG1 могут быть способны осуществлять свои эффекторные функции и, тем самым, проявлять свои терапевтические эффективности в течение более продолжительного периода по сравнению с немодифицированным IgG1. Другие примерные замещения для увеличения связывания с FcRn включают Gln в положении 250 и/или Leu в положении 428. Во всех положениях в константном участке используется нумерация EU.
Олигосахариды, ковалентно прикрепленные к консервативному Asn297, вовлечены в способность участка Fc IgG связывать FcγR (Lund et al., 1996, J. Immunol. 157: 4963-69; Wright and Morrison, 1997, Trends Biotechnol. 15: 26-31). Инженерия этой гликоформы на IgG может значительно улучшить IgG-опосредованный ADCC. Добавление разделяющих N-ацетилглюкозаминных модификаций (Umana et al., 1999, Nat. Biotechnol. 17: 176-180; Davies et al., 2001, Biotech. Bioeng. 74: 288-94) к этой гликоформе или удаление фукозы (Shields et al., 2002, J. Biol. Chem. 277: 26733-40; Shinkawa et al., 2003, J. Biol. Chem. 278: 6591-604; Niwa et al., 2004, Cancer Res. 64: 2127-33) из этой гликоформы представляют собой два примера иженерии IgG Fc, которая улучшает связывание между IgG Fc и FcγR, тем самым увеличивая Ig-опосредованную активность ADCC.
Системные замещения подверженных воздействию растворителя аминокислот участка Fc IgG1 человека сгенерировали варианты IgG с измененными FcγR-связывающими аффиностями (Shields et al., 2001, J. Biol. Chem. 276: 6591-604). При сравнении с родительским IgG1 субпопуляция этих вариантов, имеющих замещения в Thr256/Ser298, Ser298/Glu333, Ser298/Lys334 или Ser298/Glu333/Lys334 на Ala, демонстрирует увеличение как в связывающей аффинности по направлению к активности FcγR и активности ADCC (Shields et al., 2001, J. Biol. Chem. 276: 6591-604; Okazaki et al., 2004, J. Mol. Biol. 336: 1239-49).
Комплементсвязывающая активность антител (как связывание C1q, так и активность CDC) может быть улучшена путем замещений у Lys326 и Glu333 (Idusogie et al., 2001, J. Immunol. 166: 2571-2575). Те же замещения на остове IgG2 человека может превращать изотип антитела, который слабо связывается с C1q и значительно лишенный комплементной активирующей активности, в изотип, который может как связывать C1q, так и опосредовать CDC (Idusogie et al., 2001, J. Immunol. 166: 2571-75). Применяются также некоторые другие способы улучшения комплементсвязывающей активности антител. Например, пересадка 18-аминокислотной карбоксил-концевой хвостовой части IgM на карбоксильный конец IgG значительно увеличивает активность их CDC. Это наблюдается даже с IgG4, у которого обычно не обнаруживается активность CDC (Smith et al., 1995, J. Immunol. 154: 2226-36). Также, замещение Ser444, расположенного близко к карбокси-концу IgG1 тяжелой цепи, на Cys, вызвало димеризацию хвост-к-хвосту IgG1 с 200-кратным увеличением активности по сравнению с мономерным IgG1 (Shopes et al., 1992, J. Immunol. 148: 2918-22). Кроме того, биспецифичный конструкт диатела со специфичностью к C1q также придает CDC-активность (Kontermann et al., 1997, Nat. Biotech. 15: 629-31).
Комплементная активность может быть снижена путем превращения по меньшей мере одного из аминокислотных остатков 318, 320 и 322 тяжелой цепи в остаток, имеющий отличающуюся боковую цепь, такую как Ala. Другие алкилзамещенные неионные остатки, такие как Gly, Ile, Leu или Val, или такие ароматические неполярные остатки, как Phe, Tyr, Trp и Pro в месте любого одного из трех остатков также снижают или исключают связывание C1q. Ser, Thr, Cys и Met могут быть использованы в остатках 320 и 322, а не 318, чтобы уменьшить или исключить C1q-связывающую активность. Замена остатка 318 (Glu) полярным остатком может модифицировать, но не исключить C1q-связывающую активность. Замена остатка 297 (Asn) на Ala приводит к устранению литической активности, но лишь незначительно снижает (примерно в три раза слабее) аффинность для C1q. Это изменение разрушает сайт гликозилирования и наличие углевода, который требуется для активации комплемента. Любая другая замена на этом сайте также разрушают сайт гликозилирования. Следующие мутации и любых их комбинации также уменьшают связывание C1q: D270A, K322А, Р329А и P311S (см. WO 06/036291).
Ссылка на константный участок человека включает константный участок с любым природным аллотипом или любой перестановкой остатков, занимающих полиморфные положения в природных аллотипах. Также вплоть до 1, 2, 5 или 10 мутаций могут присутствовать близко к природному константному участку человека, такие, как указано выше, для снижения Fcgamma-рецепторного связывания или увеличения связывания с FcRN.
D. Экспрессия рекомбинантных антител
Гуманизированные антитела, как правило, получают путем рекомбинантной экспрессии. Рекомбинантные полинуклеотидные конструкции обычно включают контролирующую экспрессию последовательность, функционально связанную с кодирующими последовательностями цепей антитела, включая природно ассоциированные участки или гетерологичные промоторные участки. Предпочтительно, контролирующие экспрессию последовательности являются эукариотическими промоторными системами в векторах, способных трансформировать или трансфектировать эукариотические клетки-хозяева. Как только вектор был включен в соответствующего хозяина, хозяина сохраняют в условиях, подходящих для высокого уровня экспрессии нуклеотидных последовательностей, и для сбора и очистки перекрестно-реагирующих антител.
Клетки млекопитающих являются предпочтительным хозяевами для экспрессирующих нуклеотидных сегментов, кодирующих иммуноглобулины или их фрагменты. См. Winnacker, From Genes to Clones, (VCH Publishers, NY, 1987). В данной области техники был разработан ряд подходящих линий клеток-хозяев, способных секретировать интактные гетерологичные белки, и включает линии клеток СНО (напр., DG44), различные линии клеток COS, клетки HeLa, клетки НЕК293, L-клетки и не продуцирующие антитела миеломы, включая Sp2/0 и NS0. Предпочтительно, клетки получены не от человека. Экспрессирующие векторы для этих клеток могут включать контролирующие экспрессию последовательности, такие как точка начала репликации, промотор, энхансер (Queen et al., Immunol. Rev. 89: 49 (1986)), и необходимые обрабатывающие информационные сайты, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминации транскрипции. Предпочтительными контролирующими экспрессию последовательностями, являются промоторы, полученные из эндогенных генов, цитомегаловируса, SV40, аденовируса, бычьего вируса папилломы и подобного. См. Со et al., J. Immunol. 148: 1149 (1992).
После экспрессии антитела могут быть очищены в соответствии со стандартными процедурами, известными в данной области техники, включая очистку ВЭЖХ, колоночную хроматографию, гель-электрофорез и подобное (см., в общем, Scopes, Protein Purification (Springer-Verlag, NY, 1982))
IV. Нуклеиновые кислоты
Изобретение дополнительно обеспечивает нуклеиновые кислоты, кодирующие любую из гуманизированных тяжелых и легких цепей, описанных выше. Как правило, нуклеиновые кислоты также кодируют сигнальный пептид, слитый с зрелыми тяжелыми и легкими цепями. Кодирующие последовательности на нуклеиновых кислотах могут быть функционально связаны с регуляторными последовательностями, чтобы обеспечить экспрессию кодирующих последовательностей, таких как промотор, энхансер, сайт связывания рибосомы, сигнал терминации транскрипции и подобное. Нуклеиновые кислоты, кодирующие тяжелые и легкие цепи, могут встречаться в изолированной форме или могут быть клонированы в один или более векторов. Нуклеиновые кислоты могут быть синтезированы путем, например, твердофазного синтеза или ПЦР перекрывающихся олигонуклеотидов. Нуклеиновые кислоты, кодирующие тяжелые и легкие цепи, могут быть соединены в виде одной непрерывной нуклеиновой кислоты, напр., в вектор экспрессии, или могут быть разделены, напр., каждая клонирована в свой собственный вектор экспрессии.
V. Конъюгаты антитела с лекарственным средством
Антитела анти-LIV-1 могут быть конъюгированы с цитотоксическими или цитостатическими фрагментами (включая их фармацевтически приемлемые соли) с образованием конъюгатов антител с лекарственным средством (ADC). Особенно подходящими фрагментами для конъюгации с антителами являются цитотоксические агенты (напр., химиотерапевтические агенты), преобразующие пролекарство ферменты, радиоактивные изотопы или соединения или токсины (эти фрагменты совместно называются терапевтическим агентом). Например, антитело анти-LIV-1 может быть конъюгировано с цитотоксическим агентом, таким как химиотерапевтический агент или токсин (напр., цитостатический или разрушающий клетки агент, такой как, напр., абрин, рицин А, экзотоксин синегнойной палочки или дифтерийный токсин).
Антитело анти-LIV-1 может быть конъюгировано с преобразующим пролекарство ферментом. Преобразующий пролекарство фермент, может быть рекомбинантно слит с антителом или химически конъюгирован к ним с использованием известных способов. Примерами ферментов, преобразующих пролекарство, являются карбоксипептидаза G2, бета-глюкуронидаза, пенициллин-V-амидаза, пенициллин-G-амидаза, β-лактамаза, β-глюкозидаза, нитроредуктаза и карбоксипептидаза А.
Методики для конъюгирования терапевтических агентов с белками, и, в частности, с антителами, хорошо известны. (См., напр., Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy," in Monoclonal Antibodies And Cancer Therapy (Reisfeld et al. eds., Alan R. Liss, Inc., 1985); Hellstrom et al., "Antibodies For Drug Delivery," in Controlled Drug Delivery (Robinson et al. eds., Marcel Dekker, Inc., 2nd ed. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications (Pinchera et al. eds., 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy," in Monoclonal Antibodies For Cancer Detection And Therapy (Baldwin et al. eds., Academic Press, 1985); and Thorpe et al., 1982, Immunol. Rev. 62: 119-58. См. также, напр., публикацию РСТ WO 89/12624.)
Терапевтический агент может быть конъюгирован таким образом, что снижается его активность до тех пор, пока оно не отщепляется от антитела (напр., путем гидролиза, деградации антитела или с помощью расщепляющего агента). Такой терапевтический агент прикреплен к антителу с расщепляемым линкером, который чувствителен к расщеплению во внутриклеточной среде LIV-1-экспрессирующей раковой клетки, но по существу не чувствителен к внеклеточной среде, так что конъюгат отщепляется от антитела, когда он поглощается LIV-1-экспрессирующей раковой клеткой (напр., в эндосомальной среде или, например, в силу чувствительности к рН или к протеазе, в лизосомальной среде или в кавеолярной среде).
Как правило, ADC содержит линкерный участок между терапевтическим агентом и антителом анти-LIV-1. Как отмечено ранее, как правило, линкер расщепляется при внутриклеточных условиях, таких что расщепление линкера высвобождает терапевтический агент из антитела во внутриклеточную среду (напр., в пределах лизосомы, или эндосомы, или кавеолы). Линкер может быть, напр., пептидильным линкером, который расщеплен внутриклеточной пептидазой или ферментом протеазы, включая лизосомальную или эндосомальную протеазу. Как правило, пептидильный линкер по меньшей мере длину в две аминокислоты или по меньшей мере длину в три аминокислоты. Расщепляющие агенты могут включать катепсины В и D и плазмин (см., напр., Dubowchik and Walker, 1999, Pharm. Therapeutics 83: 67-123). Наиболее типичными являются пептидильные линкеры, которые расщепляются с помощью ферментов, которые присутствуют в LIV-1-экспрессирующих клетках. Например, может быть использован пептидильный линкер, который расщепляется с помощью тиол-зависимой протеазы катепсина-В, который экспрессируется на высоком уровне в раковой ткани (напр., линкер, содержащий пептид Phe-Leu или Gly-Phe-Leu-Gly). Другие такие линкеры описаны, напр., в Патенте США No. 6,214,345. В конкретных вариантах выполнения изобретения пептидильный линкер, расщепляемый внутриклеточной протеазой, содержит линкер Val-Cit или дипептид Phe-Lys (см., напр., Патент США 6,214,345, в котором описывается синтез доксорубицина с линкером Val-Cit). Одним из преимуществ использования внутриклеточного протеолитического высвобождения терапевтического агента является то, что агент, как правило, ослаблен, когда конъюгирован, и сывороточная стабильность конъюгатов, как правило, высока.
Расщепляющий линкер может быть рН-чувствительным, т.е. чувствительным к гидролизу при определенных значениях рН. Как правило, рН-чувствительный линкер гидролизуется в кислых условиях. Например, может быть использован кислотно-лабильный линкер, который гидролизуется в лизосоме (напр., гидразон, семикарбазон, тиосемикарбазон, цис-аконитовый амид, сложный ортоэфир, ацеталь, кеталь или тому подобное). (См., напр., Патент США No 5,122,368; 5,824,805; 5,622,929; Dubowchik and Walker, 1999, Pharm. Therapeutics 83: 67-123; Neville et al., 1989, Biol. Chem. 264: 14653-14661.). Такие линкеры относительно стабильны при условиях нейтрального рН, например, таких как в крови, но нестабильны при рН ниже 5,5 или 5,0, приблизительном рН лизосомы. В некоторых вариантах выполнения изобретения гидролизуемый линкер представляет собой тиоэфирный линкер (такой как, напр., тиоэфир, прикрепленный к терапевтическому агенту через ацилгидразоновую связь (см., напр., Патент США No. 5,622,929)).
Другие линкеры являются расщепляемыми в восстановительных условиях (напр., дисульфидный линкер). Дисульфидные линкеры включают те, которые могут быть сформированы с использованием SATA (N-сукцинимидил-S-ацетилтиоацетата), SPDP (N-сукцинимидил-3-(2-пиридилдитио)пропионата), SPDB (N-сукцинимидил-3-(2-пиридилдитио)бутирата) и SMPT (N-сукцинимидил-алкилоксикарбонил-альфа-метил-альфа-(2-пиридил-дитио)толуола), SPDB и SMPT. (См., напр., Thorpe et al., 1987, Cancer Res. 47: 5924-5931; Wawrzynczak et al., In Immunoconjugates: Antibody Conjugates in Radioimagery and Therapy of Cancer (C.W. Vogel ed., Oxford U. Press, 1987. См. также Патент США No. 4,880,935)
Линкер может быть также малонатным линкером (Johnson et al., 1995, Anticancer Res. 15: 1387-93), малеимидобензоильным линкером (Lau et al., 1995, Bioorg-Med-Chem. 3(10): 1299-1304) или 3'-N-амидным аналогом (Lau et al., 1995, Bioorg-Med-Chem. 3(10): 1305-12).
Линкер также может быть нерасщепляющимся линкером, таким как малеимидоалкиленовым или малеимидоариловым линкером, который напрямую прикреплен к терапевтическому агенту (напр., лекарственному средству). Активное лекарственное средство-линкер высвобождается при разрушении антитела.
Как правило, линкер по существу не чувствителен к внеклеточной среде, что означает, что не более чем около 20%, как правило, не более чем около 15%, более предпочтительно не более чем около 10% и еще более предпочтительно не более чем около 5%, не более чем около 3% или не более чем около 1% линкеров в образце ADC расщепляется, когда ADC присутствует во внеклеточной среде (напр., в плазме). Является ли линкер по существу не чувствительным к внеклеточной среде, может быть определено, например, путем независимого инкубирования с плазмой (а) ADC («образец ADC») и (б) эквимолярного количества неконъюгированного антитела или терапевтического агента («контрольный образец») в течение заранее определенного периода времени (напр., 2, 4, 8, 16 или 24 часа) и затем сравнения количества неконъюгированного антитела или терапевтического агента, присутствующего в образце ADC с тем, что присутствует в контрольном образце, измеренного, напр., с помощью высокоэффективной жидкостной хроматографии.
Линкер может также промотировать клеточное поглощение. Линкер может промотировать клеточное поглощение, когда конъюгирован с терапевтическим агентом (т.е., в среде фрагмента ADC линкер-терапевтический агент или производного ADC, как описано в настоящем документе). Альтернативно, линкер может промотировать клеточное поглощение, когда конъюгирован как с терапевтическим агентом, так и с антителом анти-LIV-1 (т.е., в среде ADC, как описано в настоящем документе).
Различные линкеры, которые могут быть использованы с композициями по настоящему изобретению, описаны в WO 2004-010957 и имеют вид

где:
-А- представляет собой стретчерную единицу;
а равно 0 или 1;
каждый -W- независимо представляет собой аминокислотую единицу;
w независимо представляет собой целое число в диапазоне от 0 до 12;
-Y- представляет собой спейсерную единицу; и
y представляет собой 0, 1 или 2.
Представители стретчерных единиц изображены в квадратных скобках Формул (Ia) и (Ib; см. ниже), где А-, -W-, -Y-, -D, w и y являются такими, как определено выше, и R1выбирается из -C1-С10 алкилена-, -С3-C8 карбоцикло-, -O-(C1-C8 алкила)-, -арилена-, -C1-С10 алкилен-арилена-, -арилен-C1-C10 алкилена-, -C1-С10 алкилен-(С3-С8 карбоцикло)-, -(С3-C8 карбоцикло)-С1-С10-алкилена-, -С3-C8 гетероцикло-, -C1-C10 алкилен-(С3-С8 гетероцикло)-, -(С3-C8 гетероцикло)-С1-С10-алкилена-, -(CH2CH2O)r- и -(CH2CH2O)r-СН2-; и r представляет собой целое число в диапазоне 1-10. Ab представляет собой антитело.

Нагрузка лекарственным средством представлена посредством p, числа молекул лекарственное средство-линкер на антитело. В зависимости от контекста, p может представлять собой среднее число молекул лекарственное средство-линкер на антитело, также называемой средней нагрузкой лекарственным средством. Р варьируется от 1 до 20 и, предпочтительно составляет от 1 до 8. В некоторых предпочтительных вариантах выполнения изобретения, когда p означает среднюю нагрузку лекарственным средством, p варьируется от около 2 до около 5. В некоторых вариантах выполнения изобретения p равно около 2, около 3, около 4 или около 5. Среднее число лекарственных средств на антитело в препарате может быть охарактеризовано с помощью обычных средств, таких как масс-спектроскопия, анализ ELISA и ВЭЖХ.
Аминокислотная единица (-W-), если присутствует, связывает стретчерную единицу (-А-) со спейсерной единицей (-Y-), если спейсерная единица присутствует, и связывает стретчерную единицу с цитотоксическим или цитостатическим агентом (Единица лекарственного средства; D), если спейсерная единица отсутствует.
Если присутствует, -Ww- предпочтительно представляет собой дипептидную, трипептидную, тетрапептидную, пентапептидную, гексапептидную, гептапептидную, октапептидную, нонапептидную, декапептидную, ундекапептидную или додекапептидную единицу.
Спейсерная единица (-Y-), когда присутствует, связывает аминокислотную единицу с единицей лекарственного средства. Спейсерные единицы делятся на два основных типа: самоуничтожаемые и несамоуничтожаемые. Несамоуничтожаемая спейсерная единица представляет собой ту, в которой часть или вся спейсерная единица остается связанной с единицей лекарственного средства после ферментативного отщепления аминокислотной единицы из конъюгата антитело анти-LIV-1-линкер-лекарственное средство или соединения лекарственное средство-линкер. Примеры несамоуничтожаемой спейсерной единицы включают (глицин-глициновую) спейсерную единицу и глициновую спейсерную единицу. Когда конъюгат антитело анти-LIV-1-линкер-лекарственное средство, содержащий глицин-глициновую спейсерную единицу или глициновую спейсерную единицу, подвергается ферментативному отщеплению с помощью ассоциированной с опухолевыми клетками протеазы, ассоциированной с клетками рака протеазы или ассоциированной с лимфоцитами протеазы, фрагмент глицин-глицин-лекарственное средство или фрагмент глицин-лекарственное средство отщепляется от Ab-Aa-Ww-. Для высвобождения лекарственного средства должна иметь место независимая реакция гидролиза в клетке-мишени для расщепления связи глицин-лекарственное средство.
Альтернативно, конъюгат антитела анти-LIV-1 и лекарственного средства, содержащий самоуничтожаемую спейсерную единицу, может высвобождать лекарственное средство (D) без необходимости отдельной стадии гидролиза. В некоторых из этих вариантов выполнения изобретения -Y- представляет собой единицу п-аминобензилового спирта (РАВ), которая связана с -Ww- через атом азота группы РАВ и соединена непосредственно с -D через карбонатную, карбаматную или простую эфирную группу. Другие примеры самоуничтожаемых спейсеров включают ароматические соединения, которые являются электронно эквивалентны группе РАВ, такие как производные 2-аминоимидазол-5-метанола (см. для примеров Hay et al., 1999, Bioorg. Med. Chem. Lett. 9: 2237) и орто- или пара-аминобензилацетали. Могут быть использованы спейсеры, которые легко подвергаются циклизации при гидролизе амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., 1995, Chemistry Biology 2: 223), соответствующим образом замещенные бицикло[2.2.1] и бицикло[2.2.2] кольцевые системы (Storm et al., 1972, J. Amer. Chem. Soc. 94: 5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry et al., 1990, J. Org. Chem. 55: 5867). Элиминирование амин-содержащих лекарственных средств, которые замещены в α-положении глицина (Kingsbury, et al., 1984, J. Med. Chem. 27: 1447), также являются примерами стратегий самоуничтожаемых спейсеров, которые могут быть применены к конъюгатам антитело анти-LIV-1-линкер-лекарственное средство. Альтернативно, спейсерная единица представляет собой разветвленную единицу бис(гидроксиметил)стирола (BHMS), которая может быть использован для включения дополнительных лекарственных средств.
Пригодные классы цитотоксических агентов для конъюгирования с антителами анти-LIV-1 включают, например, антитубулиновые агенты, связывающиеся с малой бороздкой ДНК агенты, ингибиторы репликации ДНК, химиотерапевтические сенсибилизаторы или подобные. Другие типичные классы цитотоксических агентов включают антрациклины, ауристатины, камптотецины, дуокармицины, этопозиды, мейтанзиноиды и алкалоиды барвинка. Некоторые типичные цитотоксические агентов включают ауристатины (напр., ауристатин Е, AFP, MMAF, ММАЕ), связывающиеся с малой бороздкой ДНК агенты (напр., энедиины и лекситропсины), дуокармицины, таксаны (напр., паклитаксел и доцетаксел), винка алкалоиды, доксорубицин, морфолино-доксорубицин и цианоморфолино-доксорубицин.
Цитотоксический агент может представлять собой химиотерапевтическое средство, такое как, например, доксорубицин, паклитаксел, мелфалан, алкалоиды барвинка, метотрексат, митомицин С или этопозид. Агент также может быть аналогом СС-1065, калихеамицином, мейтанзином, аналогом доластатина 10, ризоксином или палитоксином.
Цитотоксический агент может быть также ауристатином. Ауристатин может быть производным ауристатина Е, напр., сложным эфиром, образованным между ауристатином Е и кетокислотой. Например, ауристатин Е может быть подвергнут взаимодействию с параацетилбензойной кислотой или бензоилвалериановой кислотой с получением АЕВ и AEVB соответственно. Другие типичные ауристатины включают AFP, MMAF и ММАЕ. Синтез и структура различных ауристатинов описаны, например, в US 2005-0238649 и US 2006-0074008.
Цитотоксический агент может быть связывающимся с малой бороздкой ДНК агентом. (См., напр., Патент США No. 6,130,237). Например, связывающийся с малой бороздкой агент, может быть соединением CBI или энедиином (напр., калихеамицином).
Цитотоксический или цитостатический агент может быть антитубулиновым агентом. Примеры антитубулиновых агентов включают таксаны (напр., Taxol® (паклитаксел), Таксотер® (доцетаксел)), Т67 (Tularik), алкалоиды барвинка (напр., винкристин, винбластин, виндезин и винорелбин) и ауристатины (напр., ауристатин Е, AFP, MMAF, ММАЕ, АЕВ, AEVB). (Типичные ауристатины показаны ниже в формулах III-XIII). Другие подходящие антитубулиновые агенты включают, например, производные баккатина, аналоги таксана (напр., эпотилон А и В), нокодазол, колхицин и колцимид, эстрамустин, криптофизины, цемадотин, мейтанзиноиды, комбретастатины, дискодермолид и элеутеробин.



Цитотоксический агент может быть мейтанзиноидом, другой группой антитубулиновых агентов. Например, мейтанзиноид может быть мейтанзином или мейтанзином, содержащим линкер лекарственного средства, такой как DM-1 или DM-4 (ImmunoGen, Inc.; см. также Chari et al., 1992, Cancer Res. 52: 127-131).
Типичные конъюгаты антител включают следующие конъюгаты антител vcMMAE и mcMMAF, где p и Ab являются такими, как описано ранее в настоящем документе:


или его фармацевтически приемлемая соль.
VI. Другие Антитела к LIV-1
Так же как гуманизированные формы антител BR2-14a и BR2-22a, описанные выше, другие антитела, связывающиеся с внеклеточным доменом LIV-1 могут быть использованы в некоторых способах по изобретению, в частности, для лечения тройного негативного рака молочной железы. Коллекция мышиных антител к LIV-1 описана в US 20080175839. Эти антитела включают 1.1F10, 1.7А4, BR2-10b, BR2-11a, BR2-13a, BR2-14a, BR2-15a, BR2-16a, BR2-17a, BR2-18a, BR2-19a, BR2-20a, BR2-21a, BR2-22a, BR2-23a, BR2-24a и BR2-25a, из которых предпочтительны BR2-19a, продуцируемое гибридомой инвентарный номер АТСС № РТА-5706 или BR2-23a, продуцируемое гибридомой инвентарный номер АТСС № РТА-5707 в дополнение к BR2-14a и BR2-22a. Гуманизированные, химерные или венированные формы этих антител могут быть получены обычными методами, приведенными ниже.
Другие антитела к LIV-1 могут быть получены de novo путем иммунизации с LIV-1 или его одним или более внеклеточным доменом. Получение других моноклональных антител не от человека, напр., мышиных, из морских свинок, из приматов, из кроликов или крыс, против иммуногена может быть выполнено, как описано в Harlow & Lane, Antibodies, A Laboratory Manual (CSHP NY, 1988) (включено посредством ссылки для всех целей). Такой иммуноген может быть получен из природного источника путем синтеза пептида или путем рекомбинантной экспрессии.
Могут быть получены гуманизированные, химерные или венированные формы этих антител не от человека. Общая методика получения гуманизированных антител описана Queen, US 5,530,101 и 5,585,089; Winter, US 5,225,539; Carter, US 6,407,213; Adair, US 5,859,205; и Foote, US 6,881,557). Химерное антитело представляет собой антитело, в котором зрелые вариабельные участки легкой и тяжелой цепей антитела не от человека (напр., мыши) сочетаются с константными участками легкой и тяжелой цепи человека. Такие антитела по существу или полностью сохраняют специфичность связывания антитела мыши, и около двух третей последовательности человека. Венированное антитело представляет собой тип гуманизированного антитела, которое сохраняет некоторые и обычно все CDR, и некоторые из каркасных остатков вариабельного участка не-человека антитела не-человека, но заменяет другие каркасные остатки вариабельногой участка, которые могут участвовать в В- или Т-клеточных эпитопах, например, экспонированных остатках (Padlan, Mol. Immunol. 28: 489, 1991), с остатками из соответствующих положений последовательности антитела человека. Результатом является антитело, в котором CDR полностью или по существу из антитела не-человека и каркасы вариабельного участка антитела не-человека сделаны более подобными человеческим посредством замен.
Антитела человека против LIV-1 могут быть обеспечены различными методиками, описанными ниже. Способы получения антител человека включают триомный способ по Oestberg et al., Hybridoma 2: 361-367 (1983); Oestberg, Патент США No. 4,634,664; и Engleman et al., Патент США 4,634,666; использование трансгенных мышей, включающих гены иммуноглобулина человека (см., напр., Lonberg et al., WO 93/12227 (1993); US 5,877,397, US 5,874,299, US 5,814,318, US 5,789,650, US 5,770,429, US 5,661,016, US 5,633,425, US 5,625,126, US 5,569,825, US 5,545,806, Nature 148, 1547-1553 (1994), Nature Biotechnology 14, 826 (1996), Kucherlapati, WO 91/10741 (1991) и способы фагового отображения (см., напр., Dower et al., WO 91/17271 и McCafferty et al., WO 92/01047, US 5,877,218, US 5,871,907, US 5,858,657, US 5,837,242, US 5,733,743 и US 5,565,332.
Любые из антител могут быть выбраны, чтобы иметь одинаковую или перекрывающуюся эпитопную специфичность, как и типичное антитело, такое как антитело BR2-14a, посредством анализа конкурентного связывания или иным образом.
VII. Терапевтические Применения
Гуманизированные антитела по изобретению, отдельно или как их конъюгаты антитела LIV-1 с лекарственным средством, могут быть использованы для лечения рака. Некоторые из таких раковых заболеваний показывают детектируемые уровни LIV-1, измеренные либо на белке (напр., с помощью иммунологического анализа с использованием одного из приведенных в качестве примера антител), либо на уровене мРНК. Некоторые из таких раковых заболеваний показывают повышенные уровни LIV-1 относительно нераковой ткани того же типа, предпочтительно из того же пациента. Типичный уровень LIV-1 на раковых клетках, поддающихся лечению, составляет 5000-150000 молекул LIV-1 на клетку, хотя могут быть излечены более высокие или более низкие уровни. Необязательно, уровень LIV-1 у рака измеряется перед выполнением лечения.
Примеры раковых заболеваний, связанных с экспрессией LIV-1 и поддающихся лечению, включают рак молочной железы, рак предстательной железы, рак яичников, рак эндометрия, шейки матки, печени, желудка, почек и плоскоклеточные карциномы (напр., мочевого пузыря, головы, шеи и легких), раковые заболевания кожи, напр., меланома, мелкоклеточный рак легких или легочный карциноид. Лечение может применяться к пациентам с первичными или метастатическими опухолями этих видов. Лечение может также применяться к пациентам, которые не поддаются обычному лечению (напр., гормонами, тамоксифеном, герцептином) или у которых произошел рецидив после реакции на такое лечение. Эти способы могут также использоваться при тройных негативных раковых заболеваниях молочной железы. Тройной негативный рак молочной железы является термином уровня техники для рака без обнаруживаемых рецепторов эстрогена и прогестерона и без сверхэкспрессии HER2/neu при окрашивании антителом любого из этих рецепторов, как описано в примерах. Окрашивание может быть выполнено относительно иррелевантного контрольного антитела и в отсутствие экспрессии, показанной от фонового уровня окрашивания, является таким же или похожим для контроля в пределах экспериментальной ошибки. Аналогично, отсутствие сверхэкспрессии показано путем окрашивания при таком же или аналогичном уровне в пределах экспериментальной ошибки доброкачественные ткани молочной железы, предпочтительно полученной из того же пациента.
Альтернативно или дополнительно, тройные нативные раковые заболевания молочной железы характеризуются отсутствием реакции на гормоны, взаимодействующие с этими рецепторами, агрессивным поведением и различными схемой метастазирования.
Антитела hLIV14 могут быть использованы для лечения раковых заболеваний, которые экспрессируют LIV-1. В одном варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с LIV-1-экспрессирующим раком молочной железы. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с LIV-1-экспрессирующим раком предстательной железы. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующей LIV-1 меланомой. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком яичников. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком эндометрия. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком шейки матки. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком печени. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком желудка. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком почки. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с плоскоклеточными карциномами, экспрессирующими LIV-1 (напр., мочевого пузыря, головы, шеи и рак легких). В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком молочной железы. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с экспрессирующим LIV-1 раком кожи. В другом варианте выполнения изобретения антитело hLIV14 используется для лечения субъекта с плоскоклеточной карциномой легких или карциноидом легких, экспрессирующими LIV-1.
Антитела hLIV22 могут быть использованы для лечения раковых заболеваний, которые экспрессируют LIV-1. В одном варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком молочной железы. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком предстательной железы. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующей LIV-1 меланомой. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком яичников. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком эндометрия. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком шейки матки. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком печени. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком желудка. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком почки. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с плоскоклеточными карциномами, экспрессирующими LIV-1 (напр., мочевого пузыря, головы, шеи и рак легких). В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком молочной железы. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с экспрессирующим LIV-1 раком кожи. В другом варианте выполнения изобретения антитело hLIV22 используется для лечения субъекта с мелкоклеточной карциномой легких или карциноидом легких, экспрессирующими LIV-1.
Это применение обеспечивает первое раскрытие того, что белок LIV-1 экспрессируется на поверхности клеток меланомы. Таким образом, антитела, которые связываются с LIV-1, могут быть использованы для лечения пациентов, которые страдают меланомами, которые экспрессируют LIV-1. Такие антитела включают антитела, описанные в настоящем документе, напр., hLIV14 и hLIV22, но не ограничиваются антителами, описанными в настоящем документе.
Гуманизированные антитела, по отдельности или в виде их конъюгатов, вводят в эффективном режиме, означающем дозировку, путь введения и частоту введения, которые задерживают начало, снижают тяжесть, ингибируют дальнейшее ухудшение и/или улучшает по меньшей мере одно проявление или симптом рака. Если пациент уже страдает от рака, режим может называться терапевтически эффективным режимом. Если пациент имеет повышенный риск рака по отношению к общей популяции, но еще не испытывает симптомы, режим может называться профилактически эффективным режимом. В некоторых случаях терапевтическая или профилактическая эффективность может наблюдаться у отдельных пациентов по сравнению с историческим контролем или прошлым опытом у того же пациента. В других случаях терапевтическая или профилактическая эффективность может быть продемонстрирована в доклинических или клинических исследованиях в популяции пациентов, получавших лечение, по сравнению с контрольной популяцией пациентов, которые не получали лечение.
Типичные дозы моноклонального антитела составляют от 0,1 мг/кг до 50 мг/кг на массу тела пациента, более предпочтительно от 1 мг/кг до 30 мг/кг, от 1 мг/кг до 20 мг/кг, от 1 мг/кг до 15 мг/кг, от 1 мг/кг до 12 мг/кг или от 1 мг/кг до 10 мг/кг или от 2 мг/кг до 30 мг/кг, от 2 мг/кг до 20 мг/кг, от 2 мг/кг до 15 мг/кг, от 2 мг/кг до 12 мг/кг или от 2 мг/кг до 10 мг/кг или от 3 мг/кг до 30 мг/кг, от 3 мг/кг до 20 мг/кг, от 3 мг/кг до 15 мг/кг, от 3 мг/кг до 12 мг/кг или от 3 мг/кг до 10 мг/кг. Типичные дозы моноклонального антитела или его конъюгатов антитело-лекарственное средство составляют от 1 мг/кг до 7,5 мг/кг или от 2 мг/кг до 7,5 мг/кг или от 3 мг/кг до 7,5 мг/кг на массу тела субъекта, или 0,1-20, или 0,5-5 мг/кг массы тела (напр., 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг/кг) или 10-1500 или 200-1500 мг в качестве фиксированной дозы. В некоторых способах пациенту вводят дозу по меньшей мере 1,5 мг/кг, по меньшей мере, 2 мг/кг или по меньшей мере 3 мг/кг, введенную один раз каждые три недели или больше. Дозировка зависит от частоты введения, состояния пациента и реакции на предшествующее лечение или любого из указанного, если лечение является профилактическим или терапевтическим или расстройство является острым или хроническим, среди других факторов.
Введение может быть парентеральным, внутривенным, пероральным, подкожным, внутриартериальным, внутричерепным, интратекальным, внутрибрюшинным, местным, интраназальным или внутримышечным. Введение может также быть локализовано непосредственно в опухоли. Введение в системный кровоток путем внутривенного или подкожного введения является предпочтительным. Внутривенное введение может быть, например, путем инфузии в течение периода, такого как 30-90 мин, или путем однократной болюсной инъекции.
Частота введения зависит от времени полужизни антитела или конъюгата в кровотоке, состояния пациента и пути введения среди других факторов. Частота может быть ежедневной, еженедельной, ежемесячной, ежеквартальной или с нерегулярными интервалами в ответ на изменения в состоянии пациента или прогрессирование рака, подлежащего лечению. Типичная частота для внутривенного введения находится в интервале двух раз в неделю и ежеквартально при непрерывном курсе лечения, хотя также возможно более или менее частое дозирование. Другие типичные частоты для внутривенного введения находятся между еженедельным или три в каждые четыре недели при непрерывном курсе лечения, хотя также возможно более или менее частое дозирование. Для подкожного введения типичной частотой дозирования является от ежедневного до ежемесячного, хотя также возможно более или менее частое дозирование.
Количество введенных доз зависит от природы рака (напр., наличия острых или хронических симптомов) и реакции нарушения на лечение. При острых расстройствах или острых обострениях хронического заболевания часто достаточно от 1 до 10 доз. Иногда одной болюсной дозы, при необходимости в измельченном виде, достаточно для острого нарушения или острого обострения хронического нарушения. Лечение можно повторить при возвращениии острого нарушения или острого обострения. Для хронических нарушений антитело может быть введено через регулярные промежутки времени, напр., еженедельно, раз в две недели, ежемесячно, ежеквартально, раз в полгода в течение по меньшей мере 1, 5 или 10 лет, или жизни пациента.
Фармацевтические композиции для парентерального введения являются предпочтительно стерильными и по существу изотоническими и изготовленными в соответствии с надлежащей производственной практикой (GMP). Фармацевтические композиции могут быть представлены в единичной дозированной форме (напр., дозе для однократного введения). Фармацевтические композиции могут быть составлены с применением одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ. Составы зависят от выбранного пути введения. Для инъекции антитела могут быть приготовлены в виде водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнка, раствор Рингера, или физиологическом солевом растворе или ацетатном буфере (чтобы уменьшить дискомфорт в месте инъекции). Раствор может содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, антитела могут быть в лиофилизированной форме для восстановления перед использованием с подходящим носителем, например, стерильной апирогенной водой. Концентрация антитела в жидком составе может быть, напр., 1-100 мг/мл, такой как 10 мг/мл.
Лечение антителами по изобретению можно комбинировать с химиотерапией, радиацией, лечением стволовыми клетками, хирургией, другими способами лечения, эффективными против нарушения, подлежащего лечению. Полезные классы других агентов, которые могут быть введены с гуманизированными антителами к LIV-1, включают, например, антитела к другим рецепторам, экспрессированным на раковых клетках, антитубулиновые агенты (напр., ауристатины), связывающиеся с малой бороздкой ДНК агенты, ингибиторы репликации ДНК, алкилирующие агенты (напр., комплексы платины, такие как цисплатин, моно(платина), бис(платина) и три-ядерные комплексы платины и карбоплатин), антрациклины, антибиотики, антифолаты, антиметаболиты, химиотерапевтические сенсибилизаторы, дуокармицины, этопозиды, фторированные пиримидины, ионофоры, лекситропсины, нитрозомочевины, платинолы, предварительно образованные соединения, пуриновые антиметаболиты, пуромицины, радиационные сенсибилизаторы, стероиды, таксаны, ингибиторы топоизомеразы, винка алкалоиды и тому подобное.
Лечение с помощью гуманизированного антитела анти-LIV-1, необязательно в комбинации с любыми другими агентами, или режимы, описанные выше, отдельно или в качестве конъюгата антитела с лекарственным средством, может увеличить среднюю выживаемость без прогрессирования и общее время выживания пациентов с опухолями (напр., молочной железы, предстательной железы, меланомой), в особенности в случае рецидивирующих или рефракторных, по меньшей мере на 30% или 40%, но предпочтительно 50%, от 60% до 70% или даже 100% или больше, по сравнению с таким же лечением (напр., химиотерапией), но без антитела анти-LIV-1 отдельно или в виде конъюгата. Дополнительно или альтернативно, лечение (напр., стандартная химиотерапия), включающее антитело анти-LIV-1 одно или в виде конъюгата, может увеличить полный ответ, частичный ответ или объективный ответ (полный + частичный) пациентов с опухолями по меньшей мере, на 30% или 40%, но предпочтительно на 50%, от 60% до 70% или даже 100% по сравнению с таким же лечением (напр., химиотерапией), но без антитела анти-LIV-1.
Как правило, в клинических исследования (напр., фаза II, фаза II/III или фаза III исследований) вышеупомянутые увеличения средней выживаемости без прогрессирования и/или ответа пациентов, получавших стандартную терапию плюс гуманизированное антитело анти-LIV-1, по сравнению с контрольной группой пациентов, получавших только стандартную терапию (или плюс плацебо), являются статистически значимыми, например, при уровне р=0,05 или 0,01 или даже 0,001. Степени полного и частичного ответов определяются на основе объективных критериев, обычно используемых в клинических исследованиях рака, напр., из списка или принятых National Cancer Institute и/или Food and Drug Administration.
VIII. Другие Применения
Гуманизированные антитела анти-LIV-1 могут быть использованы для обнаружения LIV-1 в контексте клинической диагностики или лечения или исследования. Экспрессия LIV-1 на раке обеспечивает индикацию того, что рак поддается лечению антителами по настоящему изобретению. Антитела также могут быть проданы как исследовательские реагенты для лабораторного исследования по выявлению клеток, несущих LIV-1, и их реакции на различные раздражители. При таком использовании моноклональные антитела могут быть помечены флуоресцентными молекулами, спин-меченными молекулами, ферментами или радиоизотопами, и могут быть предоставлены в виде набора со всеми необходимыми реагентами для выполнения анализа на LIV-1. Антитела, описанные в настоящем документе, BR2-14a, BR2-22a и их гуманизированные версии, напр., hLIV14 и hLIV22, могут быть использованы для обнаружения экспрессии белка LIV-1 и определения, поддается ли рак лечению с помощью LIV-1 ADC. В качестве примера, BR2-14a, BR2-22a и их гуманизированные версии, напр., hLIV14 и hLIV22, могут быть использованы для обнаружения экспрессии LIV-1 на клетках рака молочной железы, клетках меланомы, клетках рака шейки клетки или клетках рака предстательной железы. Антитела могут быть также использованы для очистки LIV-1, напр., путем аффинной хроматографии.
IX. LIV-1 яванского макака
Изобретение дополнительно обеспечивает аминокислотную последовательность LIV-1 (CY LIV-1) от яванского макака в SEQ ID NO: 85 с или без сигнального пептида, который занимает приблизительно остатки 1-28 из SEQ ID NO: 85, а также нуклеиновые кислоты, которые кодируют аминокислотные последовательности. Варианты, отличающиеся вплоть до 1, 2, 3, 4 или 5 замещений, делеций или включений, также включены при условии, что варианты CY не включают природную последовательность LIV-1 человека. По аналогии с LIV-1 человека ссылка на CY-LIV-1 означает по меньшей мере внеклеточный домен белка и обычно полный белок, другой чем расщепляемый сигнальный пептид (аминокислоты 1-28). Изобретение дополнительно обеспечивает антитела, которые специфично связываются с SEQ ID NO: 85 с или без специфичного связывания с LIV-1 человека (т.е. связывания с LIV-1 человека на уровне отрицательного контрольного иррелевантного антитела). Изобретение далее относится к антителам, которые предпочтительно связывают CY-LIV-1 по сравнению с LIV-1 человека и наоборот. Предпочтительное связывание означает ассоциацию выше ошибки эксперимента и предпочтительно по меньшей мере в 2, 3 или 4 раза выше. Изобретение дополнительно обеспечивает антитела, которые показывают тот же профиль связывания для человеческого и CY LIV-1 в пределах экспериментальной ошибки, как любое из приведенных в качестве примера антител, описанные ниже. Изобретение дополнительно обеспечивает способы анализа связывания антитела к CY LIV-1. Такие способы включают контактирование антитела с CY LIV-1, определение, связывается ли антитело специфично с CY LIV-1 и необязательно определение силы связывания, такой как, как константа ассоциации.
Все поданные патенты, вебсайты, другие публикации, инвентарные номера и подобное, приведенные выше или ниже, включены посредством ссылки во всей их полноте для всех целей в такой же степени, как если бы каждый отдельный элемент был конкретно и индивидуально указан как включенная ссылка. Если разные версии последовательности связаны с инвентарным номером в разное время, имеется в виду версия, связанная с регистрационным номером на эффективную дату подачи этой заявки. Эффективная дата подачи означает более раннюю из фактической даты подачи или дату подачи приоритетной заявки со ссылкой на инвентарный номер, если это применимо. Аналогичным образом, если разные версии публикации, вебсайта или тому подобного опубликованы в разное время, это означает версию, опубликованную последней на эффективную дату подачи заявки, если не указано иное. Любой признак, стадия, элемент, вариант выполнения или аспект изобретения может быть использован в сочетании с любым другим, если не указано иное. Хотя настоящее изобретение описано более подробно путем иллюстрации и примера в целях ясности и понимания, будет очевидно, что определенные изменения и модификации могут быть осуществлены в рамках прилагаемой формулы изобретения.
ПРИМЕРЫ
I. Гуманизация BR2-14a
Материалы
Линии клеток, описанные в следующих примерах, поддерживали в культуре в соответствии с условиями, определенными American Type Culture Collection (ATCC), National Cancer Institute (NCI) или Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Germany (DMSZ). Реагенты культуры клеток были получены от Invitrogen Corp. (Carlsbad, CA.) или других поставщиков.
Методологии:
Анализы насыщенного связывания
1×105 клеток, экспрессирующих антиген (либо клетки MCF7 (АТСС), экспрессирующие LIV-1 человека, трансфицированная линия клеток СНО, экспрессирующих LIV-1 человека, либо трансфицированная линия клеток СНО, экспрессирующих цино LIV-1) аликвотировали в лунку 96-луночных планшетов с V-образным дном. Добавили меченый AlexaFluor-647 мышиный LIV-1 mAb, например, BR2-14a в концентрациях, варьирующихся от 0,66 пМ до 690 нМ, и инкубировали на льду в течение 30 минут. Клетки пеллетировали и промывали 3Х с PBS/BSA. Затем клетки пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связывания и для последующего вычисления выявленного Kd.
Анализы конкурентного связывания
1×105 клеток СНО, экспрессирующих рекомбинантный LIV-1 человека, в PBS/BSA аликвотировали в каждую лунку 96-луночных планшетов с V-образным дном на льду. Клетки инкубировали в течение 1 часа с 5 нМ меченого AlexaFluor-647 (AF) родительского мышиного LIV-1 mAb и возрастающими концентрациями (от 0,038 нМ до 600 нМ) немеченого гуманизированного LIV-1 mAb, комбинациями гуманизированных легких цепей LA-LF и гуманизированных тяжелых цепей НА-НЕ. Клетки пеллетировали и промывали 3 раза с PBS/BSA. Клетки пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связанных меченых мышиных LIV-1 mAb и для последующего экстраполирования ЕС50 путем нанесения данных на сигмоидальную кривую доза-ответ с переменным наклоном.
1×105 клеток MCF7, экспрессирующих LIV-1, в PBS/BSA аликвотировали в каждую лунку 96-луночных планшетов с V-образным дном на льду. Клетки инкубировали в течение 1 часа с 5 нМ меченого AlexaFluor-647 мышиного LIV-1 mAb и возрастающими концентрациями (от 0,038 нМ до 600 нМ) немеченого гуманизированного LIV-1 mAb, комбинациями гуманизированных легких цепей LA-LF и гуманизированных тяжелых цепей НА-НЕ. Клетки пеллетировали и промывали 3 раза с PBS. Клетки пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связанных меченых мышиных LIV-1 mAb и для последующего экстраполирования ЕС50 путем нанесения данных на сигмоидальную кривую доза-ответ с переменным наклоном.
1×105 клеток СНО, экспрессирующих рекомбинантный цино LIV-1, в PBS аликвотировали в каждую лунку 96-луночных планшетов с V-образным дном на льду. Клетки инкубировали в течение 1 часа с 5 нМ меченого AlexaFluor-647 мышиного LIV-1 mAb и возрастающими концентрациями (от 0,038 нМ до 600 нМ) немеченого гуманизированного LIV-1 mAb, комбинациями гуманизированных легких цепей LA-LF и гуманизированных тяжелых цепей НА-НЕ. Клетки пеллетировали и промывали 3 раза с PBS. Клетки пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связанных меченых мышиных LIV-1 mAb и для последующего экстраполирования ЕС50 путем нанесения данных на сигмоидальную кривую доза-ответ с переменным наклоном.
Количественный проточный цитометрический анализ
Подсчет числа копий LIV-1 на поверхностях клеток определяли с использованием мышиных LIV-1 mAb в качестве первичного антитела и косвенным анализом проточной цитометрии DAKO QiFiKit, как описано производителем (DAKO A/S, Glostrup, Denmark), и оценивали в проточном цитометре Becton Dickinson FACS®can.
Анализ цитотоксичности
Опухолевые клетки инкубировали с конъюгатами антитела LIV-1 с лекарственным средством в течение 96-144 часов при 37°С. В качестве отрицательного контроля использовали несвязывающие (Н00) ADC. Жизнеспособность клеток измеряли с помощью резазурина (Sigma) при конечной концентрации 50 мкМ. Клетки инкубировали в течение от четырех до шести часов при температуре 37°. Флуоресцентный сигнал измеряли на флуоресцентном планшетном ридере Fusion HT (Perkin Elmer, Waltham, MA). Результаты представлены в виде IC50, концентрации соединения, необходимой для получения 50%-ного снижения жизнеспособности, по сравнению с инертно-обработанными клетками (контроль = 100%).
Получение конъюгатов антитела с лекарственным средством
Конъюгаты антитела LIV-1 с лекарственным средством получали, как описано в US 20050238649. Линкеры vcMMAE (также называемые 1006) и mcMMAF (называемые 1269) оба описаны в US 20050238649. Получение цистеиновых мутантов IgG1 антител, в общем, описано в US 20100158919. US 20050238649 и US 20100158919 включены в настоящий документ посредством ссылки для всех целей.
Получение нефукозилированного анти-LIV-1 mAb
Линию клеток СНО DG44, продуцирующую гуманизированное IgG1 анти-LIV-1 моноклональное антитело, HBLB mAb (hLIV-14), культивировали при 3,0×105 клеток на мл в 30 мл культуральной среды СНО при 37°, 5% CO2 и встряхивании при 100 об/мин в 125 мл колбе для встряхивания. Среду дополнили инсулиноподобным фактором роста (IGF), пенициллином, стрептомицином и 65 мкМ 2-фторфукозы перацетатом (SGD-2084) (см. US 20090317869). Культуры подпитали на третий день 2% объема питательно среды. На четвертый день культуру разделили 1:4 в свежую культуральную среду. Культуры подпитали 6% объема производства питательной среды на дни 5, 7, 9 и 10. Кондиционированную среду собирали на день 13 путем пропускания культуры через фильтр 0,2 мкм. Очистку антитела проводили нанесением кондиционированной среды в колонку с белком А, предварительно уравновешенную 1X забуференным фосфатом физиологическим раствором (PBS), рН 7,4.
После промывания колонки 20 объемами колонки 1X PBS, антитела элюировали с помощью 5 объемов колонки элюирующего буфера IgG Immunopure (Pierce Biotechnology, Rockford, IL). К элюированной фракции добавили 10% объема 1М Tris рН 8,0. Образец диализировали в течение ночи в 1х PBS.
Антитело-зависимая клеточная цитотоксичность (ADCC)
ADCC-активность измеряли с использованием стандартного анализа высвобождения51Cr. Вкратце, опухолевые клетки-мишени MCF-7 метили 100 мКи Na51CrO4, промывали и предварительно инкубировали с тестируемыми антителами перед добавлением эффекторных (природных киллеров, NK) клеток. Клетки NK (CD16+CD56+) приготовили из неадгезивных мононуклеарных клеток периферической крови (РВМС), полученных из нормальных FcγRIIIA 158V/V доноров (Lifeblood, Memphis, TN) с иммуномагнитными шариками (EasySep, StemCell Technologies, Vancouver, ВС, Canada). Жизнеспособные клетки NK добавили к клеткам-мишеням в соотношении эффектора к клетке-мишени как 10:1. Использовали IgG1κ человека (Ancell, Bayport, MN) в качестве отрицательного контроля в этом анализе. После 4 часов инкубации супернатанты собирали и сушили в течение ночи на планшетах Лума. Затем детектировали гамма-излучение, испускаемое из лизированных MCF-7 клеток, с использованием TopCount Microplate Scintillation and Luminescence Counter (Perkin Elmer, Waltham, Massachusetts). Активность ADCC представлена в % специфичного лизиса.
Исследование активности In Vivo
В бестимусные (nu/nu) мыши (7-8 животных/группа) имплантировали опухолевые клетки, выращенные в культуре: MCF-7 из NCI (5×106 клеток в 25% матригеле), РС3 из АТСС (2.5×106 клеток в 25% матригеле) и РС3 из DSMZ (5×105 в 25% матригеле). Для in vivo роста клеток MCF-7, самки мышей также получали подкормку эстрогеном путем имплантации гранул эстрогена с замедленным высвобождением (90 день высвобождения). Начинали дозирование либо химерного, либо гуманизированного LIV-1 ADC, либо несвязывающего контрольного ADC (3 мг/кг), когда опухоли достигали 100 мм3 (q4d×4 внутрибрюшинных инъекций). Объемы опухолей контролировали с помощью калиперов и животных подвергали эвтаназии, когда объем опухоли достигал ~800 мм3. Продолжали нанесение на график кривые средних объемов опухоли продолжали в каждой группе до тех пор, пока умерщвляли одно или более животных. Все процедуры с животными проводили в рамках протокола, одобренного Institutional Animal Care and Use Committee, в учреждении, аккредитованном Association for Assessment and Accreditation of Laboratory Animal Care.
Иммуногистохимическое (IHC) окрашивание LIV-1
Способ
Опухолевые микрочипы (ТМА) и отдельные образцы опухоли были получены из коммерческих источников. Микрочипы тканей от нормальных или опухолевых фиксированных формалином и залитых парафином (FFPE) тканей были приобретены либо у US Biomax Inc., либо у Cybrdi. Замороженный чип был приобретен у BioChain. Отдельные секции были приобретены у NDRI, Asterand, Tissue Solution или CHTN. Набор из 25 залитых парафином образцов метастатического гормонорезистентного рака предстательной железы (соответствующие метастатическим сайтам в костях и мягких тканях) был предоставлена Dr. R. Vessella, University of Washington, Genitourinary Cancer Department. Все образцы обрабатывали на автоматическом окрашивателе Bond-Max™ (Leica).
IHC окрашивание тканей FFPE:
Слайды FFPE или ТМА, секционированные на предметных стеклах, депарафинизировали с использованием раствора Bond™ Dewax (Leica, cat # AR9222) при 72°C и регидратировали. Демаскирование антигена проводили с использованием Bond™ Epitope Retrieval Solution 2 на основе ЭДТА (Leica, cat # AR9640) в течение 20 мин при 95-100°С перед инкубацией с первичным мышиным LIV-1 mAb (1-2 мкг/мл в течение 30-45 минут при 25°С). Изотипически совпадающий мышиный IgG1 (Sigma; cat # M5284) использовали в качестве отрицательного контроля для фонового окрашивания. Для автоматизированного окрашивания IHC мы использовали либо набор Refine DAB, либо набор для детектирования на основе щелочной фосфатазы: набор Bond™ Polymer АР Red Detection (Leica, cat # DS9305). Слайды инкубировали с мышиными моноклональными первичными антителами против мышиного LIV-1 mAb в течение 45 мин при 1 мкг/мл с предварительным 30 мин протеиновым блоком (DAKO cat # X0909). После хромогенного развития срезы докрашивали гематоксилином и покрывали. Слайды оценивались и подсчитывались патологом и изображения получали с использованием микроскопа Zeiss Axiovert 200M (Carl Zeiss, Inc., Thornwood, NY).
IHC замороженных тканей:
5 мкм срезы замороженных/ОСТ образцов фиксировали ацетоном в течение 10 мин., сушили на воздухе в течение 30 мин и предварительно обрабатывали 20 мин с 1x Morphosave при комнатной температуре. Слайды загружали в автоматический окрашиватель Bond-Max™ (Leica) и окрашивали в течение 45 мин с первичным антителом с предварительным 30 мин протеиновым блоком (DAKO cat # X0909). IgG1 мыши (BD Pharmingen cat # 550878) использовали в качестве отрицательного контроля. Для обнаружения мы использовали набор Bond Polymer Refine на основе DAB (Leica, cat # DS9800). После хромогенного развития срезы докрашивали гематоксилином и покрывали. Слайды оценивались и подсчитывались патологом.
Результаты
1. Связывание антитела мыши
KD для моноклонального антитела LIV-1 мыши антитело BR2-14a (US 2004141983) определяли для LIV-1 человека, экспрессированного в виде эндогенного белка в линии клеток рака молочной железы человека или в виде рекомбинантного белка в линии клеток СНО. KD для мышиного LIV-1 антитела BR2-14a также определяли для цино LIV-1, экспрессированного в виде рекомбинантного белка в линию клеток СНО. MCF7 представляет собой линии клеток рака молочной железы человека. 293F представляет собой эмбриональную линию клеток почки человека. Таблица 1 показывает, что антитело имело в 5 раз меньшую константу диссоциации для нерекомбинантного LIV-1, экспрессированного из линии клеток человека, чем рекомбинантный LIV-1, в независимости от человека (hLIV-1) или от яванского макака (cyLIV-1).

2. Разработка и тестирование гуманизированных антител
Отправной точкой или донорским антителом для гуманизации в этом Примере является антитело BR2-14a мыши, продуцируемое гибридомой, имеющей инвентраный номер АТСС № РТА-5705А и описанной в US 2004141983. Подходящие акцепторные последовательности человека представляют собой геномные последовательности, обеспечиваемые VH1-02 и JH5 для тяжелой цепи и VK2-30 и JK4 для легкой цепи. Акцепторные последовательности человека показывают 68 и 85 процентную идентичность последовательностям донора в каркасе вариабельного участка. Легкая цепь CDR акцепторных последовательностей человека представляет собой тот же канонический тип, что и CDR последовательностей донора. В противоположность этому, тяжелая цепь CDR акцепторных последовательностей человека отличалась по каноническому типу (зародышевая линия была 1-3 против 1-2 для мышиного донора).
Выравнивание последовательностей донора показало одиннадцать позиций в тяжелой цепи (Н27, Н28, Н29, Н30, Н48, Н66, Н67, Н71, Н76, Н93 и Н94) и пять позиций в легкой цепи (L36, L37, L45, L46 и L39), при которых акцепторные последовательности человека отличались от последовательности донора, и что может влиять на связывание антитела как результат непосредственного контакта антигена с влиянием конформации CDR или влиянием упаковки между тяжелой и легкой цепями. Пять гуманизированных тяжелых цепей и шесть гуманизированных легких цепей были получены путем включения обратных мутаций в различные перестановки этих позиций (Фигура 1 (выравнивание последовательностей) и Таблица 2).


Гуманизированные антитела были затем экспрессированы, представляя каждую перестановку этих цепей (30 вариантов) гуманизированных тяжелых и легких цепей. Кривые связывания для рекомбинантного LIV-1 человека, экспрессированного из клеток СНО, показаны на Фигуре 2. ЕС50 отражены в Таблице 3 ниже.


Эти данные указывают на значительное отличие ЕС50 между 30 гуманизированными антителами, протестированных с HBLB и HELE, показывая по меньшей мере двухкратное улучшенное связывание, чем следующее гуманизированное антитело HBLF и более широкие пределы по сравненью с большей частью гуманизированных антител. Кривые связывания на Фигуре 2 показывают, что оба HBLB и HELE имели более сильное связывание, чем исходное антитело мыши.
Антитело HBLB было выбрано как лучшее из гуманизированных антител, поскольку оно имеет (вместе с HELE) самое сильное связывание, но меньше обратных мутаций по сравнению с HELE, причем имеют место четыре обратные мутации в HBLB и двенадцать - в HELE.
ЕС50 для гуманизированного LIV-1 mAb, которое связало LIV-1 человека, экспрессированный на клетках СНО, определяли для LIV-1 человека, экспрессированного в виде нативного белка в линии клеток MCF7 (Фигура 3). Снова LIV-1 mAb HBLB и HELE были определены как самые сильные связыватели.
Kd для HBLB к LIV-1 человека на линии клеток MCF7 определили из среднего значения нескольких кривых насыщающего связывания как 1,5 нМ, тогда как для антитела мыши - 2,9 нМ. Другими словами, антитело HBLB имеет примерно двойную аффинность для нативного LIV-1 человека как мышиное антитело. Кривая насыщенного связывания, показанная на Фигуре 4, является типичным примером.
Две формы HBLB сравнивали по связыванию с LIV-1 человека, рекомбинантно экспрессированного из клеток СНО. Одна форма была экспрессирована с IgG1 человека дикого типа и каппа константными участками. Другая форма была такой же, за исключением мутации S239C (ЕС нумерация) в тяжелой цепи IgG1 (называемой LIV-14d или HBLB S239C), которая уменьшает связывание антитела с рецепторами Fc-гамма. Кривые связывания и ЕС50 этих антител сравнивали с донорским антителом мыши, как показано на Фигуре 5. ЕС50 в обеих формах HBLB были похожи друг на друга (в пределах ошибки испытания), и обе были сильнее, чем мышиное антитело.
ЕС50 для гуманизированного LIV-1 mAb HBLB и HBLB S239C также определяли для цино LIV-1, экспрессированного в виде рекомбинантного белка в линии клеток СНО. Оба антитела связаны с равной афинностью (лучше, чем мышиный LIV-1 mAb).
Данные экспрессии для LIV-1
Мышиные LIV-1 mAb (по меньшей мере 2 для совпадения) использовали для иммуногистохимического анализа различных типов опухолей с использованием фиксированных в формалине залитых парафином тканей.

Мы наблюдали более низкую положительность LIV-1 IHC в исследованиях, проведенных с использованием тканевых микрочипов, по сравнению с крупными срезами ткани. Различие в экспрессии сильно значительно, что указывает на то, что предпочтительным является анализ экспрессии LIV-1 в больших срезах ткани. Было хорошее совпадение экспрессии при использовании по меньшей мере 2 различных анти-LIV-1 mAb. На Фигурах 6 и 7 показан высокий уровень экспрессии LIV-1 в пост-гормональных (тамоксифен или ингибиторы ароматазы) получавших лечение опухолях молочной железы и предстательной железы, обеспечивающий сильного обоснование для использования этих опухолей как мишени для LIV-1 ADC. На Фигуре 8 показана детектируемая экспрессия LIV-1 в тройных отрицательных (ER-, PgR-, Her2-) тканях рака молочной железы. Уровень экспрессии LIV-1 в тройных негативных тканях рака молочной железы посредством иммуногистохимического окрашивания был сравним с уровнем на модели животного РС3, где мы показали противоопухолевую активность LIV-1 ADC. Тройной негативный рак молочной железы представляет собой, таким образом, потенциальную таргетную популяцию, особенно тройной негативный рак молочной железы, который был найден для экспрессии LIV-1.
In vitro противоопухолевая активность hLIV-14 mAb в качестве ADC и mAb (SEA) с усиленной эффективной функцией
Противоопухолевую активность LIV-1 ADC in vitro измеряли с использованием как цитотоксических анализов (Фигура 9), так и антитело-зависимой клеточной цитотоксичности (ADCC) (Фигуры 10 и 11). Во-первых, мы провели обследование экспрессии LIV-1 в различных линиях клеток с помощью количественного анализа FACS. Линия клеток рака молочной железы MCF-7 из АТСС имела самый высокий уровень связывания LIV-1 сайты/клетка по сравнению с линией клеток MCF-7 из других источников (данные не показаны). Мы использовали эту клеточную линию для обоих in vitro анализов. Ссылаясь на Фигуру 9, различные LIV-14 ADC (антитело HBLB, конъюгированное с vcMMAE (называемым 1006) или mcMMAF (называемым 1269) (оба являются небольшими молекулами и/или линкерами, описанными в US 20050238649)), были высоко эффективны в уничтожении клеток MCF-7 по сравнению с несвязывающими и мышиными контрольными конъюгатами (mIgG-1006, mIgG-1269, hIgG-1006 и hIgG-1269). Кроме того, цистеиновые мутанты LIV-14d ADC, имеющие в среднем два линкера лекарственного средства на антитело, были также высоко эффективны в уничтожении клеток MCF-7, как измерено цитотоксическим анализом. Ссылаясь на Фигуры 10 и 11, в анализах ADCC активность фукозилированных/дикого типа (WT) mAb и ADC сравнивали с версиями усиленной эффекторной функцией (нефукозилированных mAb и ADC, называемых SEA). Результаты показали, что LIV-1 mAb и ADC с усиленной эффекторной функцией имеют хорошую ADCC активностью в отношении клеток MCF-7 по сравнению с LIV-1 mAb или ADC с неусиленной эффекторной функцией (сравнение, например, Фигура 10 hLIV-1 SEA vcMMAE c hLIV-1 vcMMAE). Обращаясь снова к Фигуре 9, эффекторная функция усиленной LIV-1 ADC (указано как SEA) также имела подобный уровень цитотоксической активности как дикого типа (не-фукозилированных) ADC (сравнение hLIV SEA-1 1006 (vcMMAE) c hLIV-1 1006 (vcMMAE)). Таким образом, на цитотоксичность может влиять как эффекторная функция, так и действие конъюгата.
In Vivo противоопухолевая активность hLIV-14 ADC
Используя модели рака молочной железы (MCF-7) и рака предстательной железы (РС-3), мы определили in vivo противоопухолевую активность LIV-1 ADC (химерное и гуманизированное (HBLB) mAb в среднем с 4 лекарственными средствами на антитело) (Фиг. 12-15). LIV-1 ADC, конъюгированные с vcMMAE, показали значительную задержку опухоли по сравнению с необработанными и контрольными ADC. По меньшей мере один полный регресс (CR) наблюдался во всех исследованиях с использованием LIV-1-vcMMAE в дозе 3 мг/кг с количеством животных, имеющих опухоли, которые были статичными или росли медленно по сравнению с контрольными группами. Ссылаясь на Фигуру 12, химерная форма родительского мышиного антитела, конъюгированного с vcMMAE, привела к полным регрессиям у 3 из 7 мышей. Ссылаясь на Фигуру 13, те же химерные ADC произвели полную регрессию в 1 из 8 мышей. Ссылаясь на Фигуру 14, гуманизированное ADC (HBLB), конъюгированное с vcMMAE (hLIV-14-vcMMAE (4)), произвело полный регресс в 1 из 8 мышей. В дополнение, цистеиновая мутантная форма антитела HBLB, линкера лекарственного средства vcMMAE, конъюгированного с каждой тяжелой цепью в положении 239, продуцирующем конъюгат со средней нагрузкой лекарственным средством в 2 линкера лекарсвтенного средства на антитело; обозначенный hLIV-14d-vcMMAE (2)) проявлял похожую активность, как и 4-нагруженная форма. Ссылаясь на Фигуру 15, гуманизированное ADC (HBLB), конъюгированное с vcMMAE (hLIV-14-vcMMAE (4)), произвело полный регресс в 1 из 8 мышей. В противоположность этому, активность двух нагруженных цистеиновых мутантов была не столь выражена в этой модели (сравнение hLIV-14-vcMMAE (4) с hLIV-14d-vcMMAE (2), и hLIV-14-mcMMAF (4) с hLIV-14d-mcMMAF (2). В итоге, эти исследования демонстрируют, что LIV-1 ADC может остановить или задержать рост рака, экспрессирующего LIV-1, включая рак молочной железы и предстательной железы.
II. Гуманизация BR2-22a
BR2-22a, иногда также называемое mAb2, представляет собой мышиное моноклональное антитело изотипа IgG1 Каппа.
Методологии:
Если иное не указано ниже, способы, описанные для гуманизации и тестирования BR2-14a, также применимы к BR2-22.
Анализы насыщающего связывания
1×105 клеток, экспрессирующих антиген (либо клетки MCF7 (АТСС), экспрессирующие LIV-1 человека, трансфицированная линия клеток СНО, экспрессирующих LIV-1 человека, либо трансфицированная линия клеток СНО, экспрессирующих цино LIV-1) аликвотировали в лунку 96-луночных планшетов с V-образным дном. Добавили меченый AlexaFluor-647 мышиный LIV-1 mAb, например, BR2-22a в концентрациях, варьирующихся от 0,66 пМ до 690 нМ, и инкубировали на льду в течение 30 минут. Клетки пеллетировали и промывали 3Х с PBS/BSA. Затем клетки пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связывания и для последующего вычисления выявленного Kd.
Анализы конкурентного связывания
1×105 клеток СНО, экспрессирующих рекомбинантый LIV-1, в PBS/BSA аликвотировали в каждую лунку 96-луночных планшетов с V-образным дном на льду. Клетки инкубировали в течение 1 часа с 5 нМ меченого AlexaFluor-647 (AF) родительского BR2-22a и возрастающими концентрациями (от 0,038 нМ до 600 нМ) немеченого гуманизированного антитела BR2-22a во всех комбинациях гуманизированных легких цепей LA-LG и гуманизированных тяжелых цепей HA-HG. Клетки пеллетировали и промывали 3 раза с PBS. Клетки затем пеллетировали и ресуспендировали в 125 мкл PBS/BSA. Флуоресценцию анализировали с помощью проточной цитометрии с использованием процента насыщенного флуоресцентного сигнала для определения процента связанных меченых гуманизированного антитела BR2-22a и для последующего экстраполирования ЕС50 путем нанесения данных на сигмоидальную кривую доза-ответ с переменным наклоном.
Исследование активности In Vivo
В бестимусные (nu/nu) мыши (7-8 животных/группа) имплантировали опухолевые клетки, выращенные в культуре: MCF-7 (NCI) при 5×106 в 25% матригеле, РС3 из АТСС (2,5×106 клеток в 25% матригеле) и РС3 из DSMZ (5×105 в 25% матригеле). Для in vivo роста клеток MCF-7, самки мышей также получали подкормку эстрогеном путем имплантации гранул эстрогена с замедленным высвобождением (90 день высвобождения). Начинали дозирование либо химерного, либо гуманизированного LIV-1 ADC, либо несвязывающего контрольного ADC (3 мг/кг), когда опухоли достигали 100 мм3 (q4d×4 внутрибрюшинных инъекций). Объемы опухолей контролировали с помощью калиперов и животных подвергали эвтаназии, когда объем опухоли достигал ~800 мм3. Продолжали нанесение на график кривые средних объемов опухоли продолжали в каждой группе до тех пор, пока умерщвляли одно или более животных. Все процедуры с животными проводили в рамках протокола, одобренного Institutional Animal Care and Use Committee, в учреждении, аккредитованном Association for Assessment and Accreditation of Laboratory Animal Care.
Краткое изложение результатов и обсуждение
Насыщенное связывание
BR2-22a показывает 94% идентичность с BR2-14a в зрелом вариабельном участке тяжелой цепи и 91% идентичность в зрелом вариабельном участке легкой цепи. KD для мышиного LIV1 из BR2-22a (Таблица 5) был определен для LIV-1 человека, экспрессированного как эндогенный белок в линии клеток рака молочной железы человека, в клетках 293F или в виде рекомбинантного белка в линии клеток СНО. KD для BR2-22a также определяли для цино LIV-1, экспрессированного как рекомбинантный белок в линии клеток СНО.

Стратегия гуманизации
Антитело BR2-22a гуманизировали с использованием акцепторной последовательности зародышевой линии VH1-02 JH5 для тяжелой цепи и акцепторной последовательности VK2-30 JK4 для легкой цепи. Эти акцепторные последовательности выбирали на основании наличия у них самой высокой идентичности в последовательности со зрелыми каркасами вариабельных участков Br2-22А тяжелых и легких цепей. Изначально были построены пять вариантов тяжелых цепей. Каждый включал три Kabat CDR из тяжелой цепи BR2-22a, причем цепи отличались по наличию от нуля (VA) до 11 (VE) обратных мутаций. Изначально были построены шесть вариантов легких цепей. Каждый включал три Kabat CDR из легкой цепи BR2-22a и от нуля (LA) до четырех обратных мутаций (LF). Эти обратные мутации были выбраны в результате моделирования антитела BR2-22A для идентификации положений с потенциалом к взаимодействию непосредственно с антигеном, влиянию конформации CDR или влиянию взаимодействия между тяжелой и легкой цепями, и на основании предшествующего опыта по гуманизации BR2-14a из-за высокой идентичности в последовательности между BR2-14a и BR2-22a. Действительно, те же одиннадцать положений в тяжелой цепи и те же четыре позиции в легкой цепи считались как обратныу мутации в обоих BR2-14a и BR2-22a (L39 не считалась в BR2-22a, так как мышиный остаток является таким же, как остаток человека). Обратные мутации, присутствующие в каждом варианте гуманизированного BR2-22a, показаны в Таблицах 6 и 7 ниже.



Полная последовательность зрелого вариабельного участка каждого варианта показана на Фигурах 16А и 16В.
Все перестановки этих пяти тяжелых цепей и шести легких цепей затем протестировали в конкурентном анализе по сравнению с BR2-22a (см. Фигуру 17). Неожиданно, с учетом опыта с антителом BR2-14a, в котором улучшенное связывание относительно антитела мыши было получено только с четырьмя обратными мутациями и дополнительные обратные мутации необязательно повышали связывающую аффинность, только комбинация гуманизированных цепей, которая показала связывающую аффинность, приблизительную со связывающей аффинностью BR2-22a, представляла собой HELF с 15 обратными мутациями. Другие перестановки показали плохое или незначительное связывание с LIV-1. EC50 различных перестановок показаны в Таблице 8 ниже.


Хотя HELF показывает удовлетворительное связывание, антитело содержит в общей сложности 15 обратных мутаций, число большее, чем идеальное относительно потенциальной иммуногенности. Таким образом, цепи НЕ и LF были систематически изменены для проверки эффекта удаления отдельных обратных мутаций. На Фигуре 18 показаны протестированные варианты. Каждая LF-1 до LF-4 отличается от LF отсутствием различной обратной мутации, присутствующей в LF. Подобно этому, в НЕ-1 до HE-11 отсутствует одна из обратных мутаций, присутствующих в НЕ. На Фигуре 19 сравниваются LF-1 до LF-4 (каждая в паре с НЕ). На Фигуре 19 показано, что LF-2 и LF-3 теряют существенную связывающую аффинность по отношению к LF (указаны как первоначальный контроль HELF на графике), тогда как LF-1 и LF-4 - нет. Сделан вывод, что обратные мутации L36 и L46 вносят существенный вклад в сохранение связывающей аффинности, в то время как без обратных мутаций в положениях L37 и L45 можно обойтись без значительного влияния на связывание. На Фигуре 20 показаны подобные кривые связывания для вариантов НЕ. На Фигуре 20 показано, что HE-11 теряет большую часть своего связывания, показывая, что обратная мутация в положении Н94 имеет наибольшее влияние на связывающую аффинность протестированных обратных мутаций. Потеря обратных мутаций в положениях Н27, Н29 и Н30 также вызвала значительную потерю аффинности. Роль Н30 можно объяснить с помощью мышиного остатка, являющегося результатом соматической мутации. Потеря обратной мутации в положении Н76 вызвала некоторую потерю аффинности. Без других обратных мутаций в положениях Н28, Н48, Н66, Н67, Н71 и Н93 с небольшим влиянием или отсутствием влияния на связывающую аффинность можно обойтись.
В свете этих экспериментов, тяжелые цепи HF и HG были построены как легкая цепь LG. HF включала обратные мутации в Н27, Н29, Н30 и Н94, и HG включала эти мутации и обратную мутацию в Н76. LG содержит обратные мутации в L36 и L46. Несколько перестановок HF, HG, LE и LF были протестированы для конкурентного связывания, как показано на Фигуре 21, и все показали связывание в пределах фактора трех из тех BR2-22a мыши.
В свете этого эксперимента, HGLG было выбрано для дальнейших экспериментов как представляющее наилучшее сочетание связывающей аффинности и наименьших обратных мутаций. Это антитело далее называется hLIV22. Насыщение связывающей аффинности hLIV22 для LIV-1 человека и цино LIV-1, экспрессированных из клеток СНО, показано на Фигуре 22 в сравнении с hLIV14. На Фигуре 22 показано, что hLIV22 имеет в около четырех раз более высокую аффинность (обратная константа диссоциации) для LIV-1 человека, чем для hLIV14. Кроме того, аффинность hLIV22 для LIV-1 человека такая же в пределах ошибки эксперимента, как его аффинность к цино LIV-1, тогда как hLIV14 показывает двойную аффинность для LIV-1 человека, как для цино LIV-1. Аффинность hLIV22 для человеческого LIV-1 такая же в пределах экспериментальной ошибки, что и для родительского мышиного антитела, BR2-22a.
In vitro противоопухолевая активность hLIV22 ADC
Противоопухолевую активность hLIV22 ADC in vitro измеряли с использованием анализов цитотоксичности. Во-первых, мы провели обследование экспрессии LIV-1 в различных линиях клеток с помощью количественного анализа FACS. Линия клеток рака молочной железы MCF-7 из АТСС имела самый высокий уровень связывания сайты/клетка LIV-1 по сравнению с линией клеток MCF-7 из других источников (данные не показаны). Мы использовали эту линию клеток для in vitro анализов. Мы наблюдали, что различные hLIV22 ADC (конъюгированные с vcMMAE (называемые 1006) или mcMMAF (называемыее 1269) (оба малые молекулы, описанные в US 2005-0238649)), были высоко эффективны в уничтожении клеток MCF-7, что измерено in vitro цитотоксическим анализом. На Фигурах 23 и 24 сравниваются hLIV22, конъюгированные с 1006 или 1269, с несвязывающим контрольным антителом, конъюгированным с 1006 или 1269.
In vivo противоопухолевая активность LIV-1 ADC
Используя модели рака предстательной железы (РС-3) и рака молочной железы (MCF-7), как показано на Фигурах 25 и 26, мы определили противоопухолевую активность hLIV22 ADC (в среднем 4 лекарственных средства на антитело) in vivo. hLIV22 ADC, конъюгированные с vcMMAE, показали значительную задержку опухоли по сравнению с необработанными и контрольными ADC. Наблюдалось несколько полных регрессий в исследования MCF-7 с использованием hLIV22-vcMMAE в дозе 3 мг/кг. Дополнительно, во всех исследованиях был ряд животных, которые имели опухоли, которые были статическими или росли медленно по сравнению с контрольными. Эти исследования демонстрируют, что hLIV22 ADC может остановить или задержать рост рака, экспрессирующего LIV-1, включая рак молочной железы и предстательной железы. На Фигуре 27 сравнивается активность hLIV22 ADC и hLIV14 ADC на модели MCF-7. Хотя оба антитела были эффективными, hLIV22 был немного более эффективным.
hLIV22 ADC также были протестированы на модели рака шейки матки. Для анализа использовали модель ксенотрансплантата клеток HeLA. После роста опухоли до подходящего размера животным вводили hLIV22, конъюгированный с vcMMAE, в дозе 3 мг/кг и 1 мг/кг. Контрольный конъюгат антитела вводили в дозе 3 мг/кг. Полная и частичная регрессия наблюдались у животных, которые получили 3 мг/кг конъюгата hLIV22 vcMMAE. (Данные не показаны). Таким образом, антитела LIV-1 и конъюгаты антител с лекарственным средством могут быть использованы для лечения рака шейки матки, экспрессирующего LIV-1.
III. Лечение рака кожи с использованием антител анти-LIV-1
Экспрессия белка LIV-1 на образцах опухоли меланомы
Образцы меланомы от пациентов оценивали на экспрессию LIV-1 с использованием окрашивания IHC. Слайды FFPE депарафинизировали с использованием раствора Bond™ Dewax (Leica, cat # AR9222) при 72°С. Демаскирование антигена проводили с использованием Bond™ Epitope Retrieval Solution 2 на основе ЭДТА (Leica, cat # AR9640) в течение 20 мин при 100°С. Для окрашивания IHC мы использовали набор для детектирования на основе щелочной фосфатазы: набор Bond™ Polymer Red Detection (Leica, cat # DS9390). Слайды инкубировали с мышиными моноклональными первичными антителами против LIV-1 (BR2-14a) в течение 45 мин при 1 мкг/мл с предварительным 30 мин протеиновым блоком (DAKO cat # Х0909). Мышиный IgG1 (Sigma; cat # M5284) использовали в качестве отрицательного контроля. После хромогенного развития срезы докрашивали гематоксилином и покрывали. Слайды оценивались и подсчитывались патологом.
Результаты показаны на Фигуре 28. Семьдесят два процента испытуемых образцов меланомы от пациентов (21/29) оказались положительными на экспрессию LIV-1. Это означает, что ингибиторы LIV-1, напр., антитела анти-LIV-1, могут быть использованы для лечения меланомы.
In vivo анти-меланомная активность LIV-1 ADC
В бестимусную (nu/nu) мышь (7-8 животных/группа) имплантировали 10×106 клеткок SK-MEL-5 (линия клеток, полученная из меланомной опухоли), выращенные в культуре. Опухолям позволили вырасти in vivo до 100 мм3 при измерении с использованием штангенциркуля. Гуманизированные LIV-1 ADC, напр., hLIV14 или hLIV22, вводят в дозе 3 мг/кг. Нагруженные лекарственным средством конъюгаты представляют собой, напр., vcMMAE или mcMMAF. Контрольные ADC также вводили контрольным животным в дозе 3 мг/кг. АЦП вводили как q4d×4 внутрибрюшинные инъекции. Объемы опухолей контролировали с помощью калиперов и животных подвергали эвтаназии, когда объем опухоли достигал ~800 мм3. Введение hLIV14 ADC или hLIV22 ADC значительно снижает рост опухоли у животных по сравнению с животными, получавшими контрольные ADC.
Реферат
Изобретение относится к области биохимии, в частности к гуманизированному антителу, которое специфично связывается с LIV-1, а также к нуклеиновой кислоте, кодирующей зрелый вариабельный участок тяжелой цепи и к нуклеиновой кислоте, кодирующей зрелый вариабельный участок легкой цепи вышеуказанного антитела. Также раскрыт конъюгат вышеуказанного гуманизированного антитела с цитотоксическим или цитостатическим агентом для лечения или профилактического лечения рака, связанного с экспрессией LIV-1. Изобретение также относится к способу лечения или профилактического лечения пациента, имеющего рак или подверженного риску рака, связанного с экспрессией LIV-1, а также к фармацевтической композиции для лечения или профилактического лечения рака, связанного с экспрессией LIV-1. Изобретение позволяет эффективно осуществлять лечение или профилактическое лечение рака, связанного с экспрессией LIV-1. 6 н. и 15 з.п. ф-лы, 28 ил., 8 табл., 3 пр.

Комментарии