Конъюгаты антитело-уреаза для терапевтических целей - RU2689689C2
Код документа: RU2689689C2
Чертежи






Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании даты подачи предварительной заявки США № 62/107210, поданной 23 января 2015 года. Указанная заявка включена в настоящее описание путем ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит список последовательностей, представленный в электронном виде в формате ASCII, который полностью включен в настоящее описание путем ссылки. Указанная копия ASCII, созданная 14 января 2016 года, называется 105013-1610_SL.txt и имеет размер 11000 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Настоящее изобретение предоставляет конъюгаты антитело-уреаза, которые можно использовать в терапии. Более конкретно, изобретение относится к терапевтическим конъюгатам, содержащим одно или несколько антител, конъюгированных с уреазой, к содержащим их композициям, а также к способам их применения и получения.
УРОВЕНЬ ТЕХНИКИ
[0004] Уреаза представляет собой фермент, который катализирует гидролиз мочевины с образованием диоксида углерода и амиака. Более конкретно, уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата, а указанный карбамат разлагается в результате спонтанного гидролиза с образованием другой молекулы аммиака и карбоновой кислоты. В данной связи активность уреазы способствует повышению рН местной среды в результате образования аммиака, который представляет собой основную молекулу, обладающую общей токсичностью.
[0005] Концепция применения антител, специфичных к опухолеассоциированным антигенам, для лечении рака проверялась в течение некоторого времени (Herlyn et al., (1980) Cancer Research 40, 717). Уреаза обеспечивает токсичный компонент, которым является щелочная среда, образующаяся в результате ферментативной деградации мочевины, кроме того, используют фрагменты антител, обладающие высоким сродством.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Технология настоящего изобретения направлена на конъюгат антитело-уреаза. Настоящее изобретение предоставляет фармацевтическую композицию, содержащую фармацевтически приемлемый водный раствор, подходящий для внутривенного введения, и конъюгат антитело-уреаза, которая практически не содержит уреазу, неконъюгированное антитело и/или неводные растворители, используемые для ВЭЖХ.
[0007] В некоторых аспектах конъюгат характеризуется коэффициентом конъюгации, составляющим 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 фрагментов антитела на фрагмент уреазы. В некоторых аспектах конъюгат характеризуется коэффициентом конъюгации, составляющим примерно 6 или более фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат характеризуется коэффициентом конъюгации, составляющим 6, 7, 8, 9, 10, 11 или 12 фрагментов антитела на фрагмент уреазы. В некоторых аспектах конъюгат характеризуется коэффициентом конъюгации, составляющим 8, 9, 10, 11 или 12 фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат характеризуется средним коэффициентом конъюгации, составляющим примерно 6 или более фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат характеризуется средним коэффициентом конъюгации, составляющим примерно 8-11 фрагментов антител на фрагмент уреазы. В некоторых аспектах уреаза представляет собой уреазу бобовых.
[0008] В некоторых аспектах антитело представляет собой гуманизированное или нечеловеческое антитело. В некоторых аспектах молекулярная масса антитела составляет примерно от 5 кДа до 200 кДа. В некоторых аспектах молекулярная масса антитела составляет примерно от 5 кДа до 50 кДа. В некоторых аспектах антитело представляет собой однодоменное антитело. В некоторых аспектах размер однодоменного антитела составляет не более 110 аминокислотных остатков, или примерно от 90 до 130 аминокислотных остатков. В некоторых аспектах молекулярная масса однодоменного антитела составляет примерно от 10 кДа до 50 кДа. В некоторых аспектах молекулярная масса однодоменного антитела составляет примерно от 12 кДа до 15 кДа. В некоторых аспектах антитело обладает специфичностью к антигену опухолевой клетки. В некоторых аспектах антитело обладает специфичностью к опухолевому антигену, экспрессируемому клетками немелкоклеточной карциномы легкого. В некоторых аспектах антитело обладает специфичностью к CEACAM6.
[0009] В некоторых аспектах антитело обладает сродством к CEACAM6, характеризующимся значением Kd, которое не превышает примерно 1×10-6 M. В некоторых аспектах конъюгат обладает сродством к CEACAM6, характеризующимся значением Kd, которое не превышает примерно 1×10-8 M. В некоторых аспектах конъюгат обладает сродством к CEACAM6, характеризующимся значением Kd, которое не превышает примерно 1×10-10 M. В некоторых аспектах конъюгат обладает сродством к CEACAM6, характеризующимся значением IC50, которое не превышает примерно 5 нМ. В некоторых аспектах значение IC50 составляет примерно от 3 нМ до 5 нМ. В некоторых аспектах значение IC50 составляет примерно 3,22 нМ. В некоторых аспектах конъюгат связывает CEACAM6 со значением IC50 примерно от 10 мкг/мл до 30 мкг/мл. В некоторых аспектах конъюгат связывает CEACAM6 со значением IC50 примерно 20 мкг/мл.
[0010] В некоторых аспектах антитело содержит полипептид, имеющий аминокислотную последовательность SEQ ID NO. 1. В некоторых аспектах антитело содержит полипептид, аминокислотная последовательность которого содержит по меньшей мере одно изменение по сравнению с SEQ ID NO. 1.
[0011] Технология настоящего изобретения предоставляет способ лечения рака у индивидуума, нуждающегося в этом, включающий введение индивидууму терапевтически эффективного количества описанной здесь композиции, обеспечивающего лечение рака у индивидуума.
[0012] В некоторых аспектах рак представляет собой одно или несколько заболеваний, выбранных из немелкоклеточной карциномы легкого, рака молочной железы, поджелудочной железы, яичника, легкого, толстой кишки, или их сочетания. В некоторых аспектах рак представляет собой немелкоклеточную карциному легкого. В некоторых аспектах индивидуум представляет собой человека.
[0013] Технология настоящего изобретения предоставляет способ получения композиции, содержащей конъюгат антитело-уреаза и по существу не содержащей уреазу, причем этот способ включает объединение активированного антитела и уреазы в водном буфере, имеющем рН примерно 6,0-7,0, например примерно 6,5, доведение pH до 8,0-9,0, например примерно до 8,3, с получением конъюгата антитело-уреаза и очистки конъюгата антитело-уреаза, где способ не включает стадию хроматографической очистки, такой как широко используемые хроматографические способы очистки белков, например гель-хроматография (SEC), ионообменная хроматография, аффинная хроматография, афинная хроматография с использованием иммобилизованных металлов, иммуноаффинная хроматография, хроматография с адсорбцией жидкости на твердом веществе, хроматография с гидрофобным взаимодействием (HIC), хроматография на обращенной фазе (RPC), высокоэффективная жидкостная хроматография (ВЭЖХ) и т.д. В некоторых аспектах конъюгат антитело-уреаза очищают ультрадиафильтрацией.
[0014] В некоторых аспектах конъюгат антитело-уреаза характеризуется коэффициентом конъюгации 8-11 фрагментов антител на фрагмент уреазы. В некоторых аспектах буфер, имеющий рН примерно 6,5, представляет собой натрий-ацетатный буфер. В некоторых аспектах рН доводят примерно до 8,3 путем добавления раствора бората натрия.
[0015] Технология настоящего изобретения предоставляет способ повышения сродства антитела к опухолевому антигену, включающий конъюгирование нескольких молекул антител с молекулой уреазы с образованием конъюгата антитело-уреаза, где сродство конъюгата к опухолевому антигену по меньшей мере примерно в 100 раз превышает сродство неконъюгированного антитела.
[0016] В некоторых аспектах антитело представляет собой гуманизированное или нечеловеческое антитело. В некоторых аспектах антитело представляет собой однодоменное антитело. В некоторых аспектах опухолевый антиген экспрессируется клетками немелкоклеточной карциномы легкого. В некоторых аспектах антитело обладает специфичностью к CEACAM6.
[0017] Технология настоящего изобретения также предоставляет набор, содержащий описанную здесь композицию и инструкции по применению композиции.
[0018] Эти и другие аспекты изобретения более подробно описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
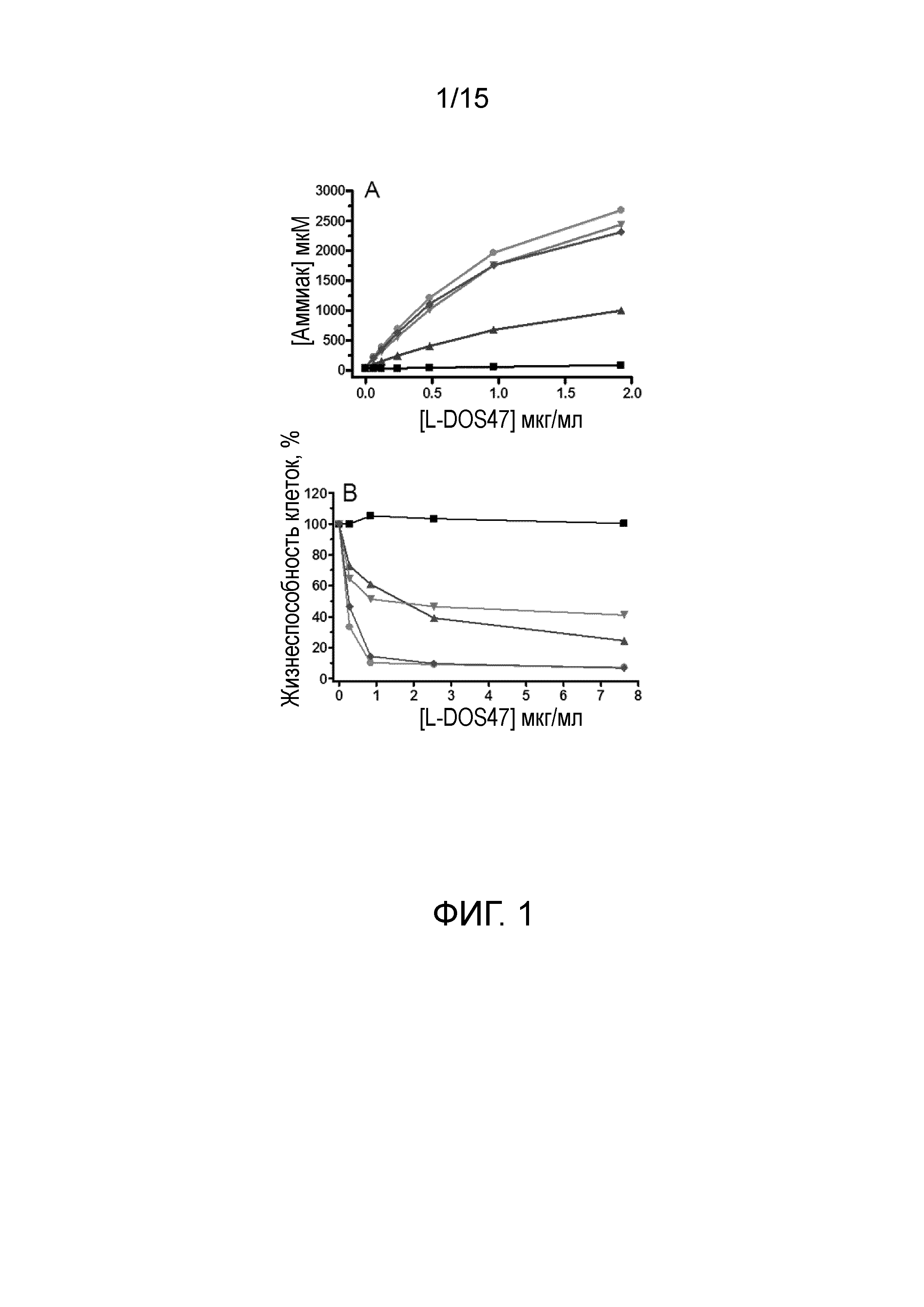
[0019] На фиг.1А-В изображены результаты исследований связывания и цитотоксичности L-DOS47 на линиях раковых клеток. (A) Непосредственное связывание L-DOS47 с пятью линиями раковых клеток: BxPC-3, Capan-1, ZR-75-30, LS174T и MDA-MB231. Сигнал, свидетельствующий о наличии связывания, представлял собой количество аммиака, образующегося при инкубации с 20 мМ мочевиной. L-DOS47 хорошо связывается с клетками BxPC-3 (●), Capan-1 (▼) и ZR-75-30 (◆), умеренно связывается с клетками LS174T (▲) и не связывается с клетками MDA-MB231 (■). Кроме того, отсутствует связывание соответствующих клеточных линий с неконъюгированным контролем DOS47 (данные не показаны), позволяя предположить, что связывание L-DOS47 является специфическим и обуславливается фрагментом антитела. (B) L-DOS47 индуцирует цитотоксический эффект в линиях раковых клеток после добавления 20 ммоль мочевины. В клетках MDA-MB231 никакие эффекты не наблюдаются (■), что согласуется с результатами исследования связывания. BxPC-3 (●) и ZR-75-30 (◆) являются очень чувствительными к L-DOS47, тогда как в клетках Capan-1 (▼) и LS174T (▲ обнаружены лишь умеренные эффекты.
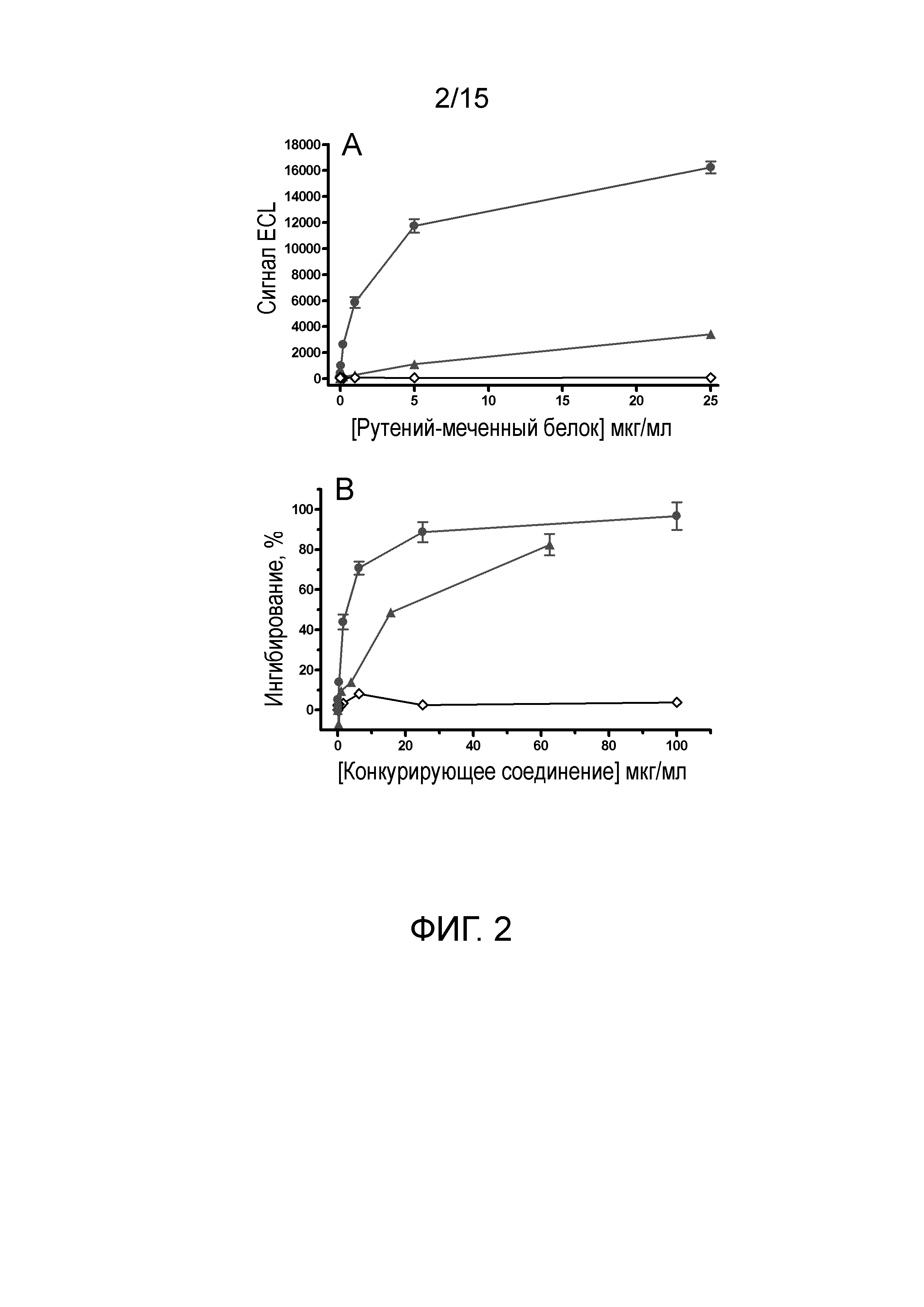
[0020] На фиг.2А-В показаны результаты анализа непосредственного и конкурентного связывания L-DOS47, DOS47 и антитела AFAIKL2 с клетками BxPC-3. (A) Связывание меченного рутением L-DOS47, антитела AFAIKL2 и неконъюгированного DOS47 с клетками BxPC-3. С помощью электрохемилюминесцентного анализа можно непосредственно измерить связывание L-DOS47 и антитела AFAIKL2 с клетками BxPC-3. Антитело AFAIKL2 дает слабый сигнал связывания (▲), тогда как L-DOS47 индуцирует гораздо более сильный сигнал связывания (●) вследствие авидности нескольких антител AFAIKL2, входящих в состав конъюгата. Связывание с отрицательным контролем DOS47 отсутствует (↓). (B) L-DOS47-метка конкурирует за связывание с клетками BxPC-3 с L-DOS47, антителом AFAIKL2 или DOS47. Кажущееся сродство L-DOS47 и антитела AFAIKL2 можно сравнить посредством IC50 (количество конкурирующего соединения, необходимое для уменьшения связывания на 50%) тестируемых соединений. Определяют значения IC50 для L-DOS47 (●) и антитела AFAIKL2 (▲), которые составляют 2 и 20 мкг/мл (или 3,22 нМ и 1,55 мкМ) соответственно, свидетельствуя о том, что сродство L-DOS47 примерно в 500 раз превышает сродство антитела AFAIKL2. Отрицательный контроль DOS47 не вызывает ингибирование (↓). Результаты представлены в виде среднего значения от нескольких (n=3) типичных экспериментов.
[0021] На фиг.3А-С изображены результаты, иллюстрирующие повышенную экспрессию и нокдаун гена CEACAM6. (A) Связывание L-DOS47 с CEACAM6-трансфицированными клетками H23. Популяцию обогащают трансфицированной клеточной линией (▲) путем сортировки клеток методом FACS наряду с применением повышенного количества антибиотика, используемого для селекции. Профиль связывания по сравнению с нативными клетками H23 (⃝) и клетками A549 (ρ) демонстрирует, что CEACAM6 экспрессируется в трансфицированных клетках на более низком уровне, чем в клетах A549. (B) Анализ цитотоксичности L-DOS47 в отношении клеток H23, трансфицированных CEACAM6. Сверхэкспрессия CEACAM6 в клетках H23 (▲) значительно повышает их чувствительность к цитотоксичности L-DOS47 по сравнению с BxPC-3 (●), A549 (ρ) и нативными клетками H23 (⃝). Интересно, что трансфицированные клетки H23 являются более чувствительными к цитотоксичности L-DOS47, чем клетки A549 и BxPC-3, несмотря на более слабое связывание L-DOS47, обнаруженное в (A). (C) Связывание L-DOS47 с клетками BxPC-3, несущими нокдаун гена CEACAM6. Интенсивный сигнал связывания наблюдается в нативных (●) и контрольных (HUSH-TR3 ▲) клетках BxPC-3. Однако связывание L-DOS47 уменьшается после сайленсинга гена CEACAM6 под действием кшРНК (HUSH#6 ▼ и HUSH#7 ρ), свидетельствуя о том, что CEACAM6 является поверхностным антигеном, распознаваемым конъюгатом, содержащим антитела. Результаты представлены в виде среднего значения от нескольких (n=3) типичных экспериментов. Стандартное отклонение (SD) составляет менее 10% для всех значений.
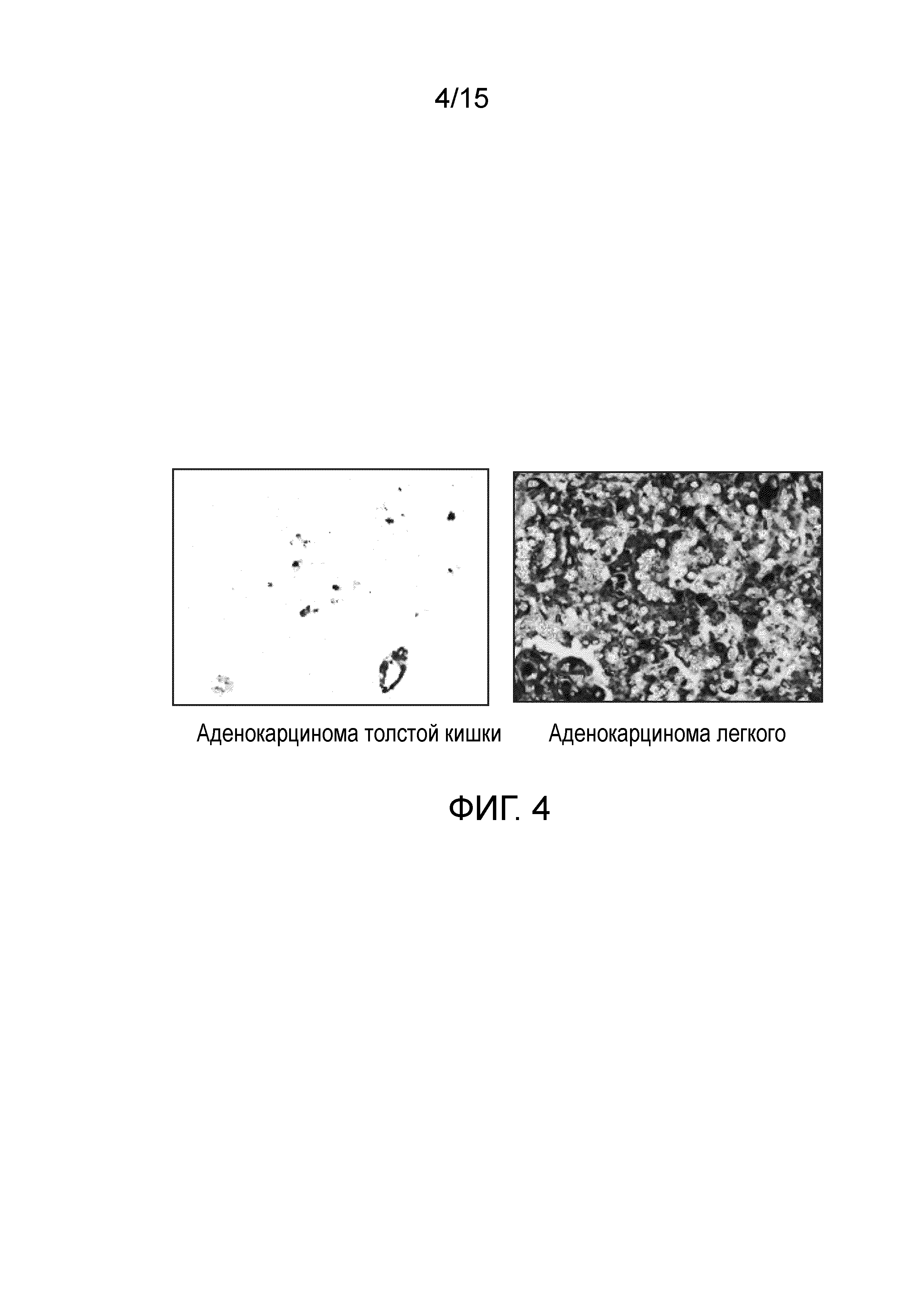
[0022] На фиг. 4 изображены результаты иммуногистохимического окрашивания аденокарциномы толстой кишки и легких человека с использованием L-DOS47. Положительное окрашивание отмечено темным цветом.
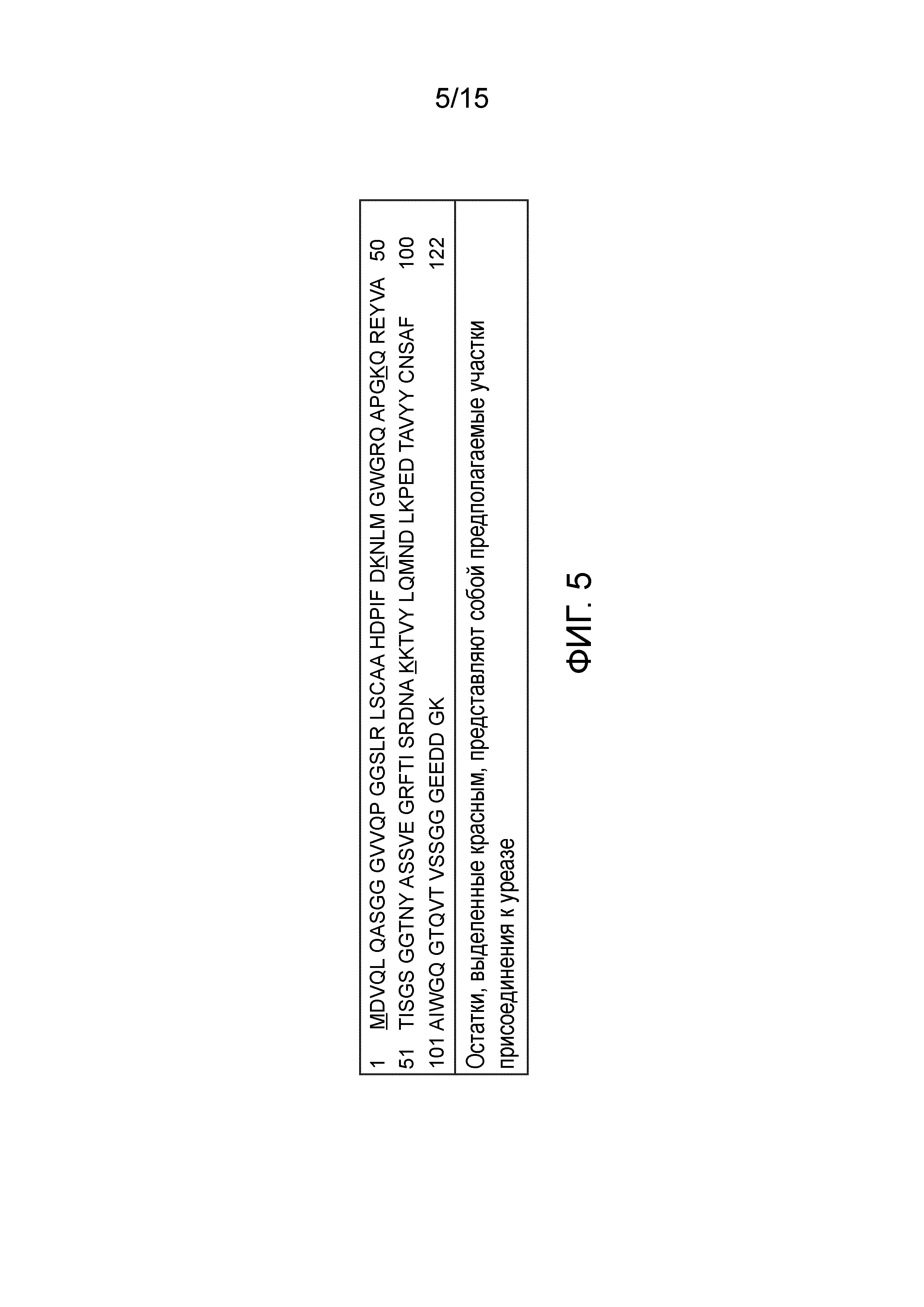
[0023] На фиг. 5 изображена аминокислотная последовательность антитела AFAIKL2 (SEQ ID NO: 1).
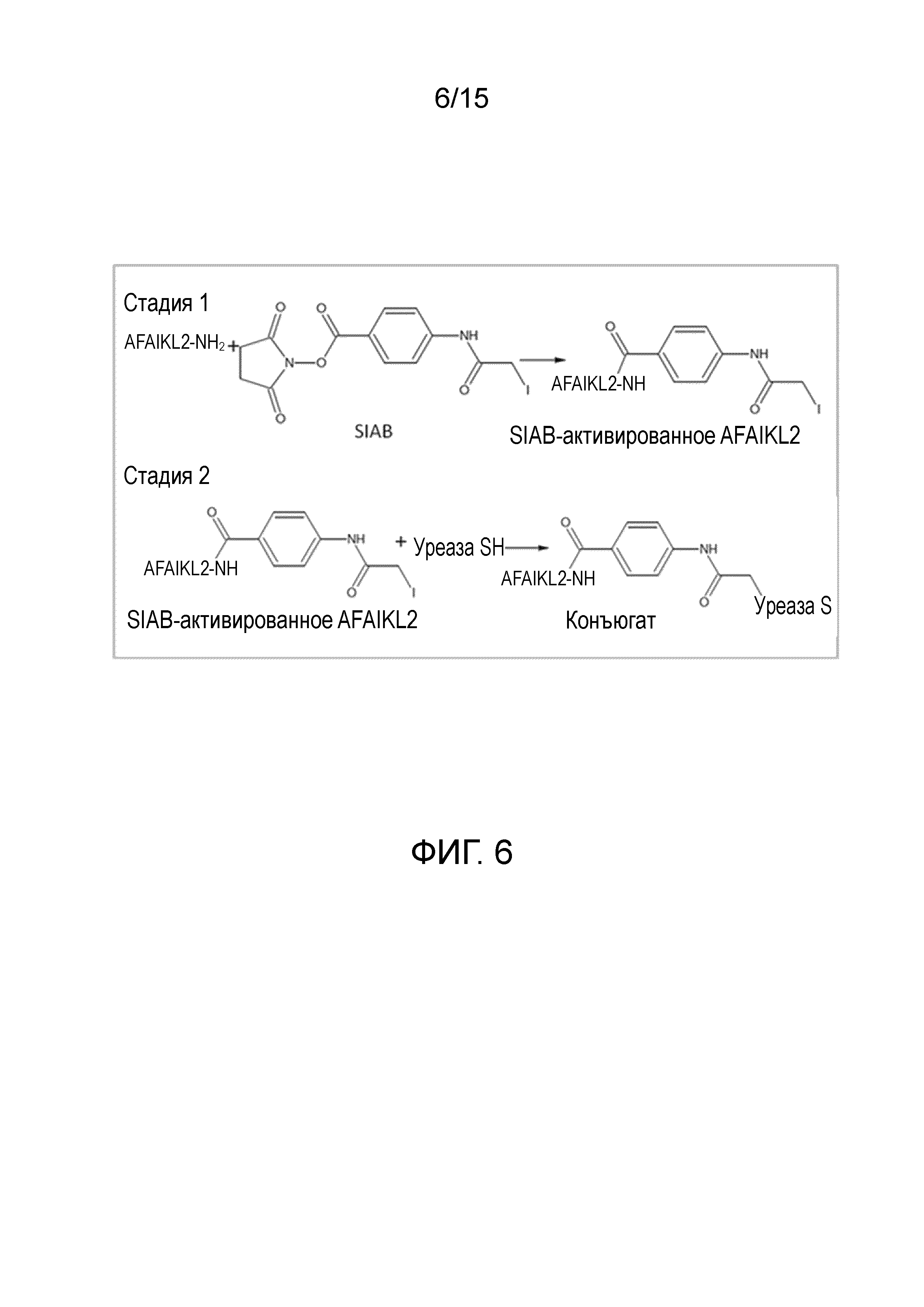
[0024] На фиг. 6 показан синтез конъюгата L-DOS47 путем двухстадийной реакции. На стадии 1 проводят активацию антитела с использованием SIAB, а на стадии 2 проводят конъюгацию активированного антитела с ферментом уреазой с образованием биоконъюгата L-DOS47.
[0025] На фиг. 7 показаны результаты гель-хроматографии пустой композиции, AFAIKL2, высокочистой уреазы (HPU) и конъюгата L-DOS47. Очень маленький пик димера наблюдается для каждого компонента перед пиками соответствующих мономеров. Пустая композиция содержит 10 мМ гистидин, 1% сахарозы, 0,2 мМ ЭДТА, рН 6,8.
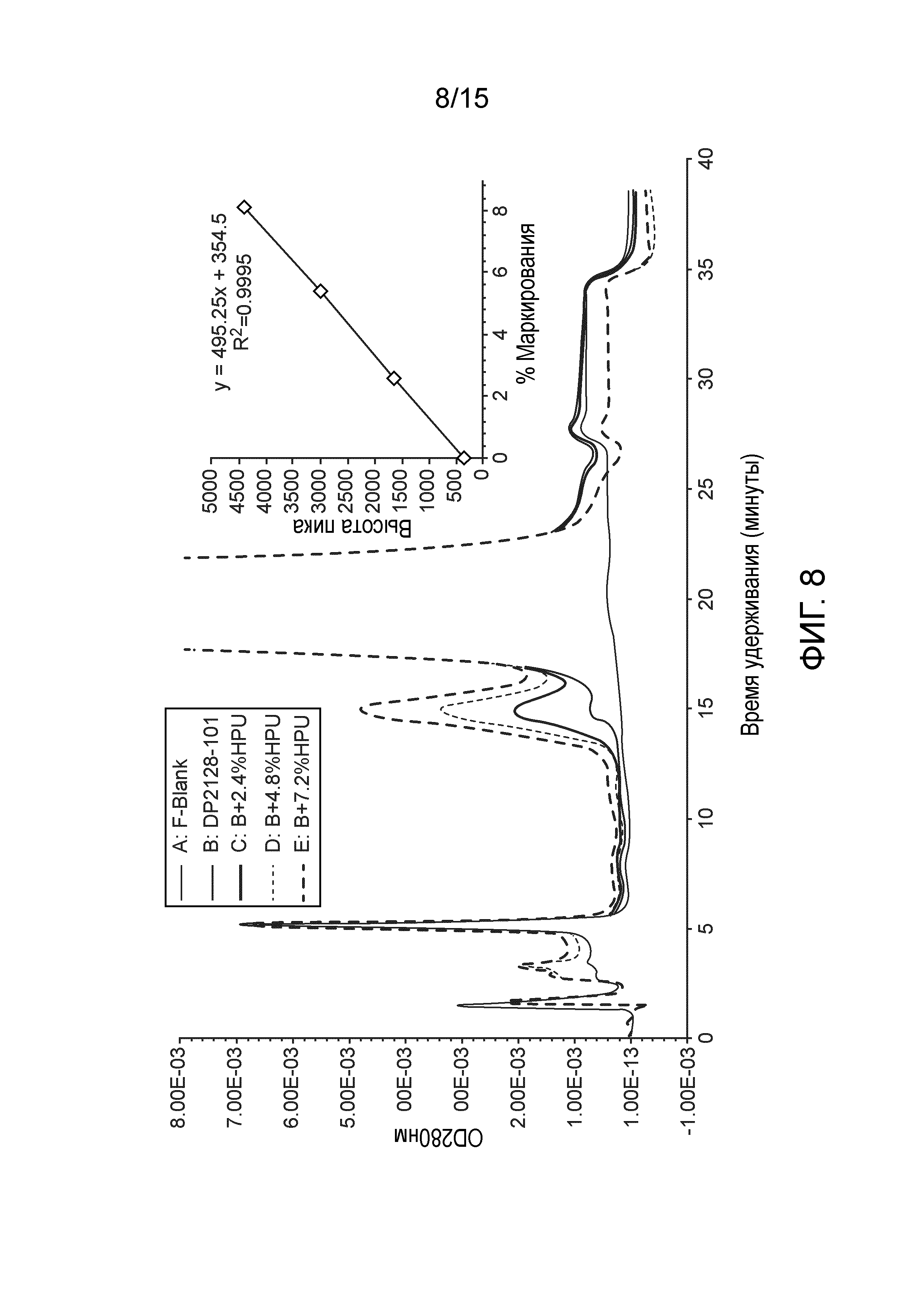
[0026] На фиг. 8 показаны результаты ионообменной хроматографии пустой композиции (A), композиции L-DOS47 (B) и композиции L-DOS47, содержащей 2,4% (C), 4,8% (D) и 7,2% (E) уреазы HP (HPU). Пустая композиция содержит 10 мМ гистидин, 1% (мас./об.) сахарозы, 0,2 мМ ЭДТА, рН 6,8.
[0027] На фиг. 9 изображен иллюстративный снимок окна Experion SDS. Панель 1: наложение электрофореграмм полос 2 и 4. Панель 2: полоса 1, шкала молекулярных масс (MW); полосы 1, 2, 7 и 8: L-DOS47, полученный с использованием активированного AFAIKL2, дополнительно очищенного методом IEC; полосы 3-6: L-DOS47, полученный с использованием AFAIKL2, не подвергавшегося дополнительной очисте методом IEC; полосы 9 и 10, HPU. На панели 1 номера 2-14 по оси x представляют собой номера пиков, присутствующих на электроферограмме полосы 1; 3* обозначает пик маркера с наименьшей молекулярной массой, а 14* обозначает пик маркера с наивысшей MW, используемых в качестве внутренних стандартов MW.
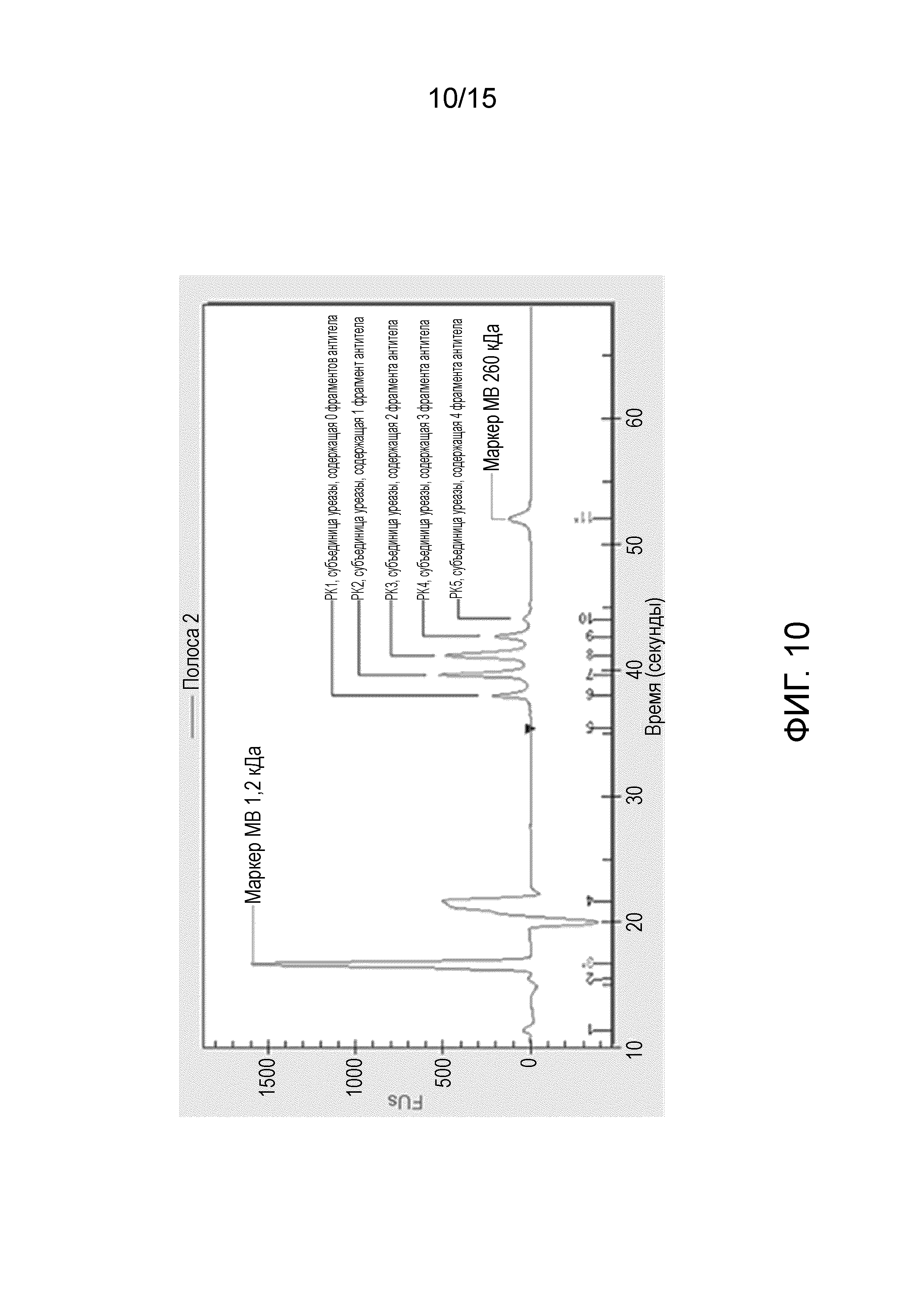
[0028] На фиг. 10 изображена электрофореграмма L-DOS47 (полоса 2 на фиг. 9), на которой можно видеть отдельные пики субъединиц уреазы, связанных с 0-4 молекулами антитела. Номера 1-11 по оси x представляют собой номера пиков; 3* обозначает пик маркера с наименьшей молекулярной массой, а 11* обозначает пик маркера с наивысшей MW, используемых в качестве внутренних стандартов MW.
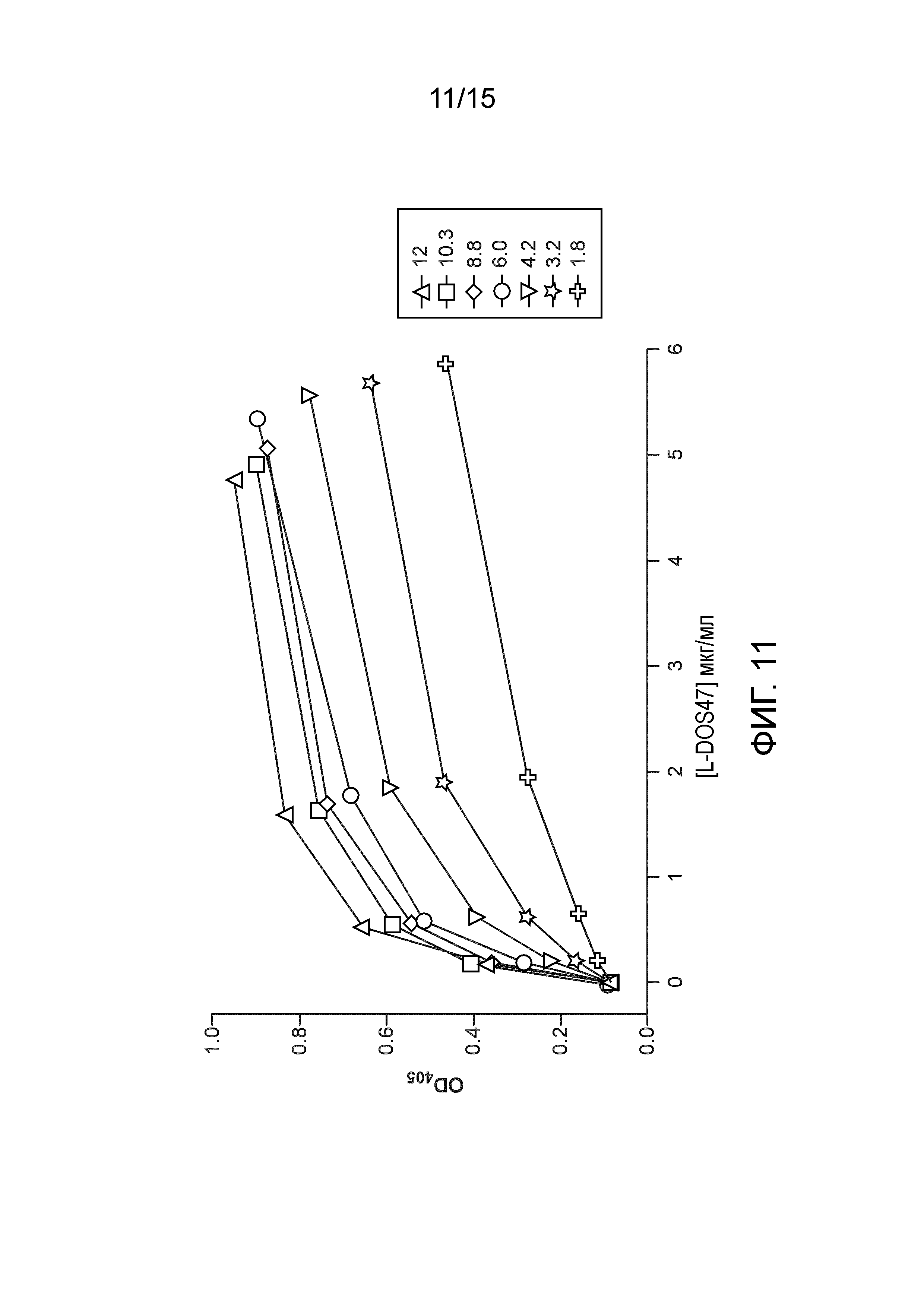
[0029] На фиг. 11 показано влияние коэффициента конъюгации на связывающую активность L-DOS47. Получают L-DOS47 с разными коэфициентами конъюгации с антителами (от 1,8 до 12). Определяют непосредственное связывание образцов L-DOS47 с иммобилизованными молекулами CEACAM6-A.
[0030] На фиг. 12 изображены результаты анализа AFAIKL2, уреазы и L-DOS47 методом вестерн-блоттинга. Левая панель: гель-электрофорез L-DOS47, уреазы и AFAIKL2 (окрашивание кумасси синим). Средняя панель: вестерн-блоттинг AFAIKL2, уреазы и L-DOS47 (стандартная нагрузка и 5-кратная перегрузка) с использованием в качестве зонда антитела против AFAIKL2. Правая панель: вестерн-блоттинг AFAIKL2, уреазы и L-DOS47 (стандартная нагрузка и 5-кратная перегрузка) с использованием в качестве зонда антитела против уреазы. Вставка: концентрация L-DOS47.
[0031] На фиг. 13 показаны результаты анализа триптического гидролизата AFAIKL2-Cys-FL методом ОФ-ВЭЖХ при 420 нм. Идентифицированные конъюгированные пептиды и их массы отмечены на соответствующих пиках ВЭЖХ.
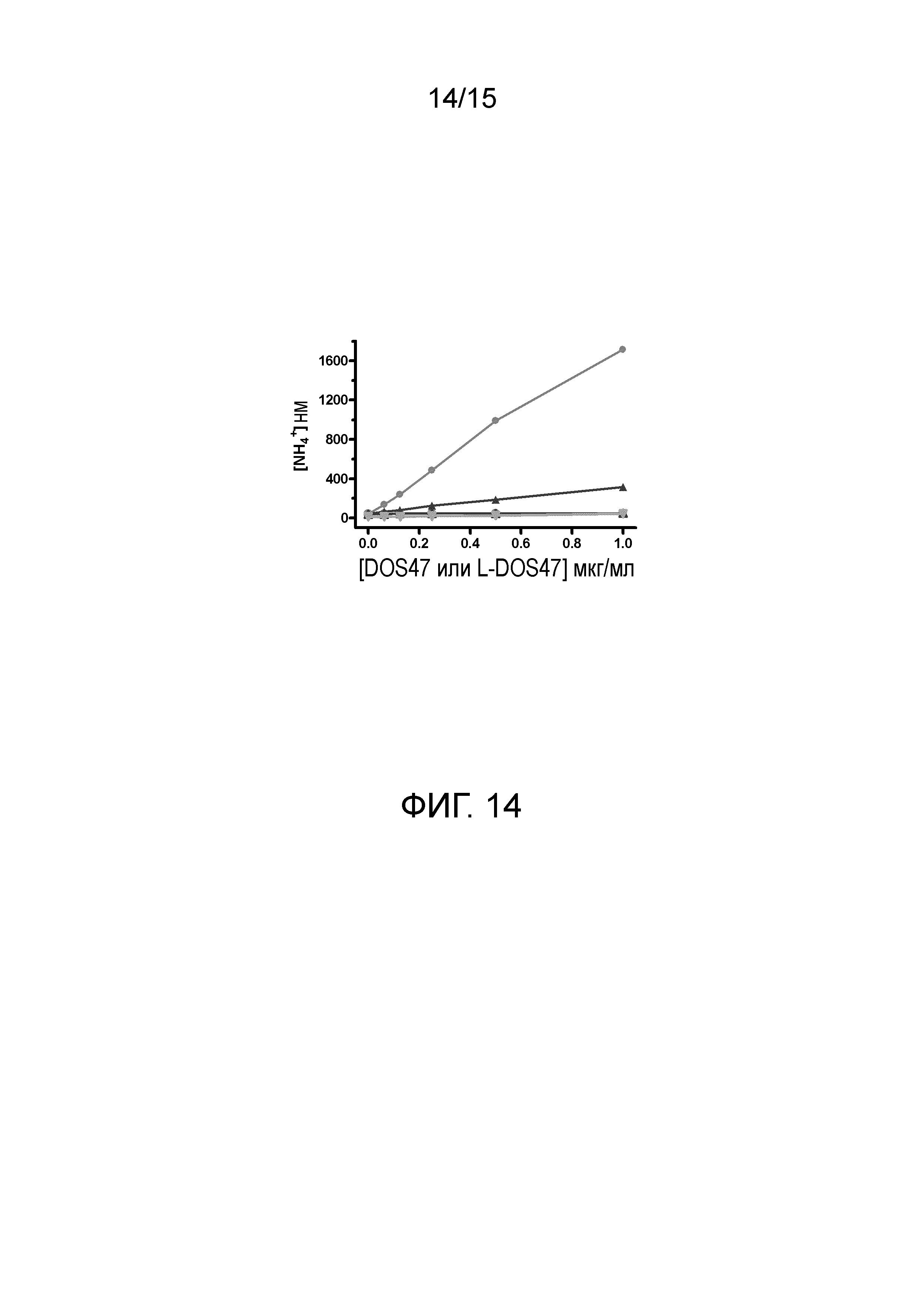
[0032] На фиг. 14 показаны результаты анализа непосредственного связывания L-DOS47 с линиями раковых клеток BxPC-3, A549 и MCF7. Сигнал, свидетельствующий о наличии связывания, представляет собой количество аммиака, образующееся при инкубации с 20 мМ мочевиной. L-DOS47 связывается с клетками BxPC-3 (•) на повышенном уровне, с клетками A549 (▲) на среднем уровне, а с клетками MCF7 (▼) не связывается. Кроме того, связывание неконъюгированного контроля DOS47 с соответствующими клеточными линиями (O, Δ, V) отсутствует, свидетельствуя о том, что L-DOS47 специфически связывается с клетками BxPC-3 и A549.
[0033] На фиг. 15 показаны результаты анализа L-DOS47-индуцированной цитотоксичности на клетках BxPC-3 и A549 после добавлении 20 ммоль мочевины. В клетках MCF7 никакие эффекты не наблюдаются (▼). Клетки BxPC-3 (•) являются очень чувствительными к L-DOS47, тогда как в клетках A549 наблюдаются лишь умеренные эффекты (▲). Кроме того, связывание неконъюгированного контроля DOS47 с соответствующими линиями клеток (⃝, Δ, ∇) отсутствует. Результаты приведены в виде среднего значения от нескольких (n=3) типичных экспериментов. Стандартное отклонение (SD) составляет менее 10% для всех значений.
ПОДРОБНОЕ ОПИСАНИЕ
[0034] Следует понимать, что настоящее описание не ограничивается конкретными описанными аспектами или вариантами осуществления, которые, разумеется, могут варьировать. Следует также понимать, что используемая здесь терминология предназначена только для описания конкретных аспектов или вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего раскрытия ограничивается лишь прилагаемой формулой изобретения.
[0035] Подробное описание настоящего изобретения разделено на несколько разделов только для удобства читателя, поскольку описание, присутствующее в одном разделе, может быть объединено с описанием, присутствующим в другом разделе. Если не указано иначе, все используемые здесь технические и научные термины имеют традиционное значение, известное рядовым специалистам в области техники, к которой относится настоящее изобретение.
Определения
[0036] Следует отметить, что в настоящем описании и в прилагаемой формуле изобретения форма единственного числа включает в себя ссылку на форму множественного числа, если контекст явно не указывает иное. Так, например, термин "соединение" включает в себя множество соединений.
[0037] В настоящем описании термин "примерно", используемый перед численными значениями, например, температуры, времени, количества, концентрации и т.д., включающими диапазоны значений, указывает, что значения могут варьировать в сторону (+) или (-) в пределах 10%, 5% или 1% от величины указанного значения.
[0038] В настоящем описании термин "введение" может относиться к введению одной дозы непрерывно или периодически, или к введению нескольких частей дозы, которые в совокупности составляют однократную дозу. Дозирование можно проводить на протяжении всего курса лечения. Способы определения наиболее эффективных способов введения и вводимых доз известны специалистам в данной области и могут варьировать в зависимости от типа композиции, используемой для лечения, цели лечения, вида клеток, на которые направлено лечения, и индивидуума, подлежащего лечению. Однократное или многократное введение можно проводить с использованием уровней доз и схем введения, выбранных лечащим врачом. Подходящие лекарственные формы и способы введения лекарственных средств известны в данной области. Также можно определить способ введения, причем метод определения наиболее эффективного способа введения известен специалистам в данной области и может варьировать в зависимости от композиции, используемой для лечения, цели лечения, состояния здоровья или стадии заболевания подлежащего лечению индивидуума, а также от вида клетки- или ткани-мишени. Неограничивающие примеры способа введения включают пероральное введение, вагинальное введение, назальное введение, инъекцию, местное применение, подъязычное введение, легочное введение и введение посредством суппозиториев.
[0039] Используемый здесь термин "сродство" относится к прочности связывания рецепторов с их лигандами, например, антитела с его антигеном. Термин "Kd" или "константа диссоциации" характеризует сродство антитела к антигену, то есть прочность связывания антитела с конкретным антигеном. Термин "IC50" или "концентрация полумаксимального ингибирования" представляет собой количество конкурирующего соединения, необходимое для уменьшения связывания тестируемых соединений на 50%.
[0040] Используемый здесь термин "аминокислота" относится к L-аминокислоте или D-аминокислоте или их смеси, включая как природную аминокислоту, так и синтетическую аминокислоту и т.п., при условии, что полипептид сохраняет желательное функциональное свойство. NH2 в начале пептидной последовательности представляет собой свободную аминогруппу, находящуюся на аминоконце (или N-конце) полипептида. COOH в конце пептидной последовательности представляет собой свободную карбоксильную группу, находящуюся на карбоксильном конце (или С-конце) полипептида. Аминокислотные остатки, входящие в состав полипептидов, имеют следующие стандартные сокращенные обозначения: A (Ala или аланин); C (Cys или цистеин); D (Asp или аспарагиновая кислота); E (Glu или глутаминовая кислота); F (Phe или фенилаланин); G (Gly или глицин); H (His или гистидин); I (IIe или изолейцин); K (Lys или лизин); L (Leu или лейцин); M (Met или метионин); N (Asn или аспарагин); P (Pro или пролин); Q (Gln или глутамин); R (Arg или аргинин); S (Ser или серин); T (Thr или треонин); V (Val или валин); W (Trp или триптофан); X (Xaa или неизвестный или др.); Y (Tyr или тирозин); Z (Glx/Gln/Glu или глутаминовая кислота/глутамин) и Dpr (2,3-диаминопропионовая кислота). Все последовательности аминокислотных остатков описываются здесь формулами в ориентации слева направо, в традиционном направлении от аминоконца к карбоксиконцу. Черточка в начале или конце последовательности аминокислотных остатков обозначает пептидную связь с другой последовательностью, состоящей из одного или нескольких аминокислотных остатков, или ковалентную связь с аминоконцевой группой, такой как NH2 или ацетил, или с карбокси-концевой группой, такой как СООН.
[0041] Используемый здесь термин "содержащий" или "содержит" означает, что композиции и способы включают в себя упомянутые элементы, но не исключают наличия других. Термин "состоящий, в основном, из", применяющийся для описания композиций и способов, означает исключение других элементов, имеющих какое-либо существенное значение для сочетания, используемого с указанной целью. Таким образом, не исключается присутствие в композициях или способах, состоящих, в основном, из указанных здесь элементов, других материалов или стадий, которые не оказывают существенного влияния на основные и новые характеристики изобретения. Термин "состоящий из" означает отсутствие элементов или других ингредиентов в количествах, превышающих следовые, и существенных стадий способа. Варианты осуществления, определенные каждым из указанных переходных терминов, входят в объем настоящего изобретения.
[0042] В настоящем описании термины "активное средство", "лекарственное средство" и "фармакологически активное средство" используются как взаимозаменяемые для обозначения химического вещества или соединения, которое при введении индивидууму вызывает желательный фармакологический эффект, и охватывают терапевтические средства, включая радионуклиды, лекарственные средства, противораковые средства, токсины и т.п. Примером активного средства является конъюгат антитела с уреазой.
[0043] В данном описании термин "антитело" относится к пептиду, полипептиду или белку, который обладает сродством к антигену. Структурный элемент типичного антитела представляет собой тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара содержит одну "легкую" цепь и одну "тяжелую" цепь. На N-конце каждой цепи находится вариабельный участок, состоящий из 100-110 или более аминокислот, в основном отвечающих за распознавание антигена. Термины "вариабельная легкая цепь" (VL) и "вариабельная тяжелая цепь" (VH) относятся к указанным легким и тяжелым цепям, соответственно. Антитела существуют в виде интактных иммуноглобулинов, или в виде фрагментов, таких как F(ab)'2, димер Fab, который представляет собой легкую цепь, соединенную с VH-CH1 дисульфидной связью, или мономер Fab', который может образоваться в результате разрушения дисульфидной связи в шарнирном участке. Мономер Fab' представляет собой, по существу, Fab с частью шарнирного участка (более подробное описание других фрагментов антител можно найти в Fundamental Immunology, W. E. Paul, ed., Raven Press, N.Y. (1993)). Фрагменты антител можно получить путем расщепления интактного антитела, например, под действием разных пептидаз, синтеза de novo с использованием химических методов, либо технологии рекомбинантных ДНК. Таким образом, в настоящем описании термин "антитело" также включает фрагменты антител, полученные путем модификации антител или синтеза de novo с использованием технологии рекомбинантных ДНК. Антитела включают в себя одноцепочечные антитела, такие как одноцепочечные антитела Fv (sFv), в которых VH и VL соединяются (непосредственно или через пептидный линкер) с образованием одного полипептида.
[0044] Используемый здесь термин "однодоменное антитело" (sdAb или "VHH") относится к одному вариабельному домену тяжелой цепи антитела, который в некоторых случаях можно обнаружить у млекопитающих семейства верблюдовых, у которых в природе отсутствуют легкие цепи. В некоторых аспектах однодоменное антитело может быть получено из участка VH, участка VHH или участка VL. В некоторых аспектах однодоменное антитело имеет человеческое происхождение. В некоторых аспектах человеческое однодоменное антитело содержит последовательности тяжелых или легких цепей, раскрытые в WO2006/099747, WO2009/079793 и WO2012/100343, включенных в настоящее описание путем ссылки во всей их полноте. В одном аспекте человеческое однодоменное антитело содержит последовательности тяжелых или легких цепей с дисульфидными связями в каркасном участке, как описано в WO 02012/100343.
[0045] Используемый здесь термин "фрагмент антитела" также включает в себя любой синтетический или сконструированный методом генной инженерии белок, который действует подобно антителу путем связывания специфического антигена с образованием комплекса.
[0046] Используемый здесь термин "конъюгат" относится к двум или более молекулам, ковалентно связанным с образованием более крупной конструкции. В одном аспекте две молекулы соединяют прямой связью, образующейся в результате взаимодействия реакционноспособной функциональной группы уреазы с комплементарной реакционноспособной функциональной группой антитела, например, путем взаимодействия функциональной аминогруппы лизина с функциональной карбоксигруппой аспарагиновой или глутаминовой кислоты. Следует понимать, что для таких реакций может потребоваться традиционная модификация карбоксильной группы, повышающая ее реакционноспособность. В другом аспекте две молекулы соединяют через линкерный фрагмент.
[0047] В настоящем описании термины "белок", "полипептид" или "пептид" используются как взаимозаменяемые. Белок имеет первичную структуру, представленную последовательностью его субъединиц, и может иметь вторичные спиральные или складчатые структуры, а также общую трехмерную структуру. Хотя термин "белок" обычно относится к относительно большому полипептиду, например, содержащему 100 или более аминокислот, а термин "пептид" относится к более мелкому полипептиду, термины используются здесь как взаимозаменяемые. То есть термин "белок" может относиться к более крупному полипептиду, а также к более мелкому пептиду, и наоборот.
[0048] Используемый здесь термин "направляющий фрагмент" относится к молекуле, способной связываться с определенной популяцией клеток или выбранным типом клеток. Направляющий фрагмент может связываться с рецептором, олигонуклеотидом, субстратом фермента, антигенной детерминантой или другим связывающим участком, присутствующим на или в клетке-мишени или целевой клеточной популяции. Типичным направляющим фрагментом является антитело. Фрагменты антител и небольшие пептидные последовательности, способные распознавать экспрессированные антигены, также можно использовать в качестве направляющих фрагментов.
[0049] Используемые здесь термины "лечить", "лечение" или "терапия" включают в себя облегчение, ослабление или улучшение заболевания или состояния или одного или нескольких симптомов, предотвращение появления других симптомов, улучшение или предотвращение метаболических причин симптомов, ингибирование заболевания или состояния, например, прекращение или подавление развития заболевания или состояния, облегчение заболевания или состояния, индукцию регрессии заболевания или состояния, облегчение состояния, вызванного заболеванием или состоянием, или подавление симптомов заболевания или состояния, и кроме того, указанные термины относятся к профилактике. Эти термины также включают в себя облегчение болезни или состояния, например, индукцию регрессии клинических симптомов. Термины также включают достижение терапевтического улучшения и/или профилактического улучшения. Под терапевтическим улучшением подразумевается устранение или улучшение основного расстройства, подлежащего лечению. Кроме того, терапевтическое улучшение достигается при устранении или улучшении одного или нескольких физиологических симптомов, связанных с основным расстройством, так что улучшение наблюдается у индивидуума, несмотря на то, что индивидуум по-прежнему страдает от основного расстройства.
[0050] Термины "индивид", "индивидуум" и "пациент" используются здесь как взаимозаменяемые и относятся к любой мишени лечения. Кроме того, технология настоящего изобретения включает способ лечения опухолевых клеток in situ или в их обычном положении или местонахождении, например, неопластических клеток опухолей молочной железы или простаты. Указанные опухоли in situ могут находиться внутри множества хозяев, или на множестве хозяев, таких как люди-хозяева, хозяева семейства собачьих, хозяева семейства кошачьих, хозяева семейства лошадиных, хозяева семейства бычьих, хозяева семейства свинообразных и т.п. Любой хозяин, в организме которого находятся опухоль или опухолевые клетки, может может подвергаться лечению в соответствии с технологией настоящего изобретения. Таким образом, индивидуум включает позвоночное животное, предпочтительно млекопитающее, более предпочтительно человека.
[0051] Используемый здесь термин "по существу не содержит" частиц, означает, что частицы утрачены полностью или почти полностью, причем при этом наблюдается такой же эффект, как в случае полной утраты частиц. Другими словами, композиция, которая "по существу не содержит" ингредиент или элемент, в действительность может по-прежнему содержать такой элемент, при условии отсутствия измеримого эффекта. Термин "по существу", если не указано иное, означает более чем примерно 90%, более чем примерно 95%, более чем примерно 96%, более чем примерно 97%, более чем примерно 98% или более чем примерно 99%. В некоторых вариантах осуществления композиция, содержащая конъюгаты антитело-уреаза, по существу не содержит неконъюгированной уреазы, то есть композиция содержит более чем примерно 90% конъюгатов антитело-уреаза, более чем примерно 95% конъюгатов антитело-уреаза, более чем примерно 96% конъюгатов антитело-уреаза, более чем примерно 97% конъюгатов антитело-уреаза, более чем примерно 98% конъюгатов антитело-уреаза или более чем примерно 99% конъюгатов антитело-уреаза. Другими словами, композиция содержит менее чем примерно 0,1% неконъюгированной уреазы, менее чем примерно 0,5% неконъюгированной уреазы, менее чем примерно 1% неконъюгированной уреазы, менее чем примерно 2% неконъюгированной уреазы, менее чем примерно 3% неконъюгированной уреазы, менее чем примерно 4% неконъюгированной уреазы, менее чем примерно 5% неконъюгированной уреазы, или менее чем примерно 10% неконъюгированной уреазы. Термин "неконъюгированная уреаза" относится к уреазе, не конъюгированной с антителом.
[0052] Используемый здесь термин "уреаза" относится к ферменту, обладающему ферментативной активностью карбамид-амидогидролазы (E.C. 3.5.1.5), либо природному, либо полученному, например, с помощью методов рекомбинантных нуклеиновых кислот и/или химического синтеза. Уреаза также включает гибридные белки, содержащие полноразмерную уреазу, ее субъединицы или фрагменты, и/или уреазу, содержащую аминокислотные замены, делеции или добавления, которая сохраняет карбамид-амидогидролазную активность полипептида.
[0053] Используемый здесь термин "DOS47" относится к очищенной уреазе.
Конъюгация антитело-уреаза
[0054] Технология настоящего изобретения направлена на конъюгат антитело-уреаза. Технология настоящего изобретения предоставляет фармацевтическую композицию, содержащую фармацевтически приемлемый водный раствор, подходящий для внутривенной инъекции, и конъюгат антитело-уреаза, который по существу не содержит уреазу, неконъюгированное антитело и неводные растворители, используемые для ВЭЖХ. Неводные растворители, используемые для ВЭЖХ, включают органические растворители, обычно используемые для проведения препаративной ВЭЖХ или очистки методом ВЭЖХ, такие как метанол, ацетонитрил, трифторуксусная кислота и т.д. В некоторых аспектах конъюгат антитело-уреаза по существу не содержит фосфат из фосфатного буфера. В некоторых аспектах для очистки методом SEC используют фосфатный буфер, содержащий 10 мМ фосфат, 50 мМ NaCl, pH 7,0. В некоторых аспектах при промышленном получении конъюгата антитело-уреаза очистку методом ВЭЖХ не проводят.
[0055] В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий примерно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 антител на уреазный фрагмент. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий примерно 6, 7, 8, 9, 10, 11 или 12 фрагментов антител на уреазный фрагмент. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий примерно 8, 9, 10, 11 или 12 фрагментов антител на уреазный фрагмент. В некоторых аспектах конъюгат имеет средний коэффициент конъюгации, составляющий примерно 6 или более фрагментов антител на уреазный фрагмент. В некоторых аспектах конъюгат имеет средний коэффициент конъюгации, составляющий примерно 8, 9, 10 или 11 фрагментов антител на уреазный фрагмент.
[0056] В некоторых аспектах связь представляет собой ковалентную связь или прямую связь, образованную в результате взаимодействия реакционноспособной функциональной группы уреазы с комплементарной реакционноспособной функциональной группой антитела, например, в результате взаимодействия функциональной аминогруппы (NH2), например, лизина, с функциональной карбоксигруппой (COOH), например, аспарагиновой или глутаминовой кислоты, или сульфгидрильной группой (SH) цистеина. Следует понимать, что для таких реакций может потребоваться традиционная модификация карбоксильной группы, повышающая ее реакционноспособность.
[0057] Реакционноспособные функциональные группы могут представлять собой функциональные группы щавелевой кислоты, янтарной кислоты и т.п., или могут представлять собой ортогональные функциональные группы, такие как аминогруппа (которая превращается в NH после конъюгации) и карбоксигруппа (которая превращается в CO или COO после конъюгации). Альтернативно антитело и/или уреазу можно дериватизировать, чтобы экспонировать или присоединить дополнительные реакционноспособные функциональные группы. Дериватизация может включать присоединение одной из линкерных молекул, таких как молекулы, поставляемые Pierce Chemical Company, Rockford Ill.
[0058] "Линкер", в соответствии с настоящим описанием, представляет собой молекулу, которую можно использовать для присоединения направляющего фрагмента к активному средству, например, для присоединения антитела к уреазе. Линкер способен образовывать ковалентные связи как с направляющим фрагментом, так и с активным средством. Подходящие линкеры хорошо известны специалистам в данной области и включают, без ограничения, углеродные линкеры с прямой или разветвленной цепью, гетероциклические углеродные линкеры или пептидные линкеры. Если направляющий фрагмент и молекула активного средства представляют собой полипептиды, линкеры можно присоединить к входящим в их состав аминокислотам через боковые группы (например, посредством дисульфидной связи с цистеином). В одном предпочтительном аспекте линкеры присоединяют к альфа-углеродным аминогруппам и карбоксильным группам концевых аминокислот. В некоторых аспектах соединение осуществляют через линкер, содержащий две или более функциональные группы, такие как карбоксигруппа или аминогруппа, которые позволяют ему взаимодействовать как с уреазой, так и с антителом. Линкеры хорошо известны в данной области и обычно содержат от 1 до 20 атомов, включая атомы углерода, азота, водорода, кислорода, серы и т.п.
[0059] Для получения целевого иммуноконъюгата можно использовать бифункциональный линкер, одна функциональная группа которого взаимодействует с функциональной группой уреазы, а другая группа взаимодействует с антителом. Альтернативно можно провести дериватизацию путем химической обработки направляющего фрагмента, например гликолевое отщепление сахарного фрагмента гликопротеинового антитела под действием периодата с образованием свободных альдегидных групп. Свободные альдегидные группы на антителе можно подвергнуть взаимодействию со свободными аминогруппами или гидразиновыми группами, присутствующими на активном средстве, чтобы присоединить указанное средство (см. патент США № 4671958). Также известны способы получения свободных сульфгидрильных групп на полипептиде, таком как антитело или фрагмент антител (см. патент США №4659839).
[0060] Другие линкерные молекулы и способы их применения включают описанные, например, в Европейской патентной заявке № 188256; патентах США №№ 4671958, 4659839, 4414148, 4699784; 4680338; 4569789; и 4589071; а также в Borlinghaus et al. (1987) Cancer Res. 47:4071-4075).
[0061] В некоторых аспектах связь расщепляется в целевом участке или вблизи него и уреаза отделяется от направляющего фрагмента, когда молекула конъюгата достигает целевого участка. Расщепление связи с отделением уреазы от направляющего фрагмента может происходить под действием ферментативной активности или условий, которым конъюгат подвергается либо внутри клетки-мишени, либо вблизи целевого участка. В некоторых аспектах можно использовать линкер, который расщепляется в условиях, присутствующих в участке опухоли (например, при воздействии опухоль-ассоциированных ферментов или кислых значений рН).
[0062] Расщепляемые линкеры включают в себя линкеры, описанные, например, в патентах США №№ 4618492; 4542225 и 4625014. Механизмы отделения активного средства от указанных линкерных групп включают, например, облучение фотолабильной связи и кислотно-катализируемый гидролиз. Например, в патенте США № 4671958 описаны иммуноконъюгаты, содержащие линкеры, которые расщепляются в целевом участке in vivo под действием протеолитических ферментов системы комплемента пациента. В некоторых аспектах подходящий линкер представляет собой остаток аминокислоты или пептидный спейсер, состоящий из двух или более аминокислот.
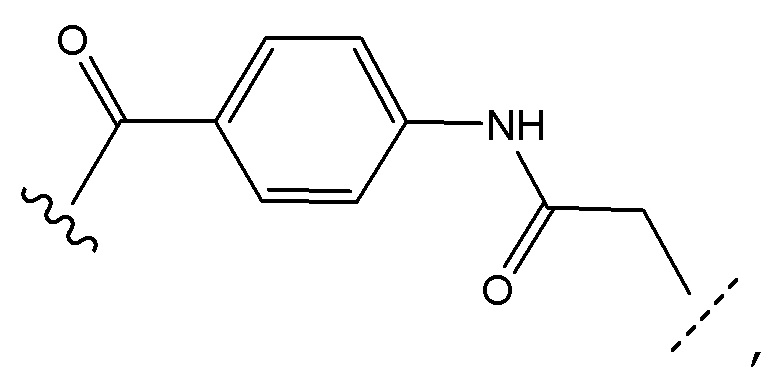
[0063] В некоторых аспектах подходящий линкер представляет собой R1-L-R2, где R1 и R2 обозначают одинаковые или разные функциональные группы, одна из которых связывается с антителом, а другой связывается с уреазой. R1 и R2 могут быть независимо выбраны, без ограничения, из -NH-, -CO-, -COO-, -O-, -S-, -NHNH-, -N=Ν-, =N-NH- и т.д. L может обозначать прямую или разветвленную углеводородную цепь, такую как алкильная цепь, где один или несколько атомов углерода необязательно замещены кислородом, азотом, амидом, серой, сульфоксидом, сульфоном, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом и т.д. В некоторых аспектах линкер может представлять собой аминокислотный остаток или пептидом. В некоторых случаях линкер расщепляется в результате действия фермента или изменения рН в целевом участке или вблизи него. Некоторые линкеры и способы, подходящие для получения конъюгатов, описаны в патентах США №№ № 4414148, 4545985, 4569789, 4671958, 4659839, 4680338, 4699784, 4894443 и 6521431. В некоторых аспектах линкер представляет собой
где


[0064] В некоторых аспектах линкер представляет собой остаток связующего средства формулы:

где X обозначает бром или иод, а L обозначает линкер, описанный в настоящем документе.
[0065] В некоторых аспектах связующее средство представляет собой SBAP (сукцинимидил-3-[бромацетамино]пропионат) или SIA (N-сукцинимидилиодацетат), которые можно использовать для конъюгации в таких же условиях (например, в которых не требуется хроматографическая очистка методом ВЭЖХ и может потребоваться только ультрафильтрация), что и SIAB. В некоторых аспектах длина связующего фрагмента SIAB (10,6 ангстрем) является более подходящей/активизируемой, чем длина SBAP (6,2 Å) и SIA (1,5 Å). В некоторых аспектах связующее средство представляет собой SPDP (сукцинимидил-3-(пиридилдитио)пропионат), SMPT (сукцинимидилоксикарбонилметил-(2-пириддитио)толуол) или SMCC (сукцинимидил-4-(N-малеимидометил)циклогексанкарбоксилат), которые можно использовать для конъюгации, однако в этом случае для отделения непрореагировавшей уреазы от реакционного раствора может потребоваться несколько способов разделения, например, IEC и фракционирование этанолом, что может привести к более низкому выходу.
[0066] Кроме того, для дополнительного усиления терапевтического эффекта к антителам можно присоединить другие компоненты, включающие, без ограничения, терапевтические средства, такие как противораковые средства.
Уреаза
[0067] С помощью многочисленных исследований была получена подробная информация о генетике уреаз из ряда эволюционно различных бактерий, растений, грибов и вирусов (Mobley, H. L. T. et al. (1995) Microbiol. Rev. 59:451-480; Eur J. Biochem., 175, 151-165 (1988); Labigne, A. (1990) Международная публикация № WO 90/04030; Clayton, C. L. et al. (1990) Nucleic Acid Res. 18, 362; и патенты США №№ 6248330 и 5298399, где каждый из указанных документов включен в настоящее описание путем ссылки). Особый интерес представляет уреаза, обнаруженная у растений (Sirko, A. and Brodzik, R. (2000) Acta Biochim Pol 47 (4): 1189-95). Одним из примеров растительных уреаз является уреаза бобовых. Последовательности других практически используемых уреаз можно найти в общедоступных базах данных, например в Entrez (ncbi.nlm.nih.gov/Entrez).
[0068] В некоторых аспектах уреаза представляет собой уреазу из канавалии мечевидной. Уреаза канавалии мечевидной имеет аминокислотную последовательность SEQ ID NO. 2, приведенную ниже:
MKLSPREVEKLGLHNAGYLAQKRLARGVRLNYTEAVALIASQIMEYARDGEKTVAQLMCLGQHLLGRRQVLPAVPHLLNAVQVEATFPDGTKLVTVHDPISRENGELQEALFGSLLPVPSLDKFAETKEDNRIPGEILCEDECLTLNIGRKAVILKVTSKGDRPIQVGSHYHFIEVNPYLTFDRRKAYGMRLNIAAGTAVRFEPGDCKSVTLVSIEGNKVIRGGNAIADGPVNETNLEAAMHAVRSKGFGHEEEKDASEGFTKEDPNCPFNTFIHRKEYANKYGPTTGDKIRLGDTNLLAEIEKDYALYGDECVFGGGKVIRDGMGQSCGHPPAISLDTVITNAVIIDYTGIIKADIGIKDGLIASIGKAGNPDIMNGVFSNMIIGANTEVIAGEGLIVTAGAIDCHVHYICPQLVYEAISSGITTLVGGGTGPAAGTRATTCTPSPTQMRLMLQSTDDLPLNFGFTGKGSSSKPDELHEIIKAGAMGLKLHEDWGSTPAAIDNCLTIAEHHDIQINIHTDTLNEAGFVEHSIAAFKGRTIHTYHSEGAGGGHAPDIIKVCGIKNVLPSSTNPTRPLTSNTIDEHLDMLMVCHHLDREIPEDLAFAHSRIRKKTIAAEDVLNDIGAISIISSDSQAMGRVGEVISRTWQTADKMKAQTGPLKCDSSDNDNFRIRRYIAKYTINPAIANGFSQYVGSVEVGKLADLVMWKPSFFGTKPEMVIKGGMVAWADIGDPNASIPTPEPVKMRPMYGTLGKAGGALSIAFVSKAALDQRVNVLYGLNKRVEAVSNVRKLTKLDMKLNDALPEITVDPESYTVKADGKLLCVSEATTVPLSRNYFLF (SEQ ID No. 2)
[0069] Последовательности практически используемых уреаз можно найти в общедоступных базах данных, например Entrez (Http://www.ncbi.nlm.nih.gov/Entrez). Кроме того, праймеры, подходящие для амплификации уреаз из широкого ряда организмов, можно использовать по способу, описанному Baker, K. M. and Collier, J. L. (http://www.science.smith.edu/departments/Biology/lkatz/NEMEB_webpage/abstracts.html), или с использованием CODEHOP (COnsensus-DEgenerate Hybrid Oligonucleotide Primer), как описано в Rose, et al. ( 1998) Nucl. Acids Res. 26:1628.
[0070] Уреаза может превращать субстрат-мочевину в аммиак и карбамат. В результате такой ферментативной активности может повышаться рН, делая окружающую среду более основной. Среда, окружающая раковую клетку, обычно является кислой (Webb, S.D., et al. (2001) Novartis Found Symp 240:169-81). Следовательно, повышение рН внеклеточной среды в результате указанной активности приводит к ингибированию роста раковых клеток. Соответственно, добавление конъюгатов антитело-уреаза в некоторых аспектах технологии настоящего изобретения приводит к повышению рН интерстициальной жидкости примерно на 0,1 единицы рН, например на 0,1-0,5 единиц рН или более.
[0071] Уреаза, подходящая для применения в технологии настоящего изобретения, включает в себя природные формы уреазы, а также их функционально активные варианты. Существуют два общих типа вариантов аминокислотных последовательностей. Варианты аминокислотной последовательности представляют собой последовательности, содержащие замены одной или нескольких конкретных аминокислот, которые не подавляют активность уреазы. Эти варианты включают молчащие варианты и консервативно модифицированные варианты, которые по существу гомологичны и функционально эквивалентны нативным белкам. Вариант нативного белка "по существу гомологичен" нативному белку, если его аминокислотная последовательность по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, даже еще более предпочтительно на 98% и наиболее предпочтительно по меньшей мере примерно на 99% идентична аминокислотной последовательности нативного белка. Вариант может отличаться только на 1 аминокислоту, или на несколько аминокислот, до 10 или более.
[0072] Второй тип вариантов включает варианты уреазы по размеру, которые представляют собой выделенные активные фрагменты уреазы. Варианты по размеру можно получить, например, путем фрагментации уреазы в результате химической модификации, расщепления протеолитическим ферментом или их сочетания. Кроме того, для получения вариантов по размеру можно использовать методы генной инженерии, а также методы синтеза полипептидов непосредственно из аминокислотных остатков.
[0073] Под термином "функционально эквивалентный" подразумевается, что последовательность варианта определяет цепь, которая продуцирует белок, имеющий, по существу, такую же биологическую активность, что и нативная уреаза. Такие функционально эквивалентные варианты, которые содержат существенные вариации последовательности, также охватываются технологией настоящего изобретения. Таким образом, функционально эквивалентный вариант белка нативной уреазы обладает биологической активностью, достаточной для терапевтического применения. В данной области техники существуют способы определения функциональной эквивалентности. Биологическую активность можно измерить с помощью анализов, специально разработанных для измерения активности белка нативной уреазы. Кроме того, антитела, полученные против биологически активного нативного белка, можно тестировать на способность связываться с функционально эквивалентным вариантом, причем эффективное связывание свидетельствует о том, что белок имеет конформацию, подобную конформации нативного белка.
[0074] Белковые последовательности уреазы, подходящие для применения в технологии настоящего изобретения, включая консервативно замещенные последовательности, могут являться частью более крупных полипептидных последовательностей, например, образованных путем добавления одного или нескольких доменов, облегчающих очистку белка (таких как сегменты поли-His, сегменты маркера FLAG и т.д.), где дополнительные функциональные домены оказывают небольшое влияние, или вообще не влияют на активность уреазного белкового фрагмента, или где дополнительные домены можно удалить на стадиях постсинтетической обработки, такой как обработка протеазой.
[0075] Добавление одной или нескольких нуклеиновых кислот или нуклеотидных последовательностей, которые не изменяют кодирующую активность молекулы нуклеиновой кислоты, подходящей для применения в технологии настоящего изобретения, например, добавление нефункциональной последовательности, представляет собой консервативную модификацию основной молекулы нуклеиновой кислоты, а добавление одного или нескольких аминокислотных остатков, которые не изменяют активность полипептида, подходящего для применения в технологии настоящего изобретения, представляет собой консервативную модификацию основного полипептида. Добавления обоих указанных типов являются признаками технологии настоящего изобретения. Для специалиста в данной области техники должно быть очевидно, что многие консервативные модификации раскрытых конструкций нуклеиновых кислот дают функционально идентичные конструкции.
[0076] Можно использовать ряд способов определения взаимоотношений последовательностей, включая ручное выравнивание, а также выравнивание и анализ последовательностей с помощью компьютера. Последний способ является предпочтительным в технологии настоящего изобретения благодаря повышенной пропускной способности, обеспечиваемой компьютерными методами. Для выравнивания последовательностей можно использовать ряд существующих компьютерных программ или программы, созданные специалистами.
[0077] Как отмечено выше, последовательности нуклеиновых кислот и полипептидов (а также их фрагменты), используемые в технологии настоящего изобретения, не обязательно должны быть идентичными, но могут быть по существу идентичными (или по существу подобными) соответствующей последовательности полипептида или молекулы нуклеиновой кислоты уреазы (или ее фрагменту), используемой в технологии настоящего изобретения, или родственной молекуле. Например, полипептиды можно подвергать разным изменениям, таким как одна или несколько вставок, делеций и замен аминокислот или нуклеиновых кислот, консервативным или неконсервативным, включая изменения, которые могут обеспечить определенные преимущества при их применении, например, при терапевтическом применении или в административном приложении.
Направляющие фрагменты
[0078] Направляющие фрагменты представляют собой химические объекты, подходящие для применения в технологии настоящего изобретения, и обладающие способностью связываться с определенным, выбранным типом клеток, или с популяцией клеток-мишеней, таких как раковые клетки. Подходящие направляющие фрагменты включают антитела и фрагменты антител, пептиды и гормоны. В качестве направляющих фрагментов также можно использовать белки, соответствующие известным рецепторам клеточной поверхности (такие как липопротеины низкой плотности, трансферрин и инсулин), фибринолитические ферменты, белки, связывающиеся с тромбоцитами, такие как аннексины, и модификаторы биологического ответа (такие как интерлейкин, интерферон, эритропоэтин и колониестимулирующий фактор). Кроме того, в технологии настоящего изобретения в качестве направляющих фрагментов можно использовать олигонуклеотиды, например, антисмысловые олигонуклеотиды, комплементарные фрагменту нуклеиновой кислоты клетки-мишени. Направляющие фрагменты могут представлять собой олигонуклеотиды, которые связываются с поверхностью клетки-мишени. В качестве направляющих фрагментов также можно использовать аналоги вышеперечисленных направляющих фрагментов, которые сохраняют способность связываться с определенной популяцией клеток-мишеней.
[0079] В технологии настоящего изобретения в качестве направляющих фрагментов также можно использовать функциональные эквиваленты вышеупомянутых направляющих фрагментов. Примером функционального эквивалента целевого фрагмента является органическая химическая конструкция, имитирующая конфигурацию и/или ориентацию, обеспечивающую связывание направляющего фрагмента с клеткой-мишенью. Другим примером функционального эквивалента целевого фрагмента является короткий полипептид, обладающий сродством к фрагменту-мишени.
[0080] В некоторых аспектах направляющие фрагменты настоящего изобретения представляют собой антитела, пептиды, олигонуклеотиды и т.п., способные взаимодействовать с антигеном, присутствующим на поверхности клетки-мишени. Можно использовать как поликлональные, так и моноклональные антитела, коммерчески доступные или описаные в литературе. Антитела могут представлять собой целые антитела или их фрагменты. Моноклональные антитела и их фрагменты можно получить с помощью традиционных методов, таких как гибридомный синтез, методы рекомбинантных ДНК и белковый синтез. Подходящие для применения моноклональные антитела и их фрагменты можно получить из любых видов (включая людей), или их можно получить в виде химерных белков, содержащих последовательности более чем из одного вида.
[0081] В некоторых аспектах направляющий фрагмент представляет собой гуманизированное или нечеловеческое антитело. В некоторых аспектах направляющий фрагмент представляет собой однодоменное антитело. В некоторых аспектах однодоменное антитело (sdAb) или "VHH" представляет собой один вариабельный домен тяжелой цепи антитела, принадлежащего к типу, который может встречаться у млекопитающих семейства верблюжьих, которое в природе не содержит легких цепей. В некоторых аспектах однодоменное антитело можно сконструировать из участка VH, участка VHH или участка VL. В некоторых аспектах однодоменное антитело имеет человеческое происхождение. В некоторых аспектах человеческое однодоменное антитело содержит последовательности тяжелых или легких цепей, раскрытые в WO 2006/099747 и WO2009/079793 и WO2012/100343, включенных в настоящий документ путем ссылки во всей их полноте. В одном аспекте человеческое однодоменное антитело содержит последовательности тяжелых или легких цепей, соединенные дисульфидными связями в каркасных участках, как описано в WO 02012/100343.
[0082] В некоторых аспектах направляющий фрагмент (такой как антитело) обладает специфичностью к опухолевому антигену, экспрессируемому карциномами, лейкозами, лимфомами и саркомами. Карциномы могут представлять собой карциномы ануса, желчного тракта, мочевого пузыря, молочной железы, толстой кишки, прямой кишки, легких, ротоглотки, гипофаринкса, пищевода, желудка, поджелудочной железы, печени, почек, желчного пузыря и желчных протоков, тонкого кишечника, мочевых путей, яичников, мелкоклеточную карциному легких, карциному половых путей, карциному эндокринной железы, карциному щитовидной железы и кожи. В некоторых аспектах направляющий фрагмент (такой как антитело) обладает специфичностью к опухолевому антигену, экспрессируемому карциноидными опухолями, такими как стромальные опухоли желудочно-кишечного тракта, опухоли головы и шеи, первичные опухоли, гемангиомы, меланомы, злокачественная мезотелиома, множественная миелома и опухоли головного мозга, нервов, глаз и оболочек головного мозга. В некоторых аспектах направляющий фрагмент (например, антитело) обладает специфичностью к опухолевому антигену, экспрессируемому карциномой, раком молочной железы, поджелудочной железы, яичников, легких и толстой кишки. В некоторых аспектах направляющий фрагмент (такой как антитело) обладает специфичностью к опухолевому антигену, экспрессируемому немелкоклеточной карциномой легкого.
[0083] В некоторых аспектах антитело обладает специфичностью к опухолевому антигену, экспрессируемому немелкоклеточной карциномой легкого. В некоторых аспектах опухолевый антиген, экспрессируемый немелкоклеточной карциномой легкого, представляет собой СЕАКАМ6 (молекулу 6 клеточной адгезии, родственную карциноэмбриональному антигену), а антитело обладает специфичностью к СЕАКАМ6. CEACAM6, также известный как неспецифический перекрестно-реагирующий антиген (NCA) или CD66c, представляет собой хорошо охарактеризованный раковый антиген (11, 12). Его последовательность в высокой степени гомологична последовательностям других человеческих карциноэмбриональных антигенов, таких как CEACAM1, CEACAM7 и CEACAM8. Он представляет собой связанный с гликозилфосфоинозитолом (GPI) клеточный поверхностный белок, не содержащий известный цитоплазматический домен. Экспрессия CEACAM6 значительно повышена в тканях рака молочной железы, поджелудочной железы, яичников, легких и толстой кишки. Его повышенная экспрессия свидетельствует об инвазивном и метастатическом характере опухолевых клеток (13). В некоторых аспектах антитело обладает сродством к CEACAM6, характеризующимся значением Kd выше, чем примерно 1×10-6 M. В некоторых аспектах конъюгат обладает сродством к CEACAM6, характеризующимся значением Kd, не превышающим примерно 1×10-68 M, 1×10-9 M, 1×10-10 M или 1×10-20 M. В некоторых аспектах антитело представляет собой фрагмент однодоменного антитела верблюжьих (AFAIKL2, SEQ ID NO: 1), который распознает CEACAM6 на клетках аденокарциномы легких. В некоторых аспектах антитело содержит полипептид, содержащий аминокислотную последовательность SEQ ID NO. 1, показанную на фигуре 5. В некоторых аспектах антитело содержит полипептид, несущий по меньшей мере одну модификацию аминокислотной последовательности SEQ ID NO. 1. В некоторых аспектах антитело содержит полипептид, последовательность которого по меньшей мере на 80%, 85%, 90%, 95%, 98% и 99% гомологична аминокислотной последовательности SEQ ID NO. 1.
[0084] В некоторых аспектах антитело CEACAM6 представляет собой антитело против CEACAM6 (9A6): sc-59899, поставляемое Santa Cruz Biotech. Антитело против CEACAM6 (9A6) представляют собой мышиный моноклональный IgG1, предоставляемый в концентрации 200 мкг/мл, который получают против CEACAM6-экспрессирующих линий опухолевых клеток человеческого происхождения. Его рекомендуют использовать для детекции CEACAM6 человеческого происхождения.
[0085] В некоторых аспектах антитело против CEACAM6 представляет собой антитело против CEACAM6 (ab56234), поставляемое abeam. Антитело против CEACAM6 (ab56234) представляет собой кроличье поликлональное антитело против CEACAM6. Его получают против участка синтетического пептида (IQNPASANRS DPVTLNVLYG PDGPTISPSK ANYRPGENLN LSCHAASNPP (SEQ ID NO: 3)), который соответствует внутренним аминокислотам 217-266 последовательности человеческого CEACAM6.
[0086] В некоторых аспектах антитело против CEACAM6 представляет собой антитело против CEACAM-6/CD66c, поставляемое Novus Biologicals, которое представляет собой кроличье поликлональное антитело против CEACAM6, проверенное методами вестерн-блоттинга и иммуногистохимии-P. Его получают против синтетического пептида (EIQNPASANRSD (SEQ ID NO: 4)), направленного против среднего участка человеческого CEACAM6 (NP_002474).
[0087] В некоторых аспектах антитело против CEACAM6 представляет собой антитело против CEACAM6 EPR4403, поставляемое OriGene, моноклональное кроличье антитело против CEACAM6 (клон EPR4403). Его получают против синтетического пептида, соответствующего остаткам человеческого CEACAM6. Оно способно взаимодействовать с мышиным, крысиным и человеческим CEACAM6.
[0088] В некоторых аспектах конъюгат обладает сродством к CEACAM6, харктеризующимся значением IC50, не превышающим примерно 10 нМ. В некоторых аспектах конъюгат обладает сродством к CEACAM6, харктеризующимся значением IC50, не превышающим примерно 5 нМ. В некоторых аспектах конъюгат обладает сродством к CEACAM6, харктеризующимся значением IC50, не превышающим примерно 4 нМ. В некоторых аспектах значение IC50 составляет примерно 3,22 нМ. В некоторых аспектах конъюгат связывается с CEACAM6 со значением IC50 примерно 10-30 мкг/мл. В некоторых аспектах конъюгат связывается с CEACAM6 со значением IC50 примерно 20 мкг/мл. Сродство антитела или конъюгата к целевому антигену можно определить с помощью способов, описанных здесь или известных в данной области. В некоторых аспектах технология настоящего изобретения описывает конъюгат антитело против CEACAM6-уреаза (L-DOS47). В некоторых аспектах технология настоящего изобретения описывает конъюгат антитело-уреаза, например, AFAIKL2-уреазу. Фаговую библиотеку, полученную из набора тяжелых цепей антител ламы, используют для идентификации однодоменного антитела (sdAb) путем пэннинга против немелкоклеточной аденокарциномы легкого A549. SdAb обозначают как AFAI. Генную последовательность AFAI оптимизируют в целях конъюгации и переименовывают как AFAIKL2. В некоторых аспектах антитело AFAIKL2 клонируют и экспрессируют в системе E. coli BL21 (DE3) pT7-7.
[0089] Гуманизированные направляющие фрагменты способны уменьшать иммунореактивность антитела или полипептида в организме хозяина-реципиента, что позволяет увеличить период полувыведения и уменьшить неблагоприятные иммунные реакции. Мышиные моноклональные антитела можно гуманизировать, например, путем генетической рекомбинации нуклеотидной последовательности, кодирующей мышиный участок Fv, или его гипервариабельные участки, и нуклеотидной последовательности, кодирующей участок человеческого константного домена и участка Fc. Мышиные остатки также можно сохранить в каркасных доменах человеческого вариабельного участка, чтобы гарантировать надлежащие характеристики связывания с мишенью. Антитела, сконструированные методами генной инженерии для доставки разных активных средств к раковым клеткам, описаны в Bodey, B. (2001) Expert Opin Biol. Ther. 1(4): 603-17.
[0090] В некоторых аспектах направляющий фрагмент представляет собой лиганд, способный взаимодействовать с рецептором на поверхности клетки-мишени. Таким образом, направляющий фрагмент может включать в себя, без ограничения, гормоны, обладающие сродством к клеточному связывающему компоненту, любую молекулу, содержащую углеводный фрагмент, распознаваемый клеточным связывающим компонентом, а также лекарственные средства или небольшие молекулы, способные связыватьтся с клеточным связывающим компонентом. Фраза "связывающий компонент" относится как к рецепторным, так и к акцепторным молекулам. Предпочтительно связывающий компонент является клеточным поверхностным связывающим компонентом. В одном аспекте направляющий фрагмент представляет собой природный белок, такой как инсулин, способный связываться с участком-мишенью. В качестве специфических направляющих фрагментов также можно использовать цитокины, включающие в себя интерлейкины и факторы, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и фактор некроза опухоли (TNF), которые, как известно, связываются с определенными клетками, экспрессирующими высокие уровни их рецепторов (Terlikowski, SJ (2002) Toxicology 174(3):143-152).
[0091] Чтобы уменьшить воздействие уреазы или другого активного средства на клетки или ткани, не являющиеся мишенями, направляющие фрагменты можно подвергнуть скринингу чтобы идентифицировать фрагменты, которые проявляют минимальную реакционноспособность в отношении объектов, не являющихся мишенями, сохраняя при этом специфичность и реакционноспособность в отношении мишеней. Благодаря уменьшению воздействия на немишени (и неблагоприятной локализации и/или токсичности вне мишеней) можно вводить повышенные дозы уреазы или другого активного средства. Это позволяет вводить максимально возможную концентрацию уреазы или другого терапевтического средства, обеспечивающую максимальное воздействие на клетки-мишени, не превышая порог неприемлемой токсичности в отношении клеток-немишеней.
[0092] В некоторых аспектах используют два или более конъюгата активное средство-направляющий фрагмент, при этом все конъюгаты содержат разные направляющие фрагменты, например, антитела разных видов. Каждый из используемых направляющих фрагментов связывается с другим участком-мишенью, который может асоциироваться с таким же или другим участком-мишенью. Компоненты активного средства, содержащиеся во вводимых конъюгатах, могут быть одинаковыми или разными. См., например, патенты США №№ 4867962 и 5976535, каждый из которых включен в настоящий документ путем ссылки. В некоторых аспектах улучшается накопление конъюгата, содержащего активное средство, в участке-мишени, поскольку каждый направляющий фрагмент, например, антитело конкретного вида, распознает другой участок-мишень (то есть эпитоп). Такой подход с использованием альтернативных участков-мишеней обеспечивает больше потенциальных точек связывания участка-мишени с активным средством. Следовательно, можно избежать фактического или эффективного насыщения участка-мишени, например, в результате эпитопного насыщения и/или стерического затруднения. Таким образом можно достичь дополнительного накопления активного средства, например уреазы. Альтернативно, или вместе с тем, в качестве активных средств можно использовать другие уреаза-специфичные генные продукты, например, способные образовывать каталитически активный голофермент в участке-мишени. Типичный апофермент уреазы содержит гамма-, бета- и альфа-субъединицы, кодируемые бактериальной генами ureABC (Burne, R.A. и Chen, Y.M. (2000) Microbes and Infection 2: 533-542).
[0093] Можно проанализировать способность моноклональных антител, направленных против конкретного участка-мишени, к перекрестному взаимодействию, чтобы идентифицировать ряд из двух или более мишень-специфичных моноклональных антител с неперекрывающейся перекрестной реакционноспособностью для применения в терапии. Фраза "неперекрывающаяся перекрестная реакционноспособность" означает, что ткани-немишени, связываемые антителом одного вида, существенно отличаются от тканей-немишеней, связываемых антителом другого вида. Типы перекрестной реакционноспособности отличаются по степени пропорционального уменьшения воздействия активного средства при терапевтическом применении. Предпочтительной является пара антител (или набор из большего числа антител), характеризующаяся минимальным перекрыванием.
[0094] Скрининг антител можно проводить разными способами. Для определения реакционноспособности в отношении ткани-мишени и перекрестной реакционноспособности в отношении ткани-немишени можно использовать иммуногистохимический анализ. Ткани, с которыми связываются антитела, можно идентифицировать путем подвергания ткани воздействию антитела; промывания ткани с целью удаления несвязанного антитела; и детекции присутствия связанного антитела. Гистохимические методы in vitro известны в данной области. См., например, Sanchez-Islas, E. and Leon-Olea, M. (2001) Nitric Oxide 5(4):302-16.
[0095] Если направляющий фрагмент является относительно коротким, его можно синтезировать с помощью стандартных методов химического синтеза пептидов. В одном аспекте способа химического синтеза полипептидов можно использовать твердофазный синтез, в котором С-концевую аминокислоту последовательности присоединяют к нерастворимому носителю с последующим последовательным добавлением остальных аминокислот последовательности. Методы твердофазного синтеза описаны в Barany and Merrifield, Solid-Phase Peptide Synthesis; pp. 3-284 in The Peptides: Analysis, Synthesis, Biology. Vol. 2: Special Methods in Peptide Synthesis, Part A., Merrifield, et al. J. Am. Chem. Soc., 85: 2149-2156 (1963), и Stewart et al., Solid Phase Peptide Synthesis, 2nd ed. Pierce Chem. Co., Rockford, III. (1984).
[0096] ДНК, кодирующую антитело или уреазу, можно получить любым подходящим способом, включающим, например, клонирование и рестрикцию соответствующих последовательностей, или прямой химический синтез с использованием, например, фосфотриэфирного метода, описанного Narang et al. (1979) Мет. Enzymol. 68: 90-99; фосфодиэфирного метода, описанного Brown et al. (1979) Мет. Enzymol. 68: 109-151; диэтилфосфорамидитного метода, описанного Beaucage et al. (1981) Tetra. Lett., 22: 1859-1862; и твердофазного метода, описанного в патенте США № 4458066.
[0097] С помощью химического синтеза можно получить одноцепочечный олигонуклеотид. Его можно превратить в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации под действием ДНК-полимеразы с использованием одной цепи в качестве матрицы. Специалистам в данной области известно, что, хотя химический синтез ДНК ограничен последовательностями, содержащими примерно 100 оснований, более длинные последовательности можно получить путем лигирования более коротких последовательностей.
[0098] Альтернативно можно клонировать подпоследовательности с последующим расщеплением соответствующих подпоследовательностей с помощью подходящих рестрикционных ферментов. Затем фрагменты можно лигировать с получением желательной последовательности ДНК.
Способы получения конъюгатов антитело-уреаза
[0099] Технология настоящего изобретения предоставляет способ получения композиции, содержащей конъюгат антитело-уреаза и практически не содержащей неконъюгированную уреазу, например, содержащей не более чем примерно 5%, 4%, 3%, 2% или 1% уреазы по отношению к массе конъюгата антитело-уреаза, где указанный способ включает (1) объединение активированного антитела и уреазы в растворителе, в котором активированное антитело и уреаза практически не взаимодействуют, например, протекает не более 10%, 5% или 1% реакции в час, с получением реакционной смеси, содержащей активированное антитело и уреазу, равномерно распределенные в растворителе, и (2) изменение параметра смеси (1), обеспечивающее легкое взаимодействие активированного антитела с уреазой с образованием конъюгата антитело-уреаза. В некоторых аспектах параметр смеси (1) представляет собой значение рН. В некоторых аспектах изменение параметра смеси (1) включает повышение рН до значения, при котором активированное антитело легко взаимодействует с уреазой с образованием конъюгата антитело-уреаза. В некоторых аспектах на стадии (2) активированное антитело легко взаимодействует с уреазой, например, в реакцию вступает по меньшей мере 90% или по меньшей мере 95% активированного антитела, со скоростью, обеспчивающей фактическое отсутствие неконъюгированной уреазы в смеси примерно через 6 часов, примерно через 5 часов, примерно через 4 часа, примерно через 3 часа, примерно через 2 часа или примерно через 1 час после изменения параметра смеси.
[0100] В некоторых аспектах способ включает объединение активированного антитела и уреазы в кислом водном буфере, имеющем рН примерно 6,0-7,0, например, примерно 6,5, изменение значения рН до основного, составляющего примерно 8,0-9,0, например, примерно 8,3, с получением конъюгата антитело-уреаза и очистку конъюгата антитело-уреаза методом ультрадиафильтрации, причем этот способ не включает стадию хроматографической очистки. В некоторых аспектах водный буфер имеет рН примерно от 5 до 8. В некоторых аспектах активированное антитело и уреазу объединяют в кислом водном буфере. В некоторых аспектах отношение активированного антитела к уреазе составляет примерно от 3 до 12. В некоторых аспектах конъюгат антитело-уреаза имеет коэффициент конъюгации 6-15 антител на фрагмент уреазы. В некоторых аспектах конъюгат антитело-уреаза имеет коэффициент конъюгации 8-11 фрагментов антител на фрагмент уреазы. В некоторых аспектах средство, используемое для регуляции рН, представляет собой буферное средство или буферный раствор. В некоторых аспектах средство, используемое для регуляции рН, содержит одно или несколько соединений, выбранных из соляной кислоты, серной кислоты, азотной кислоты, борной кислоты, угольной кислоты, бикарбоновой кислоты, глюконовой кислоты, гидроксида натрия, гидроксида калия, водного раствора аммиака, лимонной кислоты, моноэтаноламина, молочной кислоты, уксусной кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, фосфорной кислоты, метансульфоновой кислоты, яблочной кислоты, пропионовой кислоты, трифторуксусной кислоты, их солей или сочетаний. В некоторых аспектах буферное средство содержит одно или несколько соединений, выбранных из глицина, уксусной кислоты, лимонной кислоты, борной кислоты, фталевой кислоты, фосфорной кислоты, янтарной кислоты, молочной кислоты, винной кислоты, угольной кислоты, соляной кислоты, гидроксида натрия, их солей или сочетаний. В некоторых аспектах буферный раствор содержит один или несколько буферов, выбранных из гидрохлорида глицина, ацетатного буфера, цитратного буфера, лактатного буфера, фосфатного буфера, лимонная кислота-фосфатного буфера, фосфат-ацетат-боратного буфера, фталатного буфера или их сочетаний. В некоторых аспектах буфер не является фосфатным буфером. В некоторых аспектах кислый буфер представляет собой натрий-ацетатный буфер. В некоторых аспектах значение рН доводят до основного путем добавления водного раствора основания, такого как раствор бората натрия (например, 0,1-5 М или 1 М). Не желая быть связанными с теорией, авторы полагают, что натрий-ацетатный буфер, имеющий низкую буферную емкость, подходит для доведения рН до 8,3, а с помощью 1 М боратного буфера можно довести рН до 8,5. В некоторых аспектах для доведения рН смеси до 8-9, например до 8,3, используют буфер Tris-HCl (например, 1M Tris-HCl).
[0101] В некоторых аспектах значения времени реакции и отношения антитело/уреаза оставляют постоянными. В некоторых аспектах молярное отношение антитело/уреаза в реакционной смеси составляет примерно 25, или примерно 21, или от 1,8 до 12 антител/уреазу. В некоторых аспектах молярное отношение антитело/уреаза регулируют в диапазоне от 4 до 25. В некоторых аспектах молярное отношение антитело/уреаза составляет не менее 6.
[0102] В некоторых аспектах после очистки, например методом ультрадиафильтрации, в смеси присутствует не более 1% или 2% непрореагировавшего антитела. В некоторых аспектах можно использовать другие способы очистки, отличные от ВЭЖХ. Например, для очистки с более низким выходом можно использовать кристаллизацию из этанола/фракционирование в этаноле. В некоторых аспектах молекулярная масса антитела составляет не более 50 кДа, например примерно 10-20 кДа или примерно 13 кДа, а очистку проводят методом ультрадиафильтрации. В некоторых аспектах способ позволяет получить конъюгат антитело-уреаза с выходом, составляющим по меньшей мере примерно 60% по отношению к общему белку по массе, примерно 70% по отношению к общему белку по массе, примерно 80% по отношению к общему белку по массе, или по меньшей мере 90% по отношению к общему белку по массе. Общий белок представляет собой общее количество (по массе) уреазы и антитела AFAIKL2. В некоторых аспектах перед очисткой в реакционной смеси остается не более 10-20% (по отношению к массе общего белка) неконъюгированного антитела.
[0103] Технология настоящего изобретения предоставляет стабильную композицию, которая содержит активированное антитело и уреазу в кислом водном растворителе (как описано выше) и по существу не содержит конъюгат антитело-уреаза, например, она содержит не более чем примерно 5%, 4%, 3%, 2% или 1% конъюгата антитело-уреаза в пересчете на массу уреазы. Технология настоящего изобретения также предоставляет композицию, которая содержит конъюгат антитело-уреаза и по существу не содержит неконъюгированную уреазу, например, она содержит не более чем примерно 5%, 4%, 3%, 2% или 1% уреазы в пересчете на массу конъюгат антитело-уреаза в водном растворителе, где водный растворитель имеет рН примерно 8-9, например, 8,3 (как описано выше). В некоторых аспектах композиция, которая содержит конъюгат антитело-уреаза, также содержит не более 40-60% неконъюгированного антитела в пересчете на общее антитело (активированное антитело и непрореагировавшее антитело). В некоторых аспектах композиция, содержащая конъюгат антитело-уреаза, также содержит не более 10-20% неконъюгированного антитела в пересчете на общий белок.
[0104] Поскольку уреаза вызывает высвобождение аммиака in vivo, который проявляет общую токсичность и сам не является специфичным к опухолям, присутствие неконъюгированной уреазы повышает риск присутствия уреазы и проявления токсичности в нормальных тканях. Однако из-за размера и других характеристик уреазы конъюгация антител с уреазой не приводит к получению продукта, размер или другие характеристики которого не отличаются от соответствующих характеристик уреазы в достаточной степени, чтобы обеспечить легкое разделение конъюгата антитело-уреаза и неконъюгированной уреазы методами хроматографической очистки, особенно в крупном масштабе.
[0105] Неожиданно было обнаружено, что технология настоящего изобретения позволяет достичь практически полной конъюгации уреазы с антителами, так что полученный продукт по существу не содержит неконъюгированной уреазы при отсутствии какой-либо хроматографической очистки. Благодаря практически полному отсутствию уреазы описанные здесь композиции обеспечивают доставку по существу всех фрагментов уреазы, содержащихся в композиции, в целевой участок после системного введения. Направленная доставка уреазы в целевой участок уменьшает или устраняет общую токсичность аммиака, продуцируемого уреазой, и уменьшает количество уреазы, необходимое для достижения терапевтического эффекта. Технология настоящего изобретения особенно подходит для получения в крупных масштабах, таких как по меньшей мере примерно 1 г, 10 г, 100 г или 1 кг, конъюгата антитело-уреаза, который по существу не содержит уреазу и может использоваться для клинических применений, в частности для лечения метастатических опухолей, которые трудно или невозможно лечить путем местного введения уреазы.
[0106] Технология настоящего изобретения также предоставляет способ увеличения сродства антитела к опухолевому антигену, включающий конъюгирование нескольких молекул антитела с молекулой уреазы с получением конъюгата антитело-уреаза, где конъюгат обладает сродством к опухолевому антигену, примерно в 100 раз, например, примерно в 200 раз, примерно в 300 раз, примерно в 400 раз и примерно в 500 раз превышающим сродство неконъюгированного антитела. В некоторых аспектах анализ конкурентного связывания показывает, что сродство конъюгата антитело-уреаза примерно в 100 раз, примерно в 200 раз, примерно в 300 раз, примерно в 400 раз и примерно в 500 раз превышает сродство нативного однодоменного антитела вследствие повышенной авидности. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 фрагментов антител на уреазный фрагмент. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий примерно 6 или более фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий 6, 7, 8, 9, 10, 11 или 12 фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат имеет коэффициент конъюгации, составляющий 8, 9, 10 или 11 фрагментов антител на фрагмент уреазы. В некоторых аспектах конъюгат имеет средний коэффициент конъюгации, составляющий примерно 8, 9, 10 или 11 фрагментов антител на фрагмент уреазы. В некоторых аспектах уреаза представляет собой уреазу бобовых. В некоторых аспектах антитело представляет собой гуманизированное или нечеловеческое антитело. В некоторых аспектах антитело представляет собой однодоменное антитело. В некоторых аспектах опухолевый антиген экспрессируется немелкоклеточной карциномой легкого. В некоторых аспектах антитело обладает специфичностью к CEACAM6. В некоторых аспектах антитело обладает сродством к CEACAM6, характеризующимся значением Kd, превышающим примерно 1×10-6 M. В некоторых аспектах конъюгат связывается с CEACAM6 со значением Kd, не превышающим примерно 1×10-8 M. В некоторых аспектах конъюгат связывается с CEACAM6 со значением Kd, не превышающим примерно 1×10-10 M. В некоторых аспектах конъюгат связывается с CEACAM6 со значением IC50, не превышающим примерно 5 нМ. В некоторых аспектах значение IC50 составляет примерно 3,22 нМ. В некоторых аспектах конъюгат связывается с CEACAM6 со значением IC50, составляющим примерно 20 мкг/мл. CEACAM6, также известный как неспецифический перекрестно-реагирующий антиген (NCA) или CD66c, представляет собой хорошо охарактеризованный раковый антиген. Его последовательность в высокой степени гомологична последовательностям других человеческих карциноэмбриональных антигенов, таких как CEACAM1, CEACAM7 и CEACAM8. Он представляет собой связанный с гликозилфосфоинозитолом (GPI) клеточный поверхностный белок, не содержащий известный цитоплазматический домен. Экспрессия CEACAM6 значительно повышена в тканях рака молочной железы, поджелудочной железы, яичников, легких и толстой кишки.
Композиционные составы
[0107] Композиции технологии настоящего изобретения содержат конъюгат антитело-уреаза, практически не содержат уреазу и необязательно не содержат неводные растворители, используемые для ВЭЖХ. В некоторых аспектах композиция представляет собой фармацевтически приемлемую композицию. Композиция может дополнительно содержать биосовместимые фармацевтические носители, вспомогательные средства или наполнители. В некоторых аспектах композиция находится в виде твердой формы. В некоторых аспектах композиция находится в виде водного раствора, содержащего примерно 0,1-10 мг/мл, примерно 0,5-5 мг/мл, примерно 1-5 мг/мл, или примерно 1,5-2,0 мг/мл конъюгата. В некоторых аспектах водный раствор дополнительно содержит вспомогательное вещество, например, одно или несколько соединений, выбранных из гистидина, сахарозы и ЭДТА. В некоторых аспектах водный раствор содержит примерно 1-20 мМ, например 10 мМ гистидин, примерно 0,1-5 мас./об.%, например 1 мас./об.% сахарозы, примерно 0,1-0,5 мМ, например 0,2 мМ ЭДТА. В некоторых аспектах водный раствор имеет рН, составляющий примерно 6,5-7, например примерно 6,8. В некоторых аспектах водный раствор не содержит фосфат. В некоторых аспектах композиция представляет собой твердую форму, полученную путем лиофилизации водного раствора. В некоторых аспектах твердая форма не содержит фосфат.
[0108] Композиция также может содержать другие нуклеотидные последовательности, полипептиды, лекарственные средства или гормоны, смешанные с наполнителем (наполнителями) или другими фармацевтически приемлемыми носителями. Композиции, отличные от фармацевтических композиций, необязательно содержат жидкость, т.е. воду или жидкость на водной основе.
[0109] Фармацевтически приемлемые наполнители, добавляемые к фармацевтическим композициям, также хорошо известны специалистам в данной области и легко доступны. Выбор наполнителя отчасти зависит от конкретного способа введения продукта. Соответственно, существует широкий спектр композиций, подходящих для применения в контексте настоящей технологии.
[0110] Способы получения и введения фармацевтических композиций, которые можно найти в Remington's Pharmaceutical Sciences, 19 Ed., 19 Ed., Williams & Wilkins, 1995, хорошо известны специалистам в данной области. Выбор наполнителя отчасти зависит от конкретного способа введения продукта согласно технологии настоящего изобретения. Соответственно, существует широкий спектр композиций, подходящих для применения в контексте настоящей технологии. Нижеследующие способы и наполнители являются только иллюстративными, но никоим образом не ограничивающими.
[0111] Фармацевтические композиции согласно технологии настоящего изобретения можно производить с использованием любого традиционного способа, включающего, например, процессы смешивания, растворения, гранулирования, растирания в порошок, эмульгирования, инкапсулирования, улавливания, охлаждения расплава на вращающемся диске, сушки распылением или лиофилизации. Однако оптимальный тип фармацевтической композиции определяется специалистом в данной области в зависимости от способа введения и желательной дозировки. Такие композиции могут влиять на физическое состояние, стабильность, скорость высвобождения введенного средства in vivo и скорость клиренса введенного средства in vivo.
[0112] Фармацевтические композиции составлены так, чтобы они содержали подходящие фармацевтически приемлемые носители и могут необязательно содержать наполнители и вспомогательные вещества, облегчающие обработку активных соединений в препараты, которые можно использовать в фармацевтических целях. Способ введения обычно определяет природу носителя. Например, композиции для парентерального введения могут содержать водные растворы активных соединений в водорастворимой форме. Носители, подходящие для парентерального введения, могут быть выбраны из физиологического раствора, забуференного физиологического раствора, раствора декстрозы, воды и других физиологически совместимых растворов. Предпочтительными носителями для парентерального введения являются физиологически совместимые буферы, такие как раствор Хэнкса, растворы Рингера или забуференный физиологический раствор. Композиции, предназначенные для тканевого или клеточного введения, могут содержать пенетранты, соответствующие конкретному барьеру, который должен быть преодолен. Такие пенетранты широко известны в данной области. В случае препаратов, содержащих белки, композиция может содержать стабилизирующие средства, такие как полиолы (например, сахароза), и/или поверхностно-активные вещества (например, неионные поверхностно-активные вещества) и т.п.
[0113] Альтернативно композиции для парентерального применения могут содержать суспензии активных соединений, приготовленных в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло и синтетические эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно суспензия может также содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений, чтобы обеспечить получение высококонцентрированных растворов. Также можно использовать эмульсии, например дисперсии "масло-в-воде" и "вода-в-масле", необязательно стабилизированные эмульгатором или диспергатором (поверхностно-активные вещества). Как описано выше, для парентерального введения также можно использовать липосомы, содержащие активное средство.
[0114] Альтернативно можно получить фармацевтические композиции, содержащие средство в дозах, подходящих для перорального введения, с использованием фармацевтически приемлемых носителей, хорошо известных в данной области. Препараты, предназначенные для перорального введения, могут находиться в виде таблеток, пилюль, капсул, облаток, лепешек, жидкостей, гелей, сиропов, взвесей, суспензий или порошков. Например, фармацевтические композиции для перорального введения можно получить путем объединения активных соединений с твердым наполнителем, необязательно путем измельчения полученной смеси и обработки смеси гранул после добавления подходящих вспомогательных веществ, если желательно, с получением таблеток. Пероральные композиции могут содержать жидкие носители, подобные описанным для парентерального применения, например, забуференные водные растворы, суспензии и т.п.
[0115] Указанные препараты могут содержать один или несколько наполнителей, которые включают, без ограничения: a) разбавители, такие как сахара, включающие лактозу, декстрозу, сахарозу, маннит или сорбит; b) связующие средства, такие как силикат магния алюминия, крахмал из кукурузы, пшеницы, риса, картофеля и т.д.; c) целлюлоза-содержащие вещества, такие как метилцеллюлоза, гидроксипропинелцеллюлоза и карбоксиметилцеллюлоза натрия, поливинилпирролидон, камеди, такие как гуммиарабик и трагакант, и белки, такие как желатин и коллаген; d) дезинтегрирующие или солюбилизирующие средства, такие как сшитый поливинилпирролидон, крахмалы, агар, альгиновая кислота или ее соль, такая как альгинат натрия; или шипучие композиции; e) смазывающие средства, такие как диоксид кремния, тальк, стеариновая кислота, или ее магниевая или кальциевая соль, и полиэтиленгликоль; f) ароматизаторы и подсластители; g) красители или пигменты, используемые, например для идентификации продукта или для характеристики количества (дозы) активного средства; и h) другие ингредиенты, такие как консерванты, стабилизаторы, средства, способствующие набуханию, эмульгаторы, средства, способствующие растворению, соли для регуляции осмотического давления и буферы.
[0116] Фармацевтическая композиция может быть предоставлена в виде соли активного средства, которая может быть образована многими кислотами, включающими, без ограничения, соляную, серную, уксусную, молочную, винную, яблочную, янтарную и др. Соли, как правило, лучше растворяются в водных или других протонных растворителях, чем соответствующие свободные основания.
[0117] Характеристики самого конъюгата и композиции, содержащей конъюгат, могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo вводимого конъюгата. Такую информацию о фармакокинетических и фармакодинамических параметрах можно получить в ходе доклинических исследований in vitro и in vivo, и затем подтвердить с помощью клинических испытаний на людях. Руководство по проведению клинических испытаний на людях на основе результатов испытаний на животных in vivo можно найти в ряде источников, таких, как, например, http://www.clinicaltrials.gov. Таким образом, терапевтически эффективную дозу любого соединения, используемого в способе технологии настоящего изобретения для введения млекопитающим, в частности людям, можно исходно определить с помощью биохимических и/или клеточных анализов. Затем дозировку можно скорректировать на животных моделях, чтобы достичь желательного диапазона концентраций в кровотоке, который модулирует активность конъюгата. Исследования на людях дают дополнительную информацию относительно соответствующих уровней дозировки и продолжительности лечения разных заболеваний и состояний.
[0118] Токсичность и терапевтическую эффективность конъюгата можно оценить с помощью стандартных фармацевтических анализов, проводимых на культурах клеток или на экспериментальных животных, например, путем определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции).
Дополнительные активные средства
[0119] В состав композиции, подходящей для применения в технологии настоящего изобретения, также могут входить другие активные средства. Другие активные средства, такие как противоопухолевое средство (средство, активность которого направлена против пролиферирующих клеток), можно использовать в композиции до, одновременно или после приведения клеток в контакт с первым активным средством. Например, уреаза после доставки к опухолевым клеткам может обладать способностью модулировать или регулировать внешнюю среду опухоли, например, путем изменения рН. После этого активные средства, такие как противоопухолевые средства, которые благоприятствуют образованию основной среды, являются более эффективными.
[0120] В некоторых аспектах в качестве активных средств используют субстраты, на которые направлена ферментативная активность уреазы. В некоторых аспектах активное средство представляет собой субстрат, который уреаза может использовать для образования ионов аммония, такой как мочевина.
[0121] Примеры противоопухолевых средств включают цитокины и другие соединения, такие как интерлейкины (например, IL-2, IL-4, IL-6, IL-12 и т.п.), трансформирующий фактор роста бета, лимфотоксин, фактор некроза опухоли, интерфероны (например, гамма-интерферон), колониестимулирующие факторы (например, GM-CSF, M-CSF и т.п.), фактор сосудистой проницаемости, лектиновые стимуляторы воспалительного ответа (селектины), такие как L-селектин, E-селектин, P-селектин, и белковые соединения, такие как рецепторные белки C1q и NK. Другие подходящие противоопухолевые средства включают соединения, которые ингибируют ангиогенез и, как следствие, метастазирование. Примеры таких средств включают протаминмедроксипрогестерон, полисульфат пентозана, сурамин, таксол, талидомид, ангиостатин, интерферон-альфа, ингибиторы металлопротеиназы, тромбоцитарный фактор 4, соматостатин, тромбоспондин. Другие иллюстративные и неограничивающие примеры активных средств, подходящих для применения в технологией настоящего изобретения, включают винкристин, винбластин, виндезин, бусульфан, хлорамбуцил, спироплатин, цисплатин, карбоплатин, метотрексат, адриамицин, митомицин, блеомицин, цитозина арабинозид, арабинозиладенин, меркаптопурин, митотан, прокарбазин, дактиномицин (антиномицин D), даунорубицин, доксорубицина гидрохлорид, таксол, пликсамицин, аминоглютетимид, эстрамустин, флутамид, лейпролид, мегестрола ацетат, тамоксифен, тестолактон, трилостан, амсакрин (m-AMSA), аспарагиназа (L-аспарагиназа) этопозид, продукты крови, такие как гематопорфирины, или производные вышеперечисленных соединений. Другие примеры активных средств включают генетический материал, такой как нуклеиновые кислоты, РНК и ДНК природного или синтетического происхождения, в том числе рекомбинантные РНК и ДНК. ДНК, кодирующую определенные белки, можно использовать для лечения многочисленных заболеваний разных типов. Например, гены фактора некроза опухоли или интерлейкина-2 можно использовать для лечения запущенных злокачественных опухолей; гены тимидинкиназы можно использовать для лечения рака яичников или опухолей головного мозга; а гены интерлейкина-2 можно использовать для лечения нейробластомы, злокачественной меланомы или рака почек. Другие активные средства, подходящие для применения в технологии настоящего изобретения, описаны в патенте США № 6261537, который включен в настоящее описание путем ссылки во всей полноте. Противоопухолевые средства и способы скрининга для детекции таких средств описаны в Monga, M. and Sausville, E.A. (2002) Leukemia 16(4):520-6.
[0122] В некоторых аспектах активное средство представляет собой слабоосновное противоопухолевое соединение, эффективность которого уменьшается в условиях градиента, включающего более высокие внутриклеточные/более низкие внеклеточные значения рН, присутствующего в солидной опухоли. Примерами слабоосновного противоопухолевого соединения являются доксорубицин, даунорубицин, митоксантрон, эпирубицин, митомицин, блеомицин, алкалоиды барвинка, такие как винбластин и винкристин, алкилирующие средства, такие как циклофосфамид и мехлорэтамина гидрохлорид, а также противоопухолевые производные пуринов и пиримидинов.
[0123] В некоторых аспектах композиция содержит уреазу и практически не содержит цитокины, такие как фактор некроза опухоли и/или интерфероны. В этом аспекте уреаза сама по себе, или вместе с активными средствами, отличными от цитокинов, в сочетании с низкомолекулярными противоопухолевыми средствами эффективно ингибирует рост раковых клеток. Таким образом, в этом аспекте композиция может необязательно действовать совместно с эндогенными или нативными цитокинами, присутствующими в организме подлежащего лечению индивидуума, но вводимая композиция не содержит другие, экзогенные цитокины.
[0124] В некоторых аспектах дополнительное активное средство не является пеметрекседом и/или карбоплатином. В некоторых аспектах дополнительное активное средство не является фолатным антиметаболитом и/или платина-содержащим средством.
Способы доставки и введения
[0125] Композицию, содержащую конъюгат антитело-уреаза, можно доставлять к раковым клеткам с помощью ряда способов, известных в данной области. При терапевтическом применении композицию вводят пациенту, несущему раковые клетки, в количестве, достаточном для ингибирования роста раковых клеток. Воздействия фармацевтических композиций на раковые клетки можно достичь путем введения разными способами, включающими, без ограничения, парентеральное введение, энтеральное введение, трансэпителиальное введение, трансмукозальное введение, трансдермальное введение и/или введение хирургическим способом.
[0126] Способы парентерального введения включают в себя, например, внутривенные, внутриартериальные, внутрибрюшинные, интрамедуллярные, внутримышечные, внутрисуставные, интратекальные и внутрижелудочковые инъекции, подкожные, внутригонадные или внутриопухолевые игольные болюсные инъекции, или длительные непрерывные, периодические или планируемые перфузии или микроинфузии с использованием соответствующей насосной технологии. Способы энтерального введения включают, например, пероральное (в том числе буккальное и сублингвальное) и ректальное введение. Способы трансэпителиального введения включают, например, введение через слизистую оболочку и чрезкожное введение. Трансмукозальное введение включает, например, энтеральное введение, назальное введение, введение путем ингаляции, а также и глубокое легочное введение, вагинальное введение и ректальное введение. Трансдермальное введение включает пассивные или активные способы трансдермального или чрескожного введения, включающие, например, применение пластырей и устройств для ионтофореза, а также местное применение паст, кремов или мазей. Хирургические способы включают имплантацию композиций-депо (резервуарных), осмотических насосов и т.п.
[0127] Можно осуществлять однократное или многократное введение активного средства, в зависимости от дозировки и частоты, по мере необходимости и переносимости индивидуумом. В любом случае композиция должна обеспечивать количество активного средства, достаточное для эффективного лечения индивидуума.
[0128] В некоторых аспектах технология настоящего изобретения включает применение везикул, таких как липосомы и/или нанокапсулы, в качестве химических средств для доставки фармацевтической композиции, содержащей конъюгат антитело-уреаза, к раковым клеткам. Такие препараты могут предпочтительно использоваться для введения описанных здесь фармацевтически приемлемых композиций полипептидов, фармацевтических средств и/или антител. Способы получения и применения липосом широко известны специалистам в данной области. (См., например, Backer, M.V., et al. (2002) Bioconjug Chem 13(3):462-7). В предпочтительном аспекте раскрытая композиция может быть заключена в липосому.
[0129] Как правило, нанокапсулы улавливают соединения в стабильной и воспроизводимой манере (Whelan, J. (2001) Drug Discov Today 6 (23): 1183-84). Чтобы избежать побочных эффектов, обусловленных высоким содержанием полимеров внутри клетки, такие сверхмелкие частицы (размером примерно 0,1 мкм) можно изготовить из полимеров, способных деградировать in vivo. Биоразлагаемые наночастицы из полиизобутилцианоакрилата, которые отвечают указанным требованиям, подходят для применения в технологии настоящего изобретения, причем такие частицы можно легко получить по способу, описанному, например, в Lambert, G., et al. (2001) Int J Pharm 214 (1-2): 13-6. Способы получения и применения полиалкилцианоакрилатных наночастиц, содержащих биологически активные вещества, описаны в патентах США №№ 4329332, 4489055 и 4913908. Нанокапсулы можно приобрести на коммерческой основе, например, в Capsulution, Inc. (www.capsulution.com).
[0130] Фармацевтические композиции, содержащие нанокапсулы, обеспечивающие доставку композиций, описаны в патентах США № №№ 5500224, 5620708 и 6514481. В патенте США 5500224 описана фармацевтическая композиция в виде коллоидной суспензии нанокапсул, содержащая масляную фазу, состоящую в основном из масла, содержащего растворенное в нем поверхностно-активное вещество, и суспендированного в нем множества нанокапсул, имеющих диаметр менее 500 нанометров. В патенте США № 5620708 описаны композиции и способы введения лекарственных средств и других активных средств. Композиции содержат частицы носителя активного средства, присоединенные к связывающему фрагменту, который специфически связывается с молекулой-мишенью, присутствующей на поверхности энтероцита млекопитающих. Связывающий фрагмент связывается с молекулой-мишенью со сродством или авидностью, достаточной для инициации эндоцитоза или фагоцитоза частиц носителя активного средства, в результате которого носитель поглощается энтероцитом. Затем активное средство высвобождается из носителя в системный кровоток хозяина. С использованием такого способа можно избежать деградации в кишечнике чувствительных к деградации лекарств, таких как полипептиды, и достичь увеличения абсорбции белков и полипептидов из кишечного тракта. Альтернативно технология настоящего изобретения обеспечивает высвобождение активного средства в среду, окружающую клетку-мишень. Например, в одном аспекте конъюгаты антитело-уреаза высвобождаются из нанокапсул после связывания направляющего фрагмента с клеткой-мишенью, в результате чего уреаза высвобождается в микросреду, окружающую клетку-мишень, например опухолевую клетку. В патентах США №№ 6379683 и 6303150, которые включены в настоящее описание путем ссылки, описаны способы получения и применения нанокапсул.
[0131] Используемую фармацевтическую композицию вводят индивидууму в эффективном количестве. Как правило, эффективное количество представляет собой количество, эффективное для (1) снижения симптомов заболевания, подлежащего лечению; или (2) индукции фармакологического изменения, имеющего отношение к лечению заболевания, подлежащего лечению. В случае рака эффективное количество может представлять собой количество, эффективное для: уменьшения размера опухоли; замедления роста опухоли; предотвращения или ингибирования метастаз; или увеличения продолжительности жизни пораженного индивидуума. Приведение в контакт включает в себя добавление к клеткам конъюгата, содержащего направляющий фрагмент, и первый спираль-образующий пептид, характеризующийся выбранным зарядом и способностью взаимодействовать со вторым, противоположно заряженным спираль-образующим пептидом с образованием стабильного α-спирального гетеродимера, имеющего биспиральную структуру. Затем к клеткам добавляют липосому. Липосома имеет внешнюю поверхность и внутренний отсек; активное средство, например уреаза, находится во внутреннем отсеке липосомы; и совокупность вторых пептидов, причем каждый второй пептид соединен с внешней поверхностью липосомы.
[0132] В некоторых аспектах приведение в контакт включает добавление липосом к клеткам, где липосомы содержат активное средство, например конъюгаты антитело-уреаза, во внутреннем отсеке, а наружные поверхности липосомы содержат элемент, направленный на клетки, способный специфически связываться с поверхностью-мишенью, и гидрофильное полимерное покрытие, обеспечивающее эффективную защиту целевого фрагмента от взаимодействия с поверхностью-мишенью. Гидрофильное полимерное покрытие может состоять из полимерных цепей, ковалентно связанных с липидными компонентами поверхностей липосом посредством поддающихся разрушению связей. В некоторых аспектах к опухолевым клеткам добавляют высвобождающее средство в количестве, обеспечивающем разрушение значительной части связей в добавленных липосомах, тем самым создавая возможность для взаимодействия направляющего фрагмента с поверхностью-мишенью. Разрушаемые связи могут представлять собой восстанавливаемые химические связи, такие как дисульфидные, сложноэфирные и пептидные связи.
[0133] В некоторых аспектах изобретение предоставляет способ лечения индивидуума-млекопитающего с использованием липосом. Способ включает в себя системное введение индивидууму, например внутривенное введение, липосом, содержащих связанный с поверхностью направляющий фрагмент и гидрофильное полимерное покрытие. Гидрофильное полимерное покрытие, состоящее из полимерных цепей, соединенных разрушаемыми связями, эффективно защищает направляющий фрагмент от взаимодействия с его мишенью. Введенным липосомам позволяют циркулировать в кровотоке до достижения желательного биораспределения. Высвобождающее средство вводят индивидууму в количестве, эффективном для расщепления значительной части, например, более чем примерно 50%, предпочтительно более чем примерно 70% и более предпочтительно более чем примерно 90% разрушаемых связей в введенных липосомах. После высвобождения цепей гидрофильного полимера направляющий фрагмент экспонируется для взаимодействия с мишенью.
[0134] В некоторых аспектах липосомы используют для лечения солидной опухоли. Липосомы содержат во внутреннем отсеке конъюгат антитело-уреаза и необязательно другое активное средство, например противоопухолевое лекарственное средство, и направляются к участку опухоли посредством направляющего фрагмента, способного специфически связываться с опухолеспецифическим антигеном. В иллюстративном способе липосомы направляют к клеткам эндотелия сосудов опухолей путем включения в липосомы лиганда VEGF, обеспечивающего селективное присоединение к рецепторам Flk-1,2, экспрессирующимся в эндотелиальных клетках пролиферирующих опухолей (Niederman, T.M., et al. ( 2002) Proc Natl Aced Sci 99 (10): 7009-14).
[0135] В некоторых аспектах липосомы имеют размер в диапазоне примерно 30-400 нм. Показано, что липосомы, соответствующие указанному диапазону размеров, могут проникать в опухоли через "щели", присутствующие в эндотелиальных клетках, выстилающих сосудистую сеть опухоли (Maruyama, K, et al. (1999) Adv Drug Deliv Rev 40 (1-2): 89-102).
[0136] Через промежуток времени после введения липосом, например внутривенного введения, достаточный для распределения липосом в организме индивидуума и связывания с опухолью, индивидууму вводят высвобождающее средство, чтобы удалить гидрофильное поверхностное покрытие липосом. Удаление поверхностного покрытия приводит к экспонированию направляющего фрагмента, обеспечивающего связывание липосом с клетками-мишенями. В одном аспекте гидрофильное поверхностное покрытие присоединяется к липосомам посредством рН-чувствительных связей. Связи разрушаются после связывания липосом с опухолью.
[0137] В любом из описанных выше аспектов липосомы могут необязательно содержать одно или несколько противоопухолевых средств или визуализирующих средств, или те и другие. Липосомы можно добавить и оставить их распределяться, после чего можно ввести высвобождающий средство, чтобы удалить гидрофильное поверхностное покрытие, экспонировать присоединенный направляющий фрагмент и инициировать связывание. Для получения и введения липосом можно использовать способы, описанные в патенте США № 6043094, который включен в настоящее описание путем ссылки.
[0138] В технологии настоящего изобретения можно использовать и другие средства доставки, такие как небольшие однослойные везикулы (SUV), описанные в патенте США № 6180114, который включен в настоящее описание путем ссылки во всей своей полноте.
[0139] Специалистам в данной области техники известно, что существуют некоторые участки, которые характеризуются плохой васкуляризацией, или которые защищены клетками, соединенными прочными связями, и/или активными механизмами транспорта, которые уменьшают или предотвращают проникновение макромолекул в кровоток. Так, например, системное введение терапевтических средств для лечения глиом или других видов рака мозга может ограничиваться гематоэнцефалическим барьером, который препятствует проникновению макромолекул в субарахноидальное пространство. При лечении таких типов опухолей терапевтическую композицию предпочтительно вводить непосредственно в участок опухоли. Так, например, опухоли головного мозга можно лечить путем введения терапевтической композиции непосредственно в участок опухоли, например, посредством болюсной инъекции, микроинфузии или катетера, имплантированного хирургическим путем.
Дозировка
[0140] В способе технологии настоящего изобретения можно использовать любой эффективный режим, определяющий время и последовательность введения доз. Типичные уровни доз, подходящие для введения индивидууму-человеку, зависят от способа введения, стадии (размера и распространения) опухоли, массы пациента и ответа пациента на лечение рака с помощью уреазы.
[0141] При введении композиции, содержащей конъюгат антитело-уреаза, например, путем инъекции непосредственно в опухоль, типичная доза составляет примерно от 0,1 до 100010 мкг/кг массы тела, например, примерно от 0,2 до 5 мкг/кг, или примерно от 0,5 до 2 мкг/кг. Положение инъекционной иглы можно контролировать с помощью традиционных методов визуализационного контроля, например, с помощью флюороскопии, позволяющей врачу видеть положение иглы относительно ткани-мишени. Такие инструменты контроля могут включать ультразвук, флюороскопию, КТ или МРТ.
[0142] В некоторых аспектах эффективность или распределение вводимой дозы конъюгатов антитело-уреаза можно контролировать во время или после введения конъюгата антитело-уреаза в опухоль путем мониторинга опухолевой ткани с помощью инструмента, позволяющего обнаружить изменение рН в участке раковой ткани индивидуума. Такие инструменты могут включать рН-зонд, который может быть внедрен непосредственно в опухоль, или инструмент визуализации, такой как магнитно-резонансная томография (МРТ), компьютерная томография (КТ) или флюороскопия. МРТ-обследование можно проводить в отсутствии дополнительных средств визуализации, основываясь только на различиях в магнитных свойствах ткани в зависимости от рН. Для проведения КТ или флюороскопической визуализации может потребоваться применение дополнительного рН-чувствительного средства визуализации, прозрачность которого зависит от рН тканевой среды. Такие средства хорошо известны специалистам в данной области.
[0143] Перед любым введением конъюгата антитело-уреаза опухолевую ткань можно визуализировать по более низкому значению рН, чем в окружающей нормальной ткани. Так, нормальная ткань может иметь нормальное значение рН, составляющее примерно 7,2, тогда как рН опухолевой ткани может быть на 0,1-0,4 или более единиц ниже. То есть, перед любым введением конъюгата антитело-уреаза размер опухолевой ткани можно определить по более низкому значению рН. После введения уреазы pH участка опухоли, содержащего уреазу, начнет расти, причем увеличение pH можно определить путем сравнения полученных изображений с изображениями, полученными ранее до введения.
[0144] С помощью такого анализа ткани можно контролировать степень изменения рН и размер пораженной ткани. На основе результатов указанного анализа врач может ввести другую композицию в участок опухоли, и/или он может ввести композицию в другие сегменты опухолевого участка. Эту процедуру можно повторять до тех пор, пока не будет достигнута желательная степень изменения рН, например от 0,2 до 0,4 единицы рН, по всему участку солидной опухоли.
[0145] Введение, например путем прямой инъекции, можно повторять через подходящие интервалы времени, например, каждую неделю или два раза в неделю, до тех пор, пока не будет достигнут желательный результат, предпочтительно существенная или полная регрессия опухолевой массы. Эффективность лечения можно контролировать, как указано выше, путем визуализации изменений рН обработанной ткани в ходе лечения. Таким образом, перед каждой дополнительной инъекцией рН ткани можно визуализировать для определения существующего объема опухоли, после чего изменение рН ткани можно использовать для контроля введения в ткань новой дозы композиции антитело-уреаза.
[0146] Если композицию антитело-уреаза вводят парентерально способом, отличным от прямой инъекции, примерная доза композиции антитело-уреаза составляет 100-100000 международных единиц/кг активности уреазы/кг массы телаиндивидуума. Как отмечено в настоящем документе, композиция антитело-уреаза в этом способе содержит антитело для нацеливания уреазы на раковые клетки, например на участок солидной опухоли, или для секвестрирования уреазы, например, в липосомальной форме, селективно в участке опухоли.
[0147] Технологии визуализации, чувствительные к изменениям рН ткани, можно использовать для контроля эффективности вводимой дозы. Поскольку достижение мишени может занять несколько часов или более, способ может включать в себя определение рН опухоли, как указано выше, перед введением композиции антитело-уреаза и через несколько часов после введения, например, через 12-24 часов, для подтверждения того, что в участок опухоли была введена достаточная доза, о чем свидетельствует повышение рН в участке опухоли. В зависимости от результатов этого анализа способ может включать в себя дополнительное введение до достижения желательного увеличения рН, например, на 0,2-0,4 единицы рН. После определения дозы пациент может регулярно получать подобную дозу уреаза-содержащей композиции, например, один или два раза в неделю, до тех пор, пока не будет достигнуто изменение размера или состояния опухоли.
[0148] Конечный режим дозирования определяет лечащий врач с учетом успешной медицинской практики, в зависимости от разных факторов, влияющих на действие лекарственных средств, таких как удельная активность средства, тяжесть болезненного состояния, восприимчивость пациента, возраст, состояние, масса тела, пол и рацион пациента, тяжесть какой-либо инфекции и т.п. Другие факторы, которые можно принять во внимание, включают время и частоту введения, сочетиние (сочетиния) лекарственных средств, чувствительность реакции и толерантность к терапии/ответ на терапию. Дальнейшее уточнение дозы, подходящей для лечения с использованием одной из упомянутых здесь композиций, проводит трдиционным способом специалист-практик, предпочтительно с учетом информации о дозах и результатов описанных здесь анализов, а также фармакокинетических данных, полученных в клинических испытаниях. Подходящие дозы можно установить с помощью анализов, разработанных для определения концентрации средства в жидкости организма, или в другом образце, наряду с данными о зависимости между дозой и эффектом.
[0149] Частота введения дозы зависит от фармакокинетических параметров средства и способа введения. Дозировку и введение регулируют, чтобы обеспечить достаточный уровень активного средства или поддерживать желательный эффект. Соответственно, фармацевтические композиции можно вводить в виде однократной дозы, нескольких дискретных доз, непрерывной инфузии, депо с замедленным высвобождением или их сочетаний, в зависимости от того, какая схема введения обеспечивает поддержание желательного минимального уровня средства.
[0150] Фармацевтические композиции кратковременного действия (то есть с коротким периодом полувыведения) можно вводить один раз в день или чаще, чем один раз в день (например, два, три или четыре раза в день). Фармацевтические композиции длительного действия можно вводить каждые 3-4 дня, каждую неделю, или раз в две недели. Можно использовать насосы, такие как подкожные, внутрибрюшинные или субдуральные насосы для непрерывной инфузии.
[0151] Композиции, содержащие конъюгат в фармацевтически приемлемом носителе, после получения можно поместить в соответствующий контейнер и маркировать для лечения указанного состояния. Состояния, указанные на этикетке, могут включать, без ограничения, разные типы рака. Изобретение также предлагает описанные ниже наборы, которые содержат лекарственную форму фармацевтической композиции и вкладыш в упаковку, содержащий инструкции по применению композиции для лечения медицинского состояния.
[0152] Как правило, конъюгат-содержащие композиции вводят индивидууму в эффективном количестве. Эффективное количество обычно представляет собой количество, эффективное для (1) уменьшения симптомов заболевания, подлежащего лечению; или (2) индукции фармакологического изменения, связанного с лечением заболевания, подлежащего лечению. В случае рака эффективное количество может представлять собой количество, эффективное для: уменьшения размера опухоли; замедления роста опухоли; предотвращения или ингибирования метастазирования; или увеличения продолжительности жизни пораженного индивидуума.
Способ лечения
[0153] Технология настоящего изобретения предоставляет способ лечения рака у индивидуума, который включает введение индивидууму терапевтически эффективного количества описанной здесь композиции, обеспечивающего лечение рака у индивидуума. Раковые заболевания, подходящие для лечения с помощью описанных здесь способов, включают в себя, как правило, карциномы, лейкозы, лимфомы и саркомы. Карциномы могут представлять собой карциномы ануса, желчного тракта, мочевого пузыря, молочной железы, толстой кишки, прямой кишки, легких, ротоглотки, гипофаринкса, пищевода, желудка, поджелудочной железы, печени, почек, желчного пузыря и желчных протоков, тонкого кишечника, мочевыводящих путей, яичников, толстой кишки, немелкоклеточную карциному легких, карциномы половых путей, эндокринных желез, щитовидной железы и кожи. Другие подходящие виды рака включают карциноидные опухоли, стромальные опухоли желудочно-кишечного тракта, опухоли головы и шеи, первичные опухоли, гемангиомы, меланомы, злокачественную мезотелиому, множественную миелому, а также опухоли головного мозга, нервов, глаз и оболочек мозга.
[0154] В некоторых аспектах раковые заболевания, подлежащие лечению, образуют солидные опухоли, такие как карциномы, саркомы, меланомы и лимфомы. В некоторых аспектах рак представляет собой одно или несколько заболеваний, выбранных из немелкоклеточной карциномы легкого, рака молочной железы, поджелудочной железы, яичников, легких, толстой кишки или их сочетаний. В некоторых аспектах рак представляет собой немелкоклеточную карциному легкого. В некоторых аспектах индивидуум представляет собой человека.
[0155] Терапевтически эффективную дозу можно определить с помощью способов, хорошо известных в данной области. Животные модели рака, такие как иммунокомпетентные мыши с мышиными опухолями или иммунокомпромиссные мыши (например голые мыши), несущие ксенотрансплантаты опухолей человека, хорошо известны в данной области и широко описаны во многих публикациях, включенных в настоящее описание путем ссылки. Такую информацию используют в сочетании с результатами исследований безопасности на крысах, собаках и/или нечеловеческих приматов для определения безопасных и потенциально полезных для людей исходных доз. Дополнительную информацию для определения дозы, подходящей для введения организмам, может получить с помощью клинических испытаний реального рака человечека.
[0156] В некоторых аспектах способ лечения рака предназначается для лечения, а также улучшения по меньшей мере одного симптома рака. Считается, что лечение раковых больных проходит успешно, если пациент излечивается от рака, наблюдается ремиссия рака, удлиняется выживаемость в статистически значимой манере, статистически значимо увеличивается время до развития опухоли, наблюдается уменьшение нагрузки лимфоцитарной или гематопоэтической опухоли, определяемое на основании стандартных критериев, установленных для каждого типа лимфоцитарного или гемопоэтического злокачественного заболевания, или уменьшение массы солидной опухоли, определяемое на основании критериев оценки ответа солидных опухолей (RECIST 1.0 или RECIST 1.1, Therasse et al. J Natl. Cancer Inst. 92(3):205-216, 2000 and Eisenhauer et al. Eur. J. Cancer 45:228- 247, 2009). Используемый здесь термин "ремиссия" относится к отсутствию растущих раковых клеток у пациента, ранее имевшего симптомы рака. Так, если раковый пациент находится в состоянии ремиссии, это означает, что либо он излечен от рака, либо рак присутствует, но с трудом диагностируется. Например, рак может находиться в состоянии ремиссии, если опухоль не может увеличиваться или метастазировать. Полная ремиссия, в соответствии с настоящим описанием, включает отсутствие заболевания по данным диагностических методов, таких как визуализация, например, с помощью рентгена, МРТ, КТ и PET, или биопсия крови или костного мозга. Если раковый пациент переходит в состояние ремиссии, за этим может последовать рецидив, при котором рак снова возобновляется.
[0157] В некоторых аспектах лечение не проводят в сочетании с применением пеметрекса и/или карбоплатина. В некоторых аспектах лечение не проводят в сочетании с применением фолатного антиметаболита и/или платина-содержащего средства.
Наборы
[0158] В некоторых аспектах технология настоящего изобретения предоставляет наборы для ингибирования роста опухолевых клеток с помощью описанных здесь способов. В состав наборов входит контейнер, содержащий одно или несколько активных средств. Наборы могут дополнительно содержать любой из описанных здесь других компонентов, подходящих для осуществления способов технологии настоящего тхобретения.
[0159] В состав наборов могут необязательно входить инструкции, содержащие руководства (то есть протоколы) по применению активных средств для ингибирования роста опухолевых клеток. Таким образом, в одном аспекте в состав набора входят фармацевтическая композиция, содержащая активное средство, предпочтительно фермент уреазу, и инструкции по введению композиции индивидууму с целью лечения рака у индивидуума. В одном аспекте инструкция обучает введению уреаза-содержащей композиции индивидууму в количестве, которое зависит от размера опухоли и составляет от 0,1 до 100 международных единиц уреазной активности на мм3 опухоли, если композицию вводят посредством прямой инъекции в опухоль, и в количестве от 100 до 100000 международных единиц уреазной активности/кг массы тела, если композицию вводят индивидууму парентеральным способом, отличным от прямой инъекции в опухоль.
[0160] В другом аспекте инструкция обучает введению уреаза-содержащей композиции индивидууму, который также получает слабоосновное противоопухолевое соединение, эффективность которого снижается в условиях градиента более высокое значение внутриклеточного рН/более низкое значение внеклеточного рН, наблюдающегося в солидной опухоли, где уреаза присутствует в количестве, эффективном для уменьшения или устранения градиента более высокое значение внутриклеточного рН/более низкое значение внеклеточного рН, наблюдающегося в солидной опухоли.
[0161] Альтернативно инструкция обучает введению уреаза-содержащей композиции индивидууму, имеющему, или предположительно имеющему солидную опухоль, в условиях, эффективных для локализации уреазы в солидной опухоли индивидуума, обследованию индивидуума с помощью диагностического инструмента, позволяющего обнаружить изменение внеклеточного рН в ткани индивидуума, и идентификации участка ткани индивидуума, в котором наблюдается повышение внеклеточного рН после указанного введения.
[0162] Хотя инструкции обычно содержат письменные или печатные материалы, они не ограничиваются таковыми. Любые носители информации, способные хранить такие инструкции и предоставлять их конечному пользователю, входят в объем технологии настоящего изобретения. Такие носители включают в себя, без ограничения, электронные носители (например, магнитные диски, кассеты, картриджи, чипы), оптические носители (например, CD-ROM) и т.п. Указанные носители могут содержать ссылки на интернет-сайты, которые предоставляют такие инструкции.
ПРИМЕРЫ
[0163] Нижеследующие примеры приведены для иллюстрации разных аспектов изобретения. Они не предназначены для ограничения изобретения каким-либо образом. Для специалиста в данной области будет очевидно, что с использованием настоящего описания можно достичь указанных целей, результатов и преимуществ, а также любых целей, результатов и преимуществ, присущих настоящему изобретению. Приведенные примеры (наряду с описанными здесь способами) представляют предпочтительные аспекты. Они являются иллюстративными и не предназначены для ограничения объема изобретения. Вариации и другие способы применения, которые входят в объем изобретения, определяющийся формулой изобретения, будут очевидны для специалистов в данной области.
Пример 1: L-DOS47: Конъюгат антитело-уреаза, направленный на CEACAM6-экспрессирующие опухоли
[0164] Микросреда в опухолях часто является кислой по сравнению с нормальной тканью. Непосредственной причиной, вероятно, является накопление лактата в результате анаэробного гликолиза в ответ на местную гипоксию, обусловленную аберрантной сосудистой сетью (1, 2). Однако раковые клетки продолжают метаболизировать глюкозу анаэробно даже в присутствии кислорода (3). Это позволяет предположить, что конвертированный метаболический фенотип и образовавшаяся кислая среда могут дать раковым клеткам преимущество в росте (4).
[0165] Показано, что уреаза бобовых, которая превращает мочевину в аммиак и повышает рН раствора, является цитотоксичной для раковых клеток (8). Внутриопухолевая инъекция фермента мышам, несущим ксенотрансплантаты молочной железы и легких человека, также значительно замедляет рост опухолей (8). Однако внутриопухолевую доставку противоракового терапевтического средства в клинических условиях трудно осуществить. Для пациентов с запущенным и в значительной степени метастатическим заболеванием внутриопухолевая инъекция не является жизненноважной процедурой. Более практичный подход заключается в доставке фермента путем внутривенной инъекции. Однако уреаза не содержит направляющий домен и системная доставка фермента может привести к проявлению токсичности вне мишени. Конъюгат антитело-фермент, который является специфичным к опухоли, используют для доставки уреазы в участок раковой опухоли. Антитело, входящее в состав конъюгата, специфически распознает CEACAM6 у пациентов с немелкоклеточным раком легкого.
[0166] Фрагмент однодоменного верблюжьего антитела (AFAIKL2, SEQ ID NO.1), который распознает CEACAM6 на клетках аденокарциномы легких (17), используют для конъюгации с уреазой бобовых (DOS47) с получением противоракового терапевтического средства. Технология настоящего изобретения описывает некоторые из соответствующих доклинических исследований конъюгата антитело против CEACAM6-уреаза (L-DOS47), который в настоящее время находится в фазе I клинического испытания на людях.
[0167] Противоопухолевую активность уреазы бобовых объединяют со специфичностью однодоменного антитела против СЕКАКАМ6 в виде конъюгата антитело-уреаза (L-DOS47). L-DOS47 специфически связывается к CEACAM6-экспрессирующими линиями раковых клеток и обладает сильным цитотоксическим эффектом. Анализ конкурентного связывания демонстрирует, что сродство L-DOS47 примерно в 500 раз выше, чем сродство нативного однодоменного антитела вследствие повышенной авидности. Цитотоксичность L-DOS47 зависит от наличия мочевины in situ и чувствительности клеток-мишеней к токсичности аммиака. Клетки BxPC-3 защищены от эффектов L-DOS47 вследствие сайленсинга гена CEACAM6, тогда как повышенная экспрессия CEACAM6 придает трансфицированным клеткам H23 чувствительность к цитотоксичности L-DOS47. Иммунохимическое окрашивание нормальной и раковой тканей человека демонстрирует, что L-DOS47 связывается преимущественно с аденокарциномой легких, а также с аденокарциномой толстой кишки и поджелудочной железы с положительным, но более слабым окрашиванием. Исследование метастазов клеток аденокарциномы легких A549 у мышей также демонстрирует, что L-DOS47 в концентрации 10 мкг/мл эффективно уменьшает число раковых клеток в легких.
[0168] Материалы. Уреазу бобовых (Canavalia ensiformis) получают от BioVectra Inc. (PEI, Канада) и затем очищают путем осаждения в присутствии кислоты, фракционирования в спирте и ионообменной хроматографии. Чистота фермента составляет >97% по данным SDS-PAGE, ВЭЖХ и масс-спектрометрии. Одну единицу уреазы определяют как количество фермента, продуцирующее 1 мкмоль/мин аммиака при 25°С и рН 7,6.
[0169] Фаговую библиотеку, полученную из набора тяжелых цепей антител ламы, используют для идентификации однодоменного антитела (sdAb) путем пэннинга против клеток немелкоклеточной аденокарциномы легкого A549. sdAb обозначают как AFAI (17). Генную последовательность AFAI оптимизируют в целях конъюгации и переименовывают в AFAIKL2. Затем антитело AFAIKL2 клонируют и экспрессируют в системе E. coli BL21 (DE3) pT7-7. Антитело очищают от тел включения методом ионообменной хроматографии. Конъюгирование антитела с уреазой проводят с использованием гетеробифункционального сшивающего средства N-сукцинимидил (4-иодацетил)аминобензоата (SIAB). Антитело AFAIKL2 сначала активируют с помощью NHS-сложноэфирного фрагмента линкера SIAB через первичные аминогруппы. Активированное антитело присоединяют к уреазе через иодацетильную группу сшивающего средства посредством свободных сульфгидрильных групп, присутствующих на ферменте. Желательный коэффициент конъюгации (от 1:6 до 1:10, отношение уреазы к антителу) достигают путем смешивания высокочистой уреазы с активированным антителом в массовом соотношении 2:1. Конъюгат антитело-уреаза очищают ультрафильтрацией.
[0170] Мочевину, трипсин (со степенью чистоты, подходящей для культивирования тканей), этосульфат феназина (PES), нитропруссид натрия, раствор гипохлорита натрия, фенол, NaCl, KH2PO4, MgSO4, NaHCO3 и глутаральдегид приобретают у Sigma Chemical Co. (Сент-Луис, Миссури). 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий (МТС) и трипсин (для применения в анализе, включающем в себя фрагментацию пептидов и масс-спектрометрию) приобретают у Promega Corp. (Мэдисон, ВИ). Перекись водорода (30%), SIAB, KCl, D-глюкозу, HCl, Na2HPO4 и NaH2PO4 приобретают у Fisher Scientific (Ottawa, ON). Фракцию V быьего сывороточного альбумина (BSA) приобретают у Roche (Indianapolis, IN). Хлорид аммония (0,100 М) приобретают у Ricca Chemical (Arlington, TX). Конъюгат антитело AFAIKL2-пероксидаза получают в Rockland Immunochemicals (Gilbertsville, PA). Среду для культивирования клеток (RPMI), фетальную бычью сыворотку и антибиотики получают от Life Technologies (Burlington, ON). Самок голых мышей CrTac:NCr-Foxn1nu получают от Taconic (Hudson, NY). В экспериментах используют модифицированный буфер Кребса-Рингера (KRB), содержащий NaCl (98,3 мМ), KCl (4,73 мМ), KH2PO4 (1,19 мМ), MgSO4 (1,19 мМ), D-глюкозу (11,7 мМ), Na2HPO4 (11,1 мМ) и NaH2PO4 (2,77 мМ), pH 7,2.
Индофенольный анализ
[0171] Количество аммиака, продуцируемое в процессе ферментативной реакции уреазы, определяют с помощью модифицированного индофенольного анализа (18). Коротко говоря, свежий раствор А получают путем растворения 165 мг фенола и 132 мг гранул NaOH в 10 мл воды с последующим добавлением 66 мкл раствора нитропруссида натрия (10 мг/мл). Раствор В получают путем добавления 40 мкл гипохлорита натрия к 5 мл воды. Растворы образцов (30 мкл каждого) из анализа связывания целых клеток (см. ниже) переносят в новый 96-луночный планшет, содержащий 50 мкл/лунку 5N NaOH:H2O (3,3:46,7) и 20 мкл/лунку воды. Добавляют раствор А (50 мкл/лунку) и раствор В (50 мкл/лунку), после чего планшеты переносят в ридер для микропланшетов и дают развиваться окрашиванию при 37°С в течение 30 минут. OD измеряют при 630 нм. Количество аммиака, образующегося в лунках, рассчитывают по калибровочной кривой с использованием хлорида аммиака в качестве стандарта (в концентрации от 0 до 150 мкм).
Анализ связывания L-DOS47 с целыми клетками
[0172] Клеточные монослои получают путем высевания 100 мкл/лунку опухолевых клеток (4×104 клеток/лунку) в 96-луночные культуральные планшеты с последующей инкубацией в течение ночи при 37°С. Из планшетов удаляют среду, а монослои клеток фиксируют с помощью 100 мкл/лунку 0,05% глутаральдегида (в забуференном фосфатом физиологическом растворе, PBS) в течение 10 минут при комнатной температуре (КТ). Затем планшеты промывают PBS, добавляют 120 мкл/лунку раствора глицина (50 мМ) и инкубируют при 37°С в течение 20 минут. После инкубации планшеты блокируют с помощью 120 мкг/лунку 1% BSA/PBS при 37°C в течение 30 минут. Затем планшеты промывают 3 раза буфером А (0,05% BSA в PBS), добавляют 80 мкл/лунку разведенных растворов L-DOS47 или DOS47 и инкубируют при 37°С в течение 1,5 часов. Сигнал связывания генеруют с помощью способов, включающих применение либо мочевины, либо антитела: (1) В способе, включающем применение мочевины, планшеты промывают 4 раза буфером А, добавляют 80 мкл/лунку из 20 мМ раствора мочевины (в 0,1 М фосфатном буфере, рН 7,6) и инкубируют при 37°С в течение 30 минут. После инкубации для остановки реакции добавляют 40 мкл/лунку 1N HCl. Количество аммиака, образовавшегося в каждой лунке, определяют с помощью индофенольного анализа. (2) В способе, включающем применение антител, вначале гасят эндогенную пероксидазу с использованием 100 мкл/лунку 0,3% перекиси водорода в течение 30 минут, до начала стадии блокирования. После инкубации с тестируемыми соединениями планшеты промывают PBS и готовят разведения конъюгата антитело против AFAIKL2-пероксидаза (1:8000) в буфере А, содержащем 0,05% твин-20 и 0,1% сухого молока. Планшеты промывают 3 раза буфером А и добавляют конъюгат антитело-пероксидаза в количестве 100 мкл/лунку. После инкубации при 37°С в течение 1 часа планшеты промывают 3 раза буфером А. Добавляют 1 мМ раствор субстрата пероксидазы в натрий-цитратном буфере, содержащем 0,03% H2O2, в количестве 100 мкл/лунку и инкубируют при комнатной температуре в течение 30 минут. Планшеты переносят в ридер для микропланшетов и измеряют OD при 405 нм.
Анализ цитотоксичности L-DOS47
[0173] Монослои клеток получают путем высевания 100 мкл/лунку опухолевых клеток (4×10 клеток/лунку) в 96-луночные культуральные планшеты и инкубируют в течение ночи при 37°С. Из каждой лунки удаляют среду и добавляют 80 мкл/лунку либо L-DOS47, либо DOS47, после чего дополнительно инкубируют при 37°C в течение 2 часов. После инкубации планшеты промывают 3 раза буфером А. Затем к планшетам добавляют 100 мкл/лунку мочевины (20 мМ) в KRB и инкубируют при 37°С в течение ночи. Среду заменяют на среду, не содержащую тестируемые компоненты, в количестве 100 мкл/лунку. Жизнеспособность клеток определяют с помощью анализа жизнеспособности клеток MTS, в котором готовят смесь растворов MTS/PES (20:1 об/об, MTS, 2 мг/мл, PES, 1 мг/мл) и затем в планшеты добавляют 20 мкл/лунку смеси. Планшеты инкубируют при 37°С в течение 1-2 часов и измеряют OD при 630 нм и для сравнения при 490 нм.
Электрохемолюминесцентный анализ связывания с использованием клеток (ECL)
[0174] L-DOS47, AFAIKL2 и DOS47 метят рутений-NHS-сложным эфиром (Sulfo-Tag, Meso Scale Discovery MSD, Rockville, MD) в соответствии с инструкциями производителя. Указанные с меченные рутением белки позволяют непосредственно измерять связывание L-DOS47 и AFAIKL2 с целевым антигеном. Для анализа непосредственного связывания получают монослой клеток BxPC-3 на 96-луночном планшете SECTOR PR High-Bind (MSD). После фиксации и блокировки добавляют разные количества меченных L-DOS47 или AFAIKL2. Планшет инкубируют при 37°С в течение 1,5 часов. После инкубации планшет промывают два раза и заполняют буфером для прочтения (MSD). Затем прочитывают сигнал ECL с помощью ридера SECTOR PR-100 (MSD). Для конкурентного анализа связывания используют L-DOS47 или антитело AFAIKL2, которые ингибируют связывание меченного L-DOS47 с клетками BxPC-3. Меченный L-DOS47 используют для связывания с клетками BxPC-3 в концентрации 1 мкг/мл. Используют разные концентрации соединений (L-DOS47 или AFAIKL2), конкурирующих за связывание с меченным L-DOS47. После инкубации планшет промывают два раза и заполняют буфером для прочтения. Затем планшет сразу прочитывают с помощью ридера SECTOR PR-100.
Нокдаун гена CEACAM6 в клетках BxPC-3
[0175] Чтобы подтвердить, что CEACAM6 является специфическим антигеном, распознаваемым L-DOS47, осуществляют сайленсинг гена CEACAM6 в положительной клеточной линии BxPC-3 с использованием клонов HuSH-29, обеспечивающих экспрессию шпилечных конструкций и поставляемых OriGene (Rockville, MD). Указанные плазмиды обеспечивают транскрипцию последовательностей коротких шпилечных РНК (кшРНК), которые блокируют транскрипцию гена-мишени посредством РНК-интерференции. Клетки BxPC-3 трансфицируют плазмидами HuSH, после чего стабильно трансфицированные клетки отбирают с использованием пуромицина. В результате трансфекции HuSH6 (AAGGCGAAAGAGTGGATGGCAACAGTCTA (SEQ ID NO: 5)), HuSH7 (AAGAAGCAACCGGACAGTTCCATGTATAC (SEQ ID NO: 6)) и контрольной плазмиды HuSH-TRS получают разные клоны. Две положительные стабильные клеточные линии (HUSH#6 и HUSH#7) и контроль-содержащие клетки (HUSH-TRS) отбирают с использованием антибиотиков. Затем указанные клоны проверяют на способность связываться с L-DOS47, используя анализа связывания с целыми клетками. После инкубации с L-DOS47 планшеты промывают 3 раза буфером А и добавляют 80 мкл/лунку 20 мМ раствора мочевины (в 0,1 М фосфатном буфере, рН 7,6). Планшеты инкубируют при 37°С в течение 30 минут. Ферментативную реакцию останавливают путем добавления 40 мкл/лунку 1N HCl. Количество продуцируемого аммиака определяют с использованием индофенольного анализа.
Трансфекция гена CEACAM6 в клетки H23
[0176] Вектор, обеспечивающий экспрессию в клетках млекопитающих и содержащий селектируемый маркер G418, клонируют вместе с генами PMP-GFP (плазматический мембранный белок-зеленый флуоресцентный белок) и CEACAM6. Для трансфекции экспрессирующего вектора в клетки H23 используют реагент целлфектин (Life Technologies). Коротко говоря, клетки H23 в количестве 2×106 клеток/лунку в 2 мл полной среды RPMI (содержащей 10% фетальной бычьей сыворотки, 50 ед/мл пенициллина и 50 мкг/мл стрептомицина) высевают в 6-луночный культуральный планшет и инкубируют при 37°С в течение ночи. Реагент целлфектин (10 мкл) и ДНК (1-2 мкл) разводят 100 мкл среды RPMI, не содержащей сыворотку, соответственно. Затем два разведенных раствора объединяют, осторожно перемешивают и инкубируют при комнатной температуре в течение 30 минут. Планшеты дважды промывают 1,5 мл среды RPMI, не содержащей сыворотку. Объединенный раствор разводят 0,8 мл среды RPMI, не содержащей сыворотку, осторожно перемешивают и добавляют к клеткам. Клетки инкубируют при 37°С в СО2-инкубаторе в течение ночи. На следующий день среду заменяют на 2 мл полной среды RPMI. Трансфицированные клетки совместно экспрессируют GFP из той же мРНК, что и CEACAM6. Трансфицированные клетки отбирают путем инкубации в среде, содержащей 400 мкг/мл антибиотика G418. Клетки сортируют сразу после инкубации с использованием c5.5-меченного L-DOS47, который свидетельствует о наличии поверхностной экспрессии CEACAM6.
Иммунохимическое окрашивание опухолевых тканей человека с использованием L-DOS47
[0177] Подвергают скринингу всего 400 образцов ткани, представляющих 42 раковые и нормальные ткани (Axel Wellmann, University Hospital Aachen, RWTH Aachen Germany). Срезы сначала инкубируют в сушильном шкафу при 62°С в течение 1 часа в вертикальном положении, чтобы удалить парафин. Затем срезы депарафинизируют в ксилоле всего 5×4 минут. Срезы гидратируют в 100%, 95% и 75% этаноле в течение 2×3 минут каждый, после чего их погружают в водопроводную воду на 5 минут. Эндогенную пероксидазу гасят 0,3% H2O2 в течение 30 минут. Для детекции связывания L-DOS47 со срезами используют набор Vectastain Elite ABC (Vector Labs, Burlington, ON). Коротко говоря, после промывания PBS в течение 3×5 минут срезы инкубируют в блокирующей сыворотке при 4°С в течение ночи. Затем срезы инкубируют в растворе L-DOS47 (20 мкг/мл в буфере А) при 37°С в течение 1,5 часов. После промывания PBS срезы инкубируют с мышиным антителом против уреазы (Sigma, 1:1500) при 37°C в течение 1 часа. После промывания PBS срезы инкубируют с раствором биотинилированного вторичного антитела (Vector Labs) в течение 30 минут. После промывания PBS срезы инкубируют с реагентом Vectastain Elite ABC в течение 30 минут. После промывания PBS срезы инкубируют в свежей смеси, содержащей раствор субстрата пероксидазы DAB (3,3'-диаминобензидин) (Vector Labs) при комнатной температуре в течение 2 минут. Реакцию останавливают промыванием водопроводной водой в течение 5 минут. Затем срезы подвергают контрастному окрашиванию гематоксилином Мейера в течение 10 секунд. Срезы дегидратируют в 75, 80, 95 и 100% этаноле. После очистки в ксилоле срезы заключают в гистологическую среду Clarion.
Исследование метастазирования A549
[0178] Опухолевые клетки A549 (5×106) высевают и выращивают в чашках с низким связыванием. После достижения достаточного числа клеток их собирают и ресуспендируют в культуральной среде в концентрации 5×106 клеток/мл. Затем клетки помещают в 6-луночные планшеты для культивирования тканей с низким связыванием в количестве 1 мл/лунку. Затем в каждую лунку добавляют L-DOS47 (1 мл) до конечной концентрации 10 или 15 мкг/мл. Изотипический контроль обрабатывают конъюгатом V21-DOS47 (конъюгат антитело-уреаза, направленный на рецептор фактора роста эндотелия сосудов (VEGF)) в концентрации 10 мкг/мл. Клетки инкубируют при 37°С в течение 4 часов. После инкубации клетки центрифугируют, три раза промывают стерильным PBS и ресуспендируют в 1×107 клеток/мл в стерильном PBS. Затем каждая мышь однократно получает 1×106 обработанных клеток. В этом исследовании участвует 4 группы самок мышей CrTac:NCr-Foxn1nu (необработанные, получающие изотипический контроль и L-DOS47 (10 и 15 мкг/мл)). В общей сложности сорока мышам (10 в каждой группе) инокулируют внутривенно через хвостовую вену опухолевые клетки A549.
[0179] Пять животных из каждой группы подвергают эвтаназии на 22-й день (3 недели), а остальных животных держат до 71 дня (10 недель). После умерщвления животным внутритрахеально вводят китайскую тушь (Calvert Labs, Olyphant, PA); затем легкие выделяют и фиксируют их в растворе Фекете (Calvert Labs). Влияние испытуемого соединения на метастазирование опухоли определяют путем подсчета числа метастатических опухолей (очагов) в каждом легком с помощью препаровальной лупы. Фотографируют легкие, типичные для каждой группы.
Связывание L-DOS47 с разными линиями раковых клеток
[0180] Разные профили связывания L-DOS47 наблюдают среди пяти линий опухолевых клеток - BxPC-3, Capan-1, ZR-75-30, LS174T и MDA-MB231 (фиг. 1А). Результаты демонстрируют, что L-DOS47 хорошо связывается с двумя линиями клеток поджелудочной железы (BxPC-3 и Capan-1) и с линией клеток молочной железы (ZR-75-30), свидетельствуя о том, что антиген CEACAM6 экспрессируется на клеточной поверхности. Также наблюдается умеренная способность к связыванию линии клеток толстой кишки LS174T, тогда как связывание с линией клеток молочной железы MDA-MB231 (отрицательный контроль) не обнаружено. Антитело AFAIKL2, конъюгированное с ферментом уреазой, обеспечивает специфичность в отношении клеток, экспрессирующих CEACAM6. Это подтверждает отсутствие сигнала связывания в клетках, обработанных DOS47 (данные не показаны).
Цитотоксичность L-DOS47
[0181] На фигуре 1B показано, что и BxPC-3, и ZR-75-30 чувствительны к цитотоксичности L-DOS47. В этих двух клеточных линиях наблюдается быстрое снижение выживаемости клеток, обработанных L-DOS47 в концентрации менее 1 мкг/мл. Умеренные эффекты наблюдаются в клетках Capan-1 и LS174T. L-DOS47 не оказывает никакого влияния на клеточную линию MDA-MB231, используемую в качестве отрицательного контроля. Результаты анализов связывания и цитотоксичности других клеточных линий показаны в таблице 1. Цитотоксичность L-DOS47 непосредственно зависит от способности L-DOS47 связываться с соответствующими клеточными линиями. Более слабый цитотоксический ответ A549 и Capan-1 обусловлен повышенной толерантностью этих двух клеточных линий к токсичности аммиака (данные не показаны). С другой стороны, клетки H23 обладают высокой чувствительностью к аммиаку (данные не показаны). Несмотря на отсутствие антигена CEACAM6 на клеточной поверхности, клетки H23 все-таки дают некоторый слабый цитотоксический ответ на L-DOS47, вероятно, вследствие присутствия в лунках неспецифически связанного L-DOS47.
Таблица 1. Результаты разных анализов связывания и цитотоксичности L-DOS47, полученные на девяти линиях опухолевых клеток человека.
Где:+обозначает положительный ответ (число+указывает на величину активности); - обозначает отрицательный ответ
[0182] В пяти клеточных линиях (BxPC-3, Capan-1, ZR-75-30, LS174T и A549) из четырех тканей человека наблюдается сильное связывание L-DOS47 и высокая чувствительность к цитотоксичности L-DOS47 (за исключением A549), как показано в таблице 1. Цитотоксические эффекты L-DOS47 в большей или меньшей степени зависят от относительной силы связывания с раковыми клетками. Приведенные на графиках результаты представляют собой среднее значение от нескольких (n=3) типичных экспериментов. Стандартное отклонение (SD) составляет менее 10% для всех значений.
Прямое и конкурентное связывание L-DOS47 с клетками BxPC-3
[0183] Клеточныый электрохемилюминесцентный анализ связывания позволяет непосредственно обнаружить связанный с опухолевыми клетками конъюгат, содержащий меченное рутением антитело. На фиг. 2А показано, что и меченный рутением L-DOS47, и антитело AFAIKL2 связываются с клетками BxPC-3, тогда как меченный рутением DOS47 действует как отрицательный контроль. L-DOS47 обладает гораздо более высоким сродством, чем антитело AFAIKL2, вследствие более высокой авидности антител (6-10 антител), входящих в состав L-DOS47. Результаты дополнительно подтверждают с использованием L-DOS47 и антитела AFAIKL2 в качестве конкурентных соединений, способных ингибировать связывание клеток BxPC-3 с меченным рутением L-DOS47 (фиг. 2B). И L-DOS47, и антитело AFAIKL2 ингибируют связывание меченного рутением L-DOS47 с BxPC-3, и, как и ожидалось, L-DOS47 обладает более высоким сродством и, следовательно, сильнее ингибирует связывание меченного рутением L-DOS47 с BxPC-3, чем антитело AFAIKL2. Величины кажущегося сродства L-DOS47 и антитела AFAIKL2 можно сравнить с использованием IC50 (количество конкурентного соединения, необходимое для уменьшения связывания на 50%) тестируемых соединений. Значения IC50 L-DOS47 и антитела AFAIKL2 составляют 2 и 20 мкг/мл, соответственно; или 3,22 нМ для L-DOS47 (МВ=622k при коэффициенте конъюгации 6 антител на 1 уреазу) и 1,55 мкМ для AFAIKL2 (MW=12,9k). Полученные результаты позволяют предположить, что сродство L-DOS47 примерно в 500 превышает сродство антитела AFAIKL2.
Повышенная экспрессия трансфицированного гена CEACAM6 в клетках H23
[0184] После трансфекции геном CEACAM6 идентифицируют положительный клон H23-CC6#7. Клоны с уровнем CEACAM6, близким к уровню, присутствующему в клетках A549, получают путем повторного сортинга клона H23-CC6#7 с использованием L-DOS47-cy5.5. Последующая инкубация клона в присутствии повышенного количества антибиотика G418 (800 мкг/мл) позволяет выбрать клон с более высоким уровнем экспрессии CEACAM6. Хотя H23-CC6#7 экспрессирует меньше CEACAM6 на поверхности, чем клетки A549 и BxPC-3, этот CEACAM6-трансфицированный клон является более чувствительным к цитотоксичности L-DOS47, чем клетки BxPC-3 (фиг. 3B), вследствие его высокой чувствительности к токсичности аммиака (данные не показаны).
Нокдаун гена CEACAM6 в клетках BxPC-3
[0185] L-DOS47 связывается с двумя клонами с нокдауном CEACAM6 (HUSH#6 и HUSH#7) значительно хуже, чем с нативными клетками BxPC-3 и контрольным клоном (HUSH-TR3) (фиг. 3С). Эксперимент отчетливо демонстрирует, что присутствие CEACAM6 на поверхности клетки имеет важное значение для связывания L-DOS47. Сайленсинг гена значительно уменьшает связывание L-DOS47.
Иммунохимическое окрашивание опухолевых тканей человека с использованием L-DOS47
[0186] Скрининг нормальных и раковых тканей демонстрирует, что L-DOS47 распознает почти исключительно подтип аденокарциномы (таблица 2). Среди более 400 образцов тканей, которые представляют 42 группы, состоящие из разных раковых и соответствующих нормальных тканей, значительное окрашивание наблюдается в тканях аденокарциномы легких, причем распознается более 80% клеток. Нормальные легочные ткани, полученные в соответствующей возрастной группе, являются отрицательными с оттенком фокального окрашивания в нескольких активированных пневмоцитах. Другие ткани, в которых наблюдается положительное, но слабое окрашивание, включают аденокарциному толстой кишки и поджелудочной железы. На фигуре 4 показано иммунохимическое окрашивание аденокарциномы толстой кишки и легкого с использованием L-DOS47.
Таблица 2. Скрининг нормальных и раковых тканей человека на способность связывать L-DOS47
[0187] Иммуногистохимическое окрашивание аденокарциномы толстой кишки и легкого человека с использованием L-DOS47 проводят, как показано на рисунке 4.
Исследование метастазирования A549
[0188] Через 3 недели у мышей, получавших клетки A549, обработанные 10 и 15 мкг/мл L-DOS47, наблюдается значительное уменьшение числа опухолей легких (p <0,05) по сравнению с необработанной контрольной группой (таблица 3). Однако через 10 недель значимое уменьшение среднего числа опухолевых клеток не наблюдается. Через 3 и 10 недель после введения 10 мкг/мл L-DOS47 наблюдается согласующееся, хотя и статистически не значимое, уменьшение числа опухолевых клеток по сравнению с необработанной контрольной группой (таблица 3). Интересно, что изотипический контроль (V21-DOS47) также оказывает влияние и уменьшает число опухолей в легких. Таким образом, обработка клеток A549 с помощью L-DOS47 в концентрации 10 мкг/мл уменьшает среднее число опухолей легких через 3 недели после введения, однако этот эффект является временным, поскольку через 10 недель после введения не наблюдается значительное снижение среднего числа опухолей.
Таблица 3. Среднее число опухолей легких, подсчитанное в исследовании метастазов A549
#Среднее значение±sem; *p <0,05 по сравнению с необработанной контрольной группой.
[0189] Как показано в таблице 3, клетки аденокарциномы легкого человека A549 обрабатывают L-DOS47 или изотипическим контролем (V21-DOS47) in vitro. После инкубации при 37°С в течение 4 часов клетки трижды промывают PBS и ресуспендируют в PBS в концентрации 1×107 клеток/мл. Затем каждой мыши однократно вводят 1×106 обработанных клеток. Пять животных в каждой группе подвергают эвтаназии через 3 недели и 10 недель после инъекции. Влияние тестируемого соединения на метастазирование опухоли определяют путем подсчета числа метастатических опухолей в каждом легком с помощью препаровальной лупы. Рост метастатической опухоли в группе, обработанной L-DOS47, и в необработанной контрольной группе сравнивают с помощью непарного t-теста. Совместная инъекция L-DOS47 через 3 недели после введения значительно уменьшает количество опухолей.
[0190] Описано применение уреазы в качестве потенциального противоракового терапевтического средства, действие которого основано на опосредованном ферментом образовании аммиака и местном повышении рН (8). Однако отсутствие селективности фермента в отношении опухолевых клеток по сравнению с нормальными клетками ограничивает его применение в качестве противоракового терапевтического средства. Применение конъюгата антитело-лекарственное средство (ADC) или, более конкретно, антитело-направленной ферментной пролекарственной терапии (ADEPT) в рамках описанной технологии позволяет обойти это ограничение. В этом примере получают конкретную форму конъюгата антитело-уреаза (L-DOS47) путем конъюгирования CEACAM6-специфического однодоменного антитела ламы (AFAIKL2) с уреазой (DOS47). Конъюгированные антитела AFAIKL2 обеспечивают специфичность и, следовательно, повышают эффективность фермента уреазы в отношении CEACAM6-экспрессирующих опухолей. Специфичность L-DOS47 в отношении раковых клеток, экспрессирующих CEACAM6 на поверхности, определяют с помощью анализов связывания in vitro (фиг.1 и 2). Результаты этих анализов демонстрируют, что L-DOS47 связывается с клеточными линиями, экспрессирующими CEACAM6 (BxPC-3, Capan-1, ZR-75-30 и LS174T), но не с клеточными линиями, которые не экспрессируют CEACAM6 (MDA-MB231). Кроме того, функциональную роль CEACAM6 подтверждают экспериментами с нокдауном и повышенной экспрессией CEACAM6 в раковых клетках (фиг. 3). Повышенную экспрессию CEACAM6 достигают путем трансфекции CEACAM6-кодирующей плазмиды в клетки H23, тогда как нокдаун гена проводят путем опосредованного короткой шпилечной РНК истощения клеток BxPC-3 по CEACAM6. Анализы связывания демонстрируют, что L-DOS47 связывается с высоким сродством с нативными клетками BxPC-3, но не с клетками BxPC-3, в которых проведен нокдаун гена CEACAM6 (фиг. 3С). И наоборот, повышенная экспрессия CEACAM6 в клетках H23 делает клетки способными к связыванию L-DOS47 и чувствительными к цитотоксичности L-DOS47 (фиг. 3A и 3B). Полученные результаты демонстрируют, что специфическое связывание L-DOS47 с антигеном CEACAM6 играет важную роль в индукции антитело-содержащим конъюгатом противоопухолевой цитотоксичности. Другим преимуществом конъюгата антител с уреазой по сравнению с индивидуальным антителом является общее увеличение авидности. Анализы связывания иетодом ECL демонстрируют, что L-DOS47 с молярным коэффициентом конъюгации 6-10 антител на 1 молекулу уреазы связывается с клетками BxPC-3 в 500 раз лучше, чем отдельное антитело (фиг. 2B). Другие анализы связывания конъюгата позволяют предположить, что соотношение антител к ферменту, превышающее 6:1, является оптимальным для связывания L-DOS47 с CEACAM6 (данные не показаны).
[0191] Механизм действия исследуют с помощью анализов in vitro и in vivo. Уреаза является активным компонентом L-DOS47, причем предыдущие исследования продемонстрировали, что уреаза является цитотоксичной для опухолевых клеток человека in vitro (8). Внутриопухолевое введение уреазы в опухоли A549 (опухоль легкого) и MCF-7 (опухоль молочной железы) у голых мышей приводит к значительному ингибированию роста опухоли (8). Однако цитотоксическая эффективность уреазы или L-DOS47 также зависит от чувствительности линий опухолевых клеток к аммиаку. Например, на фигуре 1A показано, что L-DOS47 почти одинаково хорошо связывается с BxPC-3, ZR-75-30 и Capan-1, однако Capan-1 дает умеренный цитотоксический ответ по сравнению с двумя другими клеточными линиями (фиг. 1B). Линия Capan-1 менее чувствительна к цитотоксическому эффекту аммиака, чем BxPC-3 и ZR-75-30 (данные не показаны). Подобным образом, клетки аденокарциномы легкого человека H23 чувствительны к присутствию аммиака; после трансфекции геном CEACAM6 клеточная линия становится чувствительной к цитотоксичности L-DOS47 (фиг. 3B), несмотря на то, что на поверхности клеток присутствует меньше антигенов CEACAM6, чем на клетках BxPC-3 (данные не показаны) и A549 (фиг. 3A). В заключение следует отметить, что для проявления цитотоксического эффекта L-DOS47 в отношении опухоли требуется наличие двух важных факторов, экспрессии CEACAM6 на поверхности клетки и чувствительности к аммиаку.
[0192] Скрининг раковых тканей человека с помощью иммуногистохимического анализа демонстрирует, что L-DOS47 специфичен к аденокарциномам легких, толстой кишки и поджелудочной железы (таблица 2), но не к соответствующим нормальным тканям. Конъюгация нескольких антител на поверхности уреазы значительно повышает специфичность к антигену CEACAM6 (фиг. 1A и 2) и уменьшает способность фермента к неспецифическому связыванию (данные не показаны). Исследования in vivo также подтверждают эффективность L-DOS47 против опухолевого ксенотрансплантата. Ингибирование роста опухоли наблюдается в исследовании опухолевого ксенотрансплантата и метастаз аденокарциномы легкого A549 (таблица 3) после в/в введения L-DOS47 голым мышам (данные не показаны). Значительное уменьшение легочных очагов наблюдается при использовании клеток A549, обработанных 10 или 15 мкг/мл L-DOS47, через 3 недели после инъекции (таблица 3). Однако через 10 недель существенные различия отсутствуют, возможно, вследствие выведения L-DOS47 из организма животного. Изотипический контроль (V21-DOS47, конъюгат антитело против VEGFR2-DOS47) также вызывает некоторое уменьшение легочных очагов, несмотря на то, что клетки A549 не экспрессируют VEGFR2 в нормальном состоянии. Ohwada et al (19) описывают, что функциональные свойства VEGFR индуцируются в клетках A549 после воздействия 50 мМ HCl. Пониженную пролиферацию больных клеток A549 можно восстановить путем экзогенного введения VEGF, а добавление нейтрализующих антител против VEGFR1 и против VEGFR2 снова подавляет клеточную пролиферацию. Однако ни VEGF, ни антитело против VEGFR не влияют на контрольные клетки. Не желая быть связанными с теорией, авторы полагают, что функциональные свойства VEGFR2 в клетках A549 могут индуцироваться в процессе получения клеток в указанном исследовании метастазирования. Это объясняет уменьшение числа клеток, наблюдаемое в изотипической контрольной группе. Результаты исследований in vitro и in vivo демонстрируют, что конъюгация антител на уреазе обеспечивает специфическую направленность антитело-содержащего конъюгата на CEACAM6-экспрессирующие опухоли с хорошей селективностью и эффективностью, что подтверждает концепцию клинической разработки L-DOS47.
Пример 2. Исследование влияния повышающихся доз L-DOS47 на рецидивирующий или метастатический неплоскоклеточный NSCLC (немелкоклеточный рак легкого).
Основной целью этого исследования является оценка безопасности, переносимости и эффективности диапазона доз L-DOS47, применяющегося в сочетании со стандартной дублетной терапией пеметрексед/карбоплатин, у пациентов с рецидивирующим или метастатическим неплоскоклеточным немелкоклеточным раком легкого IV стадии (TNM M1a и M1b).
[0194] Основные результаты приведены ниже. Число пациентов с неблагоприятными явлениями, как показатель безопасности и переносимости L-DOS47, используемого в сочетании с лечением пеметрекседом/карбоплатином, относится к участникам, за которыми наблюдают в течение 12 недель. Его характеризуют как проблему безопасности. Период исследования AE начинается с 1 дня 1 цикла и длится до последнего в исследовании визита. Вторичные результаты заключаются в следующем. Время целевого ответа у пациентов, получающих сочетанное лечение в соответствии с RECIST 1.1, составляет не более 12 недель и не рассматривается как проблема безопасности. Целевой опухолевый ответ оценивают в соответствии с RECIST версии 1.1 у пациентов, которые завершили по меньшей мере 2 цикла исследования, и у которых есть по меньшей мере 1 оценка заболевания после лечения. Число пациентов, испытывающих устойчивое клиническое улучшение, определяют на протяжении 12 недель, причем оно не считается проблемой безопасности. Определяют процент пациентов, у которых после сочетанного лечения L-DOS47+пеметрексед/карбоплатин наблюдается полный ответ, частичный ответ и стабильное заболевание. Максимальную концентрацию L-DOS47 в плазме (Cmax) после введения в сочетании с лечением пеметрекседом/карбоплатином регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Время достижения максимальной наблюдаемой концентрации L-DOS47 в плазме (Tmax) после введения в сочетании с лечением пеметрекседом/карбоплатином регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Площадь под кривой зависимости концентрации L-DOS47 от времени (AUC) после введения в сочетании с лечением пеметрекседом/карбоплатином регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Конечный период полувыведения L-DOS47 после введения в сочетании с лечением пеметрекседом/карбоплатином регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Наличие антител против L-DOS47 у пациентов, получающих L-DOS47 в сочетании с лечением пеметрекседом/карбоплатином, регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Образцы сыворотки собирают у всех пациентов, получающих L-DOS47, и анализируют.
[0195] Проводят эксперименты с использованием пеметрекседа и карбоплатина плюс L-DOS47. Пациентов рапределяют в группы, получающие увеличивающиеся дозы L-DOS47, причем каждая группа состоит минимум из 3 и максимум из 6 пациентов. Начальная доза L-DOS47 составляет 0,59 мкг/кг; в исследовании также используют дозы, составляющие 0,78, 1,04, 1,38 и 1,84 мкг/кг. Стандарт используемых для лечения доз пеметрекседа [500 мг/м2] и карбоплатина [AUC6], соответственно, подлежащий введению в сочетании с L-DOS47, остается неизменным во всех группах. Цикл лечения составляет 21 день, при этом пациенты получают L-DOS47 на 1, 8 и 15 дни, а пеметрексед/карбоплатин в 1 день каждого цикла лечения. Предполагается, что пациенты получают 4 цикла сочетанного лечения с использованием L-DOS47+пеметрексед/карбоплатин. Пациенты, у которых заболевание не прогрессирует после 4 циклов сочетанного лечения и не проявляется неприемлемая токсичность, получают возможность продолжать лечение L-DOS47 до тех пор, пока наблюдается клиническое улучшение и доза хорошо переносится по мнению исследователя, до прогрессирования заболевания. Пациенты, которые не могут завершить 4 цикла лечения сочетанием L-DOS47+пеметрексед/карбоплатин вследствие токсичности пеметрекседа/карбоплатина, получают возможность продолжать лечение L-DOS47 после прекращения введения пеметрекседа/карбоплатина до тех пор, пока наблюдается клиническое улучшение и доза хорошо переносится по мнению исследователя, до прогрессирования заболевания.
Пример 3. Фаза I/II открытого, нерандомизированного исследования с повышением дозы иммуноконъюгата L-DOS47, используемого для лечения немелкоклеточного рака легких
[0196] Основной целью исследования является определение безопасности, переносимости и эффективности диапазона доз L-DOS47 у пациентов с неплоскоклеточным немелкоклеточным раком легкого при введении в качестве монотерапии.
[0197] Основные результаты описаны ниже. Встречаемость и тяжесть связанных с лекарственным средством побочных явлений как меру безопасности и переносимости L-DOS47 регистрируют в течение периода до 12 недель и относят к проблемам безопасности. Их оценивают в течение периода описания AE, начинающегося в 1 день 1 цикла и длящегося до последнего в исследовании визита.
[0198] Вторичные результаты заключаются в следующем. Токсичность, связанная с L-DOS47, длится первые 2 часа после введения и считается проблемой безопасности. Ее оценивают по встречаемости и тяжести AE и SAE и изменениям жизненноважных признаков. Встречаемость и тяжесть всех зарегистрированных неблагоприятных явлений и серьезных неблагоприятных явлений относятся к временной рамке, включающей в себя 12 недель наблюдения за участниками и 30 дней периода последующего наблюдения. Указанные показатели обозначают как проблемы безопасности и оценивают в течение периода описания AE, начинающегося в 1 день 1 цикла и длящегося до последнего в исследовании визита. Изменения по сравнению с исходным уровнем дополнительных параметров безопасности (клинические лабораторные анализы, жизненноважные показатели, вес, потребность в кислороде и ЭКГ с 12 отведениями) определяют во временной рамке, составляющей до 12 недель, и обозначают как проблемы безопасности. Параметры безопасности включают клинические лабораторные анализы, жизненноважные показатели, вес, потребность в кислороде и ЭКГ с 12 отведениями. Уровень антител против L-DOS47 определяют с течением времени в период до 12 недель и обозначают как проблему безопасности. Образцы сыворотки собирают у всех пациентов, получающих L-DOS47, и анализируют.
[0199] Другие результаты заключаются в следующем. Максимальную концентрацию L-DOS47 в плазме (Cmax) для каждого уровня дозы регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Время достижения максимальной наблюдаемой концентрации L-DOS47 в плазме (Tmax) для каждого уровня дозы регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Площадь под кривой зависимости концентрации L-DOS47 от времени (AUC) для каждого уровня дозы регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Конечный период полувыведения L-DOS47 для каждого уровня дозы регистрируют в течение периода до 12 недель и не считают проблемой безопасности. Фармакокинетические параметры L-DOS47 определяют с использованием образцов плазмы, собранных у всех пациентов, получающих L-DOS47. Пациентов распределяют в группы, получающие L-DOS47 с увеличением дозы, причем каждая группа состоит минимум из 3 и максимум из 6 пациентов. Начальная доза L-DOS47 составляет 0,12 мкг/кг; в исследовании также используют дозы, составляющие 0,21, 0,33, 0,46, 0,59, 0,78, 1,04, 1,38, 1,84, 2,45, 3,26 и 4,33 мкг/кг. Цикл лечения составляет 21 день, при этом пациенты получают L-DOS47 на 1 и 8 дни цикла.
[0200] Пациентов распределяют в группы, причем каждая группа состоит минимум из 3 и максимум из 6 пациентов. Все пациенты, получающие определенный уровень дозы, должны завершить 1 цикл (3-недельный период), после чего может продолжаться повышение дозы у следующих пациентов. Решение о повышении дозы до следующего уровня принимают после того, как комитет, координирующий исследование (TSC), пересмотрит данные по безопасности и доступных фармакокинетических (ПК) параметрах. Повышение дозы L-DOS47 продолжают до достижения максимально переносимой дозы (MTD). После определения MTD L-DOS47 в фазе I используют до 20 пациентов (прошедших фазу I), чтобы оценить предварительную эффективность L-DOS47 (т.е. скорость ответа с использованием критериев оценки ответа в твердых опухолях [RECIST] версия 1.1, прогрессирование заболевания и выживание); мониторинг включает в себя радиологические анализы в каждом втором цикле. Кроме того, оценивают безопасность и переносимость L-DOS47. Собирают информацию о фармакокинетических параметрах, а также проводят соответствующие наблюдения за активностью L-DOS47.
[0201] Лечение всех пациентов с использованием L-DOS47 продолжают до тех пор, пока у пациента не прекратится прогрессирование заболевания, или не будет наблюдаться неприемлемая токсичность, или пациент больше не будет давать согласие, или если пациент после завершения четырех циклов не захочет продолжать лечение с участием в дополнительных циклах, в зависимости от того, что произойдет раньше. После четырех циклов пациенты могут продолжать получать L-DOS47 до тех пор, пока, по мнению исследователя, есть устойчивое клиническое улучшение, и пока L-DOS47 хорошо переносится.
Пример 4: Получение и характеристика конъюгата однодоменное верблюжье антитело-фермент уреаза для лечения немелкоклеточного рака легкого (NSCLC)
[0202] Эффективность наиболее часто используемых противораковых химиотерапевтических средств ограничена их узкими терапевтическими индексами и низкой селективностью в отношении опухолевых клеток. Направляемая антителом ферментная пролекарственная терапия (ADEPT) характеризуется повышенной селективностью благодаря доставке конъюгатов антитело-фермент в участки опухолей, где они связываются с опухоль-ассоциированными антигенами, а оставшиеся несвязанными конъюгаты удаляются из кровотока [20]. После накопления конъюгатов антитело-фермент вводят пролекарство, которое в участке опухоли превращается в активную цитотоксическую форму под действием ферментного фрагмента конъюгата антитело-фермент, тем самым достигая селективной гибели опухолевых клеток. Концепция ADEPT описана Bagshawe в 1987 году [20-22], а другие исследователи используют вариации этой концепции для разработки более активных и специфических противораковых лекарственных средств. [22-24]. Разработаны разные поколения галактозидных пролекарств и конъюгатов антитело-галактозидаза, обеспечивающие уменьшение системной токсичности при увеличении цитотоксичности активированного лекарственного средства [25]. Мутированные формы пуриннуклеозидфосфорилазы человека были спроектированы для повышения специфичности пролекарств на основе аденозина в качестве субстрата [26]. Кроме того, разработаны разные типы иммуноферментных, подходящих для инфузии, белков, характеризующихся повышенной ферментативной активность и авидностью антител [27-29].
[0203] Описаны способы получения и характеристики L-DOS47, который представляет собой химический конъюгат однодоменного рекомбинантного антитела и уреазы бобовых с коэффициентом конъюгацией примерно 10 антител на молекулу нативной уреазы. При применении иммуноконъюгата L-DOS47 в качестве пролекарства, обеспечивающего продукцию аммиака, используют мочевину, которая в природе присутствует в опухолевых тканях в большом количестве. Селективное связывание антитела AFAIKL2 с опухоль-ассоциированным антигеном CEACAM6 [33] на опухолевых клетках-мишенях приводит к накоплению уреазы и последующему гидролизу внеклеточной мочевины с образованием аммиака, который обладает цитотоксическим действием и создает щелочную среду, неблагоприятную для раковых клеток [34]. Вследствие сложной структуры и размера конъюгата, который может иметь молекулярную массу до 680 кДа, разрабатывают процедуры конъюгационной химии, реакции и разделения, позволяющие решить проблемы крупномасштабного производства. Поскольку уреаза содержит несколько участков, по которым можно осуществить конъюгацию с выбранным антителом, с помощью микроканальной системы гель-электрофореза Experion SDS [31,32] определяют коэффициент конъюгации L-DOS47, который имеет важное значение для эффективности лекарственного средства. Чистоту конъюгата L-DOS47 определяют методом гель-хроматографии. Химическую идентичность L-DOS47 характеризуют с помощью методов пептидного картирования с использованием масс-спектрометрии и вестерн-блоттинга. Поскольку первичный амин (K32) присутствует на участке CDR3 однодоменного антитела, распределение участков конъюгации на молекуле антитела определяют методами ОФ-ВЭЖХ и масс-спектрометрии MALDI. Участки конъюгации как на антителе, так и на уреазе также характеризуют методом масс-спектрометрии ESI. Влияние коэффициента конъюгации на сродство L-DOS47 к CEACAM6 оценивают методом ELISA. Чтобы подтвердить способность L-DOS47 связываться с CEACAM6-экспрессирующими линиями раковых клеток и вызывать цитотоксичность, проводят исследования in vitro.
[0204] Иммуноконъюгат (L-DOS47) разрабатывают и характеризуют как терапевтическое средство против опухолей, экспрессирующих CEACAM6. Однодоменное антитело AFAIKL2, специфичное к CEACAM6, экспрессируют в системе E. coli BL21 (DE3) pT7-7. Уреазу высокой чистоты (HPU) экстрагируют из размолотых бобов и очищают. AFAIKL2 активируют, используя N-сукцинимидил[4-иодацетил]аминобензоат (SIAB) в качестве сшивающего средства, затем конъюгируют с уреазой. Реакции активации и конъюгации контролируют по изменению рН. В этих условиях соотношение исходных веществ позволяет достичь коэффициента конъюгации 8-11 антител на молекулу уреазы, содержание оставшейся свободной уреазы является практически незначительным (<2%), а высокочистый (>95%) конъюгат L-DOS47 можно получить с помощью только ультрадиафильтрации, позволяющей удалить непрореагировавшее антитело и гидролизованное сшивающее средство. L-DOS47 характеризуют с помощью ряда аналитических методов, включающих в себя SEC, IEC, вестерн-блоттинг, ELISA и пептидное картирование LC-MSE. По мере увеличения коэффициента конъюгации антитело-уреаза наблюдается более интенсивный сигнал связывания. Однако эффект является менее выраженным при коэффициенте конъюгации, превышающем 6 антител на молекулу уреазы. Специфичность и цитотоксичность L-DOS47 подтверждают путем скрининга на трех клеточных линиях (BxPC-3, A549 и MCF7). Обнаружено, что BxPC-3, CEACAM6-экспрессирующая клеточная линия, является наиболее чувствительной к L-DOS47. L-DOS47 проходит испытание в фазе I клинических исследований на людях как потенциальное терапевтическое средство для лечения немелкоклеточного рака легкого (NSCLC).
[0205] Высокочистую уреазу как промежуточное соединение (далее называемую сырой уреазой или DOS47) получают от BioVectra Inc. (Charlottetown, PE Canada). Перед использованием в конъюгации сырую уреазу очищают, чтобы удалить белки бобовых, присутствующие в виде примесей, такие как канавалин и конканавалин A. Сырую уреазу растворяют в высокочистой воде, доводят рН до 5,15 с помощью 10 мМ уксусной кислоты и 0,2 мМ ЭДТА (буфер, содержащий ацетат-EDTA), затем фильтруют в вакууме, используя суспензию целита 503. Осадок промывают 10 мМ ацетатом натрия, 1 мМ EDTA, pH 5,15, и сушат в вакууме. Уреазосодержащий фильтрат охлаждают до 0-4°С и фракционируют путем добавления охлажденного этанола до конечной концентрации 25% (об./об.). Смесь перемешивают в течение 15 минут, затем фильтруют в вакууме с использованием промытого целита 503. Осадок промывают буфером ацетат-EDTA, содержащим 25% (об./об.) этанола и сушат в вакууме.
[0206] Кек ресуспендируют в буфере ацетат-ЭДТА, суспензию фильтруют в вакууме через целит и собирают фильтрат. Полученный кек промывают буфером ацетат-ЭДТА и сушат в вакууме. Смыв и исходный фильтрат фильтруют через капсулу 0,65 мкм. Полученный после фракционирования этанолом уреазосодержащий фильтрат концентрируют ~2× с использованием двух полиэфирсульфоновых мембран MWCO Sartorius Sartocon 100000 Да с последующей заменой буфера на ацетат-EDTA.
[0207] Имидазол и TCEP (трис(2-карбоксиэтил)фосфина гидрохлорид) добавляют к полученной уреазе средней степени чистоты в конечных концентрациях 20 мМ и 1 мМ соответственно, после чего рН доводят до 6,5. Белковый раствор загружают в быстропроточную колонку с DEAE-сефарозой, предварительно уравновешенную 20 мМ имидазолом, 1 мМ TCEP, pH 6,5 (буфер имидазол-TCEP). Все стадии проводят при скорости потока 500 мл/мин. Колонку промывают буфером имидазол-TCEP и затем буфером имидазол-TCEP, содержащим 80 мМ NaCl, чтобы удалить несвязанные примеси. Уреазу элюируют буфером имидазол-TCEP, содержащим 180 мМ NaCl. Фракции с A280 >0,1 и чистотой по данным SEC от 90 до 97%, объединяют.
[0208] Объединенные фракции концентрируют до концентрации целевого белка 6-8 мг/мл с использованием двух мембран MWCO PESU Sestorious Sartocon 100000 Да, затем подвергают диафильтрации против буфера ацетат-EDTA, содержащего 10 мМ ацетат натрия, 1 мМ EDTA, pH 6,5. Выход на этой стадии обычно составляет >55% от исходной активности. Способы экспрессии и очистки промежуточного лекарственного средства AFAIKL2 и аминокислотная последовательность антитела AFAIKL2 показаны на фиг.5 (SEQ ID NO: 1).
[0209] Ген антитела экспрессируют в системе E. coli BL21 (DE3) pT7-7. Один флакон полученных из банка исходных клеток в асептических условиях инокулируют посредством трех стадий высеваная в Luria HiVeg (20 г/л) объемом 350 л, содержащий 50 мг/л канамицина, 1 г/л церелозы, 0,02 г/л MgSO4, и 0,01% противовспенивающего реагента Biospumex, в ферментере объемом 500 л. Процесс контролируют, поддерживая содержание растворенного кислорода >20%, температуру на уровне 37°C±2°C, обратное давление от 5 до 20 фунтов на квадратный дюйм, рН 7,0±0,2, OD600 в диапазоне 0,5-40 и концентрацию глюкозы 1-3 г/л. После того, как OD600 в культуре достигает значения в диапазоне 7-10, индуцируют экспрессию антитела путем добавления IPTG до конечной концентрации 1 мМ и продолжают инкубацию в течение 6-8 часов. Клетки собирают центрифугированием, промывают и лизируют для высвобождения тел включения, затем ресуспендируют в 10 объемах 50 мМ имидазола, рН 6,8. Клеточную суспензию гомогенизируют партиями, гомогенат пропускают сначала через санитарно-техническое сито из нержавеющей стали 75 мкм, затем через микрожидкостной фильтр при минимальном давлении 10000 фунтов на квадратный дюйм с тремя пассажами, поддерживая температуру ниже 10°C. Клеточный лизат центрифугируют, нерастворимые вещества объединяют, осадок ресуспендируют путем гомогенизации в 10 объемах 1% тритона X-100, содержащего 5 мМ DTT. Промытый осадок собирают центрифугированием. Такое промывание повторяют, затем промывают 25 мМ ацетатом натрия, pH 4,0, содержащим 5 мМ DTT, чтобы удалить остаточный тритон Х-100 и забуферить осадок до рН 4.
[0210] Осадок, содержащий промытые тельца включения, ресуспендируют в буфере, содержащем 8М мочевину, 25 мМ DTT, 125 мМ ацетат натрия, рН 4,0, затем солюбилизируют поочередно гомогенизатором Росса и вертикальной мешалкой до тех пор, пока внешний вид не перестанет изменяться, а затем перемешивают с помощью только вертикальной мешалки в течение в общей сложности 3 часов. Солюбилизированные тельца включения центрифугируют и осветленный супернатант загружают со скоростью 550 мл/мин на колонку SP-Sepharose XL, предварительно уравновешенную 8М раствором мочевины в 125 мМ ацетате натрия, рН 4,0 (уравновешивающий буфер SP). После загрузки осветленного супернатанта колонку промывают уравновешивающим буфером до тех пор, пока A280 элюата не опустится ниже 0,05, а затем 8М раствором мочевины в ацетате натрия, pH 4,0, содержащим 50 мМ NaCl до тех пор, пока A280 элюата не опустится ниже 0,05. Скорость насоса уменьшают до 275 мл/мин, после чего на колонку наносят 3 cv буфера, содержащего 8М мочевину, 25 мМ ацетат натрия, 180 мМ NaCl, рН 4,0, чтобы элюировать AFAIKL2. Фракции, в которых A280 >0,4, а отношение A280/A260 >1,5 объединяют и анализируют на чистоту и содержание белка. Выход на этой стадии обычно составляет 35-45%. Объединенные фракции разбавляют уравновешивающим буфером SP до концентрации <2,5 г/л, рН доводят до 8,0 с помощью 2М Tris-Cl, pH 8,0, добавляют DTT до 2,5 мМ, после чего кондиционированную смесь перемешивают в течение 60 минут, чтобы полностью восстановить денатурированный белок. Затем раствор денатурированного белка разбавляют до конечной концентрации менее 0,1 мг/мл в буфере для рефолдинга, содержащем 25 мМ Трис-Cl, pH 8,5. Рефолдинг проводят при 2-8°С и отслеживают с помощью анализа Эллмана и жидкостной хроматографии на обращенной фазе С18 до тех пор, пока уровень свободных сульфгидрильных групп не станет <0,75 мкМ и можно будет обнаружить только полностью окисленный белок.
[0211] После рефолдинга раствор белка загружают на колонку Q-Sepharose XL, предварительно уравновешенную 25 мМ раствором имидазола, рН 6,8, после чего колонку промывают уравновешивающим буфером до тех пор, пока А280 не станет <0,05, а затем 25 мМ раствором имидазола, рН 6,8, содержащим 50 мМ NaCl, до тех пор, пока А280 не станет <0,01. Затем белок элюируют 25 мМ раствором имидазола, рН 6,8, содержащим 150 мМ NaCl, и собирают фракции до тех пор, пока А280 не станет <0,3. Фракции объединяют с получением целевого пула с чистотой не менее 97% и выходом не менее 45%. Затем пул концентрируют до 3-5 г/л с помощью системы UF/DF, используя картриджи Hydrosart, содержащие регенерированную целлюлозу 5000 MWCO, после чего буфер заменяют на 10 мМ фосфатный буфер, pH 7,0, и лиофилизируют.
Конъюгационная химия
[0212] Конъюгацию проводят в две стадии (фиг.6). На первой стадии первичные аминогруппы AFAIKL2 активируют путем взаимодействия с NHS-сложноэфирным фрагментом SIAB. На второй стадии активированное AFAIK2 присоединяют к тиольным группам уреазы через иодацетамидный фрагмент SIAB. Как показано на фиг.6, синтез конъюгата L-DOS47 представляет собой двухстадийную реакцию. На стадии 1 проводят активацию антитела с использованием SIAB, а на стадии 2 осуществляют конъюгацию активированного антитела с ферментом уреазой с получением биоконъюгата L-DOS47.
[0213] Активация антитела AFAIKL2. Лиофилизированное AFAIKL2 (25 г) растворяют в воде для инъекций (WFI). SIAB (2,00 г) растворяют в безводном ДМФ и добавляют к раствору AFAIKL2 тремя равными порциями с 60-минутным перемешиванием после каждого добавления. Через час после последнего добавления SIAB все оставшиеся непрореагировавшие NHS-группы гасят добавлением 10-кратного молярного избытка глицина по сравнению с исходным количеством добавленного SIAB. Чтобы удалить гидролизованный и гашенный глицином SIAB, реакционный раствор концентрируют до 10 мг/мл AFAIKL2 с помощью Sartorious Sartocon MWCO 5000 Да и затем буфер заменяют на 10 мМ ацетат натрия, pH 6,5, 1 мМ EDTA.
[0214] Конъюгация активированного антитела с уреазой. Уреазу высокой чистоты (50 г) смешивали с активированным AFAIKL2 в 10 мМ ацетате натрия, pH 6,5, 1 мМ ЭДТА. Затем pH доводили до 8,3 путем добавления 1 М бората натрия, рН 8,5, что позволяет иодацетильной группе активированного антитела реагировать с доступными остатками цистеина на уреазе. Реакционную смесь оставляли на 90 мин при перемешивании. Непрореагировавшие иодацетильные группы затем гасили добавлением 10-кратного молярного избытка цистеина по сравнению с исходным количеством добавленного SIAB и раствор перемешивали в течение 60 минут. Для удаления неконъюгированного AFAIKL2 L-DOS47 концентрировали до мишени 6 мг/мл, используя 100000 Da MWCO Sartorious Sartocon с последующим буферным обменом на 10 мМ L-гистидина с pH 6,8, 0,2 мМ EDTA. Сахарозу добавляли до конечной концентрации 1% мас./Об. И L-DOS47 разбавляли до целевой концентрации 1,8 г/л с помощью 10 мМ L-гистидина с pH 6,8, 0,2 мМ ЭДТА.
[0215] Гель-хроматография (SEC) для определения чистоты. Используют систему ВЭЖХ Waters 2695 с 996 PAD и программное обеспечение Empower 2 для сбора и обработки данных. Хроматограммы регистрируют в диапазоне 210-400±4 нм, извлекая для обработки сигнал при 280 нм. Разделение проводят на колонке с суперозой 6 100/300 GL (GE). Белки элюируют буфером, содержащим 10 мМ фосфат, 50 мМ NaCl, 0,2 мМ ЭДТА, рН 7,2. Разделение проводят в изократическом потоке со скоростью 0,5 мл/мин после введения 100 мкл чистых образцов. Колонку держат при комнатной температуре, а температуру образца контролируют при 5±2°С.
[0216] Ионообменная хроматография (IEC) для определения остаточной уреазы. Используют систему ВЭЖХ Waters 2695 с 996 PAD и программное обеспечение Empower. Хроматограммы регистрируют в диапазоне 210-400±4 нм, извлекая для обработки сигнал при 280 нм. Колонку (Mono-Q 5/50 GL, GE) используют при комнатной температуре, а температуру образца держат при 5±2°C. Буферы для элюирования содержат 50 мМ ацетат, 0,025% полисорбата 80 (суперчистый, HX2, NOF Corporation, Tokyo) в присутствии (буфер B) или в отсутствии (буфер A) 0,70 М NaCl, pH 5,50. Колонку уравновешивают смесью, содержащей 15% буфера B и 85% буфера А, в течение 6 мин при скорости потока 1 мл/мин (6 CV), до введения образцов. После цикла промывания (15% буфера B при 1,0 мл/мин в течение 6 мин) белки элюируют в градиенте 15-60% буфера В в течение 20 минут со скоростью потока 0,5 мл/мин. После очистки 100% буфером В в течение 6 минут при 1,0 мл/мин, колонку повторно уравновешивают 15% буфером B перед введением следующего образца. Чистые образцы L-DOS47 объемом 800 мкл маркируют высокочистой уреазой в качестве образца для сравнения с конечным содержанием 0-8% масс/масс и вводят 50 мкл/образец. Высоту пика используют для расчета содержания остаточной уреазы с добавлением стандарта в качестве метода калибровки.
[0217] Для определения коэффициента конъюгации используют микроканальный гель-электрофорез Experion SDS. Для анализа коэффициентов конъюгации L-DOS47 используют автоматизированную систему для электрофореза BioRad Experion и набор для гель-электрофореза BioRad SDS (набор Pro260). Образцы разводят буфером Трис-HCl (10 мМ, 0,2 мМ ЭДТА, рН 7,0) до концентрации целевого белка 0,5 мг/мл, затем 4 мкл разведенного образца или стандарта молекулярной массы смешивают с 2 мкл буфера для образцов и быстро центрифугируют. Образцы нагревают при 70°С в течение 10 минут и затем загружают в микроканальный чип после заполнения системы и каналов гелеобразным, содержащим краситель раствором. Электрофореграммы автоматически регистрируют с помощью программного обеспечения Experion.
[0218] Вестерн-блоттинг для характеристики идентичности. Тестируемые образцы L-DOS47 и контрольные образцы AFAIKL2/HPU разделяют методом гель-электрофореза SDS-PAGE, затем переносят на нитроцеллюлозную мембрану с помощью системы Invitrogen iBlot. Дублирующие пятна получают из параллельных гелей. Для подтверждения идентичности AFAIKL2 проводят детекцию с использованием кроличьего IgG против AFAIKL2 (Rockland) в качестве первичного антитела и конъюгат козьего антитела против кроличьих IgG с щелочной фосфатазой (AP) (Sigma) в качестве вторичного антитела. Для подтверждения идентичности уреазы проводят детекцию с использованием кроличьего IgG против уреазы (Rockland) в качестве первичного антитела и конъюгат козьего антитела против кроличьих IgG с AP (Sigma) в качестве вторичного антитела. Для детекции с использованием IgG против AFAIKL2 образцы L-DOS47 разбавляют до 0,002 мг/мл 1×TBS, содержащим 0,1 мг/мл BSA, затем смешивают 1:1 с буфером для загрузки белков на гель, нагревают при 70°C в течение 10 минут и 0,01 мкг L-DOS47 загружают на полосу. Для детекции с использованием IgG против уреазы образцы L-DOS47 разбавляют до 0,02 мг/мл 1×TBS, содержащим 0,1 мг/мл BSA, затем смешивают 1:1 с буфером для загрузки белков на гель, нагревают при 70°C в течение 10 минут и 0,1 мкг L-DOS47 загружают на полосу. Конечную обработку вестерн-блотов проводят с помощью буфера AP, содержащего NBT/BCIP.
Анализ L-DOS47 с разными коэффициентами конъюгации методом ELISA
[0219] Чтобы исследовать влияние коэффициента конъюгации на сродство L-DOS47 к его антигену-мишени CEACAM6, получают конъюгаты L-DOS47 с разными коэффициентами конъюгации в лабораторном масштабе путем варьирования молярного отношения AFAIKL2/HPU в процессе конъюгации. Коэффициенты конъюгации полученных конъюгатов определяют с помощью SDS-Experion, а концентрацию белка определяют с помощью микрометода Лоури с использованием набора для определения общего белка (Sigma, TP0200). Микротитровальные планшеты покрывают 100 мкл/лунку CEACAM6-A, доменом A полноразмерного антигена CEACAM6 (2,5 мкг/мл в PBS) и инкубируют при комнатной температуре в течение 6 часов. Планшеты дважды промывают буфером A (0,05% BSA в PBS), блокируют 150 мкл/лунку 3% BSA/PBS при 4°C в течение ночи, после чего дважды промывают буфером A. Все последующие стадии проводят при комнатной температуре с осторожным встряхиванием. Добавляют L-DOS47 (100 мкл/лунку) и инкубируют в течение 2 часов, затем планшеты промывают 3 раза буфером А, добавляют 100 мкл/лунку IgG против уреазы (1:12000, Rockland) и инкубируют в течение 1 часа. После трех промываний буфером А добавляют 100 мкл/лунку конъюгата козлиное антитело против кроличьих IgG-AP (1:6000, Sigma) и инкубируют в течение 1 часа. После трех промываний буфером А добавляют 100 мкл/лунку раствора субстрата AP и инкубируют в течение 25 мин. Поглощение детектируют при 405 нм.
Определение участков активации на антителе AFAIKL2
[0220] Чтобы получить меченого флуоресцеином цистеин (Cys-FL), избыток цистеина подвергают взаимодействию с NHS-сложноэфирными группами флюоресцеина (Pierce) в 1М борате, pH 8,0 в течение 60 минут при комнатной температуре. Реакционный раствор разделяют методом ОФ-ВЭЖХ на колонке С8. Фракцию, соответствующую пику Cys-FL, идентифицируют методом масс-спектрометрии MALDI, а его концентрацию определяют методом спектрометрии в соответствии с коэффициентом экстинкции при 493 нм и рН 7. Аликвоты пиковой фракции лиофилизируют и хранят в темноте при -20°С. Сначала антитело AFAIKL2 активируют сшивающим реагентом SIAB в лабораторном масштабе, а затем гидролизованный SIAB удаляют с помощью обессоливающей колонки G25 собственного производства. Активированному антителу дают взаимодействовать с меченым флуоресцеином цистеином (Cys-FL) в 100 мМ боратном буфере с рН 8,3 в течение 90 минут при комнатной температуре. Реакционный раствор подвергают замене буфера на 30 мМ гидрокарбонат аммония с помощью обессоливающей колонки G25, после чего полученный AFAIKL2-Cys-FL разбавляют до 0,5-0,8 мг/мл 30 мМ раствором гидрокарбоната аммония, содержащим 20% ацетонитрила. Добавляют трипсин (Promega) с конечным отношением белка к трипсину 20:1 и проводят расщепление при 37°C в течение 36 часов. Полученный триптический гидролизат восстанавливают добавлением 0,1 М TCEP до конечной концентрации 2 мМ, затем разделяют методом ВЭЖХ на обращенной фазе (система Agilent 1100 с колонкой Zobax 300SB-C18, 5 мкм, 4,6×150 мм, градиент от 0 до 45% ацетонитрила, 0,025% TFA в течение 55 минут) и регистрируют поглощение при 420 нм. Поскольку SIAB-активированный лизин на AFAIKL2 связан с меченым флуоресцеином цистеином, он вряд ли является доступным трипсину, следовательно, может образоваться пептид (XnKXm)-Cys-FL. Собирают пиковые фракции, содержащие модифицированные флуоресцеином пептиды, и анализируют их методом масс-спектрометрии MALDI в режиме Reflectron (Micromass Tof 2e). Площади пиков ВЭЖХ соответствующих пептидов используют для расчета процента распределения каждого участка активации.
[0221] Картирование пептидов и идентификацию конъюгированных пептидов проводят методом масс-спектрометрии ESI. Используют масс-спектрометр Waters Xevo G2 QTOF и систему Acquity UPLC класса H с колонкой BEH300 C18 (1,7 мкм, 2,1×150 мм). Каждый образец L-DOS47 (1,5-2,0 мг/мл, 50,0 мкл) смешивают с 0,063±0,003 г гуанидин-HCl. После полного растворения соли добавляют 1,50 мкМ 0,7 М DTT и раствор инкубируют при 60°С в течение 30 минут. Добавляют 0,20 М иодацетамид (IAA) и рН доводят до 8,0-8,5 насыщенным раствором трис-основания. Образец инкубируют при 37°С в течение 60 минут. 50,0 мкл каждого алкилированного образца смешивают с 15,0 мкл 0,1 М CaCl2 и 80,0 мкл Трис-буфера (50 мМ Трис-HCl, pH 8,0), затем добавляют 3,00 мкг 0,5 мг/мл раствора трипсина. Расщепление трипсином проводят при 37°С в течение 20-24 часов. После расщепления трипсином 50,0 мкл гидролизата смешивают с 0,50 мкл чистой муравьиной кислоты для анализа методом ЖХ-МС. Температуру колонки устанавливают при 60°C, для разделения методом UPLC используют растворитель A (0,075% об/об раствор муравьиной кислоты в воде) и растворитель B (0,075% раствор муравьиной кислоты в ацетонитриле). UPLC проводят со скоростью потока 0,15 мл/мин в градиенте от 0 до 55% растворителя B в течение 80 минут.
[0222] Анализ LC-MS контролируется программным обеспечением Masslynx V4.1. Сбор данных LC-MSE TIC (общий счет ионов) проводят в диапазоне M/Z 50-2000 Да в режиме разрешения со скоростью сканирования 0,3/с, напряжением на капилляре 3,0 кВ, напряжением 25 В, напряжением на конусе для образцов 4,0 кВ. Сбор данных TIC при фрагментации, индуцированной высокоэнергетическим столкновением, проводят в режиме возрастания энергии столкновения с 20 до 40 В. Температуру источника ионов устанавливают при 100°С, а температуру десольватации устанавливают при 300°С. Скорость потока газа при десольватации составляет 600 л/час. Ряд исходных данных TIC при фиксации массы в режиме реального времени (скан/20 с) получают с использованием 100 фмоль/мкл Glu-Fib B при скорости потока 3,0 мкл/мин.
[0223] Масс-спектрометрические исходные данные обрабатывают с помощью BioPharmalynx (v1.2) в режиме отображения пептидов с разрешением 20000. Фиксированную массу 785,8426 Да используют для калибровки массы в режиме реального времени. Порог интенсивности ионов низкой энергии MS устанавливают при 3000 импульсов, а порог интенсивности ионов высокой энергии MSE устанавливают при 300 импульсов. Допуски для соответствия масс устанавливают равными 15 м.д. для наборов данных как MS, так и MSE. Аминокислотные последовательности AFAIKL2 и уреазы вводят в библиотеку последовательностей для поиска совпадения/идентификации пептидов. Переменные модификаторы, включающие дезамидирование N, дезамидирование сукцинимида N, окисление M, окисление 2xM, +K, +Na и фиксированный модификатор карбамидометил С (для алкилированного цистеина) используют для анализа пептидной карты. Чтобы идентифицировать участвующие в конъюгации пептиды со стороны AFAIKL2, получают пептиды, содержащие цистеинсодержащие участки уреазы и участок связывания сшивающего средства SIAB (C9H7O2N, 161,0477 Да) в качестве переменных модификаторов и включают их в библиотеку переменных модификаторов. В этом случае карбамидометил С используют в качестве переменного модификатора. Чтобы идентифицировать участвующие в конъюгации пептиды со стороны уреазы, получают пептиды AFAIKL2 с лизином в середине XnKXm, содержащие участок связывания SIAB, которые используют в качестве переменных модификаторов и включают их в библиотеку переменных модификаторов.
Анализ связывания L-DOS47 с целыми клетками
[0224] Клеточные монослои получают путем высевания 100 мкл/лунку клеток MCF-7, BxPC-3 и A549 (4×104 клеток/лунку) в 96-луночные планшеты для культивирования и инкубируют в течение ночи при 37°C. Затем из планшетов удаляют среду и монослои клеток фиксируют 100 мкл/лунку 0,05% раствора глутаральдегида в PBS в течение 10 мин при комнатной температуре (КТ). Затем планшеты промывают PBS и добавляют 120 мкл 50 мМ глицина. После инкубации при 37°С в течение 20 мин планшеты блокируют 120 мкл/лунку 1% BSA/PBS при 37°С в течение 30 мин. Затем планшеты промывают 3 раза буфером А (0,05% BSA в PBS) и добавляют 80 мкл/лунку разбавленного L-DOS47 или DOS47 и инкубируют при 37°С в течение 1,5 часов. Планшеты промывают 4 раза буфером А и добавляют 80 мкл/лунку 20 мМ раствора мочевины в 0,1 М PBS, рН 7,6, после чего инкубируют при 37°С в течение 30 мин. После инкубации для остановки реакции добавляют 40 мкл/лунку 1N HCl. Количество аммиака, полученного в каждой лунке, определяют с помощью модифицированного индофенольного анализа. Коротко говоря, получают свежий раствор А путем растворения 165 мг фенола и 132 мг NaOH в 10 мл воды с последующим добавлением 66 мкл раствора нитропруссида натрия (10 мг/мл). Раствор В получают путем добавления 40 мкг гипохлорита натрия к 5 мл воды. Образцы растворов (30 мкл каждого) из анализа связывания целых клеток переносят в новый 96-луночный планшет, содержащий 50 мкл/лунку 5N NaOH:H2O (3,3: 46,7) и 20 мкл/лунку воды. Добавляют раствор A (50 мкл/лунку) и раствор B (50 мкл/лунку), после чего планшеты переносят в ридер для микропланшетов, где происходит развитие окрашивания при 37°С в течение 30 минут. OD измеряют при 630 нм. Количество аммиака, образовавшегося в лунках, рассчитывают по калибровочной кривой, используя в качестве стандартов 0-150 мМ растворы хлорида аммония.
[0225] Анализ цитотоксичности L-DOS47. Клеточные монослои получают путем высевания 100 мкл/лунку клеток MCF-7, BxPC-3 и A549 (4×104 клеток/лунку) в 96-луночные планшеты для культивирования и инкубируют в течение ночи при 37°C. Затем из планшетов удаляют среду и добавляют 80 мкл/лунку разведенного L-DOS47 или DOS47 и дополнительно инкубируют при 37°С в течение 2 часов. После инкубации планшеты промывают 3 раза буфером KR-II/0,05% BSA и добавляют 100 мкл/лунку 20 мМ раствора мочевины. Планшеты инкубируют при 37°С в течение ночи, затем среду удаляют и заменяют 100 мкл/лунку среды, не содержащей тестируемых компонентов. Жизнеспособность клеток определяют с помощью анализа жизнеспособности клеток MTS, для проведения которого в планшеты добавляют 20 мкл/лунку смеси 21:1 об/об растворов MTS/PES (2 мг/мл MTS, 1 мг/мл PES). Затем планшеты инкубируют при 37°С в течение 1 часа и измеряли OD при 630 нм по сравнению с 490 нм.
[0226] Уреаза бобовых представляет собой гексамерный фермент, состоящий из шести идентичных субъединиц, каждая примерно по 91 кДа, содержащий 15 несвязанных остатков цистеина на субъединицу. Антитело AFAIKL2 содержит семь первичных аминогрупп и дисульфидную связь. Первичные аминогруппы антитела и остатки цистеина уреазы используют для химической конъюгации посредством гетеробифункционального сшивающего средства. Однако молекулярный размер конъюгата и природа двух белков создают проблемы при масштабировании способов получения, очистки и характеристики конъюгата. Иммуноконъюгат, подходящий для применения в качестве парентерального лекарственного средства, должен быть растворимым и стабильным в водных средах при значениях рН, близких к физиологическим; следовательно, для получения нужной изоэлектрической точки (pI) требуется тщательное конструирование последовательности рекомбинантного антитела, поскольку уреазу экстрагируют из растительного источника и ее pI (наблюдаемый pI 4,8-5,1) не может быть изменен. Оптимизация, позволяющая гарантировать однородность реакции, а также удаление остаточных реагентов и побочных продуктов, имеет важное значение для конъюгационной химии. Хотя несколько сшивающих средств [24, 30], широко используемых для конъюгации белков, были подвергнуты скринингу во время разработки, для получения конъюгата L-DOS47 выбран N-сукцинимидил[4-иодацетил]аминобензоат (SIAB) благодаря разным оптимальным значениям рН для двух реакций сшивки. В процессе получения антитело активируют сшивающим реагентом при рН 7,0, затем заменяют буфер на pH 6,5 и смешивают с уреазой. Затем антитело присоединяют к уреазе, увеличивая рН реакционной среды до 8,3. Поскольку скорость реакции присоединения активированного AFAIKL2 к уреазе очень низкая при рН 6,5, однородность материала в большом реакционном сосуде обеспечивают путем предварительного перемешивания при рН 6,5. Следовательно, распределение остаточной свободной уреазы и разновидностей конъюгата уреаза-(Ab)x определяется исключительно вероятностью и молярными соотношениями исходных веществ. При коэффициентах конъюгации 8-11 антител/уреазу содержание остаточной уреазы теоретически незначительно, а конъюгат L-DOS47 можно очистить, используя ультрадиафильтрацию для удаления непрореагировавшего антитела и гидролизованного сшивающего средства. Гель-хроматограммы конъюгата L-DOS47, свободного AFAIKL2 и свободной уреазы показаны на фигуре 7.
[0227] Конъюгат L-DOS47 элюируется через ~24,6 мин, димер (возможно, связанный дисульфидной связью или молекулой AFAIKL2, активированной двумя SIAB) элюируется в виде небольшого неразрешенного пика через 20,5 мин, а полимер элюируется в виде остаточного пика с пустым объемом колонки (~15 минут). Остаточный пик, элюирующийся через ~40 минут, соответствует компонентам буфера. Ширина пика конъюгата L-DOS47 несколько больше, чем ширина пика свободной уреазы, но сопоставима с ней, что позволяет предположить равномерное распределение реакции конъюгации. Свободное антитело элюируется через 37 минут. Небольшой неразрешенный пик перед пиком антитела соответствует димеру, образованному нековалентными связями. В производственных партиях обычно присутствует антитело высокой степени чистоты (>95%) с низким содержанием, не превышающем 5%, высокомолекулярных примесей, включающих димеры. HPU обычно элюируется в виде основного пика через ~26,9 мин, небольшого пика димера через 24 минуты и следового пика полимера через 15 минут. Путем очистки сырой уреазы получают HPU, содержащую ~97% мономера и не более 3% димера и полимера в сумме. Степень чистоты L-DOS47 более 95% обычно достигают путем простой очистки с использованием только ультрадиафильтрации. Поскольку SEC проводят в природных условиях, она может обуславливать изменение эффективной молекулярной массы вследствие деградации и диссоциации четвертичной структуры белка; поэтому этот метод также используют для анализа стабильности L-DOS47. Присутствие остаточной свободной уреазы в L-DOS47 определяют методом ионообменной хроматографии (фиг. 8).
[0228] Остаточная свободная уреаза элюируется через 15,33 минут, очень близко к пику маркированной уреазы (15,42 минуты). Пик HPU довольно хорошо отделен от большого пика L-DOS47 (Rs 1,48). Как показано на вставке фиг.8, стандартный метод добавления (L-DOS47, содержащий 2,4%, 4,8% и 7,2% масс/масс HPU), используемый для определения содержания остаточной уреазы, демонстрирует хорошую линейность (R2 0,9995). Рассчитанное содержание остаточной уреазы в этом образце составляет 0,72%, причем содержание остаточной уреазы не превышает 2% во всех производственных партиях, полученных до настоящего времени, что свидетельствует о том, что содержание остаточной уреазы практически незначительно в этих условиях и производственный процесс не требует дополнительной стадии для разделения конъюгата L-DOS47 и неконъюгированной уреазы.
[0229] В процессе промышленного получения L-DOS47 каждую из шести мономерных субъединиц уреазы можно конъюгировать с нулем, одной, двумя, тремя или четырьмя молекулами AFAIKL2; следовательно, в денатурирующих условиях анализ L-DOS47 методом SDS-Experion дает несколько дискретных пиков/полос от ~90 до 155 кДа. Кроме того, в процессе реакции активации антитела небольшая часть молекул антитела может произвольно активироваться двумя SIAB на молекулу антитела (AFAIKL2-(SIAB)2), что приводит к конъюгации каждой из таких молекул антител с двумя субъединицами уреазы. Следовательно, одно-антитело-две субъединицы дают меньший второй набор слабо разрешенных пиков/полос в диапазоне 200-260 кДа.
[0230] На фигуре 9, панель 2, приведено действительное изображение геля, а на панели 1 - наложение электрофореграмм полос 1 и 4. Экспериментальный образец L-DOS47, присутствующий в полосах 1-2 и 7-8, получают с использованием активированного AFAIKL2, очищенного ионообменной хроматографией перед второй реакцией конъюгации. Поскольку молекулы AFAIKL2-(SIAB)2 удалены, полученный конъюгат не содержит связанных между собой субъединиц и наблюдается только один набор пиков/полос. Для получения образца L-DOS47, присутствующего на полосах 3-6, AFAIKL2 используют непосредственно в реакции конъюгации после стадии активации без дополнительной очистки и, следовательно, присутствует небольшой второй набор пиков/полос. Полосы 9 и 10 перегружены образцом HPU.
[0231] Площади пиков (фиг.9, панель 1) и интенсивности полос (фиг.9, панель 2) зависят от относительного содержания субъединиц уреазы, связанных с соответствующим числом молекул антител. Площади пиков интегрируются программным обеспечением после коррекции по исходному уровню, а коэффициент конъюгации L-DOS47 (CR) рассчитывают по следующей формуле (см. фигуру 10, на которой приведена полоса 2 из геля, показанного на фигуре 9):
CR= 6*(PK1*0+PK2*1+PK3*2+PK4*3+PK5*4)/(PK1+PK2+PK3+PK4+PK5)
Где PKi (i=1-5) обозначает площадь пика субъединицы уреазы, связанной с i-1 молекулами антитела.
[0232] Поскольку активированное антитело не подвергают очистке методом ионообменной хроматографии в процессе крупномасштабного производства L-DOS47, на электрофореграммах этих образцов присутствует второй набор пиков с плохим разрешением. Однако два набора пиков предположительно имеют одинаковые картины интенсивности, поскольку распределение участков активации определяется вероятностью и молярным отношением антитела к SIAB. Следовательно, указанный второй набор пиков не используют для расчета коэффициентов конъюгации, поскольку полосы имеют плохое разрешение и перекрываются с маркером молекулярной массы 260 кДа. Хотя молекулы AFAIKL2-(SIAB)2 теоретически могут образовывать димерные или полимерные конъюгаты, связываясь с двумя субъединицами из разных молекул нативной уреазы, минимальные уровни (менее 3%) объединенных площадей пиков димеров и полимеров, наблюдаемые на гель-хроматограмме образца L-DOS47 (фиг. 7) свидетельствуют о том, что большинство молекул AFAIKL2-(SIAB)2 способствуют связыванию между субъединицами одной молекулы нативной уреазы с получением мономера L-DOS47, а не образованию межмолекулярных связей с получением димерных и полимерных конъюгатов. Кроме того, присутствие указанных пиков димера и полимера в хроматограммах SEC можно логически объяснить наличием дисульфидных связей, поскольку аналогичные пики также присутствуют в гель-хроматограммах уреазы HP. Поэтому второй набор пиков в электрофореграммах не используют в качестве параметра контроля качества.
[0233] Коэффициент конъюгации L-DOS47 оказывает большое влияние на сродство к CEACAM6, опухолевому антигену, на который направлено антитело. L-DOS47 с разными коэффициентами конъюгации (от 1,8 до 12 AFAIK на уреазу) получают путем варьирования молярных соотношений AFAIKL2/уреазы HP для оценки влияния коэффициента конъюгации на сродство. Обнаружено, что сродство L-DOS47 к иммобилизованному CEACAM6-A прямо пропорционально числу антител, конъюгированных с уреазой (фигура 11). Чем больше присоединено антител, тем выше сигнал связывания. Однако этот эффект является менее выраженным при коэффициенте конъюгации 6 или более.
[0234] Анализ L-DOS47 методом двойного вестерн-блоттинга (фиг. 12) подтверждает картину полос, наблюдаемую при проведении SDS-Experion. На вставке показано увеличение заключенного в рамку участка основного пятна, в котором обозначены уреаза и конъюгированные молекулы (N1-N4, соответствующие уреазе, конъюгированной с 1-4 молекулами AFAIKL2). После обработки антителом против уреазы наиболее сильно визуализируется полоса уреазы, соответствующая 91 кДа, а интенсивность полос, соответствующих более высокой молекулярной массе (то есть молекулам с более высокой степенью конъюгации) уменьшается. И наоборот, после обработки антителом против AFAIKL2 полоса, соответствующая 91 кДа, едва заметна, а следующие две полосы, соответствующие более высокой молекулярной массе, являются наиболее интенсивными (N1 и N2). Это связано с тем, что они являются доминирующими полосами в конъюгате. Способность L-DOS47 визуализироваться как антителом против AFAIKL2, так и антителом против уреазы, свидетельствует о присутствии обеих молекул в конъюгате, а специфичность антител подтверждается тем фактом, что антитело против AFAIKL2 не связывается с уреазой, а антитело против уреазы не связывается с AFAIKL2.
[0235] Поскольку L-DOS47 представляет собой химический конъюгат AFAIKL2 и уреазы, в триптическом гидролизате конъюгата можно обнаружить пептиды, представляющие собой фрагменты как антитела, так и фермента уреазы, а также ковалентно связанные фрагменты обоих белков. Для характеристики конъюгата проводят пептидное картирование ESI LC-MSE. Как показано в соответствующем разделе, пептиды из AFAIKL2 можно обнаружить в спектре L-DOS47, но не в спектре уреазы HP. Пептиды, присутствующие в триптическом гидролизате L-DOS47, на 100% охватывают аминокислотные последовательности как AFAIKL2, так и уреазы с типичной массовой ошибкой менее 6 м.д., причем каждый из пептидов подтверждается наличием ионов высокой энергии MS/MS b/y с массовыми ошибками менее ±15 м.д.
[0236] Чтобы идентифицировать участки активации AFAIKL2 и определить распределение каждого участка конъюгации, AFAIKL2 активируют с помощью SIAB и затем конъюгируют с меченым флуоресцеином цистеином (Cys-FL). После расщепления трипсином полученного AFAIKL2-Cys-FL и разделения методом ОФ-ВЭЖХ собирают пиковые фракции и подвергают их анализу MALDI-MS, чтобы идентифицировать образовавшиеся в результате триптического гидролиза пептиды, связанные с Cys-FL. Поскольку только SIAB-активированные участки могут быть связаны с Cys-флюоресцеином, максимальная длина волны поглощения которого в 0,025% TFA составляет 420 нм, при 420 нм можно обнаружить пики только активированных пептидов. Например, если лизин 32 AFAIKL2 активировать с помощью SIAB, он может связываться с Cys-FL, и этот участок расщепления трипсином будет пропущен во время триптического гидролиза; следовательно, можно наблюдать пик с молекулярной массой 2768,113 Да, который соответствует Cys-FL, связанному с лизином в середине пептида (LSCAAHDPIFDK32NLMGWG)-Cys-FL (SEQ ID NO: 7), обозначаемому как L2K32-Cys-FL. Хроматограмма ОФ-ВЭЖХ триптического гидролизата AFAIKL2-Cys-FL показана на фигуре 13.
[0237] Идентифицированные конъюгированные пептиды с определенными значениями массы также помечают на соответствующих пиках ВЭЖХ на фиг.13. Согласно аминокислотной последовательности антитела, первичные аминогруппы шести остатков лизина и N-концевая аминогруппа теоретически доступны для реакции активации. Однако на практике только четыре из них активируются в существенной степени. Это, скорее всего, связано с третичной структурой антитела, обуславливающей экспонирование четырех указанных первичных аминогрупп на поверхности и углубление других внутри нативной структуры. Распределение каждого участка активации (таблица 4) рассчитывают в соответствии с площадью пика и суммой площадей всех идентифицированных пиков ВЭЖХ, показанных на фигуре 13.
[0238] Таблица 4. Площади пиков ВЭЖХ и процент распределения каждого участка активации на AFAIKL2
[0239] Как показано в таблице 4, наиболее активным участком антитела для сшивающего средства является L2K76, затем L2M1 и L2K44. L2K32 необходим для связывания антитела и также является наименее активным участком, но все же вносит вклад до ~18% в общую реакционную способность. Для получения L-DOS47 проводят ковалентное присоединение активированного сшивающим средством AFAIKL2 к остаткам цистеина, экспонированным на поверхности четвертичной структуры уреазы. Следовательно, ковалентно сшитые пептиды можно обнаружить в спектре пептидов триптического гидролизата L-DOS47.
[0240] Чтобы идентифицировать указанные ковалентно сшитые пептиды, исходные данные ESI LC-MSE триптических гидролизатов образцов L-DOS47 обрабатывают с помощью BiopharmaLynx, но проводят поиск в библиотеке вариабельных модификаторов, содержащей набор модификаторов, созданный пользователями для всех 15 цистеиновых остатков на фрагменте уреазы. В соответствии с распределением активации, приведенным в таблице 4, указанные модификаторы, созданные пользователем, представляют собой три пептида, содержащие лизин в середине, а также связующий фрагмент SIAB (C9H5O2N, 159,0320 да) (их обозначают L2K76, L2K44 and L2K32) и N-концевой метионин плюс связь (обозначают L2M1). Результаты (подробно описанные в соответствующем разделе) демонстрируют, что среди 15 остатков цистеина каждой субъединицы уреазы только 6 активно участвуют в конъюгации. Наиболее доступным остатком цистеина является UC824, затем в порядке уменьшения доступности следуют UC663, UC59, UC207, UC329 и UC268. Остаток цистеина Cys592, который необходим для проявления ферментной активности уреазы, практически не участвует в конъюгации. Четыре участка AFAIKL2, активированные сшивающим средством, также обладают разной относительной доступностью для каждого из шести остатков цистеина, присутствующих на фрагменте уреазы. Например, UC329 является доступным только для L2M1. Указанные участки практической конъюгации также подтверждают профилями фрагментов MS/MS. Например, конъюгированный пептид L2K32UC663, имеющий последовательность (LSCAAHDPIFDKNLMGWGR (SEQ ID NO: 8))-связь-(CDSSDNDNFR (SEQ ID NO: 9)) и массу 3517,4873, идентифицируют с ошибкой совпадения массы 2,1 м.д. путем поиска его как пептида уреазы CDSSDNDNFR (SEQ ID NO: 9), модифицированного (LSCAAHDPIFDKNLMGWGR (SEQ ID NO: 8))-связь (2346,0674 Да) со стороны AFAIKL2 в качестве модификатора. Тот же пептид также идентифицируют с ошибкой совпадения массы 2,1 м.д. путем поиска его как пептида AFAIKL2 LSCAAHDPIFDKNLMGWGR (SEQ ID NO: 8), модифицированного связь-(CDSSDNDNFR (SEQ ID NO: 9)) (1330,4520 Да) со стороны мочевины в качестве модификатора. Индуцированный высокоэнергетическими столкновениями MS/MS-спектр указанного конъюгированного пептида картируют с использованием 9 ионов фрагментов b/y со стороны уреазы путем поиска его как пептида уреазы, модифицированного модификатором со стороны AFAIKL2. Тот же спектр был также картируют с использованием 14 ионов b/y со стороны AFAIKL2 путем поиска его как пептида AFAIKL2 с модификатором со стороны уреазы.
[0241] Разные профили связывания L-DOS47 наблюдаются в отношении клеточных линий BxPC-3, A549 и MCF7 (фигура 14). Результаты демонстрируют, что L-DOS47 хорошо связывается с линией клеток поджелудочной железы BxPC-3, свидетельствуя о том, что антиген CEACAM6 экспрессируется на поверхности клетки. Умеренное связывание наблюдается с линией клеток легких A549, однако связывание с линией клеток молочной железы MCF7 не было обнаружено. Антитело AFAIKL2, конъюгированное с ферментом уреазой (DOS47), обеспечивает специфическую направленность на клетки, экспрессирующие CEACAM6. Это подтверждается отсутствием сигнала связывания в трех клеточных линиях, обработанных неконъюгированным контролем DOS47.
[0242] Клетки BxPC-3 являются очень чувствительными к цитотоксичности L-DOS47 (фиг. 15), о чем свидетельствует быстрое снижение выживаемости клеток, наблюдаемое при обработке клеток L-DOS47 в дозе менее 1 мкг/мл. Умеренная цитотоксичность наблюдается в отношении клеток A549, тогда как в отношении MCF7 никакие эффекты не наблюдаются, что согласуется с результатами исследования связывания. Кроме того, отрицательный контроль DOS47 не оказывает цитотоксического воздействия ни на одну из клеточных линий.
[0243] Процедуры, разработанные для конъюгации и очистки иммуноконъюгата L-DOS47, можно успешно использовать в крупномасштабном производстве. С использованием разработанных химии конъюгации и условий реакции достигают хорошей однородности путем предварительного перемешивания активированного сшивающим средством антитела с уреазой HP, используемой в качестве промежуточного соединения, с последующей корректировкой рН для активации реакции конъюгации. При коэффициентах конъюгации, находящихся в диапазоне 8-11 антител на молекулу уреазы, содержание остаточной уреазы является практически незначительным, следовательно, конъюгат L-DOS47 можно очистить с помощью только ультрадиафильтрации, позволяющей удалить непрореагировавшее антитело и гидролизованное сшивающее средство, и сложную стадию отделения остаточной уреазы от полученого иммуноконъюгата можно избежать. С помощью этой процедуры получают высокочистый L-DOS47 (>95%), в котором содержание свободной уреазы составляет менее 2%. Сродство L-DOS47 к иммобилизованному CEACAM6-A по данным анализа ELISA, прямо пропорционально числу антител, конъюгированных с уреазой, и достигает предельного значения, когда коэффициент конъюгации превышает 6. Коэффициенты конъюгации варьируют от 9 до 11 антител на молекулу уреазы во всех крупномасштабных партиях, демонстрируя, что в этих условиях достигается оптимальное конъюгирование. Химическую идентичность конъюгата подтверждают методом вестерн-блоттинга с использованием двойного антитела. Анализ путем пептидного картирования методом ESI LC-MSE позволяет достичь 100% охвата последовательностей как антитела, так и уреазы, входящих в состав иммуноконъюгата L-DOS47. Пептидные последовательности, содержащие более трех аминокислотных остатков, включающие С-концевые и N-концевые последовательности как AFAIKL2, так и уреазы, подтверждают картами фрагментов соответствующих пептидов, полученными методом MS/MS b/y. Эффективные участки конъюгации (4 со стороны AFAIKL2 и 6 со стороны уреазы) идентифицируют путем пептидного картирования образцов L-DOS47 методом ESI LC-MSE. Указанные сшитые пептиды подтверждают с помощью карт фрагментов соответствующих пептидов как со стороны антитела, так и со стороны уреазы, методом MS/MS b/y.
[0244] Специфичность L-DOS47 по отношению к двум CEACAM6-экспрессирующим клеточным линиям BxPC-3 и A549 иллюстрируют отсутствием связывания и цитотоксической активности DOS47 по сравнению с антитело-конъюгированным L-DOS47. Среди трех тестируемых клеточных линий самый интенсивный сигнал связывания наблюдается у BxPC-3, тогда как связывание A549 происходит только в умеренной степени. Сигнал связывания BxPC-3 примерно в пять раз превышает сигнал связывания A549. Полученные результаты согласуются с результатами анализов цитотоксичности. L-DOS47 оказывает на BxPC-3 гораздо более сильный цитотоксический эффект, чем на A549. В MCF-7 цитотоксический ответ не наблюдается вследствие отсутствия связывания L-DOS47. L-DOS47 участвует в фазе I клинических исследований на людях как потенциальное терапевтическое средство против немелкоклеточного рака легкого.
[0245] Следует понимать, что, хотя настоящее изобретение описывается с использованием вышеупомянутых аспектов, приведенные выше описание и примеры предназначены для иллюстрации, но не для ограничения объема настоящего изобретения. Другие аспекты, преимущества и модификации, входящие в объем настоящего изобретения, будут очевидны для специалистов в области, к которой относится настоящее изобретение.
[0246] Объем настоящего изобретения не должен ограничиваться конкретными описанными аспектами, предназначенными только для иллюстрации отдельных положений настоящего изобретения, причем любые функционально эквивалентные композиции или способы входят в объем настоящего изобретения. Для специалистов в данной области техники должно быть очевидно, что можно осуществить разные модификации и вариации способов и композиций настоящего изобретения, не отступая от сущности или объема изобретения. Следовательно, предполагается, что настоящее изобретение охватывает модификации и вариации при условии, что они входят в объем прилагаемой формулы изобретения и ее эквивалентов.
[0247] Все публикации и патентные заявки, упомянутые в настоящем описании, включены в данный документ посредством ссылки в той степени, как если бы каждая отдельная публикация или патентная заявка была специально и индивидуально указана для включения в качестве ссылки.
Список литературы
1. Stubbs M, McSheehy PMJ, Griffiths JR, et al. Causes and consequences of tumor acidity and implications for treatment. Mol Med Today 2000; 6:15-9.
2. Raghunand N, Gillies RJ. pH and Chemotherapy. In: Goode JA, Chadwick DJ, eds. The tumor microenvironment: causes and consequences of hypoxia and acidity. Chichester: John Wiley & Sons Ltd. 2001; 199-211.
3. Schornack PA, Gillies RJ. Contributions of cell metabolism and H+ diffusion to the acidic pH of tumors. Neoplasia 2003; 5:135-45.
4. Helmlinger G, Sckell A, Dellian M, et al. Acid production in glycolysis-impaired tumors provides new insights into tumor metabolism. Clin Cancer Res 2002; 8:1284-91.
5. Izumi H, Torigoe T, Ishiguchi H, et al. Cellular pH regulators: potentially promising molecular targets for cancer chemotherapy 2003; 29:541-9.
6. Robey IF, Baggett BK, Kirkpatrick ND, et al. Bicarbonate increases tumor pH and inhibits spontaneous metastases. Cancer Res 2009;69:2260-8.
7. Mahoney BP, Raghunand N, Baggett B, et al. Tumor acidity, ion trapping and chemotherapeutics I. Acid pH affects the distribution of chemotherapeutic agents in vitro. Biochem Pharmacol 2003; 66:1207-18.
8. Wong WY, DeLuca CI, Tian B, et al. Urease-induced alkalinization of extracellular pH and its antitumor activity in human breast and lung cancers. J Exp Ther Oncol 2005; 5:93-9.
9. Teicher BA, Chari RVJ. Antibody conjugate therapeutics: Challenges and potential. Clin Cancer Res 2011; 17:6389-97.
10. Xu G, McLeod HL. Strategies for enzyme/prodrug cancer therapy. Clin Cancer Res 2001; 7:3314-24.
11. Kuespert K1, Pils S, Hauck CR. CEACAMs: their role in physiology and pathophysiology. Curr Opin Cell Biol 2006; 18:565-71.
12. Pavlopoulou A, Scorilas A. A comprehensive phylogenetic and structural analysis of the carcinoembryonic antigen (CEA) gene family. Genome Biol Evol 2014; 6:1314-26.
13. Blumenthal RD, Hansen HJ, Goldenberg DM. Inhibition of adhesion, invasion, and metastasis by antibodies targeting CEACAM6 (NCA-90) and CEACAM5 (carcinoembryonic antigen). Cancer Res 2005; 65:8809-17.
14. Baral TN, Murad Y, Nguyen TD, et al. Isolation of functional single domain antibody by whole cell immunization: implications for cancer treatment. J Immunol Methods 2011; 371:70-80.
15. Strickland LA, Ross J, Williams S, et al. Preclinical evaluation of carcinoembryonic cell adhesion molecule (CEACAM) 6 as potential therapy target for pancreatic adenocarcinoma. J Pathol 2009; 218:380-390.
16. Duxbury MS, Matros E, Ito H, et al. Systemic siRNA-mediated gene silencing: A new approach to targeted therapy of cancer. Annals of Surgery 2004; 240:667-76.
17. Zhang J, Li Q, Nguyen TD, et al. A pentavalent single-domain antibody approach to tumor antigen discovery and the development of novel proteomics reagents. J Mol Biol 2004; 341:161-9.
18. Weatherburn MW. Phenol-hypochlorite reaction for determination of ammonia. Anal Chem 1967; 39:971-4.
19. Ohwada A, Yoshioka Y, Iwabuchi K, et al. VEGF regulates the proliferation of acid-exposed alveolar lining epithelial cells. Thorax 2003; 58:328-32.
20. Napier, M. P. et al., (2000) Antibody-directed Enzyme Prodrug Therapy: Efficacy and Mechanism of Action in Colorectal Carcinoma1. Clinical Cancer Research 6, 765-772.
21. Bagshawe, K. D. (1987) Antibody directed enzymes revive anti-cancer prodrugs concept. Br. J. Cancer56, 531-532.
22. Bagshawe K.D.(2006) Antibody-directed enzyme prodrug therapy (ADEPT) of cancer. Expert Rev Anticancer Ther 6, 1421-1431.
23. Tietze, L. F. and Feuerstein, T. (2003) Enzyme and Proton-Activated Prodrugs for a Selective Cancer Therapy. Curr. Pharm. Des. 9, 2155-2175.
24. Denny, W. A. (2004) Tumor-activated Prodrugs -A New Approach to Cancer Therapy. Cancer Invest. 22, 604-619.
25. Pasquetto M.V., Vecchia, L., Covini,D., Digilio, R., and Scotti, C., (2011) Targeted Drug Delivery Using Immunoconjugates: Principles and Applications Journal of Immunother 34, 611-628.
26. Tietze, L.F., and Krewer, B. (2009) Antibody-directed enzyme prodrug therapy: a promising approach for a selective treatment of cancer based on prodrugs and monoclonal antibodies. Chem Biol Drug Des 74, 205-211.
27. Afshar, S., Asai. T., and Morrison, S.L.(2009)Humanized ADEPT Comprised of an Engineered Human Purine Nucleoside Phosphorylase and a Tumor Targeting Peptide for Treatment of Cancer. Mol Cancer Ther 2009, 8 1-9.
28. Afshar, S., Olafsen, T., Wu A.M., and Morrison, S.L., (2009) Characterization of an engineered human purine nucleoside phosphorylase fused to an anti-her2/neu single chain Fv for use in ADEPT. J ExpClin Cancer Res 28:147.
29. Alderson R.A., Toki, B.e., Roberge, M., Geng, W., Basler, J., Chin, R., Liu, A., Ueda, R., Hodges, D., Escandon, E., Chen, T., Kanavarioti, T., Babé, L., Senter, P.D., Fox, J.A., Schellenberger, V., (2006) Characterization of a CC49-Based Single-Chain Fragment-â-Lactamase Fusion Protein for Antibody-Directed Enzyme Prodrug Therapy (ADEPT). Bioconjugate Chem, 17, 410-418.
30. http://www.piercenet.com/method/crosslinking-applications
31. Kim, J.H., Kim, Y-W., Kim, I-W., Park, D.C., Kim, Y.W., Lee, K-H., Jang,C.K., Ahn, W.S., (2013) Identification of candidate biomarkers using the Experion™ automated electrophoresis system in serum samples from ovarian cancer patients. International Journal of Oncology 42940, 1257-1262.
32. Chan, O.T.M., and Herold, D.A., (2009) Chip Electrophoresis as a Method for Quantifying Total Albumin in Cerebrospinal Fluid. Journal of the Association for Laboratory Automation 14, 6-11.
33. Zhang, J., Li, Q., Nguyen, T.D., Tremblay,T-L., Stone, E., To, R., Kelly, J., and MacKenzie, C.R., (2004) A pentavalent single-domain antibody approach to tumor antigen discovery and the development of novel proteomics reagents. J Mol Biol 41 161-1699.
34. Wong, W.Y., DeLuca, C.I., Tian, B., Wilson, I., Molund, S., Warriar, N., Govindan, M.V., Sega, l D., and Chao, H., (2005) Urease-induced alkalinization of extracellular pH and its antitumor activity in human breast and lung cancers. J Exp Ther Oncol 5, 93-9.
Реферат
Изобретение относится к области биотехнологии, медицины, биохимии и молекулярной биологии. Заявлены фармацевтическая композиция, содержащая конъюгат антитела к CEACAM6 с уреазой, а также способ ее получения, применение и набор. Изобретение может быть использовано в медицине для терапии рака. 4 н. и 27 з.п. ф-лы, 15 ил., 4 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Коньюгат антимеланомного антитела и цитотоксического агента и способ ингибирования меланомы

Комментарии