Анти-неr2 антитело и его конъюгат - RU2656161C1
Код документа: RU2656161C1
Чертежи













Описание
Область техники
[01] Настоящее изобретение относится к новому HER2 антителу или его функциональным фрагментам, содержащим сконструированные тяжелые цепи и легкие цепи. Настоящее изобретение дополнительно относится к конъюгатам усовершенствованного HER2 антитела c низкомолекулярными лекарственными средствами. Настоящее изобретение дополнительно относится к применению антитела и конъюгатов в получении лекарственного средства для лечения опухолей.
Уровень техники
1. Краткий обзор HER2
[02] ErbB2, также известный как HER2/neu, является вторым членом семейства EGFR, который образует гетеродимер с другими тремя членами в семействе EGFR, так что он проявляет биологическую функцию. К настоящему времени лиганд, который может непосредственно связывать ErbB2, все еще не был обнаружен. Ген neu, кодирующий ErbB2, первоначально был выделен из крысиной нейробластомы. Гомологичный neu ген в человеческих соматических клетках, известный как HER2, расположен на хромосоме 17q21.1. Кодируемый продукт представляет собой ErbB2, который составлен из 1255 аминокислот с молекулярной массой приблизительно 185 кДа, в котором положения 720-987 принадлежат активному домену тирозинкиназы. В добавление к роли посредством сигнального пути PI3K и MAPK, ErbB2 может также снижать экспрессирование циклина D и c-myc, посредством чего снижать экспрессирование ингибитора ациклин-зависимой киназы (cdk) p27kipl, таким образом приводя к клеточной пролиферации, являющейся результатом ингибирования активности cdk2 [1].
[03] В ходе в возрастающей степени расширяющихся и углубляющихся исследований было обнаружено, что HER2 экспрессирован или сверхэкспрессирован в различных опухолях. До настоящего времени было сообщено, что позитивный уровень экспрессирования, уровень сверхэкспрессирования HER2 в некоторых опухолях и у некоторых людей, у которых HER2 сверхэкспрессирован, является следующим: рак яичников, 45%, 21%, 23316 человек [2]; рак молочной железы, 58%, 38%, 223112 человек [3]. Вследствие этого, существует острая необходимость в клинической практике для эффективных лекарственных средств, нацеленных на HER2 для лечения злокачественной опухоли. По настоящее время коммерчески доступные моноклональные антитела, которые нацелены на HER2, включают Трастузумаб и Пертузумаб.
2. Трастузумаб и Пертузумаб
[04] Герцептин® (Трастузумаб), разработанный Genentech, является гуманизированным моноклональным антителом, которое нацелено на HER2. В 1998 Трастузумаб в комбинации с паклитакселом был одобрен US FDA в качестве лечебного режима для лечения первой линии метастатического рака молочной железы со сверхэкспрессированным HER2/neu, или в качестве единственного лекарственного средства для лечения метастатического рака молочной железы с сверхэкспрессированным HER2/neu, который ранее был подвержен по меньшей мере одному циклу химиотерапии. Трастузумаб не только обладает высокой аффинностью к HER2 рецептору, но также разрешает проблему иммуногенности вызванной посредством применения полученного из мышей антитела по отношению к человеческому организму. Результаты клинических испытаний демонстрируют, что применение только Трастузумаба имеет уровень эффективности 11,6%~16%, тогда как его комбинированная терапия с химическими лекарственными средствами имеет уровень эффективности вплоть до 50%. По сравнению с только химиотерапией указанная комбинация предоставляет пациентам с рецидивирующим раком молочной железы на поздней стадии более продолжительный срок жизни и сниженную смертность.
[05] Другим лекарственным антителом, которое нацелено на HER2 является пертузумаб [4], который также был разработан Genentech. Пертузумаб связывается с областью II внеклеточного домена HER2 рецептора, ингибируя образование димера, посредством чего ингибируя рецептор-опосредованный сигнальный путь, при этом Трастузумаб (Герцептин) связывается с областью IV внеклеточного домена HER2 рецептора. Пертузумаб был одобрен US FDA 8 июня, 2012, для лечения пациентов с HER2-позитивным метастатическим раком молочной железы на поздней стадии (см. CN101023100B).
3. Конъюгаты антитело-лекарственное средство
[06] Моноклональному антителу было уделено все больше и больше внимания из-за его характеристик высокой специфичности к мишени, низкого побочного эффекта и тому подобного. Однако, при использовании отдельно его лечебный эффект ограничен. В настоящее время, наиболее успешными лекарственными средствами на основе моноклонального антитела против опухоли являются средства против лимфоцитомы, такой как хроническая неходжкинская лимфоцитома (НХЛ). Фаза II клинического исследования Ритуксана, направленного на НХЛ, демонстрирует, что общий уровень ответа составлял только 6%. Для Герцептина® против метастатического рака молочной железы только 15% имеют ответ. Следовательно, большинство лекарственных моноклональных антител используют в комбинации с химиотерапией. Например, Ритуксан используют в комбинации со стандартной химиотерапией для лечения хронической лимфоцитомы, что может увеличить уровень эффективности вплоть до 90%. По настоящее время основным путем для увеличения лечебного эффекта моноклонального антитела являются конъюгаты антитело-лекарственное средство.
[07] Конъюгат антитело-лекарственное средство принадлежит к типу нового противоракового “биологического реактивного” лекарственного средства, которое составлено из трех частей: антитело, цитотоксин и линкер, который соединяет две части. Моноклональное антитело объединено с цитотоксином посредством химического объединения. Таким образом, конъюгат антитело-лекарственное средство специфически распознает рецептор на поверхности раковых клеток и связывается с рецептором посредством использования нацеливающего моноклонального антитела, и затем конъюгат проникает в клетки, и предотвращает пролиферирование раковых клеток и убивает раковые клетки посредством использования протеазы в клетках, которые могут высвобождать цитотоксин. Технология объединения антитело-лекарственное средство делает низкомолекулярное лекарственное средство и биологический белок слитыми вместе, что может обладать преимуществами обоих и значительно увеличивать действенность лекарственных средств, снижать побочные эффекты, и таким образом она преобразуется в новое поколение терапевтического продукта.
[08] Первым успешным примером в клинической практике нацеленного конъюгата антитело-лекарственное средство является Гемтузумаб озогамицин (Wyeth, коммерческое название: Милотарг). Милотарг является первым одобренным конъюгатом моноклональное антитело-лекарственное средство. Это лекарственное средство составлено из анти-CD33 антитела, Калихимицина (лекарственное средство, которое разрушает ДНК) и химического линкера AcBut. Милотарг является лекарственным средством, в котором гуманизированное анти-CD33 IgG4 объединено с противопухолевым лекарственным средством Калихимицином, для лечения острой миелоидной лейкемии [5]. Милотарг является первым поколением конъюгата антитело-лекарственное средство, который имеет три критичных дефекта в технологии: во-первых, линкер, используемый для связывания токсина, является очень неустойчивым, время полужизни которого составляет только два дня, что приводит к сильной потере токсина и высокому токсическому побочному эффекту в клинической практике; во-вторых, антитело объединено с линкером через аминогруппу лизина, тем не менее, имеют место десятки лизинов на поверхности антитела, и места объединения являются случайными, что частично воздействует на действенность лекарственных средств; что более существенно, так как технология объединения то время не являлась сформировавшейся, только 50% антитела могут связаться с лекарственным средством, что приводит в результате к неудовлетворительной действенности лекарственных средств в клинической практике; в-третьих, используемое антитело представляет собой IgG4, у которого имеется недостаток антителозависимой клеточноопосредованной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC). Вследствие этого, через десять лет после появления на рынке, Милотарг был снят с продажи из-за высокого токсического побочного эффекта и ограниченного лечебного эффекта.
[09] Вторым успешным примером в клинической практике нацеленного конъюгата антитело-лекарственное средство является новое лекарственное средство для лечения лимфомы Ходжкина. Так как оно имело очень хороший лечебный эффект, оно было одобрено US FDA в 2011 после проведения лишь фазы II клинического испытания. Это лекарственное средство было разработано Seattle Genetics в качестве нового нацеленного конъюгата антитело-лекарственное средство (ADC), который является нацеленным лечением для двух типов пациентов с лимфомой, экспрессирующей антиген CD30. Этот конъюгат антитело-лекарственное средство, брентуксимаб ведотин, составлен из моноклонального антитела против CD30, ингибитора микротрубочек (MMAE) и дипептидного химического линкера. Этот конъюгат антитело-лекарственное средство имеет характеристики низкого побочного эффекта и эффективного ингибирования лимфомы. В фазе II клинического испытания в одной группе, 102 пациента возрастом от 15 до 77 лет (средний возраст=31) с рецидивирующей или рефрактерной лимфомой Ходжкина, получали лечение с брентуксимабом ведотином, и серединное лечение содержит 9 циклов. Когда серединный курс лечения составлял 6,7 месяцев, общий уровень ответа составлял 73%. Когда серединный курс лечения составлял 20,5 месяцев, полный уровень ответа оставлял 34%; у 40% пациентов, которые получали лечение, был достигнут частичный ответ [7]. Наиболее частой нежелательной реакцией является повреждение периферического нерва. Успех этого лекарственного средства предполагает технологическую осуществимость и очень благоприятные перспективы нацеленного конъюгата антитело-лекарственное средство.
[10] Другим успешным примером нацеленного конъюгата антитело-лекарственного средства является T-DM1 против злокачественного рака молочной железы, разработанный Genentech Inc. [8]. Моноклональным антителом этого конъюгата антитело-лекарственное средство является анти-HER2 (ErbB2) антитело на поверхности клеток рака молочной железы, которое объединено с цитотоксином, ингибитором микротрубочек DM1. Результат в фазе III клинического испытания этого лекарственного средства демонстрирует более сильный лечебный эффект, чем химиотерапия, и более низкий побочный эффект. У таких пациентов с раком молочной железы, которые получали лечение с химиотерапевтическими лекарственными средствами Герцептином и таксанами ранее, все еще прогрессировали заболевания. Однако получение лечения конъюгатом антитело-лекарственное средство может значительно продлевать продолжительность выживания пациентов с HER2-позитивным раком молочной железы с предпосылкой того, что заболевание не ухудшится [9]. На основании хорошего лечебного эффекта этого лекарственного средства лекарственное средство было одобрено US FDA 22 февраля, 2013, для лечения пациентов с HER2-позитивным метастатическим раком молочной железы на поздней стадии (см. CN100482281C).
[11] Хотя Герцептин является крупным достижением в истории лечения сверхэкспрессирующего HER2 рака молочной железы, в отношении которого уже были предприняты попытки различных противораковых лечений, около 85% пациентов не имели или имели только слабый ответ на терапию с Герцептином [11]. Было продемонстрировано, что HER2 экспрессирован или сверхэкспрессирован в различных опухолях. Таким образом, имеет место острая потребность в клинической практике для разработки противораковых лекарственных средств, нацеленных на HER2, для таких пациентов со сверхэкспрессирующими HER2 опухолями или другими экспрессирующими HER2 релевантными заболеваниями (включая не только рак молочной железы), которые не имеют или имеют только слабый ответ на терапию с Герцептином.
[12] Следовательно, имеет место острая потребность в клинической практике для разработки лекарственного средства, нацеленного на HER2. Данное изобретение предоставляет техническое решение для удовлетворения этой потребности.
Сущность изобретения
[13] В одном аспекте настоящее изобретение относится к антителу или его функциональным фрагментам, которые могут специфически связываться с HER2. В частности, антитело содержит тяжелую цепь и легкую цепь, в которых:
(i) тяжелая цепь содержит три области CDR, из которых по меньшей мере одна из CDR областей имеет аминокислотную последовательность, как показано в SEQ ID NO: 1, 2 или 3, или имеет по меньшей мере 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательности с SEQ ID NO: 1, 2 или 3; и
(ii) легкая цепь содержит три области CDR, из которых по меньшей мере одна из CDR областей имеет аминокислотную последовательность, как показано в SEQ ID NO: 4, 5 или 6, или имеет по меньшей мере 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательности с SEQ ID NO: 4, 5 или 6.
[14] В конкретном варианте осуществления антитело содержит тяжелую цепь и легкую цепь, в которых:
(i) тяжелая цепь содержит три области CDR, каждая из которых имеет аминокислотную последовательность, как показано в SEQ ID NO: 1, 2 и 3, соответственно; и/или
(ii) легкая цепь содержит три области CDR, каждая из которых имеет аминокислотную последовательность, как показано в SEQ ID NO: 4, 5 и 6, соответственно.
[15] В предпочтительном варианте осуществления настоящее изобретение относится к антителу, секретируемому из гибридомных клеток (депонированных в China General Microbiological Culture Collection Center (расположенном в Institute of Microbiology, Chinese Academy of Sciences, No. 3, 1st Beichen West Rd., Chaoyang District, Beijing 100101, P. R.China) 22 августа, 2013, под номером доступа 8102 (CGMCC No. 8102)), или антителу, полученному из него (дата переноса в Будапештский договор - 29 октября, 2013). В другом предпочтительном варианте осуществления настоящее изобретение относится к антителу, секретируемому из клеток яичника китайского хомячка (CHO) (депонированы в China General Microbiological Culture Collection Center (расположенный в Wuhan University, Luojia Mountain, Wuchang District, Wuhan City, Hubei 430072, P. R.China) 6 ноября, 2013, под номером доступа C2013170 (CCTCC C2013170)) или антителу, полученному из него.
[16] В другом аспекте настоящее изобретение относится к выделенному полинуклеотиду, кодирующему антитело согласно настоящему изобретению.
[17] В дополнительном аспекте настоящее изобретение относится к комбинации выделенных полинуклеотидов, которая содержит полинуклеотид, кодирующий легкую цепь антитела согласно настоящему изобретению или его функциональные фрагменты, и полинуклеотид, кодирующий тяжелую цепь антитела согласно настоящему изобретению или его функциональные фрагменты.
[18] В дополнительном аспекте настоящее изобретение относится к экспрессионному вектору, который содержит полинуклеотид в соответствии с настоящимнастоящим изобретением или комбинацию полинуклеотидов в соответствии с настоящимнастоящим изобретением, в котором полинуклеотид функционально соединяется с регуляторной последовательностью, которая позволяет, чтобы полипептид, кодируемый полинуклеотидом, экспрессировался в клетке-хозяине или бесклеточной экспрессирующей системе.
[19] В другом аспекте настоящее изобретение относится к конъюгату, содержащему антитело согласно настоящему изобретению или его функциональные фрагменты, которые объединены с одним или более терапевтических агентов. Предпочтительно терапевтический агент является цитотоксическим лекарственным средством (таким как антиметаболиты, противопухолевые антибиотики, алкалоиды), иммунопотенциаторы или радиоактивные изотопы. Более предпочтительно терапевтический агент выбран из майтанзиноидов (таких как Ансамитоцин или Мертансин), доластатина и их производных. Наиболее предпочтительно терапевтический агент выбран из MMAE (Монометил ауристатин E) и MMAF (Монометил ауристатин F). В других вариантах осуществления терапевтический агент может также быть выбран из приведенных в таблице 1 ниже.
[20] В некоторых конкретных вариантах осуществления терапевтический агент объединен с указанным антителом или его функциональными фрагментами через линкер. Линкер, используемый в настоящем изобретении, может быть соединен с антителом любыми способами, известными в данной области, предпочтительно соединен посредством тиола и/или амина. В конкретном предпочтительном варианте осуществления антитело согласно настоящему изобретению соединено с линкером посредством тиола. Линкер, используемый в настоящем изобретении, может являться расщепляемым линкером (то есть, линкер может быть разрушен in vivo milieu) или нерасщепляемым линкером. В некоторых вариантах осуществления линкер согласно настоящему изобретению выбран из расщепляемых линкеров, предпочтительно из пептидного, гидразонового и дисульфидного линкеров, таких как малеимидокапроил-валин-цитруллин-п-аминобензилоксикарбонил (сокращенно обозначаемый в настоящем описании mc-vc-pAB или vc). В других вариантах осуществления линкер согласно настоящему изобретению выбран из нерасщепляемых линкеров, таких как малеимидокапроил (сокращенно обозначаемый в настоящем описании mc). В других вариантах осуществления линкер может также быть выбран из приведенных в таблице 2 ниже.
[21] В другом аспекте настоящее изобретение относится к конъюгату антитело-лекарственное средство, имеющему общую формулу Ab-(L-U)n, в которой Ab представляет антитело в соответствии с настоящимнастоящим изобретением или его функциональные фрагменты, L представляет линкер (например, mc-vc-pAB или mc), U представляет терапевтический агент (предпочтительно терапевтический агент выбран из цитотоксического лекарственного средства, иммунопотенциаторов и радиоактивных изотопов; более предпочтительно терапевтический агент выбран из майтанзиноидов, доластатина и его производных; наиболее предпочтительно терапевтический агент выбран из MMAE и MMAF), и n представляет целое число от 1 до 8 (например, 1, 2, 3, 4, 5, 6, 7 или 8). Линкер, используемый в настоящем изобретении, может являться расщепляемым линкером (то есть, линкер может быть разрушен in vivo) или нерасщепляемым линкером.
[22] В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, которая содержит антитело в соответствии с настоящимнастоящим изобретением или его функциональные фрагменты и/или конъюгат в соответствии с настоящимнастоящим изобретением, а также фармацевтически приемлемый носитель.
[23] В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака (в особенности HER2-позитивного рака), который включает введение антитела, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора, конъюгата и/или фармацевтической композиции в соответствии с настоящим изобретением в терапевтически эффективном количестве пациенту.
[24] В дополнительном аспекте настоящее изобретение относится к применению антитела, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора, конъюгата и/или фармацевтической композиции в соответствии с настоящим изобретением в получении лекарственного средства для лечения или профилактики рака.
[25] В дополнительном аспекте настоящее изобретение относится к антителу, полинуклеотиду, комбинации полинуклеотидов, экспрессионному вектору, конъюгату и/или фармацевтической композиции в соответствии с настоящим изобретением, которые используются для лечения или профилактики рака. Предпочтительно рак является HER2-позитивным раком. Более предпочтительно рак выбран из рака молочной железымолочной железы, рака яичника или рака желудка. Более предпочтительно рак является Лапатиниб- и/или Герцептин-резистентным раком, таким как Лапатиниб- и/или Герцептин-резистентный рак молочной железымолочной железы, раком яичника или раком желудка.
[26] В дополнительном аспекте настоящее изобретение относится к клетке гибридомы, которая была депонирована в China General Microbiological Culture Collection Center 22 августа, 2013 под номером доступа 8102 (дата переноса в Будапештский договор - 29 отября, 2013).
[27] В дополнительном аспекте настоящее изобретение относится к клетке CHO, которая была депонирована в China General Microbiological Culture Collection Center 6 ноября, 2013, под номером доступа C2013170.
[28] В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство (ADC), который может лечить рак. Конъюгат содержит моноклональное антитело, которое способно специфически связываться с поверхностным рецептором раковой клетки, низкомолекулярное лекарственное средство с цитотоксическим эффектом, а также линкер, который может связывать вышеупомянутые две части вместе посредством ковалентной связи. Настоящее изобретение также относится к применению этих конъюгатов в производстве медицинского средства для лечения рака молочной железы и/или рака яичника и/или рака желудка.
[29] В некоторых конкретных вариантах осуществления настоящее изобретение относится к конъюгату антитело-лекарственное средство, который имеет общую формулу Ab-(L-U)n, в которой Ab представляет моноклональное антитело, нацеленное на HER2, L выбран из mc-vc-pAB или mc, U выбран из MMAE или MMAF, и n представляет целое число от 1 до 8.
[30] В частности, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, в котором области CDR тяжелой цепи являются такими, как показано в SEQ ID NO. 1, SEQ ID NO. 2 и SEQ ID NO. 3, соответственно.
[31] В частности, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, в котором области CDR легкой цепи являются такими, как показано в SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, соответственно.
[32] Более конкретно, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, которое является секретируемым из клеток, депонированных в China General Microbiological Culture Collection Center 6 ноября, 2013, под номером доступа C2013170.
[33] Трастузумаб (Герцептин®) является рекомбинантным гуманизированным моноклональным антителом, селективно нацеленным на внеклеточный домен человеческого рецептора эпидермального фактора роста-2 (HER2), в основном используемого для лечения HER2-позитивного рака. Гуманизированное антитело RC48 согласно настоящему изобретению является рекомбинантным человеческим HER2 антителом, которое способно связываться с внеклеточным доменом HER2 с высокой аффинностью. В in-vitro экспериментах и in vivo моноклональное антитело RC48 демонстрирует высокую способность ингибировать пролиферацию сверхэкспрессирующих HER2 человеческих опухолевых клеток.
[34] Двумя низкомолекулярными цитотоксинами, задействованными в настоящем изобретении, являются MMAE (Монометил ауристатин E) или MMAF (Монометил ауристатин F) (см. фиг. 6), которые являются двумя видами ингибирующей клеточный тубулин малой молекулы. Настоящее изобретение также относится к двум видам линкеров: Малеимидокапроил (сокращенно обозначаемый в настоящем описании mc) и Малеимидо-Капроил-Валин-Цитруллин-п-АминоБензилокси (сокращенно обозначаемый в настоящем описании mc-vc-pAB, который также представлен просто посредством vc в названии конъюгата) (см. фиг. 7); первый линкер является нерасщепляемым, тогда как второй является расщепляемым, и соответствующие конъюгаты демонстрируют различную стабильность и время полужизни in vivo. Следующие три конъюгата антитело-лекарственное средство образованы моноклональным антителом RC48, соединенным с линкером через цистеин: RC48-vc-MMAE (см. фиг. 8), RC48-vc-MMAF (см. фиг. 9) и RC48-mc-MMAF (см. фиг. 10).
[35] Конъюгат согласно настоящему изобретению имеет связывающую способность антиген-антитело, сопоставимую in vitro с голым антителом RC48 и T-DM1. В анализе жизнеспособности клеток его цитотоксичность является значительно более высокой, чем цитотоксичность голого антитела RC48, Герцептина, T-DM1, в котором клетки, используемые в эксперименте, включают клеточный штамм высоко экспрессирующего HER2 рака молочной железы SK-BR-3 (Фиг. 12) и клеточный штамм высоко экспрессирующего HER2 рака молочной железы рака яичника SK-OV-3 (Фиг. 13). В экспериментах на животных с трансплантационной моделью опухоли у голых мышей конъюгат согласно настоящему изобретению имеет значительный противопухолевый эффект для несущей опухоль BT474 человеческого рака молочной железы голой мыши (Фиг. 14), и предпочтительный конъюгат демонстрирует значительную противопухолевую активность для несущей Герцептин®- и Лапатиниб-резистентную опухоль голой мыши, с эффектом, значительно лучшим, чем у позитивных контрольных лекарственных средств (Фиг. 15); при этом конъюгат антитела согласно настоящему изобретению неожиданно демонстрирует противопухолевый эффект для несущей трансплантационную опухоль рака яичника и рака желудка голой мыши (Фиг. 16 и фиг. 17). Посредством эксперимента in vivo на мыши, определено, что максимальные переносимые дозы конъюгата согласно настоящему изобретению являются следующими: RC48-mc-MMAF: >150 мг/кг, RC48-vc-MMAF: 60 мг/кг, RC48-vc-MMAE: 100 мг/кг, соответственно. Дополнительно, осуществляли тестирование эффективности посредством использования модели трансплантационной опухоли человеческого рака яичника голых мышей, и было обнаружено, что во время введения лекарственного средства, посредством наблюдения изменения объемов модели опухоли мышей и массы тела мышей per se, действенность конъюгата значительно выше, чем действенность голого антитела и T-DM1. Более того, массы тела мышей были увеличены (Фиг. 18), что демонстрирует хорошую действенность с низкой токсичностью и высокую эффективность. Конъюгат предоставляет новый вариант выбора лекарственного средства для лечения HER2-позитивного рака, резистентного к лекарственному HER2 антителу рака, резистентного к ингибитору тирозинкиназы рака и других релевантных заболеваний.
[36] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются выделенными.
[37] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются моноклональным антителом.
[38] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются гуманизированным антителом.
[39] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты имеют ADCC активность.
[40] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты имеют CDC активность.
[41] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты специфически связываются с HER2, при этом по существу не связываются с EGFR, HER3 и HER4.
[42] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются антителом IgG1κ.
[43] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты пригодны для лечения или профилактики рака, при котором рак сверхэкспрессирует HER2.
Краткое описание чертежей
[44] Фиг. 1 представляет фигуру ДСН-ПААГ-электрофореза очищенного человеческого рекомбинантного белка HER2-ECD, который окрашен с кумасси бриллиантовым голубым. Каждую лунку нагружали с 10 нг.
[45] Фиг. 2 представляет фигуры анализа ДСН-ПААГ-электрофореза cRC48, RC48, в котором каждую лунку нагружали с 2 нг антитела.
[46] Фиг. 3 демонстрирует связывающую аффинность между гуманизированным антителом RC48 и HER2-ECD, определенную посредством анализа ELISA, и рассчитанную константу связывающей аффинности Kd. Герцептин и cRC48 использовали в качестве контроля в этом анализе.
[47] Фиг. 4A представляет анализ связывающей способности гуманизированного анти-HER2 антитела RC48 с HER2+ клетками (SK-BR3, BT474) и HER2- клетками (MDA-MB468) посредством проточной цитометрии. Фиг. 4B демонстрирует анализ связывающей способности анти-HER2 антитела с клеточным поверхностным антигеном BT474 посредством проточной цитометрии при различных концентрациях антитела. Анти-HER2 антитело включает Герцептин, cRC48, RC48. В общей сложности анализировали 5×104 клеток.
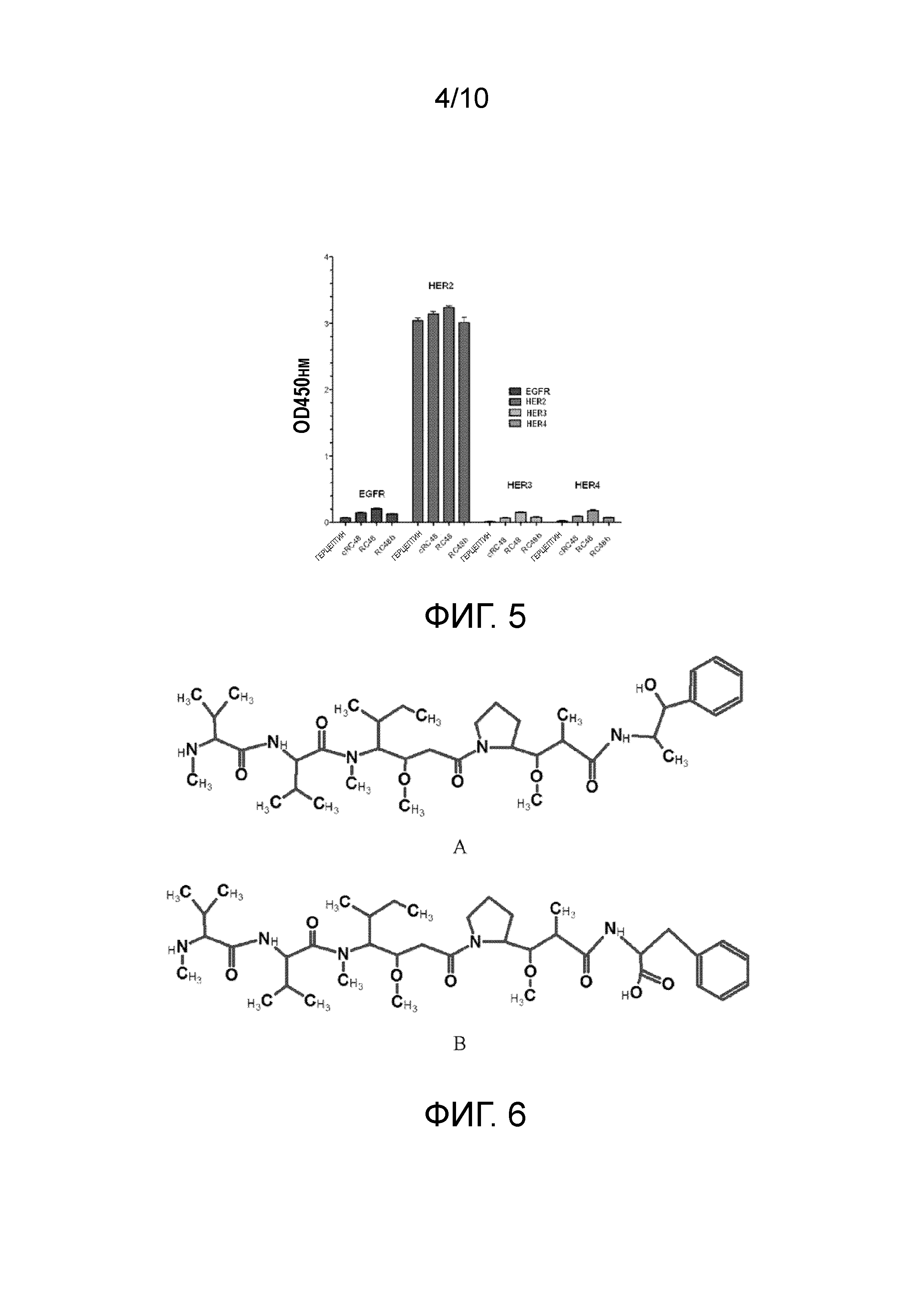
[48] Фиг. 5 показывает, что RC48 демонстрирует только специфическую связывающую аффинность с HER2, но не с EGFR, HER3 и HER4.
[49] Фиг. 6 демонстрирует молекулярные структуры антитубулина, MMAE и MMAF.
[50] Фиг. 7 демонстрирует молекулярные структуры химических линкеров, mc-vc-pAB и mc.
[51] Фиг. 8 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-vc-MMAE).
[52] Фиг. 9 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-vc-MMAF).
[53] Фиг. 10 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-mc-MMAF).
[54] Фиг. 11 демонстрирует противопухолевый эффект RC48, направленного на трансплантационную модель опухоли человеческого рака молочной железы BT474.
[55] Фиг. 12 демонстрирует рост ингибирующего эффекта конъюгата RC48, направленного на HER2-позитивную клетку SK-BR-3.
[56] Фиг. 13 демонстрирует рост ингибирующего эффекта конъюгата RC48, направленного на HER2-позитивную клетку SK-OV-3.
[57] Фиг. 14 демонстрирует противопухолевый эффект конъюгата RC48, направленного на несущую опухоль человеческого рака молочной железы BT474 модель голой мыши.
[58] Фиг. 15 демонстрирует лечебные эффекты RC48-vc-MMAE, T-DM1, направленных на Герцептин- и Лапатиниб-резистентные трансплантационные опухоли человеческого рака молочной железы BT-474/L1.9 у голой мыши.
[59] Фиг. 16 демонстрирует противопухолевый эффект конъюгата RC48, направленного на трансплантационную модель опухоли человеческого рака яичника SK-OV-3.
[60] Фиг. 17 демонстрирует лечебные эффекты RC48-vc-MMAE, Герцептина, Лапатиниба, направленных на трансплантационные опухоли человеческого рака желудка NCI-N87 у голой мыши.
[61] Фиг. 18 демонстрирует эффект различных конъюгатов антитело-лекарственное средство на массы тела мышей.
Описание конкретных вариантов осуществления
Определения
[62] Если не указано иное, все из технических терминов, используемых в настоящем описании, имеют такие же значения, как понимает специалист в данной области. В отношении определений и терминов в данной области, специалист может консультироваться в Current Protocols in Molecular Biology (Ausubel) для больших подробностей. Аббревиатура аминокислотного остатка является стандартным трехбуквенным и/или однобуквенным кодом, используемым в данной области, который представляет одну из 20 обычных L-аминокислот.
[63] Хотя в настоящем изобретении используется числовой диапазон и приближенное значение параметра в широком смысле, количество, как показано в конкретном примере, приведено настолько точно, насколько возможно. Однако, любое число само по себе до некоторой степени неминуемо включает ошибку, что вызвано стандартным отклонением, полученным из каждого из их измерений. Более того, все из диапазонов, как раскрыто в настоящем изобретении, необходимо понимать как охватывающие любые и все из субдиапазонов, содержащихся в них. Например, диапазон “от 1 до 10”, как приведено, необходимо рассматривать, как содержащий любые и все из субдиапазонов между минимальным значением 1 и максимальным значением 10 (включая конечные точки); то есть, все из субдиапазонов, начиная с минимального значения 1 или с другой большей точки (такой как от 1 до 6,1), и субдиапазоны, заканчивая максимальным значением 10 или другой меньшей точкой (такой как от 5,5 до 10). Более того, любые из ссылок, обозначенных как “включенные в настоящее описание”, необходимо понимать являющиеся полностью включенными.
[64] Более того, необходимо отметить, что, как это использовано в настоящем описании, форма единственного числа включает форму множественного числа указанного объекта, если она не ограничена однозначно и определено одним указанным объектом. Термин “или” может быть использован взаимозаменяемо с “или/и”, если только он не указан однозначно в контексте.
[65] Термин “фармацевтическая композиция”, “комбинационное лекарственное средство” и “ комбинация лекарственного средства”, как использовано в настоящем описании, могут быть использованы взаимозаменяемо, что означает комбинацию для достижения некоторой конкретной цели посредством комбинирования вместе по меньшей мере одного вида лекарственных средств и по желанию фармацевтически приемлемого носителя или адъюванта. В некоторых вариантах осуществления фармацевтическая композиция включает комбинацию, отделенную на временном и/или на пространственном уровне, при условии, что это может достичь цель данного изобретения посредством функционирования вместе. Например, ингредиенты, содержащиеся в фармацевтической композиции (такой как антитело, молекула нуклеиновой кислоты, комбинация и/или конъюгатные молекулы нуклеиновой кислоты), могут быть введены объекту полностью или отдельно. Когда ингредиенты, содержащиеся в фармацевтической композиции, вводят объекту отдельно, ингредиенты могут быть введены одновременно или последовательно. Предпочтительно фармацевтически приемлемый носитель является водой, буферизированным водным раствором, изотоническим солевым раствором, таким как PBS (фосфатный буферный раствор), глюкозой, маннитом, декстрозой, лактозой, крахмалом, стеаратом магния, целлюлозой, карбонатом магния, 0,3% глицерина, гиалуроновой кислотой, этанолом или полиалкиленгликолем, таким как поли(полипропилен гликоль), триглицерид, и тому подобным. Типы используемых фармацевтически приемлемых носителей в частности зависят от того, если композиция в соответствии с настоящим изобретением сформулирована для орального, назального, внутрикожного, подкожного, внутримышечного или внутривенного введения. Композиция в соответствии с настоящим изобретением может содержать увлажнитель, эмульгатор или буферные вещества в качестве добавки.
[66] Композиция, вакцина или фармацевтический состав в соответствии с настоящим изобретением могут быть введены любыми пригодными путями, такими как оральное, назальное, внутрикожное, подкожное, внутримышечное или внутривенное введение.
[67] Термин “терапевтический агент” в используемом в настоящем описании значении означает любое вещество или элемент, которые играют роль в лечении (например, лечение, предотвращение, облегчение или ингибирование любых заболеваний и/или состояний), включая, но без ограничения ими: химический терапевтический агент, радиоактивный терапевтический агент, иммунный терапевтический агент, термический терапевтический агент и тому подобное.
[68] “Область CDR ” или “CDR”, как это применено в настоящем описании, означает гипервариабельную область тяжелой цепи и легкой цепи иммуноглобулина, как определено Kabat et al., (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991 и последующие версии, NIH, 1991 и последующие версии). Существует три CDRs тяжелой цепи и три CDRs легкой цепи. В зависимости от обстоятельств термин “CDR” или “CDRs”, как это применено в настоящем описании, подразумевает ссылку на одну из или несколько или даже все из этих областей, которые содержат большинство аминокислотных остатков, которые ответственны за связывания посредством аффинности антитела, направленной на антиген или его эпитоп распознавания.
[69] Под терминами “однотипность”, “идентичность ” или “сходство” между двумя нуклеиновыми кислотами или аминокислотными последовательностями в настоящем изобретении подразумевается процентное содержание идентичных нуклеотидов или аминокислотных остатков между двумя последовательностями, которые должны быть подвергнуты сравнению, полученное после наилучшего выравнивания (оптимального выравнивания). Это процентное содержание является исключительно статистическим, и различия между двумя последовательностями являются случайно распределенными и охватывают их всю длину. Сравнение последовательностей между двумя нуклеиновыми кислотами или аминокислотными последовательностями обычно выполняют сравнением этих последовательности после их оптимального сопоставления. Указанное сравнение может быть выполнено посредством сегмента или “окна сравнения”. В добавление к выполнению ручным способом оптимальное выравнивание для последовательного сравнения может быть выполнено посредством алгоритма локальной гомологии Smith and Waterman (1981) (Ad. App. Math. 2:482), посредством алгоритма локальной гомологии Neddleman and Wunsch (1970) (J. Mol. Biol. 48:443), посредством способа поиска сходства Pearson and Lipman (1988) (Proc. Natl. Acad. Sci. USA 85:2444) и посредством компьютерных программных обеспечений с использованием этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, или посредством использования программного обеспечения для сравнения BLAST N или BLAST P).
[70] “Терапевтически эффективное количество” или “эффективное количество”, как это применено в настоящем описании, относится к дозе, достаточной для демонстрации преимуществ, направленных на объект подвергающийся введению. Фактическая доза, а также скорость и период времени введения будут варьироваться в зависимости от самочувствия и уровня тяжести объекта, подвергающегося лечению. Предписание лечения (такое как определение дозы и т.д.), в конечном счете, является ответственностью общепрактикующего врача и других врачей, и определение осуществляется на основании вышеприведенных факторов. Обычно определение осуществляется, принимая во внимание заболевание, подвергающееся лечению, индивидуальное состояние пациента, место доставки, способ введения и любые другие факторы, известные врачам.
[71] Термин “объект”, как это применено в настоящем описании, означает млекопитающих, таких как человеческое существо, и также может являться другими животными, такими как дикие животные (такие как цапля, аист, журавль и т.д.), домашний скот (такой как утка, гусь и т.д.) или лабораторные животные (такие как шимпанзе, обезьяна, крыса, мышь, кролик, морская свинка, сурок, земляная белка и т.д.).
[72] Термин “антитело” означает интактное антитело и его любые антиген-связывающие фрагменты (“антиген-связывающий участок”) или одиночную цепь. “Полноразмерное антитело” означает белок, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, взаимносоединенные дисульфидными связями. Каждая тяжелая цепь содержит одну вариабильную область тяжелой цепи (сокращенно обозначаемую VH) и одну константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит одну вариабильную область легкой цепи (сокращенно обозначаемую VL) и одну константную область легкой цепи. Константная область легкой цепи содержит один домен, CL. Области VH и VL могут быть дополнительно подразделены на различные области с гипервариабельностью, обозначаемые определяющая комплементарность область (CDR), распределенные между различными областями, которые являются более консервативными, обозначаемые каркасная область (FR). Каждая VH и VL, составленная из трех CDR и четырех FR, расположенных с амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Эти вариабильные области тяжелых цепей и легких цепей содержат связывающий домен для взаимодействия с антигеном. Константная область антител может опосредовать связывание иммуноглобулина с питающими тканями или факторами, включая различные клетки иммунной системы (такие как эффекторные клетки) и первый компонент классической ситемы коплемента (C1q). Химерное или гуманизированное антитело также охватывается посредством термина антитело в соответствии с настоящим изобретением.
[73] Термин “гуманизированное антитело” относится к антителу, содержащему область CDR из антитела нечеловеческого происхождения, и другие участки этой молекулы антитела происходят из одного (или нескольких) типа(ов) человеческого антитела. Более того с целью сохранения связывающей аффинности, некоторые остатки в сегменте каркасной области (FR) могут быть модифицированы (Jones et al., Nature 321:522-525, 1986; Verhoeyen et al., Science, 239:1534-1536, 1988; Riechmann et al., Nature 332:323-327, 1988). Гуманизированное антитело или его фрагменты в соответствии с настоящим изобретением могут быть приготовлены посредством технологий, известных специалисту в данной области (таких как описанные в следующих документах: Singer et al., J. Immun. 150:2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10:1-142, 1992; or Bebbington et al., Bio/Technology, 10:169-175, 1992).
[74] Термин “химерное антитело” относится к антителу, в котором последовательность вариабильной области происходит из одних видов, при этом последовательность константной области происходит из других видов; например, последовательность вариабильной области происходит из мышиного антитела, при этом последовательность константной области происходит из человеческого антитела. Химерное антитело или его фрагменты в соответствии с настоящим изобретением могут быть приготовлены посредством использования технологии рекомбинантных генов. Например, химерное антитело может быть продуцировано клонированием рекомбинантной ДНК, которая содержит промотор и последовательность, кодирующую вариабильную область нечеловеческого (в частности мышиного) моноклонального антитела в соответствии с настоящим изобретением, и последовательность, кодирующую константную область человеческого антитела. Химерное антитело согласно настоящему изобретению, кодируемое этим рекомбинантным геном, будет являться, например, мышино-человеческой химерой, которая имеет специфичность, определяемую вариабильной областью, полученной из мышиной ДНК, и ее изотип определяется константной областью, полученной из человеческой ДНК. Для способа получения химерного антитела, могут быть осуществлены ссылки, например, на Verhoeyn et al. (BioEssays, 8:74, 1988).
[75] Термин “моноклональное антитело” означает молекулярный препарат антитела с одиночным молекулярным строением. Композиция моноклонального антитела демонстрирует одиночную связывающую специфичность и аффинность, направленную на конкретный эпитоп.
[76] Термин “антитело mRC48”, как он используется в настоящем описании, означает, если не указано обратное, полученное из мышей моноклональное анти-HER2 антитело mRC48, полученное изобретателем. Термин “RC48 антитело”, как он используется в настоящем описании, означает, если не указано обратное, гуманизированное анти-HER2 антитело RC48, которое получено из антитела mRC48 гуманизированным конструированием.
[77] Антитело cRC48, как этот термин используется в настоящем описании, означает химерное антитело RC48, т.е., человеческо-мышиное химерное антитело, которое содержит полученную из мышей вариабильную область и полученную из человека константную область. Различие между антителом cRC48 и антителом RC48 заключается только в различии каркасной области в вариабильной области, то есть, каркасная область cRC48 является полученной из мыши, тогда как каркасная область RC48 является полученной из человека.
[78] Термин “функциональный фрагмент”, как он используется в настоящем описании, в частности означает фрагмент антитела, такой как Fv, scFv (sc указывает на одиночную цепь), Fab, F(ab')2, Fab', scFv-Fc фрагменты или диатело, или любые фрагменты, которые могут увеличивать время полужизни посредством химической модификации или посредством включения в липосому. Указанная химическая модификация включает, например, добавление поли(алкилен) гликоля, такого как полиэтиленгликоль (“пегилированный”) (называемые Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или Fab'-PEG пегилированные фрагменты, “PEG” обозначает полиэтиленгликоль), и указанные фрагменты имеют EGFR-связывающую активность. Предпочтительно функциональный фрагмент составлен из или содержит частичные последовательности из тяжелых или легких вариабильных цепей антитела, полученного из него, частичной последовательности достаточно для сохранения такой же связывающей специфичности и достаточной аффинности как у антитела, полученного из них (для EGFR, предпочтительно по меньшей мере эквивалентно 1/100 аффинности антитела, полученного из него, более предпочтительно по меньшей мере эквивалентно 1/10). Этот функциональный фрагмент будет содержать по меньшей мере 5 аминокислот, предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот последовательности антитела, полученной из него.
[79] Как правило, в целях получения моноклонального антитела или его функциональных фрагментов, в частности полученного из мышей моноклонального антитела или его функциональных фрагментов, могут быть осуществлены ссылки на технологии, подробно описанные в руководстве “Antibodies” (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spri нг Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988), или технологии для получения из гибридомных клеток, как описано Kohler and Milstein (Nature, 256:495-497, 1975).
[80] Моноклональное антитело в соответствии с настоящим изобретением может являться, например, очищенным на аффинной колонке, на которой уже предварительно был зафиксирован с антиген HER2 (напр., HER2-ECD) или один из фрагментов, содержащих эпитоп, который может быть специфически распознан моноклональным антителом в соответствии с изобретением. Более конкретно, моноклональное антитело может быть очищено следующим образом: хроматографией с белком A и/или G, с последующей или без последующей ионообменной хроматографии, которая нацелена на элиминирование остаточных белковых загрязняющих примесей, а также ДНК и ЛПС, с последующей или без последующей эксклюзионной хроматографии на сефарозном геле, которая нацелена на элиминирование потенциальных агрегатов, вызванных димерами или другими полимерами. В более предпочтительном пути все из этих технологий могут быть использованы одновременно или непрерывно.
[81] Термин “доластатин”, как он используется в настоящем описании, означает полипептид, выделенный из типа морского организма Dollabella auricularia, который включает, но без ограничения ими, доластатин 10 и доластатин 15. Доластатин является ингибитором митоза, который демонстрирует сильную противораковый активность, и таким образом рассматривается в качестве возможного противоракового лекарственного средства. Исследователи дополнительно открывают и синтезируют многие производные доластатина, такие как MMAE и MMAF.
[82] Термин “линкер”, как он используется в настоящем описании, означает часть, которая связывает антитело с лекарственным средством в конъюгате антитело-лекарственное средство (т.е. ADC), который может быть расщепляемым или нерасщепляемым. Расщепляемый линкер (т.е., разрушаемый линкер или биодеградируемый линкер) может быть разрушен или на клетках-мишенях, и посредством чего высвобождая лекарственное средство. В некоторых вариантах осуществления линкер согласно настоящему изобретению имеет очень хорошую стабильность и значительно снижает высвобождение лекарственного средства во время процесса доставки в мишень (напр., в крови), посредством чего снижая побочный эффект и токсичность. В некоторых конкретных вариантах осуществления линкер согласно настоящему изобретению выбран из расщепляемого линкера, такого как линкер на основании дисульфида (который селективно разрушается в опухолевых клетках при более высокой концентрации тиола), пептидного линкера (который расщепляется ферментом в опухолевых клетках) и гидразонового линкера. В дополнительных конкретных вариантах осуществления линкер согласно настоящему изобретению выбран из нерасщепляемого линкера, такого как тиоэфирный линкер. Предпочтительно линкер согласно настоящему изобретению выбран из расщепляемого линкера mc-vc-pAB и нерасщепляемого линкера mc.
[83] Следующие примеры представлены для демонстрации и дополнительного объяснения некоторых предпочтительных вариантов осуществления и аспектов настоящего изобретения, и не должны истолковываться как ограничивающие объем изобретения.
Пример 1 Получение и анализ последовательности полученного из мышей моноклонального антитела mRC48
[84] 1) Экспрессирование и очистка антигена HER2
[85] Сперва в настоящем исследовании готовили рекомбинантный человеческий HER2 белок HER2-ECD, состоящий из его внеклеточного домена (ECD), и использовали в качестве антигена для следующей иммунизации и генерирования моноклонального антитела, а также для различных биологических испытаний.
[86] Фрагмент кДНК, кодирующий HER2-ECD (аминокислоты с Thr23 по Thr652, номер доступа в GenBank M11730), клонировали в экспрессионный вектор pcDNA3 (Invitrogen Inc.) посредством ПЦР.
[87] Детальный способ содержал: получение кодирующей области кДНК HER2-ECD из HER2+ клеточного штамма SKBR3 (ATCC NO. HTB-30) посредством способа ОТ-ПЦР (применяли набор обратной транкрипционной системы ImProm-IITM от Promega Inc.). Праймеры были следующими:
P1: 5'CGGGATCCTGCCACCAGCTGTGCGCC (SEQ ID NO: 7),
P2: 5'GCTCTAGA TCAGTTGATGGGGCAAGGCT (SEQ ID NO: 8);
подчеркнутые последовательности вводили сайты ферментов BamHI, XbaI соответственно. Амплификацию ПЦР проводили с матрицей кДНК обратно транскрибированного HER2-ECD посредством использования вышеупомянутых праймеров, с условиями амплификации, содержащими 30 циклов денатурирования при 94°C в течение 30 с, отжиг при 60°C в течение 30 с, удлинение при 72°C в течение 1 мин, в заключение удлинение при 72°C в течение 10 мин. Затем, ПЦР фрагменты выделяли, расщепляли с ферментами BamHI и XbaI (NEB), и соединяли с вектором pcDNA3. На C-конец HER2-ECD добавляли полигистидиновую метку для очистки удобным образом. Клетки HEK293 (US ATCC) трансфицировали со сконструированным экспрессионным ДНК вектором, и растворимый белок HER2-ECD с His-tag очищали из клеточной культуральной среды посредством Ni-NTA аффинной хроматографии (Qiagen). ДСН-ПААГ-электрофорез и окрашивание кумасси бриллиантовым голубым указывало на то, что очищенные белки HER2-ECD имели гомогенность больше, чем 95%, и результат показан на фиг. 1. Растворимый HER2-ECD был в форме мономера с относительной молекулярной массой ~75 кДа, что было немного больше, чем рассчитанная молекулярная масса (71 кДа), что предполагает, что белок был гликозилирован в клетках HEK293. Полученный в результате очищенный белок HER2-ECD дополнительно концентрировали, и переносили в стерильный буфер PBS (pH7,4), для последующего анализа in vivo и in vitro.
[88] 2) Получение и скринирование гибридомных клеток
[89] HER2-ECD, как описано выше, использовали в качестве антигена для иммунизации мыши и генерирования моноклонального антитела. Иммунизацию, слияние гибридомных клеток и первичное скринирование проводили в соответствии со стандартными процедурами (ссылки: WHO Technical Report Series, No. 822, 1992 Annex 3). Четырех мышей Balb/c (приобретенных у Slac Laboratory Animal Co. Ltd.) иммунизировали с равным объемом хорошо перемешанных 0,25 мл белка HER2-ECD (50-100 нг) и 0,25 мл полного адъюванта Фрейнда (Difco Lab). Через две недели осуществляли вторую инъекцию с неполным адъювантом Фрейнда (Difco Lab), в которой количество антигена составляло 25-50 нг/0,5 мл/мышь. Через три недели осуществляли третью инъекцию, где количество было таким же, как во второй инъекции. Через десять дней после третьей инъекции отбирали кровь. Сыворотку мышей детектировали фермент-связанным иммуносорбентным анализом (ELISA), и отбирали селезенки двух мышей с самым высоким титром анти-HER2 антитела в сыворотке, которые затем сливали с клеткой миеломы P3X63Ag8 (ATCC CRL-1580). Слитые клетки разбавляли на десяти 96-луночных планшетах, и осуществляли предварительное скринирование посредством способа ELISA в зависимости от связывающей способности с HER2-ECD. В классическом анализе ELISA 96-луночный планшет Nunc Maxisord покрывали с HER2-ECD (0,2-1 нг/ мл) и затем инкубировали с градиентно разбавленной мышиной сывороткой или супернатантом гибридомы (100 мкл). Полученное из мышей анти-HER2 антитело детектировали посредством козьего F(ab')2 анти-мышиного IgG Fc специфичного вторичного антитела, объединенного с пероксидазой хрена (Invitrogen Inc.).
[90] Супернатанты 400 клеток штаммов гибридомы скринировали посредством способа ELISA, 36 из которых демонстрировали сильную HER2-ECD связывающую способность. Выбирали десять штаммов гибридомных клеток с наибольшей HER2 связывающей способностью и скринировали субклон штаммов клетки гибридомы посредством способа ограниченного разбавления. Связывающую аффинность субклона штаммов клетки гибридомы с HER2 определяли посредством суспензионной культуры субклона штаммов клетки гибридомы, очистки белка и ELISA, и связывающую способность субклона штаммов клетки гибридомы с HER2, естественно экспрессированного на поверхности клеточных штаммов человеческого рака молочной железы, дополнительно проверяли посредством проточного цитометра (BD FACS Calibur) (см. Пример 4 для более подробного описания). В заключение, штамм клетки гибридомы mRC48 (полученный из мышей IgG1k) определяли посредством анализа последовательности, который обладал сильной HER2 связывающей способностью, и затем его дополнительно анализировали посредством ELISA и клеточных экспериментов. Клетку гибридомы mRC48 депонировали в China General Microbiological Culture Collection Center 22 августа, 2013, с номером доступа 8102 (дата переноса в Будапештский договор Октября 29, 2013).
[91] 3) Анализ последовательности клона mRC48 клеточной гибридомы анти-HER2
[92] Вариабильные области тяжелых и легких цепей клона mRC48 клетки гибридомы секвенировали посредством 5-концевой быстрой амплификации с использованием коммерчески доступного набора SMARTTM RACE cDNA Amplification Kit (Clontech Inc.) в соответствии с инструкцией.
[93] Экстрагировали тотальную РНК из гибридомных клеток посредством набора RNApure Tissue (Beijing Kangweishiji Biological Technology Co. Ltd.) и осуществляли обратную транкрипцию тотальной РНК посредством SMART™ RACE cDNA Amplification Kit с использованием тотальной РНК в качестве матрицы, используя праймеры в наборе, добавляя обратную транкриптазу SMARTScribeTM Reverse Transcriptase и получая RACE-Ready первую цепь кДНК посредством обратной транкрипции в соответствии с этапами, как представлено в наборе, и затем проводили два цикла ПЦР, в которых: первый цикл ПЦР осуществляли посредством использования полученной кДНК в качестве матрицы, UPM, предоставленного в наборе в качестве 5'-концевого праймера, и mRC48-VL-1/mRC48-VH-1 в качестве 3'-концевого праймера. Реакционные условия ПЦР включали в себя предварительное денатурирование при 94°C в течение 5 мин, 25 циклов амплификации (денатурирование при 94°C в течение 30 с, отжиг при 68°C в течение 30 с, удлинение при 72°C в течение 2 мин), в заключение удлинение при 72°C в течение 10 мин.
[94] Второй цикл ПЦР осуществляли посредством использования продукта первого цикла ПЦР в качестве матрицы, NUP, предоставленного в наборе в качестве 5'-концевого праймера, и mRC48-VL-2/mRC48-VH-2 в качестве 3'-концевого праймера. Реакционные условия ПЦР содержали: предварительное денатурирование при 94°C в течение 5 мин, 25 циклов амплификации (денатурирование при 94°C в течение 30 с, отжиг при 68°C в течение 30 с, удлинение при 72°C в течение 2 мин), в заключение удлинение при 72°C в течение 10 мин. Таким образом, получали вариабильные области тяжелых и легких цепей вышеприведенного клона mRC48 клетки гибридомы.
[95] Продукты ПЦР очищали электрофорезом в агарозном геле и субклонировали в pCR2.1TOPO для клонирования (Invitrogen Inc.). Посредством ПЦР получали ДНК из 10 независимо клонированных плазмид, и дополнительно секвенировали посредством использования прямого и обратного праймера M13. Анализ последовательности ДНК показал то, что, все из этих 10 клонов имели кДНК, кодирующую одинаковый полипептид VH или VL. Аминокислотная последовательность определяющей комплементарность области (CDR) была такой, как определено посредством кода Кэбота, и она приведена в таблице 3. Анализ сравнения последовательностей показал то, что CDR анти-HER2 mRC48 является значительно отличным от CDR известных HER2 антител, включая Герцептин (Трастузумаб).
Пример 2 Гуманизация моноклонального анти-HER2 антитела mRC48
[96] Мы гуманизировали мышиное моноклональное анти-HER2 антитело mRC48 посредством трансплантации его CDRs легкой цепи или тяжелой цепи в каркасную область человеческого IgG1κ.
[97] В соответствии с опубликованными способами нам известно, что человеческий IgG1κ является высоко гомологичным мышиному RC48 антителу (mRC48). Таким образом, мы сконструировали вариабильную область легкой цепи гуманизированного антитела RC48 (RC48-VL) и вариабильную область тяжелой цепи гуманизированного антитела RC48 (RC48-VH) комбинированием их с гуманизированным анти-HER2 антителом: RC48. Общая последовательность RC48-VH имела сходство 84% с человеческим геном VH IgG1. Антитело RC48 содержало вариабильную область легкой цепи RC48-VL и вариабильную область тяжелой цепи RC48-VH.
[98] Гуманизированное анти-HER2 моноклональное антитело RC48 получали способом трансплантации CDR, в котором вариабильную область тяжелой или легкой цепи синтезировали непосредственно посредством GenScript (Nanjing) Co. Ltd., и синтезированная вариабильная область содержала консенсусную последовательность Козака, инициирующий кодон, сигнальный пептид тяжелой или легкой цепи, полученную из человека каркасную область и полученную из мышей CDR, которая была соединена с константной областью человеческого IgG1κ для образования целого фрагмента посредством способа ПЦР с перекрывающимися праймерами.
[99] Праймеры ПЦР с перекрывающимися праймерами содержали:
тяжелая цепь:
VH1:5'CGCGGATCC GCCGCCACCATGGGATGGAGCT3' (SEQ ID NO: 13)
VH2:5'GATGGGCCCTTGGTGCTAGCGGAGCTCACTGTCACCAGTGTT3' (SEQ ID NO: 14)
CH1: 5'GCTAGCACCAAGGGCCCATC 3' (SEQ ID NO: 15)
CH2: 5'CCGGAATTCTTTACCGGGAGACAGGGAGA 3' (SEQ ID NO: 16)
легкая цепь:
VL1:5'CGCGGATCC GCCGCCACCATGGACATGAGGGT 3' (SEQ ID NO: 17)
VL2:5'GATGGTGCAGCCACAGTACGCTTTATCTCAACTTTTG TAC3' (SEQ ID NO: 18)
CL1: 5'CGTACTGTGGCTGCACC ПРИ 3' (SEQ ID NO: 19)
CL2:5'CCGGAATTCACACTCTCCCCTGTTGAAGC3' (SEQ ID NO: 20).
[100] Амплификацию тяжелой цепи осуществляли следующим образом: сперва использовали синтезированную вариабильную область в качестве матрицы и VH1 и VH2 в качестве праймеров для амплифицирования вариабильной области тяжелой цепи; использовали константную область тяжелой цепи человеческого IgG1κ в качестве матрицы и CH1 и CH2 в качестве праймеров для амплифицирования константной области тяжелой цепи. Условия амплификации включали в себя 30 циклов денатурирования при 94°C в течение 30 с, отжига при 60°C в течение 30 с, удлинения при 72°C в течение 1 мин, в заключение удлинение при 72°C в течение 10 мин. Затем, последовательность тяжелой цепи RC48 амплифицировали посредством использования двух продуктов ПЦР в качестве матрицы и VH1 и CH2 в качестве праймеров. Условия амплификации включали в себя 30 циклов денатурирования при 94°C в течение 30 с, отжига при 60°C в течение 30 с, удлинения при 72°C в течение 2 мин, в заключение удлинение при 72°C в течение 10 мин.
[101] Амплификацию легкой цепи осуществляли следующим образом: сперва использовали синтезированную вариабильную область в качестве матрицы и VL1 и VL2 в качестве праймеров для амплифицирования вариабильной области легкой цепи; использовали константную область легкой цепи человеческого IgG1κ в качестве матрицы и CL1 и CL2 в качестве праймеров для амплифицирования константной области легкой цепи. Условия амплификации включали в себя 30 циклов денатурирования при 94°C в течение 30 с, отжига при 60°C в течение 30 с, удлинения при 72°C в течение 1 мин, в заключение удлинение при 72°C в течение 10 мин. Затем, последовательность легкой цепи амплифицировали посредством использования двух продуктов ПЦР в качестве матрицы и VL1 и CL2 в качестве праймеров. Условия амплификации включали в себя 30 циклов денатурирования при 94°C в течение 30 с, отжига при 60°C в течение 30 с, удлинения при 72°C в течение 2 мин, в заключение удлинение при 72°C в течение 10 мин.
[102] Следовательно, мы получали гуманизированное анти-HER2 моноклональное антитело RC48, где RC48 содержало константную область тяжелой цепи человеческого IgG1κ и вариабильную область тяжелой цепи RC48-VH, и константную область легкой цепи человеческого IgG1κ и вариабильную область легкой цепи RC48-VL.
[103] Человеческо-мышиное химерное антитело cRC48 также получали такими же способами, в которых мышиная вариабильная область была соединена с константной областью человеческого IgG1κ с образованием полного фрагмента посредством ПЦР с перекрывающимися праймерами.
[104] Каждый из амплифицированных фрагментов субклонировали в экспрессионный вектор pcDNA3.0 соответственно. Различные сконструированные плазмиды трансфицировали в суспендированные клетки CHO (Invitrogen), для рейтинга генов различных рекомбинантных антител, очистку осуществляли посредством белка A и выполняли последующие характеристические анализы. Химерное анти-HER2 RC48 (называемое cRC48) было составлено из тяжелой цепи и легкой цепи мышино-человеческого химерного cRC48. RC48 содержит гуманизированную тяжелую цепь RC48-VH и гуманизированную легкую цепь RC48-VL. Оба из cRC48 и RC48 имели возможность быть экпрессированными, и собирали антитела из супернатанта клетка CHO, очищали посредством белка A, и анализировали посредством анализа с ДСН-ПААГ-электрофорезом при восстановительных и невосстановительных условиях (см. фиг. 2). Вышеупомянутые клетки CHO, секретирующие антитело RC48 (то есть, клетки CHO, трансфицированные с константной областью тяжелой цепи человеческого IgG1κ и вариабильной областью тяжелой цепи RC48-VH, и константной областью легкой цепи человеческого IgG1κ и вариабильной областью легкой цепи RC48-VL) депонировали в China General Microbiological Culture Collection Center 6 ноября, 2013 под номером доступа C2013170.
Пример 3 Характеризационный анализ анти-HER2 RC48 антитела
[105] Константы HER2-связывающей аффинности (Kd) химерного cRC48 и гуманизированного антитела RC48 (RC48) определяли посредством способа ELISA, и детальный способ можно найти в примере 1, т.е., 96-луночный планшет покрывали растворимым белком HER2-ECD, затем инкубировали с разбавленными антителами (Герцептин и химерное cRC48 в качестве контролей), и детектировали HER2-ECD релевантные антитела (все из форм человеческого IgG1κ) посредством HRP-связанного козьего F(ab')2 анти-человеческого IgG Fc специфичного вторичного антитела (invitrogen). Строили кривую связывания и дополнительно рассчитывали значение константы (Kd) поверхностной связывающей аффинности для каждого анти-HER2 антитела посредством нелинейного уравнения специфического связывания одиночного сайта (Journal of Immunological Methods, 270:155-162, 2002) (на Фиг. 3 показана типичная кривая связывания HER2, полученная из 3 независимых анализов ELISA). Результаты анализов ELISA продемонстрированы на фиг. 3.
[106] Как известно по 3 независимым анализам, в сравнении с cRC48 (средняя константа аффинности 77 пМ) и Герцептином (средняя константа аффинности 97 пМ), гуманизированное анти-HER2 антитело RC48 имело более высокую HER2-ECD связывающую аффинность, со средней константой аффинности 44 пМ. Результат показан в таблице 4.
Пример 4 Связывающая способность гуманизированного антитела RC48 с HER2
[107] 1) Эксперименты связывающей аффинности антитела RC48 с HER2
[108] Связывающую способность гуманизированного анти-HER2 антитела RC48 с HER2, который был эндогенно экспрессирован в клетках человеческого рака молочной железы, детектировали посредством проточного цитометра, и результат показан на фиг. 3. 6 нг человеческого IgG (контрольная группа), Герцептин, cRC48, RC48 совместно инкубировали с двумя видами клеточной линии клетки человеческого рака молочной железы HER2+ SK-BR-3, BT474 и клеткойHER2-MDA-MBA468 (2×107 клеток) на льду в течение 30-45 минут, соответственно. После 2 тщательных промываний с 4 мл холодного PBS детектировали антитела, связывающиеся с клеточной поверхностью R-PE-связанным козьим анти-человеческим IgG Fc специфичным вторичным антителом (15 мкл, 25 нг/ мл), и затем анализировали посредством проточного цитометра (BD FACSCalibur). Не было детектировано связывания между человеческим IgG1 (контрольная группа) и тремя видами раковых клеток. В отличие от этого имело место сильное связывание между Герцептином, cRC48, RC48 и двумя видами HER2 позитивных клеток, при этом не имело место связывание с HER2 негативными клетками, что предполагает, что это связывание было HER2 специфичным (как показано на фиг. 4a). Посредством сравнения средней интенсивности флуоресценции изотипа контрольной группы, было обнаружено, что по сравнению с Герцептином и cRC48 RC48 демонстрировал более высокую связывающую аффинность. Посредством титрования концентрации анти-HER2 антитела и анализирования количества клеток в проточной цитометрии получали основанную на клетках кривую связывания анти-HER2 антитела с HER2 на клеточной поверхности, и результат показан на фиг. 4b. Гуманизированное анти-HER2 антитело RC48 продемонстрировало значительную связывающую аффинность, которая имела связывающую аффинность (Kd) с HER2 на клеточной поверхности BT474 4 нМ, при этом связывающие аффинности к Герцептину и cRC48 составляли 10 нМ и 5 нМ соответственно, и результаты показаны в таблице 5.
[109] 2) Эксперимент антиген связывающей специфичности
[110] Связывающие способности Герцептина, cRC48, RC48 с различными поверхностными антигенами EGFR, HER2, HER3 и HER4 определяли посредством способа ELISA. Способ ELISA можно найти в примере 1. 96-луночный планшет покрывали антигенами EGFR, HER2, HER3, HER4, соответственно, каждую лунку которых нагружали с 20 нг, и инкубировали с различными анти-HER2 антителами, т.е., антителами Герцептин, cRC48, RC48, и затем детектировали посредством связанного с пероксидазой хрена козьего F(ab')2 анти-мышиного IgG Fc специфичного вторичного антитела (Invitrogen Inc.). Результат показан на фиг. 5, при этом он указывает на то, что антитела Герцептин, cRC48, RC48 почти не имели связывающей способности с EGFR, HER3 и HER4, но имели сильную связывающую способность с HER2, что предполагает, что Герцептин, RC48 высокоспецифично связывается с HER2.
Пример 5 Испытание на ингибирование опухоли посредством RC48 по отношению к трансплантационной модели опухоли человеческого рака молочной железы +BT474
[111] Трансплантационную модель опухоли человеческого рака молочной железы BT474 голой мыши формировали инокулированием клеток BT474 голой мыши подкожно. После выращивания непрерывно in vivo в течение 3 поколений, отбирали опухолевую ткань, которая сильно росла, и разрезали на приблизительно 1,5 мм3, и инокулировали подкожно в правостороннюю подмышечную впадину голой мыши (предоставленной Shanghai Slac Laboratory Animal Co. Ltd., с сертификатом No. 2007000540582 и лицензией No. SCXK(hu)2012-0002) при стерильных условиях. Диаметр трансплантационной опухоли голой мыши измеряли штангенциркулем с нониусом. Животных разделяли на группы случайно до того, как опухоль вырастала вплоть до 100~300 мм3. Вводили тестируемые лекарственные средства huIgG1, Герцептин, RC48 (каждое 10 мг/кг), и через одну неделю дозировали во второй раз, и через еще две недели дозировали в третий раз, то есть, лекарственные средства вводили в общем три раза.
[112] Результат показан на фиг. 11. После введения huIgG1, опухоль не была ингибирована, и ее объем все еще непрерывно рос. После введения Герцептина и RC48 обе опухоли BT474 были ингибированы. В сравнении с Герцептином RC48 имел значительно больший ингибирующий опухоль эффект.
Пример 6 Приготовление конъюгата лекарственного антитела
[113] 1) Очистка моноклонального антитела RC48
[114] Моноклональное антитело RC48 фиксировали из культуры клетки CHO посредством белка A, который затем подвергали ДСН-ПААГ-электрофорезу, с чистотой вплоть до 95% или выше посредством анализа SEC. Полученные белки антитела диализировали ультрафильтрацией в буфер PBS посредством использования мембранного пакета 30KD, концентрировали, и концентрацию калибровали ультрафиолетовым спектрометром для последующей реакции объединения.
[115] 2) Связывание моноклонального антитела RC48 с молекулой лекарственного средства
[116] Восстановительный агент и защитный агент были смешаны с буфером PBS следующим образом: 1~20ммоль/L TCEP (трис-2-карбоксиэтилфосфин), 1~20 ммоль/л ДТПА (Диэтилентриаминпентауксусная кислота) стоковый раствор, восстановительный агент, который может быть добавлен в некотором диапазоне концентраций с количеством, зависящим от требуемого соотношения лекарственного антитела, смешивали с моноклональным антителом с некоторой концентрацией (напр., 5~30 мг/мл) с некоторым объемным соотношением (напр., 1:1), в котором молярное соотношение конечной концентрации TCEP к антителу составляло 0,5~6,0: 1, и реакцию выполняли с перемешиванием в течение 2 ч при 25°C. Концентрацию свободного тиола детектировали при 412 нМ способом DTNB, и рассчитывали количества свободного тиола с молярным соотношением антитела. Восстановительная реакция с TCEP имела очень хорошую воспроизводимость, и количества свободного тиола могли достичь 1,0-8,0 после восстановления.
[117] После восстановления с TCEP антитело может быть напрямую подвержено последующему конъюгированию. Лекарственные средства (vc-MMAE, vc-MMAF, mc-MMAF) (приобретенные у Shanghai Haoyuan Chemexpress Co. Ltd.) с некоторыми концентрациями (10 мМ) расстворяли в 25% ДМСО (диметилсулюфоксид), для чего лекарственные средства добавляли медленно с молярным соотношением лекарственного средства к тиолу 0,3~2,8:1, и реакцию выполняли с перемешиванием в течение 2 ч при 25°C. Концентрацию свободного тиола (близкую к нулю) детектировали при 412 нм способом DTNB, остаточные непрореагировавшие лекарственные средства и свободные малые молекулы, такие как ДМСО, удаляли очисткой посредством Sephadex G-25, и условие связывания определяли посредством ДСН-ПААГ-электрофореза, способами обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) и гидрофобной высокоэффективной жидкостной хроматографии (HIC-ВЭЖХ).
Пример 7 Испытание аффинности ADC
[118] Испытание аффинности способом ELISA
[119] Планшет для ELISA покрывали рекомбинантным белком HER2-ECD (с концентрацией 0,5 мг/ мл) в течение ночи при 2-8°C. Планшет промывали 3 раза с промывателем для лунок. Использовали раствор 3% BSA-PBST при 37°C для блокирования в течение 2 ч. Планшет промывали 3 раза с промывателем для лунок. Образцы загружали следующим образом: при 37°C, 11 точек градиентно разбавляли от 1000 нг/ мл (стандартная линия) раствором PBST, 100 мкл/лунка, в течение 2 часов. Планшет промывали 3 раза с промывателем для лунок. Вторичное антитело (козий анти-человеческий IgG-Fc-HRP) разбавляли 5000-кратно раствором PBST. Добавляли придающий окрашивание реагент TMB для придания окрашивания в течение 8-10 минут без света при комнатной температуре. Реакцию останавливали посредством 2M H2SO4, и считывали при 450/655 нМ в инструменте с мечением ферментом. Результат показан в таблице 6.
[120] Как известно по результатам аффинности RC48-vc-MMAE, RC48-vc-MMAF и RC48-mc-MMAF с HER2-ECD являются сопоставимыми с аффинностями T-DM1.
Пример 8 Ингибирующий эффект RC48 ADC на опухолевые клетки
[121] Хорошо выросшие клетки расщепляли с трипсином (приобретен у Sigma), после чего ресуспендировали HER2 позитивную клетку рака молочной железы SK-BR-3, HER2 позитивную клетку рака яичника SK-OV-3 со средой DMEM, содержащей 10% фетальной бычьей сыворотки, средой McCoy's 5A (обе из сред были приобретены у Gibco), и инокулировали в 96-луночный планшет с плотностью 5000, 4000 клеток/лунку, соответственно, и инкубировали в инкубаторе при 37°C, в 5% CO2 в течение 24 ч. RC48, Герцептин, RC48-vc-MMAE, RC48-vc-MMAF, RC48-mc-MMAF и T-DM1 (готовили сами) разбавляли со средой, содержащей 10% фетальной бычьей сыворотки в концентрациях, как показано в последующей фигуре, перед добавлением в 96-луночный планшет. После подвергания инкубированию в инкубаторе при 37°C в 5% CO2 в течение 72 ч, осуществляли детектирование посредством использования набора CCK-8 (приобретенного у DOJINDO), и полученные в результате данные подвергали статистическому анализу с применением программного обеспечения Prism.
[122] Результаты показаны на фиг. 12 и фиг. 13, из них известно, что лекарственное средство ADC согласно настоящему изобретению имело значительно более сильный ингибирующий эффект по отношению к различным клеткам, чем голое лекарственное антитело с такой же концентрацией, и степень ингибирования, направленная на клеточную пролиферацию могла быть увеличена наполовину. Лекарственное средство ADC, объединенное с MMAF в соответствии с настоящим изобретением, имеет более сильный ингибирующий эффект, направленный на клетки SK-BR-3, SK-OV-3, чем лекарственное средство ADC, объединенное с MMAE в соответствии с настоящим изобретением, тем не менее, оба имели значительно лучшие эффекты, чем позитивный контроль T-DM1.
Пример 9 Анти-опухолевая активность конъюгатов лекарственного антитела, направленных на рак молочной железы
[123] 1) противоопухолевый эксперимент конъюгатов, направленных на несущую опухоль модель человеческого рака молочной железы BT474 голой мыши
[124] Пять миллионов клеток BT474 суспендировали в PBS, и инокулировали в подмышечную впадину голой мыши BALB/c (предоставленной Shanghai Slac Laboratory Animal Co. Ltd., с сертификатом No. 2007000540582 и лицензией No. SCXK(hu)2012-0002). После того, как опухоль была сформирована, опухолевую ткань, которая сильно росла отбирали и разрезали на около 1,5 мм3, и инокулировали подкожно в правостороннюю подмышечную впадину голой мыши при стерильных условиях. Диаметр трансплантационной опухоли голой мыши измеряли посредством штангенциркуля с нониусом. Животных разделяли на группы случайно до тех пор, пока опухоль не вырастала вплоть до 100~300 мм3. Тестируемые лекарственные средства RC48 10 мг/кг, RC48-vc-MMAE 10 мг/кг, RC48-vc-MMAF 10 мг/кг и RC48-mc-MMAF 10 мг/кг вводили, и в общем лекарственные средства вводили три раза; негативной контрольной группе вводили равное количество физиологического солевого раствора.
[125] Как показано на фиг. 14, через 37 дней после дозирования объем опухоли негативной контрольной группы достигал 485 мм3, при этом объем опухоли в группе RC48 оставлял 83% от контрольной группы, что указывало на то, что RC48 в некоторой степени имел ингибирующий эффект на рост опухоли BT474. Все из трех конъюгатов антитела, тестируемые в данном эксперименте (RC48-vc-MMAE, RC48-vc-MMAF, RC48-mc-MMAF), могли ингибировать опухолевый рост значительно, и через 37 дней после дозирования, объемы опухоли сокращались до 13-19% от контрольной группы. Во время 37-дневного эксперимента, было 3 мертвых мыши в контрольной группе, при этом все мыши в группе RC48-vc-MMAE выживали.
[126] 2) Противоопухолевый эксперимент RC48-vc-MMAE, направленного на модель Герцептин®- и Лапатиниб-резистентной подкожно трансплантированной голой мыши опухоли человеческого рака молочной железы BT-474/L1.9
[127] BT474/L1.9 является клеткой BT-474, которая была подвержена лечению в течение длительного времени с Герцептином® и Лапатинибом и также резистентна к Герцептину® и Лапатинибу.
[128] Голых мышей SPF-level BALB/c инокулировали подкожно с некоторым количеством опухолевых клеток BT-474/L1.9, и после выращивания опухоли до 100-200 мм3, животных случайно разделяли на группы. Доза была указана посредством условных обозначений: для RC48-vc-MMAE, Kadcyla™ (приобретено у Roche Pharmaceuticals), дозирование раз в неделю, в общем 2 раза; для Герцептина® (приобретен у Roche Pharmaceuticals), дозирование раз в неделю, в общем 3 раза; для Лапатиниба (приобретен у GSK), дозирование ежедневно. Объем опухоли измеряли 2 раза в неделю. Измеряли массу мышей и наблюдали резистентную способность несущих опухоль мышей по отношению к лекарственным средствам. Данные регистрировали. Рассчитывали объем опухоли и степень ингибирования опухоли каждой несущей опухоль мыши в различные моменты наблюдения.
[129] Как показано на фиг. 15, степень ингибирования опухоли Герцептином® (10 мг/кг) по отношению к подкожной трансплантационной опухоли BT474/L1.9 голой мыши составляла 51%; степень ингибирования опухоли Лапатинибом (200 мг/кг) по отношению к BT474/L1.9 составляла 45%; это предполагало, что рак молочной железы BT474/L1.9 был резистентным как к Герцептину®, так и к Лапатинибу. RC48-vc-MMAE (1,5, 5 мг/кг) ингибировал рост подкожной трансплантационной опухоли BT474/L1.9 голой мыши дозо-зависимым образом, со степенью ингибирования опухоли 38% и 91% соответственно; степень ингибирования опухоли референсного лекарственного средства Kadcyla™(5 мг/кг) по отношению к подкожной трансплантационной опухоли BT474/L1.9 голой мыши составляла 58%, что указывает на то, что BT474/L1.9 была также резистентной к Kadcyla™. Несущие опухоль мыши были весьма резистентны ко всем из вышеприведенных лекарственных средств.
[130] В заключение, ADC согласно настоящему изобретению демонстрирует значительную противоопухолевую активность по отношению к клеточной подкожной модели трансплантационной опухоли BT474/L1.9 голой мыши, которая является значительно более сильной, чем у Герцептина и Лапатиниба (p<0,01); в сравнении с Kadcyla™ с такой же дозой 5 мг/кг, ингибирующий опухоль эффект RC48-vc-MMAE согласно настоящему изобретению имеет явное преимущество (p<0,01), со степенью ингибирования опухоли 91%: 58%.
Пример 10 Противоопухолевая активность лекарственных конъюгатов по отношению к раку яичника
[131] 1) Эксперимент ингибирования опухоли конъюгатами RC48 по отношению к трансплантационной модели опухоли человеческого рака яичника SK-OV-3
[132] Трансплантационную модель опухоли человеческого рака яичника SK-OV-3 голой мыши формировали инокулированием клеток SK-OV-3 голой мыши (предоставленной Shanghai Slac Laboratory Animal Co. Ltd., с сертификатом No. 2007000540582 и лицензией No. SCXK(hu)2012-0002) подкожно. Животных разделяли на группы случайно до того, пока опухоль не вырастала вплоть до 100~300 мм3. Вводили тестируемые лекарственные средства RC48 10 мг/кг, T-DM1 10 мг/кг, RC48-vc-MMAE 3 мг/кг, RC48-vc-MMAE 10 мг/кг, RC48-vc-MMAF 3 мг/кг, RC48-vc-MMAF 10 мг/кг, RC48-mc-MMAF 3 мг/кг и RC48-mc-MMAF 10 мг/кг, дозирование раз в неделю, дозирование в общем 3 раза; паклитаксел 10 мг/кг, 3 раза в неделю, в общем 3 недели; при этом негативный контроль вводили с равным количеством физиологического солевого раствора.
[133] Ингибирующие опухоль эффекты RC48, соединенного с различными линкерами и лечебными агентами, на SK-OV-3 предполагают, что: в сравнении с голым антителом RC48, которое не является объедининенным, все из ADC согласно настоящему изобретению имеют хорошие ингибирующие опухоль эффекты; в сравнении с T-DM1 в такой же дозой 10 мг/кг, ингибирующие опухоль эффекты конъюгатов RC48 согласно настоящему изобретению имеют очевидное преимущество. Подробные результаты продемонстрированы на фиг. 16.
Пример 11 Эксперимент ингибирования опухоли лекарственными конъюгатами по отношению к модели подкожной трансплантационной клеточной опухоли HER2 позитивного человеческого рака желудка NCI-N87 у голой мыши
[134] Клетки NCI-N87 человеческого рака желудка высоко экспрессировали HER2 и EGFR, были резистентны к Герцептину®, и модель устанавливали таким же способом, как в примере 9. Результат показан на фиг. 17.
[135] Как показано на фиг. 17, одиночная внутривенная инъекция RC48-vc-MMAE (2,5, 5, 10 мг/кг) могла значительно ингибировать рост высоко экспрессирующей HER2 подкожной трансплантационной опухоли человеческого рака желудка NIC-N87 голой мыши со степенью ингибирования опухоли 133%, 193% и 200%. Группа с низкой дозой вызывала частичную регрессию опухоли у 6/6 мышей; группа со средней дозой вызывала частичную регрессию опухолей у 1/6 мыши и полную регрессию у 5/6 мышей; группа с высокой дозой вызывала полную регрессию опухолей у всех (6/6) мышей, которые не рецидивировали до окончания эксперимента (D21). Референсное лекарственное средство Герцептин® (10 мг/кг, дозирование раз в неделю, 3 раза) могло ингибировать рост подкожной трансплантационной опухоли NCI-N87 голой мыши, со степенью ингибирования опухоли только 49%; другое референсное лекарственное средство, низкомолекулярный EGFR/HER2 ингибитор Лапатиниб (200 мг/кг, дозирование раз в неделю, в течение 21 дня), имело эффект на подкожную трансплантационную опухоль NCI-N87 голой мыши, со степенью ингибирования опухоли 78%. Несущие опухоль мыши были резистентны ко всем из вышеприведенных лекарственных средств, и не было симптомов, таких как потеря массы тела.
[136] Этот результат исследования указывает: 1) одиночная внутривенная инъекция RC48-vc-MMAE (2,5, 5, 10 мг/кг) может значительно ингибировать рост высоко экспрессирующей HER2 подкожной трансплантационной опухоли человеческого рака желудка NIC-N87 у голой мыши, вызывая частичную или даже полную регрессию опухолей; 2) лечебный эффект RC48-vc-MMAE по отношению к подкожной трансплантационной опухоли NCI-N87 голой мыши является очевидно более сильным, чем эффект референсных лекарственных средств Герцептина® и Лапатиниба (p<0,01).
Пример 12 Испытание переносимости конъюгатов RC48 у мышей
[137] Самцов и самок мышей KM, которые прошли карантинную инспекцию, случайно разделяли на следующие группы доз в соответствии с массами тела: MMAE 2 мг/кг, MMAF 50 мг/кг, RC48-vc-MMAE 25 мг/кг (соответствующая доза MMAE составляла 0,5 мг/кг) ~ 200 мг (доза MMAE составляла 4,0 мг/кг), RC48-vc-MMAF 50 мг/кг (доза MMAF составляла 1,0 мг/кг) ~ 450 мг/кг (доза MMAF составляла 9,0 мг/кг) и RC48-mc-MMAF 50 мг/кг (доза MMAF составляла 1,0 мг/кг) ~ 450 мг/кг (доза MMAF составляла 9,0 мл/кг), где имело место 13 групп различных доз, с половиной самцов и половиной самок, и соответствующие лекарственные жидкие среды были инъецированы внутривено. Группы мышей из одной партии применяли в качестве контрольных групп, которым вводили инъекции 0,9% NaCl такого же объема через хвостовую вену. После дозирования измеряли массу тела один раз в два дня до дня 16. Кривая увеличения массы тела MMAE или MMAF мышей приведена на фиг. 18, соответственно.
[138] Результат эксперимента показывает: при условиях данного эксперимента токсичность RC48-vc-MMAE была ниже, чем у не объедининенного MMAE с такой же дозой. Максимальная допустимая доза мыши по отношению к RC48-vc-MMAE составляет между 100 мг/кг (доза MMAE составляет 2,0 мг/кг) и 150 мг/кг (доза MMAE составляет 3,0 мг/кг).
[139] Токсичность RC48-vc-MMAF является очевидно более высокой, чем токсичность у RC48-mc-MMAF с такой же дозой. Максимальная допустимая доза для мыши по отношению к RC48-vc-MMAF составляет между 50 мг/кг (доза MMAF составляет 1,0 мг/кг) и 100 мг/кг (доза MMAF составляет 2,0 мг/кг). МДД для мыши по отношению к RC48-mc-MMAF составляет между 150 мг/кг (доза MMAF составляет 3,0 мг/кг) и 450 мг/кг (доза MMAF составляет 9,0 мг/кг).
Пример 13 Эксперименты токсичности лекарственных конъюгатов по отношению к крысе SD, дозированной через одиночное внутривенное вливание
[140] Крыс SPF-level SD (сертификат No. SCXK (jing) 2012-0001), приобретенных у Beijing Vital River Laboratories Animal Technology Co, Ltd., случайно разделяли на 7 групп в соответствии с полом, где имело место 10 крыс в группе половиной самцов и половиной самок. Эти 7 групп включали в себя группу негативного контроля с физиологическим солевым раствором, контрольную группу 0,48 мг/кг MMAE, контрольную группу 40 мг/кг голого антитела RC48 и ряд RC48-vc-MMAE групп доз, в которых крыс дозировали посредством вливания в хвостовую вену, и экспериментальный период наблюдения составлял 21 день. Измеряли массы тела в D1 (предварительное дозирование), D8, D15 и D22. После периода наблюдения животных умерщвляли и выполняли общее патологическое анатомическое наблюдение, и патологические ткани или органы, наблюдаемые посредством общего анатомического наблюдения, подвергали гистологическому исследованию.
[141] Смертельные состояния животных: 9/10 животных (контрольная группа MMAE), 1/10 животное (RC48-vc-MMAE, 30 мг/кг группа) и 2/10 животных (RC48-vc-MMAE, 40 мг/кг группа) были обнаружены мертвыми во время экспериментов, при этом в оставшихся группах животных не было обнаружено мертвых животных или в агональном состоянии.
[142] При условиях данного эксперимента смертельная доза RC48-vc-MMAE для крысы составляла 30 мг/кг, и максимально допустимая доза была больше или равной 24 мг/кг (соответствующая доза объединенного MMAE составляла 0,48 мг/кг). Голое антитело RC48 вводили крысе SD с дозой 40 мг/кг посредством одиночного внутривенного вливания, и не имел место симптом токсического ответа, что предполагает, что максимальная допустимая доза для крысы была большей, чем или равной 40 мг/кг. Этот результат продемонстрировал, что даже если конъюгат согласно настоящему изобретению использовали с дозой намного выше, чем доза неконъюгированного лекарственного средства MMAE (40 мг/кг вместо 0,48 мг/кг), он все еще демонстрировал токсичность намного ниже, чем токсичность неконъюгированного лекарственного средства MMAE, что демонстрирует, что при формировании ADC объединением MMAE с антителом токсичность значительно снижалась.
[143] Вышеприведенное является только предпочтительными вариантами осуществления, которые должны рассматриваться только в качестве примеров, при этом не ограничивая комбинацию неотъемлемых особенностей для воплощения данного изобретения. Не подразумевается, что представленные подзаголовочные данные ограничивают различные варианты осуществлений данного изобретения. Термины, такие как “включает”, “содержит” и “включает” не подразумеваются ограничивающими. Более того, если не указано обратное, термин без численных модификаций включает его множественные формы, и “или” означает “или/и”. Если в контексте не указано иное, все технические и научные термины, как это применено в настоящем описании, имеют такие же значения, как понимает специалист в данной области.
[144] Все из публикаций и патентов, упомянутые в данной заявке, включены в настоящее описание посредством ссылок. Без выхода за рамки объема и основной идеи данного изобретения различные модификации и варианты способов и композиций, описанных в настоящем изобретении, являются очевидными для специалиста в данной области. Хотя данное изобретение описано посредством конкретных предпочтительных вариантов осуществления, необходимо понимать, что данное изобретение не должно быть ненадлежащим образом ограничено этими конкретными вариантами осуществления. На самом деле, подразумевается, что различные варианты, которые являются очевидными для специалиста в данной области для осуществления способов, описанных в настоящем изобретении, включены в объем прилагаемой формулы изобретения.
Ссылки
[1] Nahta, R.and F.J.Esteva(2007). Trastuzumab triumphs and tribulations. Oncogene 6(25) 3637-43.

[4] de Bono JS, Bellmunt J, Attard G, Droz JP, Miller K, Flechon A, Sternberg C, Parker C, Zugmaier G, Hersberger-Gimenez V, Cockey L, Mason M, Graham J Open-label phase II study evaluating the efficacy and safety of two doses of pertuzumab in castrate chemotherару-naive patients with hormone-refractory prostate cancer, JClin Onco, 2007, Jan 20;25 (3) :257-62.
[5] Petersdorf SH, Kopeeky KJ, Slovak M, Willman C, Nevill T, Brandwein J, Larson RA, Erba HP, Stiff PJ, Stuart RK, Walter RB, Tallman MS, Stenke L, Appelbaum FR. A phase III study of gemtuzumab ozogamicin during induction and post-consolidation therapy in younger patients with acute myeloid leukemia. Blood. 2013 Apr 16.
[6] de Vries JF, Zwaan CM, De Bie M, Voerraan JS, den Boer ML, van Dongen JJ, van der Velden VH. The novel calicheamicin-conjugated CD22 antibody inotuzumab ozogamicin (CMC-544) effectively kills primary pediatric acute lymphoblastic leukemia cells. Leukemia. 2012 Feb;26(2):255-64.
[7] Katz J, Janik JE, Younes A. 2011 Brentuximab Vedotin (SGN-35).Clin Cancer Res. 2011 Oct 15;17(20):6428-36.
[8] Girish S, Cupta M, Wang В et ai. Clinical pharmacology of trastuzumab emtansine (T-DM1): an antibody-drug conjugate in development for the treatment of HER2-positive cancer. Cancer Cheraotherapy and Pharmacology 2012;69:1229-40.
[9] Lems Phillips GD,Li G, Dugger DL et al. Targeting HER2-Positive Breast Cancer with Trastuzumab-DMl, an Antibody-Cytotaxic Drug Conjugate. Cancer Research 2008; 68:9280-90.
[10] Krop IE, Beeram M,Modi S et al. Phase I Study of Trastuzumab-DMl, an HER2 Antibody-Drug Conjugate, Given Every 3 Weeks to Patients With HER2-Positive Metastatic Breast Cancer , Journal of Clinical Oncology 2010; 28:2698-2704.
[11] Baselga J. Treatment of HER2-overexpressing breast Cancer . Annals of Oncology 2010; 21:vii36-vii40.
[12] Joseph A. Francisco, Charles G. Cerveny, Damon L. Meyer, Bruce J. Mixan, Kerry Klussman,Dana, F. Chace, Starr X. Rejniak, Kristine A. Gordon, Ron DeBlanc, Brian E. Toki, Che-Leung Law, Svetlana O. Doronina, Clay B. Siegall, Peter D. Senter and Alan F. Wahl. 2003 cAC10-vcMMAE, an anti-CD30-monomethyl auristatin E conjugate with Potent and selective antitumor activity. Blood. 2003 102:1458-1465.
[13] Dosio F P. Brusa and L Cattel. 2011 Immunotaxins and anticancer drugs conjugate assemblies: the role of the linkage between components. Toxins 3:848-883.
[14] Concortis Biosystems Corp. USA www.concortisbiosystems.com.
[15] CN1993146A.
Указания относительно депонированного микроорганизма или другого биологического материала
(правило 13bis PCT)
Дополнительный лист для биологического материала
Идентификация дополнительных депонирований:
1) Названия и адреса депозитных учреждений для депонирований:
China Center for Type Culture Collection
Wuhan University, Luojia Mountain, Wuchang District, Wuhan City, Hubei 430072, P. R.China
Дополнительные указания для вышеупомянутых депонирований:
Клетки яичника китайского хомячка
2) Депонент:
Все вышеупомянутые депонирования были осуществлены:
RC Biotechnologies, Ltd.
No.1 Rongchang Road, ETDZ Yantai, Shandong 264006
Реферат
Изобретение относится к области биотехнологии, конкретно к получению анти-HER2 антитела и конъюгата анти-HER2 антитела и низкомолекулярного медицинского средства, и может быть использовано в медицине. Полученное антитело и его конъюгат, а также фармацевтическую композицию на их основе применяют для лечения и профилактики рака. Также рассмотрены полинуклеотид, комбинация полинуклеотидов и экспрессионные векторы. Кроме того, описано применение антитела и фармацевтических композиций в приготовлении лекарственного средства для лечения или профилактики рака. Изобретение позволяет получить противораковое лекарственное средство, нацеленное на HER2, для пациентов со сверхэкспрессирующими HER2 опухолями или другими экспрессирующими HER2 релевантными заболеваниями, которые не имеют или имеют слабый ответ на терапию с Герцептином. 12 н. и 6 з.п. ф-лы, 18 ил., 6 табл., 13 пр.


Комментарии