Иммуноконъюгаты, направленные на cd138, и их применение - RU2547939C2
Код документа: RU2547939C2
Чертежи














Описание
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет на основании предварительной заявки США 61/016620, поданной 26 декабря 2007, предварительной заявки 61/087466, поданной 8 августа 2008 и предварительной заявки 61/087590, также поданной 8 августа 2008, которые полностью включены в данное описание в качестве ссылки.
Область техники изобретения
Настоящее изобретение относится к улучшенным средствам, направленным на антиген CD138, иммуноконъюгатам, содержащим такие средства, композициям, содержащим эти иммуноконъюгаты, и к способам их применения.
Уровень техники изобретения
CD138, который действует как рецептор внеклеточного матрикса, сверхэкспрессируется на клетках множественной миеломы (MM) и, как показано, влияет на развитие и/или пролиферацию клеток MM. CD138 также экспрессируется, в числе прочих, на клетках карциномы яичника, карциномы почки, карциномы желчного пузыря, карциномы молочной железы, рака простаты, рака легкого, карциномы толстой кишки, а также на клетках ходжкинской и неходжкинской лимфом и хронического лимфолейкоза (CLL).
Публикации и другие материалы, в том числе патенты, используемые в данном документе для иллюстрации изобретения и, в особенности для предоставления дополнительных деталей, касающихся применения на практике, включены в настоящее описание в качестве ссылки. Для удобства ссылки на публикации приводятся в нижеследующем тексте по фамилии автора и дате публикации и/или они перечисляются в алфавитном порядке по фамилии авторов в прилагающейся библиографии.
Tassone et al. (2004) описывают превосходное связывание мышиного антитела IgG1 B-B4 с антигеном CD138, экспрессируемым на поверхности клеток MM. Tassone также описывают высокую цитотоксическую активность иммуноконъюгата B-B4-DM1, который содержит мутансиноид DM1 в качестве эффекторной молекулы, в отношении клеток множественной миеломы (см. также публикацию патента США 20070183971).
Хотя Tassone et al. вносят большой вклад в разработку эффективного способа лечения MM и композиций, которые могут применяться для такого лечения, в данной области остается ряд проблем.
Существует потребность в иммуноконъюгатах на основе B-B4, которые не обладают некоторыми свойствами и/или функциями, присущими B-B4. В частности, существует потребность в разработке химерного антитела на основе B-B4, которое связывает CD138 так же эффективно, как и B-B4, но не оказывает серьезных побочных эффектов при введении людям. Также существует потребность в иммуноконъюгате на основе B-B4, который имеет одно или несколько преимуществ по сравнению с его мышиным аналогом. Указанные преимущества включают улучшенное связывание антигена, более эффективное уничтожение опухолевых клеток, в особенности опухолевых клеток, экспрессирующих CD138, и вспомогательных клеток или более гомогенное связывание с мишенью.
Сущность изобретения
Настоящее изобретение направлено на иммуноконъюгат, содержащий:
(a) сконструированное антитело против мишени и
(b) эффекторную молекулу,
где указанный иммуноконъюгат гомогенно направлен на клетки-мишени, экспрессирующие CD138.
Сконструированное антитело против мишени по настоящему изобретению может
(i) состоять по существу из антиген-связывающего участка (ABR) против CD138 нечеловеческого антитела, или
(ii) содержать антиген-связывающий участок (ABR) против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела, и
дополнительный участок антитела, где, по меньшей мере, часть указанного дополнительного участка антитела относится к человеческому антителу.
ABR может содержать:
(a) CDR3 вариабельного участка тяжелой цепи, содержащий аминокислотные остатки 99-111 последовательности SEQ ID NO: 1; и
(b) CDR3 вариабельного участка легкой цепи, содержащий аминокислотные остатки 89-97 последовательности SEQ ID NO: 2, соответственно.
ABR может дополнительно содержать:
(a) CDR1 и CDR2 вариабельного участка тяжелой цепи, содержащие аминокислотные остатки 31-35 и 51-68 последовательности SEQ ID NO: 1; и/или
(b) CDR1 и CDR2 вариабельного участка легкой цепи, содержащие аминокислотные остатки 24-34 и 50-56 последовательности SEQ ID NO: 2, соответственно.
Дополнительный участок антитела может содержать:
(a) аминокислотные остатки 123-448 последовательности SEQ ID NO: 1; и/или
(b) аминокислотные остатки 108-214 последовательности SEQ ID NO: 2, соответственно;
и их мутации, которые
(i) сохраняют на прежнем уровне или снижают антитело-зависимую цитотоксичность и/или комплемент-зависимую цитотоксичность сконструированного антитела против мишени; и/или
(ii) стабилизируют сконструированное антитело против мишени.
Эффекторную молекулу можно присоединить к указанному сконструированному антителу против мишени через линкер. Линкер может содержать дисульфидную связь. Эффекторная молекула (например, DM4) может обеспечивать стерическое затруднение между антителом против мишени и эффекторной молекулой. Эффекторная молекула может представлять собой, по меньшей мере, один майтансиноид (например, DM1, DM3 или DM4), таксан, или CC1065, или его аналог.
Иммуноконъюгат может связывать CD138 с вариацией нацеливания менее чем на 150%, 140%, 130%, 120%, 110%, 100%, 90%, 80%, 70%, 60% или 50%.
Настоящее изобретение также направлено на иммуноконъюгат, содержащий:
Направляющее средство, направленное на CD138, включающее выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1. Константный участок указанной тяжелой цепи иммуноглобулина или ее указанной части может представлять собой константный участок изотипа IgG4.
Настоящее изобретение также направлено на способ лечения MM у субъекта, включающий:
получение одного или нескольких из описанных здесь иммуноконъюгатов и
введение указанному субъекту указанного иммуноконъюгата в количестве, эффективном для лечения множественной миеломы.
Направляющее средство иммуноконъюгата может содержать последовательность легкой цепи, которая, по меньшей мере, на 70% идентична последовательности SEQ ID NO:2. Направляющее средство иммуноконъюгата может содержать последовательность тяжелой цепи, которая, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1.
Настоящее изобретение также направлено на опосредованный иммуноконъюгатом способ доставки лекарственного средства, который включает:
получение одного или нескольких из описанных здесь иммуноконъюгатов и
введение указанного иммуноконъюгата в терапевтически эффективном количестве, где указанный изотип IgG4 облегчает состояние при ADCC, повышает комплемент-зависимую цитотоксичность и/или Fc-опосредованное нацеливание печеночного FcR.
Настоящее изобретение также направлено на способ ингибирования, замедления и/или предотвращения роста опухолевых клеток в клеточной культуре, включающий
введение в указанную клеточную культуру одного или нескольких из описанных здесь иммуноконъюгатов в количестве, эффективном для ингибирования, замедления и/или предотвращения роста опухолевых клеток. Эффективное количество может вызывать гибель опухолевых клеток, экспрессирующих CD138, или прекращение непрерывного клеточного цикла в указанных клетках, и, необязательно, во вспомогательных клетках, которые не экспрессируют CD138, в особенности в клетках стромы опухоли. Клетки указанной клеточной культуры можно получить от ракового пациента и, после введения указанного эффективного количества указанного иммуноконъюгата, клетки указанной клеточной культуры можно реимплантировать указанному раковому пациенту.
Настоящее изобретение также направлено на способ ингибирования, замедления и/или предотвращения роста опухоли, содержащей опухолевые клетки CD138, и/или распространения клеток такой опухоли у пациента, нуждающегося в этом, где указанный способ включает
введение указанному пациенту, по меньшей мере, одного или нескольких описанных выше иммуноконъюгатов, способных ингибировать рост указанной опухоли и/или уменьшать количество или распространение указанных опухолевых клеток,
где указанный иммуноконъюгат ингибирует, замедляет или предотвращает рост и/или распространение указанных опухолевых клеток. Эффекторная молекула указанного иммуноконъюгата (иммуноконъюгатов) может представлять собой токсин, цитотоксический фермент, низкомолекулярное цитотоксическое средство, порообразующее средство, модификатор биологического ответа, фермент, активирующий пролекарство, антитело, цитокин или радионуклид.
Однократная доза иммуноконъюгатов по настоящему изобретению составляет примерно от 5 мг/м2 до 300 мг/м2, ее можно вводить с часовыми, суточными, недельными интервалами, или можно использовать сочетания таких режимов.
Режимы, включающие введение нескольких доз с часовыми, суточными и недельными интервалами, являются частью настоящего изобретения и конкретно включают введение с интервалами в 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 часов, 1, 2, 3, 4, 5, 6, 7 дней, 1, 2, 3, 4, 5, 6, 7 или 8 недель.
Настоящее изобретение также направлено на способ ингибирования, замедления и/или предотвращения роста опухоли и/или распространения клеток злокачественной опухоли у пациента, нуждающегося в этом, включающий
(a) введение указанному пациенту одного или нескольких цитотоксических средств и/или облучения в количестве, эффективном для уменьшения опухолевой нагрузки; и
(b) введение указанному пациенту, по меньшей мере, одного из описанных здесь иммуноконъюгатов в количестве, ингибирующем, замедляющем или предотвращающем рост опухоли и/или распространение опухолевых клеток,
где указанный иммуноконъюгат ингибирует, замедляет или предотвращает рост и/или распространение опухолевых клеток, включающих клетки, экспрессирующие CD138.
Цитотоксическое средство может представлять собой, например, мефалан, винкристин, доксорубицин, дексаметазон, циклофосфамид, этопозид, цитарабин, цисплатин, талидомид, преднизон, талидомид, бортезомид, леналидомид, сорафениб, ромидепсин или их сочетания, или оно может быть получено на основе антитела.
Настоящее изобретение также направлено на способ лечения субъекта, имеющего состояние, которое может улучшаться в результате подавления выживания клеток миеломы, включающий:
(a) получение, по меньшей мере, одного из описанных здесь иммуноконъюгатов; и
(b) введение иммуноконъюгата субъекту с целью селективного уменьшения выживания или роста указанных клеток миеломы у указанного субъекта.
Настоящее изобретение также направлено на фармацевтическую композицию, содержащую любой из описанных здесь иммуноконъюгатов, для ингибирования, замедления и/или предотвращения роста опухолей и/или распространения опухолевых клеток, и один или несколько фармацевтически приемлемых наполнителей.
Фармацевтическая композиция может содержать цитотоксические средства, описанные в данном документе.
Настоящее изобретение также направлено на набор, содержащий в отдельных контейнерах фармацевтические композиции для применения в сочетании для ингибирования, замедления и/или предотвращения роста опухолей и/или распространения опухолевых клеток, где один контейнер содержит эффективное количество вышеуказанной фармацевтической композиции, а другой контейнер содержит вторую фармацевтическую композицию, содержащую эффективное количество другого средства, предпочтительно цитотоксического средства для ингибирования, замедления и/или предотвращения роста опухолей и/или распространения опухолевых клеток, и один или несколько фармацевтически приемлемых наполнителей.
Настоящее изобретение также направлено на способ ингибирования, замедления и/или предотвращения роста опухоли, содержащей клетки CD138, и/или распространения клеток такой опухоли у субъекта, нуждающегося в этом, включающий
(a) получение иммуноконъюгата, содержащего:
сконструированное антитело, направленное против CD138, присоединенное к эффекторной молекуле через расщепляемый линкер, где указанная эффекторная молекула обеспечивает стерическое затруднение; и
(b) введение указанному субъекту иммуноконъюгата (a) в количестве, ингибирующем, замедляющем и/или предотвращающем рост указанной опухоли и/или распространение указанных опухолевых клеток, где (a) ингибирование роста опухоли под действием указанного иммуноконъюгата превышает ингибирование роста опухоли под действием незатрудненного аналога примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40% или больше.
Ингибирование роста опухоли под действием незатрудненного аналога, содержащего нерасщепляемый линкер, может превышать ингибирование роста опухоли под действием незатрудненного аналога, содержащего расщепляемый линкер, по меньшей мере, примерно на 5%, по меньшей мере, примерно на 10%, примерно до 15%.
Указанное сконструированное антитело, направленное против CD138, может состоять по существу из антиген-связывающего участка против CD138 нечеловеческого антитела, или оно может содержать антиген-связывающий участок против CD138 нечеловеческого антитела и дополнительный участок антитела, где, по меньшей мере, часть указанного дополнительного участка антитела получена из человеческого антитела.
Указанный расщепляемый линкер может содержать дисульфидную связь. Эффекторная молекула может представлять собой DM4. Иммуноконъюгат, который может составлять часть фармацевтической композиции, можно вводить субъекту, по меньшей мере, в одной дозе, составляющей от примерно 5 мг/м2 до примерно 300 мг/м2.
Настоящее изобретение предлагает иммуноконъюгат для применения в качестве лекарственного средства, где иммуноконъюгат содержит:
(a) сконструированное антитело против мишени,
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела,
дополнительный участок антитела, где, по меньшей мере, часть дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138.
Настоящее изобретение предлагает другой иммуноконъюгат для применения в качестве лекарственного средства, содержащий:
направленное средство, направленное против CD138, включающее
выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1.
В частности, в одном аспекте данного изобретения указанный в предыдущем абзаце иммуноконъюгат предназначен для лечения множественной миеломы. Например, иммуноконъюгат можно использовать для промышленного получения лекарственного средства для лечения множественной миеломы.
Настоящее изобретение также предлагает иммуноконъюгат для применения в опосредованном иммуноконъюгатом способе доставки лекарственного средства пациенту, в особенности для облегчения ADCC, повышения комплемент-зависимой цитотоксичности и/или эффективности Fc-опосредованного нацеливания печеночного FcR, где иммуноконъюгат содержит направляющее средство, направленное на CD138, включающее выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1, и где константный участок указанной тяжелой цепи иммуноглобулина или ее части, представляет собой константный участок изотипа IgG4.
Настоящее изобретение также предлагает опухолевые клетки для лечения рака у пациента, где опухолевые клетки обрабатывают в клеточной культуре иммуноконъюгатом, содержащим:
(a) сконструированное антитело против мишени,
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела, и
дополнительный участок антитела, где, по меньшей мере, часть указанного дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138.
Настоящее изобретение также предлагает опухолевые клетки для лечения рака у пациента, где опухолевые клетки обрабатывают в клеточной культуре иммуноконъюгатом, содержащим:
направленное средство, направленное против CD138, включающее
выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1.
Настоящее изобретение предлагает иммуноконъюгат для ингибирования, замедления и/или предотвращения роста опухоли, содержащей клетки CD138, и/или распространения клеток такой опухоли у пациента, где иммуноконъюгат содержит:
(a) сконструированное антитело против мишени
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела, и
дополнительный участок антитела, где, по меньшей мере, часть указанного дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138.
Альтернативно настоящее изобретение предлагает иммуноконъюгат для ингибирования, замедления и/или предотвращения роста опухоли, содержащей опухолевые клетки CD138, и/или распространения клеток такой опухоли у пациента, где иммуноконъюгат содержит:
направляющее средство, направленное против CD138, включающее
выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1.
Далее настоящее изобретение предлагает лекарственное средство, содержащее иммуноконъюгат и одно или несколько противораковых средств в виде комбинированного препарата, которые можно использовать одновременно, раздельно или последовательно для лечения опухолевых клеток, включающих клетки, экспрессирующие CD138, где иммуноконъюгат содержит:
(a) сконструированное антитело против мишени,
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела,
дополнительный участок антитела, где, по меньшей мере, часть дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138,
и где одно или несколько противораковых средств могут уменьшать массу опухоли.
Альтернативно настоящее изобретение предлагает лекарственное средство, содержащее иммуноконъюгат и одно или несколько противораковых средств в виде комбинированного препарата, которые можно использовать одновременно, раздельно или последовательно для лечения опухолевых клеток, включающих клетки, экспрессирующие CD138, где иммуноконъюгат содержит:
направляющее средство, направленное против CD138, включающее
выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1, и где одно или несколько противораковых средств могут уменьшать массу опухоли.
В следующем аспекте применения двух предыдущих параграфов комбинированный препарат вводят пациенту после лучевой терапии.
В альтернативном аспекте настоящее изобретение предлагает применение иммуноконъюгата в производстве лекарственного средства для лечения у пациента опухолевых клеток, включающих клетки, экспрессирующие CD138, где иммуноконъюгат содержит:
(a) сконструированное антитело против мишени,
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела,
дополнительный участок антитела, где, по меньшей мере, часть дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138,
и где лекарственное средство вводят пациенту после лучевой терапии для уменьшения опухолевой нагрузки.
Настоящее изобретение также предлагает применение иммуноконъюгата в производстве лекарственного средства для лечения у пациента опухолевых клеток, включающих клетки, экспрессирующие CD138, где иммуноконъюгат содержит:
направляющее средство, направленное против CD138, включающее
выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина или ее часть, где указанная тяжелая цепь иммуноглобулина или ее часть, по меньшей мере, на 70% идентична последовательности SEQ ID NO:1,
и где лекарственное средство вводят пациенту после лучевой терапии для уменьшения опухолевой нагрузки.
Лекарственное средство, упомянутое в предыдущих параграфах, способно ингибировать, замедлять и/или предотвращать рост опухоли и/или распространение клеток злокачественной опухоли у пациента.
Далее настоящее изобретение предлагает иммуноконъюгат, уменьшающий выживание клеток миеломы у субъекта, где иммуноконъюгат содержит:
(a) сконструированное антитело против мишени,
(i) состоящее по существу из антиген-связывающего участка против CD138 нечеловеческого антитела; или
(ii) содержащее антиген-связывающий участок против CD138, где указанный антиген-связывающий участок получен из нечеловеческого антитела,
дополнительный участок антитела, где, по меньшей мере, часть указанного дополнительного участка антитела получена из человеческого антитела; и
(b) эффекторную молекулу,
где указанный иммуноконъюгат специфически связывается с CD138.
Далее настоящее изобретение предлагает иммуноконъюгат, уменьшающий выживание клеток миеломы у субъекта, где иммуноконъюгат содержит:
направляющее средство, направленное против CD138, включающее
Указанный в двух предыдущих параграфах иммуноконъюгат, в частности, способен селективно уменьшать выживание или рост указанных клеток миеломы у субъекта.
Кроме того, настоящее изобретение предлагает иммуноконъюгат для ингибирования, замедления и/или предотвращения роста опухоли, содержащей опухолевые клетки CD138, и/или распространения клеток такой опухоли у субъекта, где иммуноконъюгат содержит сконструированное антитело против мишени против CD138, присоединенное к эффекторной молекуле через расщепляемый линкер, где указанная эффекторная молекула стерически затруднена.
Ингибирующая активность указанного в предыдущем параграфе иммуноконъюгата в отношении роста опухоли, в частности, превышает ингибирующую активность незатрудненного аналога примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40% или больше.
Краткое описание чертежей
На фиг. 1 приведено схематическое изображение nBT062, содержащего присоединенные эффекторные молекулы.
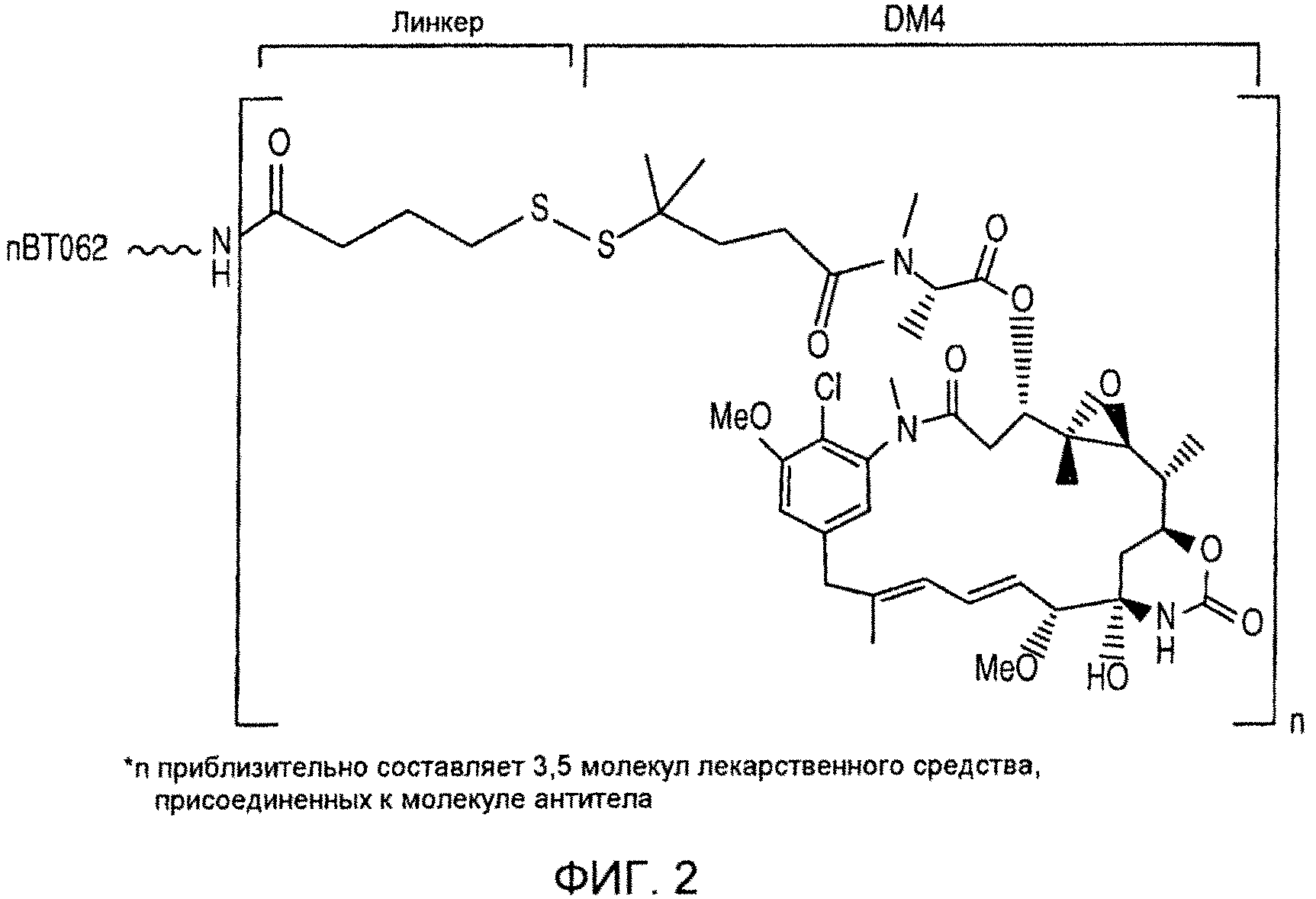
На фиг. 2 приведено схематическое изображение BT062.
На фиг. 3 показано превращение ансамитоцина P-3 в майтансинол (стереохимия опущена или упрощена).
На фиг. 4 приведена типичная схема синтеза DM4.
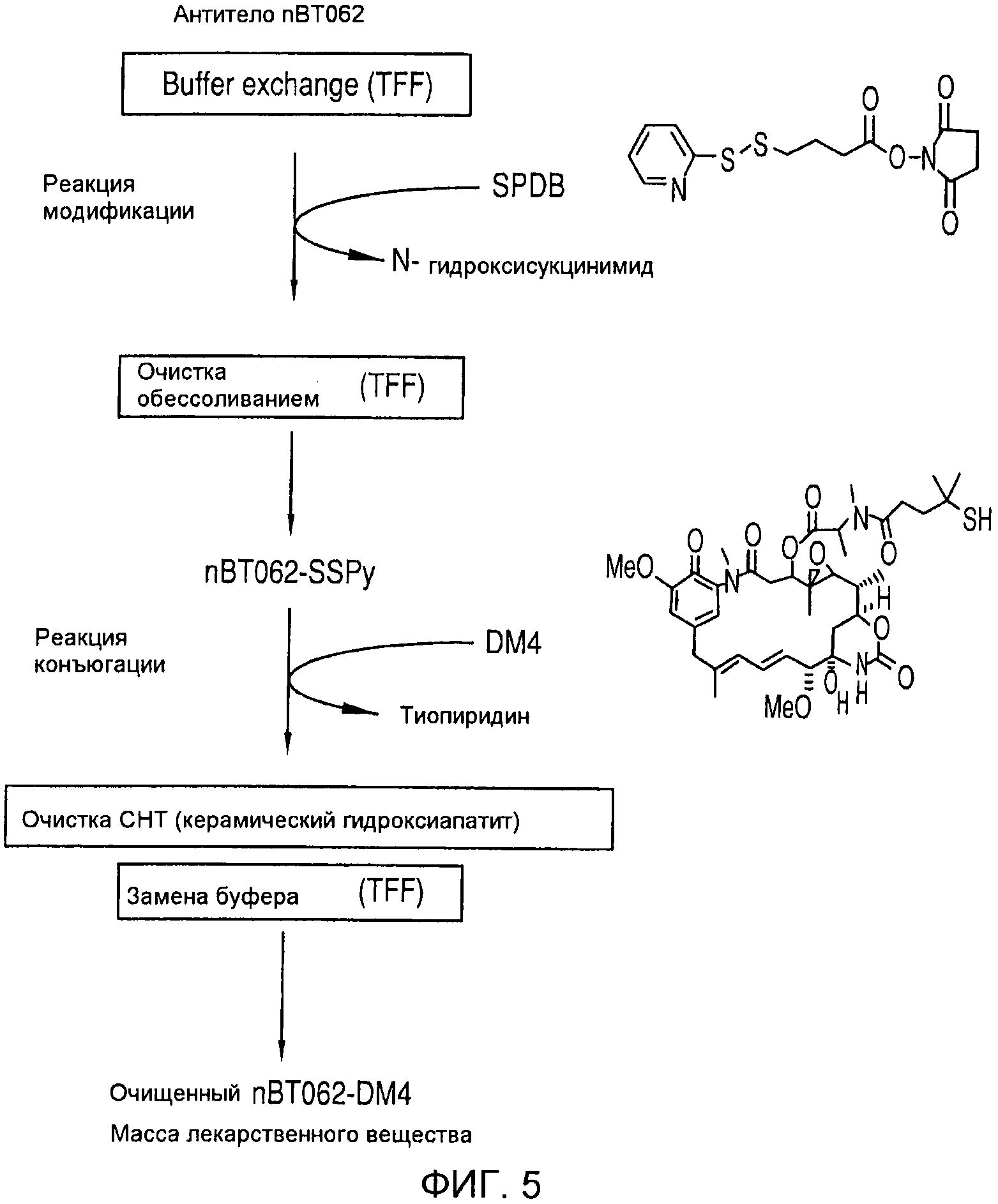
На фиг. 5 приведено схематическое получение конъюгата антитела (nBT062 с DM4).
На фиг. 6 показан анализ связывания антитела nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 и nBT062 с клетками OPM-2. К клеткам добавляют разные концентрации nBT062 и конъюгатов и измеряют флуоресценцию методом FACS.
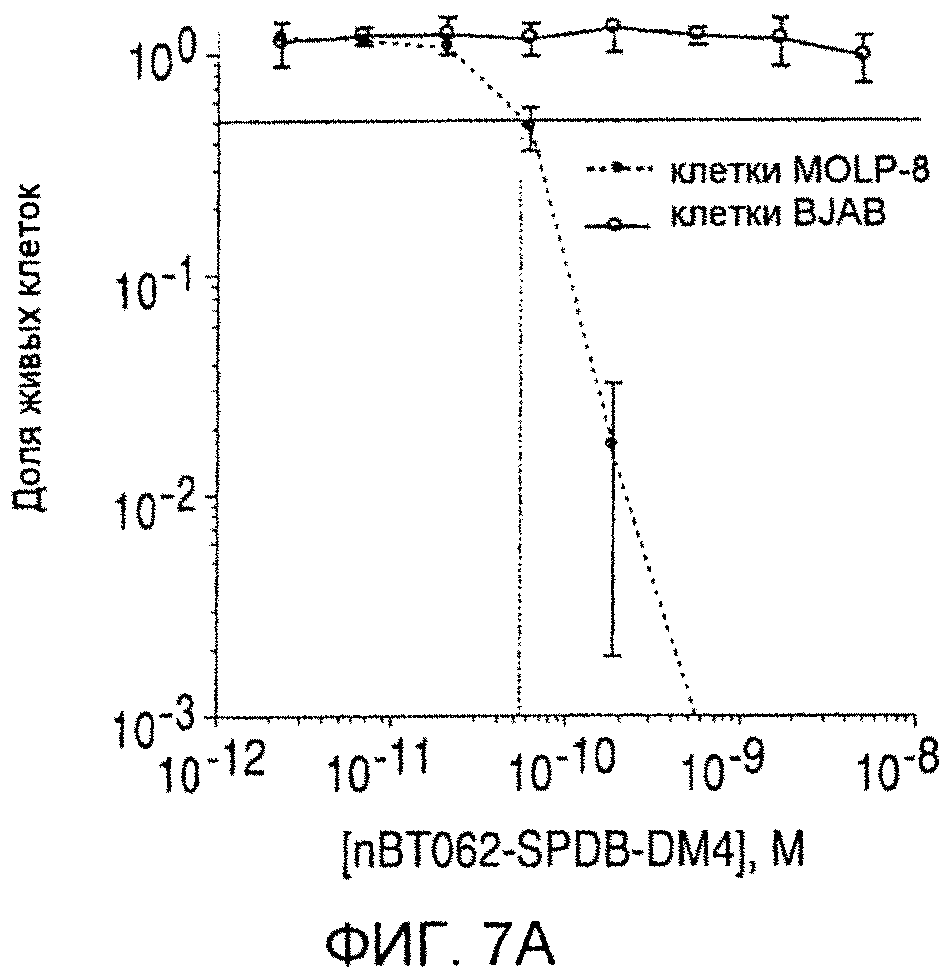
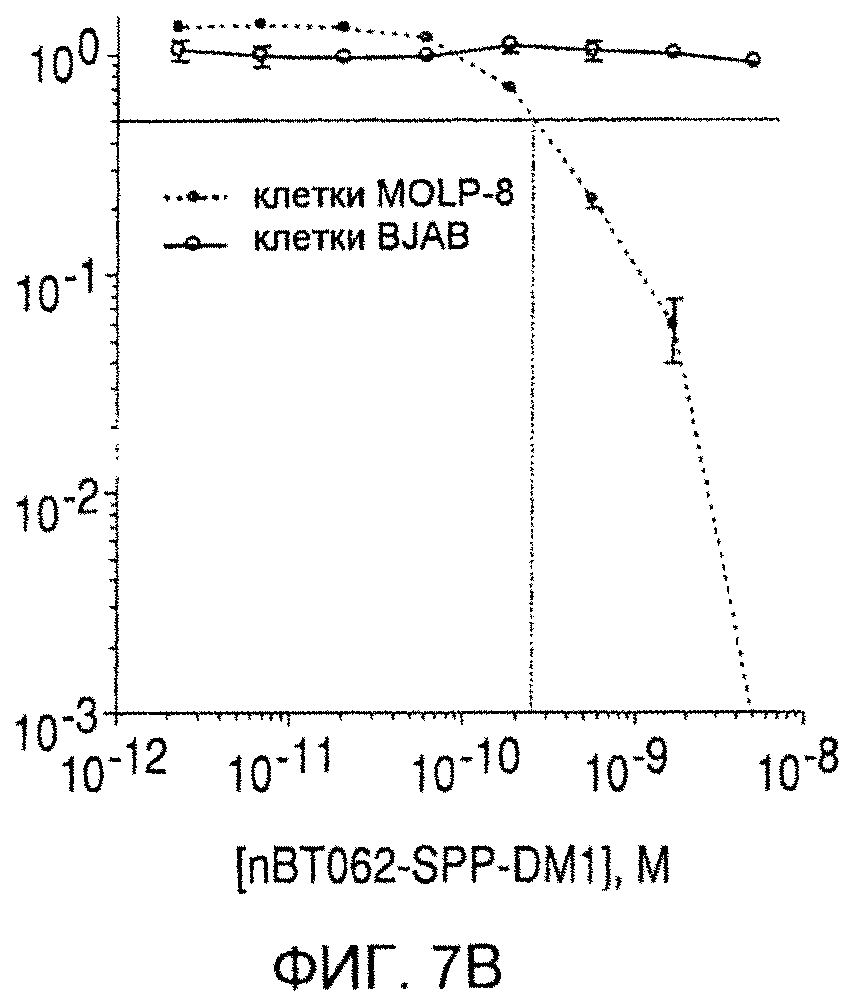
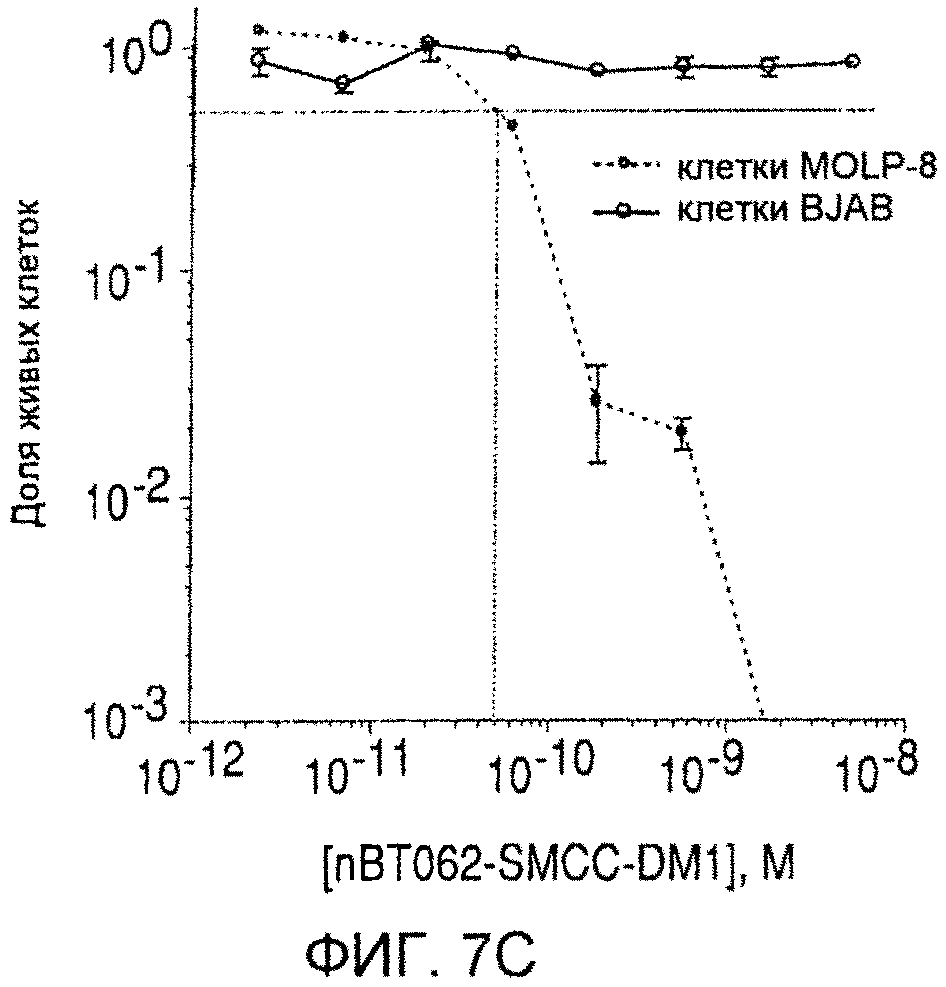
На фиг. 7 (A)-(D) приведена цитотоксичность конъюгатов nBT062-DMx в отношении клеток MOLP-8 (CD138+) и BJAB (CD138+) in vitro. Клетки культивируют в плоскодонных планшетах и инкубируют с указанными концентрациями иммуноконъюгатов в течение 5 дней. Чтобы определить жизнеспособность клеток, к ним добавляют реагент WST и инкубируют в течение 3 часов. В секции (D) цитотоксическую активность nBT062-SPDB-DM4 анализируют в присутствии или отсутствии блокирующего антитела (1 мкМ nBT062).
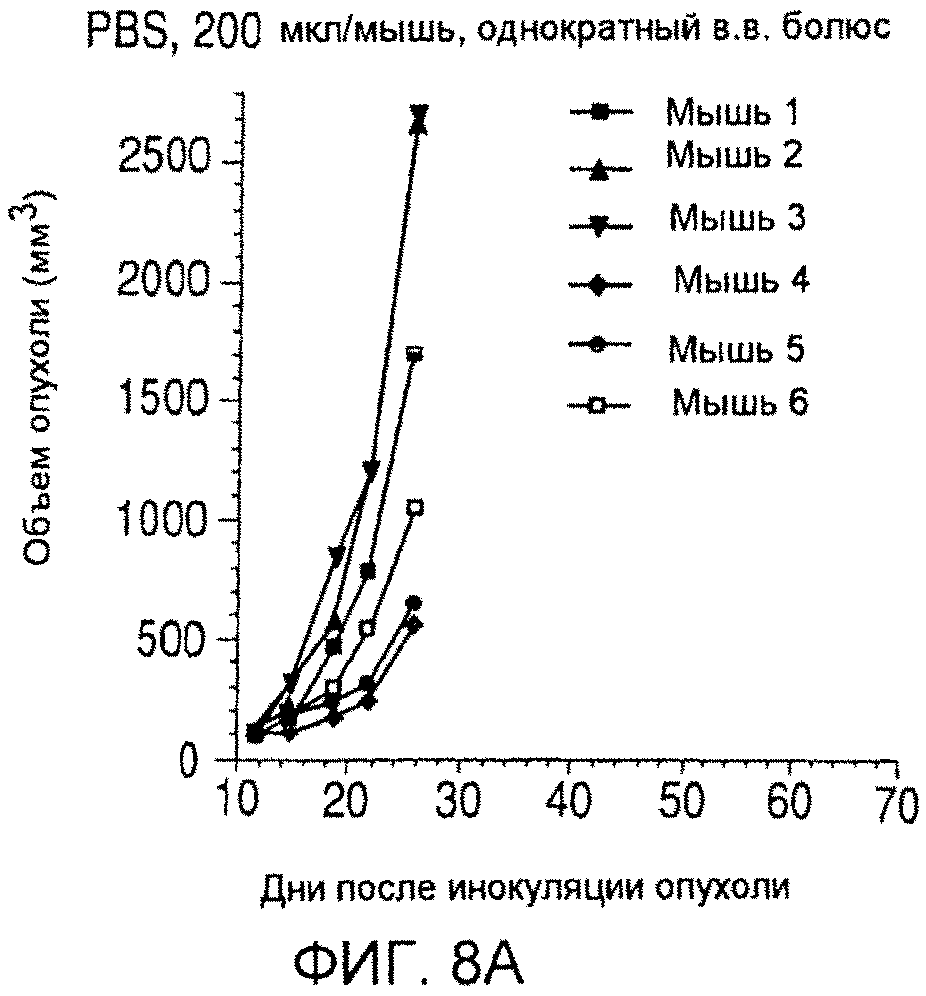
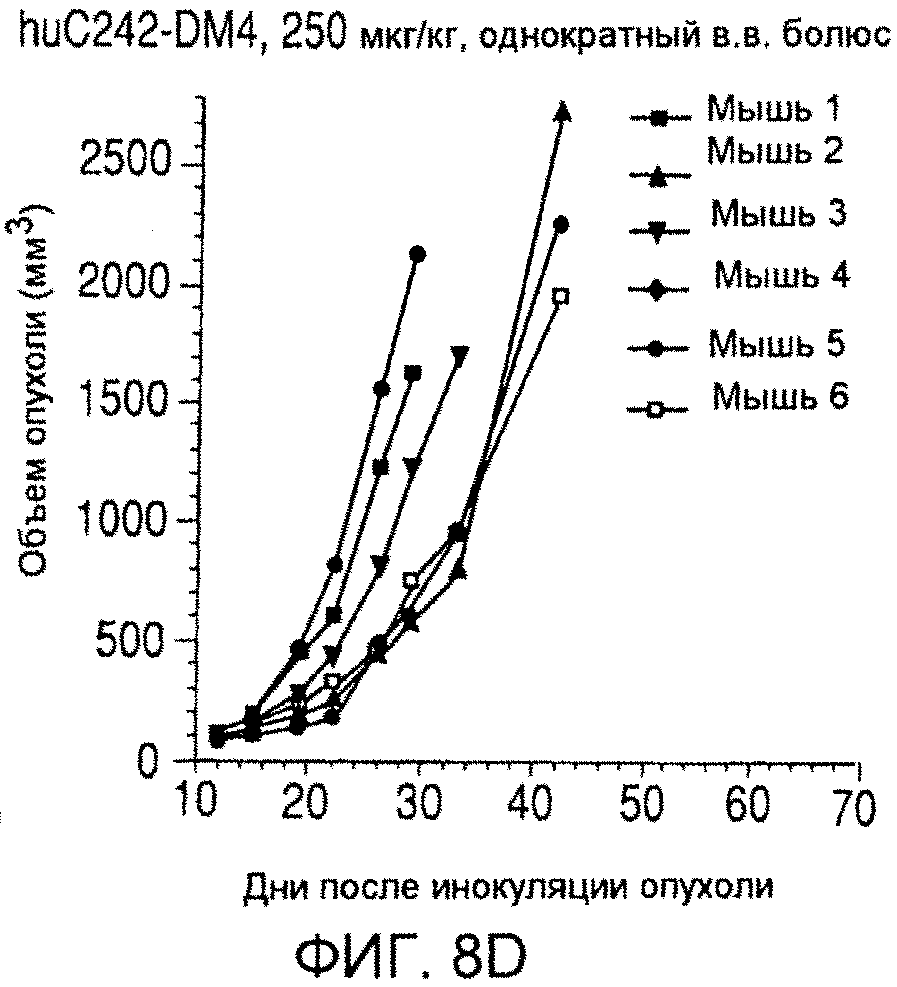
На фиг. 8 показаны объемы опухолей у отдельных мышей, обработанных (A) PBS, (B) антителом nBT062, (C) свободным DM4 или (D) неспецифическим конъюгатом huC242-DM4 через некоторое время (дни) после инокуляции опухолевых клеток MOLP-8.
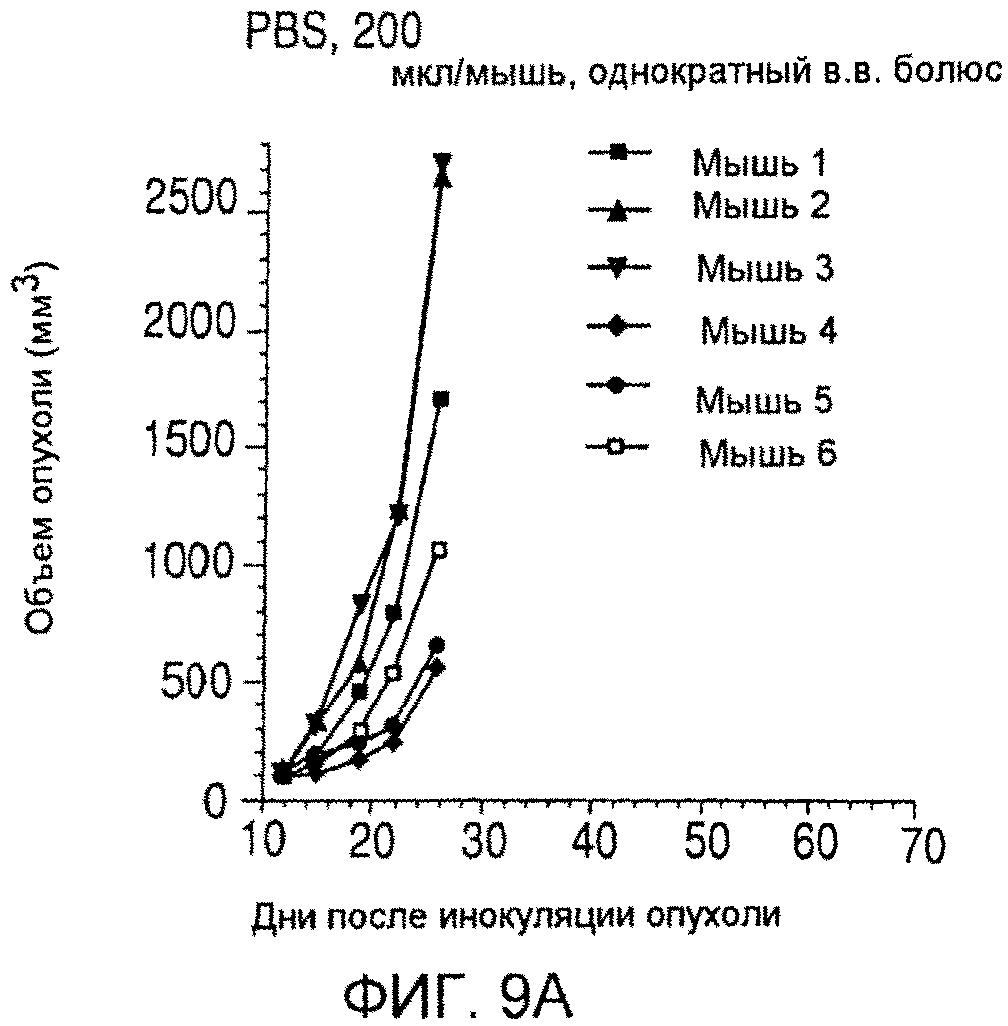
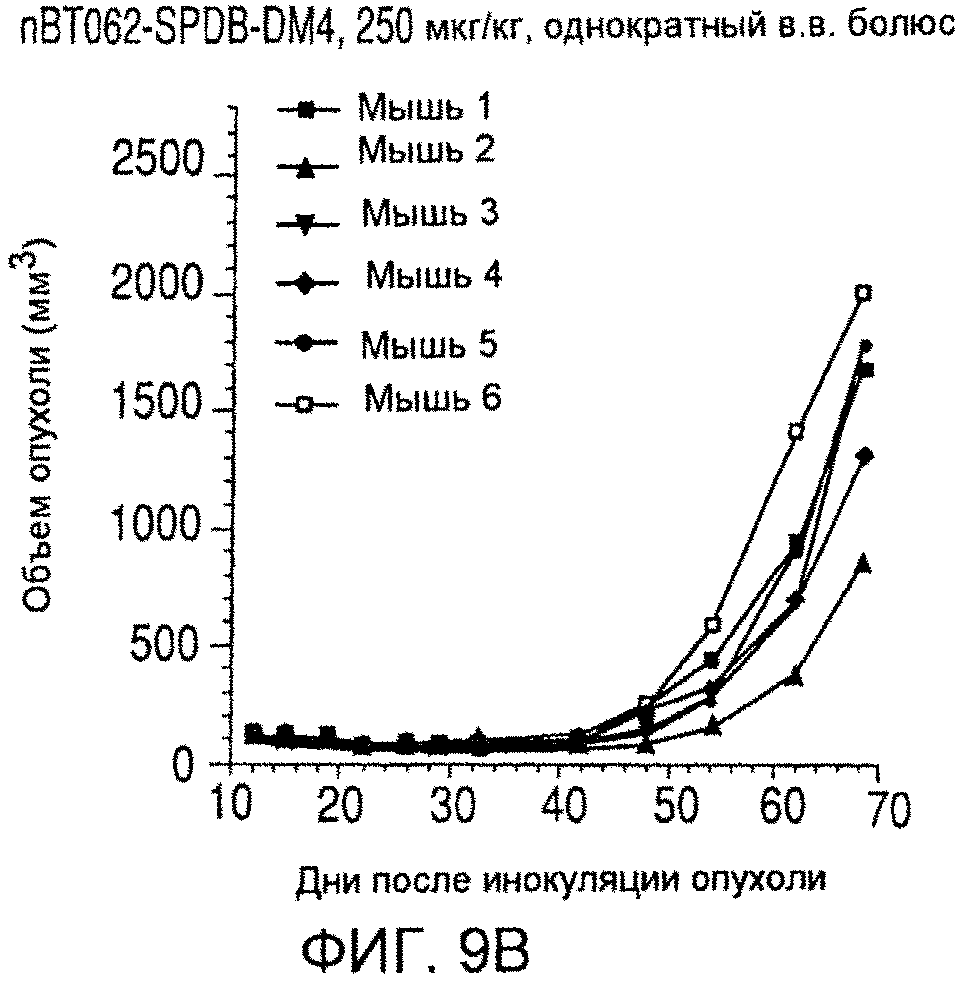
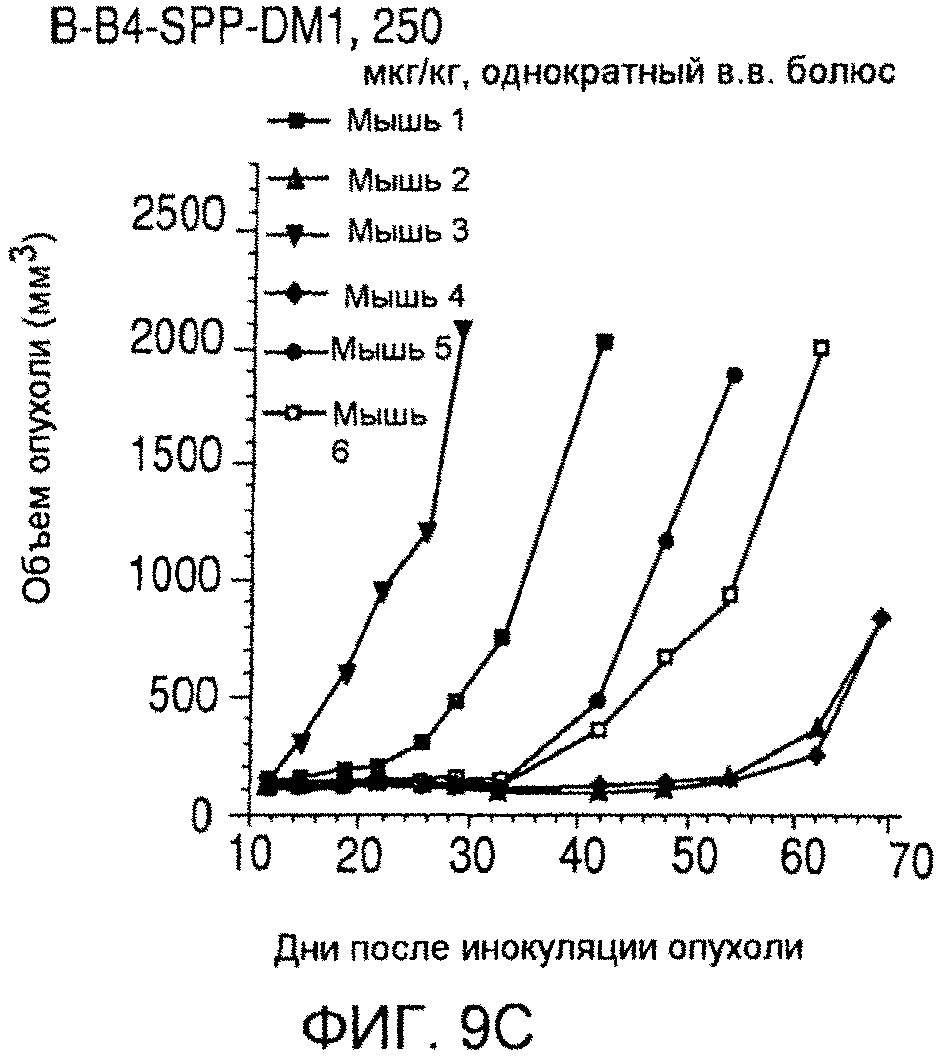
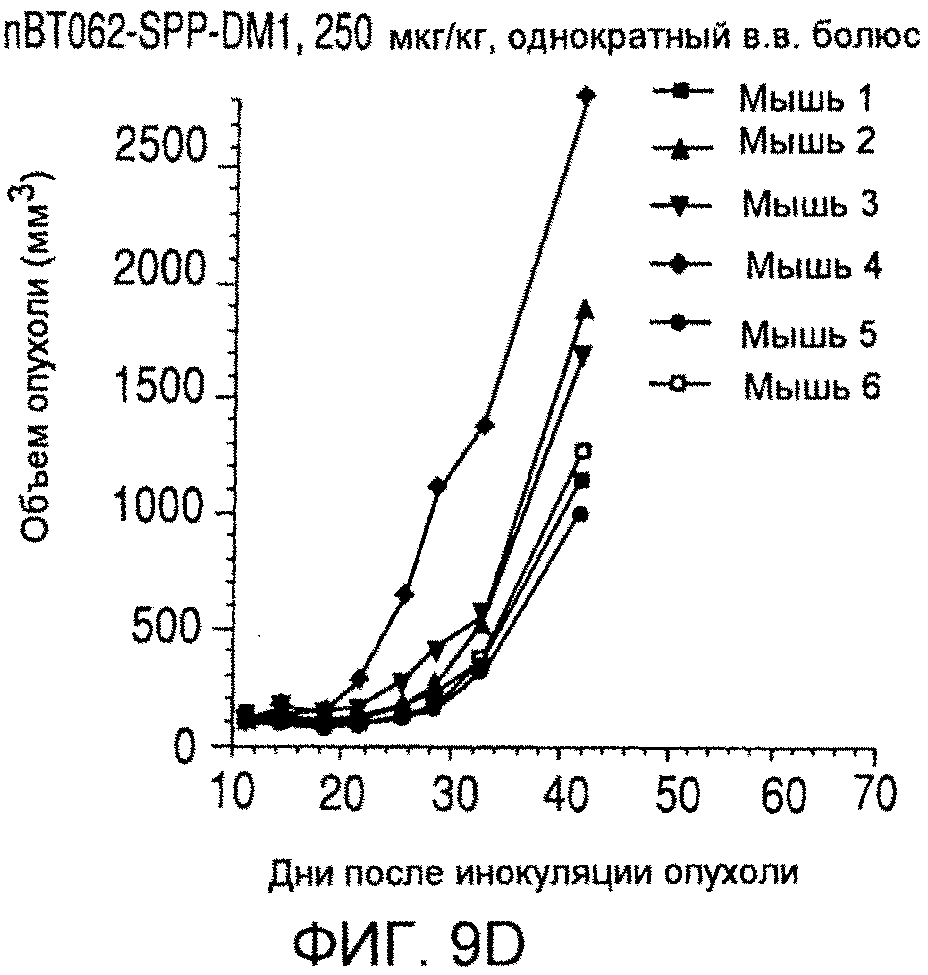
На фиг. 9 показаны объемы опухолей у отдельных мышей, обработанных (A) PBS, (B) nBT062-SPDB-DM4, (C) B-B4-SPP-DM1 или (D) nBT062-SPP-DM1 через некоторое время (дни) после инокуляции опухолевых клеток MOLP-8.
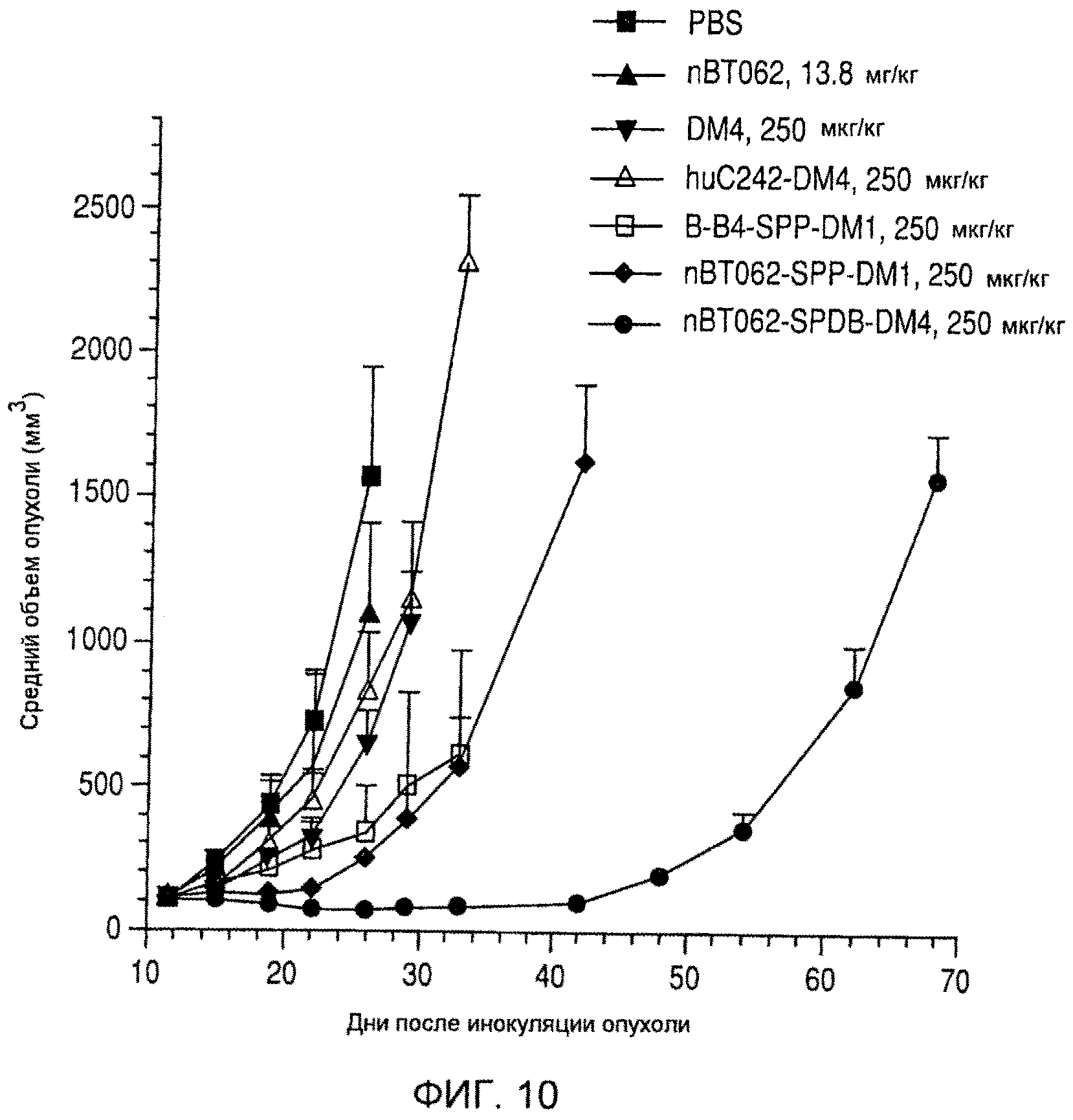
На фиг. 10 показаны средние объемы опухолей (+/-SD) ксенотрансплантатов множественной миеломы человека MOLP-8 у мышей CB.17 SCID через некоторое время (дни) после инокуляции.
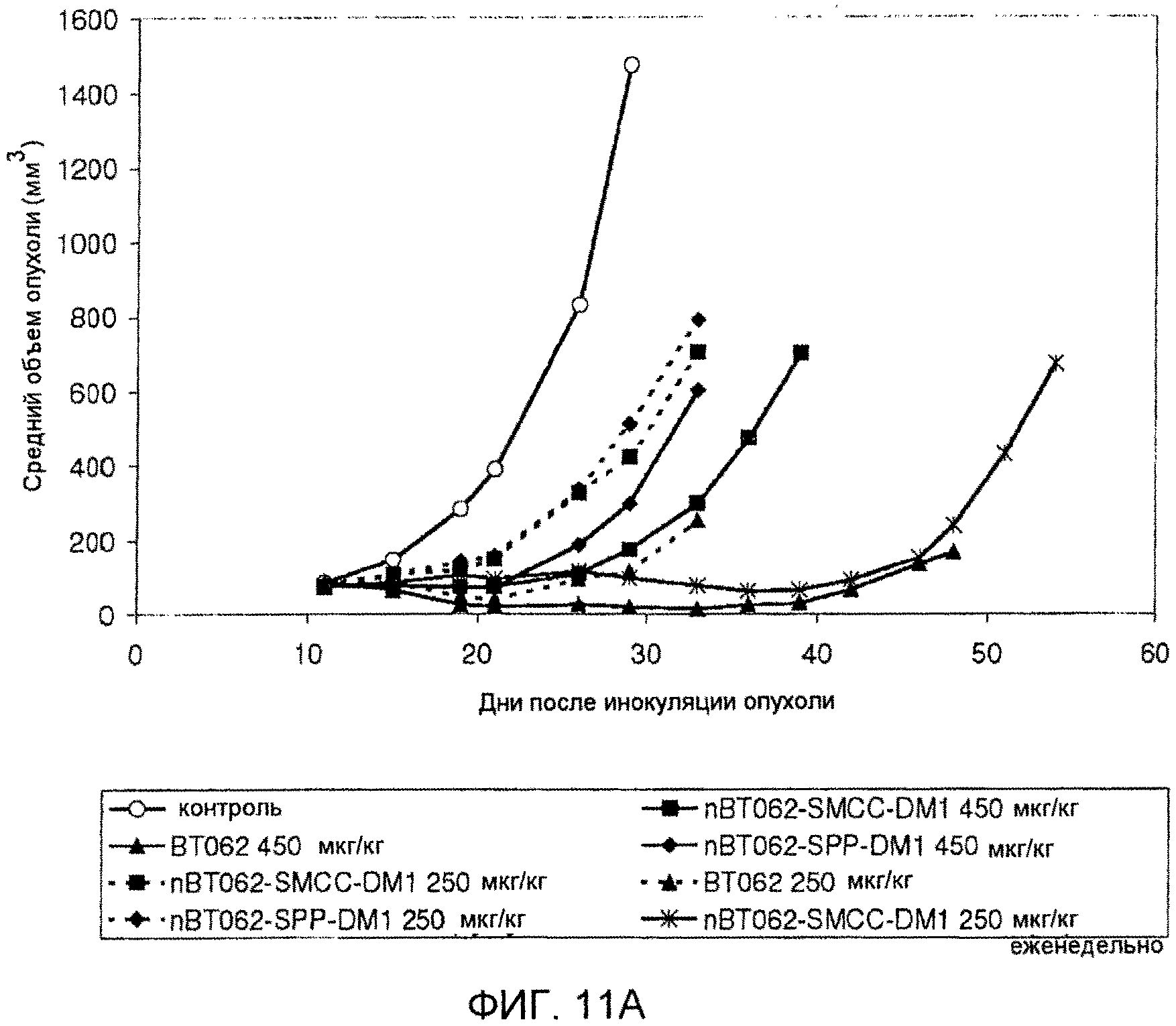
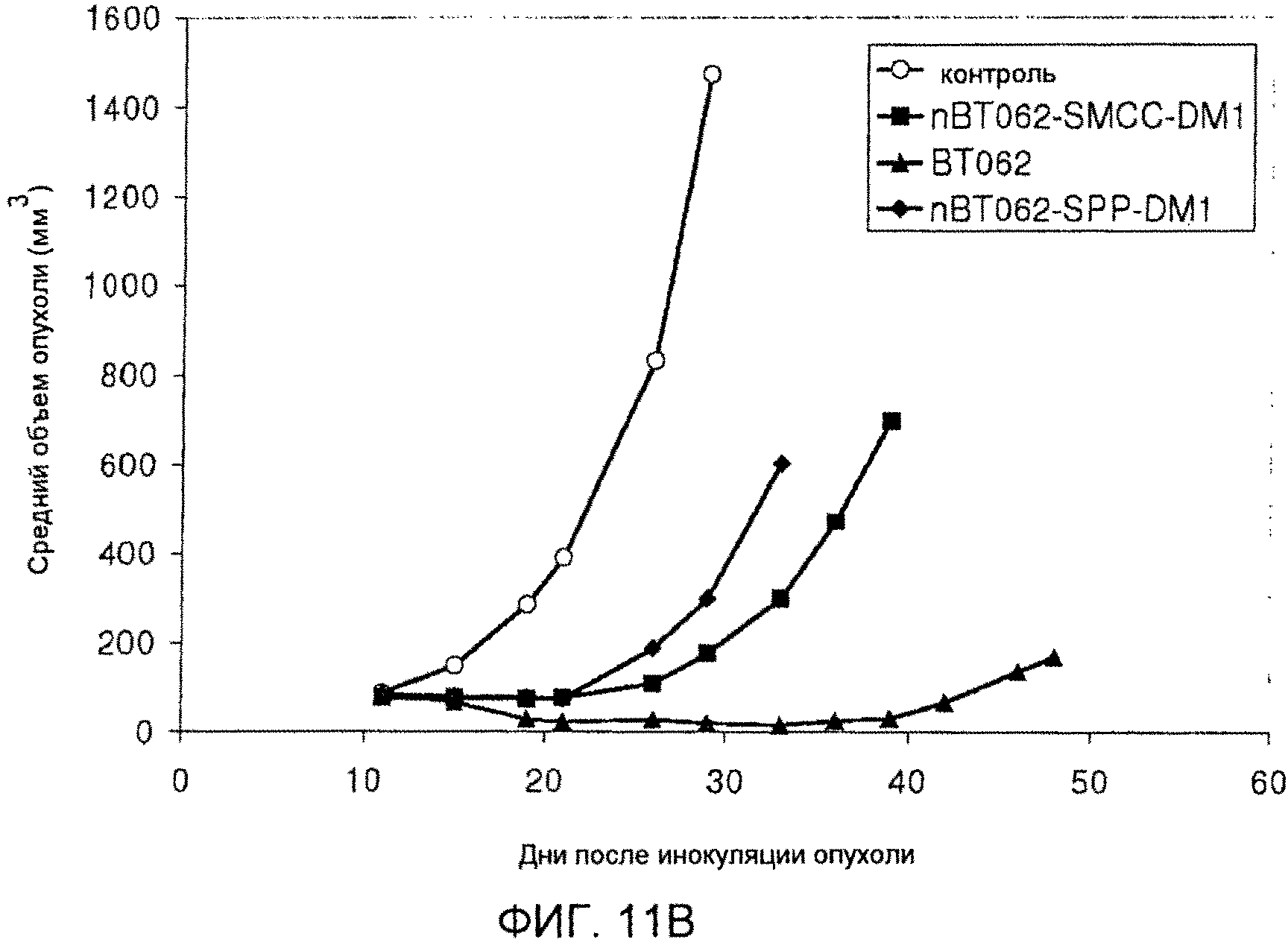
На фиг. 11 A и B показана противоопухолевая активность nBT062-DMx в отношении опухолевых клеток CD138+ MOLP-8 модели массивной опухоли MOLP-8 у мышей SCID. Объем опухоли приведен в виде среднего значения для каждой группы (+/-SD).
На фиг. 12 приведен график, отражающий противоопухолевую эффективность конъюгатов nBT062 и DMx на модели SCIDhu/INA-6 в отношении клеток множественной миеломы в среде костного мозга человека. Растворимый человеческий рецептор IL-6, продуцируемый клетками множественной миеломы (shuIL-6R), используют в качестве показателя опухолевой массы. Треугольники: nBT062-SPP-DM1, квадраты: nBT062-SPDB-DM4; ромбы: контроль-среда.
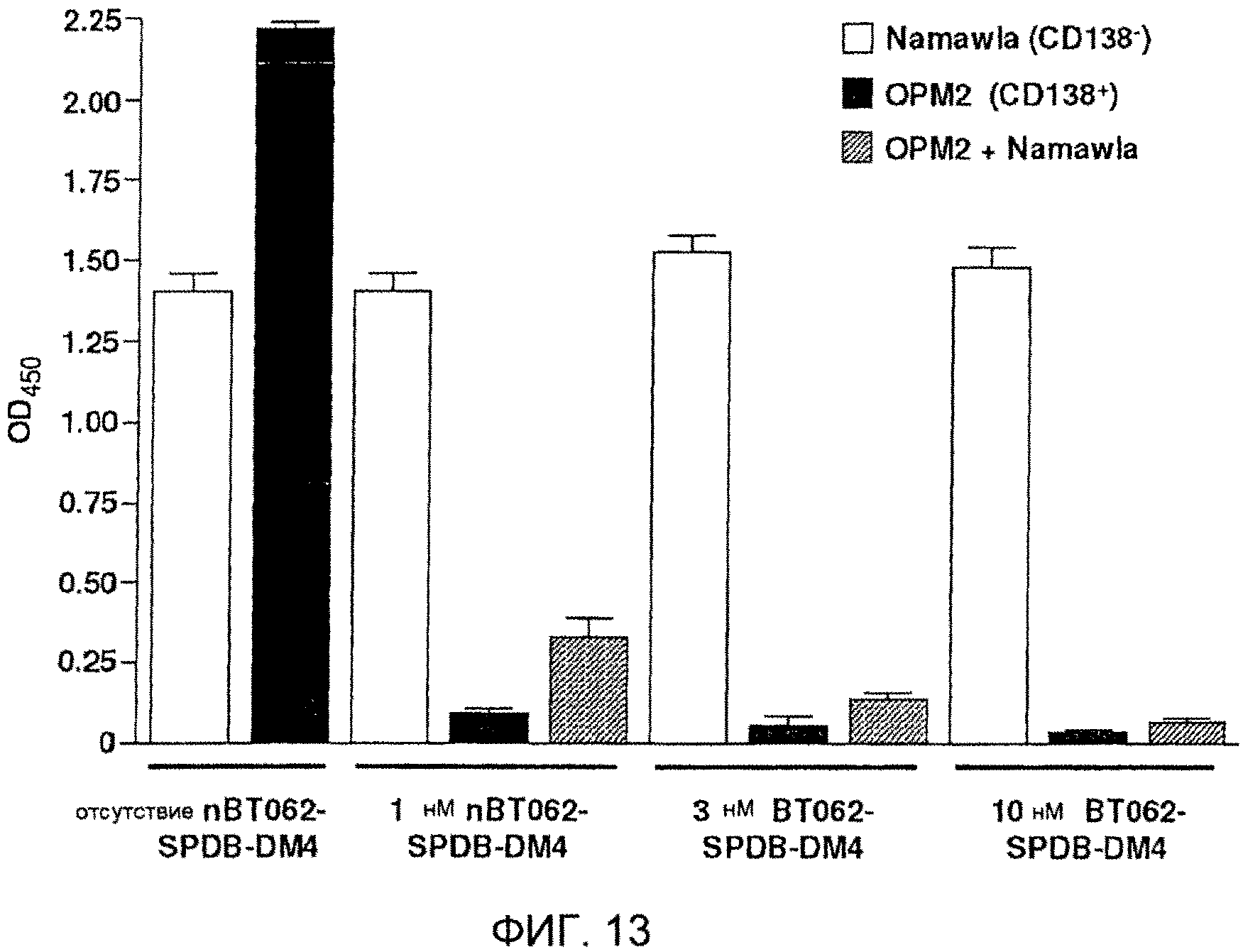
На фиг. 13 показано nBT062-SPDB-DM4-опосредованное уничтожение соседних клеток in vitro. CD138-положительные клетки OPM2 и CD138-отрицательные клетки Namawla культивируют с nBT062-SPDB-DM4 в разных концентрациях и определяют жизнеспособность клеток. Значения OD450 служат показателем жизнеспособности клеток.
Подробное описание разных и предпочтительных
воплощений данного изобретения
Настоящее изобретение относится к иммуноконъюгатам, содержащим средства, направленные на CD138, а также к доставке эффекторной молекулы (эффекторных молекул) иммуноконъюгатов к участкам-мишеням и к сайт-специфическому высвобождению эффекторной молекулы (эффекторных молекул) в целевых клетках, тканях или органах, или вблизи них. Более конкретно, настоящее изобретение относится к иммуноконъюгатам, содержащим средства, направленные на CD138, и к активным эффекторным молекулам, присоединенным к направляющему средству. Эффекторные молекулы могут активироваться в результате отщепления/диссоциации от направляющего фрагмента иммуноконъюгата в целевом участке.
Иммуноконъюгаты по настоящему изобретению можно вводить субъекту, нуждающемуся в терапевтическом лечении, или в клетки, полученные от такого субъекта, нуждающегося в терапевтическом лечении. Эффекторная молекула или эффекторные молекулы могут высвобождаться из иммуноконъюгата в результате отщепления/диссоциации в целевых клетках, тканях или органах, или вблизи них.
В одном примере иммуноконъюгат, содержащий антитело nBT062, направленное на клетки, экспрессирующие CD138, и, по меньшей мере, одно высокоэффективное цитотоксическое средство или токсин в качестве эффекторной молекулы, вводят пациенту, страдающему раком. В данном примере терапевтически эффективное количество иммуноконъюгата вводят пациенту внутривенно, после чего иммуноконъюгат локализуется в раковых клетках. Затем эффекторная молекула или эффекторные молекулы отделяются от антитела под действием природных факторов. После или в процессе отщепления эффекторная молекула может стабилизироваться в результате алкилирования и может диффундировать в соседние вспомогательные клетки, такие как клетки стромы, которые не экспрессируют CD138.
Во втором примере пациенту, страдающему раком, вводят иммуноконъюгат, содержащий антитело nBT062, которое направлено на клетки, экспрессирующие CD138, и, по меньшей мере, одно высокоэффективное цитотоксическое средство или токсин в качестве эффекторной молекулы, и другое цитотоксическое средство. В данном примере терапевтически эффективные количества иммуноконъюгата и цитотоксического средства совместно вводят пациенту внутривенно, после чего они локализуются в раковых клетках. Цитотоксическое средство разрушает более 50% раковых клеток, экспрессирующих CD138, однако иммуноконъюгат эффективно присоединяется к большему количеству раковых клеток, экспрессирующих CD138. Эффекторная молекула или эффекторные молекулы отделяются от антитела под действием природных факторов. После или в процессе отщепления эффекторная молекула может стабилизироваться в результате алкилирования и может диффундировать в соседние вспомогательные клетки, такие как клетки стромы, которые не экспрессируют CD138.
В третьем примере иммуноконъюгат, содержащий антитело nBT062 и, по меньшей мере, одно высокоэффективное цитотоксическое средство или токсин, вводят в популяцию клеток, полученную от ракового пациента. В данном примере количество иммуноконъюгата, вызывающее гибель клеток или прекращение непрерывного клеточного цикла, вводят в популяцию клеток, после чего иммуноконъюгат локализуется в раковых клетках. Эффекторная молекула или эффекторные молекулы отделяются от антитела под действием природных или внешних факторов, вызывая гибель или прекращение непрерывного клеточного цикла раковых клеток.
В четвертом примере пациенту, страдающему раком, вводят иммуноконъюгат, содержащий антитело nBT062 и, по меньшей мере, одно высокоэффективное цитотоксическое средство или токсин в качестве эффекторной молекулы. В данном примере терапевтически эффективное количество иммуноконъюгата вводят пациенту внутривенно, после чего иммуноконъюгат локализуется в раковых клетках. Эффекторная молекула или эффекторные молекулы отделяются от антитела под действием внешних факторов, вызывая гибель или прекращение непрерывного клеточного цикла раковых клеток.
CD138 или синдекан-1 (также обозначаемый SYND1; СИНДЕКАН; SDC; SCD1; CD138 ANTIGEN, номер доступа SwissProt: P18827 человеческий) является членом гликопротеина, который вначале был обнаружен на клетках эпителиального происхождения и затем на гематопоэтических клетках (Sanderson, 1989). CD138 содержит длинный внеклеточный домен, который связывается с растворимыми молекулами (например, с факторами роста EGF, FGF, HGF) и с нерастворимыми молекулами (например, с компонентами внеклеточного матрикса коллагеном и фибронектином) через цепи гепарансульфата (Langford, 1998; Yang, 2007) и действует как рецептор внеклеточного матрикса. CD138 также опосредует прилипание клеток друг к другу посредством гепарин-связывающих молекул, экспрессируемых прилипающими клетками. Показано, что CD138 может служить сорецептором факторов роста клеток миеломы (Bisping, 2006). Исследования дифференциации плазматических клеток демонстрируют, что CD138 следует рассматривать как антиген дифференциации (Bataille, 2006).
При злокачественном гематопоэзе CD138 интенсивно экспрессируется на большинстве клеток MM, карциномы яичника, карциномы почки, карциномы желчного пузыря, карциномы молочной железы, рака простаты, рака легкого, карциномы толстой кишки, ходжкинской и неходжкинской лимфом, хронического лимфолейкоза (CLL) (Horvathova, 1995), острого лимфобластного лейкоза (ALL), острого миелобластного лейкоза (AML) (Seftalioglu, 2003 (a); Seftalioglu, 2003 (b)), сарком твердых тканей, карциномы толстой кишки, а также на клетках других гематологических злокачественных заболеваний и солидных опухолей (Carbone et al., 1999; Sebestyen et al.,1999; Han et al., 2004; Charnaux et al., 2004; O'Connell et al.,2004; Orosz and Kopper, 2001).
Другие раковые заболевания, характеризующиеся экспрессией CD138, включают многие аденокарциномы яичников, переходно-клеточные карциномы мочевого пузыря, светлоклеточные карциномы почек, плоскоклеточные карциномы легких; карциномы молочной железы и раковые заболевания матки (см., например, Davies et al., 2004; Barbareschi et al., 2003; Mennerich et al., 2004; Anttonen et al., 2001; Wijdenes, 2002).
В нормальном гематопоэтическом компартменте человека экспрессия CD138 ограничивается плазматическими клетками (Wijdenes, 1996; Chilosi, 1999) и CD138 не экспрессируется на лимфоцитах, моноцитах, гранулоцитах и красных кровяных клетках периферической крови. В частности, стволовые клетки и клетки-предшественники CD34+ не экспрессируют CD138 и mAb против CD138 не влияют на число колониеобразующих единиц в культурах гематопоэтических стволовых клеток (Wijdenes, 1996). В негематопоэтических компартментах CD138 в основном экспрессируется на однослойном и многослойном эпителии легких, печени, кожи, почек и кишечника. На эндотелиальных клетках наблюдается лишь слабое окрашивание (Bernfield, 1992; Vooijs, 1996). Показано, что CD138 присутствует на полиморфных формах клеток лимфомы человека (Gattei, 1999).
Моноклональные антитела B-B4, BC/B-B4, B-B2, DL-101, 1D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, в особенности B-B4, описаны как специфичные к CD138. Из них B-B4, 1D4 и MI15 распознают как интактную молекулу, так и центральный белок CD138, причем показано, что они распознают такие же или близкородственные эпитопы (Gattei, 1999). Предыдущие исследования показывают, что B-B4 распознает CD138 только в мембраносвязанной форме, но не распознает растворимый CD138 (Wijdenes, 2002).
B-B4, мышиное mAb IgG1, связывается с линейным эпитопом между остатками 90 и 95 центрального белка человеческого синдекана-1 (CD138) (Wijdenes, 1996; Dore, 1998). Показано, что B-B4 в соответствии с характером экспрессии CD138 интенсивно взаимодействует с плазматической клеточной линией RPMI8226, но не взаимодействует с эндотелиальными клетками. Также в соответствии с харктером экспрессии CD138, B-B4 взаимодействует с линиями эпителиальных клеток A431 (полученными из кератиноцитов) и HepG2 (полученными из гепатоцитов). Иммунотоксин B-B4-сапорин тоже является высокотоксичным в отношении плазматической клеточной линии RPMI8226, фактически, значительно более токсичным, чем свободный сапорин. Однако показано, что из двух тестируемых эпителиальных клеточных линий B-B4-сапорин оказывает токсическое действие только на клеточную линию A431, хотя в клоногенном анализе B-B4 сапорин не ингибирует рост клеток A431 (Vooijs, 1996). Другие исследователи отмечают отсутствие специфичности MM-ассоциированных антигенов по отношению к опухолям (Couturier, 1999).
Термин антитело/иммуноконъюгат "состоящее по существу" из определенных компонентов, в контексте настоящего изобретения означает, что антитело/иммуноконъюгат состоит из указанных компонентов и любых других веществ или компонентов, которые не оказывают существенного влияния на основные характеристики антитела.
В соответствии с настоящим изобретением термин "опухолевая клетка" включает раковые клетки наряду с предраковыми клетками, которые могут необязательно образовывать часть солидной опухоли.
"Направляющее средство" или «средство против мишени» в соответствии с настоящим изобретением способно взаимодействовать с молекулой, экспрессируемой клеткой-мишенью, и включает как пептиды, так и не пептиды. В частности, направляющие средства в соответствии с настоящим изобретением включают антитела против мишени и отличные от иммуноглобулинов специфические молекулы, в основе которых могут лежать отличные от иммуноглобулинов белки, включающие, без ограничения, молекулы AFFILIN®, ANTICALINS® и AFFIBODIES®. Отличные от иммуноглобулинов направляющие молекулы включают не пептидные специфические молекулы, такие как олигонуклеотиды ДНК и РНК (аптамеры), а также физиологические лиганды, в особенности лиганды рассматриваемого антигена, такого как CD138.
"Направляющее антитело" или «антитело против мишени» в соответствии с настоящим изобретением представляет собой природное антитело или молекулу, в основе которой лежит природное, или синтетическое, или рекомбинантное антитело, которое связывается с антигеном на представляющих интерес клетках (клетках-мишенях). Направляющее антитело по настоящему изобретению включает моноклональное антитело, поликлональное антитело, полиспецифическое антитело (например, биспецифическое антитело) или фрагмент антитела. Направляющее антитело можно сконструировать, например, улучшая сродство антитела к клеткам-мишеням (Ross, 2003) или уменьшая его иммуногенность. Направляющее антитело можно присоединить к липосомальной композиции, содержащей эффекторные молекулы (Carter, 2003). Фрагмент антитела включает часть интактного антитела, предпочтительно, антиген-связывающий или вариабельный участок интактного антитела. Примеры фрагментов антител в соответствии с настоящим изобретением включают фрагменты Fab, Fab', F(ab')2 и Fv, а также диатела; доменные антитела (dAb) (Ward, 1989; Патент США 6005079); линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, полученные из фрагментов антител. В одноцепочечном вариабельном фрагменте антитела (scFv) тяжелые и легкие цепи (VH и VL) могут соединяться через короткий аминокислотный линкер, содержащий, например, последовательность (glycine4serine)n, которая является достаточно гибкой, чтобы позволить двум доменам образовать функциональный антиген-связывающий карман. Добавление разных сигнальных последовательностей может обеспечить более точную направленность направляющего антитела. Добавление константного участка легкой цепи (CL) может привести к димеризации посредством дисульфидных связей с повышением стабильности и авидности. Если mAb против представляющей интерес мишени является доступным, вариабельные участки для конструирования scFv можно получить методом ОТ-ПЦР путем клонирования вариабельных участков мРНК, экстрагированной из исходной гибридомы. Альтернативно scFv можно получить de novo методом фагового дисплея (Smith, 2001). В данном документе термин "функциональный фрагмент", используемый в применении к направляющему антителу, относится к части направляющего антитела, которая способна специфически связывать антиген, специфически связывающийся с указанным антителом. Биспецифическое антитело по настоящему изобретению, например, может содержать, по меньшей мере, одно плечо, обладающее реакционноспособностью в отношении ткани-мишени, и одно плечо, обладающее реакционноспособностью в отношении линкерного фрагмента (патентная публикация США 20020006379). Биспецифическое антитело по настоящему изобретению может связываться с несколькими антигенами на клетке-мишени (Carter, 2003). Антитело по настоящему изобретению можно модифицировать, например, путем введения остатков цистеина с получением тиольных групп (Olafsen, 2004).
В соответствии с настоящим изобретением направляющее антитело может быть получено из любого источника и может представлять собой, без ограничения, верблюжье антитело, мышиное антитело, химерное человеческое/мышиное антитело или химерное человеческое/обезьянье антитело, в особенности химерное человеческое/мышиное антитело, такое как nBT062.
Гуманизированные антитела, которые содержат последовательности человеческого и нечеловеческого антител, также входят в объем настоящего изобретения. Подходящие способы получения гуманизированных антител включают прививание CDR (прививание гипервариабельных участков) (EP 0239400; WO 91/09967; патенты США 5530101; и 5585089), венирование или восстановление поверхности (EP 0592106; EP 0519596; Padlan, 199; Studnicka et al., 1994; Roguska et al., 1994), перетасовку цепей (патент США 5565332) и DelmmunosationTM (Biovation, LTD). В случае прививания CDR, мышиные гипервариабельные участки (CDR), например, из mAb B-B4, прививают на каркасные участки человеческих вариабельных участков и затем присоединяют их к человеческим константным участкам с получением человеческого антитела B-B4 (hB-B4). Некоторые антитела, гуманизированные путем прививания CDR, такие как MYLOTARG (Sievers et al., 2001) and HECEPTIN (Pegram et al, 1998), в настоящее время применяются в клинике.
В технологии восстановления поверхности, используя сочетание методов молекулярного моделирования, статистического анализа и мутагенеза, изменяют поверхности не относящихся к CDR вариабельных участков антитела так, чтобы они напоминали поверхности известных антител нужного хозяина. Стратегии и способы восстановления поверхности антитела, а также другие способы уменьшения иммуногенности антител в организме другого хозяина раскрыты, например, в патенте США 5639641. Человеческие антитела можно получить с помощью ряда способов, известных в данной области, в том числе, с помощью методов фаговых дисплеев. См. также патенты США 4444887, 4716111, 5545806 и 5814318; и публикации международных патентных заявок WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741.
Направляющие антитела, которые в результате модификации отличаются от природных, такие как химерные человеческие/мышиные антитела или химерные человеческие/обезьяньи антитела, гуманизированные антитела или антитела, полученные рекомбинантными методами, например, с целью повышения сродства к клеткам-мишеням или уменьшения иммуногенности, а также фрагменты антител, в частности функциональные фрагменты таких направляющих антител, которые в результате модификации отличаются от природных, диатела; доменные антитела; линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, в данном описании называют рекомбинантные направляющие антитела.
Химерные антитела содержат связывающий участок (ABR или участок Fab) нечеловеческого антитела, например мышиного антитела, на основе которого их получают, тогда как все константные участки могут быть получены, например, из человеческого антитела. Как правило, химеризация и/или замена константных участков антитела не влияет на сродство антитела, поскольку участки антитела, участвующие в связывании антигена, не затрагиваются в процессе данной замены. В предпочтительном воплощении настоящего изобретения рекомбинантное, в частности химерное, антитело по настоящему изобретению может обладать более высоким сродством связывания (выраженным в виде значений KD), чем исходное нечеловеческое антитело. Например, антитело nBT062 и полученные на его основе антитела могут иметь более высокое сродство, чем мышиное антитело B-B4. В другом предпочтительном воплощении настоящего изобретения иммуноконъюгаты, содержащие указанные рекомбинантные/химерные антитела также могут обладать более высоким сродством. В некоторых воплощениях такие иммуноконъюгаты также могут обладать другими улучшенными свойствами, например, они могут более эффективно уменьшать массу опухоли, чем их B-B4-содержащие аналоги. В предпочтительном воплощении сродство связывания рекомбинантных, в особенности химерных направляющих антител, характеризуется константами диссоциации KD (нМ), составляющими менее чем 1,6, менее чем 1,5 или примерно 1,4 или менее, тогда как их мышиные аналоги имеют константы диссоциации KD (нМ), составляющие примерно 1,6 или более. Предпочтительные иммуноконъюгаты, содержащие направляющие средства, такие как направляющие антитела, могут характеризоваться константами диссоциации KD (нМ), составляющими менее чем 2,6, менее чем 2,5, менее чем 2,4, менее чем 2,3, менее чем 2,2, менее чем 2,1, менее чем 2,0, примерно 1,9 или менее, тогда как иммуноконъюгаты, содержащие исходные мышиные антитела, могут характеризоваться константами диссоциации KD (нМ), составляющими примерно 2,6 или более (см. таблицу 3, раздел Материалы и методы).
Также можно использовать полностью человеческие антитела. Селекцию данных антител можно проводить методом фагового дисплея, где CD138 или его антигенную детерминанту используют для селективного связывания фага, экспрессирующего, например, вариабельные участки B-B4 (см. Krebs, 2001). Чтобы улучшить аффинность антитела, данный метод можно объединить с методом аффинного созревания. Все антитела, описываемые в данном документе, представляют собой выделенные антитела.
В одном воплощении направляющее антитело в неконъюгированной форме интернализуется умеренно или слабо. Умеренная интернализация составляет примерно от 30% до 75% интернализации антитела, слабая интернализация составляет примерно от 0,01% до 30% интернализации после 3 часов инкубации при 37°C. В другом предпочтительном воплощении направляющее антитело, связывающееся с CD138, включает, например, антитела B-B4, BC/B-B4, B-B2, DL-101, 1D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, в особенности B-B4. Клетки гибридомы, которые получают путем гибридизации клеток миеломы SP02/0 с клетками селезенки мышей Balb/c, депонируют в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1, D-38124 Braunschweig, 11 декабря 2007. Указанные гибридомные клетки, экспрессирующие B-B4, имеют идентификационный номер DSM ACC2874. В другом воплощении направляющее антитело практически не связывается с CD138, экспрессирующимся не на клеточной поверхности. Если, в контексте настоящего изобретения название специфического антитела объединяют с термином "направляющее антитело", например, "направляющее антитело nBT062", это означает, что указанное направляющее антитело имеет такую же специфичность связывания, как и антитело nBT062. Если указано, что направляющее антитело "получено на основе" специфического антитела, это означает, что данное направляющее антитело имеет такую же специфичность связывания, как и указанное антитело, однако оно может принимать любую форму в соответствии с приведенным выше описанием направляющего антитела. Если, в контексте настоящего изобретения название специфического антигена объединяют с термином "направляющее антитело", например, "CD138-направляющее антитело", это означает, что указанное направляющее антитело обладает специфичностью связывания в отношении CD138. Если в контексте настоящего изобретения указано, что направляющее антитело выполняет некоторые функции "селективно", например, "селективно связывается с CD138, экспрессирующимся на клеточной поверхности", или является "селективным" в отношении определенных факторов, это означает, что существует достоверная селективность (т.е. более высокое сродство в отношении CD138-положительных клеток по сравнению с CD138-отрицательными клетками) в случае приведенного примера, в отношении CD138, экспрессирующегося на клеточной поверхности, по сравнению с любыми другими антигенами. Благодаря указанной селективности неблагоприятные побочные эффекты в конкретной среде значительно уменьшаются или даже отсутствуют.
"Отличные от иммуноглобулинов направляющие молекулы" в соответствии с настоящим изобретением включают направляющие молекулы, полученные из отличных от иммуноглобулинов белков, а также из непептидных направляющих молекул. Маленькие, отличные от иммуноглобулинов белки, которые входят в объем данного определения, конструируют таким образом, чтобы они имели специфическое сродство в отношении, в частности, экспрессирующегося на поверхности CD138. Указанные маленькие, отличные от иммуноглобулинов белки включают рекомбинантные молекулы на основе определенного каркаса, такие как such as Affilin®, которые имеют относительно низкую молекулярную массу, например от 10 кДа до 20 кДа. Подходящие каркасы включают, например, гамма-кристаллин. Такие молекулы в нативной форме не обладают специфической связывающей активностью в отношении молекул-мишеней. В результате модификации поверхностей белков методом генной инженерии посредством локально определенной рандомизации контактирующих с растворителем аминокислот получают совершенно новые участки связывания. Таким образом, несвязывающие исходные белки превращают в белки, способные к специфическому связыванию. Такие молекулы можно конкретно сконструировать так, чтобы они специфически связывали мишень, такую как CD138, и обеспечивали специфическую доставку одной или нескольких эффекторных молекул (см., scil Proteins GmbH на www.scilproteins.com, 2004). Другой вид отличных от иммуноглобулинов специфических молекул, получаемых из липокалинов, включает, например ANTICALINS®, который по структуре несколько напоминает иммуноглобулины. Однако липокалины состоят из одной полипептидной цепи, содержащей от 160 до 180 аминокислотных остатков. Связывающий карман липокалинов можно видоизменить так, чтобы он связывал представляющую интерес молекулу с высокими сродством и специфичностью (см., например, Beste et al., 1999). Искусственные бактериальные рецепторы, например, поставляемые на рынок под торговым наименованием Affibody® (Affibody AB), также входят в объем настоящего изобретения. Молекулы указанных искусственных бактериальных рецепторов представляют собой маленькие простые белки, которые могут состоять из трехспиральных жгутов на основе каркаса одного из IgG-связывающих доменов белка A (Staphylococcus aureus). Указанные белки имеют связывающие свойства, подобные связывающим свойствам многих иммуноглобулинов, однако их молекулярная масса значительно меньше, чем у иммуноглобулинов, и зачастую не превышает 10 кДа, кроме того, они являются сравнительно стабильными. Подходящие молекулы искусственных бактериальных рецепторов описаны, например, в патентах США 5831012; 6534628 и 6740734.
Другие "отличные от иммуноглобулинов направляющие молекулы" представляют собой физиологические лиганды рассматриваемого антигена. Например, физиологические лиганды CD138 включают, без ограничения, ADAMTS4 (аггреканаза-1), антитромбин-3, bFGF, катепсин G, CCL5 (RANTES), CCL7, CCL11, CCL17, CD44, коллагены (коллаген типа 1, коллаген типа 2, коллаген типа 3, коллаген типа 4, коллаген типа 5, коллаген типа 6), CXCL1, эластазу, gp120, HGF [фактор роста гепатоцитов], ламинин-1, ламинин-2, ламинин-5, мидкин, MMP-7, эластазу нейтрофилов и плейотропин (HBNF, HBGF-8). Непептидные специфические молекулы включают, без ограничения, олигонуклеотиды ДНК и РНК, которые связываются с CD138 (аптамеры).
"Эффекторная молекула" в соответствии с настоящим изобретением представляет собой молекулу, или ее производное, или аналог, которую присоединяют к направляющему средству, такому как направляющее антитело и/или сконструированное антитело против мишени, и которая оказывает желательное действие, например, вызывает апоптоз, или другой тип гибели клетки, или прекращение непрерывного клеточного цикла у клетки-мишени или клеток-мишеней. Эффекторные молекулы в соответствии с настоящим изобретением представляют собой молекулы, которые могут оказывать желательное действие на клетку-мишень и включают, без ограничения, токсины, лекарственные средства, в особенности низкомолекулярные цитотоксические средства, радионуклиды, модификаторы биологических ответов, порообразующие средства, рибонуклеазы, белки апоптотических сигнальных каскадов с апоптоз-индуцирующей активностью, цитотоксические ферменты, ферменты, активирующие пролекарства, антисмысловые олигонуклеотиды, антитела или цитокины, а также их функциональные производные или аналоги/фрагменты. Токсины могут включать бактериальные токсины, такие как, без ограничения, дифтерийный токсин или экзотоксин A, растительные токсины, включающие, без ограничения, рицин. Белки апоптотических сигнальных каскадов с апоптоз-индуцирующей активностью, включают, без ограничения, гранзим B, гранзим A, каспазу-3, каспазу-7, каспазу-8, каспазу-9, укороченный Bid (tBid), Bax и Bak.
В предпочтительном воплощении эффектор улучшает внутреннюю эффекторную доставку иммуноконъюгата, в особенности если нативная форма антитела, на основе которого получено направляющее антитело иммуноконъюгата, плохо интернализуется. В другом предпочтительном воплощении эффектор в нативной форме является неселективным. В некоторых воплощениях эффектор в нативной форме обладает высокой неселективной токсичностью, в том числе, системной токсичностью. "Нативная форма" эффекторной молекулы по настоящему изобретению представляет собой эффекторную молекулу перед присоединением к направляющему средству с получением иммуноконъюгата. В другом предпочтительном воплощении неселективная токсичность эффекторной молекулы практически отсутствует после конъюгирования с направляющим средством. В другом предпочтительном воплощении эффекторная молекула после достижения клетки-мишени вызывает ее гибель или прекращение непрерывного клеточного цикла в данной клетке. Молекула лекарственного средства-эффектора в соответствии с настоящим изобретением может представлять собой, без ограничения, лекарственное средство, включающее, например, маленькие средства с высокой цитотоксичностью, которые действуют как ингибиторы полимеризации тубулина, такие как майтансиноиды, доластатины, ауристатин и критофицин; ДНК-алкилирующие средства, такие как аналоги или производные CC-1065 (патенты США 5475092; 5585499; 6716821) и дуокармицин; энедииновые антибиотики, такие как каличемицин и эсперамицин; и активные таксоидные средства (таксан) (Payne, 2003). Особенно предпочтительны майтансиноиды и каличемицины. Эффектор-майтансиноид может иметь любое происхождение и включает, без ограничения, синтетический майтансинол, а также аналоги и производные майтансинола. Другие эффекторные молекулы, входящие в объем настоящего изобретения, включают доксорубицин, дауномицин, метотрексат, винбластин, неокарзиностатин, макромицин, тренимон и α-аманитин. В объем настоящего изобретения в качестве эффекторных молекул также входят антисмысловые молекулы ДНК. Если название, например, конкретного лекарственного средства или класса лекарственных средств упоминается вместе с термином "эффектор" или "эффекторная молекула", подразумевается эффектор иммуноконъюгата по настоящему изобретению, полученный на основе конкретного лекарственного средства или класса лекарственных средств.
Майтансин представляет собой природный продукт, изначально полученный из эфиопского кустарника Maytenus serrata (Remillard, 1975; Патент США 3896111). Это лекарственное средство ингибирует полимеризацию тубулина, вызывая прекращение митоза и гибель клетки (Remillard, 1975; Bhattacharyya, 1977; Kupchan, 1978). Цитотоксичность майтансина в 200-1000 раз превышает цитотоксичность используемых в клинике противораковых средств, которые влияют на полимеризацию тубулина, таких как алкалоиды барвинка или таксол. Однако клинические испытания показывают, что у майтансина отсутствует терапевтическое окно вследствие его высокой системной токсичности. Майтансин и майтансиноиды обладают высокой цитотоксичностью, однако их клиническое применение в противораковой терапии сильно ограничено вследствие тяжелых системных побочных эффектов, в основном, связанных с плохой селективностью майтансиноидов в отношении опухолей. Клинические испытания показывают, что майтансин оказывает тяжелое вредное воздействие на центральную нервную систему и желудочно-кишечную систему.
Майтансиноиды также выделяют из других растений, в том числе, из семян Trewia nudiflora (патент США 4418064).
Некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и сложные эфиры майтансинола C-3 (патент США 4151042).
Настоящее изобретение направлено на майтансиноиды любого происхождения, включающие синтетический майтансинол и аналоги майтансинола, которые раскрыты, например, в патентах США 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4362663; 4364866; 4371533; 4424219 и 4151042.
В предпочтительном воплощении майтансиноид представляет собой тиолсодержащий майтансиноид, более предпочтительно, полученный с помощью способов, раскрытых в патенте США 6333410, Chari et al, или в Chari et al.(Chari, 1992).
DM-1 (N2-деацетил-N2-(3-меркапто-1-оксопропил)майтансин) в контексте настоящего изобретения представляет собой предпочтительную эффекторную молекулу. DM1 в 3-10 раз более токсичен, чем майтансин, и его можно превратить в пролекарство путем присоединения через дисульфидную связь (дисульфидные связи) к моноклональному антителу, направленному против опухолеспецифического антигена. Некоторые из указанных конъюгатов (иногда называемых "активируемые опухолью пролекарства" (TAP)) не проявляют цитотоксичность в кровотоке, но активируются после связывания с клеткой-мишенью и интернализации, в результате чего происходит высвобождение лекарственного средства (Blattler, 2001). Разработано несколько конъюгатов антитело-DM1 (Payne, 2003), которые подвергались клиническим испытаниям. Например, huC242-DM1 после введения пациентам с раком толстой и прямой кишки хорошо переносится, не вызывает детектируемого иммунного ответа и долго пребывает в кровотоке (Tolcher, 2003).
Другие особенно предпочтительные майтансиноиды содержат боковую цепь, в состав которой входит стерически затрудненная тиольная связь, и включают, без ограничения, майтансиноиды N2'-деацетил-N2'-(4-меркапто-1-оксопентил)майтансин, также обозначаемый "DM3", и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтансин, также обозначаемый "DM4". Синтез DM4 показан на фиг. 3 и 4 и описан в данном документе. DM4 отличается от DM1 и DM3 тем, что он несет метильные группы на αC. Это вызывает стерическое затруднение при присоединении DM4 к направляющему средству, такому как nBT062, через линкер, в частности, без ограничения, через линкер, содержащий дисульфидную связь. Широкий ряд майтансиноидов, несущих стерически затрудненную тиольную группу (содержащую один или два заместителя, в особенности алкильные заместители, такие как метильные заместители DM4) раскрыт в публикации патента США 2004/0235840, опубликованной 25 ноября 2004, которая включена в данное описание в качестве ссылки во всей полноте. Стерическое затруднение, создаваемое алкильными группами, такими как метильные группы DM3 и DM4, присутствующие на атоме углерода, соседним с атомом серы, может влиять на скорость внутриклеточного расщепления иммуноконъюгата. Следовательно, вариабельный алкильный фрагмент может влиять на активность, эффективность и безопасность/токсичность in vitro и in vivo.
Как описано в публикации патента США 2006/0233814, такое затруднение индуцирует алкилирование (например, метилирование) свободного лекарственного средства после того, как лекарственное средство высвобождается на его мишени. Алкилирование может повышать стабильность, обеспечивая так называемый неспецифический эффект («bystander effect»). Однако, как может определить специалист в данной области, другие эффекторные молекулы, содержащие такие заместители, как алкильные группы, в положениях, обеспечивающих стерическое затруднение при присоединении эффектора к направляющему средству через линкер, являются частью настоящего изобретения (публикация патента США 2004/0235840). Предпочтительно указанное затруднение индуцирует химическую модификацию свободного средства, такую как алкилирование, которая повышает его общую стабильность и позволяет лекарственному средству не только индуцировать гибель клетки или прекращение непрерывного клеточного цикла в опухолевых клетках, экспрессирующих CD138, но и, необязательно, оказывать влияние на вспомогательные клетки, например, поддерживающие или защищающие опухоль от лекарственных средств, в частности клетки стромы опухоли и сосудистой сети опухоли, которые обычно не экспрессируют CD138, уменьшая или устраняя их поддерживающую или защитную функцию.
ДНК-алкилирующие средства также являются особенно предпочтительными в качестве эффекторных молекул и включают, без ограничения, аналоги или производные CC-1065. CC-1065 представляет собой активное противоопухолевое антибиотическое средство, выделяемое из культур Streptomyces zelensis, которое, как показано, обладает высокой цитотоксичностью in vitro (патент США 4169888). В объем настоящего изобретения входят, например, аналоги или производные CC-1065, описанные в патентах США 5475092, 5585499 и 5739350. Специалист в данной области может легко определить, что модифицированные аналоги или производные CC-1065, описанные в патенте США 5846545, и пролекарственные формы аналогов или производных CC-1065, описанные, например, в патенте США 6756397, также входят в объем настоящего изобретения. В некоторых воплощениях данного изобретения аналоги или производные CC-1065, например, можно синтезировать по способу, описанному в патенте США 6534660.
Другая группа соединений, которые можно использовать в качестве предпочтительных молекул, включает таксаны, особенно высокоактивные таксаны, а также таксаны, которые содержат тиольные или дисульфидные группы. Таксаны представляют собой яды митотического веретена, которые ингибируют деполимерзацию тубулина и приводят к увеличению скорости сборки микротрубочек и гибели клеток. Таксаны, входящие в объем настоящего изобретения раскрыты, например, в патентах США 6436931; 6340701; 6706708 и публикациях патентов США 20040087649; 20040024049 и 20030004210. Другие таксаны описаны, например, в патенте США 6002023, патенте США 5998656, патенте США 5892063, патенте США 5763477, патенте США 5705508, патенте США 5703247 и патенте США 5367086. Для специалистов в данной области очевидно, что ПЭГилированные таксаны, такие как таксаны, описанные в патенте США 6596757, также входят в объем настоящего изобретения.
Калихемициновые эффекторные молекулы в соответствии с настоящим изобретением включают гамма 1I, N-ацетилкалихемицин и другие производные калихемицина. Калихемицин связывается в последовательность-специфическим образом с малой бороздкой ДНК, после чего ДНК подвергается реаранжировке и воздействию свободных радикалов с последующим расщеплением двухцепочечной ДНК, приводящим к апоптозу и гибели клетки. Пример калихемициновой эффекторной молекулы, который можно использовать в контексте настоящего изобретения, описан в патенте США 5053394.
Иммуноконъюгат по настоящему изобретению содержит, по меньшей мере, одно направляющее средство, такое как направляющее антитело, и одну эффекторную молекулу. Иммуноконъюгат может содержать другие молекулы, например, обеспечивающие стабилизацию. В применении к иммуноконъюгатам термин "конъюгат", как правило, используют для обозначения функционального соединения направляющего средства с одной или несколькими эффекторными молекулами, причем данный термин не предназначается для обозначения какого-либо одного типа функционального соединения и не ограничивается химической "конъюгацией". Можно использовать любой способ соединения, при условии, что он позволяет сохранить способность направляющего средства связываться с участком-мишенью и обеспечивает достаточное предполагаемое функционирование присоединенного эффектора, в особенности после доставки к участку-мишени. Способы конъюгации в соответствии с настоящим изобретением включают, без ограничения, непосредственное присоединение эффекторной молекулы к направляющему антителу, необязательно с предварительной модификацией эффекторной молекулы и/или направляющего антитела, или присоединение через линкеры. В зависимости от реакционноспособности линкеры можно подразделить, например, на кислотолабильные линкеры, фотолабильные линкеры, линкеры, расщепляемые ферментами, такими как пептидазы. Для многих воплощений данного изобретения предпочтительны расщепляемые линкеры. Такие расщепляемые линкеры могут расщепляться в условиях, присутствующих в клеточной среде, в особенности во внутриклеточной среде, и не оказывают вредного влияния на лекарственное средство, высвобождающееся после расщепления. Низкие значения pH, например от 4 до 5, которые могут присутствовать в некоторых внутриклеточных компартментах, способствуют расщеплению кислотолабильных линкеров, тогда как фотолабильные линкеры могут расщепляться, например, под действием инфракрасного света. Однако предпочтительными являются линкеры, которые расщепляются под действием физиологическихх условий, присутствующих в большинстве клеток, и в данном описании называются физиологически расщепляемыми линкерами. Соответственно, дисульфидные линкеры являются предпочтительными для многих воплощений данного изобретения. Такие линкеры расщепляются в результате дисульфидного обмена, который может происходить в физиологических условиях. Предпочтительные гетеробифункциональные дисульфидные линкеры включают, без ограничения, N-сукцинимидил 3-(2-пиридилдитио)пропионат (SPDP) (см., например, Carlsson et al.(1978)), N-сукцинимидил 4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США № 4563304), N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP) (см., например, CAS регистрационный номер 341498-08-6), N-сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC) (см., например, Yoshitake et al., (1979)) и N-сукцинимидил 4-метил-4-[2-(5-нитропиридил)-дитио]пентаноат (SMNP) (см., например, патент США № 4563304). Наиболее предпочтительными для применения в композициях по настоящему изобретению линкерными молекулами являются SPP, SMCC и SPDB.
Другие подходящие линкеры, которые могут содержать "нерасщепляемые" связи, включают, без ограничения, сульфосукцинимидил малеимидометил циклогексан карбоксилат (SMCC), который представляет собой гетеробифункциональный линкер, способный связываться с соединениями, содержащими SH-группы. Бифункциональные и гетеробифункциональные линкерные молекулы, например углевод-специфические гетеробифункциональные линкерные молекулы, такие как S-(2-тиопиридил)-L-цистеингидразид (TPCH), также входят в объем настоящего изобретения (Vogel, 2004). Эффекторную молекулу, такую как майтансиноид, можно конъюгировать со специфическим антителом путем двустадийной реакции, первая стадия которой включает модификацию направляющего антитела поперечно-сшивающим реагентом, таким как N-сукцинимидилпиридилдитиопропионат (SPDP), с введением в направляющее антитело дитиопиридильных групп. На второй стадии к модифицированному антителу добавляют реакционноспособный майтансиноид, содержащий тиольную группу, такой как DM1, и, в результате замещения тиопиридильных групп модифицированного антитела получают цитотоксический конъюгат майтансиноид/антитело, содержащий дисульфидные связи (патент США 5208020). Однако одностадийные способы конъюгирования, например, раскрытые в публикации патента США 20030055226, Chari et al, также входят в объем настоящего изобретения. В одном воплощении настоящего изобретения к направляющему антителу присоединяют несколько одинаковых или разных эффекторных молекул. Как указано в данном описании, природа используемых линкеров может влиять на неспецифический цитолиз (Kovtun et al., 2006). См. также описание фиг. 13.
Аналоги или производные CC-1065 можно конъюгировать с направляющим средством, например, через ПЭГ-линкерные группы, как описано PEG в патенте США 6716821.
Калихемицины можно конъюгировать со специфическими антителами через линкеры (патент США 5877296 и патент США 5773001), или в соответствии со способами конъюгации, раскрытыми в патенте США 5712374 и патенте США 5714586. Другой предпочтительный способ получения конъюгатов калихемицина раскрыт в публикации патента США 20040082764. Иммуноконъюгаты по настоящему изобретению могут принимать форму рекомбинантных гибридных белков.
Термин "цитотоксические средства" включает "цитотоксические/противораковые средства", в том числе химиотерапевтические средства, такие как мелфалан, циклофосфамид, винкристин, доксорубицин и липосомальный доксорубицин (DOXIL), циклофосфамид, этопозид, цитарабин и цисплатин, кортикостероиды, такие как преднизон и дексаметазон, и такие средства, как талидомид, бортезомид, леналидомид, а также ингибиторы киназы, такие как сорафениб или HDAC (гистондеацетилаза), такие ингибиторы как ромидепсин, а также средства, ингибирующие рост, антигормональные средства, антиангиогенные средства, кардиозащитные средства, иммуностимулирующие средства, иммуносуппрессорные средства, ингибиторы ангиогенеза, ингибиторы протеинтирозинкиназы (PTK). Данное определение также охватывает цитотоксические средства на основе антител, включающие иммуноконъюгаты и антитела, обладающие известным в данной области цитотоксическим эффектом. Предпочтительным является антитело против CD40. Другие антитела включают, без ограничения, например, AVASTIN (бевацизумаб) или MYELOMACIDE (милатузумаб).
THALOMID (α-(N-фталимидо)глутаримид; талиомид) представляет собой иммуномодулирующее средство. Талидомид имеет эмпирическую формулу C13H10N2O4 и грамммолекулярный вес 258,2. CAS-номер талидомида 50-35-1. Он имеет несколько механизмов действия, включающих ингибирование разными путями роста и выживания клеток миеломы и ингибирование роста новых кровеносных сосудов.
VELCADE представляет собой ингибитор протеасомы, используемый для лечения множественной миеломы. Полагают, что VELCADE действует на клетки миеломы, вызывая их гибель, и/или он действует косвенно, ингибируя рост и выживание клеток миеломы путем влияния на микросреду кости. Таким образом, без связи с какой-либо конкретной теорией или способом действия, VELCADE нарушает нормальные клеточные процессы, приводя к ингибированию протеасом и инициации апоптоза.
REVLIMID представляет собой иммуномодулирующее средство. Полагают, что REVLIMID действует на несколько путей в клетках миеломы, индуцируя апоптоз, ингибируя рост клеток миеломы и фактор роста эндотелия сосудов (VEGF), что приводит к ингибированию ангиогенеза и уменьшению адгезии клеток миеломы к стромальным клеткам костного мозга.
Дексаметазон представляет собой синтетический глюкокортикоидный стероидный гормон, который действует как противовоспалительное и иммуносуппрессорное средство. При введении раковым пациентам дексаметазон может нейтрализовать побочные эффекты противораковой терапии. Дексаметазон можно вводить отдельно или вместе с другими противораковыми средствами, включающими талидомид, адриамицин или винкристин.
Термин "в сочетании с" не ограничивается одновременным введением. Данный термин охватывает введение иммуноконъюгата по настоящему изобретению и другого терапевтического режима (например, лучевой терапии) или средства, включающего описанные выше цитотоксические средства, последовательно и через определенные интервалы времени, так, чтобы они могли действовать вместе, вызвая улучшение в большей степени, чем иммуноконъюгат по настоящему изобретению или, например, другое средство или средства по отдельности. Предпочтительно, если иммуноконъюгат и другое средство или средства действуют аддитивно, и особенно предпочтительно, если они действуют синергически. Такие молекулы обычно используют в количествах, эффективных для предполагаемой цели. Опытный врач может определить подходящую дозу или дозы каждого терапевтического средства, а также подходящие временные режимы и способы введения эмпирически или на основании данных о фармакокинетике и способах действия средств. Термин "совместное введение" в контексте настоящего изобретения относится к введению одновременно с иммуноконъюгатом, зачастую в одной лекарственной форме.
Термин "идентичность последовательностей" относится к мере идентичности нуклеотидных или аминокислотных последовательностей. Как правило, последовательности выравнивают, чтобы получить наивысший порядок совпадений. "Идентичность" сама по себе имеет известное в данной области определение и может рассчитываться с помощью опубликованных методов. (См., например: Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991). Хотя существуют разные способы измерения идентичности двух полинуклеотидных или полипептидных последовательностей, термин "идентичность" хорошо известен специалистам в данной области (Carillo, H. & Lipton, D., SIAM J Applied Math 48:1073 (1988)).
Является ли конкретная молекула нуклеиновой кислоты идентичной, например, нуклеотидной последовательности nBT062 или ее части, по меньшей мере, на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, можно определить традиционными способами с помощью известных компьютерных программ, таких как DNAsis (Hitachi Software, San Bruno, Calif.), выполняя исходное выравнивание последовательностей с помощью программы для выравнивания нескольких последовательностей ДНК/белка ESEE, версия 3.0 (cabot@trog.mbb.sfu.ca).
Является ли аминокислотная последовательность идентичной, например SEQ ID NO:1 или SEQ ID NO:2, или ее части, по меньшей мере, на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, можно определить традиционными способами с помощью известных компьютерных программ, таких как BESTFIT (пакет для анализа последовательностей Wisconsin, версия 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, Wis. 53711). Для поиска сегмента наилучшей гомологии двух последовательностей BESTFIT использует алгоритм локальной гомологии Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981).
При использовании DNAsis, ESEE, BESTFIT или любой другой программы для выравнивания последовательностей, чтобы определить, действительно ли конкретная последовательность, например, на 95% идентична последовательности сравнения в соответствии с настоящим изобретением, параметры устанавливают таким образом, чтобы процент идентичности рассчитывался по всей длине нуклеотидной или аминокислотной последовательности сравнения и чтобы пробелы в гомологии составляли до 5% от общего числа нуклеотидов последовательности сравнения.
Если в контексте настоящего изобретения делается ссылка на некоторую идентичность последовательностей с сочетанием остатков конкретной последовательности, указанная идентичность последовательности относится к сумме всех указанных остатков.
Основная молекула антитела представляет собой бифункциональную структуру, где вариабельные участки связывают антиген, а оставшиеся константные участки могут обуславливать антиген-независимые ответы. Основные классы антител, IgA, IgD, IgE, IgG и IgM определяются константными участками. Данные классы можно дополнительно подразделить на подклассы (изотипы). Например, класс IgG имеет четыре изотипа, а именно IgG1, IgG2, IgG3 и IgG4, в зависимости от природы константных участков. Известно, что среди разных классов человеческих антител эффективно активируют систему комплемента только человеческие IgG1, IgG2, IgG3 и IgM. Хотя константные участки не образуют антиген-связывающих центров, конфигурация константных участков и шарнирного участка может придавать молекуле сегментную гибкость, которая обеспечивает связывание с антигеном.
Разные изотипы IgG могут связываться с рецепторами Fc на клетках, таких как моноциты, B-клетки и NK-клетки, что приводит к активации клеток и высвобождению цитокинов. Разные изотипы также могут активировать комплемент, вызывая локальное или системное воспаление. В частности, разные изотипы IgG могут связывать FcyR с разной интенсивностью. FcyR составляют группу поверхностных гликопротеинов, которые принадлежат к суперсемейству Ig и экспрессируются, в основном, на лейкоцитах. Гликопротеины FcyR разделяют на три класса, обозначаемые FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). В то время как IgG1, IgG2 и IgG3 прочно связываются с рядом гликопротеинов FcyR указанных классов, IgG4 связывается с ними гораздо слабее. В частности, IgG4 представляет собой средство, связывающее FcγRI с промежуточной интенсивностью, которое индуцирует относительно низкую ADCC (антитело-зависимую клеточную цитотоксичность), или совсем не индуцирует ADCC, и не связывающее FcγRIIIA или FcγRIIA. IgG4 также слабо связывает FcγRIIB, который является ингибиторным рецептором. Кроме того, IgG4 опосредует, причем необязательно, только слабую фиксацию комплемента и слабую комплемент-зависимую цитотоксичность (CDC). В контексте настоящего изобретения IgG4 можно конкретно использовать для предотвращения Fc-опосредованного нацеливания печеночного FcR, поскольку он не взаимодействует с FcRγII на LSEC (синусоидальные эндотелиальные клетки печени), слабо взаимодействует или не взаимодействует с FcRγI-III на купферовских клетках (макрофагах) и не взаимодействует с FcRγIII на печеночных NK-клетках. Некоторые мутации, которые дополнительно уменьшают CDC, также входят в объем настоящего изобретения. Например, показано, что остатки IgG4 в положениях 327, 330 и 331 уменьшают ADCC (антитело-зависимую клеточную цитотоксичность) и CDC (Amour, 1999; Shields, 2001). Одна или несколько мутаций, стабилизирующих антитело, также являются частью настоящего изобретения (также называемые "стабилизирующие мутации"). Указанные мутации включают, в частности, замены лейцина на глутаминовую кислоту в участке CH2 IgG4 и серина на пролин в шарнирном участке IgG4. В некоторых воплощениях изобретения указанные мутации уменьшают количество половинных молекул до менее 10%, менее 5% и, предпочтительно, менее 2% или 1%. Кроме того, период полужизни in vivo стабилизированных таким образом молекул может увеличиваться до нескольких дней, и составлять, например, 1, 2, 3, 4, 5 или более дней (Schuurman, 1999).
Направляющие средства, включающие раскрытые в настоящем документе направляющие антитела, могут быть описаны или определены с точки зрения их связывающего сродства к антигену, в частности к CD138. Предпочтительное сродство связывания направляющих средств, таких как направляющие антитела, характеризуется константой диссоциации KD (нМ), составляющей менее чем 1,6, менее чем 1,5 или примерно 1,4 или менее. В случае иммуноконъюгатов, содержащих указанные направляющие средства, такие как направляющие антитела, предпочтительные значения константы диссоциации KD (нМ) менее чем 1,6, менее чем 1,5, или менее чем 2,5, менее чем 2,4, менее чем 2,3, менее чем 2,2, менее чем 2,1, менее чем 2,0, или примерно 1,9 или менее.
Антиген-связывающий участок (ABR) в соответствии с настоящим изобретением варьирует в зависимости от типа используемого направляющего антитела или сконструированного направляющего антитела. В природном антителе и в большинстве химерных и гуманизированных антител антиген-связывающий участок состоит из легкой цепи и первых двух доменов тяжелой цепи. Однако в антителе, которое состоит из тяжелых цепей и не содержит легкие цепи, антиген-связывающий участок состоит, например, только из первых двух доменов тяжелой цепи, тогда как в одноцепочечном антителе (ScFv), которое объединяет в одной полипептидной цепи вариабельные домены легкой и тяжелой цепи молекулы антитела, ABR представлен только одной полипептидной молекулой. Фрагменты FAB, которые обычно получают в результате расщепления папаином, содержат одну легкую цепь и часть тяжелой цепи и, следовательно, содержат ABR, состоящий только из одного антиген-связывающего участка. С другой стороны, диатела представляют собой маленькие фрагменты антител, содержащие два антиген-связывающих участка. Однако в контексте настоящего изобретения антиген-связывающий участок направляющего антитела или сконструированного антитела против мишени представляет собой любой участок, который в первую очередь определяет специфичность связывания направляющего антитела или сконструированного антитела против мишени.
Если указано, что ABR или дополнительный участок направляющего антитела относится к "определенному антителу", например к человеческому или нечеловеческому антителу, в контексте настоящего изобретения это означает, что ABR либо идентичен соответствующему природному ABR, либо получен на его основе. Считается, что ABR получен на основе природного ABR, если он имеет специфичность связывания природного ABR. Однако такой ABR может содержать, например, точечные мутации, добавления, делеции или посттрансляционные модификации, такие как гликозилирование. Такой ABR может быть, например, более чем на 70%, более чем на 80%, более чем на 90%, предпочтительно, более чем на 95%, более чем на 98% или более чем на 99% идентичен последовательности природного ABR.
Гомогенная направленность направляющего средства, такого как направляющее антитело, в особенности содержащего его иммуноконъюгата, в контексте настоящего изобретения представляет собой меру вариаций, связанных с получением желательного результата указанной специфичности направляющего средства. В некоторых воплощениях данного изобретения целевой результат получают в результате простого связывания с мишенью. Данная ситуация, например, связана с воплощениями, в которых конкретное направляющее средство обеспечивает защиту от последующего связывания. Однако гомогенность направляющего средства можно легко оценить, например, по эффективности иммуноконъюгата, содержащего указанное направляющее средство. Например, эффективность указанного иммуноконъюгата, содержащего эффектор, способствующий разрушению опухолевых клеток и/или прекращению роста опухоли, в отношении опухолевого антигена, такого как CD138, можно определить по степени подавления роста опухоли, которая содержит клетки, экспрессирующие антиген CD138. Эффективность такого иммуноконъюгата может варьировать. Он может, например, иногда прекращать рост опухоли с высокой эффективностью, а в других случаях с эффективностью, едва превышающей эффективность контроля. С другой стороны, низкая вариация эффективности иммуноконъюгата показывает, что иммуноконъюгат и/или направляющее средство, соответственно, неизменно обеспечивает желательный результат. Способ количественного определения гомогенности заключается в расчете вариации специфичности. В контексте прекращения роста опухоли под действием иммуноконъюгата, содержащего конкретное направляющее средство, вариацию специфичности можно рассчитать путем определения вначале времени, в течение которого опухоль достигает заданного объема, например 300 мм3. Предпочтительно заданный объем выбирают так, чтобы рост любой опухоли до и после достижения указанного заданного объема непрерывно увеличивался примерно с одной и той же скоростью. После определения такого времени для группы субъектов рассчитывают среднее значение указанного времени (Tm) в группе субъектов (например, мышей SCID или других подходящих моделей с гомогенным ростом опухоли). Затем Tm сопоставляют с данными, полученными для субъекта группы, имеющего минимальную эффективность направленности, и, следовательно, связанного с опухолями, которым нужно минимальное время (Tf) для достижения указанного заданного объема, и, с другой стороны, с данными, полученными для субъекта группы, имеющего максимальную эффективность направленности, и, следовательно, связанного с опухолями, которым нужно максимальное время (Ts) для достижения указанного заданного объема, путем расчета вариации специфичности для заданного объема по следующей формуле:
Вариация специфичности [%] = Ts-Tf/Tm×100
В предпочтительном воплощении вариация специфичности иммуноконъюгата, содержащего сконструированное антитело против мишени по настоящему изобретению, составляет менее 150%, менее 140%, менее 130%, менее 120%, менее 110%, менее 100%, менее 90%, менее 80%, менее 70%, менее 60%, или менее 50%, а в некоторых воплощениях даже менее 45%. Предпочтительно, вариация специфичности находится в интервале примерно от 10% до 150%, предпочтительно примерно от 10% до 100%, примерно от 10% до 80%, примерно от 10% до 70%, примерно от 10% до 60%, примерно от 10% до 50%.
Гомогенность направленности также можно количественно определить с помощью других способов, например путем определения замедления роста опухоли. Кроме того, что очевидно для специалиста в данной области, объем опухоли представляет собой только один параметр, на основе которого можно определить вариацию специфичности. В зависимости от желательного результата, можно использовать другие параметры, включающие время (например, при измерении замедления роста опухоли) или % связывания. Специалист в данной области может легко установить такие параметры.
На фиг. 9 в секциях (C) и (D) показаны различия гомогенности направленности/связывания среди иммуноконъюгатов, содержащих мышиное антитело BB4 (BB4-SPP-DM1; фиг. 9C) и полученное на его основе сконструированное антитело против мишени nBT062 (nBT062-SPP-DM1; фиг. 9D). Как можно видеть из указанных графиков, результаты, полученные с использованием иммуноконъюгата, содержащего сконструированное антитело против мишени, являются значительно более гомогенными, чем результаты, полученные с использованием иммуноконъюгата, содержащего мышиное антитело. Это имеет особое значение, поскольку связывающий участок антитела BB4 не модифицируют при получении nBT062. Таким образом, иммуноконъюгат, содержащий связывающий участок мышиного антитела, но не другие фрагменты мышиного антитела, имеет свойства, значительно превышающие результаты, которые может ожидать специалист в данной области.
nBT062 (см. также фиг. 1) представляет собой мышино-человеческое химерное mAb IgG4, химерную версию B-B4. Данную химерную версию B-B4 получают с целью уменьшения ответа HAMA (опосредованного человеческими антителами против мышиных антител), сохраняя функциональные свойства участка антитела B-B4, связывающего CD138. Неожиданно обнаружено, что результаты, полученные с использованием иммуноконъюгата, содержащего сконструированное антитело против мишени, являются гораздо более гомогенными (вариации результатов уменьшаются). Способ получения nBT062 описан ниже. Клетки яичников китайского хомяка, экспрессирующие nBT062, депонируют в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, MascheroderWeg 1, D-38124 Braunschweig, 11 декабря 2007. Идентификационный номер DSM ACC2875. Направляющее химерное антитело против CD138, полученное на основе B-B4, в данном описании обычно обозначают с-B-B4.
Аминокислотные последовательности тяжелых и легких цепей теоретически выводятся на основе трансляции нуклеотидной последовательности, кодирующей nBT062. Теоретические аминокислотные последовательности тяжелых и легких цепей приведены в таблице 1. Теоретические вариабельные участки выделены жирным шрифтом, теоретические CDR подчеркнуты.
BT062 представляет собой иммуноконъюгат, содержащий CD138-направляющее химерное антитело nBT062, которое присоединяется через линкер, здесь SPDB, к цитостатическому производному майтансиноида DM4. Химическая схема BT062 приведена на фиг. 1 и 2. Иммуноконъюгаты, содержащие nBT062 и майтансиноидную эффекторную молекулу, зачастую характеризуются с учетом линкера и майтансиноидного эффектора, например, nBT062-SMCC-DM1 представляет собой иммуноконъюгат, содержащий nBT062, SMCC ("нерасщепляемый" линкер, содержащий сложную тиоэфирную связь) и DM1 в качестве эффектора. В более общем случае иммуноконъюгат, содержащий nBT062 и эффекторную молекулу, также можно обозначить как nBT062-линкер-эффектор или только как nBT062-эффектор (nBT062N, где N представляет собой любой описанный здесь эффектор).
В данном описании упоминается стерически незатрудненный аналог (UI: назатрудненный иммуноконъюгат) иммуноконъюгата, содержащий сконструированное антитело против мишени против CD138, присоединенное к эффекторной молекуле через расщепляемый линкер (CL), обозначаемый здесь как UICL, который противопоставляется иммуноконъюгату, в котором указанная эффекторная молекула стерически затруднена, и содержит расщепляемый линкер (HICL - затрудненный иммуноконъюгат, расщепляемый линкер). UICL представляет собой иммуноконъюгат, эквивалентный HICL, содержащему сконструированное антитело против мишени, в котором, однако, эффекторная молекула не является стерически затрудненной. Примером пары HICL/UICL являются BT062 и nBT062-SPP-DM1. Незатрудненный аналог такого иммуноконъюгата, содержащий нерасщепляемый линкер (UINCL), относится к эквивалентному иммуноконъюгату, содержащему сконструированное антитело против мишени, в котором эффекторная молекула стерически не затруднена, и который содержит нерасщепляемый линкер. nBT062-SMCC-DM1 является примером незатрудненного аналога BT062, содержащего нерасщепляемый линкер (UNICL).
Ингибирующая активность иммуноконъюгата в отношении роста опухоли (= ингибирующая активность в отношении опухолевого роста) является относительной мерой. Она описывает ингибирующую активность конъюгата в отношении опухолевого роста по сравнению с активностью иммуноконъюгата, обладающего наивысшей эффективностью, активность которого принимается за 100%. Например, если активность иммуноконъюгата, например BT062, который вызывает задержку роста опухоли (TGD) на 32 дня, принимают за 100%, активность, например, nBT062-DM1, который вызывает задержку роста опухоли (TGD) на 18 дней, рассчитывают следующим образом:
Ингибирующая активность в отношении опухолевого роста =
100×(TGDnBT062-DM1/TGDBT062),
в более общем случае:
Ингибирующая активность в отношении опухолевого роста =
100×(TGDобразца/TGDэталона).
В таблице 3 приведены подходящие примеры на основе результатов, изображенных на фиг. 11B:
В примере, приведенном в таблице 2, BT062 проявляет ингибирующую активность в отношении роста опухоли, которая превышает соответствующую активность незатрудненного аналога (nBT062-SPP-DM1) на 60%, и ингибирующую активность в отношении роста опухоли, которая превышает соответствующую активность незатрудненного аналога иммуноконъюгата, содержащего нерасщепляемый линкер (nBT062-SMCC-DM1), на 44%.
Описано, что расщепляемый линкер, например, в иммуноконъюгатах huC242-майтансиноид может вызывать так называемый неспецифический эффект. Goldmahker et al. (публикация патента США 2006/0233814) также описывают, что неспецифический эффект, в частности, индуцируется, если эффекторная молекула после отщепления от направляющего средства подвергается дополниетльной модификации, такой как алкилирование. Goldmahker et al. также демонстрируют, что UICL вызывают TGD более эффективно, чем соответствующие UINCL (см., например, фиг. 6 публикации патента США 2006/0233814).
Однако общая эффективность иммуноконъюгатов HICL/UICL/UINCL варьирует от иммуноконъюгата к иммуноконъюгату и/или от мишени к мишени. Например, HICL трастузумаб-SPP-DM4 по способности уменьшать размер опухоли отчетливо превосходит UINCL трастузумаб-SMCC-DM1, тогда как эффективность иммуноконъюгата UICL трастузумаб-SPP-DM1 практически такая же, как у соответствующего HICL (см. публикацию патента США 2008/0171040, Eberts et al.), что воспроизводит данные, полученные по функционированию иммуноконъюгата и мишени.
В данном исследовании обнаружена еще одна закономерность. Хотя HICL превосходит UICL и UNICL, неожиданно было обнаружено, что применение UICL в высокой однократной дозе (250 мкг/кг) в действительности не приводит к получению более хороших результатов, чем применение UINCL. Фактически, при применении UICL в таком режиме наблюдаемая TGD в днях реально ниже, чем при применении UINCL. Данный факт становится более заметным при увеличении дозы (450 мкг/кг). Итак, как показано на фиг. 11A, HICL превосходит UICL в экспериментах с использованием как однократных, так и многократных (не показано) доз, в неожиданной степени. Кроме того, неожиданно было обнаружено, что UICL превосходит UINCL при применении в более высоких дозах.
Направляющие средства, в особенности направляющие антитела и/или раскрытые здесь иммуноконъюгаты, можно вводить любым способом, в том числе внутривенно, парентерально, перорально, внутримышечно, интратекально или в виде аэрозоля. Способ доставки зависит от желаемого эффекта. Опытный специалист может легко выбрать наилучший способ введения для конкретного способа лечения по настоящему изобретению. Соответствующая доза зависит от способа введения и предписанного лечения и может быть легко установлена опытным специалистом с учетом существующих в настоящее время способов лечения.
Фармацевтические композиции, содержащие в качестве активных ингредиентов неконъюгированное направляющее средство, иммуноконъюгат по настоящему изобретению и/или любое другое цитотоксическое средство, можно получить с помощью традиционных способов получения фармацевтических препаратов. См., например, Remington's Pharmaceutical Sciences, 17th Ed. (1985, Mack Publishing Co., Easton, Pa.). Как правило, активные ингредиенты в эффективных количествах смешивают с фармацевтически приемлемым носителем. Носитель может широко варьировать в зависимости от формы препарата, используемой для введения, такого как внутривенное введение, пероральное введение, парентеральное введение, интратекальное введение, чрезкожное введение или введение в виде аэрозоля.
В случае перорального введения направляющее средство, и/или иммуноконъюгат, и/или цитотоксическое средство могут входить в состав твердых или жидких форм, таких как капсулы, пилюли, таблетки, пастилки, расплавы, порошки, суспензии или эмульсии. Для получения композиций в виде пероральных лекарственных форм можно использовать любые традиционные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты, ароматизирующие средства, консерванты, окрашивающие средства, суспендирующие средства и т.п., в случае пероральных жидких препаратов (таких как, например, суспензии, эликсиры и растворы); или такие носители, как крахмалы, сахара, разбавители, гранулирующие средства, смазывающие средства, связующие средства, дезинтегрирующие средства и т.п., в случае пероральных твердых препаратов (таких как, например, порошки, капсулы и таблетки). Вследствие простоты введения таблетки и капсулы представляют собой наиболее предпочтительную пероральную стандартную лекарственную форму, для получения которой, естественно, используют твердые фармацевтические носители. При желании таблетки могут иметь сахарное или энтеросолюбильное покрытие, которое наносят с помощью стандартных методов. Активное средство должно быть стабильным при прохождении через желудочно-кишечный тракт. При необходимости можно использовать подходящие средства, обеспечивающие стабильное прохождение, которые могут включать фосфолипиды или производные лецитина, описанные в литературе, а также липосомы и микрочастицы (в том числе, микросферы и макросферы).
В случае парентерального введения направляющее средство, и/или иммуноконъюгат, и/или цитотоксическое средство можно растворить в фармацевтическом носителе и ввести в виде раствора или суспензии. Примерами подходящих носителей являются вода, физиологический раствор, забуференный фосфатом физиологический раствор (PBS), растворы декстрозы, растворы фруктозы, этанол или животные, растительные или синтетические масла. Носитель также может содержать другие ингредиенты, например консерванты, суспендирующие средства, солюбилизирующие средства, буферы и т.п. Если неконъюгированное направляющее средство, и/или иммуноконъюгат, и/или цитотоксическое средство вводят интрацеребровентрикулярно или интратекально, они могут быть растворены в цереброспинальной жидкости.
Дозы, вводимые субъекту, могут быть указаны в виде количества на единицу площади поверхности субъекта (который включает человека, а также отличных от человека животных). Доза, которую можно вводить такому субъекту, составляет предпочтительно, но без ограничения, примерно от 5 мг/м2 до 300 мг/м2, в том числе примерно 20 мг/м2, примерно 50 мг/м2, примерно 100 мг/м2, примерно 150 мг/м2, примерно 200 мг/м2 и примерно 250 мг/м2. Направляющие средства/иммуноконъюгаты можно вводить в один прием или в несколько приемов. В режиме с многократным приемом указанные количества можно вводить один раз в день, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель или один раз в шесть недель. Ударные дозы, включающие одну высокую дозу или, альтернативно, более низкие дозы, которые вводят сразу одну за другой и затем с более длительными интервалами, составляют предпочтительное воплощение настоящего изобретения. В предпочтительном воплощении временной режим введения лекарственного средства корректируют в применении к субъекту так, чтобы перед вторым и/или последующим введением прошло достаточно времени, чтобы предыдущая доза практически метаболизировалась, но в системе субъекта осталось количество иммуноконъюгата, обеспечивающее ингибирование, замедление и/или предотвращение роста опухоли. Пример режима "с повторяющимся введением однократной дозы" включает введение начальной дозы иммуноконъюгата, составляющей примерно 200 мг/м2, один раз в три недели. Альтернативно, введение высокой начальной дозы может сопровождаться введением поддерживающей дозы, составляющей примерно 150 мкг/м2, два раза в неделю. Однако можно использовать и другие режимы введения. Результаты такого лечения можно легко отслеживать с помощью известных методов и анализов. Доза может варьировать в зависимости от того, вводят ли ее с профилактическими или терапевтическими целями, от курса предыдущей терапии, истории болезни пациента и ответа на направляющее средство/иммуноконъюгат, а также от решения лечащего врача.
В одном воплощении иммуноконъюгат вводят с одним или несколькими другими цитотоксическими средствами, такими как соответствующее антитело или его фрагмент, которые являются эффективными для лечения того же заболевания или сопутствующей патологии; например, CD138-специфический иммуноконъюгат можно вводить в сочетании с антителом, которое распознает другой антиген, экспрессирующийся на повышенном уровне при раке целевого типа. Примером антитела, которое можно вводить в сочетании с CD138-специфическим иммуноконъюгатом, является антитело против CD40 (Tai et al., 2006).
Другие противораковые антитела и иммуноконъюгаты, которые можно вводить вместе с описанными здесь иммуноконъюгатами, включают, без ограничения, например, AVASTIN (бевацизумаб) или MYELOMACIDE (милатузумаб).
В частности, иммуноконъюгат по настоящему изобретению также можно вводить в режимах лечения, включающих введение высоких доз химиотерапевтических средств (предпочтительно, таких как мелфалан, мелфалан/преднизон (MP), винкристин/доксорубицин/дексаметазон (VAD), липосомальный доксорубицин/винкристин, дексаметазон (DVd), циклофосфамид, этопозид/дексаметазон/цитарабин, цисплатин (EDAP)), трансплантатов стволовых клеток (например, трансплантатов аутологичных стволовых клеток или трансплантатов аллогенных стволовых клеток, и/или трансплантатов миниаллогенных (не связанных с отделением миелоцитарного ростка кроветворных клеток) стволовых клеток), стероидов (таких как кортикостероиды, дексаметазон, талидомид/дексаметазон, преднизон, мелфалан/преднизон), поддерживающей терапии (такой как введение бифосфонатов, факторов роста, антибиотиков, внутривенное введение иммуноглобулина, облучение маленькими дозами и/или ортопедические вмешательства), THALOMID (талидомид, Celgene), VELCADE (бортезомид, Millennium) и/или REVLIMID (леналидомид) (Chelgene Corporation) и/или других способов лечения множественной миеломы, включающих лучевую терапию.
Если иммуноконъюгат по настоящему изобретению вводят в сочетании с цитотоксическими средствами, часто используют вышеуказанные дозы и режимы. Однако, если иммуноконъюгат и цитотоксическое средство вводят совместно, в некоторых воплощениях каждый из указанных терапевтических компонентов предпочтительно использовать в низких дозах. В таких случаях иммуноконъюгат можно вводить в дозах, составляющих примерно от 5 мг/м2 до 200 мг/м2 и включающих примерно 20 мг/м2, примерно 50 мг/м2, примерно 100 мг/м2, примерно 150 мг/м2, тогда как цитотоксическое средство вводят в более низких дозах, чем дозы, рекомендуемые при отдельном введении, например, в дозах, составляющих примерно от 80% до 20% от рекомендуемой дозы.
Экспериментальные данные, полученные с использованием клеточных культур (фиг. 7) и мышей (фиг. 8-11), дополнительно подтверждают описанные результаты.
Патогенез множественной миеломы включает связывание клеток миеломы посредством клеточных поверхностных молекул адгезии со стромальными клетками костного мозга (BMSC), а также с внеклеточным матриксом (ECM). Данное связывание инициирует и, следовательно, обуславливает рост клеток множественной миеломы, устойчивость к лекарственным средствам и миграцию клеток MM в среду костного мозга (Munshi et al. 2008). В частности, адгезия клеток множественной миеломы к ECM посредством синдекана-1 (CD138) и коллагена типа I индуцирует экспрессию матриксной металлопротеиназы 1, инициируя резорбцию кости и инвазию опухоли (Hideshima et al. 2007). Взаимодействие клеток множественной миеломы с микросредой костного мозга приводит к активации плейотропной пролиферации и антиапоптотического каскада.
Адгезия клеток множественной миеломы к BMSC после хоминга клеток множественной миеломы в стромальный компартмент костного мозга вызывает повышающую регуляцию многих цитокинов, таких как интерлейкин-6 (IL-6) и инсулиноподобный фактор роста 1 (IGF-1), которые обладают ангиогенной активностью и способностью инициировать опухолевый рост (Hideshima et al. 2007). Сигнальные каскады, инициированные указанными цитокинами, в конечном счете обуславливают устойчивость клеток MM к традиционным терапевтическим средствам (Anderson et al. 2000; Hideshima et al. 2006).
In vivo эффективность nBT062-SPDB-DM4 и nBT062-SPP-DM1 в отношении CD138-положительных опухолевых клеток в присутствии человеческого костного мозга анализируют на мышиной модели, результаты приведены на фиг. 12. Результаты показывают, что и HICL, и UICL хорошо функционируют в такой среде. Увеличение уровня shuIL-6R, который у данной модели может служить показателем роста клеток MM, подавляется под действием указанных иммуноконъюгатов.
В соответствии с настоящим изобретением MM лечат с помощью нижеследующего способа с использованием BT062 в качестве примера. Данный пример не предназначается для ограничения настоящего изобретения каким-либо образом, и опытный специалист может легко идентифицировать другие иммуноконъюгаты или системы на основе nBT062, которые входят в объем настоящего изобретения, а также другие режимы лечения, которые можно использовать для лечения таких заболеваний, как MM.
Благодаря селективной экспрессии CD138 на клетках MM у пациента, на клетках, доступных для кровотока, специфичности nBT062 и стабильности BT062 в кровотоке, BT062 устраняет системную токсичность DM4 и обеспечивает возможность целевой гомогенной доставки DM4-эффекторной молекулы (эффекторных молекул). Иммуноконъюгаты данного изобретения позволяют эффективно вводить эффекторные молекулы в участки клеток, где эффекторные молекулы могут высвобождаться из иммуноконъюгатов. Такая целевая доставка и высвобождение в нужном участке составляют значительное преимущество при лечении множественной миеломы, тогда как используемые в настоящее время для ее лечения химиотерапевтические методы иногда приводят к неполной ремиссии.
В соответствии с настоящим изобретением множественную миелому можно лечить с помощью следующего способа. Одно или несколько цитотоксических средств вводят в дозах и лекарственных формах, соответствующих схемам лечения, традиционно используемым для данных цитотоксических средств, субъекту, который также получает иммуноконъюгат по настоящему изобретению.
Например, используют режим лечения, включающий пероральное введение пациенту дозы мелфалана в соответствии с инструкциями производителя (например, в виде пилюли, поставляемой под торговым наименованием ALKERAN) и подходящей дозы BT062, например 100 мг/м2, в соответствии с настоящим изобретением с определенными интервалами, например в начале или в конце сеанса введения мелфалана, чтобы дополнить результат обработки мелфаланом.
В соответствии с настоящим изобретением, в частности, солидные опухоли также можно лечить с помощью нижеследующего способа, используя BT062 в качестве примера. Данный пример не предназначается для ограничения настоящего изобретения каким-либо способом, и опытный специалист может легко выбрать другие иммуноконъюгаты по настоящему изобретению и другие режимы лечения, подходящие для лечения солидных опухолей. Вначале, чтобы уменьшить размер опухоли, ее обрабатывают, например, химиотерапевтическими средствами, такими как липосомальный доксорубицин, или радиоактивным облучением. Последующее введение BT062 данного изобретения представляет собой высокоэффективный способ устранения остаточных раковых клеток. Введение иммуноконъюгата обеспечивает специфическую направленность на указанные остаточные клетки и высвобождение эффекторных молекул в целевом участке. Высокая эффективность иммуноконъюгата позволяет, в предпочтительных воплощениях, использовать режим однократного введения. Такая целевая доставка и высвобождение в нужном участке составляют значительное преимущество при обработке остаточных раковых клеток, тогда как используемые для этого в настоящее время химиотерапевтические методы иногда приводят к неполной ремиссии.
Далее настоящее изобретение описывается с помощью нижеследующих примеров, которые приведены для иллюстрации и не предназначены для ограничения изобретения каким-либо способом. В указанных примерах используют стандартные методы, хорошо известные в данной области, или методы, специально описанные ниже.
Материалы и методы
Получение химерного антитела (cB-B4: nBT062)
B-B4
В данных экспериментах используют ранее охарактеризованное мышиное антитело B-B4 (Wijdenes et al., Br J Haematol., 94 (1996), 318).
Клонирование и экспрессия B-B4 и cB-B4/nBT062
Стандартные методы рекомбинантных ДНК проводят по способам, подробно описанным в руководствах, например, в J. Sambrook; Molecular Cloning, A Laboratory Manual; 2nd Ed. (1989), Cold Spring Harbor Laboratory Press, USA, или, в случае использования наборов в соответствии с инструкциями производителя. Клонирование с использованием ПЦР и модификацию мышиных вариабельных участков проводят с помощью стандартных методов ПЦР. Используют праймеры, указанные в соответствующем разделе описания результатов.
Экспрессия cB-B4/nBT062
В экспоненциальной фазе роста клетки COS, культивированные в среде DMEM, содержащей 10% FCS, 580 мкг/мл L-глутамина, 50 единиц/мл пенициллина и 50 мкг/мл стрептомицина, собирают после обработки трипсином, центрифугируют и промывают PBS. Клетки ресуспендируют в PBS до конечной концентрации 1×107 клеток/мл. 700 мкл суспензии клеток COS переносят в кювету Gene Pulser и смешивают с ДНК-вектором экспрессии, кодирующим тяжелую и легкую каппа-цепь (10 мкг каждого или 13 мкг Supervector). Клетки подвергают электропорации при 1900 В, 25 мкФ, используя Gene Pulser Bio-Rad. Трансформированные клетки культивируют в среде DMEM, дополненной 10% FBS, не содержащей гамма-глобулина, 580 мкг/мл L-глутамина, 50 единиц/мл пенициллина и 50 мкг/мл стрептомицина, в течение 72 ч, после чего собирают супернатанты клеточной культуры, содержащие антитело.
Определение уровней экспрессии cB-B4/nBT062 матодом ELISA с улавливанием
96-луночные планшеты покрывают аликвотами объемом 100 мкл, содержащими 0,4 мкг/мл козлиных антител против человеческих IgG, разбавленных PBS (4°C, в течение ночи). Планшеты промывают три раза 200 мкл/лунку буфера для промывания (PBS+0,1% твин-20). Лунки блокируют, используя 0,2% BSA, 0,02% твина-20 в PBS, после чего добавляют 200 мкл супернатантов клеточной культуры, содержащих секретируемое антитело (инкубация при 37°C в течение одного часа). Лунки промывают шесть раз буфером для промывания, после чего связанное антитело детектируют с помощью конъюгата козлиных антител против человеческой легкой каппа-цепи с пероксидазой.
Выделение cB-B4/nBT062 из супернатантов клеточной культуры
Антитело cB-B4 выделяют из супернатантов трансформированных клеток COS7, используя белок A-содержащий набор ImmunoPure Plus (Pierce, Rockford, IL) в соответствии с рекомендациями производителя.
Конкурентный анализ связывания cB-B4
Анализ связывающей активности B-B4 и cB-B4 в отношении CD138 проводят с использованием набора sCD138 Diaclone (Besancon, France) в соответствии с рекомендациями производителя и с учетом изменений, описанных в разделе Результаты.
Получение РНК и синтез кДНК
Чтобы выделить РНК, клетки гибридомы B-B4 выращивают и обрабатывают с использованием набора Qiagen Midi (Hilden, Germany) в соответствии с инструкциями производителя. Примерно 5 мкг РНК B-B4 подвергают обратной транскрипции с получением кДНК B-B4, используя набор для синтеза 1-ой цепи Amersham Biosciences (Piscataway, NJ) в соответствии с инструкциями производителя.
Клонирование кДНК иммуноглобулина B-B4
кДНК тяжелой цепи иммуноглобулина (IgH) амплифицируют методом ПЦР с использованием праймера IgH MHV7 (5'-ATGGGCATCAAGATGGAGTCACAGACCCAGG-3') [SEQ ID NO:3] и праймера константного участка IgG1 MHCG1 (5'-CAGTGGATAGACAGATGGGGG-3') [SEQ ID NO:4]. Подобным образом кДНК легкой цепи иммуноглобулина (IgL) амплифицируют с использованием трех разных праймеров lgκ MKV2 (5'-ATGGAGACAGACACACTCCTGCTATGGGTG-3') [SEQ ID NO:5], MKV4 (5'-ATGAGGGCCCCTGCTCAGTTTTTTGGCTTCTTG-3') [SEQ ID NO:6] и MKV9 (5'-ATGGTATCCACACCTCAGTTCCTTG-3') [SEQ ID NO:7], каждый из которых используют в сочетании с праймером MKC (5'-ACTGGATGGTGGGAAGATGG-3') [SEQ ID NO:8]. Все продукты амплификации непосредственно лигируют в вектор pCR2.1-TOPO, используя набор для клонирования TOPO-TA (Invitrogen, Carlsbad, CA) в соответствии с инструкцией производителя.
Бактерии E. coli TOP10 (Invitrogen), трансформированные лигированными конструкциями вектора pCR2.1, подвергают селекции на чашках с агаром LB-ампициллин-Xgal. Мелкомасштабные культуры инокулируют единичными белыми колониями, выращенными в течение ночи, после чего выделяют плазмиды, используя набор QIAprep Spin Miniprep kit в соответствии с инструкцией производителя.
Определение последовательности кДНК
Плазмиды секвенируют с использованием готового реакционного набора для циклического секвенирования BigDye Termination v3.0 (ABI, Foster City, CA). Каждую выбранную плазмиду секвенируют в обоих направлениях, используя праймеры 1210 и 1233, циклизованные на машине для ПЦР GeneAmp9600. Электрофоретический анализ последовательности проводят на капиллярном секвенаторе ABI.
Полный цикл ОТ-ПЦР, клонирования и анализа последовательности ДНК повторяют, получая три совершенно независимых набора данных для каждой цепи иммуноглобулина.
Последовательность ДНК B-B4 Vκ
Синтез 1-ой цепи включает три независимые реакции. Продукты ПЦР, полученные с использованием праймеров MKC и MKV2 (последовательности приведены выше), лигируют в векторы pCR2.1-TOPO в соответствии с инструкцией производителя. Клоны, полученные с помощью каждого независимого набора реакций ОТ-ПЦР, секвенируют в обоих направлениях. Последовательность продукта, полученного с использованием праймера MKV2, имеет высокую степень подобия с последовательностями стерильных транскриптов каппа, полученных от партнера миеломных клеток по гибридизации, таких как MOPC-21, SP2 и Ag8 (Carroll et al., MoI Immunol., 25 (1988), 991; Cabilly et al., Gene, 40 (1985); 157), и, следовательно, может игнорироваться.
Продукты ПЦР, полученные с использованием MKC и праймеров MKV4 и MKV9, похожи друг на друга и различаются только по воббл-положениям в праймере лидерной последовательности.
Последовательность ДНК B-B4 VH
Синтез 1-й цепи проводят, используя три независимые реакции, после чего продукты ПЦР клонируют и секвенируют из каждой полученной 1-й цепи. Пять клонов секвенируют из каждой 1-й цепи.
Конструирование химерных векторов экспрессии cB-B4
Конструирование химерных векторов экспрессии включает добавление подходящей лидерной последовательности в VH и Vκ, с предварительным добавлением участка рестрикции BamVW и последовательности Козака. Консенсусная последовательность Козака играет ключевую роль в эффективной трансляции последовательности вариабельного участка. Она определяет правильный кодон AUG, с которого рибосома может начинать трансляцию, и что одним наиболее важным основанием является аденин (или, менее предпочтительно, гуанин) в положении -3, выше старт-кодона AUG. В качестве лидерной последовательности выбирают последовательность с максимальным подобием по базе данных Кабат (Kabat et al., NIH National Technical Information Service, 1991). Указанные добавления кодируются прямыми (For) праймерами (оба они имеют последовательность 5'-AGAGAAGCTTGCCGCCACCATGATT-GCCTCTGCTCAGTTCCTTGGTCTCC-3' [SEQ ID NO:9]; участки рестрикции подчеркнуты; последовательность Козака выделена жирным шрифтом). Кроме того, конструирование химерных векторов экспрессии включает введение 5'-фрагмента человеческого константного участка гамма 1 до естественного участка рестрикции ApaI, примыкающего к 3'-концу J-участка B-B4, и, в случае легкой цепи, добавление донорного участка сплайсированного фрагмента и участка HindIII. Последовательность донора сплайсированного фрагмента играет важную роль в правильном присоединении вариабельного участка к соответствующему ему константному участку в рамке считывания, обеспечивая таким образом сплайсинг интрона V:C. Каппа-интрон + Cκ кодируются конструкцией экспрессии ниже последовательности Vκ B-B4. Подобным образом, CH гамма-4 кодируется конструкцией экспрессии ниже последовательности VH B-B4.
Гены VH и Vκ B-B4 вначале тщательно анализируют, чтобы идентифицировать любые нежелательные донорные участки сплайсированных фрагментов, акцепторные участки сплайсированных фрагментов, последовательности Козака и все участки рестрикции экстрасубклонирования, которые позже могут препятствовать субклонированию и/или экспрессии целого функционального антитела. В последовательности Vκ обнаружен нежелательный участок HindIII, который обязательно удаляют путем сайт-направленного мутагенеза методом ПЦР, без изменения аминокислотной последовательности. В данных реакциях используют олигонуклеотидные праймеры BT03 (5'-CAACAGTATAGTAAGCTCCCTCGGACGTTCGGTGG-3') [SEQ ID NO:10] и BT04 (5'-CCACCGAACGTCCGAGGGAGCTTACTATACTGTTG-3') [SEQ ID NO:11], а мутагенез проводят, используя набор Stratagene (La JoIIa, CA) Quickchange Mutagenesis.
Праймеры для химеризации каппа-цепи
Проводят выравнивание определенной лидерной последовательности Vκ B-B4, не зависящей от последовательности праймера ПЦР, и мышиных лидерных последовательностей с использованием базы данных Кабат. Наиболее близким совпадением с лидерной последовательностью VH B-B4 является ARS-A VK-10 (Sanz et al., PNAS, 84 (1987), 1085). Предполагают, что данная лидерная последовательность может быть корректно отрезана алгоритмом SignalP (Nielsen et al., Protein Eng, 10 (1997); 1). Праймеры CBB4Kfor (см. выше) и g2258 (5'-CGCGGGATCCACTCACGTTTGATTTCCAGCTTGGTGCCTCC-3' [SEQ ID NO: 12]; участок рестрикции подчеркнут) конструируют так, чтобы получить продукт ПЦР, содержащий указанную полную лидерную последовательность, участок VK B-B4 и концевые участки рестрикции HindIII и BamHI для клонирования в векторе экспрессии pKN100. Прямой праймер CBB4K вводит участок рестрикции HindIII, участок инициации трансляции Козака и лидерную последовательность ARS-A VK-10. Обратный праймер g2258 вводит донорный участок сплайсированного фрагмента и участок рестрикции BamHI. Полученный фрагмент клонируют в векторе pKN100 с использованием участков рестрикции HindIII/BamHI.
Праймеры для химеризации тяжелой цепи
Проводят выравнивание определенной лидерной последовательности VH B-B4, не зависящей от последовательности праймера ПЦР, и мышиных лидерных последовательностей с использованием базы данных Кабат. Наиболее близким совпадением с лидерной последовательностью VK B-B4 является VH17-1A (Sun et al., PNAS, 84 (1987), 214). Предполагают, что данная лидерная последовательность может быть корректно отрезана алгоритмом SignalP. Праймеры cBB4Hfor (см. выше) и g22949 (5'-CGATGGGCCCTTGGTGGAGGCTGAGGA-GACGGTGACTGAGGTTCC-3' [SEQ ID NO:13]; участок рестрикции подчеркнут) конструируют так, чтобы получить продукт ПЦР, содержащий лидерную последовательность VH 17-1A, участок VH B-B4 и концевые участки рестрикции HindIII и ApaI для клонирования в векторе экспрессии pG4D200. Прямой праймер cBBHFor вводит участок рестрикции HindIII, участок инициации трансляции Козака и лидерную последовательность VH17-1A. Обратный праймер g22949 вводит 5'-конец С-участка гамма 4 C и естественный участок рестрикции ApaI. Полученный фрагмент клонируют в векторе pG4D200 с использованием участков рестрикции с получением вектора pG4D200cBB4.
Получение антитела cBB4
Один флакон клеток COS7 оттаивают и клетки выращивают в среде DMEM, содержащей 10% сыворотки фетального клона I и антибиотики. Через неделю клетки (0,7 мл суспензии с концентрацией 107 клеток/мл) подвергают электропорации с использованием pG4D200cBB4 и pKN100cBB4 (10 мкг ДНК в каждом) или в отсутствии ДНК. Клетки выращивают в чашках в 8 мл питательной среды в течение 4 дней. Электропорацию повторяют семь раз.
Детекция химерного антитела
Концентрацию антитела в супернатантах COS 7 измеряют методом сэндвич-ELISA. Транзиторно трансформированные клетки COS 7 секретируют антитело в концентрации, составляющей примерно 6956 нг/мл (данные не показаны).
Связывающая активность cB-B4
Связывающую активность cB-B4 в супернатанте культуры COS 7 анализируют методом твердофазного сэндвич-ELISA, используя набор Diaclone sCD138. Моноклональным антителом, специфичным к sCD138, покрывают лунки присутствующих в наборе микротитровальных плосок. В процессе первой инкубации SCD138 и биотинилированное антитело B-B4 (био-B-B4) одновременно инкубируют с серийными разведениями немеченого тестируемого антитела (B-B4 или cB-B4).
Концентрации био-B-B4 в данном анализе уменьшают, чтобы достичь конкуренции с низкими концентрациями немеченого антитела (иначе концентрация cB-B4 в супернатантах культуры клеток COS 7 будет слишком низкой, чтобы составить достаточную конкуренцию). Результаты данного анализа показывают, что оба антитела имеют одинаковую специфичность по отношению к CD138 (данные не показаны).
Очистка cB-B4
Химерное антитело B-B4 выделяют из супернатантов клеток COS 7 с использованием белок А-содержащего набора ImmunoPure Plus (Pierce) в соответствии с инструкцией производителя (данные не показаны).
Определение KD: Сравнение nBT062/BB4
Очистка растворимого CD138
Растворимый антиген CD138 выделяют из супернатанта культуры клеток U-266 методом FPLC, используя колонку "HiTrap NHS-activated HP" объемом 1 мл с иммобилизованным B-B4. Супернатант клеточной культуры загружают на колонку в PBS-буфере pH 7,4 и затем антиген CD138 элюируют 50 мМ триэтиламином pH 11 во фракциях объемом 2 мл. Чтобы предотвратить структурные и/или функциональные повреждения, элюированный CD138 сразу нейтрализуют 375 мкл 1 M Tris-HCl, pH 3.
Биотинилирование CD138
Для мечения CD138 используют Sulfo-NHS-LC (Pierce). NHS-активированные биотины эффективно взаимодействуют с первичными аминогруппами, например, присутствующими на остатках лизина, в буферах, имеющих pH 7-9, с получением стабильных амидных связей.
Чтобы провести биотинилирование, 50 мкл CD138 обессоливают, используя вращающиеся колонки для обессоливания белков (Pierce). Биотинилирующий реагент (EZ-Link Sulfo NHS-LC-Biotin, Pierce) растворяют в охлажденной на льду деионизированной воде до конечной концентрации 0,5 мг/мл. Растворы биотинилирующего реагента и улавливающего реагента смешивают, причем молярный избыток биотинилирующего реагента по отношению к улавливающему реагенту составляет 12 (50 пмоль CD138 и 600 пмоль биотинилирующего реагента), и инкубируют 1 ч при комнатной температуре при осторожном встряхивании флакона. Несвязанный биотинилирующий реагент удаляют с помощью колонки для обессоливания белков.
Иммобилизация bCD138
Сенсорный чип (SENSOR CHIP SA, BIACORE AB), используемый в анализе BIACORE, способен связывать биотинилированные молекулы при анализе взаимодействия в системах BIACORE. Его поверхность представляет собой карбоксиметилированный декстрановый матрикс с иммобилизованным стрептавидином, способный к высокоаффинному улавливанию биотинилированных лигандов. Иммобилизацию bCD138 проводят на SENSOR CHIP SA с использованием скорости потока 10 мкл/мин и ручного введения. Поверхность чипа кондиционируют тремя последовательными 1-минутными инъекциями 1 M NaCl в 50 мМ NaOH. Затем в течение 1 минуты вводят биотинилированный CD138.
Определение KD разных антител с помощью BIACORE
В программном обеспечении BIACORE C для разных экспериментов, в которых можно менять только некоторые установки, используются заранее заданные шаблоны, так называемые "мастера". Поскольку BIACORE C изначально разработано для измерения концентраций, в нем отсутствует мастер по проведению измерений аффинности. Однако при использовании соответствующих установок мастер "неспецифического связывания" можно использовать для измерения констант скорости аффинных взаимодействий и, следовательно, его можно использовать для определения KD. С помощью данного мастера проводят измерения в двухпоточных ячейках, устанавливая фазу диссоциации на 90 с, путем проведения "регенерации 1" с использованием рабочего буфера BIACORE. "Регенерацию 2", которая эквивалентна реальной регенерации, проводят с использованием 10 мМ глицин-HCl pH 2,5. После данной стадии лиганд CD138 снова приобретает способность к связыванию. В течение всей процедуры в качестве рабочего буфера и буфера для разведения используют HBS-EP. Чтобы определить связывание разных антител (~150 кДа) с CD138, ассоциацию и диссоциацию анализируют при разных концентрациях (100, 50, 25, 12,5, 6,25 и 3,13 нМ). Равновесные константы диссоциации определяют путем вычисления констант скорости ka и kd. Затем рассчитывают значения KD анализируемых образцов по отношению ka к kd с помощью программного обеспечения BIAevaluation. Результаты приведены в таблице 4.
Обсуждение
Средние значения KD для каждого антитела рассчитывают из трех независимых экспериментов. Результаты показывают, что во всех замерах nBT062 имеет немного более низкие значения KD, чем B-B4 (средние значения KD составляют 1,4 и 1,6 нМ, соответственно).
Получение иммуноконъюгатов
nBT062-DM1 и huC242-DM1
Тиолсодержащий майтансиноид DM1 синтезируют из продукта микробиологической ферментации ансамитоцина P-3 по способу, описанному ранее Chari (Chari et al., Cancer Res. 1 (1992), 127). Получение гуманизированного C242 (huC242) (Roguska et al., PNAS, 91 (1994), 969) описано ранее. Конъюгаты антитело-лекарственное средство получают с помощью описанного ранее способа (Liu et al., PNAS, 93 (1996), 8618). В среднем к молекуле антитела присоединяют 3,5 молекулы DM1.
nBT062-DM4
BT062 представляет собой конъюгат антитело-лекарственное средство, состоящий из цитотоксического майтансиноидного лекарственного средства, DM4, соединенного через линкер посредством дисульфидных связей с химерным моноклональным антителом nBT062. Майтансиноиды представляют собой антимитотические средства, которые ингибируют полимеризацию тубулина и сборку микротрубочек (Remillard et al., Science 189 (1977), 1002). Химическая формула и схематическое изображение BT062 (nBT062-DM4) приведены на фиг. 1 и 2.
Синтез DM4
DM4 получают из хорошо известного производного майтансинола (Kupchan et al., J. Med. Chem., 21 (1978), 31). Майтансинол получают путем восстановительного расщепления сложноэфирного фрагмента продукта микробиологической ферментации, ансамитоцина P3, гидридом лития триметоксиалюминия (см. фиг. 3).
DM4 синтезируют путем ацилирования майтансинола N-метил-N-(4-метилдитиопентаноил)-L-аланином (боковая цепь DM4) в присутствии дициклогексилкарбодиимида (DCC) и хлорида цинка с получением дисульфидсодержащего майтансиноида DM4-SMe. DM4-SMe восстанавливают дитиотреитолом (DTT) с получением целевого тиолсодержащего майтансиноида DM4 (схема способа получения DM4 приведена на фиг. 4).
Иммуноконъюгат BT062
Способ получения nBT062-DM4 изображен на фиг. 5. Антитело nBT062 модифицируют N-сукцинимидил-4-(2-пиридилдитио)бутиратом (линкер SPDB), чтобы ввести дитиопиридильные группы. DM4 смешивают с модифицированным антителом в концентрации, превышающей в эквивалентах число дитиопиридильных групп. Конъюгат BT062 получают в результате реакции дисульфидного обмена между тиольной группой DM4 и дитиопиридильными группами, введенными в антитело с линкером. Очистка хроматографией и диафильтрацией приводит к удалению низкомолекулярных реагентов (DM4) и продуктов реакции (тиопиридин), а также агрегатов конъюгированного антитела, и к получению основной массы лекарственного вещества.
Анализ FACS и анализы цитотоксичности WST
Анализ FACS
Клетки OPM-2 представляют собой линии плазматических лейкемических клеток, интенсивно экспрессирующих CD138. Клетки OPM-2 инкубируют с nBT062, nBT062-SPDB-DM4, nBT062-SPP-DM1 или nBT062-SMCC-DM1 в разных концентрациях (показано на фиг. 6). Клетки промывают и затем CD138-связанные антитела или конъюгаты детектируют с использованием флуоресцентно-меченого вторичного антитела методом FACS. Строят график зависимости среднего значения флуоресценции, полученного в данных экспериментах, от концентрации антитела.
Анализ жизнеспособности клеток
Клетки CD138+ MOLP-8 высевают в плоскодонные планшеты в количестве 3000 клеток/лунку. Контрольные клетки CD138- BJAB высевают в количестве 1000 клеток/лунку. Клетки обрабатывают nBT062-SPDB-DM4, nBT062-SPP-DM1 или nBT062-SMCC-DM1 в разных концентрациях (показано на фиг. 7) в течение пяти дней. Жизнеспособность клеток измеряют с помощью реагента WST (водорастворимая соль тетразолия, ROCHE) в соответствии с инструкцией производителя (ROCHE). Реагент инкубируют в течение 7,5 ч с клетками MOLP-8 и в течение 2 ч с клетками BJAB. Величину фракции живых клеток рассчитывают на основе оптической плотности, измеренной стандартным способом с помощью ридера для микропланшет.
Обсуждение
Связывание nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 или nBT062 анализируют методом FACS. Клетки-мишени CD138+ OPM-2 инкубируют с nBT062 или иммуноконъюгатами, после чего связанные с клетками молекулы детектируют с помощью флуоресцентно-меченого вторичного антитела. На фиг. 6 приведен график зависимости среднего значения флуоресценции, отражающего количество связанного с клетками антитела, от концентрации антитела или конъюгата. Результаты показывают, что nBT062-SPDB-DM4, nBT062-SPP- DM1 и nBT062-SMCC-DM1 имеют очень похожие характеристики связывания. Кроме того, полученные результаты позволяют предположить с большой вероятностью, что токсины после присоединения не изменяют характеристики связывания неконъюгированного антитела.
В анализе жизнеспособности клеток определяют цитотоксическую активность антитела против клеток-мишеней CD138+ MOLP-8 и против контрольных клеток B-лимфобластомы CD138- BJAB. Обе клеточные линии высевают в плоскодонные планшеты и инкубируют с увеличивающимися концентрациями иммуноконъюгатов. Неконъюгированное антитело используют в качестве контроля. Цитотоксическую активность анализируют через пять дней после добавления иммуноконъюгатов путем измерения жизнеспособности клеток с использованием реагента WST. На фиг. 7 (A)-(C) приведен график зависимости доли выживших клеток, определенной в сравнении с контрольными клетками, обработанными средой, от повышающихся концентраций иммуноконъюгата. Результаты показывают, что nBT062-SPDB-DM4, nBT062-SPP-DM1 и nBT062-SMCC-DM1 обладают очень похожей цитотоксической активностью по отношению к клеткам MOLP-8. Как и предполагалось, иммуноконъюгаты не убивают контрольные клетки CD138- BJAB, свидетельствуя о том, что все иммуноконъюгаты действуют посредством CD138-специфического связывания с клетками. В конкурентных анализах клетки MOLP-8 предварительно инкубируют с молярным избытком неконъюгированного nBT062. Предварительная инкубация в значительной степени блокирует цитотоксичность nBT062-SPDB-DM4, являясь дополнительным доказательством того, что иммуноконъюгаты убивают клетки посредством специфического связывания с CD138 на клеточной поверхности (фиг. 7 (D)).
Эксперименты с мышиными ксенотрансплантатами
Чтобы оценить роль направленности на CD138 в проявлении противоопухолевой активности конъюгатов антитело-майтансиноид с использованием человеческой химерной версии антитела B-B4, nBT062, проводят эксперименты на мышах, несущих ксенотрансплантаты. Получают две версии конъюгатов nBT062-майтансиноид, которые различаются по химической стабильности дисульфидных связей (nBT062-SPP-DM1 и nBT062-SPDB-DM4). Противоопухолевую активность указанных конъюгатов антитело-лекарственное средство сравнивают с активностью конъюгата B-B4-SPP-DM1 (содержащего исходное мышиное антитело), а также неконъюгированного свободного майтансиноида (DM4), нативного немодифицированного антитела nBT062 и ненаправленного (иррелевантного) конъюгата IgG1-майтансиноид. Конъюгаты анализируют на модели CD138-положительного ксенотрансплантата (MOLP-8) человеческой множественной миеломы у мышей с тяжелым комбинированным иммунодефицитом (SCID).
У данных мышей подкожные опухоли прививают (самки мышей CB.17 SCID) путем инокуляции клеточных суспензий MOLP-8. Когда объем опухоли достигает среднего размера 113 мм3, проводят лечение путем однократной болюсной внутривенной инъекции. Изменения объема опухоли и массы тела регистрируют два раза в неделю. Эксперименты проводят через 68 дней после инокуляции опухолевых клеток.
Эксперименты с мышиными ксенотрансплантатами A
Мыши
Самок мышей CB.17 SCID возрастом пять недель получают от Charles River Laboratories.
Линии клеток человеческой опухоли
MOLP-8, клеточной линии человеческой множественной миеломы, поставляются ATCC. Клетки MOLP-8, которые экспрессируют антиген CD138 на поверхности и вызывают развитие ксенотрансплантантных опухолей у мышей SCID, поддерживают в среде RPMI-1640, содержащей 4 мМ L-глутамин (Biowhittaker, Walkersville, MD), 10% фетальной бычьей сыворотки (Hyclone, Logan, Utah) и 1% стрептомицина/пенициллина, при 37°C во влажной атмосфере, содержащей 5% CO2.
ЧАСТЬ I
Рост опухоли у мышей
Каждой мыши подкожно в область верхнего правого плеча вводят 1x107 клеток MOLP-8. Общий объем составляет 0,2 мл на мышь с соотношением бессывороточной среды к матригелю (BD Bioscience, Bedford, MA) 1/1 (об./об.). Перед лечением ксенотрансплантатным опухолям дают развиваться, регистрируя каждый день их рост. Примерно через 11 дней после инокуляции опухолевых клеток объем опухоли достигает приблизительно 113 мм3. У мышей CB.17 SCID опухоли приживаются в 100% случаев.
Через одиннадцать дней после инокуляции опухолевых клеток отбирают 42 мыши на основе объема опухоли и массы тела. Объем опухоли находится в интервале от 68,2 до 135,9 мм3. Сорок две мыши произвольно делят на семь групп (A-G) по шесть животных в каждой в зависимости от объема опухоли.
Каждая из шести мышей группы A получает 200 мкл PBS в качестве контроля-среды. Все мыши из группы B получают 13,8 мг/кг "голого" антитела nBT062. Указанная доза эквивалентна количеству компонента антитела nBT062, присутствующему в 250 мкг/кг конъюгата с майтансиноидом. Отношение молекулярной массы майтансиноида к молекулярной массе антитела nBT062 в молекуле конъюгата составляет примерно 1/55. Все мыши из группы C получают 250 мкг/кг DM4. Все мыши из группы D получают 250 мкг/кг huC242-DM4. Мыши из групп E, F и G получают 250 мкг/кг nBT062-SPDB-DM4, B-B4-SPP-DM1 и nBT062-SPP-DM1 соответственно.
Все средства вводят внутривенно в виде однократной болюсной инъекции в латеральную хвостовую вену с помощью шприца объемом 1 мл, снабженного иглой 27 калибра, ½ дюйма. Перед введением исходные растворы антитела nBT062, nBT062-SPDB-DM4 и nBT062-SPP-DM1 разбавляют стерильным PBS до концентраций 2 мг/мл, 28,1 мкг/мл и 28,1 мкг/мл соответственно, чтобы объем, вводимый каждой мыши, находился в интервале от 120 до 220 мкл.
ЧАСТЬ II
Во второй серии экспериментов клетки MOLP-8 (1,5×107 клеток на мышь), суспендированные в смеси бессывороточной среды и матригеля 50:50, вводят подкожно в область под правым плечом в объеме 100 мкл. Объемы опухолей достигают примерно 80 мм3 на 11 день, а на 25 день после инокуляции клеток среднее значение объемов опухолей у контрольных животных составляет примерно 750 мм3. Время удвоения объема опухоли составляет 4,58 дней. Каждая мышь в контрольной группе (n=6) получает 0,2 мл стерильного PBS путем введения в латеральную хвостовую вену (в.в.) в виде болюсной инъекции. Все экспериментальные дозы устанавливают на основе конъюгированного майтансиноида. Девять групп (n=6) получают одну внутривенную инъекцию nBT062-SMCC-DM1, nBT062-SPDB-DM4 или nBT062-SPP-DM1, каждый из которых вводят в дозе 450, 250 и 100 мкг/кг. Другая группа (n=6) получает многократное введение 250 мкг/кг nBT062-SMCC-DM1 (еженедельно в течение пяти недель). Мышей произвольно распределяют в одиннадцать групп (n=6) в зависимости от объема опухоли, который определяют с помощью программы LabCat. Объемы опухолей варьируют от 40,0 до 152,5 мм3. Дозы для мышей устанавливают в зависимости от индивидуальной массы тела.
Размер опухоли в трех направлениях измеряют два раза в неделю с помощью системы LabCat (Tumor Measurement and Tracking, Innovative Programming Associated, Inc., Princeton, NJ). Объем опухоли в мм3 рассчитывают с помощью способа, описанного Tomayko et al., Cancer Chemother. Pharmacol, 24 (1989), 148:
Объем = Длина×Ширина×Высота×1/2
Log10 числа погибших клеток рассчитывают по формуле, описанной Bissery et al., Cancer Res., 51 (1991), 4845:
Log10 числа погибших клеток = (T-C)/Td×3,32
где (T-C), или задержка роста опухоли, представляет собой среднее время в днях, необходимое для того, чтобы опухоли в экспериментальной группе (T) и в контрольной группе (C) достигли заданного размера (600 мм3). Td представляет собой время удвоения опухоли на основе среднего объема опухоли у контрольных мышей, и 3,32 представляет собой число удвоений клеток на log клеточного роста.
Результаты
Рост опухолей у отдельных мышей показан на фиг. 8 и 9. Среднее значение роста опухолей (+/-SD) для каждой группы показано на фиг. 10.
По сравнению с ростом опухолей у животных, получающих PBS, введение антитела nBT062, неконъюгированного свободного DM4 или иррелевантного неспецифического конъюгата huC242-DM4 не вызывает существенного ингибирования роста опухоли.
Все три CD138-направленных конъюгата, nBT062-SPDB-DM4, B-B4-SPP-DM1 и nBT062-SPP-DM1, в дозе 250 мкг/кг вызывают значительное замедление роста опухоли. На основе средних объемов опухолей в экспериментальных группах определяют, что конъюгат DM4, nBT062-SPDB-DM4, является наиболее активным, тогда как конъюгат nBT062-SPP-DM1 обладает активностью, незначительно превышающей активность его мышиного аналога B-B4-SPP-DM1 (фиг. 10). Результаты, полученные на отдельных мышах, также показывают, что противоопухолевая активность B-B4-SPP-DM1 является более гетерогенной и, следовательно, менее предсказуемой, чем активность nBT062-SPP-DM1. С точки зрения гомогенности противоопухолевой активности другой конъюгат, который содержит nBT062 в качестве направляющего антитела, nBT062-SPDB-DM4, ведет себя подобно nBT062-SPP-DM1.
Ни в одной экспериментальной группе не наблюдается уменьшение массы тела, свидетельствуя о том, что лечение хорошо переносится.
Обсуждение
Результаты анализа введения трех CD138-направленных конъюгатов экспериментальным животным показывают, что направленная доставка имеет важное значение для проявления противоопухолевой активности. Тогда как майтансиноидсодержащие конъюгаты человеческого химерного антитела nBT062 и мышиного антитела B-B4 обладают значительной активностью, измеренной в виде log числа погибших клеток, введение неконъюгированного DM4, немодифицированного нативного антитела huBT062 или неспецифического контрольного конъюгата (huC242-DM4) не оказывает значительного влияния на рост опухоли.
Иммуноконъюгат, полученный из человеческого химерного антитела, nBT062-SPP-DM1, обладает немного более высокой противоопухолевой активностью, чем конъюгат, полученный из его мышиного аналога, B-B4-SPP-DM1. Кроме того, введение nBT062-SPP-DM1 и nBT062-SPDB-DM4 вызывает более гомогенные ответы у отдельных мышей, чем введение B-B4-SPP-DM1. Высокая вариация связывания B-B4-SPP-DM1 объясняется тем, что измерение среднего объема опухоли (+/-SD) в ксенотрансплантатах множественной миеломы человека MOLP-8 у мышей CB.17 SCID через определенное время (дни) после инокуляции в действительности для B-B4-SPP-DM1 дает более хорошие результаты, чем для nBT062-SPP-DM1 (данные не показаны). Данная особенность иммуноконъюгатов, содержащих nBT062 в качестве направляющего антитела, по-видимому, является преимуществом, особенно, для терапевтического применения конъюгатов.
И наконец, среди майтансиноидсодержащих конъюгатов наиболее активным, после однократного в.в. введения мышам SCID с ксенотрансплантатами MOLP-8, является nBT062-SPDB-DM4.
Неспецифическое уничтожение клеток (анализ жизнеспособности клеток)
Клетки CD138+ OPM2 и клетки CD138- Namalwa высевают в круглодонные планшеты либо в отдельные лунки, либо в одну лунку в виде совместной культуры. Клетки обрабатывают nBT062-SPDB-DM4 в концентрации, варьирующей от 1×10-8 до 1×10-9 M. Долю живых клеток определяют с помощью реагента WST (водорастворимая соль тетразолия, ROCHE) в соответствии с инструкцией производителя (ROCHE). Фракцию живых клеток рассчитывают на основе оптической плотности, измеренной стандартным способом с помощью ридера для микропланшет.
Обсуждение
Неспецифическое уничтожение клеток, отличных от клеток-мишеней и непосредственно примыкающих к клеткам множественной миеломы (как это происходит в круглодонных лунках), в результате обработки nBT062-SPDB-DM4 анализируют in vitro с помощью исследования, в котором CD138-положительные клетки OPM2 культивируют совместно с CD138-отрицательными клетками Namawla (фиг. 13). Как правило, в то время как CD138-положительные клетки эффективно уничтожаются под действием nBT062-SPDB-DM4, данный конъюгат не оказывает воздействия на CD138-отрицательные клетки. Однако при совместном культивировании в круглодонных лунках nBT062-SPDB-DM4 также уничтожает антиген-отрицательные клетки, непосредственно примыкающие к антиген-положительным клеткам (эффект, который часто называют неспецифическое уничтожение). Kovtun et al. (2006) описывают, что неспецифическое уничтожение, опосредуемое майтансиноидсодержащими конъюгатами, происходит только в непосредственной близости от антиген-положительных клеток. Kovtun et al. (2006), в публикации, которая включена в настоящее описание в качестве ссылки во всей полноте, также обсуждают значение линкерсодержащих иммуноконъюгатов. In vivo неспецифическое уничтожение может вносить вклад в 1) устранение опухолевых клеток, которые экспрессируют CD138 гетерогенно, 2) разрушение опухолевой микросреды путем уничтожения клеток стромы опухоли и 3) предотвращение селекции CD138-отрицательных nBT062-SPDB-DM4-устойчивых клеток.
Эффект неспецифического уничтожения имеет особое значение в случае уменьшения активности иммуноконъюгата в результате гетерогенного характера экспрессии антигена-мишени в опухолях. В данном случае, если конкретная клетка опухоли экспрессирует антиген в количестве, которое не обеспечивает эффективную специфическую направленность соответствующего иммуноконъюгата и уничтожение указанной клетки под действием данного иммуноконъюгата. Противоопухолевая эффективность nBT062-SPDB-DM4 в отношении CD138-отрицательных клеток при совместном культивировании с CD138-положительными клетками демонстрирует, что присутствие клеток-мишеней влияет в соответствующих условиях на цитотоксическую активность nBT062-SPDB- DM4 в отношении клеток, отличных от клеток-мишеней.
Эксперименты с мышиными ксенотрансплантатами В
В данной серии экспериментов восьмидесяти пяти мышам инокулируют клетки MOLP-8 (1,5×107 клеток/мышь) подкожно в область правого плеча. Опухоли приживаются в 100% случаев. Шестьдесят шесть мышей SCID, несущих опухоли MOLP-8 со средним объемом примерно 80 мм3, случайным образом распределяют в одиннадцать экспериментальных групп (n=6). Мышам вводят однократную дозу одного из трех конъюгатов (nBT062-SMCC-DM1, nBT062-SPDB-DM4 или nBT062-SPP-DM1). Другая группа получает пять еженедельных доз nBT062-SMCC-DM1, а контрольная группа получает одну дозу PBS. Средние объемы опухолей приведены на фиг. 11A. Для каждого конъюгата получают кривую доза-ответ. Средний объем опухоли 750 мм3 у животных, получающих PBS, достигается на 25 день. Время удвоения объема опухоли, определенное методом наилучшего приближения кривой линейной регрессии на прямо пропорциональном графике роста контрольной опухоли, составляет 4,58 дней. Животные, получающие nBT062-SPDB-DM4 в дозе 450 мкг/кг, имеют наивысший log числа погибших клеток (LCK=2,89), после них следуют животные, еженедельно получающие nBT062-SMCC-DM1 в дозе 250 мкг/кг (LCK=2,1; см. таблицу 5). Сравнение кривых среднего роста опухоли для экспериментальных групп путем повторяющихся измерений ANOVA с использованием критерия множественного сравнения Даннетта демонстрирует значительное различие между контрольной группой, получающей PBS, и группами, получающими 450 мкг/кг nBT062-SPDB-DM4 (p<0,01), 250 мкг/кг nBT062-SPDB-DM4 (p<0,05) и пять еженедельных доз 250 мкг/кг nBT062-SMCC-DM1 (p<0,05). Частичная или полная регрессия опухоли не наблюдается ни в одной из экспериментальных групп, за исключением одного животного, получающего 450 мкг/кг nBT062-SPDB-DM4, у которого наблюдается частичная регрессия опухоли до 85 дня после инокуляции.
Эффективность nBT062-SPDB-DM4 и nBT062-SPP-DM1 в среде костного мозга in vivo
Получение мышей SCID, содержащих имплантанты человеческой зародышевой кости
Человеческие зародышевые длинные кости (стружку человеческих зародышевых костей) имплантируют в верхнюю часть организма мышей CB17 SCID (SCID-hu) с помощью описанного ранее способа (Urashima et al., 1997) и получают модель хоминга клеток человеческой MM к клеткам человеческого BM в организме мыши.
Режим лечения (мыши SCID-hu/INA-6)
Через 4 недели после имплантации кости 2,5×106 клеток INA-6 в конечном объеме 100 мкл клеточной культуральной среды RPMI-1640 вводят непосредственно в человеческую костно-мозговую полость мышей SCID-hu, описанных выше. Увеличение уровней растворимого человеческого рецептора IL-6 (shuIL-6R), который высвобождается клетками INA-6, используют в качестве показателя роста клеток MM и тяжести заболевания.
У мышей детектируемый уровень shuIL-6R в сыворотке появляется примерно через 4 недели после введения клеток INA-6, и затем им вводят 0,176 мг конъюгата или среды в качестве контроля путем инъекции в хвостовую вену еженедельно в течение 7 недель. После каждого введения образцы крови собирают и нализируют на уровни shuIL-6R методом иммуноферментного твердофазного анализа (ELISA, R&D Systems, Minneapolis, MN). Результаты приведены на фиг. 12.
Обсуждение
Интерлейкин 6 (IL-6) функционирует как фактор роста и выживания клеток множественной миеломы. INA-6 представляет собой IL-6-зависимую линию клеток человеческой миеломы, которая также заставляет пролиферировать клетки стромы костного мозга (BMSC). Клеточные линии INA-6 продуцируют растворимый рецептор IL-6 (shuIL-6R). Увеличение уровней shuIL-6R можно использовать в качестве показателя роста клеток MM и тяжести заболевания.
Таким образом, мыши sCID-hu/INA-6 предоставляют модель клеток множественной миеломы, растущих в обычной для них среде костного мозга. Опухолевые клетки данной модели, которые непосредственно взаимодействуют с человеческим костным мозгом, очень напоминают ситуацию у пациентов, у которых рост опухолевых клеток также инициируется в присутствии стромальных клеток. Поскольку клетки INA-6 высвобождают растворимый человеческий рецептор интерлейкина-6 (shuIL-6R), концентрации данного белка в сыворотке можно использовать в качестве меры массы опухолеввых клеток у данных мышей. Активность nBT062-SPDB-DM4 и nBT062-SPP-DM1 in vivo тестируют в такой среде.
Обработка мышей SCIDhu/INA-6 путем еженедельных в.в. введений nBT062-SPDB-DM4 или nBT062-SPP-DM1 в течение семи недель приводит к эффективной регрессии опухоли, которую детектируют по уменьшению уровней shuIL-6R в сыворотке по сравнению с контролем, что указывает на хорошую эффективность конъюгатов даже в среде человеческого костного мозга, и отражает соответствующую ситуацию у пациентов (фиг. 12).
Следует понимать, что способы и композиции по настоящему изобретению могут существовать в виде ряда воплощений, из которых только несколько раскрыты в данном описании. Специалисту в данной области должно быть ясно, что существование других воплощений не нарушает сущности данного изобретения. Следовательно, описанные воплощения являются иллюстративными и не предназначаются для ограничения.
Библиография
Akkina RK, Rosenblatt JD, Campbell AG, Chen IS, Zack JA. Modeling human lymphoid precursor cell gene therapy in the SCID-hu mouse. Blood. 1994;84:1393-1398.
Armour KL, Clark MR, Hadley AG, et al. Recombinant human IgG molecules lacking Fcgamma receptor I binding and monocyte triggering activities. Eur J Immunol. 1999; 29(8):2613-24.
Anderson КС, Kyle RA, Dalton WS, Landowski T, Shain K, Jove R, Hazlehurst L, Berenson J. Multiple Myeloma: New Insights and Therapeutic Approaches. Hematology 2000;147-165.
Anttonen A, Heikkila P, Kajanti M, Jalkanen M, Joensuu H. High syndecan-1 expression is associated with favourable outcome in squamous cell lung carcinoma treated with radical surgery. Lung Cancer. 2001 Jun; 32(3):297-305.
Barbareschi M, Maisonneuve P, Aldovini D, Cangi MG, Pecciarini L, Angelo Mauri F, Veronese S, Caffo O, Lucenti A, Palma PD, Galligioni E, Doglioni C. High syndecan-1 expression in breast carcinoma is related to an aggressive phenotype and to poorer prognosis. Cancer. 2003 Aug 1;98(3):474-83.
Bataille R, Jego G, Robillard N, Barille-Nion S, Harousseau JL, Moreau P, Amiot M, Pellat-Deceunynck C. The phenotype of normal, reactive and malignant plasma cells. Identification of "many and multiple myelomas" and of new targets for myeloma therapy. Haematologica. 2006 Sep;91 (9): 1234-40. Review.
Bernfield M, Kokenyesi R, Kato M, Hinkes MT, Spring J, Gallo RL, Lose EJ. Biology of the syndecans: a family of transmembrane heparan sulfate proteoglycans. Annu Rev Cell Biol. 1992;8:365-393.
Beste G, Schmidt FS, Stibora T, Skerra A. Small antibody-like proteins with prescribed ligand specificities derived from the lipocalin fold. Proc. Natl. Acad. Sci. USA. 1999: 96, 1898-1903.
Bhattacharyya B, Wolff J. Maytansine binding to the vinblastine sites of tubulin. FEBS Lett. 1977;75:159-162.
Bisping G, Kropff M, Wenning D, Dreyer B, Bessonov S, Hilberg F, Roth GJ, Munzert G, Stefanic M, Stelljes M, Scheffold C, Muller-Tidow C, Liebisch P, Lang N, Tchinda J, Serve HL, Mesters RM, Berdel WE, Kienast J. Targeting receptor kinases by a novel indolinone derivative in multiple myeloma: abrogation of stroma-derived interleukin-6 secretion and induction of apoptosis in cytogenetically defined subgroups. Blood. 2006 Mar 1;107(5):2079-89. Epub 2005 Nov 8.
Blättler WA and Chari RVJ. Drugs to Enhance the Therapeutic Potency of Anticancer Antibodies: Antibody-Drug Conjugates as Tumor-Activated Prodrugs. In: Ojima, I., Vite, G.D. and Altmann, K.-H., Editors, 2001. Anticancer Agents-Frontiers in Cancer Chemotherapy, American Chemical Society, Washington, DC, pp. 317-338.
Bross PF, Beitz J, Chen G, Chen XH, Duffy E, Kieffer L, Roy S, Sridhara R, Rahman A, Williams G, Pazdur R. Approval summary: gemtuzumab ozogamicin in relapsed acute myeloid leukemia. Clin Cancer Res. 2001;7:1490-1496.
Carbone A, Gaidano G, Gloghini A, Ferlito A, Rinaldo A, Stein H. AIDS-related plasma- blastic lymphomas of the oral cavity and jaws: a diagnostic dilemma.Ann. Otol. Rhinol. Laryngol. 1999; 108: 95-99.
Carlsson J, Drevin H, Axen R. Protein thiolation and reversible protein-protein conjugation. N-succinimidyl-3-(2-pyridyldithio)propionate, a new heterobifunctional reagent. Biochem J 1978; 173: 723-737.
Carter P. Improving the efficacy of antibody-based cancer therapies. Nat Rev Cancer. 2001;1:118-129.
Chari RV, Martell BA, Gross JL, Cook SB, Shah SA, Blattler WA, McKenzie SJ, Goldmacher VS. Immunoconjugates containing novel maytansinoids: promising anticancer drugs. Cancer Res. 1992;52:127-131.
Chari RV, Jacket KA, Bourret LA, Derr SM, Tadayoni BM, Mattocks KM, Shah SA, Liu C, Blättler WA and Goldmacher VS. Enhancement of the selectivity and antitumor efficacy of a CC-1065 analogue through immunoconjugate formation. Cancer Res. 1995; 55: 4079-4084.
Charnaux N, Brule S, Chaigneau T, Saffar L, Sutton A, Hamon M, Prost C, Lievre N, Vita C, Gattegno L. RANTES (CCL5) induces a CCR5-dependent accelerated shedding of syndecan-1 (CD138) and syndecan-4 from HeLa cells and forms complexes with the shed ectodomains of these proteoglycans as well as with those of CD44. Glycobiology. 2004 Sep 8 [Epub ahead of print]
Chen BP, Galy A, Kyoizumi S, Namikawa R, Scarborough J, Webb S, Ford B, Cen DZ, Chen SC. Engraftment of human hematopoietic precursor cells with secondary transfer potential in SCID-hu mice. Blood. 1994;84:2497-2505.
Chilosi M, Adami F, Lestani M, Montagna L, Cimarosto L, Semenzato G, Pizzolo G, Menestrina F. CD138/syndecan-1: a useful immunohistochemical marker of normal and neoplastic plasma cells on routine trephine bone marrow biopsies. Mod Pathol. 1999;12:1101-1106.
Clement C, Vooijs, W.C., Klein, В., and Wijdenes, J. In: al. SFSe, ed. J. Leukocyte Typing V. Oxford: Oxford University Press; 1995:714-715.
Couturier O, Faivre-Chauvet A ; Filippovich IV; Thedrez P, SaT-Maurel C; Bardies M; Mishra AK; Gauvrit M; Blain G;Apostolidis C; Molinet R; Abbe JC; Bateille R; Wijdenes J; Chatal JF; Cherel M; Validation of 213Bi-alpha radioimmunotherapy for multiple myeloma. Clinical Cancer Research 5(10 Suppl.) (Oct 1999) 3165s-3170s.
Davies EJ et al., Blackball FH, Shanks JH, David G, McGown AT, Swindell R, Slade RJ, Martin-Hirsch P, Gallagher JT, Jayson GC. Distribution and Clinical Significance of Heparan Sulfate Proteoglycans in Ovarian Cancer Clin Cancer Res. 2004; 10(15):5178-86.
Dhodapkar MV, Abe E, Theus A, Lacy M, Langford JK, Barlogie B, Sanderson RD. Syndecan-1 is a multifunctional regulator of myeloma pathobiology: control of tumor cell survival, growth, and bone cell differentiation. Blood. 1998;91:2679-2688.
Dore JM, Morard F, Vita N, Wijdenes J. Identification and location on syndecan-1 core protein of the epitopes of B-B2 and B-B4 monoclonal antibodies. FEBS Lett. 1998;426:67-70.
Dowell JA, Korth-Bradley J, Liu H, King SP, Berger MS. Pharmacokinetics of gemtuzumab ozogamicin, an antibody-targeted chemotherapy agent for the treatment of patients with acute myeloid leukemia in first relapse. J Clin Pharmacol. 2001;41:1206-1214.
Edinger M, Sweeney TJ, Tucker AA, Olomu AB, Negrin RS, Contag CH. Noninvasive assessment of tumor cell proliferation in animal models. Neoplasia. 1999;1:303-310.
Gattei V, Godeas C, Degan M, Rossi FM, Aldinucci D, Pinto A. Characterization of Anti-CD138 monoclonal antibodies as tools for investigating the molecular polymorphism of syndecan-1 in human lymphoma cells. Br J Haematol. 1999;104:152-162.
Hamann PR, Hinman LM, Beyer CF, Lindh D, Upeslacis J, Flowers DA, Bernstein I. An anti-CD33 antibody-calicheamicin conjugate for treatment of acute myeloid leukemia. Choice of linker. Bioconjug Chem. 2002;13:40-46.
Han I, Park H, Oh ES. New insights into syndecan-2 expression and tumourigenic activity in colon carcinoma cells. J Mol Histol. 2004: 35(3):319-26.
Hideshima T, Catley L, Yasui H, Ishitsuka K, Raje N, Mitsiades C, Podar K, Munshi NC, Chauhan D, Richardson PG, Anderson КС. Perifosine, an oral bioactive novel alkylphospholipid, inhibits Akt and induces in vitro and in vivo cytotoxicity in human multiple myeloma cells. Blood 2006; 107(10):4053-62.
Hideshima T, Mitsiades C, Tonon G, Richardson PG, Anderson КС. Understanding multiple myeloma pathogenesis in the bone marrow to identify new therapeutic targets. Nat Rev Cancer 2007;7(8):585-98.
Horvathova M, Gaillard, J.-P., Liutard, J., Duperray, C, Lavabre-Bertrand, Т., Bourquard, P et al. In: al. SFSe, ed. Leucocyte Typing V. Oxford: Oxford University Press; 1995:713-714.
Kovtun YV, Audette CA, Ye Y, Xie H, Ruberti MF, Phinney SJ, et al. Antibody-drug conjugates designed to eradicate tumors with homogeneous and heterogeneous expression of the target antigen. Cancer Res 2006;66 (6):3214-21.
Krebs B, Rauchenberger R, Reiffert S, Rothe C, Tesar M, Thomassen E, Cao M, Dreier T, Fischer D, Hoss A et al. High-throughput generation and engineering of recombinant human antibodies. 2001. J. Immunol. Methods 254, pp. 67-84.
Kupchan SM, Sneden AT, Branfman AR, Howie GA, Rebhun LI, Mclvor WE, Wang RW, Schnaitman TC. Structural requirements for antileukemic activity among the naturally occurring and semisynthetic maytansinoids. J Med Chem. 1978;21:31-37.
Kyoizumi S, Baum CM, Kaneshima H, McCune JM, Yee EJ, Namikawa R. Implantation and maintenance of functional human bone marrow in SCID-hu mice. Blood. 1992;79:1704-1711.
Kyoizumi S, Murray LJ, Namikawa R. Preclinical analysis of cytokine therapy in the SCID-hu mouse. Blood. 1993;81:1479-1488.
Langford JK, Stanley MJ, Cao D, Sanderson RD.Multiple heparan sulfate chains are required for optimal syndecan-1 function. J Biol Chem. 1998 Nov 6;273(45):29965-71.
Liu C, Tadayoni BM, Bourret LA, Mattocks KM, Derr SM, Widdison WC, Kedersha NL, Ariniello PD, Goldmacher VS, Lambert JM, Blattler WA, Chari RV. Eradication of large colon tumor xenografts by targeted delivery of maytansinoids. Proc Natl Acad Sci USA. 1996;93:8618-8623.
McCune JM, Namikawa R, Kaneshima H, Shultz LD, Lieberman M, Weissman IL. The SCID-hu mouse: murine model for the analysis of human hematolymphoid differentiation and function. Science. 1988;241:1632-1639.
Mennerich D, Vogel A, Klaman I, Dahl E, Lichtner RB, Rosenthal A, Pohlenz HD, Thierauch KH, Sommer A. Shift of syndecan-1 expression from epithelial to stromal cells during progression of solid tumours. Eur J Cancer. 2004 Jun; 40(9): 1373-82.
Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63.
Munshi NC, Longo DL, Anderson КС. Plasma cell disorders. In: Braunwald E, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL, editors. Harrison's Principles of Internal Medicine. 16th ed. New York: McGraw-Hill Medical Publishing Division; 2008. p. 700-7.
Namikawa R, Ueda R, Kyoizumi S. Growth of human myeloid leukemias in the human marrow environment of SCID-hu mice. Blood. 1993;82:2526-2536.
O'Connell FP, Pinkus JL, Pinkus GS. CD138 (Syndecan-1), a Plasma Cell Marker Immunohistochemical Profile in Hematopoietic and Nonhematopoietic Neoplasms. Am J Clin Pathol 2004; 121:254-263.
Ojima I, Geng X, Wu X, Qu C, Borella CP, Xie H, Wilhelm SD, Leece BA, Bartle LM, Goldmacher VS and Chari RV. Tumor-specific novel taxoid-monoclonal antibody conjugates. 2002. J. Med. Chem. 45, pp. 5620-5623.
Olafsen.T, Cheung, CC, Yazaki, PJ, Li L, Sundaresan G, Gambhir SS, Sherman, MA, Williams, LE, Shively, JE, Raubitschek, AA, and Wu, AM. Covalent disulfide-linked anti-CEA diabody allows site-specific conjugation and radiolabeling for tumor targeting applications. 2004; Prot. Eng. Design & Selection 17:1: 21-27.
Orosz Z, Kopper L. Syndecan-1 expression in different soft tissue tumours. Anticancer Res. 2001: 21(1B):733-7.
Padlan, EA. A possible procedure for reducing the immunogenicity of antibody variable domains while preserving their ligand-binding properties. Mol. Immunol. 1991; 28: 489-498.
Payne G. Progress in immunoconjugate cancer therapeutics. Cancer Cell. 2003;3:207-212.
Pegram MD, Lipton A, Hayes DF, Weber BL, Baselga JM, Tripathy D, Baly D, Baughman SA, Twaddell T, Glaspy JA and Slamon DJ. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment. 1998. J. Clin. Oncol. 16, pp. 2659-2671.
Rawstron AC, Owen RG, Davies FE, Johnson RJ, Jones RA, Richards SJ, Evans PA, Child JA, Smith GM, Jack AS, Morgan GJ. Circulating plasma cells in multiple myeloma: characterization and correlation with disease stage. Br J Haematol. 1997;97:46-55.
Remillard S, Rebhun LI, Howie GA, Kupchan SM. Antimitotic activity of the potent tumor inhibitor maytansine. Science. 1975;189:1002-1005.
Roguska MA, Pedersen JT, Keddy CA, Henry AH, Searle SJ, Lambert JM, Goldmacher VS, Blattler WA, Rees AR, Guild ВС. Humanization of murine monoclonal antibodies through variable domain resurfacing. Proc Natl Acad Sci USA. 1994;91:969-973.
Ross S, Spencer SD, Holcomb I, Tan C, Hongo J, Devaux B, Rangell L, Keller GA, Schow P, Steeves RM, Lutz RJ, Frantz G, Hillan K, Peale F, Tobin P, Eberhard D, Rubin MA, Lasky LA, Koeppen H. Prostate stem cell antigen as therapy target: tissue expression and in vivo efficacy of an immunoconjugate. Cancer Res. 2002 May 1 ;62(9):2546-53.
Ross JS, Gray K, Gray G, Worland PJ, Rolfe M. Anticancer Antibodies, Am J Clin Path. (4/17/2003).
Sanderson RD, Lalor P, Bernfield M. В lymphocytes express and lose syndecan at specific stages of differentiation. Cell Regul. 1989;1:27-35.
Sandhu JS, Clark BR, Boynton EL, Atkins H, Messner H, Keating A, Hozumi N. Human hematopoiesis in SCID mice implanted with human adult cancellous bone. Blood. 1996;88:1973-1982.
Sasaki A, Boyce BF, Story B, Wright KR, Chapman M, Boyce R, Mundy GR, Yoneda T. Bisphosphonate risedronate reduces metastatic human breast cancer burden in bone in nude mice. Cancer Res. 1995;55:3551-3557.
Schneider U, van Lessen A, Huhn D, Serke S. Two subsets of peripheral blood plasma cells defined by differential expression of CD45 antigen. Br J Haematol. 1997;97:56-64.
Schuurman J, Van Ree R, G. J. Perdok GJ, Van Doom HR, Tan KY, Aalberse RC, Normal human immunoglobulin G4 is bispecific: it has two different antigen-combining sites, Immunology 1999; 97:693-698.
Sebestyen A, Berczi L, Mihalik R, Paku S, Matolcsy A, Kopper L. Syndecan-1 (CD138) expression in human non-Hodgkin lymphomas. Br J Haematol. 1999; 104(2):412-9.
Seftalioglu A, Karakus S. Syndecan-1/CD138 expression in normal myeloid, acute lymphoblastic and myeloblasts leukemia cells. Acta Histochem. 2003;105:213-221.
Seftalioglu A, Karakus S, Dundar S, Can B, Erdemli E, Irmak MK, Oztas E, Korkmaz C, Yazar F, Cavusoglu I. Syndecan-1 (CD138) expression in acute myeloblasts leukemia cells-an immuno electron microscopic study. Acta Oncol. 2003;42:71-74.
Senter PD, Doronina S, Cerveny C, Chace D, Francisco J, Klussman K, Mendelsohn B, Meyer D, Siegall CB, Thompson J et al. (2002). Cures and regressions of established tumors with monoclonal antibody auristatin conjugates. Abstract #2062, American Assoication for Cancer Res. (San Francisco, CA: American Association for Cancer Res.), 414.
Shields RL, Namenuk AK, Hong K, Meng YG, Rae J, Briggs J, Xie D, Lai J, Stadlen A, Li B, Fox JA, Presta LG.. High resolution mapping of the binding site on human lgG1 for Fc gamma Rl, Fc gamma Rll, Fc gamma Rill, and FcRn and design of lgG1 variants with improved binding to the Fc gamma R. J Biol Chem. 2001; 276(9):6591-604.
Sievers EL, Larson R.A., Stadtmauer, E.A., Estey, E., Lowenberg, В., Dombret, H., Karanes, C, Theobald, M., Bennett, J.M., Sherman, M.L etal. Efficacy and safety of gemtuzumab ozogamicin in patients with CD33-positive acute myeloid leukemia in first relapse. 2001. J. Clin. Oncol. 19, pp. 3244-3254.
Sievers EL and Linenberger M. Mylotarg: antibody-targeted chemotherapy comes of age. 2001. Curr. Opin. Oncol. 13, pp. 522-527.
Smith R., Single chain antibody variable region fragments; www.Stanford.edu/~smithr/science/scfv.html (last updated on May, 2001).
Studnicka GM, Soares S, Better M, Williams RE, Nadell R, Horwitz AH. Human-engineered monoclonal antibodies retain full specific binding activity by preserving non-CDR complementarity-modulating residues.Protein Eng. 1994: 7(6): 805-814.
Tai YT, Li XF, Catley L, Coffey R, Breitkreutz I, Bae J, Song W, Podar K, Hideshima T, Chauhan D, Schlossman R, Richardson P, Treon SP, Grewal IS, Munshi NC, Anderson КС. Immunomodulatory drug lenalidomide (CC-5013, IMiD3) augments anti-CD40 SGN-40-induced cytotoxicity in human multiple myeloma: clinical implications. Cancer Res. 2005 Dec 15; 65(24): 11712-20.
Tassone P, Goldmacher VS, Neri P, Gozzini A, Shammas MA, Whiteman KA, Hylander-Gans LL, Carrasco DR, Hideshima T, Shringarpure R, Shi J, Allam CK, Wijdenes J, Venuta S, Munshi NC, Anderson КС, Cytotoxic activity of the maytansinoid immunoconjugate B-B4-DM1 against CD138+ multiple myeloma cells, Blood, 2004, 104 (12), pp. 3688-3696.
Tolcher AW, Ochoa L, Hammond LA, Patnaik A, Edwards T, Takimoto C, Smith L, de Bono J, Schwartz G, Mays T, Jonak ZL, Johnson R, DeWitte M, Martino H, Audette C, Maes K, Chari RV, Lambert JM, Rowinsky EK. Cantuzumab mertansine, a maytansinoid immunoconjugate directed to the CanAg antigen: a phase I, pharmacokinetic, and biologic correlative study. J Clin Oncol. 2003;21:211-222.
Urashima M, Chen BP, Chen S, Pinkus GS, Branson RT, Dedera DA, Hoshi Y, Teoh G, Ogata A, Treon SP, Chauhan D, Anderson КС. The development of a model for the homing of multiple myeloma cells to human bone marrow. Blood. 1997;90:754-765.
Vogel CW. Preparation of immunoconjugates using antibody oligosaccharide moieties. Methods in Molecular Biology: Bioconjugation protocols strategies and methods. 2004;283:087-108.
Vooijs WC, Post J, Wijdenes J, Schuurman HJ, Bolognesi A, Polito L, Stirpe F, Bast EJ, de Gast GC. Efficacy and toxicity of plasma-cell-reactive monoclonal antibodies B-B2 and B-B4 and their immunotoxins. Cancer Immunol Immunother. 1996;42:319-328.
Ward, E.S., D. Gussow, A.D. Griffiths, P.T. Jones, and G. Winter. Binding activities of a repertoire of single immunoglobin variable domains secreted from Escherichia coli. Nature. 1989. 341:544-546.
Wargalla UC, Reisfeld RA. Rate of internalization of an immunotoxin correlates with cytotoxic activity against human tumor cells. Proc. Natl. Acad. Sci. USA. 1989;86:5146-5150.
Wijdenes J, Vooijs WC, Clement C, Post J, Morard F, Vita N, Laurent P, Sun RX, Klein B, Dore JM. A plasmocyte selective monoclonal antibody (B-B4) recognizes syndecan-1. Br J Haematol. 1996;94:318-323.
Wijdenes J, Dore JM, Clement C, Vermot-Desroches C. CD138, J Biol Regul Homeost Agents. 2002 Apr-Jun; 16(2): 152-5.
Witzig ТЕ, Kimlinger TK, Ahmann GJ, Katzmann JA, Greipp PR. Detection of myeloma cells in the peripheral blood by flow cytometry. Cytometry. 1996;26:113-120.
Xie H, Audette C, Hoffee M, Lambert JM, Blattler W. Pharmacokinetics and biodistribution of the antitumor immunoconjugate, cantuzumab mertansine (huC242-DM1), and its two components in mice.J Pharmacol Exp Ther. 2004 Mar;308(3): 1073-82.
Yang M, Jiang P, An Z, Baranov E, Li L, Hasegawa S, Al-Tuwaijri M, Chishima T, Shimada H, Moossa AR, Hoffman RM. Genetically fluorescent melanoma bone and organ metastasis models. Clin Cancer Res. 1999;5:3549-3559.
Yang M, Baranov E, Jiang P, Sun FX, Li XM, Li L, Hasegawa S, Bouvet M, Al-Tuwaijri M, Chishima T, Shimada H, Moossa AR, Penman S, Hoffman RM. Whole-body optical imaging of green fluorescent protein-expressing tumors and metastases. Proc Natl Acad Sci USA. 2000;97:1206-1211.
Yang Y, MacLeod V, Dai Y, Khotskaya-Sample Y, Shriver Z, Venkataraman G, Sasisekharan R, Naggi A, Torri G, Casu B, Vlodavsky I, Suva LJ, Epstein J, Yaccoby S, Shaughnessy JD Jr, Barlogie B, Sanderson RD. The syndecan-1 heparan sulfate proteoglycan is a viable target for myeloma therapy.Blood. 2007 Sep 15;110(6):2041-8. Epub 2007 May 29.
Yoshitake S, Yamada Y, Ishikawa E, Masseyeff R. Conjugation of glucose oxidase from Aspergillus niger and rabbit antibodies using N-hydroxysuccinimide ester of N-(4-carboxycyclohexylmethyl)-maleimide. Eur J Biochem 1979;101:395-399.
Реферат
Изобретение относится к области иммунологии. Описан иммуноконъюгат, направленный на клетки, экспрессирующие CD138, содержащий: антитело против CD138 изотипа IgG4, содержащее тяжелую цепь, имеющую CDRs из и SEQ ID NO: 1, представленной в описании, и по меньшей мере на 70% идентичной SEQ ID NO: 1, и легкую цепь, имеющую CDRs из и SEQ ID NO: 2, представленной в описании, и по меньшей мере на 70% идентичной SEQ ID NO: 2; и эффекторную молекулу, представляющую собой ингибитор полимеризации тубулина, и где эффекторная молекула присоединена к указанному сконструированному антителу против мишени через расщепляемый линкер, содержащий дисульфидную связь. Кроме того, описаны фармацевтическая композиция и набор для ингибирования, замедления и/или предотвращения роста опухолей и/или распространения опухолевых клеток, экспрессирующих CD138, где композиция содержит указанный иммуноконъюгат в эффективном количестве и один или несколько фармацевтически приемлемых наполнителей; а набор содержит в отдельных контейнерах фармацевтические композиции, где один контейнер содержит эффективное количество фармацевтической композиции по настоящему изобретению, а другой контейнер содержит вторую фармацевтическую композицию, содержащую эффективное количество дополнительного средства, предпочтительно цитотоксического средства, и один или несколько фармацевтически приемлемых наполнителей. Предложены следующие способы, основанные на введении указанного иммуноконъюгата: а) способ лечения множественной миеломы у субъекта; б) способ опосредованной иммуноконъюгатом доставки лекарственного средства; в) способ ингибирования, замедления и/или предотвращения роста о�
Формула
(a) сконструированное антитело против CD138, и
(b) эффекторную молекулу, вызывающую гибель клеток или прекращение непрерывного клеточного цикла клеток-мишеней, экспрессирующих CD138,
где указанное сконструированное антитело против мишени содержит тяжелую цепь, имеющую, по меньшей мере, 70% идентичность последовательности SEQ ID NO: 1, и легкую цепь, имеющую, по меньшей мере, 70% идентичность последовательности SEQ ID NO: 2, где
(i) вариабельный участок тяжелой цепи содержит аминокислотные остатки 31-35 (CDR1), 51-68 (CDR2) и 99-111 (CDR3) последовательности SEQ ID NO: 1, и
(ii) вариабельный участок легкой цепи содержит аминокислотные остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) последовательности SEQ ID NO: 2,
и где константная область указанной тяжелой цепи представляет собой константную область изотипа IgG4,
где эффекторная молекула представляет собой ингибитор полимеризации тубулина и где эффекторная молекула присоединена к указанному сконструированному антителу против мишени через расщепляемый линкер, содержащий дисульфидную связь.
(a) указанная тяжелая цепь дополнительно содержит аминокислотные остатки 123-448 последовательности SEQ ID NO: 1, и/или
(b) указанная легкая цепь дополнительно содержит аминокислотные остатки 108-214 последовательности SEQ ID NO: 2, соответственно,
и их мутации, которые
(i) поддерживают или снижают антитело-зависимую цитотоксичность и/или комплемент-зависимую цитотоксичность сконструированного антитела против мишени и/или
(ii) стабилизируют сконструированное антитело против мишени.
получение иммуноконъюгата по п.1 или 9, и
введение указанному субъекту указанного иммуноконъюгата в количестве, эффективном для лечения множественной миеломы.
получение иммуноконъюгата по п.1 или 9, и
введение указанного иммуноконъюгата в терапевтически эффективном количестве, где указанный изотип IgG4 снижает ADCC комплемент-зависимую цитотоксичность и/или Fc-опосредованное нацеливание печеночного FcR.
введение в указанную клеточную культуру количества иммуноконъюгата по пп.1, 2 или 9, эффективного для ингибирования, замедления и/или предотвращения роста опухолевых клеток.
введение указанному пациенту, по меньшей мере, одного иммуноконъюгата по пп.1, 2 или 9 в количестве, ингибирующем или уменьшающем рост указанной опухоли и/или распространение указанных опухолевых клеток,
где указанный иммуноконъюгат ингибирует, замедляет или предотвращает рост и/или распространение указанных опухолевых клеток.
(a) введение указанному пациенту, по меньшей мере, одного иммуноконъюгата по пп.1, 2 или 9 в количестве, ингибирующем, замедляющем или предотвращающем рост опухоли и/или распространение опухолевых клеток; и
(b) введение указанному пациенту одного или нескольких цитотоксических средств и/или облучения в количестве, эффективном для уменьшения опухолевой нагрузки,
где указанный иммуноконъюгат ингибирует, замедляет или предотвращает рост и/или распространение опухолевых клеток, включающих клетки, экспрессирующие CD138.
(a) получение, по меньшей мере, одного иммуноконъюгата по пп.1, 2 или 9, и
(b) введение иммуноконъюгата субъекту с целью селективного уменьшения выживания или роста указанных клеток миеломы у указанного субъекта.
(a) получение иммуноконъюгата по п.1, где указанная эффекторная молекула стерически затруднена, и
(b) введение указанному субъекту иммуноконъюгата (a) в количестве, ингибирующем, замедляющем и/или предотвращающем рост указанной опухоли и/или распространение указанных опухолевых клеток.
введение указанному субъекту, по меньшей мере, одного иммуноконъюгата по пп.1, 2 или 9 в количестве, эффективном для уменьшения числа указанных клеток, находящихся в непосредственном или опосредованном контакте с указанными опухолевыми клетками, экспрессирующими CD138.
введение в указанные опухолевые клетки и указанные клетки, находящиеся в непосредственном или опосредованном контакте с указанными опухолевыми клетками, по меньшей мере, одного иммуноконъюгата по пп.1, 2 или 9 в количестве, эффективном для уменьшения числа указанных клеток, находящихся в непосредственном или опосредованном контакте с указанными опухолевыми клетками, экспрессирующими CD138.



Комментарии